Трансплантация сердца, наличие трансплантированного сердца, отмирание и отторжение трансплантата сердца
 Версия: Клинические рекомендации РФ 2023 (Россия)
Версия: Клинические рекомендации РФ 2023 (Россия)
Общая информация
Краткое описание
- Российское трансплантологическое общество
Одобрено Научно-практическим Советом Минздрава РФ
В соответствии с Правилами поэтапного перехода медицинских организаций к оказанию медицинской помощи на основе клинических рекомендаций, разработанных и утвержденных в соответствии с частями 3, 4, 6 –9 и 11 статьи 37 Федерального закона «Об основах охраны здоровья граждан в Российской Федерации», утвержденных постановлением Правительства Российской Федерации от 19.11.2021 № 1968, клинические рекомендации применяются следующим образом:
– размещенные в Рубрикаторе после 1 июня 2022 года – с 1 января 2024 года.
Клинические рекомендации
Трансплантация сердца, наличие трансплантированного сердца, отмирание и отторжение трансплантата сердца
Возрастная категория: Взрослые,Дети
Год утверждения: 2023
Пересмотр не позднее: 2025
Дата размещения: 16.03.2023
Статус: Действует
ID: 762
Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
В настоящее время, несмотря на достижения в области фармакотерапии сердечно- сосудистых заболеваний, операция ортотопической трансплантации сердца (ОТТС) является общепризнанным золотым стандартом лечения терминальной сердечной недостаточности (СН), существенно улучшающим прогноз и качество жизни [1,2,3].
Улучшение выживаемости без нежелательных событий у реципиентов сердца, обусловлено, в первую очередь, снижением периоперационной и ранней послеоперационной смертности [5]. Факторы, определяющие прогноз пациента, отличаются в зависимости от времени, прошедшего после операции. Факторами, влияющими на смертность и выживаемость пациентов в течение первого года после ОТТС, являются периоперационные (возраст и вес донора, длительность ишемии трансплантата, повторная трансплантация сердца, возраст реципиента, исходная тяжесть его состояния и необходимость в механической поддержке кровообращения в предоперационном и периоперационном периодах, легочная гипертензия в послеоперационном периоде, почечная недостаточность, количество трансплантаций, выполняемых трансплантологическим центром), а также инфекционные осложнения и отторжение трансплантата. Наибольший риск отторжения сердечного трансплантата – в течение первого года, но сохраняется пожизненно. В отдаленные сроки после трансплантации сердца основными причинами необратимой дисфункции сердечного трансплантата и гибели пациентов, помимо отторжения, являются болезнь коронарных артерий трансплантированного сердца и осложнения, связанные с приемом иммуносупрессивной терапии, – инфекции, артериальная гипертония, новообразования, нефропатия, сахарный диабет [6]. Реципиенты трансплантированного сердца получают медицинскую помощь и проходят плановые обследования в специализированных трансплантологических центрах, но находятся под наблюдением врачей-терапевтов участковых (врачей общей практики) и врачей-кардиологов по месту жительства. Своевременное выявление осложнений и сопутствующих заболеваний, а также проведение плановых скрининговых обследований являются факторами, в наибольшей степени определяющими прогноз и качество жизни реципиентов сердца, и здесь роль врачей первичного звена здравоохранения является ключевой.
Настоящие рекомендации предназначены для врачей-хирургов (трансплантологов), врачей-кардиологов и врачей широкого профиля, находятся в соответствии и не противоречат основным положениям рекомендаций Международного общества по трансплантации сердца и легких, а также рекомендациям Европейского общества кардиологов и Российского кардиологического общества, рекомендациям по количественной оценке структуры и функции камер сердца, рекомендациям по диагностике и коррекции нарушений липидного обмена с целью профилактики и лечения атеросклероза, рекомендациям по функциональному состоянию почек и прогнозированию сердечно-сосудистого риска, рекомендациям по кардиоваскулярной профилактике, рекомендациям по прогнозированию и профилактике кардиальных осложнений внесердечных хирургических вмешательств у кардиологических пациентов, рекомендациям по эффективности и безопасности лекарственной терапии при первичной и вторичной профилактике сердечно-сосудистых заболеваний.
Определение заболевания или состояния (группы заболеваний или состояний)
Представлено описание технологии оказания медицинской помощи, предполагающей проведение обследований с целью выбора тактики ведения пациентов с сердечной недостаточностью в терминальной стадии, определения показаний для трансплантации сердца или имплантации устройств механической поддержки кровообращения, определения периоперационного риска и статуса очередности для включения пациентов в лист ожидания трансплантации сердца, а также стабилизацию клинического состояния и оценку возможности восстановления/реабилитации пациента после проведения операции ортотопической трансплантации сердца, ведение пациентов после выполненной трансплантации сердца.
Категория возрастная: взрослые, дети;
Пол: любой;
Фаза: компенсация/декомпенсация, острая;
Стадия: терминальная (Стражеско-Василенко IIБ-III ст.);
Осложнения: Сердечная недостаточность III-IV классов по функциональной классификации Нью-Йоркской ассоциации сердца (NYHA);
Вид медицинской помощи: ВМП, ОМС;
Условия оказания медицинской помощи: стационарно;
Форма оказания медицинской помощи: плановая, неотложная, экстренная.
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статической класификации болезней и проблем, связанных со здоровьем
Данные рекомендации применимы для пациентов с первичным или вторичным поражением сердца, определяющим прогноз жизни при отсутствии сопутствующих заболеваний, которые могут повлиять на риск развития периоперационных осложнений или значимо ухудшить прогноз выживаемости в послеоперационном периоде.
Коды диагнозов заболеваний по МКБ-10, с формированием критической сердечной недостаточности, требующей хирургических методов лечения:
-
T86.2 Отмирание и отторжение трансплантата сердца;
-
Z94.1 Наличие трансплантированного сердца.
Классификация
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Критическая сердечная недостаточность может быть следствием острой или хронической недостаточности кровообращения.
Для классификации хронической недостаточности кровообращения в Российской Федерации используются функционально-морфологическая классификация Стражеско-Василенко, отражающая степень прогрессирования заболевания сердца, и Нью-Йоркская классификация функционального состояния (NYHA).
Согласно классификации Стражеско-Василенко, выделяют три стадии прогрессирования заболевания: I, II (A и Б) и III. Для I-й стадии характерно появление симптомов сердечной недостаточности только на фоне физической нагрузки и исчезновение в состоянии покоя. При стадии IIA отмечаются умеренные признаки недостаточности кровообращения в состоянии покоя лишь в одном из отделов сердечно-сосудистой системы в малом или большом круге кровообращения, которые купируются на фоне медикаментозной терапии, включающей диуретики, ингибиторы ангиотензинпревращающего фермента или антагонисты рецепторов ангиотензина II, бета-адреноблокаторы и так называемые «калийсберегающие диуретики», обладающие антиминералкортикоидным действием – спиронолактон и эплеренон. Стадия IIБ характеризуется наличием признаков недостаточности кровообращения как в малом, так и большом кругах кровообращения, в той или иной степени сохраняющимся, несмотря на прием медикаментозной терапии. У пациентов с III-й стадией имеют место выраженные нарушения гемодинамики и признаки венозного застоя в обоих кругах кровообращения, а также значительные нарушения перфузии и метаболизма органов и тканей.
Острая сердечная недостаточность – клинический синдром, характеризующийся быстрым развитием или утяжелением симптомов и признаков недостаточности кровообращения. Острая сердечная недостаточность предполагает необходимость незамедлительного оказания пациенту медицинской помощи.
В основе острой сердечной недостаточности могут лежать многочисленные сердечно-сосудистые и несердечные заболевания с вовлечением различных механизмов патогенеза, что следует учитывать при диагностике, стратификации риска и выборе подходов к лечению.
В настоящее время под эгидой Европейского общества кардиологов (ESC) создана классификация, в которой выделено 6 типов острой сердечной недостаточности:
- ESC-1. Острая декомпенсация ХСН:
Впервые выявленная СН или декомпенсированная ХСН;
Клинические признаки кардиогенного шока, отека легких и гипертонического криза отсутствуют.
- ESC-2. Острая недостаточность кровообращения на фоне гипертонического криза:
Клинические признаки СН на фоне высокого АД на фоне сохранной систолической функции левого желудочка сердца.
- ESC-3. Отек легких:
Клинические признаки отека легких.
- ESC-4. Кардиогенный шок:
Признаки гипоперфузии органов и тканей, артериальная гипотония, олиго/анурия и изменение уровня сознания.
- ESC-5. СН с высоким СВ:
Характеризуется высоким сердечным выбросом, обычно сопровождающимся тахикардией, теплыми конечностями, застоем в малом круге кровообращения, как правило, носит вторичный характер (развивается на фоне инфекционно-токсического шока, тиреотоксикоза, анемии и др.).
- ESC-6. Правожелудочковая СН:
Характеризуется синдромом низкого выброса на фоне повышенного центрального венозного давления, артериальной гипотонией, увеличением размеров печени.
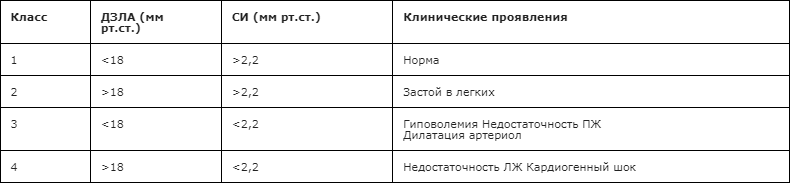
Для описания степени тяжести острой сердечной недостаточности используют классификацию Киллипа (Таблица 1) или классификацию Форрестера (Таблица 2), первая основана на клинических проявлениях заболевания, вторая – на определении гемодинамических показателей.
Таблица 1. Классификация тяжести острой недостаточности кровообращения по Киллипу (Killip)

Таблица 2. Классификация тяжести острой недостаточности кровообращения по Форрестеру (Forrester)
1.5.1 Классификация отторжения сердечного трансплантата
- Степень 0R – нет данных за отторжение, гистологические и иммунопатологические признаки отрицательные;
- Степень 1R – мононуклеарная инфильтрация миокарда с наличием или отсутствием единичного очага повреждения кардиомиоцитов;
- Степень 2R – мононуклеарная инфильтрация миокарда с множественными очагами повреждения кардиомиоцитов;
- Степень 3R – мононуклеарная инфильтрация с диффузным повреждением кардиомиоцитов и/или признаками отека, кровоизлияний или васкулита.
Классификация острого гуморального отторжения (ISHLT 2013):
- pAMR0 – гистологические и иммуногистохимические признаки отсутствуют.
- pAMR1 – наличие только гистологических признаков [pAMR1 (H+) или только иммунофлуоресцентных признаков [pAMR1 (I+)], но не обоих.
- pAMR1(H+) – наличие только гистологических признаков: активация эндотелия сосудов, периваскулярного клеточного инфильтрата, периваскулярного отека внутрисосудистых макрофагов, интерстициального отека, возможен некроз кардиомиоцитов.
- pAMR1(I+) – наличие только иммунофлуоресцентных признаков: C4d компонента комплемента в стенке интерстициальных капилляров.
- pAMR2 – сочетание гистологических и иммунофлуоресцентных признаков (pAMR (H+) + pAMR (I+) = pAMR2).
- pAMR3 – выраженные гистологические признаки и распространенное свечение C4d компонента комплемента в стенке капилляров миокарда.
Классификация васкулопатии сердечного трансплантата (ISHLT 2010):
- ISHLT CAV 0 (васкулопатия сердечного трансплантата не значимая): ангиографических изменений не выявлено;
- ISHLT CAV 1 (легкая): стеноз ствола ЛКА <50%, основных ветвей <70%, или любой ветви < 70% (включая диффузное сужение) без дисфункции трансплантата;
- ISHLT CAV 2 (умеренная): стеноз ствола ЛКА >50%, основных ветвей >70%, или любой ветви второго порядка > 70% без дисфункции трансплантата;
- ISHLT CAV 3 (выраженная): стеноз ствола ЛКА >50%, двух и более основных ветвей > 70%, или любой ветви второго порядка >70% во всех трех основных бассейнах; или ISHLT CAV 1, или ISHLT CAV 2 в сочетании с дисфункцией трансплантата (определяемая как ФИЛЖ <45%, обычно в сочетании с нарушением локальной сократимости ЛЖ), или признаки значимой рестриктивной диастолической дисфункции.
Этиология и патогенез
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Основным показанием к трансплантации сердца и имплантации устройств механической поддержки кровообращения является критическая острая или декомпенсированная хроническая сердечная недостаточность, развившаяся у пациентов с кардиомиопатией, ишемической болезнью сердца, тяжелыми декомпенсированными заболеваниями клапанов сердца (при невозможности выполнения иных методов хирургического лечения), миокардитами, врожденными пороками сердца, а также другими заболеваниями сердца, которые существенно ограничивают физическую активность и сопровождаются риском смерти в течение года, превышающим 50%.
Эпидемиология
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Клиническая картина
Cимптомы, течение
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
1.6.1 Клиническая картина сердечной недостаточности
Клиническая картина при сердечной недостаточности включает типичные симптомы (одышка, ортопное, пароксизмальная ночная одышка, снижение толерантности к физическим нагрузкам, повышенная утомляемость, отеки лодыжек) и признаки (повышенное давление в яремной вене, гепатоюгулярный рефлюкс, «ритм галопа», смещение верхушечного толчка влево), вызванные нарушением структуры и/или функции сердца.
Критическая сердечная недостаточность может быть следствием острой или хронической недостаточности кровообращения.
Острая сердечная недостаточность – клинический синдром, характеризующийся быстрым развитием или утяжелением симптомов и признаков недостаточности кровообращения. Острая сердечная недостаточность предполагает необходимость незамедлительного оказания пациенту медицинской помощи.
В основе острой сердечной недостаточности могут лежать многочисленные сердечно-сосудистые и несердечные заболевания с вовлечением различных механизмов патогенеза, что следует учитывать при диагностике, стратификации риска и выборе подходов к лечению.
Острая сердечная недостаточность может быть как впервые выявлена у лиц без диагностированных сердечно-сосудистых заболеваний, так и развиваться на фоне декомпенсации хронической сердечной недостаточности.
Относительно специфичные клинические симптомы хронической сердечной недостаточности: ортопноэ, периферические отеки, повышенное яремно-венозное давление, кардиомегалия, сердечные шумы, гепатомегалия. Одышка является единственным симптомом с высокой чувствительностью, но ее специфичность значительно ниже. Причиной одышки при хронической сердечной недостаточности является застойное полнокровие в легких, что приводит к повышению давления в легочных венах и капиллярах. Одышка на начальных стадиях сердечной недостаточности связана с физической нагрузкой (выраженность одышки нарастает при физической нагрузке). По мере прогрессирования переносимость физических нагрузок ухудшается: одышка возникает при меньшем уровне физической нагрузки, появляется повышенная утомляемость, снижается толерантность к физической нагрузке, в дальнейшем развивается ортопное. Подтвердить или исключить кардиоваскулярный генез отеков помогают клинические особенности отеков, выявление системной венозной гипертензии и наличие признаков органического заболевания сердца. При хронической сердечной недостаточности отеки локализуются в наиболее низко расположенной части тела (нижние конечности, при нарастании сердечной недостаточности - отеки мошонки, живота, поясницы) и симметричны.
Острое клеточное отторжение чаще всего развивается в течение первых месяцев после трансплантации сердца и обусловлено, в основном, активированными Т- лимфоцитами. В течение первого года после трансплантации сердца острое клеточное отторжение развивается у 20-40% реципиентов. У большинства пациентов отторжение трансплантата на ранних стадиях не имеет клинических проявлений. Это обуславливает необходимость проведения регулярных плановых биопсий миокарда с целью раннего выявления признаков отторжения и своевременного начала лечения.
Учитывая высокую частоту развития рестенозов и вероятность развития новых очагов поражения у реципиентов сердца, особенно после проведения баллонной ангиопластики, повторную коронарографию следует проводить не позже, чем через 6 месяцев после процедуры ангиопластики.
Дисфункция эндотелия является ранним проявлением васкулопатии сердечного трансплантата и может быть диагностирована при помощи измерения резерва коронарного кровотока и эндотелий-зависимой вазодилятации. Метод оценки резерва коронарного кровотока позволяет диагностировать ранние нарушения в микроциркуляторном русле, даже при отсутствии изменений в крупных эпикардиальных артериях. Показано, что выявление сниженного резерва коронарного кровотока является предиктором развития васкулопатии трансплантата и нарушения сократительной функции желудочков трансплантата в течение последующих 2-х лет.
-
Среди неинвазивных методов ранней диагностики васкулопатии трансплантата наиболее информативными являются радиоизотопные методы оценки перфузии миокарда, стресс эхокардиографическое исследование с добутамином** и тканевое допплеровское исследование сократительной функции миокарда.
Диагностика
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
-
В стационаре всем пациентам рекомендован осмотр врачей специалистов: врача-кардиолога, врача-анестезиолога-реаниматолога, врача-сердечно-сосудистого хирурга [11, 208].
-
При необходимости рекомендуются дополнительные консультации врачей-специалистов: врача-невролога, врача-эндокринолога, врача-нефролога, врача-инфекциониста, врача-уролога, врача-стоматолога [11, 208].
-
Рекомендуется проведение следующих лабораторных клинических обследований: общий (клинический) анализ крови, анализ крови биохимический общетерапевтический (креатинин, мочевина, билирубин, АЛТ, АСТ, щелочная фосфатаза, ГГТ, холестерин ЛПВП, холестерин ЛПНП, триглицериды, С реактивный белок, альбумин, глюкоза, общий белок), электролиты крови (калий, натрий), коагулограмма (агрегация тромбоцитов, АЧТВ, ПТИ, фибриноген), гормоны щитовидной железы (ТТГ, Т4 своб., Т3), общий (клинический) анализ мочи, определение основных групп по системе AB0, определение антигена D системы Резус (резус-фактор), молекулярно-биологическое исследование крови на вирус Эпштейна-Барр (Epstein - Barr virus), молекулярно-биологическое исследование крови на цитомегаловирус (Cytomegalovirus), молекулярно-биологическое исследование крови на вирус простого герпеса (Herpes simplex virus), определение антител к вирусу иммунодефицита человека (ВИЧ) типов 1, 2, определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови, определение антител к вирусу гепатита C (Hepatitis C virus) в крови, определение антител к бледной трепонеме (Treponema pallidum) в нетрепонемных тестах (RPR, РМП) (качественное и полуколичественное исследование) в сыворотке крови, проведение пробы на совместимость по иммунным антителам реципиента и антигенам главного комплекса гистосовместимости донора, определение HLA-антигенов [11, 208].
-
Помимо рутинных лабораторных методов исследования, указанных в разделе «2.3.1», всем реципиентам сердца показано регулярное определение уровней циклоспорина** или такролимуса** или эверолимуса** в крови (в зависимости от принимаемой иммуносупрессивной терапии).
-
Рекомендуется проведение следующих методов инструментальной диагностики: электрокардиографическое (ЭКГ) исследование в 12-ти отведениях; эхокардиографическое трансторакальное исследование; ультразвуковое исследование органов брюшной полости (комплексное), включая УЗИ брюшной аорты и нижней полой вены; пульсоксиметрия; исследование неспровоцированных дыхательных объемов и потоков; исследование спровоцированных дыхательных объемов; компьютерная томография органов грудной клетки с внутривенным контрастированием по показаниям; компьютерная томография органов брюшной полости и забрюшинного пространства с внутривенным контрастированием по показаниям; компьютерная томография головного мозга; эзофагогастродуоденоскопия [11, 18, 19, 208].
-
Чрезвенозная диагностическая катетеризация правых отделов сердца с определением показателей давления в полостях сердца, а также сердечного выброса (СВ), сердечного индекса (СИ), транспульмонарного градиента (ТПГ) и показателя легочного сосудистого сопротивления (ЛСС) рекомендуется всем потенциальным реципиентам при включении в лист ожидания трансплантации сердца [19, 20, 21, 22, 56, 208].
-
Если при проведении чрезвенозной катетеризации правых отделов сердца выявлены признаки легочной гипертензии, характеризующихся значениями показателей систолического давления в легочной артерии > 50 мм рт.ст., транспульмонарного градиента (ТПГ) > 15 мм рт. ст. и легочного сосудистого сопротивления (ЛСС) > 5 единиц Вуда, рекомендуется повторить измерения на фоне назначения лекарственных средств, обладающих вазодилятирующим действием на легочные артерии (окись азота, силденафил и др.) [22,56].
-
Холтеровское мониторирование сердечного ритма, ЭКГ с применением лекарственных препаратов (дополнительно к основной ЭКГ); ортостатическая проба при ЭКГ (дополнительно к основной ЭКГ); дуплексное сканирование аорты; дуплексное сканирование брахиоцефальных артерий с цветным допплеровским картированием кровотока; дуплексное сканирование сосудов (артерий и вен) верхних конечностей; дуплексное сканирование сосудов (артерий и вен) нижних конечностей; дуплексное сканирование брюшного отдела аорты, ее висцеральных ветвей, подвздошных и общих бедренных артерий; эхокардиография чреспищеводная; эхокардиография с фармакологической нагрузкой; эхокардиография с физической нагрузкой; сцинтиграфия миокарда; сцинтиграфия миокарда с функциональными пробами; проведение теста с физической нагрузкой с использованием велоэргометра; проведение теста с однократной физической нагрузкой меняющейся интенсивности [11,208].
-
Рекомендовано проведение перфузионной сцинтиграфии миокарда с тетрофосмином, синхронизированной с ЭКГ; Эндомиокардиальной биопсии – у пациентов с трансплантированным сердцем выполняется в рамках обязательного планового обследования и у пациентов с клиническими признаками дисфункции сердечного трансплантата по показаниям; коронарографии у пациентов с клиническими признаками ишемической кардиопатии с целью выявления возможностей реваскуляризации миокарда как способа лечения сердечной недостаточности, а также у реципиентов трансплантированного сердца в рамках обязательного планового обследования и у пациентов с клиническими признаками дисфункции сердечного трансплантата [19, 20, 21, 22, 56, 208].
Лечение
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
- Трансплантация сердца показана больным с терминальной (критической) сердечной недостаточностью, сопровождающейся клинически значимыми признаками декомпенсации кровообращения, и неблагоприятным прогнозом жизни, несмотря на назначение максимально переносимой этиотропной медикаментозной терапии и при невозможности выполнения иных органосохраняющих вмешательств и не имеющих противопоказаний [2, 9].
- Пациентов, госпитализированных с острой или декомпенсированной хронической сердечной недостаточностью, требующих непрерывной инфузии адренергических и дофаминергических средств или находящихся на механической поддержке кровообращения, рекомендовано включать в приоритетный лист ожидания трансплантации сердца. Пациенты, включенные в лист ожидания и не нуждающиеся в постоянной медикаментозной инотропной или механической поддержке кровообращения, наблюдаемые амбулаторно, должны проходить регулярные обследования для оценки статуса [33-37].
- Критериями неблагоприятного прогноза у пациентов с сердечной недостаточностью рекомендовано считать:
- Старший возраст пациента не является противопоказанием для проведения трансплантации сердца, однако, у лиц старше >65 лет, при наличии сопутствующих клинически значимых синдромов или заболеваний, связанных с повышенным риском периоперационных осложнений, выполнение трансплантации сердца не рекомендовано [2, 31, 56].
- Не рекомендована трансплантация сердца пациентам с ожирением, характеризующимся значениями показателя индекса массы тела 30-35 кг/м2 [2, 56, 208].
- При наличии сопутствующих заболеваний, повышающих риск развития периоперационных осложнений, трансплантация сердца не рекомендована:
- Не рекомендована трансплантация сердца пацинетам при наличии состояний и заболеваний, которые могут сопровождаться нарушением режима приема лекарственных средств в послеоперационном периоде:
- Не рекомендована трансплантация сердца при наличии хронических инфекционных заболеваний:
- Не рекомендована трансплантация сердца пациентам в возрасте старше 80 лет и сопутствующими заболеваниями, повышающими периоперационный риск и ограничивающие отдаленный прогноз [2, 31, 56].
- Не рекомендована трансплантация сердца пациентам при наличии сопутствующих заболеваний, повышающих риск развития периоперационных осложнений:
- Не рекомендована трансплантация сердца пациентам при наличии сопутствующих заболеваний, сопровождающихся риском смерти в течение 5 лет, превышающим 50% (напр., онкологические заболевания с неблагоприятным прогнозом жизни) [2, 56, 208].
- Не рекомендуется трансплантация сердца пациентам с легочной гипертензией, характеризующейся значениями показателей систолического давления в легочной артерии (СДЛА) > 50 мм рт.ст., транспульмонарного градиента (ТПГ) > 15 мм рт. ст. и легочного сосудистого сопротивления (ЛСС) > 5 единиц Вуда, рефрактерная к назначению средств, обладающих вазодилятирующим действием на легочные артерии, поскольку она является противопоказанием для проведения ортотопической трансплантации сердца [22, 56].
- Рекомендованы следующие хирургические методики: биатриальная (анастомозы накладываются между предсердиями донора и реципиента) и бикавальная (анастомозы накладываются между полыми венами донора и реципиента) для выполнения трансплантации сердца [207, 208].
Перед анастомозированием аорты трансплантата и реципиента также оценивают соответствие их диаметров. При соотношении 1:2 выполняют клиновидное иссечение участка верхней стенки аорты большего диаметра с наложением на края разреза обвивного непрерывного шва или рассечение верхней стенки меньшего диаметра на протяжении 1,5-2 см.
3.3 Госпитальный послеоперационный период у реципиентов трансплантированного сердца
- Рекомендовано использование добутамина** при умеренно выраженных нарушениях сократительной функции миокарда сердечного трансплантата и отсутствии выраженной артериальной гипотензии в раннем послеоперационном периоде после ортотопической трансплантации сердца, а также при нарушениях сократительной функции миокарда сердечного трансплантата по правожелудочковому типу [208, 219].
- Рекомендовано использование допамина** в раннем послеоперационном периоде после ортотопической трансплантации сердца при острой сердечно-сосудистой недостаточности, синдроме низкого сердечного выброса, артериальной гипотензии, сопровождающимся низким общим периферическом сосудистом сопротивлении. При гемодинамически значимом нарушении сократительной функции сердечного трансплантата рекомендован базовый препарат эпинефрин** (изолированно или в комбинации с другими адренергическими и дофаминергическими средствами). Потребность в использовании эпинефрина** возрастает после ТС с длительным сроком ишемии сердечного трансплантата. При использовании эпинефрина** рекомендовано учитывать потенциальное сосудосуживающее действие на малый круг, что может оказаться нежелательным у реципиентов с преимущественно правожелудочковой недостаточностью сердечного трансплантата [208, 219, 448, 449].
- У взрослых рекомендовано применение левосимендана** с целью улучшения сократительной функции миокарда сердечного трансплантата и уменьшения доз адренергических и дофаминергических. Гемодинамическими показаниями для терапии левосименданом являются: ДПП > 12 мм рт. ст., ДЗЛА > 15 мм рт. ст., СИ < 2,5 л/мин/м2 при необходимости в кардиотонической терапии допамином** и/или добутамином** > 15 мкг/кг/мин и эпинефрином** > 100 нг/кг/мин. С учетом возможного системного вазодилатирующего действия рекомендуется введение левосимендана методом постоянной инфузии (100 нг/кг/мин) без предварительного болюсного введения нагрузочной дозы [208, 218, 219].
- При проведении периоперационного мониторинга реципиентов сердца рекомендуется выполнять непрерывное мониторирование ЭКГ, инвазивный мониторинг артериального давления, давления в правом предсердии или центрального венозного давления заклинивания легочной артерии, периодическое измерение сердечного выброса, измерение сатурации О2, интраоперационная чреспищеводная эхокардиография, постоянная оценка диуреза [208, 218, 219].
- Наблюдение пациентов в отдаленном периоде после трансплантации сердца рекомендовано осуществляеть специалистам центра трансплантации в сотрудничестве с местными органами здравоохранения и социальной поддержки [208-230];
- Местным органам здравоохранения рекомендуется информировать центр трансплантации в случаях: любой госпитализации пациента в лечебное учреждение; изменений медикаментозной терапии, включая назначение любых антибиотиков, противогрибковых или противовирусных средств; перевод на лекарственный препарат другого торгового наименования внутри одного МНН при его центральной закупке допускается при отсутствии данных об индивидуальной непереносимости, строго под наблюдением врача и под контролем концентрации лекарственного препарата в крови; развития артериальной гипотонии или снижения уровней систолического АД более чем на 20 мм рт.ст. по сравнению с прежними уровнями; подъема температуры до 38°С в течение двух суток; выполнения любых хирургических вмешательств; появления жалоб на одышку; пневмонии или любых инфекционных заболеваний органов дыхания; появления болей в грудной клетке; боли в животе; появления тошноты, рвоты или диареи; клинических признаков нарушения мозгового кровообращения, обморока или изменений когнитивного (ментального) статуса [208, 228-230].
- Основными задачами регулярной плановой госпитализации пациентов после трансплантации сердца являются выявление признаков отторжения трансплантата и возможных нежелательных событий. Рекомендовано включить в план обследования: полное физикальное обследование; анализ изменений в клинических назначениях и выявление возможной связи изменений в назначениях с изменением клинического статуса пациента; общий и биохимический анализы крови; эхокардиографическое исследование; коронарография (каждые 2 года); проведение эндомиокардиальной биопсии согласно графику; проведение обучения в рамках образовательных программ для пациентов, их родственников и медицинских работников разных специальностей, работающих с пациентом [208, 230];
- Рекомендовано проведение эндомиокардиальных биопсий планово однократно в первую госпитализацию после трансплантации сердца, в последующие госпитализации проведение биопсии миокарда по показаниям [208, 236, 237].
- При выявлении во время операции регургитации 2 и более степени на трехстворчатом клапане рекомендована повторная оценка с помощью трансторакальной или чрезпищеводной эхокардиографии в течение 24 часов после ТС. В дальнейшем рекомендовано руководствоваться клиническими и гемодинамическими проявлениями [239-240].
- Рекомендовано выполнение аннулопластики трикуспидального клапана по методу ДеВега для нормализации размеров фиброзного кольца [238-240].
- Все реципиенты сердечного трансплантата должны получать иммуносупрессивную терапию пожизненно, начиная с момента трансплантации сердца [208, 481-483]. Уровень убедительности рекомендаций А (уровень достоверности доказательств 2)
- Решение о применении индукционной иммуносупрессивной терапии при проведении трансплантации сердца принимается индивидуально для каждого пациента с учетом риска развития острого отторжения трансплантата, почечной дисфункции, инфекционных осложнений и злокачественных новообразований [208].
- Индукционная иммуносупрессивная терапия с использованием #базиликсимаба** или иммуноглобулина антитимоцитарного** рекомендована реципиентам с высоким риском отторжения сердечного трансплантата (пациенты с донор-специфическими антителами, лица молодого возраста, лица женского пола, особенно рожавшие женщины, и пр.), а также пациентам с нарушением функции почек [451-454, 460, 505-507].
- #Базиликсимаб** в качестве индукционной иммуносупрессивной терапии при трансплантации сердца у взрослых рекомендуется вводить дважды в дозе 20 мг - в день трансплантации сердца и на 4-е сутки после операции. [484, 485]
- #Базиликсимаб** в качестве индукционной иммуносупрессивной терапии при трансплантации сердца у детей рекомендуется вводить дважды в дозе 20 мг - в день трансплантации сердца и на 4-е сутки после операции. [486, 487]
- Рекомендовано использовать #базиликсимаб** реципиентам с ожидаемым повышенным риском развития оппортунистических инфекций в качестве приоритетного средства для индукционной иммуносупрессии [466, 506].
- Реципиентам с ожидаемым повышенным риском развития оппортунистических инфекций #базиликсимаб** может быть назначен в низкой дозе - 10 мг - в день трансплантации сердца и на 4-е сутки после операции [467].
- Препараты ингибитора кальциневрина – такролимуса** или циклоспорина** рекомендуются всем пациентам в качестве поддерживающей иммуносупрессивной терапии после трансплантации сердца [249]
- Рекомендовано назначать #микофеноловую кислоту** и #миокофенолата мофетил** неопределенно долго в составе комбинированной иммуносупрессивной терапии в сочетании с такролимусом** или циклоспорином** [241, 243, 245, 249, 256, 261, 488, 489].
- Рекомендованы препараты глюкокортикоидов всем пациентам в составе индукционной и поддерживающей иммуносупрессивной терапии после трансплантации сердца, а также при лечении отторжения сердечного трансплантата у взрослых [249, 473-475].
- Рекомендованы препараты глюкокортикоидов всем пациентам в составе индукционной и поддерживающей иммуносупрессивной терапии после трансплантации сердца, а также при лечении отторжения сердечного трансплантата у детей [490].
- Рекомендовано постепенное снижение суточной дозы глюкокортикостероидов у реципиентов сердца с низким риском развития отторжения сердечного трансплантата: суточная доза метилпреднизолона** постепенно снижается до 4 мг в сутки (однократно, перорально) в течение 6-12 недель после операции [246, 491-493].
- Рекомендована отмена глюкокортикоидов в течение 3-6 месяцев после трансплантации сердца у пациентов с низким риском отторжения трансплантата (пациенты без циркулирующих анти-HLA, нерожавшие женщины, пациенты без отторжения в анамнезе, пациенты старшего возраста) [241, 246, 249, 256, 491, 494-496].
У пациентов после трансплантации сердца (ТС) большее количество несовпадений по HLA антигенам является важным фактором риска нежелательных событий в случае снижения дозы глюкокортикоидов. Таким образом, при выборе индивидуальной тактики лечения глюкокортикоидами необходимо учитывать степень иммунологического несоответствия между донорским органом и реципиентом.
По данным исследований, ранняя отмена преднизолона** в течение первого месяца после трансплантации сердца была успешна у 49-70% пациентов. В связи с тем, что чаще всего острое отторжение трансплантата развивается в течение первых месяцев после трансплантации сердца, отмена глюкокортикоидов по прошествии месяцев может быть успешно проведена у 80% пациентов, даже при отсутствии предшествующей индукционной терапии. Согласно данным регистра Международного общества трансплантации сердца и легких (ISHLT), более 40% пациентов могли успешно обходиться без глюкокортикоидов на протяжении 5-летнего периода. Обычно при отмене глюкокортикоидов руководствуются стандартизированным протоколом и контрольными результатами серийной биопсии миокарда.
- С целью снижения риска развития нежелательного нефротоксического действия и васкулопатии коронарных артерий пересаженного сердца спустя 6 месяцев после операции трансплантации сердца некоторым взрослым пациентам может быть рекомендована смена такролимуса** или циклоспорина** на #сиролимус или эверолимус**[255, 260, 261, 258, 497, 508].
- С целью снижения риска развития нежелательного нефротоксического действия и васкулопатии коронарных артерий пересаженного сердца спустя 6 месяцев после операции трансплантации сердца некоторым детям может быть рекомендована смена такролимуса** или циклоспорина** на #сиролимус или #эверолимус**[497, 498].
- Не рекомендовано назначение #сиролимуса или эверолимуса** в течение первых шести месяцев после трансплантации сердца [259, 262, 476, 498].
- У отдельных пациентов с низким риском развития отторжения трансплантата рекомендована ранняя отмена глюкокортикоидов и назначение такролимуса** или циклоспорина** в монотерапии [241,245].
-
Взрослым реципиентам сердца, независимо от уровней холестерина, рекомендовано назначение средств из группы ингибиторов ГМГ-КоА редуктазы (статинов) [265, 266].
- Рекомендовано назначать начальные дозы ингибиторов ГМГ-КоА редуктазы ниже, чем рекомендуемые для профилактики нежелательных событий в общей популяции, в связи с учетом особенностей лекарственного взаимодействия [271].
- Рекомендованы ингибиторы ГМГ-КоА-редуктазы детям и подросткам с высоким риском развития болезни коронарных артерий сердечного трансплантата [268].
- Рекомендован прием ингибиторов ГМГ-КоА редуктазы пациентам после трансплантации сердца, в связи с тем, что он снижает риск развития БКАПС и улучшает выживаемость без нежелательных событий, включая снижение риска развития злокачественных новообразований и улучшение общей выживаемости [269-271].
- При подозрении на острое отторжение трансплантата рекомендовано проведение эндомиокардиальной биопсии с проведением патолого-анатомическое исследования биопсийного (операционного) материала как можно раньше [284,434].
- Пациентов с клинической картиной криза отторжения рекомендовано госпитализировать, а при наличии сопутствующих гемодинамических нарушений рекомендовано перевести в отделение интенсивной терапии [285].
- Внутривенная пульс-терапия глюкокортикоидами в высоких дозах рекомендована как средство первого выбора при наличии клинических симптомов острого клеточного отторжения независимо от степени тяжести отторжения [275].
-
При сохранении признаков нарушения гемодинамики на фоне проведенной пульс-терапии глюкокортикоидами или отсутствия признаков улучшения в течение 12-24 часов после начала введения глюкокортикоидов [278, 499], рекомендовано назначение антитимоцитарного иммуноглобулина**.
Для детей: Уровень убедительности рекомендаций С (уровень достоверности доказательств 5)
- Рекомендовано проведение внутривенной терапии адренергическими и дофаминергическими средствами для поддержания адекватного сердечного выброса и системного артериального давления до восстановления адекватной сократительной функции трансплантата сердца [230, 284, 500, 501].
- Одновременно с пульс-терапией глюкокортикоидами и введением иммуномодулирующих или иммунодепрессивных средств рекомендовано проведение профилактической терапии антибактериальными препаратами системного действия [208, 231].
- С целью снижения риска рецидива отторжения рекомендовано назначение адекватной поддерживающей терапии иммунодепрессантами. Возможные варианты коррекции поддерживающей иммуносупрессивной терапии включают увеличение доз принимаемых иммунодепрессивных средств, добавление нового компонента или замену одного препарата на другой. Также необходимо оценить соблюдение пациентом режима приема лекарственных средств [208, 231].
- Следующую эндомиокардиальную биопсию рекомендовано выполнять через 1-2 недели от начала лечения острого клеточного отторжения [208, 237].
- Для оценки эффективности терапии у пациентов с острым отторжением рекомендовано использование трансторакального эхокардиографического исследования сократительной функции трансплантата сердца [282, 502].
- У пациентов с клиническими признаками сердечной недостаточности и легкой степенью острого клеточного отторжения, оцененного по результатам гистологического исследования, рекомендовано подозревать острое гуморальное (антителоопосредованное) отторжение [208, 285].
- Базиликсимаб** не рекомендовано применять для лечения острого клеточного отторжения трансплантата сердца [208].
- При выявлении во время проведения планового патологоанатомического исследования биопсийного материала тканей миокарда гистологических признаков тяжелого острого клеточного отторжения рекомендовано лечение, несмотря на отсутствие симптомов отторжения или дисфункции трансплантата [296].
- При тяжелом бессимптомном остром клеточном отторжении (3) рекомендовано проводить внутривенную пульс-терапию глюкокортикоидами [275].
- При тяжелом и умеренном бессимптомном остром клеточном отторжении (3 и 2) рекомендована коррекция поддерживающей иммуносупрессивной терапией (увеличение дозы принимаемых иммунодепрессантов, добавление нового компонента или замена на другой лекарственный препарат) [282].
- В медикаментозную терапию при лечении отторжения рекомендовано включать профилактическое назначение антибактериальных препаратов системного действия [230, 294].
- Повторную эндомиокардиальную биопсию рекомендовано выполнять через 2-4 недели от начала лечения тяжелого или умеренного бессимптомного острого клеточного отторжения [282, 436].
- Бессимптомное острое клеточное отторжение легкой степени (1) в большинстве случаев не рекомендовано для лечения [280, 281].
- Бессимптомное острое клеточное отторжение умеренной степени в сроки более года после ТС также может самостоятельно регрессировать без лечения, но в таком случае рекомендован тщательный мониторинг, включающий оценку клинической картины, эхокардиографию, повторные эндомиокардиальные биопсии [281].
- При возвратном или стероидорезистентном остром клеточном отторжении рекомендуется проводить лечение иммуноглобулином антитимоцитарным** [278].
- При развитии у пациента возвратного или стероидорезистентного криза клеточного отторжения схему поддерживающей иммуносупрессивной терапии рекомендовано пересмотреть [208, 436].
- Независимо от наличия и выраженности клинических признаков недостаточности трансплантата сердца, пациентам с возвратным или резистентным к терапии клеточным отторжением рекомендовано проведение регулярных повторных эхокардиографических исследований с целью мониторирования сократительной функции трансплантата [208, 282].
- Рекомендовано проведение дополнительного гистологического исследования на наличие гуморального компонента отторжения и определение наличия в крови реципиента анти-HLA [285].
- Лечение сверхострого отторжения рекомендовано начать незамедлительно с момента выявления, желательно еще в операционной. Лечение может включать: 1) внутривенную пульс-терапию глюкокортикоидами, 2) плазмаферез, 3) внутривенное введение #иммуноглобулина человека нормального** (в дозе 100–1,000 мг/кг 1-3 раза в неделю), 4) введение иммунодепрессантов , 5) внутривенное введение адренергических и дофаминергических средств, 6) механическую поддержку кровообращения [436].
- Для подтверждения диагноза сверхострого отторжения рекомендовано выполнение интраоперационной биопсии миокарда с патолого-анатомическим исследованием биопсийного (операционного) материала [208, 436].
- При неэффективности вышеуказанных методов лечения рекомендуется экстренная ретрансплантация сердца. При этом следует учитывать, что летальность у пациентов со сверхострым отторжением трансплантата достаточно высока [326, 503].
- С целью уменьшения повреждающего действия антител на трансплантат сердца рекомендовано использовать: внутривенное введение глюкокортикоидов в высоких дозах и/или иммунодепрессантов[285, 288, 504].
- Для удаления циркулирующих анти-HLA или снижения их активности рекомендовано использовать: плазмаферез, иммуноадсорбция, внутривенное введение препаратов #иммуноглобулина человека нормального** (в дозе 100–1,000 мг/кг 1-3 раза в неделю) [291, 436].
- Для поддержания адекватного сердечного выброса и артериального давления рекомендовано назначение адренергических и дофаминергическими средствами, использование систем вспомогательного кровообращения [230, 284].
- При подозрении на гуморальное отторжение рекомендовано выполнять патологоанатомическое исследование биопсийного (операционного) материала тканей миокарда, патологоанатомическое исследование биопсийного (операционного) материала с применением иммуногистохимических методов для выявления компонентов системы комплемента и специфических антител [208, 436].
- Рекомендуется проведение пробы на совместимость по иммунным антителам реципиента и антигенам главного комплекса гистосовместимости донора [208, 436].
- Повторную эндомиокардиальную биопсию с иммуногистохимическим исследованием рекомендуется проводить через 1-4 недели после начала лечения гуморального отторжения [237, 436].
- При необходимости рекомендуется провести коррекцию поддерживающей иммуносупрессивной терапии: увеличить дозу принимаемых лекарственных препаратов, добавить новый или заменить один препарат на другой [231, 249, 260].
- Рекомендовано назначение антикоагулянтной терапии с целью снижения риска развития тромбоза сосудов трансплантата сердца [85, 208, 436].
- При неэффективности терапии у пациентов с острым гуморальным отторжением рекомендовано рассмотрение вопроса о возможности выполнения экстренной ретрансплантации [359, 360, 362].
- При выявлении признаков острого отторжения сердечного трансплантата рекомендуется оценить адекватность назначений и соблюдение пациентом режима приема иммуносупрессивных лекарственных средств [231, 276, 346].
- Рекомендовано составление индивидуального графика проведения плановой биопсии миокарда у пациентов с высоким риском развития острого отторжения трансплантата сердца в отдаленные сроки после операции [237, 295].
- Рекомендуется обучение пациентов выявлению у себя клинических признаков отторжения трансплантата и разъяснение необходимости тщательного соблюдения режима назначений лекарственной терапии и образа жизни для снижения риска нежелательных событий и улучшению отдаленного прогноза [208].
- Частое проведение повторных биопсий миокарда у пациентов с низким риском отторжения не рекомендуется, так как не способствует улучшению прогноза, следует учитывать риск осложнений при проведении биопсии миокарда [237, 436].
- У пациентов с низким риском развития отторжения трансплантата рекомендуется применение неинвазивных функциональных методов диагностики в отдаленном периоде после трансплантации сердца, так как они могут быть альтернативой частым повторным биопсиям миокарда [208, 225, 436].
- Рекомендуется проведение коронарографии один или два раза в год, что позволяет оценить состояние коронарных артерий пересаженного сердца и на ранних этапах выявить БКАПС. При отсутствии БКАПС спустя 3-5 лет после трансплантации сердца, особенно у пациентов с признаками почечной недостаточности, коронарография может выполняться реже [208, 305].
- Для выявления возможного атеросклеротического поражения коронарных артерий донорского сердца, до 6 недель после трансплантации сердца рекомендовано выполнять ангиографию коронарных артерий [208, 305,436].
- Рекомендуется выполнение внутрисосудистого ультразвукового исследования коронарных артерий спустя 4-6 недель после трансплантации сердца и через год после трансплантации сердца, что позволяет оценить отдаленный прогноз, выявить наличие атеросклеротического поражения донорского сердца и диагностировать быстропрогрессирующую БКАПС [304, 305, 308].
- При подозрении на БКАПС рекомендуется использовать неинвазивные методы выявления ишемии миокарда – проба с физической нагрузкой, стресс-эхокардиографическое исследование или изотопные неинвазивные методы оценки перфузии миокарда, с целью определения показаний для проведения коронарографии [225].
- Рекомендуется выполнение ангиопластики коронарных артерий со стентированием, с использованием стентов с лекарственным покрытием как детям, так и взрослым с БКАПС. Этот метод лечения позволяет добиться эффективной реваскуляризации миокарда при наличии возможности ее выполнения [356, 357].
- Повторная коронарография рекомендуется пациентам, перенесшим трансплантацию сердца, через полгода после ангиопластики коронарных артерий в связи с более высоким риском развития рестенозов [304, 305, 308].
- Пациентам с признаками необратимого нарушения сократительной функции миокарда сердечного трансплантата или выраженной̆ БКАПС при отсутствии противопоказаний рекомендовано выполнение повторной трансплантации сердца [359-361].
- Рекомендуется рассмотрение вопроса ретрансплантации у реципиентов с клиническими проявлениями сердечной недостаточности в отсутствие признаков острого отторжения трансплантата [326-329].
- Рекомендуется рассмотрение вопроса ретрансплантации у реципиентов с выраженными изменениями в коронарных артериях трансплантата при отсутствии либо с небольшими/умеренными признаками сердечной недостаточности [326-329].
- Рекомендуется рассмотрение вопроса ретрансплантации у реципиентов с сердечной недостаточностью, развившейся на фоне острого отторжения трансплантата в течение первых месяцев после первой трансплантации сердца [326-329].
- взаимодействие организма реципиента и сердечного трансплантата,
- необходимость в пожизненном приеме иммуносупрессивной терапии,
- особенность течения основного заболевания, приведшего к терминальной сердечной недостаточности в дотрансплантационном периоде,
- специфические аспекты психологической, физической и социальной адаптации.
Следует учитывать особенности физиологии трансплантированного сердца, являющегося денервированным органом, а именно отсутствие болезненных ощущений при развитии ишемии миокарда, отсутствие вагусного влияния и зависимость сократительной функции левого желудочка от объема притекающей крови [331]. Во время операции трансплантации сердца пересекаются волокна блуждающего нерва, содержащие эфферентные парасимпатические и афферентные чувствительные волокна, и постсинаптические волокна симпатических нервов. Пересечение этих волокон сопровождается необратимой парасимпатической и афферентной денервацией, в то время как симпатические волокна, по крайней мере частично, спустя несколько лет восстанавливаются. Следствием денервации сердца являются тахикардия в состоянии покоя, нарушение барорефлексов, отсутствие болезненных ощущений при ишемии миокарда, зависимость сократительной функции ЛЖ от объема притекающей крови, а также отсроченная и нарушенная реакция на физическую нагрузку [332]. Повышение частоты сердечных сокращений (ЧСС) в состоянии покоя до 80–110 в мин. приводит к увеличению минутного объема, объема сердца и, соответственно, повышению АД. Выполнение физической нагрузки у реципиентов сердца сопровождается отсроченной реакцией ЧСС и уровней АД. Оба эти показателя при кратковременных нагрузках могут практически не изменяться. В то же время при прекращении физической нагрузки может наблюдаться «парадоксальное» увеличение ЧСС и АД.
Эмоциональные и болевые раздражители, употребление даже небольшого количества алкоголя могут приводить к гипертоническим кризам, сопровождающимся высокой ЧСС. Для «изолированного» сердца характерно увеличение чувствительности к катехоламинам. При этом общее число адренорецепторов не изменяется, но развивается относительное преобладание числа β2-адренорецепторов над колическтвом β1-адренорецепторов.
Высокая ЧСС сопровождается избыточной стимуляцией механорецепторов, расположенных в сосудистом эндотелии, активацией генетических проатерогенных механизмов, дисфункцией эндотелия [333], которые могут приводить к повышению ригидности стенок магистральных артерий и увеличению системного сосудистого сопротивления. Важными факторами, определяющими системное сосудистое сопротивление, являются структурные и функциональные показатели гладкомышечных клеток и соединительной ткани артериальной стенки [334]. Прием препаратов такролимуса или циклоспорина, повышение уровней АД, синусовая тахикардия в состоянии покоя, дислипидемия, гипергликемия, циркулирующие антитела, иммунные комплексы и цитокины способствуют развитию структурного и функционального ремоделирования артерий. В одном из наших исследований было показано, что у реципиентов трансплантированного сердца показатель, характеризующий ригидность стенки общей сонной артерии, существенно выше, чем у практически здоровых лиц и неоперированных пациентов с тяжелой сердечной недостаточностью. Более того, величина показателя ригидности стенки общей сонной артерии значительно возрастала во время кризов отторжения сердечного трансплантата и снижалась на фоне их лечения, что легло в основу метода неинвазивного скрининга острого отторжения сердечного трансплантата [335].
Увеличение скорости проведения пульсовой волны, обусловленной повышением ригидности сосудистой стенки, и тахикардия у реципиентов трансплантированного сердца приводят к развитию феномена десинхронизации прямой и отраженной пульсовых волн. Пульсовая волна, создаваемая в систолу сердца, распространяется по магистральным артериям, а затем отражается, доходя до места ответвления сосудов второго и третьего порядков, возвращаясь к аорте и левому желудочку. У здоровых лиц скорость распространения пульсовой волны не превышает 15 м/с. При такой скорости распространения отраженная пульсовая волна возвращается уже после закрытия аортального клапана, способствуя повышению диастолического АД и повышая коронарный кровоток [336]. У реципиентов трансплантированного сердца скорость распространения пульсовой волны обычно превышает 20 м/с и может достигать 40–60 м/с [337], поэтому отраженная пульсовая волна достигает ЛЖ до закрытия аортального клапана, увеличивая постнагрузку в сердце, и, накладываясь на систолическую волну, способствует повышению систолического АД.
Являясь проявлением защитной реакции организма донора против чужеродных клеток, реакция отторжения включает механизмы врожденного, клеточного и антителоопосредованного иммунного ответа. Выделяют сверхострое отторжение, острое клеточное отторжение, острое отторжение и хроническое гуморальное отторжение. Болезнь коронарных артерий трансплантированного сердца, имеющую иммунную природу, также считают формой хронического гуморального отторжения.
Клинически отторжение сердечного трансплантата проявляется недостаточностью кровообращения, основным методом диагностики его является эндомиокардиальная биопсия. Воспаление и гибель клеток, сопровождающие острое отторжение трансплантата, вначале приводят к интерстициальному отеку и снижению эластичности миокарда, что в свою очередь проявляется нарушением диастолической функции. В дальнейшем при отсутствии адекватного лечения и на фоне прогрессирования патологического процесса развивается нарушение систолической функции и развитие СН со снижением фракции выброса. Вначале острое отторжение может проявляться неспецифическими симптомами - общим недомоганием, утомляемостью, слабостью, тошнотой, рвотой, повышением температуры. Правожелудочковая недостаточность может развиваться как вторично, на фоне левожелудочковой недостаточности, так и являться следствием острого клеточного или гуморального отторжения. Остро возникшие нарушения ритма и проводимости также могут быть проявлением отторжения сердечного трансплантата.
У большинства пациентов отторжение трансплантата на ранних стадиях не имеет клинических проявлений, и клиническим проявлением отторжения может быть внезапная смерть. Это обуславливает необходимость в проведении регулярных плановых биопсий миокарда с целью раннего выявления признаков отторжения и своевременного начала лечения [345, 346].
Васкулопатия трансплантата сердца является одним из основных факторов, оказывающих влияние на отдаленный прогноз. На фоне улучшения эффективности цитостатической медикаментозной терапии и снижения частоты острого отторжения сердечного трансплантата, отмечающихся в последние годы, вероятность развития васкулопатии трансплантата остается неизменной. Вследствие того, что сердечный трансплантат является денервированным органом, ишемия миокарда не сопровождается болезненными ощущениями, и пациенты самостоятельно обращаются за помощью лишь в тех случаях, когда ишемия миокарда приводит к сердечной недостаточности, и это бывает, как правило, уже при значительных изменениях в коронарных артериях пересаженного сердца. В связи с этим раннее выявление изменений в сосудах трансплантата имеет важное значение [347].
- Подготовку к операции и анестезиологическому пособию реципиентов пересаженного сердца рекомендуется осуществлять совместно с врачами, прошедшими специальную подготовку или повышение квалификации в трансплантологическом центре [208].
- Рекомендуется профилактическое назначение антибактериальных препаратов системного действия перед проведением оперативного вмешательства [208, 346].
- При проведении анестезиологического пособия рекомендуется учитывать, что трансплантат сердца денервирован [353].
- Рекомендуется поддержание нормального объема циркулирующей крови у пациентов после трансплантации сердца [208, 341].
- Не рекомендовано изменение назначений иммунодепрессантов без согласования с врачами-хирургами (трансплантологами) в связи с тем, что иммунодепрессанты обладают узким терапевтическим диапазоном [394, 434].
Медицинская реабилитация
4. Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
-
Пациентам, перенесшие трансплантацию сердца, рекомендована психологическая, физическая и социальная реабилитации, направленные на лечение и профилактику депрессивных расстройств, социализацию, развитие дисциплинированности в соблюдении врачебных рекомендаций по приему лекарственных средств и образу жизни, а также стимулирование самостоятельности и независимости [361].
-
Всем пациентам после трансплантации сердца рекомендованы физические тренировки с аэробной нагрузкой [363-366].
-
Тренировки с утяжелениями рекомендованы пациентам с признаками снижения минеральной плотности костной ткани, а также с целью профилактики остеопороза и нежелательного действия на мышечную ткань препаратов глюкокортикостероидов и такролимуса или циклоспорина [368].
-
Рекомендовано возобновление социальной активности и трудовой деятельности после трансплантации сердца [361, 369].
-
Рекомендовано возобновление трудовой деятельности пациентами после трансплантации сердца (возможно при поддержке органов социальных служб) [370].
-
Селективные ингибиторы обратного захвата серотонина, особенно циталопрам и антидепрессанты нового поколения, такие как миртазапин, не оказывающие существенного влияния на уровни артериального давления, частоту сердечных сокращений, внутрисердечную проводимость и ритм сердца – рекомендованы как препараты выбора для медикаментозной терапии депрессии у пациентов после трансплантации сердца [371, 372].
-
Не рекомендовано назначение лекарственных средств, метаболизирующихся с участием системы цитохрома Р-450 (например, таких как Флувоксамин, Тразодон), во избежание лекарственного взаимодействия с циклоспорином** и такролимусом** следует по возможности избегать назначения [372].
-
Антидепрессанты из группы трициклических соединений (такие как имипрамин**, амитриптилин**,) могут оказывать нежелательные побочные действия на сердечно-сосудистую систему и цитотоксическое действие на миокард (замедление внутрисердечной проводимости, ортостатическая гипотензия, антихолинергическое действие), в связи с чем их рекомендовано назначать только пациентам с признаками тяжелой депрессии, рефрактерной к другим лекарственным средствам [372].
-
При каждом визите пациента рекомендовано оценить правильность выполнения им рекомендаций по приему лекарственных средств и образу жизни [372, 373].
-
Рекомендовано оценивать правильность выполнения рекомендаций любыми способами, такими как: сбор анамнеза, анализ дневниковых записей и информации, полученной от близких родственников и наблюдающего медицинского персонала [371].
-
Рекомендовано оценивать соответствие приема назначениям не только иммуносупрессивных лекарственных средств, но также всей медикаментозной терапии и немедикаментозных методов профилактики нежелательных событий [371, 373, 375].
-
Рекомендовано сложности, возникающие при соблюдении приема лекарственных средств, обсуждать вместе с пациентом [375].
-
Рекомендовано осуществлять наблюдение и ведение пациента в контакте с близкими пациенту людьми, вовлекая их в образовательные программы [375].
-
Рекомендовано стимулировать стремление пациента к независимости и самообслуживанию [371, 372, 375].
-
Медицинскому персоналу (врачи и медсестры), наблюдающему пациента по месту жительства, рекомендовано обучиться всем аспектам ведения пациентов после трансплантации сердца [376].
-
Рекомендовано регулярно обследовать пациента доступными методами для выявления у него признаков депрессии [374].
-
Среди специалистов, занимающихся ведением пациента после трансплантации сердца, рекомендовано быть медицинскому психологу, специализирующемуся в выявлении и лечении депрессивных состояний [354].
4.4.1 Рекомендации по планированию и ведению беременности у реципиентов сердца
-
Для ведения и наблюдения беременности у пациентов, перенесших трансплантацию сердца, рекомендован мультидисциплинарный подход с привлечением врачей-специалистов: врачей-акушеров-гинекологов, врачей-неонатологов, врачей-кардиологов, врачей-хирургов (трансплантологов), медицинских психологов и врачей-генетиков [377, 378].
-
Тактика ведения беременности и разрешения родов разрабатывается с учетом индивидуальных особенностей матери и состояния трансплантированного органа. Рекомендована госпитализация и родоразрешение в центре трансплантологии [378, 379].
-
При планировании беременности учитываются индивидуальные факторы: риск отторжения трансплантата, риск развития инфекционных осложнений, особенности назначаемых лекарственных средств, которые могут обладать токсическим или тератогенным действием, а также особенности пересаженного органа. При выявлении риска неблагоприятного исхода или осложнения предстоящей беременности, ее рекомендовано предотвратить [208, 378, 379].
-
Беременность не рекомендовано планировать в течение 1-го года после трансплантации сердца в связи с повышенным риском отторжения трансплантата [208, 378, 379, 436].
-
У потенциальной матери, планирующей беременность, рекомендовано включать в план обследования электрокардиографическое, эхокардиографическое исследования и коронарография (если не было выполнено в предыдущие месяцы), а в случае клинических показаний - эндомиокардиальную биопсию [208, 378, 379, 436].
-
У беременных реципиенток пересаженного сердца рекомендовано осуществлять регулярный мониторинг функции печени и почек, измерение уровней артериального давления, посевы мочи, а также необходимые диагностические мероприятия для выявления ранних признаков преэклампсии и гестационного диабета [208, 378, 379, 436].
-
Прием лекарственных препаратов такролимуса** или циклоспорина** и глюкокортикостероидов беременным реципиенткам рекомендовано продолжить, микофеноловую кислоту** или микофенолата мофетил** рекомендовано отменить [378, 379].
-
В течение беременности рекомендовано проводить тщательный мониторинг уровней такролимуса** или циклоспорина** в крови в связи с высокой вариабельностью фармакодинамики этих лекарственных средств на фоне обусловленных беременностью изменений объема плазмы крови и интерстициальной жидкости, а также функции печени и почек [378, 379].
-
Рекомендованы частые обследования для выявления возможного отторжения трансплантата у беременных. При этом следует избегать проведения эндомиокардиальной биопсии под рентгеновским контролем. При проведении эндомиокардиальной биопсии предпочтение отдается ультразвуковому контролю, при необходимости рентгеновского контроля необходимо тщательное экранирование всех участков тела для защиты плода от рентгеновского облучения [208, 378, 379, 436].
-
Грудное вскармливание младенцев не рекомендовано в связи с тем, что безопасность средств, применяемых в настоящее время в качестве иммуносупрессивной терапии, не изучена [380].
-
Прогестагены и эстрогены рекомендовано назначать после оценки факторов риска возможных тромботических осложнений (тромбоэмболии в анамнезе или у близких родственников) [380, 381, 382].
-
Рекомендовано мониторирование концентрации препаратов иммуносупрессивной терапии в крови у пациентов, получающих комбинированную иммуносупрессивную терапию, в связи с тем, что прогестагены и эстрогены (фиксированные сочетания) оказывают ингибирующее действие на CYP3A4 [380, 381, 382].
-
Барьерные методы контрацепции не обеспечивают адекватного уровня предохранения от нежелательной беременности. Вместе с тем, они рекомендованы всем пациентам после пересадки сердца, ведущим активную сексуальную жизнь, как средство профилактики заражения инфекциями, передающимися половым путем [380, 381, 382].
-
Внутриматочные контрацептивы не рекомендованы для использования у пациентов после трансплантации сердца, особенно у нерожавших женщин, в связи с возможным риском воспалительных и инфекционных осложнений и бесплодия [380, 381, 382].
-
Использование депонированной формы медроксипрогестерона** может сопровождаться уменьшением минеральной плотности костной ткани и в связи с этим не рекомендуется у пациентов после трансплантации сердца [380, 381, 382].
-
Оральные контрацептивы не рекомендуются пациентам после трансплантации сердца с артериальной гипертонией, БКАПС, эстроген-зависимыми опухолями или заболеваниями печени [380, 381, 382].
-
Эректильная дисфункция после трансплантации сердца может быть вызвана ятрогенными причинами. Пациентам с эректильной дисфункцией рекомендуется рассмотреть вопрос о замене лекарственных средств с учетом их эффективности и побочных действий [383].
-
Селективные ингибиторы циклогуанозинмонофосфат (цГМФ)-специфической фосфодиэстеразы-5 рекомендованы в качестве лекарственных средств для лечения эректильной дисфункции у пациентов после трансплантации сердца. При этом рекомендуется избегать сочетанного назначения ингибиторов фосфодиэстеразы с нитратами (потенцирование гипотензивного действия) [384].
-
Вопросы возможности управления транспортным средством рекомендовано обсуждать с пациентами на раннем послеоперационном этапе [387-389].
-
Вопрос о возможности управления транспортным средством рекомендовано решать на основании неврологического осмотра пациента (исключаются тремор, оценивается устойчивость осанки, исследуется зрение) [387, 388].
-
У пациентов с брадикардией допуск к управлению автомобилем рекомендуется при наличии искусственного водителя ритма [389].
Госпитализация
6. Организация оказания медицинской помощи
- Пациентам после трансплантации сердца рекомендовано находиться под постоянным наблюдением центра трансплантации и получать необходимую медицинскую помощь по месту жительства [208, 431].
- Наблюдение пациентов в отдаленном периоде после трансплантации сердца рекомендовано осуществлять специалистами центра трансплантации в сотрудничестве с местными органами здравоохранения и социальной поддержки [208, 436].
- Местным органам здравоохранения рекомендовано проинформировать центр трансплантации в случаях:
- Всем реципиентам сердца рекомендовано пожизненно стоять на учете и наблюдаться в трансплантологическом центре, где им была выполнена трансплантация сердца [434].
6.1 Показания для плановой госпитализации
Реципиенты сердца нуждаются в регулярных плановых обследованиях. Регулярные плановые обследования реципиентов сердца включают амбулаторные обследования по месту жительства или в трансплантологическом центре и плановые обследования в условиях стационара.
- Рекомендовано выполнять плановые амбулаторные обследования не реже 1 раза в 3 месяца [244,434].
- Профилактические врачебные осмотры следует выполнять не реже 1 раза в десять дней в течение первого месяца после выписки из стационара, не реже 2-х раз в течение 2-го месяца, ежемесячно в течение 1-го года и каждые 3-6 месяцев по прошествии 1 года после трансплантации сердца [434].
6.2 Показания для экстренной госпитализации
6.3 Показания к выписке пациента из стационара
- Отсутствие показаний для экстренного или неотложного инвазивного вмешательства или исследования;
6.4 Иные организационные технологии: мультидисциплинарный подход в наблюдении за пациентами после трансплантации сердца
- Врачам-хирургам (трансплантологам) рекомендуется предоставлять необходимую контактную информацию врачам, наблюдающим реципиента трансплантированного сердца по месту жительства, позволяющую связаться с центром трансплантологии в любое время и гарантировать адекватную помощь, связанную с наблюдаемым пациентом [208, 428-431].
- Врачам, наблюдающим пациента по месту жительства, рекомендуется иметь полную информацию о необходимых плановых консультациях и госпитализациях в центр трансплантологии [208, 428-431].
- Врачам, наблюдающим реципиента донорского сердца, рекомендуется предоставлять информацию о результатах обследования пациента и дальнейших планах по наблюдению и лечению [208, 428-431].
Профилактика
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- У пациентов после трансплантации сердца рекомендовано проводить мониторинг эффективности и безопасности иммуносупрессивной терапии. При развитии специфических побочных действий рекомендовано производить снижение дозы (замену) лекарственных средств при поддержании адекватного уровня иммуносупрессии [262, 393, 394].
- Пациентам в качестве первичной профилактике БКАПС после пересадки сердца рекомендуется строгий контроль факторов риска сердечно-сосудистых заболеваний (артериальная гипертония, сахарный диабет, гиперлипидемия, курение, ожирение), а также профилактика цитомегаловирусной инфекции [208, 436].
- У пациентов после трансплантации сердца прием ингибиторов ГМГ-КоА редуктазы снижает риск развития БКАПС и улучшает выживаемость без нежелательных событий, включая снижение риска развития злокачественных новообразований и улучшение общей выживаемости. Ингибиторы ГМГ-КоА-редуктазы рекомендованы всем пациентам после трансплантации сердца (взрослым и детям) [269-271, 304, 310, 397].
- Специфических рекомендаций по профилактике инфекционного эндокардита у пациентов после трансплантации сердца нет. С учетом высокого риска развития у таких пациентов приобретенной клапанной недостаточности и крайне неблагоприятного прогноза в случае развития инфекционного эндокардита, все стоматологические манипуляции рекомендовано проводить на фоне профилактического назначения антибактериальных препаратов системного действия [188, 189, 191, 208, 436].
- У пациентов после трансплантации сердца отмечается высокий риск развития кожных новообразований, в связи с чем им рекомендовано проведение профилактических мероприятий, включая участие в образовательных программах и ежегодный осмотр врача-дерматовенеролога [400].
- Пациентам после трансплантации сердца рекомендовано пройти первичное обследование и в дальнейшем рекомендовано наблюдение у специалиста с целью раннего выявления и профилактики посттрансплантационных лимфопролиферативных заболеваний [400-402].
- У пациентов после трансплантации сердца с солидными новообразованиями, не связанными с лимфоидной системой, необходимости в уменьшении дозы иммуносупрессивных лекарственных средств нет. Таким пациентам рекомендовано получать адекватную иммуносупрессивную терапию в полном объеме за исключением случаев, когда имеется необходимость коррекции дозы или отмены отдельных лекарственных средств, обусловленных сопутствующими заболеваниями, например, при развитии лейкопении следует отменить или уменьшить дозы лекарственных средств, подавляющих кроветворную функцию красного костного мозга [399-401].
- В отдаленном периоде после трансплантации сердца рекомендовано по возможности уменьшить дозы иммунодепрессантов [208, 400,436].
- Рекомендуется выполнять всем пациентам после трансплантации сердца оценку скорости клубочковой фильтрации, рассчитанной по формуле, общий анализ (клинический) мочи и оценку соотношения [альбумин в моче]/[креатинин сыворотки крови] не реже 1 раза в год [405-407].
Почечная недостаточность у пациентов после трансплантации сердца приводит к таким же последствиям, что и в общей популяции: развитию прогрессирования атеросклероза коронарных и периферических артерий, артериальной гипертонии, анемии и остеопорозу.
Наиболее эффективным методом лечения тяжелой почечной недостаточности у пациентов после пересадки сердца является трансплантация почки, после которой отдаленный прогноз существенно лучше, чем на фоне гемодиализа.
- Реципиентам после трансплантации сердца со значениями показателя СКФ <30 мл/мин/1.73м2 или протеинурией >500 мг/сут, или с быстрым снижением значения показателя СКФ >4 мл/мин/1.7 3м в год рекомендовано обследование и лечение под наблюдением врача-нефролога с целью коррекции метаболических нарушений и других осложнений почечной недостаточности. При выраженной почечной недостаточности рекомендовано рассмотреть вопрос о трансплантации почки [404-410].
- У всех реципиентов донорского сердца с признаками почечной недостаточности рекомендовано снизить дозы препаратов такролимуса** или циклоспорина** до минимального уровня, необходимого для поддержания адекватной иммуносупрессии. У пациентов, принимающих азатиоприн**, это может быть достигнуто путем замены азатиоприна** на микофенолата мофетил** [264, 403-406].
- Если на фоне снижения дозировки или отмены препаратов такролимуса** или циклоспорина** явления почечной недостаточности не уменьшаются, назначение этих лекарственных средств рекомендуется возобновить или продолжить в связи с более высокой эффективностью в профилактике отторжения трансплантата [262].
- У пациентов после трансплантации сердца рекомендованы контроль гликемии, нормализация артериального давления, использование АПФ блокаторов или блокаторов ангиотензиновых рецепторов. У пациентов с сахарным диабетом тактика лечения должна соответствовать имеющимся рекомендациям по профилактике и лечению сахарного диабета. Целевые уровни артериального давления должны соответствовать принятым клиническим рекомендациям [208, 404, 405].
- Общий анализ крови и оценка содержания гемоглобина у пациентов с ХБП после трансплантации сердца рекомендовано выполнять не реже 1 раза в год. У пациентов с анемией (уровни гемоглобина в крови Hb< 13,5 г/дл у мужчин и Hb <12 г/дл у женщин) следует оценить содержанием железа в крови и назначить лекарственные средства, стимулирующие гемопоэз для поддержания целевых уровней гемоглобина в крови в пределах 11 -13 г/дл [208, 404, 406].
- У пациентов после трансплантации сердца при развитии тяжелой почечной недостаточности рекомендовано рассмотреть вопрос о трансплантации почки, предпочтительно от живого донора [208, 404-406, 436].
- Пациентам с признаками почечной недостаточности рекомендованными и антигипертензивными средствами являются АПФ блокаторы или АРА; при их непереносимости или противопоказаниях целесообразно использовать блокаторы кальциевых каналов [404, 405].
5.6 Рекомендации по профилактике и лечению артериальной гипертонии после трансплантации сердца
- Адекватная антигипертензивная терапия рекомендована пациентам после трансплантации сердца, так как эффективно снижает риск развития нежелательных сердечно-сосудистых событий, включая смерть, инсульт, инфаркт миокарда, сердечную недостаточность, нарушения ритма [411].
Чаще всего при суточном мониторировании АД у пациентов после трансплантации сердца выявляют повышение систолического АД в ночное время и постоянное повышение уровней диастолического АД.
- Рекомендованные первичные целевые уровни для медикаментозной терапии: 140/90 мм рт. ст. [411-413].
- Рекомендованные антигипертензивные средства у реципиентов сердца: ингибиторы АПФ (АПФ блокаторы) или при их непереносимости - антагонисты рецепторов ангиотензина II (АРА) и блокаторы кальциевых каналов [412, 509, 510].
- Рекомендована комбинированная антигипертензивная терапия, так как позволяет использовать низкие дозы антигипертензивных средств и более эффективна, чем монотерапия [412].
- Рекомендовано лечение сахарного диабета и контроль уровней липидов у всех пациентов АГ [419].
- Рекомендовано регулярное измерение АД, суточное мониторирование пациентам после трансплантации сердца с целью выявления гипертонии [411-412].
- Рекомендовано включать в лечение эпилептоидных припадков/обмороков у пациентов после трансплантации сердца уменьшение дозы или отмену препаратов такролимуса** или циклоспорина** (при сохранении адекватной иммуносупрессии) и коррекцию гипомагниемии (если таковая выявлена) [414-415].
- При развитии энцефалопатии в отдаленном периоде после трансплантации сердца рекомендована консультация врача-невролога и проведение методов интракраниальной визуализации (КТ, МРТ) для выявления возможных причин [414-415].
- При развитии обратимого лейкоэнцефалопатического синдрома с поражением задних отделов мозга (PRES-синдрома) рекомендовано уменьшение дозы препаратов такролимуса** или циклоспорина** или их замена на другие лекарственные средства [414-416].
- При сохранении эпизодов эпилептических припадков/обмороков на фоне уменьшения доз препаратов такролимуса** или циклоспорина** рекомендована отмена препаратов такролимуса** или циклоспорина** и замена на ингибиторы протеинкиназы (#сиролимус, эверолимус**) [414-416].
5.8 Рекомендации по диагностике, профилактике и лечению сахарного диабета у пациентов после трансплантации сердца
- Учитывая высокий риск развития сахарного диабета, оказывающего неблагоприятное влияние на прогноз и качество жизни, рекомендовано включать в программу ведения пациентов после трансплантации сердца мероприятия по профилактике и ранней диагностике этого заболевания; пациенты с сахарным диабетом должны получать адекватную терапию [416, 417].
2. «Посттрансплантационные» факторы:
- Рекомендованные скрининговые исследования для выявления сахарного диабета включают определение уровней гликозилированного гемоглобина, определение уровней глюкозы в крови натощак и тест на толерантность к глюкозе. Периодичность этих измерений определяется индивидуальными факторами риска пациента и особенностями иммуносупрессивной терапии [417-419].
- Рекомендовано проводить медикаментозную терапию сахарного диабета совместно с врачом-эндокринологом и в соответствии с современными рекомендациями по лечению сахарного диабета [417-419].
- В немедикаментозную терапию для профилактики и лечения сахарного диабета у реципиентов сердечного трансплантата рекомендовано включать поддержание нормального веса тела, соблюдение диеты и физические тренировки [417-419].
- При выявлении факторов риска или установке диагноза сахарного диабета рекомендовано пересмотреть режим иммуносупрессии и по возможности снизить дозировку или исключить лекарственные средства, обладающие диабетогенным действием, но только в том случае, если изменения в медикаментозной терапии не будут ухудшать эффективности иммуносупрессии [417-419].
- Глюкокортикостероиды и такролимус** или циклоспорин** снижают толерантность к глюкозе и обладают диабетогенным действием, в связи с этим у реципиентов сердечного трансплантата с сахарным диабетом и высоким риском развития сахарного диабета указанные лекарственные средства рекомендовано назначать в невысоких дозах или заменять на альтернативные [417- 419].
- Артериальная гипертония и дислипидемия существенно ухудшают прогноз у пациентов с сахарным диабетом и повышают риск развития осложнений; рекомендована адекватная антигипертензивная терапия, прием ингибиторов ГМГ-КоА редуктазы и немедикаментозные методы профилактики, которые позволяют снизить риск нежелательных событий у реципиентов сердечного трансплантата с сахарным диабетом [397, 411, 417-419].
- Пациентам после трансплантации сердца с сахарным диабетом не реже одного раза в год рекомендовано проведение обследования с целью выявления возможных осложнений сахарного диабета [417- 419].
- Пациентам после трансплантации сердца при выявлении в скрининговых анализах крови повышенных уровней глюкозы или гликозилированного гемоглобина рекомендована консультация врача-эндокринолога [417- 419].
- У всех пациентов, ожидающих трансплантацию сердца, рекомендовано проводить первичный скрининг/обследование с целью выявления существующих заболеваний костной ткани. Целесообразно выполнять рентгенденситометрическое исследование с оценкой минеральной плотности костной ткани в области поясничного отдела позвоночника и шейки бедренной кости [420-427].
- Выявление снижения минеральной плотности костной ткани или компрессионного перелома позвонков предполагает тщательное клиническое обследование и выявление вероятных причин. Лечение остеопороза рекомендовано начинать до трансплантации сердца. Бифосфонаты являются наиболее эффективными лекарственными средствами для лечения остеопороза [422, 423, 426].
- Рекомендовано потреблять адекватное количество кальция (1000-1500 мг/сут в зависимости от возраста и наличия менопаузы) и препаратов витамина D и его аналогов (400-1000 МЕ/сут) всем пациентам, ожидающим трансплантацию сердца, и реципиентам для поддержания концентрации 25- гидроксивитамина D в крови выше 30 нг/мл или 75 нмоль/л) [422, 423,426].
- Рекомендовано назначить физические тренировки с биологической обратной связью пациентам после трансплантации сердца по гемодинамическим показателям (ЧСС, артериальное давление) [420, 422, 423].
- Рекомендован профилактический прием бифосфанатов на протяжении как минимум первого года после трансплантации сердца всем пациентам после трансплантации сердца в течение года [422, 424, 426].
- Рекомендовано применение лекарственных препаратов бифосфанатов в комбинации с препаратами кальция и препаратов витамина D и его аналогами, что предотвращает потерю костной ткани и снижает риск развития переломов у пациентов после трансплантации сердца [208, 422, 426].
- Рекомендовано всем взрослым пациентам, ожидающим трансплантацию сердца, рентгеновское исследование позвоночника с целью выявления травматических переломов костей конечностей и компрессионных переломов позвоночника [420].
- Если через год после трансплантации сердца глюкокортикоиды отменены, минеральная плотность костной ткани остается в пределах нормальных значений (значение показателя Т>1.5), рекомендовано отменить препараты бифосфанатов [427].
- Длительность непрерывного приема препаратов бифосфанатов не рекомендована более 5 лет [208, 422-426].
- Денситометрия минеральной плотности костной ткани рекомендована всем реципиентам донорского сердца через год после трансплантации. Дальнейшее ежегодное обследование с оценкой минеральной плотности костной ткани показано пациентам, получающим глюкокортикостероиды, имеющим признаки остеопороза и принимающим бисфосфонаты. В дальнейшем рентгенденситометрическое исследование следует повторять через каждые два-три года [420, 422].
- Рекомендовано назначение лекарственных препаратов витамина D и его аналогов в качестве средств первой линии у пациентов со сниженной минеральной плотностью костной ткани. В случае назначения этих лекарственных средств показано регулярное измерение содержания уровней кальция в крови и моче (кальциемия, кальциурия - побочное действие этой группы лекарственных средств) [208, 422-426].
- Препараты кальцитонина в качестве средства для профилактики остеопороза не рекомендованы пациентам после трансплантации сердца [421, 422].
Информация
Источники и литература
-
Клинические рекомендации Российского трансплантологического общества
- Maddox T.M., Januzzi J.L., Allen L.A., et al. 2021 Update to the 2017 ACC Expert Consensus Decision Pathway for Optimization of Heart Failure Treatment: Answers to 10 Pivotal Issues About Heart Failure With Reduced Ejection Fraction: A Report of the American College of Cardiology Solution Set Oversight Committee. J Am Coll Cardiol. 2021; 77 (6): 772–810. McDonagh T.A., Metra M., Adamo M., et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) With the special contribution of the Heart Failure Association (HFA) of the ESC. European Heart Journal. 2021; 42 (36): 3599–3726. Готье С.В., Шевченко А.О., Кормер А.Я, Попцов В.Н., Саитгареев Р. Ш., Шумаков Д.В., Захаревич В.М. Три десятилетия трансплантации сердца в ФНЦ ТИО имени академика В.И. Шумакова: отдаленные результаты. Вестник трансплантологии и искусственных органов. 2015. Т. 15. № 2. С. 70-73. Lund et al. The Registry of the International Society for Heart and Lung Transplantation: Thirty-second Official Adult Heart Transplantation Report—2015. J Heart Lung Transplant 2015; 34:1244–1254. Готье С.В., Шевченко А.О., Попцов В.Н., Саитгареев Р.Ш., Захаревич В.М., Шумаков Д.В., Акопов Г.А. Опыт 800 трансплантаций сердца в НМИЦ трансплантологии и искусственных органов им. акад. В.И. Шумакова. Вестник трансплантологии и искусственных органов. 2017. Т. 19. № S. С. 52-53. Gautier SV, Shevchenko AO, et al. Thirty-Year Dynamics of Survival among Heart Recipients: A Single Center Russian Experience. Transplantation. 2018; 102: S827. DOI: 10.1097/01.tp.0000543875.50643.83. Клинические рекомендации «Хроническая сердечная недостаточность», одобрены Научно-практическим Советом Минздрава РФ в 2020. https://cr.minzdrav.gov.ru/schema/156_1#doc_a1 Готье С.В., Шевченко А.О., Кормер А.Я., Попцов В.Н., Шевченко О.П. Перспективы улучшения отдаленных результатов трансплантации сердца. Вестник трансплантологии и искусственных органов. 2014. Т. XVI. № 3. С. 23-30. Готье C.В., Захаревич В.М., Халилулин Т.А, Шевченко А.О, Попцов В.Н, Р.Л. Ахмадзай, Гольц А.М., Закирьянов А.Р., Колоскова Н.Н., Захаревич Н.Ю., Никитина Е.А., Поздняков О.А., Кирьяков К.С. Трансплантация сердца как радикальный метод восстановление качества жизни у реципиентов с терминальной стадии сердечной недостаточности. Вестник трансплантологии и искусственных органов. 2019. Т. XXI. № 2. С. 70-73. Levy WC, Mozaffarian D, Linker DT, et al. The Seattle Heart Failure Model: prediction of survival in heart failure. Circulation 2006;113:1424-33. Goda A, Williams P, Mancini D, Lund LH. Selecting patients for heart transplantation: comparison of the Heart Failure Survival Score (HFSS) and the Seattle heart failure model (SHFM). J Heart Lung Transplant 2011;30:1236-43. Levy WC, Mozaffarian D, Linker DT, Farrar DJ, Miller LW. Can the Seattle heart failure model be used to risk-stratify heart failure patients for potential left ventricular assist device therapy? J Heart Lung Transplant 2009;28:231-6. Kalogeropoulos AP, Georgiopoulou VV, Giamouzis G, et al. Utility of the Seattle Heart Failure Model in patients with advanced heart failure. J Am Coll Cardiol 2009;53:334-42. Herz M I. The Registry of the International Society for Heart and Lung Transplantation--Introduction to the 2012 annual reports: new leadership, same vision. J Heart Lung Transplant. 2012;31:1045–1051. Arias M, Rush D N, Wiebe C, Gibson I W, Blydt-Hansen T D, Nickerson P W. et al. Antibody-mediated rejection: analyzing the risk, proposing solutions. Transplantation. 2014;98:3–21.[(Suppl 3)]. Mehra M R. Contemporary concepts in prevention and treatment of cardiac allograft vasculopathy. Am J Transplant. 2006; 6:1248–1256. Mitchell R N, Libby P. Vascular remodeling in transplant vasculopathy. Circ Res. 2007;100:967–978. Tuzcu E M, Kapadia S R, Sachar R, Ziada K M, Crowe T D, Feng J. et al. Intravascular ultrasound evidence of angiographically silent progression in coronary atherosclerosis predicts long-term morbidity and mortality after cardiac transplantation. J Am Coll Cardiol. 2005;45:1538–1542. Goda A, Williams P, Mancini D, Lund LH. Selecting patients for heart transplantation: comparison of the Heart Failure Survival Score (HFSS) and the Seattle heart failure model (SHFM). J Heart Lung Transplant 2011; 30: 1236-43. Patel P., Glumova A., LaPorte K., Mahle W.T., Deshpande S.R. High Pulmonary Vascular Resistance in Pediatric Heart Transplant Patients and Role of Sildenafil. The Journal of Heart and Lung Transplantation, Vol. 36, Issue 4, S270. Ardehali A, Hughes K, Sadeghi A, et al. Inhaled nitric oxide for pulmonary hypertension after heart transplantation. Transplantation 2001;72:638-41. Auler Junior JO, Carmona MJ, Bocchi EA, et al. Low doses of inhaled nitric oxide in heart transplant recipients. J Heart Lung Transplant 1996;15:443-50. De Santo LS, Mastroianni C, Romano G, et al. Role of sildenafil in acute posttransplant right ventricular dysfunction: successful experience in 13 consecutive patients. Transplant Proc 2008;40:2015-8. Mikus E, Stepanenko A, Krabatsch T, et al. Reversibility of fixed pulmonary hypertension in left ventricular assist device support recipients. Eur J Cardiothorac Surg 2011; 40: 971-7. Kutty RS, Parameshwar J, Lewis C, et al. Use of centrifugal left ventricular assist device as a bridge to candidacy in severe heart failure with secondary pulmonary hypertension. Eur J Cardiothorac Surg 2013; 43:1237-42. Попцов В.Н., Спирина Е.А., Ухренков С.Г., Алиев Э.З., Хатуцкий В.М., Догонашева А.А. Механическая поддержка кровообращения при ранней дисфункции сердечного трансплантата. Вестник трансплантологии и искусственных органов. 2017. Т. 19. № S. С. 58. Готье С.В., Попцов В.Н., Захаревич В.М., Шевченко А.О., Спирина Е.А., Ухренков С.Г., Масютин С.А., Алиев Э.З., Воронков В.Ю., Чибисов Н.С., Устин С.Ю., Бондаренко Д.М. Пятилетний опыт применения периферической вено-артериальной экстракорпоральной мембранной оксигенации как метода механической поддержки кровообращения у потенциальных реципиентов сердца.// Вестник трансплантологии и искусственных органов. 2016. Т. 18. № 4. С. 16-25. Попцов В.Н., Спирина Е.А., Ухренков С.Г., Бондаренко Д.М., Догонашева А.А., Алиев Э.З. Временная механическая поддержка кровообращения у потенциальных реципиентов сердца. Вестник трансплантологии и искусственных органов. 2017. Т. 19. № 4. С. 113-123. Готье С.В., Попцов В.Н., Спирина Е.А., Саитгареев Р.Ш., Захаревич В.М., Акопов Г.А., Шумаков Д.В., Закирьянов А.Р., Халилулин Т.А., Гольц А.М., Шевченко А.О., Колоскова Н.Н. Сравнительный анализ факторов, потенциально влияющих на результаты трансплантации сердца, в группах пациентов, ранее оперированных на открытом сердца и ранее не оперированных. Вестник трансплантологии и искусственных органов. 2017. Т. 19. № S. С. 55-56. Готье С.В., Попцов В.Н., Саитгареев Р.Ш., Шумаков Д.В., Акопов Г.А., Тарабарко Н.Н., Анискевич Г.В. Пересадка сердца после коррекции клапанной патологии сердечного трансплантата.// Вестник трансплантологии и искусственных органов. 2017. Т. 19. № S. С. 65-66. Попцов В.Н., Спирина Е.А., Масютин С.А., Пчельников В.В., Ухренков С.Г., Алиев Э.З., Устин С.Ю., Хатуцкий В.М., Догонашева А.А. Периоперационный период при трансплантации сердца от доноров 55 лет и старше. Вестник трансплантологии и искусственных органов. 2017. Т. 19. № S. С. 62. Taylor DO, Edwards LB, Boucek MM, et al. Registry of the International Society for Heart and Lung Transplantation: twenty-fourth official adult heart transplant report — 2007. J Heart Lung Transplant 2007;26:769. Taylor DO, Stehlik J, Edwards LB, et al. Registry of the International Society for Heart and Lung Transplantation: twenty-sixth official adult heart transplant report — 2009. J Heart Lung Transplant 2009;28:1007. Leprince P, Aubert S, Bonnet N, et al. Peripheral extracorporeal membrane oxygenation (ECMO) in patients with posttransplant cardiac graft failure. Transplant Proc 2005;37:2879. Taylor DO, Edwards LB, Boucek MM, Trulock EP, Waltz DA, Keck BM, et al. Registry of the International Society for Heart and Lung Transplantation: Twenty-third official adult heart transplantation report-2006. JHLTX 2006; 25:869-79. Gardner RS, McDanagh TA, MacDonald M, Dargie HJ, Murday AJ, Petrie MC. Who needs a heart transplant? Eur Heart J 2006; 27:770-2. Hunt SA, Kouretas PC, Balsam LB, Robbins RC. Heart transplantation. In Zipes DP, Libby P, Bonow RO, Braunwald E. Braunwald’s Heart Disease. 7 th edition. Elsevier Saunders 2005. Packer M, Coats AJ, Fowler MB, et al. Effect of carvedilol on survival in severe chronic heart failure. N Engl J Med 2001; 344 :1651-8. Lewis EF, Tsang SW, Fang JC, et al. Frequency and impact of delayed decisions regarding heart transplantation on long-term outcomes in patients with advanced heart failure. J Am Coll Cardiol 2004; 43:794-802. Feldman D. et al. The 2013 International Society for Heart and Lung Transplantation Guidelines for mechanical circulatory support. The Journal of Heart and Lung Transplantation, 2013 Vol. 32, Issue 2, p157–187. Иткин Г.П., Попцов В.Н. Механизмы правожелудочковой недостаточности в условиях левожелудочкового вспомогательного кровообращения и методы бивентрикулярного обхода сердца. Вестник трансплантологии и искусственных органов. 2013. Т. X . № 4. С. 126-135. Kirklin J.K., Naftel D.C., Pagani F.D., et al. Seventh INTERMACS annual report: 15,000 patients and counting. J. Heart Lung Transplant. 2015; 34: 1495– 1504. Готье С.В., Иткин Г.П., Шемакин С.Ю., Саитгареев Р.Ш, Попцов В.Н., Захаревич В.М., Акопов Г.А., Кормер А.Я., Халилулин Т.А., Шевченко О.П., Невзоров А.М., Филатов И.А., Селищев С.В. Первый опыт клинического применения отечественного аппарата вспомогательного кровообращения на базе имплантируемого осевого насоса для двухэтапной трансплантации сердца. Вестник трансплантологии и искусственных органов. 2013. Т. X . № 3. С. 92-101 Taylor Clare J, Ordóñez-Mena José M, Roalfe Andrea K, Lay-Flurrie Sarah, Jones Nicholas R, Marshall Tom et al. Trends in survival after a diagnosis of heart failure in the United Kingdom 2000-2017: population based cohort study BMJ 2019; 364 :l223 Brown KN, Kanmanthareddy A. Heart Transplantation Patient Selection. [Updated 2020 Oct 12]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK537090/.
Информация
Список сокращений
Термины и определения
Трансплантация сердца – кардиохирургическая операция, в результате которой патологически измененное сердце реципиента заменяется на удовлетворительно функционирующее сердце донора.
Отторжение трансплантированного сердца – патологический процесс, при котором иммунная система реципиента распознает сердечный трансплантат как чужеродный объект и активируется система гуморального и/или клеточного воспалительного ответа, что может привести к выраженной дисфункции органа.
Механическая поддержка кровообращения – хирургический метод лечения тяжелой сердечной недостаточности, при котором центральная гемодинамика поддерживается благодаря работе имплантируемого или внешнего устройства механической поддержки кровообращения на основе электрического насоса.
Реципиент трансплантированного сердца – пациент, у которого была выполнена трансплантация сердца.
Потенциальный реципиент сердца – пациент с показаниями к трансплантации сердца, включенный в лист ожидания.
Сердечная недостаточность – синдром, характеризующийся совокупностью симптомов, обусловленных неспособностью сердечно-сосудистой системы обеспечить ткани и органы пациента адекватным количеством крови. При первичной сердечной недостаточности причиной патологического состояния является нарушение функции миокарда или структурные изменения в сердце.
Критерии оценки качества медицинской помощи
Таблица 3. Критерии оценки качества медицинской помощи пациентам с критической сердечной недостаточностью
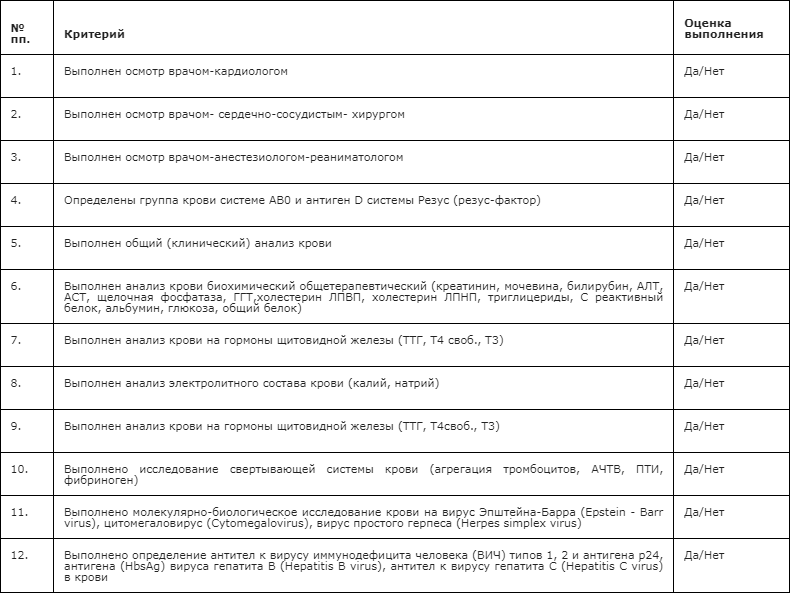
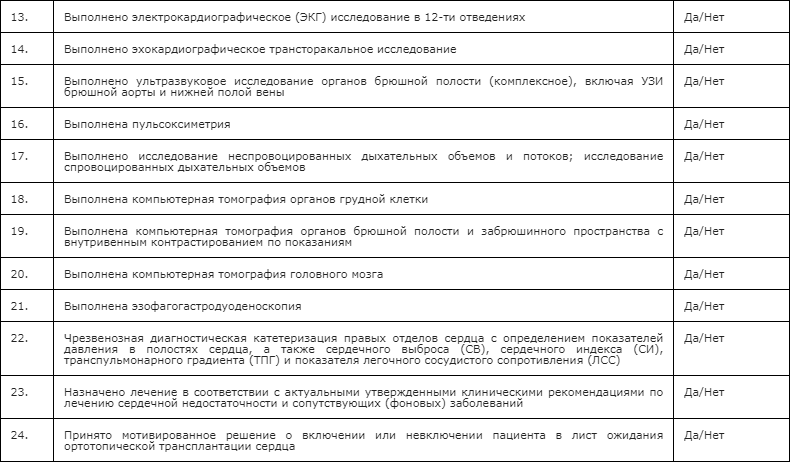
Таблица 4. Критерии оценки качества медицинской помощи реципиентам трансплантированного сердца
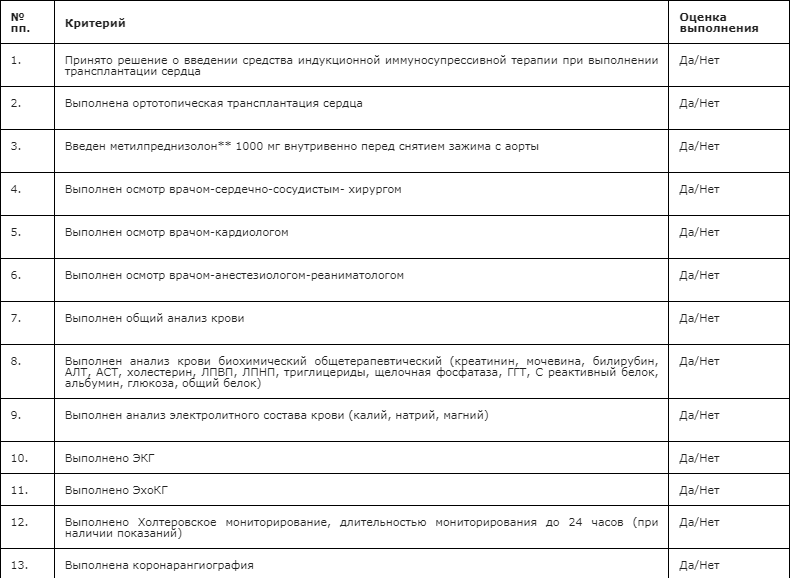
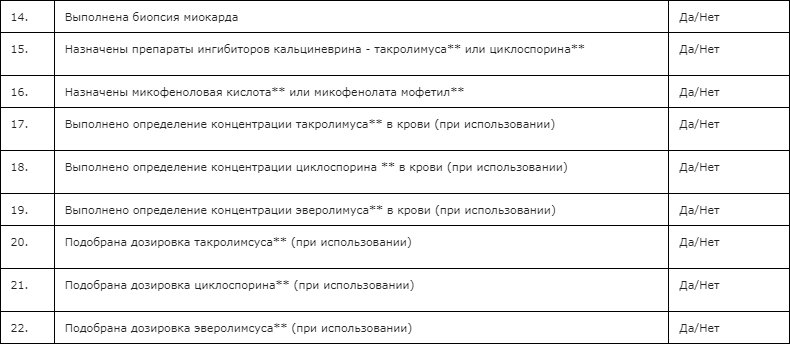
Таблица 5. Критерии оценки качества медицинской помощи реципиентам трансплантированного сердца с клиническими признаками отторжения/дисфункции сердечного трансплантата
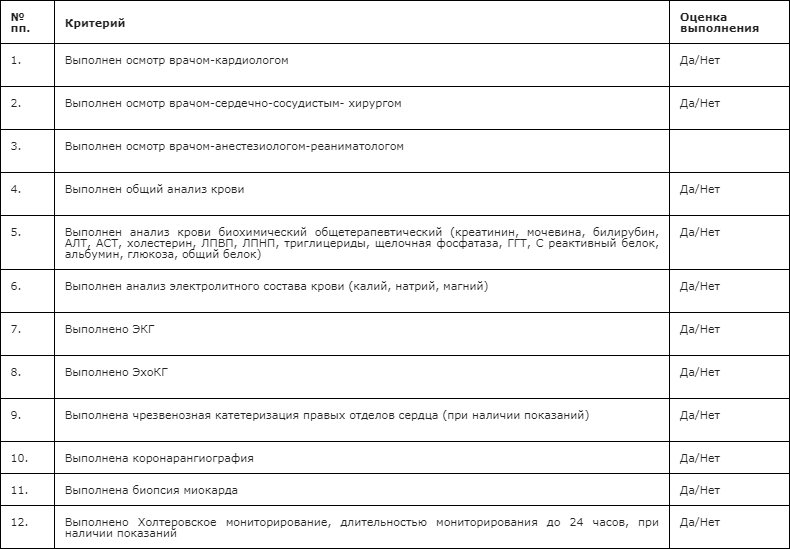
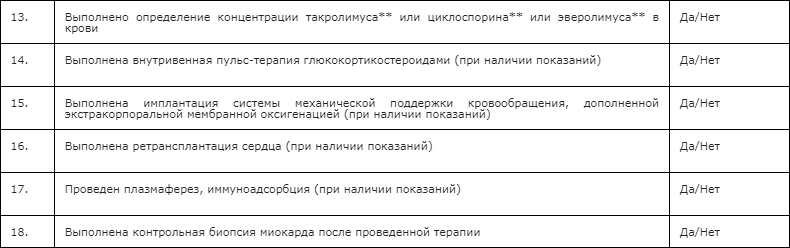

Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
Врачи следующих специальностей:
- Кардиология
- Терапия
- Общая врачебная практика (семейная медицина)
- Анестезиология-реаниматология
- Детская кардиология
- Патологическая анатомия
- Сердечно-сосудистая хирургия
- Рентгенэндоваскулярные диагностика и лечение
Методы, используемые для сбора/селекции доказательств: поиск в электронных базах данных.
Классификация рекомендаций и степени доказанности
Таблица №6. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)

Таблица №7. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)

Таблица №8. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)

Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года или при появлении новой информации о тактике ведения пациентов с данным заболеванием. Решение об обновлении принимает МЗ РФ на основе предложений, представлены медицинскими некоммерческими профессиональными организациями.
Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Федеральный закон от 21.11.2011 N 323-ФЗ (ред. от 31.04.2021) "Об основах охраны здоровья граждан в Российской Федерации", Статья 47. Донорство органов и тканей человека и их трансплантация (пересадка)
Приказ Минздрава России "Об утверждении Порядка оказания медицинской помощи по профилю "хирургия (трансплантация органов и (или) тканей человека)"" от 31 октября 2012 г. № 567н С изменениями и дополнениями от 12 декабря 2018 г.
Приказы Минздравсоцразвития России "О медицинском заключении о необходимости трансплантации органов и (или) тканей человека" от 25 мая 2007 г. № 358
Приказы Минздрава России "Об утверждении перечня видов высокотехнологичной медицинской помощи" от 29 декабря 2012 г. № 1629н
Приказ МЗ РФ от 29.12.2012 №1653н «Об утверждении стандарта первичной медико-санитарной помощи при наличии трансплантированного сердца
Приложение Б. Алгоритмы действий врача
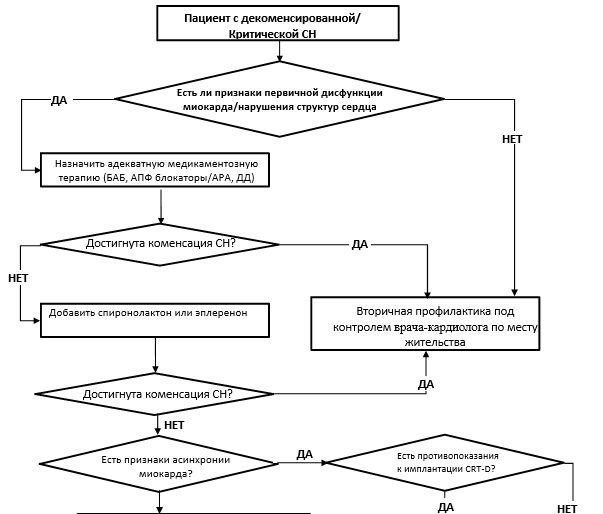
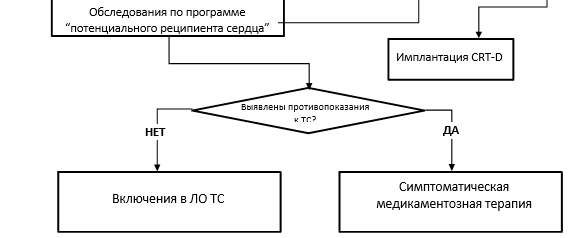
Алгоритм действий врача при возникновении жизнеугрожающих ситуаций у реципиентов сердца
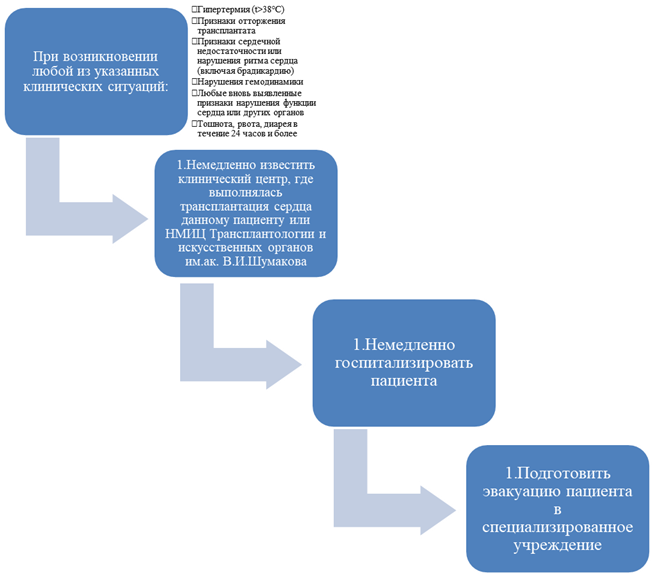
Типичные симптомы и клинические признаки отторжения сердечного трансплантата:
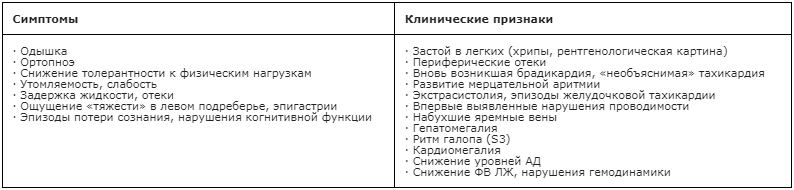
Что такое трансплантация сердца?
Операция ортотопической трансплантации сердца является общепризнанным золотым стандартом лечения терминальной сердечной недостаточности, существенно улучшающим прогноз и качество жизни. Суть операции заключается в замене пораженного нежизнеспособного органа пациента донорским органом. В нашей стране подобные операции выполняются с 1987 года.
На основании комплексного обследования врачи выбирают наиболее оптимальную тактику лечения заболевания, и если принимается решение о необходимости выполнения трансплантации сердца, пациент включается в лист ожидания, ему даются рекомендации по лечению и образу жизни в период ожидания операции.
Как проходит операция?
Операция трансплантации сердца совершенно безболезненна для пациента. Несмотря на то, что сама операция может длиться много часов, пациент не ощущает ни боли, ни дискомфорта, поскольку он спит, находясь под действием комбинации лекарственных препаратов.
Сколько живут пациенты с трансплантированным сердцем?
Приложение Г1. Классификация ХСН Нью-Йоркской ассоциации сердца (NYHA).
Название на русском языке: Классификация ХСН Нью-Йоркской ассоциации сердца (NYHA)
Оригинальное название (если есть): the New York Heart Association (NYHA) Functional Classification
Источник: https://www.heart.org/en/health-topics/heart-failure/what-is-heart-failure/classes-of-heart-failure
Тип: шкала оценки
Назначение: классификация ХСН по функциональному классу
Содержание:
Таблица №9. Классификация ХСН Нью-Йоркской ассоциации сердца (NYHA)
Название на русском языке: Классификация ХСН Н.Д. Стражеско и В.Х. Василенко (1935)
Оригинальное название (если есть): Классификация ХСН Н.Д. Стражеско и В.Х. Василенко (1935)
Источник:
Тип: шкала оценки
Назначение: оценка хронической недостаточности кровообращения
Содержание:

Название на русском языке: Классификация острой сердечной недостаточности по Killip
Оригинальное название (если есть): The Killip classification
Источник:
Тип: шкала оценки
Назначение: оценка острой сердечной недостаточности
Содержание:
Таблица №11. Классификация острой сердечной недостаточности по Killip

Название на русском языке: Классификация острой сердечной недостаточности по данным центральной гемодинамики (Forrester)
Оригинальное название (если есть): The Forrester classification
Источник:
Тип: шкала оценки
Назначение: оценка острой сердечной недостаточности по данным центральной гемодинамике
Содержание:
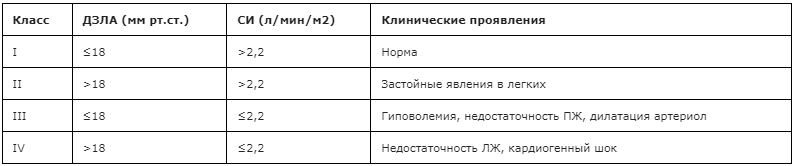
Название на русском языке: Классификация острого клеточного отторжения (ISHLT 2004)
Оригинальное название (если есть): ISHLT 2004 Acute cellular Rejection Granding Scheme
Источник:
Тип: шкала оценки
Назначение: оценка острого клеточного отторжения в эндомиокардиальном биоптате
Содержание:

Название на русском языке: Классификация острого гуморального отторжения (ISHLT 2013)
Оригинальное название (если есть): ISHLT 2013 Acute Humoral Rejection Granding Scheme
Источник:
Тип: шкала оценки
Назначение: оценка острого гуморальноого отторжения в эндомиокардиальном биоптате
Содержание:
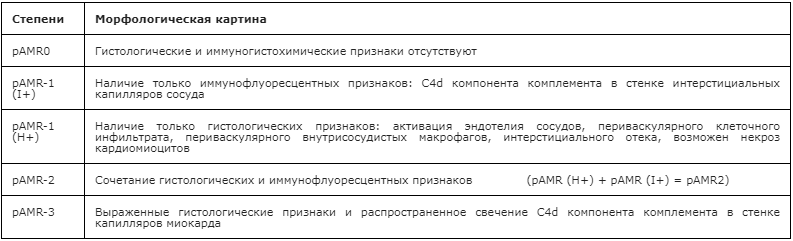
Название на русском языке: Классификация васкулопатии сердечного трансплантата (ISHLT 2010)
Оригинальное название (если есть):
Источник
Тип: шкала оценки
Назначение: оценка васкулопатии сердечного трансплантата по данным ангиографического исследования
Содержание:

Название на русском языке: Определение статуса неотложности пациентов в листе ожидания трансплантации сердца (по UNOS)
Оригинальное название (если есть):
Источник:
Тип: шкала оценки
Назначение: степень неотложности оперативного вмешательства (трансплантации сердца) пациенту в листе ожидания
Содержание:

Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.