Лимфома маргинальной зоны
 Версия: Клинические рекомендации РФ 2023 (Россия)
Версия: Клинические рекомендации РФ 2023 (Россия)
Общая информация
Краткое описание
Разработчик клинической рекомендации
Российское общество онкогематологов
Национальное гематологическое общество
Ассоциация онкологов России
Одобрено Научно-практическим Советом Минздрава РФ
В соответствии с Правилами поэтапного перехода медицинских организаций к оказанию медицинской помощи на основе клинических рекомендаций, разработанных и утвержденных в соответствии с частями 3, 4, 6 –9 и 11 статьи 37 Федерального закона «Об основах охраны здоровья граждан в Российской Федерации», утвержденных постановлением Правительства Российской Федерации от 19.11.2021 № 1968, клинические рекомендации применяются следующим образом:
– размещенные в Рубрикаторе после 1 июня 2022 года – с 1 января 2024 года.
Клинические рекомендации
Лимфома маргинальной зоны
Год утверждения (частота пересмотра): 2023
Возрастная категория: Взрослые
Пересмотр не позднее: 2025
Статус: Действует
Определение заболевания или состояния (группы заболеваний или состояний)
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
С83.0 – лимфома маргинальной зоны
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
-
Нодальная – 2% от неходжкинских лимфом (НХЛ)
-
Экстранодальная мукозо-ассоциированная (MALT) – 8% НХЛ
-
Селезенки – 1% НХЛ
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Многие рекомендованные методы диагностики заболевания и связанных с ним состояний имеют ограниченную доказательную базу (в соответствии с шкалами оценки УДД и УРР) по причине отсутствия посвященных им клинических исследований. Невзирая на это, они являются необходимыми элементами обследования пациента для установления диагноза и выбора тактики лечения, так как более эффективные и доказанные методы в настоящее время не разработаны.
-
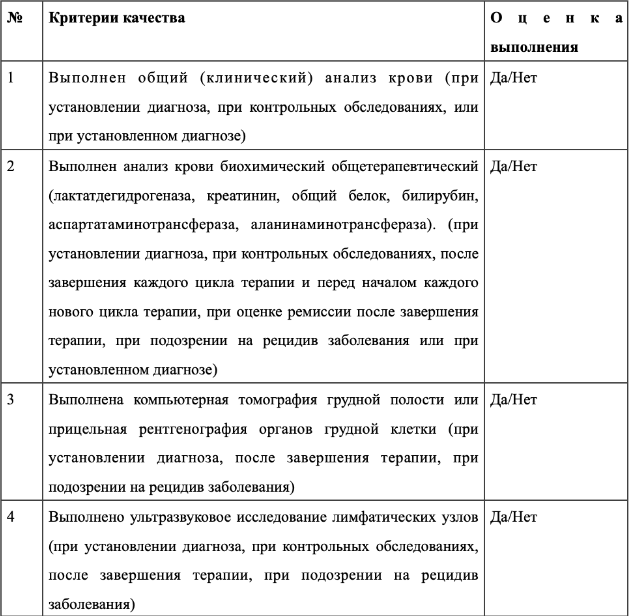
Пациентам с подозрением на ЛМЗ, а также пациентам с верифицированной ЛМЗ на каждом врачебном приеме рекомендуется сбор анамнеза для оценки состояния пациента, а также для установления факторов, которые могут оказать влияние на определение лечебной тактики пациента [3–5].
-
Пациентам с подозрением на ЛМЗ, или с выявленной ЛМЗ, при первичном или повторном приеме, при контрольных обследованиях и при подозрении на рецидив/прогрессирование заболевания рекомендуется выполнение визуального осмотра терапевтического, пальпации терапевтической и аускультации терапевтической для уточнения распространенности заболевания и оценки состояния пациента по органам и системам [3–5].
-
При обследовании пациентов с нодальными ЛМЗ рекомендовано тщательное исследование областей, прилежащих к зоне нодального поражения, для исключения инфильтрации прилегающих тканей и л/у [5]:
-
л/у шеи – глаза, околоушные и другие слюнные железы, щитовидная железа;
-
подмышечные л/у – легкие, молочная железа, кожа;
-
медиастинальные л/у – легкие, плевра;
-
л/у брюшной полости – селезенка и ЖКТ;
-
паховые и подвздошные л/у – ЖКТ и кожа
-
-
Пациентам с подозрением на ЛМЗ или выявленной ЛМЗ при первичном или повторном приеме и перед началом каждого нового цикла терапии, при оценке ремиссии после завершения терапии, перед спленэктомией и в раннем послеоперационном периоде в случае развития лихорадки, при контрольных обследованиях, и при подозрении на рецидив заболевания рекомендуется для уточнения состояния пациента, планирования терапевтической тактики и определения необходимости ее модификации, а также для определения потребности в сопутствующей и сопроводительной терапии выполнить следующие диагностические исследования [3–5]:
-
Всем ранее не получавшим лечение пациентам с ЛМЗ перед проведением первой линии противоопухолевой терапии либо перед выполнением спленэктомии для оценки возможности выполнения гемотрансфузии при наличии показаний, до, во время или после терапии рекомендуется [3,4]:
-
Всем ранее не получавшим лечение пациентам с ЛМЗ перед проведением первой линии противоопухолевой терапии либо перед выполнением спленэктомии рекомендуется для уточнения наличия сопутствующих инфекционных заболеваний и планирования необходимой сопутствующей терапии выполнение следующих исследований[3–5]:
-
Всем пациентам с ЛМЗ, перед началом противоопухолевой терапии рекомендуется при возможности проведение иммунохимического исследования белков сыворотки крови и мочи для исключения моноклональной патологической секреции [8].
-
В случае развития эпизода тяжелой инфекции при возможности рекомендуется определение уровня иммуноглобулинов G, A и M в крови для уточнения риска развития инфекционных осложнений и необходимости назначения соответствующей профилактики [9].
-
При обнаружении анемии и тромбоцитопении в клинической анализе крови, а также повышенного уровня ретикулоцитов перед началом специфической терапии рекомендуется определение антиэритроцитарных антител, прямой и непрямой пробы Кумбса для исключения иммунного компонента (гемолиза) [10].
-
Всем пациентам при установлении диагноза ЛМЗ, перед выполнением спленэктомии и в раннем послеоперационном периоде в случае развития лихорадки, при оценке ответа на лечение, а также при подозрении на рецидив заболевания рекомендуется выполнить компьютерную томографию (КТ) шеи, грудной полости, органов брюшной полости и малого таза (с контрастированием) для стадирования заболевания и уточнения наличия, размеров и распространенности опухолевых очагов [4,5,11].
-
Пациентам с противопоказаниями к КТ, либо при невозможности выполнения КТ, при установлении диагноза ЛМЗ, перед выполнением спленэктомии и в раннем послеоперационном периоде в случае развития лихорадки, при оценке ответа на лечение, а также при подозрении на рецидив заболевания рекомендуется для стадирования заболевания и уточнения наличия, размеров и распространенности опухолевых очагов выполнить следующие диагностические исследования [4]:
-
Всем пациентам при установлении диагноза MALT-лимфомы желудка, при оценке ответа на лечение и при подозрении на рецидив заболевания, а также пациентам с ЛМЗ перед выполнением спленэктомии рекомендуется выполнить эзофагогастроскопию и, при возможности, эндосонографию желудка со множественной биопсией пораженных участков слизистой [3,12,13].
-
Пациентам с MALT-лимфомой желудка рекомендуется выполнить фиброларингоскопию [3,12,13]
-
Пациентам с ЛМЗ, при наличии неврологической симптоматики перед началом лечения рекомендуется выполнить МРТ головного мозга, люмбальную пункцию для исключения ЛМЗ твердой мозговой оболочки [14]
-
Всем пациентам при установлении диагноза ЛМЗ, при оценке ответа на лечение, а также при подозрении на рецидив заболевания рекомендуется при наличии возможности выполнить позитронную эмиссионную томографию всего тела с туморотропными радиофармпрепаратами (РФП) (флудезоксиглюкозой [18F]) для более точного стадирования заболевания и лучшей оценки эффекта на терапию [15].
-
Всем пациентам с установленным диагнозом ЛМЗ при наличии неврологической симптоматики перед началом лечения рекомендуется выполнить КТ или МРТ головного мозга для исключения ЛМЗ твердой мозговой оболочки и планирования противоопухолевой терапии [4].
-
Всем пациентам с установленным диагнозом ЛМЗ, которым планируется лечение по поводу впервые установленного заболевания, либо по поводу рецидива, рекомендуется для своевременного выявления сопутствующей патологии со стороны сердечно-сосудистой, дыхательной и пищеварительной систем и для определения необходимости их профилактики или лечения рекомендуется выполнить следующие исследования [4]:
-
Всем пациентам с подозрением на ЛМЗ или с подозрением на рецидив ЛМЗ рекомендуется выполнить биопсию (взятие биопсийного материала) лимфатического узла либо другого очага поражения, патолого-анатомическое исследование биопсийного (операционного) материала с применением иммуногистохимических методов для верификации диагноза [4,17].
-
Пациентам с MALT лимфомой желудка при наличии возможности рекомендуется выполнить патолого-анатомическое исследование биопсийного (операционного) материала с применением метода флуоресцентной гибридизации in situ (FISH) для исключения t(11;18) [3,5,11].
-
Всем пациентам при подозрении или наличии подтвержденного диагноза ЛМЗ первично (для стадирования заболевания), после завершения терапии (для оценки противоопухолевого ответа), при подозрении на рецидив заболевания рекомендуется [4]:
-
Всем пациентам при установлении диагноза ЛМЗ желудка рекомендуется выполнить микробиологическое (культуральное) исследование биоптата стенки желудка на хеликобактер пилори (Helicobacter pylori) с определением чувствительности к антибактериальным препаратам [3,19].
-
Всем пациентам при установлении диагноза ЛМЗ желудка в случае отрицательных результатов микробиологического (культурального) исследования биоптата стенки желудка на хеликобактер пилори (Helicobacter pylori) рекомендуется выполнить определение антител к хеликобактер пилори (Helicobacter pylori) в крови, определение антигена хеликобактера пилори в фекалиях и 13С-уреазный дыхательный тест на Helicobacter pylori [3,19].
-
Всем пациентам с ЛМЗ кожи при возможности рекомендуется молекулярно-биологическое исследование крови и биоптата кожи на возбудителей иксодовых клещевых боррелиозов группы Borrelia burgdorferisensulato для выявления ассоциированного с данным заболеванием инфекционного агента [3,12].
-
Пациентам с ЛМЗ в сложных диагностических случаях, при неоднозначных результатах морфоиммуногистохимического и иммунофенотипического исследования, рекомендовано дополнительное определение В-клеточной клональности методом ПЦР на биопсийном материале [20].
-
Пациентам с верифицированной ЛМЗ при первичном обследовании и планировании терапии рекомендуется в зависимости от сопутствующей патологии прием (осмотр, консультация)врача-кардиолога, врача-эндокринолога, врача-невролога, врача- инфекциониста и других врачей-специалистов для определения необходимости терапии сопутствующих заболеваний [4].
-
Пациентам с верифицированной ЛМЗ при первичном обследовании и планировании терапии рекомендуется оценить риск развития венозных тромбоэмболических осложнений (шкала оценки риска ВТЭО по Khorana – см. приложение Г2 данных рекомендаций) для выявления пациентов, требующих назначения и определения способов профилактики тромботических осложнений при проведении цитостатической терапии [6,7,21–23].
-
Всем женщинам детородного возраста с впервые выявленной ЛМЗ, а также с рецидивом ЛМЗ перед началом терапии рекомендуется выполнение комплекса исследований по определению беременности для коррекции терапевтической тактики и консультации врача-акушера-гинеколога в случае наличия беременности и желания женщины ее сохранить [4,24].
-
Женщинам детородного возраста с индолентным течением ЛМЗ и при желании пациентки сохранить детородную функцию рекомендуется консультация врача-акушера-гинеколога для решения вопроса о возможности заготовки яйцеклеток перед началом химиотерапии и в последующем – проведении овариопротекции [4,24].
-
Пациентам с ЛМЗ, которым показана постановка центрального венозного катетера, перед выполнением катетеризации рекомендуется рентгенография органов грудной клетки или – предпочтительно – компьютерная томография органов грудной клетки (КТ), с болюсным контрастным усилением, а также ультразвуковая допплерография артерий верхний конечностей [25–30].
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
-
Пациентам с верифицированными ранними стадиями MALT-лимфомы желудка, инфицированным H. Pylori, рекомендовано проведение эрадикационной терапии H. pylori в соответствии с клиническими рекомендациями по язвенной болезни у взрослых пациентов [31].
-
Пациентам с верифицированными ранними стадиями MALT-лимфомы желудка с выявленной t(11;18), инфицированным H. Pylori, после завершения эрадикационной терапии H. pylori, независимо от ее эффективности, рекомендовано назначение лучевой терапии (ЛТ), или монотерапии #ритуксимабом**, или иммунохимиотерапии [5,11,12,32–34].
-
Пациентам с верифицированными ранними стадиями MALT-лимфомы желудка, инфицированным H. Pylori, при морфологически доказанной регрессии лимфомы и эрадикации H. pylori через 3 месяца эрадикационной терапии рекомендовано динамическое наблюдение [31].
-
Пациентам с верифицированными ранними стадиями MALT-лимфомы желудка, инфицированным H. Pylori, при сохранении инфицированности H. pylori через 3 месяца эрадикационной терапии рекомендована антихеликобактерная терапия 2 линии до полной эрадикации инфекции (в соответствии с профильными рекомендациями по лечению язвенной болезни желудка) [5,11,12].
-
Пациентам с верифицированными ранними стадиями MALT-лимфомы желудка, инфицированным H. Pylori, при эрадикации H. pylori, но сохранении лимфомы без клинических симптомов, рекомендована выжидательная тактика с регулярным выполнением эзофагогастроскопии (каждые 3 месяца) [5,11,12].
-
Пациентам c верифицированными ранними стадиями MALT-лимфомы желудка, у которых H. Pylori и антитела к нему не обнаружены, также рекомендовано проведение эрадикационной терапии H. pylori в соответствии с клиническими рекомендациями по язвенной болезни у взрослых пациентов [5,31].
-
Пациентам c верифицированными ранними стадиями MALT-лимфомы желудка, у которых H. Pylori и антитела к нему не обнаружены, при отсутствии положительной динамики при повторном эндоскопическом исследовании через 3-6 мес. после начала проведения эрадикационной терапии H. pylori, рекомендовано проведение специфического противоопухолевого лечения: лучевой терапии (ЛТ), или монотерапии #ритуксимабом**, или иммунохимиотерапии. [5,11,12,32–34].
-
Пациентам с верифицированными ранними стадиями MALT-лимфомы желудка при изъязвленной кровоточащей опухоли рекомендовано хирургическое лечение [5,35].
-
Пациентам с MALT-лимфомами других локализаций рекомендовано начало специфической терапии при наличии одного из следующих симптомов [5,11,12]:
-
болевой синдром,
-
нарушение функции органа,
-
кровотечение,
-
массивное поражение
-
-
Пациентам с ранними стадиями MALT-лимфомы других локализаций при наличии показаний к началу терапии рекомендована ЛТ на вовлеченные области СОД 30-36 Гр [5,11,12].
-
Пациентам с ранними стадиями MALT-лимфомы других локализаций при наличии показаний к началу терапии и при наличии противопоказаний или невозможности проведения ЛТ рекомендована монотерапия #ритуксимабом** или иммунохимиотерапия [5,11,12,32–34].
-
Полностью обследованным пациентам с солитарным очагом MALT-лимфомы в одном из таких органов, как легкое, молочная железа, щитовидная железа, толстая кишка рекомендована консультация врача-хирурга и, при наличии возможности, хирургическое удаление опухоли [12].
-
Пациентам с верифицированными раcпространенными стадиями MALT-лимфомы других локализаций рекомендовано проведение иммунохимиотерапии в соответствии с рекомендациями для распространенных стадий ФЛ I-II цитологического типа [5,11,12].
-
Пациентам с верифицированными раcпространенными стадиями MALT-лимфомы рекомендовано начало специфической терапии при наличии одного из следующих симптомов [5,11,12]:
-
болевой синдром,
-
конституциональные В-симптомы
-
нарушение функции органа,
-
кровотечение,
-
массивное поражение
-
-
Пациентам с верифицированными раcпространенными стадиями MALT-лимфомы с показаниями к началу терапии рекомендовано проведение иммунохимиотерапии, или монотерапии #ритуксимабом** [5,11,12,32–34]
-
Пациентам с MALT-лимфомой, у которых иммуногистохимически выявляется крупноклеточный компонент, независимо от стадии заболевания рекомендовано проведение иммунохимиотерапии в соответствии с рекомендациями для ДВКЛ (см. клинические рекомендации по лечению агрессивных В-клеточных лимфом) [12].
Лечение пациентов с нодальной лимфомой маргинальной зоны
-
Пациентам с верифицированной нодальной ЛМЗ рекомендовано проведение монотерапии #ритуксимабом**, или иммунохимиотерапии [5,11,12,32–34].
-
Пациентам с верифицированной лимфомой маргинальной зоны селезенки рекомендовано начало специфической терапии при наличии показаний [5,11,12]:
-
симптоматическая и прогрессирующая спленомегалия
-
прогрессирующая цитопения (гемоглобин ˂100 г/л, тромбоциты ˂80 ◊ 109/л, нейтрофилы ˂1,0 ◊ 109/л)
-
аутоиммунные осложнения (АИГА, идиопатическая тромбоцитопеническая пурпура).
При отсутствии показаний возможно динамическое наблюдение.
-
Пациентам с верифицированной лимфомой маргинальной зоны селезенки и с гепатитом С рекомендовано проведение терапии вирусного гепатита С в соответствии с клиническими рекомендациями по лечению гепатита С [5,11,12]
-
Пациентам с верифицированной лимфомой маргинальной зоны селезенки с показаниями к лечению, при негативных результатах обследования на гепатит С или при противопоказаниях к противовирусному лечению рекомендована монотерапия #ритуксимабом** или иммунохимиотерапия, или спленэктомия [5,11,12,32–34,39].
-
значительная или быстро нарастающая спленомегалия (в т. ч. с угрозой разрыва или инфарктом селезенки);
-
глубокая цитопения (не является абсолютным показанием);
-
противопоказания к проведению иммунотерапии или иммунохимиотерапии.
-
Пациентам с ЛМЗ, достигшим полной или частичной ремиссии после первой линии терапии с применением монотерапии #ритуксимабом** или полихимиотерапии с включением #ритуксимаба**, опционально может быть рекомендовано поддерживающее лечение #ритуксимабом** 375 мг/м2 1 раз в 2 месяца в течение 2 лет, всего 12 введений для поддержания ремиссии [40,41,48].
Лечение рецидивов и рефрактерных форм ЛМЗ
-
Пациентам с рецидивами и рефрактерными формами ЛМЗ при наличии показаний к лечению рекомендовано проведение терапии в соответствии с рекомендациями для рецидивов и рефрактерных форм ФЛ I-II цитологического типа (режимы лекарственного лечения – см. приложение А3.1) и ЛТ, если она не проводилась ранее [5,11,12].
-
Пациентам с рецидивом ЛМЗ, развившимся менее чем через 6 месяцев после иммунохимиотерапии с включением #ритуксимаба**, при наличии показаний к началу лечения может быть рекомендовано применение альтернативных вариантов химиотерапии (например, #бендамустин** после CHOP) в комбинации с другим анти-CD20 МКА (например, #обинутузумаб** после #ритуксимаба**). Обинутузумаб вводится в дозе 1000 мг (дни 1, 8, и 15, цикл 1; день 1, циклы 2-6), бендамустин – в дозе 90 мг/м(2) в сутки (дни 1 and 2, циклы 1-6). [50].
-
Пациентам с рецидивами и рефрактерными формами ЛМЗ, уже получившим как минимум один курс #ритуксимаба**, при наличии показаний к лечению в качестве одной из опций лечения может быть рекомендовано проведение терапии ибрутинибом** (режимы лекарственного лечения – см. приложение А3.1) [5,11,51].
-
Пациентам с рецидивами и рефрактерными формами ЛМЗ, уже получившим не менее одного курса лекарственного лечения с включением #ритуксимаба**, при наличии показаний к лечению в качестве одной из опций лечения может быть рекомендовано назначение #занубрутиниба 160 мг 2 раза в сутки до прогрессирования или неприемлемой токсичности [52].
-
Пациентам с рецидивом ЛМЗ, развившемся в любые сроки, при наличии показаний к началу лечения в качестве одной из терапевтических опций может быть рекомендовано применение комбинации #ритуксимаба** и леналидомида** (режимы лекарственного лечения – см. приложение А3.1) [53].
Леналидомид** применяли в дозе 20 мг/день с 1 по 21 день 28-дневного цикла (12 циклов), если клиренс креатинина составлял от 30 до <60 мл/мин, то доза леналидомида** составляла 10 мг/день. #Ритуксимаб** назначали в дозе 375 мг/м2 в дни 1, 8, 15, 22 первого цикла и в день 1 циклов 2-5.
В ходе исследования было продемонстрировано статистически значимое улучшение выживаемости без прогрессирования заболевания (ВБП) в группе пациентов, получавших схему R2. Продолжительность ВБП при лечении комбинацией R2 по сравнению с группой контроля составила 39,4 мес. и 14,1 мес., соответственно (p = < 0,0001). ОЧО в группе R2 составила 78% против 53% в группе контроля (p = 0,001). Длительность ответа в группе R2 составила 36,6 мес., а в группе контроля – 21,7 мес. (p = < 0,0015). Время до следующей противолимфомной терапии в группе R2 не было достигнуто. В группе контроля этот показатель достиг 32,3 мес. (p = < 0,0007).
-
Пациентам с ЛМЗ, кандидатам на трансплантацию, с рецидивом, развившемся менее чем через 24 месяца после начала индукционной терапии (POD24), или при рефрактерном течении рекомендована терапия по протоколам для лечения рецидивов ДВКЛ (R-GEMOX, R-ICE, R-DHAP, R-GDP и др.) (см. клинические рекомендации по лечению агрессивных неходжкинских лимфом) и, в случае достижения ответа на терапию рецидива, проведение высокодозной химиотерапии (ВДХТ) с трансплантацией аутологичных гемопоэтических стволовых клеток с целью консолидации ремиссии (аутоТГСК, см. приложение А3.11) [11,17,54,55].
-
Пациентам с ЛМЗ, кандидатам на трансплантацию, с ранним агрессивным рецидивом ЛМЗ, развившимся после трансплантации аутологичных стволовых клеток, при возможности рекомендована аллогенная трансплантация костного мозга (аутоТГСК, см. приложение А3.11) [56–58].
-
Пациентам с рецидивом ЛМЗ, ответившим на терапию рецидива с включением #ритуксимаба**, опционально может быть рекомендована поддерживающая терапия #ритуксимабом** 375 мг/м2 1 раз в 2 месяца в течение 2 лет [11,17,41].
-
Всем пациентам с ЛМЗ, получающим противоопухолевое лечение, после завершения всей программы лечения, рекомендуется оценка ответа на терапию в соответствии со стандартными критериями ответа на лечение лимфом (см. раздел 7.4 данных рекомендаций) [4,59].
-
Пациентам с ЛМЗ с массивным опухолевым поражением, получающим противоопухолевую терапию, рекомендуется профилактика и лечение синдрома массивного лизиса опухоли: #аллопуринол** 10 мг/кг/сут и инфузионная терапия 3 л/м2/сут с защелачиванием раствором #натрия гидрокарбоната** 40–80 ммоль/л под контролем диуреза и лабораторным контролем кислотно-основного состояния, при необходимости – плановым назначением #фуросемида** в дозе от 1 до 10 мг/кг до достижения диуреза 200–250 мл/час, [60,61].
-
Пациентам c ЛМЗ, получающим противоопухолевую химио- или лучевую терапию, для профилактики тошноты и рвоты рекомендуется применение соответствующих препаратов (см. приложение А3.8 данных рекомендаций) [62–65].
-
Пациентам с ЛМЗ на фоне приема глюкокортикоидов рекомендуется проведение профилактики язвенной болезни желудка и 12-перстной кишки (см. приложение А3.9 данных рекомендаций) [66].
-
Пациентам с ЛМЗ при проведении курсов иммунохимиотерапии (R-CHOP, G-CHOP) с высоким риском фебрильной нейтропении (ФН), превышающем 20%, или с промежуточным риском ФН 10–20% с наличием факторов риска, рекомендована первичная профилактика фебрильной нейтропении колониестимулирующими факторами [67–70].
-
Пациентам с ЛМЗ после зафиксированного ранее эпизода ФН, дозолимитирующей афебрильной нейтропении (после единственного эпизода удлинения интервалов между курсами и/или редукции дозы) рекомендована вторичная профилактика фебрильной нейтропении Г-КСФ [67–69].
-
Пациентам с ЛМЗ с симптоматической гипогаммаглобулинемией, а также пациентам, страдающим тяжелыми или рецидивирующими инфекциями при неэффективности антибактериальных препаратов, рекомендовано проведение заместительной терапии #иммуноглобулином человека нормальным** 0,2–0,4 г/кг в/в каждые 3–4 нед. либо 0,05–0,1 г/кг п/к еженедельно в течение 12 мес. для лечения вторичного иммунодефицита [9,71–74]
-
Пациентам c ЛМЗ, получающим лечение леналидомидом**, рекомендована профилактика тромбозов низкими дозами #ацетилсалициловой кислоты** (75-325 мг в сутки для пациентов стандартного риска венозной тромбоэмболии (ВТЭ) или низкомолекулярными гепаринами (НМГ) (из группы B01AB группа гепарина по АТХ классификации) для пациентов высокого риска ВТЭ на протяжении всего периода терапии (см. приложение А3.10 данных рекомендаций) [76,77].
-
Пациентам с ЛМЗ при наличии симптомной анемии или тромбоцитопении рекомендуется проведение трансфузий компонентов крови (см. приложение А.5) [24]
-
Пациентам c ЛМЗ, которым проводится трансфузия тромбоцитов, в случаях, когда с помощью индивидуального подбора донорских тромбоцитов не удаётся получить достаточный прирост тромбоцитов и клинический эффект от трансфузий концентрата тромбоцитов, рекомендован плазмаферез для улучшения эффективности индивидуального подбора пары «донор-реципиент» (см. приложение А3.6) [78–81].
-
Пациентам c ЛМЗ с повышенным риском развития периоперационных тромботических осложнений, которым планируется проведение спленэктомии, рекомендовано назначение НМГ (из группы B01AB группа гепарина по АТХ классификации) в профилактических дозах (см. приложение А3.10) [82].
Медицинская реабилитация
Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
-
Всем пациентам с ЛМЗ на всех этапах терапии заболевания, а также после завершения лекарственного лечения рекомендуется комплексная реабилитация, а также, при необходимости, поддерживающая терапия [83].
Госпитализация
Организация оказания медицинской помощи
- Проведение терапии в случаях, требующих круглосуточного наблюдения за пациентом по причине тяжести состояния, обусловленного опухолью, или по причине риска осложнений, связанных с программой лечения или сопутствующими заболеваниями.
- Обследование пациента, включающее биопсию и инвазивные вмешательства, в случаях, когда оно не может быть проведено амбулаторно.
Показания для экстренной госпитализации:
- Развитие инфекции (необязательна госпитализация в гематологический стационар).
- Развитие угрожающих жизни цитопений (глубокой анемии, геморрагического синдрома, нейтропении).
- Развитие осложнений ЛМЗ, угрожающих жизни.
- Развитие осложнений терапии, включая синдром лизиса опухоли, тяжелые инфузионные реакции, миелотоксический агранулоцитоз с лихорадкой и другие осложнения, угрожающие жизни.
Показания к выписке пациента из стационара:
- Завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи, в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях.
- Отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь, при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях.
- Необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
- Решение врачебной комиссии об отсутствии показаний к пребыванию пациента в стационаре в связи с бесперспективностью лечения и необходимостью оказания только паллиативной помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию составляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
-
Взрослым пациентам, завершившим лечение по поводу ЛМЗ с достижением ПР, рекомендуется диспансерный прием (осмотр, консультация) врача-онколога или врача-гематолога с соблюдением следующей частоты обследований пациента - в течение первого года после завершения терапии каждые 3 месяца, 2-го года – каждые 6 месяцев, в дальнейшем – ежегодно, после 5 лет – каждые 2 года [4].
Информация
Источники и литература
-
Клинические рекомендации Ассоциации онкологов России
- Клинические рекомендации Ассоциации онкологов России - 1. Swerdlow S.H. et al. WHO classification of tumours of haematopoietic and lymphoid tissues. Revised 4th ed. Lyon, France: International Agency for Research in Cancer (IARC) / ed. Swerdlow SH, Campo E, Harris NL, Jaffe ES, Pileri SA, Stein H T.J. 2017. 585 p. 2. Armitage J.O. A clinical evaluation of the International Lymphoma Study Group classification of non-Hodgkin’s lymphoma // Blood. 1997. Vol. 89, № 11. P. 3909–3918. 3. Поддубная И.В., Птушкин В.В. Лимфома маргинальной зоны // Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 52–58. 4. Демина Е.А. et al. Общие принципы диагностики лимфом // Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 9–27. 5. Zucca E. et al. Marginal zone lymphomas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up // Ann. Oncol. Elsevier Ltd, 2020. Vol. 31, № 1. P. 17–29. 6. Kuderer N.M. et al. A Validated Risk Score for Venous Thromboembolism Is Predictive of Cancer Progression and Mortality // Oncologist. Alphamed Press, 2016. Vol. 21, № 7. P. 861–867. 7. Santi R.M. et al. PO-03 - Khorana score and histotype predict the incidence of early venous thromboembolism (VTE) in Non Hodgkin Lymphoma (NHL). A pooled data analysis of twelve clinical trials of Fondazione Italiana Linfomi (FIL) // Thromb. Res. Elsevier BV, 2016. Vol. 140. P. S177. 8. Witzig T.E. et al. Elevated Monoclonal and Polyclonal Serum Immunoglobulin Free Light Chain (FLC) as Prognostic Factors in B- and T-cell Non-Hodgkin Lymphoma // Am. J. Hematol. NIH Public Access, 2014. Vol. 89, № 12. P. 1116. 9. Srivastava S., Wood P. Secondary antibody deficiency-causes and approach to diagnosis // Clin. Med. J. R. Coll. Physicians London. 2016. 10. Xing L. et al. Characteristics of patients with autoimmune haemolytic anaemia secondary to lymphoproliferative disorder: A single-centre retrospective analysis // Sci. Rep. 2019. Vol. 9, № 1. 11. Zelenetz A.D. et al. B-cell lymphomas. NCCN Clinical Practice Guidelines in Oncology. Version 5.2022. 2022. 12. Поддубная И.В. Неходжкинские лимфомы маргинальной зоны // Гериатрическая гематология. Заболевания системы крови в старших возрастных группах. Под редакцией Л.Д. Гриншпун, А.В. Пивника. 2012. P. 176–187. 13. Levy M. et al. Conservative treatment of primary gastric low-grade B-cell lymphoma of mucosaassociated lymphoid tissue: predictive factors of response and outcome // Am. J. Gastroenterol. Ovid Technologies (Wolters Kluwer Health), 2002. Vol. 97, № 2. P. 292–297. 14. Bhagavathi S. et al. Extranodal marginal zone lymphoma of the dura mater with IgH/MALT1 translocation and review of literature // J. Hematop. Springer, 2008. Vol. 1, № 2. P. 131. 15. Мухортова О.В. Использование ПЭТ/КТ при лимфопролиферативных заболеваниях // Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 168–179. 16. Fekri M.S., Zade M.K., Fatehi S. The association of deep vein thrombosis with cancer treatment modality: Chemotherapy or surgery? // Iran. Red Crescent Med. J. Kowsar Medical Publishing Company, 2014. Vol. 16, № 9. 17. Бабичева Л.Г., Тумян Г.С., Кравченко С.К. Фолликулярная лимфома // Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 43–52. 18. Криволапов Ю.А., Леенман Е.Е. Морфологическая диагностика лимфом. КОСТА, СанктПетербург, 2006. 19. Маев И.В. et al. Эволюция представлений о диагностике и лечении инфекции Helicobacter pylori (по материалам консенсуса Маастрихт, Флоренция, 2010) // Вестник практического врача. 2012. Vol. Спецвыпуск. 20. Ruskoné-Fourmestraux A. et al. EGILS consensus report. Gastric extranodal marginal zone B-cell lymphoma of MALT // Gut. Gut, 2011. Vol. 60, № 6. P. 747–758. 21. Бокерия Л.А., Затевахин И.И., Кириенко А.И. Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений (ВТЭО). // Флебология. 2015. Vol. 4, № 2. P. 3–52. 22. Кириенко А.И., Галстян Г.М., Савченко В.Г. Профилактика венозных тромбоэмболических осложнений при лимфопролиферативных заболеваниях // Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 268–278. 23. Santi R.M. et al. Khorana score and histotype predicts incidence of early venous thromboembolism in Non-Hodgkin lymphomas: A Pooled-Data analysis of 12 clinical trials of fondazione italiana linfomi (FIL) // Thromb. Haemost. Schattauer GmbH, 2017. Vol. 117, № 8. P. 1615–1621. 24. Шмаков Р.Г., Демина Е.А. Лимфомы и беременность // Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 143–150. 25. Spirin M., Galstyan G., Drokov M. Central venous access in lymphoma patients (pts) with superior vena cava syndrome (SVCS) // Intensive Care Med. E[perimental. 2019. Vol. 7, № Suppl. 3:001341. P. 388–389.
Информация
Список сокращений
** – жизненно необходимые и важнейшие лекарственные препараты
Общие требования к морфологической диагностике лимфом
-
Макроскопическое описание материала, присланного для исследования; при исследовании готовых блоков и микропрепаратов в протоколе должны быть указаны количество и идентификационные номера всех присланных объектов.
-
Гистологическое описание лимфомы с указанием типа роста (диффузный, нодулярный и т. п.), характеристики клеточного состава (мелкие, крупные клетки, полиморфный состав, анапластическая, бластная/бластоидная морфология, наличие многоядерных форм, характеристика ядер), наличия реактивных и резидуальных компонентов.
-
Результаты иммуногистохимического исследования с указанием использованных антител и подробностей окрашивания, указывающих на специфический характер реакции (например, окрашивание ядер в реакциях с антителами к TdT, BCL-6, Cyclin D1; цитоплазмы – в реакциях на CD79a; гранулярная цитоплазматическая реакция - цитотоксические молекулы; окрашивание цитоплазмы или мембраны - в реакциях с антителами к CD3, тяжелым или легким цепям иммуноглобулинов; мембраны – в реакциях на CD20, CD10), интенсивность, особенности иммуногистоархитектоники. Представление результатов иммуногистохимических тестов только в виде «крестов» («плюсов») и перечня антител недопустимо.
-
Патологоанатомическое заключение, сформулированное в соответствии с действующей редакцией классификации опухолей гемопоэтической и лимфоидной тканей (ВОЗ, 2017 г.).
Обязательным компонентом определения распространенности опухолевого процесса (стадии) является гистологическое исследование трепанобиоптата костного мозга. В процессе первичного обследования рекомендуется выполнять биопсию билатерально.
|
Схема стадирования лимфом ЖКТ (Лугано, 1993 г.)
|
Стадия по Ann Arbor
|
Стадия по TNM
|
Распространение опухоли
|
|
|
Поражение ограничено ЖКТ
|
||||
|
IЕ1
|
Слизистая, подслизистая
|
IЕ
|
T1 N0 M0
|
Слизистая, подслизистая
|
|
IЕ2
|
Мышечный слой, сероза
|
IЕ
|
T2 N0 M0
|
Мышечный слой
|
|
IЕ
|
T3 N0 M0
|
Серозная оболочка
|
||
|
Распространение на брюшную полость
|
||||
|
IIЕ1
|
Вовлечение ближайших локальных л/у
|
IIE
|
T1-3 N1 M0
|
Перигастральные л/у
|
|
IIЕ2
|
Вовлечение
отдаленных регионарных узлов
|
IIE
|
T1-3 N2 M0
|
Отдаленные л/у
|
|
Пенетрация серозы и переход на соседние органы и ткани
|
IIE
|
T4 N0 M0
|
Инвазия прилежащих структур
|
|
|
IV
|
Диссеминированное экстранодальное поражение или поражение наддиафрагмальных л/у
|
IIIE
|
T1-4 N3 M0
|
Поражение л/у по обе стороны диафрагмы, отдаленные метастазы (КМ, дополнительные экстранодальные очаги)
|
|
IV
|
T1-4 N0-3 M1
|
|||
Таблица 7.3.2. Стадирование лимфом по Ann Arbor (модификация Лугано, 2014) [32]:
|
Стадия
|
Поражение лимфоузлов
|
Экстранодальное поражение
|
|
Стадия I
|
Вовлечение одного ЛУ или одной группы ЛУ
|
Локализованное поражение одного экстралимфатического органа или ткани без поражения ЛУ
|
|
Стадия II
|
Вовлечение ≥ 2 групп ЛУ по одну сторону диафрагмы
Стадия II bulky–стадия II c массивным поражением ЛУ
|
Локализованное поражение экстралимфатического органа или ткани + поражение регионарных ЛУ по одну сторону диафрагмы
|
|
Стадия III
|
Вовлечение ЛУ по обе стороны диафрагмы или вовлечение ЛУ выше диафрагмы с поражением селезенки
|
|
|
Стадия IV
|
Диффузное или диссеминированное поражение экстралимфатического органа или ткани с/без вовлечения ЛУ либо поражение экстранодального органа или ткани + поражение нерегионарных ЛУ
|
|
Оценка ответа на лечение при лимфомах
Полная ремиссия (ПР):
-
Полное исчезновение всех проявлений заболевания, в том числе выявляемых при помощи лабораторных и лучевых методов диагностики, а также клинических симптомов, если они имели место до начала лечения.
-
Размеры лимфатических узлов:
-
≤ 1,5 см по наибольшему диаметру, если до начала лечения размеры лимфатических узлов были больше 1,5 см
-
≤ 1,0 см по наибольшему диаметру, если до начала лечения размеры лимфатических узлов были 1,5–1,1 см
-
-
Печень, селезенка, если были увеличены до начала лечения, не пальпируются, по данным лучевых методов объемные образования в них не выявляются.
-
Костный мозг без признаков опухолевого поражения. Если результат морфологического исследования костного мозга неоднозначный, наличие или отсутствие поражения должно определяться иммуногистохимически.
Неуверенная полная ремиссия (ПРн) констатируется только у пациентов, которым не выполнялась ПЭТ-КТ для оценки эффекта:
-
Остаточные изменения, выявляемые только при помощи лучевых методов исследования (особенно это касается остаточных объемных образований в месте массивного опухолевого поражения, чаще всего в средостении), в случае сокращения опухоли более чем на 75% от исходных размеров по сумме двух наибольших её диаметров. Эти остаточные изменения не должны увеличиваться в течение более чем 3 месяцев.
-
По другим показателям – соответствие критериям полной ремиссии.
Частичная ремиссия (ЧР):
-
Уменьшение суммы диаметров всех измеряемых очагов (лимфоузлов и/или очагов экстранодального поражения) не менее чем на 50%. Если размеры пораженных очагов менее 3см по наибольшему диаметру, то 2 наибольших очага должны уменьшиться не менее, чем на 50% по наибольшему диаметру. При наличии более чем 6 очагов поражения более 3 см, достаточна оценка 6 наибольших очагов, доступных четкому измерению в двух перпендикулярных направлениях. При наличии медиастинальных и/или ретроперитонеальных очагов поражения, они обязательно должны учитываться при измерении.
-
Отсутствие новых очагов поражения, отсутствие признаков увеличения какого-либо из ранее диагностированных очагов поражения.
-
В случае исходного поражения костного мозга статус костного мозга для определения ЧР не значим. Однако при сохранении поражения костного мозга в процессе и/или после завершения лечения, обязательно уточнение характеристики опухолевых клеток. Пациенты с исходным поражением костного мозга, у которых после завершения лечения клинически диагностируется ПР, но при этом сохраняется поражение костного мозга или костный мозг не может быть оценен, относятся к ЧР.
Стабилизация
-
Появление новых очагов (увеличение лимфатических узлов или объемных образований экстранодальных локализаций) более 1,5 см в наибольшем измерении в процессе или после завершения лечения, вне зависимости от изменения размеров других очагов поражения.
-
Увеличение как минимум одного уже известного очага более чем на 25% от минимального. Для очагов менее 1 см в наибольшем измерении – увеличение до 1,5 см и более.
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
-
Птушкин Вадим Вадимович – д.м.н., профессор, заместитель главного врача по гематологии ГБУЗ «ГКБ им. С.П. Боткина», главный внештатный специалист-гематолог Департамента здравоохранения города Москвы, член Национального гематологического общества и Российского общества онкогематологов.
-
Поддубная Ирина Владимировна – академик РАН, заслуженный деятель образования РФ, д.м.н., профессор, зав. кафедрой онкологии и паллиативной медицины, проректор по лечебной работе и международному сотрудничеству ГБОУ ДПО РМАНПО Минздрава России, председатель Российского общества онкогематологов.
-
Бабичева Лали Галимовна – к.м.н., доцент кафедры онкологии и паллиативной медицины им. академика А.И. Савицкого ФГБОУ ДПО РМАНПО Минздрава России, член Российского общества онкогематологов
-
Нестерова Екатерина Сергеевна – к.м.н., научный сотрудник, врач-гематолог отделения интенсивной высокодозной химиотерапии гемобластозов с дневным и круглосуточным стационаром, ФГБУ «НМИЦ гематологии» Минздрава России, член Ассоциация содействия развитию гематологии и трансплантации костного мозга «Национальное гематологическое общество»
-
Османов Евгений Александрович – д.м.н., профессор, зав. отделом гематологии и трансплантации костного мозга ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, профессор кафедры онкологии ФГАОУ ВО Первый МГМУ имени И.М. Сеченова Минздрава России, член правления Российского общества онкогематологов.
-
Кравченко Сергей Кириллович – к.м.н., доцент, зав. отделением интенсивной высокодозной химиотерапиис круглосуточным и дневным стационаром ФГБУ «НМИЦ гематологии» Минздрава России, член Ассоциация содействия развитию гематологии и трансплантации костного мозга «Национальное гематологическое общество»
-
Смольянинова Анна Константиновна – к.м.н., врач-гематолог отделения гематологии и химиотерапии лимфом с блоком трансплантации костного мозга и гемопоэтических стволовых клеток ФГБУ «НМИЦ гематологии» Минздрава России, член Ассоциация содействия развитию гематологии и трансплантации костного мозга «Национальное гематологическое общество»
-
Аль-Ради Любовь Саттаровна – к.м.н., старший научный сотрудник отдела диагностики и лечения гематологических заболеваний ФГБУ «НМИЦ гематологии» Минздрава России, член Ассоциация содействия развитию гематологии и трансплантации костного мозга «Национальное гематологическое общество»
-
Фалалеева Наталья Александровна – д.м.н., зав. отделением противоопухолевого лекарственного лечения МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России, член Ассоциации онкологов России и Российской Ассоциации терапевтических радиационных онкологов.
-
Стефанов Дмитрий Николаевич – научный сотрудник, зав. научно-организационным отделом, ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России, член Российского общества онкогематологов
-
Байков Вадим Валентинович – д.м.н., профессор кафедры патологической анатомии, заведующий лабораторией патоморфологии НИИ детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова Минздрава России, член президиума Российского общества патологоанатомов, член правления Российского общества онкогематологов.
-
Ковригина Алла Михайловна – д.б.н., профессор кафедры патологической анатомии, цитологии и молекулярной патологии Института повышения квалификации ФМБА РФ, заведующая патологоанатомическим отделением «НМИЦ гематологии» Минздрава России, член президиума Российского общества патологоанатомов, член правления Российского общества онкогематологов.
-
Криволапов Юрий Александрович – д.м.н., профессор, зав. патологоанатомическим отделением клинической молекулярной морфологии клиники им. Э.Э. Эйхвальда ФГБОУ СЗГМУ им. И.И. Мечникова Минздрава России, член панели патологов Европейской сети исследования лимфом, член Европейской рабочей группы исследования костного мозга, член президиума Российского общества патологоанатомов
-
Коновалов Дмитрий Михайлович – к.м.н., зав. патологанатомическим отделением ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России, член президиума Российского общества патологоанатомов
-
Трофимова Оксана Петровна – д.м.н., профессор кафедры онкологии и паллиативной медицины им.А.И.Савицкого ФГБОУ ДПО РМА НПО МЗ РФ
-
Сотников Владимир Михайлович – д.м.н., заведующий отделом «Методический аккредитационно-симуляционный центр по специальности «Радиотерапия» ФГБУ РНЦРР МЗ РФ
-
Виноградова Юлия Николаевна – д.м.н., доцент, руководитель отдела лучевых и комбинированных методов лечения ФГБУ РНЦРХТ им. ак. А. М. Гранова Минздрава России
-
Ильин Николай Васильевич – д.м.н., проф., главный научный сотрудник отдела фундаментальных методов исследования ФГБУ РНЦРХТ им. ак. А. М. Гранова
Конфликт интересов: отсутствует
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
| УДД | Расшифровка |
| 1 | Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
| 2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
| 3 | Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая |
| 5 | Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
| УДД | Расшифровка |
| 1 | Систематический обзор РКИ с применением мета-анализа |
| 2 | Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа |
| 3 | Нерандомизированные сравнительные исследования, в т.ч. когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
| 5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
| УУР | Расшифровка |
| А | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
| В | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
| С | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Приложение А3.1 Режимы лекарственного лечения ЛМЗ
-
#Ритуксимаб** 375 мг/м2 в/в кап., 1 раз в неделю в течение 4 недель
R-хлорамбуцил** [84–86]
-
#Ритуксимаб**
-
375 мг/м2 в/в кап. в дни 1, 8, 15, 22, далее в день 1 соответствующих циклов приема #хлорамбуцила** (недели 9, 13, 17, 21)
-
-
375 мг/м2 в/в кап. в дни 1, 8, 15, 22, далее #ритуксимаб** 1400 мг п/к в день 1 соответствующих циклов приема #хлорамбуцила** (недели 9, 13, 17, 21) [87–90]
-
#Хлорамбуцил** 6 мг/м2 в сутки внутрь в течение недели, недели 1–6, 9–10, 13–14, 17–18, 21–22
R-CHOP [42,43]
-
#Ритуксимаб**
-
375 мг/м2 в/в кап., день 0 или 1 все циклы курса
-
-
375 мг/м2 в/в кап. 1 цикл, далее #ритуксимаб** 1400 мг п/к, день 0 или 1[87–90]
-
Доксорубицин** 50 мг/м2 в/в кап., день 1
-
Циклофосфамид** 750 мг/м2 в/в кап., день 1
-
#Винкристин** 1,4 мг/м2 (суммарно не более 2 мг) в/в, день 1
-
#Преднизолон** 100 мг внутрь, дни 1–5
-
Филграстим** 5 мкг/кг подкожно (п/к) через 24–72 часа после окончания введения химиопрепаратов и до восстановления нормального числа нейтрофилов после надира или пэгфилграстим в дозе 6 мг или эмпэгфилграстим** в дозе 7,5 мг подкожно, однократно, не менее чем через 24 часа после окончания введения химиопрепаратов [67–70]
R-CVP [42,44]
-
#Ритуксимаб**
-
375 мг/м2 в/в кап., день 0 или 1 все циклы курса
-
-
375 мг/м2 в/в кап. 1 цикл, далее ритуксимаб** 1400 мг п/к, день 0 или 1[87–90]
-
Циклофосфамид** 750 мг/м2 в/в кап., день 1
-
#Винкристин** 1,4 мг/м2 (суммарно не более 2 мг) в/в, день 1
-
#Преднизолон** 100 мг внутрь, дни 1–5
-
#Ритуксимаб**
-
375 мг/м2 в/в кап., день 0 или 1 все циклы курса
-
-
375 мг/м2 в/в кап. 1 цикл, далее #ритуксимаб** 1400 мг п/к, день 0 или 1[87–90]
-
#Бендамустин** 90 мг/м2 в/в кап., дни 1, 2
-
#Ритуксимаб** 375 мг/м2 в/в кап., дни 1, 8, 15, 22 первого цикла и в день 1 циклов 2-5
-
Леналидомид** 20 мг/день внутрь (при клиренсе креатинина 30-60 мл/мин – 10 мг/день), дни 1-21
-
Ибрутиниб** – 560 мг/сут (4 капсулы) внутрь 1 раз в день до прогрессирования или развития непереносимой токсичности.
Приложение А3.2 Лучевая терапия при ЛМЗ.
Параметры лучевой терапии определяются в зависимости от первичной распространенности процесса, локализации и объема опухолевого поражения. Определение исходных очагов поражения должно осуществляться с использованием компьютерной томографии с внутривенным контрастированием, позитронно-эмиссионной томографии.
-
Трансфузионная тактика [82,94–96,100]:
-
Профилактика тромботических осложнений [82]:
-
Накануне в вечернее время проводится постановка очистительной клизмы.
-
Премедикация накануне вечером по назначению врача-анестезиолога-реаниматолога.
3. Интраоперационное ведение [82,94,96,101,102]:
| Расшифровка | HBs-Ag | Анти-HBc | Анти-HBs | ДНК HBV | Действия |
| Не контактировал с HBV | - | - | - | - |
Провести вакцинацию. Противопоказаний к анти-CD20 нет |
| Вакцинация проведена | - | - | + | - |
Противопоказаний к анти-CD20 нет |
| Реконвалесцент | - | + | + | - |
Противопоказаний к анти-CD20 нет |
| Возможное латентное носительство HBV | - | + | - | +/- | Контроль ДНК HBV каждые 2 мес. во время терапии анти-CD20, назначение противовирусной терапии при появлении HBsAg или ДНК HBV |
| Неактивное носительство HBsAg | + | ± | - | ± | Назначение противовирусных препаратов во время терапии анти-CD20+ + год после окончания |
| Хронический гепатит B | + | * | * | ± | Отказаться от анти-CD20 или противовирусная терапия до терапии, весь период лечения + 1 год после окончания* |
Рекомендуемая начальная скорость первой инфузии — 50 мг/ч, в дальнейшем ее можно увеличивать на 50 мг/ч каждые 30 мин, доводя до максимальной скорости — 400 мг/ч. Последующие инфузии можно начинать со скорости 100 мг/ч и увеличивать ее на 100 мг/ч каждые 30 мин до максимальной скорости 400 мг/ч.
-
посттрансфузионные осложнения в анамнезе
-
беременность
-
рождение детей с гемолитической болезнью новорожденного в анамнезе
-
аллоиммунные антитела.
Индивидуальный подбор не отменяет постановку пробы на совместимость на плоскости при комнатной температуре и биологическую пробу врачом, проводящим трансфузию.
Трансфузии концентрата тромбоцитов
При некоторых гематологических заболеваниях, ассоциированных с повышенным риском геморрагических осложнений, пороговый уровень тромбоцитов должен быть увеличен. У беременных пациенток с опухолевыми гематологическими заболеваниями пороговый уровень тромбоцитов составляет 30 ◊ 109/л.
Переливание тромбоцитов не показано при тромбоцитопении иммунного генеза, за исключением случаев, когда оно необходимо по жизненным показаниям при развившемся кровотечении. При тромбоцитопатиях трансфузия тромбоцитов также рутинно не показана, и осуществляется только в неотложных ситуациях: при массивных кровотечениях, операциях, родах.
Показания к переливанию концентрата тромбоцитов с профилактической целью приведены в табл. А3.6.1.
Таблица А3.6.1. Показания к переливанию концентрата тромбоцитов
| Показание | Количество тромбоцитов в периферической крови | Примечания |
| Во время или после химиотерапии, в период миелотоксического агранулоцитоза | Менее 20 ◊ 109/л | При синдроме повышенного потребления тромбоцитов* данный порог необходимо повысить |
| Установка ЦВК | Менее 30 ◊ 109/л | - |
| Люмбальная пункция | Менее 50 ◊ 109/л | - |
| Объемные операции и малообъемные инвазивные вмешательства | Менее 50 ◊ 109/л | Помимо профилактической трансфузии, необходимо резервирование концентрата тромбоцитов для проведения операции. Доза определяется массой тела пациента, а количество трансфузий — объемом операции |
| Беременные | Менее 30 ◊ 109/л | - |
| Пациенты с ОПЛ | Менее 50 ◊ 109/л | - |
| ДВС-синдром | Менее 50 ◊ 109/л | Как часть основной терапии ДВС- синдрома |
Наличие у пациента геморрагического синдрома — прямое показание к переливанию концентрата тромбоцитов независимо от лабораторных показателей. Оценка тяжести геморрагического синдрома проводится по шкале ВОЗ (табл. А3.4.2).
| 1 степень (не требует трансфузии) |
|
Кровоточивость кожи и слизистых, включая полость рта Петехии менее 2 мм Пурпура менее 2,54 см в диаметре Экхимозы (очаги менее 10 см в диаметре) Ротоглоточные кровотечения Кровоизлияния в конъюнктиву Носовые кровотечения продолжительностью менее 1 часа, не требующие вмешательства Аномальные ациклические маточные кровотечения (менее двух прокладок в сутки) |
| 2 степень (в основном не требуют трансфузии) |
|
Экхимозы (более 10 см в диаметре) Гематомы Носовые кровотечения продолжительностью более 1 часа или требующие тампонады Кровоизлияния в сетчатку без ухудшения зрения Аномальные ациклические маточные кровотечения (более двух прокладок в сутки) Мелена, рвота с кровью, кровохарканье, гематурия, стул с кровью Кровотечения после инвазивных вмешательств, мышечно-суставные кровоизлияния |
| 3 степень (требуют трансфузии) |
|
Мелена Рвота с кровью Кровохарканье Гематурия, включая непрекращающееся кровотечение без свертывания Аномальные маточные кровотечения Стул с кровью Носовое кровотечение Ротоглоточное кровотечение Кровотечения после инвазивных вмешательств, мышечно-суставные кровоизлияния или кровоизлияния в мягкие ткани |
| 4 степень (требуют трансфузии) |
|
Кровоизлияния в сетчатку с нарушением зрения Нефатальные кровоизлияния в ЦНС с неврологической симптоматикой Фатальные кровотечения вне зависимости от источника |
Оптимальная доза для лечебных трансфузий — спорный вопрос; на основании общего консенсуса, терапевтические трансфузии должны увеличить количество тромбоцитов до уровня, обеспечивающего адекватный гемостаз.
Критерии эффективности трансфузий концентрата тромбоцитов
-
Экстренная реверсия действия антагонистов витамина К (группа В01АА по АТХ классификации); переливают СЗП из расчета 5–8 мл/кг.
-
Коррекция геморрагического синдрома при увеличении (>1,5 раз по сравнению с нормой) протромбинового времени или АЧТВ.
-
Возмещение объема при проведении плазмафереза.
-
Показания к переливанию фактора свертывания крови VIII** (B02BD02 по АТХ классификации)
-
Гипофибриногенемия (<1 г/л).
-
Периоперационный период или массивные кровотечения при уровне фибриногена <1,5 г/л.
Расчетная доза фактора свертывания крови VIII** (B02BD02 по АТХ классификации) составляет 1 ед. на 5 кг массы тела пациента или 15–20 ед. при массе тела 70 кг. В 1 единице содержится: фибриногена не менее 140 мг, FVIII — не менее 70 МЕ.
-
лейкоредуцированные — содержание лейкоцитов в дозе переливаемой среды снижено до 1 ◊ 106 клеток;
-
облученные эритроциты и тромбоциты (гамма-излучение или рентегновское излучение в дозе 25–50 Гр);
-
ограничение использования донорской плазмы путем использования взвешивающих растворов для эритроцитов;
-
после исследования донорской крови на маркеры вирусных инфекций посредством молекулярно-биологических методов.
С целью повышения безопасности трансфузий дополнительно могут применяться следующие технологии:
-
инактивация патогенов в концентрате тромбоцитов;
-
применение добавочных растворов для замещения донорской плазмы в концентрате тромбоцитов;
-
расширение спектра тестируемых маркеров вирусных инфекций (цитомегаловирус, вирус гепатита B, T-лимфотропный вирус человека и другие).
Степень тяжести посттрансфузионных реакции и осложнений можно определить по шкале, приведенной в табл. А3.6.4.
| Категория | Определение |
| 0 | Реакции и осложнений нет |
| 1 | Легкой степени: температура < 38°C, другие незначительные симптомы, без долгосрочных патологических последствий. Не требует терапевтического вмешательства |
| 2 | Средней степени: симптомы, требующие терапевтического вмешательства, стабильные гемодинамические и вентиляционные показатели, возможны долгосрочные последствия (например, аллосенсибилизация в качестве причины рефрактерности к трансфузиям) |
| 3 | Тяжелой степени (непосредственная угроза жизни реципиента): нестабильные гемодинамические и вентиляционные показатели |
| 4 | Смерть от осложнения, выявленного в первые 24 часов после трансфузии |
Нежелательные реакции, связанные с трансфузией донорской крови и (или) ее компонентов:
-
иммунные:
-
обусловленное трансфузией острое повреждение легких
-
обусловленная трансфузией одышка
-
-
неиммунные:
-
обусловленная трансфузией циркуляторная перегрузка
-
посттрансфузионная гипертензия
-
острый неиммунный гемолиз
-
септический шок
-
хроническая перегрузка железом
-
Решение вопроса о введении глюкокортикоидов и выбор дозы зависит от выраженности посттрансфузионной реакции или осложнения в анамнезе, степени тяжести сопутствующей патологии – инфекционные осложнения (особенно в период глубокой нейтропении), сахарный диабет, артериальная гипертензия и другие.
Лечебный плазмаферез в терапии рефрактерности к трансфузиям тромбоцитов
-
альбумин человека** 5% – (500–1000 мл), в среднем 800 мл;
-
раствор натрия хлорида** 0,9% в среднем 800 мл (500–1 000 мл).
Методические аспекты проведения ПА при тромбоцитопении, рефрактерной к трансфузиям концентрата тромбоцитов:
-
СЗП – в среднем 500 мл (500–1000 мл);
-
Альбумин человека** 5% 200–300мл (10–15 г);
-
Раствор натрия хлорида 0,9% в среднем 800 мл (500–1000 мл).
Соотношение СЗП + раствора 5% альбумина и раствора натрия хлорида** 0,9% составляет 2:1 при уровне общего белка ≤55 г/л:
-
СЗП – в среднем 800 мл (500–1000 мл);
-
Альбумин человека** 5% 200–300 мл (10–15 г);
-
Раствор натрия хлорида** 0,9% – в среднем 500 мл (500–1000 мл).
Приложение А3.7 Обеспечение сосудистого доступа
-
ограниченный доступ к периферическим венам,
-
необходимость проведения химиотерапии или парентерального питания, массивная инфузионная терапия,
-
необходимость мониторинга гемодинамики (центральное венозное давление),
-
необходимость мониторинга давления в легочной артерии,
-
установка кардиостимулятора,
-
необходимость проведения заместительной почечной терапии.
-
Абсолютные:
-
воспаление в планируемом месте доступа
-
недавно проведенное оперативное вмешательство в месте доступа
-
-
Относительные
-
выраженный геморрагический синдром (вследствие тромбоцитопении, гипофибриногенемии, наследственных или приобретенных коагулопатий).
-
-
ранение магистральных артерий,
-
развитие гематомы в месте пункции сосуда
-
развитие пневмоторакса, гемоторакса,
-
ранение грудного лимфатического протока,
-
повреждение нервных сплетений,
-
неправильная установка катетера
Поздние осложнения, возникающие во время или после эксплуатации катетера, бывают тромботическими, стенотическими и инфекционными.
Под катетер-ассоциированным тромбозом (КАТ) понимают сочетание клинических и инструментальных признаков тромбоза.
-
Клинические признаки: гиперемия кожи, отек подкожной клетчатки и боль, усиление подкожного сосудистого рисунка на стороне установки катетера, нарушение проходимости катетера, истечение жидкости по каналу катетера при проведении инфузии.
-
Инструментальные признаки: выявление при УЗИ гиперэхогенного образования в месте установки катетера, полностью или частично перекрывающего просвет сосуда, препятствующее смыканию стенок вен при компрессии датчиком, полное или частичное отсутствие кровотока при УЗИ в допплеровском режиме, появление турбулентного тока крови; дефекты контрастирования сосудов при КТ-ангиографии или прямой ангиографии.
Тромботические осложнения, ассоциированные с ЦВК, можно разделить на три вида:
-
«фибриновый чехол»,
-
обструкция катетера
-
пристеночный или обтурирующий внутрисосудистый тромбоз.
Бессимптомные КАТ более распространены, но их клиническое значение не ясно. Частота выявления КАТ колеблется, по разным данным, от 5% до 12-14% [113,114]. Факторы, предрасполагающие к развитию КАТ, разделяют на три группы:
-
связанные с пациентом (пол, возраст, наличие опухолевого заболевания, тромбофилии);
-
связанные с катетером (большой диаметр, материал катетера, т. е. «жесткий» катетер);
-
связанные с лечением (химиотерапия, парентеральное питание и введение других раздражающих веществ).
Наличие опухолевого заболевания увеличивает риск тромбоза.
-
Туннельная инфекция – местное воспаление по ходу сформированного туннеля от места выходного отверстия катетера до манжеты или с локализацией только в области фиксации манжеты.
-
Инфекция выходного отверстия – местное воспаление, с локализацией только в месте выхода катетера на поверхность кожи.
-
Инфекция подкожного кармана – местное воспаление, локализующееся в месте установки камеры порт-системы.
Способы контроля дистального конца ЦВК
Обследование пациента, подготовка к манипуляции
-
общий (клинический) анализ крови развернутый (при необходимости – с исследованием уровня тромбоцитов в крови по мазку)
-
коагулограмма (ориентировочное исследование системы гемостаза) с определением АЧТВ, протромбинового индекса, фибриногена, при необходимости – с исследованием агрегации тромбоцитов
-
определение основных групп крови по системе AB0, определение антигена D системы Резус (резус-фактор)
Инструментальная диагностика
-
рентгенография органов грудной клетки или – предпочтительно – компьютерная томография органов грудной клетки (КТ), с болюсным контрастным усилением (для исключения травмы легкого, контроля правильности установления ЦВК)
-
ультразвуковая допплерография артерий верхний конечностей
-
ЭКГ
Ультразвуковое сопровождение в реальном времени обеспечивает возможность выбора направления иглы при пункции внутренней яремной, аксиллярной, подмышечной или бедренной вены, позволяя тем самым избежать случайного ранение артерии [121].
Использование ультразвукового сопровождения даже при установке ЦВК при тромбоцитопении менее 20 ◊ 109/л позволяет избежать серьезных геморрагических осложнений.
В настоящее время УЗИ считается «золотым стандартом» при установке центрального венозного катетера с использованием яремного доступа, так как ВЯВ близко прилежит к поверхности кожи, нет мышц, которые бы могли затруднить визуализацию [30]. Помимо этого, правая ВЯВ образует практически прямую линию, что уменьшает травму сосуда и риск возникновения КАТ при использовании катетера.
Ультразвуковое сопровождение катетеризации центральных вен не исключает знания анатомии и поверхностных анатомических ориентиров, которые остаются необходимыми для ориентации как иглы, так и самого ультразвукового датчика. Ультразвуковое сопровождение катетеризации позволяет визуализировать не только вену, но и располагающиеся вблизи анатомические структуры.
В случае выявления поражения средостения по данным рентгенологического исследования, а также при клинической картине синдрома сдавления верхней полой вены, перед катетеризацией необходимо выполнение КТ органов грудной клетки с болюсным контрастным усилением для оценки проходимости крупных венозных сосудов, диагностики тромботических осложнений.
-
Ультразвуковое сопровождение катетеризации центральных вен
С использованием линейного датчика 10 МГц, который обеспечивает поверхность сканирования 20–50 мм и глубину до 80 мм или в допплеровском режиме.
Методы профилактики поздних осложнений
В случае перерывов в лечении катетер необходимо промывать 1 раз в 24 часа для нетуннелируемых ЦВК, 1 раз в 7 (10) дней для ПИЦВК и туннелируемых катетеров, 1 раз в 30 дней для порт-систем.
Асептическая повязка накладывается на место выхода катетера на кожу. Частота замены повязки с обязательной обработкой места выхода катетера, в соответствии с общими принципами хирургической обработки, 2 раза в неделю при использовании нетуннелируемых катетеров, 1 раз в неделю для туннелируемых катетеров и ПИЦВК, и при необходимости (таб. А3.7.1). Предпочтительно использовать прозрачные повязки для возможности ежедневной оценки кожи в месте установки катетера на наличие воспалительных изменений.
| Промывание катетера | Введение препаратов | Промывать катетеры необходимо до и после введения лекарственных препаратов и компонентов крови. Использовать болюсное (импульсный режим) промывание 10 мл физиологического раствора для всех внутривенных катетеров (за исключением периферических катетеров, где достаточно 5 мл). |
| Парентеральное питание, компоненты крови | После введения в катетер компонентов крови или парентерально питания использовать 20 мл (10 мл ◊ 2) для промывания катетера. Промывать необходимо чередуя импульсный режим и струйное болюсное введение. | |
| Закрытие катетера | Объем |
1 мл для периферических катетеров 1,5 мл для катетеров типа MidLine, ПИЦВК, нетуннелируемых ЦВК и туннелируемых ЦВК с небольшим (≤1 мм) внутренним диаметром 2,0–2,5 мл для туннелируемых ЦВК с большим (≥1 мм) внутренним диаметром (в каждый ход), порт систем |
| Режимы |
Каждые 8–24 ч для кратковременных ЦВК Еженедельно – для туннелируемых ЦВК и ПИЦВК Каждые 6–8 недель для порт-систем |
-
Физикальный осмотр
-
Выбор типа ЦВК после физикального осмотра, сбора анамнеза, ознакомления с результатами лабораторных и инструментальных методов исследования.
-
Дуплексное сканирование вен в месте планируемой установки ЦВК (определяется диаметр вены, наличие сдавления вен в месте пункции и по ходу установленного ЦВК, тромба в просвете вен, наличие клапанного аппарата и его состоятельность. Устанавливать ЦВК в вену, диаметр которой не превышает 50% диаметра катетера и/или выявлен тромбоз недопустимо).
-
Имплантация ЦВК с обязательным позиционированием дистального конца у кава-атриального соединения в случае катетеризации ВПВ и кава-атриального соединения или ниже устья почечных вен при катетеризации НПВ.
-
Закрепление катетера на коже больного у места выхода с использованием шовных материалов или устройств бесшовной фиксации.
-
Наложение асептической повязки.
-
Заполнение протокола катетеризации с обязательным указанием ранних осложнений, количества попыток катетеризации, типа установленного ЦВК.
Дополнительные сведения об особенностях выполнения обработки катетера (смена повязки):
-
При проведении процедуры обработки (перевязки) с ЦВК пациент может сидеть или лежать на спине, рука, на стороне которой в вене находится катетер, расположена вдоль туловища. При применении дополнительных зажимов не катетере снятие заглушки не связано с фазой дыхания. При проведении процедуры с катетером, находящимся в бедренной вене, ножной конец кровати опущен на 25°. Снятие заглушки не связано с фазой дыхания.
-
При смене повязки у пациентов с чувствительной кожей рекомендуется нанести стерильное барьерное средство для защиты кожи вокруг места установки сосудистого катетера и дождаться полного его высыхания.
-
Выбор повязки необходимо осуществлять с учетом индивидуальных особенностей пациента. Если существуют предрасполагающие к развитию инфекции факторы (длительность стояния ЦВК свыше трех суток; сниженный иммунный статус (онкологические пациенты и т.д.); повышенный риск колонизации катетера), то рекомендуется выбирать прозрачную полиуретановую повязку, содержащую гелевую подушечку с хлоргексидином. Для прочих случаев оптимальным выбором является стерильная прозрачная повязка.
-
Если наблюдается кровоточивость вокруг места входа катетера в первые сутки после его введения, допустимо использование нетканой повязки с впитывающей подушечкой, которая подлежит замене на прозрачную через 24ч.
-
Замена прозрачных полиуретановых повязок на ЦВК производится каждые 5-7 сут (при условии, что фиксация не нарушена, нет выделений, сохранен обзор).
-
Визуальный осмотр места установки сосудистого катетера проводить не реже 1 раза в сутки
Приложение А3.8 Профилактика и лечение тошноты и рвоты
-
Острая рвота – развивается в первые 24 ч после ПХТ; отличается высокой интенсивностью; редко сопровождается тошнотой.
-
Отсроченная рвота – развивается на 2–5 сутки после начала ПХТ; менее интенсивна, чем острая; часто сопровождается постоянной тошнотой.
-
Условно-рефлекторная рвота – развивается как условный рефлекс на ПХТ и/или сопутствующие ей манипуляции и окружающую обстановку; риск ее развития увеличивается с количеством курсов ПХТ; может сохраняться в течение длительного времени после окончания ПХТ.
-
Неконтролируемая тошнота и рвота – развивается на фоне адекватной антиэметической профилактики и требует дополнительной коррекции.
-
Рефрактерная рвота – возникает на последующих курсах ПХТ при неэффективности противорвотной профилактики и / или препаратов резерва на предыдущих курсах лечения.
Эметогенный потенциал противоопухолевых препаратов
-
минимальный – развитие рвоты менее чем у 10% пациентов;
-
низкий – развитие рвоты у 10–30% пациентов;
-
средний – развитие рвоты у 30–90% пациентов;
-
высокий – развитие рвоты более чем у 90% пациентов.
Таблица А3.8.1. Уровень эметогенности отдельных противоопухолевых препаратов, применяемых при лечении ЛМЗ
| Уровень эметогенности | Противоопухолевые препараты для внутривенного введения | Противоопухолевые препараты для перорального приема |
|
Высокий (>90 %) |
|
|
| Умеренный (30–90 %) |
|
|
|
Низкий (10–30 %) |
|
|
| Минимальный (<10 %) |
|
|
-
Блокаторы серотониновых 5HT3-рецепторов. Эта группа препаратов включает ондансетрон**, гранисетрон, трописетрон, палоносетрон. Механизм действия препаратов обусловлен способностью селективно блокировать серотониновые 5-HT3-рецепторы, предупреждая возникновение рвотного рефлекса вследствие стимуляции афферентных волокон блуждающего нерва серотонином, выделяющимся из энтерохромаффинных клеток слизистой оболочки ЖКТ. Антагонисты 5-HT3-рецепторов также угнетают центральные звенья рвотного рефлекса, блокируя 5-HT3-рецепторы дна IV желудочка головного мозга. Препараты назначаются за 30–60 минут до ХТ. Необходим мониторинг ЭКГ, электролитов у больных с признаками кардиальных нарушений. Блокаторы 5-HT3-рецепторов могут удлинять интервал QT, в связи с чем у пациентов с синдромом удлинения QT следует избегать применения 5-HT3-антагонистов, за исключением палоносетрона, который не оказывает влияния на интервал QT. Палоносетрон – высокоселективный антагонист серотониновых рецепторов, имеющий самый длительный период полувыведения (до 40 часов). Применяется однократно с 1-го дня 1-го цикла при однодневном курсе ПХТ и через день – при многодневном курсе ПХТ.
Таблица А3.8.2. Режим дозирования антагонистов 5-HT3-рецепторов
| Препарат | Разовая доза, мг | Способ применения |
| Ондансетрон** |
8 16 16 |
в/в внутрь суппозитории ректальные |
| Гранисетрон |
3 2 |
в/в внутрь |
| Трописетрон | 5 | в/в или внутрь |
| Палоносетрон | 0,25 | в/в |
-
Глюкокортикоиды. Если схема ХТ содержит глюкокортикоиды, дополнительного назначения #дексаметазона** с противорвотной целью не требуется. Добавление #дексаметазона** к антагонистам серотониновых рецепторов позволяет уменьшить риск появления острой тошноты и рвоты и предотвращает развитие отсроченной тошноты и рвоты. Кроме того, он обладает самостоятельной противорвотной активностью и может использоваться в монотерапии для профилактики острой рвоты после введения низкоэметогенных цитостатиков. Препарат назначается в дозе 12 мг внутривенно однократно за 30–60 минут до ХТ. В случае высокоэметогенной терапии в последующие дни назначается внутрь в дозе 8 мг два раза в сутки, продолжительностью до 5 дней [62,123,125].
-
Антагонисты рецепторов нейрокинина-1 (NK-1) – отдельные препараты из группы «A04AD другие противорвотные препараты». В эту группу препаратов входят апрепитант и фосапрепитант. Апрепитант – селективный высокоаффинный антагонист рецепторов NK-1 центрального механизма действия (за счет связывания с NK1-рецепторами головного мозга). Центральное действие апрепитанта обладает большой продолжительностью, причем он ингибирует как острую, так и отсроченную фазы рвоты, а также повышает противорвотную активность блокаторов серотониновых 5HT3-рецепторов (например, ондансетрона**) и глюкокортикоидов (дексаметазона**). Антагонисты NK1-рецепторов являются умеренными ингибиторами CYP3A4, что необходимо учитывать при одновременном использовании препаратов, метаболизируемых этой же системой (так, апрепитант снижает эффективность гормональных контрацептивов, в связи с чем, необходимо использовать альтернативные методы контрацепции; апрепитант повышает концентрацию глюкокортикоидов, в связи с чем в комбинации с апрепитантом доза дексаметазона** должна быть снижена приблизительно на 50%; у пациентов, поручающих варфарин**, необходимо дополнительно контролировать уровень международного нормализованного отношения). Антагонисты NK1-рецепторов применяют в комбинации с глюкокортикоидами и блокаторами серотониновых 5HT3-рецепторов. Апрепитант принимается за час до ХТ, фосапрепитант вводится за 30 минут до ХТ в дозах, представленных в таблице 7.6.3.
Таблица А3.8.3. Режим дозирования антагонистов NK1-рецепторов
| Препарат | Разовая доза, мг |
Способ применения / Режим дозирования |
| Апрепитант |
125 80 |
Внутрь в 1 день Внутрь во 2 и 3 дни ПХТ |
| Фосапрепитант | 150 | В/в однократно |
-
Блокаторы рецепторов допамина могут использоваться для профилактики тошноты при низкоэметогенной химиотерапии В эту группу входят стимуляторы моторики ЖКТ (метоклопрамид**), алифатические производные фенотиазина (#хлорпромазин** 25 мг внутрь каждые 6 часов [62,123,125]), производные бутирофенона (галоперидол** 1–2 мг внутрь каждые 4-6 часов), производные бензодиазепина (#лоразепам 0,5–2 мг внутрь или внутримышечно\внутривенно, разовая доза 50 мкг\кг каждые 4–6 часов [62,123,125]). Препараты обладают седативными и анксиолитическими свойствами. Метоклопрамид**, широко использовавшийся ранее в высоких дозах для профилактики острой тошноты и рвоты после высоко- и среднеэметогенной ПХТ, в настоящее время применяется реже, так как при сопоставимой эффективности с антагонистами серотониновых рецепторов имеет значительное количество выраженных побочных эффектов. Согласно международным рекомендациям, использование метоклопрамида** допустимо в стандартных дозах для профилактики острой тошноты и рвоты после низкоэметогенной химиотерапии, для профилактики отсроченной рвоты в комбинации с #дексаметазоном**. Режим дозирования – 10 мг 1–3 раза в сутки внутривенно или внутрь. Добавление блокаторов рецепторов допамина к схеме противорвотной терапии проводится по показаниям на усмотрение лечащего врача.
-
Нейролептики (диазепины, оксазепины, тиазепины и оксепины – N05AH по АТХ классификации). Добавление нейролептиков к схеме противорвотной терапии проводится по показаниям на усмотрение лечащего врача (например, при возникновении неконтролируемой тошноты и рвоты – #оланзапин 5–10 мг в сутки внутрь [62,125]).
Принципы профилактики и терапии тошноты и рвоты.
-
Определить эметогенный потенциал назначенного режима ХТ
-
Назначить профилактическую терапию, исходя из эметогенности режима ХТ, начиная с первого курса
-
Назначить лечение в случае развития тошноты и рвоты на фоне профилактической терапии
-
В случае развития тошноты и рвоты внести изменения в профилактическую терапию на последующих циклах ХТ
-
Критерием эффективности противорвотной терапии является полное отсутствие (полный контроль) рвоты и тошноты в течение 24 часов (период развития острой рвоты) с момента введения противоопухолевых препаратов.
Профилактика острой и отсроченной тошноты и рвоты при высоко-эметогенной ХТ
Профилактика острой и отсроченной тошноты и рвоты при умеренно-эметогенной ХТ
Профилактика тошноты и рвоты при лучевой терапии
Терапия неконтролируемой тошноты и рвоты
Развитие неконтролируемой или рефрактерной рвоты может развиться у пациентов с так называемым сверхбыстрым метаболическим фенотипом (ускоренный метаболизм антагонистов 5-HT3-рецепторов в печени). В таком случае целесообразна смена 5-HT3-блокатора на другой антиэметик данного класса препаратов.
-
Назначать антиэметики строго по часам, а не при появлении тошноты или рвоты.
-
Оценивать предпочтительный путь введения препаратов (парентерально, в ректальных суппозиториях, или внутрь).
-
Осуществлять адекватную гидратацию и коррекцию электролитов.
-
Добавлять при диспепсии блокаторы Н2-гистаминовых рецепторов или ингибиторы протонного насоса.
При возникновении неконтролируемой тошноты и рвоты на фоне трехкомпонентной противорвотной схемы стандартного подхода нет, следует рассмотреть добавление препаратов иного класса из группы резерва [62,125]:
-
производные бензодиазепина (например, #лоразепам по 0,5–2 мг каждые 4–6 ч);
-
#метоклопрамид** по 20 мг каждые 6 ч);
-
алифатические производные фенотиазина (например #хлорпромазин** 25 мг 4 раза в сутки);
-
производные бутирофенона (например, галоперидол** 1–2 мг каждые 4–6 ч).
Возможно также использование альтернативного варианта профилактики тошноты и рвоты [125]:
-
#оланзапин 5–10 мг в сутки внутрь с 1 по 3 дни;
-
палоносетрон 0,25 мг в/в за 60 минут до ХТ в 1 день однократно;
-
#дексаметазон** 20 мг в/в за 30 минут до ХТ в 1 день.
Профилактика и терапия условно-рефлекторной рвоты
Приложение А3.9 Профилактика язвенной болезни желудка и 12-перстной кишки на фоне терапии глюкокортикоидами
Диагностика язвенной болезни желудка и 12-перстной кишки при применении ГСК
Ингибиторы протонного насоса (ИПН)
Время суток и прием пищи не влияют на активность ИПН. Коррекции дозы при почечной недостаточности не требуется. При невозможности перорального приема ИПН вводятся внутривенно.
| Факторы риска | Рекомендуемые действия |
|
Индивидуальные для пациента:
|
0–1 факторов риска: - ацетилсалициловая кислота** 75–325 мг/сут
≥ 2 фактора риска: - НМГ (из группы B01AB Группа гепарина по АТХ классификации) (эквивалентно 40 мг/сут эноксапарина натрия**) или - Прямые оральные антикоагулянты (B01AE Ингибиторы тромбина прямые по АТХ классификации) |
Определение продолжительности антитромботической профилактики должно проводиться на основании оценки сохранения/прекращения действия факторов риска развития тромбоза. К таким факторам, в первую очередь, относятся активность основного заболевания, химио- и лучевая терапия, ограничение подвижности пациента, наличие у него воспалительной активности инфекционного или неинфекционного генеза, дыхательной или сердечной недостаточности. В случае неполного устранения провоцирующих тромбоз факторов и сохранения высокого риска развития ВТЭО необходимо продолжение антитромботической профилактики. На начальной стадии антитромботической профилактики у пациентов с 0–1 фактором риска ВТЭО может применяться ацетилсалициловая кислота**; у пациентов с ≥2 факторами риска препаратами выбора являются низкомолекулярные гепарины (НМГ – отдельные препараты из группы В01АВ группа гепарина, включающие #далтепарин натрия 100 МЕ / кг 2 раза в сутки или 200 МЕ / кг 1 раз в сутки, #эноксапарин натрия** 100 МЕ / кг 2 раза в сутки или 150 МЕ / кг 1 раз в сутки, #надропарин кальция 86 МЕ / кг 2 раза в сутки или 172 МЕ / кг 1 раз в сутки, парнапарин натрия**, бемипарин натрия), антагонисты витамина К (АВК – варфарин**) или прямые оральные антикоагулянты (ПОАК – B01AE ингибиторы тромбина прямые [#дабигатрана этексилат**], B01AF #ривароксабана** B01AF01, #апиксабана** B01AF02, прямые ингибиторы фактора Xа и B01AX другие антитромботические средства [фондапаринукс натрия]) [133]. Нет однозначных преимуществ тех или иных НМГ, АВК или АВК.
| Дни приема варфарина** 2–5 | Дни приема варфарина** 6 и далее |
| МНО 1.1–1.3 – повторить инициальную дозу | МНО 1.1–1.4 – увеличить дозу на 20% |
| МНО 1.4–1.9 – 50% инициальной дозы | МНО 1.5–1.9 – увеличить дозу на 10% |
| МНО 2.0–3.0 – 50% инициальной дозы | МНО 2.0–3.0 – продолжать без изменений |
| МНО 3.1–3.5 – 25% инициальной дозы | МНО 3.1–3.5 – уменьшить дозу на 10% |
| МНО > 3.5 – пауза до тех пор, пока МНО не станет < 3.5, затем начать повторный прием 50% предшествующей дозы | МНО 3.6–4.0 – однократно 50% дозы, затем в уменьшенной на 20% дозе |
| МНО > 4.0 пауза до тех пор, пока МНО не станет < 3.5, затем начать повторный прием (25% предшествующей дозы) |
В случае если при лечении варфарином** появляется патологическая кровоточивость, необходимо определить протромбин по Квику (МНО), отменить варфарин**. В лечении тяжелых варфариновых кровотечений используются: концентраты протромбинового комплекса или свежезамороженная плазма (СЗП).
-
лечение прямыми пероральными антикоагулянтами должно быть начато за 0–2 часа до следующего планового введения парентерального антикоагулянта;
-
замена введения очередной дозы парентерального препарата приемом дозы перорального антикоагулянта для НМГ и фондапаринукса натрия – через 24 часа, для НФГ – через 8 часов (для #ривароксабана** (B01AF01 по АТХ классификации) – прием пероральной формы сразу после отмены НФГ).
Препараты АВК и ПОАК можно использовать в виде монотерапии для профилактики тромботических нарушений во время ХТ и других видов специфического лечения.
-
для дабигатрана этексилата** (B01AE07 по АТХ классификации) или #ривароксабана** (B01AF01 по АТХ классификации) необходим перерыв 24 часа с приема последней дозы, после чего нужно ввести парентеральный антикоагулянт;
-
для #апиксабана** (B01AF02 по АТХ классификации) – выждать 12 часов с приема последней дозы и ввести парентеральный антикоагулянт.
Приложение А3.11 Трансплантация аутологичных гемопоэтических стволовых клеток
-
оценка статуса больного (наличие показаний для трансплантации аутологичных гемопоэтических стволовых клеток (ауто-ТГСК), стандартное обследование для исключения факторов, препятствующих проведению высокодозного лечения, коморбидность, согласие больного, изучение предшествующей терапии - количество курсов и сроки окончания лечения, использование лучевой терапии)
-
оценка статуса болезни - глубина противоопухолевого ответа, наличие ремиссии, сроки ее достижения;
-
оценка состояния кроветворения (гистологическое исследование костного мозга позволит выявить угнетение ростков кроветворения, а также инфильтрацию костного мозга опухолевыми клетками)
Наиболее доступным иммунологическим маркером кроветворных предшественников является экспрессия антигена СD34. Эта молекула присутствует как на наиболее примитивных стволовых клетках, так и на дифференцированных предшественниках, однако на зрелых гемопоэтических клетках экспрессии CD34 нет.
Именно суммарный пул CD34+ клеток определяет сроки восстановления кроветворения после трансплантации [135,136]. Неоднократно предпринимались попытки установить количество CD34+ клеток, необходимое для быстрого и успешного восстановления гемопоэза после трансплантации[136–139].
К факторам доказанного риска неудачи относятся два параметра: если показатели циркулирующих в крови СD34+ не достигают 20 клеток в 1 мкл. на 4-6-й дни после старта Г–КСФ или же заготовлено менее 2 х 106 CD34+ клеток/кг за 3 лейкафереза.
-
Г-КСФ в монорежиме
-
Г-КСФ после миелосупрессивной химиотерапии (ХТ + Г-КСФ)
-
Г-КСФ в сочетании с плериксафором
Данный режим также называют «мобилизация на стабильном состоянии кроветворения», так как у пациента не развивается миелотоксический агранулоцитоз (МТА).
-
Мобилизация ГСК у здоровых доноров;
-
Мобилизация ГСК у пациентов с онкогематологическими заболеваниями;
-
Мобилизация ГСК у пациентов, проведение которым режима «ХТ + Г-КСФ» не является безопасным (при наличии коморбидности, кардиальной патологии, диализ-зависимой почечной недостаточности);
-
Повторная мобилизация после неудачи первой мобилизации ГСК схемами, включающими миелосупрессивные препараты.
Схема мобилизации ГСК
Таблица 1. Схема мобилизации ГСК «Г-КСФ в монорежиме»
| Дни | 1 | 2 | 3 | 4 | 5 | 6 |
|
Филграстим**, 10 мкг/кг |
Х | Х | Х | Х | Х | отмена |
| Лейкаферез | V | V | V |
-
Мобилизация ГСК у пациентов с онкогематологическими заболеваниями
Схема мобилизации ГСК «ХТ + Г-КСФ»
При условии восстановления лейкоцитов периферической крови и адекватного количества среди них CD34+ клеток начинаются процедуры сбора ГСК (как правило, на 6–8 день введения Г-КСФ).
На рисунке 1 представлен алгоритм определения показаний к проведению первого лейкафереза. Количество лейкаферезов зависит от результата сбора ГСК (от 1 до 5). В заключительный день проведения лейкафереза Г-КСФ не вводится.

Если период МТА осложнился тяжелым инфекционным процессом и к моменту сбора ГСК сохраняются осложнения, угрожающие жизни, от лейкафереза следует воздержаться. Если состояние стабилизировано, мобилизация и сбор ГСК продолжаются.
-
Повторная мобилизация после неудачи первой мобилизации ГСК схемами, включающими миелосупрессивные препараты в сочетании с Г-КСФ или применения Г-КСФ в монорежиме у пациентов с лимфомами и ММ;
-
Неудовлетворительные результаты текущей мобилизации у пациентов с лимфомами и ММ.
Неудовлетворительные результаты текущей мобилизации:
-
количество CD34+ клеток в периферической крови в день предполагаемого первого лейкафереза менее 10 клеток/мкл (при планируемой одной аутотрансплантации) и 10-20 клеток/мкл (при планируемой тандемной аутотрансплантации);
-
за первый лейкаферез заготовлено менее 30–50% от необходимого количества CD34+ клеток.
Схема мобилизации ГСК
| Дни | 1 | 2 | 3 | 4 | 5 | 6 |
|
Филграстим**, 10 мкг/кг |
Х | Х | Х | Х | Х | |
| Плериксафор, 240 мкг/кг | Х | (Х) | ||||
| Лейкаферез | V | V |
| Режим мобилизации | Преимущества | Недостатки |
| Г-КСФ в монорежиме |
Уменьшение сроков госпитализации, четко планируемые сроки лейкаферезов, отсутствие антибиотикотерапии, заместительной трансфузионной терапии
|
Неэффективна у предлеченных больных |
| ХТ+ Г-КСФ | Высокая эффективность мобилизации |
Цитопения Инфекционные осложнения Трансфузии компонентов крови Нет четкого планирования сроков лейкаферезов Небезопасна при коморбидности |
Продолжаются многочисленные исследования, направленные на оптимизацию режимов мобилизации стволовых клеток, обсуждаются возможности применения новых ростовых факторов, апробируются различные дозы цитостатических препаратов.
-
Если есть сложности с доступом к периферическим венам, перед началом сбора ГСК устанавливается перфузионный катетер в центральную вену;
-
С целью профилактики тромботических осложнений проводится введение #эноксапарина натрия** 40 мг или его эквивалент в профилактической дозе подкожно один раз в сутки на фоне введения Г-КСФ и в течение 2-3 суток после его отмены [147];
-
Адекватное обезболивание при болевом синдроме в костях, вызванном введением Г-КСФ. Предпочтение отдается опиоидам (тримеперидин** 10 мг в/в, трамадол** 100 мг в/в, фентанил** 25 мкг/час трансдермально), при отсутствии миелотксического агранулоцитоза возможно использование нестероидных противовоспалительных и противоревматических препаратов.
-
необходима установка центрального венозного катетера (ЦВК) для обеспечения сосудистого доступа. Если есть сложности с доступом к периферическим венам, перед началом сбора ГСК центральный катетер меняют на перфузионный;
-
круглосуточное введение #гепарина натрия** с целью профилактики тромботических осложнений. Начальная доза #гепарина натрия** 12 000 ЕД/сут, далее – под контролем АЧТВ (АЧТВ 1,5–2 нормы) [147];
-
введение химиопрепаратов сопровождается массивной гидратацией из расчета 1,5–3 л/м2, гипоурикемической терапией (за исключением схем, содержащих метотрексат**), диуретической терапией.
-
при наличии в схеме ХТ ифосфамида**, циклофосфамида** для защиты слизистой мочевого пузыря и мочевыводящих путей в день введения препарата назначается месна** в дозировке в соответствии с инструкцией по применению препарата;
-
при наличии в схеме ХТ метотрексата** через 12 ч после окончания его введения назначается кальция фолинат** в дозе 25 мг внутрь и внутривенно 6 раз в сутки 4 дня или до достижения концентрации метотрексата** в крови менее 0,1 мкмоль/л.
-
противорвотная терапия (см. приложение А3.8);
-
профилактика язвенной болезни желудка и 12-перстной кишки (см. приложение А3.9)
-
овариопротекция проводится женщинам фертильного возраста
Лейкаферез и криоконсервирование
При содержании CD34+ клеток в периферической крови более 10–20 в 1 мкл. можно начинать первый лейкаферез.
Если абсолютное количество CD34+ клеток в крови более 20 в 1 мкл., высока вероятность заготовки трансплантата за 1–2 процедуры лейкафкереза.
-
Общий (клинический) анализ крови развернутый
-
Анализ крови биохимический (общетерапевтический) с обязательным определением уровней общего белка, альбумина, креатинина, мочевой кислоты, калия, кальция, лактатдегидрогеназы
-
Общий (клинический) анализ мочи
-
Исследование уровня глюкозы в крови
-
Коагулограмма (ориентировочное исследование системы гемостаза)
-
Получение цитологического препарата костного мозга путем пункции, цитологическое исследование мазка костного мозга (миелограмма)
-
Получение гистологического препарата костного мозга, патолого-анатомическое исследование биопсийного (операционного) материала костного мозга (в том числе с применением иммуногистохимических методов)
-
Исследование биологического материала (костного мозга) методом проточной цитометрии для определения маркеров минимальной остаточной болезни.
-
Определение основных групп крови по системе AB0, определение антигена D системы Резус (резус-фактора), определение подгруппы и других групп крови меньшего значения A-1, A-2, D, Cc, E, Kell, Duffy
-
Молекулярно-биологическое исследование крови на вирус гепатита B (Hepatitis B virus) и на вирус гепатита C (Hepatitis C virus); молекулярно-биологическое исследование крови на вирус иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV-1)
-
Регистрация электрокардиограммы
-
Эхокардиография
-
Холтеровское мониторирование сердечного ритма – при выявлении нарушений ритма и проводимости на ЭКГ
-
УЗИ брюшной полости (комплексное)
-
Ультразвуковая допплерография сосудов (артерий и вен) нижних конечностей - при необходимости
-
Эзофагогастродуоденоскопия с биопсией – при наличии диспепсических расстройств или язвенной болезни желудка/ двенадцатиперстной кишки в анамнезе
-
МРТ головного мозга
-
КТ органов грудной полости
-
Люмбальная пункция с последующим цитологическим, комплексным иммунохимическим и иммунофенотипическим исследованием ликвора при подозрении на вовлечение в патологический процесс центральной нервной системы
-
Осмотр врача-акушера-гинеколога и УЗИ органов малого таза - для женщин
-
Позитронно-эмиссионная томография, совмещенная с КТ
-
Исследование клональности (В/Т в зависимости от варианта заболевания) в периферической крови, костном мозге методом полимеразной цепной реакции
-
Определение уровня иммуноглобулинов G, А и M в крови
-
УЗИ периферических лимфоузлов
-
КТ органов грудной полости/ брюшной полости/ таза – для оценки противоопухолевого ответа при отсутствии возможности выполнить ПЭТ/КТ или наличии противопоказаний
Противопоказания к выполнению ауто-ТГСК
Относительные противопоказания к выполнению ауто-ТГСК
Обследование пациентов перед ауто-ТГСК
-
Общий (клинический) анализ крови развернутый
-
Анализ крови биохимический (общетерапевтический) с обязательным определением уровней общего белка, альбумина, креатинина, мочевой кислоты, калия, кальция, лактатдегидрогеназы
-
Общий (клинический) анализ мочи
-
Исследование уровня глюкозы в крови
-
Коагулограмма (ориентировочное исследование системы гемостаза)
-
Получение цитологического препарата костного мозга путем пункции, цитологическое исследование мазка костного мозга (миелограмма)
-
Получение гистологического препарата костного мозга, патолого-анатомическое исследование биопсийного (операционного) материала костного мозга (в том числе с применением иммуногистохимических методов)
-
Исследование биологического материала (костного мозга) методом проточной цитометрии для определения маркеров минимальной остаточной болезни.
-
Определение основных групп крови по системе AB0, определение антигена D системы Резус (резус-фактора), определение подгруппы и других групп крови меньшего значения A-1, A-2, D, Cc, E, Kell, Duffy
-
Молекулярно-биологическое исследование крови на вирус гепатита B (Hepatitis B virus) и на вирус гепатита C (Hepatitis C virus); молекулярно-биологическое исследование крови на вирус иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV-1)
-
Регистрация электрокардиограммы
-
Эхокардиография
-
Функция внешнего дыхания
-
Холтеровское мониторирование сердечного ритма – при выявлении нарушений ритма и проводимости на ЭКГ
-
УЗИ брюшной полости (комплексное)
-
Ультразвуковая допплерография сосудов (артерий и вен) нижних конечностей - при необходимости
-
Эзофагогастродуоденоскопия с биопсией – при наличии диспепсических расстройств или язвенной болезни желудка/ двенадцатиперстной кишки в анамнезе
-
МРТ головного мозга, придаточных пазух носа с целью выявления скрытых очагов инфекций
-
КТ органов грудной полости
-
Люмбальная пункция с последующим цитологическим, комплексным иммунохимическим и иммунофенотипическим исследованием ликвора при подозрении на вовлечение в патологический процесс центральной нервной системы
-
Осмотр врача-стоматолога.
-
Осмотр врача-акушера-гинеколога и УЗИ органов малого таза - для женщин.
-
Позитронно-эмиссионная томография, совмещенная с КТ.
-
Исследование клональности (В/Т в зависимости от варианта заболевания) в периферической крови, костном мозге методом полимеразной цепной реакции.
-
Определение уровня поликлональных иммуноглобулинов (A, G,M).
-
КТ органов грудной полости с контрастированием при первичном вовлечении средостения.
-
УЗИ периферических лимфоузлов.
-
Активность лактатдегидрогеназы.
-
КТ грудной полости/ брюшной полости/ таза – для оценки противоопухолевого ответа при отсутствии возможности выполнить ПЭТ/КТ или наличии противопоказаний.
| Препарат | Дни введения перед ауто-ТГСК | Разовая доза | Суточная доза | Курсовая доза | Особенности введения |
| #Кармустин** | -6 день | 300мг/м2 | 300мг/м2 | 300мг/м2 | Вводится в/в в виде инфузии в течение 2 ч в 500 мл 0,9% натрия хлорида** |
| #Этопозид** | -5, -4, -3, -2 дни | 200мг/м2 | 200мг/м2 | 800 мг/м2 | Вводится в/в в виде инфузии в течение 30 минут в 500 мл 0,9% натрия хлорида** |
| #Цитарабин** | -5, -4, -3, -2 дни | 200мг/м2 | 400 мг/ м2 | 1600 мг/м2 | Вводится в/в в виде инфузии в течение 30 минут в 500 мл 0,9% натрия хлорида** |
| #Мелфалан** | - 1 день | 140 мг/м2 | 140 мг/м2 | 140 мг/м2 | Вводится в/в в виде инфузии в течение 1ч в 500 мл 0,9% натрия хлорида** |
Для снижения токсичности режима предтрансплантационной подготовки BEAM в ряде случаев вместо кармустина используется ломустин (CEAM / LEAM). Схема введения препаратов и дозы представлены в таблице 5.
| Препарат | Дни введения перед ауто-ТГСК | Разовая доза | Суточная доза | Курсовая доза | Особенности введения |
| #Ломустин** | -6 день | 200мг/м2 | 200мг/м2 | 200мг/м2 | Внутрь |
| #Этопозид** | -5, -4, -3, -2 дни | 200мг/м2 | 200мг/м2 | 800 мг/м2 | Вводится в/в в виде инфузии в течение 30 минут в 500 мл 0,9% натрия хлорида** |
| #Цитарабин** | -5, -4, -3, -2 дни | 200мг/м2 | 400 мг/м2 | 1600 мг/м2 | Вводится в/в в виде инфузии в течение 30 минут в 500 мл 0,9% натрия хлорида** |
| #Мелфалан** | - 1 день | 140 мг/м2 | 140 мг/м2 | 140 мг/м2 | Вводится в/в в виде инфузии в течение 1ч в 500 мл 0,9% натрия хлорида** |
| Препарат | Дни введения перед ауто-ТГСК | Разовая доза | Суточная доза | Курсовая доза | Особенности введения |
| #Бендамустин** | -7, -6 день | 200мг/м2 | 200мг/м2 | 400 мг/м2 | Вводится в/в в виде инфузии в течение 30-60 минут в 500 мл 0,9% натрия хлорида** |
| #Этопозид** | -5, -4, -3, -2 дни | 200мг/м2 | 200мг/м2 | 800 мг/м2 | Вводится в/в в виде инфузии в течение 30 минут в 500 мл 0,9% натрия хлорида** |
| #Цитарабин** | -5, -4, -3, -2 дни | 200мг/м2 | 400 мг/м2 | 1600 мг/м2 | Вводится в/в в виде инфузии в течение 30 минут в 500 мл 0,9% натрия хлорида** |
| #Мелфалан** | - 1 день | 140мг/м2 | 140мг/м2 | 140мг/м2 | Вводится в/в в виде инфузии в течение 1ч в 500 мл 0,9% натрия хлорида** |
-
Все инфузии проводятся в центральный венозный катетер
-
На этапе предтрансплантационного кондиционирования объем инфузионной терапии составляет 2–3 литра в сутки, после трансплантации объем инфузий должен составлять не менее 1,5 литров в сутки, водная нагрузка распределяется равномерно в течение суток.
-
У пациентов на гемодиализе объем солевых растворов не должен превышать 1 литр в сутки, при этом калия хлорид** назначается только при развитии гипокалиемии.
-
Для оценки состояния водного баланса, предотвращения объемной перегрузки следует ежедневно взвешивать пациента, контролировать центральное венозное давление, артериальное давление, диурез и баланс жидкости.
-
При развитии фебрильной лихорадки объем инфузионной терапии должен быть увеличен до 3–4 литров в сутки под контролем водного баланса.
-
Регулярный контроль электролитов (калия, натрия, кальция, хлора, магния) необходим для коррекции инфузионной терапии, при выраженной гипокальциемии, гипомагниемии назначается внутривенное введение препаратов кальция, магния.
-
Во время предтрансплантационного кондиционирования проводится гипоурикемическая терапия.
-
Во время предтрансплантационного кондиционирования рекомендуется назначение мочегонных средств для форсированного диуреза.
Антисекреторная терапия
В настоящее время ИПН являются средством базисной терапии. Результаты рандомизированных сравнительных исследований свидетельствуют о высокой эффективности ИПН по сравнению с Н2-блокаторами [130]. ИПН практически в 1,5 раза эффективнее Н2-блокаторов в отношении эпителизации язвенного дефекта [129].
Пациентам во время проведения курсов специфической противоопухолевой терапии, с профилактической целью также могут назначаться препараты из группы блокаторов Н2-гистаминовых рецепторов.
Антимикробная терапия
| Показания | Исследование |
| Температура ≥38оС, впервые возникшая | Взятие крови из периферической вены или из центральной вены в 2 флакона для гемокультуры (вена-катетер или вена-вена). |
| Температура ≥38оС в течение ≥5 дней и нейтропения |
Повторное взятие крови из периферической вены или из центральной вены для гемокультуры 1 раз в неделю. Микробиологическое (культуральное) исследование мочи на бактериальные патогены с применением автоматизированного посева. КТ органов грудной клетки. Микробиологическое (культуральное) исследование фекалий/ректального мазка на микроорганизмы рода сальмонелла (Salmonella spp.), на иерсинии (Yersinia spp.), на патогенные кампилобактерии (Campylobacter jejuni/coli), на возбудитель диффициального клостридиоза (Clostridium difficile) с определением чувствительности к антибактериальным препаратам. |
| Температура ≥38оС, длительная, сохраняется после выхода из нейтропении | УЗИ брюшной полости. |
| Катетер-ассоциированная инфекция |
Взятие крови из периферической вены и из центральной вены (ЦВК) одновременно для гемокультуры. При подтверждении необходимо удалить ЦВК. |
| Нейтропения более 10 дней | Определение антител к грибам рода аспергиллы (Aspergillus spp.) в крови 2 раза в неделю. |
| Эзофагит | Эзофагоскопия (тромбоцитов не менее 50 ◊ 109/л). |
|
Симптомы инфекции мочевыводящих путей Лейкоцитурия |
Микробиологическое (культуральное) исследование мочи на бактериальные патогены с применением автоматизированного посева |
| Пневмония |
КТ органов грудной клетки. Бронхо-альвеолярный лаваж (БАЛ). Цитологическое исследование лаважной жидкости. Определение антител к грибам рода аспергиллы (Aspergillus spp.) в крови. Определение антител классов M, G (IgM, IgG) к микоплазме пневмонии (Mycoplasma pneumoniae) в крови. Определение антител к хламидиям (Chlamydia spp.) в крови |
| Симптомы менингита. Мозговая симптоматика на фоне фебрильной нейтропении. Обнаружение очага (очагов) в головном мозге |
Спинномозговая пункция. Общий (клинический) анализ спинномозговой жидкости, микроскопическое (культуральное) исследование спинномозговой жидкости на аэробные и факультативно-аэробные условно-патогенные микроогранизмы, |
| Диарея | Микробиологическое (культуральное) исследование фекалий/ректального мазка на на возбудитель диффициального клостридиоза (Clostridium difficile) с определением чувствительности к антибактериальным препаратам. |
|
Парапроктит Трещина в области прямой кишки |
Микробиологическое (культуральное) исследование фекалий/ректального мазка на микроорганизмы рода сальмонелла (Salmonella spp.), на иерсинии (Yersinia spp.), на патогенные кампилобактерии (Campylobacter jejuni/coli), на возбудитель диффициального клостридиоза (Clostridium difficile) с определением чувствительности к антибактериальным препаратам |
| Инфильтраты на коже |
Биопсия. Патолого-анатомическое исследование биопсийного (операционного) материала кожи. Микробиологическое (культуральное) исследование отделяемого высыпных элементов кожи на чувствительность к антибактериальным и противогрибковым препаратам |
Ежедневный осмотр пациента
-
Активный опрос больного относительно возможных симптомов инфекции, включая наличие болей по ходу пищевода, в промежности.
-
Ежедневный осмотр слизистой оболочки полости рта при нейтропении, особенно периодонта. Обращают внимание на рыхлость, отек слизистой оболочки (мукозит), наличие налетов, язв.
-
Осмотр кожи в отношении возможного появления септикопиемических очагов при лихорадке, даже в отсутствие жалоб больного. При лечении глюкокортикоидами септикопиемические очаги могут быть и при нормальной температуре.
-
Осмотр места установки венозного катетера.
-
Внимательная аускультация грудной клетки. Жесткое дыхание в отсутствие хрипов, минимальное количество влажных хрипов на ограниченном участке могут быть начальным проявлением пневмонии.
-
Тщательная пальпация живота. Первые симптомы псевдомембранозного колита — это появление боли или «урчание» при пальпации в правой подвздошной области (область слепой кишки).
Микробиологическое исследование крови
Кровь из вены берут до введения антибиотиков в два флакона (аэробы/анаэробы или аэробы/аэробы) одновременно из вены и из ЦВК или из разных вен; при перитоните или абдоминальной операции в два разных флакона (для аэробов и для анаэробов); при бактериальном эндокардите — 3 раза с интервалом 1—2 часа; при подозрении на катетер-ассоциированную инфекцию — одновременно из вены и из ЦВК во флаконы для автоматического бактериологического анализатора гемокультур (Bactek или другие автоматические анализаторы). На основании разницы во времени (2 часа и более) появления роста микроорганизмов можно предположить инфицирование венозного катетера. При катетер-ассоциированной инфекции положительная гемокультура из ЦВК опережает на 2 часа и более положительную гемокультуру из вены.
-
Гиперемия (инфильтрат) в месте установки катетера.
-
Повышение температуры сопряжено с инфузиями в катетер.
-
Плохая проходимость катетера (проблемы при промывании или заборе крови из катетера).
-
Возникновение температуры >38°С при восстановлении числа нейтрофилов (число гранулоцитов >0,5 × 109 /л).
-
Возникновение температуры >38°С вне нейтропении (число гранулоцитов >0,5 × 109 /л) и наличие центрального венозного катетера, давность установки которого ≥ 7 дней.
-
Подозрение на катетер-ассоциированную инфекцию.
-
Выделение дрожжевых или мицелиальных грибов из крови.
-
Перевод больного из другого стационара с ЦВК.
-
Восстановление числа гранулоцитов у больных сепсисом, обусловленным грамотрицательными бактериями.
Если больной переведен из другого стационара с ЦВК, то катетер удаляют в день поступления в другую клинику.
-
Симптомы инфекции мочевыводящих путей.
-
Лейкоцитурия.
-
Длительная лихорадка неясной этиологии.
Для исследования направляют утреннюю среднюю порцию мочи; доставку мочи в лабораторию проводят немедленно, максимально допустимое время с момента забора до доставки в лабораторию — 2 часа.
Микробиологическое исследование мочи, взятой из катетера Фоли, мочесборных мешков, не проводят из-за контаминации пластика. Исследование мочи в этих случаях проводят в день постановки мочевого катетера. Микробиологическое исследование удаленного катетера Фоли также не проводят.
-
Симптомы менингита.
-
«Мозговая» симптоматика на фоне лихорадки и нейтропении.
-
Обнаружение очага (очагов) в головном мозге при КТ или МРТ.
Доставка материала в лабораторию должна быть немедленной в стерильной пробирке или в шприце с закрытым наконечником.
Во всех случаях следует провести тест на токсин Clostridium difficile.
При нейтропении обращают внимание на выделение Candida spp., грамотрицательных бактерий, особенно Pseudomonas aeruginosa или Stenotrophomonas maltophilia, энтеробактерий (Escherichia coli, Klebsiella spp.), продуцирующих БЛРС или карбапенемазы.
-
Воспаление или повреждение слизистой (трещина, парапроктит и др.) прямой кишки.
-
У больных с фебрильной нейтропенией более 3-4 дней.
На основании выделенных микроорганизмов может быть проведена коррекция антимикробной терапии при сохраняющейся фебрильной нейтропении в случаях отсутствия диагностически значимых результатов исследований из клинически значимых образцов.
Обращают внимание, прежде всего на выделение полирезистентных грамотрицаетельных бактерий - Pseudomonas aeruginosa, энтеробактерий (Escherichia coli, Klebsiella spp.), продуцирующих БЛРС или карбапенемаз.
Микробиологическое исследование со слизистой оболочки носовых ходов
Исследование проводят только на плесневые (мицелиальные) грибы.
Рутинное исследование материала, взятого из носоглотки, ротоглотки, прямой кишки, а также посев мочи в отсутствие признаков поражения не представляет большой клинической ценности.
Микробиологическое исследование биоптатов кожи
Проводят биопсию тех образований, давность которых составляет 1—2 суток. Биопсию проводят с захватом дермы.
Проводят гистологическое и микробиологическое исследование на наличие бактерий, включая микобактерии, и грибов. Кроме культурального исследования проводят микроскопию всех образцов (окраска по Граму, Цилю— Нильсену, калькофлюором белым).
Компьютерная томография легких
-
Лихорадка неясной этиологии ≥ 5 дней в период нейтропении при нормальной физикальной картине в легких.
-
Контроль выявленных изменений в легких (первое контрольное исследование проводят через 7 дней от момента диагностики пневмонии и начала антибактериальной или противогрибковой терапии, далее — по мере необходимости).
КТ легких следует проводить без предварительной рентгенографии грудной клетки.
КТ легких при лихорадке в период нейтропении проводят независимо от аускультативной картины легких.
Перечень диагностических тестов:
-
Исследование жидкости бронхоальвеолярного лаважа (БАЛ):
-
Цитология мазков.
-
Микроскопия мазков (окраска по Граму, Цилю—Нильсену).
-
Флюоресцентная микроскопия на грибы с калькофлуором белым.
-
Микробиологическое исследование (посев) на бактерии, включая нокардии, и грибы (обязательно на мицелиальные — посев на среду Чапека).
-
Микробиологическое исследование (посев) на Legionella spp.
-
Исследование на микобактерии (ПЦР).
-
Флюоресцентная микроскопия на Pneumocystis jiroveci.
-
Определение ДНК Pneumocystis jirovecii (ПЦР).
-
Определение антигена Aspergillus (галактоманнан) в жидкости БАЛ.
-
Определение антигена Legionella pneumophilia в моче.
-
Определение ДНК Mycoplasma pneumonia, Chlamydophila pneumoniae в жидкости БАЛ.
-
Определение ДНК вирусов (ЦМВ, вирусов гриппа, парагриппа, респираторного синтициального вируса, короновирусов, метапнемовируса человека, герпесвируса человека 6 типа) в жидкости БАЛ (ПЦР).
-
Определение антигенов грибов
-
Антиген Aspergillus (галактоманнан)
-
Обнаружение антигена Aspergillus включено в критерии диагностики инвазивного аспергиллеза.
Образцы для исследования:
-
кровь;
-
жидкость БАЛ;
-
СМЖ.
Результат определения антигена Aspergillus считают положительным в крови при индексе оптической плотности ≥ 0,5, в жидкости БАЛ ≥ 1,0, в СМЖ ≥ 0,5.
-
антиген Candida (маннан): ≥125 пг/мл;
-
антитела к Candida (антиманнан): ≥10 ME.
-
множественные очаги в печени и/или селезенке (подозрение на гепатолиенальный кандидоз);
-
предполагаемый инвазивный кандидоз.
-
кровь;
-
жидкость БАЛ;
-
СМЖ;
-
моча.
-
исследование всех первых образцов СМЖ при симптомах инфекции ЦНС у больных опухолями системы крови;
-
исследование второго образца спинномозговой жидкости при некупируемой инфекции ЦНС;
-
исследование антигена Cryptococcus (глюкуроноксиломаннан) в крови в случае предполагаемой криптококковой инфекции.
При положительных результатах определения IgG и наличии лихорадки исследование повторяют через 10—14 дней.
МРТ головного мозга
При выявлении очага (очагов) в веществе головного мозга необходимо выполнение люмбальной пункции с последующими цитологическим и микробиологическими исследованиями.
Ультразвуковое исследование или компьютерная томография органов брюшной полости
УЗИ и КТ при гепатолиенальном кандидозе не являются взаимоисключающими диагностическими процедурами. У части больных очаги в печени и/или селезенке могут быть обнаружены только при УЗИ, у других — только при КТ. Наибольшее диагностическое значение имеет МРТ печени и селезенки.
При диагностике гепатолиенального кандидоза контрольное исследование проводят не ранее чем через 3—4 недели терапии системными противогрибковыми препаратами ввиду крайне медленной регрессии очагов.
Оценивать состояние очагов (размеры, плотность) в печени и селезенке необходимо всегда при числе гранулоцитов >0,5 × 109 /л. Проведение исследования в период нейтропении дает ложную информацию о меньшем размере очагов.
Дополнительные исследования
Назначают препарат, при использовании которого было достигнуто излечение от инвазивного микоза.
Пациенты с наличием в анамнезе острого или хронического диссеминированного кандидоза (обычно один препарат из перечня):
-
Флуконазол**, по 400 мг в сутки, внутривенно или внутрь.
-
Микафунгин**, по 50 мг в сутки внутривенно.
-
#Анидулафунгин, по 100 мг в сутки внутривенно.
Пациенты с наличием в анамнезе инвазивного аспергиллеза (обычно один препарат из перечня):
-
Вориконазол**, по 200 мг 2 раза в сутки внутрь (в таблетках, натощак) или 3–4 мг/кг 2 раза в сутки внутривенно.
-
Позаконазол** (суспензия), по 200 мг 3 раза в сутки внутрь (после еды).
-
Итраконазол (суспензия), по 5 мг/кг 2 раза в сутки внутрь (натощак).
Противовирусная профилактика [168]
Проводится пероральная профилактика G05AB противовирусных препаратов (например, #валацикловиром в дозе 500 мг 2 раза в сутки) с момента начала предтрансплантационного кондиционирования.
Профилактика пневмоцистной пневмонии [147,169]
-
Терапия глюкокортикоидами.
-
Лечение препаратами, приводящими к снижению числа лимфоцитов CD4.
-
Пациенты, имеющие в анамнезе пневмоцистную пневмонию.
Назначают один из следующих препаратов:
-
Ко-тримоксазол [Сульфаметоксазол+Триметоприм]** назначают по 480 мг ежедневно.
-
#Дапсон, 100 мг внутрь ежедневно.
Препараты применяют в период цитостатической терапии и в течение всего периода нейтропении.
Использование ко-тримоксазола [сульфаметоксазол+триметоприм]** одновременно предупреждает инфекции, вызываемые Toxoplasma gondii, Listeria monocytogenes, Nocardia asteroides.
-
Общий (клинический) анализ крови 1 раз в 2–3 дня.
-
Анализ крови биохимический общетерапевтический 1 раз в 2–3 дня.
-
Коагулограмма (ориентировочное исследование системы гемостаза) 1 раз в 3–4 дня.
-
Исследование уровня глюкозы в крови 1 раз в 3–4 дня.
-
Общий (клинический) анализ мочи - еженедельно.
-
Регистрация электрокардиограммы – еженедельно.
Нутритивная терапия
-
Поддержание оптимальной массы тела.
-
Предотвращение или коррекция дефицита макро- и микронутриентов.
-
Повышение переносимости высокодозной ХТ.
-
Снижение выраженности побочных эффектов ХТ.
-
Повышение качества жизни.
Показания к нутритивной поддержке
-
индекс массы тела <20 кг/м2;
-
темп потери массы тела;
-
гипопротеинемия <60 г/л или гипоальбуминемия <30 г/л.;
-
невозможность адекватного энтерального питания;
-
побочные проявления высокодозной химиотерапии:
-
тошнота,
-
рвота,
-
потеря аппетита,
-
дисфагия,
-
мукозиты различной степени тяжести,
-
нарушения вкуса и обоняния,
-
некротическая энтеропатия средней и тяжелой степени.
Своевременное выявление пациентов из группы нутритивного риска позволяет защитить пациента от прогрессирующей потери массы тела и развития рефрактерной кахексии. Для первичного скрининга можно использовать хорошо зарекомендовавшие себя шкалы, такие как NRS-2002, ИНР (индекс нарушения питания по Buzby G.P.), бальную шкалу А.Б.В.Г. (ESMO, 2008), индекс массы тела по Кетле и другие [170–172].
В том случае, если проведение энтерального питания невозможно или неэффективно, необходимо назначать парентеральное питание [174]. Доставка белка должна быть не менее 1 г/кг/сут, однако при возможности нужно стремиться к 1,5 г/кг/сут.
-
дополнение к пероральному питанию (сипинг) – пероральный прием лечебного (специализированного) питания маленькими глотками;
-
энтеральное питание – возможно через назогастральный/назоинтестинальный зонд или через стому (чрескожную, эндоскопическую, лапароскопическую, лапаротомную);
-
парентеральное питание.
Энтеральное питание является предпочтительным способом нутритивной поддержки за счет его физиологичности, способности поддерживать функцию кишечника, уменьшать гиперметаболический ответ на повреждение, уменьшать транслокацию бактерий и токсинов из кишечника.
Энтеральное питание может проводиться при наличии хотя бы частичной функции ЖКТ. Отсутствие выслушиваемой перистальтики не является противопоказанием для энтерального питания.
-
полимерные: состоят из неизмененных белков, жиров и углеводов;
-
олигомерные (полуэлементные): состоят из расщепленных белков и простых углеводов и содержат масла среднецепочечных триглицеридов;
-
смеси для определенных состояний, изготовленные с учетом потребностей конкретного пациента, страдающего тем или иным заболеванием (сахарный диабет, заболевания почек, печени, легких).
-
механическая кишечная непроходимость;
-
выраженная тошнота и рвота, не купирующаяся антиэметической терапией;
-
гипоксия (раО2 70 мм рт. ст.).
-
краткосрочное ПП (10–15 суток):
-
острый и тяжелый мукозит, илеус, некупируемая рвота;
-
-
длительное (более 30 суток):
-
тяжелая мальабсорбция;
-
подострый или хронический энтерит;
-
тяжелая энтеропатия [170,175].
-
Необходимые организму нутриенты вводятся непосредственно в кровь. Основными составляющими парентерального питания являются:
-
источники энергии: 10–20% растворы углеводов, жировые эмульсии;
-
источники пластического материала: растворы кристаллических аминокислот;
-
поливитаминные комплексы для парентерального введения: – препараты водорастворимых витаминов; – препараты жирорастворимых витаминов; – препараты водо- и жирорастворимых витаминов; – комплексы микроэлементов для парентерального введения [171].
-
«модульная» – использование флаконов с аминокислотами, глюкозой, жировыми эмульсиями; (главным недостатком данного метода является различная скорость введения препаратов);
-
система «все в одном» предполагает использование двух- и трехкомпонентных контейнеров с подобранным необходимым количеством и метаболически верным соотношением аминокислот, глюкозы, липидов и электролитов.
-
возможность энтерального питания;
-
невозможность обеспечения адекватного сосудистого доступа;
-
отсутствие признаков белково-энергетической недостаточности;
-
гипоксия (раО2 70 мм рт. ст., сывороточный лактат >3 ммоль/л);
-
анурия или гипергидратация без диализа.
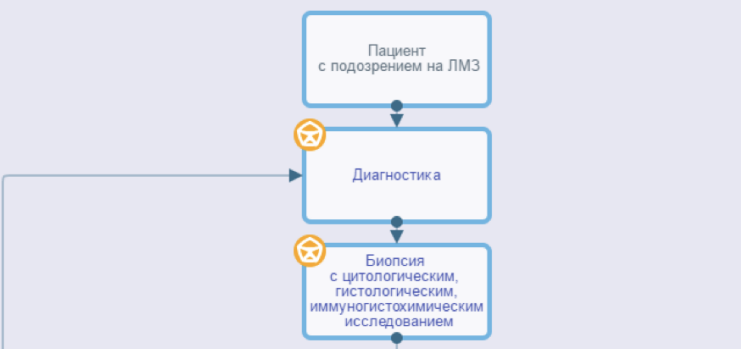


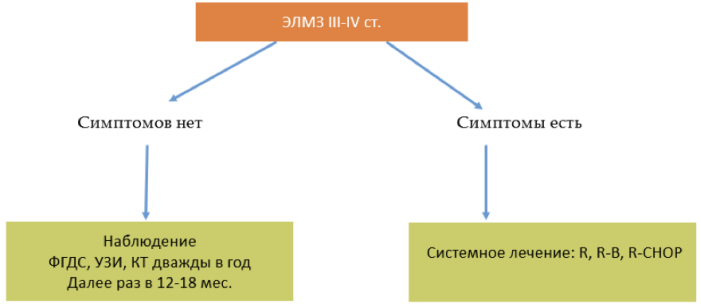
Приложение В. Информация для пациента
Источник: Oken M.M. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am. J. Clin. Oncol. 1982;5(6):649–65 [176]
| Статус (баллы) | Описание общего состояния пациента |
| 0 | Пациент полностью активен, способен выполнять все, как и до заболевания. |
| 1 | Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу). |
| 2 | Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50 % времени проводит активно – в вертикальном положении. |
| 3 | Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50 % времени бодрствования. |
| 4 | Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели. |
| 5 | Смерть пациента |
Источник: Development and Validation of a predictive model for chemotherapy associated thrombosis. Blood. 2008;111(10):4902-4907 [177]
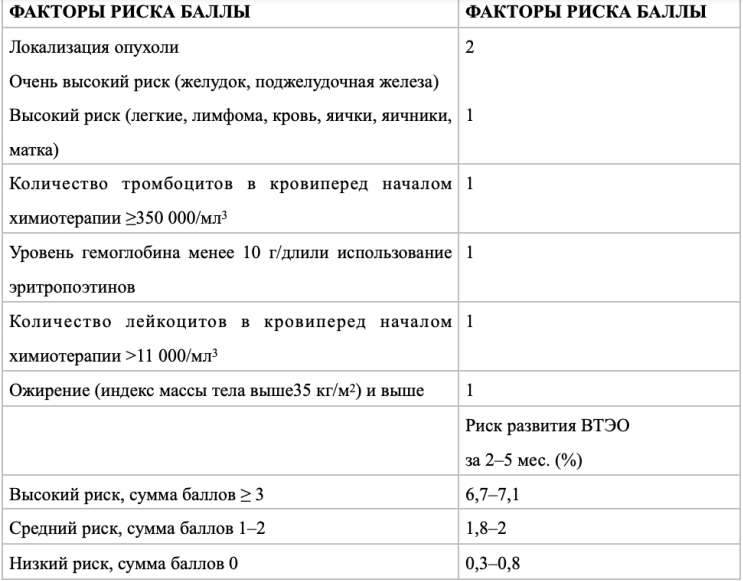
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.