Коарктация аорты
 Версия: Клинические рекомендации РФ 2023 (Россия)
Версия: Клинические рекомендации РФ 2023 (Россия)
Общая информация
Краткое описание
Разработчик клинической рекомендации
- Ассоциация сердечно-сосудистых хирургов России
- Всероссийская общественная организация "Ассоциация детских кардиологов России"
- Общероссийская общественная организация содействия развитию лучевойдиагностики и терапии "Российское общество рентгенологов и радиологов"
- Российское научное общество специалистов по рентгенэндоваскулярной диагностике илечению
Одобрено Научно-практическим Советом Минздрава РФ
В соответствии с Правилами поэтапного перехода медицинских организаций к оказанию медицинской помощи на основе клинических рекомендаций, разработанных и утвержденных в соответствии с частями 3, 4, 6 –9 и 11 статьи 37 Федерального закона «Об основах охраны здоровья граждан в Российской Федерации», утвержденных постановлением Правительства Российской Федерации от 19.11.2021 № 1968, клинические рекомендации применяются следующим образом:
– размещенные в Рубрикаторе после 1 июня 2022 года – с 1 января 2024 года.
Возрастная категория: Взрослые, Дети
Пересмотр не позднее: 2025
Статус: Действует
Применение отложено
Определение заболевания или состояния (группы заболеваний или состояний)
Коарктация аорты (КА) – это врожденное сужение верхней части нисходящей грудной аорты, граничащей с областью впадения открытого артериального протока (так называемого перешейка аорты). В наиболее тяжелых формах отмечается атрезия просвета аорты, но при этом сохраняется непрерывность стенки аорты.
Коарктация аорты обусловлена интерпозицией дуктальной ткани (ДТ), формирующей концентрическую складку в виде мембраны [1]. Под «дуктальной тканью» подразумевается скопление в субэндотелиальном слое интимы артериального протока и смежных с ним структур гиалуронового экстрацеллюлярного матрикса – так называемой, «неоинтимы» [1,2,3].
Рекоарктация аорты – рецидив обструкции кровотока по дуге аорты в отдаленные сроки после хирургической коррекции КА [4].
Морфологические критерии порока [2-3,5-7]:
-
локальное сужение просвета аорты на границе дуги и нисходящего отдела;
-
наличие мембраны (интерпозиция дуктальной неоинтимы в стенке аорты) с отверстием либо без (гемодинамический перерыв дуги);
-
дуктальная ткань может иметь разную степень и направление распространения в стенке аорты (на нисходящий отдел и/или перешеек аорты), а также внедряться в приустьевые участки близлежащих брахиоцефальных сосудов – как правило, левой подключичной артерии, реже – аберрантной правой подключичной артерии или отходящей отдельным устьем левой вертебральной артерии.
-
естественная эволюция области КА морфологически сходна с естественной эволюцией ОАП: первоначально, обструкция обусловлена избыточным объемом ДТ, поэтому диаметр просвета аорты не коррелирует с ее внешним поперечным размером; по мере фиброзного метаморфоза ДТ ее объем сокращается, и область коарктации принимает характерную форму песочных часов.
-
степень персистенции ОАП различная, вплоть до полного закрытия протока у пациентов старше 1 месяца жизни.
-
с момента естественного закрытия ОАП у пациентов, переживших указанный период, на протяжении всей последующей жизни непрерывно развиваются межсистемные коллатерали;
-
турбулентный кровоток ниже области обструкции предопределяет возможность постстенотического расширения этой части аорты;
-
у взрослых пациентов при естественном течении заболевания формируются вторичные экстракардиальные морфологические изменения, обусловленные системной гипертензией в бассейне предуктального отдела аорты и развитием межсистемных коллатералей.
Сопутствующие пороки [8,9]:
-
открытый артериальный проток – выявляется у всех новорожденных с коарктацией аорты и впоследствии может оставаться открытым (до 33%) в различной степени значимости, либо закрываться.
-
гипоплазия дистальных отделов дуги аорты; как правило, наблюдается у пациентов имеющих нерестриктивный межжелудочковый дефект, допускающий возможность шунта крови слева направо; гипоплазированные отделы дуги аорты могут иметь избыточную (для новорожденного – более 5 мм) длину (тубулярная гипоплазия) и, реже, патологическую извитость (кинкинг) [10-12].
-
двустворчатый клапан аорты (до 60%);
-
дефект межжелудочковой перегородки (до 48%);
-
единственный желудочек сердца (до 7%);
-
транспозиция магистральных артерий (до 6%);
-
атриовентрикулярный канал (до 4%)
-
различные формы двухотточного правого желудочка, в т.ч., аномалия Тауссиг-Бинга (до 3%)
-
прочие врожденные аномалии развития сердца и магистральных сосудов сопутствуют коарктации аорты менее чем в 1% случаев.
- КА сопутствует синдрому гипоплазии левых отделов сердца в 80% случаев и более [13], однако при такой анатомии ее следует рассматривать как одну из морфологических составляющих данного синдрома.
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статической класификации болезней и проблем, связанных со здоровьем
Q25.1 – Коарктация аорты.
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
Коарктация аорты:
1. С дуктус-зависимой гемодинамикой:
-
Изолированная (в т.ч., с межпредсердным сообщением)
-
С дефектом межжелудочковой перегородки
-
Со сложными ВПС
2. С гемодинамикой, не зависимой от персистенции артериального протока:
-
Изолированная (в т.ч., с межпредсердным сообщением)
-
С дефектом межжелудочковой перегородки
-
Со сложными ВПС
3. Коарктация аорты с гипоплазией перешейка аорты:
1. С дуктус-зависимой гемодинамикой:
-
Изолированная (в т.ч., с межпредсердным сообщением)
-
С дефектом межжелудочковой перегородки
-
Со сложными ВПС
2. С гемодинамикой, не зависимой от персистенции артериального протока:
-
Изолированная (в т.ч., с межпредсердным сообщением)
-
С дефектом межжелудочковой перегородки
-
Со сложными ВПС
4. КА с гипоплазией перешейка и дистального отдела дуги аорты:
1. С дуктус-зависимой гемодинамикой:
-
Изолированная (в т.ч., с межпредсердным сообщением)
-
С дефектом межжелудочковой перегородки
-
Со сложными ВПС
2. С гемодинамикой, не зависимой от персистенции артериального протока:
-
Изолированная (в т.ч., с межпредсердным сообщением)
-
С дефектом межжелудочковой перегородки
-
Со сложными ВПС [18]
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Генез КА связан с избыточным количеством гиалуронового экстрацеллюлярного матрикса дуктального происхождения в субэндотелиальном слое интимы участка аорты, непосредственно прилегающего к устью ОАП (юкстадуктальный отдел аорты, граница дуги и нисходящей части аорты, граница пре- и постдуктального сегментов эмбриональной аорты) [14].
Естественный тканевой метаморфоз стенки аорты в области коарктации напоминает таковой для стенки ОАП. Сразу после рождения прирост парциального давления кислорода в крови и снижение уровня хорионального простагландина Е2 приводят к продукции и накоплению в субэндотелиальном слое интимы гиалуронового экстрацеллюлярного матрикса («неоинтимы»), что прогрессивно сокращает просвет сосуда, обусловливая нарастающую обструкцию кровотоку, вплоть до полной окклюзии.
Позже, мигрировавшие в неоинтиму недифференцированные предшественники гладкомышечных клеток, преобразовавшиеся в фибробласты, обусловливают соединительнотканный метаморфоз (уплотнение и сокращение в объеме) этой ткани дуктального происхождения с образованием характерной мембраны в просвете аорты («созревание» КА).
Гемодинамика КА характеризуется обструкцией антеградного магистрального кровотока на границе предуктального и постдуктального эмбриональных сегментов грудной аорты.
После рождения, по мере закрытия ОАП, кровоток в нисходящей аорте меняется с магистрального дукстус-зависимого на магистральный антеградный, который имеет разную степень дефицита в зависимости от степени обструкции.
У пациентов, переживших естественное закрытие ОАП, редуцированный магистральный кровоток в бассейне нисходящей аорты со временем компенсируется коллатеральным.
При персистенции ОАП направление сброса крови в нем может меняться с право-левого на перекрестный либо лево-правый, в зависимости от характера и преимущественной локализации обструкции в области КА.
Гемодинамика в бассейне аорты проксимальнее области КА характеризуется прогрессирующей артериальной гипертензией, предопределяющей характерные морфологические изменения магистральных и периферических сосудов, а также левого желудочка (ЛЖ).
Изменения ЛЖ выражаются в компенсаторной гипертрофии его миокарда, а впоследствии (либо при резко выраженной обструкции) – дилатации его полости.
Наличие значимого сброса крови слева направо по персистирующему ОАП при КА сопровождается гиперволемией малого круга кровообращения и прогрессирующей легочной гипертензией.
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
КА встречается примерно у 2 – 5 на 10 000 новорожденных, что составляет 6 – 7% от всех выявляемых ВПС. КА у новорожденных детей относится к критическим ВПС. При дуктус-зависимой гемодинамике требуется хирургическое лечение в первые недели жизни ребенка. Около 80% всех выявленных случаев КА не сочетается с какими-либо сопутствующими ВПС. КА в 2 раза чаще встречается у представителей мужского пола [15-17].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Критическая коарктация аорты (предуктальная КА): характеризуется «дуктус-зависимой» гемодинамикой в нисходящей грудной аорте. При естественном закрытии артериального протока проявления дефицита кровотока доминируют над симптомами сердечной недостаточности. Отмечается прогрессирующая ишемия, которая в первую очередь отражается на функции почек, желудочно-кишечного тракта и проявляется прогрессирующим снижением темпа диуреза и ослаблением моторики желудочно-кишечного тракта с последующим развитием полиорганной недостаточности (сердечной, почечной, печеночной, дыхательной) на фоне тканевой гипоксии. Прогноз для жизни в этих случаях неблагоприятный, даже при условии выполнения неотложного хирургического вмешательства.
Последствия ишемического повреждения желудочно-кишечного тракта проявляются позже, как правило, среди оперированных пациентов. Помимо дисфункции кишечной трубки, они могут выражаться в развитии ряда жизнеугрожающих осложнений (желудочно-кишечное кровотечение, язвенно-некротический энтероколит) в ранние сроки после хирургического вмешательства.
Поэтому у данной группы пациентов важно медикаментозное поддержания функции ОАП на дооперационном этапе у пациентов с «дуктус-зависимой» гемодинамикой [7,19-20].
Некритическая коарктация аорты. Сердечная недостаточность определяет тяжесть состояния младенцев с системной гемодинамикой, не зависящей от функции артериального протока. Клинически она проявляется общими (тахикардия, одышка, акроцианоз, крепитирующие хрипы в легких, увеличение размеров сердца и печени, периферические отеки) и свойственными младенческому возрасту симптомами (повышенное беспокойство, потливость, быстрая утомляемость при крике и кормлении, дефицит массы тела, анемия и пр.) Отмечается разница в темпах развития верхней и нижней половин тела. [7,19].
С возрастом течение заболевания переходит в фазу относительной компенсации, выражающуюся в первую очередь в развитии многочисленных межсистемных коллатералей. В клинической картине заболевания доминирует артериальная гипертензия, которая регистрируется на верхних конечностях. Пациенты жалуются на головные боли, шум в ушах, регулярные носовые кровотечения, расстройства зрения (мелькание мушек, искры в поле зрения), склонность к кровотечениям при травмах верхней части тела. Истощение компенсаторных ресурсов миокарда сопровождается сердечной недостаточностью [19,21-24].
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии заболевания/тяжести состояния на основе жалоб/объективного обследования:
-
Для критической коарктации аорты в периоде новорожденности - это, прогрессирующая ишемия нижней половины туловища, которая в первую очередь отражается на функции почек, желудочно-кишечного тракта и проявляется прогрессирующим снижением темпа диуреза и ослаблением моторики желудочно-кишечного тракта. Также для критического состояния характерно ослабление пульсации (вплоть до полного его отсутствия) на сосудах нижних конечностей, разница артериального давления (измеренного на руках и ногах: на ногах АД ниже либо не определяется), разница насыщения крови кислородом между верхними и нижними конечностями более 3% по данным пульсоксиметрии [8,19-20,25-26].
-
Для некритической коарктацией аорты у пациентов до 1 года – это, общие признаки (тахикардия, одышка, акроцианоз, увеличение размеров сердца и печени, периферические отеки), признаки сердечной недостаточности (одышка в покое или при физической нагрузке, учащенное сердцебиение, повышенная утомляемость, плохой аппетит, задержка в прибавке веса). В возрасте старше года основными критериями ВПС является артериальная гипертензия, которая регистрируется на верхних конечностях, жалобы на головные боли, шум в ушах, регулярные носовые кровотечения, расстройства зрения (мелькание мушек, искры в поле зрения), склонность к кровотечениям при травмах верхней части тела. Отмечается разница в темпах развития верхней и нижней половин тела [7,19,21,27-29].
Жалобы и анамнез
-
Рекомендуется осмотр, тщательный сбор жалоб и анамнеза у новорожденных с «дуктус-зависимой» гемодинамикой с целью определения тяжести состояния пациента и тактики лечения [8,25].
УДД 5, УУР С
Комментарии: у новорожденных с критической коарктацией аорты и «дуктус-зависимой» гемодинамикой клиническое ухудшение развивается в первые дни жизни в связи с нарастающей ишемией внутренних органов бассейна нисходящей аорты. Это, в первую очередь, выражается в прогрессирующем снижении темпа диуреза и угнетении функции желудочно-кишечного тракта. Дефицит дуктус-зависимого кровотока в нисходящей аорте выражается в ослаблении пульсации (вплоть до полного его отсутствия) на сосудах нижних конечностей, в разнице артериального давления (АД), измеренного на руках и ногах (на ногах АД ниже либо не определяется), а также в разнице насыщения крови кислородом между верхними и нижними конечностями [8,25-26].
-
Рекомендуется осмотр, сбор жалоб и анамнеза у пациентов с некритической коарктацией аорты с целью определения тяжести состояния пациента и дальнейшей тактики лечения [21,27-29].
УДД 5, УУР С
Комментарии: у пациентов грудного возраста с некритической коарктацией аорты в клинической картине доминируют признаки сердечной недостаточности (СН) (одышка в покое или при физической нагрузке, учащенное сердцебиение, беспокойство и повышенная утомляемость, плохой аппетит, задержка в прибавке веса, отставание в физическом развитии, бледность кожных покровов и слизистых оболочек, деформация грудной клетки в виде сердечного горба) [21,27-28].
Дети в возрасте от 1 года до 15 лет обычно не предъявляют жалоб, коарктация аорты обнаруживается при случайном осмотре и обследовании по другим причинам. При этом обычно находят шум над областью сердца и повышение артериального давления. в сосудах верхней половины тела (разница в темпах развития верхней и нижней половины тела, головные боли, шум в ушах, регулярные носовые кровотечения, расстройства зрения в виде мелькания мушек, искр в поле зрения, склонность к обильным кровотечениям при травмах верхней части тела). У пациентов, переживших младенческий возраст, жалобы, связанные с проявлениями артериальной гипертензии, доминируют. Лишь у 5% больных в этом возрасте имеются признаки сердечной недостаточности [27,29].
Физикальное обследование
-
У детей и у взрослых с целью определения гемодинамической и клинической значимости коарктации аорты рекомендовано проводить симметричную сравнительную пальпацию периферических артерий и измерение артериального давления (АД) на 4-х конечностях с последующим определением разницы полученных величин [7,29-31].
УДД 5, УУР С
Комментарии: У пациентов отмечается систолическая артериальная гипертензия на руках, отсутствие нормальной асимметрии систолического артериального давления на верхних и нижних конечностях (в норме САД на руках ниже, чем на ногах на 20 и более мм рт.ст.). Артериальное давление у пациентов с сердечной недостаточностью возможно измерить только после стабилизации гемодинамики и в/в инфузии инотропных препаратов. В редких случаях отхождения левой подключичной и/или правой аберрантной подключичной артерий от нисходящей аорты диагностическая ценность этих признаков нивелируется. У новорожденных с компенсированным дуксут-зависимым магистральным кровотоком в бассейне нисходящей аорты пульсация и АД в сосудах ног могут быть сопоставимы с таковыми на руках даже при критической степени обструкции.
-
Рекомендовано у детей в возрасте старше года при осмотре обращать внимание на наличие усиленной пульсации межреберных артерий и артерий в лопаточной области (симптомы развития коллатерального кровообращения) [19,29,31].
Комментарии: Выявление пульсации коллатералей имеет важное значение у взрослых больных для исключения такой патологии, как атеросклеротическая окклюзия брюшной аорты или бедренных артерий.
УДД 5 УУР С
-
У детей и у взрослых с коарктацией аорты рекомендовано проводить пульсоксиметрию верхних и нижних конечностей [29-31].
УДД 5, УУР С
Комментарии: при разнице насыщения крови кислородом более 3% между правой рукой и нижними конечностями следует думать о коарктации аорты и проводить дополнительную инструментальную диагностику ВПС.
-
У детей и у взрослых с коарктацией аорты рекомендовано проводить аускультацию. Для коарктации аорты характерным считается систолический шум, который выслушивается по левому краю грудины, точка максимального выслушивания коарктации находится в межлопаточной области слева от позвоночника [27, 101].
УДД 5, УУР С для детей
УДД 4 УУР С для взрослых
Комментарии: У симптомных новорождённых II тон на основании сердца значительно усилен, нередок «ритм галопа», выслушивается систолический шум над область сердца неспецифичен и встречается у 50% пациентов, шум может усиливаться на фоне стабилизации гемодинамики. У асимптомных новорождённых и пациентов более старшего возраста II тон на основании сердца нормальный, может быть ослабление его аортального компонента, выслушивается средней интенсивности (2-4/6) систолический шум изгнания во II межреберье справа о грудины и межлопаточной области слева, иногда выслушивается диастолический шум недостаточности бикуспидального клапана аорты в III межреберье слева от грудины.
-
У детей и у взрослых с коарктацией аорты рекомендовано оценить перистальтику путем аускультации живота, оценить путем перкуссии и пальпации: пневматоз кишечника, наличие свободной жидкости в брюшинной полости у новорожденных [27].
УДД 5, УУР С
Комментарии: при нарушении кровотока в нисходящей аорте отмечается нарушение ф-ции кишечника, что проявляется в резком снижении, либо отсутствие перистальтики.
-
Рекомендуется исследование кислотно-основного состояния и газов крови для новорожденных в критическом состоянии с целью выявления и оценки степени метаболических нарушений. Причем набор капиллярной пробы необходимо одновременно проводить как с верхней, так и с нижней конечности [27,29-31].
УДД 5, УУР С
Комментарии: при разнице насыщения крови кислородом более 3% между верхними и нижними конечностями следует думать о коарктации аорты и проводить дополнительную инструментальную диагностику ВПС.
Инструментальные диагностические исследования
-
У детей и у взрослых с коарктацией аорты рекомендуется трансторакальное эхокардиографическое исследование (ЭхоКГ): с определением степени и характера обструкции на границе дуги и нисходящей аорты, наличия и гемодинамической значимости ОАП, анатомии дуги аорты (положение дуги, диаметр и протяженность каждого из сегментов, характер отхождения брахицефальных ветвей, наличие прочих особенностей строения), размеров восходящей аорты и ее клапанного кольца (в том числе, Z-score показатель), анатомия клапана аорты и гемодинамика (количество и функциональность створок, стеноз/регургитация), оценить степень «магистральности» кровотока в брюшной аорте [19,29,31-32].
УДД 5, УУР С
-
У детей и у взрослых с коарктацией аорты для определения патологического градиента АД между руками и ногами, а также для определения характера кровотока на артериях нижних конечностей (магистральный/коллатеральный) рекомендовано проведение дуплексное сканирование артерий верхних и нижних конечностей [26,29,31, 110].
УДД 5, УУР С
-
У детей старшего возраста и у взрослых пациентов с коарктацией аорты с целью определения выраженности артериальной гипертензии и характера ее течения рекомендовано проведение суточного мониторинга артериального давления [26-27,31, 110].
УДД 5, УУР С
-
Рекомендуется выполнение КТ сердца и грудной аорты с внутривенным болюсным контрастированием или МРТ сердца и магистральных сосудов с внутривенным болюсным контрастированием (предпочтительно) у пациента с КА при планировании хирургического лечения. У пациентов с КА, находящихся в критическом состоянии при планировании хирургического лечения рекомендуется выполнение КТ-ангиографии сердца и сосудов [19,33-35,106].
УДД 5, УУР C
Комментарии: прямая визуализация дуги и проксимального отдела нисходящей грудной аорты часто ограничена при трансторакальной ЭхоКГ, кроме того при наличии обширных коллатералей тяжесть обструкции КА трудно оценить только при помощи доплер-ЭхоКГ, в таких случаях томография помогает определить или подтвердить точную локализацию, длину, степень обструкции, наличие гипоплазии, удлинения, извитости, перегиба без сужения просвета или перерыва дуги аорты, а также наличие и развитость коллатеральных сосудов, вариантную анатомию ветвей грудной аорты, исключить наличие сосудистых колец со сдавлением трахеи и бронхов, сопутствующую патологию органов грудной клетки. Мультимодальная визуализация у пациентов с КА повышает эффективность и качество диагностики, следует отдавать предпочтение неинвазивными и безопасным для пациента методам исследований. МРТ является универсальным методом для оценки аорты и ассоциированных с заболеваниями аорты патологий (применимо к пациентам с КА: наличие двустворчатого аортального клапана (ДАК) и аневризм корня и восходящей аорты). МРТ рекомендовано использовать для предоперационной и послеоперационной оценки состояния аорты, ее ветвей и прилегающих структур. Кроме морфологических изменений, МРТ обеспечивает получение точных и воспроизводимых функциональных данных, включая количественную характеристику прямого и обратного кровотока в аорте, картирование векторов и скоростей кровотока, определение выраженности обструкции кровотока, оценку жесткости и эластичности стенки аорты, а также морфологию и движение створок аортального клапана. Абсолютными преимуществами метода являются: неинвазивность, возможность получить информацию без воздействия ионизирующего излучения и, в некоторых случаях, без необходимости внутривенного введения контраста. При планировании хирургической коррекции КА и необходимости использования МРТ проведение МРТ-ангиографии обязательно, с целью получения трехмерного набора изображений аорты и ее ветвей. При критическом состоянии пациента, отсутствии технической возможности и/или квалифицированного персонала для проведения МРТ сердца и сосудов с внутривенным болюсным контрастированием, и/или при наличии абсолютных противопоказаний к МРТ, она может быть заменена КТ-ангиографией; это обусловлено широкой доступностью, высокой скоростью получения данных и высокой диагностической эффективностью метода КТА в диагностике заболеваний аорты. Высокая информативность и детализация трехмерных моделей позволяет прогнозировать техническую реализуемость различных способов хирургической коррекции КА и на этом основании избирать оптимальную, в каждом конкретном случае, тактику хирургического лечения.
-
При сложных врожденных пороках сердца (ВПС) или по клиническим показаниям рекомендовано выполнение МРТ (или КТ, только в случаях применения этого метода, например, у пациентов с критической КА) исследования головного мозга при планировании хирургического лечения КА с целью выявления патологических изменений, которые влияют на результаты хирургической коррекции и могут повлиять на выбор анестезиологического и перфузионного пособия [19,33-35,106].
УДД 5, УУР C
-
При сочетании КА с другими ВПС, требующими инвазивной диагностики, в качестве альтернативы контрастному томографическому исследованию может быть рекомендована чрезвенозная катетеризация сердца с введением контрастных средств [19,31,36].
УДД 5, УУР С
Комментарии: Катетеризация аорты выполняется в случае выполнения интервенционного лечения (баллонная ангиопластика, стентирование аорты). У пациентов с изолированной КА не рекомендуется выполнение с целью диагностики инвазивного рентгеноконтрастного исследования (катеризации) сердца и аорты [106].
-
Пациентам с легкой степенью обструкции на уровне КА, не требующей вмешательства, рекомендовано ежегодно проводить трансторакальную ЭхоКГ и периодически (каждые 3-5 лет) МРТ сердца и магистральных сосудов или КТ для контроля за размерами аорты [19,33-35,106].
УДД 5, УУР С
Комментарии: для динамического наблюдения должен использоваться один и тот же метод и один и тот же протокол проведения измерений. Протокол и методика проведения измерений должны быть стандартизованы.
-
Рекомендовано пациентам с коарктацией аорты после выполнения хирургического лечения [19,36,41-45]:
—При рутинном обследовании всем пациентам по клиническим показаниям и/или у пациентов с гипоплазией дуги в анамнезе рекомендовано проведение МРТ сердца и сосудов, срок и кратность проведения определяется в индивидуальном порядке (3-5 лет) в зависимости от данных ЭхоКГ при ежегодном наблюдении.
При наличии клинических проявлений дополнительно рекомендовано МРТ-обследование головного мозга и УЗИ / МРТ брахиоцефальных, почечных сосудов и почек с бесконтрастной ангиографией в протоколе сканирования для оценки анатомии сосудов и параметров кровотока.
—При планировании повторных оперативных вмешательств всем пациентам рекомендовано проведение МРТ сердца и магистральных сосудов с внутривенным болюсным контрастированием (предпочтительно) или КТ сердца и грудной аорты с внутривенным болюсным контрастированием.
УДД 5, УУР С
Комментарии: пациенты с предшествующей пластикой КА нуждаются в регулярном наблюдении за сердечно-сосудистой системой с применением визуализирующих методов обследования (ЭхоКГ, УЗИ, МРТ, КТ) для оценки клинического состояния и сердечно-сосудистых осложнений, таких как рецидивирующая КА, дилатация восходящей и нисходящей грудной аорты и расслоение аорты. Проведение ЭхоКГ или МРТ сердца, головного мозга, почек и сосудов направлено на раннее выявление в отдаленном периоде после операции возможных осложнений со стороны сердца и экстракардиальных органов-«мишеней». Программы сканирования и обработки МР-изображений для получения данных о функции не только ЛЖ, но и правого желудочка, морфометрии камер и диаметра сосудов на различном уровне без введения контрастных препаратов дают возможность получения исчерпывающей информации о гемодинамике. В протоколе требуется выполнять 3D-МР-ангиографию для оценки состояния аорты и ее ветвей и МР-программы отсроченного контрастирования миокарда с целью выявления очагов фиброза левого и правого желудочка, играющего роль в возникновении аритмий и развитии декомпенсации. Пациентам со сложной рекоарктацией и/или с сопутсивующими сердечно-сосудистыми заболеваниями, требующими оперативного или эндоваскулярного вмешательства, такими как ишемическая болезнь сердца или аортальный стеноз требуется всесторонняя визуализация с помощью методов МРТ и/или КТ.
Иные диагностические исследования
У детей и взрослых пациентов с КА иные методы лабораторной и инструментальной диагностики не применяются [27, 85, 90].
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
1. Консервативное лечение
-
Всем новорожденным с КА и дуктус-зависимой гемодинамикой в бассейне нисходящей аорты рекомендована внутривенная инфузия простагландинов [19, 37-40].
УДД 5, УУР С
-
Всем новорожденным с КА и дуктус-зависимой гемодинамикой в бассейне нисходящей аорты рекомендована внутривенная инфузия простагландинов [19, 37-40, 106-108].
УДД 5, УУР С
Комментарии: Инфузия простагландинов продолжается вплоть до операции [106-108].
-
У младенцев с КА и проявлениями сердечной недостаточности рекомендованы: ограничение энергозатрат, в т.ч. снижение нагрузки по дыханию, инотропная терапия, сбалансированная водная нагрузка (введение жидкости в объеме меньше физиологических потребностей, при необходимости – стимуляция диуреза) [19,40].
УДД 5, УУР С
Комментарии: при непрогрессирующей сердечной недостаточности оптимально обходиться препаратами из фармакотерапевтической группы альфа- и бета-адреностимуляторов без адренергических и дофаминергических средств. Но при прогрессировании СН необходимо назначение препаратов из фармакотерапевтической группы адренергических и дофаминергических средств: рекомендуемым является добутамин** или допамин** (в начальных дозах от 2,5 мкг/кг/мин с последующим титрованием дозы до получения желаемого эффекта); при недостаточной эффективности вышеописанных препаратов, необходимо дополнительное назначение #эпинефрина** (в начальной дозе 0,01 мкг/кг/мин с последующим титрованием дозы под контролем АД и газового состава крови до получения желаемого эффекта) [94-96].
-
У детей и у взрослых с коарктацией аорты не рекомендуется терапия высокими дозами препаратов из фармакотерапевтической группы альфа- и бета-адреностимуляторов и препаратами, ограничивающими частоту сердечных сокращений (сердечные гликозиды) [19,40].
УДД 5, УУР С
-
В случае необходимости новорожденным пациентам с критической КА с дуктус-зависимой гемодинамикой, получающих инфузию простагландины СО1ЕА рекомендовано назначение дополнительной дотации кислорода [19,40].
УДД 5, УУР С
Комментарии: пациентам с дуктус-зависимой гемодинамикой не рекомендовано назначение дополнительной дотации кислорода, т.к. кислород способствует закрытию ОАП. Инфузия простагландинов имеет обратный эффект – поддерживает проходимость артериального протока. Однако, в случае крайней тяжести состояния (чаще при наличии сопутствующей патологии дыхательной системы, либо наличии сопутствующей ВПС) и низкой сатурации крови возможно назначение данным пациентам с дуктус-зависимой гемодинамикой дополнительной дотации кислорода для стабилизации состояния и транспортировки пациента в специализированный кардиохирургический стационар.
-
Новорожденным с пограничной степенью обструкции, лево-правым сбросом на ОАП, отсутствием легочной гипертензии - рекомендовано динамическое наблюдение в течение всего срока естественного гемодинамического закрытия ОАП [19,41- 46].
УДД 5, УУР С
2. Хирургическое лечение
Наличие коарктации аорты является показанием к хирургическому/ эндоваскулярному лечению.
Оперативное лечение коарктации аорты делится на хирургическое и эндоваскулярное лечение. Хирургические методики коррекции представлены следующими методами.
Истмопластика синтетическими заплатами. Требует минимального времени пережатия аорты, исключает формирование непрерывного циркулярного обвивного шва. Однако данная методика характеризуется высокой частотой не только рекоарктации аорты, но и высоким риском формирования аневризм с вероятностью последующего их разрыва (за счет нерастяжимости синтетических материалов и создания излишнего давление на противоположную заплате стенку аорты). В связи с высокой вероятностью формирования ложных аневризм и резидуальной артериальной гипертензии данная методика в настоящее время крайне редко применяется как у детей, так и у взрослых пациентов [47-51].
Истмопластика лоскутом подключичной артерии (непрямая истмопластика). При данной методике не удаляется дуктальная ткань и участок гипоплазированной дуги аорты. Нет необходимости в широкой мобилизации нисходящей аорты и непрерывном циркулярном обвивном шве. Однако перевязка левой подключичной артерии приводит к сосудистой мозговой недостаточности в следствие синдрома позвоночно-подключичного обкрадывания головного мозга, нарушению артериального питания и отставанию в росте левой руки, а также к высокой частоте рекоарктации аорты [52-54].
Расширенный анастомоз «конец–в–конец». Золотым стандартом устранения коарктации аорты стала, предложенная в 1977 году Joseph J. Amato [55], техника резекций коарктации с расширенным анастомозом «конец-в-конец», при которой эффективно устраняется гипоплазия дуги аорты, удаляется дуктальная ткань, сохраняется подключичная артерия и возможность адекватного роста дуги аорты. Последние два десятилетия расширенный косой анастомоз «конец-в-конец» во всем мире стал методом выбора у детей первого года жизни как с гипоплазией дуги аорты, так и без нее, а также же у взрослых пациентов. Аберрантная правая подключичная артерия является единственным фактором операционного риска и риска развития рекоарктации аорты при такой технике [48,56-60].
Анастомоз «конец-в-бок». В 1990 году данную методику впервые применили у пациентов с коарктацией аорты и гипоплазией проксимальной дуги аорты S. Sano и R. B. Mee (Royal Children"s Hospital, Melbourne, Australia) [61]. Показания к данной технике: 1) протяженная гипоплазия проксимальной дуги; 2) отхождение брахиоцефального ствола и левой общей сонной артерии одним стволом; 3) длинная, более 10 мм, выраженная гипоплазия дистальной дуги. Поскольку данная методика требует срединного доступа и подключения искусственного кровообращения, то считается обязательным устранение внутрисердечных аномалий одномоментно с реконструкцией дуги в неонатальном периоде. Техника анастомоза «конец-в-бок» сопровождается низкой летальностью, низкой частотой рекоарктации аорты и артериальной гипертензии [62-63]. У детей старшего возраста и у взрослых пациентов данная техника не применяется.
Резекция коарктации аорты с протезированием. Учитывая меньшую эластичность тканей у взрослых и отсутствие выраженного соматического роста, хирургическая коррекция нативной коарктации у данных пациентов чаще всего требует применения графтов (протезов), так как выполнение прямого анастомоза зачастую невозможно (особенно если коарктация протяженная, либо присутствует гипоплазия приксимального отдела дуги). У взрослых пациентов предпочтение отдается боковой торакотомии, потому что у них редко бывает сопутствующая внутрисердечная патология [64-65]. Основными показаниями к резекции коарктации аорты с протезированием у детей старшего возраста и взрослых является наличие протяженного сегмента коарктации, гипоплазии пре и/или постенотических сегментов аорты, а также наличие паракоарктационных аневризм.
Метод экстраанатомического шунтирования. Применяется у взрослых пациентов с рекоарктацией, с протяженным участком сужения дистального отдела дуги и перешейка аорты, при низкой толерантности головного мозга к ишемии при пережатии сонных артерий, а также при выраженном спаечном процессе в зоне интереса [66-68]. Методом выбора экстраанатомической операции является аорто-аортальное шунтирование от восходящей к нисходящей грудной аорте из правосторонней торакотомии.
-
Неотложная хирургическая коррекция коарктации аорты рекомендуется пациентам с критической (дуктусзависимой) коарктацией аорты независимо от измеренного градиента на перешейке аорты[19, 41-46, 106].
УДД 5, УУР С.
-
Пациентам со стабильной гемодинамикой, не зависящей от функции ОАП и с градиентом систолического артериального давления в месте сужения аорты > 20 мм рт. ст., рекомендована хирургическая коррекция в плановом порядке [19, 41-46,106].
УДД 5, УУР С.
-
Хирургическая или эндоваскулярная коррекция коарктации аорты рекомендуется пациентам с систолическим градиентом на перешейке аорты < 20 мм рт. ст. при наличии артериальной гипертензии (в покое или при физической нагрузке или данным суточного мониторирования АД) или при значительном сужении перешейка аорты (отношение диметра суженного участка аорты к диаметру аорты на уровне диафрагмы <80%) [19, 41-46, 106].
УДД 5, УУР С.
-
Коррекцию изолированной коарктации рекомендуется выполнять как из боковой торакотомии по 3-4-му межреберному промежутку со стороны расположения дуги аорты (т.е., при типичном их расположении слева от позвоночника доступ осуществляется из левосторонней боковой торакотомии), так и из центрального доступа с применением искусственного кровообращения [19,44-46,69-73].
УДД 4, УУР С.
-
Рекомендуемым методом коррекции КА у новорожденных и грудных детей является резекция области обструкции (у новорожденных – с максимально возможным иссечением участков стенки аорты, содержащих дуктальную ткань в субэндотелиальном слое) с наложением непосредственного, «косого» (расширенного за счет дополнительных продольных надрезов сшиваемых участков аорты) анастомоза типа «конец в конец» между дугой и нисходящей аортой, шовным материалом минимально допустимого сечения (определяется весом пациента и индивидуальными особенностями стенки аорты) [19,41-46].
УДД 4, УУР С.
-
При сопутствующей гипоплазии проксимальных отделов дуги аорты у новорожденных и детей раннего возраста рекомендовано наложение непосредственного анастомоза «конец в бок» между нисходящей аортой и восходящей аортой в условиях искусственного кровообращения аорты. [61-63,74-75].
УДД 4, УУР С.
Комментарий: у детей старшего возраста и взрослых в подобных случаях методом выбора является экстраанатомическое шунтирование от восходящей к нисходящей грудной аорте [93].
-
Коррекция путем прямой истмопластики у новорожденных с сохранением дуктальной ткани или мембраны дуктального происхождения не рекомендована в связи с высоким риском резидуальной и/или рецидивирующей обструкции [19,46,52-54].
УДД 5, УУР C.
Комментарии: в связи с высоким риском резидуальной и/или рецидивирующей обструкции.
-
Коррекция путем непрямой истмопластики с помощью заплаты не рекомендована как у новорожденных, так и у детей старшего возраста и у взрослых [19,46-51].
УДД 4, УУР C.
Комментарии: помимо рецидива обструкции в связи с персистенцией дуктальной ткани/мембраны, чревата формированием ложной аневризмы в отдаленном послеоперационном периоде.
-
Коррекция путем непрямой истмопластики лоскутом отсеченной подключичной артерии по Waldhausen – Nahrwold не рекомендована новорожденным в связи с сохранением дуктальной ткани/мембраны, вероятностью формирования аневризмы в отдаленном послеоперационном периоде, риском развития синдрома обкрадывания вертебро-базилярного кровотока через позвоночную артерию, утратой пути магистрального кровоснабжения левой руки [19,52-54,76-77].
УДД 4, УУР C.
Комментарии: в случае выполнения непрямой истмопластики, чтобы избежать развития синдрома обкрадывания вертебро-базилярного кровотока через позвоночную артерию и утраты магистрального кровоснабжения левой руки целесообразно выполнять реплантацию отсеченной подключичной артерии в левую общую сонную артерию.
-
Использование биологических или синтетических кондуитов для реконструкции аорты при коррекции КА в раннем детском возрасте не рекомендовано [19,76-77].
УДД 5, УУР C.
-
Взрослым пациентам с коарктацией аорты и клиническими проявлениями вследствие дисфункции ЛЖ, выраженной артериальной гипертензии или ишемии нижних конечностей рекомендовано выполнение открытых хирургических или эндоваскулярных вмешательств [29,31].
УДД 5, УУР С
3. Рентгенэндоваскулярное лечение
Существуют два метода рентгенэндоваскулярного лечения больных с коарктацией и рекоарктацией аорты: транслюминальная баллонная ангиопластика и стентирование.
3.1 Транслюминальная баллонная ангиопластика
-
Транслюминальная баллонная ангиопластика рекомендуется как метод выбора при лечении рекоарктации аорты (при градиенте систолического давления >20 мм рт.ст.) после открытой хирургической коррекции, независимо от возраста больного [19,36,41-45,97-99].
УДД 5, УУР C
-
Баллонная ангиопластика рекоарктации рекомендована при градиенте систолического давления на перешейке аорты <20 мм рт.ст. и наличии крупных коллатеральных сосудов у детей, а также у пациентов со сложными ВПС (единственным желудочком сердца, ДОС от правого и левого желудочка и др.) или со значительной дисфункцией желудочков сердца [36, 97-99].
УДД 5, УУР C
-
Транслюминальная баллонная ангиопластика КА рекомендована детям с «взрослым типом» КА старше 1 года жизни без сопутствующей гипоплазии дуги аорты и при умеренно выраженной, локальной («песочные часы») обструкции. [19,29,36, 97-99]
УДД 5, УУР C
-
Рекомендовано выполнение ТЛБАП нативной коарктации аорты в качестве паллиативной меры для стабилизации состояния ребёнка, независимо от возраста, если имеются такие отягчающие обстоятельства, как выраженное снижение фракции выброса желудочков сердца, тяжелая митральная регургитация, низкий сердечный выброс или системное заболевание [36, 97-99].
УДД 5, УУР C
-
Транслюминальная баллонная ангиопластика КА у младенцев с сопутствующей гипоплазией дуги аорты не рекомендована [41-47,77].
УДД 5, УУР С
Комментарии: при ТЛБАП крайне редко возможно развитие таких осложнений, как диссекция и разрыв аорты. В послеоперационном периоде после ТЛБАП частота рестеноза колеблется от 18% до 53%, возможно формирования аневризмы аорты (6-55%) [47,51,78-81, 97-99].
3.2 Стентирование
Применяются две технологии стентирования: голометалическими стентами и стентами с покрытием.
-
Стентирование рекомендовано всем пациентам с рекоарктацией аорты и градиентом систолического давления на перешейке аорты >20 мм рт. ст., если анатомия перешейка, возраст и вес пациента позволяют имплантировать стент, который в последующем возможно расширить до размеров аорты взрослого [36,97,100-101].
УДД 5, УУР C
-
Стентирование коарктации или рекоарктации аорты рекомендовано наравне с хирургическим лечением у взрослых пациентов с артериальной гипертензией и градиентом >20 мм рт.ст. на перешейке аорты [31,36,102-105, 110].
УДД 5, УУР C
Комментарии: выполнение стентирования коарктации и рекоарктации у детей до 10 лет требует в отдаленном периоде повторной редилатации из-за соматического роста пациента [82-84, 97,100-101].
-
Стентирование рекомендовано всем пациентам с коарктацией аорты и градиентом систолического давления на перешейке аорты >20 мм рт. ст., если анатомия перешейка, возраст и вес пациента позволяют имплантировать стент, который в последующем возможно расширить до размеров аорты взрослого [36, 97,100-101].
УДД 4, УУР C
Комментарий: Стентирование обладает более высокой эффективностью в сравнении с изолированной ТЛБАП. Стентирование редко применяется у новорожденных в связи с невозможностью имплантации стента, расширяемого в дальнейшем до размеров взрослого человека. Стентирование постепенно стало операцией выбора у детей старшего возраста и взрослых, за исключением случаев, когда коарктация сочетается с гипоплазией перешейка или дуги аорты, извитостью перешейка, тубулярной коарктацией аорты. Но даже при таком сочетании возможно стентирование с применением покрытых стентов. У пациентов с критической коарктацией аорты для профилактики возможных осложнений (образование аневризмы и разрывов аорты) также необходимо использовать стенты с покрытием. Стенты с покрытием можно использовать при сочетании коарктации аорты с открытым артериальным протоком для одномоментной коррекции пороков [97, 100, 101]
-
Стентирование не рекомендовано детям весом менее 15 кг из-за размеров доставляющих устройств и необходимости проведения их через бедренную артерию (это приводит к высокому риску повреждения бедренной артерии с последующим вероятным развитием тромбозов поврежденной бедренной артерии) [31,36,82-84,103-105].
УДД 5, УУР С
Комментарий: При наличии ДМЖП возможно проведение стентирования коарктации и рекоарктации аорты у детей трансвенозным доступом для профилактики возможных артериальных тромбозов [97,100,101].
-
Стентирование перешейка аорты рекомендовано в исключительных случаях у новорожденных и грудных детей, после проведенных неэффективных хирургических или эндоваскулярных операций, если повторная хирургическая операция имеет высокий риск [36, 97].
УДД 5, УУР C
Комментарии: имплантация стента, диаметр которого невозможно расширить до диаметра аорты взрослого, накладывает обязательства на хирургическую бригаду удалить такой стент в дальнейшем, когда его максимальный диаметр будет ограничивать кровоток по аорте [36, 97].
4. Иное лечение
Нет.
Медицинская реабилитация
Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
-
Пациентам после хирургической коррекции КА рекомендуется в течение 4-6 последующих месяцев жизни избегать тракционных нагрузок на верхнюю конечность со стороны послеоперационного шва [19, 27].
УДД 5, УУР С
-
Младенцам после хирургической коррекции КА рекомендуется в течение 4-х последующих месяцев избегать процедур лечебной гимнастики [19, 27]
УДД 5, УУР С
Прогноз
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
В периоде новорожденности тяжесть состояния пациентов с обструктивными аномалиями развития дуги аорты и прогноз естественного течения заболевания предопределяют следующие факторы:
-
Характер кровотока в бассейне нисходящей аорты: он может быть «дуктус-зависимым» и компенсированным магистральным. Во втором случае даже при закрытии артериального протока через суженный перешеек аорты обеспечивается адекватное кровоснабжение нижней половины тела. Развитых межсистемных коллатералей, способных обеспечить компенсированный коллатеральный кровоток в нисходящей аорте, у новорожденных, как правило, не бывает.
-
Сброс крови «слева направо» через нерестриктивный ДМЖП или аорто-легочное окно усугубляют тяжесть состояния пациентов и прогноз.
-
Особенности внутрисердечной анатомии: изолированная форма коарктации, как правило, имеет более благоприятное течение и прогноз, нежели ее сочетание с септальным дефектом (ДМЖП, аорто-легочное окно) и, тем более, перерыв дуги аорты. Сложная внутрисердечная анатомия, как при коарктации, так и при перерыве дуги, делает прогноз гораздо более серьезным.
-
Среди внесердечных факторов риска следует выделить низкую массу тела, недоношенность и морфофункциональную незрелость при рождении, перинатальное инфицирование, сопутствующие внесердечные пороки развития и стигмы дизэмбриогенеза [19,89-92].
Госпитализация
Организация оказания медицинской помощи
Этапы оказания медицинской помощи и показания к госпитализации:
1. уточнение диагноза;
2. в случае подтверждения «критической» коарктации аорты начало консервативной терапии и организация экстренного перевода в кардиохирургический стационар для неотложной хирургической помощи, тотчас после медикаментозной стабилизации клинического состояния;
3. асимптомные формы коарктации аорты – близкие к физиологическому значения градиента давления на перешейке у новорожденных и «пограничная» степень обструкции у пациентов более старшего возраста (более 20 мм рт.ст.) – нуждаются в динамическом наблюдении.
4. показанием к хирургическому лечению коарктации аорты является любая клинически манифестирующая форма патологии. Поэтому при первичном отсутствии клинических проявлений коарктации аорты и отсроченном развитии клинической картины также рекомендован перевод пациентов в специализированный кардиохирургический стационар для определения дальнейшей тактики лечения.
Основы консервативной терапии
-
Ключевая роль в предоперационной консервативной терапии в случае «критической» коарктации аорты при этом отводится внутривенной инфузии простагландинов СО1ЕА поддерживающих проходимость артериального протока;
-
Критериями эффективности предоперационной консервативной терапии являются нормализация кислотно-щелочного равновесия, регресс содержания сывороточного лактата, тенденция к нормализации диуреза и сокращение уровня остаточного азота плазмы крови.
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
-
Пациентам, перенесшим хирургическую коррекцию КА, рекомендуется в течение первого года после операции не менее 2 раз пройти обследование (консультация врача-детского кардиолога, врача-кардиолога, ЭхоКГ) В последующем, при отсутствии необходимости повторного хирургического вмешательства, возможно наблюдение по месту жительства не реже 1 раза в год [41,69].
УДД 5, УУР C
Комментарии: наиболее значимым осложнением в отдаленные сроки после операции является развитие повторного сужения в области операции – рекоарктация, которая в свою очередь может инициировать другие осложнения, такие как артериальная гипертензия, развитие аневризмы аорты и сосудов головного мозга, дисфункция левого желудочка, появление нарушений ритма, нарушений мозгового кровообращения. Пациенты, после устранения коарктации аорты, находятся под постоянной угрозой развития рекоарктации аорты. Пациенты даже после успешной операции должны быть под постоянным наблюдением врача-кардиолога на протяжении всей жизни. В структуру рутинных обследований должны быть включены ежегодный амбулаторный 24-часовой мониторинг артериального давления, эхокардиография с измерением размеров проксимальной и дистальной дуги аорты пересчитанные с учетом Z-score, измерением пикового градиента давления по Допплеру [85-86].
-
Всем пациентам после ранее выполненного оперативного устранения коарктации аорты рекомендуется динамическое наблюдение для своевременного выявления осложнений [41,69].
Комментарии: в случае выявления рецидива обструкции срок очередного амбулаторного обследования либо госпитализации в стационар устанавливается врачом-кардиологом.
УДД 5, УУР C
-
Пациентам после хирургической коррекции КА рекомендуется контроль АД на руках и ногах с целью оценки градиента давления и оценки эффективности выполненной операции, а также целесообразности назначения/продолжения медикаментозной гипотензивной терапии [41,69].
УДД 5, УУР C
Комментарии: самым распространенным осложнением является развитие артериальной гипертензии, от которой страдают до половины пациентов к 40 годам жизни [47,87-88].
-
Пациентам после хирургической коррекции КА, в случае сохранения резидуальной артериальной гипертензии, рекомендуется проведение обследований и лечения согласно клиническим рекомендациям по артериальной гипертензии [19, 27, 109].
УДД 5, УУР С.
-
Пациентам после хирургической коррекции КА в рамках амбулаторного эхокардиографического обследования рекомендуется оценивать характер кровотока по дуге аорты и наличие градиента давления в области анастомоза, морфофункциональные параметры левого желудочка и митрального клапана, а также клапана аорты и субаортального пространства [41,69].
УДД 5, УУР C
Информация
Источники и литература
-
Клинические рекомендации Ассоциации детских кардиологов России
- 1. Joseph J. Amato, MD, Ralph J. Galdieri, MD, and Joseph V. Cotroneo, MD. Role of Extended Aortoplasty Related to the Definition of Coarctation of the Aorta. The Annals of Thoracic Surgery, 1991 Sep., Vol. 52, Issue 3, Pages 615-620. 2. Ho SY, Anderson RH. Coarctation, tubular hypoplasia and the ductus arteriosus. Histological study of 35 specimens. Br Heart J 1979; 41:268. 3. Hutchins GM. Coarctation of the aorta explained as a branch-point of the ductus arteriosus. Am J Pathol 1971; 63:203. 4. Brom AG. Narrowing of the aortic isthmus and enlargement of the mind. J Thorac Cardiovasc Surg 1965; 50:166. 5. Edwards JE, Christensen NA, Clagett OT, McDonald JR. Pathologic considerations in coarctation of the aorta. Mayo Clin Proc1948; 23:324. 6. Pellegrino A, Deverall PB, Anderson RH, Smith A, Wilkinson JL,Russo P, et al. Aortic coarctation in the first three months of life. An anatomopathological study with respect to treatment. J Thorac Cardiovasc Surg 1985; 89:121. 7. Rudolph AM, Heymann MA, Spitznas U. Hemodynamic considerations in the development of narrowing of the aorta. Am J Cardiol 1972; 30:514. 8. Quaegebeur J.M., Jonas R.A., Weinberg A.D., Blackstone E.H., Kirklin J.W. Outcomes in seriously ill neonates with coarctation of the aorta. A multi institutional study. J Thorac Cardiovasc Surg 1994; 108:841–851; discussion 52–54. 9. Roos-Hesselink J.W., Schölzel B.E., Heijdra R.J., Spitaels S.E., Meijboom F.J., Boersma E., Bogers A.J., Simoons M.L. Aortic valve and aortic arch pathology after coarctation repair. Heart. 2003 Sep;89 (9):1074-7. 10. Shiokawa Y, Becker AE. The surgical anatomy of the left ventricular outflow tract in hearts with ventricular septal defect and aortic arch obstruction. Ann Thorac Surg. 1998 May;65(5):1381-7. 11. Winer HE, Kronzon I, Glassman E, Cunningham JN Jr, Madayag M. Pseudocoarctation and mid-arch aortic coarctation. Chest 1977; 72:519. 12. Allan LD, Crawford DC, Tynan M. Evolution of coarctation of the aorta in intrauterine life. Br Heart J 1984; 52:471. 13. Elzenga N.J., Gittenberger-de Groot A.C. (1985) Coarctation and related aortic arch anomalies in hypoplastic left heart syndrome. Int J Cardiol 8:379–393. 14. Russell G.A., Berry P.J., Watterson K., Dhasmana J.P., Wisheart J.D. Patterns of ductal tissue in coarctation of the aorta in the first three months of life. J Thorac Cardiovasc Surg. 1991 Oct;102(4):596-601. 15. Report of the New England Regional Infant Cardiac Program. Pediatrics 1980; 65:375. 16. Shinebourne E.A., Tarn A.S., Elseed A.M., Paneth M., Lennox S.C., Cleland W.P., et al. Coarctation of the aorta in infancy and childhood. Br Heart J 1976; 38:375. 17. Hoffman J.I., Kaplan S. The incidence of congenital heart disease. J Am Coll Cardiol (2002) 39:1890–1900. 18. Amato JJ, Douglas WI, James T, Desai U. Coarctation of the aorta. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu. 2000; 3:125-141. 19. Бокерия Л.А., Шаталов К.В. Детская кардиохирургия. 2016. Изд. НМИЦ ССХ им. А.Н.Бакулева. 20. Talner NS, Berman MA. Postnatal development of obstruction in coarctation of the aorta: role of the ductus arteriosus. Pediatrics 1975; 56:562. 21. Tawes RL Jr, Aberdeen E, Waterston DJ, Carter RE. Coarctation of the aorta in infants and children. A review of 333 operative cases including 179 infants. Circulation 1969;39: I173. 22. Shearer WT, Rutman JY, Weinberg WA, Goldring D. Coarctation of the aorta and cerebrovascular accident. A proposal for early corrective surgery. J Pediatr 1970; 77:1004. 23. Калашникова ЕА, Никитина НА, Галич СР. Диагностика, клиника, лечение и прогноз при коарктации аорты у детей. Здоровье ребенка. 2015;(1):129-132. 24. Allen HD, Driscoll DJ, Shaddy RE, Feltes TF. In. Moss & Adams’ Heart Disease in Infants, Children, and Adolescents: Including the Fetus and Young Adult. V.2. Lippincott Williams & Wilkins; 2013: 799-809. 25. Freundlich E, Engle MA, Goldberg HP. Coarctation of aorta in infancy. Analysis of 10-year experience with medical management. Pediatrics 1961; 27:427. 26. Keith JD, Rowe RD, Vlad P. Heart disease in infancy and childhood. New York: Macmillan, 1978, p. 738. 27. Шарыкин А.С. Врожденные пороки сердца. Москва. 2005; с.224 – 236. 28. Kenny D, Hijazi ZM. Coarctation of the aorta: from fetal life to adulthood. Cardiol J 2011; 18:487–95. 29. Hiratzka LF, Bakris GL, Beckman JA, et al. 2010 CCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM guidelines for the diagnosis and management of patients with thoracic aortic disease. A report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines, American Association for Thoracic Surgery, American College of Radiology, American Stroke Association, Society of Cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, Society of Interventional Radiology, Society of Thoracic Surgeons, and Society for Vascular Medicine. J Am Coll Cardiol 2010;55: e27–129. 30. Lacour-Gayet F, Bruniaux J, Serraf A, Chambran P, Blaysat G, Losay J, Petit J, Kachaner J, Planché C. Hypoplastic transverse arch and coarctation in neonates. Surgical reconstruction of the aortic arch: a study of sixty-six patients. J Thorac Cardiovasc Surg. 1990 Dec;100(6):808-16. 31. Warnes CA, Williams RG, Bashore TM, et al. ACC/AHA 2008 guidelines for the management of adults with congenital heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Develop Guidelines on the Management of Adults With Congenital Heart Disease). Developed in collaboration with the American Society of Echocardiography, Heart Rhythm Society, International Society for Adult Congenital Heart Disease, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. J Am Coll Cardiol 2008;23: e143–263. 32. Matsui H, Mellander M, Roughton M, Jicinska H, Gardiner HM. Morphological and physiological predictors of fetal aortic coarctation. Circulation 2008; 118:1793-801. 33. Becker C, Soppa C, Fink U, Haubner M, Muller-Lisse U,Englmeier KH, et al. Spiral CT angiography and 3D reconstruction in patients with aortic coarctation. Eur Radiol 1997; 7:1473. 34. Allen HD, Driscoll DJ, Shaddy RE, Feltes TF. In. Moss & Adams’ Heart Disease in Infants, Children, and Adolescents: Including the Fetus and Young Adult. V.2. Lippincott Williams & Wilkins; 2013: 799-809. 35. Mavroudis C., Backer C.L. Pediatric cardiac surgery, 4th ed, 2013, 256-282 36. Feltes TF, Bacha E, Beekman RH 3rd, et al. American Heart Association Congenital Cardiac Defects Committee of the Council on Cardiovascular Disease in the Young; Council on Clinical Cardiology; Council on Cardiovascular Radiology and Intervention. Indications for cardiac catheterization and interventions for cardiac catheterization and intervention in pediatric cardiac disease; a scientific statement from the American Heart Association. Circulation 2011; 123:2607–52. 37. Calder AL, Kirker JA, Neutze JM, Starling MB. Pathology of the ductus arteriosus treated with prostaglandins: comparisons with untreated cases. Pediatr Cardiol 1984; 5:85. 38. Elliott RB, Starling MB, Neutze JM. Medical management of the ductus arteriosus. Lancet 1975; 1:140. 39. Neutze JM, Starling MB, Elliott RB, Barratt-Boyes BG. Palliation of cyanotic congenital heart disease in infancy with E-type prostaglandins. Circulation 1977; 55:238. 40. Khalil M, Jux C, Rueblinger L, Behrje J, Esmaeili A, Schranz D. Acute therapy оf newborns with critical congenital heart disease. Transl Pediatr. 2019 Apr;8(2):114-126.
Информация
Список сокращений
АД – артериальное давление
АКГ – ангиокардиография
ВПС – врожденный порок сердца
ДАК – двустворчатый аортальный клапан
ДМЖП – дефект межжелудочковой перегородки
ДТ – дуктальная ткань
КА – коарктация аорты
КС – контрастное средство
КТ – компьютерная томография
КТА – КТ-ангиография
ЛЖ – левый желудочек
МК – митральный клапан
МРА – МР-ангиография
МРТ – магнитно-резонансная томография
НК – недостаточность кровообращения
ОАП – открытый артериальный проток
РКА – рекоарктация аорты
СН – сердечная недостаточность
ТЛБАП – транслюминальная баллонная ангиопластика
ЭКГ – электрокардиография
ЭхоКГ – эхокардиография
Термины и определения
Ангиокардиография – инвазивный метод лучевой диагностики, заключающийся в визуальном отображении полостей сердца и сосудов путем введения в кровоток рентген-контрастного препарата, при непосредственном измерении давления в полостях сердца и сосудах, получении проб крови из них для оценки ее газового состава, а также выполнении морфометрических расчетов на основе полученных рентген-контрастных изображений сердечно-сосудистой системы.
Компьютерная томография (КТ) – неинвазивный метод лучевой диагностики, позволяющий получить серию послойных субмиллиметровых аксиальных изображений органов и структур тела человека, основанный на измерении и сложной компьютерной обработке разности ослабления рентгеновского излучения различными по плотности тканями; для улучшения дифференцировки органов друг от друга, а также нормальных и патологических структур, применяют различные методики контрастного усиления/контрастирования, с использованием йодсодержащих рентгеноконтрастных препаратов. Для визуализации структур сердечно-сосудистой системы применяют КТ-ангиографию – методику внутривенного болюсного введения рентгеноконтрастного препарата в кровоток с помощью системы внутрисосудистого введения контрастного вещества, с установленной скоростью и временем введения препарата, на основе полученных данных посредством компьютерной постобработки с 3D-реконструкцией строится трехмерная модель сердца и сосудов.
Магнитно-резонансная томография (МРТ) – неинвазивный нерентгеновский компьютерный метод получения томографических медицинских изображений для исследования внутренних органов и тканей, основанный на явлении ядерного магнитного резонанса и на измерении электромагнитного отклика атомных ядер, находящихся в сильном постоянном магнитном поле, в ответ на возбуждение их определенным сочетанием электромагнитных волн; такими ядрами являются ядра атомов водорода, присутствующие в теле человека в составе воды и других веществ. МР-ангиография – метод получения изображения просвета сосудов при помощи магнитно-резонансного томографа. Метод позволяет оценивать как анатомические, так и функциональные особенности кровотока. МР-ангиография основана на отличии сигнала от перемещающихся протонов (крови) от окружающих неподвижных тканей, что позволяет получать изображения сосудов без использования каких-либо контрастных средств – бесконтрастная ангиография (фазово-контрастная МР-ангиография). В ряде случаев применяется внутривенное болюсное контрастирование с использованием контрастных препаратов на основе парамагнетиков (гадолиний).
Прямая истмопластика – способ коррекции коарктации аорты, заключающийся в продольном рассечении стенки аорты через область обструкции с последующим ушиванием разреза в поперечном направлении.
Непрямая истмопластика – способ коррекции коарктации аорты, заключающийся в продольном рассечении стенки аорты через область обструкции с последующим вшиванием в полученный разрез аутологичного или гетерологичного (биологического либо синтетического) пластического материала.
Транслюминальная баллонная ангиопластика (ТЛБАП) – рентгенхирургический способ коррекции обструктивных поражений сосудов путем раздутия в просвете суженного сосуда баллона на конце специального катетера, проведенного пункционно через магистральный сосуд.
Перешеек аорты – участок аорты, который локализуется сразу после отхождения брахиоцефальных сосудов и соединяет дугу аорты с грудным отделом нисходящей аорты,
Дуктус-зависимый порок – ВПС, при котором поддержание адекватной гемодинамики зависит от функции открытого артериального протока. Декомпенсация состояния развивается по мере закрытия АП.
Критерии оценки качества медицинской помощи
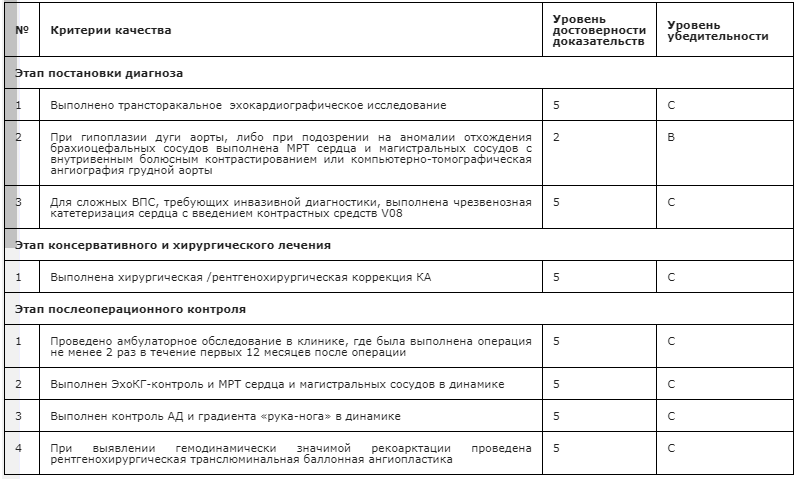
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
1. Авраменко А.А., (Самара)
2. Алекян Б.Г., академик РАН (Москва) «Российское Научное Общество Специалистов по Рентгенэндоваскулярной Диагностике и Лечению»
3. Аракелян В.С., проф. (Москва)
4. Богданов В.Н., (Челябинск)
5. Бокерия Л.А., академик РАН (Москва), "Ассоциация сердечно-сосудистых хирургов России"
6. Борисков М.В., д.м.н. (Краснодар)
7. Бродский А.Г., к.м.н. (Сургут)
8. Гаврилов Р.Ю., (Волгоград), "Ассоциация сердечно-сосудистых хирургов России"
9. Григорян А.М. к.м.н. (Москва) «Российское Научное Общество Специалистов по Рентгенэндоваскулярной Диагностике и Лечению»
10. Горбатиков К.В., д.м.н. (Тюмень)
11. Горбатых Ю.Н., д.м.н. (Новосибирск)
12. Есаян А.А., к.м.н. (Москва)
13. Калашников С.В., к.м.н. (Москва)
14. Ким А.И., проф. (Москва), "Ассоциация сердечно-сосудистых хирургов России"
15. Ковалёв И.А., д.м.н. (Москва), "Ассоциация детских кардиологов России"
16. Кокшенев И.В., проф. (Москва), "Ассоциация сердечно-сосудистых хирургов России"
17. Кривощеков Е.В., д.м.н. (Томск),"Ассоциация сердечно-сосудистых хирургов России"
18. Купряшов А.А., проф. (Москва)
19. Левченко Е.Г., д.м.н. (Москва)
20. Мовсесян Р.Р., член-корреспондент РАН, (Санкт-Петербург), "Ассоциация сердечно-сосудистых хирургов России"
21. Налимов К.А., к.м.н. (Хабаровск)
22. Петрушенко Д.Ю., к.м.н. (Казань)
23. Плотников М.В., к.м.н. (Астрахань), "Ассоциация сердечно-сосудистых хирургов России"
24. Свободов А.А., проф. (Москва)
25. Синельников Ю.С., д.м.н. (Пермь)
26. Теплов П.В., (Красноярск)
27. Трунина И. И., проф. (Москва) "Ассоциация детских кардиологов России"
28. Александрова С.А., к.м.н. (Москва) Общероссийская общественная организация содействия развитию лучевой диагностики и терапии «Российское общество рентгенологов и радиологов»
29. Барышникова И.Ю., к.м.н. (Москва) Общероссийская общественная организация содействия развитию лучевой диагностики и терапии «Российское общество рентгенологов и радиологов»
30. Берген Т.А., д.м.н. (Новосибирск) Общероссийская общественная организация содействия развитию лучевой диагностики и терапии «Российское общество рентгенологов и радиологов»
31. Рычина И.Е., к.м.н. (Москва) Общероссийская общественная организация содействия развитию лучевой диагностики и терапии «Российское общество рентгенологов и радиологов»
32. Синицын В.Е., д.м.н., профессор (Москва) Общероссийская общественная организация содействия развитию лучевой диагностики и терапии «Российское общество рентгенологов и радиологов»
33. Юрпольская Л.А., д.м.н. (Москва) Общероссийская общественная организация содействия развитию лучевой диагностики и терапии «Российское общество рентгенологов и радиологов»
Конфликт интересов отсутствует. Все члены Рабочей группы подтвердили отсутствие финансовой поддержки/конфликта интересов, о которых необходимо сообщить.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
-
Врач-педиатр
-
Врач-кардиолог
-
Врач- детский кардиолог
-
Врач-рентгенолог
-
Врач ультразвуковой диагностики
-
Врач функциональной диагностики
-
Врач-сердечно-сосудистый хирург
-
ординаторы.
Методы, используемые для сбора/селекции доказательств: поиск в электронных базах данных.
Описание методов, использованных для оценки качества и силы доказательств: доказательной базой для рекомендаций являются публикации, вошедшие в базы данных PubMed, Scopus. Глубина поиска составляла 30 лет.
Методы, использованные для оценки качества и силы доказательств
· консенсус экспертов;
· оценка качества рекомендаций в соответствии с рейтинговой схемой (таблица П1).
· оценка силы доказательств в соответствии с рейтинговой схемой (таблица П2).
В ходе разработки КР использована новая система шкал УДД и УУР для лечебных, реабилитационных, профилактических вмешательств и диагностических вмешательств (Таблицы П1, П2 и П3), введенная в 2018 г. ФГБУ ЦЭККМП Минздрава РФ. Формирование Национальных рекомендаций проводилось на основе рекомендаций ЕОК, с учетом национальной специфики, особенностей обследования, лечения, учитывающих доступность медицинской помощи.
Таблица П1. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)

Таблица П2. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
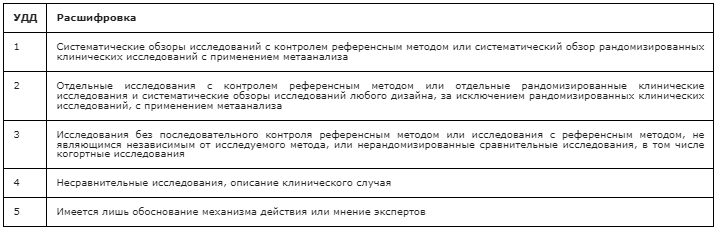
Таблица П3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)

Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию — не реже чем один раз в три года, — а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
1. Об основах охраны здоровья граждан в Российской Федерации (ФЗ №323 от 21.11.2011)
2. Порядок оказания медицинской помощи больным с сердечно-сосудистыми заболеваниями (Приказ Минздрава России №918н от 15.11.2012)
3. «О классификации и критериях, используемых при осуществлении медико-социальной экспертизы граждан федеральными государственными учреждениями медико-социальной экспертизы» (Приказ Минздрава России №1024н от 17 декабря 2015 г.)
4. Приказ Минздрава России от 28.02.2019 N 103н "Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности, включаемой в клинические рекомендации информации" (Зарегистрировано в Минюсте России 08.05.2019 N 54588);
5. Приказ Министерства здравоохранения Российской Федерации от 10 мая 2017 г. № 203н "Об утверждении критериев оценки качества медицинской помощи";
6. Приказ Министерства здравоохранения Российской Федерации от 13 октября 2017 г. № 804н «Об утверждении номенклатуры медицинских услуг»;
7. Приказ Министерства здравоохранения Российской Федерации от 7 октября 2015 г. № 700н «О номенклатуре специальностей специалистов, имеющих высшее медицинское и фармацевтическое образование»; Приказ Минздрава России от 20.12.2012 N 1183н (ред. от 01.08.2014) «Об утверждении Номенклатуры должностей медицинских работников и фармацевтических работников»;
8. Приказ Минздрава России от 06.06.2012 N 4н (ред. от 25.09.2014) "Об утверждении номенклатурной классификации медицинских изделий"
9. Приказ Минздрава России №560н от 9 июня 2020 года «Об утверждении Правил проведения рентгенологических исследований»
Технология выполнения трансторакальной эхокардиографии
Требования: У новорожденных: датчики с частотой 7.5-12 МГц, у взрослых – 2.5-7 МГц.
Противопоказания: нет.
Ограничения: случаи неудовлетворительного акустического окна
Важные показатели при анализе и интерпретации полученных изображений: Проведение трансторакальной ЭхоКГ
Обзорная эхокардиография (перед проведением исследования аорты) для исключения сочетанного ВПС, оценки размеров и сократительной функции сердца, функциональной состоятельности клапанов (митрального и аортального). Измерение конечного диастолического размера левого желудочка (ЛЖ) и количественную оценку сократительной функции ЛЖ определяют в М-режиме из левого парастернального доступа в проекции по длинной оси ЛЖ или короткой оси ЛЖ на уровне конца створок митрального клапана (МК), которые будут служить ориентиром для постановки курсора - перпендикулярно линии смыкания створок МК. Измерения производят от задней поверхности межжелудочковой перегородки до передней поверхности задней стенки ЛЖ. Визуальная оценка ЛЖ: из апикальной четырехмерной позиции в сравнении с правыми отделами. Левый парастернальный доступ: по длинной оси оценка диаметра фиброзного кольца (ФК) аортального клапана, и размеры корня и восходящей аорты.
Восходящая аорта (у грудных детей), дуга и перешеек аорты, проксимальная часть грудного отдела: супрастернальный доступ.
Нисходящая аорта: оценка на уровне диафрагмы или ниже, но не близко к мезентериальным сосудам в режиме импульсно-волнового допплера. Особое внимание следует уделять выравниванию ультразвукового луча с длинной осью нисходящей аорты. Признак КА: измененный (не магистральный, коллатеральный) поток в брюшной аорте и снижение максимальной линейной скорости кровотока (норма у новорожденных 60-80 см/с с коррекцией угла ультразвукового луча). На допплерограмме: низкоскоростной систоло-диастолический поток с минимальными фазовыми изменениями. У подростков и взрослых максимальная скорость менее 50 см/с и скорость диастолического потока в нисходящей аорте более 25 см/с указывает на коллатеральный кровоток.
Для установления КА необходимо учитывать совокупность гемодинамических показателей (градиент систолического давления в области сужения, линейную скорость кровотока и спектр потока в брюшной аорте) и анатомических особенностей строения аорты, сочетанной патологии.
Количественная оценка:
Шкала Z-score. Z-оценка менее - 2 и диаметр перешейка аорты менее 50% от диаметра брюшной аорты также являются критериями, подтверждающими гипоплазию дуги и перешейка аорты.
Произвести сравнение диаметров восходящей аорты к диаметру интересующего сегмента дуги. КА: менее 60% для проксимального сегмента дуги; менее 50% для дистального сегмента дуги; менее 40 % для перешейка аорты.
Формула нормального диаметра перешейка аорты новорожденного: в норме минимальный поперечный размер перешейка аорты должен составлять масса тела новорожденного+1 мм.
Важные показатели при анализе и интерпретации полученных изображений:
· тип дуги аорты (правая/левая);
· наличие/отсутствие обструктивных изменений дуги аорты;
· локализацию сужения аорты;
· тип коарктации;
· размеры, пульсацию, интенсивность и сравнение антеградного и ретроградного кровотока пре- и постстенотических участков аорты;
· в режиме цветного допплеровского картирования: ускоренный турбулентный кровоток в месте сужения (определение градиента систолического давления - косвенно отражает степень выраженности коарктации).
Следует обращать особое внимание на:
Максимальный (пиковый) градиент систолического давления (измерительный курсор устанавливается сразу за областью обструкции) более 20 мм рт ст с типичным «зубчатым» паттерном на спектрограмме.
Сложности: гемодинамическое разобщение грудной аорты дистальнее 3-го брахицефального сосуда, при наличии крупного открытого артериального протока. При допплеровском исследовании, вследствие снижения скорости и объема потока через область обструкции, заниженные характеристики гемодинамики возможны: при наличии хорошо развитых артериальных коллатералей; открытого артериального протока; при гипоплазии дуги аорты; сниженной систолической функции желудочков; гемодинамически значимой регургитации на атриовентрикулярных клапанах. Завышения градиентных показателей возможны: при умеренном повышении скорости потока в нисходящей аорте вследствие нормального ускорения в дуге аорты после хирургического вмешательства без признаков сужения сосуда; увеличении систолической скорости потока и его турбулентности из-за отсутствия ригидности аорты в участке пластики при отсутствии значительного сужения.
Технология проведения КТ сердца и грудной аорты с внутривенным контрастированием
Условия проведения
КТ выполняют в медицинских учреждениях, оказывающих медицинскую помощь по профилю «сердечно-сосудистая хирургия», имеющих опыт проведения КТ-исследований сердца и сосудов у детей и взрослых с врожденными пороками сердца. КТ проводится в условиях кабинета КТ с использованием системы внутрисосудистого введения контрастного средства (КС).
Специалисты, выполняющие КТ: врач-рентгенолог, рентгенолаборант; врач анестезиолог-реаниматолог при проведении исследования у детей младшего возраста или тяжелых пациентов.
КТ выполняют по назначению лечащего врача. Содержание направления включает четко изложенные цели проведения исследования, показатель скорости клубочковой фильтрации (СКФ) или креатинина и обязательное указание на наличие или отсутствие у пациента противопоказаний к введению контрастных препаратов.
Требуемые технические параметры
- компьютерный томограф с числом рядов детекторов не менее 64 (предпочтительны аппараты с большим количеством детекторов, двухтрубочные аппараты),
- система внутрисосудистого введения КВ (предпочтительны двухколбовые модели).
Перед проведением КТА аорты:
- установка периферического венозного катетера,
- отсутствие противопоказаний к введению КВ (аллергия, выраженное нарушение функции почек и т.д.),
- предпочтительно проведение исследования натощак (спустя как минимум 3 часа после приема пищи),
- оценка предыдущих данных рентгенологических или инструментальных исследований,
- наличие результата ЭхоКГ.
Проведение КТА аорты: Укладка пациента: лежа на спине (с поднятыми вверх руками по возможности).
Область исследования: грудная клетка от уровня ниже диафрагмы (средина печени) до устьев брахиоцефальных сосудов. Минимальная зона исследования: от дуги аорты, с захватом отхождения брахиоцефального ствола, на 1-2 см ниже верхушки сердца; зона может меняться в зависимости от задач (например, нужно визуализировать доступ для эндоваскулярной процедуры). Для периферических доступов исследование выполняется без ЭКГ-синхронизации: 1 для феморального – абдоминальная аорта от чревного ствола до головки бедренной кости; 2 для подключичного – с верхней точки подключичной артерии до передней срединной линии; 3 для комбинированного доступа – с верхней точки подключичной артерии до головки бедренной кости.
ЭКГ-синхронизация: да.
Нативное сканирование: нет.
Задержка дыхания: на вдохе.
Внутривенное контрастирование: во всех случаях.
Предпочтительно использование двух или трехфазного протокола введения КС, предполагающего введение 10-30 мл физиологического раствора в качестве первой фазы, КС в качестве второй фазы, физиологического раствора в качестве третей фазы. Возможно также использование более сложных протоколов введения КС.
Применяется КС с концентрацией йода 300-400 мг/мл (чаще всего - 350-370 мг/мл).
Выбор скорости введения контрастного препарата и физиологического раствора
1. Скорость введения КС – в зависимости от напряжения на трубке.
2. Объем КС = время сканирования + техническая задержка + 2 Х скорость введения КС
3. Мониторинг: на восходящей аорте 120-140 ед. Нu при использовании методики автоматического отслеживания болюса (BolusTracking, SureStart, SmartPrep).
4. Зона сканирования: вся грудная клетка – возможна 1 ЭКГ синхронизированная серия + серия без ЭКГ синхронизации через 25 секунд при необходимости венозной фазы контрастирования.
5. Реконструкции по 0,75мм в ангиографическом фильтре.
Скорость введения для взрослых пациентов
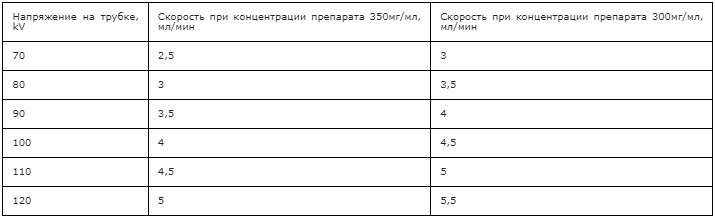
Сканирование детей
1. Скорость введения КС:
· при сканировании на 70 кВ – скорость введения – 0.6 – 0.7мл/с
· при сканировании на 80 кВ – скорость введения – 0.8мл/с
· при сканировании на 100кВ – скорость введения – не менее 1мл/с
2. Объем контрастного вещества при сканировании на 70 кВ = вес + 2. Объем контрастного вещества при сканировании более 80 кВ = вес х 2
3. Зона сканирования – вся грудная клетка. Возможна 1 ЭКГ синхронизированная серия + серия без ЭКГ синхронизации через 10-15 сек.
4. Мониторинг КВ: старт с левого предсердия – при сканировании на 70кВ – 80 ед.Н, при напряжении более 80кВ – 60 ед.Н при использовании методики автоматического отслеживания болюса (BolusTracking, SureStart, SmartPrep).
Возможно для автоматического запуска сканирования по триггеру – моменту достижения целевой плотности выше 120 Hu от исходной в области интереса (например, в просвете нисходящей аорты на уровне бифуркации трахеи, на уровне расположенным дистальнее места стеноза, следует обратить внимание, что такой подход не гарантирует получения хорошего контрастирования сердца и сосудов у новорожденных и детей младшей возрастной группы).
Опорные моменты интерпретации полученных изображений: универсальный посегментный анализ анатомии сердца и магистральных сосудов; морфометрия сосудов и камер сердца; расположение, размеры и тяжесть обструкции аорты; расположение дуги и порядок ветвления брахиоцефальных артерий, наличие и размеры ОАП; морфология аортального клапана; наличие аневризмы, расслоения или коллатеральных сосудов нисходящей аорты; расчет функциональных параметров правых и левых отделов сердца в зависимости от задач исследования; топографическая анатомия сердца и сосудов (при выборе хирургического доступа); анализ изображений других органов грудной клетки с целью выявления сопутствующей экстракардиальной патологии; для пациентов после хирургических или эндоваскулярных операций – анализ с целью оценки результатов вмешательств и на предмет наличия осложнений.
МРТ сердца и магистральных сосудов с внутривенным болюсным контрастированием
Условия проведения
МРТ выполняют в специализированных медицинских учреждениях, имеющих опыт проведения МР-исследований сердца и сосудов у детей и взрослых с ВПС. МРТ проводится в условиях кабинета МРТ с использованием системы внутрисосудистого введения контрастного средства (КС).
Специалисты, выполняющие МРТ: врач-рентгенолог, рентгенолаборант; врач анестезиолог-реаниматолог при проведении исследования у детей младшего возраста или тяжелых пациентов.
МРТ выполняют по назначению лечащего врача. Содержание направления включает четко изложенные цели проведения исследования, необходимость введения контрастного вещества, показатель скорости клубочковой фильтрации (СКФ) или креатинина и обязательное указание на наличие или отсутствие у пациента противопоказаний к введению контрастных препаратов.
Требуемые технические параметры
- магнитно-резонансный томограф с напряженностью поля не менее 1,5 Т
- необходимое техническое оснащение для проведения кардиологических МР-исследований (поверхностные многоканальные катушки, катушка для головного мозга, ЭКГ-синхронизация, кардиопакет программ для сканирования и обработки МР-изображений сердца и сосудов, с возможностью расчета параметров кровотока)
- при необходимости введения контрастного препарата- система внутрисосудистого введения КВ (предпочтительны двухколбовые модели)
- наличие соответствующего немагнитного оборудования жизнеобеспечения и наблюдения при проведении МР-исследований у детей грудного возраста, младшей возрастной группы и тяжелых больных в условиях наркоза или глубокой седации
Проведение МРТ: исследование выполняют при отсутствии противопоказаний; с внутривенным контрастированием - натощак; для установки периферического катетера используют любую доступную вену (предпочтительна кубитальная вена).
Укладка пациента: лежа на спине
Внутривенное контрастирование: доза контрастного вещества рассчитывается индивидуально в каждом конкретном случае и зависит от клинической ситуации, цели и массы тела (ммоль/кг), примерные дозы приведены в таблицы (таб.1)
Табл.1 Стандартный МР-протокол введения контрастных препаратов
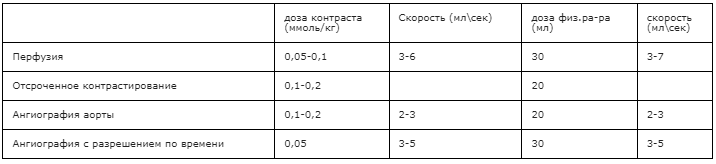
Область исследования: грудная клетка от уровня ниже диафрагмы (средина печени) до устьев брахиоцефальных сосудов
Протокол сканирования
Обязательные последовательности
1. Локатор в 3-х стандартных плоскостях для последующего позиционирования
2. Модуль для оценки анатомии порока (спиновое эхо)
3. киноМРТ: плоскость дуги аорты по длинной оси с визуализацией всей грудной аорты и устьев брахиоцефальных артерий
4. Модуль для оценки функции (кино-МРТ): в плоскости 2-х и 4-камер ЛЖ, по короткой оси сердца (серия срезов через все сердце)
5. Бесконтрастная 3D-МРангиография аорты (SSFP) или МР-ангиграфия с в/в болюсным контрастированием (Angio-3D- в корональной плоскости), область сканирования должна захватывать всю грудную аорту с брахиоцефальными сосудами. Постпроцесс включает построение изображений максимальной интенсивности и объемных реконструкций (VRT)
6. Фазово-контрастная последовательность для количественной оценки параметров кровотока; срезы устанавливают на уровнях грудной аорты: аортальный клапан, восходящая аорта, дуга (дополнительно в области гипоплазии, если она есть), перешеек, нисходящая аорта ниже коарктации и нисходящая аорта на уровне диафрагмы, а также в стволе легочной артерии, ориентировочно VENC=120-250 см/сек, в зависимости от степени сужения
Дополнительные последовательности
7. Спиновое эхо: плоскость дуги аорты по длинной оси
8. Кино МРТ: плоскость корня аорты по короткой оси для морфологии
9. Модуль отсроченного МР-контрастирования миокарда ЛЖ и правого желудочка (в плоскости 2-х, 4-камер, по короткой оси сердца (на 3-х уровнях)
Коментарий: толщина среза выбирается в зависимости от размера исследуемой области и возраста пациента (обычно 5-7мм)
Опорные моменты интерпретации изображений: Посегментный анализ анатомии сердца и сосудов; морфометрию сосудов и камер сердца; расположение, размеры и тяжесть обструкции аорты; расположение дуги и порядок ветвления; наличие аневризмы, расслоения или коллатеральных сосудов нисходящей аорты; показатели пиковой и объемной скорости кровотока на исследуемых уровнях грудной аорты; параметры желудочков, включая массу миокарда левого желудочка, абсолютные и индексированные на массу тела значения; фракцию выброса правого и левого желудочка; морфологию аортального клапана, степень стеноза и регургитации; при проведении отсроченного контрастирования миокарда необходимо указать наличие, локализацию, характер и тип накопления контрастного препарата.
МРТ исследование головного мозга, почек, брахиоцефальных артерий и почечных сосудов
Требуемые технические параметры
- магнитно-резонансный томограф с напряженностью поля не менее 1,5 Т
- необходимое техническое оснащение для проведения МР-исследований (поверхностные катушки: для головы, сосудов шеи; для почек и почечных сосудов; при необходимости введения контрастного препарата- система внутрисосудистого введения КВ, программы для сканирования и обработки изображений головного мозга, почек и сосудов, с возможностью расчета параметров кровотока)
- наличие соответствующего немагнитного оборудования жизнеобеспечения и наблюдения при проведении МР-исследований у детей грудного возраста, младшей возрастной группы и тяжелых больных в условиях наркоза или глубокой седации
Проведение МРТ
Исследование выполняют при отсутствии противопоказаний; при необходимости введения контрастного вещества- натощак; для установки периферического катетера используют любую доступную вену (предпочтительна кубитальная вена).
Укладка пациента: лежа на спине
Протокол сканирования головного мозга дети до 6 месяцев: с обязательным включением блока 3D-Т1-изображений, dual-echo изображений, блока аксиальных срезов диффузно-взвешенных изображений, T2*/SWI. Возраст более 6 месяцев: с обязательным включением блока аксиальных Т2-изображений, Т1-изображений (предпочтительно 3D-Т1); блока фронтальных изображений «инверсия-восстановление»-FLAIR; блока аксиальных срезов диффузно-взвешенных изображений, блока T2*/SWI.
МРТ брахиоцефальных артерий: бесконтрастная ангиография («время-пролетная» (TOF) или фазовоконтрастная ангиография (РС)) с отсечением венозного кровотока, область сканирования от бифуркации общих сонных артерий с захватом интракраниальных артерий и построением 3D-реконструкций для оценки анатомии экстакраниальных сегментов и виллизиева круга. Введение контрастного вещества по показаниям.
Опорные моменты интерпретации изображений: анатомия экстакраниального и интракраниального отделов брахиоцефальных артерий и обязательным описанием анатомии виллизиевого круга, отметив наличия его замкнутости.
МРТ почек и почечных сосудов с обязательным включением Т1 и Т2 изображений почек в поперечной, фронтальной и сагиттальной плоскостях. Для оценки скоростных параметров кровотока в почечных сосудах используют для сканирования фазово-контрастную последовательность, скорость кодирования подбирают индивидуально, в зависимости от скорости кровотока: в среднем, при отсутствии сужений, VENC для артерий=40-80 см/сек, для вен=30-40 см/сек; срезы ориентируют «перпендикулярно» сосуду: почечной артерии- на уровне до деления ее на ветви, и вены.
Опорные моменты интерпретации изображений: с обязательным указанием размеров почек, наличия добавочных артерий, хода вен и артерий, их диаметров, описанием ворот почек, состояния паренхимы, лоханок, размеров коркового вещества и состояния мозгового слоя. Из параметров кровотока анализируют объем кровотока в секунду и пиковую скорость кровотока на описанных уровнях.
Приложение Б. Алгоритмы действий врача
Алгоритм диагностики КА
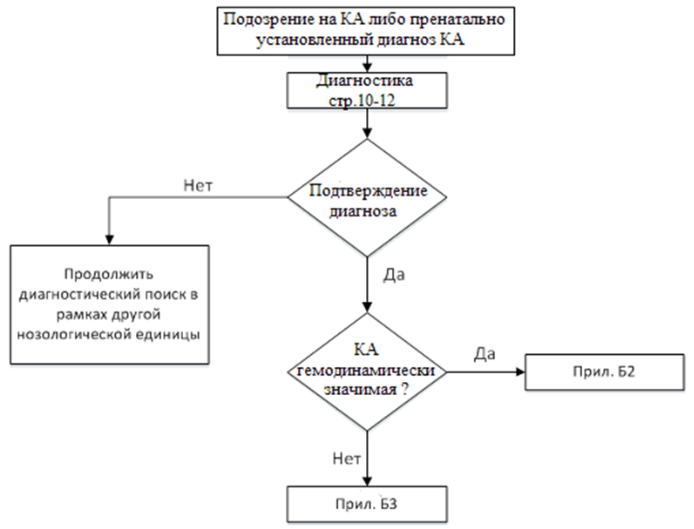
Алгоритм ведения пациентов с гемодинамически значимой КА
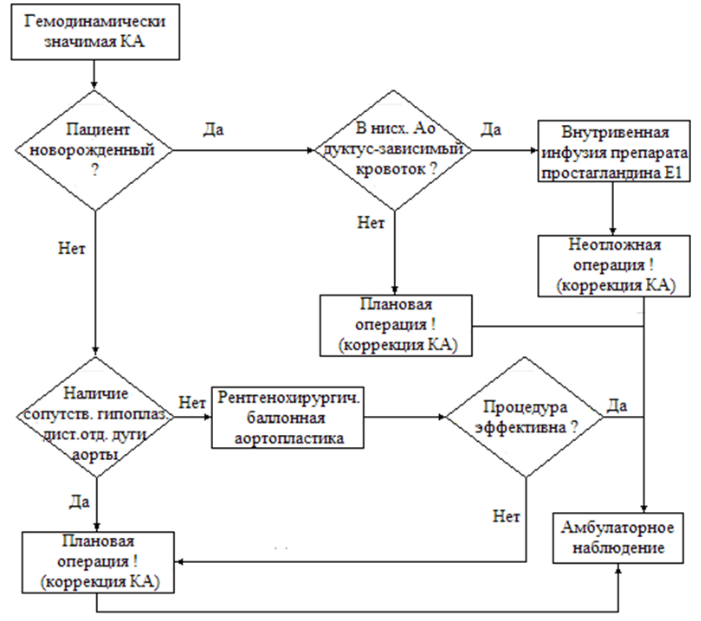
Алгоритм ведения пациентов с гемодинамически не значимой (пограничная степень обструкции) КА
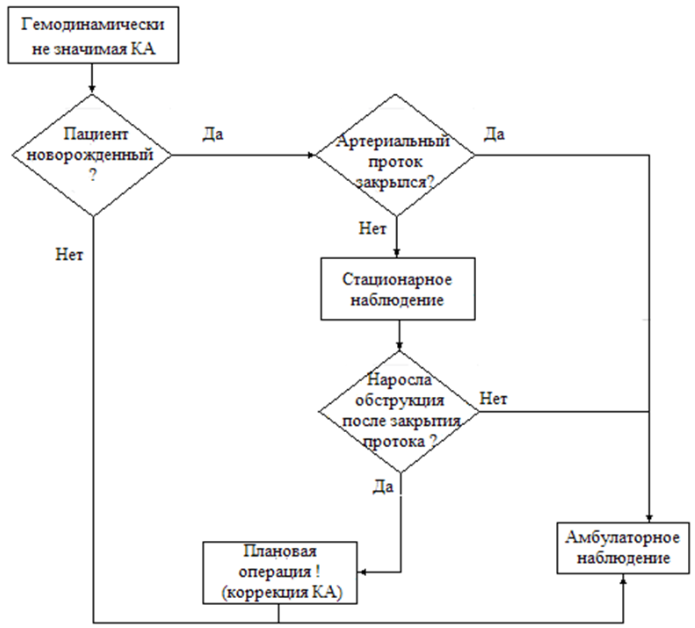
Использование методов лучевой диагностики при подозрении на коарктацию аорты и ведении пациентов с коарктацией аорты
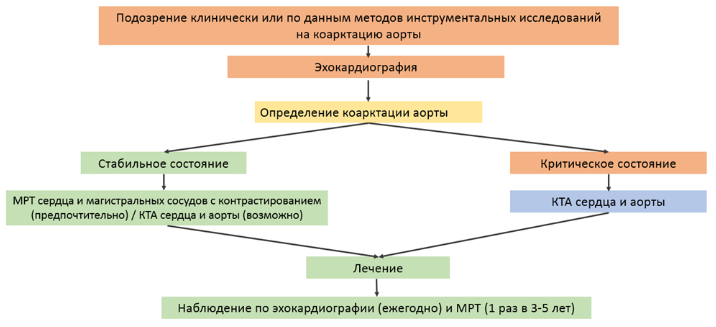
Приложение В. Информация для пациента
Уважаемый пациент (родители пациента), результаты обследования выявили у Вас (Вашего ребенка) врожденный порок сердца – коарктацию аорты. Добровольно соглашаясь на операцию, Вы должны понимать цель и опасности операции, о которых Вам расскажет лечащий врач.
Предпосылки к формированию ювенильной КА закладываются в период внутриутробного развития. Причины их многочисленны. Среди возможных факторов риска следует упомянуть внутриутробное инфицирование, перенесенные матерью вирусные инфекции в первом триместре беременности, вредные привычки родителей, экологические и наследственные факторы и пр. В зависимости от степени препятствия кровотоку по аорте, наличия и характера сопутствующих аномалий развития сердца нарушения гемодинамики и клинические проявления порока могут существенно варьировать. Необходимость хирургического лечения может возникнуть в первые дни жизни Вашего ребенка, в более поздние сроки либо операция может не потребоваться вовсе. В ряде случаев вместо полостной открытой операции может быть выполнена минимально инвазивная процедура при помощи специальных гибких трубок (катетеров) с небольшим баллоном на конце, проводимых под рентгенологическим контролем через крошечный прокол на бедре. В некоторых случаях, особенно при наличии сопутствующих аномалий развития сердца, может потребоваться несколько хирургических вмешательств в разные периоды жизни. В любом случае, при наличии КА, значимой для кровообращения, без должного хирургического лечения здоровье Вашего ребенка будет прогрессивно ухудшаться и может возникнуть серьезная угроза для жизни.
Собственно хирургическое вмешательство также сопряжено с риском для жизни и здоровья, особенно у младенцев. Операция выполняется под наркозом, а все сопутствующие хирургические манипуляции – в условиях общего или местного обезболивания. Во время операции дышать за Вашего ребенка будет аппарат искусственной вентиляции легких. Также во время и после операции может потребоваться переливание компонентов донорской крови, что является жизненно важным, поэтому требует Вашего согласия.
Во время операции хирург выделит аорту из окружающих тканей, перевяжет лигатурой артериальный проток, выключит из кровообращения участок аорты с областью коарктации при помощи специальных зажимов. Область коарктации будет иссечена (вырезана), а между смежными краями аорты – сформировано соустье при помощи шва тончайшими нитями. После снятия зажимов с аорты кровоток по ней более не будет иметь значимого препятствия. Незначительное остаточное препятствие кровотоку в области шва допустимо. Однако важно помнить, что по мере роста область шва будет несколько отставать в развитии от остальной части аорты, что может (!) со временем привести к рецидиву обструкции – рекоарктации. Если степень рекоарктации будет гемодинамически значимой возникнет необходимость ее хирургического устранения. В большинстве случаев рекоарктацию удается устранить без повторного открытого хирургического вмешательства, путем вышеописанной баллонной рентгенохирургической процедуры, как правило не требующей наркоза, медикаментозного сна и искусственной вентиляции легких.
После операции Ваш ребенок некоторое время проведет в отделении интенсивной терапии, где он будет пробужден (выведен из наркоза), постепенно отлучен от аппарата искусственной вентиляции легких и только после этого переведен в общую палату. Первые часы и дни после операции – самые важные. Находясь по уходу в палате с Вашим ребенком, Вам следует неукоснительно следовать всем назначениям и рекомендациям Вашего лечащего врача и медицинского персонала. Важно помнить об осложнениях, которые могут возникнуть в ранние сроки после операции и касаться не только сердца, но и других органов ребенка. О возможных осложнениях Вам расскажет оперирующий хирург.
В большинстве случаев операция приводит к улучшению состояния и исчезновению жалоб. В некоторых случаях могут потребоваться повторные вмешательства, чаще всего связанные с ростом ребенка.
Особенно важными являются контрольные обследования после операции для своевременной оценки результатов коррекции и выявления возможных отдаленных (поздних) осложнений.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Нет.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.