Гидронефроз
 Версия: Клинические рекомендации РФ 2023 (Россия)
Версия: Клинические рекомендации РФ 2023 (Россия)
Общая информация
Краткое описание
- Общероссийская общественная организация "Российское общество урологов"
Одобрено Научно-практическим Советом Минздрава РФ 27 декабря 2022г
В соответствии с Правилами поэтапного перехода медицинских организаций к оказанию медицинской помощи на основе клинических рекомендаций, разработанных и утвержденных в соответствии с частями 3, 4, 6 –9 и 11 статьи 37 Федерального закона «Об основах охраны здоровья граждан в Российской Федерации», утвержденных постановлением Правительства Российской Федерации от 19.11.2021 № 1968, клинические рекомендации применяются следующим образом:
– размещенные в Рубрикаторе после 1 июня 2022 года – с 1 января 2024 года.
Клинические рекомендации
Год утверждения: 2023
Пересмотр не позднее: 2025
Дата размещения: 31.01.2023
Статус: Действует
ID: 17
Определение заболевания или состояния (группы заболеваний или состояний)
Гидронефроз (стеноз лоханочно-мочеточникового сегмента) — это стойкое и прогрессивно нарастающее расширение чашечно-лоханочной системы, сопровождающееся нарушением оттока мочи из почки в проксимальные отделы мочеточника. Данное патологическое состояние приводит к повышению внутрилоханочного давления и атрофии почечной паренхимы [1].
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статической класификации болезней и проблем, связанных со здоровьем
N13.0 – Гидронефроз с обструкцией лоханочно-мочеточникового соединения
N13.1 – Гидронефроз со стриктурой мочеточника, не классифицированный в других рубриках
Q62.0 – Врожденный гидронефроз
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
Для оценки выраженности гидронефротической трансформации (ГНТ) в России наиболее распространена классификация, предложенная академиком Н.А. Лопаткиным (1969), согласно которой выделяют три стадии гидронефроза, но при этом третью – подразделяют на две подстадии 3А и 3Б [13]:
1-я стадия – начальный гидронефроз, характеризующийся пиелоэктазией без развития значимого гидрокаликоза и нарушения функции почки;
2-я стадия – ранний гидронефроз, при котором расширение ЧЛС сопровождается ухудшением функции почки;
3-я (А и Б) стадия – терминальный гидронефроз, характеризующийся значительным расширением чашечно-лоханочной системы и существенным снижение почечной функции. 3А стадия гидронефроза потенциально обратима, при 3Б стадии гидронефроза почечная паренхима атрофируется; изменения необратимы.
В мировой практике у взрослых и детских урологов популярна ультразвуковая классификация гидронефроза Onen A. (2007) [14] – модификация системы оценок Society for Fetal Urology (SFU, 1993) [15]. По сравнению с классификацией SFU, система Onen включает не только оценку дилатации ЧЛС, но и состояния почечной паренхимы.
Выделяют 4 степени гидронефроза:
I степень – расширение почечной лоханки без расширения чашечек (пиелоэктазия);
II степень – расширение почечной лоханки и больших чашечек (пиелокаликоэктазия);
III степень – расширение лоханки, больших и малых чашечек, истончение паренхимы до 50% относительно нормы;
IV степень – расширение лоханки и чашечек с истончением паренхимы более 50% относительно нормы.
Обе классификации приемлемы и в целом совпадают: 3Б стадия по Н.А. Лопаткину предполагает необратимые изменения почечной паренхимы и, следовательно, гибель почки, IV степень по A. Onen также предполагает наличие выраженных изменений органа, пограничных с терминальными.
В детской урологии для диагностики и оценки степени тяжести пренатального и постнатального гидронефроза в основном используют две ультразвуковые классификационные системы: «Antero-posterior Diameter of Renal Pelvis» (APDRP) A. Grignon et al. [16] и альтернативная система оценок SFU (Society for Fetal Urology) A. Onen, представленная выше [14].
Система классификации «Antero-posterior Diameter of Renal Pelvis» (APDRP) представляет собой количественную оценку степени расширения лоханки на основе измерения ее максимального переднезаднего диаметра (ПЗД) на сонографических изображениях почки, полученных в поперечной плоскости в проекции ворот почки [16].
По пороговым значениям ПЗД лоханки на различных сроках гестации классифицирует антенатальный гидронефроз (АНГ) легкой, средней и тяжелой степени:
· Легкая степень: ПЗД от 4 до 7 мм во 2 триместре, 7-9 мм – в 3 триместре;
· Умеренная степень: ПЗД от 7 до 9 мм во 2 триместре, 9-15 мм – в 3 триместре;
· Тяжелая степень: ПЗД >10 мм во 2 триместре, >15 мм – в 3 триместре.
Высокий риск клинически значимого гидронефроза определяют значения ПЗД лоханки ≥ 10 мм до 28 недели гестации и >15 мм после 28 недели [17,18].
В постнатальном периоде на основе оценки ПЗР лоханки и классификации SFU выделяют легкую, умеренную и тяжелую степень гидронефроза:
· Легкая степень: ПЗД <20 мм или SFU I-II степени;
· Умеренная степень: ПЗД в диапазоне 20-30 мм или SFU III степени;
· Тяжелая степень: ПЗД >30 мм или SFU IV степени.
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
В зависимости от времени возникновения гидронефроз может быть врождённым или приобретённым.
Первичный (врождённый) гидронефроз развивается вследствие аномалии верхних мочевых путей в зоне пиело-уретерального сегмента (ПУС).
Вторичный (приобретённый) гидронефроз является следствием рубцовых изменений лоханочно-мочеточникового сегмента (ЛМС) неясного происхождения или результатом осложнений различных заболеваний, приводящих к нарушению оттока мочи из почки.
Врожденный и приобретенный гидронефроз могут быть следствием разнообразных внутренних и внешних причин, приводящих к сужению (стенозу) просвета мочеточника в прилоханочном отделе.
Этиология врожденного стеноза/обструкции ЛМС и первичного гидронефроза:
Внутренняя причина - сужение (стеноз) просвета мочеточника в прилоханочном отделе за счет структурных изменений стенки мочеточника.
Внутренние причины обструкции/стеноза ЛМС:
1. Стеноз мочеточника в ЛМС из-за аномального развития гладкомышечных структур и нарушения иннервации [2], что определяет наличие адинамичного, аперистальтического сегмента мочеточника, который не позволяет развивать эффективную перистальтическую волну (наиболее распространенная причина гидронефроза,75%) [3];
2. Врожденные уротелиальные клапаны мочеточника в зоне ЛМС.
Внешние причины - сужение внутреннего просвета ЛМС за счет компрессии (сдавления) снаружи.
Внешние причины обструкции/стеноза ЛМС:
1. Вазоуретеральный конфликт. Добавочный нижнесегментарный (аберрантный) сосуд, вызывающий сдавление ЛМС и/или верхней трети (в/3) мочеточника и нарушающий отток мочи из ЧЛС. Аберрантный сосуд может встречаться в 40% случаев. При этом сам факт его наличия в области ЛМС не означает, что сосуд является непосредственной причиной обструкции. В некоторых случаях пересечение мочеточника с сосудом вызывает только механическое препятствие. Тем не менее с течением времени перекрестные сосуды приводят к воспалению ЛМС, фиброзу и гипертрофии гладких миоцитов, что впоследствии приводит к обструкции. При наличии вазоуретерального конфликта принято говорить о комбинированной причине нарушения оттока мочи из чашечно-лоханочного сегмента (ЧЛС) – добавочного сосуда и рубцово измененного ЛМС. Пересечение аберрантным сосудом чаще встречается по передней поверхности [4].
2. Изгибы мочеточника, фиксированные эмбриональными спайками;
3. Аномальное расположение (дистопия) ЛМС - высокое отхождение мочеточника от лоханки.
Этиология приобретенного стеноза ЛМС и вторичного гидронефроза:
1. Рубцевание ЛМС неизвестного происхождения;
2. Фиброэпителиальные полипы (редкая причина стеноза ПУС) [5];
3. Злокачественные новообразования мочеточника;
4. Рубцово-спаечный процесс в области ЛМС после травмы или операций на верхних мочевых путях (ВМП);
5. Поствоспалительный периуретерит с рубцеванием ЛМС при нефролитиазе (длительном стоянии конкремента в ЛМС).
Врожденные аномалии ВМП, ассоциированные с гидронефрозом:
· Подковообразная почка;
· Удвоение почки;
· Поясничная дистопия почки [6].
Так же многолетние изучения причин антенатально выявленного гидронефроза свидетельствуют о том, что в большинстве случаев данная патология имеет функциональный или транзиторный характер (41-88%), является следствием дисфункции созревания лоханки и/или мочеточника и спонтанно разрешается в раннем постнатальном периоде [7]. Данная категория пациентов в дальнейшем может не иметь никакой клинической симптоматики и не нуждаться в хирургическом лечении.
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Пороки развития мочеполовой системы составляют 30% от всех внутриутробно выявленных аномалий. Среди них гидронефроз является одной из наиболее часто обнаруживаемых патологий, наблюдаемых примерно у 1–5% всех беременностей, и это происходит по разным причинам [8]. Семейный, наследственный анамнез наличия гидронефроза так же является фактором риска развития данного заболевания [9].
Стеноз/обструкция ЛМС занимает второе место по частоте встречаемости после транзиторного гидронефроза среди причин антенатально выявленного гидронефроза (50%). Частота гидронефроза у новорожденных составляет 1:1500. У мальчиков встречается в два раза чаще, чем у девочек, и обычно (в 2/3 случаев) выявляется с левой стороны. Двустороннюю обструкцию отмечают примерно в 30% (в диапазоне 10-46%) случаев [10, 11]. Гидронефроз встречается у 1% пациентов 20-40 лет, причём у женщин в 1,5 раза чаще, чем у мужчин [12]. У пациентов старше 40 лет гидронефроз часто служит проявлением других заболеваний.
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клинических симптомов, характерных для гидронефроза, нет. До введения антенатального УЗ-скрининга, пальпируемая опухоль в животе была наиболее частым симптомом у новорожденных и детей грудного возраста, а вторым по частоте клиническим симптомом – инфекция мочевых путей (ИМП).
В настоящее время, благодаря широкому применению скринингового ультразвукового обследования беременных, гидронефроз диагностируется антенатально, что позволяет выделить популяцию детей с данной патологией до развития осложнений (почечной дисфункции, рецидивирующего течения инфекции мочевых путей, образования мочевых камней и артериальной гипертензии).
Многие случаи гидронефроза протекают бессимптомно в течении длительного времени или выявляются случайно при УЗ обследовании по другим причинам. Выраженность клинических проявлений гидронефроза главным образом зависит от стадии заболевания, причины обструкции ЛМС и осложнений.
У взрослых и детей старшего возраста симптомы могут включать периодическую боль в животе или поясничной области, тошноту, рвоту, гематурию или признаки инфекции мочевыводящих путей. Лабораторные исследования могут выявить микрогематурию или пиурию [9, 19]. В редких случаях возможна артериальная гипертензия. В случае развития полной непроходимости ЛМС проявляется клиническая картина «блока почки». При двустороннем ГН наблюдаются жалобы, обусловленные нарастающим нарушением функции почек и азотемией.
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза:
1. Периодически возникающая боль в животе или поясничной области на стороне поражения, тошнота, рвота, гематурия или признаки инфекции мочевыводящих путей
2. Расширение ЧЛС в связи с сужение ЛМС по данным визуализирующих методов диагностики
При подозрении на гидронефроз проводится дифференциальная диагностика с различными заболеваниями почек и органов брюшной полости в зависимости от преобладающих в клинической картине проявлений [58]:
При наличии боли дифференциальную диагностику проводят с нефролитиазом и нефроптозом. Обзорная урография или СКТ позволяют подтвердить или опровергнуть нефролитиаз. В отличие от гидронефроза при нефроптозе боль возникает при движении и физическом напряжении и быстро стихает в покое. Сравнение экскреторных урограмм в положении лёжа и стоя позволяет диагностировать нефроптоз. Стриктура ЛМС и нефроптоз могут сочетаться.
При пальпируемом образовании в забрюшинном пространстве следует дифференцировать гидронефроз от опухоли, поликистоза почек и простой кисты почки.
При опухоли - почка малоподвижна, плотной консистенции, с бугристой поверхностью. На пиелограмме видна характерная деформация лоханки со сдавлением или «ампутацией» чашечек.
При поликистозе обе почки увеличены, бугристы. Выявляют признаки почечной недостаточности. На пиелограмме видны удлинённая лоханка и ветвистые чашечки, вытянутые в виде полулуний.
При простой кисте почки на пиелограмме обнаруживают сдавление чашечно-лоханочной системы соответственно расположению кисты. Диагноз устанавливают после выполнения УЗИ и МСКТ.
При гематурии и пиурии гидронефроз следует дифференцировать от опухоли лоханки, пионефроза и туберкулёза почки (в основном рентгенологическими методами).
При выявлении пиелокаликоэктазии гидронефроз следует дифференцировать от следующих состояний и заболеваний (проведение радиоизотопного исследования при большинстве указанных состояний не выявляет нарушения функции почки):
— несахарный диабет;
— приём диуретиков;
— физиологическая полидипсия и полиурия;
— «чашечковые» дивертикулы;
— полимегакаликоз;
— экстраренальная лоханка;
— синдром Пруне–Белли (Prune–Belly syndrome);
— парапельвикальная киста;
— папиллярный некроз;
— физиологическое расширение ВМП на фоне беременности.
При обнаружении уретеропиелокаликоэктазии уретрогидронефроз следует дифференцировать от:
— пузырно-мочеточникового рефлюкса (диагностируют с помощью микционной уретроцистографии);
— уретероцеле;
— мегауретера;
— аномалий положения мочеточника (ретрокавальный, ретроилеакальный мочеточник).
Диагноз помогают установить экскреторная урография и МСКТ.
Жалобы и анамнез
Соответствующие жалобы и анамнез перечислены в разделе Клиническая картина (Приложение Б).
Физикальное обследование
-
Для диагностики гидронефроза рекомендуется проведение физикального осмотра всем пациентам [20].
Уровень убедительности рекомендаций С (уровень достоверности доказательства – 5)
Комментарии: осмотр, пальпация, перкуссия, аускультация в начальных и ранних стадиях ГН мало- или вовсе неинформативны. Только при прогрессировании заболевания, усугублении и изменении ВМП и ухудшении функционального состояния почечной паренхимы проявляются симптомы, приобретающие большое значение в диагностике ГН.
Пальпация почек и живота – ненадежный метод для диагностики ГН. Пока структурно-функциональное состояние ВМП компенсировано, пальпация не дает никакой существенной информации. Лишь при терминальном А и Б ГН, часто сопровождающемся гигантской дилатацией ЧЛС, бимануальной пальпацией определяют баллотирующую опухоль. Перкуссия живота над измененной почкой обычно не позволяет выявить какие-либо изменения.
При аускультации живота у пациентов со стенозом ЛМС и ГН характерные признаки тоже отсутствуют. Таким образом, объективные методы обследования при осмотре решающего значения в диагностике стеноза ЛМС и ГН не имеют, особенно на начальном этапе их развития.
Лабораторные диагностические исследования
-
Всем пациентам с подозрением на гидронефроз рекомендуется выполнение общего (клинического) анализа крови для исключения острого воспалительного процесса [21].
Уровень убедительности рекомендаций С (уровень достоверности доказательства – 5)
Комментарии: клинический анализ крови при гидронефрозе может соответствовать возрастным нормам, но наличие лейкоцитоза (повышение уровня лейкоцитов крови) может свидетельствовать о наличии острого воспалительного или инфекционного процесса.
-
Всем пациентам с подозрением на гидронефроз рекомендуется выполнение биохимического общетерапевтического анализа крови (креатинин, мочевина, альбумин, калий, натрий, хлориды) для оценки функции почек [21].
Уровень убедительности рекомендаций С (уровень достоверности доказательства – 5)
Комментарии: в биохимическом анализе крови функция почек определяется по следующим показателям – креатинин, мочевина, альбумин, электролиты (калий, натрий, хлориды). При двустороннем гидронефрозе могут быть диагностированы: повышение уровня креатинина и мочевины крови, изменения электролитов крови (повышение или снижение калия, натрия, хлоридов), свидетельствующие о нарушении функции почек (почечная недостаточность). Кроме того, гиперкалиемия, вследствие гидронефроза, является жизнеугрожающим состоянием.
-
Всем пациентам с подозрением на гидронефроз рекомендуется выполнение общего (клинического) анализа мочи для исключения инфекции мочеполовых путей [21].
Уровень убедительности рекомендаций С (уровень достоверности доказательства – 5)
Комментарии: клинический анализ мочи при гидронефрозе обычно без отклонений от нормативных величин, но присутствие белых кровяных телец (лейкоцитурия) и красных кровяных телец (гематурия) может свидетельствовать о наличии мочекаменной болезни или опухоли, которые нередко являются причинами обструкции и в дальнейшем гидронефроза, или же, когда обструкция мочевых путей осложняется инфицированием. Пиурия (наличие гноя) свидетельствует о наличии инфекции мочеполовых путей. Микроскопическая гематурия указывает на наличие камня или опухоли в мочевыделительной системе.
-
У пациентов с нефростомическим дренажем рекомендуется проведение исследования функции нефронов по клиренсу креатинина (проба Реберга) для уточнения характера изменений почечной паренхимы и оценки фильтрационной функции почки [20].
Уровень убедительности рекомендаций С (уровень достоверности доказательства – 5)
Комментарии: для оценки функционального состояния почек у пациентов с нефростомой раздельно исследуют очистительную функцию почечной паренхимы (клубочковую фильтрацию) по клиренсу эндогенного креатинина с учётом объёма выделенной мочи. Определяют способность почек к закислению мочи, которая снижена при выраженных дегенеративных изменениях канальцевого эпителия (характерно для пациентов с поздними, необратимыми стадиями ГН).
Инструментальные диагностические исследования
-
Рекомендуется выполнение ультразвукового исследования почек (УЗИ) всем пациентам с подозрением на гидронефроз для подтверждения и определения степени гидронефроза, оценки состояния паренхимы пораженной и контралатеральной почки [19].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: УЗИ занимает первое место среди диагностических процедур, применяемых для выявления стеноза ЛМС, ГН. Однако, данная методика не дает информацию о накопительно-выделительной функции почек. Поскольку расширение ЧЛС не всегда является результатом стеноза ЛМС, ультразвуковое исследование может оказаться ложноположительным. УЗИ может быть рекомендовано как метод динамического наблюдения за пациентами, перенесшими реконструктивно-пластические или эндоскопические операции путем измерения переднезаднего диаметра (ПЗД) лоханки до и после хирургического пособия [22, 23].
-
Рекомендуется выполнение ультразвукового исследования почек с функциональной (фармакологической (диуретической) нагрузкой (ФУЗИ или ДУЗИ)) взрослым пациентам с подозрением на гидронефроз для оценки эвакуаторной функции, сократительной активности ЧЛС, степени обструкции ЛМС и нарушения уродинамики [19, 20].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: ультразвуковое исследование почек с оценкой размеров ЧЛС до и после введения препарата из группы сульфонамиды (код АТХ C03CA) исторически является классической методикой для подтверждения взаимосвязи боли со стенозом ЛМС и нарушенным оттоком мочи из почки, визуализации ВМП, а также - оценки компенсаторных резервов чашечно-лоханочной системы. Роль ФУЗИ (ДУЗИ) для подтверждения стеноза ЛМС может иметь важное клиническое значение, особенно в стационарах, не имеющих современных методов визуализации мочевых путей. Имеет ограничения в применении у пациентов со значительным снижением объема функционирующей паренхимы почки, новорожденных и при значительном расширении ЧЛС.
У пациентов детского возраста показания к ДУЗИ те же что и у взрослых, а также - для дифференциации обструктивного гидронефроза и необструктивной дилатации ЧЛС.
-
Рекомендуется выполнение дуплексного сканирования артерий почек всем пациентам с ГН для оценки кровоснабжения почек, выявления добавочных сосудов при недостаточной информативности иных лучевых методик [29].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: нарушение оттока мочи из ЧЛС приводит к изменению допплеровской формы волны, определяемой с помощью индекса резистентности (RI). Значение RI больше 0,7 указывает на обструкцию. У взрослых пациентов этот диагностический тест имеет чувствительность 92% и специфичность 88%.
-
Рекомендуется выполнение внутривенной урографии всем пациентам с подозрением на гидронефроз с возраста 1 месяца для оценки структурно-функционального состояния ВМП, а также - размеров чашечно-лоханочной системы и степени нарушения оттока мочи по времени эвакуации диагностического радиофармацевтического средства вещества из собирательной системы гидронефротически измененной почки [19].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: традиционная методика для диагностики стеноза ЛМС, ГН. Может быть оправданным методом исследования первой линии в центрах, не оснащенных кабинетами спиральной компьютерной томографии (СКТ). Однако, использование данной методики противопоказано у детей в возрасте возрастом менее двух недель, ограничено - у детей первых месяцев жизни из-за незрелости почечной паренхимы и высокого риска осложнений (от аллергических реакций и развития контраст-индуцированной нефропатии до тромбоза почечных вен и медуллярного некроза [30]. Внутривенная урография противопоказана пациентам в случае непереносимости рентгеноконтрастных средств, содержащих йод (код АТХ V08A).
Выполнение внутривенной урографии противопоказано у детей возрастом менее двух недель, имеет ограничения у младенцев первых месяцев жизни из-за возможных токсических эффектов контрастных средств (вплоть до развития контраст-индуцированной нефропатии, острой почечной недостаточности) и высокой лучевой нагрузки.
-
Рекомендуется выполнение внутривенной (инфузионной) урографии у новорожденных и пациентов грудного возраста при сниженной концентрационной функции почек для улучшения визуализации мочевых путей, а также из-за морфологической «незрелости» нефрона, снижающей четкость контрастирования почек [31].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
-
При необходимости проведения нагрузочных диуретических проб при проведении инструментальных исследований рекомендовано применение препарата из группы сульфонамиды (код АТХ С03СА) в следующих режимах:
— 1 мг/кг для пациентов первого года жизни и 0,5 мг/кг - пациентам в возрасте от одного до шестнадцати лет, до максимальной дозы у детей - 20 мг [39, 43, 45];
— 0,5 мг/кг для пациентов 18 лет и старше, максимальная доза 40 мг [39].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
-
Рекомендуется выполнение опорожняющей цистоуретрографии или микционной цистоуретрографии (МЦУГ) пациентам в возрасте до 1 года с подозрением на ГН и эхо-признаками гидронефроза высокой степени (SFU III-IV с ПЗР лоханки ≥ 15 мм), расширения дистального отдела мочеточника (одно- или двустороннее), а также в случаях выраженной дисфункции мочеиспускания (остаточная моча) и наличия в анамнезе указаний на фебрильную инфекцию мочевых путей для исключения пузырно-мочеточникового рефлюкса. и дифференциальной диагностики обструкции ЛМС и ГН от уретерогидронефроза в результате нарушения функции нижних мочевых путей [24].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: МЦУГ не используется в качестве скрининга пузырно-мочеточникового рефлюкса (ПМР) у новорожденных и пациентов грудного возраста с обструкцией ЛМС, ГН из-за инвазивного характера данного исследования, лучевой нагрузки и высокого риска инфицирования мочевых путей [25] и высокой дозой облучения [26].
У пациентов детского возраста с гидронефрозом средней и тяжелой степени (SFU III-IV) уретероцистография помогает отличить обструктивную причину ГН от причины, обусловленной ПМР, который будет диагностирован с ипсилатеральной стороны примерно у 20% этих пациентов [27].
Пациенты с ГН низкой степени (SFU I-II), с нормальной почечной паренхимой и симметричным размером почек не нуждаются в МЦУГ [28].
Объем водорастворимого нефротропного низкоосмолярного рентгеноконтрастного средства (Йогексол** или йодиксанол), вводимого через установленный в мочевой пузырь стерильный катетер, соответствует возрастному объему пузыря рассчитываемому у детей до двух лет по формуле: V (мл) = Вес (кг) × 7, а у детей старше двух лет по формуле Коффа: V(мл) = 30 × (возраст в годах + 1). У пациентов старшего детского возраста и взрослых пациентов – соответствует средней эффективной емкости мочевого пузыря, вычисленной по данным оценки ритма спонтанных мочеиспусканий.
-
Рекомендуется выполнение компьютерной томографии почек и верхних мочевыводящих путей с внутривенным болюсным контрастированием пациентам старше 3 месяцев с подозрением на гидронефроз для оценки структурно-функционального состояния верхних мочевых путей, тяжести атрофических процессов в паренхиме на фоне обструкции ЛМС, а также выявления возможных внешних причин ГН (аберрантных или сегментарных сосудов, ретрокавального расположения мочеточника) [32, 33, 34].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: СКТ предоставляет информацию о функции пораженной почки и анатомии ВМП и окружающих тканей. Предпринимаются попытки использовать компьютерную томографию для оценки функции почек по толщине паренхиматозной ткани. В дооперационной диагностике стеноза (обструкции) ЛМС СКТ имеет 98 % чувствительность и 100 %, специфичность [33]. В дооперационной диагностике уро-вазального (вазоуретерального) конфликта СКТ имеет 91% чувствительность и 100% специфичность [34]. В настоящее время СКТ является ведущим рентгенологическим методом диагностики ГН.
Показания для выполнения СКТ у пациентов детского возраста должны быть строго обоснованными из-за значительной лучевой нагрузки. Необходимость обязательной седации (общей анестезии) из-за длительности исследования ограничивают их использование у детей первых лет жизни. Величина эффективной дозы существенно выше по сравнению с другими лучевыми и радионуклидными методами диагностики заболеваний мочевой системы [35,36]. При выполнении 4 сканов за исследование, эффективная доза у пациентов раннего возраста составляет 4.5-6,2 мЗв, у пациентов 3-7 лет – 6,5-9 мЗв, 8-12 лет – 8,8-14 мЗв, а у подростков может достигать 18 мЗв [37].
Противопоказания к проведению СКТ: возраст пациента до трех месяцев, выраженное нарушение концентрационной способности почек, непереносимость рентгеноконтрастных средств, содержащих йод (код АТХ V08A).
-
Рекомендуется выполнение сцинтиграфии почек и мочевыделительной системы с кальция тринатрия пентетатом** всем пациентам с гидронефрозом для определения секреторной и экскреторной (выделительной) функции поражённой и противоположной почек, а также - характера выведения диагностических радиофармацевтические средства (код АТХ V09) из ВМП [19, 38, 39].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: дифференциальная (раздельная) функция почек (ДФП) рассчитывается в интервале 1-2 минуты после введения ДРС и считается нормальной при значении ДФП в диапазоне 45-55%. Функция почечной паренхимы слабая при ДФП менее 20% и умеренно снижена при ДФП – 29-39% [40]. Нарушение оттока мочи из лоханки оценивается по Т½ (время выведения 50% ДРС). В основном при стенозе ЛМС, ГН - обструктивный тип кривой мочевыведения с периодом полувыведения ДРС более 40 минут.
Важное значение в диагностике обструктивных нарушений уродинамики имеет кинетический параметр трансфера ДРС – время кортикального транзита ДРС (КТТ). Нормальное время КТТ – 3 минуты после инъекции метки при сканировании с использованием Кальция тринатрия пентетата**. Отсроченное КТТ (результат снижения СКФ) – значимый предиктор стеноза ЛМС и необходимости хирургического вмешательства у детей с односторонним гидронефрозом [41].
-
Рекомендуется выполнение сцинтиграфии почек и мочевыделительной системы с применением радиофармацевтического диагностического средства Технемаг 99mTc пациентам детского возраста с гидронефрозом для определения секреторной и экскреторной (выделительной) функции поражённой и противоположной почек, а также характера выведения диагностического радиофармацевтического средства (код АТХ V09) из ВМП, в связи с незрелостью клубочкового аппарата [42,43].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: рекомендуемое время проведения диуретической ренографии - после 4-6 недель жизни. Оптимальным сроком первого изотопного исследования почек является возраст пациента 3 месяца. В других возрастных группах для проведения исследования ДНСГ – используется клубочковый ДРС –Кальция тринатрия пентетат**.
-
Рекомендуется выполнение сцинтиграфии почек с нагрузочными пробами (препарат из группы сульфонамиды (код АТХ C03CA) - режим дозирования см. выше) детям с односторонним или двусторонним гидронефрозом средней и тяжелой степени тяжести (SFU III-IV, ПЗД ≥ 15 мм), у которых исключен пузырно-мочеточниковый рефлюкс, а также пациентам с ухудшением степени ГН по данным УЗИ для исследования уродинамики ВМП в условиях форсированного диуреза с целью дифференциации стеноза ЛМС от необструктивного гидронефроза [19, 38, 39].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: сцинтиграфия почек с нагрузочными пробами (препарат из группы сульфонамиды (код АТХ C03CA) является наиболее часто используемым диагностическим методом для выявления функциональной значимости проблем с нарушением оттока мочи из ЧЛС. На результаты теста могут влиять состояние гидратации пациента, сниженная функция почки (СКФ <15 мл/мин), объем ЧЛС, степень наполнения мочевого пузыря на момент исследования [44]. Рекомендуется проведение исследования в стандартных условиях (потребление пероральной жидкости до обследования, осуществление микции перед введением ДРС. Дренирование мочевого пузыря катетером только в случае нарушения функции мочевого пузыря и подозрения на наличие пузырно-мочеточникового рефлюкса.
Введение препарата из группы сульфонамиды (код АТХ C03CA) через 20 минут после введения радиометки является наиболее часто используемым протоколом Кальция тринатрия пентетата. У пациентов детского возраста целесообразно использовать протокол с Технемаг 99mTc – препарат из группы сульфонамиды (код АТХ C03CA) - вводят одновременно с ДРС, что сокращает время исследования.
Анализ периода полувыведения (Т1/2) ДРС после введения диуретика осуществляется по одинаковым стандартам: Т1/2 менее 10-15 мин – данных за обструкции мочеточника нет; T1/2 превышающее 20 минут - означает выраженную обструкцию ЛМС; T1/2 в диапазоне 15-20 мин, результат диуретического теста является сомнительным.
Поскольку незрелость почечной функции приводит к уменьшению поглощения ДРС, Сцинтиграфия почек и мочевыделительной системы у пациентов детского возраста проводится после 6-8 недели жизни, но может быть выполнена раньше у пациентов с тяжелым гидронефрозом и истончением коры. Сцинтиграфия почек и мочевыделительной системы с функциональными пробами не показана при оценке ГН низкой степени (SFU 1-2) с нормальной почечной паренхимой и симметричным размером почек.
Рекомендуемое время проведения сцинтиграфии почек с функциональными пробами (препарат из группы сульфонамиды (код АТХ C03CA) - после 4-6 недель жизни. Оптимальным сроком первого изотопного исследования почек является возраст пациента 3 месяца. В других возрастных группах для проведения исследования ДНСГ – используется клубочковый ДРС – Кальция тринатрия пентетат**
-
Рекомендуется сцинтиграфии почек в статическом режиме с Технеция [99mTc] сукцимером** взрослым пациентам с гидронефрозом для более точной оценки функциональной активности почечной паренхимы и выявления фокальных или диффузных ее изменений с обструктивным гидронефрозом по классификации SFU [35, 46 - 50].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии: является одной из основных методик выявления изменений структурно-функционального состояния почечной паренхимы, нередко при отсутствии клинической и лабораторной симптоматики. СНСГ эффективна в оценке функции почечной паренхимы на ранних стадиях уродинамических нарушений. Чувствительность и специфичность сцинтиграфии почек в статическом режиме с Технеция [99mTc] сукцимером в выявлении склеротических изменений почечной паренхимы – 88% и 84% соответственно.
Недостатком способа является его низкая информативность при симметричном поражении почек и у больных с единственной почкой.
-
Рекомендуется проведение магнитно-резонансной томографии урографии (МРТ) с нагрузочными пробами (препарат из группы сульфонамиды (код АТХ C03CA) - режим дозирования см. выше) пациентам с гидронефрозом независимо от возраста для получения более точной анатомической детализации пораженной почки, оценки дифференциальной функции почек и исследования уродинамики в условиях диуретической нагрузки [51-56].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: обеспечивает комплексную морфологическую и функциональную информацию. С помощью различных режимов при МРТ с контрастом с нагрузочными пробами можно также получить изображение почечных сосудов и провести виртуальную уретерореноскопию. При выявлении дилатации ЧЛС чувствительность МРТ составляет 95-100%, специфичность – 83-90%, в случае стеноза ЛМС данные показатели составляют 92-100% и 80-95%, для уретеровазального конфликта – 89-96% и 88-96% соответственно. Особый интерес к функциональному методу в детской урологии в первую очередь связан с отсутствием ионизирующего излучения, в отличие от лучевых визуализирующих методик. Несмотря на высокую информативность метода в диагностике обструктивного ГН, существенным ограничением проведения МРТ у пациентов младшего возраста является необходимость обязательной седации из-за длительности исследования [36].
-
Рекомендуется выполнение ретроградной уретеропиелографии взрослым пациентам с гидронефрозом для четкой визуализации ВМП со стороны поражения, с целью подтверждения диагноза, определения анатомического состояния ЛМС, точной локализации обструкции и протяженности зоны сужения мочеточника [19].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Показанием считают отсутствие визуализации мочеточника ниже уровня обструкции по результатам неинвазивных лучевых методов диагностики. Исследование значимо при планировании повторных хирургических вмешательств в случае подозрения на стеноз уретеропиелоанастомоза.
-
Рекомендуется выполнение антеградной пиелоуретерографии пациентам с гидронефрозом вне зависимости от возраста при наличии нефростомического дренажа для визуализации ВМП, локализации и протяженности стеноза мочеточника [19].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
-
Рекомендуется выполнение пиеломанометрии (Whitaker’s test - антеградное измерение давления в ВМП) пациентам с гидронефрозом при наличии нефростомического дренажа для оценки сократительной способности верхних мочевых путей [57].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Тест Whitaker показан для пациентов с нефростомой или при сомнительных результатах других менее инвазивных диагностические тестов. Тест предполагает измерение давления в ЧЛС с фиксированной скоростью 10 мл/мин.
Интерпретация результатов:
— нормальной считают разницу менее 15 см водного столба;
— наличие обструкции подтверждают при разнице более 22 см водного столба;
— при разнице более 15 см водного столба, но менее 22 см водного столба, результат считают сомнительным и повышают скорость введения до 15 мл/мин.
-
Рекомендуется выполнение уретероскопии пациентам с гидронефрозом, вне зависимости от возраста, для исключения стеноза уретеропиелоанастомоза после предшествующей реконструктивно-пластической операции или подозрении на рецидив стеноза ЛМС после перкутанной (чресфистульной) эндопиелотомии [20].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: учитывая высокоинвазивный характер исследования при планировании последующей эндоскопической коррекции уретеропиелоанастомоза, уретероскопию целесообразно выполнять с диапевтической целью (комбинация диагностики стеноза анастомоза и хирургической коррекции единовременно).
Возможность проведения уретероскопа через зону предполагаемого сужения в лоханку не означает отсутствие стеноза.
Иные диагностические исследования
Иные диагностические исследования отсутствуют.
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Медикаментозное лечение
Медикаментозное лечение не имеет основного значения и играет вспомогательную роль при подготовке пациента к оперативному лечению и предотвращению осложнений гидронефроза [62].
Хирургическое лечение
Основная цель оперативного лечения – восстановление нормального пассажа мочи, сохранение функции почки, профилактика прогрессирования хронического пиелонефрита и атрофии почечной паренхимы.
Варианты лечения ГН на фоне стеноза ЛМС у детей и у взрослых в целом идентичны и включают широкий спектр подходов.Согласно рекомендациям, EAU/ЕSРU, ранняя хирургическая коррекция стеноза ЛМС показана детям с III-IV степенью ГНТ (SFU), переднезадним диаметром лоханки >20 мм, дифференциальной функцией почки (ДФП) <40% и отрицательной диуретической пробой (Т1/2> 20 мин). Для взрослых пациентов показанием для пластической операции является гидронефроз 2-3А стадий. Переход от наблюдения к пиелопластике рекомендован при снижении ДФП более чем на 10% в течение периода наблюдения, увеличении ПЗД лоханки, нарастании степени гидронефроза (SFU) и появлении симптомов (боль/ИМП) [10].
-
Рекомендуется выполнение открытых пластических операций с целью предотвращения гибели почки детям с III-IV степенью ГНТ (SFU) и взрослым с гидронефроз 2-3А стадий [19].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: золотым стандартом лечения стеноза ЛМС, ГН долгие годы считалась открытая пиелопластика, осуществляемая через передний экстраперитонеальный или люмботомический доступ. Эффективность открытых пластических операций составляет около 87-95%. В настоящее время основными недостатками данного хирургического вмешательства считают высокую послеоперационную морбидность и длину разреза, снижающего косметический эффект. Золотым стандартом реконструктивной хирургии гидронефроза считают ампутационную пиелопластику (АП) или операцию Hynes-Anderson. Основной принцип операции заключается в удалении измененного ЛМС, а при необходимости - патологически измененного участка в/3 мочеточника и части почечной лоханки с последующим прецизионным сопоставлением анастомозируемых поверхностей мочеточника и лоханки. Однако данная методика не зарекомендовала себя как основной метод лечения при протяженных или множественных стриктурах в/3 мочеточника, а также при небольших внутрипочечных лоханках.
При протяженных стриктурах в/3 мочеточника наиболее целесообразно выполнять лоскутные пиелопластики с целью создания анастомоза без натяжения и минимальной деваскуляризации ЛМС. К таким пластикам относят пластику спиральным лоскутом по Culp-DeWeerd и пластику вертикальным лоскутом по Scardino-Prince.
При высоком отхождении мочеточника может быть выполнена Y-V образная пластика по Фолею (Foley) или пиелопластика по Альбаррану-Лихтенбергу (Albarran- Lichtenberg). В проведенных исследованиях, сравнивающих методику по Фолею Foley с операцией Hynes-Anderson, выполненных в аналогичных условиях отмечалось значительное сокращение интраоперационных временных затрат, и простота наложения интракорпоральных швов в группе Y-V при аналогичных исходах операции [63]. В другом исследовании, сравнивающем успешность операции Hynes-Anderson и Y-V пластику по Фолею Foley, отмечено что в первой группе успех был несколько выше, но разница была статистически не значимой [64].
Наличие вазоуретерального конфликта как возможной причины гидронефроза требует проведения операции, предполагающей одновременное удаление суженного участка мочеточника и устранение этого конфликта. Наиболее популярна – антевазальная пиелопластика по Hynes-Anderson.
У взрослых пациентов ВМП после операции дренируются стентом (стент мочеточниковый с двойной петлей для пиелопластики,) на 4-6 недель. Нет единого мнения в отношении каким методом необходимо выполнять установку стента (стент мочеточниковый с двойной петлей для пиелопластики) – ретроградным или антеградным [65]. Существуют исследования по бездренажной пластике, тем не менее дренирование ВМП регламентировано у пациентов с единственной почкой, протяженными стенозами в/3 мочеточника, выраженной интраоперационной геморрагией из анастомозируемых поверхностей, а также у пациентов с уретеритом [66].
-
Рекомендуется выполнение лапароскопических и ретроперитонеоскопических пластических операций с целью предотвращения гибели почки детям с III-IV степенью ГНТ (SFU) и взрослым с гидронефроз 2-3А стадий [19].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: в настоящее время золотым стандартом лечения гидронефроза считается лапароскопическая пиелопластика (ЛП, выполненная впервые в 1993 г. Schuessler et al). Основными преимуществами методики считают не значимую кровопотерю, низкую послеоперационную морбидность, хороший косметический эффект и сопоставимые результаты с открытыми пиелопластиками. Данный хирургический доступ показал свою эффективность как у детей <1 года, так и у пожилых пациентов (>70 лет) [67, 68]. ЛП с успехом применяется и у пациентов с подковообразной почкой [6]. В крупных исследованиях эффективность методики составляет от 85 до 100% [69].
Операция может быть осуществлена трансперитонеально или экстраперитонеально. В проведенных исследованиях, сравнивающих данные доступы, различий в послеоперационных функциональных результатах не выявлено, однако, для выполнения пиелопластики ретроперитонеоскопическим доступом требуется больше временных затрат [70,71].
Интраоперационно верхние мочевые пути дренируются стентом (стент мочеточниковый с двойной петлей для пиелопластики) сроком на 4-6 недель. Нет единого мнения в отношении каким методом необходимо выполнять установку стента (стент мочеточниковый с двойной петлей для пиелопластики) – ретроградным или антеградным [65].
-
Рекомендуется выполнение робот-ассистированных пластических операций с целью предотвращения гибели почки детям с III-IV степенью ГНТ (SFU) и взрослым с гидронефроз 2-3А стадий [19].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: роботические системы значительно уменьшают недостатки лапароскопических методик за счет трехмерного изображения, отсутствия тремора и 5 степеней подвижности инструментов. Однако, имеются недостатки в виде отсутствия тактильной обратной связи и экономической затратности. Клинические испытания показали безопасность и эффективность методики, однако различий в функциональных результатах и количестве осложнений по сравнению с ЛП не выявлено [72, 73]. Исследования, сравнивающие открытую и робот-ассистированную пиелопластику у детей, показали, что в последней группе значительно ниже послеоперационный койко-день, низкая послеоперационная морбидность и интраоперационная кровопотеря [74]. Также проведенные исследования показали, что за 2 года наблюдений за пациентами после робот-ассистированной пиелопластики только 5% пациентов потребовали повторного хирургического вмешательства по поводу стеноза анастомоза в сравнении с 13% пациентов, перенесших традиционную открытую ЛП [75].
Интраоперационно верхние мочевые пути дренируются стентом (стент мочеточниковый с двойной петлей для пиелопластики,) сроком на 4-6 недель. Нет единого мнения в отношении каким методом необходимо выполнять установку стента (стент мочеточниковый с двойной петлей для пиелопластики) – ретроградным или антеградным [65].
-
Рекомендуется выполнение минимально-инвазивных эндоскопических операций у пациентов со стенозом ЛМС, ГН с целью предотвращения гибели почки [19].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: перкутанная (чресфистульная) эндопиелотомия была впервые описана в 1984 г. Ramsay et al. Преимуществами данного хирургического пособия можно считать снижение послеоперационного койко-дня и быстрое послеоперационное восстановление. Однако функциональные результаты данной малоинвазивной методики хуже по сравнению с открытой, лапароскопической и робот-ассистированной пиелопластикой. Проведенные исследования показали, что перкутанная (чресфистульная) эндопиелотомия может быть эффективна в 65-93% [76]. Однако, при правильном отборе пациентов, данная методика может иметь клиническую и функциональную эффективность. Исследования показали, что пациенты с ранним гидронефрозом (2 по Лопаткину) и сохранной функцией почки имеют хорошие результаты хирургического вмешательства по сравнению с пациентами с выраженным гидронефрозом (3A по Лопаткину). Следует помнить, что при стенозах, превышающих 2 см в длину, результаты перкутанной (чресфистульной) и трансуретральной эндопиелотомии могут быть неблагоприятными [77]. Эндопиелотомия редко используется у пациентов детского возраста.
Альтернативным эндоскопическим методом может служить баллонная дилатация. Баллонная дилатация наиболее эффективна при выявлении стеноза уретеропиелоанастомоза при условии выполнения ее в первые 2-3 месяца после первичной реконструктивной операции. Высокая эффективность может быть обусловлена отсутствием грубой соединительной ткани в зоне сужения.
Эндоскопическая баллонная дилатация высокого давления применяется и для малоинвазивного лечения стеноза ЛМС у пациентов первых лет жизни (до 18 месяцев), для которых свойственна недостаточная сформированность тканевых структур лоханки и ЛМС. Процент положительных результатов баллонной дилатации составляет 70-80% [78-80].
Эффективность методики несколько ниже по сравнению с открытыми оперативными вмешательствами, но превосходит их по комплаентности и малотравматичности.
-
Рекомендуется выполнение нефрэктомии у пациентов с терминальным 3Б ГН с целью избавления от нефункционирующего органа [19].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: нефрэктомия может быть выполнена у симптоматических пациентов с нарушенной функцией почки (ДФП менее 15-20%) или нефункционирующей почкой, или при отсутствии технической возможности выполнения повторных реконструктивных операций. Данная хирургическая операция должна рассматриваться только в случае сохранной функции контралатеральной почки.
-
Рекомендуется выполнение чрескожной пункционной нефростомии (ЧПНС) или установка внутреннего стента (стент мочеточниковый с двойной петлей для пиелопластики) у пациентов со стенозом ЛМС, ГН в следующих целях:
- Предотвращение обострения хронического пиелонефрита;
- Предотвращение прогрессирования ХПН при двустороннем процессе или гидронефрозе единственной анатомической либо функционирующей почки;
- купирование болевого симптома;
- решение вопроса о выборе между нефрэктомией и органосохраняющей операцией [13, 22, 59, 81].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: в терминальных стадиях гидронефроза при необходимости решения вопроса о выборе между нефрэктомией и органосохраняющей операцией выполняется дренирование почки. Через 1-2 недели после дренирования исследуется очистительная и концентрационная функция пораженной почки (если был установлен нефростомический дренаж) и выполняется динамическая нефросцинтиграфия.
Медицинская реабилитация
Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
Специфическая рекомендация не требуется
Госпитализация
Организация оказания медицинской помощи
Показания для плановой госпитализации:
1. подтвержденный стеноз лоханочно-мочеточникового сегмента, гидронефроз 2-3 стадии на основании инструментальных методов диагностики для проведения реконструктивной операции.
Показания для экстренной госпитализации:
1. острый обструктивный пиелонефрит
Показания к выписке пациента из стационара:
1) Отсутствие необходимости в стационарном наблюдении и лечении после проведенной операции при адекватной проходимости стента (стент мочеточниковый с двойной петлей для пиелопластики) .
2) Отсутствие гнойно-септических осложнений после хирургического вмешательства
3) Отсутствие тромбоэмболических осложнений после хирургического вмешательства
4) Достигнут беспрепятственный пассаж мочи по ВМП в результате хирургического вмешательства согласно данным УЗИ или (при необходимости) СКТ
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
-
Динамическое наблюдение рекомендуется всем пациентам в постнатальном периоде с функцией почки > 40% и ПЗД лоханки <15 мм с целью своевременного выявления необходимости хирургического лечения [1, 12, 22, 23, 59].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: консервативная тактика ведения новорожденных и пациентов грудного возраста основана на возможности гидронефроза I-II степени SFU спонтанно регрессировать в течение первых 12-14 месяцев жизни в 65% случаев [60]. Гидронефротическая трансформация в этих случаях связана с преходящей дисфункции созревания структурных элементов лоханки/мочеточника (вследствие задержки и гетерохронности созревания).
Наблюдение за пациентами сопровождается проведением регулярных УЗИ почек, для взрослых пациентов рекомендуется использование изотопных исследований с Технемагом 99mTc (или Технеция [99mTc] сукцимером). Ультразвуковой мониторинг – 1 раз в 3 месяца в течение первого года жизни для оценки динамики ретенционных изменений почек. При отсутствии отрицательной динамики УЗИ рекомендуется – 1 раз в 6 месяцев и нефросцинтиграфия с Технемагом 99mTc для оценки функции почечной паренхимы – 1 раз в год. Возможно выполнение УЗИ с диуретической пробой (исследование динамики ПЗД лоханки и RI на фоне форсированного диуреза), исследование уровня биохимических маркеров повреждения паренхимы (трансформирующий фактор роста β1 (TGFβ1), эпидермальный фактор роста (EGF), эндотелин-1 (ЕТ-1), моноцитарный хемоаттрактантный протеин-1 (МСР-1), низкомолекулярный ß2-микроглобулин и канальцевые ферменты (γ-глютамилтрансфераза, щелочная фосфатаза, N-ацетил-β-D-глюкозаминидаза и др.) [61]. При увеличении степени ГНТ – динамическая нефросцинтиграфия с Технемагом 99mTc с диуретической пробой.
-
Рекомендуется всем пациентам с гидронефрозом выполнить УЗИ почек 1 раз в 6 мес., а сцинтиграфию почек и мочевыделительной системы — 1 раз спустя 1 год после оперативного лечения для оценки динамики заболевания. [13].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
-
Рекомендуется всем пациентам с гидронефрозом диспансерное наблюдение в течение 3-х лет после операции у участкового врача-уролога. При наличии остаточной дилатации ЧЛС диспансерное наблюдение может быть пролонгировано для оценки динамики заболевания [21].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
-
При наличии у пациентов дилатации чашечно-лоханочной системы, не соответствующей срокам послеоперационного лечения, рекомендуется выполнение СКТ и уретероскопии для исключения стеноза уретеропиелоанастомоза [22, 59].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Информация
Источники и литература
-
Клинические рекомендации Всероссийского общества урологов
- 1. Hashim Hashim, Christopher R.J. Woodhouse Ureteropelvic Junction Obstruction EUROPEAN UROLOGY SUPPLEMENTS 11 (2012) 25–32 doi:10.1016/j.eursup.2012.01.004 2. Maizels M, Stephens FD. Valves of the ureter as a cause of primary obstruction of the ureter: anatomic, embryologic and clinical aspects. J Urol 1980;123:742–7. 3. Hosgor M, Karaca I, Ulukus C, et al. Structural changes of smooth muscle in congenital ureteropelvic junction obstruction. J Pediatr Surg 2005;40:1632–6. 4. Lowe FC, Marshall FF. Ureteropelvic junction obstruction in adults. Urology 1984;23:331–5. 5. Adey GS, Vargas SO, Retik AB, et al. Fibroepithelial polyps causing ureteropelvic junction obstruction in children. J Urol 2003;169: 1834–6. 6. Lallas CD, Pak RW, Pagnani C, et al. The minimally invasive management of ureteropelvic junction obstruction in horseshoe kidneys. World J Urol 2011;29:91–5. 7. Сизонов В.В. Диагностика обструкции пиелоуретерального сегмента у детей. Вестник урологии. 2016г. №4 с 56-120 8. Сapello S. A., Kogan B. A., Giorgi L. J. et al. Prenatal ultrasound has led to earlier detection and repair of ureteropelvic junction obstruction. J Urol. 2005; 174:1425–1428 9. Сohen B, Goldman SM, Kopilnick M, Khurana AV, Salik JO. Ureteropelvic junction obstruction: its occurrence in 3 members of a single family. J Urol 1978;120:361–4. 10. Pediatric urology guidelines, ЕSРU. 2015; 41-44.; Pediatric urology guidelines, European association of urology. 2018; 49-53 11.Thomas DFM. Upper tract obstruction. In: Thomas DFM, Duffy PG, Rickwood AMK, editors. Essentials of paediatric urology. Ed. 2. London, UK: Informa Healthcare; 2008. P. 73–92. 12. Nonomura K., Yamashita Т., Kanagawa K. et al. Management and outcome of antenatally diagnosed hydronephrosis // Int. J. Urol. — 1994 — Vol. 1 — P. 121—128. 13. Лопаткин Н.А. Руководство по урологии // Москва: Медицина, 1998. — Т. 2. — С. 190. 14. Onen A. An alternative grading system to refine the criteria for severity of hydronephrosis and optimal treatment guidelines in neonates with primary UPJ-type hydronephrosis. J. Pediatr. Urol. 2007; 3 (3): 200-205. Doi: 10.1016/j.jpurol.2006.08.002 15. Fernbach SK, Maizels M, Conway JJ. Ultrasound grading of hydronephrosis: Introduction to the system used by the Society for Fetal Urology. Pediatr Radiol 1993; 23: 478-480 16. Grignon A, Filion R, Filiatrault D, Robitaille P, Homsy Y, Boutin H, et al. Urinary tract dilatation in utero: classifica- tion and clinical applications. Radiology. 1986;160: 645-7 17. Дерюгина Л.А. Антенатальная диагностика врожденных заболеваний мочевыводящей системы и обоснование тактики ведения детей в постнатальном периоде. Дис. Д-ра мед. Наук. — М, 2008. 18. Nguyen, H.T., Herndon, C.D., Cooper C., et al. The Society for Fetal Urology consensus statement on the evaluation and management of antenatal hydronephrosis. J Pediatr Urol. 2010; 6: 212–231. Doi: 10.1016/j.jpurol.2010.02.205. 19. Wojciechowska J, Dembowski J, Zdrojowy R, Szydełko T. Hydronephrosis in the course of ureteropelvic junction obstruction: An underestimated problem? Current opinions on the pathogenesis, diagnosis and treatment. Adv Clin Exp Med. 2017 Aug;26(5):857-864. Doi: 10.17219/acem/59509. 20. Глыбочко П.В., Аляев Ю.Г. Гидронефроз. М: ГЕОТАР-Медиа, 2011г, 32 с. 21. Урология, национальное руководство/ под редакцией акад. РАМН Н.А. Лопаткина. Москва, «ГЭОТАР-Медиа», 2009г с. 370. 22. Григорян В.А. Хирургическое лечение гидронефроза: Дис. Д-ра мед. Наук. — М, 1998. 23. Heinlen JE, Manatt CS, Bright BC, Kropp BP, Campbell JB, Frimberger D. Operative versus nonoperative management of ureteropelvic junction obstruction in children. Urology 2009; 73:521–5 24. Ebel KD. Uroradiology in the fetus and newborn: diagnosis and follow-up of congenital obstruction of the urinary tract. Pediatr Radiol 1998;28(8):630–5. http://www.ncbi.nlm.nih.gov/pubmed/9716640 25. Ismaili K, Avni FE, Hall M. Results of systematic voiding cystourethrography in infants with antenatally diagnosed renal pelvis dilatation. J Pediatr. 2002; 141:21–4 26. Ward VL. Patient dose reduction during voiding cystourethrography. Pediatr Radiol. 2006; 36:168-72 27. Herndon C.D., McKenna P.H., Kolon T.F. et al. A multicenter outcomes analysis of patients with neonatal reflux presenting with prenatal hydronephrosis. J Urol. 1999; 162: 1203-1208. DOI: 10.1016/S0022-5347(01)68134-5 28. Capolicchio J.P., Braga L.H., Szymanski K.M. Canadian Urological Association/Pediatric Urologists of Canada guidelines on the investigation and management of antenatally detected hydronephrosis. Can Urol Assoc J. 2018;12(4):85-92. https://doi.org/10.5489/cuaj.5094 29. Mitterberger M, Pinggera GM, Neururer R, et al. Comparison of contrast-enhanced color Doppler imaging (CDI), computed tomography (CT), and magnetic resonance imaging (MRI) for the detection of crossing vessels in patients with ureteropelvic junction obstruction UPJO). Eur Urol.2008 ; 53:12 5 4 –126 0 30. Васильев, А.Ю. Лучевая диагностика в педиатрии. / А.Ю. Васильев. ГЭОТАР- Медиа. 2009. – С. 217. 31. Talner LB. Specific disorders of the urinary tract. In: Clinical Urography, Pollack HM, Dyer RB, editors. By: WB Saunders: Philadelphia. 2000 32. Ramaswamy K, Marien T, Mass A, Stifelman M, Shah O. Simplified approach to estimating renal function based on computerized tomography. Can J Urol. 2013; 20:6833–6839. 33. Каситериди И.Г. Сравнительная оценка современных методов исследования при гидронефрозе. Дис. К-та мед. Наук. — М., 2005. 34. Khaira H.S., Platt J.F., Cohan R.H. et al. Helical computed tomography for identification of crossing vessels in ureteropelvic junction obstruction-comparison with operative findings. Urology. 2003; 62 (1); 35-39. 35. Krzemien, G. Importance of different imaging methods in diagnosis of significant urodynamically uretropelvic junction obstruction in children with congenital hydronephrosis. Pol Merkur Lekarski. 2008; 24(4): 41- 45. 36. Thukral, B. B. Problems and preferences in pediatric imaging. Indian J Radiol Imaging. 2015; 25 (4):359-364. 37. Towbin R., Baskin K. Pediatric Interventional Radiology. Cambridge University Press. 2015; 493 38. Esmaeili M, Ghane F, Alamdaran A. Comparison Between Diuretic Urography (IVP) and Diuretic Renography for Diagnosis of Ureteropelvic Junction Obstruction in Children. Iran J Pediatr. 2016 Feb;26(1):e4293. Doi: 10.5812/ijp.4293. Epub 2016 Jan 30. 39. Taylor AT, Brandon DC, de Palma D. et al. SNMMI Procedure Standard/EANM Practice Guideline for Diuretic Renal Scintigraphy in Adults With Suspected Upper Urinary Tract Obstruction. Semin Nucl Med. 2018 Jul;48(4):377-390. Doi: 10.1053/j.s 40. Prigent A., Cosgriff P., Gates G.F. et al. Consensus report on quality control of quantitative measurements of renal function obtained from renogram: International Consensus Committee from the Scientific Committee of Radionuclides in Nephrourology. Semin. Nucl. Med. 1999; 91:46–59. 41. Lee J.N., Kang J.K., Jeong S.Y. et al. Predictive value of cortical transit time on MAG3 for surgery in antenatally detected unilateral hydronephrosis caused by ureteropelvic junction stenosis. J Pediatr Urol. 2018;14(1):55.e1-55.e6. doi: 10.1016/j.jpurol.2017.08.009 42. O´ Reilly P., Aurell M., Britton K. et al. Consensus on diuresis renography for investigating the dilated upper urinary tract. J. Nucl. Med. 1996; 37 (11):1872-76. 43. Gordon I., Piepsz A., Sixt R. Auspices of Paediatric Committee of European Association of Nuclear Medicine. Guidelines for standard and diuretic renogram in children. Eur. J. Nucl. Med. Mol. Imaging. 2011; 38 (6):1175- 88. DOI 10.1007/s00259-011-1811-36 44. Rao NP, Srirangam SJ, Preminger GM. Nuclear Medicine Investigations. Urological Tests in Clinical Practice. London: Springer-Verlag; 2007. P. 132-62. 45. Majd M, Bar-Sever Z, Santos AI, De Palma D. The SNMMI and EANM Procedural Guidelines for Diuresis Renography in Infants and Children. J Nucl Med. 2018;59(10):1636-1640. Doi: 10.2967/jnumed.118.215921 46. Piepsz A, Sixt R., Gordon I. Performing renography in children with antenatally detected pelvi-ureteric junction stenosis: errors, pitfalls, controversies. Q. J. Nucl. Med. Mol. Imaging. 2010; 54(4):350-62 47. Павлов, А.Ю., Сабирзянова З.Р., Фомин Д.К. и др. Современные возможности лучевой диагностики пороков развития мочевыделительной системы у детей. Российский электронный журнал радиологии. 2011; 1 (2): 135-136. 48. Mendichovszky I. Nuclear Medicine in Pediatric Nephro-Urology: An Overview. Semin Nucl Med. 2017; 47 (3): 204-228. 49. Ritchie G. Wilkinson A.G., Prescott R.J. Comparison of differential renal function using technetium-99m mercaptoacetyltriglycine (MAG3) and technetium-99m dimercaptosuccinic acid (DMSA) renography in a paediatric population. Ped. Radiol. 2008; 38(8):857-62. Doi: 10.1007/s00247-008-0908-8. 50. Яцык С.П., Зубовский Г.А., Фомин Д.К. Способ оценки жизнеспособности почечной паренхимы. Пат. № 2270605, РФ. Бюл. 2006; № 6
Информация
Список сокращений
МКБ 10 - международная классификация болезней 10-го пересмотра
ГН – гидронефроз
ГНТ – гидронефротическая трансформация
АНГ – антенатальный гидронефроз
ВМП – верхние мочевые пути
ИМП – инфекция мочевых путей
ЛМС – лоханочно-мочеточниковый сегмент
ПУС – пиело-уретеральный сегмент
ЧЛС – чашечно-лоханочная система
в/3 – верхняя треть
УЗИ – ультразвуковое исследование
RI - индекс резистентности при эходопплерографии
ПЗД – переднезадний диаметр (лоханки)
ФУЗИ – фармакологическое ультразвуковое исследование (син. ДУЗИ)
ДРС – диагностическое радиофармацевтическое средство
ДФП – дифференциальная (раздельная) функция почек
Т 1/2 – период полувыведения ДРС из ЧЛС на фоне диуретика
ТТП - время паренхиматозного транзита ДРС
КТ – компьютерная томография
СКТ – спиральная компьютерная томография
МРТ – магнитно-резонансная томография
МЦУГ– микционная цистоуретрография
СНСГ – статическая нефросцинтиграфия
мм – миллиметр
мм рт. ст. – миллиметр ртутного столба
СОЭ – скорость оседания эритроцитов
ХПН — хроническая почечная недостаточность
ЛП – лапароскопическая пиелопластика
ЧПНС – чрескожная пункционная нефростомия
SFU – Society оf Fetal Urology (Общество Фетальной Урологии)
EAU – Еuropean Association Urology (Европейская Ассоциация Урологов)
ЕSРU – Еuropean Society for Paediatric Urology (Европейская Ассоциация Детских Урологов)
Термины и определения
Гидронефроз (греч. hydōr – вода, nephros – почка; син. гидронефротическая трансформация) – расширение чашечно-лоханочной системы почки.
Диапевтика – единовременный перевод диагностического этапа в эффективное инструментальное лечебное воздействие.
Лоханочно-мочеточниковый сегмент (от греч. pyelos – корыто, лохань и ureter – мочеточник) – начальный отрезок проксимальной части мочеточника длиной около 1 см, являющийся местом перехода почечной лоханки в мочеточник.
Обструкция (лат. оbstructio – препятствие, помеха) лоханочно-мочеточникового сегмента – нарушение проходимости прилоханочного отдела мочеточника из-за внутреннего сужения (стеноза) или внешнего сжатия его просвета
Пластика лоханочно-мочеточникового сегмента – это реконструктивно-пластическая операция по восстановлению проходимости мочеточника в зоне перехода лоханки в мочеточник
Стеноз лоханочно-мочеточникового сегмента – стойкое сужение просвета лоханочно-мочеточникового сегменте
Эндопиелотомия – это эндоскопический метод восстановления проходимости ЛМС путем внутреннего рассечения тканей, сужающего его просвет.
Критерии оценки качества медицинской помощи

Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
1. Еникеев Михаил Эликович – доктор медицинских наук, профессор института Урологии и репродуктивного здоровья человека Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет)
2. Ростовская Вера Васильевна – доктор медицинских наук, профессор кафедры детской хирургии и урологии-андрологии им. Л.П. Александрова имени Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет)
3. Рапопорт Леонид Михайлович – доктор медицинских наук, профессор института Урологии и репродуктивного здоровья человека Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет)
4. Григорян Вагаршак Арамаисович – доктор медицинских наук, профессор института Урологии и репродуктивного здоровья человека Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет)
5. Лобанов Михаил Владимирович – кандидат медицинских наук, врач-уролог клиники Урологии Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет)
6. Семенякин Игорь Владимирович – доктор медицинских наук, доцент кафедры урологии МГМСУ им. А.И. Евдокимова
Конфликт интересов:
Все члены Рабочей группы подтвердили отсутствие финансовой поддержки/конфликта интересов, о которых необходимо сообщить.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций: специалисты, имеющие высшее медицинское образование по следующим специальностям:
1. Урология
2. Терапия
3. Общая врачебная практика (семейная медицина)
4. Хирургия.
5. Акушерство и гинекология.
6. Анестезиология-реаниматология.
7. Детская урология-андрология.
8. Педиатрия.
В данных клинических рекомендациях все сведения ранжированы по уровню достоверности (доказательности) в зависимости от количества и качества исследований по данной проблеме.
1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
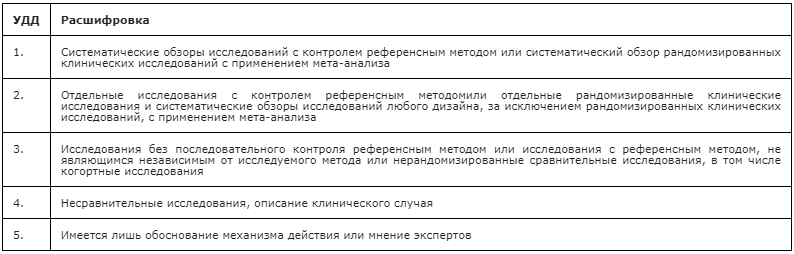
2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)

3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)

Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года или при появлении новой информации о тактике ведения пациентов с данным заболеванием. Решение об обновлении принимает МЗ РФ на основе предложений, представленных медицинскими некоммерческими профессиональными организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Данные клинические рекомендации разработаны с учётом следующих нормативно-правовых документов:
1. Клинические рекомендации европейской ассоциации урологов.
2. Приказ Минздрава России от 12 ноября 2012 г. N 907н «Об утверждении порядка оказания медицинской помощи взрослому населению по профилю «урология»».
Приложение Б. Алгоритмы действий врача

Приложение В. Информация для пациента
Пациента информируют о клинической картине заболевания, знакомят с различными методами лечения и их потенциальными результатами. Выбор метода лечения следует выполнять в результате такого собеседования после того, как пациент имел возможность задать все интересующие его вопросы.
Пациент должен быть информирован о возможных течениях заболевания, рисках, связанных с прогрессированием гидронефроза и атрофией почечной паренхимы, вплоть до потери функции почки.
Следует информировать пациента о симптоматике, различных осложнениях гидронефроза, включая вторичное камнеобразования, обострения острого пиелонефрита, артериальную гипертензию, возникновение терминальных изменений почечной паренхимы.
Особое внимание следует уделить пациентам с гидронефрозом единственной почки. Их необходимо предупредить о необходимости находиться под постоянным наблюдением ввиду риска развития анурии и острой почечной недостаточности.
Пациенту должны быть разъяснены возможные риски и последствия как оперативного лечения (Пиелопластика, Перкутанная (чресфистульная) эндопиелотомия, Трансуретральная эндопиелотомия и иные), так и динамического наблюдения. Необходимо информировать пациента о малой эффективности медикаментозного лечения.
После проведения оперативного пособия необходимо разъяснить пациенту сроки удаления стента (стент мочеточниковый с двойной петлей для пиелопластики) и последующего динамического мониторинга. Необходимо разъяснить сроки восстановления нормальной уродинамики; объяснить о возможности резидуальной дилатации ЧЛС при УЗИ, что само по себе еще не означает рецидива заболевания.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Не предусмотрены.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.