Врожденная цитомегаловирусная инфекция
 Версия: Клинические рекомендации РФ 2023 (Россия)
Версия: Клинические рекомендации РФ 2023 (Россия)
Общая информация
Краткое описание
Разработчик клинической рекомендации:
- Общероссийская общественная организация содействия развитию неонатологии «Российское общество неонатологов»
- Общественная организация "Российская ассоциация специалистов перинатальной медицины"
Одобрено Научно-практическим Советом Минздрава РФ
В соответствии с Правилами поэтапного перехода медицинских организаций к оказанию медицинской помощи на основе клинических рекомендаций, разработанных и утвержденных в соответствии с частями 3, 4, 6 –9 и 11 статьи 37 Федерального закона «Об основах охраны здоровья граждан в Российской Федерации», утвержденных постановлением Правительства Российской Федерации от 19.11.2021 № 1968, клинические рекомендации применяются следующим образом:
– размещенные в Рубрикаторе после 1 июня 2022 года – с 1 января 2024 года.
Клинические рекомендации
Врожденная цитомегаловирусная инфекция
Возрастная категория: Дети
Год утверждения: 2023
Пересмотр не позднее: 2025
Дата размещения: 12.07.2023
Статус: Действует
Применение отложено
Определение заболевания или состояния (группы заболеваний или состояний)
Врожденная цитомегаловирусная инфекция – инфекционное заболевание, развившееся в результате антенатальной передачи возбудителя от матери к плоду при первичном заражении беременной, реактивации ранее приобретенной инфекции во время беременности или заражении серопозитивной беременной другим штаммом цитомегаловируса [1–3]. Врожденная ЦМВИ может являться причиной пороков развития плода, анте- или интранатальной гибели плода, тяжелого генерализованного заболевания новорожденного вплоть до летального исхода, а также необратимых инвалидизирующих поражений, таких как нейросенсорная тугоухость, слепота, детский церебральный паралич, задержка нервно-психического развития.
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статической класификации болезней и проблем, связанных со здоровьем
Р35.1 – врожденная цитомегаловирусная инфекция
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
Врожденная ЦМВИ [39]:
1. клинические формы:
- среднетяжелая и тяжелая
- легкая
- изолированное снижение слуха
2. субклиническая форма
3. Осложнения
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Возбудитель инфекции относится к виду Cytomegalovirus hominis, подцарству Deoxyvira, классу Deoxicubika, порядку Haplovirales, семейству Herpesviridae (герпесвирус человека 5 типа), подсемейству Betahepresviridae, роду Cytomegalovirus. Зарегистрировано 4 штамма ЦМВ (АД169, Davis, Towne, Kerr), все они патогенны для человека.
ЦМВ характеризуется значительным антигенным разнообразием. При инфицировании серопозитивного человека другим штаммом вируса формирование специфического иммунитета с образованием специфичных антител класса М сходно с таковым при первичном контакте.
ЦМВИ является первичной в том случае, если инфицирование цитомегаловирусом и развитие инфекционного процесса происходит у ранее серонегативного человека.
Если серонегативная женщина инфицируется цитомегаловирусом во время беременности, то, независимо от входных ворот инфекции, следствием активной репликации вируса в пораженных клетках является развитие транзиторной виремии, продолжительность которой зависит от скорости формирования приобретенного иммунитета. Наличие ЦМВ в крови ведет к инфицированию плаценты, ее поражению и передаче вируса плоду. Проникший через плаценту вирус активно реплицируется в эндотелиальных клетках сосудов плода и распространяется с клетками крови в органы-мишени. В результате поражаются клетки почек (репликация вируса в которых приводит к попаданию вируса в амниотические воды), печени, миокарда, головного мозга. Заглатывание плодом инфицированных околоплодных вод может приводить к поражению клеток кишечника.
Степень поражения внутренних органов плода во многом зависит от срока его внутриутробного развития, на котором произошло инфицирование [4]. Тяжесть и степень выраженности органных нарушений вследствие внутриутробного инфицирования тем выше, чем ниже гестационный возраст плода [3,5–7]. Также на частоту трансмиссии плоду при первичном заражении беременной влияет наличие ДНК цитомегаловируса в крови и околоплодных водах [8–10]. В случаях, когда заражение плода происходит незадолго до родов или во время родов, поражение внутренних органов и систем реализуется в неонатальном периоде.
В периоде новорожденности заболевание может протекать в клинической и субклинической форме. Тяжелые поражения ЦНС, обусловленные вирусной диссеминацией, более часто возникают при инфицировании на ранних сроках беременности [11].
Частота развития симптоматической формы врожденной ЦМВИ и отдаленных последствий, таких как нейросенсорная тугоухость, при внутриутробном инфицировании плода не зависят от первичного или вторичного (реактивации латентной ЦМВИ или суперинфекции новым штаммом ЦМВ) инфицирования беременной [12–15].
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
ЦМВ встречается повсеместно. Специфические антитела класса IgG, подтверждающие перенесенную инфекцию, обнаруживаются примерно у 60% взрослого населения в развитых странах, доходит до 90-100% в развивающихся странах и значительно варьирует в различных популяциях даже в пределах одной страны в зависимости этнических и социально-экономических факторов [16–18]. В Российской Федерации частота серопозитивности составляет от 50% до 80% [19–23]. Закономерности инфицирования широко варьируют в разных популяциях, что связано с географическими, этническими и социально-экономическими особенностями. Показатели серопозитивности по ЦМВ зависит от возраста, социального статуса, уровня материального благополучия, сексуальной активности. Среди беременных женщин частота выявления ЦМВ-антител достигает 42,6-94,5% [24].
Источником инфекции для беременной женщины является человек, зараженный ЦМВ. После первичной инфекции выделение вируса из организма обычно продолжается несколько месяцев. У детей при заражении в перинатальный период выделение вируса может продолжаться до 5 лет [12,25]. Как у взрослых, так и у детей состояние латентной инфекции может чередоваться с периодической реактивацией, во время которых вновь начинается выделение вируса.
Частота первичной ЦМВИ у женщин во время беременности колеблется достигает, в среднем, 2%, частота внутриутробного инфицирования плода в среднем составляет 32% [16,26]. Вероятность передачи вируса плоду при первичном заражении матери возрастает по мере увеличения срока беременности (с 30% в 1 триместре до 72% в 3 триместре) [7]. При этом наиболее тяжелые поражения плода возникают при заражении в 1 триместре беременности [6,7,11]. Трансплацентарное инфицирование в 1 триместре приводит к порокам развития ЦНС, желудочно-кишечного тракта, желчевыводящих путей (атрезии ЖВП), врожденному циррозу печени, хориоретинитам, блокаде проводящих путей сердца. Инфицирование на более поздних сроках беременности может быть причиной развития прогрессирующей желтухи, геморрагического синдрома, гепатоспленомегалии, пневмонии.
При реактивации латентного вируса или реинфекции ЦМВ во время беременности частота его передачи плоду существенно меньше: около 1,5-2% случаев при обострении инфекции и до 20% при повторном заражении ЦМВ [16]. Дифференцировать реактивацию латентной ЦМВИ и суперинфекцию другим штаммом вируса можно только с помощью молекулярного анализа выделенных изолятов. Согласно ряду исследований, учитывая, что в период беременности реактивации или реинфекции ЦМВ имеет место существенно чаще, чем первичное заражение вирусом в период беременности, именно вторичная инфекция обуславливает 50-80% всех случаев внутриутробного инфицирования [15,27,28].
Частота распространенности врожденной ЦМВИ среди живорожденных новорожденных детей находится в пределах от 0,5 до 2,5%, составляя в среднем около 1%, и значительно варьирует в различных изучаемых популяциях [16,29]. В странах Западной Европы и Северной Америки ЦМВИ рассматривается как самая частая врожденная вирусная инфекция (до 2,2% среди всех живорожденных с учетом бессимптомного носительства) [16,30].
Частота развития клинических форм врожденной ЦМВИ по данным когортных исследований различных стран колеблется от 10 до 70%, при которых от 20% до 60% детей развивают тяжелые и среднетяжелые необратимые последствия, такие как нарушения слуха, эпилепсию, задержку умственного, психомоторного и речевого развития, атрофию зрительного нерва [12,31–34]. 30-90% инфицированных новорожденных имеют субклиническую форму врожденной ЦМВИ, при которой 10-20% детей в дальнейшем развивают отдаленные необратимые последствия [31,32,34].
Согласно данным Росстата, за период 2010-2018 гг. в РФ официально зарегистрировано 22 240 случаев заболеваний ЦМВИ, в том числе в 2018 г. – 2023 случаев. Реальное число больных ЦМВИ, как детей, так и взрослых, во много раз превышает количество зарегистрированных случаев заболевания. Показатели ежегодной заболеваемости врожденной ЦМВИ в РФ за период 2008-2018 гг. имеют тенденцию к снижению с 0,15 в 2008 году до 0,09 на 100 тыс. населения в 2018 году [35]. Однако, статистические данные не отражают реальной картины. По данным форм федерального статистического наблюдения №2 за период с 2009 по 2018 гг. в Москве зарегистрировано лишь 63 случая врожденной ЦМВИ [36]. На сегодня количество зарегистрированных случаев болезни ничтожно по сравнению с расчетным числом случаев врожденной ЦМВИ у младенцев. Учитывая, что количество родов в 2019 г. в РФ насчитывало 1 648 954, в Москве – 137 355, а частота врожденной ЦМВИ составляет, в среднем, 0,5-1% среди живых новорожденных, то количество младенцев, антенатально инфицированных ЦМВ, в отчетном году должно составлять от 8000 до 16000 в стране и от 700 до 1400 в Москве, из них 800-1600 и 70-140 должны иметь клинически выраженную форму болезни [37,38].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клинические формы врожденной ЦМВИ являются результатом трансплацентарного заражения плода, как правило, до 20 недели беременности. Наиболее тяжелой является генерализованная клинически выраженная ЦМВ-инфекция, характеризующаяся поражением костного мозга, печени, ЖКТ и нервной системы. Основные клинические проявления и симптомы представлены в табл. 1. При нейросонографическом исследовании (НСГ) и компьютерной томографии (КТ) головного мозга могут регистрироваться следующие изменения: кальцинаты (наиболее часто перивентрикулярные, а также кортикальные), кисты (субэпендимальные, перивентрикулярные, порэнцефалические), вентрикулодилатация, лентикулостриарная васкулопатия, редко – интракраниальные кровоизлияния. Магнитно-резонансная томография (МРТ) – недостаточно чувствительный метод для выявления кальцификатов, но с ее помощью наилучшим образом можно диагностировать нарушения нейрональной миграции, мальформации коры (атипичный рисунок извилин в виде лисэнцефалии или полимикрогерии), кортикальную атрофию и задержку миелинизации [40–45]. Летальность среди новорожденных с тяжелой формой врожденной ЦМВИ достигает 5-7% [46,47].
Таблица 1. Возможные клинические проявления и симптомы у детей с врожденной ЦМВИ [48].
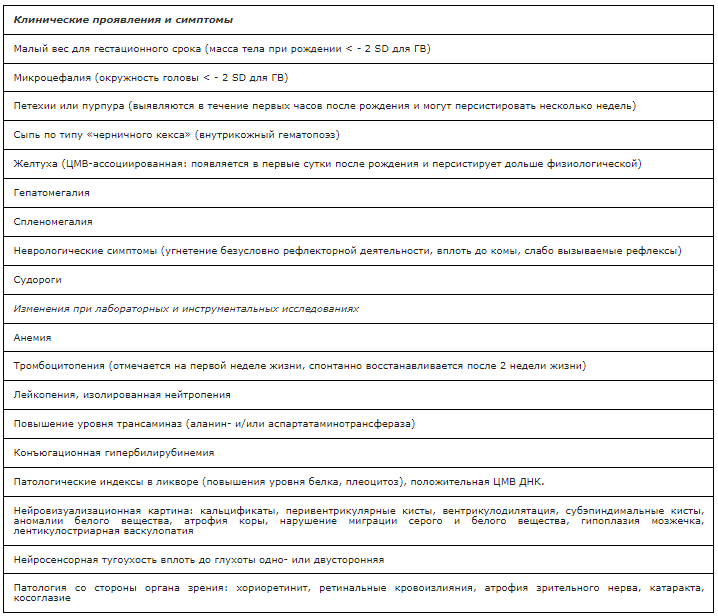
В 2015 году эксперты в области лечения врожденной цитомегаловирусной инфекции у детей пришли к консенсусу о необходимости классифицировать клиническую форму врожденной ЦМВИ по тяжести заболевания [39,48].
К среднетяжелой и тяжелой форме относятся клинические и инструментальные проявления поражения ЦНС, жизнеугрожающее течение болезни или множественные проявления, характерные для врожденной ЦМВИ [39]:
-
множественные проявления (тромбоцитопения, петехии, гепато- и спленомегалия, малый размер к сроку гестации, гепатит (повышение трансаминаз и/или билирубина))
-
клинические признаки менингоэнцефалита, в том числе судороги
-
офтальмологические признаки хориоретинита
-
микроцефалия
-
выявленные при НСГ, КТ или МРТ характерные нарушения структуры головного мозга (кальцификаты, перивентрикулярные кисты, вентрикулодилятация, субэпиндимальные псевдокисты, аномалии белого вещества, атрофия коры, нарушение миграции серого и белого вещества, гипоплазия мозжечка, мозговая гипоплазия, дисплазия гипокампа, лентикулостриарная васкулопатия).
К легкой форме относятся изолированные проявления (1 или 2), клинически незначимые или транзиторные, такие как невыраженная гепатомегалия, либо однократное измерение низкого количества тромбоцитов или однократное повышение аланин аминотрансферазы.
Врожденная ЦМВИ с изолированным снижением слуха. При данной форме отсутствуют клинические и лабораторные признаки заболевания, за исключением изолированного снижения слуха (равно или более 21 дБ). Вместе с тем, у детей, не прошедших исследование слуха у новорожденного с помощью отоакустической эмиссии, необходимо проводить дифференциальный диагноз между врожденной ЦМВИ и другими причинами тугоухости.
Врожденная ЦМВИ, субклиническая форма устанавливается при наличии в биологических жидкостях (кровь, моча, слюна) цитомегаловируса при отсутствии клинически значимых признаков заболевания, изменений в гемограмме, биохимическом профиле крови и при инструментальном обследовании. Несмотря на это, у значительной части таких детей до 10-20% случаев врожденной ЦМВИ, протекающей бессимптомно в периоде новорожденности, в течение первых 3-6 месяцев жизни постепенно начинают формироваться задержка психомоторного развития, нейросенсорная тугоухость, хориоретинит («поздние» проявления врожденной ЦМВИ). Дети с субклинической формой требуют динамического наблюдения на амбулаторном этапе.
Снижение слуха (вплоть до глухоты) может прогрессировать в течение нескольких лет. У детей с врожденной формой ЦМВИ (в том числе, субклинической) мониторинг функции слуха должен продолжаться до школьного возраста, так как около 40% нарушений слуха формируются после неонатального периода у детей с нормальным результатом слухового теста в неонатальном периоде [40,41,49,50].
Осложнения.
Риск неблагоприятных отдаленных последствий наиболее высок при клинически выраженной цитомегаловирусной инфекции [50–53]. Могут развиваться задержка психомоторного, умственного развития (50% случаев), нейросенсорная глухота (50%) или двустороннее снижение слуха (37%), нарушение восприятия речи при сохранении слуха (27%), нарушения зрения (22-58%) одно или более из следующих признаков (микроцефалия, судороги, парезы/параличи, хориоретинит) с частотой около 50% случаев [14,30,53–56]. Врожденная ЦМВИ ассоциируется с нейросенсорной инвалидностью [57]. При наличии микроцефалии – частота инвалидности составляет более 50% [51,58]. В 25–40% случаев дети имеют умственные недостатки, проявляющиеся в более старшем возрасте: когнитивные нарушения, низкую обучаемость в школе, неспособность к чтению, гиперактивность в сочетании с невозможностью сосредоточиться, поведенческие проблемы [51].
Могут формироваться хронический гепатит и цирроз печени, поражения почек (кистозные дисплазии, нефротический синдром), пневмосклероз, внутрижелудочковые кровоизлияния.
Не только клинически выраженная, но и субклиническая ЦМВИ может приводит к формированию осложнений в виде значительного ухудшения слуха (5-23% случаев), снижения зрения, судорожных расстройств, задержки в физическом и умственном развитии (4-5%), нейросенсорных нарушений, сложностей при обучении [14,31,50,51,54,56,59]. Поражения ЦНС, связанные с ЦМВ у ребенка, увеличивают уровень детской инвалидности, снижают показатели умственного, психического и физического развития ребенка. Тугоухость при врожденной ЦМВИ сопровождается поражением вестибулярного аппарата (до 92.3%), которое нередко прогрессирует (до 50%) [52,60]. Имеет место значительная недооценка изолированных нарушений равновесия при сохранном слухе. При латентной врожденной ЦМВИ нарушения вестибулярной функции различной степени выраженности диагностируются почти у половины (до 45%) детей в младшем школьном возрасте [61].
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза:
Доказательством наличия антенатального заражения ЦМВ является обнаружение ДНК ЦМВ в любом биологическом материале (мазок со слизистой оболочки ротоглотки/слюна, кровь, моча, и/или спинномозговая жидкость) в первые 3 недели жизни ребенка [48,62,63]. Согласно проведенным исследованиям, чувствительность выявления ДНК ЦМВ методом полимеразной цепной реакции (ПЦР) в моче у младенцев с врожденной ЦМВИ находится на уровне 98,8-100% при 99,1% специфичности, чувствительность обнаружения ДНК ЦМВ в соскобе со слизистой ротовой полости составляет 80-100% при специфичности 99-100% [64–69]. Доказательная база по прогностическому значению положительной ДНК в спинномозговой жидкости противоречива [44,70–72]. В наиболее крупном когортном исследовании положительная ДНК ЦМВ в спинномозговой жидкости ассоциирована с высокой частотой симптомов врожденной ЦМВИ, включая нейросенсорную тугоухость, в неонатальном периоде, тогда как взаимосвязь с нейросенсорной тугоухостью в 6 месяцев не выявлена [73]. Положительная ДНК ЦМВ в спинномозговой жидкости подтверждает вовлеченность ЦНС в инфекционный процесс, однако, отрицательный результат не исключает нейроинфекции [72]. Чувствительность метода составляет 81%, специфичность 47,8% [73].
Определение антител класса IgM к ЦМВ может быть использовано для установления диагноза врожденной ЦМВИ в случае недоступности ПЦР или в сомнительных случаях как дополнительное исследование, но необходимо учитывать возможные ложноотрицательные и ложноположительные результаты. Чувствительность метода колеблется от 40,7% до 84,4%, специфичность составляет 100% [74–76].
Диагноз «Врожденная ЦМВИ» не может быть установлен на основании выявления у новорожденного антител класса IgG к ЦМВ [77].Убедительные данные о диагностической значимости авидности IgG для диагностики врожденной ЦМВИ у новорожденных в литературе отсутствуют. На диагностический результат могут оказывать влияние трансплацентарные материнские антитела [78–80].
Диагноз «Врожденная цитомегаловирусная инфекция» с указанием тяжести клинической формы устанавливается новорожденному при подтверждении факта антенатального заражения ЦМВ и наличии характерных признаков заболевания (таблица 1), этиология которых подтверждена выявлением в биоматериалах ДНК цитомегаловируса методом ПЦР [39,48].
Тяжесть клинической формы устанавливается в соответствии с критериями, перечисленными в подразделе 1.6.
Диагноз «Врожденная цитомегаловирусная инфекция, субклиническая форма» устанавливается новорожденному при подтверждении факта антенального заражения цитомегаловирусом путем выявления в любом из биологических материалов (слюна, моча, кровь) ДНК ЦМВ и отсутствии характерных признаков заболевания (таблица 1)[39,48].
Таблица 2. Показания к проведению обследования на врожденную ЦМВИ у новорожденных [48].
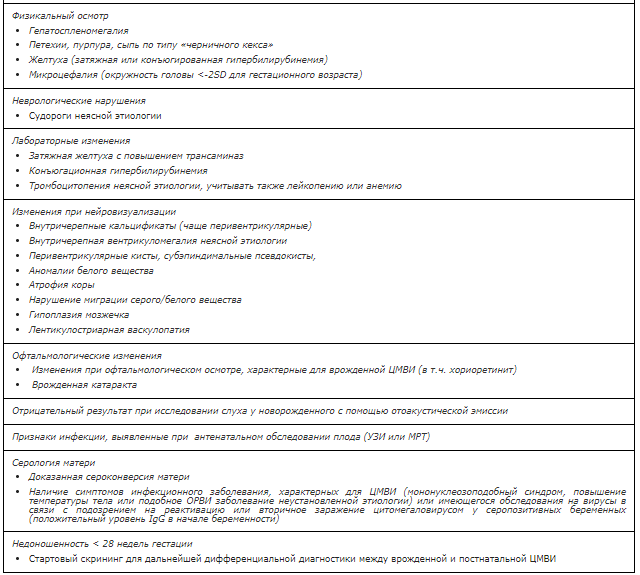
Жалобы и анамнез
-
При наличии в анамнезе матери подозрения или подтвержденных данных, свидетельствующих о перенесенной (первичной, латентной, реинфекции другим штаммом) ЦМВИ во время беременности, рекомендуется новорожденному назначить обследование на ЦМВИ для своевременной диагностики врожденной ЦМВИ [13,28,48,81,82].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: Подозрением на возможно перенесенную ЦМВИ во время беременности может служить наличие подобного ОРВИ заболевания или повышение температуры во время беременности при отсутствии подтверждения этиологии данных клинических проявлений [83]. При недоступности количественного исследования возможно использование качественного.
-
При признаках внутриутробной инфекции, выявленных антенатально при УЗ и МРТ исследовании плода, рекомендуется новорожденному назначить обследование на ЦМВИ для своевременной диагностики и терапии врожденной ЦМВИ [48,81,84–88].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: К специфичным УЗ признакам ЦМВИ относятся кальцификаты в головном мозге (чаще перивентрикулярно), вентрикуломегалия, микроцефалия, гепатоспленомегалия. Менее специфичными, но встречающимися при ЦМВИ, могут быть такие УЗ признаки, как перивентрикулярные кисты, субэпиндимальные кисты, аномалии белого вещества, атрофия коры, нарушение миграции серого и белого вещества, гипоплазия мозжечка, лентикулостриарная васкулопатия, задержка развития плода, асцит, гидроторакс [48,84]. Наличие антенатальных УЗ признаков внутриутробной инфекции, по данным нескольких исследований, обладают 50%-90,6% чувствительностью, 66,4 -97,5% специфичностью, 61,1%-84,4% положительной прогностической значимостью, 83,8-96,1% отрицательной прогностической значимостью в качестве предиктора врожденной ЦМВИ [84,85,88]. При недоступности количественного исследования возможно использование качественного.
-
Всем недоношенным новорожденным гестационным возрастом 28 недель и менее рекомендуется назначить обследование на ЦМВИ для дальнейшей дифференциальной диагностики в случае развития постнатальной цитомегаловирусной инфекции [48,89–92].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: при недоступности количественного исследования возможно использование качественного.
-
При обнаружении при патоморфологическом исследовании последа гистологических признаков поражения плаценты, характерных для ЦМВИ или антигенов ЦМВ, рекомендуется новорожденному назначить обследование на ЦМВИ для своевременной диагностики и терапии врожденной ЦМВИ [93].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии: при недоступности количественного исследования возможно использование качественного.
-
При наличии у новорожденного лабораторных и/или инструментальных признаков, характерных для ЦМВИ, рекомендуется назначить обследование на ЦМВИ для своевременной диагностики и терапии врожденной ЦМВИ [13,48,53,55,94–97].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: Спектр возможных лабораторных и инструментальных изменений представлен в таблицах 1 и 2. При недоступности количественного исследования возможно использование качественного.
Физикальное обследование
-
Новорожденному с подозрением на врожденную ЦМВИ рекомендуется проведение визуального терапевтического осмотра [39,48,51].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: Основные клинические признаки, характерные для врожденной ЦМВИ, представлены в таблице 1.
Наиболее часто у новорожденных с врожденной ЦМВИ встречается микроцефалия, которая является прогностическим признаком неблагоприятных отдаленных неврологических исходов, в связи чем большинство экспертов рекомендует обследование новорожденных с малым размером к сроку гестации в сочетании с микроцефалией, а не рутинное обследование новорожденных с малым размером к сроку гестации [48]. По данным мета-анализа микроцефалия значимо коррелирует с неблагоприятными неврологическими исходами [97].
-
При наличии клинических признаков врожденной инфекции рекомендуется новорожденному назначить обследование на ЦМВИ для своевременной диагностики и терапии врожденной ЦМВИ [48,51,53,95].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: Основные клинические признаки, характерные для врожденной ЦМВИ, представлены в таблице 1.
Лабораторные диагностические исследования
-
В качестве основного диагностического метода у новорожденных детей с подозрением на врожденную ЦМВИ рекомендуется использовать определение ДНК цитомегаловируса (Cytomegalovirus) методом ПЦР в периферической и пуповинной крови, определение ДНК цитомегаловируса (Cytomegalovirus) методом ПЦР в слюне, определение ДНК цитомегаловируса (Cytomegalovirus) в мазках со слизистой оболочки ротоглотки методом ПЦР, определение ДНК цитомегаловируса (Cytomegalovirus) в моче методом ПЦР, количественное исследование в первые 3 недели жизни для этиологической верификации вирусной инфекции [48,64,65,67]. При недоступности количественного исследования возможно использование качественного.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: Рекомендуется провести диагностику как можно в более ранние сроки. При выделении вируса после 3 недель жизни уже нельзя исключить интранатальное или ранее постнатальное заражение. Наиболее информативным для выявления ЦМВ является исследование слюны/мазка со слизистой ротоглотки и мочи, в меньшей степени крови. Слюна/мазок со слизистой ротоглотки и/или моча содержат большую концентрацию вируса, чем кровь, поэтому исследования являются высокочувствительными, а также неинвазивными [64,65,68,98]. При исследовании слюны у новорожденных, находящихся на грудном вскармливании, следует исключить попадание молока в образец во избежание диагностики ЦМВ, который может присутствовать в грудном молоке, в связи с чем рекомендуется взятие образца слюны через 90 мин после кормления, а в случае положительного результата – провести подтверждающий анализ мочи методом ПЦР [27,48,65,98].
По данным исследований вирусная нагрузка в крови коррелирует с тяжестью ЦМВИ и с вовлеченностью ЦНС. На сегодняшний день клиническое значение различных концентраций ДНК ЦМВ в биоматериалах ребенка точно не охарактеризовано. Требуются дополнительные исследования [99,100].
-
При недоступности метода ПЦР, а также в сомнительных случаях для обследования новорожденных детей с подозрением на врожденную ЦМВИ рекомендуется использовать определение антител класса M (IgM) к цитомегаловирусу (Cytomegalovirus) в крови для этиологической верификации вирусной инфекции [74–76].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 3)
Комментарии: Исследование проводится методом ИФА (или ХЛИА) с указанием пороговых значений чувствительности по данной тест-системе (для IgG – в МЕ/мл, для IgM – в условных единицах, в виде коэффициента позитивности или величин оптической плотности исследуемого образца и положительной контрольной сыворотки). Специфические IgM в первые дни жизни свидетельствуют о первичной инфекции, но необходимо учитывать возможные ложноотрицательные и ложноположительные результаты. Первое исследование крови для серологической диагностики у новорожденного должно быть проведено до введения иммуноглобулинов.
-
Новорожденным с подозрением на врожденную ЦМВИ рекомендуется проведение общего (клинического) анализа крови развернутого для выявления лабораторных признаков ЦМВИ (анемия, тромбоцитопения, лейкопения, нейтропения) [46,95,101,102].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
-
При лечении противовирусными препаратами прямого действия (код АТХ J05A) группы нуклеозиды и нуклеотиды, кроме ингибиторов обратной транскриптазы (код АТХ J05AB) новорожденным с врожденной ЦМВИ рекомендуется проведение общего (клинического) анализа крови развернутого для контроля эффективности и безопасности лечения [39,48,103,104].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: Контроль общего (клинического) анализа крови проводится еженедельно первые 6 недель, далее на 8 неделе и далее ежемесячно на протяжении всего курса противовирусной терапии [39]. При необходимости контроль анализов может проводиться чаще на усмотрение врача.
При нейтропении менее 500 клеток в 1 мкл противовирусный препарат прямого действия (код АТХ J05A) группы нуклеозиды и нуклеотиды, кроме ингибиторов обратной транскриптазы (код АТХ J05AB) временно отменяется на несколько дней, либо можно снизить дозу в 2 раза, и, если количество нейтрофилов не нормализуется, то препарат следует отменить [104] или, если проводится терапия #ганцикловиром**, перейти на менее миелотоксический препарат #валганцикловир**. Также в случае тяжелой нейтропении назначаются колониестимулирующие факторы (код АТХ L03AA). #Ганцикловир** может вызывать развитие тромбоцитопении. При персистировании тромбоцитопении на фоне лечения #ганцикловиром** до уровня тромбоцитов менее 25,0·109 /л препарат временно отменяется [43,62,103,105].
-
Новорожденным с подозрением на врожденную ЦМВИ, а также при подозрении на органные поражения, обусловленные врожденной ЦМВИ (гепатит, острое повреждение почек), рекомендуется проведение биохимического анализа крови общетерапевтического (аланинаминотрансфераза, аспартатаминотрансфераза, свободный и связанный билирубин, креатинин, мочевина) для выявления лабораторных признаков ЦМВИ и степени органных поражений [39,46,95,101,102,106].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии: лабораторные изменения, характерные для ЦМВИ, представлены в таблице 1 и 2. Для выявления органных поражений используются соответствующие показатели биохимического анализа крови.
-
При лечении противовирусными препаратами прямого действия (код АТХ J05A) группы нуклеозиды и нуклеотиды, кроме ингибиторов обратной транскриптазы (код АТХ J05AB) новорожденным с врожденной ЦМВИ рекомендуется проведение биохимического анализа крови общетерапевтического для контроля эффективности и безопасности лечения для своевременной коррекции дозы противовирусного препарата [39,48,103,104].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: Контроль показателей (аланинаминотрансфераза, аспартатаминотрансфераза, свободный и связанный билирубин, креатинин, мочевина, натрий, калий) проводится ежемесячно в течении курса терапии [39]. При необходимости контроль анализов может проводиться чаще на усмотрение врача.
-
Новорожденным с подозрением на врожденную ЦМВИ не рекомендуется рутинное определение ДНК цитомегаловируса (Cytomegalovirus) в спинномозговой жидкости методом ПЦР, количественное исследование для определения вовлеченности ЦНС [48,51,73].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: В ряде исследований продемонстрировано отсутствие ДНК ЦМВ в спинномозговой жидкости в случаях поражений ЦНС, подтвержденных методами нейровизуализации, а также у детей, не имевших клинических и нейровизуальных нарушений, развивших впоследствии тяжелые неврологические нарушения, обусловленные врожденной ЦМВИ [51,73].
-
При лечении противовирусными препаратами прямого действия (код АТХ J05A) новорожденным с врожденной ЦМВИ рекомендуется определение ДНК цитомегаловируса (Cytomegalovirus) методом ПЦР в периферической крови и пуповинной крови, количественное исследование для контроля эффективности лечения [48,103,104].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: Контроль вирусной нагрузки методом ПЦР (количественный) в крови необходимо провести в начале лечения и в динамике каждые 2-4 недели на протяжении лечения [48,103,104].
Инструментальные диагностические исследования
-
Новорожденному с подозрением на врожденную ЦМВИ или с подтвержденной врожденной ЦМВИ, а также антенатально выявленным УЗ или МРТ изменениям головного мозга, рекомендуется проведение нейросонографии для выявления поражений ЦНС [13,45,48,97].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3)
-
Новорожденному с подозрением на врожденную ЦМВИ или с подтвержденной врожденной ЦМВИ, а также антенатально выявленным УЗ или МРТ изменениям головного мозга, рекомендуется исследование слуха у новорожденного с помощью отоакустической эмиссии для выявления нейросенсорной тугоухости [45,48,50,57,59,107,108].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 3)
Комментарии: Глубоко недоношенным детям исследование слуха с помощью отоакустической эмиссии проводят после достижения ими постконцептуального возраста 34 недели.
-
Новорожденному с подтвержденной врожденной ЦМВИ при наличии неврологических нарушений и УЗ патологических изменений головного мозга рекомендуется проведение магнитно-резонансной томографии головного мозга для уточнения объема и характера структурных поражений ЦНС [45,48,109–112].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: Данный метод выполняется при условии наличия в конкретной медицинской организации возможности его проведения. Магнитно-резонансная томография более чувствительный метод, чем компьютерная томография.
-
Новорожденному с подтвержденной врожденной ЦМВИ при подозрении на органное поражение для его выявления рекомендуется проведение ультразвукового исследования брюшной полости (комплексное), ультразвукового исследования почек и надпочечников, эхокардиографии, рентгенографии легких, обзорной рентгенографии органов брюшной полости в зависимости от вовлеченности в инфекционный процесс внутренних органов [106,113–120].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3) для УЗИ почек и надпочечников
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4) для УЗИ брюшной полости, эхокардиографии, для рентгенографии легких и обзорной рентгенографии органов брюшной полости
Иные диагностические исследования
-
Новорожденному с подтвержденной врожденной ЦМВИ рекомендуется осмотр врача-офтальмолога для выявления поражений органа зрения [48,55].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии: Для выявления поражений органа зрения у глубоко недоношенных детей, находящихся на стационарном этапе выхаживания, рекомендуется повторные осмотры врача-офтальмолога не реже 1 раза в 2 недели.
-
Новорожденному с подтвержденной врожденной ЦМВИ рекомендуется осмотр врача-невролога для выявления неврологических нарушений [13,103,104].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарий: Для выявления неврологических нарушений у глубоко недоношенных детей, находящихся на стационарном этапе выхаживания, рекомендуется проводить повторные осмотры врача-невролога не реже 1 раза в 2 недели.
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
1. Консервативное лечение
Этиотропная терапия
Лечение врожденной ЦМВИ осуществляется противовирусными препаратами прямого действия (код АТХ J05A), которые до настоящего времени относятся к группе «off-label» - #ганцикловир**, #валганцикловир**. Препараты имеют серьезные побочные действия и, кроме того, в эксперименте выявлен их канцерогенный эффект и токсическое воздействие на гонады [62,63,104]. В связи с высокой токсичностью применяются данные препараты по жизненным показаниям при тяжелом или среднетяжелом течении ЦМВИ после получения информированного согласия родителей.
#Ганцикловир** ингибирует ДНК-полимеразу ЦМВ и тем самым его репликацию. #Ганцикловир** применяют при жизнеугрожающем течении болезни у новорожденных и риске инвалидизации (поражения ЦНС, легких, миокарда, печени, глаза). Препарат может вызывать миелотоксический эффект с развитием тяжелой нейтропении, тромбоцитопении, обладает тератогенной, мутагенной и канцерогенной активностью. #Валганцикловир** (предшественник #ганцикловира**) является менее токсичным по сравнению с #ганцикловиром**. В России зарегистрирована таблетированная форма #валганцикловира**, в форме суспензии препарат не зарегистрирован в России.
Лечение противовирусными препаратами прямого действия (код АТХ J05A) ведет к снижению вирусной нагрузки, но к концу шестинедельного курса терапии вирус может определяться у более чем 50% пациентов [63,121,122]. Следует учитывать, что после отмены противовирусного препарата вирусная экскреция и виремия могут вернуться к исходному уровню [42,43]. Выявление нарастания количества копий ЦМВ на фоне лечения противовирусным препаратом прямого действия (код АТХ J05A), скорее всего, будет свидетельствовать о резистентности вируса к данному препарату [122], что наблюдается крайне редко.
Достижение отрицательных результатов ПЦР в крови, слюне, моче не является непосредственной целью терапии в остром периоде клинической формы.
Решение о прекращении этиотропной терапии или ее пролонгировании принимается по результатам клинико-лабораторной и инструментальной оценки динамики заболевания (по решению врачебного консилиума). Если после отмены этиотропной терапии наблюдается рецидив заболевания, она возобновляется.
Имеются публикации, где авторы представляют клинические случаи и когорты с описанием сочетанного применения противовирусного препарата и иммуноглобулина человека антицитомегаловирусного у детей с врожденной ЦМВИ [105,123–131]. В экспериментах показан положительный эффект иммуноглобулина человека антицитомегаловирусного при поражении головного мозга у новорожденных животных [132].
Иммуноглобулин человека антицитомегаловирусный, 1 мл которого содержит 100 МЕ нейтрализующей активности, назначается одновременно с противовирусными препаратами прямого действия (код АТХ J05A) методом непрерывного внутривенного введения в дозе 1 мл/кг массы тела каждые 48 часов до достижения клинико-лабораторного улучшения. Внутривенное введение иммуноглобулина человека антицитомегаловирусного выполняется в строгом соответствии с инструкцией к препарату.
Возможность использования в комплексной терапии врожденной ЦМВИ у новорожденных иммуноглобулинов нормальных человеческих (код АТХ J06BA) обусловлена наличием в нем антител к ЦМВ (15-20 МЕ/мл), а также антител разных классов к ряду других микроорганизмов, но их эффективность при активной ЦМВИ существенно ниже иммуноглобулина человека антицитомегаловирусного.
-
Пациенту с тяжелой и среднетяжелой формой врожденной ЦМВИ рекомендуется терапия противовирусными препаратами прямого действия (код АТХ J05A) группы нуклеозиды и нуклеотиды, кроме ингибиторов обратной транскриптазы (код АТХ J05AB) (#ганцикловир**, #валганцикловир**) длительностью 6 месяцев для основного этиотропного лечения и снижения неблагоприятных отдаленных неврологических исходов, включая нейросенсорную тугоухость [39,103,104].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: Старт противовирусной терапии проводится по возможности в максимально короткие сроки после постановки диагноза.
#Ганцикловир** назначается в разовой дозе 6 мг/кг 2 раза в сутки путем непрерывного внутривенного введения с последующим переходом на #валганцикловир** в разовой дозе 16 мг/кг 2 раза в сутки перорально. #Валганцикловир** является препаратом выбора как менее токсичный препарат и, при отсутствии толерантности к энтеральному питанию, лечение можно начинать с #валганцикловира**, либо переход на прием #валганцикловира** должен быть осуществлен в максимально короткие сроки. При отсутствии клинического эффекта от терапии #валганцикловиром** возобновляется терапия #ганцикловиром**. Рекомендуемая общая продолжительность введения #ганцикловира** не более 6 недель [133].
-
Новорожденному с легкой формой врожденной ЦМВИ рутинно не рекомендуется лечение противовирусными препаратами прямого действия (код АТХ J05A) [39].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Лечение может быть назначено в индивидуальном порядке по решению врачебного консилиума и согласию родителей. Дозы препаратов представлены в вышеизложенной тезис-рекомендации.
-
Новорожденному с врожденной ЦМВИ с изолированным снижением слуха рутинно не рекомендуется терапия противовирусными препаратами прямого действия (код АТХ J05A) группы нуклеозиды и нуклеотиды, кроме ингибиторов обратной транскриптазы (код АТХ J05AB) (#ганцикловир**, #валганцикловир**) [39].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: В настоящее время недостаточно данных о лечении изолированного снижения слуха при врожденной ЦМВИ. Проведенные исследования включали общую когорту детей с клинической и субклинической формой врожденной ЦМВИ и с малым количеством пациентов с изолированным снижением слуха, либо с поздним началом противовирусной терапии (4 мес и более) [54,103,104,134–136]. Имеющиеся в литературе данные о прогрессировании и восстановлении слуха без проведенной терапии противоречивы [137–139]. Ретроспективное исследование терапии изолированного снижения слуха демонстрирует улучшение слуха после 1 года терапии противовирусными препаратами прямого действия (код АТХ J05A) [140]. Для определения научно обоснованной тактики лечения врожденной ЦМВИ с изолированным снижением слуха американскими исследователями организованы два двойных слепых плацебо контролируемых рандомизированных клинических исследования терапии #валганцикловиром** длительностью 6 месяцев ValEAR (NCT03107871) (дата завершения исследования июль 2024г) и длительностью 6 недель с поздним началом от 1 мес до 4 лет (NCT01649869)(завершен набор участников) [141,142]. Также завершен набор пациентов нидерландского нерандомизированного исследования с группой контроля по лечению изолированного снижения слуха при врожденной ЦМВИ «The Leiden CONCERT Study 2.0» #валганцикловиром** курсом 6 недель (NCT02005822) [143]. Результаты пока не опубликованы.
Учитывая вышеизложенное, терапия врожденной ЦМВИ с изолированным снижением слуха может проводится в индивидуальном порядке по решению врачебного консилиума и согласию родителей.
-
Новорожденному с субклинической формой врожденной ЦМВИ рутинно не рекомендуется лечение противовирусными препаратами прямого действия (код АТХ J05A) [39].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: В настоящее время отсутствуют научно обоснованные данные по лечению субклинической формы врожденной ЦМВИ. Для определения научно обоснованной тактики ведения пациентов с субклинической формой продолжается набор участников в нерандомизированное исследование по предупреждению развития нейросенсорной тугоухости у детей с врожденной субклинической формой ЦМВИ терапией #валганцикловиром** длительностью 4 месяца (NCT03301415)(дата завершения исследования декабрь 2024г) [144].
-
Новорожденному с клиническими формами врожденной ЦМВИ, требующими лечения противовирусными препаратами прямого действия (код АТХ J05A), рекомендуется назначение иммуноглобулина человека антицитомегаловирусного в сочетании с противовирусными препаратами прямого действия (код АТХ J05A) группы нуклеозиды и нуклеотиды, кроме ингибиторов обратной транскриптазы (код АТХ J05AB) (#ганцикловир**, #валганцикловир**) для формирования ЦМВ-специфичного иммунного ответа и повышения эффективности лечения [124,125,127–131,145,146]
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: Иммуноглобулин человека антицитомегаловирусный назначается в дозе 1 мл/кг каждые 48 часов до исчезновения клинических симптомов. В имеющихся в литературе клинических случаях описаны курсы до 6 введений [128,130,146]. Дозы и длительность лечения противовирусными препаратами прямого действия (код АТХ J05A) группы нуклеозиды и нуклеотиды, кроме ингибиторов обратной транскриптазы (код АТХ J05AB) (#ганцикловир**, #валганцикловир**) указаны в тезис-рекомендации по лечению тяжелой и среднетяжелой формы.
2. Хирургическое лечение
Не применимо
3. Иное лечение
Патогенетическая терапия
Объем и характер патогенетической терапии определяются ведущими синдромами. Развитие признаков внутренней гидроцефалии и стойкой внутричерепной гипертензии может стать показанием к консультации врача-нейрохирурга. Наличие хориоретинита требует наблюдения врача-офтальмолога.
Симптоматическая терапия
Симптоматическая терапия включает в себя назначение лекарственных средств в зависимости от клинических проявлений течения инфекционного процесса (антигеморрагическая, гемостатическая, противосудорожная, седативная, кардиотоническая, вазопрессорная, волюмэспандерная терапия).
Грудное вскармливание
-
Новорожденным с любой формой врожденной ЦМВИ не рекомендуется прекращать вскармливание материнским молоком [147].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Медицинская реабилитация
Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
Медицинская реабилитация проводится в зависимости от органных поражений по направлению профильных специалистов (врач-невролог, врач-сурдолог-отоларинголог, врач-офтальмолог).
Госпитализация
Организация оказания медицинской помощи
Новорожденный с подозрением на клиническую форму врожденной ЦМВИ должен быть переведен из акушерского стационара в профильное отделение (отделение патологии новорожденных и недоношенных детей, отделение реанимации и интенсивной терапии новорожденных детской больницы, перинатального центра и др.). Обследование ребенка может проводиться как на этапе акушерского стационара, так и в профильных отделениях (зависит от возможностей конкретных медицинских организаций). Новорожденных от матерей с первичной ЦМВИ во время беременности и/или антенатальными признаками врожденной ЦМВИ, но без характерных клинико-лабораторных проявлений врожденной ЦМВИ после рождения, по возможности, необходимо направить на второй этап выхаживания для обследования и исключения врожденной ЦМВИ.
Если ребенок по какой-то причине не был госпитализирован из родильного дома на второй этап выхаживания или у новорожденного выявлен отрицательный результат при исследовании слуха у новорожденного с помощью отоакустической эмиссии, то в рекомендациях по выписке указывается необходимость обследования новорожденного и реализации динамического наблюдения в амбулаторных условиях для исключения/подтверждения субклинической формы (в т.ч. и изолированного снижения слуха) врожденной ЦМВИ. В этом случае верификация (исключение) врожденной ЦМВИ осуществляется амбулаторно специалистами детской поликлиники (врач-педиатр, врач-инфекционист). В случае выявления амбулаторно клинической формы врожденной ЦМВИ, а также при невозможности выполнить определение ДНК ЦМВ методом ПЦР или недостаточной информативности динамических серологических исследований новорожденный ребенок должен быть направлен согласно региональной маршрутизации в ту профильную МО, в которой будет обеспечено полноценное обследование и лечение новорожденного с врожденной инфекционной патологией.
Лечение новорожденных детей с клинической формой врожденной ЦМВИ должно начинаться в стационарных условиях (как внутривенной, так и оральной формой противовирусных препаратов прямого действия (код АТХ J05A)). Учитывая длительный курс противовирусной терапии, после выписки из стационара на амбулаторном этапе лечение продолжается оральной формой противовирусных препаратов прямого действия (код АТХ J05A) при условии стабильного состояния ребенка. Контроль эффективности и безопасности лечения проводится как в стационаре, так и на амбулаторном этапе.
Показания к выписке пациента из медицинской организации
1) Стабильное удовлетворительное состояние ребенка
2) Стабилизация лабораторных показателей
3) Отсутствие противопоказаний к выписке
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Профилактика
В опубликованных протоколах по ведению беременных из группы риска по заражению ЦМВ или с подтвержденной цитомегаловирусной инфекцией целью основных мероприятий по профилактике врожденной ЦМВИ является снижение первичного и повторного заражения беременной женщины и предупреждение вертикальной трансмиссии во время беременности [148]. По данным проведенных исследований наиболее эффективным методом профилактики является информирование беременной о соблюдение гигиены для предупреждения заражения [149–151]. В качестве терапии, направленной на предупреждение вертикальной трансмиссии у беременных с острой или вторичной активной ЦМВИ, зарубежными исследователями изучались использование #валацикловира и #иммуноглобулина человека антицитомегаловирусного. В настоящее время ряд нерандомизированных исследований продемонстрировал эффективность применения #иммуноглобулина человека антицитомегаловирусного [152–156]. Однако, проведенные рандомизированные исследования не показали эффективность данной терапии [157,158]. Проведенное двойное слепое плацебо контролируемое РКИ продемонстрировало эффективность и безопасность применения #валацикловира в первом триместре у беременных с острой ЦМВИ в качестве профилактики заражения плода ЦМВИ или снижения его последствий, если инфицирование уже произошло [159]. В то же время, опубликованный метаанализ, продемонстрировавший эффективность профилактики #валацикловиром в отношении снижении риска заболеваемости врожденной ЦМВИ, указал на низкую степень доказательности включенных исследований и отсутствие данных о влиянии препарата на течение инфекции и снижении риска развития симптоматической формы у плода, что требует дополнительного изучения [160]. Методы специфической профилактики врожденной ЦМВИ, основанные на вакцинации женщин высокого риска, в настоящее время находятся в стадии клинических испытаний.
Диспансерное наблюдение
-
Новорожденным с любой формой врожденной ЦМВИ рекомендуется диспансерное наблюдение врача-сурдолога-отоларинголога для контроля функции слуха [39,48,59,94,108,139].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: Диспансерное наблюдение врача-сурдолога-отоларинголога проводится каждые 3-6 месяцев на первом году жизни, каждые 6 месяцев до трехлетнего возраста и ежегодно до 10-19 лет [39,48,94,139].
-
Новорожденным с любой формой врожденной ЦМВИ рекомендуется диспансерное наблюдение врача – инфекциониста [48].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Диспансерное наблюдение врача-инфекциониста проводится ежегодно до 2 лет [48].
-
Новорожденным с любой формой врожденной ЦМВИ рекомендуется диспансерное наблюдение врача – офтальмолога [39,48,55,161].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 3)
Комментарии: Диспансерное наблюдение врача-офтальмолога проводится на 1 месяце жизни, далее ежегодно до 18 лет, либо чаще по рекомендации врача-офтальмолога [39,48,55,161]. Отдаленные последствия врожденной ЦМВИ как клинической, так и субклинической форм, такие как страбизм, нистагм, атрофия зрительного нерва, корковое нарушение зрения, реактивация хориоретинита могут развиваться в течении всего детского возраста. Крупное когортное исследование показало, что атрофия зрительного нерва у детей с врожденной ЦМВИ в среднем была выявлена в возрасте 5,4 лет, корковое нарушение зрения – в 5,1 год, страбизм - в 4,5 года при клинической форме врожденной ЦМВИ и в 10,9 лет при субклинической, нистагм – в 7,9 лет, реактивация хориоретинита на 1-2 году жизни. Различные нарушения зрения при субклинической форме диагностировались до 17,1 года [161].
-
Новорожденным с любой формой врожденной ЦМВИ рекомендуется диспансерное наблюдение врача – невролога [39,48,50,134].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: Диспансерное наблюдение врача-невролога проводится ежегодно до 7 лет, либо чаще по рекомендации врача-невролога [34,50,134].
Информация
Источники и литература
-
Клинические рекомендации Российского общества неонатологов
- Elizabeth C. Swanson, DO and Mark R. Schleiss M. Congenital cytomegalovirus infection : new prospects for prevention and therapy . Congenital cytomegalovirus infection : current strategies and future perspectives . Antiviral treatment of cytomegalovirus infection . // pediatr Clin North Al. 2013. Vol. 60, № 2. P. 1–17. Lazzarotto T. et al. Congenital Cytomegalovirus Infection: A Narrative Review of the Issues in Screening and Management From a Panel of European Experts // Front. Pediatr. 2020. Vol. 8. Davis N.L., King C.C., Kourtis A.P. Cytomegalovirus infection in pregnancy // Birth Defects Res. 2017. Vol. 109, № 5. P. 336–346. Шахгильдян В.И. Диагностика и лечение цитомегаловирусной инфекции у беременных и новорожденных // Неонатология: новости, мнения, обучение. 2017. № 3. P. 70–82. Emery V.C., Lazzarotto T. Cytomegalovirus in pregnancy and the neonate // F1000Res. 2017. Vol. 6. P. 138. Picone O. et al. A series of 238 cytomegalovirus primary infections during pregnancy: Description and outcome // Prenat. Diagn. 2013. Vol. 33, № 8. P. 751–758. Enders G. et al. Intrauterine transmission and clinical outcome of 248 pregnancies with primary cytomegalovirus infection in relation to gestational age // J. Clin. Virol. Elsevier B.V., 2011. Vol. 52, № 3. P. 244–246. Simonazzi G. et al. Congenital Cytomegalovirus Infection: Prognostic Value of Maternal DNAemia at Amniocentesis // Clin Infect Dis. 2017. Vol. 64, № 2. P. 207–210. Zavattoni M. et al. Monitoring of human cytomegalovirus DNAemia during primary infection in transmitter and non-transmitter mothers // J. Clin. Virol. Elsevier B.V., 2016. Vol. 82. P. 89–93. Delforge M.L. et al. Presence of Cytomegalovirus in urine and blood of pregnant women with primary infection might be associated with fetal infection // J. Clin. Virol. 2017. Vol. 90. P. 14–17. Pass R.F. et al. Congenital cytomegalovirus infection following first trimester maternal infection: Symptoms at birth and outcome // J. Clin. Virol. 2006. Vol. 35, № 2. P. 216–220. Townsend C.L. et al. Long-term outcomes of congenital cytomegalovirus infection in Sweden and the United Kingdom // Clin. Infect. Dis. 2013. Vol. 56, № 9. P. 1232–1239. Maltezou PG, Kourlaba G, Kourkouni Ε, Luck S, Blázquez-Gamero D, Ville Y, Lilleri D, Dimopoulou D, Karalexi M P. V. Maternal type of CMV infection and sequelae in infants with congenital CMV: Systematic review and meta-analysis. // J Clin Virol. 2020. Vol. 129. P. 104518. Fowler K.B., Boppana S.B. Congenital cytomegalovirus (CMV) infection and hearing deficit // J. Clin. Virol. 2006. Vol. 35, № 2. P. 226–231. Puhakka L. et al. Primary versus non-primary maternal cytomegalovirus infection as a cause of symptomatic congenital infection–register-based study from Finland // Infect. Dis. (Auckl). Informa UK Limited, trading as Taylor 8 Francis Group, 2017. Vol. 49, № 6. P. 445–453. Kenneson A C.M. Review and meta-analysis of the epidemiology of congenital cytomegalovirus (CMV) infection // Rev Med Virol. 2007. Vol. 17, № 4. P. 253–276. Mussi-Pinhata M.M. et al. Birth prevalence and natural history of congenital cytomegalovirus infection in a highly seroimmune population // Clin. Infect. Dis. 2009. Vol. 49, № 4. P. 522–528. Mussi-Pinhata M.M. et al. Seroconversion for Cytomegalovirus Infection during Pregnancy and Fetal Infection in a Highly Seropositive Population: “the BraCHS Study” // J. Infect. Dis. 2018. Vol. 218, № 8. P. 1200–1204. Козлова С.Н., Савельева Е.В. Распространенность герпесвирусных инфекций у детей дошкольного образовательного учреждения Prevalence of herpes virus infections in children from preschool // Уральский медицинский журнал. 2015. Vol. 4, № 127. P. 45–50. Аистова Л.Г., Провоторов В.Я., Калуцкий П.В. Встречаемость вирусов герпетической группы у вич - инфицированных лиц // Научные ведомости Белгородского государственного университета. серия: медицина. фармация. 2015. Vol. 4, № 201. P. 57–60. Баратова М.А., Баратова Д.А., Нурлыханов Е.Б. Иммуногенетические показатели и распространенность носительства вируса Эпштейн-Барр, цитомегаловируса у потенциальных доноров гемопоэтических стволовых клеток // Современные проблемы науки и образования. 2014. Vol. 5. P. 446. Майлян Э.А., Майлян Д.Э.. Частота регистрации маркеров цитомегаловирусной инфекции по данным иммуноферментного анализа у жителей донецкого региона // Медико-социальные проблемы семьи. 2013. Vol. 18, № 2. P. 123–127. Алямовская Г.А., Кешищян Е.С., Адуева С.М. и др. Выявление прямых маркеров цитомегаловируса и противовирусных антител у детей раннего возраста // Вопросы вирусологии. 2005. Vol. 50, № 1. P. 14–18. Яцык Г.В., Одинаева Н.Д., Беляева И.А.. Цитомегаловирусная инфекция // Практика педиатра. 2009. № 10. P. 5–12. Cannon M.J., Hyde T.B., Schmid D.S. Review of cytomegalovirus shedding in bodily fluids and relevance to congenital cytomegalovirus infection // Rev. Med. Virol. 2011. Vol. 21, № 4. P. 240–255. Hyde TB, Schmid DS C.M. Cytomegalovirus seroconversion rates and risk factors: implications for congenital CMV. // Rev Med Virol. 2010. Vol. 20, № 5. P. 311–326. Leruez-Ville M, Magny JF, Couderc S et al. Risk factors for congenital CMV infection following primary and non-primary maternal infeciton // Clin Infect Dis. 2017. Vol. 65, № 13. P. 398–404. Wang C. et al. Attribution of congenital cytomegalovirus infection to primary versus non-primary maternal infection // Clin. Infect. Dis. 2011. Vol. 52, № 2. P. 11–13. Ssentongo P. et al. Congenital Cytomegalovirus Infection Burden and Epidemiologic Risk Factors in Countries with Universal Screening: A Systematic Review and Meta-analysis // JAMA Netw. Open. 2021. Vol. 4, № 8. P. 1–17. Manicklal S. et al. The “Silent” global burden of congenital cytomegalovirus // Clin. Microbiol. Rev. 2013. Vol. 26, № 1. P. 86–102. Dollard SC, Grosse SD R.D.. New estimates of the prevalence of neurological and sensory sequelae and mortality associated with congenital cytomegalovirus infection // Rev Med Virol. 2007. Vol. 17, № 5. P. 355–363. Lin C. et al. Diagnosis and medical care for congenital cytomegalovirus infection An observational study using claims data in Japan, 2010 to 2017 // Med. (United States). 2020. Vol. 99, № 10. Mussi-Pinhata M.M., Yamamoto A.Y. Natural history of congenital cytomegalovirus infection in highly seropositive populations // J. Infect. Dis. 2021. Vol. 221, № Suppl 1. P. S15–S22. Korndewal M.J. et al. Long-term impairment attributable to congenital cytomegalovirus infection: a retrospective cohort study // Dev. Med. Child Neurol. 2017. Vol. 59, № 12. P. 1261–1268. Александрова Е. П., Шахгильдян В.И. Анализ заболеваемости цитомегаловирусной инфекции в Российской Федерации за период 2008-2018 гг // Инфекционные болезни в современном мире: эпидемиология, диагностика, лечение и профилактика : Сборник трудов XII Ежегодного Всероссийского интернет-конгресса по инфекционным болезням с международным участием / ed. Под ред. В.И. Покровского. Москва: Общество с ограниченной ответственностью “Медицинское Маркетинговое Агентство,” 2020. P. 9–10. Шахгильдян В.И. Врожденная цитомегаловирусная инфекция: актуальные вопросы, возможные ответы // Неонатология: новости, мнения, обучение. 2020. Vol. 8, № 4. P. 61–72. Кистенева Л.Б., Сухоруков В.С., Царегородцев А.Д. [и др.]. Персистирующие герпес-вирусные инфекции у детей. Москва: Медицинское информационное агентство, 2021. 280 p. Шахгильдян В.И., Александрова Е.П., Козырина Н.В., Шипулина О.Ю., Додонова Э.А., Шахгильдян Н.В.. Цитомегаловирусная инфекция у беременных и новорожденных: эпидемиологический анализ, новые подходы к диагностике и лечению // Акушерство и гинекология новости, мнения, обучение. 2020. Vol. 8, № 2. P. 80–94. Rawlinson W.D. et al. Congenital cytomegalovirus infection in pregnancy and the neonate: consensus recommendations for prevention, diagnosis, and therapy // Lancet Infect. Dis. 2017. Vol. 17, № 6. P. e177–e188. Volpe J.J. Neurology of the newborn. 5th editio. Saunders Elsevier, 2008. 1094 p. Buonsenso D, Serranti D, Gargiullo L, Ceccarelli M, Ranno O. et al. Congenital cytomegalovirus infection: current strategies and future perspectives // Eur Rev Med Pharmacol Sci. 2012. Vol. 16, № 7. P. 919–935. Hayakawa J, Kawakami Y, Takeda S, Ozawa H, Fukazawa R, Takase M, Fukunaga Y. A. A neonate with reduced cytomegalovirus DNA copy number and marked improvement of hearing in the treatment of congenital cytomegalovirus infection. // J Nippon Med Sch. 2012. Vol. 79, № 6. P. 471–477. Nishida K. et al. Neurological outcomes in symptomatic congenital cytomegalovirus-infected infants after introduction of newborn urine screening and antiviral treatment // Brain Dev. The Japanese Society of Child Neurology, 2016. Vol. 38, № 2. P. 209–216. Halwachs-Baumann G. et al. Human cytomegalovirus load in various body fluids of congenitally infected newborns // J. Clin. Virol. 2002. Vol. 25, № SUPPL. 3. P. 81–87. Diogo M.C. et al. The MRI spectrum of congenital cytomegalovirus infection // Prenat. Diagn. 2020. Vol. 40, № 1. P. 110–124. Kylat R.I., Kelly E.N., Ford-Jones E.L. Clinical findings and adverse outcome in neonates with symptomatic congenital cytomegalovirus (SCCMV) infection // Eur. J. Pediatr. 2006. Vol. 165, № 11. P. 773–778. Inagaki K. et al. Risk Factors, Geographic Distribution, and Healthcare Burden of Symptomatic Congenital Cytomegalovirus Infection in the United States: Analysis of a Nationally Representative Database, 2000-2012 // J. Pediatr. Elsevier Inc., 2018. Vol. 199. P. 118-123.e1. Luck S.E. et al. Congenital cytomegalovirus a European expert consensus statement on diagnosis and management // Pediatr. Infect. Dis. J. 2017. Vol. 36, № 12. P. 1205–1213. Duval M., Park A.H. Congenital cytomegalovirus: What the otolaryngologist should know // Curr. Opin. Otolaryngol. Head Neck Surg. 2014. Vol. 22, № 6. P. 495–500. Bartlett A.W. et al. Hearing and neurodevelopmental outcomes for children with asymptomatic congenital cytomegalovirus infection: A systematic review // Rev. Med. Virol. 2017. Vol. 27, № 5. P. 1–10.
Информация
Список сокращений
IgG – иммуноглобулины класса G
IgM - иммуноглобулины класса M
SD – стандартное отклонение
АЛТ – аланинаминотрансфераза
АСТ – аспартатаминотрансфераза
АТХ – Анатомо-терапевтическо-химическая классификация лекарственных средств
ГВ – гестационный возраст
ДНК – дезоксирибонуклеиновая кислота
ЖКТ – желудочно-кишечный тракт
ИФА – иммуноферментный анализ
КТ – компьютерная томография
МЕ – международные единицы
МКБ-10 - международная классификация болезней 10 пересмотр
МО – медицинская организация
МРТ - магнитно-резонансная томография
НСГ – нейросонография
ОРВИ – острая респираторная вирусная инфекция
ПЦР – полимеразная цепная реакция
РКИ – рандомизированные клинические исследования
УЗИ – ультразвуковое исследование
ХЛИА - иммунохемилюминисцентный анализ
ЦМВ - цитомегаловирус
ЦМВИ – цитомегаловирусная инфекция
ЦНС – центральная нервная система
Термины и определения
Врожденная цитомегаловирусная инфекция – инфекционное заболевание, развившееся в результате антенатальной передачи возбудителя от матери к плоду при первичном заражении беременной, реактивации ранее приобретенной инфекции во время беременности или заражении серопозитивной беременной другим штаммом цитомегаловируса.
Цитомегаловирусная инфекция (далее – ЦМВИ) – распространенная вирусная инфекция, вызываемая цитомегаловирусом (Human Cytomegalovirus) (ЦМВ), характеризующаяся многообразными проявлениями от бессимптомного течения до тяжелых генерализованных форм с поражением внутренних органов и центральной нервной системы (у лиц с иммунодефицитом и при внутриутробном поражении плода).
Критерии оценки качества медицинской помощи
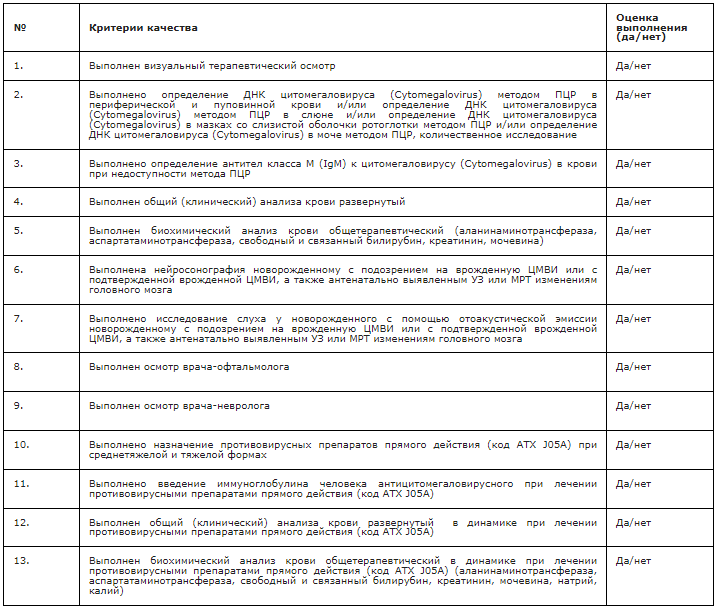
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
-
Балашова Екатерина Николаевна – кандидат медицинских наук, ведущий научный сотрудник ОРИТ имени проф. А.Г. Антонова Института неонатологии и педиатрии, доцент кафедры неонатологии, ФГБУ «НМИЦ АГП имени В.И. Кулакова» Минздрава России, член Совета Российского общества неонатологов
-
Вайнштейн Наталья Петровна - кандидат медицинских наук, заведующая инфекционным отделением № 1 для новорожденных ДГКБ № 9 им. Г.Н. Сперанского, доцент кафедры госпитальной педиатрии РГМУ им. Н.И. Пирогова
-
Васильев Валерий Викторович - доктор медицинских наук, профессор кафедры инфекционных болезней ФГБОУ ВО СЗГМУ им. И.И.Мечникова Минздрава России, руководитель отдела врожденной инфекционной патологии, ведущий научный сотрудник ФГБУ ДНКЦИБ ФМБА России, профессор
-
Володин Николай Николаевич - доктор медицинских наук, академик РАН, профессор, Президент РАСПМ, Руководитель отдела педиатрии ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» МЗ РФ
-
Дегтярев Дмитрий Николаевич - доктор медицинских наук, профессор заместитель директора по научной работе ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России, заведующий кафедрой неонатологии Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» МЗ РФ (Сеченовский Университет), член Совета Российского общества неонатологов
-
Дегтярева Марина Васильевна - доктор медицинских наук, профессор, заведующая кафедрой неонатологии ФДПО ФГБОУ ВО «Российский Национальный Исследовательский Медицинский Университет имени Н. И. Пирогова» Минздрава России, член Совета Российского общества неонатологов
-
Зубков Виктор Васильевич - доктор медицинских наук, директор Института неонатологии и педиатрии, заведующий кафедрой неонатологии ФГБУ «НМИЦ АГП имени В.И. Кулакова» Минздрава России, профессор кафедры неонатологии Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» МЗ РФ (Сеченовский Университет), член Совета Российского общества неонатологов
-
Иванова Анна Александровна - врач – клинический фармаколог СПб ГБЗУ «Детская городская больница №17 Святителя Николая Чудотворца»
-
Игнатко Ирина Владимировна - доктор медицинских наук, член-корреспондент РАН, профессор кафедры акушерства, гинекологии и перинатологии Первого МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет)
-
Ионов Олег Вадимович - доктор медицинских наук, заведующий ОРИТ имени проф. А.Г. Антонова Института неонатологии и педиатрии ФГБУ «НМИЦ АГП имени В.И. Кулакова» Минздрава России, профессор кафедры неонатологии Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» МЗ РФ (Сеченовский Университет), Председатель Российского общества неонатологов
-
Карпова Анна Львовна - кандидат медицинских наук, заместитель главного врача по неонатологии ГБУЗ "Городская клиническая больница № 67 им. Л.А. Ворохобова ДЗМ", главный внештатный неонатолог МЗ Калужской области, член Совета Российского общества неонатологов.
-
Лобзин Юрий Владимирович - доктор медицинских наук, профессор, директор ФГБУ НИИ детских инфекций ФМБА России, академик РАН
-
Малютина Людмила Вячеславовна - кандидат медицинских наук, главный внештатный специалист неонатолог Минздрава Московской области, заместитель главного врача по педиатрической части Щелковского перинатального центра, доцент кафедры неонатологии Московского областного научно-исследовательского клинического института им. М. Ф. Владимирского, член Совета Российского общества неонатологов
-
Овсянников Дмитрий Юрьевич - доктор медицинских наук, профессор, заведующий кафедрой педиатрии РУДН
-
Панкратьева Людмила Леонидовна - кандидат медицинских наук, ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» МЗ РФ, заведующая отделением
-
Савенкова Марина Сергеевна - доктор медицинских наук, профессор кафедры клинической и функциональной диагностики ФГБОУ ВО РНИМУ им Н.И. Пирогова
-
Сенькевич Ольга Александровна - доктор медицинских наук, профессор, заведующая кафедрой педиатрии, неонатологии и перинатологии с курсом неотложной медицины Института непрерывного профессионального образования и аккредитации ФГБОУ ВО Дальневосточный государственный медицинский университет МЗ РФ, член Совета Российского общества неонатологов
-
Шабалов Николай Павлович - доктор медицинских наук, профессор, заведующий кафедрой детских болезней Военно-медицинской Академии им. С.М. Кирова
-
Шахгильдян Василий Иосифович - кандидат медицинских наук, старший научный сотрудник ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора, врач-инфекционист Госпиталя MD-GROUP (Перинатального центра) и Клинического госпиталя «Лапино» Группы компаний «Мать и дитя»
Конфликт интересов отсутствует
Приложение А2. Методология разработки клинических рекомендаций
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных.
Описание методов, использованных для сбора/селекции доказательств: доказательной базой для рекомендаций являлись публикации, вошедшие в Кохрановскую библиотеку, базы данных PubMed, EMBASE и MEDLINE, Scopus, Web of Science, e-library, clinicaltrial.gov, электронные библиотеки, клинические рекомендации, размещенные на ресурсах The National Institute for Health and Care Excellence, The European Association of Perinatal Medicine, The European Society for Pediatric Research, The European Foundation for the Care of Newborn Infants, The European Society for Neonatology. Глубина поиска составляла 34 года.
Методы, использованные для оценки качества и силы доказательств:
-
консенсус экспертов;
-
оценка значимости в соответствии с рейтинговой схемой.
Шкалы оценки уровней достоверности доказательств (УДД) (Таблица 1,2) для методов диагностики, профилактики, лечения и реабилитации (диагностических, профилактических, лечебных, реабилитационных вмешательств) с расшифровкой и шкала оценки уровней убедительности рекомендаций (УУР) (Таблица 3) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств).
Методы, использованные для анализа доказательств:
-
обзоры опубликованных метаанализов;
-
систематические обзоры с таблицами доказательств.
Описание методов, использованных для анализа доказательств.
При отборе публикаций, как потенциальных источников доказательств, использованная в каждом исследовании методология изучалась для того, чтобы убедиться в её валидности. Методологическое изучение базировалось на вопросах, которые сфокусированы на тех особенностях дизайна исследований, которые оказывают существенное влияние на валидность результатов и выводов.
Для минимизации потенциальных ошибок субъективного характера каждое исследование оценивалось независимо, по меньшей мере, двумя членами рабочей группы. Какие-либо различия в оценках обсуждались всей группой в полном составе. При невозможности достижения консенсуса привлекался независимый эксперт.
Экономический анализ:
Анализ стоимости не проводился, и публикации по фармакоэкономике не анализировались
Метод валидизации рекомендаций:
-
внешняя экспертная оценка;
-
внутренняя экспертная оценка.
Описание метода валидизации рекомендаций:
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать, прежде всего, то, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Получены комментарии со стороны врачей первичного звена и участковых педиатров в отношении доходчивости изложения рекомендаций и их оценки важности рекомендаций, как рабочего инструмента повседневной практики.
Предварительная версия была также направлена рецензенту, не имеющему медицинского образования, для получения комментариев, с точки зрения перспектив пациентов.
Комментарии, полученные от экспертов, тщательно систематизировались, и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался, и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультация и экспертная оценка:
Последние изменения в настоящих рекомендациях представлены для дискуссии в предварительной версии. Обновленная версия для широкого обсуждения была размещена на сайте Российской ассоциации специалистов перинатальной медицины (РАСПМ) www.raspm.ru., Российского общества неонатологов (РОН) www.neonatology.pro для того, чтобы все заинтересованные лица имели возможность принять участие в обсуждении и совершенствовании рекомендаций.
Проект рекомендаций рецензирован независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Целевая аудитория данных клинических рекомендаций:
1. врачи-неонатологи
2. врачи-анестезиологи-реаниматологи
3. врачи-педиатры
4. врачи-инфекционисты
5. врачи-акушеры-гинекологи
6. Врачи-неврологи
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
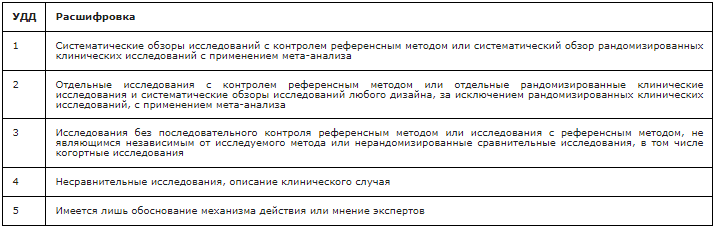
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
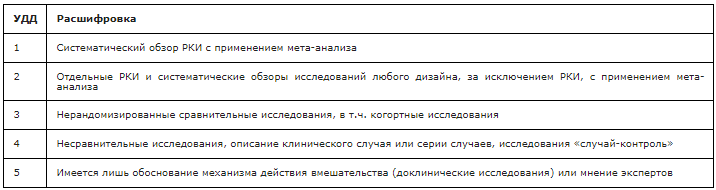
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)

Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года или при появлении новой информации о тактике ведения пациентов с данным заболеванием, но не чаще 1 раза в 6 месяцев. Решение об обновлении принимает МЗ РФ на основе предложений, представленных медицинскими некоммерческими профессиональными организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
-
Федеральный закон «Об основах охраны здоровья граждан в Российской Федерации» от 21.11.2011 № 323 Ф3.
-
МЗ РФ, Приказ от 10 мая 2017 г. N 203н «Об утверждении критериев оценки качества медицинской помощи».
-
Порядок оказания медицинской помощи по профилю «Неонатология» (Приказ Министерства здравоохранения РФ от 15 ноября 2012 г. N 921н).
-
Международная классификация болезней, травм и состояний, влияющих на здоровье, 10-го пересмотра (МКБ-10) (Всемирная организация здравоохранения) версия 2019.
-
Номенклатура медицинских услуг (Министерство здравоохранения и социального развития Российской Федерации) 2020 г.
-
Перечень жизненно необходимых и важнейших лекарственных препаратов на 2020 г. (Распоряжение Правительства РФ от 12 октября 2019 г. N 2406-р).
-
Методическое письмо Минздрава России № 15-4/И/2-2570 от 04.03.2020 «Реанимация и стабилизация состояния новорожденных детей в родильном зале». Под ред. Байбариной Е.Н. М.: Министерство здравоохранения РФ; 2020.
Приложение Б. Алгоритмы действий врача
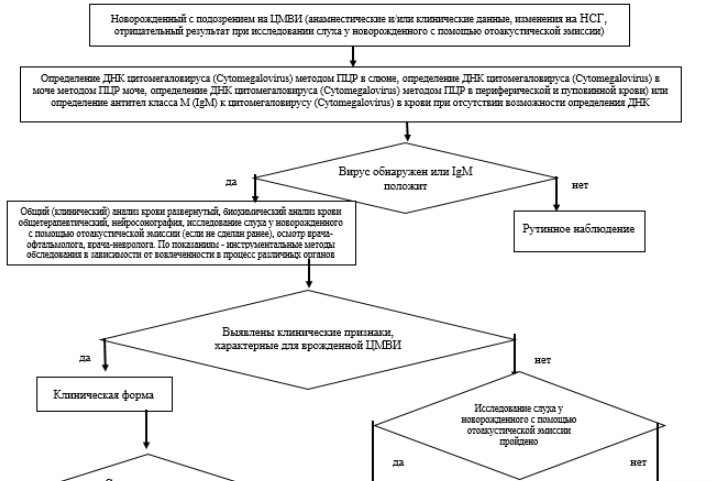
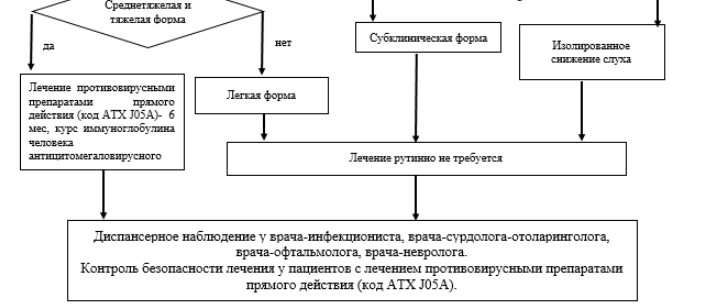
Приложение В. Информация для пациента
Беременным о цитомегаловирусной инфекции.
Цитомегаловирусная инфекция при беременности, последствия которой могут быть необратимыми, — это серьезное заболевание, вызванное цитомегаловирусом (ЦМВ). Как показывают медицинские данные, 65-70% людей имеют у себя в организме данный вирус. Женщины же чаще подвержены этому заболеванию. По этой причине цитомегаловирусная инфекция при беременности — довольно частое явление.
Передается вирус путем тесного контакта с больным человеком, при интимной близости или же путем пренебрежения личной гигиены (использования одного полотенца, зубной щетки, посуды и т.д.). Большой опасностью для заражения является инфицированный ребенок. Дети, инфицированные ЦМВ, могут выделять вирус в течении 5 лет. Поэтому, если в семье заболел хоть один человек, вероятно инфицирование у всех членов семьи.
Размножается вирус во всех тканях организма и может быть обнаружен во всех биологических жидкостях больного: в слюне, моче, сперме, грудном молоке, крови и т.д. Поэтому риск заразиться очень велик при сексуальном контакте, при переливании крови, пересадке органов и тканей, при родах или же при грудном вскармливании.
Возбудителем является цитомегаловирус, который относится к группе герпетических вирусов. Помимо этого, в группу входит вирус простого герпеса, опоясывающий лишай или вирус ветрянки, вирус Эпштейна-Барр. Данный вирус может проникать в ткани нервной системы, поэтому при заражении вероятна опасность поражения нервных клеток.
Симптоматика цитомегаловирусной инфекции может никак не проявляться, но у 10% людей наблюдаются следующие симптомы: тошнота, повышение температуры, головная боль, утомляемость, боли в мыщцах, покашливание, боль в горле, увеличение лимфоузлов, кожные высыпания.
Во время беременности снижается иммунитет, и женщина может быть подвержена инфицированию или обострению уже имеющейся цитомегаловирусной инфекции. Заболевание может протекать как бессимптомно, так и с проявлениями, подобными ОРВ инфекции: небольшими катаральными явлениями, повышением температуры, увеличением лимфоузлов, сухим кашлем. Наибольшей опасностью цитомегаловирусной инфекции во время беременности является заражение плода или новорожденного ребенка.
Внутриутробно при первичном инфицировании заражаются около 45-50% детей. Ребенок может родиться как без каких-либо проявлений болезни, так и с минимальными проявлениями (например, изменения в клиническом анализе крови) или выраженными симптомами врожденной ЦМВ-инфекции, такими как увеличенная печень и селезенка, желтуха, геморрагическая сыпь на коже, кровотечения различной локализации, судороги, дыхательная недостаточность. В анализах крови могут отмечаться изменения, характерные для печеночной, почечной недостаточности, может отмечаться сниженный уровень тромбоцитов и лейкоцитов. Цитомегаловирус может поражать различные органы (легкие, печень, почки, кишечник, глаза, головной мозг), вызывая соответственно пневмонию, гепатит, нефрит, энтерит, хориоретинит, менингоэнцефалит. Одним из тяжелых последствий врожденной цитомегаловирусной инфекции является нейросенсорная тугоухость, вследствие воздействия вируса на центральную нервную систему, которая требует длительного лечения и наблюдения у врача-сурдолога- отоларинголога.
Для снижения риска заражения во время беременности, следует соблюдать меры личной гигиены. Избегать каких-либо контактов с биологическими секретами (мочой, слюной и т.д.), так как вирус в биологической жидкости может быть активен вне организма человека на протяжении нескольких часов. Если первичное инфицирование произошло в I триместре беременности, то риск заражения плода очень велик, в это время может случиться выкидыш или же у ребенка могут развиться различные заболевания. В этом случае проводится перинатальный консилиум, который может посоветовать прерывание беременности. Во II триместре, если произошло заражение матери, необходимо пройти дополнительные обследования, сделать УЗИ плода и проверить амниотическую жидкость. Если ребенок инфицирован, то вероятности, что он родится здоровым, нет никакой. Первичное инфицирование в III триместре не вызывает тяжелые поражения у плода, но стоит провести более тщательное наблюдение и постараться укрепить иммунитет. Беременность может проходить без каких-либо жалоб.
Лечение ЦМВ-инфекции при беременности затруднено, так как все противовирусные препараты прямого действия (код АТХ J05A) (#ацикловир**,#ганцикловир**) имеют противопоказания. Лечением беременной женщины должен заниматься врач-акушер-гинеколог, врач-аллерголог-иммунолог, врач-инфекционист, врач-терапевт.
Для предупреждения передачи ЦМВ плоду врач может назначить препараты иммуноглобулинов (например, иммуноглобулина человека антицитомегаловирусного).
При первичном инфицировании во время беременности или обострении цитомегаловирусной инфекции к лечению нужно подойти со всей ответственностью. Терапия должна проводиться в соответствии со сроком беременности. После 20 недели гестации врач-акушер-гинеколог, совместно с врачом-инфекционистом и врачом-терапевтом могут принять решение о назначении противовирусного препарата прямого действия -#валацикловира (код АТХ J05A).
Лечение, которое начато своевременно и проходит под контролем лечащего врача, дает благоприятные результаты: вероятность того, что ребенок будет инфицирован, сводится к минимуму. Если же ребенок заразился ЦМВ, то следующую беременность стоит планировать только через три года.
Профилактические меры для предотвращения ЦМВИ весьма затруднительны, ввиду того что вирус может подстерегать нас повсюду. Единственный совет, который можно дать женщинам, планирующим беременность — остерегаться беспорядочных сексуальных контактов, соблюдать личную гигиену, тогда вероятность заразиться будет минимальной.
Существует еще один способ, который может защитить беременную женщину - это вакцина, которая на сегодняшний день еще находится в фазе клинических испытаний.
Существуют группы риска беременных женщин, которым необходимо пройти первичное обследование на ЦМВ-инфекцию. К ним относятся:
-
беременные, возрастом младше 25 лет;
-
беременные, перенесшие (особенно, в первой половине беременности) ОРВИ-подобное заболевание с незначительными катаральными проявлениями, в сочетании с увеличением лимфоузлов, увеличением печени и селезенки, обнаружением в крови атипичных лимфоцитов;
-
беременные, работающие в организованных детских коллективах (ясли, детский сад, школа и др.), а также беременные, чьи дети посещают эти коллективы;
-
беременные, у которых на УЗИ плода обнаружены признаки ЦМВИ плода, многоводие, увеличение плаценты.
Вот несколько советов женщинам, которые имеют постоянный контакт с детьми:
1. Тщательно мыть руки с мылом и теплой водой после следующих действий:
замены пеленок/подгузников,
кормления либо купания детей раннего возраста,
ухода за малышом в случае насморка или вытирании слюны,
контакта с детскими игрушками,
поскольку именно дети считаются активными носителями ЦМВ, и вероятность заражения от них очень велика.
2. Следует избегать контакта со слюной ребенка младше 5 лет, когда целуете его.
3. Пусть у вас и детей будет отдельная посуда и столовые приборы.
4. Не употребляйте еду и напитки, предназначенные для детей. Не следует доедать за детьми и пользоваться посудой после детей!
5. Не облизывайте соску-пустышку после ребенка.
6. Не пользуйтесь зубной щеткой, которая ранее использовалась для ухода за полостью рта ребенка.
7. Тщательно обрабатывайте игрушки, поверхности стола и других предметов, которые могут быть контаминированы слюной или мочой ребенка.
8. Работницам детских учреждений, яслей, детских садов желательно во время беременности взять отпуск или же ограничить контакт с детьми.
9. Закаляйтесь, посещайте бассейн, достаточное время находитесь на свежем воздухе (старайтесь укрепить иммунитет, особенно до беременности
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Не применяются.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.