Хронический болевой синдром (ХБС) у взрослых пациентов, нуждающихся в паллиативной медицинской помощи
 Версия: Клинические рекомендации РФ 2023 (Россия)
Версия: Клинические рекомендации РФ 2023 (Россия)
Общая информация
Краткое описание
- Ассоциация профессиональных участников хосписной помощи
- Некоммерческое партнёрство "Ассоциация Междисциплинарной Медицины"
- Межрегиональная общественная организация "Общество специалистов доказательной медицины"
- Общероссийская общественная организация "Российское научное медицинское общество терапевтов"
Одобрено Научно-практическим Советом Минздрава РФ
В соответствии с Правилами поэтапного перехода медицинских организаций к оказанию медицинской помощи на основе клинических рекомендаций, разработанных и утвержденных в соответствии с частями 3, 4, 6 –9 и 11 статьи 37 Федерального закона «Об основах охраны здоровья граждан в Российской Федерации», утвержденных постановлением Правительства Российской Федерации от 19.11.2021 № 1968, клинические рекомендации применяются следующим образом:
– размещенные в Рубрикаторе после 1 июня 2022 года – с 1 января 2024 года.
Клинические рекомендации
Хронический болевой синдром (ХБС) у взрослых пациентов, нуждающихся в паллиативной медицинской помощи
Год утверждения: 2023
Пересмотр не позднее: 2025
Дата размещения: 15.02.2023
Статус: Действует
ID: 400
Применение отложено
Боль, не классифицированная в других рубриках (R52):
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
Наиболее часто используемые классификации боли:
Этиология и патогенез
Основной причиной возникновения хронического болевого синдрома является длительно существующая постоянная боль, которая вызывает дисбаланс в работе периферической и центральной нервной системы. Нейрональные рецепторы и волокна в этом случае подвергаются постоянной активизации, что приводит к возрастающей стимуляции центральной нервной системы (спинного и головного мозга) болевыми раздражителями. Одна из основных причин хронической боли – появление комплексов гиперреактивных нейронов на различных уровнях ЦНС. Их патологическая активность обусловлена поломкой механизмов нейронального торможения, повышенной возбудимостью нейронов и активацией неактивных синапсов, что объединяет эти нейроны в единый очаг возбуждения с самоподдерживающейся эктопической активностью. Эта активность приводит к функциональным, структурным и адаптивным (нейропластическим) изменениям в головном и спинном мозге, из-за чего боль продолжается, даже когда ее причина устранена [4, 5].
Боль, вызванная злокачественным опухолевым процессом, имеет свою специфику. Опухолевые клетки быстро растут, сдавливая прилежащие здоровые ткани, которые чувствительны к механическим воздействиям (висцеральные боли), либо прорастают или сдавливают периферические и центральные структуры нервной системы (например, нейропатические боли). В процессе развития и роста опухоль выделяет специфические алгогены: эндотелин, простагландины и фактор некроза опухолей-альфа (TNF-α), которые возбуждают или повышают восприимчивость периферических рецепторов и нервных волокон к сенсорным раздражителям. Опухоли выделяют ионы водорода Н+, что приводит к местному ацидозу, сопровождающемуся сходным эффектом. Протеолитические ферменты, вырабатываемые опухолевыми клетками, постоянно возбуждают и дестабилизируют сенсорную симпатическую иннервацию, что приводит к нейропатической боли. Боль, вызванная метастазами опухоли, возникает в результате прямого опухолевого повреждения С-афферентов сенсорных нейронов, иннервирующих костный мозг, а также из-за нарушения баланса между активностью остеокластов и остеобластов. Кости теряют прочность, подвержены остеолизу, патологическим переломам и микропереломам, в результате механическая деформация периоста становится основным источником боли [6].
Ноцицептивная висцеральная боль возникает при повреждении симпатически иннервируемых органов (при поражении поджелудочной железы, стенок желудка и кишечника, растяжении капсулы печени и пр.). Эта боль плохо локализована, имеет разлитой характер (тупая с приступами обострения, сжимающая, схваткообразная, тянущая, изнуряющая и пр.) [7].
Нейропатическая боль является результатом повреждения нервной системы на периферическом или центральном уровне, или патологического процесса в соматосенсорной системе. Зачастую она сопровождает тяжелые ноцицептивные болевые синдромы, но иногда встречается, как самостоятельный вид боли, например, после хирургического лечения, или при проведении химиотерапии, а также в результате сдавления нерва опухолью, при вирусном повреждении нерва, при тяжелых формах диабета [6, 7].
Ноципластическая (дисфункциональная) боль – боль, возникающая при отсутствии активации ноцицепторов и видимого органического повреждения, в том числе со стороны нервной системы. Главное отличие дисфункционального типа боли от ноцицептивной и нейропатической в том, что при традиционном обследовании не удается выявить причину боли или органические заболевания, которые могли бы объяснить ее происхождение. К типичным примерам такой боли относятся фибромиалгия, головная боль напряжения и психогенные боли (соматоформное болевое расстройство) [10].
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
2) заболевания, опасные для жизни (могут провоцировать одновременно острую и хроническую боль, например, злокачественные новообразования, ВИЧ/СПИД).
Онкологические пациенты составляют около 1/3 от всего контингента взрослых паллиативных пациентов [56]. При этом боль является одним из основных симптомов, причиняющих страдания при ЗНО. Несмотря на выдающиеся успехи, достигнутые в диагностике и терапии опухолей, по прогнозам экспертов ВОЗ в ближайшем будущем заболеваемость и смертность от онкологических заболеваний будет увеличиваться, соответственно будет расти число пациентов с болевым синдромом, обусловленным опухолевым процессом.
В России на учете состоит около 4 млн пациентов (в 2020 году - 3 973 295 человек) с установленным диагнозом ЗНО, из них ежегодно умирает около 300 тыс. и выявляется более 560 тыс. новых случаев заболевания [57]. На начальных стадиях опухолевого процесса 35–50% больных жалуются на боль, при прогрессировании ЗНО их число увеличивается до 75%, а в терминальной стадии – до 95–100%. Таким образом, число онкологических больных, нуждающихся в обезболивающей терапии, значительно превышает число умерших от ЗНО и только в нашей стране составляет более 430 тыс. пациентов [7].
Клиническая картина
Cимптомы, течение
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний), медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза хронического болевого синдрома
- Рекомендуется для оценки интенсивности боли и эффективности лечения при каждом посещении или осмотре больного применять специальные шкалы, регистрировать локализацию болевых ощущений, время появления боли, характер и тип боли, длительность болевого синдрома (при движении и в покое) [2, 10, 12, 69, 113].
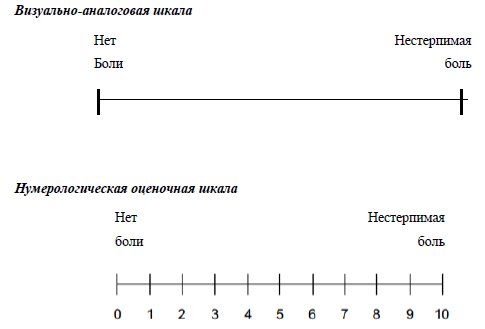
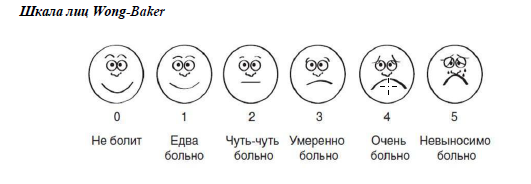
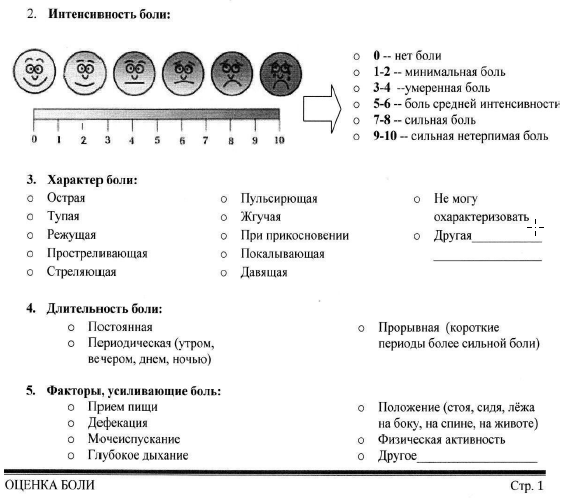
Интенсивность боли оценивается по различным шкалам, наиболее часто используемые из них: нумерологическая оценочная шкала (НОШ, синоним: числовая рейтинговая шкала), имеющая цифровую градуировку, соответствующую баллам от 0 до 10, и визуально-аналоговая шкала (ВАШ), представляющая собой отрезок 10 см без градуировки и отражающая силу боли в миллиметрах от 0 до 100 мм (рис. 1, см. Приложение Г1. Визуальная аналоговая шкала, Приложение Г2. Нумерологическая оценочная шкала (числовая рейтинговая шкала и Приложение Г3. Шкала лиц Wong-Baker). Больному предлагается отметить свое восприятие боли за последние 24 часа на шкале (от минимальной до нестерпимой), что позволяет количественно выразить оценку в миллиметрах по ВАШ или в баллах по НОШ [14].
Уменьшение интенсивности боли по НОШ на 2 балла или 30% считается клинически значимым, изменения больше, чем на 3 балла по НОШ или на 50% по ВАШ – существенными; результаты лечения интерпретируют в зависимости от природы болевого синдрома, но обычно изменение более 20 мм считают существенным [58].
Оценка боли у лиц с когнитивными нарушениями основана на схожих принципах оценки боли у детей. Основой являются поведенческие реакции и возможность отвлечь или утешить, причем степень выраженности проявлений оценивается в динамике. Крайне важным является холистический (целостный) подход к купированию целого ряда симптомов, которые могут быть связаны между собой или выражаться в различных формах (например, когда боль проявляется в виде ажитации). В связи с этим, все изменения в поведении пациента следует расценивать как возможное проявление боли при спутанности сознания:
Для определения причины дискомфорта (например, боль, ощущение холода) при тяжелой форме когнитивных расстройств необходимо учитывать мнение нескольких лиц, осуществляющих уход за пациентом.
Для скрининга и мониторинга состояния пациентов с умеренной и тяжелой формами когнитивных расстройств, в литературе описаны различные инструменты оценки боли у пациентов с когнитивными нарушениями, но до настоящего времени они не прошли языковую адаптацию и валидацию в РФ.
Для выявления нейропатической боли следует использовать скрининговый опросник (см. Приложение Г4. Диагностический опросник нейропатической боли DN4) [59, 60], предназначенный для врачей лечебных специальностей, не являющихся неврологами. Опросник дает возможность выявить наличие нейропатической боли с достоверностью более 80%. Наличие нейропатической боли у пациента высоко вероятно, если сумма баллов по опроснику DN4 составляет ≥4.
- Не рекомендуется для выбора и проведения обезболивающей терапии у пациентов, получающих паллиативную медицинскую помощь, использовать инструментальные методы обследования, поскольку они не подтверждают и не опровергают наличие боли [61,62,63].
Иные диагностические исследования
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
1. Консервативная терапия
Таким образом, выбор терапии хронического болевого синдрома должен определяться интенсивностью и патогенетической характеристикой боли. Терапия опиоидами остается основным методом лечения боли при оказании паллиативной медицинской помощи онкологическим и неонкологическим больным.

Рисунок 2 – «Лестница обезболивания» Всемирной организации здравоохранения [68].
- Рекомендуется использовать в качестве стартовой терапии хронической боли парацетамол**, НПВП, опиоид, как по-отдельности, так и в комбинации, в зависимости от клинической оценки и интенсивности болевого синдрома, с целью достижения быстрого, эффективного и безопасного обезболивания [69,70].
- Рекомендуется использовать для поддерживающей терапии хронической боли любой опиоид в корректной дозе (в виде монотерапии или в комбинации с парацетамолом** / НПВП), на основании клинической оценки и интенсивности болевого синдрома, с целью достижения устойчивого, эффективного и безопасного обезболивания [69,70].
- Рекомендуется обезболивающий препарат вводить неинвазивно, следует ограничить использование инъекций [15, 17, 18, 19].
- Рекомендуется обезболивающий препарат вводить регулярно через определенные интервалы времени с учетом периода полувыведения или «по часам» [15, 18, 20].
- Рекомендуется применять обезболивающий препарат, увеличивая дозировку «по восходящей» [15, 18, 20].
- Рекомендуется обезболивающий препарат применять «индивидуально» – с учетом индивидуальных реакций организма конкретного пациента и с учетом особенностей его физического состояния [15, 18, 20].
Комментарии: эффективное обезболивание достигается путем подбора анальгетика и его адекватной дозы (титрование дозы препарата), обеспечивающей обезболивание до приема следующей дозы. Не существует единой дозы и комбинации лекарственных препаратов универсальных для всех. Кроме того, ранее эффективные доза и/или препарат/ы у одного и того же больного в определенный момент могут стать неэффективны из-за прогрессирования основного заболевания, нарушения всасывания, развития толерантности (при использовании опиоидов) и др. причин, что является основанием для пересмотра и коррекции схемы обезболивания.
- Рекомендуется обезболивающий препарат применять «с вниманием к деталям» [15, 18, 20].
- Рекомендуется для фармакотерапии боли слабой интенсивности использовать неопиоидные анальгетики / НПВП, при необходимости дополнительно назначать адъювантные анальгетики [21, 22, 71,72,73,74].
Эффективность неопиоидного анальгетика центрального действия нефопама, выпускаемого только в форме раствора для инфузий и внутримышечного введения, оценивалась у пациентов с хроническим болевым синдромом лишь в отдельных исследованиях. По всей видимости, его собственная анальгетическая активность в рекомендуемом диапазоне суточных доз не имеет клинического значения, тем не менее, на фоне его применения отмечена тенденция к уменьшению потребности в опиоидах (опиоид-сберегающий эффект) [75]. Кроме того, согласно инструкции по применению, нефопам показан к применению при остром болевом синдроме.
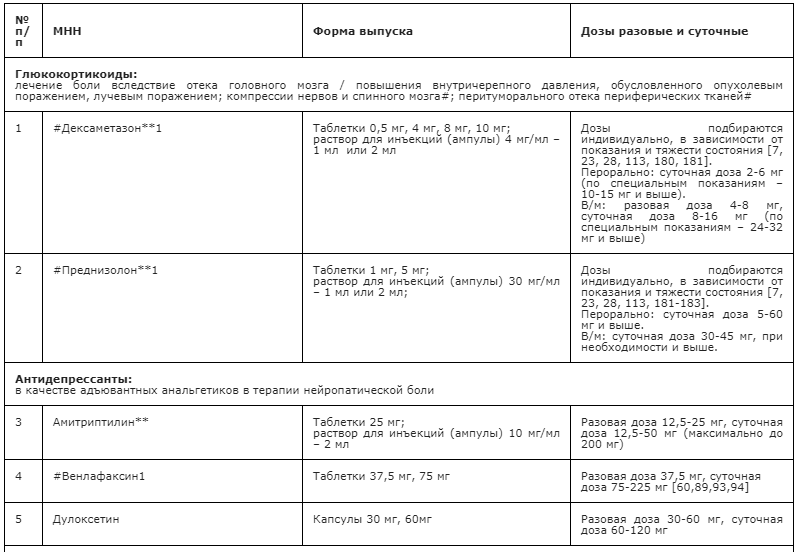
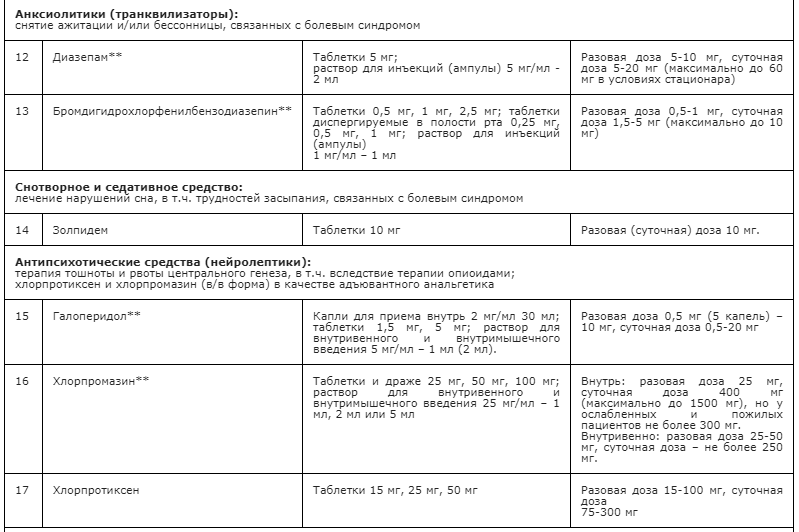
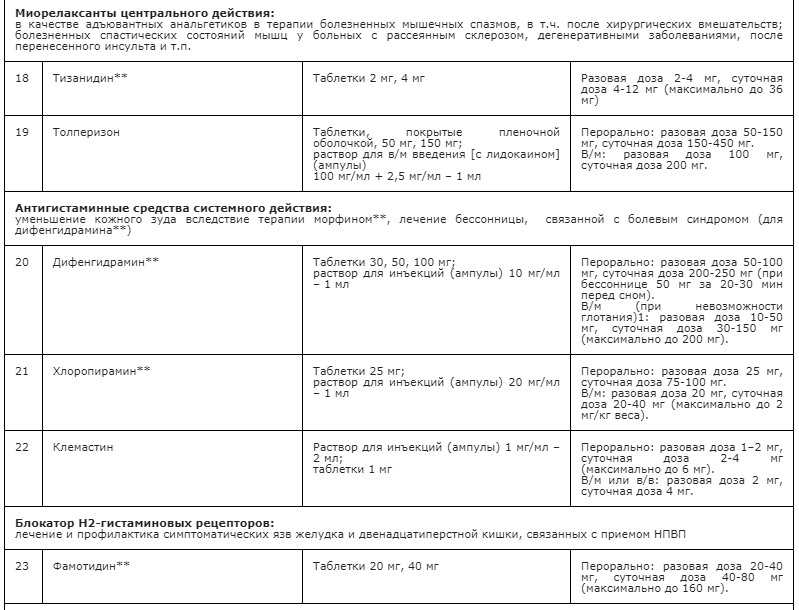
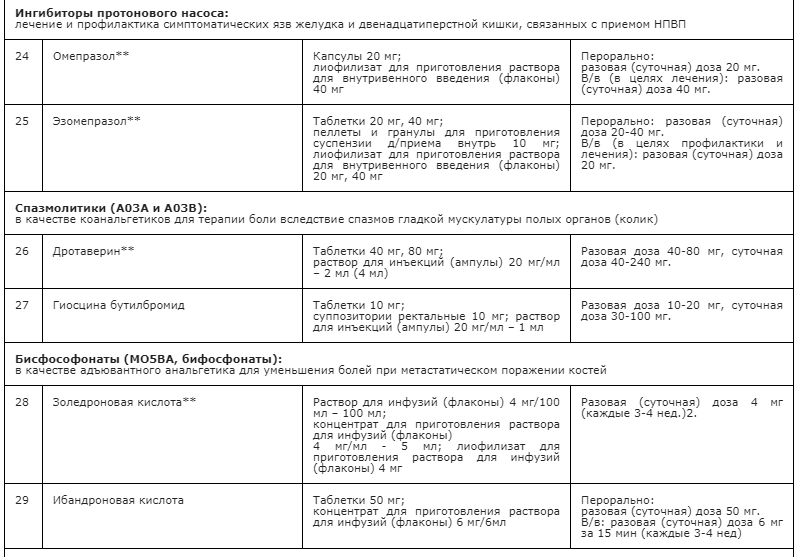
Применение неопиоидных анальгетиков/НПВП при необходимости сопровождается адъювантной и симптоматической терапией: противоэпилептическими средствами, антидепрессантами, спазмолитиками (A03A и A03B), миорелаксантами центрального действия, анксиолитиками, снотворными и седативными средствами (в т.ч. бензодиазепиноподобными средствами), глюкокортикостероидами, бисфосфонатами (МО5ВА, бифосфонаты) и др. препаратами [23] (см. Приложение А3. Адъювантные анальгетики и средства для симптоматической терапии). Цель применения таких препаратов – повысить эффективность обезболивающей терапии с учетом специфики патогенеза болевого синдрома у пациента, избегая при этом эскалации дозы основного анальгетика или перехода на более сильный препарат, тем более, неоправданного. В частности, антидепрессанты и противоэпилептические средства рекомендованы в качестве средств первой линии терапии нейропатической боли [60, 94] (см. раздел 3.1.9). Анксиолитики необходимы для снятия ажитации, связанной с болевым синдромом; седативные и снотворные препараты - для лечения нарушений сна, в т.ч. расстройств засыпания, связанных с болевым синдромом [148, 149]. Спазмолитики (A03A и A03B) потенцируют эффект анальгетиков при спастических болях и коликах; миорелаксанты центрального действия - для терапии болезненных спазмов скелетной мускулатуры (крампи); глюкокортикоиды эффективны при компрессии нервов и спинного мозга, а также в случаях выраженного перитуморального отека при прогрессирующих злокачественных новообразованиях [113, 147]. Бисфосфонаты рекомендуется использовать для уменьшения боли, связанной с метастатическим поражением костей, если исчерпаны стандартные методы терапии [156].
• Рекомендуется учитывать специфические нежелательные эффекты НПВП и оценивать факторы риска развития осложнений терапии у конкретного пациента [76,77,78].
Таблица 1 – Опиоиды для терапии умеренной боли при оказании паллиативной медицинской помощи в Российской Федерации
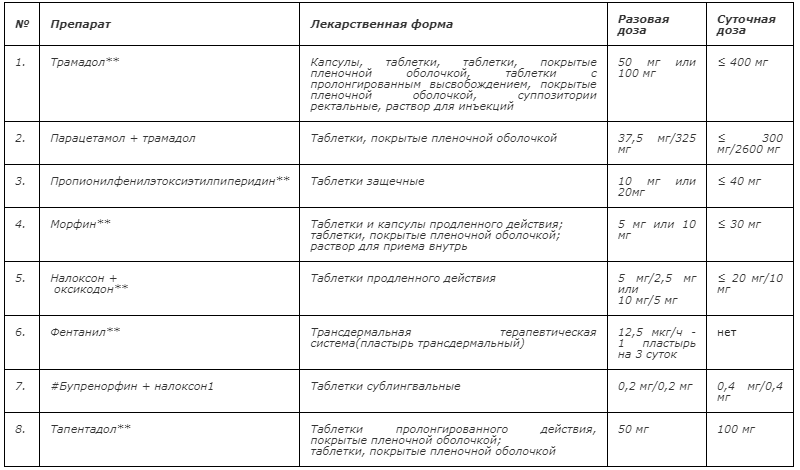
1 #Бупренорфин + налоксон применяется при Z51.5 [7, 171, 174, 179].
В качестве адъювантных анальгетиков могут дополнительно применяться неопиоидные анальгетики / НПВП, противоэпилептические средства, антидепрессанты, анксиолитики, снотворные и седативные средства (в т.ч. бензодиазепиноподобные средства), антигистаминные средства системного действия, глюкокортикоиды, спазмолитики (A03A и A03B), миорелаксанты, бисфосфонаты (МО5ВА, бифосфонаты) и пр. (см выше раздел 3.1.2.). Дополнительно целесообразно назначить терапию, уменьшающую побочные эффекты применяемых препаратов: ингибиторы протонового насоса, слабительные средства, противорвотные препараты, блокаторы H2-гистаминовых рецепторов и др. (см. Приложение А3. Адъювантные анальгетики и средства для симптоматической терапии).
- Рекомендуется для фармакотерапии боли умеренной интенсивности использовать слабые опиоиды (трамадол**), при необходимости дополнительно назначать неопиоидные и адъювантные анальгетики [13, 22].
- Рекомендуется при умеренно выраженной боли в качестве альтернативы трамадолу, применять препараты сильных опиоидов в низких дозах (морфин**, налоксон+оксикодон**, фентанил**, бупренорфин**, тапентадол**) [15,17].
- Рекомендуется для терапии умеренной боли применять лекарственный препарат пропионилфенилэтоксиэтилпиперидин** в защечных таблетках 20-40 мг/сут [24, 25, 26].
- Рекомендуется в качестве альтернативы пероральным опиоидам, применять трансдермальную форму фентанила** [15, 31, 32].
- Рекомендуется в случае невозможности применения пероральных форм препаратов и использования ТТС назначать парентеральное введение морфина** [15, 22, 33].
- Рекомендуется для фармакотерапии сильной боли использовать сильные опиоиды, при необходимости дополнительно назначать неопиоидные анальгетики / НПВП и адъювантные анальгетики (Таблица 2 и см. Приложение А3. Адъювантные анальгетики и средства для симптоматической терапии). [15, 23, 84].
Таблица 2 – Опиоидные анальгетики в неинвазивных лекарственных формах для терапии сильной боли при оказании паллиативной медицинской помощи в Российской Федерации
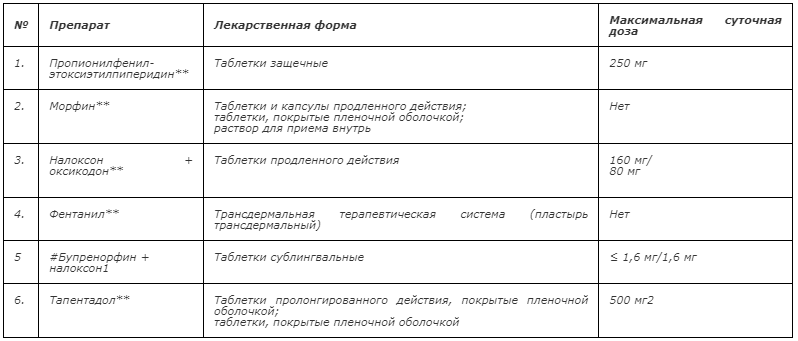
Комментарии: к сильным опиоидам, зарегистрированным в РФ для терапии хронического болевого синдрома, относятся морфин**, налоксон +оксикодон** , фентанил**, бупренорфин** и тапентадол** и пропионилфенилэтоксиэтилпиперидин** (см. Приложение А3. Перечень зарегистрированных препаратов опиоидов в инъекционных лекарственных формах, Перечень зарегистрированных препаратов опиоидов в неинвазивных лекарственных формах, Краткая характеристика препаратов опиоидов в неинвазивных лекарственных формах). Пролонгированными формами сильных опиоидов являются: морфин** в капсулах и в таблетках, комбинированный препарат налоксон + оксикодон** в таблетках, тапентадол** в таблетках, ТТС фентанила** (Таблица 2).
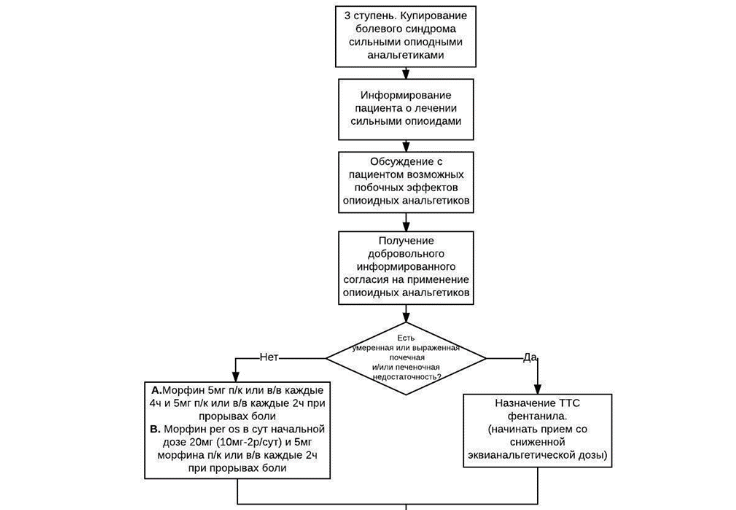
У пациентов, без нарушения функции глотания и явлений умеренной и выраженной почечной и печеночной недостаточности, с учетом его пожелания, терапию сильной боли начинают с таблетированных форм лекарственных препаратов (морфин**, налоксон +оксикодон**, тапентадол**) [15, 50] (см. Приложение А3. Определение степени печеночной недостаточности и Определение степени нарушения почечной функции). У пациентов с нарушением глотания можно использовать раствор морфина для перорального приема, а также содержимое капсул морфина пролонгированного действия, где морфин представлен в виде микрогранул с замедленным высвобождением, в т.ч. через назогастральный зонд или гастростому. В случае если по объективным причинам прием пероральных форм невозможен, включая случаи отказа пациента от приема лекарств через рот, наличия тошноты или рвоты, непереносимости препаратов морфина или налоксон +оксикодон**, или тапентадола**, терапию начинают с ТТС фентанила**. Имеющиеся данные свидетельствуют об отсутствии значимых различий в анальгетической эффективности между сильными опиоидами, назначаемыми перорально, – морфином** и препаратом налоксон+оксикодон**, и позволяют дать лишь частично обоснованные рекомендации по использованию любого из этих двух препаратов в качестве препарата выбора.
- Рекомендуется использовать трансдермальные опиоиды, как альтернативу пероральным препаратам при нарушении функции глотания, тошноте и рвоте, почечной и печеночной недостаточности, отказе пациента от пероральных форм, в случае наличия у пациента сильной боли постоянного характера, когда произведен подбор адекватной обезболивающей суточной дозы опиоидами короткого действия [15].
- Рекомендуется с осторожностью применять опиоиды у пациентов с печеночной и почечной недостаточностью [15, 29, 34, 35].
- Рекомендуется назначать морфин** парентерально пациентам, которым невозможно по различным причинам обеспечить адекватное обезболивание неинвазивными опиоидами [14, 15, 22, 30].
- Не рекомендуется использовать тримеперидин** (таблетки, раствор для инъекций) для длительной терапии боли [37].
- Рекомендуется при подборе необходимой дозы базового обезболивания с применением препаратов в пролонгированных формах проводить ее титрование препаратами короткого действия [15, 28, 36].
Почечная недостаточность может привести к накоплению активных метаболитов морфина**, поэтому при ее наличии, следует избегать его назначения и использовать иные опиоиды (например, бупренорфин** или фентанил**). Однако, в отдельных случаях, при наличии легкой или средней степени нарушения функции почек, возможно применение препаратов морфина** в меньших дозах, увеличивая интервалы между приемами (до 6-8 ч.), или применяя последующие дозы только в случае необходимости [52].
Для титрования дозы тапентадола** можно использовать его лекарственную форму с немедленным высвобождением – таблетки, покрытые пленочной оболочкой по 50 мг каждые 4-6 часов; причем при отсутствии эффекта, вторая доза препарата может быть принята через 1 ч после приема начальной дозы.
Для титрования дозы препарата налоксон + оксикодон** используются таблетки пролонгированного действия в дозировке 5 мг/2,5 мг каждые 12 ч; такая схема может быть затруднительна в случае усиления боли в течение интервала дозирования, для купирования которой потребуется применение быстродействующего сильного опиоида (например, морфина**).
- Рекомендуется при переходе с одного опиоида на другой, осуществляемом из-за недостаточного обезболивания и/или трудно контролируемых побочных эффектов или иным причинам, использовать начальную дозировку нового препарата ниже, чем дозировку, рассчитанную по таблицам соответствия доз опиоидов по анальгезирующему эффекту (см. Приложение А3. Таблица пересчета эквипотенциальных доз опиоидов) [130, 131].
- Не рекомендуется чередование опиоидов без необходимости [15, 35].
- Рекомендуется для экстренной терапии приступа сильной боли, возникающей на фоне адекватно контролируемой фоновой персистирующей боли (при «прорыве» боли) использовать опиоид в лекарственной форме с немедленным высвобождением («препарат спасения») [13, 15, 21, 27, 38, 85, 86, 87, 88].
- Рекомендуется использовать пероральные опиоиды с немедленным высвобождением для предупреждения эпизодов предсказуемой прорывной боли, принимая препарат за 20-30 мин до известного провоцирующего воздействия, а также для купирования эпизода прорывной боли с медленным началом развития [27, 41, 86].
- Рекомендуется использовать парентеральные опиоиды и трансмукозальные формы фентанила для купирования эпизодов непредсказуемой прорывной боли и эпизодов прорывной боли с быстрым началом развития [85-88].
Препараты опиоидов для лечения прорывной боли на фоне терапии фоновой персистирующей боли пролонгированными формами сильных опиоидов (ТТС фентанила**, морфин**, налоксон+оксикодон**, тапентадол** в таблетках или капсулах):
Б. терапия непредсказуемой боли и боли с быстрым началом развития:
- Рекомендуется дополнительно к опиоидам для профилактики и терапии запора назначать слабительные средства, как сопроводительную терапию [22, 31, 132-137] (см. Приложение А3. Адъювантные анальгетики и средства для симптоматической терапии).
- Рекомендуется применять дофаминергические препараты, например, метоклопрамид** (A03FA стимуляторы моторики желудочно-кишечного тракта), галоперидол** (N05AD производные бутирофенона) для лечения тошноты и рвоты, связанных с приемом опиоидов [22, 34, 47, 138-141] (см. Приложение А3. Адъювантные анальгетики и средства для симптоматической терапии и Препараты для лечения тошноты и рвоты при применении опиоидов).
- Рекомендуется пациентам с умеренными или тяжелыми явлениями со стороны ЦНС (когнитивные расстройства, сонливость), вызванными применением опиоидов, снижать их дозировки, если болевой синдром контролируется достаточно, или менять (ротировать) опиоиды, если болевой синдром не контролируется [40, 44].
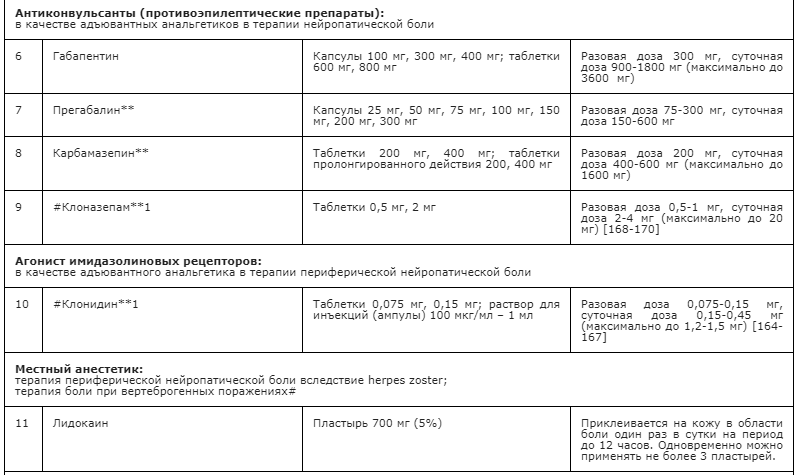
- Рекомендуется в качестве первой линии терапии НБ использовать противоэпилептические препараты (габапентин, прегабалин**, карбамазепин**), антидепрессанты – неселективные ингибиторы обратного захвата моноаминов (в частности, амитриптилин**) или селективные ингибиторы обратного захвата серотонина и норадреналина (ИОЗСН, N06AX другие антидепрессанты, в частности, дулоксетин и #венлафаксин (при Z51.5) [60, 90, 94, 175, 176, 177].
- Рекомендуется в качестве второй линии терапии НБ использовать опиоиды (трамадол**, тапентадол**, налоксон+оксикодон, морфин**) [60, 178].
- Рекомендуется в качестве третьей линии терапии НБ использовать препараты для местного применения (пластырь с 5% лидокаином - при НБ после herpes zoster и других причинах периферической НБ при Z51.5, #ботулинический токсин типа А (в виде подкожных инъекций) при Z51.5 [60].
- Дополнительно в терапии нейропатической боли при Z51.5 используются другие адъювантные средства, в частности #клонидин, #клоназепам [164-170].
Наиболее характерные побочные эффекты габапентиноидов: сонливость, головокружение, слабость, атаксия, утомляемость. Эти явления не опасны для жизни, но требуют осторожности при подборе дозы у ослабленных пациентов, и у больных получающих опиоиды.
Неселективные ингибиторы обратного захвата моноаминов (амитриптилин**) имеют анальгетический механизм, опосредованный ингибированием обратного захвата серотонина и норадреналина в нейрональных синапсах, а также восстановлением нисходящих антиноцицептивных нейрональных потоков. ТЦА широко применяются у больных с НБ, вызванной различными причинами: при диабетической химио-индуцированной полиневропатии, при герпетической и тригеминальной невралгии, при фантомных болях, при НБ у онкологических больных [60,89,92].
При этом следует учитывать, что амитриптилин** подвергается биотрансформации в печени образованием активных метаболитов, которые выводятся длительно почками, выделительная функция которых у паллиативных больных нередко нарушена. Нежелательные реакции препарата связаны с блокадой М-холинорецепторов: сухость во рту, задержка мочеиспускания и кишечной перистальтики, повышенное потоотделение, что снижает качество жизни пациентов. Следует учитывать, что амитриптилин** кардиотоксичен, противопоказан при глаукоме, гиперплазии предстательной железы, пилоростенозе и др. поэтому доза амитриптилина** у паллиативных больных обычно не превышает 50 мг в сутки.
Селективные ингибиторы обратного захвата серотонина и норадреналина (N06AX другие антидепрессанты) дулоксетин и #венлафаксин имеют механизм действия, подобный неселективным ингибиторам обратного захвата моноаминов, но, в отличие от последних, не имеют выраженного сродства к гистаминовым, мускариновым и альфа-адренорецепторам, что обеспечивает их лучшую переносимость. Наиболее исследованы в отношении влияния на НБ дулоксетин и #венлафаксин. Дулоксетин исследован при болевой диабетической полинейропатии, центральной постинсультной боли и НБ вследствие повреждения спинного мозга, #венлфаксин (при Z51.5) – только при лечении диабетической полинейропатии и периферической нейропатии [60,89,93,94]. В РФ дулоксетин зарегистрирован для лечения болевой диабетической полиневропатии, а #венлафаксин – только для лечения депрессии. Дулоксетин применяется в разовых дозах 30-60 мг, суточная составляет 60-120 мг. Особенности: с осторожностью назначается пациентам с кардиальной патологией, стенокардией, глаукомой, почечной недостаточностью. Элиминация: подвергается метаболизму в печени с образованием неактивных метаболитов, которые выводится почками. Предостережения: при первых днях приема возможны тошнота, рвота, головокружение, астения, бессонница, повышенная возбудимость, повышение АД, гиперемия кожи. #Венлафаксин применяется для лечения НБ (при Z51.5) в разовой дозе 37,5-70 мг, суточная доза достигает 70-225 мг [60,89,93,94]. Особенности: с осторожностью назначается пациентам с кардиальной патологией, стенокардией, глаукомой, почечной недостаточностью. Элиминация: подвергается метаболизму в печени с образованием активных метаболитов, которые выводятся почками (87%). При применении возможны: головокружение, астения, слабость, бессонница, повышенная нервная возбудимость, повышение АД, гиперемия кожи.
Препараты второй линии – опиоиды – рассмотрены в предыдущих разделах клинических рекомендаций. В отдельных исследованиях показано, что опиоид тапентадол обладает собственным антинейропатическим действием за счет механизма действия, который опосредован не только воздействием на опиоидные рецепторы, но и ингибицией обратного захвата норадреналина в нейрональных структурах [96,97].
Препараты третьей линии. Местный анестетик лидокаин в форме 5% пластыря назначается при локальных невропатиях с преобладанием болевых расстройств кожной чувствительности (зонах аллодинии, гипералгезии, патологического зуда и др.). Доза: от 1 до 3 пластырей, на 12 ч с последующим перерывом на 12 ч. Особенности: не токсичен, не имеет лекарственных взаимодействий, поскольку лидокаин не попадает в системный кровоток. В РФ зарегистрирован для лечения постгерпетической невралгии. В ряде исследований показана эффективность местного применения 5% лидокаина также по той же схеме при болевой диабетической полиневропатии [89,100,105] и вертеброгенных болях [160-163]. Предостережения: не следует проводить аппликацию пластыря на поврежденную поверхность кожи.
#Ботулинический токсин типа А по данным ряда исследований показал эффективность при повторных (с интервалом 12 недель) подкожных инъекциях в дозе 50-200 ЕД при диабетической, постгерпетической и тригеминальной невралгиях [89, 103]. В России препарат не зарегистрирован для лечения НБ ни при одном из заболеваний/состояний её вызывающих. Использование для лечения периферической НБ возможно при Z51.5 при наличии опыта применения.
Дополнительные адъювантные средства, которые могут быть рассмотрены в случае неэффективности основных препаратов для лечения НБ у пациентов, получающих паллиативную медицинскую помощь (Z51.5): #клонидин, #клоназепам. #Клонидин может быть эффективен периферической нейропатической боли [164-167]. В качестве адъюванта #клонидин применяется интратекально и периневрально в дозах 50-150 мкг в комбинации с местными анестетиками или перорально 0,15 мг до 3 р/сут. #Клонидин возбуждает центральные альфа2-адренорецепторы, за счет чего снижается тонус сосудодвигательного центра продолговатого мозга (гипотензивный эффект), а также пресинаптические альфа2-адренорецепторы, за счет чего уменьшается высвобождение катехоламинов из симпатических терминалей и ослабляется симпатический компонент боли (нейропатической и висцеральной). Необходимо учитывать риск седации, гипотензии и ортостатических реакций. #Клоназепам может быть эффективен при нейропатической раковой боли, фантомных болях [168-170]. Титрование дозы #клоназепама начинается с 0,5 мг перорально (предпочтительно на ночь в виду седативного эффекта) с последующим увеличением дозы на 0,5 мг ежедневно с учетом переносимости в среднем до суммарной 2-4 мг в сутки. Действие #клоназепама как адъювантного анальгетика связано с ГАМК-опосредованным ингибированием эктопической активности периферических нервов после повреждения [170].
- Не рекомендуется снижать подобранную дозу опиоида из-за пониженного уровня артериального давления или спутанности сознания (если они не являются следствием применения неверно подобранной дозы препарата) [142, 143].
- Рекомендуется сохранять прием опиоидов даже при отсутствии сознания, применяя титрование дозы до эффективной [33, 43, 45].
- Рекомендуется отменять опиоиды путем постепенного снижения дозы препарата [40, 44].
- Рекомендуется оценивать уровень и динамику других тягостных симптомов, которые могут усиливать страдания пациента [40, 44].
- Рекомендуется при рефрактерности болевого синдрома решить вопрос возможной медикаментозной седации [144-146].
Физическая активность. Активность и подвижность (стимуляция, смена деятельности, улучшение кровоснабжения) положительно воздействуют на способность организма самостоятельно подавлять боль [123]. Помимо этого, повышается эластичность и расширяются функциональные возможности тканей, в частности, тканей мышц или межпозвоночных дисков.
Расслабление. Техники релаксации крайне важны для расслабления напряженных мышц и снижения уровня общего физического напряжения. Чтение, музыка, встречи с друзьями, медитация, танцы и прогулки – примеры эффективных способов расслабиться. Специальные техники релаксации, например, прогрессивное мышечное расслабление или аутотренинг, также эффективны [124].
Психотерапия. Психологическая терапия боли предполагает более эффективное, чем раньше, использование своих ресурсов для преодоления боли. В рамках терапии изучаются стратегии снижения боли. Кроме того, терапия включает в себя обучение тому, как изменить поведение и образ мыслей, которые способствуют развитию боли. Психотерапия способствует тому, что боль занимает все меньше места в повседневной жизни пациента, а на первый план выходят другие, более важные сферы жизни [47, 54]. Сочетание физической активности, психотерапевтического и медикаментозного лечения называется «мультимодальной терапией» и, как правило, применяется при междисциплинарном подходе [125,126].
Медицинская реабилитация
Госпитализация
В рамках оказания паллиативной первичной доврачебной и врачебной медицинской помощи лечение хронического болевого синдрома, в том числе с назначением лекарственных препаратов, содержащих наркотические средства и психотропные вещества списков II и III Перечня, осуществляется фельдшерами, при условии возложения на них функций лечащего врача и иными медицинскими работниками со средним медицинским образованием фельдшерских здравпунктов, фельдшерско-акушерских пунктов, врачебных амбулаторий, иных медицинских организаций (их структурных подразделений), оказывающих первичную доврачебную медико-санитарную помощь, врачами-терапевтами, врачами терапевтами-участковыми, врачами общей практики (семейными врачами), врачами-специалистами медицинских организаций, оказывающих первичную медико-санитарную помощь, первичную специализированную медицинскую помощь [127].
При оказании первичной доврачебной и врачебной паллиативной медицинской помощи и паллиативной специализированной медицинской помощи в амбулаторных условиях назначение лекарственных препаратов, в том числе содержащих наркотические средства и психотропные вещества списков II и III Перечня, осуществляется медицинским работником самостоятельно, исходя из тяжести и характера заболевания пациента. Сведения о назначенном лекарственном препарате (наименование лекарственного препарата, дозировка, способ введения и применения, режим дозирования, продолжительность лечения и обоснование назначения лекарственного препарата) вносятся медицинским работником в медицинскую документацию пациента. Медицинский работник оформляет назначение лекарственных препаратов, в том числе содержащих наркотические средства и психотропные вещества списков II и III Перечня, на рецептурном бланке, оформленном на бумажном носителе за своей подписью, и (или) с согласия пациента или его законного представителя на рецептурном бланке в форме электронного документа с использованием усиленной квалифицированной электронной подписи медицинского работника [128].
Пациентам с хроническим болевым синдромом любого генеза повторное назначение лекарственных препаратов, содержащих наркотические средства и психотропные вещества списков II и III Перечня, производится медицинским работником самостоятельно [128].
Количество назначенных лекарственных препаратов, включенных в перечень препаратов, подлежащих предметно-количественному учету, при оказании пациентам паллиативной медицинской помощи, может быть увеличено с учетом клинических рекомендаций не более чем в 2 раза по сравнению с количеством наркотических средств или психотропных веществ, которое может быть выписано в одном рецепте [128].
В случаях необходимости оформления рецепта на наркотический (психотропный) лекарственный препарат на дому в рамках оказания паллиативной медицинской помощи допускается предварительное заверение рецепта штампом медицинской организации, печатью медицинской организации либо структурного подразделения медицинской организации "Для рецептов", которая проставляется лицом, уполномоченным руководителем медицинской организации, с указанием фамилии, имени, отчества (последнее - при наличии) и проставлением его личной подписи. Факт оформления рецепта на дому может быть дополнительно подтвержден фото- и (или) видеоматериалами [128].
При оказании скорой медицинской помощи лекарственные препараты, в том числе содержащие наркотические средства и психотропные вещества списков II и III Перечня, назначаются медицинским работником выездной бригады скорой медицинской помощи, медицинским работником медицинской организации при наличии у пациента, признанного нуждающимся в паллиативной медицинской помощи, болевого синдрома, не купируемого имеющимися анальгетиками [129].
Согласование назначения лекарственных препаратов с заведующим отделением или ответственным дежурным врачом либо другим лицом, уполномоченным приказом главного врача медицинской организации, а также, при наличии, с врачом - клиническим фармакологом необходимо в случаях назначения лекарственных препаратов, в том числе содержащих наркотические средства и психотропные вещества списков II и III Перечня, не входящих в перечень жизненно необходимых и важнейших лекарственных препаратов.
В указанных случаях назначение лекарственных препаратов фиксируется в медицинской документации пациента и заверяется подписью медицинского работника и заведующего отделением (ответственного дежурного врача или другого уполномоченного лица) [128].
По решению врачебной комиссии пациентам при оказании им паллиативной медицинской помощи в стационарных условиях назначаются лекарственные препараты, не включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, в случае их замены из-за индивидуальной непереносимости, по жизненным показаниям.
Медицинский работник медицинской организации (ее структурного подразделения), расположенной в сельском населенном пункте, осуществляет назначение лекарственных препаратов, в том числе содержащих наркотические средства и психотропные вещества списков II и III Перечня, единолично [128].
При выписке пациента из медицинской организации, в которой ему оказывалась паллиативная медицинская помощь в стационарных условиях, данному пациенту по решению руководителя медицинской организации назначаются с оформлением рецепта в форме электронного документа и (или) на бумажном носителе (за исключением оформления рецептов на лекарственные препараты, подлежащие отпуску бесплатно или со скидкой) либо выдаются (пациенту или его законному представителю) одновременно с выпиской из истории болезни лекарственные препараты, в том числе содержащие наркотические средства и психотропные вещества списков II и III Перечня, сильнодействующие лекарственные препараты, на срок приема пациентом до 5 дней [128].
При наличии показаний больные с ХБС госпитализируются в структурные подразделения медицинских организаций, оказывающие паллиативную специализированную медицинскую помощь в стационарных условиях.
Показаниями для госпитализации больных с ХБС в хоспис для взрослых являются:
Профилактика
Информация
Источники и литература
-
Клинические рекомендации Ассоциации профессиональных участников хосписной помощи
- Raja S.N., Carr D.B., Cohen M. et al. The revised International Association for the Study of Pain definition of pain: concepts, challenges, and compromises. Pain. 2020; 161(9): 1976-82 Артеменко А.Р., Вейн А.М., Вознесенская Т.Г., Голубев В.Л. и др. Болевые синдромы в неврологической практике. 3-е изд., перераб. и доп. – М.: МЕДпресс-информ, 2010. – 336 С. Данилов А.Б., Данилов Ал.Б., Управление болью. Биопсихосоциальный подход.-М.: «АММ ПРЕСС».- 2012.-568 С. Данилов А.Б., Данилов Ал.Б., Биопсихосоциокультурная модель и хроническая боль. Современная терапия в психиатрии и неврологии. -№ 1.- 2013.- С. 30-36. Крыжановский Г.Н. Центральные патофизиологические механизмы патологической боли. Тезисы докл. научно-практической конференции с международным участием Клинические и теоретические аспекты боли. М.: – 2001. – С. 14. Paice J.A., Bell R.F., Kalso E.A., Soyannwo O.A. Cancer Pain. From Molecules to Suffering. - IASP Press. Seattle. – 2010. – 354 Р. Каприн А.Д., Абузарова Г.Р., Хороненко В.Э., Алексеева Г.С., Костин А.А., Старинский В.В., Алексеев Б.Я., Александрова Л.М. Фармакотерапия хронического болевого синдрома у онкологических пациентов. – М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «ФМИЦ им. П.А. Герцена» Минздрава России. - 2015.-илл. - 48 с. Attal N., Cruccua G., Baron R., Haanpaa M., Hansson P., Jensen T. S., Nurmikko T. EFNS guidelines on the pharmacological treatment of neuropathic pain: 2009 revision // EFNS European Journal of Neurology. – 2010. – Vol.17. - №8. - P.1010-1018. De Angelis L.M., Posner J.B. Neurologic Complications of Cancer, Oxford University Press, Hardback, 2008, 2-nd Ed. 656 Р. Данилов А.Б. Боль смешанного типа. Патофизиологические механизмы – значение для клинической практики. Подходы к диагностике и лечению смешанных типов болевых синдромов. - М.: РМЖ. - 2014. - Специальный выпуск. С. 10-16. Worldwide palliative care alliance (WPCA); World Health Organization 2015.http://www.who.int/nmh/Global_Atlas_of_Palliative_Care.pdf Кукушкин М.Л. Патофизиологические механизмы болевых синдромов // Боль. М.: – 2003. - №1. – С.5-16. Jost L., Roila F., ESMO Guidelines Working Group. Management of cancer pain: ESMO Clinical Practice Guidelines. Ann Oncol 2010; 21(Suppl 5): Р. 257–260. Обезболивание при раке и паллиативное лечение: доклад комитета экспертов ВОЗ. - Женева: 1992, 76 С. URL: http://www.who.int/iris/handle/10665/89602. Use of Opioid Analgesics in the Treatment of Cancer Pain: Evidence-based Recommendations from the EAPC. - Lancet Oncol 2012; 13: e58–e68. Gourlay G.K., Cherry D.A., Cousins M.J. A comparative study of the efficacy and pharmacokinetics of oral methadone and morphine in the treatment of severe pain in patients with cancer. Pain 1986; 25(3): Р. 297–312. Glossary of Globalization, Trade and Health Terms of the World Health Organization. http://who.int/trade/glossary/en/. American Society of Clinical Oncology 2016. All rights reserved. www.asco.org/chronicpain-guideline World Health Organization. Cancer pain relief. With a guide to opioid availability. 2nd edn. – Geneva, WHO. – 1996. - 70 Р. Усенко О. О рациональном использовании опиоидных анальгетиков в лечении хронической боли у инкурабельных онкологических больных - Врач № 5. М.: Русский врач, 2013. – С. 9 – 19. Clinical Pain Management. Cancer Pain edited by Sykes N., Bennett M.I., Yuan C. 2-nd edition. – Hodder Arnold, UK London: 2008. – 443 Р. Michael J. Fisch, Allen W. Burton. Cancer Pain Management. - The McGraw-Hill C. 2006. – 319 Р. Lussier D., Portenoy R.K. Adjuvant analgesic drugs. In: Bruera E., Higginson I.J., Ripamonti C., von Gunten C., editors. Textbook of palliative medicine. London: Edward Arnold Publishers; 2006. Р. 402-414. Абузарова Г. Р. Диагностика и дифференцированная фармакотерапия хронического болевого синдрома у онкологических больных. Москва : ГЭОТАР-Медиа, 2015. - 240 с. (глава 9. Оценка эффективности и переносимости препарата пропионилфенилэтоксиэтилпиперидина (просидола) в буккальных таблетках). Абузарова Г.Р. «Просидол в лечении хронического болевого синдрома у онкологических больных», диссертация на соискание уч. ст. кандидата мед. наук. М.: 2001. – 124 С. Абузарова Г.Р., Осипова Н.А., Данилова Т.В., Петрова Г.В. Возвращение отечественного опиоидного анальгетика просидола в клиническую практику российской онкологии. Рос. онкологич. журнал. 2010; 6: 42-6. Davies A.N., et al. The management of cancer-related breakthrough pain: recommendations of a task group of the Science Committee of the Association for Palliative Medicine of Great Britain and Ireland.Eur J Pain 13, 2009. - 331-338 Р. Hanks GW, Conno F, Cherny N et al. Morphine and alternative opioids in cancer pain: The EAPC recommendations. British Journal of Cancer. 2001; 84: 587–593 Р. Инструкция к препарату морфин сульфат на официальном сайте Государственный реестр лекарственных средств http://grls.rosminzdrav.ru/ Инструкция к препарату таргин (оксикодон+налоксон) на официальном сайте Государственный реестр лекарственных средств http://grls.rosminzdrav.ru/ Пчелинцев М.В. Проблемы применения сильных опиоидов при хронической боли в России. Возможные пути их решения. – Врач № 5. М.: Русский врач, 2013 -С.19-22. Инструкция к препарату ТТС фентанила на официальном сайте Государственный реестр лекарственных средств http://grls.rosminzdrav.ru/ Caraceni A., Cherny N., Fainsinger R. et al. The Steering Committee of the EAPC Research Network. Pain measurement tools and methods in clinical research in palliative care: recommendations of an expert working group of the European Association of Palliative Care. J. Pain Symptom Manage. 2002; 23(3): 239-55. Moore R.A., Mc. Quay H.J. Prevalence of opioid adverse events in chronic nonmalignant pain: systematic review of randomised trials of oral opioids. Arthritis Res Ther 2005; 7(5): R104651 Р. Onishi H., J. et al. Opioid rotation from morphine to fentanyl in delirious cancer patients: an open-label trial. J. Pain Symptom Manage. 2005 Jul; 30(1): 96-103. Freye E., Levy J.V., Braun D. Effervescent morphine results in faster relief of breakthrough pain in patients compared to immediate release morphine sulfate tablet. Pain Practice. 2007; 7: 324–331. Latta K.S., Ginsberg B., Barkin R.L. Meperidine: a critical review. Am J Ther. 2002; 9(1): 53-68. The management of cancer-related breakthrough pain: recommendations of a task group of the Science Committee of the Association for Palliative Medicine of Great Britain and Ireland. Eur J Pain. 2009; 13(4): 331–338. Coluzzi P.H., Schwartzberg L., Conroy J.D. et al. Breakthrough cancer pain: A randomized trial comparing oral transmucosal fentanyl citrate (OTFC) and morphine sulfate immediate release (MSIR). Pain. 2001; 91:123–130. Robert A., Swarm, Judit Paice et al. National comprehencive cancer network NCCN Clinical practice Guidelines in oncology, 2014. Oscar A.L.C. Cancer Pain: pharmacological, interventional, and palliative approaches. - Saunders Elsevier. Philadelphia. USA. 2006. – 591 Р. Full guideline May 2012 Developed for NICE by the National Collaborating Centre for Cancer © http://www.dft.gov.uk/dvla/medical/ataglance.aspx/ Fallon M., Hanks G., Cherny N. Principles of control of cancer pain. BMJ. 2006; 332: 1022–1024 P. National Institute for Health and Clinical Effectiveness (NICE). Guide to the Methods of Technology Appraisal [reference N0515]. 2004. Mercadante S., Radbruch L., Caraceni A. et al. Episodic (breakthrough) pain. Consensus Conference of an expert working group of the European Association for Palliative Care. Cancer 2002; 94: 832–839 P. Pain Daniel B. Carr, Lars Arendt-Nielsen, Kay Brune, Control Near the End of Life, Pain Clin Updates 2003. XI (1). Kurz A, Sessler DI. Opioid-induced bowel dysfunction: pathophysiology and potential new therapies. Drugs. 2003; 63(7): 649-671 P. А.Б. Данилов, Ал.Б. Данилов. Биопсихосоциальная концепция боли. Управляй Болью. Manage Pain. М.: 2013, № 1, C. 7-11. Twycross R.D. Strong opioids and the relief of cancer pain. Information for patients, families and friends. Printed by Lightning Source, UK.: 2013. P. 45. palliativedrugs.comLtd. Инструкция к препарату Тапентадол на официальном сайте Государственный реестр лекарственных средств http://grls.rosminzdrav.ru/
Информация
Критерии оценки качества медицинской помощи

1. Абузарова Гузель Рафаиловна – доктор медицинских наук руководитель центра паллиативной помощи онкологическим больным МНИОИ им П.А. Герцена - филиал ФГБУ "НМИЦ радиологии " Минздрава России
Экспертный состав:
В клинических рекомендациях приведены правила фармакотерапии хронического болевого синдрома у онкологических пациентов и пациентов с неонкологической патологией паллиативного профиля с учетом особенностей перечня опиоидов, зарегистрированных в России. В соответствии с рекомендациями Всемирной организации здравоохранения, а также Европейскими рекомендациями по паллиативной медицине, основным методом контроля хронического болевого синдрома является фармакотерапия на основе неинвазивных форм опиоидов. Она применяется амбулаторно и в стационаре независимо от стадии заболевания. Полноценный контроль боли должен осуществляться на всех этапах лечения пациента, в том числе при оказании паллиативной медицинской помощи.
При подготовке клинических рекомендаций использовалась современная рейтинговая оценка силы доказательств по системе GRADE. Доказательной базой для рекомендаций являлись публикации, вошедшие в Кохрайновскую библиотеку, базы данных EMBASE и MEDLINE, а также результаты исследований, выполненных в России. Глубина поиска составила 15 лет. При формулировании рекомендаций использовался консенсус экспертов. При изложении текста рекомендаций приводятся уровни достоверности доказательств (1-5) отдельно для методов диагностики (таблица А2-1) и методов профилактики, лечения, медицинской реабилитации (таблица А2-2), а также уровни убедительности рекомендаций (A, B, C) (таблица А2-3), в соответствии с рекомендуемыми приказом Министерства здравоохранения РФ от 28 февраля 2019 г. N 103н «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации» [106].
Таблица А2-1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств) [106].

Таблица А2-2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, лечебных, реабилитационных вмешательств) [106].
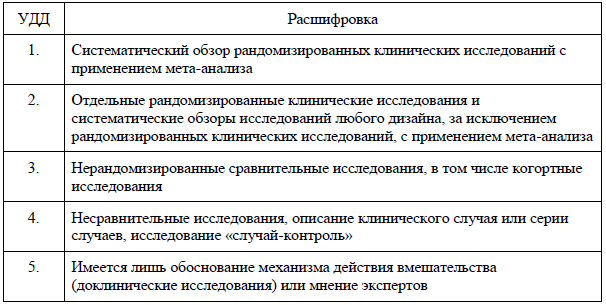
Таблица А2-3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, диагностических, лечебных, реабилитационных вмешательств) [106].

Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
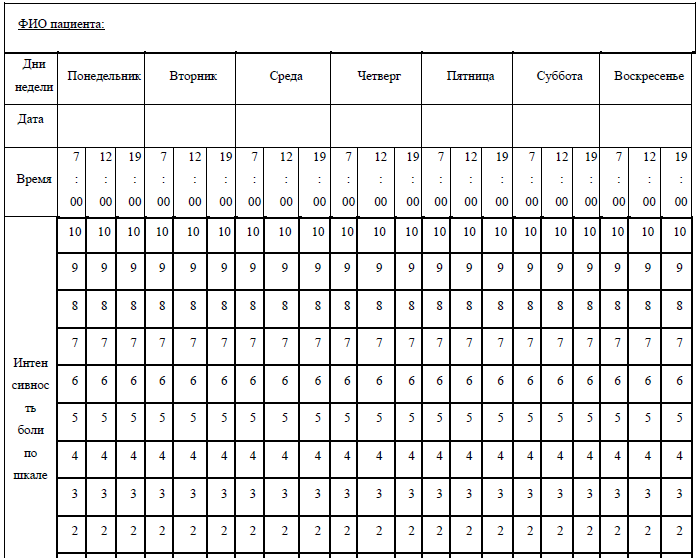
Примерная форма опросного листа для первичной оценки боли


Факторы риска развития осложнений, связанных с приемом НПВП (для общей популяции), и рекомендации по назначению терапии [76, 107, 108]

Примечания: 1инфаркт миокарда, острый коронарный синдром, реваскуляризация коронарных и других артерий, острое нарушение мозгового кровообращения / транзиторная ишемическая атака, клинически выраженная ИБС, аневризма аорты, заболевания периферических артерий, хроническая сердечная недостаточность; 2с повреждением органов-мишеней или другими факторами риска; 3общий холестерин ≥8 ммоль/л, или ЛПНП >6 ммоль/л, или АД ≥180/100 мм рт. ст.
Адьювантные анальгетики и средства для симптоматической терапии

Перечень зарегистрированных препаратов опиоидов в инъекционных лекарственных формах

Перечень зарегистрированных препаратов опиоидов в неинвазивных лекарственных формах
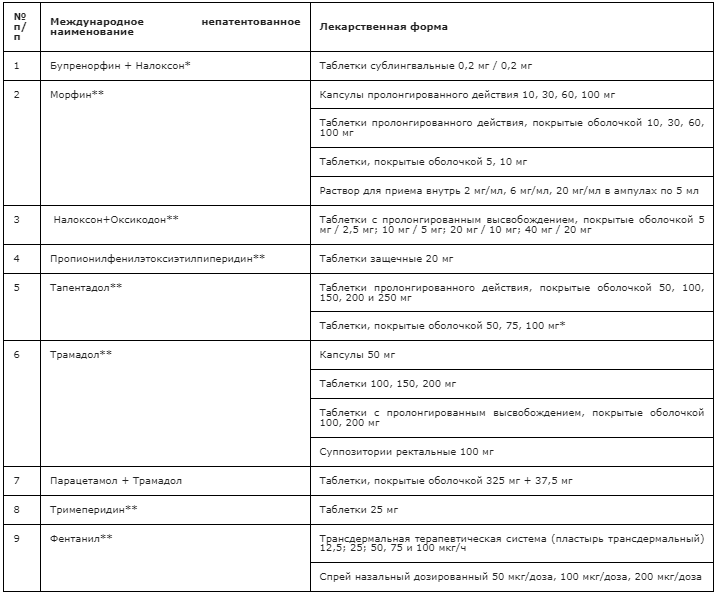
Примечания: * препарат предназначен для терапии острой боли
Морфин**
При нарушении глотания у пациента можно рассмотреть использование морфина** в форме раствора для приема внутрь, который допустимо вводить через назогастральный зонд, гастростому или маленькими порциями через рот (при этом следует учитывать горький привкус морфина**).
Морфин** метаболизируется в печени путем глюкуронизации с образованием практически неактивного морфин-3-глюкоронида и активного морфин-6-глюкуронида, обладающего нейротоксичными свойствами. Экскреция морфина** и метаболитов осуществляется на 90% почками и на 10% кишечником.
У пациентов с печеночной или почечной недостаточностью рекомендуется редуцировать дозу морфина** или выбрать другой препарат (препарат выбора – фентанил**).
Разовая (стартовая) доза: 5-10 мг для опиоид-наивных пациентов.
Максимальная суточная доза: отсутствует для опиоид-толерантных пациентов.
Лекарственные формы: таблетки, покрытые пленочной оболочкой, 5 мг и 10 мг; раствор для приема внутрь 2 мг, 6 мг или 20 мг / 1 мл в ампулах по 5 мл; капсулы пролонгированного действия 10, 30, 60, 100 мг; таблетки с пролонгированным высвобождением (пролонгированного действия), покрытые пленочной оболочкой, 10 мг, 30 мг, 60 мг, 100 мг.
Рецептурный бланк: 107/у-НП.
Пластырь трансдермальный (ТТС) фентанила** – достаточно удобная лекарственная форма для терапии хронической боли. Необходимо учитывать особенности фармакокинетики трансдермальной формы. При первом применении пластыря обезболивающий эффект развивается медленно, в течение 24 ч, по мере достижения терапевтической концентрации фентанила** в крови. Поэтому в течение первых суток пациенту может потребоваться дополнительное обезболивание. Наиболее целесообразно применять трансдермальный фентанил** у пациентов с подобранной (стабильной) дозой опиоида, осуществляя ротацию согласно принципов, изложенных в тексте настоящих рекомендаций (см. раздел 3.1.6). Стационарная концентрация фентанила** достигается, как правило, к концу второй 72-часовой аппликации пластыря, когда можно делать вывод о достаточности дозы или необходимости ее коррекции (это справедливо в т.ч. для оценки эффекта после увеличения дозировки пластыря). В подкожной жировой клетчатке создается депо фентанила**, поддерживающее стабильную концентрацию вещества в крови и позволяющее сохранить обезболивание при замене. При снижении обезболивающего эффекта после самой первой аппликации пластыря допустима замена пластыря через 48 ч на пластырь той же дозировки с последующим увеличением дозы при необходимости только через 72 ч.
Трансдермальный фентанил** реже вызывает запоры, тошноту и рвоту. Он удобен у пациентов с нарушением глотания. Однако у пациентов с кахексией, лихорадкой, повышенной потливостью применение пластыря может быть затруднительно, и в первых двух случаях требует ревизии дозы препарата.
Фентанил** является опиоидом выбора у пациентов с умеренной и тяжелой степенью почечной и печеночной недостаточностью.
Разовая (стартовая) доза: 12,5 мкг/ч для опиоид-наивных пациентов.
Максимальная суточная доза: нет для опиоид-толерантных пациентов.
Лекарственные формы: пластырь трансдермальный (ТТС) 12,5 мкг/ч, 25 мкг/ч, 50 мкг/ч, 75 мкг/ч, 100 мкг/ч; спрей назальный дозированный 50 мкг/доза, 100 мкг/доза, 200 мкг/доза (в настоящее время данная лекарственная форма не доступна для применения).
Рецептурный бланк: 148-1/у-88 (для пластыря трансдермального).
Оксикодон и налоксон метаболизируются в печени посредством микросомального окисления (CYP3A4, CYP2D6) и глюкуронизации. В ходе окисления оксикодона образуется активный метаболит оксиморфон, не имеющий существенного вклада в суммарный эффект препарата. Выведение оксикодона, налоксона и их метаболитов осуществляется, главным образом, почками.
У пациентов с почечной недостаточностью и печеночной недостаточностью легкой степени применять препарат следует с осторожностью. При печеночной недостаточности средней и тяжелой степени препарат противопоказан в виду значимого увеличения системной экспозиции оксикодона и особенно налоксона.
Разовая (стартовая) доза: 5 мг налоксона + 10 мг оксикодона для опиоид-наивных пациентов.
Максимальная суточная доза: 80 мг налоксона + 160 мг оксикодона (из-за наличия налоксона в составе препарата).
Лекарственные формы: таблетки с пролонгированным высвобождением, покрытые пленочной оболочкой, 2,5 мг + 5 мг, 5 мг + 10 мг, 10 мг + 20 мг, 20 мг + 40 мг.
Рецептурный бланк: 148-1/у-88.
Метаболизм бупренорфина осуществляется в печени с помощью микросомального окисления (CYP3A4). При этом активные метаболиты экскретируются почками (30%) и печенью (70%)
Совместное применение препарата с «чистыми» агонистами опасно в отношении развития синдрома отмены и прорыва боли!
Бупренорфин относится к опиоидам выбора у пациентов с печеночной и почечной недостаточностью. Однако необходимо иметь в виду существенное увеличение плазменной концентрации налоксона у пациентов с печеночной недостаточностью средней и тяжелой степени, что может нивелировать обезболивающее действие бупренорфина.
Основное ограничение для применения препарата – показание для терапии острой боли согласно инструкции по применению лекарственного препарата, зарегистрированного в РФ.
Анальгетический потенциал бупренорфина при сублингвальном приеме по сравнению с пероральным морфином** составляет 75 (более высокий). Предназначен для терапии острой боли умеренной и сильной интенсивности (при Z51.5).
Разовая (стартовая) доза: 1-2 таблетки.
Максимальная суточная доза: 8 таблеток (1,6 мг + 1,6 мг).
Лекарственные формы: таблетки сублингвальные 0,2 мг + 0,2 мг.
Рецептурный бланк: 148-1/у-88.
Аналогично другим опиоидам трамадол** обладает противокашлевым эффектом. Имеет меньший наркогенный (аддиктивный) потенциал, слабее подавляет дыхательный центр и реже вызывает запор в сравнении с другими опиоидами.[114]
Метаболизм трамадола** опосредуется системой цитохрома P450 (CYP450), преимущественно изоформой CYР2D6, активность которой в силу генетических полиморфизмов подвержена вариабельности. Это обусловливает различный ответ пациентов в отношении эффективности и переносимости препарата и, следовательно, скорости подбора дозы и ее величины. Требуется учет потенциальных лекарственных взаимодействий с модуляторами активности CYP. Прием трамадола** ассоциируется с риском серотонинового синдрома, особенно при использовании больших доз и при одновременном приеме с другими опиоидами или серотонинергическими средствами – антидепрессантами (СИОЗС, СИОЗСиН, трициклическими, ингибиторами МАО), противомигренозными (агонистами 5-HT1-серотониновых рецепторов), противорвотными (антагонистами 5-HT3-серотониновых рецепторов). К симптомам серотонинового синдрома относятся: спутанность сознания, ажитация, гипертермия, потливость, атаксия, тремор, гиперрефлексия, тахикардия, артериальная гипертензия, миоклонус, диарея.
У пациентов с печеночной или почечной недостаточностью рекомендуется редуцировать дозу трамадола** или увеличивать интервалы между приемами препарата.
Разовая (стартовая) доза: от 50 мг до 200 мг в зависимости от интенсивности боли.
Максимальная суточная доза: 400 мг (у лиц старше 75 лет – 300 мг/сут).
Лекарственные формы: капсулы 50 мг; таблетки 50 и 100 мг; таблетки с пролонгированным высвобождением, покрытые пленочной оболочкой, 100 мг; суппозитории ректальные 100 мг (в настоящее время данная лекарственная форма не доступна для применения). Доступна фиксированная комбинация трамадола 37,5 мг с парацетамолом 325 мг в таблетках: эффективность 2-х таблеток этой комбинации сопоставима со 100 мг трамадола при меньших побочных эффектах; максимальная суточная доза составляет 8 таблеток.
Рецептурный бланк: 148-1/у-88.
У пациентов с тяжелой печеночной или почечной недостаточностью применение тапентадола** противопоказано; при умеренно выраженной печеночной недостаточности необходимо соблюдать осторожность и уменьшать стартовую суточную дозу на 50%.
Разовая (стартовая) доза: 50 мг.
Максимальная суточная доза: 500 мг (таблетки пролонгированного действия) и 600 мг (таблетки с немедленным высвобождением).
Лекарственные формы: таблетки пролонгированного действия, покрытые пленочной оболочкой, 50 мг, 100 мг, 150 мг, 200 мг, 250 мг; таблетки, покрытые пленочной оболочкой, 50 мг, 75 мг, 100 мг.
Рецептурный бланк: 148-1/у-88.
В первые дни приема возможна ортостатическая гипотония. Имеет быстрое начало действия (в течение 5-10 мин), в связи с чем больше подходит для купирования прорывной боли. Применение препарата в качестве основного анальгетика, особенно в высоких дозах в течение продолжительного времени, целесообразно избегать ввиду его высокого наркогенного потенциала. Не применяется при стоматите, гингивите и других заболеваниях слизистой полости рта.
Метаболизируется путем глюкуронизации в печени до неактивных метаболитов, экскретируемых преимущественно почками.
Противопоказан у пациентов с печеночной или почечной недостаточностью.
Анальгетический потенциал пропионилфенилэтоксиэтилпиперидина** в сравнении с пероральным морфином**: 0,9. Предназначен для терапии боли умеренной и сильной интенсивности, требующей назначения опиоидов.
Разовая (стартовая) доза: 10-20 мг у опиоид-наивных пациентов.
Максимальная суточная доза: 250 мг.
Лекарственные формы: таблетки защечные 20 мг.
Рецептурный бланк: 107/у-НП.
Метоклопрамид** - противорвотное средство первой линии, способствует уменьшению тошноты, стимулирует перистальтику верхних отделов желудочно-кишечного тракта (прокинетическое действие), повышает тонус нижнего сфинктера пищевода (по АТХ относится к группе A03FA стимуляторы моторики желудочно-кишечного тракта). Разовая доза: 20 мг; суточная - 60 мг (для всех способов введения). Частота приема - 1-3 раза в сутки. Особенности: при одновременном применении с нейролептиками (особенно фенотиазинового ряда и производных бутирофенона) повышается риск возникновения экстрапирамидных реакций; при одновременном применении с пероральным морфином ускоряется абсорбция морфина из кишечника и усиливается его седативное действие. При недостаточном эффекте его действие можно потенцировать назначением дексаметазона дважды в сутки (утром и в обед). Может вызывать удлинение интервала QT на ЭКГ и аритмии сердца, в т.ч. по типу «пируэт».
Галоперидол** – эффективный антипсихотический препарат (нейролептик) мощным центральным антиэметическим действием. Назначают по 0,3–0,5 мг 2–3 раза в день (1,5-3 мг/сут). Галоперидол** в сочетании с опиоидом, транквилизатором или снотворным может усиливать угнетающее влияние этих препаратов на сознание. Галоперидол**, обладающий центральными адренолитическими свойствами, может способствовать развитию артериальной гипотензии, особенно у пациентов в состоянии гиповолемии. Удлиняет интервал QT на ЭКГ, в особенности на фоне гипокалиемии, приеме других препаратов, увеличивающих продолжительность интервала QT. Однако при назначении низких доз, побочные эффекты встречаются крайне редко. Противопоказан при клинически значимых заболеваниях сердца (в т.ч. после недавно перенесенного острого инфаркта миокарда, декомпенсированной сердечной недостаточности, аритмиях и блокадах сердца II и III степени).
Хлорпромазин** – антипсихотический препарат, альтернатива галоперидолу**, но менее эффективен. Разовые дозы: 12,5-25 мг 3 раза в день.
При неукротимой и обильной рвоте необходимо помимо противорвотной терапии дополнительно назначать медикаменты, угнетающие гастроинтестинальную секрецию, например, М-холинолитик - полусинтетический алкалоид красавки четвертичной структуры гиосцина бутилбромид суточной дозе до 100 мг перорально, ректально или в виде инъекций.
Большинство противорвотных препаратов, прежде всего антипсихотические средства (нейролептики), могут вызывать экстрапирамидные нарушения (особенно у молодых пациентов, длительном применении и максимальных дозах) и нуждаются в коррекции тригексифенидилом. Кроме того, при применении всех вышеперечисленных препаратов необходимо учитывать риск удлинения интервала QT на ЭКГ и возникновения аритмий сердца, в т.ч. желудочковых по типу «пируэт».
Таблица пересчета эквипотенциальных доз опиоидов
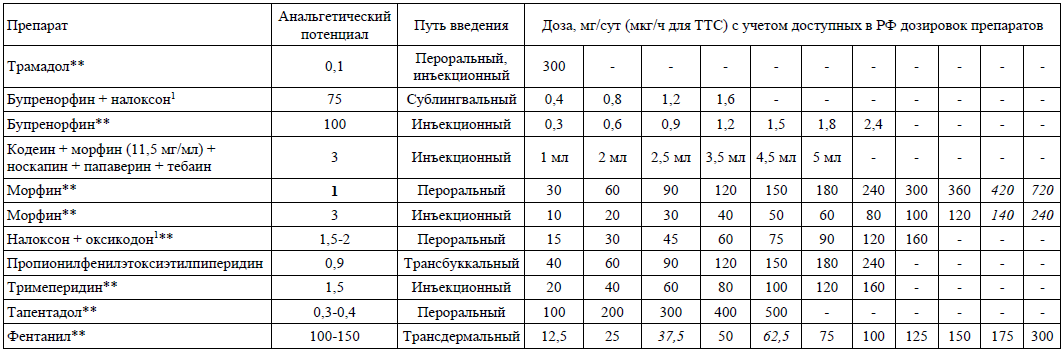
Комментарии:
Определение степени печеночной недостаточности
2. Оценка по классификации Child-Turcotte-Pugh (Чайлда-Тюркотта-Пью) [119].
Применяется для оценки тяжести цирроза печени и прогноза выживаемости в течение 1 года.

Бесплатные онлайн калькуляторы шкалы Child-Turcotte-Pugh:
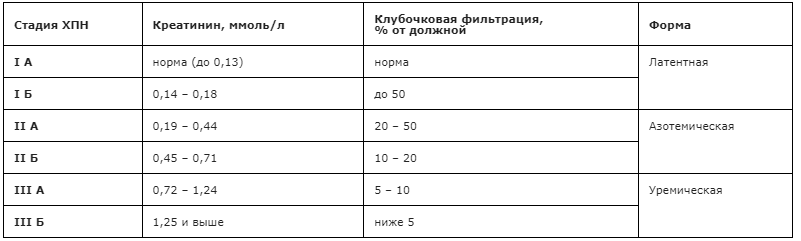
1. Степень тяжести хронической почечной недостаточности по Рябову С.И. и Б.Б. Бондаренко [120].
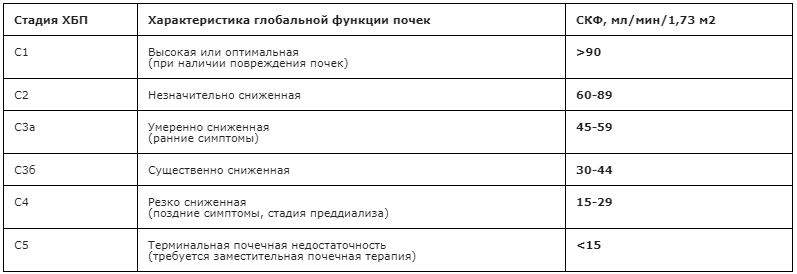
2. Классификация хронической болезни почек (ХБП) согласно Kidney Disease: Improving Global Outcomes (KDIGO) [121].
3. Стадии острого повреждения почек согласно критериям KDIGO [122].

Общая схема диагностики и лечения пациента с хронической болью
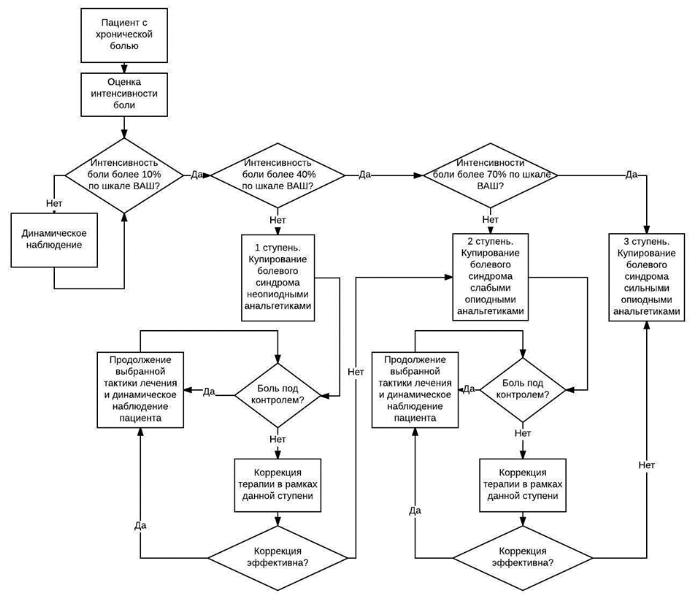
Схема 3-ей ступени обезболивания

1. Что такое опиоидные анальгетики (сильнодействующие опиоиды)?
2. Почему Вам назначили сильнодействующий опиоид?
4. Опиоидные анальгетики (сильнодействующие опиоиды) совсем избавляют от боли?
5. Почему одним пациентам нужна большая доза сильнодействующих опиоидов, чем другим?
6. Не лучше ли отложить опиоидные анальгетики (сильнодействующие опиоиды) до того момента, когда боль станет нестерпимой?
8. Как долго мне нужно принимать сильнодействующие опиоиды? Эффект со временем ослабевает?
9. Появится ли зависимость от приема опиоидов?
10. Возможно ли перестать принимать опиоидные анальгетики (сильнодействующие опиоиды)?
12. Что будет, если сильнодействующие опиоиды не снимут боль?
13. Сильнодействующие опиоиды вызовут у меня запор?
15. Что делать, если Вас мучает сухость во рту на фоне приема опиоидов?
17. Влияет ли табакокурение на нужную дозу опиоида?
18. Нужно ли продолжать прием сильнодействующих опиоидов больному тогда, когда он в бессознательном состоянии?
Приложение Г1. Визуальная аналоговая шкала
Назначение: оценка интенсивности боли.
Пояснение: ВАШ представляет собой линию 10 см (100 мм), на которой пациенту предлагается сделать отметку, соответствующую интенсивности боли, испытываемой в данный момент (или в течение определенного времени, например, за последнюю неделю), пациент делает выбор между «нет боли» и «невыносимая боль». Далее измеряют сантиметром расстояние между началом шкалы («нет боли») и отметкой пациента, сантиметры затем переводят в баллы (1 см = 10мм= 1 баллу).

Пояснения: помимо медицинских работников использовать данную шкалу могут законные представители/лица по уходу после инструктажа медицинского работника.
Назначение: оценка интенсивности боли.
Пояснение: шкала представляет собой горизонтальную линию, длиной 10 см, с расположенными на ней цифрами от 0 до 10, где 0 — «отсутствие боли», 10 — «нестерпимая боль». Пациента просят выбрать число от 0 до 10, соответствующее выраженности его болевых ощущений.
Содержание (шаблон):

Пояснения: помимо медицинских работников использовать данную шкалу могут законные представители/лица по уходу после инструктажа медицинского работника.
Назначение: общая оценка интенсивности боли.
Содержание (шаблон):

Пояснения: помимо медицинских работников использовать данную шкалу могут законные представители/лица по уходу после инструктажа медицинского работника.
Назначение: для врачей лечебных специальностей, не являющихся неврологами.
Содержание (шаблон):

Пояснения: опросник дает возможность выявить наличие нейропатической боли с достоверностью более 80%.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.