Диагностика и лечение злокачественных новообразований: Рак молочной железы
 Версия: Клинические протоколы 2006-2019 (Беларусь)
Версия: Клинические протоколы 2006-2019 (Беларусь)
Злокачественное новообразование молочной железы (C50)
Онкология
Общая информация
Краткое описание
ПОСТАНОВЛЕНИЕ
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
6 июля 2018 г. № 60
Об утверждении клинического протокола «Алгоритмы диагностики и лечения злокачественных новообразований»
На основании подпункта 8.3 пункта 8 Положения о Министерстве здравоохранения Республики Беларусь, утвержденного постановлением Совета Министров Республики Беларусь от 28 октября 2011 г. № 1446 «О некоторых вопросах Министерства здравоохранения и мерах по реализации Указа Президента Республики Беларусь от 11 августа 2011 г. № 360», Министерство здравоохранения Республики Беларусь
ПОСТАНОВЛЯЕТ:
1. Утвердить прилагаемый клинический протокол «Алгоритмы диагностики и лечения злокачественных новообразований».
2. Начальникам главных управлений по здравоохранению областных исполнительных комитетов, председателю комитета по здравоохранению Минского городского исполнительного комитета, руководителям государственных организаций, подчиненных Министерству здравоохранения Республики Беларусь, обеспечить проведение диагностики, лечение и профилактику заболеваний в соответствии с клиническим протоколом.
3. Настоящее постановление вступает в силу после его официального опубликования.
Министр В.А.Малашко
УТВЕРЖДЕНО
Постановление
Министерства здравоохранения
Республики Беларусь
06.07.2018 № 60
КЛИНИЧЕСКИЙ ПРОТОКОЛ «Алгоритмы диагностики и лечения злокачественных новообразований»
ГЛАВА 22
РАК МОЛОЧНОЙ ЖЕЛЕЗЫ (С50)
Классификация
ГЛАВА 1
ОБЩИЕ СВЕДЕНИЯ О TNM КЛАССИФИКАЦИИ
Система TNM для классификации злокачественных опухолей была разработана французом Р. Denoix в 1943–1952 гг. В 1953 г. Комитет по номенклатуре опухолей и статистике, организованный UICC, и Международная комиссия по стадированию рака достигли соглашения по классификации анатомической распространенности опухолей на основе системы TNM. В 1954 г. Международный противораковый союз (UICC) создает Комитет по клинической классификации и прикладной статистике, который в 1958 г. публикует первые рекомендации по клинической классификации рака молочной железы и гортани.
В результате многолетней деятельности Комитета в 1968 г. издается первая редакция TNM классификация злокачественных опухолей. По мере разработки классификации для новых локализаций опухолей и уточнения более ранних рекомендаций в 1974, 1978, 1987, 1997, 2002 и 2009 гг. публикуются 2-я, 3-я, 4-я, 5-я, 6-я и 7-я редакции.
Настоящая (8-я) редакция правил классификации и стадирования полностью соответствуют 8-й редакции руководства по стадированию рака и одобрена всеми национальными TNM комитетами.
В данном руководстве используются морфологические формы злокачественных новообразований в соответствии с классификацией МКБ-О-3, адаптированной под МКБ-10 (проставление кодов врачом-патологом в морфологическом заключении обязательно).
UICC признает необходимость постоянства TNM классификации в течение определенного периода времени, необходимого для накопления данных. Поэтому классификация не должна изменяться до тех пор, пока не будут сделаны крупные достижения в диагностике и лечении злокачественных опухолей, требующие пересмотра настоящей классификации.
Общие правила системы TNM.
TNM система для описания анатомической распространенности болезни основывается на оценке 3 компонентов:
Т – распространение первичной опухоли;
N – отсутствие или наличие метастазов в регионарных лимфатических узлах и степень их поражения;
М – отсутствие или наличие отдаленных метастазов.
К этим трем компонентам добавляются цифры, указывающие на распространенность злокачественного процесса:
Т0, Т1, Т2, Т3, Т4; N0, N1, N2, N3; M0, M1.
В действительности система является «стенографическим» описанием распространенности злокачественной опухоли.
Общие правила классификации, применяемые для опухолей всех локализаций, следующие:
Для каждой локализации имеются две классификации:
Клиническая классификация, обозначаемая TNM (или cTNM). Она основывается на результатах обследования до лечения. Эти данные получают при врачебном осмотре, лучевой диагностике, эндоскопии, биопсии, хирургическом диагностическом вмешательстве и других методах обследования.
Патологическая классификация, обозначаемая pTNM. Она основана на данных обследования до лечения, дополненных или измененных в результате хирургического вмешательства и морфологического исследования. Гистологическая оценка первичной опухоли включает резецированную опухоль или биопсию, позволяющую оценить наивысшую Т категорию. Гистологическая оценка регионарных лимфатических узлов включает исследование удаленных узлов в количестве, адекватном для установления отсутствия метастазов в регионарных лимфатических узлах (pN0) и достаточном для оценки наиболее высокой pN категории. Отдаленные метастазы должны быть подтверждены при микроскопическом исследовании (рМ).
После обозначения Т, N, М и/или рТ, pN и рМ категорий они могут группироваться по стадиям. TNM классификация и стадии, установленные однажды, должны оставаться неизменными в медицинских документах. Клиническая стадия служит основой для выбора лечения, тогда как патологическая стадия обеспечивает наиболее точные данные для оценки прогноза и расчета конечных результатов.
При сомнении в правильности оценки Т, N или М категории должно быть выбрано меньшее значение категории, (т.е. меньшее распространение опухоли).
В случае множественных опухолевых очагов в органе должна классифицироваться опухоль с более высокой Т категорией, а в скобках указываться множественность (т) или количество опухолей, например: Т2(т) или Т1(5). При одновременном поражении парных органов каждая опухоль должна классифицироваться отдельно. При опухолях печени, яичников и фаллопиевой трубы множественные очаги поражения являются критерием Т классификации.
Выявление второй опухоли в одном органе в течение 2 месяцев с момента выявления первой нужно расценивать как синхронное поражение.
TNM категории и стадия могут подразделяться или объединяться для клинических и научных целей (например, любые Т, N или М могут быть разбиты на подгруппы). Однако рекомендованные основные обозначения не должны изменяться.
Анатомические области и локализации.
Локализации в этой классификации обозначаются кодовым номером Международной классификации онкологических болезней.
TNM/pTNM классификация.
Используются следующие общие определения:
Т/рТ – первичная опухоль:
TX/рTX – первичная опухоль не может быть оценена;
Т0/рТ0 – нет доказательств первичной опухоли;
Tis/pTis – рак «in situ»;
Т1/рТ1, Т2/рТ2, ТЗ/рТЗ, Т4/рТ4 – размер или местное распространение опухоли в порядке увеличения.
N/pN – регионарные лимфатические узлы:
Nx/pNx – регионарные лимфатические узлы не могут быть оценены;
N0/pN0 – отсутствуют метастазы в регионарных лимфоузлах;
Nl/pNl, N2/pN2, N3/pN3 – возрастающее поражение регионарных лимфатических узлов.
Непосредственное распространение первичной опухоли на лимфатические узлы классифицируется как метастазы в лимфатических узлах. Метастаз в любом лимфоузле, не относящемся к регионарному, расценивается как отдаленный метастаз.
Опухолевый узел в области регионарных лимфатических узлов, не имеющий гистологических признаков лимфоузла, классифицируется как метастаз в регионарном лимфатическом узле, если имеет форму и ровный контур лимфатического узла. Опухолевый узел с неровным контуром классифицируется в рТ категории.
Когда размер является критерием pN классификации, производится измерение метастатического очага, а не всего лимфатического узла.
Случаи с микрометастазами, когда размеры метастазов не превышают 0,2 см, могут обозначаться добавлением «(mi)», например: pNl(mi) или pN2(mi).
М/рМ – отдаленные метастазы:
МХ/рМХ – отдаленные метастазы не могут быть оценены;
М0/рМ0 – нет отдаленных метастазов;
М1/рМ1 – имеются отдаленные метастазы;
Категория М может быть в дальнейшем специфицирована в соответствии со следующими обозначениями (таблица 1.1):
Таблица 1.1
| Легкие | PUL | Костный мозг | MAR |
| Кости | OSS | Плевра | PLE |
| Печень | HEP | Брюшина | PER |
| Головной мозг | BRA | Надпочечники | ADR |
| Лимфоузлы | LYM | Кожа | SKI |
| Другие | ОТН |
Подразделения TNM
Главные категории в классификации могут иметь подразделения, придающие критерию большую специфичность (например; Tla, lb или N2a, 2b).
Сигнальный лимфоузел
Это первый лимфоузел, получающий лимфу из первичной опухоли. Если в нем имеется метастаз, то и другие лимфоузлы могут быть поражены. Если этот лимфоузел не поражен, то и наличие метастазов в других узлах маловероятно. Иногда встречаются более одного сигнальных лимфоузлов.
При оценке сигнального лимфоузла применяются следующие определения:
Главные категории в классификации могут иметь подразделения, придающие критерию большую специфичность (например; Tla, lb или N2a, 2b).
Сигнальный лимфоузел
Это первый лимфоузел, получающий лимфу из первичной опухоли. Если в нем имеется метастаз, то и другие лимфоузлы могут быть поражены. Если этот лимфоузел не поражен, то и наличие метастазов в других узлах маловероятно. Иногда встречаются более одного сигнальных лимфоузлов.
При оценке сигнального лимфоузла применяются следующие определения:
- pNX(sn) – сигнальный узел не может быть оценен; pN0(sn) – нет поражения сигнального узла;
- pN1(sn) – есть поражение сигнального узла.
Отдельные опухолевые клетки
Отдельные опухолевые клетки (ITC) представляют собой единичные опухолевые клетки или маленькие кластеры клеток не более 0,2 мм в наибольшем измерении. ITC обычно не демонстрируют метастатической активности (пролиферацию или реакцию стромы) или инвазии стенок сосудистого или лимфатического синуса. Случаи с ITC в лимфатических узлах или отдаленных органах и тканях должны классифицироваться как N0 или М0 соответственно.
Это же применимо и к случаям, когда наличие опухолевых клеток или их компонентов подтверждается неморфологическими исследованиями, такими как проточная морфометрия или анализ ДНК.
Случаи с ITC должны анализироваться отдельно.
Классификация ITC:
- pN0 – гистологически не выявляются метастазы в регионарных лимфатических узлах, не проводились исследования по выявлению ITC;
- pN0(i-) – гистологически нет метастазов в регионарных лимфатических узлах, негативные морфологические данные по выявлению ITC;
- pN0(i+) – гистологически нет метастазов в регионарных лимфатических узлах, позитивные морфологические данные по выявлению ITC;
- pN0(mol-) – гистологически нет метастазов в регионарных лимфатических узлах, негативные неморфологические данные по выявлению ITC;
- pN0 (mol+) – гистологически нет метастазов в регионарных лимфатических узлах, неморфологическими методами выявляются ITC.
При исследовании ITC в сигнальном лимфоузле к обозначениям выше приведенной классификации в скобках указывается «(sn)», например: pN0(i+) (sn).
Отдельные опухолевые клетки, выявленные в костном мозгу морфологическими методами, классифицируются аналогично схеме для N, например: pM0(i+), а неморфологическими – pM0(mol+).
Гистопатологическая дифференцировка.
Это стадирование позволяет оценить степень агрессивности опухолей некоторых гистологических типов и может влиять на прогноз и выбор лечения.
Для большинства локализаций выделяется 4 степени дифференцировки опухолей:
- G1 – хорошо дифференцированные;
- G2 – умеренно дифференцированные;
- G3 – низко дифференцированные;
- G4 – недифференцированные.
При наличии различных степеней дифференцировки в опухоли указывается наименее благоприятная степень.
Саркомы костей и мягких тканей классифицируется также с использованием градаций «высокая степень» и «низкая степень» дифференцировки.
Для некоторых форм рака (молочной железы, тела матки, печени) рекомендуются специальные системы стадирования по степеням.
Дополнительные дескрипторы.
Для идентификации особых случаев в TNM/pTNM используются символы m, у, r, а.
Хотя они не влияют на группировку по стадиям, но указывают опухоли, которые должны анализироваться отдельно:
- m – используется для обозначения множественных опухолей одной локализации;
- у – в тех случаях, когда классификация приводится в течение или после проведения комбинированного (многокомпонентного) лечения, cTNM или pTNM категория обозначается префиксом «у», например: ycTNM или ypTNM. При оценке распространения опухоли до начала комбинированного лечения символ «у» не исключается;
- r – рецидив опухоли после радикального лечения при классификации обозначается префиксом «r» (rcTNM или rpTNM);
- а – применяется для обозначения классификации опухолей, впервые выявленных при аутопсии.
Необязательные дескрипторы
L – инвазия лимфатических сосудов
Классифицируется как LX, L0 и L1.
V – инвазия вен
Классифицируется как VX, VO, VI (микроскопическая инвазия) и V2 (макроскопическая инвазия). Макроскопическое вовлечение стенки вены при отсутствии опухоли в просвете сосуда классифицируется как V2.
С-фактор
С-фактор или «фактор надежности» отражает достоверность классификации с учетом использованных методов диагностики. Его использование не является обязательным.
Определения С-фактора:
- С1 – данные стандартных диагностических методов (осмотр, пальпация, рентгенологическое исследование, эндоскопическое исследование),
- С2 – данные, полученные при использовании специальных диагностических методов (рентгенологическое исследование в специальных проекциях, томография, компьютерная томография, ультразвуковое исследование, лимфография, ангиография, сцинтиграфия, магнитно-резонансная томография, ПЭТ/КТ, эндоскопия, биопсия, цитологическое исследование);
- С3 – данные хирургического диагностического вмешательства, включая биопсию и цитологическое исследование;
- С4 – данные, полученные после радикальной операции и гистологического исследования удаленного препарата;
- С5 – данные патологоанатомического вскрытия.
Степени С-фактора могут использоваться при описании категорий Т, N и М (например: Т3С2, N2C1, М0С2).
Клиническая классификация TNM соответствует CI, С2 и С3 степеням, тогда как pTNM эквивалентна С4.
Классификация остаточных опухолей (R)
TNM/pTNM классификация описывает анатомическую распространенность опухоли без рассмотрения вопросов лечения. R-классификация описывает статус опухоли после лечения. Она отражает эффект лечения и является прогностическим фактором. При R- классификации оценивается не только первичная опухоль, но и остающиеся отдаленные метастазы.
Эта классификация может применяться после хирургического лечения, лучевой или химиотерапии, а также после комбинированного лечения. После консервативного лечения остаточная опухоль оценивается клиническими методами. После хирургического лечения R-классификация требует тесного сотрудничества хирурга и морфолога.
Случаи с макроскопически определяемой остаточной опухолью (R2) могут подразделяться на R2a (без микроскопического подтверждения) и R2b (микроскопически подтвержденные).
R0 группа может включать пациентов как с М0, так и с Ml. В последнем случае отдаленные метастазы, как и первичная опухоль, должны быть полностью удалены. Трудности с R-классификацией могут возникнуть при удалении опухоли по частям, а не «en blok». В таких случаях уместна категория RX.
Наличие микроскопически определяемой инвазивной опухоли по линии резекции классифицируется как R1, а в случае неинвазивной карциномы – R1 (is).
Группировка по стадиям.
Комбинация всех значений дескрипторов TNM позволяет получить 24 категории TNM, описывающие распространенность опухоли. Для табличного представления данных и анализа эти категории объединяются в ограниченное количество групп – стадий. Каждая стадия более или менее однородна по прогнозу и критерию выживаемости относящихся к ней пациентов.
Карцинома «in situ» относится к стадии 0, а опухоли с отдаленными метастазами – к стадии IV (за исключением некоторых локализаций, например, папиллярного и фолликулярного рака щитовидной железы).
Для патологической стадии необходимо морфологическое исследование достаточного количества тканей, позволяющее оценить наибольшее значение Т и N. Если же имеется морфологическое подтверждение отдаленных метастазов, то и классификация (рМ1) и стадия являются патологическими.
Термин «стадия» употребляется только для комбинаций Т, N, М или рТ, pN или рМ категорий. Необходимо избегать выражений типа «Т стадия» или «N стадия»
РАК МОЛОЧНОЙ ЖЕЛЕЗЫ (С50)
22.2. Гистологическая классификация
22.2.1. Эпителиальные опухоли
Инвазивная карцинома не специфицированная 8500/3
Плеоморфная карцинома 8022/3
Инвазивная лобулярная карцинома 8520/3
Тубулярная карцинома 8211/3
Крибриформная карцинома 8201/3
Муцинозная карцинома 8480/3
Медуллярная карцинома 8510/3
Инвазивная микропапиллярная карцинома 8507/3
Метапластическая карцинома не специфицированная 8575/3
Плоскоклеточная карцинома 8070/3
Веретеноклеточная карцинома 8032/3
Смешанная метапластическая карцинома 8575/3
Миоэпителиальная карцинома 8982/3
Инвазивная папиллярная карцинома 8503/3
Ацинозноклеточная карцинома 8550/3
Слизисто-эпидермоидная карцинома 8430/3
Полиморфная карцинома 8525/3
22.2.2. Неинвазивные опухоли
Протоковая карцинома in situ 8500/2
Классическая дольковая карцинома in situ 8520/2
Плеоморфная дольковая карцинома in situ 8519/2´
22.2.3. Мезенхимальные опухоли
Липосаркома 8850/3
Ангиосаркома 9120/3
Рабдомиосаркома 8900/3
Остеосаркома 9180/3
Лейомиосаркома 8890/3
22.2.4. Фиброэпителиальные опухоли
Филлоидная опухоль с малигнизацией 9020/3
22.2.5. Опухоли соска
Болезнь Педжета соска 8540/3
22.2.6. Опухоли молочной железы у мужчин
Инвазивная карцинома 8500/3
Карцинома in situ 8500/2
22.2.7. Клинические формы
Воспалительная карцинома 8530/3
22.3. Классификация TNM (8-е издание, 2017 год)
Правила классификации:
Классификацию применяют к карциномам, в том числе к женской и мужской молочной железе. Требуется гистологическое подтверждение новообразования. Необходимо указать анатомическую локализацию опухоли.
В случаях множественных симультанных первичных опухолей в одной молочной железе для классификации нужно использовать опухоль с наибольшей категорией Т. Симультанный двусторонний рак молочной железы необходимо классифицировать независимо от разделения по гистологическому типу.
22.3.1. Анатомические отделы
Сосок (С50.0)
Центральная зона (С50.1)
Верхне-внутренний квадрант (С50.2)
Нижне-внутренний квадрант (С50.3)
Верхне-наружный квадрант (С50.4)
Нижне-наружный квадрант (С50.5)
Подмышечная область (С50.6)
22.3.2. Регионарные лимфатические узлы
1. Подмышечные (на стороне поражения): межгрудные лимфатические узлы (Роттера (Rotter)) и узлы вдоль подмышечной вены и ее ветвей, которые могут быть разделены на следующие уровни:
a. Уровень I (нижне-подмышечный): лимфатические узлы снаружи латерального края малой Грудной мышцы.
b. Уровень II (средне-подмышечный): лимфатические узлы между медиальным и латеральным краями малой Грудной мышцы и межгрудные (Роттера) лимфатические узлы.
c. Уровень III (верхушечно-подмышечный): верхушечные лимфатические узлы и узлы, расположенные внутри от медиального края малой Грудной мышцы, за исключением подключичных.
Примечание: интрамаммарные лимфатические узлы классифицируют как подмышечные узлы уровня
2. Подключичные (на стороне поражения)
3. Внутренние маммарные (на стороне поражения): лимфатические узлы в межреберных промежутках вдоль края Грудины во внутригрудной фасции
4. Надключичные (на стороне поражения)
Примечание: метастазы в любые другие лимфатические узлы, включая шейные и внутренние маммарные с противоположной стороны, классифицируют как отдаленные метастазы (М1).
При лечении рака молочной необходимо определить точное место расположения опухоли. Регионарными для этой анатомической области являются следующие Группы лимфатических узлов, которые разделяют на 3 уровня (относительно малой Грудной мышцы):
Уровень I
1. Передние Грудные лимфатические узлы находятся сразу под краем большой Грудной мышцы на уровне III–IV ребер. Ближайший к молочной железе чаще всего является первым лимфатическим узлом, куда метастазирует опухоль (сторожевой узел – Sentinel limph node (SLN)).
2. Нижние Грудные лимфатические узлы располагаются ниже, латеральнее боковых Грудных сосудов; принимают лимфу от нижних отделов железы.
3. Задние Грудные (подлопаточные) лимфатические узлы находятся по ходу подлопаточных сосудов, принимают лимфу от верхней части спины, лопатки; поражаются редко.
4. Верхние Грудные лимфатические узлы находятся в верхне-наружном отделе подмышечной впадины, принимают лимфу от верхней конечности; как правило, метастатическими раковыми клетками не поражаются.
5. Центральные лимфатические узлы находятся в верхневнутреннем углу подмышечной впадины, служат коллектором для всех лимфатических сосудов верхней конечности, Грудной стенки, молочной железы.
Уровень II
1. Межпекторальные лимфатические узлы – лимфатические узлы Роттера – находятся между большой и малой Грудными мышцами; поражаются редко.
2. Субпекторальные лимфатические узлы находятся непосредственно под малой Грудной мышцей. Принимают лимфу от тканей Грудной стенки, молочной железы.
Уровень III
1. Подключичные лимфатические узлы находятся между краем малой Грудной мышцы и ключицей, принимают лимфу от всех Групп узлов.
Все перечисленные Группы узлов связаны между собой лимфатическими сосудами, образуя сплетение: plexus lymphaticus axillaris et subclavius.
От основания железы лимфатические сосуды идут к лимфатическим узлам ретромаммарного пространства, далее пронизывают большую Грудную мышцу и вливаются в межпекторальные узлы (узлы Роттера), от которых лимфа оттекает в центральные подмышечные лимфатические узлы.
Часть лимфатических сосудов прободает не только большую, но и малую Грудную мышцу и через межреберье проникает к парастернальным лимфатическим узлам. К непостоянным лимфатическим узлам молочной железы относятся узлы, лежащие между малой и большой Грудными мышцами. В них поступает лимфа от верхних квадрантов железы. Выносящие сосуды несут лимфу в подмышечные и подключичные узлы.

Рисунок 22.1 – Пути оттока лимфы от молочной железы:
1 – парамаммарные лимфатические узлы;
2 – центральные подмышечные лимфатические узлы;
3 – подключичные лимфатические узлы;
2 – центральные подмышечные лимфатические узлы;
3 – подключичные лимфатические узлы;
4 – надключичные лимфатические узлы;
5 – глубокие шейные лимфатические узлы;
5 – глубокие шейные лимфатические узлы;
6 – парастернальные лимфатические узлы;
7 – перекрестные лимфатические пути, соединяющие лимфатические системы обеих молочных желез;
7 – перекрестные лимфатические пути, соединяющие лимфатические системы обеих молочных желез;
8 – лимфатические сосуды, идущие в брюшную полость;
9 – поверхностные паховые лимфатические узлы
Парастернальные лимфатические узлы поражаются чаще при медиально расположенных опухолях.
Надключичные лимфатические узлы являются последними регионарными лимфоузлами, которые поражаются при раке молочной железы.
Лимфатическое метастазирование при раке молочной железы может идти в 7–8 направлениях (см. рисунок 22.1):
1. пекторальный путь – к парамаммарным узлам и далее к лимфатическим узлам подмышечной впадины (см. рисунок 22.1 (1)). Встречается наиболее часто (60–70 % случаев);
2. транспекторальный путь – к центральным (верхним) подмышечным лимфатическим узлам (см рисунок 22.1 (2)). Встречается редко;
3. подключичный путь – к подключичным лимфатическим узлам (см. рисунок 22.1 (3)). Встречается в 2–30 % случаев;
4. парастернальный путь – к парастернальным лимфатическим узлам (см. рисунок 22.1 (6)). Встречается в 10 % случаев;
5. позадигрудинный путь – к медиастинальным лимфатическим узлам минуя парастернальные (см. рисунок 22.1 (7,8)). Встречается в 2 % случаев.
6. перекрестный путь – в подмышечные лимфатические узлы противоположной стороны и в молочную железу (см. рисунок 22.1 (7)). Встречается в 5 % случаев;
7. по лимфатическим путям Герота – к эпигастральным лимфатическим узлам и узлам брюшной полости (см. рисунок 22.1 (8)). Встречается редко;
8. внутрикожный – по брюшной стенке к паховым узлам (см. рисунок 22.1 (9)). Встречается редко.
22.3.3. Т – первичная опухоль
TX – первичная опухоль недоступна оценке.
Т0 – нет признаков первичной опухоли.
Tis – рак in situ:
Tis (DCIS) – протоковая карцинома in situ
Tis (LCIS) – дольковая карцинома in situ
Tis (Paget) – болезнь Педжета соска, не связанная с инвазивной карциномой, и/или карциномой in situ (DCIS и/или LCIS) в подлежащей паренхиме молочной железы. Карциному паренхимы молочной железы, сочетающейся с болезнью Педжета, классифицируют на основании размеров и характеристик опухоли паренхимы, при этом должно быть отмечено наличие болезни Педжета
Т1 – опухоль не более 2 см в наибольшем измерении
Т1mi – микроинвазия (не более 0,1 см в наибольшем измерении)*
Примечание: *микроинвазия представляет собой распространение опухолевых клеток за пределы базальной мембраны в прилежащие ткани при отсутствии очагов более 0,1 см в наибольшем измерении. При наличии множественных очагов микроинвазии для ее классификации используют размер наибольшего очага (т.е. не сумму размеров всех очагов!). Наличие множественных очагов микроинвазии должно быть отмечено так же, как при множественных крупных инвазивных карциномах.
Т1а – более 0,1 см, но не более 0,5 см в наибольшем измерении
Т1b – более 0,5 см, но не более 1 см в наибольшем измерении
Т1с – более 1 см, но не более 2 см в наибольшем измерении
Т2 – опухоль более 2 см, но не более 5 см в наибольшем измерении
Т3 – опухоль более 5 см в наибольшем измерении
Т4 – опухоль любого размера с непосредственным распространением на Грудную стенку и/ или кожу (изъязвление или узелки на коже)
Примечание: инвазию в дерму не расценивают как Т4. Грудная стенка включает ребра, межреберные мышцы и переднюю зубчатую мышцу, но не Грудные мышцы.
Т4а – распространение на Грудную стенку за исключением инвазии в Грудную мышцу
Т4b – изъязвление, сателлитные узелки на коже или отек кожи (включая вид «лимонной корочки») пораженной железы
Т4с – признаки Т4а и Т4b вместе
Т4d – воспалительная форма карциномы*
Примечание:
* Воспалительная форма карциномы молочной железы характеризуется диффузным уплотнением кожи с эризипелоидными краями, обычно без подлежащих масс. Если результат биопсии кожи отрицательный и нет локального, поддающегося измерению очага первичной карциномы, категорию Т классифицируют как патологическую стадию рTX воспалительной формы карциномы (Т4d). Формирование углублений на коже, втяжение соска или другие изменения кожи, кроме описанных в T4b и T4d, могут развиваться при Т1, Т2 или Т3 без учета в классификации.
22.3.4. N – регионарные лимфатические узлы
Nx – регионарные лимфатические узлы не могут быть оценены (например, предварительно удалены)
N0 – нет метастазов в регионарных лимфатических узлах
N1 – метастаз в подвижном подмышечном лимфатическом узле (узлах) I, II уровня на стороне поражения
N2 – метастазы в подмышечных лимфатических узлах I, II уровня на стороне поражения, спаянные между собой; клинически определяемый* внутренний маммарный лимфатический узел (узлы) на стороне поражения при отсутствии клинических признаков метастазов в подмышечных лимфатических узлах
N2a – фиксированные друг с другом или с другими структурами метастазы в подмышечных лимфатических узлах
N2b – метастазы в клинически определяемых* внутренних маммарных лимфатических узлах (узле) при отсутствии клинических признаков метастазов в подмышечных лимфатических узлах
N3 – метастазы в подключичных лимфатических узлах III уровня на стороне поражения с вовлечением или без вовлечения подмышечных лимфатических узлов I, II уровня; или метастазы в клинически определяемых* внутренних маммарных лимфатических узлах (узле) на стороне поражения при наличии клинических признаков метастазов в подмышечных лимфатических или метастазы в подключичных лимфатических узлах (узле) с или без метастазов в подмышечных и внутренних маммарных лимфатических узлах
N3a – метастазы в подключичных лимфатических узлах (узле)
N3b–метастазы во внутренних маммарных и подмышечных лимфатических узлах
N3c – метастазы в надключичных лимфатических узлах (узле)
Примечание: *Клинически определяемый – выявляемый при клиническом обследовании либо с помощью лучевых методов исследования (за исключением лимфосцинтиграфии) и имеющий признаки злокачественности или предполагающий макрометастаз на основании тонкоигольной аспирационной биопсии с цитологическим исследовании аспирационного биоптата без инцизионной биопсии обозначают символом (f), например cN3a(f).
Инцизионную биопсию лимфатического узла или биопсию «сторожевого» лимфатического узла при отсутствии указания рТ классифицируют как клиническую N, например cN1. Патологоанатомическую классификацию pN используют для оценки данных инцизионной биопсии или биопсии «сторожевого» лимфатического узла только в сочетании с патологоанатомическим указанием категории Т.
22.3.5. М – отдаленные метастазы
М0 – отдаленные метастазы не определяются.
М1 – имеются отдаленные метастазы.
22.4. Патогистологическая классификация pTNM
22.4.1. pT – Первичная опухоль
Патологоанатомическая классификация оценивает первичную карциному при отсутствии макроскопических признаков в краях резекции. Наблюдение может быть классифицировано как рТ, если имеются только микроскопические признаки опухоли в крае. Категория рТ соответствует категории Т.
Примечание: при классификации рТ, кроме опухоли, измеряют и инвазивный компонент. Если имеется широкий компонент in situ (например, 4 см) и небольшой инвазивный компонент (например, 0,5 см), то опухоль классифицируют как рТ1а.
22.4.2. pN – регионарные лимфатические узлы
Для патологоанатомической классификации необходимо удаление и исследование как минимум нижних подмышечных лимфатических узлов (I уровень). При этом должно быть удалено не менее 6 лимфатических узлов.
Если в лимфатических узлах метастазы не выявлены, но исследовано меньшее количество узлов, то классифицируют как pN0.
pNx – регионарные лимфатические узлы не могут быть оценены
pN0 – нет метастазов в регионарных лимфатических узлах*
pN1 – микрометастазы; или метастазы в 1–3 подмышечных лимфатических узлах на стороне поражения; и/или в клинически не определяемых* внутренних маммарных узлах при наличии метастаза, выявленного во время биопсии «сторожевого» лимфатического узла
pN1mi – микрометастазы (более 0,2 мм, но не более 2 мм и/или более 200 клеток)
pN1a – метастазы в 1–3 подмышечных лимфатических узлах, один из которых более 2 мм в наибольшем измерении
pN1b – клинически не определяемые* внутренние маммарные лимфатические узлы с микроскопическими или макроскопическими метастазами, выявленными во время биопсии «сторожевого» лимфатического узла
pN1c – метастазы в 1–3 подмышечных лимфатических узлах и в клинически не определяемых* внутренних маммарных лимфатических узлах с микроскопическими или макроскопическими метастазами, выявленными во время биопсии «сторожевого» лимфатического узла.
pN2 – метастазы в 4–9 подмышечных лимфатических узлах на стороне поражения или метастаз в клинически определяемом* внутреннем маммарном лимфатическом узле (узлах) на стороне поражения при отсутствии метастазов в подмышечных лимфатических узлах
pN2а – метастазы в 4–9 подмышечных лимфатических узлах, один из метастазов более 2 мм
pN2b – метастазы в клинически определяемых* внутренних маммарных лимфатических узлах (узле), при отсутствии метастаза в подмышечном лимфатическом узле
pN3 – метастазы:
pN3a – метастазы в 10 или более подмышечных лимфатических узлах (один из которых более 2 мм) или метастазы в подключичных лимфатических узлах
pN3b – метастазы в клинически определяемых* внутренних маммарных лимфатических узлах (узле) при наличии метастазов в подмышечных лимфатических узлах (узле); или метастазы более, чем в 3 клинически не определяемых* подмышечных лимфатических узлах с микроскопическими или макроскопическими метастазами, выявленными при биопсии «сторожевого» лимфатического узла.
pN3c метастазы в надключичных лимфатических узлах на стороне поражения.
Примечание:
* Изолированные клетки опухоли (ИКО). Скопление (кластер) ИКО представляет собой наличие единичных опухолевых клеток или их мелких скоплений размером не более 0,2мм в наибольшем измерении, которое определяется при рутинном исследовании препаратов, окрашенных гематоксилином и эозином, или при иммуногистохимическом исследовании. Дополнительным критерием для отнесения к скоплению ИКО является выявление менее 200 клеток в одном гистологическом срезе. Узлы, содержащие только ИКО, исключают из общего числа позитивных узлов при классификации категории N, но они должны быть включены в общее количество исследованных узлов.
22.4.3. ypN после лечения (у – классификация после первичного комплексного лечения, sn – сторожевой лимфатический узел).
ypN после лечения должно быть оценено так же, как и до лечения (клинически N). Обозначение (sn) используют в том случае, если оценка «сторожевого» узла была проведена после лечения. Если обозначение (sn) отсутствует, то предполагается, что оценка подмышечных узлов была выполнена после их диссекции
рубрикацию Х (ypNX) нужно использовать, если не была выполнена оценка ypN после лечения (sn) или диссекции подмышечных лимфатических узлов
категории N аналогичны тем, которые используют для pN.
Примечание: *Клинически определяемый – выявляемый при клиническом обследовании либо с помощью лучевых методов исследования (за исключением лимфосцинтиграфии) и имеющий признаки злокачественности или предполагающий патологический макрометастаз на основании тонкоигольной аспирационной биопсии с цитологическим исследованием. Клинически не определяемый – не выявляемый при клиническом обследовании или с помощью лучевых методов исследования (за исключением лимфосцинтиграфии).
22.4.4. М – отдаленные метастазы
рМ1 – отдаленный метастаз подтвержден при гистологическом исследовании
22.4.5. G – гистопатологическая классификация
G1 – высокая степень дифференцировки.
G2 – средняя степень дифференцировки.
G3 – низкая степень дифференцировки.
22.5. Группировка по стадиям
Таблица 22.2. Группировка по стадиям
| Стадия | T | N | M |
| Стадия 0 | Tis | N0 | M0 |
| Стадия IA | T1* | N0 | M0 |
| Стадия IB | T0, T1* | N1mi | M0 |
| Стадия IIA |
T0, T1*
T2
|
N1
N0
|
M0 |
| Стадия IIB |
T2 T3 |
N1
N0
|
M0 |
| Стадия IIIA |
T0, Т1*,T2
T3
|
N2
N1, N2
|
M0 |
| Стадия IIIB | T4 |
N0, N1, N2
|
M0 |
| Стадия IIIC | Любая T | N3 | M0 |
| Стадия IV | Любая T | Любая N | M1 |
______________________________
*T1 включает Т1mi.
Эпидемиология
22.1. Основные статистические показатели С50
Таблица 22.1. Основные статистические показатели
| Показатель | Число | |
| 2011 | 2016 | |
| Число вновь выявленных случаев заболевания | 3889 | 4428 |
| Заболеваемость на 100 000 населения (грубый интенсивный показатель) | 76,7 | 87,2 |
|
Диагноз установлен в I стадии заболевания (% к вновь выявленным
случаям)
|
25,2 | 31,9 |
|
Диагноз установлен в II стадии заболевания (% к вновь выявленным
случаям)
|
50,8 | 41,8 |
|
Диагноз установлен в III стадии заболевания (% к вновь выявленным
случаям)
|
18,4 | 19,7 |
|
Диагноз установлен в IV стадии заболевания (% к вновь выявленным
случаям)
|
5,6 | 6,6 |
|
Прожили менее года с момента установления диагноза из числа
заболевших в предыдущем году (одногодичная летальность в %)
|
6,4 | 4,8 |
| Умерло от злокачественных новообразований | 1200 | 1184 |
| Смертность на 100 000 населения Грубый интенсивный показатель | 23,7 | 23,3 |
| Отношение смертности к заболеваемости в % (интенсивные показатели) | 30,9 | 26,7 |
| Число пациентов, состоящих на учете на конец года | 36467 | 41863 |
| Из них состоящих на учете 5 и более лет, % | 59,4 | 59,9 |
Факторы и группы риска
22.6. Прогностические факторы
Таблица 22.3. Прогностические факторы
| Прогностические факторы | Связанные с опухолью |
Связанные с
пациентом
|
Связанные с окружающей
средой
|
| Существенные |
Эстрогенорецеп-торы HER2/neu рецепторы
Гистологическая степень злокачественности
Число и процент вовлеченных лимфатических узлов
Размер опухоли
Наличие лимфатической или сосудистой инвазии (LVI+)
Статус краев резекции
|
Возраст
Менопаузальный
статус
|
Предшествующее облучение, включающее Грудную клетку и средостение (например, лимфома Ходжкина)
|
| Дополнительные |
Рецепторы прогестерона
Характеристика опухоли
|
Мутации BRCA1/2
Ожирение
|
Применение постменопаузального гормонозамещения
|
| Новые и перспективные | Ki 67 |
Уровень активности или физической нагрузки.
Полиморфизмы
одиночных нуклеотидов, связанные с метаболизмом лекарственных препаратов или их действием.
|
Диагностика
22.7. Диагностические мероприятия
Диагностика рака молочной железы (РМЖ) включает оценку состояния первичного очага и выполнение адекватного стадирования опухолевого процесса.
Оценка первичного очага предусматривает клиническое обследование в комплексе с методами визуализации и патоморфологическим исследованием.
Клиническое обследование включает сбор анамнеза, осмотр и пальпацию молочных желез и регионарных зон.
Методы визуализации включают двустороннюю маммографию, ультразвуковое исследование молочных желез и регионарных зон.
Маммография и ультразвуковое исследование (УЗИ) дополняют друг друга, т.к. при маммографии могут быть видны опухоли, которые не определяются при УЗИ, и наоборот. При непальпируемых опухолях выполняется тонкоигольная биопсия или трепан-биопсия под контролем УЗИ либо маммографа.
При непальпируемой опухоли в молочной железе, отсутствии ультразвуковых и маммографических данных в пользу опухоли и наличии метастазов в регионарных лимфатических узлах, при расхождении маммографических и сонографических данных, для уточняющей диагностики, при оккультной форме опухоли выполняется магнитно-резонансная томография (МРТ) молочных желез. При воспалительной форме рака молочной железы и отсутствии опухоли в железе по данным УЗИ, маммографии, МРТ выполняется биопсия измененной кожи и подлежащих тканей.
С целью адекватного стадирования опухолевого процесса выполняются:
- УЗИ органов брюшной полости и таза;
- остеосцинтиграфия
- рентгенологическое исследование органов Грудной клетки
- консультация гинеколога
- консультация невролога
- трепан-биопсия опухоли с морфологическим исследованием
- пункционная биопсия регионарных лимфатических узлов (при подозрении на их поражение) с цитологическим исследованием.
-
КТ органов Грудной клетки, брюшной полости и малого таза, консультация невролога, КТ или МРТ головного мозга с контрастированием назначаются:
- пациентам с III стадией опухолевого процесса,
- пациентам с триплет-негативными опухолями,
- пациентам моложе 35 лет
- пациентам с первично и вторично диссеминированным опухолевым процессом.
По решению мультидисциплинарного консилиума назначается позитронно-эмиссионная томография совмещенная с компьютерной томографией (ФДГ ПЭТ-КТ).
У пациентов с отягощенным семейным анамнезом, а также у пациентов моложе 40 лет определяются мутации в генах BRCA1-2.
Морфологическая диагностика выполняется до начала специального лечения и включает выполнение трепан-биопсии (в отдельных случаях пункционной (тонкоигольной) биопсии) первичного очага и регионарных лимфатических узлов (при подозрении на их поражение). Трепан-биопсия опухоли с обязательным определением рецепторов эстрогена (ER), прогестерона (PR), эпидермального фактора роста HER2/neu, Ki-67 показана при планировании неоадъювантной терапии. При уровне экспрессии протеина HER2/neu 2+ необходимым является FISH или CISH – исследование.
22.7.1. Оценка гормонорецепторного статуса опухоли
В балльной шкале Аллреда (от 0 до 8) учитываются количественные соотношения и интенсивность окрашивания.
Число баллов 0 или 2 (обычно эквивалент 1 % клеток) считается отрицательным.
Число баллов 3–5 считается (и должно указываться в заключении) слабо положительным.
Число баллов 6–8 считается интенсивно положительным.
Таблица 22.4. Балльная шкала Аллреда
|
Соотношение окрашивания
|
Средняя интенсивность окрашивания
|
|
0=no nuclei staining – нет окрашенных ядер
|
0=None – нет
|
|
1=<1 % nuclei staining – ядерных прокрашиваний
|
1=Weak – слабая
|
|
2=1–10 % nuclei staining – ядерных прокрашиваний
|
2=Moderate – средняя
|
|
3=11–33 % nuclei staining – ядерных прокрашиваний
|
3=Strong – сильная
|
|
4=34–66 % nuclei staining – ядерных прокрашиваний
|
|
|
5=67–100 % nuclei staining – ядерных прокрашиваний
|
|
22.7.2. HER2/neu
Балльная система, используемая при всех иммуногистохимических анализах, должна соответствовать Британским рекомендациям по HER2/neu- тестированию, а именно:
0 – окрашивание отсутствует или окрашено <10 % мембран опухолевых клеток
1 – слабое окрашивание мембран выявляется в >10 % опухолевых клеток, но клетки окрашены только в части мембран
2 – слабое до умеренного окрашивание всей мембраны в >10 % опухолевых клеток
3 – интенсивное окрашивание всей мембраны в >10 % опухолевых клеток
Число баллов 0 ил 1 считается отрицательным
Число баллов 3 – положительное
Случаи с числом баллов 2 считаются пограничными, и выполняется анализ ISH для определения числа копий гена (это может быть FISH – флюоресцентная in situ гибридизация или CISH – хромогенная in situ гибридизация).
Определение амплификации гена HER2/neu
ISH используется для определения числа копий гена HER2/neu. В настоящее время число копий гена HER2/neu оценивается по отношению к числу копий хромосомы 17. В описание должны включаться как среднее число копий, так и отношение числа копий HER2/neu к числу копий хромосомы 17. Таким образом, отношение сигналов HER2/neu к сигналам хромосомы 17 описывается следующим образом:
- отношение <1,8 – амплификации нет, HER2/neu отрицательный;
- отношение 1,8–2,2 является пограничным, отношение сообщается или тест повторяется;
- если счет баллов остается 1,8–2,0, случай рассматривается как пограничный, амплификации нет, HER2/neu отрицательный;
- счет баллов 2,0–2,2 считается пограничным, но амплификация есть, и опухоль в целом HER2/neu – положительная;
- счет баллов >2,2 свидетельствует об амплификации HER2/neu, и опухоль считается HER2/neu – положительной.
При необходимости с диагностической целью выполняется секторальная резекция молочной железы с опухолью и/или биопсия пораженного лимфатического узла.
После выполнения радикального хирургического вмешательства в гистологическом заключении должны быть отражены молекулярно-генетические характеристики опухоли с обязательным указанием рецепторного статуса (ER, PR), эпидермального статуса, Ki-67, степени посттерапевтических изменений в первичной опухоли и лимфатических узлах (при проведении НПХТ). В морфологическом заключении должны указываться количество, максимальный диаметр опухолевых узлов в молочной железе, тип опухоли, степень дифференцировки опухоли, инвазия лимфатических и кровеносных сосудов, состояние краев отсечения (расстояние от края отсечения до края инвазии опухоли), количество удаленных и пораженных лимфатических узлов, характер их поражения – опухолевые клетки, микрометастазы, макрометастазы, прорастание капсулы лимфоузла.
При биопсии сигнальных лимфатических узлов указывается: число лимфоузлов, присутствие/отсутствие метастазов, диаметр метастазов в миллиметрах.
Клинико-лабораторные исследования включают:
- ЭКГ;
- группа крови и резус-фактор;
- анализ крови на сифилис (реакция микропреципитации);
- общий анализ крови;
- общий анализ мочи;
- биохимическое исследование крови (мочевина, креатинин, билирубин, глюкоза, АсАТ, АлАТ, щелочная фосфатаза, Са общий);
- коагулограмма (АЧТВ, ПВ, ТВ, фибриноген).
22.17. Наблюдение, сроки, объем обследования
После окончания специального лечения в течение первых двух лет женщины наблюдаются каждые 3 месяца, со 2-го по 5-й год – 1 раз в 6 месяцев, затем 1 раз в год пожизненно. Наблюдение осуществляется в областных и межрайонных онкологических диспансерах по месту жительства.
При каждом посещении необходимы осмотр онкологом, гинекологом, УЗИ молочных желез и регионарных зон.
При назначении тамоксифена перед началом его приема необходимо выполнить эндовагинальное УЗИ. Контроль за состоянием эндометрия осуществляется 1 раз в 3 месяца.
УЗИ органов брюшной полости и таза выполняется 1 раз в 6 месяцев в течение первых 2-х лет, затем 1 раз в год.
Рентгенологическое исследование органов Грудной клетки, маммография необходимо выполнять 1 раз в год.
Женщинам, принимающим ингибиторы ароматазы, с целью контроля за плотностью костной ткани рекомендуется 1 раз в 2 года выполнять денситометрию.
В случае появления признаков развития лимфедемы необходима консультация врача-реабилитолога.
Лечение
22.8. Общие принципы лечения
Рак молочной железы – гетерогенное заболевание с различными вариантами клинического течения опухолевого процесса. В связи с этим возникает необходимость выбора тактики лечения с учетом не только стадии заболевания, но и основных прогностических факторов.
Лечение РМЖ на современном этапе предполагает использование хирургического, лучевого компонентов, а также проведение системной цитостатической, эндокринной, биотерапии.
Важной составляющей комплексного лечения является операция.
Выбор того или иного вида радикальной операции определяется не только степенью распространения опухолевого процесса, но и клинической формой, локализацией опухоли, возрастом пациента и некоторыми другими факторами, характеризующими его общее состояние.
В последнее время все большее значение придается вопросам улучшения качества жизни, которое достигается выполнением органосохраняющих операций на молочной железе, а также реконструктивно-восстановительных операций с использованием местных тканей, имплантатов.
Выполнение органосохраняющей операции (лампэктомии с лимфаденэктомией) предполагает иссечение ткани железы с опухолью на всю глубину до фасции большой Грудной мышцы, отступив от краев опухоли не менее 2–10,0 мм. При выполнении органосохраняющих операций обязательным является гистологическое исследование краев резекции. В случае позитивного края выполняется повторная операция до негативных краев или мастэктомия.
При близком расположении опухоли к сосково-ареолярному комплексу обязательным является удаление подареолярной клетчатки. При медиальной локализации опухоли возможно ее удаление и выполнение лимфаденэктомии из отдельных доступов.
При выполнении органосохраняющей операции обязательным является интраоперационная маркировка ложа опухоли танталовыми скрепками (в количестве не менее 4), которые устанавливаются на Грудную мышцу в проекции удаленной опухоли для планирования и проведения послеоперационной лучевой терапии.
22.8.1. Абсолютные и относительные противопоказания к выполнению органосохраняющего лечения
Абсолютные противопоказания:
- предшествующее облучение Грудной стенки и молочной железы,
- наличие диффузных злокачественных микрокальцинатов,
- опухоль молочной железы, которую невозможно удалить с достижением негативного края резекции и получения удовлетворительного косметического результата.
Относительные противопоказания:
- наличие активного заболевания соединительной ткани с вовлечением кожи (в частности, склеродермия и системная красная волчанка);
- наличие опухоли, размером более 5,0 см;
- позитивный край иссечения опухоли;
- развитие рака молочной железы у женщин моложе 35 лет;
- наличие в анамнезе известной или подозреваемой генетической предрасположенности, что создает высокий риск развития ипсилатерального рецидива или контралатерального рака молочной железы.
Реконструктивно-восстановительные операции могут выполняться при I–III стадиях РМЖ по желанию пациента.
Женщина должна быть ознакомлена со всеми видами хирургических вмешательств, а также со всем комплексом планируемых лечебных мероприятий.
Реконструкция молочной железы. Восстанавливать молочную железу можно как одномоментно, так и отсрочено (после завершения комплексного лечения). Для восстановления молочной железы можно использовать имплантаты, кожно-мышечные лоскуты, либо сочетание имплантатов и собственных тканей пациента.
Предполагаемая частота локального рецидива при подкожной (кожесохраняющей) мастэктомии такая же, как и при обычной мастэктомии.
Режимы и показания к проведению послеоперационной лучевой терапии после кожесохраняющей мастэктомии такие же, как и после обычной мастэктомии.
Сосково-ареолярный комплекс при выполнении кожесохраняющей мастэктомии удаляется при локализации опухоли в центральной зоне или в зоне, прилежащей к ареоле.
Выбор метода реконструкции молочной железы основывается на совокупности ряда факторов: оценке комплексного противоопухолевого лечения, конституциональных особенностей пациента, сопутствующих заболеваний, пожеланий пациента. Пациенты должны быть информированы об увеличении риска послеоперационных осложнений, частичных и полных некрозах лоскутов у курильщиц.
22.8.2. Адъювантная химиотерапия
При отсутствии серьезных сопутствующих заболеваний нет возрастного ценза для проведения адъювантной химиотерапии.
Адъювантная химиотерапия проводится в дополнение к хирургическому лечению и позволяет снизить риск возврата болезни и смерти.
При планировании адъювантной химиотерапии необходимо учитывать факторы риска возврата болезни, возможные побочные эффекты, сопутствующую патологию, а также предпочтения самого пациента. Лечение необходимо начинать в сроки от 2 до 6 недель после операции.
Вид адъювантной лекарственной терапии определяется молекулярно-биологическим подтипом опухоли молочной железы (таблицы 22.5, 22.6).
Таблица 22.5. Молекулярно-биологические подтипы рака молочной железы (St. Gallen, 2015)
|
Молекулярно-биологический подтип
|
Характеристики подтипа
|
|
Люминальный А
|
Наличие всех факторов:
ER положительные
HER2/neu отрицательный
Ki67 низкий (20 %)
PR высокие (>20 %)
|
|
Люминальный В
HER2 отрицательный
Люминальный В
HER2 положительный
|
ER положительные
HER2/neu отрицательный
и наличие одного из следующих факторов:
Ki67 высокий (>20 %)
PR низкие (<20 %)
ER положительные
HER2/neu положительный
Ki67 любой
PR любые
|
|
HER2 положительный (не люминальный)
|
HER2/neu положительный
ER и PR отрицательные
|
|
Тройной негативный
|
отрицательные ER, PR, HER2 /neu
|
Таблица 22.6. Системная терапия в зависимости от молекулярно-биологического подтипа рака молочной железы
|
Молекулярно-биологический подтип
|
Системная терапия
|
Примечания
|
|
Люминальный А
|
В большинстве случаев только гормонотерапия
|
Химиотерапия (в большинстве случаев АС – 4 курса, CMF-6 курсов) назначается дополнительно к гормонотерапии при наличии одного из факторов:
– большая распространенность опухолевого процесса: Т≥3, количество пораженных лимфатических узлов ≥4;
– III степень злокачественности;
– молодой возраст пациента (<35 лет);
выраженная лимфоваскулярная инвазия |
|
Люминальный В HER2/neu отрицательный
|
В большинстве случаев гормонотерапия +химиотерапия
|
Химиотерапевтические режимы должны включать антрациклины и таксаны
|
|
Люминальный В HER2/neu положительный
|
Химиотерапия + гормонотерапия + анти-HER2/neu
|
Нет данных о целесообразности отказа от химиотерапии при этом подтипе опухоли
Химиотерапевтические режимы должны включать антрациклины и таксаны
|
|
HER2/neu положительный (не люминальный)
|
Химиотерапия +анти-HER2/neu
Химиотерапевтические режимы должны
включать антрациклины и таксаны
|
Анти-HER2/neu терапия показана при ≥Т1b или N+
|
|
Тройной негативный
|
Химиотерапия с включением антрациклинов и таксанов
|
Препараты платины могут быть включены в схему химиотерапии у пациентов с мутациями гена BRCA
|
22.8.3. Неоадъювантная лекарственная терапия первично резектабельного рака молочной железы
При отсутствии серьезных сопутствующих заболеваний нет возрастного ценза для проведения неоадъювантной химиотерапии.
Проведение неоадъювантной терапии при первично операбельном раке молочной железы позволяет:
- создать условия для выполнения органосохраняющих и реконструктивно-восстановительных операций на молочной железе;
- улучшить прогноз в случае достижения полной патоморфологической регрессии;
- оценить эффект лекарственной терапии и своевременно изменить тактику лечения.
Начинать неоадъювантную терапию можно только при наличии полной информации о гистологической и молекулярно-генетической структуре опухоли. Перед началом неоадъювантной терапии при наличии данных о поражении регионарных лимфатических узлов показана верификация процесса путем пункционной биопсии узлов без или под сонографическим контролем. За исходную точку оценки эффективности принимается объем опухоли молочной железы до начала специального лечения. Оценка эффективности неоадъювантной химиотерапии проводится после каждых 2-х курсов. Неоадъювантную терапию по выбранной схеме проводят до стабилизации процесса или до достижения полной регрессии опухоли. При получении «быстрого» клинического ответа (после 2–4 курсов) объем химиотерапии не следует сокращать. Общее количество курсов – 6–8.
При отсутствии эффекта после проведения 2-х курсов неоадъювантной химиотерапии возможно или выполнение операции, или переход на другую схему, если пациент настаивает на органосохраняющей или реконструктивно-восстановительной операции.
Пациентам с люминальным А подтипом рака молочной железы в ряде случаев в качестве неоадъювантного лечения может быть назначена гормонотерапия, которая проводится в течение 4–8 месяцев с периодическим контролем ее эффективности.
22.8.4. Режимы адъювантной и неоадъювантной химиотерапии
Таблица 22.7. Режимы адъювантной и неоадъювантной химиотерапии
|
FAC
|
5-фторурацил 500 мг/м2 в/в+ доксорубицин 50 мг/м2 в/в + циклофосфамид 500 мг/м2 в/в 1 раз в 3 недели 6 циклов (возможна замена доксорубицина на эпирубицин в равно эффективной дозе)
|
|
CAF
|
циклофосфамид 100 мг/м2 внутрь 1–14 дни + доксорубицин 30 мг/м2 в/в в 1-й и 8-й день, 5-фторурацил 500 мг/м2 в/в в 1-й и 8-й день 1 раз в 4 недели 6 циклов
|
|
АС
|
доксорубицин 60 мг/м2 в/в + циклофосфамид 600 мг/м2 в/в 1 раз в 3 недели 4–6 циклов
|
|
AC×4→D×4
|
Режим АС 1 раз в 3 недели 4 цикла → доцетаксел 75–100 мг/м2 в/в 1 раз в 3 нед. 4 цикла (при использовании доцетаксела в дозе 100 мг/м2 обязательно профилактическое назначение колониестимулирующих факторов)
|
|
AC×4→Р×12
|
Режим АС 1 раз в 3 недели 4 цикла → паклитаксел 80 мг/м2 в/в еженедельно 12 введений
|
|
CMF
|
циклофосфамид 100 мг/м2 внутрь в 1-14 дни + метотрексат 40 мг/м2 в/в в 1 и 8 дни + 5- фторурацил 600 мг/м2 в в/в 1 и 8 дни 1 раз в 4 недели 6 циклов
|
|
ТС
|
доцетаксел 75 мг/м2 в/в + циклофосфамид 600 мг/м2 в/в 1 раз в 3 недели 4–6 циклов
|
|
АТ
|
доксорубицин 50 мг/м2 в/в в течение 20–30 мин в 1-й день; паклитаксел 200 мг/м2 в/в в 1-й день на фоне пре- постмедикации; Интервал 3 недели, 6 циклов
|
|
ТАС
|
доцетаксел 75 мг/м2 в/в, доксорубицин 50 мг/м2 в/в, циклофосфамид 500 мг/м2 в/в, каждые
3 недели, 6 циклов (обязательно профилактическое назначение колониестимулирующих
факторов: пэгфилграстим – 6 мг п/к во 2-ой день или филграстим – 5мкг/кг п/к
ежедневно со 2-го дня как минимум в течение 5 дней)
|
|
Винорелбин+
циклофосфамид+
флуороурацил
|
винорелбин – 30 мг/м2 в/в 1-й и 5-й дни +
циклофосфамид – 500мг/м2 в/в 1-й день +
флуороурацил – 600 г/м2/сутки в виде непрерывной инфузии с 1-го по 5-й дни, интервал 3 недели
|
22.8.5. Адъювантная гормонотерапия
Адъювантная гормонотерапия показана всем пациентам с гормонозависимыми опухолями. Гормонозависимыми считаются опухоли с экспрессией ER в ≥1 % клеток инвазивного РМЖ. При значениях ER от 1 % до 9 % назначение только гормонотерапии является недостаточным. Адъювантная гормонотерапия проводится после окончания адъювантной химиотерапии. Если адъювантная химиотерапия не показана, то адъювантная гормонотерапия проводится после хирургического лечения и может сочетаться с лучевой терапией и с введением трастузумаба. Длительность гормонотерапии составляет 5 лет и более. Выбор режима гормонотерапии зависит от функции яичников и сопутствующей патологии.
Тамоксифен может использоваться как у пациентов в пременопаузе (с сохраненной функцией яичников), так и в менопаузе. Ингибиторы ароматазы противопоказаны при сохраненной функции яичников и могут назначаться только пациентам, достигшим стойкой менопаузы (в том числе с помощью овариальной супрессии). Критериями менопаузы являются:
- билатеральная овариэктомия;
- возраст >60 лет;
- возраст <60лет: при отсутствии химиотерапии, терапии тамоксифеном и овариальной супрессии аменорея в течение >1–2месяцев в сочетании с постменопаузальными уровнями фолликулостимулирующего гормона (ФСГ) и эстрадиола;
- при терапии тамоксифеном постменопаузальные уровни ФСГ и эстрадиола.
Для достижения овариальной супрессии могут быть использованы:
- билатеральная овариэктомия – необратимое выключение функции яичников;
- применение аналогов гонадотропин-релизинг-гормона (ГРГ) (прием ингибиторов ароматазы следует начинать через 6–8 недель после первого введения ГрГ) – обратимое выключение функции яичников. Оптимальная продолжительность не определена. Обычно назначается на срок 2–5 лет, необходима в течение всего срока приема ингибиторов ароматазы.
22.8.6. Рекомендуемые режимы адъювантной гормонотерапии в зависимости от функции яичников
Таблица 22.8. Рекомендуемые режимы адъювантной гормонотерапии в зависимости от функции яичников
|
Пременопауза
|
|
|
Тамоксифен – 5 лет
|
–
|
|
Тамоксифен – 10 лет
|
при наличии хотя бы одного фактора неблагоприятного прогноза
|
|
Тамоксифен 5 лет → ингибиторы ароматазы – 5 лет
|
Для пациенток, достигших стойкой менопаузы к моменту окончания приема тамоксифена, при наличии хотя бы одного фактора неблагоприятного прогноза
|
|
Менопауза
|
|
|
Тамоксифен – 5 лет
|
–
|
|
Ингибиторы ароматазы – 5 лет
|
При противопоказаниях к приему тамоксифена, при наличии хотя бы одного фактора неблагоприятного прогноза
|
|
Тамоксифен – 10 лет
|
При наличии хотя бы одного фактора неблагоприятного прогноза
|
|
Тамоксифен 5 лет → ингибиторы ароматазы – 5 лет
|
При наличии хотя бы одного фактора неблагоприятного прогноза
|
|
Ингибиторы ароматазы – 2–3 года, далее тамоксифен – 2–3 года
|
При использовании режимов перехода с одного вида гормонотерапии на другой на первом этапе следует использовать ингибиторы ароматазы
|
Факторы неблагоприятного прогноза:
возраст < 35 лет, Т3-4, поражение ≥4 подмышечных лимфатических узлов, III степень злокачественности, положительный Her2/neu, высокий Ki67, выраженная лимфоваскулярная инвазия.
Прием тамоксифена сопряжен с повышенным риском развития тромбоэмболических осложнений и гиперплазии эндометрия, вплоть до развития рака эндометрия. В связи с этим, пациентам показано выполнение эндовагинального УЗИ до начала приема тамоксифена и периодически (1 раз в 3 месяца) в ходе проведения эндокринотерапии.
Прием ингибиторов ароматазы сопряжен с риском развития остеопороза. В связи с этим необходимо назначать терапию сопровождения – кальций и витамин Д. Международная организация по борьбе с остеопорозом рекомендует постменопаузальным женщинам, получающим терапию ингибиторами ароматазы как минимум 800, а максимум 2000 МЕ витамина Д в день, ежедневный прием 1300 мг кальция. Рекомендуется также периодический контроль плотности костной ткани – денситометрия.
Пациентам с гормонозависимым раком молочной железы в менопаузе может быть назначена золедроновая кислота (4 мг в/в 1 раз в 6 месяцев в течение 3–5 лет) для профилактики остеопороза и снижения риска рецидива болезни.
22.8.7. Лучевая терапия
Предлучевая подготовка проводится с использованием фиксирующих устройств либо других приспособлений на компьютерных томографах и рентгентопометрических симуляторах.
Назначение лучевой терапии должно быть основано на стадии заболевания, установленной до проведения неоадъювантной терапии.
Лучевая терапия при раке молочной железы проводится с использованием конформного 3D, IMRT или 4D планирования (при наличии соответствующего радиотерапевтического оборудования).
Размеры первичной опухоли более 5,0 см, вне зависимости от поражения лимфатических узлов, а также обнаружение метастазов в более, чем трех лимфатических узлах, являются безоговорочными показаниями к послеоперационной лучевой терапии.
Лучевая терапия у пациентов после химиотерапии должна быть начата в течение 3–4 недель после окончания лекарственной терапии, но не позднее 6 месяцев после операции.
Пациенты, которым не показана адъювантная химиотерапия, должны начать лучевую терапию в течение первых 8 недель после операции.
Лучевая терапия у пациентов после химиотерапии должна быть начата в течение 3–4 недель после окончания лекарственной терапии, но не позднее 6 месяцев после операции.
Пациенты, которым не показана адъювантная химиотерапия, должны начать лучевую терапию в течение первых 8 недель после операции.
Длительные перерывы в лечении должны быть исключены; максимальная задержка между лечебными циклами – не более 1 недели.
22.8.8. Таргетная терапия
Пациентам с гиперэкспрессией HER2/neu или амплификацией HER2/neu, в том числе при ≥ рТ1b или pN+, показано назначение трастузумаба. Трастузумаб вводится внутривенно 1 раз в 3 нед. в дозе 6 мг/кг (первая доза – 8 мг/кг) или еженедельно в дозе 2 мг/кг (первая доза – 4 мг/кг). Стандартная продолжительность лечения трастузумабом составляет 1 год (17 введений). Трастузумаб может вводиться подкожно 600 мг с интервалом 1 раз в 3 недели независимо от веса пациентки.
Введение трастузумаба рекомендуется начинать одновременно с химиотерапией (одновременно с таксанами, но после антрациклинов). Трастузумаб не должен назначаться женщинам со снижением сократительной способности миокарда (ФВЛЖ<50 %). В процессе лечения трастузумабом необходим контроль сократительной способности миокарда (ФВЛЖ) с периодичностью 1 раз в 3мес.
Таблица 22.9. Режимы адъювантной химиотерапии с трастузумабом
|
АС – P + Т
|
доксорубицин, 60 мг/м2 + циклофосфамид 600 мг/м2 в/в в 1-й день каждые 3 недели, 4 курса.
Через 3 недели паклитаксел 80 мг/м2 в/в еженедельно, 12 курсов или 175 мг/м2 в/в в 1-й день каждые 3 недели, 4 курса + трастузумаб 8 мг/кг (первое введение) → 6 мг/кг в/в или 600 мг подкожно каждые 3 недели в течение 1 года.
Введение трастузумаба начинается одновременно с введением паклитаксела
|
|
АС – D + Т
|
доксорубицин 60 мг/м2 в/в + циклофосфамид 600 мг/м2 в/в в 1-й день каждые 3 недели, 4 курса через 3 недели доцетаксел 100 мг/м2 в/в в 1-й день каждые 3 недели, 4 курса + трастузумаб 8 мг/кг (первое введение) → 6 мг/кг в/в или 600 мг подкожно каждые 3 недели в течение 1 года.
Введение трастузумаба начинается одновременно с введением доцетаксела
|
|
ТСН
|
(доцетаксел, 75 мг/м2, + карбоплатин AUC 6) в/в в 1-й день каждые 3 недели, 6 курсов + трастузумаб 8 мг/кг (первое введение) → 6 мг/кг в/в или 600 мг подкожно каждые 3 недели в течение 1 года.
Введение трастузумаба начинается одновременно с началом химиотерапии
|
При использовании доцетаксела в дозе 100 мг/м2 обязательно профилактическое назначение колониестимулирующих факторов.
22.9. Лечение по стадиям
22.9.1. Внутрипротоковая карцинома in situ
Возможны следующие варианты лечения:
1) резекция молочной железы без вмешательства на лимфоаппарате с последующим облучением всей молочной железы.
Возможно проведение следующих схем лучевой терапии:
РОД 2,66 Гр, 16 фракций, СОД 42,56 Гр.
РОД 1,8–2Гр, СОД 45–50 Гр.
Проводится конформная лучевая терапии (3D), лучевая терапия с модуляцией интенсивности дозы излучения (IMRT), при левосторонней локализации опухолевого процесса возможно использование 4D (с учетом фазы дыхания) планирования при наличии соответствующего радиотерапевтического оборудования.
У пациентов с низким риском локального рецидива (размер опухоли <10 мм, низкая и средняя степень злокачественности, адекватный край иссечения) консилиумом специалистов может обсуждаться вопрос об отказе от лучевой терапии.
2) мастэктомия:
± биопсия сигнального лимфатического узла;
± реконструкция Груди.
После выполнения мастэктомии послеоперационная лучевая терапия не проводится.
При положительном гормонорецепторном статусе опухоли пациентам назначается гормонотерапия в течение 5 лет (в пременопаузе – тамоксифен в постменопаузе – тамоксифен или ингибиторы ароматазы).
22.9.2. Дольковая карцинома in situ
Лобулярная неоплазия является фактором риска развития инвазивного рака обеих молочных желез.
После установления диагноза, при иссечении опухоли с получением «чистых краев», дальнейшее лечение направлено на снижение риска развития инвазивного рака обеих молочных желез.
Возможны следующие варианты:
профилактическая двусторонняя мастэктомия с/без первичной маммопластики;
гормонотерапия с ежегодным контрольным обследованием.
Послеоперационная лучевая терапия не проводится за исключением плеоморфного варианта, лечение которого такое же как и при внутрипротоковой карциноме in situ.
22.9.3. IA (T1N0M0) IB (T0-1N1mi M0) IIA (Т2N0М0)
Возможны следующие варианты лечения:
1) органосохраняющая операция с лимфаденэктомией I–II уровней ± химиотерапия /гормонотерапия + лучевая терапия.
Возможно проведение следующих схем лучевой терапии:
РОД 2,66 Гр, 16 фракций, СОД 42,56 Гр ± дополнительное облучение ложа опухоли РОД 2 Гр, СОД 10–16 Гр (фотонное излучение, брахитерапия, электронный пучок.
РОД 1,8–2 Гр, СОД 45–50 Гр на всю молочную железу ± дополнительное облучение ложа опухоли РОД 2 Гр, СОД 10–16 Гр (фотонное излучение, брахитерапия, электронный пучок).
Возможно также облучение всей молочной железы и ложа опухоли РОД 3,2 Гр с добавлением дозы 0,7 Гр (интегрированный буст) на ложе опухоли два раза в день через 6 часов 5 раз в неделю, всего 10 сеансов. СОД на всю молочную железу составляет 32,0 Гр (изоэквивалентная дозе 50 Гр в режиме стандартного облучения), на ложе опухоли – 39 Гр (изоэквивалентная дозе 66 Гр в режиме стандартного облучения).
Проводится конформная лучевая терапии (3D), лучевая терапия с модуляцией интенсивности дозы излучения (IMRT), при левосторонней локализации опухолевого процесса возможно использование 4D (с учетом фазы дыхания) планирования при наличии соответствующего радиотерапевтического оборудования.
Дополнительное лучевое воздействие (буст) локально на ложе удаленной опухоли молочной железы (при условии интраоперационного клиппирования) проводят по показаниям:
- пациентам моложе 50 лет,
- при наличии признаков сосудистой инвазии,
- опухолевых клетках в краях резекции,
- низкой степени дифференцировки опухоли (G3),
- выраженном внутрипротоковом компоненте.
2) мастэктомия с лимфаденэктомией I–II уровней ± первичная маммопластика ± химиотерапия/ гормонотерапия.
После мастэктомии лучевая терапия не проводится.
У пациентов с недостаточным объемом железы для выполнения органосохраняющих или реконструктивно-восстановительных операций с хорошим косметическим результатом, но при их желании выполнить подобные операции лечение может быть начато с неоадъювантной химиотерапии или гормонотерапии. Далее следует хирургический этап лечения (органосохраняющая операция/мастэктомия с лимфаденэктомией I–II уровней + первичная маммопластика) ± химиотерапия (суммарное количество курсов 6–8) / гормонотерапия ± лучевая терапия.
Альтернативой подмышечной лимфаденэктомии является биопсия сторожевого лимфатического узла. При выявлении метастатического поражения сторожевого лимфатического узла на усмотрение хирурга удаляют лимфатические узлы I–II или I–III уровней. При отсутствии поражения сторожевого лимфатического узла подмышечную лимфаденэктомию не выполняют. При невозможности использовать технологию удаления сторожевого лимфатического узла показано удаление лимфатических узлов I–II уровней
Выбор схемы химиотерапии определяется молекулярно-генетической структурой опухоли.
Выбор гормонотерапии определяется менструальным статусом пациента и характером сопутствующей патологии.
22.9.4. IIA (T0N1M0; T1N1M0)
Возможны следующие варианты лечения:
1) органосохраняющая операция с лимфаденэктомией I–II / I–III уровней ± химиотерапия / гормонотерапия + лучевая терапия.
Возможно проведение следующих схем лучевой терапии: РОД 2,66 Гр, 16 фракций, СОД 42,56 Гр на всю молочную железу и зоны регионарного метастазирования (над-подключичная область на стороне поражения) ± дополнительное облучение ложа опухоли РОД 2 Гр, СОД 10–16 Гр (фотонное излучение, брахитерапия, электронный пучок).
РОД 1,8–2 Гр, СОД 45–50 Гр на всю молочную железу и зоны регионарного метастазирования (над-подключичная область на стороне поражения) ± дополнительное облучение ложа опухоли РОД 2 Гр, СОД 10–16 Гр (фотонное излучение, брахитерапия, электронный пучок).
Проводится конформная лучевая терапии (3D), лучевая терапия с модуляцией интенсивности дозы излучения (IMRT), при левосторонней локализации опухолевого процесса возможно использование 4D (с учетом фазы дыхания) планирования при наличии соответствующего радиотерапевтического оборудования.
- пациентам моложе 40 лет,
- при наличии лимфоваскулярной инвазии,
- при мультицентричном росте опухоли,
- при количестве исследованных лимфатических узлов менее 10,
- при распространении опухоли за капсулу лимфатического узла,
- при низкой степени дифференцировки опухоли (G3),
- при триплет-негативных опухолях,
-
при высокой пролиферативной активности опухоли (Ki 67 >20).
Лучевая терапия на парастернальную область проводится при клиническом или патогистологическом подтверждении поражения парастернальных лимфатических узлов.
2) мастэктомия с лимфаденэктомией I–III уровней ± первичная маммопластика ± химиотерапия/ гормонотерапия ± лучевая терапия.
Возможно проведение следующих схем лучевой терапии:
РОД 2,66 Гр, 16 фракций, СОД 42,56 Гр на Грудную стенку и зоны регионарного метастазирования (над-подключичная область на стороне поражения)
РОД 1,8–2 Гр, СОД 45–50 Гр на Грудную стенку и зоны регионарного метастазирования (над-подключичную область на стороне поражения)
Лучевая терапия на парастернальную область проводится при клиническом или патогистологическом подтверждении поражения парастернальных лимфатических узлов.
______________________________
*При проведении лучевой терапии на Грудную стенку в объем облучения включается Грудная стенка, послеоперационный рубец и зоны дренажей.
Проводится конформная лучевая терапии (3D), лучевая терапия с модуляцией интенсивности дозы излучения (IMRT) при наличии соответствующего радиотерапевтического оборудования.
3) неоадъювантная химиотерапия или гормонотерапия + хирургический этап (органосохраняющая операция/мастэктомия с лимфаденэктомией I–III уровней ± первичная маммопластика) ± химиотерапия (суммарное количество курсов 6–8) / гормонотерапия ± лучевая терапия.
Выбор схемы химиотерапии определяется молекулярно-генетической структурой опухоли.
Выбор гормонотерапии определяется менструальным статусом пациента и характером сопутствующей патологии.
22.9.5. II B (T2N1M0; T3N0M0)
Возможны следующие варианты лечения:
1) органосохраняющая операция с лимфаденэктомией I–III уровней ±химиотерапия / гормонотерапия + лучевая терапия
Органосохраняющая операция выполняется на первом этапе, если соотношение размеров первичного очага и молочной железы позволяют ее выполнить с соблюдением онкологических канонов и достижением хорошего эстетического результата.
Возможно проведение следующих схем лучевой терапии:
РОД 2,66 Гр, 16 фракций, СОД 42,56 Гр на всю молочную железу и зоны регионарного метастазирования (над-подключичная область на стороне поражения) ± дополнительное облучение ложа опухоли РОД 2 Гр, СОД 10–16 Гр (фотонное излучение, брахитерапия, электронный пучок).
РОД 1,8–2 Гр, СОД 45–50 Гр на всю молочную железу и зоны регионарного метастазирования (над-подключичная область на стороне поражения) ± дополнительное облучение ложа опухоли РОД 2 Гр, СОД 10–16 Гр (фотонное излучение, брахитерапия, электронный пучок).
Лучевая терапия на парастернальную область проводится при клиническом или патогистологическом подтверждении поражения парастернальных лимфатических узлов, при первичной опухоли более 5 см, медиально-центральном ее расположении.
Проводится конформная лучевая терапии (3D), лучевая терапия с модуляцией интенсивности дозы излучения (IMRT), при левосторонней локализации опухолевого процесса возможно использование 4D (с учетом фазы дыхания) планирования при наличии соответствующего радиотерапевтического оборудования.
2) мастэктомия с лимфаденэктомией I–III уровней ± первичная маммопластика ± химиотерапия / гормонотерапия ± лучевая терапия.
Возможно проведение следующих схем лучевой терапии:
РОД 2,66 Гр, 16 фракций, СОД 42,56 Гр на Грудную стенку и зоны регионарного метастазирования (над-подключичная область на стороне поражения).
РОД 1,8–2Гр, СОД 45–50 Гр на Грудную стенку и зоны регионарного метастазирования (над-подключичная область на стороне поражения).
Лучевая терапия на парастернальную область проводится при клиническом или патогистологическом подтверждении поражения парастернальных лимфатических узлов, при первичной опухоли более 5 см, медиально-центральном ее расположении.
Проводится конформная лучевая терапии (3D), лучевая терапия с модуляцией интенсивности дозы излучения (IMRT) при наличии соответствующего радиотерапевтического оборудования.
3) неоадъювантная химиотерапия или гормонотерапия + хирургический этап (органосохраняющая операция/мастэктомия с лимфаденэктомией I–III уровней ± первичная маммопластика) ± химиотерапия (суммарное количество курсов 6–8) / гормонотерапия ± лучевая терапия.
При отсутствии эффекта от проведения неоадъювантной терапии и желании пациента выполнить органосохраняющую или реконструктивную операцию, назначается вторая линия химиотерапии. При отсутствии эффекта на альтернативную схему выполняется мастэктомия ± реконструкция.
Выбор схемы химиотерапии определяется молекулярно-генетической структурой опухоли.
Выбор гормонотерапии определяется менструальным статусом пациента и характером сопутствующей патологии.
При поражении 1–3 лимфатических узлов лучевую терапию на зоны регионарного метастазирования (над-подключичная область на стороне поражения) проводят:
- пациентам моложе 40 лет,
- при наличии лимфоваскулярной инвазии,
- при мультицентричном росте опухоли,
- при количестве исследованных лимфатических узлов менее 10,
- при распространении опухоли за капсулу лимфатического узла,
- при низкой степени дифференцировки опухоли (G3),
- при триплет-негативных опухолях,
- при высокой пролиферативной активности опухоли.
22.9.6. IIIA – T3N1M0
Возможны следующие варианты лечения:
1) неоадъювантная химиотерапия + органосохраняющая операция с лимфаденэктомией I–III уровней ± химиотерапия (суммарное количество курсов 6–8) /гормонотерапия + лучевая терапия.
Возможно проведение следующих схем лучевой терапии:
РОД 2,66 Гр, 16 фракций, СОД 42,56 Гр на всю молочную железу и зоны регионарного метастазирования (над-подключичная область на стороне поражения) ± дополнительное облучение ложа опухоли РОД 2 Гр, СОД 10–16 Гр (фотонное излучение, брахитерапия, электронный пучок).
РОД 1,8–2 Гр, СОД 45–50 Гр на всю молочную железу и зоны регионарного метастазирования (над-подключичная область на стороне поражения) ± дополнительное облучение ложа опухоли РОД 2 Гр, СОД 10–16 Гр (фотонное излучение, брахитерапия, электронный пучок).
Лучевая терапия на парастернальную область проводится при клиническом или патогистологическом подтверждении поражения парастернальных лимфатических узлов, при первичной опухоли более 5 см, медиально-центральном ее расположении.
Проводится конформная лучевая терапии (3D), лучевая терапия с модуляцией интенсивности дозы излучения (IMRT), при левосторонней локализации опухолевого процесса возможно использование 4D (с учетом фазы дыхания) планирования при наличии соответствующего радиотерапевтического оборудования.
2) неоадъювантная химиотерапия или гормонотерапия + мастэктомия с лимфаденэктомией I–III уровней ± первичная маммопластика ± химиотерапия (суммарное количество курсов 6–8) /гормонотерапия + лучевая терапия.
Возможно проведение следующих схем лучевой терапии:
РОД 2,66 Гр, 16 фракций, СОД 42,56 Гр на Грудную стенку и зоны регионарного метастазирования (над-подключичная область на стороне поражения).
РОД 1,8–2Гр, СОД 45–50 Гр на Грудную стенку и зоны регионарного метастазирования (над-подключичная область на стороне поражения)
Лучевая терапия на парастернальную область проводится при клиническом или патогистологическом подтверждении поражения парастернальных лимфатических узлов, при первичной опухоли более 5 см, медиально-центральном ее расположении.
Проводится конформная лучевая терапии (3D), лучевая терапия с модуляцией интенсивности дозы излучения (IMRT) при наличии соответствующего радиотерапевтического оборудования.
При отсутствии эффекта на неоадъювантную терапию и желании пациента выполнить органосохраняющую или реконструктивную операцию, назначается вторая линия химиотерапии. При отсутствии эффекта на альтернативную схему выполняется мастэктомия без реконструкции.
3) мастэктомия с лимфаденэктомией I–III уровней ± химиотерапия / гормонотерапия ± лучевая терапия.
Возможно проведение следующих схем лучевой терапии:
РОД 2,66 Гр, 16 фракций, СОД 42,56 Гр на Грудную стенку и зоны регионарного метастазирования (над-подключичная область на стороне поражения).
РОД 1,8–2Гр, СОД 45–50 Гр на Грудную стенку и зоны регионарного метастазирования (над-подключичная область на стороне поражения).
Лучевая терапия на парастернальную область проводится при клиническом или патогистологическом подтверждении поражения парастернальных лимфатических узлов, при первичной опухоли более 5 см, медиально-центральном ее расположении.
Проводится конформная лучевая терапии (3D), лучевая терапия с модуляцией интенсивности дозы излучения (IMRT) при наличии соответствующего радиотерапевтического оборудования.
Выбор схемы химиотерапии определяется молекулярно-генетической структурой опухоли.
Выбор гормонотерапии определяется менструальным статусом пациента и характером сопутствующей патологии.
22.9.7. IIIA (T0N2M0; T1N2M0; T2N2M0; T3N2M0) IIIB (T4N0M0; T4N1M0; T4N2M0)
Возможные варианты лечения:
1) мастэктомия с лимфаденэктомией I–III уровней ± химиотерапия / гормонотерапия / таргетная терапия + лучевая терапия.
Возможно проведение следующих схем лучевой терапии:
РОД 2,66 Гр, 16 фракций, СОД 42,56 Гр на Грудную стенку и зоны регионарного метастазирования (над-подключичная область на стороне поражения).
РОД 1,8–2Гр, СОД 45–50 Гр на Грудную стенку и зоны регионарного метастазирования (над-подключичная область на стороне поражения).
Лучевая терапия на парастернальную область проводится при клиническом или патогистологическом подтверждении поражения парастернальных лимфатических узлов, при первичной опухоли более 5 см, медиально-центральном ее расположении и при поражении 4 и более лимфатических узлов.
Проводится конформная лучевая терапии (3D), лучевая терапия с модуляцией интенсивности дозы излучения (IMRT) при наличии соответствующего радиотерапевтического оборудования.
2) неоадъювантная химиотерапия или гормонотерапия + мастэктомия с лимфаденэктомией I–III уровней ± химиотерапия (суммарное количество курсов 6–8) / гормонотерапия / таргетная терапия + лучевая терапия.
Возможно проведение следующих схем лучевой терапии:
РОД 2,66 Гр, 16 фракций, СОД 42,56 Гр на Грудную стенку и зоны регионарного метастазирования (над-подключичная область на стороне поражения).
РОД 1,8–2Гр, СОД 45–50 Гр на Грудную стенку и зоны регионарного метастазирования (над-подключичная область на стороне поражения).
Лучевая терапия на парастернальную область проводится при клиническом или патогистологическом подтверждении поражения парастернальных лимфатических узлов, при первичной опухоли более 5 см, медиально-центральном ее расположении и при поражении 4 и более лимфатических узлов.
Проводится конформная лучевая терапии (3D), лучевая терапия с модуляцией интенсивности дозы излучения (IMRT) при наличии соответствующего радиотерапевтического оборудования.
Выбор схемы химиотерапии определяется молекулярно-генетической структурой опухоли.
Выбор гормонотерапии определяется менструальным статусом пациента и характером сопутствующей патологии.
22.9.8. Первично нерезектабельный рак молочной железы IIIC стадия (Т любая N3M0)
Всем пациентам лечение начинают с неоадъювантной химиотерапии. Перед началом лечения в обязательном порядке показано выполнение трепан-биопсии первичной опухоли.
Схема лечения представлена на рисунке
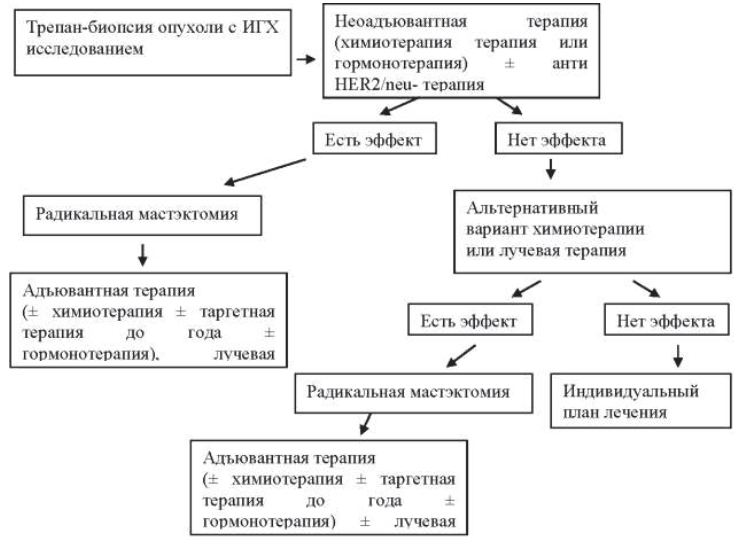

22.9.9. Нерезектабельный опухолевый процесс после завершения лекарственного лечения или отказ от операции
Дистанционная лучевая терапия проводится в период от 2 до 4 нед после завершения лекарственной терапии, возможно одновременно с лекарственной терапией (после консилиума радиационного онколога и химиотерапевта).
Лучевая терапия проводится РОД 1,8–2Гр, СОД 45–50 Гр на молочную железу и зоны регионарного метастазирования (над-подключично-подмышечную область на стороне поражения, на парастернальную область).
Через 3–4 недели – решение вопроса о хирургическом лечении. Если возможно хирургическое лечение – предпочтительно выполнение радикальной мастэктомии.
22.9.10. Воспалительная (инфламаторная) форма рака молочной железы (T4d N0-3M0)
Всем пациентам лечение начинают с неоадъювантной химиотерапии.
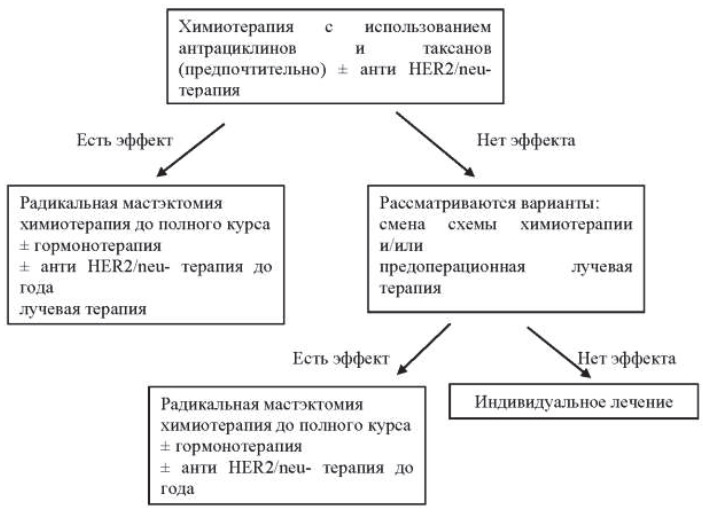

22.9.11. Первично диссеминированный рак молочной железы (Т любая N любая M1)
Методом выбора первично диссеминированного гормонозависимого рака молочной железы при отсутствии признаков висцерального криза является гормонотерапия.
Признаки висцерального криза:
- массивное, быстро нарастающее, симптоматичное метастатическое поражение внутренних органов, мозговых оболочек, костного мозга;
- лептоменингеальные метастазы;
- метастатическое поражение печени, сопровождающееся явлениями печеночной недостаточности (повышение уровня билирубина, АЛТ, АСТ);
- лимфангоит легких и/или множественное метастатическое поражение легких, сопровождающееся явлениями дыхательной недостаточности;
- метастатическое поражение костного мозга;
- литические метастазы в костях как дебют заболевания и/или прогрессирования болезни, сопровождающиеся гиперкальциемией.
При наличии у пациента изъязвленной опухоли, осложненной инфицированием и/или кровотечением, первым этапом выполняется паллиативная мастэктомия или ампутация молочной железы.
Перед началом лечения выполняется трепан-биопсия опухоли или биопсия метастатического лимфатического узла с обязательным ИГХ-исследованием.
Алгоритм лечения пациентов с метастатическим раком молочной железы основывается на гормональном статусе и состоянии экспрессии HER-2/neu.
Пациентам с гормонозависимым HER-2/neu – позитивным раком молочной железы, без висцерального криза, может быть назначена гормонотерапия с трастузумабом. Гормонотерапия одной линии проводится до прогрессирования болезни или признаков неприемлемой токсичности. При этом назначаются последовательно все возможные линии гормонотерапии.
У постменопаузальных женщин при гормонопозитивном Her2/neu-негативном метастатическом раке молочной железы при отсутствии висцерального криза значительно увеличивается эффект лечения при назначении в первой линии терапии палбоциклиба (ингибитор CDK 4 / 6) с ингибиторами ароматазы. В качестве второй линии гормонотерапии у постменопаузальных женщин при отсутствии висцерального криза назначается схема палбоциклиб с фулвестрантом. Решение о назначении данной схемы лечения принимается решением мультидисциплинарного консилиума специалистов онкологического учреждения.
В качестве альтернативы постменопаузальным пациентам с гормонопозитивным Her2/neu-негативным раком молочной железы после развития резистентности к летрозолу или анастрозолу при отсутствии висцерального криза может быть назначен эверолимус в комбинации с ингибиторами ароматазы. Решение о назначении данной схемы лечения принимается решением мультидисциплинарного консилиума специалистов онкологического учреждения.
В случае отсутствия эффекта, что свидетельствует о резистентности к гормонотерапии, назначается химиотерапия. Одновременное использование химио- и гормонотерапии не рекомендуется.
Показаниями к назначению химиотерапии являются:
- гормононезависимый рак молочной железы;
- люминальный рак молочной железы, резистентный к гормонотерапии;
- люминальный рак молочной железы с признаками висцерального криза.
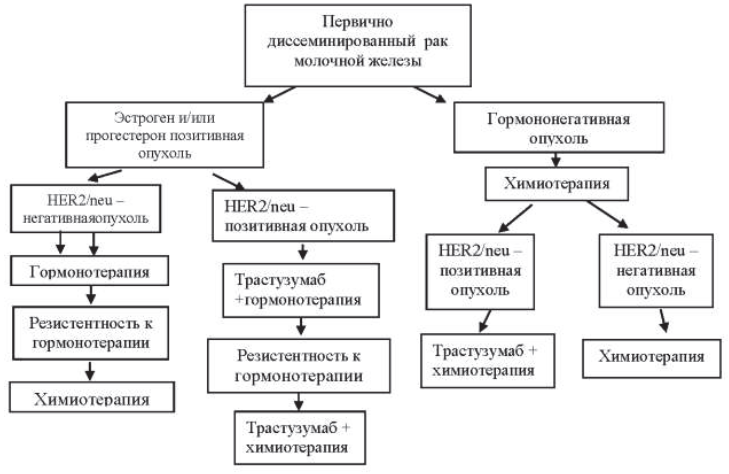
Стандартной химиотерапии первой линии метастатического рака молочной железы нет. Выбор схемы определяется молекулярно-генетической структурой опухоли, ранее проводимым лечением, индивидуальными особенностями пациента.
Рекомендуется последовательное назначение химиопрепаратов в монотерапии с последующим переходом на полихимиотерапию.
Химиотерапия по выбранной схеме проводится до момента установления прогрессирования болезни. Длительная стабилизация расценивается как положительный эффект и не является основанием для прекращения или смены терапии при отсутствии выраженной токсичности.
При HER2/neu – позитивным раке молочной железы анти- HER2/neu-терапия сочетается с гормоно- или химиотерапией.
В качестве первой линии рекомендуется назначение трастузумаба в сочетании с лекарственными средствами Группы таксанов. Перед назначением и в процессе лечения трастузумабом необходимо проводить оценку сократительной способности миокарда (УЗИ сердца–определение фракции выброса левого желудочка).
В отдельных случаях, если пациент ранее не получал лечение трастузумабом, решением мультидисциплинарного консилиума специалистов онкологического учреждения может быть назначена схема лечения, включающая пертузумаб – пертузумаб+трастузумаб+доцетаксел:
пертузумаб, 840 мг (первое введение), в последующем 420 мг внутривенно в день 1 каждые 3 нед + трастузумаб, 8 мг/кг (первое введение), в последующем 6 мг/кг внутривенно в день 1-й каждые 3 недели (или 600 мг подкожно каждые 3 недели) + доцетаксел, 75 мг/м2 внутривенно в день 1-й каждые 3 недели. При хорошей переносимости первого цикла доза доцетаксела может быть повышена до 100 мг/м2.
При первом эпизоде прогрессирования возможно продолжить анти- HER2/neu-терапию со сменой химио- или гормонотерапевтического компонента.
Оценка эффективности гормонотерапии проводится каждые 2–3 месяца, химиотерапии – каждые 2–3 курса.
Показанием к смене лечения является прогрессирование опухолевого процесса, которое может проявиться в виде:
- появление новых или усугубление имеющихся симптомов заболевания;
- появление новых или существенное увеличение имеющихся ранее опухолевых очагов;
- ухудшение общего состояния пациента, немотивированная потеря веса;
- выраженные изменения со стороны крови, не связанные с токсичностью химиотерапии.
При гиперкальциемии и литических метастазах в костях длительно назначаются бисфосфонаты (золедроновая кислота). Первые 3 введения выполняются ежемесячно, далее 1 раз в 3 месяца.
Лучевая терапия может быть использована с симптоматической целью.
При HER2/neu – позитивным раке с метастатическим поражением головного мозга показано назначение химиотерапии капецитабином в сочетании с лапатинибом.
Пациентам, ранее получавшим трастузумаб, у которых развился рецидив заболевания в течение или в пределах шести месяцев от момента завершения адьювантной терапии, решением мультидисциплинарного консилиума специалистов онкологического учреждения может быть назначена схема лечения, включающая трастузумаб эмтанзин: доза трастузумаба эмтанзина составляет 3,6 мг/кг массы тела, которая вводится внутривенно каждые 3 недели (21-дневный цикл).
22.9.12. Возврат болезни
22.9.12.1. Локорегионарный рецидив рака молочной
При появлении локорегионарного рецидива тактика лечения как при первичной опухоли.

«Псевдо-адъювантная терапия» назначается после полного морфологического исследования с ИГХ рецидивной опухоли.
Выбор системной терапии определяется молекулярно-генетической структурой рецидивной опухоли и характером ранее проведенного лечения.
22.9.12.2. Вторично диссеминированный рак молочной железы
Лечение вторично диссеминированного рака молочной железы направлено на улучшение качества жизни пациента и увеличение ее продолжительности. Перед началом лечения проводится рестадирование. С целью определения гистологической и молекулярно-генетической структуры рецидивной опухоли выполняется трепан-биопсия или эксцизионная/инцизионная биопсия одного из метастатических узлов (по возможности).
Основным методом лечения вторично-диссеминированного рака молочной железы является лекарственная терапия. Выбор схемы лекарственной терапии определяется молекулярно-генетической структурой рецидивной опухоли, общим состоянием пациента и характером проведенного ранее лечения. Основные подходы к лекарственной терапии вторично диссеминированного рака молочной железы такие же, как и при первично-диссеминированном процессе.
При необходимости системная терапия может быть дополнена локальными видами лечения – лучевой терапией и хирургическим вмешательством.
Контроль за диссеминированным раком молочной железы должен осуществляться специалистами мультидисциплинарной бригады.
При метастатическом поражении головного мозга, печени, костей, легких тактика определяется консилиумом специалистов.
22.9.13. Режимы монохимиотерапии при первично и вторично диссеминированном раке молочной железы
|
доксорубицин
|
60–75 мг/м2 в/в в 1-й день, интервал 21 день
или
20 мг/м2 в/в еженедельно
|
|
паклитаксел
|
175 мг/м2 в/в в 1-й день, интервал 21 день
или
80 мг/м2 в/в еженедельно
|
|
капецитабин
|
1000–1250 мг/м2 внутрь 2 раза в день с 1–14 дни,
каждые 21 день
|
|
гемцитабин
|
800–1200 мг/м2 в/в 1, 8, и 15 дни, каждые 28 дней
|
|
винорелбин
|
20–30 мг/м2 в/в в 1-й день, еженедельно
|
|
винорелбин
|
60–80 мг/м2 внутрь, в 1-й день, еженедельно
|
|
доцетаксел
|
60–100 мг/м2 в/в в 1-й день, каждые 21 день
или
35мг/м2 в/в, еженедельно, 6 недель, 2 недели перерыв и повторение схемы
|
|
циклофосфамид
|
50 мг/м2 внутрь с 1–21дни, каждые 28 дней
|
|
карбоплатин
|
AUC 6, в/в в 1-й день, каждые 21–28 дней
|
|
цисплатин
|
75 мг/м2 в/в в 1-й день, каждые 21 день
|
22.9.14. Режимы полихимиотерапии при первично и вторично диссеминированном раке молочной железы
|
CAF
|
циклофосфамид 100 мг/м2/сут внутрь в дни 1-й – 14-й + доксорубицин, 30 мг/м2 в/в в 1-й
и 8-й дни +
5-фторурацил 500 мг/м2 в/в в 1-й и 8-й дни
каждые 4 недели
|
|
FAC
|
5-фторурацил 500 мг/м2 в/в в 1-й день +
доксорубицин 50 мг/м2 в/в в 1-й день +
циклофосфамид 500 мг/м2 в/в в 1-й день
каждые 3 недели
|
|
FEC
|
5-фторурацил 500 мг/м2 в/в в 1-й день +
эпирубицин 50–100 мг/м2 в/в в 1-й день + циклофосфамид 500 мг/м2 в/в в 1-й день
каждые 3недели
|
|
АС
|
доксорубицин 60 мг/м2 в/в в 1-й день +
циклофосфамид 600 мг/м2 в/в в/в в 1-й день
каждые 3 недели
|
|
EC
|
эпирубицин 75 мг/м2 в/в в 1-й день +
циклофосфамид 600 мг/м2 в/в в 1-й день
каждые 3 нед
|
|
AP
|
доксорубицин 60 мг/м2 в/в в 1-й день +
паклитаксел 125–200 мг/м2 в/в в 1-й день
каждые 3 недели
|
|
АD
|
доксорубицин 50 мг/м2 + доцетаксел 75 мг/м2 в/в в 1-й день каждые 3 недели
|
|
CMF
|
циклофосфамид 100 мг/м2/сут внутрь в 1–14-й дни + метотрексат 40 мг/м2 в/в в 1-й и 8-й
дни +
5-фторурацил 600 мг/м2 в/в в дни 1-й и 8-й дни
каждые 4 недели
|
|
DCар
|
доцетаксел 75 мг/м2 в/в в день 1 + капецитабин 1500–2000 мг/м2/сут внутрь в дни 1–14
каждые 3 недели
|
|
PG
|
паклитаксел 175 мг/м2 в/в в 1-й день +
гемцитабин 1250 мг/м2 в/в в 1-й и 8-й дни
каждые 3 недели
|
|
СapVnb
|
капецитабин 2000 мг/м2/сут внутрь в дни 1–14 + винорелбин 25 мг/м2 в/в в 1-й и 8-й дни
каждые 3 недели
1 неделя перерыв
|
|
VnbСap
|
капецитабин 2000 мг/м2/сут внутрь в дни 1–14 + винорелбин 60 мг/м2 внутрь в 1-й и 8-й
дни
каждые 3 недели
1 неделя перерыв
|
|
CP
|
карбоплатин AUC 6 + паклитаксел, 175 мг/м2 в/в в день 1 каждые 3 недели
|
|
CD
|
карбоплатин AUC 6 + доцетаксел 75 мг/м2 в/в в день 1 каждые 3 недели
|
|
Винорелбин+
циклофосфамид+
флуороурацил
|
винорелбин – 30 мг/м2 в/в 1-й и 5-й дни +
циклофосфамид – 500мг/м2 в/в 1-й день +
флуороурацил – 600 г/м2/сутки в виде непрерывной инфузии с 1-го по 5-й дни, интервал
3 недели
|
Суммарная доза антрациклинов не должна превышать 450–500 мг/м2 для доксорубицина и 900 мг/м2 для эпирубицина (с учетом всех линий химиотерапии).
22.9.15. Метрономный режим
циклофосфамид 50 мг/сут внутрь ежедневно +
метотрексат 5 мг/сут внутрь (по 2,5 мг 2 раза в день) в дни 1 и 2 каждой недели
22.9.16. Режимы анти-HER/neu-терапии первично и вторично диссеминированного рака молочной железы
|
Трастузумаб – 2мг/кг (нагрузочная доза – 4 мг/кг) в/в еженедельно или 6 мг/кг (нагрузочная доза – 8 мг/кг) в/в в 1-й день или 600 мг подкожно каждые 3 недели в сочетании с одним из следующих режимов:
|
|
Паклитаксел – 60 мг/м2 в/в в 1-й, 8-й, 15-й дни каждые 4 недели + карбоплатин AUC2 в/в в 1-й, 8-й, 15-й дни каждые 4 недели
|
|
Паклитаксел – 80 мг/м2 в/в еженедельно
|
|
Винорелбин – 25–30 мг/м2 в/в в 1-й и 8-й дни каждые 3 недели
|
|
Винорелбин – 60 мг/м2 внутрь в 1-й и 8-й дни каждые 3 недели
|
|
Капецитабин – 2000 мг/м2 внутрь в 1-й – 14-й дни каждые 3 недели
|
|
Пертузумаб – 420 мг (нагрузочная доза – 840 мг) в/в в 1-й день +доцетаксел 75 мг/м2 в/в в 1-й день каждые
3 недели
|
22.9.17. Гормонотерапия первично и вторично диссеминированного рака молочной железы
Методом выбора терапии гормонозависимого рака молочной железы даже при наличии висцеральных метастазов является гормонотерапия. Исключение составляют быстрорастущие варианты рака молочной железы, сопровождающиеся висцеральным кризом, а также гормонорезистентные опухоли.
Пациентам гормонозависимым HER2/neu-позитивным раком молочной железы без висцерального криза назначается гормонотерапия в сочетании с анти- HER2/neu- препаратом.
Гормонотерапия одной линии проводится до прогрессирования опухолевого процесса. При этом перед началом гормонотерапии определяется целевой очаг для оценки эффективности проводимого гормонального лечения. При отсутствии висцерального криза последовательно назначаются все возможные линии гормонотерапии.
Неэффективность трех последовательных линий свидетельствует о резистентности к данному виду лечения и необходимости перехода к химиотерапии.
При выборе варианта гормонотерапии учитывается функция яичников, предшествующая гормонотерапия, ее эффективность, сопутствующая патология.
22.9.18. Препараты для гормонотерапии первично и вторично диссеминированного рака молочной железы
|
Аналоги ГрГ –
Только для пациентов в пременопаузе
|
Гозерелин 3,6 мг в/м 1 раз в 28 дней
|
|
Селективные модуляторы рецепторов эстрогенов – для пациентов в пременопаузе и менопаузе
|
Тамоксифен 20 мг/сут внутрь ежедневно
|
|
Механизм действия связан с подавлением активности и деградацией эстроген-рецепторов, антиэстроген
|
Фулвестрант 500 мг в/м 1 раз в мес. (в первый месяц – по 500 мг в/м в 1 и15 дни)
|
|
Ингибиторы ароматазы – только для пациентов в менопаузе
|
|
|
Прогестагены – только для пациентов в менопаузе
|
Медроксипрогестерона ацетат 500 мг/сут внутрь ежедневно
Мегестрола ацетат 160 мг/сут внутрь ежедневно
|
Одновременное использование гормонотерапии и химиотерапии не рекомендуется.
Пациенты с сохранной функцией яичников
Если адъювантной терапии тамоксифеном не было или после его отмены прошло более 1 года:
тамоксифен 20 мг/сут. ± выключение функции яичников или выключение функции яичников + гормонотерапия ингибиторами ароматазы в сочетании с препаратами Са++ и вит. D
Если адъювантная терапия тамоксифеном была в течение ближайшего года:
выключение функции яичников + гормонотерапия ингибиторами ароматазы в сочетании с препаратами Са++ и вит. D
Пациенты в менопаузе
Если адъювантной терапии тамоксифеном или ингибиторами ароматазы не было или после их отмены прошло более 1 года:
ингибиторы ароматазы
в сочетании с препаратами Са++ и вит. D или
тамоксифен 20 мг/сут.
Если адъювантная терапия тамоксифеном была в течение ближайшего года:
ингибиторы ароматазы
в сочетании с препаратами Са++ и вит. D
Если адъювантная терапия ингибиторами ароматазы была в течение ближайшего года:
тамоксифен 20 мг/сут. или
ингибиторы ароматазы со сменой нестероидного препарата
на стероидный и наоборот.
Вторая линия гормонотерапии у пациентов в менопаузе может включать тамоксифен, препараты третьего поколения ингибиторов ароматазы (если они не использованы ранее), прогестины в зависимости от того, какие препараты пациент получал ранее.
22.10. Рак молочной железы у мужчин
Рак молочной железы у мужчин лечится также, как и рак молочной железы у женщин при центральной локализации опухоли. Следует помнить, что органосохраняющие операции у мужчин не выполняются. Во всех случаях производится мастэктомия. Пациентам с гормоночувствительными опухолями рекомендован в адъювантном режиме тамоксифен по 20 мг в течение 5 лет.
22.11. Рак Педжета
Болезнь Педжета может проявляться в нескольких клинических ситуациях:
- процесс локализуется только в области сосково-ареолярного комплекса;
- процесс сочетается с наличием опухолевого очага в молочной железе (инвазивный рак или карцинома in situ).
Для правильного установления диагноза болезни Педжета необходимо выполнить следующие диагностические мероприятия:
- клиническое обследование
- двустороннюю маммографию
- УЗИ молочных желез и регионарных зон
- биопсию сосково-ареолярного комплекса и кожи молочной железы на всю ее глубину
- рентгенологическое исследование органов Грудной клетки
- УЗИ органов брюшной полости и малого таза.
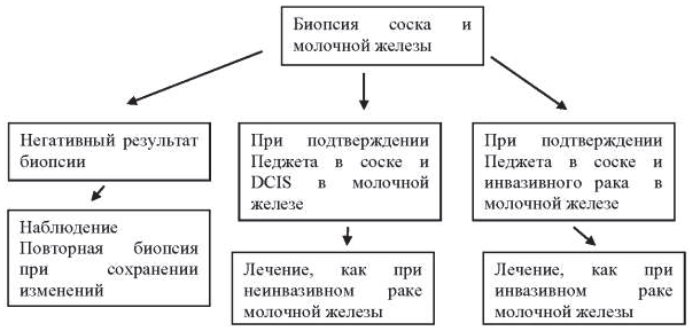
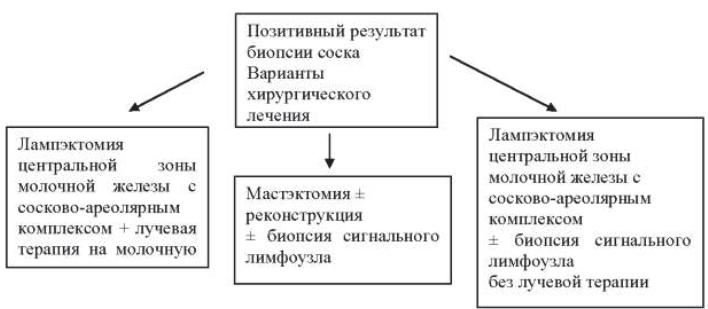
При сочетании рака Педжета с протоковой карциномой in situ лечение дополняется назначением тамоксифена в течение 5 лет.
При сочетании рака Педжета с инвазивной карциномой молочной железы проводится лечение как при инвазивной карциноме соответствующей стадии.
22.12. Саркомы молочной железы
Саркомы молочной железы гистологически представляют собой злокачественные опухоли, происходящие из мезенхимальных тканей. К ним относится целый ряд новообразований, включающий лимфомы, злокачественные листовидные цистосаркомы и широкий спектр соединительнотканных опухолей. Биологическая структура сарком молочной железы сходна и протекает аналогично саркомам мягких тканей других локализаций.
Кроме истинных первичных сарком, в молочных железах встречаются злокачественные опухоли, возникшие в результате малигнизации стромального компонента предсуществующих доброкачественных филлоидных фиброаденом (так называемых листовидных фиброаденом) и карциносаркомы. Карциносаркомы сочетают в себе морфологические признаки эпителиальной злокачественной опухоли и саркомы.
Лимфогенное метастазирование не характерно, диссеминация при этих опухолях происходит преимущественно гематогенно. Для сарком молочной железы характерно метастазирование в легкие и кости.
Лимфогенное метастазирование не характерно, диссеминация при этих опухолях происходит преимущественно гематогенно. Для сарком молочной железы характерно метастазирование в легкие и кости.
Объем обследования при саркомах молочной железы тот же, что и при саркомах мягких тканей.
Хирургическое лечение является методом выбора при лечении сарком молочной железы. Иссечение клинически не определяемых подмышечных лимфатических узлов считается нецелесообразным. Подмышечная лимфаденэктомия показана лишь в тех случаях, когда при пальпации выявляются увеличенные лимфатические узлы, либо когда это необходимо по техническим соображениям для радикального удаления первичной опухоли и при морфологически верифицированном метастатическом поражении регионарного лимфатического аппарата.
Показания к лучевой и химиотерапии при лечении саркомы молочной железы во многом зависят от радикальности оперативного вмешательства и гистологического строения опухоли, особенно от степени ее дифференцировки.
Лучевая терапия применяется с целью уменьшения риска развития местного рецидива, при сомнении в радикализме операции. Золотым стандартом химиотерапии является использование схем, содержащих препараты антрациклинового ряда в сочетании с цисплатином. Возможны следующие схемы полихимиотерапии: CYVADIK (циклофосфан + винкристин + доксорубицин + дакарбазин), АР (доксорубицин + цисплатин), PC (цисплатин + циклофосфан).
В настоящее время при лечении опухолей этого вида не применяется гормонотерапия, так как в саркомах молочной железы не обнаруживаются гормональные рецепторы.
22.13. Рак молочной железы на фоне беременности
Сам по себе факт сочетания рака молочной железы и беременности не может служить противопоказанием к лечению. Прерывание беременности у женщины, страдающей РМЖ, не является эффективной и адекватной мерой борьбы с заболеванием, так как статистически значимо не улучшает их выживаемость.
Если женщина принимает решение о прерывании беременности, то планирование лечения РМЖ в дальнейшем не отличается от такового у небеременных женщин.
В настоящее время существует стратегия, позволяющая начать лечение женщины при сохранении беременности. Такой вариант предполагает применение как современных оперативных вмешательств, так и противоопухолевой лекарственной терапии.
Обследование беременной женщины с подозрением на рак молочной железы должно начинаться с физикальных методов. Особое внимание должно быть уделено состоянию регионарного лимфатического аппарата.
Для оценки степени распространенности опухолевого процесса показано выполнение УЗИ молочной железы и регионарных зон, УЗИ органов брюшной полости и малого таза. Для морфологической верификации диагноза выполняется трепан-биопсия опухоли, позволяющая получить материал для гистологического исследования и определения уровней экспрессии ER, PR, HER2-/neu и Ki-67. Необходимость в проведении дополнительных методов обследования определяется клинической ситуацией. Для оценки степени распространения заболевания могут быть выполнены рентгенография органов Грудной клетки с абдоминальной защитой и бесконтрастная МРТ Грудного и поясничного отделов позвоночника.
Необходимо получить от акушер-гинеколога заключение о состоянии матери и плода с оценкой сопутствующих заболеваний, течения предыдущих беременностей, подтверждение роста и развития плода, примерное определение даты родов. Заключение о состоянии матери и плода должно включать рекомендацию о сохранении или прерывании беременности.
Оптимальная стратегия лечения должна определяться консилиумом в составе хирурга-онкомаммолога, химиотерапевта, акушер-гинеколога, радиационного онколога, неонатолога и зависит от триместра беременности:
I триместр – 1–13 недель беременности;
II триместр – 14–27 недель беременности;
III триместр – 28–42 недели беременности.
В обсуждении стратегии лечения необходимо участие беременной женщины и ее семьи. Тактика лечения определяется следующим образом (см. приложение – стр. 51):
Хирургическое лечение может выполняться как в объеме мастэктомии, так и органосохраняющей операции. В тех случаях, когда это возможно, любой вид хирургического вмешательства необходимо отложить до второго триместра. Во втором и третьем триместрах хирургическое лечение не должно существенно отличаться у беременных по сравнению с небеременными. При выполнении операции в 25-недельном сроке беременности обязательным является присутствие акушер-гинеколога и перинатального специалиста, помощь которых может понадобиться в случае преждевременных родов жизнеспособного плода.
Показания к проведению системной химиотерапии те же, что и у небеременных, но химиотерапию не рекомендуется проводить ни при каких обстоятельствах в течение первого триместра.
Важным фактором при назначении химиотерапии становится выбор лекарственных средств. Доксорубицин в меньшей степени воздействует на плод и является относительно безопасным; следующее место по степени токсичности занимает циклофосфамид. Метотрексат и 5-фторурацил оказывают на плод наибольшее повреждающее действие. Побочные эффекты таксанов изучаются. Таким образом, доксорубицин и циклофосфан в большинстве случаев являются лекарственными средствами выбора, если химиотерапия назначается во II–III триместре беременности.
При проведении химиотерапии необходим мониторинг состояния плода перед началом каждого курса. Химиотерапия не должна проводиться после 35-й недели беременности или в пределах 3 недель до планируемых родов, с целью предупреждения возможных гематологических осложнений во время родов.
Гормонотерапия и лучевая терапия противопоказаны во время беременности. При наличии показаний к этим видам лечения, необходимо их начинать не ранее послеродового периода.
Последующее наблюдение проводится в соответствии с общепринятыми стандартами.
При желании женщины (в пременопаузе) рожать после окончания специального лечения курсы полихимиотерапии проводятся на фоне овариальной супрессии. С этой целью назначаются аналоги гонадотропин-рилизинг-гормонов. Препарат вводится 1 раз в 28 дней.
22.14. Профилактическая мастэктомия
Снижающие риск хирургические вмешательства, такие как мастэктомия с реконструкцией, могут быть предложены женщинам, находящимся в Группе риска. Риск развития рака снижается примерно на 90–95 %, однако, абсолютные гарантии относительно возникновения в дальнейшем рака молочной железы невозможны.
Показания к применению:
1. Показания к выполнению двусторонней профилактической мастэктомии у женщин, не имеющих на данный момент рака молочной железы (с целью снижения риска развития первичного рака молочной железы):
- мутации генов BRCA1и BRCA2;
- отягощенный семейный анамнез (наличие рака молочной железы у родственников I–II линии) без доказанной мутации;
- гистологические факторы риска – атипичная протоковая или лобулярная гиперплазия.
2. Показания к выполнению профилактической контралатеральной мастэктомии у женщин, имеющих на данный момент или в прошлом рак молочной железы:
- впервые выявленный односторонний рак молочной железы I–II стадии, либо рак молочной железы I–II стадии в анамнезе (с целью снижения риска развития рака в контралатеральной молочной железе и достижения симметрии с оперированной молочной железой);
-
лобулярная карцинома in situ.
Противопоказания к применению:
- возраст старше 70 лет;
- общие противопоказания к хирургическому лечению;
-
синхронные и метахронные злокачественные опухоли, за исключением рака кожи.
22.15. Скрытый (оккультный) рак
Особую форму представляет собой оккультный рак молочной железы, первыми клиническими признаками которого являются увеличенные пораженные метастазами подмышечные или над-, подключичные лимфатические узлы без определяемой клинически опухоли в самой железе.
В диагностическом плане показано проведение УЗИ молочных желез и регионарного лимфатического аппарата, маммографии, трепан-биопсии лимфатических узлов под УЗ-контролем. Использование МРТ молочных желез позволяет выявить первичную опухоль при негативных результатах маммографического и сонографического исследований. При отсутствии данных за первичную опухоль в молочной железе показано выполнение эксцизионной биопсии подмышечных лимфатических узлов для проведения гистологического и гистохимического анализов с определением маммоглобина.
При данной форме рака молочной железы показано КТ органов Грудной, брюшной полости и малого таза, остеосцинтиграфия или ПЭТ-КТ.
Для пациентов с распространенностью опухолевого процесса T0N1M0 могут быть использованы следующие варианты лечения:
1) мастэктомия с лимфаденэктомией I–III уровней на стороне поражения;
2) лимфаденэктомия с лучевой терапией всей молочной железы с/без облучения регионарных зон.
Системная терапия назначается как при II–III стадиях заболевания.
Неоадъювантная терапия показана при T0N2-3M0 стадиях заболевания с последующим хирургическим лечением в объеме мастэктомии с лимфаденэктомией.
22.16. Филлоидные опухоли (филлоидные цистосаркомы)
Филлоидные опухоли состоят как из стромальных, так и из эпителиальных элементов. Существуют доброкачественные, пограничные и злокачественные подтипы филлоидных опухолей, хотя нет общих единых рекомендаций относительно критериев их отнесения к тому или иному подтипу и прогнозирования их биологического поведения.
В плане риска развития рецидива более важным представляется состояние края резекции, чем гистологический подтип опухоли.
Лечение филлоидных опухолей – хирургическое. Предпочтительным видом операции является удаление опухоли или частичная резекция молочной железы, отступив от края опухоли 1,0 см и более. Выполнение мастэктомии необходимо только тогда, когда не представляется возможным получить невовлеченные (чистые) края резекции при выполнении органосохраняющей операции.
Поскольку филлоидные опухоли редко метастазируют в подмышечные лимфоузлы, хирургическое стадирование или выполнение подмышечной лимфодиссекции не нужны, если при клиническо-инструментальной диагностике не выявляются их патологические изменения.
Лечение местных рецидивов – широкое иссечение со свободным от опухоли краем резекции.
Хотя эпителиальный компонент большинства филлоидных опухолей содержит рецепторы к стероидным гормонам, нет доказательств, что эндокринная терапия может быть использована для лечения филлоидных опухолей. Аналогичным образом, нет доказательств, что адъювантная цитостатическая терапия или лучевая терапия уменьшают риск развития рецидива или смертности.
Лечение филлоидных цистосарком с отдаленными метастазами проводится в соответствии с рекомендациями по лечению сарком мягких тканей.
Информация
Источники и литература
-
Постановления и приказы Министерства здравоохранения Республики Беларусь об утверждении клинических протоколов 2006-2019
- Постановления и приказы Министерства здравоохранения Республики Беларусь об утверждении клинических протоколов 2006-2019 -
-
www.minzdrav.gov.by
- www.minzdrav.gov.by -
Информация
ГЛАВА 2
ОЦЕНКА ОБЩЕГО СОСТОЯНИЯ ОНКОЛОГИЧЕСКОГО ПАЦИЕНТА
Общее состояние онкологического пациента (Performance status) рекомендовано оценивать по индексу Карновского (0–100 баллов) или шкале ECOG (0–4 балла) (таблицы 2.1, 2.2).
Таблица 2.1. Индекс Карновского
Таблица 2.1. Индекс Карновского
|
Нормальная физическая активность, пациент не нуждается в специальном уходе
|
100 баллов | Состояние нормальное, нет жалоб и симптомов заболевания |
| 90 баллов | Нормальная активность сохранена, но имеются незначительные симптомы заболевания | |
| 80 баллов | Нормальная активность возможна при дополнительных усилиях, при умеренно выраженных симптомах заболевания | |
|
Ограничение нормальной активности при сохранении полной независимости пациента
|
70 баллов | Пациент обслуживает себя самостоятельно, но не способен к нормальной деятельности или работе |
| 60 баллов | Пациент иногда нуждается в помощи, но в основном обслуживает себя сам | |
| 50 баллов | Пациенту часто требуется помощь и медицинское обслуживание | |
|
Пациент не может обслуживать себя самостоятельно, необходим уход или госпитализация
|
40 баллов | Большую часть времени пациент проводит в постели, необходим специальный уход и посторонняя помощь |
| 30 баллов | Пациент прикован к постели, показана госпитализация, хотя терминальное состояние не обязательно | |
| 20 баллов | Сильные проявления болезни, необходима госпитализация и поддерживающая терапия | |
| 10 баллов | Умирающий пациент, быстрое прогрессирование заболевания | |
| 0 баллов | Смерть |
Таблица 2.2. Оценка статуса пациента по шкале ECOG
| Оценка | |
| 0 | Пациент полностью активен, способен выполнять все, как и до заболевания (90–100 баллов по шкале Карновского) |
| 1 | Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу, 70–80 баллов по шкале Карновского) |
| 2 | Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50 % времени бодрствования проводит активно – в вертикальном положении (50–60 баллов по шкале Карновского) |
| 3 | Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50 % времени бодрствования (30–40 баллов по шкале Карновского) |
| 4 | Пациент, совершенно не способен к самообслуживанию, прикован к креслу или постели (10–20 баллов по шкале Карновского) |
Приложение
ТАБЛИЦЫ СООТВЕТСТВИЯ «СТАДИЯ-TNM» ДЛЯ РЯДА ЛОКАЛИЗАЦИЙ: ТОНКИЙ КИШЕЧНИК, АМПУЛА ФАТЕРОВА СОСКА, ТИМОМА, МЕЗОТЕЛИОМА ПЛЕВРЫ, КАРЦИНОМА МЕРКЕЛЯ КОЖИ, КОРА НАДПОЧЕЧНИКА
ТОНКИЙ КИШЕЧНИК C17
Таблица 1. Группировка по стадиям
| Стадия 0 | Tis | N0 | M0 |
| Стадия I | Т1, Т2 | N0 | M0 |
| Стадия IIА | Т3 | N0 | M0 |
| Стадия IIB | T4 | N0 | M0 |
| Стадия IIIA | Любая Т | N1 | M0 |
| Стадия IIIB | Любая Т | N2 | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
АМПУЛА ФАТЕРОВА СОСКА C24.1
Таблица 2. Группировка по стадиям
| Стадия 0 | Tis | N0 | M0 |
| Стадия IA | Т1a | N0 | M0 |
| Стадия IB | Т1b, Т2 | N0 | M0 |
| Стадия IIА | Т3a | N0 | M0 |
| Стадия IIB | Т3b | N0 | M0 |
| Стадия IIIA | Т1a, Т1b, Т2, T3 | N1 | M0 |
| Стадия IIIB | Т4 | Любая N | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
ТИМОМА C37, C38.1-3
Таблица 3. Группировка по стадиям
| Стадия I | T1 | N0 | M0 |
| Стадия II | T2 | N0 | M0 |
| Стадия IIIА | T3 | N0 | M0 |
| Стадия IIIB | T4 | N0 | M0 |
| Стадия IVA | Любая Т |
N1
N0, N1
|
M0
M1A
|
| Стадия IVB | Любая Т | Любая N | M1B |
МЕЗОТЕЛИОМА ПЛЕВРЫ C45.0
Таблица 4. Группировка по стадиям
| Стадия IA | T1 | N0 | M0 |
| Стадия IB | T2, T3 | N0 | M0 |
| Стадия II | T1, T2 | N1 | M0 |
| Стадия IIIА | T3 | N1 | M0 |
| Стадия IIIB | T1, T2, T3, T4 |
N1 Любая N |
M0 |
| Стадия IV | Любая Т | Любая N | M1 |
КАРЦИНОМА МЕРКЕЛЯ C44, C63.2
Таблица 5а. Группировка по стадиям клиническая
| Стадия 0 | Tis | N0 | M0 |
| Стадия I | Т1 | N0 | M0 |
| Стадия IIА | T2, Т3 | N0 | M0 |
| Стадия IIB | Т4 | N0 | M0 |
| Стадия III | Любая Т | N1, N2, N3 | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
Таблица 5б. Группировка по стадиям патоморфологическая
| Стадия 0 | Tis | N0 | M0 |
| Стадия I | Т1 | N0 | M0 |
| Стадия IIА | Т2, T3 | N0 | M0 |
| Стадия IIB | Т4 | N0 | M0 |
| Стадия IIIA |
Т0
Т1, Т2, T3, Т4
|
N1b
N1a
|
M0 |
| Стадия IIIB | Любая Т | N1, N2, N3 | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
КОРА НАДПОЧЕЧНИКА C74.0
Таблица 6. Группировка по стадиям
| Стадия I | Т1 | N0 | M0 |
| Стадия II | Т2 | N0 | M0 |
| Стадия III |
Т1, T2
Т3, T4
|
N1
N0, N1
|
M0 |
| Стадия IV | Любая Т | Любая N | M1 |
Под редакцией
д-р мед. наук, проф. О.Г.Суконко,
д-р мед. наук, проф., член-корр. НАН Беларуси С.А.Красный
Авторский коллектив:
Антоненкова Нина Н., д.м.н., доц.;
Ануфреенок И.В., к.м.н.;
Артемова Н.А., д.м.н., доц.;
Баранов А.Ю., к.м.н.;
Баранов Е.В., к.м.н.;
Бармотько М.А.;
Грачев Ю.Н., к.м.н.;
Демешко П.Д., д.м.н.;
Демидчик Ю.Е., д.м.н., проф.;
Дзюбан В.П.;
Доломанова Е.В.;
Дубровский А.Ч., к.м.н.;
Евмененко А.А.;
Ермаков Н.Б., к.м.н.;
Жаврид Э.А., д.м.н., проф.;
Жарков В.В, д.м.н., проф.;
Жиляева Е.П.;
Жуковец А.Г., к.м.н.;
Зеленкевич И.А., к.м.н.;
Ильин И.А., к.м.н.;
Караник В.С., к.м.н.;
Карман А.В., к.м.н., доц.;
Киселев П.Г., к.м.н.;
Клименко Д.П.;
Колядич Г.И., к.м.н.;
Кондратович В.А.;
Котов А.А., к.м.н.;
Кохнюк В.Т., д.м.н., проф.;
Красный С.А., д.м.н., проф.;
Крутилина Н.И., д.м.н., проф.;
Курченков А.Н., к.м.н.;
Курчин В.П., д.м.н.;
Левин Л.Ф.;
Леонова Т.А.;
Мавричев А.С., д.м.н., проф.;
Мавричев С.А., к.м.н.;
Малькевич В.Т., д.м.н., доц.;
Маньковская С.В.;
Матылевич О.П., к.м.н.;
Минайло И.И., к.м.н.;
Минич А.А., к.м.н.;
Моисеев П.И., к.м.н.;
Набебина Т.И., к.м.н.;
Науменко Л.В., к.м.н.;
Океанов А.Е., д.м.н., проф.;
Пархоменко Л.Б., к.м.н., доц.;
Петрушенко Ю.И.;
Писаренко А.М.;
Поляков С.Л., к.м.н.;
Портянко А.С., д.м.н., доц.;
Прохорова В.И., д.м.н., проф.;
Ребеко И.В., к.м.н.;
Ревтович М.Ю., к.м.н.;
Ролевич А.И., д.м.н.;
Рындин А.А.;
Рябчевский А.Н.;
Синайко В.В., к.м.н.;
Субоч Е.И., к.м.н.;
Суколинская Е.В., к.м.н.;
Суконко О.Г., д.м.н., проф.;
Суслова В.А., к.м.н.;
Тризна Н.М., к.м.н.;
Фридман М.В., д.м.н.;
Шаповал Е.В., д.м.н.;
Шмак А.И., д.м.н.
Список сокращений:
CTV – клинический объем облучения
GTV – определяемый объем опухоли
ICD – Международная классификация болезней
ITC – отдельные опухолевые клетки
PTV – планируемый объем облучения
UICC – Международный противораковый союз
АЛТ – аланинаминотрансфераза
АСТ – аспартатаминотрансфераза
АЧТВ – активированное частичное тромбопластиновое время
ВАТС – видео-ассистированной тораскопии
ВОЗ – Всемирная организация здравоохранения
ВПЧ – вирус папилломы человека
ВЯВ – внутренняя яремная вена;
ГИСО – гастроинтенстинальные стромальные опухоли
ГПДР – гастропанкреатодуоденальная резекция
ГЦР – гепатоцеллюлярный рак
ЖКТ – желудочно-кишечный тракт
ИГХ – иммуногистохимическое исследование
ИОУЗИ – интраоперационное УЗИ
КТ – компьютерная томография
ЛДГ – лактатдегидрогеназа
МНО – международное нормализованное отношение
МРТ – магнитно-резонансная томография
МСКТ – многослойная компьютерная томография
ОГК – органы Грудной клетки
ПВ – протромбиновое время
ПЖ – поджелудочная железа
ПЭТ – позитронно-эмиссионная томография
РЖП – рак желчного пузыря
РОД – разовая облучающая доза
РПК – рак прямой кишки
РПХГ – ретроградная панкреатохолангиография
СОД – суммарная облучающая доза
ТВ – тромбиновое время
ТДПЭ – тотальная дуоденопанкреатэктомия
УЗИ – ультразвуковое исследование
ФВД – функция внешнего дыхания
ФДГ – фтордезоксиглюкоза
ФЭГДС – фиброгастродуоденоскопия
ХЦР – холангиоцеллюлярного рака
ЦНС – центральная нервная система
ЧЧХГ – чрескожная чреспеченочная холангиография
ЧЭИ – чрескожная этаноловая инъекция
ЩФ – щелочная фосфатаза
ЭВВ – эмболизация воротной вены
ЭКГ – электрокардиограмма
ЭУЗИ – эндоскопическое ультразвуковое исследование
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.