Гепатоцеллюлярная карцинома
 Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Злокачественное новообразование печени и внутрипеченочных желчных протоков (C22)
Онкология
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «14» декабря 2023 года
Протокол №198
КЛИНИЧЕСКИЙ ПРОТОКОЛ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
ГЕПАТОЦЕЛЛЮЛЯРНАЯ КАРЦИНОМА
Гепатоцеллюлярная карцинома – первичная злокачественная опухоль из гепатоцитов.
ГЦК является наиболее частой злокачественной опухолью печени, развивается у пациентов с гепатитом и циррозом печени, ассоциированными с вирусами гепатитов В, С, D, алкогольной и неалкогольной жировой болезнью печени, аутоиммунными и холестатическими заболеваниями, гемохроматозом, болезнью Вильсона-Коновалова, альфа 1-антитрипсиновой недостаточностью, внося значительный вклад в смертность от онкологических заболеваний (пятое место в мире) [1-3].
ВВОДНАЯ ЧАСТЬ
Код(ы) МКБ-10:
| МКБ-10 | |
| Код | Название |
| C22 | Злокачественное новообразование печени и внутрипеченочных желчных протоков |
| C22.0 | Печеночноклеточный рак |
| C22.1 | Рак внутрипеченочного желчного протока |
| C22.2 | Гепатобластома |
| C22.3 | Ангиосаркома печени |
| C22.4 | Другие саркомы печени |
| C22.7 | Другие уточненные раки печени |
| C22.9 | Злокачественное новообразование печени неуточненное |
Дата разработки/пересмотра протокола: 2015 год (пересмотр 2018 г., /2022 г.).
Пользователи протокола: онкологи, гастроэнтерологи, гепатологи, хирурги, химиотерапевты, терапевты, врачи общей практики, врачи лучевой диагностики.
Категория пациентов: взрослые.
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с не высоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С |
Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+).
Результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++или+), результаты которых не могут быть непосредственно распространены на соответствующую популяцию.
|
| D | Описание серии случаев или неконтролируемое исследование, или мнение экспертов. |
Классификация
Клиническая классификация [2,3,6,11]
Гистологическая классификация:
1) Эпителиальные опухоли: гепатоцеллюлярные.
Доброкачественные:
- Гепатоцеллюлярная аденома;
- Фокальная узловая гиперплазия.
Рак-ассоциированные и предраковые поражения:
- Крупноклеточные изменения (ранее «дисплазия»);
- Мелкоклеточные изменения (ранее «дисплазия»).
2) Диспластические узлы:
- Легкой степени;
- Тяжелой степени.
Злокачественные:
- Гепатоцеллюлярная карцинома;
- Гепатоцеллюлярная карцинома (Фиброламеллярный вариант);
- Гепатобластома, эпителиальный вариант;
- Недифференцированная карцинома;
- Эпителиальные опухоли: билиарные.
Доброкачественные:
- Аденома желчного протока (гемартома пребилиарных желез и др);
- Микрокистозная аденома;
- Билиарная аденофиброма.
Предраковые поражения:
- Интраэпителиальная билиарная неоплазия класс 3;
- Внутрипротоковая папиллярная неоплазия с низкой и средней степени интраэпителиальной неоплазии;
- Внутрипротоковая папиллярная неоплазия с высокой степени интраэпителиальной неоплазии;
- Муцинозная кистозная неоплазия с низкой и средней степени интраэпителиальной неоплазии;
- Муцинозная кистозная неоплазия с высокой степени интраэпителиальной неоплазии.
Злокачественные:
- Интраэпительная холангиокарцинома;
- Внутрипротоковая папиллярная неоплазия ассоцированная с инвазивной карциномой;
- Муцинозная кистозная неоплазия ассоцированная с инвазивной карциномой.
Злокачественные новообразования смешанного и неясного генеза:
- Кальцинированные эпителиально-стромальные опухоли;
- Карциносаркома;
- Комбинированные гепатоцеллюлярные-холангиосаркомы;
- Гепатобластомы, смешанные эпителиально-мезенхимальные;
- Озлакачествленные рабдо-опухоли.
Мезенхимальные опухоли:
Доброкачественные:
- Ангиомиолипома;
- Кавернозная гемангиома;
- Инфантильная гемангиома;
- Лимфангиома;
- Лимфангиоматоз;
- Мезенхимальные гемартома;
- Солитарная фиброзная опухоль.
Злокачественные:
- Ангиосаркома;
- Эмбриональная саркома (недифференцированная саркома);
- Эпителиоидная гемангиоэндотелиома;
- Саркома Капоши;
- Лейомиосаркома;
- Рабдомиосаркома;
- Синовиальная саркома.
Опухоли зародышевых клеток:
- Тератомы;
- Опухоли желточного мешка (опухоль эндодермального синуса);
- Лимфомы;
- Вторичные опухоли.
Классификация ГЦК по категориям TNM8 (2017 г.) приведена в таблице 1 [11].
Таблица 1. Классификация ГЦК по категориям TNM8 (2017 г.)
| Т – Первичная опухоль | ТХ | Первичная опухоль не может быть оценена |
| Т0 | Отсутствие данных о первичной опухоли | |
| Т1a | Солитарная опухоль 2 см или менее в наибольшем измерении с или без сосудистой инвазии. | |
| T1b | Солитарная опухоль более 2 см в наибольшем измерении без сосудистой инвазии | |
| T2 | Солитарная опухоль с сосудистой инвазией более 2 см или множественные очаги опухоли не более 5 см в наибольшем измерении | |
| ТЗ | Несколько опухолей размером более 5 см в наибольшем размере | |
| Т4 | Опухоль(и), прорастающая(ие) главную ветвь воротной или печеночной вен с непосредственной инвазией в соседние органы (включая диафрагму), за исключением желчного пузыря или с перфорацией висцеральной брюшины | |
| N – Региональные лимфатические узлы | NX | Региональные лимфатические узлы не могут быть оценены |
| N0 | Нет метастазов в региональных лимфатических узлах | |
| N1 | Есть метастазы в региональных лимфатических узлах | |
| М – Отдаленные метастазы | М0 | Нет отдаленных метастазов |
| М1 | Есть отдаленные метастазы |
Группировка ГЦК по стадиям (TNM8) приведена в таблице 2.
Таблица 2. Группировка ГЦК по стадиям TNM8 (2017 г.)
Таблица 3. Модифицированная Барселонская система стадирования ГЦК (BCLC)
Таблица 4. Класс тяжести ЦП по критериям CTP
| Стадия | T | N | M |
| IA | Т1a | N0 | М0 |
| ІB | Т1b | N0 | М0 |
| ІІ | Т2 | N0 | М0 |
| ІІІА | Т3 | N0 | М0 |
| ІІІВ | Т4 | N0 | М0 |
| ІVA | Любая Т | N1 | М0 |
| ІVB | Любая Т | Любая N | М1 |
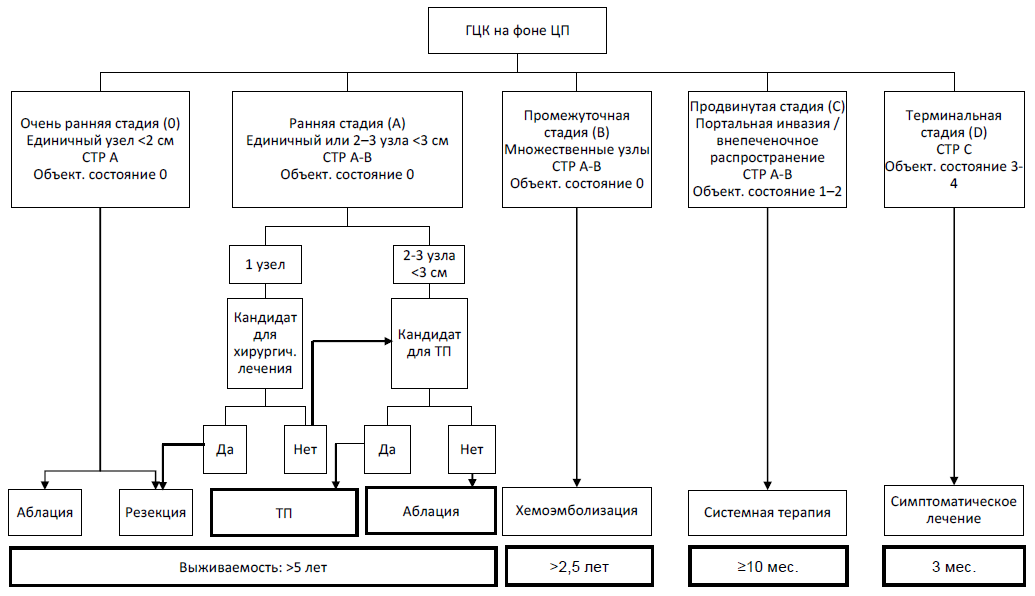
Барселонская система стадирования ГЦК (Barcelona Clinic Liver Cancer classification) учитывает распространенность опухолевого процесса, функциональное состояние печени, объективное состояние пациента и предполагаемую эффективность лечения (таблица 3) [2,3,6]. Согласно BCLC, выделяют 5 стадий: от 0 (очень ранней) и А (ранней) до D (терминальной). Данная классификация имеет прогностическую значимость для пациентов с ГЦК безотносительно наличия ЦП. В последней редакции этой классификации (2018 г.) вместо классов цирроза A–B по Child – Pugh используется формулировка «сохранная функция печени», что соответствует оценке <8 баллов по классификации Child – Pugh [35]. BCLC также предусматривает алгоритм лечения в зависимости от стадии заболевания, при этом сама стадия, прогноз заболевания и тактика лечения могут меняться при прогрессировании либо эффективном лечении.
Таблица 3. Модифицированная Барселонская система стадирования ГЦК (BCLC)
| Стадия | Характер опухоли | Класс ЦП по СТР | Объективное состояние | |
| 0 | Очень ранняя | Единичный узел <2 см | А | 0 |
| А | Ранняя | Единичный или 2–3 узла <3 см | А-В | 0 |
| В | Промежуточная | Множественные узлы | А-В | 0 |
| С | Продвинутая | Портальная инвазия / внепеченочное распространение | А-В | 1-2 |
| D | Терминальная | Любой | С | 3-4 |
Класс тяжести фонового ЦП (функциональный статус печени), необходимый для расчета BCLC, определяется по классификации Child-Turcotte-Pugh (CTP) (Таблица 4) [6,7,12,13], имеется он-лайн калькулятор: https://www.mdcalc.com/child-pugh-score-cirrhosis-mortality.
Таблица 4. Класс тяжести ЦП по критериям CTP
| Показатель | Баллы | ||
| 1 | 2 | 3 | |
| Асцит | Нет | Незначительный или корригируемый медикаментозно | Умеренный / Значительный или некорригируемый медикаментозно |
| Энцефалопатия | Нет | 1-2 степени или корригируемая медикаментами | 3-4 степени или некорригируемая медикаментами |
| Билирубин, мкмоль/л | <34,2 | 34,2-51,3 | >51,3 |
| Альбумин, г/л | >35 | 28-35 | <28 |
| МНО (Протромбиновое время, сек) | <1,71 (<4) | 1,7-2,3 (4-6) | >2,3 (>6) |
| Класс A = 5-6 баллов; класс B = 7-9 баллов; класс C = 10-15 баллов | |||
Функциональный статус пациента, необходимый для расчета BCLC, определяется по шкале ECOG (Таблица 5) [1], имеется он-лайн калькулятор: https://www.mdcalc.com/eastern-cooperative-oncology-group-ecog-performance-status.
Таблица 5. Функциональный статус пациента по шкале ECOG
| Функциональный статус | Характеристика |
| 0 | Пациент полностью активен, в том же объеме, что и до болезни |
| 1 | Больной неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или офисную работу) |
| 2 | Больной лечится амбулаторно, способен к самообслуживанию, но нетрудоспособен. Более 50% времени бодрствования проводит активно – в вертикальном положении |
| 3 | Больной способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования |
| 4 | Совершенно не способен к самообслуживанию, прикован к креслу или постели |
Классификация (шкала) MELD применяется у пациентов с ГЦК и ЦП для оценки прогноза заболевания (в том, числе, у пациентов с планируемой резекцией печени) (таблица 6). В контексте трансплантации печени наличие ГЦК является исключением, когда при соответствии Миланским критериям (один очаг ГЦК от 2 до 5 см или двумя-тремя очагами менее 3 см в диаметре при отсутствии сосудистой инвазии или внепеченочых метастазов) шкале MELD автоматически присваивается оценка, равная 22 (28 в случае гипероксалурии), с увеличением на 10% каждые 3 месяца с момента постановки диагноза. Для расчета используется формула: MELD(i) = 0.957 × ln(Cr) + 0.378 × ln(bilirubin) + 1.120 × ln(INR) + 0.643, имеется он-лайн калькулятор: https://www.mdcalc.com/meld-score-model-end-stage-liver-disease-12-older.
Таблица 6. Прогноз смертности (Шкала MELD)
Таблица 7. Прогноз выживаемости (Шкала ALBI)
| Значение MELD | Смертность |
| ≤9 | 1,9% |
| 10–19 | 6,0% |
| 20–29 | 19,6% |
| 30–39 | 52,6% |
| ≥40 | 71,3% |
Классификация (шкала) ALBI (Albumin-Bilirubin Grade) применяется для оценки выживаемости при ГЦК (таблица 7) [44]. Для расчета используется формула: ALBI = (log10 bilirubin μmol/L × 0.66) + (albumin g/L × -0.085), имеется он-лайн калькулятор: https://www.mdcalc.com/albi-albumin-bilirubin-grade-hepatocellular-carcinoma-hcc.
Таблица 7. Прогноз выживаемости (Шкала ALBI)
| Значение ALBI | Степень | Средняя выживаемость, мес. |
| ≤-2,60 | 1 | 18,5-85,6 |
| >-2,60 – ≤-1,39 | 2 | 5,3-46,5 |
| >-1,39 | 3 | 2,3-15.5 |
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ [3].
Диагностические критерии
Жалобы и анамнез
Жалобы, связанные с фоновым заболеванием печени, включают:
- Слабость или утомляемость;
- Зуд;
- Увеличение живота;
- Кровотечения, мелену.
Жалобы, связанные с опухолью, включают:
- Потерю веса, лихорадку, вздутие живота, тошноту, потерю аппетита;
- Боль и дискомфорт в верхнем правом квадранте живота.
В анамнезе у пациентов с ГЦК следует выявлять этиологические факторы/предопухолевые состояния, а также факторы риска [8].
Таблица 8. Предопухолевые заболевания и факторы риска развития ГЦК
| Заболевания / Этиологические факторы | Группы / факторы риска |
| Хронический вирусный гепатит В, D, C |
|
| Алкогольная болезнь печени |
|
| Неалкогольная (метаболически-ассоциированная) жировая болезнь печени |
|
| Аутоиммунные заболевания (аутоиммунный гепатит, первичный билиарный холангит, синдром перехлеста) |
|
|
Наследственные заболевания (наследственный гемохроматоз,
болезнь Вильсона-Коновалова,
α-1-антитрипсиновая недостаточность, тирозинемия,
болезни накопления гликогена 1 типа)
|
|
| Лекарственно-индуцированные повреждения печени |
|
| Токсические воздействия факторов окружающей среды |
|
| Цирроз печени как таковой |
|
Физикальное обследование.
Специфические для ГЦК симптомы отсутствуют. В редких случаях визуально и физикально определяется объемное образование в правом подреберье. Обычно выявляются признаки ЦП, включая признаки печеночной недостаточности и портальной гипертензии, такие как [6,7]:
- Гепатомегалия, спленомегалия;
- Желтуха;
- Асцит, периферические отеки;
- Порхающий тремор;
- Потеря мышечной массы;
- Признаки кровотечения;
- Когнитивные, неврологические нарушения, нарушения сознания;
- Для объективизации оценки используются бумажные психометрические тесты (тесты связи чисел, число-буква, линии, почерка, арифметический, пересказа), компьютеризированные психометрические тесты (задержки времени реакции, ингибиторного контроля, SCAN-тест, тест Струпа [Stroop test], доступного в виде приложения для смартфона) и нейрофизиологические тесты.
Лабораторные исследования
Основные:
- ОАК с подсчетом тромбоцитов. Могут быть выявлены анемия (в результате гиперспленизма, кровотечений из ВРВ), лейкопения, тромбоцитопения (в результате гиперспленизма и прямого миелодепрессивного влияния ВГС), ускорение СОЭ (при инфекционных осложнениях) [5, 7];
- Биохимический профиль включает определение показателей АЛТ, АСТ, ГГТП, альбумина, билирубина, щелочной фосфатазы, МНО или ПВ, а также рутинных (глюкозы, креатинина, холестерина, калия, натрия), и некоторых специфических показателей, таких как, гамма-глобулины, IgG (скрининг аутоиммунного гепатита), сывороточное железо и ферритин (скрининг гемохроматоза и вторичной перегрузки железом), церулоплазмин (скрининг болезни Вильсона-Коновалова). Активность АЛТ и АСТ, как правило, коррелирует с некровоспалительными изменениями в печени. Уровень билирубина может повышаться при внепеченочном и внутрипеченочном холестазе, а также свидетельствовать об органной недостаточности на поздней стадии заболевания, в особенности при снижении уровня альбумина, увеличении МНО или ПВ и повышении концентрации креатинина и мочевины (при развитии почечной дисфункции) [5, 7];
- Серологические исследования (HBsAg, anti-HBs, anti-HBc, anti-HCV у всех пациентов; HBeAg, anti-HBe, anti-HDV у носителей HBsAg) и вирусологические (ПЦР: HBV ДНК, HCV РНК, HDV РНК) используются для установления этиологии фонового заболевания печени согласно соответствующим клиническим протоколам диагностики и лечения [6-9];
- Альфа-фетопротеин (АФП) - опухолеспецифический маркер, синтезируемый клетками ГЦК и в следовых количествах – здоровой печенью (нормальный уровень в плазме крови – до 20 нг/мл); рекомендуется определять пациентам с подозрением на ГЦК или установленным диагнозом ГЦК, получающим специализированную противоопухолевую терапию, или находящимся в процессе динамического наблюдения после лечения для оценки прогрессирования, прогноза заболевания и контроля эффективности лечения. Результат анализа на АФП считается положительным при уровне >100 нг/мл или ежемесячном увеличении на 7 нг/мл в месяц по результатам 3 последовательных измерений. Уровень АФП может неспецифически повышаться при хронических заболеваниях печени, например, при острых и хронических вирусных гепатитах, некоторых других онкологических заболеваниях (гепатоидном раке желудка, герминогенных опухолях и т. д.), а также при беременности [10, 11].
- Коагулограмма (ПВ, МНО, фибриноген, АЧТВ).
Дополнительные:
- PIVKA-II - представляет собой аномальную форму протромбина, который экспрессируется в результате дефекта посттрансляционного карбоксилирования на фоне дефицита витамина К. Может быть использован для оценки не только риска развития ГЦК, но и прогноза рецидива после хирургического лечения [53,54].
- ОАМ, копрограмма.
На основании результатов клинико-лабораторного исследования рекомендовано проводить динамическую объективную оценку функционального состояния печени (в том числе, для оценки противопоказаний к назначению / продолжению и токсичности противоопухолевой терапии) и прогноза выживаемости по шкале СТР. Прогноз выживаемости для пациентов с ГЦК может быть также оценен по шкале ALBI.
Инструментальные исследования:
Диагностика ГЦК основана на результатах лучевых методов исследования, и в отдельных случаях – результатах гистологического исследования.
Лучевая диагностика ГЦК
Основные:
- Мультифазная МРТ или КТ органов брюшной полости с внутривенным контрастным усилением позволят выявить типичные для ГЦК признаки, такие как:
- диффузное (не кольцевидное) контрастное усиление в поздней артериальной фазе и «вымывание» контрастного вещества в венозной фазе при опухолях >1 см в диаметре;
- наличие псевдокапсулы в отсроченной (равновесной) фазе в опухолевых узлах >2 см в диаметре;
- рост опухоли менее чем за 6 мес. на 50 % или увеличение размеров опухоли не менее чем на 5 мм за 6 мес. [3, 7].
- МРТ органов брюшной полости рекомендуется выполнять с применением гепатоспецифического контрастного препарата (гадоксетовой кислоты) для корректного стадирования опухолевого процесса перед началом лечения, дифференциальной диагностики и контроля эффективности лечения (УД-А) [3, 35, 53, 54];
- КТ органов грудной клетки и сцинтиграфия используются с целью диагностики метастазов ГЦК:
- После установления диагноза ГЦК обязательны КТ органов грудной клетки и сцинтиграфия (в случае наличия у пациента костных болей), так как ГЦК обычно метастазирует в легкие, лимфоузлы брюшной полости, брюшину и кости;
- По меньшей мере 3-фазная КТ или МРТ используется для оценки распространения опухолевого процесса, обнаружения малигнизированных лимфоузлов и инвазии сосудов для определения возможности радикальной терапии;
- Увеличенные регионарные лимфоузлы не обязательно означают малигнизацию; они часто наблюдаются при вирусных гепатитах, первичном билиарном холангите, аутоиммунном гепатите и других фоновых заболеваниях печени [2, 3, 6].
Дополнительные:
- УЗИ органов брюшной полости является скрининговым методом. ГЦК лоцируется в виде очагового образования печени (часто с гипоэхогенным «halo» ободком), эхоструктура которого может различаться в зависимости от размеров опухоли. ГЦК размером ≤ 3 см в диаметре чаще представлена хорошо отграниченным гипоэхогенным образованием; опухоли > 3 см отличаются наличием стеатоза, кальцификации, некротических изменений, кровоизлияний и часто могут быть гиперэхогенными. УЗИ с ЦДК и энергетическая допплерография выявляют гиперваскулярность с кровоток опухоли от периферии к центру. лучше выявляет сосудистый кровоток опухоли от периферии к центру. Ценность УЗИ заключается также в обеспечении контроля при выполнении прицельной биопсии очагов в печени [3, 7].
- УЗИ органов брюшной полости с контрастным усилением обладает преимуществом в выявлении гиперваскулярных узлов и может использоваться при дифференциальной диагностике очаговых образований печени. ГЦК характеризуется интенсивным пиком усиления эхо-сигнала в артериальную фазу, околоопухолевым и внутриопухолевым хаотическим скоплением атипичных сосудов (обусловленных неоангиогенезом), а также наличием питающих сосудов [3, 7].
- ПЭТ-сканирование ФДГ не рекомендуется для ранней диагностики ГЦК из-за высокой вероятности ложноотрицательных результатов (УД-С). Может быть рассмотрена для выявления внепеченочных метастазов (с холином, ФДГ) [36].
Прицельная биопсия печени [2,3,6]:
У пациентов с установленным ЦП и типичными результатами контрастирования очагового образования печени при лучевой визуализации (МРТ или КТ с внутривенным контрастным усилением) диагноз ГЦК может быть выставлен без морфологического подтверждения;
У пациентов с установленным ЦП с нетипичными для ГЦК результатами лучевой визуализации (МРТ или КТ с внутривенным контрастным усилением), в особенности, при поражениях диаметром менее 2 см, когда диагностическая значимость лучевых методов исследования снижается, для постановки диагноза ГЦК показана прицельная биопсия узловых образований печени;
У пациентов без ЦП лучевая диагностика сама по себе не считается достаточной, и для постановки диагноза ГЦК требуется морфологическое подтверждение;
В случаях, когда установление или исключение ЦП затруднительно, диагностические подходы соответствуют таковым для пациентов без ЦП (т.е. морфологическая верификация обязательна);
Толсто- и тонкоигольная биопсия печени имеют свои преимущества и недостатки. Толстоигольная биопсия более информативна и позволяет сохранить образец ткани в парафине для дальнейших иммунногистохимических и гистологических обследований, и, кроме того, имеет более высокую чувствительность (ложноотрицательные результаты встречаются реже). Тонкоигольная биопсия менее инвазивна и реже приводит к осложнениям, особенно при расположении патологического очага в глубине органа и вблизи крупных сосудов;
Диагностическая значимость прицельной биопсии во многом зависит от опыта и квалификации проводившего ее врача, а также морфолога; в любом случае, отрицательный результат биопсии не гарантирует отсутствия ГЦК, особенно при небольших размерах патологического очага. Пациенты с отрицательным, либо неокончательным гистологическим результатом, должны находиться под тщательным наблюдением с проведением повторных лабораторных и инструментальных обследований, включая повторную биопсию, особенно в случае роста очага.
Скрининг ГЦК
Скрининг ГЦК проводится исходя из следующих принципов [3]:
Скринингу подлежат конкретные целевые группы с повышенными рисками развития ГЦК, к которым относятся [3]:
- Пациенты с ЦП класса А и В по СТР (УД-A);
- Пациенты с ЦП класса С по СТР, находящиеся в листе ожидания трансплантации печени (УД-C);
- Пациенты без ЦП с ХГВ со средним или высоким риском ГЦК (согласно классам по PAGE-B 10-17 и ≥18 баллов соответственно) (УД-C);
- Риск ГЦК при ХГВ может быть рассчитан по шкале REACH-B, включающую пол, возраст, АЛТ, HBeAg, [HBV DNA], имеется он-лайн калькулятор: https://www.mdcalc.com/reach-b-score-hepatocellular-carcinoma-hcc#evidence;
- Пациенты без ЦП, но с выраженным фиброзом F3 согласно индивидуальной оценке риска (УД-C);
- Роль скрининга пациентов с НАЖБП без ЦП неясна (УД-C);
- Пациентам с ХГВ, не получающим терапию по поводу XГВ, и имеющим низкий риск ГЦК, целесообразно проходить скрининг ГЦК, по крайней мере, ежегодно (УД-С).
Скрининг ГЦК проводится каждые 6 месяцев квалифицированным специалистом и включает УЗИ органов брюшной полости (B) ± АФП;
АФП, АФП-L3 и дезгаммакарбоксипротромбин (DCP) не обладают высокой специфичностью и являются субоптимальными с точки зрения экономической эффективности для рутинного наблюдения и раннего выявления ГЦК (УД-A).
У пациентов с высоким риском развития ГЦК c узлами <1 см, которые были обнаружены на УЗИ, скрининг нужно проводить c интервалами ≤ 4-месяцев в первый год; при отсутствии увеличения размеров и количества узлов, дальнейший скрининг может проводиться с обычным 6-месячным интервалом.
Рекомендации по диагностике ГЦК:
Диагноз ГЦК у пациентов с ЦП основываться на неинвазивных критериях (результатах лучевой диагностики) и/или гистологии (УД-А);
Неинвазивные диагностика ГЦК может быть использована только у пациентов с ЦП и узлом (узлами) ≥1 см и основывается на результатах мультифазной МРТ или КТ с динамическим контрастным усилением (УД-А) или УЗИ с контрастным усилением (УД-В); из-за более высокой чувствительности и возможности полного обзора печени МРТ или КТ следует использовать в первую очередь (УД-В);
Лучевая диагностика основана на выявлении признаков ГЦК, которые различаются в зависимости от метода визуализации и используемого контрастного вещества (типично интенсивное контрастирование в артериальную фазу с последующим значительным либо полным вымыванием контрастного вещества в позднюю венозную фазу);
В лучевой диагностике / дифференциальной диагностике ГЦК может использоваться рентгенологическая классификация LI-RADS [7, 17]. В рандомизированных исследованиях доказано, что категория LI-RADS 4–5 имеет высокую специфичность (95–100 %) для пациентов группы высокого риска ГЦК с узлом размером >10 мм [18, 19];
У пациентов без ЦП диагноз ГЦК должен быть подтвержден гистологически (УД-В);
Патоморфологическая диагностика ГЦК должна быть основана на рекомендациях Международного Консенсуса [15,16] с применением необходимых гистологических и иммуногистологических анализов (УД-А).
Показания для консультации узкими специалистами:
Консультация гастроэнтеролога (для лечения фонового гепатита или цирроза печени, портальной гипертензии, а также других сопутствующих заболеваний органов ЖКТ);
Консультация невропатолога и/или нейрохирурга (при наличии болевого синдрома, метастазов в позвоночник или других заболеваниях центральной либо периферической нервной системы);
Консультация торакального хирурга (при наличии метастазов в легкие);
Консультация кардиолога (пациентам старше 50 лет и все пациентам при наличии сопутствующей кардиоваскулярной патологии);
Консультация нефролога (при наличии острого или хронического почечного повреждения).
Диагностический алгоритм.
Алгоритм лучевой диагностики ГЦК в соответствии с классификацией LI-RADS представлен на схеме 1 [46]. Алгоритм диагностики и повторных обследований пациентов с циррозом и объемным образованием печени представлен на схеме 1 и схеме 2.
Схема 1. Алгоритм лучевой диагностики ГЦК в соответствии с классификацией LI-RADS.
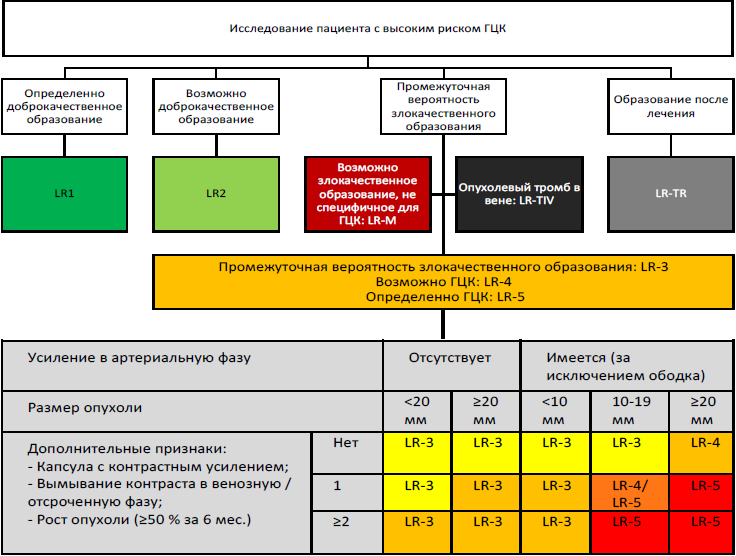
Схема 2: Алгоритм диагностики и повторных обследований пациентов с циррозом и объемным образованием печени.
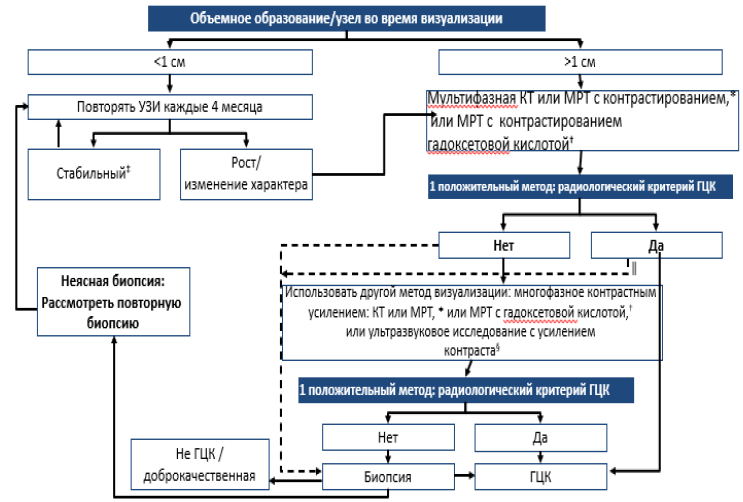
*Использование внеклеточных контрастных агентов МРТ; †Диагностические критерии: контрастирование в артериальную фазу и вымывание в портальную венозную фазу;
‡Пациентов с узлами <1 см, стабильными в течение12 месяцев (3 контроля каждые 4 месяца) можно перевести в группу регулярного скрининга каждые 6 месяцев;
§Диагностические критерии: накопление контраста в артериальную фазу и вымывание после 60 секунд;
Лабораторная диагностика
Дифференциальный диагноз
Дифференциальный диагноз ГЦК [1,2].
| Объекты диф. диагностики | Фоновые заболевания / Факторы риска | УЗИ, УЗДГ | 3 (4)-фазная КТ | 3 (4)-фазная МРТ |
| ГЦК | Цирроз печени (чаще), хронический гепатит (реже) | Гипо- или гиперэхогенное образование, иногда с хало- ободком, чаще гиперваскулярное с повышенным объемом кровотока и расширением спектра при УЗДГ | Гиперваскулярное образование, часто гетерогенное, с неровным контуром, накоплением контраста в артериальной фазе и феноменом вымывания в венозной фазе |
При низкодиффернцированн ом ГЦК: гипоинтенсивный сигнал на Т1- и гиперинтенсивный - на Т2-взвешенных изображениях; при выскодифференцирован ной ГЦК: гиперинтенсивный сигнал на Т1- и изоинтенсивный - на
Т2-взвешенных изображениях. Гиперваскулярное образование, часто гетерогенное, с неровным контуром, накоплением контраста в артериальной фазе и феноменом вымывания в венозной фазе
|
| Диспластический узел | ЦП | Чаще гипоэхогенное образование, диаметром в пределах 1 см | Фазный характер накопления и вымывания контраста, характерный для ГЦК, не прослеживается | Гиперинтенсивное образование на Т1-и изо- или гипоинтенсивное образование на Т2- взвешенном изображении. Фазный характер накопления и вымывания контраста, характерный для ГЦК, не прослеживается |
| Холангиокарцинома | Первичный склерозирующий холангит | Расширение желчных протоков (при вовлечении крупных желчных протоков) | Низкоплотное образование с отсроченным накоплением контраста | Гипоинтенсивное образование на Т1- и гиперинтенсивное - на Т2-взвешенных изображениях с накоплением контраста в позднюю венозную фазу. МР- холангионграфия может помочь в диагностике |
| Отдаленный метастаз | Злокачественные образования внепеченочной локализации | Гипо- или гиперэхогенное образование со сниженным индексом и объемом кровотока при УЗДГ, иногда наличие кистозного компонента | Гипер- или гиповаскулярные, или кистозные образования; накопление контраста по контуру образования (корона- эффект) (SS 49%-74%) |
Образование низкой интенсивности на Т1- и высокой интенсивности – на Т2-взвешенных изображениях; накопление контраста по контуру образования
|
| Гемангиома | Отсутствуют | Гиперэхогенное образование (на фоне стеатоза может выглядеть гипоэхогенным), с четким контуром (при больших размерах – гетерогенное), повышенной звукопроводимостью, вариабельным кровотоком, отсутствием спектрального расширения | Образование, накапливающее контраст в артериальную фазу от периферии к центру, с сохранением контраста в последующие фазы | Гиперинтенсивное образование на Т2 и гипоинтенсивное – на Т1- взвешенных изображениях, с периферическим / центрипетальным контрастированием в артериальной фазе и последующей задержкой контраста |
| Фокальная нодулярная гиперплазия |
Отсутствуют (врожденная
аномалия)
|
Гомогенное изо-, гипо- или гиперэхогенное образование с цетральной гиперэхогенной зоной, с усиленным кровотоком и расширением спектра при УЗДГ | Образование с гомогенным контрастирован ие в артериальную фазу и центральным рубцом низкой плотности, накапливающи м контраст в равновесную фазу | Гипо- или изоинтенсивное образование на Т1- взвешенных изображениях, накапливющее контраст в артериальную фазу, с центральным рубцом, гиперинтенсивным на Т2- взвешенных изображениях, накапливающим контраст в венозную фазу |
| Аденома | Женский пол, репродуктивный возраст, прием гормональных контрацептивов | Гетерогенное образование с анэхогенным центром, иногда гиперэхогенное (в случае кровоизлияния), с различными характеристиками кровотока при УЗДГ | Чаще гомогенное, реже гетерогенное образование с отсроченным периферически м накоплением контраста | Наличие капсулы, гиперинтенсивность на Т1-взвешенных изображениях |
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ
План лечения ГЦК
План лечения ГЦК обсуждается мультидисциплинарной группой на базе специализированных центров и должен учитывать [3,36]:
Распространенность опухолевого процесса;
Функциональные резервы печени;
Объективное состояние пациента;
Этиологию;
Наличие и класс ЦП;
Прогноз основного и фонового заболеваний печени;
Сопутствующую патологию;
Пожелания пациента.
Локальная деструкция опухоли:
Стереотаксическая лучевая терапия.
Регионарная терапия:
Системная лекарственная терапия;
Алгоритм выбора лечения ГЦК (EASL-EORTIC, 2018) зависит от стадии по BCLC.
Схема 3. Модифицированная Барселонская система стадирования и лечения ГЦК (BCLC)
Рекомендации по немедикаментозному лечению включают [5, 51]:
*1В соответствии с правилами применения незарегистрированных ЛС.
Таблица 10. Режимы 2 линии системной терапии ГЦК
*В соответствии с правилами применения незарегистрированных ЛС;
Симптоматическое лечение проводится согласно следующим рекомендациям [3]:
Таблица 11. Перечень лекарственных средств на амбулаторном уровне с вероятность применения 100%
Таблица 12. Перечень лекарственных средств на амбулаторном уровне с вероятность применения менее 100%
Хирургическое вмешательство: нет.
Дальнейшее диспансерное наблюдение пациентов с ГЦК
Оценка ответа на противоопухолевую терапию ГЦК проводится исходя из следующих рекомендаций:
Таблица 13. Критерии RECIST 1.1 и mRECIST [41]
Методы и алгоритм лечения ГЦК
В лечении ГЦК применяются следующие методы:
Хирургическое лечение:
- Резекции печени;
- Трансплантация печени (ТП).
Локальная деструкция опухоли:
- Термическая деструкция (радиочастотная, микроволновая, крио-аблация);
- Инъекции этанола;
Стереотаксическая лучевая терапия.
Регионарная терапия:
- Трансартериальная химиоэмболизация;
- Трансартериальная радиоэмболизация.
Системная лекарственная терапия;
Лучевая терапия;
Лечение фонового заболевания печени;
Паллиативное (симптоматическое) лечение.
Алгоритм выбора лечения ГЦК (EASL-EORTIC, 2018) зависит от стадии по BCLC.
Схема 3. Модифицированная Барселонская система стадирования и лечения ГЦК (BCLC)

Немедикаментозное лечение
Рекомендации по немедикаментозному лечению включают [5, 51]:
Минимизацию факторов риска прогрессирования (исключение алкоголя, табака, марихуаны, гепатотоксичных лекарственных средств, включая биологически активные добавки, нормализацию веса тела и т.д.);
Недопущение гиподинамии с прогрессирующим увеличением физической активности с учетом статуса заболевания и функциональных возможностей
Дозированные физические нагрузки, в том числе, рекомендуемые пациентам с классом тяжести ЦП А-B по СТР;
Охранительный режим с ограничением физических нагрузок у пациентов с классом тяжести ЦП С по СТР и высоким риском кровотечений.
Рекомендации по питанию, в целом, соответствуют таковым при ЦП [51].
Запрещается потребление алкоголя;
Калораж пищи должен определяться из расчета не менее 35 ккал/кг/день, при этом учитывается фактический вес больного, с коррекцией в случае наличия асцита;
У пациентов с ожирением (ИМТ>30 кг/м2), страдающих ЦП, для достижения целевой потери веса (>5-10%) целесообразна гипокалорийная диета (с дефицитом 500-800 ккал/сутки);
При составлении рациона целесообразно учитывать предпочтения пациента;
Минимальное потреблении белка, необходимое для поддержания баланса азота при ЦП, составляет 1,2–1,5 г/кг веса тела в сутки;
Не допускается сокращение потребления белка, за исключением непосредственно эпизодов тяжелой ПЭ, особенно при наличии портосистемных шунтов;
Растительный белок переносится лучше животного; целесообразна комбинация растительных белков (фасоль, горох и т.д.), молочных продуктов, птицы, рыбы, длинноцепочных аминокислот;
Поощряется употребление овощей и фруктов; если при этом возникает вздутие живота, то необходимо провести коррекцию рациона;
Поощряется потребление черного кофе до 2-3 чашек в сутки (при удовлетворительной переносимости);
У пациентов с асцитом требуется ограничение потребления натрия (в пределах 80 ммоль в день, что соответствует 2 г натрия и 5 г соли, добавляемой ежедневно к рациону); поскольку это может привести к потере аппетита и снижению потребления калорий и белка, необходимо принять меры по улучшению органолептических свойств пищи; может потребоваться некоторое время для привыкания к такой диете;
Предпочтительно дробное питание с сокращением промежутков между приемами пищи; целесообразно 3 основных приема пищи (завтрак, обед и ужин) и 3 перекуса (второй завтрак, полдник и поздний ужин);
Необходим достаточный общий объем потребляемой жидкости (до 2–3 литров в сутки), за исключением случаев дилюционной гипонатриемии у пациентов с асцитом;
Саплементация минералами (селен, цинк) и витаминами (К, D) показана при их клинически или лабораторно подтвержденном дефиците; в частности при уровне 25-гидроксивитамина D <20 нг/мл показан его пероральный прием до достижения уровня >30 нг/мл;
Для восполнения выраженного дефицита белка, а также макро- и микронутриентов, в особенности у пациентов с ПЭ, могут назначаться специализированные жидкие стерильные готовые к использованию энтеральные питательные смеси, содержащие аминокислоты с разветвленной цепью (АКРЦ) (Растворы аминокислот, применяемые при печеночной недостаточности, в качестве добавки к пище от 50 до 200 г/сутки внутрь);
В случаях выраженного истощения и/или невозможности энтерального питания показано парентеральное питание из расчета 35-40 ккал/кг идеальной массы тела/сутки, с включением аминокислот с разветвленной цепью (АКРЦ) и лейцина (специализированные растворы аминокислот применяемые при печеночной недостаточности);
Требуется соблюдение рекомендаций по питанию, специфичных для конкретной этиологии ЦП (например, исключение легкоусваиваемых углеводов при СД или инсулинорезистентности, исключение продуктов, содержащих медь при болезни Вильсона-Коновалова и т.д.).
Первичная профилактика ГЦК включает [20-25]:
Вакцинацию против гепатита В;
Достоверно снижает риски HBV-ассоциированной ГЦК;
Изменения социальной / культурной / медицинской практики (снижение потребления / вреда инъекционных наркотиков, профилактику заболеваний, передаваемых половым путем, эффективный скрининг препаратов крови);
В целях снижения рисков вирусных гепатитов В, С, D;
Модификацию образа жизни (рациональное питание, физические нагрузки, снижение потребления алкоголя);
В целях снижения риска жировой болезни печени;
Снижение риска контакта с канцерогенами (афлатоксин, табак) путем совершенствования законодательства, контроля, информационного обеспечения.
Вторичная профилактика ГЦК включает этиотропную и базисную патогенетическую терапию фонового гепатита согласно соответствующим клиническим рекомендациям [9, 10, 13, 26-34]:
Противовирусную терапию хронического гепатита В, С, D;
Модификацию образа жизни и таргетную терапию компонентов метаболического синдрома при метаболически-ассоциированной (неалкогольной) жировой болезни печени;
Абстиненцию при алкогольном стеатогепатите;
Третичная профилактика ГЦК включает:
Иммуносупрессивную терапию аутоиммунного гепатита;
Антихолестатическую терапию первичного билиарного холангита;
Антикомлексоновую терапию при болезни Вильсона-Коновалова, гемохроматозе и пр.
Третичная профилактика ГЦК включает:
Регулярное динамическое наблюдение с использованием КТ или МРТ с внутривенным контрастным усилением,
Меры по предотвращению рецидива ГЦК, в том числе с помощью противоопухолевой терапии и этиотропной терапии фонового заболевания печени.
Системная терапия ГЦК показана пациентам с распространенным опухолевым процессом (стадия С по BCLC) в целях улучшения выживаемости и контроля роста опухоли при:
Медикаментозное лечение
Системная терапия ГЦК показана пациентам с распространенным опухолевым процессом (стадия С по BCLC) в целях улучшения выживаемости и контроля роста опухоли при:
Наличии объективных признаков опухолевого процесса и удовлетворительном общем состоянии (ECOG 0–1);
Сохранной функции печени (СТР А или В, 5–7 баллов);
Невозможности применения локальных методов лечения (резекции, трансплантации печени, (химио-)эмболизации);
Внутрипеченочной локализации ГЦК (в качестве «терапии ожидания» ТП) [2, 3, 6].
Во время системной терапии необходим тщательный мониторинг функции печени, проведение активной профилактики и коррекция осложнений ЦП.
Таблица 9. Режимы 1 линии системной терапии ГЦК
Таблица 9. Режимы 1 линии системной терапии ГЦК
|
Группа
|
Препарат | Режим | Рекомендации | УД |
| Мультикиназный ингибитор (МКИ), ингибитор протеинкиназы | Сорафениб |
400 мг внутрь 2 раза в сутки длительно
(400 мг внутрь 1 раз в сутки при ЦП с классом тяжести СТР В7)
|
Стандартная терапия 1 линии у пациентов с ЦП CTP А-СТР В7. Возможно назначение на стадии BCLC-B при прогрессировании или противопоказаниях к локо-регионарной терапии | А |
| МКИ, ингибитор протеинкиназы | Ленватиниб |
8 мг внутрь (при массе тела < 60 кг) 1 раз в сутки длительно
12 мг внутрь (при массе тела ≥ 60 кг) 1 раз в сутки длительно
|
Имеет сопоставимую эффективность с сорафенибом и показан для терапии пациентов с ЦП СТР А. Возможно назначение на стадии BCLC-B при прогрессировании или противопоказаниях к локо-регионарной терапии. | А |
|
Моноклональное антитело к PD-1 + Моноклональное антитело к VEGF |
Атезолизумаб + Бевацизумаб |
Атезолизумаб 1200 мг в/в +
Бевацизумаб 15 мг/кг в/в 1 раз в 3 нед. длительно
|
Данная комбинация продемонстрировала достоверное увеличение беспрогрессивной и общей выживаемости в сравнении с сорафенибом | А |
| Моноклональное антитело к PD-1 | Ниволумаб* | 240 мг в/в 1 раз в 2 нед. длительно (или 480 мг 1 раз в 4 нед.) | Вариант выбора 1 линии терапии при нарушенной функции печени (СТР В 7–8) и / или при противопоказаниях к МКИ | С |
Таблица 10. Режимы 2 линии системной терапии ГЦК
|
Вид терапии
|
Препарат | Режим | Рекомендации | УД |
| МКИ, ингибитор протеинкиназы | Регорафениб | 160 мг внутрь 1 раз в сутки; в течение 3 нед., с интервалом каждые 4 нед. | Рекомендован при прогрессировании на сорафенибе (при условии переносимости сорафениба в дозе ≥ 400 мг/сут.), общем состоянии ECOG 0–1 и компенсированной функцией печени (CTP A). Назначение регорафениба возможно через 1–2 нед. после окончания сорафениба | А |
|
МКИ, ингибитор протеинкиназы
|
Кабозантиниб | 60 мг внутрь 1 раз в сутки длительно | Рекомендован пациентам с общим состоянием ECOG 0–1 и компенсированной функцией печени (СТР A). Непереносимость сорафениба не является противопоказанием к назначению | А |
| Моноклональное антитело к VEGFR 2 |
Рамуцирумаб
|
10 мг/кг в/в 1 раз в 2 нед. | Рекомендован пациентам с уровнем АФП ≥ 400 нг / мл. при прогрессировании на сорафенибе или его непереносимости с общим состоянием ECOG 0–1 и компенсированной функцией печени (СТР A) | А |
|
Моноклональное антитело к PD-1
|
Ниволумаб* | 240 мг в/в 1 раз в 2 нед. длительно (или 480 мг 1 раз в 4 нед.) | Рекомендован в качестве 2 и последующих линий при СТР В7-8 и / или противопоказаниях к МКИ и рамуцирумабу. Нет данных о негативном влиянии на течение ЦП. Вероятность реактивации вирусных гепатитов низка, хотя в случаях HBsAg+ необходима одновременная противовирусная терапия аналогами нуклеоз(т)идов | С |
|
Моноклональное антитело к PD-1 + Моноклональное антитело к CTLA-4 |
Ниволумаб1 + Ипилимумаб* |
Ниволумаб1 1 мг/кг в/в +
Ипилимумаб 3 мг/ кг в/в 1 раз в 3 нед. - 4 курса; далее через 6 нед.: Ниволумаб1 240 мг в/в 1 раз в 2 нед. (или 480 мг в/в 1 раз в 4 нед.) длительно
|
Рекомендован в качестве 2-й и 3-й линий терапии при непереносимости или противопоказаниях к МКК | С |
|
Моноклональное антитело к PD-1
|
Пембролизумаб | 200 мг в/в 1 раз в 3 нед. длительно | Рекомендован в качестве 2 и 3 линий терапии при непереносимости или противопоказаниях к МКК | С |
Лечение фонового заболевания печени включает этиотропную или базисную патогенетическую терапию гепатита, а также осложнений ЦП согласно соответствующим клиническим рекомендациям [5, 51].
Симптоматическое лечение проводится согласно следующим рекомендациям [3]:
При ГЦК на фоне ЦП (УД-С):
Для купирования умеренной боли может использоваться Парацетамол ≤3 г в сутки;
Применение нестероидных противовоспалительных средств следует избегать;
Для купирования боли средней или сильной интенсивности могут использоваться опиоидные анальгетики (возможны запоры);
При костных метастазах с болевым синдромом или высоким риском вторичных спонтанных переломов возможно применение паллиативной лучевой терапии (УД-С);
Применение психотропных препаратов (в частности, бензодиазепинов) для лечения психологического стресса у пациентов с декомпенсированным ЦП ассоциировано с повышенным риском обмороков, травм и изменением психического состояния (УД-С);
Психологическая поддержка рекомендуется пациентам в соответствии с их статусом (УД-С).
Таблица 11. Перечень лекарственных средств на амбулаторном уровне с вероятность применения 100%
|
Фармакотерапевтическая группа / Код АТХ
|
МНН | Способ применения* | УД |
|
Ингибитор протеинкиназы
L01XE05
|
Сорафениб | 400-800 мг в сутки внутрь | А |
|
Ингибитор протеинкиназы
L01XE28
|
Ленватиниб | 8-12 мг в сутки внутрь | А |
|
Моноклональное антитело к PD-1
L01XC32
Моноклональное антитело к VEGF
L01XC07
|
Атезолизумаб
+
Бевацизумаб |
1200 мг в сутки в/в
+
15 мг/кг в/в 1 раз в 3 нед. |
А |
| Ингибитор протеинкиназы L01XE21 | Регорафениб | 160 мг внутрь 1 раз в сутки; в течение 3 нед., с интервалом каждые 4 нед. | А |
| Ингибитор протеинкиназы L01XE26 | Кабозантиниб | 60 мг внутрь 1 раз в сутки длительно | А |
Таблица 12. Перечень лекарственных средств на амбулаторном уровне с вероятность применения менее 100%
|
Фармакотерапевтическая группа / Код АТХ
|
МНН | Способ применения* | УД |
|
Моноклональное антитело к PD-1
L01XC17
|
Ниволумаб* | 240 мг в/в 1 раз в 2 нед. или 480 мг 1 раз в 4 нед.) | С |
|
Моноклональное антитело к CTLA-4
L01XC11
|
Ипилимумаб* | Ипилимумаб 3 мг/ кг в/в 1 раз в 3 нед. | С |
|
Моноклональное антитело к PD-1
L01XC18
|
Пембролизумаб
|
200 мг в/в 1 раз в 3 нед. | С |
|
Моноклональное антитело к VEGFR 2
L01XC21
|
Рамуцирумаб | 10 мг/кг в/в 1 раз в 2 нед. | А |
*В соответствии с правилами применения незарегистрированных ЛС.
Хирургическое вмешательство: нет.
Дальнейшее диспансерное наблюдение пациентов с ГЦК
|
Категории
|
Исследования | Периодичность |
| Пациенты после завершения радикального лечения | АФП (в особенности, если исходный уровень был повышен) | Каждые 3–4 мес. в первые 2 года, далее 1 раз в 6 мес. |
| УЗИ органов брюшной полости | Каждые 3–4 мес. | |
| Мультифазная КТ или МРТ органов брюшной полости с внутривенным контрастированием | Каждые 3–6 мес. | |
| Рентгенография или КТ органов грудной клетки | Каждые 12 мес. | |
| Пациенты, проходящие противоопухолевое лечение (для раннего выявления прогрессирования заболевания) | АФП | Каждые 3–4 мес. |
| УЗИ органов брюшной полости | Каждые 2–3 мес. | |
| Мультифазная КТ или МРТ органов брюшной полости с внутривенным контрастированием | Каждые 3–4 мес. | |
| Рентгенография или КТ органов грудной клетки | Каждые 6 мес. | |
| Сцинтиграфия костей всего тела | По показаниям | |
| ЭГДС | По показаниям | |
| Все пациенты с ГЦК |
ОАК с подсчетом тромбоцитов
Биохимический анализ крови (АЛТ, АСТ, ГГТП, ЩФ, билирубин, альбумин, креатинин, мочевина, глюкоза, калий, натрий), МНО
|
Каждые 3 мес.; по достижении ремиссии ГЦК при компенсированном заболевания печени (СТР А) - не реже, чем каждые 6 мес. |
| Пациенты С ГЦК в зависимости от этиологии фонового заболевания печени | Серологический и вирусологический статус (HBsAg, anti-HDV, anti-HCV, HBV ДНК, HDV РНК, HCV РНК) у пациентов с хроническим гепатитом /ЦП В±D, С | Согласно соответствующим клиническим рекомендациям |
| Глюкоза, инсулин, Hb A1c, липидограмма при НАСГ у пациентов с неалкогольным стеатогепатитом / ЦП | ||
| Уровень церулоплазмина, меди в крови и суточной моче, выраженность кольца Кайзера-Флейшера у пациентов с болезнью Вильсона-Коновалова | ||
| Уровень ферритина, ОЖСС, насыщение сывороточного трансферрина у пациентов с гемохроматозом | ||
| Белковые фракции (гамма-глобулины), IgG при АИГ у пациентов с аутоиммунным гепатитом / ЦП холангитом | ||
| Щелочная фосфатаза, ГГТП, IgM у пациентов с первичным билиарным холангитом | ||
| Пациенты с ГЦК отдельными осложнениями ЦП |
УЗДГ сосудов печени и селезенки (на предмет тромбоза воротной и печеночных вен)
УЗИ плевральных полостей (рентгенография органов грудной клетки) для оценки / мониторинга печеночного гидроторакса
Психометрические, нейрофизиологические тесты для оценки / мониторинга печеночной энцефалопатии
ЭКГ, ЭхоКГ для оценки / мониторинга портопульмональной гипертензии, цирротической кардиомиопатии
Оценка по шкалам SARC-F и EWGSOP2 для оценки / мониторинга саркопении
25-гидроксивитамин D, ионизированный кальций для оценки / мониторинга минерального обмена
|
Не реже, чем каждые 6 мес. при ЦП СТР А и каждые 3 мес. – при ЦП СТР В, С |
| ЭГДС (скрининг / мониторинг варикозного расширения вен пищевода, желудка) | Ежегодно при компенсированном ЦП (СТР А) с показателями непрямой эластографии >20 кПа и количеством тромбоцитов <150/мкл, при декомпенсированном ЦП, а также у всех пациентов с ранее выявленным варикозным расширением | |
| Двухэнергетическая рентгеновская абсорбциометрия для оценки / мониторинга остеопороза | Каждые 12 месяцев | |
| Иные исследования по показаниям | Согласно соответствующим клиническим рекомендациям |
Индикаторы эффективности лечения
Индикаторами эффективности лечения ГЦК являются:
Ответ (регрессия) опухоли на противоопухолевую терапию
Безрецидивная выживаемость (трех- и пятилетняя);
Удовлетворительное качество жизни
Оценка ответа на противоопухолевую терапию ГЦК проводится исходя из следующих рекомендаций:
Для оценки эффективности противоопухолевого лечения у пациентов с ГЦК необходимо проводить мультифазную КТ или МРТ (с контрастным усилением) каждые 2–3 мес. с использованием критериев RECIST 1.1 и/или mRECIST (при ЦП);
Оценку ответа на локорегионарную терапию следует использовать критерии mRECIST (УД-В) (таблица 15);
Для оценки ответа на системную терапию рекомендованы как критерии RECIST, так и 1.1 mRECIST (УД-В) (таблица 15);
Для оценки ответа после резекции, локорегиональной или системной терапии рекомендуются многофазная КТ или МРТ с контрастным усилением (УД-В);
Определение АФП в динамике целесообразно пациентам с его исходно высоким уровнем; самостоятельного клинического значения данный показатель не имеет (УД-С).
Таблица 13. Критерии RECIST 1.1 и mRECIST [41]
|
RECIST 1.1
|
mRECIST | |
| Полный ответ (ПО) | Исчезновение всех целевых образований | Исчезновение любого внутриопухолевого артериального усиления во всех целевых образованиях |
| Частичный ответ (ЧО) | Уменьшение суммы диаметров целевых образований ≥30% | Уменьшение суммы диаметров целевых образований с внутриопухолевым артериальным усилением ≥30% |
| Стабилизация заболевания (СЗ) | Не подходит под категории ПО или ЧО | Не подходит под категории ПО или ЧО |
| Прогрессирование заболевания (ПЗ) | Увеличение суммы диаметров целевых образований ≥20% | Увеличение суммы диаметров целевых образований с внутриопухолевым артериальным усилением ≥20% |
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ
Карта наблюдения пациента, маршрутизация пациента: Алгоритм выбора лечения ГЦК (EASL-EORTIC, 2018) зависит от стадии по BCLC (см. Схема 3).
Немедикаментозное лечение
Рекомендации по немедикаментозному лечению включают [5, 51]:
Минимизацию факторов риска прогрессирования (исключение алкоголя, табака, марихуаны, гепатотоксичных лекарственных средств, включая биологически активные добавки, нормализацию веса тела и т.д.);
Недопущение гиподинамии с прогрессирующим увеличением физической активности с учетом статуса заболевания и функциональных возможностей
Дозированные физические нагрузки, в том числе, рекомендуемые пациентам с классом тяжести ЦП А-B по СТР;
Охранительный режим с ограничением физических нагрузок у пациентов с классом тяжести ЦП С по СТР и высоким риском кровотечений.
Рекомендации по питанию, в целом, соответствуют таковым при ЦП [51]:
Запрещается потребление алкоголя;
Калораж пищи должен определяться из расчета не менее 35 ккал/кг/день, при этом учитывается фактический вес больного, с коррекцией в случае наличия асцита;
У пациентов с ожирением (ИМТ>30 кг/м2), страдающих ЦП, для достижения целевой потери веса (>5-10%) целесообразна гипокалорийная диета (с дефицитом 500-800 ккал/сутки);
Трансплантация печени является радикальным методом лечения ГЦК (в том числе, не выявленных очагов), а также фонового заболевания печени. Успешная ТП возможна при соответствии Миланским критериям (Mazzaferro et al., 1996), т.е. наличии одной опухоли диаметром не более 5 см, либо до 3 опухолей включительно диаметром не более 3 см каждая. В связи с этим, ТП – метод выбора для пациентов на ранней стадии ГЦК и декомпенсированным ЦП (классы B и C по CTP) [3].
При составлении рациона целесообразно учитывать предпочтения пациента;
Минимальное потреблении белка, необходимое для поддержания баланса азота при ЦП, составляет 1,2–1,5 г/кг веса тела в сутки;
Не допускается сокращение потребления белка, за исключением непосредственно эпизодов тяжелой ПЭ, особенно при наличии портосистемных шунтов;
Растительный белок переносится лучше животного; целесообразна комбинация растительных белков (фасоль, горох и т.д.), молочных продуктов, птицы, рыбы, длинноцепочных аминокислот;
Поощряется употребление овощей и фруктов; если при этом возникает вздутие живота, то необходимо провести коррекцию рациона;
Поощряется потребление черного кофе до 2-3 чашек в сутки (при удовлетворительной переносимости);
У пациентов с асцитом требуется ограничение потребления натрия (в пределах 80 ммоль в день, что соответствует 2 г натрия и 5 г соли, добавляемой ежедневно к рациону); поскольку это может привести к потере аппетита и снижению потребления калорий и белка, необходимо принять меры по улучшению органолептических свойств пищи; может потребоваться некоторое время для привыкания к такой диете;
Предпочтительно дробное питание с сокращением промежутков между приемами пищи; целесообразно 3 основных приема пищи (завтрак, обед и ужин) и 3 перекуса (второй завтрак, полдник и поздний ужин);
Необходим достаточный общий объем потребляемой жидкости (до 2–3 литров в сутки), за исключением случаев дилюционной гипонатриемии у пациентов с асцитом;
Саплементация минералами (селен, цинк) и витаминами (К, D) показана при их клинически или лабораторно подтвержденном дефиците; в частности при уровне 25-гидроксивитамина D <20 нг/мл показан его пероральный прием до достижения уровня >30 нг/мл;
Для восполнения выраженного дефицита белка, а также макро- и микронутриентов, в особенности у пациентов с ПЭ, могут назначаться специализированные жидкие стерильные готовые к использованию энтеральные питательные смеси, содержащие аминокислоты с разветвленной цепью (АКРЦ) (Растворы аминокислот, применяемые при печеночной недостаточности, в качестве добавки к пище от 50 до 200 г/сутки внутрь);
В случаях выраженного истощения и/или невозможности энтерального питания показано парентеральное питание из расчета 35-40 ккал/кг идеальной массы тела/сутки, с включением аминокислот с разветвленной цепью (АКРЦ) и лейцина (специализированные растворы аминокислот применяемые при печеночной недостаточности);
Требуется соблюдение рекомендаций по питанию, специфичных для конкретной этиологии ЦП (например, исключение легкоусваиваемых углеводов при СД или инсулинорезистентности, исключение продуктов, содержащих медь при болезни Вильсона-Коновалова и т.д.).
Резекция печени выполняется, исходя из следующих положений:
Показания к резекции печени у пациентов с ГЦК и ЦП должны быть основаны на (УД-А):
Резекция печени рекомендована при единичном очаге ГЦК любого размера, в особенности, >2 см в диаметре при сохранной функции и достаточном объеме печени (УД-А);
При ГЦК в пределах Миланских критериев (один очаг до 5 см или два-три очага менее 3 см в диаметре), резекция печени возможна в зависимости от (УД-С):
Макрососудистая инвазия, обусловленная ГЦК, является противопоказанием к проведению резекции печени (УД-В):
Неоадъювантная или адъювантная терапия не рекомендована в связи с отсутствием доказательств в улучшении исходов пациентов после резекции печени (УД-А);
Рекомендуется последующее наблюдение после резекции с учетом высокой частоты рецидивов (А):
Хирургическое лечение
Хирургическое лечение проводится на ранних стадиях ГЦК и включает резекцию и трансплантацию печени [3].
Резекция печени выполняется, исходя из следующих положений:
Хирургическая резекция является методом выбора у пациентов с ГЦК без ЦП (УД-С);
Показания к резекции печени у пациентов с ГЦК и ЦП должны быть основаны на (УД-А):
- Мультипараметрической композиционной оценке функции печени (схема 3);
- Наличию портальной гипертензии;
- Планируемом объеме гепатэктомии и ожидаемом объеме остатка печени;
- Функциональном статусе пациента;
- Сопутствующих заболеваниях пациента.
Резекция печени рекомендована при единичном очаге ГЦК любого размера, в особенности, >2 см в диаметре при сохранной функции и достаточном объеме печени (УД-А);
Ожидаемая смертность перед резекцией (определяемая по валидированным шкалам CTP, MELD) должна быть >3 лет;
В специализированных центрах резекцию печени рекомендуется выполнять лапароскопическим / малоинвазивными способом, особенно при переднебоковых и поверхностных локализациях опухоли (УД-В);
При ГЦК в пределах Миланских критериев (один очаг до 5 см или два-три очага менее 3 см в диаметре), резекция печени возможна в зависимости от (УД-С):
- Функционального статуса пациента;
- Сопутствующих заболеваний;
- Функции и остаточного объема печени.
Макрососудистая инвазия, обусловленная ГЦК, является противопоказанием к проведению резекции печени (УД-В):
- Резекция печени при дистальной портальной инвазии на сегментарном или субсегментарном уровне требует дальнейшего изучения в рамках проспективных исследований.
Неоадъювантная или адъювантная терапия не рекомендована в связи с отсутствием доказательств в улучшении исходов пациентов после резекции печени (УД-А);
Рекомендуется последующее наблюдение после резекции с учетом высокой частоты рецидивов (А):
- Целесообразны 3-4-месячные интервалы.
Схема 5. Оценка пост-резекционных рисков у пациентов с ГЦК
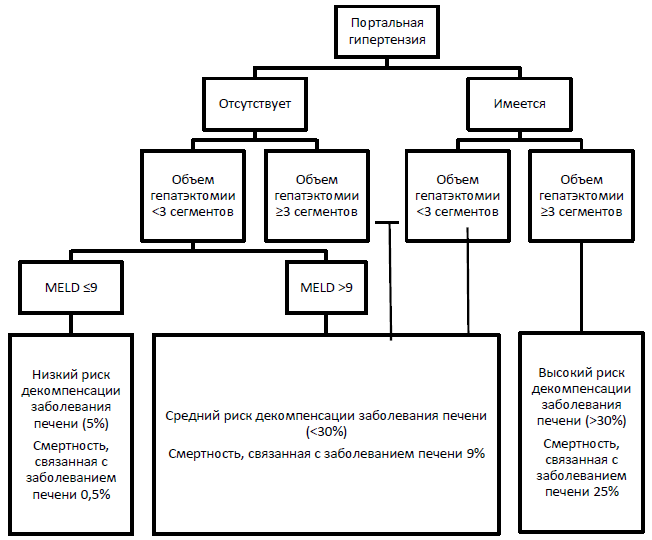
Схема 5. Оценка пост-резекционных рисков у пациентов с ГЦК

Трансплантация печени является радикальным методом лечения ГЦК (в том числе, не выявленных очагов), а также фонового заболевания печени. Успешная ТП возможна при соответствии Миланским критериям (Mazzaferro et al., 1996), т.е. наличии одной опухоли диаметром не более 5 см, либо до 3 опухолей включительно диаметром не более 3 см каждая. В связи с этим, ТП – метод выбора для пациентов на ранней стадии ГЦК и декомпенсированным ЦП (классы B и C по CTP) [3].
При проведении ТП у пациентов с ГЦК руководствуются следующими положениями:
При соответствии Миланским критериям, ТП рекомендована в качестве первой линии лечения пациентам с ГЦК, которым резекция печени не может быть выполнена (А);
При изначальном несоответствии Миланским критериям, после успешного снижения стадии заболевания до Миланских критериев в рамках определенных протоколов лечения, пациенты могут рассматриваться в качестве кандидатов для ТП;
Сосудистая инвазия и внепеченочные метастазы являются абсолютными противопоказаниями для ТП (А);
Локальная деструкция ГЦК
Таблица 14. Рекомендации по локальной деструкции ГЦК [3]
Таблица 15. Рекомендации по регионарной терапии ГЦК [3, 35–43]
Медикаментозное лечение на стационарном уровне
Дальнейшее динамическое наблюдение пациентов с ГЦК (см. Амбулаторный уровень)
Индикаторы эффективности лечения (см. Амбулаторный уровень)
При наличии возможности, пациентам с ГЦК, ожидающим ТП, рекомендуется предтрансплантационная (неоадъювантная) локорегионарная терапия, что позволяет:
- Снизить риски предтрансплантационного выбывания пациентов;
- Уменьшить частоту посттрансплантационных рецидивов, в особенности, при достижении полного или частичного ответа;
Критерии приоритезации для трупной трансплантации при ГЦК включают опухолевую нагрузку, характеристику / индикаторы опухоли, ответ на лечение, время ожидания;
ТП от живого донора может рассматриваться в качестве возможного варианта лечения в условиях специализированных центров.
Для более подробной информации рекомендуется ознакомиться с клиническим протоколом МЗ РК «Трансплантация печени». [52]
Локальная деструкция ГЦК
Таблица 14. Рекомендации по локальной деструкции ГЦК [3]
|
Методы
|
Рекомендации | УД |
| Термическая радиочастотная абляция (РЧА) |
Стандарт лечения пациентов со стадией BCLC-0 и BCLC-A, не подходящих для хирургического вмешательства (А)
РЧА единичных опухолей размером 2–3 см является альтернативой хирургической резекции в зависимости от технических факторов (локализация опухоли), функции печени и внепеченочной патологии;
У пациентов с очень ранней стадией ГЦК (BCLC-0) РЧА может рассматриваться в качестве первой линии терапии даже у пациентов с показаниями к хирургическому лечению, при технически доступной локализации опухоли
|
В |
| Микроволновая абляция | Продемонстрированы многообещающие результаты в качестве метода локального контроля опухоли и выживаемости | С |
| Инъекции этанола | Вариант лечения в отдельных случаях, когда термическая аблация не является технически осуществимой, в особенности, при опухолях менее 2 см | А |
| Дистанционная лучевая терапия | Применение дистанционной лучевой терапии находиться в процессе изучения и в настоящее время убедительные данные в поддержку применения данного метода в терапии ГЦК отсутствуют | С |
Регионарная терапия
Таблица 15. Рекомендации по регионарной терапии ГЦК [3, 35–43]
|
Методы
|
Рекомендации |
| Трансартериальная химиоэмболизация (ТАХЭ) |
ТАХЭ выполняется у пациентов с промежуточной (BCLC B), а также ранней (BCLC А) стадией ГЦК при противопоказаниях к хирургическому лечению; Критериями отбора для ТАХЭ являются функциональный статус пациента не ниже ECOG 0-1, компенсированное фоновое заболевание печени и переносимость процедуры эмболизации (одномоментной или поэтапной) всех узлов;
В целом, ТАХЭ предпочтительна у пациентов с узловой формой ГЦК без ЦП либо с ЦП класса С по CTP без сосудистой инвазии;
ТАХЭ рекомендована пациентам со стадией BCLC-В и должна проводиться выборочно (УД - А);
Использование гранул с лекарственным покрытием показало сходную с обычным ТАХЭ эффективность, в связи с чем может использоваться любой из методов (УД - А);
ТАХЭ не следует применять у пациентов с (УД - А):
- Декомпенсированным заболеванием печени;
- Выраженной печеночной и/или почечной дисфункцией;
- Макроскопической сосудистой инвазией;
- Внепеченочными метастазами.
Нет достаточных доказательств для выбора критериев оценки при отборе пациентов со стадией BCLC-B для проведения первой или последующих процедур ТАХЭ (УД - В).
При отсутствии эффекта от 2 последовательно выполненных сеансов ТАХЭ в целях улучшения выживаемости рекомендуется системная терапия (УД - С).
|
| Трансартериальная радиоэмболизация (ТАРЭ) и селективная внутренняя лучевая терапия (СВЛТ) с микросферами иттрия-90 |
ТАРЭ и СВЛТ исследовались у пациентов со стадией BCLC-A в рамках переходной терапии перед ТП, со стадией BCLC-B в сравнении с ТАХЭ, со стадией BCLC-C в сравнении с сорафенибом.
Продемонстрировали хороший профиль безопасности и локальный контроль опухоли, но не преимущества в увеличении общей выживаемости в сравнении с сорафенибом у пациентов со стадией BCLC-B (УД - C).
|
| Мягкая эмболизация, селективная внутриартериальная химиотерапия и липиодолизация | Недостаточно доказательств по применению для регионарного лечения ГЦК (УД - В). |
Лучевая терапия
Лучевая терапия может быть проведена пациентам с ГЦК для улучшения контроля роста опухоли и выживаемости в случаях, когда другие варианты локорегионарного лечения и/или резекции не могут быть использованы (УД - С);
Конформная 3D-лучевая терапия (30–60 Гр) может проводиться у пациентов без ЦП и признаков опухолевой инвазии в нижнюю полую вену, портальную вену и ее ветви (УД - С) [49].
Медикаментозное лечение на стационарном уровне
Системная терапия ГЦК на стационарном уровне показана пациентам с распространенным опухолевым процессом (стадия С по BCLC) в целях улучшения выживаемости и контроля роста опухоли и соответствует таковой на амбулаторном уровне (см. Таблица № 9, 10, 11, 12).
Дальнейшее динамическое наблюдение пациентов с ГЦК (см. Амбулаторный уровень)
Индикаторы эффективности лечения (см. Амбулаторный уровень)
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ
Показания для плановой госпитализации включают [1]:
Проведение прицельной биопсии печени;
Хирургическое лечение (резекция печени, ТП);
Локальная деструкция опухоли (радиочастотная, микроволновая аблация)
Регионарное лечение (трансартериальная химиоэмболизация, трансартериальная радиоэмболизация, селективная внутренняя лучевая терапия с микросферами иттрия-90);
Лучевая терапия;
Парентеральная системная терапия и побочные явления системной терапии при среднетяжелом и тяжелом состоянии пациента.
Показания для экстренной госпитализации при ГЦК могут быть связаны с осложнениями фонового заболевания печени (развитие острого тромбоза воротной вены, рефрактерный асцит и т.д.) и определяются соответствующими клиническими рекомендациями [51].
Профилактика
Первичная профилактика ГЦК включает [20-25]:
- Вакцинацию против гепатита В;
- Достоверно снижает риски HBV-ассоциированной ГЦК;
- Изменения социальной / культурной / медицинской практики (снижение потребления / вреда инъекционных наркотиков, профилактику заболеваний, передаваемых половым путем, эффективный скрининг препаратов крови);
- В целях снижения рисков вирусных гепатитов В, С, D;
- Модификацию образа жизни (рациональное питание, физические нагрузки, снижение потребления алкоголя);
- В целях снижения риска жировой болезни печени;
- Снижение риска контакта с канцерогенами (афлатоксин, табак) путем совершенствования законодательства, контроля, информационного обеспечения.
Вторичная профилактика ГЦК включает этиотропную и базисную патогенетическую терапию фонового гепатита согласно соответствующим клиническим рекомендациям [9,10,13,26-34]:
- Противовирусную терапию хронического гепатита В, С, D;
- Модификацию образа жизни и таргетную терапию компонентов метаболического синдрома при метаболически-ассоциированной (неалкогольной) жировой болезни печени;
- Абстиненцию при алкогольном стеатогепатите;
- Иммуносупрессивную терапию аутоиммунного гепатита;
- Антихолестатическую терапию первичного билиарного холангита;
- Антикомлексоновую терапию при болезни Вильсона-Коновалова, гемохроматозе и пр.
Третичная профилактика ГЦК включает:
- Регулярное динамическое наблюдение с использованием КТ/МРТ с внутривенным контрастным усилением;
- Меры по предотвращению рецидива ГЦК, в том числе с помощью противоопухолевой терапии и этиотропной терапии фонового заболевания печени.
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2023
- Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2023 - 1) American Joint Committee on Cancer (AJCC). AJCC Cancer Staging Manual, 7th ed. Edge S.B., Byrd D.R., Carducci M.A. et al., eds. New York: Springer. 2) NCCN Clinical Practice Guidelines in Oncology, Hepatobiliary Cancers, Version 1.2021 3) EASL CPG HCC. EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma. J Hepatol 2018; doi: 10.1016/j.jhep.2018.03.019 4) Forner A., Reig M., Bruix J. Hepatocellular carcinoma. Lancet 2018;391(10127):1301–14. 5) Fattovich G., Stroffolini T., Zagni I., Donato F. Hepatocellular carcinoma in cirrhosis: incidence and risk factors. Gastroenterology 2004;127(5 Suppl 1):S35–50. 6) Vogel A., Cervantes A., Chau I. et al. Hepatocellular carcinoma: ESMO Clinical Practice. Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2018;29(Suppl 4):iv238–55. 7) Marrero J.A., Kulik L.M., Sirlin C.B. et al. Diagnosis, staging, and management of hepatocellular carcinoma: 2018 practice guidance by the American Association for the Study of Liver Diseases. Hepatology 2018;68(2):723–50. 8) Yezaz Ahmed Ghouri, Idrees Mian, Julie H. Rowe. J Carcinog. 2017; 16: 1. doi: 10.4103/jcar.JCar_9_16. 9) EASL CPG: Autoimmune hepatitis. J Hepatol 2015 vol. 63: 971–1004. 10) EASL CPG: Wilson’s disease. J Hepatol 2012 vol. 56: 71–685. 11) Arrieta O., Cacho B., Morales-Espinosa D. et al. The progressive elevation of alpha fetoprotein for the diagnosis of hepatocellular carcinoma in patients with liver cirrhosis. BMC Cancer 2007;7:28. 12) Yezaz Ahmed Ghouri, Idrees Mian, Julie H. Rowe. J Carcinog. 2017; 16: 1. doi: 10.4103/jcar.JCar_9_16. 13) Kris V. Kowdley, Kyle E. Brown, Joseph Ahn, Vinay Sundaram. ACG Clinical Guideline: Hereditary Hemochromatosis. Am J Gastroenterol Vol. 114 | Aug 2019: 1202-1218. 14) Robert A. Sandhaus, Gerard Turino. CPG«The Diagnosis and Management of Alpha-1 Antitrypsin Deficiency in the Adult» J COPD Foundation. Vol 3, Nr 3, 2016: 668-682. 15) Bosman FT, et al. WHO Classification of Tumours of the Digestive System. Fourth Edition. IARC press; 2010; 16) Cerny M., Chernyak V., Olivié D. et al. LI-RADS Ver 2018 Ancillary Features at MRI. Radiographics 2018;38(7):1973–2001. 17) Cerny M., Chernyak V., Olivié D. et al. LI-RADS Ver 2018 Ancillary Features at MRI. Radiographics 2018;38(7):1973–2001. 18) Chernyak V., Santillan C.S., Papadatos D. et al. LI-RADS® algorithm: CT and MRI. Abdom Radiol 2018;43(1):111–26. 19) Ludwig D.R., Fraum T.J., Cannella R. et al. Expanding the Liver Imaging Reporting and Data System (LI-RADS) v2018 diagnostic population: performance and reliability of LI-RADS for distinguishing hepatocellular carcinoma (HCC) from non-HCC primary liver carcinoma in patients who do not meet strict LI-RADS high-risk criteria. HPB (Oxford) 2019;28(6):pii: S1365-182X(19)30525-8. 20) Zanetti,A.R.;VanDamme,P.;Shouval,D.T Vaccine 2008, 26, 6266–6273. 21) Ni,Y.-H.;Chang,M.-H.;Huang,L.-M.;Chen,H.-L.; et al. Ann. Intern. Med. 2001, 135, 796–800Н 22) Chen,C.-H.;Yang,P.-M.;Huang,G.-T.;Lee,H.-S.; et al. J. Formos. Med. Assoc. 2007, 106, 148–155. 23) Aitken,C.;Lewis,J.;Hocking,J.;Bowden,D.;Hellard,M. Hepat Monthly. 2009, 9, 17–23. 24) Razali,K.; Thein,H.-H.;Bell,J.;Cooper-Stanbury,M.; et al. Drug Alcohol Depend. 2007, 91, 228–235. 25) Azziz-Baumgartner, E.; Lindblade, K.; Gieseker, K.; Rogers, H.S.;et al. Environ. Heal. Perspect. 2005, 113, 1779–1783. 26) Eun, J.R.; Lee, H.J.; Kim, T.N.; Lee, K.S. J. Hepatol. 2010, 53, 118–125. 27) Papatheodoridis, G.V.; Lampertico, P.; Manolakopoulos, S.; Lok, A. J. Hepatol. 2010, 53, 348–356. 28) Janjua, N.Z.; Wong, S.; Darvishian, M.; Butt, Z.A.; et al. J. Viral Hepat. 2020, 27, 781–793. 29) Ioannou, G.N.; Green, P.K.; Berry, K. J. Hepatol. 2018, 68, 25–32. 30) Ioannou, G.N.; Beste, L.A.; Green, P.K.; Singal, A.G.; et al. Gastroenterology 2019, 157, 1264–1278.e4. 31) Hamdane, N.; Jühling, F.; Crouchet, E.; El Saghire, H.; et al. Gastroenterology 2019, 156, 2313–2329.e7. 32) Carrat F, Fontaine H, Dorival C, Simony M et al. Lancet. 2019 Apr 6;393(10179):1453-1464. 33) Huang P, Liu M, Zang F, Yao Y et al. Carcinogenesis. 2018 Dec 31;39(12):1497-1505. 34) EASL CPG: The diagnosis and management of patients with primary biliary cholangitis. J Hepatol 2017 vol. 67: 145–172. 35) Клинические рекомендации Ассоциации Онкологов России, Рак печени (гепатоцеллюлярный), 2022 г. 36) Бредер В.В., Базин И.С., Балахнин П.В., Виршке Э.Р., Косырев В.Ю., Ледин Е.В. и соавт. Практические рекомендации по лекарственному лечению больных злокачественными опухолями печени и желчевыводящей системы. Злокачественные опухоли : Практические рекомендации RUSSCO #3s2, 2022 ( том 12 ). 467–529. 37) Rand T., Loewe C., Schoder M. et al. Arterial embolization of unresectable hepatocellular carcinoma with use of microspheres, lipiodol, and cyanoacrylate. Cardiovasc Intervent Radiol 2005;28:313–8. 38) Bonomo G., Pedicini V., Monfardini L. et al. Bland embolization in patients with unresectable hepatocellular carcinoma using precise, tightly size-calibrated, anti-inflammatory microparticles: first clinical experience and one-year follow-up. Cardiovasc Intervent Radiol 2010;33:552–9. 39) Llovet J.M., Real M.I., Montana X. et al. Arterial embolisation or chemoembolisation versus symptomatic treatment in patients with unresectable hepatocellular carcinoma: a randomised controlled trial. Lancet 2002;359:1734–9. 40) Affonso BB, Galastri FL, da Motta Leal Filho JM et al., Long-term outcomes of hepatocellular carcinoma that underwent chemoembolization for bridging or downstaging World J Gastroenterol. 2019 Oct 7;25(37):5687-5701. 41) Lencioni R, Llovet JM. Modified RECIST (mRECIST) assessment for hepatocellular carcinoma. Semin Liver Dis. 2010 Feb;30(1):52-60. 42) Raoul JL, Sangro B, Forner A, et al. Evolving strategies for the management of intermediate-stage hepatocellular carcinoma: available evidence and expert opinion on the use of transarterial chemoembolization. Cancer Treat Rev 2011;37:212–220. 43) Forner A, Gilabert M, Bruix J, Raoul JL. Treatment of intermediate-stage hepatocellular carcinoma. Nat Rev Clin Oncol 2014;11:525–535. 44) Zech, C.J., Ba-Ssalamah, A., Berg, T. et al. Consensus report from the 8th International Forum for Liver Magnetic Resonance Imaging. Eur Radiol 30, 370–382 (2020). 45) Jeong WK, Kim YK, Song KD, Choi D, Lim HK. The MR imaging diagnosis of liver diseases using gadoxetic acid: emphasis on hepatobiliary phase. Clin Mol Hepatol. 2013;19(4):360-366. 46) Choi SH, Lee SS, Kim SY et al (2017) Intrahepatic cholangiocarcinoma in patients with cirrhosis: differentiation from hepatocellular carcinoma by using gadoxetic acid-enhanced MR imaging and dynamic CT. Radiology 282:771–781. 47) International Consensus Group for Hepatocellular Neoplasia. Hepatology 2009;49:658–64; 48) Johnson PJ, Berhane S, Kagebayashi C, et al. Assessment of liver function in patients with hepatocellular carcinoma: a new evidence-based approach-the ALBI grade. J Clin Oncol. 2015 Feb 20;33(6):550-8. doi: 10.1200/JCO.2014.57.9151. 49) Chino F, Stephens SJ, Choi SS, et al. The role of external beam radiotherapy in the treatment of hepatocellular cancer. Cancer. 2018 Sep 1;124(17):3476-3489. 50) Schima, W., Heiken, J. LI-RADS v2017 for liver nodules: how we read and report. Cancer Imaging 18, 14 (2018). https://doi.org/10.1186/s40644-018-0149-51. 51) Нерсесов А.В., Раисова А.М., Джумабаева А.Е., и др. Цирроз печени и его двадцать клинически значимых осложнений (руководство для врачей). Москва, ГэотарМедиа, 2021.- 160 с. 52) Клинический протокол МЗ РК «Трансплантация печени». 2019 г. 53) Kudo M, Kawamura Y, Hasegawa K, et al. Management of Hepatocellular Carcinoma in Japan: JSH Consensus Statements and Recommendations 2021 Update. Liver Cancer. 2021 Jun;10(3):181-223. doi: 10.1159/000514174. 54) Korean Liver Cancer Association – National Cancer Center Korea Practice Guidelines for the management of hepatocellular carcinoma. Gut Liver. 2019; 13(3): 227–99. https://doi.org/10.5009/gnl19024.
Информация
Сокращения, используемые в протоколе:
|
АИГ
|
аутоиммунный гепатит |
| АЛТ | аланинаминотрансфераза |
| АСТ | аспартатаминотрансфераза |
| АФП | альфа-фетопротеин |
| АФП-L3 | изоформа L3 альфа-фетопротеина |
|
АЧТВ
|
активированное частичное тромбопластиновое время |
| в/в | внутривенно |
| в/м | внутримышечно |
| ГЦК | гепатоцеллюлярная карцинома |
| ДКП | дез-гамма-карбоксипротромбин |
|
ЕД
|
единицы |
| ЖКТ | желудочно-кишечный тракт |
| ЗНО | злокачественное новообразование |
| ИФА | иммуноферментный анализ |
|
КТ
|
компьютерная томография |
| ЛТ | лучевая терапия |
| МКИ | мультикиназный ингибитор |
| МНО | международное нормализованное отношение |
| МРТ | магнитно-резонансная томография |
|
ОАК
|
общий анализ крови |
| ОАМ | общий анализ мочи |
| ПБХ | первичный билиарный холангит |
| п/к | подкожно |
| ПТВ | протромбиновое время |
| ПТИ | протромбиновый индекс |
|
ПЭТ
|
позитронно –эмиссионная томография |
| РЧА | радиочастотная аблация |
| ССС | сердечно-сосудистая система |
| СВЛТ | селективная внутренняя лучевая терапия |
| ТАРЭ | трансартериальная радиоэмболизация |
| ТАХЭ | трансартериальная химиоэмболизация |
| ТП | трансплантация печени |
|
УЗДГ
|
ультразвуковая допплерография |
| УЗИ | ультразвуковое исследование |
| ХГВ | хронический гепатит В |
| ХГС | хронический гепатит С |
| ХГD | хронический гепатит D |
| ЦП | цирроз печени |
|
ЭГДС
|
эзофагогастродуоденоскопия |
| ЭКГ | электрокардиограмма |
| ЭхоКГ | эхокардиография |
| ФДГ | фтордезоксиглюкоза |
|
ALBI
|
ALBI (Albumin-Bilirubin) grade, шкала для оценки выживаемости при ГЦК |
|
BCLC
|
Barcelona Clinic Liver Cancer (BCLC) classification, Барселонская система стадирования ГЦК |
|
CTP
|
Child-Turcotte-Pugh, шкала оценки класса цирроза печени |
|
per os
|
перорально |
|
PIVKA-II
|
протеин, индуцируемый дефицитом витамина К |
|
TNM
|
Tumor Nodulus Metastasis - международная классификация стадий злокачественных новообразований |
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ПРОТОКОЛА
Список разработчиков протокола с указание квалификационных данных:
1) Нерсесов Александр Витальевич – гастроэнтеролог, доктор медицинских наук, профессор, заведующий кафедрой гастроэнтерологии НАО «Национальный медицинский университет имени С. Д. Асфендиярова» МЗ РК, Председатель ОО «Казахская ассоциация по изучению печени», член EASL, AASLD, APASL.
2) Абдрахманов Рамиль Зуфарович – онколог, кандидат медицинских наук, заведующий отделением «Дневной стационар химиотерапии», Председатель химиотерапевтического совета АО «Казахский научно-исследовательский институт онкологии и радиологии».
3) Баймаханов Болатбек Бимедеевич – хирург, трансплантолог, доктор медицинских наук профессор, Академик НАН РК, председатель правления АО «Национальный научный центр хирургии им. А. Н. Сызганова».
4) Макалкина Лариса Геннадиевна – клинический фармаколог, кандидат медицинских наук, доцент кафедры клинической фармакологии интернатуры НАО «Медицинский Университет Астана».
Указание на отсутствие конфликта интересов: нет.
Рецензенты
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
5) Джуманов Абай Игликович - хирург, онколог, руководитель центра абдоминальной онкологии АО «Казахский научно-исследовательский институт онкологии и радиологии».
Указание на отсутствие конфликта интересов: нет.
Рецензенты
1) Павлов Чавдар Савович – гастроэнтеролог, доктор медицинских наук, профессор, заведующий кафедрой терапии Первого государственного медицинского университета им. И. М. Сеченова (Сеченовского университета), член EASL, AASLD, APASL, г. Москва, Российская Федерация.
2) Омарова Индира Милатовна – онколог, доктор медицинских наук, заведующая химиотерапевтическим отделением КГП на ПХВ «Многопрофильная больница № 3, г. Караганда» УЗ Карагандинской области.
3) Рахметова Венера Саметовна – гастроэнтеролог, доктор медицинских наук, профессор кафедры внутренних болезней №3 НАО «Медицинский университет Астана», Председатель ОО «Общество специалистов гастроэнтерологического и гепатологического профиля».
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.