Анестезиологическое обеспечение хирургических вмешательств
 Версия: Клинические протоколы 2023 (Беларусь)
Версия: Клинические протоколы 2023 (Беларусь)
Беременность, роды и послеродовой период (O00-O99), Болезни органов пищеварения (K00-K93), Болезни системы кровообращения (I00-I99), Состояние выздоровления после хирургического вмешательства (Z54.0), Травмы, отравления и некоторые другие последствия воздействия внешних причин (S00-T98)
Анестезиология, Реаниматология
Общая информация
Краткое описание
УТВЕРЖДЕНО
Постановление
Министерства здравоохранения
Республики Беларусь
19.04.2023 № 57
КЛИНИЧЕСКИЙ ПРОТОКОЛ
«Анестезиологическое обеспечение хирургических вмешательств»
ГЛАВА 1
ОБЩИЕ ПОЛОЖЕНИЯ
2. Требования настоящего клинического протокола являются обязательными для юридических лиц и индивидуальных предпринимателей, осуществляющих медицинскую деятельность в порядке, установленном законодательством о здравоохранении.
3. Для целей настоящего клинического протокола используются основные термины и их определения в значениях, установленных Законом Республики Беларусь «О здравоохранении», а также следующие термины и их определения:
1. Настоящий клинический протокол устанавливает общие требования к объему оказания анестезиологической медицинской помощи пациентам (взрослое население) при хирургических вмешательствах в амбулаторных и стационарных условиях.
2. Требования настоящего клинического протокола являются обязательными для юридических лиц и индивидуальных предпринимателей, осуществляющих медицинскую деятельность в порядке, установленном законодательством о здравоохранении.
3. Для целей настоящего клинического протокола используются основные термины и их определения в значениях, установленных Законом Республики Беларусь «О здравоохранении», а также следующие термины и их определения:
анальгезия – угнетение болевой чувствительности при сохранении сознания пациента;
интубация – введение эндотрахеальной трубки (далее – ЭТТ) в трахею для обеспечения проходимости дыхательных путей и их защиты от аспирации содержимого ротоглотки;
местная анестезия – блокада болевых и иных видов чувствительности из области хирургического вмешательства путем прерывания нервной передачи при помощи лекарственных препаратов для местной анестезии;
общая анестезия – обратимое состояние с утратой сознания, потерей болевой чувствительности и угнетением защитной рефлекторной активности, которое достигается применением лекарственных препаратов для общей анестезии;
спинальная анестезия – блокада всех видов чувствительности, которая достигается введением лекарственного препарата для местной анестезии в цереброспинальную жидкость (ликвор), заполняющую субарахноидальное пространство;
эпидуральная анестезия – блокада всех видов чувствительности, которая достигается введением лекарственного препарата для местной анестезии в эпидуральное пространство.
класс II – пациенты со слабыми или умеренными системными расстройствами, связанными или не связанными с предстоящим хирургическим вмешательством (легкие заболевания без существенных функциональных ограничений (ожирение (индекс массы тела (далее – ИМТ) >30), контролируемая артериальная гипертензия (далее – АГ)), курящие, беременные женщины);
класс III – пациенты с выраженными системными расстройствами, связанными или не связанными с предстоящим хирургическим вмешательством (одно или несколько заболеваний средней и тяжелой степени тяжести: плохо контролируемые сахарный диабет (далее – СД); АГ или хроническая обструктивная болезнь легких (далее – ХОБЛ); морбидное ожирение с ИМТ >40; активный гепатит, психические и поведенческие расстройства вследствие употребления алкогольных, слабоалкогольных напитков, пива, потребления наркотических средств, психотропных веществ, их аналогов, токсических или других одурманивающих веществ, имплантированный кардиостимулятор; умеренное снижение фракции выброса; пациенты с хронической почечной недостаточностью (далее – ХПН) и регулярным плановым диализом);
класс IV – пациенты с тяжелыми системными расстройствами, несущими угрозу жизни в связи с хирургическим вмешательством и (или) без него (перенесенные в течение трех месяцев острый инфаркт миокарда, острое нарушение мозгового кровообращения, транзиторная ишемическая атака, ишемия миокарда или тяжелая дисфункция клапанов, выраженное снижение фракции выброса, сепсис, синдром диссеминированного внутрисосудистого свертывания крови, ХПН без регулярного планового диализа);
класс V – умирающие пациенты с невысокой вероятностью выжить, у которых хирургическое вмешательство рассматривается в качестве последнего шанса (разрыв аневризмы брюшной или грудной аорты, массивная травма, внутричерепное кровоизлияние с масс-эффектом, мезотромбоз в сочетании с выраженной сердечной патологией, полиорганная дисфункция);
класс VI – умерший донор.
4. Оценка физического состояния пациента проводится по классификации ASA:
класс I – пациенты без органических, физиологических, биохимических и психических расстройств (здоровый, не курящий пациент, не употребляющий или минимально употребляющий алкогольные, слабоалкогольные напитки, пиво);
класс II – пациенты со слабыми или умеренными системными расстройствами, связанными или не связанными с предстоящим хирургическим вмешательством (легкие заболевания без существенных функциональных ограничений (ожирение (индекс массы тела (далее – ИМТ) >30), контролируемая артериальная гипертензия (далее – АГ)), курящие, беременные женщины);
класс III – пациенты с выраженными системными расстройствами, связанными или не связанными с предстоящим хирургическим вмешательством (одно или несколько заболеваний средней и тяжелой степени тяжести: плохо контролируемые сахарный диабет (далее – СД); АГ или хроническая обструктивная болезнь легких (далее – ХОБЛ); морбидное ожирение с ИМТ >40; активный гепатит, психические и поведенческие расстройства вследствие употребления алкогольных, слабоалкогольных напитков, пива, потребления наркотических средств, психотропных веществ, их аналогов, токсических или других одурманивающих веществ, имплантированный кардиостимулятор; умеренное снижение фракции выброса; пациенты с хронической почечной недостаточностью (далее – ХПН) и регулярным плановым диализом);
класс IV – пациенты с тяжелыми системными расстройствами, несущими угрозу жизни в связи с хирургическим вмешательством и (или) без него (перенесенные в течение трех месяцев острый инфаркт миокарда, острое нарушение мозгового кровообращения, транзиторная ишемическая атака, ишемия миокарда или тяжелая дисфункция клапанов, выраженное снижение фракции выброса, сепсис, синдром диссеминированного внутрисосудистого свертывания крови, ХПН без регулярного планового диализа);
класс V – умирающие пациенты с невысокой вероятностью выжить, у которых хирургическое вмешательство рассматривается в качестве последнего шанса (разрыв аневризмы брюшной или грудной аорты, массивная травма, внутричерепное кровоизлияние с масс-эффектом, мезотромбоз в сочетании с выраженной сердечной патологией, полиорганная дисфункция);
класс VI – умерший донор.
Диагностика
ГЛАВА 2
ОРГАНИЗАЦИЯ ПРЕДОПЕРАЦИОННОГО ОСМОТРА И ПРЕДОПЕРАЦИОННОГО ОБСЛЕДОВАНИЯ
5. Общими принципами организации предоперационного осмотра пациента являются:
- при плановом хирургическом вмешательстве пациент осматривается врачом-анестезиологом-реаниматологом не позднее чем за сутки до предполагаемого хирургического вмешательства;
- при экстренном хирургическом вмешательстве пациент осматривается врачом-анестезиологом-реаниматологом после выявления медицинских показаний к хирургическому вмешательству;
- в исключительных случаях (поступление пациента в операционную из приемного отделения) допускается предоперационный осмотр пациента на операционном столе с отметкой об этом в протоколе осмотра врача-анестезиолога-реаниматолога.
6. В процессе предоперационного осмотра пациента проводится:
- оценка психического состояния пациента, его настроя в отношении предполагаемого хирургического вмешательства, вида анестезиологического пособия, а также определение необходимости проведения медикаментозной подготовки;
- разъяснение пациенту сути и хронологии предстоящих событий (общий план анестезии, предполагаемые манипуляции, возможные осложнения при них и их встречаемость, процесс пробуждения, вопросы послеоперационного обезболивания и иные);
- учет индивидуальных особенностей и пожеланий пациента;
- информирование пациента об альтернативных вариантах анестезиологического пособия.
При необходимости заполняется опросник по перенесенным заболеваниям (анамнез) по форме согласно приложению 1.
7. При предоперационном осмотре врачом-анестезиологом-реаниматологом оцениваются результаты лабораторных и инструментальных исследований, назначенных, в том числе, врачом-специалистом по результатам предварительного предоперационного осмотра.
8. По итогам предоперационного осмотра пациента врач-анестезиолог-реаниматолог:
- заполняет протокол осмотра врача-анестезиолога-реаниматолога;
- оценивает риск развития сердечно-сосудистых осложнений в соответствии с факторами риска развития сердечно-сосудистых осложнений согласно приложению 2;
- определяет и обосновывает необходимость проведения дополнительных лабораторных и инструментальных исследований и (или) врачебных консультаций (консилиумов);
- определяет необходимость подбора медикаментозной терапии по схеме подбора оптимальной медикаментозной терапии, установленной согласно приложению 3, или коррекции приема лекарственных препаратов в периоперационном периоде по схеме, установленной согласно приложению 4;
- определяет необходимость повторного предоперационного осмотра пациента в амбулаторных условиях.
9. Предоперационные лабораторные и инструментальные исследования назначаются врачом-анестезиологом-реаниматологом по медицинским показаниям с учетом предполагаемой патологии с целью ее исключения или подтверждения, а также для оценки степени компенсации диагностированных ранее заболеваний.
Лабораторные и инструментальные исследования перед хирургическим вмешательством выполняются при наличии медицинских показаний к выполнению лабораторных и инструментальных исследований, зависящих от вида хирургического вмешательства и класса физического состояния пациента по ASA, установленных согласно приложению 5.
Общий анализ мочи перед хирургическим вмешательством назначается по медицинским показаниям. Возможно назначение общего анализа мочи с микроскопией осадка и бактериологическим исследованием (посев мочи на флору) в случаях, когда выявление инфекции мочевыводящих путей может служить основанием для отмены хирургического вмешательства или своевременного назначения этиотропной антибиотикотерапии.
Гликированный гемоглобин (далее – HbA1C) перед хирургическим вмешательством измеряется у пациентов с СД при отсутствии данных о его значении за последние 3 месяца.
Рентгенография органов грудной клетки перед хирургическим вмешательством проводится по медицинским показаниям, в том числе при наличии у пациента патологии органов дыхания или соответствующих клинических проявлений, декомпенсированной сердечно-сосудистой патологии.
Эхокардиография перед хирургическим вмешательством не проводится, за исключением наличия у пациента признаков или симптомов сердечной недостаточности или иных медицинских показаний.
Медицинские показания для выполнения отдельных лабораторных и инструментальных исследований установлены в перечне согласно приложению 6. Решение о необходимости выполнения дополнительного исследования при наличии медицинских показаний, не указанных в данном перечне, принимается индивидуально в каждом конкретном случае с учетом имеющейся или предполагаемой патологии у пациента, вида хирургического вмешательства и вида планируемой анестезии.
Срок давности лабораторных исследований не должен превышать 14 календарных дней, инструментальных исследований – 90 календарных дней. При необходимости исследования могут быть проведены повторно. Основанием для повторного выполнения лабораторных исследований может служить острое изменение состояния пациента (простудные заболевания, обострение хронической патологии и иные), произошедшее после забора биологического материала для исследования.
10. Предоперационное исследование сердечно-сосудистой системы включает:
- оценку симптомов, указывающих на возможное наличие основных сердечно-сосудистых заболеваний – ишемической болезни сердца (далее – ИБС), поражения клапанного аппарата, застойной сердечной недостаточности (одышку при нагрузке или в положении лежа на спине, боли в груди или обмороки, атипичные клинические проявления ИБС у пациентов в возрасте старше 60 лет и пациентов с СД);
- выявление пациентов, имеющих в анамнезе стентирование коронарных артерий (коронарное шунтирование) или имплантируемый кардиостимулятор (кардиовертер);
- измерение частоты сердечных сокращений (далее – ЧСС) и артериального давления (далее – АД) с учетом степени предоперационной тревоги у пациента. За исходное принимается среднее значение АД, полученное при выполнении не менее двух измерений в состоянии покоя с интервалом 1–2 минуты;
- оценку сердечно-сосудистого риска, коррекцию медикаментозной терапии и определение необходимости применения дополнительных методов обследования по алгоритму, установленному согласно приложению 7, при наличии у пациента сердечно-сосудистой патологии;
- оценку индекса риска инсульта и тромбоэмболических осложнений при фибрилляции предсердий по шкале оценки риска инсульта и системной тромбоэмболии у пациентов с фибрилляцией предсердий CHA2DS2-VASc согласно приложению 8;
- определение функциональных резервов согласно приложению 9;
- исследование (перед хирургическим вмешательством и в первые 48 часов после) уровня высокочувствительного тропонина T (тропонина I) у пациентов с низким функциональным резервом, которым запланировано выполнение хирургического вмешательства высокого риска из перечня рисков при хирургических вмешательствах, установленного согласно приложению 10, с целью своевременной диагностики повреждения миокарда в периоперационном периоде.
11. К декомпенсированным состояниям сердечно-сосудистой системы относятся:
- нестабильная стенокардия;
- стабильная стенокардия функциональных классов (далее – ФК) III–IV по Канадской классификации;
- хроническая сердечная недостаточность (далее – ХСН) ФК III–IV по NYHA;
- нарушения ритма и проводимости (атриовентрикулярная блокада II–III степени, симптоматическая частая желудочковая экстрасистолия, впервые выявленная устойчивая желудочковая тахикардия, симптоматическая синусовая брадикардия, бради-тахисистолическая форма фибрилляции, трепетания предсердий);
- клинически значимое поражение клапанного аппарата сердца (стеноз аортального клапана площадью менее 1 см2 или со средним градиентом давления более 40 мм рт. ст., стеноз митрального клапана площадью менее 1,5 см2 и давление в легочной артерии систолическое более 50 мм рт. ст.);
- инфаркт миокарда, перенесенный в течение последних 30 дней.
12. Клиническими факторами сердечно-сосудистого риска являются:
- ИБС (жалобы на стенокардитические боли, терапия нитратами, инфаркт миокарда в анамнезе, патологический зубец Q на электрокардиографии (далее – ЭКГ), положительный стресс-тест в анамнезе);
- ХСН;
- инсульт или транзиторная ишемическая атака в анамнезе;
- почечная дисфункция (креатинин более 170 мкмоль/л или скорость клубочковой фильтрации (далее – СКФ) менее 60 мл/мин.);
- СД, требующий терапии инсулином.
13. Предоперационное исследование дыхательной системы включает:
- скрининговую оценку по данным анамнеза: курение; одышка; толерантность к физической нагрузке; кашель; прием бронхолитиков или стероидов; использование ингаляторов; недавно перенесенная инфекция верхних дыхательных путей; стридор, храп или сонное апноэ;
- физикальный осмотр с оценкой частоты дыхания, использования пациентом при дыхании вспомогательных мышц, цвета ногтевых лож, способности пациента вести беседу или ходить без одышки;
- аускультацию для возможного обнаружения ослабления дыхания, хрипов, стридора;
- идентификацию доказанных факторов риска развития послеоперационных легочных осложнений: возраст старше 60 лет; ХОБЛ; курение; застойная сердечная недостаточность; функциональная зависимость (недостаточность);
- рекомендацию отказа от курения не менее чем за 4 недели до планового хирургического вмешательства с учетом отрицательного влияния курения на реактивность дыхательных путей, продукцию мокроты и повышение уровня карбоксигемоглобина, а также стимуляцию сердечно-сосудистой системы;
- выяснение у пациента с сопутствующей бронхиальной астмой информации о провоцирующих факторах, степени тяжести и текущем состоянии заболевания (частота применения бронхолитиков, госпитализации по поводу обострения астмы, а также потребность в системных стероидах являются признаками тяжелого течения заболевания и сохранения гиперреактивности дыхательных путей), что учитывается при планировании анестезии;
- выявление у пациента симптомов обструктивного сонного апноэ (далее – ОСА): периодическая обструкция верхних дыхательных путей во время сна с десатурацией и гиперкапнией, ассоциированная с хронической легочной гипертензией и правожелудочковой сердечной недостаточностью;
- оценку риска наличия синдрома ОСА по шкале STOP-BANG согласно приложению 11 при наличии у пациента: ожирения (ИМТ 35 кг/м2 и более); увеличенной окружности шеи (более 40 см); тяжелой гипертрофии миндалин; заложенности носа; анатомических аномалий верхних дыхательных путей;
- определение необходимости дополнительного обследования пациента с высоким риском синдрома ОСА по шкале STOP-BANG согласно приложению 11 (направление на полисомнографию и определение медицинских показаний к проведению СРАР-терапии во время сна в периоперационном периоде). Если исследование сна является неоправданным или невозможным, считается, что ОСА подтвержден;
- резервирование места в отделении анестезиологии и реанимации для госпитализации пациентов после высокотравматичных хирургических вмешательств (за исключением кардиохирургических) в связи с повышенным риском послеоперационных легочных осложнений (ателектазы, пневмонии, обострение ХОБЛ, отек легких и длительная потребность в механической вентиляции легких).
14. Предоперационное обследование эндокринной системы включает опрос пациента на предмет наличия симптомов эндокринных заболеваний, которые могут повлиять на течение периоперационного периода:
- СД;
- заболевания щитовидной и паращитовидной желез;
- патология надпочечников.
Предоперационное обследование пациентов с СД включает:
- выявление наличия СД у пациента, определение степени поражения органов-мишеней: сосудов головного мозга; периферических сосудов и почек (СД является ведущей причиной почечной недостаточности, требующей диализа);
- планирование периоперационного ведения пациентов с СД с учетом восприимчивости к травмам кожи и мягких тканей вследствие позиционирования во время и после хирургических вмешательств в связи с периферическими невропатиями и сосудистыми поражениями, предрасположенности пациента к гемодинамической нестабильности во время анестезии, а также увеличения времени опорожнения желудка и, соответственно, риска легочной аспирации вследствие вегетативной нейропатии, риска трудной интубации у пациентов с длительным анамнезом СД;
- лабораторные исследования: определение уровня глюкозы в крови, электролитов, креатинина; уровень HbA1C (для пациентов, которым планируется выполнение хирургического вмешательства высокого риска или протезирование крупных суставов); общий анализ мочи (наличие кетонов в моче);
- отмену планового хирургического вмешательства до оптимизации предоперационного гликемического контроля, если имеется кетонурия, увеличен уровень HbA1C и есть нарушения электролитов. При стабильном течении диабета рутинное предоперационное исследование гликемического профиля не требуется. Алгоритм ведения пациента с СД установлен согласно приложению 12;
- ЭКГ.
15. Предоперационное обследование пациентов с заболеваниями щитовидной (при гипотиреозе) и паращитовидной желез включает:
- выявление при осмотре и опросе пациента характерных клинических проявлений заболеваний с назначением исследования уровня тиреоидных гормонов и консультации врача-эндокринолога (по медицинским показаниям);
- осмотр области шеи пациента при увеличении щитовидной железы, большая масса которой в положении пациента лежа на спине может сдавливать или смещать верхние дыхательные пути, вызывая инспираторный стридор или хрипы, и назначение рентгенографии органов грудной клетки или компьютерной томографии для выявления признаков отклонения или сужения трахеи;
- контроль уровня ионизированного кальция в сыворотке крови у пациентов с гиперпаратиреозом для исключения гиперкальциемии.
16. Предоперационное обследование пациентов с патологией надпочечников включает:
- выявление клинических проявлений феохромоцитомы во всех случаях необъяснимой перемежающейся АГ у пациента, которая сопровождается головной болью, повышенной потливостью и тахикардией;
- исключение признаков недостаточности коры надпочечников у пациентов, которые принимают длительно кортикостероиды, в случае выявления при необходимости осуществляется коррекция жидкостных и электролитных нарушений, а также прием стероидных гормонов в качестве предоперационной подготовки.
17. Предоперационное исследование функции почек имеет важное значение для обмена жидкости и электролитов, а также для метаболизма лекарственных препаратов и включает:
- медицинский осмотр;
- оценку СКФ у пациентов с нарушением функции почек, так как дозы некоторых лекарственных препаратов рассчитываются исходя из степени снижения СКФ;
- уточнение сроков выполнения последней процедуры программного гемодиализа, если пациент его получает, контроль показателей кислотно-щелочного состояния, содержания электролитов в сыворотке крови и оценка волемического статуса пациента для определения необходимости выполнения гемодиализа перед хирургическим вмешательством;
- проведение планового гемодиализа накануне хирургического вмешательства (оптимально – за 1 день);
- выполнение общего анализа крови.
18. Предоперационное обследование пациентов с патологией печени включает:
- сбор анамнеза для выявления специфических рисков развития заболеваний печени (предшествующие переливания крови, употребление алкогольных, слабоалкогольных напитков, пива, потребление наркотических средств, психотропных веществ, их аналогов, токсических или других одурманивающих веществ);
- определение наличия нарушений свертываемости крови (кровоподтеки, кровотечения и варикозное расширение вен пищевода, патологии синтеза факторов свертывания и (или) тромбоцитопении), которые могут препятствовать выбору регионарных методов анестезии;
- физикальное обследование для определения наличия признаков патологии печени (желтуха, паутинные невусы, асцит, гепатоспленомегалия или ладонная эритема);
- оценку степени тяжести печеночной недостаточности по шкалам Чайлд-Пью и MELD-Na пациентам с установленным диагнозом цирроза печени;
- планирование хирургических вмешательств у пациентов с хроническими заболеваниями печени в соответствии с периоперационным риском, который возрастает с увеличением тяжести печеночной дисфункции.
19. Предоперационная оценка пациентов с отягощенным аллергическим анамнезом включает выявление пациентов с риском развития анафилактических реакций во время анестезии, к которым относятся пациенты:
- с документально подтвержденной аллергией на один из лекарственных препаратов или продуктов, которые могут быть использованы во время хирургического вмешательства;
- с анамнезом возможной аллергической реакции во время предыдущей анестезии;
- с анамнезом возможной аллергии на латекс независимо от обстоятельств;
- с анамнезом предполагаемой аллергии к овощам, плодоовощным или хлопьям (имеются данные о частой перекрестной реактивности с латексом).
20. Для оценки риска и предупреждения легочной аспирации учитываются следующие факторы:
- экстренность хирургического вмешательства;
- время последнего приема пищи;
- наличие заболеваний или состояний, которые способствуют замедлению опорожнения желудка.
Наиболее распространенными причинами, предрасполагающими к аспирации, являются:
- экстренная хирургия;
- неадекватная анестезия;
- абдоминальная патология;
- ожирение;
- применение опиатов;
- неврологический дефицит;
- литотомическое положение пациента;
- трудные дыхательные пути;
- рефлюксная болезнь;
- грыжа пищеводного отверстия диафрагмы;
- беременность.
Лечение
ГЛАВА 3
ПОДГОТОВКА ПАЦИЕНТА К ХИРУРГИЧЕСКОМУ ВМЕШАТЕЛЬСТВУ
21. Врач-анестезиолог-реаниматолог в процессе предоперационного осмотра пациента проводит психологическую подготовку пациента к хирургическому вмешательству, а также определяет необходимость и объем использования лекарственных препаратов, о чем делает соответствующую запись в протоколе осмотра врача-анестезиолога-реаниматолога.
22. Психологическая подготовка пациента к хирургическому вмешательству проводится с целью получить от пациента доверие и поддержку, а также вселить в него уверенность в благоприятном исходе предполагаемого анестезиологического пособия.
23. Проведение медикаментозной подготовки с целью облегчения анестезиологического пособия назначается для:
- снижения уровня тревожности перед хирургическим вмешательством, когда психологической подготовки пациента недостаточно;
- иных лечебно-профилактических целей (обезболивание перед хирургическим вмешательством, медицинская профилактика аспирационного синдрома).
24. При выборе лекарственного препарата для проведения медикаментозной подготовки из перечня лекарственных препаратов для премедикации, установленного согласно приложению 13, учитываются психологическое и физическое состояния пациента, его возраст и лекарственный анамнез, а также иные медицинские показания к назначению лекарственных препаратов. Как правило, таблетированные лекарственные препараты назначаются за 2 часа до подачи пациента в операционную, внутривенные формы назначаются в зависимости от скорости развития необходимого эффекта.
26. Наркотические анальгетики показаны при необходимости купирования болевого синдрома у пациента, при отсутствии болевого синдрома они могут вызвать дисфорию. Опиоиды назначаются для обеспечения анальгоседации (в сочетании с производными бензодиазепина) при проведении регионарных методик анестезии, установке инвазивного мониторинга или венозных линий, если эти манипуляции планируется выполнять у пациентов в сознании.
27. Блокаторы гистаминовых H2-рецепторов назначаются с целью снижения кислотности и уменьшения объема содержимого желудка при угрозе регургитации и легочной аспирации.
29. Противосудорожный лекарственный препарат габапентин может быть назначен для премедикации и седации пациентов, так как он снижает послеоперационное использование опиоидных анальгетиков для лечения болевого синдрома и обладает анксиолитическим эффектом. Наиболее частыми нежелательными реакциями могут быть головная боль и головокружение.
30. Пероральная премедикация ингибитором циклооксигеназы2 (далее – ЦОГ-2) целекоксибом1 (в дозе 400 мг) может быть назначена в предоперационный период для снижения болевого синдрома в раннем послеоперационном периоде. Применение данного лекарственного препарата ограничено нежелательными реакциями и медицинскими противопоказаниями (пептические язвы, бронхиальная астма, тяжелые заболевания сердца и почек, повышенная чувствительность к сульфаниламидам, нарушение свертываемости крови, беременность, болезнь Крона, язвенный колит).
25. Для купирования тревожности лекарственными препаратами выбора являются производные бензодиазепина, не обладающие анальгетическим эффектом. При этом при их применении может развиться парадоксальная реакция, проявляющаяся в усилении тревожности вплоть до психомоторного возбуждения и бреда.
26. Наркотические анальгетики показаны при необходимости купирования болевого синдрома у пациента, при отсутствии болевого синдрома они могут вызвать дисфорию. Опиоиды назначаются для обеспечения анальгоседации (в сочетании с производными бензодиазепина) при проведении регионарных методик анестезии, установке инвазивного мониторинга или венозных линий, если эти манипуляции планируется выполнять у пациентов в сознании.
27. Блокаторы гистаминовых H2-рецепторов назначаются с целью снижения кислотности и уменьшения объема содержимого желудка при угрозе регургитации и легочной аспирации.
28. Блокатор м-холинорецепторов: атропин (раствор для инъекций 1 мг/мл) назначается для снижения саливации и повышения качества местной анестезии при проведении фиброоптической интубации (далее – ФОИ) в сознании или в других отдельных случаях. С ваголитической целью (при наличии медицинских показаний) более эффективно интраоперационное введение атропина. Нежелательные реакции на введение атропина включают в себя центральный антихолинергический синдром, повышение внутриглазного давления у пациентов с глаукомой и интраоперационную гипертермию.
29. Противосудорожный лекарственный препарат габапентин может быть назначен для премедикации и седации пациентов, так как он снижает послеоперационное использование опиоидных анальгетиков для лечения болевого синдрома и обладает анксиолитическим эффектом. Наиболее частыми нежелательными реакциями могут быть головная боль и головокружение.
30. Пероральная премедикация ингибитором циклооксигеназы2 (далее – ЦОГ-2) целекоксибом1 (в дозе 400 мг) может быть назначена в предоперационный период для снижения болевого синдрома в раннем послеоперационном периоде. Применение данного лекарственного препарата ограничено нежелательными реакциями и медицинскими противопоказаниями (пептические язвы, бронхиальная астма, тяжелые заболевания сердца и почек, повышенная чувствительность к сульфаниламидам, нарушение свертываемости крови, беременность, болезнь Крона, язвенный колит).
______________________________
1 Off-label (назначается врачебным консилиумом).
32. Прием пищи прекращается пациентом за 6 часов до планового хирургического вмешательства. Интервал между последним приемом молока или молочных продуктов (кефир, сливки, ряженка и иные) и хирургическим вмешательством должен составлять не менее 6 часов. Прием прозрачных жидкостей (вода, негазированные безалкогольные напитки, соки без мякоти, чай, кофе без добавления молока, сливок) прекращается за 2 часа до хирургического вмешательства. Допускается прием лекарственных препаратов менее чем за 2 часа до хирургического вмешательства, при этом пациент может запить лекарственные препараты небольшим количеством воды (до 50 мл). При несоблюдении пациентом требований по приему пищи плановое хирургическое вмешательство отменяется и переносится на следующий день.
Для ускорения опорожнения желудка может быть назначен метоклопрамид (раствор для внутривенного введения 5 мг/мл) внутривенно за 1 час до начала хирургического вмешательства 10 мг.
Для предупреждения аспирации желудочного сока пациентам с факторами риска (ожирение, беременность, высокое внутрибрюшное давление, парез кишечника, низкий тонус пищеводного сфинктера, гастроэзофагеальный рефлюкс, замедленное высвобождение пищи из желудка) внутривенно назначаются блокаторы гистаминовых Н2-рецепторов: ранитидин (раствор для внутривенного введения 25 мг/мл) 2 мл в разведении раствором натрия хлорида 9 мг/мл до 20 мл внутривенно, или фамотидин (лиофилизированный порошок для приготовления раствора для внутривенного введения 20 мг) в разведении раствором натрия хлорида 9 мг/мл до 20 мл внутривенно или ингибиторы протонной помпы: омепразол (лиофилизированный порошок для приготовления раствора для внутривенного введения 40 мг) в разведении раствором натрия хлорида 9 мг/мл до 20 мл внутривенно, или пантопразол (лиофилизированный порошок для приготовления раствора для внутривенного введения 40 мг) в разведении раствором натрия хлорида 9 мг/мл до 20 мл внутривенно за 1 час хирургического вмешательства.
44. Во время проведения анестезии, в том числе в амбулаторных условиях, проводится контроль за ее течением и функциями организма пациента. Выделяются обязательный анестезиологический мониторинг, который проводится при любой анестезии, и дополнительный, который проводится по медицинским показаниям.
Обязательный анестезиологический мониторинг включает мониторирование следующих параметров:
57. Спинальная (субарахноидальная) анестезия и анальгезия выполняются врачом-анестезиологом-реаниматологом в операционной или манипуляционной, где необходимо наличие аппаратуры для проведения гемодинамического мониторинга, дыхательной аппаратуры, кислорода, дефибриллятора, ларингоскопа, инфузионных сред, а также лекарственных препаратов для проведения сердечно-легочной реанимации. Перед проведением регионарных методов обезболивания налаживается гемодинамический мониторинг, а также обеспечивается венозный доступ. Преинфузия используется только при наличии медицинских показаний.
76. Пациентам, которым планируется проведение общей анестезии, проводится медицинская профилактика ПОТР в соответствии с алгоритмом медицинской профилактики ПОТР, установленным согласно приложению 21.
99. К трудным дыхательным путям относятся:
Пациентам, которым планируется проведение анестезиологического пособия или выполнение хирургического вмешательства на дыхательных путях, по возможности проводится комплексная оценка дыхательных путей по шкале «Москва-TD» по алгоритму, установленному согласно приложению 27, и рассчитывается ИТИ.
Врач-анестезиолог-реаниматолог подробно описывает состояние дыхательных путей, а также проблемы, которые возникли при обеспечении их проходимости, в медицинских документах.
Сочетание признаков предстоящей трудной интубации трахеи и трудной вентиляции легких или сочетание признаков предстоящей трудной интубации трахеи и «полного желудка» являются медицинскими показаниями к интубации трахеи с сохранением сознания пациента.
ИТИ (совокупность баллов по шкале «Москва-TD»): 0 – трудности не ожидаются; 1–2 – возможна трудная интубация; 3–4 – высокая вероятность трудной интубации; 5 и более – предстоит трудная интубация.
При наличии времени пациенту проводится преоксигенация 100 % кислородом со скоростью потока не менее 10 л/мин. в течение 3–5 минут или пациент делает 4 глубоких вдоха. В экстренной ситуации рассматривается возможность проведения кратковременной масочной вентиляции 100 % кислородом перед началом интубации (при этом учитывается опасность аспирации содержимым желудка).
Интубация трахеи выполняется под общей анестезией. Выбор лекарственного препарата для общей анестезии зависит от состояния гемодинамики пациента. Может проводиться стандартная или быстрая последовательная индукция.
Интубация трахеи без использования миорелаксантов затруднена и увеличивает вероятность осложнений.
У пациента в состоянии глубокой комы (3 балла по шкале ком Глазго) интубация трахеи выполняется без общей анестезии и миорелаксации.
Высокая вероятность трудной интубации – ИТИ 3–4 балла.
После осуществления коникотомии и стабилизации состояния пациента решается вопрос о пробуждении пациента или начале хирургического вмешательства в зависимости от клинических проявлений.
Выделяют два вида экстубации трахеи:
При выполнении экстубации трахеи в кратчайшие сроки возобновляется подача кислорода пациенту. Недопустимо проводить так называемый «тест на спонтанное дыхание», когда пациент отсоединяется от дыхательного аппарата и дышит значительное время атмосферным воздухом через ЭТТ.
Проводится преоксигенация 100 % кислородом, положение пациента с приподнятой головой, особенно важно для пациентов с морбидным ожирением. Выполняется санация ротоглотки. С целью купирования рефлекторных реакций со стороны дыхательных путей на экстубацию трахеи возможно назначение наркотических анальгетиков, лидокаина, кетамина, β-блокаторов (с учетом состояния пациента).
После экстубации проводится тщательный мониторинг состояния пациента. Оптимальное положение пациента после экстубации трахеи – с приподнятым головным концом кровати. Обеспечивается подача кислорода с высоким потоком. При наличии возможности, используется мониторинг капнометрии (капнографии). Сразу после экстубации пациента не следует кормить (поить), так как защитная функция гортани может быть нарушена.
109. Набор для ведения пациентов с трудными дыхательными путями включает:
31. При необходимости резервирования для хирургического вмешательства крови, ее компонентов врач-анестезиолог-реаниматолог во время подготовки пациента к хирургическому вмешательству определяет их объем с учетом предполагаемой кровопотери.
Порядок резервирования крови и ее компонентов определяется организацией здравоохранения, оказывающей медицинскую помощь в стационарных условиях.
32. Прием пищи прекращается пациентом за 6 часов до планового хирургического вмешательства. Интервал между последним приемом молока или молочных продуктов (кефир, сливки, ряженка и иные) и хирургическим вмешательством должен составлять не менее 6 часов. Прием прозрачных жидкостей (вода, негазированные безалкогольные напитки, соки без мякоти, чай, кофе без добавления молока, сливок) прекращается за 2 часа до хирургического вмешательства. Допускается прием лекарственных препаратов менее чем за 2 часа до хирургического вмешательства, при этом пациент может запить лекарственные препараты небольшим количеством воды (до 50 мл). При несоблюдении пациентом требований по приему пищи плановое хирургическое вмешательство отменяется и переносится на следующий день.
Для ускорения опорожнения желудка может быть назначен метоклопрамид (раствор для внутривенного введения 5 мг/мл) внутривенно за 1 час до начала хирургического вмешательства 10 мг.
Пациенты, которым планируется выполнение экстренного хирургического вмешательства, рассматриваются как пациенты с полным желудком с выбором соответствующей тактики их ведения.
Для предупреждения аспирации желудочного сока пациентам с факторами риска (ожирение, беременность, высокое внутрибрюшное давление, парез кишечника, низкий тонус пищеводного сфинктера, гастроэзофагеальный рефлюкс, замедленное высвобождение пищи из желудка) внутривенно назначаются блокаторы гистаминовых Н2-рецепторов: ранитидин (раствор для внутривенного введения 25 мг/мл) 2 мл в разведении раствором натрия хлорида 9 мг/мл до 20 мл внутривенно, или фамотидин (лиофилизированный порошок для приготовления раствора для внутривенного введения 20 мг) в разведении раствором натрия хлорида 9 мг/мл до 20 мл внутривенно или ингибиторы протонной помпы: омепразол (лиофилизированный порошок для приготовления раствора для внутривенного введения 40 мг) в разведении раствором натрия хлорида 9 мг/мл до 20 мл внутривенно, или пантопразол (лиофилизированный порошок для приготовления раствора для внутривенного введения 40 мг) в разведении раствором натрия хлорида 9 мг/мл до 20 мл внутривенно за 1 час хирургического вмешательства.
ГЛАВА 5
АНЕСТЕЗИОЛОГИЧЕСКИЙ МОНИТОРИНГ И ПРОВЕДЕНИЕ ОТДЕЛЬНЫХ ВИДОВ АНЕСТЕЗИИ
44. Во время проведения анестезии, в том числе в амбулаторных условиях, проводится контроль за ее течением и функциями организма пациента. Выделяются обязательный анестезиологический мониторинг, который проводится при любой анестезии, и дополнительный, который проводится по медицинским показаниям.
45. Обязательный анестезиологический мониторинг включает в себя следующие требования:
- присутствие медицинских работников, прошедших подготовку по анестезиологии и реаниматологии, рядом с пациентом на протяжении всего анестезиологического пособия;
- не допускается оставление пациента без медицинского наблюдения;
- не допускается проведение анестезии одним врачом-специалистом более чем одному пациенту одновременно.
Обязательный анестезиологический мониторинг включает мониторирование следующих параметров:
- неинвазивное АД;
- пульсоксиметрия (частота пульса, насыщение артериальной крови кислородом, фотоплетизмография);
- мониторинг ЭКГ (II стандартное отведение, при необходимости – дополнительное грудное отведение);
- капнография (при проведении пациенту общей анестезии с вспомогательной вентиляцией легких или искусственной вентиляцией легких (далее – ИВЛ));
- мониторинг концентрации кислорода и ингаляционных анестетиков во вдыхаемой и выдыхаемой смеси (при проведении пациенту общей анестезии с вспомогательной вентиляцией легких или ИВЛ и с использованием ингаляционных анестетиков).
46. Дополнительный анестезиологический мониторинг проводится по медицинским показаниям в сочетании с основным анестезиологическим мониторингом и включает в себя:
- мониторинг нейромышечной проводимости (желателен во всех случаях использования мышечных релаксантов);
- измерение температуры (при длительных хирургических вмешательствах, опасности гипо- или гипертермии);
- оксиметрия (при проведении пациенту общей анестезии с вспомогательной вентиляцией легких или ИВЛ);
- измерение диуреза (при длительных (более 3 часов) хирургических вмешательствах, интраоперационном использовании диуретиков, хирургических вмешательствах с риском повреждения почек либо мочеточников, сопутствующей почечной патологии и дополнительном риске повреждения почек (нестабильная гемодинамика, введение нефротоксичных лекарственных препаратов и иные));
- измерение инвазивного АД (при нестабильной гемодинамике, необходимости частого исследования газов артериальной крови в ходе анестезиологического пособия, при высокотравматичных хирургических вмешательствах, хирургических вмешательствах высокого риска и хирургических вмешательствах с большим объемом кровопотери);
- измерение центрального венозного давления (при необходимости мониторинга давления в правом предсердии, введения вазопрессорных и инотропных лекарственных препаратов), сатурации смешанной венозной крови;
- измерение давления в легочной артерии;
- транспищеводная эхография;
- определение биспектрального индекса или спектрального анализа (желателен в случаях проведения тотальной внутривенной анестезии, при угрозе сохранения сознания у пациента в процессе проведения анестезиологического пособия);
- измерение церебральной оксиметрии;
- мониторинг сердечного выброса методом транспульмональной термодилюции;
- расширенный гемодинамический мониторинг (вариации пульсового давления, вариации систолического давления, вариации ударного объема, измерение коллабирования полой вены под ультразвуковым контролем – по медицинским показаниям).
47. Общая ингаляционная анестезия может проводиться с сохраненным спонтанным дыханием или в условиях фармакологически индуцированной миоплегии. При проведении ингаляционной анестезии со спонтанным дыханием или ИВЛ на индукцию допускается суммарно до 3 МАК, на поддержание анестезии – суммарно до 1,5 МАК
Общая ингаляционная анестезия включает в себя следующие компоненты:
- преоксигенация: 100 % кислород через плотно прижатую маску 5 минут, поток кислорода должен быть больше минутной вентиляции пациента, осуществляется контроль за качеством преоксигенации по показателям оксиметрии на выдохе (более 90 %);
- дополнительная седация и анальгезия следующими лекарственными препаратами (при необходимости):
- фентанил (раствор для внутривенного и внутримышечного введения 0,05 мг/мл) в дозе 1–2 мкг/кг внутривенно, при необходимости метамизол натрия (раствор для внутривенного и внутримышечного введения 500 мг/мл) в дозе 2 г внутривенно, либо лорноксикам (лиофилизат для приготовления раствора для внутривенного и внутримышечного введения в комплекте с растворителем 8 мг) 8 мг внутривенно, либо кетопрофен (раствор для внутривенного и внутримышечного введения 50 мг/мл) в дозе 100 мг, либо декскетопрофен (раствор для внутривенного и внутримышечного введения 25 мг/мл) в дозе 50–100 мг, при необходимости мидазолам (раствор для внутривенного, внутримышечного, ректального введения 5 мг/мл) в дозе 0,03–0,05 мг/кг внутривенно;
- индукция анестезии: внутривенная индукция (тиопентал 3–5 мг/кг, или пропофол – 1,5–2,5 мг/кг; или кетамин: доза подбирается индивидуально в зависимости от клинического ответа, состояния пациента и может варьироваться от 1 мг/кг до 4,5 мг/кг (в среднем 2 мг/кг) либо ингаляционная индукция (болюсная методика с использованием севофлюрана: поток свежего газа 4–8 л/мин. (поток свежего газа должен быть больше минутной вентиляции пациента), 100 % кислород, севофлюран 6–8 об. % (менее 2 мин. До наступления эффекта), либо пошаговая методика с использованием севофлюрана: поток свежего газа 4–8 л/мин. (поток свежего газа должен быть больше минутной вентиляции пациента), 100 % кислород, севофлюран 1 об. % (с последующим увеличением на 1 об. % каждые 4–5 вдохов до максимальной концентрации 6–8 об. % (до наступления эффекта). Вместо 100 % кислорода может использоваться смесь кислорода и закиси азота (концентрация закиси азота в смеси не более 65 %, учитывается эффект «второго газа» и корректируется концентрация севофлюрана при использовании закиси азота). Изофлюран для ингаляционной индукции не используется (вызывает раздражение дыхательных путей);
После индукции анестезии и миоплегии (если она показана) проводится обеспечение проходимости верхних дыхательных путей (инсталляция ларингеальной маска либо интубация трахеи).
- миоплегия для проведения интубации трахеи, если она планируется: суксаметоний (раствор для внутривенного введения 20 мг/мл) в дозе 1 мг/кг или атракурий (раствор для внутривенного введения 10 мг/мл) в дозе 0,5–0,6 мг/кг внутривенно (пациенты не выше 2 баллов по ИТИ, или цисатракурий (раствор для внутривенного введения 2 мг/мл) в дозе 0,15 мг/кг (пациенты не выше 2 баллов по ИТИ), или рокурония бромид (раствор для внутривенного введения 10 мг/мл) в дозе 0,6 мг/кг (пациенты не выше 2 баллов по ИТИ, для быстрой последовательной индукции доза рокурония бромида составляет 1,0 мг/кг. Желательно наличие в доступности специфического антагониста рокурония бромида – сугаммадекса).
После индукции анестезии и миоплегии (если она показана) проводится обеспечение проходимости верхних дыхательных путей (инсталляция ларингеальной маска либо интубация трахеи).
48. Поддержание анестезии: 35–100 % кислород плюс воздух либо закись азота (не более 65 %) плюсизофлуран или севофлуран до необходимого уровня МАК плюс фентанил внутривенно 1–10 мкг/кг/ч либо болюсно по 1–2 мкг/кг каждые 5–30 минут (по потребности).
Поддержание миорелаксации: внутривенно атракурий 0,1–0,2 мг/кг или пипекуроний бромид 0,01–0,015 мг/кг, или рокурония бромид 0,1–0,2 мг/кг, или цисатракурий 0,03 мг/кг (по данным нейромышечного мониторинга либо по клиническим данным).
49. При выходе из анестезии необходимо соблюдать следующие требования:
- обеспечение упреждающей послеоперационной анальгезии не менее чем за 30 минут до экстубации: морфин (раствор для инъекций 10 мг/мл) в дозе 0,1–0,15 мг/кг внутривенно, или парацетамол (раствор для инфузий 10 мг/мл) в дозе 1000 мг внутривенно плюс при необходимости другие нестероидные противовоспалительные препараты (далее – НПВП) (метамизол натрия, кетопрофен, декскетопрофен согласно приложению 25, при необходимости регионарный компонент);
- оценка степени восстановления нейромышечной проводимости (по данным нейромышечного мониторинга и клиническим данным) и проведение декураризации: после предварительного введения атропина (раствор для внутривенного введения 1 мг/мл) в дозе 0,015 мг/кг используется неостигмин (раствор для внутривенного введения 0,5 мг/мл) в дозе 0,02 мг/кг (2–4 мл) при отсутствии нейромышечного мониторинга. Если проводится нейромышечный мониторинг, доза неостигмина подбирается в зависимости от значений TOF. При значении TOF = 0–30 декураризацию проводить рано, при значении 30–60 доза неостигмина составляет 0,06 мг/кг, при TOF >60 – 0,02 мг/кг;
- рассмотрение вопроса о продленной ИВЛ в условиях отделения анестезиологии и реанимации при продленном нейромышечном блоке, неэффективности неостигмина или наличии медицинских противопоказаний для его введения. Учитывается, что декураризация противопоказана при наличии глубокого нейромышечного блока;
- прекращение подачи ингаляционного анестетика и закиси азота по мере завершения хирургического вмешательства, переход к моменту окончания хирургического вмешательства на вентиляцию 80–100 % кислородом с потоком, превышающим минутную вентиляцию пациента (при планировании экстубации в сознании). Проводится санация ротоглотки и при необходимости трахеи. После восстановления сознания, полного восстановления нейромышечной проводимости, способности к продуктивному контакту и выполнению команд пациент экстубируется;
- выполнение экстубации пациента без сознания при наличии мониторинга нейромышечной проводимости, ИТИ не выше 2, не выше 2-й степени по шкале Лихен–Кормак. При наличии у пациента глубокой анестезии: восстанавливается спонтанное дыхание у пациента без прекращения подачи ингаляционного анестетика на уровне 0,5–0,4 МАК, затем проводится преоксигенация и санация ротоглотки и при необходимости трахеи. Пациент экстубируется, устанавливается воздуховод, прекращается подача ингаляционных анестетиков и обеспечивается вентиляция пациента лицевой маской 100 % кислородом с потоком, превышающим минутную вентиляцию пациента для обеспечения элиминации ингаляционного анестетика и пробуждения.
50. Общая внутривенная анестезия может проводиться с сохраненным спонтанным дыханием или с применением ИВЛ (тотальная внутривенная анестезия с ИВЛ).
Преоксигенация осуществляется в следующем порядке: подается 100 % кислород через плотно прижатую маску в течение 5 минут, поток кислорода должен быть больше минутной вентиляции пациента, контролируется качество преоксигенации по показателям оксиметрии на выдохе (более 90 %).
Индукция анестезии осуществляется следующими лекарственными препаратами: пропофол 2,5–2,5 мг/кг или тиопентал натрия 3–5 мг/кг, или кетамин 1–2 мг/кг, или мидазолам 0,15–0,2 мг/кг (0,3–0,35 мг/кг без премедикации), или этомидат, который вводится внутривенно в дозе 150–300 мкг/кг в течение 10–30 сек., при необходимости проводится повторное введение, не ранее чем через 4 минуты после предыдущего введения в дозе 150 мкг/кг, что увеличивает продолжительность наркоза до 10 минут. Максимальная разовая доза этомидата составляет 30 мг.
53. После индукции анестезии и миоплегии (если она показана) проводится обеспечение проходимости верхних дыхательных путей (инсталляция ларингеальной маски либо интубация трахеи).
51. Дополнительные седация и анальгезия осуществляются следующими лекарственными препаратами (при необходимости):
- фентанил 1–2 мкг/кг внутривенно, при необходимости метамизол натрия 2 г внутривенно либо лорноксикам 8 мг внутривенно, либо кетопрофен 100 мг, либо декскетопрофен 100 мг ± мидазолам 0,03–0,05 мг/кг внутривенно.
Индукция анестезии осуществляется следующими лекарственными препаратами: пропофол 2,5–2,5 мг/кг или тиопентал натрия 3–5 мг/кг, или кетамин 1–2 мг/кг, или мидазолам 0,15–0,2 мг/кг (0,3–0,35 мг/кг без премедикации), или этомидат, который вводится внутривенно в дозе 150–300 мкг/кг в течение 10–30 сек., при необходимости проводится повторное введение, не ранее чем через 4 минуты после предыдущего введения в дозе 150 мкг/кг, что увеличивает продолжительность наркоза до 10 минут. Максимальная разовая доза этомидата составляет 30 мг.
52. Миоплегия для проведения интубации трахеи, если она планируется, осуществляется следующими лекарственными препаратами: суксаметоний 1,5 мг/кг или атракурий 0,5–0,6 мг/кг (пациенты не выше 2 баллов по ИТИ), или цисатракурий 0,15 мг/кг (пациенты не выше 2 баллов по ИТИ), или рокуроний бромид 0,6 мг/кг (пациенты не выше 2 баллов по ИТИ, для быстрой последовательной индукции доза рокурония бромида составляет 1,2 мг/кг, желательно наличие в доступности специфического антагониста рокурония бромида – сугаммадекса).
53. После индукции анестезии и миоплегии (если она показана) проводится обеспечение проходимости верхних дыхательных путей (инсталляция ларингеальной маски либо интубация трахеи).
54. Поддержание анестезии осуществляется следующими лекарственными препаратами: инфузия по целевой концентрации пропофол (эмульсия для внутривенного введения 10 мг/мл) 50–150 мкг/кг/мин. плюс фентанил (раствор для внутривенного и внутримышечного введения 0,05 мг/мл) 1–5 мкг/кг/час внутривенно или пропофол (эмульсия для внутривенного введения 10 мг/мл) болюсно по 40–50 мг по мере необходимости плюс фентанил (раствор для внутривенного и внутримышечного введения 0,05 мг/мл) болюсно 1–2 мкг/кг каждые 5–30 минут.
Также пропофол можно вводить по следующей схеме: 12 мг/кг/час в течение первых 10 минут, затем 9 мг/кг/час в течение следующих 10 минут, затем 6 мг/кг/час до конца хирургического вмешательства, фентанил в этом случае вводится болюсно или в виде постоянной инфузии.
Допустимы следующие схемы применения лекарственных препаратов для поддержания анестезии:
- мидазолам (раствор для внутривенного, внутримышечного, ректального введения 5 мг/мл) в дозе 0,05–0,1 мг/кг внутривенно;
- пропофол (эмульсия для внутривенного введения 10 мг/мл) в дозе 50–100 мкг/кг/мин. плюс фентанил (раствор для внутривенного и внутримышечного введения 0,05 мг/мл) 1–5 мкг/кг/час;
- тиопентал (порошок лиофилизированный (лиофилизат) для приготовления раствора для внутривенного введения (для инъекций) 0,5 г, 1 г) в дозе 3–5 мг/кг;
- кетамин (раствор для внутривенного и внутримышечного введения (для инъекций) 50 мг/мл) 0,5–1 мг/кг ± диазепам (раствор для внутривенного и внутримышечного введения 5 мг/мл) в дозе 5–10 мг;
- мидазолам (раствор для внутривенного, внутримышечного, ректального введения 5 мг/мл) в дозе 0,05–0,1 мг/кг/час.
55. При выходе из анестезии необходимо:
- обеспечить упреждающую послеоперационную анальгезию не менее чем за 30 минут до экстубации: морфин (раствор для инъекций 10 мг/мл) в дозе 0,1–0,15 мг/кг внутривенно, парацетамол (раствор для инфузий 10 мг/мл) 1000 мг внутривенно плюс при необходимости другие НПВП согласно приложению 25, при необходимости регионарный компонент;
- оценить степень восстановления нейромышечной проводимости (по данным нейромышечного мониторинга и клиническим данным) и провести декураризацию: после предварительного введения атропина (раствор для инъекций 1 мг/мл) в дозе 0,015 мг/кг используется неостигмин (раствор для внутривенного введения 0,5 мг/мл) в дозе 0,02 мг/кг (2–4 мл) при отсутствии нейромышечного мониторинга. Если проводится нейромышечный мониторинг, доза неостигмина подбирается в зависимости от значений TOF. При значении TOF 0 или 1 декураризацию проводить рано, при значении 2 доза неостигмина составляет 0,06 мг/кг, при 3–4 – 0,05 мг/кг, ratio <0,4 – 0,04 мг/кг, ratio >0,4–0,02 мг/кг. При продленном нейромышечном блоке, неэффективности неостигмина или наличии медицинских противопоказаний для его введения рассматривается вопрос о продленной ИВЛ в условиях отделения анестезиологии и реанимации. Следует учитывать, что декураризация противопоказана при наличии глубокого нейромышечного блока;
- прекратить инфузию пропофола при планировании экстубации в сознании. Провести санацию ротоглотки и при необходимости трахеи. После восстановления сознания, полного восстановления нейромышечной проводимости, способности к продуктивному контакту и выполнению команд экстубировать пациента;
- выполнить экстубацию при наличии у пациента глубокой анестезии при планировании экстубации пациента без сознания: восстановить у пациента спонтанное дыхание, не прекращая подачи пропофола, затем провести преоксигенацию и санацию ротоглотки и при необходимости трахеи. Экстубировать пациента, установить воздуховод, прекратить подачу пропофола и обеспечить вентиляцию пациента лицевой маской 100 % кислородом до пробуждения пациента. Также возможно использовать методику замены ЭТТ на ларингеальную маску.
56. Недопустимо проведение общей анестезии с сохраненным спонтанным дыханием длительностью более 1 часа. При необходимости проведения общей анестезии более 1 часа применение ИВЛ обязательно.
57. Спинальная (субарахноидальная) анестезия и анальгезия выполняются врачом-анестезиологом-реаниматологом в операционной или манипуляционной, где необходимо наличие аппаратуры для проведения гемодинамического мониторинга, дыхательной аппаратуры, кислорода, дефибриллятора, ларингоскопа, инфузионных сред, а также лекарственных препаратов для проведения сердечно-легочной реанимации. Перед проведением регионарных методов обезболивания налаживается гемодинамический мониторинг, а также обеспечивается венозный доступ. Преинфузия используется только при наличии медицинских показаний.
58. Коррекция артериальной гипотензии осуществляется путем введения вазопрессоров (фенилэфрин, норэпинефрин, эфедрин). Постоянная внутривенная инфузия фенилэфрина (раствор для инъекций 10 мг/мл) в дозе 0,04–0,18 мг/мин. или норэпинефрина (концентрат для приготовления раствора для внутривенного введения 2 мг/мл) 0,03–0,3 мкг/кг/мин. либо болюсные внутривенные введения фенилэфрина по 0,05–0,1 мг, либо болюсные внутривенные введения эфедрина (раствор для инъекций 50 мг/мл) по 5–10 мг (допустимо введение эфедрина за 30–40 минут до хирургического вмешательства внутримышечно в дозе 50 мг).
Коррекция брадикардии осуществляется путем болюсного введения раствора атропина (раствор для инъекций 1 мг/мл) по 0,3–0,5 мг.
59. В асептических условиях проводится люмбальная пункция субарахноидального пространства на уровне ниже L3–L4 или L2–L3. Выполняется однократное введение раствора местного анестетика ± адьюванта суфентанил2 (раствор для инъекций 50 мкг/мл) в дозе 5–10 мкг ± морфин (раствор для эпидурального и интратекального введения 1 мг/мл) в дозе 75–150 мкг. При этом учитывается влияние объема раствора адъюванта на баричность местного анестетика). После наступления анестезии проводится оценка уровня сенсорного и степени выраженности моторного блока. Перечень местных анестетиков для спинальной анестезии установлен согласно приложению 16.
______________________________
2 Off-label (назначается врачебным консилиумом).
При использовании для спинальной анестезии изобарических растворов обеспечивается непрерывное медицинское наблюдение за пациентом в течение минимум 2 часов после выполнения блокады.
Изобарические анестетики противопоказаны пациентам с повышенным внутрибрюшным давлением (беременные, пациенты с морбидным ожирением и иные).
При блокаде седалищного нерва применяются раствор для инъекций лидокаина 1–1,5 мг/мл 20–40 мл, раствор для инъекций бупивакаина изобарический 2,5–5 мг/мл 20–30 мл, раствор для инъекций ропивакаина изобарический 5–7,5 мг/мл 10–30 мл или раствор для инъекций левобупивакаина изобарический 2,5–5 мг/мл 20–30 мл. Эпинефрин в качестве добавки к местному анестетику при блокаде седалищного нерва не используется.
При блокаде поперечного пространства живота (TAP-блок) на каждую сторону применяется: раствор для инъекций бупивакаина изобарический 2,5 мг/мл раствор 20–30 мл, раствор для инъекций ропивакаина изобарический 5 мг/мл 20–30 мл или раствор для инъекций левобупивакаина изобарический 2,5 мг/мл 20–30 мл. Используется только в сочетании с общей анестезией.
При блокаде влагалища прямых мышц живота (RS-блок) на каждую сторону применяются: раствор для инъекций бупивакаина изобарический 2,5 мг/мл 10 мл, раствор для инъекций ропивакаина изобарический 5 мг/мл 10 мл или раствор для инъекций левобупивакаина изобарический 2,5 мг/мл 10 мл. Используется только в сочетании с общей анестезией.
60. Спинальная анальгезия используется для обеспечения анальгетического компонента в интра- и послеоперационном периоде. Учитывая вероятность отсроченной депрессии дыхания после субарахноидального введения морфина, пациенту показано медицинское наблюдение медицинским персоналом в течение 24 часов.
При использовании для спинальной анестезии изобарических растворов обеспечивается непрерывное медицинское наблюдение за пациентом в течение минимум 2 часов после выполнения блокады.
Изобарические анестетики противопоказаны пациентам с повышенным внутрибрюшным давлением (беременные, пациенты с морбидным ожирением и иные).
При выполнении хирургических вмешательств на одной из нижних конечностей возможно применение односторонней спинальной анестезии. Особенность методики заключается в выполнении люмбальной пункции в положении пациента лежа на боку таким образом, чтобы оперируемая конечность находилась внизу. Срез спинальной иглы должен быть обращен в сторону оперируемой конечности. После получения прозрачного ликвора в субарахноидальное пространство вводится не более 7,5 мг бупивакаина (раствор для интратекального введения 5 мг/мл (гипербарический)). После нахождения пациента в таком положении в течение 15 минут оценивается выраженность сенсорного и моторного блока. В дальнейшем осуществляется необходимая укладка пациента на операционном столе.
61. Альтернативой каудальной анестезии может быть седельный блок для обезболивания хирургических вмешательств на промежности.
Люмбальная пункция выполняется в положении сидя. Срез спинальной иглы должен быть обращен вниз. После введения бупивакаина (раствор для интратекального введения 5 мг/мл (гипербарического)) в количестве 7,5–10 мг пациент остается в положении сидя на протяжении 15–20 минут. В дальнейшем осуществляется необходимая укладка пациента на операционном столе.
62. Коррекция артериальной гипотензии осуществляется путем введения следующих вазопрессоров (фенилэфрин, норэпинефрин, эфедрин):
- постоянная внутривенная инфузия фенилэфрина (раствор для инъекций 10 мг/мл) в дозе 0,04–0,18 мг/мин;
- норэпинефрина (раствор для инъекций внутривенно 1 мг/мл, концентрат для приготовления раствора для внутривенного введения 2 мг/мл) в дозе 0,03–0,3 мкг/кг/мин;
- болюсные внутривенные введения фенилэфрина (раствор для инъекций 10 мг/мл) по 0,05–0,1 мг;
- болюсные внутривенные введения эфедрина (раствор для инъекций 50 мг/мл) по 5–10 мг (допустимо введение эфедрина за 30–40 минут до хирургического вмешательства внутримышечно в дозе 50 мг).
Коррекция брадикардии осуществляется путем болюсного введения атропина (раствор для инъекций 1 мг/мл) по 0,3–0,5 мг.
63. Эпидуральная анестезия и анальгезия выполняются врачом-анестезиологом-реаниматологом в операционной или манипуляционной, где необходимо наличие аппаратуры для проведения гемодинамического мониторинга, дыхательной аппаратуры, кислорода, дефибриллятора, ларингоскопа, инфузионных сред, а также лекарственных препаратов для проведения сердечно-легочной реанимации. Перед проведением регионарных методов обезболивания налаживается гемодинамический мониторинг, а также обеспечивается венозный доступ. При эпидуральной анестезии и анальгезии в асептических условиях проводится пункция и катетеризация эпидурального пространства. Эпидуральная анестезия используется изолированно для обезболивания хирургических вмешательств. Эпидуральная анальгезия используется для послеоперационного обезболивания, обезболивания родов, лечения болевых синдромов. Выполняется посредством инъекции в эпидуральное пространство через предварительно установленный эпидуральный катетер раствора местного анестетика с адьювантом или без него. Пункция эпидурального пространства выполняется иглой Туохи, для верификации эпидурального пространства используются тактильные (тест потери сопротивления) и визуальные методы (отсутствие вытекания ликвора из павильона иглы Туохи, метод «висячей капли» – всасывание капли раствора натрия хлорида 9 мг/мл из павильона иглы при достижении эпидурального пространства иглой). Глубина проведения катетера в эпидуральное пространство составляет 3–5 см. Для идентификации правильного положения катетера используются аспирационная и гравитационная пробы, а также введение тест-дозы лидокаина (раствор для внутривенного и внутримышечного введения (для инъекций) 20 мг/мл) дважды по 2 мл с интервалом 5 минут.
Использование разных концентраций местных анестетиков позволяет добиться дифференцированного эпидурального блока: низкие концентрации местного анестетика обеспечивают развитие эпидуральной анальгезии, более высокие – анестезии и выраженного моторного блока.
При этом необходимо учитывать общую дозу местного анестетика во избежание системной токсической реакции, а также снижать дозу у пациентов старше 60 лет, беременных и ослабленных пациентов. Изделия медицинского назначения, медицинская техника и лекарственные препараты для лечения системной токсичности местных анестетиков должны быть готовы к применению.
64. Перечень местных анестетиков для эпидуральной анестезии установлен согласно приложению 17.
Использование разных концентраций местных анестетиков позволяет добиться дифференцированного эпидурального блока: низкие концентрации местного анестетика обеспечивают развитие эпидуральной анальгезии, более высокие – анестезии и выраженного моторного блока.
При этом необходимо учитывать общую дозу местного анестетика во избежание системной токсической реакции, а также снижать дозу у пациентов старше 60 лет, беременных и ослабленных пациентов. Изделия медицинского назначения, медицинская техника и лекарственные препараты для лечения системной токсичности местных анестетиков должны быть готовы к применению.
65. Для проведения хирургических вмешательств в условиях эпидуральной анестезии используются растворы местных анестетиков в следующих концентрациях: бупивакаин 5 мг/мл; ропивакаин 5–10 мг/мл; левобупивакаин 5 мг/кг в объеме 10–20 мл (ориентировочно из расчета 1–2 мл раствора местного анестетика на каждый сегмент спинного мозга, который необходимо блокировать). Для получения адекватного эпидурального блока блокируется не менее 10 смежных сегментов. Катетеризация позволяет вводить расчетную дозу местного анестетика дробно, в несколько приемов.
66. Эпидуральная анестезия может сочетаться со спинальной (комбинированная спинально-эпидуральная анестезия), а также с общей эндотрахеальной или ларингеальномасочной анестезией (комбинированная общая и эпидуральная анестезия).
Для эпидуральной анестезии как компонента комбинированного обезболивания хирургических вмешательств на органах грудной клетки и брюшной полости используется однократное или постоянное введение анестетика через эпидуральный катетер. Применение минимально необходимых объемов эпидурального, интраоперационно вводимого местного анестетика при комбинированной общей и эпидуральной анестезии снижает риск гипотензии и достигается при условии расположения кончика эпидурального катетера в середине зоны требуемой сегментарной блокады области выполнения хирургического вмешательства. Необходимые области хирургических вмешательств, сегментарные границы блокады, оптимальный уровень установки кончика катетера в эпидуральном пространстве и минимальные объемы местного анестетика при комбинированной общей и эпидуральной анестезии установлены согласно приложению 18.
Дозы эпидурально вводимого морфина для анальгезии установлены согласно приложению 19.
При выполнении эпидуральной анестезии могут использоваться следующие наркотические анальгетики как адъюванты для потенциирования действия местных анестетиков и послеоперационной анальгезии:
- морфин (раствор для инъекций 10 мг/мл) в дозе 0,05 мг/кг или морфин (раствор для эпидурального и интратекального введения 1 мг/мл – (2–6 мг), длительность действия 12–18 часов;
- фентанил (раствор для внутривенного и внутримышечного введения 0,05 мг/мл) в дозе 0,05–0,1 мг, длительность действия 2–4 часа;
- суфентанил3 (раствор для инъекций 50 мкг/мл) в дозе 0,0002 мг/кг (не более 0,03 мг суммарно), длительность действия 3 часа.
Дозы эпидурально вводимого морфина для анальгезии установлены согласно приложению 19.
Учитывая вероятность отсроченной депрессии дыхания после эпидурального введения морфина, пациенту показано медицинское наблюдение медицинским персоналом до 24 часов с мониторингом витальных функций (сознание, частота дыхания, ЧСС, пульс и АД).
______________________________
3 Off-label (назначается врачебным консилиумом).
67. При каудальной анестезии в асептических условиях проводится пункция крестцово-копчиковой мембраны с введением иглы в сакральный канал. При этом необходимо избегать глубокого введения иглы для предотвращения случайной пункции дурального мешка, при истечении ликвора из иглы манипуляция прекращается.
Местными анестетиками для каудальной блокады являются: раствор для инъекций бупивакаина, изобарический 0,25–0,5 % 15–25 мл, раствор для инъекций ропивакаина, изобарический 0,5–0,25 % 15–25 мл, раствор для инъекций левобупивакаина, изобарический 0,25–0,5 % 15–25 мл. Доза анестетика вводится дробно: изначально 3–4 мл, после исключения непреднамеренного субарахноидального введения вводится остальная доза.
68. При комбинированной спинально-эпидуральной анестезии в варианте «игла через иглу» пункция эпидурального пространства выполняется на уровне L3–L4 позвонков. После идентификации эпидурального пространства спинальной иглой (спинальная игла длиннее эпидуральной на 1–2 см) пунктируется субарахноидальное пространство, и после получения ликвора выполняется спинальная анестезия раствором для интратекального введения 5 мг/мл (изобарическим или гипербарическим). После удаления спинальной иглы в эпидуральное пространство в краниальном направлении инсталлируется эпидуральный катетер на 3–4 см. После присоединения замка типа Луэр выполняется аспирационная проба, при отрицательной аспирационной пробе присоединяется бактериальный фильтр. Эпидуральный катетер выводится на левое надплечье, фиксируется в месте выхода из кожи и на протяжении пластырем.
При комбинированной спинально-эпидуральной анестезии в варианте двухсегментарной блокады пункция эпидурального пространства выполняется на уровне L2–L3 позвонков. После идентификации эпидурального пространства устанавливается эпидуральный катетер, который проводится в краниальном направлении на 3–4 см. После присоединения замка типа Луэр выполняется аспирационная проба, при отрицательной аспирационной пробе присоединяется бактериальный фильтр. Спинальная анестезия выполняется на уровне L3–L4 позвонков с помощью стандартной спинальной иглы раствором для интратекального введения 5 мг/мл (изобарическим или гипербарическим). Место пункции закрывается асептической наклейкой. Эпидуральный катетер выводится на левое надплечье, фиксируется в месте выхода из кожи и на протяжении пластырем.
В асептических условиях при паравертебральной анестезии и нанальгезии проводятся пункция и катетеризация паравертебрального пространства. Идентификация паравертебрального пространства осуществляется методом утраты сопротивления по анатомическим ориентирам (техника использования анатомических ориентиров) или с использованием ультразвуковых исследований (далее – УЗИ) (УЗИ-ассистированных техник). Поверхностные анатомические ориентиры маркируются перед выполнением блокады. Для подтверждения правильного положения катетера используется аспирационная и гравитационная пробы. Для анестезии используется однократное или постоянное введение анестетика через паравертебральный катетер.
После проведения паравертебральной блокады на грудном уровне обязательно выполняется рентгенография органов грудной клетки через 2 часа после блокады (либо сразу после хирургического вмешательства, если его длительность превышает два часа).
При проведении УЗИ-ассистированных блокад, как правило, требуются меньшие объемы анестетиков. Необходимо учитывать общую дозу местного анестетика во избежание системной токсической реакции, а также снижать дозу у пациентов старше 60 лет и ослабленных пациентов.
69. Паравертебральная анестезия и анальгезия используется как один из компонентов комбинированного анестезиологического обеспечения интраоперационно, а также для послеоперационного обезболивания.
В асептических условиях при паравертебральной анестезии и нанальгезии проводятся пункция и катетеризация паравертебрального пространства. Идентификация паравертебрального пространства осуществляется методом утраты сопротивления по анатомическим ориентирам (техника использования анатомических ориентиров) или с использованием ультразвуковых исследований (далее – УЗИ) (УЗИ-ассистированных техник). Поверхностные анатомические ориентиры маркируются перед выполнением блокады. Для подтверждения правильного положения катетера используется аспирационная и гравитационная пробы. Для анестезии используется однократное или постоянное введение анестетика через паравертебральный катетер.
Местный анестетик: бупивакаин (раствор для инъекций (изобарический) 5 мг/мл) 20–25 мл, или ропивакаин (раствор для инъекций (изобарический) 5 мг/мл) 20–25 мл, или левобупивакаин (раствор для инъекций (изобарический) 5 мг/мл) 20–25 мл при однократном введении, при многократном введении – 4–5 мл местного анестетика на один уровень. Опиаты в качестве адъювантов при паравертебральной блокаде не используются. Необходимо учитывать общую дозу местного анестетика во избежание системной токсической реакции, а также снижать дозу у пациентов старше 60 лет и ослабленных пациентов.
После проведения паравертебральной блокады на грудном уровне обязательно выполняется рентгенография органов грудной клетки через 2 часа после блокады (либо сразу после хирургического вмешательства, если его длительность превышает два часа).
70. При периферических регионарных блокадах для поиска нервных стволов и сплетений используется нейростимулятор, УЗИ либо сочетание двух способов. Использование методики поиска нервных структур по парестезиям не показано. Местный анестетик вводится однократно либо используется продленная катетеризация.
При проведении УЗИ-ассистированных блокад, как правило, требуются меньшие объемы анестетиков. Необходимо учитывать общую дозу местного анестетика во избежание системной токсической реакции, а также снижать дозу у пациентов старше 60 лет и ослабленных пациентов.
При блокаде плечевого сплетения (межлестничная, надключичная, подключичная, подмышечная блокады) применяются: раствор для инъекций лидокаина 1–1,5 мг/мл 25–40 мл, раствор для инъекций бупивакаина изобарический 2,5–5 мг/мл 25–40 мл, раствор для инъекций ропивакаина изобарический 5–7,5 мг/мл 10–40 мл или раствор для инъекций левобупивакаина, изобарический 2,5–5 мг/мл 25–40 мл. Местный анестетик может использоваться с эпинефрином 1:200 000 или без него.
При изолированных блокадах нервов верхней конечности (блокада лучевого, срединного и локтевого нервов) применяются: раствор для инъекций лидокаина 1–1,5 мг/мл 5 мл (на каждый нерв), раствор для инъекций бупивакаина изобарический 5 мг/мл 5 мл (на каждый нерв), раствор для инъекций ропивакаина, изобарический 7,5 мг/мл 5 мл (на каждый нерв) или раствор для инъекций левобупивакаина, изобарический 5 мг/мл 5 мл (на каждый нерв). При этом необходимо учитывать общую дозу анестетика во избежание системной токсической реакции.
При блокаде бедренного нерва применяются: раствор для инъекций лидокаина 1–1,5 мг/мл 15–20 мл, раствор для инъекций бупивакаина изобарический 2,5–5 мг/мл 15–20 мл, раствор для инъекций ропивакаина изобарический 5–7,5 мг/мл 15–20 мл или раствор для инъекций левобупивакаина изобарический 2,5–5 мг/мл 15–20 мл. Местный анестетик может использоваться с эпинефрином 1:200 000 или без него.
При блокаде седалищного нерва применяются раствор для инъекций лидокаина 1–1,5 мг/мл 20–40 мл, раствор для инъекций бупивакаина изобарический 2,5–5 мг/мл 20–30 мл, раствор для инъекций ропивакаина изобарический 5–7,5 мг/мл 10–30 мл или раствор для инъекций левобупивакаина изобарический 2,5–5 мг/мл 20–30 мл. Эпинефрин в качестве добавки к местному анестетику при блокаде седалищного нерва не используется.
При блокаде запирательного нерва применяются: раствор для инъекций лидокаина 1–1,5 мг/мл 5–7 мл на каждый нервный ствол, раствор для инъекций бупивакаина изобарический 2,5–5 мг/мл 10 мл, раствор для инъекций ропивакаина изобарический 5–7,5 мг/мл 10 мл или раствор для инъекций левобупивакаина изобарический 2,5–5 мг/мл 10 мл. Местный анестетик может использоваться с эпинефрином 1:200 000 или без него.
При блокаде поперечного пространства живота (TAP-блок) на каждую сторону применяется: раствор для инъекций бупивакаина изобарический 2,5 мг/мл раствор 20–30 мл, раствор для инъекций ропивакаина изобарический 5 мг/мл 20–30 мл или раствор для инъекций левобупивакаина изобарический 2,5 мг/мл 20–30 мл. Используется только в сочетании с общей анестезией.
При блокаде квадратной мышцы поясницы (QL-блок) на каждую сторону применяются: раствор для инъекций бупивакаина изобарический 2,5 мг/мл 15–20 мл, раствор для инъекций ропивакаина изобарический 5 мг/мл 15–20 мл или раствор для инъекций левобупивакаина изобарический 2,5 мг/мл 15–20 мл. Используется только в сочетании с общей анестезией.
При блокаде влагалища прямых мышц живота (RS-блок) на каждую сторону применяются: раствор для инъекций бупивакаина изобарический 2,5 мг/мл 10 мл, раствор для инъекций ропивакаина изобарический 5 мг/мл 10 мл или раствор для инъекций левобупивакаина изобарический 2,5 мг/мл 10 мл. Используется только в сочетании с общей анестезией.
При пекторальной блокаде (Pecs I и Pecs II) применяются: раствор для инъекций бупивакаина изобарический 2,5 мг/мл, раствор для инъекций ропивакаина изобарический 5 мг/мл или раствор для инъекций левобупивакаина изобарический 2,5 мг/мл – 0,2 мл/кг. Используется только в сочетании с общей анестезией.
При блокаде передней зубчатой мышцы применяются: раствор для инъекций бупивакаина изобарический 2,5 мг/мл, раствор для инъекций ропивакаина изобарический 5 мг/мл или раствор для инъекций левобупивакаина изобарический 2,5 мг/мл – 0,4 мл/кг. Используется только в сочетании с общей анестезией.
При выполнении блокад бупивакаином его максимальная доза не должна превышать 150 мг в 4 часа и 400 мг в сутки.
При выполнении блокад бупивакаином его максимальная доза не должна превышать 150 мг в 4 часа и 400 мг в сутки.
ГЛАВА 7
ОЦЕНКА, МЕДИЦИНСКАЯ ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ПОТР
75. Методами (способами), позволяющими снизить риск развития ПОТР являются:
74. У пациентов, которым планируется проведение общей анестезии, оценивается риск развития ПОТР в соответствии с факторами риска ПОТР согласно приложению 20.
75. Методами (способами), позволяющими снизить риск развития ПОТР являются:
- минимизация использования опиатов в периоперационном периоде за счет применения мультимодального подхода в анальгезии;
- предпочтительное использование регионарных методов обезболивания (вместо общей анестезии);
- предпочтительное использование постоянной инфузии пропофола для поддержания анестезии;
- избежание по возможности использования ингаляционных анестетиков и закиси азота;
- обеспечение адекватной гидратации (нормоволемии);
- применение сугаммадекса вместо неостигмина для реверсии нейромышечного блока.
76. Пациентам, которым планируется проведение общей анестезии, проводится медицинская профилактика ПОТР в соответствии с алгоритмом медицинской профилактики ПОТР, установленным согласно приложению 21.
Перечень лекарственных препаратов, используемых для медицинской профилактики ПОТР, установлен согласно приложению 22.
Если медицинская профилактика ПОТР проводилась, при возникновении ПОТР используются лекарственные препараты из другой фармакологической группы, чем те, что использовались для медицинской профилактики. Если лекарственные препараты из других фармакологических групп недоступны, то возможно повторное введение антагонистов 5НТ3-рецепторов (если прошло более 6 часов с момента введения первой дозы) или лекарственных препаратов, производных бутирофенона – дроперидол.
78. Быстрая последовательная индукция – анестезиологическая техника, которая применяется у пациентов с высоким риском аспирации желудочного содержимого. Цель данной техники – снижение риска аспирации путем максимального уменьшения времени манипуляции, когда дыхательные пути не защищены (от начала индукции до постановки ЭТТ).
80. При проведении быстрой последовательной индукции необходимо иметь набор для проведения интубации трахеи, аспиратор с набором санационных катетеров, операционный стол с возможностью быстрого изменения положения пациента. Может быть рассмотрено предварительное введение пациенту лекарственных препаратов, снижающих объем и уменьшающих кислотность желудочного содержимого (Н2-блокаторы, ингибиторы протонной помпы, метоклопрамид, цитрат натрия). При наличии клинических и (или) инструментальных данных о повышенном объеме содержимого в желудке (>1,5 мл/кг) проводится опорожнение желудка при помощи зонда.
77. При возникновении ПОТР, если медицинская профилактика не проводилась, лекарственными препаратами выбора являются антагонисты 5НТ3-рецепторов – ондансетрон (раствор для инъекций 2 мг/мл) доза для купирования ПОТР 4 мг внутривенно, трописетрон (раствор для инъекций 1 мг/мл), доза для ПОТР 0,5–2 мг внутривенно однократно, гранисетрон (раствор для инъекций 1 мг/мл), доза для ПОТР 0,1 мг внутривенно однократно. Лекарственным препаратом второй линии является прометазин (раствор для инъекций 25 мг/мл), доза для ПОТР – 6,25 внутривенно однократно.
Если медицинская профилактика ПОТР проводилась, при возникновении ПОТР используются лекарственные препараты из другой фармакологической группы, чем те, что использовались для медицинской профилактики. Если лекарственные препараты из других фармакологических групп недоступны, то возможно повторное введение антагонистов 5НТ3-рецепторов (если прошло более 6 часов с момента введения первой дозы) или лекарственных препаратов, производных бутирофенона – дроперидол.
ГЛАВА 8
БЫСТРАЯ ПОСЛЕДОВАТЕЛЬНАЯ ИНДУКЦИЯ
78. Быстрая последовательная индукция – анестезиологическая техника, которая применяется у пациентов с высоким риском аспирации желудочного содержимого. Цель данной техники – снижение риска аспирации путем максимального уменьшения времени манипуляции, когда дыхательные пути не защищены (от начала индукции до постановки ЭТТ).
79. Медицинскими показаниями к проведению быстрой последовательной индукции являются состояния с высоким риском аспирации желудочного содержимого, а именно:
- экстренное хирургическое вмешательство;
- патологические состояния, сопровождающиеся несостоятельностью нижнего пищеводного сфинктера (грыжа пищеводного отверстия диафрагмы, гастроэзофагеальная рефлюксная болезнь, морбидное ожирение (ИМТ >40 кг/м2);
- патология ЖКТ или других органов, связанная с нарушением опорожнения желудка;
- беременность в сроке 16 недель и более.
80. При проведении быстрой последовательной индукции необходимо иметь набор для проведения интубации трахеи, аспиратор с набором санационных катетеров, операционный стол с возможностью быстрого изменения положения пациента. Может быть рассмотрено предварительное введение пациенту лекарственных препаратов, снижающих объем и уменьшающих кислотность желудочного содержимого (Н2-блокаторы, ингибиторы протонной помпы, метоклопрамид, цитрат натрия). При наличии клинических и (или) инструментальных данных о повышенном объеме содержимого в желудке (>1,5 мл/кг) проводится опорожнение желудка при помощи зонда.
81. При проведении быстрой последовательной индукции:
- проверяется готовность изделий медицинского назначения, медицинской техники и лекарственных препаратов;
- проводится преоксигенация 100 % кислородом в течение 5 минут или пациент делает четыре глубоких вдоха (при дефиците времени). При проведении преоксигенации маска герметично прижимается к лицу, оценивается эффективность преоксигенации по медицинским показаниям оксиметрии (концентрация кислорода на выдохе выше 90 %);
- пациенту вводится расчетная доза гипнотика (пропофол, кетамин, этомидат или тиопентал натрия). Доза лекарственного препарата для внутривенной индукции в анестезию определяется до начала индукции согласно инструкции по медицинскому применению (листку-вкладышу) и клиническому статусу пациента;
этомидат (раствор для инъекций 2 мг/мл я нашла только такую форму) вводится в дозе от 0,15 мг/кг до 0,3 мг/кг внутривенно в зависимости от стабильности пациента,
или кетамин (раствор для внутривенного и внутримышечного введения (для инъекций) 50 мг/мл) в дозе 1–2 мг/кг внутривенно,
или пропофол (эмульсия для инфузий (для внутривенного введения) 10 мг/мл) в дозах от 0,5 мг/кг до 2 мг/кг внутривенно в зависимости от гемодинамической стабильности;
- вводится, не дожидаясь действия гипнотического агента, расчетная доза миорелаксанта (в качестве миорелаксанта можно использовать суксаметоний (раствор для внутривенного введения (для инъекций) 20 мг/мл) 1,5 мг/кг или рокурония бромид (раствор для внутривенного введения 10 мг/мл) 1,0 мг/кг; в случае применения рокурония бромида, желательно иметь в доступности специфический антагонист рокурония бромида – сугаммадекс);
- выполняется прием Селлика после введения гипнотика и миорелаксанта;
- поддерживается с момента введения гипнотика и миорелаксанта до момента начала интубации трахеи проходимость дыхательных путей и осуществляется апнойная оксигенация пациента (плотное прижатие маски, поддержание дыхательных путей в открытом состоянии, клапан APL закрыт на уровень 5 см вод. ст.);
- проводится масочная вентиляция до интубации трахеи при необходимости (угроза гипоксемии) и при значениях давления на вдохе не выше 20 см вод. ст. (контролируется при помощи клапана APL наркозного аппарата);
- выполняется интубация трахеи, раздувается манжетка ЭТТ, подсоединяется контур наркозного аппарата к ЭТТ и подтверждается ее положение капнографически и аускультативно после наступления полной миорелаксации (TOF счет 0 по данным мониторинга нейромышечной проводимости или временной интервал с момента введения миорелаксанта составляет не менее 60 секунд);
- прекращается после подтверждения правильного положения ЭТТ выполнение приема Селлика и фиксируется ЭТТ, осуществляется переход к проведению основной анестезии;
- в случае неуспешной попытки интубации трахеи дальнейшие действия проводятся по общему алгоритму действий при неожиданно трудной интубации согласно приложению 23.
Сугаммадекс предназначен для реверсии нейромышечной блокады, вызванной рокуронием. Раствор для инъекций сугаммадекса 10 % 2 мл. Доза для реверсии блока 4–32 мг/кг внутривенно болюсно, в зависимости от глубины мышечного блока (4 мг/кг при глубине 1–2 посттетанических сокращений, 32 мг/кг – при полном блоке).
82. Возможными осложнениями при проведении быстрой последовательной индукции являются:
- аспирация содержимого желудка;
- трудная или невозможная интубация и (или) вентиляция;
- случайная интубация пищевода;
- артериальная гипотензия;
- нарушения сердечного ритма и (или) проводимости;
- анафилактические реакции на вводимые лекарственные препараты.
ГЛАВА 10
ДЫХАТЕЛЬНЫЕ ПУТИ В АНЕСТЕЗИОЛОГИИ
99. К трудным дыхательным путям относятся:
трудная масочная вентиляция;
трудная ларингоскопия и интубация;
трудная установка ларингеальной маски;
трудная коникотомия.
Пациентам, которым планируется проведение анестезиологического пособия или выполнение хирургического вмешательства на дыхательных путях, по возможности проводится комплексная оценка дыхательных путей по шкале «Москва-TD» по алгоритму, установленному согласно приложению 27, и рассчитывается ИТИ.
Факторами трудной масочной вентиляции легких являются: лучевая терапия по поводу рака головы и шеи в анамнезе; мужской пол; ОСА в анамнезе; наличие бороды; оценка дыхательных путей по Маллампати 3–4 балла; выраженное ожирение; окружность шеи более 40 см.
Врач-анестезиолог-реаниматолог подробно описывает состояние дыхательных путей, а также проблемы, которые возникли при обеспечении их проходимости, в медицинских документах.
Сочетание признаков предстоящей трудной интубации трахеи и трудной вентиляции легких или сочетание признаков предстоящей трудной интубации трахеи и «полного желудка» являются медицинскими показаниями к интубации трахеи с сохранением сознания пациента.
Дополнительными методами обследования для уточнения состояния дыхательных путей пациента являются: рентгенография органов клетки; КТ или МРТ органов грудной клетки; осмотр гортани врачом-оториноларингологом; фибробронхоскопия.
ИТИ (совокупность баллов по шкале «Москва-TD»): 0 – трудности не ожидаются; 1–2 – возможна трудная интубация; 3–4 – высокая вероятность трудной интубации; 5 и более – предстоит трудная интубация.
100. При интубации трахеи у пациента без признаков трудных дыхательных путей проверяются наличие и исправность изделий медицинского назначения, медицинской техники, необходимых для интубации трахеи и последующей ИВЛ (рабочий и запасной ларингоскопы с набором клинков, ЭТТ, набор для проведения трудной интубации, отсасыватель медицинский, аппарат дыхательный ручной, аппарат ИВЛ). При высоком риске аспирации можно рассмотреть возможность эвакуации желудочного содержимого через зонд (перед началом преоксигенации зонд удаляется). Удаляются зубные протезы.
При наличии времени пациенту проводится преоксигенация 100 % кислородом со скоростью потока не менее 10 л/мин. в течение 3–5 минут или пациент делает 4 глубоких вдоха. В экстренной ситуации рассматривается возможность проведения кратковременной масочной вентиляции 100 % кислородом перед началом интубации (при этом учитывается опасность аспирации содержимым желудка).
Интубация трахеи выполняется под общей анестезией. Выбор лекарственного препарата для общей анестезии зависит от состояния гемодинамики пациента. Может проводиться стандартная или быстрая последовательная индукция.
Интубация трахеи без использования миорелаксантов затруднена и увеличивает вероятность осложнений.
У пациента в состоянии глубокой комы (3 балла по шкале ком Глазго) интубация трахеи выполняется без общей анестезии и миорелаксации.
В случае нестабильной гемодинамики и отсутствия сознания у пациента возможно выполнение интубации трахеи без использования лекарственных препаратов для общей анестезии на фоне медикаментозной миорелаксации.
Рот пациента открывается ножницеобразным движением пальцев или надавливанием на нижнюю челюсть, при этом следует избегать попадания губ в пространство между зубами и клинком.
Прямой клинок вводится в полость рта по средней линии, ориентируясь на язычок, затем на надгортанник. Кончик прямого клинка подводится непосредственно под надгортанник, затем поднимается надгортанник, избегая давления на верхние зубы пациента, и обнажается голосовая щель.
Оценка видимости голосовой щели по Кормак–Лихену при прямой ларингоскопии проводится согласно приложению 28.
При недостаточном обзоре голосовой щели возможно выполнение приема BURP (Backward, Upward, Rightward Pressure) – наружное смещение гортани пациента вниз, вперед и вправо. Выполнение интубации трахеи в этом случае может облегчить использование интубационного стилета, который изгибается необходимым образом вместе с ЭТТ для придания ей нужной формы, при этом дистальный край стилета не должен выходить за пределы ЭТТ.
При плохом обзоре голосовой щели (3 степень обзора по Кормак–Лихену) используется интродьюсер для интубации, по которому затем осуществляется введение ЭТТ.
101. Для выполнения интубации трахеи используется изогнутый (тип Макинтоша) или прямой (тип Миллера или Фореггера) клинок соответствующего размера. При выборе размера клинка учитываются возраст пациента, размер его ротовой полости и длина шеи. В сомнительных случаях делают выбор в пользу клинка большего размера.
Рот пациента открывается ножницеобразным движением пальцев или надавливанием на нижнюю челюсть, при этом следует избегать попадания губ в пространство между зубами и клинком.
Изогнутый клинок вводится в полость рта по средней линии, оттесняя язык клинком влево. Возможно введение изогнутого клинка в правый угол рта с последующим выходом на среднюю линию по мере продвижения к надгортаннику. Изогнутый клинок заводится в грушевидную ямку над основанием надгортанника, после чего аккуратным движением вверх по оси рукоятки ларингоскопа надгортанник поднимается кверху, обнажая голосовую щель.
Прямой клинок вводится в полость рта по средней линии, ориентируясь на язычок, затем на надгортанник. Кончик прямого клинка подводится непосредственно под надгортанник, затем поднимается надгортанник, избегая давления на верхние зубы пациента, и обнажается голосовая щель.
Оценка видимости голосовой щели по Кормак–Лихену при прямой ларингоскопии проводится согласно приложению 28.
ЭТТ соответствующего размера проводится с правой стороны под контролем зрения с визуальным отслеживанием процесса прохождения трубки за голосовые складки. Введение ЭТТ в трахею останавливается после того, как контрольная метка, расположенная за манжетой, оказалась за голосовыми складками.
При недостаточном обзоре голосовой щели возможно выполнение приема BURP (Backward, Upward, Rightward Pressure) – наружное смещение гортани пациента вниз, вперед и вправо. Выполнение интубации трахеи в этом случае может облегчить использование интубационного стилета, который изгибается необходимым образом вместе с ЭТТ для придания ей нужной формы, при этом дистальный край стилета не должен выходить за пределы ЭТТ.
При плохом обзоре голосовой щели (3 степень обзора по Кормак–Лихену) используется интродьюсер для интубации, по которому затем осуществляется введение ЭТТ.
Зафиксировав введенную ЭТТ рукой, врач-анестезиолог-реаниматолог выводит клинок ларингоскопа из полости рта. При помощи шприца манжетка ЭТТ наполняется воздухом (необходимо избегать ее сильного раздувания). К ЭТТ присоединяются дыхательный контур, подтверждается ее правильное положение капнографически и аускультативно, после чего трубка фиксируется.
102. Осложнения при выполнении интубации трахеи могут возникать вследствие несовершенства методики, наличия анатомических особенностей пациента и его дыхательных путей, а также при ошибочных действиях врача-специалиста и ограничении времени, предназначенного для выполнения интубации трахеи. ЭТТ – инородный предмет, на который организм пациента отвечает общими реакциями, которые не всегда можно предвидеть или предупредить.
Возможными осложнениями интубации трахеи являются:
- повышение АД, внутричерепного и внутриглазного давления, нарушения сердечного ритма;
- травматическое повреждение зубов, глотки, заглоточного пространства, гортани, голосовых складок, трахеи и главных бронхов, а также кровотечение;
- эмфизема средостения;
- перелом и вывих шейных позвонков;
- повреждение язычного нерва;
- интубация пищевода, травматическое повреждение пищевода;
- острое расширение желудка в результате интубации пищевода;
- аспирация желудочного содержимого или инородных тел;
- однолегочная интубация с возможным развитием ателектазов в невентилируемом легком;
- обструкция дыхательных путей;
- смещение ЭТТ;
- боли в горле, кашель, затруднения при глотании;
- стенозы гортани или трахеи;
- язвы и гранулемы гортани;
- рубцовые изменения голосовых складок;
- инфекционно-септические осложнения;
- иные осложнения.
103. Возможная трудная интубация – интубация с ИТИ 1–2 балла по шкале «Москва-TD».
При возможной трудной интубации проводится преоксигенация 100 % кислородом в течение не менее 3 минут, затем быстрая последовательная индукция с последующей контрольной ларингоскопией при сохраненном спонтанном дыхании. При необходимости для облегчения интубации внутривенно можно ввести суксаметоний (раствор для инъекций 20 мг/мл) в дозе 1,5 мг/кг. Правильное положение ЭТТ подтверждается аускультативно и (по возможности) капнографически.
Высокая вероятность трудной интубации – ИТИ 3–4 балла.
При высокой вероятности трудной интубации необходимо подготовить набор для выполнения трудной интубации трахеи и трудной вентиляции. При возможности следует позвать на помощь иных врачей-анестезиологов-реаниматологов.
В случае успешной визуализации надгортанника выполняются попытки интубации трахеи (не более двух). Количество попыток интубации трахеи минимизируется, так как каждая последующая попытка приводит к нарастанию отека дыхательных путей и прогрессивному ухудшению визуализации анатомических ориентиров. Если интубация трахеи не удается после второй попытки, то от введения миорелаксантов следует отказаться. При неудаче интубации трахеи поддерживается проходимость дыхательных путей, обеспечивается подача 100 % кислорода на фоне сохраненного спонтанного дыхания, после чего медицинские работники дожидаются пробуждения пациента. Далее выполняется ФОИ, при их недоступности показана интубация трахеи в сознании через нос «вслепую» или ретроградная интубация трахеи в условиях локорегионарной анестезии дыхательных путей. Правильное положение ЭТТ подтверждается аускультативно и (по возможности) капнографически.
Если пациент имеет признаки трудной вентиляции или высокий риск регургитации и аспирации, от выключения сознания следует отказаться, интубация трахеи выполняется в сознании. В случае принятия решения о выключении сознания и возможности интубации трахеи при помощи прямой ларингоскопии, выполняется анестезия ротоглотки лидокаином (спрей для местного применения 100 мг/мл). Хирургической бригаде необходимо быть готовой к выполнению хирургического доступа к дыхательным путям. Проводится преоксигенация 100 % кислородом в течение не менее 3 минут, затем выполняется индукция, затем прямая ларингоскопия при сохраненном спонтанном дыхании. При наличии видеоларингоскопа целесообразно использовать его для визуализации.
В случае успешной визуализации надгортанника выполняются попытки интубации трахеи (не более двух). Количество попыток интубации трахеи минимизируется, так как каждая последующая попытка приводит к нарастанию отека дыхательных путей и прогрессивному ухудшению визуализации анатомических ориентиров. Если интубация трахеи не удается после второй попытки, то от введения миорелаксантов следует отказаться. При неудаче интубации трахеи поддерживается проходимость дыхательных путей, обеспечивается подача 100 % кислорода на фоне сохраненного спонтанного дыхания, после чего медицинские работники дожидаются пробуждения пациента. Далее выполняется ФОИ, при их недоступности показана интубация трахеи в сознании через нос «вслепую» или ретроградная интубация трахеи в условиях локорегионарной анестезии дыхательных путей. Правильное положение ЭТТ подтверждается аускультативно и (по возможности) капнографически.
104. Заведомо трудная интубация трахеи – интубация с ИТИ 5 баллов и более.
При заведомо трудной интубации показана интубация трахеи в сознании любым способом. Методы выбора – ФОИ трахеи или интубация при помощи видеоларингоскопа в сознании, при их недоступности показана интубация трахеи в сознании через нос «вслепую» или ретроградная интубация трахеи в условиях локорегионарной анестезии дыхательных путей. Правильное положение ЭТТ подтверждается аускультативно и при возможности капнографически. Миорелаксанты вводятся после гарантированного обеспечения проходимости дыхательных путей.
В отдельных случаях (лицевая травма, обструкция дыхательных путей) методом выбора для обеспечения проходимости дыхательных путей при прогнозируемой трудной интубации может стать коникотомия (трахеостомия), которая выполняется медицинскими работниками, являющимися членами хирургической бригады.
Как правило, ФОИ проводится с сохранением сознания у пациента. Вопрос о необходимости седации при ФОИ решается врачом-специалистом индивидуально, при этом важно не допустить потери контроля над дыхательными путями.
При проведении ФОИ трахеи в сознании под местной анестезией готовится к работе фибробронхоскоп, ЭТТ хорошо смазывается мазью с глюкокортикоидом: преднизолон (мазь для наружного применения 5 мг/г), или гидрокортизон (мазь для наружного применения 10 мг/г), назначаются холиноблокаторы: атропин (раствор для инъекций 1 мг/мл) в дозе 0,5 мг внутривенно. Если планируется назотрахеальная интубация, полость носа орошается раствором альфа-адреномиметика.
Пациент оксигенируется при помощи носовых катетеров, выполняется ФОИ. Если при продвижении ЭТТ в трахею она цепляется за черпаловидные хрящи, целесообразно немного повернуть ее против часовой стрелки на 90°.
После подтверждения правильного положения ЭТТ в трахее (визуально и при возможности капнографически) проводится индукция и налаживается ИВЛ.
план В – установка надгортанного устройства (ларингеальная маска и иные) и поддержание оксигенации пациента. Допустимо не более 3 попыток установки надгортанных устройств. В случае успешной установки вентиляция легких с подачей пациенту кислорода продолжается, а также рассматриваются альтернативные варианты действий: возможно ли разбудить пациента; возможно ли выполнить интубацию трахеи через надгортанное устройство; возможно ли отказаться от интубации трахеи; есть ли необходимость в хирургическом доступе к дыхательным путям. Если попытки установки надгортанного устройства окончились неудачей, врач-анестезиолог-реаниматолог объявляет о провале плана B и о переходе к плану C;
план D – показано немедленное выполнение хирургической или пункционной коникотомии, при этом предпочтительнее хирургическая коникотомия. По возможности хирургическая коникотомия выполняется хирургической бригадой.
Если перстне-щитовидная мембрана пальпируется:
105. При наличии видеоларингоскопа и навыков работы с ним проводится интубация трахеи с выключением сознания или под местной анестезией (при наличии индивидуальных медицинских показаний).
Как правило, ФОИ проводится с сохранением сознания у пациента. Вопрос о необходимости седации при ФОИ решается врачом-специалистом индивидуально, при этом важно не допустить потери контроля над дыхательными путями.
При проведении ФОИ трахеи в сознании под местной анестезией готовится к работе фибробронхоскоп, ЭТТ хорошо смазывается мазью с глюкокортикоидом: преднизолон (мазь для наружного применения 5 мг/г), или гидрокортизон (мазь для наружного применения 10 мг/г), назначаются холиноблокаторы: атропин (раствор для инъекций 1 мг/мл) в дозе 0,5 мг внутривенно. Если планируется назотрахеальная интубация, полость носа орошается раствором альфа-адреномиметика.
Местная анестезия при проведении ФОИ трахеи в сознании включает в себя обезболивание ротоглотки (носоглотки), гортаноглотки и подсвязочного пространства: орошение слизистой оболочки раствором лидокаина (спрей для местного применения 100 мг/мл) + местная анестезия надсвязочного пространства через канал бронхоскопа (лидокаин, раствор для инъекций 40 мг/мл) + анестезия подсвязочного пространства путем введения лидокаина (раствор для инъекций 10 мг/мл) через перстне-щитовидную мембрану (общая доза лидокаина – 9 мг/кг, расчет объемов растворов и подготовка шприцов производятся заранее).
Пациент оксигенируется при помощи носовых катетеров, выполняется ФОИ. Если при продвижении ЭТТ в трахею она цепляется за черпаловидные хрящи, целесообразно немного повернуть ее против часовой стрелки на 90°.
После подтверждения правильного положения ЭТТ в трахее (визуально и при возможности капнографически) проводится индукция и налаживается ИВЛ.
106. При неожиданно трудной интубации используется следующий алгоритм:
план А – порядок начальных действий врача-анестезиолога-реаниматолога при столкновении с неожиданными трудностями во время интубации трахеи. Врач-анестезиолог-реаниматолог, выполняющий интубацию трахеи, сообщает о том, что при интубации трахеи возникли проблемы. Допускается не более 3–4 попыток интубации трахеи с проведением масочной вентиляции легких между попытками интубации;
план В – установка надгортанного устройства (ларингеальная маска и иные) и поддержание оксигенации пациента. Допустимо не более 3 попыток установки надгортанных устройств. В случае успешной установки вентиляция легких с подачей пациенту кислорода продолжается, а также рассматриваются альтернативные варианты действий: возможно ли разбудить пациента; возможно ли выполнить интубацию трахеи через надгортанное устройство; возможно ли отказаться от интубации трахеи; есть ли необходимость в хирургическом доступе к дыхательным путям. Если попытки установки надгортанного устройства окончились неудачей, врач-анестезиолог-реаниматолог объявляет о провале плана B и о переходе к плану C;
план С – попытка вентиляции легких пациента через лицевую маску перед принятием решения о хирургическом доступе к дыхательным путям. Параллельно готовится набор для коникотомии и хирургическая бригада для ее выполнения (при наличии возможности). Для вентиляции легких допустимо использование орального либо назального воздуховода. Могут быть полезны изменения положения головы пациента. В случае если предварительно были введены недеполяризующие миорелаксанты, вводятся их антагонисты. При успешной вентиляции легких дожидаются пробуждения пациента. Если не удалось обеспечить вентиляцию легких через лицевую маску, отмечается прогрессирующее падение сатурации, констатируется невозможность вентиляции и невозможность интубации (провал плана С), врач-анестезиолог-реаниматолог приступает к осуществлению хирургического доступа к дыхательным путям;
план D – показано немедленное выполнение хирургической или пункционной коникотомии, при этом предпочтительнее хирургическая коникотомия. По возможности хирургическая коникотомия выполняется хирургической бригадой.
107. Для выполнения хирургической коникотомии необходимо иметь в наличии скальпель, интродьюсер для интубации и ЭТТ № 6.
Если перстне-щитовидная мембрана пальпируется:
- гортань фиксируют пальцами, указательный палец ставится на перстне-щитовидную мембрану;
- скальпелем, расположенным под прямым углом к оси трахеи, прокалывается мембрана, проворачивается в разрезе скальпель режущей частью лезвия в каудальном направлении, после чего скальпель не извлекается, а в образовавшееся отверстие рядом со скальпелем вводится интродьюсер для интубации;
- скальпель извлекается, а интродьюсер продвигается в трахею и по нему вводится смазанная мазью (с глюкокортикоидом) ЭТТ № 6;
- положение ЭТТ подтверждается аускультативно и (при наличии возможности) капнографически, начинается вентиляция пациента 100 % кислородом.
Если перстне-щитовидная мембрана пальпируется плохо:
- выполняется вертикальный разрез кожи длиной 8–10 см в проекции гортани, затем выполняется тупая диссекция тканей по направлению к гортани;
- идентифицируется и стабилизируется гортань, указательный палец ставится на мембрану;
- скальпелем, расположенным под прямым углом к оси трахеи, прокалывается мембрана, проворачивается в разрезе скальпель режущей частью лезвия в каудальном направлении, в отверстие вводится интродьюсер для интубации;
- после этого скальпель извлекается, а интродьюсер продвигается в трахею и по нему вводится смазанная мазью (с глюкокортикоидом) ЭТТ № 6;
- положение трубки подтверждается аускультативно и (при наличии возможности) капнографически, начинается вентиляция пациента 100 % кислородом.
После осуществления коникотомии и стабилизации состояния пациента решается вопрос о пробуждении пациента или начале хирургического вмешательства в зависимости от клинических проявлений.
108. При выполнении экстубации трахеи выделяются четыре шага: планирование экстубации, подготовка к экстубации, выполнение экстубации, мероприятия после экстубации.
Выделяют два вида экстубации трахеи:
экстубация у пациентов с низким риском развития осложнений;
экстубация у пациентов с высоким риском развития осложнений.
Экстубация трахеи у пациентов с высоким риском развития осложнений: исходно трудные дыхательные пути, ухудшение состояния дыхательных путей в процессе проведения ИВЛ, ограниченный доступ к дыхательным путям и (или) наличие общих факторов риска (нарушение функции внешнего дыхания и сердечно-сосудистой системы, неврологические нарушения, гипо- или гипертермия, коагулопатия, нарушения КОС и электролитный дисбаланс).
Экстубация трахеи у пациентов с низким риском развития осложнений: дыхательные пути пациента были в норме на момент введения в анестезию и остались без изменений на момент экстубации; отсутствуют общие факторы риска (функция внешнего дыхания и сердечно-сосудистой системы не нарушены, отсутствуют неврологические нарушения, гипо- или гипертермия, коагулопатия, нарушения КОС и электролитный дисбаланс).
Экстубация трахеи у пациентов с высоким риском развития осложнений: исходно трудные дыхательные пути, ухудшение состояния дыхательных путей в процессе проведения ИВЛ, ограниченный доступ к дыхательным путям и (или) наличие общих факторов риска (нарушение функции внешнего дыхания и сердечно-сосудистой системы, неврологические нарушения, гипо- или гипертермия, коагулопатия, нарушения КОС и электролитный дисбаланс).
Подготовка к экстубации включает в себя подготовку к экстубации трахеи со стороны дыхательных путей, подготовку к экстубации трахеи со стороны общего состояния пациента, мобилизацию технических ресурсов.
При подготовке к экстубации трахеи со стороны дыхательных путей необходимо:
- оценить возможность обеспечения масочной вентиляции;
- исключить механическую обструкцию или отек дыхательных путей (особенно после хирургических вмешательств в полости рта, при необходимости выполняется ларингоскопия);
- при наличии медицинских показаний выполняется тест с утечкой воздуха мимо спущенной манжеты ЭТТ для оценки состояния гортани;
- оценить состояние нижних дыхательный путей, при необходимости выполнить рентгенографию органов грудной клетки;
- оценить состояние желудка и провести его декомпрессию при необходимости;
- оценить состояние шеи пациента, так как после экстубации трахеи не исключается возможность хирургического доступа к дыхательным путям.
При подготовке к экстубации трахеи со стороны общего состояния пациента необходимо:
- полностью купировать мышечную релаксацию (отказ от декураризации возможен только в том случае, если с момента введения мышечного релаксанта прошло более трех периодов его полувыведения). При использовании нейромышечного мониторинга целевое значение TOF должно составлять 0,9 или более;
- скорректировать нарушения функций сердечно-сосудистой системы, нарушений КОС и водно-электролитного баланса, коагулопатий;
- обеспечить адекватное обезболивание (по медицинским показаниям).
При мобилизации технических ресурсов необходимо:
- обеспечить мониторинг ЧСС, сатурации, частоты дыхания, АД;
- подготовить изделия медицинского назначения для ручной вентиляции легких (контур Mapleson С или саморасправляющийся мешок типа Амбу, или Laerdal с резервным мешком, подключенным к источнику кислорода);
- обеспечить наличие необходимых для реинтубации трахеи изделий медицинского назначения, медицинской техники.
При экстубация трахеи у пациентов с высоким риском развития осложнений используются специальные обменные катетеры со съемным 15 мм коннектором, позволяющим подключать их к дыхательному контуру и проводить оксигенацию пациента или вентиляцию с использованием источника кислорода высокого давления, с помощью этого катетера также возможно выполнить реинтубацию трахеи.
При выполнении экстубации трахеи в кратчайшие сроки возобновляется подача кислорода пациенту. Недопустимо проводить так называемый «тест на спонтанное дыхание», когда пациент отсоединяется от дыхательного аппарата и дышит значительное время атмосферным воздухом через ЭТТ.
Проводится преоксигенация 100 % кислородом, положение пациента с приподнятой головой, особенно важно для пациентов с морбидным ожирением. Выполняется санация ротоглотки. С целью купирования рефлекторных реакций со стороны дыхательных путей на экстубацию трахеи возможно назначение наркотических анальгетиков, лидокаина, кетамина, β-блокаторов (с учетом состояния пациента).
Алгоритм экстубации трахеи у пациентов с низким риском развития осложнений:
- обеспечивается подача пациенту 100 % кислорода через контур дыхательного аппарата;
- выполняется санация ротоглотки;
- по медицинским показаниям вводятся антагонисты миорелаксантов, перед введением неостигмина (раствор для внутривенного введения 0,5 мг/мл) обязательно введение атропина (раствор для инъекций 1 мг/мл);
- подтверждается восстановление сознания и адекватность спонтанного дыхания;
- сводятся к минимуму движения головы и шеи;
- распускается манжета и извлекается ЭТТ с поддерживанием положительного давления в дыхательных путях;
- обеспечивается пациенту подача 100 % кислорода, проверяется проходимость дыхательных путей и адекватность спонтанного дыхания, продолжается оксигенотерапия до полного восстановления пациента.
При экстубации трахеи у пациентов с высоким риском необходимо определить, что безопаснее: экстубация трахеи, отсрочка экстубации до улучшения состояния пациента или выполнение трахеостомии. В случае если принимается решение об экстубации трахеи у пациента с высоким риском развития осложнений, допустимо использование специальных обменных катетеров со съемным 15 мм коннектором.
После экстубации проводится тщательный мониторинг состояния пациента. Оптимальное положение пациента после экстубации трахеи – с приподнятым головным концом кровати. Обеспечивается подача кислорода с высоким потоком. При наличии возможности, используется мониторинг капнометрии (капнографии). Сразу после экстубации пациента не следует кормить (поить), так как защитная функция гортани может быть нарушена.
При отеке дыхательных путей назначаются кортикостероиды (в эквиваленте 100 мг гидрокортизона каждые 6 ч), длительность лечения – не менее 12 ч.
109. Набор для ведения пациентов с трудными дыхательными путями включает:
- запасной ларингоскоп с набором клинков Макинтоша и Миллера;
- интубационный стилет;
- интродьюсер для интубации;
- воздуховоды типа Guedel (орофарингеальные иназофарингеальные, разных размеров);
- ларингеальные маски № 3, 4 и 5;
- гель для ларингеальных масок;
- скальпель стерильный;
- кровоостанавливающий зажим, изогнутый типа Бильрота, стерильный;
- ЭТТ № 6 с манжетой (2 шт.);
- перевязочный материал (салфетки средние и малые, шарики) стерильный.
Лечение (амбулатория)
ГЛАВА 4
АНЕСТЕЗИОЛОГИЧЕСКАЯ МЕДИЦИНСКАЯ ПОМОЩЬ В АМБУЛАТОРНЫХ УСЛОВИЯХ
33. С целью сокращения сроков госпитализации для выполнения плановых хирургических вмешательств и диагностических мероприятий проведение предоперационных осмотров врачом-анестезиологом-реаниматологом, компенсация сопутствующей патологии и проведение дополнительных исследований могут осуществляться в амбулаторных условиях.
34. Врачи-специалисты организаций здравоохранения, ответственные за планирование хирургических вмешательств, направляют на предоперационный осмотр врачом-анестезиологом-реаниматологом в амбулаторных условиях пациентов:
- старше 55 лет при планировании хирургических вмешательств среднего хирургического риска;
- при планировании хирургических вмешательств высокого хирургического риска;
- имеющих сопутствующие сердечно-сосудистую патологию, заболевания органов дыхания, эндокринной системы, требующие постоянного приема лекарственных препаратов, независимо от возраста и хирургического риска планируемого хирургического вмешательства;
- при планировании выполнения хирургического вмешательства в день госпитализации.
35. Оптимальный срок проведения предоперационного осмотра пациентов за 7–28 календарных дней до даты госпитализации, но не позднее чем в день, предшествующий дню выполнения хирургического вмешательства либо диагностического мероприятия.
36. Отбор пациентов для хирургических вмешательств в амбулаторных условиях проводится совместно врачом-хирургом и врачом-анестезиологом-реаниматологом. При хирургических вмешательствах в амбулаторных условиях медицинский осмотр врача-анестезиолога-реаниматолога в день хирургического вмешательства проводится непосредственно перед хирургическим вмешательством без предварительной консультации врача-анестезиолога-реаниматолога.
При оценке состояния пациента могут использоваться различные инструменты для скрининга анамнеза пациента и его физического состояния (бумажные или электронные анкеты, заполняемые пациентом самостоятельно или совместно с медицинским работником; интервью, проводимые медицинскими работниками, в том числе с применением телемедицинских технологий, и иные).
37. Медицинскими противопоказаниями для хирургического вмешательства с анестезиологическим обеспечением в амбулаторных условиях являются:
- острые инфекции верхних дыхательных путей;
- инфаркт миокарда давностью <6 недель;
- класс III–V по ASA;
- аортальный стеноз (умеренной или тяжелой степени) с клиническими проявлениями (стенокардия, одышка при физической нагрузке, обмороки);
- персистирующая бронхиальная астма средней или тяжелой степени, неконтролируемая бронхиальная астма;
- плохо контролируемый СД (гликемия натощак >11 ммоль/л или гликемия не натощак >16 ммоль/л, HbA1C >9 % или признаки кетоза по данным анализа кислотно-основного состояния (далее – КОС) венозной крови);
- высокий риск трудной интубации (индекс трудной интубации (далее – ИТИ) 3 и более баллов), трудная или осложненная интубация в анамнезе;
- ожирение III степени (ИМТ >40 кг/м2);
- синдром ОСА (по данным полисомнографии) или высокий риск его наличия (5 и более баллов по шкале STOP-BANG);
- частые судорожные припадки;
- наличие у пациента психических и поведенческих расстройств вследствие употребления алкогольных, слабоалкогольных напитков, пива, потребления наркотических средств, психотропных веществ, их аналогов, токсических или других одурманивающих веществ.
Проведение плановых хирургических вмешательств в амбулаторных условиях у беременных (особенно в 1 и 3 триместрах) не показано с целью ограничения риска выкидыша или преждевременных родов.
38. Хирургические вмешательства и манипуляции с анестезиологическим пособием выполняются в операционных и хирургических отделениях организаций здравоохранения в амбулаторных условиях в специально выделенное время и при наличии медицинской техники и изделий медицинского назначения из перечня медицинской техники и изделий медицинского назначения, необходимых для оказания медицинской помощи пациентам с хирургическими заболеваниями для выполнения хирургических вмешательств и манипуляций с анестезиологическим пособием в амбулаторных условиях, установленного согласно приложению 14.
Выполнение хирургических вмешательств и манипуляций в условиях общей анестезии в амбулаторных условиях допускается при участии анестезиологической бригады (обязательно наличие врача-анестезиолога-реаниматолога и медицинской сестры-анестезиста (медицинского брата-анестезиста).
39. При выполнении хирургических вмешательств и манипуляций с анестезиологическим пособием при необходимости назначаются производные бензодиазепина: мидазолам (раствор для внутривенного, внутримышечного, ректального введения 5 мг/мл) внутривенно в дозе 1–5 мг непосредственно перед транспортировкой пациента в операционную. Внутримышечное введение лекарственных препаратов допускается в случае невозможности использования других способов введения.
Вид анестезии определяется врачом-анестезиологом-реаниматологом с учетом факторов, связанных с хирургическим вмешательством, и пожеланий пациента.
40. Предпочтение отдается лекарственным препаратам короткого действия: пропофол (эмульсия для внутривенного введения 10 мг/мл), фентанил (раствор для внутривенного и внутримышечного введения 0,05 мг/мл), суфентанил (раствор для инъекций 50 мкг/мл), севофлюран (жидкость для ингаляций) с минимальными и легко поддающимися лечению побочными эффектами. Выбор миорелаксантов, если они применяются, зависит от типа и длительности хирургического вмешательства. Для минимизации нежелательных эффектов и достижения максимального терапевтического эффекта используется мультимодальный подход (применяются различные фармакологические группы анальгетиков с разными путями введения при отсутствии медицинских противопоказаний).
При планируемой продолжительности ингаляционной анестезии с сохраненным спонтанным дыханием более 30 минут или при планируемой продолжительности хирургического вмешательства под внутривенной анестезией с сохраненным спонтанным дыханием более 1 часа применяются оро-, назотрахеальная интубация или установка ларингеальной маски.
Периферические блокады выполняются только под ультразвуковой навигацией и (или) с использованием нейростимулятора. Методики регионарной анестезии, сопряженные с риском скрытых осложнений, не показаны. Показана инфильтрация раны местным анестетиком врачом-хирургом, если не выполнялись регионарные блокады.
Спинальная и эпидуральная анестезии в амбулаторных условиях не показаны.
42. Для выписки состояние пациента, которому проводилась анестезия, должно соответствовать перечисленным критериям:
Длительные хирургические вмешательства и манипуляции (более 1 часа), проводимые под мультифокальной местной анестезией в сочетании с анальгоседацией, могут приводить к кумуляции местных анестетиков, седативных лекарственных препаратов, риску гипотермии, гиперкапнии и гиповентиляции. В таких случаях применяются оро-, назотрахеальная интубация или установка ларингеальной маски.
При планируемой продолжительности ингаляционной анестезии с сохраненным спонтанным дыханием более 30 минут или при планируемой продолжительности хирургического вмешательства под внутривенной анестезией с сохраненным спонтанным дыханием более 1 часа применяются оро-, назотрахеальная интубация или установка ларингеальной маски.
Периферические блокады выполняются только под ультразвуковой навигацией и (или) с использованием нейростимулятора. Методики регионарной анестезии, сопряженные с риском скрытых осложнений, не показаны. Показана инфильтрация раны местным анестетиком врачом-хирургом, если не выполнялись регионарные блокады.
Спинальная и эпидуральная анестезии в амбулаторных условиях не показаны.
41. Объем мониторинга и мероприятия, проводимые в ходе хирургического вмешательства, сроки медицинского наблюдения в послеоперационном периоде в амбулаторных условиях соответствуют объему мониторинга и мероприятиям, проводимым в ходе хирургического вмешательства, срока медицинского наблюдения в послеоперационном периоде в стационарных условиях.
42. Для выписки состояние пациента, которому проводилась анестезия, должно соответствовать перечисленным критериям:
- состояние пациента оценивается в 9 или 10 баллов по модифицированной шкале Альдретта, установленной согласно приложению 15;
- выраженность болевого синдрома (по визуально-аналоговой шкале (далее – ВАШ) или простой цифровой шкале (далее – ПЦШ) от 0 до 10 баллов) составляет 3 балла или менее;
- синдром послеоперационной тошноты и рвоты (далее – ПОТР) отсутствует или присутствует в минимальной степени выраженности;
- кровотечение из места хирургического вмешательства отсутствует или минимальное;
- пациент способен принимать жидкость внутрь.
43. Пациенты, которым проводилась анестезия, могут быть выписаны при условии сопровождения совершеннолетним не ранее чем через 2 часа после окончания анестезиологического обеспечения.
Пациенту предоставляются письменные инструкции для ухода в послеоперационном и последующих периодах в зависимости от типа проведенного хирургического вмешательства и выбранной анестезии, а также информация о временных ограничениях после общей анестезии (запрет на курение и употребление алкогольных, слабоалкогольных напитков, вождение автомобиля и иное) и возможных осложнениях, о способах получения скорой медицинской помощи, контакты организации здравоохранения, в которой проводилось хирургическое вмешательство, для получения консультативной медицинской помощи при необходимости.
До выписки пациенту желательно принять первые дозы назначенного на послеоперационный период перорального анальгетика.
Лечение (стационар)
ГЛАВА 6
МЕДИЦИНСКОЕ НАБЛЮДЕНИЕ В ПОСЛЕОПЕРАЦИОННОМ ПЕРИОДЕ
Сроки послеоперационного медицинского наблюдения составляют:
Медицинское наблюдение за пациентом производится в специально оборудованных палатах пробуждения или при их отсутствии в палатах отделения анестезиологии и реанимации (при нестабильном состоянии пациента). При стабильности состояния, не требующем респираторной и гемодинамической поддержки, медицинское наблюдение за пациентом может проводиться в палатах профильных отделений.
Пациент в палате пробуждения (палате отделения анестезиологии и реанимации) располагается на медицинской кровати либо на каталке для перевозки пациента с возможностью изменения положения головного конца медицинской кровати либо каталки, оснащенных боковыми ограничителями.
При поступлении пациента из операционной в палату пробуждения (палату отделения анестезиологии и реанимации) и непосредственно перед переводом пациента из палаты пробуждения (палаты отделения анестезиологии и реанимации) врач-анестезиолог-реаниматолог отражает данные о состоянии пациента в протоколе анестезии.
Перевод пациента в общее отделение допускается в случае, если по модифицированной шкале Альдретта состояние пациента оценивается в 9 или 10 баллов, и выраженность болевого синдрома (по ВАШ или ПЦШ от 0 до 10 баллов) составляет 4 балла или менее.
71. После окончания хирургического вмешательства (манипуляции) пациентам вне зависимости от вида проведенной анестезии показано медицинское наблюдение медицинскими работниками, прошедшими подготовку по анестезиологии и реаниматологии.
Сроки послеоперационного медицинского наблюдения составляют:
- не менее 2 часов после общей анестезии (при условии полной стабилизации дыхания и гемодинамики, полного восстановления сознания и нейромышечной проводимости);
- время, необходимое для полной стабилизации дыхания и гемодинамики, а также для полного восстановления двигательных функций после блокады (после нейроаксиальных регионарных методик);
- время, необходимое до полной стабилизации гемодинамики и дыхания (после периферических регионарных блокад).
Медицинское наблюдение за пациентом производится в специально оборудованных палатах пробуждения или при их отсутствии в палатах отделения анестезиологии и реанимации (при нестабильном состоянии пациента). При стабильности состояния, не требующем респираторной и гемодинамической поддержки, медицинское наблюдение за пациентом может проводиться в палатах профильных отделений.
72. Помещение, в котором осуществляется медицинское наблюдение пациента в послеоперационном периоде, должно быть оснащено:
- источником кислорода и устройством подачи увлажненного кислорода через носовые канюли или лицевую маску;
- монитором пациента, обеспечивающим мониторинг (измерение) АД, частоты пульса, ЭКГ с ЧСС, насыщения гемоглобина артериальной крови кислородом (далее – SpO2), частоты дыхания;
- электроаспиратором или вакуум-аспиратором с набором одноразовых катетеров для аспирации из ротовой полости и трахеи;
- набором для интубации трахеи и экстренного восстановления проходимости дыхательных путей, включающим в себя ларингоскоп с клинками трех различных размеров, лицевые маски, ЭТТ и ларингеальные маски разных размеров (соответствующие возрастной категории пациентов, за которыми осуществляется медицинское наблюдение), ротоглоточные (носоглоточные) воздуховоды (воздуховоды Гведела) (не менее трех различных размеров);
- мешком Амбу.
Пациент в палате пробуждения (палате отделения анестезиологии и реанимации) располагается на медицинской кровати либо на каталке для перевозки пациента с возможностью изменения положения головного конца медицинской кровати либо каталки, оснащенных боковыми ограничителями.
73. Медицинское наблюдение пациента в палате пробуждения (палате отделения анестезиологии и реанимации) осуществляется медицинской сестрой-анестезистом (медицинским братом-анестезистом) с участием врача-анестезиолога-реаниматолога. При необходимости в послеоперационном медицинском наблюдении может участвовать оперирующий врач-хирург и другие врачи-специалисты.
- При поступлении пациента в палату пробуждения (палату отделения анестезиологии и реанимации) медицинские работники осуществляют оценку пациента с отражением в медицинских документах:
- уровня сознания;
- проходимости дыхательных путей;
- состояния дыхательной системы;
- состояния сердечно-сосудистой системы;
- нейромышечной проводимости (наличие остаточной миорелаксации);
- наличия и выраженности болевого синдрома (при помощи оценочных шкал);
- наличия синдрома ПОТР;
- наличие синдрома непреднамеренной гипотермии (дрожь);
- состояния повязок в области хирургического вмешательства, дренажей, зондов и катетеров.
В течение всего периода медицинского наблюдения за пациентом в палате пробуждения (палате отделения анестезиологии и реанимации) осуществляется мониторинг:
- неинвазивного АД – не реже чем каждые 15 минут, при артериальной гипотензии – не реже чем каждые 5 минут;
- измерение SpO2 – непрерывно;
- частоты пульса – непрерывно;
- ЭКГ и ЧСС – непрерывно;
- частоты дыхания – непрерывно;
- показателей лабораторного исследования (по медицинским показаниям);
- других параметров (по медицинским показаниям).
Мероприятия, осуществляемые при медицинском наблюдении за пациентом в послеоперационном периоде:
- ингаляция увлажненного кислорода через носовые катетеры или лицевую маску;
- согревание пациента (при необходимости);
- продолжение инфузионной терапии (при необходимости);
- послеоперационное обезболивание (при необходимости);
- лечение синдрома ПОТР (при необходимости);
- лечение осложнений, которые развились или были диагностированы в период медицинского наблюдения в палате пробуждения.
При поступлении пациента из операционной в палату пробуждения (палату отделения анестезиологии и реанимации) и непосредственно перед переводом пациента из палаты пробуждения (палаты отделения анестезиологии и реанимации) врач-анестезиолог-реаниматолог отражает данные о состоянии пациента в протоколе анестезии.
Перевод пациента в общее отделение допускается в случае, если по модифицированной шкале Альдретта состояние пациента оценивается в 9 или 10 баллов, и выраженность болевого синдрома (по ВАШ или ПЦШ от 0 до 10 баллов) составляет 4 балла или менее.
ГЛАВА 9
ОЦЕНКА И ЛЕЧЕНИЕ БОЛЕВОГО СИНДРОМА В ПОСЛЕОПЕРАЦИОННОМ ПЕРИОДЕ
Оценка интенсивности боли должна быть проспективной, проводится через определенные промежутки времени. Выраженность болевого синдрома определяется в состоянии покоя или при мобилизации (массаж и лечебная гимнастика, кашель, первый подъем с постели).
83. Оценка боли включает:
степень выраженности болевого синдрома (интенсивность боли);
тип боли (острая или хроническая, ноцицептивная, нейропатическая или смешанная).
Оценка интенсивности боли должна быть проспективной, проводится через определенные промежутки времени. Выраженность болевого синдрома определяется в состоянии покоя или при мобилизации (массаж и лечебная гимнастика, кашель, первый подъем с постели).
84. Степень выраженности болевого синдрома можно оценивать с помощью шкал самооценки, которые представляют собой одномерные шкалы, определяющие интенсивность боли на основании оценки, выставляемой пациентом:
- ВАШ, которая представляет собой непрерывную шкалу в виде горизонтальной или вертикальной линии длиной 10 см (100 мм) и расположенными на ней двумя крайними точками: отсутствие боли и сильнейшая боль, какую можно представить;
- ПЦШ, когда пациент указывает отметку с количественной оценкой испытываемой им боли от 0 до 10, где 0 соответствует отсутствию боли, а 10 – сильнейшей боли, которую себе можно представить. ПЦШ так же эффективна в послеоперационном периоде, как и ВАШ;
- у невербальных пациентов оценка выраженности болевого синдрома может осуществляться по критериям оценки боли невербальных пациентов, установленным согласно приложению 24.
Фармакотерапия необходима при ВАШ >30, ПЦШ >3.
Ступенчатая схема состоит из:
При возникновении сильной послеоперационной боли или прорывных болей при онкологических заболеваниях терапия начинается с инвазивного введения сильных опиоидных анальгетиков (ступень IIIb) с целью купирования острой боли и предотвращения формирования хронического болевого синдрома. Дальнейшая терапия может быть осуществлена без применения сильных опиоидных анальгетиков или с дальнейшим введением сильных опиатов.
85. Лечение болевого синдрома в послеоперационном периоде проводится поэтапно в соответствии со ступенчатой схемой.
Ступенчатая схема состоит из:
ступени I: НПВП (парацетамол, метамизол натрия, кеторолака, ацетилсалициловая кислота, целекоксиб4, лорноксикам, ибупрофен, диклофенак, эториксикаб);
ступени II: трамадол в сочетании с НПВП ступени I;
ступени IIIa: сильные опиоидные анальгетики (морфин, оксикодон, гидроморфон, бупренорфин, фентанил);
ступени IIIb: опиоидные анальгетики, вводимые внутривенно.
При возникновении сильной послеоперационной боли или прорывных болей при онкологических заболеваниях терапия начинается с инвазивного введения сильных опиоидных анальгетиков (ступень IIIb) с целью купирования острой боли и предотвращения формирования хронического болевого синдрома. Дальнейшая терапия может быть осуществлена без применения сильных опиоидных анальгетиков или с дальнейшим введением сильных опиатов.
______________________________
4 Off-label (назначается врачебным консилиумом).
86. Медицинскими показаниями для использования НПВП являются:
- острая послеоперационная боль;
- острая боль при воспалительном процессе: после травм, хирургических вмешательств, родов или ожогов;
- хроническая боль при онкологических заболеваниях, хронических поражениях костно-суставного аппарата или мышц;
- костные метастазы, поражение десен, расширение почечной лоханки и чашечек, некоторые типы головной боли;
- почечная недостаточность (требуется корректировка дозы при клиренсе креатинина менее 60 мл/мин.).
Одновременно не назначаются два НПВП, в том числе ингибитор ЦОГ-2 или ацетилсалициловая кислота в дозе более 500 мг/сутки.
Перечень ненаркотических анальгетиков установлен согласно приложению 25.
87. Методом, обеспечивающим быстрое обезболивание, адаптированное к потребностям пациента, является титрование морфина (раствор для инъекций 10 мг/мл) под медицинским наблюдением медицинских работников в палате послеоперационного наблюдения по следующей методике:
- начинается с внутривенного болюса в дозе 5 мг (медицинские противопоказания: выраженная седация, депрессия дыхания, тяжелая дыхательная, печеночная или почечная недостаточность);
- продолжается введением 2–3 мг каждые 5–7 минут до получения удовлетворительной анальгезии (ВАШ <30 или ПЦШ <3). При этом у пациентов, ранее не принимавших опиоиды, суммарная доза не должна превышать 10 мг, чтобы избежать развития острой толерантности и опиоид-индуцированной гипералгезии;
- соблюдаются правила безопасности путем многократной регулярной оценки: боли, уровня седации, частоты дыхания (с частотой – первично каждые 15 минут в течение часа, далее ежечасно в течение 4 часов);
- систематически оценивается уровень бодрствования пациента при лечении морфином гидрохлоридом при любом пути введения с использованием шкалы седации: 0 – пациент бодрствует; 1 – пациент временами сонлив, легко переходит в состояние бодрствования; 2 – пациент дремлет большую часть времени, переходит в состояние бодрствования при вербальной стимуляции; 3 – пациент дремлет большую часть времени, переходит в состояние бодрствования только при тактильной стимуляции.
88. Эпидуральное введение опиоидов проводится с использованием (для моноанальгезии или в сочетании с местным анестетиком):
- морфина (раствор для эпидурального и интратекального введения 1 мг/мл) в дозе 1–6 мг (осложнения: задержка мочеиспускания и кожный зуд, риск отсроченной депрессии дыхания, в связи с чем необходимо медицинское наблюдение в течение 24 ч);
- фентанила (раствор для инъекций 50 мкг/мл)2: болюс 0,05–0,1 мг, в виде инфузии 0,025–0,05 мг/ч;
- суфентанила5 (раствор для инъекций 50 мкг/мл) болюс 10–25 мкг (риск депрессии дыхания в течение 4–6 ч).
______________________________
5 Off-label (назначается врачебным консилиумом).
89. Субарахноидальное введение опиоидов проводится с использованием:
- морфина (раствор для эпидурального и интратекального введения 1 мг/мл): 0,1–0,2 мг, латентный период 30–60 минут, продолжительность действия от 6 до 24 ч. Необходимо медицинское наблюдение в течение 24 ч. Осложнения: задержка мочеиспускания и кожный зуд;
- суфентанила5 (раствор для инъекций 50 мкг/мл): 0,02–0,05 мг, в виде инфузии 0,01–0,025 мг/час, в сочетании с местным анестетиком при спинальной анестезии в дозировке 0,005 мг: латентный период 5 минут, продолжительность действия и риск депрессии дыхания – 2–4 ч.
90. Медицинскими показаниями к коррекции доз наркотических анальгетиков являются:
- пожилой возраст (старше 60 лет);
- печеночная недостаточность;
- при тяжелой почечной недостаточности требуется увеличение интервала между введениями.
91. Нежелательными реакциями опиоидных анальгетиков являются:
- депрессия дыхания: риск увеличивается при наличии дыхательной и (или) почечной недостаточности или при сочетании с производными бензодиазепинами. Антагонист опиатов – налоксон (раствор для инъекций 400 мкг/мл): вводится в дозе 100–200 мкг внутривенно дробно каждые 2–3 минуты до восстановления адекватного спонтанного дыхания;
- тошнота, рвота;
- задержка мочеиспускания, также может быть купирована налоксоном;
- запор;
- кожный зуд.
Лечение: пропофол в субгипнотической дозе (менее 1,5 мг/кг/ч); седация или эйфория, привыкание при несоблюдении дозировок и продолжительном использовании.
92. Трамадол (раствор для инъекций 50 мг/мл, таблетки 50 мг, капсулы 50 мг) является слабым агонистом опиоидных рецепторов, одновременно подавляет обратный захват серотонина и норадреналина. Дозировка: по 50 мг 4 раза в сутки внутривенно или внутрь.
Следует избегать одновременного приема трамадола и морфина, поскольку они ослабляют действие друг друга.
При печеночной и (или) почечной недостаточности доза трамадола уменьшается наполовину.
Медицинскими показаниями к применению фентанила являются: хронические боли, стабильные, интенсивные, устойчивые к другим опиоидным анальгетикам.
Медицинскими противопоказаниями к применению фентанила являются: установленная аллергия к фентанилу или силиконовым составляющим пластыря; декомпенсированная дыхательная недостаточность; грудное вскармливание.
При приеме фентанила следует избегать сочетания с приемом агонистов-антагонистов или частичных агонистов.
93. При трансдермальном введении фентанила эквивалентность дозы анальгетика: один пластырь 25 мкг/ч = 60 мг пероральной дозы морфина/сутки.
Медицинскими показаниями к применению фентанила являются: хронические боли, стабильные, интенсивные, устойчивые к другим опиоидным анальгетикам.
Медицинскими противопоказаниями к применению фентанила являются: установленная аллергия к фентанилу или силиконовым составляющим пластыря; декомпенсированная дыхательная недостаточность; грудное вскармливание.
При приеме фентанила следует избегать сочетания с приемом агонистов-антагонистов или частичных агонистов.
94. Гипералгезия купируется следующими лекарственными препаратами и их комбинациями:
- кетамин (раствор для внутривенного и внутримышечного введения (для инъекций) 50 мг/мл);
- габапентин (капсулы 100 мг, капсулы 300 мг, капсулы 400 мг);
- прегабалин (капсулы 75 мг, капсулы 150 мг);
- клонидин (раствор для инъекций 0,1 мг/мл, таблетки 0,15 мг);
- дексмедетомидин (концентрат для приготовления раствора для инфузий 100 мкг/мл);
- магния сульфат (раствор для внутривенного и внутримышечного введения (для инъекций) 250 мг/мл);
- лидокаин (раствор для внутривенного и внутримышечного введения (для инъекций) 10 мг/мл).
Кетамин раствор для внутривенного и внутримышечного введения (для инъекций) 50 мг/мл) показан:
в интраоперационном периоде в случае предоперационной боли, приема наркотических средств в предоперационный период, длительного хирургического вмешательства, высокотравматичного хирургического вмешательства, опасного в плане развития интенсивной длительной боли; при хронической боли: синдром толерантности к морфину.
В интраоперационном периоде уснувшему пациенту вводится первый болюс кетамина (из-за риска развития психотических расстройств). После вводного наркоза до разреза вводится болюс 0,125–0,25 мг/кг, затем осуществляется продленное введение со скоростью 0,125–0,25 мг/кг/ч, если хирургическое вмешательство длится более 2 ч. Введение прекращается за 30 минут до окончания анестезии.
Нежелательными реакциями при приеме раствора для инъекций кетамина являются психотические расстройства.
В интраоперационном периоде уснувшему пациенту вводится первый болюс кетамина (из-за риска развития психотических расстройств). После вводного наркоза до разреза вводится болюс 0,125–0,25 мг/кг, затем осуществляется продленное введение со скоростью 0,125–0,25 мг/кг/ч, если хирургическое вмешательство длится более 2 ч. Введение прекращается за 30 минут до окончания анестезии.
95. Медицинскими показаниями для применения раствора для инъекций лидокаина являются: длительное хирургическое вмешательство, высокотравматичное хирургическое вмешательство, опасное в плане развития интенсивной длительной боли. После вводного наркоза до разреза вводится болюс 1 мг/кг, затем продленное введение со скоростью 1 мг/кг/ч, если хирургическое вмешательство длится более 2 ч. Прекращается введение за 30 минут до окончания анестезии.
Нежелательными реакциями при приеме габапентина являются: сонливость, атаксия, головокружение, повышенная возбудимость, бессонница, нистагм, парестезии, тревожное возбуждение, астения, головные боли, тошнота, рвота, редко нарушения со стороны печени (цитолитические и холестатические реакции).
Режим дозирования: 600–1200 мг однократно за 2 ч до начала хирургического вмешательства вместо обычного анксиолитического лекарственного препарата либо в комбинации с ним. В послеоперационном периоде: 300–3600 мг/сутки (в среднем – 1200 мг/сутки) в 2–3 приема при лечении нейропатической боли и для послеоперационного обезболивания.
96. Габапентин является противоэпилептическим лекарственным препаратом и показан для лечения хронической нейропатической боли. Назначается в предоперационном периоде, позволяет уменьшить послеоперационную боль, снизить потребление морфина и хронизацию послеоперационной боли. В предоперационном периоде полезно его анксиолитическое и седативное действие.
Нежелательными реакциями при приеме габапентина являются: сонливость, атаксия, головокружение, повышенная возбудимость, бессонница, нистагм, парестезии, тревожное возбуждение, астения, головные боли, тошнота, рвота, редко нарушения со стороны печени (цитолитические и холестатические реакции).
Медицинскими противопоказаниями при приеме габапентина являются: аллергия, грудное вскармливание, врожденная галактоземия, синдром малабсорбции глюкозы и галактозы или лактазная недостаточность.
Режим дозирования: 600–1200 мг однократно за 2 ч до начала хирургического вмешательства вместо обычного анксиолитического лекарственного препарата либо в комбинации с ним. В послеоперационном периоде: 300–3600 мг/сутки (в среднем – 1200 мг/сутки) в 2–3 приема при лечении нейропатической боли и для послеоперационного обезболивания.
97. Медицинскими показаниями для применения прегабалина являются: лечение периферической и центральной нейропатической боли.
Нежелательными реакциями при применении прегабалина являются: сонливость, головокружение, сухость во рту, нарушения зрения. При долгосрочном приеме возможно увеличение веса.
Медицинскими противопоказаниями для применения прегабалина являются: аллергия, беременность, грудное вскармливание.
Режим дозирования: 150 мг перед хирургическим вмешательством однократно или продолжение приема в дозировке по 150 мг 2 раза в сутки в послеоперационный период в течение 5–14 дней. При почечной недостаточности доза снижается.
При почечной недостаточности применяются сильные опиоиды, на элиминацию которых нарушение функции почек оказывает меньшее влияние: фентанил, суфентанил6. Также предпочтительны методики местной и регионарной анальгезии.
При боли и тяжелой печеночной недостаточности противопоказаны: НПВП (усиление риска геморрагических осложнений и риска развития острой почечной недостаточности); парацетамол.
Предпочтение следует отдавать методикам местной и регионарной анальгезии (если это позволяет состояние системы гемостаза).
98. При тяжелой почечной недостаточности клиренс креатинина составляет менее 30 мл/мин. Режим дозирования адаптируется на основании клиренса креатинина во избежание появления побочных эффектов, связанных с накоплением активного лекарственного препарата и (или) его метаболитов. НПВП, блокаторы ЦОГ-2 и ацетилсалициловая кислота назначаются с осторожностью, так как они повышают риск геморрагических осложнений и снижения СКФ, в связи с чем необходимо своевременно корректировать дозу.
При почечной недостаточности применяются сильные опиоиды, на элиминацию которых нарушение функции почек оказывает меньшее влияние: фентанил, суфентанил6. Также предпочтительны методики местной и регионарной анальгезии.
При боли и тяжелой печеночной недостаточности противопоказаны: НПВП (усиление риска геморрагических осложнений и риска развития острой почечной недостаточности); парацетамол.
Лекарственные препараты, доза которых требует коррекции:
- морфин и его производные (коррекция дозы во избежание риска передозировки и накопления метаболитов (удвоенный период полувыведения, утроенный пик плазматической концентрации); пациент-контролируемая анальгезия: необходимо отказаться от постоянной подачи и увеличить рефрактерный период до 60 минут; при подкожном введении необходимо начинать с дозировки 5 мг 4 раза в сутки);
- производные бензодиазепина: применение с осторожностью, снижение дозы наполовину.
Предпочтение следует отдавать методикам местной и регионарной анальгезии (если это позволяет состояние системы гемостаза).
Режим дозирования лекарственных препаратов при тяжелой почечной недостаточности может изменяться согласно приложению 26.
______________________________
6 Off-label (назначается врачебным консилиумом).
Информация
Источники и литература
-
Постановления и приказы Министерства здравоохранения Республики Беларусь об утверждении клинических протоколов 2023
-
www.minzdrav.gov.by
Информация
ПОСТАНОВЛЕНИЕ
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ
РЕСПУБЛИКИ БЕЛАРУСЬ
19 апреля 2023 г. № 57
Об утверждении клинического протокола
На основании абзаца девятого части первой статьи 1 Закона Республики Беларусь от 18 июня 1993 г. № 2435-XII «О здравоохранении», подпункта 8.3 пункта 8, подпункта 9.1 пункта 9 Положения о Министерстве здравоохранения Республики Беларусь, утвержденного постановлением Совета Министров Республики Беларусь от 28 октября 2011 г. № 1446, Министерство здравоохранения Республики Беларусь
ПОСТАНОВЛЯЕТ:
1. Утвердить клинический протокол «Анестезиологическое обеспечение хирургических вмешательств» (прилагается).
2. Настоящее постановление вступает в силу после его официального опубликования.
Министр Д.Л.Пиневич
СОГЛАСОВАНО
Брестский областной исполнительный комитет
Витебский областной исполнительный комитет
Гомельский областной исполнительный комитет
Гродненский областной исполнительный комитет
Могилевский областной исполнительный комитет
Минский областной исполнительный комитет
Минский городской исполнительный комитет
Государственный пограничный комитет Республики Беларусь
Комитет государственной безопасности Республики Беларусь
Министерство внутренних дел Республики Беларусь
Министерство обороны Республики Беларусь
Министерство по чрезвычайным ситуациям Республики Беларусь
Национальная академия наук Беларуси
Управление делами Президента Республики Беларусь
Форма
1. Фамилия, собственное имя, отчество (если таковое имеется)
Медицинские показания к выполнению лабораторных и инструментальных исследований, зависящих от вида хирургического вмешательства и класса физического состояния пациента по ASA9


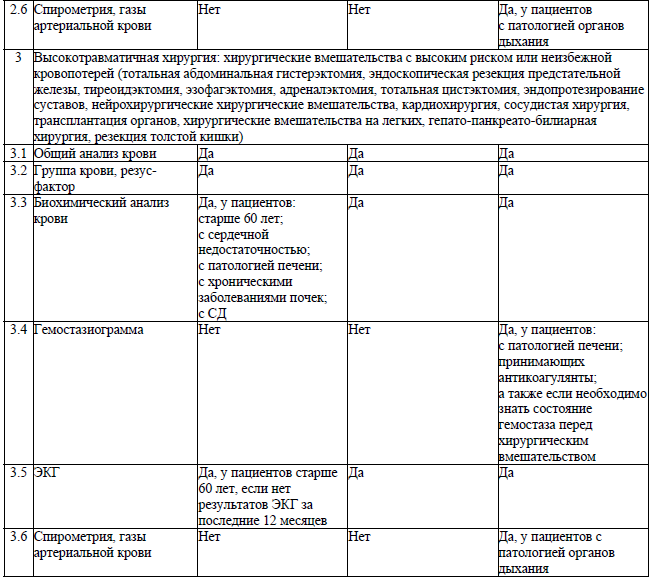
Приложение 6
Перечень медицинских показаний для выполнения отдельных лабораторных и инструментальных исследований
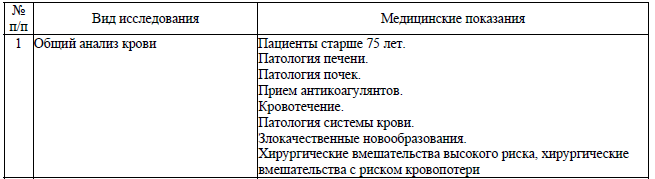

Алгоритм оценки сердечно-сосудистого риска, коррекции медикаментозной терапии и определения необходимости применения дополнительных методов обследования

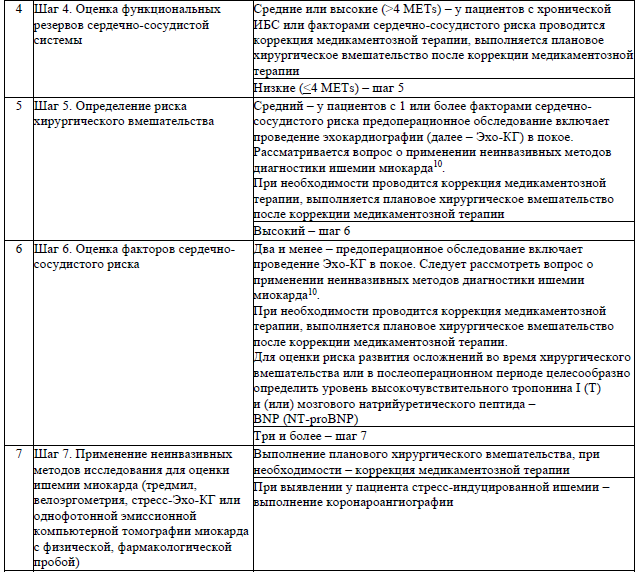
Приложение 8
Шкала оценки риска инсульта и системной тромбоэмболии у пациентов с фибрилляцией предсердий CHA2DS2-VASc11


Приложение 9
Функциональные резервы

Перечень рисков при хирургических вмешательствах


Шкала STOP-BANG12

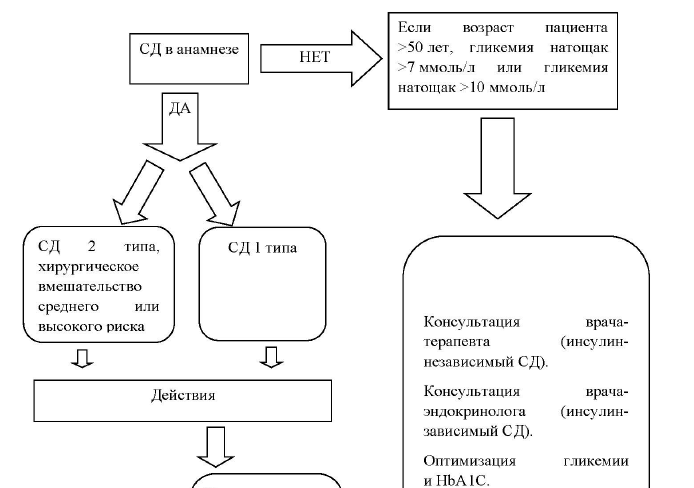

Перечень лекарственных препаратов для премедикации


Перечень медицинской техники и изделий медицинского назначения, необходимых для оказания медицинской помощи пациентам с хирургическими заболеваниями для выполнения хирургических вмешательств и манипуляций с анестезиологическим пособием в амбулаторных условиях
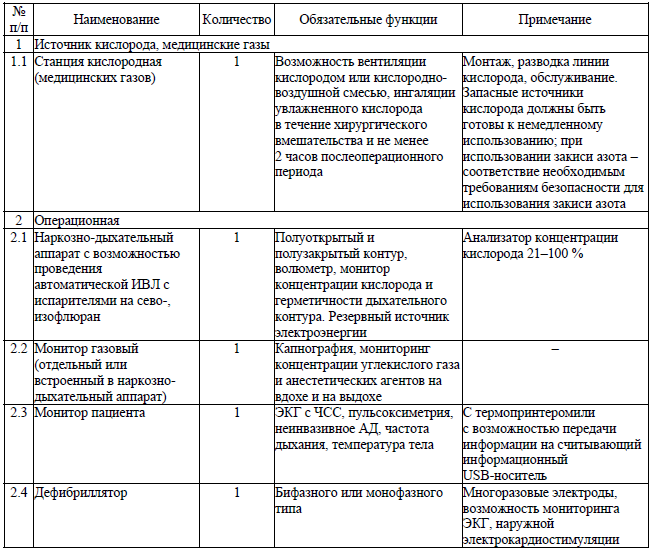


Модифицированная шкала Альдретта14

Перечень местных анестетиков для эпидуральной анестезии
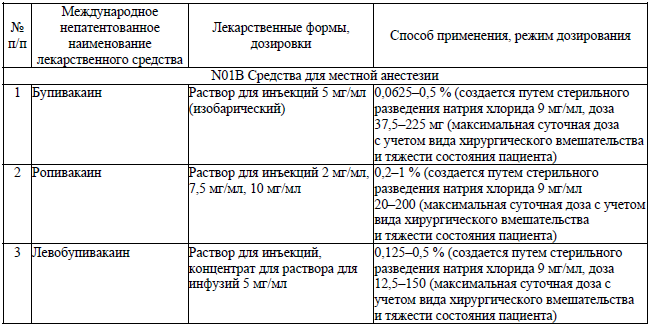
Области хирургических вмешательств, сегментарные границы блокады, оптимальный уровень установки кончика катетера в эпидуральном пространстве и минимальные объемы местного анестетика при комбинированной общей и эпидуральной анестезии

Дозы эпидурально вводимого морфина (раствор для эпидурального и интратекального введения 1 мг/мл) для анальгезии
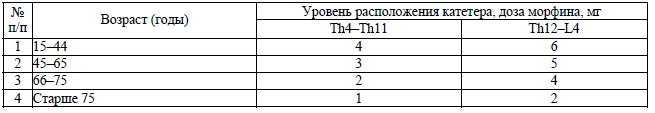
Факторы риска ПОТР

Алгоритм медицинской профилактики ПОТР

Перечень лекарственных препаратов, используемых для медицинской профилактики ПОТР
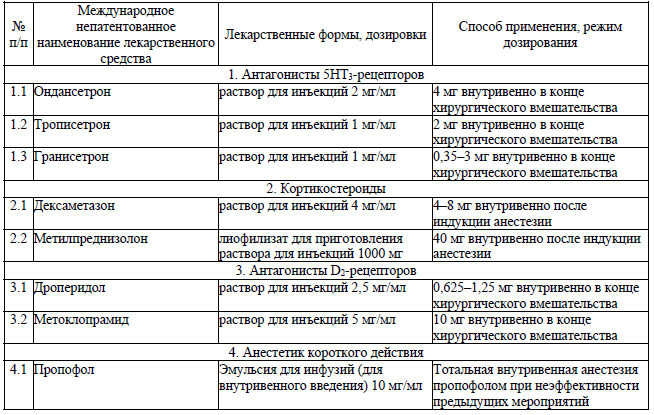
Общий алгоритм действий при неожиданно трудной интубации

Критерии оценки боли невербальных пациентов15


Приложение 25
Перечень ненаркотических анальгетиков16

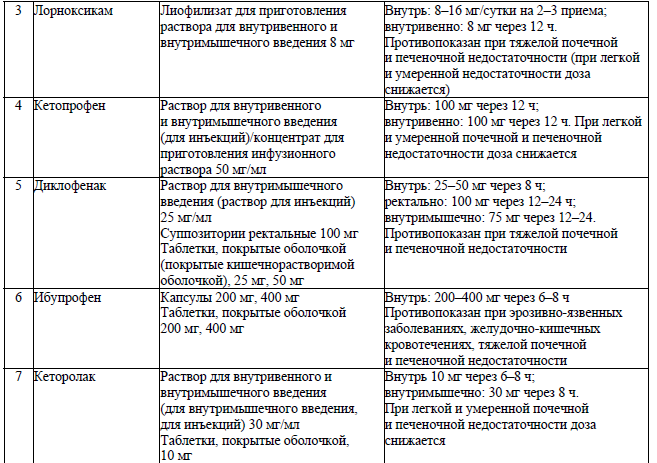

Приложение 26
Режим дозирования лекарственных препаратов при тяжелой почечной недостаточности


Алгоритм комплексной оценки дыхательных путей по шкале «Москва-TD»17


Приложение 1
к клиническому протоколу
«Анестезиологическое обеспечение хирургических вмешательств»
Форма
Опросник по перенесенным заболеваниям (анамнез)
1. Фамилия, собственное имя, отчество (если таковое имеется)
_____________________________________________________________________________
2. Вид хирургического вмешательства7 _______________________________________
3. Вид анестезии __________________________________________________________
4. Хирургическое вмешательство в амбулаторных, стационарных условиях (нужное подчеркнуть).
5. Дата проведения хирургического вмешательства _____________________________
6. Возраст _______________________________________________________________
7. Пол ___________________________________________________________________
8. Вес, кг ________________________________________________________________
9. Рост, см _______________________________________________________________
10. Род занятий ___________________________________________________________
11. Простужены ли Вы сейчас? (например, кашель, насморк, боль в горле, повышенная температура) □ нет □ да
12. Принимали ли Вы в течение последних 4 недель лекарственные препараты для разжижения крови (например, ацетилсалициловая кислота, варфарин, гепарин, клопидогрел, ривораксабан)? Если да, то какие и когда был последний прием? _____________________________________________________________________________
13. Принимаете ли Вы регулярно лекарственные препараты (например, от давления, сердечные лекарственные препараты, обезболивающее, снотворное, успокоительное, антидепрессанты, диабетические средства, слабительное, противозачаточные лекарственные препараты)? Если да, то какие? _____________________________________
14. Были ли у Вас ранее хирургические вмешательства? Если да, то какие и когда (укажите год)? ________________________________________________________________
15. Были ли ранее у Вас или у Ваших близких родственников проблемы, связанные с наркозом, региональной анестезией или обезболивающими лекарственными препаратами местного действия (например, тошнота, рвота, повышение температуры, аллергические реакции)? Если да, то какие? ____________________________________________________
16. Имеется ли у Вас склонность к тошноте и рвоте (например, во время поездок)? □ нет □ да
17. Имели ли место осложнения в случае переливания крови, ее компонентов? □ нет □ да
18. Укажите все заболевания или симптомы заболеваний, которые у Вас есть или были:
18.1. заболевания сердца, системы кровообращения (например, расстройства сердечного ритма, порок сердца, стенокардия, инфаркт миокарда, миокардит, повышенное (пониженное) артериальное давление, одышка при физических нагрузках, иные):
_____________________________________________________________________________;
18.2. заболевания сосудов (например, варикозное расширение вен, тромбоз, эмболия, нарушение кровоснабжения, инсульт, иные): ______________________________________;
18.3. нарушение свертывания крови (также у близких родственников), частые носовые кровотечения или кровоточивость десен, склонность к кровоподтекам, синякам, кровотечения после хирургических вмешательств, ранений
_____________________________________________________________________________;
18.4. заболевания дыхательных путей, легких (например, хронический бронхит, астма, воспаление легких, туберкулез, эмфизема легких, синдром сонного апноэ, парез голосовых связок, диафрагмы, иные): ____________________________________________;
18.5. заболевания печени, желчного пузыря (например, желтуха, гепатит, цирроз печени, жировая болезнь печени, желчно-каменная болезнь, иные):
_____________________________________________________________________________;
18.6. заболевания почек, мочевого пузыря (например, нарушение функции почек, потребность в диализе, воспаление, камни в почках, мочевом пузыре, иные):
_____________________________________________________________________________;
18.7. заболевания пищевода, желудка, кишечника (например, язвы, сужения, расстройства пищеварения, изжога, рефлюкс, иные): _______________________________;
18.8. заболевания, связанные с нарушением обмена веществ (например, подагра, диабет, иные): ________________________________________________________________;
18.9. заболевания щитовидной железы (например, гиперфункция или гипофункция, зоб, иные): ___________________________________________________________________;
18.10. заболевания скелетной системы (например, суставов, спины, межпозвоночных дисков, иные): _______________________________________________________________;
18.11. слабость мышечной системы, мышечные заболевания (также у близких родственников), предрасположенность к злокачественной гипертермии, миастения _____________________________________________________________________________;
18.12. заболевания нервной системы, психические заболевания (например, эпилепсия, инсульт, паралич, синдром беспокойных ног, хроническая боль, частые головные боли, депрессия, иные): _______________________________________________;
18.13. заболевания глаза (глаз) (например, глаукома, катаракта, иные), ношение контактных линз ______________________________________________________________;
18.14. тугоухость, наличие слухового аппарата _______________________________;
18.15. наличие аллергии (например, сенной насморк, повышенная чувствительность к продуктам питания, лекарственным препаратам, успокоительным, обезболивающим, дезинфицирующим лекарственным препаратам, йоду, пластырю, латексу (например, резиновым перчаткам), иной) ___________________________________________________;
18.16. иные заболевания, расстройства здоровья ______________________________;
18.17. наличие имплантов в теле (например, дефибриллятор, эндопротезы, сердечные клапаны, стенты, металл, силикон, иные) _________________________________________;
18.18. наличие шатающихся зубов, кариеса, пародонтоза, зубных протезов _____________________________________________________________________________;
19. Вы курите? Если да, то что и какое количество раз в день?
_____________________________________________________________________________
20. Вы употребляете алкогольные, слабоалкогольные напитки, пиво? Если да, то что, какое количество и как часто? __________________________________________________
21. Вы употребляете (употребляли) наркотики? □ нет □ да
22. Вы беременны? □ нет □ да
23. Вы кормите грудью? □ нет □ да
________________ ________________ _________________________________
(дата) (подпись) (инициалы (инициал собственного имени), фамилия)
______________________________
7 Пункты 2–5 заполняются врачом-специалистом.
Факторы риска развития сердечно-сосудистых осложнений8

Приложение 2
к клиническому протоколу
«Анестезиологическое обеспечение хирургических вмешательств»
Факторы риска развития сердечно-сосудистых осложнений8

______________________________
8 Риск развития инфаркта миокарда или смерти от сердечно-сосудистой патологии в периоперационном периоде при отсутствии факторов риска составляет 0,4 % (очень низкий), а при наличии одного, двух, трех и более – 0,9 % (низкий), 6,6 % (средний), более 11 % (высокий) соответственно.
Схема подбора оптимальной медикаментозной терапии



Схема коррекции приема лекарственных препаратов в периоперационном периоде



Приложение 3
к клиническому протоколу
«Анестезиологическое обеспечение хирургических вмешательств»
Схема подбора оптимальной медикаментозной терапии



Приложение 4
к клиническому протоколу
«Анестезиологическое обеспечение хирургических вмешательств»
Схема коррекции приема лекарственных препаратов в периоперационном периоде



Приложение 5
к клиническому протоколу
«Анестезиологическое обеспечение хирургических вмешательств»
Медицинские показания к выполнению лабораторных и инструментальных исследований, зависящих от вида хирургического вмешательства и класса физического состояния пациента по ASA9



______________________________
9 «Да» – рутинное выполнение исследования обязательно, «Нет» – рутинное выполнение исследования необязательно.
Приложение 6
к клиническому протоколу
«Анестезиологическое обеспечение хирургических вмешательств»
Перечень медицинских показаний для выполнения отдельных лабораторных и инструментальных исследований


Приложение 7
к клиническому протоколу
«Анестезиологическое обеспечение хирургических вмешательств»
Алгоритм оценки сердечно-сосудистого риска, коррекции медикаментозной терапии и определения необходимости применения дополнительных методов обследования


______________________________
10 Решение о необходимости применения неинвазивных методов диагностики ишемии миокарда принимается врачом-кардиологом, врачом-терапевтом (врачом общей практики) или заведующим отделением анестезиологии и реанимации.
Приложение 8
к клиническому протоколу
«Анестезиологическое обеспечение хирургических вмешательств»
Шкала оценки риска инсульта и системной тромбоэмболии у пациентов с фибрилляцией предсердий CHA2DS2-VASc11


______________________________
11 Индекс рассчитывается как сумма баллов при тестировании по шкале CHA2DS2-VASc.
Интерпретация результатов: риск низкий: индекс CHA2DS2-VASc 0 баллов – риск инсульта 0 %, риск средний:
индекс CHA2DS2-VASc 1 балл – риск инсульта 1,3 %, риск высокий: индекс CHA2DS2-VASc 2–9 баллов – риск инсульта 2,2–15,2 %.
Приложение 9
к клиническому протоколу
«Анестезиологическое обеспечение хирургических вмешательств»
Функциональные резервы

Приложение 10
к клиническому протоколу
«Анестезиологическое обеспечение хирургических вмешательств»
Перечень рисков при хирургических вмешательствах


Приложение 11
к клиническому протоколу
«Анестезиологическое обеспечение хирургических вмешательств»
Шкала STOP-BANG12

______________________________
12 Интерпретации результата:
0–2 балла – низкий риск наличия синдрома ОСА;
3–4 балла – средний риск наличия синдрома ОСА;
5 и более баллов – высокий риск наличия синдрома ОСА.
Алгоритм ведения пациента с СД
Приложение 12
к клиническому протоколу
«Анестезиологическое обеспечение хирургических вмешательств»
Алгоритм ведения пациента с СД


Приложение 13
к клиническому протоколу
«Анестезиологическое обеспечение хирургических вмешательств»
Перечень лекарственных препаратов для премедикации


______________________________
13 Off-label (назначается врачебным консилиумом).
Приложение 14
Приложение 14
к клиническому протоколу
«Анестезиологическое обеспечение хирургических вмешательств»
Перечень медицинской техники и изделий медицинского назначения, необходимых для оказания медицинской помощи пациентам с хирургическими заболеваниями для выполнения хирургических вмешательств и манипуляций с анестезиологическим пособием в амбулаторных условиях



Приложение 15
к клиническому протоколу
«Анестезиологическое обеспечение хирургических вмешательств»
Модифицированная шкала Альдретта14

______________________________
14 Интерпретация результата:
менее 9 баллов – необходимо медицинское наблюдение врача-анестезиолога-реаниматолога; 9 и более баллов – пациент готов к переводу в специализированное отделение.
Перечень местных анестетиков для спинальной анестезии

Приложение 16
к клиническому протоколу
«Анестезиологическое обеспечение хирургических вмешательств»
Перечень местных анестетиков для спинальной анестезии

Приложение 17
к клиническому протоколу
«Анестезиологическое обеспечение хирургических вмешательств»
Перечень местных анестетиков для эпидуральной анестезии

Приложение 18
к клиническому протоколу
«Анестезиологическое обеспечение хирургических вмешательств»
Области хирургических вмешательств, сегментарные границы блокады, оптимальный уровень установки кончика катетера в эпидуральном пространстве и минимальные объемы местного анестетика при комбинированной общей и эпидуральной анестезии

Приложение 19
к клиническому протоколу
«Анестезиологическое обеспечение хирургических вмешательств»
Дозы эпидурально вводимого морфина (раствор для эпидурального и интратекального введения 1 мг/мл) для анальгезии

Приложение 20
к клиническому протоколу
«Анестезиологическое обеспечение хирургических вмешательств»
Факторы риска ПОТР

Приложение 21
к клиническому протоколу
«Анестезиологическое обеспечение хирургических вмешательств»
Алгоритм медицинской профилактики ПОТР

Приложение 22
к клиническому протоколу
«Анестезиологическое обеспечение хирургических вмешательств»
Перечень лекарственных препаратов, используемых для медицинской профилактики ПОТР

Приложение 23
к клиническому протоколу
«Анестезиологическое обеспечение хирургических вмешательств»
Общий алгоритм действий при неожиданно трудной интубации

Приложение 24
к клиническому протоколу
«Анестезиологическое обеспечение хирургических вмешательств»
Критерии оценки боли невербальных пациентов15


______________________________
15 Интерпретация результата:
0–1 – нет боли, покой, выжидательная тактика;
2–5 – боль есть, но медикаментозная терапия не обязательна (решает врач-специалист);
6–8 – боль есть, рассматривается медикаментозная терапия (решает врач-специалист).
Приложение 25
к клиническому протоколу
«Анестезиологическое обеспечение хирургических вмешательств»
Перечень ненаркотических анальгетиков16



______________________________
16 Режим дозирования может отличаться в зависимости от рекомендаций, содержащихся в инструкции по медицинскому применению (листке-вкладыше).
Приложение 26
к клиническому протоколу
«Анестезиологическое обеспечение хирургических вмешательств»
Режим дозирования лекарственных препаратов при тяжелой почечной недостаточности


Приложение 27
к клиническому протоколу
«Анестезиологическое обеспечение хирургических вмешательств»
Алгоритм комплексной оценки дыхательных путей по шкале «Москва-TD»17

______________________________
17 ИТИ равен сумме баллов:
ИТИ 0 – трудности не ожидаются;
ИТИ 1–2 – возможна трудная интубация;
ИТИ 3–4 – высокая вероятность трудной интубации;
ИТИ 5 и более – облигатная трудная интубация.
Оценка видимости голосовой щели по шкале Кормак–Лихена при прямой ларингоскопии18
Приложение 28
к клиническому протоколу
«Анестезиологическое обеспечение хирургических вмешательств»
Оценка видимости голосовой щели по шкале Кормак–Лихена при прямой ларингоскопии18

______________________________
18 1 степень. Если визуализируется большая часть голосовой щели, трудностей при интубации трахеи нет.
2 степень. Если визуализируется только задняя часть голосовой щели, могут возникнуть трудности при интубации трахеи. Легкое надавливание на область гортани почти всегда позволяет увидеть черпаловидные хрящи, а иногда и голосовые связки.
3 степень. Если ни одна часть голосовой щели не визуализируется, но виден надгортанник, могут возникнуть серьезные трудности при интубации трахеи.
4 степень. Если не визуализируется надгортанник, то интубация трахеи без использования специальных методик невозможна. Данная ситуация предсказуема при наличии явной патологии, но крайне редко встречается и у пациентов с нормальной анатомией.
Ларингоскопическая картина по Cormack–Lehane соответствует шкале Маллампати не более чем в 25 % случаев. Несмотря на это, учитывать шкалу Маллампати перед интубацией трахеи необходимо всегда.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.