Цервикальная интраэпителиальная неоплазия, эрозия и эктропион шейки матки
 Версия: Клинические рекомендации РФ 2024 (Россия)
Версия: Клинические рекомендации РФ 2024 (Россия)
Гипертрофическое удлинение шейки матки (N88.4), Дисплазия шейки матки (N87), Другие уточненные невоспалительные болезни шейки матки (N88.8), Лейкоплакия шейки матки (N88.0), Старые разрывы шейки матки (N88.1), Стриктура и стеноз шейки матки (N88.2), Эрозия и эктропион шейки матки (N86)
Акушерство и гинекология
Общая информация
Краткое описание
Разработчик клинической рекомендации
- Российское общество акушеров-гинекологов
- Общероссийская общественная организация «Российское общество специалистов по профилактике и лечению опухолей репродуктивной системы»
Одобрено Научно-практическим Советом Минздрава РФ
– размещенные в Рубрикаторе после 1 января 2024 года – с 1 января 2025 года.
Клинические рекомендации
Цервикальная интраэпителиальная неоплазия, эрозия и эктропион шейки матки
Год утверждения (частота пересмотра): 2024
Возрастная категория: Взрослые, Дети
Пересмотр не позднее: 2026
ID: 597
Определение заболевания или состояния (группы заболеваний или состояний)
Эктропион шейки матки – это выворот слизистой оболочки цервикального канала шейки матки на эктоцервикс.
Эрозия шейки матки (истинная) – это нарушение целостности (дефект) слизистой оболочки, выстилающей влагалищную часть шейки матки.
Лейкоплакия шейки матки определяется как кератоз или гиперкератоз (ороговение неороговевающего эпителия), в ряде случаев с признаками дисплазии шейки матки в подлежащих слоях.
Цервикальные интраэпителиальные неоплазии (CIN) – это группа заболеваний, характеризующихся нарушением созревания, дифференцировки и стратификации многослойного плоского эпителия.
LSIL - low-grade squamous intraepithelial lesions – плоскоклеточные интраэпителиальные поражения низкой степени. LSIL включает койлоцитоз, CIN I и кондиломы шейки матки [8], [9].
HSIL - high grade squamous intraepithelial lesions – плоскоклеточные интраэпителиальные поражения высокой степени. HSIL включают CIN II (умеренную дисплазию), CIN III (тяжелую дисплазию и внутриэпителиальный рак (carcinoma in situ - CIS)) [8], [9] См Приложение А3.6 Таблица 4. HSIL относится к облигатному предраку шейки матки.
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Согласно МКБ 10:
N86 Эрозия и эктропион шейки матки, включены декубитальная (трофическая) язва, выворот шейки, исключена связь с воспалительной болезнью шейки матки, в том числе цервицитом, эндоцервицитом, экзоцервицитом (N72)
N87 Дисплазия шейки матки (цервикальная интраэпителиальная неоплазия), исключена карцинома in situ шейки матки (D06)
N87.0 Слабая цервикальная дисплазия, цервикальная интраэпителиальная неоплазия I степени (CIN I). Низкая степень плоскоклеточных интраэпителиальных поражений (LSIL).
N87.1 Умеренная цервикальная дисплазия, включена цервикальная интраэпителиальная неоплазия II степени (CIN II)
N87.2 Выраженная цервикальная дисплазия, тяжелая дисплазия шейки матки, не включенная в другие уточненные группы болезней. Не включена цервикальная интраэпителиальная неоплазия III степени (CIN III, независимо от указания на тяжелую дисплазию или карциному in situ шейки матки – кодируемую как D06)
N87.9 Цервикальная дисплазия неуточненная
N88.0 Лейкоплакия шейки матки
N88.1 Старый разрыв шейки матки
N88.2 Стриктура и стеноз шейки матки
N88.4 Гипертрофическое удлинение шейки матки
N88.8 Другие уточненные невоспалительные болезни шейки матки
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
Согласно Международной гистологической классификации Всемирной Организации Здравоохранения (ВОЗ), 5-ое издание, 2020 [18] прединвазивные поражения из плоского эпителия (плоскоклеточные интраэпителиальные поражения – SIL) подразделяют на:
- внутриэпителиальное поражение плоского эпителия легкой степени (LSIL);
- внутриэпителиальное поражение плоского эпителия тяжелой степени (HSIL).
В настоящее время общепринятой цитологической классификацией заболеваний шейки матки является классификация Бетесда (Terminology Bethesda System, TBS) [9], [19] (Приложение А3).
Гистологическая градация тяжести поражения зависит от количества и расположения незрелых недифференцированных клеток в эпителиальном пласте – его стратификации [20].
1. CIN I — недифференцированные клетки занимают нижнюю треть эпителиального пласта.
2. CIN II — незрелые клетки занимают нижние две трети толщины эпителия.
3. CIN III (включают тяжелую дисплазию и преинвазивный рак) — незрелые аномальные клетки занимают более чем две трети толщи эпителиального пласта или всю его толщину, но инвазия в подлежащую строму отсутствует.
Соотношение классификаций предраковых поражений шейки матки представлено в таблице (Приложение А3).
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Главным этиологическим фактором развития рака шейки матки является вирус папилломы человека высокого канцерогенного риска (ВПЧ ВКР) - 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68 типы [10].
ВПЧ-инфекция шейки матки в основном передается половым путем и представляет значительный риск интраэпителиальной неоплазии шейки матки. Несмотря на это, лишь у небольшой части женщин, пораженных вирусом, развивается тяжелая форма цервикальной интраэпителиальной неоплазии или инвазивный рак шейки матки. Прогрессирование этих состояний зависит от различных факторов, наиболее важным из которых является тип ВПЧ. Существует около 100 подтипов ВПЧ, которые подразделяются на онкогенные и неонкогенные.
В 55 - 60% случаев рака шейки матки выявляется наиболее канцерогенный штамм ВПЧ 16. На долю канцерогенного штамма ВПЧ 18 приходится от 10 до 15% случаев рака шейки матки.
Длительная персистенция ВПЧ (более 2-х лет) является основным фактором возникновения и прогрессирования неоплазий. Согласно клинико-морфологической концепции развития цервикальных неоплазий, ВПЧ ВКР поражает полипотентные стволовые и амплифицирующиеся клетки в переходной зоне - зоне стыка многослойного плоского эпителия (МПЭ) и цилиндрического эпителия (ЦЭ), под цилиндрическим эпителием эктопии, в формирующейся зоне трансформации с ее верхней границей – переходной зоной, а также в расположенном выше канале и эндоцервикальных криптах. Под влиянием ранних генов вируса (Е6, Е7) физиологический процесс метаплазии приобретает аномальный характер за счет чрезмерной пролиферации незрелых клеток и формирования неоваскулярной сети для трофического обеспечения растущей массы неопластических клеток. Аномальные клетки, соответственно тяжести их генетических повреждений и степени неоплазии, занимают от трети до всей толщины эпителиального пласта, кучно расположены в межакантотических пространствах, окруженных сосудистой сетью. Эта сосудистая сеть, «точечно» определяющаяся в верхушках сосочков или в виде горизонтально расположенных сосудов, окружающих массы незрелых клеток, является морфологическим субстратом аномальных кольпоскопических картин, таких как АБЭ различной толщины, нежная или грубая мозаика и пунктуация, сосочки, гребни, пласты [11], [12]. Возможно сосуществование разных степеней CIN у одной пациентки[1], что может послужить причиной морфологической гиподиагностики степени неоплазии с недооценкой по ограниченным биоптатам [5].
Врожденный эктропион шейки матки - это смещение границ цилиндрического эпителия эндоцервикса за пределы наружного зева на влагалищную часть шейки матки у женщин молодого возраста (не имевших беременностей и родов). Приобретенный (посттравматический) эктропион образуется в результате повреждений шейки матки, которые не были устранены или неправильно восстановлены после родов. Иногда к развитию эктропиона приводят травмы шейки матки во время искусственного прерывания беременности на поздних сроках гестации. Разрыв и последующее рубцевание шейки матки сопровождаются нарушением микроциркуляции, иннервации и трофики тканевых структур цервикального канала, что приводит к его деформации - нарушению веретенообразной формы цервикального канала, «зиянию» наружного зева и вывороту эндоцервикса [1], [13].
Истинная эрозия возникает вследствие травматического воздействия на эпителий шейки матки механических, термических, химических факторов (аборты, диагностические выскабливания, грубый половой контакт, инородные предметы во влагалище, применение тампонов, некоторых лекарственных препаратов в форме свечей и вагинальных таблеток). Также на возникновение истинной эрозии шейки матки могут оказывать влияние ИППП, длительное хроническое воспаление, гормональные нарушения, атрофия эпителия, снижение иммунитета [13]. Эрозия и эктропион шейки матки не являются предраковыми заболеваниями и при отсутствии ВПЧ не озлокачествляются.
[1] Письмо Министерства здравоохранения РФ от 2 ноября 2017 г. N 15-4/10/2-7676 О направлении клинических рекомендаций (протокола лечения) "Доброкачественные и предраковые заболевания шейки матки с позиции профилактики рака".
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Распространенность РШМ в РФ в 2022 году составила 127,6 случаев на 100 тыс. женского населения, активно выявлено на профилактических осмотрах - 34,9% случаев [14]. При этом carcinoma in situ шейки матки в 2022 г диагностирована всего в 5 869 случаев, что составляет 37,6 на 100 впервые выявленных случаев РШМ. Это крайне неблагоприятное соотношение - преинвазивный рак должен диагностироваться многократно чаще, чем инвазивный. Выявление заболевания на поздних стадиях существенно не снижается и в 2022 году составило 34,2% [14].
Распространенность интраэпителиальных поражений шейки матки различается в популяциях и составляет для LSIL – 1,5 - 7,7%, для HSIL - 0,4 - 1,5% [15], [16], [17].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
У подавляющего большинства пациенток с CIN I-III отсутствуют клинические проявления (бессимптомное течение). Крайне редко встречаются «контактные» кровянистые выделения из половых путей [1], [3].
При истинной эрозии шейки матки могут наблюдаться кровянистые выделения из травмированных сосудов и бели разных характеристик, как симптомы воспаления шейки матки [1], [3].
Как при эктропионе и эктопии, которые являются вариантами нормального строения шейки матки, так и при лейкоплакии и кондиломах, клинические симптомы чаще всего отсутствуют или сочетаются с сопутствующим воспалением (хроническим цервицитом) и не являются патогномоничными [1], [3].
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии постановки диагноза являются: осмотр шейки матки в зеркалах, визуальная оценка шейки матки после обработки уксусной кислотой (VIA), цитологическое исследование микропрепарата шейки матки, ВПЧ-тестирование (молекулярно-биологическое исследование отделяемого из цервикального канала на вирус папилломы человека (Papilloma virus)), кольпоскопия, биопсия шейки матки [21]. Для верификации диагноза используется патолого-анатомическое исследование биопсийного материала матки.
1. Жалобы и анамнез
- Рекомендуется всем пациенткам проведение анализа анамнестических данных с целью выявления факторов риска развития CIN [21].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Факторами риска развития CIN являются раннее начало половой жизни, большое число и частая смена половых партнеров, курение, сопутствующие половые инфекции, большое количество беременностей и родов, травматизации шейки матки, наличие иммунокомпрометирующих заболеваний (гепатита B, С, ВИЧ), иммуносупрессивная терапия, длительный прием комбинированных оральных контрацептивов (КОК – по анатомо-терапевтическо-химической классификации (АТХ) – гестагены и эстрогены, фиксированные комбинации)). Необходимо уточнить возраст сексуального дебюта, число половых партнеров. При «контактных» кровянистых выделениях из половых путей уточнить их длительность, выяснить наличие в анамнезе хирургических вмешательств на шейке матки, ВПЧ инфекции, оценить результаты ранее проведенного цервикального скрининга. CIN I/II/III, включая преинвазивный рак шейки матки (CIS), не имеют патогномоничных клинических проявлений и диагностируются только морфологическими методами [21], [22], [23].
2. Физикальное обследование
- Рекомендуется всем пациенткам проведение осмотра влагалища и шейки матки в зеркалах с целью выявления патологии шейки матки [21].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Визуальный метод не позволяет выявить интраэпителиальные поражения шейки матки. Для установления окончательного диагноза требуется цитологическое исследование микропрепарата шейки матки (мазков с экзо- и эндоцервикса), ВПЧ-тестирование (молекулярно-биологическое исследование отделяемого из цервикального канала на вирус папилломы человека (Papilloma virus)), кольпоскопия, биопсия шейки матки с патологоанатомическим исследованием биопсийного материала матки [21].
Эктропион выглядит как наличие цилиндрического эпителия на экзоцервиксе, иногда в сочетании с деформацией наружного зева.
Истинная эрозия шейки матки характеризуется наличием на неизмененном экзоцервиксе ярко-красного дефекта с четкими неправильными краями, представленными «оборванным» многослойным плоским эпителием, нередко с отеком, расширением сосудов, фибринозным налетом и контактной кровоточивостью.
3. Лабораторные диагностические исследования
- Рекомендуется проведение цитологического исследования микропрепарата шейки матки всем женщинам в возрасте от 21 до 65 лет с интервалом в 3 года с целью выявления CIN [24], [25][1].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: Возможно проведение цитологического исследования при обращении пациентки менее 21 года при половой жизни более 3 лет.
Материал должен быть получен с эктоцервикса и из эндоцервикса (при отсутствии атрезии цервикального канала).
Цитологическое исследование мазков с экто- и эндоцервикса (традиционная и жидкостная цитология) относится к основным методам диагностики состояния шейки матки. Для выявления CIN II+ чувствительность и специфичность традиционной цитологии - 62,5 и 96,6% соответственно, чувствительность и специфичность жидкостной цитологии - 72,9 и 90,3% соответственно [26]. Следует учитывать низкую воспроизводимость результатов повторных мазков, взятых в течение 1,5-2 мес. после первичных, в связи с чем при необходимости целесообразен пересмотр первичных аномальных мазков. Около 10% традиционных цитологических мазков являются неадекватными, что связано с неправильной техникой забора материала и приготовления препарата [27], [28], [29], [30]. См.приложение А 3.1.
Жидкостная цитология является более эффективной для выявления LSIL и HSIL ввиду многократного уменьшения числа неадекватных мазков [31], [32].
- Рекомендуется проведение молекулярно-биологического исследования отделяемого из цервикального канала (соскоба эпителия шейки матки) на вирус папилломы человека (Papilloma virus) (далее – тестирование на ВПЧ) на всю группу ВПЧ ВКР- 13-14 типов (без включения типов низкого канцерогенного риска), в качестве скринингового метода всем женщинам в возрасте от 30 до 65 лет с целью выявления группы риска предрака и РШМ[2] [33], [34].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Возможно тестирование на ВПЧ ВКР с помощью устройств для самостоятельного взятия пробы [35], [36], [37], [38], [39].
ВПЧ-тестирование целесообразно проводить всем женщинам в качестве скринингового метода с 30 лет в сочетании с цитологическим исследованием микропрепарата шейки матки - цервикального образца (ко-тест) [40], [41], [42].
- Рекомендуется выполнить молекулярно-биологическое исследование отделяемого из цервикального канала на вирус папилломы человека (Papilloma virus) пациенткам с цитологическим заключением ASCUS и LSIL вне зависимости от возраста для определения дальнейшей тактики [41], [42].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Целесообразно проведение ВПЧ-тестирования с генотипированием (частичным или полным) для оценки степени риска, выбора тактики ведения и оценки эффективности лечения CIN [43].
Аномальные результаты цитологии – ASCUS, LSIL на фоне ВПЧ ВКР и ASC-H, HSIL, AGC, AGC-NOS, AGC-FN - независимо от результатов ВПЧ-теста, являются показанием для проведения кольпоскопии, по результатам которой определяется необходимость и метод выполнения биопсии шейки матки [44]. Кольпоскопия также показана всем инфицированным ВПЧ 16 и/или 18 типами, независимо от результатов цитологии.
[1] Приказ от 27.04.2021 № 404н “Об утверждении порядка проведения профилактического медицинского осмотра и диспансеризации определенных групп взрослого населения”
[2] Письмо Министерства здравоохранения РФ от 2 ноября 2017 г. N 15-4/10/2-7676 О направлении клинических рекомендаций (протокола лечения) "Доброкачественные и предраковые заболевания шейки матки с позиции профилактики рака".
4. Инструментальные диагностические исследования
- Рекомендуется выполнить расширенную кольпоскопию для выявления и оценки измененных участков шейки матки, а также с целью выбора места и метода биопсии тканей матки для гистологической верификации диагноза при: визуальных изменениях шейки матки; аномалиях в мазках ASCUS или LSIL и положительном тесте на ВПЧ ВКР; ASC-H, HSIL, AGC независимо от результатов ВПЧ- теста; инфицированным ВПЧ 16 и /или 18 типами, независимо от результатов цитологии [43], [44], [45].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 3).
Комментарии: Информативность кольпоскопической диагностики снижается при невозможности полной визуализации всей зоны трансформации (ЗТ) и зоны стыка МПЭ и ЦЭ (ЗТ 3 типа).
- Рекомендуется получить эндоцервикальный образец (ЭЦО) для патолого-анатомическое исследование биопсийного материала матки в дополнение к кольпоскопии: у пациенток с цитологическим диагнозом HSIL, ASC-H, AGC; у всех положительных на ВПЧ 16 и/или 18; при положительных результатах двойного окрашивания на p16/Ki67; у всех пациенток, ранее лечившихся по поводу известного или подозреваемого HSIL, независимо от кольпоскопической картины; у пациенток, которым планируется наблюдение CIN2; если при кольпоскопии не удается полностью визуализировать зону трансформации. ЭЦО приемлем для всех небеременных пациенток, подвергающихся кольпоскопии [7].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Термин «ЭЦО» используется для обозначения всех методов отбора проб из цервикального канала – выскабливания кюреткой или забора материала эндоцервикальной щеткой [7], [21], [45], [46].
- Рекомендуется выполнить прицельную (предпочтительно мультифокальную) биопсию тканей (шейки) матки под контролем кольпоскопа для гистологической верификации диагноза пациенткам: с цитологическим заключением ASCUS и LSIL при наличии ВПЧ ВКР и аномальной кольпоскопической картины, ASC-H и аномальной кольпоскопической картины независимо от результатов ВПЧ ВКР [19], [47].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Диагноз и степень тяжести CIN устанавливаются только на основании патологоанатомического исследования. Результаты цитологического исследования не всегда совпадают с гистологическим диагнозом [41], [48].
Поскольку у одной пациентки возможно наличие CIN разной степени тяжести, постановка диагноза на основании ограниченных биоптатов может быть затруднена, возможна недооценка степени неоплазии [12], [46], [48].
- Рекомендуется при результатах цитологии HSIL выполнить петлевую эксцизию зоны трансформации (ЗТ) шейки матки (НМУ - Электроэксцизия новообразования шейки матки) с учетом результатов кольпоскопии, с последующим выскабливанием цервикального канала и патолого-анатомическим исследованием биопсийного (операционного) материала матки для подтверждения диагноза [21], [30], [47], [49].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: У молодых пациенток допустимо выполнение прицельной биопсии при условии полной визуализации ЗТ и отсутствия кольпоскопических признаков подозрения на инвазию [21], [30], [45], [49]. У женщин c HSIL старше 50 лет или при наличии ЗТ 3 типа показано проведение конусовидной эксцизии ЗТ (конизации) шейки матки с взятием ЭЦО.
- Рекомендуется для оценки риска наличия поражений высокой степени тяжести выполнить иммуноцитохимическое исследование биологического материала или патолого-анатомическое исследование биопсийного (операционного) материала матки с применением иммуногистохимических методов – с определением коэкспрессии белков p16/Ki67 в ходе иммуноцитохимического (ИЦХ) исследования или белка р16 в ходе иммуногистохимического (ИГХ) исследования (при наличии возможности) [8], [50].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Иммуноцитохимическое исследование биологического материала является дополнительным морфологическим методом. Положительная экспрессия р16 и Ki67 при ASCUS, ASC-H и LSIL предполагает большую вероятность наличия HSIL [50], [51], [52]
5. Иные диагностические исследования
- Рекомендовано использовать оптико-электронную диагностическую технологию в режиме реального времени для получения немедленного заключения о наличии цервикального поражения в условиях отсутствия лабораторной инфраструктуры при проведении скрининга рака шейки матки [53], [54], [55].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарии: Оптико-электронная технология обеспечивает чувствительность, сопоставимую с жидкостным цитологическим исследованием микропрепарата шейки матки и может использоваться как в качестве метода первичного скрининга, так и для сортировки пациенток с положительным результатом ВПЧ-тестирования [53], [54], [55].
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Диетотерапия не применяется.
- Рекомендуется проводить патогенетическое лечение истинной эрозии шейки матки в соответствии с причиной, вызвавшей десквамацию эпителия (воспалительные заболевания, травма, возрастная атрофия слизистых) [1], [3].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Не рекомендуется применять локально средства, влияющие на тканевой обмен, содержащие алоэ, облепихи масло, масло шиповника и др., в связи с возможным усилением пролиферативных процессов [1], [3].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Не рекомендуется лечить неосложненный эктропион шейки матки [47], [56].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Врожденный эктропион (эктопия) у ВПЧ негативных женщин является неопасным состоянием в отношении развития предрака и РШМ [1], [3], [57].
- Не рекомендуется проводить деструкцию эктопии, т.к. эктопия шейки матки является вариантом нормы и не требует лечения [47], [56].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: Необоснованная деструкция эктопии и нормальной ЗТ в случае развития неоплазии не предупреждает прогрессию заболевания в скрытой части канала, но способствует трудностям в диагностике [1], [3], [12].
- Не рекомендуется медикаментозное лечение плоскоклеточных интраэпителиальных поражений в качестве самостоятельного метода [12], [41], [49].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Лечение иммуномодуляторами (по АТХ – L03 Иммуностимуляторы) продуктивного компонента ВПЧ-инфекции, инициирующей и поддерживающей прогрессию CIN, возможно лишь в дополнение к основно й тактике.
В исследованиях с низким уровнем доказательности показан ряд положительных результатов в отношении препаратов на основе дииндолилметана, инозина пранобекса, гистидил-глицил-валил-серил-глицил-гистидил-глицил-глутаминил-гистидил-глицил-валил-гистидил-глицина и некоторых других препаратов [3], [12], [58], [59], [60], [61], [62].
- Рекомендуется при LSIL динамическое наблюдение c использованием цитологического исследования микропрепарата шейки матки 1 раз в 6 месяцев в течение 18-24 месяцев (с целью раннего выявления прогрессирования) [49], [63], [64].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 2).
Комментарии: У молодых пациенток с морфологически подтвержденным диагнозом LSIL (признаки ВПЧ инфекции, койлоцитоз, CIN I) и отсутствием АКК поражения высокой степени тяжести предпочтительна выжидательная тактика c динамическим наблюдением за состоянием шейки матки в течение 18-24 месяцев в виде цитологического контроля 1 раз в 6 месяцев и ВПЧ-тестирования 1 раз в 12 месяцев. Хирургическое лечение показано в случае отсутствия регрессии через 18-24 месяцев [1], [3], [12], [49], [64].
- Рекомендуется деструктивное или эксцизионное лечение (в зависимости от типа ЗТ) при сохранении поражений, соответствующих LSIL более 18-24 месяцев с целью профилактики прогрессирования [12], [39], [49].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Деструкция возможна только у молодых пациенток с LSIL при I типе ЗТ, отсутствии аномалий в мазках из цервикального канала и отсутствии расхождений результатов цитологического, кольпоскопического и патологоанатомического исследований. В остальных случаях, даже в возрасте моложе 25 лет, показана эксцизионная биопсия измененного эпителия [12], [34], [65].
- Рекомендуется женщинам старше 40 лет с LSIL в биоптате эктоцервикса с лечебно-диагностической целью проводить петлевую эксцизию ЗТ (НМУ - Электроэксцизия новообразования шейки матки) в связи с риском синхронных тяжелых поражений, скрытых в канале [12], [66], [67].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
- Рекомендуется проводить хирургическое лечение при HSIL (CIN II, CIN III) – электроэксцизию шейки матки или конизацию в зависимости от типа ЗТ с последующим выскабливанием цервикального канала с целью исключения злокачественного процесса [3], [12], [39], [41], [42], [34].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: При обнаружении в удалённом конусе микроинвазии пациентка должна быть направлена к врачу-онкологу с готовыми гистологическими препаратами и блоками. При эксцизии необходимо иссечь всю ЗТ с переходной зоной и часть вышележащих эндоцервикальных крипт. При ЗТ 1 типа, располагающейся полностью на эктоцервиксе, независимо от размера, глубина иссечения должна быть не менее 7 мм. При ЗТ 2 типа глубина иссечения увеличивается до 10 мм. При затруднении или невозможности визуализации стыка МПЭ и ЦЭ (ЗТ 3 типа) глубина иссечения не должна быть менее 15 мм – конизация [3], [11], [12].
У молодых женщин с диагнозом CIN II в биоптате при р16-негативном результате ИГХ допустимо динамическое наблюдение, как при LSIL, с использованием цитологического контроля, ВПЧ -тестирования и кольпоскопии 1раз в 6 месяцев в течение 2 лет [8], [50], [51].
В случае отсутствия регресса перейти к активной тактике (эксцизия шейки матки). У пациенток с диагнозом CIN II в биоптате при р16-позитивном результате ИГХ необходима безотлагательная эксцизия шейки матки [8], [52].
- Рекомендуются деструктивные методы только для лечения LSIL [3], [12], [39].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Условиями для методов деструкции (радиоволновая терапия шейки матки, аргоноплазменная (НМУ - Хирургическое лечение заболеваний шейки матки с использованием различных энергий), криодеструкция шейки матки, лазерная вапоризация шейки матки) являются: полная визуализация зоны трансформации (I тип ЗТ – поражения ограничены эктоцервиксом); отсутствие кольпоскопических признаков поражения эктоцервикальных желез с погружением АБЭ в них; отсутствие данных о вовлечении эндоцервикса в патологический процесс; отсутствие хирургического лечения шейки матки в анамнезе; отсутствие расхождений между данными цитологического исследования микропрепарата шейки матки, кольпоскопии и патолого-анатомического исследования биопсийного материала матки [65], [66].
- Рекомендуется при CIN III направлять пациенток на прием (осмотр, консультацию) к врачу-онкологу/врачу-акушеру-гинекологу или в специализированные гинекологические центры для оперативного лечения [1], [3], [12], [30], [68].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: При патологоанатомическом подтверждении диагноза и отсутствии опухолевых клеток в краях резекции и соскобе из оставшейся части цервикального канала проведенный объем хирургического вмешательства считается адекватным. Если в краях резекции шейки матки или соскобе из оставшейся части цервикального канала обнаруживается HSIL целесообразно повторное оперативное лечение [3], [11], [12], [49], [68].
Пациентки после надвлагалищной ампутации матки наблюдаются по стандартной схеме в зависимости от возраста. При выявлении заболеваний культи шейки матки HSIL оперативное лечение целесообразно проводить в стационарах 2-3 группы (стационары, оказывающие специализированную, в том числе высокотехнологичную, медицинскую помощь, разрабатывающие новые методы диагностики и лечения гинекологической патологии) в связи с изменениями топографо-анатомических взаимоотношений и возможными интраоперационными осложнениями.
Алгоритмы действий врача при выявлении отдельных видов аномальных мазков и у отдельных групп пациенток представлены в Приложении Б.
Медицинская реабилитация
Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Специфическая реабилитация не разработана.
Госпитализация
Организация оказания медицинской помощи
Эксцизионные и аблативные методы лечения предпочтительно проводить в амбулаторных условиях или в условиях дневного стационара.
Показания для госпитализации:
- ножевая конизация шейки матки с диагностическим выскабливанием цервикального канала и слизистой полости матки;
- эксцизия шейки матки при невозможности проведения в амбулаторных условиях (например, поражение шейки матки до сводов, предельное укорочение шейки матки, тяжелая экстрагенитальная патология, отказ от выполнения процедуры под местной анестезией и т.д.).
Критерии выписки пациентки: Выздоровление.
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Профилактика
- Рекомендовано придерживаться принципов контроля ВПЧ и профилактики РМШ, предложенных ВОЗ [21].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии:
Профилактика РШМ (ВОЗ, 2014) [21]:
1. Первичная профилактика: вакцинация против вируса папилломы человека, ориентированная на девочек в возрасте 9-13 лет и до начала половой жизни (Приложение А3.3).
2. Вторичная профилактика: доступность скрининга с последующим лечением выявленного предрака шейки матки (скрининг РШМ представлен в Приложении А3.4) [12].
Стратегии скрининга [19], [21][1]:
- 21-29 лет:
1. цитология/жидкостная цитология (цитологическое исследование микропрепарата шейки матки) 1 раз в 3 года.
2. Цитологическое исследование микропрепарата шейки матки (ПАП-тест) NILM– повторить цитологическое исследование (ПАП-тест) через 3 года.
3. При наличии аномалий в мазках от ASCUS и более показано ВПЧ-тестирование:
4. При наличии ASCUS и ВПЧ-тест (-) – повторное ко-тестирование через 3 года; ВПЧ-тест (+) – кольпоскопия с возможной биопсией шейки матки.
- 30-65 лет
1. Предпочтительный вариант – ко-тестирование (цитология/жидкостная цитология и ВПЧ- тест)
2. Цитологическое исследование микропрепарата шейки матки (ПАП-тест) NILM и
ВПЧ (-) – повторное ко-тестирование через 5 лет.
3. Цитологическое исследование микропрепарата шейки матки (ПАП-тест) = ASCUS и
ВПЧ (-) – повторное ко-тестирование через 3 года.
4. Цитологическое исследование микропрепарата шейки матки (ПАП-тест) NILM и
ВПЧ (+) – повторное ко-тестирование через 1 год.
5. Цитологическое исследование микропрепарата шейки матки (ПАП-тест) ≥ASCUS и ВПЧ (+) – кольпоскопия и биопсия шейки матки.
ASC-H и ВПЧ (+/-) - кольпоскопия с возможной биопсией.
HSIL и ВПЧ (+/-) старше 25 лет – кольпоскопия и петлевая эксцизия (НМУ - Электроэксцизия новообразования шейки матки) или конизация.
HSIL и ВПЧ (+/-) младше 25 лет – кольпоскопия, прицельная биопсия тканей матки или петлевая эксцизия (НМУ - Электроэксцизия новообразования шейки матки).
AGC и ВПЧ (+/-) - кольпоскопия с возможной биопсией тканей (шейки) матки, раздельное диагностическое выскабливание цервикального канала, у женщин старше 35 лет - биопсия тканей матки (эндометрия).
Допустимый вариант – на первом этапе ВПЧ-тестирование.
ВПЧ (-) – повторный ВПЧ-тест через 5 лет.
При ВПЧ (+) необходимо цитологическое исследование микропрепарата шейки матки (ПАП-тест).
Следует проводить профилактические медицинские осмотры или диспансеризацию групп здоровья9:
I группа здоровья – 21-29 лет - цитологическое исследование микропрепарата шейки матки не реже 1 раза в 3 года.
30-65 лет - проведение цитологического исследования микропрепарата шейки матки и ВПЧ-тестирования 1 раз в 5 лет
II группа здоровья - при наличии факторов риска, ВПЧ - позитивные пациентки: рекомендуется провести цитологическое исследование микропрепарата шейки матки (ПАП-тест). При наличии ≥ASCUS – кольпоскопия, при выявлении NILM – повторное ко-тестирование через 1 год.
III группа здоровья - при наличии доброкачественных заболеваний шейки матки: лечение в соответствии с рекомендациями.
- Рекомендуется наблюдение пациенток после хирургического лечения HSIL с проведением цитологического исследования микропрепарата шейки матки и молекулярно-биологического исследования отделяемого из цервикального канала на вирус папилломы человека (Papilloma virus) для раннего выявления остаточного поражения и рецидива [68], [69], [70].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарий: Первый ко-тест (цитологическое исследование и ВПЧ – тестирование) целесообразно выполнить через 3 месяца после хирургического лечения, затем каждые 6 месяцев в течение 2 лет, затем ежегодно в течение 20 лет [12], [68], [69], [70]. Критерием излеченности (отсутствие остаточного поражения) является отрицательный ВПЧ тест, отсутствие аномалий в мазках и при кольпоскопии. В случае подозрения на остаточное поражение (рецидив) рекомендована расширенная кольпоскопия и реконизация с патологоанатомическим исследованием [68]; консультация врача-онколога для определения объема операции. Для лечения рецидива CIN II/III предпочтительным методом является ампутация шейки матки или гистерэктомия [12], [49], [68], [69].
Диспансерное наблюдение
- Рекомендовано динамическое наблюдение при LSIL c использованием цитологического исследования микропрепарата шейки матки 1 раз в 6 месяцев в течение 18-24 месяцев для раннего выявления рецидива заболевания [12], [63], [64].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2).
Комментарии: У молодых пациенток с патологоанатомическим подтвержденным диагнозом LSIL (признаки ВПЧ инфекции, койлоцитоз, CIN I) предпочтительна выжидательная тактика c динамическим наблюдением за состоянием шейки матки в течение 18-24 месяцев и цитологическим контролем 1 раз в 6 месяцев и молекулярно-биологического исследования соскоба из цервикального канала на вирус папилломы человека 1 раз в 12 месяцев. При отсутствии регрессии LSIL через 18-24 месяцев рекомендуется хирургическое лечение [3], [12], [49], [64].
После хирургического лечения LSIL проводится цитологическое исследование микропрепарата шейки матки и ВПЧ-тестирование через 6-12 месяцев.
После хирургического лечения HSIL проводится цитологическое исследование микропрепарата шейки матки и ВПЧ-тестирование [67]. Первый ко-тест (цитологическое исследование и ВПЧ – тестирование) целесообразно выполнить через 3 месяца после хирургического лечения, затем каждые 6 месяцев в течение 2 лет, затем ежегодно в течение 20 лет [12], [69], [70]. Пациентки с микроинвазивным РШМ должны быть консультированы у врача-онколога с дальнейшим обследованием и наблюдением.
Информация
Источники и литература
-
Клинические рекомендации Российского общества акушеров-гинекологов
- Клинические рекомендации Российского общества акушеров-гинекологов - 1. Серов В. Н. и др. Руководство по амбулаторно-поликлинической помощи в акушерстве и гинекологии //М.: ГЭОТАР-Медиа. – 2016., ГЭОТАР-Мед. Москва. 2. Апгар Б. С., Броцман Г. Л., Шпицер М. Клиническая кольпоскопия. Практическое руководство //М.: Практическая медицина. – 2014. – Т. 384., Практическ. Москва. 3. Роговская С. И., Липова Е. В. Шейка матки, влагалище, вульва //Физиология, патология, кольпоскопия, эстетическая коррекция: Руководство для практикующих врачей. – 2014. . 4. Сайт «Международная ассоциация по патологии шейки матки и кольпоскопии». URL: www IFCPC info/ com. . 5. Bruno MT, Cassaro N, Bica F, Boemi S. Progression of CIN1/LSIL HPV Persistent of the Cervix: Actual Progression or CIN3 Coexistence. Infect Dis Obstet Gynecol. 2021 Mar 9;2021:6627531. . 6. Global Cancer Observatory: World. (2022). Accessed: February 15, 2024: https://gco.iarc.who.int/media/globocan/factsheets/populations/900-world-fact-sheet.pdf. . 7. Massad L Stewart, Perkins Rebecca B et al. Colposcopy Standards: Guidelines for Endocervical Curettage at Colposcopy. J Low Genit Tract Dis. 2023 Jan 1;27(1):97-101. . 8. The International Agency for Research on Cancer (IARC) of the World Health Organization, Atlas of visual inspection of the cervix with acetic acid for screening, triage, and assessment for treatment 2023. . 9. Nayar R., Wilbur D. C. The Bethesda System for reporting cervical cytology: a historical perspective //Acta cytologica. – 2017. – Т. 61. – №. 4-5. – С. 359-372. . 10. Bouvard V et al. WHO International Agency for Research on Cancer Monograph Working Group. A review of human carcinogens--Part B: biological agents. Lancet Oncol. 2009 Apr;10(4):321-2. . 11. Короленкова Л. И., Ермилова В. Д. Зона трансформации шейки матки как объект канцерогенного действия вирусов папилломы человека при возникновении цервикальных интраэпителиальных неоплазий и инвазивного рака //Архив патологии. – 2011. – Т. 73. – №. 6. – С. . 12. Короленкова Л. И. Цервикальные интраэпителиальные неоплазии и ранние формы рака шейки матки: клинико-морфологическая концепция цервикального канцерогенеза. – 2017. Москва. 13. Kohale M. G., Dhobale A.V., Hatgoankar K., et al. Comparison of Colposcopy and Histopathology in Abnormal Cervix. (February 15, 2024) Cureus 16(2): e54274. . 14. Состояние онкологической помощи населению России в 2022 году. Под ред. Каприна, А.Д., Старинского, В.В., Петровой, Г.В. МНИОИ им. П.А. Герцена филиал ФГБУ «НМИЦрадиологии» Минздрава России. 2023. . 15. Sanad A. S., Kamel H. H., Hasan M. M. Prevalence of cervical intraepithelial neoplasia (CIN) in patients attending Minia Maternity University Hospital //Archives of gynecology and obstetrics. – 2014. – Т. 289. – №. 6. – С. 1211-1217. . 16. Benard V. B. et al. Population-based incidence rates of cervical intraepithelial neoplasia in the human papillomavirus vaccine era //JAMA oncology. – 2017. – Т. 3. – №. 6. – С. 833-837. . 17. Shahida S. M. et al. Prevalence of Cervical Intraepithelial Neoplasia in four Upazila of Dhaka Division //Mymensingh medical journal: MMJ. – 2019. – Т. 28. – №. 3. – С. 655. . 18. Y. R. Kurman RJ, Carcangiu ML, Herrington CS, WHO Classification of Tumours of Female Reproductive Organs. 2014. 19. Fontham E. T. H. et al. Cervical cancer screening for individuals at average risk: 2020 guideline update from the American Cancer Society //CA: a cancer journal for clinicians. – 2020. . 20. Richart RM. Natural history of cervical intraepithelial neoplasia. Clin Obstet Gynecol. 1967;10:748. . 21. Comprehensive Cervical Cancer Control: A Guide to Essential Practice. 2nd ed. Geneva: World Health Organization; 2014. . 22. Roura E et al. The Influence of Hormonal Factors on the Risk of Developing Cervical Cancer and Pre-Cancer: Results from the EPIC Cohort. PLoS One. 2016. . 23. Li XY et al. Non-Genetic Factors and Risk of Cervical Cancer: An Umbrella Review of Systematic Reviews and Meta-Analyses of Observational Studies. Int J Public Health. 2023. . 24. Unim B. et al. Role of pap-test in cervical cancer prevention: a systematic review and meta-analysisBrigid Unim //European Journal of Public Health. – 2014. – Т. 24. – №. suppl_2. . 25. Шабалова И. П., Касоян К. Т. Цитология жидкостная и традиционная при заболеваниях шейки матки //Цитологический атлас. – 2016. . 26. Koliopoulos G. et al. Cytology versus HPV testing for cervical cancer screening in the general population //Cochrane Database of Systematic Reviews. – 2017. – №. 8. . 27. Савельева Г. М. и др. Национальное руководство //Акушерство–М.: Гэотар-Медиа. – 2015. . 28. Nayar R., Wilbur D. C. The pap test and Bethesda 2014 //Acta cytologica. – 2015. – Т. 59. – №. 2. – С. 121-132. . 29. Каприн А. Д. и др. Скрининг рака шейки матки—нерешенные проблемы //Research’n Practical Medicine Journal. – 2015. – Т. 2. – №. 1. . 30. Сухих Г. Т. и др. Профилактика рака шейки матки. – 2012. .31. Honarvar Z et al. Comparison of conventional and liquid-based Pap smear methods in the diagnosis of precancerous cervical lesions. J Obstet Gynaecol. 2022 Aug;42(6):2320-2324. . 32. Artymuk N. V., Marochko K. V. Predictive value of different diagnostic methods for detection of cervical intraepithelial neoplasia and cervical cancer //Lietuvos akušerija ir ginekologija. – 2017. – Т. 20. – №. 3. – С. 222-227. . 33. European Commission European Health Union: New Approach on Cancer Screening.. Available online: https://ec.europa.eu/commission/presscorner/detail/en/ip_22_7548. . 34. Jeronimo J. et al. Secondary prevention of cervical cancer: ASCO resource-stratified clinical practice guideline. J Glob Oncol. 2017; 3 (5): 635-57. . 35. Белокриницкая Т. Е. и др. Результативность и приемлемость обследования на вирус папилломы человека при самостоятельном и врачебном заборе вагинального отделяемого // Акушерство и гинекология. – 2017. – №. 2. – С. 97-105. . 36. Артымук Н. В., Марочко К. В. Эффективность выявления вируса папилломы человека при помощи устройства для самостоятельного забора вагинального отделяемого //Акушерство и гинекология. – 2016. – №. 3. – С. 85-91. . 37. Arbyn M, Smith Sara B, Temin Sarah et al. Detecting cervical precancer and reaching underscreened women by using HPV testing on self samples: updated meta-analyses. BMJ. 2018. . 38. Gennaro GD et al. Does self-sampling for human papilloma virus testing have the potential to increase cervical cancer screening? An updated meta-analysis of observational studies and randomized clinical trials. Front Public Health. 2022. . 39. WHO guideline for screening and treatment of cervical pre-cancer lesions for cervical cancer prevention, second edition. World Health Organization 2021. . 40. Royal College of Obstetricians and Gynaecologists: “Progress in Cervical Screening in the UK” Scientific Impact Paper No.7. . 41. Khan M.J., Cervical Cancer Screening: Evolution of National Guidelines and Current Recommendations. Clin Obstet Gynecol. . 2023 Sep 1;66(3):470-477, vol. 127, no. 1. 2016. 42. FIGO guidance for sustainable implementation of vaccination programs for women: Pregnancy and HPV 2023 https://doi.org/10.1002/ijgo.14894. 2009. 43. Bonde J. H. et al. Clinical Utility of Human Papillomavirus Genotyping in Cervical Cancer Screening: A Systematic Review //Journal of lower genital tract disease. – 2020. – Т. 24. – №. 1. – С. 1-13. . 44. Katki H. A. et al. Five-year risk of CIN3+ and cervical cancer for women with HPV-positive and HPV-negative high-grade Pap results //Journal of lower genital tract disease. – 2013. – Т. 17. – №. 5 0 1. – С. S50. .45. Rampuria S, Chandwaskar N : Comparative study of PAP smear and colposcopy with cervical biopsy. Int J Reprod Contracept Obstet Gynecol. 2023, 12:2113-18. 10.18203/2320-1770.ijrcog20231919. . 46. Goksedef BP, Api M, Kaya O et al. Diagnostic accuracy of two endocervical sampling method: randomized controlled trial. Arch Gynecol Obstet. 2013 Jan;287(1):117-22. . 47. Shafi M. I. European quality standards for the treatment of cervical intraepithelial neoplasia (CIN). European Federation for Colposcopy. – 2007. . 48. Se Ik Kim et al. Pathologic discrepancies between colposcopy-directed biopsy and loop electrosurgical excision procedure of the uterine cervix in women with cytologic high-grade squamous intraepithelial lesions. Gynecol Oncol. 2020. . 49. Perkins Rebecca B.et al. 2019 ASCCP Risk-Based Management Consensus Guidelines for Abnormal Cervical Cancer Screening Tests and Cancer Precursors. J Low Genit Tract Dis. 2020. . 50. Feldman S., Crum C. P, Cervical cancer screening tests: Techniques for cervical cytology and human papillomavirus testing. Up Today version Jul. 2024. . 51. Yu L. L. et al. Evaluation of p16/Ki-67 dual staining in detection of cervical precancer and cancers: a multicenter study in China //Oncotarget. – 2016. – Т. 7. – №. 16. – С. 21181. . 52. Peeters E. et al. Meta‐analysis of the accuracy of p16 or p16/Ki‐67 immunocytochemistry versus HPV testing for the detection of CIN2+/CIN3+ in triage of women with minor abnormal cytology //Cancer cytopathology. – 2019. – Т. 127. – №. 3. – С. 169-180. . 53. Зароченцева Н.В., Белая Ю.М. Заболевания шейки матки у молодых женщин. Вопросы практической кольпоскопии. Генитальные инфекции. 2023. . 54. Yu Ma et al. Comparison of the detection rate of cervical lesion with TruScreen, LBC test and HPV test: A Real-world study based on population screening of cervical cancer in rural areas of China. PLoS One. 2020. . 55. Yingting Wei et al. Clinical evaluation of a real-time optoelectronic device in cervical cancer screening. Eur J Obstet Gynecol Reprod Biol. 2021. . 56. World Health Organization et al. WHO guidelines for screening and treatment of precancerous lesions for cervical cancer prevention. 2023 //Geneva. WHO. – 2023. . 57. COTARCEA S. et al. The Importance of Ultrasound Monitoring of the Normal and Lesional Cervical Ectropion Treatment //Current health sciences journal. – 2016. – Т. 42. – №. 2. – С. 188. . 58. Del Priore G. et al. Oral diindolylmethane (DIM): pilot evaluation of a nonsurgical treatment for cervical dysplasia //Gynecologic oncology. – 2010. – Т. 116. – №. 3. – С. 464-467. .59. Castanon A. et al. Effect of diindolylmethane supplementation on low-grade cervical cytological abnormalities: double-blind, randomised, controlled trial //British journal of cancer. – 2012. – Т. 106. – №. 1. – С. 45. . 60. Белокриницкая Т. Е. и др. Проспективная оценка эффективности лечения цервикальных энтраэпителиальных неоплазий, ассоциированных с папилломавирусной инфекцией // Акушерство и гинекология. – 2016. – №. 4. – С. 86-93. . 61. Сухих Г.Т. и др. Исследование эффективности и безопасности препарата на основе дииндолметана у пациенток с цервикальной интраэпителиальной неоплазией (CIN 1–2). // Акушерство и гинекология. – 2018. №. 9. . 62. Ashrafian L. et al. Double-blind randomized placebo-controlled multicenter clinical trial (phase IIa) on diindolylmethane’s efficacy and safety in the treatment of CIN: implications for cervical cancer prevention //EPMA Journal. – 2015. – Т. 6. – №. 1. –. . 63. Mantoani PTS, Jammal MP, Caixeta JM, et al. Association of lesion area measured by colposcopy and cervical neoplasia. J Obstet Gynaecol. 2022;42(2)306-9. . 64. Elit L. et al. Expectant management versus immediate treatment for low‐grade cervical intraepithelial neoplasia: a randomized trial in Canada and Brazil //Cancer. – 2011. . 65. NHS. Cervical Screening Programme. http://www.cancerscreening.nhs.uk/cervical/publications/reviews-leaflets.html. . 66. P. P. Martin-Hirsch, Ed., Lei, L., Zhang, L., Zheng, Y. et al. Clinical analysis of 314 patients with high-grade squamous intraepithelial lesion who underwent total hysterectomy directly: a multi-center, retrospective cohort study. BMC Cancer 24, 575 (2024). John Wiley & Sons, Ltd. 67. van der Heijden E. et al. Follow‐up strategies after treatment (large loop excision of the transformation zone (LLETZ)) for cervical intraepithelial neoplasia (CIN): Impact of human papillomavirus (HPV) test //Cochrane Database of Systematic Reviews. . 68. Tanaka Y. et al. Predictors for recurrent/persistent high-grade intraepithelial lesions and cervical stenosis after therapeutic conization: a retrospective analysis of 522 cases //International journal of clinical oncology. – 2017. – Т. 22. – №. 5. – С. 9. . 69. Kew F. M., Cruickshank D. J. Routine follow-up after treatment for a gynecological cancer: a survey of practice //International Journal of Gynecologic Cancer. – 2006. – Т. 16. – №. 1. – С. 380-384. . 70. Минкина Г. Н. и др. Постлечебный мониторинг цервикальных интраэпителиальных неоплазий //Журнал акушерства и женских болезней. – 2011. – Т. 60. – №. 1. . 71. Meijer C. et al. Validation of high-risk HPV tests for primary cervical screening //Journal of Clinical Virology. – 2009. – Т. 46. – С. S1-S4. .72. Poljak M et al. Commercially available molecular tests for human papillomaviruses: a global overview. Clin Microbiol Infect. 2020. . 73. Vaccines against human papillomavirus infection: WHO position paper. Strategic Advisory Group of Experts (SAGE) on Immunization. Document and Report to SAGE March 2022, no. 43. 2014. 74. Баранов А. А. и др. Вакцинопрофилактика заболеваний, вызванных вирусом папилломы человека: позиции доказательной медицины. Обзор клинических рекомендаций //Вопросы современной педиатрии. – 2017. – Т. 16. – №. 2. . 75. Jura EA, Kirgiu M, Bosch Forex, et al. Human papillomavirus vaccination: ESGO-European Society EFC Position Paper of Gynecological Oncology and that of the European Federation for colposcopy. Euro J Cancer. 2019. . 76. Marta del Pino, Alex Vorsters A., Joura E., et.al., Risk factors for human papillomavirus infection and disease: A targeted literature summary. Medical virology. 2024, vol. 129, no. 6. 2017. 77. Report of the Meeting of the WHO Global Advisory Committee on Vaccine Safety, 15–16 May 2023 ttps://www.who.int/publications/i/item/who-wer9832-345-354. . 78. Вакцины против папилломавирусной инфекции человека: документ по позиции ВОЗ., http://www.who.int/wer, № 19, 2017. . 79. Kjaer S et al. A 12-year follow-up on the long-term effectiveness of the quadrivalent human papillomavirus vaccine in 4 Nordic countries. Clinical Infectious Diseases. 2018;66(3):339–345. . 80. Naud P. S. et al. Sustained efficacy, immunogenicity, and safety of the HPV-16/18 AS04-adjuvanted vaccine: final analysis of a long-term follow-up study up to 9.4 years post-vaccination //Human vaccines & immunotherapeutics. – 2014. – Т. 10. – №. 8. – С. . 81. Sharpless Kathryn E et al. ASCCP Committee Opinion: Adjuvant Human Papillomavirus Vaccine for Patients Undergoing Treatment for Cervical Intraepithelial Neoplasia. J Low Genit Tract Dis. 2023. . 82. Cao D, Wu D, Xu Y. Vaginal intraepithelial neoplasia in patients after total hysterectomy. Curr Probl Cancer. 2021. .
Информация
Список сокращений
|
АБЭ
|
ацетобелый эпителий
|
|---|---|
|
АКК
|
аномальная кольпоскопическая картина
|
|
ВПЧ
|
вирус папилломы человека
|
|
ВПЧ ВКР
|
вирус папилломы человека высокого канцерогенного риска
|
|
ДЭК
|
диатермоэлектрокоагуляция
|
|
ЗТ
|
зона трансформации
|
|
ИППП
|
инфекции, передаваемые половым путем
|
|
ИЦН
|
истмико-цервикальная недостаточность
|
|
КС
|
кольпоскопия
|
|
КОК
|
комбинированные оральные контрацептивы (по анатомо-терапевтическо-химической классификации лекарственных средств - гестагены и эстрогены, фиксированные комбинации)
|
|
МПЭ
|
многослойный плоский эпителий
|
|
ЛШМ
|
лейкоплакия шейки матки
|
|
РШМ
|
рак шейки матки
|
|
тестирование на ВПЧ
|
молекулярно-биологическое исследование отделяемого из цервикального канала на вирус папилломы человека (Papilloma virus)
|
|
ЦИН
|
цервикальная интраэпителиальная неоплазия
|
|
ЦЭ
|
цилиндрический эпителий
|
|
ЭЦО
|
эндоцервикальный образец
|
|
AGC
|
atypical glandular cells - атипические железистые клетки
|
|
ASC-H
|
atypical squamous cells can not exclude HSIL - атипические клетки плоского эпителия, нельзя исключить интраэпителиальное поражение тяжелой степени
|
|
ASC-US
|
atypical squamous cells of undetermined significance - атипические клетки плоского эпителия неясного значения
|
|
AGC-NOS
|
Atypical glandular cells not otherwise specified - атипичные железистые клетки неясного значения
|
|
AGC-FN
|
Atypical glandular cells favor neoplastic - Атипичные железистые клетки, похожие на неопластичные
|
|
CIN
|
cervical intraepithelial neoplasia - цервикальная интраэпителиальная неоплазия
|
|
CIS
|
carcinoma in situ
|
|
HSIL
|
high-grade squamous intraepithelial lesion – плоскоклеточное интраэпителиальное поражение высокой степени
|
|
LEEP
|
loop electrosurgical excision procedure - петлевая электрохирургическая эксцизионная процедура
|
|
LLETZ
|
large loop excision of the transformation zone – широкая петлевая эксцизия зоны трансформации
|
|
LSIL
|
low-grade squamous intraepithelial lesion – плоскоклеточное интраэпителиальное поражение низкой степени
|
|
NILM
|
negative for intraepithelial lesion or malignancy - отсутствие
интраэпителиального поражения или злокачественного новообразования
|
|
SIL
|
squamous intraepithelial lesion – плоскоклеточное интраэпителиальное поражение
|
|
VIA
|
визуальная инспекция шейки матки после обработки уксусной кислотой
|
|
ЭХВЧ-конизация
|
электрорадиохирургическая высокочастотная конизация шейки матки
|
|
CINII +
|
CINII, CIN III, рак шейки матки
|
Термины и определения
Эрозия шейки матки и эктропион шейки матки классифицируются Международной федерацией патологии шейки матки и кольпоскопии (Рио-Де-Жанейро, 2011) как неспецифические изменения шейки матки.
Эктропион шейки матки – это выворот слизистой оболочки цервикального канала шейки матки на эктоцервикс. Эктропион подразделяется на врожденный (вариант нормального строения шейки матки, синоним – эктопия) и посттравматический [1], [2], [3].
Эрозия шейки матки (истинная) – это нарушение целостности (дефект) эпителиального покрова, выстилающего влагалищную часть шейки матки [1], [2], [3].
Лейкоплакия шейки матки (ЛШМ) без клеточной атипии классифицируется как кератоз или гиперкератоз, с признаками атипии – дисплазией шейки матки. Международной федерацией патологии шейки матки и кольпоскопии (Рио-Де-Жанейро, 2011) ЛШМ отнесена к неспецифическим аномальным кольпоскопическим картинам (АКК) [4]. Лейкоплакия без атипии клеток является доброкачественным поражением шейки матки и при отсутствии ВПЧ не озлокачествляется [1], [3].
Цервикальные интраэпителиальные неоплазии (Cervical Intraepithelial Neoplasia - CIN) – это группа заболеваний, характеризующихся нарушением созревания, дифференцировки и стратификации многослойного плоского эпителия шейки матки. CIN инициируются персистирующей инфекцией, вызванной вирусами папилломы человека преимущественно высокого канцерогенного риска (ВПЧ ВКР), которая поддерживает прогрессию поражений до инвазии. CIN I характеризуется высокой вероятностью регрессии, не всегда ассоциирована с ВПЧ ВКР и не относится к предраку шейки матки. Способность CIN I прогрессировать до CIN II-III подвергается сомнению, возможно развитие CIN II-III без формирования CIN I и возможно сосуществование поражений CIN I и CIN III на одной шейке [5]. CIN II-III предшествуют раку шейки матки (РШМ) на протяжении нескольких лет и даже десятилетий. За столь длительный период CIN могут быть выявлены и излечены до развития инвазивного рака несложными органосохраняющими эксцизиями [1], [2], [3].
Основной патологией шейки матки, опасной для жизни женщины, является рак шейки матки (РШМ). Все диагностические методы и методики обследования шейки матки разрабатывались для ранней и дифференциальной диагностики именно этого заболевания и его облигатного предрака.
РШМ – частое злокачественное новообразование из эпителия шейки матки, идеально соответствующее требованиям к заболеваниям, подлежащим высокоэффективному и экономически целесообразному скринингу: большая распространенность и социальная значимость, визуальность формы, длительный период предрака с возможностью ранней диагностики и высокоэффективного лечения с сохранением фертильности, наличие достаточно чувствительных и специфичных тестов [1], [2], [3].
Петлевая эксцизия шейки матки (LEEP, loop electrosurgical excision procedure) – это метод иссечения аномальной ткани тонкими проволочными петлями различных размеров и форм с захватом части цервикального канала. Включает в себя широкую петлевую эксцизию зоны трансформации (LLETZ, large loop excision of the transformation zone, - процедура петлевой электрохирургической эксцизии всей зоны трансформации полукруглой петлей с небольшой вышерасположенной частью цервикального канала») и электрорадиохирургическую высокочастотную конизацию шейки матки (ЭХВЧ-конизацию – удаление аномальной зоны трансформации с более глубоким (1,5 см и более) иссечением эндоцервикальных крипт проволочным электродом в форме паруса) (Приложение Г5) [1], [2], [3].
Эндоцервикальный образец (ЭЦО) – это материал, полученный из цервикального канала для морфологического исследования (цитологического исследования микропрепарата тканей матки или патолого-анатомического исследования биопсийного (операционного) материала матки) с помощью эндоцервикальной щетки или кюретки [6], [7].
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Отсутствует.
Критерии оценки качества медицинской помощи
|
№
|
Критерии качества
|
Оценка выполнения
Да/Нет
|
|---|---|---|
|
1.
|
Выполнено цитологическое исследование микропрепарата шейки матки
|
|
|
2.
|
Выполнено молекулярно-биологическое исследование отделяемого из цервикального канала на вирус папилломы человека (Papilloma virus).
|
|
|
3.
|
Выполнена расширенная кольпоскопия при наличии показаний
|
|
|
4.
|
Выполнена биопсия тканей (шейки) матки (при наличии показаний) с патолого-анатомическим исследованием биопсийного материала матки (биоптатов шейки матки) для установления диагноза
|
|
|
5.
|
Выполнена эксцизия (Электроэксцизия новообразования шейки матки) или конизация шейки матки (при наличии показаний)
|
|
|
6.
|
Выполнено раздельное диагностическое выскабливание цервикального канала при наличии показаний
|
|
|
7.
|
Направлена на прием (осмотр, консультацию) к врачу-онкологу при выявлении злокачественных новообразований
|
|
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
Адамян Лейла Владимировна – академик РАН, доктор медицинских наук, профессор, заместитель директора ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России, Заслуженный деятель науки России, заведующая кафедрой акушерства, гинекологии и Репродуктивной медицины Российского Университета Медицины, главный специалист Минздрава России по гинекологии, является членом общества по репродуктивной медицине и хирургии, Российской ассоциации гинекологов-эндоскопистов, Российской ассоциации по эндометриозу, Российского общества акушеров-гинекологов.
Аполихина Инна Анатольевна – д.м.н., профессор, руководитель гинекологического отделения восстановительного лечения ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» Минздрава России (г. Москва).
Артымук Наталья Владимировна – д.м.н., профессор, заведующая кафедрой акушерства и гинекологии имени профессора Г.А. Ушаковой ФГБОУ ВО «Кемеровский государственный медицинский университет» Минздрава России, главный внештатный специалист Минздрава России по акушерству и гинекологии в Сибирском федеральном округе (г. Кемерово), является членом президиума правления Российского общества акушеров-гинекологов, президент Кемеровской региональной общественной организации «Ассоциация акушеров-гинекологов».
Асатурова Александра Вячеславовна – д.м.н., заведующая 1-м патолого-анатомическим отделением ФГБУ «Научный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства Здравоохранения РФ.
Ашрафян Левон Андреевич – академик РАН, профессор, руководитель отделения онкогинекологии, ФГУ «Российский научный центр рентгенорадиологии», заслуженный врач РФ, член Американской Ассоциации гинекологов-лапароскопистов (г. Москва)
Баранов Игорь Иванович – д.м.н., профессор, заведующий организационно-методическим отделом Службы научно-организационного обеспечения ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова» Минздрава России, член Российского обществ акушеров-гинекологов (г. Москва)
Байрамова Гюльдана Рауфовна – д.м.н, заведующий по клинической работе научно-поликлинического отделения ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова» Минздрава России, член Российского обществ акушеров-гинекологов (г. Москва)
Белокриницкая Татьяна Евгеньевна – д.м.н., профессор, заслуженный врач Российской Федерации, зав. кафедрой акушерства и гинекологии ФПК и ППС Читинской государственной медицинской академии, главный внештатный специалист Минздрава России по акушерству и гинекологии в Дальневосточном федеральном округе, член Правления Российского общества акушеров-гинекологов, президент Забайкальского общества акушеров-гинекологов (г. Чита)
Долгушина Наталья Витальевна – д.м.н., профессор, заместитель директора – руководитель департамента организации научной деятельности ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» Минздрава России (г. Москва).
Зароченцева Нина Викторовна – д.м.н., профессор РАН, заместитель директора по научной работе БУЗ МО «Московский областной научно-исследовательский институт акушерства и гинекологии», профессор кафедры акушерства и гинекологии ФУВ ГБУЗ МО «Московский областной научно-исследовательский клинический институт им М.Ф. Владимирского», член «Ассоциации по патологии шейки матки и кольпоскопии», член Российского обществ акушеров-гинекологов (г. Москва)
Кедрова Анна Генриховна - доктор медицинских наук, профессор, Лауреат премии Правительства РФ, заведующая кафедрой акушерства и гинекологии Академии постдипломного образования ФНКЦ Федерального Медико-биологического Агентства, главный внештатный онколог ФМБА России.
Короленкова Любовь Ивановна – д.м.н., профессор, старший научный сотрудник ФГБУ «Национальный медицинский исследовательский центр онкологии имени Н.Н. Блохина» МЗ РФ (г. Москва)
Кузнецов Игорь Николаевич – зам. директора института онкогинекологии и маммологии ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова» Минздрава России, член Российского обществ акушеров-гинекологов (г. Москва)
Минкина Галина Николаевна – д.м.н., профессор, профессор кафедры акушерства, гинекологии и репродуктивной медицины Научно- образовательного института Клинической медицины им. Н.А.Семашко Российского университета медицины; член «Ассоциации по патологии шейки матки и кольпоскопии», член Российского общества акушеров-гинекологов (г. Москва)
Мингалева Наталия Вячеславовна – д.м.н., профессор кафедры акушерства, гинекологии и перинатологии ФПК и ППС ФГБОУ ВО КубГМУ МЗ РФ, главный внештатный специалист по амбулаторной акушерско-гинекологической помощи МЗ Краснодарского края, член Российского обществ акушеров-гинекологов (г. Москва)
Назарова Нисо Мирзоевна – д.м.н., профессор, ведущий научный сотрудник научно-поликлинического отделения ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова» Минздрава России, член Российского обществ акушеров-гинекологов (г. Москва)
Прилепская Вера Николаевна – д.м.н., профессор, заслуженный деятель науки РФ, заместитель директора по научной работе ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова» Минздрава России, член президиума Российского общества акушеров-гинекологов, президент «Российского общества по контрацепции», президент «Ассоциации по патологии шейки матки и кольпоскопии», член Совета директоров Европейского общества по контрацепции и «Европейского Совета по профилактике рака шейки матки», член Европейской ассоциации по кольпоскопии (г. Москва)
Уварова Елена Витальевна – д.м.н., профессор, заслуженный деятель науки Российской Федерации, заведующий 2 гинекологическим отделением (детского и юношеского возраста) ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова» Минздрава России, профессор кафедры акушерства, гинекологии, перинатологии и репродуктологии института профессионального образования врачей Первого Московского Государственного Медицинского Университета им. И.М. Сеченова, главный внештатный специалист по гинекологии детского и юношеского возраста Министерства здравоохранения Российской федерации, президент Межрегиональной общественной организации «Объединение детских и подростковых гинекологов», член Российского обществ акушеров-гинекологов (г. Москва)
Филиппов Олег Семенович – д.м.н., профессор, заслуженный врач РФ, главный внештатный акушер-гинеколог ФМБА России, заместитель директора ФНКЦ детей и подростков ФМБА России, профессор кафедры акушерства, гинекологии и Репродуктивной медицины Российского Университета Медицины.
Шабалова Ирина Петровна – д.м.н., профессор, профессор кафедры клинической лабораторной диагностики ГБОУ РМАПО, президент Ассоциации клинических цитологов (г. Москва)
Конфликт интересов: отсутствует
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
1. Врачи-специалисты: врачи-акушеры-гинекологи; врачи-онкологи, врачи-детские онкологи; врачи-урологи, в том числе детские урологи-андрологи; врачи-педиатры, врачи-дерматовенерологи и др.
2. Ординаторы, аспиранты и слушатели циклов повышения квалификации по указанным специальностям.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
|
УДД
|
Расшифровка
|
|---|---|
|
1
|
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
|
|
2
|
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
|
|
3
|
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая
|
|
5
|
Имеется лишь обоснование механизма действия или мнение экспертов
|
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
|
УДД
|
Расшифровка
|
|---|---|
|
1
|
Систематический обзор РКИ с применением мета-анализа
|
|
2
|
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа
|
|
3
|
Нерандомизированные сравнительные исследования, в т. ч. когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль»
|
|
5
|
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
|
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
|
УУР
|
Расшифровка
|
|---|---|
|
A
|
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
|
|
B
|
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
|
|
C
|
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
|
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Приложение А3.1 Инструкция по проведению цитологического исследование соскобов экзо- и эндоцервикса
Для получения адекватного материала необходимо:
1. Использовать современные инструменты — комбинированные щетки с эндоцервикальным компонентом или две отдельные щетки. Следует исключить из употребления все шпатели (Эйра, деревянные и металлические), кюретажные ложечки, часто входящие в одноразовый гинекологический набор, как не позволяющие получить достойный скарификат из зоны трансформации и переходной зоны и разрушающие клеточные элементы при распределении материала на стекло.
2. Получать материал в виде скарификата до «кровавой росы», чтобы был получен образец максимально богатый клетками.
3. Ввиду того, что часть повреждений может находиться за пределами эктоцервикса, полноценный цервикальный образец должен быть получен из цервикального канала и крипт эндоцервикса.
 Рисунок 1. Вид рабочей части щеток для получения адекватного материала как с экто-, так и из эндоцервикса. Материал должен быть получен либо двумя щетками (А, Б), либо комбинированной щеткой с эндоцервикальным компонентом (В).
Рисунок 1. Вид рабочей части щеток для получения адекватного материала как с экто-, так и из эндоцервикса. Материал должен быть получен либо двумя щетками (А, Б), либо комбинированной щеткой с эндоцервикальным компонентом (В).
 Рисунок 1. Вид рабочей части щеток для получения адекватного материала как с экто-, так и из эндоцервикса. Материал должен быть получен либо двумя щетками (А, Б), либо комбинированной щеткой с эндоцервикальным компонентом (В).
Рисунок 1. Вид рабочей части щеток для получения адекватного материала как с экто-, так и из эндоцервикса. Материал должен быть получен либо двумя щетками (А, Б), либо комбинированной щеткой с эндоцервикальным компонентом (В).Правила забора традиционного мазка на онкоцитологию:
1. Шейку матки обнажают в зеркалах.
2. Материал берется с зоны трансформации с ее поверхности - переходной зоны стыка эпителиев и из эндоцервикальных крипт, то есть с экто- и из эндоцервикса. В связи с тем, что неопластический процесс изначально и наиболее активно развивается в месте стыка эпителиев (переходной зоне) и зоне трансформации, соскоб (мазок) обязательно должен включать эпителий этих зон. Из-за поражения эндоцервикальных крипт важно присутствие в материале эндоцервикального компонента.
3. Необходимо использование специального одноразового инструмента, гарантирующего взятие материала со всех указанных зон и обеспечивающего информативность препарата.
Использование нестандартизованных инструментов недопустимо: это приводит к снижению эффективности цитологического исследования
4. Мазок необходимо брать до проведения кольпоскопии и различных проб, бимануального исследования во избежание лизирования и деформации клеточных элементов.
5. Биоматериал для цитологических исследований берется всегда и только в первую очередь. Биоматериал для молекулярно-биологических исследований и/или микробиологических исследований берется строго после получения материала для цитологического исследования. Биоматериал для общеклинического микроскопического исследования берется в последнюю очередь.
6. Забор материала проводят после удаления слизи стерильным сухим мягким ватным тампоном, без грубого давления на шейку во избежание утраты эпителия.
7. Взятие материала для цитологического исследования проводится при помощи цитощётки (экзоцервикс) и эндоцервикальной щётки (эндоцервикс) и представляет собой получение соскоба-скарификата. При получении клинического материала для цитологических исследований нужно отдавать предпочтение расходным материалам (цитощеткам, универсальным урогенитальным зондам) с жесткими щетинками.
8. Рекомендуемая методика забора материала: цитощетку, расположенную преимущественно на экзоцервиксе, поверните 5 раз по часовой стрелке на 360° (рис. 2). Если забор материала осуществляется цитощёткой с эндоцервикальным штифтом, её рекомендуется повернуть не менее 3-х раз на 360°.

Рисунок 2. Правила забора материала для цитологического исследования цитощеткой и техника приготовления мазка.
9. Для взятия материала с эндоцервикса эндоцервикальную щетку после её введения следует повернуть не менее трех раз против часовой стрелки (рис. 3b). Закономерно появление "кровавой росы", что свидетельствует о получении информативного цервикального образца, где, кроме слизи, присутствуют клетки практически всех слоев эпителиального пласта.
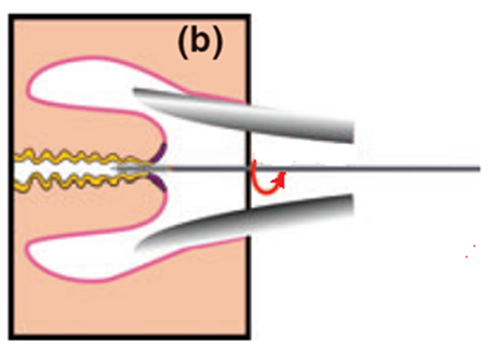
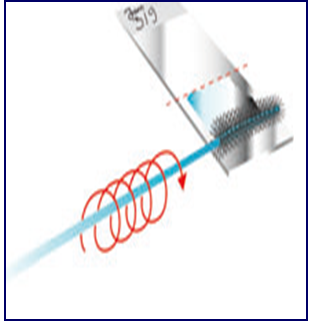
Рисунок 3. Правила забора материала для цитологического исследования эндоцервикальной щеткой и техника приготовления мазка (обязательно: щетка совершает вращательные движения).
10. Адекватный мазок должен быть максимально тонким и не должен содержать "толстые участки", включающие "непросматриваемые" скопления или комплексы клеток. Правила и варианты приготовления мазка представлены на рисунках 2 и 3.
11. Материал должен распределяться равномерно вдоль обезжиренного, сухого стекла (а не поперек или кругами) по всей поверхности стекла с равномерным распределением наибольшего количества полученного скарификата (рис. 2).
12. При использовании окраски по Романовскому-Гимзе специальные фиксаторы не применяются, препарат высушивается на воздухе.
13. При использовании окраски гематоксилином и эозином применяют стандартную методику.
14. Мазки должны быть маркированы: на обороте стекла препарата сбоку по короткому краю указывают фамилию пациентки, локализацию забора (экто-, эндоцервикс) и регистрационный номер исследования (рис. 2,3).
15. При планируемой окраске по Папаниколау мазок следует фиксировать спиртовым раствором.
16. В Российской Федерации направление, прилагаемое к препарату, является стандартной формой N 446/у, утверждённой приказом Министерства здравоохранения Российской Федерации от 24 апреля 2003 N 174 "Об утверждении учетных форм для цитологических исследований". Необходимо заполнить все пункты лицевой стороны бланка (в графе "Проведенное лечение" обязательно указать, какое, например, ДЭК 2002 год).
Мазок для цитологического исследования не следует брать:
-
ранее 24 часов после полового контакта;
-
во время менструации;
-
в период лечения генитальных инфекций;
-
ранее 48 часов после расширенной кольпоскопии с обработкой 3-5% растворами уксусной кислоты (ФС-001785) или Люголя (по АТХ - Антисептики), после использования любрикантов, тампонов или спермицидов;
-
после вагинального исследования или спринцевания.
Приложение А3.2 Виды ВПЧ - тестов (Для всех видов тестов -в НМУмолекулярно-биологическое исследование соскоба из цервикального канала на вирус папилломы человека (Papilloma virus)) [71], [72].
1. Полимеразная цепная реакция (ПЦР) – многократное копирование определенного участка вирусной ДНК типоспецифическими и видоспецифическими праймерами – качественное определение ВПЧ ВКР с типированием вируса. Рекомендуется исследование 13-14 типов ВПЧ ВКР.
2. RT (real-time) PCR – ПЦР в реальном времени – оценивается вирусная нагрузка в логарифмах, дифференцируются клинически значимые количества ВПЧ с рисками присутствия неоплазии от малозначимых, соответствующих транзиторной и разрешившейся ВПЧ-инфекции.
3. Качественные ДНК ПЦР-тесты на 14 типов ВПЧ ВКР с частичным генотипированием особо «опасных» типов ВПЧ (16 и 18 типов и остальных). Разработаны и применяются тест системы, которые позволяют выполнить идентификацию генов ВПЧ 16, 18, 31, 45, 51, 52 и 59 типов, остальные типы ВПЧ ВКР определяются в двух группах: 33, 56, 58, 66 и 35, 39, 68.
4. Тест двойного гибридного захвата (Hybrid Capture II – HC2) = ВПЧ Digene-тест. Тест основан на гибридизации участков ДНК ВПЧ ВКР с РНК- зондами, улавливаемых антителами с флюоресцентной меткой. При позитивном результате указывается клинически значимая концентрация 13 типов ВПЧ ВКР, в копиях ДНК ВПЧ на 1 мл образца. Отрицательный результат теста практически исключает присутствие CIN2-3.
5. Тесты на основе обнаружения РНК ВПЧ: PreTect HPV-Proofer (амплификация мРНК Е6/Е7 пяти типов ВПЧ высокого риска (16, 18, 31, 33 и 45)) и Aptima (Gen-Probe) основан на целевом захвате и гибридизации мРНК Е7 для выявления экспрессии мРНК 14 типов ВПЧ ВКР с частичным генотипированием.
Методика получения материала дли ВПЧ-исследования
1. Щеточкой возьмите мазок-соскоб из зоны трансформации с переходной зоной и крипт цервикального канала - щеткой, вращательными движениями обрабатывается сначала часть эктоцервикса, затем она вводится в нижнюю треть канала, где производится 3-5 оборотов.
2. Поместите щеточку в специальный контейнер с консервантом.
3. Промаркируйте контейнер: напишите имя женщины, номер амбулаторной карты или истории болезни и дату.
При самостоятельном приготовлении образца для ВПЧ-теста пациенткой необходимо следовать инструкции к прибору для самозабора материала [32], [35], [36], [72].
Приложение А3.3 Основные принципы вакцинопрофилактики против ВПЧ, показания, противопоказания
В Российской Федерации зарегистрированы 2 вакцины: Вакцина против вируса папилломы человека рекомбинантная, адсорбированная, содержащая адъювант AS04 (типов 16 и 18), и вакцина против вируса папилломы человека квадривалентная, рекомбинантная (типов 6, 11, 16, 18).
Схемы вакцинации ВОЗ (2017)
Для девочек младше 15 лет (оптимально – в возрасте 9-13 лет до начала половой жизни): двукратное введение вакцины с интервалом 6 месяцев (интервал может быть увеличен до 12-15 месяцев). Если интервал между 1 и 2 дозой меньше 5 месяцев, то рекомендуется введение 3 дозы вакцины не позднее 6 месяцев от начала вакцинации [73], [74].
Для девочек старше 15 лет: рекомендовано трехкратное введение вакцины по схеме 0, 1-2, 6 месяцев [73], [74].
Противопоказаниями для проведения вакцинации являются повышенная чувствительность к компонентам вакцины, развитие тяжелых системных аллергических реакций или поствакцинальных осложнений на предшествующее введение вакцины против ПВИ. Острые инфекционные и неинфекционные заболевания, а также обострение хронических заболеваний являются временными противопоказаниями, иммунизация проводится через 1–2 недели после выздоровления, или в период реконвалесценции, или ремиссии. При легких формах респираторных, кишечных и других инфекций прививки можно проводить после нормализации температуры [74].
При наступлении беременности после начала серии вакцинации, введение оставшейся дозы должно быть отложено до окончания беременности [75], [74]. Нет необходимости возобновлять полный курс вакцинации в послеродовом периоде.
Грудное вскармливание не является абсолютным противопоказанием для вакцинации четырехвалентной вакциной против ВПЧ [74]. Однако, учитывая профилактический характер вакцин от ВПЧ и очень малую вероятность первичного инфицирования ВПЧ ВКР в период лактации, от вакцинации следует воздержаться, поскольку риски вреда для младенца превышают предполагаемую пользу.
Девочкам-подросткам перед выполнением вакцинации нет необходимости в проведении специального гинекологического осмотра. Проведение ВПЧ-тестирования до вакцинации не рекомендовано [74], [76].
Не установлено связи вакцинации против ВПЧ с влиянием на фертильность, развитием аутоиммунных заболеваний или смерти – частота встречаемости данных осложнений не отличалась от таковой для общей популяции [77].
Следует информировать женщин о том, что вакцинация [74] не отменяет необходимость проведения регулярных гинекологических осмотров для проведения вторичной профилактики, поскольку вакцина не защищает от всех заболеваний, вызванных разными типами ВПЧ [21], [78].
Порядок наблюдения после вакцинации
Вакцинация проводится в центрах иммунопрофилактики, в прививочных кабинетах поликлиник и медицинских учреждений, включая детские.
После вакцинации девушки и женщины также подлежат стандартному цервикальному скринингу, включающему цитологическое исследование и ВПЧ-тест, согласно действующим приказам [21], [78].
Ревакцинация
Опубликованы данные по эффективной защите на протяжении 9,4 лет для двухвалентной вакцины и как минимум 10 лет для четырехвалентной вакцины [79], [80]. В настоящее время рекомендаций по проведению ревакцинации нет.
Адъювантная вакцинация против ВПЧ у ранее невакцинированных лиц, проходящих лечение от CINII +
Американское общество кольпоскопии и патологии шейки матки (ASCCP) рекомендует вакцинацию против ВПЧ лиц в возрасте от 9 до 26 лет, а также, учитывая возможную пользу адъювантной вакцинации против ВПЧ, невакцинированных лиц в возрасте от 27 до 45 лет, которые проходят лечение по поводу CINII+ [81].
Приложение А3.4 Рекомендуемый алгоритм скрининга РШМ [33], [19]:
-
Начало скрининга – 21 год (возможно проведение цитологического исследования микропрепарата шейки матки при обращении пациентки менее 21 года при половой жизни более 3 лет).
-
Конец скрининга – 65 лет (при условии предыдущего адекватного скрининга в течение 10 лет и отсутствии в течение 20 лет – CIN II-III)
-
21-29 лет – цитологическое исследование микропрепарата шейки матки не реже 1 раза в 3 года.
-
30-65 лет – цитологическое исследование микропрепарата шейки матки + ВПЧ - тест не реже 1 раза в 5 лет.
Комментарий: залог эффективности скрининга – широта охвата населения (не менее 70%). Этот вопрос может быть решен с помощью активной рассылки приглашений на обследование с помощью электронной почты и мобильной связи, а также использованием технологии самостоятельного взятия проб на ВПЧ ВКР, что имеет сходную эффективность в сравнении с материалом, полученным врачом [38], [39].
Пациентки с иммуносупрессией (ВИЧ инфекция, длительный прием стероидных гормонов, иммунодепрессантов после трансплантации органов и др.) могут нуждаться в более частом обследовании [49].
Скрининг пациенток после гистерэктомии
Пациенткам после гистерэктомии, не имеющим в анамнезе HSIL (CIN II +) забор материала со сводов влагалища не рекомендуется.
Пациентки, перенесшие гистерэктомию по поводу HSIL (CIN II +), могут быть подвержены повышенному риску развития рака влагалища. Данные пациентки должны пройти три последовательных ежегодных теста со сводов влагалища на ВПЧ ВКР и/или цитологических, прежде чем перейти к долгосрочному наблюдению. Пациентки с аномальной цитологией и/или позитивным ВПЧ-тестом должны быть направлены на вагинальную кольпоскопию [49], [82].
Приложение А3.5 Схематичное изображение двух вариантов эксцизии пораженной ЗТ и вышележащих крипт — LLETZ и конизации.
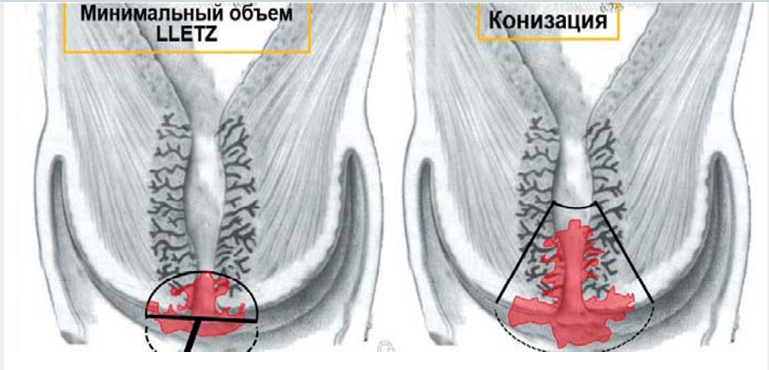
Приложение А3.6 Таблица 4. Соотношение классификаций предраковых поражений шейки матки [9].
Таблица демонстрирует соотношение цитологических заключений по данным различных классификаций.
|
Система Папаниколау
|
Описательная система ВОЗ
|
CIN
|
ТБС (Терминологическая система Бетесда)
|
|---|---|---|---|
|
Класс 1 (норма)
|
Отсутствие злокачественных клеток
|
Отсутствие неопластических изменений
|
Норма
|
|
Класс 2 (метаплазия эпителия, воспалительный тип)
|
Атипия, связанная с воспалением
|
Реактивные изменения клеток ASC: ASCUS; ASC - Н
|
|
|
Класс 3 ("дискариоз")
|
Слабая дисплазия
|
CIN I Койлоцитоз
|
LSIL
|
|
Умеренная дисплазия
|
CIN II
|
HSIL
|
|
|
Тяжелая дисплазия
|
CIN III
|
||
|
Класс 4 (клетки, подозрительные на рак или карцинома in situ)
|
Карцинома in situ
|
||
|
Класс 5 (рак)
|
Инвазивная карцинома
|
Карцинома
|
Карцинома
|
Треминологическая система Бетесда, 2014 (полный вариант)
Тип мазка (обязательно): традиционный мазок, жидкостной мазок или другое
Адекватность мазка (обязательно): адекватный/неадекватный для оценки
Общая характеристика (опционально)
1) Интраэпителиальные поражения и признаки злокачественности не выявлены (Negative for intraepithelial lesion or malignancy, NILM)
2) Изменения эпителиальных клеток обнаружены: см. раздел «интерпретация/результат», указать, если это возможно, к чему относится патология - к железистым или плоским клеткам)
3) Другое: см. раздел «интерпретация/результат» (например, наличие эндометриальных клеток в женщин 45 лет)
Интерпретация/результат (обязательно)
1) Интраэпителиальные поражения и признаки злокачественности не выявлены (Negative for intraepithelial lesion or malignancy, NILM)
2) Изменения, не относящиеся к неопластическим
- Плоскоклеточная метаплазия
- Кератотические изменения
- Метаплазия по типу эпителия, выстилающего слизистую оболочку маточной трубы
- Атрофические изменения
- Изменения, связанные с беременностью
-
Реактивные изменения клеток: указать причину:
- воспаление (с или без репаративными признаками),
- лимфоцитарный (фолликулярный) цервицит
- изменения, связанные с радиацией
- изменения, связанные с установленной внутриматочнной спиралью
- Наличие железистых клеток после гистерэктомии
-
Наличие инфекционные агентов:
- Trichomonas vaginalis
- Инфекционные агенты, относящиеся к классу грибов, морфологически соответствующие роду Candida
- Изменения микрофлоры, позволяющие предположить бактериальный вагиноз
- Изменения клеток, ассоциированные с вирусом простого герпеса
- Изменения клеток, ассоциированные с цитомегаловирусом
- Другое
- Наличие эндометриальных клеток (у женщин ≥ 45 лет)
3) Изменения эпителиальных клеток
-
Изменения плоских клеток
- Атипические плоские клетки
- Неясного значения (ASC-US)
-
Нельзя исключить интраэпителиальное поражение тяжелой степени, HSIL (ASC-H)
- Плоскоклеточное поражение легкой степени (LSIL)
- Плоскоклеточное поражение тяжелой степени (LSIL)
-
С признаками, подозрительными на инвазивное поражение (если есть)
- Плоскоклеточная карцинома
-
Изменения железистых клеток
- Атипические
- Эндоцервикальные клетки (БДУ без дополнительного уточнения или уточнить в комментариях)
- Эндометриальные клетки (БДУ, без дополнительного уточнения или уточнить в комментариях)
- Железистые клетки (БДУ, без дополнительного уточнения или уточнить в комментариях)
- Эндоцервикальные клетки, подозрительные в отношении неопластических
-
Железистые клетки, подозрительные в отношении неопластических
- Аденокарцинома эндоцервикса in situ
- Аденокарцинома
- Эндоцервикальная
- Эндометриальная
- Внематочная
- БДУ, без дополнительного уточнения или уточнить в комментариях
4) Другие злокачественные новообразования (уточнить какие)
5) Дополнительные данные
- Дополнительные исследования: уточнить метод исследования и результат (например, использование иммуноцитохимического метода или клеточных блоков)
- Использование автоматических компьютерных ассистентов для оценки цитологического мазка и результат оценки
- Образовательные заметки и комментарии (например, ссылки на актуальные публикации или гайдлайны)
Приложение Б. Алгоритмы действий врача
Алгоритм обследования и ведения пациенток с патологией шейки матки, выявленной при скрининговом исследовании
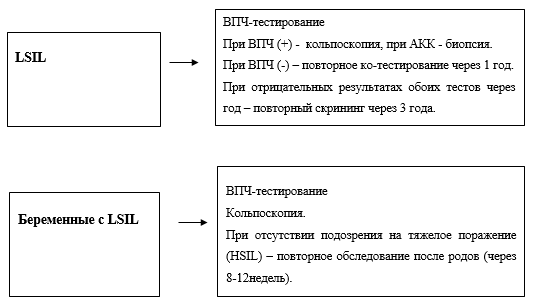

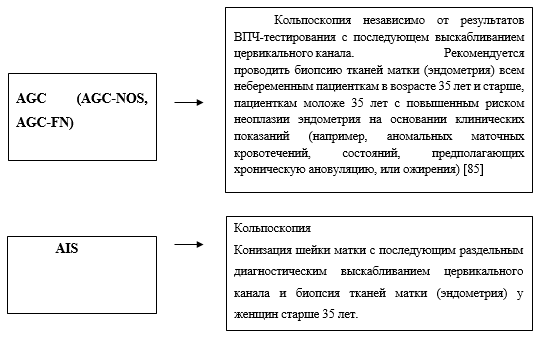
Приложение В. Информация для пациента
Рак шейки матки занимает одно из ведущих мест в структуре онкологических заболеваний репродуктивной системы женщины. В связи с этим понимание механизмов развития и выявление патологических состояний шейки матки имеет важное значение. Вовремя выявленные патологические процессы в шейке матки позволяют сохранить репродуктивную функцию, избежать развития серьезных онкологических заболеваний и в некоторых случаях даже сохранить жизнь. Давно известно, что в развитии рака шейки матки принимает участие вирус папилломы человека. Раннее начало половой жизни и частая смена половых партнеров увеличивают риски заражения вирусом папилломы человека. Важно отметить, что предрак и начальный рак шейки матки обычно протекают бессимптомно.
В связи с этим крайне важны регулярные профилактические осмотры у гинеколога, осмотр шейки матки, проведение цитологического исследования соскобов шейки матки, тестирование на наличие вируса папилломы человека. После получения результатов лабораторных исследований в некоторых ситуациях требуется дополнительная более глубокая диагностика – кольпоскопия (осмотр шейки матки под увеличением с помощью специального оптического прибора) и проведение биопсии. В случае выявления тяжелых поражений, вплоть до рака шейки матки, проводят лечебные мероприятия, начиная от эксцизии (удаление патологических участков на шейке матки с использованием электрохирургической петли) или конизации шейки матки (хирургический метод лечения, позволяющий иссечь наружную поверхность шейки матки и участок цервикального канала) до удаления матки. В некоторых случаях при легкой степени поражения шейки матки возможно динамическое наблюдение. Важно отметить, что проведение лечения не исключает риска повторного заражения вирусом папилломы человека. Именно поэтому профилактические осмотры должны проводиться с регулярной периодичностью, не реже 1 раз в 5 лет. С другой стороны, не менее важное значение имеет вакцинация от вируса папилломы человека. Целесообразно проводить вакцинацию до начала половой жизни, оптимально в возрасте 9-13 лет.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Не используются.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.