Хроническая сердечная недостаточность
 Версия: Клинические протоколы КР 2024 (Кыргызстан)
Версия: Клинические протоколы КР 2024 (Кыргызстан)
Застойная сердечная недостаточность (I50.0), Сердечная недостаточность (I50), Сердечная недостаточность неуточненная (I50.9)
Кардиология
Общая информация
Краткое описание
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ КЫРГЫЗСКОЙ РЕСПУБЛИКИ
НАЦИОНАЛЬНЫЙ ЦЕНТР КАРДИОЛОГИИ И ТЕРАПИИ им. М. МИРРАХИМОВА при МЗ КР
Диагностика и лечение хронической сердечной недостаточности
Клиническое руководство
Клиническое руководство по диагностике и лечению хронической сердечной недостаточности принято Экспертным советом по оценке качества клинических руководств/протоколов и утверждено Приказом МЗ КР № 841 от 7 августа 2024 года.
Клиническая проблема
Хроническая сердечная недостаточность
Название документа
Клиническое руководство по диагностике и лечению хронической сердечной недостаточности
Этапы оказания помощи Первичный, вторичный и третичный уровень оказания помощи
Цель создания клинического руководства
Создание единой системы по диагностике, лечению и профилактике хронической сердечной недостаточности, основанной на принципах доказательной медицины и отраженной в последних достижениях мировой медицинской науки и практики
Целевые группы
Семейные врачи, врачи общей практики, врачи кардиологических и терапевтических стационаров, а также врачи всех других специальностей, принимающих участие в лечении больных с хронической сердечной недостаточностью, эксперты ФОМС.
Клиническое руководство применимо к пациентам с хронической сердечной недостаточностью старше 18 лет
Дата создания
Создано в 2024г.
Планируемая дата обновления
Проведение следующего пересмотра планируется в 2027 году, либо раньше при появлении новых ключевых доказательств. Все поправки будут опубликованы в периодической печати.
Введение
В структуре причин смертности населения Кыргызстана первое место занимают болезни системы кровообращения. По последним данным на долю сердечно-сосудистых заболеваний пришлось 51,8 процента всех смертей (1). В то же время ХСН является, к сожалению, самым распространенным и прогностически неблагоприятным исходом большинства сердечно-сосудистых и других заболеваний. Несмотря на значительный прогресс в лечении ХСН за последние десятилетия, смертность при данном состоянии остается крайне высокой, достигая 60% у мужчин и 45% у женщин в течение пяти лет после установления диагноза. ХСН является одним из самых дорогих, затратных хронических заболеваний, т.к. до 50% пациентов имеют регоспитализацию в течение 6-12 месяцев. В то же время ХСН зачастую впервые диагностируется в уже клинически выраженной стадии с признаками застоя по малому и большому кругам кровообращения и плохим прогнозом. Поздняя диагностика и лечение данной патологии обуславливает увеличение расходов на дальнейшую терапию пациентов с ХСН, повышает количество повторных госпитализаций в стационары и частоту обращений к врачу амбулаторно в поликлиники и в станции скорой медицинской помощи, существенно снижает качество жизни и увеличивает смертность. При этом большинство госпитализаций в кардиологические стационары обусловлены либо остро возникшей, либо обострением (декомпенсацией) сердечной недостаточности. Декомпенсация ХСН является ключевой причиной смертности и регоспитализацииэтих пациентов, что приводит к возрастающей нагрузке на общественное здравоохранение, включая социальные и экономические аспекты. В то же время в последнюю декаду появилось множество новых направлений в подходах к лечению ХСН, основанных на данных высококачественных рандомизированных клинических исследований (РКИ) (2,3,4).
Таким образом, все выше перечисленноеобуславливает необходимость создания клинического руководства по ХСН с учетом всех мировых достижений, основанных на доказательной медицине по диагностике, лечению и профилактике сердечной недостаточности.
Цели и задачи создания клинического руководства
Цель: разработка данного руководства проводится с целью помочь медицинским работникам осуществлять своевременную диагностику и лечение больных с ХСН в соответствии с наилучшими доступными доказательствами.
Цели и задачи создания клинического руководства
Цель: разработка данного руководства проводится с целью помочь медицинским работникам осуществлять своевременную диагностику и лечение больных с ХСН в соответствии с наилучшими доступными доказательствами.
Задачи: создание современной стратегии для решения актуальных вопросов по диагностике, лечению и профилактике ХСН на уровне первичного, вторичного и третичного звеньев здравоохранения, основанной на принципах доказательной медицины, с использованием последних достижений мировой медицинской науки.
Ожидаемые результаты. Использование данного клинического руководства поможет кардиологам, врачам общей практики, семейным врачам, терапевтам, а также врачам других специальностей улучшить оказание квалифицированной медицинской помощи на различных уровнях здравоохранения пациентам с ХСН. Кроме того, ожидается, что внедрение данного клинического руководства позволит: 1) повысить выявление случаев ХСН, в том числе с сохраненной фракцией выброса; 2) определить правильную тактику ведения больных с ХСН; 3) увеличить назначение «квадротерапии» ХСН – базового лечения сердечной недостаточности, влияющего напрямую на прогноз и смертность у данных пациентов; 4) уменьшить число регоспитализаций при ХСН; 5) оптимизировать обоснованность надлежащего использования лекарственных средств для контроля сердечной недостаточности с целью профилактики декомпенсации ХСН.
Целевая группа клинического руководства
Клиническое руководство по диагностике и лечению ХСН рекомендуется применять к пациентам старше 18 лет. Руководство разработано, в основном, для кардиологов, терапевтов, семейных врачей, врачей общей практики, но при необходимости может быть использовано врачами других специальностей. Установление диагноза, назначение обследования и лечения входит в обязанности семейного врача и врача общей практики, который при необходимости и по показаниям направляет пациента на консультацию кардиолога или в стационар. В свою очередь, кардиолог и врачи стационара обязаны при консультации и выписке из стационара представить пациенту рекомендации, а также выписку с подробными рекомендациями для семейного врача/врача общей практики. В то же время необходимо отметить, что решение о стратегии ведения отдельного пациента с ХСН должно приниматься на основании данных рекомендаций в сочетании с клиническим опытом врача и с учетом особенностей пациента и течения заболевания. Рекомендации не отменяют индивидуальной ответственности медицинских работников за принятие соответствующих и точных решений с учетом состояния здоровья каждого пациента и после консультаций с этим пациентом или лицом, осуществляющим уход за пациентом, где это уместно и/или необходимо. В обязанности медицинского работника также входит проверка правил и положений, применяемых в КР к лекарствам и устройствам и соблюдение этических правил медицинской профессии.
Классификация
Классификация хронической сердечной недостаточности.
ХСН принято считать прогрессирующим состоянием. В связи с чем Американской ассоциацией сердца (АНА) предложена классификация ХСН по стадиям, которая предполагает развитие и прогрессирование патологического состояния в зависимости от этиологии и факторов риска развития СН на протяжении всего сердечно-сосудистого континуума с определением объема профилактических и лечебных вмешательств, тактику ведения этих больных.
Классификация ХСН по стадиям АНА/ACC/HFSA:
Стадия А: повышен риск развития СН. Имеются факторы риска, но нет симптомов и признаков СН (в настоящей момент или в анамнезе) или признаков структурного поражения сердца, включая повышение биомаркеров – натрийуретических пептидов (НУП).
Стадия В: пре-недостаточность. Нет симптомов и признаков СН (в настоящей момент или в анамнезе), но есть признаки структурного поражения сердца, нарушения его функции или повышение уровня НУП.
Стадия С: клиническая сердечная недостаточность. Есть симптомы и признаки СН (сейчас или в прошлом), вызванные нарушением структуры и/или функции сердца.
Стадия D: тяжелая сердечная недостаточность. Выраженные симптомы и признаки СН в покое, повторные госпитализации, несмотря на ведение в соответствии с действующими рекомендациями; рефрактерность или непереносимость лекарственных препаратов, назначенных в соответствии с действующими рекомендациями; потребность в таких серьезных вмешательствах, как пересадка сердца, механическая поддержка кровообращения или паллиативная помощь (2).
Стадии СН адаптированы из американского клинического руководства Hunt S.A., 2009 года (7) с учетом современных представлений по сердечно-сосудистому континууму, разработок и внедрений по медикаментозному и нефармакологическому лечению при ХСН в последние годы.
Стадии СН адаптированы из американского клинического руководства Hunt S.A., 2009 года (7) с учетом современных представлений по сердечно-сосудистому континууму, разработок и внедрений по медикаментозному и нефармакологическому лечению при ХСН в последние годы.
- Стадия А – предполагает развитие СН при наличии определенных факторов риска. Эта стадия подразумевает подверженность пациента высокому риску развития ХСН из-за наличия у него следующих факторов риска. Чаще всего - артериальной гипертензии, КБС, предиабета/сахарного диабета 2 типа, дислипидемии, ожирения, метаболического синдрома. Кроме того, выявление в семейном анамнезе случаев внезапной сердечной смерти, преждевременной КБС с развитием инфаркта миокарда, инсульта, кардиомиопатий, нарушений ритма, амилоидоза предполагает повышенный риск из-за наследственной отягощенности. Помимо этого, наличие в анамнезе приема кардиотоксичных препаратов, применяемых при химиотерапии: антрациклиновые антибиотики, трастузумаб, ингибиторы иммунных контрольных точек, алкилирующие агенты, ингибиторы тирозинкиназы или прием лекарств с потенциальной кардиотоксичностью при длительном применении: амфетамин, анаболические стероиды, эфедрин, амиодарон и др., либо история облучения органов грудной клетки, злостное курение, перенесенный COVID-19 также предполагает повышенный риск развития сердечной недостаточности.
- Стадия В –следующая стадия сердечно-сосудистого континуума, когда факторы риска уже привели к развитию структурных изменений с объективным их подтверждением, включая повышение уровня натрийуретических пептидов и систолической дисфункции ЛЖ, но еще отсутствуют клинические симптомы СН.
- Стадия С – уже выявляются явные признаки и симптомы ХСН на фоне структурных/ функциональных критериев сердечной недостаточности и повышения уровня натрийуретических пептидов.
- Стадия D- пациенты характеризуются тяжелыми симптомами и признаками СН в покое (III, IVпо NYHA), которые прогрессируют, несмотря на оптимальную медикаментозную и аппаратную терапию, нуждаются в механической поддержке кровообращения, трансплантации сердца и паллиативной помощи. Эту стадию называют еще терминальной (2).
Выделение стадий ХСН используется наряду с классификацией Нью-Йоркской ассоциации сердца (NYHA), по функциональным классам NYHA, поскольку клиническая симптоматика и переносимость физических нагрузок не всегда соответствуют структурным изменениям в сердце. Так, иногда выраженная систолическая дисфункция ЛЖ может протекать без особого ограничения физической активности, и, наоборот, при декомпенсации выраженная одышка может наблюдаться у пациентов с сохраненной ФВ. Кроме того, ФК ХСН может меняться, как в сторону ухудшения (прогрессирование заболевания), так и в сторону улучшения (на фоне лечения).
На основе NYHA для оценки выраженности симптомов выделяют четыре функциональных класса (ФК) сердечной недостаточности в зависимости от переносимости физической нагрузки (8). Классификация ХСН по NYHA (1964) представлена в таблице№3. ФК СН отражаются в диагнозе, в отличие от стадий ХСН.
Таблица 4. Классификация ХСН по NYHA
|
Функциональные классы ХСН
|
|
|
I ФК
|
Ограничения физической активности отсутствуют: привычная физическая активность не сопровождается быстрой утомляемостью, появлением одышки или сердцебиения. Повышенную нагрузку больной переносит, но она может сопровождаться одышкой и/или замедленным восстановлением сил.
|
|
II ФК
|
Незначительное ограничение физической активности: в покое симптомы отсутствуют, привычная физическая активность сопровождается утомляемостью, одышкой или сердцебиением.
|
|
III ФК
|
Заметное ограничение физической активности: в покое симптомы отсутствуют, физическая активность меньшей интенсивности по сравнению с привычными нагрузками сопровождается появлением симптомов.
|
|
IV ФК
|
Невозможность выполнить какую-либо физическую нагрузку без появления дискомфорта; симптомы СН присутствуют в покое и усиливаются при минимальной физической активности.
|
Согласно новой терминологии Eвропейскогообщества кардиологов (ЕSC), которую поддержала и приняла АHA, сердечная недостаточность подразделяется на фенотипы по фракции выброса (ФВ) левого желудочка (ЛЖ), которые не отражаются в диагнозе, но определяют объем вмешательств, основанных на высококачественных РКИ:
1. СН со сниженной ФВ ЛЖ (СНнФВ) определяется при ее значении ≤40%, т.е. у пациентов со значительным снижением систолической функции ЛЖ;
2. СН с умеренным снижением ФВ ЛЖ (СНусФВ) от 41 до 49%, т.е. пациенты имеют умеренное снижение систолической функции ЛЖ;
3. СН с сохраненной ФВ ЛЖ (СНсФВ), т.е. пациенты с ФВ равной или превышающей 50%, с симптомами/признаками СН, с признаками структурных и/или функциональных нарушений сердечной деятельности и/или повышенным содержанием натрийуретических пептидов (BNP/NT-proBNP);
4. СН с улучшенной ФВ ЛЖ при условии с исходной ФВ ЛЖ ≤40%, с последующим приростом ФВ ЛЖ ≥10% от исходного уровня, подтвержденным при повторном измерении ФВ ЛЖ >40% (2,3).
Этиология и патогенез
Этиология ХСН
ХСН является исходом практически всех сердечно-сосудистых заболеваний и другой патологии. Чаще всего это осложнение заболеваний, приводящих к поражению сердечной мышцы вследствие ишемии, некроза, воспаления, повышения сосудистого сопротивления, перегрузки, малого/высокого сердечного выброса и т.д. (3). Основные заболевания, которые могут быть этиологическими причинами ХСН приведены ниже в таблице №4.
Таблица 5. Причины хронической сердечной недостаточности
| 1. КБС (постинфарктный кардиосклероз, нарушения ритма и проводимости) |
| 2. Артериальная гипертензия |
| 3. Приобретенные и врожденные пороки сердца |
| 4. Кардиомиопатии: дилатационная, гипертрофическая, рестриктивная, некомпактная кардиомиопатия, аритмогенная дисплазия правого желудочка, не классифицируемые |
| 5. Миокардиты: инфекционные, токсические, аутоимунные |
| 6. Нарушения ритма (предсердные тахиаритмии и желудочковые аритмии) |
| 7. Эндокринные заболевания: СД2 типа, ожирение, гипер/гипотиреоз, феохромоцитома, акромегалия, синдром Кушинга и др. |
| 8. Токсические поражения миокарда (алкоголь, наркотики, лекарства (цитостатики, антиаритмические средства и др.), тяжелые металлы (ртуть, кобальт, мышьяк и др.) |
| 9. Болезни перикарда, эндокарда |
| 10. Хронические заболевания легких, приводящие к развитию хронического легочного сердца (ХОБЛ, туберкулез и др.) |
| 11. Инфильтративные заболевания, болезни накопления и коллагенозы (амилоидоз, саркаидоз, неоплазия, ДЗСТ, гемохроматоз, болезнь Фабри) |
| 12. Состояния с высоким сердечным выбросом (анемия, сепсис, гипертиреоз, болезнь Педжета, артериовенозная фистула) |
| 13. Перегрузка объемом (почечная недостаточность, введение жидкости в послеоперационном периоде) |
| 14. Нервно-мышечная патология (мышечная дистрофия, атаксия Фридрейха) |
| 15. Прочие (дефицит витаминов, микроэлементов, деформация грудной клетки и др.) |
Эпидемиология
Эпидемиология
По данным ВОЗ более 64,3 млн человек страдают ХСН. Распространенность ХСН составляет 1-2% среди взрослых жителей мира. Вследствие старения населения планеты и успехов медицины в лечении сердечно-сосудистых заболеваний общая заболеваемость СН увеличивается. Однако в развитых странах заболеваемость может снижаться с поправкой на возраст (4,9). В настоящее время,в странах Европы она составляет около 3 на 1000 человеко-лет (все возрастные группы) или около 5 на 1000 человеко-лет у взрослых.
Поскольку исследования обычно включают только выявленные или диагностированные случаи СН, истинная распространенность, вероятно выше. Кроме того, она увеличивается с возрастом: примерно с 1% у лиц младше 55 лет до 10% в возрасте 70 лет и старше.
Согласно регистру ЕSC среди госпитализированных пациентов СНнФВ имеют около 50%, в то время как среди амбулаторных пациентов СНнФВ имеют 60%, 24% - СНусФВ и у 16% - СНсФВ, женщины преобладают при фенотипе с сохраненной ФВ (4).
По данным исследования ЭПОХА, ЭПОХА-ХСН в Российской федерации СН диагностируется в 7-10% случаев, причем наличие жестких критериев увеличивает число больных с ХСН III-IVФК, а использование более мягких критериев расширяет популяцию пациентов с I-II ФК ХСН. Выявилось значительное увеличение пациентов с ХСН за последние два десятилетия лет с 4,9 до 8,5%, при этом абсолютное число пациентов с ХСН увеличилось с 1998 года более, чем в 2 раза (с7,18 до 12,35 млн человек), а больных тяжелой СН III-IVФК – с 1,8 до 3,1% (с 1,76 до 4,5 млн человек) (10,11).
Диагностика
Диагностика ХСН
Диагностика ХСН основана на установлении: 1) симптомов и/или признаков СН, 2) уровня НУП3) объективных доказательств сердечной дисфункции. Ключевую роль играет установление этиологии заболевания, приведшего к СН. Это позволяет определить стратегию как диагностического поиска, так и лечебных, профилактических вмешательств. Необходимо проведение комплексной оценки состояния больного с учетом жалоб, анамнеза, объективного обследования, данных лабораторных исследований, в том числе натрийуретических пептидов (НУП), ЭКГ, ЭхоКГ, рентгенографии органов грудной клетки, и других методов, позволяющих уточнить не только этиологию основного и сопутствующих заболеваний, но и степень систолической и диастолической дисфункции миокарда, структурных и функциональных повреждений сердца и других органов (2,3).
Рисунок 1. Диагностический алгоритм при сердечной недостаточности
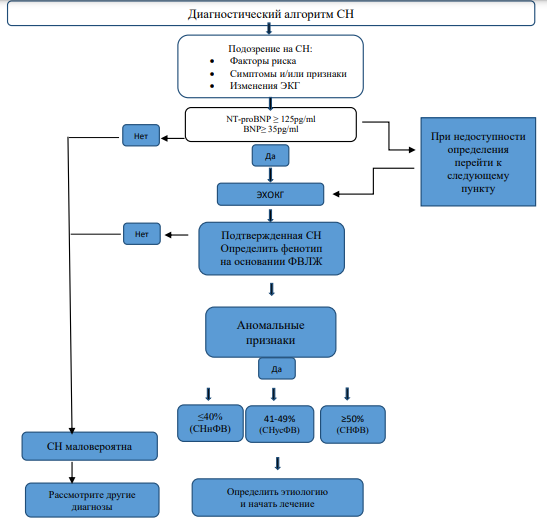
Примечание: СНнФВ – сердечная недостаточность с низкой фракцией выброса, СНусФВ - сердечная недостаточность с умеренно сниженной фракцией выброса, СНсФВ – сердечная недостаточность с сохранной фракцией выброса, BNP – натрийуретический пептид В-типа, NT-proBNP = N-концевой натрийуретический пептид про-В-типа. Адаптировано ESC, 2021.
При выявлении патологических изменений со стороны уровня NТ-proBNP и/или данных ЭХОКГ семейным врачом/врачом общей практики, необходимо направить пациента к кардиологу.
Симптомы и признаки ХСН
Симптомы и признаки ХСН
Длительное время ХСН может протекать бессимптомно. Сбор анамнеза и физикальное обследование остаются краеугольным камнем в оценке пациентов с СН. При опросе и объективном обследовании обязательно выявление симптомов и признаков основного заболевания, вызвавшего развитие сердечной недостаточности для определения стратегии диагностики и лечения. Не менее важно определение сопутствующих заболеваний, лечение которых может в разной степени влиять на терапию ХСН.
При сборе анамнеза необходимо уделить особое внимание поиску причинных факторов развития ХСН: артериальной гипертензии (АГ), коронарной болезни сердца (КБС), постинфарктной, ишемической кардиомиопатии, СД 2 типа, предиабета, ожирения, нарушений липидного обмена, атеросклероза периферических артерий, ревматической лихорадки и клапанных поражений сердца, врожденных пороков сердца, острого/перенесенного миокардита, инфекционных и паразитарных заболеваний, которые могут стать причиной миокардита (ОРВИ, дифтерия, скарлатина, ангина и т.д.), воздействия кардиотоксических агентов, включая лекарственные препараты (химиотерапия, лечение противотуберкулезными препаратами, винкристином и т.д.), недавней беременности, приема алкоголя (в настоящем или в прошлом), курения, системных заболеваний соединительной ткани, заболеваний щитовидной железы, бронхо-легочной системы, наследственной патологии и др.
При сборе семейного анамнеза необходимо обратить внимание на наличие у близких родственников следующих заболеваний: инфаркта миокарда или мозгового инсульта, внезапной смерти, кардиомиопатии, системных заболеваний соединительной ткани, мышечной дистрофии и другой генетически обусловленной патологии. У пациентов с подозрением на наследственную кардиомиопатию следует собрать генеалогический анамнез, в виде генеалогического древа, включающий как минимум 3 поколения исследуемого пробанда. Например, генетические варианты встречаются у 25– 40% пациентов с дилатационной кардиомиопатией с положительным семейным анамнезом, а также у 10–30% пациентов без установленного семейного анамнеза (19, 20).
Представляется важным выявление факторов, которые способствовали декомпенсации ХСН (перенесенная инфекция, анемия, лихорадка, чрезмерная физическая нагрузка, обильный прием поваренной соли и/или жидкости, прием лекарственных препаратов (НПВС, антагонисты кальция, антиаритмические препараты) и др.
Важнейшим компонентом сбора анамнеза и физикального обследования является оценка клинического застоя, т. е. тех признаков и симптомов, которые возникают в результате повышенного давления наполнения сердца. Выраженность застойных явлений напрямую связана с качеством жизни и прогнозом, а также является целью коррекции приема медикаментов и/или различного рода инвазивных/аппаратных вмешательств.
Таблица 6. Симптомы и признаки сердечной недостаточности
|
Симптомы
|
Признаки
|
|
Типичные
|
Более специфичные
|
|
Одышка
|
Повышенное давление в яремной вене
|
|
Ортопноэ
|
Гепато-югулярный рефлюкс
|
|
Пароксизмальная ночная одышка
|
Третий тон сердца (ритм галопа)
|
|
Снижение толерантности к физическим нагрузкам
|
Разлитой, усиленный и смещенный латерально верхушечный толчок
|
|
Утомляемость, усталость, увеличенное время восстановления после физической нагрузки
|
Отеки голеней
|
|
Отеки голеней
|
|
|
Менее типичные
|
Менее специфичные
|
|
Ночной кашель
|
Увеличение веса (˃2 кг в неделю)
|
|
Хрипы
|
Снижение веса (при тяжелой СН)
|
|
Ощущение отечности
|
Истощение (кахексия)
|
|
Потеря аппетита
|
Сердечные шумы
|
|
Энцефалопатия (особенно у пожилых)
|
Периферический отек (голеностопный, крестцовый, мошоночный)
|
|
Депрессия
|
Легочная крепитация
|
|
Сердцебиение
|
Плевральный выпот
|
|
Головокружение
|
Тахикардия
|
|
Обморок
|
Дыхание Чейн-Стокса
|
|
Бендопноэ (одышка, возникающая при наклоне туловища вперед)
|
Гепатомегалия
|
|
|
Перикардиальный выпот
|
|
|
Асцит, анасарка
|
|
|
Холодные конечности
|
|
|
Олигоурия
|
|
|
Узкое пульсовое давление
|
Необходимо учитывать, что все вышеперечисленные симптомы и признаки появляются и прогрессируют при декомпенсации, затем после лечения диуретиками и базовыми препаратами могут уменьшаться и даже нивелироваться (2,3).
Натрийуретические пептиды и другие лабораторные тесты при ХСН
Для исключения диагноза СН рекомендуется в начале провести оценку уровня НУП в плазме у всех пациентов с симптомами СН. Диагноз СН маловероятен, если уровень мозгового НУП (BNP) в крови ≤35пг/мл или N-концевого фрагмента про мозгового НУП (NT-proBNP) ≤125 пг/мл (21,22). Обнаружение повышенных уровней НУП в сыворотке крови подтверждает диагноз СН и помогает провести оценку прогноза. Однако, следует отметить, что существует множество кардиальных и не кардиальных причин повышения НУП. И наоборот, концентрации НУП могут быть непропорционально низкими у пациентов с ожирением (22).Таким образом, повышенный уровень НУП увеличивает вероятность наличия ХСН, когда диагноз ясен, однако он не должен использоваться изолированно для подтверждения или исключения диагноза ХСН.
Таким образом, верхние пределы нормы при исключении острой патологии составляют 35 пг/мл для BNP и 125 пг/мл для NT-proBNP.
Причины повышенных концентраций натрийуретических пептидов
- Кардиальные: СН, включая СН ПЖ, ОКС, ТЭЛА, миокардиты, перикардиты, ГЛЖ, ГКМП и другие кардиомиопатии, заболевания клапанов, врожденные пороки сердца, предсердные и желудочковые тахиаритмии, контузия сердца, кардиоверсия, в том числе ИКД, хирургические вмешательства на сердце, ЛАГ
-
Не кардиальные: пожилой возраст, ишемический инсульт, субарахноидальное кровотечение, острое или хроническое заболевание почек, печеночная дисфункция, паранеопластический синдром, химиотерапия рака, ХОБЛ, тяжелые инфекции (включая пневмонии и сепсис), обструктивное апное во сне, тяжелые ожоги, анемия, выраженные метаболические и гормональные нарушения (н: тиреотоксикоз, диабетический кетоацидоз).
Ключевые принципы интерпретации уровня натрийуретических пептидов
- Исследование уровня НУП должно применяться как дополнение к оценке клинической картины СН
- НУП не определяет причину СН, в связи с чем повышение уровня НУП должно рассматриваться совместно с результатами визуализирующих методов исследования
-
У пациентов с ожирением наблюдаются более низкие НУП, поэтому применимо использование низких пороговых концентраций (50% от исходного).
Другие лабораторные тесты у пациентов с СН позволяют уточнить наличие основного сердечно-сосудистого или иного заболевания, сопутствующей патологии, провести дифференциальную диагностику, оценить функцию внутренних органов, наличие провоцирующих/усугубляющих декомпенсацию факторов, определить тактику и оценить эффективность лечения, а также провести мониторинг побочных эффектов лекарственных средств. Перечень основных лабораторных тестов у больных с ХСН представлен в таблице 6.
Таблица 7. Перечень основных лабораторных тестов у больных с ХСН
|
Обязательные анализы
|
По показаниям
|
|
1. Общий анализ крови
2. Общий анализ мочи 3. Натрийуретические пептиды (BNP/NT-proBNP) 4. Креатинин крови с рСКФ 5. Сахар крови натощак (гликированный гемоглобин, 2-х часовая постпрандиальная гликемия у пациентов с предиабетом и СД 2 типа) 6. Электролиты крови (калий, магний, натрий сыворотки крови) 7. Липидный спектр 8. Оценка функции печени (АЛТ, АСТ) 9. Сатурация кислорода в крови |
1. Ревмотесты (АСЛО, СРБ) – у больных с ревматической болезнью сердца, миокардитом
2. Тропонины крови – при подозрении на острый коронарный синдром 3. МНО, ПТИ – у больных с мерцательной аритмией или получающих антикоагулянты 4. Общий белок, альбумин крови 5. ТТГ, Т4 (свободный) – выявление дисфункции щитовидной железы 6. Статус железа (железо сыворотки крови, % насыщения трансферрина и ферритин) 7. Специфический лабораторный поиск в соответствии с клиникой |
Примечание: АЛТ – аланиновая аминотрансфераза, АСЛО – антистрептолизин –О, АСТ – аспарагиновая аминотрансфераза, МНО – международное нормализованное отношение, ПТИ – протромбиновый индекс, СРБ – «С» реактивный белок.
Тщательный лабораторный контроль необходим на всех этапах лекарственной терапии, назначаемой по поводу ХСН: в момент ее инициации, при повышении доз препаратов, при наблюдении за ходом лечения. В первую очередь, это касается уровня электролитов крови и функции почек. Так, гипокалемия является достаточно частым побочным эффектом терапии диуретиками и может стать причиной фатальных нарушений ритма, а также увеличивает риск развития дигиталисной интоксикации. В то же время гиперкалемия может развиться на фоне длительного приема ИАПФ, блокаторов рецепторов ангиотензина АII (БРА) и антагонистов альдостерона. Развитие гипонатриемии, анемии и дисфункции почек может быть признаком прогрессирования ХСН и ассоциируется с неблагоприятным прогнозом. При снижении функции почек может потребоваться коррекция доз препаратов (диуретики, ингибиторы РААС, АРНИ, препараты дигиталиса и т.д). При увеличении уровня креатинина в крови целесообразно определение рСКФ, которая в большинстве случаев наиболее точно отражает степень нарушения функции почек.
Возможные отклонения лабораторных тестов у больныхХСН, их интерпретация, поиск причин и действия врача представлена в таблице 7.
Таблица 8. Возможные отклонения лабораторных анализов у пациентов с ХСН
|
Результат анализа
|
Интерпретация/ причины
|
Дальнейшие действия
|
|
Анемия: (Hb<130 г/л у мужчин и <120 г/л у женщин)
|
- клинические симптомы сходны с симптомами при ХСН: слабость, сердцебиение, одышка, может усугублять течение ХСН
- гемодилюция, - потеря железа |
- железо сыворотки крови, % насыщения трансферрина и ферритин, установить источник кровотечения, заболевания ЖКТ, злокачественные образования, ХПН, заболевания крови
- коррекция анемии |
|
Повышение СОЭ, лейкоцитоз
|
- наличие системного воспаления, миокардит (ревмокардит) как возможная причина ХСН
-сопутствующие заболевания: ХОБЛ, инфекция мочевыводящих путей и др. |
- продолжить диагностический поиск
- лечение инфекций |
|
Протеинурия, бактериурия в общем анализе мочи
|
- как маркер поражения почек при ХСН,
- наличие заболевания почек |
- суточная протеинурия, анализ мочи по Нечипоренко, посев мочи на флору и чувствительность к антибиотикам, УЗИ почек, мочевого пузыря
|
|
Почечная недостаточность (СКФ<60 мл/мин)
|
- «застойная почка»
- сахарный диабет -дегидратация, - заболевание почек, -терапия (ИАПФ/БРА/АРНИ, АМКР, иSGLT2) - Прием НПВС или других нефротоксичных препаратов |
- определить рСКФ, уровень калия, остаточного азота крови, протеинурии, гликемии
-оценить необходимость коррекции дозы иАПФ/БРА/АРНИ, АМКР, иSGLT - отменить нефротоксичные препараты |
|
Дисбаланс электролитов: - гипонатриемия (Na+<135 ммоль/л)
|
- гемодилюция,
- массивная диуретическая терапия (особенно тиазиды) |
- ограничение приема жидкости,
- коррекция дозы диуретиков, - ультрафильтрация, - антагонисты вазопрессина |
|
- гипернатриемия (Na+>150 ммоль/л)
|
- массивный диурез
- неадекватный прием жидкости (<800 мл/сут) |
- оценить диурез и количество выпитой жидкости
- провести коррекцию терапии |
|
- гипокалиемия (К + < 3,5 ммоль/л)
|
- высокий риск аритмий
- потеря К+ (диуретики) - вторичный гиперальдостеронизм |
- коррекция дозы АМКР, ИАПФ/БРА,
- коррекция гипокалемии, расчет дозы препаратов калия (в/в) |
|
- гиперкалиемия (К + >5,5 ммоль/л)
|
- высокий риск серьезных аритмий
- возможна ХПН - прием АМКР, ИАПФ/БРА, препаратов калия |
- отменить препараты калия, АМКР
- коррекция доз ИАПФ/БРА/АРНИ, - контроль функции почек |
|
Гипергликемия (сахар крови натощак>6,1 ммоль/л)
|
- возможен сахарный диабет или предиабет;
|
- опросник по FINDRISK -2-х часовая постпрандиальная гликемия, гликогемоглобин, оральный тест на толерантность к глюкозе,
- гипогликемическая диета - коррекция углеводных нарушений |
|
Дислипидемия (ОХС, ЛПНП-ХС, ЛПВП-ХС, ТГ)
|
- атеросклероз коронарных артерий, КБС, как возможная причина ХСН
- наличие нефротического синдрома |
- провести диагностический поиск для исключения КБС и нефротического синдрома
- коррекция дислипидемии |
|
Повышение уровня печеночных ферментов (АЛТ, АСТ, билирубин)
|
- нарушение функции печени (застойная печень) при ХСН,
- поражение печени (токсины, гепатит, жировой гепатоз, цирроз и т.д.) |
- исключить вирусный гепатит, жировой гепатоз и токсическое поражение печени
|
|
Повышение уровня тропонинов
|
- небольшое повышение возможно при ХСН
- высокие титры - наличие острого повреждения миокарда (инфаркт миокарда) - другие причины: миокардит, сепсис, ХПН, тромбоэмболия ветвей легочной артерии |
- диагностика и терапия ОКС
-диагностический поиск для исключения других причин |
|
Изменение показателей ТТГ, Т3, Т4 (свободный)
|
- дисфункция щитовидной железы с гипер-гипотиреозом
- прием амиодарона |
- УЗИ щитовидной железы, при необходимости биопсия узлов
- коррекция дисфункции щитовидной железы - оценить безопасность терапии амиодароном - диагностика поражения амиодароном других органов |
|
Повышение уровня АСЛО, СРБ
|
- ревматическая лихорадка, миокардит, как возможная причина ХСН
|
- провести лечение острой/повторной ревматической лихорадки
- ЭхоКГ для оценки наличия поражения клапанов сердца, вальвулита |
|
Снижение уровня общего белка и альбумина в крови: (альбумин <30 г/л)
|
-протеинурия в результате рено-кардиального/кардиоренального синдрома, как причина отечного синдрома (гипоонкотические отеки)
- заболевание печени, «кардиальный» цирроз печени |
- провести дифференциальную диагностику с заболеваниями почек, печени
- провести коррекцию уровня альбумина |
|
Уровень МНО, ПТИ
|
контроль терапии антикоагулянтами
|
- провести коррекцию дозы антикоагулянтов
- оценить функцию печени при гипокоагуляции |
Примечание: АЛТ – аланиновая аминотрансфераза, АСЛО – антистрептолизин –О, АСТ – аспарагиновая аминотрансфераза, и-АПФ – ингибиторы ангиотензин превращающего фермента, БАР – блокаторы рецепторов ангиотензиа II, ЛПВП-ХС – холестерин липопротеинов высокой плотности, ЛПНП-ХС – холестерин липопротеиннов низкой плотности, МНО – международное нормализованное отношение, ОХС – общий холестерин, ПТИ – протромбиновый индекс, СОЭ – скорость оседания эритроцитов, СРБ – С реактивный белок, ТГ – триглицериды
Таблица 9. Рекомендуемые диагностические тесты для всех пациентов с подозрением на хроническую сердечную недостаточность
|
Рекомендации
|
Класс
|
Уровень
|
|
BNP/NT-proBNP
|
I
|
В
|
|
ЭКГ в 12 отведениях
|
I
|
С
|
|
Трансторакальная эхокардиография
|
I
|
С
|
|
Рентгенография органов грудной клетки
|
I
|
С
|
|
Стандартные анализы крови на наличие сопутствующих заболеваний, включая общий анализ крови, уровень креатинина и электролитов, трансаминазы, функцию щитовидной железы, уровень глюкозы натощак и HbA1c, липидный профиль, статус железа (железо сыворотки крови, % насышения ферритина и ферритин)
|
I
|
С
|
Для уточнения этиологии ХСН необходимы дополнительные и, иногда, специфические методы исследования представленные в таблице 9.
Таблица 10. Перечень ключевых диагностических исследований в зависимости от этиологии и клинических проявлений
|
Причина
|
Примеры
|
Ключевые диагностические исследования
|
|
КБС
|
Инфаркт миокарда;
Стенокардия/аналог стенокардии; Аритмии |
Инвазивная коронарография;
МСКТ коронарография; Нагрузочные тесты с визуализацией (ЭхоКГ, МРТ) |
|
АГ
|
СН с сохранной ФВ;
Злокачественная гипертензия/острый отек легких |
Суточное мониторирование АД;
Плазменные метанефрины, визуализация почечных артерий, надпочечников, сосудов Ренин, альдостерон, кортизол |
|
Поражения клапанов сердца
|
Первичное клапанное заболевание, например, стеноз аорты;
Вторичное клапанное заболевание, например, функциональная регургитаци я; Врожденный порок клапана |
ЭхоКГ чреспищеводное/стрессовое
|
|
Аритмии
|
Предсердные тахиаритмии;
Желудочковые аритмии |
ЭКГ;
Электрофизиологическое исследование по показаниям |
|
Кардиомиопатии
|
Гипертрофическая, Дилатационная, Рестриктивная, Перипартальная, синдром Такоцубо, аритмогенная, кардиомиопатия ПЖ, токсины: алкоголь, кокаин, железо, медь
|
МРТ, генетическое тестирование;
Катетеризация правых и левых отделов сердца; МРТ, ангиография; Скрининг микроэлементов, токсинов, функциональные печеночные тесты, гаммаглютаминтрансфераза |
|
Врожденный порок сердца
|
Врожденная исправленная/восстановленная транспозиция магистральных артерий;
Поражения шунта; Восстановленная тетрада Фалло; Аномалия Эбштейна |
МРТ, ангиография
|
|
Инфекции
|
Вирусный миокардит;
Болезнь Шагаса; ВИЧ; Болезнь Лайма |
МРТ, биопсия сердца;
Скрининг инфекций, вирусов |
|
Лекарственно индуцированные
|
Антрациклины;
Трастузумаб; Ингибиторы сосудистого эндотелиального фактора роста (VEGF); Ингибиторы иммунных контрольных точек; Ингибиторы протеасом; Ингибиторы ревматоидного фактора+митогенактивированной протеинкиназы |
|
|
Инфильтративные процессы
|
Амилоидоз;
Саркоидоз; Неопластический синдром |
Иммунофиксационный электрофорез сыворотки и мочи, скрининг на наличие моноклональных легких цепей иммуноглобулинов, определение концентрации свободных легких цепей в сыворотке;
Сцинтиграфия костей пирофосфатом технеция, МРТ, КТ-ПЭТ, биопсия сердца; Ангиотензин превращающий фермент, МРТ, фтордезоксиглюкозная-ПЭТ, КТ грудной клетки, биопсия сердца; МРТ |
|
Болезни накопления
|
Гемохроматоз;
БолезньФабри; Болезни накопления гликогена |
Исследования железа, генетическое тестирование, МРТ (визуализация T2 *);
Биопсия, a-галактозидаза A, генетическое тестирование, МРТ (картирование T1) |
|
Эндомиокардиальные поражения
|
Лучевая терапия;
Эндомиокардиальный фиброз/эозинофилия; Карциноид |
МРТ, ЭМБ (биопсия);
Суточная моча на 5-гидроксииндолуксусную кислоту |
|
Перикардиальные поражения
|
Кальцификация;
Инфильтративные процессы |
КТ грудной клетки, МРТ, катетеризация правых и левых отделов сердца
|
|
Нервно-мышечное заболевание
|
Атаксия Фридрейха;
Мышечная дистрофия |
Исследования нервной проводимости, электромиограмма, Генетическое тестирование Креатинкиназа, электромиограмма, генетическое тестирование
|
|
Легочная гипертензия различной этиологии
|
ХОБЛ, бронхиальная астма, бронхоэктатическая болезнь, туберкулез, хроническая ТЭЛА, инфаркт ПЖ ВПС с перегрузкой правых отделов, шунты слева – направо Цирроз печени ДЗСТ: СКВ, Склеродермия…
|
Анализ газов крови, ФВД, спирометрия, ЭхоКГ, ЭКГ, Rграфия органов грудной клетки, КТ грудной клетки, МРТ, катетеризация правых и левых отделов сердца ЭхоКГ, ЭКГ, R-графия органов грудной клетки, КТ грудной клетки, МРТ, катетеризация правых и левых отделов сердца, газы крови Печеночные тесты, доплерэхография, УЗИ, КТ, МРТ биопсия печени/ эластография Лабораторное специфическое тестирование, биопсия
|
Визуализирующие методы обследования
Визуализация сердца играет ключевую роль при первоначальном обследовании лиц с подозрением на СН и, при наличии показаний, при периодическом обследовании пациентов с СН. После сбора анамнеза и физикального обследования комплексная трансторакальная ЭхоКГ является наиболее полезным первоначальным диагностическим тестом, учитывая огромный объем предоставляемой диагностической и прогностической информации. Определение ФВ ЛЖ является фундаментальным шагом для классификации СН и определения научно обоснованной фармакологической и аппаратной терапии. В определенных ситуациях ЭхоКГ не может точно оценить структуру и/или функцию сердца или требуется дополнительная информация для определения причины сердечной дисфункции. Другие методы визуализации, такие как магнитная резонансная томография сердца (МРТ), однофотонная эмиссионная компьютерная томография (ОФЭКТ) или радионуклидная вентрикулография, позитронно-эмиссионная томография (ПЭТ) или КТ сердца или инвазивная коронарная ангиография, могут предоставить дополнительную и дополняющую ультразвуковое исследование сердца информацию.
Визуализация сердца играет ключевую роль при первоначальном обследовании лиц с подозрением на СН и, при наличии показаний, при периодическом обследовании пациентов с СН. После сбора анамнеза и физикального обследования комплексная трансторакальная ЭхоКГ является наиболее полезным первоначальным диагностическим тестом, учитывая огромный объем предоставляемой диагностической и прогностической информации. Определение ФВ ЛЖ является фундаментальным шагом для классификации СН и определения научно обоснованной фармакологической и аппаратной терапии. В определенных ситуациях ЭхоКГ не может точно оценить структуру и/или функцию сердца или требуется дополнительная информация для определения причины сердечной дисфункции. Другие методы визуализации, такие как магнитная резонансная томография сердца (МРТ), однофотонная эмиссионная компьютерная томография (ОФЭКТ) или радионуклидная вентрикулография, позитронно-эмиссионная томография (ПЭТ) или КТ сердца или инвазивная коронарная ангиография, могут предоставить дополнительную и дополняющую ультразвуковое исследование сердца информацию.
Рентгенография грудной клетки является полезным начальным диагностическим тестом для оценки пациентов с признаками и симптомами СН, поскольку она позволяет оценить кардиомегалию, наличие легочного венозного застоя, интерстициального или альвеолярного отека легких, выявить альтернативные причины сердечных, легочных и других заболеваний, которые могут вызывать или способствовать СН.
Пациентам с подозрением или впервые выявленной СН во время первоначального обследования следует проводить трансторакальную ЭхоКГ для оценки структуры и функции сердца.
Эхокардиография
Трансторакальная эхокардиография (М-режим, 2D, 3D, тканевое доплерографическое исследование) является наиболее доступным, безопасным, портативным и удобным для пациентов методом исследования, который позволяет получить наибольшую информацию по оценке структур и объемов сердца при ХСН, в том числе в экстренных случаях. При трансторакальной ЭхоКГ проводится оценка структур сердца - полостей, стенок и клапанов, наличие врожденных и приобретенных пороков, выявление клапанных вегетаций и внутрисердечных тромбов. Все клапаны оцениваются на предмет анатомических нарушений и нарушений кровотока. измерение давления в лёгочной артерии и центрального венозного давления. Кроме того, проводится количественная оценка объемов ЛЖ, геометрии ЛЖ, массы миокарда, размеров левого предсердия (ЛП), количественная оценка объемов ЛП, оценка корня аорты, ПЖ, правого предсердия. легочной артерии, трансклапанных и иных потоков, показателей деформации миокарда желудочков и предсердий для оценки не только систолической, но и диастолической функции и оценке давления наполнения ЛЖ и в ЛП. Градиент регургитации трикуспидального клапана в сочетании с диаметром нижней полой вены и ее реакцией во время дыхания позволяет оценить систолическое давление в легочной артерии и центральное венозное давление. Показатели деформации миокарда, такие как глобальная продольная деформация, могут идентифицировать субклиническую систолическую дисфункцию ЛЖ, которая связана с повышенным риском развития СН или повторных госпитализаций по поводу СН. По показаниям проводится чрез пищеводная ЭхоКГ, внутрисосудистое ЭхоКГ. С учетом безопасности трансторакальная ЭхоКГ позволяет проводить исследование сердца и сосудов повторно в динамике и в необходимом объеме (23, 2).
Эхокардиография
Трансторакальная эхокардиография (М-режим, 2D, 3D, тканевое доплерографическое исследование) является наиболее доступным, безопасным, портативным и удобным для пациентов методом исследования, который позволяет получить наибольшую информацию по оценке структур и объемов сердца при ХСН, в том числе в экстренных случаях. При трансторакальной ЭхоКГ проводится оценка структур сердца - полостей, стенок и клапанов, наличие врожденных и приобретенных пороков, выявление клапанных вегетаций и внутрисердечных тромбов. Все клапаны оцениваются на предмет анатомических нарушений и нарушений кровотока. измерение давления в лёгочной артерии и центрального венозного давления. Кроме того, проводится количественная оценка объемов ЛЖ, геометрии ЛЖ, массы миокарда, размеров левого предсердия (ЛП), количественная оценка объемов ЛП, оценка корня аорты, ПЖ, правого предсердия. легочной артерии, трансклапанных и иных потоков, показателей деформации миокарда желудочков и предсердий для оценки не только систолической, но и диастолической функции и оценке давления наполнения ЛЖ и в ЛП. Градиент регургитации трикуспидального клапана в сочетании с диаметром нижней полой вены и ее реакцией во время дыхания позволяет оценить систолическое давление в легочной артерии и центральное венозное давление. Показатели деформации миокарда, такие как глобальная продольная деформация, могут идентифицировать субклиническую систолическую дисфункцию ЛЖ, которая связана с повышенным риском развития СН или повторных госпитализаций по поводу СН. По показаниям проводится чрез пищеводная ЭхоКГ, внутрисосудистое ЭхоКГ. С учетом безопасности трансторакальная ЭхоКГ позволяет проводить исследование сердца и сосудов повторно в динамике и в необходимом объеме (23, 2).
В настоящее время ХСН классифицируется на фенотипы по эхокардиографическим данным ФВ ЛЖ, таблица 10.
Таблица 11. Критерии фенотипов ХСН
|
Тип СН
|
СНнФВ
|
СНусФВ
|
СНсФВ
|
|
Критерии
|
1.Симптомы± Признаки1
|
Симптомы± Признаки1
|
Симптомы± Признаки1
|
|
|
2.ФВ ЛЖ ≤ 40%
|
ФВ ЛЖ2 41 - 49%
|
ФВ ЛЖ ≥50%
|
|
|
-
|
-
|
Объективные доказательства структурных и/или функциональных аномалий сердца, соответствующих наличию диастолической дисфункции ЛЖ/повышенного давления наполнения ЛЖ, включая повышенное содержание натрийуретических пептидов3
|
СНнФВ – СН с низкой ФВ, СНусФВ – СН с умеренно сниженной ФВ, СНсФВ – СН с сохраненной ФВ.
1 – Признаки могут отсутствовать на ранних стадиях СН, СНсФВ и у пациентов, получающих оптимальное лечение
2 – Для диагностики СНусФВ наличие других признаков структурного заболевания сердца (например, увеличение левого размера предсердия, гипертрофия ЛЖ или признаки нарушения наполнения ЛЖ) делает диагноз более вероятным
3 – Для диагностики СНсФВ чем больше количество признаков, тем выше вероятность СНсФВ
2 – Для диагностики СНусФВ наличие других признаков структурного заболевания сердца (например, увеличение левого размера предсердия, гипертрофия ЛЖ или признаки нарушения наполнения ЛЖ) делает диагноз более вероятным
3 – Для диагностики СНсФВ чем больше количество признаков, тем выше вероятность СНсФВ
Кроме того, выделяют еще фенотип «СН с улучшенной ФВ ЛЖ» – для ситуаций, когда исходная СН с ФВ ≤40% и увеличением ФВ ≥10%, если при повторном измерении ФВ ЛЖ ˃ 40% на фоне проводимого лечения. Причем, такие пациенты должны продолжать то же лечение, которое было назначено на фоне более низкой ФВ. Такое подразделение на фенотипы определяется дифференцированным подходом к лечению, основанному на результатах РКИ (2,4).
Диагноз СНусФВ требует наличия симптомов и/или признаков СН и умеренно сниженной ФВ (41-49%). Наличие повышенных BNP ≥35 пг/мл или NT-proBNP ≥125 пг/мл) и другие свидетельства структурной болезни сердца (увеличение размера ЛП, ГЛЖ или эхокардиографические измерения наполнения ЛЖ) делают диагноз более вероятным, но не являются обязательными для диагностики, если есть уверенность в измерении ФВЛЖ.
Клинические признаки и симптомы, факторы риска, модели ремоделирования сердца и исходы в категориях ФВ ЛЖ при СН во многом совпадают у пациентов с СНусФВ и СНнФВ, чем при СНсФВ. Однако амбулаторные пациенты с СНсФВ имеют более низкую смертность, чем пациенты с СНнФВ. Пациенты с СНусФВ могут включать пациентов с ФВ, которая возросла ≥40% или снизилась менее 50%.
Диагностика СНнФВ и СНусФВ обычно не вызывает затруднений в клинической практике. В то же время для диагностики СНсФВ ЛЖ ≥50% необходимо, наряду с симптомами и/или признаками СН, выявление объективных структурных, функциональных и серологических количественных показателей диастолической дисфункции ЛЖ/повышенного давления наполнения ЛЖ, указанные в таблице 11.
Таблица 12. Основные структурные, функциональные и серологические показатели диастолической дисфункции ЛЖ/повышенного давления наполнения ЛЖ
|
Показатель
|
Результат
|
|
Индекс массы ЛЖ
|
≥95 g/m2 (жен), ≥115 g/m2 (муж)
|
|
Относительная толщина стенки
|
>0.42
|
|
Индекс объема ЛП
|
>34 mL/m2 (СР) >40 mL/m2 (ФП)
|
|
Отношение E / e'
|
в состоянии покоя >9 при пиковом напряжении ≥15
|
|
Септальная e'
|
<7см/с
|
|
Латеральное e'
|
<10см/с
|
|
Систолическое давление ЛА
|
>35 mmHg
|
|
TР скорость
|
в покое >2.8 m/s, при максимальной нагрузке> 3,4 м / с.
|
|
Глобальная продольная деформация ЛЖ
|
< -16%
|
|
NT-proBNP
|
>125 (СР) или >365 (ФП) pg/mL
|
|
BNP
|
>35 (СР) или >105 (ФП) pg/mL
|
Отношение E / e'- скорость раннего наполнения по трансмитральному доплеру/скорость ранней релаксации по тканевому доплеру, TР скорость - скорость трикуспидальной регургитации.
Примечание: чем больше количество аномалий, тем выше вероятность СНсФВ(HFpEF). В таблице перечислены только часто используемые индексы; для менее часто используемых индексов обратитесь к согласованному документу ASE/ EACVI (23,4).
Другие методы визуализации и инвазивное обследованиепри ХСН
Пациентам, для которых ЭхоКГ неэффективна (узкое окно и др.), для оценки ФВ ЛЖ рекомендуется использовать альтернативные методы визуализации (МРТ, компьютерную томографию сердца, радионуклидную сцинтиграфию). У пациентов с СН и КБС, которые являются кандидатами на коронарную реваскуляризацию, можно рассмотреть возможность неинвазивной стресс-визуализации ишемии миокарда (стресс-ЭхоКГ, ОФЭКТ, МРТ или ПЭТ) перед проведением коронарной реваскуляризации.
Пациентам, для которых ЭхоКГ неэффективна (узкое окно и др.), для оценки ФВ ЛЖ рекомендуется использовать альтернативные методы визуализации (МРТ, компьютерную томографию сердца, радионуклидную сцинтиграфию). У пациентов с СН и КБС, которые являются кандидатами на коронарную реваскуляризацию, можно рассмотреть возможность неинвазивной стресс-визуализации ишемии миокарда (стресс-ЭхоКГ, ОФЭКТ, МРТ или ПЭТ) перед проведением коронарной реваскуляризации.
Инвазивное обследование пациентов с СН может предоставить важную клиническую информацию для определения причины СН и вариантов лечения, когда другие методы (ЭхоКГ, КТ, МРТ, ПЭТ, ОЭКТ, сцинтиграфия) недостаточны для выявления обратимых/излечимых причин СН. При необходимости проводится коронарография, электрофизиологическое исследование (ЭФИ), эндомиокардиальная биопсия. Каждый из методов применяется в клинике с учетом преимуществ и ограничений в диагностике различных состояний (2,4, 11).
Эндомиокардиальная биопсия может быть полезна при поиске конкретного диагноза, который повлияет на лечение, поэтому биопсию следует рассматривать у пациентов с быстро прогрессирующей клинической СН или усугублением желудочковой дисфункции, которая сохраняется, несмотря на соответствующее медикаментозное лечение. Эндомиокардиальную биопсию следует также рассмотреть у пациентов с подозрением на острое отторжение сердца после трансплантации сердца или с инфильтративными процессами миокарда. Конкретным примером является определение лечения амилоидоза легких цепей (AL) или транстиретинового амилоидоза (ТТА). Дополнительные показания к эндомиокардиальной биопсии включают пациентов с быстро прогрессирующим поражением миокарда и СН, без эффекта на оптимальную медикаментозную терапию (ОМТ), когда возможно биопсией уточнить диагноз с целью проведения специфического лечения при наличии условий для осуществления полноценного анализа биоптата. В то же время пациентам с СН не следует проводить рутинную эндомиокардиальную биопсию из-за риска осложнений, включая перфорацию, тампонаду сердца и образование тромбов, а также ограниченной диагностической эффективности/невозможности проведения полноценного анализа биоптата (24, 25, 26).
Таблица 13. Специализированные диагностические тесты у отдельных пациентов с ХСН для выявления обратимых/излечимых причин сердечной недостаточности
|
Рекомендации
|
Класс
|
Уровень
|
|
МРТ
|
||
|
МРТ рекомендуется для оценки структуры и функции миокарда у пациентов с плохими акустическими эхокардиографическими окнами.
|
I
|
С
|
|
МРТ рекомендуется для характеристики ткани миокарда при подозрении на инфильтративное заболевание, болезнь Фабри, воспалительное заболевание (миокардит), отсутствие уплотнения ЛЖ, амилоидоз, саркоидоз, перегрузку железом/гемохроматоз.
|
I
|
С
|
|
МРТс гадолинием следует рассматривать при ДКМП, чтобы различать ишемическое и не ишемическое повреждение миокарда
|
IIa
|
С
|
|
Инвазивная коронарная ангиография (для тех, кто считается подходящим для потенциальной коронарной реваскуляризации)
|
||
|
Инвазивная коронарная ангиография рекомендуется пациентам со стенокардией, несмотря на фармакологическое лечение или больным с симптомными желудочковыми аритмиями.
|
I
|
В
|
|
Инвазивная коронарная ангиография может быть рассмотрена у пациентов с СНнФВс промежуточной и высокой вероятностью КБСдо теста/наличием ишемии в не инвазивных стресс тестах
|
IIb
|
В
|
|
Не инвазивное тестирование
|
||
|
Коронарную КТ-ангиографию следует рассматривать у пациентов с низкой или средней вероятностью КБС до проведения теста или у пациентов с сомнительными неинвазивными стресс-тестами, чтобы исключить стеноз коронарной артерии
|
IIa
|
С
|
|
Не инвазивная стресс-визуализация (МРТ, стресс эхокардиография, однофотонная эмиссионная КТ, ПЭТ) может быть рассмотрена для оценки ишемии миокарда и жизнеспособности пациентов с КБС, которые считаются подходящими для коронарной реваскуляризации
|
IIb
|
В
|
|
Для выявления обратимой ишемимиокардаи исследования причины одышки можно рассмотреть возможность проведения тестов с физической нагрузкой
|
IIb
|
С
|
|
Кардиопульмональные тесты с физической нагрузкой
|
||
|
Кардиопульмональные тесты с физической нагрузкой рекомендуются как часть оценки перед трансплантацией сердца и/или имплантации механических поддерживающих устройств
|
I
|
С
|
|
Следует рассмотреть возможность проведения кардиопульмональных нагрузочных тестов для оптимизации назначения тренировок с физической нагрузкой.
|
IIa
|
С
|
|
Для выявления причины необъяснимой одышки и/или непереносимости физических нагрузок следует рассмотреть возможность проведения кардиопульмональных нагрузочных тестов
|
IIa
|
С
|
|
Катетеризация правых отделов сердца
|
||
|
Катетеризация правых отделов сердца рекомендуется пациентам с тяжелой СН, которым проводится трансплантация сердца или механическая поддержка кровообращения.
|
I
|
С
|
|
Катетеризацию правых отделов сердца следует рассмотреть у пациентов, у которых считается, что СН вызвана констриктивным перикардитом, рестриктивной кардиомиопатией, врожденным пороком сердца и состояниями с повышенным выбросом.
|
IIa
|
С
|
|
Катетеризацию правых отделов сердца следует рассмотреть у пациентов с вероятной легочной гипертензией, оцениваемой с помощью ЭхоКГ, чтобы подтвердить диагноз и оценить его обратимость перед коррекцией клапанного/структурного порока сердца.
|
IIa
|
С
|
|
Катетеризация правых отделов сердца может быть рассмотрена у отдельных пациентов с СНсФВ для подтверждения диагноза.
|
IIb
|
С
|
|
Биопсия сердца
|
||
|
Биопсию сердца следует рассматривать у пациентов с быстропрогрессирующей СН, несмотря на стандартную терапию, когда существует вероятность конкретного диагноза, который может быть подтвержден только в образцах миокарда.
|
IIa
|
С
|
Лечение
Лечение ХСН
Нефармакологические вмешательства.
Ведение пациентов с ХСН в мультидисциплинарной команде.
Современное ведение пациента с ХСН предполагает участие мультидисциплинарной команды, включающей специалистов по сердечной недостаточности, кардиологов, врачей общей практики, семейных врачей, узкопрофильных специалистов. Состав мультидисциплинарной команды определяется индивидуально, в зависимости от этиологии СН, коморбидных состояний, необходимости инвазивных и иных вмешательств у конкретного пациента.
По данным метаанализов–программы мультидисциплинарных вмешательств снизили количество госпитализаций и/или смертность от всех причин (27, 28). В систематическом обзоре и метаанализе 43-х РКИ было показано, что ведение сложных пациентов в мультидисциплинарной команде привело к снижению смертности от всех причин, повторной госпитализации по всем причинам и повторной госпитализации по поводу СН (29). Оптимальная реализация мультидисциплинарной программы лечения СН позволяет устанавливать пациентам точный диагноз, проводить обоснованные исследования и вмешательства, соответствующую доказательную терапию, обучение и адекватное последующее наблюдение. Система медицинского сопровождения пациентов стационарно в комбинации с амбулаторным контролем врачами кардиологами позволяет сохранить более высокую приверженность к терапии, которая подтверждается снижением риска повторных госпитализаций, снижением рисков общей и сердечно-сосудистой смертности (29). В связи с чем необходима селективная подготовка кардиологов и медсестер, специализирующихся на СН для оказания оптимальной помощи пациентам с ХСН.
Основные компоненты мультидисциплинарного вмешательства
1. Оптимизированное управление: модификация образа жизни, фармакологическое лечение, необходимость в различных девайсах.
2. Обучение пациентов с особым упором на самопомощь и контроль симптомов.
3. Предупреждение прогрессирования/обострения заболевания, контроль симптомов и соответствующее вмешательство в ответ, включая симптомы застоя, функционального статуса, качества жизни, проблем со сном, психосоциальных проблем или других результатов (например, лабораторных показателей).
4. Наблюдение после выписки (клиника, визиты на дом, поддержка по телефону или дистанционный телемониторинг).
5. Легкий доступ к медицинской помощи, особенно для предотвращения и лечения декомпенсации.
6. Доступ к передовым вариантам лечения, поддерживающая и паллиативная помощь
7. Оказание психосоциальной поддержки пациентам и членам их семей, осуществляющим уход.
Рекомендуется ведение пациентов с ХСН врачами-кардиологами в комплексе со специализированной мультидисциплинарной командой в стационаре с дальнейшим ведением пациента в условиях амбулаторного наблюдения врачом кардиологом и патронажными сестрами маломобильных пациентов, с проведением телефонного контроля для снижения риска смертельных исходов (ЕSC IА).
Обучение пациентов, модификация образа жизни и cамопомощь
2. Обучение пациентов с особым упором на самопомощь и контроль симптомов.
3. Предупреждение прогрессирования/обострения заболевания, контроль симптомов и соответствующее вмешательство в ответ, включая симптомы застоя, функционального статуса, качества жизни, проблем со сном, психосоциальных проблем или других результатов (например, лабораторных показателей).
4. Наблюдение после выписки (клиника, визиты на дом, поддержка по телефону или дистанционный телемониторинг).
5. Легкий доступ к медицинской помощи, особенно для предотвращения и лечения декомпенсации.
6. Доступ к передовым вариантам лечения, поддерживающая и паллиативная помощь
7. Оказание психосоциальной поддержки пациентам и членам их семей, осуществляющим уход.
Рекомендуется ведение пациентов с ХСН врачами-кардиологами в комплексе со специализированной мультидисциплинарной командой в стационаре с дальнейшим ведением пациента в условиях амбулаторного наблюдения врачом кардиологом и патронажными сестрами маломобильных пациентов, с проведением телефонного контроля для снижения риска смертельных исходов (ЕSC IА).
Обучение пациентов, модификация образа жизни и cамопомощь
Важным аспектом в успешном лечении ХСН является модификация факторов риска (отказ от курения, контроль АД при АГ, контроль уровня сахара крови при СД 2 типа, поддержание нормальной массы тела), соблюдение рекомендаций по питанию (ограничение потребления поваренной соли, умеренное употребление жидкости) и физической активности. Оптимальная модификация факторов риска возможна при совместных усилиях со стороны медперсонала и самого пациента. Пациент должен быть ознакомлен с причинами, симптомами заболевания, обучен навыкам самопомощи и контроля за основными параметрами, отражающими его состояние, модификации образа жизни.
Адекватная самопомощь пациента имеет важное значение для эффективного лечения СН с помощью самоконтроля. Непонимание, заблуждения и недостаток знаний способствуют недостаточному самообслуживанию, поэтому обучение пациентов имеет жизненно важное значение. Пациенты с СН, которые используют эффективно самопомощь имеют лучшее качество жизни, более низкие показатели повторной госпитализации и меньшую смертность (30, 31, 32). Развитие навыков самообслуживания имеет основополагающее значение для улучшение знаний пациентов о своем состоянии (32). Обучение, направленное на улучшение самопомощи, должно быть адаптировано к конкретному пациенту и основано, если таковые имеются, на научных данных или мнении экспертов.
Существует мало доказательств того, что конкретные рекомендации по образу жизни улучшают качество жизни или прогноз, однако предоставление этой информации стало ключевым компонентом обучения самообслуживанию. Общеобразовательные подходы включают в себя: предоставление информации в различных форматах с учетом уровня образования и медицинской грамотности, распознавание барьеров для общения (язык, социальные навыки, когнитивные способности, тревога/депрессия, проблемы со слухом или зрением), обсуждение возникающих вопросов, приглашение пациентов в сопровождении члена семьи или друга, ознакомление с сайтами для пациентов с ХСН (31, 32).
Физическая активность
Имеются убедительные доказательства того, что физическая подготовка с помощью физических упражнений улучшает толерантность к физической нагрузке и качество жизни, связанное со здоровьем, у пациентов с ХСН. Клиническими исследованиями установлено, что реабилитация физической нагрузкой у больных с СНнФВ улучшает способность к физической нагрузке и качество жизни. Некоторые мета-анализы также показывают, что физическая нагрузка снижает количество госпитализаций по всем причинам и по поводу СН, хотя сохраняется неопределенность относительно ее влияния на смертность (33,34).
Всем пациентам с ХСН рекомендуются физические упражнения, которые они в состоянии переносить, из-за улучшения качества жизни и сокращения риска госпитализации по поводу СН (ЕSC I А).
Ограничение потребления натрия с пищей
Ограничение потребления натрия (соли) с пищей является распространенной рекомендацией по диете при лечении пациентов с СН и застойными явлениями. Однако конкретные количественные рекомендации по ограничению потребления соли с пищей не имеют качественной доказательной базы и основаны на мнениях экспертов. Большинство исследований, посвященных потреблению соли при ХСН, были пилотными с небольшой выборкой и проводились на фоне приема фармакологического лечения с нечеткими влиянием на прогноз (35-38).В то же время ряд исследований выявили снижение натрия в моче, улучшение уровней НУП и качества жизни при ограничении соли с приемом пищи (39-43).В настоящее время AHA (2022) рекомендует снизить потребление натрия до <2300 мг/день для общего укрепления здоровья сердечно-сосудистой системы, но исследований с положительным результатом, подтверждающих этот уровень ограничений у пациентов с СН не проводилось. В то же время для пациентов с СН стадии C, т.е. с клиническими признаками застоя, АНА(2022)рекомендует «разумно» избегать чрезмерного потребления натрия, чтобы уменьшить симптомы СН (2).В рекомендациях ЕSC по лечению больных с ХСН, 2021 г – правильное питание, без чрезмерного потребления соли (>5 г/день) и поддержка здоровой массы тела (3). В рекомендациях Российского общества кардиологов по лечению больных с ХСН (2020) отмечено, что проведенные исследования не подтвердили необходимость жесткого ограничения потребления воды и соли (36,45,46), а дизайн и мощность исследований не позволяют сформулировать четкие рекомендации с указанием класса и уровнем доказательности. Тем не менее, пациентам с СН рекомендовано контролировать объем потребляемой жидкости (1,5-2 литра в сутки) и соли (не более 6 граммов соли сутки) (11). Однако, следует подчеркнуть, что нет исследований, подтверждающих этот уровень ограничения соли у пациентов с СН.
Соблюдение средиземноморской диеты DASHв исследовании «MEDIT-AHF» не влияло на отдаленную смертность после эпизода острой декомпенсации СН, но было связано со снижением частоты повторных госпитализаций в течение следующего года(47). Следует отметить, что диета DASH богата антиоксидантами, калием и может обеспечить ограничение натрия без ущерба для адекватности питания при сопровождении диетического консультирования. Практические рекомендации по модификации жизни, обучению пациентов с ХСН приведены в приложении №1.
Медикаментозное лечение больных СН с низкой ФВ (Класс I)
Цели лечения пациентов с СНнФВ: снижение смертности от сердечно-сосудистых и всех причин, предотвращение повторных госпитализаций, улучшение клинического статуса, функциональных возможностей и качества жизни.
Медикаментозная терапия является основой лечения СН наряду с нефармакологическими и инвазивными/аппаратными вмешательствами. Многочисленными исследованиями было показано, что модуляция ренин-ангиотензин-альдостероновой (РААС), неприлизиновой и симпатической нервной системы ингибиторами ангиотензинпре вращающего фермента (иАПФ) или ингибитором рецептора ангиотензина-неприлизина (сакубитрил/валсартан (АРНИ)) или блокатором рецептора ангиотензина (БРА), бета-адреноблокаторами (ББ), ингибиторами натрий-глюкозного котранспортера 2 (иSGLT2) и антагонистами минералокортикоидных рецепторов (АMКР) влияют положительно на прогноз, т.е. снижают сердечно-сосудистую смертность, снижают риск госпитализаций по поводу СН и уменьшают симптомы у пациентов с СНнФВ. КвадротерапияиАПФ/АРНИ/БРА, ББ, иSGLT2, АМКР рекомендуется в качестве краеугольного метода терапии (IA) для этих пациентов, наряду с диуретиками, за исключением случаев, когда препараты противопоказаны или не переносятся (2,3, 11, 48).
Порядок последовательности назначения (введения в лечение) 4-х групп препаратов зависит от клинического состояния пациента, уровня АД, ЧСС, рСКФ, электролитов сыворотки крови, коморбидной патологии, наличия показаний и противопоказаний, к различного рода, медикаментозным вмешательствам. По современным алгоритмам рекомендовано уже в стационаре осуществить как можно раннее введение в лечение всех 4-х групп препаратов в отсутствие противопоказаний. Важным условием лечения пациентов с СН является преемственность между стационаром и амбулаторным звеном. Препараты следует повышать постепенно до доз, используемых в клинических исследованиях или, если это невозможно, до максимально переносимых доз. Диуретики назначают при признаках застоя, затем переводя на поддерживающую минимальную дозу с целью сохранения эуволемии при СН (2,3,11).
К дополнительным препаратам для лечения СНнФВ (II Класс) относятся ивабрадин, дигоксин, верицигуат, ацетозаламид. Препараты II Класса подключают к лечению при персистировании симптомов СН, несмотря на лечение 4-мя основными группами препаратов и диуретиками, и безусловно, в присутствии клинической ситуации, необходимой для их назначения (2,3,11).
К дополнительным препаратам для лечения СНнФВ (II Класс) относятся ивабрадин, дигоксин, верицигуат, ацетозаламид. Препараты II Класса подключают к лечению при персистировании симптомов СН, несмотря на лечение 4-мя основными группами препаратов и диуретиками, и безусловно, в присутствии клинической ситуации, необходимой для их назначения (2,3,11).
Таблица 14. Фармакологическое лечение пациентов с СНнФВ
|
Рекомендации
|
Класс
|
Уровень
|
|
Класс I
|
||
|
Петлевые диуретики
|
I
|
С
|
|
ББ рекомендуются пациентам со стабильной СНнФВ для снижения риска госпитализации и смерти при СН
|
I
|
А
|
|
АМКР рекомендуется пациентам с СНнФВ для снижения риска госпитализации и смерти при СН
|
I
|
А
|
|
Дапаглифлозин или эмпаглифлозин рекомендуются пациентам с СН для снижения риска госпитализации и смерти от СН
|
I
|
А
|
|
АРНИ (сакубитрил/валсартан) рекомендуется в качестве замены иАПФ у пациентов с СНнФВ, чтобы снизить риск госпитализации и смерти при СН
|
I
|
А
|
|
иАПФ рекомендуются пациентам с СНнФВ для снижения риска госпитализации и смерти от СН, когда использование AРНИ невозможно
|
I
|
А
|
|
БРА рекомендованы при непереносимости ИАПФ пациентам со СНнФВ для снижения риска госпитализации и смерти, когда применение АРНИ невозможно
|
I
|
А
|
|
AРНИ не следует назначать одновременно с иАПФ или в течение 36 часов после последней дозы иАПФ
|
III
|
С
|
|
Класс II
|
||
|
Ивабрадин рекомендован для пациентов СНнФВ, ФВ ЛЖ ≤35% с синусовым ритмом, ЧСС ≥70 ударов в минуту в покое, которые получают лечение, рекомендованное клиническими руководствами, включая ББ в максимально переносимой дозе, для снижения количества госпитализаций по поводу СН и смертности от сердечнососудистых заболеваний.
|
IIa
|
В
|
|
Верицигуат может быть рассмотрен у пациентов с СНнФВ, NYHAII-IV, которые имеют ухудшение СН, несмотря на лечение, рекомендованное клиническими руководствами для снижения риска кардиоваскулярной смерти и госпитализации.
|
IIb
|
В
|
|
Дигоксин может быть рассмотрен у пациентов с синусовым ритмом и симптоматической СНнФВ, несмотря на лечение, рекомендованное клиническими руководствами, для снижения риска госпитализации по поводу СН/ всех случаев госпитализации.
|
IIb
|
В
|
|
Гидралазин/динитратизосорбид может быть рассмотрен у пациентов негроидной расы, которые имеют ухудшение СН, несмотря на лечение, рекомендованное клиническими руководствами для снижения риска смертности и госпитализаций по поводу СН у пациентов с СНнФВ и ФК III–IV по NYHA
|
IIb
|
В
|
Ингибирование ренин-ангиотензиновой системы: АРНИ, иАПФ/БРА
Ингибирование РААС рекомендуется для снижения заболеваемости, смертности и риска госпитализации у пациентов с СНнФВ, а АРНИ, иАПФ или БРА используются в качестве терапии первой линии (49-57). Если у пациентов имеется симптоматическая СНнФВII-III ФК (NYHA) и они переносят иАПФ или БРА, их следует перевести на АРНИ для снижения заболеваемости и смертности (49-52,58). AРНИ рекомендуется также в качестве лечения «denovo» госпитализированным пациентам с острой декомпенсацией СН перед выпиской при улучшении состояния и гемодинамической стабильности, снижении уровня NT-proBNP для улучшения параметров ремоделирования ЛЖ по сравнению с иАПФ/БРА. Использование АРНИ может быть эффективным в качестве лечения «denovo» у пациентов с симптоматической хронической СНнФВ, без предварительной терапии иАПФ/БРА, для упрощения лечения. БРА можно использовать в качестве альтернативы иАПФ при непереносимом кашле или в качестве альтернативы иАПФ и АРНИ у пациентов с кашлем и ангионевротическим отеком в анамнезе, когда нет возможности лечения АРНИ(2, 3, 59-62).
АРНИ- комбинированный препарат, состоит из валсартана и ингибитора неприлизина, фермента, который расщепляет натрийуретические пептиды, брадикинин, адреномедуллин и другие вазоактивные пептиды. В PARADIGM-HF (проспективное сравнение AРНИ с иАПФдля определения влияния на общую смертность и заболеваемость при СН) -РКИ, в котором сравнивали первый одобренный АРНИ (сакубитрил-валсартан) с эналаприлом у симптоматических пациентов с СНнФВ, переносящих адекватную дозу любого из них. Сакубитрил-валсартан значительно снижал комбинированную конечную точку сердечно-сосудистой смерти или госпитализации по поводу СН на 20% по сравнению с «золотым» стандартом лечения СН среди иАПФ -эналаприлом (63). Положительное воздействие АРНИ при ХСН и потенциальные нецелевые эффекты могут быть связаны с ингибированием фермента неприлизина, который имеет несколько биологических мишеней. В открытом исследовании TRANSITION пациенты с СНнФВ, госпитализированные с ухудшением СН, были рандомизированы для начала приема АРНИ до или после выписки. Результаты по безопасности были одинаковыми в обеих группах, что позволяет предположить, что раннее начало может упростить ведение терапии (вместо того, чтобы сначала начинать и повышать иАПФ, а затем переключаться на АРНИ). АРНИ следует начинать denovo у пациентов, госпитализированных с острой декомпесацией СНнФВ, до выписки при отсутствии противопоказаний. АРНИ можно начинать denovo у пациентов с хронической симптоматической СНнФВ для упрощения лечения, хотя данные ограничены (64).
Исследование PIONEER-HF показало, что AРНИ снижает уровень NT-proBNP у пациентов, госпитализированных по поводу острой декомпенсированной СН, без увеличения частоты побочных эффектов (ухудшение функции почек, гиперкалиемия, симптоматическая гипотензия, ангионевротический отек) по сравнению с эналаприлом(65). Сакубитрил-валсартан одобрен для лечения пациентов с симптоматической СН, в том числе для пациентов, ранее не принимавших иАПФ/БРА до начала АРНИ (64, 65). Применение сакубитрила-валсартана чаще было связано с симптоматической гипотензией и сопоставимой частотой развития ангионевротического отека по сравнению с эналаприлом (63).Если пациентов переводят с иАПФ на АРНИ или наоборот, между дозами иАПФ и АРНИ должно пройти не менее 36 часов. Это связано с неблагоприятным эффектом, который может возникнуть из-за того, что иАПФ и неприлизин расщепляют брадикинин, который может прямо или косвенно вызывать ангионевротический отек (66, 67).
ИАПФ снижают заболеваемость и смертность при СНнФВ. РКИ четко установили преимущества ингибирования АПФ у пациентов с легкими, умеренными или тяжелыми симптомами СН, а также у пациентов с КБС или без нее (68-74).Данные свидетельствуют о том, что между доступными иАПФ нет различий в их влиянии на симптомы или выживаемость (73). ИАПФ следует начинать с низких доз и постепенно повышать их до доз, которые, как показали клинические исследования, снижают риск сердечно-сосудистых событий. ИАПФ могут вызывать кашель и ангионевротический отек. Кроме того, иАПФ следует назначать с осторожностью пациентам с низким системным АД, почечной недостаточностью или повышенным уровнем калия в сыворотке (>5,0 мэкв/л).
Если максимальные дозы не переносятся, следует попробовать промежуточные дозы, т.к. резкое прекращение ингибирования АПФ может привести к клиническому ухудшению и его следует избегать. Хотя использование АРНИ вместо иАПФ при СНнФВ оказалось более эффективным, для тех пациентов, для которых АРНИ не подходит, по-прежнему настоятельно рекомендуется продолжать применение иАПФ при всех ФКСНнФВ (74).
БРА снижает смертность и количество госпитализаций по поводу СН у пациентов с СНнФВ, что было показано в РКИ (59-62,75,76). Длительное лечение БРА у пациентов с СНнФВ дает гемодинамические, нейрогормональные и клинические эффекты, соответствующие ожидаемым после вмешательства в ренин-ангиотензиновую систему(60,71,76,77). В отличие от иАПФ, БРА не влияют непосредственно на метаболизм брадикинина и связаны с низкой частотой ангионевротического отека (78). Пациентам с непереносимостью иАПФ из-за кашля или ангионевротического отека следует начинать прием БРА. БРА следует начинать с низких доз и постепенно повышать их, пытаясь использовать дозы, которые, как показали клинические исследования, снижают риск сердечно-сосудистых событий. БРА следует назначать с осторожностью пациентам с низким системным АД, почечной недостаточностью или повышенным уровнем калия в сыворотке (>5,0 мэкв/л). Хотя БРА являются альтернативой для пациентов с ангионевротическим отеком, вызванным иАПФ, следует соблюдать осторожность, поскольку у некоторых пациентов при приеме БРА также развивается ангионевротический отек. Тем пациентам, для которых иАПФ или АРНИ не подходят, по-прежнему рекомендуется использование БРА (2,3).
Практическое руководство по применению иАПФ, БРА или АРНИ приведено в приложении №2.
Бета-адреноблокаторы
Лечение ББ (карведилол, бисопролол, метопрололсукцинат, небивалол)снижает риск смерти и комбинированный риск смерти или госпитализации у пациентов с СНнФВ(2,3, 79 -86). ББ при длительном применении может улучшить клинический статус и ФВЛЖ, уменьшить симптомы СН(79-86).Эти преимущества ББ наблюдались у пациентов с КБС или без нее, у пациентов с СД 2 типа или без него, у пожилых пациентов, а также у женщин и представителей разных расовых и этнических групп (79-86). У пациентов с СН следует продолжать длительное лечение ББ, чтобы снизить риск серьезных сердечно-сосудистых событий, даже если клинические симптомы явно не улучшаются. Клинические исследования показали, что ББ следует назначать всем пациентам с диагнозом СНнФВ, в том числе в стационаре, за исключением случаев, когда они противопоказаны или не переносятся (79-86).У тяжелых пациентов, госпитализированных сострой декомпенсацией СН, ББ следует назначать с осторожностью в стационаре после того, как пациент гемодинамически стабилизирован (3).ББ следует начинать с низких доз, затем титровать и приложить все усилия для достижения целевых доз, эффективность которых была доказана в крупных клинических исследованиях, при условии их переносимости и отсутствия противопоказаний (2,3, 79-86).
Бета-адреноблокаторы
Лечение ББ (карведилол, бисопролол, метопрололсукцинат, небивалол)снижает риск смерти и комбинированный риск смерти или госпитализации у пациентов с СНнФВ(2,3, 79 -86). ББ при длительном применении может улучшить клинический статус и ФВЛЖ, уменьшить симптомы СН(79-86).Эти преимущества ББ наблюдались у пациентов с КБС или без нее, у пациентов с СД 2 типа или без него, у пожилых пациентов, а также у женщин и представителей разных расовых и этнических групп (79-86). У пациентов с СН следует продолжать длительное лечение ББ, чтобы снизить риск серьезных сердечно-сосудистых событий, даже если клинические симптомы явно не улучшаются. Клинические исследования показали, что ББ следует назначать всем пациентам с диагнозом СНнФВ, в том числе в стационаре, за исключением случаев, когда они противопоказаны или не переносятся (79-86).У тяжелых пациентов, госпитализированных сострой декомпенсацией СН, ББ следует назначать с осторожностью в стационаре после того, как пациент гемодинамически стабилизирован (3).ББ следует начинать с низких доз, затем титровать и приложить все усилия для достижения целевых доз, эффективность которых была доказана в крупных клинических исследованиях, при условии их переносимости и отсутствия противопоказаний (2,3, 79-86).
Практическое руководство по применению ББ приведено в приложении №2.
Антагонисты минерало-кортикоидных рецепторов
РКИ по применению АМКР (ранее известные как антагонисты альдостерона) при ХСН демонстрируют последовательное снижение смертности от всех причин, госпитализаций по поводу СН и внезапной сердечной смерти среди пациентов с СНнФВ (87-89). Ключевые клинические исследования, которые выявили благоприятное влияние на прогноз АМКР: RALES – эффективность альдактона (спиринолактона) у пациентов с выраженной СН, ФВ ЛЖ ≤35% (87); EPHESUS- выживаемость после острого инфаркта миокарда (ИМ) с ФВ ЛЖ ≤40% при применении эплеренона (88); EMPHASIS-HF-исследование эплеренона на выживаемость у пациентов с умеренными симптомами и ФВ ЛЖ ≤30% при госпитализации с СН (89). Благодаря этим исследованиям удалось выявить преимущество АMКР по всему широкому спектру больных сСНнФВ, включая различную этиологию и степень тяжести заболевания.
Антагонисты минерало-кортикоидных рецепторов
РКИ по применению АМКР (ранее известные как антагонисты альдостерона) при ХСН демонстрируют последовательное снижение смертности от всех причин, госпитализаций по поводу СН и внезапной сердечной смерти среди пациентов с СНнФВ (87-89). Ключевые клинические исследования, которые выявили благоприятное влияние на прогноз АМКР: RALES – эффективность альдактона (спиринолактона) у пациентов с выраженной СН, ФВ ЛЖ ≤35% (87); EPHESUS- выживаемость после острого инфаркта миокарда (ИМ) с ФВ ЛЖ ≤40% при применении эплеренона (88); EMPHASIS-HF-исследование эплеренона на выживаемость у пациентов с умеренными симптомами и ФВ ЛЖ ≤30% при госпитализации с СН (89). Благодаря этим исследованиям удалось выявить преимущество АMКР по всему широкому спектру больных сСНнФВ, включая различную этиологию и степень тяжести заболевания.
Целесообразно начать лечение АМКР в амбулаторных или стационарных условиях. Начальная доза спиронолактона и эплеренона составляет 25 мг перорально в день, через месяц ее увеличивают до 50 мг в день перорально, в отсутствие противопоказаний; при рСКФ от 31 до 49 мл/мин/1,73 м 2 дозу следует уменьшить вдвое. Регулярные проверки уровня калия в сыворотке крови и функции почек следует проводить в зависимости от клинического статуса примерно через 1 неделю после назначения, затем через 4 недели, а затем каждые 6 месяцев после начала или увеличения дозы АМКР, с более частым тестированием в период клинической нестабильности СН (90, 91).
Спиронолактон и эплеренон частично выводятся через почки, что вызывает опасения по поводу безопасности, когда рСКФ составляет менее 30 мл/мин/1,73 м 2(92, 93). Спиронолактон и эплеренон снижают экскрецию калия почками, повышая риск гиперкалиемии, особенно когда АMКР назначается при уровне сывороточного калия ≥5,0 мэкв/л и продолжается при уровне ≥5,5 мэкв/л. Частота клинически значимых случаев гиперкалиемии составляла <1% в группах EPHESUS и EMPHASIS-HF, без существенной разницы между эплереноном и плацебо (88,89). Совместное применение АMКР с иАПФ или БРА слегка увеличивает риск гиперкалиемии. Риск гиперкалиемии был ниже при приеме AРНИ у пациентов с ХСН в исследовании PARADIGM-HF (63), но не различался у пациентов с СН, у которых была декомпенсация в исследовании PIONEER-HF (65) по сравнению с иАПФ. Диарея, вызывающая обезвоживание, или прекращение терапии петлевыми диуретиками из-за ухудшения функции почек или гиперкалиемии, должны стать поводом для временного прекращения приема АMКР. Развитие ухудшения функции почек или гиперкалиемии часто является отражением острых клинических изменений или прогрессирования заболевания, что требует тщательной оценки всей схемы лечения и других причин гиперкалиемии, помимо применения АМКР. Эффективность использования препаратов, связывающих калий (например, патиромера, циклосиликата натрия-циркония) для улучшения результатов за счет возможности продолжить применение АМКР неясна (93, 94). Пациенты с риском развития почечной дисфункции или гиперкалиемии требуют тщательного наблюдения, а рСКФ<30 мл/мин/1,73 м2 или уровень калия в сыворотке крови ≥5,0 мэкв/л являются противопоказаниями к началу лечения АМКР (90,91). Из-за более высокой селективности эплеренона в отношении рецепторов альдостерона побочные эффекты, такие как гинекомастия и вагинальные кровотечения, наблюдаются реже у пациентов, принимающих эплеренон, чем у тех, кто принимает спиронолактон.
Финеренон – препарат последнего поколения АМКР, рекомендуется для профилактики риска госпитализации по поводу СН у пациентов с СД2 и ХБП(см. главу 11.1.). Практическое руководство по применению АМКР приведено в приложении №2.
Ингибиторы SGLT2
Ранее иSGLT2 применялись как гипогликемические средства. Затем, при обязательном для гипогликемических средств изучении риска сердечно-сосудистых осложнений, на прием иSGLT2 (дапаглифлазина, эмпаглифлазина) в нескольких РКИ у больных с СД2 типа были выявлены дополнительные благоприятные эффекты при СН. Эти эффекты выражались в снижении риска госпитализаций по причине СН и снижении смертности от кардиоваскулярных событий (95, 96). Так, в РКИ «DAPA-HF» изучались долгосрочные эффекты дапаглифлозина (ингибитор SGLT2) по сравнению с плацебо в дополнение к оптимальной медикаментозной терапии на заболеваемость и смертность у амбулаторных пациентов с СНнФВ (95). В исследовании участвовали пациенты, относящиеся к классу II-IV по NYHA и ФВ ЛЖ ≤40%, с повышенным NT-proBNP в плазме и рСКФ ≥30 мл/мин/1,73 м2 на фоне оптимальной медикаментозной терапии. Терапия дапаглифлозином привела к снижению на 26% первичной конечной точки: сочетание прогрессирования СН (госпитализация или срочное посещение, приведшее к внутривенной терапии при СН) или смерти от ССЗ. Оба эти компонента были значительно снижены. Более того, дапаглифлозин снизил смертность от всех причин, а также облегчил симптомы СН, улучшил физическую толерантность и качество жизни у пациентов с симптоматической СНнФВ. Причем, преимущества были замечены сразу после начала приема дапаглифлозина, а абсолютное снижение риска было значительным. Положительные эффекты в отношении выживаемости наблюдались в одинаковой степени у пациентов СНнФВ с СД 2 типа и без него.
Затем в РКИ «EMPEROR-Reduced»было установлено, что эмпаглифлозин снижает комбинированную первичную конечную точку смерти от сердечно-сосудистых заболеваний или госпитализаций по причине СН на 25% у пациентов II-IV класса по NYHA и ФВЛЖ≤40% на фоне оптимальной медикаментозной терапии (96).Отмечалось также улучшение качества жизни. Впоследствии мета-анализ исследований «DAPA-HF» и «EMPEROR-Reduced» не выявил неоднородности в смертности от сердечно-сосудистых заболеваний (97).Таким образом, дапаглифлозин или эмпаглифлозин, первыми среди ингибиторов SGLT,были рекомендованы в дополнение к оптимальной медикаментозной терапии (иАПФ/АРНИ/БРА, ББ, АМКР)пациентам с СНнФВ независимо от статуса сахарного диабета. Продолжается изучение других ингибиторов SGLT по влиянию на сердечно-сосудистую смертность и риск госпитализации при СН.
Диуретические (натрийуретические) свойства ингибиторов SGLT2 могут дать дополнительные преимущества в уменьшении отечного синдрома и могут позволить снизить потребность в петлевых диуретиках (98).Среди побочных эффектов при терапии ингибиторами SGLT2 может повышаться риск рецидивов грибковых инфекций мочеполовых органов. Ожидается небольшое снижение рСКФ после начала приема, однако, это снижение обратимо и не должно приводить к преждевременному прекращению приема препарата.
Практические рекомендации по применению ингибиторов SGLT2 (дапаглифлозина и эмпаглифлозина приведены в приложении №2.
Диуретики
Целью лечения диуретиков является устранение клинических признаков задержки жидкости, используя минимально возможную дозу мочегонных средств для поддержания эуволемии. Рекомендуются, в основном, петлевые диуретики для уменьшения симптомов и/или признаков застоя у пациентов с СН. Влияние диуретиков на заболеваемость и смертность не совсем ясна, за исключением АМКР (87-92, 98-104). РКИ диуретиков показали, что они повышают экскрецию натрия с мочой, уменьшают объективные признаки задержки жидкости и улучшают симптомы, качество жизни и толерантность к физической нагрузке (96-101). В то же время все ключевые РКИ с базисными препаратами, влияющими на прогноз приХСН, проводились на фоне применения петлевых диуретиков. Данные из реестра госпитализированных пациентов с СН «OPTIMIZE-HF» показали снижение 30-дневной смертности от всех причин и количества госпитализаций по поводу СН при использовании диуретиков по сравнению с отсутствием использования диуретиков после выписки из больницы (4).Мета-анализ РКИ, посвященный диуретикам, показал, что у пациентов с СНнФВ петлевые и тиазидные диуретики, по-видимому, снижают риск смерти и ухудшения СН по сравнению с плацебо, а по сравнению с активным контролем диуретики улучшают переносимость физической нагрузки (105).
Петлевые диуретики (фуросемид, буметанид и торасемид) ингибируют реабсорбцию натрия или хлоридов в петле Генле, тогда как тиазиды и тиазидо подобные диуретики действуют в дистальных извитых канальцах, а калийсберегающие диуретики (например, спиронолактон) - в собирательных трубочках (106, 107). Предпочтительными диуретиками для применения у большинства пациентов с СН являются петлевые диуретики. Тиазидные диуретики, такие как хлорталидон или гидрохлоротиазид, можно рассмотреть у пациентов с АГ, СН и легкой задержкой жидкости. Метолазон или хлортиазид можно добавлять к петлевым диуретикам у пациентов с рефрактерными отеками, не реагирующими на лечение только петлевыми диуретиками. Петлевые диуретики производят более интенсивный и более короткий диурез, чем тиазиды, хотя они действуют с инергетически (последовательная блокада нефронов), и их комбинация может использоваться для лечения резистентности к диуретикам. Однако при этом побочные эффекты более вероятны, и такие комбинации следует использовать только с осторожностью. Любые диуретики при ХСН следует назначать пациентам, у которых есть признаки застоя или задержки жидкости. В то же время у пациентов с застойными явлениями в анамнезе следует рассмотреть возможность назначения поддерживающих доз диуретиков, чтобы избежать рецидива симптомов. У амбулаторных пациентов с СН терапию диуретиками обычно начинают с низких доз, затем дозу увеличивают до тех пор, пока не увеличится диурез и не уменьшится масса тела, обычно на 0,5–1,0 кг в день. Пациенты могут перестать реагировать на высокие дозы диуретиков, если они потребляют большое количество натрия с пищей, имеют значительные нарушения функции почек или перфузии, принимают препараты, которые могут блокировать действие диуретиков (например, НПВП).
Резистентность к диуретикам можно преодолеть различными способами, включая увеличение дозы петлевых диуретиков, внутривенное введение диуретиков (болюсно, в/в длительно или непрерывной инфузией) (108) или комбинацию различных классов диуретиков (109-112). Применение тиазидов или тиазидоподобных диуретиков (например, метолазона) в сочетании с петлевыми диуретиками ингибирует компенсаторную дистальную канальцевую реабсорбцию натрия, что приводит к усилению натрийуреза. Однако у госпитализированных пациентов с СН было обнаружено, что добавление метолазона к петлевым диуретикам увеличивает риск гипокалиемии, гипонатриемии, ухудшения функции почек и смертности, что отрицательно влияло на выживаемость (113). Тогда как использование более высоких доз петлевых диуретиков больные переносили лучше. Хотя рандомизированные данные, сравнивающие две диуретические стратегии, ограничены, исследование «DOSE» (оценка стратегии оптимизации диуретиков) подтверждает эффективность использования высоких доз внутривенных петлевых диуретиков с учетом их фармакодинамики (114).
Следует отметить, что АРНИ, АМКР и ингибиторы SGLT2 также могут обладать мочегонными свойствами (115, 116). Диуретики не следует использовать изолированно, а всегда в сочетании с модифицирующими прогноз препаратами при СН, что снижает количество госпитализаций и продлевает выживаемость. У некоторых пациентов с эуволемией/гиповолемией использование диуретического препарата может быть уменьшено или даже прекращено (117). Пациенты должны быть обучены самостоятельно корректировать дозу диуретика на основе мониторинга симптомов/признаков застоя и ежедневного измерения веса (2,3).
Практическое руководство по применению диуретиков приведено в приложении №2.
Дополнительные группы лекарственных средств для лечения ХСН (Класс II)
ИнгибиторыIf-каналов в синусовом узле (Ивабрадин)
Ивабрадин замедляет частоту сердечных сокращений (ЧСС) за счет ингибирования канала If в синусовом узле, поэтому эффективен только у пациентов с синусовым ритмом. ЧСС является сильным предиктором сердечно-сосудистых исходов в общей популяции и у пациентов с сердечно-сосудистыми заболеваниями, включая СН. В исследовании SHIFT (результаты применения ивабрадина при ХСН) проверялась гипотеза о том, что снижение ЧСС у пациентов с СН улучшает сердечно-сосудистые исходы (115). SHIFT продемонстрировал эффективность ивабрадина в снижении комбинированной конечной точки сердечно-сосудистой смерти или госпитализации по поводу СН у пациентов с симптоматической СНнФВи ФВ ЛЖ ≤35% с синусовым ритмом и ЧСС ≥70 уд./мин, которые получали терапию, основанную на доказательствах, включая иАПФ (или БРА), ББ и АМКР (115-121).Однако только 25% пациентов, исследованных в SHIFT, получали оптимальные дозы терапии ББ. Учитывая хорошо доказанные преимущества терапии ББ в отношении смертности при СН, ББ следует титровать до целевых/максимально переносимых доз при отсутствии противопоказаний, прежде чем оценивать ЧСС в покое для рассмотрения вопроса о начале терапии ивабрадином (118-121).
Петлевые диуретики (фуросемид, буметанид и торасемид) ингибируют реабсорбцию натрия или хлоридов в петле Генле, тогда как тиазиды и тиазидо подобные диуретики действуют в дистальных извитых канальцах, а калийсберегающие диуретики (например, спиронолактон) - в собирательных трубочках (106, 107). Предпочтительными диуретиками для применения у большинства пациентов с СН являются петлевые диуретики. Тиазидные диуретики, такие как хлорталидон или гидрохлоротиазид, можно рассмотреть у пациентов с АГ, СН и легкой задержкой жидкости. Метолазон или хлортиазид можно добавлять к петлевым диуретикам у пациентов с рефрактерными отеками, не реагирующими на лечение только петлевыми диуретиками. Петлевые диуретики производят более интенсивный и более короткий диурез, чем тиазиды, хотя они действуют с инергетически (последовательная блокада нефронов), и их комбинация может использоваться для лечения резистентности к диуретикам. Однако при этом побочные эффекты более вероятны, и такие комбинации следует использовать только с осторожностью. Любые диуретики при ХСН следует назначать пациентам, у которых есть признаки застоя или задержки жидкости. В то же время у пациентов с застойными явлениями в анамнезе следует рассмотреть возможность назначения поддерживающих доз диуретиков, чтобы избежать рецидива симптомов. У амбулаторных пациентов с СН терапию диуретиками обычно начинают с низких доз, затем дозу увеличивают до тех пор, пока не увеличится диурез и не уменьшится масса тела, обычно на 0,5–1,0 кг в день. Пациенты могут перестать реагировать на высокие дозы диуретиков, если они потребляют большое количество натрия с пищей, имеют значительные нарушения функции почек или перфузии, принимают препараты, которые могут блокировать действие диуретиков (например, НПВП).
Резистентность к диуретикам можно преодолеть различными способами, включая увеличение дозы петлевых диуретиков, внутривенное введение диуретиков (болюсно, в/в длительно или непрерывной инфузией) (108) или комбинацию различных классов диуретиков (109-112). Применение тиазидов или тиазидоподобных диуретиков (например, метолазона) в сочетании с петлевыми диуретиками ингибирует компенсаторную дистальную канальцевую реабсорбцию натрия, что приводит к усилению натрийуреза. Однако у госпитализированных пациентов с СН было обнаружено, что добавление метолазона к петлевым диуретикам увеличивает риск гипокалиемии, гипонатриемии, ухудшения функции почек и смертности, что отрицательно влияло на выживаемость (113). Тогда как использование более высоких доз петлевых диуретиков больные переносили лучше. Хотя рандомизированные данные, сравнивающие две диуретические стратегии, ограничены, исследование «DOSE» (оценка стратегии оптимизации диуретиков) подтверждает эффективность использования высоких доз внутривенных петлевых диуретиков с учетом их фармакодинамики (114).
Следует отметить, что АРНИ, АМКР и ингибиторы SGLT2 также могут обладать мочегонными свойствами (115, 116). Диуретики не следует использовать изолированно, а всегда в сочетании с модифицирующими прогноз препаратами при СН, что снижает количество госпитализаций и продлевает выживаемость. У некоторых пациентов с эуволемией/гиповолемией использование диуретического препарата может быть уменьшено или даже прекращено (117). Пациенты должны быть обучены самостоятельно корректировать дозу диуретика на основе мониторинга симптомов/признаков застоя и ежедневного измерения веса (2,3).
Практическое руководство по применению диуретиков приведено в приложении №2.
Дополнительные группы лекарственных средств для лечения ХСН (Класс II)
ИнгибиторыIf-каналов в синусовом узле (Ивабрадин)
Ивабрадин замедляет частоту сердечных сокращений (ЧСС) за счет ингибирования канала If в синусовом узле, поэтому эффективен только у пациентов с синусовым ритмом. ЧСС является сильным предиктором сердечно-сосудистых исходов в общей популяции и у пациентов с сердечно-сосудистыми заболеваниями, включая СН. В исследовании SHIFT (результаты применения ивабрадина при ХСН) проверялась гипотеза о том, что снижение ЧСС у пациентов с СН улучшает сердечно-сосудистые исходы (115). SHIFT продемонстрировал эффективность ивабрадина в снижении комбинированной конечной точки сердечно-сосудистой смерти или госпитализации по поводу СН у пациентов с симптоматической СНнФВи ФВ ЛЖ ≤35% с синусовым ритмом и ЧСС ≥70 уд./мин, которые получали терапию, основанную на доказательствах, включая иАПФ (или БРА), ББ и АМКР (115-121).Однако только 25% пациентов, исследованных в SHIFT, получали оптимальные дозы терапии ББ. Учитывая хорошо доказанные преимущества терапии ББ в отношении смертности при СН, ББ следует титровать до целевых/максимально переносимых доз при отсутствии противопоказаний, прежде чем оценивать ЧСС в покое для рассмотрения вопроса о начале терапии ивабрадином (118-121).
Ивабрадин рекомендован для пациентов с СНнФВФВЛЖ ≤35%, которые получают лечение, рекомендованное клиническими руководствами, включая ББ в максимально переносимой дозе, и у которых имеется синусовый ритм с ЧСС ≥70 ударов в минуту в покое для снижения количества госпитализаций по поводу СН и смертности от сердечно-сосудистых заболеваний (IIаB).
Практическое руководство по применению ивабрадина при ХСН дано в приложении №2.
Комбинация гидралазина и изосорбидадинитрата
До настоящего времени не существует четких доказательств, позволяющих рекомендовать использование этой комбинированной терапии с фиксированными дозами у всех пациентов с СНнФВ. РКИ, проведенное в 2004 году среди афроамериканских пациентов с ХСН. В РКИ добавление комбинации гидралазина и изосорбидадинитрата к основной терапии (иАПФ, ББ и диуретики) показало снижение смертности и количества госпитализаций по поводу СН у пациентов с СНнФВ и ФК III–IV по NYHA (122). Кроме того, для снижения смертности может быть рассмотрена комбинация гидралазина и изосорбидадинитрата у симптоматических пациентов с СНнФВ, которые не переносят иАПФ/БРА либо, если они противопоказаны. Однако эта рекомендация основана также на результатах исследования, проведенного в 1986 году, в которое были включены только пациенты мужского пола с симптоматической СНнФВ, которых лечили дигоксином и диуретиками (123). Результаты данных исследований имеют ряд ограничений для применения у всей популяции пациентов с СН.
До настоящего времени не существует четких доказательств, позволяющих рекомендовать использование этой комбинированной терапии с фиксированными дозами у всех пациентов с СНнФВ. РКИ, проведенное в 2004 году среди афроамериканских пациентов с ХСН. В РКИ добавление комбинации гидралазина и изосорбидадинитрата к основной терапии (иАПФ, ББ и диуретики) показало снижение смертности и количества госпитализаций по поводу СН у пациентов с СНнФВ и ФК III–IV по NYHA (122). Кроме того, для снижения смертности может быть рассмотрена комбинация гидралазина и изосорбидадинитрата у симптоматических пациентов с СНнФВ, которые не переносят иАПФ/БРА либо, если они противопоказаны. Однако эта рекомендация основана также на результатах исследования, проведенного в 1986 году, в которое были включены только пациенты мужского пола с симптоматической СНнФВ, которых лечили дигоксином и диуретиками (123). Результаты данных исследований имеют ряд ограничений для применения у всей популяции пациентов с СН.
Дигоксин
На сегодняшний день проведено только одно крупномасштабное РКИ (DIG)эффективности применения дигоксина у пациентов с СН (124). В DIG включались пациенты с СН ФК II–III класса по NYHA и было показано, что лечение дигоксином в течение 2–5 лет не влияло на смертность и качество жизни, но умеренно снижало комбинированный риск смерти и госпитализации. Влияние дигоксина на количество госпитализаций было подтверждено несколькими ретроспективными исследованиями и мета-анализами (125-128). Эффекты дигоксина у пациентов с СНнФВ и ФП в РКИ не изучались. Дигоксин может быть полезен для лечения пациентов с СНнФВ и ФП с высокой частотой желудочковых сокращений, когда другие терапевтические варианты не могут быть применены (129-132). Наблюдательные исследования и ретроспективный анализ показали улучшение симптомов и толерантности к физической нагрузке при легкой и умеренной СН, но в большинстве случаев отмечалось либо отсутствие снижения смертности, либо повышенная смертность, связанная с дигоксином (133). Дигоксин имеет узкое терапевтическое окно, поэтому его уровень следует контролировать, стремясь к концентрации дигоксина в сыворотке <1,2 нг/мл(133,134). Терапию дигоксином обычно начинают и продолжают в дозе от 0,125 до 0,25 мг в день. Следует также соблюдать осторожность при использовании препарата у женщин, пожилых людей, ослабленных и истощенных людей, пациентов с гипокалиемией. У пациентов со сниженной функцией почек можно рассмотреть возможность применения дигитоксина. Таким образом, применение дигоксина требует осторожности у пациентов с СН и предназначено только для тех, у кого сохраняются симптомы, несмотря на оптимизацию терапии, рекомендованной клиническими руководствами. Применение дигоксина у пациентов с СНнФВ при синусовом ритме может рассматриваться для снижения риска госпитализации. У пациентов с сохраняющимися симптомами СНнФВ, несмотря на оптимальную медикаментозную терапию (либо у тех, кто не способен переносить оптимальную медикаментозную терапию), следует рассмотреть возможность применения дигоксина для уменьшения количества госпитализаций по поводу СН (4,6,11).
Стимулятор рецепторов растворимой гуанилатциклазы
Пероральный растворимый стимулятор гуанилилциклазы – верицигуат - напрямую связывает и стимулирует рГЦ и увеличивает выработку цГМФ. цГМФ оказывает несколько потенциально полезных эффектов у пациентов с СН, включая расширение сосудов, улучшение функции эндотелия, а также уменьшение фиброза и ремоделирование сердца (134-136).В исследовании VICTORIA у рандомизированных 5050 пациентов оценивалась эффективность и безопасность перорального стимулятора рецепторов гуанилатциклазыверицигуата у пациентов со сниженной ФВ и недавно развившейся декомпенсацией ХСН по сравнению с плацебо. Пациенты, принимавшие нитраты длительного действия с САД <100 мм.рт.ст. или рСКФ<15 мл/мин/1,73 м2, были исключены. Частота первичной конечной точки смерти от сердечно-сосудистых причин или госпитализации по поводу СН была ниже среди тех, кто получал верицигуат, чем среди тех, кто получал плацебо (137). Снижения смертности от всех причин или смертности от сердечно-сосудистых заболеваний не наблюдалось. Хотя это и не было статистически значимым, симптоматическая гипотония (9,1% против 7,9%; P = 0,12) и обмороки (4,0% против 3,5%; P = 0,30) были численно выше в группе верицигуата по сравнению с плацебо. Таким образом, верицигуат можно рассматривать в дополнение к стандартной терапии СНнФВ для снижения риска сердечно-сосудистой смертности и госпитализаций по поводу СН.
Пероральный растворимый стимулятор гуанилилциклазы – верицигуат - напрямую связывает и стимулирует рГЦ и увеличивает выработку цГМФ. цГМФ оказывает несколько потенциально полезных эффектов у пациентов с СН, включая расширение сосудов, улучшение функции эндотелия, а также уменьшение фиброза и ремоделирование сердца (134-136).В исследовании VICTORIA у рандомизированных 5050 пациентов оценивалась эффективность и безопасность перорального стимулятора рецепторов гуанилатциклазыверицигуата у пациентов со сниженной ФВ и недавно развившейся декомпенсацией ХСН по сравнению с плацебо. Пациенты, принимавшие нитраты длительного действия с САД <100 мм.рт.ст. или рСКФ<15 мл/мин/1,73 м2, были исключены. Частота первичной конечной точки смерти от сердечно-сосудистых причин или госпитализации по поводу СН была ниже среди тех, кто получал верицигуат, чем среди тех, кто получал плацебо (137). Снижения смертности от всех причин или смертности от сердечно-сосудистых заболеваний не наблюдалось. Хотя это и не было статистически значимым, симптоматическая гипотония (9,1% против 7,9%; P = 0,12) и обмороки (4,0% против 3,5%; P = 0,30) были численно выше в группе верицигуата по сравнению с плацебо. Таким образом, верицигуат можно рассматривать в дополнение к стандартной терапии СНнФВ для снижения риска сердечно-сосудистой смертности и госпитализаций по поводу СН.
У отдельных пациентов высокого риска с СНнФВ и недавним ухудшением СН, уже получающих ОМТ, можно рассмотреть возможность перорального применения растворимого стимулятора гуанилатциклазы (верицигуат) для снижения госпитализации по поводу СН и смертности от сердечно-сосудистых заболеваний -IIbB (4,6).
Сердечный активатор миозина
В исследовании GALACTIC-HF оценивалась эффективность и безопасность сердечного активатора миозина (omecamtivmecarbil) у пациентов с СНнФВ, в котором участвовали пациенты как в стационарных, так и в амбулаторных условиях. Первичная конечная точка первого события СН или смерти от сердечно-сосудистых заболеваний снизилась на 8%. Значительного снижения смертности от сердечно-сосудистых заболеваний не произошло. В настоящее время этот препарат не лицензирован для применения при СН. Однако в будущем, в результате РКИ, возможно его применение в дополнение к стандартной терапии СНнФВ для снижения риска сердечно-сосудистой смертности и госпитализации по поводу СН (138).
Рисунок 2. Упрощенный алгоритм стратегии лечения для пациентов с СНнФВ для снижения смертности(3)
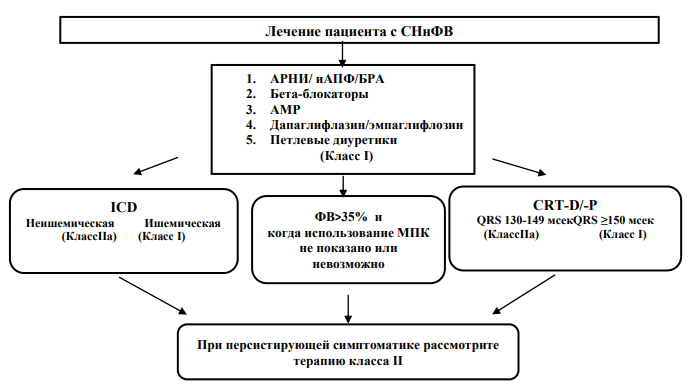
Примечание: АМКР-антагонист минералокортикоидных рецепторов; АРНИ-ингибитор рецептора ангиотензина-неприлизина; ICD-имплантируемый кардиовертер-дефибриллятор; CRT-D/P – кардиоресинхронизирующая терапия- дефибриллятор/пейсмекер. МПК -механическая поддержка кровообращения
Таблица 15. Дозы препаратов, влияющих на прогноз при ХСН в ключевых рандомизированных исследованиях у пациентов СН с низкой фракцией выброса
|
|
Стартовая доза
|
Целевая доза
|
|
иАПФ
|
||
|
Каптоприл
|
6,25мг 3 р/день
|
50 мг 3 р/д
|
|
Эналаприл
|
2,5 мг 2 р/д
|
10-20 мг 2 р/д
|
|
Лизиноприл
|
2,5-5 мг 1 р/д
|
20-30 мг 1 р/д
|
|
Рамиприл
|
2,5 мг 2 р/д
|
5 мг 2 р/д
|
|
Трандалаприл
|
0,5 мг 1 р/д
|
4 мг 1 р/д
|
|
АРНИ
|
||
|
Сакубитрил/валсартан1
|
49/51 мг 2 р/д1
|
97/103 мг 2 р/д
|
|
Бета-блокаторы
|
||
|
Бисопролол
|
1,25 мг 1 р/д
|
10 мг 1р/д
|
|
Карведилол
|
3,125 мг 2 р/д
|
25 мг 2 р/д2
|
|
Метопрололсукцинат
|
12,5 мг 1 р/д
|
200 мг 1 р/д
|
|
Небиволол
|
1,25 мг 1 р/д
|
10 мг 1 р/д
|
|
АМКР
|
||
|
Эплеренон
|
25 мг 1 р/д
|
50 мг 1 р/д
|
|
Спиринолактон2
|
25 мг 1 р/д3
|
50 мг 1 р/д
|
|
Ингибиторы SGLT2
|
||
|
Дапаглифлазин
|
10 мг 1 р/д
|
10 мг 1 р/д
|
|
Эмпаглифлазин
|
10 мг 1 р/д
|
10 мг 1 р/д
|
|
БРА
|
||
|
Кандесартан
|
4 мг 1 р /д
|
32 мг 1 р/д
|
|
Лозартан
|
50 мг 1 р /д
|
150 мг 1 р /д
|
|
Валсартан
|
40 мг 2 р/д
|
160 мг 2 р/д
|
|
Другие препараты
|
||
|
Ивабрадин
|
5 мг 2 р/д
|
7,5 мг 2 р/д
|
|
Верицигуат
|
2,5 мг 1 р/д
|
10 мг 1 р/д
|
|
Дигоксин
|
62,5 мкг 1 р/д
|
250 мкг 1 р/д
|
|
Гидралазин/динитратизосорбид
|
37,5 мг 3 р/д/20 мг 3 р/д
|
75 мг 3 р/д/40 мг 3 р/д
|
1Сакубитрил/валсартан может иметь необязательную более низкую начальную дозу 24/26 мг два раза в день для пациентов с симптоматической гипотонией в анамнезе.
2Спиронолактон имеет необязательную начальную дозу 12,5 мг для пациентов, у которых почечный статус или гиперкалиемия требуют осторожности.
Сердечная недостаточность с умеренно сниженной ФВ
Диагноз СНусФВ требует наличия симптомов и/ или признаков СН, умеренно сниженной ФВ (41-49%) и объективных доказательств структурных и/или функциональных аномалий сердца, соответствующих наличию диастолической дисфункции ЛЖ/повышенного давления наполнения ЛЖ, включая повышенное содержание натрийуретических пептидов (BNP ≥35 пг/мл или NTproBNP ≥125 пг/мл). Причем, признаки могут отсутствовать у пациентов, получающих оптимальное лечение. Для диагностики СНусФВот 41 до 49% наличие других признаков структурного заболевания сердца (например, увеличение левого предсердия, гипертрофия ЛЖ или признаки повышения наполнения ЛЖ) делает диагноз более вероятным, но не является обязательным, если есть определенность в отношении измерения ФВ ЛЖ. Алгоритм диагностики СНусФВтакой же, как и для СНнФВ (рис.1.). Чрезвычайно важным является уточнение этиологии СН, т.к. это определяет причины сердечной недостаточности и лечение основного заболевания. В фармакологическом лечении СНусФВ применяется та же «квадротерапия» группами препаратов, модифицирующих заболевание (АРНИ/иАПФ/БРА, ББ, иSGLT2, АМКР) как и при СНнФВс различием по уровню доказательности и диуретики при признаках застоя.
В течение последних лет стали доступны результаты двухРКИ ингибиторов SGLT2 (эмпаглифлозина и дапаглифлозина) у пациентов с СНФВ ЛЖ >40%, что привело к обновлению рекомендаций как для СНусФВ, так и для СНсФВ (139, 140).Первым исследованием, о котором сообщалось, было исследование EMPEROR-Preserved, в которое были включены 5988 пациентов с СН ФК II–IV по NYHA с ФВ ЛЖ>40% и наблюдались повышенные концентрации в плазме NT-proBNP> 300 пг/мл для лиц с синусовым ритмом или >900 пг/мл для лиц с фибрилляцией предсердий (141). Они были рандомизированы на группы эмпаглифлозина (10 мг один раз в день) или плацебо. Первичной конечной точкой была совокупная смерть от сердечно-сосудистых заболеваний или госпитализация по поводу СН. При медиане наблюдения 26,2 месяца эмпаглифлозин снижал первичную конечную точку (ОР 0,79, 95% ДИ 0,69–0,90; P < 0,001). Эффект был, главным образом, обусловлен снижением количества госпитализаций по поводу СН в группе приема эмпаглифлозина, при этом не наблюдалось снижения смертности от сердечно-сосудистых заболеваний. Эффект наблюдался у пациентов как с СД2 типа, так и без него. Большинство пациентов принимали иАПФ/БРА/АРНИ (80%) и ББ (86%), а 37% получали АMКР (141).
Год спустя в исследовании DELIVER сообщалось об эффектах дапаглифлозина (10 мг один раз в день) по сравнению с плацебо у 6263 пациентов с СН ФК II–IV по NYHA, ФВ ЛЖ >40%, но также были включены те, у кого ранее ФВ ЛЖ была <40% и улучшилась до >40% (142). Обязательным критерием включения также была повышенная концентрация NT-proBNP>300 пг/мл для лиц с синусовым ритмом или >900 пг/мл для лиц с фибрилляцией предсердий (139, 142, 143). Дапаглифлозин снижал первичную конечную точку, связанную с сердечно-сосудистой смертью или ухудшением СН (госпитализация по поводу СН или срочное посещение по поводу СН) (ОР 0,82, 95% ДИ 0,73– 0,92; P<0,001). Основной эффект был обусловлен снижением усугубления СН и отсутствием снижения смертности от сердечно-сосудистых заболеваний. Дапаглифлозин также улучшил выраженность симптомов. Полученные эффектыне зависели от статуса СД2 (143).
Эффективность дапаглифлозина была постоянной у тех, у кого сохранялись симптомы, несмотря на улучшение ФВ ЛЖ, что позволяет предположить, что ингибирование SGLT2 также может принести пользу этим пациентам (139, 142, 143). Польза от дапаглифлозина также была одинаковой во всем диапазоне изученной ФВ ЛЖ (143,144). Фоновое использование терапии сопутствующего сердечно-сосудистого заболевания было высоким: 77% принимали петлевые диуретики, 77% принимали иАПФ/БРА/АРНИ, 83% принимали ББ и 43% принимали АМКР (142).
Последующий метаанализ совокупных данных двух исследований подтвердил снижение на 20% комбинированной конечной точки, связанной с смертью от сердечно-сосудистых заболеваний или первой госпитализацией по поводу СН (ОР 0,80, 95% ДИ 0,73– 0,87; P <0,001). Смертность от сердечно-сосудистых заболеваний существенно не снизилась (ОР 0,88, 95% ДИ 0,77–1,00; P = 0,052). Госпитализация по поводу СН снизилась на 26% (ОР 0,74, 95% ДИ 0,67–0,83; P < 0,001). Во всем изучаемом диапазоне ФВ ЛЖ наблюдалось последовательное снижение первичной конечной точки (145). Другой мета-анализ данных отдельных пациентов, включавший данные DAPA-HF (дапаглифлозин и профилактика неблагоприятных исходов при СНнФВ)и DELIVER, подтвердил отсутствие доказательств того, что эффект дапаглифлозина различался в зависимости от ФВ (146). Это также показало, что дапаглифлозин снижает риск смерти от сердечно-сосудистых причин (ОР 0,86, 95% ДИ 0,76–0,97; P = 0,01) (142).
Таким образом, оба РКИ достигли своих основных конечных результатов, но сделали это за счет снижения комбинированной конечной точки (смерть от сердечно-сосудистых заболеваний или количества госпитализацией по поводу СН), а не смертности от сердечно-сосудистых заболеваний. Принимая во внимание эти два исследования, были даны следующие рекомендации для СHусФВ иСНсФВ.
Как и при других формах СН, для контроля отечного синдрома следует использовать диуретики, преимущественно петлевые.
Таблица 16. Фармакологические ведение пациентов сердечной недостаточностью с умеренно сниженной фракцией выброса
|
Рекомендации
|
Класс
|
|
Пациентам с застойными явлениями на фоне СНусФВ рекомендуются диуретики для облегчения симптомов и признаков
|
I С
|
|
Ингибиторы SGLT2 могут быть рассмотрены для пациентов с СНусФВ для снижения риска госпитализации или кардиоваскулярной смерти
|
I А
|
|
иАПФ/AРНИ/БРА могут быть рассмотрены для пациентов с СНусФВ для снижения риска госпитализации и смерти в связи с СН
|
IIb
|
|
Бета-блокаторы могут быть рассмотрены для пациентов с СНусФВ для снижения риска госпитализации и смерти в связи с СН
|
IIb
|
|
АМКР могут быть рассмотрены для пациентов с СНусФВ для снижения риска госпитализации и смерти в связи с СН.
|
IIb
|
Сердечная недостаточность с сохраненной фракцией выброса
В данном руководстве сохранена номенклатура СНсФВ с использованием порогового значения ФВ, равного и выше 50%, с учетом известной вариабельности эхокардиографических измерений ФВЛЖ, трудности с интерпретацией ФВЛЖ, измеренных с использованием различных методов визуализации и сохраняющихся разногласий относительно точного порогового значения ФВЛЖ для определения «нормального», которое может варьироваться в зависимости от пола, возраста и этнической принадлежности. Практическим врачам важно знать, что ФВЛЖ является непрерывной переменной с нормальным распределением в общей популяции, и поэтому пороговые значения ФВ, используемые в фенотипах, являются в определенной степени произвольными. Более того, хотя пороговое значение ФВЛЖ для определения «нормального», вероятно, будет выше 50%, наличие очень высокой ФВ (например, выше 65-70%) также должно побудить к поиску патологии, такой как амилоидоз сердца или гипертрофическая кардиомиопатия, при которой «сверхнормальная» ФВ может быть результатом уменьшения конечного диастолического объема ЛЖ (знаменатель при расчете ФВ).
В данном руководстве сохранена номенклатура СНсФВ с использованием порогового значения ФВ, равного и выше 50%, с учетом известной вариабельности эхокардиографических измерений ФВЛЖ, трудности с интерпретацией ФВЛЖ, измеренных с использованием различных методов визуализации и сохраняющихся разногласий относительно точного порогового значения ФВЛЖ для определения «нормального», которое может варьироваться в зависимости от пола, возраста и этнической принадлежности. Практическим врачам важно знать, что ФВЛЖ является непрерывной переменной с нормальным распределением в общей популяции, и поэтому пороговые значения ФВ, используемые в фенотипах, являются в определенной степени произвольными. Более того, хотя пороговое значение ФВЛЖ для определения «нормального», вероятно, будет выше 50%, наличие очень высокой ФВ (например, выше 65-70%) также должно побудить к поиску патологии, такой как амилоидоз сердца или гипертрофическая кардиомиопатия, при которой «сверхнормальная» ФВ может быть результатом уменьшения конечного диастолического объема ЛЖ (знаменатель при расчете ФВ).
Распространенность и клиническая характеристика пациентов с СНсФВимеет свои особенности по сравнению с больными СНнФВ и СНусФВ.Среди пациентов с ХСН чаще всего встречается СНсФВ - у 53%, СНнФВ- у 24% и СНусФВ – у 23% (147). Причем, в основном, у пожилых пациентов, женского пола, ожирением, АГ, СД 2 типа и другими сопутствующими заболеваниями, как связанными, так и не связанными с сердечно-сосудистой патологией, имеющими фибрилляцию предсердий, ХБП и т.д. Зачастую это обусловлено тем, что существует множество потенциальных этиологических причин СНсФВ. Соответственно патофизиология развития СНсФВ отличается, и поэтому они требуют различных методов лечения. Например, при подозрениина амилоидоз сердца, следует учесть наличие низкого АД у пациентов с АГ в анамнезе, непереносимости ББ или иАПФ, двустороннего туннельного синдрома запястья, низкого вольтажа зубцов на ЭКГ и эхокардиографических признаков, таких как утолщение межжелудочковой перегородки, задней стенки или стенки правого желудочка, увеличения предсердий, небольшого выпота в перикарде или утолщения клапанов. Кроме того, важно исключить другую патологию, могущую имитировать клинику СНсФВ (например, заболевания легких, анемия, ожирение и нарушение кондиционирования).
Диагностика СНсФВ остается сложной задачей. Врачи для установления СНсФВ не всегда могут иметь доступ ко всем специализированным экспертным тестам, что ограничивает их широкое клиническое применение. В связи с чем, рекомендуется упрощенный прагматический подход, который выделяет основные элементы в диагностических критериях в исследованиях, широкодоступных клиницистам (23, 4).
Диагностика СНсФВ остается сложной задачей. Врачи для установления СНсФВ не всегда могут иметь доступ ко всем специализированным экспертным тестам, что ограничивает их широкое клиническое применение. В связи с чем, рекомендуется упрощенный прагматический подход, который выделяет основные элементы в диагностических критериях в исследованиях, широкодоступных клиницистам (23, 4).
Таблица 17. Комментарии по структурным, функциональным и серологическим показателям диастолической дисфункции ЛЖ/повышенного давления наполнения ЛЖ
|
Показатель
|
Результат
|
Комментарии
|
|
Индекс массы миокарда ЛЖ
|
≥95 g/m2 (жен), ≥115 g/m2 (муж)
|
Хотя наличие концентрического ремоделирования или гипертрофии ЛЖ является поддерживающим признаком, отсутствие гипертрофии ЛЖ не исключает диагноза СНсФВ
|
|
Индекс объема ЛП
|
>34 mL/m2 (СР) >40 mL/m2 (ФП)
|
При отсутствии ФП или клапанной болезни увеличение ЛП отражает хронически повышенное давление наполнения ЛЖ
|
|
Отношение E / e'
|
в покое >9 при пиковом напряжении ≥15
|
Чувствительность 78%, специфичность 59% на наличие СНсФВ по данным инвазивных тестов с физической нагрузкой, хотя сообщаемая точность достаточно вариабельная. Более высокое пороговое значение 13 имело более низкую чувствительность (46%), но более высокую специфичность (86%).
|
|
Септальная e'
|
<7см/с
|
|
|
Латеральное e'
|
<10см/с
|
|
|
Систолическое давление ЛА
|
>35 mmHg
|
Чувствительность 54%, специфичность 85% на наличие СНсФВ по данным инвазивных тестов с физической нагрузкой
|
|
TР скорость
|
в покое >2.8 m/s, при макс. нагрузке> 3,4 m/s
|
|
|
Глобальная продольная деформация ЛЖ
|
< -16%
|
Чувствительность для продольной деформации 67%, специфичность 89%
|
|
NT-proBNP
|
>125 (СР) >365 (ФП) pg/mL
|
До 20% пациентов с инвазивно доказанной СНсФВ имеют уровни ниже диагностических порогов, особенно при наличии ожирения
|
|
BNP
|
>35 (СР) или >105 (ФП) pg/mL
|
Отношение E / e'- скорость раннего наполнения по трансмитральномудопплеру/скорость ранней релаксации по тканевому допплеру, СР -синусовый ритм, ФП -фибрилляция предсердий, TР скорость -скорость трикуспидальнойрегургитации.
Примечание: чем больше количество аномалий, тем выше вероятность СНсФВ (HFpEF). В таблице перечислены только часто используемые индексы; для менее часто используемых индексов обратитесь к согласованному документу ASE/ EACVI, 2016 (23,4).
Для оценки вероятности СНсФВ рекомендовано использовать шкалу H2FPEF на первичном уровне и шкалу HFA-PEFF на третичном уровне здравоохранения (148, 149).
Таблица 18. Шкала оценки вероятности СНсФВ -H2FPEF
|
H2
|
Heavy
|
Индекс массы тела ˃30 кг/м2
|
2
|
|
Hypertesive
|
2 или больше антигипертензивных средств
|
1
|
|
|
F
|
Atrial Fibrillation
|
ФП (пароксизмальная/персистирующая)
|
3
|
|
P
|
Pulmonary Hypertension
|
Систолическое давление в легочной артерии ˃35 мм.рт.ст. (допплерЭхоКГ)
|
1
|
|
E
|
Elder
|
Возраст ˃60 лет
|
1
|
|
F
|
Filling Pressure
|
допплерЭхоКГ – Е/е' ˃9
|
1
|
|
H2FPEF score
|
0-9
|
||
Баллы <2 низкая вероятность СНсФВ, баллы ≥6 высокая вероятность СНсФВ, баллы от 2 до 5 требуют дополнительной оценки гемодинамики с помощью ЭхоКГ с нагрузкой или катетеризации сердца для подтверждения или опровержения диагноза СНсФВ.
Использование шкалы H2FPEF может помочь отличить СНсФВ от некардиальных причин одышки, а также для определения необходимости дальнейшего диагностического тестирования при обследовании пациентов с необъяснимой одышкой при нагрузке на амбулаторном и стационарном этапах.
На третичном уровне возможно использование алгоритма диагностики СНсФВ: HFA-PEFF (Heart Failure Association, ESC), включающей углубленное исследование сердечно-сосудистой системы (149).
Таблица 19. Шкала оценки вероятности СНсФВ - HFA-PEFF
|
P
|
Шаг 1: предварительная оценка
|
Симптомы и/или признаки СН Риск факторы/коморбидности ЭКГ Стандартная ЭхоКГ НУП Эргометрия/тест 6-минутной ходьбой, кардиопульмональный тест
|
|
E
|
Шаг 2: Эхокардиографическое обследование и оценка НУП
|
Расширенная ЭхоКГ НУП, если раннее не назначались
|
|
F1
|
Шаг 3: Расширенное обследование. Функциональное тестирование в случаях неопределенности
|
диастолический стресс-тест с физической нагрузкой,ЭхоКГ с последующим инвазивным измерением гемодинамики, если необходимо
|
|
F2
|
Шаг 4: Этиологическое обследование
|
МРТ сердца Биопсия сердца Сцинтиграфия/КТ/ПЭТ Генетическое тестирование Другие специфичные лабораторные тесты
|
Алгоритм включает в себя 4 этапа:
Шаг 1 -обычно выполняется в амбулаторных условиях и включает оценку симптомов и признаков СН, типичных клинических демографических данных (ожирение, гипертония, сахарный диабет, пожилой возраст, фибрилляция предсердий), а также диагностические лабораторные исследования, ЭКГ иЭхоКГ. При отсутствии явных несердечных причин одышки можно заподозрить СНсФВ при наличии нормальной фракции выброса левого желудочка, отсутствии значимого поражения сердечного клапана или сердечной ишемии и хотя бы одного типичного фактора риска. Повышенный уровень НУП поддерживает, но нормальный уровень не исключает диагноз СНсФВ;
Шаг 2 -проводится расширенная ЭхоКГ и НУП, если раннее не проводились. Эхокардиографические измерения включают раннюю диастолическую скорость митрального кольца (e ′), давление наполнения ЛЖ, оцениваемое с помощью E / e ′, индекс объема левого предсердия, индекс массы ЛЖ, относительную толщину стенки ЛЖ, скорость трикуспидальнойрегургитации, глобальную продольную систолическую деформацию ЛЖ. Определяются уровни натрийуретических пептидов в сыворотке крови. На основе этих мер были определены основные (2 балла) и второстепенные (1 балл) критерии. Оценка ≥5 баллов означает выраженную СНсФВ; ≤1 балл делает СНсФВ маловероятной. Промежуточный балл (2–4 балла) подразумевает диагностическую неопределенность, и в этом случае рекомендуется третий этап.
Шаг 3 - функциональное тестирование в случаях неопределенности диагноза, включая ЭхоКГдиастолический стресс-тест с физической нагрузкой или инвазивные гемодинамические нагрузочные тесты при необходимости;
Шаг 4 – рекомендуется для установления возможной конкретной причины СНсФВ, посвящен углубленному уточнению этиологии СНсФВ, включая тестирование для исключения других кардиологических/некардиологических причин одышки и/или отеков (149).
В плане лечения пациентам с СНсФВ рекомендуется прежде всего скрининг и этиологическая терапия сердечно-сосудистых и не сердечно-сосудистых сопутствующих заболеваний. Акцентируется внимание врачей, что необходимо в первую очередь определить причину СН и провести все мероприятия профилактического и лечебного вмешательств (например: АГ, ожирения, СД 2 типа, КБС, гипертиреоза, амилоидоза и т.д.). В то же время получение результатов двух РКИ ингибиторов SGLT2 - EMPEROR-Preserved (эмпаглифлозина) и DELIVER (дапаглифлозина) у пациентов с СН ФВ ЛЖ >40%, в том числе СН ФВ ЛЖ >50%, а затем последующий мета-анализ подтвердили снижение комбинированной конечной точки, связанной с смертью от сердечно-сосудистых заболеваний или первой госпитализацией по поводу СН. Смертность от сердечно-сосудистых заболеваний существенно не снизилась, зато госпитализация по поводу СН снизилась на 26%. Во всем изучаемом диапазоне ФВ ЛЖ наблюдалось последовательное снижение первичной конечной точки (141,142). В обеих РКИ подтвердился положительный эффект снижения комбинированной конечной точки (смерть от сердечно-сосудистых заболеваний или количества госпитализацией по поводу СН) для эмпаглифлозина и дапаглифлазинау пациентов сСНсФВ с/без СД 2 типа (143-146).
Таблица 20. Рекомендации по лечению пациентов с сердечной недостаточностью с сохраненной фракцией выброса
|
Рекомендации
|
Класс
|
Уровень
|
|
Ингибиторы SGLT2 (эмпаглифлозин, дапаглифлозин) могут быть рассмотрены для пациентов с СНсФВ для снижения риска госпитализации или кардиоваскулярной смерти
|
I
|
A
|
|
Пациентам с СНсФВ рекомендуется скрининг и этиологическое лечение сердечно-сосудистых и не сердечно-сосудистых сопутствующих заболеваний(АГ, КБС, заболевания клапанов сердца, СД, амилоидоз и др.)
|
I
|
C
|
|
Диуретики рекомендуются пациентам с СНсФВ с признаками застоя для облегчения симптомов и признаков.
|
I
|
C
|
Интервенционные и хирургические методы лечения СН
В этом разделе представлены интервенционные методы лечения СН при управлении сердечным ритмом. Представлены рекомендации по использованию имплантируемых кардиовертеров-дефибрилляторов (ИКД) и сердечной ресинхронизирующей терапии (СРТ)
Имплантируемые кардиовертер-дефибрилляторы
Внезапная сердечная смерть (ВСС) у больных с СН в разы выше, чем у больных без СН, причем ВСС может возникать даже у больных с оптимальной медикаментозной терапией. Было показано, что методы лечения, которые улучшают или замедляют прогрессирование сердечно-сосудистых заболеваний, снижают ежегодный уровень внезапной смерти, но они не лечат аритмические события, когда они возникают. ВСС у больных с СН часто проявляется внезапно из-за электрических нарушений, таких как желудочковые аритмии, брадикардия и асистолия. ИКД эффективны против ВСС и брадикардий.
Внезапная сердечная смерть (ВСС) у больных с СН в разы выше, чем у больных без СН, причем ВСС может возникать даже у больных с оптимальной медикаментозной терапией. Было показано, что методы лечения, которые улучшают или замедляют прогрессирование сердечно-сосудистых заболеваний, снижают ежегодный уровень внезапной смерти, но они не лечат аритмические события, когда они возникают. ВСС у больных с СН часто проявляется внезапно из-за электрических нарушений, таких как желудочковые аритмии, брадикардия и асистолия. ИКД эффективны против ВСС и брадикардий.
ИКД эффективны в снижении смертности у выживших после остановки сердца и пациентов с симптоматическими желудочковыми аритмиями по сравнению с амиодароном. Установка ИКД рекомендуется для повышения шансов выживания, с учетом мнения пациента, ФВ ЛЖ и отсутствия других факторов риска. Анализ данных более 40 тыс. пациентов из 12 исследований показывает снижение частоты внезапной сердечной смерти на 44% за последние два десятилетия благодаря прогрессу в лечении СН. Риск внезапной смерти выше у пациентов с КБС, поэтому абсолютная польза от ИКД больше у этой группы. Пациенты с ограниченной продолжительностью жизни или серьезными сопутствующими заболеваниями также не получат значительной пользы от ИКД (150).
Таблица 21. Рекомендации для имплантации ИКД у пациентов с СН
|
Рекомендации
|
Класс
|
Уровень
|
|
Вторичная профилактика
|
||
|
ИКД рекомендуется для снижения риска внезапной смерти и смертности от всех причин у пациентов, перенесших желудочковую аритмию, вызвавшую гемодинамическую нестабильность, и у которых предполагается продолжительность жизни >1 года с хорошим функциональным статусом при отсутствии обратимых причин, или если желудочковая аритмия не возникла менее чем через 48 ч после ИМ.
|
I
|
A
|
|
Первичная профилактика
|
||
|
ИКД рекомендуется для снижения риска внезапной смерти и смертности от всех причин у пациентов с симптоматической СН (II-III ФК по NYHA) ишемической этиологии (если они не перенесли ИМ в предшествующие 40 дней — см. ниже) и ФВ ЛЖ ≤35%, несмотря на ≥3 мес. ОМТ, при условии, что ожидается, что они проживут значительно дольше 1 года с хорошим функциональным статусом.
|
I
|
A
|
|
ИКД следует рассматривать для снижения риска внезапной смерти и смертности от всех причин у пациентов с симптоматической СН (II-III ФК по NYHA) не ишемической этиологии и ФВ ЛЖ ≤35%, несмотря на ≥3 мес. ОМТ, при условии, что ожидается, что они проживут значительно дольше 1 года с хорошим функциональным статусом.
|
II b
|
A
|
|
Пациенты должны быть тщательно обследованы опытным кардиологом перед заменой генератора, поскольку цели лечения, потребности пациента и его клиническое состояние могли измениться.
|
II a
|
A
|
|
Носимое ИКД можно рассматривать для пациентов с СН, у которых существует риск внезапной сердечной смерти в течение ограниченного периода времени, или в качестве моста к имплантированному устройству
|
II b
|
B
|
|
Имплантация ИКД не рекомендуется в течение 40 дней после ИМ, поскольку имплантация в это время не улучшает прогноз.
|
III
|
A
|
|
Терапия ИКД не рекомендуется пациентам с IV ФК по NYHA с тяжелыми симптомами, рефрактерными к фармакологической терапии, за исключением случаев, когда они являются кандидатами на СРТ, ВЖУ или ТС.
|
III
|
C
|
Примечание: a — класс рекомендаций, b — уровень доказательности. Сокращения: ВЖУ — вспомогательное желудочковое устройство, ИКД — имплантируемый кардиовертер-дефибриллятор, ИМ — инфаркт миокарда, ОМТ — оптимальная медикаментозная терапия, СН — сердечная недостаточность, СРТ — сердечная ресинхронизирующая терапия, ТС — трансплантация сердца, ФВ ЛЖ — фракция выброса левого желудочка, ФК — функциональный класс, NYHA — Нью-Йоркская ассоциация сердца.
Сердечная ресинхронизирующая терапия
У больных с выраженной СН при записи ЭКГ часто встречается полная блокада левой ножки пучка Гиса (ПБЛНПГ), при этом ЭХОКГ исследование позволяет выявить несинхронность сокращения стенок ЛЖ и ПЖ. С целью устранения несинхронности сокращения сердца была предложена – сердечная ресинхронисирующая терапия. При этой методике используется схема трехкамерной стимуляции сердца: один электрод в правом предсердии, второй в ПЖ и третий (через коронарный синус, реже эпикардиально) в ЛЖ.
У больных с выраженной СН при записи ЭКГ часто встречается полная блокада левой ножки пучка Гиса (ПБЛНПГ), при этом ЭХОКГ исследование позволяет выявить несинхронность сокращения стенок ЛЖ и ПЖ. С целью устранения несинхронности сокращения сердца была предложена – сердечная ресинхронисирующая терапия. При этой методике используется схема трехкамерной стимуляции сердца: один электрод в правом предсердии, второй в ПЖ и третий (через коронарный синус, реже эпикардиально) в ЛЖ.
Такая система позволяет установить оптимальную для каждого больного атрио-вентрикулярную задержку (паузу между навязанным сокращением предсердий и желудочков) и устранить асинхронию в работе желудочков путем их одновременной стимуляции. Различают два варианта устройств СРТ – СРТ-П и СРТ-Д, где П – означает стимуляцию (pacing) а Д – означает дефибирилляцию. Таким образом СРТ-П – это просто трехкамерный стимулятор, а СРТ-Д – это трехкамерный стимулятор с функцией дефибрилляции (151).
В многочисленных исследованиях было доказано, что СРТ при правильном выборе пациентов, снижает заболеваемость, смертность, улучшает сердечную функцию и качество жизни больных.
Продолжительность QRS может быть более важным предиктором благоприятного ответа на СРТ, чем морфология QRS или этиология заболевания. Исследование EchoCRT и мета анализ указывают на возможный вред от СРТ при продолжительности QRS <130 мс, поэтому не рекомендуется ее имплантация в таких случаях. Для пациентов с ФВ ЛЖ ≤35% и БЛНПГ, рассматривается СРТ-Д при QRS 130-149 мс и рекомендуется при QRS ≥150 мс. Выбор между СРТ-П и СРТ-Д зависит от целей лечения, особенно, если основной причиной имплантации является облегчение симптомов (152).
У больных со сниженной ФВ ЛЖ электрокардио стимуляция ПЖ может ухудшить сердечную диссинхронию и привести к дальнейшему снижению ФВ ЛЖ и нарастанию СН, однако таких проблем можно избегать с использованием СРТ, способствуя улучшению результатов лечения. В общем, рекомендуется использовать СРТ, а не стимуляцию ПЖ, для пациентов с СНнФВ, независимо от ФК NYHA, для снижения заболеваемости, хотя влияние на смертность неоднозначно. Пациентов с ранее импланитированными ЭКС с ухудшением СН можно рассмотреть для "обновления" до СРТ (153).
Таблица 22. Рекомендации для имплантации СРТ у пациентов с СН
|
Рекомендации
|
Класс
|
Уровень
|
|
СРТ рекомендуется симптомным пациентам с СН при СР с длительностью комплекса QRS ≥150 мс и морфологией комплекса QRS БЛНПГ и с ФВ ЛЖ ≤35%, несмотря на ОМТ, для улучшения симптомов и снижения заболеваемости и смертности.
|
I
|
A
|
|
СРТ, а не стимуляция ПЖ, рекомендуется пациентам с СНнФВ независимо от ФК по NYHA или ширины комплекса QRS, которым показана желудочковая стимуляция при АВ-блокаде высокой степени с целью снижения заболеваемости. Сюда входят пациенты с ФП
|
I
|
A
|
|
СРТ следует рассматривать для симптоматических пациентов с СН при СР с продолжительностью комплекса QRS ≥150 мс и морфологией QRS без БЛНПГ и с ФВ ЛЖ ≤35%, несмотря на ОМТ, для улучшения симптомов и снижения заболеваемости и смертности
|
II a
|
B
|
|
СРТ следует рассматривать для симптоматических пациентов с СН при СР с продолжительностью QRS 130-149 мс и морфологией QRS БЛНПГ и с ФВ ЛЖ ≤35%, несмотря на ОМТ, чтобы улучшить симптомы и снизить заболеваемость и смертность.
|
II a
|
B
|
|
Пациенты с ФВ ЛЖ ≤35%, которые получили обычный кардиостимулятор или ИКД и впоследствии у них развивается ухудшение СН, несмотря на ОМТ, и у которых значительная часть стимуляции ПЖ, должны быть рассмотрены для "обновления" до СРТ.
|
II a
|
B
|
|
СРТ может быть рассмотрена у симптомных пациентов с СН при СР с продолжительностью QRS 130-149 мс и морфологией QRS без БЛНПГ и с ФВ ЛЖ ≤35%, несмотря на ОМТ, для улучшения симптомов и снижения заболеваемости и смертности.
|
II b
|
B
|
|
СРТ не рекомендуется пациентам с длительностью комплекса QRS <130 мс, у которых нет показаний к кардиостимуляции из-за АВ-блокады высокой степени.
|
III
|
B
|
Примечание: a — класс рекомендаций, b — уровень доказательности. Сокращения: АВ — атриовентрикулярный, БЛНПГ — блокада левой ножки пучка Гиса, ИКД — имплантируемый кардиовертер-дефибриллятор, ОМТ — оптимальная медикаментозная терапия (рекомендуемая медикаментозная терапия I класса в течение не <3 мес.), ПЖ — правый желудочек, СН — сердечная недостаточность, СНнФВ — сердечная недостаточность со сниженной фракцией выброса, СР — синусовый ритм, СРТ — сердечная ресинхронизирующая терапия, ФВ ЛЖ — фракция выброса левого желудочка, ФК — функциональный класс, ФП — фибрилляция предсердий, NYHA — Нью-Йоркская ассоциация сердца.
Коррекция нарушений ритма и проводимости у больных СН
Фибрилляция предсердий (ФП) и сердечная недостаточность часто взаимосвязаны, взаимодействуя между собой через структурное ремоделирование сердца, активацию нейрогормональных систем и связанные с ЧСС нарушения левого желудочка. У пациентов с СН, развивающейся ФП, доля тех, у кого ФП возникает, увеличивается с возрастом и уровнем СН. У пациентов с ХСН пароксизм ФП отрицательно влияет на прогноз, с увеличением риска инсульта и смерти (154,155). Тактика управления пациентами с сочетанной СН и ФП включает следующие шаги: 1. Выявление и лечение возможных причин или триггеров ФП. 2. Управление СН. 3. Профилактика эмболических событий. 4. Контроль частоты сердечных сокращений. 5. Контроль ритма.
Выявление триггеров и лечение СН. Выявление триггеров включает идентификацию и устранение потенциальных причин или провоцирующих факторов, таких как гипертиреоз, электролитные нарушения, неконтролируемая гипертензия, порок митрального клапана и инфекция. При ухудшении застоя, вызванного ФП, рекомендуется применение диуретиков. Улучшение оттока жидкости может снизить симпатическую активность, уменьшить частоту сокращений желудочков и повысить вероятность спонтанного возврата к синусовому ритму.
Профилактика эмболических событий. Для профилактики тромбоэмболических осложнений у всех пациентов с СН и пароксизмальной, персистирующей или постоянной ФП рекомендуется использование пероральных антикоагулянтов прямого действия. Эти препараты предпочтительны у пациентов с ФП, не имеющих тяжелого митрального стеноза и/или механических протезов клапанов. Они обладают сравнимой эффективностью с антагонистами витамина К (АВК), но при этом снижают риск внутричерепного кровоизлияния по сравнению с АВК.
Контроль ЧСС. Высокая ЧСС связана с худшими результатами в наблюдательных исследованиях. Поэтому стратегия мягкого контроля ЧСС (ЧСС в покое <110 уд./мин) считается приемлемым начальным подходом. Однако лечение направлено на достижение более низкой ЧСС в случае стойких симптомов или сердечной дисфункции, связанной с тахикардией. ББ могут использоваться для контроля ЧСС у пациентов с СН и ФП из-за их безопасности. В случае неэффективности или противопоказанности ББ, дигоксин или дигитоксин могут быть рассмотрены как альтернативы. Для пациентов с СН IV ФК по NYHA и/или гемодинамической нестабильностью в/в введение амиодарона может быть рассмотрено для снижения частоты сокращений желудочков (156).
Абляцию атриовентрикулярного узла можно рассматривать у пациентов с плохим контролем желудочкового ритма, несмотря на медикаментозную терапию, не подходящую для контроля ритма с использованием катетерной абляции, или у пациентов с бивентрикулярной стимуляцией.
Контроль ритма. Контроль ритма у пациентов c ФП и СН представляет различные стратегии. Экстренная электрическая кардиоверсия рекомендуется в условиях острого ухудшения СН у пациентов с учащенным желудочковым ритмом и гемодинамической нестабильностью, при условии рассмотрения риска тромбоэмболии. Кардиоверсию также следует рассматривать для улучшения симптомов у пациентов с персистирующей и симптоматической ФП, несмотря на оптимальное фармакологическое лечение. У пациентов, не получающих хроническую терапию пероральными антикоагулянтами и с началом ФП более 48 часов, перед кардиоверсией требуется минимум 3 недели терапии пероральными антикоагулянтами с последующим проведением чреспищеводной ЭхоКГ.
Катетернаяаблация представляет собой важную стратегию в контроле ритма у пациентов с ФП и СН. Исследование CASTLE-AF продемонстрировало, что катетернаяаблация улучшает прогноз, уменьшая смертность от всех причин и госпитализацию по поводу СН в сравнении с медикаментозным лечением. Несмотря на некоторые перспективные данные, вопрос о выборе стратегии контроля ритма требует дополнительных исследований и индивидуального подхода к каждому пациенту (157).
Желудочковые нарушения ритма
Желудочковые аритмии могут осложнять и в некоторых случаях быть причиной СН. Частые желудочковые экстрасистолы могут привести к обратимой систолической дисфункции. Лечение желудочковых аритмий при СН должно включать коррекцию нарушения электролитного баланса, особенно гипо/гиперкалиемии, и антиаритмические препараты. Амиодарон эффективен для подавления желудочковых аритмий, но не снижает частоту внезапной сердечной смерти или общую смертность. Применение амиодарона может уменьшить частоту рецидивирующих аритмий и улучшить симптомы и функцию левого желудочка, но следует учитывать его побочные эффекты.
Желудочковые аритмии могут осложнять и в некоторых случаях быть причиной СН. Частые желудочковые экстрасистолы могут привести к обратимой систолической дисфункции. Лечение желудочковых аритмий при СН должно включать коррекцию нарушения электролитного баланса, особенно гипо/гиперкалиемии, и антиаритмические препараты. Амиодарон эффективен для подавления желудочковых аритмий, но не снижает частоту внезапной сердечной смерти или общую смертность. Применение амиодарона может уменьшить частоту рецидивирующих аритмий и улучшить симптомы и функцию левого желудочка, но следует учитывать его побочные эффекты.
Радиочастотная абляция желудочковой экстрасистолии может улучшить функцию левого желудочка и, возможно, исходы у пациентов с тахикардиомиопатией, когда желудочковая экстрасистолия способствует дисфункции левого желудочка (8).
При брадикардии, паузах и атриовентрикулярных блокадах рекомендуется имплантация ЭКС. Однако стимуляция правого желудочка может оказывать неблагоприятное влияние на систолическую функцию левого желудочка, поэтому в случае АВ-блокады или медленной фибрилляции предпочтительнее использовать бивентрикулярную стимуляцию. В поисках более физиологичной альтернативы стимуляции ПЖ все чаще используется физиологическая стимуляция.
Рисунок 3. Лечение ФП у пациентов с СН (3)
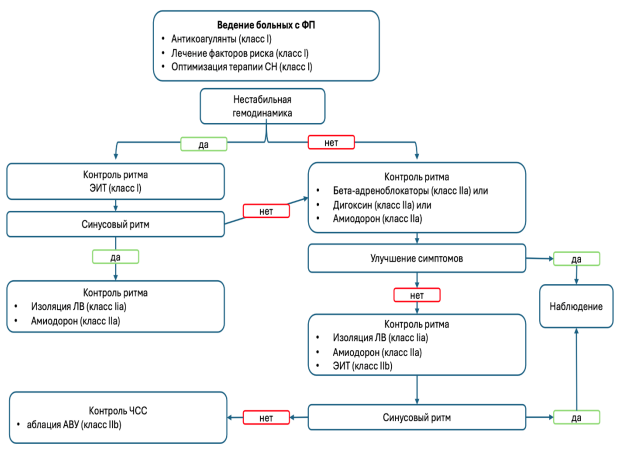
Примечание: АВ - атриовентрикулярный, в/в — внутривенно, ЛВ — легочная вена, СН — сердечная недостаточность, ФП — фибрилляция предсердий, ЭИТ — электроимпульсная терапия.
Реваскуляризация миокарда у больных СН
Данных про реваскуляризацию миокарда у больных с СН мало. В некоторых исследованиях, где проводилось сравнение медикаментозной терапии и АКШ не было выявлено существенной разницы между этими группами в отдаленные сроки наблюдение.
Данных про реваскуляризацию миокарда у больных с СН мало. В некоторых исследованиях, где проводилось сравнение медикаментозной терапии и АКШ не было выявлено существенной разницы между этими группами в отдаленные сроки наблюдение.
В настоящее время не было проведено РКИ сравнивающее медикаментозную терапию и реваскуляризацию у больных с СН. Так же нет РКИ где сравнивалось бы АКШ и чрескожное вмешательство. В одном проспектовом исследовании было показано, что АКШ имеет лучший исход по сравнению с ЧКВ у больных с дисфункцией ЛЖ и поражением ствола или многососудистым поражением коронарных артерий (158).
Таблица 23. Рекомендации по реваскуляризации миокарда у больных СНнФВ
|
Рекомендации
|
Класс
|
Уровень
|
|
АКШ следует рассматривать как стратегию реваскуляризации первого выбора у пациентов, подходящих для хирургического вмешательства, особенно при наличии у них диабета и при многососудистом поражении.
|
IIa
|
B
|
|
Коронарную реваскуляризацию следует рассматривать для облегчения персистирующих симптомов стенокардии (или стенокардии, эквивалентной) у пациентов с СНнФВ, ХКС и коронарной анатомией, подходящей для реваскуляризации, несмотря на ОМТ, включающую антиангинальные препараты.
|
IIa
|
C
|
|
Кандидатам на иЛЖ, нуждающимся в реваскуляризации коронарных артерий, следует по возможности избегать АКШ.
|
IIa
|
C
|
|
Коронарная реваскуляризация может рассматриваться как улучшение исходов у пациентов с СНнФВ, ХКС и коронарной анатомией, подходящей для реваскуляризации, после тщательной оценки индивидуального соотношения риска и пользы, включая коронарную анатомию (т.е. проксимальный стеноз >90% крупных сосудов, стеноз левой главной или проксимальной ПМЖА), сопутствующие заболевания, ожидаемую продолжительность жизни и перспективы пациента.
|
IIb
|
C
|
|
ЧКВ можно рассматривать как альтернативу АКШ на основании оценки кардиологической бригады с учетом анатомии коронарных артерий, сопутствующих заболеваний и хирургического риска
|
IIb
|
C
|
Сокращения: АКШ - коронарное шунтирование,
иЛЖ — искусственный левый желудочек,
ОМТ — оптимальная медикаментозная терапия,
ПМЖА — передняя межжелудочковая артерия,
СНнФВ — сердечная недостаточность со сниженной фракцией выброса,
ХКС — хронический коронарный синдром,
ЧКВ — чрескожное коронарное вмешательство.
иЛЖ — искусственный левый желудочек,
ОМТ — оптимальная медикаментозная терапия,
ПМЖА — передняя межжелудочковая артерия,
СНнФВ — сердечная недостаточность со сниженной фракцией выброса,
ХКС — хронический коронарный синдром,
ЧКВ — чрескожное коронарное вмешательство.
Клапанные пороки сердца и СН
Стеноз аортального клапана.
Прогноз у больных с симптомами СН и с тяжелым АС крайне неблагоприятен. Поэтому вмешательство на аортальном клапане рекомендуется при площади отверстия аортального клапана ≤1 см2 и среднем градиенте ≥40 мм рт.ст. независимо от ФВ ЛЖ (159). Было показано, что TAVI не уступает хирургической замене АК в снижении клинический событий, у пациентов с высоким и средним риском хирургического вмешательства (оценка STSPROM или EuroSCORE II <4%). Таким образом TAVI рекомендуется пациентам в возрасте более 75 лет или при высоком хирургическом риске (STSPROM или EuroSCORE II >8%) (160,161).
Недостаточность аортального клапана.
Операция на аортальном клапане рекомендуется пациентам с тяжелой АН и симптомами СН независимо от ФВ ЛЖ. В случае высокого хирургического риска TAVI также используется для лечения АН. Вмешательство на аортальном клапане, TAVI или SAVR, рекомендуется пациентам с СН и тяжелым высоко градиентным аортальным стенозом для снижения смертности и улучшения симптомов. Рекомендуется, чтобы выбор между TAVI и SAVR делала кардиологическая бригада в соответствии с индивидуальными предпочтениями пациента и особенностями, включая возраст, хирургический риск, клинические, анатомические и процедурные аспекты, взвешивая риски и преимущества каждого подхода (2,3).
Рисунок 4. Ведение пациентов с тяжелым АС и СН (3)
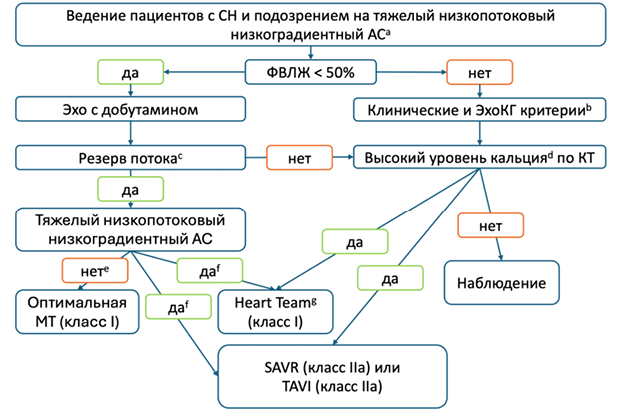
Примечание: a — площадь клапана ≤1 см2, пиковая скорость 70 лет, типичные симптомы без других объяснений, гипертрофия ЛЖ или снижение продольной функции ЛЖ, средний градиент 30-40 мм рт.ст., площадь клапана ≤0,8 см2, индекс ударного объема ≤35 мл/м2, оцененный методами, отличными от стандартной допплерографии, c — резерв потока определяется как увеличение индекса ударного объема >20%, d — АС очень вероятен, если показатель кальция ≥3000 у мужчин и ≥1600 у женщин. АС вероятен, если показатель кальция ≥2000 у мужчин и ≥1200 у женщин. АС маловероятен, если показатель кальция 1,0 см2 в ответ на увеличение потока (резерв потока) во время эхо добутамина. f — увеличение среднего градиента по крайней мере до 40 мм рт.ст. без значительного изменения площади клапана в ответ на увеличение потока (резерв потока) во время эхо добутамина, g — SAVR рекомендуется пациентам в возрасте до 75 лет и с низким хирургическим риском (по шкале STS-PROM или EuroSCORE II 8%). Во всех остальных случаях выбор между TAVI и SAVR рекомендуется принимать кардиологической бригаде (Heart Team), взвешивая все за и против каждой процедуры в соответствии с возрастом, ожидаемой продолжительностью жизни, индивидуальными предпочтениями пациента и особенностями, включая клинические и анатомические аспекты. Цветовой код для классов рекомендаций: зеленый для класса рекомендаций I; желтый для класса рекомендации IIa (дополнительную информацию о классах рекомендаций см. в табл. 1). Сокращения: АС — аортальный стеноз, КТ — компьютерная томография, ЛЖ — левый желудочек, СН — сердечная недостаточность, ФВ — фракция выброса, ЭхоКГ — эхокардиография, EuroSCORE II — Европейская система оценки риска сердечно-сосудистых заболеваний II, SAVR — хирургическая замена аортального клапана, STS-PROM — Прогнозируемый риск смертности по заключению Общества торакальных хирургов, TAVI — транскатетерная имплантация аортального клапана.
Недостаточность митрального клапана
Митральная недостаточность, может быть первичной – обусловленной аномалией структур клапана, или вторичной – возникшей вследствие заболевания ЛЖ, или дилатации ЛП. У пациентов с тяжелой МН и СНнФВ, требующих реваскуляризации, следует рассмотреть хирургию МК и АКШ. Изолированная операция на МК может быть рассмотрена у симптоматических пациентов с тяжелым течением болезни, несмотря на оптимальную терапию, и низким хирургическим риском. В последние годы проводились РКИ, где сравнивалось эффективность чрескожной пластики МК «край в край» и ОМТ у больных с низкой ФВ ЛЖ. Было показано эффективность ЧКВ «край в край» у отобранных больных.
Рекомендуется чрескожную пластику МК "край в край" рассматривать для улучшения исхода только у тщательно отобранных пациентов, у которых сохраняются симптомы (СН II-IV ФК по NYHA), несмотря на ОМТ, с митральной недостаточностью(EROA ≥30 мм2), благоприятными анатомическими условиями и походящих для критериев включения в исследование COAPT (т.е. ФВ ЛЖ 20- 50%, конечно-систолический диаметр ЛЖ < 70мм, систолическое легочное давление < 70 мм. рт. ст., отсутствие умеренной или тяжелой дисфункции ПЖ, отсутствие тяжелой трикуспидальной регургитации, отсутствие гемодинамической нестабильности) (162, 163).
Чрескожную пластику митрального клапана "край в край" следует рассматривать у тщательно отобранных пациентов со вторичной МН, не имеющих показаний к хирургическому вмешательству и не нуждающихся в реваскуляризации коронарных артерий, у которых сохраняются симптомы, несмотря на ОМТ, и которые соответствуют критериям для достижения снижения частоты госпитализаций по поводу СН.У пациентов с СН, тяжелой вторичной МН и ИБС, нуждающихся в реваскуляризации, одномоментная операция АКШ и операции на митральном клапане должны быть рассмотрены (2,3).
Рисунок 5. Лечение выраженной митральной регургитации у пациентов с СН (3)
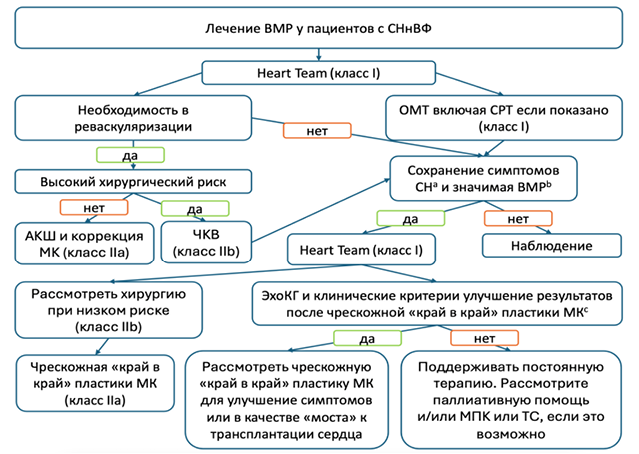

Примечание: ВМР – выраженная митральная регургитация; ОМТ – оптимальная медикаментозная терапия; СРТ -сердечная ресинхронизирующая терапия; СН – сердечная недостаточность; АКШ - аорто-коронарное шунтирование; ЧКВ – чрескоронарное вмешательство; МК – митральный клапан.
Таблица 24. Рекомендации по лечению клапанных пороков сердца у больных с СН
|
Рекомендации
|
Класс
|
Уровень
|
|
Аортальный стеноз
|
|
|
|
Вмешательство на аортальном клапане, TAVI или SAVR, рекомендуется пациентам с СН и тяжелым высоко градиентным аортальным стенозом для снижения смертности и улучшения симптомов.
|
I
|
B
|
|
Рекомендуется, чтобы выбор между TAVI и SAVR делала кардиологическая бригада в соответствии с индивидуальными предпочтениями пациента и особенностями, включая возраст, хирургический риск, клинические, анатомические и процедурные аспекты, взвешивая риски и преимущества каждого подхода.
|
I
|
C
|
|
Митральная недостаточность
|
|
|
|
Чрескожную пластику митрального клапана "край в край" следует рассматривать у тщательно отобранных пациентов со вторичной МН, не имеющих показаний к хирургическому вмешательству и не нуждающихся в реваскуляризации коронарных артерий, у которых сохраняются симптомы, несмотря на ОМТ, и которые соответствуют критериям для достижения снижения частоты госпитализаций по поводу СН.
|
IIa
|
B
|
|
У пациентов с СН, тяжелой вторичной МН и КБС, нуждающихся в реваскуляризации, одномоментная операция АКШ и операции на митральном клапане должны быть рассмотрены.
|
IIa
|
C
|
|
Чрескожную пластику митрального клапана "край в край" можно рассматривать для улучшения симптомов у тщательно отобранных пациентов с вторичной МН, не подходящих для хирургического вмешательства и не нуждающихся в коронарной реваскуляризации, с высокой симптоматикой, несмотря на ОМТ, и которые не соответствуют критериям для снижения госпитализации по поводу СН.
|
IIb
|
C
|
Примечание: a — класс рекомендаций, b — уровень доказательности, c — NYHA II-IV ФК, d — должны быть выполнены все следующие критерии: ФВ ЛЖ 20-50%, КСРЛЖ<70 мм, систолическое давление в легочной артерии<70мм рт.ст., отсутствие умеренной или тяжелой правожелудочковой дисфункции или тяжелой ТР, отсутствие гемодинамической нестабильности. Сокращения: АКШ — аортокоронарное шунтирование, ИБС — ишемическая болезнь сердца, КСРЛЖ — конечно-систолический размер левого желудочка, МН — митральная недостаточность, ОМТ — оптимальная медикаментозная терапия, СН — сердечная недостаточность, ТР — трикуспидальная недостаточность, ФВ ЛЖ — фракция выброса левого желудочка, ФК — функциональный класс, TAVI — транскатетерная имплантация аортального клапана, SAVR — хирургическая замена аортального клапана.
Механическая поддержка кровообращения, трансплантация сердца
Основным показанием для проведения трансплантации сердца и имплантации механических устройств поддержки кровообращения является критическая острая или декомпенсированная хроническая сердечная недостаточность. Это состояние может развиваться у пациентов с кардиомиопатией, КБС, тяжелыми декомпенсированными заболеваниями клапанов сердца (в случае невозможности проведения других методов хирургического лечения), миокардитами, врожденными пороками сердца, а также другими сердечными заболеваниями, которые существенно ограничивают физическую активность и сопровождаются риском смерти в течение года, превышающим 50% (3).
Использование механической поддержки кровообращения (МПК) может значительно улучшить выживаемость и симптомы у пациентов, страдающих прогрессирующей сердечной недостаточностью. По длительности поддержки различают краткосрочную и длительную МПК. Краткосрочная МПК предназначена для временного улучшения перфузии органов и устранения гипоксии при кардиогенном шоке. Ее применение возможно на короткий срок, от нескольких дней до нескольких недель, с целью поддержания нормальной деятельности центральной нервной системы и органов.
Краткосрочную МПК рекомендуется у пациентов в качестве "моста" к дальнейшему лечению, выздоровлению или для перехода к долгосрочной МПК или трансплантации сердца. Долгосрочная МПК рассматривается для пациентов, у которых медикаментозная терапия оказалась неэффективной или когда краткосрочная МПК не привела к улучшению состояния. Она может быть рассмотрена как "мост" к трансплантации сердца, чтобы продлить жизнь пациента или как пожизненная терапия (3). Пациенты, рассматриваемые для долгосрочной MПК, должны иметь хорошее соблюдение режима лечения, соответствующую способность обращаться с устройствами и оказывать психосоциальную поддержку (IС).
В наше время, несмотря на значительные успехи в области фармакотерапии сердечно-сосудистых заболеваний, операция ортотопической трансплантации сердца остается широко признанным "золотым" стандартом лечения терминальной сердечной недостаточности, значительно улучшающим прогноз и качество жизни. Каждый год в мире проводится более 4000 трансплантаций сердца, преимущественно в странах Европы и Северной Америки (2,3).
Показания для трансплантации сердца:
- трансплантация сердца рекомендуется пациентам с терминальной (критической) СН, сопровождающейся клинически значимыми признаками декомпенсации кровообращения и неблагоприятным прогнозом жизни, несмотря на применение максимально переносимой медикаментозной терапии и при отсутствии возможности проведения других органосохраняющих вмешательств или наличии противопоказаний (IС) (164).
Пациентов, госпитализированных с острой или декомпенсированной хронической сердечной недостаточностью, требующих непрерывной инфузии адренергических и дофаминергических средств или находящихся на механической поддержке кровообращения, рекомендуется включать в приоритетный список ожидания трансплантации сердца.
Пациенты, включенные в список ожидания и не нуждающиеся в постоянной медикаментозной инотропной или механической поддержке кровообращения, должны проходить регулярные амбулаторные обследования для оценки статуса.
Критериями неблагоприятного прогноза у пациентов с сердечной недостаточностью считаются:
- фракция выброса левого желудочка менее 20%;
- давление заклинивания в легочной артерии более 20 мм рт. ст.;
- снижение максимального O2 менее 12 мл/кг/мин у пациентов, не получающих бета-адреноблокаторы, или менее 14 мл/кг/мин на фоне приема максимально переносимой дозы бета-адреноблокаторов;
- признаки тяжелой ишемии миокарда у пациентов с КБС, которые значительно ограничивают повседневную деятельность при невозможности проведения реваскуляризации методами коронарного шунтирования или чрескожной ангиопластики коронарных артерий;
- рецидивирующие жизне угрожающие нарушения ритма, не поддающиеся медикаментозной терапии или электрофизиологическим методам лечения (катетерная абляция и/или имплантация кардиовертера-дефибриллятора) (164).
Противопоказания к трансплантации сердца:
- активная инфекция,
-тяжелые периферические артериальные и церебролваскулярные заболевания,
- фармакологическая необратимая легочная гипертензия (следует рассматривать возможность LVAD для устранения повышенного легочного сосудистого сопротивления с последующей повторной оценкой для установления кандидатуры),
- злокачественное новообразование с плохим прогнозом (необходимо сотрудничество со специалистами-онкологами для стратификации каждого пациента в отношении риска прогрессирования или рецидива опухоли, который увеличивается при использовании иммуносупрессии),
- необратимая дисфункция печени (цирроз) или необратимая дисфункция почек (например, клиренс креатинина <30 мл/мин/1,73 м²). Можно рассмотреть возможность комбинированной трансплантации сердца-печени или сердца-почки,
- системное заболевание с полиорганным поражением,
- другие серьезные сопутствующие заболевания с плохим прогнозом,
- ИМТ до трансплантации >35 кг/м² (рекомендуется снижение веса для достижения ИМТ <35 кг/м²),
- текущее злоупотребление алкоголем или наркотиками,
- психологическая нестабильность, которая ставит под угрозу надлежащее наблюдение и интенсивный терапевтический режим после трансплантации сердца,
- недостаточная социальная поддержка для обеспечения надлежащего ухода в амбулаторных условиях (3).
Ведение пациентов с ХСН и сопутствующей патологией
Сахарный диабет 2 типа
У пациентов с СД 2 типа риск развития сердечно-сосудистых заболеваний повышен минимум в два раза. В то же время вероятность сердечно-сосудистой смерти у пациентов с СД 2 типа и СН увеличена на 50—90% в сравнении с больными, которые страдают только СН. При этом СД 2 типа остается не выявленным у 25—40% пациентов с сердечно-сосудистыми заболеваниями, поэтому настоятельно рекомендуется проводить систематический скрининг на сахарный диабет среди всех пациентов с сердечно-сосудистыми заболеваниями (165).
В последнем руководстве Европейского общества кардиологов по ведению сердечно-сосудистых заболеваний у пациентов с СД 2 типа всем пациентам с диабетом и сердечно-сосудистыми заболеваниями вне зависимости от гликемического статуса рекомендован прием ингибиторов SGLT2 и/или агонистов рецепторов глюкагоно подобного пептида-1 (аGLP-1) (165).
- текущее злоупотребление алкоголем или наркотиками,
- психологическая нестабильность, которая ставит под угрозу надлежащее наблюдение и интенсивный терапевтический режим после трансплантации сердца,
- недостаточная социальная поддержка для обеспечения надлежащего ухода в амбулаторных условиях (3).
Ведение пациентов с ХСН и сопутствующей патологией
Сахарный диабет 2 типа
У пациентов с СД 2 типа риск развития сердечно-сосудистых заболеваний повышен минимум в два раза. В то же время вероятность сердечно-сосудистой смерти у пациентов с СД 2 типа и СН увеличена на 50—90% в сравнении с больными, которые страдают только СН. При этом СД 2 типа остается не выявленным у 25—40% пациентов с сердечно-сосудистыми заболеваниями, поэтому настоятельно рекомендуется проводить систематический скрининг на сахарный диабет среди всех пациентов с сердечно-сосудистыми заболеваниями (165).
В последнем руководстве Европейского общества кардиологов по ведению сердечно-сосудистых заболеваний у пациентов с СД 2 типа всем пациентам с диабетом и сердечно-сосудистыми заболеваниями вне зависимости от гликемического статуса рекомендован прием ингибиторов SGLT2 и/или агонистов рецепторов глюкагоно подобного пептида-1 (аGLP-1) (165).
Особое внимание в руководстве уделяется лечению СН у пациентов с СД 2 типа. Во время каждого клинического визита для обеспечения раннего лечения рекомендовано проводить скрининг на признаки и симптомы СН. У пациентов с СД 2 типа и ХСН рекомендовано назначение ингибиторов SGLT2 в целях снижения вероятности госпитализации по поводу сердечной недостаточности или смерти от сердечно-сосудистых заболеваний (165).
Алгоритм лечения ХСН с любой ФВ ЛЖ одинаков как у пациентов с СД 2 типа, так и без него. Препараты, модифицирующие прогноз при ХСН (АРНИ/иАПФ/БРА, ББ, ингибиторы SGLT2, АМКР), а также диуретики лежат в основе лечения СН. В то же время не все противодиабетические препараты безопасны и снижают риск возникновения осложнений, связанных с ССЗ и СН. Гипогликемические средства различаются по своему эффекту у пациентов с ССЗ и СН. Поэтому любое новое гипогликемическое средство тестируется на предмет частоты развития основных сердечно-сосудистых событий у больных с СД, а затем получает конкретные показания к применению. Проблема настолько важна и актуальна, что Европейским обществом кардиологов разрабатывается и обновляется отдельное клиническое руководство по профилактике и лечению сердечно-сосудистых заболеваний у пациентов с диабетом. Ингибиторы SGLT2 — первый класс гипогликемических средств, получивший рекомендации для лечения пациентов с СНнФВ, затем СНусФВ и СНсФВ (2,3,11,48).
Лечение пациентов с СД 2 типа с помощью ингибиторов SGLT2, включая дапаглифлозин, эмпаглифлозин, канаглифлозин и сотаглифлозин, связано со снижением частоты основных неблагоприятных сердечно-сосудистых событий, включая госпитализацию по поводу СН и сердечно-сосудистую смертность (150). Однако механизмы, лежащие в основе улучшения сердечно-сосудистых исходов, приписываемых ингибиторам SGLT2i, неизвестны в полной мере и, по-видимому, лишь частично связаны с глюкозурическим эффектом (166,167). Ингибиторы SGLT2: дапаглифлозин, эмпаглифлозин, канаглифлозин, эртуглифлозин и сотаглифлозин изучались у пациентов с установленным сердечно-сосудистым заболеванием в исследованиях EMPA-REG OUTCOME и VERTIS-CV, с установленным сердечно-сосудистым заболеванием или факторами риска сердечно-сосудистых заболеваний в исследованиях и DECLARE -TIMI 58, а также риск ХБП и сердечно-сосудистых заболеваний в исследовании SCORED соответственно (168-172). Эмпаглифлозин и канаглифлозин снижали первичную комбинированную конечную точку основных сердечно-сосудистых нежелательных явлений, включая сердечно-сосудистую смерть или нефатальный ИМ или нефатальный инсульт, а также госпитализации по поводу сердечной недостаточности в исследованиях EMPA-REG OUTCOME и CANVAS соответственно (169,173). Эмпаглифлозин также снижал смертность от всех причин или смертность от сердечно-сосудистых заболеваний. Влияние на первичную конечную точку было обусловлено снижением числа событий, связанных с СН (169). В исследовании DECLARE-TIMI 58 дапаглифлозин не уменьшал основные сердечно-сосудистые события, но снижал комбинированную конечную точку эффективности: смерть от сердечно-сосудистых заболеваний или госпитализацию по поводу СН и госпитализацию по поводу СН в отдельности (170). Результаты исследований дапаглифлозина и эмпаглифлозина у пациентов с СНнФВ и СД 2 типа или без него, а также ингибитора SGLT1/2 сотаглифлозина у пациентов с СД 2 типа были подтверждены после госпитализации по поводу острой СН или в течение 3 дней после выписки (165-168). В метаанализе перечисленных исследований и еще одного РКИ у пациентов с ХБП (CREDENCE), в целом ингибиторы SGLT2, снизили количество госпитализаций по поводу СН и сердечно-сосудистых заболеваний на 22% (166). EMPA-REG OUTCOME, CANVAS, DECLARE-TIMI 58 и VERTIS-CV также показали снижение ухудшения функции почек, наступления терминальной стадии почечной недостаточности или смертности от почечных причин при приеме ингибиторов SGLT2 (168-171, 173).
Мета-анализ РКИ от 2023 года объединил результаты по применению иSGLT у пациентов с СН, СД2 или ХБП. Было включено 13 РКИ (n = 90 413). проведена оценка исходов: -совокупность первой госпитализации по поводу СН или смерти от ССЗ (первая смерть от СН/кардиоваскулярных событий), -первой смерти от СН и смерти от ССЗ. Оказалось, что иSGLT2 снижают риск смерти при госпитализации по СН/кардиоваскулярных событий при СН на 24%, при СД2 на 23% на 23% при ХБП.
Причем, преимущество было постоянным как при при СН со сниженной или сохраненной фракцией выброса, так и при СН с СД2 или без него, либо СН с ХБП или без нее. Кроме того, преимущество также было постоянным и при СД2 с ХБП или без него,СД2 без СН,ХБП без СН, а также у пациентов со всеми тремя сопутствующими заболеваниями в совокупности. Ингибиторы SGLT2 значительно снижали смертность от сердечно-сосудистых заболеваний: на 16% при СН, на 15% при СД2и на 12% при ХБП (174). На основании этих результатов ингибиторы SGLT канаглифлозин, дапаглифлозин, эмпаглифлозин, эртуглифлозин или сотаглифлозин рекомендуются для предотвращения сердечно-сосудистой смертности и сердечно-сосудистых заболеваний, а также ухудшения функции почек у пациентов с СД 2 типа и сердечно-сосудистыми заболеваниями и/или сердечно-сосудистыми факторами риска, либо ХБП.
Таким образом, лечение пациентов с СД 2 типа с помощью ингибиторов SGLT2, включая дапаглифлозин, эмпаглифлозин, канаглифлозин и сотаглифлозин, связано со снижением частоты основных неблагоприятных сердечно-сосудистых событий, включая госпитализацию по поводу СН и сердечно-сосудистую смертность (48,165, 174). Американская диабетическая ассоциация рекомендует использовать ингибиторы SGLT2 в качестве препарата первой линии для лечения гипергликемии у пациентов с СД 2 типа с СН или с высоким риском СН (175). Во всех РКИ ингибиторы SGLT2 хорошо переносились, хотя они могут вызывать генитальные грибковые инфекции кожи и, редко, диабетический эугликемический кетоацидоз (48, 165).
Среди других групп препаратов, помимо ингибиторов SGLT2, обязательных к назначению при СН, изменения при лечении пациентов с СД 2 типа с сопутствующей СН коснулись АМКР, в частности финеренона. Поскольку поражение почек на фоне сахарного диабета — ведущая причина ХБП, рекомендовано проводить скрининг пациентов с СД 2 типа на наличие дисфункции почек не реже одного раза в год путем измерения расчетной скорости клубочковой фильтрации (рСКФ), уровня альбумина в моче и соотношением альбумина и креатинина в моче. Пациентам с СД 2 типа и ХБП следует назначать ингибитор SGLT2 и/или финеренон в дополнение к стандартному лечению (165, 176).
Финеренон - селективный нестероидный АМКР последнего поколения был протестирован в двух исследованиях у пациентов с диабетической нефропатией. В исследование FIDELIO-DKD были включены 5734 пациента с соотношением альбумина и креатинина в моче 30–300 мг/г, рСКФ 25–60 мл/мин/1,73 м 2 и диабетической ретинопатией или соотношением альбумина и креатинина в моче 300–5000 мг/г и рСКФ 25–75 мл/мин/1,73 м 2 (177). Основным результатом исследования, оцененным с помощью анализа времени до события, была совокупность почечной недостаточности, устойчивого снижения рСКФ на ≥40% от исходного уровня в течение периода ≥4 недель или смерти от почечных причин. Почечная недостаточность определялась как терминальная стадия заболевания почек или рСКФ<15 мл/мин/1,73 м 2. Терминальную стадию заболевания почек определяли как начало длительного диализа (в течение ≥90 дней) или трансплантацию почки. Первичная конечная точка исследования была снижена при приеме финеренона по сравнению с плацебо на 18% (ОР 0,82, 95% ДИ 0,73–0,93; P = 0,001) в течение медианы наблюдения 2,6 года. Не было обнаружено никаких доказательств снижения количества госпитализаций по поводу СН при приеме финеренона по сравнению с плацебо (ОР 0,86, 95% ДИ 0,68–1,08). В то же время фирененон был связан с более низкой частотой возникновения ключевой вторичной конечной точки, состоящей из смертности от сердечно-сосудистых заболеваний, нефатального инфаркта миокарда, не смертельного инсульта и госпитализации по поводу СН (ОР 0,86, 95% ДИ 0,75–0,99; P = 0,03). При анализе субгрупп FIDELIO-DKD влияние финеренона на совокупные сердечно-сосудистые и почечные исходы, включая госпитализации по поводу СН, не зависело от предшествующей СН (177).
В более позднем исследовании FIGARO-DKD первичным результатом, оцененным с помощью анализа времени до события, была совокупность смерти от сердечно-сосудистых причин, нефатального инфаркта миокарда, нефатального инсульта или госпитализации по поводу СН (178). В исследование были включены взрослые пациенты с СД 2 типа и ХБП, получавшие ингибитор ренин-ангиотензиновой системы в максимально переносимой дозе. ХБП определяли по одному из двух наборов критериев: стойкая, умеренно повышенная альбуминурия (отношение альбумина к креатинину в моче от 30 до <300 мг/г) и рСКФ 25–90 мл/мин/1,73 м2 (от 2 до 4 стадии ХБП); или стойкая, сильно повышенная альбуминурия (отношение альбумина к креатинину в моче 300–5000 мг/г) и рСКФ>60 мл/мин/1,73 м 2 (т.е. 1 или 2 стадия ХБП). На момент скрининга у пациентов должен был быть уровень калия в сыворотке крови <4,8 ммоль/л. В исследование были включены 7437 пациентов, рандомизированных к фиренону или плацебо. При медиане наблюдения 3,4 года частота первичных исходов, смерти от сердечно-сосудистых заболеваний, нефатального инфаркта миокарда, нефатального инсульта или госпитализации по поводу СН была ниже в группе лечения по сравнению с плацебо (ОР 0,87, 95 % ДИ 0,76–0,98; P = 0,03). Преимущество было обусловлено численно небольшим, но статистически значимым снижением частоты госпитализаций по поводу СН при приеме финеренона по сравнению с плацебо (3,2% против 4,4%; ОР 0,71, 95% ДИ 0,56–0,90) без различий в смертности от сердечно-сосудистых заболеваний (178).
Как в FIDELIO-DKD, так и в FIGARO-DKD частота возникновения гиперкалиемии была выше в группе финеренона по сравнению с группой плацебо. Однако частота нежелательных явлений в обеих группах была одинаковой. Предварительно определенный объединенный анализ на уровне отдельных пациентов, включающий 13 026 пациентов с диабетической нефропатией, наблюдаемых в течение в среднем 3,0 года, в исследованиях FIDELIO-DKD и FIGARO-DKD показал снижение комбинированного сердечно-сосудистого исхода, включая сердечно-сосудистые заболевания: не смертельный инсульт, нефатальный инфаркт миокарда, смерть и госпитализации по поводу СН, а также госпитализации по поводу СН только с финереноном по сравнению с плацебо (ОР 0,86, 95% ДИ 0,78–0,95; P = 0,0018; и ОР 0,78, 95% ДИ 0,66–0,92; P = 0,0030 соответственно) (179). Таким образом, на основании результатов этих исследований финеренон был рекомендован для снижения риска госпитализации по поводу СН у пациентов с ХБП и СД 2 типа.
В более позднем исследовании FIGARO-DKD первичным результатом, оцененным с помощью анализа времени до события, была совокупность смерти от сердечно-сосудистых причин, нефатального инфаркта миокарда, нефатального инсульта или госпитализации по поводу СН (178). В исследование были включены взрослые пациенты с СД 2 типа и ХБП, получавшие ингибитор ренин-ангиотензиновой системы в максимально переносимой дозе. ХБП определяли по одному из двух наборов критериев: стойкая, умеренно повышенная альбуминурия (отношение альбумина к креатинину в моче от 30 до <300 мг/г) и рСКФ 25–90 мл/мин/1,73 м2 (от 2 до 4 стадии ХБП); или стойкая, сильно повышенная альбуминурия (отношение альбумина к креатинину в моче 300–5000 мг/г) и рСКФ>60 мл/мин/1,73 м 2 (т.е. 1 или 2 стадия ХБП). На момент скрининга у пациентов должен был быть уровень калия в сыворотке крови <4,8 ммоль/л. В исследование были включены 7437 пациентов, рандомизированных к фиренону или плацебо. При медиане наблюдения 3,4 года частота первичных исходов, смерти от сердечно-сосудистых заболеваний, нефатального инфаркта миокарда, нефатального инсульта или госпитализации по поводу СН была ниже в группе лечения по сравнению с плацебо (ОР 0,87, 95 % ДИ 0,76–0,98; P = 0,03). Преимущество было обусловлено численно небольшим, но статистически значимым снижением частоты госпитализаций по поводу СН при приеме финеренона по сравнению с плацебо (3,2% против 4,4%; ОР 0,71, 95% ДИ 0,56–0,90) без различий в смертности от сердечно-сосудистых заболеваний (178).
Как в FIDELIO-DKD, так и в FIGARO-DKD частота возникновения гиперкалиемии была выше в группе финеренона по сравнению с группой плацебо. Однако частота нежелательных явлений в обеих группах была одинаковой. Предварительно определенный объединенный анализ на уровне отдельных пациентов, включающий 13 026 пациентов с диабетической нефропатией, наблюдаемых в течение в среднем 3,0 года, в исследованиях FIDELIO-DKD и FIGARO-DKD показал снижение комбинированного сердечно-сосудистого исхода, включая сердечно-сосудистые заболевания: не смертельный инсульт, нефатальный инфаркт миокарда, смерть и госпитализации по поводу СН, а также госпитализации по поводу СН только с финереноном по сравнению с плацебо (ОР 0,86, 95% ДИ 0,78–0,95; P = 0,0018; и ОР 0,78, 95% ДИ 0,66–0,92; P = 0,0030 соответственно) (179). Таким образом, на основании результатов этих исследований финеренон был рекомендован для снижения риска госпитализации по поводу СН у пациентов с ХБП и СД 2 типа.
Относительно других сахаро снижающих препаратов метформин считается безопасным у пациентов с СН по сравнению с инсулином и препаратами сульфонил мочевины, ограничения касаются пациентов с рСКФ<30 мл/мин/1,73 м2 или печеночной недостаточностью из-за риска развития лактатного ацидоза (180, 165).
Ингибиторы дипептидилпептидазы-4 (ДПП-4), в целом, показали нейтральное влияние на смертность или сердечно-сосудистые заболевания. При применении алоглиптина, ситаглиптина и линаглиптина не было обнаружено различий по сравнению с плацебо в отношении сердечно-сосудистых событий и СН (181-183). Однако, в исследованиях по применению саксаглиптина и видаглиптина, мета-анализах ингибиторов ДПП-4 количество госпитализаций по поводу СН увеличилось на 27% (саксаглиптин), большее число смертей и событий (видаглиптин) у пациентов с диабетом и СН (184, 185). Поэтому эти препараты не рекомендуются для снижения сердечно-сосудистых событий у пациентов с СД 2 типа и СН. В то же время эксперты рекомендуют алоглиптин, ситаглиптин и линаглиптин для лечения гипергликемии, наряду с ингибиторами SGLT и агонистыми рецепторов GLP-1 (165).
Ингибиторы дипептидилпептидазы-4 (ДПП-4), в целом, показали нейтральное влияние на смертность или сердечно-сосудистые заболевания. При применении алоглиптина, ситаглиптина и линаглиптина не было обнаружено различий по сравнению с плацебо в отношении сердечно-сосудистых событий и СН (181-183). Однако, в исследованиях по применению саксаглиптина и видаглиптина, мета-анализах ингибиторов ДПП-4 количество госпитализаций по поводу СН увеличилось на 27% (саксаглиптин), большее число смертей и событий (видаглиптин) у пациентов с диабетом и СН (184, 185). Поэтому эти препараты не рекомендуются для снижения сердечно-сосудистых событий у пациентов с СД 2 типа и СН. В то же время эксперты рекомендуют алоглиптин, ситаглиптин и линаглиптин для лечения гипергликемии, наряду с ингибиторами SGLT и агонистыми рецепторов GLP-1 (165).
Агонисты рецепторов GLP-1 снижают риск инфаркта миокарда, инсульта и смерти от сердечно-сосудистых заболеваний у пациентов с СД 2 типа, но не уменьшают частоту возникновения СН (186). В связи с чем агонисты рецепторов GLP-1 не рекомендуются для профилактики событий СН (165).
При истощении функции бета-клеток пациентам с СД 2 типа для контроля гипергликемии, а также при СД 1 типа необходим инсулин. Известно, что инсулин задерживает натрий в организме человека и может потенцировать задержку жидкости у пациентов с СН. Однако в РКИ, в котором участвовали пациенты с СД 2 типа, нарушенной толерантностью к глюкозе или нарушением уровня глюкозы натощак, инсулин не повышал риск возникновения СН (187). Если пациенту с СН необходим инсулин, при его назначении необходим тщательный контроль за признаками СН для своевременной коррекции лечения (165).
Среди сахаро снижающих средств у больных с сопутствующей СН необходимо избегать назначения производных сульфонил мочевины в связи с высоким риском развития и ухудшения СН, а также тиазолидиндионов (глитазонов) которые вызывают задержку жидкости и повышают риск декомпенсации СН и госпитализации по поводу СН (188,189). Производные сульфонил мочевины и тиазолидиндионы противопоказаны пациентам с СН в сочетании с СД 2 типа (165).
Среди сахаро снижающих средств у больных с сопутствующей СН необходимо избегать назначения производных сульфонил мочевины в связи с высоким риском развития и ухудшения СН, а также тиазолидиндионов (глитазонов) которые вызывают задержку жидкости и повышают риск декомпенсации СН и госпитализации по поводу СН (188,189). Производные сульфонил мочевины и тиазолидиндионы противопоказаны пациентам с СН в сочетании с СД 2 типа (165).
Таблица 25. Рекомендации по ведению пациентов с СД 2 типа и ХБП при хронической сердечной недостаточности
|
Рекомендации
|
Класс
|
Уровень
|
|
Ингибиторы SGLT (дапаглифлазин, эмпаглифлазин, канаглифлазин, эртуглифлазин и сотаглифлазин) рекомендованы у пациентов с СД 2 типа с риском кардиоваскулярных событий для снижения госпитализации по поводу СН, развития больших кардиоваскулярных событий, терминальной почечной дисфункции и кардиоваскулярной смерти
|
I
|
A
|
|
Ингибиторы SGLT (дапаглифлазин, эмпаглифлазин и сотаглифлазин) рекомендованы у пациентов с СД 2 типа и СНнФВ для снижения госпитализации по поводу СН и кардиоваскулярной смерти
|
I
|
A
|
|
У пациентов с СД 2 типа и ХБП финеренон рекомендован для снижения риска госпитализации по поводу СН
|
I
|
A
|
|
Тиазолидиндионы (глитазоны) не рекомендуются пациентам с СН, так как они повышают риск ее ухудшения и госпитализации по поводу СН
|
III
|
A
|
|
Ингибитор дипептидилпептидазы-4 (DPP-4) саксаглиптин не рекомендуется применять у пациентов с СН в связи с ухудшением прогноза
|
III
|
B
|
Артериальная гипертония и СН
АГ, наряду с КБС, является ведущим фактором риска развития СН. Почти две трети пациентов с СН в прошлом страдали гипертензией (175).Гипертензия является наиболее важной причиной СНсФВ, ее распространенность составляет от 60% до 89% (190). Неконтролируемая гипертензия у пациентов с СНнФВ встречается редко, при условии, что пациент получает ОМТ в рекомендованных для лечения СН дозах. Практически все рекомендуемые клиническими руководствами базовые группы препаратов для лечения ХСН, включая диуретики снижают АД. В связи с чем, рекомендуется титровать дозы ОМТ (иАПФ/АРНИ/БРА, ББ, АМКР, и SGLT2 и диуретики) при сопутствующей АГ до максимально доказанных в РКИ с учетом клинических показателей пациента (2,3,11,48).
Модификации образа жизни, т.е. здоровое питание, контроль веса, снижение потребления натрия и повышение физической активности, являются полезными дополнительными мерами. Пациенты с СНсФВ также часто имеют преувеличенную гипертензивную реакцию на физическую нагрузку и может проявляться острым гипертоническим отеком легких (191). Антигипертензивные средства, включая иАПФ, БРА, ББ, АРНИ и диуретики, снижают частоту возникновения СН (2,3,192). Плохо контролируемая АГ может спровоцировать эпизоды декомпенсации СН. Причины вторичной гипертензии, такие как заболевания сосудов почек или паренхимы, первичный гиперальдостеронизм и синдром обструктивного апноэ во сне (СОАС), следует исключить или, в случае подтверждения, рассмотреть возможность лечения. При АГ стратегию лечения, используемую при СНнФВ, следует учитывать и при СНусФВ, однако необходимо учитывать, что БРА, иАПФ и БКК вызывают более эффективную регрессию ГЛЖ, чем ББ или диуретики (193). Адекватное снижение АД приводит также к регрессии ГЛЖ, степень которой зависит от класса применяемого препарата (194). Лечение АГ одинаково при СН с любой ФВ ЛЖ и нормотензией. Если требуется дальнейшее снижение АД, при отсутствии признаков перегрузки жидкостью могут быть рассмотрены амлодипин и фелодипин, которые безопасны при СНнФВ (195,196). Недигидропиридиновые БКК (дилтиазем и верапамил) и препараты центрального действия, такие как моксонидин, противопоказаны, поскольку связаны с ухудшением прогноза (197). Альфа-блокаторы можно использовать для лечения сопутствующей гиперплазии предстательной железы, т.к. они не влияют на выживаемость, но их следует отменить в случае гипотонии (198,199). Целевые значения АД при СН индивидуальны и зависят от сопутствующей патологии (КБС, сахарного диабета, ХБП, инсульта…), а также от возраста, пола. В любом случае при СН чаще необходимо избегать гипотонии, при которой усугубляется гипоперфузия органов и тканей, а также становится проблематичным назначение большинства рекомендованных препаратов, учитывая их гипотензивное действие.
Онкологические заболевания и кардиотоксичность
Сердечно-сосудистые осложнения терапии онкологических заболеваний, особенно кардиомиопатия и СН, могут привести к значительной заболеваемости и прерыванию лечения, влияя как на краткосрочную, так и на долгосрочную выживаемость. СН, вторичная по отношению к кардиомиопатии, связанной с терапией рака, ассоциирована со значительно худшими исходами. Пациентам, у которых развивается СН во время приема потенциально кардиотоксичной терапии, следует прекратить эту терапию и провести диагностическое обследование для выяснения причины СН и начала ГДМТ. Для снижения сердечно-сосудистых рисков необходимо создание единой системы лечения кардиомиопатии, связанной с терапией рака, определяемой как систолическая дисфункция ЛЖ, снижение ФВ ЛЖ на 10% или более до значения ниже 50% (200).Кардиоонкология – это практика предраковой терапии, стратификация сердечно-сосудистого риска, профилактика, раннее выявление и лечение сердечно-сосудистых осложнений (2,3).Количественное определение ФВ ЛЖ перед терапией у пациентов, получающих потенциально кардиотоксическую противораковую терапию, преследует 4 цели:
1) стратификация риска до терапии и диагностика уже существующей кардиомиопатии
2) установление эталонного исходного уровня, с которым можно сравнивать повторные оценки,
3) начало приема кардиопротекторных препаратов перед началом лечения рака,
4) руководство по выбору терапии рака.
Онкологические заболевания и кардиотоксичность
Сердечно-сосудистые осложнения терапии онкологических заболеваний, особенно кардиомиопатия и СН, могут привести к значительной заболеваемости и прерыванию лечения, влияя как на краткосрочную, так и на долгосрочную выживаемость. СН, вторичная по отношению к кардиомиопатии, связанной с терапией рака, ассоциирована со значительно худшими исходами. Пациентам, у которых развивается СН во время приема потенциально кардиотоксичной терапии, следует прекратить эту терапию и провести диагностическое обследование для выяснения причины СН и начала ГДМТ. Для снижения сердечно-сосудистых рисков необходимо создание единой системы лечения кардиомиопатии, связанной с терапией рака, определяемой как систолическая дисфункция ЛЖ, снижение ФВ ЛЖ на 10% или более до значения ниже 50% (200).Кардиоонкология – это практика предраковой терапии, стратификация сердечно-сосудистого риска, профилактика, раннее выявление и лечение сердечно-сосудистых осложнений (2,3).Количественное определение ФВ ЛЖ перед терапией у пациентов, получающих потенциально кардиотоксическую противораковую терапию, преследует 4 цели:
1) стратификация риска до терапии и диагностика уже существующей кардиомиопатии
2) установление эталонного исходного уровня, с которым можно сравнивать повторные оценки,
3) начало приема кардиопротекторных препаратов перед началом лечения рака,
4) руководство по выбору терапии рака.
Эхокардиография рекомендуется в качестве метода первой линии для оценки ФВ ЛЖ, учитывая ее доступность, безопасность, относительно низкую стоимость и способность предоставлять структурную и функциональную информацию помимо ФВ ЛЖ (2,3). ФВ ЛЖ до терапии является сильным предиктором серьезных неблагоприятных сердечно-сосудистых событий у пациентов, получающих потенциально кардиотоксичную терапию (200-202).Доказательства, на основе которых были разработаны рекомендации по кардиоонкологии, были основаны на исследованиях кардиомиопатии, вызванной антрациклинами и трастузумабом (203-210).Имеющиеся данные у пациентов с кардиомиопатией, вызванной антрациклинами и трастузумабом, позволяют предположить, что ББ и иАПФ эффективны в улучшении дисфункции ЛЖ (203-205, 207,211, 212). Однако кардиомиопатия, связанная с терапией рака, представляет собой гетерогенное заболевание с широким спектром проявлений — от бессимптомной дисфункции ЛЖ до СН с кардиогенным шоком — и лекарственно-зависимыми патофизиологическими механизмами, которые еще плохо изучены (211-213). До тех пор, пока не будут доступны достаточные высококачественные доказательства по конкретным препаратам и анализ экономической эффективности для скрининга и мониторинга, эти рекомендации применимы к потенциально кардиотоксичным методам лечения.
Таблица 26. Медикаменты, применяемые при онкологических заболеваниях, которые могут быть ассоциированы с кардиомиопатией/СН
|
Терапия рака
|
Индикация
|
|
Антрациклиновая химиотерапия
(доксорубицин, эпирубицин, даунорубицин, идарубицин) |
Рак молочной железы, лимфома, острый лейкоз, саркома
|
|
HER2-таргетная терапия
(трастузумаб, пертузумаб, трастузумабэмтанзин Т-DM1, лапатиниб, нератиниб, тукатиниб) |
HER2+ рак молочной железы HER2+ рак желудка
|
|
Ингибиторы VEGF
ИТК (сунитиниб, пазопаниб, сорафениб, акситиниб, тивозаниб, кабозантиниб, регорафениб, ленватиниб, вандетиниб) и антитела (бевацизумаб, рамуцирумаб) |
ИТК VEGF: рак почки, гепатоцеллюлярный рак, рак щитовидной железы, рак толстой кишки, саркома, ГИСО. Антитела: рак молочной железы, рак яичников, рак желудка, рак желудочно-пищеводного тракта, рак толстой кишки.
|
|
Многоцелевые ингибиторы киназ:
ИТК BCR-ABL второго и третьего поколения (понатиниб, нилотиниб, дазатиниб, бозутиниб) |
Хронический миелолейкоз
|
|
Ингибиторы протеасом
(карфилзомиб, бортезомиб, иксазомиб) Иммуномодулирующие препараты (леналидомид, помалидомид) |
Множественная миелома
|
|
Комбинация ингибиторов RAF и MEK
(дабрафениб+траметиниб, вемурафениб+кобиметиниб, энкорафениб+биниметиниб) |
RAF-мутантная меланома
|
|
Андрогенная депривационная терапия
Агонисты ГнРГ (гозерелин, лейпрорелин) Антиандрогрены (абиратерон) |
Рак простаты, рак молочной железы
|
|
Ингибиторы иммунных контрольных точек:
ингибиторы против запрограммированной гибели клеток 1 (ниволумаб, пембролизумаб) антицитотоксический, ассоциированный с Т-лимфоцитами ингибитор белка 4 (ипилимумаб) ингибиторы антипрограммируемоголиганда смерти 1 (авелумаб, атезолизумаб, дурвалумаб) |
Меланома (метастатическая и адъювантная) Метастатический рак почки, не мелкоклеточный рак легкого, мелкоклеточный рак легкого, рефрактерная лимфома Ходжкина, метастатический тройной негативный рак молочной железы, метастатический уротелиальный рак, рак печени, рак с дефицитом MMR
|
Таблица 27. Рекомендации для ведения онкологических пациентов, планирующим лечение/имеющим кардиомиопатию, ассоциированную с терапией рака
|
Всем онкологическим пациентам, планирующим лечение, которое может вызвать СН, следует рассмотреть базовую оценку риска сердечнососудистых заболеваний.
|
IC
|
|
Рекомендуется для онкологических пациентов с повышенным риском кардиотоксичности, определяемым анамнезом или факторами риска сердечно-сосудистых заболеваний, предшествующей кардиотоксичностью или воздействием кардиотоксических агентов, проходить оценку сердечнососудистой системы перед запланированной противоопухолевой терапией, предпочтительно у кардиолога с опытом/знаниями в области кардиоонкологии
|
IC
|
|
У пациентов, у которых развивается кардиомиопатия или СН, связанная с терапией рака, для улучшения лечения рекомендуется междисциплинарное обсуждение с участием пациента соотношения риска и пользы прерывания, прекращения или продолжения терапии рака
|
IC
|
|
У бессимптомных пациентов с кардиомиопатией, связанной с терапией рака (ФВ <50%), целесообразно назначение БРА/иАПФ и бета-блокаторов для предотвращения прогрессирования сердечной недостаточности и улучшения сердечной функции
|
IIa
|
|
Лечение препаратами иАПФ/БРА и ББ (предпочтительно карведилолом) следует рассматривать у онкологических больных, у которых во время химиотерапии антрациклином развивается систолическая дисфункция ЛЖ, определяемая как снижение ФВ ЛЖ на 10% или более до значения ниже 50%
|
IC
|
|
У пациентов с сердечно-сосудистыми факторами риска или известным заболеванием сердца, рассматриваемым в качестве потенциально кардиотоксичной противораковой терапии, предварительная оценка сердечной функции целесообразна для установления исходного уровня сердечной функции и выбора терапии рака
|
IIa
|
|
У пациентов, которым рассматривается возможность применения потенциально кардиотоксичной терапии, серийное измерение сердечного тропонина может быть целесообразным для дальнейшей стратификации риска
|
IIb
|
Амилоидоз и СН
Сердечный амилоидоз представляет собой рестриктивную кардиомиопатию с внеклеточным отложением белков миокарда, чаще всего моноклональных легких цепей иммуноглобулинов (амилоидная кардиомиопатия [AL-CM] или транстиретиновый амилоидоз (ATTR-CM). ATTR может быть вызван патогенными вариантами гена транстиретина TTR (вариантный транстиретиновый амилоидоз, ATTRv) или транстиретином дикого типа (транстиретиновый амилоидоз дикого типа, ATTRwt).
Сердечный амилоидоз представляет собой рестриктивную кардиомиопатию с внеклеточным отложением белков миокарда, чаще всего моноклональных легких цепей иммуноглобулинов (амилоидная кардиомиопатия [AL-CM] или транстиретиновый амилоидоз (ATTR-CM). ATTR может быть вызван патогенными вариантами гена транстиретина TTR (вариантный транстиретиновый амилоидоз, ATTRv) или транстиретином дикого типа (транстиретиновый амилоидоз дикого типа, ATTRwt).
При диагностике ATTR-CM необходимо учитывать наличие у больного наряду содышкой, утомляемостью, отеками,низкого АД у пациентов с АГ в анамнезе, непереносимости ББ или иАПФ, двустороннего туннельного синдрома запястья, низкого вольтажа зубцов на ЭКГ и эхокардиографических признаков, таких утолщение задней стенки ЛЖ ≥14 мм, утолщение межжелудочковой перегородки или стенки правого желудочка, увеличения предсердий, небольшого выпота в перикарде или утолщения клапанов, а также диффузное усиление позднего гадолиния на МРТ сердца. При ATTR-CM часто встречается СНсФВ, тяжелый аортальный стеноз, синдром запястного канала, поясничный спинальный стеноз и автономная или сенсорная полинейропатия (214-217).
Сцинтиграфия костей пирофосфатом технеция и одновременно скрининг на наличие моноклональных легких цепей иммуноглобулинов может различить амилоидную кардиомиопатию или транстиретиновый амилоидоз. Для исключения AL-CM оценивают концентрацию свободных легких цепей в сыворотке и иммунофиксационный электрофорез в сыворотке и моче. Одновременная оценка иммунофиксационого электрофореаз в сыворотке и моче, а также определение концентрации свободных легких цепей в сыворотке более чем на 99% чувствительно к AL-амилоидозу (214-219).
Использование сцинтиграфии костей позволяет проводить неинвазивную диагностику ATTR-CM. При отсутствии аномалий легкой цепи сканирование костей пирофосфатом технеция является диагностическим для ATTR-CM, если имеется сердечный захват 2/3 степени или соотношение H/CL >1,5. Фактически, наличие сердечного захвата 2/3 степени при отсутствии моноклонального белка в сыворотке или моче имеет очень высокую специфичность и положительную прогностическую ценность для ATTR-CM. ОФЭКТ оценивается при всех положительных результатах сканирования для подтверждения того, что поглощение представляет собой удержание индикатора в миокарде, а не сигнал поглощения в пуле крови или ребрах. Если ATTR-CM идентифицирован, то генетическое секвенирование гена TTR определит, есть ли у пациента патологический вариант (ATTRv) или заболевание дикого типа (ATTRwt). Дифференциация ATTRv от ATTRwt важна, поскольку подтверждение ATTRv повлечет за собой генетическое консультирование и потенциальный скрининг членов семьи и методы лечения инотерсеном и патисираном, которые одобрены только для ATTRv с полинейропатией(2,3,217-221). Наследственную форму следует исключить с помощью генетического тестирования. Эндомиокардиальная биопсия является золотым стандартом диагностики АTTR-CМ с почти 100% чувствительностью и специфичностью, если образцы собираются из>4 различных мест и проверяются на наличие амилоидных отложений с помощью окрашивания Конго красным. Однако биопсия не требуется при положительном результате сцинтиграфии 2–3 степени с ОФЭКТ.
Таблица 28. Клинические признаки - «красные флажки» - для наиболее распространенных форм сердечного амилоидоза
|
Тип
|
«красные флажки»
|
ТТР
|
|
Экстракардиальный
|
Полинейропатия
|
Х
|
|
Дизавтономия
|
Х
|
|
|
Синяки на коже
|
|
|
|
Макроглоссия
|
|
|
|
Глухота
|
Х
|
|
|
Двусторонний синдром запястного канала
|
Х
|
|
|
Разрыв сухожилия двуглавой мышцы
|
Х
|
|
|
Стеноз позвоночного канала поясничного отдела
|
Х
|
|
|
Стекловидные отложения
|
Х
|
|
|
История семьи
|
Х
|
|
|
Протеинурия
|
|
|
|
Почечная недостаточность
|
|
|
|
Кардиальный
|
Клинически: гипотензия или нормотензия, если ранее была гипертензия
|
|
|
ЭКГ: изменения по типу псевдоинфаркта
|
ХХХ
|
|
|
Низкий/сниженный вольтаж QRS в зависимости от степени толщины ЛЖ
|
|
|
|
Нарушения A-V проводимости
|
|
|
|
Лабораторно: непропорционально повышенный NT-proBNP до степени СН, сохраняющийся повышенный уровень тропонина
|
ХХ
|
|
|
ЭхоКГ:
|
ХХХХХ
|
|
|
Зернистая сверкающая часть миокарда
|
|
|
|
Увеличение толщины стенки ПЖ
|
|
|
|
Увеличенная толщина АV-клапана
|
|
|
|
Перикардиальный выпот
|
|
|
|
Снижение продольной деформации с сохранением апикальной части
|
|
|
|
МРТ: Субэндокардиальное позднее усиление гадолиния
|
Х
|
|
|
Повышенные собственные значения Т1
|
Х
|
|
|
Увеличение внеклеточного объема
|
Х
|
|
|
Аномальная кинетика гадолиния
|
Х
|
При лечении пациентов с амилоидозом и симптомами СН необходимо учитывать, что больные с ATTR-CM и ФВ ЛЖ ≤40% могут плохо переносить ОМТ, рекомендованную при СНнФВ. Сосудорасширяющее действие АРНИ, ингибиторов АПФ, БРА и ББ могут усугублять гипотонию, особенно при амилоид-ассоциированной вегетативной дисфункции и ухудшить симптомы СН (214, 222).
Терапия, модифицирующая амилоидоз, включает сайленсерытранстиретина (TTR) (нарушают синтез в печени посредством ингибирования/деградации мРНК: инотерсен и патисиран), стабилизаторы TTR (предотвращают неправильное сворачивание/отложение: дифлунизал и тафамидис) и разрушители TTR (выведение целевых тканей: доксициклин, тауроурсодезоксихолевая кислота и эпигаллокатехин-3-галлат). Сердечный амилоидоз легких цепей лечится специалистами-гематологами-онкологами и выходит за рамки полномочий кардиологов, но диагноз часто ставится кардиологами, когда проявляется сердечный амилоид. AL-амилоидоз поддается лечению и пациентов с AL-амилоидозом с поражением сердца следует незамедлительно направлять в гематологическое онкологическое отделение для своевременного лечения. Инотерсен и патисиран связаны с более медленным прогрессированием полинейропатии, связанной с амилоидозом, при ATTRv-CM. Продолжаются исследования влияния инотерсена и патисирана, а также ингибиторов-деградаторов мРНК нового поколения на сердечно-сосудистую заболеваемость или смертность (2, 222-227).
Терапия, модифицирующая амилоидоз, включает сайленсерытранстиретина (TTR) (нарушают синтез в печени посредством ингибирования/деградации мРНК: инотерсен и патисиран), стабилизаторы TTR (предотвращают неправильное сворачивание/отложение: дифлунизал и тафамидис) и разрушители TTR (выведение целевых тканей: доксициклин, тауроурсодезоксихолевая кислота и эпигаллокатехин-3-галлат). Сердечный амилоидоз легких цепей лечится специалистами-гематологами-онкологами и выходит за рамки полномочий кардиологов, но диагноз часто ставится кардиологами, когда проявляется сердечный амилоид. AL-амилоидоз поддается лечению и пациентов с AL-амилоидозом с поражением сердца следует незамедлительно направлять в гематологическое онкологическое отделение для своевременного лечения. Инотерсен и патисиран связаны с более медленным прогрессированием полинейропатии, связанной с амилоидозом, при ATTRv-CM. Продолжаются исследования влияния инотерсена и патисирана, а также ингибиторов-деградаторов мРНК нового поколения на сердечно-сосудистую заболеваемость или смертность (2, 222-227).
Тафамидис в настоящее время является единственным препаратом, улучшающим сердечно-сосудистые исходы при ATTR-CM. Тафамидис связывает сайттироксина TTR. В клиническом исследовании ATTR-ACT, где изучалась безопасность и эффективность тафамидиса у пациентов с транстиретиновой кардиомиопатией у пациентов с ATTRwt-CM или ATTRv-CM и симптомами класса I–III по NYHA, тафамидис имел более низкую смертность от всех причин 29,5 % против 42,9% и снижение частоты госпитализаций по поводу сердечно-сосудистых заболеваний через 30 месяцев. Учитывая, что тафамидис предотвращает, но не обращает вспять отложение амилоида, ожидается, что тафамидис будет иметь большую пользу при назначении на ранних стадиях заболевания. Поскольку кривые выживаемости через 18 месяцев расходятся, следует отбирать пациентов, у которых не кардиологические заболевания не будут ограничивать выживаемость. Польза не наблюдалась у пациентов с ФК IV (NYHA), тяжелым аортальным стенозом или нарушением функции почек при СКФ <25 мл·мин/1,73 м-2. Тафамидис доступен в двух формах выпуска. Тафамидисмеглумин в капсулах по 20 мг назначается по 80 мг (4 капсулы) один раз в день. Тафамидис также доступен в капсулах по 61 мг, также одобренная FDA доза этого нового препарата составляет 61 мг один раз в день (2, 223, 224).
Внутрисердечный тромбоз встречается примерно у трети пациентов с сердечным амилоидозом, в некоторых случаях как при диагностированной ФП, так и в отсутствии ФП и независимо от оценки CHA 2 DS 2 -VASc. Согласно ретроспективному исследованию, использование антикоагулянтов снижало риск внутрисердечных тромбов. Выбор прямых пероральных антикоагулянтов (ПОАК) по сравнению с варфарином не изучался у пациентов с ATTR, а также не изучалась роль устройств для закрытия ушка левого предсердия. Влияние антикоагулянтов на риск кровотечения у пациентов с ATTR-CM и ФП не установлено. Однако, хотя у пациентов с AL-амилоидозом могут быть приобретенные нарушения гемостаза, включая дефицит факторов свертывания крови, гиперфибринолиз и дисфункцию тромбоцитов, TTR-амилоидоз не связан с нарушениями гемостаза (2, 225,228).
Внутрисердечный тромбоз встречается примерно у трети пациентов с сердечным амилоидозом, в некоторых случаях как при диагностированной ФП, так и в отсутствии ФП и независимо от оценки CHA 2 DS 2 -VASc. Согласно ретроспективному исследованию, использование антикоагулянтов снижало риск внутрисердечных тромбов. Выбор прямых пероральных антикоагулянтов (ПОАК) по сравнению с варфарином не изучался у пациентов с ATTR, а также не изучалась роль устройств для закрытия ушка левого предсердия. Влияние антикоагулянтов на риск кровотечения у пациентов с ATTR-CM и ФП не установлено. Однако, хотя у пациентов с AL-амилоидозом могут быть приобретенные нарушения гемостаза, включая дефицит факторов свертывания крови, гиперфибринолиз и дисфункцию тромбоцитов, TTR-амилоидоз не связан с нарушениями гемостаза (2, 225,228).
Таблица 29. Рекомендации по лечению амилоидоза
|
Рекомендации
|
Класс
|
|
У некоторых пациентов с диким типом или вариантным транстиретиновым амилоидозом сердца и ФК СН I по III (NYHA), терапия стабилизатором тетрамера транстиретина (тафамидисом) показана для снижения сердечно-сосудистой заболеваемости и смертности.
|
I
|
|
У пациентов с амилоидозом сердца и ФП целесообразно назначение антикоагулянтов для снижения риска инсульта независимо от оценки по шкале CHA2DS2-VASc
|
IIа
|
Рисунок 6. Алгоритм диагностики и лечения сердечного амилоидоза (2)
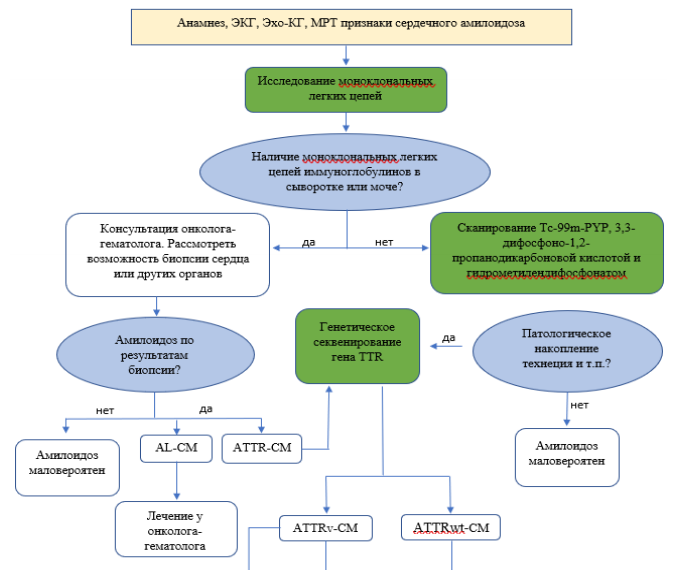


Примечание: ФП - фибрилляция предсердий; AL-CM - амилоидная кардиомиопатия; ATTR-CM -транстиретиновая амилоидная кардиомиопатия; ATTR - вариант транстиретинового амилоидоза; ATTRwt - транстиретиновый амилоидоз дикого типа; PYP – пирофосфат; Тс – технеций; TTR – транстиретин (2).
Перипартальная кардиомиопатия
Перипартальная кардиомиопатия (ППКМ) представляет собой относительно редкое, но жизненно угрожающее состояние, сопровождающееся систолической дисфункцией с дилатацией ЛЖ, снижением ФВ ЛЖ, чаще<45%, возникающее на поздних сроках беременности или в раннем послеродовом периоде при исключении любых других причин СН (229-231). Хотя признается, что во время беременности повышение нагрузки на сердечно-сосудистую систему из-за увеличения объема циркуляции и сердечного выброса может привести к явным клиническим проявлениям СН вследствие ранее существовавшей, но не диагностированной патологии сердца. Согласно определению экспертов Европейского Общества Кардиологов (ESC) - «ППКМ является идиопатической кардиомиопатией, представленной СН вследствие систолической дисфункции ЛЖ, развившейся к концу беременности или в течение 6 месяцев после родов, если не определена другая причина СН» (229). По типу ремоделирования выделяют дилатационный тип (сочетание выраженной систолической дисфункции и дилатации ЛЖ/всех полостей) и гипокинетический тип (не дилатированный или мало дилатированный ЛЖ) (229).
ПКМП встречается во всем мире, распространенность имеет существенные различия в зависимости от региональных и этнических особенностей. Самая высокая заболеваемость регистрируется в Нигерии, Гаити и Южной Африке, реже в западных странах. Распространенность варьирует от 1/102 родов в Нигерии до 1/346 в Китае, 1/5719 в Швеции и реже всего 1/20000 родов в Японии. Заболеваемость в СШАсо временем возрастает и составляет от 1 на 1000 до 8000 родов(229, 230-238). Международный регистр EURObservationalResearchProgramme, охватывающий 43 страны, показал, что данные по распространенности ПКМП вероятнее всего занижаются, но несмотря на это, само заболевание встречается глобально и у женщин любого этнического происхождения (234). К тому же, диагностические ошибки могут маскировать реальное количество больных, учитывая, что ПКМП является диагнозом исключения.
Этиология до конца не изучена и, как полагают, много факторна. Предполагаемые, но не доказанные механизмы развития: дефицит питания, дефицит селена, вирусный миокардит, аутоиммунные процессы на фоне генетических девиаций, гемодинамический окислительный стресс во время беременности, патологическое расщепление пролактина массой 16 кДа. Образование 16 кДа фрагмента пролактинаприводит к кардиотоксическому действию за счет активации эндотелиальной микроРНК-146а и плацентарной секреции растворимого Fms-подобного тирозинкиназного рецептора 1 (sFlt-1) приводящего к дисфункции эндотелия и гибели кардиомиоцитов. Придается важное значение плацентарным ангиогенным факторам. Частота преэклампсии связывается с активацией, sFlt-1–антиангиогенного белка, секретируемого плацентой в экспоненциально возрастающих количествах к концу беременности. sFlt-1 изолирует циркулирующий сосудистый эндотелиальный фактор роста (VEGF) и плацентарный фактор роста (PlGF) и считается основным механизмом АГ и эндотелиальной дисфункции при преэклампсии.
Кроме того, уровни sFlt-1 коррелируют с глобальной продольной деформацией миокарда и увеличением массы левого желудочка у женщин с преэклампсией. В конечном итоге, перечисленные кардиотоксические и васкулотоксические механизмы приводят к миокардиальной и сосудистой дисфункции с развитием систолической и диастолической СН (229-244).
Факторы риска развития ППКМ включают возраст матери ˂18 лет или ˃30 лет, преэклампсию, многоплодная беременность, использование ЭКО, АГ в период беременности, СД, ожирение, анемия, дефицит питания, дисфункция щитовидной железы, токолитическая терапия, аутоиммунные заболевания, негроидная раса(229,231,232, 235-241).
Клиника варьирует от быстрой прогрессии до терминальной стадии СН в течение нескольких суток до спонтанного разрешения и полного выздоровления в течение нескольких месяцев. У большинства женщин с ППКМ симптомы развиваются в 1 месяц после родов, но может проявляться в третьем триместре или до 6 месяцев после родов. Клинически выявляется утомляемость, одышка при физической нагрузке, пароксизмальная ночная одышка, сердцебиение, перебои в работе сердца, ортопноэ, периферические отеки ног, поясницы, асцит, пульсация яремных вен, застойные хрипы в легких, гепатомегалия, синусовая тахикардия, аритмии, гипотония, кардиогенный шок, отек легких, тромбоз полостей сердца, вен, тромбоэмболии, неврологический дефицит за счет эмболизации сердечного тромба, мозговой инсульт, тромбоэмболия ветвей легочной артерии, сердечная смерть (229-241).
Диагноз ПКМП является диагнозом исключения. Диагностические критерии: ФВ ЛЖ <45% с/без дилатации желудочков в конце беременности или в первые 6 месяцев после родов, в отсутствии других причин СН. Весь объем клинической, инструментальной и лабораторной диагностики при ППКМ направлен на подтверждение СН и исключение иных этиологических причин последней. Поздняя диагностика ППКМ повышает риск развития серьезных нежелательных явлений и необратимой терминальной ХСН. Кроме того, не выявленная своевременно ПКМП при повторной беременности может привести к более тяжелой СН и смертельному исходу Величины ФВ ЛЖ и КДР могут служить предикторами прогноза «quoadvitam». Плохими предикторами считаются КДР > 60 мм и ФВ < 30 % (229-231).
ПКМП необходимо дифференцировать с ранее существовавшей кардиомиопатией, миокардитом, пороками клапанов, легочной гипертензией. В перипартальном и в раннем послеродовом периодах повышается риск инфаркта миокарда в результате разрыва атеросклеротической бляшки или спонтанного расслоения коронарной артерии в три-четыре раза, риск легочной эмболии в 5-10 раз и эмболии околоплодными водами по сравнению с небеременными женщинами, тем самым увеличивая диагностический поиск для исключения ПКМП (239? 240). В конце концов, симптомы ПКМП схожи с симптомами нормальной беременности и могут быть пропущены при первоначальном обследовании.
Лечение ХСН при ППКМ проводится, согласно последним рекомендациям Европейского общества кардиологов (ESC). Однако имеются свои особенности с учетом дебюта ПКМП во время беременности либо в послеродовом периоде (2,3). Следует всегда учитывать действие лекарственных средств на плод и возможность проникновения в грудное молоко, вследствие чего необходимо прекращение лактации.
Во время беременности:
-
ИАПФ, БРА, АРНИ, АМКР, ингибиторы SGLT2, ивабрадин противопоказаны для применения при беременности, учитывая возможные тератогенные и антиандрогенные действия препаратов,
-
ввиду отсутствия тератогенного действия, в отсутствие противопоказаний, рекомендуется использовать ББ, преимущественно b1-кардиоселективные (бисопролол и метопрололасукцинат), т.к. блокада b2-адренорецепторов может оказать антитоколитическое действие и стимулировать сокращение матки,
-
при наличии симптомов застойной СН - диуретики (петлевые), с учетом возможного ухудшения плацентарного кровотока.
Рекомендована антикоагулянтная терапия во время беременности и в первые 2 месяца после родов в связи с тем, что ПКМП ассоциируется с более высокой частотой тромбоэмболических осложнений, чем другие виды кардиомиопатий. Согласно рекомендациям ESC и AHA антикоагулянтную терапию следует назначать пациенткам с ПКМП, ФВ ЛЖ ≤35% и принимающим бромокриптин(2,3,245-250). Другие эксперты рекомендуют антикоагулянтную терапию всем женщинам с ПКМП после родов до восьми недель (230,231). Варфарин противопоказан вследствие фетотоксичности. Разрешен гепарин, но использование нефракционированного гепарина (эноксапарина) предпочтительно из-за более короткого периода полувыведения. При наличии жизне угрожающих аритмий может потребоваться введение антиаритмических препаратов. Кардио версия и дефибрилляция считаются безопасными на протяжении всей беременности, но под строгим контролем состояния плода, из-за возможного развития вторичных аритмий у него(230).
Отсутствие нормализации систолической функции ЛЖ в течение 6 месяцев после родов может служить предиктором неблагоприятного прогноза и говорить о развитии стойкой, необратимой кардиомиопатии. Риск рецидива при последующих беременностях составляет примерно 30-50%.
Лечение включает ОМТ, рекомендованную при СН с учетом беременности, а также наличия/отсутствия грудного вскармливания. С учетом роли патогенного пролактина массой 16 кДа рекомендовано применение агониста дофамина – бромокриптина, в среднем 8 недель на фоне приема антикоагулянтов (2,3, 245-250). Прогноз зависит от исходной ФВ ЛЖ, тромбоза ЛЖ, поражения ПЖ, преэклампсии, географического региона и расовой принадлежности. Восстановление и выживаемость, в целом, благоприятны в развитых странах. Регистр из 100 пациентов в США показал 93% выживаемость без трансплантации/МПК в течение 1 года.
Крайне важно междисциплинарное планирование, ориентированное на пациента, включая раннее начало механической поддержки кровообращения при шоке (250)
Что касается профилактики, к сожалению, предупредить послеродовую кардиомиопатию невозможно, т.к. немаловажная роль отводится генетической предрасположенности, но мы можем усилить пренатальный скрининг с целью выявления возможных факторов риска развития данной патологии с обязательным проведением Эхо-КГ, ЭКГи дальнейшей коррекцией. ПКМП – редкое и потенциально опасное заболевание для жизни матери и ребенка, требующее особого внимания и комплексного подхода с участием не только кардиологов, но и акушер-гинекологов, реаниматологов и педиатров.
Анемия и СН
Наличие анемии при ХСН независимо связано с тяжестью заболевания и смертностью от СН, а дефицит железа, ассоциируется со снижением толерантности к физической нагрузке (251-252). Дефицит железа обычно определяется как уровень ферритина <100 мкг/л или от 100 до 300 мкг/л, если насыщение трансферрина <20%. Было показано, что внутривенное пополнение запасов железа улучшает способность к физической нагрузке и качество жизни (253). Исследование FAIR-HF (оценка карбоксимальтозы железа у пациентов с дефицитом железа и ХСН) показало значительное улучшение СН по классификации NYHA, тесту 6-минутной ходьбы и качеству жизни 459 амбулаторных пациентов, которые еженедельно получали внутривенно карбоксимальтозу железа до восполнения запасов железа(253). Эти результаты были подтверждены в двух недавних исследованиях ( 254,255). Однако исследование IRONOUT HF (влияние восполнения запасов железа на поглощение кислорода при СН) не выявило такого улучшения при пероральном приеме добавок железа (256). Это объясняется плохой абсорбцией перорального железа и его недостаточностью для пополнения запасов железа у пациентов с СН. Таким образом, пероральное введение железа недостаточно для лечения железодефицитной анемии у пациентов с ХСН. Хотя эти исследования не смогли выявить снижение серьезных клинических конечных точек, два метаанализа показали, что внутривенное введение железа связано со снижением смертности от сердечно-сосудистых заболеваний и госпитализаций (257,258). Совсем недавно многоцентровое исследование AFFIRM-AHF, в которое вошли 1132 пациента с ФВ <50%, госпитализированных по поводу СН, показало снижение частоты госпитализаций по поводу СН при внутривенном введении карбоксимальтозы железа по сравнению с плацебо (ОР 0,74; 95% ДИ 0,58–0,94), но не привело к снижению смертности от сердечно-сосудистых заболеваний (259).
Анемия у пациентов с СН связана с нарушением выработки эритропоэтина, при этом низкие уровни связаны с худшими долгосрочными исходами (260,261). Хотя небольшие исследования по изучению использования препаратов, стимулирующих эритропоэтин, для лечения анемии у пациентов с СН, указывают на тенденцию к улучшению функциональных возможностей и снижению частоты госпитализаций, высококачественное рандомизированное исследование дарбэпоэтина альфа с участием 2278 пациентов не выявило никакой пользы и увеличение числа тромботических событий, включая инсульт (262,263). Метаанализ 13 исследований подтверждает эти результаты (264). Соответственно терапия препаратами, стимулирующими эритропоэтин, не рекомендуется для лечения анемии у пациентов с СН.
Таблица 30. Рекомендации по лечению анемии при ХСН
|
Рекомендации
|
Класс
|
|
У пациентов с СНнФВ и дефицитом железа с анемией или без нее целесообразно внутривенное заместительное введение железа для улучшения функционального статуса и качества жизни
|
IIa
|
|
У пациентов с СН и анемией не следует использовать препараты, стимулирующие эритропоэтин, для снижения заболеваемости и смертности
|
III
|
Практические рекомендации по коррекции дефицита железа приведены в приложении № 2
Заболевания щитовидной железы и СН
Тиреоидные гормоны влияют на сократимость миокарда, общее периферическое сопротивление и ЧСС. Гипертиреоз характеризуется низким уровнем ТТГ, связанным с повышением свободного Т4. При гипертиреозе усиливается сократительная способность миокарда за счет активации миозина, а также стимуляции бета-адренергической системы.
Было показано, что гипертиреоз провоцирует аритмии (экстрасистолы, ФП) сосудистые изменения и ремоделирование миокарда. Избыток Т4 (своб.) может приводить к тахикардии, увеличению пульсового давления, увеличению сердечного выброса и снижению общего периферического сопротивления. Эти изменения могут снижать сердечный выброс и способствовать развитию СН. Наиболее частым сердечным феноменом, отмечаемым при гипертиреозе, является тахикардия, которая часто проявляется нерегулярным ритмом. Длительная или чрезвычайно быстрая тахиаритмия может привести к СН. Эта форма кардиомиопатии, вызванной тахикардией, приводит к уменьшению диастолы и увеличению давления наполнения. Лечение ФП основанона возвращении к эутиреоидному состоянию и антикоагулянтной терапии. В эутиреоидном состоянии у пациента с большей вероятностью сохранится нормальный синусовый ритм.
Примечательно, что синусовая тахикардия остается наиболее распространенной аритмией при гипертиреозе. Гипотиреоз, состояние с низким уровнем Т4 и Т3 и, компенсаторно, высоким уровнем ТТГ может привести к диастолической гипертензии, синусовой брадикардии, нарушениям проводимости, гидроперикарду и СН. Хронический гипотиреоз увеличивает риск атеросклероза и КБС из-за его связи с гиперлипидемией (265).
Оценка функции щитовидной железы рекомендуется всем пациентам с СН, поскольку как гипо-, так и гипертиреоз могут вызвать или спровоцировать СН, нарушения ритма. Субклинический гипотиреоз и изолированный низкий уровень трийодтиронина были связаны с худшими результатами в наблюдательных исследованиях у пациентов с СН (266). Лечение заболеваний щитовидной железы должно проводиться в соответствии с общими эндокринными рекомендациями. Рандомизированных исследований по оценке эффективности заместительной терапии щитовидной железы при субклиническом гипотиреозе не проводилось, но существует общее мнение о необходимости ее коррекции при уровне ТТГ >10 мМЕ/л, особенно у пациентов <70 лет. Коррекцию также можно рассмотреть при более низких уровнях ТТГ (7–10 мМЕ/л) (267). Пациентам с гипотиреозом и КБС первоначально следует использовать более низкие дозы левотироксина с постепенным увеличением дозы. Врачи могут рассмотреть возможность начала лечения левотироксином в дозе 12,5 мкг перорально в день и увеличения дозы через 6 недель, чтобы снизить периферическое сосудистое сопротивление и, таким образом, уменьшить ишемию миокарда и достичь эутиреоидного состояния. Таким образом, при гипо- и гипертиреозе, осложненном СН лечение основано на мультидисциплинарном подходе совместно с эндокринологами. Терапия включает достижение эутиреоидного состояния и лечение СН согласно клиническим рекомендациям (2,3, 48, 11)
Лечение (амбулатория)
Амбулаторное ведение пациентов с ХСН, телемедицина
Пациенты с СН, даже если симптомы хорошо контролируются и стабильны, требуют последующего наблюдения для обеспечения постоянной оптимизации терапии, выявления бессимптомного прогрессирования СН или сопутствующих заболеваний и обсуждения любых новых достижений в лечении. Европейское общество кардиологов рекомендует проводить наблюдение с интервалом не более 6 месяцев для проверки симптомов, ЧСС и ритма, АД, общего анализа крови, электролитов и функции почек (3).
Пациенты с СН, даже если симптомы хорошо контролируются и стабильны, требуют последующего наблюдения для обеспечения постоянной оптимизации терапии, выявления бессимптомного прогрессирования СН или сопутствующих заболеваний и обсуждения любых новых достижений в лечении. Европейское общество кардиологов рекомендует проводить наблюдение с интервалом не более 6 месяцев для проверки симптомов, ЧСС и ритма, АД, общего анализа крови, электролитов и функции почек (3).
Для пациентов, недавно выписанных из больницы, или для тех, кто проходит повышение дозы препарата, интервалы наблюдения должны быть более частыми. Американский колледж кардиологов и Американская кардиологическая ассоциация по лечению СН рекомендуют первый контакт по телефону после выписки в течение 3 дней и последующий визит через 7–14 дней после выписки, а рекомендации Европейского общества кардиологов рекомендуют первое последующее амбулаторное посещение в течение 7 дней после выписки (2,3).
После выписки клинические характеристики включают множественные сопутствующие заболевания, низкое САД, высокую ЧСС, прогрессирующие признаки застоя. Лабораторные параметры, которые требуют должного контроля, включают низкий уровень натрия в сыворотке, повышенный уровень азота мочевины, креатинина в сыворотке, низкий уровень сывороточного альбумина и повышенный уровень НУП. В оценке динамики застоя необходимо применять все другие методы многопараметрической оценки повышения давления наполнения желудочков в дополнение к традиционным ЭхоКГ параметрам. Клиницисты должны уделять приоритетное внимание всестороннему клиническому обследованию пациентов с СН с тщательным наблюдением за этими признаками декомпенсации и выполнять целевые вмешательства, направленные на устранение застоя и обучение пациентов на уязвимом раннем этапе после выписки.
Инновационные модели оказания медицинской помощи все чаще исследуются как инструменты улучшения результатов лечения пациентов с СН после выписки, однако результаты на данный момент неоднозначны. Одной из компонентов наблюдения после выписки, наряду с посещением врача в поликлинике, визитов на дом, поддержке по телефону, является телемониторинг. Телемониторинг позволяет пациентам удаленно предоставлять цифровую медицинскую информацию для поддержки и оптимизации лечения. Такие данные, как симптомы, вес, частота сердечных сокращений и АД, можно собирать, хранить в электронной медицинской карте и использовать для помощи пациентам (непосредственно или через медицинского работника), коррекции терапии или для получения дополнительной консультации. Домашний телемониторинг (HTM) может помочь поддерживать качество медицинской помощи, облегчить быстрый доступ к медицинской помощи в случае необходимости, сократить расходы на поездки пациентов и свести к минимуму частоту посещений клиники (268). Для проведения телемониторинга возможно использование различных систем, в том числе мобильных приложений, разработанных для удаленного контроля за динамикой симптомов, признаков ХСН и своевременной коррекции терапии. Системы, которые ориентированы на оптимизацию управления, а не на выявление и управление неотложными медицинскими ситуациями, должны быть укомплектованы персоналом только в стандартные рабочие часы. Некоторые системы предназначены также для оказания поддержки в любое время по запросу пациента. Сравнительная эффективность и экономическая эффективность каждой стратегии неопределенны. Системы, которые сосредоточены на постоянной оптимизации ухода (подход к поддержанию здоровья), а не на попытках предвидеть и контролировать эпизоды ухудшения (стратегия, которая страдает от большого количества ложноположительных сигналов), кажутся более успешными (269). Домашний телемониторинг — это эффективный метод обучения и мотивации пациентов, а также оказания удаленной медицинской помощи, но его следует адаптировать для синергии с существующим медицинским обслуживанием в стране (270).
Кокрейновский систематический обзор выявил 39 соответствующих исследований HTM, в основном, основанных на оценке симптомов, веса, частоты сердечных сокращений и ритма, а также АД. Выявлено, что HTM был связан со снижением смертности от всех причин на 20% и госпитализаций по поводу СН - 37% (271). С тех пор было опубликовано несколько нейтральных исследований и одно положительное исследование (272). Важно отметить, что HTM нужно только продемонстрировать, что он не уступает современным методам оказания помощи, чтобы быть подходящим средством поддержки ухода за пациентами с ХСН.
Многие имплантированные терапевтические устройства могут передавать по беспроводной сети и удаленно информацию либо о самом устройстве (генераторная и проводящая функция), аритмиях, либо о физиологии пациента (частота сердечных сокращений, активность, тоны сердца, биоимпеданс). Также доступны устройства, которые обеспечивают только функцию мониторинга. Имплантируемые петлевые записывающие устройства можно вводить подкожно и использовать для мониторинга частоты сердечных сокращений и ритма, активности и биоимпеданса. Устройства мониторинга также можно разместить в легочной артерии для беспроводного контроля давления, т.к. повышение давления в легочной артерии может быть одним из самых ранних признаков застоя. Однако внешний считыватель, необходимый для обнаружения сигнала устройства, довольно громоздкий и требует сотрудничества с пациентом. В исследовании CHAMPION значительное снижение количества госпитализаций по поводу СН наблюдалось через 6-18 месяцев лечения, основанного на передаче давления в легочной артерии на дому с помощью имплантированного датчика давления, по сравнению с обычным лечением (273). Имеются убедительные доказательства того, что мониторинг с помощью различных устройств может обнаружить патологию раньше, чем обычный мониторинг, и может быть полезен для выявления аритмий, таких как ФП.
Однако имеется мало доказательств того, что мониторинг устройства снижает количество госпитализаций по поводу СН или смертности (274). Таким образом, неинвазивная HTM имеет свои преимущества и может быть рассмотрена у пациентов с СН, чтобы снизить риск повторных госпитализаций по поводу сердечно-сосудистых заболеваний и СН, а также смерти от сердечно-сосудистых заболеваний. В то же время, ожидаются дальнейшие данные по лечению с использованием имплантированных систем (275).
Таблица 31. Рекомендации по использованию НТМ при ХСН
|
Рекомендации
|
Класс
|
Уровень
|
|
Неинвазивный HTM может быть рассмотрен у пациентов с СН, чтобы снизить риск повторного сердечно-сосудистого заболевания, госпитализации по поводу СН и смерти от сердечно-сосудистых заболеваний.
|
IIb
|
В
|
|
Мониторинг давления в легочной артерии с использованием беспроводной системы гемодинамического мониторинга может быть рассмотрен у симптоматических пациентов с СНнФВ для улучшения клинических результатов.
|
IIb
|
В
|
Примечание: HTM = домашний телемониторинг, СН = сердечная недостаточность; СНнФВ = сердечная недостаточность со сниженной фракцией выброса.
Прогноз
Течение и прогноз ХСН
Прогноз и качество жизни больных с СН стали улучшаться в течение последних десятилетий в связи с разработкой и внедрением патогенетически обоснованной терапии, влияющей на исход: ингибиторов ангиотензинпревращающего фермента (иАПФ), бета-адреноблокаторов (ББ), антагонистов минералокортикоидных рецепторов (АМКР), ангиотензиновых рецепторов и неприлизина ингибиторов (АРНИ), ингибиторов натрий-глюкозного котранспортера 2-го типа (иSGLT2), блокаторов рецепторов ангиотензина (БРА) и ряда других медикаментозных, инвазивных и аппаратных вмешательств (12,13). В то же время в объединенном исследовании когорт FraminghamHeartStudy и CardiovascularHealthStudy выявлена 67% смертность в течение 5 лет после постановки диагноза СН (13).
Пациенты с СНсФВ имеют более низкий риск смерти, чем пациенты с СНнФВ, причем эта разница наблюдается независимо от возраста, пола и этиологии СН. В то же время различие невелико, и абсолютная смертность у пациентов с СНсФВ имеет неприемлемо высокий показатель (14).
При оценке временных тенденций заболеваемости и смертности при СН за последние два десятилетия отмечается снижение заболеваемости СНнФВ, тогда как СНсФВ увеличилась, при стабильной общей частоте СН и высоком риске смертности. Мужчины имеют более высокую частоту СНнФВ, чем женщины, причем у женщин выживаемость выше при любом фенотипе. Смертность не сильно различается: при СНнФВ оказалась 33%, а при СНсФВ - 29% в течение 5 лет.Недавний метаанализ, включавший более 1,5 миллионов пациентов с сердечной недостаточностью всех типов, показал, что 1, 2, 5 и 10-летняя выживаемость составляет 87%, 73%, 57% и 35% соответственно (4).Не было выявлено существенных различий в показателях смертности (в целом, от сердечно-сосудистых и несердечно-сосудистых заболеваний) в течение десятилетий в пределах фенотипов СН или между СНнФВ и СНсФВ в течение десятилетия. (14,15). Известно, что декомпенсация СН и, следовательно, частота госпитализаций влияют на прогноз. Риск госпитализации при СН в 1,5 раза выше у пациентов с СД 2 типа по сравнению с контрольной группой. Сильными предикторами госпитализаций по поводу СН являются фибрилляция предсердий (ФП), более высокий индекс массы тела (ИМТ) и более высокий уровень гликированного гемоглобина (HbA 1c), а также низкая расчетная скорость клубочковой фильтрации (рСКФ) (16).Предполагают, что в будущем из-за прогрессирующего роста населения, старения и увеличения ко-полиморбидности абсолютное число госпитализаций по поводу СН значительно возрастет до 50% в следующие 25 лет (17,18).
Госпитализация
Показания к госпитализации
Большинство пациентов с ХСН должны получать лечение амбулаторно.
Показаниями для госпитализации являются:
1. Острая декомпенсация ХСН
2. Присоединение новых сердечно-сосудистых событий:
- ИМ/ОКС,
- развитие жизнеугрожающих нарушений ритма сердца,
- гипертонический криз,
- высокая степень активности кардита при ревматической лихорадке и миокардите,
- появление свежих вегетаций при бактериальном эндокардите и т.д.
3. Рефрактерность к проводимой терапии на амбулаторном этапе, для уточнения диагноза и подбора терапии
4. Необходимость в инотропной терапии (гипотония, признаки кардиогенного шока и т.д.)
4. Необходимость в инотропной терапии (гипотония, признаки кардиогенного шока и т.д.)
5. Выраженная задержка жидкости: отек легких и т.д.
6. Присоединение/обострение нефротического синдрома, прогрессирующее ухудшение функции почек.
6. Присоединение/обострение нефротического синдрома, прогрессирующее ухудшение функции почек.
В то же время больные с терминальной стадией ХСН, где невозможно улучшить прогноз должны получать стандартное лечение и наблюдаться по месту жительства.
Показания для перенаправления на третичный уровень
1. Невозможность уточнить диагноз и генез ХСН на первичном/вторичном уровне.
2. Проведение инвазивных методов исследования.
3. Необходимость в проведении инвазивного лечения (хирургическая коррекция клапанных поражений, реваскуляризация, имплантация кардиовертера дефибриллятора, электрокардиостимулятора и т.д.) – перенаправление в кардиохирургию
4. Рефрактерность к проводимой терапии, кроме пациентов с терминальной ХСН.
1. Невозможность уточнить диагноз и генез ХСН на первичном/вторичном уровне.
2. Проведение инвазивных методов исследования.
3. Необходимость в проведении инвазивного лечения (хирургическая коррекция клапанных поражений, реваскуляризация, имплантация кардиовертера дефибриллятора, электрокардиостимулятора и т.д.) – перенаправление в кардиохирургию
4. Рефрактерность к проводимой терапии, кроме пациентов с терминальной ХСН.
Информация
Источники и литература
-
Клинические протоколы Министерства здравоохранения Кыргызской Республики
- Клинические протоколы Министерства здравоохранения Кыргызской Республики - 1. Национальный статистический комитет Кыргызской Республики, 022. www.stat.kg. 2. Heidenreich PA, Bozkurt B, Agular D, et. al.: 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure: A report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation 145:e876–e894, 2022 3. McDonagh TA, Metra M, Adamo M et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the Europian Society of Cardiology (ESC) With the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart Journal (2021) 00, 1-42. 4. Epidemiology of heart failure. Amy Groenewegen, Frans H.Rutten, Arend Mosterd, Arno W.Hoes. Eur J Heart Fail. 2020. Aug; 22 (8):1342-1356. 5. Bozkurt B, et al "Universal definition and classification of heart failure" J Card Fail; DOI: 10.1016/j.cardfail.2021.01.022. 6. Arrigo M, Huber LC, Winnik S et al. Right ventricular failure: pathophysiology, diagnosis and treatment Card. Fail. Rev. 2019; 5:140–146 7. Hunt S.A., Abraham W.T., Chin M.N. et.al. 2009 Focused Update Incorporated Into the ACC/AHA 2005 Guidelines for the Diagnosis and Management of Heart Failure in Adults. J Am Coll Cardiol. 2009;53;e1-e90. 8. The Criteria Committee of the New York Heart Assotiation.Diseases of the heart and blood vessels: nomenclature and criteria for diagnosis. 6th edition. Boston, MA: Little, Brown, 1964. 9. GBD 2017 Disease and Injury Incidence and Prevalence Collaborators . Global, regional, and national incidence, prevalence, and years lived with disability for 354 diseases and injuries for 195 countries and territories, 1990‐2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet 2018;392:1789–1858. 10. Фомин И. В. Хроническая сердечная недостаточность в Российской Федерации: что сегодня мы знаем и что должны делать. Российский кардиологический журнал. 2016; (8):7–13. 11. Терещенко С. Н., Галявич А. С., Ускач Т. М и др. Хроническая сердечная недостаточность. Клинические рекомендации 2020. Российский кардиологический журнал, Том 25, № 11 (2020) 12. McMurray JJ, Clinical practice. Systolic heart failure. N Engl Med 2010; 362:228-238 13. Pocock SJ, Ariti CA, McMurray JJ et al. Meta-Analysis Global Group in Chronic Heart Failure. Predicting survival in heart failure: a risk score based on 39 372 patients from 30 studies. (MAGGIC). Eur Heart J 2013;34:1404–1413 14. Тsao CW, Lyass A, Enserro D et al. Temporal trends in the incidence of and mortality associated with heart failure with preserved and reduced ejection fraction. JACC Heart Fail. 2018;6:678685. 15. Motiejunaite J, Akiyama E, Cohen-Solal A et.al. The association of long-term outcome and biological sex in patients with acute heart failure from different geographic regions. Eur Heart J 2020;41:13571364. 16. Mosterd A, Hoes AW. Clinical epidemiology of heart failure. Heart 2007;93:1137–1146. 17. Savarese G, Lund LH. Global public health burden of heart failure.Card Fail Rev 2017;3:7–11. 18. Al-Mohammad A, MantJ,LarameeP,SwainS. Chronic Heart Failure Guideline Development Group.Diagnosis and management of adults with chronic heart failure: summary of updated NICE guidance.BMJ2010;341:c. 4130114 19. Pugh TJ, Kelly MA, Gowrisankar S, et al. Landscape of genetic variations in dilated cardiomyopathy as determined by clinical DNA sequencing. Genet Med. 2014; 16:601–608. Crossref Medline Google Scholar 20. 4. Haas J, Frese KS, Peil B, et al. Atlas of clinical genetics of human dilated cardiomyopathy. Eur Hart J. 2015; 36:1123–1135a. 21. Gardner RS, Ozalp F, Murday AJ et al. N-terminal pro-brain natriuretic peptide. A new gold standard in predicting mortality in patients with advanced heart failure. Eur Heart J 2003;24:1735 – 1743. 22. Maisel A, Mueller C, Adams K Jr.et al. State of the art: using natriuretic peptide levels in clinical practice. Eur J Heart Fail 2008; 10:824–839. 23. ASE/EACVI Guidelines and Standards. Recommendations for the Evaluation of Left Ventricular Diastolic Function by Echocardiography: An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Sherif F. Nagueh, Otto A. Smiseth, Christopher P. Appleton, et al. Journal of the American Society of Echocardiography. Volume 29, Issue 4, April 2016, 277-314. 24. J.W. Deckers, J.M. Hare, K.L. Baughman. Complications of transvenous right ventricular endomyocardial biopsy in adult patients with cardiomyopathy: a seven-year survey of 546 consecutive diagnostic procedures in a tertiary referral center. J Am Coll Cardiol, 19 (1992), pp. 43-47. 25. L.T. Cooper, K.L. Baughman, A.M. Feldman, et al. The role of endomyocardial biopsy in the management of cardiovascular disease: a scientific statement from the American Heart Association, the American College of Cardiology, and the European Society of Cardiology. Endorsed by the Heart Failure Society of America and the Heart Failure Association of the European Society of Cardiology. J Am Coll Cardiol, 50 (2007), pp. 1914-1931. 26. G. Veress, C.J. Bruce, K. Kutzke, et al. Acute thrombus formation as a complication of right ventricular biopsy. J Am Soc Echocardiogr, 23 (2010), pp. 1039-1044. 27. Holland R, Battersby J, Harvey I, et al. Systematic review of multidisciplinary interventions in heart failure.Heart.2005; 91:899–906. 28. Parajuli DR, Kourbelis C, Franzon J, et al. Effectiveness of the pharmacist-involved multidisciplinary management of heart failure to improve hospitalizations and mortality rates in 4630 patients: a systematic review and meta-analysis of randomized controlled trials.J Card Fail. 2019; 25:744–756. 29. Takeda A, Martin N, Taylor RS, Taylor SJ. Disease management interventions for heart failure.Cochrane Database Syst Rev.2019; 1:CD002752. 30. Riegel B, Bennett JA, Davis A et.al.Cognitive impairment in heart failure: issues of measurement and etiology. Am J Crit Care 2002;11:520–528. 31. Jonkman NH, Westland H, Groenwold RH et.al. What are effective program characteristics of self-management interventions in patients with heart failure? An individual patient data meta-analysis. J Card Fail 2016;22:81–271. 32. Lainscak M, Blue L, Clark AL et.al. Self-care management of heart failure: practical recommendations from the Patient Care Committee of the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail 2011;13:115–126. 33. Flynn KE, Pina IL,Whellan DJ et.al.HF-ACTION Investigators. Effects of exercise training on health status in patients with chronic heart failure: HF-ACTION randomized controlled trial.JAMA 2009;301:1451–1459. 34. Taylor RS, Walker S, Ciani O et.al. Exercise-based cardiac rehabilitation for chronic heart failure: the EXTRAMATCH II individual participant data meta-analysis.Health Technol Assess 2019; 23:1–98. 35. Philipson H, Ekman I, Forslund HB, et al. Salt and fluid restriction is effective in patients with chronic heart failure.Eur J Heart Fail. 2013; 15:1304–1310.115 36. Doukky R, Avery E, Mangla A, et al. Impact of dietary sodium restriction on heart failure outcomes.J Am Coll Cardiol HF. 2016; 4:24–35. 37. Yancy CW, Jessup M, Bozkurt B, et al. 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines.Circulation. 2013; 128:e240–e32 38. Yancy CW. Sodium restriction in heart failure: too much uncertainty-do the trials.JAMA Intern Med. 2018; 178:1700–1701 39. Bilgen F, Chen P, Poggi A, et al. Insufficient calorie intake worsens post-discharge quality of life and increases readmission burden in heart failure.J Am Coll Cardiol HF. 2020; 8:756–764 40. Machado d’Almeida KS, Rabelo-Silva ER, Souza GC, et al. Aggressive fluid and sodium restriction in decompensated heart failure with preserved ejection fraction: results from a randomized clinical trial.Nutrition. 2018; 54:111–117 41. Welsh D, Lennie TA, Marcinek R, et al. Low-sodium diet self-management intervention in heart failure: pilot study results.Eur J Cardiovasc Nurs. 2013; 12:87–95. 42. Colin-Ramirez E, McAlister FA, Zheng Y, et al. Changes in dietary intake and nutritional status associated with a significant reduction in sodium intake in patients with heart failure. A sub-analysis of the SODIUM-HF pilot study.ClinNutr ESPEN. 2016; 11:e26–e32. 43. Hummel SL, Karmally W, Gillespie BW, et al. Home-delivered meals postdischarge from heart failure hospitalization.Circ Heart Fail. 11;2018:e004886. 44. Kalogeropoulos A, Papadimitriou L, Georgiopoulou VV, et al. Low- versus moderate-sodium diet in patients with recent hospitalization for heart failure: the PROHIBIT (Prevent Adverse Outcomes in Heart Failure by Limiting Sodium) pilot study.Circ Heart Fail. 2020;13:e006389. 45. Paterna S, Gaspare P, Fasullo S, Sarullo FM, Di Pasquale P. Normalsodium diet compared with low-sodium diet in compensated congestive heart failure: is sodium an old enemy or a new friend? Clinical Science. 2008;114 (3):221–30. 46. De Vecchis R, Paccone A , Di Maio M. Effects of a Restricted Water Intake on Various Clinical and Laboratory Outcomes in Patients With Heart Failure: A Meta-Analysis of Randomized Controlled Trials. Minerva Cardioangiol . 2020 Feb 20. 47. O Miró, R. Estruch, F. J. Martin-Sánchez et al. Adherence to the Mediterranean diet and all-cause mortality after an episode of acute heart failure: results from the MEDIT-AHF study JACC: Heart Failure, 2018; 6:52-62. 48. McDonagh TA, Metra M, Adamo M et al. 2023 Focused Update of the 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the task force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) With the special contribution of the Heart Failure Association (HFA) of the ESC. European Heart Journal, Volume 44, Issue 37, 1 October 2023, Pages 3627–3639. 49. McMurray JJ, Packer M, Desai AS, et al. Angiotensin-neprilysin inhibition versus enalapril in heart failure.N Engl J Med. 2014; 371:993–1004. 50. Wachter R, Senni M, Belohlavek J, et al. Initiation of sacubitril/valsartan in haemodynamicallystabilised heart failure patients in hospital or early after discharge: primary results of the randomised TRANSITION study.Eur J Heart Fail. 2019; 21:998– 1007. 51. Velazquez EJ, Morrow DA, DeVore AD, et al. Angiotensin-neprilysin inhibition in acute decompensated heart failure.N Engl J Med. 2019; 380:539–548. 52. Desai AS, Solomon SD, Shah AM, et al. Effect of sacubitril-valsartan vs enalapril on aortic stiffness in patients with heart failure and reduced ejection fraction: a randomized clinical trial.JAMA. 2019; 322:1077–1084.116 53. Consensus Trial Study Group. Effects of enalapril on mortality in severe congestive heart failure. Results of the Cooperative North Scandinavian Enalapril Survival Study (CONSENSUS).N Engl J Med. 1987; 316:1429–1435. 54. Effect of ramipril on mortality and morbidity of survivors of acute myocardial infarction with clinical evidence of heart failure. The Acute Infarction Ramipril Efficacy (AIRE) Study Investigators.Lancet. 1993; 55. . Konstam MA, Neaton JD, Dickstein K, et al; HEAAL Investigators. Effects of high-dose versus low-dose losartan on clinical outcomes in patients with heart failure (HEAAL study): a randomised, double-blind trial.Lancet. 2009; 374:1840–1848. 56. Ruilope LM, Dukat A, Böhm M, et al. Blood-pressure reduction with LCZ696, a novel dual-acting inhibitor of the angiotensin II receptor and neprilysin: a randomised, double-blind, placebo-controlled, active comparator study.Lancet. 2010; 375:1255–1266. 57. Telmisartan RandomisedAssessmeNt Study in ACE iNtolerant subjects with cardiovascular Disease (TRANSCEND) InvestigatorsYusuf S, Teo K, et al. Effects of the angiotensin-receptor blocker telmisartan on cardiovascular events in high-risk patients intolerant to angiotensin-converting enzyme inhibitors: a randomised controlled trial.Lancet. 2008; 372:1174–1183. 58. Wang Y, Zhou R, Lu C, et al. Effects of the angiotensin-receptor neprilysin inhibitor on cardiac reverse remodeling: meta-analysis.J Am Heart Assoc. 2019;8:e012272. 59. Cohn J.N. , Tognoni G. , Valsartan Heart Failure Trial Investigators A randomized trial of the angiotensin-receptor blocker valsartan in chronic heart failure. N Engl J Med, 345 (2001), pp. 1667-1675. 60. M.A. Pfeffer, J.J. McMurray, E.J. Velazquez, et al. Valsartan, captopril, or both in myocardial infarction complicated by heart failure, left ventricular dysfunction, or both [published correction appears in N Engl J Med. 2004;350:203. 61. Telmisartan RandomisedAssessmeNt Study in ACE iNtolerant subjects with cardiovascular Disease (TRANSCEND) Investigators, S. Yusuf, K. Teo, et al. Effects of the angiotensin-receptor blocker telmisartan on cardiovascular events in high-risk patients intolerant to angiotensin-converting enzyme inhibitors: a randomised controlled trial. Lancet, 372 (2008), pp. 1174-1183 62. M.A. Konstam, J.D. Neaton, K. Dickstein, et al., HEAAL Investigators Effects of high-dose versus low-dose losartan on clinical outcomes in patients with heart failure (HEAAL study): a randomised, double-blind trial Lancet, 374 (2009), pp. 1840-1848 63. McMurray JJ, Packer M, Desai AS, et al. Angiotensinneprilysin inhibition versus enalapril in heart failure. N Engl J Med. 2014;371:993–1004. 64. Wachter R, Senni M, Belohlavek J, et al. Initiation of sacubitril/valsartan in haemodynamicallystabilised heart failure patients in hospital or early after discharge: primary results of the randomised TRANSITION study. Eur J Heart Fail. 2019;21:998– 1007. 65. Velazquez EJ, Morrow DA, DeVore AD, et al. Angiotensin-neprilysin inhibition in acute decompensated heart failure. N Engl J Med. 2019;380:539– 548. 66. J.B. Kostis, M. Packer, H.R. Black, et al. Omapatrilat and enalapril in patients with hypertension: the Omapatrilat Cardiovascular Treatment vs. Enalapril (OCTAVE) trial. Am J Hypertens, 17 (2004), pp. 103-111 67. O. Vardeny, R. Miller, S.D. Solomon. Combined neprilysin and renin-angiotensin system inhibition for the treatment of heart failure. J Am Coll Cardiol HF, 2 (2014), pp. 663-670.
Информация
Адрес для переписки с рабочей группой
Кыргызская республика, г. Бишкек
ул. Т. Молдо, 3, 720040,
Национальный центр кардиологии и терапии
Тел: 996 312 62 56 98, 996 312 62 56 76
Кыргызская республика, г. Бишкек
ул. Т. Молдо, 3, 720040,
Национальный центр кардиологии и терапии
Тел: 996 312 62 56 98, 996 312 62 56 76
E-mail: noruzbaeva@mail.ru
Список сокращений:
АГ - артериальная гипертензия
АД - артериальное давление
АМКР - антагонисты минералокортикоидных рецепторов
АРНИ - ангиотензиновых рецепторов и неприлизина ингибиторы
ББ - бета-адреноблокаторы
БРА - блокаторы рецепторов к ангиотензину II
ДЗСТ - диффузные заболевания соединительной ткани
ИАПФ - ингибиторы ангиотензин-превращающего фермента
иSGLT2 - ингибиторы натрий-глюкозного котранспортера 2-го типа
КБС - коронарная болезнь сердца
КДД ЛЖ - конечно-диастолическое давление в левом желудочке
КДО ЛЖ - конечно-диастолическое объем ЛЖ
МПК - механическая поддержка кровообращения
ЛЖ - левый желудочек
НУП - натрийуретические пептиды
ОМТ - оптимальная медикаментозная терапия
ОДСН - острая декомпенсация сердечной недостаточности
ОДСН - острая сердечная недостаточность
ПКМП - перипартальная кардиомиопатия
ПЖ - правый желудочек
РКИ - рандомизированное клиническое исследование
рСКФ - расчетная скорость клубочковой пульсации
САД - систолическое артериальное давление
САС - симпато-адреналовая система
СН - сердечная недостаточность
СНнФВ- СН с низкой ФВ
СНусФВ- СН с умеренно сниженной ФВ
СНсФВ- СН с сохраненной ФВ
ССЗ - сердечно-сосудистые заболевания
ФВ - фракция выброса
ФК - функциональный класс
ФП - фибрилляция предсердий
ХСН - хроническая сердечная недостаточность
ЧСС - частота сердечных сокращений
ЭКГ - электрокардиограмма
ЭКС - электрокардиостимулятор
ЭХОКГ - эхокардиография
Состав рабочей группы по разработке клинического руководства
Для создания клинического руководства по диагностике и лечению хронической сердечной недостаточности (ХСН) у взрослых была создана междисциплинарная группа разработчиков. Это было обусловлено следующими причинами:
- ХСН является итогом практически всех сердечно-сосудистых заболеваний и иной патологии,
- в диагностике и лечении ХСН участвуют специалисты различных звеньев и отраслей медицины, в том числе кардиологи, врачи общей практики, семейные врачи, эндокринологи, кардиохирурги, инвазивные хирурги и аритмологи, реаниматологи, пульмонологи, онкологи, гинекологи и др.,
- создание междисциплинарной группы позволило включить в процесс разработки рекомендаций все заинтересованные стороны и рассмотреть данную проблему с различных аспектов,
- создание междисциплинарной группы позволило включить в процесс разработки рекомендаций все заинтересованные стороны и рассмотреть данную проблему с различных аспектов,
- междисциплинарная группа исключает личную заинтересованность разработчиков и снижает риск систематической ошибки.
В состав междисциплинарной группы, кроме руководителей проекта, вошли кардиологи, врачи общей практики, семейные врачи, фармакологи, инвазивные кардиохирурги, эксперты по разработке и оценке качества клинических руководств, а также пациенты, страдающие ХСН.
В состав междисциплинарной группы, кроме руководителей проекта, вошли кардиологи, врачи общей практики, семейные врачи, фармакологи, инвазивные кардиохирурги, эксперты по разработке и оценке качества клинических руководств, а также пациенты, страдающие ХСН.
Руководитель группы:
Норузбаева Айгуль Мукашевна – д.м.н., профессор, заведующая отделением хронической сердечной недостаточности НЦКиТ им. М. Миррахимова. Руководитель обеспечивал разработку клинического руководства, написание текста, а также эффективную деятельность группы и координацию между членами рабочего коллектива.
Ответственные исполнители:
Калысов Курбан Абдишукурович - к.м.н., руководитель группы интервенционного лечения аритмий и СН НЦКТ, ответственный за написание текста по интервенционным методам лечения при ХСН.
Калысов Курбан Абдишукурович - к.м.н., руководитель группы интервенционного лечения аритмий и СН НЦКТ, ответственный за написание текста по интервенционным методам лечения при ХСН.
Аббасова Мадина Азатовна– м.н.с. отделения хронической сердечной недостаточности НЦКиТ, ответственная за написание текста приложений по практическому применению медикаментозных средств при ХСН.
Медицинские консультанты:
|
Миррахимов Э.М.
|
д.м.н., профессор, зав. кафедрой факультетской терапии КГМА
|
кардиология
|
|
Султаналиева Р.Б.
|
д.м.н., профессор кафедры терапии №1 КРСУ
|
эндокринология, терапия
|
|
БатыралиевТ.А
|
д.м.н., профессор, главный кардиолог МЗ КР
|
кардиология, инвазивный хирург
|
|
Бримкулов Н.Н.
|
д.м.н., профессор кафедры семейной медицины последипломного образования КГМА
|
пульмонология, врач общей практики
|
|
Исмаилова Ф.М.
|
Зав. кардиологическим отделением Центра общеврачебной практики Ысык-атинского района, Чуйской области
|
кардиология
|
|
Абдибаитова М.А.
|
Зав. отделением кардиоревматологии, ЦОВП, г. Кызыл-Кия, Баткенской области
|
врач общей практики
|
|
Кылчыкбаев Т.Э.
|
Пенсионер
|
пациент с ХСН
|
В группу разработчиков включены авторы составители и консультанты, имеющие опыт клинической и научной работы, знающие английский язык и владеющие навыками работы на компьютере, практикующие семейные врачи из ЦСМ, врачи-кардиологи из отделений кардиологии, научные сотрудники НЦКТ, а также профессорско-преподавательский состав КГМА, КРСУ. Приглашение медицинских консультантов в состав разработчиков позволило обсудить достоверность отдельных рекомендаций, а также вопросов применимости руководства в учреждениях первичного звена здравоохранения Кыргызской Республики.
Мнение разработчиков не зависело от производителей лекарственных средств и медицинской техники. О конфликте интересов не заявил никто.
Внешняя и внутренняя экспертиза
Рецензенты:
Мураталиев Т.М. Д.м.н., профессор, консультант отделения острого инфаркта миокарда НЦКТ, профессор кафедры КГМА внутренний рецензент
Бейшенкулов М.Т. д.м.н., профессор, зав отделением УКиР№1 НЦКТ внутренний рецензент
Камбаралиева Б.А. Клинический фармаколог, координатор ПМСП МЗКР внешний рецензент
Камбаралиева Б.А. Клинический фармаколог, координатор ПМСП МЗКР внешний рецензент
Методологическая экспертная поддержка:
Саадакбаева Г.А. Врач-эксперт отдела доказательной медицины и медицинских технологий ЦРЗиМТ
Стратегия поиска
Актуальность проблемы ХСН обуславливает во всем мире непрерывное проведение активного поиска новых методов диагностики, профилактики, лечения и ведения пациентов с сердечной недостаточностью. В настоящее время существует достаточное количество клинических руководств, содержащих соответствующие рекомендации по различным аспектам ХСН, имеющих строгую научную базу. В связи с чем рабочей группой по разработке данного руководства было принято решение о создании адаптированного к условиям здравоохранения Кыргызской Республики клинического руководства на основе уже существующих руководств и международных консенсусов высокого методологического качества, основанных на принципах доказательной медицины.
Поиск клинических руководств по ХСН осуществлялся в национальных и международных реестрах клинических руководств с использованием электронных баз данных в сети Интернет: http://www.ncbi.nlm.nih.gov/; http://guidelines.cardiology.ca/; http://escardio.com/; https://www.heartfailurematters.org/; https://www.acc.org/; htps://www.heart.org/; https://hfsa.org/; https://ossn.ru/; http://scardio.ru/; http:/www.circ.ahajournals.org/ http://guidelines.gov/; http://www.bmj.com/; http://www.nejm.com/
C учетом быстрого обновления данных в медицинской литературе, появления большого количества новых публикаций, нами был проведен дополнительный поиск рандомизированных клинических исследований, посвященных ХСН в англоязычных библиографических системах Medline и Embase, в TheCochraneLibrary, а также ручной поиск по ссылкам литературы оригинальных статей через каталог медицинских журналов (www.healthinternetwork.org).
Использовались следующие «ключевые слова» в прямом и перекрестном поиске: heart failure, heart failure with reduced ejection fraction, heart failure with preserved ejection fraction, heart failure with mildly reduced ejection fraction, systolic heart failure, heart failure rehabilitation, chronic heart failure, acute decompensated heart failure, beta blockers, mineralocorticoid receptor antagonists (MRA), ACE-inhibitors, angiotensin and neprilysin receptor antagonist (ARNi), sacubitril valsartan, angiotensin receptor antagonis,; Sodium glucose co-transporter 2 or SGLT2 inhibitors, cardiac amyloidosis, atrial fibrillation, congestive heart failure, guideline-directed medical therapy, diabetes mellitus, cardiomyopathy, cardiac amyloidosis, valvular heart disease, mitral regurgitation, cardiomyopathy in pregnancy, reduced
ejection fraction, right heart pressure, diuretics, atrial fibrillation, cardiac resynchronisation therapy, ICD, Pacemaker, coronary artery disease, cardiomyopathy, catheter ablation, echocardiography, mechanical circulatory support, heart transplantation, HFpEF, HFrEF, HFmrEF.
После проведённой оценки литературы с помощью инструмента AGREE GRS за основу были взяты 4 клинических руководства, в которых четко отражены вопросы диагностики, лечения и ведения пациентов с хронической сердечной недостаточностью (см. табл.1 Характеристика отобранных клинических руководств).
Таблица 1. Характеристика отобранных клинических руководств по ХСН
Таблица 1. Характеристика отобранных клинических руководств по ХСН
| Название руководства | Качество | Новизна | Применимость | |
| 1 |
McDonagh TA, Metra M, Adamo M et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the Europian Society of Cardiology (ESC) With the special contribution of the Heart Failure Association (HFA) of the ESC.
Eur Heart Journal (2021) 00, 1-42.
|
+++ | ++ | +++ |
| 2 | Paul A Heidenreich, Biykem Bozkurt, David Agular et al.2022 HA/ACC/HFSA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines Circulation. 2022;145:e895–e1032. | ++ | ++ | +++ |
| 3 | McDonagh TA, Metra M, Adamo M et al. 2023 Focused Update of the 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the task force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) With the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart Journal, Vol 44, Oct 2023, 3627–3639. | +++ | +++ | +++ |
| 4 |
Терещенко С. Н., Галявич А. С., Ускач Т. М и др.
Хроническая сердечная недостаточность.
Клинические рекомендации 2020. Российский кардиологический журнал, Том 25, № 11 (2020)
|
++ | + | ++ |
Апробация клинического руководства
Проект данного клинического руководства неоднократно обсуждался на заседаниях и конференциях Кардиологического общества Кыргызстана, Ассоциации врачей внутренней медицины, апробирован путем обучения кардиологов, терапевтов, семейных врачей, врачей общей практики на различных форумах в гг. Бишкек, Ош, Джалал-Абад, Каракол, Чолпон-Ата, Токмок, Ошской, Чуйской, Нарынской, Иссык-кульской, Таласской, Баткенской областей в 2023-2024 гг. Проект клинического руководства получил одобрение всех специалистов.
В процессе апробации и рецензирования были получены комментарии и рекомендации, которые были учтены при его доработке. После апробирования и получения комментариев и/или рецензий, данное клиническое руководство было утверждено кыргызским обществом кардиологов.
Декларация конфликта интересов
Данное клиническое руководство было разработано без внешнего финансирования. Конфликт интересов у членов группы разработчиков данного руководства отсутствовал. Никто из членов авторского коллектива не имел коммерческой заинтересованности или другого конфликта интересов с фармацевтическими компаниями или другими организациями, производящими продукцию для диагностики, лечения и профилактики ХСН у взрослых.
Классы и уровни доказательности
Градация рекомендаций соответствует классификации Европейского общества кардиологов
Декларация конфликта интересов
Данное клиническое руководство было разработано без внешнего финансирования. Конфликт интересов у членов группы разработчиков данного руководства отсутствовал. Никто из членов авторского коллектива не имел коммерческой заинтересованности или другого конфликта интересов с фармацевтическими компаниями или другими организациями, производящими продукцию для диагностики, лечения и профилактики ХСН у взрослых.
Классы и уровни доказательности
Градация рекомендаций соответствует классификации Европейского общества кардиологов
Таблица 2. Классы рекомендаций
| Классы рекомендаций | Определение | Возможная формулировка для использования |
| Класс I | Доказательства и/или общее согласиев отношении того, что данное лечение или процедура является благоприятным, полезным и эффективным | Данное лечение/манипуляция рекомендовано или показано |
| Класс II | Противоречивые данные и/или расхождение во мнениях относительно полезности/эффективности данного лечения или процедуры | |
| Класс IIа | Вес доказательств/мнений в пользу полезности/эффективности данного лечения или процедуры | Следует рассмотреть |
| Класс IIb | Менее обоснованные доказательства/мнения относительности полезности/эффективности данного лечения или процедуры | Можно рассмотреть |
| Класс III | Доказательства или общее согласие в отношении того, что данное лечение или процедура не является полезным/эффективным, а в некоторых случаях может быть вредным | Не рекомендовано |
Таблица 3. Уровни доказательности
| Уровень доказательности А | Данные получены из мультицентровых РКИ или мета-анализов |
| Уровень доказательности В | Доказательства получены из одноцентровых РКИ или больших не рандомизированных исследований |
| Уровень доказательности С |
Консенсусное мнение экспертов и/или доказательства из небольших или ретроспективных исследований, регистров |
Основные термины, определения и классификация ХСН
Используемые в настоящее время определения сердечной недостаточности довольно гетерогенны и не стандартизованы. Некоторые из них фокусируются на клинической картине и диагностике, другие – на гемодинамике и физиологических аспектах. Рабочая группа от Американского общества специалистов по СН, Ассоциации специалистов по СН Европейского общества кардиологов, Японского общества специалистов по СН опубликовала следующее Универсальное определение и классификацию сердечной недостаточности в 2021 году, которая используется в данном руководстве (5).
Сердечная недостаточность – это клинический синдром, включающий в себя симптомы и признаки, вызванные структурной и/или функциональной аномалией сердца, подтвержденный повышенным уровнем натрийуретического пептида и/или объективным свидетельством застоя по малому или большому кругам кровообращения (5).
Универсальное определение необходимо врачам, исследователям, администраторам, а также структурам, осуществляющим оплату и контроль качества оказания медицинской помощи.
ХСН является следствием длительно существующей сердечно-сосудистой и иной патологии, характеризуется постепенным нарастанием клинической симптоматики, проявляется появлением/усилением одышки, утомляемости, слабости, сердцебиения, отеков, гипотонии. По динамике развития клинической картины выделяют острую и хроническую СН. Острая сердечная недостаточность (ОСН) – клинический синдром, характеризующийся быстрым возникновением симптомов, характерных для нарушенной систолической и/или диастолической функций сердца (сниженный сердечный выброс, недостаточная перфузия тканей, повышенное давление в капиллярах легких, застой в тканях). Это состояние, которое развивается в результате остро возникшей несостоятельности миокарда (острый инфаркт миокарда, острый диффузный миокардит, острые тяжелые аритмии, гипертонический криз и т.д.). ОСН необходимо отличать от острой декомпенсации ХСН, которая по клинической картине сходна с ОСН, также требует госпитализации в стационары кардиологического профиля. Однако, при ОСН, в отличие от постепенно нарастающей симптоматики при острой декомпенсации ХСН, обычно отсутствуют признаки задержки жидкости в организме.
Помимо острой и хронической различают также систолическую и диастолическую ХСН, хотя признано, что обе функции сердца тесно взаимосвязаны. Клинические проявления СН связывают со снижением сократительной способности миокарда, которая условно оценивается по величине фракции выброса (ФВ) левого желудочка (ЛЖ). Снижение ФВ ЛЖ ≤ 49% расценивают как систолическую дисфункцию миокарда, которая, безусловно, сопровождается и диастолической дисфункцией. При оценке больных с клинической симптоматикой ХСН, имеющих ФВ ЛЖ ≥ 50% рекомендовано пользоваться термином ХСН с сохраненной ФВ. Чаще всего у этих больных наряду с симптомами/признаками СН имеется диастолическая дисфункция миокарда, подтвержденная объективными методами (эхокардиографией (ЭхоКГ) и/или инвазивными методами) на фоне сохраненной систолической функции ЛЖ. В таких случаях состояние расценивается как диастолическая дисфункция миокарда или диастолическая ХСН.
Среди других терминов различают также левожелудочковую, правожелудочковую и смешанную СН в соответствии с нарушением функции той или иной камеры сердца и преобладания застойных явлений в малом или большом кругах кровообращения.
Правожелудочковая СН – сложный клинический синдром, включающий различные механизмы патогенеза и патологические процессы в результате дисфункции правого желудочка(ПЖ) с признаками и симптомами СН. Чаще всего причиной правожелудочковой СН является прогрессирующая левожелудочковая СН: АГ, КБС, кардиомиопатии, пороки сердца, миокардиты, СД2, ожирение и т.д.
В то же время правожелудочковая СН может быть результатом легочной гипертензии различной этиологии, приводящей к развитию дисфункции ПЖ, механика и функции которого изменяются при перегрузке давлением либо объемом: ХОБЛ, бронхиальная астма, бронхоэктатическая болезнь, туберкулез, хроническая ТЭЛА, саркоидоз, фиброз, амилоидоз легких, инфаркт ПЖ, врожденные пороки сердца с перегрузкой правых отделов, шунты слева – направо, аномалии трикуспидального клапана, легочной артерии, аритмогенная кардиомиопатия ПЖ, заболевания перикарда, цирроз печени, диффузные заболевания соединительной ткани, рестриктивная кардиомиопатия, длительная гипоксия, ацидемия, сепсис, постоперационная травма/ишемия- посткардиотомический синдром (6).
Клинические индикаторы, отражающие качество и эффективность лечения ХСН
Клинические индикаторы, отражающие качество и эффективность лечения ХСН
|
№
|
Индикатор
|
Условия ухода
|
Измерение
|
|
1
|
Оценка ФВЛЖ
|
Амбулаторный Стационар
|
Диагностика Мониторинг
|
|
2
|
Оценка симптомов и признаков
|
Амбулаторный Стационар
|
Диагностика Мониторинг
|
|
3
|
Оценка НУП
|
Амбулаторное Стационарное
|
Диагностика
|
|
4
|
Терапия бета-блокаторами при СНнФВ
|
Амбулаторное Стационарное
|
Лечение
|
|
5
|
Терапия иАПФ/БРА/АРНИ при СНнФВ
|
Амбулаторное Стационарное
|
Лечение
|
|
6
|
АМКР-терапия при СНнФВ
|
Амбулаторное Стационарное
|
Лечение
|
|
7
|
Терапия ингибиторами SGLT2
|
Амбулаторное Стационарное
|
Лечение
|
|
8
|
Лабораторный мониторинг иАПФ/БРА/АРНИ,АМКР, иSGLT2
|
Амбулаторное Стационарное
|
Лечение Мониторинг
|
|
9
|
Консультирование по поводу установки ИКД пациентам с СНнФВ на ОМТ
|
Амбулаторное Стационарное
|
Лечение
|
|
10
|
Консультирование по поводу имплантация СРТ пациентам с СНнФВ на ОМТ
|
Амбулаторное Стационарное
|
Лечение
|
|
11
|
Обучение пациентов самообслуживанию
|
Амбулаторное Стационарное
|
Мониторинг Лечение
|
|
12
|
Прием пациентов с СН после выписки из больницы
|
Амбулаторное
|
Мониторинг Лечение
|
Примечание: ФВ ЛЖ – фракция выброса левого желудочка, НУП – натрийуретические пептиды, СНнФВ – сердечная недостаточность с низкой фракцией выброса, иАПФ- ингибиторы ангиотензин превращающего фермента, БРА- блокаторы рецепторов ангиотензина 1, АРНИ- сакубитрил-валсартан, АМКР- антагонисты минерало-кортикоидных рецепторов, ОМТ -оптимальная медикаментозная терапия
Приложения
Приложение 1.
Обучение пациентов с ХСН
Приложения
Приложение 1.
Обучение пациентов с ХСН
|
Предмет обсуждения
|
Цель для пациента и ухаживающего лица
|
Цель для врача
|
|
Этиология и патогенез СН
|
Понять причину, симптомы и методы лечения СН
|
Предоставить информацию
|
|
Течение и стадия СН
|
Понять развитие, прогноз, возможные исходы и пути течения СН. Принимать совместные решения по лечению, учитывая стадию СН у пациента
|
Деликатно сообщить информацию о прогнозе состояния пациента во время постановки диагноза, выборе метода лечения и при изменении клинического состояния, а также по запросу самого пациента или родственника.
|
|
Медикаментозное лечение
|
||
|
Лекарственный препарат
|
Понять показания, преимущества, необходимость длительного и правильного соблюдения режима приема препаратов с соблюдением дозировки. Знать побочные эффекты медикаментов, уметь их распознавать и при необходимости предпринять действия в отношении них.
|
Предоставить письменную и устную информацию о показаниях, преимуществах, дозировке и побочных эффектах лекарственных препаратов. Обсудить возможные вопросы касательно оптимального времени приема препарата, случайного пропуска его и приема двойной дозы при следующем применении и т. д. Обсудить возможные противопоказания для приема лекарств. Посоветовать вспомогательные средства для напоминания соблюдения режима приема лекарств (использование таблетниц, установление напоминания на сотовое устройство и т. д.) при необходимости.
|
|
Имплантируемые устройства
|
Уметь принимать совместные решения по необходимости имплантации устройств для вспомогательной работы сердца. Понять показания, важность и необходимость проверки имплантируемых устройств, а также порядок проведения. Уметь распознать возможные осложнения имплантируемых устройств (включая риск неуместных разрядов дефибриллятора) и знать какие действия предпринять при их возникновении.
|
Объяснить важность своевременной проверки устройства. Обсудить возможное влияние на вождение. Четко определить ситуации, в которых устройство может быть деактивировано или эксплантировано. Привлечь пациента и ухаживающего лица к принятию решений.
|
|
Самоуход
|
||
|
Двигательная активность и физически упражнения
|
Регулярно заниматься спортом и быть физически активным, учитывая возможности собственного организма и стадию СН. Уметь приспособить физическую активность к своему состоянию.
|
Посоветовать упражнения, учитывающие физические и функциональные ограничения, такие как слабость, повышенную утомляемость, одышку и сопутствующие заболевания. Предоставить и объяснить программу упражнений или другие режимы активности. Обсудить возможные препятствия, побочные эффекты и ресурсы.
|
|
Режим труда и отдыха
|
Признать важность сна и отдыха для здоровья. Уметь правильно распределить время на труд и отдых. Выявить проблемы со сном и суметь скорректировать.
|
Объяснить важность соблюдения режима «труд-отдых», необходимость хорошего сна. Предоставить рекомендации по сохранению здорового сна, правильно назначить прием лекарственных препаратов, возможно влияющих на сон (например, прием диуретиков в утреннее время). Рассмотреть и тщательно обсудить преимущества и вредные последствия снотворных препаратов.
|
|
Соблюдение водно-питьевого режима
|
Избегать употребления большого количества жидкости. Ограничение жидкости на 1,5 - 2 л/день у пациентов с тяжелой СН/гипонатриемией для облегчения симптомов и предотвращения застоя жидкости. При появлении сухости во рту и жажды необходимо: прополоскать рот, добавить в воду лимон или кусочек льда, сделать маленький глоток воды. Для профилактики обезвоживания в период высокой температуры/влажности, возникновения рвоты/диареи увеличить потребление жидкости, если до этого прием был ограничен.
|
Предоставить и разъяснить информацию по важности, преимуществах и недостатках ограничения жидкости. Посоветовать адаптировать потребление жидкости к весу, температурным условиям и сопутствующим заболеваниям, в частности сопровождающиеся обезвоживанием (рвота, диарея, лихорадка…) Корректировать рекомендации по водно-питьевому режиму в период острой декомпенсации.
|
|
Рациональное, здоровое питание
|
Не допускать недоедание и переедание. Избегать чрезмерного потребления соли (>5 г/день). Поддерживать здоровую массу тела.
|
Обсудить текущий рацион питания, роль соли, роль микро- и макроэлементов. Обсудить необходимость приема добавок в случае дефицита питательных веществ, но не на регулярной основе. Обсудить поддержание здорового веса тела.
|
|
Прием алкоголя
|
Избегать приема алкоголя (особенно при алкогольной КМП). Ограничить употребление алкоголя в соответствии с рекомендациями по профилактике сердечно-сосудистых заболеваний.
|
Обсудить с пациентом вред алкоголя (особенно при алкогольной КМП). Разъяснить употребление алкоголя в соответствии с рекомендациями по профилактике сердечнососудистых заболеваний (не более 2-х порций в день для мужчин или 1 порции в день для женщин).
|
|
Вакцинация
|
Знать о необходимости вакцинации против гриппа и пневмококковой инфекции.
|
Информировать о необходимости вакцинации. Обсудить преимущества, возможные противопоказания и последствия вакцинации.
|
|
Курение и прием/использование наркотических средств
|
Осознавать последствия для здоровья от курения и употребления наркотиков. Бросить курить (включая электронные сигареты) и принимать наркотики.
|
Информировать, обсудить и помочь в принятии решений. Обратиться за консультацией к специалисту по вопросам прекращения курения, употребления наркотиков и заместительной терапии. Рассмотреть возможность направления на когнитивно поведенческую терапию и психологическую поддержку, если пациент желает бросить курить или принимать наркотики.
|
|
Путешествие, отдых, вождение
|
Планировать путешествия и отдых в соответствии с физическими возможностями организма. Уметь принимать осознанное решение при вождении.
|
Информировать и обсудить практические вопросы, связанные с дальними поездками, пребыванием за границей, физико географическими и климатическими условиями местности, воздействием солнца (эффект амиодарона), высокой влажностью или жарой (обезвоживание) и большой высотой (окисление). Дать практические советы, связанные с хранением лекарств, устройствами (держите лекарства в ручной клади, имейте список лекарств, название устройства/карту и лечебные центры). Информировать о местных/национальных/международных правилах, касающихся вождения.
|
|
Сексуальная активность
|
Иметь возможность возобновить или адаптировать сексуальную активность в соответствии с физическими возможностями. Выявить возможные проблемы с сексуальной активностью и их связь с СН или ее лечением.
|
Сообщить и обсудить, что сексуальная активность безопасна для пациентов со стабильной СН. Дать советы по устранению факторов, способных привести к сексуальным проблемам. Обсудить и предоставить доступное фармакологическое лечение сексуальных проблем. При необходимости направить к специалисту.
|
|
Ведение дневника самоконтроля
|
Контроль АД, ЧСС/пульса (можно использовать автоматический тонометр), измерение веса утром натощак, при необходимости подсчет количества выпиваемой и выделяемой жидкости.
|
Объяснить правила и методику ведения дневника самоконтроля (например, увеличение веса на 1-1,5 кг за день может указывать на задержку жидкости и необходим совет врача по коррекции терапии).
|
|
Контроль симптомов и оказание самопомощи
|
Контролировать симптомы и суметь выявить какие-либо изменения в них, с последующим оказанием первой помощи. Адекватно реагировать на изменение симптомов. Знать когда и как обратиться за медицинской помощью
|
Предоставить и разъяснить пациенту или ухаживающему лицу методы оказания самопомощи (например, при усилении одышки, появлении/нарастании отеков или внезапного увеличения веса более чем на 2 кг за 3 дня пациенты могут увеличить дозу диуретиков и/или обратиться за помощью к своему лечащему врачу).
|
|
Психологические проблемы
|
Иметь возможность прожить хорошую жизнь с СН. Суметь обратиться за посторонней помощью в случае психологических проблем (при симптомах депрессии, тревоги, плохом настроении), которые могут возникнуть на любой стадии СН.
|
Регулярно информировать пациента и ухаживающее лицо о состоянии, вариантах лечения, уходе за собой и необходимости самоконтроля. Регулярно обсуждать важность поддержки. При необходимости направить к специалисту для психологической поддержки.
|
|
Родственники, опекуны и лица, ухаживающие за пациентом
|
Иметь возможность попросить поддержки, помощи, в том числе психологической.
|
Обсудить важность участия опекуна/родственника в уходе за пациентом. Уважительно относиться к пациентам и лицам, осуществляющим уход
|
Приложение 2.
Практическое использование основных и дополнительных лекарственных средств, применяемых при ХСН
Практические рекомендации по использованию ингибиторов ангиотензин превращающего фермента (иАПФ)
|
Препарат
|
Стартовая доза
|
Целевая доза
|
|
Каптоприл
|
6,25 мг х 3 раза/сут
|
50 мг х 3 раза/сут
|
|
Эналаприл
|
2,5 мг х 2 раза в сут
|
10-20 мг х 2 раза в сут
|
|
Лизиноприл
|
2,5-5 мг
|
20-40 мг
|
|
Рамиприл
|
1,25-2,5мг
|
10 мг
|
|
Трандолаприл
|
0,5мг
|
4 мг
|
|
Периндоприл
|
2 мг
|
8-16 мг
|
|
Лизинорпил
|
2,5-5 мг
|
20-40 мг
|
Противопоказания:
-
выраженная дисфункция почек (креатинин >221 ммоль/л (>2,5 мг/дл) или рСКФ<30 мл/мин/1,73 м2)
-
гиперкалиемия (>5,5 ммоль/л)
-
ангионевротический отек в анамнезе
-
двусторонний стеноз почечных артерий
-
беременность/лактация
С осторожностью:
-
гиперкалиемия (>5,0 ммоль/л)
-
дисфункция почек или рСКФ<35 мл/мин/1,73 м2)
-
артериальная гипотония (САД <90 мм рт. ст.)
Взаимодействие с другими ЛС:
-
калийсберегающие диуретики или препараты калия - гиперкалиемия
-
петлевые, тиазидные диуретики-гипокалиемия, нарушение функции почек
-
диуретики и вазодилататоры-гипотензия
-
соли лития - увеличение концентрации лития в сыворотке крови
-
НПВС – ингибирование простагландинов приводит к задержке натрия и воды, повышению системного сосудистого сопротивления, вазоконстрикции, уменьшению СВ и притуплению реакции на диуретики.
-
цитостатики, аллопуринол или прокаинамид –гематологические нарушения, синдром Стивенса-Джонсона
Правила пользования:
-
проверить функцию почек и уровень электролитов
-
начинать с низкой дозы
-
удвоить дозу не менее чем через 2 недели (более быстрое повышение дозы может быть проведено у пациентов, находящихся в стационаре или под тщательным наблюдением)
-
достичь целевой дозы или максимально переносимой (даже маленькая доза иАПФ лучше, чем ничего)
-
контроль креатинина, калия, мочевины через 12 недель после начала лечения и через 12 недель после титрования последней дозы, далее каждые 4 месяца
Особые указания:
-Артериальная гипотония:
-
бессимптомная - не требует изменений
-
симптоматическая гипотония (головокружение/предобморочное состояние) чаще всего временно — пациентов следует успокоить.
-
пересмотреть необходимость приема нитратов, блокаторов кальциевых каналов и других вазодилататоров (уменьшить дозу/прекратить прием, если это возможно)
-
если нет признаков застоя снизить дозы диуретиков.
-Кашель (не всегда требует прекращения лечения):
-
чаще всего у пациентов с заболеваниями легких на фоне курения
-
исключить отек легких (как проявление декомпенсации ХСН)
-Повышение креатинина, калия и мочевины:
-
небольшое и бессимптомное, никаких действий не требуется: калий до 5,5 ммоль/л; креатинин до 50 % по сравнению с исходным уровнем или 266 ммоль/л (3 мг/дл)/СКФ <25 мл/мин/1,73 м2
-
при чрезмерном повышении рассмотреть возможность прекращения других нефротоксичных или калийсодержащих препаратов (например, НПВП, триамтерен, амилорид)
Если несмотря на коррекцию сопутствующих препаратов сохраняется повышение уровня креатинина или калия доза иРААС снижается вдвое; контроль креатинина, калия и мочевины через 12 недель.
Отмена препарата:
-
стойкая и симптоматическая артериальная гипотония
-
кашель, связанный с приемом иАПФ (т. е. если купируется после отмены иАПФ и рецидивирует при повторном применении) – замена на БРА.
-
увеличение уровня креатинина на >100% или до >221 ммоль/л (2,5 мг/дл)/СКФ <30 мл/мин/1,73 м2
-
гиперкалиемия>5,5 ммоль/л
Практические рекомендации по использованию блокаторов ангиотензиновых рецепторов 1 типа (БРА II1)
|
Препарат
|
Стартовая доза
|
Целевая доза
|
|
Валсартан
|
20-40 мг х 2 раза/с
|
160 мг х 2 раза/с
|
|
Лозартан
|
25-50 мг
|
50-150 мг
|
|
Кандесартан
|
4-8 мг
|
32 мг
|
Противопоказания:
-
выраженная дисфункция почек (креатинин >221 ммоль/л (>2,5 мг/дл) или рСКФ<30 мл/мин/1,73 м2)
-
гиперкалиемия (>5,5 ммоль/л)
-
двусторонний стеноз почечных артерий
-
беременность/лактация
С осторожностью:
-
гиперкалиемия (>5,0 ммоль/л)
-
дисфункция почек или рСКФ<35 мл/мин/1,73 м2)
-
артериальная гипотония (САД <90 мм рт. ст.)
Взаимодействие с другими ЛС:
-
калийсберегающие диуретики или препараты калия - гиперкалиемия
-
петлевые, тиазидные диуретики-гипокалиемия, нарушение функции почек
-
диуретики и вазодилататоры-гипотензия
-
соли лития - увеличение концентрации лития в сыворотке крови.
-
НПВС – ингибирование простагландинов приводит к задержке натрия и воды, повышению системного сосудистого сопротивления, вазоконстрикции, уменьшению СВ и притуплению реакции на диуретики.
-
цитостатики, аллопуринол или прокаинамид –гематологические нарушения, синдром Стивенса-Джонсона
Правила пользования:
-
проверить функцию почек и уровень электролитов
-
начинать с низкой дозы
-
удвоить дозу не менее чем через 2 недели (более быстрое повышение дозы может быть проведено у пациентов, находящихся в стационаре или под тщательным наблюдение)
-
достичь целевой дозы или максимально переносимой (даже маленькая доза БРА лучше, чем ничего)
-
контроль креатинина, калия, мочевины через 12 недель после начала лечения и через 12 недель после титрования последней дозы, далее каждые 4 месяца
Особые указания:
Артериальная гипотония:
-
бессимптомная - не требует изменений
-
симптоматическая гипотония (головокружение/предобморочное состояние) чаще всего временно — пациентов следует успокоить.
-
пересмотреть необходимость приема нитратов, блокаторов кальциевых каналов и других вазодилататоров (уменьшить дозу/прекратить прием, если это возможно)
-
если нет признаков застоя снизить дозы диуретиков.
Повышение креатинина, калия и мочевины:
-
небольшое и бессимптомное, никаких действий не требуется: калий до 5,5 ммоль/л; креатинин до 50 % по сравнению с исходным уровнем или 266 ммоль/л (3 мг/дл)/СКФ <25 мл/мин/1,73 м2
-
при чрезмерном повышении рассмотреть возможность прекращения других нефро токсичных или калийсодержащих препаратов (например, НПВП, триамтерен, амилорид)
Если несмотря на коррекцию сопутствующих препаратов сохраняется повышение уровня креатинина или калия доза иРААС снижается вдвое; контроль креатинина, калия и мочевины через 12 недель.
Отмена препарата:
-
стойкая и симптоматическая артериальная гипотония
-
увеличение креатинин >221 ммоль/л (>2,5 мг/дл) или рСКФ<30 мл/мин/1,73 м2
-
гиперкалиемия>5,5 ммоль/л
Практические рекомендации по использованию Сакубитрил/Валсартана (АРНИ)
|
Препарат
|
Стартовая доза
|
Целевая доза
|
|
Сакубитрил/Валсартан
|
49/51 мг х 2 раза в сутки 24/26 мг х 2 раза в сутки у отдельных пациентов с артериальной гипотонией
|
97/103 мг х 2 раза в сутки
|
*Временной промежуток между последним приемом иАПФ/БРА и первым применением АРНИ должен составлять не <36 часов во избежание повышения риска развития ангионевротического отека.
Противопоказания:
-
выраженная дисфункция почек (креатинин >221 ммоль/л (>2,5 мг/дл) или рСКФ<30 мл/мин/1,73 м2)
-
гиперкалиемия (>5,5 ммоль/л)
-
ангионевротический отек в анамнезе
-
двусторонний стеноз почечных артерий
-
беременность/лактация
-
симптомы гипотонии или САД <90 мм рт.ст.
С осторожностью:
-
гиперкалиемия (>5,0 ммоль/л)
-
дисфункция почек - рСКФ<35 мл/мин/1,73 м2)
-
артериальная гипотония (САД <90 мм рт. ст.)
Взаимодействие с другими ЛС:
-
калийсберегающие диуретики или препараты калия - гиперкалиемия
-
петлевые, тиазидные диуретики-гипокалиемия, нарушение функции почек
-
диуретики и вазодилататоры-гипотензия
-
соли лития - увеличение концентрации лития в сыворотке крови.
-
НПВС – ингибирование простагландинов приводит к задержке натрия и воды, повышению системного сосудистого сопротивления, вазоконстрикции, уменьшению сердечного выброса и притуплению реакции на диуретики.
-
цитостатики, аллопуринол или прокаинамид –гематологические нарушения, синдром Стивенса-Джонсона
Правила пользования:
-
проверить функцию почек и уровень электролитов
-
начинать с низкой дозы: у некоторых пациентов (с САД 100–110 мм рт.ст., ранее не принимавших иАПФ/БРА) можно рассмотреть возможность снижения начальной дозы (24/26 мг два раза в день)
-
удвоить дозу не менее чем через 2 недели (более быстрое повышение дозы может быть проведено у пациентов, находящихся в стационаре или под тщательным наблюдение)
-
достичь целевой дозы или максимально переносимой -NB! Даже маленькая доза АРНИ лучше, чем ничего)
-
контроль креатинина, калия, мочевины через 12 недель после начала лечения и через 12 недель после титрования последней дозы, далее каждые 4 месяца
-
временной промежуток между последним приемом иАПФ и первым применением AРНИ должен составлять не менее чем 36 часов во избежание повышения риска развития ангионевротического отека.
Особые указания:
Артериальная гипотония:
-
бессимптомная - не требует изменений
-
симптоматическая гипотония (головокружение/предобморочное состояние) чаще всего временно — пациентов следует успокоить.
-
пересмотреть необходимость приема нитратов, блокаторов кальциевых каналов и других вазодилататоров (уменьшить дозу/прекратить прием, если это возможно)
-
если нет признаков застоя снизить дозы диуретиков.
Кашель (не всегда требует прекращения лечения):
-
чаще всего у пациентов с заболеваниями легких на фоне курения
-
исключить отек легких (как проявление ДХСН)
Повышение креатинина, калия и мочевины:
-
небольшое и бессимптомное, никаких действий не требуется: калий до 5,5 ммоль/л и рСКФ>30 мл/мин/1,73 м2
-
при чрезмерном повышении рассмотреть возможность прекращения других нефро токсичных или калийсодержащих препаратов (например, НПВП, триамтерен, амилорид)
Если несмотря на коррекцию сопутствующих препаратов сохраняется повышение уровня креатинина или калия доза АРНИ снижается вдвое; контроль креатинина, калия и мочевины через 12 недель.
Отмена препарата:
-
стойкая и симптоматическая артериальная гипотония
-
неприятный кашель (например, не позволяющий пациенту спать), вызванный ингибированием неприлизина (т. е. если купируется после отмены ARNI и рецидивирует при повторном применении) – замена на БРА.
-
увеличение уровня креатинина на >100% или до >221 ммоль/л (2,5 мг/дл)/СКФ <30 мл/мин/1,73 м2
-
гиперкалиемия>5,5 ммоль/л
Прекращение приема АРНИ требуется очень редко, и в случае отмены лечения вполне вероятно клиническое ухудшение.
Практические рекомендации по использованию бета-адреноблокаторов
|
Препарат
|
Стартовая доза
|
Целевая доза
|
|
Карведилол
|
3,125 мг х 2 раза в/с
|
25 мг х 2 раза
50 мг два раза в день, если >85 кг
|
|
Бисопролол
|
1,25 мг
|
10 мг
|
|
Метопрололасукцинат (пролонигрованный)
|
12,5-25 мг
|
200 мг
|
|
Небиволол
|
1,25мг
|
10 мг
|
Противопоказания:
-
брадикардия <50 ударов в минуту
-
АV-блокада II или III степени (при отсутствии постоянного кардиостимулятора).
-
критическая ишемия конечностей
-
известная аллергическая реакция/другая нежелательная реакция (специфичная для препарата).
-
относительное противопоказание – бронхиальная астма (назначение ББ только под тщательным медицинским наблюдением, с учетом рисков за и против).
При ХОБЛ не является противопоказанием, однако предпочтительнее кардиоселективные ББ.
С осторожностью:
-
тяжелая СН (IV класс по NYHA).
-
текущее или недавнее (<4 недель) обострение СН (например, госпитализация с ухудшением СН)
-
нарушение AV проводимости или склонность к брадикардии
-
бронхо обструктивный синдром
-
при беременности только бисопролол, под тщательным медицинским наблюдением, с учетом рисков за и против (риск преждевременных родов, выкидыша).
Взаимодействие с другими ЛС:
-
дигоксин, амиодарон, ивабрадин – риск брадикардии и AV-блокады
-
антигипертензивные и сосудорасширяющие средства – потенцирование гипотензивного эффекта
-
инсулин и пероральных гипогликемические средства – потенцирование гипогликемического эффекта
-
препараты, снижающие содержание катехоламинов (резерпин, ингибиторы МАО) -увеличивают риск развития артериальной гипотензии и выраженной брадикардии.
-
общие анестетики усиливают отрицательный инотропный и гипотензивный эффекты ББ
Правила пользования:
-
начинать с низкой дозы при стабильной СН
-
удвоить дозу не менее чем через 2 недель (некоторым пациентам может потребоваться более медленное повышение дозы).
-
стремиться к целевой дозе или к максимально переносимой дозе (прием ББ лучше, чем их отсутствие).
-
контролировать ЧСС, АД и клинический статус (особенно признаки застоя и массу тела).
Особые указания:
-
начать прием ББ при уменьшении признаков застоя и достижении эуволемии.
-
усиление признаков застоя (одышки и массы тела (>1,5-2,0 кг/сут)): увеличить дозу диуретика или уменьшить вдвое дозу ББ (если увеличение дозы диуретика не помогает).
-
при брадикардии (<50 ударов в минуту) и выраженной утомляемости: рассмотреть необходимость применения других препаратов, замедляющих ЧСС (например, дигоксина, ивабрадина, амиодарона), уменьшить дозу ББ вдвое.
-
бессимптомная артериальная гипотония: не требует изменений в терапии.
-
симптоматическая артериальная гипотония (головокружение, спутанность сознания): пересмотреть необходимость приема других сосудорасширяющих препаратов, влияющих на АД (нитратов, блокаторов кальциевых каналов); если нет признаков/симптомов застоя - рассмотреть возможность снижения дозы диуретиков.
Если вышеперечисленные меры не решили проблему – прекратить прием ББ.
Прием ББ не следует прекращать внезапно, за исключением случаев крайней необходимости (риск симптома «рикошета»: усиление ишемии, инфаркт миокарда и аритмии).
Практические рекомендации по использованию АМКР
|
Препарат
|
Стартовая доза
|
Целевая доза
|
|
Эплеренон
|
25 мг
|
50 мг
|
|
Спиронолактон
|
25 мг
|
50 мг
|
|
Финеренон
|
10 мг
|
10-20 мг/с
|
Противопоказания:
-
выраженная дисфункция почек (креатинин до>221 ммоль/л (>2,5 мг/дл) или рСКФ<30 мл/мин/1,73)
-
гиперкалиемия (>6,0 ммоль/л)
-
беременность/лактация
С осторожностью:
-
гиперкалиемия (>5,0 ммоль/л)
-
дисфункция почек -рСКФ<35 мл/мин/1,73)
-
артериальная гипотония (САД < 90/60 мм рт. ст.)
Взаимодействие с другими ЛС:
-
калийсберегающие диуретики (амилорид, триамптерен) или препараты калия -гиперкалиемия
-
петлевые, тиазидные диуретики-гипокалиемия, нарушение функции почек
-
иАПФ/БРА/ARNI, диуретики, вазодилататоры-гипотензия
-
соли лития - увеличение концентрации лития в сыворотке крови
-
НПВС – уменьшение СВ и ухудшение состояния у пациентов с СН за счет ингибирования синтеза простагландинов и вазоконстрикции; острая почечная недостаточность за счет подавления клубочковой фильтрации
-
одновременное применение эплеренона с мощными ингибиторами CYP3A4, такими как кетоконазол, итраконазол, ритонавир, нелфинавир, кларитромицин, телитромицин и нефазодон, противопоказано.
Правила пользования:
-
проверить функцию почек и уровень электролитов
-
начинать с низкой дозы
-
удвоить дозу не менее чем через 4-8 недель (более быстрое повышение дозы может быть проведено у пациентов, находящихся в стационаре или под тщательным наблюдение)
-
достичь целевой дозы или максимально переносимой (NB! Даже маленькая доза БМКР лучше, чем ничего)
-
контроль креатинина, калия, мочевины через 1 и 4 недели после начала/увеличения дозы, а также через 8 и 12 недель, 6, 9 и 12 месяцев, далее каждые 4 месяца
Особые указания:
-Артериальная гипотония:
-
бессимптомная - не требует изменений
-
симптоматическая гипотония (головокружение/предобморочное состояние) чаще всего временно — пациентов следует успокоить.
-
пересмотреть необходимость приема нитратов, блокаторов кальциевых каналов и других вазодилататоров (уменьшить дозу/прекратить прием, если это возможно)
-
если нет признаков застоя снизить дозы диуретиков.
-Повышение креатинина, калия и мочевины:
-
при повышении калия > 5,5 ммоль/л или уровня креатинина до 221 ммоль/л (2,5 мг/дл)/СКФ <30 мл/мин/1,73 м2, уменьшить дозу вдвое и внимательно следить за биохимическими показателями крови (креатинин, мочевина, калий).
-
высокий нормальный уровень калия может быть желательным у пациентов с СН, особенно если они принимают дигоксин
-
избегать применения других калий-сберегающих и нефро токсичных препаратов
-Гинекомастия, гирсутизм, дисменорея, постменопаузальные маточные кровотечения
-
пациента/пациентку следует перевести на эплеренон.
Отмена препарата:
-
увеличение уровня креатинина на >100% или до >221ммоль/л (2,5 мг/дл), рСКФ<30 мл/мин/1,73 м2
-
гиперкалиемия>6,0 ммоль/л
-
стойкая и симптоматическая артериальная гипотония
Практические рекомендации по использованию ингибиторов SGLT2
|
Препарат
|
Стартовая доза
|
Целевая доза
|
|
Эмпаглифлозин
|
10 мг
|
10 мг
|
|
Дапаглифлозин*
|
10 мг
|
10 мг
|
Противопоказания:
-
выраженная дисфункция почек (креатинин >310 ммоль/л (3,5 мг/дл) или рСКФ<20 мл/мин/1,73 м2)
*В исследование DAPA-CKD (дапаглифлозин) были включены пациенты с рСКФ>25 мл/мин/1,73 м2.
-
симптоматическая артериальная гипотензия (САД <90 мм рт.ст.)
-
беременность/лактация Сахарный диабет 1 типа не является абсолютным противопоказанием, однако следует учитывать индивидуальный риск развития диабетического эугликемического кетоацидоза.
С осторожностью:
-
дисфункция почек (креатинин >221 ммоль/л (>2,5 мг/дл) или рСКФ<30 мл/мин/1,73 м2)
-
артериальная гипотония
-
глюкозурия (как следствие действия глифлозинов) может предрасполагать к грибковым мочеполовым инфекциям
-
риск развития диабетического эугликемического кетоацидоза повышается при:
-
острых процессах и обострении хронических заболеваний
-
заболеваниях поджелудочной железы или операциях на поджелудочной железе в анамнезе
-
снижении дозы инсулина
-
злоупотреблении алкоголем
-
голодании и низкоуглеводной диете
-
хирургическом вмешательстве
-
Взаимодействие с другими ЛС:
-
противодиабетические препараты, включая инсулин – риск гипогликемии
-
тиазиды и петлевые диуретики – риск избыточного диуреза, дегидратации, симптоматической гипотонии и преренальной почечной недостаточности
Правила пользования:
-
проверить функцию почек перед началом, с последующим постоянным контролем (вначале лечения рСКФ немного снижается)
-
регулярно контролировать уровень гликемии, особенно при наличии диабета. Возможно, рассмотреть оптимизацию назначения других диабетических препаратов.
-
определить факторы риска, предрасполагающие к кетоацидозу и, по возможности, устранить их.
-
регулярно контролировать баланс жидкости, особенно при одновременном применении диуретиков, у пожилых и/или у пациентов с истощением. Возможно, рассмотреть оптимизацию доз диуретических препаратов и приема жидкости
-
перед началом лечения следует исключить симптомы/признаки инфекций мочеполовой системы. При выявлении инфекций мочевыводящих путей – отложить назначение и SGLT2 до их купирования.
Особые указания:
-
при наличии симптомов диабетического кетоацидоза пациенты должны незамедлительно обследоваться для его исключения независимо от концентрации глюкозы крови. Прием эмпаглифлозина/ дапаглифлазина следует прекратить, обследовать пациента и незамедлительно назначить лечение.
-
у пациентов в возрасте 75 лет и старше имеется повышенный риск обезвоживания и чаще отмечаются нежелательные реакции, вызванные гиповолемией.
-
в случае развития повышенной потери жидкости из организма (например, при заболеваниях ЖКТ), следует проводить тщательный мониторинг состояния пациента, АД, а также контролировать гематокрит и электролитный баланс. Может потребоваться временное, вплоть до восстановления водного баланса, прекращение приема глифлозинов.
-
в случае развития осложненных инфекций мочевыводящих путей необходимо временное прекращение терапии глифлозинами.
-
согласно механизму действия, у пациентов, получающих глифлозины, определяется глюкоза в моче.
Отмена препарата:
-
стойкая и симптоматическая артериальная гипотония
-
увеличение уровня креатинина на >100% или до >310 ммоль/л (3,5 мг/дл)/СКФ <20 мл/мин/1,73 м2
-
аллергическая реакция
Практические рекомендации по использованию дополнительных групп препаратов
Диуретики
|
Препарат/выведение Na
|
Стартовая доза
|
Обычная доза
|
Максимальная допустима я суточная доза
|
Начало действия
|
Максимум действия
|
Продолжительность действия
|
|
Петлевые диуретики
|
||||||
|
Фуросемид 20-25%
|
20-40 мг
|
40-240 мг
|
400-600 мг при почечной дисфункци и 1000-1500 мг
|
в/в: 5-10 мин в таб: 30 мин п/к: 30 мин
|
в/в: 1-2ч в таб: 2-4 ч
|
в/в: 1-3 ч в таб: 6-8 ч
|
|
Торасемид 20-25%
|
в/в: 10-20 мг
в таб: 5-10 мг
|
10-20-
40 мг
|
в/в: 100 мг в таб: 200 мг
|
в/в: 5-10
минут в таб: 1 ч
|
в/в: 2 ч peros: 2-6 ч
|
в/в: 4-6 ч в таб: 12-16 ч
|
|
Буметанид 20-25%
|
0,5мг
|
0,5-1,5 мг
|
в/в:10 мг в таб: 2 мг
|
в/в: 3-5 мин в таб: 30-60
мин
|
в/в: 15-30 мин в таб: 1-2 ч
|
в/в: 3-4 ч в таб: 4-6 ч
|
|
Ингибитор карбоангидразы
|
||||||
|
Ацетозаломид
4%
|
250-375 мг в/в 500 мг длительностью 3-5 дней
|
250-
375 мг в/в 500 мг
|
500 мг
|
в/в: 15-60
мин в таб: 40-60
мин
|
1-3 ч
|
12-24 ч
|
|
Тиазидные/тиазидоподобные диуретики
|
||||||
|
Гидрохлортиази д 5%
|
25 мг
|
12,5-50 мг
|
200 мг
|
1,5-2 ч
|
4 ч
|
6-12 ч
|
|
Метолазон 5-8%
|
2,5 мг
|
2,5-10 мг
|
20 мг
|
|
|
12-24 ч
|
|
Хлорталидон 5-8%
|
12,5-25 мг
|
12,5-25 мг
|
100 мг
|
2-4 ч
|
12 ч
|
24-72 ч
|
|
Индапамид 5-8%
|
2,5 мг
|
2,5 мг
|
5 мг
|
3-6 ч
|
12 ч
|
24-36 ч
|
-
при наличии симптомов/признаков застоя, независимо от ФВЛЖ.
-
для поддержания эуволемии (при отсутствии симптомов/признаках застоя) в минимальной эффективной таблетированной форме у пациентов с СН.
-
преимущественно петлевые диуретики
-
при резистентности к петлевым диуретикам применяется комбинированная терапия: 1 линия – петлевые диуретики+тиазиды; 2 линия – петлевые диуретики+ацетозоламид/амилорид/АМКР в диуретических дозах
Противопоказания:
-
известная аллергическая реакция/другая нежелательная реакция (специфичная для препарата).
-
прогрессирование почечной дисфункции, анурия, нарастание азотемии, креатинина, рСКФ<5 мл/мин/1,73 м2 для петлевых диуретиков
-
прогрессирование почечной дисфункции, нарастание креатинина,рСКФ<30 мл/мин/1,73 м2 для тиазидных/тиазидо подобных диуретиков
-
метаболический ацидоз для ацетозоламида
С осторожностью:
-
значительная гипокалиемия (<3,5 ммоль/л) – может усугубиться приемом диуретиков
-
значительная дисфункция почек (креатинин >221 ммоль/л (>2,5 мг/дл) или рСКФ<30 мл/мин/1,73 м2) — может ухудшиться от приема диуретиков, или пациент может не реагировать на диуретики (особенно при использовании тиазидных диуретиков)
-
симптоматическая или тяжелая бессимптомная гипотония (САД <90 мм рт.ст.) – может усугубиться гиповолемией, вызванной диуретиками
-
у пациентов с циррозом печени – риск печеночной комы вследствие изменения баланса жидкости и электролитов
-
у беременных – риск нарушения маточно-плацентарного кровотока, гипоксии, электролитных нарушений и тромбоцитопении у плода (FDAC)
-
гиперчувствительность к препаратам сульфаниламидов и сульфонилмочевины – может возникнуть перекрестная чувствительность к фуросемиду
Взаимодействие с другими ЛС:
-
иРААС/ARNI и ББ - риск гипотонии,
-
диуретики других групп - риск гиповолемии, гипотонии, дисэлекролитемии и нарушения функции почек,
-
дигоксин – возрастает риск токсического действия наперстянки, связанного с гипокалиемией и гипомагниемией,
-
ГКС – повышается риск развития гипокалиемии и тромбоза,
-
антикоагулянты - их эффекты могут снижаться в результате уменьшения объема плазмы, приводящей к концентрации факторов свертывания в крови; кроме того, ослабление застойных явлений в печени, вызываемое диуретиками, может приводить к улучшению функции печени, в результате чего увеличивается синтез факторов свертывания, что потребует корректировки доз,
-
НПВП - ослабляет эффект диуретиков (за счет подавления синтеза простагландинов в почках и/или вследствие задержки натрия и жидкости),
-
аминогликозиды, цефалоспорины – повышается риск ототоксического эффекта,
-
левотироксин натрия – петлевые диуретики в высоких дозах могут ингибировать связывание гормонов щитовидной железы с белками-переносчиками, что вначале сопровождается повышением уровня свободных фракций гормонов с последующим снижением общей фракции.
Правила пользования:
-
проверить функцию почек и уровень электролитов,
-
ввести нагрузочную дозу болюсно в течение 1-2 минут, с последующим введением диуретиков в виде прерывистой (3-4 раза в сутки, через каждые 4-6-8 часов, что предпочтительнее однократной кратковременной инфузии, во избежание постдиуретической задержки натрия) или непрерывной инфузии (в течение 24 часов) до достижения эуволемии для поддержания противо застойного эффекта,
-
для поддержания эуволемии перевести на пероральный прием петлевого диуретика в минимально эффективной дозе на длительный период,
-
начинать с низкой дозы,
-
пациентам, находящимся на хронической терапии диуретиками, начальная доза петлевого диуретика может быть эквивалентна или превышать общую поддерживающую дозу, принимаемую больным ежедневно,
-
максимальная болюсная доза 80 мг, дозы выше этой следует вводить в виде инфузий (прерывистой/непрерывной),
-
достигнуть минимально эффективной дозы для достижения пациентом положительного диуреза с одновременным снижением массы тела на 0,75–1,0 кг/сут.,
-
корректировать дозу в соответствии с симптомами и/или признаками застоя, АД и функцией почек,
-
положительный ответ расценивается как выделение 100-150 мл мочи в час в течение первых 6 часов и содержание натрия в моче > 50–70 мэкв/л через 2 часа; при меньшем количестве - увеличить дозу диуретика на 50%; при более 200 мл/ч -уменьшить дозу диуретика на 50%,
-
при достижении максимальной дозы петлевого диуретика и отсутствии положительного диуреза рассмотреть вопрос о добавлении диуретика с другим механизмом действия (т.к. увеличение диуретика сверх предельной дозы не вызывает увеличения диуреза/натрийуреза),
-
контроль креатинина, мочевины, электролитов сыворотки крови через 12 недель после начала лечения и после любого увеличения дозы,
-
возможно обучить пациентов самостоятельно изменять дозу диуретиков в зависимости от симптомов/признаков застоя и изменений веса.
*Чрезмерный диурез более опасен, чем отеки
В/м введение только в исключительных случаях (при невозможности перорального приема и в/в введения). Не подходит при острых состояниях, как отек легких.
Особые указания:
-Бессимптомная артериальная гипотония:
-Бессимптомная артериальная гипотония:
-
при отсутствии симптомов или признаков застоя - уменьшить дозу диуретика
-Симптоматическая артериальная гипотония (головокружение, спутанность сознания):
-
при отсутствии симптомов или признаков застоя - уменьшить дозу диуретика
-
пересмотреть необходимость приема нитратов, блокаторов кальциевых каналов и других вазодилататоров.
-Гипокалиемия/гипомагниемия:
-
ü увеличить дозу иАПФ/БРА или АМКР,
-
ü добавить калий/магний-содержащие препараты
-Гипонатриемия (<135-138 ммоль/л):
-
Истощение жидкости
-
прекратить прием тиазидных диуретиков,
-
уменьшить дозу/отменить петлевые диуретики, если возможно.
-
-
Перегрузка жидкостью
-
ограничить прием жидкости
-
увеличить дозу петлевого диуретика
-
рассмотреть возможность применения антагониста аргинин-вазопрессина (например, толваптана, если он доступен)
-
инотропная поддержка
-
рассмотреть возможность ультрафильтрации
-
-Гиперурикемия/подагра
-
с целью профилактики добавить аллопуринол (не начинать во время обострения)
-
при обострении подагры добавить колхицин для облегчения симптомов
-
избегать приема НПВП
-Гиповолемия/обезвоживание (тахикардия, гипотония, низкое давление в яремных венах, жажда, сухость слизистых оболочек, сонливость, олигурия, снижение тургора кожи, судороги, миалгии)
-
оценить состояние, снизить дозу диуретика
-
дозу может потребоваться уменьшить при потере жидкости (например, из-за диареи/рвоты, чрезмерного потоотделения).
-
отмена/коррекция дозы перед любой плановой операцией за 1 неделю
-Резистентность к диуретикам:
-
проверить соблюдение режима лечения и прием жидкости/соли
-
увеличить дозу пелевого диуретика
-
рассмотреть возможность перехода с фуросемида на торасемидили буметанид
-
добавить/увеличить дозу АМКР
-
комбинировать петлевые и/или тиазидные диуретики и/или ацетазоламид
-
принимать петлевые диуретики два (или более раз) в день или натощак
-
рассмотреть возможность изменения скорости внутривенного введения петлевого диуретика
-
рассмотреть возможность ультрафильтрации
-Почечная недостаточность (повышение уровня креатинина/мочевины):
-
проверить наличие гиповолемии/обезвоживания
-
исключить использование других нефротоксичных средств
-
при одновременном применении петлевого и тиазидного диуретиков, прекратить прием последнего
-
рассмотреть возможность снижения дозы иАПФ/БРА и/или АМКР
-
рассмотреть возможность гемофильтрации/диализа
-Ототоксичность
-
мониторинг слуха, особенно у пациентов получающих высокие дозы диуретиков (>120 мг фуросемида) либо при быстром в/в введении
-Эквивалентность доз (возможны индивидуальные особенности)
-
40 мг фуросемида в/в эквивалентен ≈ 20 мг торасемидаили 1мг буметанида,
-
20 мг фуросемида для в/в введения ≈ 40 мг фуросемида для перорального приема,
-
10 мг торасемида для в/в введения ≈ 10-20 мг торасемида для перорального приема,
-
40 мг фуросемида для перорального приема ≈ 10-20 мг торасемида для перорального приема.
Техника парентерального введения фуросемида
1)Болюсное (нагрузочная/ударная доза), в качестве оказания первой помощи при ОДСН/декомпенсация ХСН
1)Болюсное (нагрузочная/ударная доза), в качестве оказания первой помощи при ОДСН/декомпенсация ХСН
-
концентрация 10 мг/мл
-
разовая доза: начальная 20-40, максимальная 80 мг
-
разведение: в неразведенном/разведенном в физиологическом растворе виде. При отсутствии разведения между болюсным введением рекомендована промывка 5–10 мл физиологическим раствором в течение 1–5 минут
-
скорость: 1-5 минут (более медленная скорость может быть предпочтительна у пациентов с лабильным АД)
-
кратность: до 4 раз в сутки
-
ручным способом или через инфузионный насос (инфузомат)
2) Периодическая/прерывистая инфузия (для разовых доз >80 мг)
Необходимо болюсно ввести нагрузочную дозу диуретика перед началом инфузии с ранней оценкой диуретического эффекта.
-
концентрация 10 мг/мл
-
максимальная суточная доза 400 мг (в отдельных случаях в случае резистентности допускается постепенное повышение дозы до 1000-1500 мг/сут.)
-
максимальная разовая доза 160-200 мг
-
разведение: предпочтительнее в неразведенном виде либо в подходящем объеме изотонической жидкости (например, 250 мг фуросемида + 50 мл физиологического раствора), чтобы избежать риска чрезмерной гидратации. При отсутствии разведения между инфузиями рекомендована промывка 5–10 мл физиологического раствора с той же скоростью, что и инфузия
-
максимальная скорость: 4 мг/мин или 0,4 мл/мин (24 мл/ч) - при нормальной функции почек; 2,5 мг/мин или 0,25 мл/мин (15 мл/ч) – при повышении креатинина > 5 мг/дл (85,5 мкмоль/л)
-
кратность: каждые 4-6-8 часов (в зависимости от скорости введения, АД и по усмотрению лечащего врача)
-
ручным способом или через инфузионный насос (инфузомат)
3) Непрерывная инфузия (для разовых доз >80 мг)
Необходимо болюсно ввести нагрузочную дозу диуретика перед началом инфузии с ранней оценкой диуретического эффекта
-
концентрация 10 мг/мл
-
максимальная суточная доза 100 мг (в отдельных случаях в случае резистентности допускается постепенное повышение дозы до 1000-1500 мг/сут)
-
разведение: только в неразведенном/чистом виде
-
скорость устанавливается в зависимости от дозы диуретика (см. табл.1)
-
кратность: непрерывно в течение 24 часов
-
длительность: продолжить до достижения эуволемии либо перейти на прерывистое дозирование, с последующим переводом на пероральную терапию
-
через инфузионный насос (инфузомат)
Доза и скорость введения фуросемида при непрерывной (24 часовой) инфузии
|
Общая доза за 24 часа (мг)
|
Общий объем за 24 часа (мл)
|
Скорость введения (мл/ч)
|
Количество введенного вещества за 1 час (мг/ч)
|
|
100
|
10
|
0,4
|
4,2
|
|
120
|
12
|
0,5
|
5
|
|
200
|
20
|
0,8
|
8,3
|
|
240
|
24
|
1
|
10
|
|
300
|
30
|
1,25
|
12,5
|
|
600
|
60
|
2,5
|
25
|
|
1000
|
100
|
4,17
|
41,7
|
|
1500
|
150
|
6,25
|
62,5
|
Ивабрадин
|
Препарат
|
Стартовая доза
|
Целевая доза
|
|
Ивабрадин
|
5 мг х 2 раза в/с 2,5 мг х 2 раза в/с >75 лет
|
5 мг 3 раза в/с 7,5 мг 2 раза в/с
|
Показания: для пациентов с СНнФВФВЛЖ ≤35% и синусовым ритмом с ЧСС ≥70 ударов в минуту в покое, которые получают лечение, рекомендованное клиническими руководствами, включая ББ в максимально переносимой дозе, для снижения количества госпитализаций по поводу СН и смертности от сердечно-сосудистых заболеваний (IIаB).
Противопоказания:
-
нестабильные сердечно-сосудистые состояния (ОКС, инсульт/ТИА, тяжелая гипотония)
-
фибрилляция предсердий
-
тяжелая дисфункция печени или почек (нет данных о безопасности или фармакокинетике при клиренсе креатинина <15 мл/мин)
-
беременность/лактация
-
известная аллергическая реакция/другая нежелательная реакция (специфичная для препарата)
С осторожностью:
-
тяжелая СН (IV класс по NYHA)
-
текущее или недавнее (<4 недель) обострение СН (например, госпитализация по поводу ухудшения СН)
-
ЧСС в состоянии покоя <50 ударов в минуту во время лечения
-
умеренное нарушение функции печени
-
хронические заболевания сетчатки, в том числе пигментный ретинит.
Взаимодействие с другими ЛС:
-
ББ, дигоксин, амиодарон - риск брадикардии и удлинения интервала QT в результате брадикардии
-
противогрибковые азолы (кетоконазол, итраконазол), макролидные антибиотики (кларитромицин, эритромицин), ингибиторы ВИЧ-протеазы (нелфинавир, ритонавир, нефазодон (атипичный антидепрессант) -сильные ингибиторы изофермента CYP3A4
Правила пользования:
-
начать с низкой дозы
-
суточную дозу может быть увеличена/снижена/прекращена в зависимости от ЧСС в состоянии покоя
-
увеличить дозу не ранее чем через 2 недели (некоторым пациентам может потребоваться более медленное повышение титра)
-
стремиться к целевой или к максимально переносимой дозе в зависимости от ЧСС в состоянии покоя
-
если ЧСС в состоянии покоя составляет от 50 до 60 ударов в минуту, текущую дозу следует сохранить
-
контролировать ЧСС, АД и клинический статус
Особые указания:
-
уменьшить дозу/прекратить прием, если ЧСС в состоянии покоя постоянно снижается <60 ударов в минуту или если возникают симптомы брадикардии
-
рассмотреть необходимость применения других препаратов, замедляющих ЧСС, или препаратов, влияющих на метаболизм ивабрадина в печени
-
снять ЭКГ для исключения других нарушений ритма, помимо синусовой брадикардии
-
исключить вторичные причины брадиаритмий (например, гипотиреоз)
-
зрительные явления обычно преходящи и исчезают в течение первых нескольких месяцев лечения ивабрадином и не связаны с серьезной дисфункцией сетчатки
Отмена препарата:
-
развитие фибрилляции предсердий во время терапии
-
ЧСС <60 ударов в минуту в состоянии покоя
-
AV-блокады II-III степени
-
выраженный дискомфорт в глазах, фотопсии
-
непереносимость лактозы или галактозы (компоненты таблетки ивабрадина)
Верицигуат
|
Препарат
|
Стартовая доза
|
Целевая доза
|
|
Верицигуат
|
2,5 мг х 1 раз в/с
|
10 мг х 1 раз в/с
|
Противопоказания:
-
выраженная дисфункция почек (рСКФ<15 мл/мин/1,73 м2 и пациенты, находящиеся на гемодиализе) - исследования не проводились
-
выраженная дисфункция печени (класс C по Чайлд-Пью) - исследования не проводились
-
симптоматическая артериальная гипотония (САД <90 мм рт. ст.)
-
беременность/лактация
-
известная аллергическая реакция/другая нежелательная реакция (специфичная для препарата)
Пациенты с терминальной СН, получающие инотропную терапию, с наличием имплантируемого желудочкового вспомогательного устройства и с острым миокардитом из исследования были исключены, потому нет данных об эффективности и безопасности применения верицигуата у данной категории больных.
С осторожностью:
-
бессимптомная артериальная гипотония (САД <90-100 мм рт. ст.)
-
возраст >75 лет
-
анемия тяжелой степени
Взаимодействие с другими ЛС:
-
ü ингибиторы ФДЭ-5, нитраты длительного действия, донаторы NO – совместное использование противопоказано из-за недостаточности данных о безопасности и потенциальном риске развития устойчивой гипотонии
-
омепразол, гидроксид магния и алюминия - снижают абсорбцию верицигуата
Правила пользования:
-
начать с низкой дозы
-
увеличить дозу не ранее чем через 2 недели
-
стремиться к целевой или к максимально переносимой дозе
-
контроль АД, ЧСС, гемоглобина
-
контрольNT-proBNP (для оценки эффективности терапии)
Особые указания:
-
при легкой или умеренной печеночной недостаточностью (класс А или В по Чайлд-Пью) коррекция дозы не рекомендуется
-
у пациентов с рСКФ ≥15 мл/мин/1,73 м2 коррекция дозы не рекомендуется
-
титрование дозы в зависимости от АД
-
при нормальных показателях АД, но наличие ортостатической гипотензии: оценить клинико-объективный статус, скорректировать/уменьшить диуретическую терапию и другие препараты, снижающие АД (не связанные с СН). При неэффективности – уменьшить дозу верицигуата
Алгоритм назначения/прекращения приема верицигуата в зависимости от клинико-объективных показателей (137)
Инструкция по возобновлению приема верицигуата после кратковременного перерыва

Инструкция по возобновлению приема верицигуата после кратковременного перерыва
|
Дозировка до перерыва
|
Продолжительность перерыва
|
Дозировка после перерыва
|
|
2,5 мг
|
Любой интервал времени
|
2,5 мг
|
|
5 мг
|
Любой интервал времени
|
2,5 мг
|
|
10 мг
|
>5 дней
|
2,5 мг
|
|
10 мг
|
≤5 дней
|
5 мг
|
Отмена препарата:
-
выраженная дисфункция почек (рСКФ<15 мл/мин/1,73 м2 и пациенты, находящиеся на гемодиализе)
-
выраженная дисфункция печени (класс C по Чайлд-Пью)
-
симптоматическая артериальная гипотония (САД <90 мм рт. ст.)
Амиодарон
Противопоказания:
Противопоказания:
-
AV-блокада II-III степени, СА-блокады, дву пучковые внутри желудочковые блокады (без кардиостимулятора)
-
симптоматическая брадикардия (без кардиостимулятора)
-
синдром слабости синусового узла (без кардиостимулятора)
-
синдром пред возбуждения желудочков (WPW-синдром) + ФП
-
врожденное/приобретенное удлинение интервала QT (>500 мсек)
-
беременность/лактация
-
известная аллергическая реакция/другая нежелательная реакция (специфичная для препарата)
С осторожностью:
-
повышенная чувствительность к йоду
-
нарушение электролитного состава (гипо/гиперкалиемия, гипо/гипермагниемия, гипокальциемия) – высокий риск развития желудочковой тахикардии типа "пируэт" (TdP)
-
артериальная гипотония (САД <100 мм рт. ст.)
-
пожилой возраст (высокий риск развития выраженной гипотонии и брадикардии)
-
декомпенсированная СН
-
AV-блокада I степени
-
печеночная недостаточность
-
дисфункция щитовидной железы (гипо/гипертиреоз)
-
интерстициальные заболевания легких
Взаимодействие с другими ЛС:
Препарат обладает высокой степенью взаимодействия с другими ЛС, т.к. является субстратом цитохрома P450 (CYP3A4, CYP2C8) и Р-гликопротеина, также ингибирует CYP1A1, CYP1A2, CYP3A4, CYP2C9, CYP2D6 и P-гликопротеина.
NB! в связи с продолжительным Т1/2 амиодарона взаимодействие с другими ЛС может наблюдаться даже через несколько месяцев после прекращения приема.
-
грейпфрут/грейпфрутовый сок, противовирусные (ингибиторы ВИЧ-протеазы, ледипасвир, софосбувир) - увеличение плазменной концентрации амиодарона и его эффекта за счет ингибирования CYP3A4
-
антиаритмические препараты (класса IA: хинидин, гидрохинидин, дизопирамид, прокаинамид), соталол; нейролептики, трициклические антидепрессанты, макролидные антибиотики, фторхинолоны, противомалярийные препараты – удлинение интервала QT, повышается риск возникновения TdP
-
ББ, блокаторы кальциевых каналов (верапамил, дилтиазем) и другие препараты с отрицательным хронотропным действием – брадикардия и нарушения проводимости
-
сердечные гликозиды – дигиталисная интоксикация, брадикардия
-
диуретики, слабительные – нарушение электролитного баланса (риск TdP)
-
дабигатран, варфарин – повышение риска развития кровотечения (увеличивается ПТВ, МНО)
-
статины (симвастатин, аторвастатин и ловастатин) - увеличение риска рабдомиолиза, миопатии
-
клопидогрел - снижение эффективности антиагреганта
-
рифампицин, препараты зверобоя - снижение плазменной концентрации амиодарона и его эффекта за счет индукции CYP3A4
Правила пользования:
-
контроль ЭКГ
-
контроль электролитов (нарушения должны быть скорректированы до начала терапии амиодароном)
-
при наличии имплантируемых устройств, проверить их исправность
-
перед началом терапии (за исключением случаев неотложной помощи) и на фоне перорального приема каждые 6 месяцев контроль:
-
печеночных трансаминаз
-
рентгенография ОГК (при наличии изменений на рентгене, необъяснимом кашле, одышке или подозрении на легочную токсичность необходимо провести функциональные тесты легких (в т.ч. DLCO) или КТ ОГК)
-
лабораторно-инструментальное исследование щитовидной железы (ТТГ и УЗИ, при необходимости Т4своб.)
-
при приеме варфарина: ПТИ, МНО
-
офтальмологическое обследование (консультация офтальмолога, исследование глазного дна)
-
-
начинать с минимально эффективных доз
-
инфузии предпочтительнее инъекций, за исключением случаев неотложной помощи (ФЖ/ЖТ без пульса)
-
при инфузиях центральный доступ безопаснее периферического
-
периферический доступ возможен не более чем в течение 24 часов и не дистальнее кубитальной ямки (доступ должен проверяться медицинским персоналом каждый час; попросить пациента незамедлительно сообщить о любой боли/дискомфорте в руке)
-
перед применением амиодарон необходимо развести, разбавлять только 5% глюкозой (несовместим с изотоническим раствором хлорида натрия).
-
не смешивать амиодарон с другими препаратами
-
при суточной дозе ≥ 1000 мг или при возникновении диспептического синдрома, рекомендуется назначение препарата в несколько приемов и совместно с употреблением пищи.
Использование периферического доступа опасно риском развития тромбофлебита. Чем больше доза и продолжительность инфузии, и меньше калибр сосуда, тем выше риск флебита.
Контроль гемодинамических показателей (ЧСС, АД), ЭКГ и физического обследования пациента на выявление возможных побочных эффектов, осуществляется в течение 1-ой недели терапии
Из-за длительного периода полувыведения побочные явления могут возникнуть/сохраняться в течение года после прекращения приема препарата, соответственно контроль вышеперечисленных обследований продолжаются в течение этого периода времени.
Особые указания:
ЭКГ-изменения:
ЭКГ-изменения:
-
при увеличении QT корригированного ≥ 450 мс или ≥ 25% от первоначальной величины – снизить дозу
Легочная токсичность:
-
при наличии подозрения на поражение легких – тщательно обследовать пациента, не спешить с отменой антиаритмика. Легочная токсичность – диагноз исключения.
Дисфункция щитовидной железы:
-
при развитии тахикардии, ФП/ТП на фоне приема амиодарона– проверить функцию щитовидной железы
-
если значение TТГ находится на верхней/нижней границе нормы – контроль ТТГ через 6 недель
-
при развитии гипотиреоза возможно продолжение приема амиодарона под прикрытием левотироксина натрия
-
повышение Т4 до 40% выше исходного уровня является нормальным действием амиодарона – лечение можно продолжать
-
при тиреотоксикозе антиаритмик следует приостановить
-
при субклиническом состоянии – контроль тиреоидных гормонов через 4 недели
Дисфункция органов зрения:
-
микроотложения на роговице не влияют на остроту зрения – лечение можно продолжать
-
снижение остроты зрения – консультация офтальмолога для исключения неврита и атрофии зрительного нерва
Фотосенсибилизация:
-
рекомендуется защита от солнечных лучей и, по возможности, снижение дозы
Дисфункция печени:
-
первоначально ожидается повышение активности печеночных ферментов -лечение можно продолжать
-
при повышении уровня более чем в два-три раза по сравнению с нормальным значением - амиодарон следует приостановить
Совместный прием с варфарином
-
контроль МНО через 1 неделю после отмены амиодарона – требуется коррекция дозы варфарина (см. взаимодействие с другими ЛС)
общая симптоматика (неврологическая, диспептический синдром, анорексия)
-
консультация узких специалистов
-
уменьшить дозу амиодарона
-
перед хирургическим вмешательством предупредить анестезиолога о приеме амиодарона (риск гемодинамической нестабильности, острого респираторного дистресс-синдрома; требуется тщательный контроль пациентов на ИВЛ)
Режим дозирования: при ХСН для перорального приема рекомендована максимальная доза амиодарона 400 мг/с. При неотложных ситуациях возможно назначение больших доз.
При злокачественной желудочковой аритмии
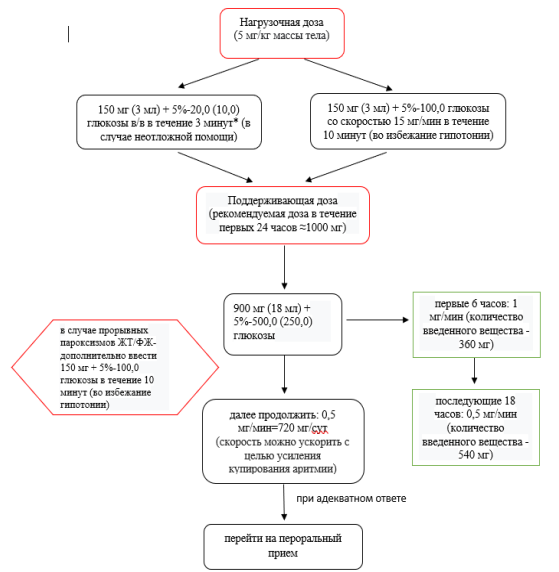
Максимальная общая суточная доза (нагрузочная+поддерживающая+дополнительные):
≥ 60 кг = 1200 мг
< 60 кг = 20 мг/кг
Оптимальная доза при переводе на пероральный прием зависит от уже введенной внутривенно дозы амиодарона.
Отмена препарата:
-
стойкая и симптоматическая брадикардия и нарушения проводимости
-
удлинение интервала QT: QT корригированный >500 мсек или на 50% от исходного (до лечения амиодароном), или на 60 мсек от исходного (до лечения амиодароном)
-
повышение печеночных трансаминаз в 3 раза от верхней границы нормы
-
неврит, невропатия зрительного нерва (на фоне терапии амиодароном) во избежание слепоты
-
тиреотоксикоз
Практические рекомендации по коррекции дефицита железа
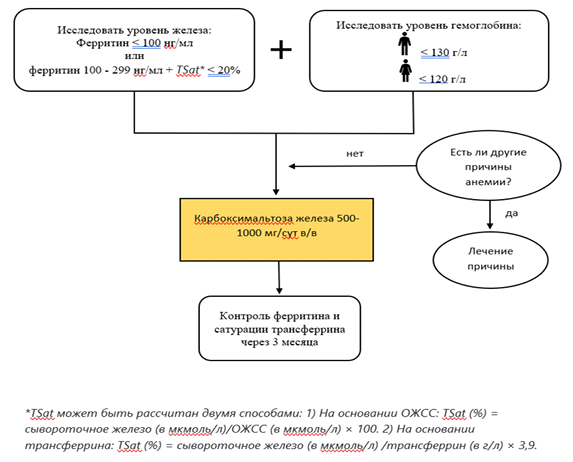
Инфузия начальной дозы 500 мг, с последующим увеличением до 1000 мг с интервалом 6 недель.
Поддерживающая доза 500 мг может быть назначена пациентам на 12, 24 и 36 неделе в зависимости от уровня ферритина в сыворотке и сатурации трансферрина.
Cравнение эффектов карбоксимальтозы и пероральных препаратов железа
|
Параметр
|
Карбоксимальтоза железа
|
Пероральный препарат железа
|
|
Уровень гемоглобина
|
+++
|
+
|
|
Улучшение класса NYHA
|
+
|
-
|
|
Улучшение HRQL*
|
+
|
-
|
|
Физическая работоспособность
|
+
|
-
|
|
Желудочно-кишечные побочные эффекты
|
+/-
|
+
|
*Health-RelatedQualityofLife – качество жизни, связанное со здоровьем
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.