Т-клеточные лимфомы у взрослых
 Версия: Клинические протоколы МЗ РК - 2022 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2022 (Казахстан)
Анапластическая крупноклеточная лимфома, ALK-отрицательная (С84.7), Анапластическая крупноклеточная лимфома, ALK-положительная (С84.6), Ангиоиммунобластная Т-клеточная лимфома (C86.5), Болезнь Сезари (C84.1), Грибовидный микоз (C84.0), Другие и неуточненные t-клеточные лимфомы (C84.5), Периферическая t-клеточная лимфома (C84.4), Почечно-селезеночная Т-клеточная лимфома (C86.1), Экстрадодальная NK/Т-клеточная лимфома, назальный тип (C86.0), Энтеропатическая (кишечная) Т-клеточная лимфома (C86.2)
Гематология, Онкогематология, Онкология
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «30» января 2023 года
Протокол №178
КЛИНИЧЕСКИЙ ПРОТОКОЛ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Т-КЛЕТОЧНЫЕ ЛИМФОМЫ
Нодальные периферические Т-клеточные лимфомы представляют собой гетерогенную группу лимфопролиферативных заболеваний, развивающихся из зрелых Т-клеток (посттимических) и составляющих около 10% неходжкинских лимфом [1]. Наиболее распространенным подтипом является ПТКЛ неуточненная (26%), далее следуют ангиоиммунобластная Т-клеточная лимфома (19%), анапластическая крупноклеточная лимфома, АЛК-положительная (7%), АККЛ, АЛК-отрицательная (6%), и Т-клеточная лимфома, ассоциированная с энтеропатией (<5%)[2].
Кожные Т-клеточные лимфомы представляют собой группу неходжкинских лимфом, которые в основном присутствуют в коже и иногда прогрессируют, поражая лимфатические узлы, кровь и внутренние органы [3].
Периферическая Т-клеточная лимфома, неспецифическая – представляет собой гетерогенную группу лимфом из зрелых Т-лимфоцитов, которые не соответствуют ни одной из клинико-морфологических категорий предусмотренных классификацией ВОЗ. Обычно развивается в пожилом возрасте, медиана возраста 60 лет. Чаще заболевают мужчины. Заболевание чаще манифестирует с увеличения лимфатических узлов любой локализации, вторично вовлекаются костный мозг (20-30%), селезенка, экстранодальные ткани (кожа, желудочно-кишечный тракт, реже легкие, центральная нервная система), часто заболевание протекает с наличием В-симптомов [4,5] ПТКЛн ассоциируется с плохой общей выживаемостью и безпрогрессивной выживаемостью по сравнению с В-клеточными лимфомами [6].
Ангиоиммунобластная Т-клеточная лимфома - образована клетками с фенотипом периферических Т-лимфоцитов. Развивается из фолликулярных Т-хелперов, которые в норме находятся в герминативных центрах. Обычно эта лимфома возникает в пожилом возрасте (60-70 лет). Несколько чаще у мужчин. Вирус Эпштейна-Барр считается вероятным этиологическим фактором и обнаруживается в В-клетках в 80-95% случаев [4]. Чаще проявляется генерализованной лимфаденопатией, а также поражением печени, селезенки и костного мозга. Среди лабораторных показателей обнаруживают поликлональную гипергаммаглобулинемию, Кумбс-положительную гемолитическую анемию, холодовые агглютинины, криоглобулины, антитела к гладкой мускулатуре и антинуклеарные антитела, а также ревматоидный фактор [4] Прогноз аналогичен ПТКЛн. В исследовании одного учреждения, в котором рассматривались данные 199 пациентов с ПТКЛ, 5-летняя ОВ и БПВ составили 36% и 13%, соответственно, для подгруппы пациентов с АИБЛ [7].
Анапластическая крупноклеточная лимфома - представляет собой две различные нозологические формы – АККЛ, ALK+ и АККЛ, ALK-, ключевое различие между которыми заключается в наличии или отсутствии экспрессии ALK протеина. Химерный белок ALK-NPM является продуктом транслокации между хромосомами 2 и 5. Локус р23 на хромосоме 2 кодирует киназу анапластической лимфомы, трансмембранный рецептор, близкий лейкоцитарным тирозиновым киназам, чья физиологическая экспрессия в постнатальном периоде ограничивается клетками центральной нервной системы. Локус q35 5-й хромосомы содержит ген нуклеофосмина, кодирующий кислый фосфопротеин, локализующийся в ядре и в зоне расположения ядрышковых организаторов. Так как белок ALK в норме выявляется только в нервной ткани, то обнаружение его при лимфоме свидетельствует об аберрантной экспрессии гена, обусловленной транслокацией t(2;5). Большинство пациентов с АККЛ имеют III или IV стадию заболевания (у 65% АЛК-положительных и 58% для АЛК отрицательных), часто ассоциированную с системными симптомами и экстранодальным поражением [8]. Общая 5-я выживаемость с АККЛ, АЛК+ составляет 70-80%, при АЛК негативной АККЛ прогноз хуже 5-ти летняя ОВ составляет 49%. Однако у пациентов с перестройкой DUSSP-22 прогноз благоприятный, 5-ти летняя ОВ составляет 90%, а у пациентов с перестройкой TP63 прогноз плохой и ОВ составляет 17% [4].
Экстранодальная NK/Т-клеточная лимфома назального типа – лимфома преимущественно экстранодальной локализации, ассоциированная с ВЭБ. Большинство этих лимфом имеет фенотип NK-клеток, остальные – фенотип цитотоксических Т-лимфоцитов. Чаще встречается у лиц азиатского происхождения. Наиболее высокая заболеваемость отмечена среди лиц среднего возраста (44-54года), опухоль может развиваться у детей и молодых взрослых. Мужчины болеют чаще. Наиболее значимый этиологический фактор ВЭБ, выявляемый практически во всех случаях. Чаще проявляется ввиде опухоли с инвазивным ростом в полости и придаточных пазухах носа, нёбе и носоглотке. Учитывая деструктивный характер опухоли и склонность к изъязвлению, ее называли ранее «летальной срединной гранулемой». Возможна диссеминация с поражением кожи, ЖКТ и шейных лимфатических узлов. Рецидив часто сопровождается диссеминацией. Редко встречается NK/Т-клеточная лимфома с локализацией вне срединных структур лицевого черепа (экстраназальная) чаще поражающая кожу, мягкие ткани, ЖКТ или яички[4].
Т-клеточная лимфома, ассоциированная с энтеропатией – первичная Т-клеточная лимфома кишечника, которая встречается у пациентов с целиакией. Эта лимфома намного чаще встречается в странах Запада (из-за высокой распространенности целиакии) и редко в Азии. Болеют преимущественно лица пожилого возраста (60-70 лет); отмечается небольшое преобладание мужчин. У одних пациентов целиакия предшествует Т-клеточной лимфоме, ассоциированной с энтеропатией, у других целиакию, в том числе без выраженных клинических проявлений, диагностируют одновременно с лимфомой. Заболевание обычно проявляется болью в животе, диареей, мальабсорбцией или рецидивом мальабсорбции у пациентов, ранее положительно ответивших на безглютеновую диету. Чаще развивается в тонкой (тощей и подвздошной), реже в толстой кишке и желудке. В 30% случаев лимфома распространяется в лимфатические узлы брюшной полости, реже в костный мозг и другие органы[4].
Мономорфная эпителиотропная Т-клеточная лимфома кишечника – первичная Т-клеточная лимфома, которая не связана с целиакией. Чаще встречается в Азии. Заболеваемость преобладает среди мужчин. Чаще поражается тонкая кишка, реже толстая кишка и желудок. В кишке лимфома распространяется диффузно. Возможна отдаленная диссеминация. Часто поражаются брыжеечные лимфоузлы. Медиана продолжительности жизни менее 1 года[4].
Грибовидный микоз – первичная эпидермотропная Т-клеточная лимфома, характеризующаяся пролиферацией малых и средних Т-лимфоцитов с церебриформными ядрами [9]. Грибовидный микоз является наиболее часто встречающейся формой кожной Т-клеточной лимфомы и составляет 1% всех неходжкинских лимфом, 50% первичных лимфом кожи и 65% кожных Т-клеточных лимфом. Более 75% случаев грибовидного микоза наблюдается у пациентов старше 50 лет, средний возраст дебюта заболевания составляет 55–60 лет. Грибовидный микоз может также поражать детей и подростков (1% случаев) [9].
Синдром Сезари – это Т-клеточная лимфома кожи, характеризующаяся эритродермией, генерализованной лимфоаденопатией и наличием в крови циркулирующих злокачественных Т-лимфоцитов (клеток Сезари)[9]. Синдром Сезари составляет менее чем 5% от всех первичных кожных лимфом. Болеют преимущественно люди пожилого возраста с преобладанием пациентов мужского пола, средний возраст начала заболевания составляет 60–65 лет[9].
ВВОДНАЯ ЧАСТЬ
Дата разработки/пересмотра протокола: 2016 год (пересмотр 2022 год).
Категория пациентов: взрослые, беременные.
Нодальные периферические Т-клеточные лимфомы представляют собой гетерогенную группу лимфопролиферативных заболеваний, развивающихся из зрелых Т-клеток (посттимических) и составляющих около 10% неходжкинских лимфом [1]. Наиболее распространенным подтипом является ПТКЛ неуточненная (26%), далее следуют ангиоиммунобластная Т-клеточная лимфома (19%), анапластическая крупноклеточная лимфома, АЛК-положительная (7%), АККЛ, АЛК-отрицательная (6%), и Т-клеточная лимфома, ассоциированная с энтеропатией (<5%)[2].
Кожные Т-клеточные лимфомы представляют собой группу неходжкинских лимфом, которые в основном присутствуют в коже и иногда прогрессируют, поражая лимфатические узлы, кровь и внутренние органы [3].
Периферическая Т-клеточная лимфома, неспецифическая – представляет собой гетерогенную группу лимфом из зрелых Т-лимфоцитов, которые не соответствуют ни одной из клинико-морфологических категорий предусмотренных классификацией ВОЗ. Обычно развивается в пожилом возрасте, медиана возраста 60 лет. Чаще заболевают мужчины. Заболевание чаще манифестирует с увеличения лимфатических узлов любой локализации, вторично вовлекаются костный мозг (20-30%), селезенка, экстранодальные ткани (кожа, желудочно-кишечный тракт, реже легкие, центральная нервная система), часто заболевание протекает с наличием В-симптомов [4,5] ПТКЛн ассоциируется с плохой общей выживаемостью и безпрогрессивной выживаемостью по сравнению с В-клеточными лимфомами [6].
Ангиоиммунобластная Т-клеточная лимфома - образована клетками с фенотипом периферических Т-лимфоцитов. Развивается из фолликулярных Т-хелперов, которые в норме находятся в герминативных центрах. Обычно эта лимфома возникает в пожилом возрасте (60-70 лет). Несколько чаще у мужчин. Вирус Эпштейна-Барр считается вероятным этиологическим фактором и обнаруживается в В-клетках в 80-95% случаев [4]. Чаще проявляется генерализованной лимфаденопатией, а также поражением печени, селезенки и костного мозга. Среди лабораторных показателей обнаруживают поликлональную гипергаммаглобулинемию, Кумбс-положительную гемолитическую анемию, холодовые агглютинины, криоглобулины, антитела к гладкой мускулатуре и антинуклеарные антитела, а также ревматоидный фактор [4] Прогноз аналогичен ПТКЛн. В исследовании одного учреждения, в котором рассматривались данные 199 пациентов с ПТКЛ, 5-летняя ОВ и БПВ составили 36% и 13%, соответственно, для подгруппы пациентов с АИБЛ [7].
Анапластическая крупноклеточная лимфома - представляет собой две различные нозологические формы – АККЛ, ALK+ и АККЛ, ALK-, ключевое различие между которыми заключается в наличии или отсутствии экспрессии ALK протеина. Химерный белок ALK-NPM является продуктом транслокации между хромосомами 2 и 5. Локус р23 на хромосоме 2 кодирует киназу анапластической лимфомы, трансмембранный рецептор, близкий лейкоцитарным тирозиновым киназам, чья физиологическая экспрессия в постнатальном периоде ограничивается клетками центральной нервной системы. Локус q35 5-й хромосомы содержит ген нуклеофосмина, кодирующий кислый фосфопротеин, локализующийся в ядре и в зоне расположения ядрышковых организаторов. Так как белок ALK в норме выявляется только в нервной ткани, то обнаружение его при лимфоме свидетельствует об аберрантной экспрессии гена, обусловленной транслокацией t(2;5). Большинство пациентов с АККЛ имеют III или IV стадию заболевания (у 65% АЛК-положительных и 58% для АЛК отрицательных), часто ассоциированную с системными симптомами и экстранодальным поражением [8]. Общая 5-я выживаемость с АККЛ, АЛК+ составляет 70-80%, при АЛК негативной АККЛ прогноз хуже 5-ти летняя ОВ составляет 49%. Однако у пациентов с перестройкой DUSSP-22 прогноз благоприятный, 5-ти летняя ОВ составляет 90%, а у пациентов с перестройкой TP63 прогноз плохой и ОВ составляет 17% [4].
Экстранодальная NK/Т-клеточная лимфома назального типа – лимфома преимущественно экстранодальной локализации, ассоциированная с ВЭБ. Большинство этих лимфом имеет фенотип NK-клеток, остальные – фенотип цитотоксических Т-лимфоцитов. Чаще встречается у лиц азиатского происхождения. Наиболее высокая заболеваемость отмечена среди лиц среднего возраста (44-54года), опухоль может развиваться у детей и молодых взрослых. Мужчины болеют чаще. Наиболее значимый этиологический фактор ВЭБ, выявляемый практически во всех случаях. Чаще проявляется ввиде опухоли с инвазивным ростом в полости и придаточных пазухах носа, нёбе и носоглотке. Учитывая деструктивный характер опухоли и склонность к изъязвлению, ее называли ранее «летальной срединной гранулемой». Возможна диссеминация с поражением кожи, ЖКТ и шейных лимфатических узлов. Рецидив часто сопровождается диссеминацией. Редко встречается NK/Т-клеточная лимфома с локализацией вне срединных структур лицевого черепа (экстраназальная) чаще поражающая кожу, мягкие ткани, ЖКТ или яички[4].
Т-клеточная лимфома, ассоциированная с энтеропатией – первичная Т-клеточная лимфома кишечника, которая встречается у пациентов с целиакией. Эта лимфома намного чаще встречается в странах Запада (из-за высокой распространенности целиакии) и редко в Азии. Болеют преимущественно лица пожилого возраста (60-70 лет); отмечается небольшое преобладание мужчин. У одних пациентов целиакия предшествует Т-клеточной лимфоме, ассоциированной с энтеропатией, у других целиакию, в том числе без выраженных клинических проявлений, диагностируют одновременно с лимфомой. Заболевание обычно проявляется болью в животе, диареей, мальабсорбцией или рецидивом мальабсорбции у пациентов, ранее положительно ответивших на безглютеновую диету. Чаще развивается в тонкой (тощей и подвздошной), реже в толстой кишке и желудке. В 30% случаев лимфома распространяется в лимфатические узлы брюшной полости, реже в костный мозг и другие органы[4].
Мономорфная эпителиотропная Т-клеточная лимфома кишечника – первичная Т-клеточная лимфома, которая не связана с целиакией. Чаще встречается в Азии. Заболеваемость преобладает среди мужчин. Чаще поражается тонкая кишка, реже толстая кишка и желудок. В кишке лимфома распространяется диффузно. Возможна отдаленная диссеминация. Часто поражаются брыжеечные лимфоузлы. Медиана продолжительности жизни менее 1 года[4].
Гепатолиенальная Т-клеточная лимфома – редкая агрессивная лимфома. На ее долю приходиться 1-2%, всех Т-клеточных лимфом. В большинстве случаев развивается из гамма-дельта цитотоксических Т-лимфоцитов. Чаще болеют молодые мужчины, медиана возраста начала заболевания 35 лет. Характерна гепатоспленомегалия без лимфоаденопатии. Практически всегда сопровождается поражением костного мозга[4].
Грибовидный микоз – первичная эпидермотропная Т-клеточная лимфома, характеризующаяся пролиферацией малых и средних Т-лимфоцитов с церебриформными ядрами [9]. Грибовидный микоз является наиболее часто встречающейся формой кожной Т-клеточной лимфомы и составляет 1% всех неходжкинских лимфом, 50% первичных лимфом кожи и 65% кожных Т-клеточных лимфом. Более 75% случаев грибовидного микоза наблюдается у пациентов старше 50 лет, средний возраст дебюта заболевания составляет 55–60 лет. Грибовидный микоз может также поражать детей и подростков (1% случаев) [9].
Синдром Сезари – это Т-клеточная лимфома кожи, характеризующаяся эритродермией, генерализованной лимфоаденопатией и наличием в крови циркулирующих злокачественных Т-лимфоцитов (клеток Сезари)[9]. Синдром Сезари составляет менее чем 5% от всех первичных кожных лимфом. Болеют преимущественно люди пожилого возраста с преобладанием пациентов мужского пола, средний возраст начала заболевания составляет 60–65 лет[9].
ВВОДНАЯ ЧАСТЬ
Дата разработки/пересмотра протокола: 2016 год (пересмотр 2022 год).
Пользователи протокола: врачи общей практики, терапевты, онкологи, гематологи, акушер-гинекологи.
Категория пациентов: взрослые, беременные.
Классификация
Классификация
В классификации ВОЗ Т/NK-клеточные лимфопролиферативные заболевания разделены на три основные подгруппы: протекающие с лейкемизацией, преимущественно экстранодальные или кожные, преимущественно нодальные[10].
Рисунок 1. Классификация NK/Т-клеточных лимфом
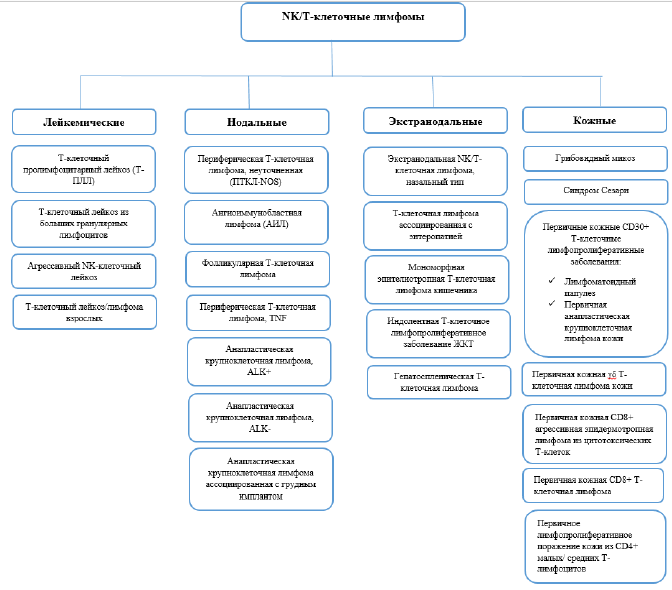
Совместно с определением варианта ПТКЛ, у каждого пациента нодальной ПТКЛ должна быть определена стадия заболевания согласно классификации Ann Arbor [11], а также группа риска согласно одной из прогностических моделей для ПТКЛ [12-15].
Система стадирования Ann-Arbor в модификации Cotswold [11]:

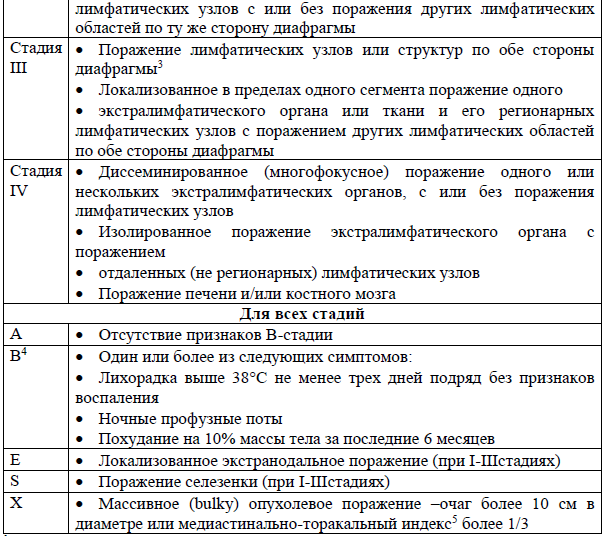
1 К лимфатическим структурам относят лимфатические узлы, селезенку, вилочковую железу, кольцо Вальдейера, червеобразный отросток, пейеровы бляшки.
2 При лимфоме Ходжкина для второй стадии необходимо дополнительно арабской цифрой указывать количество пораженных лимфатических зон (например, стадия II4).
3 Рекомендуется различать стадию III, с поражением верхних абдоминальных лимфатических узлов (ворота печени, селезенки, чревные л/у), и стадию III2, с поражением забрюшинных лимфоузлов.
4 Кожный зуд исключен из симптомов интоксикации.
5 Медиастинально-торакальный индекс – отношение ширины срединной тени в самом широком месте к диаметру грудной клетки в самом широком ее месте – на уровне Th5-6на стандартных прямых рентгенограмм.
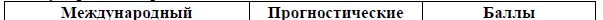
Стратификация группы Периферических Т-клеточных лимфом.
Международный прогностический индекс [12].
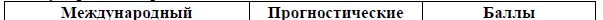
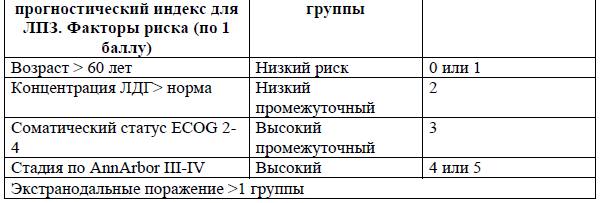
Прогностический индекс для ПТКЛ-неуточненной [13].
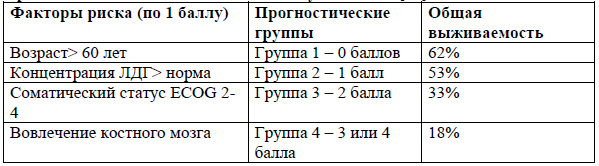
Модифицированный прогностический индекс для ПТКЛ-неуточненной [14].
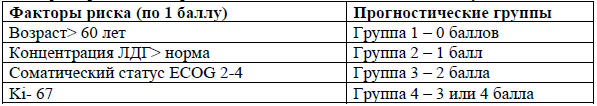
PINK - Прогностический индекс для NK/T-клеточной лимфомы [15].
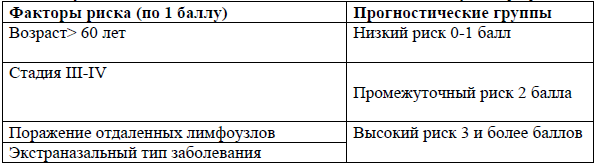
PINK-E - Прогностический индекс для NK/T-клеточной лимфомы [15].


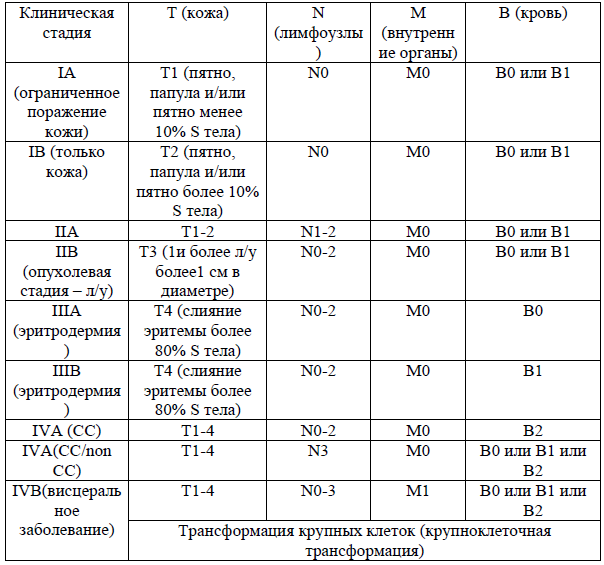
КЛИНИЧЕСКОЕ СТАДИРОВАНИЯ ГМ/СС [16]:
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ
Диагностические критерии:
Решающее значение для верификации диагноза лимфомы являются гистологическое и иммуногистохимическое исследования. Дополнительные методы необходимы для определения распространенности опухолевого процесса и стратификации пациентов по группам риска[9].
Диагноз должен быть установлен на основании исследования хирургически удаленного (резекция) лимфоузла или участка экстранодального поражения, при этом количество материала должно быть достаточным для фиксации в формалине и приготовления парафиновых блоков. Обязательно выполнение адекватного иммуногистохимического исследования. Панель ИГХ для Т-клеточных лимфом может включать: CD20, CD3, CD10, BCL6, Ki-67, CD5, CD30, CD2, CD4, CD8, CD7, CD56, CD21, CD23, EBER-ISH, TCRβ, TCRδ, PD1/CD279, ALK, TP63 с или без анализа маркеров клеточной поверхности методом проточной цитометрии kappa/lambda, CD45, CD3, CD5, CD19, CD10, CD20, CD30, CD4, CD8, CD7, CD2; TCRαβ, TCRγδ [17].
Дополнительное иммуногистохимическое исследование для характеристики подмножеств ПТКЛ, включая маркеры происхождения T-фолликулярных хелперов: CXCL13, ICOS, и цитотоксические Т-клеточные маркеры (TIA-1, granzyme-B, perforin)[17].
Жалобы, анамнез, данные физического исследования играют важную роль в диагностике и дифференциальной диагностике лимфопролиферативных заболеваний, но неспецифичны в связи с чем не относятся к диагностическим критериям[9].
Диагноз устанавливается на основе морфологического и иммуногистохимического исследования биопсийного материала и формулируется в соответствии с пересмотренной классификацией опухолей гемопоэтической и лимфоидной тканей ВОЗ[9].
Физикальное обследование:
В-симптомы: повышение температуры тела, преимущественно в вечернее и ночное время; снижение массы тела (снижение веса на 10% и более от исходного уровня);
количество и размер высыпаний (наличие пятен и бляшек указывает на возможную ассоциацию с ГМ); наиболее частая локализация высыпаний — верхние и нижние конечности. В 25 % случаев наблюдается спонтанная регрессия кожных поражений;
идентификация пальпируемых л/у и органомегалии представлена одним или несколькими узлами, имеющими тенденцию к изъязвлению;
увеличение лимфоузлов различной локализации;
увеличение размеров печени и селезенки.
Жалобы и анамнез:
увеличение лимфоузлов (чаще безболезненное);
кашель без выделения мокроты – возникает за счет сдавления дыхательных путей увеличенными лимфоузлами средостения;
отеки лица, шеи, рук – возникают за счет сдавления верхней полой вены; тяжесть в левом подреберье – за счет увеличения селезенки;
общая слабость, повышенная утомляемость;
пойкилодермия (пятнистая пигментация, телеангиоэктазии, атрофия кожи); феномен одновременного прогрессирования и регрессирования отдельных высыпаний;
множественность высыпаний, несколько зон вовлечения;
характерная локализация высыпаний на участках кожи, не подвергающихся солнечному облучению;
кожный зуд, часто сопровождающий высыпания;
деструкции в области срединных структур лица – полость носа, рта, ротоглотка, орбита (характерно для NK/T-клеточной лимфомы назального типа).
пойкилодермия (пятнистая пигментация, телеангиоэктазии, атрофия кожи); феномен одновременного прогрессирования и регрессирования отдельных высыпаний;
множественность высыпаний, несколько зон вовлечения;
характерная локализация высыпаний на участках кожи, не подвергающихся солнечному облучению;
кожный зуд, часто сопровождающий высыпания;
деструкции в области срединных структур лица – полость носа, рта, ротоглотка, орбита (характерно для NK/T-клеточной лимфомы назального типа).
Физикальное обследование:
В-симптомы: повышение температуры тела, преимущественно в вечернее и ночное время; снижение массы тела (снижение веса на 10% и более от исходного уровня);
количество и размер высыпаний (наличие пятен и бляшек указывает на возможную ассоциацию с ГМ); наиболее частая локализация высыпаний — верхние и нижние конечности. В 25 % случаев наблюдается спонтанная регрессия кожных поражений;
идентификация пальпируемых л/у и органомегалии представлена одним или несколькими узлами, имеющими тенденцию к изъязвлению;
увеличение лимфоузлов различной локализации;
увеличение размеров печени и селезенки.
Лабораторные исследования:
Общий анализ крови – подсчет лейкоформулы, тромбоцитов в мазке: ОАК может быть в пределах нормы, однако может быть умеренный лейкоцитоз. Часто отмечается ускорение СОЭ до значительных цифр. Анемия наблюдается редко и является независимым неблагоприятным прогностическим признаком;
Биохимический анализ крови – лактатдегидрогеназа, общий белок, альбумин, креатинин, мочевина, электролиты, мочевая кислота, для выявления синдрома лизиса опухоли, а также сопутствующего поражения органов
Гистологическое исследование биоптата лимфоузла или образования – с целью верификации морфологической формы ЛПЗ;
Иммуногистохимическое исследование биоптата лимфоузла или образования – с целью верификации морфологической формы ЛПЗ.
Гистологическое исследование гребня подвздошной кости - обязательным компонентом определения распространенности опухолевого процесса (стадии) является гистологическое исследование трепанобиоптата костного мозга. В процессе первичного обследования рекомендуется выполнять биопсию билатерально. В случае первичного поражения костного мозга, трепанобиопсия должна выполняться в рестадировании и при завершении терапии. Морфологическое исследование пунктата костного мозга не заменяет гистологическое исследование трепанобиоптата [9].
ИФТ периферической крови - является обязательным при Синдроме Сезари для определения циркулирующих лимфоцитов с иммунофенотипом характерным для синдрома Сезари;
Гистологическое исследование гребня подвздошной кости - обязательным компонентом определения распространенности опухолевого процесса (стадии) является гистологическое исследование трепанобиоптата костного мозга. В процессе первичного обследования рекомендуется выполнять биопсию билатерально. В случае первичного поражения костного мозга, трепанобиопсия должна выполняться в рестадировании и при завершении терапии. Морфологическое исследование пунктата костного мозга не заменяет гистологическое исследование трепанобиоптата [9].
ИФТ периферической крови - является обязательным при Синдроме Сезари для определения циркулирующих лимфоцитов с иммунофенотипом характерным для синдрома Сезари;
Инструментальные исследования:
ПЭТ/КТ – для более точного стадирования процесса в дебюте заболевания, а также адекватной оценки ответа на лечение, в том числе при подозрении на рецидив заболевания является необходимым проведение позитронно эмиссионной томографии, совмещенную с компьютерной томографией с туморотропными радиофармпрепаратами [17-20].
КТ с контрастированием (шеи, ОГК, ОБП, малого таза) – при невозможности проведения ПЭТ/КТ рекомендуется выполнить КТ шеи, грудной клетки, органов брюшной полости и малого таза с контрастированием для стадирования заболевания и уточнения наличия, размеров и распространенности опухолевых очагов [9].
УЗИ периферических и внутрибрюшных лимфоузлов – увеличение размеров и изменение структуры лимфоузлов;
МРТ-головного мозга – при подозрении на поражение головного мозга
Для планирования терапевтической тактики и определения необходимости ее модификации, а также для определения потребности в сопутствующей и сопроводительной терапии рекомендовано выполнить следующие диагностические исследования:
ОАК с лейкоформулой, подсчетом количества тромбоцитов;
Биохимический анализ крови (натрий, калий, кальций, глюкоза, мочевина, креатинин, мочевая кислота, общий белок, альбумин, общий билирубин, прямой, билирубин, ЛДГ, АСТ, АЛТ, СРБ, щелочная фосфатаза);
Определение группы крови по системам АВО;
Определение резус-фактора;
Общий анализ мочи;
Коагулограмма (АЧТВ, ПВ, МНО, ПТИ, фибриноген, АТ-3, Д-димер);
Определение СКФ;
Определение маркеров вирусного гепатита В и С методом ИФА или ИХЛ;
ВИЧ-инфекции (HIVAg/anti-HIV) методом ИФА;
ПЦР на вирусные гепатиты В и С (качественно);
ПЦР на вирусные гепатиты В, С (количественно);
Вирус Эбштейна-Барр, герпес 1-2 типа, цитомегаловирус, токсоплазмоз методом ПЦР;
Комплекс серологических реакций на сифилис;
ПЦР на СOVID-19;
Исследование спинномозговой жидкости: общий анализ ликвора+/- вирусологическое, бактериологическое исследование;
Определение ферритина, фолаты, сывороточное железо, Витамин В12;
ProBNP;
Прокальцитонин;
Для женщин фертильного возраста- тест на беременность, определение ХГЧ;
ЭКГ;
ЭхоКГ;
УЗИ ОБП+почек.
Рентгенография придаточных пазух носа;
Ортопантомограмма;
Компьютерная томография грудного сегмента;
ФГДС;
NB! Объем исследований определяется лечащим врачом
МРТ-головного мозга – при подозрении на поражение головного мозга
Для планирования терапевтической тактики и определения необходимости ее модификации, а также для определения потребности в сопутствующей и сопроводительной терапии рекомендовано выполнить следующие диагностические исследования:
ОАК с лейкоформулой, подсчетом количества тромбоцитов;
Биохимический анализ крови (натрий, калий, кальций, глюкоза, мочевина, креатинин, мочевая кислота, общий белок, альбумин, общий билирубин, прямой, билирубин, ЛДГ, АСТ, АЛТ, СРБ, щелочная фосфатаза);
Определение группы крови по системам АВО;
Определение резус-фактора;
Общий анализ мочи;
Коагулограмма (АЧТВ, ПВ, МНО, ПТИ, фибриноген, АТ-3, Д-димер);
Определение СКФ;
Определение маркеров вирусного гепатита В и С методом ИФА или ИХЛ;
ВИЧ-инфекции (HIVAg/anti-HIV) методом ИФА;
ПЦР на вирусные гепатиты В и С (качественно);
ПЦР на вирусные гепатиты В, С (количественно);
Вирус Эбштейна-Барр, герпес 1-2 типа, цитомегаловирус, токсоплазмоз методом ПЦР;
Комплекс серологических реакций на сифилис;
ПЦР на СOVID-19;
Исследование спинномозговой жидкости: общий анализ ликвора+/- вирусологическое, бактериологическое исследование;
Определение ферритина, фолаты, сывороточное железо, Витамин В12;
ProBNP;
Прокальцитонин;
Для женщин фертильного возраста- тест на беременность, определение ХГЧ;
ЭКГ;
ЭхоКГ;
УЗИ ОБП+почек.
Рентгенография придаточных пазух носа;
Ортопантомограмма;
Компьютерная томография грудного сегмента;
ФГДС;
Бронхоскопия;
Колоноскопия;
УЗДГ сосудов (вен и/или артерий);
Спирография;
УЗИ плевральной полости, периферических лимфоузлов, ОМТ, мочевого пузыря;
Холтеровское – мониторирование ЭКГ;
Колоноскопия;
УЗДГ сосудов (вен и/или артерий);
Спирография;
УЗИ плевральной полости, периферических лимфоузлов, ОМТ, мочевого пузыря;
Холтеровское – мониторирование ЭКГ;
NB! Объем исследований определяется лечащим врачом
Показания для консультации специалистов:
Консультация гинеколога – беременность, метроррагии, меноррагии, консультация при назначении комбинированных оральных контрацептивов; для диагностики и лечения заболеваний репродуктивной системы;
Консультация кардиолога – для коррекции/подбора базисной терапии при АГ, хронической сердечной недостаточности, нарушения ритма сердечной деятельности; для диагностики и лечения заболеваний ССС;
Консультация нефролога (эфферентолог) – для диагностики и лечения заболеваний почек;
Консультация оториноларинголога – для диагностики и лечения воспалительных заболеваний придаточных пазух носа и среднего уха;
Консультация офтальмолога – нарушения зрения, воспалительные заболевания глаз и придатков;
Консультация хирурга – для решение вопроса о биопсии лимфатического узла/ образования, при развитии хирургических осложнений на курсах химиотерапии, определение показаний для хирургических вмешательств;
Консультация торакального хирурга – для определения показаний к биопсии легкого/образования средостения;
Консультация реаниматолога – нарушение витальных функций;
Консультация фтизиатра – диагностика туберкулеза;
Консультация челюстно-лицевого хирурга - инфекционно-воспалительные заболевания зубо-челюстной системы.
NB! Консультации узких специалистов – по показаниям.
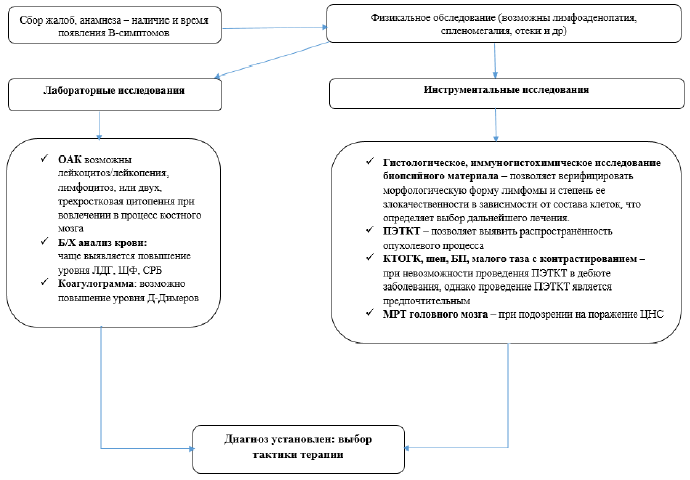
Диагностический алгоритм:
Диагностический алгоритм включает в себя выявление образования или увеличенных лимфоузлов с помощью методов лучевой диагностики, проведение биопсии и/или удаление выявленного образования с последующим гистологическим и иммуногистохимическим исследованиями. В зависимости от клинической ситуации перечень диагностических мероприятий может быть расширен.
Схема 1. Алгоритм диагностики лимфопролиферативных заболеваний:
Схема 1. Алгоритм диагностики лимфопролиферативных заболеваний:

Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований:
Таблица 1. Основные нодальные и экстранодальные зрелые Т-клеточные новообразования в соответствии с классификацией лимфом ВОЗ 2016г., с кратким описанием их основных характеристик (клеточное происхождение, иммунофенотип и генетические изменения) [4,5,21].
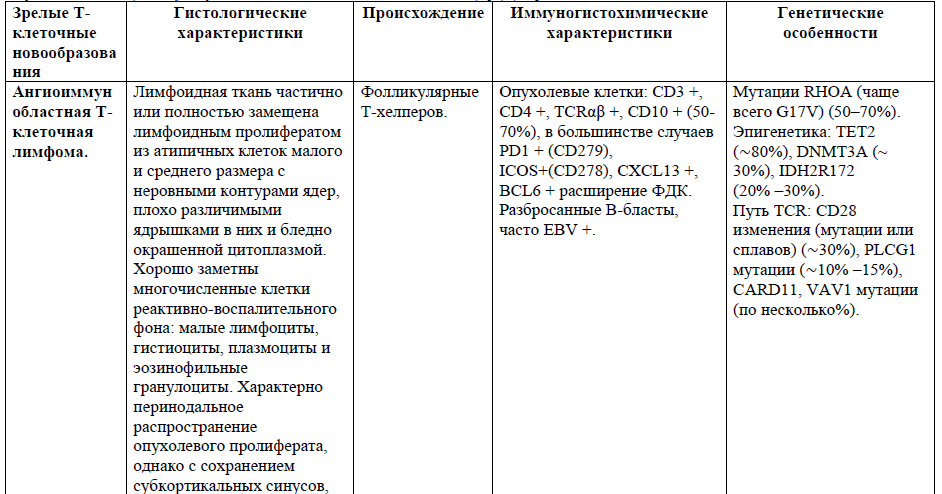

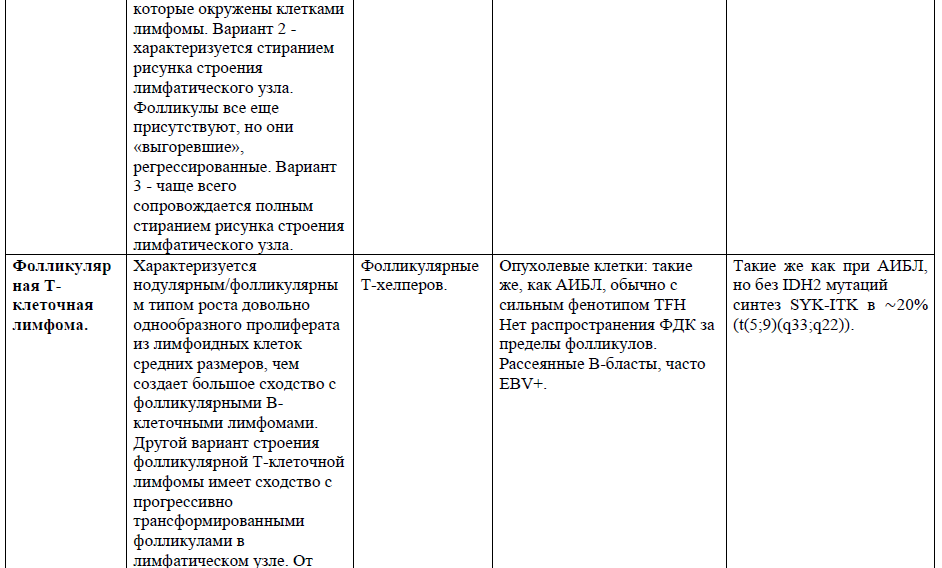
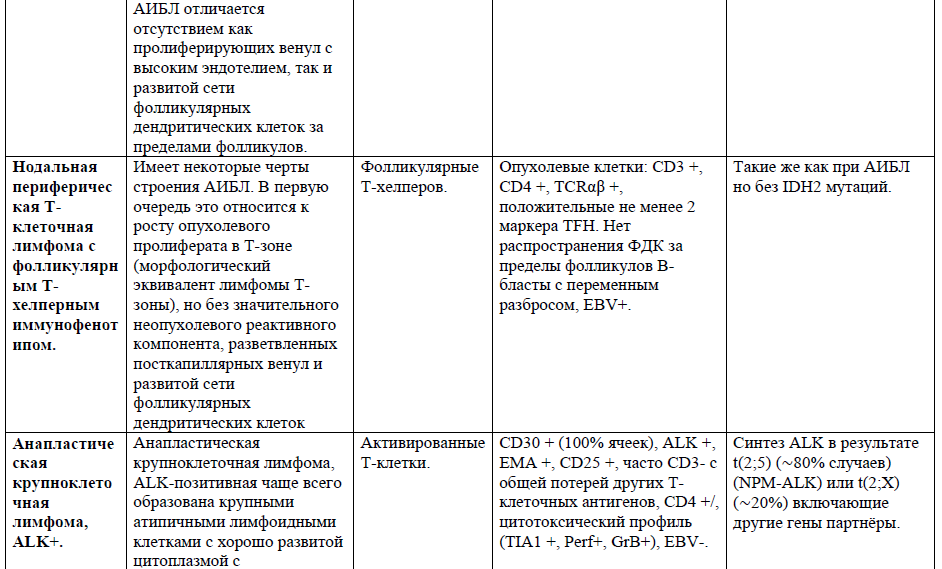

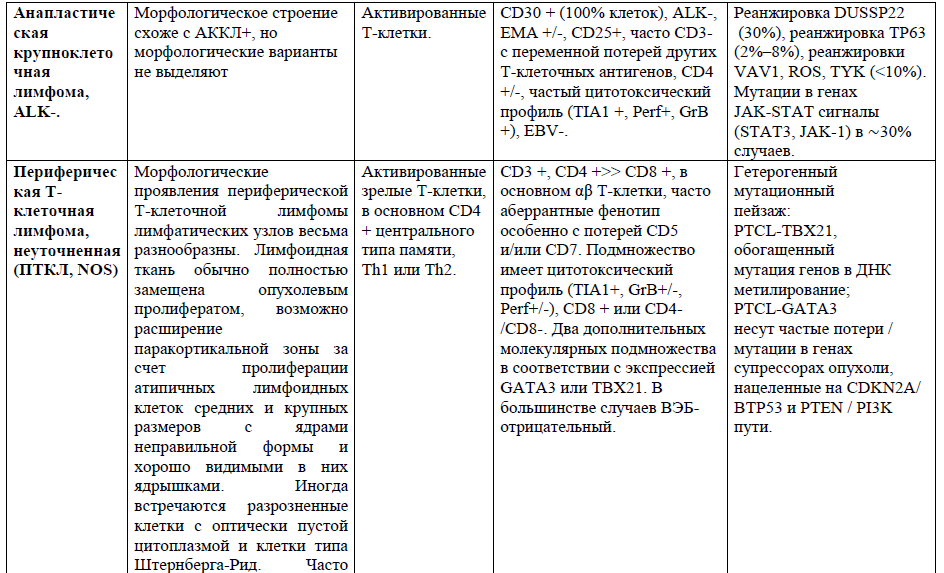

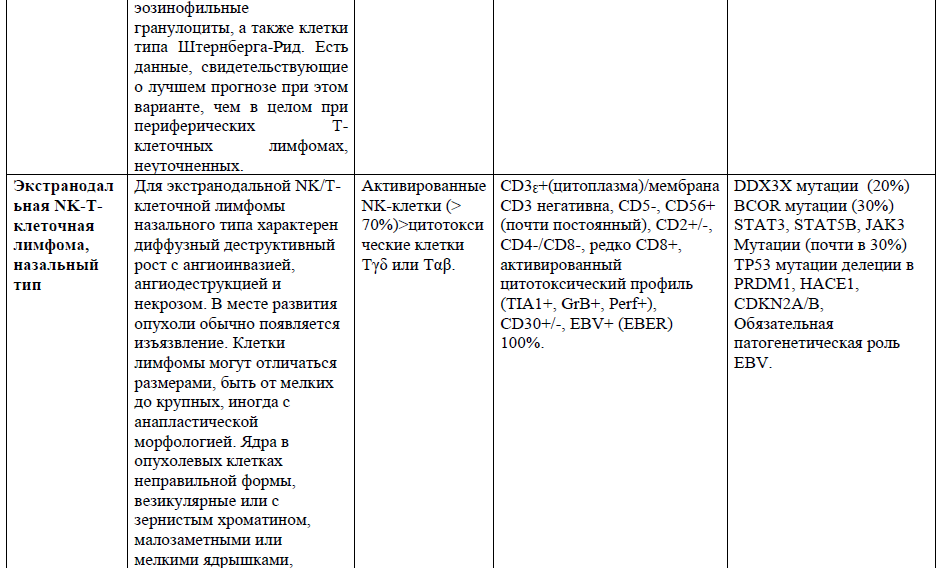
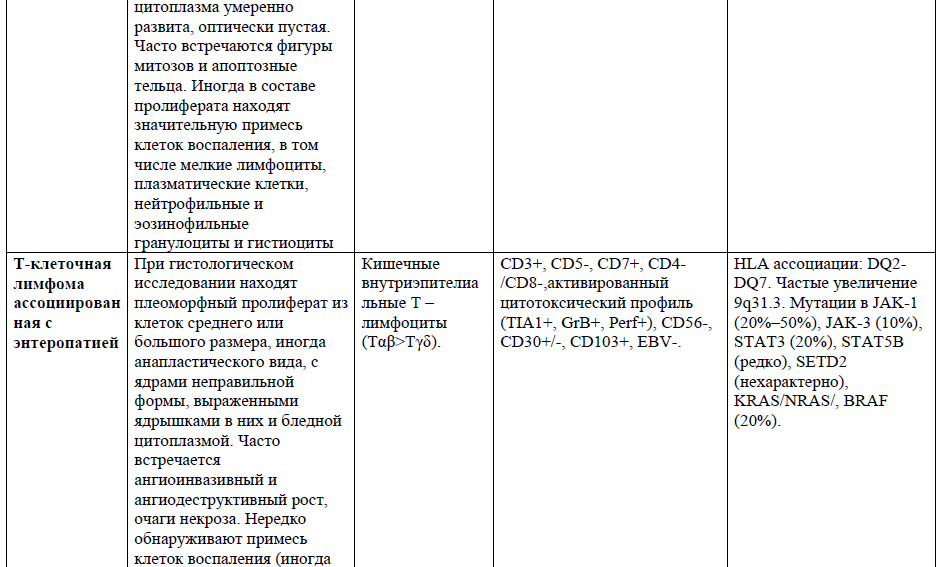
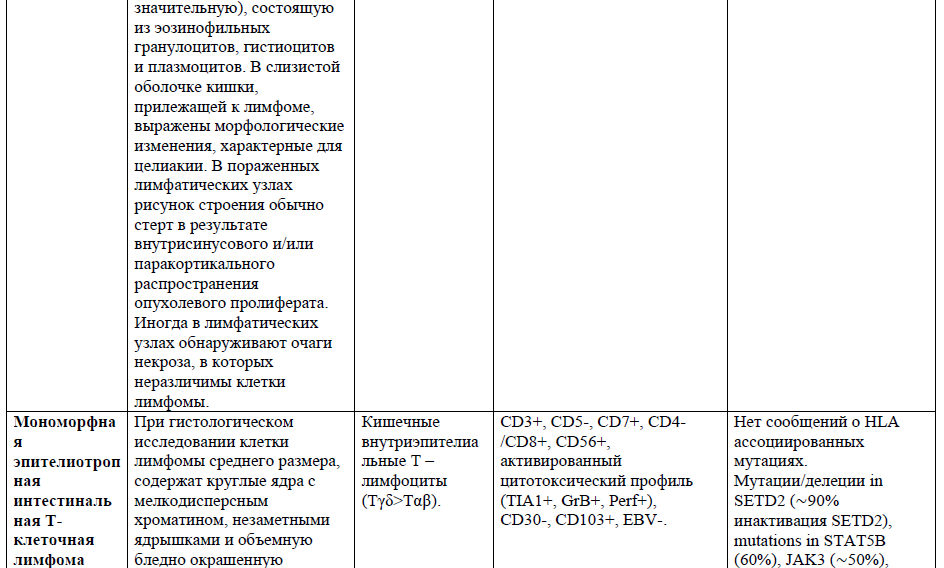
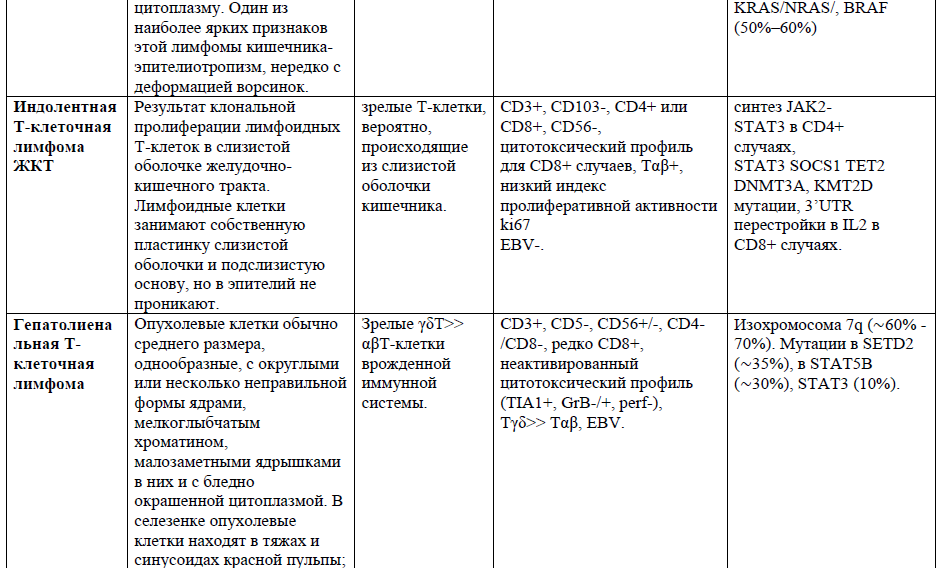

Таблица 2,3. Основные кожные Т-клеточные лимфомы (ГМ/СС) в соответствии с классификацией лимфом ВОЗ 2016г., с кратким описанием их основных характеристик [9].


1Для повышения достоверности гистологического исследования необходимо отменять лечение любыми наружными препаратами, особенно содержащими кортикостероиды, а также системными кортикостероидами и иммуносупрессантами за 2 недели до проведения биопсии. В неясных случаях рекомендуется проведение нескольких биопсий из разных очагов и повторных биопсий через 2-4 недели (без назначения наружной терапии).
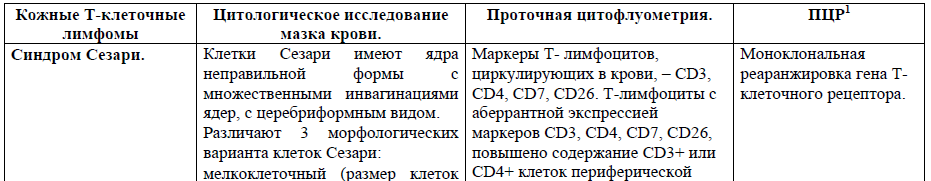
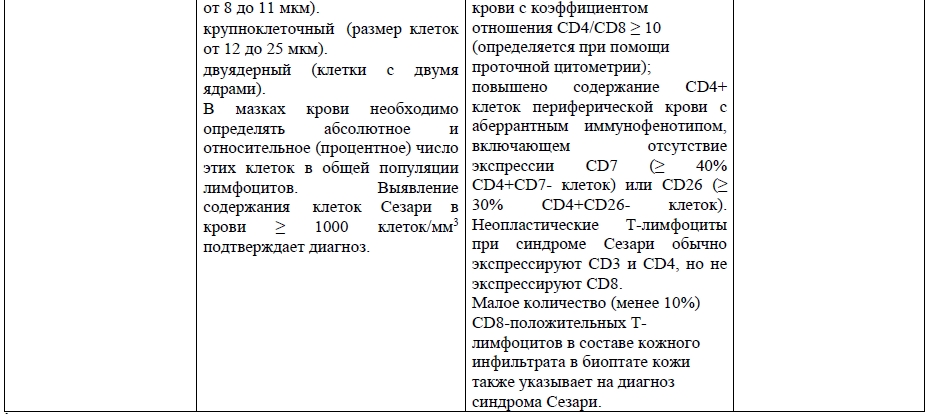
1Дополнительный метод исследования кожи и лимфоузлах (в случае их увеличения ≥ 1,5 см), у пациентов с хронической эритродермией неясной этиологии.
Международным обществом лимфом кожи (ISCL) и Европейской организацией по изучению и лечению рака (EORTC) выработаны следующие критерии диагностики СС[9]:
1. Отсутствие предшествующего ГМ.
2. Генерализованная эритродермия (диффузная эритема, покрывающая не менее 80% поверхности тела с/без шелушения).
3. Наличие в крови доминантного клона Т-лимфоцитов (определяется при помощи ПЦР или Southern blot).
4. Наличие одного или более следующих признаков:
Абсолютное количество клеток Сезари в крови ≥ 1000 клеток/мм3.
Повышено содержание CD3+ или CD4+ клеток периферической крови с коэффициентом отношения CD4/CD8 ≥ 10 (определяется при помощи проточной цитометрии).
Повышено содержание CD4+ клеток периферической крови с аберрантным иммунофенотипом, включающем отсутствие экспрессии CD7 (≥ 40% CD4+СD7-клеток) или CD26 (≥ 30% CD4+CD26- клеток).
Гистологическое, иммуногистохимическое и молекулярно-биологическое (определение реаранжировки гена Т-клеточного рецептора методом ПЦР) исследования кожи и лимфатических узлов (в случае их увеличения ≥ 1,5 см) являются дополнительными методами диагностики в неясных диагностических ситуациях у пациентов с хронической эритродермией неясной этиологии.
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ:
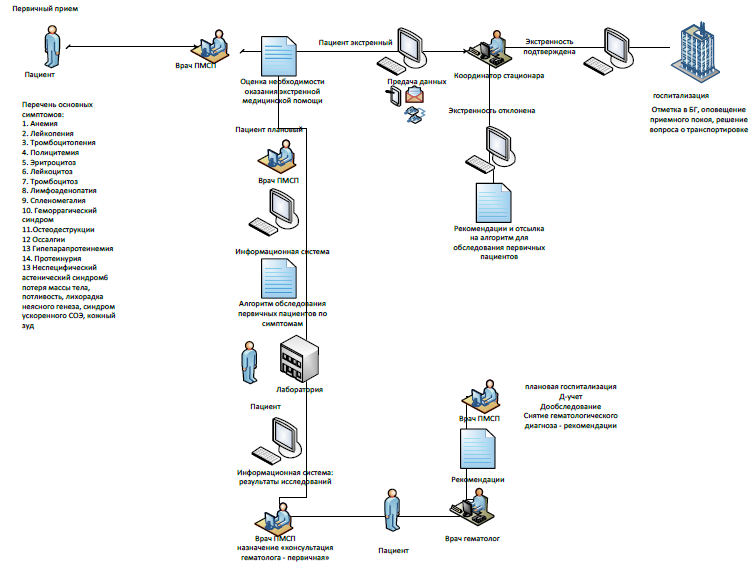
Тактика ведения на амбулаторном уровне сводиться к выявлению, своевремнному направлению к гематологу/онкологу пациентов с подозрением на ЛПЗ, а также пациентов находящихся на диспансерном учете с установленным диагнозом.
Обезболивающая и другая симптоматическая терапия по показаниям. Список дополнительных лекарственных средств в приложении 12.
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ:
Первая линия терапии ПТКЛ:
Пациентам до 60 лет без тяжелых сопутствующих заболеваний с ПТКЛн, АИБЛ, АККЛ, ALK+/-, ТЛАЭ, МЭТЛ, ФТКЛ в качестве инициальной терапии рекомендовано проведение курсов химиотерапии с добавлением этопозида CHOEP-21/14 или DA-EPOCH [22,23,24].
Ранее не получавшим лечение пациентам до 60 лет с АККЛ возможно рассмотреть проведение курсов с брентуксимаб-ведотином (BV-CHP) [25].
В ряде рандомизированных проспективных исследований, проведенных немецкой группы DSHNHL, показаны улучшение результатов лечения при включении этопозида к курсам CHOP. Данный режим (CHOEP) позволил достичь более высокой частоты полных ремиссий в сравнении со стандартной схемой CHOP: 88% и 79% соответственно, а также улучшил показатели выживаемости без прогрессии: 69% и 58% соответственно.
По результатам одноцентрового исследования 2 фазы, где изучалось использование DA-EPOCH (этопозид, преднизолон, винкристин, циклофосфамид и доксорубицин) после периода наблюдения в 24 месяца, показали положительные результаты с 2-х летним периодом безпрогрессивной и общая выживаемости 53% и 73% соответственно[23].
Единственным явно положительным исследованием было ECHELON-2, большое рандомизированное исследование в котором сравнивали эффективность классического CHOP (6 курсов) с CHP (т.е. без винкристина) в сочетании с брентуксимаб ведотином[26]. Результаты показали превосходную БПВ для комбинации Брентуксимаб-ведотин+CHP. [25]. Однако 75% пациентов в исследовании были с АККЛ, и польза от данного режима не была статистически значимой для других подтипов ПТКЛ (72 - ПТКЛн и 54- АИБЛ). Однако данная схема одобрена FDA (с 2018г) у впервые выявленных ранее нелеченных пациентов с СD 30+ положительными ПТКЛ согласно исследованию ESHELON-2.
Пациентам до 60 лет с ПТКЛн, АИБЛ, АККЛ, ALK-, ТЛАЭ, МЭТЛ, ФТКЛ, а также АККЛ, ALK+ группы высокого риска по IPI достигшим полного или частичного ответа после индукционной (инициальной) терапии, рекомендовано проведение сбора гемопоэтических стволовых клеток, с последующим проведением высокодозной химиотерапии с поддержкой аутологичных ГСК в качестве консолидации [26,27].
Ауто-ТГСК пациентам с рефрактерным заболеванием, не отвечающим на терапию спасения не показана.
Схема 2-4. Алгоритм инициальной терапии ПТКЛ пациентов до 60 лет.
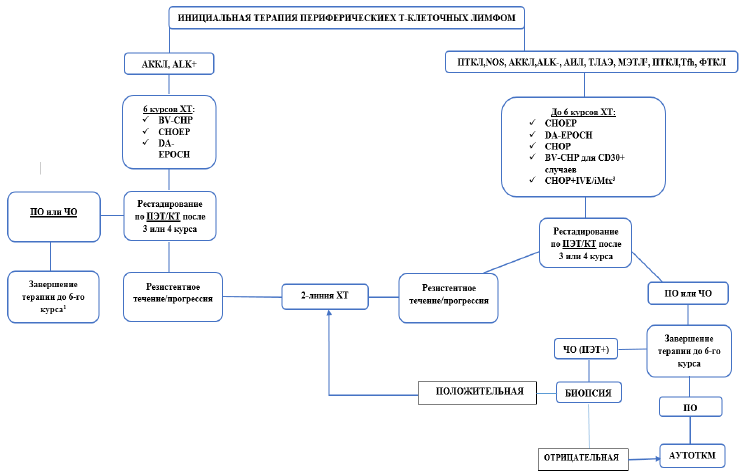

CHOEP [22].

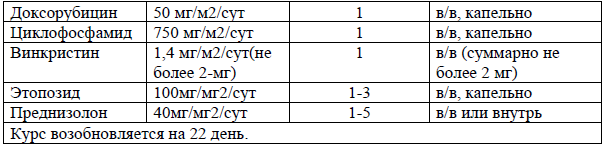
DA-EPOCH [23,24]
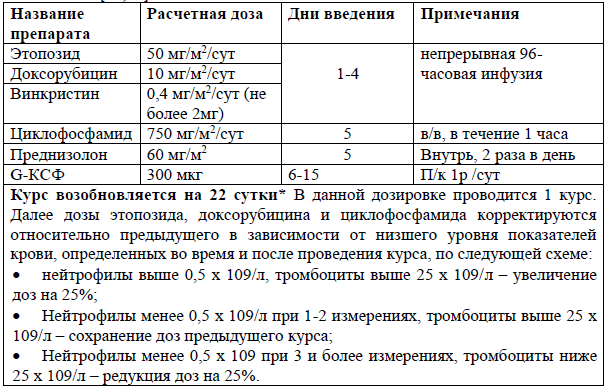
BV-CHP [25]
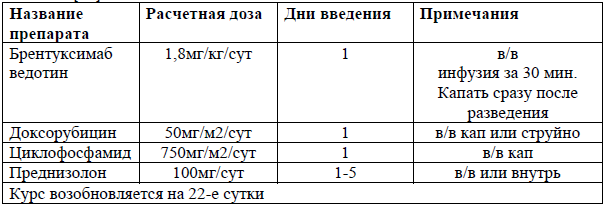
CHOP/IVE/iMtx [28]
DeVIC [30]
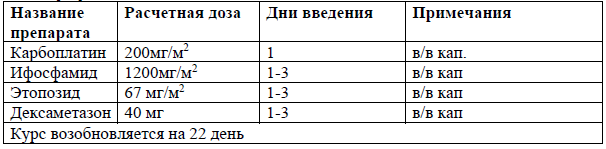
VIPD [31]
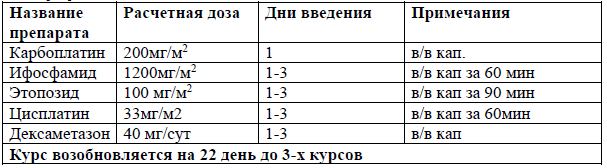
SMILE [33]
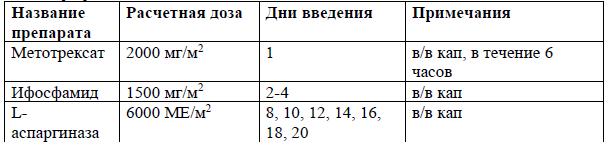

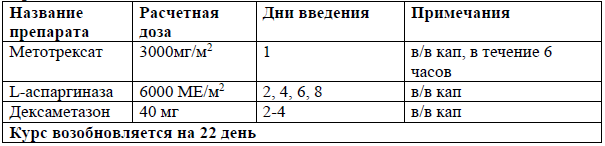
AspMetDex [33]
ICE [37,43]
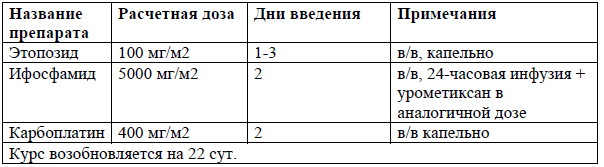
DHAP [40]
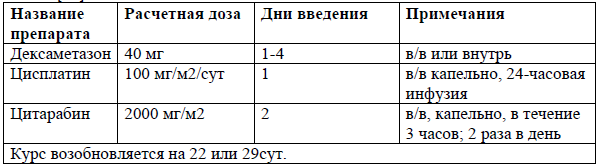
DHAX [41]
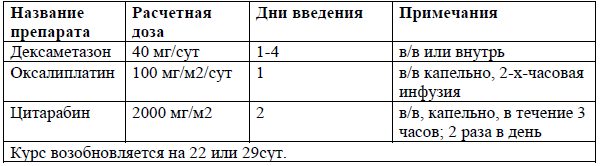
ESHAP [44]
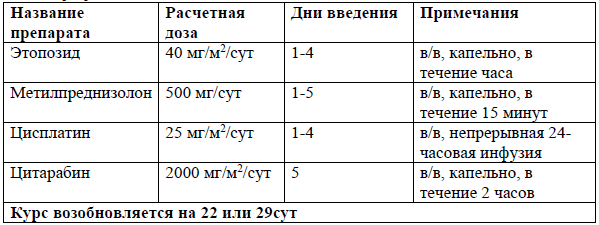
GDP[46]
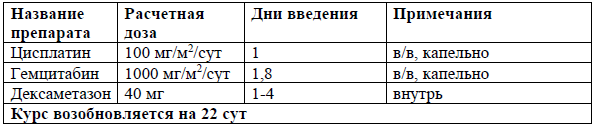
GemOх[48]
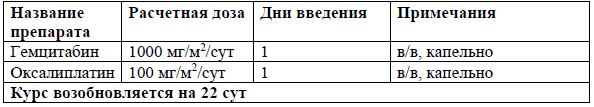
Монотерапия Брентуксимаб-ведотином [49, 65]
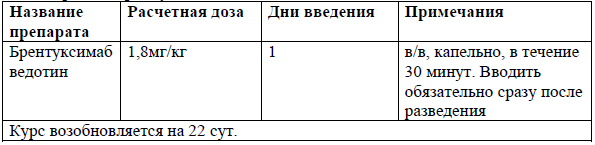
Монотерапия Пралатрексатом [52]


Монотерапия Белиностатом [53]

Монотерапия Бендамустин [54]
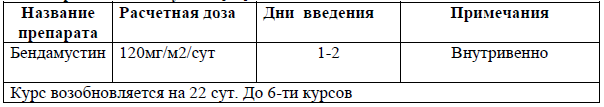
Монотерапия леналидомидом [55]

Монотерапия Пембролизумабом [56]
Монотерапия Ниволумабом [57]


Интерферон (IFN-α) [59]

Флударабин [9]

Гемцитабин [60]

Деоксикоформицин (пентостатин) [61]

Липосомальный доксорубицин пегилированный[62]

Ретиноиды (13-цис-ретиноевая кислота: изотретиноин, этретинат) [63]

Ромидепсин [64]

Концентрат тромбоцитов:
При Т-клеточной лимфоме ассоциированной с энтеропатией исход после стандартной химиотерапии CHOP обычно плохой. Недавние отчеты показывают, что для пациентов, которые способны перенести более агрессивные режимы химиотерапии, результаты могут быть значительно улучшены. Схема с ифосфамидом, винкристином, этопозидом и метотрексатом (IVE/MTX) с последующей АутоТКМ показала многообещающие результаты с 5-летней ОВ и БПВ 60% и 52% соответственно [28].
В исследовании регистров EBMT 4-летняя общая и безпрогрессивная выживаемость пациентов с ТЛАЭ после интенсивных схем индукции с последующим проведением АутоТКМ в первую ремиссию при полном или частичном ответе составили 59% и 54% соответственно [29].
Схема 2-4. Алгоритм инициальной терапии ПТКЛ пациентов до 60 лет.

1 Рекомендовано проведение консолидации с АутоТКМ в первой ремиссии у пациентов высокой группы риска по IPI.
2 МЭТЛ только недавно был выделен в отдельную нозологию, и оптимальное лечение еще не определено.
3 Рекомендовано для пациентов с ТЛАЭ.
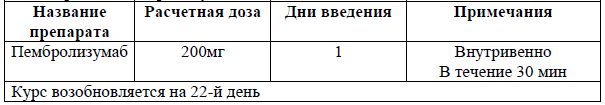
Пациентам с I-II стадиями экстранодальной NK/T-клеточной лимфомы, назального типа, в качестве первой линии терапии рекомендовано проведение одного из следующих вариантов лечения:
Пациентам с I-II стадиями экстранодальной NK/T-клеточной лимфомы, назального типа, в качестве первой линии терапии рекомендовано проведение одного из следующих вариантов лечения:
Одновременная химиолучевая терапия: ЛТ СОД 50 Гр и выполнение редуцированного (2/3) курса DeVIC с последующей консолидацией – 3 курса DeVIC [30];
Либо ЛТ СОД 40-44 Гр и еженедельное введение цисплатина (30 мг/м2), с последующей консолидацией – 3 курса VIPD [31];
Последовательная химиолучевая терапия: ХТ по схеме VIPD с последующей ЛТ 36-44 Гр (для пожилых пациентов) [32].
Пациентам с распространенными (III-IV) стадиями экстранодальной NK/T-клеточной лимфомы, назального типа и для всех стадий экстраназального типа экстранодальной NK/T-клеточной лимфомы рекомендовано проведение химиотерапии на основе L-аспарагиназы: AspMtxDex или SMILE, +/- ЛТ 45-50 Гр с целью индукции ремиссии [33].

Пациентам с локализованными (I-II) стадиями ПТКЛн, АИБЛ или АККЛ, ответившим на индукционную терапию (достигнута частичная ремиссия или более), не являющимися кандидатами для аутоТГСК, после завершения индукционной терапии, рекомендовано проведение лучевой терапии на зоны исходного поражения 30-36 Гр (в случае достижения ПО после ХТ) или 40-50 Гр (в случае достижения ЧО после ХТ) с целью консолидации достигнутого ответа [34].
Пациентам с I-II стадиями экстранодальной NK/T-клеточной лимфомы, назального типа, при наличии противопоказаний к ХТ рекомендовано проведение ЛТ СОД 50-55 Гр [35].
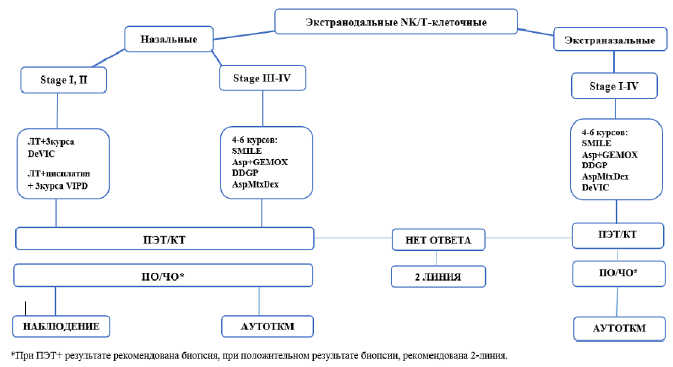
Гепатоспленическая (гепатолиенальная) Т-клеточная лимфома - имеет один из наихудших прогнозов среди периферических Т-клеточных лимфом с 5-летним показателем ОВ менее 10%. CHOP не является адекватной терапией для ГЛТЛ. [36]. Пациентам до 60лет с ГЛТЛ рекомендованы интенсивные схемы, такие как ICE, IVAC (ифосфамид, цитарабин, этопозид) или высокодозированные CHOEP/DA-EPOCH (этопозид, винкристин, доксорубицин, циклофосфамид и преднизолон) [37]. Цель терапии – достигнуть полный или частичный ответ перед ТКМ. Пациенты должны иметь очень низкую опухолевую нагрузку вовремя ТКМ. Полный курс химиотерапии может не потребоваться для достижения адекватного ответа, позволяющего провести ТКМ.
ПЭТ-сканирование при ГЛТЛ недостаточно для оценки ответа. Отрицательный ответ по ПЭТ должен быть подтвержден биопсией костного мозга и, в отдельных случаях, биопсией печени.
ГЛТЛ не является нодальным заболеванием, и критерии ответа Lugano к нему не применяются.
Предпочтительным является проведение аллогенной ТКМ после достижения ответа, однако при отсутствии донора рекомендовано проведение аутоТКМ. [38].

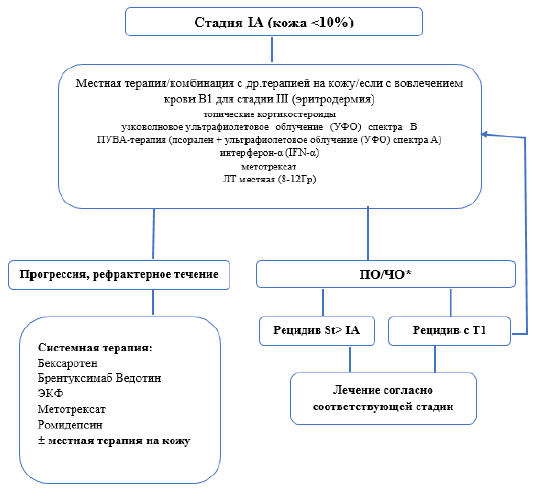
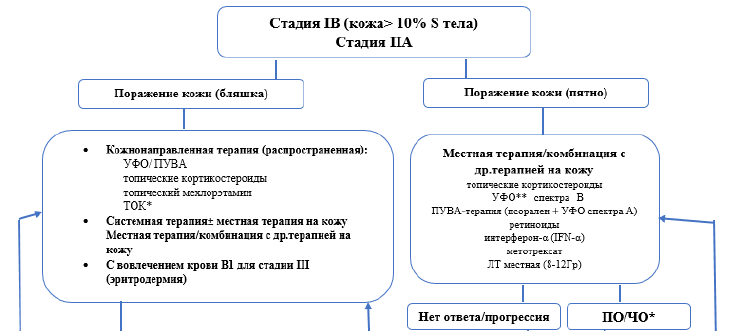
Терапия первой линии ранних стадий ГМ[ 9].
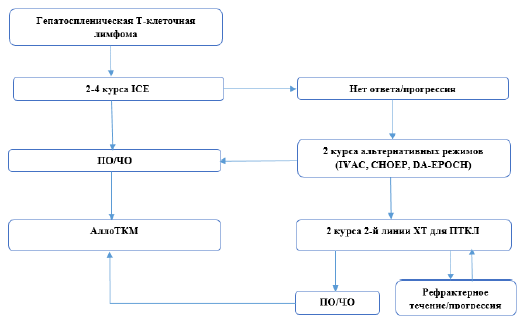
Для пациентов в IA стадии с небольшими очагами поражения кожи допускается тактика «наблюдай и жди» под строгим наблюдением врача.
У пациентов с IA, IB и IIA стадиями используются следующие виды наружной терапии(НТ):
Топические кортикостероиды (класс I, бетаметазона дипропионат 0,05% или мометазона фуорат 0,1%) наносятся на поверхность высыпаний 2 раза в день до полного разрешения.
Узковолновое ультрафиолетовое облучение (УФО) спектра В. Облучение проводится 2-3 раза в неделю, первая экспозиция должна быть не более 70% от ранее определенной минимальной эритемной дозы. Последующие экспозиции проводятся следующим образом: при отсутствии эритемы – время экспозиции увеличивается на 40%, при слабой эритеме – на 20%, при выраженной эритеме – остается тем же. Рекомендовано для пятен и тонких бляшек. Непосредственные побочные эффекты – эритема, зуд, ощущение жжения.
Схемы 5-7. Алгоритм инициальной терапии ГМ пациентов до 60 лет.
ПУВА-терапия (псорален + ультрафиолетовое облучение спектра А). За 2 часа до облучения пациент принимает перорально 8-метоксипсорален в дозе 0,6 мг/кг, начальная доза облучения зависит от типа кожи (0.25-1.0 Дж/см2), затем с каждым сеансом доза повышается на 0,25-0,5 Дж/см2 или более в зависимости от выраженности эритемы. Лечение проводится 3-4 раза в неделю до разрешения высыпаний (30-35 сеансов). Общая доза варьирует от 50 до 80 Дж/см2, что бывает достаточным для достижения клинической ремиссии. Применяется при распространенных и более инфильтрированных элементах, фолликулярной форме ГМ. Побочные эффекты включают эритему, тошноту, зуд, фотодерматит и фотокарциногенез.
Локальная лучевая терапия используется у пациентов с небольшим количеством высыпаний (10-20 Гр на курс).
Тотальное облучение кожи обычно проводится пациентам с распространенными высыпаниями и может назначаться как терапия первой или второй линии больным с Т2 и Т3 стадиями с отсутствием эффекта от топической терапии. ТОК проводится с использованием нескольких (чаще всего шести) электронных полей (переднее, заднее, правое и левое передние косые поля, правые и левые задние косые поля). Во время лечения экранируются глаза и ногти. РОД – 1-1,2-1,5 Гр, СОД – 30-40 Гр. Необходимо помнить о лучевых повреждениях – эритема кожи, частичная или полная алопеция, дистрофия ногтей, выраженная сухость кожи. У большинства больных эти проявления обратимы (<2 лет). ПУВА-терапия используется в качестве поддерживающего лечения после ТОК.
Схемы 5-7. Алгоритм инициальной терапии ГМ пациентов до 60 лет.

При отсутствии или недостаточном эффекте наружной терапии в качестве второй линии при ранних стадиях ГМ могут использоваться [9]:
Ретиноиды (13-цис-ретиноевая кислота (изотретиноин, этретинат) в дозе 0,5–1 мг/кг массы тела в течение 2–3 месяцев, могут назначаться в комбинации с ПУВА, IFN-α.
Интерферон-α (IFN-α) также может использоваться как препарат первой линии для IIB, III и СС и эффективен в умеренно высоких дозах: 3-10 МЕ ежедневно или 3 раза в неделю. Можно комбинировать с ПУВА, ретиноидами и химиотерапией.
Метотрексат назначают в дозах от 25 до 75 мг в неделю, можно комбинировать с IFN-α.
Брентуксимаб ведотин для лечения взрослых пациентов при отсутствии или недостаточном эффекте после минимум одной линии предшествующей системной терапии при наличии экспрессии CD30 + антигена. Режим дозирования: 1,8 мг/кг внутривенно каждый 21 день. Лечение проводят в течение 8 циклов, при достижении частичного ответа допускается проведение еще 8 циклов. При появлении побочных эффектов (наиболее часто – периферическая полинейропатия) допустимо снижение дозы до 1,2 мг/кг и увеличение интервала между циклами [39]
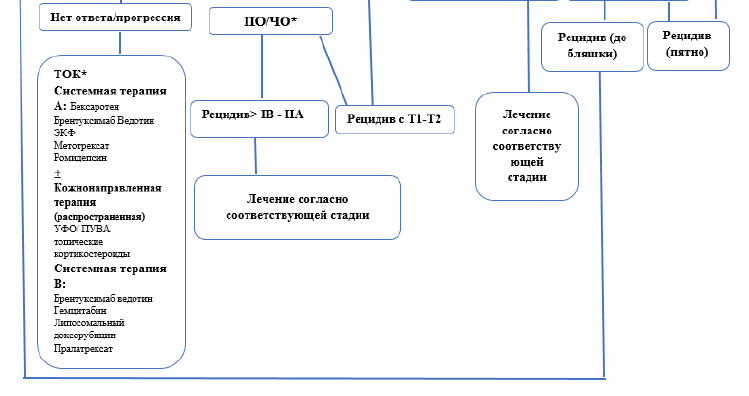


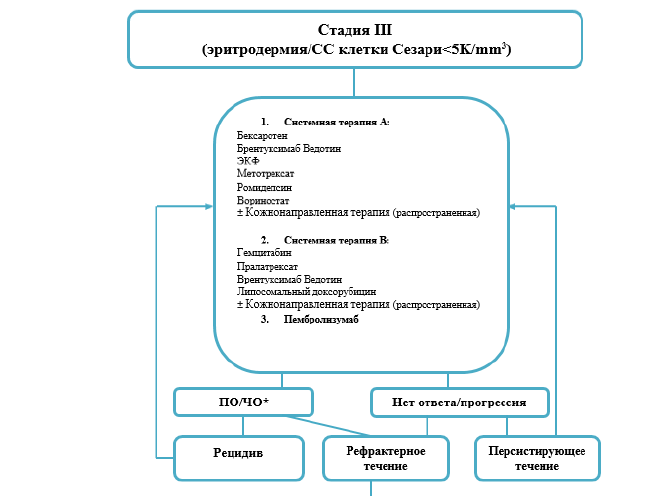
Терапия поздних стадий ГМ [9].
ингибиторы гистондеацетилаз (HDAC). Вориностат назначается перорально по 400 мг ежедневно. Назначается перорально по 400 мг ежедневно. Лечение проводят до достижения полного контроля (отсутствие признаков дальнейшего прогрессирования) или до появления признаков неприемлемой токсичности.
электронно-лучевая терапия является крайне эффективным методом лечения ГМ/СС и может применяться как при ранних, так и при поздних стадиях как терапия первой линии и при рецидивах/прогрессировании заболевания
в качестве системной химиотерапии может применяться монотерапия циклофосфамидом или гемцитабином или режимы, применяемые для лечения нодальных лимфом: CHOP, EPOCH, CMED/ABV, флударабин +IFN-α. (30)
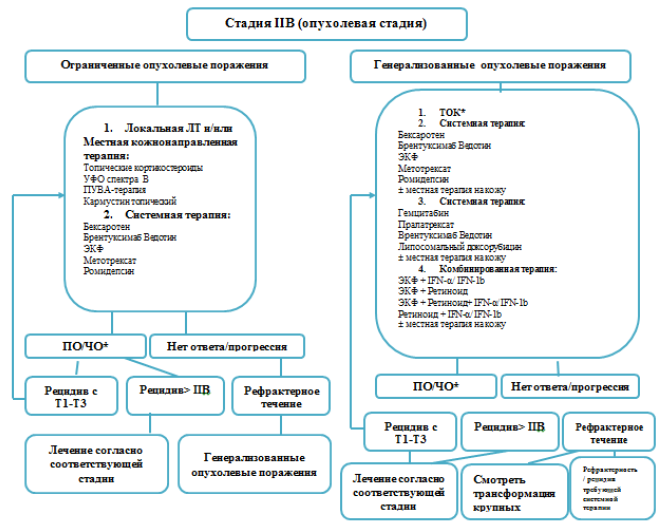

Синдром Сезари [9].
При назначении терапии рекомендовано соблюдать те же принципы, которые лежат в основе лечения ГМ:
подходы к лечению определяются массой опухоли и скоростью прогрессии.
по возможности необходимо избегать подавления иммунного ответа.
При необходимости системного лечения предпочтительно назначение иммуномодулирующей терапии, а не химиотерапии.
комбинированная или мультимодальная (например, сочетание системной иммуномодулирующей терапии и наружной).
своевременная диагностика и лечение инфекционных осложнений (иногда даже при отсутствии клинических признаков инфекционного процесса на коже) приводит к улучшению состояния пациента.
большое значение имеет лечение зуда, значительно снижающего качество жизни.
Терапия первой линии СС[9]:
Наиболее эффективным методом первой линии терапии в настоящее время у пациентов с СС является экстракорпоральный фотоферез. Перед проведением ЭКФ необходимо определить циркулирующий клон Т-лимфоцитов в крови. ЭКФ не показан пациентам с поражением л/у и висцеральных органов (стадии IVA и IVB). Сеансы проводят один раз в день в течение 2-х дней с 4-х недельным перерывом. Для устранения отрицательного воздействия на организм фотоокисленных продуктов в период проведения фотофереза рекомендуется назначение антиоксидантов (токоферола, бета- каротина, селена).
Интерферон-α (IFN-α) также может использоваться как препарат первой линии для СС, он эффективен в более высоких дозах, чем при ГМ: 9-18 MU ежедневно в течение 3-х месяцев, затем 3 раза в неделю. При непереносимости высоких доз назначают 3-6 MU ежедневно или 3 раза в неделю.
Терапия низкими дозами метотрексата (<100 мг/неделю) может назначаться как монотерапия при отсутствии возможностей проведения других видов лечения.
Схема 8-9. Алгоритм инициальной терапии СС пациентов до 60 лет



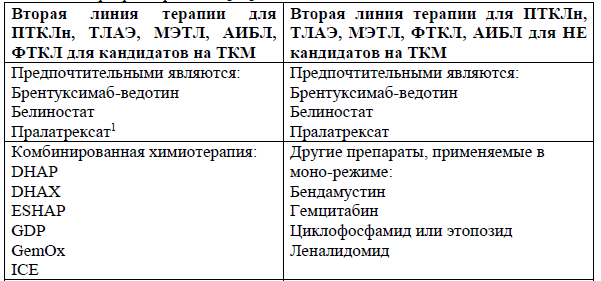
Лечение рецидивов/рефрактерного течения ПТКЛ:
Несмотря на то, что значительное число пациентов с нодальными ПТКЛ чувствительны к химиотерапии, продолжительность их ответа короткая и рецидивы случаются часто.
При принятии решения о лечении рецидивирующей или рефрактерной ПТКЛ следует прежде всего решить вопрос о том, является ли пациент кандидатом на трансплантацию аллогенных гемопоэтических стволовых клеток. Для таких пациентов Национальная комплексная онкологическая сеть рекомендуют в качестве терапии спасения комбинированную химиотерапию или препараты в моно-режиме. Пациентам, которые не являются кандидатами на трансплантацию, обеспечивается паллиативная терапия с минимальной токсичностью.
Схемы комбинированной химиотерапии для ПТКЛ включают стандартные схемы лечения для лимфом, такие как ICE, DHAP, DHAX и ESHAP [40-44]. Режимы на основе гемцитабина также показали активность, включая GDP, GemOx[45-48].
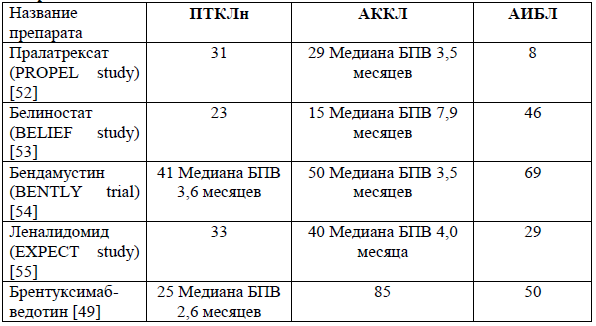
За исключением CD30 + АККЛ, для рецидивирующих/рефрактерных ПТКЛ стандарта терапии не разработано. Единственный одобренный во всем мире препарат используемый в качестве терапии спасения представляет собой конъюгат анти-CD30 антител брентуксимаб ведотин (БВ). В ключевом исследовании II фазы монотерапия брентуксимаб-ведотином у тяжело предлеченных пациентов с нодальными АККЛ, ЧОО составила 86% (66% полных и 20% частичных ответов), частота полного ответа 57% при средней продолжительности ответа 12,6 месяца [49].
Пациентам с рецидивами или рефрактерными формами АККЛ с экспрессией CD30 рекомендовано проведение терапии брентуксимабом ведотином в монорежиме или в сочетании с режимом химиотерапии для лечения рецидивов [49,50].
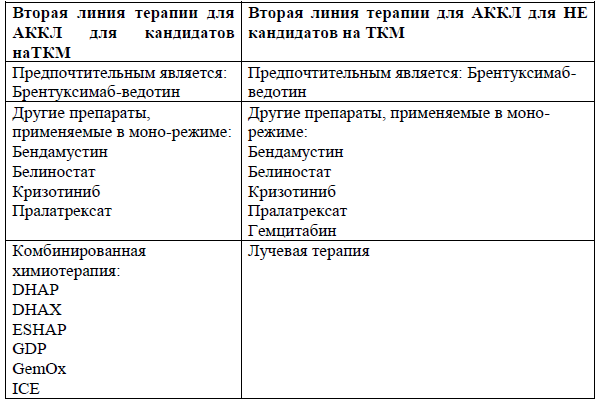
При рефрактерной/рецидивирующей форме ALK-позитивной АККЛ после проведения всех линий терапий в качестве альтернативы возможно применение селективного ингибитора ALK – Кризотиниб, в качестве альтернативного лечения до прогрессирования [51].

Показатели общей выживаемости (%) при лечении препаратами, одобренными FDA.
Пациентам с рецидивами или рефрактерными формами АККЛ с экспрессией CD30 рекомендовано проведение терапии брентуксимабом ведотином в монорежиме или в сочетании с режимом химиотерапии для лечения рецидивов [49,50].

При рефрактерной/рецидивирующей форме ALK-позитивной АККЛ после проведения всех линий терапий в качестве альтернативы возможно применение селективного ингибитора ALK – Кризотиниб, в качестве альтернативного лечения до прогрессирования [51].


1при АИБЛ имеет ограниченную активность, и не является предпочтительным
Показатели общей выживаемости (%) при лечении препаратами, одобренными FDA.

Пациентам с рецидивами или рефрактерными формами экстранодальной NK/T-клеточной лимфомы рекомендуется проведение химиотерапии рецидива по одной из схем терапии на основе аспарагиназы (AspMetDex или SMILE) если ранее не применялись либо комбинированная химиотерапия второй линии для ПТКЛ [5].
В настоящее время согласно международным рекомендациям предпочтительным является использование ингибиторов иммунной контрольной точки (PD-1) Пембролизумаб или Ниволумаб [56,57].
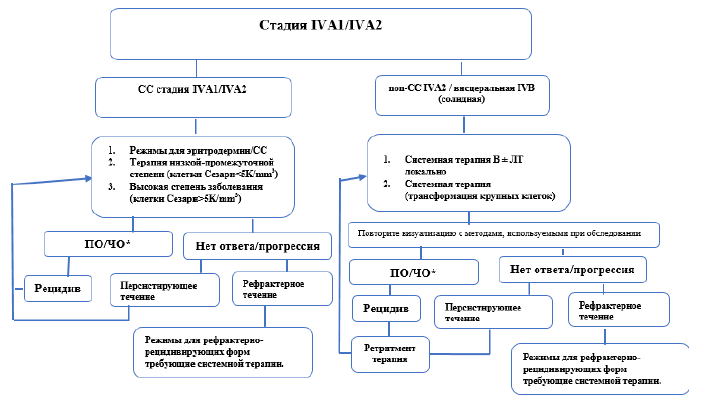
Лечение рецидивов/рефрактерного течения ГМ/СС.
При рецидиве или прогрессировании ГМ/СС необходимо выполнять повторную биопсию кожи для исключения крупноклеточной трансформации, при необходимости – повторную процедуру стадирования. Тактика лечения рецидивов также базируется на определении стадии заболевания, учитывается развитие резистентности к предыдущим видам терапии[9].
Выбор лечения зависит от возраста пациента, степени тяжести поражения крови, общего соматического статуса и предыдущих методов.
В терапии второй линии при лечении ГМ/СС используются следующие препараты:
хлорамбуцил в сочетании с системными глюкокортикостероидами: хлорамбуцил 2-12 мг/день + преднизолон 20мг/день.
ингибиторы гистондеацетилаз (HDACi) (Вориностат). Назначается перорально по 400 мг ежедневно до достижения полного контроля (отсутствие признаков дальнейшего прогрессирования) или же до появления признаков неприемлемой токсичности.
пегилированный липосомальный доксорубицин: вводится в дозе 20-30 мг/м2в/в каждые 2- 4недели.
гемцитабин: 1200 мг/м2в 1, 8 и 15 день 28-дневного цикла (3-6курсов).
деоксикоформицин (деоксикоформицин): 4-8 мг/м2/день 3 дня каждые 28дней.
сочетание флударабина (25 мг/м2каждые 3-4 недели) и циклофосфамида (250 мг/м2/день 3 дня 1 раз в месяц) в течение 3-6месяцев.
В настоящее время согласно международным рекомендациям при рецидивирующем/рефрактерном заболевании ГМ, требующем системной терапии, возможно использование ингибиторов иммунной контрольной Пембролизумаба, так же Ромидепсин включен в качестве предпочтительной схемы терапии для пациентов с СС с высоким содержанием клеток Сезари[39].
Карта наблюдения пациента, маршрутизация пациента:
Лечение лимфом во время беременности.
При диагностике лимфомы в 1-й триместр беременности до начала химиотерапии рекомендуется обсудить вопрос о прерывании беременности. Химиотерапия в 1-м триместре беременности имеет 10-20% риск развития тяжелых аномалий развития. Необходимо обсудить с пациентом все аргументы за и против искусственного прерывания беременности[9].
При диагностике лимфомы в 1-й триместр беременности до начала химиотерапии рекомендуется обсудить вопрос о прерывании беременности. Химиотерапия в 1-м триместре беременности имеет 10-20% риск развития тяжелых аномалий развития. Необходимо обсудить с пациентом все аргументы за и против искусственного прерывания беременности[9].
В самом большом многоцентровом ретроспективном исследовании 90 пациентов с лимфомой (40 ЛХ и 50 НХЛ) отметили, что стандартная полихимиотерапия, не связанная с антиметаболитами, назначенная во 2-м и 3-м триместрах, привели к ожидаемым исходам для матери без увеличения тяжелых неблагоприятных внутриутробных или перинатальных событий. 3-летняя БПВ и ОВ 53% и 82% соответственно. Уровень выкидышей был низким - 1,1%[58].
Для лечения НХЛ во время беременности в настоящее время предпочтительнее использование схемы СНОР[9].
Карта наблюдения пациента, маршрутизация пациента:

Немедикаментозное лечение
Режим: общеохранительный.
Диета: стол №15 (общая).
Основные схемы химиотерапии:
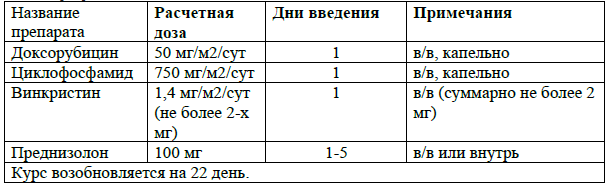
CHOP [22].
Медикаментозное лечение
Основные схемы химиотерапии:
CHOP [22].

CHOEP [22].


DA-EPOCH [23,24]

*Если уровень нейтрофилов выше 0,8 тыс/мкл, уровень тромбоцитов выше 100тыс/мкл
BV-CHP [25]

CHOP/IVE/iMtx [28]

DeVIC [30]

VIPD [31]

SMILE [33]


AspMetDex [33]

ICE [37,43]

DHAP [40]

DHAX [41]

ESHAP [44]

GDP[46]

GemOх[48]

Монотерапия Брентуксимаб-ведотином [49, 65]

Монотерапия Пралатрексатом [52]


Монотерапия Белиностатом [53]

Монотерапия Бендамустин [54]

Монотерапия леналидомидом [55]

Монотерапия Пембролизумабом [56]

Монотерапия Ниволумабом [57]


Интерферон (IFN-α) [59]

Флударабин [9]

Гемцитабин [60]

Деоксикоформицин (пентостатин) [61]

Липосомальный доксорубицин пегилированный[62]

Ретиноиды (13-цис-ретиноевая кислота: изотретиноин, этретинат) [63]

Ромидепсин [64]

Трансфузионная поддержка:
Показания к проведению трансфузионной терапии определяются в первую очередь клиническими проявлениями индивидуально для каждого пациента с учетом возраста, сопутствующих заболеваний, переносимости химиотерапии и развития осложнений на предыдущих этапах лечения;
Лабораторные показатели для определения показаний имеют вспомогательное значение, в основном для оценки необходимости профилактических трансфузий концентрата тромбоцитов;
Показания к трансфузиям также зависят от времени, после проведения курса химиотерапии – принимаются во внимание, прогнозируемое снижение показателей в ближайшие несколько дней.
Концентрат тромбоцитов:
При снижении уровня тромбоцитов менее 10 х109/л или появлении геморрагических высыпаний на коже (петехии, синячки) проводится профилактическая трансфузия аферезных тромбоцитов;
Профилактическая трансфузия аферезных тромбоцитов у пациентов с лихорадкой, пациентам, которым планируется инвазивное вмешательство может проводится при более высоком уровне – 20 х109/л;
При наличии геморрагического синдрома петехиально-пятнистого типа (носовые, десневые кровотечения, мено-, метроррагии, кровотечения других локализаций) трансфузия концентрата тромбоцитов проводится с лечебной целью.
Эритроцитарная масса/взвесь:
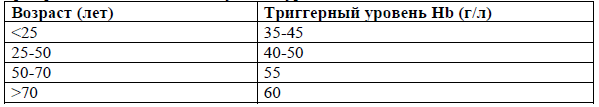
Уровень гемоглобина не нужно повышать, пока обычные резервы и компенсационные механизмы достаточны для удовлетворения потребностей тканей в кислороде;
Существует только одно показание для трансфузий эритроцитсодержащих сред при хронических анемиях – симптомная анемия (проявляющаяся тахикардией, одышкой, стенокардией, синкопе, de-novo депрессией или элевацией ST);
Уровень гемоглобина менее 30 г/л является абсолютным показанием для трансфузии эритроцитов;
При отсутствии декомпенсированных заболеваний сердечно-сосудистой системы и легких показаниями для профилактической трансфузии эритроцитов при хронических анемиях могут быть уровни гемоглобина:

Свежезамороженная плазма:
• Трансфузии СЗП проводятся у пациентов с кровотечением или перед проведением инвазивных вмешательств;
• Пациенты с МНО ≥2.0 (при нейрохирургических вмешательствах ≥1.5) рассматриваются как кандидаты для трансфузии СЗП при планировании инвазивных процедур. При плановых вмешательствах возможно назначение не менее, чем за 3 дня до вмешательства фитоменадиона не менее 30 мг/сут внутривенно или внутрь.
Перечень основных лекарственных средств (имеющих 100% вероятность применения).
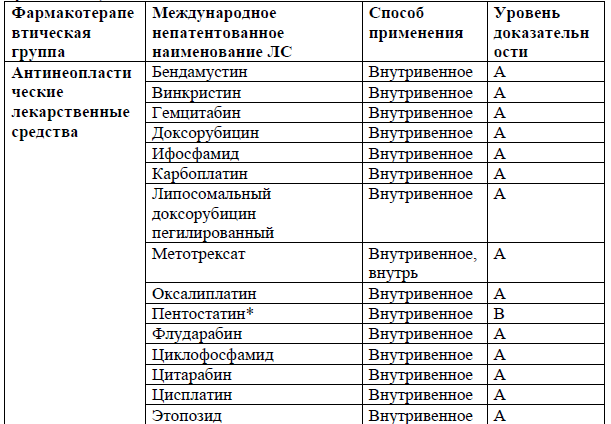
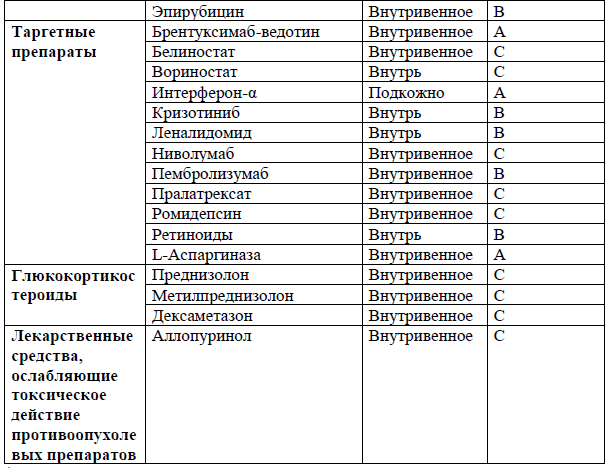
NB! Дополнительное медикаментозное лечение проводится соответственно протоколам лечения развившихся осложнений.
Перечень основных лекарственных средств (имеющих 100% вероятность применения).


*В соответствии с правилами применения незарегистрированных ЛС.
NB! Дополнительное медикаментозное лечение проводится соответственно протоколам лечения развившихся осложнений.
Хирургическое вмешательство:
• Резекционная биопсия лимфоузла или образования - для гистологического и иммуногистохимического исследования с целью верификации диагноза (и/или подтверждения рецидива заболевания).
• Полная спленэктомия - для гистологического и иммуногистохимического исследования с целью верификации диагноза (и/или подтверждения рецидива заболевания) при отсутствии других локализаций лимфомного поражения.
• Иссечение анальной трещины (острой/хронической) - по показаниям в рамках профилактики / лечения септических состояний у пациентов с гемобластозами.
• Удаление геморроидальных узлов (геморроидэктомия) - по показаниям в рамках профилактики / лечения септических состояний у пациентов с гемобластозами.
• Вскрытие парапроктита/инфильтрата - по показаниям в рамках профилактики/лечения септических состояний у пациентов с гемобластозами.
Основным противопоказанием к хирургическим вмешательствам является не купируемый геморрагический синдром
NB! Хирургическое лечение прочих сопутствующих хирургических патологии в рамках лечения соответствующего протокола.
Нодальные периферические Т-клеточные лимфомы:
• Выведение стомы кишечника - по показаниям (при острой и хронической анальной трещины) в рамках профилактики/лечения септических состояний у пациентов с гемобластозами.
• Плевральная пункция - по показаниям при гидротораксе плеврите.
• Лапароцентез - по показаниям при асците.
Основным противопоказанием к хирургическим вмешательствам является не купируемый геморрагический синдром
NB! Хирургическое лечение прочих сопутствующих хирургических патологии в рамках лечения соответствующего протокола.
Дальнейшее ведение.
Нодальные периферические Т-клеточные лимфомы:
Полный ответ должен быть подтвержден по ПЭТКТ через 3 месяца от завершения инициальной терапии [5].
Пациентам, завершившим лечение по поводу ПТКЛ с достижением ПО, рекомендуется диспансерное наблюдение у врача-онколога или врача-гематолога в течение 1-го года после завершения терапии каждые 3 месяца, 2-го года – каждые 6 месяцев, в дальнейшем – ежегодно [5]. Обследование включает: ОАК, Биохимический анализ крови необходимо проводить каждые 3 месяца в течение 1-го года жизни, затем каждые 6 месяцев в течении 2-го года и в дальнейшем – один раз в год.
В случае применения лучевой терапии (ЛТ) на область шеи, рекомендован контроль ТТГ как минимум ежегодно.
КТ шеи, ОГК, ОБП, малого таза с контрастированием каждые 6-месяцев в первые 2 года от завершения терапии, либо по клиническим показаниям.
ПЭТКТ проводиться в случае если последний ПЭТКТ соответствовал 4-5б Deauville для подтверждения полного ответа/ в случае подозрения на прогрессию/рецидив заболевания [5].
При проведении АллоТКМ наблюдение проводиться согласно протоколу аллогенной родственной/неродственной трансплантации костного мозга в течении 5-ти лет с мониторингом минимальной остаточной болезни (методом ПЦР, FISH, NGS) и донорского химеризма.
Грибовидный микоз, Синдром Сезари:
Грибовидный микоз, Синдром Сезари:
Ранние стадии – ежегодно (физикальный осмотр с картированием кожи, рентгенография органов грудной клетки и УЗИ периферических лимфатических узлов);
Поздние стадии – каждые 6 месяцев (физикальный осмотр с картированием кожи, УЗИ периферических лимфатических узлов, КТ органов грудной клетки, брюшной полости и малого таза) [9].
Индикаторы эффективности лечения:
Всем пациентам с ПТКЛ, после 3-4 циклов химиотерапии и после завершения всей программы лечения, необходима оценка ответа на терапию в соответствии с критериями ответа по Lugano (см. приложение 3) [17].
Для группы пациентов, которым в дебюте заболевания и для рестадирования проводится ПЭТ/КТ, эффективность лечения оценивается по шкале Deauville (смотрите приложение 4).
При ГМ/СС используются критерии ответа на лечение, предложенные ISCL, EORTC и Американским консорциумом по кожным лимфомам (USCLC) (смотрите приложение 5).
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ
Показания для плановой госпитализации:
Проведение курсов химиотерапии, таргетной терапии.
Проведение биопсии лимфатического узла/экстранодального образования или трепанобиопсии.
Проведения мобилизации аутологичных гемопоэтических стволовых клеток.
Проведение аутологичной/аллогенной трансплантации гемопоэтических стволовых клеток.
Контрольное обследование перед/после Ауто/Алло-ТКМ.
Показания для экстренной госпитализации:
Соматически тяжелый пациент (ECOG≥3 баллов):
− Опухолевая интоксикация, синдром сдавление.
− Тяжелой анемический/геморрагический синдром, требующий заместительной терапии.
− Полиорганная недостаточность в следствии основного заболевания.
Фебрильная нейтропения.
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2022
- 1) A clinical evaluation of the International Lymphoma Study Group classification of nоn-Ноdgkin's lymphoma. The Non-Hodgкin's Lymphoma Classification Proјect Blood 1997; 89:3909-3918. 2) Vose J. Armitagе J, Weisenburger D. International peripheral T-cell and natural killer/T-cell lymphoma study: pathology findings аnd clinical outcome J Clinical Oncology 2008; 26:4124-4130. 3) Bradford RT, Devesa SS, Anderson WF, Toro JR. Cutaneous lymphoma incidence patterns in the United States: a population-based study of 3884 cases. Blood 20093113: 5064-5073. 4) M.R Nasr., Anamarija M.Perry., P.Skrabek. Патология лимфатических узлов для клиницистов.; перевод с английского под редакцией Ю.А Криволапова – Практическая медицина, 2020, стр 156-185. 5) Тумян Г.С et.al Федеральные клинические рекомендации по диагностики и лечению Нодальных Т-клеточных лимфом, НОДГО 2020. 6) Gisselbrecht C, Gaulard P, Lepage E, et al. Prognostic significance of the T-cell phenotype in aggressive non-Нodgkin's lymphomas. Blood 1998; 92: 76-82. 7) Savage KJ, Chhanabhai M, Gascoyne RD, Connors JM. Characterization of peripheral T-cell lymphomas in a single North American institution by the WHO classification. Annals of Oncology 2004; 15: 1467-1475. 8) Weisenburger JD, Savage KJ, Harris NL, et al. Peripheral T-cell lymphoma without further specification: a 340-case report from the International Peripheral T-Cell Lymphoma Project. Blood 2011; 117: 3402-3408. 9) Демина Е.А et.al Общие принципы диагностики лимфом. Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний и др. Под ред. И.В. Поддубной, В.Г. Савченко. 2018. 10) Swerdlow S, Саmро E, Pileni SA, et al The 2016 revision of the World Health Organization classification of lymphoid neoplasms. Blood 2016;127: 2375-2390. 11) Cheson B.D, Fisher RI, Barrington SF et al. Recommendations for initial evaluation, staging, and response assessment of Hodgkin and non-Hodgkin lymphoma: the Lugano classification. J Clinical Oncology 2014. 12) The internatioпаl Non-Hodgkin's Lymphoma Prognostic Factors Project. A predictive model for aggressive non-hodgkin’s lymphoma. New England journal., 1993,329:987-994. 13) Gallamini A, Stelitano C, Calvi R. et al. Peripheral T-cell lymphoma: unspecified (PTCL-U): A new prognostic model from a retrospective multicentric clinical study. Blood 2004;103:2474-2479. 14) Went P., Agostinelli C., Gallamini A., et al. Marker expression in peripheral T-ce1 lymphoma: proposed clinical-pathologic prognostic score. Clinical Oncology 2006;24:2472-2479. 15) Kim SJ, Yoon DH, Jaccard A, et al. A prognostic index for natural killer cell lymphoma after non-anthracycline-based treatment a multicenter, retrospective analysis. Lancet Oncology 2016; 17: 389-400. 16) Olsen E., Vonderheid E., et.al. Revisions to the staging and classification of mycosis fungoides and Sézary syndrome: a proposal of the International Society for Cutaneous Lymphomas (ISCL) and the cutaneous lymphoma task force of the European Organization of Research and Treatment of Cancer (EORTC). Blood (2007) 110 (6): 1713–1722. 17) Horwitz S.M. et al. T-Cell Lymphomas. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines). Version 1.2021. 18) Cottereau A.S. et al. Predictive value of PET response combined with baseline metabolic tumor volume in peripheral T-Cell lymphoma patients // J. Nucl. Med. Society of Nuclear Medicine Inc., 2018. Vol. 59, № 4. P. 589–595. 19) Pellegrini C. et al. Prognostic Value of Interim Positron Emission Tomography in Patients With Peripheral T-Cell Lymphoma // Oncologist. Alphamed Press, 2014. Vol. 19, № 7. P. 746–750. 20) Tomita N. et al. Post-therapy 18F-fluorodeoxyglucose positron emission tomography for predicting outcome in patients with peripheral T cell lymphoma // Ann. Hematol. Springer Verlag, 2015. Vol. 94, № 3. P. 431–436. 21) Bachy, Emmanuel; Broccoli, Alessandro; Dearden, Claire; de Leval, Laurence; Gaulard, Philippe; Koch, Raphael; Morschhauser, Franck; Trümper, Lorenz; Zinzani, Pier Luigi Controversies in the Treatment of Peripheral T-cell Lymphoma, HemaSphere4 (5):e461, October 2020. 22) Cederleuf H. et al. The addition of etoposide to CHOP is associated with improved outcome in ALK+ adult anaplastic large cell lymphoma: A Nordic Lymphoma Group study // Br. J. Haematol. Blackwell Publishing Ltd, 2017. Vol. 178, № 5. P. 739–746. 23) Maeda Y. et al. Dose-adjusted EPOCH chemotherapy for untreated peripheral T-cell lymphomas: A multicenter phase II trial of West-JHOG PTCL0707 // Haematologica. Ferrata Storti Foundation, 2017. Vol. 102, № 12. P. 2097–2103. 24) Dunleavy K, Pittaluga S, Shovin M, et al. Phase Il trial of dose adjusted EPOCH in untreated systemic anaplastic large cell lymphoma. Hatatologica 2016: 101: e27-e29. 25) Horvitz S, O'Connor OA, Pro B, et.al Brentuximab vedotin with chemotherapy for CD30-positive peripheral T-cell lymphoma (ECHELON- 2): a global, double-blind, randomised, phase 3 trial. Lancet 2019,393: 229-246. 26) Han X., Zhang W., Zhou D., et al. Autologous stem cell transplantation as frontline strategy for peripheral T-cell lymphoma: a single-center experience. J Int Med Res 2017; 45:290-302. 27) G.Fossard, F. Broussais, I. Coelho, S. Role of up-front autologous stem-cell transplantation in peripheral T-cell lymphoma for patients in response after induction: an analysis of patients from LYSA centers’. Annals of Oncology Volume 29, Issue 3, March 2018; p 715-723. 28) Sieniawski M, Angamuthu N, Boyd K et al. Evaluation of enteropathy-associated T-cell lymphoma comparing standard therapies with a novel regimen including autologous stem cell transplantation. Blood 2010; 115: 3664–3670. 29) Jantunen E, Boumendil A, Finel H et al. Autologous stem cell transplantation for enteropathy-associated T-cell lymphoma: a retrospective study by the EBMT, Blood 2013; 121: 2529–2532. 30) Yamaguchi M, Tobinai K, Oguchi M, et al. Concurrent chemoradiotherapy for localized nasal natural killer/T-cell lymphoma: an updated analysis of the Japan clinical oncology group study JCOG0211. J Clin Oncol 2012; 30: 4044-4046. 31) Kim SJ, Kim K, Kim BS, et al. Phase II trial of concurrent radiation and weekly cisplatin followed by VIPD chemotherapy in newly diagnosed, stage IE to IIE, nasal, extranodal NK / T-cell lymphoma: Consortium for Improving Survival of Lymphoma study. J Clin Oncol 2009, 27: 6027-6032. 32) Yamaguchi M, Suzuki R, Oguchi M, et al. Treatments and outcomes of patients with extranodal natural killer / T-cell lymphoma diagnosed between 2000 and 2013: A cooperative study in Japan. J Clin Oncol 2017; 35: 32-39. 33) Yamaguchi M., Suzuki R., Oguchi M. Advances in the treatment of extranodal NK/T-cell lymphoma, nasal type // Blood. American Society of Hematology, 2018. Vol. 131, № 23. P. 2528–2540. 34) Illidge T. et al. Modern radiation therapy for nodal non-Hodgkin lymphoma - Target definition and dose guidelines from the international lymphoma radiation oncology group // International Journal of Radiation Oncology Biology Physics. Elsevier Inc., 2014. Vol. 89, № 1. P. 49–58. 35) Yamaguchi M., Suzuki R., Oguchi M. Advances in the treatment of extranodal NK/T-cell lymphoma, nasal type // Blood. American Society of Hematology, 2018. Vol. 131, № 23. P. 2528–2540. 36) Klebaner D., Koura D., Tzachanis D., et.al. Intensive induction therapy compared with CHOP for Hepatosplenic T-cell lymphoma. Clin Lymphoma Myeloma Leuk 2020; 20:431-437 e432. 37) Voss MH, Lunning MA, Maragulia JC et al. Intensive induction chemotherapy followed by early high-dose therapy and hematopoietic stem cell transplantation results in improved outcome for patients with hepatosplenic T-cell lymphoma: a single institution experience. Clin Lymphoma Myeloma Leuk 2013; 13: 8–14. 38) Tanase A, Schmitz N, Stein H et al. Allogeneic and autologous stem cell transplantation for hepatosplenic T-cell lymphoma: a retrospective study of the EBMT Lymphoma Working Party. Leukemia 2015; 29: 686–688. 39) Horwitz S.M. et al. Primary cutaneous lymphomas. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines). Version 1.2021. 40) Velasquez WS, Cabanillas F Salvador P, et al. Effective salvage therapy for lymphoma with cisplatin in combination with high-dose Ara-C and dexamethasone (DHAP). Blood 1988; 71: 117-122. 41) Rigacci L, Fabbri A, Puccini B, et al. Oxaliplatin-based chemotherapy (dexamethasone, high-dose cytarabine, and oxaliplatin) +/-rituximab is an effective salvage regimen in patients with relapsed or refractory lymphoma. Cancer 2010: 116: 4573-4579. 42) Tixier F. Ranchon F, Iltis A, et al. Comparative toxicities of 3 platinum-containing chemotherapy regimens in relapsed / refractory lymphoma patients. Hematol Oncol 2017; 35: 584-590. 43) Horwitz S, Moskowitz C Kewalramani T, et al. Second-line therapy with ICE followed by high dose therapy and autologous stem cell transplantation for relapsed /refractory peripheral T-cell lymphomas: minimal benefit when analyzed by intent to treat (abstract). Blood 2005: 166: Abstract 2679. 44) Velasquez Ws, McLaughlin P, Tucker S, et al. ESНAP - an effective chemotherapy regimen in refractory and relapsing lymphoma: a 4-year follow-up study. J Clin Oncol 1994,12: 1169-1176. 45) Zinzani PL, Magagnoli M, Bendandi M, et al. Therapy with gemcitabine in pretreated peripheral T-cell lymphoma patients. Ann Oncol 1998; 9: 1351-1353. 46) Connors JM, Sehn LH, Villa D, et al. Gemcitabine, dexamethasone, and cisplatin (GDP) as secondary chemotherapy in relapsed/refractory peripheral T-cell lymphoma Blood 2013: 122-Abstract 4345. 47) Park BB, Kim WS, Suh C, et al. Salvage chemotherapy of gemcitabine, dexamethasone, and cisplatin (GDP) for patients with relapsed or refractory peripheral T-cell lymphomas: a consortium for improving survival of lymphoma (CISL) trial Ann Hematol 2015; 94: 1845-1851. 48) Lopez A, Gutierrez A, Palacios A, et al. GEMOX-R regimen is a highly effective salvage regimen in patients with refractory / relapsing diffuse large-cell lymphoma: A phase ll study. Eur J Natol 2008: 80: 127-132. 49) Pro B. et al. Five-year results of brentuximab vedotin in patients with relapsed or refractory systemic anaplastic large cell lymphoma // Blood. American Society of Hematology, 2017. Vol. 130, № 25. P. 2709–2717. 50) Heidegger S. et al. Combination therapy with brentuximab vedotin and cisplatin/cytarabine in a patient with primarily refractory anaplastic lymphoma kinase positive anaplastic large cell lymphoma // Onco. Targets. Ther. Dove Medical Press Ltd., 2014. Vol. 7. P. 1123–1127. 54.
Информация
Код(ы) МКБ-9.10.11:
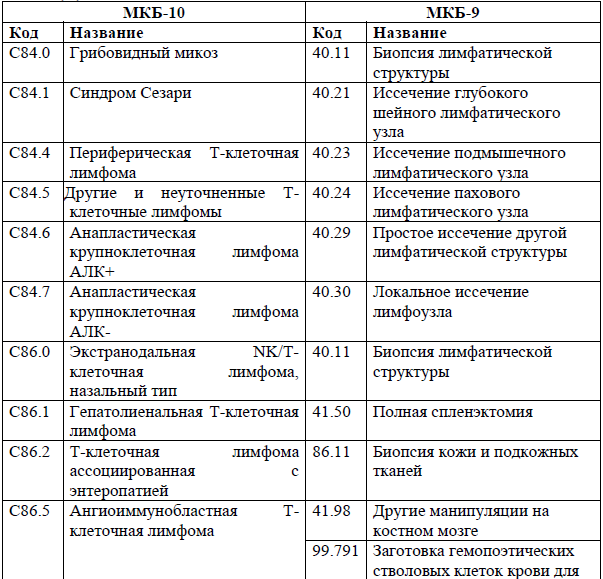

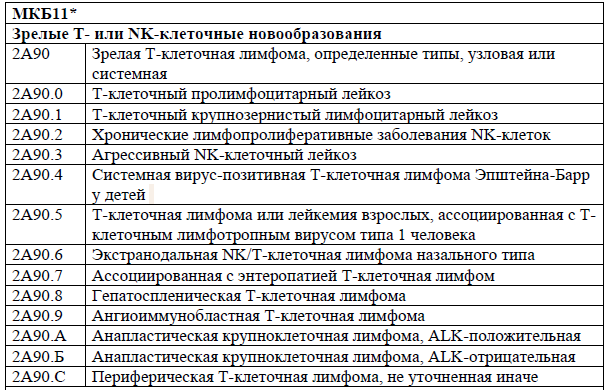

NB! Использование после разрешения к применению в РК*
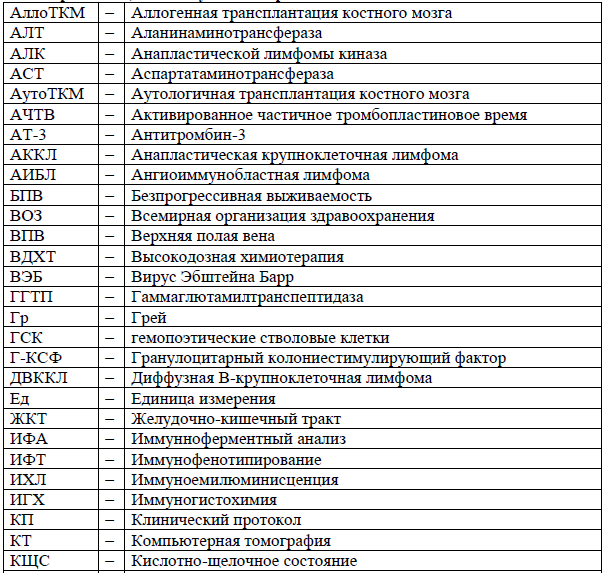
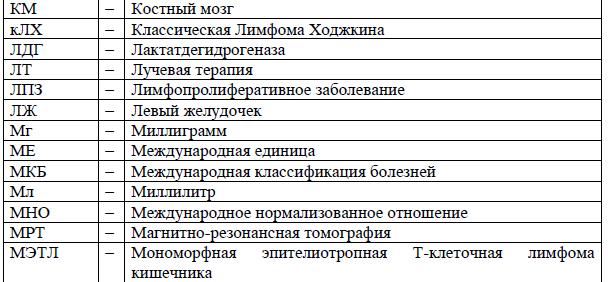
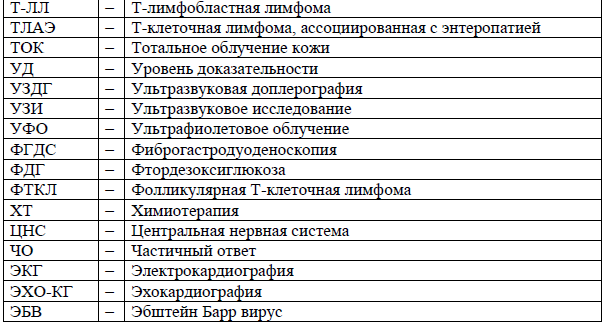
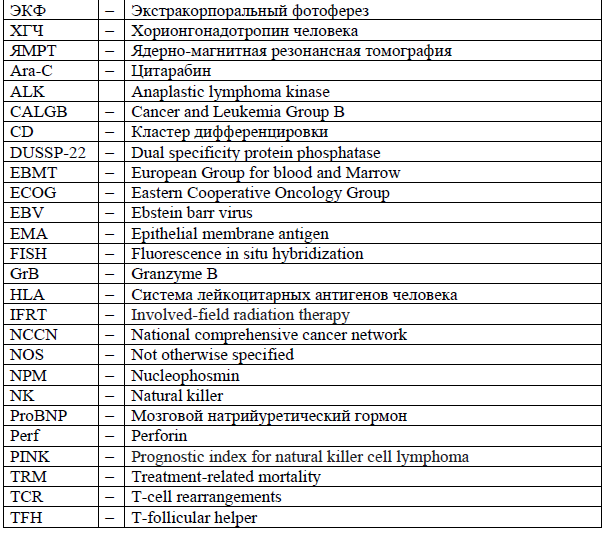
Сокращения, используемые в протоколе:

Шкала уровня доказательности:


ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ПРОТОКОЛА.
Список разработчиков протокола с указание квалификационных данных:
1) Кемайкин Вадим Матвеевич - кандидат медицинских наук, врач-гематолог высшей квалификационной категории, руководитель центра онкогематологии и ТКМ, ТОО «Национальный научный онкологический центр».
2) Жүніс Гүлжанат Қуанышқызы - врач-гематолог центра онкогематологии и ТКМ, ТОО «Национальный научный онкологический центр».
3) Сарина Сабила Тұрғанбайқызы - врач-гематолог центра онкогематологии и ТКМ, ТОО «Национальный научный онкологический центр».
4) Габбасова Сауле Телембаевна - врач гематолог высшей категории, магистр общественного здравоохранения, член общества онкогематологов РК, член Ассоциации онкологов РК, руководитель центра гематологии с трансплантацией костного мозга КазНИИиОР. 5) Клодзинский Антон Анатольевич – кандидат медицинских наук, врач гематолог, ТОО «Центр гематологии».
6) Рапильбекова Гульмира Курбановна - доктор медицинских наук, профессор КФ UMC «Национальный научный центр материнства и детства», старший ординатор акушерского отделения №1, врач акушер-гинеколог. 7) Худайбергенова Махира Сейдуалиевна - клинический фармаколог, ТОО «Национальный научный онкологический центр».
Указание на отсутствие конфликта интересов: нет.
Рецензенты: Рамазанова Райгуль Мухамедовна – доктор медицинских наук, врач-гематолог высшей квалификационной категории, профессор кафедры внутренних болезней НАО «Казахский Национальный Медицинский университет имени С.Д Асфендиярова».
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Приложение 1
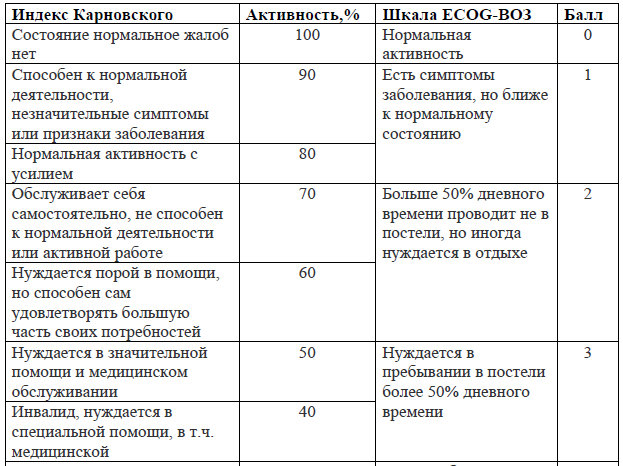
Индекс Карновского/Шкала ECOG-ВОЗ
Общее состояние онкологического больного рекомендовано оценивать по индексу Карновского (0-100%) или Шкале ECOG-ВОЗ (0-4 балла).

Приложение 2
Классификация лимфом. ВОЗ 2016 год.
В- клеточные опухоли:
Хронический лимфолейкоз/ лимфома из малых лимфоцитов;
Моноклональный В-клеточный лимфоцитоз;
В-пролимфоцитарный лейкоз;
Лимфома селезенки из клеток маргинальной зоны;
Волосатоклеточный лейкоз;
Лимфома/ лейкоз селезенки, неклассифицируемый:
- Диффузная мелкоклеточная В- клеточная лимфома красной пульпы селезенки;
- Волосатоклеточный лейкоз- подобный вариант.
Лимфоплазмоцитарная лимфома
- Макроглобулинемия Вальденстрема
Моноклональные гаммапатии неясного генеза (MGUS), IgM:
- Болезнь α- тяжелых цепей;
- Болезнь γ- тяжелых цепей;
- Болезнь μ- тяжелых цепей.
Моноклональные гаммапатии неясного генеза (MGUS), IgG/A:
- Плазмоклеточная миелома;
- Солитарная плазмоцитома кости;
- Экстрамедуллярная миелома;
- Болезнь накопления моноклональных иммуноглобулинов.
Экстранодальная лимфома из клеток маргинальной зоны лимфоидной ткани, ассоциированной со слизистой оболочкой (MALT- лимфом);
Нодальная лимфома из клеток маргинальной зоны;
Нодальная лимфома из клеток маргинальной зоны, педиатрический вариант;
Фолликулярная лимфома:
- In situ фолликулярная неоплазия;
- Фолликулярная лимфома дуоденального типа.
Фолликулярная лимфома, педиатрический вариант;
Крупноклеточная В- клеточная лимфома с IRF4;
Первичная кожная центрофолликулярная лимфома;
Лимфома из клеток мантии:
- In situ неоплазия из клеток мантии;
Диффузная крупноклеточная В- клеточная лимфома, NOS:
- GCB-тип(анг. germinal center B-cell-like);
- ABC-тип (англ. activated B-cell-like).
В-клеточная лимфома, богатая T-клетками/гистиоцитами;
Первичная ДВККЛ центральной нервной сиситемы (ЦНС);
Первичная кожная диффузная крупноклеточная В- клеточная лимфома с поражением нижних конечностей;
EBV1+ DLBCL, NOS;
EBV1+, кожно-слизистая язва;
ДВККЛ, связанная с хроническим воспаленнием;
Лимфоматоидный гранулематоз;
Первичная медиастинальная (тимическая) крупноклеточная В- клеточная лимфома;
Внутрисосудистая крупноклеточная В- клеточная лимфома;
ALK + крупноклеточная В- клеточная лимфома;
Плазмобластная лимфома;
Первичная экссудативная лимфома;
HHV81 DLBCL, NOS*;
Лимфома Беркитта;
Беркитоподобная лимфома с абберацией 11q;
В-клеточная лимфома высокой степени злокачественности, с мутациями MYC и BCL2 и /или BCL6;
В-клеточная лимфома высокой степени злокачественности, NOS;
В- клеточная лимфома, неклассифицируемая, с признаками, промежуточными между диффузной крупноклеточной В- клеточной лимфомой и лимфомой Ходжкина;
Т/ NK- клеточные опухоли:
Т- клеточный пролимфоцитарный лейкоз;
Т- клеточный гранулярный лимфоцитарный лейкоз;
Хроническое лимфопролиферативное NK- клеточное заболевание;
Агрессивный NK- клеточный лейкоз;
Системная EBV Т-клеточная лимфома у детей;
Гидроаоспенновидно- подобнаялимфома;
Т- клеточная лимфома/ лейкоз взрослых;
Экстранодальная NK/ T- клеточная лимфома, назальный тип;
Ассоциированная с энтеропатией Т- клеточная лимфома;
Мономорфная эпителиотропная кишечная Т-лимфома;
Индолетние Т-клеточные лимфопролиферативные заболевания ЖКТ;
Гепатоспленическая Т- клеточная лимфома;
Подкожная панникулит- подобная Т- клеточная лимфома;
Грибовидный микоз;
Синдром Сезари;
Первичные кожные CD30- позитивные Т- клеточные лимфомы;
Лимфоматоидный папуллез;
Первичная кожная анапластическая крупноклеточная лимфома;
Первичная кожная γδ Т- клеточная лимфома;
Первичная кожная CD8+ агрессивная эпидермотропная цитотоксическая Т- клеточная лимфома;
Первичная кожная CD8+ Т- клеточная лимфома
Первичная кожная периферическая CD8+ Т- клеточная лимфома
Первичная кожная CD4+ мелко/ среднеклеточная Т- клеточная лимфома;
Периферическая Т- клеточная лимфома, неуточненная;
Ангиоиммунобластная Т- клеточная лимфома;
Фолликулярная Т-клеточная лимфома;
Нодальная периферическая Т-клеточная лимфома с фенотипом TFH;
Анапластическая крупноклеточная лимфома, ALK- позитивная;
Анапластическая крупноклеточная лимфома, ALK- негативная;
Грудной имплантат-ассоциированной анапластическая крупно-клеточная лимфома;
Лимфома Ходжкина:
Нодулярная с лимфоидным преобладанием лимфома Ходжкина;
Классическая лимфома Ходжкина;
Лимфома Ходжкина, вариант нодулярный склероз;
Лимфома Ходжкина, вариант, богатый лимфоцитами;
Лимфома Ходжкина, смешанноклеточный вариант;
Лимфома Ходжкина, вариант с лимфоидным истощением.
Новообразования гистиоцитарных и дендритных клеток:
Пострансплантационные лимфопролиферативные заболевания (PTLD):
Плазматическая гиперплазия (PTLD);
Инфекционный мононуклеоз (PTLD);
Багровая фолликулярная гиперплазия;
Полиморфная PTLD;
Мономорфная PTLD (B- и T-/NK-клеточные типы)
Классическая лимфома Ходжкина (PTLD).
Новообразования гистиоцитарных и дендритных клеток:
Гистиоцитарная саркома;
Гистиоцитоз из клеток Лангергаса;
Саркома из клеток Лангергаса;
Неопределенный опухоль дендритных клеток;
Саркома из дендритных клеток;
Саркома фолликулярных дендритных клеток;
Опухоль из ретикулярных фибробластических клеток;
Рассеянная юношеская ксантогранулома
Болезнь Эрдгейма-Честера
ПЭТ должно быть проведено с контрастным усилением и КТ (можно провести одновременно или по отдельности).
Неопределенный опухоль дендритных клеток;
Саркома из дендритных клеток;
Саркома фолликулярных дендритных клеток;
Опухоль из ретикулярных фибробластических клеток;
Рассеянная юношеская ксантогранулома
Болезнь Эрдгейма-Честера
Приложение 3
Критерии LUGANO для оценки ответа при НХЛ
ПЭТ должно быть проведено с контрастным усилением и КТ (можно провести одновременно или по отдельности).
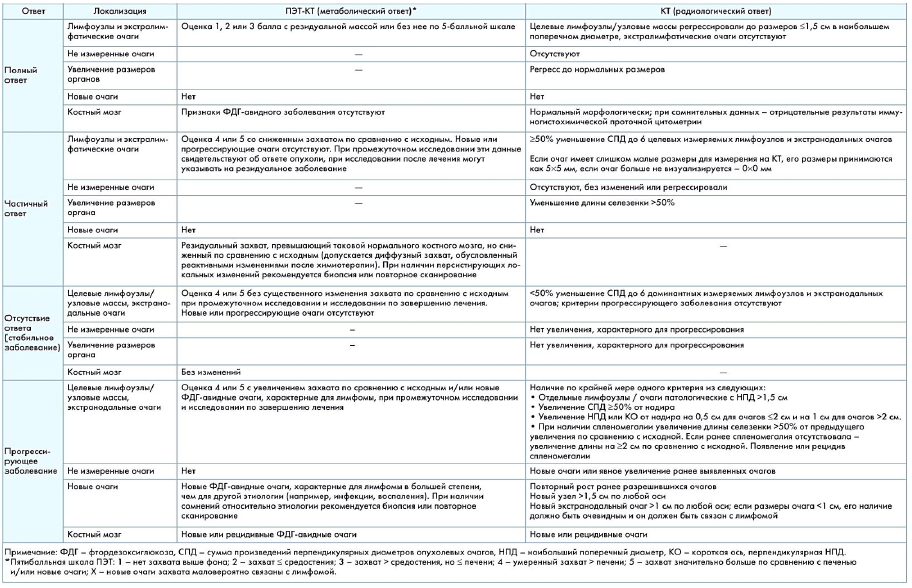
a3 балла по шкале Deauville у многих пациентов указывает на хороший прогноз при стандартной терапии, особенно при промежуточном рестадировании. Однако, в испытаниях с участием ПЭТ, где исследовались деэскалация доз химиопрепаратов, ответ 3 балла по шкале Deauville расценивался как неадекватный ответ (чтобы избежать недостаточного лечения).
Приложение 4
Оценка эффективности проведенной терапии по шкале Deauville
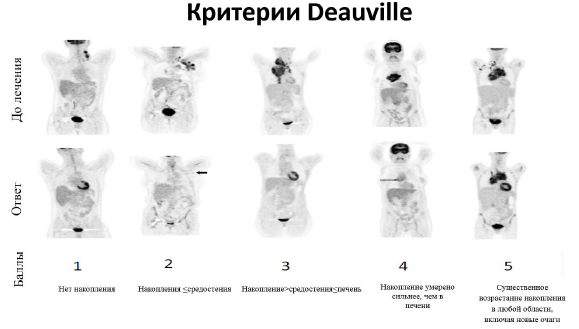
Приложение 5
Критерии ответа СС/ГМ предложенные ISCL, EORTC и Американским консорциумом по кожным лимфомам (USCLC):




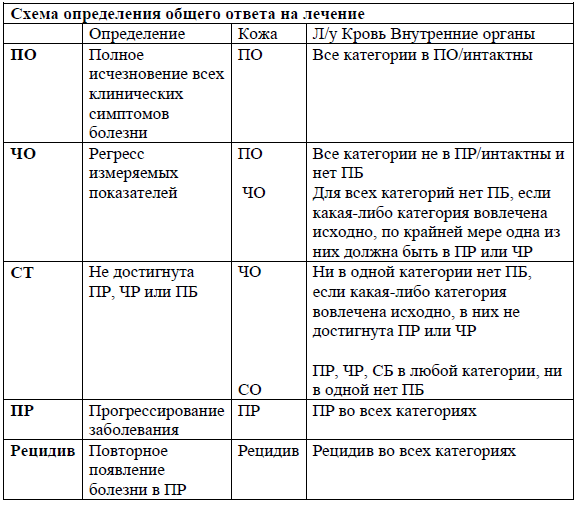
Учитывая критерии ответа для кожи, лимфатических узлов, висцеральных органов и крови, определяется общий критерий ответа на лечение (представлена в таблице).
Приложение 6
Клинические и технические требования к лучевой терапии
Факторы риска и профилактика тромботических и тромбоэмболических осложнений у пациентов, которые получают талидомид или леналидомид
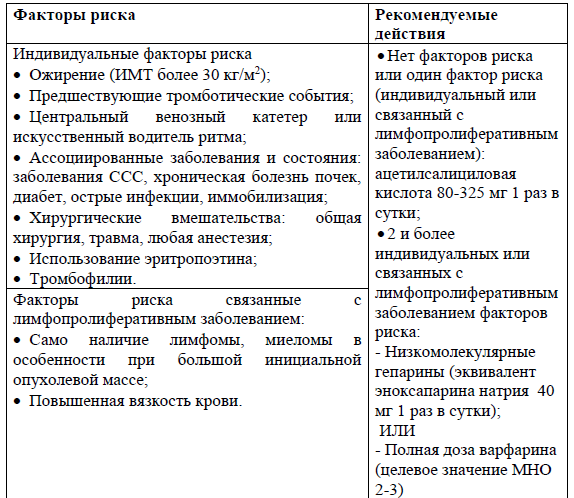

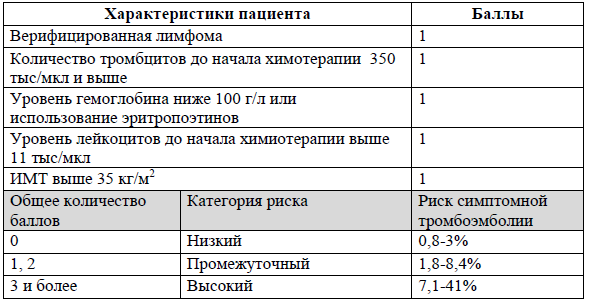
Рекомендации American Society of Clinical Oncology по профилактике и лечению тромбозов вен и тромбоэмболий у онкологических больных*
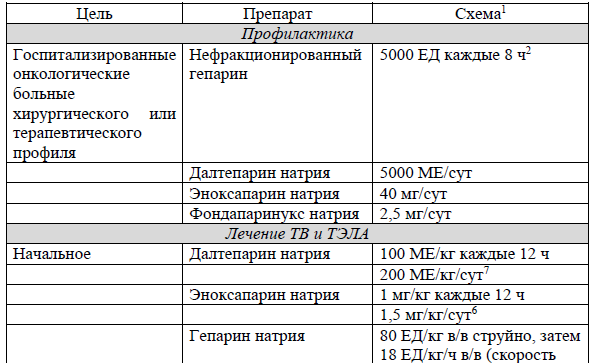
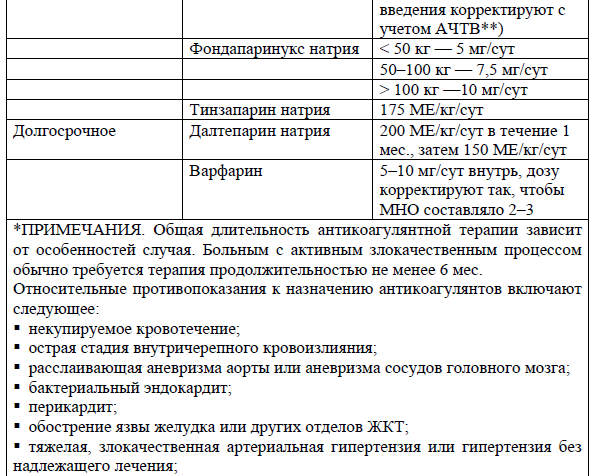


Приложение 9
Клинические требования.
Оптимальный интервал между окончанием ХТ и началом лучевой терапии – 4 недели (но не более 6 недель). Очень важным для планирования лучевой терапии является качество стадирования заболевания до начала химиотерапии. Описание очагов поражения по данным клинического осмотра, КТ, МРТ должно включать анатомически точную их локализацию, количество, максимальные размеры в сантиметрах, особенно зон массивного поражения, указание 3-х размеров зоны поражения, включая протяжённость. При описании поражения средостения обязательно определение медиастинально-торакального индекса по прямому рентгеновскому снимку. Для атипично расположенных пораженных лимфатических узлов, помимо описания их, необходимо указывать их координаты (расстояние в см по горизонтали и вертикали от легко определяемых анатомических ориентиров). Всю указанную выше информацию рекомендуется изображать графически на анатомической схеме человеческого тела во фронтальной проекции.
До начала ХТ при наличии полной информации об объеме исходного поражения рекомендуется совместная консультация гематологов-онкологов и радиологов. Особо должны быть выделены зоны сомнительного или вероятного поражения, лечебная тактика в отношении которых должна быть предварительно согласована и повторно обсуждена после окончания ХТ.
Оптимальный интервал между окончанием ХТ и началом лучевой терапии – 4 недели (но не более 6 недель). Очень важным для планирования лучевой терапии является качество стадирования заболевания до начала химиотерапии. Описание очагов поражения по данным клинического осмотра, КТ, МРТ должно включать анатомически точную их локализацию, количество, максимальные размеры в сантиметрах, особенно зон массивного поражения, указание 3-х размеров зоны поражения, включая протяжённость. При описании поражения средостения обязательно определение медиастинально-торакального индекса по прямому рентгеновскому снимку. Для атипично расположенных пораженных лимфатических узлов, помимо описания их, необходимо указывать их координаты (расстояние в см по горизонтали и вертикали от легко определяемых анатомических ориентиров). Всю указанную выше информацию рекомендуется изображать графически на анатомической схеме человеческого тела во фронтальной проекции.
До начала ХТ при наличии полной информации об объеме исходного поражения рекомендуется совместная консультация гематологов-онкологов и радиологов. Особо должны быть выделены зоны сомнительного или вероятного поражения, лечебная тактика в отношении которых должна быть предварительно согласована и повторно обсуждена после окончания ХТ.
При всех поддиафрагмальных поражениях в случае планирования облучения селезёнки рекомендуется радиоизотопное исследование функции почек. При наличии единственной левой почки либо при значительном нарушении функции правой почки следует обсудить целесообразность спленэктомии, как альтернативы ее облучению.
Технические требования.
Для проведения лучевой терапии можно использовать гамма-излучение Со60, фотонное излучение энергией 6 МЭВ и 18 МЭВ (18 МЭВ используется в случае глубокого расположения мишени, при больших значениях передне-задних размеров). Электронное излучение различных энергий может использоваться для лечения поверхностно расположенных лимфатических узлов.
Расчёт дозы ЛТ должен проводиться в соответствии с МКРЕ-50-62, где указаны относительные точки и суммарные дозы. Разовая очаговая доза не должна превышать 1,8-2,0 Гр, лечение проводится ежедневно 5 раз в неделю.
В зависимости от технической оснащенности радиологического отделения могут использоваться различные методики лучевой терапии: от лечения несколькими фигурными полями (требующего четкой стыковки смежных полей облучения во избежание пере- или недооблучения) до новейших методик конформной лучевой терапии (IMRT, RAPIDARC), сводящих к минимуму лучевое воздействие на нормальные ткани.
Для точного воспроизведения положения пациента во время лечения необходимо использовать фиксирующие приспособления – подголовники, индивидуальные пластиковые маски, подставки для нижних конечностей. При облучении всех пораженных зон, кроме паховых и бедренных лимфатических узлов, используются встречные передне-задние фигурные поля (они формируются с помощью защитных блоков или многолепестковых коллиматоров диафрагмы ускорителя).
При дополнительном облучении отдельных групп лимфатических узлов возможно любое расположение полей, минимизирующее лучевое повреждение здоровых тканей. При ЛТ остаточных объёмных опухолей рекомендуется объёмное планирование облучения, применение методики облучения тангенциальными полями, использование компенсаторных клиньев, методик конформной лучевой терапии (3D CRT).
При поражении лимфоидной ткани кольца Вальдейера облучение проводится с двух боковых встречных полей (необходима предварительная санация полости рта, использование защитных кап).
Каждое лечебное поле должно подтверждаться рентгеновскими снимками с помощью симулятора или системой контроля изображения на ускорителе.
Объёмы облучения
Для выбора адекватного объёма облучения необходимо помнить об определении областей и зон поражения. На V международном симпозиуме по лимфоме Ходжкина в 2001г. было уточнено, что термином «зона» обозначаются анатомические зоны, по которым устанавливается стадия заболевания в соответствии с классификацией Ann Arbor. Термин «область» – более широкое понятие, область может включать в себя одну или более зон. Так в одну область были включены шейные, над- и подключичные лимфатические узлы с одной стороны. Также в одну область объединены медиастинальные лимфатические узлы и лимфатические узлы корней легких, одной областью считаются лимфатические узлы «верхнего этажа» брюшной полости (ворота печени, ворота селезенки и корень брыжейки) и одной областью – лимфатические узлы “нижнего этажа” брюшной полости - парааортальные и мезентериальные (рисунок 1).
Рисунок 1. Области и зоны поражения при лимфомах
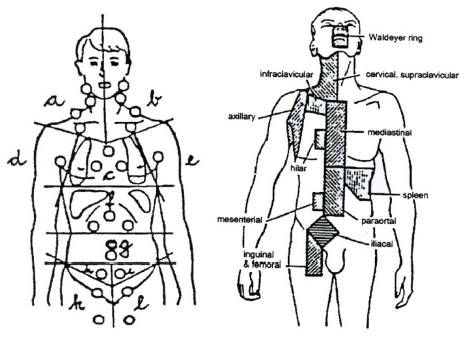
Технические требования.
Для проведения лучевой терапии можно использовать гамма-излучение Со60, фотонное излучение энергией 6 МЭВ и 18 МЭВ (18 МЭВ используется в случае глубокого расположения мишени, при больших значениях передне-задних размеров). Электронное излучение различных энергий может использоваться для лечения поверхностно расположенных лимфатических узлов.
Расчёт дозы ЛТ должен проводиться в соответствии с МКРЕ-50-62, где указаны относительные точки и суммарные дозы. Разовая очаговая доза не должна превышать 1,8-2,0 Гр, лечение проводится ежедневно 5 раз в неделю.
В зависимости от технической оснащенности радиологического отделения могут использоваться различные методики лучевой терапии: от лечения несколькими фигурными полями (требующего четкой стыковки смежных полей облучения во избежание пере- или недооблучения) до новейших методик конформной лучевой терапии (IMRT, RAPIDARC), сводящих к минимуму лучевое воздействие на нормальные ткани.
Для точного воспроизведения положения пациента во время лечения необходимо использовать фиксирующие приспособления – подголовники, индивидуальные пластиковые маски, подставки для нижних конечностей. При облучении всех пораженных зон, кроме паховых и бедренных лимфатических узлов, используются встречные передне-задние фигурные поля (они формируются с помощью защитных блоков или многолепестковых коллиматоров диафрагмы ускорителя).
При дополнительном облучении отдельных групп лимфатических узлов возможно любое расположение полей, минимизирующее лучевое повреждение здоровых тканей. При ЛТ остаточных объёмных опухолей рекомендуется объёмное планирование облучения, применение методики облучения тангенциальными полями, использование компенсаторных клиньев, методик конформной лучевой терапии (3D CRT).
При поражении лимфоидной ткани кольца Вальдейера облучение проводится с двух боковых встречных полей (необходима предварительная санация полости рта, использование защитных кап).
Каждое лечебное поле должно подтверждаться рентгеновскими снимками с помощью симулятора или системой контроля изображения на ускорителе.
Объёмы облучения
Для выбора адекватного объёма облучения необходимо помнить об определении областей и зон поражения. На V международном симпозиуме по лимфоме Ходжкина в 2001г. было уточнено, что термином «зона» обозначаются анатомические зоны, по которым устанавливается стадия заболевания в соответствии с классификацией Ann Arbor. Термин «область» – более широкое понятие, область может включать в себя одну или более зон. Так в одну область были включены шейные, над- и подключичные лимфатические узлы с одной стороны. Также в одну область объединены медиастинальные лимфатические узлы и лимфатические узлы корней легких, одной областью считаются лимфатические узлы «верхнего этажа» брюшной полости (ворота печени, ворота селезенки и корень брыжейки) и одной областью – лимфатические узлы “нижнего этажа” брюшной полости - парааортальные и мезентериальные (рисунок 1).
Рисунок 1. Области и зоны поражения при лимфомах

Приложение 7
Факторы риска и профилактика тромботических и тромбоэмболических осложнений
Факторы риска и профилактика тромботических и тромбоэмболических осложнений у пациентов, которые получают талидомид или леналидомид


Приложение 8
Прогностическая модель ассоциированных с химиотерапией тромбоэмболических осложнений KhoranaА.А. и соавторы.

Рекомендации American Society of Clinical Oncology по профилактике и лечению тромбозов вен и тромбоэмболий у онкологических больных*




Приложение 9
Синдром лизиса опухоли
При разрушении опухолевых клеток образуется пять основных субстанций, которые выводятся исключительно почками: продукты распада пурина - ксантин, гипоксантин и мочевая кислота; калий; фосфат.
Аллопуринол тормозит распад ксантина и гипоксантина до мочевой кислоты путем ингибирования ксантиноксидазы, снижая образование уратов в сыворотке крови.
При превышении порога растворимости ксантин, гипоксантин и мочевая кислота могут кристаллизоваться в почечных канальцах и собирательных трубочках. Фосфат, соединяясь с кальцием, образует фосфат кальция и выпадает как в почечных канальцах, так и в концевых капиллярах тканей, следствием чего являются гипокальциемия, олиго/анурия и тканевые некрозы. Растворимость ксантина и мочевой кислоты в щелочной среде намного выше, чем в кислой, но щелочная среда напротив благоприятствует выпадению в осадок фосфата кальция. Кроме того при рh>7,5 может кристаллизоваться гипоксантин. Следовательно перезащелачивание мочи тоже может благоприятствовать выпадению продуктов клеточного распада.
Если перед началом циторедуктивной терапии наблюдается повышение уровня мочевой кислоты и/или калия, и/или фосфатов и/или креатинина, то мероприятия по нормализации этих показателей должны быть проведены до начала циторедуктивной терапии. Однако начало этой терапии не должно откладываться более чем на 24 часа.
Главным мероприятием является инициирование и поддержание высокого диуреза - 100-250 мл/м2/ час. Если этого удается добиться, то метаболические нарушения бывают редко.
Если адекватного диуреза несмотря на достаточный объём инфузии, применение различных мочегонных средств добиться не удается, должны быть своевременно сделаны все необходимые приготовления к гемодиализу. Причиной олиго/анурии в этом случае является распространённое опухолевое поражение почек и/или обструкция опухолью (лимфомой) нисходящих мочевых путей, либо развитие тяжёлой уратной или кальциево-фосфатной нефропатии, либо комбинация этих патологических состояний.
Гиперкалиемия является наиболее опасным осложнением синдрома острого лизиса опухоли. Если после проведения профилактических/терапевтических мероприятий уровень калия повышается или при предшествующей гиперкалиемии не происходит его быстрого снижения, то угрожающее состояние может развиться в течение нескольких ближайших часов.
Тяжелый синдром острого лизиса опухоли часто осложняется развитием гипокоагуляционной фазы синдрома диссеминированного внутрисосудистого свертывания, требующего массивной заместительной терапии свежезамороженной плазмой (не мене 1000 мл 2 раза в день), концентратами тромбоцитов и нередко – проведения плазмафереза.
2. Инфузионная терапия:



Тяжелый синдром острого лизиса опухоли часто осложняется развитием гипокоагуляционной фазы синдрома диссеминированного внутрисосудистого свертывания, требующего массивной заместительной терапии свежезамороженной плазмой (не мене 1000 мл 2 раза в день), концентратами тромбоцитов и нередко – проведения плазмафереза.
Профилактика синдрома лизиса опухоли
1. Аллопуринол - 10 мг/кг в сутки в 2-3 приема (max – 600 мг/сутки) в течение 3 - 8 дней.
2. Инфузионная терапия:
Объем = 3000-5000 мл/м2/сутки.
5% раствор декстроза ↔ 0,9% раствор NaCl = 1 : 1.
Удельная плотность мочи < 1010.
Контроль баланса жидкостей. Баланс: количество выделенной мочи = количество введенной жидкости потери жидкости с дыханием.
Контрольное взвешивание 1-2 раза в сутки.
Интенсивность контроля за диурезом должна соответствовать ситуации и возрасту пациента.
при недостаточном мочевыведении – фуросемид 1-10 мг/кг в сутки внутривенно или инфузией, при сопутствующей гипопротеинемии даже умеренной - альбумин, при необходимости - допамин 3-5 мкг/кг/мин.
Инициальная инфузия - без калия. Умеренная гипокалиемия - желательна.
Защелачивание мочи: - NaHCO340 - 80 ммоль/л добавить к постоянной инфузии (или 100-200 ммоль/м2/сутки параллельной инфузией).
Регулирование необходимого объёма NaHCO3 соответственно pH мочи.
значение pH мочи=7,0 является идеальным! - сохраняется достаточная растворимость для мочевой кислоты и ксантина и отсутствует опасность образования фосфорнокальциевых конкрементов.
Лабораторный контроль каждые 12-24 часа: биохимический анализ крови - Na+, K+, Cl-, Ca++, фосфаты, мочевая кислота, креатинин, мочевина, белок, альбумин.
Приложение 10
Коррекция водно-электролитных нарушений




Приложение 11
Критерии вовлеченности (по D.Cheson соавторы в модификации)
Приложение 12
Перечень дополнительных лекарственных средств
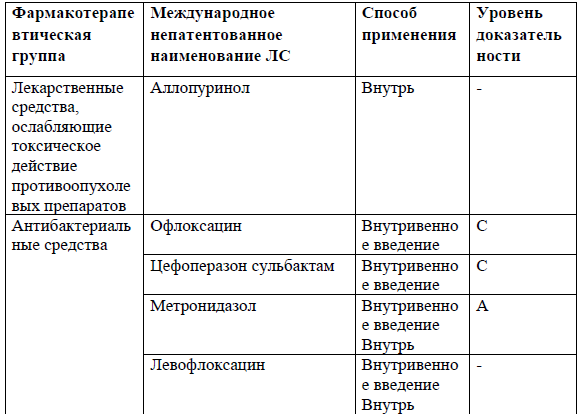
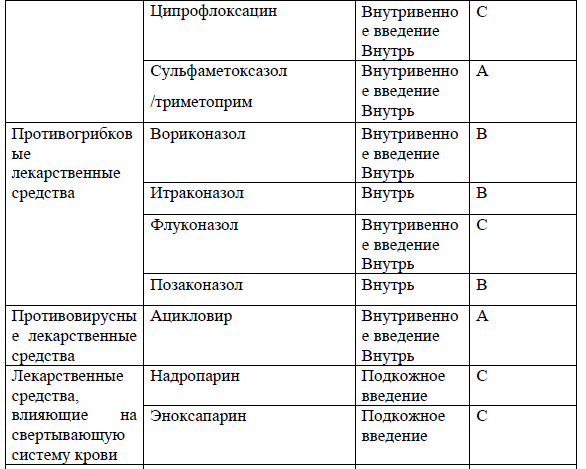
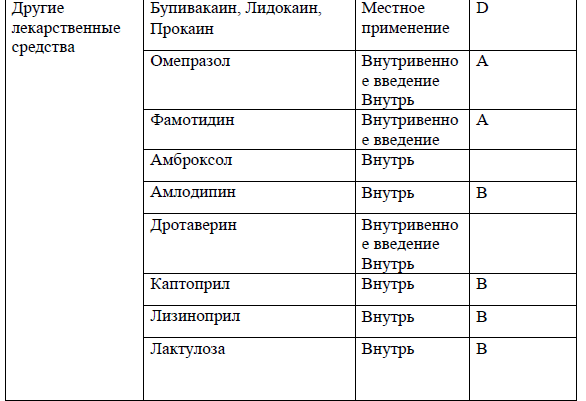
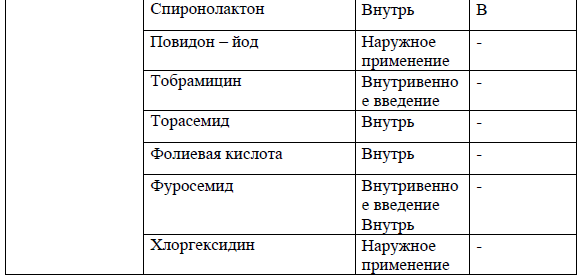
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.