Сахарный диабет 2 типа у детей
 Версия: Клинические рекомендации РФ 2024 (Россия)
Версия: Клинические рекомендации РФ 2024 (Россия)
Общая информация
Краткое описание
Разработчик клинической рекомендации
- Российская ассоциация эндокринологов
Одобрено Научно-практическим Советом Минздрава РФ
В соответствии с Правилами поэтапного перехода медицинских организаций к оказанию медицинской помощи на основе клинических рекомендаций, разработанных и утвержденных в соответствии с частями 3, 4, 6 –9 и 11 статьи 37 Федерального закона «Об основах охраны здоровья граждан в Российской Федерации», утвержденных постановлением Правительства Российской Федерации от 19.11.2021 № 1968 с изменения, клинические рекомендации применяются следующим образом:
– размещенные в Рубрикаторе после 1 января 2024 года – с 1 января 2025 года.
Возрастная категория: Дети
Пересмотр не позднее: 2026
Определение заболевания или состояния (группы заболеваний или состояний)
Сахарный диабет (СД) — это комплексное нарушение обмена веществ, которое характеризуется хронической гипергликемией, обусловленной нарушением секреции или действия инсулина, или сочетанием этих нарушений. Нарушение секреции инсулина и/или снижение реакции тканей на инсулин в составе сложных гормональных процессов приводят к нарушению воздействия инсулина на ткани-мишени, что, в свою очередь, вызывает нарушения углеводного, жирового и белкового обмена. У одного и того же пациента могут одновременно наблюдаться нарушение секреции инсулина и нарушение его действия [1].
СД 2 типа (СД2) – полигенное заболевание, возникающее в результате несоответствия секреции инсулина уровню инсулинорезистентности, т.е. относительной недостаточности инсулина. Как правило, развитие СД2 ассоциировано с другими составляющими метаболического синдрома (дислипидемией, артериальной гипертензией, синдромом поликистозных яичников, неалкогольной жировой болезнью печени).
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
E11.2 - Сахарный диабет 2 типа: с поражениями почек;
E11.3 - Сахарный диабет 2 типа: с поражениями глаз;
E11.4 - Сахарный диабет 2 типа: с неврологическими осложнениями;
E11.5 - Сахарный диабет 2 типа: с нарушениями периферического кровообращения;
E11.6 - Сахарный диабет 2 типа: с другими уточненными осложнениями;
E11.7 - Сахарный диабет 2 типа: с множественными осложнениями;
E11.8 - Сахарный диабет 2 типа: с неуточненными осложнениями;
E11.9 - Сахарный диабет 2 типа: без осложнений.
R73.0 - Отклонения результатов нормы теста на толерантность к глюкозе.
Пример формулировки диагноза: Сахарный диабет 2 типа с неврологическими осложнениями (код по МКБ-10: E11.4).
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
Классификация СД представлена в таблице 1.
Таблица 1 – Этиологическая классификация сахарного диабета (ISPAD, 2022[12])
|
Тип сахарного диабета |
|
|---|---|
|
I. Сахарный диабет 1 типа |
· иммуноопосредованный (характеризуется наличием одного или более аутоиммунных маркеров) · идиопатический |
|
II. Сахарный диабет 2 типа |
Инсулинорезистентность с относительной инсулиновой недостаточностью |
|
III. Другие специфические типы |
A. Наиболее распространенные моногенные формы; B. Генетические дефекты действия инсулина; C. Болезни экзокринной функции поджелудочной железы; D. Эндокринопатии; E. Нарушения, индуцированные приемом фармакологических или химических препаратов F. Инфекции G. Необычные формы иммунно-опосредованного диабета
|
|
IV. Гестационный СД |
Возникает во время беременности |
a Кроме манифестного СД.
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Формирование СД2 является результатом сочетания генетических факторов, факторов окружающей среды и индивидуальных особенностей обмена веществ. Так же, как у взрослых, рост заболеваемости СД2 у детей ассоциирован с увеличением распространенности избыточного веса и ожирения [2,3].
Среди специфичных факторов риска развития СД2 в детском возрасте в настоящее время выделены: внутриутробная задержка роста плода с последующим быстрым набором веса в грудном возрасте, отягощенная наследственность по СД2 среди родственников 1 степени родства, гестационный диабет у матери, как во время пренатального развития ребенка, так и в другие беременности, принадлежность к этническим группам высокого риска развития СД2.
В основе развития СД2 лежат периферические нарушения действия инсулина и/или первичные нарушения секреции инсулина b-клетками. Дефект функции поджелудочной железы в начале заболевания характеризуется потерей первой фазы инсулиновой секреции в ответ на секреторные стимулы. Повышение уровня гликемии в целом, в свою очередь, увеличивает секреторную нагрузку на b-клетки и вызывает гиперинсулинемию [4]. Постепенное усиление периферической инсулинорезистентности происходит одновременно с первичными изменениями в поджелудочной железе. В результате усиливается рабочая нагрузка на b-клетки, что приводит к нарастанию гиперинсулинемии. В результате формируется «порочный круг» изменений с последующим истощением функции b-клеток и манифестацией диабета. При прогрессировании заболевания секреция инсулина значимо снижается и в короткие сроки может развиться абсолютный дефицит инсулина [1].
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Общая численность пациентов с СД2 до 18 лет в Российской Федерации на 31.12.2022 г. составила 697 чел. (2,3 на 100 тыс. детского населения), заболеваемость 177 чел. (0,6 на 100 тыс. детского населения). Распространенность СД2 в 2022 гг. у детей составила 1,18 на 100 тыс. детского населения, у подростков – 8,7 на 100 тыс. подросткового населения. Заболеваемость СД2 у детей в 2022 г. составила 0,33 на 100 тыс. детского населения, у подростков – 2,07 на 100 тыс. подросткового населения [5–10].
Согласно результатам эпидемиологических исследований, заболеваемость СД2 у детей и подростков значительно варьирует. В США среди подростков 12-19 лет самый высокий уровень распространенности СД2 наблюдался среди американских индейцев (1,74 на 1000), следующий - у афроамериканцев (1,05 на 1000), азиатских/тихоокеанских островитян (0,54 в 1000), испанцев (0,48 на 1000), и белых неиспанцев (0,19 в 1000). Увеличение заболеваемости и распространенности СД2 среди молодежи в США и в ряде других популяций, очевидно, является результатом преобладания в них этнических групп высокого риска. Ряд исследований в Европе показывает, что СД2 у подростков остается редким в европейских популяциях, составляя только 1-2% всех случаев диабета [11].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клинические особенности течения СД 2 в подростковом возрасте [13]:
-
В большинстве случаев СД2 возникает у подростков, имеющих избыток массы тела или ту или иную степень ожирения, вплоть до морбидного. При выраженном ожирении нередко отмечается развитие апное во сне.
-
Возраст диагностики в большинстве случаев приходится на середину пубертатного периода (в среднем 13-14 лет) – стадия 3 и выше по Таннеру.
-
Девочки болеют чаще, чем мальчики, в соотношении – 1,2-1,7:1, в зависимости от этнической принадлежности.
-
Отягощенная по СД2 наследственность: 50-75% пациентов имеют родителя с СД2, до 90 % - от 1 до нескольких родственников 1-2 ст. родства с СД2 [4,14].
-
Этническая принадлежность играет важную роль в восприимчивости к СД2.
-
Общим доминирующим признаком является инсулинорезистентность. СД2 у подростков ассоциирован с другими симптомами «метаболического синдрома»: абдоминальным ожирением, артериальной гипертензией, дислипидемией, микроальбуминурией, acanthosis nigricans, неалкогольной жировой болезнью печени.
-
Диапазон клинических проявлений СД2 в возрасте до 18 лет достаточно широк - от умеренной бессимптомной гипергликемии до тяжелого кетоацидоза (крайне редко). У многих пациентов СД2 диагностируется при рутинном обследовании в лаборатории при диспансеризации, при обследовании по поводу ожирения или отягощенной наследственности [14]. До 20 % подростков с СД2 имеют полиурию, полидипсию и потерю веса. До 25 % девочек с СД2 главной жалобой в дебюте имеют влагалищную инфекцию.
Часть подростков с СД2 в дебюте или в течение заболевания развивают кетоз или диабетический кетоацидоз (ДКА), механизм которого не до конца ясен. Предполагается, что инсулинорезистентность в комбинации с неблагоприятным влиянием хронической гипергликемии на секрецию и действие инсулина («глюкозотоксичность») приводит к относительному дефициту инсулина. Когда дефицит становится серьезным (из-за длительной гипергликемии или интеркуррентного заболевания), он приводит к усилению липолитических процессов и повышению уровня свободных жирных кислот, кетонемии и кетонурии [4]. Наиболее часто ДКА встречается у афроамериканцев и испанских пациентов. Проведенные исследования показали, что базальная чувствительность к инсулину в этих группах ниже, чем у их сверстников-европиоидов, что, возможно, увеличивает их чувствительность к развитию относительной инсулиновой недостаточности.
-
Гипергликемическое гиперосмолярное состояние при СД2 описано в основном у афроамериканцев с тяжелыми сопутствующими заболеваниями. Провоцирующие факторы - инфекционные заболевания, медикаменты, некомплаентность, недиагностированный диабет, токсикомания, наличие других хронических заболеваний. Как и у взрослых, это состояние у подростков ассоциировано с высокой смертностью. Причиной смерти являлись гиповолемический шок, полиорганная недостаточность, массивная легочная эмболия и др. В редких случаях у подростков описаны такие осложнения как панкреонекроз, распространенный некроз тонкого кишечника и тромбоз восходящей брыжеечной артерии.
-
Течение СД2 обычно волнообразное. Периоды ухудшения сменяются периодами стабилизации и улучшения. На течение заболевания оказывали влияние смена сезонов года, эмоциональное напряжение, изменение массы тела и др.
-
При СД2 у подростков высок риск развития специфических микро- и макрососудистых осложнений, который значительно превышает таковой при СД1, а также СД2, развывшейся в более старшем возрасте.
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза/состояния:
1) Уровень гликемии и/или уровень гликированного гемоглобина в крови, соответствующие критериям СД (Таблица 2) в сочетании с клинической картиной;
2) Отсутствие аутоантител ассоциированных с СД1 и молекулярно-генетических данных указывающих на моногенный характер СД;
3) Ожирение или избыток массы тела, клинические и/или лабораторные признаки инсулинорезистентности - повышенный уровень инсулина и/или С-пептида натощак и/или в процессе проведения ОГТТ, положительные индексы инсулинорезистентности, другие составляющие «метаболического синдрома» (дислипидемия, артериальная гипертензия (АГ), овариальная гиперандрогения и др.), отягощенный по СД2 наследственный анамнез среди родственников 1 степени родства.
Таблица 2 – Критерии установления СД (ISPAD, 2018 [15])
|
I. Классические симптомы СД или гипергликемического кетоацидотического состояния в сочетании с концентрацией глюкозы в плазме венозной крови ≥11,1 ммоль/л (случайное определение) |
|---|
|
или II. Уровень глюкозы в плазме венозной крови натощак ≥7,0 ммоль/л. (Состояние натощак определяется как отсутствие потребления калорий в течение, по крайней мере, 8 ч.)a |
|
или III. Уровень глюкозы в плазме венозной крови через 2 ч после нагрузки ≥11,1* ммоль/л при проведении перорального глюкозотолерантного теста (ПГТТ)a |
|
или IV. HbA1c ≥ 6,5% b. |
a При отсутствии явной гипергликемии диагноз СД, поставленный на основании этих критериев, необходимо подтверждать повторными тестами.
b Уровень менее 6,5% не исключает возможности диагностики СД по уровню глюкозы. Роль самого по себе HbA1c в диагностике СД1 у детей до конца неясна.
В соответствии с рекомендациями Всемирной Организации Здравоохранения, которых придерживается Российская ассоциация эндокринологов, нормальный уровень глюкозы в плазме венозной крови натощак <6,1 ммоль/л, через 2 ч после нагрузки <7,8 ммоль/л при проведении ПГТТ. Промежуточными стадиями в процессе прогрессирования нарушений углеводного обмена от нормального гомеостаза глюкозы до клинического СД1 являются: нарушенная толерантность к глюкозе (НТГ) и нарушенная гликемия натощак (НГН). Данные состояния не являются самостоятельными нозологическими единицами, а расцениваются как «предиабет» [15,16], что отражает высокий риск развития СД.
НТГ и НГН - не взаимозаменяемые понятия, так как представляют собой разные уровни нарушения регуляции глюкозы: базального метаболизма и динамического ответа на стандартизированную нагрузку глюкозой.
Критерии диагностики НГТ и НГН [17]:
-
НГН определяется как уровень глюкозы в плазме венозной крови натощак ≥6,1 и <7,0 ммоль/л;
-
НТГ определяется как уровень глюкозы в плазме венозной крови через 2 ч после нагрузки ≥7,8 <11,1ммоль/л при проведении ПГТТ.
1. Жалобы и анамнез
Дебют СД2 у детей приходится на второе десятилетие жизни, совпадая с периодом полового созревания. Заболевания крайне редко манифестирует в допубертатном возрасте. Клиническая картина манифестации СД2 у детей варьирует от бессимптомной гипергликемии, до ярко выраженной клинической симптоматики СД.
Большинство подростков в дебюте СД2 предъявляют жалобы на жажду, полиурию, усталость, повышенную утомляемость, в некоторых случаях отмечается снижение веса, рецидивирующие вульвиты и баланиты. При развитии кетоза отмечается запах ацетона изо рта, сухость кожных покровов и слизистых, рвота, нарушение сознания вплоть до коматозного состояния при ДКА. У части детей проявления гипергликемии и обезвоживания в дебюте СД2 отсутствуют и диагностика заболевания может быть случайной при диспасеризации или обследовании по поводу ожирения или других состояний [14].
Развитие заболевания у большинства детей происходит на фоне избыточного веса и ожирения. Пациенты предъявляют жалобы на повышение артериального давления, потемнение кожных покровов в естественных складках, нарушение сна, храп, сонливость днем, у девочек может отмечаться нарушение менструального цикла и повышенное оволосение [18].
2. Физикальное обследование
Физикальное обследование включает осмотр кожных покровов на наличие потемнений в естественных складках (acantosis nigricans) и признаков гирсутизма (у девочек), измерение массы тела и роста с расчетом индекса массы тела и SDS ИМТ, оценку наличия перераспределения подкожно-жировой клетчатки по абдоминальному типу, измерение АД на периферических артериях [14].
3. Лабораторные диагностические исследования
-
Рекомендуется исследование уровня глюкозы в крови в лабораторных условиях для диагностики СД2 у пациентов с клиническими проявлениями СД и/или гипергликемией [15,17].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии:
o Не рекомендуется исследование уровня глюкозы в крови с помощью глюкометров для диагностики СД2, так как глюкометры не обладают достаточной точностью для убедительной постановки диагноза и могут привести к ошибкам при диагностике;
o В отсутствии симптомов диагностика СД2 не может основываться только на однократном измерении гликемии. Если есть сомнения в диагнозе, может потребоваться продолжительное наблюдение с исследованием гликемии натощак и/или через 2 часа после еды и/или проведение ПГТТ;
o Гипергликемия, определенная в условиях стресса, на фоне острой инфекции, травмы, хирургического вмешательства, нарушения дыхательной функции, проблем с кровообращением и т.п., может быть транзиторной и требовать лечения, но сама по себе не указывает на наличие СД.
-
При отсутствии клинических симптомов СД у пациентов с гипергликемией, рекомендуется проведение повторного исследования уровня глюкозы в крови в лабораторных условиях и/или ПГТТ для диагностики СД2 [15,17].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: ПГТТ не должен проводиться, если СД можно диагностировать с помощью показателей гликемии натощак, постпрандиально или в течение дня.
Правила проведения ПГТТ:
ПГТТ следует проводить утром на фоне не менее чем 3-дневного неограниченного питания и обычной физической активности. Тесту должно предшествовать ночное голодание в течение 8–10 часов (можно пить воду). Последний вечерний прием пищи должен содержать 30–50 г углеводов. После забора крови натощак испытуемый должен не более чем за 5 мин выпить раствор #декстрозы** из расчета 1,75 г безводной #декстрозы** (1,925 г моногидрата #декстрозы**) на кг массы тела, но не более 75 г (82,5 г), растворенных в 250–300 мл воды [12]. В процессе теста не разрешается курение. Через 2 часа осуществляется повторный забор крови.
Для предотвращения гликолиза и ошибочных результатов определение концентрации глюкозы проводится сразу после взятия крови, или кровь должна быть центрифугирована сразу после взятия, или храниться при температуре 0–4°С, или быть взята в вакуумную пробирку с фторидом натрия и ЭДТА.
ПГТТ не проводится:
-
на фоне острого заболевания;
-
на фоне кратковременного приема препаратов, повышающих уровень гликемии.
-
Рекомендуется у детей с клиническими проявлениями СД и/или гипергликемией исследование уровня гликированного гемоглобина в крови в лабораторных условиях для диагностики СД2 [15].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии:
o Исследование уровня гликированного гемоглобина должно проводиться методами (оборудование и наборы), сертифицированными NGSP и стандартизированными по Diabetes Control and Complications Trial (DCCT);
o Значительное расхождение показателей гликированного гемоглобина с уровнем глюкозы в крови может быть обусловлено наличием различных вариантов гемоглобина (гемоглобинопатия) у пациента, что влияет на результат, получаемый рядом методов и в этом случае, следует использовать альтернативный метод определения гликированного гемоглобина.
o В условиях, влияющих на продолжительность жизни эритроцитов (железодефицитная, серповидно-клеточная анемия, беременность, гемодиализ, недавняя кровопотеря или переливание, или терапия эритропоэтином и др.), для диагностики СД2 следует использовать только определение уровня глюкозы в плазме крови.
-
Рекомендуется у детей с клиническими проявлениями СД и/или гипергликемией обнаружение кетоновых тел в моче или крови для диагностики степени нарушения углеводного обмена [15].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: При значительном повышении кетонов в крови или моче требуется безотлагательно начинать лечение, ребенок должен быть направлен к специалисту по диабету в тот же день в связи с высоким риском развития ДКА.
3.1 Лабораторные диагностические исследования, проводимые в целях дифференциальной диагностики
-
Рекомендуется у детей с подозрением на СД2 определение содержания антител к антигенам островковых клеток поджелудочной железы в крови (GADA; IA-2; антитела к клеточному транспортеру ZnT8) для исключения СД1 [19,20] .
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 3)
Комментарии: Наличие одного или более аутоантител, ассоциированных с диабетом (аутоантитела к глутаматдекарбоксилазе – GADA; аутоантитела к тирозинфосфотазе – IA-2; аутоантитела к транспортеру цинка 8 – ZnT8), подтверждает диагноз СД1.
При отрицательном титре островковых аутоантител, учитывая гетерогенность и «перекрытие» клинической картины различных типов СД у детей, целесообразно рассмотреть вопрос о проведении молекулярно-генетического исследования в следующих случаях:
-
Наличие СД в семье с аутосомно-доминантным типом наследования;
-
Умеренной гипергликемией натощак (5,5-8,5 ммоль/л), особенно в младшем возрасте, без ожирения;
-
Длительным «медовым месяцем» (более 1 года) или необычно низкой потребностью в инсулине (менее 0,5 ЕД/кг/сут) при длительности СД более года;
-
Ассоциированными состояниями, такими как глухота, атрофия диска зрительных нервов, или синдромальными формами (митохондриальные болезни, липоатрофический диабет, синдром Рабсона-Менделхола, синдром Альстрема).
-
Рекомендуется исследование тощакового и стимулированного уровня С-пептида в крови и/или инсулина плазмы крови у детей с подозрением на СД2 для выявления инсулинорезистентности/оценки степени секреции эндогенного инсулина [21].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: повышенный уровень С-пептида/инсулина не характерен для СД1 через 12-14 месяцев от начала заболевания, определяемый уровень С-пептида не характерен для СД1 через 5 лет от начала заболевания.
4. Инструментальные диагностические исследования
Специальных инструментальных диагностических исследований для диагностики СД2 не предусмотрено. Инструментальные диагностические исследования для диагностики осложнений и сопутствующей патологии СД2 представлены в соответствующем разделе.
5. Иные диагностические исследования
Не применяется.
Осложнения
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
СД2 у детей и подростков, как правило, сопровождается наличием у пациента ожирения и инсулинорезистентности. К факторам риска развития СД2 и инсулинорезистентности относятся: преждевременное адренархе [60], малый вес при рождении по отношению к гестационному возрасту, ожирение матери во время беременности [61], также ожирение и малоподвижный образ в раннем детском возрасте.
1. Осложнения и коморбидные состояния СД2
Специфические осложнения СД в подростковом возрасте - микрососудистые нарушения: диабетические ретинопатия (ДР), нефропатия (ДН), нейропатия.
Факторы риска:
-
большая длительность заболевания, старший возраст и пубертатный период;
-
курение;
-
АГ;
-
дислипидемия;
-
отягощенная наследственность в отношении развития осложнений;
-
ожирение;
-
сидячий образ жизни.
Патогенез специфических осложнений СД сложен: нарушения микроциркуляции, свертывающей и фибринолитической систем крови, системы антиоксидантной защиты, обмена белковых компонентов сосудистой стенки и проницаемости сосудов. Хроническая гипергликемия активирует процессы неферментативного гликирования белков, полиоловый путь метаболизма глюкозы и прямую глюкозотоксичность.
1.1 Диабетическая нефропатия
Диабетическая нефропатия (ДН) - специфическое поражение почек при СД, сопровождающееся формированием узелкового гломерулосклероза, приводящего к развитию терминальной почечной недостаточности, требующей проведения заместительной почечной терапии (диализ, трансплантация). Факторами, способствующими прогрессированию являются: длительность СД2, уровень гликированного гемоглобина выше индивидуального целевого показателя, повышение диастолического артериального давления (АД) [62].
Классификация
Диагноз ДН устанавливается в соответствии с классификацией хронической болезни почек (ХБП) по стадии снижения скорости клубочковой фильтрации и уровню альбуминурии [63].
Стадии ХБП у больных СД
|
СКФ (мл/мин/1,73м2) |
Определение |
Стадия |
|---|---|---|
|
>90 |
Высокая и оптимальная |
С1 |
|
60-89 |
Незначительно сниженная |
С2 |
|
45-59 |
Умеренно сниженная |
С3а |
|
30-44 |
Существенно сниженная |
С3б |
|
15-29 |
Резко сниженная |
С4 |
|
<15 |
Терминальная почечная недостаточность |
С5 |
*СКФ – скорость клубочковой фильтрации
Формула Шварца (модификация Bedside) [64,65] для расчета СКФ у детей:
СКФ (мл/мин/1.73 м²) = (36.2 × Рост(см)) / Креатинин плазмы крови (мкмоль/л)
Для определения креатинина в сыворотке крови должны использоваться методы с калибровкой по масс-спектрометрии с изотопным разведением.
Классификация ХБП по уровню альбуминурии
|
Категория |
А/Кр мочи |
СЭА (мг/24 часа) |
Описание |
|
|---|---|---|---|---|
|
мг/моль |
мг/г |
|||
|
А1 |
<3 |
<30 |
<30 |
Норма или незначительно повышена |
|
А2 |
3-30 |
30-300 |
30-300 |
Умеренно повышена |
|
А3 |
>30 |
>300 |
>300 |
Значительно повышена* |
Примечание: А/Кр – отношение альбумин/креатинин, СЭА – скорость экскреции альбумина, *включая нефротический синдром (экскреция альбумина >2200 мг/24 час [А/Кр>2200 мг/г; >220 мг/ммоль])
Пример формулировки диагноза: Диабетическая нефропатия, ХБП С1А2.
При нормальном уровне СКФ и альбумина в моче (стадия С1А1) диагноз ХБП может быть выставлен только при наличии других маркеров повреждения почек [66,67].
-
Рекомендуется ежегодно у детей с СД2, начиная с момента установления диагноза определение альбумина в моче и исследование уровня креатинина в моче с оценкой соотношения альбумин/креатинин с целью своевременного выявления ДН [66,67].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: Наличие микроальбуминурии подтверждается следующим: соотношение альбумин/креатинин от 2,5 до 30 мг/ммоль или от 30 до 300 мг/ г (разовая порция мочи) у мужчин и от 3,5 до 30 мг/ммоль или от 42 до 300 мг/ г у женщин (из-за снижения экскреции креатинина).
Разовая порция мочи на микроальбуминурию предпочтительнее из-за известных суточных колебаний экскреции альбумина и постуральных эффектов. Сбор суточной мочи на микроальбуминурию затруднителен и малоинформативен.
Вследствие биологической вариабельности необходимо использовать два из трех положительных образца утренней мочи на микроальбуминурию для ее подтверждения. Стойкая альбуминурия (протеинурия) определяется наличием изменений в двух или всех трех пробах в течение периода от 3 до 6 месяцев.
Факторами, которые могут давать ложноположительные результаты являются следующие: предшествующая физическая нагрузка, инфекции, повышенная температура тела, менструальные выделения, заболевания почек, лихорадка и выраженная гипергликемия. Аномальные (ложноположительные) результаты тестирования должны перепроверяться, так как микроальбуминурия может быть преходящей.
-
Рекомендуется использование препаратов из группы ингибиторов ангиотензинпревращающего фермента (АПФ) (Таблица 4) у детей с СД2 и постоянной микроальбуминурией для снижения уровня и прогрессирования альбуминурии [21]. [68–72]
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии:
Таблица 4 – Ингибиторы АПФ
|
Анатомо-терапевтическо-химическая классификация (АТХ) |
Международное непатенотованное название (МНН) |
Способ применения |
Доза и длительность приема |
Ссылки |
|---|---|---|---|---|
|
ингибиторы АПФ |
#каптоприл** |
Внутрь, 2-3 раза в день. |
0,9 мг/кг/день |
[68–73]
|
-
Рекомендуется исследование уровня креатинина в крови и оценка скорости клубочковой фильтрации (СКФ) у детей с СД2 при наличии стойкой альбуминурии (протеинурии) для определения степени нарушения почечной функции [74].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
-
Рекомендуется прием (осмотр, консультация) врача-нефролога у детей с СД2 при наличии стойкой альбуминурии (протеинурии) для дифференциальной диагностики с недиабетическими поражениями почек и лечения хронической болезни почек [74].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
1.2 Диабетическая ретинопатия
Диабетическая ретинопатия (ДР) - специфичное позднее нейромикрососудистое осложнение СД, развивающееся, как правило, последовательно от изменений, связанных с повышенной проницаемостью и окклюзией ретинальных сосудов до появления новообразованных сосудов и фиброглиальной ткани.
Диабетический макулярный отек (ДМО) — утолщение сетчатки, связанное с накоплением жидкости в межклеточном пространстве нейроэпителия вследствие нарушения гематоретинальных барьеров и несоответствия между транссудацией жидкости, и способности к ее реабсорбции. ДМО может развиться при любой стадии ДР.
Классификация ДР выделяет три основных стадии заболевания:
1. Непролиферативная: микроаневризмы, мелкие интраретинальные кровоизлияния, «мягкие» («ватные») экссудаты.
2. Препролиферативная: наличие хотя бы одного из 3 признаков:
o венозные деформации в 2-х и более квадрантах
o умеренные ИРМА хотя бы в одном квадранте
o множественных ретинальные геморрагии в 4-х квадрантах глазного дна.
3. Пролиферативная (у детей редко): неоваскуляризация (и/или фиброзная пролиферация) диска зрительного нерва и/или сетчатки, преретинальные и/или витреальные кровоизлияния (гемофтальм), тракционная (или тракционно-регматогенная) отслойка сетчатки, неоваскулярная глаукома.
-
Рекомендуется ежегодно у детей с СД2, начиная с момента установления диагноза, прием (осмотр и консультация) врача-офтальмолога с целью своевременного выявления ДР [75,76].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: Скрининг на ДР проводится с помощью определения ретинальной остроты зрения (визометрия), биомикроскопии глазного дна, офтальмоскопии при расширенном зрачке (осмотр периферии глазного дна с использованием трехзеркальной линзы Гольдмана) и биомикрофотография глазного дна с использованием фундус-камеры [77].
-
Рекомендуется проводить скрининг на ДР чаще одного раза в год у детей с СД2 при высоком риске потери зрения с целью его предотвращения [77]. [75,76].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: В связи с потенциальным ухудшением течения ДР у детей с длительным плохим гликемическим контролем при его стабильном улучшении рекомендуется проводить офтальмологический мониторинг до начала интенсивного лечения и каждые три месяца в течение 6-12 месяцев после его начала, особенно если ДР перед началом интенсификации терапии находилась на умеренной непролиферативной стадии или более тяжелой, или произошло ее прогрессирование на фоне лечения.
-
Рекомендуется у детей с СД2 и тяжелой непролиферативной или пролиферативной ретинопатией, и\или диабетическим макулярным отеком проведение панретинальной лазерной коагуляции сетчатки и интравитреальное введение средств, препятствующих новообразованию сосудов (дозы соответствуют инструкциям по медицинскому применению лекарственных препаратов данной фармакологической группы относительно взрослых пациентов), с целью предотвращения или снижения частоты и/или уровня потери зрения [77–80].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: несмотря на то, что не имеется достаточно литературных данных, подтверждающих эффективность и безопасность панретинальной лазерной коагуляции сетчатки и интравитреального введения средств, препятствующих новообразованию сосудов (анти-VEGF) у детей с СД2, данные методы обладают доказанной эффективностью при ДР у взрослых пациентов с СД1 [77–80]. Поэтому, нет никаких оснований предполагать, что эти данные не могут распространяться на детей с СД2.
1.3. Диабетическая нейропатия
Диабетическая нейропатия – комплекс клинических и субклинических синдромов, каждый из которых характеризуются диффузным или очаговым поражением периферических и/или автономных нервных волокон в результате СД2. Диабетическая дистальная полинейропатия (ДПП) является наиболее распространенной генерализованной формой, при котором присутствует диффузное повреждение всех периферических моторных и сенсорных нервных волокон. Такое повреждение появляется бессимптомно, но затем прогрессирует вначале до снижения сенсорных функций и позднее приводит к утрате моторной функции с распределением по типу чулок и перчаток. Автономная кардиоваскулярная нейропатия (КАН) возникает в результате поражения вегетативного отдела нервной системы и может проявляться в виде ортостатической гипотензии, нарушению адекватной реакции показателей частоты сердечного ритма (ЧСС) и удлинению интервала Q-T. КАН ассоциирована с риском внезапной смерти и другими сердечно-сосудистыми факторами риска [76,80–82].
-
Рекомендуется ежегодно у детей с СД2 с момента установления диагноза прием (осмотр, консультация) врача-невролога с целью своевременного выявления диабетической нейропатии [21,81,83,84].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Специфические тесты для диагностики ДПП и включают в себя оценку общей и вибрационной чувствительности, рефлексов. Специфические тесты для диагностики КАН могут включать в себя проведение кардиоваскулярных тестов и/или оценку ВРС в частотном или временном диапазоне на коротких или длительных промежутках времени [84,85].
1.4. Дислипидемия
-
Рекомендуется исследование уровня холестерина липопротеинов высокой плотности в крови, исследование уровня триглицеридов в крови, исследование уровня холестерина в крови, исследование уровня холестерина липопротеинов низкой плотности у детей с СД2 при диагностике заболевания и затем один раз в год с целью своевременного выявления дислипидемии, в случае выявления дислипидемии исследование повторяют 1 раз в 6 месяцев [85,86].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Повышение уровня триглицеридов, снижение ЛПВП характерно для СД2, ожирения и гиперинсулинизма [87]. Высокий уровень холестерина ЛПНП определяется при его значениях выше 2,6 ммоль/л, низкий уровень холестерина ЛПВП - менее 0,91 ммоль/л, высокий уровень триглицеридов – более 1,7 ммоль/л. В этих случаях детям с СД2 рекомендуется улучшение метаболического контроля, изменения в питании (гипохолестериновая диета) и увеличение физической активности.
-
При сохранении дислипидемии через 6 месяцев, а также при повышении уровня триглицеридов натощак более 5,6 ммоль/л рекомендуется прием (осмотр, консультация) врача-детского кардиолога [21,86,87].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Повышение уровня триглицеридов повышает риск развития панкреатита.
1.5. Артериальная гипертензия
Гипертония у пациентов с СД2 ассоциирована с эндотелиальной дисфункцией, повышенным риском развития сердечно-сосудистых и почечных заболеваний. Частота встречаемости у молодых пациентов с СД2 от 13,9 через 7 месяцев от диагностики СД 2 до 33,8% через 3,9 лет [87].
-
Рекомендуется проводить измерение артериального давления на периферических артериях. у детей с СД2 начиная с момента диагностики заболевания и далее каждые 6 месяцев для своевременного выявления стабильного повышения уровня АД [21]. [87].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: При выявленном впервые повышении АД более 95 перцентили рекомендовано снижение массы тела, ограничение потребления пищевой соли, расширение физических нагрузок [21]. Поддержание показателей АД в целевом диапазоне в исследовании UKPDS у взрослых пациентов с СД2 показало достоверную корреляцию со снижением частоты развития микро- и макро-сосудистых осложнений в той же степени, что и улучшение метаболического контроля.
-
Рекомендуется прием (осмотр, консультация) врача-детского кардиолога детям с СД2 с диагностированным стабильным (при сохраняющемся повышении АД более 95 перц через 6 месяцев) повышением уровня АД с целью своевременной диагностики, подтверждения диагноза и назначения терапии АГ [66,85].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
-
Рекомендуется применение препаратов из группы ингибиторов АПФ у детей с АГ и СД2 для снижения АД [66,85,88,89].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: несмотря на то, что не имеется достаточно литературных данных, подтверждающих эффективность и безопасность данной терапии у детей с СД2 и АГ, она обладает доказанной эффективностью при АГ у детей без СД [85] и при АГ у молодых взрослых пациентов с СД2 [87]. Поэтому, нет никаких оснований предполагать, что эти данные не могут распространяться на детей с СД2. Режим дозирования определяется в соответствии с инструкцией по медицинскому применению конкретного лекарственного препарата данной фармакологической группы.
-
Рекомендуется у детей с СД2 в дебюте заболевания и далее по показаниям проведение эхокардиографии и ультразвукового исследования почек для исключения патологии сердца и почек различного генеза [21,86].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
1.6. Овариальная гиперандрогения
Наличие гиперандрогении в детском возрасте является фактором риска развития синдрома поликистозных яичников у взрослых
-
Рекомендуется проведение осмотра для выявления наличия гирсутизма и/или признаков гиперандрогении, а также фиксировать данные о регулярности менструального цикла у пациенток с СД2 начиная с дебюта заболевания и далее каждые 6 месяцев [21].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
-
Рекомендован прием (осмотр, консультация) врача-акушера-гинеколога при олиго- или аменореи, гирсутизме и других признаках гиперандрогении с целью своевременной диагностики, подтверждения диагноза и назначения терапии [21,90].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
1.7. Неалкогольная жировая болезнь печени (НАЖБП)
Стеатогепатит диагностируется у 25-50% пациентов с СД2, при прогрессировании заболевания развивается цирроз печени, портальная гипертензия [91,92].
-
Рекомендуется определение активности аланинаминотрансферазы и аспартатаминотрансферазы в крови, ультразвуковое исследование органов брюшной полости (комплексное) при диагностике СД2 и далее каждые 6 месяцев для своевременного выявления НАБЖП [93].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
-
Рекомендуется детям с СД2 при повышении уровня печеночных ферментов более чем в 2,5 раза и/или ультразвуковых изменений структуры печени прием (осмотр, консультация) врача-гастроэнтеролога с целью своевременной диагностики, дифференциальной диагностики и назначения терапии [94,95].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
1.8. Синдром обструктивного апноэ сна (СОАС)
-
Рекомендуется особенно обращать внимание на следующие жалобы: снижение качества ночного сна, храп, апноэ, утренние головные боли, дневную сонливость, никтурию, энурез у детей с СД2, начиная с момента диагностики и далее каждые 6 месяцев для своевременного выявления СОАС [96,97].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: При выявлении вышеперечисленных жалоб у детей с СД2 необходима прием (осмотр, консультация) врача-невролога (сомнолога) с целью своевременной диагностики, подтверждения диагноза и назначения терапии СОАС [21].
2. Диабетический кетоацидоз
ДКА при СД2 встречается очень редко. Терапия проводится как при СД1.
3. Гипогликемия
В настоящее время принята следующая классификация гипогликемий [98]:
Уровень 1: значения глюкозы плазмы от 3,0 до < 3,9 ммоль/л (с симптомами или без) у пациентов с СД, получающих сахароснижающую терапию, указывают на риск развития гипогликемии и требуют начала мероприятий по купированию гипогликемии независимо от наличия или отсутствия симптомов.
Уровень 2: значения глюкозы плазмы <3,0 ммоль/л, с симптомами или без – клинически значимая гипогликемия, требующая немедленного купирования.
Уровень 3: тяжелая гипогликемия – гипогликемия в пределах вышеуказанного диапазона с таким нарушением когнитивных функций (включая потерю сознания, т.е. гипогликемическую кому), которые требуют помощи другого лица для купирования.
-
Рекомендуется начинать мероприятия по лечению гипогликемии у пациентов с СД2 при уровне глюкозы плазмы крови < 3,9 ммоль/л для профилактики развития тяжелой гипогликемии [98].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Основная причина гипогликемии: избыток инсулина в организме по отношению к поступлению углеводов извне (с пищей) или из эндогенных источников (продукция глюкозы печенью), а также при ускоренной утилизации углеводов (мышечная работа).
Провоцирующие факторы:
- передозировка препарата инсулина и его аналогов: ошибка пациента, ошибка функции инсулиновой шприц-ручки, инсулиновой помпы***, глюкометра, намеренная передозировка; ошибка врача (слишком низкий целевой уровень гликемии, слишком высокие дозы);
- изменение фармакокинетики препарата инсулина и его аналогов: высокий титр антител к инсулину, неправильная техника инъекций;
- повышение чувствительности к препарату инсулина и его аналогов: длительная физическая нагрузка, ранний послеродовой период, надпочечниковая или гипофизарная недостаточность;
- пропуск приема или недостаточное количество ХЕ, алкоголь, ограничение питания для снижения массы тела (без соответствующего уменьшения дозы инсулина); замедление опорожнения желудка (при автономной нейропатии), рвота, синдром мальабсорбции;
-
Рекомендуется пероральный прием 10-15 грамм или 0,3 грамм/кг быстро усваиваемых углеводов при возникновении легкой гипогликемии (не требующей помощи другого лица, глюкоза < 3,9 ммоль/л) у пациентов с СД2 для профилактики развития тяжелой гипогликемии [98].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Лечение гипогликемии должно повысить уровень глюкозы в крови примерно на 3-4 ммоль/л. В зависимости от обстоятельств (гипогликемия в ночное время, физическая нагрузка и др.), после быстро усваиваемых углеводов следует принять дополнительные медленно усвояемые углеводы, чтобы предотвратить повторение гипогликемии. После приема углеводов следует повторно измерить уровень глюкозы в крови через 10-15 минут, чтобы убедиться, что был достигнут целевой уровень глюкозы. При отсутствии достаточного повышения уровня глюкозы необходимо повторить прием быстро усваиваемых углеводов с последующим измерением глюкозы крови еще через 10–15 минут.
3.1 Тяжелая гипогликемия
Тяжелая гипогликемия определяется как событие с тяжелыми когнитивными нарушениями (включая кому и судороги), требующее помощи другого человека для активного введения углеводов, глюкагона** или других корректирующих действий. Гипогликемическая кома является одним из видов тяжелой гипогликемии, которая приводит к потере сознания (коме) и судорогам. Тяжелая гипогликемия требует безотлагательного лечения.
-
Рекомендуется введение декстрозы** (10% раствор 2-3 мл/кг массы тела внутривенно) или введение глюкагона** (1 мг при массе тела ≥25 кг или 0,5 мг при массе тела <25 кг внутримышечно или подкожно или 3 мг #глюкагона интраназально[1]) у пациентов с СД2 для лечения тяжелой гипогликемии [98].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Глюкагон** должен быть доступен для всех пациентов, родителей и лиц, обеспечивающих уход за детьми с СД2, получающих инсулинотерапию, особенно когда существует высокий риск тяжелой гипогликемии. Данные лица должны быть должным образом обучены технике инъекции препарата [99].
[1] Способ применения (путь введения) прошел клинические испытания, но данный способ введения отсутствует в инструкции к лекарственному препарату в Российской Федерации на момент публикации клинических рекомендаций
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Лечение СД2 у детей складывается из следующих основных компонентов:
-
сахароснижающая терапия;
-
обучение самоконтролю и проведение его в домашних условиях;
-
питание;
-
физические нагрузки;
- психологическая помощь.
1. Оценка и целевые показатели гликемического контроля
-
Рекомендуется у всех детей с СД2 исследование уровня гликированного гемоглобина в крови каждые три месяца с целью оценки гликемического контроля и эффективности проводимого лечения [21,22].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
-
Рекомендуется достижение и поддержание гликированного гемоглобина у детей с СД2 на уровне <7,0% для снижения риска развития и прогрессирования хронических осложнений СД [22–24].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: Необходимыми условиями достижения целевого уровня гликемического контроля является:
o Регулярный контроль НвА1с (4 раза в год).
o Регулярный самоконтроль гликемии. Частота контроля индивидуальна, основывается на уровне компенсации заболевания и вида применяемой сахароснижающей терапии (от измерения гликемии натощак и после еды несколько раз в неделю при хорошей компенсации, до 6-10 раз в день на интенсифицированной схеме инсулинотерапии).
o Регулярная оценка и коррекция лечения.
o В связи с отсутствием систематических данных в возрастной категории «дети и подростки» данные экстраполированы возрастной категории «взрослые и молодые взрослые»
2. Медикаментозная терапия
В терапии СД2 у детей используются препараты метформина** и препараты инсулина и его аналогов, как в монотерапии, так и в комбинации, в зависимости от выраженности симптомов СД, степени гипергликемии, наличия или отсутствия кетоза/кетоацидоза. Применение лираглутида при СД2 у подростков показало свою эффективность и безопасность в клинических исследованиях. Целью медикаментозной терапии является достижение и поддержание оптимального гликемического контроля, предотвращение развития острых и хронических осложнений, улучшение чувствительности к инсулину, повышение эндогенной секреции инсулина [4,25].
-
Рекомендуется у детей с СД2 в возрасте >10 лет применение метформина** для достижения целевых показателей гликемического контроля [26].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: При диагностике СД2, метформин** может быть назначен в виде монотерапии, при уровне гликированного гемоглобина <8,5% и отсутствии кетоза или в сочетании с инсулинотерапией при уровне гликированного гемоглобина ≥8,5% или наличии кетоза/ДКА (назначается после устранения кетоза). Во втором случае, переход к монотерапии метформином** после манифестации СД2 обычно возможен в течение 2-6 недель. При добавлении препаратов метформина**, доза инсулина и его аналогов снижается на 30-50% при каждом повышении дозы метформина** (Приложение Б).
Начальная доза метформина** составляет 500 мг в день. Доза титруется 1 раз в неделю. Максимальная суточная доза составляет 1000 мг дважды в день или 850 мг трижды в день.
o Риск развития гипогликемии при монотерапии метформином** крайне низок.
o Побочные эффекты со стороны желудочно-кишечного тракта (боли в животе, диарея, тошнота) возможны при применении метформина**, но в большинстве случаев могут быть минимизированы путем медленной титрации доз (в течение 3-4 недель) и приемом совместно с едой.
o Риск развития лактатацидоза на фоне приема метформина** крайне низок. Однако метформин** не следует назначать пациентам с кетоацидозом, почечной, сердечно-сосудистой и легочной недостаточностью. Терапию метформином** следует временно отменить при необходимости применения радиоконтрастных веществ, в случае желудочно-кишечных заболеваний.
-
Рекомендуется у детей с СД2 применение инсулинов длительного действия и их аналогов для инъекционного введения (таблица 3), с целью достижения целевого уровня гликемического контроля [21,27].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: инсулины длительного действия (и их аналоги для инъекционного введения) назначаются: 1) при диагностике СД2 и уровне гликированного гемоглобина ≥8,5% и/или кетозе/ДКА в виде монотерапии или в сочетании с метформином** у детей старше 10 лет (после купирования ДКА), или 2) при НвА1с выше целевого уровня в случае монотерапии метформином** в течение 3-4 месяцев (Приложение Б).
Инсулины длительного действия (и их аналоги для инъекционного введения) и схема их введения подбираются индивидуально для каждого пациента исходя из профиля действия препарата и индивидуальной переносимости. Начальная доза инсулина длительного действия (и его аналогов для инъекционного введения) составляет 0,25-0,5 ЕД/кг/сут. Титрация доз проводится по показателям гликемии до достижения целевых показателей гликемического контроля.
Таблица 3 – Виды и профиль действия препаратов инсулина
|
Анатомо-терапевтическо-химическая классификация (АТХ) |
Вид инсулина |
Международное непатентованное наименование (МНН) |
Начало действия (ч) |
Пик действия (ч) |
Длительность действия (ч) |
Возрастные ограничения |
|---|---|---|---|---|---|---|
|
Инсулины короткого действия и их аналоги для инъекционного введения |
Сверхбыстрого действия (аналоги инсулина человека), ИСБД |
Инсулин аспарт** (имеющий в составе вспомогательные вещества: никотинамидa и аргининa) [28,29] |
5-10 минут |
1-3 |
3-5 |
Старше 1 года |
|
Ультракороткого действия (аналоги инсулина человека), ИУКД |
Инсулин аспарт** [30,31] |
10–20 минут |
1-3 |
3-5 |
Старше 1 года |
|
|
Инсулин глулизин** [32,33] |
Старше 6 лет |
|||||
|
Инсулин лизпро** 100 ЕД/мл [33–36] |
Нет |
|||||
|
Короткого действия, ИКД |
Инсулин растворимый человеческий генно-инженерный** [34,35] |
0,5-1 |
2–4 |
5–8 |
Нет |
|
|
Инсулины средней продолжительности действия и их аналоги для инъекционного введения |
Средней продолжительности действия (НПХ-инсулины) |
Инсулин-изофан человеческий генно-инженерный** [37–39] |
2-4 |
4-12 |
12-24 |
Нет |
|
Инсулины длительного действия и их аналоги для инъекционного введения |
Длительного действия (аналоги инсулина человека), ИДД |
Инсулин гларгин** 100 ЕД/мл [37,38] |
2-4 |
8-12 |
22-24 |
Старше 2 лет |
|
Инсулин детемир** [39–41] |
1-2 |
4-7 |
20-24 |
|
||
|
Сверхдлительного действия (аналоги инсулина человека), ИСДД |
Инсулин гларгин** 300 ЕД/мл [42] |
2-6 |
Не выражен |
30-36 |
Старше 6 лет |
|
|
Инсулин деглудек** [31,40,43] |
0,5-1,5 |
Не выражен |
Более 42 |
Старше 1 года |
||
|
Инсулины средней продолжительности действия или длительного действия и их аналоги в комбинации с инсулинами короткого действия для инъекционного введения |
Комбинация ИСДД и ИУКД (аналоги инсулина человека) |
инсулин деглудек + инсулин аспарт** [30] |
Такие же, как у инсулинов аспарт и деглудек, т.е. в комбинации они действуют раздельно |
Старше 2 лет |
||
Дозы препаратов инсулина и его аналогов и схема введения подбираются индивидуально для каждого пациента исходя из возраста, профиля действия инсулина, индивидуальной переносимости и пр. на основании данных гликемического контроля (показателей гликемии и уровня НbА1с).
Перевод с одного препарата инсулина и его аналогов на другой происходит достаточно часто. При переводе пациента с одного инсулина на другой необходимо соблюдать следующий алгоритм требований для наилучшего обеспечения безопасности пациента [44]:
1. В случае разных МНН.
• Перевод с одного препарата инсулина и его аналогов на другой должен осуществляться строго по медицинским показаниям, только при участии врача, требует более частого самоконтроля уровня глюкозы, обучения пациента и коррекции дозы вновь назначенного инсулина и его аналогов.
• Перевод может быть осуществлен с одного препарата инсулина и его аналогов на другой как в рамках одной группы по АТХ-классификации, так и со сменой АТХ-группы (например, перевод с человеческого инсулина на аналог инсулина и наоборот).
2. В случае одного и того же МНН.
• Перевод пациентов с одного инсулина и его аналогов на другой с подтвержденной взаимозаменяемостью (т.е. подтвержденной биоэквивалентностью в отношении фармакокинетики, фармакодинамики и безопасности действия), как правило, не требует более частого самоконтроля уровня глюкозы, обучения пациента и коррекции дозы вновь назначенного инсулина.
• Перевод пациентов с одного инсулина и его аналогов на другой в рамках одного МНН, но с разной фармакокинетикой и фармакодинамикой должен осуществляться по правилам, указанным для препаратов с разными МНН.
3. В случае развития нежелательных явлений как при назначении инсулинотерапии, так и переводе с одного препарата инсулина и его аналогов на другой, к которым относятся ухудшение гликемического контроля, существенное изменение потребности/дозы инсулина, развитие аллергических реакций, обязательно сообщение в Федеральную службу по надзору в сфере здравоохранения.
Решение о переводе с одного препарата инсулина и его аналогов на другой принимает врач с учетом актуальной инструкции по применению.
-
Рекомендуется у детей с СД2 применение инсулинов короткого действия и их аналогов для инъекционного введения (таблица 3), с целью достижения целевого уровня гликемического контроля [21,45] (Приложение Б).
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: рекомендуется добавление инсулинов короткого действия и их аналогов для инъекционного введения, когда не удается достичь целевого уровня гликированного гемоглобина на комбинации метформина** и инсулинов длительного действия и их аналогов для инъекционного введения (при максимальной суточной дозе 1,5 ЕД/кг/сут) с целью оптимизации гликемического контроля.
Инсулин короткого действия и схема введения подбираются индивидуально для каждого пациента исходя из профиля действия инсулина и индивидуальной переносимости. Титрация доз инсулина и его аналогов проводится по показателям гликемии.
-
Рекомендуется у детей в возрасте >10 лет с СД2, при декомпенсации углеводного обмена на фоне проводимой терапии, применение лираглутида подкожно один раз в сутки в дозах до 1,8 мг/сут, с целью достижения целевого уровня гликемического контроля [46] (Приложение Б).
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии: в случае неэффективности монотерапии метформином** или комбинации метформина** с инсулинами и их аналогами (уровень гликированного гемоглобина выше целевого уровня), возможно назначение терапии аналогом глюкагоноподобного пептида-1 (GLP-1) лираглутидом в дополнение к проводимой терапии.
-
Рекомендуется у детей с СД2 при проведении инсулинотерапии соблюдать правила по технике инъекций инсулина с целью снижения риска формирования липодистрофий [47,48].
Уровень убедительности рекомендаций С (уровень достоверности доказательств –5)
-
Рекомендуется у детей с СД2, получающих инсулинотерапию, проводить визуальный осмотр мест инъекций и оценивать навыки инъекций пациента с целью снижения риска формирования липодистрофии [47,48].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарий: Дети с СД2 и их родители должны научиться самостоятельно осматривать места инъекций и распознавать липодистрофии.
-
Рекомендуется у детей с СД2, получающих инсулинотерапию, при каждой инъекции менять место введения, использовать большие области для введения, а также использовать иглы однократно с целью предотвращения образования липодистрофии [47,48].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
3. Самоконтроль глюкозы
-
Рекомендуется проведение у детей с СД2 регулярного самоконтроля глюкозы с измерением глюкозы крови глюкометром с целью достижения оптимального гликемического контроля и снижения риска осложнений [21,22].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Контроль ГК проводится с использованием глюкометров. В домашних условиях используются индивидуальные глюкометры. В настоящее время существуют глюкометры с настройкой индивидуального целевого диапазона гликемии, а также глюкометры с функцией беспроводной передачи данных об уровне глюкозы медицинским специалистам, родственникам или в установленное на смартфон пациента специальное приложение для использования при дистанционном наблюдении.
Индивидуальные глюкометры должны соответствовать ГОСТ Р ИСО 15197-2015 по аналитической и клинической точности. При уровне глюкозы плазмы крови <5,6 ммоль/л 95% измерений должны отклоняться от эталонного анализатора не более чем на ± 0,8 ммоль/л, при уровне глюкозы плазмы крови ≥5,6 ммоль/л 95% измерений должны отклоняться от эталонного анализатора не более чем на ±15%.
В условиях медицинских организаций, помимо лабораторных анализаторов, необходимо использовать глюкометры для профессионального применения (многопользовательские, госпитальные), обладающими более высокой точностью измерения по сравнению с индивидуальными глюкометрами и выдерживающие многократные циклы дезинфекции в соответствии с хорошо валидированными методами, представленными производителем.
Рекомендации по частоте самоконтроля гликемии при СД2 у детей индивидуальны и зависят от применяемой сахароснижающей терапии и уровня компенсации углеводного обмена.
o Измерение гликемии не реже 3-4 раз в неделю у детей на монотерапии метформином**. При целевом уровне гликированного гемоглобина на фоне монотерапии метформином** обычно достаточно нескольких измерений гликемии в течение недели: натощак и постпрандиально.
o При повышении уровня гликированного гемоглобина, во время интеркуррентного заболевания, возникновении симптомов гипер- и гипогликемии следует увеличить частоту самоконтроля.
o Пациентам на инсулинотерапии необходимо проводить самоконтроль гликемии более часто до 6-10 раз в день.
4. Обучение
Обучение является необходимым элементом успешного лечения и контроля СД, которое должно быть доступно для всех детей с СД2 и их родителей.
-
Рекомендуется обучение детей с СД2 и их семей принципам здорового образа жизни, включая изменения в питании и физической активности при диагностике заболевания и регулярно в последующем для улучшения углеводного и жирового обмена, нормализации веса [49,50].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии:
o Обучение должно быть адаптировано для каждого человека в соответствии с образом жизни, способностью к обучению и пр.
o Обучение должно быть непрерывным для поддержания уровня знаний и мотивации.
o Семья пациента должна понимать высокую значимость изменения образа жизни для эффективного лечения пациента с СД2.
o Возможная неопределенность в типе СД в начале заболевания зачастую вызывает беспокойство подростка и его семьи. Врачу, уже при диагностике СД, следует подчеркивать важность нормализации гликемии с применением сахароснижающей терапии, соответствующей степени нарушения углеводного обмена (в том числе инсулинотерапии), независимо от «типа» СД.
o В обучение следует включать консультирование по поводу контрацепции для предупреждения незапланированной беременности при СД.
o Подросткам с СД2 необходимо регулярно проводить обучение о вреде курения и последствиях злоупотребления алкоголем для лиц с сахарным диабетом в виде развития жировой болезни печени и тяжелых гипогликемий.
5. Диетотерапия
Диетотерапия является одним из элементов лечения сахарного диабета 2 типа и рекомендуется для всех детей.
-
Рекомендуется реализация последовательного изменения рациона питания у детей с СД2 и избыточным весом со снижением употребления углеводов, насыщенных жиров, увеличением употребления клетчатки для улучшения показателей гликемии и снижения веса [51,52].
Уровень убедительности рекомендаций A (уровень достоверности доказательств –2)
Комментарии: Диетические рекомендации должны быть основаны на принципах здорового питания и подходить для всех детей с СД2 и их семей с целью улучшению результатов контроля сахарного диабета и снижение сердечно-сосудистых рисков. Пищевые рекомендации должны быть адаптированы к культурным, этническим и семейным традициям, а также учитывать когнитивные и психосоциальные аспекты ребенка и семьи.
Приоритетными изменениями диеты при СД2 являются:
o Исключение сладких напитков и соков.
o Увеличение потребления фруктов и овощей.
o Сокращение потребления «готовых» продуктов питания.
o Сокращение потребления продуктов, содержащих рафинированный сахар, кукурузный сироп.
o Контроль размера порций.
o Сокращение приемов пищи вне дома.
o В семьях с азиатскими пищевыми традициями – увеличение потребления животного белка и свежих овощей с уменьшением количества высокоуглеводистых продуктов (лапши, белого риса, крахмалов).
o Замена продуктов с легкоусвояемыми углеводами на продукты с более низким гликемическим индексом (белого риса и белой муки на коричневый рис и цельнозерновую муку).
6. Физические нагрузки
Рекомендации о необходимости регулярных физических нагрузок являются важной частью лечения СД2.
-
У детей с СД2 рекомендуются регулярные физические нагрузки с целью улучшения показателей гликемического контроля, снижения избыточного веса, улучшения самочувствия [50,52–54].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2)
Комментарии: Всем подросткам c СД2 рекомендуется регулярная физическая нагрузка продолжительностью не менее 60 минут ежедневно, которая должна включать физическую активность от умеренной до интенсивной. Рекомендуемый уровень физических нагрузок выбирается индивидуально. Необходимо сокращать время, проводимое за компьютером, просмотром телевизора, видеоиграми, до, максимум, 2 часов в день [55,56]. Пациентам с пролиферативной ретинопатией и диабетической нефропатией следует подбирать вид физических нагрузок, не приводящий к значимому повышению артериального давления [57].
7. Психологическая поддержка
-
Рекомендуется прием (тестирование, консультация) медицинского психолога детям с СД2 для диагностики психологических проблем, адаптации к заболеванию, достижения и поддержания целей лечения [58,59].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
-
Рекомендуется прием (тестирование, консультация) медицинского психолога детям с хронически декомпенсированным СД2 вместе с родителями для диагностики психологических проблем, достижения и поддержания целей лечения [58,59].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
8. Обезболивание
Не предусмотрено.
9. Иное лечение
Не предусмотрено.
Медицинская реабилитация
Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Специфические реабилитационные мероприятия не предусмотрены.
В перечень реабилитационных мероприятий пациентам с СД2 могут быть включены занятия с медицинским психологом, санаторно-курортное лечение в санаториях для детей, в том числе, для детей с родителями с питьевыми минеральными водами и лечебным климатом, а также социальная адаптация с участием специалистов и социальных работников
Госпитализация
Организация оказания медицинской помощи
Показания для госпитализации в медицинскую организацию:
1) Форма - плановая; условия - стационар, дневной стационар:
a. При первичном обращении по поводу стойкой гипергликемии без клинических проявлений СД и/или кетоза;
b. Декомпенсация гликемического контроля, высокая вариабельность гликемии, частые эпизоды легкой гипогликемии;
c. Комплексный скрининг осложнений и коморбидных состояний, в отсутствии возможности обследования в амбулаторных условиях;
d. Перевод на инсулинотерапию в режиме МИИ.
2) Форма - экстренная, неотложная; условия - стационар:
a. При первичном обращении по поводу гипергликемии при наличии клинических проявлений СД и/или кетоза;
b. Тяжелая гипогликемия;
c. ДКА;
d. Острое развитие специфических осложнений.
Показания к выписке пациента из медицинской организации:
1) Форма - плановая; условия - стационар, дневной стационар:
a. Достижение индивидуальных целевых показателей глюкозы с частотой измерений (временем) в целевом диапазоне не менее 50% по данным НМГ или самоконтроля глюкозы крови (ГК);
2) Форма - экстренная, неотложная; условия - стационар:
a. Отсутствие клинически значимых метаболических отклонений (показатели кислотно-щелочного состояния (КЩС), кетоны в крови и/или моче в пределах нормы), отсутствие острой неврологической симптоматики в сочетании с достижением индивидуальных целевых показателей глюкозы с частотой измерений (временем) в целевом диапазоне не менее 50% по данным НМГ или самоконтроля ГК;
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
-
Рекомендуется детям с СД2 и с избыточной массой тела или ожирением питание с оптимальной калорийностью пищи с учетом необходимых питательных веществ, с целью нормализации и поддержания идеального веса тела [21,52].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии: Профилактика избыточного веса и ожирения является одной из ключевых стратегий в профилактике СД2.
-
Рекомендуется детям с СД2 физические нагрузки в достаточном объеме в зависимости от индивидуальных особенностей для нормализации веса, улучшения показателей гликемии, снижения риска поздних осложнений [21,52].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
-
Рекомендуется прием (осмотр, консультация) врача-детского эндокринолога не реже одного раза в три месяца для оценки состояния здоровья, гликемического контроля (гликированный гемоглобина), терапии, биохимических показателей крови, физического и полового развития, регулярности менструального цикла [21].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Амбулаторные визиты должны включать в себя периодическую оценку и регистрацию следующего:
-
Общее состояние здоровья и самочувствие:
o Жалобы с особым вниманием к симптомам, связанным с осложнениями и сопутствующей патологией. При наличии данных симптомов или признаков, может потребоваться дополнительное обследование;
o Интеркуррентные заболевания, неотложные состояния, связанные с диабетом, госпитализации. При первичном обращении провести тщательный расспрос о времени появления первых симптомов заболевания, видах и дозах вводимых инсулинов, причинах и длительности госпитализаций, в том числе в случаях развития ДКА и тяжелых гипогликемий, время и методы диагностики специфических осложнений в случае их наличия, сопутствующих эндокринных и системных заболеваниях, наследственный анамнез.
-
Гликемический контроль:
o Оценка уровня гликированного гемоглобина в крови за последние три месяца;
o Анализ показателей домашнего мониторинга глюкозы (показания глюкометра, непрерывного мониторирования гликемии (НМГ), флэш-мониторирование гликемии (ФМГ));
o Оценка частоты/степени гипогликемии, включая определение чувствительности к гипогликемии, метод лечения гипогликемии.
-
Метформин**:
o Дозы препарата;
o Коррекция терапии в зависимости от уровня глюкозы, питания и физических нагрузок;
-
Инсулинотерапия:
o Типы и дозы препарата;
o Коррекция инсулинотерапии с учетом уровня глюкозы, питания и физических нагрузок;
o Техника инъекции.
-
Общий осмотр:
o Рост, вес, индекс массы тела (ИМТ) и половое развитие;
o Кожные покровы (акантоз) и места инъекций инсулина/введений (при использовании), инфузионной системы/сенсоров НМГ (липодистрофии, местные реакции);
o Слизистые оболочки полости рта и зубы (кариес, гингивит);
o Исследование брюшной полости (гепатомегалия), стопы (мозоли, вросшие ногти на ногах и других поражений);
o АД с учетом показателей, соответствующих возрасту, полу и росту.
Информация
Источники и литература
-
Клинические рекомендации Российской ассоциации эндокринологов
- 1. Дедов И.И., Кураева Т.Л., Петеркова В.А. Сахарный диабет у детей и подростков. Москва:ГЭОТАР-Медиа, 2013. 271 p. 2. Петеркова В.А., Кураева Т.Л., Еремина И.А. Особенности диабета типа 2 у детей иподростков // Сахарный диабет типа 2: от теории к практике. Под редакцией академика РАНИ.И. Дедова, члена-корреспондента РАН М.В. Шестаковой. Москва: ООО «Медицинскоеинформационное агентство», 2016. 3. Dubinina I.A. et al. Studying progression from glucose intolerance to type 2 diabetes in obesechildren // Diabetes Metab. Syndr. Clin. Res. Rev. 2014. Vol. 8, № 3. P. 133–137. 4. Кураева Т.Л. et al. Проблемы диагностики и терапии сахарного диабета 2 типа у детей иподростков // Материалы V Городской научно-практическая конференции«Эндокринологические аспекты в педиатрии». Москва, 2011. P. 26–33. 5. Александрова Г.А. et al. Общая заболеваемость детского населения России (0 – 14 лет) в2019 году. Статистические материалы. Часть VI. Москва: Департамент мониторинга,анализа и стратегического развития здравоохранения Минздрава России, ФГБУ«ЦНИИОИЗ» Минздрава России, 2020. 6. Александрова Г.А. et al. Заболеваемость детского населения России (0 – 14 лет) в 2019 годус диагнозом, установленным впервые в жизни. Статистические материалы. Часть V. Москва:Департамент мониторинга, анализа и стратегического развития здравоохранения МинздраваРоссии, ФГБУ «ЦНИИОИЗ» Минздрава России, 2020. 7. Александрова Г.А. et al. Заболеваемость детского населения России (15 – 17 лет) в 2019 годус диагнозом, установленным впервые в жизни. Статистические материалы. Часть IX.Москва: Департамент мониторинга, анализа и стратегического развития здравоохраненияМинздрава России, ФГБУ «ЦНИИОИЗ» Минздрава России, 2020. 8. Александрова Г.А. et al. Общая заболеваемость детского населения России (15 – 17 лет) в2019 году. Статистические материалы. Часть Х. Москва: Департамент мониторинга, анализаи стратегического развития здравоохранения Минздрава России, ФГБУ «ЦНИИОИЗ»Минздрава России, 2020. 9. Дедов И.И., Шестакова М.В., Викулова О.К. Эпидемиология сахарного диабета вРоссийской Федерации: клинико-статистический анализ по данным Федерального регистрасахарного диабета. 2017. Vol. 1, № 20. P. 13–41. 10. Дедов И.И. et al. Сахарный диабет у детей и подростков по данным Федерального регистраРоссийской Федерации: динамика основных эпидемиологических характеристик за 2013-2016 гг. // Сахарный Диабет. 2017. Vol. 20, № 6. P. 392–402. 11. Dabelea D. et al. Prevalence of Type 1 and Type 2 Diabetes Among Children and AdolescentsFrom 2001 to 2009 // JAMA. 2014. Vol. 311, № 17. P. 1778. 12. Libman I. et al. ISPAD Clinical Practice Consensus Guidelines 2022: Definition, epidemiology,and classification of diabetes in children and adolescents // Pediatr. Diabetes. 2022. Vol. 23, № 8.P. 1160–1174. 13. Dabelea D. et al. Etiological Approach to Characterization of Diabetes Type: The SEARCH forDiabetes in Youth Study // Diabetes Care. 2011. Vol. 34, № 7. P. 1628–1633. 14. Eremina I.A. et al. Clinical polymorphism of type 2 diabetes in children — the first study inRussia // Probl. Endocrinol. 2015. Vol. 61, № 6. P. 10–16. 15. Mayer-Davis E.J. et al. ISPAD Clinical Practice Consensus Guidelines 2018: Definition,epidemiology, and classification of diabetes in children and adolescents // Pediatr. Diabetes. 2018.Vol. 19. P. 7–19. 16. American Diabetes Association. 2. Classification and Diagnosis of Diabetes: Standards of MedicalCare in Diabetes—2021 // Diabetes Care. 2021. Vol. 44, № Supplement 1. P. S15–S33. 17. World Health Organization, International Diabetes Federation. Definition and diagnosis ofdiabetes mellitus and intermediate hyperglycaemia: report of a WHO/IDF consultation. 2006. 18. Sabin M.A. Type 2 diabetes in children: Type 2 diabetes in children // Clin. Obes. 2013. Vol. 3, №3–4. P. 112–116. 19. Klingensmith G.J. et al. The Presence of GAD and IA-2 Antibodies in Youth With a Type 2Diabetes Phenotype: Results from the TODAY study // Diabetes Care. 2010. Vol. 33, № 9. P.1970–1975. 20. Felton J.L. et al. Islet autoantibodies as precision diagnostic tools to characterize heterogeneity intype 1 diabetes: a systematic review // Commun. Med. 2024. Vol. 4, № 1. P. 66. 21. Zeitler P. et al. ISPAD Clinical Practice Consensus Guidelines 2018: Type 2 diabetes mellitus inyouth // Pediatr. Diabetes. 2018. Vol. 19. P. 28–46. 22. Petitti D.B. et al. Glycemic Control in Youth with Diabetes: The SEARCH for Diabetes in YouthStudy // J. Pediatr. 2009. Vol. 155, № 5. P. 668-672.e3. 23. Zeitler P. et al. HbA After a Short Period of Monotherapy With Metformin Identifies DurableGlycemic Control Among Adolescents With Type 2 Diabetes // Diabetes Care. 2015. Vol. 38, №12. P. 2285–2292. 24. American Diabetes Association. 8. Pharmacologic Approaches to Glycemic Treatment: Standardsof Medical Care in Diabetes—2018 // Diabetes Care. 2018. Vol. 41, № Supplement 1. P. S73–S85. 25. Еремина И.А., Кураева Т.Л. Метформин в лечении сахарного диабета 2-го типа у детей иподростков // Проблемы эндокринологии. 2013. № 1. P. 8–13. 26. Jones K.L. et al. Effect of Metformin in Pediatric Patients With Type 2 Diabetes: A randomizedcontrolled trial // Diabetes Care. 2002. Vol. 25, № 1. P. 89–94. 27. TODAY Study Group et al. A clinical trial to maintain glycemic control in youth with type 2diabetes // N. Engl. J. Med. 2012. Vol. 366, № 24. P. 2247–2256. 28. Fath M. et al. Faster-acting insulin aspart provides faster onset and greater early exposure vsinsulin aspart in children and adolescents with type 1 diabetes mellitus: FATH et al . // Pediatr.Diabetes. 2017. Vol. 18, № 8. P. 903–910. 29. Bode B.W. et al. Efficacy and Safety of Fast-Acting Insulin Aspart Compared With Insulin Aspart,Both in Combination With Insulin Degludec, in Children and Adolescents With Type 1 Diabetes:The onset 7 Trial // Diabetes Care. 2019. Vol. 42, № 7. P. 1255–1262. 30. Battelino T. et al. Efficacy and safety of a fixed combination of insulin degludec/insulin aspart inchildren and adolescents with type 1 diabetes: A randomized trial // Pediatr. Diabetes. 2018. Vol.19, № 7. P. 1263–1270. 31. Thalange N. et al. Insulin degludec in combination with bolus insulin aspart is safe and effective inchildren and adolescents with type 1 diabetes: IDeg effective and safe in pediatric T1D // Pediatr.Diabetes. 2015. Vol. 16, № 3. P. 164–176. 32. Danne T. et al. Pharmacokinetics, prandial glucose control, and safety of insulin glulisine inchildren and adolescents with type 1 diabetes // Diabetes Care. 2005. Vol. 28, № 9. P. 2100–2105. 33. Philotheou A. et al. Comparable Efficacy and Safety of Insulin Glulisine and Insulin Lispro WhenGiven as Part of a Basal–Bolus Insulin Regimen in a 26-Week Trial in Pediatric Patients with Type1 Diabetes // Diabetes Technol. Ther. 2011. Vol. 13, № 3. P. 327–334. 34. Holcombe J.H. et al. Comparison of insulin lispro with regular human insulin for the treatment oftype 1 diabetes in adolescents // Clin. Ther. 2002. Vol. 24, № 4. P. 629–638. 35. Tupola S. et al. Post-prandial insulin lispro vs. human regular insulin in prepubertal children withType 1 diabetes mellitus // Diabet. Med. J. Br. Diabet. Assoc. 2001. Vol. 18, № 8. P. 654–658. 36. Deeb L.C. et al. Insulin Lispro Lowers Postprandial Glucose in Prepubertal Children WithDiabetes // PEDIATRICS. 2001. Vol. 108, № 5. P. 1175–1179. 37. Liu M. et al. A randomised, open-labelstudy of insulin glargine or neutral protamine Hagedorninsulin in Chinese paediatric patients with type 1 diabetes mellitus // BMC Endocr. Disord. 2016.Vol. 16, № 1. P. 67. 38. Schober E. et al. Comparative trial between insulin glargine and NPH insulin in children andadolescents with type 1 diabetes mellitus // J. Pediatr. Endocrinol. Metab. JPEM. 2002. Vol. 15, № 4. P. 369–376. 39. Robertson K.J. et al. Insulin detemir compared with NPH insulin in children and adolescents withType 1 diabetes // Diabet. Med. J. Br. Diabet. Assoc. 2007. Vol. 24, № 1. P. 27–34. 40. Thalange N. et al. The rate of hyperglycemia and ketosis with insulin degludec‐based treatmentcompared with insulin detemir in pediatric patients with type 1 diabetes: An analysis of data fromtwo randomized trials // Pediatr. Diabetes. 2019. Vol. 20, № 3. P. 314–320. 41. Danne T. et al. Insulin detemir is characterized by a consistent pharmacokinetic profile across age-groups in children, adolescents, and adults with type 1 diabetes // Diabetes Care. 2003. Vol. 26, №11. P. 3087–3092. 42. Danne T. et al. Efficacy and Safety of Insulin Glargine 300 Units/mL (Gla-300) Versus InsulinGlargine 100 Units/mL (Gla-100) in Children and Adolescents (6-17 years) With Type 1 Diabetes:Results of the EDITION JUNIOR Randomized Controlled Trial // Diabetes Care. 2020. Vol. 43, №7. P. 1512–1519. 43. Predieri B. et al. Switching From Glargine to Degludec: The Effect on Metabolic Control andSafety During 1-Year of Real Clinical Practice in Children and Adolescents With Type 1 Diabetes// Front. Endocrinol. 2018. Vol. 9. P. 462. 44. Дедов И.И. et al. Проект рекомендаций Российской ассоциации эндокринологов поприменению биосимиляров инсулина. 2021. Vol. 24, № 1. P. 76–79. 45. Arslanian S. et al. Evaluation and Management of Youth-Onset Type 2 Diabetes: A PositionStatement by the American Diabetes Association // Diabetes Care. 2018. Vol. 41, № 12. P. 2648–2668. 46. Tamborlane W.V. et al. Liraglutide in Children and Adolescents with Type 2 Diabetes // N. Engl. J.Med. 2019. Vol. 381, № 7. P. 637–646. 47. Frid A.H. et al. New Insulin Delivery Recommendations // Mayo Clin. Proc. 2016. Vol. 91, № 9. P.1231–1255. 48. Майоров А.Ю. et al. Техника инъекций и инфузии при лечении сахарного диабета.Методическое руководство. Москва: ООО «АРТИНФО», 2018. 64 p. 49. Smart C.E. et al. ISPAD Clinical Practice Consensus Guidelines 2018: Nutritional management inchildren and adolescents with diabetes // Pediatr. Diabetes. 2018. Vol. 19. P. 136–154. 50. American Diabetes Association. 4. Lifestyle Management: Standards of Medical Care in Diabetes—2018 // Diabetes Care. 2018. Vol. 41, № Supplement 1. P. S38–S50. 51. Barlow S.E. Expert Committee Recommendations Regarding the Prevention, Assessment, andTreatment of Child and Adolescent Overweight and Obesity: Summary Report // Pediatrics. 2007.Vol. 120, № Supplement 4. P. S164–S192.
Информация
Список сокращений
GADA – Glutamic Acid Decarboxylase Autoantibodies (аутоантитела к глутаматдекарбоксилазе)
IAA – Insulin Autoantibodies (аутоантитела к инсулину)
IA-2 – Insulinoma-Associated-2 Autoantibodies (аутоантитела к тирозинфосфотазе)
ICA – Islet Cell Cytoplasmic Autoantibodies (аутоантитела к структурам островковых клеток)
HbA1c – Hemoglobin A1c (гликированный гемоглобин)
HLA – Human Leukocyte Antigens (человеческий лейкоцитарный антиген)
ZnT8A – Zinc Transporter 8 (аутоантитела к транспортеру цинка 8)
АГ – артериальная гипертензия
АД – артериальное давление
АПФ – ангиотензинпревращающий фермент
АТ – антитела
АТХ – анатомо-терапевтическо-химическая классификация
ВРС – вариабельность ритма сердца
ГК – глюкоза крови
ДЗН – диск зрительного нерва
ДКА – диабетический кетоацидоз
ДМО – диабетический макулярный отек
ДНК – дезоксирибонуклеиновая кислота
ДН – диабетическая нефропатия
ДПП – диабетическая периферическая полинейропатия
ДР – диабетическая ретинопатия
ИМТ – индекс массы тела
ИДД – инсулин длительного действия (инсулины длительного действия и их аналоги для инъекционного введения)
ИКД – инсулин короткого действия (инсулины короткого действия и их аналоги для инъекционного введения)
ИСБД – инсулин сверхбыстрого действия (инсулины короткого действия и их аналоги для инъекционного введения)
ИСДД – инсулин сверхдлительного действия (инсулины длительного действия и их аналоги для инъекционного введения)
ИУКД – инсулин ультракороткого действия (инсулины короткого действия и их аналоги для инъекционного введения)
КАН – кардиоваскулярная форма автономной нейропатии
ЛПВП – липопротеины высокой плотности
ЛПНП – липопротеины низкой плотности
МИИ – множественные инъекции инсулина (и его аналогов)
МКБ 10 – международная классификация болезней 10-го пересмотра
МНН – международное непатентованное наименование
НМГ – непрерывное мониторирование глюкозы
НПИИ – непрерывная подкожная инфузия инсулина (и его аналогов)
НПХ – нейтральный протамин Хагедорна
НСД – неонатальный сахарный диабет
ПГТТ – пероральный глюкозотолерантный тест
рСКФ – расчетная скорость клубочковой фильтрации
СД – сахарный диабет
СД1 – сахарный диабет 1 типа
СД2 – сахарный диабет 2 типа
СКФ – скорость клубочковой фильтрации
УДД – уровень достоверности доказательств
УУР – уровень убедительности рекомендаций
ФМГ – флеш-мониторирование глюкозы
ЧСС – частота сердечных сокращений
ХБП – хроническая болезнь почек
ХЕ – хлебная единица
ЭКГ – электрокардиография
** – препарат входит в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения
Термины и определения
С-пептид – полипептид, состоящий из 31 аминокислоты и образующийся при расщеплении проинсулина пептидазами.
Аутоиммунитет – появление антител в организме против собственных структур и тканей
Бигуаниды – группа препаратов гипогликемизирующего действия
Аналоги инсулина – это форма инсулина, в которой произведены некоторые изменения в молекуле человеческого инсулина. Аналог действует так же, как инсулин, но с фармакокинетическими / фармакодинамическими различиями, которые могут давать преимущества
Гипергликемия – уровень глюкозы в крови выше нормальных значений
Гипогликемия – уровень глюкозы в крови ниже нормальных значений
Гликемия – концентрация глюкозы в крови
Гликированный гемоглобин – показатель, который отражает средний уровень глюкозы в крови за последние 2-3 месяца
Дислипидемия – нарушение физиологического соотношения липидов крови в виде повышения уровня триглицеридов и липопротеидов низкой плотности, снижения уровня липопротеидов высокой плотности
Инсулин – гормон, в физиологических условиях секретируемый бета-клетками поджелудочной железы и регулирующий уровень глюкозы в крови, стимулируя поглощение глюкозы тканями
Инсулинорезистентность – нарушение биологического действия инсулина и реакции инсулинчувствительных тканей на инсулин на пре- и пострецепторном уровнях, приводящее к хроническим метаболическим изменениям и сопровождающееся на первых этапах компенсаторной гиперинсулинемией.
Иммунологические маркеры аутоиммунного инсулита: IAA – антиинсулиновые антитела, ICA – островково-клеточные цитоплазматические аутоантитела, GADA – аутоантитела к глутаматдекарбоксилазе, IA2 – аутоантитела к тирозинфосфатазе, ZnT8 – антитела к клеточному транспортеру цинка Т8.
Липодистрофия – патологическое изменение жировой ткани в местах инъекций инсулина
Метаболический синдром – сочетание сахарного диабета 2 типа (СД2) или нарушенной толерантности к глюкозе (НТГ) с инсулинорезистентностью с двумя из следующих признаков: абдоминального ожирения, артериальной гипертензии (АГ), повышения в плазме триглицеридов и/или снижения липопротеидов высокой плотности (ЛПВП), микроальбуминурии.
Нарушенная толерантность к глюкозе (НТГ) – повышение уровня глюкозы в крови в условиях перорального глюкозотолерантного теста через 2 часа после нагрузки до 7,8 и выше (но ниже 11,1) ммоль/л
Ожирение – повышение индекса массы тела (выше 2 SDS)
Пероральный глюкозотолерантный тест (ПГТТ) – исследование уровня гликемии в условиях нагрузки раствором декстрозы** per os – натощак и через 2 ч. после нагрузки
Прандиальный инсулин – инсулин короткого действия, вводимый на прием пищи
Самоконтроль глюкозы – самостоятельное определение глюкозы крови пациентами в домашних условиях с помощью глюкометра или система непрерывного мониторирования глюкозы
Хлебная единица (ХЕ) – это способ оценки количества углеводов в пище. Одна хлебная единица эквивалентна 10-12 граммам углеводов.
Шприц-ручка –устройство для инъекций инсулина
Критерии оценки качества медицинской помощи
|
№ |
Критерии качества |
Оценка выполнения (да/нет) |
|---|---|---|
|
1. |
Выполнено измерение гликемии |
Да/нет |
|
2. |
Выполнено исследование уровня гликированного гемоглобина в крови |
Да/нет |
|
3. |
Выполнен анализ крови биохимический общетерапевтический (общий холестерин, липопротеины низкой плотности, триглицериды) |
Да/нет |
|
4. |
Выполнено измерение артериального давления на периферических артериях. |
Да/нет |
|
5. |
Выполнено определение альбумина в моче и исследование уровня креатинина в моче с оценкой соотношения альбумин/креатинин у пациентов |
Да/нет |
|
6. |
Выполнен прием (осмотр, консультация) врача-офтальмолога |
Да/нет |
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
РУКОВОДИТЕЛИ:
Петеркова Валентина Александровна – академик РАН, профессор, доктор медицинских наук, научный руководитель Института детской эндокринологии ФГБУ «НМИЦ эндокринологии» Минздрава России, заведующая кафедрой детской эндокринологии-диабетологии Института высшего и дополнительного профессионального образования ФГБУ «НМИЦ эндокринологии» Минздрава России, главный внештатный детский специалист эндокринолог Минздрава России.
Безлепкина Ольга Борисовна – доктор медицинских наук, заместитель директора Центра - директор Института детской эндокринологии ФГБУ «НМИЦ эндокринологии» Минздрава России, профессор кафедры детской эндокринологии-диабетологии Института высшего и дополнительного профессионального образования ФГБУ «НМИЦ эндокринологии» Минздрава России.
АВТОРЫ ТЕКСТА:
Лаптев Дмитрий Никитич – доктор медицинских наук, профессор РАН, заведующий детским отделением сахарного диабета ФГБУ «НМИЦ эндокринологии» Минздрава России, профессор кафедры детской эндокринологии-диабетологии Института высшего и дополнительного профессионального образования ФГБУ «НМИЦ эндокринологии» Минздрава России.
Еремина Ирина Александровна – кандидат медицинских наук, старший научный сотрудник детского отделения сахарного диабета ФГБУ «НМИЦ эндокринологии» Минздрава России, доцент кафедры детской эндокринологии-диабетологии Института высшего и дополнительного профессионального образования ФГБУ «НМИЦ эндокринологии» Минздрава России.
Сечко Елена Александровна – кандидат медицинских наук, старший научный сотрудник детского отделения сахарного диабета ФГБУ «НМИЦ эндокринологии» Минздрава России.
ЭКСПЕРТЫ:
Алимова Ирина Леонидовна - доктор медицинских наук , профессор, заведующая кафедрой госпитальной педиатрии с курсом неонатологии факультета ДПО ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России, главный внештатный специалист детский эндокринолог Смоленской области.
Андрианова Екатерина Андреевна – кандидат медицинских наук, ведущий научный сотрудник детского отделения сахарного диабета ФГБУ «НМИЦ эндокринологии» Минздрава России.
Башнина Елена Борисовна - доктор медицинских наук, профессор кафедры эндокринологии имени академика В.Г. Баранова ФГОУВО «Северо-Западный государственный медицинский университет имени И.И. Мечникова», главный внештатный специалист детский эндокринолог Северо-Западного ФО.
Болотова Нина Викторовна - доктор медицинских наук, профессор кафедры пропедевтики детских болезней, детской эндокринологии и диабетологии ФГБОУ ВО "Саратовский государственный медицинский университет им. В.И. Разумовского" Минздрава России.
Галкина Галина Александровна - доктор медицинских наук, заведующая детским эндокринным отделением НИИ акушерства и педиатрии ФГБОУ ВО "Ростовский государственный медицинский университет" Минздрава России, главный внештатный специалист детский эндокринолог Ростовской области, главный внештатный специалист детский эндокринолог Южного ФО.
Емельянов Андрей Олегович - кандидат медицинских наук, ведущий научный сотрудник детского отделения сахарного диабета ФГБУ «НМИЦ эндокринологии» Минздрава России, доцент кафедры детской эндокринологии-диабетологии Института высшего и дополнительного профессионального образования ФГБУ «НМИЦ эндокринологии» Минздрава России.
Кияев Алексей Васильевич - доктор медицинских наук, профессор кафедры госпитальной педиатрии ФГБОУ ВО "Уральский государственный медицинский университет" Минздрава России, руководитель Центра детской эндокринологии ГАУЗ СО «Областная детская клиническая больница», главный внештатный специалист детский эндокринолог Свердловской области, главный внештатный специалист детский эндокринолог Уральского ФО.
Кострова Ирина Борисовна - заведующая отделением детской эндокринологии ГБУ "Детская республиканская клиническая больница им. Н. М. Кураева", главный внештатный специалист детский эндокринолог республики Дагестан, главный внештатный специалист детский эндокринолог Северо- Кавказского ФО.
Кураева Тамар Леонидовна – доктор медицинских наук, главный научный сотрудник детского отделения сахарного диабета ФГБУ «НМИЦ эндокринологии» Минздрава России, доцент кафедры детской эндокринологии-диабетологии Института высшего и дополнительного профессионального образования ФГБУ «НМИЦ эндокринологии» Минздрава России.
Малиевский Олег Артурович, доктор медицинских наук, профессор кафедры госпитальной педиатрии ФГБОУ ВО «Башкирский государственный медицинский университет» Минздрава России, главный внештатный специалист детский эндокринолог Приволжского Федерального округа.
Петряйкина Елена Ефимовна - доктор медицинских наук, директор Российской детской клинической больницы ФГАОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И.Пирогова» Минздрава России, главный внештатный специалист детский эндокринолог г. Москвы, главный внештатный специалист детский эндокринолог Центрального ФО.
Самсонова Любовь Николаевна - доктор медицинских наук, заведующая кафедрой детской эндокринологии ФГБОУ ДПО "Российская медицинская академия непрерывного профессионального образования" Минздрава России.
Светлова Галина Николаевна – кандидат медицинских наук, заместитель главного врача ФГБУ «НМИЦ эндокринологии» Минздрава России ФГБУ «НМИЦ эндокринологии» Минздрава России, врач детский эндокринолог.
Таранушенко Татьяна Евгеньевна - доктор медицинских наук, заведующая кафедрой педиатрии института последипломного образования ГБОУ ВО "Красноярский государственный медицинский университет имени профессора В.Ф. Войно-Ясеневского" Минздрава России, главный внештатный специалист детский эндокринолог Красноярского края, главный внештатный специалист детский эндокринолог Сибирского ФО.
Титович Елена Витальевна - кандидат медицинских наук, ведущий научный сотрудник детского отделения сахарного диабета ФГБУ «НМИЦ эндокринологии» Минздрава России, доцент кафедры детской эндокринологии-диабетологии Института высшего и дополнительного профессионального образования ФГБУ «НМИЦ эндокринологии» Минздрава России.
Храмова Елена Борисовна - доктор медицинских наук, профессор, заведующая кафедрой детских болезней педиатрического факультета ФГБОУ ВО «Тюменский государственный медицинский университет» Минздрава России, главный внештатный специалист детский эндокринолог Тюменской области.
Конфликт интересов: авторы клинических рекомендаций декларируют отсутствие конфликта интересов.
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Приложение А2. Методология разработки клинических рекомендаций
Методы, используемые для сбора/селекции доказательств: поиск в электронных базах данных.
Описание методов, использованных для оценки качества и силы доказательств: доказательной базой для рекомендаций являлись публикации, вошедшие в Кохрейновскую библиотеку, базы данных EMBASE, MEDLINE и PubMed. Глубина поиска - 15 лет.
Методы, использованные для оценки качества и силы доказательств:
консенсус экспертов;
оценка значимости в соответствии с рейтинговой схемой.
Методы, использованные для анализа доказательств:
обзоры опубликованных мета-анализов;
систематические обзоры с таблицами доказательств.
Описание методов, использованных для анализа доказательств
При отборе публикаций, как потенциальных источников доказательств, использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее валидности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что в свою очередь, влияет на силу рекомендаций.
Для минимизации потенциальных ошибок каждое исследование оценивалось независимо. Любые различия в оценках обсуждались всей группой авторов в полном составе. При невозможности достижения консенсуса привлекался независимый эксперт.
Таблицы доказательств: заполнялись авторами клинических рекомендаций.
Методы, использованные для формулирования рекомендаций: консенсус экспертов.
Экономический анализ
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидации рекомендаций
Внешняя экспертная оценка.
Внутренняя экспертная оценка.
Описание метода валидации рекомендаций
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых, прежде всего, попросили прокомментировать, насколько доступна для понимания интерпретация доказательств, лежащая в основе рекомендаций.
От врачей первичного звена (детских эндокринологов) получены Комментарии в отношении доходчивости изложения данных рекомендаций, а также их оценка важности предлагаемых рекомендаций, как инструмента повседневной практики.
Все Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались членами рабочей группы (авторами рекомендаций). Каждый пункт обсуждался в отдельности.
Консультация и экспертная оценка
Проект рекомендаций был рецензирован независимыми экспертами, которых, прежде всего, попросили прокомментировать доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Рабочая группа
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и Комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Основные рекомендации
Сила рекомендаций (1-5) на основании соответствующих уровней доказательств (А-С) (таблица П1 и таблица П2) приводятся при изложении текста рекомендаций.
Целевая аудитория данных клинических рекомендаций:
1. Врачи – детские эндокринологи;
2. Врачи – педиатры;
3. Врачи общей практики (семейный врач).
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
|
УДД |
Расшифровка |
|---|---|
|
1 |
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
|
2 |
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
|
3 |
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая |
|
5 |
Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
|
УДД |
Расшифровка |
|---|---|
|
1 |
Систематический обзор РКИ с применением мета-анализа |
|
2 |
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа |
|
3 |
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
|
5 |
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
|
УУР |
Расшифровка |
|---|---|
|
A |
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
|
B |
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
|
C |
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Не используется
Приложение Б. Алгоритмы действий врача
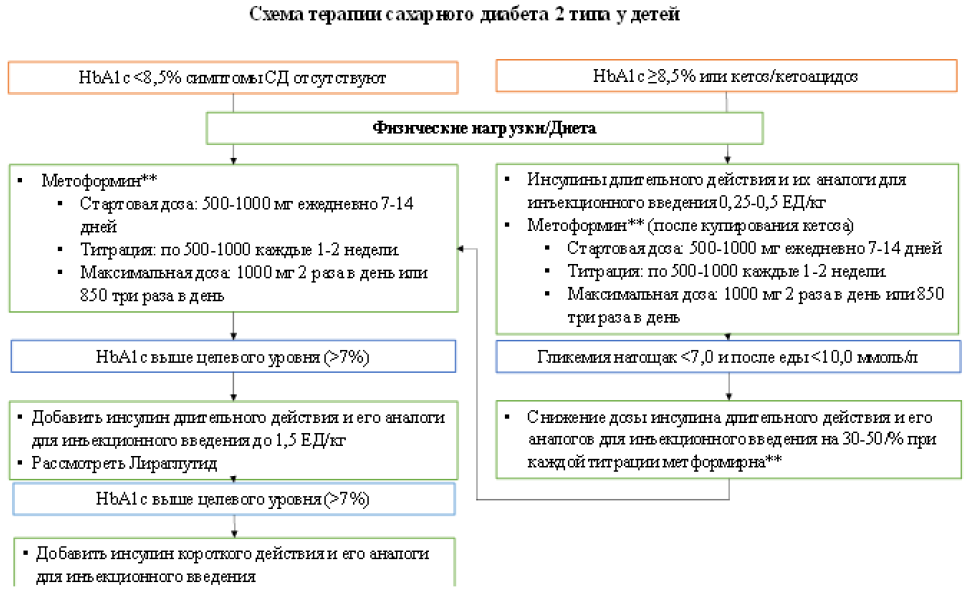
Приложение В. Информация для пациента
Таблица хлебных единиц
(1 ХЕ = количество продукта, содержащее 10-12 г углеводов)
Хлеб и хлебобулочные изделия* 1 ХЕ = ....
|
1 кусок |
Белый хлеб |
20 г |
|---|---|---|
|
1 кусок |
Черный хлеб |
25 г |
|
|
Сухари |
15 г |
|
|
Крекеры (сухое печенье) |
15 г |
|
1 ст. ложка |
Панировочные сухари |
15 г |
* - такие продукты как пельмени, блины, оладьи, пирожки, сырники, вареники, котлеты также содержат углеводы, но количество ХЕ зависит от размера и рецепта изделия.
Макаронные изделия 1 ХЕ = ....
|
1 - 2 ст. ложки в зависи- мости от формы изделия |
Вермишель, лапша, рожки, макароны * |
15 г |
|---|---|---|
* - имеется в виду несваренные; в вареном виде 1 ХЕ содержится в 2 - 4 ст. ложках продукта (50 г) в зависимости от формы изделия.
Крупы, кукуруза, мука 1 ХЕ = ....
|
1 ст. ложка |
Гречневая * |
15 г |
|---|---|---|
|
1/2 початка, среднего |
Кукуруза |
100 г |
|
3 ст. ложки |
Кукуруза консервированная |
60 г |
|
4 ст. ложки |
Кукурузные хлопья |
15 г |
|
10 ст. ложек |
Попкорн («воздушная» кукуруза) |
15 г |
|
1 ст. ложка |
Манная * |
15 г |
|
1 ст. ложка |
Мука (любая) |
15 г |
|
1 ст. ложка |
Овсяная * |
15 г |
|
2 ст. ложки |
Овсяные хлопья * |
20 г |
|
1 ст. ложка |
Перловая * |
15 г |
|
1 ст. ложка |
Пшено * |
15 г |
|
1 ст. ложка |
Рис * |
15 г |
* - имеется в виду 1 ст. ложка сырой крупы; в вареном виде (каша) 1 ХЕ содержится в 2 ст. ложках с горкой (50 г).
Картофель 1 ХЕ = ....
|
1 штука, средняя Картофель сырой и вареный |
75 г |
|
|---|---|---|
|
2 ст. ложки |
Картофельное пюре |
90 г |
|
2 ст. ложки |
Жареный картофель |
35 г |
|
|
Сухой картофель (чипсы) |
25 г |
Молоко и жидкие молочные продукты 1 ХЕ = ....
|
1 стакан |
Молоко |
250 мл |
|---|---|---|
|
1 стакан |
Кефир |
250 мл |
|
1 стакан |
Сливки |
250 мл |
|
|
Йогурт натуральный |
200 г |
Фрукты и ягоды (с косточками и кожурой) 1 ХЕ = ....
|
2-3 штуки |
Абрикосы |
110 г |
|---|---|---|
|
1 штука, крупная |
Айва |
140 г |
|
1 кусок (поперечный срез) |
Ананас |
140 г |
|
1 кусок |
Арбуз |
270 г |
|
1 штука, средний |
Апельсин |
150 г |
|
1/2 штуки, среднего |
Банан |
70 г |
|
7 ст. ложек |
Брусника |
140 г |
|
12 штук, небольших |
Виноград |
70 г |
|
15 штук |
Вишня |
90 г |
|
1 штука, средний |
Гранат |
170 г |
|
1/2 штуки, крупного |
Грейпфрут |
170 г |
|
1 штука, маленькая |
Груша |
90 г |
|
1 кусок |
Дыня |
100 г |
|
8 ст. ложек |
Ежевика |
140 г |
|
1 штука |
Инжир |
80 г |
|
1 штука, крупный |
Киви |
110 г |
|
10 штук, средних |
Клубника |
160 г |
|
6 ст. ложек |
Крыжовник |
120 г |
|
8 ст. ложек |
Малина |
160 г |
|
1/2 штуки, небольшого |
Манго |
110 г |
|
2-3 штуки, средних |
Мандарины |
150 г |
|
1 штука, средний |
Персик |
120 г |
|
3-4 штуки, небольших |
Сливы |
90 г |
|
7 ст. ложек |
Смородина |
120 г |
|
1/2 штуки, средней |
Хурма |
70 г |
|
7 ст. ложек |
Черника |
90 г |
|
1 штука, маленькое |
Яблоко |
90 г |
|
1/2 стакана |
Фруктовый сок |
100 мл |
|
|
Сухофрукты |
20 г |
Овощи, бобовые, орехи 1 ХЕ = ....
|
3 штуки, средних |
Морковь |
200 г |
|---|---|---|
|
1 штука, средняя |
Свекла |
150 г |
|
1 ст. ложка, сухих |
Бобы |
20 г |
|
7 ст. ложек, свежего |
Горох |
100 г |
|
3 ст. ложки, вареной |
Фасоль |
50 г |
|
|
Орехи |
60-90 г* |
* - в зависимости от вида.
Другие продукты 1 ХЕ = ....
|
2 ч. ложки |
Сахар-песок |
10 г |
|---|---|---|
|
2 куска |
Сахар кусковой |
10 г |
|
1/2 стакана |
Газированная вода на сахаре |
100 мл |
|
1 стакан |
Квас |
250 мл |
|
|
Мороженое |
65 г |
|
|
Шоколад |
20 г |
|
|
Мед |
12 г |
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.