Рак полового члена
 Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Злокачественное новообразование полового члена (C60)
Онкология
Общая информация
Краткое описание
Одобрено
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «14» декабря 2023 года
Протокол №198
КЛИНИЧЕСКИЙ ПРОТОКОЛ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
РАК ПОЛОВОГО ЧЛЕНА
Рак полового члена — онкологическое заболевание, при котором злокачественная опухоль, происходящая из эпителиальной ткани, локализуется в области головки, крайней плоти или тела пениса.
Код (ы)МКБ–10:
Дата разработки протокола: 2023 год.
Сокращения, используемые в протоколе:
Категория пациентов: взрослые.
Шкала уровня доказательности.
Рак полового члена — онкологическое заболевание, при котором злокачественная опухоль, происходящая из эпителиальной ткани, локализуется в области головки, крайней плоти или тела пениса.
ВВОДНАЯ ЧАСТЬ
Код (ы)МКБ–10:
| Код | Название |
| С.60 | Злокачественные новообразования полового члена |
Дата разработки протокола: 2023 год.
Сокращения, используемые в протоколе:
|
КТ – компьютерная томография
|
| ЛУ – лимфатические узлы |
| МРТ – магнитно-резонансная томография |
|
ПЭТ – позитронно-эмиссионная томография
|
| РПЧ – рак полового члена |
| ТАБ – тонкоигольная аспирационная биопсия |
|
УД – уровень доказательности
|
| УЗИ – ультразвуковое исследование |
| TNM – опухоль, лимфатический узел, метастаз |
|
ВИЧ –вирус иммунодефицита человека
|
| РПГА-реакция пассивной гемаглютинации трепонемный тест определение антител к Treponema pallidum |
| Гр-грей |
Пользователи протокола: онкологи, хирурги, радиологи, химиотерапевты, урологи, врачи общей практики, терапевты.
Категория пациентов: взрослые.
Шкала уровня доказательности.
Уровни градации рекомендаций:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с не высоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С |
Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+).
Результаты, которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++или+), результаты которых не могут быть непосредственно распространены на соответствующую популяцию.
|
| D | Описание серии случаев или неконтролируемое исследование, или мнение экспертов. |
Классификация
Классификация [1]:
Основной гистологической формой рака полового члена является плоскоклеточный рак, который составляет 95% всех новообразований полового члена.
Таблица 1. Гистологические подтипы РПЧ, их частота и прогноз.
Предопухолевые заболевания полового члена можно разделить на факультативные (с низким риском развития рака полового члена) и облигатные (высоким риск развития рака полового члена). К факультативным предопухолевым заболеваниям относятся кожный рог полового члена и папилломы полового члена . Облигатными заболеваниями являются внутриэпителиальная неоплазия полового члена (эритроплазия Квейрата (Queyrat), болезнь Боуэна (Bowen)), а также облитерирующий балантит [1].
М – отдаленные метастазы:
Таблица 1. Гистологические подтипы РПЧ, их частота и прогноз.
|
Подтип
|
Частота (случаев %) | Прогноз |
| Классический плоскоклеточный рак | 48-65 | Зависит от локализации, стадии и степени злокачественности |
|
Базалоидный
|
4-10 | Плохой прогноз, часто раннее поражение паховых Л |
|
Бородавчатый
|
7-10 | Хороший прогноз, редко метастазирует |
|
Веррукозный
|
3-8 | Хороший прогноз, не метастазирует |
|
Папиллярный
|
5-15 | Хороший прогноз, редко метастазирует |
|
Саркоматоидный
|
1-3 | Очень плохой прогноз, ранние сосудистые метастазы |
|
Смешанный
|
9-10 | Гетерогенная группа |
|
Псевдогиперпластический
|
< 1 | Крайняя плоть, связан с ксеротическим баланитом, хороший прогноз, метастазы не описаны |
|
Веретеноклеточный
|
< 1 | Вариант веррукозной карциномы, хороший прогноз, метастазы не описаны |
|
Псевдогландулярный
|
< 1 | Карцинома высокой степени злокачественности, рано метастазирует, плохой прогноз |
|
Бородавчато-базалоидный
|
9-14 | Плохой прогноз, высокий потенциал к метастазированию (выше, чем при бородавчатом типе, ниже, чем при базалоидном типе) |
|
Аденосквамозный
|
< 1 | Центральная и перимеатальная часть головки, карцинома высокой степени злокачественности, высокий потенциал к метастазированию, но низкая смертность |
|
Мукоэпидермоидный
|
< 1 | Высокая агрессивность, плохой прогноз |
|
Светлоклеточный вариант РПЧ
|
1-2 | Крайне редкий вариант, связан с ВПЧ, агрессивный, рано метастазирует, плохой прогноз, зависит от локализации, часто поражает Л |
Предопухолевые заболевания полового члена можно разделить на факультативные (с низким риском развития рака полового члена) и облигатные (высоким риск развития рака полового члена). К факультативным предопухолевым заболеваниям относятся кожный рог полового члена и папилломы полового члена . Облигатными заболеваниями являются внутриэпителиальная неоплазия полового члена (эритроплазия Квейрата (Queyrat), болезнь Боуэна (Bowen)), а также облитерирующий балантит [1].
Клиническая классификация.
TNM РПЧ 2016 г.
Т – первичная опухоль:
Тх недостаточно данных для оценки первичной опухоли Т0 первичная опухоль не определяется.
Тis карцинома in situ.
Та неинвазивная веррукозная (бородавчатая) карцинома без деструктивного инвазивного роста Т1 опухоль прорастает субэпителиальную соединительную ткань.
Т1а опухоль врастает в субэпителиальную соединительную ткань без признаков лимфоваскулярной инвазии и не является низкодифференцированной или недифференцированной (Т1G1–2).
Т1b опухоль врастает в субэпителиальную соединительную ткань с лимфоваскулярной инвазией либо является низкодифференцированной или недифференцированной (Т1G3–4).
Т2 опухоль врастает в губчатое тело с или без инвазии в уретру.
Т3 опухоль прорастает в кавернозное тело с или без инвазии в кавернозное тело.
Т4 опухоль распространяется на другие окружающие структуры.
N – регионарные лимфатические узлы (ЛУ):
Nх недостаточно данных для оценки состояния регионарных ЛУ N0 нет пальпируемых или визуально увеличенных паховых ЛУ.
N1 имеется подвижный пальпируемый паховый ЛУ с одной стороны.
N2 имеются множественные или двусторонние подвижные пальпируемые паховые ЛУ.
N3 неподвижный конгломерат паховых ЛУ или увеличение тазовых ЛУ, одностороннее или двустороннее.
М – отдаленные метастазы:
М0 нет признаков наличия отдаленных метастазов.
Патоморфологическая классификация TNM РПЧ 2016 г.:
G – гистологическая градация:
М1 имеются отдаленные метастазы.
Патоморфологическая классификация TNM РПЧ 2016 г.:
Патоморфологические категории Т соответствуют клиническим категориям Т. Категории рN основываются на данных биопсии или лимфодиссекции.
рN – регионарные ЛУ.
рNх недостаточно данных для оценки состояния регионарных ЛУ.
рN0 нет метастазов в регионарных ЛУ.
рN1 метастаз в одном или двух паховых лимфоузлах с одной стороны.
рN2 множественное или двустороннее поражение паховых ЛУ.
рN3 метастаз в одном или нескольких тазовых ЛУ с одной или обеих сторон либо экстранодальное распространение метастаза пахового ЛУ.
рМ – отдаленные метастазы.
рМ0 нет отдаленных метастазов.
рМ1 наличие отдаленных метастазов.
G – гистологическая градация:
Gх недостаточно данных для оценки гистологической дифференцировки.
G1 высокодифференцированная опухоль.
G2 умеренно дифференцированная опухоль.
G3–4 низкодифференцированная или недифференцированная опухоль.
Группировка по стадиям:
Группировка по стадиям:
| Стадия 0 |
Тis
Та
|
N0
N0
|
М0
М0
|
| Стадия I | Т1 | N0 | М0 |
| Стадия II |
Т1
Т2
Т2
|
N1
N0
N1
|
М0
М0
М0
|
| Стадия III |
Т1
Т2
Т3
Т3
Т3
|
N2
N2
N0
N1
N2
|
М0
М0
М0
М0
М0
|
| Стадия VI |
Т4
Любая Т
Любая Т
|
Любая N
N3
Любая N
|
М0
М0
М1
|
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ
Диагностические критерии
Жалобы и анамнез:
На появление на головке полового члена или внутренней поверхности крайней плоти патологических образований: эрозий, язвочек, папиллом, узелков, трещин или уплотнений бледного или, наоборот, красноватого цвета.
Физикальное обследование:
Пациенты с любыми изменениями покровного эпителия полового члена должна пройти физикальное обследование.
При первичном осмотре необходимо отметить следующее:
Размер первичного очага или подозрительной области;
Локализацию опухоли на половом члене;
Количество опухолевых образований;
Внешний вид – сосочковые, узловые, в виде язвы или плоские;
Связь с другими структурами – подслизистой основой, пещеристыми, либо губчатым телами, уретрой;
Цвет, форму очагов, а также наличие возможных наложений (фибрин, корки, гнойное или серозное отделяемое).
Регионарные лимфатические узлы: Обязательным является пальпация паховых лимфатических узлов, которая может дать следующие результаты:
Пальпируемые лимфатические узлы: При наличии пальпируемых лимфатических узлов должны быть определены следующие параметры:
Диаметр лимфатических узлов (или конгломерата);
Уни- или билатеральная локализация;
Количество лимфатических узлов, определяемых в каждой паховой области;
Подвижность или несмещаемость лимфатических узлов (или конгломерата);
Связь с другими структурами (кожей, паховой связкой);
Наличие отека на нижней конечности, и/либо на мошонке.
Дополнительные:
NB! Отдаленные метастазы:
Гистологическое или цитологическое исследование:
Показания для консультации специалистов:
Диагностический алгоритм рака полового члена
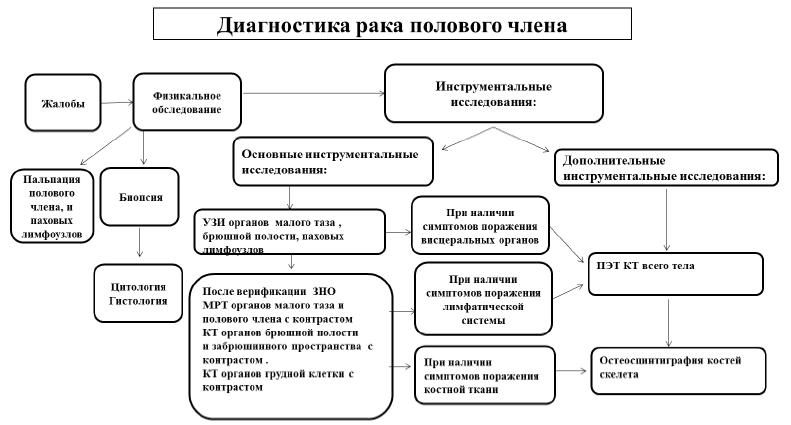
Лабораторные исследования
Основные:
Общий анализ крови – наиболее характерно наличие анемии, разной степени выраженности; повышение СОЭ, лейкоцитоз;
Общий анализ мочи – микро-, макрогематурия, возможно: лейкоцитурия, бактериурия, протеинурия.
Дополнительные:
Биохимический анализ крови – гипопротеинемия, повышение креатинина, мочевины;
Коагулограмма – склонность к гиперкоагуляции.
Дополнительные:
Инструментальные исследования
Основные:
УЗИ органов малого таза брюшной полости, паховых лимфоузлов;
МРТ органов малого таза и полового члена с контрастом;
КТ органов брюшной полости и забрюшинного пространства с контрастом;
КТ органов грудной клетки с контрастом.
Дополнительные:
остеосцинтиграфия костей скелета (наличии симптомов поражения костной ткани);
ПЭТ КТ всего тела (при наличии симптомов поражения висцеральных органов).
NB! Отдаленные метастазы:
1) При наличии метастазов в паховых ЛУ для стадирования показана КТ органов брюшной полости и малого таза, а также рентгенография/КТ органов грудной клетки. В качестве альтернативы можно выполнить ПЭТ/КТ всего тела.
2) Пациентам с системным процессом или выраженными симптомами показано выполнение остеосцинтиграфии костей скелета.
Гистологическое или цитологическое исследование:
3) Целью данных исследований является: для установления патоморфологического диагноза, и определение уровня дифференцировки опухолевых клеток.
Показания для консультации специалистов:
4) При наличии сопутствующих заболеваний консультация профильного специалиста.
Диагностический алгоритм рака полового члена

Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований:
Дифференциальная диагностика рака полового члена:
|
Диагноз
|
Обоснование для дифференциальной диагностики | Обследования | Критерии исключения диагноза |
|
Факультативные
(кожный рог полового члена и папилломы полового члена.
|
При наличии образования на половом члене и выделение |
УЗИ органов малого таза и МРТ полового члена. Цитологическое и гистологическое исследование
Вирус папилломы человека
Анализ крови на РПГА
Анализ крови на ВИЧ
|
Наличие образования по данным УЗИ и МРТ полового члена.
Цитологическое или гистологическое подтверждение диагноза
|
|
Облигатные
(внутриэпителиальная неоплазия полового члена (эритроплазия Квейрата (Queyrat), болезнь Боуэна (Bowen)), а также облитерирующий балантит)
|
При наличии образования на коже половом члене , выделение, а так же изменения формы полового члена |
МРТ полового члена.
Цитологическое и гистологическое исследование
Вирус папилломы человека
|
Наличие образования по данным МРТ полового члена.
Цитологическое или гистологическое подтверждение диагноза
|
| Туберкулез полового члена (ТПЧ) – относительно редкое заболевание. | Туберкулез полового члена может быть первичным, вторичным и ятрогенным (индуцированным инстилляциями БЦЖ по поводу поверхностного рака мочевого пузыря). ТПЧ включает туберкулез кожи пениса, туберкулез головки полового члена, туберкулез кавернозных тел. Любые изменения на половом члене заставляют предположить в первую очередь заболевания, передаваемые половым путем или злокачественное перерождение тканей. | Диагноз подтверждают преимущественно патоморфологически, идентификация МБТ методом посева, результаты ПЦР-диагностики дают положительный результат не более чем в трети случаев. | Цитологическое или гистологическое подтверждение диагноза ПЦР-диагностика |
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ: нет.
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ
Карта наблюдения пациента, маршрутизация пациента: нет.
Немедикаментозное лечение:
Режим 1 (постельный) первые сутки после операции;
Режим 2 (полупостельный) 2-3 сутки после операции;
Режим 3 (общий) свободный режим;
Диета – стол №7.
Алгоритм лечения рака полового члена:

Лучевая терапия: Использование лучевой терапии также возможно как в самостоятельном варианте, так и в комбинации с другими методами лечения. При комбинации лучевой терапии с оперативным методом лечения облучению подвергают первичный опухолевый очаг, а также зоны паховобедренных лимфатических узлов. Облучение полового члена производят с паховобедренного поля или, если его деформация не позволяет, с отдельного поля. Из-за опасности усиления отека и обострения воспаления рекомендуется использование классического фракционирования.
1. Лучевая терапия как самостоятельный метод лечения при незначительных размерах первичной опухоли (до 4 см) и хороших факторах прогноза – методика была описана выше. Из наиболее частых осложнений данного метода лечения следует отметить рубцевание (15-30%), стриктуры уретры (20-35%), телеангиэктазии (более 90%), а также поздние лучевые изменения в виде некрозов, которые зачастую бывает сложно дифференцировать с рецидивом опухоли.
2. Неоадьювантная лучевая терапия назначается с целью уменьшения размеров опухолевого образования. нежелательном назначении ввиду увеличения осложнений в виде смертельных исходов от лимфаденэктомии после неоадьювантной лучевой терапии.
3. Адьювантная лучевая терапия подразумевает снижение вероятности локальных рецидивов в зоне операции. Её назначают в суммарной дозе 40-60 Гр.
Лучевую терапию можно использовать как самостоятельный метод лечения на начальных стадиях заболевания. Близкофокусная рентгенотерапия позволяют достичь хороших результатов в лечении опухолей диаметром до 2 см. Развитие отдаленных осложнений (рубцевание, некроз кожи) встречается не редко. Использование отдельной методики позволяет достичь лучших результатов по сравнению с комбинацией дистанционной лучевой терапии.
Применяют близкофокусную рентгенотерапию или воздействие пучком электронов в разовой дозе 2-5 Гр до суммарной очаговой дозы не менее 60 Гр. При назначении БФТ очень важным моментом является выполнение циркумцизии перед данной процедурой.
В случаях наличии рака in situ показано выполнение органосохраняющего лечения. Рекомендуется применение одной из следующих методик лечения:
1 Локальная эксцизия очага.
2 Местное применение химиопрепаратов (крем с 5-фторурацилом).
Медикаментозное лечение:
Адьювантная терапия показана в случаях поражения двух и более лимфатических узлов, либо при инвазии опухоли за пределы капсулы лимфатического узла, так как у данной группы больных прогноз заболевания значительно ухудшается по сравнению с больными, у которых определяется метастатическое поражение только одного лимфоузла.
Комбинированная терапия подразумевает использование методик химиолучевого воздействия в комбинации с хирургическим вмешательством. У пациентов с первично диагностированным раком полового члена с наличием метастатического поражения тазовых лимфоузлов показано назначение неоадъювантной химиотерапии. Применение радикальной или паллиативной операции, либо лучевой терапии рассматривается с учетом ответа опухоли на химиотерапию. При плохом ответе на химиотерапию методики паллиативного оперативного лечения могут быть применены у выборочной группы больных (соматически сохранные пациенты с большой ожидаемой продолжительностью жизни).
Перечень основных лекарственных средств (имеющих 100% вероятность применения)
Химиотерапию рака полового члена используют как в различных сочетаниях с другими методами, так и в качестве самостоятельного метода лечения, особенно при наличии отделенных метастазов. Так, химиотерапию комбинируют с лучевым методом при фимозе (после циркумцизии). Её также сочетают с лучевым лечением.
Неоадъювантные курсы химиотерапии проводятся пациентам с неоперабельным, метастатическим процессом (Т4), также с метастазами в регионарные лимфатические узлы подтвержденные гистологический (схемы TIP, PF).
Адъювантная химиотерапия не входит в стандарты лечения рака полового члена, однако при наличии признаков неблагоприятного прогноза может проводится, если не было неоадъювантной химиотерапии.
Самостоятельные курсы химиотерапии последующей линии при метастатическом, рецидивирующем заболеваниях (Паклитаксел+Цетуксимаб).
В монорежиме можно использовать препараты – Цисплатин, капецитабин, паклитаксел, цетуксимаб.
Перечень основных лекарственных средств (имеющих 100% вероятность применения)
|
Фармакотерапевтическая группа
|
МНН лекарственного средства | Способ применения | Уровень доказательности |
| Алкилирующие агенты – комплексные соединения платины | цисплатин |
20 мг/м2 в/в (30-60-минутная инфузия) 1-3-й дни;
70-80 мг/м2 в/в в 1 день;
|
А |
| Препараты растительного и природного происхождения. Микротрубочковые ингибиторы – таксаны | паклитаксел | 175 мг/м2 в/в 3-часовая инфузия в 1-й день | А |
| Алкилирующие агенты – хлорэтиламины | ифосфамид | 1200 мг/м2 в/в (30-60-минутная инфузия) в 1-3 дни | А |
| Антидотом акролеина, метаболита противоопухолевых средств из группы оксазафосфоринов (ифосфамид, циклофосфамид) | месна |
800 мг в/в струйно до введения ифосфамида, через 4 и 8ч после его инфузии в 1,2,3-й дни
|
В |
| Фторпиримидины | 5-фторурацил | 800-1000 мг/м2 в/в в 1-4 дни | А |
| Моноклональное антитело, EGFR ингибитор | цетуксимаб | 400 мг/м2 в/в (2-часовая инфузия) 1 введение, затем цетуксимаб 250мг/м2 в/в (1-часовая инфузия) еженедельно | А |
Перечень дополнительных лекарственных средств (менее 100% вероятности применения)
|
Фармакотерапевтическая группа
|
МНН лекарственного средства | Способ применения | Уровень доказательности |
| Противоопухолевое средство. Антиметаболит. | капецитабин |
1000 мг/м2 внутрь 1-14 дней
Повтор каждые 21 день
|
А |
Схемы полихимиотерапии при лечении рака полового члена.
TIP: Повтор курса каждые 21 день.
4 курса – стандартный режим второй линии
|
Паклитаксел
|
175 мг/м2 в/в 3-часовая инфузия в 1-й день |
|
Ифосфамид
|
1200 мг/м2 в/в (30-60-минутная инфузия) в 1-3 дни |
|
Месна
|
800 мг в/в струйно до введения ифосфамида, через 4 и 8ч после его
инфузии в 1,2,3-й дни
|
|
Цисплатин
|
20 мг/м2 в/в (30-60-минутная инфузия) 1-3-й дни |
PF: 4 курса – Повтор курса каждые 21 день.
|
Фторурацил
|
800-1000 мг/м2 в/в в 1-4 дни |
|
Цисплатин
|
70-80 мг/м2 в/в в 1 день |
Паклитаксел+Цетуксимаб: 4 курса – Повтор курса каждые 21 день.
|
Паклитаксел
|
175 мг/м2 в/в 3-часовая инфузия в 1-й день |
|
Цетуксимаб
|
400 мг/м2 в/в (2-часовая инфузия) 1 введение, затем цетуксимаб 250мг/м2 в/в (1-часовая инфузия) еженедельно |
Схемы монохимиотерапии при лечении рака полового члена
|
Паклитаксел
|
175 мг/м2 в/в 3-часовая инфузия в 1-й день
Повтор каждые 21 день
|
|
Цисплатин
|
70-80 мг/м2 в/в в 1 день Повтор каждые 21 день |
|
Капецитабин
|
1000 мг/м2 внутрь 1-14 дней
Повтор каждые 21 день
|
|
Цетуксимаб
|
400 мг/м2 в/в (2-часовая инфузия) 1 введение, затем цетуксимаб 250мг/м2 в/в (1-часовая инфузия) еженедельно |
Общий алгоритм терапии рака полового члена может быть представлен следующим образом:
I. Рекомендации по лечению первичного очага:
стадия Tis: рекомендуется применение органосохраняющей тактики.
стадия Та-1 G1-2: рекомендуется применение органосохраняющей тактики. У больных с невозможностью осуществления динамического наблюдения показано выполнение частичной ампутации.
стадия Т1 G3, Т≥2: показано выполнение частичной либо тотальной ампутации, или эмаскуляции в зависимости от локализации и размеров опухоли. В Консервативная терапия возможна только у ограниченной выборочной группы больных с обязательным динамическим наблюдением.
локальный рецидив при консервативной терапии: показано проведение повторного курса консервативной терапии при отсутствии инвазии опухоли в кавернозные тела. В При большом рецидиве и наличии инвазии кавернозных тел показано выполнение частичной или полной ампутации полового члена.
II. Рекомендации при не пальпируемых лимфатических узлах:
низкий риск регионарного метастазирования (рТis, рТаG1-G2, рТ1G1): рекомендовано динамическое наблюдение. Для больных, которым невозможно проведение планового обследования через фиксированный промежуток времени, показано выполнение паховой лимфаденэктомии.
средний риск регионарного метастазирования (pТ1G2): при возможности, показано выполнение радиоизотопной лимфосцинтиграфии с Тс99м с последующей биопсией лимфатических узлов, накопивших радиофармпрепарат. В случае обнаружения метастатического поражения лимфоузлов, показано их удаление. При невозможности выполнение радиоизотопной лимфосцинтиграфии показано выполнение паховой лимфаденэктомии. Отказ от паховой лимфаденэктомии возможен только у строго отобранной группы больных с обязательным тщательным динамическим наблюдением. Паховая лимфаденэктомия должна быть дополнена тазовой, при наличии двух и более метастазов в паховых лимфоузлах или при определении экстракапсулярной инвазии.
высокий риск регионарного метастазирования (рТ≥2 или G3): в данной ситуации показано выполнение радикальной паховой лимфаденэктомии, которая может быть дополнена тазовой при соответствующих гистологических находках.
III. Рекомендации при метастатическом поражении пальпируемых лимфатических узлов:
Показано выполнение радикальной паховой лимфаденэктомии, которая может быть расширена до тазовой при соответствующих гистологических находках. Больным с массивными паховыми конгломератами или с увеличенными тазовыми лимфоузлами (по данным КТ и МРТ) показано проведение курса предоперационной химиотерапии или лучевой терапии. Однако неоадьювантная лучевая терапия статистически повышает смертность пациентов при последующей лимфаденэктомии. В случае появления лимфатических узлов в процессе динамического наблюдения показано выполнение паховой лимфаденэктомии с возможностью расширения до тазовой при соответствующих гистологических находках.
Хирургическое вмешательство [1]:
Метод выбора того или иного воздействия зависит от предпочтений самого хирурга и больного, размеров очага, глубины инвазии и наличия необходимого оборудования.
I. Лечение опухоли Та-1G1-2. Больным, за которыми возможно проводить после лечения дальнейшее регулярное наблюдение, показано выполнение органосохраняющих методик лечения, к которым относятся: лазерная деструкция опухоли, локальная эксцизия с реконструктивной хирургией, дистанционная лучевая терапия или брахитерапия, ампутация головки полового члена. Больным, у которых выполнение тщательного дальнейшего наблюдения в динамике является сомнительным, следует рекомендовать выполнение частичной ампутации полового члена.
Локальный рецидив:
II. Лечение опухолей Т1G3, Т≥2. Стандартным методом лечения является хирургическое вмешательство в объеме частичной или полной ампутации полового члена или эмаскуляции в зависимости от объема поражения. Только у больных с распространением опухоли не более чем на половину головки полового члена возможно проведение органосохраняющих методик лечения с обязательным строгим динамическим наблюдением.
Локальный рецидив:
Если после проведения органосохраняющего лечения развивается локальный рецидив, проведение повторного органосохраняющего лечения возможно только при исключении опухолевой инвазии кавернозных тел. При наличии глубокой опухолевой инвазии или большого опухолевого очага показано выполнение частичной или полной ампутации полового члена. Регионарные лимфатические узлы:
Радикальная лимфаденэктомия является стандартом в лечении больных с наличием метастазов в лимфатических узлах.
Не пальпируемые лимфатические узлы: Низкий риск развития регионарных метастазов: К данной группе относятся больные с характеристикой первичного очага pTis, pTaG1-G2, pT1G1. Вероятность возникновения метастазов у данной категории больных составляет менее 16.5%. Больным из данной группы с невозможностью выполнения динамического наблюдения в силу различных обстоятельств показано выполнение паховой лимфаденэктомии.
1. Средний риск развития регионарных метастазов: К данной группе относятся больные с характеристикой первичного очага pТ1G2. Риск наличия регионарных метастазов в данной группе достигает 30%. У больных без признаков сосудистой или лимфатической инвазии опухоли по данным гистологического исследования первичного очага рекомендуется тщательное обследование. Если присутствует инвазия опухоли в лимфатические или кровеносные сосуды показано выполнение паховой лимфаденэктомии. При возможности дальнейшего динамического обследования, больным из данной группы возможно выполнение биопсии лимфатических узлов под контролем радиоизотопной лимфосцинтиграфии с Тс99 При отсутствии признаков метастазирования по данным этого метода исследования, возможно применение выжидательной тактики в отношении лимфаденэктомии под контролем обязательного динамического наблюдения.
2. Высокий риск регионарного метастазирования: Сюда входят больные с характеристиками опухолевого очага рТ≥2 или G3. Риск определения метастазов в лимфатических узлах составляет 68-73%. В В данном случае обязательно выполнение радикальной паховой лимфаденэктомии, которая может быть расширена до тазовой (может быть выполнена лапароскопическая тазовая лимфаденэктомия) при наличии метастазов в лимфоузлах при плановом гистологическом исследовании. Границами тазовой лимфаденэктомии являются: сверху – бифуркация подвздошных сосудов, медиально – обтураторный нерв, латерально – подвздошно-паховый нерв.
С контралатеральной стороны, при отсутствии пальпируемых лимфоузлов, лимфаденэктомия должна выполняться изначально и может быть расширена до тазовой при обнаружении метастазов в паховых лимфоузлах при плановом гистологическом исследовании.
Фиксированные паховые конгломераты или позитивные тазовые лимфоузлы (по данным КТ или МРТ): При наличии больших объемных образований паховых областей (метастазы) или увеличенных лимфатических узлов таза (КТ, МРТ) показано назначение курсов адьювантной химиотерапии, которая может привести к частичной или полной регрессии опухоли в 21-60% случаев. Выполнение паллиативной пахово-подвздошно-обтураторной лимфаденэктомии является обязательным методом лечения. Другим вариантом лечения может быть проведение предоперационной лучевой терапии с последующей лимфаденэктомией. Появление пальпируемых лимфоузлов в период динамического наблюдения: Если при очередном обследовании у больного определяются увеличенные паховые лимфатические узлы, это свидетельствует об их метастатическом поражении практически в 100% случаев. В данной ситуации показано применение следующих методик лечения:
Пальпируемые лимфатические узлы: При определении позитивных лимфатических узлов (посредством биопсии) обязательным является выполнение паховой лимфаденэктомии. Выполнение отсроченной или одновременной тазовой лимфаденэктомии показано в случаях обнаружения двух и более метастазов в паховые лимфатические узлы или наличии инвазии опухоли за пределы капсулы лимфатического узла. В данной ситуации вероятность наличия метастазов в тазовых лимфоузлах повышается до 30%. Так, в случае наличия 2-3 метастазов в паховых лимфоузлах, вероятность тазового метастазирования 23%, и 56% при наличии более 3 пораженных паховых лимфоузлов. В данном случае вероятность излечения снижается до 14-54%.
С контралатеральной стороны, при отсутствии пальпируемых лимфоузлов, лимфаденэктомия должна выполняться изначально и может быть расширена до тазовой при обнаружении метастазов в паховых лимфоузлах при плановом гистологическом исследовании.
Фиксированные паховые конгломераты или позитивные тазовые лимфоузлы (по данным КТ или МРТ): При наличии больших объемных образований паховых областей (метастазы) или увеличенных лимфатических узлов таза (КТ, МРТ) показано назначение курсов адьювантной химиотерапии, которая может привести к частичной или полной регрессии опухоли в 21-60% случаев. Выполнение паллиативной пахово-подвздошно-обтураторной лимфаденэктомии является обязательным методом лечения. Другим вариантом лечения может быть проведение предоперационной лучевой терапии с последующей лимфаденэктомией. Появление пальпируемых лимфоузлов в период динамического наблюдения: Если при очередном обследовании у больного определяются увеличенные паховые лимфатические узлы, это свидетельствует об их метастатическом поражении практически в 100% случаев. В данной ситуации показано применение следующих методик лечения:
Выполнение двусторонней радикальной лимфаденэктомии по вышеописанным критериям.
Выполнение паховой лимфаденэктомии на стороне позитивных лимфатических узлов в случае наличия длительного интервала ремиссии. Метастазирование в паховые области происходит синхронно с двух сторон или с небольшим интервалом во времени. Таким образом, если в процессе длительного наблюдения за пациентом у него появляются метастазы в паховых лимфатических узлах с одной стороны, то вероятность их развития с контралатеральной стороны по истечению значительного промежутка времени ничтожно мала – 10%. В данном случае может быть рекомендовано выполнение унилатеральной лимфаденэктомии с последующим тщательным наблюдением. Однако, при наличии метастазов более чем в одном лимфатическом узле с одной стороны, вероятность наличия микрометастазов с контралатеральной стороны увеличивается до 30%. В данной ситуации показано выполнение билатеральной лимфаденэктомии.
Режим наблюдения:
Объем наблюдения:
Дальнейшее ведение:
Наблюдение у онколога или ВОП.
Режим наблюдения:
первый год – 1 раз в 3мес;
второй год – 1 раз в 6 мес;
в последующие до 5 лет – 1 раз в год.
Объем наблюдения:
общий анализ крови раз в 3 месяца в течении первого года, далее 1 раз в 6 месяцев;
общий анализ мочи раз в 3 месяца в течении первого года, далее 1 раз в 6 месяцев;
биохимический анализ крови (с определением шлаков, белка, сахара) раз в 3 месяца в течении первого года, далее 1 раз в 6 месяцев
УЗИ органов брюшной полости и забрюшинного пространства, УЗИ паховых лимфоузлов раз в 3 месяца в течении первого года, далее 1 раз в 6 месяцев;
Рентгенография легких каждые 6 месяцев;
КТ органов брюшной полости и забрюшинного пространства каждые 12 месяцев;
МРТ малого таза и полового члена каждые 12 месяцев.
Динамическое наблюдение - при раке полового члена рекомендуется придерживаться следующих алгоритмов при дальнейшем наблюдении за больным:
первичная опухоль: пациенты, прошедшие консервативную терапию должны обследоваться каждые 2 месяца в течение первых 2 лет, затем каждые 3 месяца в течение года, затем каждые 6 месяцев. Больной должен иметь навыки самообследования. Больным, которым была выполнена частичная либо тотальная ампутация – каждые 4 месяца в течение первых 2 лет, затем каждые 6 месяцев.
- регионарные лимфоузлы и отдаленные метастазы: После удаления первичного очага в случае намеченного динамического наблюдения показано регулярное обследование каждые 2 месяца в течение первых 2 лет, затем каждые 3 месяца в течение последующего года. Затем каждые 6 месяцев в последующие 2 года. После выполнение паховой лимфаденэктомии (рN0) показано контрольное обследование каждые 4 месяца в течение первых 2 лет, затем каждые 3 месяца в течение года. Дальнейшее наблюдение в случае отсутствия признаков метастазирования можно не выполнять. В случае выполнения паховой лимфаденэктомии (рN1-3) показано выполнение тщательного обследования (КТ малого таза, МРТ, рентгенография грудной клетки, УЗИ ОБП, малого таза) каждые 2 месяца по меньшей мере в течение 2 лет. Выполнение сканирования костей показано только при наличии симптомов поражения костной ткани.
обоснования для наблюдения
раннее выявление рецидива позволяет провести радикальное лечение. При эффективном лечении местный рецидив статистически значимо не снижает отдаленную выживаемость, в то время как поражение паховых ЛУ значительно уменьшает вероятность длительной канцероспецифической выживаемости. Кроме того, наблюдение необходимо для определения и купирования осложнений, связанных с лечением. Местный рецидив и рецидив поражения паховых ЛУ чаще всего развиваются в течение двух лет после первичного лечения . Через 5 лет после лечения определяются только местные рецидивы или новые первичные опухоли . У хорошо информированных пациентов с высоким уровнем мотивации можно прекращать наблюдение через 5 лет, однако они должны продолжать регулярное самообследование
Когда и как наблюдать:
у пациентов без поражения паховых ЛУ после местного лечения наблюдение должно включать физикальное обследование полового члена и паховой области для выявления местного и/или регионарного рецидива.
клиническая значимость дополнительных методов визуализации не подтверждена. Наблюдение должно также зависеть от метода лечения первичной опухоли. После лазерной абляции или топической химиотерапии необходимо выполнить биопсию головки для подтверждения отсутствия опухоли. После потенциально радикального лечения при метастазах в паховые ЛУ рекомендуется в течение первых двух лет каждые 3 месяца проводить КТ или МРТ для выявления отдаленных метастазов, поскольку в этой группе больных эффективна химиотерапия. Хотя в редких случаях может развиваться поздний местный рецидив, угрожающие жизни отдаленные метастазы редко наблюдаются через 5 лет после лечения. Это подразумевает, что можно прекратить регулярное наблюдение через 5 лет, при условии что пациент обратится сразу же после появления местных изменений. Больным, которые вряд ли будут проводить самообследование, может потребоваться длительное наблюдение.
Рецидив первичной опухоли:
Местный рецидив чаще развивается после органосохраняющего лечения любого типа, включая местное иссечение, лазерное лечение, брахитерапию и другие методы. Однако в отличие от регионарного рецидива он практически не влияет на выживаемость. После резекции полового члена риск местного рецидива не превышает 4–5%. Местный рецидив легко диагностируется при физикальном исследовании пациентом или врачом. Важной частью наблюдения является обучение больного, поскольку он должен обращаться к врачу при появлении каких-либо изменений.
Регионарный рецидив:
Большинство регионарных рецидивов развивается в течение первых двух лет после диагностики и лечения независимо от того, применялось ли динамическое наблюдение, биопсия сторожевого ЛУ или модифицированная паховая лимфодиссекция. Регионарные рецидивы могут также развиваться позднее, хотя и редко, поэтому рекомендуется продолжать интенсивное наблюдение этой группы больных. У пациентов, которым проводилась выжидательная тактика, выше риск рецидива (9%), чем у больных, которым выполнялось инвазивное стадирование ЛУ путем модифицированной паховой лимфодиссекции или динамической биопсии сторожевого ЛУ (2,3%).
Использование УЗИ с тонкоигольной аспирационной биопсией (ТАБ) при подозрении на рецидив позволяет улучшить раннее выявление регионарного рецидива. В настоящее время не получено данных, свидетельствующих о необходимости выполнения КТ или МРТ для наблюдения за регионарными ЛУ. У больных, которым выполнялась лимфодиссекция по поводу подтвержденных метастазов в ЛУ, риск развития регионарного рецидива увеличивается до 19% . Регионарные рецидивы требуют своевременного лечения с проведением радикальной тазовой лимфодиссекции и адъювантной терапии
Прогноз: Прогноз при раке полового члена зависит от стадии заболевания. При начальных формах заболевания прогноз вполне благоприятен – можно добиться стойкого излечения практически в 100% случаев. При II-III стадии процесса при комбинированном лечении 5-летняя выживаемость больных достигает 60-70%. При IV стадии выживаемость гораздо ниже. Без лечения больные живут в среднем около 3 лет.
Индикаторы эффективности лечения и безопасности методов диагностики и лечения, описанных в протоколе:
«ответ опухоли» - регрессия опухоли после проведенного лечения;
Полный эффект – исчезновение всех очагов поражения на срок не менее 4х недель.
Частичный эффект – большее или равное 50% уменьшение всех или отдельных опухолей при отсутствии прогрессирования других очагов.
Стабилизация – (без изменений) уменьшение менее чем на 50% или увеличение менее чем на 25% при отсутствии новых очагов поражения.
Прогрессирование – увеличение размеров одной или более опухолей более 25% либо появление новых очагов поражения[7] (УД – А).
безрецидивная выживаемость (трех и пятилетняя);
«качество жизни» включает кроме психологического, эмоционального и социального функционирования человека, физическое состояние организма больного.
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ
Показания для плановой госпитализации:
Наличие опухолевого процесса в половом члене, верифицированного гистологически или/и цитологически;
Операбельный рак полового члена (I-IV стадии).
Показания для экстренной госпитализации:
Распад опухоли и кровотечение из образования полового члена и лимфатических узлов.
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2023
- 1) Hakenberg, O.W., et al. EAU guidelines on penile cancer: 2014 update. Eur Urol, 2015. 67: 142. https://www.ncbi.nlm.nih.gov/pubmed/25457021. 2) Robinson, R.N., et al. What are the risks and benefits of adjuvant radiotherapy after inguinal lymphadenectomy for penile cancer? PROSPERO, 2015. http://www.crd.york.ac.uk/PROSPERO/display_record.php?ID=CRD42015024904. 3) Clark, P.E., et al. Penile cancer: Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw, 2013. 11: 594. https://www.ncbi.nlm.nih.gov/pubmed/23667209. 4) Van Poppel, H., et al. Penile cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and followup. Ann Oncol, 2013. 24 Suppl 6: vi115. https://www.ncbi.nlm.nih.gov/pubmed/23975666. 5) Mannweiler, S., et al. Clear-cell differentiation and lymphatic invasion, but not the revised TNM classification, predict lymph node metastases in pT1 penile cancer: a clinicopathologic study of 76 patients from a low incidence area. Urol Oncol, 2013. 31: 1378. https://www.ncbi.nlm.nih.gov/pubmed/22421354. 6) Chaux, A., et al. Epidemiologic profile, sexual history, pathologic features, and human papillomavirus status of 103 patients with penile carcinoma. World J Urol, 2013. 31: 861. https://www.ncbi.nlm.nih.gov/pubmed/22116602. 7) Arya, M., et al. Long-term trends in incidence, survival and mortality of primary penile cancer in England. Cancer Causes Control, 2013. 24: 2169. https://www.ncbi.nlm.nih.gov/pubmed/24101363. 8) Brierley, J., et al., TNM Classification of Malignant Tumours, 8th Edn. 2016. https://www.uicc.org/8th-edition-uicc-tnm-classification-malignant-tumors-published. 9) Tang, V., et al. Should centralized histopathological review in penile cancer be the global standard? BJU Int, 2014. 114: 340. https://www.ncbi.nlm.nih.gov/pubmed/24053106 53. 10) Aumayr, K., et al. P16INK4A immunohistochemistry for detection of human papilloma virusassociated penile squamous cell carcinoma is superior to in-situ hybridization. Int J Immunopathol Pharmacol, 2013. 26: 611. https://www.ncbi.nlm.nih.gov/pubmed/24067458 54. Bezerra. 11) S.M., et al. Human papillomavirus infection and immunohistochemical p16(INK4a) expression as predictors of outcome in penile squamous cell carcinomas. Hum Pathol, 2015. 46: 532. https://www.ncbi.nlm.nih.gov/pubmed/25661481. 12) Mannweiler, S., et al. Two major pathways of penile carcinogenesis: HPV-induced penile cancers overexpress p16ink4a, HPV-negative cancers associated with dermatoses express p53, but lack p16ink4a overexpression. J Am Acad Dermatol, 2013. 69: 73. https://www.ncbi.nlm.nih.gov/pubmed/23474228 56. Corbishley C., et al. 13) Carcinoma of the Penis and Distal Urethra Histopathology Reporting Guide 1st edition. International Collaboration on Cancer Reporting. 2017. 2018. http://www.iccr-cancer.org/datasets/published-datasets/urinary-male-genital/carcinoma-of-thepenis-tnm8. 14) Erbersdobler, A. Pathologic Evaluation and Reporting of Carcinoma of the Penis. Clin Genitourin Cancer, 2017. 15: 192. https://www.ncbi.nlm.nih.gov/pubmed/27594553. 15) Winters, B.R., et al. Predictors of Nodal Upstaging in Clinical Node Negative Patients With Penile Carcinoma: A National Cancer Database Analysis. Urology, 2016. 96: 29. https://www.ncbi.nlm.nih.gov/pubmed/27450944 59. 16) Feng, M.A., et al. Concordance of lymphovascular invasion diagnosed in penile carcinoma with and without the immunohistochemical markers ERG and CD31. Histol Histopathol, 2016. 31: 293. https://www.ncbi.nlm.nih.gov/pubmed/26452171 17) Giannatempo P., et al. Survival analyses of adjuvant or neoadjuvant combination of a taxane plus cisplatin and 5-fluorouracil (T-PF) in patients with bulky nodal metastases from squamous cell carcinoma of the penis (PSCC): Results of a single high-volume center. J Clin Oncol, 2014. 32: 5. https://meetinglibrary.asco.org/record/90280/abstract
Информация
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ПРОТОКОЛА
Список разработчиков:
1) Умурзаков Хусан Талипбаевич - PhD докторант, магистр медицины, врач онкоуролог, руководитель центра онкоурологии АО «Казахский научно – исследовательский институт онкологии и радиологии».
2) Гасанов Зиё Бахшиевич - PhD докторант, врач онкоуролог, старший ординатор АО «Казахский научно – исследовательский институт онкологии и радиологии».
3) Онгарбаев Бахытжан Тулигенович – врач высшей категории, врач онкоуролог, заместитель председателя по клинической работе АО «Казахский научно – исследовательский институт онкологии и радиологии».
4) Абдрахманов Рамиль Зуфарович – кандидат медицинских наук, врач онколог-химиотерапевт, руководитель Центра химиотерапии опухолей, Председатель химиотерапевтического совета АО «Казахский научно – исследовательский институт онкологии и радиологии».
5) Арыбжанов Давранбек Турсункулович – кандидат медицинских наук, профессор, врач онкоуролог, заместитель главного врача по лечебной работе ГКП на ПХВ «Областная многопрофильная клиника» УЗ области Жетыcу, доцент кафедры хирургических дисциплин №1 АО «Южно Казахстанская медицинская академия».
6) Новиков Игорь Игоревич - PhD докторант, магистр медицины, врач онколог-хирург, заместитель директора по контролю качества оказания медицинских услуг ГКП на ПХВ «Алматинская региональная многопрофильная клиника».
7) Кабыкенов Асхат Амангелдынович – врач онкоуролог высшей категории, магистр медицины ГКП на ПХВ «Центр ядерной медицины и онкологии» город Семей.
8) Рахманбердиева Эльвира Жайдаровна – врач, клинический фармаколог АО «Казахский научно – исследовательский институт онкологии и радиологии».
Указание на отсутствие конфликта интересов: нет.
Рецензенты:
1) Шалекенов Болат Уахитович. – доктор медицинских наук, профессор, заведующий кафедрой урологии и андрологии НАО «Казахский Национальный университет им. Аль-Фараби».
2) Кайдаров Бакыт Касенович – доктор медицинских наук, профессор кафедры онкологии НАО «Казахский Национальный медицинский университет им. С.Д.Асфендиярова».
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его разработки или при наличии новых методов с уровнем доказательности.
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его разработки или при наличии новых методов с уровнем доказательности.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.