Рак поджелудочной железы
 Версия: Клинические рекомендации РФ 2024 (Россия)
Версия: Клинические рекомендации РФ 2024 (Россия)
Общая информация
Краткое описание
Ассоциация онкологов России
Общероссийская общественная организация "Российское общество хирургов"
Общероссийская общественная организация «Российское общество клинической онкологии»
Общероссийская общественная организация содействия развитию лучевой диагностики и терапии "Российское общество рентгенологов и радиологов"
Одобрено Научно-практическим Советом Минздрава России
Клинические рекомендации
Рак поджелудочной железы
Год утверждения (частота пересмотра): 2024
Пересмотр не позднее: 2026
Возрастная категория: Взрослые
ID:355_5
Определение заболевания или состояния (группы заболеваний или состояний)
Рак поджелудочной железы – злокачественная опухоль, исходящая из эпителия поджелудочной железы.
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Злокачественное новообразование поджелудочной железы (С25):
С25.0 Головки поджелудочной железы
C25.1 Тела поджелудочной железы
C25.2 Хвоста поджелудочной железы
C25.3 Протока поджелудочной железы
C25.4 Островковых клеток поджелудочной железы
C25.7 Других частей поджелудочной железы
C25.8 Поражение поджелудочной железы, выходящее за пределы одной и более вышеуказанных локализаций
C25.9 Поджелудочной железы неуточненное
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
1. Международная гистологическая классификация (Международной классификации – онкология (МКБ-О) [199])
Доброкачественные и предраковые эпителиальные опухоли
8441/0 Серозная цистаденома
8148/0 Железистая интраэпителиальная неоплазия low grade
8148/2 Железистая интраэпителиальная неоплазия high grade
8453/0 Внутрипротоковая папиллярная муцинозная опухоль с дисплазией low grade
8453/2 Внутрипротоковая папиллярная муцинозная опухоль с дисплазией high grade
8455/2 Внутрипротоковая онкоцитарная папиллярная опухоль
8503/2 Внутрипротоковая тубулопапиллярная опухоль
8470/0 Муцинозная кистозная опухоль с дисплазией low grade
8470/2 Муцинозная кистозная опухоль с дисплазией high grade
Злокачественные эпителиальные опухоли
8500/3 Протоковая аденокарцинома
8560/3 Железисто-плоскоклеточный рак
8480/3 Коллоидная карцинома
8490/3 Дискогезивная карцинома
8576/3 Гепатоидная карцинома
8510/3 Медуллярный рак
8490/3 Перстневидноклеточный рак
8014/3 Крупноклеточный рак с рабдоидным фенотипом
8020/3 Недифференцированный рак
8035/3 Недифференцированный рак с остеокластоподобными гигантскими клетками
8550/3 Ацинарноклеточная карцинома
8551/3 Ацинарноклеточная цистаденокарцинома
8470/3 Внутрипротоковая папиллярная муцинозная опухоль в сочетании с инвазивной карциномой
8552/3 Комбинированный ацинарно-протоковый рак
8154/3 Комбинированный ацинарно-нейроэндокринный рак
8154/3 Комбинированный ацинарно-нейроэндокринно-протоковый рак
8154/3 Смешанный протоково-нейроэндокринный рак
8470/3 Муцинозная кистозная опухоль в сочетании с инвазивной карциномой
8971/3 Панкреатобластома
8441/3 Серозная цистаденокарцинома
8452/3 Солидная псевдопапиллярная опухоль
2. Стадирование заболевания или состояния (группы заболеваний или состояний)
Стадирование рака поджелудочной железы по системе TNM (8-е издание)
Первичная опухоль (T):
Тx – недостаточно данных для оценки первичной опухоли,
Tis – carcinoma in situ,
T1 – опухоль ограничена поджелудочной железой до 2 см в наибольшем измерении,
T1A – опухоль до 0,5 см в наибольшем измерении,
T1B – опухоль больше 0,5 см, но не более 1 см в наибольшем измерении,
T1С – опухоль больше 1 см, но не более 2 см в наибольшем измерении,
Т2 – опухоль более 2 см но не более 4 см в наибольшем измерении,
Т3 – опухоль более 4 см в наибольшем измерении,
Т4 – опухоль вовлекает чревный ствол, верхнюю брыжеечную или общую печеночную артерию вне зависимости от размера.
Региональные лимфатические узлы (N):
NХ – недостаточно данных для оценки регионарных лимфоузлов,
N0 – нет признаков метастатического поражения регионарных лимфоузлов,
N1 – наличие метастазов в 1-3 регионарных лимфоузлах,
N2 – наличие метастазов в 4 или более регионарных лимфоузлах.
Адекватное послеоперационное стадирование предполагает морфологическое изучение минимум 12 лимфатических узлов.
К регионарным лимфоузлам для опухоли головки поджелудочной железы относятся лимфоузлы вдоль общего желчного протока, общей печеночной артерии, воротной вены, пилорические, инфрапилорические, субпилорические, проксимальные брыжеечные, чревные, передние и задние панкреатодуоденальные, вдоль верхней брыжеечной вены и правой латеральной стенки верхней брыжеечной артерии. К регионарным лимфоузлам для опухоли тела и хвоста поджелудочной железы относятся лимфоузлы вдоль общей печеночной артерии, чревного ствола, селезеночной артерии, ворот селезенки, а также забрюшинные и латеральные аортальные лимфоузлы.
Существуют принципиальные разночтения в описании регионарных лимфатических узлов ТNM 8 редакции по версиям AJCC и UICC. В то же время отсутствуют ссылки на работы, на основании которых в UICC латеральные аортальные лимфатические узлы были отнесены к регионарным. Необходимо учитывать данную информацию при составлении плана лечения пациентов.
Отдаленные метастазы (M):
M0 – нет отдаленных метастазов,
M1 – наличие отдаленных метастазов.
Таблица 1. Стадирование рака поджелудочной железы
|
Стадия |
T |
N |
M |
|---|---|---|---|
|
0 |
Tis |
N0 |
M0 |
|
IA |
T1 |
N0 |
M0 |
|
IB |
T2 |
N0 |
M0 |
|
IIA |
T3 |
N0 |
M0 |
|
IIB |
T1-3 |
N1 |
M0 |
|
III |
T1-3 |
N2 |
M0 |
|
T4 |
любая N |
M0 |
|
|
IV |
любая T |
любая N |
M1 |
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
У 10% пациентов раком поджелудочной железы развитие заболевания связано с наличием известных наследственных синдромов. Наиболее распространённые – синдром Пейтц-Егерса, синдром Линча и синдром наследования рака молочной железы и яичников, связанный с мутациями генов BRCA[1]. У остальных пациентов рак поджелудочной железы имеет спорадический характер. В качестве факторов риска развития данной патологии рассматриваются: недостаток витамина Д3, злоупотребление алкоголем, хронический панкреатит, сахарный диабет, курение, ожирение, низкая физическая активность [2–4].
Патогенез рака поджелудочной железы делится на три последовательных стадии. Стадия инициации опухоли заключается в возникновении первой драйверной мутации. Клональное распространение и стадия метастазирования являются, соответственно, второй и третьей стадиями в патогенезе данного заболевания [5]. Однако накапливаются сведения, что процесс метастазирования может быть не завершающей стадией канцерогенеза [6]. Опухолевые клетки приобретают способность метастазировать на относительно ранних этапах канцерогенеза и продолжают эволюционировать независимо от первичной опухоли в отдаленных органах [7].
К предраковым заболеваниям относятся панкреатические внутриэпителиальные неоплазии (ПанИн, PanIN), внутрипротоковые папиллярные муцинозные опухоли (ВПМО, IPMN) и муцинозные кистозные опухоли (МКО). В процессе злокачественной трансформации эпителия поджелудочной железы происходит накопление мутаций ключевых генов. Чаще всего инициальной является мутация в гене KRAS. Далее появляются мутации в генах CDKN2А, TP53, SMAD4/DPC4 и BRCA2, которые определяют путь предраковых образований от легкой дисплазии до инвазивного рака. Значительную роль в опухолевой прогрессии играют компоненты стромы и микроРНК [8].
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Протоковая аденокарцинома с её более редкими микроскопическими вариантами составляет приблизительно 85-95% всех экзокринных новообразований поджелудочной железы. Поэтому данные о заболеваемости и смертности от рака поджелудочной железы фактически отражают таковые при протоковой аденокарциноме.
В структуре онкологических заболеваний населения России в 2021 году рак поджелудочной железы составил 3,5% среди мужчин и 3,1% среди женщин. Суммарно в 2021 году выявлено 13845 новых случаев заболевания. Показатель заболеваемости раком поджелудочной железы в России в 2021 году составил 6,8 на 100 тысяч населения. Прирост показателей заболеваемости раком поджелудочной железы за предшествующие 10 лет составил 15% [9,10]. Средний возраст заболевших мужчин – 65 лет, женщин – 70 лет.
Неизменным за последнее время остается позднее выявление данной патологии: в 58% случаев заболевание выявлено на IV стадии, т.е. при наличии отдаленных метастазов. На долю I-II стадии приходится только 23% выявляемых случаев. В итоге одногодичная летальность составила 65%, что является одним из наихудших показателей среди всех злокачественных новообразований[10].
В структуре смертности от онкологических заболеваний в России в 2021 году рак поджелудочной железы составил 6,6%, что соответствует 5-му месту, после рака лёгкого, желудка, ободочной кишки и молочной железы. Средний возраст умерших от рака поджелудочной железы мужчин – 65 лет, женщин – 71 год.
Эпидемиологическая ситуация в мире в целом схожа. Стандартизованные показатели заболеваемости в Европе и Северной Америке составляют 7,6-7,7 на 100 тысяч населения. В США ожидается, что к 2030 году смертность от РПЖ выйдет на второе место в структуре смертности от всех злокачественных новообразований[11].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Рак головки поджелудочной железы чаще манифестирует с развития желтухи, вызванной обструкцией желчных протоков. Однако при раке тела и хвоста поджелудочной железы первыми симптомами заболевания, как правило, являются снижение массы тела, появление болей в животе и повышение глюкозы в крови. Неспецифичность симптомов и их появление только в поздний период развития заболевания приводят к тому, что большая часть пациентов имеют III-IV стадии на момент первичной диагностики.
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза/состояния:
1) данные анамнеза;
2) данные физикального и инструментального обследования;
3) данные патолого-анатомического исследования биопсийного (операционного) материала.
1. Жалобы и анамнез
-
Рекомендуется тщательный сбор жалоб и анамнеза у всех пациентов с раком поджелудочной железы для определения тактики лечения [12].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5)
Комментарий: сбор информации о жалобах и деталях анамнеза, в том числе семейного анамнеза, проводится с целью выявления факторов, которые могут повлиять на выбор тактики лечения.
2. Физикальное обследование
-
Рекомендуется тщательный физикальный осмотр у всех пациентов с раком поджелудочной железы для определения тактики лечения и дифференциальной диагностики заболевания [12].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5)
Комментарий: особого внимания требуют оценка общего состояния по шкале ECOG (Приложение Г1), оценка алиментарного статуса, болевого синдрома, температуры тела, гемодинамики, цвета кожных покровов и склер, увеличения периферических лимфоузлов, наличие асцита.
3. Лабораторные диагностические исследования
-
Пациентам с раком поджелудочной железы рекомендуется выполнить общий (клинический) анализ крови развернутый, анализы крови биохимический общетерапевтический, исследование уровня ракового эмбрионального антигена (РЭА) в крови, исследование уровня антигена аденогенных раков СА 19-9 в крови, коагулограмму (ориентировочное исследование системы гемостаза), а также общий (клинический) анализ мочи для определения тактики лечения и дифференциальной диагностики заболевания [12–14].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5)
Комментарий: данный объем лабораторной диагностики выполняется на этапе диагностики и перед планированием лечения. В процессе проведения химиотерапии объем и кратность выполнения лабораторных исследований определяется клинической необходимостью [13]. Например, при начале первого курса химиотерапии максимальный срок давности клинического анализа крови составляет 14 дней, а в процессе химиотерапии – 5 дней. Минимальный перечень биохимического анализа крови должен включать исследование уровня глюкозы в крови, исследование уровня креатинина в крови, исследование уровня общего билирубина в крови, исследование уровня общего белка в крови, определение активности аланинаминотрансферазы в крови и определение активности аспартатаминотрансферазы в крови [15]. Необходимо помнить, что уровень СА 19-9 может быть повышен на фоне желтухи, холангита или иного воспалительного процесса в панкреатобилиарной области, в связи с чем исследование уровня антигена аденогенных раков СА 19-9 в крови должно проводиться после билиарной декомпрессии (НМУ A16.14.020 Наружное дренирование желчных протоков, A16.14.020.005 Эндохирургическое чрескожное чреспеченочное дренирование желчных протоков или A16.14.032 Стентирование желчных протоков), нормализации уровня билирубина и купирования воспалительных явлений.
-
Рекомендуется определение хромогранина А в крови тем пациентам с опухолями поджелудочной железы, которым необходимо дифференцировать аденокарциному и нейроэндокринную опухоль [12,16,17]
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5)
Комментарий: определение хромогранина А в крови может быть полезно при неубедительном патоморфологическом заключении в отношении гистопринадлежности злокачественной опухоли в сочетании с нормальным уровнем СА19-9.
4. Инструментальные диагностические исследования
-
Рекомендуется проведение биопсии поджелудочной железы с последующим патолого-анатомическим исследованием биопсийного материала поджелудочной железы тем пациентам, кому планируется начало лечения с консервативного этапа [12,18,19].
Уровень убедительности рекомендаций В (уровень достоверности доказательств 2)
Комментарий: хирургическое вмешательство в ряде случаев может быть выполнено без морфологического подтверждения. Назначение консервативного лечения требует обязательной морфологической верификации ввиду значительной вероятности ложноположительных заключений инструментальных методов исследования. Оптимальным вариантом получения материала для верификации процесса является эндосонография панкреатобилиарной зоны (A04.14.003) и тонкоигольная аспирационная биопсия поджелудочной железы. Толстоигольная биопсия поджелудочной железы под контролем эндосонографии панкреатобилиарной зоны (А04.14.003) позволяет получить дополнительный материал для ИГХ или молекулярно-генетического исследования, однако является более сложным и дорогостоящим методом. Биопсия должна быть выполнена также в ходе эксплоративной лапаротомии диагностической (A16.30.006.002) или лапароскопии диагностической (A16.30.079) у тех пациентов, которым планировалась радикальная операция без предшествующей верификации, однако интраоперационно процесс был признан нерезектабельным. Отрицательный результат биопсии при положительных данных лучевого исследования – повод для повторных процедур, пока не будет получен диагностически значимый материал. Для экономии времени и расходных материалов при выполнении биопсии под эндосонографическим контролем рекомендуется внедрить методику экспресс-окрашивания цитологических стекол и срочного анализа полученного материала на предмет достаточности для последующего планового патолого-анатомического исследования биопсийного материала поджелудочной железы.
У пациентов с резектабельными опухолями (15-20% от общего числа больных) отрицательный результат биопсии не должен приводить к задержке или отмене хирургического лечения в том случае, если тактика лечения обсуждается на междисциплинарном консилиуме и клинический диагноз РПЖ не вызывает сомнения. При этом планирование неоадъювантной терапии на первом этапе лечения (погранично) резектабельного процесса требует обязательной морфологической верификации процесса.
-
Всем пациентам с раком поджелудочной железы рекомендуется выполнить эзофагогастродуоденоскопию (ЭГДС) для оценки распространенности опухолевого процесса [20].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: ЭГДС – обязательный метод исследования пациентов с подозрением на опухоль поджелудочной железы. ЭГДС позволяет визуализировать инвазию двенадцатиперстной кишки, оценить степень опухолевого стеноза двенадцатиперстной кишки, уточнить локализацию и местную инвазию опухоли органов и структур билиопанкреатодуоденальной зоны.
-
Пациентам с раком поджелудочной железы рекомендуется выполнить компьютерную томографию органов брюшной полости и забрюшинного пространства с внутривенным болюсным контрастированием (A06.30.005.002), компьютерную томографию (КТ) органов грудной полости с внутривенным болюсным контрастированием (A06.30.005.004) и компьютерную томографию органов малого таза у женщин с контрастированием (A06.20.002.003) для оценки распространенности опухолевого процесса и дифференциальной диагностики заболевания [19,21,22].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5)
Комментарий: при выполнении КТ абдоминальной области с внутривенным контрастированием необходимо обязательное применение автоматических инжекторов. Применяемая скорость введения контрастных средств обычно составляет 2-5 мл/сек, которую можно считать вполне достаточной для получения информативных результатов.
Ручное введение контрастных средств при КТ органов брюшной полости и забрюшинного пространства с внутривенным болюсным контрастированием следует считать неприемлемым, поскольку невозможно получить информативные отображения изучаемых органов в необходимые фазы контрастирования, без анализа которых корректная диагностика, как правило, невозможна.
При расчетах основных параметров методик контрастирования необходимо учитывать технические характеристики и конструктивные особенности используемых компьютерных томографов (в частности, скорость вращения трубки, параметры тока на ней, ширину полосы детекторов и др.).
Для полноценного анализа особенностей состояния органов абдоминальной области нужно использовать 3-х или 4-фазное исследование, включающее в себя нативную, артериальную, венозную (или портально-венозную) фазы, равновесную (или отсроченную) фазы. Для каждой фазы исследования время начала сканирования от момента начала введения контрастного средства (т.е. времени задержки) определяется строго индивидуально с учетом предпочитаемой скорости введения РКС (обычно, 2-5мл/сек), его объема, цели исследования и технических параметров томографа. В современных компьютерных томографах для определения величины задержки начала сканирования используются автоматические методики (типа «bolus-tracking» "sure start" и подобные).
Наиболее распространенными величинами задержки для артериальной фазы считаются величины 20-30 сек (от начала ведения РКС), для портально- венозной фазы = 50-70 сек, для равновесной или отсроченной фазы = 100-180 сек. Ряд авторов в своих исследованиях выделяют также панкреатическую фазу (или «позднюю артериальную») с задержкой 30-50 сек (40-45сек) от начала введения рентгеноконтрастных средств (РКС)
В качестве точки отсчета (для начала сканирования) может применяться момент достижения на просвете нисходящей аорты уровня «усиления» = 100-120 HU, что происходит обычно через 18-23 сек, при этом, задержка начала сканирования от указанной точки отсчета составляет: для артериальной фазы = 5-6 сек, для панкреатической фазы = 19-22 сек, для портально-венозной фазы = 52-65 сек.
По данным отдельных авторов, для панкреатической фазы величина задержки составляла 22 сек – на 4-16 рядных томографах и 24 сек – на 64-рядных томографах (при достижении уровня контрастирования брюшной аорты в 100HU)
Значительный разброс обсуждаемых значений обусловлен особенностями гемодинамики у разных пациентов, различиями в используемой аппаратуры и разной скоростью введения РКС.
Только тщательный анализ всех фаз в/в контрастирования позволяет осуществить детальную оценку особенностей контрастирования опухоли, а в ряде случаев и уточнить ее характер, а также определить состояние всех ключевых регионарных сосудистых стволов (в частности, степень их вовлеченности в опухолевый процесс либо их интактность).
Пациентам с предполагаемым поражением ПЖ необходимо выполнять стандартное исследование всей абдоминальной области с учетом высокой частоты метастатического поражения печени.
Минимальный объем заключения при КТ, помимо описания локализации и размеров опухолевого образования, особенностей его взаимоотношений с близлежащими органами и структурами, наличия увеличенных лимфоузлов (с указанием их локализации), должен включать и детальную оценку степени его взаимосвязи (при наличии таковой) с ключевыми региональными сосудистыми стволами, в частности: с чревным стволом и его основными ветвями, ВБА и ВБВ, воротной и селезеночной венами, а именно:
-
наличие и протяженность периваскулярной опухолевой инфильтрации,
-
степень деформации (сужения) сосудов,
-
по возможности, величину тесного контакта опухоли (при отсутствии разделительных жировых прослоек) с тем или иным сосудом: менее его полуокружности (180°), более его полуокружности (180°), сосуд в толще опухоли,
-
наличие или отсутствие тромбоза (опухолевого или кровяного) тех или иных сосудов,
Необходимо описывать состояние главного панкреатического протока, внутри- и внепеченочных желчных протоков, а при их расширении – фиксировать соответствующие цифровые значения.
-
Пациентам с раком поджелудочной железы рекомендуется выполнить магнитно-резонансную томографию (МРТ) органов брюшной полости с контрастным усилением (A05.30.005.001 Магнитно-резонансная томография органов брюшной полости с внутривенным контрастированием, A05.30.005.002 Магнитно-резонансная томография органов брюшной полости с внутривенным введением гепатотропного контрастного препарата) (± магнитно-резонансная томография органов малого таза с внутривенным контрастированием (A05.30.004.001)) и получением изображений в артериальную, венозно-портальную и отсроченную фазы, а также диффузионно-взвешенных изображений в качестве альтернативы МСКТ у пациентов с аллергией на рентгенконтрастные средства, содержащие йод, при подозрении на наличие метастазов в печени, которые не удалось подтвердить/исключить другими методами, а также магнитно-резонансную холангиопанкреатографию (МРХПГ) при наличии механической желтухи, требующей миниинвазивного дренирования желчных протоков [19,21]
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5)
Комментарий: хотя карциномы поджелудочной железы могут быть хорошо визуализированы при МРТ, нет доказательств того, что МРТ имеет диагностические преимущества по сравнению с МСКТ с точки зрения стадирования первичной опухоли [23–26]. Но МРТ с большей чувствительностью и специфичностью способна визуализировать метастазы рака в печени, поэтому рекомендуется при подозрении на наличие метастазов в печени, когда их подтверждение изменит тактику лечения [27,28]. МРХПГ позволяет судить о природе стриктуры внутри- и внепечёночных желчных протоков, что сделает необязательным в дальнейшем выполнение эндоскопической ретроградной холангиопанкреатографии ЭРХПГ.
-
Всем пациентам с раком поджелудочной железы рекомендуется выполнить ультразвуковое исследование (УЗИ) органов брюшной полости (комплексное), ультразвуковое исследование забрюшинного пространства и ультразвуковое исследование органов малого таза комплексное (трансвагинальное и трансабдоминальное) (A04.16.001, A04.30.003, A04.30.010) для оценки распространенности опухолевого процесса при невозможности выполнения КТ или МРТ [19,21].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5)
Комментарий: УЗИ – наиболее простой метод визуализации образования в поджелудочной железе и оценки других органов на наличие метастазов. Однако этот метод существенно уступает КТ в отношении оценки инвазии сосудов, что важно при оценке резектабельности. УЗИ может являться альтернативой КТ в оценке эффективности лечения у пациентов, получающих паллиативную химиотерапию. Женщинам рекомендуется дополнить УЗИ органов малого таза комплексное (трансвагинальное и трансабдоминальное) (A04.30.010) в связи с риском метастазирования в придатки матки.
-
Пациентам с раком поджелудочной железы рекомендуется выполнить эндосонографию панкреатобилиарной зоны при необходимости дополнительного уточнения степени местной распространенности опухоли и для навигации при выполнении биопсии [21,29–31].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 1)
Комментарий: эндосонография панкреатобилиарной зоны является высокочувствительным методом оценки инвазии опухоли поджелудочной железы в прилежащие анатомические структуры, в том числе двенадцатиперстную кишку, желчные протоки и крупные сосуды [29]. Кроме этого, эндосонография панкреатобилиарной зоны может служить методом визуализации при выполнении биопсии новообразования [31] или нейролизиса чревного сплетения [30].
-
Пациентам с раком поджелудочной железы рекомендуется выполнить ретроградную холангиопанкреатографию (РХПГ) при наличии механической желтухи, требующей выполнения стентирования общего желчного протока [19,21].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5)
Комментарий: ввиду сложности и вероятности осложнений данный метод в настоящее время наиболее часто используется при выполнении стентирования общего желчного протока при механической желтухе (A16.14.032 Стентирование желчных протоков). Методика предпочтительна в варианте ЭХПГ, а прямое контрастирование протоковой системы поджелудочной железы следует выполнять строго по показаниям и исключительно с применением неионных рентгеноконтрастных веществ, так как высокоосмолярные ионные рентгенконтрастные средства вызывают деструкцию покровного эпителия протоков и приводят к развитию спазма, нарушению оттока секрета и развитию острого панкреатита различной степени тяжести. ЭРХПГ позволяет осуществить забор материала для патолого-анатомического исследования биопсийного (операционного) материала.
-
Пациентам с раком поджелудочной железы рекомендуется выполнить позитронную эмиссионную томографию, совмещенную с компьютерной томографией с туморотропными РФП с контрастированием (ПЭТ/КТ) при невозможности исключить метастатический процесс другими методами исследования [12,32].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 3)
Комментарий: добавление ПЭТ/КТ к стандартным методам визуализации увеличивает чувствительность выявления отдаленных метастазов с 57% до 87%. В отдельных случаях при подозрении на наличие отдаленных метастазов (напр., высокий уровень маркера СА 19-9 или крупные размеры первичной опухоли), когда их подтверждение изменит тактику лечения (например, отказ от операции), рекомендуется выполнить ПЭТ/КТ. Однако ПЭТ/КТ НЕ является заменой КТ по вышеописанному протоколу в отношении оценки первичной распространенности при решении вопроса о возможности выполнения радикальной операции.
-
Пациентам с раком поджелудочной железы рекомендуется выполнить сцинтиграфию костей всего тела при подозрении на метастатическое поражение костей скелета [33].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5)
-
Пациентам с раком поджелудочной железы рекомендуется выполнить лапароскопию диагностическую (A16.30.079) при подозрении на диссеминацию опухоли по брюшине или при невозможности морфологической верификации диагноза другими методами [19,21].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: кроме возможности забора биоматериала для морфологической верификации опухоли диагностическая лапароскопия может быть полезна у пациентов, имеющих высокий риск метастатического заболевания, например, уровень СА 19-9 более 500 Ед/мл, метастатическое поражение регионарных лимфоузлов[34].
-
Пациентам с раком поджелудочной железы рекомендуется выполнить МРТ головного мозга с контрастированием или КТ головного мозга с внутривенным контрастированием при подозрении на метастатическое поражение головного мозга [35,36].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
-
Пациентам с раком поджелудочной железы рекомендуется выполнить электрокардиографию (ЭКГ) (регистрацию электрической активности проводящей системы сердца) с целью уточнения тактики лечения [37–39].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5)
5. Иные диагностические исследования
-
Всем пациентам, которым планируется или уже начато системное лечение по поводу рака поджелудочной железы, рекомендуется молекулярно-генетическое исследование герминальных мутаций в генах BRCA1, BRCA2 в крови (A27.05.040) и молекулярно-генетическое исследование мутаций в гене PALB2 [40,41].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарий: учитывая частоту выявления мутаций в генах BRCA1, BRCA2 и PALB2 более 5%, а также существенное влияние данных мутаций на выбор схемы химиотерапии, определение данных мутаций целесообразно всем пациентам, являющимся претендентами на лекарственное лечение.
Ввиду высокой частоты моноаллельных соматических мутаций, обладающих низкой предиктивной способностью в отношении чувствительности к лекарственным препаратам, оптимальным является тестирование на наличие герминальных мутаций. В случае тестирования опухолевой ткани на данные мутации, в отчете следует указать является ли инактивирующая мутация моноаллельной или биаллельной.
Учитывая крайне низкую чувствительность существующих тест-систем на основе ПЦР, следует отдать предпочтение секвенированию следующего поколения (NGS). При невозможности секвенирования лаборатория должна использовать тест-систему на основе ПЦР, зарегистрированную для выявления мутаций при раке поджелудочной железы, что связано с наибольшей вероятностью выявления мутации в гене BRCA2 [42].
-
Всем пациентам, которым планируется или уже начато системное лечение по поводу метастатического рака поджелудочной железы, рекомендуется молекулярно-генетическое исследование мутаций в гене KRAS в биопсийном (операционном) материале (с указанием локализации конкретной мутации) и определение микросателлитной нестабильности (MSI) в биопсийном (операционном) материале методом ПЦР.
Комментарий: около 80-90% карцином поджелудочной железы имеют мутации в гене KRAS, что указывает на минимальный шанс выявления терапевтически значимого биомаркера. С другой стороны отсутствие мутации в гене KRAS свидетельствует о целесообразности дальнейшего тестирования на другие терапевтически значимые биомаркеры, например, альтерации BRAF, мутации EGFR, транслокацию ALK, NTRK, ROS1, слияние гена (fusion) NRG1, гиперэкспрессию/амплификацию HER2/neu [43,44].
Выявление MSI фенотипа в опухоли встречается менее чем в 1% случаев и не зависит от статуса KRAS [45]. Вероятность выявления MSI-H фенотипа существенно повышается в случае наличия моноаллельных мутаций в генах BRCA, а также мутаций CHEK1 [46]. Следует помнить, что генетически доказанный синдром Линча не означает обязательного наличия MSI-H в карциноме поджелудочной железы. Опухолевый материал всех пациентов с синдромом Линча должен быть протестирован на MSI-фенотип.
-
Пациентам с раком поджелудочной железы рекомендуется проводить патолого-анатомическое исследование биопсийного (операционного) материала поджелудочной железы (в том числе, с применением иммуногистохимических методов) для определения прогноза и дальнейшей тактики лечения [19,21].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5)
Комментарий: при этом в патолого-анатомическом заключении рекомендуется отразить следующие параметры:
1) расстояние от края резекции до опухоли;
2) размеры опухоли;
3) гистологический тип опухоли;
4) степень дифференцировки опухоли;
5) указание общего числа исследованных и поражённых лимфоузлов;
6) наличие поражения краев резекции (подвергаются исследованию край резекции в зоне прилегания верхней брыжеечной артерии (связка крючковидного отростка), задняя поверхность, венозный край резекции, край резекции поджелудочной железы, край резекции общего желчного протока, передняя поверхность поджелудочной железы);
7) наличие лимфоваскулярной, экстра- и интрапанкреатической периневральной инвазии (отрицательный результат также должен быть констатирован);
8) наличие инвазии стенки двенадцатиперстной кишки, интрапанкреатической части общего желчного протока;
9) наличие инвазии стенки воротной вены и/или верхней брыжеечной вены в случае их резекции (с указанием глубины);
10) степень регрессии опухоли в случае предоперационной терапии [8,47].
В настоящее время существует множество шкал оценки терапевтического эффекта после проведенной неоадъювантной химиотерапии – The College of American Pathologists (CAP), MD Anderson (MDA), Evans’ criteria, The Japanese Society (JPS), Area of residual tumor (ART). Наиболее удобной и воспроизводимой является шкала CAP (version Panc.Exo_4.2.0.2.REL_CAPC), согласно которой терапевтический эффект оценивается следующим образом (см. приложение Г3):
- Score 0 – клетки аденокарциномы отсутствуют, полный терапевтический эффект;
- Score 1 – присутствуют единичные клетки и группы клеток остаточной аденокарциномы, выраженный терапевтический эффект;
- Score 2 – выявляется остаточная опухоль с признаками регрессии с наличием как единичных, так и групп клеток аденокарциномы, частичный терапевтический эффект;
- Score 3 – остаточная опухоль без признаков терапевтического ответа [48].
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Назначение и применение лекарственных препаратов, указанных в клинической рекомендации, направлено на обеспечение пациента клинически эффективной и безопасной медицинской помощью, в связи с чем их назначение и применение в конкретной клинической ситуации определяется в соответствии с инструкциями по применению конкретных лекарственных препаратов с реализацией представленных в инструкции мер предосторожности при их применении, также возможна коррекция доз с учетом состояния пациента. Отклонения от инструкции должны быть оправданы клинической ситуацией и подтверждены решением врачебной комиссии медицинской организации. Смена режимов химиотерапии, изменения доз препаратов в схеме не подразумевает обязательного проведения для этого онкологического консилиума и может определяться лечащим врачом.
1. Хирургическое лечение
-
У пациентов с резектабельным раком поджелудочной железы I-III стадий (Т1-3N0-1M0) рекомендуется комбинированное лечение, включающее операцию и адъювантную химиотерапию [49–54].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2)
Комментарий: при резектабельном РПЖ (см. таблицу 2) рекомендуется на первом этапе проведение хирургического лечения. Альтернативным вариантом, актуальным прежде всего при клинических ситуациях, подходящих под рентгенологические критерии резектабельного процесса, но имеющих признаки высокого риска метастатического заболевания, например, уровень СА 19-9 более 500 Ед/мл, метастатическое поражение регионарных лимфоузлов (при исключении отдаленного метастазирования по данным диагностической лапароскопии или ПЭТ/КТ), является периоперационная химиотерапия длительностью 2-4 месяца до операции и 2-4 месяца после нее (суммарно 6 месяцев терапии, таблица 4).
-
У пациентов с погранично резектабельным и нерезектабельным раком поджелудочной железы (Т3-4N0-1M0) рекомендуется проводить предоперационную и индукционную химиотерапию соответственно, а в последующем направлять пациентов в крупные центры, обладающие большим опытом лечения данного заболевания, для повторной оценки резектабельности [55].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5)
Комментарий: Обязательна морфологическая верификация при начале с лекарственного лечения. Режимы предоперационной и индукционной химиотерапии представлены в таблице 4. Предпочтительными режимами (при отсутствии противопоказаний) являются FOLFIRINOX или комбинации #гемцитабина** и #паклитаксел + альбумина. При наличии у пациентов мутаций в генах BRCA или PALB2, оптимальным является применение комбинации FOLFIRINOX или комбинации #гемцитабина** с соединениями платины. Начало лечения с химиотерапии сопряжено с необходимостью биопсии опухоли для морфологической верификации диагноза и выполнения желчеразгрузочных процедур [56,57]. Длительность индукционной химиотерапии при погранично резектабельном и нерезектабельном процессе составляет 12-18 недель. В случае сохранения нерезектабельного процесса и отсутствия нарастания эффекта после окончания 16-18 нед. индукционной химиотерапии рекомендуется продолжение ранее начатого режима лечения (при его хорошей переносимости) либо проведение поддерживающей химиотерапии (например, монотерапии фторпиримидиновым производным, если до этого пациент получал FOLFIRINOX). Доказательств преимущества какой‑либо тактики на момент составления рекомендаций нет. Рекомендуемая суммарная продолжительность химиотерапии с учетом индукционного и поддерживающего этапов должна составлять не менее 6 мес. Применение химиотерапии более 6 мес. (например, до прогрессирования опухоли) также является возможной опцией ввиду отсутствия клинических исследований, посвященных изучению оптимальной длительности ХТ в этой группе пациентов. Решение о продолжении ХТ до прогрессирования по критеримя RECIST 1.1 (см. приложение Г2) должно приниматься с учетом динамики эффекта и переносимости данного лечения.
Критерии резектабельности рака поджелудочной железы изложены в таблице 2.
Таблица 2. Оценка резектабельности неметастатического рака поджелудочной железы [58]
|
Статус резектабельности |
Артерия |
Вена |
|---|---|---|
|
Резектабельный |
Нет контакта с артерией [чревный ствол (ЧС), верхняя брыжеечная артерия (ВБА) или общая печеночная артерия (ОПА)] |
Отсутствие контакта опухоли с верхней брыжеечной (ВБВ) или воротной веной (ВВ) или контакт ≤180° без нарушения контура вены. |
|
Погранично резектабельный |
Головка поджелудочной железы/крючковидный отросток:
Тело/хвост поджелудочной железы:
|
Контакт солидной опухоли с ВБВ или ВВ >180°, контакт ≤180° с неровностью контура вены или тромбозом вены, но с подходящими сосудами проксимальнее и дистальнее места вовлечения, позволяющими выполнить безопасную и полную резекцию и реконструкцию вены.
|
|
Местнораспространенный |
Головка поджелудочной железы/крючковидный отросток:
|
Отсутствие перспектив реконструкции ВБВ/ВВ из-за вовлечения опухоли или окклюзии (из-за опухоли или тромба). |
-
Если при операции по поводу рака головки поджелудочной железы у пациента процесс признается нерезектабельным, и есть угроза развития кишечной непроходимости и/или механической желтухи в ближайшие сроки, рекомендуется выполнить формирование обходных анастомозов для профилактики механической желтухи и гастростаза [19,21].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5)
-
В случае тяжелых сопутствующих заболеваний у пациентов с неметастатическим раком поджелудочной железы, исключающих выполнение оперативного вмешательства, рекомендуется проведение паллиативного лекарственного лечения, миниинвазивных процедур (например, чрескожная чреспеченочная холангиостомия ЧЧХС (A16.14.006.002 Чрескожная чреспеченочная холецистостомия, холецистохолангиостомия под контролем ультразвукового исследования), стентирование желчных протоков (общего желчного протока, A16.14.032), стентирование двенадцатиперстной кишки, (A16.15.022 Стентирование при опухолях поджелудочной железы) для купирования симптомов желтухи или высокой тонкокишечной непроходимости, а также симптоматической терапии [19,21].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: решение о невозможности хирургического лечения может приниматься только на онкологическом консилиуме с участием врачей-специалистов по проведению различных видов противоопухолевого лечения (хирургического, лекарственного, радиотерапевтического) и приглашением для участия в консилиуме врача-терапевта, врача-анестезиолога-реаниматолога.
-
У пациентов с локализацией образования в головке поджелудочной железы рекомендуется выполнить (гастро)панкреатодуоденальную резекцию (A16.15.010 Панкреатодуоденальная резекция) [21,49].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4)
Комментарий: стандартный объем лимфодиссекции (A16.06.007 Лимфаденэктомия забрюшинная) предполагает удаление следующих лимфатических узлов: надпилорические и подпилорические лимфатические узлы, лимфоузлы по ходу печеночной артерии и чревного ствола с его ветвями, лимфоузлы вдоль общего желчного протока, лимфоузлы вокруг пузырного протока, ретропанкреатические лимфоузлы, лимфоузлы по нижнему краю головки поджелудочной железы, лимфоузлы по правой полуокружности верхней брыжеечной артерии, лимфоузлы по верхнему краю головки поджелудочной железы. При отсутствии опухолевой инвазии магистральных сосудов и достаточном опыте врача-хирурга возможно выполнение операции лапароскопическим доступом.
-
У пациентов с локализацией карциномы в теле или хвосте поджелудочной железы рекомендуется выполнять дистальную субтотальную резекцию поджелудочной железы (A16.15.009.002 Дистальная резекция поджелудочной железы со спленэктомией), включающую удаление тела, хвоста железы, а также селезенки [21,50].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4)
Комментарий: при технической возможности и достаточном опыте врача- онколога возможно выполнение операции лапароскопическим доступом. Рекомендовано удаление следующих групп лимфозулов: лимфоузлы ворот селезенки, лимфоузлы вдоль селезеночной артерии, лимфоузлы по нижнему краю поджелудочной железы, вдоль общей печеной артерии и чревного ствола, расположенные вдоль левой полуокружности верхней брыжеечной артерии, средние ободочные лимфоузлы вдоль одноименной артерии.
Операция Appleby (A16.15.009 Резекция поджелудочной железы) возможна только в специализированных клиниках с участием специалистов, имеющих опыт подобных вмешательств, на фоне стабилизации или частичного клинического ответа на предоперационную терапию.
-
У пациентов с поражением карциномой всех отделов поджелудочной железы рекомендуется выполнить тотальную панкреатэктомию (A16.15.011 Тотальная дуоденопанкреатэктомия) для увеличения выживаемости пациентов [21,59].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4)
-
Пациентам с раком поджелудочной железы при отсутствии медицинских противопоказаний при хирургическом вмешательстве рекомендуется профилактика инфекционных осложнений противомикробными препаратами системного действия [60].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4)
Комментарий: выбор противомикробных препаратов системного действия лечащий врач должен определять для каждого пациента индивидуально с учетом его особенностей.
-
Пациентам с раком поджелудочной железы после хирургического вмешательства при отсутствии медицинских противопоказаний рекомендуется заместительная ферментативная терапия, а также контроль и коррекция глюкозы крови [61–63]
Уровень убедительности рекомендаций В (уровень достоверности доказательств 2)
Комментарий: частота ферментативной недостаточности составляет 36-100% после резекции поджелудочной железы. Терапия ферментативной недостаточности рекомендуется всем пациентам после операции при отсутствии противопоказаний и должна быть направлена на ее коррекцию даже при отсутствии лабораторного подтверждения диагноза. Стартовая доза заместительной ферментативной терапии (ЗФТ) включает 40000-50000 Ед панкреатина** во время приема пищи и 25000 Ед во время перекусов. В дальнейшем доза препарата может быть изменена в индивидуальном порядке. Чаще всего необходимая доза липазы после тотальной панкреатэктомии (A16.15.011 Тотальная дуоденопанкреатэктомия) существенно выше указанной начальной дозы. Более подробная информация по ЗФТ представлена в разделе 3.3.
Вторичное нарушение метаболизма глюкозы на фоне рака поджелудочной железы получило название панкреатогенного сахарного диабета (3с типа). Данное осложнение ассоциировано с риском прогрессирования, неблагоприятным прогнозом, увеличивает риски токсичности лекарственного лечения и требует коррекции у врача-эндокринолога.
2. Консервативное лечение
2.1 Периоперационная и адъювантная терапия
-
У пациентов с раком поджелудочной железы рекомендуется проведение противоопухолевой лекарственной терапии в соответствие с общими принципами, изложенными в «Практических рекомендациях по общим вопросам проведения противоопухолевой лекарственной терапии» Российского общества клинической онкологии [13].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
-
У пациентов с погранично резектабельным раком поджелудочной железы (Т3-4N0-1M0) рекомендуется проведение предоперационной химиотерапии с последующей оценкой результатов; при отсутствии отрицательной динамики рекомендуется выполнение операции [64].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: основным методом предоперационной терапии является химиотерапия. Режимы химиотерапии аналогичны изложенным для лечения метастатического рака (таблица 4). Предпочтительными режимами (при отсутствии противопоказаний) являются FOLFIRINOX или комбинации #гемцитабина** и #паклитаксел + альбумина. При наличии у пациентов мутаций в генах BRCA или PALB2, оптимальным является применение комбинации FOLFIRINOX или комбинации #гемцитабина** с соединениями платины. При выборе режима химиотерапии следует учитывать следующие данные: общее состояние пациента, возраст, наличие осложнений опухолевого процесса и серьезных сопутствующих заболеваний. Длительность предоперационной химиотерапии составляет 12-18 недель.
-
Пациентам старше 70 лет рекомендовано проведение комплексной гериатрической оценки (mycarg.org) для понимания рисков развития осложнений 3-5 степени при применении комбинаций препаратов и необходимости коррекции доз препаратов, что позволит повысить качество жизни данных пациентов и преемственность проводимого лечения [65].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 1)
-
У пациентов с нерезектабельным раком поджелудочной железы (Т3-4N0-1M0) рекомендуется проведение индукционной терапии с последующей повторной оценкой резектабельности [64,66–68].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарий: основным методом индукционной терапии является химиотерапия. Режимы химиотерапии аналогичны изложенным для лечения метастатического рака (таблица 4). Предпочтительными режимами (при отсутствии противопоказаний) являются FOLFIRINOX или комбинации #гемцитабина** и #паклитаксел + альбумина. При наличии у пациентов мутаций в генах BRCA или PALB2, оптимальным является применение комбинации FOLFIRINOX или комбинации #гемцитабина** с соединениями платины. При выборе режима химиотерапии следует учитывать следующие данные: общее состояние пациента, возраст, наличие осложнений опухолевого процесса и серьезных сопутствующих заболеваний.
Длительность индукционной химиотерапии составляет от 12 до 24 недель. В случае сохранения нерезектабельного процесса и отсутствия нарастания эффекта после окончания индукционной химиотерапии рекомендуется продолжение ранее начатого режима химиотерапии (при его хорошей переносимости) либо проведение поддерживающей химиотерапии (например, монотерапии #фторурацилом**/#капецитабином**, если до этого пациент получал FOLFIRINOX). Доказательств преимущества одного из этих подходов нет.
Рекомендуемая суммарная продолжительность химиотерапии с учетом индукционного и поддерживающего этапов должна составлять не менее 6 месяцев. Применение химиотерапии более 6 месяцев (например, до прогрессирования опухоли) также является оправданной опцией ввиду отсутствия клинических исследований, посвященных вопросу оптимальной длительности химиотерапии в этой группе пациентов. Решение о продолжении химиотерапии до прогрессирования по критеримя RECIST 1.1 (см. приложение Г2) должно приниматься с учетом динамики эффекта и переносимости данного лечения.
Роль лучевой терапии в рамках индукционной терапии рака поджелудочной железы окончательно не определена. Опубликованные рандомизированные исследования не поддерживают ее использование как при погранично резектабельном (исследование ALIANCE A021501, ESPAC5f), так и при нерезектабельном раке (исследования LAP 07, CONCKO 007). На настоящий момент применение лучевой терапии по данным показаниям не рекомендуется вне рамок клинических исследований [57,69–71].
-
После удаления карциномы поджелудочной железы I-III стадий (Т1-3N0-1M0) всем пациентам с раком поджелудочной железы при отсутствии противопоказаний рекомендуется начать в течение 3 месяцев адъювантную химиотерапию для достижения ремиссии [72].
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1)
Комментарий: лечение должно быть начато в течение 3 месяцев после операции, оптимально – в промежутке между 4 и 8 неделями после операции. Если состояние пациента после операции не позволяет начать ХТ в течение 3 мес., более позднее начало адъювантной терапии все же целесообразно, хотя и менее эффективно [73]. В случае выполнения хирургического лечения без предоперационной химиотерапии длительность адъювантной химиотерапии составляет 6 месяцев [74].
Перед началом химиотерапии целесообразно выполнить обследование (оценка грудной и брюшной полостей с в/в контрастированием, а также СА 19-9), чтобы убедиться в отсутствии прогрессирования заболевания. Наиболее предпочтительным режимом адъювантной химиотерапии является режим mFOLFORINOX, при противопоказаниях к его применению – комбинация GEMCAP, а при невозможности ее применения – монотерапия #гемцитабином** или #фторурацилом**/#капецитабином** (таблица 3) [72,74–76].
Таблица 3. Режимы адъювантной химиотерапии при раке поджелудочной железы
|
Показания |
Режим химиотерапии |
|---|---|
|
Оптимальный объем химиотерапии |
mFOLFIRINOX1,2,4 [77]: #оксалиплатин** 85 мг/м2 в/в 120 мин., #иринотекан** 150 мг/м2 в/в 90 мин., #кальция фолинат** 400 мг/м2 в/в 120 мин., #фторурацил** 2400 мг/м2 в/в инфузия в течение 46 часов, каждые 2 нед., всего 12 циклов |
|
GEMCAP3 [75]: #гемцитабин** 1000 мг/м2 в/в капельно 30 мин. в 1-й, 8-й и 15-й дни + #капецитабин** 1660 мг/м2 внутрь ежедневно с 1-го по 21-й день каждые 4 нед., всего 6 циклов |
|
|
Минимальный объем химиотерапии |
1) #Гемцитабин** 1000 мг/м2 в/в капельно 30 мин. в 1-й, 8-й и 15-й дни каждые 4 нед., всего 6 циклов [78] или 2) #Капецитабин** 2000-2500 мг/м2/сут. внутрь с 1-го по 14-й день каждые 3 нед., всего 8 циклов [79,80] или 3) #фторурацил** 425 мг/м2 в/в болюс + # кальция фолинат** 20 мг/м2 в/в болюс с 1-го по 5-й дни каждые 4 нед., всего 6 циклов4 [79] |
1 mFOLFIRINOX обладает наибольшей эффективностью, но рекомендуется только пациентам с ECOG 0-1 (приложение Г1), без серьезных осложнений хирургического лечения и сопутствующих заболеваний. С целью профилактики фебрильной нейтропении при применении режима mFOLFIRINOX возможно назначение первичной профилактики нейтропении филграстимом** в дозе 5 мкг/кг п/к через 24 часа после завершения химиотерапии до восстановления показателей нейтрофилов или пэгфилграстимом** – 6 мг п/к однократно, или эмпэгфилграстимом** – 7,5 мг п/к однократно через 24 часа после окончания каждого курса химиотерапии. Альтернативно допустима вторичная профилактика нейтропении, учитывая, что нейтропения не всегда является дозолимитирующей токсичностью и в ряде случаев более целесообразна редукция доз препаратов [58,81].
2 Несмотря на исходно сниженные дозы mFOLFIRINOX в адъювантной терапии, высокая токсичность режима у ослабленных пациентов после хирургического лечения в ряде случаев требует исходной модификации режима или снижения доз в процессе лечения при развитии непереносимой токсичности. Минимальными дозами препаратов являются для иринотекана – 120 мг/м2, для оксалиплатина – 60 мг/м2, для фторурацила – 1800 мг/м2. Модификация фолината кальция для целей снижения токсичности не предусмотрена.
3 У пациентов, которым невозможно проведение адъювантной химиотерапии mFOLFIRINOX, предпочтительным режимом является GEMCAP.
4 В случае дефектуры фолината кальция возможно уменьшение дозы этого препарата в режимах с инфузионным или струйным введением фторурацила до фиксированной дозы 50 мг в сутки или вовсе исключить из лечения без значимого влияния на эффективность и переносимость лечения.
При положительных краях резекции (R1) режимы химиотерапии остаются теми же, однако польза режима GEMCAP при R1-статусе сомнительна.
Роль адъювантной лучевой терапии в настоящее время изучается в проспективных рандомизированных исследованиях. Ее рутинное применение НЕ рекомендуется даже при положительных краях резекции (R1) или при подтвержденных метастазах в регионарных лимфоуздах (рN1-2).
-
Рекомендуется проводить химиотерапию у пациентов с неметастатическим раком поджелудочной железы общей длительностью не менее 6 месяцев [74].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарий: в случае применения предоперационной химиотерапии длительностью 6 месяцев с последующим хирургическим лечением, после операции рекомендовано динамическое наблюдение без адъювантной терапии. Если длительность предоперационной химиотерапии была меньше 6 месяцев, рекомендовано применение адъювантной химиотерапии таким образом, чтобы общая продолжительность химиотерапии составила 6 месяцев. В этом случае рекомендуется проводить адъювантный этап химиотерапии с использованием тех же противоопухолевых препаратов, которые были использованы перед операцией. Однако, учитывая более высокий риск непереносимой токсичности после операции по сравнению с предоперационным этапом, следует адаптировать дозы препаратов из предоперационного режима в соответствии с состоянием пациента после операции.
Неудовлетворительная переносимость химиотерапии может быть основанием для преждевременного прекращения терапии.
2.2. Терапия метастатического рака поджелудочной железы
-
У пациентов с метастатическим раком поджелудочной железы рекомендуется применение системной химиотерапии с целью контроля симптомов заболевания и увеличения продолжительности жизни [82–85].
Уровень убедительности рекомендаций В (уровень достоверности доказательств 1)
Комментарий: рекомендуемые режимы химиотерапии I линии при раке поджелудочной железы суммированы в таблице 4. При применении любого режима химиотерапии рекомендуется продолжение лечения до прогрессирования по критеримя RECIST 1.1 (см. приложение Г2) или до неприемлемой токсичности, которая сохраняется, несмотря на редукции доз препаратов.
Таблица 4. Химиотерапия I линии рака поджелудочной железы
|
Режим химиотерапии (лечение до прогрессирования/неприемлемой токсичности) |
Критерии отбора пациентов |
|---|---|
|
FOLFIRINOX1,2 [86] (#оксалиплатин** 85 мг/м2 в/в 120 мин, #иринотекан** 180 мг/м2 в/в 90 мин, #кальция фолинат** 400 мг/м2 в/в 120 мин, #фторурацил** 400 мг/м2 в/в болюс, #фторурацил** 2400 мг/м2 в/в инфузия в течение 46 часов, интервал между циклами 14 дней); |
|
|
#Паклитаксел + альбумин 125 мг/м2 в/в капельно 30 минут + #гемцитабин** 1000 мг/м2 в/в капельно 30 минут в 1,8,15 дни 28-дневного цикла [85] |
|
|
#Гемцитабин** 1000 мг/м2 в/в капельно 1,8 дни + #цисплатин** 50-75 мг/м2 в/в капельно 1 день 21-дневного курса [87] или #Гемцитабин** 1000 мг/м2 в/в капельно + #Оксалиплатин** 100 мг/м2 в/в капельно 120 минут каждые 2 недели [88]. |
|
|
Гемцитабин** 1000 мг/м2 в/в капельно 30 минут 1 раз в неделю в течение 7 недель с последующим недельным перерывом, далее 1,8,15 дни 28-дневного курса [83] |
|
|
#Капецитабин** 2000-2500 мг/м2 внутрь в 1-14-ый дни 21-дневного курса [80,89,90] |
|
|
Олапариб** 300 мг 2 раза в сутки внутрь ежедневно [91] |
|
1 С целью профилактики фебрильной нейтропении при применении режима FOLFIRINOX возможно назначение первичной профилактики нейтропении филграстимом** в дозе 5 мкг/кг п/к через 24 часа после завершения химиотерапии до восстановления показателей нейтрофилов или пэгфилграстимом** – 6 мг п/к однократно, или эмпэгфилграстимом** – 7,5 мг п/к однократно через 24 часа после окончания каждого курса химиотерапии. Альтернативно допустима вторичная профилактика нейтропении, учитывая, что нейтропения не всегда является дозолимитирующей токсичностью [58,81].
2 В случае дефектуры фолината кальция возможно уменьшение дозы этого препарата в режимах с инфузионным или струйным введением фторурацила до фиксированной дозы 50 мг в сутки или вовсе исключить из лечения без значимого влияния на эффективность и переносимость лечения.
Решение, какой режим предпочесть при метастатическом раке поджелудочной железы, зависит, в первую очередь, от состояния пациента. В случае удовлетворительного общего состояния ECOG 0-1 (Приложение Г1), нормальных показателях функции печени и почек, отсутствии серьезных осложнений опухолевого процесса и сопутствующих заболеваний, рекомендуется применение режимов FOLFIRINOX или #гемцитабин** + #паклитаксел + альбумин. Отдельным пациентам, имеющим значительное распространение опухолевого процесса и связанные с этим симптомы (общее состояние по шкале ECOG 2 балла), может быть рекомендована комбинация #гемцитабина** и #паклитаксел+альбумина, если ожидается, что в случае достижения противоопухолевого эффекта симптомы болезни могут регрессировать [82,85,86].
В случае неудовлетворения вышеперечисленным критериям рекомендуется монохимиотерапия гемцитабином** [83]. Пациентам в тяжелом состоянии проведение химиотерапии не рекомендуется; в этом случае следует проводить только симптоматическую терапию [19].
Комбинация гемцитабина** и эрлотиниба** не рекомендуется для применения при раке поджелудочной железы по причине клинически незначимого увеличения продолжительности жизни в неотобранной популяции при существенно большей токсичности [82,92].
Добавление фторпиримидинов к гемцитабину** не увеличивает выживаемость при местнораспространенном и метастатическом раке и не рекомендуется к практическому применению.
Добавление препаратов платины к гемцитабину** не увеличивает выживаемость при местнораспространенном и метастатическом раке и не рекомендуется к практическому применению при отсутствии мутаций BRCA или PALB2.
Значительная токсичность режима FOLFIRINOX обосновывает изначальную модификацию данного режима, которая может включать один или несколько нижеперечисленных вариантов [82]:
-
первичная профилактика нейтропении колониестимулирующим фактором;
-
редукция дозы болюсного (до 320 мг/м2 или полная отмена) и инфузионного (до 2000 мг/м2) введения #фторурацила**;
-
редукция дозы #иринотекана** (до 150 мг/м2);
-
редукция дозы #оксалиплатина** (до 65 мг/м2).
Также после 8 курсов химиотерапии FOLFIRINOX возможен переход на поддерживающую терапию #фторурацилом**/#капецитабином** или режим FOLFIRI до прогрессирования. В этом случае после прогрессирования следует рассмотреть реиндукцию режима FOLFIRINOX как одну из опций терапии второй линии [93].
-
У пациентов с метастатическим раком поджелудочной железы и патогенными герминальными мутациями в генах BRCA в случае отсутствия прогрессирования после проведения не менее 16 недель платиносодержащей химиотерапии I линии рекомендуется рассмотреть либо продолжение химиотерапии (в том числе в виде поддерживающей химиотерапии), либо переход на поддерживающую терапию олапарибом** до прогрессирования заболевания или непереносимой токсичности [91].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 2)
Комментарий: проведенное рандомизированное исследование продемонстрировало преимущество в отношении времени без прогрессирования при применении поддерживающей терапии олапарибом** в таблетках в дозе 300 мг 2 раза в сутки длительностью до прогрессирования заболевания или непереносимой токсичности при сравнении с плацебо у пациентов с метастатическим раком поджелудочной железы и патогенными герминальными мутациями в генах BRCA в случае отсутствия прогрессирования после проведения не менее 16 недель платиносодержащей химиотерапии I линии. Допустим более поздний переход на поддерживающую терапию олапарибом, в том числе при сохранении эффекта или стабилизации на фоне поддерживающей химиотерапии фторпиримидинами или FOLFIRI. Лечение олапарибом должно быть начато не позже 8 недель от даты последнего курса химиотерапии. На настоящий момент времени олапариб** не продемонстрировал увеличения продолжительности жизни при сравнении с поддерживающей терапией плацебо [91].
Использование олапариба** не в поддерживающей терапии, а в качестве самостоятельного лечения не рекомендуется ввиду низкой клинической эффективности.
-
При прогрессировании после адъювантной химиотерапии и/или химиотерапии первой линии всем пациентам с раком поджелудочной железы в удовлетворительном состоянии рекомендуется проведение химиотерапии второй линии с целью контроля симптомов заболевания и увеличения продолжительности жизни [94,95].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3)
Комментарий: Химиотерапия II линии может быть рекомендована пациентам в удовлетворительном состоянии (статус ECOG 0-1) и отдельным пациентам в состоянии средней тяжести (статус ECOG 2) (Приложение Г1), связанном с распространением опухолевого процесса, если эффект химиотерапии позволяет рассчитывать на улучшение общего состояния. Пациентам в тяжелом общем состоянии (статус ECOG 3-4) рекомендуется только симптоматическое лечение. В случае, если прогрессирование развилось более чем через 6 месяцев после прекращения предыдущей химиотерапии, целесообразно возобновление той же химиотерапии. В противном случае рекомендуется начать химиотерапию другими препаратами. Однако при исчерпанности других опций лекарственного лечения реинтродукция ранее использованных противоопухолевых препаратов может быть использована, если ранее не было зарегистрировано прогрессирования заболевания на фоне данной терапии или при первой оценке эффекта после ее завершения. Рекомендуемые режимы химиотерапии II линии при раке поджелудочной железы суммированы в таблице 5 [89,96–99].
Таблица 5. Химиотерапия II линии рака поджелудочной железы
|
Режим химиотерапии (лечение до прогрессирования/неприемлемой токсичности) |
Критерии отбора пациентов |
|---|---|
|
#Паклитаксел + альбумин 100-125 мг/м2 в/в капельно 30 минут + #гемцитабин** 750-1000 мг/м2 в/в капельно 30 минут в 1,8,15 дни 28-дневного цикла [100] |
|
|
#Гемцитабин** 1000 мг/м2 в/в капельно 1,8,15 дни + #цисплатин** 50 мг/м2 в/в капельно 1,15 дни 28-дневного курса [101] или #Гемцитабин** 1000 мг/м2 в/в капельно + #Оксалиплатин** 85-100 мг/м2 в/в капельно каждые 2 недели [102,103] |
|
|
#Гемцитабин** 1000 мг/м2 в/в капельно 30 минут (возможна редукция дозы до 750 мг/м2) 1,8,15 дни 28-дневного курса [104,105] |
|
|
mFOLFIRINOX [106,107] (#оксалиплатин** 60-85 мг/м2 в/в 120 мин, #иринотекан** 120-180 мг/м2 в/в 90 мин, #кальция фолинат** 400 мг/м2 в/в 120 мин, #фторурацил** 2000-2400 мг/м2 в/в инфузия в течение 46 часов, интервал между циклами 14 дней)1; |
|
|
FOLFOX [108] (#оксалиплатин** 85 мг/м2 в/в 120 мин, #кальция фолинат** 400 мг/м2 в/в 120 мин, #фторурацил** 400 мг/м2 в/в болюс, #фторурацил** 2400 мг/м2 в/в инфузия в течение 46 часов, интервал между циклами 14 дней); XELOX [109] (#оксалиплатин** 130 мг/м2 в/в 120 мин в день 1, #капецитабин** 2000 мг/м2 в сутки внутрь 1-14 дни 21-дневного цикла); FOLFIRI.3 [110,111, p. 3] (#иринотекан** 70-90 мг/м2 в/в 60 мин в день 1, #кальция фолинат** 400 мг/м2 в/в 120 мин в день 1, #фторурацил** 2000 мг/м2 в/в инфузия в течение 46 часов, #иринотекан** 70-90 мг/м2 в/в 60 мин в день 3 после окончания инфузии #фторурацила**, интервал между циклами 14 дней); CAPIRI [112] (#иринотекан** 200 мг/м2 в/в 90 мин в день 1, #капецитабин** 1600-2000 мг/м2 внутрь 1-14 дни 21-дневного цикла). OFF [113] (#оксалиплатин** 85 мг/м2 в/в 120 мин. в 8, 22 дни, #кальция фолинат** 200 мг/м2 в/в 30 мин. в 1,8,15,22 дни, #фторурацил** 2000 мг/м2 в/в инфузия в течение 24 часов в 1,8,15,22 дни 43-дневного цикла1 |
|
|
Пембролизумаб** 200 мг в/в 30 мин. 1 раз в 3 недели [45,114]; |
|
|
#Капецитабин** 2500 мг/м2 (возможна редукция дозы до 2000 мг/м2) в сутки внутрь 1-14 дни 21-дневного цикла [119,120]; #фторурацил** 375-425 мг/м2 в/в болюс + #кальция фолинат** 20 мг/м2 в/в болюс 1-5 дни 28-дневного цикла [121,122]. |
|
1 В случае дефектуры фолината кальция возможно уменьшение дозы этого препарата в режимах с инфузионным или струйным введением фторурацила до фиксированной дозы 50 мг в сутки или вовсе исключить из лечения без значимого влияния на эффективность и переносимость лечения.
В случае кахексии целесообразно назначение #мегестрола ацетата [141,142] в дозе 320-480 мг внутрь 1 раз в сутки и (или) оланзапина в дозе 2,5 мг в сутки внутрь с продолжительностью, определяемой индивидуально. Данных, поддерживающих применение химиотерапии III линии, не существует. Решение о применении химиотерапии III линии принимается индивидуально.
В случае выявления редких молекулярных нарушений, например, мутации BRAF, EGFR, транслокации ALK, NTRK, ROS1, гиперэкспрессии/амплификации HER2/neu при отсутствии мутаций в гене КRAS возможно применение персонализированной терапии во второй и более линии лечения, направленной на ингибирование данных сигнальных путей.
-
Пациентам с изолированным локорегионарным рецидивом после хирургического лечения, а также продолженным ростом первичной нерезектабельной опухоли после химиотерапии при отсутствии отдаленных метастазов рекомендуется рассмотреть либо хирургическое лечение (в объеме ререзекции поджелудочной железы или экстирпации культи), либо проведение химиолучевой терапии, либо проведение 3-4 месяцев химиотерапии с последующим проведением стереотаксической лучевой терапии [143,144].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5)
Комментарий: целесообразно проведение химиолучевой терапии или 3-4 месяцев химиотерапии с последующим проведением стереотаксической лучевой терапии (A07.14.001.003 Дистанционная лучевая терапия опухолей поджелудочной железы стереотаксическим методом пучками нейтронов, протонов и тяжелых ионов, A07.30.009.001 Конформная дистанционная лучевая терапия, в том числе IMRT, IGRT, ViMAT, стереотаксическая). Облучение проводится до СОД 54,4 Гр за 28 фракций в сочетании с #капецитабином** в дозе 830 мг/м2 2 раза в сутки внутрь ежедневно в дни лучевой терапии. В случае применения стереотаксической лучевой терапии рекомендуется использовать 3 фракции до СОД 30-45 Гр или 5 фракций до СОД 25-45 Гр. В объём облучения включается первичная опухоль с вовлеченными лимфатическими узлами или рецидив опухоли.
3. Коррекция осложнений опухолевого процесса и противоопухолевого лечения
-
Выполнение билиодигестивной операции (A16.14.006.002 Чрескожная чреспеченочная холецистостомия, холецистохолангиостомия под контролем ультразвукового исследования, A16.14.032 Стентирование желчных протоков) пациентам с механической желтухой рекомендуется в качестве первого этапа для подготовки к радикальной операции при наличии осложнений холестаза, например, при активном холангите, уровне общего билирубина более 250 мкмоль/л, а также при невозможности срочного (5-7 дней) выполнения хирургического лечения [99,145].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5)
Комментарий: пациенты с механической желтухой нуждаются в выполнении билиодигестивных вмешательств (A16.14.006.002 Чрескожная чреспеченочная холецистостомия, холецистохолангиостомия под контролем ультразвукового исследования, A16.14.032 Стентирование желчных протоков) , если планируется начало лечения с консервативного этапа. Гипербилирубинемия существенно не повышает риск серьезных послеоперационных осложнений, а желчеразгрузочные операции значительно и часто необоснованно отдаляют радикальное хирургическое лечение. Рекомендуется выполнение миниинвазивного желчеотведения (антеградным (чрескожные чреспеченочные вмешательства, A16.14.006.002 Чрескожная чреспеченочная холецистостомия, холецистохолангиостомия под контролем ультразвукового исследования) или ретроградным (эндоскопические вмешательства, A16.14.032 Стентирование желчных протоков) доступом. Открытые билиодигестивные вмешательства (A16.14.027 Наложение гепатодуоденоанастомоза) показаны только в случае неэффективности либо невозможности проведения миниинвазивного желчеотведения, следует применить такие виды обходных анастомозов, которые могли бы быть использованы в ходе реконструкции при выполнении радикальной операции на втором этапе (например, формирование гепатикоэнтероанастомоза; использование «длинной» петли кишки; проведение петли тощей кишки впередибодочно и т.д.).
-
Пациентам с механической желтухой рекомендуется выполнение билиодигестивных вмешательств (A16.14.006.002 Чрескожная чреспеченочная холецистостомия, холецистохолангиостомия под контролем ультразвукового исследования, A16.14.032 Стентирование желчных протоков) для желчеотведения, если планируется начало лечения с консервативной терапии [146].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарий: рекомендуется выполнение миниинвазивного желчеотведения (антеградным (чрескожные чреспеченочные вмешательства, A16.14.006.002 Чрескожная чреспеченочная холецистостомия, холецистохолангиостомия под контролем ультразвукового исследования) или ретроградным (эндоскопические вмешательства, A16.14.032) доступом. В случае стентирования (A16.14.032 Стентирование желчных протоков) следует отдать предпочтение металлическим саморасширяющимся стентам. Пластиковые стенты несут повышенные риски миграции и обструкции, что повышает риски жизнеугрожающих осложнений, особенно на фоне химиотерапии. Их применение возможно при ожидаемой продолжительности жизни менее 3 месяцев. Выполнение открытых билиодигестивных вмешательств (A16.14.022 Наложение гепатикоеюноанастомоза) показано только в случае неэффетивности либо невозможности проведения миниинвазивного желчеотведния.
-
Пациентам с непроходимостью выходного отдела желудка или двенадцатиперстной кишки, вызванной сдавлением и/или инфильтрацией опухолью пилорического отдела желудка или двенадцатиперстной кишки, рекомендуется неотложное разрешение данного осложнения в виде стентирования (A16.15.022 Стентирование при опухолях поджелудочной железы) или формирования обходных анастомозов (A16.17.017) Формирование обходного анастомоза тонкой кишки, если планируется начало лечения с консервативного этапа [146,147].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
-
Пациентам с выраженным болевым синдромом и невозможности выполнения радикальной операции рекомендуется назначение адекватных анальгетиков, выполнение блокады чревного сплетения (A22.24.004 Радиочастотная абляция периферических нервов, сплетений, вегетативных ганглиев) или паллиативной лучевой терапии (A07.14.001.003 Дистанционная лучевая терапия опухолей поджелудочной железы стереотаксическим методом пучками нейтронов, протонов и тяжелых ионов, A07.30.009 Конформная дистанционная лучевая терапия) с целью уменьшения выраженности болей [12,21,148–150].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: блокада чревного сплетения (A22.24.004 Радиочастотная абляция периферических нервов, сплетений, вегетативных ганглиев) выполняется чрескожно или эндоскопически. В качестве альтернативы с обезболивающей целью может быть применена лучевая терапия (A07.14.001.003 Дистанционная лучевая терапия опухолей поджелудочной железы стереотаксическим методом пучками нейтронов, протонов и тяжелых ионов, A07.30.009 Конформная дистанционная лучевая терапия). Возможно проведение курса стереотаксической лучевой терапии (РОД 5-6 Гр, 5 раз в неделю, СОД 25-30 Гр, в зависимости от объема облучения окружающих критических органов, с учетом их толерантности, A07.14.001.003 Дистанционная лучевая терапия опухолей поджелудочной железы стереотаксическим методом пучками нейтронов, протонов и тяжелых ионов) или курса конформной лучевоой терапии (A07.30.009 Конформная дистанционная лучевая терапия) в режиме гипофракционирования (РОД 3-4 Гр, 5 раз в неделю, СОД 30-28 Гр соответственно). Процедура верификации рассчитанного лечебного плана пациента должна предшествовать началу курса облучения при использовании методик лучевой терапии с модуляцией интенсивности (IMRT) или ротационном облучении (RapidArc). Пациент также должен получать те анальгетики, которые обеспечивают стойкое купирование болевого синдрома.
-
Рекомендуется обсуждение с пациентами, прооперированными по поводу рака поджелудочной железы, а также имеющими нерезектабельный процесс, заместительную ферментативную терапию, направленную на коррекцию экзокринной недостаточности поджелудочной железы [61–63].
Уровень убедительности рекомендаций В (уровень достоверности доказательств 2)
Комментарий: большинство пациентов имеют признаки алиментарной недостаточности, выражающейся в виде существенного снижения массы тела, кахексии, саркопении. Одной из причин данного осложнения, которая должна быть скорректирована, является экзокринная недостаточность функции поджелудочной железы. Частота ферментативной недостаточности по данным метаанализа составляет 44% у пациентов с нерезецированной поджелудочной железой и 36-100% после операции [63]. Клиническая картина ферментативной недостаточности не обладает специфическими симптомами и включает похудание, диарею, боли/дискомфорт в животе, анемию, электролитные нарушения и др. Диагностика ферментативной недостаточности не всегда дает точный результат. Прямой метод в виде оценки поступления панкреатического сока в двенадцатиперстную кишку является инвазивным и трудозатратным, ввиду чего редко используется в практике. Используются непрямые тесты, например, тест на уровень фекальной эластазы 1 (A09.19.010 Определение активности панкреатической эластазы-1 в кале) и измерение биохимических маркеров (напр., альбумин (A09.05.011 Исследование уровня альбумина в крови), пре-альбумин, магний (A09.05.127 Исследование уровня общего магния в сыворотке крови), ретинол-связывающие белки, витамины А, D (A09.05.221 Исследование уровня 1,25-OH витамина Д в крови), E)[62]. Измерение коэффициента абсорбции жира в стуле и радиоизотопный дыхательный тест не доступны для рутинного исследования. Тест на фекальную эластазу-1 (A09.19.010 Определение активности панкреатической эластазы-1 в кале) используется только для подтверждения диагноза ферментной недостаточности, но не подходит для оценки ее динамики на фоне ФЗТ.
Терапия ферментативной недостаточности показана всем пациентам после операции или в отсутствие резекции поджелудочной железы при наличии клиники ферментативной недостаточности и должна быть направлена на ее коррекцию даже при отсутствии лабораторного подтверждения диагноза. Стартовая доза заместительной ферментативной терапии (ЗФТ) включает 40000-50000 Ед панкреатина** во время приема пищи и 25000 Ед во время перекусов. В дальнейшем доза препарата может быть изменена в индивидуальном порядке. Чаще всего необходимая доза панкреатина** после тотальной панкреатэктомии существенно выше указанной начальной дозы. Данные метаанализа указывают на ухудшение общего прогноза пациентов при отказе от ЗФТ[63].
-
У пациентов с раком поджелудочной железы при выявлении гипергликемии рекомендуется прием (осмотр, консультация) врача-эндокринолога для коррекции уровня глюкозы крови[151]
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: вторичное нарушение метаболизма глюкозы на фоне рака поджелудочной железы получила название панкреатогенного сахарного диабета (3с типа). Данное осложнение ассоциировано с риском прогрессирования, плохим прогнозом, увеличивает риски токсичности лекарственного лечения и требует коррекции у врача-эндокринолога [151].
-
При лечении асцита у пациентов рекомендуется выполнение лапароцентеза (A16.30.007 Дренаж перитонеальный) и применение диуретиков с целью контроля симптомов данного осложнения [152,153].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5)
-
У пациентов с раком поджелудочной железы рекомендуется проведение поддерживающей и симптоматической терапии с целью улучшения качества жизни и переносимости противоопухолевого лечения [154].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5)
Комментарий:
Принципы лечения и профилактики тошноты и рвоты у пациентов с раком поджелудочной железы соответствуют принципам, изложенным в рекомендациях «Практические рекомендации по профилактике и лечению тошноты и рвоты у онкологических больных.» [155].
Принципы лечения и профилактики костных осложнений у пациентов с раком поджелудочной железы соответствуют принципам, изложенным в методических рекомендациях «Использование остеомодифицирующих агентов для профилактики и лечения патологии костной ткани при злокачественных новообразованиях» [156].
Принципы профилактики и лечения инфекционных осложнений и фебрильной нейтропении у пациентов раком поджелудочной железы соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по диагностике и лечению фебрильной нейтропении» [157].
Принципы профилактики и лечения гепатотоксичности у пациентов раком поджелудочной железы соответствуют принципам, изложенным в методических рекомендациях «Клинические рекомендации по коррекции гепа-тотоксичности, индуцированной противоопухолевой терапией» [158].
Принципы профилактики и лечения сердечно-сосудистых осложнений у пациентов раком поджелудочной железы соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по коррекции кардиоваскулярной токсичности противоопухолевой лекарственной терапии» [159].
Принципы профилактики и лечения кожных осложнений у пациентов раком поджелудочной железы соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по лекарственному лечению дерматологических реакций у пациентов, получающих противоопухолевую лекарственную терапию» [160].
Принципы нутритивной поддержки у пациентов раком поджелудочной железы соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по нутритивной поддержке онкологических больных» [161].
Принципы профилактики и лечения нефротоксичности у пациентов раком поджелудочной железы соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по коррекции нефротоксичности противоопухолевых препаратов» [162].
Принципы профилактики и лечения тромбоэмболических осложнений у пациентов раком поджелудочной железы соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по профилактике и лечению тромбоэмболических осложнений у онкологических больных» [163].
Принципы профилактики и лечения последствий экстравазации лекарственных препаратов у пациентов раком поджелудочной железы соответствуют принципам, изложенным в методических рекомендациях «Рекомендации по лечению последствий экстравазации противоопухолевых препаратов» [164].
Принципы профилактики и лечения иммуноопосредованных нежелательных явлений у пациентов раком поджелудочной железы соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по управлению иммуноопосредованными нежелательными явлениями» [165].
Диетотерапия
-
Рекомендуется обсуждать со всеми пациентами с раком поджелудочной железы особенности диеты и дополнительной нутритивной поддержки при выявлении признаков алиментарной недостаточности, кахексии и/или саркопении [166].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств – 3)
Комментарий: сниженное питание, кахексия и саркопения снижают качество жизни и являются факторами неблагоприятного прогноза. Сбалансированная диета, расчет калоража, назначение сипингового специализированного питания являются важными аспектами комплексного подхода к лечению пациентов. Дополнительная информация представлена в Практических рекомендациях RUSSCO по лечению синдрома анорекции-кахексии у онкологических больных [167].
Медицинская реабилитация
Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
-
Во время предреабилитации пациентам с раком поджелудочной железы рекомендуется проведение лечебной физкультуры (ЛФК), психологической и нутритивной поддержки, информирования пациентов [166,168–172].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств – 3)
Комментарии: программа комплексной преабилитации, которая включает в себя занятия ЛФК дома (комплекс физической нагрузки средней интенсивности, включающей в себя как аэробную, так и анаэробную нагрузку), консультирование по питанию, работу с медицинским психологом на преодоление тревоги и депрессии (начинается за 28 дней до операции и продолжается в течение 8 недель после) значительно улучшает качество жизни в послеоперационном периоде. Психологическая преабилитация, включающая методики, направленные на работу со стрессом (методики релаксации, формирование позитивного настроя) в течение 40-60 минут 6 дней в неделю, которая начинается за 5 дней до операции, и продолжается 30 дней после значительно улучшает качество жизни.
-
Рекомендуется применять тактики fast track реабилитации («быстрый путь») и ERAS (early rehabilitation after surgery – ранняя реабилитация после операции), включающие в себя комплексное обезболивание, раннее энтеральное питание, отказ от рутинного применения зондов и дренажей, ранняя мобилизация (активизация и вертикализация) пациентов уже с 1-2 суток после операции [171].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств – 4)
Комментарии: применение побудительной спирометрии, подъем головного конца кровати, раннее начало дыхательной гимнастики и ранняя активизация пациентов помогает профилактике застойных явлений в легких в послеоперационном периоде [173].
Для профилактики снижения мышечной массы, легочных и тромботических осложнений показано пребывание в кровати 2 часа до операции и не более 6 часов после. Дыхательная гимнастика начинается сразу после нормализации сознания пациента после операции. Тактике дыхательной гимнастики в послеоперационном периоде пациент обучается до операции. После проведения оперативного лечения рекомендовано выполнение диафрагмального дыхания, которое способствует улучшению циркуляции лимфы в организме и позволяет вентилировать нижние доли легких, которые при грудном типе дыхания обычно наполняются воздухом недостаточно.
-
Во время проведения химиотерапии рекомендуется выполнение комплекса ЛФК (A19.30.007 Лечебная физкультура с использованием тренажера), методики релаксации, включающие в себя диафрагмальное дыхание и прогрессирующую мышечную релаксацию, рассмотреть возможность назначения курса лечебного массажа (A21.01.001 Общий массаж медицинский) для улучшения общего состояния пациента [174,175].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2)
Комментарии: объем и интенсивность ЛФК подбирается индивидуально исходя из степени слабости (легкая, средняя, тяжелая). При улучшении общего состояния возможно увеличить интенсивность ЛФК. Рекомендуется сочетание аэробной нагрузки и силовой.
Прогноз
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
1. Факторы, влияющие на исход протокового рака поджелудочной железы
Результаты лечения рака поджелудочной железы улучшаются. Доля долгожителей увеличивается не только за счет совершенствования лечебных подходов у пациентов с неметастатическим процессом [77], но и за счет более успешного лечения метастатического рака [77,185].
Факторы, влияющие на исход заболевания, достаточно многочисленны и включают общее состояние пациента, сопутствующую патологию, распространенность опухолевого процесса, а также наличие осложнений опухолевого процесса. Активно изучаются биомаркеры, способные предсказать склонность опухоли к быстрому метастазированию, а также эффективность химиотерапии [186, p. 4,187,188].
Однако многочисленные исследования демонстрируют, что основным фактором, влияющим на исход, является адекватно назначенное и проведенное лечение [74,94,95]. Поэтому считается недопустимым необоснованный отказ в проведении лечения даже при запущенной стадии.
2. Особенности редких гистологических подтипов новообразований экзокринной части поджелудочной железы
Солидные псевдопапиллярные опухоли встречаются в менее чем 1% случаев из всех новообразований поджелудочной железы, преимущественно у женщин (в 90% случаев) в молодом возрасте (средний возраст 20 лет). Если ранее они классифицировались как опухоли с неопределенным потенциалом злокачественности, то в настоящее время они рассматриваются как опухоли с низкой степенью злокачественности [189–191].
Опухоли обладают индолентным течением. Прогноз благоприятный. Отдаленные метастазы выявляются в ≈8% случаев. Лечение преимущественно хирургическое, включая случаи с отдаленными метастазами. Частота рецидивов составляет менее 5%. Адъювантная терапия как правило не используется.
Для пациентов с неоперабельными метастазами протоколов химиотерапии не разработано, и опубликованные наблюдения указывают на невысокую непосредственную эффективность химиотерапии, хотя индолентное течение обеспечивает продолжительную стабилизацию. Эти опухоли часто экспрессируют рецепторы половых гормонов, и эндокринная терапия тамоксифеном или ингибиторами ароматазы в сочетании с овариальной супрессией при необходимости может быть рассмотрена [189–191].
Ацинарные карциномы и смешанные ацинарно-эндокринные карциномы отличаются более благоприятным течением по сравнению с протоковыми карциномами. Общие принципы лечения не отличаются от таковых для протокового рака поджелудочной железы. Смешанные ацинарно-эндокринные карциномы также лечатся по принципам лечения экзокринного рака.
На молекулярном уровне в этих опухолях редко встречаются мутации KRAS. Среди молекулярных нарушений, заслуживающих внимание, следует выделить альтерации BRAF. Хотя мутации BRAF выявляются редко, в 23% случаев выявляются перестройки BRAF или RAF1 (например, слияние SND1-BRAF), что делает эти опухоли потенциально чувствительными к терапии ингибиторами МЕК. Анализ небольших работ показывает также более высокую частоту мутаций в генах BRCA и MSI-H при ацинарных карциномах поджелудочной железы [140,192–194].
Внутрипротоковая папиллярная муцинозная опухоль, ассоциированная с инвазивной аденокарциномой, и муцинозная кистозная опухоль, ассоциированная с инвазивной аденокарциномой, являются группой опухолей, возникших на фоне озлокачествления доброкачественных кистозных новообразований. Их прогноз определяется биологией злокачественного компонента и распространенностью процесса. Накопленный опыт не позволяет сформировать особый алгоритм лечения. Поэтому рекомендуется следовать тем же правилам, которые сформированы для классического протокового рака [195–197].
Серозная цистаденокарцинома развивается из доброкачественного предшественника и имеет более благоприятный прогноз, несмотря на способность метастазировать. Индолентное течение ставит на первое место хирургический метод лечения даже при наличии отдаленных метастазов [198,199].
Панкреатобластома – крайне редко встречающаяся опухоль, возникающая в детском возрасте. В Мире опубликовано порядка 15 случаев диагностирования панкреатобластомы у взрослых пациентов, большинство из которых погибли в короткие сроки. Принципы хирургического лечения, (нео)адъювантной терапии и терапии диссеминированного процесса должны соответствовать клиническим рекомендациям для детей [200,201].
Госпитализация
Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с федеральным законом от 21.11.2011 №323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации», организуется и оказывается:
1) в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
2) в соответствии с порядком оказания помощи по профилю «онкология» (Приказ Министерства здравоохранения РФ от 19 февраля 2021 г. №116н "Об утверждении Порядка оказания медицинской помощи взрослому населению при онкологических заболеваниях" обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3) на основе настоящих клинических рекомендаций;
4) с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Стандарт медицинской помощи разрабатывается на основе настоящих клинических рекомендаций, одобренных и утвержденных в соответствии с настоящей статьей, в порядке, установленном уполномоченным федеральным органом исполнительной власти, и включает в себя усредненные показатели частоты предоставления и кратности применения:
1) медицинских услуг, включенных в номенклатуру медицинских услуг;
2) зарегистрированных на территории Российской Федерации лекарственных препаратов (с указанием средних доз) в соответствии с инструкцией по применению лекарственного препарата и фармакотерапевтической группой по анатомо-терапевтическо-химической классификации, рекомендованной Всемирной организацией здравоохранения;
3) медицинских изделий, имплантируемых в организм человека;
4) компонентов крови;
5) видов лечебного питания, включая специализированные продукты лечебного питания;
6) иного исходя из особенностей заболевания (состояния).
Назначение и применение лекарственных препаратов, медицинских изделий и специализированных продуктов лечебного питания, не входящих в соответствующий стандарт медицинской помощи или не предусмотренных соответствующей клинической рекомендацией, допускаются в случае наличия медицинских показаний (индивидуальной непереносимости, по жизненным показаниям) по решению врачебной комиссии.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом в центре амбулаторной онкологической помощи, а при его отсутствии в первичном онкологическом кабинете или поликлиническом отделении онкологического диспансера (онкологической больницы) и включает мероприятия по профилактике, диагностике, лечению онкологических заболеваний и медицинской реабилитации.
Врач-онколог центра амбулаторной онкологической помощи, а при отсутствии указанного центра - врач-онколог первичного онкологического кабинета или поликлинического отделения онкологического диспансера (онкологической больницы) в течение одного дня с даты установления предварительного диагноза злокачественного новообразования организует взятие биологического материала для цитологического исследования и (или) биопсийного (операционного) материала и направление в патолого-анатомическое бюро (отделение) в соответствии с правилами проведения патолого-анатомических исследований и (или) клинико-диагностическую лабораторию (отдел, отделение) в соответствии с правилами проведения лабораторных исследований, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет), биопсийного (операционного) материала или проведения иных диагностических исследований пациент направляется врачом-онкологом в онкологический диспансер (онкологическую больницу), медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Сроки проведения диагностических инструментальных и лабораторных исследований, в том числе проведение патологоанатомических исследований, в случае подозрения на онкологические заболевания не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации
Скорая медицинская помощь оказывается в соответствии с приказом Министерства здравоохранения Российской Федерации от 20 июня 2013 г. №388н "Об утверждении Порядка оказания скорой, в том числе скорой специализированной, медицинской помощи".
Скорая медицинская помощь оказывается фельдшерскими выездными бригадами скорой медицинской помощи, врачебными выездными бригадами скорой медицинской помощи в экстренной или неотложной форме вне медицинской организации, а также в амбулаторных и стационарных условиях при состояниях, требующих срочного медицинского вмешательства.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета) направляет пациента в онкологический диспансер (онкологическую больницу) или иную медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями, в том числе подведомственную федеральному органу исполнительной власти, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания), определения тактики лечения, а также в случае наличия медицинских показаний для оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Сроки ожидания оказания специализированной (за исключением высокотехнологичной) медицинской помощи не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации.
При наличии у пациента с онкологическим заболеванием медицинских показаний к оказанию высокотехнологичной медицинской помощи направление в медицинскую организацию, оказывающую высокотехнологичную медицинскую помощь, осуществляется в соответствии с порядком организации оказания высокотехнологичной медицинской помощи с применением единой государственной информационной системы в сфере здравоохранения.
В сложных клинических случаях для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания) в целях проведения оценки, интерпретации и описания результатов врач-онколог организует направление:
- цифровых изображений, полученных по результатам патоморфологических исследований, в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр) путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
- цифровых изображений, полученных по результатам лучевых методов исследований, в дистанционный консультативный центр лучевой диагностики, путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
- биопсийного (операционного) материала для повторного проведения патоморфологических, иммуногистохимических и молекулярно-генетических исследований: в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр), а также в молекулярно-генетические лаборатории для проведения молекулярно-генетических исследований.
Тактика лечения устанавливается консилиумом врачей, включающим врачей-онкологов, врача-радиотерапевта, врача-нейрохирурга (при опухолях нервной системы) медицинской организации, в составе которой имеются отделения хирургических методов лечения злокачественных новообразований, противоопухолевой лекарственной терапии, радиотерапии (далее – онкологический консилиум), в том числе онкологическим консилиумом, проведенным с применением телемедицинских технологий, с привлечением при необходимости других врачей-специалистов.
При изменении метода лечения проведение онкологического консилиума обязательно.
Решение онкологического консилиума оформляется протоколом на бумажном носителе, заполненном разборчиво от руки или в печатном виде и подписанном участниками консилиума, либо в форме электронного документа, подписанного с использованием усиленной квалифицированной электронной подписи участников консилиума.
Решение онкологического консилиума, оформленное протоколом, вносится в медицинскую документацию пациента.
При наличии у пациента с онкологическим заболеванием медицинских показаний для проведения медицинской реабилитации врач-онколог организует ее проведение в соответствии с порядком организации медицинской реабилитации взрослых.
При наличии у пациента с онкологическим заболеванием медицинских показаний к санаторно-курортному лечению врач-онколог организует его в соответствии порядком организации санаторно-курортного лечения.
Паллиативная медицинская помощь пациенту с онкологическими заболеваниями оказывается в соответствии с положением об организации оказания паллиативной медицинской помощи, включая порядок взаимодействия медицинских организаций, организаций социального обслуживания и общественных объединений, иных некоммерческих организаций, осуществляющих свою деятельность в сфере охраны здоровья.
Показания для госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную медицинскую помощь по профилю «онкология» определяются консилиумом врачей-онкологов и врачей-радиотерапевтов, с привлечением при необходимости других врачей-специалистов.
Госпитализация показана:
1) при необходимости выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2) при наличии показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, лучевая терапия, в том числе контактная, дистанционная и другие виды лучевой терапии, лекарственная терапия и др.), требующему наблюдения в условиях круглосуточного или дневного стационара;
3) при наличии осложнений онкологического заболевания, требующих оказания ему специализированной медицинской помощи в экстренной и неотложной форме.
Показанием к выписке пациента из медицинской организации является завершение курса лечения, или одного из этапов оказания специализированной, в том числе высокотехнологичной медицинской помощи, в условиях круглосуточного или дневного стационара при условиях отсутствия осложнений лечения, требующих медикаментозной коррекции или медицинских вмешательств в стационарных условиях.
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
-
Пациентам с раком поджелудочной железы рекомендуется диспансерное наблюдение после окончания лечения в соответствии с порядком диспансерного наблюдения за взрослыми с онкологическими заболеваниями [176].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: порядок диспансерного наблюдения подразумевает диспансерный прием (осмотр, консультацию) врача-онколога и обследование каждые 3 месяца в течение первого года, каждые 6 месяцев в течение второго года и далее ежегодно пожизненно [177]. Не существует доказательств того, что активное наблюдение за пациентами после проведенного лечения и раннее выявление рецидива заболевания увеличивает продолжительность жизни. Поэтому допустимо проводить только сбор жалоб пациента и физикальный осмотр на регулярной основе. Однако быстрое ухудшение состояния при прогрессировании заболевания лимитирует перспективы использования современных режимов химиотерапии. Поэтому оптимальными являются визиты пациента каждые 12 недель в течение первых двух лет, каждые 6 месяцев в последующем для выполнения следующего обследования:
- УЗИ органов брюшной полости (комплексное), ультразвуковое исследование забрюшинного пространства (A04.16.001, A04.30.003) органов брюшной полости (комплексное) или компьютерную томографию органов брюшной полости и забрюшинного пространства с внутривенным болюсным контрастированием (A06.30.005.002), или МРТ органов брюшной полости с внутривенным контрастированием (A05.30.005.001),
- УЗИ органов малого таза комплексное (трансвагинальное и трансабдоминальное) для женщин,
- Прицельная рентгенография органов грудной клетки,
- Исследование уровня ракового эмбрионального антигена в крови, исследование уровня антигена аденогенных раков CA 19-9 в крови в случае их повышенных уровней на долечебном этапе, а также общий (клинический) анализ крови и анализ крови биохимический общетерапевтический для оценки функции печени и почек [178].
-
Для целей профилактики рака поджелудочной железы рекомендован скрининг здорового населения, имеющих высокий риск развития рака поджелудочной железы [179–181].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: исследования скрининга рака поджелудочной железы находятся на ранних этапах. Однако раннее метастазирование и высокая летальность пациентов даже после проведения радикального хирургического лечения на ранних стадиях требует внедрения программы раннего выявления рака поджелудочной железы в группах повышенного риска. Проведенные исследования позволили сформировать группы повышенного риска развития рака поджелудочной железы: наличие мутации STK11, CDKN2A или наличие мутации BRCA 1/2, ATM, PALB2 или синдрома Линча при условии наличия как минимум одного родственника первой или второй линии родства, страдавшего раком поджелудочной железы. К группе высокого риска относятся также случаи семейного рака поджелудочной железы без выявленной мутации риска: это члены семей с минимум двумя случаями рака поджелудочной железы с одним родственником первой степени родства [179,182].
Для пациентов с мутациями STK11 рекомендовано начало скрининга в возрасте 30-35 лет; при мутации CDKN2A – c 40 лет или на 10 лет раньше самого молодого случая рака в семье. Скрининг в других группах риска начинается в возрасте 50 лет или на 10 лет моложе самого раннего случая рака поджелудочной железы в семье [181].
Методы скрининга включают выполнение эндосонографии (A04.14.003 Эндосонография панкреатобилиарной зоны) и/или МРХПГ (A05.15.002 Магнитно-резонансная холангиопанкреатография) на ежегодной основе. Интервалы скрининга могут быть короче при индивидуальных особенностях и подозрительных находках. Пациенты должны быть проинформированы о рисках скрининга, связанных с выявлением и последующим хирургическим лечением образований, которые при гистологическом заключении не будут иметь элементов тяжелой дисплазии или рака. Хотя доля таких операций достигает 47%, все же скрининг рака поджелудочной железы в отобранной популяции продемонстрировал экономическую эффективность [183,184]. Экспертные сообщества считают, что потенциальная польза скрининга превышает риски [180].
Информация
Источники и литература
-
Клинические рекомендации Ассоциации онкологов России
- 1. Raimondi S., Maisonneuve P., Lowenfels A.B. Epidemiology of pancreatic cancer: an overview // Nature Reviews Gastroenterology &Amp; Hepatology. 2009. Vol. 6. P. 699. 2. Wolpin B.M. et al. Plasma 25-hydroxyvitamin D and risk of pancreatic cancer // Cancer Epidemiol Biomarkers Prev. 2012. Vol. 21, № 1. P. 82–91. 3. Duell E.J. et al. Pancreatitis and pancreatic cancer risk: a pooled analysis in the International Pancreatic Cancer Case-Control Consortium (PanC4) // Ann Oncol. 2012. Vol. 23, № 11. P. 2964–2970. 4. Huang Y. et al. Prediabetes and the risk of cancer: a meta-analysis // Diabetologia. 2014. Vol. 57, № 11. P. 2261–2269. 5. Makohon-Moore A., Iacobuzio-Donahue C.A. Pancreatic cancer biology and genetics from an evolutionary perspective // Nat Rev Cancer. 2016. Vol. 16, № 9. P. 553–565. 6. Pandit S. et al. Incidental liver metastasis in pancreatic adenocarcinoma // Journal of Surgical Case Reports. 2019. Vol. 2019, № 3. 7. Ansari D. et al. Pancreatic cancer: disease dynamics, tumor biology and the role of the microenvironment // Oncotarget. 2018. Vol. 9, № 5. P. 6644–6651. 8. Khan M.A.A. et al. Molecular Drivers of Pancreatic Cancer Pathogenesis: Looking Inward to Move Forward // Int J Mol Sci. 2017. Vol. 18, № 4. P. 779. 9. Каприн А.Д. Состояние онкологической помощи населению России в 2021 году. М.: МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» Минздрава России. Москва, 2022. 10. Каприн А.Д. Злокачественные новообразования в России в 2021 году (заболеваемость и смертность). М.: МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» Минздрава России. Москва, 2022. 252 p. 11. Rawla P., Sunkara T., Gaduputi V. Epidemiology of Pancreatic Cancer: Global Trends, Etiology and Risk Factors // World J Oncol. 2019. Vol. 10, № 1. P. 10–27. 12. Ducreux M. et al. Cancer of the pancreas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up† // Annals of Oncology. 2015. Vol. 26, № suppl_5. P. v56–v68. 13. Трякин А., Бесова Н., Волков Н. Практические рекомендации по общим принципам проведения противоопухолевой лекарственной терапии // Злокачественные опухоли. Практические рекомендации RUSSCO. 2020. Vol. 10, № 3s2. 14. Приказ Министерства здравоохранения и социального развития РФ от 20 ноября 2006 г. N 783 “Об утверждении стандарта медицинской помощи больным со злокачественным новообразованием поджелудочной железы (при оказании специализированной помощи).” Министерство здравоохранения и социального развития РФ, 2006. 15. Трякин А., Бесова Н., Волков Н. Практические рекомендации по общим принципам проведения противоопухолевой лекарственной терапии // Злокачественные опухоли. Практические рекомендации RUSSCO. 2023. Vol. 13, № 3s2. P. 28–41. 16. Modlin I.M. et al. Chromogranin A—Biological Function and Clinical Utility in Neuro Endocrine Tumor Disease // Annals of Surgical Oncology. 2010. Vol. 17, № 9. P. 2427– 2443. 17. O’Toole D. et al. ENETS Consensus Guidelines for the Standards of Care in Neuroendocrine Tumors: Biochemical Markers // Neuroendocrinology. 2009. Vol. 90, № 2. P. 194–202. 18. DelMaschio A. et al. Pancreatic cancer versus chronic pancreatitis: diagnosis with CA 19-9 assessment, US, CT, and CT-guided fine-needle biopsy. // Radiology. 1991. Vol. 178, № 1. P. 95–99. 19. Tempero M.A. et al. NCCN Guidelines. Pancreatic adenocarcinoma. Version 1.2019. 2018. P. 155. 20. Tanaka K., Kida M. Role of endoscopy in screening of early pancreatic cancer and bile duct cancer // Digestive Endoscopy. John Wiley & Sons, Ltd, 2009. Vol. 21, № s1. P. S97–S100. 21. Pancreatic Cancer Guidelines. Updated: Mar 07, 2019 [Electronic resource]. URL: https://emedicine.medscape.com/article/280605-guidelines#g2 (accessed: 16.12.2019). 22. Кармазановский Г. Дифференциальная диагностика и определение резектабельности рака поджелудочной железы с помощью МСКТ и МРТ // Анналы хирургической гепатологии. 2019. Vol. 24, № 3. P. 22–35. 23. Li K.C. et al. Simultaneous measurement of flow in the superior mesenteric vein and artery with cine phase-contrast MR imaging: value in diagnosis of chronic mesenteric ischemia. Work in progress. // Radiology. 1995. Vol. 194, № 2. P. 327–330. 24. Megibow A.J. et al. Pancreatic adenocarcinoma: CT versus MR imaging in the evaluation of resectability--report of the Radiology Diagnostic Oncology Group. // Radiology. 1995. Vol. 195, № 2. P. 327–332. 25. Sheridan M.B. et al. Dynamic contrast-enhanced MR imaging and dual-phase helical CT in the preoperative assessment of suspected pancreatic cancer: a comparative study with receiver operating characteristic analysis. // American Journal of Roentgenology. 1999. Vol. 173, № 3. P. 583–590. 26. Buchs N.C. et al. Vascular invasion in pancreatic cancer: Imaging modalities, preoperative diagnosis and surgical management // World J Gastroenterol. 2010. Vol. 16, № 7. P. 818– 831. 27. Holzapfel K. et al. Comparison of diffusion-weighted MR imaging and multidetector-row CT in the detection of liver metastases in patients operated for pancreatic cancer // Abdominal Imaging. 2011. Vol. 36, № 2. P. 179–184. 28. Motosugi U. et al. Detection of Pancreatic Carcinoma and Liver Metastases with Gadoxetic Acid–enhanced MR Imaging: Comparison with Contrast-enhanced Multi–Detector Row CT // Radiology. 2011. Vol. 260, № 2. P. 446–453. 29. Li J. et al. Endoscopic Ultrasonography for Tumor Node Staging and Vascular Invasion in Pancreatic Cancer: A Meta-Analysis // Digestive Surgery. 2014. Vol. 31, № 4–5. P. 297–305. 30. Wyse J.M. et al. Randomized, Double-Blind, Controlled Trial of Early Endoscopic Ultrasound–Guided Celiac Plexus Neurolysis to Prevent Pain Progression in Patients With Newly Diagnosed, Painful, Inoperable Pancreatic Cancer // JCO. 2011. Vol. 29, № 26. P. 3541–3546. 31. Agarwal B. et al. Endoscopic Ultrasound-Guided Fine Needle Aspiration and Multidetector Spiral CT in the Diagnosis of Pancreatic Cancer // Am J Gastroenterology. 2004. Vol. 99, № 5. P. 844–850. 32. Farma J.M. et al. PET/CT Fusion Scan Enhances CT Staging in Patients with Pancreatic Neoplasms // Annals of Surgical Oncology. 2008. Vol. 15, № 9. P. 2465–2471. 33. Borad M.J. et al. Skeletal metastases in pancreatic cancer: a retrospective study and review of the literature // Yale J Biol Med. Yale Journal of Biology and Medicine, 2009. Vol. 82, № 1. P. 1–6. 34. Jambor M.A. et al. The role of staging laparoscopy in pancreatic adenocarcinoma and its effect on patients’ survival // World Journal of Surgical Oncology. 2022. Vol. 20, № 1. P. 337. 35. Sasaki T. et al. Brain metastasis in pancreatic cancer: Two case reports // Medicine. 2019. Vol. 98, № 4. 36. Lemke J. et al. Brain metastasis in pancreatic cancer // Int J Mol Sci. MDPI, 2013. Vol. 14, № 2. P. 4163–4173. 37. Bertero Edoardo et al. Linking Heart Failure to Cancer // Circulation. American Heart Association, 2018. Vol. 138, № 7. P. 735–742. 38. Buza Vitaly, Rajagopalan Bharath, Curtis Anne B. Cancer Treatment–Induced Arrhythmias // Circulation: Arrhythmia and Electrophysiology. American Heart Association, 2017. Vol. 10, № 8. P. e005443. 39. Naing A. et al. Electrocardiograms (ECGs) in phase I anticancer drug development: the MD Anderson Cancer Center experience with 8518 ECGs // Annals of Oncology. Elsevier, 2012. Vol. 23, № 11. P. 2960–2963. 40. Покатаев И.А. Консервативное лечение пациентов с местнораспространенным и метастатическим раком поджелудочной железы: Диссертация на соискание ученой степени доктора медицинских наук. Москва, 2020. 268 p. 41. Daly M. et al. Genetic/familial high-risk assessment: Breast and ovarian, version 2.2017: Featured updates to the NCCN guidelines // Journal of the National Comprehensive Cancer Network : JNCCN. 2017. Vol. 15. P. 9–20. 42. Emelyanova M. et al. Platinum-based chemotherapy for pancreatic cancer: impact of mutations in the homologous recombination repair and Fanconi anemia genes // Ther Adv Med Oncol. 2022. Vol. 14. P. 175883592210830. 43. Pishvaian M.J. et al. Outcomes in pancreatic adenocarcinoma (PDA) patients (pts) with genetic alterations in DNA damage repair (DDR) pathways: Results from the Know Your Tumor (KYT) program. // JCO. 2019. Vol. 37, № 4_suppl. P. 191–191. 44. Pishvaian M.J. et al. Overall survival in patients with pancreatic cancer receiving matched therapies following molecular profiling: a retrospective analysis of the Know Your Tumor registry trial // The Lancet Oncology. 2020. Vol. 21, № 4. P. 508–518. 45. Hu Z.I. et al. Evaluating Mismatch Repair Deficiency in Pancreatic Adenocarcinoma: Challenges and Recommendations // Clin Cancer Res. 2018. Vol. 24, № 6. P. 1326–1336. 46. Sokol E.S. et al. PARP Inhibitor Insensitivity to BRCA1/2 Monoallelic Mutations in Microsatellite Instability-High Cancers // JCO Precision Oncology. 2022. № 6. P. e2100531. 47. Qiu M. et al. Pathologic Diagnosis of Pancreatic Adenocarcinoma in the United States: Its Status and Prognostic Value // J Cancer. 2016. Vol. 7, № 6. P. 694–701. 48. Protocol for the Examination of Specimens From Patients With Carcinoma of the Pancreas [Electronic resource] // American Colledge of pathlogists. 2017. URL: https://www.cap.org (accessed: 07.03.2024). 49. Патютко Ю.И. Гепатопанкреатодуоденальная резекция - есть ли перспективы? // Хирургия. Журнал им. Н.И. Пирогова. 2011. № 8. P. 41–46. 50. Патютко Ю.И. Проксимальная и дистальная резекция поджелудочной железы с сохранением тела // Хирургия. Журнал им. Н.И. Пирогова. 2012. № 2. P. 70–73.
Информация
Список сокращений
ЖКТ – желудочно-кишечный тракт
КТ – компьютерная томография
МРТ – магнитно-резонансная томография
МСКТ – мультиспиральная компьютерная томография
ПЭТ/КТ – позитронная эмиссионная томография с туморотропными РФП, совмещенная с компьютерной томографией и в/в контрастированием
УЗИ – ультразвуковое исследование
ЧЧХС – чрескожная чреспеченочная холангиостомия
ЭКГ – электрокардиография
РХПГ – ретроградная холангиопанкреатография
МРХПГ – магнитно-резонансная холангиопанкреатография
Термины и определения
Pancreatic intraductal neoplasia (PanIN) – панкреатическая внутриэпителиальная неоплазия (ПанИн)
Mucinous cystic neoplasms (MCN) – муцинозная кистозная опухоль (МКО)
Intraductal papillary mucinous neoplasms (IPMNs) – внутрипротоковая папиллярная муцинозная опухоль (ВПМО).
FOLFIRINOX – режим химиотерапии – оксалиплатин** иринотекан** кальция фолинат** фторурацил** фторурацил**
mFOLFIRINOX – режим химиотерапии – оксалиплатин** иринотекан** кальция фолинат** фторурацил**
GEMCAP – режим химиотерапии – гемцитабин** капецитабин**
Критерии оценки качества медицинской помощи
|
№ |
Критерии качества |
Оценка выполнения |
|---|---|---|
|
1 |
Выполнена компьютерная томография органов брюшной полости и забрюшинного пространства с внутривенным болюсным контрастированием (A06.30.005.002) и/или магнитно-резонансная томография органов брюшной полости с внутривенным контрастированием (A05.30.005.001) и/или ультразвуковое исследование органов брюшной полости (комплексное) (A04.16.001) при невозможности проведения компьютерной томографии или магнитно-резонансной томографии (при установлении диагноза) |
Да/Нет |
|
2 |
Выполнено исследование уровня антигена аденогенных раков CA 19-9 в крови (при установлении диагноза) |
Да/Нет |
|
3 |
Выполнена компьютерная томография органов грудной полости (A06.09.005) (при установлении диагноза) |
Да/Нет |
|
4 |
Проведена профилактика инфекционных осложнений противомикробными препаратами системного действия при хирургическом вмешательстве (при отсутствии медицинских противопоказаний) |
Да/Нет |
|
5 |
Произведена рентгенологическая оценка резектабельности – компьютерная томография органов брюшной полости и забрюшинного пространства с внутривенным болюсным контрастированием (A06.30.005.002) при неметастатическом раке поджелудочной железы |
Да/Нет |
|
6 |
Выполнено патолого-анатомическое исследование биопсийного (операционного) материала поджелудочной железы (при хирургическом вмешательстве) |
Да/Нет |
|
7 |
Выполнен общий (клинический) анализ крови развернутый |
Да/Нет |
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
Покатаев И.А., д.м.н., руководитель службы химиотерапевтического лечения ГБУЗ «Городская клиническая онкологическая больница №1 ДЗМ», Москва
Алиева С.Б.., д.м.н., ведущий научный сотрудник отделения радиологического НИИ клинической и экспериментальной радиологии ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России
Галкин В.Н., главный врач ГБУЗ «Городская клиническая больница им. С.С. Юдина ДЗМ», Москва
Геворкян Т. Г., заместитель директора НИИ КЭР ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России.
Гладков О.А., профессор, д.м.н., ГАУЗ «Челябинский областной клинический центр онкологии и ядерной медицины», Челябинск
Загайнов В.Е., д.м.н., главный специалист по хирургии, заведующий кафедрой хирургических болезней ГБОУ ВПО НижГМА, Приволжский Окружной медицинский центр ФМБА России (ПОМЦ), Нижний Новгород
Карачун А.М., д.м.н., заведующий хирургическим отделением абдоминальной онкологи ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России
Кармазановский Г.Г., академик РАН, д.м.н., профессор, заведующий отделением рентгенологии и магнитно-резонансных исследований с кабинетом ультразвуковой диагностики ФГБУ «Национальный медицинский исследовательский центр хирургии им. А.В. Вишневского» Минздрава России
Комаров Ю.И., к.м.н., заместитель директора по организационно-методической работе ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России
Кригер А.Г., д.м.н., профессор, главный научный сотрудник ФГБУ "Российский научный центр рентгенорадиологии" Минздрава России, Москва
Кудашкин Н.Е., к.м.н., старший научный сотрудник онкологического отделения хирургических методов лечения №7 опухолей гепатопанкреатобилиарной зоны ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России
Кучин Д.М., к.м.н., врач-онколог, ФБУЗ «Приволжский Окружной медицинский центр ФМБА России (ПОМЦ)», Нижний Новгород
Лебедев К.К., к.м.н., онколог хирургического отделения абдоминальной онкологи ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России;
Лукьянченко А.Б., д.м.н., ведущий научный сотрудник рентгенодиагностического отделения ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России, Москва
Лядов В.К., д.м.н., заведующий онкологическим отделением №4 ГБУЗ «Городская клиническая больница им. С.С. Юдина ДЗМ», Москва
Малихова О.А., д.м.н., профессор кафедры Онкологии и паллиативной медицины РМАНПО, зав отделением эндоскопии ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России, Москва
Мороз Е.А., старший научный сотрудник патологоанатомического отделения отдела морфологической и молекулярно-генетической диагностики опухолей ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России, Москва
Обухова О.А., к.м.н., заведующая отделением медицинской реабилитации ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России
Патютко Ю.И., д.м.н., профессор, ведущий научный сотрудник отделением хирургическим №7 опухолей печени и поджелудочной железы ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России
Подлужный Д.В., к.м.н., заведующий отделением хирургическим №7 опухолей печени и поджелудочной железы ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России
Ткаченко Е.В., к.м.н., заведующая отделением краткосрочной химиотерапии ФГБУ «НМИЦ онкологии им. Н. Н. Петрова» Минздрава России
Трякин А.А., д.м.н., заведующий онкологическим отделением лекарственных методов лечения (химиотерапевтического) №2 ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России
Тулин П.Е., к.м.н., старший научный сотрудник отделения отделения позитронной эмиссионной томографии ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России
Фадеева Н.В., к.м.н., заведующая отделением противоопухолевой лекарственной терапии ГБУЗ «Челябинский областной клинический центр онкологии и ядерной медицины», главный внештатный химиотерапевт Министерства здравоохранения Челябинской области
Федянин М.Ю., д.м.н., руководитель службы химиотерапевтического лечения ММКЦ «Коммунарка», старший научный сотрудник онкологического отделения лекарственных методов лечения (химиотерапевтического) №2 ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России
Юричев И.Н., к.м.н., врач-эндоскопист, клинический госпиталь Лапино-1 «Мать и дитя», Московская область
Невольских А. А., д.м.н., заместитель директора по лечебной работе МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России.
Иванов С. А., профессор РАН, д.м.н., директор МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России.
Хайлова Ж. В., к.м.н., заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России.
Черных М.В., к.м.н., заместитель директора по радиологическим методам лечения НИИ клинической онкологии, заведующая отделением радиотерапии, ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России
Конфликта интересов нет.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
Врачи-онкологи;
Врачи-хирурги;
Врачи-радиологи;
Врачи-рентгенологи;
Врачи-генетики;
Студенты медицинских ВУЗов, ординаторы и аспиранты.
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных; анализ современных научных разработок по проблеме РБ в РФ и за рубежом; обобщение практического опыта российских и зарубежных специалистов.
Таблица П1 – Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
|
УДД |
Расшифровка |
|---|---|
|
1. |
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
|
2. |
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
|
3. |
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
|
4. |
Несравнительные исследования, описание клинического случая |
|
5. |
Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица П2 – Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
|
УДД |
Расшифровка |
|---|---|
|
1. |
Систематический обзор рандомизированных клинических исследований с применением мета-анализа |
|
2. |
Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
|
3. |
Нерандомизированные сравнительные исследования, в том числе когортные исследования |
|
4. |
Несравнительные исследования, описание клинического случая или серии случаев, исследование «случай-контроль» |
|
5. |
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица П3 – Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
|
УУР |
Расшифровка |
|---|---|
|
А |
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
|
В |
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
|
С |
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Методы, использованные для формулирования рекомендаций – консенсус экспертов.
Экономический анализ
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций:
-
Внешняя экспертная оценка
-
Внутренняя экспертная оценка
Описание метода валидизации рекомендаций:
Настоящие рекомендации в предварительной версии рецензированы независимыми экспертами, которые попросили прокомментировать, прежде всего, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Получены комментарии со стороны врачей-детских онкологов первичного звена в отношении доходчивости изложения рекомендаций и их оценки важности рекомендаций как рабочего инструмента повседневной практики.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультации и экспертная оценка: Проект рекомендаций рецензирован также независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Для окончательной редакции и контроля качества рекомендации повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Обновления клинических рекомендаций: актуализация проводится не реже чем один раз в три года с учетом появившейся новой информации о диагностике и тактике ведения пациентов с РБ. Решение об обновлении принимает МЗ РФ на основе предложений, представленных медицинскими профессиональными некоммерческими организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
При отборе публикаций, как потенциальных источников доказательств, использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее достоверности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что в свою очередь влияет на силу, вытекающих из нее рекомендаций.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Актуальные инструкции к лекарственным препаратам, упоминаемым в данных клинических рекомендациях, можно найти на сайте http://grls.rosminzdrav.ru.
Приложение Б. Алгоритмы действий врача
Схема 1. Блок-схема диагностики и лечения пациента раком поджелудочной железы
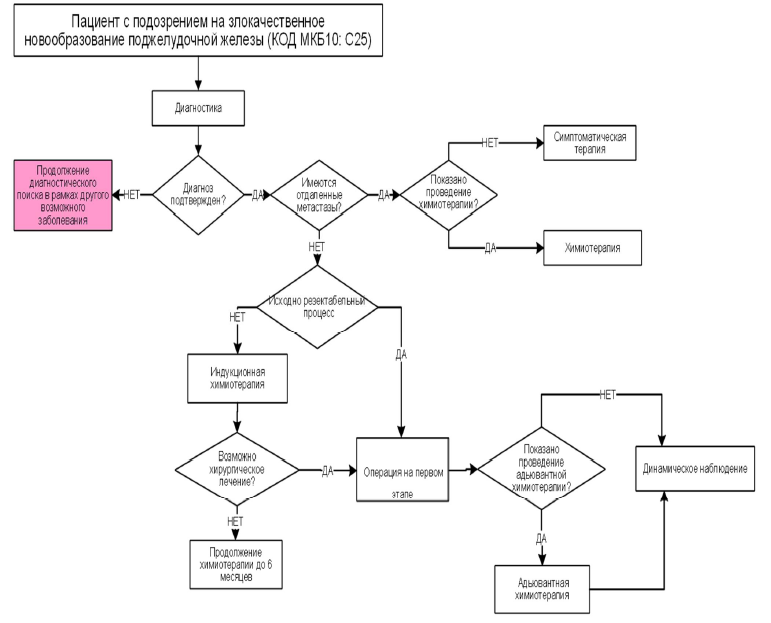
Приложение В. Информация для пациента
Информация для пациентов о диагностике, лечении и профилактике рака поджелудочной железы представлена на страницах профессиональных сообществ пациентов, например: http://www.russcpa.ru/patsientam/
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG [202]
Название на русском языке: Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG
Оригинальное название: The Eastern Cooperative Oncology Group/World Health Organization Performance Status (ECOG/WHO PS)
Источник (официальный сайт разработчиков, публикация с валидацией): https://ecog-acrin.org/resources/ecog-performance-status
Oken MM, Creech RH, Tormey DC, Horton J, Davis TE, McFadden ET, Carbone PP: Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982, 5(6):649-655
Тип: шкала оценки
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т. д.).
Содержание:
|
Балл |
Описание |
|---|---|
|
0 |
Пациент полностью активен, способен выполнять все, как и до заболевания (90-100% по шкале Карновского) |
|
1 |
Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу, 70-80% по шкале Карновского) |
|
2 |
Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени бодрствования проводит активно – в вертикальном положении (50-60% по шкале Карновского) |
|
3 |
Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования (30-40% по шкале Карновского) |
|
4 |
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели (10-20% по шкале Карновского) |
|
5 |
Пациент мертв |
Ключ (интерпретация): приведен в самой шкале
Приложение Г2. Критерии оценки ответа опухоли на лечение (RECIST 1.1)
Название на русском языке: Критерии оценки ответа опухоли на химиотерапевтическое лечение (RECIST 1.1)
Оригинальное название: Response evaluation criteria in solid tumors 1.1
Источник (официальный сайт разработчиков, публикация с валидацией):
Оригинальная публикация: Eisenhauer EA, Therasse P, Bogaerts J, Schwartz LH, Sargent D, Ford R, Dancey J, Arbuck S, Gwyther S, Mooney M et al: New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer 2009, 45(2):228-247
Тип: шкала оценки
Назначение: оценка ответа на химиотерапевтическое лечение
Содержание, ключ и шаблон на русском языке представлены в методических рекомендациях №46 ГБУЗ «Научно-практический центр медицинской радиологии» департамента здравоохранения города Москвы и доступны на веб-сайте http://medradiology.moscow/d/1364488/d/no46_2018_recist_11.pdf [203]. Данный документ является собственностью Департамента здравоохранения города Москвы, не подлежит тиражированию и распространению без соответствующего разрешения.
Приложение Г3. Критерии оценки терапевтического эффекта предоперационной терапии в операционном материале
Название на русском языке: Критерии оценки терапевтического эффекта предоперационной терапии в операционном материале
Оригинальное название: Protocol for the Examination of Specimens From Patients With Carcinoma of the Pancreas (version Panc.Exo_4.2.0.2.REL_CAPC)[48]
Источник (официальный сайт разработчиков, публикация с валидацией): Burgart LJ, Shi C, Adsay NV, et al. Protocol for the Examination of Specimens From Patients With Carcinoma of the Pancreas 2020. Available at: https://www.cap.org/protocols-and-guidelines/cancer-reporting-tools/cancer-protocol-templates.
Тип: шкала оценки
Назначение: оценка патоморфологического ответа на предоперационное лечение
Содержание:
- Score 0 – клетки аденокарциномы отсутствуют, полный терапевтический эффект;
- Score 1 – присутствуют единичные клетки и группы клеток остаточной аденокарциномы, выраженный терапевтический эффект;
- Score 2 – выявляется остаточная опухоль с признаками регрессии с наличием как единичных, так и групп клеток аденокарциномы, частичный терапевтический эффект;
- Score 3 – остаточная опухоль без признаков терапевтического ответа
Ключ (интерпретация), пояснения: приведены в самой шкале
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.