Рак гортани
 Версия: Клинические рекомендации РФ 2024 (Россия)
Версия: Клинические рекомендации РФ 2024 (Россия)
Злокачественное новообразование гортани (C32), Новообразование неопределенного или неизвестного характера гортани (D38.0)
Онкология
Общая информация
Краткое описание
Разработчик клинической рекомендации
- Ассоциация онкологов России
- Общероссийская общественная организация «Российское общество клинической онкологии»
- Общероссийская общественная организация "Российское общество специалистов по опухолям головы и шеи"
- Общероссийская общественная организация «Федерация специалистов по лечению заболеваний головы и шеи»
- Некоммерческая организация "Ассоциация онкологических организаций Сибири и Дальнего Востока
Одобрено Научно-практическим Советом Минздрава РФ
В соответствии с Правилами поэтапного перехода медицинских организаций к оказанию медицинской помощи на основе клинических рекомендаций, разработанных и утвержденных в соответствии с частями 3, 4, 6 –9 и 11 статьи 37 Федерального закона «Об основах охраны здоровья граждан в Российской Федерации», утвержденных постановлением Правительства Российской Федерации от 19.11.2021 № 1968 с изменения, клинические рекомендации применяются следующим образом:
– размещенные в Рубрикаторе после 1 января 2024 года – с 1 января 2025 года.
Клинические рекомендации
Рак гортани
Год утверждения (частота пересмотра): 2024
Возрастная категория: Взрослые
Пересмотр не позднее: 2026
ID: 475
Определение заболевания или состояния (группы заболеваний или состояний)
Рак гортани – злокачественная опухоль, развивающаяся из элементов неороговевающего эпителия гортани [1].
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Кодирование по МКБ-10
Злокачественное новообразование гортани - C32
С32.0 Злокачественное новообразование собственно голосового аппарата
C32.1 Злокачественное новообразование над собственно голосовым аппаратом
С32.2 Злокачественное новообразование под собственно голосовым аппаратом
С32.3 Злокачественное новообразование хрящей гортани
С32.8 Злокачественное новообразование, выходящее за пределы одной и более вышеуказанных локализаций
С32.9 Злокачественное образование гортани неуточненное
Новообразование неопределенного или неизвестного характера среднего уха, органов дыхания и грудной клетки - D38
D38.0 - гортани
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
Степень распространенности эпителиальных злокачественных опухолей гортани представлена в классификации TNM (международная классификация стадий развития раковых опухолей) 8-го издания в редакции AJCC (Американский объединенный комитет по раку (American Joint Committee on Cancer)).
Клиническая классификация TNM
Символ Т содержит следующие градации:
– Tx Недостаточно данных для оценки первичной опухоли;
– T0 Первичная опухоль не определяется;
– Tis Преинвазивная карцинома (сarcinoma in situ).
Надскладочный отдел:
– Т1 Опухоль ограничена одной анатомической областью надсвязочной части, подвижность голосовых связок сохранена;
– Т2 Опухоль поражает слизистую оболочку нескольких анатомических частей надсвязочной или связочной областей или область вненадсвязочной части (слизистую оболочку корня языка, язычно-надгортанное углубление, медиальную стенку грушевидного синуса) без фиксации гортани;
– Т3 Опухоль ограничена гортанью с фиксацией голосовых связок и/или распространяется на заднюю область гортанного хряща, преднадгортанную ткань; минимальная эрозия щитовидного хряща;
– Т4a Опухоль прорастает в щитовидный хрящ и/или распространяется на ткани вокруг гортани: трахею, мягкие ткани шеи, включая глубокие/наружные мышцы языка, лентовидные мышцы, щитовидную железу, пищевод;
– Т4b Опухоль прорастает в предпозвоночное пространство, структуры средостения или оболочку сонной артерии.
Складочный отдел:
– Т1 Опухоль ограничена голосовыми связками (без нарушения подвижности может быть вовлечена передняя или задняя комиссуры);
– Т1a Опухоль ограничена одной связкой;
– Т1b Опухоль распространяется на обе связки;
– Т2 Опухоль распространяется на надсвязочную и/или подсвязочную области с нарушением подвижности голосовых связок;
– Т3 Опухоль ограничена гортанью с фиксацией голосовых связок и/или прорастает в надсвязочное пространство, и/или вызывает небольшую эрозию щитовидного хряща;
– Т4a Опухоль прорастает в щитовидный хрящ или ткани вокруг гортани: трахею, мягкие ткани шеи, включая глубокие/наружные мышцы языка, лентовидные мышцы, щитовидную железу, пищевод;
– Т4b Опухоль прорастает в предпозвоночное пространство, структуры средостения или оболочку сонной артерии.
Подскладочный отдел:
– Т1 Опухоль ограничена подсвязочной частью;
– Т2 Опухоль распространяется на одну или обе голосовые связки со свободной или ограниченной подвижностью;
– Т3 Опухоль ограничена гортанью с фиксацией связок и/или вызывает эрозию щитовидного хряща;
– Т4a Опухоль прорастает в перстневидный или щитовидный хрящ и/или распространяется на ткани вокруг гортани: трахею, мягкие ткани шеи, включая глубокие/наружные мышцы языка, лентовидные мышцы, щитовидную железу, пищевод;
– Т4b Опухоль прорастает в предпозвоночное пространство, структуры средостения или оболочку сонной артерии.
Символ N указывает на наличие или отсутствие метастазов в регионарных лимфатических узлах (ЛУ):
– Nx Недостаточно данных для оценки регионарных ЛУ;
– N0 Нет признаков метастатического поражения регионарных ЛУ;
– N1 Метастаз в одном ЛУ на стороне поражения ≤3 см в наибольшем измерении, экстракапсулярная инвазия (ENE) отсутствует;
– N2 Метастаз в одном ЛУ на стороне поражения ≤3 см и ENE+, ˃3 см, но менее 6 см в наибольшем измерении и ENE–; или метастазы в нескольких ЛУ шеи на стороне поражения до 6 см в наибольшем измерении и ENE–; или метастазы в ЛУ шеи с обеих сторон или с противоположной стороны до 6 см в наибольшем измерении и ENE–;
– N2a Метастаз в одном ЛУ на стороне поражения ≤3 см и ENE+; или ˃3 см, но менее 6 см в наибольшем измерении и ENE–;
– N2b Метастазы в нескольких ЛУ на стороне поражения до 6см в наибольшем измерении и ENE-;
– N2c Метастазы в ЛУ с обеих сторон или с противоположной стороны до 6 см в наибольшем измерении и ENE–;
– N3 Метастаз в ЛУ более 6 см в наибольшем измерении и ENE–; или метастаз в одном ипсилатеральном ЛУ >3 см и ENE+; или множественные ипсилатеральные, контралатеральные или билатеральные метастазы с ENE+; или единственный контралатеральный метастаз любого размера ENE+;
– N3a Метастаз в ЛУ более 6 см в наибольшем измерении и ENE–;
– N3b Метастаз в одном ипсилатеральном ЛУ >3 см и ENE+; или множественные ипсилатеральные, контралатеральные или билатеральные метастазы с ENE+; или единственный контралатеральный метастаз любого размера и ENE+;
Символ М характеризует наличие или отсутствие отдаленных метастазов:
– Mx Недостаточно данных для определения отдаленных метастазов;
– М0 Нет признаков отдаленных метастазов;
– М1 Имеются отдаленные метастазы.
Таблица 1. Группировка по стадиям
| Стадия | Т | N | M |
|---|---|---|---|
| 0 | Tis | N0 | M0 |
| I | T1 | N0 | M0 |
| II | T2 | N0 | M0 |
| III |
T1 T2 T3
T3
|
N1
N0
|
M0
M0
|
| IVА |
T1, Т2, Т3
T4
|
N2
N0, N1, N2
|
M0
M0
|
| IVB |
T4b
Любая T
|
Любая N
N3
|
M0
M0
|
| IVC | Любая T | Любая N | M1 |
Степень дифференцировки:
– Gx Не может быть оценена;
– G1 Высокодифференцированный;
– G2 Умеренно-дифференцированный;
– G3 Низкодифференцированный.
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
В большинстве случаев в анамнезе пациентов отмечается длительный период курения, употребления алкоголя, работы в условиях повышенной запыленности (текстильное производство), вдыхание вредных канцерогенных веществ (нефти, продуктов ее перегонки, бензола, фенольных смол, асбеста). Высокий риск озлокачествления отмечается при папилломах (рак, ассоциированный с вирусом папилломы человека (ВПЧ)), рецидивирующем папилломатозе, пахидермии, дискератозе. Кроме этого, к факторам риска относятся хронические воспалительные процессы (ларингиты) [1].
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Стандартизованный показатель заболеваемости раком гортани в России в 2019 г. составил 31,1 случай на 100 тыс. населения, а уровень летальности составил 7,2% [Каприн, А.Д. Состояние онкологической помощи населению России в 2019 году / А.Д. Каприн, В.В. Старинский, А.О. Шахзадова. – Москва: МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2020. – 239 с. – ISBN 978-5-85502-255-1.
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Наиболее частыми клиническими симптомами рака гортани являются изменение тембра голоса, осиплость, поперхивания [1].
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Диагноз устанавливается на основании:
- анамнестических данных, а именно наличия новообразования;
- физикального обследования, включающего тщательный клинический осмотр, пальпацию образования и прилежащих тканей и регионарных ЛУ;
- цитологического исследования соскоба, мазков, пунктата из первичной опухоли, пунктата из увеличенных или подозрительных ЛУ;
- патолого-анатомического исследование биопсийного (операционного) материала;
- инструментального обследования, включая фиброларингоскопию, пункцию узловых образований в мягких тканях шеи под контролем ультразвукового исследования (УЗИ) мягких тканей и ЛУ шеи, компьютерную томографию (КТ)/магнитно-резонансную томографию (МРТ), позитронно-эмиссионную томографию, совмещенную с КТ (ПЭТ/КТ) [3].
1. Жалобы и анамнез
- Рекомендуется при сборе анамнеза у пациентов с предполагаемой опухолью гортани с целью диагностики заболевания обращать внимание на следующие клинические симптомы:
- стойкое нарушение голосовой функции в виде осиплости, редко кашель. Если процесс перекрывает просвет гортани, могут присоединиться явления затруднения дыхания; постоянный кашель, боль в горле, не проходящая на фоне антибактериального, протиововоспалительного лечения;
- увеличение шейных лимфатических узлов [1]
- Наличие новообразований на шее.
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
2. Физикальное обследование
- Рекомендуется у пациентов с предполагаемой опухолью гортани при физикальном осмотре с целью планирования дальнейшего обследования обращать внимание на следующие клинические симптомы:
- изменение контуров шеи;
- увеличение регионарных ЛУ;
- изменение подвижности, ширины остова гортани [1].
Уровень убедительности рекомендаций – C(уровень достоверности доказательств
3. Лабораторные диагностические исследования
Специфических лабораторных диагностических исследований не предусмотрено. Лабораторные диагностические исследования проводятся на усмотрение врача-онколога в объеме, обеспечивающем эффективное и безопасное лечение пациента. Для пациентов с распространенными стадиями, не предусматривающими только локальное лечение, показано исследование уровня экспрессии PD-L1 в опухолевых (TPS; %) и иммунных клетках с расчетом комбинированного показателя (CPS).
4. Инструментальные диагностические исследования
- Рекомендуется всем пациентам с подозрением на рак гортани проведение фиброларингоскопии с последующим патолого-анатомическим исследованием биопсийного (операционного) материала, цитологическим исследованием отпечатков, мазков с поверхности слизистой оболочки верхних дыхательных путей с целью определения распространенности и верификации опухоли [3]. При повторных неинформативных биопсиях, при наличии клинико-рентгенологических данных о наличии злокачественного процесса, показано проведение видеофиброларингоскопии с биопсией в условиях общей анестезии.
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
- Рекомендуется всем пациентам при раке гортани выполнить УЗИ ЛУ шеи с пункцией подозрительных ЛУ c целью уточнения распространенности заболевания и планирования лечения [4].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
- Рекомендуется выполнить КТ органов грудной полости с внутривенным (в/в) болюсным контрастированием или без него при распространенном раке гортани с поражением регионарных ЛУ в целях выявления отдаленных метастазов [3, 5, 6].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
- Рекомендуется выполнить позитронную эмиссионную томографию костей, совмещенную с компьютерной томографией всего тела (ПЭТ/КТ) с флудезоксиглюкозой [18F] при стадиях III–IV в целях исключения наличия отдаленных метастазов, а
- Рекомендуется также для оценки эффективности лечения, в том числе для подтверждения полной резорбции регионарных метастазов после ЛТ/химиолучевой терапии (ХЛТ) и решения вопроса об отказе от лимфаденэктомии (в случае консервативного лечения на 1-м этапе) и по индивидуальным показаниям [7].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2)
- Рекомендуется пациентам с при раке гортани выполнить КТ или МРТ мягких тканей шеи , и головного мозга с в/в контрастированием в случае подозрения распространения опухоли на хрящи гортани, основание черепа, и магистральные сосуды шеи [3, 6].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: В случае отсутствия противопоказаний и при подозрении на переход опухоли на гортаноглотку/пищевод выполнение МРТ шеи с внутривенным контрастированием целесообразно при планировании проведения ЛТ/ХЛТ [3, 8].
5. Иные диагностические исследования
- Рекомендуется при проведении хирургического лечения проводить патолого-анатомическое исследование операционного материала (исследование хирургически удаленного опухолевого препарата) с целью уточнения гистологического строения опухоли, радикальности хирургического лечения и определения дальнейшей тактики лечения [3].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: в заключении необходимо отразить следующие параметры:
- размер опухоли;
- глубина инвазии опухоли;
- гистологическое строение опухоли;
- степень дифференцировки опухоли;
- наличие лимфоваскулярной, периневральной инвазии (отрицательный результат также должен быть констатирован);
- рТ;
- рN (с указанием общего числа исследованных и пораженных ЛУ, признаков экстранодального распространения опухоли);
- наличие поражения краев резекции (отрицательный результат также должен быть констатирован).
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Складочный отдел гортани
Карцинома in situ
- Всем пациентам с карциномой in situ рекомендована эндоларингеальная резекция (удаление новообразования гортани с помощью СО2 лазера (предпочтительно) или ЛТ с целью повышения выживаемости и сохранения голосовой функции [9].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
T1, T2, N0
- Рекомендована ЛТ в самостоятельном варианте или резекция гортани (эндоскопическая (удаление новообразования гортани с помощью СО2 лазера) или открытая) с целью повышения выживаемости и сохранения голосовой функции [10].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
Комментарий: при наличии неблагоприятных прогностических факторов (НПФ) – микроскопическая остаточная опухоль в крае резекции (R1) показана ререзекция (если возможна), при невозможности – адьювантная ЛТ. Показанием для проведения послеоперационной ЛТ также является наличие следующих НПФ: периневральная, периваскулярная, перилимфатическая инвазия, pN2–3. Показанием для проведения послеоперационной одновременной ХЛТ является наличие ENE+ изолированно или в комплексе с другими НПФ [3].
T1–2, N+
- При раке гортани стадии T1–2, N+ рекомендована конкурентная ХЛТ или резекция гортани (эндоскопическая операция: удаление новообразования гортани с помощью СО2 лазера или открытая) с односторонней или двусторонней шейной лимфодиссекцией с целью увеличения показателей выживаемости и сохранения голосовой функции [9].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарий: после хирургического лечения дальнейшую тактику лечения определяют в зависимости от наличия/отсутствия НПФ по данным планового патологоанатомического исследования операционного материала. Отсутствие НПФ и pN0-статус не требуют дополнительного лечения, целесообразно динамическое наблюдение. Показанием для проведения послеоперационной ЛТ/ХЛТ является наличие следующих НПФ: периневральная, периваскулярная, перилимфатическая инвазия, pN+. При наличии только НПФ R1 показана ререзекция (если возможна), при невозможности – конкурентная ХЛТ. Наличие ENE+ изолированно или в комплексе с другими НПФ – показание для проведения конкурентной ХЛТ [3].
При полной/частичной регрессии первичного очага после индукционной ХТ (по данным КТ или МРТ с в/в контрастированием первичной опухоли и шеи, фиброларингоскопии, УЗИ шеи) целесообразна самостоятельная ЛТ или ХЛТ. При регрессии опухоли в пределах стабилизации или менее целесообразно хирургическое лечение с последующим решением вопроса о показаниях к проведению ХЛТ [9].
При наличии остаточной опухоли и/или метастатических ЛУ после окончания ЛТ/ХЛТ целесообразно хирургическое лечение. В случае полной регрессии после использования консервативных методов лечения показано динамическое наблюдение [3].
Т3, N0
- При раке гортани T3N0 пациентам рекомендована конкурентная ХЛТ с целью повышения выживаемости и сохранения голосовой функции [11].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Комментарии: При полной/частичной регрессии (согласно критериям ВОЗ), первичного очага после индукционной ХТ (по данным КТ или МРТ с в/в контрастированием первичной опухоли и шеи, фиброларингоскопии, УЗИ шеи) целесообразна самостоятельная ЛТ или ХЛТ. При регрессии опухоли в пределах стабилизации или менее 50% целесообразно хирургическое лечение с последующим решением вопроса о показаниях к проведению ХЛТ. При наличии остаточной опухоли и/или метастатических ЛУ после окончания ЛТ/ХЛТ целесообразно хирургическое лечение. В случае полной регрессии после использования консервативных методов лечения показано динамическое наблюдение [3].
- При раке гортани T3N0 пациентам рекомендована индукционная ХТ c целью сохранения органа и повышения выживаемости [12]
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Комментарии: При полной/частичной регрессии (согласно критериям ВОЗ) первичного очага после индукционной ХТ (по данным КТ или МРТ с в/в контрастированием первичной опухоли и шеи, фиброларингоскопии, УЗИ шеи) целесообразна самостоятельная ЛТ или ХЛТ. При регрессии опухоли в пределах стабилизации или менее 50%, целесообразно хирургическое лечение с последующим решением вопроса о показаниях к проведению ХЛТ. При наличии остаточной опухоли и/или метастатических ЛУ после окончания ЛТ/ХЛТ целесообразно хирургическое лечение. В случае полной регрессии после использования консервативных методов лечения показано динамическое наблюдение [3].
- При раке гортани T3N0 пациентам хирургическое лечение в объеме ларингэктомии с резекцией щитовидной железы на стороне поражения, пре- и ипсилатеральной паратрахеальной лимфодиссекцией с целью повышения выживаемости [9].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: в отдельных случаях, рассматриваемых в индивидуальном порядке, при отсутствии эрозии щитовидного хряща возможно выполнение органосохраняющей трансоральной лазерной резекции или открытой резекции.
После хирургического лечения дальнейшую тактику лечения определяют в зависимости от наличия/отсутствия НПФ по данным ПГИ. Отсутствие НПФ и pN0-статус не требуют дополнительного лечения, целесообразно динамическое наблюдение. Показанием для проведения послеоперационной ХЛТ является наличие следующих НПФ: периневральная, периваскулярная, перилимфатическая инвазия, pN+. При наличии только НПФ R1 показана ререзекция (если возможна), при невозможности – конкурентная ХЛТ. Наличие ENE+ изолированно или в комплексе с другими НПФ – показание для проведения конкурентной ХЛТ. При наличии 2 и более НПФ – показано проведение ХЛТ. При наличии 1 НПФ -показано проведение ЛТ. При наличии pN2 – показано проведение ХЛТ. [3].
Т3, N+
- При раке гортани T3N+ пациентам рекомендована одномоментная ХЛТ с целью повышения выживаемости и сохранения голосовой функции [11].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Комментарии: При полной/частичной регрессии (согласно критериям ВОЗ) первичного очага после индукционной ХТ (по данным КТ или МРТ с в/в контрастированием первичной опухоли и шеи, фиброларингоскопии, УЗИ шеи) целесообразна самостоятельная ЛТ или ХЛТ. При регрессии опухоли в пределах стабилизации или менее 50 % целесообразно хирургическое лечение с последующим решением вопроса о показаниях к проведению ХЛТ. При наличии остаточной опухоли и/или метастатических ЛУ после окончания ЛТ/ХЛТ целесообразно хирургическое лечение. В случае полной регрессии после использования консервативных методов лечения показано динамическое наблюдение [3].
- При раке гортани T3N+ пациентам рекомендована индукционная ХТ с последующей ХЛТ c целью сохранения органа [12]
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Комментарии: при полной/частичной регрессии (согласно критериям ВОЗ) первичного очага после индукционной ХТ (по данным КТ или МРТ с в/в контрастированием первичной опухоли и шеи, фиброларингоскопии, УЗИ шеи) целесообразна самостоятельная ЛТ или ХЛТ. При регрессии опухоли в пределах стабилизации или менее 50% целесообразно хирургическое лечение с последующим решением вопроса о показаниях к проведению ХЛТ. При наличии остаточной опухоли и/или метастатических ЛУ после окончания ЛТ/ХЛТ целесообразно хирургическое лечение. В случае полной регрессии после использования консервативных методов лечения показано динамическое наблюдение [3].
- При раке гортани T3N+ пациентам рекомендовано хирургическое лечение в объеме ларингэктомии с гемитиреоидэктомией/тиреоидэктомией на стороне поражения, пре- и ипсилатеральной паратрахеальной лимфодиссекцией, а также шейная лимфаденэктомия на стороне поражения с целью повышения выживаемости [9].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: в отдельных случаях, рассматриваемых в индивидуальном порядке, при отсутствии эрозии щитовидного хряща возможно выполнение органосохраняющей трансоральной лазерной резекции, либо открытой резекции гортани.
После хирургического лечения дальнейшую тактику лечения определяют в зависимости от наличия/отсутствия НПФ по данным ПГИ. Отсутствие НПФ и pN0-статус не требуют дополнительного лечения, целесообразно динамическое наблюдение. Показанием для проведения послеоперационной ХЛТ является наличие следующих НПФ: периневральная, периваскулярная, перилимфатическая инвазия, pN+. При наличии только НПФ R1 показана ререзекция (если возможна), при невозможности – конкурентная ХЛТ. Наличие ENE+ изолированно или в комплексе с другими НПФ – показание для проведения конкурентной ХЛТ. При наличии 2 и более НПФ – показано проведение ХЛТ. При наличии 1 НПФ -показано проведение ЛТ. При наличии pN2 – показано проведение ХЛТ. [3].
Т4a, любая N
- При раке гортани T4aNлюбая рекомендовано хирургическое лечение в объеме ларингэктомии с тиреоидэктомией, пре- и ипсилатеральной паратрахеальной лимфодиссекцией, односторонней или двусторонней шейной лимфодиссекцией с целью повышения выживаемости [13].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарий: После хирургического лечения дальнейшую тактику лечения определяют в зависимости от наличия/отсутствия НПФ по данным ПГИ. Отсутствие НПФ и pN0-статус не требуют дополнительного лечения, целесообразно динамическое наблюдение. Показанием для проведения послеоперационной ХЛТ является наличие следующих НПФ: периневральная, периваскулярная, перилимфатическая инвазия, pN+. При наличии только НПФ R1 показана ререзекция (если возможна), при невозможности – конкурентная ХЛТ. Наличие ENE+ изолированно или в комплексе с другими НПФ – показание для проведения конкурентной ХЛТ. При наличии 2 и более НПФ – показано проведение ХЛТ. При наличии 1 НПФ -показано проведение ЛТ. При наличии pN2 – показано проведение ХЛТ. [3].
Отдельные пациенты со стадией Т4a, которые отказались от операции
- При раке гортани T4a рекомендована синхронная ХЛТ или индукционная полихимиотерапия (ПХТ) с последующей ХЛТ, с последующей оценкой эффекта с целью повышения выживаемости пациента [3].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарий: при полной/частичной регрессии (согласно ВОЗ) первичного очага после индукционной ХТ (по данным КТ или МРТ с в/в контрастированием первичной опухоли и шеи, фиброларингоскопии, УЗИ шеи) целесообразна самостоятельная ХЛТ. При регрессии опухоли в пределах стабилизации или менее 50% целесообразно хирургическое лечение с последующим решением вопроса о показаниях к проведению ХЛТ.
При наличии остаточной опухоли и/или метастатических ЛУ после окончания ХЛТ целесообразно хирургическое лечение. В случае полной регрессии после использования консервативных методов лечения показано динамическое наблюдение [3].
T4b, любая N, неоперабельные регионарные метастазы, M1 или пациенты, не подходящие для оперативного лечения
- При оценке общего состояния пациента по шкале оценки общего состояния онкологического пациента по версии Восточной объединенной группы онкологов (ECOG) (см. Приложение Г) 0–1 пациентам со злокачественной опухолью гортани cтадии T4b любаяN, или с неоперабельными регионарными метастазами, отдаленными метастазами M1 или пациентам, не подходящим для оперативного лечения, рекомендовано рассмотреть вопрос о проведении лекарственной терапии (в отдельных случаях возможно рассмотреть ХЛТ) с целью повышения выживаемости, или симптоматическое лечение с целью облегчения симптомов болезни [3].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
- Пациентам со злокачественной опухолью гортани cтадии T4bлюбаяN, или с неоперабельными регионарными метастазами отдаленными метастазами M1 или пациентам, не подходящим для оперативного лечения, при оценке общего состояния пациента по шкале ECOG 2 (см. Приложение Г) рекомендована лекарственная терапия [3].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
- Пациентам со злокачественной опухолью cтадии T4bлюбаяN, или с неоперабельными регионарными метастазы, отдаленными метастазами M1 или пациентам, не подходящим для оперативного лечения при оценке общего состояния пациента по шкале ECOG 3 (см. Приложение Г) рекомендовано симптоматическое лечение [3].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарий: После выполнения ХЛТ по радикальной программе оценку эффекта лечения необходимо проводить не ранее, чем через 2-3 месяца.
2. Надскладочный отдел гортани
T1, T2, N0-1
- Пациентам с раком гортани T1-2N0-1 рекомендована резекция гортани (эндоскопическая или открытая) с целью повышения выживаемости и снижения токсичности лечения [14].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
- Пациентам с раком гортани T1-2N0 рекомендована ЛТ в самостоятельном варианте с целью повышения выживаемости [3].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 3).
Комментарий: ввиду высокого риска регионарного метастазирования операцию на первичном очаге целесообразно дополнять односторонней или двусторонней шейной лимфодиссекцией. При наличии НПФ R1 показана ререзекция (если возможна), при невозможности – адъювантная ХЛТ.
Показанием для проведения послеоперационной ЛТ также является наличие следующих НПФ: периневральная, периваскулярная, перилимфатическая инвазия., Показанием для проведения послеоперационной одновременной ХЛТ является наличие ENE+ изолированно или в комплексе с другими НПФ [3].
Показанием для проведения послеоперационной ЛТ также является наличие следующих НПФ: периневральная, периваскулярная, перилимфатическая инвазия., Показанием для проведения послеоперационной одновременной ХЛТ является наличие ENE+ изолированно или в комплексе с другими НПФ [3].
T1, T2, N2-3
- Пациентам при раке гортани T1-2N2-3 рекомендована одномоментная ХЛТ или индукционная ХТ с последующей ХЛТ, или резекция гортани (эндоскопическая или открытая) с односторонней или двусторонней шейной лимфодиссекцией с целью повышения выживаемости [15]
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарий: после хирургического лечения дальнейшую тактику лечения проводят в зависимости от наличия/отсутствия НПФ по данным ПГИ. Отсутствие НПФ и pN0-статус не требуют дополнительного лечения, целесообразно динамическое наблюдение. Показанием для проведения послеоперационной ХЛТ является наличие следующих НПФ: периневральная, периваскулярная, перилимфатическая инвазия, pN+. При наличии только НПФ R1 показана ререзекция (если возможна), при невозможности – одновременная ХЛТ. Наличие ENE+ изолированно или в комплексе с другими НПФ – показание для проведения синхронной ХЛТ.
При полной/частичной регрессии (согласно критериям ВОЗ)первичного очага после индукционной ХТ (по данным КТ или МРТ с в/в контрастированием первичной опухоли и шеи, фиброларингоскопии, УЗИ шеи) целесообразна самостоятельная ЛТ или ХЛТ. При регрессии опухоли в пределах стабилизации или менее 50% целесообразно хирургическое лечение с последующим решением вопроса о показаниях к проведению ЛТ/ХЛТ.
При наличии остаточной опухоли и/или метастатических ЛУ после окончания ЛТ/ХЛТ целесообразно хирургическое лечение. В случае полной регрессии после использования консервативных методов лечения показано динамическое наблюдение [3].
Т3N0–3
- Пациентам при раке гортани Т3N0–3 рекомендована одномоментная ХЛТ или индукционная ХТ в последующей ХЛТ с целью сохранения органа [16].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Комментарии: При наличии остаточной опухоли и/или метастатических ЛУ после окончания ЛТ/ХЛТ целесообразно, по данным контрольного обследования, проведенного не ранее, чем через 2-3 месяца, после завершения консервативного лечения-рассмотрение вопроса хирургического лечения. В случае полной регрессии после использования консервативных методов лечения показано динамическое наблюдение [3].
- Пациентам при раке гортани Т3N0–3 рекомендовано хирургическое лечение в объеме ларингэктомии с тиреоидэктомией с пре- и ипсилатеральной паратрахеальной лимфодиссекцией, односторонней или двусторонней шейной лимфодиссекцией [15].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: в отдельных случаях, рассматриваемых в индивидуальном порядке, при отсутствии эрозии щитовидного хряща возможно выполнение органосохраняющей резекции (открытой или эндоскопической лазерной, выполнение шейной лимфодиссекции обязательно независимо от статуса регионарных ЛУ. После хирургического лечения дальнейшую тактику лечения проводят в зависимости от наличия/отсутствия НПФ по данным ПГИ. Отсутствие НПФ и pN0-статус не требуют дополнительного лечения, целесообразно динамическое наблюдение. Показанием для проведения послеоперационной ХЛТ является наличие следующих НПФ: периневральная, периваскулярная, перилимфатическая инвазия, pN+. При наличии только НПФ R1 показана ререзекция (если возможна), при невозможности – одновременная ХЛТ. Наличие ENE+ изолированно или в комплексе с другими НПФ – показание для проведения синхронной ХЛТ
- Пациентам при раке гортани Т3N0–3 рекомендована индукционная ХТ с последующей ХЛТ с последующей оценкой эффекта с целью сохранения органа [16].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Комментарий: При полной/частичной регрессии ( согласно критериям ВОЗ) первичного очага после индукционной ХТ (по данным КТ или МРТ с в/в контрастированием первичной опухоли и шеи, фиброларингоскопии, УЗИ шеи) целесообразна самостоятельная ЛТ или ХЛТ. При регрессии опухоли в пределах стабилизации или менее 50% целесообразно хирургическое лечение с последующим решением вопроса о показаниях к проведению ЛТ/ХЛТ.
При наличии остаточной опухоли и/или метастатических ЛУ после окончания ЛТ/ХЛТ (согласно оценке, проведенной не ранее, чем через 2-3 месяца, после завершения консервативного лечения) целесообразно хирургическое лечение. В случае полной регрессии после использования консервативных методов лечения показано динамическое наблюдение [3].
T4a, N0–N3
- Пациентам при раке надскладочного отдела гортани стадии T4a, N0–N3 рекомендовано хирургическое лечение в объеме ларингэктомии с тиреоидэктомией, односторонней или двусторонней шейной лимфодиссекцией с проведением послеоперационной конкурентной ХЛТ с целью повышения выживаемости пациентов [15].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарий: После хирургического лечения дальнейшую тактику лечения проводят в зависимости от наличия/отсутствия НПФ по данным ПГИ. Отсутствие НПФ и pN0-статус не требуют дополнительного лечения, целесообразно динамическое наблюдение. Показанием для проведения послеоперационной ХЛТ является наличие следующих НПФ: периневральная, периваскулярная, перилимфатическая инвазия, pN+. При наличии только НПФ R1 показана ререзекция (если возможна), при невозможности – одновременная ХЛТ. Наличие ENE+ изолированно или в комплексе с другими НПФ – показание для проведения синхронной ХЛТ [3].
Отдельные пациенты со стадией Т4a, которые отказались от операции
- При раке надскладочного отдела гортани T4a при отказе пациента от операции рекомендована одномоментная ХЛТ или индукционная ПХТ с последующей ХЛТ, с последующей оценкой эффекта с целью повышения общей выживаемости [15].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: при полной/частичной регрессии первичного очага после индукционной ХТ (по данным КТ или МРТ с в/в контрастированием первичной опухоли и шеи, фиброларингоскопии, УЗИ шеи) целесообразна самостоятельная ЛТ или ХЛТ. При регрессии опухоли в пределах стабилизации или менее 50 %, целесообразно хирургическое лечение с последующим решением вопроса о показаниях к проведению ЛТ/ХЛТ.
При наличии остаточной опухоли и/или метастатических ЛУ после окончания ЛТ/ХЛТ (согласно оценке, проведенной не ранее, чем через 2-3 месяца, после завершения консервативного лечения) целесообразно хирургическое лечение. В случае полной регрессии после использования консервативных методов лечения показано динамическое наблюдение [3].
T4b, любая N, неоперабельные регионарные метастазы, M1 или пациенты, не подходящие для оперативного лечения
- При раке надскладочного отдела гортани стадии T4bNлюбая, наличии неоперабельных регионарных метастазов или отдаленных метастазов, а также у пациентов, при оценке общего состояния пациента по шкале ECOG 0–1 (см. Приложение Г) рекомендовано рассмотреть вопрос о проведении лекарственной терапии в отдельных случаях возможно рассмотреть ХЛТ) с целью увеличения выживаемости или симптоматическое лечение с целью облегчения состояния пациента [3]
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
- При раке надскладочного отдела гортани стадии T4bNлюбая, наличии неоперабельных регионарных метастазов или отдаленных метастазов, а также у пациентов, при оценке общего состояния пациента по шкале ECOG 2 (см. Приложение Г) рекомендована лекарственная терапия целью увеличения выживаемости или симптоматическое лечение с целью облегчения состояния пациента [3].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
- При раке надскладочного отдела гортани стадии T4bNлюбая, наличии неоперабельных регионарных метастазов или отдаленных метастазов, а также у пациентов, при оценке общего состояния пациента по шкале ECOG 3 (см. Приложение Г) рекомендовано симптоматическое лечение с целью облегчения состояния пациента [3].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Локальный рецидив без предшествующей лучевой терапии
- Пациентам с локальным рецидивом в надскладочном отделе гортани без предшествующей лучевой терапии рекомендовано хирургическое вмешательство (при резектабельных процессах) с целью увеличения выживаемости пациентов [3]
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5)
Комментарий: отсутствие НПФ и pN0-статус не требуют дополнительного лечения, целесообразно динамическое наблюдение. Показанием для проведения послеоперационной ЛТ/ ХЛТ является наличие следующих НПФ:, периневральная, периваскулярная, перилимфатическая инвазия, pN+. При наличии только НПФ R1 показана ререзекция (если возможна), при невозможности – конкурентная ХЛТ. Наличие ENE+ изолированно или в комплексе с другими НПФ – показание для проведения одновременная ХЛТ.
- Пациентам с локальным рецидивом в надскладочном отделе гортани без предшествующей лучевой терапии при ECOG 0-1 (см. Приложение Г) рекомендована одновременная ХЛТ или индукционная ХТ с последующей ЛТ или одновременная ХЛТ (при ECOG 0–1) с целью повышения выживаемости [3].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
- Пациентам с локальным рецидивом в надскладочном отделе гортани без предшествующей лучевой терапии при нерезектабельных процессах и ECOG 2 (см. Приложение Г) рекомендована паллиативная ЛТ или лекарственная терапия с целью облегчения состояния пациента [3].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Локальный рецидив или остаточная опухоль после лучевой терапии
- Пациентам с локальным рецидивом в надскладочном отделе гортани после лучевой терапии при резектабельности опухоли рекомендовано хирургическое вмешательство с обсуждением вопроса о повторной ЛТ либо одновременной ХЛТ [3].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: При нерезектабельности опухоли целесообразна повторная ЛТ/одновременная ХЛТ либо лекарственная терапия (см табл. №1), либо симптоматическое лечение.
Локальный рецидив или отдаленное метастазирование
- Пациентам с локальным рецидивом в надскладочном отделе гортани с отдаленным метастазами при оценке общего состояния пациента по шкале ECOG 0–1 (см. Приложение Г) рекомендовано рассмотреть вопрос о проведении лекарственного с целью увеличения выживаемости [3].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: в отдельных случаях при единичных метастазах возможно рассмотреть хирургическое лечение или ХЛТ
- Пациентам с локальным рецидивом в надскладочном отделе гортани с отдаленным метастазами при оценке общего состояния пациента по шкале ECOG 2 (см. Приложение Г) рекомендована лекарственная терапия [3].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
- Пациентам с локальным рецидивом в надскладочном отделе гортани с отдаленным метастазами при оценке общего состояния пациента по шкале ECOG 3 (см. Приложение Г) рекомендовано симптоматическое лечение с целью облегчения состояния пациента [3].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
3. Принципы лучевой/химиолучевой терапии
Введение. Всех пациентов до лечения должен оценивать радиотерапевт, предпочтительно специализирующийся на опухолях головы и шеи, которому следует предпринять следующие действия: рассмотреть адекватность биопсийного материала, стадирования и визуализации опухолевого процесса (по данным КТ, МРТ) для определения степени распространения опухоли, исключить наличие синхронной первичной опухоли, оценить текущий функциональный статус и возможность ЛТ/ХЛТ, разработать проспективный план наблюдения, который будет включать санацию орофарингеальной области, в том числе обследование зубов, обеспечение адекватного питания, обезболивания, ранозаживления, а также другие мероприятия, которые необходимы для максимальной реабилитации пациентов. Для пациентов, которым проводится ЛТ/ХЛТ, необходимо проработать план реализации противоопухолевой терапии в полном объеме и в оптимальные сроки. Объем облучения до радикальных доз не следует модифицировать на основании клинического ответа, полученного до ЛТ (после индукционной ПХТ), за исключением случаев прогрессии опухоли. Допустимо обсуждение вопроса о сокращении объема за счет исключения из него жизненно важных структур, свободных от опухолевого поражения на момент планирования ЛТ, в случае превышения предельно допустимой дозовой нагрузки на них согласно критериям QUANTEC (практическое руководство для оценки дозолимитирующих параметров критических органов (quantitative analyses of normal tissue effects in the clinic)).
Предпочтительно проведение конформной дистанционной ЛТ, в том числе с применением высокопрецизионных способов – IMRT (лучевая терапия с модуляцией интенсивности (volumetric modulated arc therapy)), IGRT, VMAT (объемно-модулированная лучевая терапия (volumetric modulated arc therapy)). [17].
При лучевом лечении рака голосового отдела гортани T1N0M0 возможно применение режимов гипофракционирования 50 - 55 Гр (2,75-3.5 Гр/фракция) (24,25,26)
- Пациентам при раке гортани ЛТ в самостоятельном варианте на первичный очаг и клинически определяемые регионарные метастазы рекомендована в дозе 66–70 Гр (2,0– 2,2 Гр/фракция) ежедневно с понедельника по пятницу в течение 6–7 нед; на локорегионарную область, включая регионарные ЛУ – 44-63 Гр (1,8-2,0 Гр/фракция) с целью повышения показателей выживаемости [3].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Пациентам со злокачественной опухолью гортани при выборе в качестве первичной опции одновременной ХЛТ в самостоятельном варианте ЛТ на первичный очаг и клинически определяемые регионарные метастазы рекомендована в дозе 70 Гр (2,0 Гр/фракция) ежедневно с понедельника по пятницу в течение 7 нед; на локорегионарную область, в том числе регионарные ЛУ, – 44-63 Гр (1,8–2,0 Гр/фракция) с учетом рисков [3]. Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарий: стандартом является применение цисплатина** в дозе 100 мг/м² на фоне гипергидратации в 1, 22 и 43-й дни ЛТ (суммарная доза во время ЛТ – 300 мг/м²). После индукционной ПХТ в качестве альтернативы цисплатину** целесообразно использование карбоплатина** или цетуксимаба** с учетом переносимости ХЛТ и соматического состояния пациента (при плоскоклеточном раке). Карбоплатин** применяется в режиме AUC (площадь под фармакокинетической кривой — кривой «концентрация—время») 1,5–2,0 в виде еженедельных введений с 1-го дня ЛТ. Цетуксимаб** вводится в нагрузочной дозе 400 мг/м2 за неделю до начала ЛТ, далее – в поддерживающей дозе 250 мг/м2 еженедельно в процессе ЛТ.
Отказ от платиносодержащих схем ХЛТ в пользу применения цетуксимаба** также целесообразен при высоком риске срыва/неполной реализации плана самостоятельного ХЛТ и высоком риске развития побочных эффектов препаратов соединения платины (скорость клубочковой фильтрации <50–60 мл/мин, возраст пациентов старше 65 лет, выраженная сопутствующая почечная, сердечно-сосудистая, неврологическая, печеночная патология и/или ослабленное состояние пациентов – ECOG >1 (см. Приложение Г)) [18].
- Пациентам со злокачественной опухолью гортани послеоперационная ЛТ рекомендована при стадиях pТ3–4 и N0-1 а также у отдельных пациентов со стадиями pT1–2, N0–1 (при наличии неблагоприятных признаков) [3].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: Предпочтительный интервал после операции составляет ≤6 нед и не должен превышать 3 мес. При свободном от опухоли крае резекции (R0) на область удаленной первичной опухоли и регионарных метастазов подводится доза 60 Гр (2,0 Гр/фракция). При R+ суммарная доза излучения составляет 66 Гр (2,0 Гр/фракция). На локорегионарную область, включая неизмененные регионарные ЛУ, суммарная доза составляет 44-63 Гр (1,8–2,0 Гр/ фракция) [3].
- Послеоперационная одновременная ХЛТ рекомендована пациентам со злокачественной опухолью гортани при прорастании опухолью капсулы ЛУ, положительном крае резекции (при отказе от реоперации), также обсуждается при сочетании 2 и более неблагоприятных факторов (pT3 или pT4; N2 или N3, наличие периневральной инвазии и/или эмболов в лимфатических сосудах) [3].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: При R0-резекции по данным гистологического исследования, на область удаленной первичной опухоли и регионарных метастазов подводится доза 60 Гр (2,0 Гр/фракция). При R+ суммарная доза излучения составляет 66 Гр (2,0 Гр/фракция). На локорегионарную область, включая неизмененные регионарные ЛУ, суммарная доза составляет 44-63 Гр (1,8–2,0 Гр/фракция). Целесообразно одновременное проведение ХТ цисплатином в дозе 100 мг/м2 каждые 3 нед, или комбинация доцетаксела 15 мг\м.кв + цетуксимабом в нагрузочной дозе 400 мг/м2 за неделю до начала ЛТ, далее – в поддерживающей дозе 250 мг/м2 еженедельно в процессе ЛТ (еженедельно) [3].
Комментарии: Пациентам со злокачественной опухолью гортани, которым планируется ЛТ или химиолучевая терапия, в качестве альтернативного метода лучевой терапии конформная дистанционная лучевая терапия пучками нейтронов, протонов и тяжелых ионов с целью снижения частоты и выраженности лучевых реакций и, таким образом, переносимости лечения [19].
4. Принципы лекарственной терапии
Выбор лекарственной терапии должен быть индивидуализирован в зависимости от характеристик пациента (общее состояние, цели лечения). Представленные схемы лекарственной терапии показаны при плоскоклеточном раке. Схемы лекарственной терапии при иных гистологических типах опухолей (например, саркомы) смотреть в соответствующих клинических рекомендациях.
Табл. №1. Режимы лекарственной терапии плоскоклеточного рака головы и шеи [18], [23]. [27]. [28].
| Название режима | Схема проведения |
|---|---|
| PF+ Cet | Цисплатин** 75–100 мг / м2 в / в в 1‑й день + #фторурацил** 1000 мг / м2 / сут. в / в 96‑часовая инфузия в 1–4‑й дни, каждые 3 нед. + цетуксимаб** 400 мг / м2 (нагрузочная доза), далее — 250 мг / м2 в / в еженедельно. После 6 циклов ХТ завершается, и в случае отсутствия прогрессирования рекомендовано продолжить поддерживающую терапию цетуксимабом** 250 мг / м2 в / в еженедельно [18]. |
| DС+ Cet | #Доцетаксел** 75 мг / м2 в / в в 1‑й день + цисплатин** 75 мг / м2 в / в в 1‑й день, каждые 3 нед. + цетуксимаб** 400 мг / м2 (нагрузочная доза) в / в, далее — 250 мг / м2 в / в еженедельно. После 4 циклов ХТ завершается, и в случае отсутствия прогрессирования рекомендовано продолжить поддерживающую терапию цетуксимабом** 500 мг / м2 в / в 1 раз в 2 недели [18]. |
| Цисплатин + Cet | Цисплатин** 75–100 мг / м2 1 раз в 3 недели (не более 6-8 введений) + цетуксимаб** 400 мг / м2 (нагрузочная доза) в / в в 1 день, далее — 250 мг / м2 в / в еженедельно до прогрессирования или непереносимой токсичности. [18]. |
| Pacli + Carbo + Cet | #Паклитаксел** 100 мг / м2 в / в + карбоплатин** AUC 2,5 в / в в 1‑й и 8‑й дни + цетуксимаб** 400 мг / м2 в / в (2‑часовая инфузия) в 1‑й день 1‑го цикла (нагрузочная доза), далее — 250 мг / м2 в / в (1‑часовая инфузия) еженедельно. Длительность цикла 21 день. После завершения 6 циклов ХТ в случае отсутствия прогрессирования рекомендовано продолжить поддерживающую терапию цетуксимабом** 250 мг / м2 в / в еженедельно[18]. |
| Pacli + Carbo + Cet 1 |
#Паклитаксел** 80 мг / м2 в / в еженедельно + карбоплатин** AUC 2,0 в / в еженедельно + цетуксимаб** 400 мг / м2 в / в (2‑часовая инфузия) в 1‑й день 1‑го цикла, далее — 250 мг / м2 в / в еженедельно. После завершения ХТ в случае отсутствия прогрессирования рекомендовано продолжить поддерживающую терапию цетуксимабом** 250 мг / м2
в / в еженедельно. Количество введений противоопухолевых препаратов (цитостатиков) определяется индивидуально. [18].
|
| PF 2 | Цисплатин** 75–100 мг / м2 в / в в 1‑й день + фторурацил** 1000 мг / м2 / сут. в / в 96‑часовая инфузия в 1–4‑й дни, каждые 3 нед. [23]. |
| Карбоплатин** AUC- 5 в / в в 1‑й день +#фторурацил** 1000 мг / м2 в / в 96‑часовая инфузия в 1–4‑й дни, каждые 3 нед. Общее число циклов 6, при отсутствии токсичности и нарастающей положительной динамике может быть увеличено до 8. Общее число циклов 6, при отсутствии токсичности и нарастающей положительной динамике может быть увеличено до 8.[18]. | |
| Pacli +Carbo 2 | #Паклитаксел** 175 мг / м2 в / в в 1‑й день + карбоплатин** AUC- 5–6 в / в в 1‑й день каждые 3 нед. Общее число циклов 6, при отсутствии токсичности и нарастающей положительной динамике может быть увеличено до 8. [18]. |
| #Паклитаксел** 60–80 мг / м2 в / в еженедельно + карбоплатин** AUC- 2 в / в еженедельно до прогрессирования или неприемлемой токсичности, но не более 18 недель. | |
| DС 2 | #Доцетаксел** 75 мг / м2 в / в в 1‑й день + цисплатин** 75 мг / м2 в / в в 1‑й день, каждые 3 нед. Общее число циклов 6, при отсутствии токсичности и нарастающей положительной динамике может быть увеличено до 8. [18]. |
| Ниволумаб 3 | Ниволумаб** 3 мг / кг в / в 1 раз в 2 нед. или 240 мг 1 раз в 2 нед. или 480 мг 1 раз в 4 нед. 60‑минутная инфузия (первое введение), далее — 30‑минутная инфузия до прогрессирования или неприемлемой токсичности, но не более 2 лет [18]. |
| Пембролизумаб4 | Пембролизумаб** 200 мг в / в 1 раз в 3 нед. (30‑минутная инфузия) или 400 мг 1 раз в 6 нед. до прогрессирования или неприемлемой токсичности, но не более 2 лет [18]. |
|
PF + Пембролиз-
умаб5
|
Пембролизумаб** 200 мг + карбоплатин** AUC 5 или цисплатин** 100 мг / м2 +#ФУ 1000 мг / м2 1–4 дни 1 раз в 3 недели (6 циклов), далее пембролизумаб** 200 мг 1 раз в 3 недели или 400 мг 1 раз в 6 нед. Максимум — до 35 введений в целом [18]. |
| Монотерапия для пациентов в общем состоянии по ECOG=2 баллов | |
| Цисплатин** 60–70 мг/м2 в/в 1 раз в 3 нед. Количество введений определяется индивидуально, но целесообразность длительности более 6-8 введений представляется сомнительной.[18]. | |
| Карбоплатин** AUC 5–6 в/в 1 раз в 3 нед. или карбоплатин** AUC 2 в/в еженедельно. Количество введений определяется индивидуально. [18]. | |
| #Паклитаксел** 175 мг/м2 в / в 1 раз в 3 нед. или паклитаксел** 80 мг / м2 в / в еженедельно. Количество введений определяется индивидуально. [18]. | |
| #Доцетаксел** 70–75 мг м2 в / в 1 раз в 3 нед. Количество введений определяется индивидуально. [18]. | |
| #Капецитабин** 2000 мг / м2 внутрь в 2 приема в 1–14‑й дни, перерыв 1 неделя или 2000 мг / сут. внутрь ежедневно в метрономном режиме. Длительность терапии определяется индивидуально. [27]. | |
| #Метотрексат** 40 мг / м2 в / в еженедельно. Количество введений определяется индивидуально. [18]. | |
| Цетуксимаб** 400 мг / м2 в / в (2‑часовая инфузия) в 1‑й день 1‑го курса, далее — 250 мг / м2 в / в еженедельно [28]. | |
| Ниволумаб 3 | Ниволумаб** 3 мг / кг в / в 1 раз в 2 нед. или 240 мг 1 раз в 2 нед. или 480 мг 1 раз в 4 нед. 60‑минутная инфузия (первое введение), далее — 30‑минутная инфузия до прогрессирования или неприемлемой токсичности, но не более 2 лет [18]. |
| Пембролизумаб4 | Пембролизумаб** 200 мг в / в 1 раз в 3 нед. (30‑минутная инфузия) или 400 мг 1 раз в 6 нед. до прогрессирования или неприемлемой токсичности, но не более 2 лет [18]. |
1 Для пациентов в общем состоянии по ECOG 2 балла.
2 Неоптимальные режимы лечения; возможны к применению только в случае абсолютных противопоказаний к назначению анти-EGFR МКА.
3 Во 2 и последующих линиях терапии при платино-резистентных опухолях. Может назначаться независимо от уровня экспрессии PD-L1.
4В качестве 1 линии при наличии экспрессии PD-L1 CPS ≥ 1. При прогрессировании на фоне или после ХТ, включающей препараты платины (L01XA:Соединения платины), при уровне TPS ≥ 50 %. Рекомендуемая длительность применения соответствует дизайну регистрационных исследований.
5 В качестве 1 линии при при CPS≥ 1
Комментарии: Пациентам при прогрессировании заболевания после применения противоопухолевых препаратов (цитостатиков), цетуксимаба** и иммунного препарата может быть назначен #афатиниб** 40 мг/день внутрь до прогрессирования или неприемлемой токсичности (эффективность при плоскоклеточном раке головы и шеи оценена только по данным зарубежных исследований) для улучшения безрецидивной выживаемости [55].
5. Принципы хирургического лечения
Хирургический метод лечение включает в себя операции различных объемов, направленные на удаление первичного опухолевого очага, включая органосохраняющие техники (эндоларингеальная лазерная резекция, эндоскопическая резекция), открытые резекции пораженных отделов, а также на восстановление целостности верхних отделов ЖКТ с помощью различных реконструктивно-пластических методик.
- При раке надскладочного отдела гортани при отсутствии клинических признаков поражения ЛУ шеи всем пациентам рекомендуется профилактическая одно/ двусторонняя шейная лимфодиссекция (2–4 уровни) с целью снижения риска локорегионарного рецидива и повышения выживаемости [32].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии:
- Удаление ЛУ II–V уровней целесообразно при наличии одного из следующих факторов:
- метастазы в лимфатических узлах IV или V уровне;
- регионарный метастаз более 6 см в диаметре;
- множественные метастазы более 3 см в диаметре ;
- экстракапсулярное распространение опухоли;
- регионарный рецидив.
- Пациентам с местно-распространенными формами рака головы и шеи, а также при угрозе кровотечения из опухолевых узлов в области головы и шеи рекомендовано:
Произвести клиническую оценку состояния опухолевого процесса и оценить риски возникновения кровотечения, размеры опухоли и переход опухоли на соседние структуры в случае изъявления опухоли, имеющейся полости в области опухоли или рецидива опухоли, близости к ветвям сонной артерии, наличие незаживающей раны, состоявшееся кровотечение из опухоли [49-54].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
- В случае констатации риска кровотечения из опухолевых узлов рекомендовано произвести ангиографию и при отсутствии противопоказаний произвести суперселективную внутриартериальную эмболизацию сосудов опухоли с целью снижения рисков кровотечения и фатальных осложнений [49-54].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
6. Обезболивание
Порядок и рекомендации по обезболиванию при злокачественных новообразованиях полости рта соответствуют рекомендациям, представленным в клинических рекомендациях
«Хронический болевой синдром (ХБС) у взрослых пациентов, нуждающихся в паллиативной медицинской помощи»
7. Сопроводительная терапия
Принципы профилактики и лечения анемии у пациентов с раком гортани соответствуют принципам, изложенным в клинических рекомендациях «Анемия при злокачественных новообразованиях», размещенным в рубрикаторе клинических рекомендаций Минздрава России https://cr.minzdrav.gov.ru.
Принципы лечения и профилактики тошноты и рвоты у пациентов с раком гортани соответствуют принципам, изложенным в рекомендациях «Практические рекомендации по профилактике и лечению тошноты и рвоты у онкологических больных.» (коллектив авторов: Владимирова Л. Ю., Гладков О. А., Королева И. А., Румянцев А. А., Семиглазова Т. Ю., Трякин А. А., Кутукова С.И., Овчинникова Е.Г., Новикова О.Ю., Корниецкая А.Л. Практические рекомендации RUSSCO, часть 2. Злокачественные опухоли, 2023 (том 13), #3s2, стр. 29–44., https://rosoncoweb.ru/standarts/RUSSCO/2023/2023-38.pdf).
Принципы лечения и профилактики мукозитов у пациентов с раком гортани соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по лечению и профилактике мукозитов» (коллектив авторов: Семиглазова Т.Ю., Беляк Н.П., Владимирова Л.Ю., Корниецкая А.Л., Королева И.А., Нечаева М.Н., Раджабова З.А., Телетаева Г.М., Ткаченко Е.В. Практические рекомендации RUSSCO, часть 2. Злокачественные опухоли, 2023 (том 13), #3s2, стр. 250–259., https://rosoncoweb.ru/standarts/RUSSCO/2023/2023-52.pdf).
Принципы лечения и профилактики костных осложнений у пациентов с раком гортани соответствуют принципам, изложенным в методических рекомендациях «Профилактика и лечение патологии костной ткани при злокачественных новообразованиях.» (коллектив авторов: Багрова С.Г., Басин Е.М., Борзов К.А., Бычкова Н.М., Деньгина Н. В., Копп М.В., Крылов В.В., Кочетова Т.Ю., Семиглазова Т.Ю. Практические рекомендации RUSSCO, часть 2. Злокачественные опухоли, 2023 (том 13), #3s2, стр. 45–58., https://rosoncoweb.ru/standarts/RUSSCO/2023/2023-39.pdf).
Принципы профилактики и лечения инфекционных осложнений и фебрильной нейтропении у пациентов с раком гортани соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по диагностике и лечению фебрильной нейтропении» (коллектив авторов: Сакаева Д.Д., Борисов К.Е., Булавина И.С., Когония Л.М., Курмуков И.А., Орлова Р.В., Шабаева М.М. Практические рекомендации RUSSCO, часть 2. Злокачественные опухоли, 2023 (том 13), #3s2, стр. 62–71., https://rosoncoweb.ru/standarts/RUSSCO/2023/2023-40.pdf).
Принципы профилактики и лечения гепатотоксичности у пациентов с раком гортани соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по коррекции гепатотоксичности, индуцированной противоопухолевой терапией.» (коллектив авторов: Ткаченко П.Е., Ивашкин В.Т., Маевская М.В. Практические рекомендации RUSSCO, часть 2. Злокачественные опухоли, 2023 (том 13), #3s2, стр. 69–82., https://rosoncoweb.ru/standarts/RUSSCO/2023/2023-41.pdf).
Принципы профилактики и лечения сердечно-сосудистых осложнений у пациентов с раком гортани соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по коррекции кардиоваскулярной токсичности противоопухолевой лекарственной терапии» (коллектив авторов: Виценя М.В., Агеев Ф.Т., Орлова Р.В., Полтавская М.Г., Потиевская В.И. Практические рекомендации RUSSCO, часть 2. Злокачественные опухоли, 2023 (том 13), #3s2, стр. 86–111., https://rosoncoweb.ru/standarts/RUSSCO/2023/2023-42.pdf).
Принципы профилактики и лечения кожных осложнений у пациентов с раком гортани соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по лекарственному лечению дерматологических реакций у пациентов, получающих противоопухолевую лекарственную терапию» (коллектив авторов: Королева И.А., Болотина Л.В., Гладков О.А., Горбунова В.А., Когония Л.М., Круглова Л.С., Орлова Е.В., Орлова Р.В. Практические рекомендации RUSSCO, часть 2. Злокачественные опухоли, 2023 (том 13), #3s2, стр. 108–131, https://rosoncoweb.ru/standarts/RUSSCO/2023/2023-43.pdf).
Принципы профилактики и лечения нефротоксичности у пациентов с раком гортани соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по коррекции нефротоксичности противоопухолевых препаратов» (коллектив авторов: : Громова Е. Г., Бирюкова Л. С., Джумабаева Б. Т., Курмуков И. А. . Практические рекомендации RUSSCO, часть 2. Злокачественные опухоли, 2023 (том 13), #3s2, стр. 153–166., https://rosoncoweb.ru/standarts/RUSSCO/2023/2023-47.pdf).
Принципы профилактики и лечения тромбоэмболических осложнений у пациентов с раком гортани соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по профилактике и лечению тромбоэмболических осложнений у онкологических больных» (коллектив авторов: Сомонова О.В., Антух Э.А., Варданян А.В., Громова Е.Г., Долгушин Б.И., Елизарова А.Л., Сакаева Д.Д., Сельчук В.Ю., Трякин А.А., Черкасов В.А. Практические рекомендации RUSSCO, часть 2. Злокачественные опухоли, 2023 (том 13), #3s2, стр. 170–183., https://rosoncoweb.ru/standarts/RUSSCO/2023/2023-48.pdf).
Принципы профилактики и лечения последствий экстравазации лекарственных препаратов у пациентов с раком гортани соответствуют принципам, изложенным в методических рекомендациях «А. Рекомендации по профилактике и лечению последствий экстравазации противоопухолевых препаратов» (автор: Буйденок Ю.В., Обухова О.А. Злокачественные опухоли: Практические рекомендации RUSSCO, часть 2. Злокачественные опухоли, 2023 (том 13), #3s2, стр. 179–189., https://rosoncoweb.ru/standarts/RUSSCO/2023/2023-49.pdf).
Принципы профилактики и лечения иммуноопосредованных нежелательных явлений у пациентов с раком гортани соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по управлению иммуноопосредованными нежелательными явлениями» (коллектив авторов: Проценко С.А., Баллюзек М.Ф., Васильев Д.А., Жукова Н.В., Новик А.В., Носов Д.А., Петенко Н.Н., Семенова А.И., Харкевич Г.Ю., Юдин Д.И. Практические рекомендации RUSSCO, часть 2. Злокачественные опухоли, 2023 (том 13), #3s2, стр. 213–252., https://rosoncoweb.ru/standarts/RUSSCO/2023/2023-51.pdf).
8. Диетотерапия
Необходимость назначения лечебного питания определяется нутритивным статусом пациента, а также целесообразностью коррекции сопутствующих состояний и профилактики осложнений проводимого лечения, в связи с чем принципы лечебного питания и показания представлены в разделе «Медицинская реабилитация, показания и противопоказания к применению методов реабилитации».
Принципы нутритивной поддержки у пациентов с раком гортани соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по нутритивной поддержке онкологических больных» (коллектив авторов: Сытов А.В., Лейдерман И.Н., Ломидзе С.В., Нехаев И.В., Хотеев А.Ж. DOI: 10.18027/2224-5057-2018-8-3s2-575-583, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-41.pdf).
Медицинская реабилитация
Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
- В предоперационном периоде и в раннем послеоперационном периоде всем пациентам со злокачественной опухолью гортани рекомендована медико-логопедическая процедура при дисфагии и с целью обучения пациента способности говорить. [33].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: В целях восстановления речевой функции используются методики пищеводного голоса, трахеопищеводное шунтирование, применение электронных голосообразующих аппаратов. Для логопедической реабилитации существует ряд ограничений: нельзя проводить активную функциональную тренировку в раннем послеоперационном периоде, на этапе первичного заживления и при возникновении свищей. Недопустимо нарушение режима функциональных тренировок.
Рекомендуются всем пациентам со злокачественными опухолями гортани программы профилактической гимнастики и медико-логопедическая процедура при дисфагии до начала лечения для уменьшения нарушения глотания при проведении противоопухолевой терапии [34].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Нутритивно-метаболическая реабилитация (диетотерапия) не менее 7 суток рекомендована всем пациентам с злокачественными новообразованиями гортани с целью снижения частоты послеоперационных осложнений и длительности пребывания пациента с ЗНО гортани в стационаре [35].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарии: Нутритивная поддержка при планировании хирургического лечения проводится при наличии хотя бы одного из указанных факторов: непреднамеренном снижении массы тела за последние 6 мес (потеря 10 % и более), индексе массы тела <20 кг/м2, гипопротеинемия <60 г/л или гипоальбуминемия <30 г/л, ухудшении возможности приема пищи за последнюю неделю. В случае проведения химиотерапии показаниями являются: индекс массы тела <20 кг/м2; потеря более 5% массы тела за 6 мес.; гипопротеинемия <60 г/л или гипоальбуминемия <30 г/л.; невозможность адекватного питания через рот; энтеропатия средней и тяжёлой степени
- Пациентам с ЗНО гортани, получающим лекарственное лечение, рекомендуется раннее назначение комплекса упражнений (лечебной физкультуры) с целью профилактики возникновения и прогрессирования саркопении, уменьшения слабости, улучшения качества жизни и психологического состояния пациентов, получающих адъювантную ХТ, увеличения толерантности к физической нагрузке [36].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3).
Комментарии: Проведение комплекса ЛФК с включением аэробной нагрузки, элементов Тайчи в течение 4 мес на фоне ХТ приводит к увеличению жизненной емкости легких, насыщенности крови кислородом, силы мышц, объема движений в крупных суставах, снижения индекса массы тела [37].
- Для уменьшения утомляемости и повышения выносливости всем пациентам с ЗНО гортани на фоне проведения ХЛТ рекомендуется проведение ЛФК в виде аэробных упражнений средней интенсивности в сочетании с упражнениями на сопротивление [38].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Комментарий: Сочетание ЛФК с психологической поддержкой используется в качестве комплексного лечения слабости на фоне ХТ [39]. Помимо этого, целесообразно проведение курса массажа медицинского в течение 6 нед с целью уменьшения слабости на фоне комбинированного лечения [40].
- Упражнения на тренировку баланса рекомендованы всем пациентам с ЗНО гортани, получающим химиотерапию, для коррекции полинейропатии [41].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
Комментарии: С момента проявлений и до полного исчезновения лучевого мукозита показано применение дерматопротекторов – стимуляторов репарации тканей (гели, раствор мочевины и др.). При регулярном орошении полости рта изотоническим раствором удаляются остатки пищи и накопившиеся выделения. Для аппликаций в полости рта или для закапывания в нос применяются масла (оливковое, персиковое, облепихи или шиповника). При наличии болевого синдрома применяют анестетики для местного применения и системные анальгетики [46]. Чаще всего требуется назначение опиоидов, причем следует обратить внимание на трансдермальные формы их применения [47].
С момента проявлений лучевого дерматита и до полного стихания реакций показано применение стимуляторов репарации тканей (гели, диоксометилтетрагидропиримидин, рибофлавин), а также солнцезащитных средств. Кожу необходимо оберегать от трения и раздражения. Для борьбы с ксерозом используют крем с мочевиной, масляный раствор витамина А. При биолучевом дерматите целесообразно применение крема с витамином К.
В постлучевом периоде нормальные ткани, подвергшиеся облучению, очень ранимы, поэтому к ним нужно относиться бережно. В ранние сроки следует избегать выполнения инвазивных диагностических процедур и биопсии без крайней необходимости. Показан подбор диеты, при необходимости в сочетании с противорефлюксными препаратами [48]. Травмы, алкоголь, курение, раздражающая пища легко вызывают изъязвление слизистой оболочки, что нередко сопровождается обнажением кости нижней челюсти с последующим развитием остеомиелита. Частой причиной лучевого остеомиелита является удаление зубов в зоне предшествующего облучения, с связи с чем следует по возможности ограничиваться консервативными методами и только в случае необходимости проводить удаление зубов на фоне антибиотикотерапии.
Реабилитация при лучевой терапии
Возможность успешного проведения противоопухолевого лечения и реабилитации зависит от исходного состояния пациента. Так, к факторам риска раннего возникновения и развития тяжелых побочных эффектов можно отнести истощение и тяжелое психологическое состояние пациента, пожилой возраст, сопутствующие заболевания, травмы слизистых полости рта и глотки, наличие кариозных зубов, выраженный болевой синдром, курение и прием алкоголя. Подготовка к лечению и адекватное ведение пациентов является настолько важной задачей, что участие профильных смежных специалистов в составе мультидисциплинарной команды (альголога, специалиста по питанию, стоматолога и др.), а также объем сопроводительной терапии указываются в международных рекомендациях как обязательное условие успешного лечения пациентов с опухолями головы и шеи.
Ведение пациентов со злокачественными опухолями головы и шеи, получающих/получивших лучевое лечение, требует комплексного подхода, включающего, как минимум, три базовых компонента терапии сопровождения: ранозаживление, обезболивание, нутритивная поддержка, в сочетании с обеспечением контакта с пациентом и его комплаентности к лечению на всех его этапах. Оговоримся, что методики терапии сопровождения и реабилитации намного разнообразнее и подразумевают также проведение детоксикационной терапии, коррекции гематологической токсичности, противоязвенной, противорвотной, антибиотической терапии и др. Также обязательным является тщательный мониторинг пациентов после лечения и коррекция возможных отсроченных побочных эффектов лучевой терапии (ксеростомия, некроз кости и/или мягких тканей и др.).
Адекватное питание и поддержание водного баланса являются жизненно важным. Борьба с «ятрогенной» нутритивной недостаточностью, возникшей вследствие ЛТ и ХЛТ, является важнейшей задачей в рамках успешного лечения пациентов с опухолями головы и шеи. Особую роль играет сбалансированность приема пищи, что отражает поддержание стабильной массы тела. Необходимо отметить, что нутритивная поддержка проводится с лечебной целью, поскольку период проведения ЛТ характеризуется повышенной потребностью организма в энергетическом и пластическом обеспечении. У пациентов без выраженной дисфагии, получающих ЛТ и ХЛТ, методом выбора является пероральное энтеральное питание. Нутритивная терапия должна начинаться сразу при выявлении нутритивной недостаточности или при отсутствии достаточного питания через рот в течение 7 дней. Рекомендуется рассмотреть возможность проведения профилактической НП пациентам, которым планируется проведение противоопухолевого лечение с высоким риском нарушения питания (при проведении ХЛТ пациентам местнораспространенным раком глотки и др.) 56]. Энтеральное лечебное питание начинают при неадекватности диетического питания через рот (т. е. менее 60 % от общих энергетических потребностей в течение 10 дней). Потеря более 10 % от исходной массы тела является показанием для назначения энтерального питания. Оптимальным вариантом нутритивной поддержки является сиппинг с использованием высокобелковых смесей (с учетом сопутствующей патологии, в том числе почек). При невозможности адекватного перорального питания следует обеспечить его путем установки назогастрального зонда (при ориентировочных сроках его стояния до 3-4 недель), либо путем гастростомии. Также в случае необходимости может быть подключено парентеральное питание. Расчет основных потребностей пациента ориентирован на общее количество потребляемой энергии и количественное соотношение различных субстратов. Необходимое количество калорий чаще всего рассчитывается с учетом его энергетических затрат с ориентиром на предупреждение нарастания дефицита энергии [57.]. Основной целью нутритивной поддержки является восполнение потерь как минимум из расчета: белок / аминокислоты: не менее 1,2 г/кг/сут и до 2 г/кг/сут; энергия: 25-30 ккал /кг/су [58]. Пациентам, получающим ЛТ и ХЛТ оптимально применение смесей, обогащенных омега-3 жирными кислотами и пищевыми волокнами, а также совмещение нутритивной поддержки с физическими нагрузками.
С момента проявлений и до полного исчезновения лучевого мукозита показано применение ранозаживляющих местных средств (гели, раствор мочевины и др.). При регулярном орошении полости рта изотоническим раствором удаляются остатки пищи и накопившиеся выделения. Для аппликаций в полости рта или для закапывания в нос рекомендуются масла (оливковое, персиковое, облепихи или шиповника). При наличии болевого синдрома применяют местные и системные обезболивающие средства [59.]. Обезболивание должно назначаться в соответствии со шкалой ВОЗ. Чаще всего требуется назначение опиатов, причем следует обратить внимание на трансдермальные формы их применения [Сопроводительная терапия в онкологии. Практическое руководство. Под ред. С.Ю. Мооркрафта, Д.Л.Ю. Ли, Д. Каннингэма. Пер. с англ. Под ред. А.Д. Каприна. М.: Гэотар, 2016. 432 с.].
С момента проявлений лучевого дерматита и до полного стихания реакций показано применение ранозаживляющих местных средств (гели, метилурациловая мазь, рибофлавин), а также солнцезащитных средств. Кожу необходимо оберегать от трения и раздражения. Для борьбы с ксерозом используют крем с мочевиной, масляный раствор витамина А. При биолучевом дерматите целесообразно применение крема с витамином К.
В постлучевом периоде нормальные ткани, подвергшиеся облучению, очень ранимы, поэтому к ним нужно относиться бережно. В ранние сроки не рекомендуется выполнение инвазивных диагностических процедур и биопсии без крайней необходимости. Показан подбор диеты, при необходимости в сочетании с противорефлюксными препаратами [60]. Травмы, алкоголь, курение, раздражающая пища легко вызывают изъязвление слизистой оболочки, что нередко сопровождается обнажением кости нижней челюсти с последующим развитием остеомиелита. Частой причиной лучевого остеомиелита является удаление зубов в зоне предшествующего облучения, с связи с чем следует по возможности ограничиваться консервативными методами и только в случае необходимости проводить удаление зубов на фоне антибиотикотерапии.
- Рекомендуется регулярный мониторинг (шкалы MUST, NRS 2002) и коррекция нутритивного статуса с применением специализированного питания у пациентов, которым проводится ЛТ/ХЛТ с целью с целью повышения выживаемости, улучшения качества жизни и переносимости проводимого лечения[61.].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Всем пациентам, которым планируется проведение ЛТ/ХЛТ, рекомендуется консультация стоматолога и обследование с последующим сопровождением на всех этапах лечения и реабилитации [62].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 2-5).
- Всем пациентам, получающим/получившим ЛТ/ХЛТ, при наличии болевого синдрома рекомендуется консультация альголога с целью обеспечения переносимости лечения, адекватной реабилитации и улучшения качества жизни [63.].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Пациентам с ЗНО головы и шеи, получающим химиолучевое лечение рекомендуется раннее начало физических нагрузок с целью улучшения качества жизни и переносимости проводимого лечения [51].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3).
- Рекомендуется низкоинтенсивная лазеротерапия в профилактике и лечении мукозита полости рта/глотки на фоне ХЛТ [59; 60].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Госпитализация
Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации», организуется и оказывается:
1) в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным Федеральным органом исполнительной власти;
2) в соответствии с порядком оказания помощи по профилю «онкология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3) на основе настоящих клинических рекомендаций;
4) с учетом стандартов медицинской помощи, утвержденных уполномоченным Федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, поликлиническом отделении онкологического диспансера (онкологической больницы).
При подозрении или выявлении у пациента онкологического заболевания врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, поликлиническое отделение онкологического диспансера (онкологической больницы) для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, поликлиническом отделении онкологического диспансера (онкологической больницы) должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или поликлинического отделения онкологического диспансера (онкологической больницы организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер (онкологический стационар) или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественных новообразований не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
Сроки проведения диагностических инструментальных и лабораторных исследований в случае подозрения на онкологическое заболевание не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации.
Диагноз онкологического заболевания устанавливается врачом-онкологом, а при злокачественных новообразованиях лимфоидной, кроветворной и родственных им тканей, входящих в рубрики МКБ-10 С81-С96, также врачом-гематологом.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета) направляет пациента в онкологический диспансер (онкологическую больницу) или иную медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями, в том числе подведомственную федеральному органу исполнительной власти (далее – федеральная медицинская организация), для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания), определения тактики лечения, а также в случае наличия медицинских показаний для оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
При онкологических заболеваниях, входящих в рубрики С37, C38, C40–C41, C45–C49, С58, D39, C62, C69–C70, С72, C74 МКБ-10, а также соответствующих кодам международной классификации болезней – онкология (МКБ-О), 3 издания 8936, 906-909, 8247/3, 8013/3, 8240/3, 8244/3, 8246/3, 8249/3 врач-онколог онкологического диспансера (онкологической больницы) или иной медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, для определения лечебной тактики организует проведение консультации или консилиума врачей, в том числе с применением телемедицинских технологий, в федеральных государственных бюджетных учреждениях, подведомственных Министерству здравоохранения Российской Федерации, оказывающих медицинскую помощь (далее в целях настоящего Порядка – национальные медицинские исследовательские центры).
В сложных клинических случаях для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания) в целях проведения оценки, интерпретации и описания результатов врач-онколог организует направление:
- цифровых изображений, полученных по результатам патоморфологических исследований, в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр)[1] путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
- цифровых изображений, полученных по результатам лучевых методов исследований, в дистанционный консультативный центр лучевой диагностики, путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
- биопсийного (операционного) материала для повторного проведения патоморфологических, иммуногистохимических, и молекулярно-генетических исследований: в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр), а также в молекулярно-генетические лаборатории для проведения молекулярно-генетических исследований.
Тактика лечения устанавливается консилиумом врачей, включающим врачей-онкологов, врача-радиотерапевта, врача-нейрохирурга (при опухолях нервной системы) медицинской организации, в составе которой имеются отделения хирургических методов лечения злокачественных новообразований, противоопухолевой лекарственной терапии, радиотерапии (далее – онкологический консилиум), в том числе онкологическим консилиумом, проведенным с применением телемедицинских технологий, с привлечением при необходимости других врачей-специалистов.
Диспансерное наблюдение врача-онколога за пациентом с выявленным онкологическим заболеванием устанавливается и осуществляется в соответствии с порядком диспансерного наблюдения за взрослыми с онкологическими заболеваниями.
С целью учета информация о впервые выявленном случае онкологического заболевания направляется в течение 3 рабочих дней врачом-онкологом медицинской организации, в которой установлен соответствующий диагноз, в онкологический диспансер или организацию субъекта Российской Федерации, исполняющую функцию регистрации пациентов с впервые выявленном злокачественным новообразованием, в том числе с применением единой государственной информационной системы в сфере здравоохранения.
Специализированная, в том числе высокотехнологичная, медицинская помощь в медицинских организациях, оказывающих медицинскую помощь взрослому населению при онкологических заболеваниях, оказывается по медицинским показаниям, предусмотренным положением об организации оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Специализированная, за исключением высокотехнологичной, медицинская помощь в медицинских организациях, подведомственных федеральным органам исполнительной власти, оказывается по медицинским показаниям, предусмотренным пунктом 5 порядка направления пациентов в медицинские организации и иные организации, подведомственные федеральным органам исполнительной власти, для оказания специализированной (за исключением высокотехнологичной) медицинской помощи, предусмотренного в приложении к положению об организации оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Сроки ожидания оказания специализированной (за исключением высокотехнологичной) медицинской помощи не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации.
При наличии у пациента с онкологическим заболеванием медицинских показаний для проведения медицинской реабилитации врач-онколог организует ее проведение в соответствии с порядком организации медицинской реабилитации взрослых.
При наличии у пациента с онкологическим заболеванием медицинских показаний к санаторно-курортному лечению врач-онколог организует его в соответствии порядком организации санаторно-курортного лечения.
Паллиативная медицинская помощь пациенту с онкологическими заболеваниями оказывается в соответствии с положением об организации оказания паллиативной медицинской помощи, включая порядок взаимодействия медицинских организаций, организаций социального обслуживания и общественных объединений, иных некоммерческих организаций, осуществляющих свою деятельность в сфере охраны здоровья.
При подозрении и (или) выявлении у пациента онкологического заболевания в ходе оказания ему скорой медицинской помощи его переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Показаниями для госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
1) наличие осложнений онкологического заболевания, требующих оказания ему специализированной медицинской помощи в экстренной и неотложной форме;
2) наличие осложнений лечения (хирургическое вмешательство, ЛТ, лекарственная терапия и т.д.) онкологического заболевания.
Показаниями для госпитализации в медицинскую организацию в плановой форме являются:
1) необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2) наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, ЛТ, в том числе контактная, ДЛТ и другие виды ЛТ, лекарственная терапия и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациента из медицинской организации являются:
1) завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2) отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
3) в случаях несоблюдения пациентом предписаний или правил внутреннего распорядка лечебно-профилактического учреждения, если это не угрожает жизни пациента и здоровью окружающих;
4) необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
С целью профилактики и ранней диагностики необходимо обращать внимание на следующие аспекты:
Первичные симптомы
Опухоли вестибулярной области гортани могут протекать бессимптомно на ранних стадиях заболевания. Пациенты жалуются на парестезию, сухость, чувство инородного тела в горле, ощущение неудобства при глотании, позже к этим симптомам присоединяются боли при глотании, иррадиирущие в ухо на стороне поражения, затруднение глотания, при явлениях распада присоединяются неприятный (гнилостный) запах из рта, кровохарканье. При локализации опухоли в области голосового отдела гортани симптоматика появляется достаточно рано в виде изменений голоса (охриплость), кашля, реже кровохарканья. При прогрессировании заболевания развиваются явления стеноза, боль с иррадиацией в ухо на стороне поражения, неприятный (гнилостный) запах изо рта. Клиническое течение злокачественного новообразования подскладочного отдела гортани характеризуется ранним развитием затруднения дыхания. Наличие новообразований на шее.
Канцерогенные факторы: курение (в том числе пассивное), употребление алкоголя, контакт с асбестом, древесной пылью, продуктами нефтепереработки, воздействие ионизирующего облучения, ВПЧ.
Предопухолевые заболевания: хронический гипертрофический ларингит, пахидермия слизистой оболочки гортани, лейкоплакия слизистой оболочки гортани, дисплазия слизистой оболочки, гиперкератоз слизистой оболочки, полипы голосовых складок и папилломатоз гортани.
Для оценки риска наличия ЗНО возможно использование опросника (см. Приложение Г).
Диспансерное наблюдение
- Рекомендуется соблюдать следующую периодичность и методы наблюдения после завершения лечения: в 1-й год физикальный осмотр, сбор жалоб и инструментальные обследования по показаниям рекомендуется проводить каждые 1–3 мес, во 2-й год – с интервалом в 2–6 мес, на сроке 3–5 лет – 1 раз в 4–8 мес, после 5 лет с момента операции визиты проводятся 1 раз в год или при появлении жалоб, у пациентов с высоким риском рецидива или появлением жалоб перерыв между обследованиями может быть сокращен [3].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Объем обследования:
- анамнез и физикальное обследование;
- УЗИ ЛУ шеи с 2 сторон, органов брюшной полости и малого таза;
- КТ/МРТ шеи и головного мозга по показаниям, а также при недоступности зоны адекватному физикальному осмотру;
- фиброларингоскопия;
- прицельная рентгенография органов грудной клетки каждые 12 мес;
- КТ органов грудной полости, КТ\МРТ органов брюшной полости по показаниям
- Позитронная эмиссионная томография совмещенная с компьютерной томографией с туморотропными РФП с контрастированием ПЭТ/КТ A07.30.043.001 для оценки реализации эффекта индукционной ХТ - не ранее, чем, через 2-3 месяца; в остальных случаях - по показаниям;
- определение уровня тиреотропного гормона каждые 6–12 мес, в целях оценки функции щитовидной железы.
Информация
Источники и литература
-
Клинические рекомендации Ассоциации онкологов России
- Клинические рекомендации Ассоциации онкологов России - 1. Licitra, L., Bernier, J., Grandi, C., Locati, L., Merlano, M., Gatta, G., & Lefebvre, J.-L. (2003). Cancer of the larynx. Critical Reviews in Oncology/Hematology, 47(1), 65–80. 2. Злокачественные новообразования в России в 2015 году (заболеваемость и смертность). Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2017. С.18, 19, 142, 143 3. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®). Cancer of the Glottic Larynx. Cancer of the Supraglottic Larynx. Version 1.2020 4. Злокачественные опухоли головы и шеи. Под ред. М.А. Кропотова, С.О. Подвязникова, С.Б. Алиевой, А.М. Мудунова. Клинические рекомендации по лечению опухолей головы и шеи Общенациональной онкологической сети (США). М.: АБВ-пресс, 2011 5. Алиева С.Б., Алымов Ю.В., Кропотов М.А. и др. Рак гортани. Онкология. Клинические рекомендации. Под ред. М.И. Давыдова. М.: Издательская группа РОНЦ, 2015. С. 209–212 6. Jones T.M., De M., Foran B. et al. Laryngeal cancer: United Kingdom National Multidisciplinary guidelines. J Laryngol Otol 2016;130 (Suppl S2):S75–82 7. Fleming A.J. Jr, Smith S.P. Jr, Paul C.M. et al. Impact of [18F]-2-fluorodeoxyglucose-positron emission tomography/computed tomography on previously untreated head and neck cancer patients. Laryngoscope 2007;117:1173–9 8. Терапевтическая радиология: национальное руководство. Под ред. А.Д. Каприна, Ю.С. Мардынского. М.: ГЭОТАР-Медиа, 2018 9. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®). Cancer of the Glottic Larynx. Version 1.2020 10. Warner L., Chudasama J., Kelly C.G. et al. Radiotherapy versus open surgery versus endolaryngeal surgery (with or without laser) for early laryngeal squamous cell cancer. Cochrane Database Syst Rev 2014:Cd002027 11. Forastiere A.A., Goepfert H., Maor M. et al. Concurrent chemotherapy and radiotherapy for organ preservation in advanced laryngeal cancer. N Engl J Med 2003;349:2091–8 12. Pointreau, Y., Garaud, P., Chapet, S. et al. (2009). Randomized Trial of Induction Chemotherapy With Cisplatin and 5-Fluorouracil With or Without Docetaxel for Larynx Preservation. JNCI Journal of the National Cancer Institute, 101(7), 498–506 13. Grover, S., Swisher-McClure, S., Mitra, N., et al (2015). Total Laryngectomy Versus Larynx Preservation for T4a Larynx Cancer: Patterns of Care and Survival Outcomes. International Journal of Radiation Oncology*Biology*Physics, 92(3), 594–601 14. Zhan, C., Yang, X., Song, X., et al. (2018). Radiotherapy vs surgery for T1-2N0M0 laryngeal squamous cell carcinoma: A population-based and propensity score matching study. Cancer Medicine, 7(7), 2837–2847 15. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®). Cancer of the Supraglottic Larynx. Version 3.2019 16. Forastiere A.A., Zhang Q., Weber R.S. et al. Long-term results of RTOG 91-11: a comparison of three nonsurgical treatment strategies to preserve the larynx in patients with locally advanced larynx cancer. J Clin Oncol 2013;31:845–52 17. Стандарты лучевой терапии. Под ред. А.Д. Каприна, А.А. Костина, Е.В. Хмелевского. М.: ГЭОТАР-Медиа, 2019. С. 15–35 18. Болотина Л. В., Владимирова Л. Ю., Деньгина Н. В., Новик А. В., Романов И. С. Практические рекомендации по лечению злокачественных опухолей головы и шеи // Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2018 (том 8). С. 71– 82 19. Van der Laan HP, van de Water TA, van Herpt HE, et al. The potential of intensity-modulated proton radiotherapy to reduce swallowing dysfunction in the treatment of head and neck cancer: A planning comparative study // Acta Oncol. 2013. Vol. 52. P. 561-569 20. Jae-Sook Ahn, Sang-Hee Cho, Ok-Ki Kim et al. The Efficacy of an Induction Chemotherapy Combination with Docetaxel, Cisplatin, and 5-FU Followed by Concurrent Chemoradiotherapy in Advanced Head and Neck Cancer. Cancer Res Treat. 2007 Sep; 39(3):93-98 21. Vermorken J.B., Mesia R., Rivera F. et al. Platinum-based chemotherapy plus cetuximab in head and neck cancer. N Engl J Med 2008;359:1116–27 22. Schöffski, P., Catimel, G., Planting et al. (1999). Docetaxel and cisplatin: An active regimen in patients with locally advanced, recurrent or metastatic squamous cell carcinoma of the head and neck. Annals of Oncology, 10(1), 119–122 23. Gibson, M. K., Li, Y., Murphy, B., Hussain, M. H. A., DeConti, R. C., Ensley, J., & Forastiere, A. A. (2005). Randomized Phase III Evaluation of Cisplatin Plus Fluorouracil Versus Cisplatin Plus Paclitaxel in Advanced Head and Neck Cancer (E1395): An Intergroup Trial of the Eastern Cooperative Oncology Group. Journal of Clinical Oncology, 23(15), 3562–3567 24. Jacobs, C., Lyman, G., Velez-García, E. et al (1992). A phase III randomized study comparing cisplatin and fluorouracil as single agents and in combination for advanced squamous cell carcinoma of the head and neck. Journal of Clinical Oncology, 10(2), 257-263 25. Grau, J. josé, Caballero, M., et al (2009). Weekly paclitaxel for platin-resistant stage IV head and neck cancer patients. Acta Oto-Laryngologica, 129(11), 1294–1299 26. Catimel, G., Verweij, J., Mattijssen, V., et al (1994). Docetaxel (Taxotere®): An active drug for the treatment of patients with advanced squamous cell carcinoma of the head and neck. Annals of Oncology, 5(6), 533–537 27. Guardiola, E., Peyrade, F., Chaigneau, L. et al (2004). Results of a randomised phase II study comparing docetaxel with methotrexate in patients with recurrent head and neck cancer. European Journal of Cancer, 40(14), 2071–2076 28. Vermorken J.B., Trigo J., Hitt R. et al. Open-label, uncontrolled, multicenter phase II study to evaluate the efficacy and toxicity of cetuximab as a single agent in patients with recurrent and or metastatic squamous cell carcinoma of the head and neck who failed to respond to platinum-based therapy. J Clin Oncol 2007;25:2171–7 29. Martinez-Trufero J., Isla D., Adansa J.C. et al. Phase II study of capecitabine as palliative treatment for patients with recurrent and metastatic squamous head and neck cancer after previous platinum-based treatment. Br J Cancer 2010;102:1687–91 30. Ferris R., Blumenschein G., Fayette J. et al. Nivolumab for recurrent squamous-cell carcinoma of the head and neck. N Engl J Med 2016;375:1856–67 31. Cohen E. E. W. et al. Pembrolizumab versus methotrexate, docetaxel, or cetuximab for recurrent or metastatic head-and-neck squamous cell carcinoma (KEYNOTE-040): a randomised, open-label, phase 3 study //The Lancet. – 2019. – Т. 393. – №. 10167. – С. 156-167 32. Lindberg, R. (1972). Distribution of cervical lymph node metastases from squamous cell carcinoma of the upper respiratory and digestive tracts. Cancer, 29(6), 1446–1449 33. Dawson C., Pracy P., Patterson J., Paleri V. Rehabilitation following open partial laryngeal surgery: key issues and recommendations from the UK evidence based meeting on laryngeal cancer. J Laryngol Otol 2019;133(3):177–82 34. Clarke P., Radford K., Coffey M., Stewart M. Speech and swallow rehabilitation in head and neck cancer: United Kingdom National Multidisciplinary Guidelines. J Laryngol Otol 2016;130(S2):S176–80 35. Сытов А. В., Лейдерман И. Н., Ломидзе С. В., Нехаев И. В., Хотеев А. Ж. Практические рекомендации по нутритивной поддержке онкологических больных // Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2018 (том 8). С. 575–583 36. Zhao, S. G., Alexander, N. B., Djuric, Z., et al (2015). Maintaining physical activity during head and neck cancer treatment: Results of a pilot controlled trial. Head & Neck, 38(S1), E1086–E1096 37. Segal R., Zwaal C., Green E. et al. Exercise for people with cancer: a systematic review. Curr Oncol. 2017 Aug; 24(4): e290–e3138. Samuel S.R., Maiya G.A., Fernandes D.J. et al. Effectiveness of exercise-based rehabilitation on functional capacity and quality of life in head and neck cancer patients receiving chemo-radiotherapy. Support Care Cancer 2019 39. Mustian K.M., Alfano C.M., Heckler C. et al: Comparison of pharmaceutical, psychological, and exercise treatments for cancer-related fatigue: a meta-analysis. JAMA Oncol 2017;3:961–8 40. Kinkead B., Schettler P.J., Larson E.R. et al. Massage therapy decreases cancer-related fatigue: results from a randomized early phase trial. Cancer 2018;124(3):546–54 41. Streckmann F., Zopf E.M., Lehmann H.C. et al: Exercise intervention studies in patients with peripheral neuropathy: a systematic review. Sports Med 2014;44:1289–304 42. Rick O., von Hehn U., Mikus E. et al. Magnetic field therapy in patients with cytostatics-induced polyneuropathy: a prospective randomized placebo–controlled phase-III study. Bioelectromagnetics 2016:38(2):85–94 43. Ross M., Fischer-Cartlidge E. Scalp cooling: a literature review of efficacy, safety, and tolerability for chemotherapy-induced alopecia. Clin J Oncol Nurs 2017;21(2):226–33 44. Avci P., Gupta G.K., Clark J. et al. Low-level laser (light) therapy (LLLT) for treatment of hair loss. Lasers Surg Med 2013;46(2):144–51 45. Bensadoun R.J., Nair R.G. Low-level laser therapy in the management of mucositis and dermatitis induced by cancer therapy. Photomed Laser Surg 2015;33(10):487–91 46. Roopashri G. Radiotherapy and chemotherapy induced oral mucositis – prevention and current therapeutic modalities. IJDA 2010;2:174–9 47. Сопроводительная терапия в онкологии. Практическое руководство. Под ред. С.Ю. Мооркрафта, Д.Л.Ю. Ли, Д. Каннингэма. Пер. с англ. Под ред. А.Д. Каприна. М.: Гэотар, 2016. 432 c 48. Rosenthal D.I., Trotti A. Strategies for managing radiation-induced mucositis in head and neck cancer. Semin Radiat Oncol 2009;19:29–34, Pauloski B.R. Rehabilitation of dysphagia following head and neck cancer. Phys Med Rehabil Clin N Am 2008;9:889‒928 49. Self EM, Bumpous J, Ziegler C, Wilson L, Potts K. Risk factors for hemorrhage after chemoradiation for oropharyngeal squamous cell carcinoma. JAMA Otolaryngol Head Neck Surg. 2013 Apr;139(4):356-61. doi: 10.1001/jamaoto.2013.103. PMID: 23599070. 50. TaunkNK, HafftyBG, Kostis JB, Goyal S. Radiation-induced heart disease: pathologic abnormalities and putative mechanisms. Front Oncol. 2015 Feb 18;5:39. doi: 10.3389/fonc.2015.00039. PMID: 25741474; PMCID: PMC4332338.(Self EM, Bumpous J, Ziegler C, Wilson L, Potts K. Risk factors for hemorrhage after chemoradiation for oropharyngealsquamous cell carcinoma. JAMA Otolaryngol Head Neck Surg. 2013 Apr;139(4):356-61. doi: 10.1001/jamaoto.2013.103. PMID: 23599070.) 51. Sittel C, Gossmann A, Jungehu¨lsing M, Za¨hringer M. Superselective embolization as palliative treatment of recurrent hemorrhage in advanced carcinoma of the head and neck. Ann Otol Rhinol Laryngol. 2001;110(12):1126-1128. 52. Kumra V, Vastola AP, Keiserman S, Lucente FE. Spontaneous tonsillar hemorrhage. Otolaryngol Head Neck Surg. 2001;124(1):51-52. 53. Smith TP. Embolization in the external carotid artery. J VascIntervRadiol. 2006 Dec;17(12):1897-912; quiz 1913. doi: 10.1097/01.RVI.0000247301.64269.27. PMID: 17185685. 54. Kumar T, Yadav V, Ravi K, Ramaswamy K, Patel MH, Kothari K. External Carotid Artery Ligation in Squamous Cell Carcinomas of the Oral Cavity and Oropharynx: an Oncological Emergency. Indian J Surg. 2015 Dec;77(Suppl 3):850-2. doi: 10.1007/s12262-014-1035-4. Epub2014 Jan 23. PMID: 27011469; PMCID: PMC4775627 55. Machiels JP, Haddad RI, Fayette J, et al. Afatinib versus methotrexate as second-line treatment in patients with recurrent or metastatic squamous-cell carcinoma of the head and neck progressing on or after platinum-based therapy (LUX-Head & Neck 1): an open-label, randomised phase 3 trial. Lancet Oncol. 2015;16(5):583-594. doi:10.1016/S1470-2045(15)70124-5 56. Arends J. et al. Cancer cachexia in adult patients: ESMO Clinical Practice Guidelines. 2021. 57. Duguet A., Bachmann P., Lallemand Y. Summary report of the standards, options and recommendations for malnutrition and nutritional assessment in patients with cancer. Br J Cancer 2003;89(1):92–7. Снеговой А.В., Лейдерман И.Н., Салтанов А.И., Стрельчук В.Ю. Основные принципы и технологии клинического питания в онкологии: Методическое руководство для врачей. М., 2006. Bozzetti F., Bozzetti V. Efficacy of enteral and parenteral nutrition in cancer patients. Nestle Nutr Workshop Ser Clin Perform Programme 2005;10:127–39 58. Arends J. et al. Cancer cachexia in adult patients: ESMO Clinical Practice Guidelines. 2021 59. Roopashri G. Radiotherapy and chemotherapy induced oral mucositis – prevention and current therapeutic modalities. IJDA 2010;2:174–9 60. Сопроводительная терапия в онкологии. Практическое руководство. Под ред. С.Ю. Мооркрафта, Д.Л.Ю. Ли, Д. Каннингэма. Пер. с англ. Под ред. А.Д. Каприна. М.: Гэотар, 2016. 432 с. 61. Arends J. et al. Cancer cachexia in adult patients: ESMO Clinical Practice Guidelines. 2021; Muscaritoli M. et. al. ESPEN practical guideline: Clinical Nutrition in cancer. Clinical Nutrition 40 (2021) 2898-291362. Murdoch-Kinch CA, Zwetchkenbaum S. Dental management of the head and neck cancer patient treated with radiation therapy. J Mich Dent Assoc 2011;93:28-37; Epstein JB, Thariat J, Bensadoun RJ, et al. Oral complications of cancer and cancer therapy: from cancer treatment to survivorship. CA Cancer J Clin 2012;62:400-422. 63. Каприн А.Д., Абузарова Г.Р., с соавт. Новые клинические рекомендации Всемирной организации здравоохранения по терапии онкологической боли у взрослых и подростков. Исследования и практика в медицине. 2021;8(2):90-108. https://doi.org/10.17709/2410-1893- 2021-8-2-9
Информация
Список сокращений
AJCC – Американский объединенный комитет по раку (American Joint Committee on Cancer)
AUC (area under ROC curve) – площадь под ROC-кривой
ECOG – шкала оценки общего состояния онкологического пациента по версии Восточной объединенной группы онкологов
ENE – экстракапсулярная инвазия
ERAS – Enhanced recovery after surgery – ускоренное восстановление после операции
IMRT – лучевая терапия с модуляцией интенсивности (volumetric modulated arc therapy)
QUANTEC – практическое руководство для оценки дозолимитирующих параметров критических органов (quantitative analyses of normal tissue effects in the clinic)
VMAT – объемно-модулированная лучевая терапия (volumetric modulated arc therapy)
R0 – свободный от опухоли край резекции
R1 – микроскопическая остаточная опухоль
TNM (аббревиатура от tumor, nodus и metastasis) – международная классификация стадий развития раковых опухолей
в/в – внутривенный
ВПЧ – вирус папилломы человека КТ – компьютерная томография
ЛТ – лучевая терапия
ЛУ – лимфатический узел
ЛФК – лечебная физкультура
МРТ – магнитно-резонансная томография
НПФ – неблагоприятные прогностические факторы
ПХТ – полихимиотерапия
ПЭГ – перкутанная эндоскопическая гастростома
ПЭТ/КТ – позитронно-эмиссионная томография, совмещенная с компьютерной томографией
УДД – уровень достоверности доказательности
УУР – уровень убедительности рекомендации
ХБС – хронический болевой синдром
УЗИ – ультразвуковое исследование
ФУ – фторурацил**
ХЛТ – химиолучевая терапия
ХТ – химиотерапия
** – жизненно необходимые и важнейшие лекарственные препараты
Термины и определения
Надскладочный отдел гортани: гортанная поверхность надгортанника (включая верхушку), черпалонадгортанные связки, черпаловидные хрящи и межчерпаловидная область, часть надгортанника ниже подъязычной кости (фиксированный отдел), вестибулярные складки, гортанные желудочки.
Складочный отдел: голосовые складки, передняя комиссура, задняя комиссура.
Подскладочный отдел – от нижней поверхности голосовых складок до уровня первого кольца трахеи
Голосовой протез – специальное клапанное устройство, которое предназначено для восстановления голосовой функции и имплантируется посредством трахеопищеводного шунтирования.
Электрогортань – вибрирующий электронный аппарат, который прикладывается к подбородку и преобразует колебания мышц дна полости рта в голос. Недостатком этого метода является металлический, лишенный тембровой и эмоциональной окраски, голос.
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Факторами, влияющими на прогноз заболевания, являются:
- размер и распространенность первичной опухоли;
- степень дифференцировки опухоли;
- наличие/отсутствие периваскулярной, перилимфатической, периневральной инвазии;
- статус регионарных ЛУ (рN) (метастазы в ЛУ шеи вдвое снижают выживаемость пациентов);
- экстранодальное распространение опухоли;
- активность клеточной пролиферации (индекс Ki-67);
- статус краев резекции (R0–1).
Критерии оценки качества медицинской помощи
| № | Критерии качества | Уровень убедительности рекомендаций | Уровень достоверности доказательств |
|---|---|---|---|
| 1 | Выполнена биопсия опухоли гортани с последующим патолого-анатомическим исследованием биопсийного (операционного) материала в (при установлении диагноза) | А | 2 |
| 2 | Выполнено патолого-анатомическое исследование операционного материала(при хирургическом вмешательстве) | A | 2 |
| 3 | Выполнена профилактическая шейная лимфодиссекция при хирургическом вмешательстве при локализации опухоли в надскладочном отделе гортани | A | 2 |
| 4 | Проведена послеоперационная ПХТ при обнаружении опухоли в крае резекции и/или эктсракапсулярном распространении | А | 2 |
| 5 | Выполнено КТ/МРТ мягких тканей шеи и головного мозга с внутривенным контрастированием у пациентов с подозрением распространения опухоли на хрящи гортани, основание черепа и магистральные сосуды (при установлении диагноза). | A | 5 |
| 6 | Выполнено КТ органов грудной полости с внутривенным болюсным контрастированием или без него у пациентов с раком гортани при поражении регионарных лимфоузлов с целью исключения отдаленных метастазов. | B | 5 |
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
- Кропотов Михаил Алексеевич, д.м.н., заведующий отделением хирургическим отделением №10 опухолей головы и шеи ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России
- Раджабова Замира Ахмед-Гаджиевна, д.м.н., доцент РАН, заведующий отделением опухолей головы и шеи ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, доцент отделения дополнительного профессионального образования НМИЦ онкологии им. Н.Н. Петрова https://orcid.org/0000-0002-6895-0497
- Агабабян Татев Артаковна, заведующая отделением лучевой диагностики МРНЦ им. А.Ф. Цыба — филиала ФГБУ «НМИЦ радиологии» Минздрава России, к.м.н., Обнинск https://orcid.org/0000-0002-9971-3451
- Алиева Севил Багатуровна, д.м.н., ведущий научный сотрудник отделения радиационной онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
- Алымов Юрий Владимирович, к.м.н., врач-онколог отделения хирургических методов лечения №5 (эндокринной онкологии) НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, исполнительный директор Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи»; ORCID: https://orcid.org/0000-0002-6851-9867
- Артемьева Анна Сергеевна, к.м.н., врач-патоморфолог, руководитель научной лаборатории морфологии опухолей ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, доцент отделения дополнительного профессионального образования НМИЦ онкологии им. Н.Н. Петрова
- Бойко Анна Владимировна, д.м.н., профессор, заведующая отделением лучевой терапии с модификацией МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии» Минздрава России.
- Болотин Михаил Викторович, к.м.н., научный сотрудник отделения хирургического № 11 опухолей верхних дыхательно-пищеварительных путей ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
- Болотина Лариса Владимировна, д.м.н., доцент РАН, заведующая отделением химиотерапии МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии» Минздрава России. Председатель группы опухолей головы и шеи практических рекомендаций Российского общества клинической онкологии, член Правления.
- Виноградов Вячеслав Вячеславович, д.м.н., профессор, руководитель научно-клинического отдела лор-онкологии ФГБУ «Научно-клинический центр оториноларингологии» ФМБА России.
- Владимирова Любовь Юрьевна, д.м.н., профессор, руководитель отдела лекарственного лечения опухолей, ФГБУ «НМИЦ онкологии» МЗ РФ
- Геворков Артем Рубенович, к.м.н., с.н.с., врач-радиотерапевт отделения лучевой терапии с модификацией МНИОИ им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи»
- Гиршович Михаил Маркович, к.м.н., врач-радиотерапевт ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России; https://orcid.org/0000-0002-7925-9570
- Гулидов Игорь Александрович, заведующий отделом лучевой терапии МРНЦ им. А.Ф. Цыба- филиал ФГБУ «НМИЦ радиологии» Минздрава России
- Гузь Александр Олегович, к.м.н., врач-онколог, заведующий отделением опухолей головы и шеи ГБУЗ «Челябинский областной клинический центр онкологии и ядерной медицины»
- Дайхес Николай Аркадьевич, член-корр. РАН, д.м.н., профессор, директор ФГБУ «Научно-клинический центр оториноларингологии» ФМБА России.
- Дронова Екатерина Леонидовна, врач-радиолог ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
- Енгибарян Марина Александровна, д.м.н., заведующая отделением опухолей головы и шеи ФГБУ «НМИЦ онкологии» МЗ РФ, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
- Игнатова Анастасия Валерьевна, к.м.н., врач-онколог отделения хирургических методов лечения №5 НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи», ассистент кафедры общей и клинической стоматологии ФГАОУ ВО РУДН. ORCID: https://orcid.org/0000-0002-6796-0968
- Клименко Вероника Викторовна, к.м.н., врач клинико-диагностического отделения ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России; https://orcid.org/0000-0003-1079-4492
- Корниецкая Анна Леонидовна, к.м.н., старший научный сотрудник отделения химиотерапии отдела лекарственного лечения опухолей МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии» Минздрава России.
- Костромина Екатерина Викторовна, к.м.н., врач ультразвуковой диагностики, врач-рентгенолог отделения лучевой диагностики, научный сотрудник научного отделения диагностической и интервенционной радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» МЗ РФ, доцент кафедры лучевой диагностики и биомедицинской визуализации ФП и ДПО Санкт-Петербурского Государственного Педиатрического Медицинского Университета (СПбГПМУ), доцент кафедры радиологии, хирургии, онкологии ФГБУ "РНЦРХТ им. ак. А.М.Гранова" МЗ РФ; https://orcid.org/0000-0002-4245-687X
- Красильникова Лариса Анваровна, к.м.н., врач-цитолог ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России
- Кутукова Светлана Игоревна, д.м.н., доцент, ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова» Министерства здравоохранения Российской Федерации, СПб ГБУЗ «Городской клинический онкологический диспансер»
- Кульбакин Денис Евгеньевич, д.м.н., старший научный сотрудник, врач-онколог отделения опухолей головы и шеи НИИ онкологии Томского НИМЦ
- Мордовский Александр Валентинович – к.м.н., научный сотрудник отделения микрохирургии МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии» Минздрава России
- Мудунов Али Мурадович, д.м.н., профессор РАН, заведующий отделением хирургических методов лечения № 10 опухолей головы и шеи ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, президент Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи»
- Мусин Шамиль Исмагилович, к.м.н., заведующий хирургическим отделением N6 ГАУЗ РКОД Минздрава РБ
- Подвязников Сергей Олегович, д.м.н., профессор, ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, вице-президент Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
- Полькин Вячеслав Викторович, к.м.н. заведующий отделения лучевого и хирургического лечения заболеваний головы, шеи МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России
- Поляков Андрей Павлович, д.м.н., доцент, заведующий отделением микрохирургии МНИОИ им. П.А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи»
- Пономарева Ольга Игоревна, врач-рентгенолог отделения радиотерапии НМИЦ онкологии им. Н.Н. Петрова; https://orcid.org/0000-0002-7004-9630
- Решетов Игорь Владимирович, д.м.н., академик РАН, заведующий кафедрой онкологии, радиотерапии и реконструктивной хирургии Первого Московского медицинского университета им. И.М. Сеченова, президент Общероссийской общественной организации «Федерация специалистов по лечению заболеваний головы и шеи»
- Романов Илья Станиславович, д.м.н, старший научный сотрудник отделения онкоэндокринологии ФГБУ «НМИЦ Онкологии им. Н.Н. Блохина», доцент кафедры онкологии ФДПО, РНИМУ им Н.И. Пирогова
- Рубцова Наталья Алефтиновна, д.м.н., заведующая отделом лучевой диагностики МНИОИ им. П.А. Герцена – филиал «НМИЦ радиологии» Минздрава России. Главный внештатный специалист по лучевой и инструментальной диагностике Минздрава России по Центральному федеральному округу Российской Федерации.
- Рудык Андрей Николаевич, к.м.н., врач-онколог онкологического отделения №5 (опухолей головы и шеи) ГАУЗ «Республиканский клинический онкологический диспансер Министерства здравоохранения Республики Татарстан имени профессора М.З.Сигала», и.о. заведующего кафедрой челюстно-лицевой хирургии и хирургической стоматологии, доцент кафедры онкологии, радиологии и паллиативной медицины КГМА - филиал ФГБОУ ДПО РМАНПО Минздрава России, доцент кафедры хирургических болезней постдипломного образования ИФМиБ ФГАОУ ВО "Казанский (Приволжский) федеральный университет", г. Казань.
- Саприна Оксана Александровна, к.м.н., врач-онколог, отделение хирургиче- ское №11 опухолей головы и шеи ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Общероссийской общественной организации «Российское общество специа- листов по опухолям головы и шеи».
- Семиглазова Татьяна Юрьевна, д.м.н., профессор, заведующий научным отделом инновационных методов терапевтической онкологии и реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России
- Степанова Александра Михайловна, заведующая отделением реабилитации МНИОИ им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» Минздрава России
- Сукорцева Наталья Сергеевна, ассистент кафедры онкологии, реконструктивной хирургии и радиотерапии, врач онколог Университетской клинической больницы №1 Сеченовского университета
- Ткаченко Елена Викторовна, к.м.н., заведующий отделением краткосрочной противоопухолевой лекарственной терапии, научный сотрудник научного отдела инновационных методов терапевтической онкологии и реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, https://orcid.org/0000-0001-6375-8335
- Фалалеева Наталья Александровна, заведующий отделом лекарственного лечения злокачественных новообразований МРНЦ им. А.Ф. Цыба- филиал ФГБУ «НМИЦ радиологии» Минздрава России
- Феденко Александр Александрович, д.м.н., профессор РАН, заведующий Отделом лекарственного лечения опухолей МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России
- Хмелевский Евгений Витальевич, д.м.н., профессор, заведующий отделом лучевой терапии МНИОИ им. П. А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России, врач-радиотерапевт МНИОИ им. П. А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России.
- Ходжибекова Малика Маратовна, д.м.н., врач-радиолог отделения радионуклидной диагностики МНИОИ им. П.А. Герцена – филиал «НМИЦ радиологии» Минздрава России.
- Цырлина Евгения Владимировна, к.м.н., врач-эндокринолог отделения функциональной диагностики ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России
- Чойнзонов Евгений Лхамацыренович, д.м.н., академик РАН, директор НИИ онкологии Томского НИМЦ, заведующий отделением опухолей головы и шеи НИИ онкологии Томского НИМЦ, заведующий кафедрой онкологии ФГБОУ ВО СибГМУ Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи»
-
Яковлева Лилия Павловна, к.м.н., врач-онколог, заведующая центром диагностики и лечения опухолей головы и шеи ГБУЗ МКНЦ имени А.С. Логинова МЗ РФБлок Организация оказания медицинской помощи
- Геворкян Тигран Гагикович, заместитель директора ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России
- Иванов Сергей Анатольевич, д.м.н., профессор РАН, директор МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России
- Невольских Алексей Алексеевич, д.м.н., заместитель директора по лечебной работе МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России.
- Хайлова Жанна Владимировна, к.м.н., заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России.
Конфликт интересов отсутствует.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
- врачи –онкологи;
- врачи-хирурги;
- врачи-радиологи;
- студенты медицинских вузов, ординаторы и аспиранты.
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
| УДД | Расшифровка |
|---|---|
| 1 | Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
| 2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа |
| 3 | Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая |
| 5 | Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 3. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
| УДД | Расшифровка |
|---|---|
| 1 | Систематический обзор рандомизированных клинических исследований с применением метаанализа |
| 2 | Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа |
| 3 | Нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай–контроль» |
| 5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 4. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
| УУР | Расшифровка |
|---|---|
| A | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
| B | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
| C | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию не реже чем 1 раз в 3 года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным Клиническим рекомендациям, но не чаще 1 раза в 6 мес.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Отсутствуют
Приложение Б. Алгоритмы действий врача
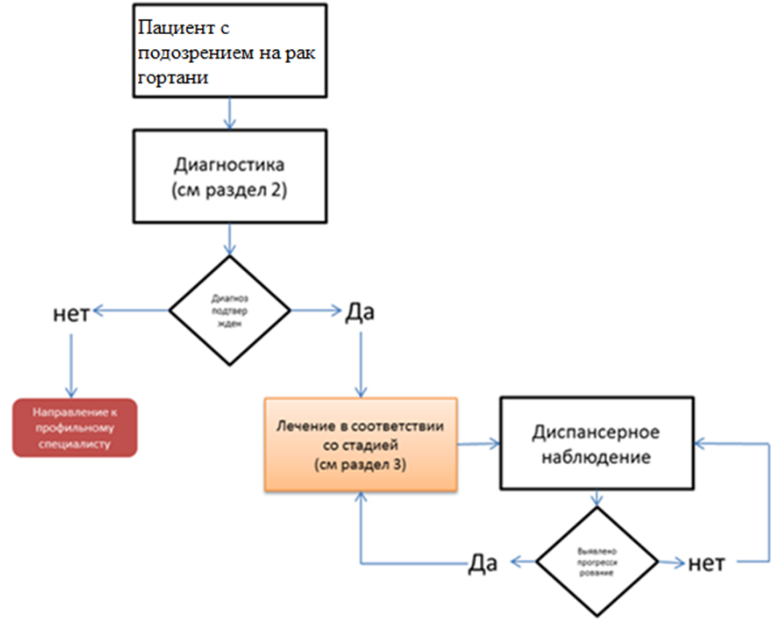

Приложение В. Информация для пациента
Рекомендации по наблюдению после завершенного лечения
Наблюдение после завершенного лечения имеет важное значение для поддержания здоровья пациента. Обычно в первые 1–2 года наблюдаться у врача-онколога рекомендуется с частотой в 1–3 мес, во 2-й год – 2–6 мес, на сроке 3–5 лет – 1 раз в 4–8 мес. После 5 лет с момента операции визиты проводятся ежегодно или при появлении жалоб. Тем не менее частота визитов к врачу может быть увеличена в зависимости от характеристик заболевания и ассоциированных рисков и оговаривается индивидуально в каждом конкретном случае. При появлении жалоб, а также возобновлении симптомов, отмечавшихся до лечения, необходимо незамедлительно обратиться к врачу, не дожидаясь очередного срока запланированного визита.
Целью визитов является контроль не только онкологического заболевания, но и побочных эффектов, в том числе отсроченных (например, гипотиреоз после проведенной ЛТ на область шеи, снижения нутритивного статуса, оценка речевой и глотательной функции и т.д.).
Рекомендации относительно образа жизни и питания должны быть индивидуализированы с учетом объема проведенного лечения, рисков и выраженности осложнений, особенностей пациента.
Преимущества отказа от табакокурения и потребления алкоголя:
– более высокие показатели выживаемости;
– большая эффективность лечения;
– меньшее количество и выраженность побочных эффектов противоопухолевого лечения (сердечно-легочные осложнения, утомляемость, снижение массы тела, мукозиты, потеря вкуса);
– ускоренное восстановление общего состояния после лечения;
– ниже риск рецидива;
– меньший риск вторых опухолей;
– меньший риск инфекций;
– выше качество жизни.
Рекомендуется при осложнениях ХТ/ХЛТ – связаться с химиотерапевтом, радиологом.
1. При повышении температуры тела до 38 °C и выше:
- начать прием антибиотиков (J01: Антибактериальные препараты системного действия): по назначению врача.
2. При стоматите:
- диета – механическое, термическое щажение;
- частое полоскание рта (каждый час) – ромашки аптечной цветки, дуба кора, шалфей лекарственного листья, смазывать рот облепиховым (персиковым) маслом;
- обрабатывать полость рта по назначению врача.
3. При диарее:
- диета – исключить жирное, острое, копченое, сладкое, молочное, клетчатку. Можно нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье;
- принимать препараты по назначению врача.
4. При тошноте:
- принимать препараты по назначению врача
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Шаблон включения клинических шкал оценки, вопросников и других оценочных инструментов состояния пациента
Название на русском языке: Вопросник при первичном обращении пациента к врачу первичной лечебной сети в рамках онконастороженности
Оригинальное название (если есть): нет
Источник (официальный сайт разработчиков, публикация с валидацией): https://oncology-association.ru/
Тип (подчеркнуть): вопросник
Назначение: оценка вероятности наличия злокачественных новообразований у пациента
Оценочный инструмент, содержание:
Вопросник при первичном обращении пациента к врачу первичной лечебной сети в рамках онконастороженности (выбрать правильные ответы, нужное подчеркнуть, при необходимости вписать)
Дата заполнения:
Ф.И.О.:
1. У Вас есть профессиональная вредность на работе?
1. Нет
2. Есть
2. Сколько лет Вы работаете/работали с профессиональной вредностью?
1. До 1 года 4. 6–10 лет
2. До 3 лет 5. Более 10 лет
3. От 3 до 5 лет 6. Более 15 лет
3. Ваши близкие родственники болели или болеют онкологическими заболеваниями лор-органов?
1. Нет
2. Болел или болеет
3. Не знаю
4. Вы курите (или курили)?
1. Нет 4. Стаж курения менее 10 лет
2. Да 5. Стаж курения 10–15 лет
3. Более 20 сигарет в день 6. Стаж курения более 20 лет
5. Вы заметили снижение своей массы тела за последний период времени?
1. Нет 3. Да, более чем на 5 кг
2. Не знаю 4. Да, я соблюдал диету
6. Вас беспокоят повышенная слабость и утомляемость, неадекватная нагрузкам?
1. Нет
2. Более 1 мес
3. Более 6 мес
7. Вас беспокоит повышенная общая потливость, возможно усиливающаяся в ночное время?
1. Нет
2. Да, появилась в течение последних 6–12 мес
3. Беспокоила всегда
8. У Вас отмечается бледность или изменение цвета кожных покровов?
1. Нет
2. Да
3. Не знаю
9. Вы отмечали в последнее время появление увеличенных лимфатических узлов или других припухлостей на шее?
1. Нет
2. Да, безболезненные
3. Да, болезненные
10. У Вас есть на коже лица, головы и шеи новообразования или длительно незаживающие язвы?
1. Нет
2. Да
3. Если да, что именно? (впишите свои варианты)
11. Вы заметили в последняя время деформацию лица за счет появившихся образований или припухлостей (изменение формы носа, глаз и т.д.)?
1. Нет
2. Да
3. Если да, что именно? (впишите свои варианты)
12. Вас беспокоит длительный кашель или покашливания?
1. Нет 3. С мокротой
2. Да 4. С примесью крови
13. Вас беспокоит охриплость?
1. Нет 3. В течение последнего месяца постоянно
2. Периодически 4. Да, не обследовался и не лечился
5. Да, проведенное лечение без эффекта
14. Вас беспокоит затруднение дыхания через естественные дыхательные пути?
1. Нет 4. Затруднение дыхание отмечается в покое
2. Иногда 5. При незначительной физической нагрузке
3. Часто 6. При значительной физической нагрузке
15. Вас беспокоит «ощущение кома или инородного тела» в горле?
1. Нет
2. Иногда
3. Часто или постоянно
16. Вас беспокоят неприятный привкус во рту и/или запах изо рта?
1. Нет
2. Иногда
3. Часто или постоянно
17. Вас беспокоят нарушения глотания пищи?
1. Нет 4. Акт глотания болезненный
2. Да, только жидкой пищи 5. Во время приема пищи появляется поперхивание и кашель
3. Да, только твердой пищи 6. В течение последнего месяца
7. Более 3 мес
18. Вас беспокоит затруднение носового дыхания?
1. Нет 4. Затруднение носового дыхание с обеих сторон
2. Редко 5. Затруднение носового дыхание справа/слева
3. Часто (постоянно) 6. Носовое дыхание отсутствует с обеих сторон
7. Носовое дыхание отсутствует справа/слева
19. Оцените свое обоняние?
1. В норме 4. С обеих сторон
2. Снижено 5. Справа/слева
3. Отсутствует
20. Вас беспокоят выделения из носа и/или стекание слизи по задней стенке глотки?
1. Нет 4. Слизистые или прозрачные
2. Редко 5. Гнойные с неприятным запахом
3. Часто (постоянно) 6. Кровянистые
21. Ощущаете ли Вы дискомфорт или болезненность лица в проекции придаточных пазух носа?
1. Нет
2. Редко
3. Часто (постоянно)
22. Появилось ли в последнее время в полости носа или в горле какое-либо новообразование?
1. Нет 3. Безболезненное
2. Да 4. Болезненное
5. Кровоточащее
Ключ (интерпретация): Утвердительные ответы на вопросы с 1-ого по 8-ой, при наличии симптоматики, описанной в вопросах с 9 по 23, позволяют заподозрить опухолевое заболевание; при этом требуется детальное обследование пациента профильными специалистами.
Приложение Г2. Шкала ECOG (0–4 балла)
Название на русском языке: Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG
Оригинальное название: The Eastern Cooperative Oncology Group/World Health Organization Performance Status (ECOG/WHO PS)
Источник (официальный сайт разработчиков, публикация с валидацией): https://ecog-acrin.org/resources/ecog-performance-status
Oken MM, Creech RH, Tormey DC, Horton J, Davis TE, McFadden ET, Carbone PP: Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982, 5(6):649-655
Тип: шкала оценки
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т. д.).
Содержание:
| Балл | Описание |
|---|---|
| 0 | Пациент полностью активен, способен выполнять все, как и до заболевания (90–100 % по шкале Карновского) |
| 1 | Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу, 70–80 % по шкале Карновского) |
| 2 | Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50 % времени бодрствования проводит активно – в вертикальном положении (50–60 % по шкале Карновского) |
| 3 | Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50 % времени бодрствования (30–40 % по шкале Карновского) |
| 4 | Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели (10–20 % по шкале Карновского) |
| 5 | Смерть |
Ключ (интерпретация): приведен в самой шкале
ПриложениеГ3. ШКАЛА NRS 2002
Название на русском языке: Шкала оценки нутритивного статуса пациентов
Оригинальное название: Nutrition Risk Screening 2002 (NRS-2002)
Тип: шкала оценки
Назначение: оценка нутритивного статуса стационарного пациента
Содержание:
Первичный скрининг
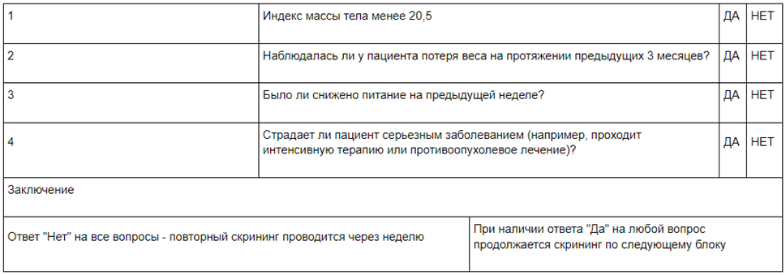

Финальный скрининг
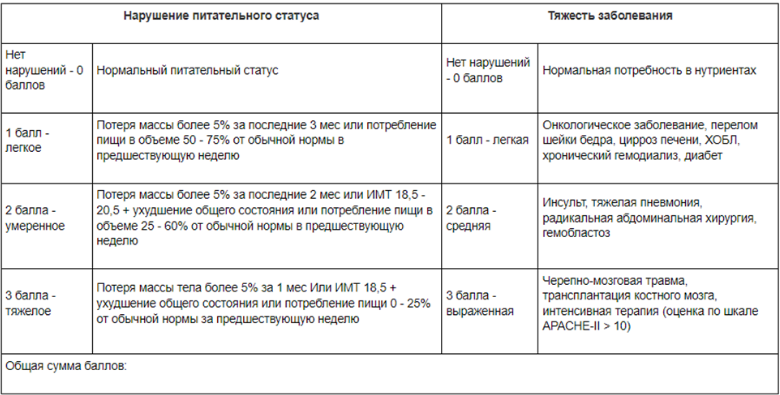

Ключ:
1. Возраст пациента 70 и более лет - прибавить 1 балл к общей сумме.
2. Более 3 балов - высокий риск питательной недостаточности, требующий разработки программы нутритивной поддержки.
3. Менее 3 баллов - повторный скрининг каждую неделю. Если планируется оперативное лечение, то необходима программа предоперационной подготовки.
Приложение Г4. Шкала MUST
Название на русском: Универсальный инструмент скрининга недостаточности питания
Оригинальное название: Malnutrition Universal Screening Tool
Источник: https://www.bapen.org.uk/must-and-self-screening/must-calculator/
Тип: шкала оценки
Назначение: оценка нутритивного статуса на амбулаторном этапе
Содержаниие:
| Скрининговая часть (А-Е) | ||
|---|---|---|
| А | Снизилось за последние 3 месяца количество пищи, которое вы съедаете, из-за потери аппетита, проблем с пищеварением, из-за сложностей при пережевывании и глотании? |
-Серьезное уменьшение количества съедаемой пищи -0 баллов
-умеренное уменьшение- 1 балл
-нет уменьшения количества съедаемой пищи -2 балла
|
| Б | Потеря массы тела за последние 3 месяца |
Потеря массы тела более, чем на 3 кг-0 баллов
Не знаю-1 балл
Потеря массы тела от 1 до 3 кг- 2 балла
Нет потеря массы тела-3 балла
|
| В | Подвижность |
Прикован к кровати/стулу- 0 баллов
Способен вставать с кровати/стула, но не выходит из дома-1 балл
Выходит из дома- 2 балла
|
| Г | Острое заболевание (психологический стресс) за последние 3 месяца |
Да-0 баллов
Нет- 2 балла
|
| Д | Психоневрологические проблемы |
Серьезное нарушение памяти или депрессия- 0 баллов
Умеренное нарушение памяти-1 балл
Нет нейропсихологических проблем-2 балла
|
| Е | Индекс массы тела |
Меньше 19 кг/м3 -0 баллов
19-20 кг/м3 —1 балл
21-22 кг/м3 – 2 балла
23 кг/м3 и выше-3 балла
|
|
Сумма баллов за скрининговую часть:_______/14
Интерпретация:
Если сумма баллов за скрининговую часть составила 12-14 баллов- нормальный пищевой статус.
Если сумма баллов по скрининговой части составила менее 12 баллов- продолжить опрос далее
|
||
| Ж | Живет независимо (не в доме престарелых или в больнице) |
Нет—0 баллов
Да—1 балл
|
| З | Принимает более трех лекарств в день |
Да— 0 баллов
Нет—1 балл
|
| И | Пролежни и язвы кожи |
Да—0 баллов
Нет—1 балл
|
| К | Сколько раз в день пациент полноценно питается |
1 раз—0 баллов
2 раза —1 балл
3 раза—2 балла
|
| Л |
Маркеры потребления белковой пищи:
Одна порция молочных продуктов (1 порция= 1 стакан молока, 60г творога, 30 г сыра, ¾ стакана йогурта) в день (да/нет)
|
если 0-1 ответ «да»- 0 баллов
если 2 ответа «да»- 0,5 баллов
если 3 ответа «да»- 1 балл
|
|
Две или более порции бобовых и яиц в неделю (1 порция= 200г бобовых, 1 яйцо)
(да/нет)
|
||
| Мясо, рыба или птица каждый день (да/нет) | ||
| М | Съедает две или более порций фруктов или овощей в день (1 порция =200 г овощей, 1 любой фрукт среднего размера) |
Нет-0 баллов
Да- 1 балл
|
| Н | Сколько жидкости выпивает в день |
Меньше 3 стаканов- 0 баллов,
3-5 стаканов-0,5 балла
Больше 5 стаканов- 1 балл
|
| О | Способ питания |
Не способен есть без помощи- 0 баллов
Ест самостоятельно с небольшими трудностями- 1 балл
Ест самостоятельно-2 балла
|
| П | Самооценка состояния пациента |
Оценивает себя как плохо питающегося- 0 баллов
Оценивает свое состояние питания неопределенно- 1 балл
Оценивает себя, как не имеющего проблем с питанием- 2 балла
|
| Р | Состояние здоровья в сравнении с другими людьми своего возраста |
Не такое хорошее – 0 баллов
Не знает-0,5 балла
Такое же хорошее- 1 балл
Лучше-2 балла
|
| С | Окружность по середине плеча |
20 см и меньше- 0 баллов
21-22 см- 0,5 балла
23 и больше- 1 балл
|
| Т | Окружность голени |
Меньше 31 см -0 баллов
31 см и больше- 1 балл
|
Общий балл:_____________/30
Ключ: Интерпретация результатов (полная шкала от А до Т):
>23,5 баллов — нормальный пищевой статус
17–23,5 баллов — риск недостаточности питания (мальнутриции)
<17 баллов — недостаточность питания (мальнутриция).
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.