Психические и поведенческие расстройства, вызванные употреблением психоактивных веществ. Синдром отмены психоактивных веществ (кроме алкоголя и никотина)
 Версия: Клинические рекомендации РФ 2024 (Россия)
Версия: Клинические рекомендации РФ 2024 (Россия)
Общая информация
Краткое описание
- Общественная организация "Российское общество психиатров"
Одобрено Научно-практическим Советом Минздрава РФ
В соответствии с Правилами поэтапного перехода медицинских организаций к оказанию медицинской помощи на основе клинических рекомендаций, разработанных и утвержденных в соответствии с частями 3, 4, 6 –9 и 11 статьи 37 Федерального закона «Об основах охраны здоровья граждан в Российской Федерации», утвержденных постановлением Правительства Российской Федерации от 19.11.2021 № 1968 с изменения, клинические рекомендации применяются следующим образом:
– размещенные в Рубрикаторе после 1 января 2024 года – с 1 января 2025 года.
Год утверждения (частота пересмотра): 2024
Возрастная категория: Взрослые, Дети
Пересмотр не позднее: 2026
Определение заболевания или состояния (группы заболеваний или состояний)
Синдром отмены (англ. – withdrawal) – это группа симптомов различного сочетания и степени тяжести, возникающих у больных с синдромом зависимости (далее – СЗ) при полном прекращении приёма или снижении дозы психоактивного вещества (далее – ПАВ) после неоднократного, обычно длительного и/или в высоких дозах его употребления. Начало и течение синдрома отмены (далее – СО) ограничены во времени и соответствуют типу ПАВ и дозе, непосредственно предшествующей воздержанию. Исключением является СЗ от галлюциногенов, для которого СО не характерен [1].
Синонимы: абстинентный синдром, абстинентное состояние, вызванное употреблением ПАВ.
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
СО является частью СЗ и кодируется самостоятельно в том случае, когда он является непосредственной причиной обращения к врачу-специалисту в случае выраженной тяжести расстройств [1].
F1x.3x – Абстинентное состояние (синдром отмены)
Вид употребляемого ПАВ уточняется третьим знаком. В случаях, когда пациенты употребляют более чем один вид ПАВ, диагноз расстройства должен быть установлен по отношению к отдельному ПАВ или классу веществ, приведшему к существующему расстройству. При возникновении сомнений расстройство кодируется по веществу или его типу, злоупотребление которым случалось наиболее часто, в особенности в случаях постоянного или ежедневного употребления. Только в случаях, когда система приема ПАВ хаотична и неопределенна, или если последствия употребления различных ПАВ неразделимо смешаны, следует использовать код F19 (Таблица 1).
Таблица 1. Формализация диагноза по МКБ-10
|
Код |
Соответствие коду |
|---|---|
|
F11.3 |
СО опиоидов |
|
F12.3 |
СО каннабиноидов |
|
F13.3 |
СО седативных или снотворных веществ |
|
F14.3 |
СО кокаина |
|
F15.3 |
СО других стимуляторов, включая кофеин**[1] |
|
F16.3 |
СО галлюциногенов |
|
F18.3 |
СО летучих растворителей |
|
F19.3 |
СО сочетания нескольких ПАВ |
Наличие или отсутствие осложнений СО уточняется пятым знаком:
F1x.30. неосложненное
F1x.31. с судорожными припадками
F1х.39. БДУ (без дополнительных уточнений)
[1] ** – данным символом обозначены лекарственные препараты, входящие в перечень ЖНВЛП.
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
В зависимости от степени выраженности клинических проявлений СО выделяют четыре варианта тяжести – легкий, средний, среднетяжелый и тяжелый. В большинстве случаев такая оценка носит субъективный характер. Исключением является СО опиоидов, степень тяжести которого объективизируется при помощи клинической шкалы тяжести синдрома отмены опиатов – Clinical Opiate Withdrawal Scale (далее – COWS) [12].
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
В результате систематически повторяющейся интоксикации ПАВ в головном мозге (далее – ГМ) активируются механизмы восстановления нарушенного гомеостаза: за счет функциональной перестройки нейромедиаторных систем происходит становление новой адаптации, лежащей в основе СЗ [2-3]. Доказано, что этот механизм един для разных ПАВ, в нем преимущественно задействованы:1) катехоламиновая (дофаминэргическая), 2) эндогенная опиоидная, 3) ГАМК-ергическая (ГАМК – гамма-аминомасляная кислота), 4) глутаматергическая, 5) метиласпартатная, 6) эндогенная каннабиноидная системы [2; 4-7]. При этом существуют некоторые особенности участия данных систем в развитии зависимости от ПАВ разных классов. При прекращении употребления ПАВ баланс вновь нарушается, проявляясь токсикогенной симптоматикой СО, противоположной фармакологическим эффектам ПАВ [2; 4; 7].
Длительное употребление ПАВ вызывает истощение компонентов данных медиаторных систем с компенсаторным увеличением активности их синтеза и ингибированием ферментов распада (моноаминооксидаза и дофамингидроксилаза). Резкое прекращение приема ПАВ способствует приостановке выброса катехоламинов (далее – КА) из депо, однако их биосинтез остается усиленным, что способствует накоплению нейромедиаторов, особенно в ткани ГМ. Общие симптомы при СО разных ПАВ отражает основное патогенетическое звено, а различия в СО, придающих им специфичность определяются различием спектра действия отдельных ПАВ. Норадренергические (далее – НА) и серотонинергические нейромедиаторные системы в большей степени вовлечены в поддержание вегетативно-соматических, а дофаминоергические – психопатологических симптомов СО разных ПАВ [2; 4; 7].
Патогенез СО опиоидов основывается на внезапном ослаблении опиоидергической передачи, что немедленно вызывает адаптационные перестройки сопряженных катехоламинергических, глутоматергических, ГАМК-ергических, холинергических нейромедиаторных систем и усиление активации областей ГМ, которые подавлялись при действии опиоидных агонистов. Ключевую роль в патогенезе СО опиоидов играют нарушения взаимодействия между опиоидной и норадренергической системами в голубом пятне (locus coeruleus). При развитии СО происходит активация цАМФ и протеинкиназы А, прекращается ингибирующее действие на голубое пятно, что приводит к повышению активности и повышению выброса НА из голубого пятна, что проявляется симптомами СО – слезотечением, тахикардией, мидриазом, тревогой, болями в мышцах, диареей, возбуждением [3].
При СО каннабиноидов основная роль принадлежит каннабиноидным рецепторам, которые распределены неодинаково в разных участках мозга. Большинство из них расположено в базальных ядрах, гиппокампе и коре ГМ [2; 4; 7].
Патогенез СО от седативных или снотворных средств (далее – СиСС) близок к патогенезу СО алкоголя и также связан с влиянием на системы 1–4 (см. информацию выше) [2; 4; 7].
Патогенез СО галлюциногенов связан с нарушением серотонинергической передачи. Галлюциногены имеют структуру, сходную с серотонином. Выраженность галлюциногенного действия коррелирует со степенью сродства к постсинаптическому 5-НТ2-рецептору. Галлюциногены способны угнетать спонтанную активность самих серотонинергических нейронов. За счет этого уровень нейромедиатора в центральной нервной системе (далее – ЦНС) не только не понижается, но, напротив, существенно возрастает. В результате происходит смещение баланса процессов торможения и возбуждения внутри самой серотонинергической системы [2; 4; 7].
Механизм действия ингалянтов и звенья патогенеза СЗ от ингалянтов до конца пока не ясны. Имеются указания на схожесть действия отдельных ингалянтов с эффектом этанола. Они основаны на стимуляции ГАМК [8] и глицин-А1 рецепторов, а также на ингибировании N-метил-D-аспартат рецепторов, приводящих к подавлению ЦНС [9].
С клинической точки зрения каждый рецептор можно рассматривать как мишень воздействия только одного нейротрансмиттера. Следовательно, дифференциальная диагностика СО строится на понимании роли каждого нейротрансмиттера [2].
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
СО является наиболее частой причиной обращения за специализированной медицинской помощью, поэтому о его распространенности судят исходя из общей распространенности СЗ от ПАВ. Во всем мире около 36,3 миллионов человек (~ 0,7% мирового населения в возрасте 15–64 лет) страдают от расстройств, связанных с употреблением ПАВ и нуждаются в лечении [10]. В России в 2022 году было зарегистрировано 229743 больных с СЗ от наркотиков или 157,8 на 100 тыс. населения, что на 1,2% больше в сравнении с предыдущим годом. За стационарной помощью в 2022 году обратилось 62328 пациентов или 42,8 на 100 тыс. населения, что на 8,4% больше в сравнении с предыдущим годом [11].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клиническая картина СО ПАВ включает в себя [2; 7]:
1) токсикогенную симптоматику, представленную неспецифичными постинтоксикационными расстройствами, такими как головная боль, разбитость, слабость, чувство дискомфорта и др. Эти симптомы, как правило, диаметрально противоположны прямому фармакологическому эффекту потребляемого ПАВ (например, опиоиды обладают обезболивающим действием; в СО будет развиваться боль);
2) нозологически специфичную аддиктивную симптоматику, представленную патологическим влечением к ПАВ – сильным желанием употребить вещество, а также психопатологическими расстройствами в виде внутренней напряжённости, раздражительности, дисфории, подавленности и др.;
3) признаки обострения разнообразной латентной патологии – органической недостаточности ГМ, нарушениями функции печени и др., связанными как с сопутствующими заболеваниями, так и с накопившимися соматическими последствиями в результате систематической интоксикации ПАВ [2; 7].
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Основное значение при постановке диагноза СО имеет клиническая диагностика, состоящая из сбора жалоб, анамнеза и анализа полученных данных. Остальные виды диагностики играют второстепенную роль [2; 7; 13; 14].
Критерии установления диагноза заболевания/состояния. Диагноз СО может быть установлен при наличии [1]:
1. объективных данных о недавнем прекращении приема или снижении доз ПАВ после его употребления в течение длительного времени и/или в высоких дозах;
2. симптомы и признаки соответствуют известным характеристикам состояния отмены конкретного вещества или веществ;
3. имеющиеся симптомы не обусловлены медицинским расстройством, не имеющим отношение к употреблению ПАВ, и не могут лучше объяснены другим психическим или поведенческим расстройством.
1. Жалобы и анамнез
СО опиоидов (F11.3)
-
Рекомендуется у всех пациентов с подозрением на СО опиоидов для верификации диагноза при выяснении жалоб и сборе анамнеза, помимо соответствия общим критериям СО, обращать внимание на присутствие следующих признаков [1]:
— сильное желание принять опиоиды;
— ринорея или чихание;
— слезотечение;
— мышечные боли или судороги;
— абдоминальные спазмы; тошнота или рвота;
— диарея;
— расширение зрачков (мидриаз);
— образование "гусиной кожи", периодический озноб;
— тахикардия или артериальная гипертензия;
— зевота;
— беспокойный сон;
— дисфория.
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5).
Комментарии: При СЗ от опиоидов формирование СО происходит стремительно: уже через 2-4 недели систематического употребления появляются первые признаки СО [7].
СО опиоидов развивается через 6-24 ч после последнего употребления наркотика. Время развития СО зависит от вида опиоидов (при употреблении уличного метадона, появление СО отсрочено на 2-5 дней), либо от примесей, входящих в наркотик (производные бензодиазепина, антигистаминные средства удлиняют время появления первых признаков СО и пролонгируют его длительность). Относительно специфическим характером при СО опиоидов обладает болевой синдром [2].
Пациенты с СО опиоидов, как правило, не скрывают осознанное, часто непреодолимое влечение к наркотику. Нередко они неуправляемы, непредсказуемы, возрастает опасность агрессивных действий, в т.ч. аутоагрессии [2; 7].
Тяжело протекает СО у пациентов с длительной, постоянной формой приема метадона, реже героина (более 3-4 лет), большой продолжительностью заболевания (более 10 лет), сопутствующими соматическими и неврологическими заболеваниями. При этом у больных дополнительно наблюдаются: акатизия, гипертермия, лабильность артериального давления (далее – АД) и частоты сердечных сокращений (далее – ЧСС), тревога, чувство страха, бессонница [2; 7].
Развитие делириозных состояний и судорожного синдрома для СО опиоидов не характерно. Если эти осложнения и развиваются, то крайне редко – при применении блокаторов (антагонистов) опиоидных рецепторов (налтрексона**), определенной коморбидной патологии или сочетанном употреблении других ПАВ [2; 7].
В случае слишком раннего использования антагонистов (налтрексона**, налоксона** и налмефена) или парциальных агонистов (бупренорфина**) опиоидных рецепторов, когда полные агонисты опиоидных рецепторов еще циркулируют в организме человека, развивается спровоцированный СО опиоидов (англ. – precipitated withdrawal). Спровоцированный СО опиоидов характеризуется резким началом, короткой продолжительностью и более выраженной симптоматикой [3].
СО каннабиноидов (F12.3)
-
Рекомендуется у всех пациентов с подозрением на СО каннабиноидов для верификации диагноза при выяснении жалоб и сборе анамнеза помимо соответствия общим критериям СО обращать внимание на присутствие следующих признаков [1]:
— желание принять каннабиноиды;
— астения, апатия, гипобулия;
— сниженное настроение;
— тревога, раздражительность;
— тремор и мышечные боли.
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5).
Комментарии: Формирование СО при систематическом регулярном употреблении каннабиноидов, составляет не менее 2-3 лет. СО развивается через 4-5 часов после последнего употребления наркотика, достигая своего пика на 3-5-е сутки. Длительность СО в среднем составляет 14 суток [2; 7; 15].
На начальном этапе СО представлен преимущественно астеническим симптомокомплексом с явлениями аффективной лабильности, повышенной утомляемости. Отмечаются сонливость и вялость в течение дня с нарушением засыпания в вечерние часы. Вегетативные реакции отличаются разнообразием: головные боли сдавливающего, иногда пульсирующего характера, колющие боли в области сердца, желудка, сердцебиение, гипертензия, учащение и лабильность пульса, стойкий красный дермографизм, гипергидроз. Неврологически определяются тремор, оживление сухожильных рефлексов, подергивание отдельных мышечных пучков. Отмечается снижение аппетита. Основными симптомами являются раздражительность, стойкие головные боли, снижение работоспособности. При употреблении препаратов конопли с низким содержанием тетрагидроканнабинола клиника СО ограничивается легкими астеническими расстройствами.
При утяжелении и прогрессировании заболевания усложняется и картина СО. Астеническая симптоматика сменяется астенодепрессивной, могут наблюдаться тяжелые расстройства настроения, безразличие, апатия, подавленность, гнетущая тоска с тягостным чувством сдавления в области сердца, неопределенными ощущениями в животе. Развивается упорная бессонница. Мысли о бесперспективности своего будущего, неверие в возможность прекратить прием наркотиков и успех лечения сопровождаются идеями малоценности и суицидальными высказываниями. Суицидальные попытки чаще демонстративные, но могут быть и истинными. Появление тревоги в картине СО указывает на возможность развития абстинентного психоза. В дальнейшем к могут присоединяться сенестопатии и парестезии. Превалируют жалобы на неприятные, тягостные ощущения онемения и похолодания конечностей, чувство сдавления в груди, спазмы в животе. На коже в различных участках тела возникают покалывание, жжение, чувство ползания мурашек. Все это сопровождается зудом с преимущественной локализацией в конечностях и волосистой части головы. На этапе полностью сформированного СО для больных становится характерной дисфорическая симптоматика: раздражение, злоба, агрессия [2; 7; 15; 16].
СО седативных или снотворных средств (F13.3)
-
Рекомендуется у всех пациентов с подозрением на СО СиСС для верификации диагноза при выяснении жалоб и сборе анамнеза помимо соответствия общим критериям СО обращать внимание на присутствие следующих признаков [1]:
- желание употребить СиСС;
- тремор пальцев вытянутых рук, языка или век;
- тошнота или рвота;
- тахикардия, постуральная гипотензия, головная боль (симптомы гиперактивности вегетативной нервной системы (далее – ВНС));
- психомоторное возбуждение;
- бессонница;
- чувство недомогания или слабости;
- эпизодические зрительные, тактильные, слуховые галлюцинации или иллюзии;
- параноидная настроенность;
- большие судорожные припадки;
- дисфория.
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5).
Комментарии: СО формируется через 4-6 месяцев систематического приема СиСС. При превышении терапевтических доз СО может манифестировать раньше. Отмена высоких доз ПАВ, как правило, сопровождается развитием эпилептических припадков и психозов, что делает СО СиСС опасным для жизни больного. Если СиСС принимались в терапевтических дозах, но длительное время, то судорожные припадки и психозы обычно не развиваются.
Сроки наступления СО и его длительность зависят от периода полувыведения принимаемого ПАВ. Более наркогенными являются вещества, относящиеся к группе производных барбитуровой кислоты [2; 7; 14].
СО барбитуратов имеет фазное течение с закономерным нарастанием симптоматики, достижения ее пика на 3-4 сутки и возможным развитием осложнений на 3-8 сутки отказа от ПАВ в виде больших судорожных припадков или психозов. Абстинентные барбитуровые психозы чаще всего представлены делирием, который по клиническим проявлениям сходен с алкогольным. В отличие от последнего, отмечается большая выраженность тревоги, напряженности, злобности, больший удельный вес слуховых галлюцинаций. Яркие зрительные фантастические галлюцинации встречаются редко. Продолжительность барбитурового психоза – от 2-3 суток до 2 недель. Галлюцинаторно-бредовые психозы встречаются редко. Длительность СО вследствие употребления барбитуратов может составлять, в среднем, 4 недели. Если психотическая симптоматика не развивается, то перелом в течение СО можно наблюдать к 10-14 дню, когда у пациента появляется аппетит [2; 7; 14].
Между СО барбитуратов и СО бензодиазепинов есть структурно-динамическое сходство. Отличия заключаются в выраженности симптоматики и ее длительности. Риск развития СО бензодиазепинов резко увеличивается при длительном (>6 месяцев) их приеме или приеме чрезмерно высоких доз. В ряде случаев могут развиваться судорожные припадки или острый психоз. Длительность СО – 2-3 недели. Такие проявления, как выраженное влечение к приему ПАВ, лабильность эмоционального фона, утомляемость, нарушенный ритм сна, бессонница, могут длиться до 1-2 месяцев [7; 14]. В последние годы список веществ, способных вызывать привыкание, зависимость и СО расширился [17–18].
СО кокаина, других стимуляторов, включая кофеин** (F14.3 и F15.3)
-
Рекомендуется у всех пациентов с подозрением на СО кокаина и других стимуляторов, включая кофеин**, для верификации диагноза при выяснении жалоб и сборе анамнеза помимо соответствия общим критериям СО обращать внимание на присутствие следующих признаков [1]:
— нарушенное настроение: депрессия и/или ангедония (облигатный признак);
— сильное желание употребить кокаин, другие стимуляторы, включая кофеин**;
— апатия и астения;
— психомоторная заторможенность или возбуждение;
— глубокий, близкий к летаргическому сон;
— повышенный аппетит;
— бессонница или гиперсомния;
— причудливые или неприятные сновидения.
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5).
Комментарии: СО кокаина возникает через 24 ч после последнего употребления наркотика. Неосложненный СО достигает максимальной выраженности на 3-4-е сутки. Острые проявления исчезают в течение 10-14 дней, в тяжёлых случаях симптомы сохраняются до 1 месяца.
Клиника СО представлена преимущественно депрессивно-дисфорическими расстройствами, на фоне которых могут возникать идеи отношения и преследования, суицидальные мысли, а также делирий или острый параноид, длительность которых составляет от 3 до 15 дней [2; 7; 14]. Больные отчётливо ощущают неполноценность собственного существования, безысходность, испытывают чувство внутренней пустоты, безрадостность. При этом влечение к наркотику имеет ясное психопатологическое оформление в виде стойкой ангедонической депрессии. Влечение нередко принимает непреодолимый характер, что приводит к рецидиву. Особенностью кокаинового СО является чередование периодов послабления и усиления симптоматики. В период послабления улучшается сон, влечение к кокаину ослабевает. Такое состояние сменяется новым приступом дисфории, тревожности, раздражительности и интенсивной потребности в кокаине [2; 7; 14].
СО амфетаминов возникает через 12-24 часа после их последнего употребления, достигая максимальной выраженности на 2-4 сутки. Характерный признак СО стимуляторов – тяжелые депрессивные расстройства. На высоте СО может развиться психоз по типу делирия или острого параноида с речевым и двигательным возбуждением. Встречаются хронические амфетаминовые психозы, продолжающиеся от 2-3 недель до нескольких месяцев.
Неврологически СО стимуляторов проявляется нарушением координации движений, фибриллярными подергиваниями отдельных мышечных групп лица и языка, миозом, слабой реакцией зрачков на свет, нистагмом. Мышечный тонус снижен. Сухожильные рефлексы повышены.
Длительность СО стимуляторов составляет 7-14 дней, в тяжелых случаях – до 1 месяца. Наиболее тяжело протекает СО производных эфедрина (эфедрон, первитин) [2; 7; 14].
СО кофеина** – редкое явление в клинике наркологических заболеваний. Систематическое употребление кофеина** в повышенных дозах (превышающих 250 мг/сутки) способствует формированию кофеиновой токсикомании. Высокими дозами кофеина** считаются 5-10 г/сутки [19-21].
Развитие СО напрямую зависит от периода полураспада кофеина** в организме, который составляет 4-6 часов. Спустя данный период времени появляются головные боли, бессонница, кошмарные сновидения. У некоторых больных наблюдаются судорожные подергивания икроножных мышц, дрожание языка, пальцев, нарушения ритма сердечной деятельности, сопровождающиеся тревогой, страхом. Отличительным признаком СО кофеина** является головная боль пульсирующего характера, усиливающаяся при двигательной, речевой, даже мимической активности [20; 21].
СО галлюциногенов (F16.3)
Для СЗ от галлюциногенов СО нехарактерен. Проявления нечеткие, мало дифференцированные, неспецифичные, диагностические критерии для состояния не установлены [1]. В Международной классификации болезней 11 пересмотра (International Classification of Diseases for for Mortality and Morbidity Statistics, ICD-11) и Диагностической и статистической классификации психических болезней пятого пересмотра (Diagnostic and Statistical Manual of Mental Disorders, Fifth Edition, DSM-5) СО галлюциногенов также не рассматривается [19].
При хронической интоксикации диссоциативными анестетиками (фенциклидин, кетамин**, некоторые другие) серотонинергическими галлюциногенами (ЛСД, псилоцибин, сальвинорин и некоторые другие) и метиловыми амфетаминами (MDA, MDMA и некоторые другие) на 1-2-ые сутки лишения возникает умеренная вегетативная дисфункция, соматический дискомфорт в виде ноющих неинтенсивных болевых ощущений без четкой локализации, а также депрессивно-астеническая симптоматика. Длительность данных расстройств также сравнительно небольшая – до 10-14 дней [2; 7; 14].
При употреблении антихолинергических галлюциногенов (скополамин, атропин**, циклодол, тропикамид**, циклопенталат) СО формируется спустя 1-1,5 года их систематического употребления в высоких дозах. Развивается, в среднем, через сутки после прекращения приема. Проявляется психопатологическими, неврологическими и соматовегетативными нарушениями. Психопатологические расстройства на начальном этапе представлены астено-депрессивной симптоматикой, которая в динамике СО нарастает. На пике присоединяется выраженная дисфория, раздражительность, злобность [14].
Неврологические и вегетативные расстройства проявляются в общем треморе всего тела, повышенном тонусе скелетной мускулатуры, нарастающей скованности движений. Характерны болезненные ощущения в мышцах спины, судорожные подергивания отдельных мышечных групп, непроизвольные движения конечностей, маскообразное лицо. Расстройства сохраняются от 1 до 2 недель, обратное развитие симптоматики также происходит через астено-депрессивный симптомокомплекс. Тремор, мышечная гипертензия, повышенные сухожильные рефлексы могут сохраняться в течение 1,5-2 месяцев. Возможно развитие осложнений (эпилептиформных припадков, делирия), особенно при наличии врожденной или приобретенной органической неполноценности ГМ [14].
СО летучих растворителей (F18.3)
-
Рекомендуется у всех пациентов с подозрением на СО летучих растворителей для верификации диагноза при выяснении жалоб и сборе анамнеза помимо соответствия общим критериям СО обращать внимание на присутствие следующих признаков [1]:
— дисфория, раздражительность, гнев;
— трудности с концентрацией внимания;
— повышенный аппетит;
— тревога;
— неусидчивость;
— сниженное настроение;
— бессонница.
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5).
Комментарии: СО формируется через 6-12 месяцев систематического употребления летучих растворителей (ингалянтов). Учитывая возрастной фактор (употребление ингалянтов свойственно детям и подросткам), его проявления нередко принимаются за вегетососудистую дистонию. Несмотря на то, что СО слабо выражен, маскирован под возрастную дисфункциональность ВНС, тем не менее, абстинентная природа состояния подтверждается выраженным влечением к ингалянтам, моментальным восстановлением психофизического благополучия при их приеме.
Ведущее место в структуре СО отводится поведенческим и аффективным расстройствам, представленными дисфорией, раздражительностью, депрессивными и ипохондрическими проявлениями. Вегетативные нарушения полиморфны, слабо выражены.
Динамика развития СО следующая. Спустя сутки после последнего приема ПАВ появляются подавленность, раздражительность, нарушения сна. Снижается аппетит, появляется жажда, больные испытывают отвращение к употреблению ингалянтов, беспокоит тупая, диффузная головная боль. На 2-3-и сутки к этим расстройствам присоединяются неприятные ощущения в различных частях тела, особенно в грудной клетке, першение в горле, затрудненность вдоха, чувство нехватки воздуха. Появляются жалобы на тошноту, боль в эпигастрии и правой подвздошной области, иногда рвоту. Может быть жидкий стул с частотой 3-6 раз в сутки. Имеют место гипергидроз, колебания АД, тахикардия, сердечная аритмия. Из неврологических нарушений присутствуют: грубо размашистый тремор пальцев рук, век. В ночное время возникают мышечная боль и судорожные подергивания в мышцах нижних конечностей. Усиливается раздражительность, появляется злобность, частыми становятся дисфорические вспышки. На 5-7-е сутки напряжение сменяется астенодепрессивной симптоматикой. Соматические расстройства купируются к концу 1-ой, психические – к началу 3-ей недели воздержания. СО в тяжелых случаях может осложниться развитием делирия, длящегося от нескольких часов до 3-х суток и протекающего с иллюзиями, истинными зрительными и слуховыми галлюцинациями. В среднем, продолжительность СО летучих растворителей составляет около 2-х недель [2; 7; 14].
2. Физикальное обследование
Данные физикального обследования не являются специфическими при СО ПАВ, они позволяют создать ориентиры в определении тяжести состояния пациента [2; 7].
-
Рекомендуется у всех пациентов с диагнозом СО ПАВ с целью оценки степени его тяжести, динамики состояния и безопасности проводимой терапии обследовать соматическое состояние: провести визуальный осмотр кожных покровов (в т.ч. для выявления следов инъекций) и видимых слизистых, склер, определить мышечный тонус, провести термометрию общую, пальпацию и перкуссию печени, почек, аускультацию сердца, измерение артериального давления на периферических артериях, исследование пульса, измерение частоты дыхания [2; 7; 22-24].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5).
-
Рекомендуется у всех пациентов с диагнозом СО ПАВ с целью оценки степени его тяжести, динамики состояния и безопасности проводимой терапии обследовать неврологическое состояние: проверить наличие или отсутствие нистагма, реакции зрачков на свет, тремора, провести исследование чувствительной и двигательной сферы при патологии периферической нервной системы, оценить статическую и динамическую координацию [2; 7; 22-24].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5).
Комментарии: Соматическое и неврологическое обследование проводится до начала терапии и в процессе проводимого лечения. Контроль за состоянием пациента в динамике важен для своевременной диагностики развития возможной соматической и неврологической патологии [2; 7; 22-24].
3. Лабораторные диагностические исследования
-
Рекомендуется всем пациентам с СО ПАВ до начала лечения проведение лабораторных методов исследования для исключения острой сопутствующей патологии, оценки возможных осложнений терапии [2; 7; 22-24]:
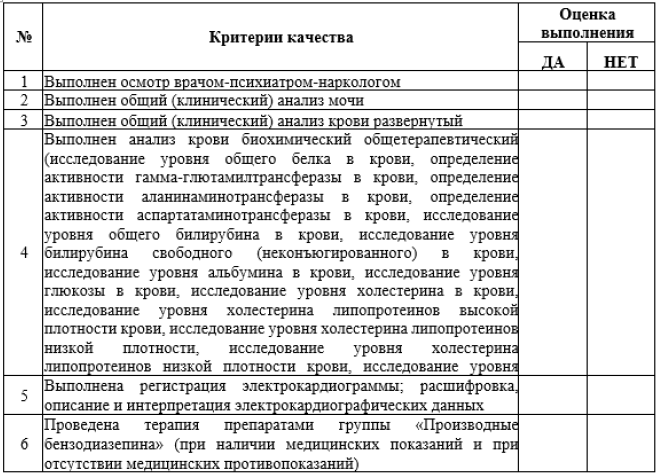
1. анализ крови биохимический общетерапевтический (исследование уровня общего белка в крови, определение активности гамма-глютамилтрансферазы в крови (далее – гамма-ГТ), определение активности аланинаминотрансферазы в крови (далее – АлАТ), определение активности аспартатаминотрансферазы в крови (далее – АсАТ), исследование уровня общего билирубина в крови, исследование уровня билирубина свободного (неконъюгированного) в крови, исследование уровня альбумина в крови, исследование уровня глюкозы в крови, исследование уровня холестерина в крови, исследование уровня холестерина липопротеинов высокой плотности крови, исследование уровня холестерина липопротеинов низкой плотности, исследование уровня холестерина липопротеинов высокой плотности, исследование уровня мочевины в крови, исследование уровня креатинина в крови);
2. общий (клинический) анализ крови (исследование уровня эритроцитов в крови, исследование уровня тромбоцитов в крови, исследование уровня лейкоцитов в крови, исследование уровня общего гемоглобина в крови, дифференцированный подсчет лейкоцитов (лейкоцитарная формула), исследование скорости оседания эритроцитов;
3. общий (клинический) анализ мочи (визуальное исследование мочи, определение удельного веса (относительной плотности) мочи, определение белка в моче, исследование уровня глюкозы в моче, исследование уровня билирубина в моче, определение уробилиногена в моче, обнаружение кетоновых тел в моче).
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5).
Комментарии: Проведение лабораторной диагностики в дополнение к классическому клиническому обследованию позволяет объективно оценить актуальное состояние пациента, исключить острые состояния, требующие оказания специализированной медицинской помощи, и скрытую органную патологию [2; 7; 22-24].
-
Рекомендуется пациентам с диагнозом СО ПАВ тяжелой степени с целью своевременной диагностики возможных осложнений и предотвращения декомпенсации состояния выполнить исследование уровня калия в крови, исследование уровня натрия в крови [25].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5).
-
Рекомендуется пациентам с диагнозом СО ПАВ тяжелой степени с целью своевременной диагностики возможных осложнений и предотвращения декомпенсации состояния выполнить исследование кислотно-основного состояния и газов крови (далее – КОС): рН, рСО2, рО2, HCO3, BE [2; 26].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5).
Комментарии: Длительный прием ПАВ, в наибольшей степени это касается метадона, СиСС, препаратов с холинолитическим действием, приводит к развитию нарушений КОС и водно-электролитным нарушениям. Тяжелые нарушения водно-электролитного и КОС крови могут привести к развитию аритмии, тканевой гипоксии и другим угрожающим жизни состояниям. Дополнительные (указанные выше в тезис- рекомендации) исследования проводятся с целью диагностики имеющихся нарушений [26].
4. Инструментальные диагностические исследования
Возможности использования инструментальной диагностики ограничены, т. к. отсутствуют специфические признаки, характерные только для СО ПАВ.
Для диагностики сопутствующей СО ПАВ патологии необходимо привлечение других специалистов. В конкретной клинической ситуации и в соответствии с показаниями назначаются инструментальные методы диагностики: ультразвуковое исследование внутренних органов, электроэнцефалография, эхоэнцефалография, рентгенография всего черепа, в одной или более проекциях, прицельная рентгенография органов грудной клетки и др. [2; 7].
-
Рекомендуется всем пациентам с диагнозом СО ПАВ до начала лечения для исключения острой сопутствующей патологии и оценки безопасности терапии выполнить регистрацию электрокардиограммы с расшифровкой, описанием и интерпретацией электрокардиографических данных [2; 7].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5).
2.5 Иные диагностические исследования
-
Рекомендуется у всех пациентов с диагнозом СО ПАВ до начала лечения с целью определения дальнейшей терапевтической тактики установить степень тяжести СО с учетом физикального, инструментального и клинического обследования [2; 7; 22-24].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5).
Комментарии: Оценка степени тяжести СО ПАВ дает возможность принять взвешенные и рациональные решения в отношении условий оказания медицинской помощи и терапевтических мероприятий [2; 7; 22-24].
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
1. Лекарственная терапия
-
Рекомендуется всем пациентам с СО ПАВ тяжелой степени для коррекции электролитных нарушений и дегидратации назначение инфузионной терапии препаратами группы «растворы, влияющие на водно-электролитный баланс» при наличии показаний, отсутствии противопоказаний к конкретным препаратам в соответствии с инструкцией [27].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5).
Комментарии: При тяжелом течении СО вид употребляемого ПАВ носит второстепенный характер, в большей степени инфузионная терапия направлена на поддержание и стабилизацию гомеостаза, улучшение реологии крови и микроциркуляции, нарушения которых связаны с нарастающим эндотоксикозом [27-29].
Поскольку инфузионная терапия сама по себе может существенно повлиять на электролитный баланс и КОС крови необходимо применять сбалансированные по составу полиионные буферизированные растворы. Современные сбалансированные инфузионные растворы, содержащие метаболизируемые анионы органических кислот (ацетата, цитрата, малата), такие как: калия хлорид+кальция хлорид+магния хлорид+натрия ацетат+натрия хлорид+яблочная кислота**; декстроза+калия хлорид+магния хлорид+натрия ацетат+натрия глюконат+натрия хлорид; калия хлорид+натрия ацетат+натрия хлорид**, #меглюмина натрия сукцинат** могут назначаться в/в при различных нарушениях водно-электролитного и КОС под контролем диуреза, уровня электролитов и значения КОС крови. Средние объемы инфузионных растворов составляют 400-3000 мл в сутки со скоростью не более 500 мл в час [2; 7].
Терапия СО опиоидов (F11.3)
-
Рекомендуется пациентам с СО опиоидов назначение #клонидина** как основного средства терапии СО при отсутствии медицинских противопоказаний [28-34].
Уровень убедительности рекомендаций A (Уровень достоверности доказательств 1).
Комментарии: #Клонидин** – стимулятор постсинаптических альфа-2-адренорецепторов тормозных структур ГМ. Для лечения СО опиоидов препарат используется с 1978 года [29]. #Клонидин** – средство, снижающее симпатическую гиперстимуляцию при СО опиоидов. Препарат воздействует на ЦНС и периферическую часть ВНС, снижая эндогенное выделение адреналина и НА, которые при СО опиоидов присутствуют в избыточном количестве. Центральная адренергическая система тесно связана с ДА и с системой эндогенных опиатов, поэтому #клонидин** оказывает нормализующее действие на систему КА нейромедиации. По сути, использование данного препарата является патогенетической терапией [2; 7; 23-25; 29; 32-35].
Методику лечения #клонидином** относят к варианту быстрой детоксикации [33]. Проводится в условиях стационара. Подбор начальной дозы #клонидина** – важный шаг, определяющий эффективность выбранной схемы терапии. В данном случае следует придерживаться правила: подбирается индивидуальная эффективная доза, способная купировать СО опиоидов при минимуме нежелательных явлений (далее – НЯ). Следует обращать внимание на развитие таких НЯ, как снижение АД, головокружение, миастения. В случае снижения АД ниже 90/60 мм рт. ст. дозу #клонидина** уменьшают [28; 29].
Минимальная доза #клонидина** составляет 0,15 мг. Суточные дозировки препарата, разделенные на 3-4 приема, не должны превышать 0,9-1,35 мг, внутрь. Максимальные дозы препарата обычно применяют во время наибольшей выраженности проявлений СО опиоидов (2-е - 4-е сутки), затем дозы начинают постепенно снижать и отменяют на 7-е - 10-е сутки [34].
#Клонидин** обладает выраженной эффективностью в отношении соматовегетативных расстройств, его влияние на психопатологические и алгические расстройства СО опиоидов менее выражено. На неврологическую симптоматику данный препарат влияния не оказывает. Среди НЯ препарата могут наблюдаться сухость во рту, выраженная седация [7; 28; 29; 32].
-
Рекомендуется пациентам с СО опиоидов назначение #прегабалина** в качестве основного средства терапии СО при непереносимости #клонидина** и при отсутствии медицинских противопоказаний [36-37].
Уровень убедительности рекомендаций В (Уровень достоверности доказательств 2).
Комментарии: По данным ряда клинических исследований (далее – КИ), протокол купирования СО опиоидов на основе использования #прегабалина** показал лучшую переносимость лечения, обусловленную менее выраженными центрально-депримирующим действием и астенией, по сравнению с клонидиновым протоколом [35]. #Прегабалин** при СО опиоидов назначается в дозах от 150 до 600 мг в сутки [36-37].
Учитывая то, что данные проведенных КИ обнадеживают, тем не менее, следует принимать во внимание риски развития зависимости от самого препарата [38-40].
-
Рекомендуется пациентам с болевым синдромом, связанным с СО опиоидов, назначение анальгезирующего средства со смешанным механизмом действия – трамадола** при отсутствии медицинских противопоказаний [41].
Уровень убедительности рекомендаций А (Уровень достоверности доказательств 2).
Комментарии: Трамадол** является агонистом m-, d-, k-опиатных рецепторов в ЦНС, а также избирательно тормозит обратный нейрональный захват серотонина и НА [41-44]. В первые дни СО при резко выраженном болевом синдроме препарат назначается внутримышечно, затем – перорально. Суточная доза трамадола** не должна превышать 600 мг. Доза препарата постепенно уменьшается по мере снижения интенсивности болевого синдрома [2; 7; 41].
Применение трамадола** при лечении СО опиоидов сопряжено с определенными трудностями. У пациентов достаточно быстро растет толерантность к препарату, могут наблюдаться НЯ. В последнем случае необходимо снижать суточную дозу трамадола** с одновременным назначением нестероидного противовоспалительного препарата (далее – НПВП) при отсутствии медицинских противопоказаний к применению последнего. Также трамадол** усиливает и потенцирует действие лекарственных средств (далее – ЛС) других групп (антипсихотических средств, производных бензодиазепина, барбитуратов и их производных, других супрессоров ЦНС), поэтому при назначении комплексной терапии необходимо обращать особое внимание на подбор адекватных доз препаратов во избежание развития осложнений [2; 7; 41-45].
-
Рекомендуется пациентам с болевым синдромом, связанным с СО опиоидов, при непереносимости или недостаточном эффекте трамадола** назначение препаратов группы «Нестероидных противовоспалительных и противоревматических препаратов» при отсутствии медицинских противопоказаний к конкретным препаратам и в соответствии с инструкцией [2; 7; 22-24; 46].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5).
Комментарии: Всемирной организацией здравоохранения (далее – ВОЗ) разработана методика снятия болевого синдрома с помощью легкодоступных средств, она представлена в виде простой и понятной схемы, имеющей название «Лестница обезболивания ВОЗ» [46]. Дозы НПВП в наркологической практике используются, как правило, средние и высокие терапевтические [2; 24; 47; 48]. При применении НПВП в течение короткого промежутка времени вероятность развития НЯ мала, однако использование высоких доз данных препаратов у пациентов, имеющих в анамнезе желудочно-кишечные нарушения, язвенную болезнь, почечную недостаточность, а также пожилых, нежелательно [49].
Для купирования болевого синдрома, связанного с СО опиоидов используются следующие препараты: кеторолак** в дозе до 90 мг в сутки [46]; #лорноксикам в дозе до 16 мг в сутки (в первые сутки – до 24 мг) [48]; ибупрофен** в дозе до 1200 мг в сутки [2; 7].
-
Рекомендуется пациентам с болевым синдромом, связанным с СО опиоидов, при непереносимости или недостаточной эффективности других обезболивающих препаратов назначение ксенона [50-52].
Уровень убедительности рекомендаций C (Уровень достоверности доказательств 2).
Комментарии: Одним из показаний к применению ксенона является лечение болевого синдрома. Ксенон является активным антагонистом NMDA-рецепторов, обладает выраженными анальгетическим, анксиолитическим и нормотимическим эффектами, показана его высокая эффективность даже при монотерапии СО опиоидов (героина и метадона) [51]. Ксенон назначается ингаляционно в смеси с кислородом в содержании 15-25% от объема газовой смеси, для его применения необходима специальная аппаратура, что ограничивает широкое применение этого ЛС в наркологической практике. Являясь ксенобиотиком, ксенон не вступает в биохимические реакции и выводится из организма в неизменном виде, что объясняет отсутствие медицинских противопоказаний к его применению в терапевтических (субнаркотических) дозах и НЯ после его применения [51]. Также его применение ограничивает высокая стоимость, тем не менее, в ряде случаев (непереносимость других ЛС, наличие тяжелых сопутствующих заболеваний) его использование вполне оправдано [50].
-
Рекомендуется пациентам с СО опиоидов назначение препаратов группы «Антипсихотические средства» в составе комплексной терапии при наличии показаний (психомоторное возбуждение, ажитация, агрессивность, опасное импульсивное поведение), отсутствии медицинских противопоказаний к конкретным препаратам и в соответствии с инструкцией [53-55].
Уровень убедительности рекомендаций C (Уровень достоверности доказательств 5).
Комментарии: Назначение препаратов группы «Антипсихотические средства», относится в части случаев к адъювантной терапии (некоторые из антипсихотических препаратов обладают обезболивающим действием, что способствует качественной редукции болевых расстройств в структуре СО опиоидов и полностью соответствует рекомендациям ВОЗ по лечению болевых расстройств), в части случаев – к симптоматической терапии (такие проявления, как тревожная ажитация, психопатоподобное поведение, психомоторное возбуждение, суицидальная настроенность, агрессия являются лишь симптомами проявления ПВН, однако требуют назначения препаратов с соответствующим спектром действия).
При выраженных болевых расстройствах, не поддающихся купированию вышеуказанными группами ЛС, тяжелой бессоннице, психомоторном возбуждении, поведенческих расстройствах, сопровождающих влечение к наркотику, назначаются антипсихотические средства [53]. Предпочтительны препараты с преобладанием седативного действия, т.к. достаточная седация в период СО является скорее необходимым условием, чем НЯ [2].
Использование антипсихотических средств в период СО опиоидов относится к патогенетически ориентированному лечению, основано на механизме действия данной группы препаратов на ДА рецепторы (блокада D2, D4 ДА-рецепторов обеспечивает снижение ДА в организме, который в период СО повышен. Это позволяет уменьшить психопатологическую симптоматику). Следует обращать внимание на подбор дозы, который всегда индивидуален [2; 22-24; 54].
В настоящее время в наркологической практике предпочтение отдается атипичным антипсихотикам, как ЛС с лучшим профилем безопасности. Атипичный антипсихотик тиаприд обладает седативным, противосудорожным, антипсихотическим и антиалгическим эффектами [54]. Препарат способствует уменьшению, а часто и купированию раздражительности, вспыльчивости, пониженного настроения, тревоги, улучшает сон, что позволяет говорить о снижении выраженности патологического влечения к наркотикам (далее – ПВН) [2; 7]. Основными показаниями к назначению тиаприда являются психомоторное возбуждение, расстройства поведения с ажитацией и агрессивностью. В отдельных случаях препарат вызывает развитие невыраженного нейролептического синдрома, который купируется либо снижением его дозировки, либо добавлением в терапевтические схемы корректоров. Средние суточные дозы тиаприда при СО опиоидов составляют 400-600 мг [22-24; 54].
Имеются данные об эффективности применения в СО опиоидов #кветиапина**. Препарат способствует редукции патологического влечения к опиоидам, уменьшает тревогу, снижает проявления болевого синдрома. Препарат назначается по 25-50 мг каждые 4 часа при жалобах на влечение к ПАВ, либо каких-либо других СО. Максимальная суточная доза #кветиапина** составляла 200 мг [55].
При грубых поведенческих расстройствах, состояниях ажитации, повышенного беспокойства, враждебности и агрессивности показал свою эффективность зуклопентиксол** в суточных дозах от 25-150 мг [54].
При наличии депрессивных состояний, тревожности, напряжения, беспокойства, бессонницы, нарушений сна, боли в структуре СО используется хлорпротиксен в суточных дозах до 500 мг на 2-3 приема [2; 22-24].
В качестве симптоматической терапии по соответствующим показаниям в СО также могут использоваться и другие антипсихотические препараты, такие как перициазин**, хлорпромазин** (показания: тревожное состояние, психомоторное возбуждение, агрессивное или опасное импульсивное поведение), левомепромазин** (показания: ажитация, тревожное состояние, психомоторное возбуждение, болевой синдром, стойкая бессонница), галоперидол** (показания: психомоторное возбуждение, агрессия), #рисперидон** (показания: агрессивное поведение) [2; 22-24]. #Рисперидон** назначается в дозах 2-4 мг в сутки.
Следует подчеркнуть, что все вышеперечисленные психопатологические расстройства являются проявлениями синдрома патологического влечения к ПАВ, назначение антипсихотических средств в данном случае является симптоматическим [2; 7].
Список используемых ЛС широк, однако до настоящего времени наблюдается дефицит сравнительных КИ, позволяющих сделать однозначные выводы об эффективности и безопасности использования антипсихотических препаратов в терапии не только СО опиоидов, но и СО других ПАВ.
-
Рекомендуется пациентам с СО опиоидов назначение препаратов группы «Производные бензодиазепина» при наличии показаний (тревога, нарушения сна), отсутствии противопоказаний к конкретным препаратам и в соответствии с инструкцией [2; 7; 22; 56].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5).
Комментарии: В терапии СО опиоидов наиболее часто используются следующие ЛС: диазепам**, бромдигидрохлорфенилбензодиазепин** в дозах, определенных инструкциями к препаратам. Разовая доза диазепама** составляет 5-10 мг внутривенно или внутримышечно. Максимальная суточная доза диазепама** – 60 мг.
Бромдигидрохлорфенилбензодиазепин** может назначаться внутрь, внутривенно или внутримышечно. Внутримышечно или внутривенно назначают 0,5-1 мг 1 раз в день. Внутрь назначают по 2-5 мг в день. Средняя суточная доза – 1,5-5 мг, ее разделяют на 2-3 приема, обычно по 0,5-1 мг утром и днем и до 2,5 мг на ночь. Максимальная суточная доза бромдигидрохлорфенилбензодиазепина** – 10 мг [2; 7; 22; 56].
Терапия СО каннабиноидов (F12.3)
Специфических ЛС для лечения СО каннабиноидов нет, терапия является симптоматической [57].
-
Рекомендуется пациентам с диагнозом СО каннабиноидов в качестве симптоматического средства терапии назначение препарата #габапентин при отсутствии медицинских противопоказаний [58].
Уровень убедительности рекомендаций В (Уровень достоверности доказательств 2).
Комментарии: Было установлено, что #габапентин в суточной дозе 1200 мг в сутки значительно снижает проявления СО каннабиноидов [58]. Тем не менее, данное единственное наблюдение требует дополнительного подтверждения клинической практикой.
-
Рекомендуется пациентам с диагнозом СО каннабиноидов в качестве симптоматического средства терапии назначение препарата #кветиапин** при отсутствии медицинских противопоказаний [59].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 2).
Комментарии: Проведенное сравнительное КИ показало, что по сравнению с плацебо #кветиапин** в дозе 200 мг в сутки улучшил качество сна, увеличил потребление калорий и уменьшил потерю веса [59]. Тем не менее, данное наблюдение требует дополнительного подтверждения клинической практикой.
-
Рекомендуется пациентам с СО каннабиноидов назначение препаратов группы «Производные бензодиазепина» при наличии показаний (тревога, нарушения сна), отсутствии противопоказаний к конкретным препаратам и в соответствии с инструкцией [2; 22; 28; 29; 60].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5).
-
Рекомендуется пациентам с СО каннабиноидов назначение препарата золпидем для лечения нарушений сна, при отсутствии медицинских противопоказаний к препарату и в соответствии с инструкцией [61].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 3).
Терапия СО СиСС (F13.3)
-
Рекомендуется пациентам с диагнозом СО СиСС ступенчатая отмена ПАВ (gradual dose reduction), к которому развилось привыкание [1; 62-65].
Уровень убедительности рекомендаций A (Уровень достоверности доказательств 1).
-
Рекомендуется пациентам с диагнозом СО бензодиазепинов назначение препаратов группы «Производные бензодиазепина» при отсутствии медицинских противопоказаний и в соответствии с инструкцией [60; 63; 65].
Уровень убедительности рекомендаций B (Уровень достоверности доказательств 1).
Комментарии: Особенностями терапии СО бензодиазепинов является замена препарата, к которому у пациента сформировалась зависимость, разрешенным к применению ЛС, сходным по действию, с его постепенной ступенчатой отменой [60; 63; 65].
-
Рекомендуется пациентам с диагнозом СО барбитуратов назначение препаратов группы «Барбитураты и их производные» при отсутствии медицинских противопоказаний и в соответствии с инструкцией [60; 65].
Уровень убедительности рекомендаций C (Уровень достоверности доказательств 5).
Комментарии: Особенностями терапии СО барбитуратов является замена препарата, к которому у пациента сформировалась зависимость, разрешенным к применению ЛС, сходным по действию, с его постепенной ступенчатой отменой [60; 65].
-
Рекомендуется пациентам с диагнозом СО гамма-оксимасляной кислоты и ее аналогов и прекурсоров назначение препаратов группы «Производные бензодиазепина» при отсутствии медицинских противопоказаний к конкретным препаратам и в соответствии с инструкцией [66-67].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 3).
Комментарии: Немногочисленные КИ показали эффективность больших доз препаратов группы «производные бензодиазепина» [66-67]. При отсутствии эффекта рекомендуется сочетать их с группой «барбитураты и их производные» или группой «антипсихотические средства» [67].
Терапия СО кокаина, других стимуляторов, включая кофеин** (F14.3, F15.3)
Специфических ЛС для лечения СО кокаина, других стимуляторов, включая кофеин** нет, терапия является симптоматической [68-69].
-
Рекомендуется пациентам с диагнозом СО кокаина, других стимуляторов, включая кофеин**, назначение препаратов группы «Производные бензодиазепина» при наличии показаний (тревога), при отсутствии медицинских противопоказаний к конкретным препаратам и в соответствии с инструкцией [68].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5).
Комментарии: В терапии наиболее часто используются следующие ЛС: диазепам**, бромдигидрохлорфенилбензодиазепин** в дозах, определенных инструкциями к препаратам [2; 7]. Производные бензодиазепина могут быть полезны в комплексной терапии СО кокаина и других стимуляторов, если в клинической картине преобладают депрессивные расстройства и/или тревога [68].
-
Рекомендуется пациентам с СО кокаина, других стимуляторов, включая кофеин**, назначение препаратов группы «Антипсихотические средства» в составе комплексной терапии при наличии показаний (психомоторное возбуждение, ажитация, агрессивность, опасное импульсивное поведение), отсутствии медицинских противопоказаний к конкретным препаратам и в соответствии с инструкцией [2; 7; 68].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5).
Комментарии: До настоящего времени наблюдается дефицит сравнительных КИ, позволяющих сделать однозначные выводы об эффективности и безопасности использования антипсихотических препаратов в терапии СО ПАВ. Антипсихотические средства используются симптоматически при наличии в клинической картине психомоторного возбуждения, агрессивности, нарастании дисфорической симптоматики, возможности импульсивных поступков, когда действия производных бензодиазепина бывает недостаточно. Следует понимать, что, как правило, данная симптоматика является проявлением синдрома ПВН. Из ЛС используются те же, что и при лечении СО оипоидов (см. информацию выше). По возможности предпочтение следует отдавать атипичными антипсихотикам [2; 7].
Терапия СО летучих растворителей (F18.3)
СО летучих растворителей может протекать тяжело, т.к. наблюдается большое количество соматических и неврологических осложнений, являющихся по механизму развития проявлениями токсикогенной симптоматики или обострением латентной патологии. К ним относится и грубая неврологическая патология, и поражения внутренних органов – сердца, почек, легких, печени, поджелудочной железы [2; 7; 14].
Универсального протокола детоксикации нет [70]. Подходы к терапии, группы применяемых ЛС идентичны таковым при СО алкоголя, а также при СО СиСС [2, 22, 60]. Лечение проводится симптоматически в соответствии с медицинскими показаниями. Базовые подходы: проведение инфузионной терапии, назначение препаратов групп «анксиолитические препараты», «барбитураты и их производные». Препараты групп «противоэпилептические средства», «антипсихотические средства» назначаются по показаниям, с осторожностью, с учетом возраста пациента (СЗ от ингалянтов является прерогативой подросткового возраста) [2; 7; 60] .
Терапия СО сочетания нескольких ПАВ (F19.3)
В клинической практике в настоящее время довольно широко распространено такое явление, как СЗ от нескольких ПАВ, соответственно, клиническая картина СО представляется пестрой, неоднородной, смешанной. В таких случаях терапевтическая тактика определяется, исходя из превалирующей клинической симптоматики с использованием рекомендованного для каждого ПАВ протокола лечения одновременно или последовательно [1; 60; 71].
-
Рекомендуется пациентам моложе 18 лет, использовать медикаментозное лечение, соответствующее таковому для взрослого населения с учетом коррекции доз ЛС, основанных на возрастных особенностях метаболизма, влияющих на фармакокинетику и фармакодинамику препаратов [2; 7; 22].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5).
2. Психотерапия
В острых состояниях, каковым является СО, проведение психотерапевтического лечения резко ограничено, так как пациенты не могут в полной мере использовать предлагаемые психотерапевтические интервенции. Основная задача психотерапевтического воздействия в этот период: вовлечение пациента и его удержание в лечебной программе, которая не ограничивается рамками купирования СО. Необходимо информировать пациента о дальнейшей терапии СЗ.
В этот период актуально провести семейное консультирование /психотерапию для членов семьи пациента с целью информирования их о хроническом характере СЗ от ПАВ, возможных стратегиях и тактике лечения пациента, а также обучения навыкам семейной мотивации пациентов на продолжение лечения и реабилитацию после купирования СО [72-74].
3. Оценка эффективности и безопасности лечения
-
Рекомендуется всем пациентам с диагнозом СО ПАВ в процессе терапии проведение клинического наблюдения врачом-психиатром-наркологом для оценки эффективности лечения [2; 7].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5).
Комментарии: Оценка эффективности комплексного лечения проводится, исходя из динамки психопатологических, соматовегетативных и неврологических нарушений у больных с диагнозом СО [2; 7].
Критерий эффективности медикаментозного лечения: стабилизация психофизического состояния больного [2; 7].
-
Рекомендуется проводить оценку частоты возникновения и развития нежелательных явлений в процессе терапии пациентов с диагнозом СО ПАВ с целью контроля безопасности лечения [2].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5).
Комментарии: Оценка безопасности и переносимости терапии проводится на всем ее протяжении по частоте возникновения и развития НЯ.
НЯ регистрируются по данным:
· спонтанных сообщений пациентов;
· физикального осмотра и клинически значимых изменений жизненно важных показателей (АД, ЧСС, частота дыхательных движений, температура тела) от исходных значений;
· клинически значимых отклонениям показателей лабораторных анализов и инструментальных методов диагностики от исходных значений.
Связь НЯ с ЛС оценивается по алгоритму Наранжо (Приложение Г) [75]. При возникновении НЯ врачу необходимо зарегистрировать свои действия в первичной документации, к примеру, назначить дополнительные препараты (какие, в какой дозе, на какой период) и др., а также заполнить соответствующую форму.
Медицинская реабилитация
Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Реабилитационные мероприятия начинаются после купирования симптомов СО, и проводятся в соответствии с Клиническими рекомендациями по лечению СЗ от ПАВ.
Госпитализация
Организация оказания медицинской помощи
Терапия СО ПАВ может осуществляться в стационарных (в т.ч. в условиях дневного стационара) и амбулаторных условиях. Курс лечения составляет, в среднем, до 10 суток [2; 7; 28; 60].
-
Рекомендуется при обращении пациента с СО ПАВ в медицинскую организацию за специализированной медицинской помощью выполнить осмотр врачом-психиатром- наркологом [2].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5).
Комментарии: Предварительный диагноз СО устанавливается в течение первых суток на основании данных клинического обследования. Основной диагноз устанавливается в течение 3-7 суток на основании данных клинического обследования, результатов инструментальных и лабораторных исследований, динамического наблюдения [2].
Показания для госпитализации:
• СО ПАВ средней и тяжелой степени тяжести;
• СО ПАВ с судорожными припадками;
• Отсутствие клинического эффекта от проводимой терапии в амбулаторных условиях и условиях дневного стационара.
Показания для амбулаторного лечения:
• СО ПАВ легкой степени тяжести.
Показания для выписки:
• Выписка пациента с диагнозом СО ПАВ проводится после устранения симптоматики СО.
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Диспансерное наблюдение осуществляется в соответствии с Порядком диспансерного наблюдения за лицами с психическими расстройствами и/или расстройствами поведения, связанными с употреблением ПАВ.
При сформированном СО наиболее важное значение приобретает третичная (модификационная) профилактика. Она является преимущественно медицинской, индивидуальной, ориентирована на лиц со сформированным СЗ от ПАВ, направлена на предупреждение дальнейшего развития заболевания, уменьшение вредных последствий и на предупреждение рецидива [2].
Информация
Источники и литература
-
Клинические рекомендации Российского общества психиатров
- 1. Психические расстройства и расстройства поведения (F00 - F99) Класс V МКБ-10,адаптированный для использования в Российской Федерации, https://psychiatr.ru/download/1998?view=1&name=МКБ-10 с гиперссылками.pdf 2. Иванец Н.Н., Анохина и.П., Винникова М.А., редакторы. Наркология: национальноеруководство. 2-е издание, переработанное и дополненное. М.:ГЭОТАР-Медиа, 2016. 944с. 3. Ветрова М.В., Блохина Е.А., Ярославцева Т.С., Палаткин В.Я. Синдром отмены опиоидов:нейробиологические, клинические и фармакологические аспекты (литературный обзор).Вопросы наркологии. 2021; 9(204): 57-71. doi: 10.47877/0234- 0623_2021_09_57 4. Кибитов А.О., Анохина И.П. Генетические основы этиологии и патогенеза болезнейзависимости от психоактивных веществ. Наркология. 2016; 6:84-104. 5. Drugs, Brains, and Behavior: The Science of Addiction. Source: National Institute on Drug Abuse;National Institutes of Health; U.S. Department of Health and Human Services. https://www.drugabuse.gov/sites/default/files/soa.pdf. 6. Taylor A.M.W., Castonguay A., Ghogha A., et al. Neuroimmune regulation of GABAergic neuronswithin the ventral tegmental area during withdrawal from chronic morphineNeuropsychopharmacology, 2016. Vol. 4(N41): 949-959. doi: 10.1038/npp.2015.221. 7. Наркология. Национальное руководство. Краткое издание (под ред. Н.Н. Иванца, М.А.Винниковой). М.: ГЭОТАР-Медиа, 2020. 704 с. doi: 10.33029/9704-5423-7-NRK-2020-1- 704. 8. Paez-Martinez N., Aldrete-Audiffred J., Gallardo-Tenorio A., et al. Participation of GABAA,GABA(B) receptors and neurosteroids in toluene-induced hypothermia: evidence ofconcentration-dependent differences in the mechanism of action. Eur J Pharmacol. 2013 Jan 5;698(1-3): 178-85. doi: 10.1016/j.ejphar.2012.10.004. 9. Shelton K.L. Discriminative Stimulus Effects of Abused Inhalants. Curr. Top. Behav. Neurosci.2018; 39:113-139. doi: 10.1007/7854 2016 22 URL: https://www.ncbi.nlm.nih.gov/pubmed/27714629 10. Доклад Международного комитета по контролю над наркотиками за 2021 год https://www.unodc.org/res/wdr2021/field/WDR21 Booklet 2.pdf] 11. Психические и поведенческие расстройства, связанные с употреблением психоактивныхвеществ, в Москве в 2021-2022 годах. Статистический сборник/ составители Масякин А.В.,Харитоненкова Е.Ю., Боровков Е.И., и др. М.: ГБУЗ «МНПЦ наркологии ДЗМ», 2024. 37 с. 12. Wesson D.R., Ling W. The Clinical Opiate Withdrawal Scale (COWS) Journal of PsychoactiveDrugs, 2003. Vol. 35(2): 253-259. doi: 10.1080/02791072.2003.10400007 13. Гофман А.Г. Клиническая наркология. М.: МИА, 2019. 386 с. 14. Рохлина М.Л. Наркомании. Токсикомании. Психические расстройства и расстройстваповедения, связанные с употреблением психоактивных веществ. М.: Изд-во «Литтерра»,2010. 255 с. 15. Budney Alan J., Moore Brent A., Vandrey Ryan G., Hughes John R. The time course andsignificance of cannabis withdrawal. J. Abnorm. Psychol. 2003 Aug; 112(3):393-402. doi:10.1037/0021-843x.112.3.393. 16. Haney M. The marijuana withdrawal syndrome: diagnosis and treatment. Curr Psychiatry Rep.2005;7(5):360-6. 17. Santos C., Olmedo R.E. Sedative-Hypnotic Drug Withdrawal Syndrome: Recognition AndTreatment. Emerg. Med. Pract. 2017 Mar;19(3):1-20. 18. Weaver M.F. Prescription Sedative Misuse and Abuse. YJBM, 88 (2015):247-256. 19. Diagnostic and statistical manual of mental disorders. 5th ed.; DSM-5; American PsychiatricAssociation, 2013: р. 481-590, 809-916. 20. Научно обоснованное мнение о безопасности кофеина. Наркология. 2015; №8: 45-58 (пер.EFSA Journal 2015 13(5)). 21. Научно обоснованное мнение о безопасности кофеина. Часть 2. Наркология. 2015; №9: 45-59 (пер. EFSAJournal 2015 13(5)). 22. Иванец Н.Н., Винникова М.А. Психические и поведенческие расстройства вследствиезлоупотребления психоактивными веществами. Психиатрия: национальное руководство.Под редакцией Т.Б. Дмитриевой, В.Н. Краснова, Н.Г. Незнанова, В.Я. Семке, А.С. Тиганова.М.: Гэотар-Медиа; 2009. с.409-442. 23. Рациональная фармакотерапия в психиатрической практике: руководство дляпрактикующих врачей. Под общей редакцией Ю.А. Александровского, Н.Г. Незнанова. М:Литтера; 2014. 1080 с. 24. Александровский Ю.А., Незнанов Н.Г. Психиатрия: национальное руководство. 2-е изд.,перераб. и доп. М.:ГЭОТАР-Медиа; 2018. 1008 с. 25. Buckley M.S. Electrolyte disturbances associated with medications in the critically ill.International Journal of Intensive Care, 2012; 19:74-79. 26. Kitterer D., Schwab M., Alscher M.D., et al. Drug-induced acid-base disorders. Pediatr. Nephrol.,2015; 30(9):1407-23. doi: 10.1007/s00467-014-2958-5. 27. Wedro B. "Dehydration". Medicine Net. Retrieved 2021. http://www.medicinenet.com/ dehydration/article.htm 28. Detoxification From Alcohol and Other Drugs. Treatment Improvement Protocol (TIP). Series,N.19. URL: https://www.ncbi.nlm.nih.gov/books/NBK64513/ 29. Detoxification and Substance Abuse Treatment. Treatment Improvement Protocol (TIP) Series,N.45. URL : https://www.ncbi.nlm.nih.gov/books/NBK64115/ 30. Ockert D.M., Volpicelli J.R., Baier Jr. A.R. et al. A nonopioid procedure for outpatient opioiddetoxification. J. Addict Med. 2011; 5(2):110-4. doi: 10.1097/ADM.0b013e3181e518cc. 31. Gowing L., Farrell M., Ali R., White J.M. Alpha2-adrenergic agonists for the management ofopioid withdrawal. Cochrane Database Syst. Rev. 2016 May 3; 2016(5): CD002024. doi:10.1002/14651858.CD002024.pub5 32. Gold M.S., Redmond D.E., Kleber H.D. Clonidine blocks acute opiate-withdrawal symptoms.Lancet. 1978; 2(8090):599-602. doi: 10.1016/s0140-6736(78)92823-4. 33. Guidelines for the Psychosocially Assisted Pharmacological Treatment of Opioid Dependence.Geneva: WHO, 2009. ISBN-13:978-92-4-154754-3 34. Gowing L., Farrell M., Ali R., White J.M. Alpha2 of opioid withdrawal. Cochrane Database ofSyst. Rev. 2016(5): Cd02024. doi: 10.1002/14651858.CD002024.pub5 35. National Guidelines for Medication-Assisted Treatment of Opioid Dependence ISBN: 9781-74241-945-9 36. Крупицкий Е.М., Илюк Р.Д., Михайлов А.Д. и др. Рандомизированное контролируемоеисследование эффективности прегабалина в терапии синдрома отмены опиатов. Журналневрологии и психиатрии им. С.С. Корсакова. 2016;7:29-36. 37. 1Kammerer N., Lemenager T., Grosshans M., Kiefer F., Hermann D. Pregabalin for the reductionof opiate withdrawal symptoms. Psychiatr Prax. 2012; 39(7):351-352. URL: https://www.ncbi.nlm.nih.gov/pubmed/22689280 38. Martinotti G. Pregabalin in clinical psychiatry and addiction: pros and cons. Expert Opin InvestigDrugs.2012; 21(9):1243-1245. URL: https://www.ncbi.nlm.nih.gov/pubmed/22725618 39. Рохлина М.Л., Ненастьева А.Ю., Усманова Н.Н., Захаров Е.Д., Демурова В.Н.Злоупотребление прегабалином (Лирикой). Вопросы наркологии. 2015;3:9-15. 40. Пискунов М.В., Кривенков А.Н., Рейхель Н.В. Зависимость от прегабалина («Лирика»):обзор литературы и собственные клинические наблюдения. Наркология. 2013; 4:52-56. 41. Shah K., Stout B., Caskey H. Tramadol for the Management of Opioid Withdrawal: A SystematicReview of Randomized Clinical Trials. Cureus. 2020; 12(7): e9128. Published online 2020 Jul 11.doi: 10.7759/cureus.9128 42. Dunn K.E., Tompkins D.A., Bigelow G.E., Strain E.C. Efficacy of Tramadol Extended- Releasefor Opioid Withdrawal: A Randomized Clinical Trial. JAMA Psychiatry. 2017; 74(9): 885-893.doi: 10.1001/jamapsychiatry.2017.1838. 43. Ziaaddini H., Ziaaddini A., Asghari N., Nakhaee N., Eslami M. Trial of tramadol plus gabapentinfor opioid detoxification. Iran Red Crescent Med. J. 2014; 17(1). 44. doi :10.5812/ircmj.18202. 45. Chawla J.M., Pal H., Lal R., Jain R., Schooler N., Balhara Y.P. Comparison of efficacy betweenbuprenorphine and tramadol in the detoxification of opioid (heroin)-dependent subjects. JournalOpioid Management. 2013; 9(1): 35-41. 46. Zarghami M., Masoum B., Shiran M.R. Tramadol versus methadone for treatment of opiatewithdrawal: a double-blind, randomized, clinical trial. Addict Dis. 2012; 31(2): 112-117. 47. Абузарова Г.Р., Невзорова Д.В., Кумирова Э.В. и др. Обезболивание взрослых и детей приоказании медицинской помощи. М.: ФГБОУ ВО РНИМУ им. Н.И. Пирогова МинздраваРоссии; 2016. 94 с. 48. Иванец Н.Н., Винникова М.А., Русинова О.И. Перспективы применения нестероидныхпротивовоспалительных препаратов в наркологической клинике (на примере кетанова).Вопросы наркологии. 2003;6:6-14. 49. Иванец Н.Н., Винникова М.А. Опыт применения ксефокама (лорноксикама) прикупировании болевого синдрома у больных героиновой наркоманией. Вопросы наркологии.2001;4:3-9. 50. Watson J.C. Лечение боли. https://www.msdmanuals.com/ru-ru 51. Цыганков Б.Д., Шамов С.А., Рыхлецкий П.З., Давлетов Л.А. Возможности примененияКсенона в комплексной терапии психопатологических расстройств у больныхнаркологического профиля. Российский медицинский журнал, №4 2013, с. 11-13. 52. Уткин С.И., Атамурадов И.Б., Винникова М.А и др. Ксенон в терапии опийногоабстинентного синдрома. Ж. Вопросы наркологии. 2014, №4:13-28. 53. Giacalone M., Abramo A.,Giunta F., Forfori F. Xenon-related Analgesia A New Target for PainTreatment. 2013, The Clinical journal of pain 29(7) doi:10.1097/AJP.0b013e31826b12f5 54. Loimer N., Presslich O., Lenz K. et al. «Induced detoxification treatment» of opiate dependentpatients - a new therapy concept. Wien Klin Wochenschr. 1989;101(13):451-454. 55. Иванец Н.Н., Винникова М.А. Применение препарата клопиксол (зуклопентиксол) прилечении больных героиновой наркоманией: сравнительное исследование. Вопросынаркологии. 2002;3:13-19.
Информация
Список сокращений
АД – артериальное давление
АлАТ – аланинаминотрансфераза (alanineaminotransferase)
АсАТ – аспартатаминотрансфераза (aspartateaminotransferase)
АТХ – анатомо-терапевтическо-химическая классификация
ВНС – вегетативная нервная система
ВОЗ – Всемирная Организация Здравоохранения
ГАМК – гамма-аминомасляная кислота
Гамма-ГТ– гамма-глютамилтрансфераза (gammaglutamiltransferase)
ГМ – головной мозг
ДА – дофамин
ЖКТ – желудочно-кишечный тракт
ЖНВЛП – жизненно необходимые и важнейшие лекарственные препараты
КА – катехоламины
КИ – клинические исследования
КОС – кислотно-основное состояние
ЛС – лекарственное средство
ЛСД – диэтиламид лизергиновой кислоты
Минздрав России – Министерство здравоохранения Российской Федерации
МКБ-10 – международная статистическая классификация болезней и проблем, связанных со здоровьем, десятый пересмотр
НА – норадреналин
НПВП – нестероидные противовоспалительные препараты (M01А – нестероидные противовоспалительные и противоревматические препараты)
НПР – неблагоприятная побочная реакция
НЯ – нежелательное явление
ПАВ – психоактивное вещество
ПВН – патологическое влечение к наркотику
ПНС – периферическая нервная система
СЗ – синдром зависимости
СО – синдром отмены
СиСС – седативные или снотворные средства
УДД – уровень достоверности доказательств
УУР – уровень убедительности рекомендаций
цАМФ – циклический аденозинмонофосфат
ЦНС – центральная нервная система
ЧСС – частота сердечных сокращений
BE (base excess (deficit)) – избыток (дефицит) оснований
COWS – Clinical Opiate Withdrawal Scale (клиническая шкала синдрома отмены опиатов)
HCO3 – стандартный бикарбонат
MDMA (МДМА) – метилендиоксиметамфетамин (экстази)
MDA (МДА) – метилендиоксиамфетамин
pCO2 – парциальное давление углекислого газа (H2CO3+CO2) в крови в физиологических условиях
pH (power hydrogen) – соотношение в жидкости кислых и щелочных элементов, отрицательный десятичный логарифм концентрации H+ в жидкой среде
pO2 – парциальное давление кислорода в цельной крови
5-HT (5-hydroxytriptamine) – 5-гидрокситриптамин, серотониновый рецептор
Термины и определения
Мидриаз (лат. – mydriasis) – расширение зрачка более 4 мм.
Миоз (лат. – miosis) – сужение зрачка менее 2 мм.
Неблагоприятная побочная реакция (англ. – adverse reaction) – любая непреднамеренная и вредная для организма человека реакция, которая возникает при использовании лекарственного препарата в рекомендуемых дозах с целью профилактики, лечения и диагностики или для изменения физиологической функции и при которой доказана причинно-следственная связь с лекарственным средством.
Перекрестная толерантность (англ. – cross-tolerance) – развитие толерантности к веществу, воздействию которого индивидуум ранее не подвергался, в результате приема другого вещества. Оба вещества, как правило, но не обязательно имеют схожее фармакологическое действие.
Синдром зависимости от психоактивного вещества (англ. – dependence syndrome) – сочетание физиологических, поведенческих и когнитивных явлений, при которых употребление психоактивного вещества занимает в системе ценностей больного ведущее место. Основной характеристикой синдрома зависимости является желание (часто сильное, иногда непреодолимое) употреблять психоактивное вещество. Имеет свои характерные симптомы, особенности развития и течения, определенные исходы.
Синдром патологического влечения (психическая зависимость) (англ. – craving) – это нозологически специфичное для болезней зависимости психопатологическое расстройство, клинически проявляющееся идеаторными (мыслительными), поведенческими, аффективными (эмоциональными), вегетативными и сенсорными нарушениями. К диагностическим критериям синдрома патологического влечения к психоактивным веществам относят: сильную потребность или необходимость принять вещество, утрату количественного и ситуационного контроля, продолжение употребления вещества, несмотря на очевидные вредные последствия при осознании связи между приемом и последствиями.
Толерантность (лат. – tolerantia, «выносливость, способность переносить») – прогрессирующее ослабление желаемого психотропного эффекта психоактивного вещества (эйфория, успокоение, расслабление и др.), что заставляет больного повышать дозы и учащать прием данного вещества.
Тремор (лат. – tremor, «дрожание») – это ритмические, быстрые сокращения мышц туловища или конечностей непроизвольного характера.
Критерии оценки качества медицинской помощи
Критерии оценки качества специализированной медицинской помощи взрослым и детям при СО ПАВ (кроме алкоголя и никотина) (код по МКБ-10: F11.3, F12.3, F13.3, F14.3, F15.3, F16.3, F18.3, F19.3)
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
Со-Председатели:
Клименко Татьяна Валентиновна д.м.н., проф.
Крупицкий Евгений Михайлович д.м.н., проф.
Масякин Антон Валерьевич д.м.н., доцент
Секретарь:
Губанов Георгий Александрович
Состав рабочей группы:
Агибалова Татьяна Васильевна д.м.н.
Аркус Максим Леонидович к.м.н.
Бузик Олег Жанович д.м.н., проф.
Корчагина Галина Александровна д.м.н., проф.
Илюк Руслан Дмитриевич д.м.н.
Лобачева Анна Станиславовна к.м.н.
Михайлов Михаил Альбертович д.м.н.
Надеждин Алексей Валентинович к.м.н.
Поплевченков Константин Николаевич к.м.н.
Рыбакова Ксения Валерьевна д.м.н.
Авторы:
1. Винникова Мария Алексеевна, доктор медицинских наук, профессор. Российское общество психиатров.
2. Ненастьева Анна Юрьевна, кандидат медицинских наук. Российское общество психиатров.
3. Уткин Сергей Ионович, кандидат медицинских наук. Российское общество психиатров. Федерация анестезиологов и реаниматологов.
Конфликт интересов: нет
Все члены рабочей группы подтвердили отсутствие финансовой поддержки/конфликта интересов, о которых необходимо сообщить.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
1. Врач психиатр-нарколог
2. Врач-психиатр-нарколог участковый
3. Врач психотерапевт
4. Медицинский психолог
При разработке настоящих клинических рекомендаций использованы следующие информационные средства:
• Приказ Минздрава России от 28.02.2019 N 103н (в редакции от 23.06.2020) «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности, включаемой в клинические рекомендации информации» (с изменениями и дополнениями, вступившими в силу 04.08.2020).
• Анализ источников научной литературы и других данных, а также интернет-ресурсов за последние 10 лет:
- отечественные: руководства для врачей, научные публикации в периодических изданиях, научная электронная библиотека e-library, Государственный Реестр Лекарственных Средств, Регистр лекарственных средств России, Федеральная служба государственной статистики Российской Федерации;
- зарубежные: Cochrane Library, Medline, MedScape, PubMed, National Institute on Alcohol Abuse and Alcoholism (NIAAA), Substance Abuse and Mental Health Services Administration (SAMSHA), European Monitoring Centre for Drugs and Drug Addiction (EMCDDA)
- Регламентирующие документы Правительства Российской Федерации и Министерства здравоохранения Российской Федерации.
При разработке настоящих клинических рекомендаций использовалась рейтинговые схемы для оценки уровня достоверности доказательств (1, 2, 3, 4, 5) и уровня убедительности рекомендаций (A, B, C).
ПриложениеА2.1- Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
|
УДД |
Расшифровка |
|---|---|
|
1 |
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных КИ с применением мета-анализа |
|
2 |
Отдельные исследования с контролем референсным методом или отдельные рандомизированные КИ и систематические обзоры исследований любого дизайна, за исключением рандомизированных КИ, с применением мета-анализа |
|
3 |
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая |
|
5 |
Имеется лишь обоснование механизма действия или мнение экспертов |
Приложение А2.2 – Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
|
Уровни достоверности доказательств (УДД) Приказ Минздрава России от 28.02.2019 N 103н (в редакции от 23.06.2020) «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности, включаемой в клинические рекомендации информации» (с изменениями и дополнениями, вступившими в силу 04.08.2020). |
|
|---|---|
|
1 |
Систематический обзор рандомизированных клинических исследований (РКИ) с применением мета-анализа |
|
2 |
Отдельные РКИ и систематические обзоры исследований любого дизайна (помимо РКИ) с применением мета-анализа |
|
3 |
Нерандомизированные сравнительные исследования, в том числе когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
|
5 |
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Приложение А2.3 – Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
|
Уровень убедительности рекомендации (УРР) Приказ Минздрава России от 28.02.2019 N 103н (в редакции от 23.06.2020) «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности, включаемой в клинические рекомендации информации» (с изменениями и дополнениями, вступившими в силу 04.08.2020). |
|
|---|---|
|
A |
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
|
B |
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
|
C |
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Приложение А2.4 – Рейтинговая схема оценки уровня убедительности рекомендаций (УРР) для лечебных, реабилитационных, профилактических вмешательств
|
УУР |
Описание |
|---|---|
|
A |
Однозначная (сильная) рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
|
B |
Неоднозначная (условная) рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
|
C |
Низкая (слабая) рекомендация – отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации ААС, наличии обоснованных дополнений/замечаний к ранее утверждённым клинических рекомендаций, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
1. Приказ Минздрава России от 30.12.2015 N 1034н (в редакции от 07.06.2022) «Об утверждении Порядка оказания медицинской помощи по профилю "психиатрия-наркология" и Порядка диспансерного наблюдения за лицами с психическими расстройствами и (или) расстройствами поведения, связанными с употреблением психоактивных веществ» (с изменениями и дополнениями, вступившими в силу 01.08.2022).
2. Приказ Минздрава России от 04.09.2012 N 124н «Об утверждении стандарта первичной медико-санитарной помощи при абстинентном состоянии, вызванном употреблением психоактивных веществ» (Зарегистрировано в Минюсте России 17.12.2012 N 26151).
3. Приказ Минздрава России от 04.09.2012 N 135н «Об утверждении стандарта специализированной медицинской помощи при абстинентном состоянии, вызванном употреблением психоактивных веществ» (Зарегистрировано в Минюсте России 19.12.2012 N 26193).
Приказ Минздрава России от 28.02.2019 N103н (в редакции от 23.06.2020) «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности, включаемой в клинические рекомендации информации»(с изменениями и дополнениями, вступившими в силу 04.08.2020).
Приложение Б. Алгоритмы действий врача
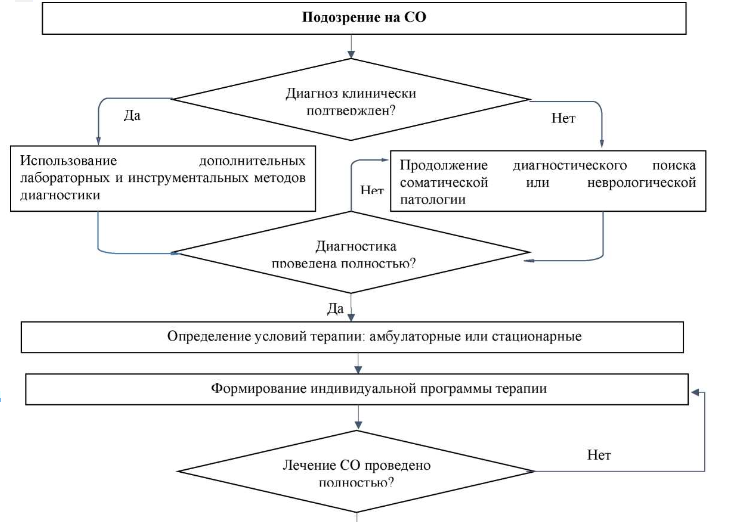
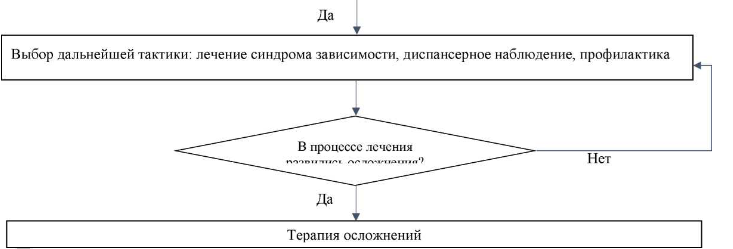
Приложение В. Информация для пациента
F11.3 СИНДРОМ ОТМЕНЫ ОПИОИДОВ
Возникновение синдрома отмены («ломки») при опийной наркомании свидетельствует о формировании качественно нового этапа заболевания – второй (средней) стадии зависимости от опиоидов. Синдром отмены формируется примерно через 2 недели – 1,5 месяца после начала систематического употребления опиоидов.
Синдром отмены возникает после прекращения употребления наркотика или резкого уменьшения его дозы, в среднем, через 6-24 часа. Время развития синдрома отмены зависит от вида употребляемого опиоида, например, при употреблении метадона характерен отсроченный характер синдрома отмены.
Основные клинические проявления синдрома отмены включают в себя вегетативные, болевые и психические расстройства. К вегетативным проявлениям относятся: зевота, слезотечение, насморк и заложенность носа с частым чиханием, понос, расширение зрачков, повышение температуры тела, учащенное сердцебиение, повышение артериального давления, потливость, озноб, пилоэрекция («гусиная кожа»). На начальных этапах зависимости, когда болевые расстройства могут быть выражены слабо или отсутствуют, пациенты нередко принимают данное состояние за грипп или ОРВИ. Нередко первым проявлением синдрома отмены являются психические расстройства: напряженность, чувство дискомфорта, тревога, раздражительность, угрюмость, сопровождающиеся общим недомоганием, физической слабостью. Нарушения сна, вплоть до полной бессонницы, появляются в течение 1 суток после прекращения употребления наркотиков и отличаются продолжительностью и устойчивостью к лечению.
В структуре синдрома отмены опиоидов болевые расстройства являются одними из важнейших и являются наиболее тяжело переживаемыми пациентами расстройствами. Отсюда сленговое название синдрома отмены опиоидов – «ломка». На вторые сутки после последнего приема наркотика появляются мышечные и суставные боли в конечностях, спине, а иногда во всем теле выкручивающего характера. Часто бывают боли в животе, понос. Болевые расстройства выражены, субъективно крайне тягостны и мучительны. Влечение к наркотику осознанное, часто непреодолимое, его не удается скрыть. Поведение становится неуправляемым, агрессивным: на состояние отмены опиоидов приходится наибольшее число правонарушений, возрастает опасность самоубийства. Максимальной выраженности синдром отмен достигает на 2-3 сутки, его продолжительность зависит от вида наркотика, длительности заболевания, проводимого лечения. Острые расстройства при героиновой зависимости на фоне лечения редко продолжаются более 5-10 дней.
Лечение
При развитии синдрома отмены лучшим вариантом для больного будет обращение к врачу, даже если проявления состояния легкие. Принципы и подходы к лечению при всех видах зависимости одинаковы. Лечение больных должно быть длительным, комплексным. Оно включает в себя несколько этапов.
1-й этап: лечение «ломки». На этом этапе выводят наркотик из организма, снимают все имеющиеся симптомы. Сейчас существует множество хороших методов и препаратов, которые позволяют облегчить страдание пациентов. Главная задача этого этапа – облегчить боль и восстановить жизненно важные функции организма.
2-й этап: лечение «тяги», поддерживающая терапия.
На этом этапе используются специфические препараты, которые снимают напряжение, улучшают настроение, выравнивают сон. Также важное внимание уделяется состоянию, и, по необходимости, лечению внутренних органов, особенно печени, почек, головного мозга.
На этом этапе проводится психотерапия, в работу включаются психологи. 1-й и 2-й этапы проходят в стационаре.
Главная задача 3-го этапа - адаптировать пациента в нормальной жизни, он называется реабилитационный. Это очень длительный этап лечения, чем он дольше, тем лучше результат.
Профилактика
Для больных опийной наркоманией существуют специфические методы терапии, направленные на поддержание трезвости, например, использование блокаторов опиоидных рецепторов – при нахождении в организме их действие уберегает больного от действия наркотиков; активно разрабатываются методы и лекарства, направленные на лечение гепатита С и других последствий наркомании. Применение каждого из перечисленных методов должно быть строго индивидуально и проводиться под наблюдением врачей.
F12.3. СИНДРОМ ОТМЕНЫ КАННАБИНОИДОВ
Синдром отмены каннабиноидов возникает, в среднем, через 2-3 года с начала употребления этой группы наркотиков. В синдроме отмены преобладают депрессивные нарушения: усталость, разбитость, раздражительность, злобность, дисфория, бессонница. Могут наблюдаться дрожание рук, потливость, тошнота, рвота. В отдельных случаях в период отмены преобладает интенсивная тревога – состояние, схожее с паническими реакциями. Возможны суицидальные попытки. Иногда отмечаются тяжело переживаемые, странные (сенестопатические) ощущения в разных частях тела: сдавление груди, затрудненное дыхание, неприятные ощущения в области сердца, чувство сжатия и сдавления головы в височной области. Влечение к наркотику может иметь разную выраженность. Своего пика синдром отмены достигает на 3-5 сутки, его продолжительность в среднем 7 дней.
Лечение
При развитии синдрома отмены лучшим вариантом для больного будет обращение к врачу, даже если имеющиеся нарушения легкие. Принципы и подходы к лечению при всех видах зависимости одинаковы (см. синдром отмены опиоидов). Специфического лечения синдрома отмены каннабиноидов нет.
Профилактика
Следует понимать, что хроническое употребление каннабиноидов (марихуаны, гашиша) приводит к изменениям личности больных. У больных развивается амотивационный синдром, в структуре которого преобладают: утрата интересов, снижение энергии, пассивность, отсутствие притязаний. Пациенты пренебрегают всеми своими обязанностями. Хроническая интоксикация препаратами конопли приводит к нарушениям памяти, внимания, а также может явиться пусковым механизмом развития шизофрении у лиц с соответствующей предрасположенностью. При массивном употреблении каннабиноидов может развиться психоз с поздним (отставленным) развитием, напоминающее подобные состояния при употреблении галлюциногенов. Основным средством профилактики является поддержание здорового, трезвого образа жизни.
F13.3 СИНДРОМ ОТМЕНЫ СЕДАТИВНЫХ ИЛИ СНОТВОРНЫХ ВЕЩЕСТВ
Сроки наступления синдрома отмены зависят от периода полувыведения принимаемого вещества. Возникает синдром отмены, как правило, на 1-2 день после последнего приема вещества, достигает максимума на 1-2 сутки и длится не менее 1 недели. Клинически синдром отмены проявляется: выраженным дрожанием пальцев вытянутых рук, кончика языка или век, тошнотой или рвотой, ускоренным сердцебиением, колебаниями артериального давления, головными болями, бессонницей, психомоторным беспокойством, судорожными припадками, возможно появление зрительных, осязательных или слуховых галлюцинаций (иллюзий), подозрительности напряженности (бредовой настороженности).
Лечение
При развитии синдрома отмены лучшим вариантом для больного будет обращение к врачу, даже если проявления состояния легкие. При лечении синдрома отмены врачами будет проводиться постепенное снижение дозы вещества. Лечение необходимо проводить в условиях больницы.
Профилактика
Хроническая интоксикация седативными и снотворными средствами приводит к выраженным и стойким изменениям со стороны соматической, неврологической и психической сфер. Отмечается повышенная утомляемость, истощаемость внимания, снижение сообразительности. По мере увеличения стажа употребления седативных веществ появляется медлительность, замкнутость, подавленность, что нередко сменяется вспышками злобы и гнева. Выявляются нарушения глотания, ухудшение почерка, вялая мимика, мышечная слабость, нарушения тонких движений и походки. Прогрессирующее снижение интеллекта приводит к утрате трудоспособности и инвалидности. Весьма высока частота смертельных исходов. Причиной смерти служат самоубийства, несчастные случаи в состоянии опьянения, передозировки. В любых случаях появления проблем настроения и сна во избежание развития выше перечисленных осложнений рекомендовано обращение к врачу. Категорически опасно заниматься самолечением.
F14.3 СИНДРОМ ОТМЕНЫ КОКАИНА,
F15.3 СИНДРОМ ОТМЕНЫ ДРУГИХ СТИМУЛЯТОРОВ, ВКЛЮЧАЯ КОФЕИН**
Синдром отмены возникает через 12-24 часа после последнего употребления амфетаминов, максимальной выраженности расстройства достигают на 2-4 сутки. Синдром отмены характеризуется усталостью, ощущением разбитости, заторможенностью, нарушениями сна – бессонницей или сонливостью с кошмарными сновидениями. Нередко отмечаются раздражительность, злобность, истерические реакции со склонностью к самоповреждению. Выраженное снижение настроения может сопровождаться идеями самообвинения и суицидальными попытками. Могут отмечаться отдельные идеи отношения, преследования. Острые проявления синдрома отмены исчезают в течение 7-14 дней, в тяжелых случаях – сохраняются до 1 месяца. В состоянии отмены стимуляторов могут наблюдаться психозы с речевым и двигательным возбуждением, продолжающиеся от 2-3 недель до нескольких месяцев.
Вслед за этим периодом, как правило, начинается период хронической дисфории (раздражительности) и ангедонии (снижения или утраты способности испытывать удовольствие и радость). Появляется отчетливое ощущение неполноценности собственного существования, безысходность, чувство внутренней пустоты, безрадостности и т.д. При этом влечение к наркотику проявляется стойким и выраженным снижением настроения, часто влечение принимает непреодолимый характер, что приводит к возобновлению употребления вещества.
Лечение
При развитии синдрома отмены лучшим вариантом для больного будет обращение к врачу, даже если проявления состояния легкие. Специфических средств терапии синдрома отмены кокаина и других стимуляторов не существует. Принципы и подходы к лечению при всех видах зависимости одинаковы (см. синдром отмены опиоидов). Основная задача терапии – предупредить развитие психических осложнений.
Профилактика
Все психостимуляторы, исключая кофеин**, чрезвычайно наркогенны. Наркогенность (способность вызывать зависимость) зависит от многих факторов: вида наркотика, способа его введения, дозы и др. Для данной формы наркомании характерно быстрое развитие психической зависимости, развитие психозов (галлюцинаций и бредовых идей), а также формирование слабоумия. Таким образом, основным средством профилактики является поддержание здорового, трезвого образа жизни.
F16.3 СИНДРОМ ОТМЕНЫ ГАЛЛЮЦИНОГЕНОВ
Синдром отмены при употреблении ЛСД, псилоцибина и мескалина, кетамина**, фенциклидина, по данным большинства исследователей, отсутствует. При длительном систематическом употреблении данных веществ могут наблюдаться: нарушения сна, колебания артериального давления, общий дискомфорт продолжительностью 7-10 дней, переходящие в состояние с выраженной слабостью, повышенной утомляемостью и утратой инициативы.
Лечение
Специфической терапии не существует. Принципы и подходы к лечению при всех видах зависимости одинаковы (см. синдром отмены опиоидов). При развитии зависимости лучше вариантом для больного будет обращение к врачу.
Профилактика
Последствия употребления галлюциногенов проявляются психической тупостью («психической глухотой») или психозами с богатой симптоматикой, наблюдающихся даже после длительного периода после последнего приема данных веществ.
Рецидивы галлюцинаций, по разным данным, возникают у 16-57% потребителей ЛСД в результате воздействия провоцирующих факторов: стрессовых ситуаций, приема другого психоактивного вещества (например, алкоголя) или развитии какого-либо заболевания.
В ряде случаев галлюциногены провоцируют развитие психического заболевания – шизофрении, предугадать или предупредить ее развитие невозможно. В связи с этим даже единичный прием галлюциногенов может быть опасен. Учитывая непредсказуемость последствий употребления галлюциногенов, наилучшим средством профилактики является поддержание здорового, трезвого образа жизни.
F18.3 СИНДРОМ ОТМЕНЫ ЛЕТУЧИХ РАСТВОРИТЕЛЕЙ
Синдром отмены летучих растворителей возникает через 6-12 месяцев после начала употребления и через 1-3 суток после последнего употребления данных веществ. Проявляется в виде вялости, разбитости, неприятных ощущений в теле, головной боли, потливости, головокружения, тошноты, плохого сна, пониженного настроения и раздражительности. Эти симптомы похожи на проявления вегето-сосудистой дистонии. На 5-7 сутки присоединяется депрессивная симптоматика. На 4-5 сутки синдром отмены может осложниться развитием острого психоза, длящегося от нескольких часов до 3 суток – с иллюзиями или зрительными и слуховыми галлюцинациями. Продолжительность синдрома отмены около 2-х недель.
Лечение
При развитии синдрома отмены лучшим вариантом для больного будет обращение к врачу, даже если проявления состояния легкие. По терапевтическим подходам схоже с лечением синдрома отмены алкоголя.
Профилактика
При употреблении ингалянтов развиваются выраженные нарушения нервной системы. Нередко встречается полинейропатия, проявляющаяся в снижении чувствительности и неприятных ощущениях в кистях и стопах, онемении по типу "носков" и "перчаток", снижении мышечной силы и нарушениями кровоснабжения. Токсическое поражение нервных окончаний в головном мозге приводит к ухудшению зрения вплоть до слепоты, а также к шуму (звону, гулу, свисту) в ушах и ослаблению слуха. Наблюдаются тяжелые, быстро нарастающие изменения личности, развивается снижение памяти и интеллекта, характерны нарушения поведения (психопатоподобное поведение). Также возникают нарушения сердечно-сосудистой, дыхательной, мочевыделительной системы.
Учитывая фактор возраста (пристрастие формируется, в основном, у лиц младшего и подросткового возраста), меры первичной профилактики, идущей от семьи, являются важнейшими в предупреждения развития зависимости.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Г1. Клиническая шкала тяжести СО опиатов COWS
Название на русском языке: Клиническая шкала тяжести СО опиатов.
Оригинальное название: The Clinical Opiate Withdrawal Scale (COWS).
Источник (официальный сайт разработчиков, публикация с валидацией): Wesson D.R., Ling W. The Clinical Opiate Withdrawal Scale (COWS) Journal of Psychoactive Drugs, 2003. Vol. 35(2): 253-259. doi: 10.1080/02791072.2003.10400007.
Руководство по фармакологическому лечению опиоидной зависимости с психосоциальным сопровождением.
http://rcn.kg/uploads/files/WHO_Opioid_dependence_Russian.pdf.
Тип (подчеркнуть): шкала оценки; индекс; вопросник; другое (уточнить):
Назначение: Шкала COWS используется для измерения тяжести симптомов отмены опиоидов у пациента. При использовании шкалы производят оценку выраженности различных соматических и психических симптомов СО опиоидов, соответствующих определённому количеству баллов, которые затем суммируют. Максимально возможное количество баллов равно 48.
Содержание (шаблон):
|
Симптом |
Характеристика |
Баллы |
|---|---|---|
|
Частота пульса в состоянии покоя
Измеряется после того, как пациент посидит или полежит в течение 1 минуты.
|
пульс < 80 в минуту |
0 |
|
пульс 81-100 в минуту |
1 |
|
|
пульс 101-120 в минуту |
2 |
|
|
пульс > 120 в минуту |
4 |
|
|
Потоотделение
Оценивается за последние полчаса без учета какой-либо физической активности или повышения температуры в помещении.
|
не сообщает об ознобе или приливах жара |
0 |
|
субъективное ощущение озноба или приливах жара |
1 |
|
|
покраснение или видимая влажность лица |
2 |
|
|
капли пота на лбу или лице |
3 |
|
|
пот струится по лицу |
4 |
|
|
Беспокойство
Наблюдение в ходе оценки. |
может сидеть неподвижно |
0 |
|
сообщает, что сидеть неподвижно трудно, но можно |
1 |
|
|
частые изменения положения или неуместные движения рук/ног |
3 |
|
|
не может сидеть спокойно дольше нескольких секунд |
5 |
|
|
Размер зрачков
Оценивается при дневном освещении.
|
зрачки сужены или нормальных размеров для комнатного света |
0 |
|
зрачки, возможно, шире, чем при комнатном свете |
1 |
|
|
зрачки умеренно расширены |
2 |
|
|
зрачки расширены настолько, что можно видеть только край радужной оболочки |
5 |
|
|
Боль в костях или суставах
Если у пациента была боль раньше, баллы ставятся только за дополнительный компонент, относимый на счет опиатов. |
отсутствует |
0 |
|
легкое генерализованное недомогание |
1 |
|
|
пациент сообщает о сильной генерализованной боли в суставах /мышцах |
2 |
|
|
пациент потирает суставы/мышцы и не может сидеть спокойно из-за недомогания |
4 |
|
|
Насморк или слезотечение
Не обусловлены симптомами простуды или аллергическими реакциями.
|
отсутствует |
0 |
|
заложен нос или необычно влажные глаза |
1 |
|
|
обильное выделение из носа или слезотечение |
2 |
|
|
постоянное выделение из носа или по щекам текут слезы |
4 |
|
|
Расстройство желудочно¬
кишечного тракта За последние полчаса. |
симптомов расстройства ЖКТ нет |
0 |
|
спазмы в желудке |
1 |
|
|
тошнота и жидкий стул |
2 |
|
|
рвота или диареи |
3 |
|
|
многократные эпизоды рвоты или диареи |
5 |
|
|
Тремор
Наблюдение за вытянутыми руками. |
дрожания нет |
0 |
|
дрожание можно почувствовать, но не заметить |
1 |
|
|
заметно легкое дрожание |
2 |
|
|
сильное дрожание или подергивание мышц |
4 |
|
|
Зевота
Наблюдение в ходе оценки. |
зевоты нет |
0 |
|
зевнул раз или два за время оценки |
1 |
|
|
зевнул три или более раз за время оценки |
2 |
|
|
зевал по несколько раз в минуту |
4 |
|
|
Тревога или раздражительность |
отсутствует |
0 |
|
пациент сообщает о нарастании раздражительности или страха |
1 |
|
|
пациент явно раздражен или находится в состоянии патологического страха |
2 |
|
|
пациент настолько раздражен или находится в таком состоянии патологического страха, что его дальнейшее участие в оценке затруднено |
4 |
|
|
«Гусиная кожа» |
кожа гладкая |
0 |
|
пилоэрекцию кожи можно почувствовать на ощупь или на руках поднимаются волосы |
3 |
|
|
пилоэрекция бросается в глаза |
5 |
Ключ (интерпретация):
|
Баллы |
Интерпретация |
|---|---|
|
5-12 |
легкий СО |
|
13-24 |
средняя тяжесть СО |
|
25-36 |
средне-тяжелый СО |
|
> 36 |
тяжелый СО |
Г2. Алгоритм Наранжо
Название на русском языке: Алгоритм Наранжо для оценки причинно-следственной связи «неблагоприятные побочные реакции (далее – НПР) - лекарство»
Оригинальное название: Naranjo algorithm
Источник (официальный сайт разработчиков, публикация с валидацией): Naranjo С.А., Busto U., Sellers E.M., et al. A method for estimating the probability of adverse drug reactions. Clinical Pharmacology and Therapeutics. 1981; 30(2):239-245. DOI: 10.1038/clpt.1981.154
Тип (подчеркнуть): шкала оценки; индекс; вопросник; другое (уточнить):
Назначение: Алгоритм Наранжо используется для оценки достоверности связи между лекарством и нежелательной побочной реакцией. Данный вопросник при определении степени достоверности взаимосвязи «лекарство - НПР» ориентирован на получение конкретных ответов, оценивающихся в баллах. Определенное число баллов соответствует определенной степени достоверности.
Содержание (шаблон):
|
№№ |
Вопросы |
Да |
Нет |
Неизвестно |
|---|---|---|---|---|
|
1 |
Были ли ранее достоверные сообщения об этой НПР? |
1 |
0 |
0 |
|
2 |
НПР возникла после введения (приема) подозреваемого лекарства? |
2 |
-1 |
0 |
|
3 |
Улучшилось ли состояние испытуемого (проявления НПР) после прекращения приема препарата или после введения специфического антидота? |
1 |
0 |
0 |
|
4 |
Возобновилась ли НПР после повторного введения препарата? |
2 |
-1 |
0 |
|
5 |
Есть ли еще причины (кроме подозреваемого лекарства), которые могли вызвать НПР? |
-1 |
2 |
0 |
|
6 |
Было ли лекарство обнаружено в крови (или других жидкостях) в концентрациях, известных как токсические? |
1 |
0 |
0 |
|
7 |
Была ли НПР более тяжелой после увеличения дозы и менее тяжелой после ее уменьшения? |
1 |
0 |
0 |
|
8 |
Отмечал ли испытуемый аналогичную реакцию на то же или подобное лекарство при прежних его приемах? |
1 |
0 |
0 |
|
9 |
Было ли НПР подтверждено объективно? |
1 |
0 |
0 |
|
10 |
Отмечалось ли повторение НПР после назначения плацебо? |
-1 |
1 |
0 |
Ключ (интерпретация):
Категории степеней достоверности взаимосвязи «НПР - лекарство» по шкале Наранжо в результате ответов на 10 вопросов определяются как:
|
Баллы |
Категории степеней достоверности взаимосвязи «НПР - лекарство» |
|---|---|
|
0 |
сомнительная |
|
1-4 |
возможная |
|
5-8 |
вероятная |
|
9 и более баллов |
определенная |
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.