Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы
 Версия: Клинические рекомендации РФ 2024 (Россия)
Версия: Клинические рекомендации РФ 2024 (Россия)
Другие формы острой ишемической болезни сердца (I24.8), Коронарный тромбоз, не приводящий к инфаркту миокарда (I24.0), Острая ишемическая болезнь сердца неуточненная (I24.9), Острый инфаркт миокарда неуточненный (I21.9), Острый трансмуральный инфаркт миокарда других уточненных локализаций (I21.2), Острый трансмуральный инфаркт миокарда неуточненной локализации (I21.3), Острый трансмуральный инфаркт нижней стенки миокарда (I21.1), Острый трансмуральный инфаркт передней стенки миокарда (I21.0), Повторный инфаркт миокарда (I22)
Кардиология
Общая информация
Краткое описание
Разработчик клинической рекомендации
- Общероссийская общественная организация «Российское кардиологическое общество»
- Ассоциация сердечно-сосудистых хирургов России
- Общероссийская общественная организация «Российское общество скорой медицинской помощи»
- Российское научное общество специалистов по рентгенэндоваскулярной диагностике и лечению
Одобрено Научно-практическим Советом Минздрава РФ
– размещенные в Рубрикаторе после 1 января 2024 года – с 1 января 2025 года.
Клинические рекомендации
Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы
Год утверждения (частота пересмотра): 2024
Возрастная категория: Взрослые
Пересмотр не позднее: 2026
ID: 157
Определение заболевания или состояния (группы заболеваний или состояний)
Острый коронарный синдром (ОКС) — термин, обозначающий любую группу клинических признаков или симптомов, позволяющих подозревать инфаркт миокарда (ИМ) или нестабильную стенокардию (НС). Термин «ОКС» используется, когда недостаточно диагностических критериев для нозологического диагноза («ИМ» или «НС») и, следовательно, представляет собой предварительный диагноз в первые часы и сутки заболевания, в то время как термины «ИМ» и «НС» используются при формулировании окончательного диагноза. Соответственно, термин «ОКС» может использоваться на догоспитальном или раннем госпитальном этапах и в дальнейшем трансформируется в диагноз «острый ИМ», «НС» либо, по результатам дифференциальной диагностики, — в любой другой диагноз, в том числе некардиологический.
ОКС может быть как проявлением дестабилизации хронического течения ишемической болезни сердца (ИБС), так и первым проявлением поражения коронарного русла у пациентов, не предьявлявших ранее каких-либо кардиологических жалоб.
Острый коронарный синдром со стойким подъемом сегмента ST на электрокардиограмме (ОКСпST) — остро возникшие клинические признаки или симптомы ишемии миокарда в сочетании с наличием стойкого (длительностью более 20 минут) подъема сегмента ST как минимум в двух смежных отведениях электрокардиограммы (ЭКГ) или остро возникшей блокады левой ножки пучка Гиса (ЛНПГ).
ИМ – острое повреждение миокарда вследствие его ишемии. Для диагностики острого ИМ, не связанного с чрескожным коронарным вмешательством (ЧКВ) или операцией коронарного шунтирования (КШ), следует документировать повышение и/или снижение концентрации сердечного тропонина в крови, которая должна как минимум однократно превысить 99-й перцентиль верхней референсной границы у пациентов без исходного повышения уровня сердечного тропонина в крови, либо увеличение и/или снижение концентрации сердечного тропонина > 20% при его исходно стабильно (вариабельность была ≤ 20%) повышенном уровне, в сочетании с хотя бы одним критерием острой ишемии миокарда.
Критерии ишемии миокарда:
- остро возникшие (или предположительно остро возникшие) ишемические изменения на ЭКГ;
- появление патологических зубцов Q на ЭКГ;
- подтверждение с помощью методов визуализации наличия новых участков миокарда с потерей жизнеспособности или нарушением локальной сократимости, характерных для ишемической этиологии;
- выявление внутрикоронарного тромбоза при коронарографии (КГ) или на аутопсии.
Подробнее критерии инфаркта миокарда представлены в Приложении А3. Критерии диагностики инфаркта миокарда [5].
Изменения на ЭКГ, характерные для ишемии миокарда:
- Остро возникшие подъемы сегмента ST на уровне точки J как минимум в двух смежных отведениях ЭКГ ≥ 0,1 мВ во всех отведениях, за исключением отведений V2–V3, где элевация сегмента ST должна составлять ≥ 0,2 мВ у мужчин в возрасте 40 лет и старше, ≥ 0,25 мВ у мужчин моложе 40 лет или ≥ 0,15 мВ у женщин (при отсутствии гипертрофии левого желудочка (ЛЖ) или блокады ЛНПГ).
- Остро возникшие горизонтальные или косонисходящие снижения сегмента ST ≥ 0,05 мВ как минимум в двух смежных отведениях ЭКГ и/или инверсии зубца Т > 0,1 мВ как минимум в двух смежных отведениях ЭКГ с доминирующим зубцом R или соотношением амплитуды зубцов R/S > 1 [5].
ИМ со стойким подъемом сегмента ST на ЭКГ (ИМпST) — ИМ, при котором в ранние сроки заболевания имеют место стойкий (длительностью более 20 минут) подъем сегмента ST как минимум в двух смежных отведениях ЭКГ. К этой категории также относят пациентов с остро возникшей блокадой ЛНПГ.
Подразумевается, что в абсолютном большинстве случаев подобные изменения ЭКГ вызваны трансмуральным ишемическим повреждением миокарда, обусловленным острой полной окклюзией крупной ветви КА. При отсутствии реваскуляризации (интервенционной, хирургической, медикаментозной или спонтанной) в дальнейшем формируется некроз достаточно большого участка сердечной мышцы, как правило, трансмуральный. Трансмуральное повреждение и, в последующем, трансмуральный некроз миокарда сопряжены с очень высоким риском смерти от фатальных нарушений ритма и проводимости сердца, разрыва миокарда и острой сердечной недостаточности (ОСН).
Постинфарктная стенокардия — стенокардия, возникшая в первые 2 недели от начала инфаркта миокарда.
В связи в тем, что «инфаркт миокарда» является нозологическим диагнозом (не может быть установлен до повышения сердечных тропонинов, доказанного лабораторными методами), а медицинская помощь должна быть оказана до его верификации (при условии, что установлен предварительный диагноз «ОКС» и его тип согласно смещению сегмента ST на ЭКГ), то приведенные в данном документе рекомендации справедливы как для диагноза «ИМпST», так и для диагноза «ОКСпST».
Чаще всего исходом ОКСпST является ИМ с формированием зубца Q на ЭКГ. В таком случае присваиваются коды I21.0–I21.2, I22.0-I22.8. В случае, если ОКСпST приводит к ИМ без формирования зубца Q, также присваиваются коды I21.0–I21.2, I22.0–I22.8.
В случае, если ОКС без подъема ST прогрессирует в ИМпST (с формированием зубца Q) присваиваются коды I21.0–I21.2, I22.0–I22.8.
В случае, когда при ОКСпST не развился ИМ (отсутствуют его критерии), в т.ч. в случаях эффективной инвазивной / медикаментозной реперфузии или спонтанной реперфузии, присваивается код I24.0. Рекомендуемая формулировка: «Острый коронарный тромбоз без развития ИМ (требуется указать — на фоне ТЛТ, ЧКВ или ТЛТ и ЧКВ)».
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
I21. Острый инфаркт миокарда
I21.0. Острый трансмуральный инфаркт передней стенки миокарда
I21.1. Острый трансмуральный инфаркт нижней стенки миокарда
I21.2. Острый трансмуральный инфаркт миокарда других уточненных локализаций
I21.3. Острый трансмуральный инфаркт миокарда неуточненной локализации
I21.9. Острый инфаркт миокарда неуточненный
I22. Повторный инфаркт миокарда
I22.0. Повторный инфаркт передней стенки миокарда
I22.1. Повторный инфаркт нижней стенки миокарда
I22.8. Повторный инфаркт миокарда другой уточненной локализации
I22.9. Повторный инфаркт миокарда неуточненной локализации
I24. Другие формы острой ишемической болезни сердца
I24.0. Коронарный тромбоз, не приводящий к инфаркту миокарда
I24.8. Другие формы острой ишемической болезни сердца
I24.9. Острая ишемическая болезнь сердца неуточненная
Чаще всего исходом ОКСпST является ИМ с формированием зубца Q на ЭКГ. В таком случае присваиваются коды I21.0–I21.2, I22.0-I22.8. В случае, если ОКСпST приводит к ИМ без формирования зубца Q, также присваиваются коды I21.0–I21.2, I22.0–I22.8.
В случае, если ОКС без подъема ST прогрессирует в ИМпST (с формированием зубца Q) присваиваются коды I21.0–I21.2, I22.0–I22.8.
В случае, когда при ОКСпST не развился ИМ (отсутствуют его критерии), в т.ч. в случаях эффективной инвазивной / медикаментозной реперфузии или спонтанной реперфузии, присваивается код I24.0. Рекомендуемая формулировка: «Острый коронарный тромбоз без развития ИМ (требуется указать — на фоне ТЛТ, ЧКВ или ТЛТ и ЧКВ)».
В случаях внезапной смерти пациента с ОКСпST (ИМ 3 типа по критериям 4-го универсального определения) в клиническом диагнозе следует использовать рубрику I24.8 (рекомендуемая формулировка: «Внезапная коронарная смерть»).
Так называемые «неуточненные» рубрики (I21.3, I21.9, I22.9, I24.9) и соответствующие им формулировки в заключительном клиническом диагнозе могут использоваться только в исключительных случаях — при наличии объективных трудностей диагностики. В патологоанатомических и судебно-медицинских диагнозах использоваться не могут.
Использование кодов Раздела I23 «Некоторые текущие осложнения острого ИМ» при кодировании основного заболевания / первоначальной причины смерти недопустимо (данные состояния являются осложнением основного заболевания — ИМ).
После 28 суток от начала симптомов ИМпST диагноз «ИМ» не применяется. В таком случае принято указывать на перенесенный ранее ИМ, обозначая это состояние как «Постинфарктный кардиосклероз».
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
Классификации ОКС и острого ИМ:
На этапе предварительного диагноза:
- ОКС с подъемом сегмента ST — ИМ с подъемом сегмента ST (эта формулировка используется также при ОКС / ИМ с остро возникшей блокадой ЛНПГ);
- ОКС без подъема сегмента ST (в настоящем документе не рассматривается).
Клинический диагноз (в том числе заключительный) после подтверждения / исключения ИМ:
- ИМ с подъемом сегмента ST (эта формулировка используется также при ИМ с остро возникшей блокадой ЛНПГ);
- ИМ без подъема сегмента ST (в настоящем документе не рассматривается);
- Нестабильная стенокардия (в настоящем документе не рассматривается).
Классификация ИМ на основании последующих изменений на ЭКГ (не обязательна к применению):
- ИМ с формированием патологических зубцов Q;
- ИМ без формирования патологических зубцов Q.
Классификация ИМ на основании глубины поражения мышечного слоя (является приоритетной для патологоанатомического / судебно-медицинского диагноза):
- Субэндокардиальный ИМ;
- Трансмуральный ИМ.
Классификация ИМ на основании локализации очага острого ишемического повреждения / некроза:
- ИМ передней стенки левого желудочка (передний ИМ);
- ИМ боковой стенки левого желудочка (боковой ИМ);
- ИМ верхушки сердца;
- ИМ нижней стенки левого желудочка (нижний ИМ);
- ИМ задней стенки ЛЖ (задний ИМ);
- ИМ межжелудочковой перегородки;
- ИМ правого желудочка;
- ИМ предсердий;
- Возможны сочетанные локализации: задненижний, переднебоковой и др.
Классификация ИМ на основании наличия ИМ в анамнезе:
- Повторный ИМ — ИМ, развившийся после 28 суток от начала предшествующего ИМ;
- Рецидив ИМ — ИМ, развившийся в течение 28 суток (включительно) от начала предшествующего ИМ.
Классификация типов ИМ [5]:
Тип 1. ИМ, развившийся вследствие разрыва или эрозии атеросклеротической АБ в КА с последующим формированием внутрикоронарного тромба (атеротромбоз) с резким снижением кровотока дистальнее поврежденной АБ или дистальной эмболизацией тромботическими массами / фрагментами АБ с последующим развитием некроза миокарда. Более редкой причиной ИМ 1 типа является интрамуральная гематома в поврежденной АБ с быстрым увеличением ее объема и уменьшением просвета артерии.
Тип 2. ИМ, развившийся в результате ишемии, вызванной причинами, не связанными с тромботическими осложнениями коронарного атеросклероза. Патофизиологически такие ИМ связаны с повышением потребности миокарда в кислороде и/или уменьшения его доставки к миокарду, например, вследствие эмболии КА, спонтанной диссекции КА, дыхательной недостаточности, анемии, нарушений ритма сердца, артериальной гипертензии (АГ) или гипотензии и т.д. ИМ 2 типа может возникать как у пациентов с наличием, так и у пациентов с отсутствием коронарного атеросклероза.
Тип 3. ИМ 3 типа соответствует случаям появления симптомов, указывающих на ишемию миокарда, сопровождающихся предположительно новыми ишемическими изменениями ЭКГ или фибрилляцией желудочков, когда пациенты умирают до появления возможности взятия образцов крови или в период до повышения активности биохимических маркеров некроза миокарда в крови. Диагноз подтверждается на основании обнаружения острого ИМ на аутопсии.
Тип 4а. ИМ, связанный с осложнениями, возникшими по время процедуры ЧКВ и в ближайшие 48 часов после нее.
Тип 4б. ИМ, связанный с тромбозом коронарного стента, документированный при КГ или аутопсии. В зависимости от сроков после имплантации стента выделяют острый (0–24 ч), подострый (>24 ч — 30 суток), поздний (>30 суток — 1 год) и очень поздний (>1 года) тромбоз стента.
Тип 4с. ИМ, связанный с рестенозом после ЧКВ. ИМ 4с типа устанавливается в случае обнаружения выраженного рестеноза в артерии, соответствующей зоне ИМ, когда отсутствуют признаки тромбоза и другие поражения инфаркт-связанной артерии.
Тип 5. ИМ, связанный с операцией коронарного шунтирования (КШ).
Критерии диагностики и дифференциальной диагностики ИМ разных типов представлены в Приложении А3. Критерии диагностики инфаркта миокарда [5, 12, 13].
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
ИМ, как правило, является следствием атеротромбоза крупной КА (син.: эпикардиальной артерии). Тромб формируется чаще всего на месте разрыва покрышки так называемой «уязвимой» (нестабильной) атеросклеротической бляшки (АБ) – с большим липидным ядром, богатой воспалительными элементами и истонченной покрышкой, однако возможно образование окклюзирующего тромба и на дефекте эндотелия (эрозии) КА, не обязательно локализованном на поверхности АБ. Нередко окклюзия развивается в месте гемодинамически незначимого стеноза КА. В отличие от ОКСбпST, основу патогенеза которого составляет неокклюзирующий пристеночный тромбоз, при ОКСпST почти всегда имеется полная и стойкая тромботическая окклюзия крупной эпикардиальной артерии, вызывающая трансмуральную ишемию / повреждение / некроз миокарда.
В КА пациентов с ИМпST нередко находят несколько «уязвимых» АБ, в том числе с нарушенной целостностью их поверхностных структур. Из-за высокого риска возникновения повторных окклюзий КА требуется сочетать у таких пациентов локальные воздействия (на уровне конкретной АБ, обусловившей развитие клинической картины ИМ) с системными лечебными мероприятиями, направленными на снижение вероятности повреждения других АБ и формирования атеротромбоза.
Тромб, расположенный на поверхности и даже в структурах АБ, может быть источником эмболий в дистальное сосудистое русло сердца. Эмболизация микрососудов миокарда сама по себе может приводить к образованию мелких очагов некроза и/или способствовать расширению основного участка некроза. Кроме того, в случае устранения окклюзии крупной КА, мелкие тромбоэмболы могут нарушать кровоток на уровне микроциркуляции, препятствуя полноценному восстановлению кровоснабжения миокарда (реперфузии).
Ишемию миокарда могут спровоцировать или утяжелить анемия, гипоксемия, воспаление, инфекция, лихорадка, а также метаболические или эндокринные расстройства (в частности, гипертиреоз). Спазм, диссекция и тромбоз КА наряду с тахикардией и повышением артериального давления (АД) могут возникнуть при применении кокаина и некоторых других препаратов.
У большинства пациентов с ОКСпST, даже при использовании своевременного лечения (реперфузии), развивается некроз миокарда различных, в большинстве случаев значительных, размеров. Количество погибающего и погибшего миокарда почти линейно связано с угрозой остановки кровообращения, вызванной асистолией сердца или фатальными желудочковыми аритмиям, прежде всего — фибрилляцией желудочков. Площадь и глубина некроза миокарда определяют риск развития еще одного потенциально фатального осложнения ИМпST — разрыва миокарда.
Следствием потери существенной части активного миокарда является процесс ремоделирования сердца. Образование очагов некроза в миокарде сопровождается изменением размера, формы и толщины стенки ЛЖ, а сохранившийся миокард испытывает повышенную нагрузку и подвергается гипертрофии. Насосная функция структурно и геометрически измененного ЛЖ ухудшается, что ведет к развитию сердечной недостаточности. Наиболее неблагоприятным проявлением ремоделирования ЛЖ при ИМ считается формирование аневризмы ЛЖ, почти всегда — с явной сердечной недостаточностью, иногда — с образованием тромба в полости аневризмы с серьезной угрозой эмболий в сосуды большого круга кровообращения.
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Болезни системы кровообращения (БСК) являются ведущей причиной смертей у взрослого населения Российской Федерации (РФ). В последние годы доля БСК в структуре причин смертности составляет более 40%: 2019 г. – 46%, 2020 г. – 45%, 2021 г. – 38% (снижение за счет большой доли инфекции COVID-19 – 17%), 2022 г. – 44% от общего числа смертельных исходов. В структуре смертности от БСК на долю ИБС в 2022 г. пришлось 42,3%. Примерно такой же вклад ИБС в смертность от БСК фиксируется в большинстве стран и регионов [6]. В этом же году ИМ как причина смерти зарегистрирован у 48911 человек (5,9% в структуре смертности от БСК) [7].
По данным мониторинга Министерства здравоохранения, в 2022 г. в РФ зарегистрировано 438315 случаев ОКС (на 12,5% меньше, чем в 2021 г.), в том числе 150845 случаев ОКСпST. Диагноз острого ИМ (включая повторный) поставлен 219240 пациентам, из них во время госпитализации умерло 23797, т.е. 10,9%. Наблюдается положительная динамика в снижении госпитальной летальности — этот же показатель в 2018 г. составил 17,7%. По данным национальных регистров в Европе летальность в стационаре находится в интервале от 4 до 12%. Госпитальная летальность при ОКС в целом в РФ в 2022 г. составила 5,6%. В последние годы соотношение между ИМпST и ИМбпST неуклонно меняется в сторону увеличения доли ИМбпST [8], в основном за счет лабораторного выявления «дополнительных» случаев ИМбпST среди тех, которые еще недавно относились к НС. Объективной предпосылкой для этого стало широкое использование для подтверждения острого повреждения миокарда сердечных тропонинов, в т.ч. определяемых высокочувствительными методами.
В последние 20 лет отмечается неуклонное увеличение частоты репурфизонной терапии при ИМпST. В 2022 г. первичное ЧКВ в РФ проведено в 70,9% случаев, а в крупных городах, в частности в Москве, его частота превысила 90%. Тромболитическая терапия (ТЛТ) проводилась 22,8% больных, у 73% из них – догоспитально. Важная информация по особенностям реперфузионной терапии ИМ получена по данным регистрового исследования РЕГИОН-ИМ, которое с 2020 г. проводится более чем в 40 субъектах РФ. Реперфузионная терапия (ЧКВ +/- ТЛТ) была проведена у 88,9% пациентов с ИМпST, первичное ЧКВ — у 60,6% пациентов. Среднее время от начала симптомов до первичного ЧКВ составило 657,4 ± 867,7 мин (медиана — 315 минут). Среднее время от ЭКГ до первичного ЧКВ составило 138 ± 124,3 мин (медиана — 110 мин). Изолированная ТЛТ была выполнена 7,4%, фармакоинвазивная тактика лечения применялась лишь в 20,9% случаев, то есть у 73% пациентов из тех, кому проведена ТЛТ. Таким образом, несмотря на высокую частоту восстановления коронарного кровотока, лечение часто проводится в поздние сроки, что существенно снижает его эффективность [9].
Несмотря на очевидный прогресс в лечении ОКС, среднесрочный и долгосрочный прогноз остается в целом неблагоприятный. По данным наблюдательных исследований, частота значимых сердечно-сосудистых осложнений (сердечная смерть, повторный ИМ, ишемический инсульт) после ИМ составляет около 20% [10]. В последующие 3 года значимые сердечно-сосудистые осложнения наблюдаются еще у 20% пациентов [11]. Следовательно, пациенты после ИМ относятся к категории очень высокого риска осложнений, что диктует необходимость диспансерного наблюдения и проведения эффективной вторичной профилактики, как медикаментозной, так и немедикаментозной.
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Для ишемии / повреждения / некроза миокарда характерны боль или чувство сжатия, давления или тяжести за грудиной, которые иногда описываются пациентом как дискомфорт. Возможны иррадиация в левую руку, левое плечо, горло, нижнюю челюсть, эпигастрий, а также нетипичные клинические проявления, такие как потливость, тошнота, боль в животе, одышка, удушье, потеря сознания, которые в некоторых случаях являются единственными или доминирующими.
При ИМ симптомы сходны по характеру с возникающими при приступе стенокардии, но отличаются по силе и продолжительности (сильнее и продолжительнее). Кроме того, при ИМ симптомы, как правило, возникают в покое, не устраняются приемом нитроглицерина**, а иногда — и повторными инъекциями наркотических анальгетиков. Интенсивность болевого синдрома при этом может быть различной — от незначительной до невыносимой; симптомы могут носить волнообразный характер и продолжаться от 20 минут до нескольких часов. При нетипичных клинических проявлениях в зависимости от преобладающей симптоматики у пациентов с развивающимся ИМ выделяют астматический, абдоминальный, аритмический, цереброваскулярный варианты, а также малосимптомную (безболевую) форму.
В клинической картине ИМпST могут присутствовать, иногда преобладать, симптомы его основных осложнений — острой сердечной недостаточности (отек легких, кардиогенный шок), выраженной брадикардии или тахикардии. Одним из возможных клинических проявлений ИМ, иногда единственным доступным для врачебной оценки, может быть набор симптомов, свойственных остановке кровообращения, вызванной желудочковой тахикардией / фибрилляцией желудочков, асистолией или электромеханической диссоциацией. У пациентов с устраненной или спонтанно разрешившейся остановкой кровообращения ведущим симптомом может быть разной степени стойкое угнетение сознания, вплоть до глубокой комы.
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза – см. Приложение А3 Критерии диагностики инфаркта миокарда.
1. Жалобы и анамнез
В начальной диагностике ИМпST рекомендуется опираться на оценку характера болевого синдрома и/или его эквиваленты. Достаточно типична иррадиация боли в шею, нижнюю челюсть и левую руку. Однако у ряда пациентов на первый план могут выходить менее характерные симптомы – одышка, боль в эпигастрии, тошнота, головокружение, слабость и другие. Положительный эффект на нитроглицерин** не исключает ИМпST.
При первичном медицинском контакте с пациентом рекомендуется опираться на клинические проявления заболевания, изменения на ЭКГ, а также фиксировать время от начала болевого эпизода до контакта с врачом (медицинским работником). Последнее важно для принятия основных решений, касающихся ведения пациента с ИМпST. В отдельных случаях дифференциальной диагностики с другими состояниями / заболеваниями, сопровождающимися развитием подъема сегмента ST на ЭКГ, следует сосредоточиться на подробном изучении характеристик болевого синдрома, а также данных других, в первую очередь визуализирующих (например, эхокардиографии (ЭхоКГ), мультиспиральной компьютерной томографии) и лабораторных методов.
- У всех пациентов с подозрением на ИМпST рекомендуется сбор и оценка жалоб и анамнеза для определения особенностей обострения ИБС, проведения дифференциальной диагностики, выявления симптомов, позволяющих оценить наличие и тяжесть других заболеваний, провоцирующих или осложняющих течение ИМпST и способных повлиять на выбор подходов к лечению, а также выявить осложнения ИМпST [14].
ЕОК IС (УУР С, УДД 5)
Комментарии: Клинические проявления ИМпST многообразны – от остановки сердечной деятельности, шока, угрожающих жизни аритмий до минимальных жалоб в виде небольшого дискомфорта за грудиной/одышки, а в ряде случаев и отсутствии какой-либо клинической симптоматики.
Болевые ощущения и дискомфорт в области сердца кроме заболеваний сердца могут быть обусловлены патологией других органов грудной клетки (легких, плевры, средостения, диафрагмы), пищеварительного тракта, костно-мышечных структур грудной стенки, заболеваниями нервной системы, а также психогенными состояниями.
На начальном этапе постановки диагноза рекомендуется опираться на клинические проявления (особенности болевого синдрома и менее характерные симптомы и признаки, потенциально связанные с острой ишемией миокарда), данные анамнеза, наличие факторов риска ИБС, характер изменений на ЭКГ, в некоторых случаях — данные о локальной сократительной функции желудочков сердца, а также на оценку времени от последнего болевого эпизода до контакта с врачом. При возможности следует проводить сопоставление ЭКГ, зарегистрированных во время и вне преходящих симптомов и признаков, потенциально связанных с ишемией миокарда, а также до текущего ухудшения клинического течения ИБС.
Дополнительные методы обследования требуются для подтверждения ишемии миокарда при недостаточной информативности ЭКГ, исключения заболеваний со схожей клинической симптоматикой, выявления ИМ и оценки (стратификации) риска неблагоприятного течения заболевания, а также для выявления состояний, влияющих на тактику ведения пациента.
Рекомендуется учитывать догоспитальное использование лекарственных средств, которые могут повлиять на тактику ведения пациента с ИМпST.
2. Физикальное обследование
- Физикальное обследование не дает информации непосредственно о критериях ОКСпST или ИМпST, но рекомендуется для своевременного выявления осложнений ИМпST (набухшие вены шеи и влажные хрипы в легких — при сердечной недостаточности, аускультативные шумы — при разрыве межжелудочковой перегородки (МЖП) или недостаточности митрального клапана), а также других причин появления симптомов (шум трения перикарда при перикардите, асимметричный пульс при аневризме аорты, перкуторные и аускультативные признаки наличия воздуха в плевральной полости при пневмотораксе и др.), т.е. для дифференциальной диагностики [14].
ЕОК 1C (УУР С, УДД 5)
3. Лабораторные диагностические исследования
- У пациентов с ОКСпST для подтверждения диагноза ИМпST рекомендуется исследование уровня сердечного тропонина Т или I (согласно номенклатуре медицинских услуг: исследование уровня тропонинов I, T в крови; при невозможности их выполнения - экспресс-исследование уровня тропонинов I, T в крови) [14-17].
ЕОК 1B (УУР A, УДД 1)
Комментарии: Применительно к ОКСпST лабораторное подтверждение острого повреждения миокарда с помощью исследования уровня сердечных тропонинов носит формальный характер и имеет непервостепенное значение, так как стратегия ведения пациента строится на основании клинической картины и ЭКГ (то есть все основные решения по оказанию помощи пациенту с ОКСпST не зависят от лабораторного подтверждения ИМпST). Более того, важнейшие решения, например, решение о введении тромболитика или проведении первичного ЧКВ, не должны откладываться до получения информации об уровне тропонина. Определение маркеров острого повреждения миокарда необходимо для подтверждения нозологического диагноза — ИМпST.
Рекомендуется использовать количественное (не качественное или полуколичественное) определение уровня сердечных тропонинов. Качественные и полуколичественные методики не позволяют оценить изменения концентрации этих маркеров, что необходимо для постановки нозологического диагноза (ИМпST).
Высокочувствительные методы определения (т.е. позволяющие обнаружить сердечный тропонин у ~ 50–95% здоровых людей), выполненные на автоматических анализаторах, обеспечивают более высокую диагностическую точность по сравнению с тестами в формате исследований по месту оказания медицинской помощи (point of care, POC). Большинство РОС-тестов не могут считаться высокочувствительными, демонстрируют более низкую диагностическую точность и прогностическое значение отрицательного результата. Однако, они имеют преимущество в быстром получения результата, Рандомизированное исследование с участием пациентов низкого риска с подозрением на острый ИМ и появлением симптомов за ≥ 2 часа до вызова скорой помощи показало, что использование стратегии исключения острого ИМ на догоспитальном этапе (однократное измерение тропонина стандартным РОС-тестом) приводило к значительному снижению 30-дневных затрат на лечение и имело сопоставимую частоту серьезных неблагоприятных сосудистых событий при сравнении со стратегией исключения при стандартном протоколе в отделении неотложной помощи [18].
В целом, автоматизированные методы исследования высокочувствительного тропонина предпочтительны, однако быстро развивающаяся система РОС-тестирования в ближайшее время заставит переоценить это предпочтение, когда станут клинически доступны более тщательно проверенные высокочувствительные POC-тесты [14].
Преходящее повышение уровня сердечного тропонина в крови свидетельствует об остром повреждении миокарда вне зависимости от причины, которая может быть связана как с первичным ограничением коронарного кровотока, так и другими, в том числе внесердечными, факторами (Приложение А3. Причины повышения концентрации сердечного тропонина в крови). Повышение и/или снижение концентрации сердечного тропонина выше 99-го перцентиля верхней референсной границы у лиц без его исходного повышения, либо повышение концентрации сердечного тропонина > 20% при его ранее стабильно повышенном уровне (вариабельность была ≤ 20%) при наличии критериев ишемии миокарда свидетельствует об остром ИМ (Приложение А3. Причины повышения концентрации сердечного тропонина в крови).
Оценка уровня сердечных тропонинов считается более чувствительным и специфичным методом, чем определение МВ-фракции креатинфосфокиназы или миоглобина. Последний не рекомендуется для использования, так как не является кардиоспецифичным маркером.
- У всех пациентов с подозрением на ИМпST рекомендуется проведение общего (клинического) анализа крови, анализа крови биохимического общетерапевтического (общий белок, мочевина, общий билирубин, определение активности аспартатаминотрансферазы и аланинаминотрансферазы в крови), общего (клинического) анализа мочи в рамках первичного обследования при поступлении в стационар и, при необходимости, последующего динамического наблюдения во время госпитализации [19-22].
ЕОК 1C (УУР C, УДД 4)
Комментарий: У всех пациентов с подозрением на ИМпST при поступлении в стационар рекомендуется исследование общего (клинического) анализа крови с оценкой уровней общего гемоглобина и гематокрита, а также уровней эритроцитов и тромбоцитов. Выявление сниженного уровня общего гемоглобина, эритроцитов и/или тромбоцитов в крови является признаком повышенного геморрагического риска; при высоком уровне тромбоцитов повышен риск раннего тромбоза стента. В период госпитализации лабораторные исследования следует повторять при наличии клинической необходимости.
- Всем пациентам с подозрением на ИМпST для оценки риска ишемических и геморрагических событий, а также для обеспечения безопасности лечения рекомендуется исследование уровня креатинина в крови при поступлении в стационар и далее при наличии клинической необходимости с расчетом скорости клубочковой фильтрации, а в случае назначения прямых оральных антикоагулянтов еще клиренса креатинина (КлКр) [23, 24].
ЕОК IA (УУР А, УДД 3)
Комментарий: Уровень креатинина в крови и расчетный показатель состояния фильтрационной функции почек важны для выбора дозы ряда лекарственных средств (выбор критерия почечной функции определяется Инструкцией к применению лекарственного средства). Расчетная скорость клубочковой фильтрации (рСКФ) используется в диагностике хронической болезни почек (ХБП) и важна для оценки риска ишемических и геморрагических событий.
- У всех пациентов с подозрением на ИМпST рекомендуется исследование уровня глюкозы в крови натощак, скрининг на наличие сахарного диабета (СД) (исследование обмена глюкозы; проведение глюкозотолерантного теста; исследование уровня гликированного гемоглобина в крови), а также повторное исследование уровня глюкозы в крови при СД в анамнезе или гипергликемии при госпитализации с целью оценки риска неблагоприятного исхода [25-30].
ЕОК IIaB (УУР В, УДД 3)
Комментарий: Уровень глюкозы в крови важен также для определения необходимости использования сахароснижающих лекарственных средств и выбора их дозы. В период госпитализации оценку концентрации глюкозы в крови следует повторять при наличии клинической необходимости.
- Пациентам с ИМпST рекомендуется как можно быстрее после госпитализации, предпочтительно в первые 24 часа, рекомендуется выполнить анализ крови для оценки нарушений липидного обмена биохимический (исследование уровня ХС крови, уровня ХС ЛНП, уровня ХС ЛВП и триглицеридов) для последующего сопоставления с уровнями липидов, достигнутыми при использовании гиполипидемических лекарственных средств [31-33].
ЕОК IC (УУР C, УДД 5)
Комментарий: Необходимо определить, как минимум, уровень холестерина (ХС), ХС липопротеидов низкой плотности (ЛНП), ХС липопротеидов высокой плотности (ЛВП) и триглицеридов.
- У всех пациентов с ИМпST для обеспечения безопасности лечения рекомендуется определение содержания электролитов крови (минимально – исследование уровня калия в крови, исследование уровня натрия в крови, оптимально – исследование уровня калия в крови, исследование уровня натрия в крови, исследование уровня общего магния в сыворотке крови) и, при наличии клинической необходимости, исследование кислотно-основного состояния и газов крови с коррекцией и повторной оценкой при наличии отклонений от нормальных величин [34, 506, 507].
ЕОК IIbС (УУР С, УДД 4)
Комментарий: В период госпитализации оценку концентрации электролитов в крови следует повторять при наличии клинической необходимости.
- Всем пациентам с ИМпST, поступающим в стационар, рекомендуется выполнение коагулограммы (АЧТВ, протромбиновое время, протромбиновый индекс, фибриноген), определение международного нормализованного отношения (МНО), в случае приема варфарина, а также для прогноза риска периоперационных кровотечений и величины кровопотери - резус фактора, определение основных групп по системе AB0, определение антигена D системы Резус (резус-фактор), определение фенотипа по антигенам C, c, E, e, Cw, K, k. Определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови, определение антител к вирусу гепатита C (Hepatitis C virus) в крови, определение антител к бледной трепонеме (Treponema pallidum) в крови, определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) в крови, определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-2 (Human immunodeficiency virus HIV 2) в крови всем пациентам с ИМпST для исключения ассоциации с ВИЧ-инфекцией, гепатитом [14, 538-546].
РКО 1C (УУР C, УДД 4)
4. Инструментальные диагностические исследования
4. Инструментальные диагностические исследования
- В течение 10 мин от начала первичного медицинского контакта с пациентом с подозрением на ОКС для определения типа ОКС и дифференциальной диагностики с иными заболеваниями рекомендуется регистрация ЭКГ на месте первичного контакта и интерпретация электрокардиографических данных квалифицированным специалистом (медицинским работником) [5, 35, 36, 508].
ЕОК IB (УУР С, УДД 5)
Комментарий: Если у медицинского персонала первичного медицинского контакта возникают сложности с интерпретацией ЭКГ на месте регистрации, рекомендуется расшифровка, описание и интерпретация данных ЭКГ-исследования с применением телемедицинских технологий. Повторная регистрация ЭКГ на этапе первого медицинского контакта может быть целесообразна в случае изменения характера болевого синдрома или клиники ОКС.
- У всех пациентов с подозрением на ИМпST для определения типа ОКС и дифференциальной диагностики с иными заболеваниями рекомендуется зарегистрировать ЭКГ в покое как в минимум в 12 стандартных отведениях [37-40, 508].
ЕОК IA (УУР A, УДД 2)
Комментарий: Если изменения на ЭКГ в 12 стандартных отведениях неинформативны (нет смещения сегмента ST, достаточного для постановки диагноза), а по клиническим данным предполагается наличие острой ишемии / повреждения миокарда, рекомендуется использовать дополнительные отведения, такие как V7–V9 и V3R–V4R. При неинформативной ЭКГ у пациентов с сохраняющимся подозрением на ОКС, продолжающимися или возобновляющимися симптомами для своевременного выявления ишемических изменений рекомендуется регистрировать ЭКГ повторно (например, с интервалами в 15–30 мин в течение первого часа) или начать мониторирование смещения сегмента ST в 12 отведениях.
- Рекомендуется использовать дополнительные отведения ЭКГ (V3R–V4R и/или V7–V9) у пациентов с ИМпST нижней стенки ЛЖ и/или подозрении на ИМ правого желудочка и/или задней стенки ЛЖ для диагностики распространения зоны инфаркта на правый желудочек и/или задние отделы ЛЖ [41-43].
ЕОК IB (УУР B, УДД 2)
- У пациентов с ИМпST для своевременного выявления и устранения нарушений ритма сердца рекомендуется скорейшее начало мониторирования ЭКГ (мониторирование электрокардиографических данных) [44-47].
ЕОК IВ (УУР С, УДД 5)
- Всем пациентам с ИМпST, поступившим в первые 48 часов от начала заболевания, рекомендуется мониторирование электрокардиографических данных не менее 24 часов для оценки эффективности лечения и своевременного выявления осложнений [14, 44, 47].
ЕОК IC (УУР C, УДД 5)
Комментарий: Целесообразность более длительного мониторирования ЭКГ, а также целесообразность и продолжительность мониторирования ритма сердца у пациентов с ИМпST, а также поступивших позднее 48 часов от начала заболевания, определяется тяжестью клинического состояния и риском развития жизнеугрожающих аритмий. К пациентам с ИМпST с высоким риском жизнеугрожающих аритмий относятся пациенты: с известным анамнезом желудочковой аритмии до ИМ, с поздним поступлением (более 12 часов от начала заболевания), с низкой ФВ ЛЖ (≤ 40%), с неоптимальным результатом реперфузионной терапии, с осложнениями при выполнении ЧКВ.
- Всем пациентам с ИМпST при наличии высокого риска возникновения желудочковой тахикардии (ЖТ) / фибрилляции желудочков (ФЖ) рекомендуется мониторирование ритма сердца более 24 часов [47].
ЕОК IC (УУР C, УДД 5)
Комментарий: К пациентам с ИМпST с высоким риском жизнеугрожающих аритмий относятся пациенты: с известным анамнезом желудочковой аритмии до ИМ, с поздним поступлением (более 12 часов от начала заболевания), с низкой ФВ ЛЖ (≤ 40%), с неоптимальным результатом реперфузионной терапии, с осложнениями при выполнении ЧКВ.
- Пациентам с ОКСпST / ИМпST для решения вопроса о необходимости выполнении ЧКВ рекомендуется КГ, обязательная как в рамках стратегии первичного ЧКВ, так и в рамках стратегии фармакоинвазивного подхода [48, 49].
ЕОК IA (УУР A, УДД 2)
Комментарий: Основная задача КГ — обнаружение острой окклюзии или осложненного стеноза КА для последующего устранения этого поражения с помощью ЧКВ (или обхода места окклюзии с помощью операции КШ).
- Всем пациентам с ИМпST для подтверждения диагноза, оценки тяжести поражения, проведения дифференциальной диагностики, выявления осложнений и определения прогноза рекомендуется выполнить трансторакальную эхокардиографию (ЭхоКГ) с обязательной оценкой ФВ ЛЖ, оптимально — в первые сутки госпитализации [14, 50-52, 509].
ЕОК 1C (УУР С, УДД 5)
Комментарий: Выполнение ЭхоКГ (как минимум, УЗИ-ассистированного обследования) не должно задерживать транспортировку пациента на КГ. ЭхоКГ необходима для оценки функции и геометрии ЛЖ, а также для распознавания таких осложнений, как тромбоз полости ЛЖ, разрывы сердца, нарушение функции клапанов сердца (в частности, митральная регургитация), ИМ правого желудочка, перикардит. При подозрении на разрыв миокарда (наружный или внутренний) или расслоение восходящего отдела аорты ЭхоКГ рекомендуется экстренно выполнить до проведения КГ. Оценка динамики локальной и глобальной функции сердца помогает уточнить эффективность лечения. Кроме того, данные ЭхоКГ, прежде всего ФВ ЛЖ, необходимы для определения прогноза заболевания.
- Магнитно-резонансную томографию (МРТ) сердца с контрастированием при ИМпST рекомендуется рассмотреть в качестве дополнительного метода для уточнения локализации и объема поражения миокарда при относительно небольших его размерах, а также для дифференциальной диагностики поражений миокарда — при наличии технических возможностей [53-59].
ЕОК IIbB (УУР С, УДД 5)
Комментарий: МРТ сердца с контрастированием не рекомендуется в качестве рутинного метода обследования пациентов с ИМпST. Она позволяет подтвердить наличие очага некроза в миокарде, дифференцировать ишемическую или воспалительную (миокардит) природу поражения, подтвердить или отвергнуть наличие синдрома такоцубо, является эталонным методом трехмерной оценки морфологии и функции камер сердца, а также клапанного аппарата. Дополнительное преимущество метода — отсутствие лучевой нагрузки. Однако технические сложности выполнения ограничивают его применение в остром периоде заболевания. Необходимость и возможность выполнить МРТ сердца не может быть основанием для задержки с проведением КГ.
- МРТ сердца рекомендуется в случае неадекватной визуализации другими методами верхушки ЛЖ у пациентов с высокой вероятностью наличия тромба ЛЖ — при наличии технических возможностей [60, 61].
ЕОК IIаС (УУР В, УДД 2)
- Компьютерно-томографическая коронарография (КТКГ) не рекомендуется как рутинный метод обследования при ИМпST [14,62-68].
EOK IIIB (УУР B, УДД 2)
- Компьютерная томография (КТ) сердца, КТ органов грудной полости с внутривенным болюсным контрастированием, вентрикулография сердца, сцинтиграфия миокарда, аортография (брюшная аортография; панаортография) не рекомендуются как рутинные методы обследования при ИМпST [14, 69, 510, 511].
EOK нет (УУР С, УДД 5)
Комментарий: Обследование с внутривенным (в/в) введением контраста может оказаться полезным для дифференциальной диагностики, позволяя выявить отличные от ИМ угрожающие жизни состояния (расслоение аорты, тромбоэмболию легочной артерии (ТЭЛА), пневмоторакс и пр.). В отдельных случаях расслоение аорты может сопровождаться развитием ИМ за счет вовлечения в расслоение КА, что может быть выявлено при КТКГ или аортографии.
5. Иные диагностические исследования
1. Стратификация риска неблагоприятного исхода
Несмотря на наличие многочисленных шкал оценки риска неблагоприятных исходов (GRACE, TIMI, DYNAMIC TIMI, CADILLAC, PAMI, Zwolle), научно обоснованных подходов, улучшающих исходы лечения ИМпST за счет конкретных действий в период госпитализации и после нее, основанных на оценке риска с помощью этих шкал, не существует. Индивидуальный риск неблагоприятного исхода определяется локализацией и распространенностью ИМ (оцениваются по данным ЭКГ и ЭхоКГ), наличием многососудистого поражения КА, осложнений данного ИМ, своевременностью и полноценностью реперфузии миокарда, возрастом и сопутствующими состояниями (прежде всего — нарушенной функцией почек и наличием / отсутствием СД). Факт и успешность реперфузионной терапии, наличие устойчивых желудочковых аритмий, сердечной недостаточности и/или низкой ФВ ЛЖ, определяют целесообразность и сроки имплантации кардиовертера-дефибриллятора (КВД).
- Рутинная стратификация риска неблагоприятных исходов с помощью шкал у пациентов с ИМпST в период госпитализации не рекомендуется из-за отсутствия доказанно эффективных вмешательств, основанных на результатах данной стратификации [14].
ЕОК IIIC (УУР C, УДД 5)
Комментарий: У отдельных пациентов с ИМпST с успешным первичным ЧКВ при принятии решения о ранней (в пределах 72 часов от поступления) выписке может быть рассмотрено использование шкалы Zwolle (Приложение Г2) [70, 71].
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
1. Реперфузионное лечение заболевания
Тромботическая окклюзия крупной КА, являющаяся следствием повреждения АБ, - общепризнанный основной патогенетический механизм развития ИМпST. Локализация и стойкость окклюзии определяют размер некроза миокарда, прямо связанный с риском смерти от основных осложнений ИМ (сердечной недостаточности, потенциально фатальных нарушений ритма и проводимости сердца, разрыва миокарда). Устранение острой окклюзии и восстановление проходимости КА (реперфузия) являются основой лечения пациентов с ОКСпST / ИМпST. Поэтому сразу после установления диагноза «ОКСпST» все пациенты (независимо от возраста или половой принадлежности) должны рассматриваться как кандидаты на реперфузионную терапию. В настоящее время реперфузионное лечение при ОКCпST / ИМпST предусматривает использование двух стратегий: первичного ЧКВ и фармакоинвазивного подхода, включающего последовательное применение ТЛТ и ЧКВ. Выбор между этими двумя стратегиями определяется, прежде всего, доступностью подразделений, способных организовать своевременное ЧКВ.
1. Выбор стратегии реперфузионного лечения заболевания
- Реперфузионная терапия для снижения риска смерти рекомендуется всем пациентам с ИМпST и длительностью симптомов < 12 часов [72, 73].
ЕОК IA (УУР C, УДД 4)
- Для снижения риска смерти рекомендуется выполнение первичного ЧКВ как предпочтительной реперфузионной стратегии в первые 12 часов от начала развития ИМпST, если ожидаемое время от момента постановки диагноза до проведения проводника в просвет инфаркт-связанной КА не превышает 120 минут [73-76].
ЕОК IA (УУР A, УДД 1)
Комментарий: Проведение первичного ЧКВ в более поздние сроки (ожидаемое время от момента постановки диагноза до проведения проводника в просвет инфаркт-связанной КА превышает 120 минут) приводит к значительному повышению смертности, поэтому нужно строго придерживаться рекомендованного алгоритма. В случае проведения первичного ЧКВ следует укладываться во временной интервал от постановки диагноза до введения проводника в просвет КА. В учреждении, реализующем первичные ЧКВ, это время не должно превышать 60 минут, а у пациентов, переведенных из «неинвазивных» учреждений, — 90 минут. Не следует рассматривать в качестве ограничений / противопоказаний к первичному ЧКВ возраст, указания на нарушенную азотвыделительную функцию почек, сопутствующие заболевания и состояния. Как относительные противопоказания к ЧКВ могут расцениваться непереносимость рентгенконтрастных веществ и чрезвычайно высокая масса тела пациента (превышающая ограничения, заявленные производителем ангиографической установки). В этих случаях возможна вынужденная ТЛТ без последующего ЧКВ.
- Рутинная стратегия первичного ЧКВ для снижения риска ишемических событий рекомендована у пациентов, поступивших в интервале 12–48 часов от начала симптомов ИМпST [77-81].
ЕОК IIaВ (УУР B, УДД 2)
- Пациентам с ИМпST вне зависимости от его давности реперфузионная терапия (а именно ЧКВ) рекомендуется в случае продолжающейся ишемии, нестабильной гемодинамики (кардиогенного шока), жизнеугрожающих аритмии, нарушении проведения сердечного импульса [82].
ЕОК IC (УУР С, УДД 4)
- Если от начала ИМпST прошло более 48 часов, рутинное реперфузионное лечение (ЧКВ или КШ) инфаркт-связанной КА не рекомендуется при ее полной окклюзии и отсутствии дополнительных клинических оснований для вмешательства (продолжающейся или рецидивирующей ишемии миокарда, симптомов тяжелой сердечной недостаточности, угрожающих жизни нарушений ритма сердца) [77, 83, 84].
ЕОК IIIА (УУР A, УДД 2)
- В связи с важностью критериев времени в выборе стратегии реперфузионного лечения у пациентов с ИМпST рекомендуется всем медицинским учреждениям, оказывающим медицинскую помощь пациентам с ИМпST, и службе скорой медицинской помощи фиксировать и контролировать на соответствие рекомендациям указанные в данном документе временные интервалы как при выполнении реперфузионной терапии, так и при отказе от нее [14].
ЕОК IС (УУР С, УДД 5)
- Рекомендуется обучение бригад скорой медицинской помощи распознаванию характерных для ИМпST изменений на ЭКГ, выбору стратегии реперфузионного лечения (фармакоинвазивный подход или транспортировка в стационар для выполнения первичного ЧКВ), определению показаний и противопоказаний для системной ТЛТ при ИМпST, технике в/в введения лекарственных средств для ТЛТ, сердечно-легочной реанимации и наружной дефибрилляции [14].
ЕОК IС (УУР С, УДД 5)
2. Первичное чрескожное коронарное вмешательство
- При выполнении первичного ЧКВ у пациентов с ИМпST для снижения риска смерти рекомендуется обязательное вмешательство на инфаркт-связанной артерии [48, 85].
ЕОК IA (УУР A, УДД 1)
- При выполнении КГ и ЧКВ у пациентов с ИМпST в качестве предпочтительного сосудистого доступа рекомендуется доступ через лучевую артерию с целью снижения риска развития кровотечений, смерти, крупных сердечно-сосудистых осложнений и осложнений в месте пункции – при условии освоенности этого доступа в данном учреждении [86-89].
ЕОК IA (УУР А, УДД 1)
- Для снижения риска рецидива ИМ и необходимости в повторной реваскуляризации у пациентов с ИМпST при первичном ЧКВ рекомендуется предпочесть транслюминальную баллонную ангиопластику со стентированием КА изолированной процедуре транслюминальной баллонной ангиопластики (без стентирования) КА [90, 91].
ЕОК IA (УУР А, УДД 1)
Комментарий: Мета-анализы не выявили преимущества стентирования КА перед ангиопластикой КА на уровне снижения риска смерти. Большая часть доказательной базы, указывающей на преимущество ЧКВ перед ТЛТ на уровне смертности, получена при использовании баллонной ангиопластики (без стентирования) КА. Поэтому воздерживаться от ЧКВ в виде баллонной ангиопластики, ссылаясь на отсутствие подходящих стентов, не оправдано.
В особых случаях поражения инфаркт-связанной КА (коронарная эмболия, эктазированная КА, спонтанная диссекция КА, вмешательство на ранее стентированном сегменте КА, диффузное поражение дистальных сегментов КА) ее реканализация может быть проведена без использования коронарного стентирования.
- При выполнении транслюминальной баллонной ангиопластики со стентированием КА у пациентов с ИМпST для снижения риска рецидива ИМ, тромбоза стента***, необходимости в повторной реваскуляризации рекомендуется использовать стент, выделяющий лекарственное средство*** (СВЛ), нового поколения, вне зависимости от длительности и состава планируемой антиагрегантной и антикоагулянтной терапии [91-95].
ЕОК IA (УУР А, УДД 1)
- Из-за отсутствия значимого влияния на риск ишемических событий и возможного увеличения риска инсульта у пациентов с ИМпST при выполнении ЧКВ рекомендуется воздержаться от рутинного использования процедуры эндоваскулярной тромбоэктомии аспирационной (син.: тромбоаспирации) [96].
ЕОК IIIA (УУР А, УДД 1)
Комментарий: Решение о выполнении тромбаспирации в начале или по ходу ЧКВ может быть принято на основании индивидуальных ангиографических и клинических данных пациента.
- Инвазивная функциональная оценка значимости других поражений в инфаркт-связанной КА у пациентов c ИМпST во время первичного ЧКВ не рекомендована [97-104].
ЕОК IIIC (УУР С, УДД 2)
- У гемодинамически стабильных пациентов с ИМпST и многососудистым поражением коронарного русла во время первичного ЧКВ или в течение 45 дней после первичного вмешательства для снижения суммарного риска ишемических событий (смерть, рецидив ИМ или необходимость в повторной реваскуляризации) рекомендуется ЧКВ на не-инфаркт-связанных КА в случае выявления в них гемодинамически значимых изменений [105-112].
ЕОК IA (УУР B, УДД 2)
Комментарий: Показания к полной реваскуляризации при ИМпST основываются на результатах ряда клинических исследований, таких как PRAMI [105], CvLPRIT [109], DANAMI-3-PRIMULTI [106], COMPARE-ACUTE [110] и COMPLETE [108]. В последнем у пациентов с ИМпST и многососудистым поражением КА выполнение этапного (второго) ЧКВ на не-инфаркт-связанных артериях приводило к значительному снижению суммарной частоты неблагоприятных событий (ИМ, сердечная смерть, повторная реваскуляризация) при сравнении с тактикой консервативного лечения после первичного ЧКВ. При этом этапное ЧКВ в исследовании COMPLETE [108] проводилось как в период госпитализации, так и после выписки (в пределах 45 суток после первичного ЧКВ). При сравнении ЧКВ не-инфаркт-связанной артерии во время первичного ЧКВ и этапного вмешательства (в течение 6 дней после индексной процедуры) в исследовании BIOVASC [111] оба подхода имели сопоставимые результаты по смертности, однако в группе этапной реваскуляризации отмечалась достоверно бóльшая частота ИМ и незапланированных реваскуляризаций. Преимущество полной реваскуляризации на основании функциональной оценки значимости стенозов были продемонстрированы в исследовании FIRE [112], где многососудистая реваскуляризация у пожилых пациентов имела достоверное преимущество перед реваскуляризацией только инфаркт-связанной КА.
Измерение фракционного резерва кровотока (ФРК) с применением гиперемических агентов, таких как #трифосаденин (внутривенно (в/в) 140 или 180 мкг/кг/мин или интракоронарно 20 или 40 мкг для одной КА) и #папаверин (интракоронарно 12-20 мг для левой КА и 8-20 мг для правой КА) [514-517], и/или моментального резерва кровотока является стандартом оценки функциональной значимости пограничных (40-90%) стенозов КА.
Стеноз считается функционально значимым при показателе ФРК ≤ 0,8, при показателе моментального резерва кровотока <0,89.
В ряде исследований ФРК продемонстрировал эффективность применения для оценки функциональной значимости стенозов и у данной категории (ИМпST) пациентов. В исследовании FRAME-AMI [104] было продемонстрировано преимущество применения ФРК в снижении частоты общей смертности, повторного ИМ и незапланированной реваскуляризации. Напротив, исследование FLOWER-MI [97] не продемонстрировала преимущества применения ФРК в снижении частоты неблагоприятных сердечно-сосудистых событий. Также в ряде наблюдений было показано, что у пациентов с ОКС может происходить неточная функциональная оценка значимости поражений, так как восстановление микроциркуляции происходит не ранее чем через 24 часа от начала ИМ [98, 99]. Поскольку представленные в настоящее время результаты исследований противоречивы, целесообразность использования ФРК у пациентов с ОКС остается предметом дальнейшего изучения. Тем не менее, измерение ФРК может применяться при выполнении этапной реваскуляризации (в течение 45 дней от начала ИМпST) с хорошими клиническими результатами, продемонстрированными в исследовании FIRE [112], где основанная на ФРК реваскуляризация у пожилых пациентов имела достоверное преимущество перед реваскуляризацией только инфаркт-связанной КА.
- Решение о реваскуляризации не-инфаркт-связанной КА во время первичного ЧКВ у пациентов с ИМпST рекомендуется принимать на основании ангиографической оценки значимости поражения [98, 103, 113].
ЕОК IB (УУР B, УДД 2)
- Ультразвуковое исследование КА внутрисосудистое (ВСУЗИ) или оптическую когерентную томографию (ОКТ) КА рекомендуется рассмотреть в качестве вспомогательных инструментов во время ЧКВ у пациентов с ИМпST для улучшения непосредственных и отдаленных результатов вмешательства, при наличии технических возможностей [114-121].
ЕОК IIaA (УУР А, УДД 2)
Комментарий: В ряде крупных мета-анализов и рандомизированных исследований внутрисосудистая визуализация (ВСУЗИ, ОКТ) продемонстрировала достоверное влияние на отдаленные результаты стентирования КА с точки зрения профилактики тромбоза и рестеноза стента. В одном из наиболее крупных мета-анализов [122], посвященном сравнению отдаленных исходов у пациентов при стентировании КА с использованием различных методов внутрисосудистой визуализации, ВСУЗИ-контроль приводил к достоверному снижению частоты сердечно-сосудистой смертности, повторных ИМ и тромбоза стента. Внутрисосудистая визуализация может быть полезна для определения инфаркт-связанного поражения КА при неочевидности ангиографических данных и для оптимизации ЧКВ.
3. Фармакоинвазивный подход
Фармакоинвазивная стратегия заключается в догоспитальной ТЛТ с последующей КГ с намерением выполнить ЧКВ в инфаркт-связанной артерии («спасающее» ЧКВ – немедленное ЧКВ при отсутствии свидетельств реперфузии миокарда после ТЛТ или появлении жизнеугрожающих состояний; «раннее рутинное» ЧКВ – в ближайшие 2-24 часа после успешной ТЛТ).
Все случаи системной ТЛТ (эффективной и неэффективной) должны рассматриваться только как начальная часть стратегии реперфузии в рамках фармакоинвазивного подхода, предусматривающего последующее выполнение ЧКВ (спасающего, срочного или отсроченного) в пределах суток от проведения ТЛТ, а не полноценная замена первичному ЧКВ.
Режимы дозирования тромболитических средств приведены в Приложении А3. Тромболитики и режимы их дозирования при ИМпST.
- Если первичное ЧКВ не может быть выполнено в течение 120 минут от момента постановки диагноза ОКСпST / ИМпST и прошло не более 12 часов от начала симптомов, рекомендуется максимально быстрое (в пределах 10 мин от постановки диагноза) начало внутривенного введения лекарственных препаратов для ТЛТ (син.: системной ТЛТ; группа B01A - антитромботические средства) при отсутствии противопоказаний к ТЛТ [74, 76].
ЕОК IА (УУР A, УДД 1)
Комментарий: Введение тромболитика должно быть начато в пределах 10 мин от постановки диагноза (время, отведенное на организацию ТЛТ, выбрано на основании медианы подобного времени (9 мин), зарегистрированной в исследовании STREAM, показавшем сходные исходы лечения при стратегии первичного ЧКВ и стратегии с фармакоинвазивным подходом) [49].
ЭКГ-критерии применения ТЛТ:
- Остро возникшие подъемы сегмента ST на уровне точки J как минимум в двух смежных отведениях ЭКГ ≥ 0,1 мВ во всех отведениях, за исключением отведений V2–V3, где элевация сегмента ST должна составлять ≥ 0,2 мВ у мужчин в возрасте 40 лет и старше, ≥ 0,25 мВ у мужчин моложе 40 лет или ≥ 0,15 мВ у женщин (при отсутствии гипертрофии левого желудочка (ЛЖ) или блокады ЛНПГ);
- Впервые (или предположительно впервые) возникшая полная блокада ЛНПГ;
Абсолютные противопоказания к ТЛТ:
— ранее перенесенный геморрагический инсульт или нарушение мозгового кровообращения неизвестной этиологии;
— ишемический инсульт в предшествующие 6 месяцев;
— повреждения или новообразования центральной нервной системы, артериовенозные мальформации центральной нервной системы;
— недавняя серьезная травма / хирургическое вмешательство/травма головы / желудочно-кишечное кровотечение (в течение предыдущего месяца);
— известные геморрагический диатез или кровоточивость (кроме менструальных кровоmeчений);
— расслоение аорты (заподозренное или подтвержденное);
— пункция некомпрессируемых сосудов, биопсия печени, спинномозговая пункция в течение предыдущих 24 ч.
Относительные противопоказания к ТЛТ:
— транзиторная ишемическая атака в предыдущие 6 мес.;
— прием пероральных антикоагулянтов;
— беременность и 1-я неделя после родов;
— рефрактерная артериальная гипертензия (АГ): систолическое артериальное давление (АД) >180 мм рт. ст. и/или диастолическое АД >110 мм рт. ст.;
— тяжелое заболевание печени;
— инфекционный эндокардит;
— травматичная или длительная сердечно-легочная реанимация;
— обострение язвенной болезни.
- При условиях, оправдывающих системную ТЛТ как начальную стратегию реперфузии (см. выше) у пациентов с ИМпST, при отсутствии противопоказаний к ней и при наличии возможностей (обученный персонал, наличие тромболитика, наружного дефибриллятора, средств для сердечно-легочной реанимации) для снижения риска смерти рекомендуется внутривенное введение лекарственных препаратов для ТЛТ на догоспитальном этапе (син.: догоспитальная ТЛТ) [123-125].
ЕОК IA (УУР A, УДД 1)
- Всем пациентам с ИМпST, получающим системную ТЛТ (догоспитально или в стационаре без возможности выполнения ЧКВ), для снижения риска смерти рекомендована незамедлительная госпитализация или незамедлительный перевод в медицинское учреждения, реализующие ЧКВ в круглосуточном режиме [126-129].
ЕОК IA (УУР А, УДД 1)
Комментарий: В период 12–24 часа от начала симптомов ИМпST при невозможности выполнения ЧКВ, сохранении симптомов и признаков трансмуральной ишемии (подъемов сегмента ST на ЭКГ) и отсутствии противопоказаний к ТЛТ рекомендуется рассмотреть возможность проведения ТЛТ у отдельных пациентов (под угрозой большая зона миокарда и/или гемодинамическая нестабильность) для снижения риска смерти [14, 512, 513]
- В случае применения системной ТЛТ при ИМпST для уменьшения риска смерти рекомендуется предпочесть фибринспецифичные тромболитики нефибринспецифичным [130].
ЕОК I B (УУР B, УДД 2)
Комментарий: Доказательство преимущества фибринспецифичного тромболитика (алтеплазы**) перед нефибринспецифичным (стрептокиназой) на уровне смертности продемонстрировано только в одном исследовании и не подтверждено при последующих мета-анализах. Предпочтительность фибриспецифичных тромболитиков в данном случае определяется не столько большей эффективностью, сколько неудачным профилем переносимости стрептокиназы (аллергические реакции и способность вызывать артериальную гипотонию) и непредсказуемой угрозой нейтрализации ее эффектов специфическими антителами (у отдельных пациентов).
- У пациентов с ИМпST старше 75 лет при выборе для системной ТЛТ тенектеплазы** рекомендуется использование половины ее стандартной дозы [49, 131].
ЕОК IIaB (УУР A, УДД 2)
Комментарий: У больных с ИМпST старше 75 лет в случае использования тенектеплазы** для снижения риска кровотечений, прежде всего внутричерепных, возможно использование половинной дозы данного тромболитика [49, 131].
- При безуспешной системной ТЛТ у пациентов с ИМпST (через 60-90 минут от начала внутривенного введения тромболитика нет снижения подъема сегмента ST на ЭКГ или снижение менее 50% от исходного подъема ST) для восстановления проходимости КА, предотвращения рецидива ИМ и сердечной недостаточности рекомендуется срочная КГ с намерением выполнения «спасающего» ЧКВ и не рекомендуется повторная системная ТЛТ [132-136].
ЕОК IA (УУР А, УДД 1)
Комментарий: В исследованиях, посвященных сравнению «спасающего» ЧКВ и консервативного (без ЧКВ) ведения пациентов с ИМпST после неэффективной ТЛТ, помимо снижения рисков рецидива ИМ и сердечной недостаточности, отмечена статистически незначимая тенденция к меньшей смертности при выполнении «спасающего» ЧКВ.
- У пациентов с ИМпST рекомендуется срочная КГ с намерением выполнения «спасающей» ЧКВ до времени оценки эффективности системной ТЛТ (60-90 минут от ее начала) при появлении признаков гемодинамической (острая сердечная недостаточность) или электрической (жизнеугрожающие аритмии) нестабильности, прогрессирующей ишемии или нестихающей боли в груди [132-136].
ЕОК IA (УУР А, УДД 1)
- После успешной системной ТЛТ у пациентов с ИМпST рекомендуется ранняя (2–24 часа после окончания ТЛТ) КГ с намерением выполнить «раннее рутинное» ЧКВ в инфаркт-связанной артерии (для снижения рецидива ИМ, суммарного риска рецидива ИМ и смерти, а также для снижения риска повторной ишемии миокарда) [127, 128].
ЕОК IA (УУР А, УДД 1)
Комментарий: Критерии успешности ТЛТ многочисленны, но на практике используется оценка изменения положения сегмента ST в наиболее информативном отведении ЭКГ (там, где на исходной ЭКГ смещение сегмента вверх было наибольшим). Желательно полное исчезновение подъема сегмента ST через 90 минут от начала ТЛТ, но для признания ТЛТ эффективной достаточно снижения подъема сегмента ST на 50% и более от исходного. В исследованиях по оценке эффектов «подготовленного» ЧКВ пациенты в рамках такой стратегии получали не только ТЛТ, но и блокатор гликопротеинового IIb/IIIa (ГП IIb/IIIa) рецептора. В настоящее время «подготовленное» ЧКВ не рекомендовано, т.к. в неоднократных сравнениях его со «стратегией первичного ЧКВ» либо отсутствовали какие-либо преимущества, либо регистрировалась более высокая частота неблагоприятных исходов, включая увеличение риска кровотечений и смерти.
- При рецидиве ишемии миокарда или других признаках реокклюзии (электрическая или гемодинамическая нестабильность) после первоначально успешной ТЛТ у пациентов с ИМпST для снижения риска смерти рекомендуется отказаться от тактики «раннего рутинного» ЧКВ (плановое выполнение в течение 2-24 часов после окончания ТЛТ) и выполнить срочную КГ для решения вопроса о целесообразности и объеме ЧКВ [137, 138].
ЕОК IС (УУР С, УДД 5)
- Если у пациента с ИМпST не удалось по каким-либо причинам выполнить КГ и ЧКВ до 24 ч после окончания ТЛТ, рекомендуется выполнить КГ и определиться с необходимостью ЧКВ в более поздний период госпитализации (для уменьшения риска рецидива ИМ) [137].
ЕОК IС (УУР С, УДД 5)
Технические рекомендации по выполнению ЧКВ после ТЛТ совпадают с таковыми для первичного ЧКВ (раздел 3.1.2 Первичное чрескожное коронарное вмешательство).
4. Защита почек при чрескожном коронарном вмешательстве
- У пациентов с ИМпST и СД рекомендуется принимать во внимание более высокий риск развития контраст-индуцированной нефропатии, что необходимо учитывать при выборе объема рентгеноконтрастных препаратов, а также при принятии решения об использовании активной профилактики (гидратация), если это позволяет состояние пациента [14, 139-142].
ЕОК IC (УУР B, УДД 2)
Комментарии: Если пациент получает метформин** и/или ингибитор натрий-глюкозного котранспортера 2 типа, после КГ/ЧКВ можно ожидать ухудшения фильтрационной функции почек. Поэтому до КГ/ЧКВ метформин** рекомендуется отменить, а в случаях, когда вмешательства нельзя отсрочить, тщательно мониторировать фильтрационную функцию почек.
- При выполнении КГ/ЧКВ у пациентов ИМпST с умеренной или тяжелой ХБП рекомендуется гидратация изотоническим раствором натрия хлорида** и применение низко- или изоосмолярного контрастного вещества (в минимальном объеме) для профилактики острого повреждения почек [139, 141-146].
ЕОК IIaB (УУР A, УДД 2)
Комментарии: У пациентов с умеренной или тяжелой ХБП (рСКФ 15–44 мл/мин/1,73 м2) рекомендуется ограничить объем вводимого контрастного вещества (соотношение объема контраста к рСКФ < 3,7). Если ожидаемый объем контрастного вещества во время КГ/ЧКВ превышает 100 мл, рекомендуется гидратация с использованием изотонического раствора натрия хлорида** – внутривенная инфузия со скоростью 1 мл/кг/час за 12 часов до процедуры (если это возможно) и как минимум 24 часа после ее окончания (для пациентов с ФВ ЛЖ ≤ 35% или ХСН более 2 ФК по NYHA – 0,5 мл/кг/ч). Возможно также использование методик с гидратацией под контролем центрального венозного давления (ЦВД) или в/в введением фуросемида** с восполнением объема потерянной жидкости изотоническим раствором натрия хлорида**.
У пациентов с тяжелой ХБП (рСКФ 15–29 мл/мин/1,73 м2) может быть рассмотрена целесообразность профилактической гемофильтрации за 6 часов до ЧКВ (если это возможно) с замещением жидкости со скоростью 1000 мл/час без ее потери и гидратация как минимум 24 часа после процедуры.
5. Спонтанная диссекция коронарной артерии
Спонтанная диссекция КА – это неатеросклеротическое поражение КА, характеризующееся отслоением интимы артерии с формированием субинтимальной гематомы и обструкцией просвета артерии спонтанной (неятрогенной) природы. Спонтанная диссекция КА встречается примерно в 4% случаев всех ОКС, преимущественно у женщин младше 60 лет. Существует 3 ангиографических типа спонтанных диссекций КА: 1 тип – наличие нескольких визуальных просветов в КА; 2 тип – наличие протяженного гладкого поражения, формирующегося за счет объемной интрамуральной гематомы; 3 тип – локальный стеноз, который выглядит как АБ.
Клинические проявления спонтанной диссекции КА не отличаются от таковых при атеротромбозе, в связи с чем первичная стратегия соответствует стандартным рекомендациям по лечению больных с ОКС (в т.ч. с ИМпST). Наиболее точными методами для подтверждения спонтанной диссекции КА во время КГ являются внутрисосудистые методы визуализации (ВСУЗИ и ОКТ).
- При тотальной обструкции КА, обусловленной наличием спонтанной диссекции, при гемодинамической нестабильности пациента, сохранении признаков ишемии, высоком риске сердечно-сосудистых осложнений, рекомендованной стратегией реваскуляризации является выполнение ЧКВ с использованием баллонной дилатации и/или имплантации коронарного СВЛ*** для восстановления коронарного кровотока [147-148].
ЕОК IC (УУР С, УДД 4)
Комментарии: Стратегии эндоваскулярного лечения пациентов со спонтанным диссекциями КА в настоящее время не определены. Основные технические аспекты эндоваскулярного лечения пациентов со спонтанными диссекциями отражены в консеснсусном документе ЕОК [149], согласно которому для подтверждения спонтанных диссекций (наличия ложного просвета и/или интрамуральной гематомы) как причины обструкции КА следует рассмотреть выполнение ВСУЗИ или ОКТ [149-151]. Внутрисосудистые методы визуализации обладают высоким разрешением и позволяют достоверно установить наличие диссекции, её тип, и определить степень компрометации просвета и позицию интракоронарного проводника (в истинном или ложном просвете).
У пациентов со спонтанной диссекцией КА при отсутствии обструкции КА, низком риске повторных событий и отсутствии признаков ишемии, рекомендуется оптимальная медикаментозная терапия до заживления спонтанной диссекции [151-154].
6. Коронарное шунтирование
КШ у пациентов с ИМпST имеет ограниченное применение и не рассматривается среди основных подходов к реперфузии миокарда. Оно не изучалось у подобных пациентов в рандомизированных исследованиях. Тем не менее, в отдельных случаях ИМпST в различные сроки от начала заболевания может обсуждаться и должно выполняться КШ.
- С целью снижения риска смерти у пациентов с ИМпST и продолжающейся или рецидивирующей ишемией миокарда при невозможности выполнения ЧКВ или безуспешном ЧКВ рекомендуется неотложное КШ [14, 137, 138].
ЕОК IIаC (УУР С, УДД 5)
Комментарий: Специальных рандомизированных клинических исследований, сравнивающих чрескожную и хирургическую реваскуляризацию у пациентов с ОКС, не проводилось. При ИМпST неотложное КШ следует рассматривать только в том случае, если первичное ЧКВ невозможно, особенно при наличии продолжающейся ишемии или больших участков пораженного миокарда [155].
- С целью снижения риска смерти и рецидива ИМ у пациентов с ИМпST и осложнениями ЧКВ (неудачное раскрытие стента, перелом стента, рецидивирующий острый тромбоз в месте вмешательства, расслоение или перфорация КА), которые не удается устранить эндоваскулярными методиками, рекомендуется КШ [14, 137, 156].
ЕОК IIbС (УУР С, УДД 5)
Комментарий: За исключением явно неотложных случаев (с продолжающейся ишемией миокарда, кардиогенным шоком, механическими осложнениями ИМ), ясности со сроками выполнения КШ при ИМпST нет. Сроки отчасти определяются необходимостью обеспечить геморрагическую безопасность вмешательства, выждав 3–7 дней после отмены ингибитора P2Y12-рецептора тромбоцитов (АТХ-группа – антиагреганты, кроме гепарина) (тикагрелор** следует отменить как минимум за 3–5 дней, клопидогрел** — как минимум за 5 дней, прасугрел — как минимум за 7 дней до планового хирургического вмешательства). У отдельных стабильных пациентов с ИМпST и многососудистом поражении коронарного русла после успешного первичного ЧКВ (c высоким индексом SYNTAX, СД, низкой ФВ ЛЖ) следует рассматривать КШ как вариант отсроченной полной реваскуляризации. При обсуждении вариантов КШ в каждом конкретном случае следует иметь в виду использование доступного вспомогательного кровообращения (до, во время и после операции) и выбор щадящих методик самой операции (например, КШ без подключения аппарата искусственного кровообращения).
7. Реперфузионное лечение у пациентов с кардиогенным шоком и внезапной остановкой кровообращения
- У пациентов с ИМпST и кардиогенным шоком для улучшения прогноза рекомендуется скорейшая реваскуляризация миокарда [157].
ЕОК IIaB (УУР В, УДД 2)
Комментарий: Выбор между ЧКВ и операцией КШ в данной клинической ситуации определяется особенностями поражения коронарного русла и наличием механических осложнений ИМ.
- У пациентов с ИМпST и кардиогенным шоком в качестве реперфузионной стратегии рекомендуется предпочесть ЧКВ с восстановлением кровотока в инфаркт-связанной КА независимо от времени возникновения симптомов [49, 123-125, 158].
ЕОК IB (УУР B, УДД 2)
- У пациентов с ИМпST и кардиогенным шоком из-за возможного увеличения риска смерти и острого почечного поврежденяи / резкого прогрессирования ХБП рекомендуется воздержаться от одномоментных многососудистых ЧКВ, ограничившись вмешательством на инфаркт-связанной КА [158].
ЕОК IIIB (УУР B, УДД 2)
- У пациентов с ИМпST и кардиогенным шоком при невозможности выполнения ЧКВ или безуспешном ЧКВ с целью снижения риска смерти рекомендуется неотложное КШ [157, 159, 160, 518, 519].
ЕОК IB (УУР B, УДД 2)
Комментарий: В исследовании SHOCK у 302 пациентов с острым ИМ, осложненным кардиогенным шоком, сравнивали экстренную реваскуляризацию (в 64% случаев выполнена ЧКВ, в 36% — КШ) с начальной медицинской стабилизацией. Около 60% пациентов имели передний ИМ, 85% — многососудистое поражение КА. Различий в 30-дневной смертности (первичная конечная точка) между группами экстренной реваскуляризации и начальной медикаментозной стабилизации зарегистрировано не было, но через 6 месяцев смертность была ниже в группе экстренной реваскуляризации. На основании этих данных пациентам с острым ИМ, осложненным КШ, рекомендуется немедленная КГ с намерением выполнить ЧКВ. Пациентам с коронарной анатомией, непригодной для ЧКВ, рекомендуется экстренное КШ [157].
- У пациентов с ОКСпST / ИМпST и кардиогенным шоком при невозможности выполнения первичного ЧКВ в течение 120 минут от постановки диагноза и отсутствии механических осложнений ИМ рекомендуется выполнение системной ТЛТ [76].
ЕОК IIaC (УУР С, УДД 5)
- У пациентов с ИМпST, перенесших кардиогенный шок и индексную процедуру реваскуляризации, при наличии продолжающейся ишемии, нестабильности гемодинамики и с учетом сопутствующих заболеваний рекомендуется выполнение этапной реваскуляризации не-инфаркт-связанных КА [137].
ЕОК IIaC (УУР С, УДД 5)
- У пациентов с ИМпST после успешной реанимации по поводу внезапной остановки кровообращения рекомендовано выполнение КГ с намерением первичного ЧКВ [126,138].
ЕОК IВ (УУР C, УДД 5)
- У пациентов после успешной реанимации по поводу внезапной остановки кровообращения, при гемодинамической стабильности и отсутствии диагностически значимого для ИМпST смещения сегмента ST на ЭКГ рутинная немедленная КГ не рекомендуется [127-130, 132, 161].
ЕОК IIIA (УУР В, УДД 2)
Комментарии: Тактика ведения пациентов с внезапной остановкой кровообращения должна определяться индивидуально и учитывать состояние пациента, его гемодинамические и неврологические характеристики. Отсутствие преимущества немедленной КГ у пациентов без ишемических изменений на ЭКГ было продемонстрировано в исследовании COACT [161]. В то же время, наличие подъема сегмента ST на ЭКГ является показанием к немедленному выполнению КГ и первичного ЧКВ.
8. Инфаркт миокарда без обструктивного поражения коронарных артерий
Инфаркт миокарда без обструктивного поражения коронарных артерий (ИМБОКА) – «рабочий» диагноз, который устанавливается у пациентов с критериями ИМ согласно Четвертому универсальному определению (Приложение А3. Критерии диагностики инфаркта миокарда) [5], когда при КГ ни в одной крупной КА не обнаружено стенозов ≥ 50%.
Термин «ИМБОКА» включает в себе гетерогенную группу патологий, как коронарных, так и некоронарных, в том числе некардиальных. Основная цель введения этого термина связана с тем, что, пациенту с диагнозом ИМБОКА необходимо проведение дальнейшего обследования для верификации окончательного диагноза и проведения адекватного лечения.
- У пациентов с отсутствием обструктивного поражения КА (стенозы как минимум на 50% по данным КГ) при наличии клинических и лабораторных признаков ИМ рекомендован обширный диагностический поиск для определения причины повреждения миокарда и верификации диагноза [162, 163].
ЕОК IС (УУР С, УДД 4)
Комментарий: Диагностический поиск у пациентов с ИМБОКА включает в себя выполнение ЭхоКГ, КГ с применением внутрисосудистых методов визуализации (ВСУЗИ или ОКТ) для исключения пристеночных тромбов, эрозий, спонтанной диссекции КА, тестов для выявления спазма крупных КА и микроциркуляторной обструкции, а также, если необходимо, дополнительных исследований для дифференциальной диагностики ОКС (перечень исследований определяется клиническими рекомендациями по альтернативному(-ым) диагнозу(-ам)).
- С целью этиологического лечения ведение пациентов пациентов с ИМБОКА рекомендуется выполнять в соответствии с текущими рекомендациями, касающимися конкретной диагностированной причины ИМБОКА [162, 163].
ЕОК IB (УУР C, УДД 4)
- При отсутствии очевидной причины ИМБОКА рекомендуется выполнение МРТ сердца с контрастом с целью уточнения причины повреждения миокарда [164].
ЕОК IВ (УУР В, УДД 3)
2. Медикаментозное лечение заболевания
1. Обезболивание
- Для устранения боли, с целью седации и снижения симпатической активности, приводящей к тахикардии и повышению АД, у пациентов с ИМпST рекомендуется внутривенное введение морфина** (группа N02AA – природные алкалоиды опия; син.: наркотические анальгетики) [165].
ЕОК IIaB (УУР С, УДД 4)
Комментарий: Отличительная особенность ангинозного приступа при ИМ — слабая реакция или отсутствие реакции на нитроглицерин** (группа C01DA – органические нитраты). Тем не менее, если ангинозный приступ не ослабевает через несколько минут после прекращения действия провоцирующего фактора (физическая нагрузка) или если он развился в покое, пациенту следует принять нитроглицерин** в дозе 0,4–0,5 мг в виде таблеток под язык или аэрозоля (спрея). Если симптомы не исчезают через 5 мин, а препарат удовлетворительно переносится, можно использовать его повторно. Если боль или дискомфорт грудной клетке сохраняются в течение 5 минут после повторного приема нитроглицерина**, необходимо немедленно вызвать скорую медицинскую помощь. Если 2–3 приема нитроглицерина** не уменьшают интенсивность приступа, дальнейший прием не имеет смысла. В связи с опасностью гипотонии постоянно контролируют АД.
Морфин** помимо обезболивания способствует уменьшению страха, возбуждения, снижает симпатическую активность, увеличивает тонус блуждающего нерва, уменьшает работу дыхания, вызывает расширение периферических артерий и вен (последнее особенно важно при отеке легких). Доза, необходимая для адекватного обезболивания, зависит от индивидуальной чувствительности, возраста, размеров тела. Перед использованием 10 мг морфина** разводят как минимум в 10 мл 0,9% раствора натрия хлорида** (группа B05BB – растворы, влияющие на водно-электролитный баланс). Первоначально следует ввести в/в медленно 2–4 мг лекарственного вещества. При необходимости введение повторяют каждые 5–15 минут по 2–4 мг до купирования боли или возникновения побочных эффектов, не позволяющих увеличить дозу.
Назначение морфина** приводит к замедлению и ослаблению основного эффекта антиагрегантов (клопидогрел**, тикагрелор**, прасугрел), что может отразиться на результатах лечения у некоторых пациентов [166-168].
При использовании морфина** возможны следующие осложнения:
- выраженная артериальная гипотензия; устраняется в горизонтальном положении в сочетании с поднятием ног (если нет отека легких). Если этого недостаточно, в/в капельно вводится 0,9% раствор натрия хлорида**. В редких случаях — адрено- и допамин-стимуляторы (группа C01CA - адренергические и дофаминергические средства);
- выраженная брадикардия в сочетании с артериальной гипотензией; устраняется атропином** (в/в 0,5–1,0 мг);
- тошнота, рвота; устраняются производными фенотиазина, в частности, метоклопрамидом** (в/в однократно 10 мг);
- выраженное угнетение дыхания; устраняется налоксоном** (в/в 0,1–0,2 мг, при необходимости повторно каждые 15 мин), при этом уменьшается и анальгезирующее действие препарата.
Опиаты могут ослаблять перистальтику кишечника и приводить к запорам. Препараты этой группы снижают тонус мочевого пузыря и затрудняют мочевыведение, особенно у мужчин с гипертрофией предстательной железы.
- При наличии признаков выраженного беспокойства и/или возбуждения у пациентов с ИМпST для их купирования рекомендуется назначение транквилизаторов (группа N05BA - производные бензодиазепина) [14, 169-170].
ЕОК IIaC (УУР С, УДД 5)
Комментарий: Для уменьшения страха обычно достаточно создать спокойную обстановку и ввести наркотический анальгетик. При выраженном возбуждении могут потребоваться транквилизаторы (например, диазепам** в/в 5–10 мг, для пожилых стартовая доза – 2,5 мг; группа N05BA - производные бензодиазепина). Важное значение для эмоционального комфорта пациента имеют соответствующий стиль поведения персонала, разъяснение диагноза, прогноза и плана лечения. У пациентов с сохраняющимся беспокойством и нарушенным поведением, а также симптомами отмены при никотиновой зависимости, также можно назначить транквилизаторы. При возбуждении и делирии достаточно эффективно и безопасно в/в введение галоперидола**.
2. Коррекция гипоксемии
- Пациентам с ИМпST при наличии гипоксемии (степень насыщения гемоглобина крови кислородом (SpO2) < 90% или парциальное давление кислорода в артериальной крови (PaO2) < 60 мм рт. cт.) для ее устранения рекомендуется ингаляторное введение кислорода (оксигенотерапия) [14, 171].
ЕОК IC (УУР С, УДД 5)
Комментарий: Подача увлажненного кислорода проводится через носовые катетеры со скоростью 2–8 л/мин. Контролируют насыщение крови кислородом, измеряя сатурацию (SpO2) неинвазивно или оценивая показатели газового состава крови (прежде всего, PaO2) лабораторно.
- Из-за отсутствия положительных эффектов на течение болезни ингаляторное введение кислорода (оксигенотерапия) не рекомендуется пациентам с ИМпST с уровнем сатурации крови (SpO2) ≥ 90% [14, 171].
ЕОК IIIB (УУР А, УДД 2)
Комментарий: Ингаляторное введение кислорода (оксигенотерапия) не только не приносит пользы пациентам с неосложненным ИМпST, но может быть вредно, что предположительно обусловлено увеличением повреждения миокарда [172].
3. Антитромботическая терапия
Режимы дозирования антитромботических средств при ИМпST приведены в Приложении А3. Медикаментозное лечение ИМпST, при нарушении фильтрационной функции почек — в Приложении А3. Дозы антитромботических лекарственных средств при нарушенной функции почек.
3.1. Антитромботическое сопровождение тромболитической терапии
Антиагреганты при ТЛТ
- Для снижения риска смерти, сосудистой смерти, повторного ИМ и ишемического инсульта всем пациентам (вне зависимости от стратегии лечения) с ИМпST, не имеющим противопоказаний, рекомендуется прием ацетилсалициловой кислоты** (АСК**) в начальной нагрузочной дозе, а затем в поддерживающей дозе на неопределенно долгий срок [14, 173, 174].
ЕОК IA (УУР A, УДД 1)
Комментарии: Рекомендуется начальная (нагрузочная) доза АСК** (группа B01AC - антиагреганты кроме гепарина) 150-300 мг (таблетку разжевать и проглотить) как можно быстрее после установления диагноза ОКСпST / ИМпST; постоянная поддерживающая доза АСК** 75-100 мг внутрь 1 раз в сутки со вторых суток ведения пациента [14, 174]. Применение АСК** на догоспитальном этапе не имеет доказательств эффективности и безопасности (в сравнении с изученным использованием в стационаре), но пациенты с доспитальным тромболизисом составляют исключение (АСК** должна быть применена до начала или во время введения тромболитика).
- Для снижения риска смерти, рецидива ИМ, суммарного риска ишемических событий (сердечно-сосудистая смерть, ИМ, инсульт, рефрактерная ишемия, требующая реваскуляризации) у пациентов с ИМпST при выборе фармакоинвазивной стратегии в дополнение к АСК** в качестве ингибитора Р2Y12-рецептора тромбоцитов при отсутствии противопоказаний рекомендован клопидогрел** – до начала или во время ТЛТ [14, 178, 179].
ЕОК IB (УУР А, УДД 2)
Комментарий: У пациентов c догоспитальным тромболизисом оправдано применение клопидогрела** (группа B01AC – антиагреганты, кроме гепарина) уже на догоспитальном этапе (клопидогрел** в нагрузочной дозе 300 мг внутрь должен быть применен до начала или во время введения тромболитика). Поддерживающая доза клопидогрела** – 75 мг 1 раз в сутки внутрь сроком на 12 месяцев. У пациентов в возрасте старше 75 лет лечение клопидогрелом следует проводить без использования нагрузочной дозы.
Клопидогрел** после его использования во время ТЛТ может быть достаточно рано (в пределах суток от начала ТЛТ) заменен на тикагрелор** (группа B01AC – антиагреганты, кроме гепарина) как в рамках фармакоинвазивного подхода, так и у пациентов, получивших только тромболитик (без последующего ЧКВ). Безопасность такого «раннего» переключения с клопидогрела** на тикагрелор** показана в исследовании TREAT [180], а большую эффективность тикагрелора** (по сравнению с клопидогрелом**) в снижении риска ишемических событий (суммарный риск сердечно-сосудистой смерти, ИМ и ишемического инсульта) в этой клинической ситуации предлагается экстраполировать из результатов исследования PLATO [181], в которое не включались пациенты с ИМпST, получившие ТЛТ.
Возможность раннего перехода с клопидогрела** на тикагрелор** у пациентов с ИМпST, получивших тромболитик, не распространяется на лиц старше 75 лет. Доказательств возможности и безопасности раннего перехода с клопидогрела** на прасугрел (группа B01AC – антиагреганты, кроме гепарина) у пациентов с ИМпST, получивших ТЛТ, в виде результатов рандомизированных контролируемых исследований не существует.
Досрочное прекращение двойной антитромбоцитарной терапии – отмена обоих антиагрегантов – увеличивает частоту коронарных осложнений. Частой причиной досрочного прекращения приема одного или обоих компонентов двойной антитромбоцитарной терапии являются кровотечения и необходимость в хирургическом вмешательстве. В случае необходимости отменить ингибитор Р2Y12-рецептора тромбоцитов из-за хирургического вмешательства крайне желательно реализовать это вмешательство в условиях многопрофильного стационара с возможностью проведения ЧКВ в случае возникновения периоперационного тромбоза стента и ИМ.
При необходимости экстренной несердечной хирургической операции или серьезном кровотечении лечение ингибитором Р2Y12-рецептора тромбоцитов следует прекратить и возобновить при первой возможности после устранения причин кровотечения.
Тикагрелор** следует отменить как минимум за 3 дня, клопидогрел** — как минимум за 5 дней, прасугрел - как минимум за 7 дней до планового хирургического вмешательства. По мере возможности АСК** следует продолжить, так как отмена обоих препаратов еще больше повышает риск коронарного тромбоза. При отсутствии возможности выдержать указанные сроки решение об оперативном лечении следует принимать консилиумом врачей разных специальностей, который должен оценить риски кровотечения и отмены двойной антитромбоцитарной терапии, а также учесть тип хирургического вмешательства, риск рецидива ишемии миокарда, степень поражения КА, время, прошедшее от начала ИМпST и ЧКВ, характеристику установленных стентов. При хирургических вмешательствах с низким риском кровотечения не следует досрочно прерывать двойную антитромбоцитарную терапию.
- У пациентов с ИМпST при выборе в качестве реперфузионной терапии системной ТЛТ в дополнение к АСК** не рекомендуются тикагрелор** и прасугрел (как до начала, так и во время ТЛТ) из-за отсутствия доказательств безопасности такого подхода [14, 180-184].
ЕОК IIIC (УУР С, УДД 5)
- У пациентов с ИМпST, высоким риском последующих ишемических событий и низким риском кровотечений, не переносивших в прошлом инсульт или ТИА и независимо от наличия/отсутствия и вида предшествующей реперфузионной терапии (то есть в том числе после ТЛТ) после прекращения парентерального введения антикоагулянта к сочетанию АСК** и клопидогрела** для снижения риска ишемических событий рекомендуется ривароксабан** внутрь в дозе 2,5 мг 2 раза в сутки сроком на 12 месяцев (в отдельных случаях – вплоть до 24 месяцев) [185].
ЕОК IIbB (УУР A, УДД 1)
Комментарии: Прием ривароксабана** в дозе 2,5 мг 2 раза в сутки в добавление к сочетанию АСК** и клопидогрела** рекомендуется начинать в первую неделю от начала лечения ИМпST, после выполнения процедур реваскуляризации миокарда (если к ним были показания) и прекращения парентерального введения антикоагулянтов [185].
Добавление ривароксабана** в дозе 2,5 мг 2 раза в сутки не изучено в сочетании с двойной антитромбоцитарной терапией, в состав которой входят прасугрел или тикагрелор**. Данный подход не может использоваться у пациентов, нуждающихся в использовании более высоких доз пероральных антикоагулянтов (в частности, при наличии фибрилляции предсердий (ФП) с повышенным риском инсульта).
- У пациентов с ИМпST при выборе в качестве реперфузионной терапии системной ТЛТ в дополнение к АСК** не рекомендуются блокаторы рецептора гликопротеинов (ГП) IIb/IIIa (как до начала, так и во время ТЛТ) из-за отсутствия доказательств эффективности и наличия указаний на увеличение риска кровотечений [186, 187].
ЕОК IIIB (УУР B, УДД 2)
- У пациентов с ИМпST и высоким риском желудочно-кишечных кровотечений во время двойной антитромбоцитарной терапии независимо от предшествующего реперфузионного лечения для защиты слизистой желудка и снижения риска желудочно-кишечных кровотечений рекомендуется использовать ингибиторы протонного насоса [188, 189].
ЕОК IA (УУР A, УДД 2)
Комментарии: Риск желудочно-кишечных кровотечений повышен при язвенной болезни или желудочно-кишечном кровотечении в анамнезе, хроническом использование нестероидных противовоспалительных средств или кортикостероидов, а также при наличии как минимум 2 из следующих признаков – возраст ≥ 65 лет, диспепсия, желудочно-пищеводный рефлюкс, инфицирование Helicobacter Pylori, хроническое употребление алкоголя).
Известно о возможном ослаблении антитромбоцитарного эффекта клопидогрела** (по результатам лабораторной оценки активности тромбоцитов) при его сочетании с омепразолом** или эзомепразолом**, но не с пантопразолом или рабепразолом. Нет доказательств, что эти лекарственные взаимодействия оказывают неблагоприятное влияние на клинические результаты лечения.
Парентеральные антикоагулянты при ТЛТ
- Парентеральные антикоагулянты (группа B01А - антитромботические средства) рекомендуются всем пациентам с ИМпST независимо от стратегии лечения (в том числе для сопровождения системной ТЛТ) с максимально ранним началом введения после установления диагноза ОКСпST / ИМпST [14, 190-195].
ЕОК IА (УУР A, УДД 1)
Комментарий: При ТЛТ длительность парентерального введения антикоагулянтов составляет от 2 до 8-х суток, если нет иных показаний к ее продлению [104, 358].
- Для сопровождения системной ТЛТ у пациентов с ИМпST в качестве парентерального антикоагулянта первого выбора (по сравнению с нефракционированным гепарином (НФГ; син.: гепарином натрия**) рекомендуется эноксапарин натрия** [196, 197].
ЕОК IA (УУР А, УДД 2)
Комментарий: многократно продемонстрированное превосходство эноксапарина натрия** (группа B01AB – группа гепарина) над гепарином натрия** (группа B01AB – группа гепарина) распространяется в основном на пациентов, получивших фибринспецифичные тромболитики [196-200]. Однако, доказательства целесообразности его применения есть и у пациентов, получавших стрептокиназу [201, 202]. Важно, что эноксапарин натрия** в упомянутых выше сравнениях не имел преимущества на уровне геморрагической безопасности.
- Для сопровождения системной ТЛТ у пациентов с ИМпST в качестве парентерального антикоагулянта рекомендуется ингибитор Xa фактора фондапаринукс натрия для снижения суммарного риска (смерть и рецидив ИМ) [203].
ЕОК IIaB (УУР B, УДД 2)
Комментарий: Превосходство фондапаринукса натрия над НФГ**/плацебо в сложном исследовании OASIS-6 [203] получено в основном в подгруппе пациентов, получавших стрептокиназу, где фондапаринукс в большинстве случаев сравнивался с плацебо. Но и у пациентов, получивших другие, в том числе фибринспецифичные, тромболитики, он был как минимум не хуже НФГ**. Не следует забывать, что фондапаринукс — средство выбора при наличии легкой и умеренной тромбоцитопении или при угрозе развития гепарин-индуцированной тромбоцитопении.
- Для сопровождения системной ТЛТ у пациентов с ИМпST в качестве парентерального антикоагулянта рекомендуется гепарин натрия** [196-200].
ЕОК IIbB (УУР C, УДД 5)
Комментарий: Применяется гепарин натрия** в виде внутривенного болюса с последующей внутривенной инфузией с контролем за активированным частичным тромбопластиновым временем (АЧТВ) и изменением скорости инфузии с целью удержания АЧТВ в диапазоне 1,5-2,0 от верхней границы нормального значения.
Среди доказанных эффектов антикоагуляции гепарином натрия** — лучшая проходимость инфаркт-связанной артерии через несколько дней после введения тромболитика. Вводимый внутривенно НФГ** (в дополнение к ТЛТ) не имеет доказательств эффективности на уровне снижения риска крупных ишемических событий или смерти как в сравнении с плацебо, так и в сравнении с другими антикоагулянтами. Тем не менее, он, как и АСК**, не одно десятилетие являлся обязательным элементом сопровождения ТЛТ у пациентов, получивших фибринспецифичные тромболитики (производные тканевого активатора плазминогена, в основном алтеплазу**). Утраченные в результате прямых сравнений с эноксапарином** 196-202], приоритетные позиции НФГ** остаются неизменными, когда выбирается антикоагулянт в дополнение к ТЛТ у пациентов с тяжелым нарушением азотвыделительной функции почек и у пациентов с очень высокой или низкой массой тела. Подразумевается, что в каждом из этих случаев изменяемая в зависимости от значений АЧТВ скорость введения НФГ** призвана сделать лечение таких пациентов более эффективным и безопасным.
3.2. Антитромботическая терапия при других стратегиях лечения
Под «другими стратегиями» лечения в этом разделе понимается выполнение ЧКВ, КШ и отсутствие любого вида реперфузионной терапии.
Антиагреганты при других стратегиях лечения у пациентов без показаний к длительному пероральному приему антикоагулянтов
- Для снижения риска смерти, сосудистой смерти, повторного ИМ и ишемического инсульта всем пациентам (вне зависимости от стратегии лечения) с ИМпST, не имеющим противопоказаний, рекомендуется прием АСК** в начальной нагрузочной дозе, а затем в поддерживающей дозе на неопределенно долгий срок [14, 173, 174].
ЕОК IA (УУР A, УДД 1)
Комментарии: Рекомендуется начальная (нагрузочная) доза 150-300 мг (таблетку разжевать и проглотить) как можно быстрее после установления диагноза ОКСпST / ИМпST; постоянная поддерживающая доза АСК** 75-100 мг внутрь 1 раз в сутки со вторых суток ведения пациента [14, 174].
Применение АСК** на догоспитальном этапе не имеет доказательств эффективности и безопасности (за исключением пациентов с догоспитальным тромболизисом). Оправданность применения АСК** у пациентов, подвергаемых первичному ЧКВ, вытекает из того, что эффективность ЧКВ в клинических исследованиях продемонстрирована у пациентов с ИМпST, получавших АСК** в качестве обязательного фонового лечения.
- Всем пациентам с ИМпST (вне зависимости от стратегии лечения, за исключением планирующегося КШ), не имеющим высокого риска кровотечений в добавление к АСК** рекомендуются ингибиторы Р2Y12-рецептора тромбоцитов (группа B01AC - ингибиторы агрегации тромбоцитов, кроме гепарина) в начальной нагрузочной дозе, а затем в поддерживающей дозе сроком на 12 месяцев для снижения суммарного риска смерти, ИМ и ишемического инсульта [14, 175-178, 182-184].
ЕОК IA (УУР A, УДД 2)
Комментарии: Выбор ингибитора P2Y12-рецептора тромбоцитов для сопровождения реперфузионного вмешательства определяется стратегией реперфузии, доступностью препаратов и их индивидуальными характеристиками, ограничивающими безопасность их применения у отдельных категорий пациентов с ИМпST.
Применения ингибитора P2Y12-рецептора тромбоцитов следует избегать при ИМпST с высокой вероятностью срочного КШ (известное поражение КА, неподходящее для ЧКВ; КШ в дополнение к операции в связи с механическими осложнениями ИМ — устранению дефекта МЖП или свободной стенки желудочка, протезированию митрального клапана).
Как и в случае с АСК**, оправданность применения ингибитора P2Y12-рецептора тромбоцитов на догоспитальном этапе не имеет полученных в рандомизированных, контролируемых исследованиях доказательств эффективности и безопасности на уровне ишемических событий. Дополнительным аргументом против догоспитального применения этих средств является увеличение риска смерти в первые сутки лечения у пациентов, получивших тикагрелор** в рамках подготовки к первичному ЧКВ в исследовании ATLANTIC [204].
Гипотетически догоспитальное назначение ингибитора P2Y12 пациентам с ИМпST можно рассматривать при соблюдении двух условий: 1) нет сомнений в диагнозе (характерная клиническая картина и типичные изменения ЭКГ); 2) существует согласованность между догоспитальным звеном и инвазивным стационаром и высокая вероятность проведения экстренного ЧКВ. При этом, неназначение ингибитора P2Y12 до ЧКВ не может являться причиной задержки вмешательства. Оснований включать догоспитальное назначение ингибиторов P2Y12 в перечень обязательных мероприятий нет. Соответственно, нельзя считать неназначение ингибиторов P2Y12 тактической ошибкой. При сомнениях в диагнозе ОКСпST и тактике лечения прием ингибиторов P2Y12 оправдано отложить до оценки коронарной анатомии.
Риски и тактика досрочного прерывания двойной антитромбоцитарной терапии описаны в разделе «Антиагреганты и ТЛТ» (дополнение для пациентов, перенесших ЧКВ: прасугрел следует отменить как минимум за 7 дней до планового хирургического вмешательства). Если прерывание двойной антитромбоцитарной терапии является абсолютно необходимым у пациента со стентом(-ами) в КА, следует иметь в виду, что альтернативного более безопасного варианта профилактики тромбоза стентов нет.
Рекомендация о необходимости защиты слизистой желудка и снижения риска желудочно-кишечных кровотечений во время двойной антитромбоцитарной терапии не зависит от предшествующего реперфузионного лечения и изложена в разделе «Антиагреганты и ТЛТ».
- Если двойная антитромбоцитарная терапия (ACK** в сочетании с ингибитором Р2Y12-рецептора тромбоцитов) у пациента с ИМпST была отложена или прервана из-за операции КШ, рекомендуется ее начать или возобновить после операции КШ на 12 месяцев для снижения риска ишемических событий [14].
ЕОК IС (УУР С, УДД 5)
- Прасугрел (нагрузочная доза 60 мг, ежедневная поддерживающая доза 10 мг внутрь) в добавление к АСК** сроком на 12 месяцев рекомендуется для снижения риска ишемических событий при коронарном стентировании у больных с ИМпST, не получавших других блокаторов Р2Y12-рецептора тромбоцитов, если к нему нет противопоказаний (внутричерепное кровоизлияние в анамнезе, ишемический инсульт / транзиторная ишемическая атака в анамнезе, продолжающееся кровотечение) [176].
ЕОК IB (УУР B, УДД 2)
Комментарии: Безопасность перехода на прием прасугрела у пациентов, уже получивших клопидогрел**, изучена недостаточно. Лечение праcугрелом не исключает применение блокатора рецептора ГП IIb/IIIa тромбоцитов при выполнении ЧКВ. У пациентов в возрасте ≥ 75 лет, с массой тела < 60 кг поддерживающую суточную дозу прасугрела необходимо снизить до 5 мг.
- При ИМпST прасугрел не рекомендуется использовать до диагностической КГ и принятия решения о ЧКВ из-за увеличения риска кровотечений [183, 184].
ЕОК IIIB (УУР В, УДД 2)
- Тикагрелор** (нагрузочная доза 180 мг, поддерживающая 90 мг 2 раза в сутки внутрь) для снижения риска ишемических событий рекомендуется в добавление к АСК** сроком на 12 месяцев у пациентов с ИМпST как при инвазивной реперфузии, так и при отсутствии любого вида реперфузионной терапии и независимо от предшествующего использования клопидогрела**, если к нему нет противопоказаний (внутричерепное кровоизлияние в анамнезе, продолжающееся кровотечение) [175].
ЕОК I B (УУР A, УДД 2)
Комментарий: Переход на прием тикагрелора**, начиная с нагрузочной дозы, возможен у пациентов, уже получивших клопидогрел**, в том числе в нагрузочной дозе. Лечение тикагрелором** не исключает применение блокаторов рецептора ГП IIb/IIIa тромбоцитов при выполнении ЧКВ.
- При выполнении первичного ЧКВ у пациентов с ИМпST в добавление к АСК** рекомендуется предпочесть прасугрел, а не тикагрелор** [183, 184].
ЕОК IIaВ (УУР В, УДД 2)
- При инвазивной реперфузии или отсутствии любого вида реперфузионной терапии у пациентов с ИМпST, которые не могут получать тикагрелор** или прасугрел из-за наличия противопоказаний, непереносимости или недоступности, для снижения риска ишемических событий в добавление к АСК** рекомендуется клопидогрел** (нагрузочная доза 600 или 300 мг, поддерживающая – 75 мг 1 раз в сутки внутрь) сроком на 12 месяцев [177, 205].
ЕОК I B (УУР A, УДД 2)
Комментарии: Если выполняется ЧКВ, рекомендуется нагрузочная доза клопидогрела** 600 мг; в остальных случаях – нагрузочная доза 300 мг.
- У пациентов с ИМпST, высоким риском последующих ишемических событий и низким риском кровотечений, не переносивших в прошлом инсульт или транзиторную ишемическую атаку и независимо от наличия / отсутствия и вида предшествующей реперфузионной терапии (то есть в том числе после инвазивной реперфузии или отсутствии любого вида реперфузионной терапии) после прекращения парентерального введения антикоагулянта к сочетанию АСК** и клопидогрела** для снижения риска ишемических событий рекомендуется ривароксабан** в дозе 2,5 мг 2 раза в сутки сроком на 12 месяцев (в отдельных случаях – вплоть до 24 месяцев) [185].
ЕОК IIbB (УУР A, УДД 1)
Комментарии: Прием ривароксабана** в дозе 2,5 мг 2 раза в сутки в добавление к сочетанию АСК** и клопидогрела** рекомендуется начинать в первую неделю от начала лечения ИМпST, после выполнения процедур реваскуляризации миокарда (если к ним были показания) и прекращения парентерального введения антикоагулянтов [185].
Добавление ривароксабана** в дозе 2,5 мг 2 раза в сутки не изучено в сочетании с двойной антитромбоцитарной терапией, в состав которой входят прасугрел или тикагрелор**. Данный подход не может использоваться у пациентов, нуждающихся в использовании более высоких доз пероральных антикоагулянтов (в частности, при наличии фибрилляции предсердий (ФП) с повышенным риском инсульта).
- При инвазивной реперфузии или при отсутствии любого вида реперфузионной терапии у пациентов с ИМпST пожилого возраста, особенно при наличии высокого риска кровотечений, в добавление к АСК** рекомендуется рассмотреть применение клопидогрела** (а не тикагрелора** или прасугрела) для повышения приверженности к лечению и снижения риска кровотечений [14, 206, 207].
ЕОК IIbB (УУР A, УДД 2)
Комментарии: В клинических исследования под пожилыми подразумевали пациентов старше 70–80 лет. При принятии решения рекомендуется также учитывать наличие и выраженность старческой астении и сопутствующих заболеваний.
- У пациентов с ИМпST ингибиторы ГП IIb/IIIa рецептора тромбоцитов (абциксимаб, тирофибан, эптифибатид, фрагменты моноклональных антител FRaMon F[ab`]2) рекомендуются только как спасительное средство при возникновениях тромботических осложнений или феномена slow flow / no-reflow во время ЧКВ [14, 208].
ЕОК IIaC (УУР С, УДД 5)
Комментарии: Ингибиторы ГП IIb/IIIa тромбоцитов были изучены преимущественно до начала широкого применения блокаторов Р2Y12-рецептора тромбоцитов [208]. Помимо осложнений во время ЧКВ введение ингибитора ГП IIb/IIIa может рассматриваться при ЧКВ высокого риска у больных, не получивших блокатор Р2Y12-рецептора тромбоцитов, наличии массивного интракоронарного тромбоза.
- В связи с высоким риском кровотечений, превышающим потенциальную пользу, у пациентов с ИМпST не рекомендуется применять ACК** при уровне тромбоцитов менее 10х109/л, клопидогрел** – менее 30х109/л, тикагрелор** или прасугрел – менее 50х109/л [14, 209].
ЕОК IIIС (УУР C, УДД 5)
Парентеральные антикоагулянты при других стратегиях лечения у пациентов без показаний к длительному пероральному приему антикоагулянтов
- Для снижения риска ишемических событий рекомендуется начинать парентеральное введение антикоагулянтов после подтверждения диагноза ИМпST у пациентов, не имеющих противопоказаний. При выборе препарата следует учитывать риск возможных ишемических осложнений и кровотечений, а также профиль эффективности и безопасности конкретного антикоагулянта [190].
ЕОК IA (УУР A, УДД 1)
Комментарии: Антикоагулянты должны использоваться в сочетании с антиагрегантами.
У пациентов, уже получающих (до развития ИМпST) антагонисты витамина К, рекомендуется не использовать парентеральное введение антикоагулянтов (в том числе во время ЧКВ) при условии, что поддерживаются значения МНО ≥ 2,0 (при ЧКВ ≥ 2,5). У пациентов, получающих прямые пероральные антикоагулянты, рекомендуется использование внутривенного болюса НФГ** во время ЧКВ независимо от времени, прошедшего после приема последней дозы прямого перорального антикоагулянта. Аналогичный подход рекомендуется у пациентов, получающих антагонисты витамина К, при значениях МНО < 2,5.
- Из-за возможного увеличения риска кровотечений продолжение антикоагуляции у пациентов с ИМпST после успешного ЧКВ в целом не рекомендуется, если только нет других оснований для лечебной (ФП, тромбоз полости ЛЖ, венозный тромбоз или ТЭЛА) или профилактической (тяжелая сердечная недостаточность, ограниченная подвижность пациента) антикоагуляции [14].
ЕОК IIIC (УУР C, УДД 5)
Комментарий: Если ЧКВ в ранние сроки ИМпST не выполняется, лечение парентеральным антикоагулянтом должно продолжаться вплоть до 8-х суток (с более ранним прекращением, если в эти сроки было выполнено ЧКВ или больной был выписан); минимальная длительность парентерального введения антикоагулянта после ТЛТ при неинвазивном лечении ИМпST составляет 24-48 часов.
- При проведении ЧКВ у пациента с ИМпST рекомендуется внутривенное болюсное введение #гепарина натрия** в дозе 70–100 МЕ/кг [14].
ЕОК IС (УУР C, УДД 5)
Комментарии: Внутривенная инфузия НФГ** должна осуществляться в дозе, обеспечивающей АЧТВ в 1,5-2,5 раза выше контрольного для данной лаборатории. При использовании НФГ** во время ЧКВ рекомендуется ввести внутривенно болюсом 70–100 МЕ/кг; необходимость повторных болюсов определяется величиной активированного времени свертывания крови (АВС). Аналогичные подходы рекомендуется использовать при срочном ЧКВ у больных, получающих прямые пероральные антикоагулянты. Если ЧКВ выполняется на фоне начатой внутривенной инфузии НФГ**, во время процедуры рекомендуется рассмотреть дополнительное внутривенное введение болюсов НФГ** под контролем АВС.
- При проведении ЧКВ у пациентов с ИМпST в качестве альтернативы гепарину натрия** для снижения риска ишемических событий рекомендуется эноксапарин натрия** [193].
ЕОК IIaB (УУР A, УДД 2)
Комментарии: Эноксапарин натрия** не рекомендуется при расчетной скорости клубочковой фильтрации (рСКФ) ниже 15 мл/мин/1,73 м2. Переход с НФГ** на эноксапарин натрия** и с эноксапарина натрия** на НФГ** не рекомендуется из-за увеличения риска кровотечений.
- Если пациент с ИМпST получал эноксапарин натрия** до ЧКВ, его следует продолжить и во время процедуры; при этом, если после подкожной инъекции до раздувания баллона в КА прошло более 8 часов, рекомендуется дополнительный внутривенный болюс препарата 0,3 мг/кг [14, 193, 526].
ЕОК IIaB (УУР В, УДД 3)
- У пациентов с ИМпST применение бивалирудина рекомендуется рассмотреть в качестве альтернативы НФГ** для антитромботической поддержки ЧКВ [210-214].
ЕОК IIaA (УУР В, УДД 1)
Комментарии: Бивалирудин — препарат выбора у пациентов с гепарин-индуцированной тромбоцитопенией. Инфузию бивалирудина рекомендуется начать одновременно с ЧКВ и продолжать до 4 часов после его завершения.
Рекомендация использовать бивалирудин как альтернативу сочетанию НФГ** с блокатором ГП IIb/IIIa рецептора тромбоцитов во время ЧКВ утратила актуальность, поскольку в условиях широкого распространения двойной антитромбоцитарной терапии применение блокатора ГП IIb/IIIa рецепторов в основном ограничивается случаями тромботических осложнений во время ЧКВ.
- У пациентов с ИМпST при проведении первичного ЧКВ не рекомендуется назначение фондапаринукс натрия [203].
ЕОК IIIB (УУР B, УДД 2)
Комментарии: Больному, который все-таки получил до ЧКВ фондапаринукс натрия, во время ЧКВ следует внутривенно вводить НФГ** – первоначальный болюс в дозе 85 МЕ/кг; необходимость повторных болюсов определяется величиной АВС крови. Фондапаринукс натрия противопоказан при выраженном нарушении фильтрационной функции почек (рСКФ ниже 20 мл/мин/1,73 м2).
Антитромботическая терапия при других стратегиях лечения у пациентов с наличием показаний к длительному пероральному приему антикоагулянтов
- У пациентов с ИМпST и показаниями к длительному применению антикоагулянтов, которые на момент начала ИМпST по какой-либо причине их не принимали, рекомендуется начинать антитромботическое лечение с тройной антитромботической терапии (сочетание АСК**, блокатора Р2Y12-рецептора тромбоцитов и парентерального антикоагулянта) с последующей заменой парентерального антикоагулянта на пероральный (апиксабан**, дабигатрана этексилат**, ривароксабан**, эдоксабан или антагонист витамина K) [14, 527-534].
ЕОК IA (УУР A, УДД 1)
Комментарии: Показания к длительному применению антикоагулянтов – ФП / трепетание предсердий; механический протез клапана сердца тромбоз полости ЛЖ, тромбоз глубоких вен (ТГВ) и/или перенесенная ТЭЛА.
У пациентов, уже получающих (до развития ИМпST) антагонисты витамина К, рекомендуется не использовать парентеральное введение антикоагулянтов (в том числе во время ЧКВ) при условии, что поддерживаются значения МНО ≥ 2,0 (при ЧКВ ≥ 2,5).
У пациентов, получающих прямые пероральные антикоагулянты, рекомендуется использование внутривенного болюса НФГ** во время ЧКВ независимо от времени, прошедшего после приема последней дозы прямого перорального антикоагулянта; аналогичный подход рекомендуется у пациентов, получающих антагонисты витамина К, при значениях МНО <2,5.
При отсуствии реперфузионной терапии у пациентов, получающих прямые пероральные антикоагулянты, в начале лечения ИМпST рекомендуется использовать парентеральные антикоагулянты.
- У пациентов с ИМпST и показаниями к длительному применению антикоагулянтов, подвергнутых стентированию КА или не получивших реперфузионной терапии, длительность тройной антитромботической терапии (сочетание антикоагулянта с АСК** и клопидогрелом**) рекомендуется ограничить несколькими днями (1–7 дней). Через 1–7 дней, после отмены АСК**, рекомендуется перейти на двойную антитромботическую терапию (пероральный антикоагулянт в сочетании с клопидогрелом**) [14, 215-220].
ЕОК IA (УУР С, УДД 5)
Комментарии: У отдельных пациентов с очень высоким риском тромбоза КА и низким риском кровотечений может быть рассмотрено применение не клопидогрела**, а тикагрелора** в течение 6 месяцев.
- У пациентов с ИМпST и показаниями к длительному применению антикоагулянтов (в частности, с ФП), подвергнутых стентированию КА и имеющих высокий риск коронарных осложнений (включая особенности коронарной анатомии и/или инвазивного вмешательства), у которых ожидаемая польза представляется выше риска кровотечений, для снижения риска тромбоза стента рекомендуется рассмотреть продление тройной антитромботической терапии (сочетания перорального антикоагулянта с АСК** и клопидогрелом**) до 1 месяца с последующей отменой АСК** и переходом на двойную антитромботическую терапию (сочетание перорального антикоагулянта с клопидогрелом**) [14, 218].
ЕОК IIaC (УУР С, УДД 4)
Комментарии: У отдельных пациентов с очень высоким риском тромбоза КА и низким риском кровотечений может быть рассмотрено применение не клопидогрела**, а тикагрелора** в течение 6 месяцев.
- Двойная антитромботическая терапия (пероральный антикоагулянт в сочетании с клопидогрелем**, реже – с АСК**) у пациентов с ИМпST и показаниями к длительному применению антикоагулянтов рекомендуется вплоть до 12 месяцев, после чего клопидогрел** (или АСК**) рекомендуется отменить и продолжить монотерапию пероральным антикоагулянтом в дозе, необходимой для профилактики и/или лечения тромботических и/или тромбоэмболических осложнений [215-220].
ЕОК IA (УУР A, УДД 2)
Комментарии: У пациентов с высоким риском кровотечений возможен переход на монотерапию пероральным антикоагулянтом через 6 месяцев после ЧКВ. Аналогичный подход можно рассматривать и у более широкого контингента больных с ИМпST, нуждающихся в длительном пероральном приеме антикоагулянтов.
У отдельных пациентов с низким риском кровотечений и сохраняющимся высоким риском коронарных осложнений может быть рассмотрено продление двойной антитромботической терапии (сочетания перорального антикоагулянты с клопидогрелом** или АСК**) более чем на 12 месяцев.
- У пациентов с ИМпST и неклапанной ФП, нуждающихся в сочетании антикоагулянтов и антиагрегантов, прямые пероральные антикоагулянты предпочтительнее антагонистов витамина К, если к ним нет противопоказаний [215–220].
ЕОК IB (УУР A, УДД 1)
Комментарий: Данные о сравнительной эффективности прямых пероральных антикоагулянтов и варфарина** у пациентов с ИМ ограничены анализом подгрупп в рандомизированных контролируемых исследованиях.
- У пациентов с ИМпST и неклапанной ФП, нуждающихся в сочетании антикоагулянтов и антиагрегантов, для предотвращения тромбоэмболических осложнений рекомендуется апиксабан** в дозе 5 мг 2 раза в сутки или 2,5 мг 2 раза в сутки, если к нему нет противопоказаний [218].
ЕОК IIaB (УУР B, УДД 2)
Комментарии: По имеющимся данным, апиксабан** безопаснее варфарина** в составе двойной и тройной антитромботической терапии при сходной с варфарином** частоте коронарных осложнений. Апиксабан** изучен как на больных с ИМпST, подвергнутых стентированию КА, так и при неинвазивном лечении ИМпST.
Стандартная доза апиксабана** в этой клинической ситуации - 5 мг 2 раза в сутки. При наличии как минимум 2 из указанных факторов – возраст ≥ 80 лет, масса тела ≤ 60 кг, креатинин в крови ≥ 133 мкмоль/л – используется доза 2,5 мг 2 раза в сутки).
- У пациентов с ИМпST и неклапанной ФП, нуждающихся в сочетании антикоагулянтов и антиагрегантов, для предотвращения тромбоэмболических осложнений рекомендуется дабигатрана этексилат** в дозе 150 мг 2 раза в сутки или 110 мг 2 раза в сутки, если к нему нет противопоказаний [215].
ЕОК IIaB (УУР B, УДД 2)
Комментарии: Дабигатрана этексилат** в дозах 110 или 150 мг 2 раза в сутки в составе двойной антитромботической терапии (в сочетании преимущественно с клопидогрелом**) у пациентов, подвергнутых коронарному стентированию, безопаснее тройной антитромботической терапии (сочетание варфарина**, преимущественно клопидогрела** и АСК**). При этом отмечена тенденция к большей частоте коронарных осложнений на дозе дабигатрана этексилата** 110 мг 2 раза в сутки. Поэтому в составе двойной антитромботической терапии (в комбинации с клопидогрелом**) после коронарного стентирования рекомендуется использовать дабигатрана этексилат** в дозе 150 мг 2 раза в сутки; дозу 110 мг 2 раза в сутки в составе двойной антитромботической терапии можно предпочесть у больных с преобладающим риском кровотечений. В составе тройной антитромботической терапии при неклапанной ФП предпочтительнее доза 110 мг 2 раза в сутки.
-
У пациентов с ИМпST и неклапанной ФП, нуждающихся в сочетании антикоагулянтов и антиагрегантов, для предотвращения тромбоэмболических осложнений при отсутствии противопоказаний рекомендуется ривароксабан** в дозе 20 мг 1 раз в сутки (при клиренсе креатинина 30-49 мл/мин – 15 мг 1 раз в сутки), а при преобладающем риске кровотечений 15 мг 1 раз в сутки (при клиренсе креатинина 30-49 мл/мин –
#10 мг 1 раз в сутки) [14, 217, 520, 537].
ЕОК IB (УУР B, УДД 2)
Комментарии: Ривароксабан** в дозе 15 мг 1 раз в сутки (при клиренсе креатинина 30-49 мл/мин – #10 мг 1 раз в сутки) в сочетании с преимущественно клопидогрелом** у больных, подвергнутых стентированию КА, безопаснее тройной антитромботической терапии (сочетание варфарина**, преимущественно клопидогрел** и АСК**). Если риск кардиоэмболических и коронарных осложнений превышает опасность кровотечений, рекомендуется применение стандартных доз ривароксабана**, рекомендованных для больных с неклапанной ФП (20 мг 1 раз в сутки, при клиренсе креатинина 30-49 мл/мин – 15 мг 1 раз в сутки).
- У пациентов с ИМпST и неклапанной ФП при применении антагонистов витамина К в сочетании с антитромбоцитарными препаратами для обеспечения геморрагической безопасности рекомендуется поддерживать МНО в диапазоне 2,0–2,5, а время нахождения МНО в терапевтическом диапазоне – не менее 70% [14].
ЕОК IIaB (УУР C, УДД 5)
Комментарии: Целевые значения МНО при других показаниях к антагонисту витамина К могут быть выше (например, у больных с механическими протезами клапанов сердца, при тромбоэмболических осложнениях на фоне указанных значений МНО).
- У пациентов с подозрением на ИМпST, получающих пероральный антикоагулянт, для уменьшения риска кровотечений не рекомендуется использовать блокаторы Р2Y12-рецептора тромбоцитов до получения результатов КГ и принятия решения о выполнении ЧКВ, а целесообразность применения ингибиторов ГП IIb/IIIa рецепторов тромбоцитов рассматривать только при очевидных тромботических осложнениях ЧКВ [14].
ЕОК IIIC (УУР С, УДД 5)
- Для защиты слизистой желудка и снижения риска желудочно-кишечных кровотечений во время применения тройной антитромботической терапии (сочетание перорального антикоагулянта с блокатором Р2Y12-рецептора тромбоцитов и АСК**) или двойной антитромботической терапии (сочетание перорального антикоагулянта с блокатором Р2Y12-рецептора тромбоцитов или АСК**) у пациентов с высоким риском желудочно-кишечных кровотечений рекомендуется использовать ингибиторы протонного насоса [221-224].
РКО IA (УУР B, УДД 2)
Комментарии: Риск желудочно-кишечных кровотечений повышен при язвенной болезни или желудочно-кишечном кровотечении в анамнезе, хроническом использование нестероидных противовоспалительных средств или кортикостероидов, а также при наличии как минимум 2 из следующих признаков – возраст ≥ 65 лет, диспепсия, желудочно-пищеводный рефлюкс, инфицирование Helicobacter Pylori, хроническое употребление алкоголя).
Известно о возможном ослаблении антитромбоцитарного эффекта клопидогрела** (по результатам лабораторной оценки активности тромбоцитов) при его сочетании с омепразолом** или эзомепразолом**, но не с пантопразолом или рабепразолом [188]. Нет доказательств, что эти лекарственные взаимодействия оказывают неблагоприятное влияние на клинические результаты лечения.
3.3. Альтернативные подходы к выбору длительности и составу двойной антитромбоцитарной терапии (сочетания АСК** с блокатором Р2Y12-рецептора тромбоцитов) в первые 12 месяцев после ИМпST
В определении длительности двойной антитромбоцитарной терапии у пациентов, перенесших ИМпST, большую роль играет соотношение риска ишемических и риска геморрагических осложнений. Критерии повышенного ишемического риска изложены в разделе 3.2.3.4 «Антитромботическая терапия через 12 месяцев после ИМпST».
В оценке геморрагического риска важную роль играют валидированные шкалы. Наиболее полную и, при этом, удобную для практического использования оценку предлагает согласительный документ, разработанный в 2018 г. тридцатью ведущими экспертами) для пациентов, планирующихся на / перенесших ЧКВ и/или требующих двойную антитромбоцитарную терапию) - шкала высокого риска кровотечений Консорциумa академических исследований (ARС-HBR - Academic Research Consortium for High Bleeding Risk). Она включает 12 клинических критериев; высокий риск кровотечений определяется при наличии хотя бы 1 большого или хотя бы 2-х малых критериев (Приложение Г1) [225].
- У пациентов с ИМпST, подвергнутых ЧКВ, без высокого риска ишемических осложнений, не имевших ишемических осложнений в период двойной антитромбоцитарной терапии (сочетание АСК** с блокатором Р2Y12-рецептора тромбоцитов), рекомендуется ограничить ее продолжительность 3-6 месяцами, перейдя на монотерапию блокатором Р2Y12-рецептора тромбоцитов, для снижения риска кровотечений и опосредованного снижения риска ишемических событий [226-232].
ЕОК IIaA (УУР A, УДД 2)
Комментарии: «Ранний» переход с двойной антитромбоцитарной терапии на монотерапию антиагрегантом после ЧКВ наиболее освоен при отмене АСК** с переходом на монотерапию тикагрелором** в дозе 90 мг 2 раза в сутки [229, 230].
- У пациентов с ИМпST и высоким риском кровотечений рекомендуется рассмотреть переход с сочетания АСК** с блокатором Р2Y12-рецептора тромбоцитов (двойная антитромбоцитарная терапия) на монотерапию ингибитором Р2Y12-рецептора тромбоцитов или АСК** через 1 месяц после начала лечения [233, 234].
ЕОК IIbB (УУР B, УДД 2)
Комментарии: Столь «ранний» переход с двойной антитромбоцитарной терапии на монотерапию антиагрегантом выглядит наиболее безопасным с точки зрения ишемических осложнений при отмене АСК** с переходом на монотерапию тикагрелором** в дозе 90 мг 2 раза в сутки у пациентов, подвергнутых ЧКВ; переход на монотерапию клопидогрелом** у пациентов с ИМпST, подвергнутых ЧКВ, в исследовании STOPDAPT-2 ACS был сопряжен с увеличением риска ИМ [234].
- У пациентов с ИМпST, подвергнутых ЧКВ, не имевших ишемических осложнений в первый месяц двойной антитромбоцитарной терапии, рекомендуется рассмотреть переход с сочетания АСК** с тикагрелором** или прасугрелом на сочетание АСК** с клопидогрелом** (“деэскалация” двойной антитромбоцитарной терапии) для снижения риска кровотечений и опосредованного снижения риска ишемических событий [235-238].
ЕОК IIbA (УУР В, УДД 2)
Комментарии: К настоящему времени “деэскалация” двойной антитромбоцитарной терапии с заменой тикагрелора** или прасугрела на клопидогрел** в первый месяц после начала лечения ОКС не рекомендуется. Подход к “деэскалации” двойной антитромбоцитарной терапии на основании лабораторных данных (с учетом остаточной реактивности тромбоцитов, полиморфизмов изофермента цитохрома Р450 С19), изученный при ОКСпST в ранние сроки после ЧКВ, не имеет преимуществ перед “деэскалацией” без привлечения лабораторных показателей.
3.4. Антитромботическая терапия через 12 месяцев после ИМпST у пациентов, не имеющих показаний к длительному пероральному приему антикоагулянтов
- У пациентов, перенесших ИМпST, с высоким риском коронарных осложнений и низким риском кровотечений, не имевших кровотечений в течение первого года лечения, для снижения риска смерти, повторного ИМ, суммарного риска ишемических событий рекомендуется продление двойной антитромботической терапии (сочетание АСК** с блокатором Р2Y12-рецепторов тромбоцитов или ривароксабаном** в дозе 2,5 мг 2 раза в сутки) на более длительный срок. При этом, в ходе наблюдения соотношение пользы и риска продления двойной антитромботической терапии должно регулярно оцениваться повторно [239-243].
ЕОК IIaА (УУР B, УДД 2)
Комментарии: В пользу высокого риска коронарных осложнений свидетельствует сочетание коронарной болезни сердца в сочетании с одним из следующих критериев: СД, требующий лечения; повторные ИМ в анамнезе; многососудистая коронарная болезнь сердца; сочетание коронарного и периферического атеросклероза; преждевременная коронарная болезнь сердца (в возрасте до 45 лет); ускоренное развитие коронарной болезни сердца (два острых коронарных события за предшествующие 2 года), хроническое системное воспалительное заболевание (системная красная волчанка, артрит, носительство вируса иммунодефицита человека); рСКФ 15-59 мл/мин/1,73 м2; технические аспекты выполненного ЧКВ – имплантация как минимум 3 стентов, вмешательство как минимум на 3 стенозах, общая длина стентов более 60 мм, комплексная реваскуляризация (стентирование ствола левой коронарной артерии, бифуркационное стентирование как минимум 2 стентами, стентирование хронических окклюзий, стентирование последнего проходимого сосуда); тромбоз стента в анамнезе на фоне лечения антиагрегантами.
О высоком риске кровотечений свидетельствуют внутричерепное кровотечение, ишемический инсульт или другая внутричерепная патология в анамнезе, недавнее желудочно-кишечное кровотечение или анемия из-за потери крови через желудочно-кишечный тракт, другая патология желудочно-кишечного тракта с повышенным риском кровотечений, печеночная недостаточность, геморрагический диатез или коагулопатия, старческий возраст или старческая астения, ХБП, требующая диализа или с рСКФ <15 мл/мин/1,73 м2.
- У пациентов, перенесших ИМпST, с высоким риском коронарных осложнений, не имевших кровотечений в первый год двойной антитромбоцитарной терапии, для снижения риска ишемических событий рекомендуется ее продление в виде сочетания АСК** с уменьшенной дозой тикагрелора** (60 мг 2 раза в сутки внутрь) на дополнительные 36 месяцев [242, 243].
ЕОК IIаB (УУР B, УДД 2)
Комментарии: В исследовании PEGASUS-TIMI 54, продемонстрировавшим целесообразность такого подхода, к пациентам, имеющим высокий риск коронарных осложнений относили лиц ≥ 50 лет, перенесших ИМ, в сочетании как минимум с одним из следующих факторов риска: возрасте ≥ 65 лет, наличие требующего медикаментозного лечения СД, два и более перенесенных ИМ, многососудистый коронарный атеросклероз, ХБП с рСКФ менее 60 мл/мин/1,73 м2. Изученная длительность применения сочетания АСК** с тикагрелором** в дозе 60 мг 2 раза в сутки составляет 36 месяцев.
- У пациентов, перенесших ИМпST, с высоким риском тромботических осложнений атеросклероза, не имевших кровотечений в течение первого года лечения, для снижения риска ишемических событий рекомендуется длительное использование сочетания АСК** с ривароксабаном** в дозе 2,5 мг 2 раза в сутки внутрь [239].
ЕОК IIаB (УУР B, УДД 2)
Комментарии: В исследовании COMPASS [188], продемонстрировавшим целесообразность такого подхода, к пациентам с высоким риском тромботических осложнений атеросклероза относили лиц, перенесших ИМ или имеющих многососудистый коронарный атеросклероз в случаях, возраст ≥65 лет, наличие атеросклеротического поражения других (не коронарных) сосудистых бассейнов, или как минимум два из следующих факторов риска: курение, СД, нетяжелая хроническая сердечная недостаточность (ХСН) в анамнезе, нелакунарный ишемический инсульт в анамнезе, ХБП с рСКФ менее 60 мл/мин/1,73 м2.
- У пациентов, перенесших ИМпST, через 12 месяцев рекомендуется рассмотреть переход не на монотерапию АСК**, а на монотерапию блокатором Р2Y12–рецептора тромбоцитов для дополнительного снижения риска ишемических событий [244, 245].
ЕОК IIbA (УУР A, УДД 1)
Комментарии: Дополнительная польза монотерапии клопидогрелом** наиболее очевидна у пациентов, 1 год назад подвергнутых коронарному стентированию (рандомизированное контролируемое исследование HOST-EXAM) [245]. Опубликованы также данные в пользу монотерапии #тикагрелором** в дозе 90 мг 2 раза в сутки (анализ GLASSY исследования GLOBAL LEADERS) [246].
4. Органические нитраты
- Из-за отсутствия доказательств положительного влияния на прогноз рутинное назначение органических нитратов в виде внутривенной инфузии, трансдермально или перорально при ИМпST не рекомендуется [247, 248].
ЕОК IIIB (УУР А, УДД 2)
Комментарий: При ИМпST нитраты назначают только по показаниям, к которым прежде всего относят постинфарктную стенокардию. Иногда нитраты назначают по поводу сердечной недостаточности, хотя для этой цели лучше подходят ингибиторы ангиотензинпревращающего фермента (иАПФ). Для профилактики толерантности к нитратам их назначают прерывисто: промежуток времени между последним приемом препарата и первым приемом на следующий день должен быть не менее 12 ч (оптимально — 16 ч).
- Внутривенная инфузия нитратов (нитроглицерина** или изосорбида динитрата**) рекомендуется для симптоматического лечения у пациентов с ИМпST и продолжающейся ишемией миокарда, АГ, сердечной недостаточностью при отсутствии противопоказаний [14, 248-251].
ЕОК IC (УУР B, УДД 2)
Комментарий: Критерий адекватно подобранной скорости введения (дозы) при в/в инфузии нитратов — уровень систолического АД, который должен быть снижен на 10–15% у нормотоников и на 25–30% – у лиц с АГ, но не ниже 100 мм рт. ст. Обычная начальная скорость введения нитроглицерина** 10 мкг/мин. При ее неэффективности скорость инфузии увеличивается на 10–15 мкг/мин каждые 5–10 мин, пока не будет достигнут желаемый эффект. Если достичь целевого уровня снижения АД не удается, даже увеличив скорость инфузии нитроглицерина** до 166 мкг/мин, то дальнейшее увеличение дозы не имеет смысла. Оптимальная продолжительность инфузии нитратов — не более 24–48 ч, т.к. в дальнейшем часто развивается толерантность. При развитии гипотонии обычно достаточно прекратить инфузию нитроглицерина**, так как у препарата короткий период полувыведения. Реже приходится проводить стандартные мероприятия по увеличению притока крови к сердцу (приподнять нижние конечности; возможно в/в введение 0,9% раствора натрия хлорида**, применение адрено- и допамин-стимуляторов).
Органические нитраты не рекомендуются при артериальной гипотонии, ИМ правого желудочка, а также после приема силденафила или варденафила в предыдущие 24 ч, тадалафила – в предыдущие 48 ч из-за высокого риска осложнений. При появлении головной боли могут использоваться анальгетики и кофеинсодержащие препараты.
5. Бета-адреноблокаторы
- Пациентам с ИМпST, с АГ и/или сохраняющейся ишемией миокарда и/или тахикардией, не имеющим признаков ОСН, для контроля за ишемией и профилактики желудочковых аритмий рекомендуется внутривенное введение бета-адреноблокатора (преимущественно метопролола**) при отсутствии противопоказаний [252-256, 277].
ЕОК IIaB (УУР А, УДД 1)
Комментарий: Пациентам с ИМпST при отсутствии признаков ОСН рекомендуется в/в введение первоначальной дозы бета-адреноблокатора, особенно при наличии АГ и/или сохраняющейся ишемии миокарда и/или тахикардии, с последующим переходом на прием препаратов внутрь. В/в бета-адреноблокаторы предотвращают развитие жизнеугрожающих желудочковых аритмий [257].
Есть данные, что польза от бета-адреноблокаторов тем выше, чем раньше начата терапия и чем быстрее проявляется их действие. Препараты и дозы для в/в введения — см. Приложение А3.
- Всем пациентам с ИМпST, не имеющим противопоказаний, для снижения риска осложнений ИМ и улучшения прогноза рекомендуется пероральный прием бета-адреноблокаторов [258].
ЕОК IIaB (УУР В, УДД 1)
Комментарий: Убедительные данные об улучшении прогноза при назначении бета-адреноблокаторов у пациентов с ОКСпST были получены в основном в дореперфузионную эру. Польза рутинного назначения бета-адреноблокаторов у пациентов, которые подверглись первичной ЧКВ, на основании рандомизированных клинических исследований и системных мета-анализов не показана [253, 259-261]. Особенно остро стоит вопрос о целесообразности назначении бета-адреноблокаторов пациентам с сохранной сократительной функцией ЛЖ. В настоящее время проводится ряд рандомизированных исследований для оценки пользы назначения бета-адреноблокаторов пациентам с ФВ ЛЖ > 40% (BETAMI, DANBLOCK, REBOOT) и ФВ ЛЖ > 50% (REDUCE-AMI) [262-265]; их результаты могут повлиять на рекомендации.
Вместе с тем, результаты некоторых регистров, ретроспективных исследований и мета-анализов говорят о том, что назначение бета-адреноблокаторов приводит к улучшению прогноза [266-270]. Однако накопленные факты неоднозначны. Так, не все регистры говорят об однозначной пользе назначения бета-адреноблокаторов пациентам с сохранной ФВ ЛЖ без сердечной недостаточности [271-273].
Гемодинамически стабильным пациентам с ИМпST бета-адреноблокаторы могут быть назначены в первые 24 ч после начала болезни. В ранние сроки ИМпST важнейшее значение имеет выбор приемлемой дозы препарата, которая не должна быть слишком большой при опасности возникновения осложнений (прежде всего — сердечной недостаточности). О достаточности дозы обычно судят по достигнутой частоте сердечных сокращений (ЧСС). Она не должна быть ниже 44–46 ударов в 1 мин в ночные часы в покое.
Абсолютные противопоказания к использованию бета-адреноблокаторов, в том числе при ИМпST: кардиогенный шок, тяжелая обструктивная болезнь легких в стадии обострения, атриовентрикулярная (АВ) блокада II–III степени у пациентов без функционирующего искусственного водителя ритма сердца, аллергия (непереносимость компонентов лекарственного препарата).
Относительные противопоказания к использованию бета-адреноблокаторов: клинические проявления сердечной недостаточности, свидетельства наличия низкого сердечного выброса, систолическое АД < 100 мм рт. ст., ЧСС < 60 ударов в 1 минуту, удлинение интервала PQ > 0,24 сек, обструктивная болезнь легких в анамнезе, наличие факторов риска возникновения кардиогенного шока.
У пациентов с существенным нарушением сократимости ЛЖ начинать лечение следует с минимальных доз бета-адреноблокаторов. Через 24–48 ч после исчезновения выраженной брадикардии, артериальной гипотензии, тяжелой сердечной недостаточности, АВ-блокады можно начать аккуратное титрование дозы препаратов для приема внутрь. При наличии исходных противопоказаний к бета-адреноблокаторам возможность их назначения следует регулярно пересматривать. Следует воздержаться от назначения бета-адреноблокаторов с внутренней симпатомиметической активностью.
Продолжительность терапии бета-блокаторами после неосложненного ИМ активно обсуждается. Имеются некоторые наблюдательные нерандомизированные исследования, показывающие, что клиническая польза терапии бета-блокаторами ограничена первым годом после индексного ОКС. В настоящее время проводятся два крупномасштабных исследования. Рандомизированные клинические исследования, проверяющие влияние отмены бета-блокаторов через 6–12 месяцев после неосложненного ОКС у пациентов с сохраненной ФВ ЛЖ: AβYSS (Beta Blocker Interruption After Uncomplicated Myocardial Infarction; SMART-DECISION (Long-term Beta-blocker Therapy After Acute Myocardial Infarction) [274, 275].
- Для уменьшения риска смерти у пациентов с ИМпST и сердечной недостаточностью и/или низкой (≤ 40%) ФВ ЛЖ рекомендуется пероральный прием бета-адреноблокаторов без внутренней симпатомиметической активности [258, 276, 277].
ЕОК IA (УУР A, УДД 1)
Комментарий: Изученными у пациентов с ИМпST считаются метопролол** (группа C07AB – селективные бета-адреноблокаторы) и карведилол** (группа C07AG – альфа- и бета-адреноблокаторы).
6. Блокаторы кальциевых каналов
- Из-за отсутствия доказательств эффективности у пациентов с ИМпST не рекомендуется рутинное назначение блокаторов кальциевых каналов [278, 279].
ЕОК IIIA (УУР B, УДД 2)
Комментарий: В связи с возможностью неконтролируемой гипотонии у пациентов с ИМпST следует избегать назначения нифедипина** (группа C08CA – производные дигидропиридина) короткого действия [280].
Амлодипин** (группа C08CA – производные дигидропиридина) можно назначать пациентам с постинфарктной стенокардией при недостаточной эффективности бета-адреноблокаторов и нитратов или при невозможности контролировать АГ другими средствами.
- При непереносимости бета-адреноблокаторов для контроля за ишемией миокарда у пациентов с ИМпST без сердечной недостаточности, без низкой ФВ ЛЖ и без других противопоказаний рекомендуется рассмотреть возможность назначения верапамила** [278].
ЕОК IIbB (УУР В, УДД 2)
Комментарий: Верапамил**, дилтиазем (группа C08DA – производные фенилалкиламина) можно назначать пациентам с постинфарктной стенокардией при недостаточной эффективности бета-адреноблокаторов и нитратов или при невозможности контролировать АГ другими средствами. Верапамил** и дилтиазем иногда используют для контроля сердечного ритма, реже — для купирования суправентрикулярных аритмий в случае неэффективности / противопоказаний к бета-адреноблокаторам. Верапамил** или дилтиазем могут использоваться только при отсутствии симптомов сердечной недостаточности и/или существенной сократительной дисфункции ЛЖ, нарушений синоатриальной и АВ проводимости и брадиаритмий. Совместный прием верапамила** или дилтиазема с бета-адреноблокатором крайне нежелателен.
7. Блокаторы ренин-ангиотензин-альдостероновой системы
Ингибиторы ангиотензинпревращающего фермента (иАПФ) и антагонисты рецептора ангиотензина II (АРА)
- Для предотвращения дисфункции ЛЖ, сердечной недостаточности и смерти рекомендуется применение иАПФ у всех пациентов с ИМпST, не имеющих противопоказаний [281].
ЕОК IIaA (УУР B, УДД 2)
- Для снижения риска смерти и развития / прогрессирования сердечной недостаточности рекомендуется раннее (в первые 24 часа ИМпST) назначение иАПФ у пациентов с сердечной недостаточностью, низкой (≤ 40%) ФВ ЛЖ, СД или ИМ передней локализации [281, 282].
ЕОК IA (УУР A, УДД 1)
Комментарий: У пациентов со стабильной гемодинамикой назначение иАПФ в первые 24 ч от начала заболевания безопасно [283]. Следует постепенно увеличивать дозу иАПФ до рекомендуемой (целевой), которая по данным клинических исследований обеспечивает положительное влияние на прогноз, а если это невозможно — до максимально переносимой (Приложение А3).
Противопоказания для начала использования иАПФ: систолическое АД <100 мм рт. ст., выраженное снижение фильтрационной функции почек, гиперкалиемия, двусторонний стеноз почечных артерий (или стеноз почечной артерии единственной почки), беременность, индивидуальная непереносимость.
- У пациентов с ИМпST, имеющих сердечную недостаточность и/или низкую (≤ 40%) ФВ ЛЖ или АГ, в случае непереносимости иАПФ для лечения сердечной недостаточности, снижения риска смерти и прогрессирования сердечной недостаточности рекомендуется использовать АРА, предпочтительно — валсартан [284].
ЕОК IB (УУР B, УДД 2)
Комментарий: Начальная доза валсартана составляет 20 мг 2 раза в сутки ; при хорошей переносимости дозу препарата постепенно увеличивают вплоть до 160 мг 2 раза в сутки.
- У пациентов с ИМпST и низкой (≤ 40%) ФВ ЛЖ и/или с признаками застоя в легких для снижения риска смерти от сердечно-сосудистых причин и госпитализации по поводу сердечной недостаточности рекомендуется назначить валсартан+сакубитрил ** [285-297].
ЕОК IIaB (УУР B, УДД 2)
Комментарий: По результатам исследования PARADISE-MI валсартан+сакубитрил ** (группа C09DX – антагонисты рецепторов ангиотензина II в комбинации с другими средствами) не уступал рамиприлу** по влиянию на частоту смерти или госпитализации по поводу утяжеления сердечной недостаточности при назначении в ранний период (от 12 часов до 7 суток) ИМпST [286-297]. В исследовании PARADIGM-HF валсартан+сакубитрил ** продемонстрировал бόльшую эффективность по сравнению с эналаприлом** в отношении снижения риска смерти или госпитализации по поводу утяжеления сердечной недостаточности у больных ХСН с низкой ФВ ЛЖ [285].
Антагонисты альдостерона
- Для снижения риска смерти и прогрессирования сердечной недостаточности у пациентов с ИМпST и низкой (≤ 40%) ФВ ЛЖ в сочетании с сердечной недостаточностью или СД рекомендуется в добавление к бета-адреноблокатору и иАПФ использовать антагонист альдостерона, предпочтительно эплеренон, при условии, что нет значительного снижения фильтрационной функции почек и гиперкалиемии [298].
ЕОК IIaB (УУР А, УДД 2)
Комментарий: Предпочтительно назначать эплеренон в первые сутки от начала ИМ [299]. Есть указания на снижение риска смерти при использовании антагонистов альдостерона, в том числе спиронолактона** (группа C03DA – антагонисты альдостерона), у пациентов ИМпST при отсутствии противопоказаний и независимо от наличия сердечной недостаточности и низкой ФВ ЛЖ [300, 301]. При таком подходе предпочтительно назначать антагонист альдостерона в пределах 72 часов от начала ИМпST.
Противопоказания к назначению антагонистов альдостерона: уровень креатинина в крови у мужчин > 220 мкмоль/л, у женщин > 175 мкмоль/л, а также концентрация в крови калия более 5 ммоль/л. Во время лечения антагонистами альдостерона контролируют уровень креатинина и калия в крови. Если уровень калия в крови превышает 5,5 ммоль/л, препараты отменяют. Рекомендуется поддерживать концентрацию калия в крови в диапазоне 4,0–5,0 ммоль/л.
8. Липидснижающая терапия
- Для снижения суммарного риска повторных ишемических событий у пациентов с ИМпST вне зависимости от исходного уровня холестерина (ХС) рекомендуется в период госпитализации начать или продолжить лечение ингибитором 3-гидрокси-3-метилглутарил коэнзима А редуктазы (ингибитором ГМГ-КоА-редуктазы) в высокой дозе при отсутствии противопоказаний [302-306].
ЕОК IА (УУР A, УДД 1)
Комментарии: Назначение (первый прием) ингибитора ГМГ-КоА-редуктазы (син.: статина) в высокой дозе рекомендуется выполнить в первые сутки госпитализации пациента с ИМпST и, при этом, как можно ранее. В случае выполнения ЧКВ первый прием ингибитора ГМГ-КоА-редуктазы рекомендуется до его начала с целью снижения вероятности развития сердечно-сосудистых осложнений и контраст-индуцированной нефропатии после ЧКВ [307-308].
И целесообразность назначения, и начальная доза ингибитора ГМГ-КоА-редуктазы при ИМпST не определяются уровнем общего ХС и его фракций, поэтому не должно быть задержки в назначении ингибитора ГМГ-КоА-редуктазы из-за ожидания результатов биохимического анализа крови.
У пациентов с ИМпST, подвергнутых первичному ЧКВ, имеются многочисленные доказательства дополнительного снижения риска ишемических событий и даже смерти при использовании высоких доз ингибиторов ГМГ-КоА-редуктазы, применение которых начато до ЧКВ (при сравнении с использованием ингибиторов ГМГ-КоА-редуктазы с началом их применения на более поздних этапах госпитализации) [307-315].
Терапия ингибиторами ГМГ-КоА-редуктазы обычно хорошо переносится, частота серьезных побочных эффектов не превышает 2%. Возможно появление миалгии и мышечной слабости, которые появляются, в основном, в первые недели после начала терапии и обычно быстро проходят после отмены ингибитора ГМГ-КоА-редуктазы. Рабдомиолиз с повышением уровня креатинкиназы более чем в 10 раз наблюдается крайне редко. Возможно бессимптомное повышение уровня трансаминаз в 3 и более раза, что требует снижения дозы или отмены препарата с дальнейшим наблюдением за активностью печеночных трансаминаз. Следует помнить, что в острую фазу ИМпST повышение уровня трансаминаз обусловлено некрозом кардиомиоцитов и не является причиной для отказа от назначения ингибиторов ГМГ-КоА-редуктазы.
Основные противопоказания для назначения ингибиторов ГМГ-КоА-редуктазы: повышенная чувствительность; активное заболевание печени или повышение активности печеночных трансаминаз в плазме крови неясного генеза более чем в 3 раза по сравнению с верхней границей нормы; женщины детородного возраста, не использующие адекватные методы контрацепции; беременность; период грудного вскармливания.
Рекомендуется применение ингибиторов ГМГ-КоА-редуктазы с наиболее выраженным гиполипидемическим действием, в частности аторвастатина** в суточной дозе 40–80 мг или розувастатина в суточной дозе 20–40 мг [315, 316].
- Для дополнительного снижения суммарного риска ишемических событий у пациентов с ИМпST в период госпитализации рекомендуется рассмотреть начало комбинированного лечения ингибитором ГМГ-КоА-редуктазы в высокой дозе и эзетимибом (вне зависимости от исходного уровня ХС и его фракций и предшествующей терапии ингибитором ГМГ-КоА-редуктазы) [317].
ЕОК IIbB (УУР B, УДД 2)
Комментарий: Эта рекомендация основана на результатах исследования IMPROVE-IT (Improved Reduction of Outcomes: Vytorin Efficacy International Trial). В ранней стадии (в первые 10 дней) ОКС эзетимиб назначали в дополнение к предшествующей терапии статинами или назначали одновременно со статинами у пациентов, ранее не принимавших статины (две трети пациентов), сравнивали с монотерапией статинами. Было показано, что лечение эзетимибом безопасно и обеспечивает долгосрочные преимущества в отношении сердечно-сосудистых исходов [317].
- У пациентов, перенесших ИМпST, рекомендуется поддерживать уровень ХС ЛНП < 1,4 ммоль/л и при этом добиваться его снижения как минимум на 50% от исходных значений для обеспечения максимального эффекта по снижению риска повторных ишемических событий [317-321].
ЕОК IA (УУР А, УДД 1)
Комментарии: Необходимо определять уровень ХС ЛНП в крови через 4–6 недель после начала лечения, после изменения дозы или добавления нового гиполипидемического препарата для оценки эффективности терапии, определения необходимости увеличения дозы и/или добавления гиполипидемических препаратов с другим механизмом действия (эзетимиб и/или алирокумаб** или эволокумаб** (группа C10AX – другие гиполипидемические средства) или инклисиран) [317, 319].
- У пациентов с ИМпST, перенесших помимо данного ИМпST еще одно сосудистое (в любом сосудистом бассейне) событие в течение предшествующих 2-х лет, для дополнительного снижения риска повторных ишемических событий рекомендуется целевой уровень ХС ЛНП < 1,0 ммоль/л [322, 323].
ЕОК IIbB (УУР С, УДД 5)
- У пациентов, которые на момент развития ИМпST уже принимали ингибитор ГМГ-КоА-редуктазы в максимально переносимой дозе и эзетимиб, но при этом при поступлении имеют уровень ХС ЛНП выше целевого, рекомендуется в дополнение к ингибитору ГМГ-КоА-редуктазы в максимально переносимой дозе и эзетимибу раннее назначение (во время госпитализации в связи с данным коронарным событием) блокатора пропротеиновой конвертазы субтилизин-кексинового типа 9 (PCSK9) – алирокумаба**, эволокумаба** или инклисирана [324-328].
ЕОК IIaC для алирокумаба и эвелокумаба,
РКО IIaC для инклисирана (УУР В, УДД 2)
Комментарий: Клиническая эффективность инклисирана показана в мета-анализах относительно небольших исследований, в которые включались в том числе больные, перенесшие ИМ. В настоящее время проводится крупномасштабное исследование ORION-4 по изучению влияния инклисирана на сердечно-сосудистые осложнения, результаты ожидаются в 2025 г.
- При значительном повышении (выше 4,0 ммоль/л) уровня ХС ЛНП у пациентов с ИМпST рекомендуется раннее назначение (во время госпитализации в связи с данным коронарным событием) назначения ингибитора ГМГ-КоА-редуктазы и эзетимиба, предпочтительно в одной таблетке или капсуле [329].
РКО IIаA (УУР А, УДД 1)
- При чрезвычайно высоком (выше 5,0 ммоль/л) повышении уровня ХС ЛНП у пациентов с ИМпST рекомендуется раннее назначение (во время госпитализации в связи с данным коронарным событием) назначения ингибитора ГМГ-КоА-редуктазы в максимально переносимой дозе + эзетимиб + ингибитор PCSK9 (алирокумаб**, эволокумаб** или инклисиран) [330-332].
РКО IIA (УУР А, УДД 1)
- Если у пациента, перенесшего ИМпST, при использовании максимально переносимой дозы ингибитора ГМГ-КоА-редуктазы концентрация ХС ЛНП в крови остаётся выше целевого уровня, рекомендуется добавить к ингибитору ГМГ-КоА-редуктазы эзетимиб для дополнительного снижения уровня ХС ЛНП в крови и риска ишемических событий, в том числе ингибитор ГМГ-КоА-редуктазы с эзетимибом в одной таблетке или капсуле [317].
ЕОК IIaB (УУР B, УДД 2)
Комментарий: Данная рекомендация относится к пациентам, у которых во время госпитализации по поводу ИМпST эзетимиб не был назначен согласно рекомендации для госпитального этапа.
- Если у пациента, перенесшего ИМпST, при использовании максимально переносимой дозы ингибитора ГМГ-КоА-редуктазы в сочетании с эзетимибом концентрация ХС ЛНП в крови остаётся выше целевого уровня, рекомендуется добавить алирокумаб** или эволокумаб** или инклисиран для дополнительного снижения уровня ХС ЛНП в крови и риска ишемических событий [320, 321].
ЕОК IВ для алирокумаба и эвелокумаба,
РКО IВ для инклисирана (УУР А, УДД 2)
Комментарий: Если на фоне терапии ингибиторами ГМГ-КоА-редуктазы в максимально переносимых дозах уровень ХС ЛНП остается значительно повышенным (> 2,5 ммоль/л), можно рассмотреть добавление алирокумаба** или эволокумаба** или инклисирана** без предварительного применения эзетимиба.
- У пациентов с ИМпST или после ИМпST с непереносимостью ингибиторов ГМГ-КоА-редуктазы для достижения целевых значений ХС ЛНП рекомендуется рассмотреть возможность использования эзетимиба и/или препарата из группы блокаторов PCSK9 (алирокумаб** или эволокумаб** или инклисирана) [320, 321].
ЕОК IIbВ для алирокумаба и эвелокумаба,
РКО IIbВ для инклисирана (УУР С, УДД 5)
3. Иное лечение
- У пациентов с ИМпST при концентрации глюкозы в крови выше 10 ммоль/л рекомендуется использование сахароснижающих лекарственных средств для контроля уровня гликемии [333-335].
ЕОК IIaС (УУР B, УДД 2)
Комментарии: Целевой уровень глюкозы в крови и гликированного гемоглобина при лечении ИМпST не определен и должен выбираться с учетом сопутствующих заболеваний. Следует избегать гипогликемии.
Для достижения целевого уровня гликемии у пациентов с ИМпST рекомендуется индивидуализированный подход к выбору сахароснижающих лекарственных средств. Наличие у пациента с ИМпST СД 2 типа не является обязательным показанием к переводу на инсулинотерапию; многие могут продолжать прием пероральных сахароснижающих препаратов. Если у пациента с СД 2 типа возникла необходимость в использовании инсулинов, после стабилизации состояния рекомендуется переход на пероральные сахароснижающие средства.
Пациенты с ИМпST без нарушения сознания и других серьезных осложнений, способные самостоятельно принимать пищу, могут находиться на подкожной инсулинотерапии при условии, что она позволяет поддерживать целевой диапазон гликемии и избегать гипогликемии. Методом выбора для быстрого и управляемого достижения компенсации углеводного обмена является непрерывная внутривенная инфузия инсулинов и аналогов быстрого действия, при необходимости — в сочетании с внутривенной инфузией декстрозы** (Приложение А3. Внутривенная инсулинотерапия при ИМпST).
- У пациентов с ИМпST без СД и при СД вне контроля уровня гликемии не рекомендуется использовать одновременную инфузию инсулинов и декстрозы**, одновременную инфузию инсулинов, декстрозы** и калия хлорида** из-за отсутствия доказательств положительного влияния на смертность и частоту нефатальных осложнений [14, 340].
ЕОК IIIC (УУР С, УДД 5)
- У пациентов с ИМпST не рекомендуется использовать нестероидные противовоспалительные и противоревматические препараты (за исключением низких доз АСК** в качестве антиагреганта и средних доз ACK** для лечения перикардита) из-за неблагоприятного влияния на прогноз [341, 342, 521].
ЕОК IIIB (УУР А, УДД 1)
Комментарии: Рекомендуется отменить нестероидные противовоспалительные и противоревматические препараты и/или не начинать их использование при госпитализации с ИМпST.
- У пациентов с ИМпST и анемией, не имеющих признаков продолжающегося кровотечения и гемодинамической нестабильности, целесообразность гемотрансфузии рекомендуется рассматривать при снижении уровня гематокрита менее 25% и/или гемоглобина менее 70 г/л для уменьшения риска осложнений, связанных с гемотрансфузий, и возможного неблагоприятного влияния гемотрансфузий на прогноз [14].
ЕОК IIbC (УУР C, УДД 5)
- Пациентам с ИМпST, которые находятся в коме после внегоспитальной или внутригоспитальной остановки кровообращения, рекомендуется контроль температуры тела, включающий постоянный мониторинг центральной температуры и активное предотвращение лихорадки (>37,7°C), в течение по меньшей мере 72 часов с целью предотвращения осложнений [343-353].
ЕОК IB (УУР В, УДД 3)
- При невозможности контроля температуры тела медикаментозным путем у пациентов с ИМпST в коме после остановки кровообращения рекомендуется рассмотреть применение аппаратной целенаправленной терморегуляции с помощью специальных устройств поверхностного или эндоваскулярного типа с постоянной обратной связью с целевой температурой 32-37°C – при наличии технических возможностей [343-356].
ЕОК IIaB (УУР В, УДД 2)
4. Осложнения
1. Острая сердечная недостаточность
ОСН может возникать как осложнение ИМпST или отражать декомпенсацию ранее существовавшей ХСН при ишемическом повреждении миокарда. При возникновении ОСН у пациентов с ИМпST увеличивается риск других осложнений: снижения фильтрационной функции почек, дыхательной недостаточности, пневмонии, повышается вероятность летального исхода заболевания.
У пациента с ОСН всегда можно диагностировать дисфункцию миокарда ЛЖ. Степень дисфункции миокарда ЛЖ является независимым предиктором смертности пациента с ИМпST. Раннее выявление нарушенной функции миокарда при проведении ЭхоКГ позволяет своевременно начать лечебные мероприятия по профилактике развития сердечной недостаточности.
Развитие ОСН у пациентов с ИМпST ухудшает краткосрочный и долгосрочный прогноз. Классификация Killip используется у пациентов с ИМпST для оценки тяжести ОСН и оценки краткосрочного прогноза.
Основной стратегией терапии у пациентов с ИМпST, осложненном ОСН, является экстренная реваскуляризация миокарда с целью ограничения ишемического повреждения.
- У пациентов с ИМпST и ОСН рекомендуется непрерывное мониторирование основных жизненно важных функций, – как минимум, сердечного ритма, АД, SpO2 и диуреза – до стабилизации гемодинамики [14, 354, 357].
РКО IIaC (УУР С, УДД 5)
- Пациентам с ИМпST при появлении признаков OCН рекомендуется срочно выполнить ЭхоКГ с целью оценки сократительной функции миокарда ЛЖ, состояния клапанов и поиска механических осложнений ИМ [14, 50-52].
РКО IIaC (УУР С, УДД 5)
Комментарий: В случае, если ЭхоКГ уже была выполнена, рекомендуется повторная ЭхоКГ для контроля за общей и локальной сократительной функцией ЛЖ и выявления / исключения механических осложнений ИМпST. Также рекомендуется контроль ЭхоКГ в динамике для оценки эффективности и безопасности проводимой терапии.
- Для оценки наличия и выраженности ОСН рекомендуется во всех случаях ИМпST использовать классификацию Killip [14, 358, 359].
ЕОК IIaC (УУР C, УДД 5)
Комментарий: Классификация Killip приведена в Приложении А3. Классификация острой сердечной недостаточности при инфаркте миокарда по Killip.
1.1. Отек легких
На фоне выраженного снижения систолической функции миокарда ЛЖ и/или механических осложнений (дисфункция митрального клапана, разрыв МЖП) происходит повышение давления крови в капиллярах малого круга и поступление жидкой компоненты крови из внутрисосудистого русла в ткань легких. Различают интерстициальный и альвеолярный отек легких. Диагностика отека легких в большинстве случаев не вызывает затруднений за счет типичной клинической картины. При осмотре наиболее характерными признаками являются: тахикардия, тахипноэ, вынужденное возвышенное положение (ортопноэ). При аускультации легких выслушиваются «застойные» мелкопузырчатые хипы. Регистрируется снижение оксигенации крови. Диагноз можно подтвердить с помощью обзорной рентгенографии грудной клетки и УЗИ легких. У пациентов с ИМпST и ОСН (особенно при отеке легких) отмечается снижение сатурации крови.
- Рекомендуется ингаляторное введение кислорода (оксигенотерапия) пациенту с ИМпST и ОСН путем ингаляции увлажненного кислорода через маску при SpO2 ниже 90% или РaO2 меньше 60 мм рт. ст. с целью коррекции гипоксемии [14, 171, 172].
ЕОК IC (УУР С, УДД 5)
Комментарий: При длительно проводимом ингаляторном введении кислорода (оксигенотерапии) рекомендуется периодическая оценка газового состава артериальной и венозной крови (исследование кислотно-основного состояния и газов крови).
Рутинное проведение оксигенотерапии пациентам без гипоксемии (SpO2 выше или равна 90%) не рекомендуется.
- Для улучшения эффективности лечения сердечной недостаточности у пациентов с ИМпST при тяжелой дыхательной недостаточности (SpO2 ниже 90% и тахипноэ выше 25 в минуту) рекомендуется рассмотреть возможность проведения неинвазивной масочной ИВЛ с постоянным положительным давлением в конце выдоха (постоянная или бифазная вентиляция) [360-362].
ЕОК IIaB (УУР А, УДД 1)
Комментарий: Применение неинвазивной вентиляции легких с целесообразно с применением маски (continuous positive airway pressure — CPAP или biphasic positive airway pressure — BiPAP). Создание положительного давления в дыхательных путях защищает альвеолы от коллабирования на выдохе и поддерживает объем дыхательной поверхности при отеке легких. В результате уменьшается работа дыхательных мышц, улучшается газообмен в легких и повышается внутригрудное давление со снижением пред- и постнагрузки. Имеются данные, что проведение неинвазивной масочной ИВЛ следует рассмотреть как можно скорее, так как она снижает вероятность необходимости интубации трахеи и проведение инвазивной ИВЛ.
Основным режимом неинвазивной вентиляции легких в данной клинической ситуации является CPAP, однако у пациентов с сопутствующей бронхолегочной патологией и гиперкапнией целесообразно использовать BiPAP.
При проведении неинвазивной ИВЛ рекомендуется периодическая оценка газового состава артериальной и венозной крови.
- При наличии у пациента с ИМпST дыхательной недостаточности, сопровождающейся выраженной гипоксемией, гиперкапнией и ацидозом, при неэффективности оксигенотерапии и неинвазивной ИВЛ рекомендуется интубация трахеи и проведение инвазивной ИВЛ [360].
ЕОК IC (УУР С, УДД 5)
- У пациентов с ИМпST и ОСН с признаками задержки жидкости рекомендуется в/в введение «петлевых» диуретиков [363, 364].
ЕОК IC (УУР С, УДД 5)
Комментарий: Используют в/в болюсное введение фуросемида** (группа C03CA -сульфонамиды). Рекомендуемая первоначальная доза — 40 мг. При развернутой картине альвеолярного отека легких, признаках задержки жидкости в организме, тяжелом нарушении фильтрационной функции почек начальная доза фуросемида** может быть увеличена до 60–80 мг. При недостаточной эффективности начальной дозы при повторном введении фуросемида** доза может быть увеличена в 2 раза и более раза.
- У пациента с ИМпST и ОСН с признаками задержки / застоя жидкости при отсутствии адекватного ответа на петлевые диуретики в нарастающих дозах с целью стабилизации состояния рекомендуется рассмотреть целесообразность назначения комбинации «петлевых» диуретиков с тиазидными диуретиками (тиазидами) [364].
ЕОК IIa B (УУР С, УДД 5)
- У пациентов с ИМпST и ОСН с признаками застоя жидкости в малом круге кровообращения и систолическим АД 110 мм рт. ст. и выше, и, особенно, при высоких цифрах АД, для уменьшения выраженности симптомов ОСН рекомендуется рассмотреть возможность в/в инфузии вазодилататоров (группа C01D - вазодилататоры для лечения заболеваний сердца) [365-369].
ЕОК IIb B (УУР С, УДД 5)
Комментарий: У пациентов с отеком легких при повышенном АД нитроглицерин** является препаратом первого ряда. При исходных значениях систолического АД ˂ 90 мм рт. ст. или признаках гипоперфузии, а также поражении правого желудочка, введение нитроглицерина** противопоказано.
- Рутинное назначение опиоидных препаратов при развитии ОСН у пациента с ИМпST не рекомендуется за исключением пациентов с тяжелым болевым синдромом или возбуждением [370-373].
ЕОК IIIC (УУР С, УДД 4)
Комментарий: Ретроспективный анализ показал, что использование опиатов ассоциировано с увеличением потребности в ИВЛ, увеличением сроков госпитализации, увеличением неблагоприятных исходов в стационаре.
1.2. Кардиогенный шок
Кардиогенный шок – самая тяжелая форма ОСН у пациентов с ИМпST. Кардиогенный шок является жизнеугрожающим состоянием, вызванным резким снижением сердечного выброса и проявляющимся признаками выраженной гипоперфузией органов и тканей и тканевой гипоксией, что проявляется клинически: снижением температуры кожных покровов и их мраморностью, снижением темпа диуреза (˂ 40 мл/ч), изменениями психического статуса и сознания.
Выделяют 3 основных патогенетических варианта кардиогенного шока :
- Истинный кардиогенный шок, связанный со снижением сократительной способности ЛЖ (гипокинетический).
- Шок вследствие относительной и абсолютной гиповолемии. Близкий к этому вариант — рефлекторный шок, связанный с реакцией на болевой приступ.
- Аритмический вариант — нарушения гемодинамики на фоне тяжелых тахи- и брадиаритмий (см. раздел «Нарушения ритма»).
Частота различных причин кардиогенного шока, по данным регистра SHOCK: у 79% - снижение сократительной функции левого желудочка, 7% - острая митральная недостаточность, 4% - разрыв межжелудочковой перегородки, 2% изолированная правожелудочковая недостаточность, 1,4% - тампонада, 7% - другие причины (осложнения катетеризации, передозировка или неоправданное назначение бета-адреноблокаторов, блокаторов медленных кальциевых каналов и др.) [157]. Основным клиническим признаком кардиогенного шока является стойкая гипотензия (систолическое АД ≤ 90 мм рт. ст.), рефрактерная к инфузионной терапии и сопровождающаяся признаками острой полиорганной недостаточности в результате гипоперфузии. Объективизация параметров гемодинамики с помощью инвазивных методик, в том числе установки катетера Свана–Ганса, на сегодняшний день не считается рутинно обязательной, однако в спорных и сложных случаях позволяет получить ряд ценных данных.
Гемодинамические критерии истинного критерии шока:
1. Гипотензия — систолическое АД < 80–90 мм рт. ст. при среднем АД ˂ 70 мм рт. ст. Формула расчета среднего АД = 1/3 систолического АД + 2/3 диастолического АД.
2. Резкое снижение сердечного индекса (СИ) по данным инвазивного мониторинга гемодинамики:
- <1,8 л/мин/м2 без вазоактивной терапии;
- <2,0–2,2 л/мин/м2 на фоне вазоактивной терапии.
3. Повышение давления наполнения желудочков:
- Конечное диастолическое давление (КДД) ЛЖ > 18 мм рт. ст.;
- КДД ПЖ > 10 мм рт. ст.
С точки зрения инвазивной гемодинамики кардиогенный шок характеризуется сниженным СИ, повышением общего периферического сопротивления сосудов (ОПСС) и давления заклинивания легочных капилляров (ДЗЛК). Однако, эти показатели могут быть и иными. Основываясь на данных инвазивного мониторинга гемодинамики, можно выделить гемодинамические варианты кардиогенного шока (Приложение А3. Гемодинамические варианты кардиогенного шока)
- Пациентам с ИМпST и кардиогенным шоком показана установка центрального венозного катетера (катетеризация подключичной и других центральных вен) с целью введения лекарственных препаратов, прежде всего, вазоактивных препаратов, измерения смешанной венозной сатурации и центрального венозного давления (ЦВД) (Приложение А3. Параметры для мониторирования у пациента с кардиогенным шоком) [14, 430, 442, 448].
РКО IIaC (УУР С, УДД 5)
- Пациентам с ИМпST и кардиогенным шоком рекомендуется клинический осмотр не реже 1 раза в час и мониторирование жизненно важных функций с целью определения клинической тяжести и реакции на лечение, с кратностью, рекомендованной в Приложении А3. Параметры для мониторирования у пациента с кардиогенным шоком [14, 430, 442, 448].
РКО IIaC (УУР С, УДД 5)
В зависимости от клинической тяжести и реакции на лечение выделяют следующие стадии кардиогенного шока: прешок, развернутая картина кардиогенного шока и резистентный кардиогенный шок (Приложение А3. Стадии кардиогенного шока в зависимости от клинической тяжести и реакции на лечение), которые также могут быть разделены на пять стадий согласно классификации Американского общества сердечно-сосудистой ангиографии и интервенции (SCAI) (Приложение А3. Стадии кардиогенного шока согласно классификации Американского общества сердечно-сосудистой ангиографии и интервенции (SCAI)) [374]:
Реперфузионная терапия и реваскуляризация миокарда является основой лечения кардиогенного шока при ИМпST.
Лечение истинного кардиогенного шока
- При появлении признаков наличии острой левожелудочковой недостаточности / кардиогенного шока у пациентов с ИМпST рекомендуется срочная реваскуляризация. миокарда, если она ранее не проводилась или была неполной [157, 375, 376].
ЕОК IА (УУР В, УДД 2)
Комментарий: См. также раздел 3.1.7. «Реперфузионное лечение у пациентов с кардиогенным шоком и внезапной остановкой кровообращения».
- У пациентов с ИМпST и кардиогенным шоком рекомендуется рассмотреть возможность проведения инвазивного мониторинга показателей центральной гемодинамики для контроля за эффективностью и безопасностью лечения, а также катетеризации легочной артерии – для уточнения причины кардиогенного шока, при наличии физических и технических возможностей [137].
РКО IIaC (УУР С, УДД 5)
- У пациентов с ИМпST и ОСН с систолическим АД менее 90 мм рт. ст. и признаками гипоперфузии для устранения гемодинамической нестабильности рекомендуется рассмотреть возможность назначения инотропых препаратов [377].
ЕОК IIbC (УУР C, УДД 5)
Комментарий: Инфузия допамина** (группа C01CA – адренергические и дофаминергические средства) начинается со скоростью 5 мкг/кг/мин, далее в зависимости от гемодинамического ответа может быть увеличена до 15-20 мкг/кг/мин. Добутамин** (группа C01CA – адренергические и дофаминергические средства) вводят с начальной скоростью 2–10 мкг/кг/мин; при необходимости скорость может быть увеличена до 20 мкг/кг/мин. Норэпинефрин** (группа C01CA – адренергические и дофаминергические средства) начинают вводить со скоростью 2 мкг/кг/мин, при необходимости скорость увеличивают. При недостаточном эффекте препараты можно комбинировать, прежде всего добутамин** и норэпинефрин**.
У пациентов c ИМпST и ОСН, длительно получавших до развития ИМпST бета-адреноблокаторы, и у пациентов с недостаточным выделением мочи в ответ на повторное в/в введение диуретиков в качестве альтернативы адренергическим агентам может рассматриваться левосимендан** (группа C01CX – другие кардиотонические средства). Инфузия левосимендана** начинается с нагрузочной дозы (6 мкг/кг), введенной в/в болюсом за 10 минут, с последующей в/в инфузией в дозе 0,1 мг/кг/мин и титрацией до 0,2 мг/кг/мин (до стабилизации систолического АД в течение не менее чем 3-х часов). Рекомендуемая продолжительность инфузии составляет 24 часа. У пациентов с систолическим АД < 100 мм рт. ст. и/или с диастолическим АД < 60 мм рт. ст. начальный болюс левосимендана** обычно не вводится для предотвращения гипотонии.
- Всем пациентам с ИМпST и ОСН с систолическим АД менее 90 мм рт. ст. без признаков гипоперфузии назначения инотропных препаратов не рекомендуется, так как потенциальная польза меньше потенциального риска [377-379].
ЕОК IIIC (УУР С, УДД 4)
- У пациентов с ИМпST и кардиогенным шоком для устранения гемодинамической нестабильности и поддержания кровоснабжения жизненно важных органов при артериальной гипотонии рекомендуется рассмотреть возможность назначения вазопрессоров, предпочтительного использования норэпинефрина** (внутривенная инфузия) по сравнению с допамином** в связи с меньшей частотой побочных действий эффектов норэпинефрина** [380-382].
ЕОК IIbB (УУР A, УДД 2)
- У пациентов с ИМпST и кардиогенным шоком при наличии технической возможности рекомендуется рассмотреть возможность использования внешних и внутренних устройств для поддержки кровообращения: внутриаортальная баллонная контрпульсация, устройство вспомогательного кровообращения с постоянным кровотоком левое предсердие-аорта, устройство вспомогательного кровообращения с постоянным кровотоком левый желудочек-аорта, устройство вспомогательного кровообращения с пульсирующим кровотоком левый желудочек-аорта, экстракорпоральная мембранная оксигенация (ЭКМО) [14, 383-388].
ЕОК IIaC (УУР С, УДД 5)
Комментарий: Этот подход используется как временная мера («мост») для стабилизации состояния пациентов, готовящихся к реваскуляризации, хирургическому устранению причин шока, трансплантации сердца или принятию другого промежуточного решения.
- У пациентов с ИМпST и кардиогенным шоком рекомендуется рассмотреть возможность использование баллонной внутриаортальной контрпульсации (ВАБК), если такое лечение является мостом к реваскуляризации, трансплантации сердца, установке системы длительной механической поддержки кровообращения или принятию другого промежуточного решения [14, 385-389].
ЕОК IIbC (УУР С, УДД 5)
- Рутинное применение системы ВАБК у пациентов с ИМпST и кардиогенным шоком не рекомендовано, если это лечение не является мостом к другому типу лечения ОСН и/или ее причины [14, 385, 386, 388].
ЕОК IIIC (УУР С, УДД 5)
Лечение гиповолемического кардиогенного шока
- Всем пациентам с ИМпST и подозрением на гиповолемический шок рекомендуется ЭхоКГ для выявления возможных причин гиповолемии (инфаркт правого желудочка, тампонада сердца и т.д.) и оценки функционального состояния сердца [14, 137, 230].
ЕОК IIbC (УУР С, УДД 5)
- У пациентов с ИМпST и признаками гиповолемического шока для обеспечения эффективности и безопасности лечение рекомендуется проводить под контролем показателей центральной гемодинамики, при наличии технических возможностей — с измерением давления ДЗЛК, используя катетер Сван-Ганcа (катетер балонный для легочной артерии, стандартный***) [137, 390].
ЕОК IIbC (УУР С, УДД 5)
Комментарий: При отсутствии возможности измерять ДЗЛК, возможна оценка ЦВД, но следует учитывать, что у пациентов с ИМпST показатели ЦВД могут не отражать КДД в ЛЖ.
- Пациентам с ИМпST и гиповолемическим шоком возмещение жидкости с целью нормализации АД рекомендуется начать с в/в введения 200–250 мл раствора натрия хлорида** 0,9%, который вводят за 5–10 мин. При сохранении артериальной гипотонии рекомендуется вводить раствора натрия хлорида** 0,9% повторно [137, 390].
ЕОК IIb C (УУР С, УДД 5)
Комментарий: Объем переливаемой пациенту жидкости может доходить до нескольких литров. При стабилизации АД, появлении диуреза инфузию прекращают. Если введение жидкости не дает эффекта, параллельно проводят лечение адрено- и допаминостимуляторами — допамином** или добутамином**.
2. Нарушения сердечного ритма и проводимости
2.1. Желудочковые аритмии
- У пациентов с ИМпST, осложненном гемодинамически значимой ЖТ или ФЖ, для восстановления кровообращения рекомендуется проведение немедленной наружной электрической кардиоверсии (дефибрилляции) соответственно [14, 47].
РКО IC (УУР С, УДД 5)
- У пациента с ИМпST и рецидивирующими ЖТ / ФЖ с целью устранения ишемии как возможной причины возникновения аритмий (в случае, если реваскуляризация ранее не проводилась или была неполной) рекомендуется выполнение экстренной и/или полной реваскуляризации (см. раздел Инвазивное лечение заболевания) [14, 47, 390, 391].
ЕОК IC (УУР С, УДД 5)
Комментарий: Особенно важно выполнение полной реваскуляризации при развитии ФЖ / ЖТ у пациентов с ИМпST со сниженной глобальной систолической функцией ЛЖ. В случае отсутствия эффективной сердечной деятельности КГ и ЧКВ могут проводиться на фоне механических компрессий грудной клетки при помощи специальных устройств — автоматических приспособлений для непрямого массажа сердца.
- У пациентов с ИМпST с полиморфной ЖТ или ФЖ при отсутствии противопоказаний рекомендуется внутривенное использование бета-адреноблокатора и/или амиодарона** [392-395].
ЕОК IB (УУР В, УДД 3)
Комментарий. Не рекомендуется раннее внутривенное введение бета-блокаторов при гипотензии, кардиогенном шоке, брадиаритмии, при подозрении на вовлеченность в очаг ишемии правого желудочка. Перед началом использования бета-адреноблокаторов следует оценить сократительную способность ЛЖ по ЭхоКГ; в случае сниженной сократительной способности ЛЖ целесообразно использование малых доз или отложить инициацию терапии. При выборе конкретного бета-блокатора, пути его введения и при титрации дозы рекомендуется регулярно переоценивать состояние пациента, переносимость терапии, достигнутый эффект и наличие ограничивающих факторов: ЧСС < 50 в минуту, АД < 90 мм рт. ст., величину ФВ ЛЖ по данным ЭхоКГ и др.
При увеличении продолжительности интервала QT > 500 мс введение амиодарона** (группа C01BD – антиаритмические препараты, класс III) должно быть прекращено.
- У пациентов с ИМпST с рецидивирующей ЖТ и отсутствием эффекта от терапии бета-блокаторами и амиодароном** или в случаях, когда эти препараты не могут быть назначены, рекомендуется рассмотреть внутривенное назначение лидокаина** [14, 392].
ЕОК IIbC (УУР C, УДД 5)
Комментарий: Лидокаин** – АТХ-группа Антиаритмические препараты, C01BB; класс IB.
- У пациентов с ИМпST и рецидивирующей жизнеугрожающей ЖТ при отсутствии эффекта от терапии бета-блокаторами и амиодароном** рекомендовано рассмотреть возможность седации или полной анестезии с целью снижения симпатического тонуса [14, 47].
ЕОК IIbC (УУР C, УДД 5)
Комментарий: Такой метод может рассматриваться только у отдельных пациентов, так как при использовании седации / полной анестезии могут повышаться риски воспалительных и тромботических осложнений.
- У пациентов с ИМпST при развитии ЖТ и/или ФЖ рекомендуется мониторинг, выявление и коррекция электролитных нарушений (в первую очередь, гипокалиемии и гипомагниемии) [137, 396].
РКО IIaC (УУР С, УДД 5)
Комментарий: С целью выявления электролитных нарушений проводится исследование уровня калия в крови, исследование уровня общего магния в сыворотке крови, исследование кислотно-основного состояния и газов крови.
Введение препаратов калия необходимо, если его уровень в крови менее 4 ммоль/л. Примерно у 40% больных одновременно с гипокалиемией обнаруживают также снижение концентрации магния. У этих больных особенно высок риск ФЖ. Следовательно, у больных ИМпST желательно определять уровень магния. Если концентрация магния составит менее 0,83 ммоль/л (2 мг/дл), следует провести коррекцию.
Для коррекции гипокалиемии может применяют внутривенно калия хлорид, для коррекции уровня магния применяют внутривенно магния сульфат; дозу, схему и длительность определяют индивидуально, в зависимости от концентрации электролитов в крови, показателей кислотно-щелочного баланса и клинической ситуации.
- У пациентов с ИМпST с рецидивирующей ЖТ / ФЖ и нестабильной гемодинамикой, несмотря на медикаментозную коррекцию, рекомендуется рассмотреть возможность проведения механической поддержки кровообращения – при наличии физических и технических возможностей [392].
ЕОК IIbC (УУР С, УДД 5)
- У пациента с ИМпST и рецидивирующей несмотря на реваскуляризацию и оптимальную медикаментозную терапию ЖТ и/или ФЖ рекомендуется рассмотреть выполнение в подострую стадию радиочастотной абляции аритмогенных зон с последующей имплантацией КВД [14].
ЕОК IIaC (УУР С, УДД 5)
- Пациентам, перенесшим ИМпST (не менее 6 недель назад) при наличии у них несмотря на оптимальную медикаментозную терапию (в течение 3-х месяцев или более) симптомной ХСН (II-III функциональный класс (ФК) по NYHA) и ФВ ЛЖ ≤ 35%, при ожидаемой продолжительности жизни не менее 1 года и сохранном функциональном статусе пациента рекомендуется имплантация КВД (при наличии показаний - в сочетании с ресинхронизирующей терапией) [397, 398, 522].
ЕОК IА (УУР В, УДД 1)
Комментарий: Критериев определения ожидаемой продолжительности жизни не разработано. Решение рекомендуется принимать индивидуально, с учетом особенностей каждого клинического случая. О малой ожидаемой продолжительности жизни свидетельствуют, в частности, поздние стадии злокачественного новообразования с метастазами и отсутствием эффекта от проводимого лечения, паллиативное лечение тяжелой ХСН.
- У пациентов с ИМпST с устойчивой ЖТ или ФЖ, возникшей позднее 48 часов от начала ИМпST и при отсутствии данных за сохраняющуюся ишемию миокарда рекомендуется имплантация КВД — при наличии технических возможностей [392].
ЕОК IА (УУР C, УДД 5)
- У пациентов с полиморфной ЖТ или ФЖ, возникшими позднее 48 часов от начала ИМпST, при условии неполной реваскуляризации миокарда, исходно низкой ФВ ЛЖ, рекомендуется рассмотреть возможность имплантации КВД*** или использования носимого КВД в период до 40 дней от развития ИМпST [14].
ЕОК IIbC (УУР C, УДД 5)
- У пациентов с ИМпST не рекомендуется лечение асимптомных и гемодинамически незначимых желудочковых аритмий с помощью антиаритмических препаратов [14, 392].
ЕОК IIIС (УУР С, УДД 5)
- У пациента с ИМпST не рекомендуется профилактическое назначение антиаритмических препаратов за исключением бета-адреноблокаторов [392].
ЕОК IIIB (УУР C, УДД 5)
2.2. Фибрилляция предсердий
ФП - наиболее частый тип наджелудочковой аритмии, встречающийся у пациентов с ИМпST. ФП, как правило, хорошо переносится, но у ряда пациентов на фоне тахисистолии может развиться гемодинамическая нестабильность. У гемодинамически стабильных пациентов, как правило, специфического лечения не требуется, за исключением антикоагулянтной профилактики тромбоэмболических осложнений.
- У пациентов с ИМпST и недавно возникшей ФП при гемодинамической нестабильности рекомендуется немедленное проведение наружной электрической кардиоверсии [14].
ЕОК IС (УУР С, УДД 5)
- У гемодинамически нестабильных пациентов с ИМпST и недавно возникшей ФП для поддержки наружной электрической кардиоверсии и снижения риска рецидива ФП рекомендуется использование амиодарона** в/в [14, 399, 400].
EOK IC (УУР C, УДД 5)
Комментарий: При увеличении продолжительности интервала QT > 500 мс введение амиодарона** должно быть прекращено. Введение амиодарона** у нестабильных пациентов должно проводиться под мониторным контролем параметров гемодинамики.
- У пациентов с ИМпST и тахисистолической формой ФП при наличии ОСН, но отсутствии тяжелой гипотонии рекомендуется в/в введение амиодарона** с целью контроля ЧСС [14, 401, 402].
ЕОК IС (УУР С, УДД 5)
Комментарии: При увеличении продолжительности интервала QT > 500 мс введение амиодарона** должно быть прекращено. Введение амиодарона** у нестабильных пациентов должно проводиться под мониторным контролем параметров гемодинамики.
- У пациентов с ИМпST и ФП при отсутствии ОСН и гемодинамической нестабильности (тяжелой гипотонии) рекомендуется использовать бета-адреноблокаторы в/в, если это необходимо для контроля ЧСС [14, 403].
ЕОК IC (УУР С, УДД 5)
- У пациентов с ИМпST и впервые возникшей в острой фазе заболевания ФП рекомендуется рассмотреть вопрос о назначении оральных антикоагулянтов на неопределенно долгий срок, с переоценкой всей антитромботической терапии — в зависимости от риска развития тромбоэмболических осложнений по шкале CHA2DS2-VASc и риска кровотечений по шкале HAS-BLED [14, 404-406].
ЕОК IIaC (УУР C, УДД 5)
Комментарий: Необходимость коррекции сроков двойной антитромбоцитарной терапии и монотерапии антиагрегантом в составе антитромботической терапии у пациентов с ИМпST и ФП определяется соотношением риска тромбоэмболических, ишемических и геморрагических осложнений и была обсуждена ранее в разделе «Антитромботическая терапия при других стратегиях лечения у пациентов с наличием показаний к длительному пероральному приему антикоагулянтов».
Предпочтительно использовать прямые оральные антикоагулянты (АТХ-группы Прямые ингибиторы тромбина, В01АЕ и Прямые ингибиторы фактора Ха, В01АF), если к ним нет противопоказаний.
2.3. Синусовая брадикардия, атриовентрикулярная блокада
- У пациентов с ИМпST при развитии гемодинамически значимой синусовой брадикардии или гемодинамически значимой АВ блокады (с неадекватным замещающим ритмом) для стабилизации гемодинамики рекомендуется в/в введение препаратов, оказывающих положительное хронотропное действие (эпинефрина**, атропина**) [14, 137, 407, 408].
ЕОК IC (УУР С, УДД 5)
Комментарий: При ЧСС 40 в минуту и/или паузах более 300 мс вводят атропин** 0,6-1,0 мг. Эпинефрин** – АТХ-группа Адренергические и дофаминергические средства, C01CA. При сохранении выраженной брадикардии устанавливают ЭКС***.
- У пациентов с ИМпST с гемодинамически значимой синусовой брадикардией или c гемодинамически значимой АВ блокадой (с неадекватным замещающим ритмом) при неэффективности атропина** для стабилизации состояния пациента рекомендуется временная эндокардиальная кардиостимуляция – при наличии физических и технических возможностей [14].
ЕОК IC (УУР С, УДД 5)
- У пациентов с ИМпST при развитии гемодинамически значимой синусовой брадикардии или гемодинамически значимой АВ блокады (с неадекватным замещающим ритмом), если ранее реваскуляризация не была проведена или она была неполной, рекомендуется неотложная КГ с намерением выполнения ЧКВ, в т.ч. объеме полной реваскуляризации [14].
ЕОК IC (УУР С, УДД 5)
- У пациентов с ИМпST при наличии общих для популяции показаний к имплантации постоянного ЭКС рекомендуется выполнить процедуру имплантации постоянного ЭКС в срок не ранее 5 дня от развития ИМпST [14, 409].
ЕОК IC (УУР С, УДД 5)
Комментарий: Решение вопроса об имплантации постоянного ЭКС*** следует проводить на 10-14 день от развития ИМпST. Более ранняя (начиная с 5-го дня от начала заболевания) имплантация ЭКС*** целесообразна у пациентов с гемодинамически значимой брадикардией и поздней и/или неполной реваскуляризацией при ИМпST передней локализации, при наличии бифасцикулярного блока; при наличии АВ блокады до развития ИМпST; с прогрессированием степени АВ блокады в первые сутки заболевания.
- У пациентов с ИМпST передней локализацией, с АВ блокадой высокой степени и выраженной сердечной недостаточностью при наличии технической возможности рекомендуется рассмотреть возможность раннего начала ресинхронизирующей терапии [14, 409].
ЕОК IIbC (УУР C, УДД 5)
Комментарий: Решение вопроса о начале ресинхронизирующей терапии рекомендуется принимать с учетом наличия у пациента с АВ-блокадой внутрижелудочковой блокады, её выраженности, клинической выраженности сердечной недостаточности и степени систолической дисфункции ЛЖ.
- Не рекомендуется проведение кардиостимуляции пациентам с ИМпST и АВ блокадой высокой степени в случаях, когда АВ блокада купировалась после реваскуляризации или спонтанно [409, 410, 411].
ЕОК IIIB (УУР С, УДД 5)
3. Механические осложнения
Механические осложнения ИМ: разрыв свободной стенки ЛЖ, разрыв разрыв МЖП, острая митральная регургитация вследствие ишемического повреждения структур клапанного аппарата, - являются жизнеугрожающими состояниями, которые в реперфузионную эру встречаются с частотой менее 1% случаев, чаще у пациентов с ИМпST.
Выбор оптимальной стратегии ведения пациентов с механическими осложнениями ИМ осуществляется мультидисциплинарной врачебной командой, с участием кардиолога, анестезиолога, рентгенэндоваскулярного хирурга и сердечно-сосудистого хирурга.
- У пациентов с ИМпST при наличие механических осложнений с гемодинамической нестабильностью рекомендуется использование системы ВАБК и/или других механических средств для вспомогательного кровообращения в качестве временной меры для стабилизации состояния до хирургического вмешательства [14, 412-415].
ЕОК IIaC (УУР С, УДД 5)
Разрыв свободной стенки левого желудочка
- При доказанном разрыве свободной стенки ЛЖ у пациента с ИМпST с развитием тампонады сердца или нарастанием угрозы её развития рекомендуются немедленная пункция и катетеризация перикарда (син.: перикардиоцентез) с последующим экстренным хирургическим вмешательством [14, 413, 415,523].
РКО IIaC (УУР С, УДД 5)
Разрыв межжелудочковой перегородки
- У пациентов с ИМпST при выявлении разрыва МЖП для предотвращения летального исхода рекомендуется хирургическое лечение (закрытие дефекта перегородки сердца) [14, 413, 414, 416].
РКО IIaC (УУР С, УДД 5)
Комментарий: Способ и время вмешательства зависят от характера дефекта и состояния пациента. В целом хирургическая реконструкция МЖП предпочтительна после стабилизации состояния, однако при выраженном нарушении гемодинамики операция проводится по экстренным показаниям.
Острая митральная регургитация
Острая митральная регургитация обычно развивается на 2–7 день от начала ИМпST вследствие разрыва папиллярной мышцы или хорды. Разрыв может быть полным или включать только отдельные головки мышцы. Наиболее часто происходит разрыв заднемедиальной мышцы вследствие особенностей ее кровоснабжения. В некоторых случаях выраженная митральная регургитация развивается у пациентов с ИМпST без разрыва или инфаркта сосочковой мышцы как следствие обширного поражения ЛЖ с его последующей дилатацией и расширением митрального кольца. Клинически острая митральная недостаточность проявляется ОСН, отеком легких, иногда кардиогенным шоком. Диагноз подтверждается на основании данных ЭхоКГ.
- У пациентов с ИМпST при развитии острой митральной недостаточности для устранения ОСН и предотвращения смерти рекомендуется хирургическое лечение — как правило, протезирование митрального клапана (протезирование митрального клапана в условиях искусственного кровообращения; пластика митрального клапана в условиях искусственного кровообращения; реконструкция подклапанных структур митрального клапана). Время вмешательства зависит от степени митральной регургитации и состояния пациента. В большинстве случаев операция проводится по экстренным показаниям [417-420].
ЕОК IIaC (УУР В, УДД 3)
Комментарий: Время вмешательства зависит от степени митральной регургитации и состояния пациента. В большинстве случаев операция проводится по экстренным показаниям.
- У пациентов с ИМпST при развитии острой митральной недостаточности в качестве временной меры для стабилизации состояния рекомендуется рассмотреть возможность использования системы ВАБК и/или других механических средств для вспомогательного кровообращения [14].
ЕОК IIbC (УУР С, УДД 5)
4. Перикардит
Перикардит может осложнять ранний период ИМпST (от нескольких часов до 4-х суток) и обычно быстро проходит самостоятельно (ранний постинфарктный перикардит, син.: эпистенокардитический перикардит) или развиваться в более поздний период (через 1–2 недели, иногда симптомы могут длиться несколько недель) – поздний постинфарктный перикардит, син.: синдром Дресслера. Как правило, вероятность развития перикардита находится в прямой зависимости от объема поражения миокарда и не имеет самостоятельного прогностического значения. Классический синдром Дресслера в виде развернутого полисерозита в последнее время встречается крайне редко.
Клинически перикардит проявляется распространенной, без четкой локализации болью в прекардиальной области, аускультатвино – шумом трения перикарда (выслушивается лишь у каждого третьего пациента, нередко в течение короткого времени; при накоплении экссудата в полости перикарда исчезает). На ЭКГ появляются конкордантные подъемы сегмента ST, иногда в сочетании с депрессией сегмента PQ. Перикардит может сопровождаться снижением амплитуды зубцов QRS во всех отведениях ЭКГ. Выявление жидкости в перикарде так же, как и контроль за изменением ее количества, осуществляется с помощью ЭхоКГ.
- У пациентов с ИМпST и ранним постинфарктным перикардитом с выраженными клиническими проявлениями в качестве противовоспалительной терапии рекомендуется применение #АСК** в дозе 500 мг каждые 8–12 ч [14, 421-423].
РКО IIaC (УУР С, УДД 5)
Комментарий: Длительность лечения обычно не превышает 5–7 дней. Использование других, альтернативных АСК**, нестероидных противовоспалительных средств, при постинфарктном перикардите не оправдано из-за потенциального отрицательного влияния на риск сердечных событий.
- У пациентов с ИМпST и поздним постинфарктным перикардитом с выраженными клиническими проявлениями в качестве противовоспалительной терапии рекомендуется применение #АСК** в дозе 500–1000 мг каждые 6–8 часов (максимальная суточная доза – 3000 мг) с последующим постепенным снижением дозы на 250–500 мг каждые 2 недели [14, 421].
РКО IIaC (УУР С, УДД 5)
- В качестве дополнительного средства лечения постинфарктного перикардита возможно использование #безвременника осеннего семян экстракта (колхицина) в течение 3-х месяцев в дозе 0,5 мг 2 раза в день (у пациентов с массой тела ≥ 70 кг) или 0,5 мг 1 раз в сутки (у пациентов с массой тела < 70 кг) [421].
РКО IIaC (УУР С, УДД 5)
Острая аневризма ЛЖ обычно развивается при обширном ИМпST передней стенки ЛЖ, особенно в отсутствие адекватной реперфузионной терапии. При острой аневризме ЛЖ увеличивается вероятность разрыва сердца, а также таких осложнений, как сердечная недостаточность, нарушения ритма сердца, перикардит, тромбоз полости ЛЖ, периферические тромбоэмболии.
Практически всегда при аневризме сердца не менее чем в половине случаев обширных передних ИМпST обнаруживают пристеночный тромбоз в полости ЛЖ. В популяции пациентов с распространенным передним ИМпST тромбоз ЛЖ встречается более чем в 9% случаев. Методом диагностики острой аневризмы ЛЖ и тромбоза в полости ЛЖ является ЭхоКГ.
- Пациентам с ИМпST при высокой клинической вероятности тромба в полости ЛЖ, но сомнительных результатах ЭхоКГ для подтверждения / исключения тромба в полости ЛЖ рекомендуется МРТ сердца (Магнитно-резонансная томография сердца с контрастированием) – при наличии физических и технических возможностей [60, 61].
ЕОК IIaC (УУР B, УДД 2)
- У пациентов с передним ИМпST в случаях нечеткой визуализации тромба в полости ЛЖ при рутинной трансторакальной ЭхоКГ для подтверждения / исключения тромба в полости ЛЖ рекомендуется рассмотреть возможность выполнения контрастной ЭхоКГ – при наличии физических и технических возможностей [51].
ЕОК IIbC (УУР С, УДД 4)
Комментарий: Метод контрастной ЭхоКГ в настоящее время в РФ на стадии внедрения в клиническую практику.
- При наличии тромба в полости ЛЖ у пациентов с ИМпST рекомендуется назначение оральных антикоагулянтов (антагонистов витамина К или прямых оральных антикоагулянтов (апиксабана**, дабигатрана этексилата**, ривароксабана**, эдоксабана) на 3-6 месяцев [424].
ЕОК IIaC (УУР С, УДД 5)
Комментарий: Абсолютным показанием для назначения антикоагулянтов являются следующие особенности тромба: мобильный (флотирующий) свободный участок, большие размеры (более 2–3см) и выраженная протрузия (выпячивание) тромба в полость ЛЖ, неоднородность структуры, фрагментация тромба.
Традиционной терапией внутриполостного тромба ЛЖ является терапия антагонистом витамина К под контролем МНО (целевые значения — 2,0–3,0), в период подбора дозы антагониста витамина К следует продолжать введение лечебной дозы парентерального антикоагулянта. Использование ПОАК не исключено, но пока мало изучено.
Ранняя постинфарктная стенокардия является вариантом нестабильной стенокардии и требует неотложных лечебных мероприятий. В основе ранней постинфарктной стенокардии может лежать как ретромбоз (частичный или полный) инфаркт-связанной артерии, так и стенозирующее поражение других КА. После выполнения ЧКВ причиной возобновления ангинозных приступов может быть тромбоз стента или диссекция КА. В ранние сроки после ИМ может отмечаться появление стенокардитических болей, обусловленных ишемией жизнеспособного миокарда в периинфарктной зоне (особенно если не проводилась реперфузионная терапия) или, реже, в других сосудистых бассейнах. Ишемия может быть связана с еще одной АБ, иногда расположенной в другой КА.
Следует дифференцировать раннюю постинфарктную стенокардию от болей, связанных с перикардитом.
В раннем периоде (до 28 дней включительно) ИМпST может развиться рецидив ИМ, приводящий к расширению зоны поражения. Рецидив ИМ следует исключать при повторном ангинозном приступе длительностью более 20 минут, сопровождающемся повышением уровня кардиомаркеров, изменениями ЭКГ и появлением новых зон нарушенной локальной сократимости.
- У пациентов с ИМпST при возникновении ангинозного болевого приступа длительностью более 20 минут для диагностики рецидива ИМ, рекомендуется исследование уровня сердечного тропонина I или Т с повторной оценкой через 6 часов. Повышение уровня сердечного тропонина на 20% и более от предшествующего уровня в сочетании с критериями ишемии миокарда свидетельствует о рецидиве ИМ [5, 14].
ЕОК IIaC (УУР С, УДД 5)
- Для предотвращения распространения зоны ИМ у пациентов с ИМпST и ранней постинфарктной стенокардией и/или рецидивом ИМ рекомендуется проведение КГ и, при необходимости, выполнение реваскуляризации [14].
ЕОК IIaC (УУР С, УДД 5)
5. ИМпST правого желудочка
Изолированный ИМ правого желудочка встречается редко, но его содружественное поражение при ИМпST нижней стенки ЛЖ наблюдается не менее чем у 25% пациентов. Клинически для ИМ правого желудочка характерны артериальная гипотензия, набухание вен шеи при отсутствии признаков застоя в малом круге. Гипотония при ИМ правого желудочка связана с относительной гиповолемией.
- У пациентов с ИМпST нижней локализации для исключения / выявления вовлечения в зону некроза миокарда правого желудочка рекомендуется регистрировать ЭКГ в правых прекордиальных отведениях (элевация сегмента ST ≥1 мм в отведениях V3R и V4R является признаком ИМ правого желудочка) и выполнить ЭхоКГ с целью выявления нарушения локальной сократимости правого желудочка, расширение полости правого желудочка [14, 41, 425, 426].
ЕОК IIaC (УУР С, УДД 3)
Комментарий: ЭхоКГ позволяет выявить нарушения локальной сократимости правого желудочка, расширение его полости.
- У пациентов с ИМпST с вовлечением правого желудочка для устранения гипотонии рекомендуется обеспечить увеличение объема притекающей к правым отделам сердца крови с помощью введения плазмоэкспандеров (например, раствор натрия хлорида** 0,9%). В более тяжелой ситуации рекомендуются адрено- и допаминстимуляторы (АТХ-группа Адренергические и дофаминергические средства, C01CA) [14].
ЕОК IIaC (УУР С, УДД 5)
- При ИМпST c вовлечением правого желудочка из-за угрозы усугубления относительной гиповолемии рекомендуется избегать назначения диуретиков и, особенно, периферических вазодилататоров [14].
ЕОК IIIC (УУР С, УДД 5)
6. Лечение пациентов пожилого и старческого возраста
- У пациентов пожилого и старческого возраста с ИМпST рекомендуется применять те же стратегии диагностики и лечения, что и у пациентов более молодого возраста – для улучшения их клинического состояния и прогноза [427, 428].
ЕОК IВ (УУР А, УДД 2)
Комментарий: Противопоказанием или ограничением к применению того или иного метода могут стать нарушения функции органов и систем органов, но не возраст сам по себе.
Анатомическая сложностью поражения КА у пациентов пожилого и старческого возраста, наличием возраст-ассоциированных заболеваний и гериатрических синдромов (старческой астении, падений, когнитивных нарушений недостаточности питания, полипрагмазии, снижения физического функционирования, инструментальной и базовой функциональной активности и др.) могут снизить эффективность лечения ИМпST и ухудшить прогноз таких пациентов как в период госпитализации, так и после выписки [429-432].
- С целью повышения безопасности применения антитромботических средств и препаратов вторичной профилактики у пациентов пожилого и старческого возраста с ИМпST выбор и дозы этих лекарственных средств рекомендуется адаптировать с учетом фильтрационной функции почек, сопутствующих заболеваний, наличия гериатрических синдромов (старческой астении, падений, когнитивных нарушений, полипрагмазии и др.) и конкретных противопоказаний к лекарственным средствам [206, 427, 433, 434].
ЕОК IВ (УУР А, УДД 2)
Комментарий: У пациентов пожилого и старческого возраста с ИМпST в период госпитализации целесообразно проводить оценку наличия гериатрических синдромов и осуществление профилактических мероприятий для снижения риска развития делирия, недостаточности питания, падений, а также планирование выписки, амбулаторного наблюдения, реабилитационных мероприятий с учетом функционального статуса и потребности в социальной помощи / системе долговременного ухода.
В идеале ведение пациентов пожилого и старческого возраста с ИМпST должно осуществляться мультидисциплинарной командой с участием врача-гериатра или врача-кардиолога, имеющего подготовку по гериатрии, начиная с момента нахождения в блоке интенсивной терапии [435-436].
Скрининг, профилактика и коррекция гериатрических синдромов у пациентов пожилого и старческого возраста с ИМпST осуществляются в соответствии с принципами, изложенными в клинических рекомендациях «Старческая астения», «Недостаточность питания (мальнутриция) у пациентов пожилого и старческого возраста» и других в зависимости от выявленных гериатрических синдромов [437, 438].
- С целью повышения безопасности лечения у каждого пациента с ИМпST с синдромом старческого астении и значимыми сопутствующими заболеваниями рекомендуется индивидуальный подход к выбору и объему интервенционного и фармакологического лечения с тщательной комплексной оценкой всех рисков и преимуществ [427, 428, 439].
ЕОК IВ (УУР А, УДД 1)
Медицинская реабилитация
Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
- Всем пациентам, перенесшим ИМпST, рекомендуется проведение кардиологической реабилитации (КР) для снижения риска смерти и частоты госпитализаций, улучшения прогноза, качества жизни и психосоциального статуса, повышения физической работоспособности, восстановления функций сердечно-сосудистой системы, оздоровления образа жизни, коррекции сердечно-сосудистых факторов риска и повышения приверженности лечению [440-444].
ЕОК IА (УУР А, УДД 1)
Комментарии: КР представлена трехэтапной системой, в рамках которой осуществляется маршрутизация пациента: 1-ый этап - в структурных подразделениях медицинской организации, оказывающих специализированную, в том числе высокотехнологичную, медицинскую помощь в стационарных условиях (отделении реанимации и интенсивной терапии (ОРИТ) и кардиологическом отделении, палате сосудистого центра или первичного сосудистого отделения); 2-ой этап - в стационарном отделении реабилитации; 3-ий этап – в амбулаторных условиях [445].
Ключевыми компонентами комплексной программы КР являются: физические тренировки (контролируемые, домашние), образовательная программа (информирование и обучение в «Школе для пациентов, перенесших ОКС»), модификация основных факторов риска (курения, нездорового питания, дислипидемии, АГ, избыточной массы тела / ожирения, гиподинамии, гипергликемии при СД), психологическая поддержка, мероприятия по повышению приверженности пациентов, сочетающиеся с назначением медикаментозной терапии в соответствии с клиническими рекомендациями.
Программа КР должна начинаться как можно раньше после стабилизации клинического состояния пациента, проводиться в плановом порядке, основываться на пациент-ориентированном подходе с учетом медицинских показаний и противопоказаний к проведению отдельных компонентов программы. Всех амбулаторных пациентов, перенесших ОКС и ранее не участвовавших в программах КР, рекомендуется направлять на КР независимо от сроков заболевания [445].
Исключение составляют пациенты с установленным диагнозом деменции.
Рекомендуемая общая продолжительность кардиореабилитационной программы на трех этапах составляет не менее 24 недель. Большая длительность программы КР (на амбулаторном этапе) повышает ее эффективность.
- У всех пациентов, перенесших ИМпST, амбулаторный этап КР рекомендуется проводить в очном, дистанционном (в домашних условиях с использованием инструментов цифрового и мобильного здравоохранения) или смешанном форматах для увеличения охвата пациентов реабилитацией и повышения их приверженности КР и лечению в целом [446-450].
ЕОК IIb В (УУР С, УДД 2)
- Для реализации программы КР у пациентов, перенесших ИМпST, рекомендуется формировать мультидисциплинарную реабилитационную команду на всех этапах с целью оценки клинико-функционального состояния пациента, определения и проведения комплекса реабилитационных мероприятий [440, 445, 451-452].
EOK IA (УУР А, УДД 1)
Комментарии: В состав мультидисциплинарной реабилитационной команды должны входить: врач-кардиолог, врач по физической и реабилитационной медицине, специалист по физической реабилитации (инструктор-методист по лечебной физической культуре), медицинский психолог и/или врач-психотерапевт, врач-диетолог, медицинская сестра по медицинской реабилитации (инструктор по лечебной физической культуре) и другие специалисты по требованию. Для оценки клинического статуса пациента, уровня его функционирования и жизнедеятельности, влияния личностных факторов и факторов окружающей среды рекомендуется использовать стандартизованные и валидные методы диагностики, а также инструменты оценки по Международной Классификации Функционирования, ограничений жизнедеятельности и здоровья (МКФ) [453, 454].
- Всем пациентам после ИМпST рекомендуется проведение теста с дозированной физической нагрузкой (теста с физической нагрузкой с использованием эргометра или тредмила) или кардиопульмонального тестирования (количественной оценки потребления кислорода в условиях эргоспирометрии) — при наличии возможности и достаточном опыте его проведения в учреждении), а при их недоступности (или противопоказаниях) – теста с 6-минутной ходьбой с целью оценки функционального статуса, толерантности к физической нагрузке, выбора оптимального режима физических тренировок, контроля их эффективности и безопасности [455, 456].
ЕОК IА (УРР C УДД 5)
Комментарий: Нагрузочное тестирование проводится перед началом программы физических тренировок и после завершения этапа КР.
- Всем пациентам, перенесшим ИМпST, рекомендуются аэробные физические тренировки (лечебная физкультура с использованием тренажеров при заболеваниях сердца и перикарда; индивидуальные занятия лечебной физкультурой при заболеваниях сердца и перикарда; групповые занятия лечебной физкультурой при заболеваниях сердца и перикарда; лечебная физкультура с биологической обратной связью при заболеваниях сердца и перикарда) умеренной интенсивности с целью улучшения функционального статуса, уменьшения симптоматики, повышения физической работоспособности, улучшения качества жизни, снижения риска сердечно-сосудистых осложнений, частоты госпитализаций и смертности [440, 444, 452, 457-459].
ЕОК IА (УУР А, УДД 1)
Комментарий. У пациентов, перенесших ИМпST, рекомендуется перед назначением физических тренировок исключить противопоказания к ним (см. Приложение А3. Основные противопоказания к проведению физических тренировок) [456, 460].
На раннем 1-ом этапе КР рекомендуется поэтапное расширение двигательной активности и использование комплексов физических упражнений. На более поздних (2-ом и 3-ем) этапах в программу КР рекомендуется включать физические тренировки в индивидуальном формате и/или в организованных группах в лечебном учреждении и/или в домашних условиях после обучения [461].
Рекомендуемая длительность физической тренировки динамического характера (например, на велотренажере или тредмиле) составляет не менее 30 минут (общая продолжительность тренировочного занятия 45-60 минут) при частоте занятий не менее 3-х раз в неделю (оптимально – 5-6 раз в неделю); интенсивность тренирующей нагрузки умеренная (55-69% от максимальной ЧСС при нагрузочном тестировании или в зоне 12-14/20 баллов по шкале Борга; Borg Rating of Perceived Exertion, Borg RPE), уровень тренирующей нагрузки в течение всей основной фазы тренировки постоянный [440, 458, 460, 462, 463].
Для очень детренированных пациентов и пациентов с сердечной недостаточностью на старте программы могут рекомендоваться интервальные тренировки низкой интенсивности.
Для безопасности физической реабилитации рекомендуется осуществлять мониторинг состояния пациента (жалоб, клинических симптомов, уровня АД, ЧСС и ЭКГ), оценивать уровень физического напряжения по шкале Борга в процессе тренировки [463].
Пациентам, перенесшим ИМпST, после окончания программ КР рекомендуется поддерживать физическую активность на уровне умеренной интенсивности не менее 150 минут в недели или высокой интенсивности не менее 75 минут в неделю. Если больной не способен поддерживать рекомендуемый уровень повседневной физической активности, то этот уровень должен находиться в пределах физических возможностей пациента и соответствовать его клиническому состоянию.
- У отдельных пациентов, перенесших ИМпST, с низким риском осложнений (включая атеротромботический и ишемический риски) и при их желании рекомендуется рассмотреть проведение высокоинтенсивных интервальных тренировок с целью повышения физической работоспособности и улучшения качества жизни [464-466].
ЕОК IIb С (УУР A, УДД 1)
Комментарий: Назначение высокоинтенсивных интервальных тренировок рекомендуется рассматривать только на 3-ем этапе КР при отсутствии противопоказаний, после оценки всех возможных рисков и безопасности данного физического воздействия.
- Пациентам, перенесшим ИМпST, рекомендуется проводить оценку психосоциального статуса посредством стандартизованных опросников или клинического интервью с целью идентификации возможных барьеров для изменения образа жизни и приверженности лечению, индивидуализации программы КР и повышения ее эффективности, оказания своевременной психологической поддержки, улучшения качества жизни и снижения сердечно-сосудистых осложнений [467-469].
ЕОК IВ (УУР C, УДД 5)
Комментарий: При наличии клинически выраженной тревожной и/или депрессивной симптоматики рекомендуется психологическое консультирование и поддержка, назначение психофармакотерапии (по показаниям), что в сочетании со структурированным обучением, физическими тренировками может уменьшать симптомы депрессии, улучшать социальное функционирование, когнитивный профиль и качества жизни пациента [169, 170, 468, 470, 471].
- Всем пациентам, перенесшим ИМпST, рекомендуется проведение образовательной программы в любом доступном формате (индивидуально и/или в группах – «Школе для пациентов, перенесших ОКС» в очном или онлайн режимах) с целью повышения их информированности о заболевании, его факторах риска и профилактики; оздоровления образа жизни, обучения методам самоконтроля и самопомощи, повышения приверженности лечебно-реабилитационным вмешательствам [472, 473].
ЕОК IA (УУР C, УДД 5)
Комментарий: Рекомендуется провести не менее 6-10 занятий; при увеличении количества занятий эффективность обучающей программы повышается (эти занятия могут проводиться в формате дистанционной поддержки).
Госпитализация
Организация оказания медицинской помощи
Показания для госпитализации
Любое подозрение на ИМпST является показанием для экстренной госпитализации.
Пациенты c ИМпST должны госпитализироваться в региональные сосудистые центры для пациентов с ОКС, в кардиологические отделения с палатой реанимации и интенсивной терапии для пациентов с ОКС (первичные сосудистые отделения). Поскольку многим пациентам с подозрением на ОКС может потребоваться углубленная дифференциальная диагностика, их оптимально госпитализировать в многопрофильный стационар с возможностью экстренной диагностики и лечения острой коронарной и иной патологии. Маршрутизация пациентов должна быть организована так, чтобы все они госпитализировались или как можно быстрее переводились в стационар с возможностью инвазивного лечения ОКС.
- На догоспитальном этапе не рекомендуется проведение инструментальных / лабораторных диагностических мероприятий, за исключением ЭКГ, направленных на подтверждение или исключение диагноза ОКСпST / ИМпST [498-499].
ЕОК IC (УУР С, УДД 5)
Комментарий: На догоспитальном этапе для принятия решения о дальнейшем ведении пациента с подозрением на ИМпST достаточно регистрации ЭКГ. Определять уровень маркеров повреждения миокарда нецелесообразно. В случае оказания помощи на догоспитальном этапе фельдшерской бригадой обязательна передача ЭКГ по каналам связи в специализированный телемедицинский центр сердечно-сосудистых рисков с целью согласования ведения и маршрутизации пациента.
- При подозрении на ИМпST пациента, госпитализированного в стационар, не располагающий возможностями для экстренной реваскуляризации, рекомендуется своевременно перевести в лечебное учреждение, где реализуется программа реваскуляризации при ОКС [14].
ЕОК IC (УУР С, УДД 5)
- В каждом регионе рекомендуется разработать региональный протокол маршрутизации пациентов с ОКСпST / ИМпST с учетом действующих рекомендаций и особенностей региона [14].
ЕОК IC (УУР С, УДД 5)
- В каждом регионе рекомендуется выделить специализированное кардиохирургическое отделение для проведения экстренных операций КШ у пациентов с ОКС, а также разработать региональные правила экстренного перевода таких пациентов [14].
ЕОК IC (УУР С, УДД 5)
Показания к выписке пациента из стационара
Продолжительность госпитализации определяется индивидуально в соответствии с сердечным риском пациента, сопутствующими заболеваниями, функциональным статусом и социальной поддержкой. В то же время пациенты не должны находиться в больнице дольше необходимого по психосоциальным причинам и с целью предупреждения внутригоспитальных инфекций.
После исключения диагноза ИМпST (например, после серийного определения динамики уровня тропонинов крови, возможно дополненного другими инструментальными методами) пациента можно перевести в профильное отделение (при наличии показаний для госпитализации) или выписать.
Пациентов рекомендуется выписывать при условии клинической стабилизации, завершения стратификации риска неблагоприятного исхода (в т.ч. проведения неинвазивных стресс-тестов у пациентов с ИМпST в случаях, когда это показано) и реализации выбранной стратегии лечения.
Безопасность ранней выписки (48–96 часов) после первичного ЧКВ определяется в первую очередь отсутствием ранних осложнений, таких как рецидив ишемии, тромбоз стента, ОСН, наджелудочковые и желудочковые аритмии, нарушения проводимости, разрыв МЖП или свободной стенки ЛЖ, острая митральная недостаточность, перикардит, тромб ЛЖ с угрозой системной эмболии.
Выполненное ЧКВ и агрессивная антитромботическая терапия могут служить причиной развития кровотечений, как связанных с местом доступа, так и других, в первую очередь желудочно-кишечных и церебральных, а также контраст-индуцированного острого почечного повреждения. Рецидив ИМ в послеоперационном периоде может быть связан либо с тромбозом стента, либо с критическим стенозом или разрывом нестабильной бляшки в изначально не симптом-связанном сегменте КА.
В качестве инструмента стратификации риска ранней выписки может быть использована шкала Zwolle, основанная на шести клинических и ангиографических признаках — возраст пациента, класс сердечной недостаточности по Killip, локализация ИМ (передний или другой локализации), время до реперфузии, наличие трехсосудистого поражения, кровоток в инфаркт связанной артерии по TIMI (Приложение Г2). Показано, что данные факторы являются независимыми предикторами 30-дневной смертности. Пациенты с ≤3 баллами по шкале Zwolle имеют 0,5% риск 30-дневной смертности и могут быть безопасно выписаны из стационара в первые 72 часа. Валидность шкалы Zwolle была показана в целом ряде исследований [70, 71, 500-502].
- Ранняя выписка пациентов с ИМпST низкого риска после первичного ЧКВ рекомендована у отдельных пациентов, если организованы ранняя реабилитация и адекватное наблюдение [502-503].
ЕОК IB (УУР A, УДД 2)
Комментарий: В случае ранней выписки за время госпитализации пациент должен начать реабилитацию, получить подробную информацию о случившемся, а также о предстоящей модификации образа жизни. Кроме того, должна быть инициирована медикаментозная терапия в рамках вторичной профилактики (оптимальная антитромбоцитарная терапия, бета-блокатор, блокатор(-ы) ренин-ангиотензин-альдостероновой системы, ингибитор ГМГ-КоА-редуктазы).
Иные организационные технологии
Иные организационные технологии
При подозрении на ИМпST рекомендуется интенсивное наблюдение за пациентами в блоке (палате) интенсивной терапии с дистанционным наблюдением за электрокардиографическими данными (мониторированием ЭКГ) для контроля ритма сердца, пока не будет подтверждено или отвергнуто наличие ИМпST, определен риск неблагоприятного исхода, выбрана стратегия ведения пациента и исключены другие угрожающие жизни заболевания и осложнения.
При неосложненном ИМпST у пациентов, не имеющих признаков, указывающих на повышенный риск возникновения жизнеугрожающих аритмий, рекомендуется интенсивное наблюдение в блоке (палате) интенсивной терапии с дистанционным наблюдением за электрокардиографическими данными (мониторированием ЭКГ) для контроля ритма сердца продолжительностью до 24 часов или до успешного ЧКВ, если оно было выполнено в первые сутки после госпитализации. В остальных случаях интенсивное наблюдение с дистанционным наблюдением за электрокардиографическими данными (мониторированием ЭКГ) для контроля ритма сердца рекомендуется продлить до клинической стабилизации.
Дистанционное наблюдение за электрокардиографическими данными (мониторированием ЭКГ) для контроля ритма сердца рекомендуется продлить более 24 часов при повышенном риске возникновения жизнеугрожающих аритмий (нестабильность гемодинамики, имевшиеся серьезные аритмии, ФВ ЛЖ ≤ 40%, безуспешные попытки реперфузионного лечения, сохраняющиеся критические стенозы в крупных КА, осложнения при ЧКВ). У пациентов, не имеющих признаков продолжающейся ишемии миокарда, продление дистанционного наблюдения за электрокардиографическими данными (мониторирования ЭКГ) для контроля ритма сердца возможно при подозрении на спазм КА, а также при наличии симптомов, не позволяющих исключить аритмию.
Перед выпиской всем пациентам следует оценить риск неблагоприятных событий в отдаленном периоде, учитывающий ФВ ЛЖ, тяжесть поражения КА и полноту коронарной реваскуляризации, наличие резидуальной ишемии, осложнения, отмеченные во время госпитализации, и уровни метаболических маркеров, определенных за время пребывания в стационаре: (исследования уровня ХС крови, уровня ХС ЛНП, уровня ХС ЛВП и триглицеридов, уровня глюкозы в крови натощак, а также показатели фильтрационной функции почек: уровня креатинина в крови, с расчетом скорости клубочковой фильтрации, а в случае назначения прямых оральных антикоагулянтов еще клиренса креатинина (КлКр).
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Профилактика
Помимо продолжения медикаментозной терапии, начатой в ранние сроки лечения ИМпST (раздел 3.2), рекомендуются вмешательства по контролю сердечно-сосудистых факторов риска и по предупреждению внезапной сердечной смерти (раздел 3.3.2).
- Для снижения риска сердечно-сосудистых событий среди пациентов, перенесших ИМпST, рекомендуются выявление курильщиков и регулярные вмешательства, направленные на полный отказ от курения, включая отказ от пассивного курения [474-476].
ЕОК IIaA (УУР А, УДД 1)
Комментарий: Мероприятия по отказу от курения рекомендуется начинать на госпитальном этапе и продолжить после выписки. Рекомендуются поведенческие и фармакологические вмешательства (никотинзаместительная терапия, варениклин или бупропион).
- Для снижения риска неблагоприятных исходов пациентам, перенесшим ИМпST, рекомендуется придерживаться принципов здорового питания, поддерживать нормальную массу тела, выполнять регулярные физические упражнения и ограничить прием алкоголя [477-481].
ЕОК IВ (УУР B, УДД 2)
Комментарий: Ключевые характеристики здорового питания: ограничение потребления насыщенных жиров и транс-изомеров жирных кислот до < 10% и < 1% от общей калорийности суточного рациона, соответственно; поваренной соли до 5 г в сутки; легкоусваиваемых углеводов; потребление большого количества фруктов (≥ 250 г в сутки), овощей (≥ 250 г в сутки) и цельнозерновых продуктов. Рекомендуется потребление рыбы 1–2 раза в неделю (хотя бы 1 раз в неделю – жирной рыбы), а также молочных продуктов с низкой жирностью, постного мяса и птицы, бобовых и несоленых орехов в количестве 30 г в день.
Суточное потребление алкоголя не должно превышать 1 стандартную дозу у женщин и 1–2 стандартных дозы у мужчин (1 стандартная доза – 40 мл крепких спиртных напитков или 120 мл сухого вина или 330 мл пива).
Целевые значения индекса массы тела составляют 20–25 кг/м2, окружности талии — менее 80 см для женщин и менее 94 см для мужчин.
- У пациентов, перенесших ИМпST, для снижения риска ишемических событий и смерти рекомендуется контроль АД и поддержание его на целевом уровне [281, 482-486].
ЕОК IA (УУР А, УДД 1)
Комментарий: Целевой уровень АД у пациентов после ИМпST — ниже 140/90 мм рт. ст. При хорошей переносимости следует рассмотреть снижение АД до 130/80 мм рт. ст. и ниже. Для контроля АД у пациентов после ИМпST предпочтительны бета-адреноблокаторы и иАПФ.
- У пациентов с СД, перенесших ИМпST, рекомендуется проводить лечение, направленное на поддержание выбранного совместно с врачом-эндокринологом индивидуального целевого уровня гликированного гемоглобина (у большинства пациентов – ниже 7,0%) для снижения риска микро- и макрососудистых осложнений СД [487,488].
ЕОК IIaB (УУР B, УДД 2)
Комментарий: У пациентов c СД 2 типа, перспективно использование аналогов глюкагоноподобного пептида-1 (GLP-1) и ингибиторов натрийзависимого переносчика глюкозы 2 типа, способствующих снижению частоты сердечно-сосудистых осложнений у пациентов с атеросклеротическими сердечно-сосудистыми заболеваниями.
- Пациентам, перенесшим ИМпST, для снижения риска сердечно-сосудистых осложнений и смерти рекомендуется ежегодная вакцинация против гриппа [489-491].
ЕОК IА (УУР А, УДД 2)
- При недостаточном контроле факторов риска или возникновении сердечно-сосудистых осложнений на фоне оптимальной медикаментозной терапии у пациентов, перенесших ИМпST, рекомендуется рассмотреть возможность применения низких доз (0,5 мг/день) #безвременника осеннего семян экстракта (колхицина) [492, 493].
ЕОК IIbA (УУР А, УДД 2)
- У пациентов, перенесших ИМпST, рекомендуется использовать фиксированные комбинации препаратов для увеличения приверженности к лечению и уменьшения риска неблагоприятных исходов [494, 495].
ЕОК IIaB (УУР B, УДД 2)
Диспансерное наблюдение
При выписке из стационара пациента, перенесшего ИМпST, ему необходимо дать информацию о его состоянии в устной и письменной форме [496, 497].
ЕОК IIaB (УУР В, УДД 3)
- Рекомендуется диспансерное наблюдение за всеми пациентами, перенесшими ИМпST, после их выписки из стационара для реализации комплекса мер по профилактике и лечению сердечно-сосудистых осложнений, своевременной коррекции терапии и повышения приверженности к лечению [14, 504, 505].
ЕОК IC (УУР C, УДД 5)
- Рекомендуется, чтобы диспансерное наблюдение за всеми пациентами в первые 12 месяцев после ИМпST осуществлялось врачом-кардиологом для реализации комплекса мер по профилактике и лечению сердечно-сосудистых осложнений, своевременной коррекции терапии и повышения приверженности к лечению. Минимальная периодичность диспансерных приемов составляет 2 раза в год; при осложненном течении заболевания, а также при необходимости титрования доз лекарственных средств (гиполипидемических, бета-адреноблокаторов, блокаторов ренин-ангиотензин-альдостероновой системы, антагонистов витамина К и других) частоту диспансерных приемов рекомендуется определять в соответствии с клинической необходимостью [505].
ЕОК IC (УУР C, УДД 5)
Комментарии: В соответствии с Приказом Министерства здравоохранения Российской Федерации от 15 марта 2022 г. №168н "Об утверждении порядка проведения диспансерного наблюдения за взрослыми", диспансерное наблюдение пациентов, в первые 12 месяцев после ИМ, ЧКВ или КШ осуществляется врачом-кардиологом.
В соответствии с Приказом Министерства здравоохранения Российской Федерации от 15 марта 2022 г. №168н "Об утверждении порядка проведения диспансерного наблюдения за взрослыми" cпустя 12 месяцев пожизненное диспансерное наблюдение осуществляется врачом-терапевтом участковым (семейным врачом), прием (осмотр, консультация) врача-кардиолога осуществляется по медицинским показаниям при направлении врача-терапевта участкового (семейного врача).
Продолжение диспансерного наблюдения врачом-кардиологом предписывается при стенокардии напряжения III-IV ФК, неэффективности медикаментозной терапии (рефрактерные симптомы, недостижение целевых уровней АД, ЧСС, ХС ЛНП), наличии сердечной недостаточности, жизнеугрожающих нарушений ритма, СД, ХБП С4 и C5 стадий, комбинированной антитромботической терапии, симптомном заболевании периферических артерий, атеросклерозе другого сосудистого бассейна при назначении двойной антиагрегантной или комбинированной антитромботической терапии.
На визитах рекомендуется измерять АД, ЧСС, определять массу тела (с расчетом индекса массы тела), измерять окружность талии, оценивать статус курения [505].
- У пациентов, перенесших ИМпST и, для оценки нарушений липидного обмена и контроля эффективности гиполипидемической терапии рекомендуется выполнять анализ крови для оценки нарушений липидного обмена биохимический (как минимум исследование уровня ХС ЛНП) с периодичностью не реже 2 раз в год [505].
ЕОК IC (УУР C, УДД 5)
Комментарии: При подборе гиполипидемической терапии уровень ХС ЛНП рекомендуется оценивать каждые 4–6 недель, пока не будут достигнуты целевые значения показателя (<1,4 ммоль/л со снижения как минимум на 50% от исходных значений).
- У пациентов, перенесших ИМпST, рекомендуются выполнять общий (клинический) анализ крови и биохимический общетерапевтический анализы крови (с расчетом рСКФ) с периодичностью не реже 1 раза в год для контроля безопасности лечения и своевременной коррекции терапии [505].
ЕОК IC (УУР C, УДД 5)
Комментарии: Общий (клинический) и/или биохимический общетерапевтический анализы крови могут выполняться чаще в соответствии с клинической необходимостью.
При применении прямых оральных антикоагулянтов рекомендуется определение КлКр.
- У пациентов, перенесших ИМпST, принимающих антагонисты витамина К, рекомендуются определение МНО с периодичностью не реже 2 раз в год, для контроля эффективности и безопасности лечения, а также подбора доза препарата [505].
ЕОК IC (УУР C, УДД 5)
Комментарии: У большинства пациентов, принимающих антагонисты витамина К, рекомендуется определение МНО 1 раз в месяц; в период подбора дозы антагонистов витамина К или при меняющихся значениях МНО возможны более частые определения МНО.
- У пациентов, перенесших ИМпST, рекомендуются регистрация ЭКГ с периодичностью не реже 1 раза в год для выявления признаков прогрессирования заболевания, нарушений сердечного ритма и проводимости, а также своевременной коррекции терапии [505].
ЕОК IC (УУР C, УДД 5)
Комментарии: ЭКГ может регистрироваться чаще в соответствии с клинической необходимостью.
- У пациентов, перенесших ИМпST, рекомендуются обзорная рентгенография органов грудной клетки с периодичностью не реже 1 раза в год для выявления признаков застоя в малом круге кровообращения [505].
ЕОК IC (УУР C, УДД 5)
- У пациентов, перенесших ИМпST, рекомендуются ЭхоКГ с обязательной оценкой ФВ ЛЖ с периодичностью не реже 1 раза в год для контроля динамики изменений, связанных с перенесенным ОКС, выявления новых патологических изменений и своевременной коррекции терапии [505].
ЕОК IC (УУР C, УДД 5)
Комментарии: ЭхоКГ может выполняться чаще в соответствии с клинической необходимостью.
- У пациентов, перенесших ИМпST, перенесших ЧКВ или КШ, рекомендуются выполнение неинвазивного стресс-теста (см. Термины и определения) с периодичностью не реже 1 раза в 2 года для выявления ишемии миокарда и/или оценки ее выраженности [505].
Комментарии: Неинвазивные стресс-тесты могут выполняться у всех пациентов, перенесших ИМпST, в соответствии с клинической необходимостью.
ЕОК IC (УУР C, УДД 5)
Информация
Источники и литература
-
Клинические рекомендации Ассоциации сердечно-сосудистых хирургов России
- Клинические рекомендации Ассоциации сердечно-сосудистых хирургов России - 1. Федеральный закон от 21.11.2011 N 323-ФЗ (ред. от 24.07.2023) "Об основах охраны здоровья граждан в Российской Федерации" (с изм. и доп., вступ. в силу с 01.09.2023). 2. Федеральное агентство по техническому регулированию и метрологии. Национальный стандарт Российской Федерации. ГОСТ Р 52379-2005. Надлежащая клиническая практика. Москва, 2005. 3. Федеральный закон от 12.04.2010 № 61-ФЗ (ред. от 03.07.2016) «Об обращении лекарственных средств». 4. Андреева Н. С., Реброва О.Ю., Зорин Н.А. и др. Системы оценки достоверности научных доказательств и убедительности рекомендаций: сравнительная характеристика и перспективы унификации. Медицинские технологии. Оценка и выбор. 2012;4:10–24. 5. Thygesen K, Alpert JS, Jaffe AS, Chaitman BR, Bax JJ, Morrow DA, White HD; ЕОК Scientific Document Group. Fourth universal definition of myocardial infarction (2018). Eur Heart J 2019; 40: 237–269. 6. Muthiah Vaduganathan, George A Mensah, Justine Varieur Turco, Valentin Fuster, Gregory A Rot The Global Burden of Cardiovascular Diseases and Risk: A Compass for Future Health. 7. Данные Росстата на 2022 год. https://rosstat.gov.ru/folder/12781 8. McManus DD, Gore J, Yarzebski J, Spencer F, Lessard D, Goldberg RJ. Recent trends in the incidence, treatment, and outcomes of patients with STEMI and NSTEMI. Am J Med 2011;124(1):40–47. 9. Статистические данные находятся в печати (журнал «Кардиология», 2024). 10. Tomas Jernberg, Pål Hasvold, Martin Henriksson, Hans Hjelm, Marcus Thuresson, Magnus Janzon. Cardiovascular risk in post-myocardial infarction patients: nationwide real world data demonstrate the importance of a long-term perspective. Eur Heart J. 2015 May 14;36(19):1163-70. doi: 10.1093/eurheartj/ehu505. Epub 2015 Jan 13. 11. Jernberg T, Hasvold P, Henriksson M, Hjelm H, Thuresson M, Janzon M. Eur Heart J. 2015;36(19):1163-1170. doi:10.1093/eurheartj/ehu505 12. Pasupathy S, Air T, Dreyer RP, Tavella R, Beltrame JF. Systematic review of patients presenting with suspected myocardial infarction and nonobstructive coronary arteries. Circulation. 2015;131:861–870. 13. Niccoli G, Scalone G, Crea F. Acute myocardial infarction with no obstructive coronary atherosclerosis: mechanisms and management. Eur Heart J 2015; 36: 475–481. 14. Byrne RA, Rossello X, Coughlan JJ, Barbato E, Berry C, Chieffo A, Claeys MJ, Dan GA, Dweck MR, Galbraith M, Gilard M, Hinterbuchner L, Jankowska EA, Jüni P, Kimura T, Kunadian V, Leosdottir M, Lorusso R, Pedretti RFE, Rigopoulos AG, Rubini Gimenez M, Thiele H, Vranckx P, Wassmann S, Wenger NK, Ibanez B; ESC Scientific Document Group. 2023 ESC Guidelines for the management of acute coronary syndromes. Eur Heart J. 2023 Oct 12;44(38):3720-3826. doi: 10.1093/eurheartj/ehad191. 15. Neumann J.T., Twerenbold R., Ojeda F., Sörensen N.A., Chapman A.R., Shah A.S.V., et al. Application of High-Sensitivity Troponin in Suspected Myocardial Infarction. N Engl J Med 2019; 380: 2529-2540. 16. Pickering JW, Than MP, Cullen L, Aldous S, Ter Avest E, Body R, Carlton EW, Collinson P, Dupuy AM, Ekelund U, Eggers KM, Florkowski CM, Freund Y, George P, Goodacre S, Greenslade JH, Jaffe AS, Lord SJ, Mokhtari A, Mueller C, Munro A, Mustapha S, Parsonage W, Peacock WF, Pemberton C, Richards AM, Sanchis J, Staub LP, Troughton R, Twerenbold R, Wildi K, Young J. Rapid Rule-out of Acute Myocardial Infarction With a Single High-Sensitivity Cardiac Troponin T Measurement Below the Limit of Detection: A Collaborative Meta-analysis. Ann Intern Med 2017; 166: 715-3724. 17. Twerenbold R, Boeddinghaus J, Nestelberger T, Wildi K, Rubini Gimenez M, Badertscher P, et al. Clinical use of high-sensitivity cardiac troponin in patients with suspected myocardial infarction. J Am Coll Cardiol 2017;70:996–1012. https://doi.org/10. 1016/j.jacc.2017.07.718. 18. Camaro C, Aarts, GWA, Abang EMM et al. Rule-out of non-ST-segment elevation acute coronary syndrome by a single, pre-hospital troponin measurement: a randomized trial // European Heart Journal, Volume 44, Issue 19, 14 May 2023, Pages 1705–1714, https://doi.org/10.1093/eurheartj/ehad056. 19. Ghaffari S, Pourafkari L, Sepehrvand N, Aslanabadi N, Faridi L, Tajlil A, Masoumi N, Nader N. Red Cell Distribution Width Is a Predictor of ST Resolution and Clinical Outcome Following Thrombolysis in Acute ST Elevation Myocardial Infarction. Thromb Res. 2016 Apr;140:1-6 20. Gore JM, Spencer FA, Gurfinkel EP, López-Sendón J, Steg PG, Granger CB, et al. Thrombocytopenia in patients with an acute coronary syndrome (from the Global Registry of Acute Coronary Events [GRACE]). Am J Cardiol 2009;103:175–180. https://doi.org/10.1016/j.amjcard.2008.08.055 21. Long M, Ye Z, Zheng J, Chen W, Li L. Dual anti-platelet therapy following percutaneous coronary intervention in a population of patients with thrombocytopenia at baseline: a meta-analysis. BMC Pharmacol Toxicol 2020;21:31. https://doi.org/10.1186/ s40360-020-00409-2 22. Mathews R, Peterson E, Chen AY, et al. In-Hospital Major Bleeding During ST-Elevation and Non–STElevation Myocardial Infarction Care: Derivation and Validation of a Model from the ACTION Registry®-GWTG™. Am J Cardiol 2011; 107: 1136–1143. 23. D"Ascenzo F, Biondi-Zoccai G, Moretti C, Bollati M, Omede P et al: TIMI, GRACE and alternative risk scores in acute coronary syndromes: a meta-analysis of 40 derivation studies on 216,552 patients and of 42 validation studies on 31,625 patients. Contemporary clinical trials. 2012;33:507–514. 24. McNamara RL, Kennedy KF, Cohen DJ, et al. Predicting In-Hospital Mortality in Patients With Acute Myocardial Infarction. JACC 2016; 68: 626-635. 25. Bartnik M, Malmberg K, Norhammar A, Tenerz A, Ohrvik J, Ryden L. Newly detected abnormal glucose tolerance: an important predictor of long-term outcome after myocardial infarction. Eur Heart J 2004;25:1990–1997. 26. Ferrannini G, De Bacquer D, De Backer G, Kotseva K, Mellbin L, Wood D, et al. Screening for glucose perturbations and risk factor management in dysglycemic patients with coronary artery disease–a persistent challenge in need of substantial improvement: a report from ESC EORP EUROASPIRE V. Diabetes Care 2020;43: 726–733. https://doi.org/10.2337/dc19-2165 27. Ritsinger V, Tanoglidi E, Malmberg K, Näsman P, Rydén L, Tenerz Å, et al. Sustained prognostic implications of newly detected glucose abnormalities in patients with acute myocardial infarction: long-term follow-up of the Glucose Tolerance in Patients with Acute Myocardial Infarction cohort. Diab Vasc Dis Res 2015;12:23–32. https://doi.org/ 10.1177/1479164114551746 28. Svensson AM, McGuire DK, Abrahamsson P, Dellborg M. Association between hyperand hypoglycaemia and 2 year all-cause mortality risk in diabetic patients with acute coronary events. Eur Heart J 2005;26:1255–1261. https://doi.org/10.1093/eurheartj/ ehi230 29. Pinto DS, Skolnick AH, Kirtane AJ, Murphy SA, Barron HV, Giugliano RP, et al. U-shaped relationship of blood glucose with adverse outcomes among patients with ST-segment elevation myocardial infarction. J Am Coll Cardiol 2005;46:178–180. https://doi.org/10.1016/j.jacc.2005.03.052 30. Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023;44(39):4043-4140. doi:10.1093/eurheartj/ehad192 31. Mach F, Baigent C, Catapano AL, Koskinas KC, Casula M, Badimon L, et al. 2019 ESC/ EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J 2020;41:111–188. https://doi.org/10.1093/eurheartj/ ehz455 32. Ference BA, Ginsberg HN, Graham I, Ray KK, Packard CJ, Bruckert E, et al. Low-density lipoproteins cause atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement from the European Atherosclerosis Society Consensus Panel. Eur Heart J 2017;38: 2459–2472. https://doi.org/10.1093/eurheartj/ehx144 33. Sidhu D, Naugler C. Fasting time and lipid levels in a community-based population: a cross-sectional study. Arch Intern Med 2012;172(22):1707–1710. 34. Goyal A, Spertus JA, Gosch K, Venkitachalam L, Jones PG, Van den Berghe G, Kosiborod M. Serum potassium levels and mortality in acute myocardial infarction. JAMA 2012; 307: 157–164. 35. Diercks DB, Peacock WF, Hiestand BC, Chen AY, Pollack CV, Kirk JD, et al. Frequency and consequences of recording an electrocardiogram >10 minutes after arrival in an emergency room in non-ST-segment elevation acute coronary syndromes (from the CRUSADE Initiative). Am J Cardiol 2006;97:437–442. https://doi.org/10.1016/j.amjcard.2005.09.073 36. Schmitt C, Lehmann G, Schmieder S, Karch M, Neumann F-J, Scho¨mig A. Diagnosis of acute myocardial infarction in angiographically documented occluded infarct vessel: limitations of ST-segment elevation in standard and extended ECG leads. Chest 2001;120:1540–1546. https://doi.org/10.1378/chest.120.5.1540 37. Fesmire FM, Percy RF, Bardoner JB et al. Usefulness of automated serial 12-lead ECG monitoring during the initial emergency department evaluation of patients with chest pain. Ann Emerg Med. 1998; 31:3–11. 38. Rouan GW, Lee TH, Cook EF, Brand DA, Weisberg MC et al. Clinical characteristics and outcome of acute myocardial infarction in patients with initially normal or nonspecific electrocardiograms (a report from the Multicenter Chest Pain Study). Am J Cardiol. 1989;64:1087–1092. 39. McCarthy BD, Wong JB, Selker HP. Detecting acute cardiac ischemia in the emergency department: a review of the literature. J Gen Intern Med. 1990;5:365–373. 40. Savonitto S, Ardissino D, Granger CB, Morando G, Prando MD et al. Prognostic value of the admission electrocardiogram in acute coronary syndromes. JAMA 1999;281: 707–713. 41. Zalenski RJ, Rydman RJ, Sloan EP et al. Value of posterior and right ventricular leads in comparison to the standard 12-lead electrocardiogram in evaluation of ST-segment elevation in suspected acute myocardial infarction. Am J Cardiol. 1997;79: 1579–1585. 42. Matetzky S, Freimark D, Feinberg MS et al. Acute myocardial infarction with isolated ST-segment elevation in posterior chest leads V7–9: "hidden" ST-segment elevations revealing acute posterior infarction. J Am Coll Cardiol. 1999;34:748–753. 43. Boden WE, Kleiger RE, Gibson RS et al. Electrocardiographic evolution of posterior acute myocardial infarction: importance of early precordial ST-segment depression. Am J Cardiol. 1987;59:782–787. 44. Winkler C, Funk M, Schindler DM, Hemsey JZ, Lampert R, Drew BJ. Arrhythmias in patients with acute coronary syndrome in the first 24 hours of hospitalization. Heart Lung 2013;42:422–427. https://doi.org/10.1016/j.hrtlng.2013.07.010 45. O’Doherty M, Tayler DI, Quinn E, Vincent R, Chamberlain DA. Five hundred patients with myocardial infarction monitored within one hour of symptoms. Br Med J (Clin Res Ed) 1983;286:1405–1408. https://doi.org/10.1136/bmj.286.6375.1405 46. Mehta RH, Starr AZ, Lopes RD, Hochman JS, Widimsky P, Pieper KS, et al. Incidence of and outcomes associated with ventricular tachycardia or fibrillation in patients undergoing primary percutaneous coronary intervention. JAMA 2009;301:1779–1789. https://doi.org/10.1001/jama.2009.600 47. Kalarus Z, Svendsen JH, Capodanno D, et al. Cardiac arrhythmias in the emergency settings of acute coronary syndrome and revascularization: an European Heart Rhythm Association (EHRA) consensus document, endorsed by the European Association of Percutaneous Cardiovascular Interventions (EAPCI), and European Acute Cardiovascular Care Association (ACCA) Europace (2019) 21, 1603–1604. 48. Keeley EC, Boura JA, Grines CL. Primary angioplasty versus intravenous thrombolytic therapy for acute myocardial infarction: a quantitative review of 23 randomised trials. Lancet. 2003;361:13–20. 49. Armstrong PW, Gershlick AH, Goldstein P, Wilcox R, Danays T, Lambert Y, Sulimov V, Rosell Ortiz F, Ostojic M, Welsh RC, Carvalho AC, Nanas J, Arntz HR, Halvorsen S, Huber K, Grajek S, FrЕОКo C, Bluhmki E, Regelin A, Vandenberghe K, Bogaerts K, Van de Werf F, STREAM Investigative Team. Fibrinolysis or primary PCI in ST-segment elevation myocardial infarction. N Engl J Med. 2013;368(15):1379–1387. 50. Funke Küpper AJ, Verheugt FW, Peels CH, Galema TW, Roos JP. Left ventricular thrombus incidence and behavior studied by serial two-dimensional echocardiography in acute anterior myocardial infarction: left ventricular wall motion, systemic embolism and oral anticoagulation. J Am Coll Cardiol 1989;13:1514–1520. https://doi.org/10.1016/ 0735-1097(89)90341-0 51. Weinsaft JW, Kim J, Medicherla CB, Ma CL, Codella NCF, Kukar N, et al. Echocardiographic algorithm for post-myocardial infarction LV thrombus: a gatekeeper for thrombus evaluation by delayed enhancement CMR. JACC Cardiovasc Imaging 2016;9:505–515. https://doi.org/10.1016/j.jcmg.2015.06.017 52. Lancellotti P, Price S, Edvardsen T, Cosyns B, Neskovic AN, Dulgheru R, et al. The use of echocardiography in acute cardiovascular care: recommendations of the European Association of Cardiovascular Imaging and the Acute Cardiovascular Care Association. Eur Heart J Cardiovasc Imaging 2015;16:119–146. https://doi.org/10.1093/ehjci/jeu210 53. Kim HW, Faraneh-Far A, Kim RJ. Cardiovascular magnetic resonance in patients with myocardial infarction. J Am Coll Cardiol. 2009;55:1–16. 54. Beek AM, van Rossum AC. Cardiovascular magnetic resonance imaging in patients with acute myocardial infarction. Heart 2010;96:237–243. 55. de Waha S, Eitel I, Desch S, Fuernau G, Lurz P, Stiermaier T, et al. Prognosis after ST-elevation myocardial infarction: a study on cardiac magnetic resonance imaging versus clinical routine. Trials 2014;15:249. https://doi.org/10.1186/1745-6215-15-249 56. Larose E, Côté J, Rodés-Cabau J, Noël B, Barbeau G, Bordeleau E, et al. Contrast-enhanced cardiovascular magnetic resonance in the hyperacute phase of ST-elevation myocardial infarction. Int J Cardiovasc Imaging 2009;25:519–527. https:// doi.org/10.1007/s10554-009-9451-4 57. Stiermaier T, Jobs A, de Waha S, Fuernau G, Pöss J, Desch S, et al. Optimized prognosis assessment in ST-segment-elevation myocardial infarction using a cardiac magnetic resonance imaging risk score. Circ Cardiovasc Imaging 2017;10:e006774. https://doi. org/10.1161/circimaging.117.006774 58. de Waha S, Desch S, Eitel I, Fuernau G, Zachrau J, Leuschner A, et al. Impact of early vs. late microvascular obstruction assessed by magnetic resonance imaging on long-term outcome after ST-elevation myocardial infarction: a comparison with traditional prognostic markers. Eur Heart J 2010;31:2660–2668. https://doi.org/10.1093/eurheartj/ ehq247 59. van Kranenburg M, Magro M, Thiele H, de Waha S, Eitel I, Cochet A, et al. Prognostic value of microvascular obstruction and infarct size, as measured by CMR in STEMI patients. JACC Cardiovasc Imaging 2014;7:930–939. https://doi.org/10.1016/j.jcmg.2014. 05.010 60. Bulluck H, Chan MHH, Paradies V, Yellon RL, Ho HH, Chan MY, et al. Incidence and predictors of left ventricular thrombus by cardiovascular magnetic resonance in acute ST-segment elevation myocardial infarction treated by primary percutaneous coronary intervention: a meta-analysis. J Cardiovasc Magn Reson 2018;20:72. https://doi.org/10.1186/s12968-018-0494-3 МРТ 61. Velangi PS, Choo C, Chen KA, Kazmirczak F, Nijjar PS, Farzaneh-Far A, et al. Long-term embolic outcomes after detection of left ventricular thrombus by late gadolinium enhancement cardiovascular magnetic resonance imaging: a matched cohort study. Circ Cardiovasc Imaging 2019;12:e009723. https://doi.org/10.1161/circimaging.119.009723]. 62. Dedic A, Lubbers MM, Schaap J, Lammers J, Lamfers EJ, Rensing BJ, et al. Coronary CT angiography for suspected ACS in the era of high-sensitivity troponins: randomized multicenter study. J Am Coll Cardiol 2016;67:16–26. https://doi.org/10.1016/j.jacc. 2015.10.045 63. Hoffmann U, Truong QA, Schoenfeld DA, Chou ET, Woodard PK, Nagurney JT, et al. Coronary CT angiography versus standard evaluation in acute chest pain. N Engl J Med 2012;367:299–308. https://doi.org/10.1056/NEJMoa1201161
Информация
Список сокращений
АБ – атеросклеротическая бляшка
АВ – атриовентрикулярная
АВС – активированное время свёртывания крови
AГ – артериальная гипертензия
АД – артериальное давление
АДФ – аденозиндифосфат
АПФ – ангиотензинпревращающий фермент
АСК – ацетилсалициловая кислота**
АЧТВ – активированное частичное тромбопластиновое время
АРА – антагонист рецептора ангиотензина II
БСК – болезни системы кровообращения
ВАБК – внутриаортальная баллонная контрпульсация
в/в – внутривенно
ВИЧ – вирус иммунодефицита человека
ВСУЗИ – внутрисосудистое ультразвуковое исследование (син.: ультразвуковое исследование коронарных артерий внутрисосудистое)
ГМГ-КоА редуктаза – 3-гидрокси-3-метилглутарил коэнзима А редуктаза
ГП IIb/IIIa – гликопротеины IIb/IIIa
ДЗЛК – давление заклинивания легочных капилляров
ЕД (ед.) – единицы действия
ЕОК – Европейское общество кардиологов
ЖТ – желудочковая тахикардия
иАПФ – ингибитор ангиотензинпревращающего фермента
ИБС – ишемическая болезнь сердца
ИВЛ - искусственная вентиляция лёгких
ИМ – инфаркт миокарда
ИМбпST – инфаркт миокарда без стойкого подъема сегмента ST на ЭКГ
ИМБОКА – инфаркт миокарда без обструктивного поражения коронарных артерий
ИМпST – инфаркт миокарда со стойким подъемом сегмента ST на ЭКГ
КА – коронарная артерия
КГ – коронарография
КВД – кардиовертер-дефибриллятор (кардиовертер-дефибриллятор имплантируемый однокамерный***; кардиовертер-дефибриллятор имплантируемый двухкамерный***; кардиовертер-дефибриллятор имплантируемый трехкамерный (бивентрикулярный)***)
КлКр – клиренс креатинина (исследование функции нефронов по клиренсу креатинина (проба Реберга) или расчет в рамках исследования уровня креатинина в крови)
КР – кардиореабилитация
КТ – компьютерная томография (компьютерная томография органов грудной полости; компьютерная томография органов грудной полости с внутривенным болюсным контрастированием; компьютерная томография грудной полости с внутривенным болюсным контрастированием, мультипланарной и трехмерной реконструкцией)
КТКГ – компьютерно-томографическая коронарография
КШ – коронарное шунтирование (коронарное шунтирование в условиях искусственного кровообращения; коронарное шунтирование на работающем сердце без использования искусственного кровообращения; коронарное шунтирование роботассистированное; коронарное шунтирование с протезированием клапанов сердца в условиях искусственного кровообращения; коронарное шунтирование с пластикой клапанов сердца в условиях искусственного кровообращения; коронарное шунтирование с протезированием и пластикой клапанов сердца в условиях искусственного кровообращения; коронарное шунтирование в сочетании с трансмиокардиальной лазерной реваскуляризацией сердца; коронарное шунтирование в сочетании с трансмиокардиальной лазерной реваскуляризацией сердца в условиях искусственного кровообращения)
ЛВП – липопротеиды высокой плотности
ЛЖ – левый желудочек
ЛНП – липопротеиды низкой плотности
ЛНПГ – левая ножка пучка Гиса
ME – международные единицы
МЖП – межжелудочковая перегородка
МНО – международное нормализованное отношение
МРТ – магнитно-резонансная томография (магнитно-резонансная томография сердца и магистральных сосудов; магнитно-резонансная томография сердца с контрастированием)
НФГ – нефракционированный гепарин (син.: гепарин натрия**)
ОКС – острый коронарный синдром
ОКСбпST – острый коронарный синдром без стойкого подъема сегмента ST на ЭКГ
ОКСпST – острый коронарный синдром со стойким подъемом сегмента ST на ЭКГ
ОКТ – оптическая когерентная томография
ОНМК – острое нарушение мозгового кровообращения
ОПCC – общее периферическое сосудистое сопротивление
ОРИТ – отделение реанимации и интенсивной терапии
ОСН – острая сердечная недостаточность
РКИ – рандомизированное клиническое исследование
рСКФ – расчётная скорость клубочковой фильтрации
РФ – Российская Федерация
РХМДЛ – рентгенохирургические методы диагностики и лечения
СБЛП – стент без лекарственного покрытия (син.: стент для коронарных артерий металлический непокрытый***)
СВЛ – стент, выделяющий лекарственное средство (стент для коронарных артерий выделяющий лекарственное средство, полностью рассасывающийся***; стент для коронарных артерий, выделяющий лекарственное средство, с рассасывающимся полимерным покрытием***; стент для коронарных артерий, выделяющий лекарственное средство, с нерассасывающимся полимерным покрытием***)
СД – сахарный диабет
СИ – сердечный индекс
син.: – синоним
ТГВ – тромбоз глубоких вен
ТИА – транзиторная ишемическая атака
ТЭЛА – тромбоэмболия легочных артерий
ТЛТ – тромболитическая терапия (син.: внутривенное введение лекарственных препаратов для тромболитической терапии)
ТП – трепетание предсердий
УДД – уровень достоверности доказательств
УЗИ – ультразвуковое исследование
УУР – уровень убедительности рекомендаций
ФВ – фракция выброса
ФЖ – фибрилляция желудочков
ФК – функциональный класс
ФРК – фракционный резерв коронарного кровотока
ФП – фибрилляция предсердий
ХБП – хроническая болезнь почек
ХС – холестерин
ХС ЛНП - холестерин липопротеидов низкой плотности
ХСН – хроническая сердечная недостаточность
ЦВД – центральное венозное давление
ЧКВ – чрескожное коронарное вмешательство (транслюминальная баллонная ангиопластика коронарных артерий; стентирование коронарных артерий; транслюминальная баллонная ангиопластика и стентирование коронарных артерий; реканализация коронарных артерий ретроградная со стентированием; реканализация коронарных артерий антеградная со стентированием; тромбоэктомия из сосудистого протеза (коронарного); эмболэктомия (из коронарной артерии); попытка стентирования коронарных артерий)
ЧСС – частота сердечных сокращений
ЭКГ – электрокардиография (син.: регистрация электрокардиограммы), электрокардиограмма
ЭКМО – экстракорпоральная мембранная оксигенация
ЭКС*** – электрокардиостимулятор (электрокардиостимулятор имплантируемый двухкамерный, без частотной адаптации***; электрокардиостимулятор имплантируемый двухкамерный, частотно-адаптивный***; электрокардиостимулятор имплантируемый однокамерный, без частотной адаптации***; электрокардиостимулятор имплантируемый однокамерный, частотно-адаптивный***; электрокардиостимулятор имплантируемый трехкамерный (бивентрикулярный)***; электрокардиостимулятор имплантируемый двухкамерный, частотно-адаптивный, совместимый с магнитно-резонансным томографом***)
ЭхоКГ – эхокардиография
ARC-HBR – Academic Research Consortium for High Bleeding Risk (шкала высокого риска кровотечений Консорциумa академических исследований)
NYHA – New York Heart Association (Нью-Йоркская ассоциация сердца)
PCSK9 – proprotein convertase subtilisin/kexin type 9 (пропротеиновая конвертаза субтилизин-кексинового типа 9)
POC – point of care (место оказания медицинской помощи)
SpO₂ – уровень насыщения крови кислородом (сатурация крови), определяемый пульсоксиметром
Термины и определения
Доказательная медицина – надлежащее, последовательное и осмысленное использование современных наилучших доказательств (результатов клинических исследований) в процессе принятия решений о состоянии здоровья и лечении пациента [1, 2].
Заболевание – возникающее в связи с воздействием патогенных факторов нарушение деятельности организма, работоспособности, способности адаптироваться к изменяющимся условиям внешней и внутренней среды при одновременном изменении защитно-компенсаторных и защитно-приспособительных реакций и механизмов организма [1].
Инструментальная диагностика – диагностика с использованием различных приборов, аппаратов и инструментов.
Инфаркт миокарда без стойкого подъема сегмента ST на ЭКГ (ИМбпST) – инфаркт миокарда, при котором в ранние сроки заболевания на ЭКГ отсутствует стойкий (длительностью более 20 минут) подъем сегмента ST как минимум в двух смежных отведениях и нет остро возникшей блокады левой ножки пучка Гиса.
Исход – любой возможный результат, возникающий от воздействия причинного фактора, профилактического или терапевтического вмешательства, все установленные изменения состояния здоровья, возникающие как следствие вмешательства [3].
Конфликт интересов – ситуация, при которой у медицинского или фармацевтического работника при осуществлении ими профессиональной деятельности возникает личная заинтересованность в получении лично либо через представителя компании материальной выгоды или иного преимущества, которое влияет или может повлиять на надлежащее исполнение ими профессиональных обязанностей вследствие противоречия между личной заинтересованностью медицинского работника или фармацевтического работника и интересами пациента [1].
Клиническое исследование – любое исследование, проводимое с участием человека в качестве субъекта для выявления или подтверждения клинических и/или фармакологических эффектов исследуемых продуктов и/или выявления нежелательных реакций на исследуемые продукты, и/или изучения их всасывания, распределения, метаболизма и выведения с целью оценить их безопасность и/или эффективность. Термины «клиническое испытание» и «клиническое исследование» являются синонимами [2, 3].
Лабораторная диагностика – совокупность методов, направленных на анализ исследуемого материала с помощью различного специализированного оборудования.
Лекарственные препараты – лекарственные средства в виде лекарственных форм, применяемые для профилактики, диагностики, лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности [4].
Медицинское вмешательство – выполняемые медицинским работником и иным работником, имеющим право на осуществление медицинской деятельности, по отношению к пациенту, затрагивающие физическое или психическое состояние человека и имеющие профилактическую, диагностическую, лечебную, реабилитационную или исследовательскую направленность виды медицинских обследований и (или) медицинских манипуляций, а также искусственное прерывание беременности [1].
Медицинский работник – физическое лицо, которое имеет медицинское или иное образование, работает в медицинской организации и в трудовые (должностные) обязанности которого входит осуществление медицинской деятельности, либо физическое лицо, которое является индивидуальным предпринимателем, непосредственно осуществляющим медицинскую деятельность [1].
Механический протез клапана сердца – протез аортального клапана механический двустворчатый***; протез митрального клапана механический двустворчатый***; протез аортального клапана механический двустворчатый в сочетании с протезом аорты из биологического полимера***.
Неинвазивные стресс-тесты – электрокардиография с физической нагрузкой, электрокардиография с применением лекарственных препаратов, эхокардиография с физической нагрузкой, эхокардиография с фармакологической нагрузкой, сцинтиграфия миокарда с функциональными пробами, однофотонная эмиссионная компьютерная томография миокарда перфузионная с функциональными пробами.
Операция коронарного шунтирования (КШ) – наложение обходного анастомоза, позволяющего улучшить кровоток дистальнее гемодинамически значимого стеноза коронарной артерии. В зависимости от методики включает аортокоронарное, маммарокоронарное и другие виды шунтирования.
Острое повреждение миокарда – повышение и/или снижение концентрации сердечного тропонина в крови, которая как минимум однократно превышает 99-й перцентиль верхней референсной границы у пациентов без исходного повышения уровня сердечного тропонина в крови, либо его увеличение > 20% при исходно повышенном уровне сердечного тропонина, если до этого он оставался стабильным (вариабельность была ≤ 20%) или снижался [5].
Острый инфаркт миокарда (ИМ) – острое повреждение миокарда вследствие его ишемии [5].
Острый коронарный синдром (ОКС) – термин, обозначающий любую группу клинических признаков или симптомов, позволяющих подозревать острый инфаркт миокарда или нестабильную стенокардию.
Острый коронарный синдром со стойким подъемом сегмента ST на ЭКГ (ОКСпST) — остро возникшие клинические признаки или симптомы ишемии миокарда в сочетании с наличием стойкого (длительностью более 20 минут) подъема сегмента ST как минимум в двух смежных отведениях ЭКГ.
Острый коронарный синдром без стойкого подъема сегмента ST на ЭКГ (ОКСбпST) – остро возникшие клинические признаки или симптомы ишемии миокарда, когда на ЭКГ отсутствует стойкий (длительностью более 20 минут) подъем сегмента ST как минимум в двух смежных отведениях и нет остро возникшей блокады левой ножки пучка Гиса.
Пациент – физическое лицо, которому оказывается медицинская помощь или которое обратилось за оказанием медицинской помощи независимо от наличия у него заболевания и от его состояния [1].
Постинфарктная стенокардия – стенокардия, возникшая в первые 2 недели от начала инфаркта миокарда.
Рабочая группа по разработке / актуализации клинических рекомендаций – коллектив специалистов, работающих совместно и согласованно в целях разработки / актуализации клинических рекомендаций, и несущих общую ответственность за результаты данной работы.
Реваскуляризация - выполнение процедур, входящих в понятия ЧКВ и/или КШ, в любых сочетаниях.
Ресинхронизирующая терапия - имплантация пациенту специального бивентрикулярного (трехкамерного) электрокардиостимулятора для ресинхронизации сердечных сокращений (кардиовертера-дефибриллятора имплантируемого трехкамерного (бивентрикулярного)*** (CRT-D); электрокардиостимулятора имплантируемого трехкамерного (бивентрикулярного)***, электростимулятора имплантируемого трехкамерного (бивентрикулярного), МРТ совместимого*** (CRT-P)).
Симптом – признак какого-либо заболевания, статистически значимое отклонение того или иного показателя от границ его нормальных величин или возникновение качественно нового, не свойственного здоровому организму явления.
Синдром – устойчивая совокупность ряда симптомов с единым патогенезом.
Состояние – изменения организма, возникающие в связи с воздействием патогенных и (или) физиологических факторов и требующие оказания медицинской помощи [3].
Стент без лекарственного покрытия (СБЛП) – стент для коронарных артерий металлический непокрытый; представляет собой металлический каркас из биологически инертного материала.
Стент, выделяющий лекарство (СВЛ) – стент для коронарных артерий***, из структур которого в течение определенного времени после установки выделяется антипролиферативное вещество, препятствующее образованию неоинтимы и за счет этого способствующее профилактике повторного стенозирования.
Тезис-рекомендация – положение, отражающее порядок и правильность выполнения того или иного медицинского вмешательства, имеющего доказанную эффективность и безопасность.
Уровень достоверности доказательств (УДД) – степень уверенности в том, что найденный эффект от применения медицинского вмешательства является истинным [3].
Уровень убедительности рекомендаций (УУР) – степень уверенности в достоверности эффекта вмешательства и в том, что следование рекомендациям принесет больше пользы, чем вреда в конкретной ситуации [3].
Хирургическое лечение – метод лечения заболеваний путём разъединения и соединения тканей в ходе хирургической операции.
Чрескожное коронарное вмешательство (ЧКВ) – восстановление кровотока в стенозированном участке коронарной артерии (КА) с использованием чрескожного введения необходимых для этого устройств.
Этапная реваскуляризация – последовательное (то есть не одновременное с реваскуляризацией проблемного сегмента КА, ответственного за данный ИМпST) выполнение процедур, входящих в понятия ЧКВ и/или КШ, в любых сочетаниях, во время индексной госпитализации или после нее с целью полной или максимально возможной реваскуляризации коронарного русла.
CHA2DS2-VASc – шкала риска ишемического инсульта при фибрилляции предсердий у пациентов без механического протеза клапанов сердца и умеренного / тяжелого митрального стеноза.
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Представлена в Приложениях А-Б.
Критерии оценки качества медицинской помощи
Критерии оценки качества первичной медико-санитарной помощи взрослым при остром инфаркте миокарда с подъемом сегмента ST электрокардиограммы (коды по МКБ-10: I21.0, I21.1, I21.2, I21.3, I21.9, I22.0, I22.1, I22.8, I22.9, I24.0, I24.8, I24.9)
|
N п/п
|
Критерии оценки качества
|
Оценка выполнения
|
|---|---|---|
|
1.
|
После выписки из стационара пациент взят на диспансерное наблюдение
|
Да/Нет
|
|
2.
|
Осуществляется программа кардиологической реабилитации
|
Да/Нет
|
|
3.
|
Выполнен общий (клинический) анализ крови с периодичностью не реже 1 раза в год
|
Да/Нет
|
|
4.
|
Выполнен биохимический общетерапевтический анализ крови (с расчетом рСКФ) с периодичностью не реже 1 раза в год
|
Да/Нет
|
|
5.
|
Выполнен анализ крови по оценке нарушений липидного обмена биохимический (как минимум исследование ХС ЛНП) с периодичностью не реже 2 раз в год
|
Да/Нет
|
|
6.
|
Выполнена регистрация ЭКГ с периодичностью не реже 1 раза в год
|
Да/Нет
|
|
7.
|
Выполнена ЭхоКГ с оценкой ФВ ЛЖ с периодичностью не реже 1 раза в год
|
Да/Нет
|
|
8.
|
Проводится терапия АСК в сочетании с ингибитором Р2Y12 рецепторов тромбоцитов (клопидогрел, тикагрелор или прасугрел), или терапия пероральным антикоагулянтом (апиксабан, дабигатрана этексилат, ривароксабан, эдоксабан или антагонист витамина К) в сочетании с антиагрегантом (клопидогрелом, реже тикагрелором) в зависимости от медицинских показаний и при отсутствии медицинских противопоказаний
|
Да/Нет
|
|
9.
|
Проводится терапия высокими дозами лекарственных препаратов из группы ингибиторов ГМГ-КоА-редуктазы при отсутствии медицинских противопоказаний; при недостижении целевого уровня ХС ЛНП (<1,4 ммоль/л) и его снижения на 50% от исходного увеличена доза ингибитора ГМГ-КоА-редуктазы или проводится комбинированная терапия (с эзетимибом и/или препаратом из группы другие гиполипидемические средства (ингибиторы PCSK9)) в зависимости от медицинских показаний и при отсутствии медицинских противопоказаний
|
Да/Нет
|
|
10.
|
Проводится терапия лекарственными препаратами из группы иАПФ или АРА (как минимум у пациентов с ФВ ЛЖ ≤40%, сердечной недостаточностью, артериальной гипертензии, хронической болезни почек, при сахарном диабете) в зависимости от медицинских показаний и при отсутствии медицинских противопоказаний
|
Да/Нет
|
|
11.
|
Проводится терапия лекарственными препаратом из группы бета-адреноблокаторов перорально (как минимум при ФВ ЛЖ ≤ 40%) при отсутствии медицинских противопоказаний
|
Да/Нет
|
Критерии оценки качества специализированной медицинской помощи взрослым при остром инфаркте миокарда с подъемом сегмента ST электрокардиограммы (коды по МКБ - 10: I21.0, I21.1, I21.2, I21.3, I21.9, I22.0, I22.1, I22.8, I22.9, I24.0, I24.8, I24.9)
|
N
п/п
|
Критерии оценки качества
|
Оценка выполнения
|
|---|---|---|
|
1.
|
В медицинской документации указан временной интервал от момента обращения за медицинской помощью до начала реперфузионного лечения
|
Да/Нет
|
|
2.
|
Проведено введение лекарственных препаратов для ТЛТ не позднее 10 минут от момента установления диагноза (при невозможности выполнения первичного ЧКВ в течение 120 мин от постановки диагноза до введения проводника в инфаркт-связанную артерию)
|
Да/Нет
|
|
3.
|
Выполнена КГ и, при необходимости, ЧКВ в пределах 2–24 ч после успешной ТЛТ
|
Да/Нет
|
|
4.
|
Время от постановки/подтверждения диагноза в ЧКВ-центре до введения проводника в инфаркт-связанную артерию при проведении первичного ЧКВ менее 60 мин
|
Да/Нет
|
|
5.
|
Выполнена ЭхоКГ с оценкой ФВ ЛЖ
|
Да/Нет
|
|
6.
|
Выполнено исследование уровня тропонинов I или T в крови (при установлении диагноза; при неинформативности первого исследования – повторно)
|
Да/Нет
|
|
7.
|
При КГ и ЧКВ использован доступ через лучевую артерию (при отсутствии медицинских противопоказаний)
|
Да/Нет
|
|
8.
|
Проводится терапия лекарственными препаратами из группы бета-адреноблокаторов (как минимум при ФВ ЛЖ ≤ 40%) при отсутствии медицинских противопоказаний
|
Да/Нет
|
|
9.
|
Проводится терапия лекарственными препаратами из группы иАПФ или АРА (как минимум у пациентов с ФВ ЛЖ ≤40%, сердечной недостаточностью, артериальной гипертензии, хронической болезни почек, при сахарном диабете) в зависимости от медицинских показаний и при отсутствии медицинских противопоказаний
|
Да/Нет
|
|
10.
|
Проводится гиполипидемическая терапия высокими дозами лекарственных препаратов из группы ингибиторов ГМГ-КоА-редуктазы при отсутствии медицинских противопоказаний
|
Да/Нет
|
|
11.
|
В начале лечения использовалось сочетание АСК, ингибитора Р2Y12-рецептора тромбоцитов (клопидорел, тикагрелор или прасугрел) и антикоагулянта с последующим переходом на сочетание АСК с ингибитором Р2Y12-рецептора тромбоцитов или, для пациентов с показаниями к длительному применению антикоагулянтов, на сочетание перорального антикоагулянта с антиагрегантом в зависимости от медицинских показаний и при отсутствии медицинских противопоказаний
|
Да/Нет
|
|
12.
|
Перед выпиской из стационара определены сроки этапной реваскуляризации (при наличии показаний)
|
Да/Нет
|
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
Президиум рабочей группы:
Аверков О.В. (Москва)
Арутюнян Г.К. (Москва)
Дупляков Д.В. (Самара)
Константинова Е.В. (Москва)
Никулина Н.Н. (Рязань)
Шахнович Р.М. (Москва)
Явелов И. С. (Москва)
Яковлев А.Н. (Санкт-Петербург)
Другие члены рабочей группы:
Абугов С.А. (Москва)
Алекян Б.Г. (Москва)
Аронов Д.М. (Москва)
Архипов М.В. (Екатеринбург)
Барбараш О.Л. (Кемерово)
Бойцов С.А. (Москва)
Бубнова М.Г. (Москва)
Вавилова Т.В. (Санкт-Петербург)
Васильева Е.Ю. (Москва)
Галявич А.С. (Казань)
Ганюков В.И. (Кемерово)
Гиляревский С.Р. (Москва)
Голубев Е.П. (Москва)
Голухова Е.З. (Москва)
Затейщиков Д.А. (Москва)
Карпов Ю.А. (Москва)
Космачева Е.Д. (Краснодар)
Лопатин Ю.М. (Волгоград)
Марков В.А. (Томск)
Меркулов Е.В. (Москва)
Новикова Н.А. (Москва)
Панченко Е.П. (Москва)
Певзнер Д.В. (Москва)
Погосова Н.В. (Москва)
Прасол Д.М. (Санкт-Петербург)
Протопопов А.В. (Красноярск)
Скрыпник Д.В (Москва)
Тарасов Р.С. (Москва)
Терещенко С.Н. (Москва)
Устюгов С.А. (Красноярск)
Хрипун А.В. (Ростов-на-Дону)
Цебровская Е.А. (Санкт-Петербург)
Шалаев С.В. (Тюмень)
Шляхто Е.В. (Санкт-Петербург)
Шпектор А.В. (Москва)
Якушин С.С. (Рязань)
Члены Рабочей группы подтвердили отсутствие финансовой поддержки/конфликта интересов. В случае сообщения о наличии конфликта интересов член(ы) рабочей группы был(и) исключен(ы) из обсуждения разделов, связанных с областью конфликта интересов.
Приложение А2. Методология разработки клинических рекомендаций
В основе рекомендаций лежат результаты крупных многоцентровых исследований, мета-анализов, регистров, которые являются основой и для других национальных и международных клинических рекомендаций. Учтены основные положения обновленных рекомендаций по диагностике и лечению ОКС Европейского общества кардиологов (ЕОК) и Американских Коллегии кардиологов/Ассоциации сердца, рекомендаций ЕОК по реваскуляризации миокарда, рекомендации ЕОК по двойной антитромбоцитарной терапии, рекомендаций ЕОК по хроническим коронарным синдромам, а также рекомендаций указанных профессиональных сообществ по антитромботической терапии у пациентов с ФП. При этом учитывались отличия и особенности оказания медицинской помощи пациентам с ОКС в Российской Федерации.
Целевая аудитория данных клинических рекомендаций:
-
Врач-кардиолог.
-
Врач-анестезиолог-реаниматолог.
-
Фельдшер скорой медицинской помощи.
-
Врач скорой медицинской помощи.
-
Врач-терапевт.
-
Врач-терапевт участковый.
-
Врач общей практики (семейный врач).
-
Врач-сердечно-сосудистый хирург.
-
Врач по рентгенэноваскулярным методам диагностики и лечения.
Шкала оценки классов рекомендаций Европейского общества кардиологов (ЕОК)
Вследствие того, что члены Российского кардиологического общества (РКО) входят в состав Европейского общества кардиологов (ЕОК) и также являются его членами, все рекомендации ЕОК формируются с участием российских экспертов, которые являются соавторами европейских рекомендаций. Таким образом, существующие рекомендации ЕОК отражают общее мнение ведущих российских и европейских кардиологов. В связи с этим формирование Национальных рекомендаций проводилось на основе рекомендаций ЕОК, с учетом национальной специфики, особенностей обследования, лечения, учитывающих доступность медицинской помощи. По этой причине в тексте настоящих клинических рекомендаций одновременно использованы две шкалы оценки достоверности доказательств тезисов рекомендаций: уровни достоверности доказательств ЕОК с УУР и УДД. Добавлены классы рекомендаций ЕОК, позволяющие оценить необходимость выполнения тезиса рекомендаций (Таблицы 1, 2, 3, 4).
Таблица 1.
Классы показаний согласно рекомендациям ЕОК
|
Класс рекомендаций ЕОК
|
Определение
|
Предлагаемая формулировка
|
|---|---|---|
|
I
|
Доказано или общепризнанно, что диагностическая процедура, вмешательство/лечение являются эффективными и полезными
|
Рекомендовано /
показано
|
|
II
IIa
IIb
|
Противоречивые данные и/или мнения об эффективности/пользе диагностической процедуры, вмешательства, лечения
Большинство данных/мнений в пользу эффективности/пользы диагностической процедуры, вмешательства, лечения
Эффективность/польза диагностической процедуры, вмешательства, лечения установлены менее убедительно
|
Целесообразно
применять
Можно
применять
|
|
III
|
Данные или единое мнение, что диагностическая процедура, вмешательство, лечение бесполезны/неэффективны, а в ряде случаев могут приносить вред.
|
Не
рекомендуется
применять
|
Таблица 2.
Уровни достоверности доказательств согласно рекомендациям ЕОК
|
Уровень
достоверности доказательств ЕОК
|
Определение
|
|---|---|
|
A
|
Данные многочисленных рандомизированных клинических исследований или метаанализов
|
|
B
|
Данные получены по результатам одного рандомизированного клинического исследования или крупных нерандомизированных исследований
|
|
C
|
Согласованное мнение экспертов и/или результаты небольших исследований, ретроспективных исследований, регистров
|
Таблица 3.
Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
|
УДД
|
Определение
|
|---|---|
|
1
|
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
|
|
2
|
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований с применением метаанализа
|
|
3
|
Исследования без последовательного контроля референсным методом, или исследования с референсным методом, не являющимся независимым от исследуемого метода, или нерандомизированные сравнительные исследования, в том числе когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая
|
|
5
|
Имеется лишь обоснование механизма действия или мнение экспертов
|
Таблица 4.
Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
|
УДД
|
Определение
|
|---|---|
|
1
|
Систематический обзор РКИ с применением метаанализа
|
|
2
|
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ с применением метаанализа
|
|
3
|
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль»
|
|
5
|
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
|
Таблица 5.
Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
|
УУР
|
Определение
|
|---|---|
|
A
|
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
|
|
B
|
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
|
|
C
|
Слабая рекомендация (отсутствие доказательств надлежащего качества; все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
|
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
-
Приказ Министерства здравоохранения Российской Федерации от 15 ноября 2012 г. №918н "Об утверждении Порядка оказания медицинской помощи больным с сердечно-сосудистыми заболеваниями" (с изменениями и дополнениями от 21.02.2020 г.).
-
Приказ Министерства здравоохранения РФ от 10 июня 2021 г. № 612н "Об утверждении стандарта медицинской помощи взрослым при остром инфаркте миокарда с подъемом сегмента ST электрокардиограммы (диагностика, лечение и диспансерное наблюдение)".
-
Приказ Министерства здравоохранения РФ от 15 марта 2022 г. №168н "Об утверждении порядка проведения диспансерного наблюдения за взрослыми".
-
«Методические рекомендации по проведению оценки научной обоснованности включаемой в клинические рекомендации информации» ФГБУ «ЦЭККМП» Минздрава России, 2019.
Критерии диагностики инфаркта миокарда
Критерии диагностики острого ИМ [5]
Термин «острый ИМ» используется в случаях, когда наряду с доказательством острого повреждения миокарда (характерная динамика уровня биомаркеров в крови) имеются свидетельства острой ишемии миокарда.
Критерии диагностики острого ИМ 1 и 2 типов
Повышение и/или снижение концентрации сердечного тропонина в крови, которая должна как минимум однократно превысить 99-й перцентиль верхней референсной границы у пациентов без исходного повышения уровня сердечного тропонина в крови, либо его увеличение >20% при исходно повышенном уровне сердечного тропонина, если до этого он оставался стабильным (вариация ≤20%) или снижался, в сочетании с хотя бы одним критерием острой ишемии миокарда:
-
симптомы ишемии миокарда;
-
остро возникшие (или предположительно остро возникшие) ишемические изменения на ЭКГ;
-
появление патологических зубцов Q на ЭКГ;
-
подтверждение с помощью методов визуализации наличия новых участков миокарда с потерей жизнеспособности или нарушением локальной сократимости, характерных для ишемической этиологии;
-
выявление внутрикоронарного тромбоза при коронарной ангиографии или атеротромбоза (или признаков нестабильной АБ) на аутопсии (для ИМ 1 типа).
Критерии дифференциальной диагностики ИМ 1 и 2 типов представлены на рисунке 3.
Критерии диагностики острого ИМ 3 типа
Сердечная смерть у пациента с симптомами, указывающими на ишемию миокарда, сопровождающимися предположительно новыми ишемическими изменениями ЭКГ или фибрилляцией желудочков, в случаях, когда пациент умирает до появления возможности взятия образцов крови или раньше, чем отмечается повышение активности биохимических маркеров некроза миокарда в крови, или наличие ИМ подтверждено на аутопсии. При выявлении на аутопсии ИМ в сочетании со свежим или недавно возникшим атеротромбозом (или признаками нестабильной АБ) в инфаркт-связанной коронарной артерии ИМ 3 типа должен быть реклассифицирован в ИМ 1 типа.
Критерии диагностики острого ИМ 4а типа (первые 48 часов после процедуры ЧКВ)
Повышение концентрации сердечного тропонина в крови более 5 раз от 99-го перцентиля верхней референсной границы у пациентов с исходно нормальным уровнем в крови (если до процедуры концентрация тропонина в крови была повышена и стабильна (вариация ≤20%) или снижалась, после процедуры она должна повыситься >20%) в сочетании как минимум с один признаком острой ишемии миокарда:
-
остро возникшие ишемические изменения ЭКГ;
-
появление патологических зубцов Q на ЭКГ;
-
подтверждение с помощью методов визуализации наличия новых участков миокарда с потерей жизнеспособности или нарушением локальной сократимости в виде паттерна, характерного для ишемической этиологии;
-
ангиографические признаки, указывающие на ограничения коронарного кровотока, связанные с процедурой (диссекция КА, окклюзия/тромбоз крупной эпикардиальной /боковой ветви, разрушение коллатерального кровотока или дистальная эмболизация);
-
посмертное выявление тромба, связанного с процедурой, в целевой артерии, или область некроза в миокарде, кровоснабжаемом этой артерией.
Критерии диагностики острого ИМ 4b типа
Критерии острого ИМ 1 типа в сочетании с тромбозом стента, документированным при коронарной ангиографии или на аутопсии.
Критерии диагностики острого ИМ 4с типа
Критерии острого ИМ 1 типа, когда при коронарной ангиографии единственной причиной возникновения ИМ представляется рестеноз (не выявляются другие поражения, потенциально связанные с развившимся ИМ, нет признаков внутрикоронарного тромбоза).
Критерии диагностики острого ИМ 5 типа (первые 48 часов после операции КШ)
Повышение концентрации сердечного тропонина в крови более 10 раз от 99-го перцентиля от верхней референсной границы у пациентов с исходно нормальным уровнем в крови (если до процедуры концентрация тропонина в крови была повышена и стабильна (вариация ≤20%) или снижалась, после процедуры она должен повыситься >20%) в сочетании как минимум с один признаком острой ишемии миокарда:
-
появление патологических зубцов Q на ЭКГ;
-
подтверждение с помощью методов визуализации наличия новых участков миокарда с потерей жизнеспособности или нарушением локальной сократимости в виде паттерна, характерного для ишемической этиологии;
-
острая окклюзия шунта или нативной коронарной артерии, документированная при коронарной ангиографии.
Для биохимической диагностики острого ИМ должны использоваться методы определения концентрации сердечного тропонина в крови, обеспечивающие коэффициент вариации определений 99-го перцентиля верхней референсной границы не выше 20% (оптимально — не выше 10%).
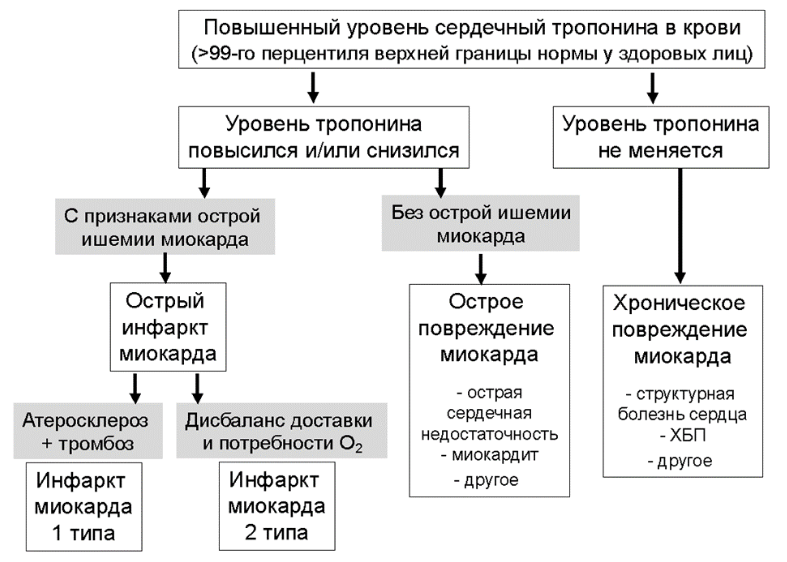
Рисунок 2. Диагностика и дифференциальная диагностика острого инфаркта миокарда 1 и 2 типов.
Критерии диагностики ранее перенесенного ИМ [5]:
-
Патологические зубцы Q на ЭКГ (с наличием предшествующих симптомов или без них) при отсутствии не ишемических причин для появления патологических зубцов Q;
-
Подтверждение с помощью методов визуализации наличия участков миокарда с потерей жизнеспособности в виде паттерна, характерного для ишемической этиологии;
-
Морфологические находки, характерные для перенесенного ИМ.
Причины повышения уровня сердечного тропонина в крови
|
Повреждение (некроз) миокарда из-за острой ишемии миокарда
- Изъязвление/разрыв атеросклеротической бляшки с тромбозом
|
|
|---|---|
|
Повреждение (некроз) миокарда из-за острой ишемии миокарда за счет дисбаланса потребности и доставки кислорода
|
|
|
Снижение перфузии миокарда:
- Спазм КА
- Дисфункция микрососудов
- Эмболия в КА
- Диссекция КА
- Устойчивая брадиаритмия
- Гипотония или шок
- Дыхательная недостаточность
- Тяжелая анемия
|
Повышение потребности миокарда в кислороде:
- Устойчивая тахиаритмия
- Тяжелая гипертония с гипертрофией ЛЖ или без нее
|
|
Другие причины повреждения (некроза) миокарда
|
|
|
Сердечные причины:
- Сердечная недостаточность
- Миокардит
- Кардиомиопатия (любая)
- Синдром Такоцубо
- Процедуры реваскуляризации миокарда
- Другие вмешательства на сердце
- Катетерная аблация
- Дефибрилляция
- Контузия сердца
|
Несердечные причины:
- Сепсис, инфекционное заболевание
- ХБП
- Инсульт
- Субарахноидальное кровоизлияние
- ТЭЛА, легочная гипертензия
- Инфильтративные заболевания
- Химиотерапевтические препараты
- Критические состояния
- Тяжелая физическая нагрузка
|
Заболевания и состояния, затрудняющие ЭКГ диагностику ИМпST
-
Синдром ранней реполяризации желудочков сердц
-
Блокада ЛНПГ
-
Возбуждение желудочков сердца по дополнительному проводящему пути
-
Гипертрофия ЛЖ
-
Синдром Бругада
-
Перикардит, миокардит
-
ТЭЛА
-
Субарахноидальное кровоизлияние
-
Метаболические нарушения (например, гиперкалиемия)
-
Кардиомиопатия
-
Холецистит
-
Сохраняющиеся изменения ЭКГ, свойственные молодому возрасту
-
Неправильное наложение электродов
-
ИМ в анамнезе с формированием патологических зубцов Q и/или сохраняющимся подъемом ST (например, хроническая аневризма ЛЖ)
-
Ритм сердца, навязанный с помощью электростимуляции желудочков
Тромболитики и режимы их дозирования при ИМпST&
|
Алтеплаза**
|
a) 90-минутный (ускоренный) режим дозирования для пациентов с ИМпST, у которых лечение может быть начато в течение 6 ч после возникновения симптомов:
15 мг в/в струйно, 50 мг — в/в инфузия в течение первых 30 мин, с последующей инфузией 35 мг в течение 60 мин до достижения максимальной дозы 100 мг.
У пациентов с массой тела менее 65 кг суммарную дозу корректируют с учетом массы тела: 15 мг в/в струйно, 0,75 мг/кг (максимум — 50 мг) в течение 30 мин в/в капельно, с последующей инфузией 0,5 мг/кг (максимум 35 мг) в течение 60 мин.
б) 3-часовой режим дозирования для пациентов, у которых лечение может быть начато в промежутке между 6 и 12 ч после развития симптомов: 10 мг в/в струйно; 50 мг — в/в инфузия в течение 1-го часа, с последующей в/в инфузией со скоростью 10 мг в течение 30 мин, до достижения в течение 3 ч максимальной дозы 100 мг.
У пациентов с массой тела менее 65 кг суммарная доза не должна превышать 1,5 мг/кг.
|
|---|---|
|
Проурокиназа**
|
Масса тела пациента более 85 кг: в/в болюс 2 000 000 МЕ и последующая инфузия 6 000 000 МЕ в течение 60 мин.
Масса тела пациента 60-85 кг: в/в болюс 2 000 000 МЕ и последующая инфузия 4 000 000 МЕ в течение 60 мин.
Масса тела пациента менее 60 кг: в/в болюс 2 000 000 МЕ и последующая инфузия 100 000 МЕ/кг х [масса тела в кг] минус 2 000 000 МЕ в течение 60 мин.
|
|
Рекомбинантный белок, содержащий аминокислотную последовательность стафилокиназы**
|
1. Однократное внутривенное введение болюсом в дозе 15 мг (предпочтительно для догоспитального введения);
2. Первый болюс внутривенно 10 мг, повторный болюс 5 мг через 30 минут после первого;
3. Внутривенный болюс 10 мг, затем внутривенная инфузия 5 мг за 30 минут.
|
|
Стрептокиназа
|
В/в инфузионно 1 500 000 МЕ в течение 60 мин
|
|
Тенектеплаза**
|
В/в болюс (в течение до 5 с, в зависимости от массы тела пациента), однократно. Рекомендуемая общая доза не должна превышать 50 мг: 30 мг при массе тела <60 кг, 35 мг при массе тела от 60 до <70 кг, 40 мг при массе тела от 70 до <80 кг, 45 мг при массе тела от 80 до <90 кг, 50 мг при массе тела ≥90 кг.
|
Примечания: & — представлены доступные и разрешенные к применению в РФ средства. Все представленные в таблице тромболитики, кроме стрептокиназы, считаются фибринспецифичными.
Антитромботические средства при ИМпST
|
Препарат
|
Рекомендации по применению
|
|---|---|
|
Антиагреганты (АТХ-группа Антиагреганты, кроме гепарина, B01AC)
|
|
|
#АСК** [14]
|
Внутрь; первая доза #150–300 мг (разжевать и проглотить), со 2-х суток — по #75–100 мг 1 раз в сутки
|
|
#Клопидогрел**
|
Сопровождение первичного ЧКВ: внутрь; первая доза 600 мг [14], затем 75 мг 1 раз/сут.
Сопровождение ТЛТ: внутрь; первая доза 300 мг или 75 мг – у пациентов старше 75 лет, со 2-х суток по 75 мг 1 раз/сут.
Сопровождение ЧКВ вскоре после ТЛТ: в первые 24 ч от введения тромболитика не получившим нагрузочной дозы клопидогрела** принять 300 мг; после 24 ч от введения тромболитика не получившим нагрузочной дозы клопидогрела** принять 600 мг, получившим нагрузочную дозу 300 мг в первые сутки принять еще 300 мг.
Отсутствие реперфузионного лечения: внутрь 75 мг 1 раз/сут; перед ЧКВ в более поздние сроки заболевания — нагрузочная доза #600 мг [14].
|
|
Прасугрел
|
Сопровождение первичного ЧКВ: внутрь; 60 мг, со следующих суток по 10 мг 1 раз в сутки (у пациентов в возрасте ≥ 75 лет, с массой тела ниже 60 кг – по 5 мг 1 раз в сутки).
|
|
Тикагрелор**
|
Сопровождение первичного ЧКВ: внутрь; первая доза 180 мг, через 12 часов по 90 мг 2 раза/сут (можно использовать у получивших нагрузочную дозу клопидогрела**). При продлении лечения через 1 год после ИМпST у пациентов с высоким риском коронарных осложнений – по 60 мг 2 раза в сутки.
|
|
Блокаторы ГП IIb/IIIa рецептора тромбоцитов
(используются для сопровождения ЧКВ)
|
|
|
F(ab`)2 фрагменты антител моноклональных FRaMon
|
В/в; 0,25 мг/кг в течение 3–5 мин.
|
|
Тирофибан
|
В/в; начальная доза 25 мкг/кг в виде болюсной инъекции в течение 3 мин, с последующей инфузией со скоростью 0,15 мкг/кг/мин в течение 12–24 ч (минимальная длительность — 12 ч) и до 48 ч [14].
|
|
Эптифибатид
|
В/в болюсно 180 мкг/кг, затем в виде непрерывной инфузии по 2 мкг/кг/мин (при уровне креатинина сыворотки ниже 1,912 ммоль/л) или 1 мкг/кг/мин (при уровне креатинина сыворотки 1,912–3,824 ммоль/л). Через 10 мин после начала инфузии повторно вводят 180 мкг/кг в виде болюса. Инфузию продолжают в течение 18–24 ч или до момента выписки больного из стационара, если она происходит раньше, но не менее 12 ч.
|
|
Антикоагулянты для парентерального введения
|
|
|
Нефракционированный гепарин
(гепарин натрия**)
|
При ЧКВ: НФГ**(гепарина натрия**) вводится внутривенно болюсно в дозе 70-100 ЕД/кг (если не планируется применение ингибиторов ГП IIb/IIla рецепторов) или в дозе 50-60 ЕД/кг (при совместном применении с ингибиторами ГП IIb/IIIa рецепторов). При необходимости повторные болюсы с целью поддерживать АВС крови 250–350 с (200–250 с при применении ингибиторов ГП IIb/IIIa тромбоцитов).
Сопровождение ТЛТ: в/в; болюсом 60 ЕД/кг (максимально 4000 ЕД) сразу вслед за этим постоянная инфузия 12 ЕД/кг/ч (максимально 1000 ЕД/ч), в последующем подбор дозы, обеспечивающей увеличение АЧТВ до 50–70 секунд или в 1,5–2 раза выше контрольной величины для конкретной лаборатории (верхняя граница нормы или среднее нормальное значение у здоровых лиц); при сочетании с ТЛТ АЧТВ следует определить через 3, 6, 12 и 24 часа после начала инфузии НФГ**, длительность инфузии 24–48 часов.
Без реперфузионной терапии, в т.ч. с другими показаниями к использованию лечебных доз антикоагулянтов: в/в, болюсом 60–70 ЕД/кг (максимально 5000 ЕД), сразу вслед за этим инфузия с начальной скоростью 12–15 ЕД/кг/ч (максимально 1000 ЕД/ч); в последующем подбор дозы, обеспечивающей увеличение АЧТВ в 1,5–2,5 раза выше контрольной величины для конкретной лаборатории (верхняя граница нормы или среднее нормальное значение у здоровых лиц).
|
|
Бивалирудин
|
Сопровождение первичного ЧКВ: в/в болюсом 0,75 мг/кг с последующей инфузией 1,75 мг/кг/ч во время процедуры (при необходимости инфузию можно продолжить в той же дозе в течение 4 ч, а затем в дозе 0,25 мг/кг/ч вплоть до 12 ч); при сниженном клиренсе креатинина скорость инфузии следует уменьшить в соответствии с инструкцией к препарату. У пациентов с клиренсом креатинина 30–59 мл/мин размер болюса остается прежним, а скорость инфузии следует уменьшить до 1,4 мг/кг/ч; у пациентов с клиренсом креатинина <30 мл/мин или находящихся на диализе бивалирудин противопоказан.
|
|
#Эноксапарин натрия**
|
Сопровождение ТЛТ (у мужчин с уровнем креатинина в крови <2,5 мг/дл (221 мкмоль/л) и женщин с уровнем креатинина в крови <2,0 мг/дл (177 мкмоль/л)): в/в болюс 30 мг; через 15 мин под кожу живота в дозе 1 мг/кг 2 раза/сут. до 8-го дня болезни или выписки из стационара или успешного ЧКВ, если это произошло раньше (первые 2 дозы для подкожного введения не должны превышать 100 мг). У лиц ≥75 лет первоначальная в/в доза препарата не вводится, а поддерживающая уменьшается до 0,75 мг/кг (первые 2 дозы не должны превышать 75 мг). При сниженной функции почек (клиренс креатинина <30 мл/мин) препарат вводится подкожно в дозе 1 мг/кг 1 раз сут. вне зависимости от возраста.
Сопровождение первичного ЧКВ: в/в болюсом 0,5 мг/кг, при процедуре длительностью более 2 часов дополнительный болюс 0,25 мг/кг [524, 525]. Данная доза применяется в т.ч. у пациентов, принимающих прямые оральные антикоагулянты (АТХ-группы Прямые ингибиторы тромбина, В01АЕ и Прямые ингибиторы фактора Ха, В01АF).
ЧКВ на фоне начатого введения лечебных доз эноксапарина натрия**: если после подкожной инъекции препарата прошло не более 8 ч, дополнительного введения антикоагулянтов не требуется (если была сделана только одна подкожная инъекция эноксапарина натрия** — перед процедурой ввести в/в болюсом 0,3 мг/кг [14, 193, 526]), после 12 ч от последней инъекции во время ЧКВ можно использовать любой антикоагулянт (в том числе эноксапарин натрия** в/в болюсом в дозе 0,5 мг/кг). Устройство для введения катетеров может быть удалено из бедренной артерии через 6–8 ч после последней п/к инъекции эноксапарина натрия** и через 4 ч после в/в введения препарата.
Профилактика венозного тромбоза и ТЭЛА:
под кожу живота, 40 мг 1 раз/сут. (если нет необходимости в более высоких дозах антикоагулянтов).
|
|
Фондапаринукс натрия
|
Сопровождение ТЛТ стрептокиназой или отсутствие реперфузионного лечения (у пациентов с уровнем креатинина в крови <3,0 мг/дл или 265 мкмоль/л): в/в болюсом 2,5 мг; со 2-х суток п/к живота в дозе 2,5 мг 1 раз/сут до 8-го дня болезни или выписки из стационара или успешного ЧКВ, если это произошло раньше. Противопоказан при клиренсе креатинина <20 мл/мин.
Профилактика венозного тромбоза и ТЭЛА: п/к живота 2,5 мг 1 раз/сут (если нет необходимости в более высоких дозах антикоагулянтов).
|
Дозы антитромботических средств при нарушенной функции почек [14]
|
Препарат
|
рСКФ 30-59 мл/мин/1,73 м2
или
КлКр 30–59 мл/мин
|
рСКФ 15-29 мл/мин/1,73 м2
или
КлКр 15–29 мл/мин
|
рСКФ < 15 мл/мин/1,73 м2
или
КлКр < 15 мл/мин
|
||
|---|---|---|---|---|---|
|
Антитромбоцитарные препараты
|
|||||
|
АСК**
|
Неотлож-ная помощь
|
Доза не меняется
|
|||
|
Плановое назначение
|
Согласно инструкции, АСК** противопоказана при тяжелом нарушении функции почек без уточнения уровня КлКр / рСКФ. В таких случаях рекомендуется индивидуальная оценка пользы/рисков назначения.
|
||||
|
Клопидог-
рел**1
|
Неотлож-
ная помощь
|
Обычная доза
|
Обычная доза
|
Нет данных. В таких случаях рекомендуется индивидуальная оценка пользы/рисков назначения с учетом данных инструкции2.
|
|
|
Плановое назначение
|
Обычная доза
|
Обычная доза
|
|||
|
Прасугрел
|
Обычная доза
|
Обычная доза
|
Опыт применения прасугрела у пациентов с почечной недостаточностью ограничен. Для пациентов с почечной недостаточностью, включая пациентов с терминальной почечной недостаточностью, коррекции дозы не требуется. Тем не менее, Рекомендации ЕОК использовать не рекомендуют [14].
|
||
|
Тикагрелор**3
|
Обычная доза
|
Обычная доза
|
Отсутствует информация о применении препарата у пациентов на гемодиализе, поэтому его применение у этих пациентов не показано. Не требуется корректировать дозу препарата у пациентов с почечной недостаточностью. Тем не менее, Рекомендации ЕОК использовать не рекомендуют.
|
||
|
РF(ab`)2 фрагменты антител моноклональных FRaMon
|
В инструкции к препарату нет ограничений со стороны функции почек. Рекомендуется учитывать общий риск геморрагических осложнений.
|
||||
|
Тирофибан
|
В инструкции к препарату нет ограничений со стороны функции почек. Рекомендуется учитывать общий риск геморрагических осложнений.
|
||||
|
Эптифибатид1
|
КлКр ≥50 мл/мин: обычная доза.
КлКр ≥30, но <50 мл/мин: доза для инфузии снижена до 1,0 мкг/кг/мин.
|
Данных нет.
Клинические рекомендации ЕОК использовать не рекомендуют.
|
|||
|
Антикоагулянты
|
|||||
|
Гепарин натрия** (НФГ)
|
Доза подбирается под контролем АЧТВ независимо от фильтрационной функции почек
|
||||
|
Эноксапарин натрия**
|
Обычная доза
|
Согласно инструкции, при тяжелой почечной недостаточности (без указания количественного уровня):
у пациентов <75 лет: увеличить интервал между введением препаратов с 12 до 24 ч;
у пациентов ≥75 лет и старше: увеличить интервал между введением препаратов с 12 до 24 ч, при этом доза на каждое введение — 1 мг/кг.
|
Не рекомендуется (нет данных)
|
||
|
Фондапаринукс натрия1
|
Не рекомендован у пациентов с КлКр <20 мл/мин. Коррекция дозы не требуется у пациентов с КлКр ≥20 мл/мин.
|
||||
|
Бивалирудин
|
Доза не меняется, за исключением
пациентов, которым предстоит ЧКВ: скорость инфузии должна быть снижена до 1,4 мг/кг/ч. (первоначальная доза 0,75 мг/кг, которую вводят струйно, не изменяется).
Во время проведения ЧКВ рекомендуется проводить контроль времени свертывания, например, АВС. Значение АВС необходимо проверять через 5 мин после струйного введения первоначальной дозы. Если величина АВС составляет менее 225 с, то необходимо повторно струйно ввести препарат в дозе 0,3 мг/кг и еще раз проверить АВС через 5 мин после введения повторной дозы.
|
Противопоказан
|
|||
|
Ривароксабан**1 в дозе 2,5 мг 2 раза в сутки
|
Доза без изменений, но применять с осторожностью при одновременном назначении препаратов, повышающих концентрацию ривароксабана** в плазме крови.
|
Доза без изменений, но применять с осторожностью
|
Противопоказан
(данных нет)
|
||
Примечания: КлКр — клиренс креатинина;
1 - для данных препаратов, согласно инструкции, оценка функции почек с целью безопасности их назначения, должна производиться с использованием КлКр;
2 - после повторных приемов клопидогрела** в дозировке 75 мг/сут у пациентов с тяжелым поражением почек (КлКр — от 5 до 15 мл/мин) ингибирование АДФ-индуцированной агрегации тромбоцитов (25%) было ниже по сравнению с таковым у здоровых добровольцев, однако удлинение времени кровотечения сравнимо с данными у здоровых добровольцев, получавших клопидогрел** в дозировке 75 мг/сут.
3 - В качестве превентивной меры следует избегать применения тикагрелора у пациентов с гиперурикемической нефропатией.
Медикаментозное лечение ИМпST
Таблица 1
Блокаторы β-адренергических рецепторов при ИМпST
|
Препарат
|
Доза*
|
|---|---|
|
Парентеральные формы
|
|
|
Метопролол**
|
В/в медленно под контролем ЭКГ и АД по 5 мг 2–3 раза с интервалом как минимум 2 мин; при хорошей переносимости через 15 мин после последнего в/в введения прием внутрь до 50 мг каждые 6 ч в течение 48 ч.
|
|
Эсмолол
|
При наджелудочковой тахикардии (за исключением синдрома предвозбуждения желудочков), когда другие в/в или пероральные бета-блокаторы нецелесообразно или невозможно применить, в/в инфузия под контролем ЭКГ и АД; нагрузочная доза 0,5 мг/кг в течение 1 мин, затем 0,05 мг/кг/мин в течение 4 мин, при недостаточном эффекте увеличение скорости инфузии на 0,05 мг/кг/мин каждые 4 мин вплоть до 0,3 мг/кг/мин; если необходим более быстрый эффект, перед 2-м и 3-м увеличением дозы можно ввести дополнительные болюсы по 0,5 мг/кг. Гемодинамический эффект сохраняется 20–30 мин после прекращения введения. При переходе на прием других бета-адреноблокаторов внутрь через 1 ч после их первого назначения необходимо снизить дозу эсмолола на 50%; обычно эсмолол отменяют после перорального приема второй дозы бета-адреноблокатора, если за это время поддерживались надлежащие ЧСС и АД.
|
|
Пероральные формы*, &
|
|
|
#Карведилол** #
|
Внутрь; начальная доза 3,125–6,25 мг 2 раза/сут., при хорошей переносимости увеличение дозы с интервалом 3–10 сут. до 25 мг 2 раза/сут. У пациентов с ХСН и другими ограничениями к применению бета-адреноблокатров целесообразна медленная титрация дозы.
|
|
Метопролол**
|
Целевая доза метопролола при ИМ внутрь 100 мг в 2 раз в сутки, при применении пролонгированных форм — 200 мг 1 раз в сутки. Начальная доза 12,5–25 мг 2 раза/сут. у пациентов с ХСН и другими органичениями к применению бета-адреноблокаторов.
|
Примечания: В пределах одной группы лекарственные средства перечислены по алфавиту; лечение β-адреноблокаторами, начатое в первые сутки заболевания, при отсутствии противопоказаний должно продолжаться неопределенно долго;
*указаны ориентировочные дозы, которые могут быть меньше или несколько выше в зависимости от индивидуальной переносимости и клинического эффекта у конкретного пациента;
**могут использоваться и другие препараты в надлежащих дозах, не обладающие внутренней симпатомиметической активностью;
#свидетельство положительного влияния на выживаемость получено у пациентов с существенно нарушенной сократительной функцией ЛЖ (ФВ ≤40%);
&положительное влияние на выживаемость пациентов с ХСН при существенно нарушенной сократительной функции ЛЖ показано для бисопролола** в целевой дозе 10 мг 1 раз в сутки, карведилола** в целевой дозе 25 мг 2 раза в сутки и метопролола сукцината пролонгированного действия в целевой дозе 200 мг 1 раз в сутки.
Таблица 2
Блокаторы ренин-ангиотензин-альдостероновой системы при ИМпST
|
Препарат
|
Доза*
|
|---|---|
|
Ингибиторы ангиотензинпревращающего фермента
|
|
|
Каптоприл**
|
Внутрь; первая доза 6,25 мг, через 2 часа 12,5 мг, через 12 часов 25 мг. Целевая доза 100 мг за 2 приема на 4 недели. По истечении 4 недель следует вновь оценить состояние пациента и при хорошей переносимости продолжить терапию в дозе 50 мг 3 раза в стуки.
|
|
Лизиноприл**
|
Внутрь; первая доза 5 мг, через 24 ч – 5 мг; целевая доза 10 мг 1 раз в сутки.
|
|
Зофеноприл
|
Внутрь; 7,5 мг 2 раза в сутки в 1–2-е сутки, при хорошей переносимости 15 мг 2 раза в сутки на 3–4-е сутки, затем 30 мг 2 раза в сутки.
|
|
Рамиприл** &
|
Внутрь; начальная доза: 2,5 мг 1 раз в сутки. Рекомендуется удваивать дозу с интервалом 1–2 недели; целевая доза 5 мг 2 раза в сутки
|
|
Эналаприл**
|
Внутрь; начальная доза 2,5 мг; целевая доза 10 мг 2 раза/сут.
|
|
Блокаторы рецептора ангиотензина II
|
|
|
Валсартан
|
Внутрь; первая доза 20 мг 2 раза в сутки с постепенным увеличением до 160 мг 2 раза/сут.
|
|
Антагонисты альдостерона
|
|
|
Эплеренон#
|
Внутрь при уровне креатинина в крови у мужчин <2,5 мг/дл (220 мкмоль/л), <2,0 мг/дл (177 мкмоль/л) у женщин и уровне калия в крови <5 ммоль/л; первая доза 25 мг 1 раз/сут при хорошей переносимости у пациентов, не принимающих амиодарон**, дилтиазем или верапамил, в ближайшие 4 недели увеличение дозы до 50 мг 1 раз/сут.
|
|
#Спиронолак-тон**
|
При наличии показаний (см. раздел 3.2.7.) внутрь при уровне креатинина в крови < 220 мкмоль/л и уровне калия к крови <5 ммоль/л; доза - 25 мг 1 раз в день. Перерыв в приеме при уровне калия в крови >5,5 ммоль/л, отмена при уровне калия в крови > 6 ммоль/л [300, 535, 536].
|
Примечания: В пределах одной группы лекарственные средства перечислены по алфавиту; лечение иАПФ следует начать как можно раньше (с первых часов заболевания), как только стабилизируется гемодинамика (в частности, САД станет не <100 мм рт.ст.) и при отсутствии противопоказаний продолжать неопределенно долго;
* особенности подбора дозы у конкретного пациента зависят от реакции АД, уровня креатинина и калия в крови; если достичь целевой дозы препарата не удается, следует использовать максимально переносимую дозу.
Таблица 3
Органические нитраты
|
Препарат
|
Доза
|
|---|---|
|
Нитроглицерин**
|
Внутривенная инфузия 5–166 мкг/мин; обычно сначала инфузия 10–20 мкг/мин с возможным увеличением на 5–10 мкг/мин каждые 5–10 мин до уменьшения симптомов и/или снижения систолического АД на 10–15% при исходно нормальном АД и на 25–30% при АГ (но не ниже 95 мм рт. ст.).
|
Внутривенная инсулинотерапия при ИМпST
Показания для инсулинотерапии у пациентов ИМпST и СД
-
СД 1 типа
-
Глюкоза плазмы при поступлении и последующих определениях стойко выше 10 ммоль/л
-
Диабетический кетоацидоз
-
Гиперосмолярное гипергликемическое состояние
-
Известное лечение высокими дозами стероидов
-
Парентеральное питание
-
Тяжелое/критическое состояние
-
Кардиогенный шок, выраженная застойная СН, тяжелая постинфарктная стенокардия, артериальная гипотензия, тяжелые нарушения сердечного ритма
-
Любая степень нарушения сознания
Алгоритм для непрерывной внутривенной инфузии инсулинов
-
Непрерывная внутривенная инфузия инсулинов проводится через отдельный инфузомат с применением раствора инсулинов и аналогов быстрого действия действия с концентрацией 1 ед/1 мл 0,9 % раствора натрия хлорида**. В отсутствие инфузомата допускается внутривенное капельное введение.
-
Рекомендуется определять уровень глюкозы плазмы 1 раз в час до ее стабилизации в выбранном целевом диапазоне минимум 4 часа; затем 1 раз в 2 часа в течение 4 часов; в дальнейшем — 1 раз в 4 часа. У пациентов в критическом состоянии требуется определять глюкозу плазмы 1 раз в час даже при стабильном целевом уровне.
-
Рекомендуемая средняя начальная скорость непрерывной внутривенной инфузии инсулинов у пациентов, уже имеющих уровень глюкозы плазмы в целевом диапазоне — 0,5–1 ед/ч, для не находящихся в целевом диапазоне — 2–3 ед/ч (при наличии кетоацидоза — 0,1 ед/кг массы тела в час (но не более 15 ед/ч). Более низкая начальная скорость (<0,5 ед/ч) используется при дефиците массы тела, почечной, печеночной или надпочечниковой недостаточности. Более высокая начальная скорость (> 3 ед/ч) используется при сверхвысокой гипергликемии (более 25 ммоль/л) и предполагаемой инсулинорезистентности (выраженном ожирении, признаках инфекции, хронической терапии стероидами).
-
Одновременно с непрерывной внутривенной инфузией инсулинов желательно наладить инфузию 5–10 % раствора глюкозы (требуется вводить 5 г глюкозы в час). Важно вводить инсулины и декстрозу** через разные инфузионные системы, так как требуется частая раздельная коррекция скорости инфузии каждого из двух растворов. При уровне глюкозы плазмы выше 14 ммоль/л глюкозу не вводят (до следующего определения ее уровня).
-
При уровне ГП менее 3,3 ммоль/л требуется остановить инфузию инсулинов и ввести внутривенно 30–60 мл 40% раствора глюкозы, при необходимости повторять введение декстрозы** каждые 20 минут. После двукратного подтверждения уровня глюкозы плазмы выше 3,9 ммоль/л следует возобновить инфузию инсулинов с меньшей скоростью.
-
При переходе на подкожное введение инсулинов его инфузию прекращают через 1–2 часа после первой подкожной инъекции инсулинов и аналогов быстрого действия, или через 2–3 часа после первой инъекции инсулинов и аналогов длительного действия.
Рекомендуемая скорость инфузии инсулинов в зависимости от уровня глюкозы плазмы
|
Глюкоза (ммоль/л)
|
<3,9
|
3,9–6,1
|
6,2–6,6
|
6,7–8,3
|
8,4–9,9
|
10–13,3
|
13,4–16,6
|
16,7–19,9
|
>20
|
|---|---|---|---|---|---|---|---|---|---|
|
Скорость введения инсулинов (ед./час)
|
Не вводить
|
0,2
|
0,5
|
1
|
1,5
|
2
|
3
|
4
|
6
|
У отдельных пациентов (ранее получавших более 80 ЕД инсулинов в сутки, получающих кортикостероиды, не достигающих целевой гликемии при использовании предлагаемого алгоритма) может потребоваться использование более интенсивных алгоритмов. У пациентов с повторным определением уровня глюкозы менее 3,9 ммоль/л (два раза подряд) требуется перейти на менее интенсивный алгоритм. Ознакомиться с этими алгоритмами можно в рекомендациях по ведению пациентов с сахарным диабетом.
Классификация сердечной недостаточности при ИМ по Killip [358, 359]
|
Класс
|
Признаки
|
Госпитальная смертность*
|
|---|---|---|
|
I
|
Нет признаков сердечной недостаточности
|
2–3%
|
|
II
|
III тон, влажные хрипы в нижних отделах легких
|
5–12%
|
|
III
|
Отек легких, влажные хрипы выше углов лопаток
|
10–20%
|
|
IV
|
Кардиогенный шок
|
50–81%
|
Гемодинамические варианты кардиогенного шока
|
Волемический статус
|
||
|---|---|---|
|
|
Мокрый
|
Сухой
|
|
Холодный
|
Классический
кардиогенный шок
(↓СИ, ↑ОПСС, ↑ДЗЛК)
|
Эуволемический кардиогенный шок
(↓СИ, ↑ОПСС, нормальное ДЗЛК)
|
|
Теплый
|
Вазодилататорный кардиогенный шок или смешанный шок
(↓СИ, ↓ОПСС, ↑ДЗЛК)
|
Вазодилататорный
(некардиогенный) шок
(↑СИ, ↓ОПСС, ↓ ДЗЛК)
|
Примечания: ДЗЛК – давление заклинивания легочных капилляров, ОПCC – общее периферическое сосудистое сопротивление, СИ – сердечный индекс, ↓ – снижение, ↑ – повышение.
Параметры для мониторирования у пациента с кардиогенным шоком
|
Параметр
|
Номенклатура медицинских услуг
|
Частота измерения
|
Обоснование
|
|---|---|---|---|
|
Кардиомониторинг, пульсоксиметрия, частота дыхательных движений
|
А12.30.004 Суточное прикроватное мониторирование жизненноважных функций и параметров,
А05.10.007 Мониторирование электрокардио-графических данных,
А05.12.008 Чрескожный мониторинг парциального давления кислорода,
А02.12.001.001 Исследование пульса методом мониторирования,
В03.003.003 Суточное наблюдение врачом-анестезиологом-
реаниматологом,
В03.003.005 Суточное наблюдение реанимационного пациента
В03.015.002 Контроль степени повреждения миокарда при инфаркте миокарда
|
Непрерывно
|
Высокий процент нарушений ритма, высокий риск отека легких, ИВЛ
|
|
Инвазивное измерение АД (артериальная линия)
|
А11.12.012 Катетеризация артерий конечностей,
А02.12.002.002
Дистанционное наблюдение за показателями артериального давления,
А14.12.001 Уход за сосудистым катетером
|
Непрерывно
|
Прекращение инвазивного мониторирования АД не ранее 12–24 ч после прекращения введения вазоактивных препаратов
|
|
ЦВД
|
А02.12.003 измерение центрального венозного давления,
А11.12.001 катетеризация подключичных и других центральных вен,
А14.12.001 Уход за сосудистым катетером
|
Не менее 4 раз в сутки
|
Продленное мониторирование ЦВД позволяет оценивать волемический статус пациента
|
|
Смешанная венозная сатурация
|
А11.12.001 катетеризация подключичных и других центральных вен
В03.016.011
Исследование кислотно-основного состояния и газов крови
А14.12.001 Уход за сосудистым катетером
В03.003.003 Суточное наблюдение врачом-анестезиологом-
реаниматологом
|
Каждые 4 ч
|
Мониторирование смешанной венозной сатурации позволяет судить о изменении сердечного выброса и оценивать эффективность вазоактивной терапии
|
|
Темп диуреза
|
А11.28.007 катетеризация мочевого пузыря,
В03.003.005 Суточное наблюдение реанимационного пациента,
А14.28.002 Уход за мочевым катетером
|
Каждый час
|
Темп диуреза и уровень креатинина сыворотки — показатель почечной перфузии
|
|
Инвазивный мониторинг гемодинамики и неинвазивный мониторинг сердечного выброса
|
А11.12.001 катетеризация подключичных и других центральных вен,
А11.10.005 Зондирование камер сердца,
А24.12.001 Исследование гемодинамики методом термодилюции,
А04.10.002 Эхокардиография,
А12.10.003 Исследование сердечного выброса,
А14.12.001 Уход за сосудистым катетером
|
При необходимос-ти
|
Является обязательным при отсутствии эффективности стартовой терапии и неясности диагноза
|
|
Общий (клинический) анализ крови
|
В03.016.002 Общий (клинический) анализ крови
В03.016.003 Общий (клинический) анализ крови развернутый
|
Каждые
12–24 ч
|
Чаще для пациентов с возможным кровотечением
|
|
Электролиты
|
А09.05.031 исследование уровня калия в крови, А09.05.127 исследование уровня общего магния в сыворотке крови,
А09.05.034 Исследование уровня хлоридов в крови,
А09.05.030
Исследование уровня натрия в крови,
А09.05.032 Исследование уровня общего кальция в крови
|
Каждые
6–12 ч
|
|
|
Креатинин
|
А09.05.020 Исследование уровня креатинина в крови
|
Каждые
12–24 ч
|
|
|
АСТ, АЛТ, ЛДГ, биллирубин
|
А09.05.041 Определение активности аспартатамино-трансферазы в крови,
А09.05.042 Определение активности аланинамино-трансферазы в крови,
А09.05.039 Определение активности лактатдегидрогеназы в крови,
А09.05.021 Исследование уровня общего билирубина в крови
|
Ежедневно
|
Мониторинг застоя в печени, острого печеночного повреждения
|
|
Лактат
|
В03.016.011 Исследование кислотно-основного состояния и газов крови
|
Каждые 1–4 ч
|
Клиренс лактата отражает тяжесть полиорганной недостаточности. Снижение выведения лактата ассоциировано с увеличением летальности
|
|
Коагулограмма (ориентировочное исследование системы гемостаза)
|
В03.005.006 Коагулограмма (ориентировочное исследование системы гемостаза)
|
Каждые 4–6 ч для пациентов с продленной инфузией НФГ**, каждые 24 ч для пациентов без антикоагулянтов
|
|
Примечания: НМУ – номенклатура медицинских услуг, АД – артериальное давление, АЛТ – aланинаминотрансфераза, АСТ – аспартатаминотрансфераза, ИВЛ - искусственная вентиляция лёгких, ЛДГ – лактатдегидрогеназа, НФГ – нефракционированный гепарин натрия**, ЦВД – центральное венозное давление.
Стадии кардиогенного шока в зависимости от клинической тяжести и реакции на лечение
|
Стадии кардиогенного шока
|
Клиническая характеристика
|
|---|---|
|
Прешок
|
У пациента нет признаков или симптомов кардиогенного шока, но есть риск развития – острый ИМ, признаки ОСН или декомпенсации ХСН
|
|
Развернутая картина кардиогенного шока
|
Признаки гипоперфузии тканей. Влажные хрипы в легких. Диурез менее 30 мл/час. Уровень лактата от 2 ммоль/л и выше. При инвазивном мониторинге гемодинамики СИ ниже 2,2 л/мин/м2, ДЗЛК выше 15 мм рт. ст.
|
|
Резистентный кардиогенный шок
|
Состояние пациентов, симптомы и признаки шока как на предыдущей стадии, но не улучшаются на фоне лечения или ухудшаются. Уровень лактата сохраняется выше 2 ммоль/л и повышается. Показатели функции печени и почек ухудшаются.
|
Примечания: ДЗЛК – давление заклинивания легочных капилляров, ИМ – инфаркт миокарда, ОСН – острая сердечная недостаточность, СИ – сердечный индекс, ХСН – хроническая сердечная недостаточность.
Cтадии кардиогенного шока согласно классификации Американского общества сердечно-сосудистой ангиографии и интервенции (SCAI)
|
Стадии кардиогенного шока
|
Характеристика пациентов
|
|---|---|
|
E (extremis)
|
Пациенты в состоянии остановки кровообращения и продолжающейся сердечно-легочной реанимации, которым проводится активная коррекция всеми методами, включая ЭКМО
|
|
D (deteriorating)
|
Пациенты с признаками кардиогенного шока, не отвечающими на терапию в течение 30 минут
|
|
C (classic)
|
Пациенты с гипоперфузией, требующей оценки и коррекции волемического статуса и лечения (инотропная, вазопрессорная или механическая поддержка кровообращения, ЭКМО)
|
|
B (beginning)
|
Пациенты с ИМ с гипотензией без признаков гипоперфузии
|
|
A (at risk)
|
Пациенты с острым ИМ
|
Примечания: Адаптировано из [374]. ИМ – инфаркт миокарда, ЭКМО - экстракорпоральная мембранная оксигенаци.
Основные противопоказания к проведению физических тренировок:
- ОКС;
- острая и подострая аневризма ЛЖ, подтвержденная инструментальными методами диагностики;
- наличие внутрисердечных тромбов;
- сердечная недостаточность IV ФК по NYHA;
- нарушения сердечного ритма (желудочковые экстрасистолы и тахикардия опасных градаций, пароксизмальные тахиаритмии, возникающие при физической нагрузке), не корригируемые оптимальной терапией;
- нарушения проводимости (синоатриальная и АВ блокады 2-3-ей степени, кроме пациентов с имплантированными ЭКС**);
- неконтролируемая АГ ( > 180/110 мм рт. ст.; снижение систолического АД ≥ 20 мм рт. ст. при физической нагрузке);
- выраженный аортальный стеноз;
- тяжелая обструктивная гипертрофическая кардиомиопатия;
- острый перикардит, миокардит, эндокардит;
- диссекция аорты;
- синкопальные состояния;
- тромбоэмболия или тромбофлебит (в сроки до 3 месяцев);
- ОНМК или ТИА (в сроки до 3 месяцев);
- неконтролируемый СД;
- острое инфекционное заболевание (в том числе и вирусные инфекции);
- заболевания опорно-двигательного аппарата;
- тяжелая сопутствующая патология.
Приложение Б. Алгоритмы действий врача
Приложение Б1. Выбор реперфузии у пациента с ИМпST
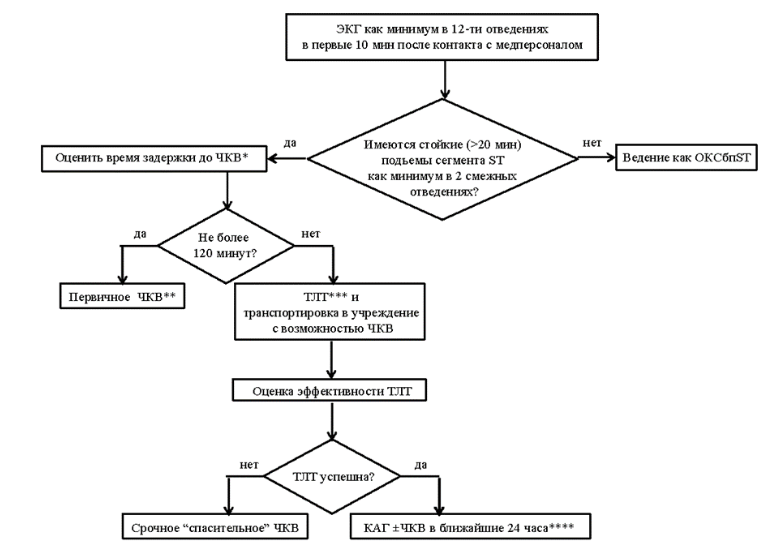

Примечания: КГ — коронарография; ТЛТ — тромболитическая терапия; ЧКВ — чрескожное коронарное вмешательство (как правило, со стентированием).
* от постановки диагноза до проведения проводника в инфаркт-связанную артерию;
** предпочтительно в первые 60 мин и максимум в первые 90 мин от постановки диагноза, предпочтительно в учреждениях с программой выполнения первичного ЧКВ 24 часа 7 дней в неделю; при невозможности выполнить первичное ЧКВ в первые 60 минут после госпитализации пациента в ЧКВ-центр (и/или в первые 120 минут от постановки диагноза догоспитально), возможно оценить целесообразность проведения госпитальной ТЛТ
*** предпочтительно на догоспитальном этапе, в течение 10 мин от постановки диагноза.
Приложение Б2. Варианты реперфузии и временные задержки при ИМпST
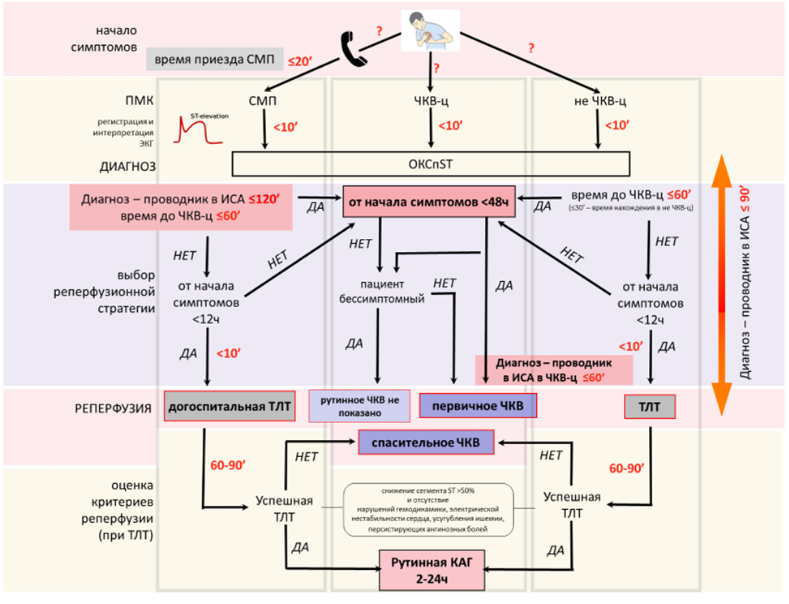
Примечания:
ИСА — инфаркт-связанная артерия; КГ — коронарография; ОКСпST — острый коронарный синдром с подъемом сегмента ST; ПМК — первичный медицинский контакт; СМП — скорая медицинская помощь; ТЛТ — тромболитическая терапия; ЧКВ — чрескожное коронарное вмешательство; ЧКВ-ц — центр с возможностью проведения чрескожного коронарного вмешательства; не ЧКВ-ц — центр без возможности проведения чрескожного коронарного вмешательства.
Пояснения:
1. НАЧАЛО СИМПТОМОВ
Время от вызова пациентом бригады скорой медицинской помощи (СМП) до ее прибытия не должно превышать 20 минут.
2. Первый медицинский контакт — ДИАГНОЗ
Первый контакт пациента с подозрением на ОКСпST с медицинским персоналом обозначается термином первичный медицинский контакт (ПМК). ПМК может осуществляться бригадой СМП, врачами стационара с возможностью проведения чрескожного коронарного вмешательства (ЧКВ-ц) или врачами стационара без возможности проведения чрескожного коронарного вмешательства (не ЧКВ-ц). Время от момента ПМК до постановки диагноза ОКСпST в каждом из трех случаев не должно превышать 10 минут. Это время необходимо для регистрации и интерпретации электрокардиограммы (ЭКГ).
3. ВЫБОР РЕПЕРФУЗИОННОЙ СТРАТЕГИИ и 4. РЕПЕРФУЗИЯ
После постановки диагноза необходимо выбрать метод реперфузии (выбор реперфузионной стратегии): первичное чрескожное коронарное вмешательство (пЧКВ) или тромболитическая терапия (ТЛТ):
- если персонал СМП или не ЧКВ-ц рассчитывает, что время от момента постановки диагноза ОКСпST до проведения проводника в инфаркт-связанную артерию (ИСА) не должно превышать 120 минут, следует выбрать тактику пЧКВ и не проводить ТЛТ. Этот временной отрезок включает время транспортировки (не более 60 минут) и время от постановки/подтверждения диагноза в ЧКВ-ц до проведения проводника в инфаркт-связанную артерию (ИСА) (не более 60 минут);
- если после постановки диагноза ОКСпST бригадой СМП пациент госпитализирован в не ЧКВ-ц, и расчетное время от момента постановки диагноза до проведения проводника в инфаркт-связанную артерию (ИСА) (т.е. до пЧКВ) не превышает 120 минут, пациент должен быть транспортирован в ЧКВ-ц, при этом время от госпитализации в не ЧКВ-ц до начала транспортировки в ЧКВ-ц не должно превышать 30 минут;
- если персонал СМП или не ЧКВ-ц рассчитывает, что время от момента постановки диагноза до проведения проводника в инфаркт-связанную артерию (ИСА) (т.е. до пЧКВ) превысит 120 минут, и от начала симптомов прошло не более 12 часов, пациенту показано проведение тромболитической терапии;
- если врачи СМП или врачи не ЧКВ-ц рассчитывают, что время от момента постановки диагноза до проведения проводника в инфаркт-связанную артерию (ИСА) (т.е. до пЧКВ) превысит 120 минут, но от начала симптомов прошло более 12 часов, пациент транспортируется в ЧКВ-ц;
- когда пациент госпитализирован в ЧКВ-ц и время от начала симптомов не превышает 48 часов, проводится пЧКВ;
- в случае, если время от начала симптомов превышает 48 часов и пациент бессимптомен (нет симптомов ишемии или гемодинамической нестабильности или жизнеугрожающих нарушений ритма и проводимости и т.д.), рутинное ЧКВ не проводится;
- в случае, если время от начала симптомов превышает 48 часов и есть симптомы ишемии или гемодинамическая нестабильность, или жизнеугрожающие нарушения ритма и проводимости, проводится пЧКВ;
- после транспортировки пациента в ЧКВ-ц время от постановки/подтверждения диагноза в ЧКВ-ц до проведения проводника в ИСА не должно превышать 60 минут;
- если в качестве реперфузионного метода выбрана ТЛТ, то время от момента принятия решения до введения тромболитического средства не должно превышать 10 минут;
- после введения тромболитического средства бригадой СМП или врачами не ЧКВ-ц пациент должен быть транспортирован в ЧКВ-ц в максимально ранние сроки.
5. ОЦЕНКА КРИТЕРИЕВ РЕПЕРФУЗИИ (ПРИ ТЛТ) и ЧКВ после ТЛТ
- через 60–90 минут после осуществления тромболизиса должна проводиться оценка достижения реперфузии на основании ЭКГ (снижение сегмента ST >50% в отведения, где элевация сегмента ST была максимальной;
- если реперфузия не достигнута (отсутствует хотя бы один критерий достижения реперфузии), необходимо провести спасительное ЧКВ в максимально ранние сроки;
- если реперфузия достигнута (присутствуют все критерии достижения реперфузии), необходимо провести коронарную ангиографию и, при необходимости, ЧКВ, в сроки от 2 до 24 часов от начала тромболизиса.
Приложение Б3. Алгоритм взаимодействия отделения кардиореанимауии и отделения рентгенхирургических методов диагностики и лечения при кардиогенном шоке при наличии возможности выполнения ЭКМО в стационаре
-
Получение информации о предстоящем поступлении пациента с кардиогенным шоком (звонок из отдела госпитализации).
-
Обеспечение незанятости рентгеноперационной отделения эндоваскулярных вмешательств до момента определения необходимости выполнения ЭКМО поступающему с кардиогенным шоком пациенту.
-
Поступление пациента в стационар, совместный осмотр пациента врачом анестезиологом-реаниматологом отделения реанимации и интенсивной терапии (ОРИТ) ОИМ, врачом-кардиологом ОРИТ ОИМ, ответственным анестезиологом-реаниматологом, дежурным врачом РХМДЛ.
-
Принятие решения о тактике лечения: реваскуляризация без механической поддержки или реваскуляризация с использованием механической поддержки (ЭКМО).
-
Выполнение фокусированного ЭхоКГ-исследования с оценкой параметров гемодинамики.
-
Доставка пациента в отделение РХМДЛ.
-
Установка системы ЭКМО.
-
Выполнение ангиографии и реваскуляризации миокарда (желательно максимально полная реваскуляризация).
-
Дальнейшее ведение пациента в ОРИТ в соответствие со стандартами и протоколами.
-
Установка катетера в легочной артерии.
-
Решение о необходимости установки системы баллонной внутриаортальной контрапульсации (ВАБК) должно быть принято через 3 часа после инициации ЭКМО при признаках объемн.ой перегрузки левого желудочка (Эхо-признаки, высокое ДЗЛК).
Приложение Б4. Догоспитальный алгоритм действий врача скорой медицинской помощи или фельдшера при ИМпST
1. Сбор жалоб, анамнеза, оценка болевого синдрома, физикальное обследование, контроль показателей гемодинамики (АД, ЧСС).
2. Ограничение двигательной активности.
3. Регистрация ЭКГ как минимум в 12-ти отведениях и осуществление дистанционного консультирования ЭКГ (при необходимости и возможности проведения).
4. Начало непрерывного мониторирования ЭКГ, обеспечение внутривенного доступа, готовность к проведению дефибрилляции и сердечно-легочной реанимации.
5. Определение стратегии реперфузионной терапии.
(А) Стратегия первичного ЧКВ, если ожидаемое время от постановки диагноза до введения проводника в окклюзированную коронарную артерию составляет менее 120 минут (альтернативно – время транспортировки не более 60 минут). В этом случае применение АСК** в дозе 150-300 мг (разжевать; не принимать внутрь кишечнорастворимые лекарственные формы препарата). Возможен дополнительный прием клопидогрела** в дозе 600 мг или тикагрелора** в дозе 180 мг. При этом неназначение на догоспитальном этапе ингибиторов P2Y12 нельзя считать лечебной ошибкой, поскольку не доказано преимущество назначения этой группы препаратов догоспитально по сравнению с назначением в стационаре.
(Б) Догоспитальная ТЛТ (если нет противопоказаний), если невозможно своевременное выполнение первичного ЧКВ. Используются фибрин-специфичные тромболитики (АТХ-группа Ферментные препараты, B01AD). Тромболитики с однократным болюсным режимом введения предпочтительней, в связи с удобством и простотой введения. В дополнение к тромболитику следует использовать АСК** (разжевать 150-300 мг), клопидогрел** (внутрь 300 мг, у пациентов старше 75 лет – 75 мг), а также антикоагулянты (АТХ-группа Гепарин и его производные, B01AB). Препарат выбора – эноксапарин натрия** (внутривенный болюс у пациентов моложе 75 лет, однократное подкожное введение), также можно использовать НФГ (внутривенный болюс и инфузия).
(В) Отсутствие реперфузионного лечения (противопоказания для проведения ТЛТ, недоступность первичного ЧКВ). При отсутствии противопоказаний рассмотреть применение АСК** в дозе 150-300 мг (разжевать; не принимать внутрь кишечнорастворимые лекарственные формы препарата). Не применяются ингибиторы P2Y12 рецептора тромбоцитов и антикоагулянты.
6. кстренная госпитализация в стационар, включенный в систему маршрутизации пациентов с ОКС, предпочтительно с наличием возможности срочного выполнения ЧКВ (для пациентов с признаками шока или подозрением на механические осложнения ИМ – срочного выполнения ЧКВ или КШ). Следует информировать принимающий стационар о транспортировке пациента с ИМпST.
7. Купирование болевого синдрома.
При отсутствии артериальной гипотонии и других противопоказаний - нитроглицерин** в дозе 0,4–0,5 мг в виде таблеток под язык или аэрозоля (спрея). Если симптомы не исчезают через 5 минут, а препарат удовлетворительно переносится, можно использовать его повторно. В связи с опасностью артериальной гипотонии необходимо постоянно контролировать АД.
В случае интенсивного болевого синдрома или при неэффективности нитроглицерина необходимо внутривенное введение наркотического анальгетика. Доза наркотического анальгетика, необходимая для адекватного обезболивания, должна подбираться индивидуально. Препаратом выбора является морфин**. Перед использованием 10 мг морфина** разводят как минимум в 10 мл 0,9% раствора натрия хлорида**. Первоначально следует ввести в/в медленно 2–4 мг лекарственного вещества. При необходимости введение повторяют каждые 5–15 мин по 2–4 мг до купирования боли или возникновения побочных эффектов, не позволяющих увеличить дозу.
8. Лечение острой сердечной недостаточности, угрожающих жизни нарушений сердечного ритма и проводимости в соответствии с разделом 3.4 данных Рекомендаций.
9. В карте вызова и сопроводительном талоне указать время начала ОКС, время первого медицинского контакта, время регистрации ЭКГ, отметить проведённое на догоспитальном этапе лечение с указанием доз препаратов, время доставки пациента в стационар. Если известно, указать препараты, принятые пациентом в ближайшие 24 часа, время их приема и дозы.
Приложение В. Информация для пациента
Инфаркт миокарда — отмирание участка сердечной мышцы из-за недостаточной доставки к ней кислорода. В большинстве случаев это происходит из-за внезапно возникшей закупорки крупной коронарной артерии сердца тромбом. Тромб, как правило, возникает на поверхности разорвавшейся атеросклеротической бляшки.
В ранние сроки инфаркта миокарда повышен риск серьезных и угрожающих жизни осложнений инфаркта. Среди них — остановка сердца, разрыв сердца и острая сердечная недостаточность. Каждое из этих осложнений может быть смертельным. Часть из них может устраняться медицинскими работниками, находящимися рядом с пациентом. Эта возможность уменьшить риск смерти определяет необходимость нахождения рядом с медицинским персоналом и специальным оборудованием. Многие из этих осложнений предотвратимы. При быстром и качественном открытии коронарной артерии удается спасти существенную часть сердечной мышцы и уменьшить риск смертельных осложнений. Поэтому важнейшее значение имеет своевременное обращение пациента с развивающимся инфарктом миокарда за медицинской помощью. Другими словами, Вам, при появлении определенных жалоб необходимо срочно вызвать бригаду скорой медицинской помощи. Для инфаркта миокарда характерно возникновение давящей боли или дискомфорта за грудиной, которые не проходят в покое и после приема нитроглицерина**. Эти ощущения могут распространяться на шею, нижнюю челюсть, левую руку, под левую лопатку, в верхние отделы живота. Разобраться в ситуации и решить, что делать дальше, может специально обученный медицинский работник. Он зарегистрирует электрокардиограмму и, если результат укажет на прекращение кровотока по крупной коронарной артерии, определится с возможностью его восстановления. Это может быть как немедленное введение лекарственного средства, разрушающего тромбы, так и срочная транспортировка в лечебное учреждение, где проходимость коронарной артерии будет восстановлена механическим способом, и в сосуд изнутри установят специально разработанный каркас (стент). В любом случае из-за опасности вышеупомянутых серьезных осложнений лечение острого инфаркта миокарда проводится в специально созданных подразделениях лечебных учреждений.
Инфаркт миокарда — как правило, проявление прогрессирования атеросклероза, который развивается во всех артериях человека. Поэтому после выписки существует угроза повторного инфаркта миокарда и сосудистых катастроф в органах, кровоснабжаемых другими артериями. В связи с этой угрозой крайне важно не прекращать лечение, начатое в стационаре, и сосредоточиться на устранении факторов, способствующих прогрессированию атеросклероза. Следует отказаться от курения, обеспечить регулярную физическую активность, соблюдать диету, разработанную для таких случаев, избавиться от лишнего веса, следуя рекомендациям врача поддерживать низкие значения холестерина в крови с помощью лекарств, обеспечить стойкую нормализацию артериального давления (при наличии артериальной гипертонии), поддерживать нормальный уровень сахара в крови (при наличии сахарного диабета). Кроме того, при обширном поражении сердечной мышцы и/или осложнениях инфаркта миокарда требуется дополнительное лечение, которое назначается врачом. Известно, что преждевременное прекращение приема необходимых лекарств существенно увеличивает риск возникновения повторного инфаркта миокарда и смерти, появления сердечной недостаточности, которая может существенно ограничить вашу ежедневную активность. Отменять лекарства. не посоветовавшись с врачом, нельзя. Для снижения риска повторных событий (инфаркта миокарда, его осложнений) для вас крайне желательно участие в специальной программе реабилитации, включающей регулярные дозированные физические нагрузки, психологическую поддержку, организацию контроля за факторами риска. Спросите своего врача о вашей программе реабилитации, необходимой лекарственной терапии и изменениях в образе жизни.
При соблюдении всех рекомендаций и регулярном наблюдении у врача ваши шансы не подпустить к себе очередной инфаркт миокарда и его грозные осложнения, очень высоки. Сотрудничайте с врачом, и всё будет хорошо.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Шкала высокого риска кровотечений Консорциумa академических исследований при планирующемся/выполненном ЧКВ и/или у пациентов, нуждающихся в двойной антитромбоцитарной терапии
Оригинальное название: Academic Research Consortium for High Bleeding Risk
(ARC-HBR)
Источник: Urban P, Mehran R, Colleran R, Angiolillo DJ, Byrne RA, Capodanno D, et al. Defining high bleeding risk in patients undergoing percutaneous coronary intervention: a consensus document from the Academic Research Consortium for High Bleeding Risk. Eur Heart J 2019;40:2632–2653. https://doi.org/10.1093/eurheartj/ehz372 [225].
Тип (подчеркнуть): шкала оценки, индекс, вопросник, другое (уточнить).
Назначение: стандартизированный способ выявления пациентов с высоким риском кровотечений, которым планируется или которые перенесли ЧКВ и/или которым требуется двойная антитромбоцитарная терапия.
Содержание:
|
Большие критерии
|
Малые критерии
|
|---|---|
|
● Ожидаемый длительный прием перорального антикоагулянта
● Тяжелая или терминальная ХБП (рСКФ <30 мл/мин/1,72 м2)
● Гемоглобин <110 г/л
● Спонтанное кровотечение, потребовавшее госпитализации и/или гемотрансфузии, в предшествующие 6 месяцев или любой давности в случае рецидивирующего кровотечения
● Умеренная или тяжелая тромбоцитопения (<100,0 × 109 /л)
● Хронический геморрагический диатез
● Цирроз печени с портальной гипертензией
● Активное онкологическое заболевание (за исключением немеланомного рака кожи) в предшествующие 12 месяцев
● Перенесенное спонтанное внутричерепное кровотечение любой давности
● Травматическое внутричерепное кровотечение в предшествующие 12 месяцев
● Указания на наличие артериовенозной мальформацию головного мозга
● Тяжелый или умеренной тяжести ишемический инсульт в предшествующие 6 месяцев
● Недавнее большое хирургическое вмешательство или серьезная травма в предшествующие 30 дней
● Неотложное большое хирургическое вмешательство у пациента, получающего двойную антитромбцитарную терапию
|
● Возраст ≥ 75 лет
● Умеренная ХБП (рСКФ 30–59 мл/мин/1,72 м2)
● Гемоглобин 110–129 г/л для мужчин и 110–119 г/л для женщин
● Спонтанное кровотечение,
потребовавшее госпитализации
и/или гемотрансфузии, в предшествующие 12 месяцев, не соответствующее большому критерию
● Длительный пероральный прием нестероидных противовоспалительных препаратов или глюкокортикоидов
● Любой ишемический инсульт независимо от его давности, не отвечающий большому критерию
|
Ключ (интерпретация): о высоком риске кровотечений свидетельствует наличие как минимум одного большого или двух малых критериев.
Пояснения: рСКФ – расчетная скорость клубочковой фильтрации, ХБП – хроническая болезнь почек, ЧКВ – чрескожное коронарное вмешательство.
Приложение Г2. Оценка риска неблагоприятных событий у пациентов с ИМпST после выписки (для принятия решения о ранней выписке по шкале Zwolle*)
|
Фактор риска
|
Число баллов
|
|---|---|
|
Класс сердечной недостаточности по Killip
|
|
|
II
|
4
|
|
III
|
9
|
|
IV
|
9
|
|
Кровоток по инфаркт-связанной артерии (TIMI)
|
|
|
0
|
2
|
|
1
|
2
|
|
2
|
1
|
|
Возраст
|
|
|
Равен или старше 60 лет
|
2
|
|
Трехсосудистое поражение при КГ
|
|
|
Трехсосудистое поражение при КГ
|
1
|
|
ИМ в прошлом (данный ИМпST повторный)
|
|
|
ИМ в прошлом
|
1
|
|
Продолжительность ишемии > 4 часов
|
|
|
Продолжительность ишемии миокарда >4 часов
|
1
|
|
Интерпретация результата
|
|
|
Ранняя выписка (в пределах 72 часов от поступления)
|
Сумма баллов
|
|
Возможна
|
≤3
|
|
Не оправдана
|
≥4
|
Примечание: * — шкала предназначена для пациентов с ИМпST, подвергнутых первичному ЧКВ [70, 71, 500-502]
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.