Острый инфаркт миокарда неуточненный (I21.9)
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
Классификация
Клиническая классификация различных типов инфаркта миокарда
| Тип 1 | Спонтанный инфаркт миокарда, связанный с ишемией вследствие первичного коронарного события, такого как эрозия и/или разрыв, трещина или расслоение бляшки. |
| Тип 2 | Инфаркт миокарда, вторичный по отношению к ишемии, возникшей либо из-за повышения потребности в кислороде, либо из-за снижения его доставки, например, из-за спазма коронарной артерии, коронарной эмболии, анемии, гипертонии или гипотонии. |
| Тип 3 | Внезапная сердечная смерть, включая остановку сердца, часто с симптомами, заставляющими предположить наличие ишемии миокарда, сопровождающимися новыми подъемами сегмента ST, или новой блокады левой ножки пучка Гиса, или признаками свежего тромба в коронарной артерии по данным ангиографии и/или аутопсии. Смерть наступает или до взятия проб крови, или до появления сердечных биомаркеров в крови. |
| Тип 4а | Инфаркт миокарда, связанный (ассоциируемый) с чрескожным коронарным вмешательством (ЧКВ). |
| Тип 4b | Инфаркт миокарда, связанный с тромбозом стента, что документировано ангиографией или аутопсией. |
| Тип 5 | Инфаркт миокарда, связанный с операцией аорто-коронарного шунтирования. |
В зависимости от размеров очагового поражения сердечной мышцы, выделяют два вида инфаркта миокарда:
При мелкоочаговых инфарктах, в отличие от крупноочаговых, не возникают
а) периферические: леволопаточная, леворучная, гортанно-глоточная, нижнечелюстная, верхнепозвоночная, гастралгическая (абдоминальная);
Этиология и патогенез
Непосредственной причиной развития инфаркта миокарда (ИМ) является остро наступающее несоответствие коронарного кровообращения запросам миокарда вследствие
Инфаркт миокарда с патологическими зубцами Q (тромботическая окклюзия коронарной артерии) развивается у 80% больных с инфарктом миокарда и приводит к трансмуральному некрозу миокарда и появлению зубца Q на ЭКГ.
При крупноочаговом инфаркте миокарда примерно на 10-е сутки на периферии очага некроза уже образуется молодая грануляционная ткань, из которой в дальнейшем формируется соединительная ткань, выполняющая рубец. Заместительные процессы идут от периферии к центру, поэтому в центре очага какое-то время могут еще оставаться очаги размягчения, а это участок, который способен растягиваться, формируя аневризму сердца или даже разрываться при грубом несоблюдении двигательного режима или других нарушениях. В месте некроза плотная рубцовая ткань окончательно формируется не ранее чем через 3-4 месяца.
При мелкоочаговом инфаркте миокарда рубец иногда образуется в более ранние сроки. На скорость рубцевания влияют не только размеры очага некроза, но и состояние коронарного кровообращения в миокарде, в особенности в периинфарктных участках. Помимо этого, имеют значение следующие факторы:
Эпидемиология
Признак распространенности: Очень распространено
Заболеваемость среди мужчин гораздо выше, чем среди женщин: в среднем 500 на 100 000 мужчин и 100 на 100 000 женщин, в возрасте старше 70 лет эта разница нивелируется.
Факторы и группы риска
Факторы риска развития инфаркта миокарда (ИМ) совпадают с таковыми при ишемической болезни сердца (ИБС).
2. Возраст. В разных популяциях выявлена прямая зависимость между возрастом человека и частотой возникновения ИБС - чем старше человек, тем выше заболеваемость ИБС.
1. Неправильное питание. Употребление пищи, богатой насыщенными жирами животного происхождения, с высоким содержанием поваренной соли и низким содержанием пищевой клетчатки.
Частота развития ОИМ возрастает в утренние часы, в течение первого часа после пробуждения. Это касается и частоты развития внезапной смерти, инсульта, транзиторной ишемии миокарда, по данным Холтеровского наблюдения. Повышение риска связывают с увеличением в это время артериального давления и
Похолодание и изменение атмосферного давления также способствуют повышению риска развития ОИМ. Так, при снижении температуры на 10°С, по сравнению со среднегодовой для данного времени года, риск развития первого ИМ возрастает на 13%, а повторного - на 38%. Изменения атмосферного давления, как в одну, так и в другую сторону, сопровождаются учащением развития ИМ на 11-12%, а повторного - на 30%.
Клиническая картина
Cимптомы, течение
Фазы острого инфаркта миокарда (ОИМ):
|
Болевой (status anginosus) |
Типичное клиническое течение, основным проявлением при котором служит ангинозная боль, не зависящая от позы и положения тела, от движений и дыхания, устойчивая к нитратам. Боль имеет давящий, душащий, жгущий или раздирающий характер с локализацией за грудиной, во всей передней грудной стенке с возможной иррадиацией в плечи, шею, руки, спину, эпигастальную область. Характерно сочетание с гипергидрозом, резкой общей слабостью, бледностью кожных покровов, возбуждением, двигательным беспокойством. |
|
Абдоминальный (status gastralgicus) |
Проявляется сочетанием эпигастральных болей с диспептическими явлениями - тошнотой, не приносящей облегчения рвотой, икотой, отрыжкой, резким вздутием живота. Возможны иррадиация болей в спину, напряжение брюшной стенки и болезненность при пальпации в эпигастрии. |
| Атипичный болевой | Болевой синдром имеет атипичный характер по локализации (например, только в зонах иррадиации - горле и нижней челюсти, плечах, руках и т.д.) и/или по характеру. |
|
Астматический (status astmaticus) |
Единственный признак - приступ одышки, являющийся проявлением острой застойной сердечной недостаточности (сердечная астма или отек легких). |
| Аритмический | Нарушения ритма служат единственным клиническим проявлением или преобладают в клинической картине. |
| Цереброваскулярный | В клинической картине преобладают признаки нарушения мозгового кровообращения (чаще - динамического): обморок, головокружение, тошнота, рвота. Возможна очаговая неврологическая симптоматика. |
| Малосимптомный (бессимптомный) | Наиболее сложный для распознавания вариант, нередко диагностируемый ретроспективно по данным ЭКГ. |
Острый период
В этом периоде острая боль стихает, поскольку процесс разрушения
На вторые сутки ферменты из поврежденных клеток и разрушенные ткани попадают в кровь, вызывая температурную реакцию: может появляться лихорадка до 39°С, а также недомогание, слабость, потливость.
Действие стрессовых гормонов (адреналина, норадреналина, дофамина) утихает, в результате чего артериальное давление снижается, иногда очень значительно.
В этот период могут появляться тупые боли в груди, усиливающиеся при дыхании, что является признаком развития плевроперикардита. У части больных интенсивные давящие боли в сердце могут возобновиться - в таком случае диагностируется постинфарктная стенокардия либо рецидив инфаркта миокарда.
Поскольку рубец еще не сформирован, а часть мышечных клеток сердца разрушена, в этот период очень важно минимизировать физическую активность, стресс. При несоблюдении этих правил может развиться аневризма сердца или наступить смерть от разрыва сердца.
Подострый период
В этот период болевые ощущения, как правило, отсутствуют. Учитывая тот факт, что сократительная способность сердца снижена, поскольку участок миокарда "выключен" из работы, могут появиться симптомы сердечной недостаточности: одышка, отеки ног. В целом же состояние пациента улучшается: температура нормализуется, артериальное давление стабилизируется, риск развития аритмии уменьшается.
В сердце происходят процессы рубцевания: организм устраняет образовавшийся дефект, замещая разрушенные кардиомиоциты соединительной тканью.
Период рубцевания инфаркта миокарда
В этот период продолжается и завершается образование полноценного рубца из грубоволокнистой соединительной ткани. Самочувствие пациента зависит от величины площади поражения и наличия или отсутствия осложнений инфаркта миокарда.
В целом, состояние нормализуется. Болевых ощущений в сердце нет либо имеется стабильная стенокардия определенного функционального класса. Человек привыкает к новым условиям жизни.
Диагностика
Электрокардиография - важнейший метод диагностики инфаркта миокарда (ИМ), позволяющий:
- выявить ИМ;
- установить локализацию ИМ, его глубину и распространенность;
- диагностировать осложнения ИМ (аритмии, формирование аневризмы сердца)
ЭКГ при ИМ формируется под влиянием трех зон, образующихся в области инфаркта и представленных в таблице ниже (Bayley)
|
Зона некроза - в центре очага поражения |
Трансмуральный ИМ | Патологический зубец Q |
| Нетрансмуральный ИМ | Отсутствие или невыраженность патологического зубца Q | |
| Зона повреждения - к периферии от зоны некроза, окружает ее | Субэндокардиальный ИМ | Депрессия сегмента ST |
| Субэпикардиальный или трансмуральный ИМ | Элевация сегмента ST | |
| Зона ишемии - кнаружи от зоны повреждения | Субэндокардиальный ИМ | Высокий и широкий зубец Т (высокий коронарный зубец Т) |
| Субэпикардиальный илитрансмуральный ИМ | Отрицательный симметричный зубец Т с заостренной вершиной (отрицательный коронарный зубец Т) |
Диагностика стадии ИМ (в динамике)
| Стадия ИМ | Наличие зон ИМ | Вид на ЭКГ (для трансмурального ИМ) | ЭКГ-критерии |
| Острейшая стадия (минуты-часы) | Вначале имеется только зона ишемии |
 |
Высокий заостренный коронарный зубец Т |
| Затем появляется зона повреждения | Куполообразное смещение сегмента ST кверху от изолинии и его слияние с зубцом Т | ||
| Острая стадия (часы-дни) |
Все три зоны поражения: а) зона ишемии |
 |
Начальное формирование зубца Т |
|
б) зона повреждения |
Куполообразное смещение сегмента ST кверху от изолинии | ||
| в) зона некроза | Наличие патологического зубца Q. Уменьшение величины зубца R. | ||
| Подострая стадия (дни) |
Характерно наличие двух зон: а) зона некроза |
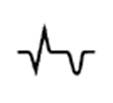 |
Возвращение сегмента ST на уровень изолинии. Наличие патологического зубца Q или QS. |
| б) зона ишемии | Отрицательный симметричный (коронарный) зубец Т с постепенно уменьшающейся глубиной | ||
| Рубцовая стадия (месяцы-годы) | Только сформированный рубец в зоне некроза |
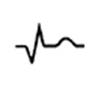 |
Сохранение патологического зубца Q Интервал ST на изолинии Отсутствие динамики зубца Т (остается отрицательным, изоэлектрическим (сглаженным) или слабоположительным) |
Топическая диагностика (локализация) ИМ
В таблице знаком (+) обозначено смещение вверх сегмента RS-Т или положительный зубец Т, знаком (–) - смещение сегмента RS-Т вниз от изолинии или отрицательный зубец Т.
| Локализация ИМ |
|
Характер изменений ЭКГ |
| Переднеперегородочный |
|
1) Q или QS 2) +(RS-T) 3) -Т |
| Передневерхушечный |
|
1) Q или QS 2) +(RS-T) 1) -Т |
| Переднебоковой |
|
1) Q 2) +(RS-T) 3) -Т |
| Распространенный передний |
|
1) Q или QS 2) +(RS-T) 3) -Т |
|
|
Реципрокные изменения: 1) -(RS-T) 2) + Т (высокие) |
|
| Высокий передний (переднебазальный) |
|
1) Q или QS 2) +(RS-T) 3) -Т |
| Заднедиафрагмальный (нижний) |
|
1) Q или QS 2) + (RS-T) 3) -T |
|
|
Реципрокные изменения: 1) -{RS-T) 2) + Т (высокие) |
|
| Заднебазальный |
|
1) Q или QS 2) +(RS-T) 3) -Т. |
|
|
Реципрокные изменения: 1) -(RS-T), 2) +Т (высокие); 3) Увеличение R. |
|
| Заднебоковой |
|
1) Q 2) +(RS-T) 3) -Т |
|
|
Реципрокные изменения: 1) увеличение R 2) -(RS-T) 3) + T (высокие). |
|
| Распространенный задний |
|
1) Q или QS 2) +(RS-T) 3) -Т |
|
|
Реципрокные изменения: 1) увеличение R 2) -(RS-T) 3) +T (высокие). |
Прекардиальное электрокардиографическое картирование сердца
Исследование применяется при остром инфаркте миокарда передней и переднебоковой стенок левого желудочка для косвенного определения размеров зоны некроза и периинфарктной зоны (участок ишемического повреждения). С этой целью после регистрации ЭКГ с 35 точек на поверхности грудной клетки строят картограмму, состоящую из 35 квадратов, каждый из которых соответствует одному из 35 отведений.
Размеры зоны некроза условно оценивают по количеству отведений, в которых выявляются признаки трансмурального некроза – комплекс QS. Это так называемая "площадь трансмурального некроза" (AQS).
Параметры определения величины периинфарктной зоны:
Указанные картографические показатели с успехом используются для наблюдения за динамикой зон некроза и периинфарктной зоны в процессе лечения больных острым инфарктом миокарда, а также для оценки прогноза заболевания; чем выше все описанные показатели, тем больше площадь и глубина поражения миокарда и, соответственно, тем хуже прогноз заболевания.
Сложные стенозы, бифуркационные поражения и извитость стенозированных сосудов служат показателями высокого риска. Самый высокий риск имеется при дефектах наполнения, так как при этом существуют внутрисосудистые тромбы. У 10-15% пациентов с болью в груди нет поражения венечных артерий и у них диагноз ИБС исключается.
КТ сердца не является оптимальным методом диагностики у больных с острым коронарным синдром из-за высокой вероятности в необходимости выполнения коронарной ангиопластики со стентированием. Это обусловлено тем, что на проведение КТ теряется время, пациент получает контрастный препарат и дозу облучения.
Транзиторная локальная акинезия и гипокинезия сегментов левого желудочка могут определяться в ходе ишемии, с восстановлением нормальной кинетики стенки при прохождении ишемии.
Отсутствие нарушений локальной сократимости исключает наличие ИМ.
ЭхоКГ имеет ценность для диагностики других причин болей в груди - расслоение и разрыв аорты, гипертрофическая
Перфузионная
Магнитно-резонансная томография
Лабораторная диагностика
Лабораторное подтверждение острого инфаркта миокарда (ОИМ) основано на выявлении:
- гиперферментемии (входит в классическую триаду признаков ОИМ: болевой синдром, типичные изменения ЭКГ, гиперферментемия).
Неспецифические показатели тканевого некроза и воспалительной реакции миокарда:
1. Лейкоцитоз, не превышающий обычно 12-15*109/л (выявляются обычно к концу первых суток от начала заболевания и при неосложненном течении инфаркта сохраняются примерно в течение недели).
2. Анэозинофилия.
3. Небольшой палочкоядерный сдвиг формулы крови влево.
4. Увеличение СОЭ (увеличивается обычно спустя несколько дней от начала заболевания и может оставаться повышенной на протяжении 2-3 недель и дольше даже при отсутствии осложнений ИМ).
Правильная трактовка этих показателей возможна только при сопоставлении с клинической картиной заболевания и данными ЭКГ.
Длительное сохранение (более 1 недели) лейкоцитоза или/и умеренной лихорадки у больных ОИМ свидетельствует о возможном развитии осложнений: (пневмония,
Гиперферментемия
Основной причиной повышения активности и содержания ферментов в сыворотке крови у больных ОИМ является разрушение кардиомиоцитов и выход высвобождающихся клеточных ферментов в кровь.
Наиболее ценным для диагностики ОИМ является определение активности нескольких ферментов в сыворотке крови:
- креатинфосфокиназы (КФК) и особенно ее МВ-фракции (МВ-КФК);
- лактатдегидрогеназы (ЛДГ) и ее изофермента 1 (ЛДГ1);
- аспартатаминотрансферазы (АСТ);
- тропонина;
- миоглобина.
Повышение активности МВ-фракции КФК, содержащейся преимущественно в миокарде, специфично для повреждения сердечной мышцы, в первую очередь, для ОИМ. МВ-фракция КФК не реагирует на повреждение скелетных мышц, головного мозга и щитовидной железы.
Динамика МВ-КФК при ОИМ:
- через 3-4 часа активность начинает возрастать;
- через 10-12 часов достигает максимума;
- через 48 часов от начала ангинозного приступа возвращается к исходным цифрам.
Степень повышения активности МВ-КФК в крови в целом хорошо коррелирует с размером ИМ - чем больше объем поражения сердечной мышцы, тем выше активность МВ-КФК 1.
Динамика КФК при ОИМ:
- к концу первых суток уровень фермента в 3-20 раз превышает норму;
- через 3-4 суток от начала заболевания возвращается к исходным значениям.
1 Следует помнить, что любые кардиохирургические вмешательства (включая коронароангиографию, катетеризацию полостей сердца и электроимпульсную терапию), как правило, сопровождаются кратковременным подъемом активности МВ-фракции КФК.
В ряде случаев при обширных инфарктах миокарда вымывание ферментов в общий кровоток замедлено, поэтому абсолютное значение активности МВ-КФК и скорость его достижения могут оказаться меньше, чем при обычном вымывании фермента, хотя и в том, и в другом случае площадь под кривой “концентрация-время” остается одинаковой.
Лактатдегидрогеназа
Активность ЛДГ при ОИМ нарастает медленнее, чем КФК и МВ-КФК, и дольше остается повышенной 2.
Динамика ЛДГ при ОИМ:
- через 2-3 суток от начала инфаркта наступает пик активности;
- к 8-14 суткам происходит возвращение к исходному уровню.
2 Следует помнить, что активность общей ЛДГ повышается также при заболеваниях печени, шоке, застойной недостаточности кровообращения, гемолизе эритроцитов и мегалобластной анемии, ТЭЛА, миокардите, воспалении любой локализации, коронароангиографии, электроимпульсной терапии, тяжелой физической нагрузке и т. д.
Изофермент ЛДГ1 более специфичен для поражений сердца, хотя он также присутствует не только в мышце сердца, но и в других органах и тканях, включая эритроциты.
Аспартатаминотрансфераза
Динамика АСТ при ОИМ:
- через 24-36 часов от начала инфаркта относительно быстро наступает пик повышения активности;
- через 4-7 суток концентрация АСТ возвращается к исходному уровню.
Изменение активности АСТ неспецифично для ОИМ: уровень АСТ вместе с активностью АЛТ повышается при многих патологических состояниях, в том числе при заболеваниях печени 3.
3 При поражениях паренхимы печени в большей степени возрастает активность АЛТ, а при заболеваниях сердца в большей степени возрастает активность АСТ. При ИМ отношение АСТ/АЛТ (коэффициент де Ритиса) больше 1,33, а при заболеваниях печени отношение АСТ/АЛТ меньше 1,33.
Тропонин
Тропонин представляет собой универсальную для поперечно-полосатой мускулатуры структуру белковой природы, локализующуюся на тонких миофиламентах сократительного аппарата миокардиоцита.
Сам тропониновый комплекс состоит из трех компонентов:
- тропонин С - ответственный за связывание кальция;
- тропонин Т - предназначен для связывания тропомиозина;
- тропонина I - предназначен для ингибирования выше указанных двух процессов.
Тропонин Т и I существуют в специфичных для миокарда изоформах, отличающихся от изоформ скелетных мышц, чем и обусловливается их абсолютная кардиоспецифичность 4.
Динамика тропонинов при ОИМ:
- спустя 4-5 часов после гибели кардиомиоцитов вследствие развития необратимых некротических изменений, тропонин поступает в периферический кровоток и определяются в венозной крови;
- в первые 12-24 часа от момента возникновения ОИМ достигается пик концентрации.
Кардиальные изоформы тропонина длительно сохраняют свое присутствие в периферической крови:
- тропонин I определяется на протяжении 5-7 дней;
- тропонин Т определяется до 14 дней.
Присутствие этих изоформ тропонина в крови пациента выявляется при помощи
4 Следует помнить, что тропонины не являются ранними биомаркерами ОИМ, поэтому у рано обратившихся больных с подозрением на острый коронарный синдром при отрицательном первичном результате необходимо повторное (через 6-12 часов после болевого приступа) определение содержания тропонинов в периферической крови. В этой ситуации даже незначительное повышение уровня тропонинов свидетельствует о дополнительном риске для больного, поскольку доказано существование четкой корреляции между уровнем возрастания тропонина в крови и размером зоны поражения миокарда.
Многочисленными наблюдениями было показано, что повышенный уровень тропонина в крови больных с острым коронарным синдромом может рассматриваться как достоверный показатель наличия у пациента ОИМ. В то же время низкий уровень тропонина у этой категории больных свидетельствует в пользу постановки более мягкого диагноза нестабильной стенокардии.
Миоглобин
Специфичность миоглобина для диагностики ОИМ примерно такая же, как КФК, но ниже, чем МВ-КФК.
Уровень миоглобина может повышаться в 2-3 раза после внутримышечных инъекций, и диагностически значимым обычно считают повышение в 10 и более раз.
Подъем уровня миоглобина в крови начинается даже раньше, чем повышение активности КФК. Диагностически значимый уровень зачастую достигается уже через 4 часа и в подавляющем большинстве случаев наблюдается через 6 часов после болевого приступа.
Высокая концентрация миоглобина в крови наблюдается только в течение нескольких часов, поэтому, если не повторять анализ каждые 2-3 часа, пик концентрации можно пропустить. Измерение концентрации миоглобина может быть применено только в случаях поступления больных в стационар менее чем через 6-8 часов после начала болевого приступа.
Принципы ферментативной диагностики ОИМ
1. У пациентов, поступивших в течение первых 24 часов после ангинозного приступа, производится определение активности КФК в крови - это следует делать даже в тех случаях, когда по клиническим и электрокардиографическим данным диагноз инфаркта миокарда не вызывает сомнения, так как степень повышения активности КФК информирует врача о размерах инфаркта миокарда и прогнозе.
2. Если активность КФК находится в пределах нормы или повышена незначительно (в 2-3 раза), либо у пациента имеются явные признаки поражения скелетной мускулатуры или головного мозга, то для уточнения диагноза показано определение активности МВ-КФК.
3. Нормальные величины активности КФК и МВ-КФК, полученные при однократном заборе крови в момент поступления больного в клинику, недостаточны для исключения диагноза ОИМ. Анализ необходимо повторить хотя бы еще 2 раза через 12 и 24 часа.
4. Если больной поступил более чем через 24 часа после ангинозного приступа, но меньше чем через 2 недели, и уровень КФК и МВ-КФК нормальный, то целесообразно определить активность ЛДГ в крови (предпочтительнее - отношение активности ЛДГ1 и ЛДГ2), АСТ вместе с АЛТ и расчетом коэффициента де Ритиса.
5. Если ангинозные боли повторяются у больного после госпитализации, то рекомендуется измерять КФК и МВ-КФК сразу после приступа и через 12 и 24 часа.
6. Миоглобин в крови целесообразно определять только в первые часы после болевого приступа, повышение его уровня в 10 раз и больше указывает на некроз мышечных клеток, однако нормальный уровень миоглобина отнюдь не исключает инфаркта.
7. Определение ферментов нецелесообразно у бессимптомных больных с нормальной ЭКГ. Диагноз на основании одной только гиперферментемии ставить все равно нельзя - должны быть клинические и (или) ЭКГ-признаки, указывающие на возможность ИМ.
8. Контроль количества лейкоцитов и величины СОЭ необходимо проводить при поступлении пациента и затем не реже 1 раза в неделю, чтобы не пропустить инфекционные или аутоиммунные осложнения ОИМ.
9. Исследование уровня активности КФК и МВ-КФК целесообразно проводить только в течение 1-2 суток от предположительного начала заболевания.
10. Исследование уровня активности АСТ целесообразно проводить только в течение 4-7 суток от предположительного начала заболевания.
11. Повышение активности КФК, МВ-КФК, ЛДГ, ЛДГ1, АСТ не является строго специфичным для ОИМ, хотя при прочих равных условиях активность МВ-КФК отличается более высокой информативностью.
12. Отсутствие гиперферментемии не исключает развития ОИМ.
Дифференциальный диагноз
1. Аллергический и инфекционно-токсический шок.
Симптомы: загрудинная боль, одышка, падение артериального давления.
Анафилактический шок может возникать при любой лекарственной непереносимости. Начало болезни острое, четко приурочено к причинному фактору (инъекция антибиотика, прививка с целью профилактики инфекционного заболевания, введение противостолбнячной сыворотки и др.). В некоторых случаях заболевание начинается через 5-8 дней от момента ятрогенного вмешательства, развивается по типу
Инфекционно-токсический шок с поражением миокарда может возникнуть при любом тяжелом инфекционном заболевании.
Клинически заболевание очень напоминает инфаркт миокарда (ИМ), отличаясь от него по этиологическим факторам. Дифференциация затрудняется в связи с тем, что при аллергическом и инфекционно-аллергическом шоке могут возникать некоронарогенные некрозы миокарда с грубыми изменениями ЭКГ, лейкоцитозом, увеличением СОЭ, гиперферментемией АСТ, ЛДГ,
В отличие от типичного ИМ, при данных шоках на ЭКГ не бывает глубокого зубца Q и комплекса QS, дискордантности изменений конечной части.
2. Перикардит (миоперикардит).
Этиологические факторы перикардита: ревматизм, туберкулез, вирусная инфекция (чаще - вирус Коксаки или ECHO), диффузные болезни соединительной ткани; нередко - терминальная ХПН.
При остром перикардите в процесс часто вовлекаются субэпикардиальные слои миокарда.
В типичном варианте при сухом перикардите возникают тупые, давящие (реже - острые) боли в прекордиальной области без иррадиации в спину, под лопатку, в левую руку, свойственные инфаркту миокарда.
Шум трения перикарда регистрируется в те же дни, что и повышение температуры тела, лейкоцитоз, увеличение СОЭ. Шум стойкий, выслушивается в течение нескольких дней или недель.
При ИМ шум трения перикарда кратковременный; предшествует лихорадке и увеличению СОЭ.
Если у больных перикардитом появляется сердечная недостаточность, то она правожелудочковая или бивентрикулярная. Для ИМ характерна левожелудочковая сердечная недостаточность.
Дифференциально-диагностическая ценность энзимологических тестов невелика. Вследствие поражения субэпикардиальных слоев миокарда у больных перикардитом может регистрироваться гиперферментемия АСТ, ЛДГ, ЛДГ1,
В правильной постановке диагноза помогают данные ЭКГ. При перикардите имеются симптомы субэпикардиального повреждения в виде элевации интервала ST во всех 12 общепринятых отведениях (нет дискордантности, свойственной ИМ). Зубец Q при перикардите, в отличие от ИМ, не выявляется. Зубец Т при перикардите может быть отрицательным, он становится положительным через 2-3 недели от начала болезни.
При появлении перикардиального экссудата очень характерной становится рентегнологическая картина.
3. Левосторонняя пневмония.
При пневмонии могут появляться боли в левой половине грудной клетки, иногда интенсивные. Однако в отличие от прекордиальных болей при ИМ, они четко связаны с дыханием и кашлем, не имеют типичной для ИМ иррадиации.
Для пневмонии характерен продуктивный кашель. Начало болезни (озноб, повышение температуры, бои в боку, шум трения плевры) совершенно не типично для ИМ.
Физикальные и рентгенологические изменения в легких помогают диагностировать пневмонию.
ЭКГ при пневмонии может меняться (низкий зубец Т, тахикардия), но никогда не бывает изменений, напоминающих таковые при ИМ.
Как и при ИМ, при пневмонии можно обнаружить лейкоцитоз, увеличение СОЭ, гиперферментемию АСТ, ЛДГ, но только при поражении миокарда повышается активность
4. Спонтанный пневмоторакс.
При пневмотораксе возникают сильная боль в боку, одышка, тахикардия. В отличие от ИМ, спонтанный пневмоторакс сопровождается тимпаническим перкуторным тоном на стороне поражения, ослаблением дыхания, рентгенологическими изменениями (газовый пузырь, коллапс легкого, смещение сердца и средостения в здоровую сторону).
Показатели ЭКГ при спонтанном пневмотораксе либо нормальные, либо выявляется преходящее снижение зубца Т.
Лейкоцитоза, увеличения СОЭ при пневмотораксе не бывает. Активность сывороточных ферментов нормальная.
5. Ушиб грудной клетки.
Как и при ИМ возникают сильные боли в груди, возможен шок. Сотрясение и ушиб грудной клетки приводят к повреждению миокарда, что сопровождается элевацией или депрессией интервала ST, негативизацией зубца Т, а в тяжелых случаях - даже появлением патологического зубца Q.
В постановке правильного диагноза решающую роль играет анамнез.
Клиническая оценка ушиба грудной клетки с изменениями ЭКГ должна быть достаточно серьезной, поскольку в основе этих изменений лежат некоронарогенные некрозы миокарда.
6. Остеохондроз грудного отдела позвоночника с компрессией корешка.
При остеохондрозе с корешковым синдромом боли в грудной клетке слева могут быть очень сильными, нестерпимыми. Но, в отличие от болей при ИМ, они исчезают, когда больной принимает неподвижное вынужденное положение, и резко усиливаются при поворотах туловища и дыхании.
Нитроглицерин, нитраты при остеохондрозе совершенно не эффективны.
При грудном "радикулите" определяется четкая локальная болезненность в паравертебральных точках, реже по ходу межреберий.
Количество лейкоцитов, а также значения СОЭ, энзимологических показателей, ЭКГ в пределах нормы.
7. Опоясывающий лишай.
Клиника опоясывающего лишая весьма напоминает описанную выше (см. описание симптомов корешкового синдрома при остеохондрозе позвоночника в грудном отделе).
У некоторых больных может регистрироваться лихорадка в сочетании с умеренным лейкоцитозом, увеличением СОЭ.
ЭКГ, ферментные тесты, как правило, часто помогают исключить диагноз ИМ.
Диагноз "опоясывающий лишай" становится достоверным со 2-4 дня болезни, когда по ходу межреберий появляется характерная пузырьковая (везикулярная) сыпь.
Астматический вариант ИМ в чистом виде встречается редко, чаще удушье сочетается с болями в предсердечной области, аритмией, симптомами шока.
9. Острая левожелудочковая недостаточность осложняет течение многих болезней сердца, в числе которых кардиомиопатии, клапанные и врожденные пороки сердца, миокардиты и другие.
10. Острый холецистопанкреатит.
При остром холецистопанкреатите, как и при гастралгическом варианте ИМ, возникают сильные боли в эпигастральной области, сопровождающиеся слабостью, потливостью, гипотензией. Однако боли при остром холецистопанкреатите локализуются не только в эпигастрии, но и в правом подреберье, иррадиируют вверх и вправо, в спину, иногда могут быть опоясывающими. Характерно сочетание болей с тошнотой, рвотой, причем в рвотных массах определяется примесь желчи.
Пальпаторно определяется болезненность в точке желчного пузыря, проекции поджелудочной железы, положительные
Вздутие живота, локальное напряжение в правом верхнем квадранте не типично для ИМ.
ЭКГ при остром холецистопанкреатите: снижение интервала ST в ряде отведений, слабо отрицательный или двухфазный зубец Т.
Крупноочаговое метаболическое повреждение миокарда существенно ухудшает прогноз панкреатита, нередко является ведущим фактором в летальном исходе.
11. Прободная язва желудка.
Как при ИМ, характерны острые боли в эпигастрии. Однако при прободной язве желудка отмечаются нестерпимые, "кинжальные" боли, максимально выраженные в момент прободения и затем уменьшающиеся в интенсивности, при этом эпицентр болей смещается несколько вправо и вниз.
При гастралгическом варианте ИМ боли в эпигастрии могут быть интенсивными, но для них не характерно столь острое, мгновенное начало с последующим спадом.
При прободной язве желудка через 2-4 часа от момента прободения симптоматика меняется. У больных с прободной гастродуоденальной язвой появляются симптомы интоксикации; язык становится сухим, черты лица заостряются; живот становится втянутым, напряженным; отмечаются положительные симптомы раздражения; перкуторно определяется "исчезновение" печеночной тупости; рентгенологически выявляется воздух под правым куполом диафрагмы.
Как при ИМ, так и при прободении язвы температура тела может быть субфебрильной, отмечается умеренный лейкоцитоз в течение первых суток.
Для ИМ типично увеличение активности сывороточных ферментов (ЛДГ, КФК, МВ КФК).
ЭКГ при прободной язве желудка в течение первых суток, как правило, не меняется. На следующий день возможны изменения конечной части за счет электролитных нарушений.
12. Рак кардиального отдела желудка.
При раке кардии нередко возникают интенсивные давящие боли в эпигастрии и под мечевидным отростком, сочетающиеся с транзиторной гипотонией.
В отличие от ИМ при раке кардии эпигастральные боли закономерно повторяются ежедневно, они связаны с приемом пищи.
СОЭ увеличивается при обоих заболеваниях, однако динамика активности ферментов КФК, МВ КФК, ЛДГ,
Для исключения гастралгического варианта ИМ необходимо ЭКГ-исследование. На ЭКГ выявляются изменения интервала ST (чаще депрессия) и зубца Т (изоэлектричный или слабо отрицательный) в III, avF отведениях, что служит поводом для диагностики мелкоочагового заднего ИМ.
При раке кардии ЭКГ "застывшая", на ней не удается определить характерной для ИМ динамики.
Диагноз рака уточняется при проведении
13. Пищевая токсикоинфекция.
Как и при ИМ появляются боли в эпигастрии, падает артериальное давление. Однако при пищевой токсикоинфекции боль в эпигастрии сопровождается тошнотой, рвотой, гипотермией. Диарея не всегда встречается при пищевой токсикоинфекции, но ее никогда не бывает при ИМ.
ЭКГ при пищевой токсикоинфекции либо не меняется, либо во время исследования определяются "электролитные нарушения" в виде корытообразного смещения вниз интервала ST, слабоотрицательного или изоэлектрического зубца Т.
Лабораторные исследования при пищевой токсикоинфекции показывают умеренный лейкоцитоз, эритроцитоз (сгущение крови), небольшое повышение активности АЛТ, АСТ, ЛДГ без существенных изменений активности КФК, МВ-КФК,
14. Острое нарушение мезентерального кровообращения.
Боль в эпигастрии, падение артериального давления возникают при обоих заболеваниях. Дифференциация усложняется тем, что тромбоз мезентеральных сосудов, как и ИМ, поражает, как правило, людей пожилого возраста с различными клиническим проявлениями ИБС, с артериальной гипертонией.
При нарушении кровообращения в системе мезентеральных сосудов боли локализуются не только в эпигастрии, но и по всему животу. Живот умеренно вздут, аускультативно не выявляются звуки перистальтики кишечника, возможно обнаружение симптомов раздражения брюшины.
Для уточнения диагноза проводится обзорная рентгенография брюшной полости и определяется наличие или отсутствие перистальтики кишечника и скопления газа в кишечных петлях.
Нарушение мезентерального кровообращения не сопровождается изменениями ЭКГ и ферментных показателей, характерных для ИМ.
При затруднении в диагностике тромбоза мезентеральных сосудов патогномоничные изменения могут быть обнаружены при лапароскопии и ангиографии.
15. Расслаивающая аневризма абдоминального отдела аорты.
При абдоминальной форме расслаивающей аневризмы аорты в отличие от гастралгического варианта ИМ, характерны следующие признаки:
- начало болезни с болей в груди;
- волнообразный характер болевого синдрома с иррадиацией в поясницу по ходу позвоночника;
- появление опухолевидного образования эластичной консистенции, пульсирующего синхронно с сердцем;
- появление систолического шума над опухолевидным образованием;
- нарастание анемии.
16. Некоронарогенные некрозы миокарда могут возникать при тиреотоксикозе, лейкозах и анемиях, системных васкулитах, гипо- и гипергликемических состояниях.
Клинически на фоне симптоматики основной болезни отмечаются боли в сердце (временами сильные), одышка.
Данные лабораторных исследований бывают малоинформативными в дифференциации некоронарогенных некрозов с ИМ атеросклеротического генеза. Гиперферментемия ЛДГ, ЛДГ1,
На ЭКГ при некоронарогенных некрозах миокарда выявляются изменения конечной части – депрессия или, реже, элевация интервала ST, негативные зубцы Т, с последующей динамикой, соответствующей нетрансмуральному ИМ.
Точный диагноз устанавливается на основе всей симптоматики заболеваний. Только такой подход дает возможность методически правильно оценить собственно сердечную патологию.
18. Опухоли сердца (первичные и метастатические).
При опухолях сердца могут появляться упорные интенсивные боли в прекордиальной области, резистентные к нитратам, сердечная недостаточность, аритмии.
На ЭКГ отмечаются патологический зубец Q, элевация интервала ST, отрицательный зубец Т. В отличие от ИМ при опухоли сердца не бывает типичной эволюции ЭКГ, она малодинамична.
Сердечная недостаточность, аритмии рефрактерны к лечению. Диагноз уточняется при тщательном анализе клинико-рентгенологических и Эхо-КГ-данных.
19. Посттахикардиальный синдром.
Посттахикардиальным синдромом называется ЭКГ-феномен, выражающийся в преходящей ишемии миокарда (депрессия интервала ST, негативный зубец Т) после купирования тахиаритмии. Данный симптомокомплекс необходимо оценивать очень осторожно.
Во-первых, тахиаритмия может быть началом ИМ и ЭКГ после ее купирования зачастую лишь выявляет инфарктные изменения.
Во-вторых, приступ тахиаритмии в такой степени нарушает гемодинамику и коронарный кровоток, что он может приводить к развитию миокардиальных некрозов, особенно при изначально дефектном коронарном кровообращении у больных со стенозирующим коронарным атеросклерозом. Следовательно, диагноз посттахикардиального синдрома достоверен после тщательного наблюдения за больным с учетом динамики клинических, ЭхоКГ-, лабораторных данных.
20. Синдром преждевременной реполяризации желудочков.
Синдром выражается в элевации интервала ST в вильсоновских отведениях, начинающегося с точки J, расположенной на нисходящем колене зубца R.
Этот синдром регистрируется у здоровых людей, спортсменов, больных с нейроциркуляторной дистонией.
Для постановки правильного диагноза надо знать о существовании ЭКГ-феномена - синдрома преждевременной реполяризации желудочков. При этом синдроме отсутствует клиника ИМ, не бывает свойственной ему динамика ЭКГ.
Примечание
При трактовке симптома "острая боль в эпигастрии" в сочетании с гипотензией при проведении дифференциального диагноза с ИМ надо иметь в виду и более редкие болезни: острую надпочечниковую недостаточность; разрыв печени, селезенки или полого органа при травме; сифилитическую сухотку спинного мозга с табетическими желудочными кризами (анизокория, птоз, рефлекторная неподвижность глазных яблок, атрофия зрительного нерва, атаксия, отсутствие коленных рефлексов); абдоминальные кризы при гипергликемии, кетоацидозе у больных с сахарным диабетом.
Осложнения
Группы осложнений инфаркта миокарда (ИМ):
1. Электрические - нарушения ритма и проводимости:
- брадитахиаритмии;
- экстрасистолии;
- внутрижелудочковые блокады;
- АВ-блокады.
Данные осложнения практически постоянно встречаются при крупноочаговом ИМ. Часто аритмии не являются угрожающими для жизни, но свидетельствуют о серьезных нарушениях (электролитных, продолжающейся ишемии, вагальной гиперактивности и др.), требующих коррекции.
2. Гемодинамические осложнения:
2.1 Вследствие нарушений насосной функции сердца:
- острая левожелудочковая недостаточность;
- острая правожелудочковая недостаточность;
- бивентрикулярная недостаточность;
- кардиогенный шок;
- аневризма желудочка;
- расширение инфаркта.
2.2 Вследствие дисфункции сосочковых мышц.
2.3 Вследствие механических нарушений:
- острая митральная регургитация вследствие разрыва сосочковых мышц;
- разрывы сердца, свободной стенки или межжелудочковой перегородки;
- аневризмы левого желудочка;
- отрывы сосочковых мышц.
2.4 Вследствие электромеханической диссоциации.
3. Реактивные и прочие осложнения:
- эпистенокардический перикардит;
- тромбоэмболии сосудов малого и большого круга кровообращения;
- ранняя постинфарктная стенокардия;
-
1. Ранние осложнения, возникающие в первые часы (нередко на этапе транспортировки больного в стационар) или в острейший период (3-4 дня):
- нарушения ритма и проводимости (90%), вплоть до фибрилляции желудочков и полной АВ-блокады (самые частые осложнения и причина летальности на догоспитальном этапе);
- внезапная остановка сердца;
- острая недостаточность насосной функции сердца - острая левожелудочковая недостаточность и кардиогенный шок (до 25%);
- разрывы сердца - наружные, внутренние; медленнотекущие, одномоментные (1-3%);
- острая дисфункция сосочковых мышц (митральная регургитация);
- ранний эпистенокардический перикардит.
2. Поздние осложнения (возникают на 2-3-й неделе, в период активного расширения режима):
- постинфарктный
- пристеночный тромбоэндокардит (до 20%);
- хроническая сердечная недостаточность;
- нейротрофические расстройства (плечевой синдром, синдром передней грудной стенки).
Как на ранних, так и на поздних стадиях течения ИМ могут возникать следующие осложнения:
- острая патология желудочно-кишечного тракта (острые язвы, желудочно-кишечный синдром, кровотечения и др.);
- психические изменения (депрессия, истерические реакции, психоз);
- аневризмы сердца (у 3-20% больных);
- тромбоэмболические осложнения: системные (вследствие пристеночного тромбоза) и ТЭЛА (из-за тромбоза глубоких вен голеней).
Тромбоэмболии клинически выявляются у 5-10% больных (на аутопсии - у 45%). Часто они имеют бессимптомное течение и являются причиной смерти у ряда госпитализированных больных с ИМ (до 20%).
У некоторых пожилых мужчин с доброкачественной гипертрофией предстательной железы развивается острая атония мочевого пузыря (снижается его тонус, нет позывов к мочеиспусканию) с увеличением объема пузыря до 2 л, задержкой мочеиспускания на фоне постельного режима и лечения наркотическими препаратами, атропином.
Лечение
Цели неотложной терапии инфаркта миокарда (ИМ):
- купирование болевого синдрома;
- восстановление коронарного кровотока;
- уменьшение работы сердца и потребности миокарда в кислороде;
- ограничение размеров ИМ;
- лечение и профилактика осложнений ИМ.
Купирование болевого приступа
Морфин - препарат выбора для купирования болевого синдрома при ИМ на догоспитальном этапе. Морфин обладает необходимыми эффектами и достаточной для транспортировки длительностью действия.
Препарат вводится внутривенно дробно: 1 мл 1% раствора разводят физиологическим раствором натрия хлорида до 20 мл (1 мл полученного раствора содержит 0,5 мг активного вещества) и вводят 2-5 мг каждые 5-15 минут до полного устранения болевого синдрома либо до появления побочных эффектов (гипотензии, угнетения дыхания, рвоты).
Суммарная доза не должна превышать 10-15 мг (1-1,5 мл 1% раствора) морфина (на догоспитальном этапе не допускается превышение дозы 20 мг).
При невыраженном болевом синдроме, пациентам старческого возраста и ослабленным больным наркотические анальгетики могут вводиться подкожно или внутримышечно. Не рекомендуется вводить подкожно более 60 мг морфина в течение 12 часов.
Для решения вопроса о возможности использования наркотических анальгетиков необходимо:
- убедиться, что типичный или атипичный болевой синдром не является проявлением “острого живота”, и изменения ЭКГ являются специфическим проявлением ИМ, а не неспецифической реакцией на катастрофу в брюшной полости;
- выяснить, имеются ли в анамнезе хронические заболевания системы дыхания (в частности - бронхиальная астма);
- уточнить, когда было последнее обострение бронхообструктивного синдрома;
- установить, имеются ли в настоящее время признаки дыхательной недостаточности, какие, какова степень ее выраженности;
- выяснить, имеется ли у больного в анамнезе судорожный синдром, когда был последний припадок.
Восстановление коронарного кровотока в острейшей фазе ИМ
Поскольку непосредственной причиной развития ИМ является окклюзия коронарной артерии, в основе лечения лежит восстановление коронарного кровотока - коронарная реперфузия путем системного тромболизиса.
Все больные ИМ должны быть безотлагательно обследованы для уточнения показаний и противопоказаний к восстановлению коронарного кровотока.
Показания к проведению тромболизиса:
1. Наличие подъема сегмента ST более чем на 1 mm по крайней мере в двух стандартных отведениях ЭКГ и более чем на 2 mm в двух смежных грудных отведениях.
2. Остро возникшая полная блокада левой ножки пучка Гиса при сроке, прошедшем с начала заболевания, более 30 минут, но не превышающем 12 часов.
Применение тромболитических средств возможно и позже, в случаях когда сохраняются подъем сегмента ST, продолжается боль и/или наблюдается нестабильная гемодинамика.
Абсолютные противопоказания к тромболитической терапии:
Относительные противопоказания к тромболитической терапии:
- недавнее (в течение предыдущих 2-4 недель) внутреннее кровотечение;
Тромболитические препараты:
- стрептокиназа;
- рекомбинантный тканевой активатор плазминогена (алтеплаза) и его модификация - тенектеплаза;
- модифицированная (рекомбинантная) проурокиназа (пуролаза).
Наиболее часто используется стрептокиназа:
- введение препарата проводится только через периферические вены, попытки катетеризации центральных вен недопустимы;
- перед инфузией возможно внутривенное введение 5-6 мл 25% магния сульфата либо 10 мл кормагнезина-200 в/в струйно, медленно (за 5 минут);
- "нагрузочная" доза аспирина (250-300 мг - разжевать) дается всегда, за исключением случаев, когда аспирин противопоказан;
- 1 500 000 Ед стрептокиназы разводится в 100 мл изотонического раствора хлорида натрия и вводится внутривенно за 30 минут.
- прекращение ангинозных приступов через 30-60 минут после введения тромболитика;
- стабилизация гемодинамики;
- исчезновение признаков левожелудочковой недостаточности;
- быстрая (в течение нескольких часов) динамика ЭКГ с приближением сегмента ST к изолинии и формированием патологического зубца Q, отрицательного зубца Т (возможно внезапное увеличение степени подъема сегмента ST с последующим его быстрым снижением);
- появление реперфузионных аритмий (ускоренного идиовентрикулярного ритма, желудочковой экстрасистолии и др.);
- быстрая динамика МВ-КФК (резкое повышение ее активности на 20-40%).
Показания к проведению антикоагулянтной терапии:
- отсутствие показаний к тромболитической терапии (поздние сроки, мелкоочаговый или не-Q-инфаркт);
- невозможность проведения тромболизиса по организационным причинам;
- отсрочка тромоболизиса до госпитального этапа;
- наличие противопоказаний к тромболизису, не являющихся противопоказанием к назначению гепарина.
При наличии показаний, гепарин вводится на догоспитальном этапе (линейной бригадой) внутривенно болюсно в дозе 10000-15000 МЕ. Если в условиях стационара не проводится тромболитическая терапия, то переходят на длительную внутривенную инфузию гепарина со скоростью 1000 МЕ/час под контролем активированного частичного тромбопластинового времени. Альтернативой может, по-видимому, служить подкожное введение низкомолекулярного гепарина в "лечебной" дозе.
Введение гепарина на догоспитальном этапе не служит препятствием к проведению тромболизиса в условиях стационара.
С первых минут ИМ всем больным, при отсутствии противопоказаний, показано назначение малых доз ацетилсалициловой кислоты (аспирина), антитромбоцитарный эффект которой достигает своего максимума уже через 30 минут и своевременное начало применения которой позволяет существенно снизить летальность.
Наибольший клинический эффект может быть получен при применении ацетилсалициловой кислоты перед проведением тромболизиса.
Доза для первого приема на догоспитальном этапе составляет 160-325 мг (разжевать).
В дальнейшем, на стационарном этапе, препарат назначается 1 раз в сутки по 100-125 мг.
Уменьшение работы сердца и потребности миокарда в кислороде. Показано полноценное обезболивание и применение следующих препаратов:
1. Вазодилататоры-нитраты.
Внутривенное введение нитратов при ОИМ не только помогает купировать болевой синдром, левожелудочковую недостаточность, артериальную гипертензию, но и уменьшает размеры некроза и летальность.
Нитраты вводят капельно под постоянным контролем артериального давления и частоты сердечных сокращений с начальной скоростью 5-10 мкг/мин. с последующим увеличением скорости на 20 мкг/мин. каждые 5 минут до достижения желаемого эффекта или максимальной скорости введения - 400 мкг/мин. Обычно эффект достигается при скорости 50-100 мкг/мин.
При отсутствии дозатора, приготовленный раствор, содержащий в 1 мл 100 мкг нитрата, вводят при тщательном контроле с начальной скоростью 6-8 капель в минуту, которая при условии стабильной гемодинамики и сохранения болевого синдрома может быть постепенно увеличена вплоть до максимальной скорости - 30 капель в минуту.
Продолжительность внутривенного введения нитратов - 24 часа и более; за 2-3 часа до окончания инфузии дается первая доза нитратов перорально.
Передозировка нитратов, вызывающая падение сердечного выброса и снижение систолического артериального давления ниже 80 мм рт. ст., может приводить к ухудшению коронарной перфузии и к увеличению размеров ИМ.
2. Бета-адреноблокаторы.
Внутривенное введение бета-адреноблокаторов, как и применение нитратов, способствует купированию болевого синдрома. Ослабляя симпатические влияния на сердце, они способствуют уменьшению размеров ИМ, подавляют желудочковые аритмии, уменьшают риск разрыва миокарда и повышают таким образом выживаемость пациентов.
При отсутствии противопоказаний бета-адреноблокаторы назначаются всем больным ОИМ.
В первые 2-4 часа заболевания показано дробное внутривенное введение пропранолола (обзидана) по 1 мг в минуту каждые 3-5 минут под контролем артериального давления, частоты сердечных сокращений и ЭКГ до достижения частоты сердечных сокращений 55-60 уд./мин. или до общей дозы 10 мг.
При наличии брадикардии, признаков сердечной недостаточности, АВ-блокакды и снижении систолического артериального давления менее 100 мм рт. ст. пропранолол не назначается; при развитии указанных изменений на фоне применения препарата, его введение прекращается.
Ограничение размеров ИМ
Необходимо адекватное обезболивание, восстановление коронарного кровотока, уменьшение работы сердца и потребности миокарда в кислороде.
Этой же цели служит оксигенотерапия, показанная при ОИМ всем больным в связи с частым развитием
Ингаляция увлажненного кислорода, проводящаяся, если это не причиняет чрезмерных неудобств, с помощью маски или через носовой катетер со скоростью 4-6 л/мин., целесообразна в течение первых 24-48 часов заболевания (начинается на догоспитальном этапе и продолжается в стационаре).
Лечение и профилактика осложнений ИМ
Проводятся дифференцированно в зависимости от варианта осложнений (отек легких, кардиогеннй шок, нарушения сердечного ритма и проводимости, а также затянувшийся или рецидивирующий болевой приступ).
Основные хирургические методы лечения ИМ (вопрос о выборе метода всегда решается индивидуально)
1. Аортокоронарное шунтирование (АКШ).
2. Внутрисосудистая операция (баллонная ангиопластика, стентирование).
Коронарная ангиопластика является инвазивным способом лечения ишемической болезни сердца, который направлен на восстановление суженного просвета коронарной артерии различными механическими устройствами, доставляемыми путем чрескожной пункции и катетеризации артериального русла.
Устройства и инструменты для коронарной ангиопластики:
- баллонные катетеры для проведения баллонной ангиопластики;
- атерэктомические катетеры;
- ротаблаторы для проведения мелкодисперсной ротационной абляции;
- лазер-баллоны для лазерной абляции;
- стенты для эндопротезирования коронарных артерий.
Основной метод коронарной ангиопластики - баллонная ангиопластика. Остальные методы имеют ограниченное применение по специальным показаниям.
При баллонной ангиопластике баллонный катетер проводится по артериальной системе к коронарным сосудам. Баллон устанавливается в место сужения коронарной артерии и раздувается под давлением, восстанавливая просвет сосуда.
Абсолютные противопоказания для коронарной ангиопластики:
- локализация стеноза в главном стволе левой коронарной артерии;
- наличие стеноза в коронарной артерии, снабжающей весь оставшийся живой миокард;
- отказ больного от лечения.
Относительные противопоказания:
- тяжелая дисфункция левого желудочка;
- многососудистое окклюзирующее поражение со сложным коллатеральным снабжением миокарда, сопоставимое со стволовым стенозом;
- сложное с точки зрения морфологии поражение коронарной артерии, снабжающей значительный объем миокарда;
- невозможность достичь полной или почти полной
- нестабильное / неконтролируемое системное или метаболическое нарушение (например, почечная недостаточность, недавний инсульт, желудочно-кишечное кровотечение, лихорадка вследствие инфекции, неконтролируемая гипертензия, тяжелые электролитные нарушения, анафилаксия).
Стентирование, как доминирующая методика эндоваскулярного лечения, является наиболее эффективным и безопасным методом лечения ОИМ. Коронарная ангиопластика со стентированием позволяет воздействовать не только на тромб, но и на атеросклеротическую бляшку, суживающую просвет венечной артерии.
Именно стентирование способно восстанавливать исходную нативную анатомию коронарной артерии, в отличие от консервативной терапии и открытой хирургии. 
Показанием к выполнению стентирования у больных с ОИМ является ИМ в ходу с признаками продолжающейся ишемии в области клинико-зависимой артерии при наличии ангиографических критериев возможности выполнения процедуры.
Определяющим фактором сохранения функционального состояния миокарда и снижения летальности у пациентов с ОИМ является время от начала ангинозного приступа до начала процедуры стентирования. Для улучшения непосредственных и отдаленных результатов стентирования необходимо сокращение до минимума временного интервала, с помощью экстренной госпитализации больных с ОИМ в специализированную клинику с наличием рентгеноперационной.
Показания к проведению коронарной ангиопластики постоянно расширяются. Основной стратегический принцип - максимально отсрочить необходимость проведения АКШ.
Поскольку коронарная ангиопластика может осложниться возникновением ситуаций, требующих срочного проведения хирургической операции, то если больной отказывается от АКШ, даже если выявленные сужения дилатируемы, коронарная ангиопластика не проводится.
При ОИМ коронарная ангиопластика (КА) или АКШ проводятся при неэффективности тромболитической терапии. Предпочтение следует отдавать проведению КА. АКШ проводится только при наличии прямых противопоказаний для КА.
При выполнении КА сразу после системного тромболизиса, ее называют немедленной, а через 1-7 суток - поздней.
Проведение немедленной КА сопряжено с высоким риском осложнений. Поэтому, если это возможно, предпочтительно ее выполнение после 4-7-дневной антикоагулянтной и антиагрегантной терапии.
Целью поздней коронарной ангиопластики является устранение остаточного стеноза, профилактика реокклюзии, ускорение восстановления функции левого желудочка. При этом существенно снижается риск формирования
Аортокоронарное шунтирование - это кардиохирургическая операция, при которой создается новый путь для кровотока в обход пораженной артерии. Для этого накладывается шунт между аортой и участком артерии после сужения. В качестве шунта применяются: большая подкожная вена, внутренняя грудная артерия, лучевая артерия, синтетический протез.
Доступ к сердцу осуществляется через разрез грудной клетки, чаще - через грудину. Еще один разрез выполняется в месте, где берут шунт. После АКШ требуется достаточно длительный период реабилитации, в течение которого заживают раны и срастается грудина.

Показания к проведению АКШ в остром периоде ИМ:
- неэффективность первичной коронароангиопластики;
- окклюзия сосуда или эндопротеза после эндоваскулярных вмешательств;
- кардиогенный шок;
- наружные и внутренние разрывы сердца.
Прогноз
Около 15-20% больных ИМ погибают на догоспитальном этапе, еще 15% - в больнице.
Общая летальность при ИМ составляет 30-35%.
Большая часть больничной летальности приходится на первые двое суток, поэтому основные лечебные мероприятия проводят именно в этот период.
Контролируемые испытания показали, что восстановление перфузии в течение первых 4-6 часов ИМ способствует ограничению его размеров, улучшению локальной и общей сократимости левого желудочка, снижению частоты больничных осложнений (сердечной недостаточности,
Позднее восстановление перфузии также сопровождается увеличением выживаемости, что связывают с улучшением заживления миокарда и уменьшением частоты аритмий (но не ограничением размеров инфаркта).
Госпитализация
Всем больным показана экстренная госпитализация.
Профилактика
Профилактические мероприятия в острой фазе ИМ
Важнейшее профилактическое значение с первых минут от начала инфаркта имеет антитромбоцитарная и антикоагулянтная терапия. Также целесообразно применение таких препаратов, как β-блокаторы, ингибиторы АПФ, нитраты, блокаторы кальциевых каналов, глюкозо-инсулино-калиевая смесь (ГИК) и др.
Вопрос о необходимости раннего, в том числе внутривенного, назначения бета-блокаторов в острой фазе остается открытым. В настоящее время рекомендуется дождаться стабилизации состояния больного и только после этого назначить бета-блокаторы обычным способом, перорально.
Не обнаружено существенных преимуществ раннего назначения нитратов, поэтому они не рекомендованы для рутинного использования, хотя возможность их применения у отдельных пациентов с продолжающейся ишемией миокарда не исключается.
Не рекомендованы для рутинного использования (без специальных показаний) также блокаторы кальциевых каналов, сульфат магния, ГИК , лидокаин.
Напротив, ингибиторы АПФ, назначаемые с первого дня ИМ, не намного, но достоверно уменьшают раннюю летальность больных. Поэтому в руководстве ESC рекомендуется начать прием ингибиторов АПФ в первые 24 часа от начала инфаркта, если нет противопоказаний.
Вторичная профилактика – общие принципы
Около 8-10% пациентов, выживших после ИМ, в течение года после выписки из стационара переживают повторный инфаркт. Летальность постинфарктных больных гораздо выше, чем смертность в общей популяции. На сегодняшний день известен ряд профилактических мероприятий, оказывающих достоверное благоприятное влияние на прогноз и уровень выживаемости таких пациентов.
1. Всем пациентам, перенесшим инфаркт, настоятельно рекомендуется отказаться от курения. Для медикаментозной поддержки больного, который бросает курить, могут использоваться бупропион и никотинсодержащие препараты, антидепрессанты.
2. Показана достаточная и регулярная физическая активность – аэробная нагрузка умеренной интенсивности как минимум 5 раз в неделю. Для больных высокого риска рекомендованы специальные реабилитационные программы с наблюдением медработников.
3. Если индекс массы тела ≥30 кг/м2 либо окружность талии превышает 102 см у мужчин или 88 см у женщин, необходимо снижение веса. Питание постинфарктных больных должно включать регулярное употребление фруктов, овощей, рыбы, отличаться низким содержанием соли и насыщенных жиров. Целесообразным может быть увеличение потребления омега-3-полиненасыщенных жирных кислот; с этой целью можно включать в рацион жирные сорта рыбы или же принимать рыбий жир. Не следует запрещать пациенту употреблять алкоголь в умеренных количествах.
4. Если у больного имеется сахарный диабет, необходимы соответствующие мероприятия по модификации образа жизни, контролю факторов риска (артериальной гипертензии, ожирения,
5. В случае артериальной гипертензии необходимы мероприятия по модификации образа жизни и фармакологическая терапия для поддержания уровня АД <130/80 мм рт. ст. .
Всем пациентам, перенесшим ИМ, при отсутствии противопоказаний как можно раньше следует назначить:
1. Антитромбоцитарную и/или антикоагулянтную терапию:
- АСК 75-100 мг/сут. постоянно;
- клопидогрель 75 мг/сут. в течение 12 месяцев в дополнение к АСК независимо от стратегии лечения (IIa, C) или постоянно вместо АСК, если прием АСК противопоказан;
- если противопоказаны и АСК, и клопидогрель, рекомендованы пероральные антикоагулянты (с удержанием
- пероральные антикоагулянты (с удержанием рекомендованного
- в случае высокого риска тромбоэмболических событий, пероральные антикоагулянты можно принимать в комбинации с низкими дозами АСК, клопидогрелем или двойной антитромбоцитарной терапией (АСК + клопидогрель).
2. β-блокаторы (независимо от уровня АД или состояния функции левого желудочка).
3. Ингибиторы АПФ (независимо от уровня АД или состояния функции левого желудочка); при непереносимости – блокаторов рецепторов ангиотензина-II.
4. Гиполипидемическую терапию:
- статины рекомендованы у всех пациентов для достижения уровня холестерина липопротеинов низкой плотности (ЛПНП) < 100 мг/дл (2,5 ммоль/л) (I, A), у пациентов высокого риска следует рассмотреть целесообразность снижения этого показателя до еще более низкого целевого уровня – < 80 мг/дл (2,0 ммоль/л);
- если уровень триглицеридов превышает 150 мг/дл (1,7 ммоль/л) и/или содержание холестерина липопротеинов высокой плотности (ЛПВП) < 40 мг/дл (1,0 ммоль/л), рекомендуются соответствующие мероприятия по модификации образа жизни;
- у пациентов, которые не переносят статины, могут использоваться фибраты и препараты омега-3-полиненасыщенных жирных кислот, особенно если уровень триглицеридов > 150 мг/дл (1,7 ммоль/л) и/или содержание холестерина ЛПВП < 40 мг/дл (1,0 ммоль/л).
5. Прививки против гриппа (I, B).
Для уменьшения риска внезапной сердечной смерти у больных с фракцией выброса ≤ 30-40% и СН ≥ II класса по NYHA (или III класса на протяжении по крайней мере 40 суток после ИМ) показана имплантация кардиовертера-дефибриллятора. Следует рассмотреть целесообразность такой тактики и у пациентов с фракцией выброса ≤ 30-35% и СН I класса по NYHA на протяжении, по крайней мере, 40 суток после ИМ.
Информация
Источники и литература
-
ACC/AHA Guideline Update for the Management of Patients With Unstable Angina and Non–ST-Segment Elevation Myocardial Infarction, 2002
-
ACC/AHA Guidelines for the Management of Patients With Unstable Angina /Non–ST-Elevation Myocardial Infarction, 2007
-
ACCF/AHA Guideline for the Management of ST-Elevation Myocardial Infarction, 2013
-
Алперт Дж., Френсис Г. Лечение инфаркта миокарда, М.: Практика, 1994
- стр. 255
-
Бабунашвили А.М., Рабкин И.X., Иванов В.А. Коронарная ангиопластика,М.: АСВ, 1996
- стр. 352
-
Байес де Луна А., Фиол-Сала М., Антман Э.М. ЭКГ при инфаркте миокарда с подъемом ST, СПб: Медицинская литература, 2009
-
Болезни сердца и сосудов. Руководство для врачей в 4 томах, под ред. Чазова Е.И., М.: Медицина, 1992
- "Хирургическое лечение ишемической болезни сердца и инфаркта миокарда" Акчурин Р. С. -
-
Гриффин Б.,Тополь Э. Кардиология (Manual of Cardiovascular Medicine), М.: Практика, 2008
-
Гурвич М.М. Заболевания сердца и сосудов. Лечебное питание, СПб:Эксмо, 2008
-
Кузьменко А.Т., Камышников В.С. Лабораторная диагностика острого инфаркта миокарда, СПб: Адукацыя i выхаванне, 2009
-
Лайбольд Г. Здоровое сердце и сосуды. Лечение и профилактика заболеваний сердечно-сосудистой системы, СПб: АСТ, Астрель, ВКТ, 2008
-
Люсов В.А., Волов Н.А., Гордеев И.Г. Инфаркт миокарда, СПб: Литтерра, 2010
-
Малышева И.С. Инфаркт. Профилактика и лечение, М.:Вектор, 2008
-
Сыркин А.Л. Инфаркт миокарда, СПб: Медицинское информационное агентство, 2006
-
Филатова М. "Жизнь после инфаркта", СПб: АСТ, Сова, 2007
-
Хубутия М.Ш., Газарян Г.А., Захаров И.В. Реперфузионная терапия в остром периоде инфаркта миокарда, СПб: ГЭОТАР-Медиа, 2010
-
Шилов А.М. Инфаркт миокарда, М.:Миклош, 2009
-
Якушин С.С. Инфаркт миокарда. Руководство, СПб: ГЭОТАР-Медиа, 2010
-
"Force on Practice Guidelines (Committee on the Management of Patients with Unstable Angina) 2002", "Journal of the American College of Cardiology" №40, 2002
-
"Myocardial infarction redefined - a consensus document of The Joint European Society of Cardiology/American College of Cardiology committee for the redefinition of myocardial infarction", "Journal of the American College of Cardiology", №36(3), 2000
-
"Дальнейшие шаги в исследовании сердечной недостаточности" Бураковский В.И., Работников В.С., Казаков Э.Н., "Грудная и сердечно-сосудистая хирургия", №7, 1991
-
"Коронарное русло, гемодинамика и сократительная функция миокарда у больных ИБС с постинфарктным кардиосклерозом в аспекте хирургического лечения" Алекян Б.Г.,автореф. дис. канд. мед. наук., М., 1980
-
"Ранние и одногодичные результаты коронарного шунтирования: связь с дислипопротеидемией" Агапов А.А., Власова Э.Е., Акчурин Р.С. и др., журнал "Кардиология", №12, 1996
-
"Факторы риска коронарного шунтирования при нестабильной стенокардии" Агапов А.А., Тарасова Л.В., Ширяев А.А., Акчурин Р.С., журнал "Кардиология", №11, 1996
Информация
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.