Нефробластомы у детей
 Версия: Клинические протоколы МЗ РК - 2022 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2022 (Казахстан)
Злокачественное новообразование почечных лоханок (C65), Злокачественное новообразование почки, кроме почечной лоханки (C64), Злокачественное новообразование: поражение мочевых органов, выходящее за пределы одной (C68.8)
Онкология, Онкология детская, Педиатрия
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «24» апреля 2025 года
Протокол №230
КЛИНИЧЕСКИЙ ПРОТОКОЛ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
НЕФРОБЛАСТОМЫ У ДЕТЕЙ
НЕФРОБЛАСТОМЫ У ДЕТЕЙ
ВВОДНАЯ ЧАСТЬ.
Код(ы) по МКБ-10:
|
МКБ 10
|
МКБ 9
|
||
|
Код
|
Название
|
код
|
Название
|
|
C64
|
Злокачественное новообразование почки, кроме почечной лоханки
|
55.39
|
Другие виды локального иссечения или деструкции пораженного участка или ткани
почки |
|
55.50
|
Полная нефрэктомия
|
||
|
55.51
|
Нефроуретерэктомия
|
||
|
55.90
|
Другие операции на почке
|
||
|
C65
|
Злокачественное новообразование почечных
лоханок |
55.40
|
Частичная нефрэктомия
|
|
C68.8
|
Поражение мочевых органов, выходящее за
пределы одной |
55.51
|
Полная нефрэктомия
|
Дата разработки/пересмотра протокола: 2016 год (пересмотр 2022 г.).
Пользователи протокола: детские онкологи/гематологи, врачи общей практики, педиатры, детские хирурги, радиологи, детские урологи, нефрологи.
Категория пациентов: дети.
Определение:
Нефробластома или опухоль Вильмса происходит из развивающихся тканей почек, метанефрогенетического ростка и составлет до 6% всех ЗН детского возраста.
Это высоко злокачественная эмбриональная опухоль. Является наиболее частым злокачественным новообразованием мочеполового тракта у детей и составляет 7,8 случаев на миллион детей в возрасте от 1 года до 14 лет. В основном встречается у детей младше 5 лет, 90% у детей в возрасте до 3 лет. В 5% случаев нефробластома возникает билатерально, в основном ввиду билатерального нефробластоматоза. Клеточный прогенитор нефробластомы еще не изучен, но предполагается, что им является эмбриональная стволовая/прогениторная клетка [2]
Опухоль почки может сочетаться со следующими синдромами:
Определение:
Нефробластома или опухоль Вильмса происходит из развивающихся тканей почек, метанефрогенетического ростка и составлет до 6% всех ЗН детского возраста.
Это высоко злокачественная эмбриональная опухоль. Является наиболее частым злокачественным новообразованием мочеполового тракта у детей и составляет 7,8 случаев на миллион детей в возрасте от 1 года до 14 лет. В основном встречается у детей младше 5 лет, 90% у детей в возрасте до 3 лет. В 5% случаев нефробластома возникает билатерально, в основном ввиду билатерального нефробластоматоза. Клеточный прогенитор нефробластомы еще не изучен, но предполагается, что им является эмбриональная стволовая/прогениторная клетка [2]
Опухоль почки может сочетаться со следующими синдромами:
-
Опухоль Вильмса:
- Определенные особенности, ассоциированные с синдромом БеквитаВидемана (омфалоцеле и/или гипогликемия у новорожденных, психическое состояние, макроглоссия, гемигипертрофия, гепатомегалия, нефромегалия);
- WAGR (аниридия, пороки развития урогенитальной системы, задержка умственного развития);
- Синдром Дениса-Драша (нефропатия и аномалии половых органов);
- Нейрофиброматоз Реклингхаузена;
- Другие редкие синдромы (синдром Симпсона - Голаби - Бемеля, синдром Костелло, синдром Перлмана, синдром Сотоса, анемия Фанкони и др.).
-
Злокачественная рабдоидная опухоль почки (MRTK):
- Герминальные мутации SMARCB.
-
Cветлоклеточная саркома почки (CCSK) и врожденная мезобластная нефрома (CMN):
- Ассоциированных синдромов нет.
-
Почечно-клеточная карцинома (RCC):
- Клинические особенности, ассоциированные с синдромом Гиппеля-Линдау (гемангиобластомы сетчатки или головного мозга, почечные кисты, феохромоцитома);
- Туберозный склероз (эпилепсия, нарушение развития и поведенческие расстройства, такие как аутизм или гиперактивность, рабдомиома сердца, гамартома сетчатки или ангиомиолипома почки);
- Синдром Бёрта -Хога - Дьюба (фиброфолликуломы, неоплазии).
Сокращения, используемые в протоколе:
|
КТ
|
компьютерная томография
|
|
ЛДГ
|
Лактатдегидрогеназа
|
|
МРТ
|
магнитно-резонансная томография
|
|
ПЭТ
|
позицитронно-эмиссионная томография
|
|
ТГСК
|
трансплантация гемопоэтических стволовых клеток
|
|
УЗИ
|
ультразвуковое исследование
|
|
ЦНС
|
центральная нервная система
|
|
Г-КСФ
|
гранулоцитарный колониестимулирующий фактор
|
|
ЛТ
|
лучевая терапия
|
|
ЛУ
|
лимфатический узел
|
|
ПО (CR)
|
полный ответ
|
|
ЧР (PR)
|
частичный ответ
|
|
NB
|
Нефробластоматоз
|
|
ПЗ (PD)
|
прогрессирование заболевания
|
|
СЗ (SD)
|
стабилизация заболевания.
|
|
ПХТ
|
Полихимиотерапия
|
|
АД
|
артериальное давление
|
|
ВГН
|
верхняя граница нормы
|
|
ВОБ
|
веннооклюзионная болезнь печени
|
|
ГР
|
группа риска
|
|
КООТ
|
клиническеий объем облучаемых тканей
|
|
КП
|
клинический протокол
|
|
ОАК
|
общий анализ крови
|
|
ОХЧО (VGPR)
|
очень хороший частичный ответ
|
|
ЭКГ
|
Электрокардиография
|
|
ЭхоКГ
|
Эхокардиография
|
|
ПООТ
|
Планируемый объем облучаемых тканей
|
|
VCR
|
Винкристин
|
|
ACT
|
Дактиномицин
|
|
VP16
|
Этопозид
|
Шкала уровней доказательности:
|
А
|
Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты, которых могут быть распространены на соответствующую популяцию.
|
|
В
|
Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию.
|
|
С
|
Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+).
Результаты, которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
|
D
|
Описание серии случаев или неконтролируемое исследование, или мнение экспертов.
|
Классификация
Классификация [1].
В классификации опухолей почки (2007) опухоль Вильмса относится к нефробластным опухолям, другие опухоли почки не являются опухолью Вильмса.
Гистологическая дифференциация в соответствии с классификацией SIOP.
Номенклатура опухолей почек у детей:
Гистологическая дифференциация в соответствии с классификацией SIOP.
Номенклатура опухолей почек у детей:
І. Опухоли низкой степени злокачественности (около 10%) («благоприятные»):
-
кистозная, частично дифференцированная нефробластома;
-
нефробластома с фиброаденоматозно-подобными структурами;
-
нефробластома с высокодифференцированным эпителиальным типом;
-
мезобластическая нефрома.
ІІ. Опухоли средней степени злокачественности (75-80%) («стандартное»):
-
нефробластома с плоходифференцированным эпителиальным типом;
-
нефробластома с регулярной или нерегулярной бластемией;
-
нефробластома с преобладанием стромы (включая фетальный рабдомиоматозный тип).
ІІІ. Высокозлокачественные опухоли (около 10-15%) («неблагоприятные»):
-
нефробластома с анаплазией;
-
нефробластома с саркоматозной стромой;
светлоклеточная саркома почки.
-
Неклассифицируемые нефробластомы:
-
нефробластома при которой некоторые характеристики сохранены;
-
полностью некротизированная нефробластома.
-
-
Другие злокачественные опухоли:
-
почечно-клеточный рак;
-
рабдоидная опухоль;
-
злокачественная лимфома.
-
Система стадирования по SIОР:
Стадия I:
- a) Опухоль ограничена почкой или окружена фиброзной (псевдо) капсулой, если жизнеспособная опухоль находится за пределами здоровых контуров почки. Почечная капсула или псевдокапсула могут быть инфильтрированы опухолью, но опухоль не достигает внешней поверхности капсулы.
- b) Опухоль может выбухать ("выступать") в систему таза и "погружаться" в мочеточник, но не инфильтрирует их стенки.
- c) Сосуды или мягкие ткани почечного синуса не поражены.
- d) Может присутствовать поражение внутрипочечных сосудов.
Примечания:
- Зрелые канальцы в пределах синуса или прикорневой области обычно представляют собой перилобарные нефрогенные остатки. Интралобарные нефрогенные остатки могут расти в пределах синуса. Истинная инфильтрация синуса/прикорневых структур обычно выглядит как бластемные очаги, тесно связанные с нервами.
- Тонкоигольная аспирационная биопсия или перкутанная кор (‘tru-cut’) биопсия не являются основанием для повышения стадии опухоли.
- Наличие некротической опухолевой ткани или вызванных химиотерапией изменений в почечном синусе, почечных венах и/или в пределах околопочечной жировой клетчатки не должно рассматриваться как основание для повышения стадии опухоли.
- Инфильтрация надпочечника не повышает стадию опухоли, если внешняя капсула надпочечника интактна.
- Печень: опухоль может прикрепляться к капсуле печени, но это не должно рассматриваться как инфильтрация прилежащего органа; только при явной инфильтрации паренхимы печени опухоль следует рассматривать как стадию III.
Стадия II:
-
Жизнеспособная опухоль присутствует в околопочечной жировой клетчатке и не покрыта (псевдо) капсулой, но она полностью резецирована (края резекции "чистые").
-
Жизнеспособная опухоль инфильтрирует мягкие ткани почечного синуса.
-
Жизнеспособная опухоль инфильтрирует кровь и лимфатические сосуды почечного синуса или почечных вен или присутствует в околопочечной ткани, но опухоль полностью резецирована.
-
Жизнеспособная опухоль инфильтрирует стенку мочеточника.
-
Жизнеспособная опухоль инфильтрирует прилежащие органы или полую вену, но опухоль полностью резецирована.
Стадия III:
-
Жизнеспособная опухоль распространяется на края резекции. Если на линии резекции, помеченной чернилами, присутствует только нежизнеспособная опухоль, она рассматривается как стадия III, только если жизнеспособная опухоль находится на расстоянии <5 мм до помеченного чернилами края. Если жизнеспособная опухоль находится на расстоянии >5 мм от линии резекции, а на помеченном чернилами крае присутствуют только регрессивные изменения, это не повышает стадию опухоли (участок ткани без жизнеспособной опухоли минимальной длиной 5 мм должен быть документально зафиксирован с использованием нескольких блоков, взятых из этого участка).
-
Любые абдоминальные лимфоузлы поражены либо жизнеспособной, либо нежизнеспособной опухолью.
-
Пред или интраоперационный разрыв опухоли, если это визуально заметно в ходе патологоанатомического исследования (независимо от других критериев стадирования).
-
Опухолевый тромб присутствует на краях резекции мочеточника, почечной вены или нижней полой вены (всегда обсуждайте края резекции с хирургом).
-
Опухолевый тромб, прикрепленный к НПВ, был фрагментарно удален хирургом.
-
До начала предоперационной химиотерапии или до хирургической операции была проведена биопсия опухоли (клиновидная/открытая биопсия).
-
Опухолевые имплантаты (жизнеспособные и/или нежизнеспособные) обнаружены в любой части брюшной полости.
-
Опухоль (жизнеспособная и/или нежизнеспособная) проросла через перитонеальную поверхность.
Примечания:
-
Проблема ретракции почечной вены: часто тромб выступает за пределы линии резекции почечной вены. Это подчеркивается в ходе ретракции вены после резекции и фиксации. Такие случаи должны обсуждаться с хирургом, чтобы установить, легко ли был удален тромб или он был прикреплен к НПВ, и хирургу пришлось использовать инструменты или особые усилия, чтобы удалить тромб. Если хирургу удалось просто извлечь тромб из сосуда, выступающий тромб на крае резекции сосуда не означает стадию III. Только в случаях, когда проводилось фрагментарное или очень сложное удаление тромба, следует рассматривать стадию III.
-
Наличие некротической опухолевой ткани или вызванных химиотерапией изменений в лимфоузле расценивается как доказательство наличия существовавшей ранее опухоли с микроскопическими остатками, и поэтому для опухоли определяется стадия III (в связи с возможностью, что некоторая часть жизнеспособной опухоли осталась в соседнем лимфоузле). Регрессивные изменения в лимфоузлах должны иметь признаки области, подобной опухоли, и иметь форму прежней опухолевой инфильтрации. Группы макрофагов в синусе не должны расцениваться как прежняя опухолевая инфильтрация.
-
Зрелые канальцы, которые можно обнаружить в лимфоузлах, часто ассоциируются с депозитами протеина Тамм-Хорсфалла, но также могут быть не связаны с ними. Это не должно расцениваться как метастаз в лимфоузле.
-
Наличие разрывов на момент постановки диагноза рассматривается как патологическая стадия III, только если это обнаружено в ходе нефрэктомии. Если нет, стадирование опухоли должно проводиться, исходя из других видимых критериев, и решение об окончательной стадии для лечения должно приниматься после обсуждения на совещании участников мультидисциплинарной команды/совета по опухолям.
Стадия IV:
Гематогенные метастазы (в легких, печени, костях, головном мозге и т.д.) или метастазы в лимфоузлах за пределами абдоминально-тазовой области.
Стадия V:
Наличие двусторонних ренальных опухолей на момент постановки диагноза. Должно проводиться дополнительное стадирование опухолей с каждой стороны в соответствии с описанными выше критериями.
Рабочая классификация по группам риска согласно SIOP-2001.
А. Для опухолей после проведения предоперационной ПХТ.
Опухоли низкого риска:
А. Для опухолей после проведения предоперационной ПХТ.
Опухоли низкого риска:
- мезобластическая нефрома;
- кистозная частично дифференцированная нефробластома;
- полностью некротическая нефробластома.
- нефробластома – эпителиальный тип;
- нефробластома – стромальный тип;
- нефробластома – смешанный тип;
- нефробластома – регрессивный тип;
- нефробластома – фокальная анаплазия.
- нефробластома – бластемальный тип;
- нефробластома – диффузная анаплазия;
- светлоклеточная саркома;
- рабдоидная опухоль почки.
В. Для первично-диагностированных нефробластом.
Опухоли низкого риска:
- мезобластическая нефрома;
- кистозная частично дифференцированная нефробластома.
Опухоли среднего риска:
- не-анапластическая нефробластома и ее варианты;
- нефробластома – фокальная анаплазия.
Опухоли высокого риска:
- нефробластома – диффузная анаплазия;
- светлоклеточная саркома;
- рабдоидная опухоль почки.
Неблагоприятные факторы прогноза:
-
опухолевая инвазия почечной вены;
-
возраст ребенка;
-
гистологическое строение нефробластомы;
-
стадия заболевания;
-
разрыв опухоли до или во время операции;
-
наличие метастазов в лимфатических узлах и диссеминация опухоли;
-
генетические факторы прогноза.
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ.
Диагностические критерии.
Анамнез:
Анамнез:
- Общее состояние пациента, общие симптомы и признаки и продолжительность периода времени, в течение которого наблюдаются симптомы;
- ЭКО и вспомогательные репродуктивные технологии в анамнезе и вес при рождении;
- Наличие синдромов/пороков развития и их описание, включая наличие в анамнезе проводившихся по поводу синдрома операций, в том числе, урологических операций и других видов лечения;
- Перенесенные злокачественные заболевания/противораковая терапия и сочетанные заболевания в анамнезе;
- Синдромы и злокачественные новообразования в семейном анамнезе;
- Предшествующая противораковая терапия.
Жалобы.
Ведущие симптомы:
- Наиболее часто выявляется между 1 и 5 годами жизни, ассоциируются с пороками развития – аниридия, гемигипертрофия, урогенитальные пороки развития и т.п.
- Клинически опухоль Вильмса у внешне здорового ребенка обнаруживается матерью или педиатром во время обычного диспансерного наблюдения. Часто первым признаком заболевания является наличие в брюшной полости гладкой, иногда с неровной поверхностью, плотной, безболезненной опухоли.
- Другими неспецифичными симптомами проявления заболевания являются желудочно-кишечные расстройства, общее недомогание, лихорадка, боли в животе и повышение артериального давления, гематурия.
Физикальные обследования:
- Врачебный осмотр - выявление наличия опухолевых образований, врожденных аномалий (особенно мочеполового тракта и аниридии), измерение АД, веса, роста.
Лабораторные исследования.
Основные:
- Общий анализ крови – оценка общеклинических показателей крови (гемоглобина, лейкоцитов, тромбоцитов) для начала химиотерапии, а также длямониторинга после каждого курса химиотерапии
- Биохимический анализ крови: печеночные показатели, уровни азотистых шлаков, электролиты, общий белок и глюкоза, СРБ, ЛДГ для оценки критериев для начала химиотерапии или проведения оперативного этапа;
- Онкомаркеры для дифференциальной диагностики с нейробластомой: NSE в крови, суточная экскреция с мочой катехоламинов (ГМК, ВМК);
- Клиренс эндогенного креатинина – оценка функции почек перед началом химиотерапии, при снижении решение вопроса о редукции дозы;
- Гистологическое исследование опухоли – для определения гистологического варианта опухоли, степени регрессии и дифференцировки и для определения терапевтически индуцированного патоморфоза;
- Общий анализ мочи – контроль за состоянием почек на фоне проводимого лечения;
Дополнительные:
- Анализ спинно-мозговой жидкости – количество клеток, содержание глюкозы, белков, тумор клеток;
- Цитогенетическое исследование костного мозга - определение хромосомных нарушений;
- Молекулярно-генетическое исследование костного мозга и опухоли – выявление амплификации гена N-MYC является важным критерием для определения тактики терапии и решения вопроса о необходимости аутотрансплантациигемопоэтических стволовых клеток;
- ИФА на ЦМВ, ВЭБ, ВПГ, зостер, аспергиллы, вирусный гепатит В и С, краснуху, токсоплазмоз – при развитии инфекционных осложнений;
- Определение времени свертываемости капиллярной крови – перед операцией;
- Коагулограмма (протромбиновое время, фибриноген,тромбиновое время,АЧТВ, ПТВ по Квику) – для выявления дискоагуляции, учитывая токсичность специфической терапии, перед оперативным вмешательством;
- Коагулограмма (РФМК, этаноловый тест, антитромбинIII, агрегации тромбоцитов) – при подозрении на дискоагуляцию;
- Иммунограмма – риск развития септических осложнении на фоне аплазии кроветворения;
- Копрограмма – для выявления нарушения функций желудочно-кишечного тракта, печени, поджелудочной железы, воспалительного процесса, гельминтов.
- Бактериальный посев кала – при подозрении на инфекционные осложнения на фоне химиотерапии;
- Бактериологические исследования (крови на бактериемию, на грибы, мазок зева, носа, мочи, кала, раны, ротовой полости и др.) при инфекционных осложнениях;
- ИФА исследование на грибы рода кандида при развитии инфекционных осложнений;
- Микробиологическое исследование крови с определением чувствительности к антибиотикам при развитии инфекционных осложнений.
- Исследование кислотно-основного состояния при декомпенсированном состоянии, развитии органной недостаточности, анемическом синдроме.
- Определение группы крови и резус-фактора – учитывая возможное переливание на фоне проводимого спецлечения;
Инструментальные исследования.
Основные:
Основные:
- Ультразвуковая томография для выявления опухоли почки и изменений в противоположной почке и наличия опухолевого тромба в полой вене;
- Компьютерная томография грудной полости – для исключения метастазированияв лѐгких;
- Компьютерная томография брюшной полости с контрастным усилением – для уточнения распространенности основного процесса в почке, исключения метастазирования в другие органы брюшной полости, лимфатические узлы; При этом объём первичного очага рассчитывается по формуле: V(мл) =X(см) x Y(см) x Z(см) x 0.523;
- МРТ брюшной полости с контрастным усилением для уточнения распространенности основного процесса в почке, исключения метастазирования в другие органы брюшной полости, лимфатические узлы;
- ЭКГ – оценка состояния сердца перед началом системной химиотерапии, оперативного лечения.
Дополнительные:
- Нейросонография – перед планированием и на фоне химиотерапии детям до 1 года;
- ЭхоКГ – при нарушения на ЭКГ, болях за грудиной, при полисерозитах дляоценки функции сердечной деятельности;
- Электромиография – при поражении ЦНС, развитии периферической нейропатиина фоне системной высокодозной химиотерапии;
- УЗИ магистральных сосудов – при дополнительной катетеризации крупных вен при невозможности установки центрального подключичного катетера;
- Аудиограмма – оценка слуха из-за ототоксичности химиопрепаратов;
- ПЭТ-КТ всего тела – для оценки распространенности процесса;
- Рентгенография органов грудной клетки, при необходимости в двух проекциях – при подозрении на воспаление легких, кардит, контроль после установки подключичного катетера;
Показания для консультации специалистов
- Консультация узких специалистов:
- консультация невропатолога – при наличии неврологической симптоматики, нарушении функции органов малого таза, развитии осложнений на фоне химиотерапии
- консультация хирурга – для планирования и проведения оперативного лечения, биопсия отдаленных метастазов, развитие сопутствующей острой хирургической патологии
- консультация гастроэнтеролога – наличие сопутствующего заболевания, развитие осложнении со стороны желудочно-кишечного тракта во время химиотерапии - консультация анестезиолога – выбор сосудистого доступа, катетеризация центральных вен, установка длительно-стоящих катетеров, перед оперативным вмешательством
- консультация реаниматолога – при необходимости коррекции интенсивной терапии
- консультация хирурга – для планирования и проведения оперативного лечения, биопсия отдаленных метастазов, развитие сопутствующей острой хирургической патологии
- консультация гастроэнтеролога – наличие сопутствующего заболевания, развитие осложнении со стороны желудочно-кишечного тракта во время химиотерапии - консультация анестезиолога – выбор сосудистого доступа, катетеризация центральных вен, установка длительно-стоящих катетеров, перед оперативным вмешательством
- консультация реаниматолога – при необходимости коррекции интенсивной терапии
Диагностический алгоритм:
NB! Биопсию образования не делать.
Алгоритм первичной диагностики НБ [1]
Алгоритм первичной диагностики НБ [1]
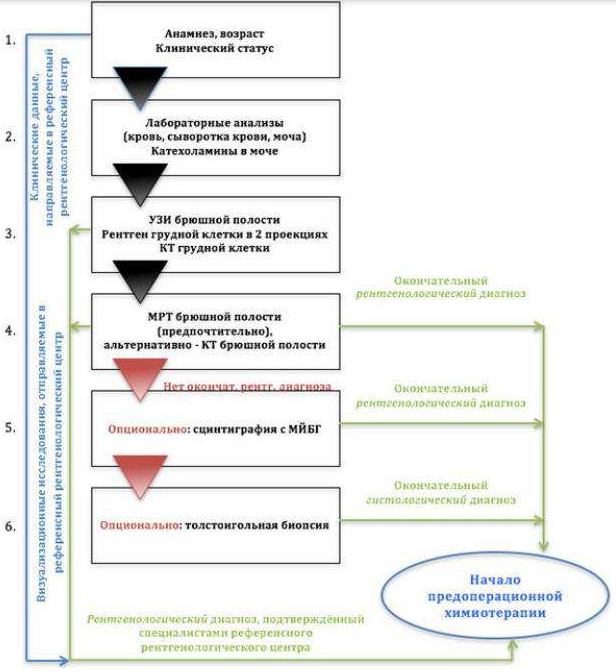
Алгоритм ведения пациента с НБ[1]
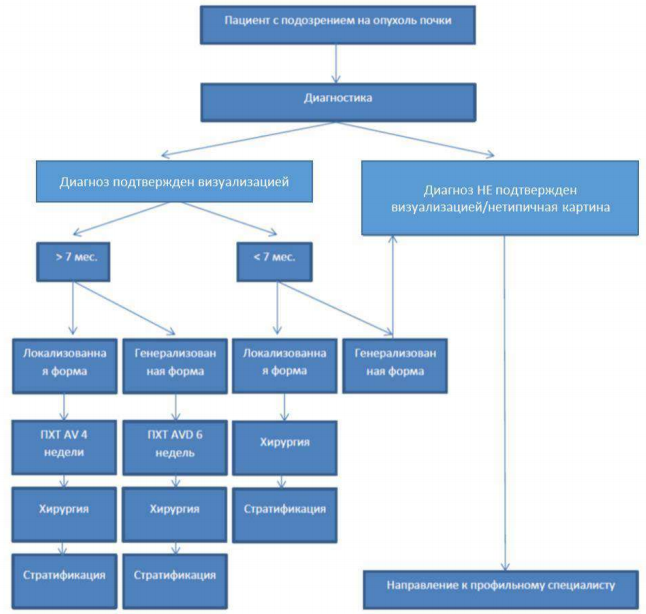
Дифференциальный диагноз
Дифференциальный диагноз:[1]
|
Диагноз
|
Пик заболеваемости
|
Обследования
|
Обоснование для
дифференциальной диагностики |
Критерии исключения диагноза
|
|
Нефробластома
|
1-6 лет
|
ЛДГ, ЩФ, Креатинин и мочевина, УЗИ ОБП (лимфоузлов в брюшной полости), КТ, МРТ(наличие лимфоузлов и инфильтраций)
|
Локализация опухоли в забрюшинном пространстве
|
Боли в животе, опухолевидное образование в брюшной полости гладкой, иногда с неровной поверхностью, плотной, безболезненной опухоли. Неспецифичные симптомы: желудочно-кишечные расстройства, общие симптомы интоксикации, повышение АД, гематурия.
|
|
Нейробластома
|
1-5 лет
|
ЛДГ, ферритин, катехоламины, НСЕ, УЗИ ОБП (лимфоузлов в брюшной полости), КТ,МРТ (наличие лимфоузлов и инфильтраций)
|
Локализация опухоли в забрюшинном пространстве
|
В зависимости от локализации первичной опухоли – односторонние пальпируемые опухолевые массы, миоз, птоз, энофтальм, вторичные опухоли орбиты с периорбитальными кровоизлияниями, диспепсические проявления, боли в животе, пальпируемая опухолевая масса в брюшной полости, нарушение
|
|
Рабдомиосаркома
|
2-6 лет
15-19 лет |
ЛДГ, УЗИ ОБП (лимфоузлов в брюшной полости), КТ,МРТ (наличие лимфоузлов и инфильтраций)
|
Локализация опухоли в забрюшинном пространстве
|
При расположении в забрюшинном пространстве возможно пальпируемое образование в брюшной полости и боли в животе. Но клинические проявления зависят от вида и степени поражения органа.
|
|
Гепатобластома
|
Дети до 3лет
|
АФП, ХГЧ, УЗИ ОБП
(лимфоузлов в брюшной полости), КТ,МРТ(наличие лимфоузлов и инфильтраций) |
Локализация опухоли в брюшной полости
|
Пальпируемое образование в брюшной полости, снижение аппетита вплоть до анорексии, потеря веса, возможно желтуха, диспепсические проявления, лихорадка.
|
|
Острые лейкозы
|
2-6 лет
15-19 лет |
Креатинин и мочевина, УЗИ ОБП (лимфоузлов в брюшной полости), миелограмма
|
Гепатоспленомегалия
|
Симптомы интоксикации, гиперпластический синдром, анемический синдром, геморрагический синдром
|
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ:
нет
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ.
Карта наблюдения пациента, маршрутизация пациента:
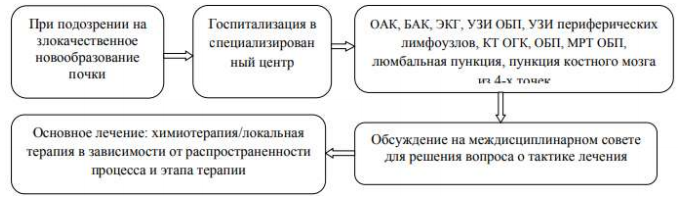
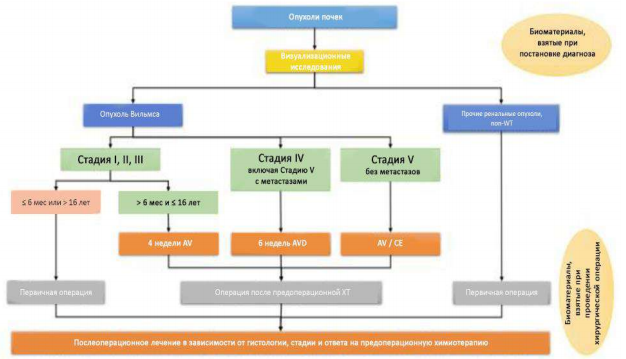
Таблица 1. Общая схема лечения опухолей почек у детей.
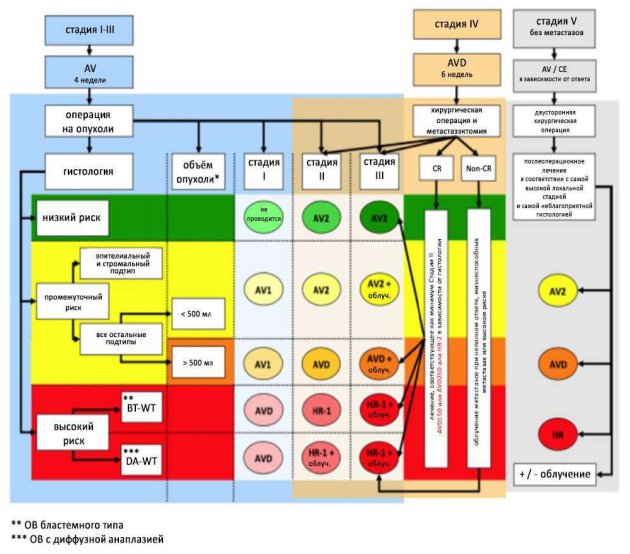
Таблица 2. Общая схема лечения Нефробластом по стадиям.
Немедикаментозное лечение:
-
ламинарный поток воздуха;
-
изолированные (боксированные) палаты;
-
усиленное питание – стол №11, 15, 16, высококалорийная диета с полуторным по сравнению с возрастными нормами количеством белков, витаминизированная, богатая минеральными веществами.
Рекомендации по проведению лучевой терапии.
В зависимости от стадии опухоли, гистологии, ответа на химиотерапию и статуса резекции, примерно у 15% детей с нефробластомой лучевая терапия (ЛТ) по- прежнему занимает важное место в рамках концепции терапии, нацеленной на излечение. Паллиативная ЛТ может дополнить варианты лечения при случаях без намерения на излечение. Показания к проведению ЛТ и терапевтические стратегии ЛТ, содержащиеся в протоколе SIOP 2011, являются надлежащими и эффективными. Не проводить буст на лимфатические узлы на стадии III с инициально позитивным статусом лимфатических узлов и полной резекцией.
- Доза тотального облучения легких сокращена до 12 Гр в случаях с гистологической группы промежуточного риска.
- Тотальное облучениe легких назначается в случае гистологической группы промежуточного риска с полной резекцией, но гистологически подтвержденным резидуальным заболеванием.
- В случае рекуррентного заболевания с метастазами в легких без предварительного облучения легкого в рамках лечения первой линии необходимо провести тотальное облучение легких при всех типах гистологии и ремиссии. IMRT и IGRT, могут применяться до тех пор, пока они будут способствовать снижению дозы облучения здоровых тканей, подверженных риску (н-р, печень, сердце), включать объем мишени согласно рекомендациям и предотвращать значительное рассеивание дозы на непораженные участки при большем объеме.
Показания к пост-операционной боковой ЛТ:
-
Гистологически средняя степень риска, III стадия (поражение лимфоузлов N+,остаточные явления болезни после операции, разрыв опухоли);
-
Высокая степень риска, II стадия, за исключением бластемного типа;
-
Высокая степень риска, III стадия;
-
IV и V стадии в соответствии с локальной стадией.
Показания к пост-операционной абдоминальной ЛТ:
- ЛТ всей брюшной полости показана при ДИФФУЗНОЙ внутрибрюшной опухоли или МАКРОСКОПИЧЕСКОМ предоперационном или периоперативном разрыве.
- Необходимо начинать абдоминальную/боковую ЛТ в течение 2 недель после абдоминальной операции. Если предполагается провести операцию по удалению легочных метастазов или легочную ЛТ, то следует отложить проведение абдоминальной ЛТ. В случае проведения операции на легких абдоминальная ЛТ начинается после этой операции. Если же операция на легких не проводится, то абдоминальная ЛТ начинается после недели 9 с легочной ЛТ или без нее.
Показания к легочной ЛТ:
-
Остаточная опухолевая ткань в легких видна на РГ грудной клетки или КТ- снимке после завершения предоперационной химиотерапии. Если есть сомнения по поводу природы легочного узелка (например, одиночный узелок не изменился под влиянием предоперационной химиотерапии), то следует рассмотреть хирургическое удаление перед вынесением окончательного решения о необходимости облучения.
-
Полное выздоровление: РГ или КТ-снимок грудной клетки не выявили никаких патологий.
-
ЛТ также показана при гистологической первичной опухоли высокой степени риска, несмотря на метастатическую реакцию (за исключением высокой степени риска ввиду бластемного преобладания, что следует обсудить с координаторами исследования).
Показания к ЛТ печени:
-
Печеночные метастазы, которые не полностью реагируют на химиотерапию и не могут быть полностью удалены с «негативными краями».
Показания к ЛТ других локализаций метастазов:
-
Пациентов с гематогенными местастазами в мозге (ЛТ всего мозга) и/или с костными метастазами (фокальная ЛТ) на момент постановки диагноза следует лечить соответствующими видами ЛТ, вне зависимости от реакции на химиотерапию.
Цели лучевой терапии:
-
Осуществление контроля над абдоминальными заболеваниями у пациентов, которые подвержены значительному риску.
-
Усиление контроля над легочными метастазами у пациентов, которые не достигли полного выздоровления.
-
Усиление контроля над метастазами в печени у пациентов, которые не достигли полного выздоровления после химиотерапии или операции (резекции R1 и R2).
-
Усиление контроля над метастазами в мозге.
-
Усиление контроля над костными метастазами.
Объем облучаемых тканей
-
Объем облучаемых тканей определяется в соответствии с рекомендациями Радиологов.
Локализация первичной опухоли и почки при боковой/абдоминальной ЛТ:
- Для планирования ЛТ необходимо определить точную локализацию опухоли до операции в соответствии с предоперационным контрастным КТ-снимком;
- Во время операции границы опухоли и почки должны быть обозначены клипсами, и если есть области с подозрением на неполное удаление образования, то они также должны быть обозначены клипсами (клипсы должны быть сделаны из материала, не мешающего работе КТ и МРТ).
- Если нет возможности сделать предоперационный контрастный КТ-снимок, следует руководствоваться вышеуказанными пунктами для установления положения и размера опухоли.
- Обозначение краев опухоли/почки является, возможно, самым важным способом установления положения и размера опухоли наряду с хирургическими и гистопатологическими отчетами.
- По бокам, снизу и сверху от этих клипс следует сделать отступ в 1 см.
- Медиальный край всегда охватывает полную ширину тела позвонков.
- При предоперационном или интраоперационном разрыве анатомическая локализация и внутрибрюшная полость (внутри/заднебрюшинная) должны быть четко обозначены в хирургической заметке или графике. Следует указать проникновение в периренальный жир с вовлечением лимфатических узлов, неполную макроскопическую резекцию, микроскопические или макроскопические разрывы.
- Если осталась макроскопическая опухоль, то для отображения (ее размера и очертаний) можно провести пост-операционную КТ брюшной полости.
Симуляция:
-
Все пациенты пройдут процедуру симуляции с традиционным или КТ- симулятором. Все пациенты будут наблюдаться в положении лежа на спине. Индивидуальные блоки переносятся на имитационных снимки и проверяются на симуляторе. По возможности все критические органы будут изолированы.
Клинический объем облучаемых тканей.
Боковая ЛТ:
-
КООТ: Включает в себя размеры пост-химиотерапевтической и предоперационной макроскопической опухоли и почки в соответствии с хирургическими и гистопатологическими протоколами и с их размерами на КТ/УЗИ-снимке. Граница КООТ равна 1 см.
-
Если нет предоперационного КТ-снимка, то КООТ обозначается клипсами на границах опухоли и почки, которые устанавливаются хирургом во время операции. Отступ от клипс в 1 см является границей КООТ.
-
Объем, подлежащий лечению, должен проходить через срединную линию, чтобы обеспечить равномерное облучение полной ширины тела позвонков. Дополнительные дозы при остаточных явлениях макроскопической болезни:
-
КООТ: должен включать участок макроскопических остаточных явлений после операции с границей в 1 см. Если есть показание к ЛТ парааортальных лимфоузлов, то граница краниальной области должна приходиться на грудной позвонок на уровне T-10-TV-11, в то время как почти 50% чревного ствола отходит от аорты на уровне ножки 12-го позвонка.
-
Весь объем позвоночных тел тоже должен получать равномерную дозу облучения.
ЛТ всей брюшной полости:
-
КООТ: включает все органы брюшной полости и брюшину, расположенных в области от купола диафрагмы до тазового дна (нижняя граница запирательного отверстия).
Легочная ЛТ:
-
КООТ: включает оба легких вместе с верхушками и реберно- диафрагмальными впадинами. Если также будет показана абдоминальная ЛТ, то обе области должны быть тщательно выровнены во избежание пробелов или наложений.
ЛТ печени:
-
КООТ: включает участок с не полностью вырезанной опухолью с границей в 2 см.
ЛТ мозговых метастазов:
-
КООТ: облучается весь мозг. ЛТ гематогенных метастазов в кости:
-
КООТ: При костных метастазах не обязательно облучать всю кость. Участок облучения включает потенциальное место с опухолью, которую видно на снимках, с границей не менее 3 см со всех сторон.
Планируемый объем облучаемых тканей (ПООТ):
-
Определение границ для ПООТ зависит от правил конкретного отдела. В целом, устанавливаются следующие границы:
-
Внутренний край: 1 см для дыхательных движений;
-
При левосторонних опухолях ЛТ сердца по возможности следует избегать.
Дозы облучения:
-
Предписание: срединная плоскость центральной оси параллельно расположенных областей (определение ICRU 50).
Боковая ЛТ:
-
Суммарная доза зависит от стадии и патологии. Доза за фракцию обусловлена возрастом ребенка и задействованной областью облучения.
III стадия, промежуточный риск: 14,4 Гр
-
Дополнительная доза при остаточных явлениях макроскопической болезни после операции: 10,8 Гр (суммарная доза 25,2 Гр). Пациенты с «положительными» лимфоузлами должны получать дополнительную дозу облучения для парааортальных лимфоузлов.
-
II стадия, III стадия, высокий риск: 25,2 Гр. Дополнительная доза для остаточных явлений макроскопической болезни: 10,8 Гр.
ЛТ всей брюшной полости:
-
Вся брюшная полость должна получить дозу облучения не более 21 Гр, и следует рассмотреть возможность дополнительной дозы для ограниченного участка (как при боковой ЛТ). Доза за фракцию должна быть понижена до 1,5 Гр.
-
На время абдоминальной лучевой терапии следует назначить молочную и безглютеновую диету.
-
Для детей младше одного года следует уменьшить дозу до 10-12 Гр.
ЛТ мозга:
-
Весь мозг получает дозу облучения в 25,5 Гр. Возможна небольшая дополнительная доза (4,5 Гр).
ЛТ печени:
-
Возможна доза в 20 Гр для участка с R1 резекцией метастазов. ЛТ кости:
-
При костных метастазах доза облучения метастаза равна 30 Гр.
Легочная ЛТ:
-
При полной ЛТ легких суммарная доза равна 15 Гр для обоих легких (с учетом тканевой неоднородности). Доза за фракцию равна 1,5 Гр и доставляется в течение 10 лечебных дней. Следует рассмотреть целесообразность дополнительной дозы в 10-15 Гр для участков с выявленными после операции макроскопическими остаточными явлениями.
Рекомендации по режиму облучения.
Ежедневная доза:
-
Доза за фракцию устанавливается лечащим онкологом-рентгенологом и зависит от возраста ребенка и задействованной области облучения.
Боковая ЛТ:
-
Доза за фракцию равна 1,8 Гр, но может быть понижена при облучении больших участков (например, всей брюшной полости).
Общая абдоминальная ЛТ:
-
Доза за фракцию составляет 1,5 Гр, но может быть понижена до 1,25 Гр для детей младше 2 лет и при токсичности.
Полная ЛТ легких:
-
Доза за фракцию равна 1,5 Гр (с учетом однородности). ЛТ мозга:
-
Доза за фракцию 1,5 Гр. ЛТ печени:
-
Доза за фракцию 1,5 Гр. Костные метастазы: Доза за фракцию 3 Гр. Количество фракций в день. Ежедневная фракция, 5 дней в неделю, понедельник- пятница.
Отдых/Перерывы:
-
Продолжительность отдыха должна быть сведена к абсолютному минимуму. Перерывы на обслуживание медицинской техники и государственные праздники должны осуществляться только в случае крайней необходимости.
Перерывы из-за миелотоксичности:
-
следует прервать ЛТ, если число нейтрофилов падает ниже 0,5 x 109/л, и не возобновлять, пока показатель не достигнет хотя бы 1,0 x 109/л.;
-
следует прервать ЛТ, если число тромбоцитов падает ниже 25 x 109/л, и не возобновлять, пока показатель не достигнет хотя бы 50 x 109/л.
-
Во время ЛТ гемоглобин должен поддерживаться на уровне 10 г/дл минимум и при необходимости скорректирован в соответствии с переливанием.
-
Можно использовать Г-КСФ, если число нейтрофилов падает ниже 0,5, и продолжать его, пока показатель не станет больше 1,0.
Согласование доз и справочно-информационные ресурсы (ICRU 50):
-
Изменение дозы в пределах объема облучаемых тканей не должно превышать 5 % - + 7% описанных доз.
Способ лечения:
-
В целом, пациенты будут наблюдаться в положении лежа. Сохранений здоровых тканей: Доза для критических органов:
-
Сохранившаяся почка: доза для сохранившейся почки не должна превышать 12 Гр.
-
Печень: доза для всей печени не должна превышать 20 Гр. Доза, превышающая 20 Гр, может быть применена только для участка, составляющего меньше половины объема печени.
-
Легкие: полная доза для легких не должна быть больше 15 Гр во фракциях по 1,5 Гр (с учетом неоднородности). Доза, превышающая 15 Гр, может быть применена только для участка, составляющего менее 25% объема легких.
Защита:
-
Суставы: при легочной ЛТ плечевые суставы должны быть защищены. При ЛТ всей брюшной полости следует защитить тазобедренные суставы.
Послеоперационная лучевая терапия.
Лучевая терапия проводится после получения гистологического заключения и установления стадии во время операции, параллельно послеоперационной ПХТ, начинается на 2-3 неделе после туморнефрэктомии. Облучение проводится на линейном ускорителе 4-6 MV. Длительность составляет 7-10 дней.
Объем облучения зависит от результатов операции и во всех случаях выполняется тщательное экранирование печени, селезенки и противоположной почки.
Показаниями послеоперационной локальной лучевой терапии с облучением ложе опухоли являются:
Объем облучения зависит от результатов операции и во всех случаях выполняется тщательное экранирование печени, селезенки и противоположной почки.
Показаниями послеоперационной локальной лучевой терапии с облучением ложе опухоли являются:
-
стандартный риск нефробластомы, III стадия (поражение регионарных лимфоузлов, разрыв опухоли, неполное удаление опухоли);
-
высокий риск (высокая степень злокачественности опухоли), стадия II (за исключением blastemreicher подтип) и III стадии;
-
стадия IV и V - в зависимости от локальной стадии.
В связи с неблагоприятным прогнозом подтипа blastemreichen на возникновение метастазов и из-за риска локального рецидива, эта опухоль требует в отличие от других опухолей высокой злокачественности стадии II локальной радиотерапии. То же самое относится и к Linkblog. Опухоли промежуточной злокачественности и опухоли объемом ≥ 500 мл из локальной стадии III также облучаются.
Суммарная доза зависит от стадии и гистологии опухоли. Фракционирование дозы зависит от возраста ребенка и объема опухоли.
Стадия III, средняя злокачественность: 14,4 Гр. У пациентов с неполной элиминацией или неоперабельных метастазах: 10,8 Гр, т.е. общая доза составляет 25,2 Гр.
Стадия II и III, высокая злокачественность: 25,2 Гр. У пациентов с неполной элиминацией или неоперабельных метастазах - 10,8 Гр, т.е. общая доза составляет 36 Гр.
В случаях интраперитониального разрыва опухоли вся брюшная полость облучается до 20 Гр (экранизация здоровой почки после 12 Гр.). Разовая доза лучевой терапии составляет 1,8-2,0 Грей, при большом объеме облучения – 1,5 Грей. Ложем опухоли является контур почки, а также предлежащие ткани вовлеченные в опухолевый процесс. Для включения в область облучения большего количества пораженных зон (например, парааортальные лимфатические узлы, вовлеченные в опухолевый процесс) порталы должны быть расширены. У всех пациентов IV стадии высокого риска проводится облучение: при локальной I стадии – только метастазы в легкие или другие органы, при II и III стадиях – локальное облучение ложа опухоли и метастазы в легкие. При метастазах в головной мозг доза облучения - 25,5 Гр. Может быть повышение дозы еще на 4,5 Гр. При наличии метастазов в легкие после химиотерапии облучаются оба легких в дозе 15 Грей, отдельные участки легких могут быть дополнительно облучены 5 - 10 Гр (на зону остаточной опухоли). При метастазах в печень – доза 20 грей. Доза всех химиопрепаратов на фоне лучевой терапии редуцируется на 1/3.
Медикаментозное лечение [ 1,6 ]:
Предоперационная химиотерапия по программе SIOP проводится в возрасте старше 6 мес. и младше 16 лет. Целью предоперационной химиотерапии является повышение числа больных с послеоперационной стадией I и уменьшение разрыва опухоли во время операции, уменьшение объема послеоперационной ПХТ, выявление «хороших ответов» и выявление «резистентной опухоли». Дозировка препаратов рассчитывается на площадь поверхности тела. Для пациентов с весом менее 12 кг – доза редуцируется на 2/3 полной дозы. Для пациентов младше 6 месяцев используется 50% дозы приведенной в протоколе.
Руководство по лечению локализованных опухолей Вильмса (стадии I - III): У детей младше 6 месяцев проведение первичной операции рекомендовано только после междисциплинарной оценки индивидуальных рисков с сопоставлением риска разрыва опухоли и риска проведения предоперационной химиотерапии. В случае серьезных сомнений в диагнозе ОВ следует рассмотреть возможность проведения тонкоигольной биопсии или биопсии tru-cut.
Предоперационная химиотерапия.
Два препарата (Винкристин (VCR) и Актиномицин Д (ACT)) x 4 нед:
-
Винкристин: 1.5 мг/м2 (максимум 2 мг) недели 1, 2, 3, 4 (5-ю дозу можно дать, если неделя 5 предшествует запланированной операции);
-
Актиномицин Д: 45 мкг/кг (максимум 2 мг), недели 1, 3.
Оба препарата вводятся внутривенно болюсно.
|
Наименование
|
Доза
|
1 неделя
|
2 неделя
|
3 неделя
|
4 неделя
|
|
Актиномицин Д
|
5мкг/кг
|
+
|
|
+
|
|
|
Винкристин
|
1,5мг/м2
|
+
|
+
|
+
|
+
|
Таблица 3. Блок VA
Повторная визуализационная оценка опухоли - неделя 4.
Операцию следует планировать на неделю 5-6. В случае задержки (что не рекомендуется) следует назначить пациенту дополнительную дозу VCR.
Послеоперационое лечение:
После проведения операции можно определить разные гистологические подтипы нефробластомы и локальную стадию опухоли. В сочетании с объемом опухоли (на основе снимка, сделанного до операции) эти прогностические факторы определят проводимое после операции лечение. В данном протоколе SIOP объем опухоли стал дополнительным фактором стратификации риска для подгруппы нефробластом. Пациентам с объемом опухоли >500 мл после проведения предоперационной химиотерапии и с гистологическим типом промежуточного риска, отличным от стромального и эпителиального, и локальной стадией II или III будет проводиться более интенсивное лечение по схеме AVD.
Все пациенты с локализованными опухолями промежуточного риска проходят лечение по протоколу SIOP 2001. Режим AVD будет проводиться только пациентам с опухолями стадий II и III смешанного или регрессивного типа и c фокальной анаплазией, если после проведения предоперационной химиотерапии объем их опухоли составит более 500 мл.
Повторная визуализационная оценка опухоли - неделя 4.
Операцию следует планировать на неделю 5-6. В случае задержки (что не рекомендуется) следует назначить пациенту дополнительную дозу VCR.
Послеоперационое лечение:
После проведения операции можно определить разные гистологические подтипы нефробластомы и локальную стадию опухоли. В сочетании с объемом опухоли (на основе снимка, сделанного до операции) эти прогностические факторы определят проводимое после операции лечение. В данном протоколе SIOP объем опухоли стал дополнительным фактором стратификации риска для подгруппы нефробластом. Пациентам с объемом опухоли >500 мл после проведения предоперационной химиотерапии и с гистологическим типом промежуточного риска, отличным от стромального и эпителиального, и локальной стадией II или III будет проводиться более интенсивное лечение по схеме AVD.
Все пациенты с локализованными опухолями промежуточного риска проходят лечение по протоколу SIOP 2001. Режим AVD будет проводиться только пациентам с опухолями стадий II и III смешанного или регрессивного типа и c фокальной анаплазией, если после проведения предоперационной химиотерапии объем их опухоли составит более 500 мл.
|
Группа риска.
|
Объем опухоли после проведения предоперационной химиотерапии
|
Стадия I
|
Стадия II
|
Стадия III
|
|
Низкий риск (только CN)
|
Любой
|
Без дальнейшего лечения
|
AV2
|
AV2
|
|
Промежуточный риск
|
≤ 500 мл
|
AV1
|
AV2
|
AV2 + RT
|
|
Промежуточный риск
|
> 500 мл
|
AV1
|
AVD
|
AVD + RT
|
|
Выс. риск
|
BT
|
Любой
|
AVD
|
HR-1
|
HR-1 + RT
|
|
DA
|
Любой
|
AVD
|
HR-1 + RT
боковой области |
HR-1 + RT
|
Таблица 4. Блоки ПХТ в зависимости от группы риска
Обзор послеоперационной терапии (за исключением опухолей стромального и эпителиального типа, лечение которых всегда проводится вне зависимости от размера опухоли: AV1 для опухолей стадии I и AV2 для опухолей стадий II и III); CN - полностью некротизированные (от англ. completely necrotic); A = Актиномицин Д, V = Винкристин, D = Доксорубицин (кумулятивная доза - 250 мг/м²), HR = гистологическая группа высокого риска; BT - бластемный тип; DA - диффузная анаплазия; RT - лучевая терапия; обратите внимание, что в случае опухолей стадии 1 гистологической группы низкого риска послеоперационная химиотерапия не проводится. Все опухоли из данной категории необходимо отправить на срочную централизованную патологоанатомическую оценку (ожидание результатов < 2 недель)).
Обзор послеоперационной терапии (за исключением опухолей стромального и эпителиального типа, лечение которых всегда проводится вне зависимости от размера опухоли: AV1 для опухолей стадии I и AV2 для опухолей стадий II и III); CN - полностью некротизированные (от англ. completely necrotic); A = Актиномицин Д, V = Винкристин, D = Доксорубицин (кумулятивная доза - 250 мг/м²), HR = гистологическая группа высокого риска; BT - бластемный тип; DA - диффузная анаплазия; RT - лучевая терапия; обратите внимание, что в случае опухолей стадии 1 гистологической группы низкого риска послеоперационная химиотерапия не проводится. Все опухоли из данной категории необходимо отправить на срочную централизованную патологоанатомическую оценку (ожидание результатов < 2 недель)).
Стадия I, гистологическая группа низкого риска: без проведения дальнейшего лечения
В случае с опухолями ОВ гистологической группы низкого риска и стадии 1 дальнейшее лечение не проводится. Важно получить результаты централизованной патологоанатомической оценки, прежде чем принимать какое- либо решение по проведению послеоперационного лечения. В случае задержки можно дать пациенту одну дополнительную дозу Винкристина.
Стадия 1, гистологическая группа промежуточного риска: Режим AV1
Важно: Данный режим проводится всем пациентам с локальной стадией I гистологической группы промежуточного риска.
Стадия 1, гистологическая группа промежуточного риска: Режим AV1
Важно: Данный режим проводится всем пациентам с локальной стадией I гистологической группы промежуточного риска.
-
Винкристин: 1,5 мг/м2(максимум 2 мг) еженедельно на протяжении 4 недель (всего 4 дозы). Первую дозу вводят после восстановления перистальтики после проведения операции, в течение 21 дня с момента введения последней дозы предоперационной химиотерапии.
-
Дактиномицин: 45 мкг/кг (максимум 2 мг), неделя 2 (день 7) послеоперационного режима лечения. Введение препарата откладывается до достижения абсолютного числа нейтрофилов >1.0 x10/л или уровня содержания тромбоцитов >100 x 10л.
Оба препарата вводятся внутривенно болюсно.
|
Наименование
|
Доза
|
1 неделя
|
2 неделя
|
3 неделя
|
4 неделя
|
|
Дактиномицин
|
45мкг/кг
|
|
+
|
|
|
|
Винкристин
|
1,5мг/м2
|
+
|
+
|
+
|
+
|
Таблица 5. Режим AV1
Стадия I, гистологическая группа высокого риска: Режим AVD.
Важно: Данный режим также проводится пациентам с опухолями стадий II и III с фокальной анаплазией, смешанного или регрессивного типа и объемом опухоли > 500 мл после проведения предоперационной химиотерапии.
Общая продолжительность послеоперационной химиотерапии составляет 27 недель.
Общая продолжительность послеоперационной химиотерапии составляет 27 недель.
-
Винкристин: 1,5 мг/м2(максимум 2 мг). Начало терапии после восстановления перистальтики после проведения операции, в течение 21 дня после предоперационной химиотерапии. Вводить еженедельно в течение 8 недель (8 доз), а затем в первый день недель 11, 12, 14, 15, 17, 18, 20, 21, 23, 24, 26, 27 (всего 20 доз)
-
Дактиномицин 45 мкг/кг (максимум 2 мг), недели 2, 5, 8, 11, 14, 17, 20, 23, 26 (всего 9 доз). Оба препарата вводятся внутривенно болюсно.
-
Доксорубицин: 50 мг/м2 в виде инфузии в течение 2-6 часов каждые 6 недель. Начало терапии на неделе 2 одновременно с первой дозой Актиномицина Д и второй дозой Винкристина. Последующие дозы - недели 8, 14, 20 и 26 (всего 5 доз - общая кумулятивная доза: 250мг/м2)
Введение Дактиномицин и Доксорубицина следует отложить, если абсолютное число нейтрофилов составляет <1.0 x109/л или если уровень содержания тромбоцитов <100 x 109/л.
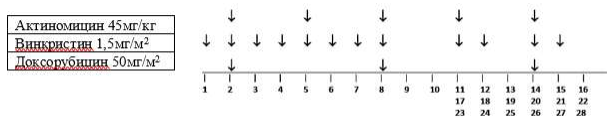
Таблица 6. Режим AVD
Стадия II/III, гистологическая группа низкого и промежуточного риска: Режим AV-2.
Важно: Данный режим проводится всем пациентам с локальными стадиями II и III. Если у пациента фокальная анаплазия, смешанный или регрессивный тип опухоли и объем опухоли > 500 мл после проведения предоперационной химиотерапии, в режим AV-2 добавляют Доксорубицин (лечение по режиму AVD, как для опухолей стадии I высокого риска).
Общая продолжительность послеоперационной химиотерапии составляет 27 недель.
Общая продолжительность послеоперационной химиотерапии составляет 27 недель.
-
Винкристин: 1,5 мг/м2(максимум 2 мг). Начало терапии после восстановления перистальтики после проведения операции, в течение 21 дня после предоперационной химиотерапии. Вводить еженедельно в течение 8 недель (8 доз), а затем в первый день недель 11, 12, 14, 15, 17, 18, 20, 21, 23, 24, 26, 27 (всего 20 доз).
-
Дактиномицин: 45 мкг/кг (максимум 2 мг), недели 2, 5, 8, 11, 14, 17, 20, 23, 26 (всего 9 доз). Оба препарата вводятся внутривенно болюсно.
Лечение следует отложить, если абсолютное число нейтрофилов <1,0x109/л или если уровень содержания тромбоцитов <100x109/л.
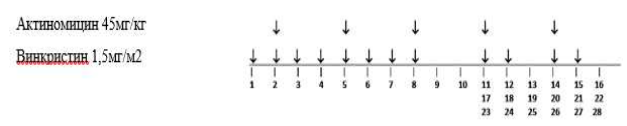
Таблица7. Режим AV-2.
Примечание: Опухоли стадии III требуют проведения локальной лучевой терапии.
Стадия II/III, Гистологическая группа высокого риска: Режим высокого риска HR-1
Общая продолжительность послеоперационного лечения составляет 34 недели. Проводится 2 чередующихся курса химиотерапии с интервалом в 21 день. Каждый курс включает 2 препарата. Первый курс терапии начинают, как только пациент восстановился после операции и его клиническое состояние позволит начать лечение. Он должен состояться в течение 21 дня после окончания предоперационной химиотерапии. Каждый цикл начинают, когда абсолютное число нейтрофилов > 1.0x109/л и уровень содержания тромбоцитов >100x109/л при условии, что наблюдается повышение уровня лейкоцитов в крови.
-
Курс 1: Циклофосфамид и Доксорубицин:
Циклофосфамид: 450мг/м2 в дни 1, 2 и 3 недель 1, 7, 13, 19, 25 и 31 (всего 6 курсов)
Доксорубицин: 50мг/м2 в день 1 недель 1, 7, 13, 19, 25 и 31 (всего 6 курсов). Терапию Доксорубицином можно начать после введения первой дозы Циклофосфамида.
Доксорубицин: 50мг/м2 в день 1 недель 1, 7, 13, 19, 25 и 31 (всего 6 курсов). Терапию Доксорубицином можно начать после введения первой дозы Циклофосфамида.
-
Курс 2: Этопозид и Карбоплатин:
Этопозид (VP16): 150мг/м2 в дни 1,2,3 недель 4, 10, 16, 22, 28 и 34 (всего 6 курсов)
Карбоплатин: 200 мг/м2 (или AUC = 2.65) в дни 1,2,3 недель 4, 10, 16, 22, 28 и 34 (всего 6 курсов). Рассмотрите возможность снижения дозы Карбоплатина до 150 мг/м2 при развитии гематотоксичности на фоне предыдущего курса.
Лечение следует отложить, если абсолютное число нейтрофилов < 1,0 x109/л или если уровень содержания тромбоцитов <100x10/9л. Допускается применение Г- КСФ в случае отсрочки терапии или при развитии нейтропении 4 степени после первых 2-4 циклов. При проведении режимов лечения для группы высокого риска в качестве профилактики пневмоцистной пневмонии рекомендуется применение сульфаметоксазола/триметоприм.
Карбоплатин: 200 мг/м2 (или AUC = 2.65) в дни 1,2,3 недель 4, 10, 16, 22, 28 и 34 (всего 6 курсов). Рассмотрите возможность снижения дозы Карбоплатина до 150 мг/м2 при развитии гематотоксичности на фоне предыдущего курса.
Лечение следует отложить, если абсолютное число нейтрофилов < 1,0 x109/л или если уровень содержания тромбоцитов <100x10/9л. Допускается применение Г- КСФ в случае отсрочки терапии или при развитии нейтропении 4 степени после первых 2-4 циклов. При проведении режимов лечения для группы высокого риска в качестве профилактики пневмоцистной пневмонии рекомендуется применение сульфаметоксазола/триметоприм.
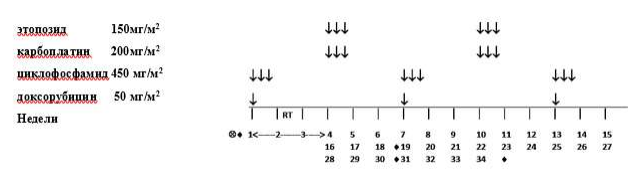
Таблица 8. Режим HR-1.
Эхокардиография: в начале лечения, перед неделями 19, 31 и в конце лечения. Ä = скорость клубочковой фильтрации (СКФ) (измерять при проведении каждого третьего курса или чаще при наличии признаков ренальной дисфункции)
Примечание: Локальная лучевая терапия проводится только при опухолях стадии II с диффузной анаплазией (это не касается опухолей стадии II бластемного типа. Все опухоли стадии III требуют проведения локальной лучевой терапии.
Руководство по лечению метастатических опухолей Вильмса (стадия IV):
-
Следует провести биопсию участков поражения с подозрением на метастазирование в отличных от легких областях, в том числе, в экстраабдоминальных лимфоузлах. Эта процедура не является обязательной.
-
Перед нефрэктомией следует провести повторную оценку всех участков поражения. При неполном ответе следует по возможности попытаться удалить их хирургическим путем, если это безопасно для пациента и не сопровождается риском развития долгосрочных осложнений.
-
В случае расхождения между гистологической группой ренальной опухоли и гистологической группой резецированных узлов/метастазов, терапевтическую стратегию следует адаптировать к гистологии "высочайшего" риска.
-
Облучение боковой области и облучение легких следует по возможности проводить одновременно (по показаниям), чтобы минимизировать токсические эффекты вследствие перекрытия полей облучения.
Предоперационная химиотерапия:
Стратификация предоперационной терапии пациентов с легочными узлами осуществляется в соответствии с размером узлов (см. ниже). Такой подход неприменим в случае с узлами с другой локализацией (например, в печени и т.д.).
Узлы размером 1-2 мм не классифицируют как легочные метастазы. Лечение состоит в проведении предоперационной химиотерапии по режиму AV в течение 4 недель - как и в случае с локализованными опухолями. Перед нефрэктомией необходимо провести повторную оценку узлов при помощи КТ грудной клетки.
Узлы размером 3-5 мм классифицируют как легочные метастазы. Таким пациентам проводится предоперационная химиотерапия по режиму AVD. Перед проведением нефрэктомии показана повторная оценка патологических участков в легких с целью определения тактики послеоперационного лечения. При персистировании узлов рекомендуется по возможности провести их хирургическое удаление с целью изучения гистологии и - если это объективно возможно - устранения патологии легких. Если полная резекция невозможна, рекомендуется удалить доступные и репрезентативные узлы. Это поможет определиться с тактикой терапии в послеоперационном периоде. Если по результатам гистологического исследования резецированных узлов будет исключено наличие жизнеспособных или некротических злокачественных тканей, рассмотрите возможность лечения по модели терапии локализованных опухолей. Если при гистологическом исследовании будут выявлены жизнеспособные или некротические метастазы или если проведение биопсии невозможно, продолжайте терапию согласно рекомендациям для стадии IV в соответствии со стадией локальной опухоли (с проведением, по крайней мере, послеоперационной терапии для стадии II), гистологической группой и степенью резекции узлов (полной/неполной).
Узлы размером 1-2 мм не классифицируют как легочные метастазы. Лечение состоит в проведении предоперационной химиотерапии по режиму AV в течение 4 недель - как и в случае с локализованными опухолями. Перед нефрэктомией необходимо провести повторную оценку узлов при помощи КТ грудной клетки.
Узлы размером 3-5 мм классифицируют как легочные метастазы. Таким пациентам проводится предоперационная химиотерапия по режиму AVD. Перед проведением нефрэктомии показана повторная оценка патологических участков в легких с целью определения тактики послеоперационного лечения. При персистировании узлов рекомендуется по возможности провести их хирургическое удаление с целью изучения гистологии и - если это объективно возможно - устранения патологии легких. Если полная резекция невозможна, рекомендуется удалить доступные и репрезентативные узлы. Это поможет определиться с тактикой терапии в послеоперационном периоде. Если по результатам гистологического исследования резецированных узлов будет исключено наличие жизнеспособных или некротических злокачественных тканей, рассмотрите возможность лечения по модели терапии локализованных опухолей. Если при гистологическом исследовании будут выявлены жизнеспособные или некротические метастазы или если проведение биопсии невозможно, продолжайте терапию согласно рекомендациям для стадии IV в соответствии со стадией локальной опухоли (с проведением, по крайней мере, послеоперационной терапии для стадии II), гистологической группой и степенью резекции узлов (полной/неполной).
Если при проведении нефрэктомии у пациентов с опухолями гистологической группы низкого или промежуточного риска узлы удалось удалить полностью, то в рамках послеоперационной терапии такие пациенты могут получать сниженную кумулятивную дозу Доксорубицина (AVD150).
Узлы ≥ 5 мм классифицируют как легочные метастазы. Таким пациентам проводится предоперационная химиотерапия по режиму AVD. В соответствии с рекомендациям для опухолей стадии IV, перед нефрэктомией следует провести повторную оценку узлов для определения тактики послеоперационного лечения.
Пациентам с метастазами любой другой локализации проводится предоперационная химиотерапия по режиму AVD и повторная оценка перед нефрэктомией. При неполном ответе следует по возможности попытаться удалить их хирургическим путем, если это безопасно для пациента и не сопровождается риском развития долгосрочных осложнений.
Повторная оценка метастазов перед проведением операции
Сама по себе данная таблица не играет решающей роли при выборе терапевтической стратегии, но будет полезна для клинико-рентгенологической квалификации и анализа исхода.
Узлы ≥ 5 мм классифицируют как легочные метастазы. Таким пациентам проводится предоперационная химиотерапия по режиму AVD. В соответствии с рекомендациям для опухолей стадии IV, перед нефрэктомией следует провести повторную оценку узлов для определения тактики послеоперационного лечения.
Пациентам с метастазами любой другой локализации проводится предоперационная химиотерапия по режиму AVD и повторная оценка перед нефрэктомией. При неполном ответе следует по возможности попытаться удалить их хирургическим путем, если это безопасно для пациента и не сопровождается риском развития долгосрочных осложнений.
Повторная оценка метастазов перед проведением операции
Сама по себе данная таблица не играет решающей роли при выборе терапевтической стратегии, но будет полезна для клинико-рентгенологической квалификации и анализа исхода.
|
Целевое поражение (первончально < 5 мм)
|
Нецелевое поражение (первоначально < 3 мм)
|
Общий ответ
|
|
CR
|
CR
|
CR
|
|
Отсутствие поражений > 2 мм и отсутствие новых поражений
|
Non-PD или SD, отсутствие новых поражений
|
VGPR
|
|
ответ > 30% и отсутствие новых поражений
|
Non-PD и новых поражений
|
PR
|
|
SD и отсутствие новых поражений
|
Non-PD и новых поражений
|
SD
|
|
увеличение > 20% или появление новых поражений
|
PD или появление новых поражений
|
PD
|
Таблица 9. Определение ответа метастазов после проведения предоперационной химиотерапии: WT-Absolute-RECIST- Merge ("WARM") толщина среза КТ - 1 мм, в иных случаях - толщина среза КТ х 2. Целевые поражения должны быть как минимум в два раза больше толщины среза КТ. Относительный ответ оценивается на основе суммы всех диаметров целевого поражения на первоначальном этапе и при проведении повторной оценки. При возникновении сомнений свяжитесь с национальным ведущим исследователем. В случае с целевыми поражениями размером 3-5 мм, единственными вариантами ответа являются полный ответ (CR) и неполный ответ (non-CR). Сокращения: CR - полный ответ, PR - частичный ответ, VGPR - очень хороший частичный ответ, PD - прогрессирование заболевания, SD - стабилизация заболевания.
Повторная оценка локальной опухоли и метастазов/узлов посредством визуализационного исследования проводится после предоперационной химиотерапии перед хирургическим вмешательством с использованием той же методики, что и при диагностике. Критерии ответа метастазов на предоперационную химиотерапию приведены в таблице-9. Они необходимы для выбора тактики дальнейшей терапии.
Послеоперационная химиотерапия у пациентов с узлами <3 мм. Послеоперационная химиотерапия проводится в соответствии с результатами КТ грудной клетки после предоперационной химиотерапии по режиму AV:
-
Если по результатам КТ грудной клетки узлов не обнаружено, послеоперационная терапия проводится в соответствии с локальной стадией и гистологией, как при локализованном заболевании. В первые два года после постановки диагноза рекомендовано проведение контрольных визуализационных исследований грудной клетки каждые 8-12 недель.
-
При персистировании узлов следует по возможности провести резекцию хотя бы репрезентативных узлов.
-
Продолжайте лечение по режиму терапии для локализованного заболевания в соответствии со стадией и гистологией, только если по результатам гистологического исследования жизнеспособных или некротических тканей не обнаружено.
-
Если по результатам биопсии определяются жизнеспособные или некротические опухолевые ткани, следует проводить лечение по режиму AVD 250 (что означает, что кумулятивная доза Доксорубицина составляет 150 мг/м, поскольку перед операцией Доксорубицин не назначался); (см. раздел 15.3.3 и 15.3.5) и осуществить повторную оценку на 10 неделе. Если на этот момент микроузлы будут сохраняться, рекомендуется проведение тотального облучения легких.
-
При диффузной анаплазии показано тотальное облучение легких, если наличие метастазов подтверждено гистологическим исследованием консультация руководителей протокола
-
Если выполнение биопсии невозможно, продолжайте лечение по режиму терапии для локализованного заболевания в соответствии с гистологией с минимальным объемом лечения по режиму AV2, вне зависимости от стадии. Следует провести повторную оценку на 10 неделе и при персистировании узлов связаться с ведущим исследователем.
-
В случае увеличения узлов следует по возможности провести резекцию хотя бы репрезентативных узлов.
-
Продолжать лечение по схеме терапии для локализованного заболевания в соответствии с гистологией с минимальным объемом лечения по режиму AV2, только если по результатам гистологического исследования жизнеспособных или некротических опухолевых тканей не обнаружено.
-
Если по результатам биопсии определяются жизнеспособные или некротические опухолевые ткани, следует проводить лечение по режиму AVD 250 (что означает, что кумулятивная доза Доксорубицина составляет 150 мг/м, поскольку перед операцией Доксорубицин не назначался);
-
и осуществить повторную оценку на 10 неделе. Если на этот момент микроузлы будут сохраняться, рекомендуется проведение тотального облучения легких.
-
При диффузной анаплазии показано тотальное облучение легких, если наличие метастазов подтверждено гистологическим исследованием (свяжитесь с национальным ведущим исследователем).
-
Если проведение биопсии невозможно, рекомендуется продолжить лечение лечение по схеме терапии для локализованного заболевания в соответствии с гистологией опухоли по режиму AVD, независимо от стадии. Следует провести повторную оценку на 10 неделе и при персистировании узлов связаться с ведущим исследователем.
Послеоперационная химиотерапия для пациентов, размер узлов у которых составляет > 3 мм.
Существует 4 послеоперационных сценария:
A. Метастазы/узлы отсутствуют (полный ответ (ПО) или очень хороший частичный ответ (ОХЧО) согласно таблицы 15.3.1) или полностью удалены хирургическим путем и , гистологическая группа промежуточного или низкого риска.
А1 Узлы в легких ≥ 3 и ≤ 5 мм на момент постановки диагноза, гистологическая группа низкого/промежуточного риска.
А2 Узлы в легких > 5 мм на момент постановки диагноза, гистологическая группа низкого/промежуточного риска.
A3 Полное хирургическое удаление исключительно незлокачественной ткани: Если исключено наличие жизнеспособной или некротической злокачественной ткани, а также определена иная незлокачественная гистологическая картина (свидетельства имеющихся ранее метастазов отсутствуют) и выполнена полная резекция участков поражения, следует приступить к послеоперационному лечению в соответствии с локальной стадией (локализованное заболевание, см. раздел 15.2).
A3 Полное хирургическое удаление исключительно незлокачественной ткани: Если исключено наличие жизнеспособной или некротической злокачественной ткани, а также определена иная незлокачественная гистологическая картина (свидетельства имеющихся ранее метастазов отсутствуют) и выполнена полная резекция участков поражения, следует приступить к послеоперационному лечению в соответствии с локальной стадией (локализованное заболевание, см. раздел 15.2).
B. Метастазы/узлы ≥ 3 мм на момент постановки диагноза, удаленные не полностью, или множественные неоперабельные узлы и принадлежность первичной опухоли к гистологической группе низкого риска.
C. Метастазы/узлы ≥ 3 мм на момент постановки диагноза, удаленные не полностью, или множественные неоперабельные узлы и принадлежность первичной опухоли к гистологической группе промежуточного риска.
D. Пациенты, первичные опухоли которых относятся к гистологической группе высокого риска (включая пациентов, достигших полного ответа после предоперационной химиотерапии и операции), или пациенты с гистологически подтвержденным прогрессированием метастазов во время предоперационного лечения (Исключение: преимущественно стромальный гистологический вариант - требует обсуждения с национальным ведущим исследователем).
C. Метастазы/узлы ≥ 3 мм на момент постановки диагноза, удаленные не полностью, или множественные неоперабельные узлы и принадлежность первичной опухоли к гистологической группе промежуточного риска.
D. Пациенты, первичные опухоли которых относятся к гистологической группе высокого риска (включая пациентов, достигших полного ответа после предоперационной химиотерапии и операции), или пациенты с гистологически подтвержденным прогрессированием метастазов во время предоперационного лечения (Исключение: преимущественно стромальный гистологический вариант - требует обсуждения с национальным ведущим исследователем).
Послеоперационное лечение группы А1.
Группа А1: Локальная стадия I/II/III, гистологическая группа низкого и промежуточного риска. Устранение метастазов (CR) в легочных узлах размером ≥3-5 мм, достигнутое за счет химиотерапии или полного удаления легочных узлов хирургическим путем.
Рекомендуемое лечение: Схема AVD150.
Примечание: Если полный ответ достигнут путем хирургической резекции узлов и определяются жизнеспособные опухолевые клетки, рекомендуется проведение лучевой терапии. В ином случае следует связаться с ведущим исследователем. Режим AVD150 по-прежнему рекомендован в случае наличия рентгенологического ответа на предоперационную химиотерапию по режиму AVD. Пациентам с локальной стадией III гистологической группы промежуточного риска проводится облучение боковой области/абдоминальное облучение.
Рекомендуемое лечение: Схема AVD150.
Примечание: Если полный ответ достигнут путем хирургической резекции узлов и определяются жизнеспособные опухолевые клетки, рекомендуется проведение лучевой терапии. В ином случае следует связаться с ведущим исследователем. Режим AVD150 по-прежнему рекомендован в случае наличия рентгенологического ответа на предоперационную химиотерапию по режиму AVD. Пациентам с локальной стадией III гистологической группы промежуточного риска проводится облучение боковой области/абдоминальное облучение.
Послеоперационное лечение группы А2.
Группа А2: Локальная стадия I/II/III, гистологическая группа низкого и промежуточного риска; устранение (ПО/ОХЧО) узлов > 5 мм на момент постановки диагноза, достигнутое за счет химиотерапии или полного удаления узлов хирургическим путем.
Рекомендуемое лечение: Режим AVD250.
Примечание: Если полный ответ достигнут путем хирургической резекции узлов и определяются жизнеспособные опухолевые клетки, рекомендуется проведение лучевой терапии. В ином случае следует связаться с ведущим исследователем. AVD250 по-прежнему рекомендована в случае наличия рентгенологического ответа на предоперационную химиотерапию по режиму AVD. Пациентам с локальной стадией III гистологической группы промежуточного риска проводится облучение боковой области/абдоминальное облучение.
Рекомендуемое лечение: Режим AVD250.
Примечание: Если полный ответ достигнут путем хирургической резекции узлов и определяются жизнеспособные опухолевые клетки, рекомендуется проведение лучевой терапии. В ином случае следует связаться с ведущим исследователем. AVD250 по-прежнему рекомендована в случае наличия рентгенологического ответа на предоперационную химиотерапию по режиму AVD. Пациентам с локальной стадией III гистологической группы промежуточного риска проводится облучение боковой области/абдоминальное облучение.
Послеоперационное лечение группы А3.
Группа А3: Локальная стадия I/II/III, гистологическая группа низкого или промежуточного риска с полным удалением других незлокачественных образований хирургическим путем:
Рекомендуемое лечение: В соответствии с локальной стадией для локализованного заболевания
Примечание: Пациентам с локальной стадией III гистологической группы промежуточного риска проводится облучение боковой области/абдоминальное облучение. Облучение легких не показано.
Примечание: Пациентам с локальной стадией III гистологической группы промежуточного риска проводится облучение боковой области/абдоминальное облучение. Облучение легких не показано.
Послеоперационное лечение группы В
Группа В: Локальная стадия I/II/III, гистологическая группа низкого риска с наличием остаточных узлов/метастазов после химиотерапии и хирургического вмешательства:
Рекомендуется проведение резекции (одного)/нескольких репрезентативных узлов. Послеоперационное лечение следует проводить в соответствии с гистологией. Возможны следующие варианты:
Рекомендуется проведение резекции (одного)/нескольких репрезентативных узлов. Послеоперационное лечение следует проводить в соответствии с гистологией. Возможны следующие варианты:
-
Если результаты исследований свидетельствуют об отсутствии метастазов (т.е. наличие жизнеспособной или некротической злокачественной ткани было исключено), следует рассмотреть возможность проведения лечения в соответствии с локальной стадией (при условии, что множественные репрезентативные узлы были удалены и наличие метастазов в оставшихся узлах весьма сомнительно). Следует обратиться к национальному ведущему исследователю для принятия решения по послеоперационной химиотерапии.
-
Если в репрезентативном количестве метастазов жизнеспособные опухолевые клетки отсутствуют, но определяются некротические узлы, следует приступить к послеоперационному лечению по режиму AVD150 в течение 27 недель с кумулятивной дозой Доксорубицина 150 мг/м2. Повторите оценку с помощью КТ на 10 неделе. Если узлы по-прежнему визуализируются: пересмотрите возможность проведения полной резекции. Лучевая терапия легких не назначается.
-
Если в резецированных легочных узлах определяются жизнеспособные опухолевые клетки, следует приступить к проведению лечения по режиму AVD250 и лучевой терапии легких. В этом случае опухоль не относится к гистологической группе низкого риска, и можно рассмотреть возможность перехода на режим CDCV.
-
Если репрезентативные легочные узлы не подлежат резекции, следует приступить к послеоперационному лечению по режиму AVD250 в течение 27 недель с кумулятивной дозой Доксорубицина 250 мг/м2 и провести повторную оценку с помощью КТ на неделе 10. Если узлы по-прежнему визуализируются, необходимо пересмотреть возможность резекции как минимум 1 узла. Кроме того, следует рассмотреть возможность облучения легких, поскольку легочные узлы могут не относится к гистологической группе низкого риска.
Примечание: Локальное облучение и облучение легких должно проводиться одновременно во избежание перекрытия полей облучения. Для этого облучение может быть отложено до недели 10. Однако показания к проведению ЛТ при опухолях, относящихся к гистологической группе низкого риска, следует обсуждать с национальным ведущим исследователем, поскольку в большинстве случаев ЛТ не показана.
Послеоперационное лечение группы С.
Группа С: Локальная стадия I/II/III, гистологическая группа промежуточного риска с остаточными метастазами.
Рекомендовано удаление (одного)/нескольких узлов. Показание к достижению полной хирургической ремиссии зависит от числа, размера и локализации узлов. Во всяком случае, если количество узлов на момент постановки диагноза и проведения хирургической операции ограничено (<10 на момент постановки диагноза, < 6 на момент проведения хирургической операции), полную резекцию легочных узлов следует обсудить со специалистами референсных хирургических центров.
Послеоперационное лечение должно проводиться в соответствии с гистологией и достигнутым уровнем устранения метастазов. Возможны следующие варианты:
Рекомендовано удаление (одного)/нескольких узлов. Показание к достижению полной хирургической ремиссии зависит от числа, размера и локализации узлов. Во всяком случае, если количество узлов на момент постановки диагноза и проведения хирургической операции ограничено (<10 на момент постановки диагноза, < 6 на момент проведения хирургической операции), полную резекцию легочных узлов следует обсудить со специалистами референсных хирургических центров.
Послеоперационное лечение должно проводиться в соответствии с гистологией и достигнутым уровнем устранения метастазов. Возможны следующие варианты:
-
Если результаты исследований свидетельствуют об отсутствии метастазов (т.е. наличие жизнеспособной или некротической злокачественной опухолевой ткани было исключено), следует рассмотреть возможность проведения терапии для локализованного заболевания (при условии, что многие узлы были удалены и наличие метастазов в оставшихся узлах весьма сомнительно). Следует обратиться к национальному ведущему исследователю для принятия решения по послеоперационной химиотерапии. Если после предоперационной химиотерапии по режиму AVD многочисленные узлы исчезли, а оставшиеся узлы не являются злокачественными, послеоперационная химиотерапия по режиму AVD250 по- прежнему может быть показана .
-
Если в репрезентативном количестве узлов жизнеспособные опухолевые клетки не обнаруживаются, но определяются узлы, содержащие некротический компонент, следует приступить к послеоперационному лечению по схеме AVD250 в течение 27 недель, с кумулятивной дозой Доксорубицина 250 мг/м. Проведение КТ органов грудной клетки на 10 неделе. Если узлы по-прежнему визуализируются: пересмотрите возможность проведения полной резекции или лучевой терапии легких. При наличии персистирующих жизнеспособных метастазов в легких на неделе 10 показана лучевая терапия легких.
-
Если в резецированных узлах определяются жизнеспособные опухолевые клетки, следует приступить к послеоперационному лечению по схеме с применением 4 препаратов в течение 34 недель и провести повторную оценку на 10 неделе после операции. Лучевая терапия легких показана, даже если ПО удается достичь к неделе 10.
-
Если репрезентативные узлы не подлежат резекции, следует приступить к послеоперационному лечению по схеме с применением 4 препаратов в течение 34 недель и провести повторную оценку на 10 неделе после операции. Лучевая терапия легких показана при наличии персистирующих узлов. В случае локальной стадии III мы настоятельно рекомендуем совмещать лучевую терапию боковой области с лучевой терапией легких во избежание перекрытия полей облучения. При необходимости можно отложить проведение лучевой терапии до 10 недели после операции.
Примечание: Если метастазы, расположенные в других органах/тканях (не в печени и легких), не подлежат полному удалению, лучевая терапия на них назначается независимо от ответа. Пациентам с локальной стадией III гистологической группы промежуточного риска проводится облучение боковой области/брюшной полости.
Послеоперационное лечение группы D.
Группа D: Локальная стадия I/II/III, гистологическая группа высокого риска, независимо от метастатического статуса, а также пациенты с прогрессированием заболевания и гистологической группой промежуточного риска (за исключением опухолей преимущественно стромального типа) и с гистологически подтвержденными метастазами.
У пациентов этой группы отмечается особенно неблагоприятный исход, несмотря на интенсивное лечение с применением 4-х препаратов, поэтому подход к лечению данной группы пациентов был пересмотрен. В эту группу попадают всего несколько пациентов в год, поэтому специалисты местных центров должны связаться с ведущим исследователем, занимающимся вопросами лечения опухолей IV стадии, с тем, чтобы получить рекомендации по самому оптимальному лечению, имеющемуся на данный момент.
У пациентов этой группы отмечается особенно неблагоприятный исход, несмотря на интенсивное лечение с применением 4-х препаратов, поэтому подход к лечению данной группы пациентов был пересмотрен. В эту группу попадают всего несколько пациентов в год, поэтому специалисты местных центров должны связаться с ведущим исследователем, занимающимся вопросами лечения опухолей IV стадии, с тем, чтобы получить рекомендации по самому оптимальному лечению, имеющемуся на данный момент.
Схемы лечения опухолей стадии IV.
Предоперационная химиотерапия по режиму AVD.
Предоперационная химиотерапия по режиму AVD.
Группа: Все пациенты с заболеванием IV стадии и с легочными узлами >2 мм Три препарата (Винкристин (VCR), Дактиномицин (ACT) и Доксорубицин) x 6 недель:
-
Винкристин: 1,5 мг/м2 (макс. 2 мг) недели 1, 2, 3, 4, 5, 6.
-
Дактиномицин: 45 мкг/кг (макс. 2 мг) недели 1, 3, 5.
-
Доксорубицин: 50 мг/м2 недели 1, 5.
Винкристин и Актиномицин Д вводятся внутривенно болюсно, Доксорубицин - в виде инфузии в течении 4-6 часов.
|
Наименование
|
Доза
|
1
неделя |
2
неделя |
3
неделя |
4
неделя |
5
неделя |
6
неделя |
|
Дактиномицин
|
45мкг/кг
|
+
|
-
|
+
|
-
|
+
|
-
|
|
Винкристин
|
1,5мг/м2
|
+
|
+
|
+
|
+
|
+
|
+
|
|
Доксорубицин
|
50 мг/м2
|
+
|
-
|
-
|
-
|
+
|
-
|
Таблица 10.Режим AVD.
-
Лечение на неделях 1, 3 и 5 зависит от результатов анализа крови. Терапию следует приостановить, если нейтрофилы <1000/µл и/или показатели крови по- прежнему снижаются. В случае тяжелой или непредвиденной тромбоцитопении необходимо рассмотреть возможность проведения диагностики и лечения веноокклюзионной болезни.
-
В исключительных случаях допускается введение дозы Винкристина на неделе 7, если предполагается некоторая задержка в проведении хирургической операции. Однако предпочтительно, чтобы нефрэктомия проводилась на неделе 7, не позднее недели 8.
-
Визуализацию в целях повторной оценки локальной опухоли и метастазов следует проводить на неделе 6/7 (см. руководство по проведению рентгенологических исследований), используя тот же самый метод, что и при постановке диагноза.
Режим AVD150.
Пациенты группы А1.
Пациенты группы А1.
Общая продолжительность послеоперационной химиотерапии составляет 27 недель.
-
Винкристин: 1,5 мг/м2 (максимум 2 мг). Начало терапии после восстановления перистальтики после проведения операции, в течение 21 дня после предоперационной химиотерапии. Вводить еженедельно в течение 8 недель (8 доз), а затем в первый день недель 11, 12, 14, 15, 17, 18, 20, 21, 23, 24, 26, 27 (всего 20 доз).
-
Дактиномицин: 45 мкг/кг (максимум 2 мг), недели 2, 5, 8, 11, 14, 17, 20, 23, 26 (всего 9 доз). Оба препарата вводятся внутривенно болюсно.
-
Доксорубицин: 50 мг/м2 в виде 4-6-часовой инфузии один раз на неделе 2 параллельно с первой дозой Актиномицина Д и второй дозой Винкристина. Последующие дозы не назначаются! (всего 1 доза - общая кумулятивная доза, включая предоперационное лечение: 150 мг/м2).
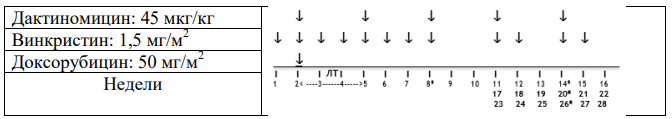
Таблица 11. Режим A1. Доксорубицин не вводится на неделях 8, 14, 20 и 26; кумулятивная доза 150 мг/м2. Эхокардиограмма на неделе 1, при выявлении отклонений от нормы ЭхоКГ следует проводить перед каждым введением Доксорубицина, а также в конце лечения. Введение Дактиномицин и Доксорубицина следует отложить, если абсолютное число нейтрофилов составляет <1.0 x10/л или если уровень содержания тромбоцитов <100 x 10/л. Циклы химиотерапии могут быть адаптированы во избежание применения Доксорубицина во время 14 дней лучевой терапии. Снизьте дозу ACT на 1/3, если введение препарата приходится на период проведения ЛТ (14 дней).
Примечание: Пациентам с локальной стадией III проводится облучение брюшной полости/боковой области. Облучение легких не показано за исключением тех случаев, когда в полностью резецированных легочных узлах определяется ткань, содержащая жизнеспособные злокачественные клетки.
Примечание: Пациентам с локальной стадией III проводится облучение брюшной полости/боковой области. Облучение легких не показано за исключением тех случаев, когда в полностью резецированных легочных узлах определяется ткань, содержащая жизнеспособные злокачественные клетки.
Режим AVD250:
Группы: А2, B и C только в случае резекции репрезентативных узлов, состоящих исключительно из некротической ткани.
Общая продолжительность послеоперационной химиотерапии составляет 27 недель.
Общая продолжительность послеоперационной химиотерапии составляет 27 недель.
-
Винкристин: 1,5 мг/м2(максимум 2 мг). Начало терапии после восстановления перистальтики после проведения операции, в течение 21 дня после предоперационной химиотерапии. Вводить еженедельно в течение 8 недель (8 доз), а затем в первый день недель 11, 12, 14, 15, 17, 18, 20, 21, 23, 24, 26, 27 (всего 20 доз).
-
Дактиномицин: 45 мкг/кг (максимум 2 мг), недели 2, 5, 8, 11, 14, 17, 20, 23, 26 (всего 9 доз). Оба препарата вводятся внутривенно болюсно.
-
Доксорубицин: 50 мг/м2 в виде 4-6-часовой инфузии каждые 6 недель, начать на неделе 2 параллельно с введением первой дозы Актиномицина D и второй дозы Винкристина. Последующие дозы вводятся на неделях 8 и 14 (всего 3 дозы - общая кумулятивная доза, включая предоперационное лечение: 250 мг/м2).
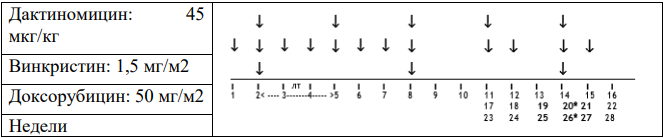
Таблица 12. Режим AVD250.
Доксорубицин не вводится на неделях 20 и 26, кумулятивная доза составляет 250 мг/м2 . Эхокардиограмма на неделе 1, при выявлении отклонений от нормы ЭхоКГ следует проводить перед каждым введением Доксорубицина, а также в конце лечения.
Введение Дактиномицин и Доксорубицина следует отложить, если абсолютное число нейтрофилов составляет <1.0 x10/л или если уровень содержания тромбоцитов <100 x 10/л. Циклы химиотерапии могут быть адаптированы во избежание применения Доксорубицина во время 14 дней лучевой терапии. Снизьте дозу ACT на 1/3, если введение препарата приходится на период проведения ЛТ (14 дней).
Примечание: Пациентам с локальной стадией III проводится облучение брюшной полости/боковой области. Облучение метастазов, локализованных в других областях (не в легких) показано в случае наличия нерезецированных или жизнеспособных метастазов. Облучение легких показано при возникновении жизнеспособных легочных метастазов в любое время.
Доксорубицин не вводится на неделях 20 и 26, кумулятивная доза составляет 250 мг/м2 . Эхокардиограмма на неделе 1, при выявлении отклонений от нормы ЭхоКГ следует проводить перед каждым введением Доксорубицина, а также в конце лечения.
Введение Дактиномицин и Доксорубицина следует отложить, если абсолютное число нейтрофилов составляет <1.0 x10/л или если уровень содержания тромбоцитов <100 x 10/л. Циклы химиотерапии могут быть адаптированы во избежание применения Доксорубицина во время 14 дней лучевой терапии. Снизьте дозу ACT на 1/3, если введение препарата приходится на период проведения ЛТ (14 дней).
Примечание: Пациентам с локальной стадией III проводится облучение брюшной полости/боковой области. Облучение метастазов, локализованных в других областях (не в легких) показано в случае наличия нерезецированных или жизнеспособных метастазов. Облучение легких показано при возникновении жизнеспособных легочных метастазов в любое время.
Режим с применением 4 препаратов (HR-2).
Группы: С - узлы жизнеспособные и резецированы не полностью или резекция репрезентативных узлов неосуществима.
Общая продолжительность послеоперационного лечения составляет 34 недели. Проводится 2 чередующихся курса химиотерапии с интервалом в 21 день. Первый курс терапии начинают, как только пациент восстановился после операции и его клиническое состояние позволит начать лечение. Он должен состояться в течение 21 дня после окончания последнего предоперационного курса химиотерапии. Каждый цикл начинают, когда абсолютное число нейтрофилов > 1.0x10/л и уровень содержания тромбоцитов >100 x 10/л при условии, что наблюдается повышение уровня лейкоцитов в крови.
Общая продолжительность послеоперационного лечения составляет 34 недели. Проводится 2 чередующихся курса химиотерапии с интервалом в 21 день. Первый курс терапии начинают, как только пациент восстановился после операции и его клиническое состояние позволит начать лечение. Он должен состояться в течение 21 дня после окончания последнего предоперационного курса химиотерапии. Каждый цикл начинают, когда абсолютное число нейтрофилов > 1.0x10/л и уровень содержания тромбоцитов >100 x 10/л при условии, что наблюдается повышение уровня лейкоцитов в крови.
-
Курс 1: Циклофосфамид и Доксорубицин на неделях 1, 7, 19 и 31 (всего 4 курса) Циклофосфамид: 450 мг/м2 в дни 1, 2 и 3; продолжительность инфузии - 1 час.
Доксорубицин: 50 мг/м2 в день 1; продолжительность инфузии - 2 - 6 часов. Кумулятивная доза Доксорубицина, включая предоперационную химиотерапию составляет 300 мг/м2 .
Начинать введение Доксорубицина следует после первой дозы Циклофосфамида.
-
Курс 2: Этопозид и Карбоплатин на неделях 4, 10, 13, 16, 22, 25, 28 и 34 (всего 8 курсов) Этопозид (VP16): 150 мг/м2 в дни 1, 2, 3; продолжительность инфузии - 1 час.
Карбоплатин: 200 мг/м2 дни 1, 2, 3; продолжительность инфузии - 1 час. Следует рассмотреть возможность уменьшения дозы Карбоплатина до 150 мг/м в случае гематотоксичности после предыдущего курса.
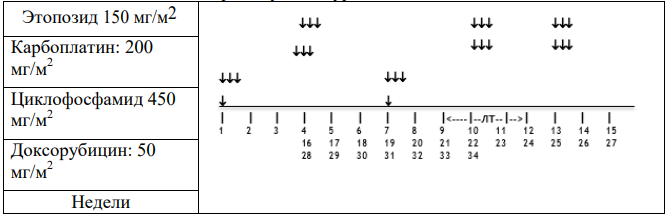
Таблица 13. Режим HR-2
Эхокардиограмма перед введением первой дозы Доксорубицина на неделе 1, при выявлении отклонений от нормы ЭхоКГ следует проводить перед каждым введением Доксорубицина, а также в конце лечения.
Лучевая терапия для локальной стадии III откладывается до недели 10 (= оценка сохраняющихся узлов) для того, чтобы совместить ее, при необходимости, с ЛТ легких. Если во время проведения нефрэктомии было подтверждено наличие жизнеспособных метастазов, показано проведение ЛТ на этот орган. Если на неделе 10 наблюдалось полное устранение метастатического поражения, следует пропустить последнюю дозу Доксорубицина с тем, чтобы ограничить кумулятивную кардиотоксичность от ЛТ и Доксорубицина.
Лечение следует отложить, если абсолютное число нейтрофилов < 1,0 x10/л или если уровень содержания тромбоцитов < 100 x 10/л. Допускается применение Г- КСФ в случае отсрочки терапии или при развитии нейтропении 4 степени. Для данного режима рекомендовано применение сульфаметоксазола/триметоприм в качестве профилактики пневмоцистной пневмонии.
Примечание: Все пациенты с опухолями III стадии нуждаются в проведении локальной лучевой терапии
Эхокардиограмма перед введением первой дозы Доксорубицина на неделе 1, при выявлении отклонений от нормы ЭхоКГ следует проводить перед каждым введением Доксорубицина, а также в конце лечения.
Лучевая терапия для локальной стадии III откладывается до недели 10 (= оценка сохраняющихся узлов) для того, чтобы совместить ее, при необходимости, с ЛТ легких. Если во время проведения нефрэктомии было подтверждено наличие жизнеспособных метастазов, показано проведение ЛТ на этот орган. Если на неделе 10 наблюдалось полное устранение метастатического поражения, следует пропустить последнюю дозу Доксорубицина с тем, чтобы ограничить кумулятивную кардиотоксичность от ЛТ и Доксорубицина.
Лечение следует отложить, если абсолютное число нейтрофилов < 1,0 x10/л или если уровень содержания тромбоцитов < 100 x 10/л. Допускается применение Г- КСФ в случае отсрочки терапии или при развитии нейтропении 4 степени. Для данного режима рекомендовано применение сульфаметоксазола/триметоприм в качестве профилактики пневмоцистной пневмонии.
Примечание: Все пациенты с опухолями III стадии нуждаются в проведении локальной лучевой терапии
Поправки к рекомендуемому лечению - Управление курсом лечения.
Следует отложить введение Актиномицина Д, Доксорубицина, Циклофосфамида, Этопозида и Карбоплатина, если:
-
Абсолютное число нейтрофилов <1,0 x10/л и тенденция к увеличению их уровня отсутствует или
-
Содержание тромбоцитов <100 x 10/л .
Следует отложить введение Актиномицина D, если:
-
Билирубин > 1.5 x верхняя граница нормы (ВГН).
-
АлАт > 5 x ВГН.
-
Клинические признаки ВОБ.
Следует отложить введение Доксорубицина, если:
-
Билирубин > 2 x ВГН.
-
АлАт > 5 x ВГН.
-
Мукозит I степени.
Если следующий курс откладывается более, чем на 1 неделю: рассмотрите возможность снижения дозы препарата на 33% для следующего курса. Рассмотрите возможность назначения Г-КСФ в случае лечения пациентов группы высокого риска.
Лечение билатеральных опухолей Вильмса.
К факторам, которые могут способствовать более благоприятным исходам у пациентов с двусторонними опухолями Вильмся, относятся:
1. Повышение эффективности средств диагностической визуализации. Двустороннее поражение диагностируется с помощью визуализационных исследований в > 95% случаев. Крайне важно проводить полное рентгенологическое обследование для определения числа, размера, особенностей и степени распространения опухоли во время постановки диагноза и в ходе последующего наблюдения. Аналогичное исследование с теми же последовательностями необходимо осуществлять в рамках всех визуализационных исследований во время последующего наблюдения. КТ и МРТ являются высокочувствительными методами визуализации, позволяющими выявлять небольшие участки поражения. МРТ (с последовательностями до и после введения контрастного вещества, а также с Т1-, Т2- и STIR- последовательностями), судя по всему, является более чувствительным методом для дифференциации нефробластоматоза (NB) и опухоли Вильмса и выявления нефрогенных остатков. Стало очевидным, что у пациентов с мультицентровыми двусторонними опухолями многие участки поражения, которые ранее считались опухолями Вильмса, на самом деле являются гиперпластическими нефрогенными остатками. Количественные методы МРТ (диффузно-взвешенная визуализация с подсчетом ИКД (ADC)) могут помочь в раннем прогнозировании ответа на лечение. К тому же необходимо принимать во внимание опасность ионизирующего излучения при КТ, в случае тех пациентов, которым требуется многократное проведение визуализационных исследований. То же самое относится и к пациентам с синдромом предрасположенности к возникновению опухолей, находящимся под наблюдением по поводу развития опухоли Вильмса. Доля таких пациентов в данной группе составляет более 20%. В заключение следует отметить, что для этой популяции пациентов МРТ, судя по всему, является оптимальным методом для определения стадии опухоли и оценки ответа на проводимое лечение. Если проведение МР-ангиографии невозможно, для предоперационного планирования может быть рекомендована КТ с 3D- реконструкцией для визуализации сосудистых ножек и оценки возможности проведения нефронсохраняющей операции. В редких случаях ПЭТ-КТ может помочь отличить активные участки поражения от рубцов. В подобных случаях следует связаться с национальным координатором.
2. Неадъювантная химиотерапия
a. При двусторонних опухолях Вильмса с целью обеспечения возможности проведения NSS.
Согласно протокола SIOP 2001, в качестве химиотерапии после визуализационной диагностики рекомендована стандартная предоперационная химиотерапия (VCR + Актиномицин D). Первая оценка ответа на данную терапию проводилась спустя 4 недели после химиотерапии, затем каждые 4 недели. Если объем опухоли продолжал сокращаться спустя 8 недель после терапии, группа GPOH (Немецкое общество детской онкологии и гематологии) сообщала о повышенном риске прогрессирования при продолжительности химиотерапии более 3 месяцев. Более того, опыт французских исследователей в протоколе SIOP 93 показал, что 3- месячная предоперационная химиотерапия позволяет провести нефронсохраняющую операцию в 67% случаев.
b. При нефробластоматозе (NB) для предотвращения развития опухоли Вильмса и сохранения функциональных единиц почки
Нефробластоматоз, или диффузные перилобарные нефрогенные остатки гиперпластического типа (DHPLNR), считается пренеопластическим пролиферативным процессом, связанным с высоким риском развития опухоли Вильмса. Информации по результатам лечения детей с этим диагнозом мало. Тем не менее, существует много данных, которые убедительно подтверждают факт того, что химиотерапия снижает число клеток, с которыми может произойти злокачественная трансформация, и сокращает риск развития опухоли Вильмса в обеих почках. В исследовании с участием 52 пациентов Perlmann и соавт. установили, что пациенты, которым проводилась адъювантная химиотерапия и хирургическая операция (большего или меньшего объема), имели более низкий риск развития опухоли Вильмса, чем те, кто не получал химиотерапии [24%].
По результатам исследования SIOP WT 2001, был рекомендован план лечения с продолжительной химиотерапией Винкристином и Актиномицином Д, двумя препаратами, признанными эффективными в лечении нефробластоматоза у детей . Prasil и соавт. подчеркивают значимость продолжительности химиотерапии и обращают особое внимание на риск оставления участков поражения в почке.
Если, несмотря на проведенную химиотерапию, у детей с диффузными гиперпластическими перилобарными нефрогенными остатками отмечается отсутствие ответа на снимках или даже прогрессирование очагов поражений, а также персистирующая гетерогенность очагов поражений или формирование сферических участков поражений, то врачи подозревают у них развитие опухоли Вильмса, что требует первичного хирургического вмешательства. Благодаря нефрон сохраняющей операции можно с уверенностью достичь безрецидивной выживаемости с сохранением максимального объема здоровой паренхимы в обеих почках. Такое консервативное лечение предпочтительнее нефрэктомии, поскольку оно имеет существенное преимущество в отношении функции почек. Иногда применение одной только химиотерапии позволяет добиться излечения некоторых пациентов.
По результатам исследования SIOP WT 2001, был рекомендован план лечения с продолжительной химиотерапией Винкристином и Актиномицином Д, двумя препаратами, признанными эффективными в лечении нефробластоматоза у детей . Prasil и соавт. подчеркивают значимость продолжительности химиотерапии и обращают особое внимание на риск оставления участков поражения в почке.
Если, несмотря на проведенную химиотерапию, у детей с диффузными гиперпластическими перилобарными нефрогенными остатками отмечается отсутствие ответа на снимках или даже прогрессирование очагов поражений, а также персистирующая гетерогенность очагов поражений или формирование сферических участков поражений, то врачи подозревают у них развитие опухоли Вильмса, что требует первичного хирургического вмешательства. Благодаря нефрон сохраняющей операции можно с уверенностью достичь безрецидивной выживаемости с сохранением максимального объема здоровой паренхимы в обеих почках. Такое консервативное лечение предпочтительнее нефрэктомии, поскольку оно имеет существенное преимущество в отношении функции почек. Иногда применение одной только химиотерапии позволяет добиться излечения некоторых пациентов.
ПЛАН ЛЕЧЕНИЯ.
Руководство по химиотерапии.
Дозы и схемы введения всех лекарственных препаратов аналогичны рекомендуемым дозам и схемам, приведенным в протоколе для односторонних опухолей.
В случае отсутствия ответа на терапию (стабилизация заболевания, прогрессирование заболевания или неосуществимость нефронсохраняющей операции) на предоперационном этапе, рекомендуется изменение лечения на Карбоплатин/Этопозид по следующей схеме:
Дозы и схемы введения всех лекарственных препаратов аналогичны рекомендуемым дозам и схемам, приведенным в протоколе для односторонних опухолей.
В случае отсутствия ответа на терапию (стабилизация заболевания, прогрессирование заболевания или неосуществимость нефронсохраняющей операции) на предоперационном этапе, рекомендуется изменение лечения на Карбоплатин/Этопозид по следующей схеме:
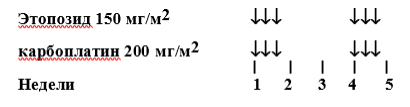
Таблица 14. Режим Carbo/Etop
Руководство по хирургическому вмешательству
Пациенты с двусторонними опухолями Вильмса должны получать помощь хирургов, обладающих большим опытом в проведении процедур по сохранению паренхимы почек. Следовательно:
-
Случай каждого пациента должен обсуждаться в рамках национального собрания хирургов для принятия решений с учетом рекомендаций национальных экспертов.
-
Хирургические вмешательства будут проводиться только в центрах, специализирующихся на лечении пациентов с данным заболеванием.
Руководство по лучевой терапии.
Рекомендации по дозам и области облучения аналогичны рекомендациям для одностороннего заболевания. По показаниям лучевая терапия может быть начата одновременно с началом адъювантной терапии.
Планы лечения.
Во всех нижеприведенных планах лечения препараты и дозы соответствуют препаратам и дозам, определенным для лечения односторонних опухолей Вильмса. Даже если после первой оценки проведение нефрон сохраняющей операции видится возможным, во время междисциплинарного консилиума необходимо обсудить вопрос о том, позволит ли еще большее уменьшение опухоли за счет проведения химиотерапии сохранить больше здоровой ткани почки.
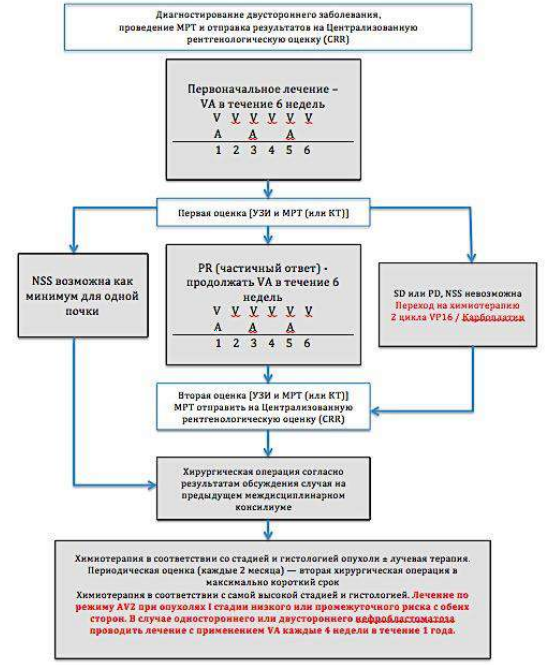
Таблица 15. Пациенты с двусторонней опухолью Вильмса.

Таблица 16. Пациенты с односторонней опухолью Вильмса и контралатеральным нефробластоматозом
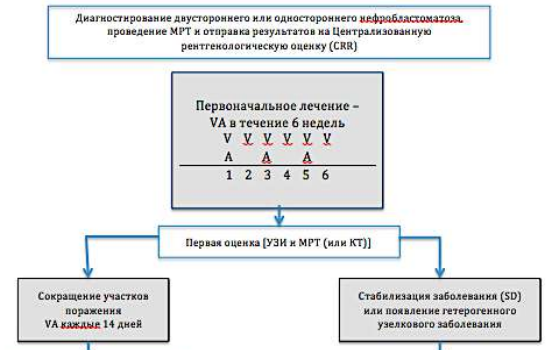
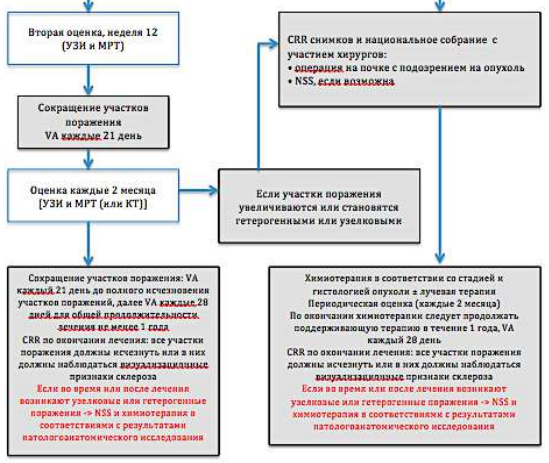
Таблица 17. Пациенты с двусторонним или односторонним нефробластоматозом.
Пациенты с односторонней опухолью и синдромом предрасположенности к развитию опухоли, о котором говорилось выше.
Эти пациенты относятся к группе высокого риска развития метахронной двусторонней опухоли, и им должна помочь стратегия лечения, подразумевающая проведение по возможности нефрон сохраняющей операции. Поэтому к ним применимы варианты лечения, предусмотренные для двустороннего заболевания.
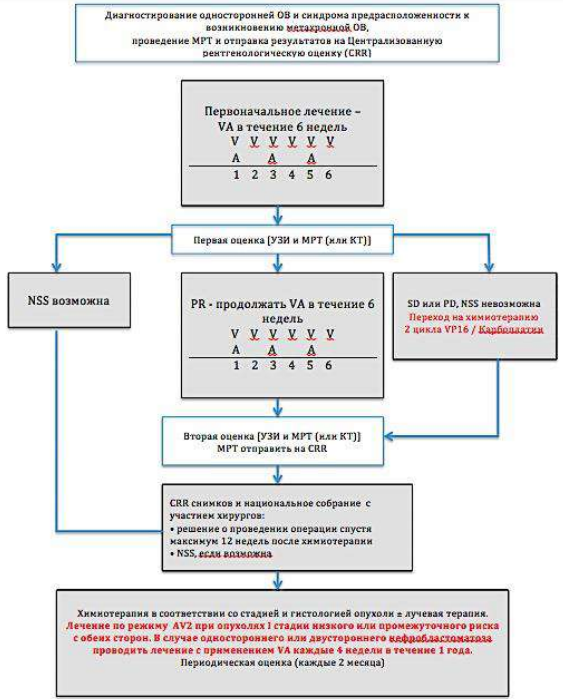 Таблица 18. Пациенты с односторонней опухолью и синдромом предрасположенности к развитию опухоли, о котором говорилось выше.
Таблица 18. Пациенты с односторонней опухолью и синдромом предрасположенности к развитию опухоли, о котором говорилось выше.
Руководство по лечению после первичной хирургической операции. Распределение по группам риска в случаях пациентов, которым проводилась первичная нефрэктомия, основывается исключительно на стадии опухоли и наличии неблагоприятной гистологии (анаплазии). Преимущественно бластемный тип опухоли относится к благоприятному гистологическому типу. Определение стадии опухоли будет производиться аналогично стадированию опухолей, которые подверглись предоперационной химиотерапии, с тем отличием, что понятие "регрессивные изменения/некротическая опухолевая ткань" применяться не будет. Крайне важно правильно определить локальную стадию. Во время проведения нефрэктомии следует надлежащим образом выполнить взятие образцов лимфоузлов.
Гистологическая группа риска в случае пациентов, которым была проведена первичная операция.
Гистологическая группа риска в случае пациентов, которым была проведена первичная операция.
ОПУХОЛИ НИЗКОГО РИСКА:
-
Мезобластная нефрома.
-
Кистозная, частично дифференцированная нефробластома.
ОПУХОЛИ ПРОМЕЖУТОЧНОГО РИСКА:
-
Нефробластома без анаплазии и ее варианты.
-
Нефробластома - фокальная анаплазия.
ОПУХОЛИ ВЫСОКОГО РИСКА:
-
Нефробластома - диффузная анаплазия.
-
Светлоклеточная саркома почки.
-
Рабдоидная опухоль почки.
Схемы послеоперационной химиотерапии для пациентов, которым была выполнена первичная резекция опухоли.
Пациенты с опухолями низкого риска не получают послеоперационную химиотерапию, даже в случае стадии II или III. В случае опухоли низкого риска стадии III следует связаться с национальным координатором для получения дальнейших рекомендаций.
Режим 1 (интенсивный VCR): Стадия I, гистологическая группа промежуточного риска (за исключением фокальной анаплазии).
-
Винкристин: 1,5 мг/м2 (максимальная доза 2 мг) еженедельно в течение 10 недель (всего 10 доз). Первая доза должна вводиться пациенту после восстановления перистальтики после хирургической операции.
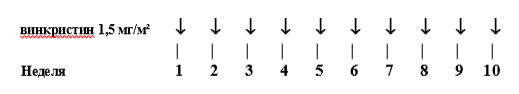
Таблица 19. Режим 1 (интенсивный VCR)
Общая продолжительность терапии: 10 недель
Примечание: Младенцам и детям весом < 12 кг следует вводить полную дозу Винкристина, если используется только один этот препарат и не наблюдается признаков токсичности. В случае токсических явлений последующая доза должна быть уменьшена на 50%, после чего дозы можно осторожно увеличивать (при хорошей переносимости).
Примечание: Младенцам и детям весом < 12 кг следует вводить полную дозу Винкристина, если используется только один этот препарат и не наблюдается признаков токсичности. В случае токсических явлений последующая доза должна быть уменьшена на 50%, после чего дозы можно осторожно увеличивать (при хорошей переносимости).
Режим 2 (AV): Стадия I, фокальная анаплазия и стадия II, промежуточный риск:
-
Винкристин: 1,5 мг/м2 (максимальная доза 2 мг) еженедельно в течение 11 недель, затем каждую 3-ю неделю, на неделях 14, 17, 20, 23 и 26 (всего 16 доз).
-
Дактиномицин: 45 мкг/кг (максимальная доза 2 мг) на неделях 2, 5, 8, 11, 14, 17, 20, 23 и 26 (всего 9 доз)
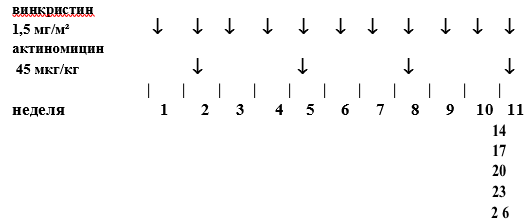
Таблица 20. Режим 2 (AV). Общая продолжительность терапии: 26 недель
Примечание: Младенцы и дети весом < 12кг получают пониженные дозы обоих препаратов, если они вводятся вместе.
Режим 3 (последовательно AVD): Стадия III, гистологическая группа промежуточного риска (включая фокальную анаплазию):
-
Винкристин: 1,5 мг/м2 (максимальная доза 2 мг) еженедельно в течение 10 недель, затем каждую 3-ю неделю, на неделях 13, 16, 19, 22, 25 и 28 (всего 16 доз).
-
Дактиномицин: 45 мкг/кг (максимальная доза 2 мг), 2/3 дозы на неделе 2*, затем полная доза на неделях 10, 16, 22, 28 (всего 5 доз).
-
Доксорубицин: 50 мг/м2 на неделях 7, 13, 19, 25 (всего 4 дозы (200 мг/м2)). Продолжительность введения каждой дозы - 4-6 часов.

Таблица 21. Режим 3 (последовательно AVD): Стадия III, гистологическая группа промежуточного риска (включая фокальную анаплазию). Применяется 2/3 дозы в связи с тем, что в ближайшее время предусматрено проведение лучевой терапии. Общая продолжительность терапии: 28 недель.
Примечание: Младенцы и дети весом < 12 Kg получают пониженные дозы обоих препаратов, если они вводятся вместе
* Лучевая терапия брюшной полости (14,4 Гр) должна быть проведена на неделях 2 - 4.
Примечание: Младенцы и дети весом < 12 Kg получают пониженные дозы обоих препаратов, если они вводятся вместе
* Лучевая терапия брюшной полости (14,4 Гр) должна быть проведена на неделях 2 - 4.
Пациенты IV стадии.
Число пациентов IV стадии, которым была проведена первичная нефрэктомия невелико и ограничивается теми пациентами, которым требуется неотложное хирургическое вмешательство, с не выявленными метастазами в легкие или печень. Им должна проводиться "предоперационная" химиотерапия тремя препаратами для опухолей IV стадии. Ответ со стороны метастазов необходимо оценить на неделе 6 с помощью КТ органов грудной клетки. Последующая химиотерапия зависит от того, была ли достигнута полная ремиссия со стороны метастазов с помощью химиотерапии +/- хирургического вмешательства, в соответствии с основными рекомендациями протокола, включая показания к проведению лучевой терапии
Примечание: Опухоли с преобладанием бластемного компонента после первичной хирургической операции относятся к группе промежуточного риска.
Примечание: Опухоли с преобладанием бластемного компонента после первичной хирургической операции относятся к группе промежуточного риска.
Послеоперационная химиотерапия при опухолях группы высокого гистологического риска, подвергшихся первичной резекции.
Диффузная анаплазия и светлоклеточная саркома почки.
Стадии I - IV - послеоперационная химиотерапия "высокого риска" по протоколу SIOP. Лучевая терапия брюшной полости назначается пациентам с локальными абдоминальными стадиями II и III. Лучевая терапия легких проводится всем пациентам с опухолями IV стадии с легочными метастазами, независимо от ответа метастазов на химиотерапию/хирургическое вмешательство.
Руководство по лучевой терапии после первичной нефрэктомии. Рекомендации по лучевой терапии, применимп к пациентам, которым проводилась первичная хирургическая операция. В случае необходимости проведения локальной лучевой терапии, ее следует начать в течение 10 дней после операции. Несмотря на то, что осуществление ЛТ позднее указанного 10- дневного срока не оказало существенного влияния на развитие опухолевого рецидива в брюшной полости или боковой области у пациентов с опухолью Вильмса с благоприятной гистологией, которые получали лечение по протоколам исследований NWTS-3 и NWTS-4, определить значимую разницу не удалось, поскольку в большинстве случаев отсрочка ЛТ составляла немногим больше 10 дней.
Рецидив опухоли Вильмса.
Распределение по группам риска.
Распределение по группам риска.
Для рекуррентных опухолей Вильмса будут определены три категории риска:
1. Группа АА: Пациенты с первоначальными опухолями Вильмса стадии I или II, гистологической группы низкого/промежуточного риска по классификации SIOP-2001, с рецидивом после терапии, включающей только Винкристин (V) и/или Дактиномицин (A), и без ЛТ. Также в эту группу будут включены пациенты, которые соответствуют тем же критериям (т.е. пациенты, которым ранее не назначались никакие препараты за исключением Винкристина и Актиномицина Д), и получающие первичную нефрэктомию, (см. пациенты из Италии или пациенты SIOP, которым проводится первичная операция).
Ожидается, что показатели бессобытийной выживаемости в данной группе будут варьироваться в пределах 70-80%, и в эту группу войдет 30% всех случаев рецидивов.
2. Группа BB: Пациенты без первичной диффузной анаплазии или бластемного типа опухоли после предоперационной химиотерапиии, первоначально получавшие ≥3 химиопрепаратов с проведением облучения или без него. В эту группу могут войти пациенты со вторым и последующими рецидивами, если предшествующая терапия проводилась им согласно терапии для группы АА, при отсутствии альтернативных терапевтических решений со стороны лечащего врача.
Ожидается, что показатели выживаемости в данной группе, куда войдут 45-50% всех детей с опухолями Вильмса, у которых развился рецидив, составят 40-50%
3. Группа СС: пациенты с первоначальными опухолями стадии II - IV диффузно-анапластического или бластемного типа после предоперационной химиотерапии. Большинство этих пациентов уже получали терапию Доксорубицином, Этопозидом, Карбоплатином, Ифосфамидом или Циклофосфамидом (согласно национальным протоколам лечения).
Предполагается, что показатели выживаемости у пациентов этой группы будут варьироваться в диапазоне 10%. К данной группе относятся 10-15% всех рецидивов опухоли Вильмса.
Примечание: имеется ввиду гистология первичной опухоли (не рецидива) Если анаплазия, не выявленная ранее в первичной опухоли, обнаруживается на момент диагностирования рецидива, мы рекомендуем обсудить данную ситуацию с национальным координатором.
Схема рекомендаций по лечению
Таблица 22. Схема рекомендаций по лечению в соответствии с группами АА, ВВ и СС. (CyD: Цикофосфамид + Доксорубицин; CE: Карбоплатин + Этопозид; I: Ифосфамид, S: хирургическая операция, CR: полная ремиссия, PR: частичная ремиссия, SD: стабилизация заболевания, PD: прогрессирование заболевания.
Терапевтические рекомендации.
Группа АА.
Группа АА.
Специфические предположения, сделанные в отношении рекомендаций для пациентов группы АА, будут основываться на проверенном опытом применении Доксорубицина, Этопозида и Циклофосфамида в отношении токсичности и эффективности, а также на том, что включение в схему Карбоплатина, эффективность которого убедительно доказана, с высокой долей вероятности поможет улучшить показатель общей выживаемости (поскольку 60-80% неудач терапии составляют системные неудачи).
Химиотерапевтическая схема предполагает два чередующихся курса химиотерапии, которые назначаются с интервалами в 21 день (всего 8 курсов). Обе комбинации препаратов состоят из двух препаратов.
Каждый цикл начинается, когда абсолютное число нейтрофилов ≥ 1.х109/л и содержание тромбоцитов > 75 x 109/л и наблюдается тенденция к повышению содержания. Рекомендуется применение сульфаметоксазола/триметоприм в качестве профилактики пневмоцистной пневмонии, а также использование Г- КСФ.
Химиотерапевтическая схема предполагает два чередующихся курса химиотерапии, которые назначаются с интервалами в 21 день (всего 8 курсов). Обе комбинации препаратов состоят из двух препаратов.
Каждый цикл начинается, когда абсолютное число нейтрофилов ≥ 1.х109/л и содержание тромбоцитов > 75 x 109/л и наблюдается тенденция к повышению содержания. Рекомендуется применение сульфаметоксазола/триметоприм в качестве профилактики пневмоцистной пневмонии, а также использование Г- КСФ.
Курс 1. Циклофосфамид и Доксорубицин (CyD).
Циклофосфамид: 500 мг/м2, каждые 12 часов в виде инфузии в течение 15 мин в Дни 1 и 2 (всего 2 г/м/курс). Месна: в/в струйно 200 мг/м2 непосредственно перед первой дозой Циклофосфамида с последующим непрерывным введением Месны в дозировке 1,0 г/м/день до тех пор, пока не пройдёт 12 часов с момента введения последней дозы Циклофосфамида.
Доксорубицин: 50 мг/м2 в виде 3-часовой инфузии в День 1. Недели: 1, 7, 13 и 19 (всего 4 курса).
Доксорубицин: 50 мг/м2 в виде 3-часовой инфузии в День 1. Недели: 1, 7, 13 и 19 (всего 4 курса).
Курс 2. Карбоплатин и Этопозид (Carbo/E).
Этопозид: 150 мг/м2 в 500 мл/мдекстрозы в растворе натрия хлорида в виде 2- часовой инфузии в Дни 1, 2 и 3.
Карбоплатин: 200 мг/м2 (или AUC = 2,65) в виде 2-часовой инфузии в Дни 1, 2 и 3.
Недели: 4, 10, 16 и 22 (всего 4 курса).
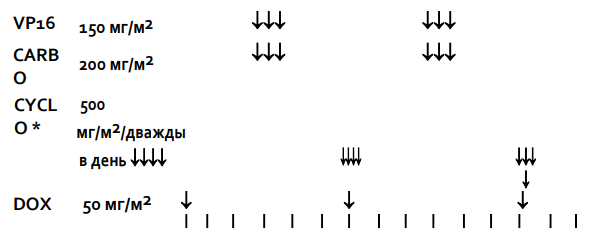
Карбоплатин: 200 мг/м2 (или AUC = 2,65) в виде 2-часовой инфузии в Дни 1, 2 и 3.
Недели: 4, 10, 16 и 22 (всего 4 курса).


Таблица 22. Режим CyD и Carbo/E. CYCLO: 500 mg/m2 каждые 12 часов в течение 2 дней (отличие от HR-1)
План лечения
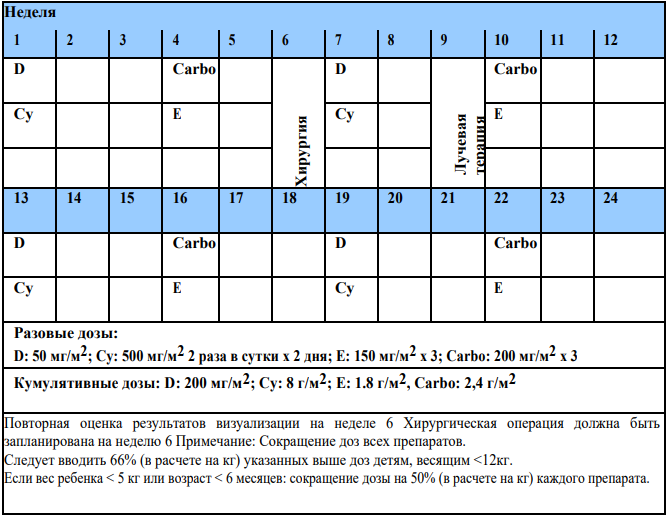 Таблица 23. Схема лечения для группы АА (D: Доксорубицин, Cy: Циклофосфамид, E: Этопозид, Carbo: Карбоплатин).
Таблица 23. Схема лечения для группы АА (D: Доксорубицин, Cy: Циклофосфамид, E: Этопозид, Carbo: Карбоплатин).Группа BB.
Специфическое предположение будет заключаться в том, что применение Мелфалана в высокой дозировке и ауто-ТГСК в качестве консолидирующей терапии у детей, достигших частичного или полного ответа на индукционную химиотерапию, улучшит показатели бессобытийной выживаемости у детей группы ВВ.
Индукционная химиотерапия.
Четыре последовательных курса химиотерапии (чередующихся ICE и CyCE), вводимые с интервалами в 21 день, до высокодозного Мелфалана.
Поскольку ожидается, что у пациентов будет продолжительная тромбоцитопения, обусловленная приемом Карбоплатина, мы рекомендуем постараться не откладывать курсы терапии и начинать последующий курс после достижения порогового значения содержания тромбоцитов 75 x 10/л.
Каждый курс начинается, когда абсолютное число нейтрофилов ≥ 1.0x1/л и содержание тромбоцитов > 75 x 10/л и наблюдается тенденция к повышению содержания. Рекомендуется применение сульфаметоксазола/триметоприм в качестве профилактики пневмоцистной пневмонии, а также использование Г- КСФ.
Поскольку ожидается, что у пациентов будет продолжительная тромбоцитопения, обусловленная приемом Карбоплатина, мы рекомендуем постараться не откладывать курсы терапии и начинать последующий курс после достижения порогового значения содержания тромбоцитов 75 x 10/л.
Каждый курс начинается, когда абсолютное число нейтрофилов ≥ 1.0x1/л и содержание тромбоцитов > 75 x 10/л и наблюдается тенденция к повышению содержания. Рекомендуется применение сульфаметоксазола/триметоприм в качестве профилактики пневмоцистной пневмонии, а также использование Г- КСФ.
Индукция.
|
Неделя
|
||||||
|
1
|
4
|
6
|
7
|
10
|
13
|
15
|
|
I
|
C
y |
Первая оценка собранных стволовых клеток периферической крови
|
I
|
Cy
|
Оценка и хирургическая операция
|
Высокодозный мелфалан
|
|
Carbo
|
Carbo
|
Carbo
|
Carbo
|
|
||
|
E
|
E
|
E
|
E
|
|
||
Таблица 24. Схема индукции.
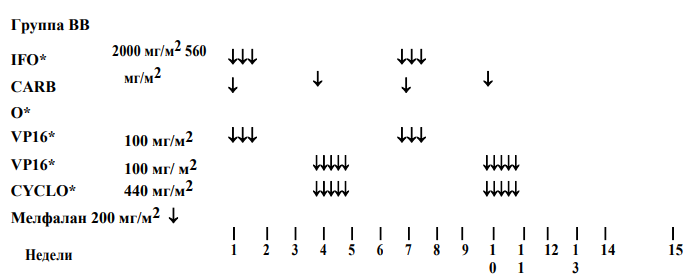
Таблица 25. Режим ВВ.
|
Лекарственн ый препарат
|
Способ применения
|
Доза
|
День (Дни)
|
|
|
Ифосфамид (I)
|
в/в
в течение 2 часов |
66,7 мг/кг/день для младенцев младше 12 месяцев
2000 мг/м² для детей от 12 месяцев |
1-3
|
|
|
Циклофосфамид (Cy)
|
в/в
в течение 15 мин |
440 мг/м 2 (всего 2,2 г/м2/курс)
|
1-5
|
|
|
|
|
СКФ
|
Доза
|
1 |
|
> 150 мл/мин/1,73м2
|
560 мг/м2
(18,7 мг/кг для младенцев) |
|||
|
100-150 мл/мин/1,73м2
|
500 мг/м2
(16,6 мг/кг для младенцев) |
|||
|
Карбоплатин
(Carbo) |
в/в в течение 1 часа
|
75-99 мл/мин/1,73м2
|
370 мг/м2
(12,3 мг/кг для младенцев) |
|
|
50-74 мл/мин/1,73м2
|
290 мг/м2
(9,7 мг/кг для младенцев) |
|||
|
30-49 мл/мин/1,73м2
|
200 мг/м2
(6,7 мг/кг для младенцев) |
|||
|
< 30 мл/мин/1,73м2
|
Приостановите введение
Карбоплатина |
|||
|
Этопозид (E) во время ICE
|
в/в
в течение 1 часа |
3,3 мг/кг/день для младенцев младше 12 месяцев
100 мг/м2 для детей от 12 месяцев |
1-3
|
|
|
Этопозид (E) во время CCE
|
в/в
в течение 1 часа |
3,3 мг/кг/день для младенцев младше 12 месяцев
100 мг/м2 для детей от 12 месяцев |
1-5
|
|
|
ГКСФ
|
|
5 µг/кг/день подкожно, начиная со дня 4 до тех пор, пока абсолютное число нейтрофилов не составит> 3000/µl
|
||
|
Месна |
с Ифосфамидом |
в/в инфузия в течение более 3 часов во время введения Ифосфамида, в эквивалетной Ифосфамиду дозировке (2000 мг/м2/д для детей > 12 месяцев) Необходимо дополнительное введение Месны 1000 мг/м2/д в виде параллельной инфузии жидкости в течении более 24 часов, на протяжении всех 3 дней ICE
Сниженная доза для детей младше 12 месяцев |
||
|
с Циклофосфа- мидом
|
в/в струйно 200 мг/м2 непосредственно перед первой дозой Циклофосфамида с последующим непрерывным введением Месны в дозировке 1,0 г/м2/день до тех пор, пока не пройдёт 12 часов с момента введения последней дозы Циклофосфамида.
Сниженная доза для детей младше 12 месяцев |
|||
Таблица 26. Схема индукции (продолжение).
Высокодозная химиотерпия и аутологичная трасплантация гематопоэтических стволовых клеток.
Все пациенты с подтвержденным ответом опухоли на терапию перейдут к высокодозной химиотерапии с аутологичной трансплантацией стволовых клеток периферической крови. У пациентов должно быть достаточное для трансплантации количество стволовых клеток (определяемое как СКПК > 3 x 10в6 клеток CD34/кг). Аферез гематопоэтических клеток-предшественников будет проводиться приблизительно на неделе 6 после химиотерапии CyCE тем пациентам, у которых отмечается ответ опухоли на лечение на момент первой оценки. Пациентам будет вводиться ГКСФ в дозировке 10 µг/кг/день спустя 48-72 часа после завершения химиотерапии. Аферез будет осуществляться в соответствии со стандартными руководствами, принятыми в участвующих центрах. Если запланированное количество CD34+не может быть собрано после максимум двух процедур, гибкий характер предложенных рекомендаций позволяет лечащим врачам принимать решение об использовании альтернативных факторов для стимуляции или о проведении дальнейшего цикла химиотерапии ICE перед следующей попыткой сбора достаточного количества клеток CD34+. Врач также может принять решение о продолжении индукционной химиотерапии без консолидации высокодозным Мелфаланом.
Для того, чтобы начать высокодозную химиотерапию, должны быть выполнены следующие требования:
-
Подтвержденный частичный или полный ответ на индукционную химиотерапию.
-
Достаточное количество стволовых клеток (определяемое как СКПК > 3 x 106 клеток CD34/кг).
-
СКФ > 70 мл/мин/1,73 мпо формуле Шварца [79] или клиренс креатинина в суточной моче или СКФ, измеренная радиоизотопным методом, > 40 мл/мин/м или > 70 мл/мин/1,73 м.
-
Функция сердца должна быть оценена как адекватная.
-
Рассмотреть возможность сохранения фертильности.
Инфузия стволовых клеток.
Минимально необходимое количество клеток - 3 x 106клеток CD34/кг (оптимальное - 5 x 106 клеток CD34/кг).
Стволовые клетки вводятся внутривенно в День 0, спустя 48 часов после завершения химиотерапии, сразу после размораживания.
Стволовые клетки вводятся внутривенно в День 0, спустя 48 часов после завершения химиотерапии, сразу после размораживания.
Высокодозная химиотерапия с последующей аутологичной трасплантацией стволовых клеток:
|
День
|
Лекарственный препарат
|
|
|
-
2 |
Мелфалан
|
|
|
-
1 |
-
|
|
|
0
|
Реинфузия аутологичных стволовых клеток
|
|
|
Дозы лекарственных препаратов во время консолидации:
|
||
|
Мелфалан
|
200 мг/м² общая доза в течение 1 часа
|
|
|
ДЕНЬ 0: 48 часов после завершения химиотерапии - процедура инфузии осуществляется в соответствии со стандартами медицинского учреждения.
Инфузии Г-КСФ (5 мкг/кг/день) начинают проводить со Дня +4 после инфузии стволовых клеток и продолжают ежедневно до тех пор, пока абсолютное число нейтрофилов составляет более ,000/µл в течение 3 последовательных дней). Бактрим начинают вводить только после восстановления уровня нейтрофилов. |
||
Таблица 26. Схема АутоТГСК.
Группа СС.
Одна их целей международного сотрудничества по опухолям Вильмса будет состоять в систематическом направлении пациентов с опухолями Вильмса для участия в ограниченном числе активных, передовых экспериментальных исследованиях. Прежде всего это касается пациентов из группы СС, а также пациентов из группы BB, у которых отмечаются повторные (следующие за первой) неудачи терапии рецидива.
При отсутствии подходящих клинических исследований ранней фазы, в которые могут быть зачислены пациенты с опухолями Вильмса, следует использовать режим с Винкристином/Иринотеканом (VI), который изучался в недавно завершенном исследовании по протоколу COG AREN0321.
В случае достижения полной или очень хорошей частичной ремиссии после терапии по режиму VI, можно рассмотреть возможность проведения консолидирующей терапии с высокодозным Мелфаланом и трансплантацией стволовых клеток периферической крови.
При отсутствии подходящих клинических исследований ранней фазы, в которые могут быть зачислены пациенты с опухолями Вильмса, следует использовать режим с Винкристином/Иринотеканом (VI), который изучался в недавно завершенном исследовании по протоколу COG AREN0321.
В случае достижения полной или очень хорошей частичной ремиссии после терапии по режиму VI, можно рассмотреть возможность проведения консолидирующей терапии с высокодозным Мелфаланом и трансплантацией стволовых клеток периферической крови.

С поддерживающей терапией, включающей применение цефиксима в качестве профилактического средства.
Необходимо учитывать следующие положения, касающиеся хирургического лечения пациентов с рецидивами:
-
Первый этап лечения - это химиотерапия второй линии. Исключение составляют поздние одиночные метастазы. Метастазирование в ЦНС может потребовать неотложного хирургического вмешательства.
-
Целью хирургического вмешательства является получение чистых краев резекции. Ложе опухоли и любое подозрительное резидуальное заболевание должны быть четко описаны для предоставления подробной информации для специалистов, проводящих лучевую терапию данных областей.
-
Операция на метастазах, продемонстрировавших прогрессирование на фоне химиотерапии, не рекомендована, за исключением случаев отдельных метастазов.
-
Если рецидив возникает в поле лучевой терапии, вероятнее всего, хирургическая операция будет являться самой эффективной локальной терапией, поэтому необходимо предпринять все необходимые меры для осуществления полной резекции.
-
В случае контралатерального рецидива в почке (метахронная опухоль Вильмса) хирургическую операцию должна проводить опытная команда врачей. У этих пациентов проведение операции также планируется после сокращения размеров опухоли посредством химиотерапии.
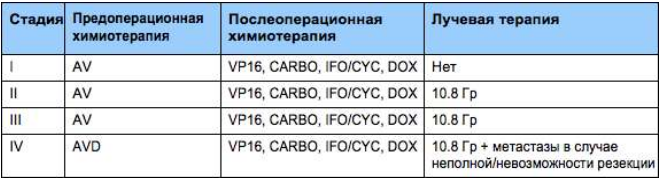
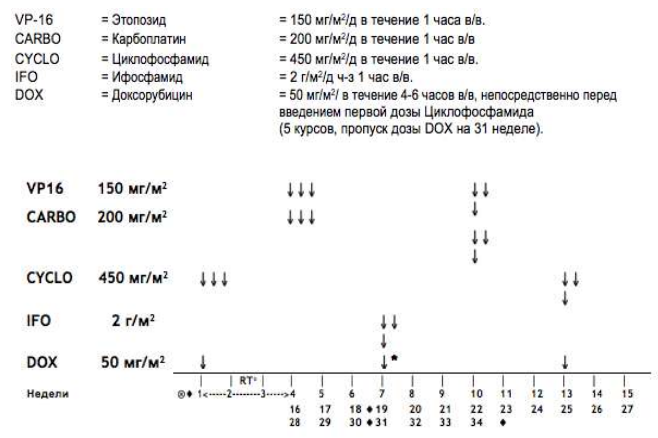
Аллогенная трансплантация гемопоэтических стволовых клеток (ТГСК).
В случае с рефрактерной/рецидивной метастатической RCC, ТГСК рассматривалась как возможность "терапии спасения", если нет данных в пользу более хорошего варианта лечения. На сегодняшний момент нет данных о том, что такая терапия будет иметь преимущества.
При проведении аллогенной трансплантации стволовых клеток с пониженной интенсивностью был обнаружен явный эффект "трансплантат против опухоли" (GVT) и сообщалось о "возможности спасения" ТГСК в случае с цитокин- рефрактерной RCC у взрослых пациентов. Применение ТГСК в случае со взрослыми пациентами было поставлено под сомнение в связи с высоким уровнем смертности, связанной с лечением. Как предполагается, дети имеют более хорошую переносимость ТГСК. Потенциал излечения, которого можно достичь благодаря ТГСК с пониженной интенсивностью, был показан на примере недавно опубликованного случая пациента детского возраста с метастатической RCC, где сообщалось о выживаемости без прогрессирования, составившей 5,7 лет после первоначальной ТГСК.
При проведении аллогенной трансплантации стволовых клеток с пониженной интенсивностью был обнаружен явный эффект "трансплантат против опухоли" (GVT) и сообщалось о "возможности спасения" ТГСК в случае с цитокин- рефрактерной RCC у взрослых пациентов. Применение ТГСК в случае со взрослыми пациентами было поставлено под сомнение в связи с высоким уровнем смертности, связанной с лечением. Как предполагается, дети имеют более хорошую переносимость ТГСК. Потенциал излечения, которого можно достичь благодаря ТГСК с пониженной интенсивностью, был показан на примере недавно опубликованного случая пациента детского возраста с метастатической RCC, где сообщалось о выживаемости без прогрессирования, составившей 5,7 лет после первоначальной ТГСК.
Подходы в лечении в случае с RCC у пациентов детского возраста.
|
Стадия заболевания
|
Подход в лечении
|
|
Локализованное заболевание (T1- 4M0N0)
|
|
|
Метастазы в регионарных лимфоузлах (T1-
4M0N1-2) |
|
|
Отдаленные метастазы
(T1-4M1N0-2) |
1. Хирургическая операция: Полная радикальная нефрэктомия + взятие образцов ткани из лимфоузлов. Хирургическая операция на отдаленные метастазы только после проведения адъювантной терапии (и оценки ответа).
2. Адъювантная терапия: наилучшая доступная терапия: Сунитиниб. В случае отсутствия ответа: ингибиторы mTOR (эверолимус, темсиролимус), ИТК (Тивантиниб) или в последнюю очередь можно рассмотреть возможность применения иммунотерапии. |
|
|
Таблица 28. Подходы в лечении в случае с RCC у пациентов детского возраста
Злокачественная рабдоидная опухоль почки (MRTK).
Рабдоидные опухоли представляют собой группу высокозлокачественных опухолей детского возраста, для которых характерно наличие общей гистологии и как правило потеря экспрессии INI1 при иммуноокрашивании. Они могут возникать в ЦНС, мягких тканях, печени и почках. Хотя эти опухоли возникают в разных тканях, обычно они все имеют биаллельную инактивацию SMARCB1 или SMARCA4. Это предполагает общее генетическое развитие рабдоидных опухолей. У одного и того же пациента рабдоидные опухоли могут возникнуть в разных участках, если он имеет герминальную мутацию.
Злокачественная рабдоидная опухоль почки (MRTK) возникает в раннем возрасте, средний возраст на момент постановки диагноза составляет 10-18 месяцев. 22-38% пациентов с MRTK имеют метастазы на момент постановки диагноза. Метастатическое заболевание часто возникает в течение первых двух лет жизни в отличие от нефробластомы, в случае с которой пациенты с заболеванием стадии IV моложе двух лет являются абсолютной редкостью. Кроме того, число опухолей со стадией III и IV высокое по сравнению с другими ренальными опухолями. Прогноз этих опухолей является неблагоприятным, большое количество рецидивов возникает рано, часто вскоре после окончания лечения или даже во время лечения.
Злокачественная рабдоидная опухоль почки (MRTK) возникает в раннем возрасте, средний возраст на момент постановки диагноза составляет 10-18 месяцев. 22-38% пациентов с MRTK имеют метастазы на момент постановки диагноза. Метастатическое заболевание часто возникает в течение первых двух лет жизни в отличие от нефробластомы, в случае с которой пациенты с заболеванием стадии IV моложе двух лет являются абсолютной редкостью. Кроме того, число опухолей со стадией III и IV высокое по сравнению с другими ренальными опухолями. Прогноз этих опухолей является неблагоприятным, большое количество рецидивов возникает рано, часто вскоре после окончания лечения или даже во время лечения.
Регистр EU-RHAB представляет собой общий подход в лечении краниальных, ренальных и экстракраниальных и экстраренальных рабдоидных опухолей. Этот подход включает в себя лечение блоками по двухнедельной схеме с двумя блоками чередующихся блоков доксорубицина (70мг/48ч), ICE (3x2г/м2 ифосфамид,1 x 500мг/м2 карбоплатин, 3 x 100мг/м2 этопозид) и VCA (винкристин 1x1,5мг/м2, циклофосфамид 1 x 1,5г/м2 и дактиномицин 2 x 25мкг/кг), после чего может идти опциональное высокодозное лечение с применением карбоплатина и тиотепы или с еще одним блоком из трех блоков (Рисунок 7 – Описание схемы лечения с или без высокодозного лечения с трансплантацией стволовых клеток (HDSCT). Облучение следует проводить как можно раньше. Рекомендованные дозы: облучение на боковую поверхность с дозой 19,8 Гр в случае с детьми в возрасте >12 месяцев и с дозой 10,8 Гр в случае с детьми в возрасте <12 месяцев. Для получения более подробной информации используйте протокол Регистра EU- RHAB, как указано выше.
Таблица 29. Описание схемы лечения с или без высокодозного лечения с трансплантацией стволовых клеток (HDSCT)
Блок DOX.
|
День
|
Доксорубицин
|
|
1
|
37,5 мг/м2
|
|
2
|
37,5 мг/м2
|
|
3
|
-
|
|
4
|
-
|
|
Суммарная доза за цикл
|
75 мг/м2
|
Таблица 29.1 Блок DOX.
Сокращение дозировки у детей < 6 мес. Или < 10 кг!
Дозировка в мг/кг: (Доза/м2 поделенная на 30 х кг от массы тела).
Сокращение дозировки у детей < 6 мес. Или < 10 кг!
Дозировка в мг/кг: (Доза/м2 поделенная на 30 х кг от массы тела).
Блок ICE.
|
День
|
Ифосфамид
|
Карбоплатинум
|
Этопозид
|
|
1
|
2000 мг/м2 более 1 ч.
|
500 мг/м2 более 1 ч.
|
100 мг/м2 более 1 ч.
|
|
2
|
2000 мг/м2 более 1 ч.
|
-
|
100 мг/м2 более 1 ч.
|
|
3
|
2000 мг/м2 более 1 ч.
|
-
|
100 мг/м2 более 1 ч.
|
|
4
|
-
|
-
|
-
|
|
Суммарная доза за цикл
|
6000 мг/м2
|
500 мг/м2
|
300 мг/м2
|
Таблица 29.2 Блок ICE.
Сокращение дозировки у детей < 6 мес. Или < 10 кг!
Дозировка в мг/кг: (Доза/м2 поделенная на 30 х кг от массы тела). Этопозид может быть замещен этопозидфосфатом, если необходимо.
Используемая дозировка – 114 мг/м2 этопозидфосфата в качестве эквивалентной дозы этопозида (100 мг).
Начинайте инфузию за 6 часов до применения карбоплатина.
Сокращение дозировки у детей < 6 мес. Или < 10 кг!
Дозировка в мг/кг: (Доза/м2 поделенная на 30 х кг от массы тела). Этопозид может быть замещен этопозидфосфатом, если необходимо.
Используемая дозировка – 114 мг/м2 этопозидфосфата в качестве эквивалентной дозы этопозида (100 мг).
Начинайте инфузию за 6 часов до применения карбоплатина.
Блок VCA
|
День
|
Винкристин
|
Циклофосфамид
|
Дактиномицин
|
|
1
|
1,5 мг/м2 макс. 2 мг
|
1500 мг/м2 более 1 ч.
|
25 μг/кг
|
|
2
|
-
|
-
|
25 μг/кг
|
|
3
|
-
|
-
|
-
|
|
8
|
1,5 мг/м2 макс. 2 мг
|
-
|
-
|
|
Суммарная доза за цикл
|
3,0 мг/м2 макс. 6 мг
|
1500 мг/м2
|
50 μг/кг
|
Таблица 29.3 Блок VCA
Сокращение дозировки у детей < 6 мес. Или < 10 кг!
Дозировка в мг/кг: (Доза/м2 поделенная на 30 х кг от массы тела).
Дозу циклофосфамида можно увеличить до 1800 мг/м2, если позволяет состояние пациента после первого применения!!!
Гидратация: 3000 мл/м2/д, 24-часовое восполнение потери жидкости до дня 4 (включительно).
Сокращение дозировки у детей < 6 мес. Или < 10 кг!
Дозировка в мг/кг: (Доза/м2 поделенная на 30 х кг от массы тела).
Дозу циклофосфамида можно увеличить до 1800 мг/м2, если позволяет состояние пациента после первого применения!!!
Гидратация: 3000 мл/м2/д, 24-часовое восполнение потери жидкости до дня 4 (включительно).
Врожденная мезобластная нефрома (CMN).
Врожденная мезобластная нефрома (CMN) - это редкая опухоль, которая составляет приблизительно 3% всех детских ренальных опухолей. Однако это наиболее распространенное новообразование почки у детей первых 3 месяцев жизни. Согласно большинству опубликованных серий случаев, средний возраст составляет ≤ 1 месяца, и часто CMN удается обнаружить до рождения или в момент рождения ребенка, что демонстрирует эмбриональное происхождение данного заболевания.
Рекомендации по лечению.
Таблица 30. Реокмендации по лечению врожденной мезобластной нефромы Химиотерапия
Предоперационная химиотерапия:
< 6 месяцев: первичная хирургическая операция.
> 6 месяцев: предоперационная химиотерапия (актиномицин-D и винкристин).
Послеоперационная химиотерапия (Перед началом химиотерапии всегда следует обращаться к национальному ведущему исследователю ):
Предоперационная химиотерапия:
< 6 месяцев: первичная хирургическая операция.
> 6 месяцев: предоперационная химиотерапия (актиномицин-D и винкристин).
Послеоперационная химиотерапия (Перед началом химиотерапии всегда следует обращаться к национальному ведущему исследователю ):
-
В случае прогрессирования заболевания во время лечения с применением актиномицина-D и винкристина, рекомендуется проводить терапию второй линии с применением ICE (см. схему лечения ниже). Другими возможными лекарственными препаратами являются циклофосфамид и доксорубицин.
Блок ICE:
|
Препараты
|
Введение
|
Дозировка
|
Дн и
|
|
|
Ифосфамид
|
Внутривенно в течение 2 часов
|
66,7 мг/кг/день для младенцев младше 12 месяцев 2,000 мг/м2 для детей ≥ 12 месяцев
|
1-3
|
|
|
Карбоплатин
|
Внутрив енно в течение 1 час
|
СКФ
|
Доза
|
1 |
|
> 150 мл/мин/1,73м2
|
560 мг/м2 (18,7 мг/кг для младенцев)
|
|||
|
100-150 мл/мин/1,73м2
|
500 мг/м2 (16,6 мг/кг для младенцев)
|
|||
|
75-99 мл/мин/1,73м2
|
370 мг/м2 (12,3 мг/кг для младенцев)
|
|||
|
50-74 мл/мин/1,73м2
|
290 мг/м2 (9,7 мг/кг для младенцев)
|
|||
|
30-49 мл/мин/1,73м2
|
200 мг/м2 (6,7 мг/кг для младенцев)
|
|||
|
<30 мл/мин/1,73м2
|
Приостановите введение Карбоплатина
|
|||
|
Этопозид
|
IV в течение 1 часа
|
3,3 мг/кг/сутки для младенцев < 12 месяцев. 100 мг/м2/сутки для детей ≥ 12 месяцев.
|
1-3
|
|
Таблица 31. Блок ICE. При тяжелом нарушении функции почек необходимо связаться с национальным ведущим исследователем для получения дальнейших рекомендаций.
Высокодозный режим для пациентов группы высокого риска (HR и HD) (пациенты группы D).
Данное лечение является возможным вариантом. Пожалуйста, всегда связывайтесь с национальным (международным) ведущим исследователем в случае с заболеванием стадии IV.
Общая продолжительность лечения составляет 25 недель. Первый курс терапии начинают, как только пациент восстановился после операции и его клиническое состояние позволит начать лечение. Он должен состояться в течение 21 дня после окончания последнего предоперационного курса химиотерапии. Каждый блок начинается, когда абсолютное количество нейтрофилов составляет >1,0 x 109/л, а количество тромбоцитов >100 x 10л при уcловии повышения уровня лейкоцитов. После первого блока VI рекомендуется провести визуализацию метастаза, чтобы документально зафиксировать статус заболевания.
Он включает семь блоков стандартной химиотерапии с комбинациями винкристин/, винкристин и иринотекан/, циклофосфамид, карбоплатин и этопозид/, винкристин, циклофосфамид и доксорубицин/ и мелфалан высокой дозы:

Таблица 32. Режимы V, VI, CCE, VDCy.
Таблица 33. Режим для пациентов группы высокого риска. SCH: Сбор стволовых клеток, в случае неудачного сбора повторите CCE и попробуйте провести повторный сбор перед проведением облучения легкого или участка(участков) с метастазами; SCT: Трансплантация стволовых клеток; ЛТ: Лучевая терапия (неделя 2-3: на боковую область, неделя 7-10 на метастаз/легкое); OP: хирургическая операция на метастазы;
* замените VCR/DOX/CYCLO на CARBO/CYCLO/VP16 (CCE), в случае отсутствия ответа на предоперационную терапию AVD на неделе 13 и19, рассмотрите уменьшение дозы CCE на 2/3 в случае задержки из-за гемотоксичности на неделе 16 и 22 +: замените IRI/VCR (VI) на CCE на неделе 10 в случае PD (прогрессирования заболевания), установленного в ходе оценки на неделе 3.
CT: оценка метастаза с помощью КТ в случае с метастазом в легких, с помощью МРТ в случае со всеми другими локализациями метастазов (неделя 3, 6 и 24).
Дозирование и приготовление препаратов для полихимиотерапии. Дозирование медикаментов как для внутривенного, так и для перорального применения осуществляется исключительно на площадь тела пациентов. У грудных детей доза препаратов составляет в первые шесть месяцев жизни 2/3 (две трети), а с седьмого по двенадцатый месяцы жизни 3/4 (три четверти) от дозы, вычисленной в соответствии с поверхностью тела. Каждый раз перед началом нового этапа терапии вновь определяется площадь поверхности тела и соответственно пересчитываются дозы препаратов.
* замените VCR/DOX/CYCLO на CARBO/CYCLO/VP16 (CCE), в случае отсутствия ответа на предоперационную терапию AVD на неделе 13 и19, рассмотрите уменьшение дозы CCE на 2/3 в случае задержки из-за гемотоксичности на неделе 16 и 22 +: замените IRI/VCR (VI) на CCE на неделе 10 в случае PD (прогрессирования заболевания), установленного в ходе оценки на неделе 3.
CT: оценка метастаза с помощью КТ в случае с метастазом в легких, с помощью МРТ в случае со всеми другими локализациями метастазов (неделя 3, 6 и 24).
Дозирование и приготовление препаратов для полихимиотерапии. Дозирование медикаментов как для внутривенного, так и для перорального применения осуществляется исключительно на площадь тела пациентов. У грудных детей доза препаратов составляет в первые шесть месяцев жизни 2/3 (две трети), а с седьмого по двенадцатый месяцы жизни 3/4 (три четверти) от дозы, вычисленной в соответствии с поверхностью тела. Каждый раз перед началом нового этапа терапии вновь определяется площадь поверхности тела и соответственно пересчитываются дозы препаратов.
Обязателен врачебный контроль приготовленных сестрой для парентерального введения цитостатических препаратов. Для уменьшения вероятности ошибки и облегчения контроля все препараты для парентерального применения должны разводиться в соответствии с требованиями, представленными в специальной таблице разведений. Парентеральное введение таких препаратов, как винкристин и даунорубицин, и пункция периферических вен для этого должны производиться врачом или опытной сестрой в обязательном присутствии врача. Такие препараты как дексаметазон, преднизолон в период нахождения больного в отделении должны приниматься ребёнком только в присутствии дежурной медсестры.
Гематологическая токсичность.
Перед каждым курсом химиотерапии следует проводить анализ на определение уровня гемоглобина, содержания лейкоцитов и тромбоцитов.
-
Нейтропения: абсолютное число нейтрофилов (ANC) должно быть больше 1000/мм3, чтобы можно было начать курс с Актиномицином Д или Доксорубицином, Циклофосфамидом, Ифосфамидом, Карбоплатином. Лечение Винкристином можно продолжить без учета ANC, если пациент находится в хорошем клиническом состоянии.
-
Тромбоцитопения: содержание тромбоцитов должно быть > 100.000/мм3, чтобы можно было начать курс лечения. Уже проводимый курс лечения следует прервать, если содержание тромбоцитов станет меньше 50.000/мм3. В случае внезапного падения уровня тромбоцитов следует вести мониторинг пациента на предмет признаков ВОБ или сепсиса/инфицирования катетера, с ежедневным проведением общего анализа крови и тестов на определение функции печени. При кровотечениях всегда показано переливание тромбоцитов.
-
Изолированную анемию в случае необходимости лечат посредством переливания крови (гемаглобин < 7 г/л). Развитие анемии не является основанием для модификации схемы лечения.
Примечание Если проведение курса лечения приведет к максимальному снижению уровня лейкоцитов (надиру) <1500/мм3 или максимальному снижению ANC<1000/мм3, ассоциированному с мукозитом и/или жаром, или максимальному снижению уровня тромбоцитов <50.000, ассоциированному со значительным увеличением печени или или кровотечениями:дозы препаратов при проведении следующего курса могут быть уменьшены до 2/3 от первоначальной дозы, и если такой курс переносится пациентом хорошо, то при проведении последующих курсов можно вновь попробовать полные дозы.
Коррекция дозы химиотерапевтических препаратов при лечении младенцев и/или при весе пациента < 12 кг
|
Наименование препарата
|
< 5 кг (66% дозы на кг)
|
5 - 12 кг (доза на кг)
|
≥ 12 кг (полная доза)
|
|
Винкристин*
|
0.033 мг/кг
|
0.05 мг/кг
|
1.5 мг/м²
|
|
Актиномицин Д
|
Исключите #
|
30 мкг/кг
|
45 мкг/кг
|
|
Доксорубицин
|
1.1 мг/кг
|
1.66 мг/кг
|
50 мг/м2
|
|
Карбоплатин
|
4.4 мг/кг
|
6.6 мг/кг
|
200 мг/м2
|
|
Циклофосфамид
|
10 мг/кг
|
15 мг/кг
|
450 мг/м2
|
|
Ифосфамид
|
Исключите (из нейротоксичнос)
|
66 мг/кг
|
2000 мг/м2
|
|
VP-16
|
Исключите (из-за содержания этанола), возможно применение Этопофоса
|
5 мг/кг
|
150 мг/м2
|
|
Мелфалан
|
Не применяется
|
6.6 мг/кг
|
200 мг/м2
|
Таблица 34. Доза пхт в зависимости от возраста. *снижения дозы Винкристина после проведения первичной операции при опухолях стадии I с благоприятной гистологией не требуется; #: обсудите с национальным координатором; Актиномицин Д противопоказан детям весом <5кг и детям младше 3 месяцев (=91 дней). Дозы препаратов при лечении детей с рецидивами частично отличаются от приведенных в таблице.
-
Перечень основных лекарственных средств (имеющих 100% вероятность применения)
| Фармакотерапевтическая группа | Международное непатентованное наименование лекарственного средства | Способ применения | Уровень доказательности |
| Винкристин* | 1,5мг/м2/сут, внутривенно (max разовая 2мг) 50мг/м2/сут, внутривенно Кумулятивная суммарная доза доксорубицина - 300 мг/м2 | В | |
| Доксорубицин | А | ||
|
Карбоплатин
|
200мг/м2/сут, внутривенно Кумулятивная суммарная доза карбоплатина - 3600 мг/м2
|
В
|
|
|
Мелфалан
|
200мг/м2/сут, внутривенно (max разовая 200мг)
|
С
|
|
|
Циклофосфамид
|
450мг/м2/сут, внутривенно Кумулятивная суммарная доза циклофосфамида - 8100 мг/м2
|
А
|
|
|
Ифосфамид
|
2000мг/м2/сут, внутривенно Кумулятивная суммарная доза циклофосфамида - 12000 мг/м2
|
В
|
|
|
Дактиномицин*
|
45мкг/кг/сут, внутривенно (max разовая 2000мкг)
|
В
|
|
|
Месна
|
1000мг/м2/сут, внутривенно
|
А
|
|
|
Этопозид*
|
150мг/м2/сут, внутривенно Кумулятивная суммарная доза этопозида - 2700 мг/м2
|
А
|
|
|
Сунитиниб
|
25-75мг/сут, внутрь (max разовая 75мг)
|
С
|
|
|
Иринотекан
|
50мг/м2/сут, внутривенно (max разовая 50мг)
|
В
|
*В соответствии с правилами применения незарегистрированных ЛС.
Дополнительные лекарственные средства:
Дополнительные лекарственные средства:
|
Фармакотерапевтическая группа
|
Международное непатентованное наименование лекарственного средства
|
Способ применения
|
Уровень доказательности
|
|
Сульфаметоксазол + Триметоприм (с целью профилактики пневмоцистной пневмонии) |
5мг/кг/сут по триметопр иму, 20мг кг/сут по сульфамет оксазолу, таблетки
|
В |
|
|
Филграстим (с целью стимуляции гранулопоэза)
|
5мкг/кг/сут, раствор |
В |
|
|
Ондансетрон (с антиэмитогенно й целью)
|
5мг/м2/сут, раствор
|
С |
Хирургическое вмешательство:
Нефрэктомия.
Полная нефрэктомия является предпочтительным методом лечения при локализованном заболевании. Следует удалять околопочечную жировую клетчатку, так как в большинстве случаев CMN инфильтрирует в окружающие ткани. Повторная резекция должна проводиться в случае неполной резекции опухоли или неполного удаления околопочечной жировой клетчатки. Метастазэктомия рекомендуется в исключительных случаях при наличии солитарных метастазов.
Полная нефрэктомия является предпочтительным методом лечения при локализованном заболевании. Следует удалять околопочечную жировую клетчатку, так как в большинстве случаев CMN инфильтрирует в окружающие ткани. Повторная резекция должна проводиться в случае неполной резекции опухоли или неполного удаления околопочечной жировой клетчатки. Метастазэктомия рекомендуется в исключительных случаях при наличии солитарных метастазов.
-
Доступ: предпочтительный вариант - длинный поперечный разрез брюшной полости. Торако-абдоминальный доступ может быть эффективным при огромных образованиях, находящихся в верхней части брюшной полости: он предотвращает увеличение частоты возникновения разрыва опухоли и других осложнений. Сэмплинг лимфоузлов должен быть осуществлен вне зависимости от типа разреза.
Ревизия брюшной полости
Ревизия брюшной полости всегда должна проводиться перед удалением опухоли. Необходимо провести обследование на предмет наличия метастазов в печени, лимфоузлах и брюшине. Провести удаление (если резектабельно) или биопсирование (если нерезектабельно) каждого участка поражения и отметить его локализацию. Взятый материал с четким обозначением его локализации направить патологоанатому в отдельном контейнере.
Тщательная ревизия противоположного ретроперитонеального пространства является обязательным только в случае, если снимок предоперационной визуализации (предпочтительно МРТ) является нечетким или показывает двустороннюю локализацию опухоли. В таких случаях может успешно применяться интраоперационное УЗИ для локализации участка поражения. Лечение при однозначных случаях опухоли стадии V будет проводиться согласно "руководству по лечению опухолей стадии V".
Цель процедуры - проведение радикальной нефроуретерэктомии за пределами фасции Герота, вместе с околопочечной жировой клетчаткой единым блоком. Следует осуществить мобилизацию толстой кишки для обнажения структур ретроперитонеального пространства. При левосторонних опухолях также может быть выполнена мобилизация селезенки. На правой стороне прием Кохера способствует обнажению нижней полой вены и почечной вены.
Необходимо осуществлять контроль почечной артерии и вены. В первую очередь следует перевязать артерию для предотвращения венозного застоя и возможного разрыва опухоли. При инфильтрирующих или очень больших опухолях первичная перевязка сосудов может быть сложной или рискованной процедурой. В подобных ситуациях в первую очередь можно удалить опухоль, отделив ее от окружающих структур, и выполнить перевязку сосудов при возможности.
Следует осуществить удаление почки вместе с жировой капсулой, фасцией Герота и, если это возможно, со всеми пораженными окружающими структурами. Не рекомендуется проводить очень обширные и калечащие резекции (н-р, панкреатэктомия), поскольку эти опухоли являются чувствительными как к химиотерапии, так и к лучевой терапии. Мочеточник должен быть перевязан и пересечен максимально близко к мочевому пузырю.
Допускается маркировка ложа опухоли при помощи титановых клипс для планирования лучевой терапии в будущем (если требуется).
Опухолевый тромб в почечной вене и нижней полой вене.
Необходимо осуществить предоперационное обследование (при помощи МРТ, КТ или УЗИ) для определения проходимости почечных вен и нижней полой вены (НПВ). Несмотря на то, что интраваскулярное распространение опухоли, как правило, выявляется во время предоперационной визуализации, необходимо выполнить тщательное обследование почечных вен и НПВ во время операции. Тип хирургической процедуры, проведение которой необходимо для полного удаления тромба, зависит от вида венозного тромба:
-
Непротяженный тромб почечной вены можно резецировать вместе с веной.
-
Подпеченочный тромб (распространяющийся до инфрапеченочной полой вены, но находящийся под печеночными венами) следует удалить путем проведения венотомии, после выполнения контроля контралатеральной вены и полой вены над тромбом и под ним.
-
Кардиопульмональное шунтирование необходимо в случае интраатриального тромба. Оно так же может быть весьма полезным при более протяженном тромбе, распространяющемся до или выше уровня печеночных вен.
-
В случаях с очень обширной инфильтрацией стенки полой вены следует пересмотреть риск и эффективность хирургического вмешательства. Даже при обширном сосудистом хирургическом вмешательстве проведение полного удаления может оказаться невозможным и лучевая терапия может оказаться более подходящим вариантом, как было продемонстрировано в SIOP9.
Надпочечник.
Надпочечник следует оставить in-situ в случае, если гарантируется наличие безопасного края резекции между опухолью и надпочечником. При опухолях, исходящих из верхней части почки, не следует сохранять надпочечник, за исключением случаев, когда на предоперационных снимках определяются ЧИСТЫЕ края или наблюдается ЧИСТАЯ плоскость во время операции.
Лимфатические узлы.
Сэмплинг и гистологическое исследование лимфатических узлов является обязательными для точного стадирования и определения последующей терапии. Сюда относятся ЛУ в области ворот почки в случае, если они не включены в препарат, полученный при радикальной нефрэктомии, и интераортокавальные ЛУ ниже уровня почечной ножки даже в случае отсутствия подозрений на вовлечение. Необходимо отметить, что интераортокавальные ЛУ, как правило, относятся к правосторонним опухолям, поскольку анатомической границей между левой и правой стороной является аорта, а не средняя линия тел позвонка, но тем не менее следует провести их исследование на левосторонние опухоли. Следует провести сэмплинг ЛУ с подозрением на вовлечение в области бифуркации аорты, ипсилатеральной подвздошной оси, месте отхождения чревного ствола и верхней брыжеечной артерии. Рекомендуется провести сэмплинг как минимум 7 узлов (предпочтительно без разрыва), включая ЛУ, сэмплинг которых выполнен вместе с взятием препарата [9–12]. Они должны быть тщательно промаркированы и отправлены по отдельности патологоанатому с точным указанием их локализации и характера. Радикальная резекция ЛУ не способствует улучшению выживаемости и, следовательно, не является частью хирургического лечения.
Разрыв опухоли.
В случае разрыва опухоли следует зафиксировать документально анатомическую локализацию опухоли и ее возможное распространение в рамках операционного поля. Необходимо подробно описать инфильтрации в прилегающую ткань, пораженные ЛУ, макроскопические остатки и макроскопические разрывы опухоли.
Нефронсохраняющая операция (NSS) при односторонних опухолях.
NSS может также иметь благоприятный результат в случаях с односторонней опухолью, однако в каждом индивидуальном случае следует точно оценить нефрологические преимущества и риск возникновения рецидива. При рассмотрении данной опции следует учитывать такие важные критерии, как контралатеральные урологические и нефрологические нарушения и генетические синдромы, ассоциированные с повышенным риском развития опухоли Вильмса, а не риск развития гиперперфузионной нефропатии в оставшейся почке.
Проведение NSS допустимо при односторонних несиндромных опухолях Вильмса при соблюдении следующих критериев:
-
Опухоль, ограниченная одним полюсом почки, или расположенная периферально на уровне первичной почки.
-
V < 300 мл на момент постановки диагноза (риск наличия позитивных ЛУ - приблизительно 2% только при небольших опухолях).
-
Отсутствие предоперационных разрывов (Критерии визуализации разрыва: ретроперитонеальная перитуморальная эффузия/кровотечение, перитонеальное кровотечение или узловые образования, спонтанно или при открытой биопсии, и отсутствие интраоперационного разрыва).
-
Отсутствие внутрипросветных опухолей в почечной лоханке на предоперационной визуализации.
-
Отсутствие инвазии окружающих органов.
-
Отсутствие тромба в почечной вене или полой вене.
-
Отсутствие многоочаговой опухоли.
-
Допускается проведение удаления с безопасным отступом от края опухоли.
-
Ожидается, что в культе почки будет наблюдаться остаточное функционирование.
-
Необходимо сохранить как минимум 66% почечной ткани после резекции опухоли с захватом края здоровой ткани для получения достаточной защиты от гиперперфузии. В случае возникновения сомнений определение послеоперационного функционирования возможно при помощи предоперационного радиоизотопного исследования (DMSA).
-
В случае наличия висцеральных метастазов следует тщательно обдумывать вариант проведения.
NSS, а не систематически его исключать.
Во всех возможных случаях NSS получение мнения специалиста референсного хирургического центра, так же подтверждающего необходимость направления данного пациента для проведения NSS в центр, сотрудники которого имеют соответствующий опыт, является обязательным.
Примечания:
Значительное сокращение объема после предоперационной химиотерапии повысит шансы успешного проведения NSS, но не является обязательным, поскольку в некоторых опухолях имеются рентгенологические модификации, предполагающие некротическую трансформацию без уменьшения в размере.
Следует рассмотреть проведение функциональной визуализации почек перед операцией.
Резекция должна быть проведена с захватом краев здоровой почечной ткани Энуклеация не является надлежащей локальной терапией. В случае неполной резекции с микроскопической остаточной опухолью проведение дальнейшей локальной терапии зависит от ряда факторов и должно быть вынесено на обсуждение с многопрофильной группой специалистов. Однако, полная нефрэктомия при неблагоприятных подтипах ренальных опухолей представляется необходимой.
Следует рассмотреть проведение функциональной визуализации почек перед операцией.
Резекция должна быть проведена с захватом краев здоровой почечной ткани Энуклеация не является надлежащей локальной терапией. В случае неполной резекции с микроскопической остаточной опухолью проведение дальнейшей локальной терапии зависит от ряда факторов и должно быть вынесено на обсуждение с многопрофильной группой специалистов. Однако, полная нефрэктомия при неблагоприятных подтипах ренальных опухолей представляется необходимой.
Положительные ЛУ при патологическом исследовании после проведения NSS указывают на необходимость проведения лучевой терапии, но НЕ обязательно полной нефрэктомии.
Интраоперационное УЗ-сканирование может применяться для определения распространения интраренальной опухоли.
После проведения NSS следует осуществлять тщательный последующий мониторинг оставшейся почки (краткосрочный и долгосрочный): Допплерография спустя 2 дня после операции. Спустя 6 месяцев следует оценить вклад сохраненной почечной ткани в общий процесс мочевыделения при помощи сцинтиграфии (DMSA). Необходимо проводить оценку клиренса креатинина и обследование на предмет наличия гипертонии и признаков почечной недостаточности каждые 3 месяца первые 2 года, в последующие 3 года - каждые 6 месяцев, а затем ежегодно. Эта информация важна для определения наличия или отсутствия потенциальных преимуществ NSS для функции почек в долгосрочной перспективе.
Все члены мультидисциплинарной команды должны совместно принимать решение по вопросу проведения NSS. Хирург дает окончательное подтверждение осуществимости NSS во время операции.
Нефробластоматоз в почечной паренхиме в препарате, полученном при NSS, может способствовать развитию метахронной нефробластомы в оставшейся почке. Следует осуществлять тщательное наблюдение за этими пациентами.
Классификация нефрон-сохраняющей операции (NSS).
Нижеследующая классификация NSS была разработана Audry и соавт. [29] и подтверждена экспертной группой хирургов:
1)ХИРУРГИЧЕСКИЙ МЕТОД
NSS(A) = Частичная нефрэктомия
= Резекция опухоли с ободком здоровой почечной паренхимы NSS (В) = Энуклеация
= Резекция опухоли без ободка здоровой почечной паренхимы
= Резекция опухоли с ободком здоровой почечной паренхимы NSS (В) = Энуклеация
= Резекция опухоли без ободка здоровой почечной паренхимы
-
ХИРУРГИЧЕСКИЙ КРАЙ РЕЗЕКЦИИ (ХКР)
Интактная псевдо-капсула = (0) Сомнение = (1)
Распространение/прорастание опухоли = (2)
Распространение/прорастание опухоли = (2)
-
ПАТОЛОГИЧЕСКИЕ КРАЯ РЕЗЕКЦИИ (PRM)
Безопасный ободок ренальной паренхимы на крае резекции, за исключением нефробластоматоза = (0)
Интактная псевдокапсула по краю резекции = (1) Распространение/прорастание опухоли = (2)
Интактная псевдокапсула по краю резекции = (1) Распространение/прорастание опухоли = (2)
-
ОСТАВШАЯСЯ ПАРЕНХИМА ПОЧКИ (RRP)
Субъективная оценка процента оставшейся почечной паренхимы в оперированной почке выполнена хирургом = (n %).
Например, удаление почки с полюсным расположением опухоли, как правило, соответствует 70% RRP.
Например, удаление почки с полюсным расположением опухоли, как правило, соответствует 70% RRP.
Отчет по классификации для каждого случая будет представлен в следующем виде:
“NSS(X)-SRM(n)-PRM(n)-RRP(n%)”.
“NSS(X)-SRM(n)-PRM(n)-RRP(n%)”.
Лапароскопическая нефроуретерэктомия
Несмотря на то, что для опухолей почек детского возраста рекомендован классический открытый доступ, при опухолях Вильмса (ОВ) допускается проведение лапароскопической или лапароскопически ассистированной радикальной нефрэктомии при условии, что будут соблюдены следующие критерии:
-
При проведении резекции необходимо придерживаться онкологических принципов, а также выполнять сэмплинг лимфатических узлов.
-
Удалять небольшие центральные опухоли с ободком "здоровой" почечной ткани.
-
Извлекать препарат в мешке, без морцелляции, путем осуществления соответствующего разреза стенки брюшной полости является обязательным не только для контроля риска диссеминации, но также и для обеспечения надлежащего гистопатологического стадирования.
-
Отдавать предпочтение NSS (при возможности проведения), даже если необходим открытый доступ.
Противопоказания к проведению лапароскопической нефрэктомии:
-
Опухоль, инфильтрирующая экстраренальные структуры или распространяющаяся за ипсилатеральную границу позвоночного столба.
-
Тромб в почечной или полой вене.
-
Периферальная локация, если проведение NSS невозможно.
-
Опухоль без ответа на химиотерапию, ввиду риска разрыва опухоли.
-
Небольшой опыт/отсутствие опыта проведения лапароскопической нефрэктомии (рассмотреть вариант перевода пациента в другое отделение или привлечения более опытных специалистов).
Во всех возможных случаях проведения лапароскопической радикальной нефрэктомии необходимо получение мнения специалиста референсного хирургического центра, так же подтверждающего необходимость направления пациента для проведения лапароскопической операции в центр, сотрудники которого имеют соответствующий опыт.
Комментарии касательно препаратов для патологанатомической оценки. Необходимо провести биопсию или резекцию всех подозрительных структур, а также осуществить их маркировку и точное описание, и отправить патологоанатому в отдельных контейнерах, при инициальной диагностике или рецидиве. Интактный хирургический препарат должен быть доставлен свежим и целым (нефиксированный в формалине и предварительно не разрезанный хирургом). Просьба оставить швы на мочеточнике, почечной вене и артерии, чтобы патологоанатом без труда смог их найти для проведения гистологического исследования. При рецидиве необходимо ориентировать препарат и четко отметить подозрительные участки.
Рекомендации по хирургическому вмешательству при опухоли Вильмса.
Стадия I-III опухоли Вильмса.
См. выше общие рекомендации по хирургическому вмешательству
См. выше общие рекомендации по хирургическому вмешательству
Стадия IV опухоли Вильмса.
Легкие.
Метастазэктомия при легочных метастазах не должна проводиться в качестве первичного вмешательства. Необходимо провести оценку ответа на предоперационную химиотерапию (см. главу 15.3) Сроки проведения операции на легких зависят от ответа на химиотерапию и протокола лечения. Допускается проведение метастазэктомии либо в качестве одноэтапного метода вместе с нефрэктомией либо предпочтительно в качестве отложенной операции после одной или двух курсов полеоперационной химиотерапии в случае, если после проведения предоперационной химиотерапии все еще имеются метастазы. Если после предоперационной химиотерапии возможно достижение полной ремиссии посредством проведения операции. В других случаях необходимо следовать рекомендациям по срокам проведения операции на легких, приведенным в разделе для опухоли стадии IV.
Торакотомический доступ рекомендован при односторонних операбельных узлах. Необходимо провести удаление двусторонних резектабельных легочных метастазов при помощи двух латеральных торакотомий, срединной стернотомии или двусторонней передней торакотомии (доступ "clamshell") в зависимости от хирургического выбора и анатомии. Размер и локализация метастазов не должны препятствовать полному удалению всех поражений с ограниченным распространением резекций. Безопасный отступ рекомендован при любом типе метастазэктомии (если возможно). Клиновидные резекции часто могут являться наилучшим вариантом. Если при помощи клиновидной резекции не удастся достичь полного удаления, допускается применение сегментэктомии или лобэктомии. Проведение пневмонэктомии не является оправданным.
Периферические узлы субплевральной локализации могут подлежать удалению через торакоскопический доступ.
Маркировка всех резецированных участков поражения легких должна выполняться с максимальной анатомической точностью, для того чтобы была возможность 1) сопоставить их с результатами рентгенологической визуализации и 2) обратиться к результатам маркировки в случае возникновения рецидивов в легких для определения их локализации (ранее резецированный участок поражения или новый).
Торакотомический доступ рекомендован при односторонних операбельных узлах. Необходимо провести удаление двусторонних резектабельных легочных метастазов при помощи двух латеральных торакотомий, срединной стернотомии или двусторонней передней торакотомии (доступ "clamshell") в зависимости от хирургического выбора и анатомии. Размер и локализация метастазов не должны препятствовать полному удалению всех поражений с ограниченным распространением резекций. Безопасный отступ рекомендован при любом типе метастазэктомии (если возможно). Клиновидные резекции часто могут являться наилучшим вариантом. Если при помощи клиновидной резекции не удастся достичь полного удаления, допускается применение сегментэктомии или лобэктомии. Проведение пневмонэктомии не является оправданным.
Периферические узлы субплевральной локализации могут подлежать удалению через торакоскопический доступ.
Маркировка всех резецированных участков поражения легких должна выполняться с максимальной анатомической точностью, для того чтобы была возможность 1) сопоставить их с результатами рентгенологической визуализации и 2) обратиться к результатам маркировки в случае возникновения рецидивов в легких для определения их локализации (ранее резецированный участок поражения или новый).
Печень.
При изолированных метастазах в печени уместно проведение клиновидной резекции после нео-адъювантной химиотерапии. Не рекомендуется проведение обширных и потенциально калечащих резекций до изучения вопроса о возможности проведения дальнейшей химиотерапии.
Другие области локализации метастазов
Метастазы за пределами легких или печени должны быть удалены полностью в случае, если возможно проведение операции без нанесения увечий или потери жизненно важных органов.
Рекомендуется проведение полного удаления метастазов, где это разумно возможно. От него и от результатов гистологического исследования может зависеть дальнейшее локальное и системное лечение. Более того, операция по полному удалению метастазов сокращает риск развития локального рецидива. Не рекомендуется проводить операцию на метастазах, которые прогрессировали во время проведения предоперационной химиотерапии, поскольку при таких обстоятельствах полное удаление метастазов редко бывает успешным. В первую очередь следует изучить вопрос о проведении альтернативной химиотерапии и/или лучевой терапии.
Рекомендуется проведение полного удаления метастазов, где это разумно возможно. От него и от результатов гистологического исследования может зависеть дальнейшее локальное и системное лечение. Более того, операция по полному удалению метастазов сокращает риск развития локального рецидива. Не рекомендуется проводить операцию на метастазах, которые прогрессировали во время проведения предоперационной химиотерапии, поскольку при таких обстоятельствах полное удаление метастазов редко бывает успешным. В первую очередь следует изучить вопрос о проведении альтернативной химиотерапии и/или лучевой терапии.
Двусторонние опухоли Вильмса (Стадия V).
При лечении двусторонних опухолей необходимо применять индивидуальный подход. Основной хирургической целью является сохранение максимально возможного объема функциональной почечной ткани. Ввиду малого количества таких случаев, рекомендуется привлечение команды специалистов, имеющих опыт в лечении таких пациентов. Хирургическое вмешательство должно проводиться командой опытных специалистов, и поэтому необходимо рассмотреть вопрос о централизации подобных случаев в несколько центров. Следовательно:
Случай каждого пациента должен обсуждаться в рамках национального собрания хирургов для принятия решения с учетом рекомендаций национальных экспертов. Хирургические вмешательства будут проводиться только в центрах, специализирующихся на лечении пациентов с данным заболеванием.
Операция планируется после получения ответа опухоли на химиотерапию в виде сокращения размера или появления рентгенологических изменений в пользу некроза. В случае отсутствия ответа на химиотерапию в виде сокращения размеров опухоли можно предположить, что это опухоль стромального подтипа, при которой следует рассмотреть выполнение резекции опухоли до усиления химиотерапии. Химиотерапия длительностью более 12 недель редко приводит к дальнейшему ответу до проведения операции, и поэтому не рекомендуется. Допускается проведение множественных резекций одной почки.
Неизменный принцип заключается в успешном выполнении двусторонних нефрон-сохраняющих резекций посредством применения одноэтапного подхода или выполнения двух отдельных операций, интервал между которыми составляет не более двух полеоперационных курсов. Биопсия хирургических краев для оценки полной резекции опухоли должна проводиться только в случае, если она не нанесет вреда оставшейся почке. В первую очередь следует оперировать менее пораженную почку. Допускается проведение полной нефрэктомии на одной стороне и NSS - на другой при условии, что будет сохранен достаточный объем функциональной почечной ткани.
Несмотря на благоприятную картину на визуализации, во время операции опухоль оказывается нерезецируемой. В таком случае можно выполнить биопсию опухолей, предпочтительно при помощи иглы Tru-cut, и провести пациенту последующую химиотерапию. Однако в редких случаях двусторонняя полная нефрэктомия является единственным вариантом хирургического вмешательства. Варианты проведения ЛТ в качестве локального лечения ограничены после проведения NSS, но имеются случаи в исследовании SIOP 9, указывающие на то, что низкодозная ЛТ (10 Гр) и химиотерапия могут привести к долгосрочной ремиссии даже после выполнения частичного удаления без изменения функции почек. Такой вариант следует рассматривать для пациентов, в случае которых проведение двусторонней нефрэктомии является единственным способом достижения полного удаления, или пациентов с синдромом Дениса-Драша с жизнеугрожающим уровнем артериального давления, не поддающемся консервативному лечению. При проведении двусторонней нефрэктомии необходимо создать сосудистый доступ для диализа (Permcath) во время повторной нефрэктомии. Также допускается проведение перитонеального диализа, но, как правило, не в ближайший постоперационный период.
Случай каждого пациента должен обсуждаться в рамках национального собрания хирургов для принятия решения с учетом рекомендаций национальных экспертов. Хирургические вмешательства будут проводиться только в центрах, специализирующихся на лечении пациентов с данным заболеванием.
Операция планируется после получения ответа опухоли на химиотерапию в виде сокращения размера или появления рентгенологических изменений в пользу некроза. В случае отсутствия ответа на химиотерапию в виде сокращения размеров опухоли можно предположить, что это опухоль стромального подтипа, при которой следует рассмотреть выполнение резекции опухоли до усиления химиотерапии. Химиотерапия длительностью более 12 недель редко приводит к дальнейшему ответу до проведения операции, и поэтому не рекомендуется. Допускается проведение множественных резекций одной почки.
Неизменный принцип заключается в успешном выполнении двусторонних нефрон-сохраняющих резекций посредством применения одноэтапного подхода или выполнения двух отдельных операций, интервал между которыми составляет не более двух полеоперационных курсов. Биопсия хирургических краев для оценки полной резекции опухоли должна проводиться только в случае, если она не нанесет вреда оставшейся почке. В первую очередь следует оперировать менее пораженную почку. Допускается проведение полной нефрэктомии на одной стороне и NSS - на другой при условии, что будет сохранен достаточный объем функциональной почечной ткани.
Несмотря на благоприятную картину на визуализации, во время операции опухоль оказывается нерезецируемой. В таком случае можно выполнить биопсию опухолей, предпочтительно при помощи иглы Tru-cut, и провести пациенту последующую химиотерапию. Однако в редких случаях двусторонняя полная нефрэктомия является единственным вариантом хирургического вмешательства. Варианты проведения ЛТ в качестве локального лечения ограничены после проведения NSS, но имеются случаи в исследовании SIOP 9, указывающие на то, что низкодозная ЛТ (10 Гр) и химиотерапия могут привести к долгосрочной ремиссии даже после выполнения частичного удаления без изменения функции почек. Такой вариант следует рассматривать для пациентов, в случае которых проведение двусторонней нефрэктомии является единственным способом достижения полного удаления, или пациентов с синдромом Дениса-Драша с жизнеугрожающим уровнем артериального давления, не поддающемся консервативному лечению. При проведении двусторонней нефрэктомии необходимо создать сосудистый доступ для диализа (Permcath) во время повторной нефрэктомии. Также допускается проведение перитонеального диализа, но, как правило, не в ближайший постоперационный период.
Проведение трансплантации следует планировать при условии, что отсутствует рекуррентное или резидуальное заболевание, и предпочтительно после 2 лет безрецидивной выживаемости.
При случайном диагностировании двусторонней опухоли во время операции у пациента, ранее не получавшего лечение, предпочтительным вариантом является NSS (если возможно). В случае, если проведение NSS не представляется возможным, необходимо рассмотреть проведение открытой или ретроперитонеальной Tru-cut биопсии под контролем УЗИ и/или первичного ушивания брюшной полости и первичной (upfront) химиотерапии, как описано выше.
Рецидивная опухоль Вильмса:
Первые рецидивы (метастатические или локальные) поддаются лечению у значительной части пациентов. Следовательно, необходимо провести лечение с намерением на излечение. Следует провести подробную визуализацию участков локализации рецидива до принятия решения по хирургическому вмешательству. Вышеизложенные общие положения касательно операции также применимы и при рецидивах. Следующие параграфы содержат дальнейшие рекомендации по проведению операции пациентам с рецидивом.
Первый этап лечения - это химиотерапия второй линии. Исключениями являются поздние (> 2 года) солитарные метастазы в легких. Природа возникновения подобных участков поражения в легких, появляющихся спустя долгое время после лечения опухоли Вильмса, может быть неясной до проведения гистологического исследования. Метастазирование в ЦНС может потребовать неотложного хирургического вмешательства.
В остальных случаях хирургическая резекция должна проводиться после очевидного проявления ответа на химиотерапию и в случае, если все персистирующие участки заболевания поддаются полному удалению. Целью хирургического вмешательства является получение чистых краев резекции. Ложе опухоли и любое подозрительное резидуальное заболевания должны быть четко описаны для предоставления подробной информации для специалистов, проводящих лучевую терапию данных областей.
Не рекомендуется проводить операцию на метастазах, прогрессировавших во время химиотерапии, поскольку при таких обстоятельствах полное удаление редко является успешным. В первую очередь следует изучить вопрос о проведении альтернативной химиотерапии и/или лучевой терапии.
Первый этап лечения - это химиотерапия второй линии. Исключениями являются поздние (> 2 года) солитарные метастазы в легких. Природа возникновения подобных участков поражения в легких, появляющихся спустя долгое время после лечения опухоли Вильмса, может быть неясной до проведения гистологического исследования. Метастазирование в ЦНС может потребовать неотложного хирургического вмешательства.
В остальных случаях хирургическая резекция должна проводиться после очевидного проявления ответа на химиотерапию и в случае, если все персистирующие участки заболевания поддаются полному удалению. Целью хирургического вмешательства является получение чистых краев резекции. Ложе опухоли и любое подозрительное резидуальное заболевания должны быть четко описаны для предоставления подробной информации для специалистов, проводящих лучевую терапию данных областей.
Не рекомендуется проводить операцию на метастазах, прогрессировавших во время химиотерапии, поскольку при таких обстоятельствах полное удаление редко является успешным. В первую очередь следует изучить вопрос о проведении альтернативной химиотерапии и/или лучевой терапии.
Операцию по резекции узлов печени или легких следует проводить при малом количестве операбельных метастазов, после химиотерапии и только в случае пациентов со стабильным течением заболевания или частичным ответом. Показания должны быть составлены совместно с хирургами, лучевыми терапевтами и онкологами.
В случае возникновения рецидива в поле облучения должны быть приложены все возможные усилия для проведения полной резекции. Локальный рецидив и метастазы в печени или легких зачастую являются резектабельными. Рецидив в лимфатические узлы, особенно в ранее облученном поле, является очень сложной проблемой. Даже радикальная парааортальная лимфаденэктомия может оказаться неэффективной для пациента, поскольку инвазия лимфатических узлов часто распространяется на средостение.
Хирургическое вмешательство при рецидиве опухоли контралатеральной почки (метахронная опухоль Вильмса) должно проводиться командой опытных специалистов. Проведение операции планируется после сокращения размеров опухоли при помощи химиотерапии также у этих пациентов.
Дальнейшее ведение:
После окончания интенсивного лечения ребенок наблюдается на динамическом учете по месту жительства:
-
осмотр участкового педиатра/ВОП, онколога/гематолога 1 раз в месяц;
-
осмотр онколога/гематолога республиканской клиники 1 раз в 6мес;
-
ОАК, биохимический анализ крови 1 раз в месяц;
-
УЗИ лимфоузлов, ОБП 1 раз в месяц в течение 1 года, далее 1 раз в 3-6 мес;
-
ПЭТ/КТ всего тела 1 раз в год;
-
КТ или МРТ пораженного участка с контрастным усилением 1 раз в 3 месяца в течение 1 года, далее 1 раз в 6-12месяцев;
-
ЭКГ, ЭхоКГ, УЗИ щитовидной железы, аудиометрия 1 раз в год;
-
ИФА на гепатиты В, С и ВИЧ в декретированные сроки;
-
консультация узких специалистов по показаниям;
Индикаторы эффективности лечения:
Эффективность лечения оценивается после окончания 2 курсов химиотерапии. При недостаточном эффекте целесообразно изменить схемы химиотерапии, замена отдельных препаратов или схемы лечения препаратами альтернативного блока, применяемых при возникновении резистентности и рецидивов заболевания.
Критериями оценки эффективности проведенного лечения является регрессия процесса.
Критериями оценки эффективности проведенного лечения является регрессия процесса.
-
Оценка ответа опухоли на лечение:
-
С – стабилизация процесса;
-
ЧР – частичная регрессия;
-
ПР– полная регрессия;
-
П – прогрессирование.
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ [1].
Показания для плановой госпитализации:
-
наличие клинических проявлений заболевания;
-
верификация диагноза;
-
повторная госпитализация на продолжение специализированного лечения.
Показания для экстренной госпитализации:
При запущенных случаях, поздней диагностике (при разрыве опухоли с клиникой острого живота), таких пациентов также необходимо госпитализировать в ОДБ по месту жительства в профильное отделение.
При ухудшении состояния в межблочном периоде (развитие цитопенического синдрома, глубокая анемия, геморрагический синдром, инфекционные осложнения), паллиативные пациенты, требующие стационарной коррекции состояния необходимо госпитализировать в ОДБ по месту жительства 9 для проведения симптоматической терапии.
При ухудшении состояния в межблочном периоде (развитие цитопенического синдрома, глубокая анемия, геморрагический синдром, инфекционные осложнения), паллиативные пациенты, требующие стационарной коррекции состояния необходимо госпитализировать в ОДБ по месту жительства 9 для проведения симптоматической терапии.
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2022
- Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2022 - 1) Treatment Guidelines Collaborative Wilms Tumour Africa Project - Phase II, 2022 https://yandex.kz/search/?text=Treatment-Guidelines-Collaborative-Wilms-Tumor- Africa-Project-Phase-II-doc-v1.8-May- 2022&clid=2411726&rdrnd=725765&lr=162&msp=1 2) NCCN Guidelines® Insights: Cervical Cancer, Version 1.2024 3) Children with Relapsed or Refractory Nephroblastoma: Favorable Long-term Survival after High-dose Chemotherapy and Autologous Stem Cell Transplantation, 2019 4) Kidney Cancer, Version 3.2022, NCCN Clinical Practice Guidelines in Oncology, 2022 5) Protocol for the Examination of Biopsy Specimens From Patients With Wilms and Other Pediatric Renal Tumors, 2022 6) Efficacy of Different Protocols in Treatment of Nephroblastoma: A revisit, 20221 7) Gadd S. et al. A Children’s Oncology Group and TARGET initiative exploring the genetic landscape of Wilms tumor // Nat. Genet. Nature Publishing Group, 2017. Vol. 49, № 10. P. 1487–1494 8) Szychot E., Apps J., Pritchard-Jones K. Wilms’ tumor: biology, diagnosis and treatment. // Transl. Pediatr. AME Publications, 2014. Vol. 3, № 1. P. 12–24. 9) Zamperlini-Netto G. et al. PO-60 - Renal tumors with extensive vascular disease: management challenges in a pediatric series from the Hospital for Sick Children. // Thromb. Res. 2016. Vol. 140 Suppl 1. P. S198-9 10) Kebudi R. et al. Seroprevalence of hepatitis b, hepatitis c, and hiv in children with cancer at diagnosis and following therapy in turkey: Progress within the last 25 years // Turk Pediatr. 61 Ars. AVES, 2019. Vol. 54, № 2. P. 82–85. 11) Stanescu A.L. et al. Pediatric Renal Neoplasms:: MR Imaging–Based Practical Diagnostic Approach // Magnetic Resonance Imaging Clinics of North America. W.B. Saunders, 2019. Vol. 27, № 2. P. 279–290 12) Voss S.D. Staging and following common pediatric malignancies: MRI versus CT versus functional imaging // Pediatric Radiology. Springer Verlag, 2018. Vol. 48, № 9. P. 1324– 1336. 13) Васильева Е.С., Вашура А.Ю., Литвинов Д.В. Нутритивный статус детей с онкологическими и гематологическими заболеваниями, находящихся на лечении в ФГБУ «ФНКЦ ДГОИ им. Дмитрия Рогачева» (результаты скринингового исследования) // Современная онкология. 2016. Vol. 18, № 4. P. 48–52. 14) Энциклопедия клинической онкологии под ред. Акад.М.И.Давыдова Москва 2004. 15) Israels T. et al. SIOP PODC: Clinical guidelines for the management of children with Wilms tumour in a low income setting // Pediatr. Blood Cancer. 2013. Vol. 60, № 1. P. 5–11 16) Стандарты оказания специализированной помощи детям и подросткам с гематологическими и онкологическими заболеваниями у детей и подростков. Медпрактика-М, Москва, 2009. 17) UMBRELLA Protocol SIOP-RTSG 2016 [Electronic resource]. 2016. P. 336. URL: http://www.fnkc.ru/docs/SIOP-RTSG2016.pdf. 18) Indolfi P. et al. Synchronous bilateral Wilms tumor: A report from the Associazione Italiana Ematologia Oncologia Pediatrica (AIEOP) // Cancer. Cancer, 2013. Vol. 119, № 8. P. 1586– 1592. 19) Joosten K.F.M., Kerklaan D., Verbruggen S.C.A.T. Nutritional support and the role of the stress response in critically ill children // Current Opinion in Clinical Nutrition and Metabolic Care. Lippincott Williams and Wilkins, 2016. Vol. 19, № 3. P. 226–233.
Информация
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ПРОТОКОЛА.
Список разработчиков:
-
Жумадуллаев Бахрам Маликайдарович - детский онколог, заведующий отделением хирургия №2, врач высшей квалификационной категории АО «Научный центр педиатрии и детской хирургии».
-
Абдилова Гульнара Калденовна – кандидат медицинских наук, врач онколог/гематолог детский, руководитель педиатрического блока АО «Научный центр педиатрии и детской хирургии».
-
Панкова Олеся Сергеевна– детский онколог/гематолог, заведующий отделения онкологии/гематологии-1 АО «Научный центр педиатрии и детской хирургии».
-
Нуржанова Гаухар Амангельдиевна– детский онколог/гематолог, заведующий отделения онкологии/гематологии-2 АО «Научный центр педиатрии и детской хирургии».
-
Алибаева Жадыра Багдатовна - детский онколог/гематолог, отделения онкологии/гематологии №1 АО «Научный центр педиатрии и детской хирургии».
-
Хашимова Зухра Махаматжановна - детский онколог/гематолог, отделения онкологии/гематологии №1 АО «Научный центр педиатрии и детской хирургии».
-
Абекенов Бахытжан Дайрабаевич – Кандидат медицинских наук, заведующий отделением урологии АО «Научный центр педиатрии и детской хирургии».
-
Шайхызада Кұндыз Ғазизқызы - детский онколог/гематолог , заведующая программы солидных опухолей, отделения онкологии, клинико -акедемический департамент педиатрии КФ UMC в Национальный Научный Центр материнства и Детства г Астаны.
-
Ералиева Бибихан Абдалиевна - кандидат медицинских наук, заведующий кафедрой клинической фармакологии Казахстанского Медицинского Уиверситета Непрервыного Образования, главный внештатный клинический фармаколог УОЗ г.Алматы.
-
Сарсекбаев Ергали Семгалиевич- детский онколог/гематолог, заведующий отделения трансплантации гемопоэтических стволовых клеток АО «Научный центр педиатрии и детской хирургии».
Указание на отсутствие конфликта интересов: нет.
Список рецензентов: Жумашев Уалихан Кошкаралиевич – врач высшей категории, доктор медицинских наук, профессор кафедры интернатуры и резидентуры в онкологии НАО «Казахский Национальный медицинский университет имени С. Д. Асфендиярова»
Пересмотр протокола: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Приложение 1
Карта наблюдения
|
Выявление рецидивов и мониторинг токсичности
|
||||||
|
Период наблюдения
|
1-й год
|
2-й год |
3-й год |
4-й год |
5-й го д
|
>5 лет |
|
Физикальное обследование
|
Раз в 3 месяца
|
Раз в 3 месяца
|
Раз в 4 месяца
|
Раз в полгода
|
Раз в год
|
Опционально
|
|
Визуализация: опухоль Вильмса*:
|
||||||
|
УЗИ брюшной полости |
Раз в 2-3** Месяц а
|
Раз в 3 месяца |
У детей младше 10 лет риск рецидива на 3-ем году низок, и дальнейшие визуализационные исследования должны проводиться в соответствии с национальными или региональными рекомендациями.
При опухолях стадии V: визуализационные исследования проводятся в зависимости от лежащих в основе заболевания генетических факторов, предрасположенности пациента, функции почек и т.д. |
|||
|
Рентген ОГК в переднезадней или заднепередней и латеральной проекциях |
Раз в 2-3** месяца |
Раз в 3 месяца |
||||
|
Визуализация: прочие ренальные опухоли (non-WT):
Ввиду ограниченности данных, рекомендуется обсудить этот момент с национальным ведущим исследователем. Стандартом является проведение следующих исследований: |
||||||
|
УЗИ брюшной полости
|
Раз в 3 месяца
|
Раз в 3 месяца
|
Раз в 4 месяца
|
Раз в полгода
|
Ра з в год
|
Не проводится |
|
Рентген ОГК в переднезадней или заднепередней и латеральной проекциях
|
Раз в 3 месяца |
Раз в 3 месяца |
Раз в 4 месяца |
Раз в полгода |
Ра з в год |
Не проводится |
|
МРТ головного мозга
|
Только в случае рецидива CCSK или MRTK или изначального наличия метастазов в головном мозге
|
|||||
|
Сцинтиграфия костей скелета с технецием или МРТ всего тела
|
Только в случае рецидива CCSK или изначального наличия костных метастазов
|
|||||
|
Моча: тест-полоска |
Раз в 3 месяца
|
Раз в 3 месяца
|
Раз в полгода
|
Раз в полгода
|
Раз в год
|
Артериальное давление + тест-полоска раз в год. При появлении симптомов инфекции мочевыводящих путей обратитесь к врачу общей практики/педиатру. |
|
Кровь: общий анализ крови, мочевина, креатинин, цистатин С; Ca++, фосфаты, Mg++, альбумин, АлАТ/АсАТ,
билирубин, газы крови. |
Раз в 3 месяца |
Раз в полгода |
Раз в полгода |
Раз в полгода |
Раз в год |
|
|
Артериальное давление
|
Раз в 3 месяца
|
Раз в 3 месяца
|
Раз в 4 месяца
|
Раз в полгода
|
Раз в год
|
|
|
Нефрологи***
|
По окончании лечения обратитесь к местному детскому нефрологу.
|
|||||
|
Генетики |
Для пациентов с лежащей в основе заболевания предрасположенностью, пороками развития и/или двусторонней опухолью.
|
|||||
|
ЭКГ/эхокардиография
|
Долгосрочное последующее наблюдение проводится в соответствии с рекомендациями Международной группы по гармонизации руководств по отдаленным последствиям детского рака (IGHG) и местными стандартами. Рекомендации IGHG можно найти по ссылке (http://www.ighg.org/).
|
|||||
|
Функция легких
|
||||||
|
Эндокринология
|
||||||
|
Аудиометрия
|
||||||
*: Обязательно проведите 4 исследования на выявление рецидива сразу после нефрэктомии, так как значительная доля рецидивов возникает во время прохождения пациентом послеоперационной терапии.
**: Гистологическая группа высокого риска (стадии III, IV и V) и гистологическая группа промежуточного риска (стадия IV) имеют значительно более высокий риск развития рецидива в течение первого года после проведения нефрэктомии. В таких случаях УЗИ/рентген следует проводить раз в 2 месяца.
***Мониторинг функции почек обязателен к проведению. Дополнительно можно рассмотреть возможность проведения теста на скорость клубочковой фильтрации (СКФ) и сбора суточной мочи.
Направьте пациента к детскому нефрологу при возникновении таких состояний как протеинурия, нефрокальциноз, гипертонус и снижение функции почек.
**: Гистологическая группа высокого риска (стадии III, IV и V) и гистологическая группа промежуточного риска (стадия IV) имеют значительно более высокий риск развития рецидива в течение первого года после проведения нефрэктомии. В таких случаях УЗИ/рентген следует проводить раз в 2 месяца.
***Мониторинг функции почек обязателен к проведению. Дополнительно можно рассмотреть возможность проведения теста на скорость клубочковой фильтрации (СКФ) и сбора суточной мочи.
Направьте пациента к детскому нефрологу при возникновении таких состояний как протеинурия, нефрокальциноз, гипертонус и снижение функции почек.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.