Нейроэндокринные опухоли
 Версия: Клинические рекомендации РФ 2025 (Россия)
Версия: Клинические рекомендации РФ 2025 (Россия)
Вторичное злокачественное новообразование органов дыхания и пищеварения (C78), Другие злокачественные новообразования кожи (C44), Злокачественное новообразование без уточнения локализации (C80), Злокачественное новообразование бронхов и легкого (C34), Злокачественное новообразование вилочковой железы (C37), Злокачественное новообразование влагалища (C52), Злокачественное новообразование вульвы (C51), Злокачественное новообразование других и неточно обозначенных локализаций губы, полости рта и глотки (C14), Злокачественное новообразование других и неточно обозначенных локализаций органов дыхания и внутригрудных органов (C39), Злокачественное новообразование других и неуточненных женских половых органов (C57), Злокачественное новообразование других и неуточненных мочевых органов (C68), Злокачественное новообразование других и неуточненных частей желчевыводящих путей (C24), Злокачественное новообразование других эндокринных желез и родственных структур (C75), Злокачественное новообразование желудка (C16), Злокачественное новообразование желчного пузыря (C23), Злокачественное новообразование заднего прохода [ануса] и анального канала (C21), Злокачественное новообразование кишечного тракта неуточненной части (C26.0), Злокачественное новообразование матки неуточненной локализации (C55), Злокачественное новообразование мозгового слоя надпочечника (C74.1), Злокачественное новообразование молочной железы (C50), Злокачественное новообразование мочеточника (C66), Злокачественное новообразование надпочечника неуточненной части (C74.9), Злокачественное новообразование носоглотки (C11), Злокачественное новообразование ободочной кишки (C18), Злокачественное новообразование печени и внутрипеченочных желчных протоков (C22), Злокачественное новообразование пищевода (C15), Злокачественное новообразование поджелудочной железы (C25), Злокачественное новообразование поражение забрюшинного пространства и брюшины, выходящее за пределы одной и более вышеуказанных локализаций (C48.8), Злокачественное новообразование почечных лоханок (C65), Злокачественное новообразование почки, кроме почечной лоханки (C64), Злокачественное новообразование предстательной железы (C61), Злокачественное новообразование прямой кишки (C20), Злокачественное новообразование пузыря (C67), Злокачественное новообразование ректосигмоидного соединения (C19), Злокачественное новообразование ротоглотки (C10), Злокачественное новообразование сердца, средостения и плевры (C38), Злокачественное новообразование тела матки (C54), Злокачественное новообразование тонкого кишечника (C17), Злокачественное новообразование трахеи (C33), Злокачественное новообразование шейки матки (C53), Злокачественное новообразование щитовидной железы (C73), Злокачественное новообразование яичника (C56), Злокачественное новообразование: неточно обозначенные локализации в пределах пищеварительной системы (C26.9), Злокачественное новообразование: поражение органов пищеварения, выходящее за пределы одной и более вышеуказанных локализаций (C26.8), Злокачественные новообразования самостоятельных (первичных) множественных локализаций (С97)
Онкология, Эндокринология
Общая информация
Краткое описание
Разработчик клинической рекомендации
Российская ассоциация эндокринологов,
Ассоциация онкологов России,
Общероссийская общественная организация «Российское общество клинической онкологии»
Ассоциация онкологов России,
Общероссийская общественная организация «Российское общество клинической онкологии»
Одобрено Научно-практическим Советом Минздрава России
Пересмотр не позднее: 2027
Кодирование по МКБ-10 происходит в соответствии с органной принадлежностью опухоли.
Классификация Всемирной организации здравоохранения (ВОЗ, 2019)
Классификация Всемирной организации здравоохранения (ВОЗ, 2019)
Классификация Всемирной организации здравоохранения (ВОЗ, 2019)
Классификация Всемирной организации здравоохранения (ВОЗ, 2019)
Классификация ВОЗ, 2019
Классификация ВОЗ, 2019
Классификация ВОЗ, 2019
Классификация ВОЗ, 2019
Классификация ВОЗ, 2019
Классификация ВОЗ, 2019
Классификация (ВОЗ, 2015)
Классификация ВОЗ, 2015
Классификация ВОЗ, 2017
Классификация ВОЗ, 2017
Классификация ВОЗ, 2012
Классификация ВОЗ, 2018
Классификация ВОЗ, 2014
Классификация (ВОЗ, 2014)
Классификация ВОЗ, 2014
Классификация ВОЗ, 2014
Классификация ВОЗ, 2016
Классификация ВОЗ, 2016
Классификация ВОЗ, 2016
Классификация ВОЗ, 2017
Классификация ВОЗ, 2017
Клинические рекомендации
Нейроэндокринные опухоли
Год утверждения (частота пересмотра): 2025
Пересмотр не позднее: 2027
ID: 610_2
Возрастная категория: Взрослые
Определение заболевания или состояния (группы заболеваний или состояний)
Нейроэндокринные опухоли (НЭО) - гетерогенная группа новообразований, происходящих из нейроэндокринных клеток эмбриональной кишки, обладающих биологически активными свойствами. Нейроэндокринные клетки имеют определенные секреторные характеристики, обусловливающие развитие синдромов гиперпродукции регуляторных пептидов, что, в свою очередь, может приводить к развитию соответствующих клинических синдромов. НЭО встречаются во всех органах, имеющих нейроэндокринные клетки.
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Кодирование по МКБ-10 происходит в соответствии с органной принадлежностью опухоли.
C10 Злокачественные образования ротоглотки
C10.0 Ямки надгортанника
C10.1 Передней поверхности надгортанника
C10.2 Боковой стенки ротоглотки
C10.3 Задней стенки ротоглотки
C10.4 Жаберных щелей
C10.8 Злокачественное новообразование ротоглотки, выходящее за пределы одной и более вышеуказанных локализаций
С10.9 Ротоглотки неуточненное
Классификация Всемирной организации здравоохранения (ВОЗ, 2019)
| Нейроэндокринная опухоль (НЭО) NOS | 8240/3 | |
|---|---|---|
| НЭО G1 | 8240/3 | |
| НЭО G2 | 8249/3 | |
| НЭО G3 | 8249/3 | |
| Нейроэндокринный рак (НЭК) NOS | 8246/3 | |
| Крупноклеточный НЭК | 8013/3 | |
| Мелкоклеточный НЭК | 8041/3 | |
| Смешанная нейроэндокринная-не-нейроэндокринная неоплазия (MINEN) | 8154/3 | |
| Комбинированная мелкоклеточная аденокарцинома | 8045/3 | |
| Комбинированная мелкоклеточная плоскоклеточная карцинома | 8045/3 | |
С11 Злокачественные образования носоглотки
С11.0 Верхней стенки носоглотки
C11.1 Задней стенки носоглотки
C11.2 Боковой стенки носоглотки
C11.3 Передней стенки носоглотки
C11.8 Злокачественное новообразование носоглотки, выходящие за пределы одной и более вышеуказанных локализаций
C11.9 Носоглотки неуточненное
Классификация Всемирной организации здравоохранения (ВОЗ, 2019)
| Нейроэндокринная опухоль (НЭО) NOS | 8240/3 | |
|---|---|---|
| НЭО G1 | 8240/3 | |
| НЭО G2 | 8249/3 | |
| НЭО G3 | 8249/3 | |
| Нейроэндокринный рак (НЭК) NOS | 8246/3 | |
| Крупноклеточный НЭК | 8013/3 | |
| Мелкоклеточный НЭК | 8041/3 | |
| Смешанная нейроэндокринная-не-нейроэндокринная неоплазия (MINEN) | 8154/3 | |
| Комбинированная мелкоклеточная аденокарцинома | 8045/3 | |
| Комбинированная мелкоклеточная плоскоклеточная карцинома | 8045/3 | |
С14 Злокачественное новообразование других и неточно обозначенных локализаций губы, полости рта и глотки
С14.0 Глотки неуточненное
С14.1 Гортаноглотки
С14.2 Глоточного кольца Вальдейера [Waldeyer]
C14.8 Злокачественное новообразование губы, полости рта и глотки, выходящее за пределы одной и более вышеуказанных локализаций
Классификация Всемирной организации здравоохранения (ВОЗ, 2019)
| Нейроэндокринная опухоль (НЭО) NOS | 8240/3 | |
|---|---|---|
| НЭО G1 | 8240/3 | |
| НЭО G2 | 8249/3 | |
| НЭО G3 | 8249/3 | |
| Нейроэндокринный рак (НЭК) NOS | 8246/3 | |
| Крупноклеточный НЭК | 8013/3 | |
| Мелкоклеточный НЭК | 8041/3 | |
| Смешанная нейроэндокринная-не-нейроэндокринная неоплазия (MINEN) | 8154/3 | |
| Комбинированная мелкоклеточная аденокарцинома | 8045/3 | |
| Комбинированная мелкоклеточная плоскоклеточная карцинома | 8045/3 | |
С15 Злокачественные образования пищевода
С15.0 Шейный отдел пищевода
С15.1 Грудной отдел пищевода
С15.2 Злокачественное новообразование абдоминального отдела пищевода
С15.3 Верхняя треть пищевода; проксимальная треть пищевода
С15.4 Средняя треть пищевода
С15.5 Нижняя треть пищевода; дистальная треть пищевода
С15.8 Злокачественное новообразование пищевода, выходящее за пределы пищевода
С15.9 Пищевод неуточненное
Классификация Всемирной организации здравоохранения (ВОЗ, 2019)
| Нейроэндокринная опухоль (НЭО) NOS | 8240/3 | |
|---|---|---|
| НЭО G1 | 8240/3 | |
| НЭО G2 | 8249/3 | |
| НЭО G3 | 8249/3 | |
| Нейроэндокринный рак (НЭК) NOS | 8246/3 | |
| Крупноклеточный НЭК | 8013/3 | |
| Мелкоклеточный НЭК | 8041/3 | |
| Смешанная нейроэндокринная-не-нейроэндокринная неоплазия (MINEN) | 8154/3 | |
| Комбинированная мелкоклеточная аденокарцинома | 8045/3 | |
| Комбинированная мелкоклеточная плоскоклеточная карцинома | 8045/3 | |
С16 Злокачественное новообразование желудка
С16.0 Кардия, БДУ
С16.1 Дно желудка
С16.2 Тело желудка
С16.3 Злокачественное новообразование преддверия привратника
С16.4 Привратник
С16.5 Малая кривизна желудка, БДУ
С16.6 Большая кривизна желудка, БДУ
С16.8 Злокачественное новообразование желудка, выходящее за пределы одной и более из вышеуказанных локализаций
С16.9 Желудок неуточненная локализация
Классификация ВОЗ, 2019
| Нейроэндокринная опухоль (НЭО) NOS | 8240/3 |
|---|---|
| Гистаминпродуцирующая ECL-клеточная НЭО | |
| Тип 1 ECL-клеточные НЭО | 8242/3 |
| Тип 2 ECL-клеточные НЭО | 8242/3 |
| Тип 3 НЭО | 8240/3 |
| НЭО G1 | 8240/3 |
| НЭО G2 | 8249/3 |
| НЭО G3 | 8249/3 |
| Соматостатинпродуцирующая D-клеточная НЭО | 8156/3 |
| Гастринпродуцирующая G-клеточная НЭО | 8153/3 |
| Серотонинпродуцирующая ЕС-клеточная НЭО | 8156/3 |
| Нейроэндокринный рак (НЭК) NOS | 8246/3 |
| Крупноклеточный НЭК | 8013/3 |
| Мелкоклеточный НЭК | 8041/3 |
| Смешанная нейроэндокринная-не-нейроэндокринная неоплазия (MINEN) | 8154/3 |
| Смешанный аденонейроэндокринная карцинома или железисто-нейроэндокринный рак (MANEC) | 8244/3 |
| Смешанная аденокарцинома-НЭО | 8244/3 |
С17.0 Злокачественное новообразование двенадцатиперстной кишки
С17.1 Злокачественное новообразование тощей кишки
С17.2 Злокачественное новообразование подвздошной кишки
С17.3 Злокачественное новообразование дивертикула Меккеля [Meckel]
С17.8 Злокачественное новообразование тонкого кишечника, выходящее за пределы одной и более из вышеуказанных локализаций
С17.9 Злокачественное новообразование тонкого кишечника неуточненной локализации
Классификация ВОЗ, 2019
| Нейроэндокринная опухоль (НЭО) NOS | 8240/3 |
|---|---|
| НЭО G1 | 8240/3 |
| НЭО G2 | 8249/3 |
| НЭО G3 | 8249/3 |
| Гастринома NOS | 8153/3 |
| Соматостатинома NOS | 8156/3 |
| Энтерохромаффиноклеточный карциноид | 8241/3 |
| Экстраадреналовая параганглиома NOS | 8693/3 |
| Нейроэндокринный рак (НЭК) NOS | 8246/3 |
| Крупноклеточный НЭК | 8013/3 |
| Мелкоклеточный НЭК | 8041/3 |
| Смешанная нейроэндокринная-не-нейроэндокринная неоплазия (MINEN) | 8154/3 |
С18.0 Злокачественное новообразование слепой кишки
С18.1 Злокачественное новообразование червеобразного отростка
С18.2 Злокачественное новообразование восходящей ободочной кишки
С18.3 Злокачественное новообразование печеночного изгиба
С18.4 Злокачественное новообразование поперечной ободочной кишки
С18.5 Злокачественное новообразование селезеночного изгиба
С18.6 Злокачественное новообразование нисходящей ободочной кишки
С18.7 Злокачественное новообразование сигмовидной кишки
С18.8 Злокачественное новообразование ободочной кишки, выходящее за пределы одной и более из вышеуказанных локализаций
С18.9 Злокачественное новообразование ободочной кишки неуточненной локализации
С19 Злокачественное новообразование ректосигмоидного соединения
С20 Злокачественное новообразование прямой кишки
Классификация ВОЗ, 2019
| Нейроэндокринная опухоль (НЭО) NOS | 8240/3 |
|---|---|
| НЭО G1 | 8240/3 |
| НЭО G2 | 8249/3 |
| НЭО G3 | 8249/3 |
| L-клеточная опухоль | 8152/3 |
| Глюкагонподобная пептидпродуцирующая опухоль | 8152/3 |
| PP/PYY-продуцирующая опухоль | 8152/1 |
| Энтерохромаффиноклеточный карциноид | 8241/3 |
| Серотонинпродуцирующая опухоль | 8241/3 |
| Нейроэндокринный рак (НЭК) NOS | 8246/3 |
| Крупноклеточный НЭК | 8013/3 |
| Мелкоклеточный НЭК | 8041/3 |
| Смешанная нейроэндокринная-не-нейроэндокринная неоплазия (MINEN) | 8154/3 |
С21.0 Злокачественное новообразование заднего прохода неуточненной локализации
С21.1 Злокачественное новообразование анального канала
С21.2 Злокачественное новообразование клоакогенной зоны
С21.8 Злокачественное новообразование прямой кишки, заднего прохода [ануса] и анального канала, выходящее за пределы вышеуказанных локализаций
Классификация ВОЗ, 2019
| Нейроэндокринная опухоль (НЭО) NOS | 8240/3 | |
|---|---|---|
| НЭО G1 | 8240/3 | |
| НЭО G2 | 8249/3 | |
| НЭО G3 | 8249/3 | |
| Нейроэндокринный рак (НЭК) NOS | 8246/3 | |
| Крупноклеточный НЭК | 8013/3 | |
| Мелкоклеточный НЭК | 8041/3 | |
| Смешанная нейроэндокринная-не-нейроэндокринная неоплазия (MINEN) | 8154/3 | |
С22 Злокачественное новообразование печени и внутрипеченочных желчных протоков
С23 Злокачественное новообразование желчного пузыря
С24.0 Злокачественное новообразование внепеченочного желчного протока
С24.1 Злокачественное новообразование ампулы фатерова сосочка
С24.8 Злокачественное новообразование желчных путей, выходящее за пределы одной и более вышеуказанных локализаций
С24.9 Злокачественное новообразование желчных путей неуточненное
С25.0 Злокачественное новообразование головки поджелудочной железы
С25.1 Злокачественное новообразование тела поджелудочной железы
С25.2 Злокачественное новообразование хвоста поджелудочной железы
С25.3 Злокачественное новообразование протока поджелудочной железы
С25.4 Злокачественное новообразование островковых клеток поджелудочной железы
С25.7 Злокачественное новообразование других частей поджелудочной железы
С25.8 Злокачественное новообразование поджелудочной железы, выходящее за пределы одной и более вышеуказанных локализаций
С25.9 Злокачественное новообразование поджелудочной железы неуточненное
Классификация ВОЗ, 2019
| Панкреатические нейроэндокринные неоплазии (PanNENs) | ||||
|---|---|---|---|---|
| Нефункционирующие панкреатические НЭО (PanNETs) | ||||
| Панкреатическая нейроэндокринная микроаденома | 8150/0 | |||
| Нейроэндокринная опухоль (НЭО) NOS | 8240/3 | |||
| НЭО G1 | 8240/3 | |||
| НЭО G2 | 8249/3 | |||
| НЭО G3 | 8249/3 | |||
| Нефункционирующая панкреатическая нейроэндокринная опухоль | 8150/3 | |||
| Функционирующая панкреатическая нейроэндокринная опухоль | ||||
| Инсулинома | 8151/3 | |||
| Глюкагонома | 8152/3 | |||
| Соматостатинома | 8156/3 | |||
| Гастринома | 8153/3 | |||
| ВИПома | 8155/3 | |||
| Серотонинпродуцирующая опухоль | 8241/3 | |||
| АКТГ-продуцирующая опухоль | 8158/3 | |||
| Панкреатический нейроэндокринный рак (PanNEC) | ||||
| Нейроэндокринный рак (НЭК) NOS | 8246/3 | |||
| Мелкоклеточный нейроэндокринный рак | 8041/3 | |||
| Крупноклеточный нейроэндокринный рак | 8013/3 | |||
| Панкреатические смешанные нейроэндокринные-не-нейроэндокринные неоплазии (MINENs) | 8154/3 | |||
| Смешанный ацинарный эндокринный рак | 8154/3 | |||
| Смешанный ацинарный нейроэндокринный рак | 8154/3 | |||
| Смешанный ацинарный эндокринный протоковый рак | 8154/3 | |||
С26.0 Злокачественное новообразование кишечного тракта неуточненной части
С26.8 Злокачественное новообразование органов пищеварения, выходящее за пределы одной и более вышеуказанных локализаций
С26.9 Злокачественное новообразование неточно обозначенных локализаций в пределах пищеварительной системы
Классификация ВОЗ, 2019
См. выше.
С33 Злокачественное новообразование трахеи
С34.0 Злокачественное новообразование главного бронха
С34.1 Злокачественное новообразование верхней доли, бронхов или легкого
С34.2 Злокачественное новообразование средней доли, бронхов или легкого
С34.3 Злокачественное новообразование нижней доли, бронхов или легкого
С34.8 Злокачественное новообразование бронхов или легкого, выходящее за пределы одной и более вышеуказанных локализаций
С34.9 Злокачественное новообразование бронхов или легкого неуточненной локализации
Классификация (ВОЗ, 2015)
| Мелкоклеточный рак | 8041/3 |
|---|---|
| Комбинированный мелкоклеточный рак | 8045/3 |
| Крупноклеточный нейроэндокринный рак | 8013/3 |
| Комбинированный крупноклеточный нейроэндокринный рак | 8013/3 |
| Карциноидные опухоли | |
| Типичный карциноид | 8240/3 |
| Атипичный карциноид | 8249/3 |
| Преинвазивные нарушения | |
| Диффузная идиопатическая легочная гиперплазия нейроэндокринных клеток | 8040/0 |
С37 Злокачественное новообразование вилочковой железы (тимуса)
С38 Злокачественное новообразование сердца, средостения и плевры
С39 Злокачественное новообразование других и неточно обозначенных локализаций органов дыхания и внутригрудных органов
Классификация ВОЗ, 2015
| Карциноидные опухоли | |
|---|---|
| Типичный карциноид | 8240/3 |
| Атипичный карциноид | 8249/3 |
| Крупноклеточный нейроэндокринный рак | 8013/3 |
| Комбинированный крупноклеточный нейроэндокринный рак | 8013/3 |
| Мелкоклеточный рак | 8041/3 |
| Комбинированный мелкоклеточный рак | 8045/3 |
C48.8 Злокачественное новообразование забрюшинного пространства и брюшины, выходящее за пределы одной и более вышеуказанных локализаций
Классификация ВОЗ, 2017
| Параганглиома | 8693/3 |
|---|
С73 Злокачественное новообразование щитовидной железы
Классификация ВОЗ, 2017
| Медуллярный рак | 8345/3 |
|---|---|
| Смешанный медуллярный и фолликулярный рак | 8346/3 |
С50 Злокачественное новообразование молочной железы
С50.0 Сосок; ареола
С50.1 Центральная часть молочной железы
С50.2 Верхневнутренний квадрант молочной железы
С50.3 Нижне-внутренний квадрант молочной железы
С50.4 Верхненаружный квадрант молочной железы
С50.5 Нижне-наружный квадрант молочной железы
С50.6 Злокачественное новообразование подмышечной задней части молочной железы
С50.8 Злокачественное новообразование молочной железы, выходящее за пределы одной и более из вышеописанных областей
С50.9 Злокачественное новообразование молочной железы неуточненной части
Классификация ВОЗ, 2012
| Рак с нейроэндокринными характеристиками | |||
|---|---|---|---|
| Нейроэндокринная опухоль, высокодифференцированная | 8246/3 | ||
|
Нейроэндокринный рак, низкодифференцированный (мелкоклеточный рак, крупноклеточный нейроэндокринный рак)
|
8041/3
8013/3
|
||
| Рак с нейроэндокринной дифференцировкой | 8574/3 | ||
С44 Другие злокачественные новообразования кожи
С44.0 Другие злокачественные новообразования кожи губы
С44.1 Другие злокачественные новообразования кожи века, включая спайку век
С44.2 Другие злокачественные новообразования кожи уха и наружного слухового прохода
С44.3 Другие злокачественные новообразования кожи других и неуточненных частей лица
С44.4 Другие злокачественные новообразования кожи волосистой части головы и шеи
С44.5 Другие злокачественные новообразования кожи туловища
С44.6 Другие злокачественные новообразования кожи верхней конечности, включая область плечевого пояса
С44.7 Другие злокачественные новообразования кожи нижней конечности, включая тазобедренную область
С44.8 Другие злокачественные новообразования кожи, выходящие за пределы одной и более вышеуказанных локализаций
С44.9 Другие злокачественные новообразования кожи неуточненной области (за исключением кожи полового члена
С60.9 и кожи мошонки С63.2)
С60.9 и кожи мошонки С63.2)
Классификация ВОЗ, 2018
| Рак из клеток Меркеля | 8247/3 |
|---|
С51.0 Злокачественное новообразование большой срамной губы
С51.1 Злокачественное новообразование малой срамной губы
С51.2 Злокачественное новообразование клитора
С51.8 Злокачественное новообразование вульвы, выходящее за пределы одной и более вышеуказанных локализаций
С51.9 Злокачественное новообразование вульвы неуточненной части
Классификация ВОЗ, 2014
| НЭК высокой степени злокачественности | |
|---|---|
| Мелкоклеточный НЭК | 8041/3 |
| Крупноклеточный НЭК | 8013/3 |
| Рак из клеток Меркеля | 8247/3 |
С52 Злокачественное новообразование влагалища
С53.0 Злокачественное новообразование внутренней части шейки матки
С53.1 Злокачественное новообразование наружной части шейки матки
С53.8 Злокачественное новообразование шейки матки, выходящее за пределы одной и более вышеуказанных локализаций
С53.9 Злокачественное новообразование шейки матки неуточненной части
Классификация (ВОЗ, 2014)
| НЭО низкой степени злокачественности | |
|---|---|
| Карциноидная опухоль | 8240/3 |
| Атипичная карциноидная опухоль | 8249/3 |
| НЭК высокой степени злокачественности | |
| Мелкоклеточный НЭК | 8041/3 |
| Крупноклеточный НЭК | 8013/3 |
С54.0 Злокачественное новообразование перешейка матки
С54.1 Злокачественное новообразование эндометрия
С54.2 Злокачественное новообразование миометрия
С54.3 Злокачественное новообразование дна матки
С54.8 Злокачественное новообразование тела матки, выходящее за пределы одной и более вышеуказанных локализаций
С54.9 Злокачественное новообразование тела матки неуточненной локализацииС55 Злокачественное новообразование матки неуточненной локализации
Классификация ВОЗ, 2014
Классификация ВОЗ, 2014
| НЭО низкой степени злокачественности | |
|---|---|
| Карциноидная опухоль | 8240/3 |
| НЭК высокой степени злокачественности | |
| Мелкоклеточный НЭК | 8041/3 |
| Крупноклеточный НЭК | 8013/3 |
С56 Злокачественное новообразование яичника
Классификация ВОЗ, 2014
| Карциноид | 8240/3 |
|---|---|
| Струма-карциноид | 9091/1 |
| Муцинозный карциноид |
8243/3
|
| Прочие опухоли (miscellaneous) | |
| Мелкоклеточная карцинома, легочный тип | 8041/3 |
| Параганглиома | 8693/1 |
С57.0 Злокачественное новообразование фаллопиевой трубы
С57.1 Злокачественное новообразование широкой связки матки
С57.2 Злокачественное новообразование круглой связки матки
С57.3 Злокачественное новообразование параметрия
С57.4 Злокачественное новообразование придатков матки неуточненных
С57.7 Злокачественное новообразование других уточненных женских половых органов
С57.8 Злокачественное новообразование женских половых органов, выходящее за пределы одной и более вышеуказанных локализаций
С57.9 Злокачественное новообразование женских половых органов неуточненной локализации
Классификация ВОЗ, 2014
См. выше.
С61 Злокачественное новообразование предстательной железы
Классификация ВОЗ, 2016
| Высокодифференцированная нейроэндокринная опухоль | 8240/3 | |||
|---|---|---|---|---|
| Мелкоклеточный нейроэндокринный рак | 8041/3 | |||
| Крупноклеточный нейроэндокринный рак | 8013/3 | |||
| Аденокарцинома с нейроэндокринной дифференцировкой | 8574/3 | |||
Классификация ВОЗ, 2016
| Высокодифференцированная нейроэндокринная опухоль | 8013/3 |
|---|---|
| Крупноклеточный нейроэндокринный рак | 8246/3 |
| Мелкоклеточный нейроэндокринный рак | 8041/3 |
| Параганглиома | 8700/0 |
С64 Злокачественное новообразование почки, кроме почечной лоханки
С65 Злокачественное новообразование почечных лоханок
С66 Злокачественное новообразование мочеточника
С67.0 Злокачественное новообразование треугольника мочевого пузыря
С67.1 Злокачественное новообразование купола мочевого пузыря
С67.2 Злокачественное новообразование боковой стенки мочевого пузыря
С67.3 Злокачественное новообразование передней стенки мочевого пузыря
С67.3 Злокачественное новообразование передней стенки мочевого пузыря
С67.4 Злокачественное новообразование задней стенки мочевого пузыря
С67.5 Злокачественное новообразование шейки мочевого пузыря
С67.6 Злокачественное новообразование мочеточникового отверстия
С67.6 Злокачественное новообразование мочеточникового отверстия
С67.7 Злокачественное новообразование первичного мочевого протока (урахуса)
С67.8 Злокачественное новообразование мочевого пузыря, выходящее за пределы одной и более вышеуказанных локализаций
С67.8 Злокачественное новообразование мочевого пузыря, выходящее за пределы одной и более вышеуказанных локализаций
С67.9 Злокачественное новообразование мочевого пузыря неуточненной части
С68.0 Злокачественное новообразование уретры
С68.1 Злокачественное новообразование парауретральных желез
С68.0 Злокачественное новообразование уретры
С68.1 Злокачественное новообразование парауретральных желез
С68.8 Злокачественное новообразование мочевых органов, выходящее за пределы одной и более вышеуказанных локализаций
С68.9 Злокачественное новообразование мочевых органов неуточненное
Классификация ВОЗ, 2016
| Высокодифференцированная нейроэндокринная опухоль | 8240/3 |
|---|---|
| Мелкоклеточный нейроэндокринный рак | 8041/3 |
| Крупноклеточный нейроэндокринный рак | 8013/3 |
| Параганглиома | 8693/1 |
С74.1 Злокачественное новообразование мозгового слоя надпочечника
С74.9 Злокачественное новообразование надпочечника неуточненной части
Классификация ВОЗ, 2017
| Феохромоцитома | 8700/3 |
|---|---|
| Параганглиома | 8693/3 |
С75.0 Злокачественное новообразование паращитовидной [околощитовидной] железы
C75.1 Злокачественное новообразование гипофиза
С75.2 Злокачественное новообразование краниофарингеального протока
С75.3 Злокачественное новообразование шишковидной железы
C75.4 Злокачественное новообразование каротидного гломуса
Классификация ВОЗ, 2017
| Параганглиома | 8692/3 |
|---|
С75.5 Злокачественное новообразование аортального гломуса и других параганглиев Классификация ВОЗ, 2017
| Параганглиома | 8692/3 |
|---|
С75.8 Злокачественное новообразование более чем одной эндокринной железы неуточненное
С75.9 Злокачественное новообразование эндокринной железы неуточненной
С78.0 Вторичное злокачественное новообразование легкого
С78.0 Вторичное злокачественное новообразование легкого
С78.1 Вторичное злокачественное новообразование средостения
С78.2 Вторичное злокачественное новообразование плевры
С78.3 Вторичное злокачественное новообразование других и не уточненных органов дыхания
С78.4 Вторичное злокачественное новообразование тонкого кишечника
С78.5 Вторичное злокачественное новообразование толстого кишечника и прямой кишки
С78.6 Вторичное злокачественное новообразование забрюшинного пространства и брюшины
С78.7 Вторичное злокачественное новообразование печени и внутрипеченочного желчного протока
С78.8 Вторичное злокачественное новообразование других и неуточненных органов пищеварения
C80.0 Злокачественное новообразование без уточнения локализации
C80.9 Злокачественное новообразование неуточненное
С97 Злокачественное новообразование самостоятельных (первичных) множественных локализаций
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
Классификация нейроэндокринных опухолей по эмбриогенезу (Williams и Sandler, 1963)
- НЭО передней кишки (FOREGUT): бронхи, желудок, поджелудочная железа (ПЖ), двенадцатиперстная кишка.
- НЭО средней кишки (MIDGUT): тонкая кишка, слепая кишка, червеобразный отросток, подвздошная кишка.
- НЭО задней кишки (HINDGUT): ободочная кишка, прямая кишка.
Классификация нейроэндокринных опухолей по степени злокачественности
Используемые в настоящее время гистологические классификации НЭО легких, ПЖ и ЖКТ имеют различия в подходах к определению степени злокачественности.
Таблица 1.
Классификация и система градации НЭО легких и тимуса (ВОЗ, 2015)
| Гистологический тип | Некрозы | Количество митозов (× 10 РПЗ) | G |
|---|---|---|---|
| Типичный карциноид | Нет | <2 | G1 |
| Атипичный карциноид | Есть фокальные | 2–10 | G2 |
|
Крупноклеточный нейроэндокринный рак
Комбинированный крупноклеточный нейроэндокринный рак
|
Есть обширные | >10 (в среднем 60) | G3 |
|
Мелкоклеточный рак
Комбинированный мелкоклеточный рак
|
Есть обширные | >10 (в среднем 70) | G3 |
Примечание. РПЗ – репрезентативное поле зрения при большом увеличении (× 40) = 2 мм2, не менее 40 полей, оцененных в областях наибольшей митотической плотности.
Соответственно в группы G1–2 входят высокодифференцированные НЭО: легких и тимуса (типичный и атипичный карциноиды); в группу G3 – низкодифференцированные нейроэндокринные карциномы (NEC): крупноклеточный нейроэндокринный рак и мелкоклеточный рак.
Алгоритм выбора лечения зависит от типа и распространенности опухоли и ориентирован на рекомендациях Европейского общества по лечению НЭО (ENETS) (2015).
Таблица 2.
Классификация и система градации нейроэндокринных неоплазий (NENs) гастроинтестинальных и гепатопанкреатобилиарных органов (ВОЗ, 2019)
| Терминология | Дифференцировка | Степень злокачественности (Grade) | Митозы/2 мм2 | Индекс Ki-67, % |
|---|---|---|---|---|
| НЭО (NET) G1 | Высокодифференцированные | Низкая | <2 | <3 |
| НЭО (NET) G2 | Промежуточная | 2–20 | 3–20 | |
| НЭО (NET) G3 | Высокая | >20 | >20 | |
| НЭК (NEC), мелкоклеточный тип (SCNEC) | Низкодифференцированные | Высокая | >20 | >20 |
| НЭК (NEC), крупноклеточный тип (LCNEC) | >20 | >20 | ||
| MINEN | Высоко- или низкодифференцированные | Различная | Различное число | Различный |
Примечание. Нейроэндокринные неоплазии – термин, объединяющий высокодифференцированные НЭО и низкодифференцированный НЭК. Термин MINEN относится к смешанным опухолям, нейроэндокринный компонент которых составляет не менее 30 %. Индекс пролиферации Ki-67 базируется на оценке ≥500 клеток в областях наиболее высокого ядерного мечения (hot spots), митотический индекс – на оценке митозов в 50 полях зрения при большом увеличении (репрезентативное поле зрения 0,2 мм2) в областях наибольшей плотности и выражается как митотический индекс в 10 РПЗ (2 мм2). Grade определяется на основании наивысшего показателя. Для оценки индекса Ki-67 рекомендуется подсчет с использованием распечатанного изображения.
Классификация нейроэндокринных опухолей по функциональной активности:
- функционирующие;
- нефункционирующие.
Классификация нейроэндокринных опухолей по локализации первичной опухоли
В случае продуцирования специфических гормонов НЭО ПЖ подразделяются на:
- гастриному – гастрин, синдром Золлингера–Эллисона;
- инсулиному – инсулин, гипогликемия;
- ВИПому – вазоинтестинальный пептид, диарея, гипокалиемия, ахлоргидрия;
- соматостатиному – соматостатин, диабет, стеаторея, желчнокаменная болезнь;
- глюкагоному – некротическая сыпь, диабет, кахексия;
- кальцитониному – кальцитонин;
- АКТГома – АКТГ-продукция, синдром Кушинга.
Имеются и другие очень редкие гормонпродуцирующие опухоли.
Множественная эндокринная неоплазия 1-го типа (МЭН-1, Синдром Вермера):
- гиперпаратиреоз;
- гастринома;
- люкагонома, инсулинома;
- ВИПома, полипептидома ПЖ, соматостатинома, нефункционирующие опухоли;
- опухоли гипофиза;
- пролактинома;
- синдрома Кушинга;
- акромегалия;
- аденома, продуцирующая тиреотропный гормон;
- нефункционирующая аденома;
- опухоль надпочечника;
- карциноид бронхов и тимуса.
Синдром Вермера – семейно-детерминированное заболевание (с частотой наследственной передачи 50 %), при котором имеется генетический дефект, расположенный в области длинного плеча хромосомы 11(11q13). Мутация в области гена на 11q13 приводит к нерегулируемой пролиферации нейроэндокринных клеток с поражением обязательной триады органов: это синхронное или асинхронное развитие гиперплазий и/или опухолей нескольких или всех 4 паращитовидных желез, эндокринных опухолей ПЖ и передней доли гипофиза. Реже одновременно возникают НЭО двенадцатиперстной кишки, желудка, еще реже – тимуса, легкого, щитовидной железы, надпочечников. Клинические проявления синдрома МЭН-1 очень вариабельны, но к 40 годам практически у всех пациентов обязательно развиваются симптомы гиперпаратиреоза, и клиническая манифестация заболевания приходится обычно на III–IV декаду.
Множественная эндокринная неоплазия 2-го типа (МЭН-2, синдром Сиппла):
- медуллярный рак щитовидной железы (МРЩЖ);
- феохромоцитома (ФХЦ);
- гиперпаратиреоз;
- марфаноподобный синдром;
- слизистые невриномы;
- нейропатии;
- амилоидоз Lichen planus.
Синдром Сиппла – аутосомно-доминантно-наследуемое сочетание МРЩЖ, ФХЦ и опухолей паращитовидных желез. В 1974 г. Сайзмор и соавт. показали, что МЭН-2 объединяет 2 группы пациентов с ФХЦ и МРЩЖ: МЭН-2а – с аденомой паращитовидных желез, МЭН-2b – без поражения паращитовидных желез, но с наличием нейрином слизистых оболочек и мезодермальными аномалиями. Генетической основой МЭН-2 является точечная мутация в RET-протоонкогене. У 95 % пациентов обнаруживают точечную мутацию протоонкогена с-ret (10q11), кодирующего рецептор нейротропного фактора, регулирующего пролиферацию и дифференцировку клеток, производных нервного гребня.
Классификация нейроэндокринных опухолей по TNM
Для НЭО ЖКТ и ПЖ существуют 2 системы стадирования TNM, разработанные ENETS и AJCC/UICC. Опухоли должны быть стадированы в соответствии с классификацией TNM органа, в котором возникли.
НЭО легких стадируются по TNM как немелкоклеточный рак легкого.
Для НЭО средостения используется классификация, рекомендованная для опухолей средостения.
Утверждены отдельные классификации TNM для НЭО следующих локализаций (NCCN Guidelines in Oncology, 2010):
- желудок;
- двенадцатиперстная кишка, фатеров сосочек, тощая и подвздошная кишка;
- ПЖ;
- червеобразный отросток;
- ободочная и прямая кишка.
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
У некоторых пациентов с НЭО заболевание связано с наличием синдромов множественных нейроэндокринных неоплазий (МЭН-1, МЭН-2а и МЭН-2b), это наследственные синдромы.
У оставшихся пациентов возникновение нейроэндокринных опухолей имеет спорадический характер. Имеется значительный рост заболеваемости НЭО во всем мире, возможно, связанный с улучшением диагностики
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
По данным реестра SEER (Surveillance, Epidemiology, and End Results), в США заболеваемость НЭО на 1 января 2004 г. составила 5,25 случая на 100 тыс. населения. Отмечается значительное увеличение заболеваемости НЭО всех локализаций за последние 30 лет. Таким образом, с учетом численности населения США в нашей стране ежегодно должно регистрироваться 7350 пациентов с НЭО (население России в 2012 г. составляло 140 млн человек). По последним данным заболеваемость нейроэндокринными новообразованиями в России выросла с 0,03 случаев на 100 тыс. населения в 2001г. до 5,19 на 100 тыс. населения в 2019г. Заболеваемость в США выросла с 5,25 на 100 тыс. населения в 2004г. до 8,4 на 100 тыс. населения в 2016г (107).
Наиболее частая локализация (66 %) НЭО – желудочно-кишечный тракт (ЖКТ); преобладающее место расположения – слепая кишка (17,1 %), прямая кишка (16,3 %). Около 30 % НЭО встречаются в бронхопульмональной системе.
НЭО часто диагностируют на распространенной стадии. Так, по данным SEER, 50 % пациентов на момент установления диагноза уже имеют локорегиональные или отдаленные метастазы [1].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клиническая картина НЭО разнообразна и зависит от локализации и функциональной активности опухоли.
Клинические проявления связаны в основном с локализацией опухоли, а также при функционирующих опухолях с синдромами, вызванными продукцией биологически активных веществ. В связи с разнообразием возникающих синдромов болезнь может длительно маскироваться под другие заболевания, что очень затрудняет постановку правильного диагноза. Нефункционирующие опухоли могут протекать длительно бессимптомно и часто бывают случайной находкой при обследовании по другим причинам. Клинические симптомы при нефункционирующих НЭО неспецифичны. Они могут быть обусловлены локальным распространением опухоли или метастатическим процессом.
К классическим симптомам относятся диарея, приливы, гиперемия кожных покровов, в редких случаях бронхоспазм. Гораздо реже могут быть кишечные колики, телеангиэктазии, отеки, цианоз, поражения суставов, миалгии, миопатии. В той или иной степени, могут возникать также потливость, отек кожи, крапивница, зуд, сухость кожи и слизистых оболочек, слезотечение, головная боль, мигрени, парестезии, плаксивость, депрессии, бессонница, повышенная возбудимость, «страх смерти». Диарея является наиболее частым симптомом и при отсутствии лечения становится постоянной, сопровождается приступами болей в животе, иногда тошнотой или рвотой. Тяжесть диареи варьирует от нескольких до 30 раз и более в сутки. Хроническая потеря жидкости проявляется симптомами дегидратации и ухудшением общего состояния, что имеет значимое влияние на качество жизни пациентов, а иногда приводит к полному истощению и инвалидизации пациентов. Приливы также являются одним из основных симптомов функционирующих НЭО. Типичный прилив – эритематозный тип, при классическом карциноидном синдроме имеет внезапное начало и проявляется розовым либо красным окрашиванием кожи лица, шеи и верхней части туловища, со временем у части пациентов на лице формируется и сохраняется постоянный цианотический оттенок, а во время приступа нос приобретает пурпурно-красный цвет. Частота возникновения приливов варьирует от нескольких раз в сутки до 1–3 и более приступов в час.
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Принципы оказания медицинской помощи пациентам с карциномой Меркеля, мелкоклеточным раком легкого, медуллярным раком щитовидной железы изложены в соответствующих клинических рекомендациях.
Критерии установления диагноза:
- данные анамнеза;
- данные лабораторных и инструментальных исследований;
- результаты патолого-анатомического исследования биопсийного (операционного) материала.
1. Жалобы и анамнез
- Рекомендуется всем пациентам при подозрении на НЭО тщательный сбор жалоб и анамнеза с целью выявления факторов, которые могут повлиять на выбор тактики лечения [3, 48, 53-56].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
2. Физикальное обследование
- Рекомендуется провести при подозрении на НЭО тщательный физикальный осмотр, включающий осмотр всех кожных покровов пациента, а также периферических ЛУ с целью выявления факторов, которые могут повлиять на выбор тактики лечения [3, 48, 53-56].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
3. Лабораторные диагностические исследования
- Рекомендуется всем пациентам с НЭО выполнить общий (клинический) анализ крови развернутый, общий (клинический) анализ мочи, коагулограмму (ориентировочное исследование системы гемостаза), а также анализ крови биохимический общетерапевтический с целью выявления факторов, которые могут повлиять на выбор тактики лечения [3,48, 53-56].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- Рекомендовано исследование уровня метилированных катехоламинов в крови или исследование уровня катехоламинов в моче (метанефрин, норметанефрин) в случае подозрения на ФХЦ, параганглиому (ПГ) как специфических маркеров данных заболеваний [35, 53, 64].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарии: ФХЦ следует заподозрить в следующих случаях [32]:
-
симптомы ФХЦ/ПГ пароксизмального типа (артериальная гипертония (АГ), тахикардия, головная боль, профузная потливость
); - инциденталома надпочечника при нативной плотности по данным КТ более 10 ед Н. (независимо от наличия АГ);
- симптомы ФХЦ/ПГ, спровоцированные медикаментозно (антагонисты допамина, опиоиды, ингибиторы моноаминоксидазы, ингибиторы обратного захвата норадреналина и серотонина, кортикостероиды и т.д.) или повышением давления в брюшной полости (пальпация, мочеиспускание, дефекация);
- отягощенный семейный анамнез по ФХЦ/ПГ;
- наличие ФХЦ/ПГ в анамнезе у пациента;
- наличие любых компонентов наследственных синдромов, ассоциированных с ФХЦ/ПГ.
- Рекомендуется при первичном обследовании пациентов с подозрением на НЭО для подтверждения заболевания, определения распространенности, биологической активности опухоли и выявления специфических осложнений определение биохимических маркеров (универсальных (общих) маркеров и ассоциированных с гиперфункциональными синдромами специфических маркеров) [42, 48, 54-56, 69].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств- 5)
Комментарии: основой неинвазивной лабораторной диагностики НЭО являются биохимические маркеры, представляющие собой биологически активные вещества, такие как гормоны, вазоактивные пептиды, амины.
Универсальные маркеры:
- ХгА в сыворотке крови – при всех типах НЭО (определение хромогранина A в крови);
- панкреатический полипептид (ПП) в плазме крови – при НЭО ПЖ;
- нейронспецифическая енолаза (НСЕ) в сыворотке крови – при НЭО легких и тимуса (исследование уровня нейронспецифической енолазы в крови).
- Гастрин сыворотки крови (исследование уровня гастрина сыворотки крови) – при высокодифференцированных НЭО желудка.
Специфические маркеры:
- серотонин в сыворотке крови и 5-гидроксииндолуксусная кислота (5-ГИУК) в суточной моче – для диагностики карциноидного синдрома (исследование уровня серотонина, его предшественников и метаболитов в крови и исследование уровня 5-гидроксииндолуксусной кислоты (5-ОИУК) в моче);
- гастрин в сыворотке крови – для диагностики синдрома Золлингера–Эллисона (гастринома) (исследование уровня гастрина сыворотки крови);
- инсулин, С-пептид в сыворотке крови, глюкоза – для диагностики инсулиномы (исследование уровня инсулина плазмы крови, исследование уровня C-пептида в крови, исследование уровня глюкозы в крови); исследование информативно только в случае регистрации гипогликемии (спонтанной или в ходе пробы с 72-часовым голоданием);
- глюкагон в плазме крови (с апротинином) – для диагностики глюкагономы (исследование уровня глюкагона в крови);
- вазоинтестинальный пептид (ВИП) в плазме крови (с апротинином) – для диагностики ВИПомы (синдрома Вернера–Моррисона);
- соматостатин в плазме крови (с апротинином) – для диагностики соматостатиномы (исследование уровня соматостатина в крови);
- гистамин в плазме крови – для диагностики карциноидного синдрома при НЭО легких и желудка (исследование уровня гистамина в крови);
- паратиреоидный гормон (ПТГ) в сыворотке крови – для диагностики гиперпаратиреоза при МЭН-1 (исследование уровня паратиреоидного гормона в крови);
- адренокортикотропный гормон (АКТГ) в плазме крови, кортизол в суточной моче и сыворотке крови в условиях с 1 мг дексаметазона в слюне в 23 часа – для диагностики паранеопластического АКТГ-эктопического синдрома (Исследование уровня адренокортикотропного гормона в крови, исследование уровня свободного кортизола в моче; исследование уровня свободного кортизола в слюне)
- N-концевой мозговой натрийуретический пропептид (pro-BNP) в сыворотке крови – для выявления карциноидного кардиофиброза (карциноидной болезни сердца) (исследования уровня N-терминального фрагмента натрийуретического пропептида мозгового (NT-proBNP) в крови).
Рекомендации по использованию биохимических маркеров в комплексной диагностике НЭО представлены в приложении Б (табл. 15).
В соответствии со стандартами диагноз функционирующей опухоли требует обязательного подтверждения гиперфункционального синдрома на основе исследования панели биохимических маркеров НЭО. В табл. 3 представлены обобщенные рекомендации по использованию биохимических маркеров с учетом имеющихся клинических признаков, синдромов и типа НЭО.
Таблица 3.
Биохимические маркеры при различных клинических проявлениях НЭО
Биохимические маркеры при различных клинических проявлениях НЭО
| Тип опухоли (синдром) | Основные клинические признаки соответствующего синдрома | Биомаркеры |
|---|---|---|
| Карциноидный синдром | Сосудистые реакции, диарея, бронхиальная обструкция, гипертонические кризы | ХгА, серотонин, 5-ГИУК, гистамин, NT-proBNP |
| Инсулинома | Частые приступы гипогликемии натощак и в утренние часы, купируемые приемом сахара или введением глюкозы | Инсулин, С-пептид, кортизол, глюкоза в условиях суточного голодания, проинсулин: в условиях 72-часового голодания или на фоне спонтанной гипогликемии, ХгА, глюкагон, ПП в плазме крови, |
| Гастринома (синдром Золлингера–Эллисона) | Язвенная болезнь агрессивного течения (характерны высокая кислотность желудочного сока, множественность и низкое расположение язв), диарея, стеаторея | ХгА, базальный и стимулированный уровень гастрина, инсулин, глюкагон, ПП в плазме крови, базальная и стимулированная кислотность желудочного сока |
| ВИПома (синдром Вернера–Моррисона) | Интермиттирующая или постоянная водная диарея с большим объемом каловых масс, гипокалиемия, гипоахлоргидрия, снижение массы тела | ХгА, ВИП, глюкагон, соматостатин, ПП в плазме крови, кислотность желудочного сока, объем стула, электролиты сыворотки кpови и cтyлa |
| Глюкагонома | Некролитическая мигрирующая эритема, сахарный диабет или нарушение толерантности к глюкозе, поражения слизистых оболочек, снижение массы тела, анемия | ХгА, глюкагон, ПП, инсулин в плазме крови, аминоацидемия, гематологический анализ |
| Соматостатинома | Холелитиаз, сахарный диабет или нарушение толерантности к глюкозе, диспепсия, ахлоргидрия, анемия, диарея/стеаторея | ХгА, соматостатин, ПП в плазме крови, кислотность желудочного сока, гематологический анализ |
| ФХЦ | Постоянная или пароксизмальная артериальная гипертензия, аритмия, диспепсия, сахарный диабет, одышка | ХгА, фракционированные метанефрин, норметанефрин в суточной моче или свободные метанефрин, норметанефрин крови |
- Рекомендуется пациентам с установленным диагнозом НЭО для наблюдения за течением опухолевого процесса и эффективности лечения анализ биохимических маркеров в зависимости от функциональной активности опухоли – см. таблицу 16 Приложения Б [42].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарии: Определение биохимических маркеров, базальные уровни которых были повышены, следует проводить каждые 3 мес, а также в случае усиления специфической симптоматики, появления новых симптомов или при клиническом подозрении на прогрессирование заболевания (рис. 1).
При высокодифференцированных НЭО желудка уровень гастрина исследуется однократно на этапе установки диагноза вне ингибиторов протонной помпы (A02BC ингибиторы протонного насоса) или H2 блокаторов (A02BA Блокаторы H2-гистаминовых рецепторов) с целью определения типа НЭО по классификации Ринди (1, 2 или 3 тип). При НЭО желудка 1 типа уровень хромогранина А остается повышенным на всех этапах лечения вследствие хронического атрофического гастрита и не является критерием рецидива НЭО [210, 211].
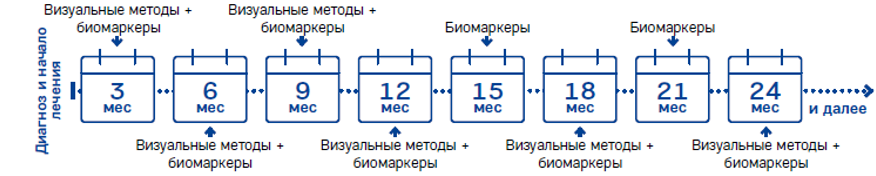
Рис. 1. Биохимический мониторинг у пациентов с НЭО (ENETS, 2017)
В ряде случаев маркеры НЭО могут быть ранним признаком рецидива или прогрессирования, выявляя патологические изменения за несколько месяцев до появления рентгенологических и клинических признаков.
Детальные рекомендации по серийному определению биохимических маркеров наряду с инструментальными методами обследования для наблюдения за течением опухолевого процесса и оценки эффективности лечения представлены в приложении Б (табл. 16). В целом, сроки наблюдения зависят от локализации, типа и статуса опухоли. Сокращение интервала между обследованиями рекомендовано при высокой степени злокачественности опухоли, большом размере опухоли, распространенности процесса (поражение печени более 30 %, метастазы в легких и костях), агрессивном течении с прогрессированием в ближайшие нескольких месяцев, тяжелых неконтролируемых эндокринных симптомах, потере массы тела, а также при уровнях ХгА, превышающих верхнюю границу нормы более чем в 10 раз.
- Рекомендуется пациентам с карциноидным синдромом и повышенными уровнями серотонина и 5-ГИУК исследования уровня N-терминального фрагмента натрийуретического пропептида мозгового (NT-proBNP) в крови как раннего маркера кардиофиброза, которое должно проводиться ежегодно в целях своевременного выявления карциноидной болезни сердца [42, 53].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарии: уровень NT-proBNP выше порогового является основанием для назначения эхокардиографического исследования.
4. Инструментальные диагностические исследования
Перечень исследований определяется локализацией опухоли. Исследования выполняются для оценки первичного очага и уточнения распространенности процесса. План лечения не следует составлять до получения данных о распространенности опухолевого процесса.
Необходимо отметить, что основной особенностью НЭО является гиперэкспрессия рецепторов соматостатина на поверхности клеток, что позволяет использовать для их визуализации методы радионуклидной диагностики, основанные на применении рецептор-специфических радиофармацевтических препаратов (РФЛП). Также возможна специфическая и метаболическая визуализация этих новообразований
- Рекомендуется всем пациентам с НЭО выполнить биопсию опухоли или метастатического очага. Для пациентов с инсулиномой – только в сложных диагностических случаях. [42, 54-56].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
- Рекомендуется всем пациентам с НЭО выполнить компьютерную томографию (КТ) органов грудной полости с внутривенным (в/в) болюсным контрастированием для оценки распространенности процесса, при наличии противопоказаний к КТ - рентгенографию органов грудной клетки [42,50, 54-56, 62, 69].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
- Рекомендуется всем пациентам с НЭО выполнить КТ или магнитно-резонансную томографию (МРТ) органов брюшной полости с в/в контрастированием для оценки распространенности процесса. [42,50, 54-56, 62, 69].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется всем пациентам с НЭО выполнить КТ или МРТ органов малого таза с в/в контрастированием для оценки структурных изменений [42,50, 69].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется пациентам с ФХЦ проведение КТ органов грудной полости, брюшной полости и малого таза с в/в болюсным контрастированием, обладающей лучшим пространственным разрешением и цифровой информацией о плотности опухоли на всех фазах исследования, в целях оценки распространенности заболевания [35,54].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
- Рекомендуется МРТ головы и шеи пациентам при ПГ головы и шеи с контрастом, в целях оценки распространенности заболевания [35,54].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств.
- Рекомендуется всем пациентам с НЭО выполнить КТ или МРТ головного мозга с в/в контрастированием при наличии клинических симптомов его поражения для исключения опухолевого поражения головного мозга. [42,50]
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется всем пациентам с НЭО выполнить сцинтиграфию костей всего тела / ОФЭКТ/КТ скелета при подозрении на метастатическое поражение костей скелета [42, 54-56].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется для оценки структурных изменений и оценки распространенности опухолевого процесса пациентам с НЭО выполнить эндоскопическое исследование в зависимости от предполагаемой области поражения :
- эзофагогастродуоденоскопия (*желудок, двенадцатиперстная кишка);
- колоноскопия (прямая и ободочная кишка);
- эндосонография – для желудка и двенадцатиперстной кишки;
- энтероскопия (интестиноскопия);
- тонкокишечная эндоскопия видеокапсульная;
- фибробронхоскопия (бронхоскопия) [42, 54-56, 200].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется всем пациентам с МЭН выполнить УЗИ шейно-надключичных областей, щитовидной и паращитовидных желез для оценки распространенности процесса. [42, 50, 54-56, 62]
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
- Рекомендуется проведение АСЗК (артериально-стимулированный забор крови) всем пациентам с топически нелокализованными гормонально-активными опухолями поджелудочной железы, а также при множественных новообразованиях в рамках синдрома МЭН [204, 205].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2).
Радионуклидная диагностика нейроэндокринных опухолей
- Рекомендуется всем пациентам с НЭО при подозрении на наличие отдаленных метастазов или при подтвержденном метастатическом или местнораспространенном процессе выполнить ПЭТ-КТ с РФЛП (A07.30.043.01 Позитронная эмиссионная томография совмещенная с компьютерной томографией с туморотропными РФП с контрастированием) на основе соматостатина и его аналогов: 68 gallium [68Ga] DOTA-(Tyr3)- octreotate (68Ga-DOTATATE) или 68Ga DOTA- (Phe1)-(Tyr3)- octreotide (68Ga-DOTATOC) или 68Ga - DOTA-(Nal3)-octreotide (68Ga-DOTANOC) для оценки рецепторного статуса и уточнения распространенности процесса, оценки возможности проведения пептид рецепторной радионуклидной терапии (ПРРТ). [100, 104].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется пациентам с НЭО при подозрении на наличие отдаленных метастазов или при подтвержденном метастатическом или местнораспространенном процессе в случае невозможности выполнения ПЭТ/КТ c РФЛП (A07.30.043.01 Позитронная эмиссионная томография совмещенная с компьютерной томографией с туморотропными РФП с контрастированием) на основе соматостатина и его аналогов (H01CB Соматостатин и его аналоги) проведение однофотонной эмиссионной компьютерной томографии с туморотропным РФП HYNIC-D-(Phe1)-(Tyr3)-octreotide [99mTc] для стадирования заболевания, оценки распространенности опухолевого процесса и оценки возможности проведения пептид рецепторной радионуклидной терапии (ПРРТ). [45,46,47].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: поскольку клетки нейроэндокринных опухолей характеризуются гиперэкспрессией рецепторов соматостатина, оправдано применение РФЛП (V09IX: Радиофармацевтические препараты для диагностики новообразований прочие на основе синтетических аналогов соматостатина (H01CB Соматостатин и его аналоги) в целях диагностики этих новообразований, что позволяет выбрать оптимальную тактику лечения, а также помогает принять решение о целесообразности биотерапии аналогами соматостатина (H01CB Соматостатин и его аналоги) или радионуклидной терапии, при условии высокого уровня их экспрессии и/или функциональной активности. [99, 100-101.]
- Рекомендуется ПЭТ-КТ с флудезоксиглюкозой [18F] (18F-ФДГ) в случае низкодефференцированных НЭН (НЭО G3, НЭК) или недоступности более специфических радиофармпепаратов (V09IX: Радиофармацевтические препараты для диагностики новообразований прочие) [45]
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: 18F-ФДГ является препаратом для неспецифической метаболической визуализации. 18F-ФДГ неэффективна при высокодифференцированных НЭО, однако успешно используется для диагностики распространенной нейробластомы и ФХЦ, злокачественной ПГ (особенно с SDHB-мутацией в гене), низкодифференцированных НЭО G3 и НЭК.
- Рекомендуется выполнение ПЭТ-КТ с 18F-ФДГ при подозрении на метастатическое поражение ФХЦ/ПГ, которая обладает большей чувствительностью по сравнению со сцинтиграфией с Йобенгуаном [123I] [35, 96].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется выполнение ПЭТ с 18F-ФДГ или ПЭТ с 68Ga-DOTA-TATE при опухолях больших размеров, высоком уровне 3-метокситирамина, наличии мутации SDHB для предоперационного стадирования при ФХЦ/ПГ [35, 36, 96].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5) - ПЭТ с 18F-ФДГ.
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2) - ПЭТ с 68Ga-DOTA-TATE.
- Рекомендуется ПЭТ-КТ с 18F-фтор-L-3,4-дигидроксифенилаланин [18F-L-DOPA] для диагностики МРЩЖ, НЭО, ПГ и ФХЦ. [97,98].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5)
Комментарий:18F-L-DOPA является препаратом для визуализации дофаминергической системы. Этот РФЛП (V09IX: Радиофармацевтические препараты для диагностики новообразований прочие) менее эффективен для диагностики метастатической ПГ с SDHB-мутацией.
- Рекомендуется рассмотреть проведение сцинтиграфии с йобенгуаном [123I] при неоперабельной или метастатической ФХЦ/ПГ, за исключением ПГ головы и шеи для оценки перспективы терапевтического использования [131I]-йобенгуана [35, 96].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
- Рекомендуется рассмотреть проведение пациентам с нейробластомой, ФХЦ/ПГ, карциноидом легких/средостения и НЭО тонкой кишки, МЭН – синдромом (МЭН-2а, МЭН-2) сцинтиграфию с йобенгуаном [123I] для оценки возможности терапевтического использования йобенгуана [131I] [36,46, 96, 201].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: препараты являются аналогами норэпинефрина** и включаются в адренергические ткани и опухоли, происходящие из них. Поэтому показания к их применению – диагностика нейробластомы, феохромоцитомы, параганглиомы, карциноидов бронха и тонкой кишки, МЭН – синдрома (МЭН-2а, МЭН-2) и планирование лечения нейробластом, феохромоцитом и параганглиом с Йобенгуан [123I] [36,46, 96].
5. Иные диагностические исследования
- Рекомендуется с целью установления морфологического диагноза НЭО проведение патолого-анатомического исследования биопсийного (операционного) материала во всех случаях [3, 48,49].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: стандартом диагностики является выполнение патологоанатомического исследования биопсийного (операционного) материала, включающего: анализ срезов ткани опухоли, окрашенных гематоксилином и эозином, иммуногистохимические методы (ИГХ анализ срезов ткани опухоли, окрашенных специфическими антителами) и анализ цитологического материала.
Патологоанатомические исследование с применением ИГХ методов.
Морфологический диагноз НЭО определяют на основе системы гистологических критериев, включенных в классификацию опухолей ВОЗ, с учетом конкретной локализации поражения. Патологоанатомические исследования проводятся по стандартным морфологическим параметрам, таким как дифференцировка, структура опухоли, характер роста, клеточные и ядерные характеристики, наличие сосудистой и периневральной инвазии, некрозов и выраженность митотической активности клеток опухоли и обязательно включает иммуногистохимическое исследование. Для хирургических образцов обязательно указание размера первичного очага и его распространенности на прилежащие ткани, наличия пораженных ЛУ.
Диагностические признаки нейроэндокринной дифференцировки в опухоли включают органоидную модель роста, мелкогранулярный хроматин (зернистая структура по типу «соль и перец» - «salt and pepper») и экспрессию нескольких ключевых нейроэндокринных маркеров, выявляемую при ИГХ-исследовании.
Верификация эпителиальной и нейроэндокринной дифференцировки новообразования проводится путем окраски срезов опухоли с помощью антител к панцитокератину АЕ1/3, цитокератину 18, цитокератину 20 (для рака из клеток Меркеля), синаптофизину и хромогранину А (ХгА). В случае отсутствия экспрессии одного из маркеров нейроэндокринной дифференцировки для дополнительной окраски используют антитела к CD56. В сложных диагностических случаях при исследовании метастазов без выявленного первичного очага используются транскрипционные факторы кишечной, легочной и панкреатической дифференцировки (CDX-2, TTF-1, PDX-1).
По современным представлениям, ФХЦ, как и любая НЭО, имеет метастатический потенциал. Существовавшие ранее категории доброкачественной и злокачественной ФХЦ пересмотрены в пользу подходов, опирающихся на стратификацию риска (классификация опухолей ВОЗ, 2017). Злокачественный потенциал ФХЦ/ПГ должен быть оценен с применением существующих на данный момент систем балльной оценки (PASS или GAPP) и выполнением ИГХ-исследования.
При опухоли (-ях) надпочечника, за исключением банальных светлоклеточных аденом коры надпочечника, показано выполнение ИГХ-исследования. Целью исследования являются дифференциальный диагноз тканевой принадлежности опухоли и определение пролиферативной активности [40].
- С целью определения уровня пролиферативной активности клеток опухоли и/или метастаза с учетом индекса Ki-67, оценки агрессивности процесса и лекарственной чувствительности новообразования рекомендуется у всех пациентов определение индекса пролиферативной активности экспрессии Ki-67 иммуногистохимическим методом [3, 48,49].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарии: данный показатель важно определять не только в первичной опухоли, но и в процессе опухолевой прогрессии при повторных биопсиях.
- При феохромоцитоме и параганглиоме с уровнем ki67>10% рекомендуется пересмотр препаратов в референсном центре [130].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарии: данный показатель важно определять не только в первичной опухоли, но и в процессе опухолевой прогрессии при повторных биопсиях метастазов в печени.
- Рекомендуется всем пациентам с НЭО в качестве дополнительного исследования возможной чувствительности НЭО к аналогам соматостатина (H01CB Соматостатин и его аналоги) определение экспрессии рецепторов SSTR2 с применением моноклональных антител к SSTR2A иммуногистохимическим методом (A08.30.026) и определение экспрессии рецепторов SSTR5 с применением моноклональных антител [3,48,49].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Всем пациентам с ФХЦ/ПГ при подозрении на наличие МЭН-синдрома, синдрома Хиппеля-Линдау, синдрома наследственных параганглиом 4 типа или других синдромов рекомендована консультация врача-генетика с рассмотрением вопроса о проведении генетического обследования. [37, 63].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: генетический поиск может основываться на конкретных фенотипических признаках заболевания и данных семейного анамнеза, однако при их отсутствии предпочтительно использовать комплексную генетическую панель генов (в настоящий момент – наборы из 14–18 генов-кандидатов). Необходимо разъяснять пациентам смысл и результат генетического тестирования до и после его проведения, важность обследования всех прямых родственников.
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Принципы оказания медицинской помощи пациентам с карциномой Меркеля, мелкоклеточным раком легкого, медуллярным раком щитовидной железы изложены в соответствующих клинических рекомендациях.
1. Хирургическое лечение (локализованные, резектабельные местно-распространенные и резектабельные метастатические нейроэндокринные опухоли)
- Рекомендуется рассматривать хирургическое вмешательство как основной метод радикального лечения пациентов с НЭО, вид оперативного вмешательства определяется характером возникновения, размером и локализацией опухоли, функциональным статусом опухоли, наличием метастазов и осложнений опухолевого процесса (см. комментарии) [42, 54-56, 69].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: хирургические вмешательства при НЭО выполняются с соблюдением основных онкологических принципов (радикализм, абластика, лимфодиссекция).
Варианты хирургических вмешательств:
- эндоскопическая резекция слизистой при небольших полиповидных НЭО желудка, двенадцатиперстной кишки, ободочной и прямой кишки;
- удаление первичной опухоли + регионарная лимфодиссекция (типовые операции);
- комбинированные и сочетанные операции (неклассифицируемые) при резектабельных местно-распространенных НЭО;
Особенности хирургического лечение высокодифференцированных НЭО ЖКТ отдельных локализаций [211-215]:
- НЭО желудка 1-2 типа – эндоскопическая резекция слизистой при опухолях G1-G2 размерами> 10 мм, в том числе при множественных и рецидивных НЭО; при опухолях > 20 мм, инвазии в мышечный слой, метастазах в лимфатических - резекция желудка или гастрэктомия;
- НЭО желудка 3 типа – эндоскопическая резекция слизистой при опухолях G1 размерами ≤10 мм. Резекция желудка или гастрэктомия во всех остальных случаях: G1> 10мм, G2-G3, инвазия в мышечный слой, метастазы в лимфатических узла;
- Дуоденальные НЭО – эндоскопическая резекция слизистой при нефункционирущих НЭО G1 размерами ≤10 мм. Резекция двенадцатиперстной кишки или панкреодуоденальная резекция во всех остальных случаях: размеры более 10 мм, функционирующие НЭО, G2-G3, инвазия в мышечный слой;
- Нефункционирующие НЭО ПЖ – при НЭО G1-G2 размерами ≤10 мм без расширения главного панкреатического протока подлежат активному динамическому наблюдению При НЭО G1 размерами >10 мм и ≤20 мм без расширения главного панкреатического протока возможно активное динамическое наблюдение либо энуклеация. При НЭО >20 мм, расширении главного панкретического протока – хирургическое лечение в различных вариантах с лимфодиссекцией;
- НЭО тонкой кишки G1-G2 – правосторонняя гемиколэктомия (локализация в пределах 20 см от Баугиниевой заслонки) или резекция тонкой кишки (локализация проксимальнее 20 см от Баугиниевой заслонки). Метастатические НЭО тонкой кишки G1-2 – удаление первичной опухоли (у всех больных) и резектабельных отдаленных метастазов;
- НЭО червеобразного отроста G1/G2 ≤ 10 мм – аппендэктомия; при НЭО аппендикса G1-2 при размере опухоли >10 мм, но ≤20 мм при наличии дополнительных факторов риска (инвазия в брыжейку >3 мм, R1, нлимфоваскулярная инвазия) и ожидаемой продолжительностью жизни >15 лет, а также при НЭО червеобразного отростка > 20 мм или G3 – правосторонняя гемиколэктомия;
- НЭО ободочной кишки G1 ≤ 10 мм – эндоскопическая резекция. Во всех остальных случаях – хирургическое лечение (резекция соответствующего отдела кишки или гемиколэктомия);
- НЭО прямой кишки G1-G3 ≤ 10 мм, НЭО прямой кишки G1-G2 >10 мм, но ≤ 20 мм –– эндоскопическпая резекция слизистой или трансанальное удаление. Хирургическое лечение (резекция или экстирпация прямой кишки) во всех остальных случаях: G3> 10 мм, G1-G2> 20 мм, инвазия в мышечный слой, метастазы в лимфатических узлах, R1 после эндоскопической резекции или трансанального удаления;
Особенности хирургического лечения высокодифференцированных метастатических НЭО:
- одномоментное или последовательное удаление первичной опухоли и резектабельных отдаленных метастазов
- удаление или деструкция отдаленных метастазов; циторедуктивные операции при функционирующих/гормонпродуцирующих опухолях;
- при нефункционирующих НЭО, когда возможно достигнуть удаление более 90% опухолевой ткани; при изолированном поражении печени метастазами НЭО - резекция печени различного объема (атипичные, сегментарные, гемигепатэктомия, расширенная гемигепатэктомия), в том числе. лапароскопическим доступом;
- у ограниченного числа молодых сохранных пациентов при НЭО высокой степени дифференцировки с изолированным билобарным поражении печени и невозможности проведения других методов локального воздействия может быть рассмотрена пересадка печени по решению мультидисциплинарного консилиума (в соответствии с Миланскими критериями).
2. Адъювантная терапия НЭН
- Рутинное применение послеоперационной терапии при НЭО G1–2 не рекомендуется [53].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2).
- Рекомендовано проведение 4-6 курсов адъювантной химиотерапии по схеме EP/EC после хирургического лечения по поводу I-III стадии нейроэндокринных карцином или НЭО G3 ki67>55% [177-180].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
Комментарий: проведение 4 курсов адъювантной химиотерапии достоверно улучшает безрецидивную и общую выживаемость при НЭК внелегочной локализации.
- Рекомендовано рассмотреть проведение 4-6 курсов адъювантной химиотерапии по решению врачебной комиссии при НЭО ЖКТ G3 [181, 182, 202].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: проведение 4 курсов адъювантной химиотерапии достоверно улучшает безрецидивную выживаемость при НЭН поджелудочной железы [181]. Большинство ретроспективных работ не продемонстрировали эффективность данного подхода, что связано с несбалансированными характеристиками групп, в связи с чем решение о назначении адъювантной химиотерапии в этой подгруппе пациентов должно приниматься в индивидуальном порядке по решению консилиума, предпочтительные режимы – TemCap, XELOX или FOLFOX, поскольку они наиболее эффективны при метастатических НЭО [182].
3. Лекарственная терапия пациентов с неоперабельными и метастатическими НЭО всех локализаций
1. Высокодифференцированные нейроэндокринные опухоли G1, G2
- Рекомендуется пациентам с неоперабельными и метастатическими высокодифференцированными НЭО ЖКТ (G1, G2) и поджелудочной железы, карциноидах легкого/средостения с положительным статусом рецепторов соматостатина 2А и/или 5 типов назначение аналогов соматостатина (H01CB Соматостатин и его аналоги) – октреотид** в дозе 100 мкг 3 раза в сутки в течение 2 недель, затем при удовлетворительной переносимости рекомендуется назначение пролонгированных форм – пролонгированный октреотид** 30 мг в/м или ланреотид** 120 мг подкожно каждые 28 дней [70-73, 124, 134 ].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2)
Комментарии: аналоги соматостатина (H01CB Соматостатин и его аналоги) являются общепринятым видом антипролиферативной терапии НЭО первой линии на основании двух плацебо-контролируемых исследований III фазы PROMID и CLARINET. Эти исследования были проведены независимо друг от друга и отличаются между собой по характеристикам пациентов и определению конечных точек. В исследовании PROMID у пациентов с высокодифференцированными НЭО средней кишки (G1, Ki67<2%) медиана ВДП при применении октреотида** составила 14.3 месяца против 6 месяцев в группе плацебо (P=0,000072) [5]. В продленном проспективном исследовании CLARINET OLE медиана ВБП у пациентов, получающих ланреотид** 120 мг составила 38,5 месяцев [95% ДИ: 30.9-59.4][6, 105]. В исследовании CLARINET представлена более гетерогенная выборка пациентов с ГЭП НЭО, что соответствует реальной клинической практике: по локализации (НЭО средней кишки и ПЖ, НЭО из невыявленного первичного очага), по степени злокачественности (G1-70%, G2-30%), индекс пролиферации Ki-67 мог варьировать в интервале до 10%. Для пролонгированных форм аналогов соматостатина (H01CB Соматостатин и его аналоги) лечение начинается с препарата короткого действия. Октреотид** короткого действия применяется подкожно в дозе 100 мкг 3 раза в сутки в течение 2 недель, затем при удовлетворительной переносимости могут быть назначены пролонгированные формы – пролонгированный октреотид** 30 мг в/м или ланреотид** 120 мг подкожно каждые 28 дней
Пролонгированный октреотид** 30 мг согласно инструкции применяется в терапии эндокринных опухолей ЖКТ и поджелудочной железы.
При прогрессировании возможно использовать более высокие дозы пролонгированного октреотида** 40 мг и выше. [115] Доза 10 мг не применяется самостоятельно, а существует только для эскалации рекомендуемой дозы. Для ланреотида** рекомендуемая доза составляет 120 мг подкожно каждые 4 недели [5–8], при прогрессировании возможно уменьшение интервала между введениями до 3–2 недель или эскалация дозы до 180 мг [31]. В проспективном открытом исследовании II фазы CLARINET FORTE сокращение интервала введения ланреотида** 120 мг до 14 дней у пациентов с прогрессированием НЭО позволило достигнуть медианы ВБП 8.3 (5.6; 11.1) месяцев в группе НЭО средней кишки и 5.6 (5.5; 8.3) месяцев в группе НЭО ПЖ с сохранением безопасности терапии и качества жизни пациентов [106]. При прогрессировании опухолевого процесса, октреотид** может быть заменен на ланреотид** и наоборот. [5–8, 110, 111]. Также, при непереносимости одного из препаратов может быть назначен другой. [31].
- Рекомендуется пациентам с нерезектабельными функционирующими высокодифференцированными НЭО поджелудочной железы (G1, G2), вне зависимости от рецепторного статуса, назначение аналогов соматостатина (H01CB Соматостатин и его аналоги) для контроля гормональных симтомов - октреотид** в дозе 100 мкг 3 раза в сутки в течение 2 недель, затем при удовлетворительной переносимости рекомендуется назначение пролонгированных форм – пролонгированный октреотид** 30 мг в/м или ланреотид** 120 мг подкожно каждые 28 дней [5,70-73].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- Пациентам с неоперабельными высокодифференцированными НЭО ЖКТ (G1, G2), поджелудочной железы или карциноидах легкого/средостения при отсутствии рецепторов соматостатина рекомендовано рассмотреть применение #интерферона альфа-2b** по 3-5 миллионов МЕ 3 раза в неделю подкожно, начальная доза 3 миллиона МЕ 3 раза в неделю подкожно, при хорошей переносимости и недостаточной эффективности возможная эскалация дозы до 5 миллионов МЕ 3 раза в неделю подкожно для контроля симптомов гормональной секреции [9, 74-75, 115, 116].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- Пациентам с неоперабельными высокодифференцированными НЭО (G1, G2) или карциноидами легкого/средостения при отсутствии рецепторов к соматостатину в I линии терапии рекомендуется назначение таргетной терапии:
#эверолимус** в дозе 10 мг/сут (при всех локализациях) ежедневно постоянно длительно, без перерыва.
#сунитиниб** 37,5 мг (только при НЭО поджелудочной железы или феохромоцитоме/параганглиоме), ежедневно постоянно длительно, без перерыва [9, 10, 28, 74, 75].
Уровень убедительности рекомендации - C (уровень доказательности –4).
- Пациентам с неоперабельными высокодифференцированными НЭО (G1, G2) во II линии после лечения аналогами соматостатина (H01CB Соматостатин и его аналоги) ИЛИ в I линии при большом объеме опухоли рекомендуется назначение таргетной терапии совместно с аналогами соматостатина:
#сунитиниб** 37,5 мг только при НЭО поджелудочной железы, ежедневно постоянно длительно, без перерыва, совместно с октреотидом** 30 мг внутримышечно или #ланреотидом** 120 мг подкожно каждые 4 недели или в монорежиме при феохромоцитоме/ параганглиоме[10, 28, 29,117];
#эверолимус** в дозе 10 мг/сут ежедневно постоянно длительно при всех локализациях НЭО за исключением феохромоцитомы/параганглиомы совместно с #октреотидом** 30 мг или ланреотидом** 120 мг каждые 4 недели (G1, Кi-67 ≤2 %) [11–13, 28, 30, 73, 118].
Уровень убедительности рекомендации - C (уровень доказательности - 4).
Комментарии: при отсутствии дозировки сунитиниба** 37,5 мг (25 мг и 12,5 мг) возможно применение режима 4 недели по 50 мг ежедневно, 2 недели перерыв.
Уровень убедительности рекомендации - A (уровень доказательности - 5).
- Пациентам с неоперабельными высокодифференцированными (G1, G2) может быть рекомендован #пазопаниб** 800 мг в сутки внутрь ежедневно непрерывно длительно при НЭО G1-G2 всех локализаций, а также карциноидах легкого/средостения может применяться совместно с пролонгированными формами аналогов соматостатина (H01CB Соматостатин и его аналоги). [112, 131, 148, 183]
Уровень убедительности рекомендации - C (уровень доказательности – 4).
Комментарии: по данным мета-анализа по результатам клинических исследований II фазы по изучению #пазопаниба** у больных нейроэндокринными опухолями. В отобранные испытания было включено 304 пациента. Прогрессирование заболевания во время предыдущего лечения было обнаружено на момент включения в исследование у 283 (93.1%) пациентов. Предыдущая терапии включала соматостатин и его аналоги (Н01СВ Соматостатин и его аналоги) (88А) у 177 (58,2%) пациентов, другие ТЫ - у 16 (5,2%), #веролимус** - у 25 (8.2%), ТК1 и #эверолимус** - у 8 (2,6%), химиотерапию - у 56 (18,4%,), локорегиональное методы лечения - у 38 (12,5%) и другие неспецифические методы лечения -у 19 (6,2%>). 114 больных (37,5%) имели опухоли желудочно-кишечного (ЖКТ) происхождения, а остальные 190 больных ( 62,5%,) имели 11111 легкого, поджелудочной железы и НЭН из НПО. Большинство пациентов (76,3%) имели Н Э Н С 1 и 2, а 15 (5%) имели НЭН 03. У 58 (18,7%) пациентов степень дифференцировки не была определена. У 70 пациентов была функционирующая опухоль (23%). 88А назначали вместе с Ипазопанибом * * 230 (75.6%) пациентам. Частичны й ответ составил 10,7% (95% доверительный интервал 2,6-20,5). Показатель стабильного заболевания составил 79,6%о (диапазон: 61,7-92,1%) с уровнем контроля заболевания (ОСИ) 90,3%. Прогрессирование зарегистрировано у 9,7% (диапазон 5,2—17,6) пациентов. Полных ответов не наблюдалось. Медиана выживаемости без прогрессирования составила 11,6 месяцев (95% ДИ: 9,2—13,9). Общая выживаемость составила 24,6 месяца (95% ДИ: 18,7-40,8) месяца. Тяжелые нежелательные явления (степень 111 - IV) включали артериальную гипертензию на 31%, повышение уровня АСТ/ А Л Т на 16%>, диарею на 10% и утомляемость на 10%. Авторами сделан вывод о том, что объединенный анализ данных по #пазопанибу** в исследованиях фазы II в основном согласуются с данными, доступными для других одобренных препаратов. Шазопаниб** был одним из первых и наиболее широко изученных ТК1 при нейроэндокринных опухолях, он не перешел в сразу III. Имеющаяся клиническая информация позволяет поддерживать использование #пазопаниба** для лечения метастатических нейроэндокринных опухолей различного происхождения, особенно опухолей желудочно-кишечного тракта.
-
Рекомендовано рассмотреть проведение ПРРТ с РФЛП 177Lu-DOTA-TATE 5,55-7,4 ГБк (150-200 мКи), в рамках первого цикла возможно введение индукционной лечебной активности 3,7 ГБк (100 мКи), количество циклов 4, интервал между циклами 8 недель во второй и последующих линиях терапии неоперабельных или метастатических НЭО различных локализаций, в том числе с метастазами НЭО из невыявленного первичного очага, ФХЦ/ПГ, карциноидах легкого/средостения при подтвержденной экспрессии рецепторов к соматостатину по данным диагностического радионуклидного исследования. Через 4-24 часа после каждого введения РФЛП 177Lu-DOTA-TATE показано введение пролонгированного октреотида** 30 мг внутримышечно или ланреотида** 120 мг подкожно. [136, 138-143, 176].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 1).
Комментарии: Пептид-рецепторная радионуклидная терапия (ПРРТ) – вариант молекулярно-направленной лучевой терапии, который обеспечивает селективную и системную доставку открытого источника ионизирующего излучения к клеткам опухоли с целью цитотоксического радиационного противоопухолевого эффекта. В качестве основного радиофармацевтического лекарственного препарата (РФЛП) для ПРРТ НЭО, экспрессирующих рецепторы соматостатина 2 типа, применяется 177Lu-DOTA-TATE, который представляет собой лиганд в виде пептида (аналог соматостатина Octreotate) и терапевтического бета-излучающего изотопа 177Lu, ковалентно связанных хелатором (DOTA).
В крупном проспективном исследовании III фазы NETTER-1 были рандомизированы 229 пациентов с прогрессирующими НЭО средней кишки для лечения либо 177Lu-DOTA-TATE, либо октреотидом** в высоких дозах. Результаты NETTER-1 показали, что лечение 177Lu-DOTA-TATE ассоциировалось со значительным улучшением ВБП (не достигнуто по сравнению с 8,4 мес. в контрольной группе, р <0.0001). Объективные ответы опухоли наблюдались у 18% пациентов, получавших 177Lu-DOTA-TATE, против 3% в контрольной группе (р<0.001).
В 2021 году были опубликованы окончательные результаты общей выживаемости и долгосрочной безопасности по результатам исследования NETTER-1: лечение 177Lu-DOTA-TATE не улучшило медиану общей выживаемости (ОВ) по сравнению с высокодозным октреотидом** длительного действия. Несмотря на то, что конечная общая выживаемость не достигла статистической значимости, разница в 11,7 месяцев в медиане ОВ при лечении 177Lu-DOTA-TATE по сравнению с только высокодозным октреотидом** длительного действия может считаться клинически значимой.
В другом крупном исследовании изучались долгосрочная эффективность, выживаемость и токсичность 177Lu-DOTA-TATE в группе из 610 голландских пациентов с метастатическими ГЭП и бронхиальными НЭО. ВБП и ОВ для всех пациентов составили 29 месяцев [95% ДИ, 26-33 месяца] и 63 месяца (95% ДИ, 55-72 месяца), соответственно. Другие небольшие исследования также выявили улучшение ОВ (58,8 месяца, n=114) и медианы ВБП (20,1 месяца при типичном заболевании и 15,7 месяца при атипичном; n=34) при ПРРТ у пациентов с распространенными бронхолегочными НЭО.
Мета-анализ 18 исследований с участием 1920 пациентов с нерезектабельными метастатическими НЭО, которым проводилась ПРРТ с 177Lu-DOTA-TATE, показал, что общая частота ответа на лечение составила 29-31%, а общая частота контроля заболевания - 74-81 %. Рекомендуемая схема ПРРТ 177Lu-DOTA-TATE: вводимая активность 5,55-7,4 ГБк (150-200 мКи), количество циклов 3-5, интервал между циклами 6-12 недель.
Пациенты с гормонально-функциональными опухолями должны продолжать применение октреотида** или ланреотида** вместе с 177Lu-DOTA-TATE. Применение соматостатина и его аналогов длительного действия таких как ланреотид** и октреотид**, не рекомендуется за 4-6 недель перед каждым введением 177Lu-DOTA-TATE. Применение короткодействующих аналогов соматостатина (Соматостатин и его аналоги) следует прекратить за 24 часа до начала лечения 177Lu-DOTA-TATE. Применение аналогов соматостатина (короткого и длительного действия) можно возобновить через 4-24 часа после каждого введения 177Lu-DOTA-TATE.
В январе 2024 года были представлены окончательные результаты III фазы исследования NETTER-2. В исследование было включено 226 пациентов с метастатическими высокодифференцированными ГЭП-НЭО 2 или 3 степени и с индексом Ki67 ≥10% и ≤55%. Опухоли поджелудочной железы составили 55%, опухоли тонкой кишки – 29%. Пациенты из экспериментальной группы (n=151) получали 177Lu-DOTA-TATE с октреотидом** в стандартной дозе (30 мг) каждые 8 недель. Пациенты из группы контроля (n=75) – только терапию октреотидом** в высокой дозе (60 мг) каждые 4 недели. В исследовании NETTER-2 были продемонстрированы следующие результаты:применение 177Lu-DOTA-TATE привело к снижению риска прогрессирования заболевания или смерти на 72% (р<0,0001), причем польза не зависела от возраста, пола, расы, степени злокачественности и локализации опухоли; ЧОО составила 43% в группе 177Lu-DOTA-TATE и 9,3% в контрольной группе, при этом полного ответа достигли 5,3% и 0% соответственно; у пациентов, получавших ПРРТ, вероятность ответа была почти в восемь раз выше (OR=7,81) по сравнению с пациентами, получавшими октреотид** в высоких дозах; медиана ВБП увеличилась с 8,5 мес. до 22,8 мес. при назначении комбинации 177Lu-DOTA-TATE с пролонгированными формами октреотидом**.
- Рекомендуется при НЭО G2 при значительной массе опухоли или прогрессировании на таргетной терапии/ПРРТ и/или наличии карциноидного синдрома использовать режимы химиотерапии (ХТ) не содержащие цисплатин** и карбоплатин** (табл 6) [14, 15, 18-20, 42,51-52, 76-81].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
Таблица 6.
Режимы ХТ
| Режим | Схема | Длительность курса |
|---|---|---|
| *Арабинопиранозилметил нитрозомочевина [217] |
500-650 мг/м2 в/в струйно 1-3 дни1
|
каждые 3-4 недели
|
| #ТemCap [15] | #Темозоломид** 150 мг/м2 внутрь в 10–14-й дни + #капецитабин** 2000 мг/м2 внутрь в 1–14-й дни | 28 дней |
| #ХЕLOХ [76] | #Оксалиплатин** 130 мг/м2 в/в в 1-й день + #капецитабин** 2000 мг/м2 внутрь в 1–14-й дни | 21 день |
| #mFOLFOX [79] |
#Оксалиплатин** 85 мг/м2 в/в в 1-й день
#Кальция фолинат** 200 мг/м2 в/в в 1-й день
#фторурацил** 400 мг/м2 в/в в 1-й день
#фторурацил** 2400 мг/м2 в/в 46 ч
|
14 дней |
| #Темозоломид** [18, 78] | #Темозоломид** 150–200 мг/м2 в сутки внутрь в 1–5-й дни | 28 дней |
| #FOLFIRI [80] |
#Иринотекан** 180 мг/м2 в/в в 1-й день
#Кальция фолинат 200 в/в в 1-й день
#фторурацил** 400 мг/м2 в/в в 1-й день
#фторурацил** 2400 мг/м2 в/в 46 ч
|
14 дней |
| #mGEMOX [20, 81] | #Оксалиплатин** 85 мг/м2 в/в капельно в 1-й день + #гемцитабин** 1000 мг/м2 в/в капельно в 1-й день | 14 дней |
| #Метрономный (применяются для лечения ослабленных пациентов) [77] | #Капецитабин** 500 мг внутрь 3 раза в день, постоянно, длительно | Ежедневно, длительно |
| #Метрономный (применяются для лечения ослабленных пациентов) [78] | #Темозоломид** 75 мг/м2 внутрь ежедневно в 1-7 дни | 14 дней |
*Имеет показание – нейроэндокринные опухоли любой локализации.
1Не более 3000 мг на курс.
- Рекомендуется пациентам с неоперабельными высокодифференцированными НЭО (G1, G2) или карциноидах легкого/средостения при недостаточном контроле карциноидного синдрома увеличить дозы аналогов соматостатина (H01CB Соматостатин и его аналоги) или сократить межкурсовые интервалы – пролонгированный октреотид** 40-60 мг в/м каждые 28 дней или ланреотид** 120 мг подкожно каждый 14-21 день или добавить к терапии интерферона альфа-2b** [9, 73, 87-88, 115, 116].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: в многоцентровое, рандомизированное, двойное слепое, плацебо-контролируемое испытание III фазы TELESTAR были включены 135 больных с метастатическими нейроэндокринными опухолями и c задокументированной историей карциноидного синдрома, некупиремого высокими дозами аналогов соматостатина (H01CB Соматостатин и его аналоги), который проявлялся 4 и более эпизодами дефекации в сутки на фоне применения стабильных доз соматостатина и его аналогов в течение как минимум 3 месяцев до включения в исследование. [113, 114, 119-120].
Пациенты были рандомизированы в соотношении 1:1:1 в 3 группы, получавших плацебо (3 р/сутки) + аналоги соматостатина(H01CB Соматостатин и его аналоги), телотристат (250 мг 3 р/сутки) + аналоги соматостатина (H01CB Соматостатин и его аналоги)или телотристат (500 мг 3 р/сутки) + аналоги соматостатина(H01CB Соматостатин и его аналоги) в течение 12 недель. От базового уровня до 12-й недели, среднее снижение частоты стула в день для плацебо, телотристат (250мг) и #телотристат (500 мг) составляли -0,9, -1,7 и -2,1 соответственно. Кроме того, обе дозы телотристата значительно снижали среднее выделение 5-ГИУК с мочой по сравнению с плацебо на 12-й неделе (Р < 0.001).
В исследовании реальной клинической практики TELEPRO у пациентов, получавших телотристат, наблюдалось уменьшение эпизодов диареи и других симптомов карциноидного синдрома. [114].
2. Высокодифференцированные нейроэндокринные опухоли G3
- Рекомендуется пациентам с неоперабельными высокодифференцированными НЭО G3 при ki67<55% в качестве терапии 1-й и последующих линий лечения проведение химиотерапии. Приоритетные режимы: TemCap, XELOX, FOLFOX, mGemOx при НЭО ЖКТ, ЕР/EC, TemCap, mGemOx при НЭО легких (см. табл. 7). [20, 42, 51,52, 84, 203, 216]
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
- Рекомендуется пациентам с неоперабельными НЭО G3 c ki67>55% в качестве приоритетной 1-й линии терапии рассмотреть назначение платиносодержащей терапии (L01XA) – ЕР/EC вне зависимости от локализации или и mFOLFIRINOX при НЭК ЖКТ (см. табл. 7). [42, 51,52, 84]
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Таблица 7.
Режимы ХТ [14, 15, 18-20]
| Режим | Схема | Длительность курса |
|---|---|---|
| *Арабинопиранозилметил нитрозомочевина [217] |
500-650 мг/м2 в/в струйно 1-3 дни1
|
каждые 3-4 недели
|
| #ТemCap [84] | #Темозоломид** 150 мг/м2 внутрь в 10–14-й дни + #капецитабин** 2000 мг/м2 внутрь в 1–14-й дни | 28 дней |
| #ХЕLOХ [76] | #Оксалиплатин** 130 мг/м2 в/в в 1-й день + #капецитабин** 2000 мг/м2 внутрь в 1–14-й дни | 21 день |
| #FOLFOX [14] |
#Оксалиплатин** 85 мг/м2 в/в в 1-й день
#Кальция фолинат** 400 мг/м2 в/в в 1-й день
#фторурацил** 400 мг/м2 в/в в 1-й день
#фторурацил** 2400 мг/м2 в/в 46 ч
|
14 дней |
| #Темозоломид** [84] | #Темозоломид** 150–200 мг/м2 внутрь в сутки в 1–5-й дни | 28 дней |
| #FOLFIRI [84] |
#Иринотекан **180 мг/м2 в/в в 1-й день
#Кальция фолинат** 400 мг/м2 в/в в 1-й день
#Фторурацил** 400 мг/м2 в/в в 1-й день
#Фторурацил** 2400 мг/м2 в/в 46 ч
|
14 дней |
| #mGEMOX [84] | #Оксалиплатин** 85 мг/м2 в/в капельно в 1-й день + #гемцитабин** 1000 мг/м2 в/в капельно в 1-й день | 14 дней |
| mFOLFIRINOX при НЭО ЖКТ с ki67>55% [175] |
#Оксалиплатин** 85 мг/м 2 в / в в 1й день +
Иринотекан** 150 мг/м2 в / в в 1 день +
кальция фолинат** 400 мг/м2 в / в в 1й день
+ фторурацил** 2400 мг/м2 в / в 46 часов
|
14 дней |
| EP при ki67>55% [84, 120] |
#Этопозид** 100 мг/м2 в / в в 1–3‑й дни +
Цисплатин** 80 мг/м2 в / в в 1й день
|
21 день |
| EC при ki67>55% [84, 120] |
# Этопозид** 100 мг/м2 в / в в 1–3й дни +
Карбоплатин** AUC 5 в / в в 1й день
|
21 день |
| #Метрономные режимы [84] (применяются для лечения ослабленных пациентов) |
#Темозоломид** 100 мг/сут внутрь
или
#Капецитабин** 500 мг 2–3 раза в сутки внутрь#
|
Ежедневно длительно
|
| #Метрономные режимы [84] (применяются для лечения ослабленных пациентов) |
#Темозоломид** 100 мг/сут внутрь
или
#Капецитабин** 500 мг 2–3 раза в сутки внутрь
|
Ежедневно длительно
|
*Имеет показание – нейроэндокринные опухоли любой локализации.
1Не более 3000 мг на курс.
- Рекомендуется пациентам с НЭО G3 для контроля симптомов, либо при наличии карциноидного синдрома, в дополнение к ХТ при положительном статуте рецепторов соматостатина типа 2А или 5 в опухоли – назначение аналогов соматостатина (H01CB Соматостатин и его аналоги) +/- интерферона альфа-2b** (схемы лечения такие же, как при высокодифференцированных НЭО G1-2) [5-8, 42,51-56, 83].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: в многоцентровое, рандомизированное, двойное слепое, плацебо-контролируемое испытание III фазы TELESTAR были включены 135 больных с метастатическими нейроэндокринными опухолями и c задокументированной историей карциноидного синдрома, некупиремого высокими дозами аналогов соматостатина, который проявлялся 4 и более эпизодами дефекации в сутки на фоне применения стабильных доз соматостатина и его аналогов в течение как минимум 3 месяцев до включения в исследование. [113, 114, 119-120]. Пациенты были рандомизированы в соотношении 1:1:1 в 3 группы, получавших плацебо (3 р/сутки) + аналоги соматостатина (H01CB Соматостатин и его аналоги), телотристат (250 мг 3 р/сутки) + аналоги соматостатина или #телотристат (500 мг 3 р/сутки) + аналоги соматостатина в течение 12 недель. От базового уровня до 12-й недели, среднее снижение частоты стула в день для плацебо, телотристат (250мг) и #телотристат (500 мг) составляли -0,9, -1,7 и -2,1 соответственно. Кроме того, обе дозы телотристата значительно снижали среднее выделение 5-ГИУК с мочой по сравнению с плацебо на 12-й неделе (Р < 0.001). В исследовании реальной клинической практики TELEPRO у пациентов, получавших телотристат, наблюдалось уменьшение эпизодов диареи и других симптомов карциноидного синдрома. [114].
- Рекомендуется пациентам с неоперабельными или метастатическими НЭО ЖКТ и поджелудочной железы G3 при ki67<55% во второй и последующих линиях лекарственной терапии рассмотреть ПРРТ с РФЛП с 177Lu-DOTA-TATE (A07.30.003.008 Радионуклидная терапия препаратами лютеция (177Lu)), количество циклов 4, интервал между циклами 8 недель при подтвержденной экспрессии рецепторов к соматостатину по данным диагностического радионуклидного исследования. Через 4-24 часа после каждого введения РФЛП 177Lu-DOTA-TATE показано введение пролонгированных форм аналогов соматостатина (H01CB Соматостатин и его аналоги). [137].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 2).
Комментарии: В январе 2024 года были представлены окончательные результаты III фазы исследования NETTER-2. В исследование было включено 226 пациентов с метастатическими высокодифференцированными ГЭП-НЭО 2 или 3 степени и с индексом Ki67 ≥10% и ≤55%. Опухоли поджелудочной железы составили 55%, опухоли тонкой кишки – 29%. Пациенты из экспериментальной группы (n=151) получали 177Lu-DOTA-TATE с #октреотидом** в стандартной дозе (30 мг) каждые 8 недель. Пациенты из группы контроля (n=75) – только терапию октреотидом** в высокой дозе (60 мг) каждые 4 недели. Назначение 177Lu-DOTA-TATE привело к снижению риска прогрессирования заболевания или смерти на 72% (р<0,0001), причем польза не зависела степени злокачественности и локализации опухоли; ЧОО составила 43% в группе 177Lu-DOTA-TATE и 9,3% в контрольной группе, при этом полного ответа достигли 5,3% и 0% соответственно; у пациентов, получавших ПРРТ, вероятность ответа была почти в восемь раз выше (OR=7,81) по сравнению с пациентами, получавшими октреотид** в высоких дозах; медиана ВБП увеличилась с 8,5 мес. до 22,8 мес. при назначении комбинации 177Lu-DOTA-TATE с пролонгированными формами #октреотида**. Учитывая, что высокие дозы октреотида** не являются стандартом первой линии лечения этих пациентов, группа контроля выбрана неадекатно. В связи с чем вопрос оптимальной первой линии лечения этих пациентов – ПРРТ + аналоги соматостатина (H01CB Соматостатин и его аналоги) или химиотерапия +/- аналоги соматостатина (H01CB Соматостатин и его аналоги) остается неопределенным.
3. Низкодифферецированный нейроэндокринный рак (НЭК, НЭК, NEC)
- Рекомендуется пациентам с низкодифферецированным нейроэндокринным раком в качестве терапии 1-й линии проведение ХТ (см. табл. 8). Предпочтительными режимами первой линии терапии являются являются режимы с использованием препаратов платины (L01XA Соединения платины) – ЕР/EC вне зависимости от локализации и mFOLFIRINOX при НЭК ЖКТ и поджелудочной железы [42, 51, 52]
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
Таблица 8.
Режимы ХТ [85-86]
| Режим | Схема | Межкурсовой интервал |
|---|---|---|
| #ЕР [86,127, 144], 4-6 циклов |
#Цисплатин** 80 мг/м2 в/в капельно в 1 день
#Этопозид** 100 мг/м2 в/в капельно в 1–3-й дни
|
21 день |
| #ЕС [85,144], 4-6 циклов |
#Карбоплатин** AUC 5 в/в капельно в 1 день
#Этопозид** 100 мг/м2 в/в капельно в 1–3-й дни
|
21 день |
| #IP [85], 4-6 циклов |
Цисплатин** 75 мг/м2 в/в капельно в 1 день
#Иринотекан** 65 мг/м2 в/в капельно в 1-й, 8-й дни
|
21 день |
| #IС [85], 4-6 циклов |
Карбоплатин** AUC 5 в/в капельно в 1-й день
#Иринотекан** 65 мг/м2 в/в капельно в 1-й, 8-й дни
|
21 день |
| #mFOLFIRINOX [175] при НЭК ЖКТ, 9-12 циклов |
#Оксалиплатин** 85 мг/м2 в/в в 1й день +
Иринотекан** 150 мг/м2 в/в в 1 день +
кальция фолинат** 400 мг/м2 в / в в 1й день
+ фторурацил** 2400 мг/м2 в / в 46 часов
|
14 дней |
| #ХЕLOХ [76] | #Оксалиплатин** 130 мг/м2 в/в в 1-й день + #капецитабин** 2000 мг/м2 внутрь в 1–14-й дни | 21 день |
| #FOLFOX [132] |
#Оксалиплатин** 85 мг/м2 в/в в 1-й день
#Кальция фолинат** 400 мг/м2 в/в в 1-й день
#фторурацил** 400 мг/м2 в/в в 1-й день
#фторурацил** 2400 мг/м2 в/в 46 ч
|
14 дней |
| #ТemCap [84] 2я и последующие линии | #Темозоломид** 150 мг/м2 внутрь в 10–14-й дни + #капецитабин** 2000 мг/м2 внутрь в 1–14-й дни | 28 дней |
| #Темозоломид** [128] 2я и последующие линии | #Темозоломид** 75 мг/м2 внутрь 1-7 день цикла | 14 дней |
| #FOLFIRI [128] при НЭК ЖКТ 2я и последующие линии |
#Иринотекан **180 мг/м2 в/в в 1-й день
#Кальция фолинат** 400 мг/м2 в/в в 1-й день
#Фторурацил** 400 мг/м2 в/в в 1-й день
#Фторурацил** 2400 мг/м2 в/в 46 ч
|
14 дней |
|
#mGEMOX [84]
2я и последующие линии
|
#Оксалиплатин** 85 мг/м2 в/в капельно в 1-й день + #гемцитабин** 1000 мг/м2 в/в капельно в 1-й день | 14 дней |
| #Доцетаксел**[129] 2я и последующие линии | #Доцетаксел** 75 мг/м2 в/в в 1 день | 21 день |
| #CAV [85] 2я и последующие линии | #Циклофосфамид** 1000 мг/м2 в/в капельно в 1-й день, #доксорубицин** 50 мг/м2 в/в в 1-й день, винкристин** 1,4 мг/м2 в/в струйно в 1-й день | 21 день |
|
# Ниволумаб** и ипилимумаб**
[147] 2я и последующие линии
|
#Ниволумаб** 3 мг / кг или 240 мг в / в капельно + Ипилимумаб** 1 мг / кг в / в капельно 1 раз в 3 нед.- 4 введения, затем — #ниволумаб** 3 мг / кг или 240 мг каждые 2 нед. в/в капельно до прогрессирования или неприемлемой токсичности, но не более 2х лет. | - |
- При прогрессировании ≥ 4 мес. после завершения 1й линии химиотерапии рекомендовано проведение ре-индукции платиносодержащей химиотерапии (L01XA) [206-207].
Уровень убедительности рекомендаций – C(уровень достоверности доказательств – 5).
- В качестве 2-й и последующих линий могут быть рекомендованы комбинации приведенные в таблице 8. Предпочтительные режимы терапии при НЭК ЖКТ и поджелудочной железы – FOLFIRI, TemCap [145].
Уровень убедительности рекомендаций – C(уровень достоверности доказательств – 5).
Комментарий: В исследовании II фазы SENECA сравнивали эффективность режимов CAPTEM и FOLFIRI во второй и последующих линиях терапии НЭК ЖКТ после прогрессирования на платиносодержащей химиотерапии. В исследование включено 53 из 112 запланированных пациентов. Контроль болезни ≥ 12 недель был достигнут у 28 и 32% пациентов, а однолетняя ОВ 32 и 28% в группах CAPTEM и FOLFIRI, соответственно. Таким образом, была показана эквивалентность данных режимов терапии.
- Рекомендуется рассмотреть назначение комбинированной иммунотерапии ниволумабом** и ипилимумабом** (см. таблицу 8) в качестве 2 и последующих линий терапии НЭК у пациентов с ECOG-статусом 0-1 (приложение Г1) [147].
Уровень убедительности рекомендаций – C(уровень достоверности доказательств – 5).
Комментарий: В небольшом исследовании 2 фазы изучалась эффективность комбинированной иммунотерапии – ниволумаб** + ипилимумаб** в качестве второй и последующих линий терапии НЭО и НЭК внепанкреатической локализации. В исследование было включено 32 пациента, медиана ki67 составилв 80%. Частота объективных ответов составила 26%. Контроль болезни ≥ 6 мес. был достигнут у 32% пациентов [147].
- Рекомендуется пациентам с низкодифференцированным нейроэндокринным раком для контроля симптомов либо при наличии карциноидного синдрома в дополнение к ХТ при положительном статуте рецепторов соматостатина типа 2А или 5 в опухоли назначение аналогов соматостатина (H01CB Соматостатин и его аналоги) и/или интерферона альфа-2b** (схемы лечения такие же, как при высокодифференцированных НЭО G1-2) [42,51-56].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: биотерапия не применяется самостоятельно в 1-й линии терапии, а существует только как вспомогательный элемент для контроля симптомов. Аналоги соматостатина (H01CB соматостатин и его аналоги) пролонгированного действия и интерфероны альфа-2b** (см. режимы) при низкодифференцированном нейроэндокринном раке имеют ограниченное значение и используются для контроля симптомов в дополнение к ХТ при наличии карциноидного синдрома либо при положительном статуте рецепторов соматостатина типа 2А или 5 в опухоли.
3. Лечение феохромоцитомы/параганлиомы
- Рекомендуется всем пациентам с ФХЦ/ПГ предоперационная подготовка альфа-адреноблокаторами, при наличии тахикардии – бета-адреноблокаторами, которые добавляют к лечению альфа-адреноблокаторами после достижения эффекта применения альфа-адреноблокаторов. Исключением являются пациенты с гормонально-неактивными опухолями головы и шеи и нормотензивные пациенты при отсутствии тахикардии и гиповолемического синдрома [35, 93-94].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарии: предоперационная подготовка альфа-адреноблокаторами и, по показаниям, бета-адреноблокаторами проводится до достижения критериев эффективности: нормализация уровня артериального давления, достижение целевой частоты сердечных сокращений, ликвидация гиповолемического синдрома, индуцированного избытком катехоламинов.
- Пациентам с ФХЦ рекомендована эндоскопическая адреналэктомия. Для больших (>6 см) и инвазивных опухолей предпочтителен открытый доступ для проведения адекватной ревизии и во избежание повреждения капсулы опухоли. Решение об эндоскопическом вмешательстве при наличии опухоли большого размера основывается на наличии соответствующего опыта хирургической бригады и возможности соблюдения принципов абластичности [35, 92].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2).
- Рекомендуется хирургическое вмешательство с открытым доступом при ПГ. Лапароскопическое вмешательство при ПГ малого размера может быть проведено в специализированных ведущих хирургических центрах [35, 37].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- Рекомендовано рассмотреть удаление рецидива при местном/операбельном рецидиве ФХЦ/ПГ с последующим динамическим наблюдением [135].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендовано при двусторонней ФХЦ/ПГ в рамках синдромов МЭН-2а и Гиппеля–Линдау, рассмотреть вопрос о проведении адреналэктомии с одной из сторон и резекции второго надпочечника, в целях предотвращения аддисонических кризов на фоне заместительной терапии хронической надпочечниковой недостаточности. Пациенту должны быть разъяснены возможные негативные аспекты этой тактики (вероятность местного рецидива и повторной операции в условиях рубцового процесса) [208].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2).
Комментарий: при других наследственных синдромах, связанных с более высоким или неопределенным злокачественным потенциалом, проведение органосохраняющих операций требует дальнейшего изучения отдаленных результатов [35, 37, 39, 90].
- Рекомендуется исследование уровня метилированных катехоламинов в крови или исследование уровня катехоламинов в моче (метанефрин, норметанефрин) через 3–6 нед после оперативного лечения ФХЦ/ПГ [37].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарии: при положительном послеоперационном уровне метанефринов проведение инструментальных диагностических исследований (раздел 2.4). При ФХЦ/ПГ с гиперсекрецией катехоламинов рекомендовано купировать симптомы гормональной гиперпродукции альфа-адреноблокаторами и бета-адреноблокаторами [95].
- В связи с высокой частотой индолентного течения метастатической ФХЦ рекомендуется рассмотреть возможность динамического наблюдения у бессимптомных пациентов с небольшой распространенностью заболевания [90].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
Комментарии: выжидательная тактика включает обследование пациента с частотой 3-6 месяцев в течение первого года, далее 1 раз в год при отсутствии прогрессии.
- При индолентном, бессимптомном течении метастатической ФХЦ/ПГ с положительной экспрессии рецепторов соматостатина по данным ИГХ или радионуклидной диагностики и прогрессировании на фоне динамического наблюдения рекомендовано рассмотреть терапию аналогами соматостатина – пролонгированный октреотид** или ланреотид** (H01CB Соматостатин и его аналоги) [124].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- При метастатической/неоперабельной ФХЦ/ПГ с большой распространенностью заболевания и/или прогрессировании на фоне динамического наблюдения и/или терапии аналогами соматостатина (H01CB Соматостатин и его аналоги), рекомендовано рассмотреть назначение следующих режимов терапии (таблица 9) [89, 117, 123, 124, 133, 209].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2).
| Режим | Схема | Длительность курса |
|---|---|---|
| # CVD [89, 123] | Циклофосфамид** 750 мг/м2 в /в в день 1, Винкристин** 1,4 мг/м2 в /в в 1 день (не более 2 г на курс), Дакарбазин** 600 мг/м2 в /в в 1-2 дни | 21-28 дней |
| # Темозоломид** [133] | 150-200 мг/м2 внутрь 1-5 дни | 28 дней |
| # Темозоломид** [209] | 75 мг/м2 внутрь 1-21 дни | 28 дней |
| # Сунитиниб** [117] | 37,5 мг внутрь 1 раз в сутки постоянно | Постоянно длительно |
| # Октреотид** [124] | 30 мг в/м | 28 дней |
| # Ланреотид** [124] | 120 мг подкожно | 28 дней |
- При метастатической ФХЦ/ПГ с положительной экспрессией рецепторов соматостатина в качестве второй и последующих линий лекарственной терапии рекомендовано рассмотреть возможность ПРРТ #177Lu-DOTATATE 5,5-7,4 GBq + пролонгированный октреотид** 30 мг в/м (H01CB Соматостатин и его аналоги) через 4-24 часа после каждого введения (ПРРТ) 4 цикла, затем поддерживающая терапия пролонгированный октреотид** 30 мг в/м каждые 28 дней до прогрессирования заболевания [124-125] или #Йобенгуан [131I] разовой активностью 3,7–11,2 ГБк [126].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2).
5. Иное лечение
Оптимальная симптоматическая терапия и сопроводительная терапия.
- При проведении цитотоксической химиотерапии пациентам (нейроэндокинными неоплазиями) рекомендуется профилактика тошноты и рвоты с использованием: A04A противорвотных препаратов (блокаторы серотониновых рецепторов 5-НТ3-рецепторов (A04AA), антагонистов нейрокининовых рецепторов (NK-1), дексаметазона**, стимуляторов моторики желудочно-кишечного тракта (метоклопрамид**), анксиолитиков, антипсихотических средств, ингибиторов протонного насоса, блокаторов Н2-гистаминовых рецепторов [149].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: выбор метода профилактики тошноты и рвоты определяется эметогенностью режима терапии, индивидуальным порогом тошноты и рвоты, сопутствующими заболеваниями. Детальный алгоритм профилактики и лечения тошноты и рвоты при проведении противоопухолевой терапии представлен в рекомендациях «Практические рекомендации по профилактике и лечению тошноты и рвоты у онкологических больных» [184].
- У пациентов с нейроэндокинными неоплазиями диагностика остеопороза осуществляется рентгеноденситометрией поясничного отдела позвоночника, бедренной кости, с целью профилактики и лечения остеопороза рекомендуется применение препаратов, влияющих на структуру и минерализацию костей, ингибиторы костной резорбции (M05B: Препараты, влияющие на структуру и минерализацию костей) [150].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Детальный алгоритм профилактики и лечения костных осложнений у пациентов (указывается нозология) представлен в методических рекомендациях «Использование остеомодифицирующих агентов для профилактики и лечения патологии костной ткани при злокачественных новообразованиях» [185].
- У пациентов с нейроэндокинными неоплазиями и метастатическим поражением костей рекомендуется применение препаратов, влияющих на структуру и минерализацию костей, ингибиторы костной резорбции (M05B: Препараты, влияющие на структуру и минерализацию костей), паллиативной лучевой терапии, вертебропластики [150].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Детальный алгоритм профилактики и лечения костных осложнений у пациентов (указывается нозология) представлен в методических рекомендациях «Использование остеомодифицирующих агентов для профилактики и лечения патологии костной ткани при злокачественных новообразованиях» [185].
- У пациентов с нейроэндокинными неоплазиями с целью диагностики венозных тромбоэмболических осложнений рекомендуется применение дуплексного сканирования вен нижних конечностей, ангиографии, компьютерной томографии органов грудной полости с внутривенным болюсным контрастированием, выполнение коагулограммы [151,152].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
- У пациентов с нейроэндокинными неоплазиями с целью профилактики и лечения венозных тромбоэмболических осложнений рекомендуется применение лекарственных препаратов (антикоагулянты (B01A Антитромботические средства)), методов физического воздействия (компрессионный трикотаж, пневмомассаж конечностей), установка венозных фильтров в нижнюю полую вену [153].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: детальный алгоритм профилактики и лечения венозных тромбоэмболических осложнений у пациентов (указывается нозология) соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по профилактике и лечению тромбоэмболических осложнений у онкологических больных» [186].
- У пациентов с нейроэндокинными неоплазиями при подозрении на наличие инфекционных осложнений с целью диагностики возбудителя и контроля эффективности терапии рекомендуется использовать бактериологические исследования, определение уровня прокальцитонина, пресепсина, С-реактивного белка, галактоманнана, исследование кислотно-основного состояния и газов крови, выполнение рентгенографии легких, компьютерной томографии органов грудной полости, компьютерной и магнитно-резонансной томографии органов брюшной полости с внутривенным контрастированием [154].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
- У пациентов с нейроэндокинными неоплазиями с целью профилактики и лечения инфекционных осложнений и фебрильной нейтропении рекомендуется применение лекарственных препаратов: антибактериальные препараты системного действия (J01CR комбинации пенициллинов, включая комбинации с ингибиторами бета-лактамаз; J01C бета-лактамные антибактериальные препараты: пенициллины; карбапенемы; J01XX прочие антибактериальные препараты (оксазолидиноны, аминогликозиды); P01 противопротозойные препараты; фторхинолоны; линкозамиды и L03AA колониестимулирующие факторы (обычные и пролонгированные формы) [ 154-156].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: детальный алгоритм диагностики, профилактики и лечения инфекционных осложнений и фебрильной нейтропении у пациентов (нейроэндокинными неоплазиями) соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по диагностике и лечению фебрильной нейтропении» [187].
- При проведении противоопухолевой терапии пациентам с нейроэндокинными неоплазиями рекомендуется коррекция гепатотоксичности: A16AA аминокислоты и их производные: A05 препараты для лечения заболеваний печени и желчевыводящих путей, A16AX прочие препараты для лечения заболеваний желудочно-кишечного тракта и нарушений обмена веществ [ 157-158]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 3)
Комментарии: детальный алгоритм проведения коррекции гепатотоксичности соответствуют принципам, изложенным в методических рекомендациях «Клинические рекомендации по коррекции гепатотоксичности, индуцированной противоопухолевой терапией» [188].
- При проведении противоопухолевой терапии пациентам с нейроэндокинными неоплазиями с целью диагностики кардиоваскулярных осложнений и мониторинга эффективности их терапии рекомендуется определение сердечных биомаркеров (исследование уровня тропонинов I, T в крови, N-терминального фрагмента натрийуретического пропептида мозгового (NT-proBNP) в крови), выполнение ЭКГ, эхокардиография, холтеровское мониторирование сердечного ритма [159, 160].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 3)
- C целью профилактики и лечения кардиоваскулярных осложнений рекомендуется применение следующих препаратов: C09CA Антогонисты рецепторов ангиотензина II, C01D вазодилататоров для лечения заболеваний сердца (C01DA: органические нитраты, препараты магния), C08CA: производных дигидропиридина, бета-адреноблокаторов [161, 162].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: выбор метода профилактики сердечно сосудистых осложнений определяется факторами риска сердечно-сосудистых осложнений. Детальный алгоритм профилактики и лечения сердечно-сосудистых осложнений при проведении противоопухолевой терапии представлен в рекомендациях «Практические рекомендации по коррекции кардиоваскулярной токсичности противоопухолевой лекарственной терапии» [189].
- При проведении цитотоксической химиотерапии пациентам (нейроэндокинными неоплазиями) рекомендуется для профилактики и лечения кожных осложнений: D11AX прочие препараты для лечения заболеваний кожи - увлажняющие кремы, кератолитические кремы, солнцезащитные кремы, D07: Глюкокортикоиды, применяемые в дерматологии ( комбинированные кортикостероиды для местного применения), D07C: Глюкокортикостероиды в комбинации с антибиотиками, J01A: тетрациклины, D06: Антибиотики и противомикробные средства, применяемые в дерматологии, D07C Глюкокортикостероиды в комбинации с антибиотиками (топический кортикостероид+антибактериальное вещество) дерматотропные средства), L04AD: ингибиторы кальциневрина, антисептики, D06B антибиотики и противомикробные препараты для местного применения, применяемые в дерматологии [163].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: выбор метода профилактики кожных осложнений определяется различными видами дерматологических реакций. Детальный алгоритм профилактики и лечения кожных осложнений представлен в методических рекомендациях «Практические рекомендации по лекарственному лечению дерматологических реакций у пациентов, получающих противоопухолевую лекарственную терапию» [190].
- При проведении цитотоксической химиотерапии пациентам с нейроэндокинными неоплазиями рекомендуется нутритивная поддержка в соответствии с клиническими рекомендациями по нутритивной поддержке [164, 165].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: выбор метода нутритивной поддержки определяется различными видами нарушений питания у пациента. Детальный алгоритм профилактики и лечения кожных осложнений представлен в методических рекомендациях «Практические рекомендации по нутритивной поддержке онкологических больных» [191].
- При проведении цитотоксической химиотерапии пациентам с нейроэндокинными неоплазиями рекомендуется профилактика и лечение нефротоксичности назначение M04A: противоподагрических препаратов, в том числе проведение гемодиализа в соответствии с рекомендациями по профилактике и лечению нефротоксичности [166].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: выбор метода профилактики и лечения нефротоксичности определяется различными вариантами нефропатий и вариантов химиотерапии у пациента. Детальный алгоритм профилактики и лечения нефротоксичности представлен в методических рекомендациях «Практические рекомендации по коррекции нефротоксичности противоопухолевых препаратов» [192].
- При возникновении иммуноопосредовванных нежелательных явлений на фоне терапии рекомендуется проводить лечение иммуноопосредованных нежелательных явлений, следующими препаратами: H02AB: глюкокортикоиды, иммунодепрессанты, A07: противодиарейные, кишечные противовоспалительные и противомикробные препараты, J01E: Сульфаниламиды и триметоприм [167, 168].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: выбор метода профилактики и лечения иммуноопосредованных нежелательных явлений определяется степенью тяжести реакции и локализации поражения у пациента. Детальный алгоритм профилактики и лечения иммуноопосредованных нежелательных явлений представлен в методических рекомендациях «Практические рекомендации по управлению иммуноопосредованными нежелательными явлениями» [193].
- С целью диагностики мукозитов у пациентов с нейроэндокинными неоплазиями рекомендуется применение компьютерной томографии органов грудной полости, компьютерной томографии органов брюшной полости с внутривенным контрастированием, эзофагогастродуоденоскопии, колоноскопии, микробиологическое (культуральное) исследование кала на аэробные и факультативно-анаэробные микроорганизмы и на возбудитель диффициального клостридиоза (Clostridium difficile) [169].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 3)
- При проведении цитотоксической химиотерапии пациентам с нейроэндокинными неоплазиями рекомендуется профилактика и лечение мукозитов следующими препаратами: D07A глюкокортикоиды, аналоги соматостатина (H01CB Соматостатин и аналоги), противодиарейные средства (A07X: Прочие противодиарейные препараты), противопротозойные препараты, J01XA: Антибиотики гликопептидной структуры, местные анестетики, антидепрессанты, установка назогастрального зонда [170].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 3).
Комментарии: выбор метода профилактики и лечения мукозитов определяется степенью тяжести реакции и локализации поражения у пациента. Детальный алгоритм профилактики и лечения мукозитов представлен в методических рекомендациях «Практические рекомендации по лечению и профилактике мукозитов» [194].
- При проведении цитотоксической химиотерапии пациентам (нейроэндокинными неоплазиями) рекомендуется лечение анемии гемотрансфузией, препаратами железа для парентерального и перорального применения, стимуляторами гемопоэза (B: Кровь и система кроветворения), витаминами [171, 172].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: выбор метода лечения анемии определяется степенью выраженности дефицитом витаминов, железа у пациента. Детальный алгоритм профилактики и лечения анемии представлен в методических рекомендациях «Практические рекомендации по лечению анемии при злокачественных новообразованиях» [195].
- При проведении цитотоксической химиотерапии пациентам с нейроэндокинными неоплазиями рекомендуется лечение синдрома анорексии-кахексии следующими препаратами: гестагенами, H02AB глюкокортикоидами, противорвотными препаратами, R06A антигистаминными средствами системного действия, N02CC Селективные агонисты серотониновых 5-HT1-рецепторов [173].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 3)
Комментарии: выбор метода лечения синдрома анорексии-кахексии определяется степенью выраженности дефицитом витаминов, железа у пациента. Детальный алгоритм профилактики и лечения синдрома анорексии-кахексии представлен в методических рекомендациях «Практические рекомендации по лечению анемии при злокачественных новообразованиях» [196].
- С целью осуществления длительных (свыше 6 часов) инфузий L01 противоопухолевых препаратов или при неудовлетворительном состоянии периферических вен пациентам с нейроэндокинными неоплазиями при цикловом лечении рекомендуется использование центрального венозного доступа и инфузионных помп [174].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: выбор варианта центрального доступа определяется запланированной длительностью всего курса лечения, предпочтениями пациента, анатомическими особенностями. При длительных (свыше 3 мес.) курсах терапии наиболее удобным является имплантация подкожной венозной порт системы. При меньших сроках альтернативой может служить периферически имплантируемый центральный венозный катетер.
Медицинская реабилитация
Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
- Рекомендуется проводить медицинскую реабилитацию пациентов с НЭО в соответствии с общими принципами реабилитации пациентов со злокачественными новообразованиями в зависимости от локализации первичной опухоли (желудок, легкое, ПЖ, прямая кишка и т.д.) (см. соответствующие клинические рекомендации) [58-61].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Госпитализация
Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 № 323-ФЗ (ред. от 25.05.2019) «Об основах охраны здоровья граждан в Российской Федерации», организуется и оказывается:
- в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным Федеральным органом исполнительной власти;
- в соответствии с порядком оказания помощи по профилю «онкология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями; на основе настоящих клинических рекомендаций;
- с учетом стандартов медицинской помощи, утвержденных уполномоченным Федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При подозрении или выявлении у пациента онкологического заболевания врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественного образования, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При подозрении и (или) выявлении у пациента онкологического заболевания в ходе оказания ему скорой медицинской помощи его переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, не должен превышать 14 календарных дней с даты гистологической верификации НЭО или 14 календарных дней с даты установления предварительного диагноза НЭО (в случае отсутствия медицинских показаний для проведения патологоанатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациентам с онкологическими заболеваниями, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов и врачей-радиотерапевтов, с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания для госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю «онкология» определяются консилиумом врачей-онкологов и врачей-радиотерапевтов, с привлечением при необходимости других врачей-специалистов.
Показаниями для госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
- наличие осложнений онкологического заболевания, требующих оказания специализированной медицинской помощи в экстренной и неотложной форме;
- наличие осложнений лечения (хирургическое вмешательство, лучевая терапия, лекарственная терапия и т.д.) онкологического заболевания.
Показаниями для госпитализации в медицинскую организацию в плановой форме являются:
- необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
- наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, лучевая терапия, в том числе контактная, дистанционная терапия и другие виды лучевой терапии, лекарственная терапия и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациента из медицинской организации являются:
- завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
- отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
- необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи. Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- Рекомендовано пожизненное диспансерное наблюдение пациентов с НЭО после завершения лечения с учетом локализации, типа и статуса опухоли (в течение всей жизни) с соблюдением следующей частоты обследований пациента:
- в 1-ый и 2-ой годы – 1 раз в 3 мес.;
- в 3–5-й годы – 1 раз в 6 мес.;
- после 5 лет – 1 раз в год [54-57].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: Задачей наблюдения является раннее выявление прогрессирования заболевания в целях раннего начала лекарственной терапии или хирургического лечения в случае хирургически операбельных клинических ситуаций. Объем обследования определяется с учетом локализации, типа и статуса опухоли - см. табл. 16 в приложении Б.
- Рекомендуется после оперативного лечения ФХЦ/ПГ при отрицательном послеоперационном уровне метанефринов в целях диагностики возможного местного рецидива, метастатического поражения, появления новой опухоли ежегодное определение уровня метанефринов и проведение топической диагностики один раз в 2–3 года [35, 37].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Информация
Источники и литература
-
Клинические рекомендации Ассоциации онкологов России
- Клинические рекомендации Ассоциации онкологов России - 1. Yao J.C., Hassan M., Phan A. et al. One hundred years after “carcinoid”: epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. J Clin Oncol 2008; 26:3063–72. 2. Kvols L.K. Metastatic carcinoid tumors and the malignant carcinoid syndrome. Ann N Y Acad Sci 1994; 733:464–70. 3. Eriksson B., Klöppel G., Krenning E. et al. Consensus guidelines for the management of patients with digestive neuroendocrine tumors – welldifferentiated jejuna-ileal tumor/carcinoma. Neuroendocrinology 2008; 87:8–19. 4. Ruszniewski P., Ish-Shalom S., Wymenga M. et al. Rapid and sustained relief from the symptoms of carcinoid syndrome: results from an open 6-month study of the 28-day prolonged-release formulation of lanreotide. Neuroendocrinology 2004;80(4):244–51. 5. Rinke A., Müller H.H., Schade-Brittinger C. et al. PROMID Study Group. Placebocontrolled, double-blind, prospective, randomized study on the effect of octreotide LAR in the control of tumor growth in patients with metastatic neuroendocrine midgut tumors: a report from the PROMID Study Group. J Clin Oncol 2009;27(28):4656–63. DOI: 10.1200/JCO.2009.22.8510. 6. Caplin M.E., Pavel M., Ćwikła J.B. et al. CLARINET Investigators. Lanreotide in metastatic enteropancreatic neuroendocrine tumors. N Engl J Med 2014;371(3):224–33. DOI: 10.1056/NEJMoa1316158. 7. Martín-Richard M., Massutí B., Pineda E. et al. TTD (Tumores del Tracto Digestivo) Study Group. Antiproliferative effects of lanreotide autogel in patients with progressive, well-differentiated neuroendocrine tumours: a Spanish, multicentre, open-label, single arm phase II study. BMC Cancer 2013; 13:427. DOI: 10.1186/1471-2407-13-427. 8. Jann H., Denecke T., Koch M. et al. Impact of octreotide long- acting release on tumour growth control as a first-line treatment in neuroendocrine tumours of pancreatic origin. Neuroendocrinology 2013;98(2):137–43. DOI: 10.1159/000353785. 9. Oberg K. Interferon-alpha versus somatostatin or the combination of both in gastroenteropancreatic tumours. Digestion 1996;57 Suppl 1:81–3. 10. Raymond E., Dahan L., Raoul J.L. et al. Sunitinib malate for the treatment of pancreatic neuroendocrine tumors. N Engl J Med 2011;364(6):501–13. DOI: 10.1056/NEJMoa1003825. 11. Yao J.C., Shah M.H., Ito T. et al. RAD001 in Advanced neuroendocrine Tumors, 3rd Trial (RADIANT-3) Study Group. Everolimus for advanced pancreatic neuroendocrine tumors. N Engl J Med 2011;364(6):514–23. DOI: 10.1056/NEJMoa1009290. 12. Panzuto F., Rinzivillo M., Fazio N. et al. Real-world study of everolimus in advanced progressive neuroendocrine tumors. Oncologist 2014;19(9):966–74. DOI: 10.1634/theoncologist.2014-0037. 13. Kamp K., Gumz B., Feelders R.A. et al. Safety and efficacy of everolimus in gastrointestinal and pancreatic neuroendocrine tumors after (177) Lu-octreotate. Endocr Relat Cancer 2013;20(6):825–31. DOI: 10.1530/ERC- 13-0254. 14. Hadoux J., Malka D., Planchard D. et al. Post-first-line FOLFOX chemotherapy for grade 3 neuroendocrine carcinoma. Endocr Relat Cancer 2015;22(3):289–98. DOI: 10.1530/ERC- 15-0075. 15. Welin S., Sorbye H., Sebjornsen S. et al. Clinical effect of Temozolomide-based chemotherapy in poorly differentiated endocrine carcinoma after progression on first-line chemotherapy. Cancer 2011;117(20):4617–22. DOI: 10.1002/cncr.26124. 16. Moertel C.G., Kvols L.K., O’Connell M.J., Rubin J. Treatment of neuroendocrine carcinomas with combined etoposide and cisplatin. Evidence of major therapeutic activity in the anaplastic variants of these neoplasms. Cancer 1991;68(2):227–32. 17. Bajetta B., Rimassa L., Carnaghi C. et al. 5-fluorouracil, dacarbazine, and epirubicin in the treatment of patients with neuroendocrine tumors. Cancer 1998; 83:372–8. 18. Ekeblad S., Sundin A., Janson E.T. et al. Temozolomide as monotherapy is effective in treatment of advanced malignant neuroendocrine tumors. Clin Cancer Res 2007;13:2986–91. 19. . Bajetta E., Catena L., Procopio G. et al. Are capecitabine and oxaliplatin (XELOX) suitable treatments for progressing low-grade and high-grade neuroendocrine tumours? Cancer Chemother Pharmacol 2007; 59:637–42. 20. Cassier P.A., Walter T., Eymard B. et al. Gemcitabine and oxaliplatin combination chemotherapy for metastatic well-differentiated neuroendocrine carcinomas: a single-center experience. Cancer 2009; 115:3392–9. 21. Wells S.A., Asa S.L., Dralle H. et al. Revised American Thyroid Association guidelines for the management of medullary thyroid carcinoma. The American Thyroid Association Guidelines Task Force on Medullary Thyroid Carcinoma. Thyroid 2015;25(6):567–610. 22. Sippel R.S., Kunnimalaiyaan M., Chen H. et al. Current management of medullary thyroid cancer. Oncologist 2008;13(5):539–47. 23. Румянцев П.О. Рак щитовидной железы: Современные подходы к диагностике и лечению. М.: ГЭОТАР-Медиа, 2009. 448 с. 24. Roman S., Lin R., Sosa J.A. Prognosis of medullary thyroid carcinoma: demographic, clinical, and pathologic predictors of survival in 1252 cases. Cancer 2006; 107:2134–42. 25. NCCN Clinical Practice Guidelines in Oncology. Thyroid carcinoma: Version 1.2018. National Comprehensive Cancer Network. Available at https://www.nccn.org/professionals/physician_gls/pdf/thyroid.pdf. 26. Valerio L., Pieruzzi L., Giani C. et al. Targeted therapy in thyroid cancer: state of the art. Clin Oncol (R Coll Radiol) 2017;29:316–24. 27. Wells S.A., Robinson B.G., Gagel R.F. et al. Vandetanib in patients with locally advanced or metastatic medullary thyroid cancer: a randomized, double-blind phase III trial. J Clin Oncol 2012;30(2):134–41. 28. Capdevila J, et al, Evaluation of the efficacy and safety of lanreotide in combination with targeted therapies in patients with neuroendocrine tumors in clinical practice: a retrospective cross-sectional analysis BMC Cancer 2015;15:495 DOI 10.1186/s12885-015-1512-6 29. Bajetta E et al Everolimus in combination with octreotide long-acting repeatable in a first-line setting for patients with neuroendocrine tumors: an ITMO group study. Cancer 2014; 120: 2457-2463 30. Yao JC, et al. N Engl J Med 2011;364:514–523 31. Albertelli M et al. Safety and Efficacy of High Doses Lanreotide Treatment in Patients with Progressive Neuroendocrine Tumors: Results from a Prospective Phase II Trial Abstract 1929 14th Annual ENETS conference (2017) 32. Martucci VL, Pacak K. Pheochromocytoma and paraganglioma: diagnosis, genetics, management, and treatment. Curr Probl Cancer 2014; 38 (1): 7–41 33. Lenders JW, Pacak K, WaltherMM, et al. Biochemical diagnosis of pheochromocytoma: which test is best? JAMA. 2002; 287:1427–1434. 34. Mullins F, O’Shea P, FitzGerald R, Tormey W. Enzyme-linked immunoassay for plasma-free metanephrines in the biochemical diagnosis of phaeochromocytoma in adults is not ideal. Clin Chem Lab Med. 2012; 50:105–110. 35. Lenders JWM, Duh Q-Y, Eisenhofer G, Gimenez-Roqueplo A-P, Grebe SKG, Murad MH, Naruse M, Karel Pacak K, Young WFJ. Pheochromocytoma and Paraganglioma: An Endocrine Society Clinical Practice Guideline. The Journal of Clinical Endocrinology & Metabolism.2014; 99(6):1915–1942 36. Janssen I, Blanchet E M, Adams K, Chen C C, Millo C M, Herscovitch P, et al. Superiority of [68Ga]-DOTATATE PET/CT to Other Functional Imaging Modalities in the Localization of SDHB-Associated Metastatic Pheochromocytoma and Paraganglioma. Clinical cancer research: an official journal of the American Association for Cancer Research 2015;17(21):3888-95. 37. Plouin PF, Amar L, Dekkers OM, Fassnacht M, Gimenez-Roqueplo AP, Lenders JW, Lussey-Lepoutre C, Steichen O; Guideline Working Group. European Society of Endocrinology Clinical Practice Guideline for long-term follow-up of patients operated on for a phaeochromocytoma or a paraganglioma. Eur J Endocrinol. 2016 May;174(5):G1-G10. 38. Goers TA, Abdo M, Moley JF, Matthews BD, Quasebarth M, Brunt LM. Outcomes of resection of extra-adrenal pheochromocytomas/ paragangliomas in the laparoscopic era: a comparison with adrenal pheochromocytoma. Surg Endosc. 2013; 27:428–433. 39. P Nockel, M El Lakis, A Gaitanidis, L Yang, R Merkel, E Kebebew. - Preoperative genetic testing in pheochromocytomas and paragangliomas influences the surgical approach and the extent of adrenal surgery. - Surgery (2017), doi: 10.1016/j.surg.2017.05.025 40. Plouin PF, Amar L, Dekkers OM, Fassnacht M, Gimenez-Roqueplo AP, Lenders JW, Lussey-Lepoutre C, Steichen O; Guideline Working Group. European Society of Endocrinology Clinical Practice Guideline for long-term follow-up of patients operated on for a phaeochromocytoma or a paraganglioma. Eur J Endocrinol. 2016 May;174(5): G1-G10. 41. Baudin et al. European Journal of Endocrinology (2014) - Therapy for malignant chromaffin tumors. 42. Neuroendocrinology. ENETS 2017 Consensus Guidelines for the Standards of Care in Neuroendocrine Tumors. Vol.105, №3, 2017Б р.192-330///]. 43. Neuroendocrinology 2015; 101: 1-17 The Status of Neuroendocrine Tumor Imaging: From Darkness to Light? Lisa Bodei, Anders Sundin, Mark Kidd, Vikas Prasad, Irvin M. Modlin 44. Visc Med 2017; 33:358–366 Theranostics of Neuroendocrine Tumors Sze Ting Lee, Harshad R. Kulkarni, Aviral Singh, Richard P. Baum 45. Taïeb, D., Hicks, R.J., Hindié, E. et al. Eur J Nucl Med Mol Imaging (2019) 46: 2112 46. Revised American Thyroid Association Guidelines for the Management of Medullary Thyroid Carcinoma The American Thyroid Association Guidelines Task Force on Medullary Thyroid Carcinoma Thyroid. 2015 Jun 1; 25(6): 567–610. 47. Cancers (Basel). 2018 Dec; 10(12): 510. Management of Typical and Atypical Pulmonary Carcinoids Based on Different Established Guidelines Rohit Gosain, Sarbajit Mukherjee, Sai S. Yendamuri, and Renuka Iyer 48. Shah M. H. et al. NCCN guidelines insights: neuroendocrine and adrenal tumors, version 2.2018 //Journal o f the National Comprehensive Cancer Network. – 2018. – Т. 16. – №. 6. – С. 693-702. 49. Bichakjian C. K. et al. Merkel cell carcinoma, version 1.2018, NCCN clinical practice guidelines in oncology //Journal of the National Comprehensive Cancer Network. – 2018. – Т. 16. – №. 6. – С. 742-774. 50. Bushnell DL, Baum RP. Standard imaging techniques for neuroendocrine tumors. Endocrinol. Metab. Clin. N. Am. 2011; 40:153–162. 51. Yamaguchi T, et al: Multicenter retrospective analysis of systemic chemotherapy for advanced neuroendocrine carcinoma of the digestive system. Cancer Sci 2014; 105: 1176–1181. 52. Sorbye H, et al: Predictive and prognostic factors for treatment and survival in 305 patients with advanced gastrointestinal neuroendocrine carcinoma (WHO G3): the NORDIC NEC study. Ann Oncol 2013; 24: 152–160. 53. Neuroendocrinology ENETS 2016 Consensus Guidelines for the Management of Patients with Digestive Neuroendocrine Tumors: An Update2016;103:186–194 54. NCCN Clinical Practice Guidelines in Oncology. Neuroendocrine tumors: Version 2.2017. National Comprehensive Cancer Network. 55. Öberg K. et al. Neuroendocrine bronchial and thymic tumors: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up //Annals of oncology. – 2012. – Т. 23. – №. suppl_7. – С. vii120-vii123. 56. Öberg K. et al. Neuroendocrine gastroenteropancreatic tumours: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up //Annals of Oncology. – 2010. – Т. 21. – №. suppl_5. – С. v223-v227. 57. Knigge U. et al. ENETS consensus recommendations for the standards of care in neuroendocrine neoplasms: follow-up and documentation //Neuroendocrinology. – 2017. – Т. 105. – №. 3. – С. 310-319. 58. Cifu D. X., Lew H. L. Braddom s Rehabilitation Care: A Clinical Handbook E-Book. – Elsevier Health Sciences, 2017. 59. Van den Berg J. P. et al. Guideline" Cancer rehabilitation" //Nederlands tijdschrift voor geneeskunde. – 2011. – Т. 155. – №. 51. – С. A4104. 60. Fu J. B., Morishita S. The future of rehabilitation in oncology. – 2017. 61. Blesch K. S. Rehabilitation of the cancer patient at home //Seminars in oncology nursing. – WB Saunders, 1996. – Т. 12. – №. 3. – С. 219-225. 62. Sundin A. et al. ENETS consensus guidelines for the standards of care in neuroendocrine tumors: radiological, nuclear medicine and hybrid imaging //Neuroendocrinology. – 2017. – Т. 105. – №. 3. – С. 212-244. 63. Muth A. et al. Genetic testing and surveillance guidelines in hereditary pheochromocytoma and paraganglioma //Journal of internal medicine. – 2019. – Т. 285. – №. 2. – С. 187-204. 64. Därr R. et al. Accuracy of recommended sampling and assay methods for the determination of plasma-free and urinary fractionated metanephrines in the diagnosis of pheochromocytoma and paraganglioma: a systematic review. – 2017. 65. Баранова О. Д. и др. Радионуклидная визуализация и терапия у пациентов с нейроэндокринными опухолями //Эндокринная хирургия. – 2017. – Т. 11. – №. 4. 66. Bombardieri E. et al. 111 In-pentetreotide scintigraphy: procedure guidelines for tumour imaging //European journal of nuclear medicine and molecular imaging. – 2010. – Т. 37. – №. 7. – С. 1441-1448. 67. Kjaer A., Knigge U. Use of radioactive substances in diagnosis and treatment of neuroendocrine tumors //Scandinavian journal of gastroenterology. – 2015. – Т. 50. – №. 6. – С. 740-747. 68. Arora, G., & Bandopadhyaya, G. (2018). Paradigm shift in theranostics of neuroendocrine tumors: conceptual horizons of nanotechnology in nuclear medicine. Annals of Nuclear Medicine, 32(3), 151–164. doi:10.1007/s12149-018-1235-2 69. Raphael M. J. et al. Principles of diagnosis and management of neuroendocrine tumours //CMAJ. – 2017. – Т. 189. – №. 10. – С. E398-E404. 70. Rinke A. et al. Placebo-controlled, double-blind, prospective, randomized study on the effect of octreotide LAR in the control of tumor growth in patients with metastatic neuroendocrine midgut tumors (PROMID): results of long-term survival //Neuroendocrinology. – 2017. – Т. 104. – №. 1. – С. 26-32. 71. Rinke A. et al. Placebo-controlled, double-blind, prospective, randomized study on the effect of octreotide LAR in the control of tumor growth in patients with metastatic neuroendocrine midgut tumors: a report from the PROMID Study Group //J Clin Oncol. – 2009. – Т. 27. – №. 28. – С. 4656-4663. 72. Caplin M. E. et al. CLARINET Investigators. Lanreotide in metastatic enteropancreatic neuroendocrine tumors. N Engl J Med. 2014 Jul 17;371(3):224-33. doi: 10.1056/NEJMoa1316158. PMID: 25014687. 73. Diamantopoulos L.N. et al. Antiproliferative Effect of Above-Label Doses of Somatostatin Analogs for the Management of Gastroenteropancreatic Neuroendocrine Tumors. Neuroendocrinology. 2021;111(7):650-659. doi: 10.1159/000509420. Epub 2020 Jun 15. PMID: 32541155. 74. Kölby, L., Persson, G., Franzén, S., & Ahrén, B. (2003). Randomized clinical trial of the effect of interferon α on survival in patients with disseminated midgut carcinoid tumours. British Journal of Surgery, 90(6), 687–693. doi:10.1002/bjs.4149 75. Al-Toubah T, Morse B, Pelle E, Strosberg J. Efficacy of FOLFOX in Patients with Aggressive Pancreatic Neuroendocrine Tumors After Prior Capecitabine/Temozolomide. Oncologist. 2021 Feb;26(2):115-119. doi: 10.1002/onco.13611. Epub 2020 Dec 8. PMID: 33225478; PMCID: PMC7873336.
Информация
Список сокращений
АГ – артериальная гипертония
АСЗК – артериально-стимулированный забор крови
АСС – соматостатин и его аналоги
АКТГ – адренокортикотропный гормон
БДУ – без дополнительного уточнения
в/в – внутривенно
ВИП – вазоинтестинальный пептид
ВОЗ – Всемирная организация здравоохранения
ЖКТ – желудочно-кишечный тракт
ИГХ – иммуногистохимический
КТ – компьютерная томография
МРТ – магнитно-резонансная томография
МРЩЖ – медуллярный рак щитовидной железы
МЭН – множественные нейроэндокринные неоплазии
НСЕ – нейронспецифическая енолаза
НЭО – нейроэндокринные опухоли
НЭК – нейроэндокринный рак
ОФЭКТ – однофотонная эмиссионная компьютерная томография
ПГ – параганглиома
ПЖ – поджелудочная железа
ПП – панкреатический полипептид
ПТГ – паратиреоидный гормон
ПРРТ – пептид-рецепторная радионуклидная терапия
ПЭТ – позитронная эмиссионная томография
ПЭТ-КТ - позитронная эмиссионная томография, совмещённая с компьютерной томографией
РНТ - радионуклидная терапия
РФЛП – радиофармацевтический лекарственный препарат
СТС – сцинтиграфия рецепторов соматостатина,
УЗИ – ультразвуковое исследование
ФХЦ – феохромоцитома
ХгА – хромогранин А
ХТ – химиотерапия
5-ГИУК – 5-гидроксииндолилуксусная кислота
ENETS (European Neuroendocrine Tumor Society) – Европейское общество по лечению нейроэндокринных опухолей
18F-ФДГ- флудезоксиглюкоза [18F]
18F-L-DOPA - 18F-фтор-L-3,4-дигидроксифенилаланин
G (grade) – степень злокачественности
68Ga-DOTATATE - 68 gallium [68Ga] DOTA-(Tyr3)- octreotate
68Ga-DOTATOC - 68Ga DOTA- (Phe1)-(Tyr3)- octreotide
68Ga-DOTANOC - 68Ga - DOTA-(Nal3)-octreotide
MINEN (mixed neuroendocrine and -non-neuroendocrine neoplasm) – смешанная нейроэндокринная и -не-нейроэндокринная неоплазия
NEC (neuroendocrine carcinoma) – нейроэндокринная карцинома
NET (neuroendocrine tumor) – нейроэндокринная опухоль
NOS (not otherwise specified) – не указано иное
NT-proBNP – N-концевой мозговой натрийуретический пропептид
SEER (Surveillance, Epidemiology, and End Results) – выживаемость, эпидемиология и конечные результаты
STS- Somatostatin Receptor Scintigraphy
99mTc- HYNIC-D-(Phe1)-(Tyr3)-octreotide
** – жизненно необходимые и важнейшие лекарственные препараты
# – препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл)
Термины и определения
Нейроэндокринные опухоли – высокодифференцированные неоплазии, развивающиеся из нейроэндокринных клеток.
Нейроэндокринный рак – низкодифференцированные неоплазии, развивающиеся из нейроэндокринных клеток.
Аналоги соматостатина (H01CB соматостатин и аналоги) химические соединения, являющиеся аналогами естественного гормона – соматостатина.
Биотерапия – метод лечения с применением интерферонов и аналогов соматостатина.
Системная химиотерапия (ХТ) – метод лечения с применением цитостатических препаратов.
Таргетная терапия – метод лечения с применением препаратов молекулярно-направленного механизма действия.
Иммунотерапия – метод лечения с применением ингибиторов контрольных точек иммунитета.
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
1. Основные требования к взятию биологического материала и исследованию маркеров нейроэндокринных опухолей
-
Взятие крови на биохимические маркеры проводится в утренние часы до выполнения любых диагностических и лечебных мероприятий (в том числе биотерапии) со строгим соблюдением необходимых преаналитических факторов, включая 12-часовое голодание.
-
Забор крови для определения уровня метанефринов в крови рекомендовано проводить в положении лежа после 30-минутного горизонтального положения.
-
Определение хромогранина A в крови и исследование уровня гастрина сыворотки крови необходимо проводить после ингибиторов протонного насоса (A02BC) за 1–2 нед., блокаторов H2-гистаминовых рецепторов (A02BC) за 1–2 дня, до введения соматостатина и аналогов (H01CB).
-
Исследование уровня серотонина, его предшественников и метаболитов в крови и исследование уровня 5-гидроксииндолуксусной кислоты (5-ОИУК) в моче необходимо проводить после исключения в течение 2–3 сут ряда продуктов питания (бананы, авокадо, сливы, ананасы, баклажаны, помидоры, грецкие орехи, шоколад, кофе) и лекарственных препаратов, влияющих на уровни исследуемых показателей.
-
Для определения специфических пептидов (соматостатин, ПП, ВИП, глюкагон) необходимо проводить взятие крови в специальные пробирки вакуумные для забора венозной крови с К2ЭДТА, апротинином/ с K3ЭДТА и апротинином.
-
Сбор суточной мочи для исследования уровня 5-гидроксииндолуксусной кислоты (5-ОИУК) в моче проводится с использованием консерванта (лимонная кислота).
-
Серийные исследования маркеров должны выполняться с использованием одинаковых тест-систем на базе одной специализированной лаборатории. При переходе на другую тест-систему пациентам должны устанавливаться новые базальные уровни. Результаты и референсные значения, полученные при использовании тест-систем разных производителей, не должны сравниваться.
-
Инструкция по подготовке пациентов к исследованию биохимических маркеров выдается в лаборатории.
Критерии оценки качества медицинской помощи
|
№
|
Критерии качества
|
Оценка выполнения
|
|---|---|---|
|
1
|
Выполнена рентгенография и/или КТ органов грудной клетки (при установлении диагноза)
|
Да/Нет
|
|
2
|
Выполнено КТ органов брюшной полости и/или МРТ органов брюшной полости (при установлении диагноза)
|
Да/Нет
|
|
3
|
Выполнено КТ органов малого таза и/или МРТ органов малого таза (при установлении диагноза)
|
Да/Нет
|
|
4
|
Выполнено сцинтиграфия костей всего тела при подозрении на поражение костей
|
Да/Нет
|
|
5
|
Выполнена биопсия опухоли и/или метастатических очагов (при установлении диагноза)
|
Да/Нет
|
|
6
|
Выполнено патологоанатомическое исследование биопсийного (операционного) материала с применением иммуногистохимических методов определения индекса пролиферативной активности экспрессии Ki-67.
|
Да/Нет
|
|
7
|
Выполнена терапия АCС и/или ХТ и/или биотерапия интерферонами и/или таргетная терапия и/или иммунотерапия, при наличии морфологической верификации диагноза и при наличии медицинских показаний – метастатическая нейроэндокринная опухоль или карцинома.
|
Да/Нет
|
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
-
Артамонова Е.В., д.м.н., профессор, заведующая отделением противоопухолевой лекарственной терапии №1 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
-
Бельцевич Д.Г., д.м.н., профессор, главный научный сотрудник ФГБУ «Эндокринологический научный центр» Минздрава России.
-
Бохян В.Ю., д.м.н., заведующий хирургическим отделением №2 (диагностики опухолей) ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
-
Гелиашвили Т.М., к.м.н., заведующая отделением радионуклидной терапии отдела радионуклидной диагностики и терапии ФГБУ «НМИЦ Онкологии им. Н.Н. Блохина» Минздрава России.
-
Горбунова В.А., д.м.н., профессор, ведущий научный сотрудник отделения химиотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
-
Делекторская В.В., д.м.н., профессор, ведущий научный сотрудник, врач-патологоанатом патологоанатомического отделения ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
-
Долгушин М.Б., д.м.н., профессор РАН и РМАНПО, заведующий отделением ПЭТ ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
-
Егоров А.В., д.м.н., профессор, заведующий отделением онкологической хирургии УКБ 1 ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России.
-
Емельянова Г.С., к.м.н., ассистент кафедры онкологии ФДПО ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России.
-
Жукова Л.Г., д.м.н., заместитель директора ГБУЗ «Московский клинический научный центр имени А.С. Логинова ДЗМ»
-
Жуликов Я.А., врач-онколог отделения противоопухолевой лекарственной терапии №1 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
-
Каспшик С.М., врач отделения ПЭТ ФГБУ «НМИЦ Онкологии им. Н.Н. Блохина» Минздрава России.
-
Крылов А.С., к.м.н., доцент, заведующий отделением радионуклидной диагностики №1 «НМИЦ Онкологии им. Н.Н. Блохина» Минздрава России;
-
Кузьминов А.Е., к.м.н., научный сотрудник отделения биотехнологий № 1 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
-
Любимова Н.В., д.б.н., ведущий научный сотрудник лаборатории клинической биохимии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина Минздрава России, профессор кафедры биохимии и лабораторной диагностики ФДПО ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России.
-
Маркович А.А., к.м.н., старший научный сотрудник поликлинического отделения ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
-
Мельниченко Г.А., д.м.н., профессор, академик РАН, Заместитель директора по научной работе ФГБУ «НМИЦ эндокринологии» Министерства здравоохранения Российской Федерации.
-
Орел Н.Ф., д.м.н., профессор кафедры онкологии и паллиативной медицины ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России.
-
Орлов С.В., член-корр. РАН, д.м.н., профессор, ведущий научный сотрудник отдела онкологии ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. И.П. Павлова» Минздрава России.
-
Орлова К.В., к.м.н., старший научный сотрудник отделения биотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
-
Орлова Р.В., д.м.н., профессор, заведующая кафедрой онкологии медицинского факультета ФГБОУ ВО «Санкт-Петербургский государственный университет», главный специалист по клинической онкологии ГБУЗ СПБГОД.
-
Пронин А.И., к.м.н., заведующий отделом радионуклидной диагностики и терапии ФГБУ «НМИЦ Онкологии им. Н.Н. Блохина» Минздрава России
-
Романов И.С., к.м.н., старший научный сотрудник отделения опухолей головы и шеи ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
-
Трифанов В.С., к.м.н., старший научный сотрудник ФГБУ «Ростовский научно-исследовательский онкологический институт» Минздрава России.
-
Хомяков В.М., заведующий Торакоабдоминального хирургического отделения Отдела торакоабдоминальной онкохирургии МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России.
-
Петров Л.О., заведующий отделения лучевого и хирургического лечения заболеваний абдоминальной области МРНЦ им. А.Ф. Цыба- филиал ФГБУ «НМИЦ радиологии» Минздрава России.
-
Пирогов С.С., заведующий Отдела эндоскопии МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России.
-
Феденко А.А., заведующий Отдела лекарственного лечения опухолей МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России.
-
Болотина Л.В., заведующая Отделения химиотерапии Отдела лекарственного лечения опухолей МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России.
-
Фалалеева Н.А., заведующая отделом лекарственного лечения злокачественных новообразований МРНЦ им. А.Ф. Цыба- филиал ФГБУ «НМИЦ радиологии» Минздрава России.
-
Филоненко Е.В., заведующая Центра лазерной и фотодинамической диагностики и терапии опухолей МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Блок по организации медицинской помощи:
-
Невольских A.A., д.м.н., заместитель директора по лечебной работе МРНЦ им. А.Ф. Цыба — филиала ФГБУ «НМИЦ радиологии» Минздрава России.
-
Хайлова Ж.В., к.м.н. заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России.
-
Иванов С.А., д.м.н., профессор, член-корреспондент РАН, заслуженный врач РФ, директор МРНЦ им. А.Ф. Цыба — филиала ФГБУ «НМИЦ радиологии» Минздрава России, главный внештатный специалист-онколог ЦФО Минздрава России.
-
Геворкян Т.Г., заместитель директора по реализации федеральных проектов ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
Конфликта интересов нет.
Все члены рабочей группы подтвердили отсутствие конфликта интересов/финансовой поддержки, о которых необходимо сообщить.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
-
врачи-онкологи;
-
врачи-хирурги;
-
врачи-радиологи;
-
врачи-эндокринологи;
-
врачи-патологоанатомы;
-
студенты медицинских вузов, ординаторы и аспиранты.
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных; анализ современных научных разработок по проблеме в России и за рубежом; обобщение практического опыта российских и зарубежных специалистов.
Таблица 1
Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
|
УДД
|
Расшифровка
|
|---|---|
|
1
|
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
|
|
2
|
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
|
|
3
|
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая
|
|
5
|
Имеется лишь обоснование механизма действия или мнение экспертов
|
Таблица 2.
Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
|
УДД
|
Расшифровка
|
|---|---|
|
1
|
Систематический обзор РКИ с применением мета-анализа
|
|
2
|
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа
|
|
3
|
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль»
|
|
5
|
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
|
Таблица 3.
Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
|
УУР
|
Расшифровка
|
|---|---|
|
A
|
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
|
|
B
|
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
|
|
C
|
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
|
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Методы, использованные для формулирования рекомендаций – консенсус экспертов.
Экономический анализ
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций:
-
внешняя экспертная оценка;
-
внутренняя экспертная оценка.
Описание метода валидизации рекомендаций
Настоящие рекомендации в предварительной версии рецензированы независимыми экспертами, которые попросили прокомментировать прежде всего, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался, и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Для окончательной редакции и контроля качества рекомендации повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Обновления клинических рекомендаций: актуализация проводится не реже чем 1 раз в 3 года с учетом появившейся новой информации о диагностике и тактике ведения пациентов с НЭО. Решение об обновлении принимает Минздрав России на основе предложений, представленных медицинскими профессиональными некоммерческими организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
При отборе публикаций как потенциальных источников доказательств использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее достоверности.
Результат изучения влияет на уровень доказательств, присваиваемый публикации, что в свою очередь влияет на силу вытекающих из нее рекомендаций.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Актуальные инструкции по применению лекарственных препаратов расположены на официальном сайте Минздрава России http://grls.rosminzdrav.ru/Default.aspx
Приложение Б. Алгоритмы действий врача
Блок 1. Первичное операбельных НЭН ЖКТ.
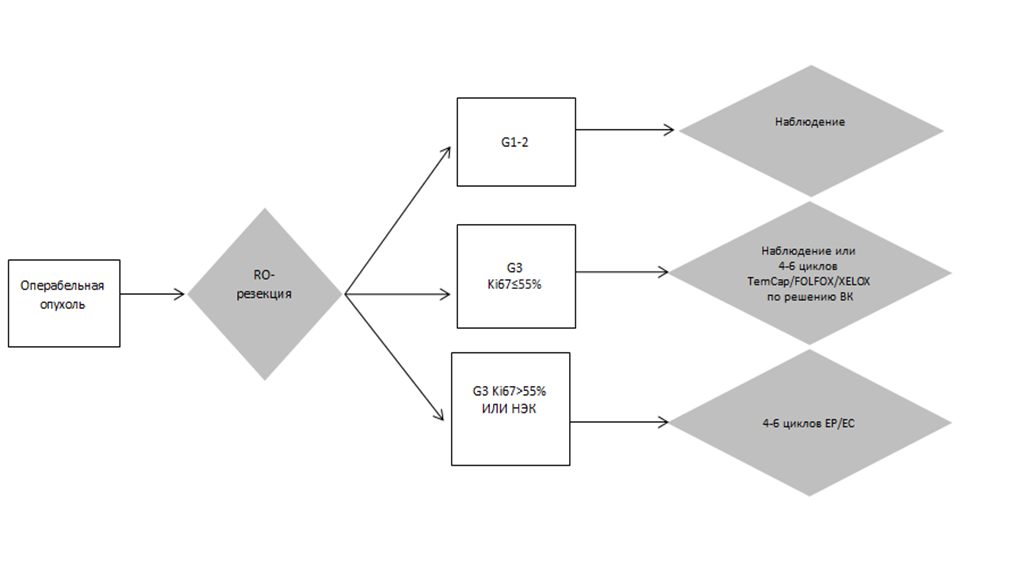
Блок 2. Алгоритм лечения местнораспространенных или метастатических НЭН ЖКТ.
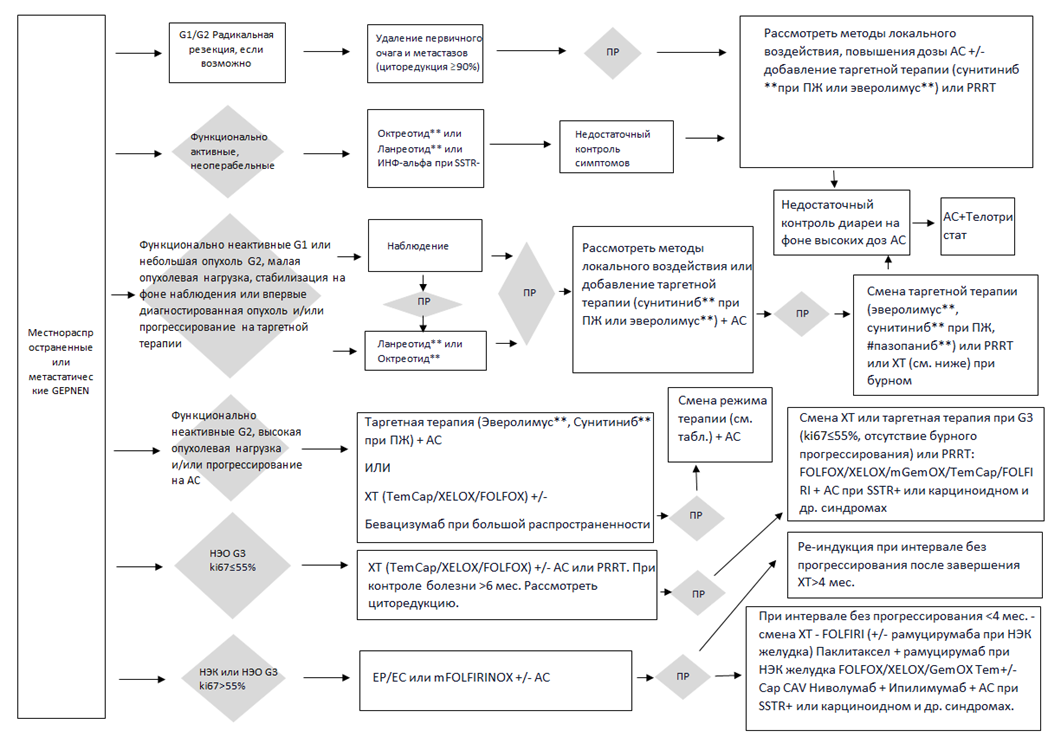
Примечание: # - см. соответствующие тезисы-рекомендации
Блок 3. Алгоритм выбора лечения при рецидивных и метастатических НЭО
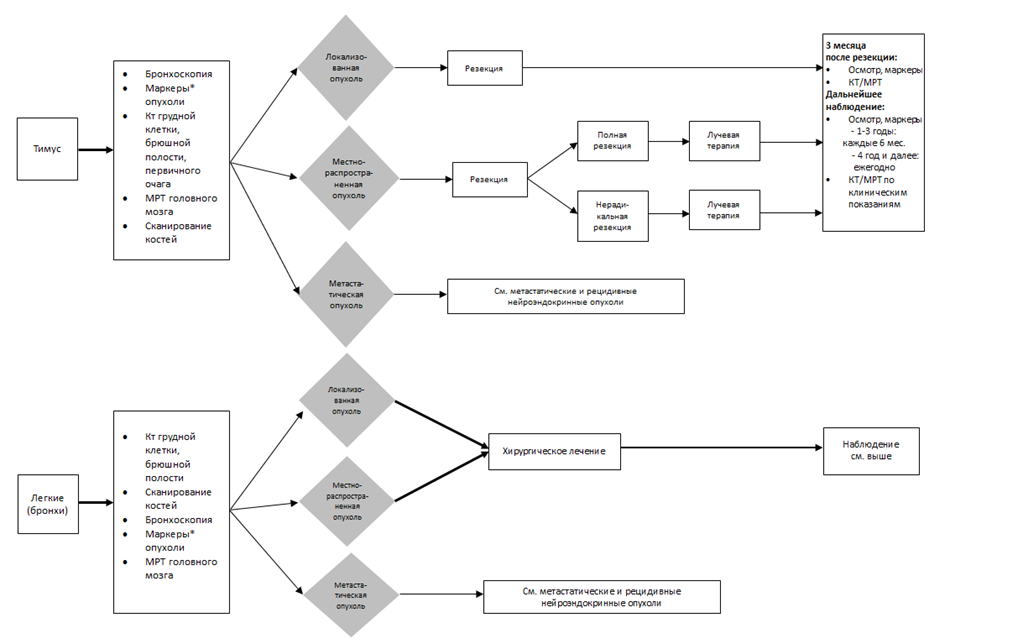
Лабораторное и инструментальное обследование пациентов с нейроэндокринными опухолями
Таблица 15.
Рекомендации по использованию маркеров НЭО (ENETS Consensus Guidelines, 2017)
|
Тип НЭО
|
Маркеры
|
|---|---|
|
|
|
|
Нефункционирующие
|
· ХгА
· ПП (НЭО ПЖ)
· НСЕ (НЭО легких и тимуса G2–3)
|
|
Функционирующие
|
· ХгА
· ПП (НЭО ПЖ и ЖКТ)
· НСЕ (НЭО легких и тимуса G2–3)
Дополнительные маркеры в соответствии с клинической картиной:
Карциноидный синдром
· 5-ГИУК
· Серотонин
Эутопическая и эктопическая гиперсекреция гормонов
· Гастрин + PH-метрия
· Инсулин + С-пептид + гликемия
· Глюкагон
· Соматостатин
· ВИП
· АКТГ, кортизол
· Кальцитонин
· ПТГ
· Пролактин
Карциноидная болезнь сердца
· Pro-BNP: ежегодно для наблюдения пациентов с карциноидным синдромом с целью выявления и контроля течения карциноидной болезни сердца
|
Таблица 16.
Рекомендации по наблюдению пациентов с НЭО с учетом локализации, типа и статуса опухоли (в течение всей жизни)
| Локализация | Тип опухоли | Статус опухоли | Срок наблюдения, мес | Биохимические маркеры | Эндоскопия | КТ/ МРТ /УЗИ мес | СРС мес | ПЭТ с 18Г18РФДГ, мес |
| Легкие | Типичный карциноид | Резецированная | 6-12 | ХгА, 5-ГИУК, серотонин | Бронхоскопия, 5-10 лет | 6-12 | 12-36 | - |
| Резидуальная/метастатическая | 3-6 | Бронхоскопия, 5-10 лет | 3-6 | 12-36 | 12-24 | |||
| Атипичный карциноид | Резецированная | 3-6 | ХгА, 5-ГИУК, серотонин, НСЕ, АКТГ, кортизол, антидиуретичес кий гормон, гистамин | Бронхоскопия, 1-3 года | 6 | 12-24 | 12-24 | |
| Резидуальная/метастатическая | 3 | Бронхоскопия, 1-3 года | 3-6 | 12-24 | 12-2 | |||
| Крупноклеточная NEC | Резецированная/нерезецированная | 2-3 | ХгА, НСЕ, 5-ГИУК, серотонин | Бронхоскопия при наличии симптомов | 2-3 | 12-24 | 12-24 | |
| Тимус | Типичный карциноид | Резецированная/рези | 6-12 | ХгА | - | 6-12 | 12-36 | 12-36 |
| Атипичный карциноид | дуальная/метастатическая | 3-6 | ХгА, НСЕ, АКТГ | - | 3-6 | 12-24 | 6-24 | |
| Низкодифференцированная NEC | Резецированная/нерезецированная | 2-3 | - | 3-6 | 12-24 | 6-24 | ||
| Пищевод | G1-2 | Резецированная/нерезецированная | 3 | ХгА | 12 мес или при наличии симптомов | 3-6 | 12-24 | - |
| G3 | 2-3 | 12-24 | 6-24 | |||||
| Желудок | ТИП 1, G1-2 | Резецированная/нерезецированная | 6-12 | Гастрин, ХгА, В12 | 12 мес или при наличии симптомов | - | - | - |
| ТИП 2, G1-2 | Г астрин, ХгА, В и, ПТГ, Са+ 2 | 6 - 1 2 мес или при наличии симптомов | 12 | 12-24 | - | |||
| ТИП 3, G1-3 | 2-3 | ХгА, | 2-6 | 12-24 | 12-24 | |||
| Двенадцатиперстная кишка | Гастринома, G1-2 | Резецированная | 6-12 | Г астрин, ХгА, Са+2, П ТГрН желудочного сока | 12 мес или при наличии симптомов | 12 | 12-24 | - |
| Гастринома. G1-2 | Нерезецированная | 3-6 | 6 - 1 2 мес или при наличии симптомов | 6-12 | 12-24 | - | ||
| Другие типы, G1-2 | Резецированная/нерезецированная | 3-6 | ХгА, соматостатин | 12 мес или при наличии симптомов | 6-12 | 12-24 | - | |
| G3 | 3 | ХгА | - | 3 | 12-24 | 12-24 | ||
| ПЖ | Инсулинома, G1-2 | Резецированная | 3-6 | Инсулин, С пептид, гликемия, ХгА | - | - | - | - |
| Нерезецированная | - | 3-6 | 12 | - | ||||
| Гастринома, G1-2 | Резецированная | 3-6 | Гастрин, ХгА, ПП, Са+2, ПТГ, В12, рН желудочного сока | - | 6-12 | 12-24 | - | |
| Нерезецированная | - | 3-6 | 12-24 | - | ||||
| Другие функционирующие, G1-2 | Резецированная/нерезецированная | 3-6 | ХгА, ПП, ВИП, глюкагон, соматостатин, серотонин, 5- ГИУК, АКТГ, кортизол | - | 3-6 | 12-24 | - | |
| Нефункционирующие, G1-2 | Резецированная/нере зецированная | 3-6 | ХгА, ПП | - | 3-6 | 12-24 | - | |
| G3 | Резецированная/нерезецированная | 3 | ХгА, ПП, ВИП, глюкагон, соматостатин, серотонин,5- ГИУК, АКТГ, кортизол | - | 2-3 | 12-24 | - | |
| Тонкий кишечник | G1-2 | Резецированная | 6-12 | ХгА, 5-ГИУК, серотонин | - | 6-12 | 24 | - |
| G1-2 | Резидуальная/метастатическая | 3-6 | - | 3-6 | 12 | - | ||
| G3 | Резецированная/нерезецированная | 3 | - | 2-3 | 12-24 | 12-24 | ||
| Аппендикс | G1-2, < 2 см | Резецированная | - | - | - | - | - | - |
| G1-2, > 2 см | Резецированная/нерезецированная | 3-6 | ХгА, 5-ГИУК, серотонин | - | 3-12 | 24 | - | |
| G3 | 3 | - | 2-3 | 12-24 | 12-24 | |||
| Ободочная кишка | G1-2 | Резецированная | 6-12 | ХгА, 5-ГИУК, серотонин | 12-24 мес. | 6-12 | 24 | - |
| G1-2 | Резидуальная/метастатическая | 3-6 | При наличии симптомов | 3-6 | 12 | - | ||
| G3 | Резецированная/нерезецированная | 3 | ХгА | 2-3 | 12-24 | 12-24 | ||
| Прямая кишка | G1-2, <1 см | Резецированная | 12 | ХгА | При наличии симптомов | - | - | - |
| G1-2, 1-2 см | 1 2 мес или при наличии симптомов | 3-12 | 12-24 | - | ||||
| G1-2, >2 см | 3-12 | 6—12 мес или при наличии симптомов | 3-12 | 12-24 | - | |||
| G3 | 3 | 3 | 12 | 12-24 | ||||
| Метастаз не выявленного первичного очага | G1-2 | Резецированные/метастатистическая | 3-6 | ХгА, 5-ГИУК, серотонин | - | 3-6 | 12 | - |
| G3 | 3 | - | 3 | 12 | 12-24 |
Примечание. Таблица адаптирована по “ENETS Consensus Recommendations for the Standarts of Care in Neuroendocrine Neoplasms: follow-up and documentation”, 2017.
Приложение В. Информация для пациента
Рекомендуется: при осложнениях ХТ – связаться с врачом-онкологом (химиотерапевтом).
1. При повышении температуры тела до 38 °C и выше:
-
связаться с врачом-онкологом (химиотерапевтом).
2. При стоматите:
-
диета – механическое, термическое щажение;
-
частое полоскание рта (каждый час) – ромашка, кора дуба, шалфей, смазывать рот облепиховым (персиковым) маслом;
-
обрабатывать полость рта в соответствии с назначением врача-онколога
3. При диарее:
-
диета – исключить жирное, острое, копченое, сладкое, молочное, клетчатку. Можно нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье.
-
принимать препараты в соответствии с назначением врача-онколога
4. При тошноте:
-
принимать препараты в соответствии с назначением врача-онколога
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Шкала оценки общего состояния пациента ВОЗ/ECOG
Название на русском: Шкала оценки общего состояния пациента ВОЗ/ECOG
Оригинальное название: The ECOG Scale of Performance Status
Источник: Oken M.M. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group // Am. J. Clin. Oncol. 1982. Vol. 5, № 6. P. 649–65
Тип: шкала оценки
Назначение: клиническая оценка общего состояния пациента
Содержание и интерпретация:
|
Статус (баллы)
|
Описание общего состояния пациента
|
|---|---|
|
0
|
Пациент полностью активен, способен выполнять все, как и до заболевания
|
|
1
|
Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу)
|
|
2
|
Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени проводит активно – в вертикальном положении.
|
|
3
|
Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования
|
|
4
|
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели
|
|
5
|
Смерть
|
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.