Нейробластома у детей
 Версия: Клинические протоколы МЗ РК - 2022 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2022 (Казахстан)
Злокачественное новообразование других и неточно обозначенных локализаций (C76), Злокачественное новообразование забрюшинного пространства и брюшины (C48), Злокачественное новообразование заднего средостения (C38.2), Злокачественное новообразование надпочечника (C74), Злокачественное новообразование периферических нервов и вегетативной нервной системы (C47)
Онкология детская, Педиатрия
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «19» сентября 2024 года
Протокол №214
КЛИНИЧЕСКИЙ ПРОТОКОЛ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
НЕЙРОБЛАСТОМА У ДЕТЕЙ
Нейробластома – эмбриональная злокачественная опухоль, развивающаяся из клеток нервного гребешка, из которых в норме образуется мозговой слой надпочечников и симпатические ганглии и может возникать в любой анатомической области, где располагается симпатическая нервная система: надпочечники, шейный, грудной и брюшной симпатические отделы, параганглии.
NB! Ежегодно нейробластомой заболевают 6—8 детей на 1 миллион до 15 лет, составляя около 7% от всех ЗН детского возраста. На момент обследования более чем у половины пациентов уже имеются метастазы в костном мозге, костях, лимфатических узлах, печени, кожи, ЦНС. По локализации различают нейробластомы надпочечника - более 30%, внеорганные нейробластомы забрюшинного пространства – до 30%, заднего средостения – до 15%, м
Код (ы) МКБ-10 и МКБ-9:
Дата разработки/пересмотра протокола: 2016 год (пересмотр 2022 г).
Категория пациентов: дети и подростки до 18 лет.
Сокращения, используемые в протоколе:
Шкала уровня доказательности:
Вводная часть
Код (ы) МКБ-10 и МКБ-9:
|
МКБ-10
|
МКБ-9 | ||
| Код | Название | Код | Название |
| С38.2 | Злокачественное новообразование заднего средостения | 34.02 | Диагностическая торакотомия |
| 34.3 | Иссечение или деструкция пораженного участка или ткани средостения | ||
| 34.99 | Другие манипуляции на грудной клетке. | ||
| С 48 | Злокачественное новообразование забрюшинного пространства | 54.11 | Диагностическая лапаротомия |
| 54.19 | Прочая лапаротомия | ||
| 07.22 | Односторонняя адреналэктомия | ||
| 55.39 | Другие виды локального иссечения или деструкции пораженного участка или ткани почки. | ||
| 55.51 | Нефроуретерэктомия | ||
| С 47 | Злокачественные новообразования периферических нервов и вегетативной нервной системы | 40.30 | Локальное иссечение лимфоузла |
| 34.02 | Диагностическая торакотомия | ||
| 54.11 | Диагностическая лапаротомия | ||
| 83.49 | Иссечение других тканей мягких | ||
|
С 74
|
Злокачественное новообразование надпочечника | 07.22 | Односторонняя адреналэктомия |
| С 76 | Злокачественные новообразование других и неточно обозначенных локализации | 34.99 | Другие манипуляции на грудной клетке |
| 54.00 | Другие операции на органах брюшной полости | ||
| 83.32 | Иссечение пораженного участка мышцы (кроме кисти) | ||
Дата разработки/пересмотра протокола: 2016 год (пересмотр 2022 г).
Пользователи протокола: детские онкологи/гематологи, врачи общей практики, педиатры, детские хирурги, урологи, радиологи, трансплантологи.
Категория пациентов: дети и подростки до 18 лет.
Сокращения, используемые в протоколе:
|
утоТГСК
|
Аутологичная трансплантация гемопоэтических стволовых клеток |
| ВМК | Ванилилминдальная кислота |
| ГВК | Гомованильная кислота |
| ЗН | Злокачественное новообразование |
| КМ | Костный мозг |
|
КТ
|
Компьютерная томография |
| КСФ | Колониестимулирующий фактор |
| ЛТ | Лучевая терапия |
| ЛДГ | Лактатдегидрогеназа |
| МРТ | Магнитнорезонансная томография |
| МИБГ | Метайодбензилгуанидин |
|
ОГК
|
Органы грудной клетки |
| ОБП | Органы брюшной полости |
| ОАК | Общий анализ крови |
| ПХТ | Полихимиотерапия |
| РКИ | Рандомизированное контролируемое исследование |
|
СОЭ
|
Скорость оседания эритроцитов |
| УЗИ | Ультразвуковое исследование |
| ХТ | Химиотерапия |
| ЦНС | Центральная нервная система |
| ЭКГ | Электрокардиограмма |
| ЭхоКГ | Эхокардиограмма |
|
ПО
|
Полный ответ |
| ОХЧО | Очень хороший частичный ответ |
| ЧО | Частичный ответ |
| СО | Смешанный ответ |
| НО | Нет ответа |
| ПБ | Прогрессирование заболевания |
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты которых могут быть распространены на соответствующую популяцию. |
| В |
Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию.
|
| С |
Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+), результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию.
|
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
Классификация
Классификация[1,2]
Международная система классификации нейробластомы по стадиям (INSS - International Neuroblastoma Staging System, 1987г).
| Стадия 1 |
Локализованная опухоль с полным макроскопическим удалением, с или без микроскопической резидуальной болезни; представленная ипсилатеральными лимфоузлами свободными от опухоли микроскопически (л/у прилежащие и удаленные с первичной опухолью могут быть позитивными).
Широко удаленная центрально расположенная опухоль без ипсилатеральных (стадия 2А) или контрлатеральных (стадия 2В) пораженных лимфоузлов считается 1 стадией.
|
| Стадия 2А | Локализованная опухоль, с неполным макроскопическим удалением, представленная ипсилатеральными не спаянными л/у отрицательными на наличие опухолевых клеток микроскопически. |
| Стадия 2В | Локализованная опухоль с или без полного макроскопического удаления, с ипсилатеральными не спаянными л/у, позитивными на наличие опухоли. Увеличенные контралатеральные л/у должны быть негативны микроскопически. |
| Стадия 3 |
Не удаленная односторонняя опухоль, инфильтрирующая через срединную линию, с или без вовлечения регионарных л/у, или локализованная односторонняя опухоль с пораженными контралатеральными регионарными л/у, или расположенная посредине опухоль с билатеральным распространением путем инфильтрации или поражением л/у.
Средняя линия определяется как позвоночный столб. Опухоль берет начало на одной стороне и пересекает среднюю линию, инфильтрируя или за пределы другой стороны позвоночного столба.
|
| Стадия 4 | Любая первичная опухоль с диссеминацией в отдаленные лимфоузлы, кости, костный мозг, печень или другие органы (исключая, определенную как стадия 4S). |
| Стадия 4S | Локализованная первичная опухоль (определенная как стадия 1, 2А или 2В) с диссеминацией ограниченной печенью, кожей, и/или КМ (ограниченная детьми до 1 года). Поражение костного мозга при 4S стадии должно быть минимальным, то есть менее 10% ядерных клеток в биопсии костного мозга или качественная оценка ядросодержащих клеток в КМ аспирате. Более интенсивное поражение КМ должно считаться 4 стадией. МИБГ сканирование должно быть отрицательным в КМ при 4S стадии. |
|
Характеристика
|
Тип 1 | Тип 2А | Тип 2В |
| NMYC |
Норма
|
Норма | Амплификация |
| ДНК-плоидность |
Гипердиплоидия
Триплоидия
|
Диплоидия
Тетраплоидия
|
Диплоидия
Тетраплоидия
|
| Делеция 1p |
Отсутствует
|
Вариабельна | Присутствует |
| 17q-gain |
Редко
|
Часто | Часто |
| Trk-A экспрессия |
Высокая
|
Различная | Низкая или отсутствует |
| Возраст |
<1 года
|
>1 года | 1-5 лет |
| Стадия |
1,2,4S
|
3,4 | 3,4 |
| 3-х летняя EFS |
95%
|
25-50% | <20% |
Мультифокальная первичная опухоль (т.е. билатеральная надпочечниковая первичная опухоль) должна стадироваться в соответствии с наибольшим распространением болезни, как определено выше и следовать с сабскриптом «М» (т.е. стадия 3М).
Клинико-генетические подгруппы нейробластомы (Brodeur 2002) [3].
Международная патологическая классификация нейробластомы (INPC, 1988) [3]
Нейробластома (Швановская бедная стромой):
Международная патологическая классификация нейробластомы (INPC, 1988) [3]
Нейробластома (Швановская бедная стромой):
Нейробластома, недифференцированная - Добавочные технологии (иммуногистохимия, электронная микроскопия, и /или цитогенетика) обычно требуются для установления диагноза. Опухолевые клетки не дифференцируются.
Нейробластома, плохо дифференцированная. Большинство опухолевых клеток недифференцированы, только <5 % популяции опухолевых клеток имеют цитоморфологические черты дифференцировки к ганлионарным клеткам. Небольшое количество нейропиля присутствует, < 50% Швановской стромы.
Нейробластома, дифференцирующаяся -> 5% популяции опухолевых клеток имеет цитоморфологические черты дифференцировки до ганглионарных клеток с синхронизацией дифференцировки ядер (увеличение эксцентрических ядрышек с везикулярным рисунком хроматина и обычно с одной выдающийся нуклеолой) и с заметной эозинофилией или амофилией цитоплазмы. Клетки ганглионарной дифференцировки могут присутствовать. Небольшое количество нейропиля присутствует. <50% Швановской стромы.
Ганлионейробластома, смешанная (Швановская богатая–стромой): Пропорция ганлиоматозного компонента к фокусам нейробластов 50%. Микроскопически гнезда нейробластических клеток смешанны или случайно представлены в ганлиоматозной ткани. Эти гнезда это смесь нейробластических клеток в различных стадиях дифференцировки, обычно доминируют диффернцирующиеся нейробласты и зрелые ганглионарные клетки. В изобилии представлен нейропиль.
1. Гаглионеврома (Швановская строма-доминирующая):
Ганлионеврома, созревающая: Преимущественно ганлионейроматозная строма. Минорный компонент рассеян, равномерно или неравномерно представлен совокупностью дифференцированных нейробластов или созревающих ганлионарных клеток, нет гнезд.
Ганлионеврома зрелая. Зрелая Швановская строма и ганлионарные клетки. Пучковый профиль невральных отростков, сопроводжающих Швановские клетки и периневритические клетки.
2. Ганлионейробластома, нодулярная (Смешанная Швановская стромой богатая/строма-доминирующая и бедная–стромой). Присутствуют макроскопические, обычно геморрагические нейробластические узлы (бедный стромой компонент) и сосуществующая ганлинейробластома, смешанная (стромой- богатый компонент) или ганлионеврома (доминирующий стромальный компонент). Грубая демаркация между узлами и богатым стромой компонентом. Пропорция богатого стромой/доминатного к нейробластическому компоненту не критически для диагноза. Богатый стромой компонент часто локализуется на периферии опухоли, может появляться как тонкие или широкие септы. Если опухоль ганлионейробластома смешанная или ганлионеврома и есть метастазы в лимфатические узлы это нейробластома, случай классифицируется как ганлионейробластома, узловая атипичная.
3. Нейробластическая опухоль, не классифицированная.
4. Нейробластома, (без дополнительных уточнений).
5. Ганлионейробластома, (без дополнительных уточнений).
Международная система оценки стадии при НБ, основанная на факторах риска при визуализации (INRGSS)
Гаагская классификация (модифицированная), 1973 [1,3]:
3-я степень - недифференцированные клетки без признаков созревания.
2-я степень - смешанное строение из недифференцированных клеток и единичных клеток с частичной ганлионарной дифференцировкой (везикулярное ядро с выступающей нуклеолой, увеличение ядерно/цитоплазматического отношения, невритическое развитие).
1-я степень - диффузная ганлионейробластома. Диффузно смешанны недифференцированные и диффренцированые клетки и зрелые ганлионарные клетки.
1-я b степень - ганлионейробластома смешанного типа. Ганлионейробластома с узлами или недифференцированная нейробластома с резким разделением между двумя компонентами.
Степень регрессии:
Степень дифференцировки:
Степень регрессии и дифференцировки
Степень регрессии:
| 1-я степень | Нет живых клеток |
| 2-я степень | <10% живых клеток |
| 3-я степень | 10-50% живых опухолевых клеток |
| 4-я степень | >50% живых опухолевых клеток |
Степень дифференцировки:
| 1-я степень | Ганлионеврома |
| 2-я степень | <10% незрелой нейробластической ткани |
| 3-я степень | 10-50% незрелой нейробластической ткани |
| 4-я степень | >50% незрелой нейробластической ткани |
|
Стадия
|
Описание |
| L1 | Локализованная опухоль, без вовлечения жизненно важных структур (факторов риска при визуализации) и ограниченная одной анатомической областью |
| L2 | Местно-распространенная опухоль при наличии одного или нескольких факторов риска при визуализации |
| M | Отдаленные метастазы (за исключением MS) |
| MS | Отдаленные метастазы у детей < 18 месяцев, ограниченные кожей, печенью и/или костным мозгом (КМ) (< 10 % ядросодержащих клеток) |
В основу данной системы положен опыт Европейской группы по изучению нейробластомы (International Society of Paediatric Oncology Europe Neuroblastoma – SIOPEN) [1,2,4], которая в своей работе использует факторы риска при визуализации (Image-Defined Risk Factors – IDRF). Факторы риска при визуализации представляют собой стандартизованную систему оценки взаимосвязи опухоли с жизненно важными анатомическими структурами, такими как паренхиматозные органы, нервные сплетения и магистральные сосуды, позволяя хирургу до проведения хирургического вмешательства прогнозировать как возможность проведения радикальной операции, так и хирургические риски.
На основании факторов риска при визуализации пациенты с локализованными стадиями заболевания в рамках системы INRGSS разделяются на L1 и L2 стадии, под которыми понимают локализованную опухоль без или с наличием указанных факторов. Важными отличиями от INSS явилось отсутствие включения статуса региональных ЛУ как стратификационного критерия. Пациенты с метастатическими формами НБ продолжают разделяться на 2 группы: стадия M и стадия MS, соответствующие 4-й и 4S стадии в INSS. Необходимо отметить, что важным изменениям подверглись критерии определения MS стадии. Возрастной порог был повышен с 12 до 18 месяцев, также для определения MS стадии более не используется характер местной распространенности первичной опухоли.
Факторы риска при визуализации (IDRF).
| Ипсилатеральное распространение опухоли в пределах 2 анатомических областей (шея-грудь, грудь-живот, живот-область таза) | |
| Шея | Опухоль охватывает каротидную и/или позвоночную артерии и/или внутреннюю яремную Вену |
| Распространение опухоли на основание черепа | |
| Сдавление опухолью трахеи | |
| Шейно-грудной отдел | Вовлечение плечевого сплетения |
| Вовлечение подключичных сосудов и/или позвоночной и/или каротидной артерий | |
| Сдавление трахеи | |
| Грудная полость | Вовлечение аорты и/или крупных ветвей |
| Сдавление трахеи и/или главных бронхов | |
| Опухоль нижних отделов средостения, инфильтрирующая реберно-позвоночный угол | |
| Брюшная полость/область таз | Инфильтрация ворот печени и/или гепатодуоденальной связки |
| Вовлечение ветвей верхней брыжеечной артерии на уровне корня брыжейки | |
| Вовлечение чревного ствола и/или верхней брыжеечной артерии | |
| Инвазия в одну/обе почечные ножки | |
| Вовлечение аорты и/или полой вены | |
| Вовлечение подвздошных сосудов | |
| Опухоль малого таза пересекает седалищную вырезку | |
| Интравертебральный рост опухоли независимо от локализации при условии: поражение более одной трети спинномозгового канала на аксиальных срезах и/или перимедуллярные лептоменингеальные пространства не визуализируются и/или нарушение сигнала от спинного мозга | |
|
Инфильтрация прилежащих органов и структур:
перикард, диафрагма, почки, печень, область 12-перстной кишки и поджелудочной железы, брыжейка
|
|
|
Состояния, требующие регистрации, но не относящиеся к IDRF:
- мультифокальная первичная опухоль плевральный выпот с/без опухолевых клеток
|
|
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ
Диагностические критерии
Жалобы и анамнез [1]:
Возможные клинические проявления нейробластомы зависят от того, какая часть тела затронута опухолью: расположением первичной опухоли или ее метастазов:
Внутригрудная опухоль - первыми симптомами могут быть боль, деформация грудной клетки, навязчивый кашель, дисфагия, нарушение дыхания, атаксия, а у малышей – частые вздрагивания.
Опухоль в брюшной полости – боль и дискомфорт в животе, рвота, пальпируемое образование, нарушение перистальтики кишечника, отеки нижних конечностей, нарушение мочеиспускания, в тяжелых случаях приводящий к гидронефрозу.
При расположении в симпатических стволах опухоль часто прорастает через межпозвоночные отверстия в позвоночный канал - так называемая опухоль по типу «песочных часов» или «гантели», вызывая сдавление спинного мозга и вследствие этого развиваются парезы и параличи конечностей и нарушение функции тазовых органов.
4) В 15- 20% случаев нейробластомы, расположенной в области шеи, грудной клетке и при повреждении симпатических ганглий на уровне Тh2 – С8 возникает парез: 1) мышцы расширяющий зрачок (m.dilatators puppilae); 2) тарзальных мышц верхнего и нижнего века (m.m.tarsalis superior et inferior); 3) глазничной мышцы (m.orbitalis); сосудов и потовых желез части лица, которая проявляется синдромом Горнера: а) анизокория (разный диаметр зрачков глаза, миоз – сужение зрачка с пораженной стороны); б) птоз - сужение глазной щели на пораженной стороне; в) энофтальм – западание глазного яблока на пораженной стороне; г) ангидроз - сухость и покраснение кожи головы части лица и вазодилатация сосудов на пораженной стороне.
У детей с метастатической нейробластомой часто отмечается ухудшение общего состояния, лихорадка, бледность, анемия, появление кровоизлияний и синяков на коже, болевой синдром в костях, иногда «летучего» характера, что вызывает раздражительность, хромату или отказ ходить. Ретробульбарная инфильтрация служит причиной характерных периорбитальных экхимозов - симптом «очков».
У грудных детей при нейробластоме могут выявляться быстро увеличивающиеся метастазы в печень, которые становятся причиной дыхательных нарушений, печеночной и почечной недостаточности. В результате метастазирования нейробластомы в кожу у младенцев могут обнаруживаться «узелки», напоминающие изюм в кексе.
Диагностический алгоритм [1,2]
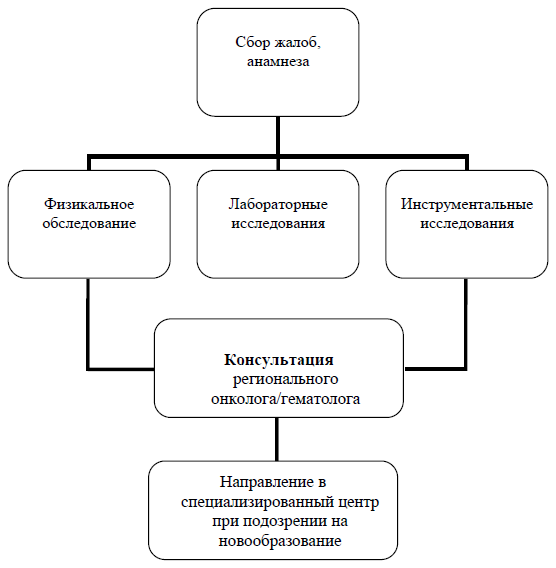
NB Другие возможные симптомы нейробластомы:
Паранеопластические синдромы: избыточная секреция катехоламина иногда приводит к приступам потливости, покраснения, побледнения, головной боли, к сердцебиению и гипертензии, частый жидкий стул.
Опсомиоклонический синдром: быстрые хаотичные движения глаз наряду с частыми нерегулярными подергиваниями мышц.
Физикальные обследования:
Врачебный осмотр - выявление наличия опухолевых образований при осмотре и пальпации, врожденных аномалий, измерение АД, веса, роста.
Лабораторные исследования:
Основные:
ОАК (развернутый) – анемия, тромбоцитопения, ускоренное СОЭ;
Биохимический анализ крови – повышение уровней ЛДГ, ферритина, NSE;
Дополнительные:
Определение уровня метаболитов катехоламинов в сыворотке крови и/или моче – повышение уровней, с целью динамического контроля;
Спинномозговая пункция – наличие опухолевых клеток;
Пункция костного мозга из 4 точек – наличие опухолевых клеток.
Патолого-анатомическое исследование ткани первичной опухоли/метастаза/трепанобиоптата костного мозга с применением иммуногистохимических методов;
Молекулярно-генетическое исследование мутаций MYCN, 1p в биопсийном (операционном) материале и определение амплификации гена MYCN, 1p в биопсийном (операционном) материале методом флюоресцентной гибридизации in situ (FISH) для определения группы риска;
Инструментальные методы исследования:
Основные:
Ультразвуковое исследование ОБП и забрюшинного пространства для выявления опухоли в трех измерениях и определение объема опухоли
Дополнительные:
Ультразвуковое исследование периферических лимфатических узлов – для исключения метастатического поражения;
Ультразвуковое исследование малого таза – для определения объема опухоли при локализации в малом тазу;
Ультразвуковое исследование образований мягких тканей - для определения объема опухоли при других локализациях;
Компьютерная томография ОГК – для исключения метастазирования в легких; для уточнения распространенности основного процесса заднего средостения;
КТ/МРТ брюшной полости, малого таза, головного мозга, позвоночного столба с контрастным усилением для уточнения распространенности основного процесса, исключения метастазирования в другие органы; При этом объём первичного очага рассчитывается по формуле: V(мл) =X(см) x Y(см) x Z(см) x 0.523;
ПЭТ КТ - для выявления метаболически активных очагов опухоли.
MIBG – сцинтиграфия для выявления костных очагов поражения.
Показания для консультации специалистов:
консультация офтальмолога – при наличии сопутствующего заболевания со стороны глаз или осложнения на фоне химиотерапии;
консультация невропатолога – при наличии неврологической симптоматики, нарушении функции органов малого таза, развитии осложнений на фоне химиотерапии;
консультация пульмонолога – при дыхательной недостаточности, при развитии воспалительных процессов со стороны органов дыхания, сопутствующие заболевания органов дыхания;
консультация кардиолога – при наличии сопутствующего заболевания со стороны сердечно-сосудистой системы, развитии осложнении во время химиотерапии;
консультация хирурга – для планирования и проведения оперативного лечения, биопсия отдаленных метастазов, развитие сопутствующей острой хирургической патологии;
консультация эндокринолога – при поражении ЦНС с признаками нарушения гормонального статуса, развитии осложнении во время химиотерапии;
консультация гастроэнтеролога – наличие сопутствующего заболевания, развитие осложнении со стороны желудочно-кишечного тракта во время химиотерапии;
консультация анестезиолога – выбор сосудистого доступа, катетеризация центральных вен, установка длительно-стоящих катетеров, перед оперативным вмешательством;
консультация радиолога – перед лучевой терапией;
консультация диетолога – для коррекции питания у пациентов с кахексией на фоне запущенного заболевания, при проведении химиотерапии;
консультация оториноларинголога – проверка слуха перед началом химиотерапии, развитие осложнений со стороны ЛОР-органов;
консультация реаниматолога – при необходимости коррекции интенсивной терапии;
консультация физиотерапевта – для проведения пассивной лечебной физкультуры;
консультация инфекциониста – при наличии сопутствующей патологии, развитии осложнений на фоне химиотерапии;
консультация нейрохирурга – при сопутствующих заболеваниях, развитии осложнений на фоне химиотерапии, планировании оперативного лечения при поражении зрительного нерва, когда есть показание для проведения совместного оперативного вмешательства с офтальмологами;
консультация фтизиатра – при наличии/подозрении сопутствующего специфического заболевания;
При необходимости возможна консультация других специалистов в зависимости от клинического случая.
Диагностический алгоритм [1,2]

Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследовании[1]:
|
Диагноз
|
Обоснование для дифференциальной диагностики | Обследования | Критерии исключения диагноза |
| Нейробластома |
Пальпируемые опухолевые массы в брюшной полости, анорексия, рвота, боли в животе, нарушение функции органов малого таза, параплегии, миоз, птоз, энофтальм (синдром Горнера), вторичные опухоли орбиты с периорбитальными кровоизлияниями, экзофтальм, экхимозы, отѐк век и конъюктивы, увеличение лимфоузлов, боли в костях, повышение АД и общие симптомы интоксикации
Пик заболеваемости <6 лет
|
- Ферритин +
- ГВК, ВМК в суточной моче +
- NSE +
- АФП -
|
Гистология: Мелко-кругло-синеклеточная опухоль. Специфические онкомаркеры: Synaptophysin, CD56,
Chromogranin, S100
|
| Нефробластома |
Боли в животе, опухоль брюшной полости гладкой, иногда с неровной поверхностью, плотной консистенции. Реже: повышение артериального давления, гематурия
Пик заболеваемости <5 лет
|
- Ферритин -
- ГВК, ВМК в суточной моче -
- NSE -
- АФП -
|
Гистология: напоминающая микроскопически незрелую почечную ткань на разных стадиях дифференцировки.
Специфические онкомаркеры: WT
|
| Саркома мягких тканей |
При расположении в забрюшинном пространстве возможно пальпируемое образование в брюшной полости и боли в животе
Пик заболеваемости 2-6 лет
15-19 лет
|
- Ферритин -
- ГВК, ВМК в суточной моче -
- NSE -
- АФП -
|
Гистология: Мелко-, кругло-, синеклеточн ая опухоль.
Специфические онкомаркеры: Desmin, Myogenin
|
| Саркома Юинга |
Зависит от локализации опухоли – локальная припухлость, боли, симптомы интоксикации
Пик заболеваемости 2-6 лет
10-15 лет
|
- Ферритин -
- ГВК, ВМК в суточной моче -
- NSE -
- АФП -
|
Гистология: Мелко-кругло-синеклеточная опухоль.
Специфические онкомаркеры: CD99, Fli 1
|
| Лимфома |
Увеличение лимфоузлов, симптомы интоксикации, возможно гепатоспленомегалия, анемический синдром, геморрагический синдром
Пик заболеваемости > 3лет
|
- Ферритин -
- ГВК, ВМК в суточной моче -
- NSE -
- АФП -
|
Гистология: Мелко-, кругло, синеклеточная опухоль.
Специфические онкомаркеры: Pax5, CD15, CD30,
Fascin, CD20
|
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ: нет.
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ:
Ведение пациентов с 1-3 стадией нейробластомы без жизнеугрожающих инициальных симптомов: Данные пациенты не получают послеоперационной химиотерапии независимо от объема выполненной операции и размера остаточной опухоли. Они подвергаются только хирургическому лечению.
Ведение пациентов с нейробластомой 1-3 стадии и инициальными жизнеугрожающими симптомами: Данные пациенты изначально подвергаются хирургическому лечению.
Объем резекции в той или иной ситуации опухоли определяется хирургом. Полная резекция показана только в том случае, если предполагаемый риск развития послеоперационного осложнения является низким. Если предполагаемый риск осложнений является высоким, допустимо проведение частичной резекции или только биопсии опухоли.
В данной ситуации пациенты получают послеоперационную химиотерапию по схеме N4 для индукции регрессии опухоли. Если прогрессирование опухоли или симптомы не контролируются после четырех курсов по схеме N4, пациент включается в среднюю группу риска.
Ведение пациентов со стадией 4S: Для стадии 4S характерна прогрессия опухоли. Рост первичной опухоли, или увеличение поражения печени или кожных метастазов без клинического ухудшения не требуют проведения операции или химиотерапии. Любые клинически симптомы ухудшения состояния могут требовать проведения химиотерапии по схеме N4 для индукции регрессии. Пациенты должны получать лечение курсами химиотерапии по схеме N4 каждый 21 день от 1 дня предыдущего цикла до момента остановки прогрессии. Как только стабилизация будет достигнута, последующая химиотерапия не требуется. Нет необходимости индуцировать частичный или полный ответ при проведении данной низкодозной химиотерапией. После прекращения химиотерапии проводится тщательное динамическое наблюдение за пациентом в соответствии с группой наблюдения этого протокола. Если прогрессирование опухоли или симптомы не контролируются после четырех циклов N4 необходимо обсуждения пациента для решения вопроса об объеме последующей терапии. У некоторых пациентов, прогрессия может быть очень быстрой. Пациенты с инициальными или появившимися метастазами в отдаленных лимфоузлах, костях скелета, орбите или поражении костного мозга, превышающим 10%, не являются пациентами с 4S стадией заболевания. Данные пациенты получают лечение в соответствие с группой среднего риска протокола NB-2004 в случае, если возраст на момент диагноза < 1 года и при отсутствии амплификации гена MYCN. Регулярное наблюдение заканчивается к концу 2 года жизни. Если остаточная опухоль не исчезла полностью, операция должна обсуждаться консилиумом после детальной оценки визуализации.
Ведение пациентов из группы наблюдения с рецидивом или прогрессией.
Если рецидив или прогрессирование диагностируются во время наблюдения, проводится полное рестадирование (опухолевые маркеры, МРТ, сцинциграфия с МЙБГ, оценка состояния костного мозга).
Местный рецидив у пациентов с 1 стадией нейробластомы.
Повторная хирургическая операция и химиотерапия должны обсуждаться коллегиально. Принятие решения возможно только после детального анализа данных визуализации.
Местная прогрессия резидуальной опухоли при 2-3 стадии.
Локальное прогрессирование должно быть подтверждено референсом визуализации. Если прогрессия подтверждается после референса визуализации или у пациента развиваются жизнеугрожающие симптомы, ассоциированные с опухолью, пациенту проводится химиотерапия по схеме N4. Как только документируется остановка роста опухоли или купирование жизнеугрожающих симптомов, дальнейшая химиотерапия не проводится. Пациент продолжает тщательно наблюдаться.
Рецидив или прогрессия до 4 стадии.
Метастатический рецидив или прогрессия до 4 стадии требуют интенсивного лечения. Дети >1 года получают лечение для высокой группы риска. Дети <1 года, у которых появились метастазы не характерные для стадии 4S (т.е. прогрессирование поражения костного мозга более 10% или появление метастазов в других органах, кроме кожи и печени) получают лечение в соответствие со средней группой риска.
Пациентам с бессимптомным интраспинальным поражением, документированным МРТ, рекомендуется проведение удаления интраспинальной части опухоли, если это не ассоциированно с риском развития послеоперационных осложнений.
Мобилизация гемопоэтических стволовых клеток, забор, и CD34-селекция:
Мобилизация стволовой клетки возможна только, когда есть ответ на проводимую терапию со стороны костного мозга. Оценка состояния костного мозга должна повторяться перед 3 и 5 циклом химиотерапии. Как только костный мозг очистился от клеток нейробластомы (т.е. процент поражения < 0,1% клеток нейробластомы по данным иммуноцитологии), забор стволовой клетки должен быть назначен после следующего цикла химиотерапии.
Карта наблюдения пациента, маршрутизация пациента:
Для мобилизации стволовой клетки КСФ назначается через 2 дня после окончания предшествующего цикла химиотерапии. Г-КСФ назначается в дозе 10 мг/кг/сут разделенный на 2 введения.
Миелоаблативная высокодозная химиотерапия (ТГСК) с последующей атоТГСК (представлен в протоколе аутоТГСК).
Карта наблюдения пациента, маршрутизация пациента:
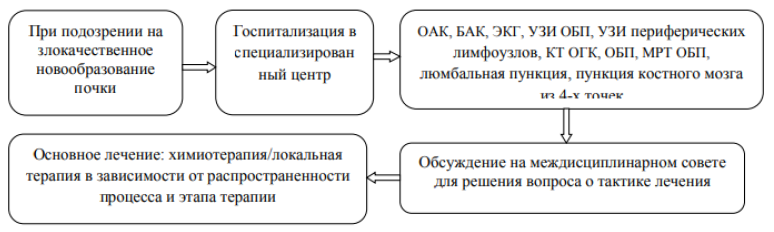
Немедикаментозное лечение:
изолированные (боксированные) палаты;
ламинарный поток воздуха;
низкобактериальная пища;
усиленное питание – стол №11,15,16, высококалорийная диета с полуторным по сравнению с возрастными нормами количеством белков, витаминизированная, богатая минеральными веществами; при назначении глюкокортикоидов рацион обогащают продуктами, содержащими много солей калия и кальция;
Дистанционная лучевая терапия.
Дистанционная лучевая терапия ложа первичной опухоли это резервная опция пациентов средней и высокой группы риска с активной остаточной опухолью присутствующей после индукционной терапии и операции. Решение о лучевой терапии основывается на статусе пациента перед поддерживающей терапией или ТКМ. Активность резидуальной опухоли определятся как:
- Накопление МИБГ (если опухоль изначально МИБГ позитивна).
- Накопление октреатида (для опухолей изначально МИБГ-негативных но 111In- октреатид позитивных или однозначного увеличение на контрастном МРТ (если опухоль была изначально полностью негативна при сцинциграфии).
В программе лечения высокой группы риска предусмотрено планом комбинация радиоизотопной терапии 131I –МИБГ перед ТКМ и дистанционная лучевая терапия после. Опухоли, которые изначально МИБГ-негативны подвергаются дистанционной лучевой терапии без 131I –МИБГ - терапии, если другие методики (т.е. однозначное увеличение на контрастном МРТ, 111In- октреатид накопление) четко демонстрируют метаболическую активность остаточной опухолевой ткани.
Системное облучение метастазов не планируется в этом трайле. Это резерв для индивидуальной паллиативной терапии.
Остаточная не прогрессирующая не активная масса, видимая только на МРТ, КТ или УЗИ исследовании не требует лучевой терапии.
Определение времени дистанционной лучевой терапии.
Для средней группы риска с активной резидуальной первичной опухолью, лучевая терапия назначается вовремя N7 циклов поддерживающей терапии и должна быть завершена перед началом консолидации 13- дневный цикл ретиноевой кислотой для избегания возможных негативных взаимодействий между ретиноевой кислотой и лучевой терапией. Пациенты из группы среднего риска не получают МИБГ- терапию.
Для группы высокого риска дистанционная лучевая терапия назначается после ТКМ. Так скоро, как только пациент стабилизируется. Рекомендовано для избегания возможных негативных взаимодействий между ретиноевой кислотой и лучевой терапией, пациент не должен получать ретиноевую кислоту во время лучевой терапии. Учитывая то, что лучевая терапии едва ли может быть начата на 30 день после ТКМ, назначается первый 14-дневный цикл ретиноевой кислоты, затем прерывание терапии ретиноевой кислотой во время дистанционной лучевой терапии и начало ретиноевой кислоты через неделю после лучевой терапии.
Дозы и фракционирование. Общая доза 36-40 Гр (21 Гр *) должна быть разделена на объем облучаемой опухоли в режиме ежедневного фракционирования от 1,6 до 2Гр (что клинически определяется возрастом пациента или объемом облучаемого поля). Доза облучения должна быть специфицирована в соответствие с ICRU 50/62 рекомендациями.
NB! Учитывая невозможность проведения сканирования с I123 МИБГ, активность опухоли будет выявляться по результатам повторной операции, при N-MYC позитивных опухолях облучение ложа опухоли в дозе 21Гр показано всем пациентам, для улучшения локального контроля за опухолью.
Применяется лучевая терапия с модулированной интенсивностью пучков (IMRT), управляемая изображениями Image Guided Radiotherapy (IGRT) и с модулированной интенсивностью дозы во время вращения (RapidArc) на высокоэнергетическом линейном ускорителе с мультилифтколлиматром и диагностическим оборудованием, интегрированным в ускоритель, которое позволяет точно позиционировать пациента во время процедуры. Для более точной фиксации пациента необходимо использовать специальные иммобилизирующие приспособления, термопластические маски. Для точного определения степени распространения опухоли и планирования ЛТ необходимо выполнение МРТ до и после операции. Необходимо минимизировать объем нормальной ткани, подвергающейся облучению в высокой дозе. Поэтому обязательным является компьютерное планирование лечения.
Объем облучения определяется согласно ICRU 50/62. Клинический объем облучения (CTV) включает размеры визуализируемой опухоли по данным МРТ и дополнительно +0,5 см от края опухоли. В случае оперативного удаления опухоли для планирования терапии ориентироваться на остаточную опухоль. Предоперационные снимки необходимы для определения участков возможной опухолевой инфильтрации. Планируемый объем облучения (PTV) включает клинический (CTV) плюс дополнительный край в зависимости от точности техники облучения (например, 0,2-0,5 см при жесткой фиксации и 0,5-1,0 см при использовании обычной маски/шлема), и зависит от режимов визуализации, принятых в отделе. При расчете клинического объема облучения (CTV) необходимо учитывать анатомические границы.
При спинальной локализации опухоли граница клинического объема облучения (CTV) в кранио-каудальном направлении должна соответствовать длине одного тела позвонка. Необязательно полностью захватывать полость, если она есть, или зону отека. В случае оперативного удаления необходимо выполнение постоперационных снимков. Латерально границы поля должны захватывать pedicles. Для спинальных локализаций дозовая нагрузка должна локализоваться на дорсальной стороне позвонка.
Медикаментозное лечение
Медикаментозное лечение в зависимости от стадии заболевания и группы риска согласно протоколу NB 2004
Алгоритм определения групп риска
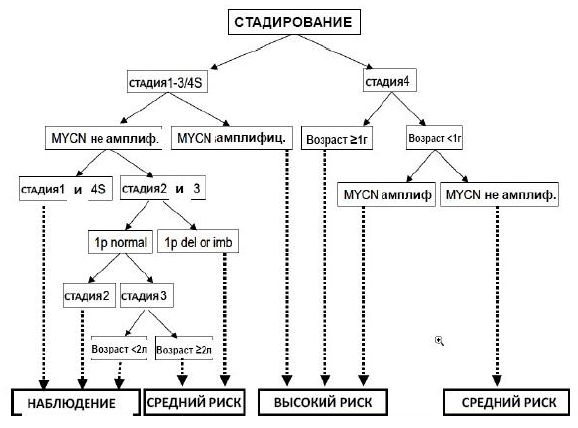
Ведение пациентов, находящихся под наблюдением ("ObservationGroup"):
Критериями отнесения данного пациента в группу наблюдения являются:
Стадия 1: все возрастные группы при отсутствии MYCN амплификации.
Стадия 2: все возрастные группы при отсутствии MYCN амплификации и делеции 1р.
Стадия 3: больные <2 лет с отсутствием MYCN амплификации и делеции 1р.
Стадия 4S: больные <1 года, при отсутствии MYCN амплификации.
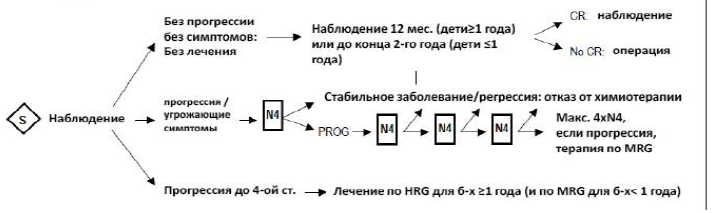
В случае прогрессии заболевания больной может быть переведѐн в группу среднего или высокого риска. Однако не любое изменение размеров опухоли должно трактоваться как прогрессия. Прогрессия заболевания определяется следующим образом:
Стадии 1-3: появление любых отдалѐнных метастазов.
Стадия 4S: увеличение опухолевых клеток в костном мозге более 10%, либо появление метастазов иных локализаций (не в коже и не в печени), т.е. переход в стадию 4.
Терапевтический план для группы больных находящихся под наблюдением [4,8]:
Ведение больных среднего риска
В группу больных среднего риска включаются пациенты с нейробластомой, если они отвечают следующим критериям:
Стадия 2: все возрастные группы с отсутствием MYCN амплификации, но с делецией 1р;
Стадия 3: больные <2 лет с отсутствием MYCN амплификации, но с делецией 1р;
Стадия 3: больные ≥2 лет с отсутствием MYCN амплификации, независимо от статуса 1р;
Стадия 4: больные <1 года с с отсутствием MYCN амплификации;
Больные из группы наблюдения с прогрессией заболевания;
План терапии пациентов среднего риска:
Инициальная биопсия опухоли или резекция
6 циклов химиотерапии в альтернирующем режиме N5 и N6, начало каждого цикла на 21 день,
Операция second-look после оценки размеров опухоли, операционного риска и резектабельности,
Дистанционная лучевая терапия при наличии активной остаточной опухоли, поддерживающая терапия в объеме 4-х циклов N7,
Ретиноевая кислота в течение 12 месяцев (6 месяцев, 3-х месячный перерыв, 3 месяца).
Терапевтический план для больных среднего риска:
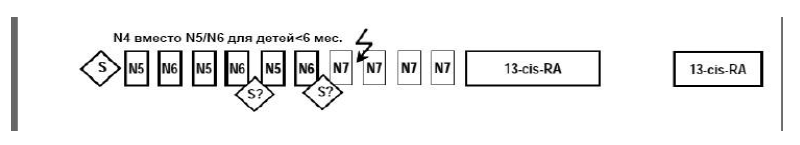
Интенсивная химиотерапия для средней группы риска.
Пациенты до 6 месячного возраста с момента диагностики начинают лечение N4 циклами вместо N5/ N6. Как только им исполнится 6 месяцев, оставшиеся циклы идут N5 и N6 до 6 циклов химиотерапии с последующей N7, поддерживающей терапией с ретиноевой кислотой.
Все пациенты > 6 месяцев на момент постановки диагноза получают в альтернирующем режиме N5 и N6 циклы до 6 циклов химиотерапии с 21-дневным интервалом. Более короткие интервалы позволительны. Более длинные интервалы иногда необходимы для преодоления депрессии костного мозга.
Ведение больных высокого риска:
В группу больных высокого риска, включаются пациенты с нейробластомой, если они отвечают следующим критериям:
Стадия 4: все больные старше 1 года независимо от MYCN статуса;
Стадии 1-3/4S: все возрастные группы при наличии MYCN амплификации.
План терапии больных высокого риска: Экспериментальная ветвь:
2 курса N8 (топотекан, циклофосфамид, этопозид) с последующей терапией в рамках стандартной ветви терапии.
Стандартная ветвь:
3 курса N5 (цисплатин, этопозид, и виндезин, в РК – винбластин);
3 курса N6 (винкристин, дакрбазин, ифосфомид, и доксорубицин);
Ауто-ТГСК (мелфалан, карбоплатин, этопозид);
9 курсов ретиноевой кислоты, длительность каждого курса 14 дней;
Сопроводительная терапия (пневмоцистная/грибковая профилактика, трансфузии, Г-КСФ)
Терапевтический план для больных высокого риска [1,10]:
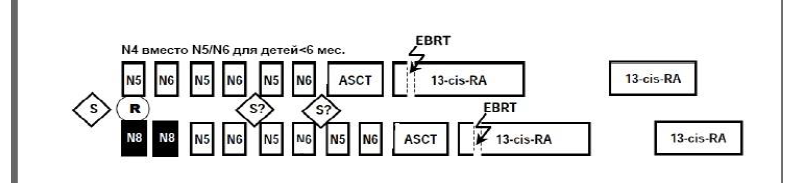
Экспериментальная ветвь, включающая химиотерапию по блоку N8 может назначаться всем пациентам старше 1 года. Новорожденные с N-MYC амплификацией классифицируются как пациенты высокой группы риска, но они не получают циклов N8, получают лечение в соответствии с группой высокого риска стандартная терапия.
Терапевтический элемент N4 (NB 2004):
Критерий для проведения данного терапевтического элемента:
Прогрессия заболевания у больных находящихся под наблюдением или присутствие угрожающих симптомов в момент диагноза у больного из группы наблюдения;
Дети<6 месяцев, отнесенные в группу среднего или высокого риска;
Лейкоциты >2000/мм3, гранулоциты >500/мм3, тромбоциты>50000/мм3.

Дозировка препаратов в зависимости от возраста в блок N4
|
Лекарственное средство
|
Дети до 1 года и дети <10 кг веса | Дети > 1 года | Дни введения |
|
Доксорубицин
|
0,5 мг/кг х день | 15 мг/м2 х день | Дни 1,3, и 5 – 30 минутная инфузия |
|
Винкристин
|
0,025 мг/кг х день |
0,75 мг/м2 х день
Максимум 2 мг
|
Дни 1,3, и 5; в/в струйно |
|
Циклофосфамид
|
10 мг/кг х день | 300 мг/м2 х день | Дни с 1 по 7; 30 минутная инфузия |
|
Месна
|
3 х 2 мг/кг | 3 х 60 мг/м2 х день |
Дни с 1 по 7; в/в струйно 0,4,8 час от начала циклофосфамида
|
| Гидратация |
50 мл мг/кг х день
+ орально неограниченно
|
2000 мл/м2 х день | Дни 1-7 |
Терапевтический элемент N5:
Критерий для проведения данного терапевтического элемента:
Лейкоциты >2000/мм3, лимфоциты >1000/мм3, тромбоциты>50000/мм3 (за исключением больных с поражением костного мозга);
Степень ототоксичности≤2 (т.е. потеря≤2 dBна 2 kHz, необходимо проведение аудиометрии);
Увеличение креатинина не более, чем на 150% от верхней границы нормы, клиренс по креатинину ≥70мл/мин х 1,73м2.
Отсутствие признаков инфекции;
Возраст >6 месяцев.
Дозировка препаратов в зависимости от возраста в блок N5:
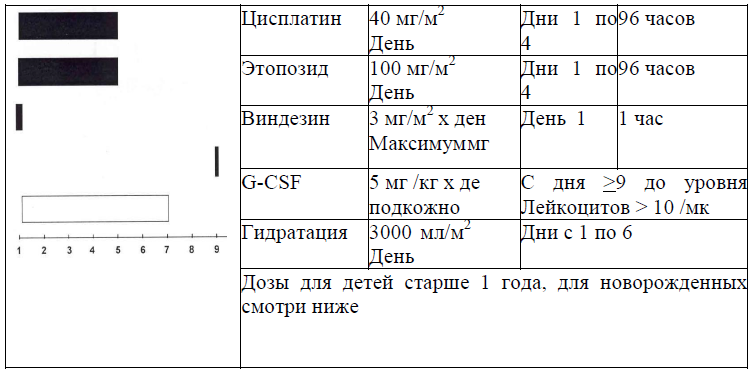
|
Лекарственное средство
|
Дети до 1 года дети <10 кг веса | Дети > 1 года | Дни введения |
|
Цисплатин
|
1,3мг/кг х день | 40 мг/м2 х день | Дни с 1 по 4 инфузия продолженная 96 часов |
|
Этопозид
|
4,2мг/кг х день | 100 мг/м2 х день | Дни с 1 по 4 инфузия продолженная 96 часов |
|
Виндезин
|
0,1мг/кг х день |
3 мг/м2 х день
|
День 1 часовая инфузия |
|
Гидратация содержащая M Ca, K
|
3000 мл/м2 х день | 3000 мл/м2 х день | Дни 1-6 |
Терапевтический элемент N6 (NB 2004):
Критерий для проведения данного терапевтического элемента:
Лейкоциты >2000/мм3, лимфоциты >1000/мм3, тромбоциты>50000/мм3 (за исключением больных с поражением костного мозга)
Увеличение креатинина не более, чем на 150% от верхней границы нормы, клиренс по креатинину ≥70мл/мин х 1,73м2
Отсутствие признаков инфекции
Отсутствие признаков кардиомиопатии (необходыми ЭКГ и ЭхоКГ)
Возраст >6 месяцев.
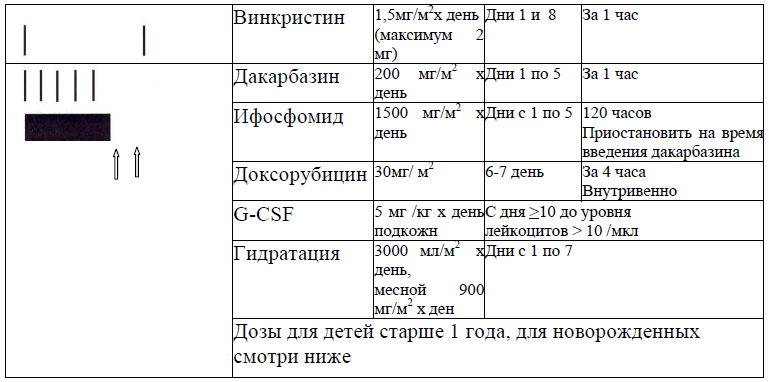
Дозировка препаратов в зависимости от возраста в блок N6:

Дозировка препаратов в зависимости от возраста в блок N6:
|
Лекарственное средство
|
Дети до 1 года и дети <10 кг веса | Дети > 1 года | Дни введения |
| Винкристин | 0,05мг/кг х день | 1,5 мг/м2 х день | Дни с 1 по 8 инфузия 1 час |
| Дакарбазин | 6,7мг/кг х день | 200 мг/м2 х день | Дни с 1 по 5 инфузия 1 час |
| Ифосфамид | 50 мг/кг х день | 1500мг/м2 х день |
День 1-5 продолженная инфузия 120 часов
|
| Доксорубицин | 1мг/кг х день | 30 мг/м2 х день | Дни 6-7 инфузия за 4 часа |
| Месна66 | 30 мг/кг х день | 900 мг/м2 х день |
Дни с 1 по 7 продолженная инфузия 120 часов
|
Терапевтический элемент N7:
Критерий для проведения данного терапевтического элемента:
Лейкоциты >2000/мм3, лимфоциты >1000/мм3, тромбоциты>50000/мм3.
Отсутствие признаков тяжелой инфекции.


Дозировка препаратов в зависимости от возраста в блок N7:
|
Лекарственное средство
|
Дети до 1 года и дети <10 кг веса | Дети > 1 года | Дни введения |
| циклофосфамид | 5мг/кг х день | 150 мг/м2 х день |
Дни с 1 по 8 через рот (или инфузия 1 час)
|
| месна | 3 х 1 мг/кг х день | 3 х 30 мг/м2 х день |
Дни с 1 по 8 через рот 0,4,8 час от начала циклофосфамида
|
Терапевтический элемент N8 (NB 2004):
Критерий для проведения данного терапевтического элемента:
Только для пациентов > 1 года группа высокого риска экспериментальная ветвь.
ОАК: Лейкоциты >2000/мкл, лимфоциты > 1000/ мкл, тромбоциты >50.000/мкл исключая пациентов с массивным поражением костного мозга).
Клиренс по эндогенному креатинину >70 мл/мин х 1,73 м2.
Отсутствие признаков инфекции.
Печеночная токсичность < 2 степени.

Дозировка препаратов в зависимости от возраста в блок N8:
|
Лекарственное средство
|
Дети до 1 года |
Дети > 1 года, дети <10 кг веса используются дозы на вес тела (1м2 = 30 кг)
|
|
| Топотекан | Не применяется | 1,0 мг/м2 х день |
Дни с 1 по 7 инфузия продолженная 168 часов начало через 6 часов после
циклофосфамида
|
| Циклофосфамид | Не применяется | 100 мг/м2 х день |
Дни с 1 -7 за 1 час, начало за 6 часов до Топотекана
|
| Этопозид | Не применяется | 100 мг/м2 х день | За 1 час |
| Месна66 | Не применяется | 3 х 20мг/м2 х день |
Дни с 1 по 7 в/в струйно на 0,4,8 час после циклофосфамида
|
В группах высокого риска, при рефрактерных формах и рецидивах возможно применение альтернативной терапии[1,10,11]:
1) Химиотерапия по схеме Иринотекан + Темозоломид:
иринотекан, разовая доза 50мг/м2 – 1-5 сутки, суточная доза 250мг/м2, интравенозно за 1 час;
темозоломид, разовая доза 150мг/м2 – 1-5 сутки, р.о, суточная доза 750мг/м2; Интервал между курсами 21-28 день. Терапия может быть продолжена до выявления прогрессии заболевания; максимальное число курсов ПХТ 12. Критерии начала блока: абсолютное число нейтрофилов >1*109/л, тромбоциты >100*109/л. G-CSF не предназначен.
иринотекан, разовая доза 50мг/м2 – 1-5 сутки, суточная доза 250мг/м2, интравенозно за 1 час;
темозоломид, разовая доза 150мг/м2 – 1-5 сутки, р.о, суточная доза 750мг/м2; Интервал между курсами 21-28 день. Терапия может быть продолжена до выявления прогрессии заболевания; максимальное число курсов ПХТ 12. Критерии начала блока: абсолютное число нейтрофилов >1*109/л, тромбоциты >100*109/л. G-CSF не предназначен.
2) Топотекан + Винкристин + Доксорубицин:
Топотекан, разовая доза 1,5мг/м2 – 1-5 сутки в/в короткой инфузией, Винкристин 1мг/м2 - 5-6 сутки в/в 48 часов (начало через 1 час после завершения инфузии топотекана), Доксорубицин 22,5мг/м2 - 5-6 сутки в/в 48 часов (начало через 1 час после завершения инфузии топотекана). Интервал между курсами 21 день.
Критерии начала блока: абсолютное число нейтрофилов >1*109/л, тромбоциты >100*109/л. G-CSF через 48 часов после инфузии винкристина, доксорубицина.
Иммунотерапия препаратом Динутуксимаб бета (анти-GD2 моноклональные антитела) + 13-цис-ретиноевая кислота.
Показания к назначению иммунотерапии
Пациенты с нейробластомой группы высокого риска старше 12 месяцев с полным или очень хорошим частичным ответом, а также частичной ремиссией по опухоли, без отдаленных метастазов после индукционной ПХТ, при отсутствии клинических противопоказаний к проведению терапии.
Динутуксимаб бета – при нейробластомы высокого риска у пациентов в возрасте 12 месяцев и старше, ранее получавших индукционную химиотерапию с последующей миелоаблацией и трансплантацией стволовых клеток, достигших ремиссии.
План терапии:
Терапия динутуксимабом бета включает в себя 5 последовательных циклов по 35 дней.
Пациенты проходят обследование до начала терапии, после 2х курсов и по окончании терапии. Общая доза динутуксимаба бета за цикл рассчитывается по площади поверхности тела и составляет 100 мг/м². Существует два метода введения:
5 дней по 20 мг/м²
10 дней по 10 мг/м² (меньше побочных эффектов, более предпочтительный)
Младенцам и детям с массой тела ниже 12 кг следует дозировать в соответствии с их массой в кг вместо их площади поверхности тела (м²) по известной формуле 30 кг = 1 м2.
Для детей весом до 5 кг рекомендуется дальнейшее снижение дозы на 1/3. Каждая доза рассчитывается на основе площади поверхности тела (BSA) или массы тела следующим образом:
Пациентам ≤ 12 кг дозируют в соответствии с их массой тела: 0,33 мг / кг / день.
Пациентам ≤ 5 кг дозируется в зависимости от их массы тела: 0,22 мг / кг / сут.
Раствор для инфузии готовится ежедневно или в объеме, достаточном для 5 дней (48 мл в день или 240 мл на 5 дней).
Для непрерывной инфузии 10мг/м² в течение 10 дней раствор вводят со скоростью 2мл/час (48 мл/сут), используя соответствующий инфузионный насос (перфузор).
Перед инфузией раствор необходимо проверить на наличие в нем частиц. Рекомендуется использовать встроенный фильтр 0,22 микрометра, за исключением эластомерных насосов, поскольку встроенный фильтр может отрицательно влиять на скорость инфузии.
5-дневная инфузия связана с большим количеством побочных эффектов. Представляет собой 5 ежедневных инфузий по 20 мг/м² каждая, вводимых за 8 часов в первые 5 дней каждого курса. Для пятидневной инфузии каждую дозу необходимо разводить на 100 мл и вводить со скоростью около 13 мл/час.
Критерии для начала иммунотерапии
Перед началом каждого из циклов иммунотерапии, пациент должен отвечать следующим критериям:
Хорошее общее состояние (оценка по шкале Карновского >60).
Пациент должен иметь центральный венозный доступ.
Время от предыдущей ТКМ не менее 1,5- 2 месяцев, желательно не более 120 дней после ТКМ.
Предыдущая другая терапия должна быть закончена за 14 дней до начала иммунотерапии.
Не должна проводится лучевая терапия.
По меньшей мере 4 недели после тяжелой операции (торакотомия, лапаротомия) и полное выздоровление после любых послеоперационных осложнений.
При поражении ЦНС соблюдаются следующие критерии: пациент ранее получал лечение, заболевание ЦНС клинически стабильно в течение 4х недель, пациент не принимает стероиды по поводу поражения ЦНС
Пациенты с эпилептическими расстройствами могут получать лечение, если они получают противосудорожную терапию и достаточно контролируются.
ОФВ1 и ФЖЕЛ >60%. При невозможности выполнения функциональных проб, у ребенка не должно быть одышки в покое, а сатурация на воздухе должна превышать 94%.
Фракция сердечного выброса по данным ЭКГ >30%.
У всех пациентов должна быть адекватная функция костного мозга. Гранулоциты > 500, тромбоциты >20, гемоглобин > 80. Допускаются трансфузии компонентов крови.
Удовлетворительная функция печени: АЛТ/АСТ < 5 норм; нормальный О.билирубин, нормальный креатинин (Формула Шварца).
Пациенты, ранее получавшие иммунотерапию, исследуются на HACA (Human Anti Chimeric Antibody).
Отложить и/или отказаться от проведения терапии у пациентов со значительными интеркуррентными заболеваниями!
Пациенты с активной инфекцией.
Пациенты с клинически значимым плевральным выпотом.
Пациенты с симптомами застойной сердечной недостаточности или неконтролируемым нарушением сердечного ритма.
Пациенты с серьёзными психическими расстройствами и неконтролируемыми приступами.
Пациенты с клинически значимым неврологическим дефицитом или объективной периферической нейропатией (степень >2).
Пациенты, которым требуются или, вероятно, потребуются кортикостероиды или другие иммунодепрессанты.
Пациенты с бронхиальной астмой.
Мониторинг и практические аспекты: Инфузию динутуксимаба бета следует проводить через центральный венозный доступ. Другие сопутствующие вещества титруются через отдельный канал катетера. Если имеется только один просвет, инфузия динутуксимаба бета подключается в непосредственной близости от точки входа катетера. Пациенты должны находится под постоянным мониторингом. Непрерывная пульсоксиметрия. Контроль АД каждые 30 минут (первые 4 часа), далее – каждый час. Контроль массы тела 2 раза в сутки.
Мониторинг и практические аспекты: Инфузию динутуксимаба бета следует проводить через центральный венозный доступ. Другие сопутствующие вещества титруются через отдельный канал катетера. Если имеется только один просвет, инфузия динутуксимаба бета подключается в непосредственной близости от точки входа катетера. Пациенты должны находится под постоянным мониторингом. Непрерывная пульсоксиметрия. Контроль АД каждые 30 минут (первые 4 часа), далее – каждый час. Контроль массы тела 2 раза в сутки.
NB! Не рекомендованные элементы терапии.
Следующие процедуры не разрешены. Глюкокортикоиды или другие препараты с известной иммуносупрессивной активностью не могут использоваться во время и в течение двух недель до начала терапии Динутуксимабом бета, за исключением симптомов, угрожающих жизни. Использование внутривенных иммуноглобулинов настоятельно не рекомендуется, так как иммуноглобулины могут влиять на специфическую клеточную токсичность антитела (Динутуксимаб бета). Внутривенный иммуноглобулин не следует вводить в течение 2 недель после начала (Динутуксимаб бета) и через 1 неделю после завершения (Динутуксимаб бета ).
Ретиноевая кислота [12,13].
Терапия ретиноевой кислотой начинается ровно через 30 дней после дня 0 аутоТКМ для пациентов группой высокого риска и на 21-й день индукционной химиотерапии для пациентов группы среднего риска.
В комбинации с иммунотерапией первый проводится во время обследования перед началом иммунотерапии. Остальные 5 после начинаются после окончания каждого цикла динутуксимаба бета.
Доза на один цикл составляет 160мг/м2/день, разделенная на два равных приёма в течение 14 дней.
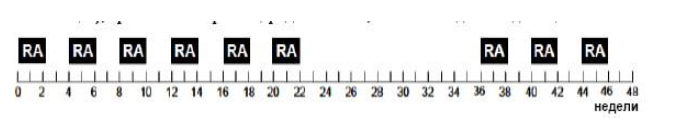
Ретиноевая кислота (RA) назначается в дозе 160 мг/м2 в сутки в 2-3 приема в течение 14 дней с последующим 14-дневным перерывом. Всего проводится 6 циклов, а после 3-х месячного перерыва проводят дополнительно еще 3 таких цикла. Допускается вскрытие капсул ретиноевой кислоты и смешивание препарата с молоком или мороженым.
Дополнительные лекарственные средства:
|
Фармакотерапевтическая группа
|
Международное непатентованное наименование лекарственного средства | Способ применения | Уровень доказательности |
| Ингибиторы синтеза мочевой кислоты | Аллопуринол | Перорально | В |
| Плазмозамещающие и перфузионные растворы | Альбумин | Внутривенно | А |
|
Аминогликозидные
антибактериальные препараты
|
Амикацин,
гентамицин
|
Внутривенно | В |
| Противогрибковые средства | Амфотерицин B, Каспофунгин | Внутривенно | А |
|
Гликопептиды
|
Ванкомицин | Перорально, внутривенно | А |
| Противогрибковые средства |
Вориконазол,
Флуконазол
|
Перорально, внутривенно | В |
|
Глюкокортикостероиды
|
Дексаметазон | Перорально, внутривенно | А |
|
НПВС
|
Ибупрофен, Кеторолак | Перорально, внутримышечно | В |
| Карбапенемы | Имипенем + циластатин, меропенем, эртапенем* | Внутривенн | В |
|
Линкозамиды
|
Клиндамицин | Перорально, внутривенно | А |
|
Оксазолидиноны
|
Линезолид | Перорально, внутривенно | В |
| Другие синтетические антибактериальные средства | Метронидазол | Перорально, внутривенно | С |
| Ингибиторы протонного насоса |
Омепразол,
Лансопразол
|
Перорально, внутривенно | А |
|
Противорвотные средства
|
Ондансетрон | Перорально, внутривенно | А |
|
Анилиды
|
Парацетамол | Перорально, внутривенно | А |
| Пенициллины | Пиперациллин +Тазобактам | Перорально, внутривенно | В |
|
Н2-гистаминовые средства
|
Фамотидин | Перорально, внутривенно | В |
| Сульфаниламиды | Сульфаметоксазол + Триметоприм | Перорально, внутривенно | В |
|
Диуретики
|
Фуросемид | Перорально, внутривенно | В |
| Цефалоспорины | Цефепим, Цефтазидим, Цефтриаксон, Цефуроксим | Внутривенно | В |
|
Фторхинолоны
|
Ципрофлоксацин | Перорально, внутривенно | В |
| Иммуноглобулины | Иммуноглобулин человека нормальный | Внутривенно | А |
| Стимуляторы гемопоэза | Колониестимулирующие факторы | Подкожно, внутривенно | А |
*В соответствии с правилами применения незарегистрированных ЛС.
NB! Дополнительное медикаментозное лечение проводится соответственно протоколам лечения развившихся осложнений.
СОПРОВОДИТЕЛЬНАЯ ТЕРАПИЯ ПРИ ОСЛОЖНЕНИЯХ:
терапия направленная на снижение токсичности химиопрепаратов, облегчения переносимости основного лечения, предупреждение и лечение развившихся инфекционных и других осложнений.
Синдром острого лизиса опухоли (СОЛ) - комплекс метаболических расстройств, возникающий в результате массивного распада опухолевых клеток и высвобождения в плазму и периферические ткани внутриклеточного содержимого и метаболитов.
При распаде опухолевых клеток образуются продукты окисления пуриновых оснований (ксантин, гипоксантин и мочевая кислота), калий и фосфат. В результате происходит 4 метаболических нарушения: гиперурикемия, гиперфосфатемия, гиперкалиемия и гипокальциемия, приводящие к почечной недостаточности.
Профилактика синдрома острого лизиса опухоли:
Аллопуринол - 10 мг/кг в сутки в 2-3 приема (max – 500 мг/сутки) в течение 3 - 8 дней.
Инфузионная терапия: объем = 3000-5000 мл/м2/сутки;5% раствор глюкозы - 0,9% раствор NaCl = 1:1;
Удельная плотность мочи < 1010.
Контроль баланса жидкостей. Баланс: количество выделенной мочи = количество введенной жидкости потери жидкости с дыханием, с потоотделением, по дренажам – при наличии асцита/плеврита;
Контрольное взвешивание 1-2 раза в сутки, у детей младшего возраста 4р/сут.;
При недостаточном мочевыведении - лазикс 1-10 мг/кг в сутки внутривенно или инфузией, при необходимости - допамин 3-5 мкг/кг/мин;
Инициальная инфузия не должна содержать калия, желательна умеренная гипокалиемия (3-3,5 ммоль/л);
Защелачивание мочи: р-р соды (NaHCO3) 40 - 80 ммоль/л добавить к постоянной инфузии (или 100-200 ммоль/м2/сутки параллельной инфузией);
Регулирование необходимого объѐма NaHCO3 соответственно pH мочи;
значение pH мочи=7,0 является идеальным! - сохраняется достаточная растворимость мочевой кислоты и ксантина и отсутствует опасность образования фосфорнокальциевых конкрементов;
Лабораторный контроль каждые 6-12-24 часа: биохимический анализ крови - Na+, K+, Cl, Ca++, мочевая кислота, креатинин, мочевина, белок, альбумин.
Гиперурикемия:
увеличить объем инфузии до 5000 мл/м2/сутки.
стабилизировать рH мочи на уровне = 7,5 при нормальном содержании фосфатов в крови и на уровне = 7,0 при повышенной концентрации фосфатов в крови. Однако постоянно держать pH мочи на уровне 7,5 нельзя в связи с опасностью кристаллизации гипоксантина.
При появлении в доступности разбуриказы последняя назначается всем больным перед началом циторедуктивной фазы.
Гиперфосфатемия (P++ > 1,5 -mol/l или 3 мг/100 мл):
Гиперкалиемия - при К>6 ммоль/л:
подготовить пациента к гемодиализу;
как неотложное мероприятие: глюкоза - 1г/кг + инсулин 0,3 E/кг инфузией свыше 30 минут: это приводит только к перераспределению K+ внутрь клетки, а через 2 - 4 часа уровень K+ возвращается к исходному. Следовательно, получается только выигрыш времени для подготовки к гемодиализу;
при ЭКГ-изменениях: глюконат кальция 10% - 0,5 - 1(-2) мл/кг внутривенно медленно (опасность брадикардии) + Р-р NaHCO3 - 2 ммоль/кг внутривенно медленно струйно;
при К>7 ммоль/л: - гемодиализ! если есть техническая возможность.
Гиперфосфатемия (P++ > 1,5 -mol/l или 3 мг/100 мл):
увеличить объем инфузии до 5000 мл/м2/сутки;
pH мочи не должен быть более 7,0;
назначить aluminiumhydroxid - 0,1 г/кг р.о. (для связывания фосфатов пищи);
при гипокальциемии - введение кальция показано только при развитии симптомов гипокальцемии (из-за выпадения в осадок фосфата кальция). Глюконат кальция 10%
- 0,5 - 1 (- 2) мл/кг внутривенно, медленно (мониторировать из-за опасности брадикардии);
если фосфат > 10 мг/100 мл (5 -моль/л) или фосфат кальция > 6,0 ммоль/л - на гемодиализ.
Гипокальциемия: Коррекция проводится только при появлении клинических симптомов гипокальциемии:
глюконат кальция 10% - 0,5 - 1 мл/кг внутривенно, медленно (монитор, опасность брадикардии);
контроль концентрации Mg++ ! При гипомагнезиемии: коррекция магния - 0,2 - 0,8 мэкв/кг в сутки длительной внутривенной инфузией (25% раствор сернокислой магнезии 0,1-0,4 мл/кг в сутки).
Олиго-/анурия: отделение мочи менее 50 мл/м2 в час, несмотря на введение фуросемида 10 мг/кг в сутки и инфузионную терапию в объеме 130-200 мл/м2 в час. ―Обычное‖ определение < 5 мл/м2 в час к данной ситуации не применимо. Быстрое возрастание, особенно K+, при ожидании ―выполнения‖ такого определения может привести к летальному исходу. Диурез должен оцениваться только вместе с объѐмом реально вводимой жидкости.
- УЗИ - может показать обструкцию мочевыводящих путей, инфильтрацию почек;
- Лабораторный контроль - калий, кальций, мочевая кислота, фосфат;
- Общий анализ мочи - кристаллы уратов, кристаллы фосфата кальция; Терапия: гемодиализ, самое позднее при подъѐме калия > 6 mmol/L.
Показания к гемодиализу:
K+> 7 mmol/L или подъѐм > 6 mmol/L несмотря на достаточную инфузионную терапию и диуретики;
фосфат > 10 мг/100 мл (5 ммоль/л) или продукт Ca x P > 6,0 ммоль/л;
отделение мочи менее 50 мл/м2 в час несмотря на введение фуросемида 10 мг/кг в сутки и инфузионную терапию в объеме 130-200 мл/м2 в час;
двусторонняя высокая или полная обструкция мочевыводящих путей.
Ведение и коррекция дозы динутуксимаба бета в зависимости от токсичности. Реакции гиперчувствительности.
Общее замечание: Несмотря на премедикацию, могут возникнуть серьёзные инфузионные осложнения, такие как синдром высвобождения цитокинов (CRS), анафилактическая реакция и реакция гиперчувствительности. Начало тяжелой инфузионной реакции (включая CRS) требует немедленного прекращения терапии динутуксимабом бета и может потребовать неотложной помощи. Синдром высвобождения цитокинов проявляется в течение нескольких минут или часов после начала первой инфузии и характеризуется системными симптомами, такими как лихорадка, гипотензия и крапивница.
Анафилактическкие реакции могут возникать даже в течение нескольких минут после первой инфузии и часто сопровождаются бронхоспазмом и крапивницей.
Во время инфузии антигистаминные препараты, адреналин и преднизолон должны находится в шаговой доступности от пациента для оказания немедленной помощи при развитии жизнеугрожающей ситуации.
Терапия должна включать в себя адреналин и преднизолон, которые вводятся внутривенно болюсно каждые 3-5 минут по мере необходимости и в соответствии с клиническим ответом.
В случае развития реакции гиперчувствительности в области бронхов и/или лёгких рекомендуются ингаляции с адреналином, которые следует повторять каждые 2 часа в соответствии с клиническим ответом.
Зуд, крапивница:
Рекомендуется антигистаминные препараты.
Профилактика анафилаксии выполняется доступными кортикостероидами.
Постоянно должна быть доступна свободная внутривенная линия.
Лёгкие симптомы (такие как локальная кожная реакция или озноб): уменьшите скорость инфузии на 50% до исчезновения симптомов, наблюдайте за пациентом, затем продолжите инфузию с первоначальной скоростью.
Антигистаминные препараты могут применяться каждые 4- 6 часов по усмотрению врача.
При умеренных симптомах (гипотензия): остановите инфузию, назначьте поддерживающую терапию, оставайтесь у постели и наблюдайте за пациентом до устранения симптомов. После инфузия может быть возобновлена с 50%-й скоростью.
При тяжелых симптомах (бронхоспазм, ангионевротический отек или анафилактический шок): немедленно прекратите инфузию. Используйте адреналин, антигистаминные и кортикостероиды, бронходилататоры и другие необходимые меры.
Пациенты должны находится в стационаре следующие 24 часа и до исчезновения симптомов.
Пациенты с сывороточной болезнью должны быть сняты с иммунотерапии.
Гипотензия:
Используйте 20 мл/кг раствора 0,9% натрия хлорида .
Если этого недостаточно, остановите инфузию динутуксимаба бета и поддерживайте давление болюсной инфузией физ. раствора и, при необходимости, вазопрессорами.
Если гипотензия купировалась болюсной инфузией, возобновите инфузию динутуксимаба бета скоростью 50%. Через час увеличьте скорость до полной.
Если гипотония рецидивирует на фоне инфузии динутуксимаба бета, не поддается коррекции или требует поддержки ИВЛ, рассмотрите возможность прекращения терапии.
При возникновении гипотонии (рассчитывается систолическое артериальное давление у детей в возрасте 1-10 лет - 70 мм рт. ст. + возраст в годах × 2]; Chameides, Samson, Schexnayder & Хазинский, 2011), прервите динутуксимаб бета и продолжайте тщательный мониторинг. Гипотония часто разрешается уменьшением скорости инфузии антител (Yu et al., 2010). При необходимости уменьшите скорость инфузии наркотика и введите физиологический раствор болюсно от 5 до 10 мл / кг.
Будьте осторожны при введении болюса физиологического раствора, поскольку это может усугубить синдром повышенной проницаемости капиляров. Когда гипотония разрешается, инфузия динутуксимаба бета может быть возобновлена на 50% скорости от предыдущей. Если через 2 часа артериальное давление остается в пределах нормы инфузия может быть увеличена как до 1,75 мг / м2 / час. Если гипотония не отвечает быстро на гидратацию или прекращение инфузии динутуксимаба бета, то адренергические вазопрессоры и перевод в отделение интенсивной терапии необходимы. Следует отметить, что динутуксимаб бета и вазопрессоры не может быть дано одновременно. Пациенты должны быть не зависимы от вазопрессоров для возобновления инфузии динутуксимаба бета.
Несмотря на то, что гипотония может купироваться не сразу, быстрое выздоровление является частым и наиболее часто не требует полного прекращения динутуксимаба бета (FDA, 2015).
Рекомендованные модификации дозы динутуксимаба бета
Нейротоксичность:
При использование динутуксимаба бета были зарегистрированы случаи тяжелой нейротоксичности (параплегии).
Пациенты, испытывающие объективную длительную слабость как признак нейротоксичности, должны получать следующую помощь:
- МРТ позвоночника/ МРТ головного мозга Пульс-терапию метилпреднизолоном Внутривенный иммуноглобулин Плазмаферез.
- Пациенты не могут продолжать терапию иммунотерапию.
Повышенная сосудистая проницаемость (синдром капиллярной у течки/СКУ):
Прекратите инфузию динутуксимаба бета.
Если синдром купируется или улучшается на фоне сопроводительной терапии, через 1 час возобновите инфузию динутуксимаба бета со скоростью 50% до завершения дозы.
Если СКУ повторяется или необходимы вазопрессоры – прекратите инфузию
Динутуксимаба бета.
Если СКУ требует поддержки ИВЛ, пациенты должны быть сняты с иммунотерапии.
NB! С осторожностью используйте диуретики и альбумин, поскольку гипотензия (диуретики) и легочная недостаточность (альбумин) могут возникнуть в результате применения этих препаратов при СКУ.
Раннее обнаружение и быстрое купирование этого побочного эффекта критичны.
Оценка для СПКП включает в себя измерение веса два раза в день, проверка и точное измерение баланса жидкости каждые 4 часа, что может служить ранними показателями задержки жидкости. Ежедневный мониторинг гемоглобина и уровень сывороточного альбумина обеспечивает контроль у пациента состояния внутрисосудистого объема жидкости. Низкий уровень альбумина и гемоглобина способствовать снижению онкотического давления в сыворотке крови, что приводит к осмотическому сдвигу жидкости из сосудистой сети в ткани. Поддержание гемоглобина ≥10 г/дл и сывороточного альбумина на верхнем пределе нормы обеспечивает повышенние онкотического давления; следовательно, утечка жидкости из капилляров уменьшается, что делает клинические симптомы СПКП менее выраженными. В результате многие учреждения переливают эритроциты (PRBC) для уровня гемоглобина ≤10 г / дл или 20 % альбумин, когда сывороточный альбумин приближается к нижней границе нормы для возраста. Введение диуретика, сразу после введения альбумина или эритроцитарной массы могут помочь в удалении избыточного внесосудистой жидкости и предотвратить перегрузку жидкостью. Минимизация внутривенных жидкостей во время терапии динутуксимабом бета может также предотвратить избыток жидкости в организме; оральная гидратация является предпочтительным видом приема жидкости. Несмотря на усилия по поддержанию более высокого онкотического давления, гемодинамический компромисс из-за СПКП действительно происходит. В этом следует остановить инфузию антител, оценить статус пациента. Если дополнительный объем жидкости требуется для управления гипотонией, то объем должен начинаться с низкого уровня от 5 до 10 мл / кг, для того чтобы минимизировать риск перегрузки жидкости. Назначение переливания эритроцитов и альбумина может исправить гипотензию, а также помочь в поддержании онкотического давления и может быть предпочтительнее внутривенных жидкостей. Если симптомы СПКП исчезнут, возобновите инфузию динутуксимаба бета на 50% скорости. Если СПКП опасен для жизни, прекратите прием динутуксимаба бета на этом курсе.
Общие признаки и симптомы СПКП включают периферические отеки /отеки лица, увеличение веса, тахипноэ, дистресс или крепитацию, увеличение удельного веса мочи. Снижение диуреза, гемодинамические проявления СПКП включают гипотензию и тахикардию, требует срочного вмешательства. Тщательный мониторинг пациентов необходим, поскольку СПКП может нарастать постепенно.
Оценка для СПКП включает в себя измерение веса два раза в день, проверка и точное измерение баланса жидкости каждые 4 часа, что может служить ранними показателями задержки жидкости. Ежедневный мониторинг гемоглобина и уровень сывороточного альбумина обеспечивает контроль у пациента состояния внутрисосудистого объема жидкости. Низкий уровень альбумина и гемоглобина способствовать снижению онкотического давления в сыворотке крови, что приводит к осмотическому сдвигу жидкости из сосудистой сети в ткани. Поддержание гемоглобина ≥10 г/дл и сывороточного альбумина на верхнем пределе нормы обеспечивает повышенние онкотического давления; следовательно, утечка жидкости из капилляров уменьшается, что делает клинические симптомы СПКП менее выраженными. В результате многие учреждения переливают эритроциты (PRBC) для уровня гемоглобина ≤10 г / дл или 20 % альбумин, когда сывороточный альбумин приближается к нижней границе нормы для возраста. Введение диуретика, сразу после введения альбумина или эритроцитарной массы могут помочь в удалении избыточного внесосудистой жидкости и предотвратить перегрузку жидкостью. Минимизация внутривенных жидкостей во время терапии динутуксимабом бета может также предотвратить избыток жидкости в организме; оральная гидратация является предпочтительным видом приема жидкости. Несмотря на усилия по поддержанию более высокого онкотического давления, гемодинамический компромисс из-за СПКП действительно происходит. В этом следует остановить инфузию антител, оценить статус пациента. Если дополнительный объем жидкости требуется для управления гипотонией, то объем должен начинаться с низкого уровня от 5 до 10 мл / кг, для того чтобы минимизировать риск перегрузки жидкости. Назначение переливания эритроцитов и альбумина может исправить гипотензию, а также помочь в поддержании онкотического давления и может быть предпочтительнее внутривенных жидкостей. Если симптомы СПКП исчезнут, возобновите инфузию динутуксимаба бета на 50% скорости. Если СПКП опасен для жизни, прекратите прием динутуксимаба бета на этом курсе.
Дополнительные побочные эффекты иммунотерапии:
В дополнение к реакциям, описанным выше, редкие побочные эффекты могут возникнуть в течение иммунотерапии, в том числе дисфункция печени (как доказано увеличение ALT [аланинаминотрансферазы] и / или AST [аспартатаминотрансфераза]) и электролитные нарушения. Гипокалиемия может быть особенно распространена у детей, нуждающихся в частом приеме фуросемида. Биохимические анализы должны быть внимательно анализироваться, и если возникают серьезные дисбалансы, то коррекция электролитов может быть необходима. Тошнота, рвота и диарея также являются потенциальными побочными эффекты и поддерживающие препараты должны быть использованы по мере необходимости для облегчения симптомов.
Рекомендованные модификации дозы динутуксимаба бета
|
Нежелательная лекарственная реакция
|
Степень тяжести | Модификация терапии |
|
Любая
|
Степень 1-2 | Снизить скорость инфузии на 50%. После разрешения возобновить инфузию с исходной скоростью. |
| Реакция гиперчувствительности | Например, гипотензия | Приостановить инфузию, применить поддерживающие меры. После разрешения возобновить инфузию с исходной скоростью. |
| Расширенные зрачки с замедленным зрачковым рефлексом +/- светобоязнь | Приостановить инфузию. После разрешения возобновить инфузию со скоростью 50%. | |
|
Любая
|
Степень ≥3 | Приостановить инфузию и применить поддерживающие меры. Возобновить инфузию со скоростью 50%, если НЛР разрешается или улучшается до степени 1-2. После полного разрешения повысить скорость до исходной. |
| Нежелательная лекарственная реакция | Степень тяжести | Модификация терапии |
| Повторное явление | Прекратить инфузию. Возобновить на следующий день, если НЛР разрешалась. | |
| Реакция гиперчувствительности | Например, бронхоспазм, ангиоотёк | Немедленно остановить инфузию и провести соответствующее лечение (см. Раздел 4.4). Возобновить терапию с началом следующего курса. |
| Синдром повышенной проницаемости капилляров | - | Приостановить инфузию и применить поддерживающие меры. Возобновить со скоростью 50%, если НЛР разрешилась или улучшилась до степени 1-2. |
Терапию динутуксимабом бета следует окончательно отменить при развитии следующих проявлений токсичности:
Анафилаксия степени 3 или 4.
Пролонгированная периферическая моторная нейропатия степени 2.
Перечень основных лекарственных средств (имеющих 100% вероятность применения): [1]
Периферическая нейропатия степени 3.
Офтальмологическая токсичность, связанная со зрением, степени 3.
Гипонатриемия степени 3 (<120 мэкв/л), несмотря на адекватное введение жидкостей.
Синдром повышенной проницаемости капилляров, который рецидивирует или достигает степени 4 (требуется вентиляционная поддержка).
Перечень основных лекарственных средств (имеющих 100% вероятность применения): [1]
|
Лекарственная группа
|
Международное непатентованное наименование ЛС | Способ применения | Уровень доказательности |
| Цитостатический препарат | Топотекан* | Внутривенно капельно | В |
| Цитостатический препарат | Циклофосфамид | Внутривенно капельно | А |
| Цитостатический препарат | Этопозид* | Внутривенно капельно | А |
| Цитостатический препарат | Цисплатин | Внутривенно капельно | В |
| Цитостатический препарат |
Виндезин*/ Винбластин/
Винкристин*
|
Внутривенно капельно /струйно | С |
| Антинеопластические и иммуномодулирующие препараты | Дакарбазин | Внутривенно капельно | А |
| Алкилирующий цитостатик | Ифосфамид | Внутривенно капельно | В |
| Противоопухолевые антибиотики | Доксорубицин | Внутривенно капельно | В |
| Цитостатический препарат | Мелфалан | Внутривенно капельно | С |
| Цитостатический препарат | Карбоплатин | Внутривенно капельно | В |
| Алкилирующий цитостатик | Иринотекан | Внутривенно капельно /интравенозно | В |
| Алкилирующий цитостатик | Темозоломид | Через рот | В |
| Иммунотерапия | Динутуксимаб бета* | Внутривенно капельно | В |
*В соответствии с правилами применения незарегистрированных ЛС.
NB! Дополнительное медикаментозное лечение проводится соответственно протоколам лечения развившихся осложнений.
Хирургическое вмешательство
Показания к радикальному оперативному лечению: по данным визуальной диагностики наличие резектабельной опухоли.
Противопоказания: крайне тяжелое состояние. При невозможности удаления опухоли из-за большого размера и распространенности процесса, лечение начинается с предоперационной химиотерапии.
Для удаления опухоли проводятся операции в зависимости от локализации: Лапаротомия, лапароскопия, торакотомия, торакоскопия, иссечение мягких тканей.
Первоначально требуется выполнение биопсии опухоли для гистологического и молекулярного исследований. Допустимым является выполнение частичной резекции или открытой биопсии первичной опухоли или метастатического очага. Полная резекция первичной опухоли не требуется. Она может быть выполнена у отдельных пациентов, при условии низких предполагаемых хирургических осложнений. Расширенные операции с целью полного удаления первичной опухоли не должны предприниматься. Нефрэктомия, повреждение крупных сосудов или другие осложнения должны избегаться при проведении первичного хирургического вмешательства.
Если при проведении рестадирования во время проведения индукционной терапии отмечен полный или очень хороший частичный ответ со стороны первичной опухоли и региональных лимфоузлов, дополнительная резекция не требуется.
После химиотерапии, резекция может быть выполнена с меньшим риском разрыва опухоли. Поэтому, попытка резекции первичной опухоли может быть предпринята после 4 или 6 цикла химиотерапии.
После лучевой терапии, выполнение операции может быть осложнено развитием постлучевого фиброза. Поэтому попытка резекции должна быть предпринята перед проведением лучевой терапии. Следует отметить, что после операции уменьшение объема опухоли может привести к уменьшению зоны облучения или полному отказу от проведения лучевой терапии.
Риск операции должен быть сбалансирован с пользой от радикального удаления первичной опухоли. Микроскопически радикальное удаления опухоли не требуется. Микроскопически и даже макроскопически остаточная опухоль является приемлемой, несмотря на то, что макроскопически полное удаление опухоли ассоциировано с лучшим исходом у пациентов с локализованной нейробластомой в возрасте > 1 года.
Поскольку разрыв опухоли менее вероятен после проведения химиотерапии, нарушение целостности опухоли приемлемо, что может способствовать резекции во время отсроченной операции.
Индикаторы эффективности лечения.
Всем пациентам после 2, 4, 6 циклов ХТ, после окончания химиотерапевтического этапа и после завершения всей программы лечения, рекомендуется оценка ответа на терапию для определения дальнейшей тактики ведения пациента.
Критерии ответа на терапию
Критерии ответа на терапию
| Ответ | Первичная опухоль | Метастатические области |
| ПО | Нет опухоли | Нет опухоли, катехоламины в норме. |
| ОХЧО | Уменьшение на 90-99% | Нет опухоли, выявляются остаточные изменения костей Тс 99 |
| ЧО | Уменьшение >50% |
Все измеряемые места уменьшаются >50%.
Кости и КМ: число позитивных мест уменьшено >50%, не более 1 позитивного места в КМ выявляется
|
| СО |
Нет новых повреждений; уменьшение некоторых измеряемых повреждений
(первичных или метастатических) более 50%, с менее 50% уменьшением в каких либо других; менее 25% увеличение некоторых существующих повреждений
|
|
| НО |
Нет новых повреждений; менее 50% уменьшения, но менее 25% увеличение в некоторых существующих повреждениях
|
|
| ПБ |
Любые новые повреждения; увеличение в некоторых измеренных повреждениях более 25%; до этого чистый костный мозг повреждается опухолью.
|
|
Один позитивный аспират КМ или биопсия позволительны для частичного ответа, если это репрезентативное снижение в числе позитивных мест на момент диагностики.
Проведение нижеперечисленных видов обследования возможно в условиях дневного стационара специализированного онкогематологического отделения.
Пациенты, без остаточной опухоли [1,13]
|
Обследование
|
1-й год | 2-5 годы | После 5-го года |
| Клиническая оценка | Каждые 6 недель | Каждые 3 месяца | Каждые 6-12 месяцев |
| Катехоламины в моче | Каждые 6 недель | Каждые 3 месяца | Каждые 6-12 месяцев |
|
УЗИ/Рентгенография грудной клетки*
|
Каждые 6 недель | Каждые 3 месяца | Каждые 6-12 месяцев |
|
ЛДГ и нейронспецифическая энолаза
|
С каждым забором венозной крови во время МРТ или сцинтиграфии | ||
|
МРТ пораженной зоны**
|
Через 3 месяца после операции, в дальнейшем только в случае подозрительных результатов УЗИ и Рентгенографии | ||
| Сцинтиграфия | Только в случае подозрительных результатов УЗИ и Рентгенографии | ||
* Для внутригрудных опухолей не применяется УЗИ исследование, и поэтому необходимо выполнение рентгенограммы грудной клетки
** более частое выполнение МРТ используется при присутствии интроспинальной/ итрафораминальной остаточной опухоли.
Пациенты с остаточной опухолью
Пациенты среднего и высокого риска
Пациенты с остаточной опухолью
|
Обследование
|
1-й год | 2-5 годы | После 5-го года |
| Клиническая оценка | Каждые 6 недель | Каждые 3 месяца | Каждые 6 месяцев |
| Катехоламины в моче | Каждые 6 недель | Каждые 3 месяца | Каждые 6 месяцев |
|
УЗИ/Рентгенография грудной клетки*
|
Каждые 6 недель | Каждые 3 месяца | Каждые 6 месяцев |
|
ЛДГ и нейронспецифическая энолаза
|
С каждым забором венозной крови во время МРТ или сцинтиграфии | ||
| МРТ пораженной зоны** |
1 раз в 6 месяцев, если первичная опухоль четка видна на УЗИ, в сомнительных случаях 1 раз в 3 месяца
|
1 раз в год | Только при подозрении |
| Сцинтиграфия | Каждые 6 месяцев до нормализации | ||
* Для внутригрудных опухолей не применяется УЗИ исследование, и поэтому необходимо выполнение рентгенограммы грудной клетки
** более частое выполнение МРТ используется при присутствии интроспинальной/ итрафораминальной остаточной опухоли.
Пациенты среднего и высокого риска
|
Обследование
|
1-й год | 2-5 годы | После 5-го года |
| Клиническая оценка | Каждые 6 недель | Каждые 3 месяца | Каждые 6 месяцев |
| Катехоламины в моче | Каждые 6 недель | Каждые 3 месяца | Каждые 6 месяцев |
|
УЗИ/Рентгенография грудной клетки*
|
Каждые 6 недель | Каждые 3 месяца | Каждые 6 месяцев |
| ЛДГ и нейронспецифическая энолаза |
С каждым забором венозной крови во время МРТ или
сцинтиграфии
|
Каждые 3 месяца | Каждые 6 месяцев |
| МРТ** | Каждые 3 месяца |
Каждые 6 месяцев, но только при предшествующем обследовании еще имелись отклонения от нормы
|
Каждые 6 месяцев |
| Сцинтиграфия | Каждые 6 месяцев до нормализации |
Каждые 6 месяцев, но только при предшествующем обследовании еще имелись отклонения от нормы
|
Каждые 6 месяцев |
|
Исследование костного мозга из 4-х точек
|
Каждые 6 месяцев до нормализации | Каждый 2-й год | Каждый 3-й год |
| ЭКГ/ ЭхоКГ, аудиометрия, контроль функции почек, гормоны щитовидной железы, кривые роста, половое развитие | В конце каждого года | Каждый 2-й год | Каждый 3-й год |
* Для внутригрудных опухолей не применяется УЗИ исследование, и поэтому необходимо выполнение рентгенограммы грудной клетки
** более частое выполнение МРТ используется при присутствии интраспинальной/ итрафораминальной остаточной опухоли.
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ
Показания для плановой госпитализации:
Наличие клинических проявлений заболевания, верификация диагноза, направительная выписка с предварительными данными исследования. Повторная госпитализация на очередной курс химиотерапии.
Показания для экстренной госпитализации:
При ухудшении общего состояния в межблочном периоде (развитие цитопенического синдрома, глубокая анемия, геморрагический синдром, инфекционные осложнения), паллиативные пациенты, требующие стационарной коррекции состояния, необходимо госпитализировать в ОДБ по месту жительства, для проведения симптоматической терапии.
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2022
- 1) NB2004 Trial Protocol for Risk Adapted Treatment of Children with Neuroblastoma. 2) Клинические рекомендации Нейробластома у детей 2020г., Качанов Денис Юрьевич, д.м.н., Шаманская Татьяна Викторовна, Варфоломеева Светлана Рафаэлевна 3) Kaatsch P., Spix C. German Childhood Cancer Registry – Annual Report 2015 (1980–2014) Institute of Medical Biostatistics, Epidemiology and Informatics (IMBEI) at the University Medical Center of the Johannes Gutenberg University Mainz. 2015. 118 p. 8. Tulla M. et al. Incidence, trends, and survival of children with embryonal tumors // Pediatrics. American Academy of Pediatrics, 2015. Vol. 136, № 3. P. e623–e632. 4) Cheung, N.K. Neuroblastoma: developmental biology, cancer genomics and immunotherapy / Cheung N.K., Dyer M.A. // Nat Rev Cancer. – 2013. – Vol. 13(6). – P.397–411. 5) Zhang, P.; Wu, X.; Basu, M.; Dong, C.; Zheng, P.; Liu, Y.; Sandler, A.D. MYCN Amplification Is Associated with Repressed Cellular Immunity in Neuroblastoma: An In Silico Immunological Analysis of TARGET Database. Front. Immunol. 2017, 8, 1473. 6) Kaatsch P, Spix C. German Childhood Cancer Registry - Annual Report 2015 (1980-2014). Institute of Medical Biostatistics, Epidemiology and Informatics (IMBEI) at the University Medical Center of the Johannes Gutenberg University Mainz, 2015. 7) Berthold, F. Neuroblastoma: current drug therapy recommendations as part of the total treatment approach / Berthold F., Hero B. // Drugs. – 2020. – Vol. 59(6). – P. 1261–1277. 8) Mody, R.; Naranjo, A.; Van Ryn, C.; Yu, A.L.; London, W.B.; Shulkin, B.L.; Parisi, M.T.; Servaes, S.E.; Diccianni, M.B.; Sondel, P.M.; et al. Irinotecan-temozolomide with temsirolimus or dinutuximab in children with refractory or relapsed neuroblastoma (COG ANBL1221): An open-label, randomised, phase 2 trial. Lancet Oncol. 2017, 18, 946–957 9) Xia J. et al. Comparison of diagnosing and staging accuracy of PET (CT) and MIBG on patients with neuroblastoma: Systemic review and meta-analysis // J. Huazhong Univ. Sci. Technol. - Med. Sci. 2017. Vol. 37, № 5. P. 649–660. 10) Khismatullina, M. Maschan, D. Balashov , J. Skvortsova, D. Shasheleva, G.Novichkova, D. Kachanov, E. Skorobogatova, T. Shamanskaya, G. Muftakhova, K.Kirgizov, S. Varvolomeeva, L. Shelikhova, A. Maschan. Retrospective comparison oftreosulphan/melphalanversus carboplatin/etoposide/melphalan as preparative regimen forautologous transplantation in pediatric neuroblastoma. 41st Annual Meeting of theEuropean Society for Blood and Marrow Transplantation. Istanbul, Turkey, 22 - 25March 2015. Bone Marrow Transplantation. 2015, Vol. 50, Issue S1. P. S308. 11) Smith, V.; Foster, J. High-Risk Neuroblastoma Treatment Review. Children 2018, 5, 114. 12) Devrim I. et al. A single center’s experience with Candida parapsilosis related long-term central venous access device infections: The port removal decision and its outcomes // Pediatr. Hematol. Oncol. Informa Healthcare, 2014. Vol. 31, № 5. P. 435–441. 13) Simon, T. I-131-meta-iodobenzylguanidine therapy improves survival in high-risk neuroblastoma patients with mIBG positive residual metastatic disease / Simon T.,Schmidt M., Decarolis B., Eggert A., Berthold F., Hero B. // Proceedings of Advances of Neuroblastoma Research Congress. – Cairns, Australia, 2016. – P. 110. 14) Качанов Денис Юрьевич, Диспансерное наблюдение за пациентами с нейробластомой группы низкого риска (за исключением 4S стадии) // Российский журнал детской гематологии и онкологии. 2015. Vol. 2 № 1. P. 101–106.
Информация
Организационные аспекты протокола
Список разработчиков протокола:
1) Манжуова Лязат Нурбапаевна – главный внештатный детский онколог/гематолог МЗ РК, заместитель председателя Правления по научно-клинической и инновационной деятельности, кандидат медицинских наук, врач онколог/гематолог детский высшей квалификационной категории Научного центра педиатрии и детской хирургии г. Алматы.
2) Жумадуллаев Бахрам Маликайдарович – кандидат медицинских наук, онколог/гематолог детский, заведующий отделением хирургии №2, Научного центра педиатрии и детской хирургии г. Алматы.
3) Абдилова Гульнара Калденовна – кандидат медицинских наук, онколог/гематолог детский, руководитель педиатрического блока, врач высшей квалификационной категории Научного центра педиатрии и детской хирургии г. Алматы.
4) Нуржанова Гаухар Амангельдиевна – врач онколог/гематолог детский, заведующая отделением онкологии/гематологии №2, Научного центра педиатрии и детской хирургии г. Алматы.
5) Кривенко Елена Владимировна - врач онколог/гематолог детский, детский хирург отделения хирургии №2, Научного центра педиатрии и детской хирургии г. Алматы
6) Ремкулова Мухаббат Ахметжановна - врач онколог/гематолог детский отделения онкологии/гематологии №4 Научного центра педиатрии и детской хирургии г. Алматы.
7) Шайхызада Кундыз Газизовна - врач онколог/гематолог детский, заведующая программы солидных опухолей, отдел онкологии, клинико-академический департамент педиатрии КФ UMC Национальный научный центр материнства и детства г. Астана. 8) Ералиева Бибихан Абдалиевна - кандидат медицинских наук, заведующий кафедрой клинической фармакологии Казахский медицинский университет непрерывного образования, главный внештатный клинический фармаколог УОЗ г.Алматы.
Указание на отсутствие конфликта интересов: нет.
Рецензенты:
Жумашев Уалихан Кошкаралиевич – доктор медицинских наук, профессор кафедры интернатуры и резидентуры в онкологии Казахский Национальный Медицинский Университет им С.Асфендиярова
Пересмотр протокола: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.