Мужское бесплодие
 Версия: Клинические рекомендации РФ 2025 (Россия)
Версия: Клинические рекомендации РФ 2025 (Россия)
Мужское бесплодие (N46), Общее консультирование и советы по восстановлению детородной функции (Z31.6)
Урология
Общая информация
Краткое описание
Разработчик клинической рекомендации
Общероссийская общественная организация "Российское общество урологов"
Одобрено Научно-практическим Советом Минздрава России
Клинические рекомендации
Мужское бесплодие
Год утверждения (частота пересмотра): 2025
Пересмотр не позднее: 2027
ID: 5_3
Возрастная категория: Взрослые
Определение заболевания или состояния (группы заболеваний или состояний)
Бесплодие – это заболевание, характеризующееся невозможностью достичь клинической беременности после 12 месяцев регулярной половой жизни без контрацепции вследствие нарушения способности субъекта к репродукции, либо индивидуальной, либо совместно с его/ее партнером. Вмешательства по поводу бесплодия могут быть начаты и ранее 1 года, основываясь на данных медицинского, сексуального и репродуктивного анамнеза, возраста, данных физикального обследования и диагностических тестов. Бесплодие – это заболевание, которое характеризуется наличием препятствия к реализации репродуктивной функции [1].
Бесплодие у пары может быть вызвано абсолютным бесплодием (стерильностью) одного или обоих партнёров, однако, чаще оно обусловлено относительной недостаточностью их репродуктивной функции (относительное бесплодие), в таких парах интерпретировать результаты обследования репродуктивной системы мужчин в отрыве от параметров обследования женщин нецелесообразно [2, 3]. Нарушение репродуктивной функции мужчины, приводящее к невозможности зачатия, свидетельствуют о мужском бесплодии, при этом его супруге (партнерше) может быть поставлен диагноз «женское бесплодие, связанное с мужскими факторами» (код МКБ-10 N97.4).
Репродуктивная функции мужчин (фертильность) определяется состоянием органов половой системы, обеспечивающих формирование сперматозоидов и их доставку, параметрами эякулята, функциональными характеристиками сперматозоидов и качеством содержащегося в них генетического материала, необходимых для оплодотворения яйцеклетки и развития эмбриона. Показатели репродуктивной функции в силу естественных причин высоко вариабельны, они зависят от сексуальной активности, возраста, генетических и фенотипических особенностей мужчин, а также от состояния организма, наличия острых и\или хронических заболеваний, образа жизни и условий среды обитания и др. Вероятность успешного взаимодействия сперматозоидов с яйцеклеткой и развития эмбриона в естественных условиях и при применении ВМИ и ВРТ, наступления и самопроизвольного прерывания беременности, а также рождения здорового ребенка может снижаться при различных заболеваниях и патологических состояниях, под воздействием неблагоприятных факторов образа жизни, загрязнения окружающей среды, профессиональных вредностей и др.. Признаком недостаточности репродуктивной функции (репродуктивной дисфункции) мужчин может быть не только бесплодие у пары, но также и привычный выкидыш у супруги (партнерши) или неудача ее лечения по поводу бесплодия с применением ВМИ и ВРТ (например, вследствие отсутствия оплодотворения ооцита или прекращения развития эмбриона) и др. Оценка состояния репродуктивной функции (Z31.6 «Общее консультирование и советы по восстановлению детородной функции») производится при профилактических осмотрах мужчин репродуктивного возраста, при планировании преконцепционной (прегравидарной) подготовки и т.п. с целью уточнения вероятности зачатия и рождения ребенка, выявления и последующего устранения препятствующих этому причин и профилактики нарушений [4, 5, 6, 7]. Заключение о состоянии репродуктивной функции целесообразно дополнять соответствующими формулировками, например, «бесплодие в паре», «привычный выкидыш у супруги (партнерши)», «неудача лечения с применением ВМИ или ВРТ» позволяющими обосновать планы последующего обследования и лечения [8].
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
N46 – Мужское бесплодие
Z31.6 – Общее консультирование и советы по восстановлению детородной функции
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
Общепринятой классификации мужского бесплодия не существует. Классификация причин мужского бесплодия строится с учетом локализации нарушения (гипоталамус, гипофиз, яички, придаточные половые железы, семявыносящие пути) и его природы (генетическая, эндокринная, воспалительная, травматическая и др.). Исходя из патогенеза нарушений, можно выделить несколько основных форм мужского бесплодия, которые могут сочетаться [8, 19, 25].
- Секреторное бесплодие, характеризующееся недостаточностью выработки сперматозоидов
- Экскреторное бесплодие, при котором нарушен транспорт сперматозоидов по семявыносящим путям
- Иммунологическое бесплодие
- Другие формы бесплодия, которые могут быть вызваны функциональной несостоятельностью сперматозоидов и содержащегося в них генетического материала (вследствие 100% аномалии формы сперматозоидов, приводящей к невозможности оплодотворения яйцеклетки, повреждениями сперматозоидов под влиянием оксилительного стресса, обусловленные дефектами структуры ДНК сперматозоидов, хромосомными перестройками, генетическими нарушениями и др.)
- Идиопатическое или необъяснимое бесплодие, при котором после проведенного обследования причины бесплодия остались нераспознанными
Неуточненным называют бесплодие у пары, при котором его причину установить не удалось.
По отношению к основному органу репродуктивной системы, яичку, также выделяют претестикулярные, тестикулярные и посттестикулярные формы бесплодия
Мужское бесплодие может быть первичным и вторичным.
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Мужское бесплодие – это симптом различных заболеваний и патологических состояний органов и систем организма, приводящих к невозможности зачатия вследствие нарушения репродуктивной функции на этапах созревания сперматозоидов, их доставки в женские половые органы и последующего продвижения, капацитации, акросомной реакции, оплодотворения яйцеклетки и развития эмбриона [9].
Негативное влияние на состояние репродуктивной функции могут оказывать [10, 11].
- врожденные аномалии развития (анорхизм, крипторхизм и недоразвитие яичек, врожденное отсутствие vas deferens, гермафродитизм, гипоспадия и др.);
- приобретенные изменения строения и дисфункция органов репродуктивной системы (обструкция семявыносящих путей, атрофия яичек и др).
- генетические нарушения (синдром Клайнфельтера, микроделеции Y хромосомы и транслокации других хромосом, точечные мутации и полиморфизм генов и др.);
- злокачественные новообразования
- инфекционно-воспалительные заболевания
- повышение температуры органов мошонки (горячие ванны, сауна и т.п., варикоцеле);
- эндокринные нарушения (недостаточность гипоталамуса и гипофиза, гиперпролактинемия, нарушение функции щитовидной железы, гипогонадизм, андрогенрезистентность и снижение чувствительности к гонадотропинам, и др.);
- иммунологические нарушения (антиспермальные антитела, системные аутоиммунные заболевания и др.);
- системные заболевания (диабет, хроническая почечная и печеночная недостаточность и др.);
- сексуальные расстройства (эректильная дисфункция, нарушения эякуляции и др.);
- факторы образа жизни и интоксикации (курение, анаболические стероиды, наркотики, стрессы, перегревание и др.);
- факторы внешней среды (воздействия физических и химических факторов, профессиональных вредностей – электромагнитного излучения, пестицидов, тяжелых металлов и др.)
- ятрогения (последствия диагностических и лечебных вмешательств: применения лекарственных средств, оперативного вмешательств и др.)
- функциональные нарушения сперматозоидов и содержащегося в них генетического материала (анеуплодии сперматозоидов, нарушение упаковки хроматина, фрагментация ДНК сперматозоидов и др.)
Состояние репродуктивной функции зависит от возраста мужчин: после 30-35 лет может наблюдаться снижение параметров эякулята, показателей, характеризующих функцию сперматозоидов и качество их генетического материала, вероятность рождения ребенка при возрасте будущего отца старше 35 лет ниже по сравнению с более молодыми отцами, в том числе и при применении ВРТ [12, 13].
Исследования последних лет показали, что неблагоприятные химические и физические факторы окружающей среды, особенности образа жизни, а также сопутствующие заболевания могут приводить к оксидативному стрессу – избыточному формированию активных форм кислорода (АФК), вызывающих повреждение клеточных структур, в частности фрагментацию ДНК сперматозоидов (ФДС), что в итоге приводит к нарушению функции сперматозоидов, а также повышает риски невынашивания беременности и развития наследственных дефектов у плода [14, 15, 16, 17].
В 30-40% случаев у мужчин не удается уточнить этиопатогенетические факторы бесплодия, они не имеют в анамнезе заболеваний, влияющих на фертильность, имеют нормальные показатели физикального осмотра и гормональных, генетических и биохимических лабораторных исследований. Считается, что нарушение репродуктивной функции у них может быть связано с пока еще неизвестными или ранее не идентифицированными патологическими факторами, которые включают, но не ограничиваются эндокринными нарушениями в результате загрязнения окружающей среды, генерацией активных форм кислорода (АФК)/повреждением ДНК сперматозоидов или генетическими и эпигенетическими аномалиями [18, 19].
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Согласно данным ВОЗ 17,5% людей сталкиваются c проблемой бесплодия в течение жизни, при этом мужское бесплодие выявляется в 8,2-21,8% случаев [20].
В России за период 2000-2018 гг. отмечено увеличение количества мужчин с бесплодием в 2,1 раза и наблюдается значительный разброс частоты регистрации мужского бесплодия, как в Федеральных округах РФ, так и в регионах одного округа [21].
В последние годы появились публикации, свидетельствующие о постепенном снижении числа и концентрации сперматозоидов мужчин в большинстве стран мира, включая РФ, а также о негативном влиянии неблагоприятных факторов окружающей среды и образа жизни мужчин на параметры эякулята и функциональные характеристики сперматозоидов [22, 23, 24].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Бесплодие в паре проявляется невозможностью достичь клинической беременности после 12 месяцев регулярной половой жизни без контрацепции. Клиническая картина мужского бесплодия представлена заболеваниями и патологическими состояниями мужчины, приводящими к невозможности зачатия естественным путем.
Недостаточность мужской репродуктивной функции (репродуктивная дисфункция) проявляется изменениями состояния органов половой системы, обеспечивающих формирование сперматозоидов и их доставку, параметров эякулята, функциональных характеристик сперматозоидов и качества содержащегося в них генетического материала, необходимых для оплодотворения яйцеклетки и развития эмбриона, она может приводить к снижению способности мужчины к воспроизведению потомства, неудачам лечения с применением ВМИ и ВРТ, а также к невынашиванию беременности [2, 26].
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Бесплодие у пары диагностируется при жалобе на невозможность достичь клинической беременности после 12 месяцев регулярной половой жизни без контрацепции. В течение первых 6 месяцев регулярной половой жизни без контрацепции зачатие происходит примерно у 80% супружеских пар. В связи с тем, что у женщин в возрасте после 30 лет способность к зачатию с каждым последующим годом уменьшается (по сравнению с женщинами 20 лет она снижена примерно в 2 раза), обследование пары по поводу отсутствия беременности у женщины в возрасте старше 35 лет может быть начато через 6 мес. активной половой жизни без контрацепции [27, 28].
Критерии установки диагноза
Мужское бесплодие диагностируется при выявлении нарушений репродуктивной функции мужчин, приводящих к невозможности зачатия – сексуальной дисфункции или анатомических дефектов, не позволяющих обеспечить доставку спермы, азооспермии и криптозооспермии, при функциональной несостоятельности сперматозоидов и содержащегося в них генетического материала, например, 100%-ной астено-, некро- и глобулозооспермии, синдроме ацефалических сперматозоидов и др. [1, 34, 35, 36].
- Диагностические мероприятия по поводу бесплодия пары должны быть начаты у мужчин и женщин одновременно, обследование мужчины проводит врач-уролог. Рекомендуемая длительность обследования составляет не более 6 месяцев, фертильность женщины необходимо учитывать при планировании диагностики и лечения у мужчин [32, 33].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
- Рекомендуется прием (осмотр, консультация) врача-уролога первичный мужчин во всех случаях выявления бесплодия в паре, а также привычного выкидыша и после неудачных протоколов лечения с применением ВРТ у жены (партнерши), с целью сбора анмнеза и жалоб при патологии мужских половых органов (A01.21.001), визуального исследования при патологии мужских половых органов (A01.21.002) пальпации при патологии мужских половых органов (A01.21.003), составления плана обследования и плана лечения [29, 30, 31].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: от состояния репродуктивной функции мужчин непосредственно зависит не только вероятность зачатия естественным путем, но и результаты оплодотворения ооцитов, развитие эмбриона в программах ВРТ, вероятность наступления и вынашивания беременности.
Обследование мужчины по поводу привычного выкидыша у жены (партнерши) и по результатам неудачного лечения по поводу бесплодия с применением ВМИ и ВРТ проводится с учетом заключения врача акушера-гинеколога.
Диагностика преследует следующие цели:
- Оценить состояние репродуктивной функции мужчины и диагностировать мужское бесплодие;
- Выявить заболевания, патологические состояния и другие причины, способствующие развитию недостаточности репродуктивной функции и мужского бесплодия, такие как факторы образа жизни и окружающей среды, профессиональные вредности, наличие острых и\или хронических заболеваний; оценить возможность проведения преконцепционной (прегравидарной) подготовки, лечения и устранения неблагоприятного воздействия, а также планирования профилактических мер и мер по укреплению здоровья; определить вероятность и сроки восстановления фертильности
- Оценить возможность лечения с применением ВМИ и ВРТ (в том числе и с применением донорской спермы) по согласованию с врачом акушером-гинекологом, уточнить причины неудач предшествующего лечения для планирования преконцепционной подготовки с целью повышения вероятности успеха последующего лечения
- Определить маршрутизацию пациента при организации междисциплинарного взаимодействия
1. Жалобы и анамнез
- Рекомендуется при сборе жалоб и анамнеза уточнить наличие факторов риска – заболеваний, факторов образа жизни и окружающей среды, способных негативно повлиять на состояние мужской репродуктивной функции для уточнения причины бесплодия [3, 8, 31].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: сбор жалоб и анамнеза должен включать следующие данные
- возраст мужчины и его супруги (партнерши)
- сведения о частоте половых актов и соответствия их проведения интервалу с наибольшей вероятностью зачатия у женщины.
- длительность бесплодия, наличие детей или беременностей у партнерш в прошлом
- общее самочувствие
- состояние сексуальной функции (полового влечения, эрекции, семяизвержения)
- сведения об аномалиях развития, наследственных заболеваниях и заболеваниях детского и подросткового возраста
- перенесенных и хронических заболеваниях, в том числе системных, злокачественных новообразованиях, лекарственной терапии, оперативных вмешательствах, результатах предшествующего лечения по поводу бесплодия, включая применение вспомогательных репродуктивных технологий
- инфекциях, передаваемых половым путем и воспалительных заболеваниях половых органов (орхита, эпидидимита, простатита), результатах предшествующего лечения
- аллергических реакциях
- неблагоприятных факторах внешней среды и образа жизни, в том числе профессиональных вредностях, воздействии токсинов и радиации
- употреблении алкоголя, курении,
- применении анаболических стероидов
- воздействии высоких температур (например, посещение бань, саун.
Вероятность зачатия максимальна при частоте половых актов 2-4 раза в неделю. Интервалы воздержания более 2 дней могут отрицательно влиять на качество сперматозоидов [37, 38, 39, 40].
2. Физикальное обследование
- Рекомендуется при физикальном обследовании мужчин оценить вторичные половые признаки, особенности телосложения, состояние грудных желез, распределение волосяного покрова, при осмотре наружных половых органов оценить расположение наружного отверстия мочеиспускательного канала, произвести пальпацию придатков яичек и яичек, семявыносящих протоков, определить объем яичек, наличие или отсутствие варикоцеле, рассчитать индекс массы тела, с целью определения факторов риска, способных негативно повлиять на состояние мужской репродуктивной функции [8].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
3. Лабораторные диагностические исследования
Лабораторные исследования направлены на оценку состояния и регуляции репродуктивной функции мужчин, выявление причин бесплодия, генетических аномалий. Проведение базовых (НМУ «Спермограмма»), расширенных и углубленных исследований эякулята в соответствии с методиками, описанными в руководстве ВОЗ [41] (определение антиспермальных антител в эякуляте, фрагментации ДНК сперматозоидов (ФДС), анеуплоидии сперматозоидов, соотношения гистонов и протаминов, оксидативного стресса, акросомальной реакции и др.) и других тестов, позволяет получить данные, свидетельствующие о функциональных характеристиках сперматозоидов и качества их генетического материала, что может помочь уточнить причину бесплодия, неудач лечения с применением ВМИ и ВРТ, невынашивания беременности. При этом при низких значениях числа, подвижности и доли нормальных форм сперматозоидов нередко выявляют более высокий уровень показателей, указывающих на их функциональную несостоятельность [42, 43].
Широкое распространение получила оценка антиспермальных антител и ФДС в эякуляте, однако, клиническую интерпретацию полученных результатов этих и других тестов затрудняет вариабельность исследуемых показателей, недостаточная стандартизация протоколов выполнения и отсутствие консенсуса в отношении референсных интервалов, которые в настоящее время каждой лаборатории предложено устанавливать самостоятельно [19, 44, 45, 46, 47].
Аутоиммунные реакции против сперматозоидов сопровождаются выработкой антиспермальных антител (АСАТ) Тест «Смешанная антиглобулиновая реакция сперматозоидов» (MAR-тест на наличие антиспермальных антител в сперме) относится к категории иммунологических, позволяет судить о наличии на поверхности сперматозоидов иммуноглобулинов IgA и IgG, снижающих фертильность. АСАТ в значениях выше 50% у мужчин с жалобами на бесплодие встречаются чаще, чем у фертильных – в 2,6%-6% и 0,9% случаев соответственно, что можно объяснить их отрицательным влиянием на компоненты репродуктивной системы и этапы реализации репродуктивной функции: целостность мембран и ДНК, концентрацию и подвижность сперматозоидов, способность проникновения через цервикальную слизь, капацитацию, акросомную реакцию, взаимодействие с яйцеклеткой. Вероятность зачатия естественным путем от мужчин с результатами MAR-теста равными 100% оказалась существенно ниже тех, у кого его значение находится в диапазоне от 50% до 99% и составила 4,5% и 30,0% соответственно. Предложенное ранее значение MAR-теста 50% в качестве пороговой величины не позволило прогнозировать вероятность наступления естественной беременности, в связи с этим авторы руководства ВОЗ сообщили об отсутствии данных, позволяющих установить референсные значения MAR-теста для эякулята и отнесли его к группе расширенных методов исследования. Наличие антиспермальных антител не влияет на частоту наступления беременности при лечении по поводу бесплодия с применением ЭКО или ИКСИ [48, 49, 50, 51, 52, 53, 54].
К расширенным методам исследования эякулята также относятся тесты оценки ФДС. В патогенез появления разрывов ДНК сперматозоидов на клеточном уровне вовлечены механизмы апоптоза, нарушения созревания хроматина сперматозоидов и окислительного стресса. Более высоким уровням ФДС соответствуют меньшая вероятность наступления и последующего вынашивания беременности, а также зачатия и рождения ребенка после ВМИ и лечения с применением ВРТ. В настоящее время применяются несколько основанных на разных принципах методов определения этого показателя, мнения о преимуществах и недостатках каждого из них, а также о границах референсных интервалов полученных значений противоречивы, в профессиональных сообществах нет единой точки зрения о показаниях к проведению этого исследования (к ним относят наличие различных заболеваний, состояний и факторов, способных оказать негативное влияние на состояние репродуктивной функции, а также привычное невынашивание беременности и предшествующие неудачи лечения с применением ВРТ у супруги и др.). Методы лечения пациентов по поводу выявленных заболеваний и состояний, лечебные мероприятия, описанные в разделе 3, а также устранение факторов риска и сокращение периода воздержания позволяют уменьшить величину ФДС, отбор сперматозоидов с меньшим значением ФДС может быть проведен на этапе применения ВРТ, в том числе путем проведения биопсии яичек и ИКСИ [15, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64].
- Рекомендуется всем мужчинам с жалобами на бесплодие выполнять базовое исследование эякулята (спермограмму), включая определение объема эякулята, концентрации сперматозоидов, общего числа сперматозоидов, долей подвижных сперматозоидов (включая доли сперматозоидов с медленной и быстрой поступательной подвижностью), доли нормальных форм сперматозоидов и концентрации круглых клеток, а при значении доли подвижных сперматозоидов менее 40% – определение доли живых сперматозоидов,с целью определения показателей фертильности [3, 8, 31, 41].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: показатели эякулята являются высоко вариабельными как между разными мужчинами, так и у одного индивидуума, они также имеют региональные особенности. Результатов одного исследования эякулята может оказаться достаточно, чтобы получить представление о сперматогенезе и рекомендовать последующее обследование мужчины, для более полного понимания состояния репродуктивной функции может потребоваться анализ двух или трех образцов эякулята, для подтверждения азооспермии необходимо провести исследование не менее двух образцов. Минимальные референсные значения показателей эякулята (5-й процентиль), полученные в когортах фертильных мужчин по данным зарубежных и российских исследователей [36, 41], представлены в таблице 1.
Таблица 1.
Минимальные референтные значения показателей эякулята фертильных мужчин (5-й процентиль)
| Параметры эякулята |
значения
(5-й процентиль)
|
|
|---|---|---|
| ВОЗ, 2021 | РФ, 2023 | |
| Объём эякулята, мл | 1,4 | 1,7 |
| Общее количество сперматозоидов в эякуляте (106 на эякулят) | 39 | - |
| Концентрация сперматозоидов (106 на мл) | 16 | 20 |
| Доля сперматозоидов с поступательной подвижностью (%) | 30 | 24 |
| Доля жизнеспособных сперматозоидов (%) | 54 | - |
| Морфология сперматозоидов (доля нормальных форм сперматозоидов по строгим критериям Тайгерберга при окраске по Папаниколау, %) | 4 | 1 |
| Число сперматозоидов с поступательной подвижностью (106 на эякулят) | - | 21 |
Минимальные референсные величины показателей эякулята фертильных мужчин не имеют клинического значения, их нельзя рассматривать, как параметры границы между фертильными и бесплодными мужчинами. В связи с этим авторы руководства ВОЗ [41] отказались от использования при описании результатов тестов, проведенных при базовом исследовании эякулята, таких терминов как «нормозооспермия», «олигозооспермия», «астенозооспермия», «тератозооспермия», указывающих на соответствие или несоответствие этим величинам. Имеется связь вероятности зачатия с количеством, жизнеспособностью, подвижностью и морфологией сперматозоидов, наиболее информативным в отношении прогнозирования возможности зачатия естественным путем является показатель числа подвижных сперматозоидов: частота наступления беременности от мужчин, имевших менее 1 млн и от 1 до 5 млн подвижных сперматозоидов в эякуляте оказалась ниже по сравнению с теми, у кого этот показатель превышал значение 5 млн (отношения шансов составили 0,371 (0,215-0,64) и 0,505 (0,307-0,832 соответственно), а при значении более 50 млн вероятность наступления беременности в течение 5 лет оказалась выше на 45%, Показатель доли нормальных сперматозоидов не позволяет в отдельно взятом случае (за исключением 100% глобулозооспермии, синдрома ацефалических сперматозоидов и т.п.) прогнозировать наступление беременности и рождение ребенка [66, 67, 68, 69, 70, 71].
Необходимо предоставить мужчине четкие указания относительно сбора образца эякулята путем мастурбации. Прерванный половой акт не рекомендуется из-за риска неполного сбора и загрязнения влагалищным отделяемым и другими примесями. В исключительных случаях эякулят может быть получен при половом акте с использованием презерватива, не содержащего снижающих подвижность сперматозоидов веществ. При сборе эякулята следует избегать использования лубрикантов. Эякулят должен быть собран полностью, мужчину следует предупредить о том, что, если это не удалось, ему потребуется сообщить о потере какой-либо части образца. Целесообразно предложить мужчине собрать эякулят для анализа после периода воздержания, характерного для обычного ритма половой активности, однако, продолжительность этого периода не должна быть менее двух дней и более 7 дней. В случае если образец собран не в непосредственной близости от лаборатории, его следует транспортировать при температуре не ниже 20°С и не выше 37°С, исследование должно начаться в интервале 30-60 минут после сбора [72].
- Всем мужчинам, у которых при базовом исследовании эякулята выявлена концентрация круглых клеток, превышающая значение 1×106 в мл, рекомендуется выполнить определение концентрации лейкоцитов в сперме с целью исключения инфекционно-воспалительных заболеваний органов репродуктивной системы [3, 46, 73, 74].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: при базовом исследовании эякулята невозможно достоверно идентифицировать среди круглых клеток лейкоциты и герминативные клетки. Увеличение числа лейкоцитов в сперме может быть одним из признаков инфекционно-воспалительного заболевания, снижающего репродуктивную функцию и требующего проведения дальнейшего обследования и лечения мужчины.[11, 75].
- При превышении уровня лейкоцитов в эякуляте пациентам рекомендуется микробиологическое (культуральное) исследование эякулята на аэробные и факультативно-анаэробные условно-патогенные микроорганизмы с целью исключения инфекционно-воспалитеьных заболеваний органов репродуктивной системы [76, 77].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
- При превышении уровня лейкоцитов в эякуляте пациентам рекомендуется молекулярно-биологическое исследование спермы на хламидии (Chlamidia trachomatis), молекулярно-биологическое исследование спермы на микоплазму хоминис (Mycoplasma hominis), молекулярно-биологическое исследование спермы на уреаплазму уреалитикум (Ureaplasma urealyticum) (НМУ – Молекулярно-биологическое исследование спермы на уреаплазмы (Ureaplasma urealyticum, Ureaplasma parvum), молекулярно-биологическое исследование спермы на гонококк (Neisseria gonorrhoeae), молекулярно-биологическое исследование спермы на трихомонас вагиналис (Trichomonas vaginalis) с целью выявления возбудителей урогенитальных заболеваний, способных негативно повлиять на состояние мужской репродуктивной функции [76, 77, 78, 79, 80, 231].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: уреаплазма парвум (Ureaplasma parvum) не связана с мужским бесплодием [79].
- Для исключения у пациента ретроградной эякуляции при азооспермии и объеме эякулята менее 1 мл рекомендуется микроскопическое исследование осадка мочи (исследование постэякуляторной мочи) [81, 82, 83].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
- С целью диагностики гипогонадизма пациентам с азооспермией и олигозооспермией рекомендуется выполнять определение уровней гормонов – исследование уровня фолликулостимулирующего гормона (ФСГ) в сыворотке крови и исследование уровня общего тестостерона крови [3, 84].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: забор крови для определения половых гормонов выполняют с 8.00 до 11.00. Исследование уровней ФСГ и лютеинизирующего гормона (ЛГ) в сыворотке крови, исследование уровня общего эстрадиола, пролактина и тиреотропного гормона в крови и прием (осмотр, консультация) врача-эндокринолога первичный показаны с целью уточнения эндокринных причин недостаточности репродуктивной функции и оценки возможности их устранения [85].
- Цитогенетическое исследование (кариотип) и прием (осмотр, консультация) врача-генетика первичный рекомендуются для выявления хромосомных аномалий пациентам с азооспермией и концентрацией сперматозоидов менее 10 млн/мл, при бесплодии неясного генеза, привычном выкидыше и повторных неудачах имплантации при лечении с применением ВРТ супруги (партнерши) [86, 87, 88, 89, 90, 91, 92, 93, 94, 95].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии: нарушение сперматогенеза и мужской фертильности может быть обусловлено хромосомными аномалиями, наследственными заболеваниями, синдромальными и несиндромальными генетическими нарушениями, их частота наибольшая у пациентов с необструктивной азооспермией. В регуляцию сперматогенеза вовлечено большое количество генов, многие из которых, вероятно, еще не идентифицированы [96, 97]. У пациентов с олигозооспермией, связанной с генетическими нарушениями (включая робертсоновские и реципрокными транслокациями), может быть проведена криоконсервация сперматозоидов (НМУ – Криоконсервация гамет (ооцитов, сперматозоидов) для последующего лечения с применением ВРТ супруге (партнерше) в программе отложенного материнства[98].
- Молекулярно-генетическое исследование микроделеции локуса AZF Y-хромосомы (НМУ – Молекулярно-генетическое исследование микроделеций в Y хромосоме в крови) и прием (осмотр, консультация) врача-генетика первичный рекомендуется пациентам с азооспермией и концентрацией сперматозоидов менее 5 млн/мл), с целью выявления факторов риска развития генетических дефектов у потомства [3, 99].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: рекомендация относится к мужчинам, не имевшим более высокую концентрацию сперматозоидов в выполненных ранее анализах. Делеции AZF являются причиной нарушения сперматогенеза, их прогностическое значение при ТЕСЕ у мужчин с азооспермией связано с типом делеции: при полных делециях локусов AZFa и/или AZFb вероятность получения сперматозоидов хирургическим путем практически равна нулю. У пациентов с олигозооспермией может быть проведена криоконсервация гамет (сперматозоидов) для последующего применения ВРТ супруге (партнерше) в программе отложенного материнства [99]. Супружеская пара должна быть информирована о том, что микроделеции Y-хромосомы всегда наследуются сыновьями, их наличие может привести к снижению репродуктивной функции и бесплодию, а при лечении с применением ВРТ наблюдают низкие показатели оплодотворения, наступления беременности и рождения ребенка [100, 101, 102, 103], при этом частичные делеции региона AZFc (b2/b3, gr/gr и другие) были обнаружены у фертильных мужчин[104].
- Рекомендуется выполнить молекулярно-генетическое исследование мутаций в гене CFTR (муковисцидоз) в крови – пациентам с врожденным одно- и двусторонним отсутствием семявыносящих протоков, с клиническими признаками обструктивной азооспермии или при азооспермии неясного генеза с целью определения рисков развития генетических заболеваний у потомства [3, 11, 105].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: в случае выявления у мужчины мутации гена CFTR важно также рекомендовать его партнерше выполнить молекулярно-генетическое исследование мутаций в гене CFTR (муковисцидоз) и обратиться за консультацией к врачу-генетику. Выделено около 2000 мутаций, ответственных за развитие симптомов муковисцидоза, Согласно данным национального регистра в России наиболее часто встречаются следующие мутации: F508del (53,14%), СFTRdele2,3 (6,18%), E92K (3,11%), 3849+10kbC>T (2,29%), 2143delT (2,05%), 2184insA (1,88%), 1677delTA (1,76%), N1303K (1,69%), W1282X (1,63%), L138ins (1,46%), G542X (1,43%) [106][[1]] Если окажется, что супруга (партнерша) является носителем такой же мутации в гене CFTR, то вероятность рождения ребенка с муковисцидозом или врожденной двусторонней аплазией семявыносящих протоков или других ассоциированных с муковисцидозом заболеваний может достигать 25-50% [99, 107]
- Рекомендовано выполнение исследования уровня антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1/2 (далее – ВИЧ) и антигена p24 (Human immunodeficiency virus HIV 1/2 +Agp24) в крови, с целью подготовки к программе ВМИ и ВРТ по согласованию с врачом акушером-гинекологом, профилактики нежелательных событий ВМИ, ВРТ, профилактики распространения ВИЧ-инфекции [116,117,118].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: согласно пункту 4.3. санитарно-эпидемиологических правил СП 3.1.5.2826-10 «Профилактика ВИЧ инфекции», стандартным методом лабораторной диагностики ВИЧ инфекции служит одновременное определение антител к ВИЧ 1,2 и антигена р24/25 ВИЧ с помощью диагностических тестов ИФА и ИХЛА [119]. При выявлении инфекции рекомендовано направить мужчину на прием (осмотр, консультация) врача-инфекциониста первичный в Центр по профилактике и борьбе со СПИДом и инфекционными заболеваниями для подтверждения/исключения диагноза. Обследование не требуется перед программой переноса криоконсервированного/размороженного эмбриона (ПРЭ).
- С целью подготовки к программе ВМИ и ВРТ по согласованию с врачом акушером-гинекологом, профилактики нежелательных событий ВМИ, ВРТ, профилактики распространения гепатита В, рекомендовано направить пациента на скрининговое обследование на гепатит В: определение антител к поверхностному антигену (HBsAg) вируса гепатита В (Hepatitis В virus) в крови или определение антигена (HbsAg) вируса гепатита В (Hepatitis В virus) в крови [120, 121, 122, 123, 124].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: при выявлении инфекции пациент направляется на прием (осмотр, консультацию) врача-инфекциониста первичный для подтверждения/исключения диагноза. Обследование партнера не требуется перед программой ПРЭ.
- С целью подготовки к программе ВМИ и ВРТ по согласованию с врачом-акушером-гинекологом, профилактики нежелательных событий ВМИ, ВРТ, профилактики распространения гепатита C рекомендовано направить пациента на скрининговое обследование на гепатит C – определение суммарных антител классов М и G (anti-HCV IgG и anti-HCV IgM) к вирусу гепатита С (Hepatitis С virus) в крови [120, 122, 123, 124].
Уровень убедительности доказательств рекомендаций С (уровень достоверности – 5)
Комментарий: при выявлении инфекции пациент направляется на прием (осмотр, консультацию) врача-инфекциониста первичный для подтверждения/исключения диагноза. Обследование партнера не требуется перед программой ПРЭ.
- С целью подготовки к программе ВМИ, ВРТ по согласованию с врачом акушером-гинекологом и профилактики нежелательных событий ВМИ, ВРТ рекомендовано направить мужчину на скрининговое обследование на сифилис (определение антител к бледной трепонеме (Treponema pallidum) в крови) в соответствии с действующими клиническими рекомендациями по заболеванию [125, 126].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарий: при выявлении инфекции пациент направляется на прием (осмотр, консультацию) врача-дерматовенеролога первичный для подтверждения/исключения диагноза. Обследование партнера не требуется перед программой ПРЭ.
4. Инструментальные диагностические исследования
- Всем мужчинам с жалобами на бесплодие для уточнения диагноза рекомендуется выполнение УЗИ органов мошонки [108, 109].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии: в дополнение к физикальному исследованию УЗИ органов мошонки помогает выявить признаки обструкции семявыносящих путей (например, расширение сети яичка или увеличение придатка яичка с кистозными изменениями), а также исключить или подтвердить наличие варикоцеле, гипоплазии (объем яичек <12 мл) и обнаружить признаки дисгенезии яичка (например, неоднородность структуры яичка, наличие микрокальцинатов, новообразований). У мужчин с тестикулярной недостаточностью и двусторонними микрокальцинатами, атрофией яичек и крипторхизмом повышен риск развития герминогенных опухолей яичка [110, 111]. При выявлении признаков новообразования яичка мужчин необходимо в кратчайшие сроки направить на консультацию к врачу-онкологу.
- Пациентам с азооспермией и низким объемом эякулята для выявления признаков дистальной обструкции семявыносящих путей рекомендуется проведение ультразвукового исследования предстательной железы трансректального (ТРУЗИ) [109, 112].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии: ТРУЗИ позволяет визуализировать кисты предстательной железы и расширение семенных пузырьков, которое указывает на обструкцию эякуляторных протоков у мужчин с низким объемом эякулята (менее 1,5 мл).
5. Иные диагностические исследования
Объем иных диагностических исследований определяется в соответствии с клинической ситуацией. Кроме указанных ниже исследований, могут быть выполнены и иные диагностические исследования в соответствии с конкретной клинической ситуацией, при наличии показаний после оценки жалоб, сбора анамнеза, проведения физикального обследования, лабораторных диагностических исследований и инструментальных диагностических исследований.
- Рекомендуется с целью уточнения причины бесплодия направлять партнершу пациента на прием (осмотр, консультацию) врача акушера-гинеколога первичный и обследование в соответствии с действующими клиническими рекомендациями «Женское бесплодие» с целью оценки состояния и функции органов женской репродуктивной системы, а также возможности лечения с применением ВМИ и ВРТ [113, 114, 115].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарий: обследование пары по поводу бесплодия должно быть начато у мужчин и женщин одновременно. Обследование женщин проводит врач акушер-гинеколог, руководствуясь клиническими рекомендациями, разработанными Российским обществом акушеров-гинекологов и Российской ассоциацией репродукции человека. Заключение врача акушера-гинеколога требуется при составлении плана лечения мужчины и проведении преконцепционной (прегравидарной) подготовки к лечению бесплодной пары с применением ВМИ и ВРТ.
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Мужчинам, у которых были выявлены заболевания, патологические состояния и другие причины, способствующие снижению репродуктивной функции и развитию мужского бесплодия, показано лечение, в ходе которого может произойти восстановление фертильности и способности к зачатию естественным путем, однако, это происходит не всегда. При планировании такого лечения необходимо учитывать фертильность женщины, вероятность сохранения у нее шансов зачатия естественным путем в ожидаемые сроки излечения мужа (партнера) и при наличии показаний (необъяснимое бесплодие, бесплодие, при котором невозможно применение других методов лечения, бесплодие, не поддающееся лечению в течение 12 месяцев с момента установления диагноза, более высокая вероятность преодоления бесплодия при использовании ВРТ по сравнению с другими методами, необходимость проведения преимплантационного генетического тестирования, ВИЧ инфицирование у дискордантных пациентов, наличие половых клеток, криоконсервированных перед снижающим репродуктивную функцию лечением – оперативным вмешательством, химио- и лучевой терапией и др. или по программе «отложенного материнства») рассматривать для преодоления бесплодия лечение пары с применением ВМИ или ВРТ по согласованию с врачом акушером-гинекологом на основе клинических рекомендаций «Женское бесплодие» [33]. При внутриматочном введении спермы обработанная в лабораторных условиях сперма вводится в полость матки с целью наступления беременности. ВРТ представляют собой методы лечения бесплодия, при применении которых отдельные или все этапы зачатия и раннего развития эмбрионов осуществляются вне материнского организма (в том числе с использованием донорских и (или) криоконсервированных гамет, тканей репродуктивных органов и эмбрионов, а также суррогатного материнства).
С целью сохранения репродуктивной функции мужчины может проводиться для последующего использования с применением ВМИ или ВРТ в программах отложенного материнства (по согласованию с врачом акушером-гинекологом) криоконсервация сперматозоидов эякулята, полученного путем мастурбации, а также криоконсервация сперматозоидов, полученных хирургическим путем. (НМУ криоконсервация гамет (ооцитов, сперматозоидов)). Получение сперматозоидов хирургическим путем применяется при отсутствии пригодных для применения сперматозоидов эякулята (при необструктивной и обструктивной азооспермии, аспермии, 100%-ной некрозооспермии и др.). Выбор оптимального способа получения сперматозоидов – чрескожных и открытых биопсий яичка – ПЕСА, ТЕСА, ТЕСЕ, МЕСА, микроТЕСЕ (с применением 6–25-кратного оптического увеличения и микрохирургической техники) осуществляется врачом-урологом в зависимости от индивидуальных особенностей пациента [72, 73, 127, 128, 129128].
Так как в сперматозоидах яичек показатели ФДС могут быть меньшими, чем в сперматозоидах эякулята, применение сперматозоидов, полученных хирургическим путем из яичек для ИКСИ может способствовать повышению вероятности успешного лечения с применением ВРТ для пар, у которых предшествующие попытки такого лечения были неудачными [64, 128].
Бесплодие и неудачи лечения по поводу бесплодия, в том числе и с применением ВМИ и ВРТ, а также необходимость обсуждать использование донорских гамет оказывают негативное психологическое влияние на мужчин, что, в свою очередь может отрицательно сказаться на сексуальной функции, качестве спермы и снизить вероятность наступления беременности, в связи с этим им может потребоваться консультация психолога [130, 131].
- Рекомендуется проводить преконцепционную (прегравидарную) подготовку мужчинам с целью оптимизации состояния репродуктивной функции при планировании естественного зачатия и перед лечением жены (партнерши) с применением ВМИ и ВРТ [2, 26, 33, 132].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: подготовка мужчины к зачатию должна быть персонифицирована с учетом имеющихся факторов образа жизни, среды обитания, острых и хронических заболеваний и др. Она может потребовать организации междисциплинарного взаимодействия с врачами терапевтами, врачами-эндокринологами, врачами-генетиками и согласования с врачами акушерами-гинекологами согласно плану лечения женщины.
1. Лечение мужского бесплодия при гипогонадотропном гипогонадизме
Гипогонадотропный (центральный) гипогонадизм является следствием недостаточности гонадотропин-рилизинг-гормона и/или гонадотропинов (ФСГ, ЛГ) [133]. У взрослых пациентов наиболее частыми причинами гипогонадотропного гипогонадизма являются опухоли гипоталамо-гипофизарной области и/или перенесенное по их поводу лечение (оперативное вмешательство, лучевая терапия). Среди врожденных (но часто диагностируемых у взрослых) причин наиболее распространенной является синдром Каллмана, который характеризуется аносмией или гипоосмией.
- Всем пациентам с бесплодием, вызванным гипогонадотропным гипогонадизмом для уточнения диагноза и формирования плана лечения, направленного на нормализацию репродуктивной функции и выявления факторов риска развития генетических дефектов у потомства требуются прием (осмотр, консультация) врача-эндокринолога первичный и прием (осмотр, консультация) врача-генетика первичный [134].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
- Рекомендуется пациентам с гипогонадотропным гипогонадизмом для стимуляции сперматогенеза применять гонадотропин хорионический** в том числе и в комбинации с фоллитропином альфа** или препаратами из АТХ-группы G03GA02 Гонадотропины (менотропин») [135, 136, 137].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: выбор лекарственных средств и режим их применения зависят от этиологии гипогонадотропного гипогонадизма. Пациентам, у которых гипогонадизм развился до наступления пубертатного периода и которые не получали терапию, для достижения нормального сперматогенеза может потребоваться 1-2 года лечения. Для стимуляции сперматогенеза пациентам с гипогонадотропным гипогонадизмом возможно назначить гонадотропин хорионический** в стартовой дозе 1000-2000 ME 2-3 раза в неделю в/м. В зависимости от результатов контрольного исследования уровня общего тестостерона в крови и спермограммы может потребоваться повышение дозы гонадотропина хорионического** до 5000 ME 2 раза в неделю в/м и/или комбинация с фоллитропином альфа** в дозе 150 ME три раза в неделю в течение не менее 4-х месяцев. Продолжительность лечения для достижения адекватного тестикулярного объема и сперматогенеза составляет от 6 до 24 месяцев [138]. Исходный тестикулярный объем является предиктором ответа на монотерапию гонадотропином хорионическим**: при объеме менее 5 мл вероятность достижения эффекта мала.
Назначаются для стимуляции сперматогенеза при гипогонадотропном гипогонадизме менотропины (G03GA02 Гонадотропины) в дозе от 75 ME до 150 ME 3 раза в неделю вместе с инъекциями гонадотропина хорионического** в дозе 2000 ME 3 раза в неделю. Лечение по этой схеме следует продолжать не менее 4 месяцев до улучшения сперматогенеза. При отсутствии положительного эффекта в течение этого времени комбинированная терапия может быть продолжена до получения положительного результата терапии. Согласно исследованиям, для улучшения сперматогенеза может понадобиться не менее 18 месяцев лечения [135, 136, 138, 139, 140, 141].
- Для лечения мужского бесплодия не рекомендуется заместительная терапия тестостероном** [142].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
Комментарии: экзогенное введение тестостерона** способствует ингибированию секреции ЛГ и ФСГ, что приводит к снижению или полному прекращению сперматогенеза.
2. Лечение бесплодия у мужчин с варикоцеле
- Рекомендовано решение о целесообразности проведения лечения (консервативного или оперативного) по поводу варикоцеле при бесплодии принимать индивидуально в соответствии с клинической ситуацией, с учетом клинической значимости варикоцеле, а также всех аспектов состояния репродуктивной функции обоих супругов в связи с отсутствием убедительных доказательств преимуществ каких-либо методов лечения [2, 3, 143].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: варикоцеле является распространенной врожденной аномалией, наблюдается примерно у 15% мужчин и может протекать бессимптомно или вызывать боль и дискомфорт, нарушение роста и развития ипсилатерального яичка с последующими клиническими проявлениями гипогонадизма, а также негативно влиять на репродуктивную функцию. Варикоцеле у мужчин с бесплодием встречается чаще – в 35-81% случаев, что связывают с его негативным влиянием на число и подвижность сперматозоидов в эякуляте, а также на целостность генетического материала сперматозоидов за счет повышения температуры мошонки, гипоксии и рефлюкса токсичных метаболитов. Оно может быть более заметно при высоких степенях варикоцеле и у мужчин старшего возраста, однако, точной связи между снижением мужской фертильности и наличием варикоцеле до настоящего времени не доказано, улучшение качества спермы после лечения по поводу варикоцеле не всегда приводит к зачатию [144, 145, 146], в связи с этим исследования его целесообразности с целью улучшения репродуктивной функции мужчин продолжаются.
С одной стороны, были получены данные о том, что оперативное лечение по поводу проявляющегося клинически варикоцеле (НМУ «Перевязка и пересечение яичковой вены», «Перевязка и пересечение яичковой вены субингвинальное», «Клипирование яичковой вены с использованием видеоэндоскопических технологий») у мужчин с олигозооспермией и НОА приводило к увеличению числа сперматозоидов и вероятности наступления зачатия естественным путем и при применении ВРТ. Однако, качество имеющихся доказательств для мужчин с НОА оказалось низким (в связи с этим риски и преимущества лечения варикоцеле у таких пациентов должны быть подробно обсуждены до начала лечения), при этом эффект лечения проявлялся сильнее при большей степени заболевания. При клинически незначимых формах варикоцеле оперативное лечение оказывалось неэффективным, кроме того, данные об возможности улучшения подвижности и повышении доли имеющих нормальную морфологию сперматозоидов путем такой операции оказались противоречивыми [147, 148, 149, 150, 151, 152, 153, 154]. Так как были получены сведения о послеоперационном снижении ФДС у пациентов с варикоцеле, проведение ее оценки мужчинам с варикоцеле после неудачного лечения по поводу бесплодия с применением ВРТ, а также при привычном выкидыше у жен (партнерш), может быть полезным для принятия решения о целесообразности хирургической коррекции с целью повышения вероятности успеха последующего лечения с помощью ВРТ и рождения ребенка. Об этом также свидетельствовали данные о более высокой частоте рождения детей после лечения с применением ИКСИ у оперированных по поводу варикоцеле мужчин [155]. Такая тактика требует согласования с врачом акушером-гинекологом по результатам оценки состояния репродуктивной функции партнерши и ожидаемого срока проявления клинического эффекта оперативного лечения, который обычно составляет 3-6 месяцев [156, 157, 158, 159]. Согласно данным мета-анализа зачатие естественным путем после оперативного лечения по поводу клинически значимого варикоцеле и олигозооспермии происходило примерно у 1 из 7 у мужчин [151], повышению показателей репродуктивной функции и вероятности зачатия в послеоперационном периоде также способствовало назначение перорального приема средств, обладающих свойствами антиоксидантов (АТХ Аминокислоты и их производные, Витамины, Препараты цинка) [160, 161, 162].
С другой стороны, метаанализ Кокрановской группы, позволил выявить лишь два исследования, сравнивающих при бесплодии влияние хирургического или радиологического лечения по поводу варикоцеле на вероятность рождения ребенка с отсутствием лечения, и выводы авторы этих работ оказались противоположными. В связи с этим было предложено считать вопрос о целесообразности такого лечения открытым до получения результатов новых сравнительных рандомизированных клинических исследований с учетом показателей живорождения, неблагоприятных событий и качества жизни. Отечественные исследователи также писали о негативном влиянии оперативного лечения по поводу варикоцеле на вероятность последующего рождения ребенка у бесплодной пары [162, 163].
В настоящее время имеются подтверждения возможности добиться улучшения состояния репродуктивной функции за счет повышения концентрации и подвижности сперматозоидов у мужчин с варикоцеле без оперативного лечения за счет перорального приема средств, обладающих свойствами антиоксидантов (АТХ Аминокислоты и их производные, витамины, препараты цинка и др.) [161]. В связи с этим решение о целесообразности проведения лечения (консервативного или оперативного) по поводу варикоцеле у мужчины следует принимать индивидуально с учетом клинической значимости варикоцеле, а также всех аспектов состояния репродуктивной функции обоих супругов и личного опыта врача [2].
3. Лечение бесплодия у мужчин с обструктивной азооспермией
Обструктивная азооспермия (ОА) обусловлена двусторонним нарушением проходимости семявыносящих путей. При ОА размеры яичек и уровень ФСГ обычно нормальные, а при объективном и инструментальном исследовании могут определяться признаки обструкции: расширение rete testis, увеличение и уплотнение придатков яичек, отсутствие семявыносящих протоков, расширение семенных пузырьков. Принято выделять интратестикулярную обструкцию, обструкцию на уровне придатка яичка, семявыносящих протоков и эякуляторных протоков [164, 165, 166, 167].
- При азооспермии, вызванной приобретенной обструкцией на уровне придатка яичка и/или проксимальной части семявыносящего протока, для восстановления фертильности мужчины рекомендуется выполнение микрохирургической вазовазостомии или тубуловазостомии (НМУ «Наложение вазо-вазоанастомоза», «Наложение вазо-эпидидимоанастомоза») [168, 169].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
Комментарии: последующее восстановление проходимости семявыносящих путей может наступить через 3-18 месяцев.
- Перед выполнением микрохирургической вазовазостомии или тубуловазостомии (НМУ «Наложение вазо-вазоанастомоза», «Наложение вазо-эпидидимоанастомоза») пациентам рекомендуется извлечение сперматозоидов хирургическим путем (НМУ «Пункция яичка», «Биопсия яичка, придатка яичка и семенного канатика» методами ПЕСА, ТЕСА, ТЕСЕ, или МЕСА) и провести криоконсервацию сперматозоидов (НМУ – криоконсервация гамет (ооцитов, сперматозоидов) для последующего их использования с применением ВРТ по согласованию с врачом акушером-гинекологом [170].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
- Для лечения бесплодия у пациентов с азооспермией вследствие обструкции семявыносящих путей на уровне яичка, дистальной части семявыносящего протока или эякуляторного протока, рекомендуется извлечение сперматозоидов хирургическим путем (НМУ «Пункция яичка», «Биопсия яичка, придатка яичка и семенного канатика» методами ПЕСА, ТЕСА, ТЕСЕ, или МЕСА) и последующее применение ВРТ по согласованию с врачом акушером-гинекологом. Этот подход также может быть рекомендован при невозможности или отказе пациента от реконструкции семявыносящих путей. Необходимо обеспечить проведение криоконсервации сперматозоидов, полученных хирургическим путем (НМУ – криоконсервация гамет (ооцитов, сперматозоидов) [167, 170, 171].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
Комментарии: при азооспермии, обусловленной поствоспалительными обструкциями эякуляторных протоков или их сообщением с кистами предстательной железы, может быть проведена трансуретральная резекция выходных отделов эякуляторных протоков в зоне семенного бугорка (НМУ «Внутренняя (трансуретральная) уретротомия» [167], при этом необходимо обсудить с пациентом низкую эффективность такого лечения в отношении последующего наступления спонтанной беременности по сравнению с аспирацией сперматозоидов и ИКСИ, а также риск развития послеоперационных осложнений: ретроградного семяизвержения и рефлюкса мочи в семявыбрасывающие протоки, семенные пузырьки и семявыносящие протоки.
4. Лечение бесплодия у мужчин с ретроградной эякуляцией и анэякуляцией
Ретроградная эякуляция (РЭ) и анэякуляция (аспермия) в структуре обращений за медицинской помощью по поводу бесплодия в браке составляют менее 3% случаев [172]. При отсутствии эффекта этиотропной терапии эякуляторных нарушений, направленной на восстановление фертильности, с целью лечения бесплодия супружеским парам показано применение ВРТ.
- Для лечения бесплодия у пациентов с РЭ, рекомендуется использовать в программах ВРТ сперматозоиды, полученные из постэякуляторной мочи [173, 174].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
Комментарии: предварительно (за 12 часов и за 2 часа перед получением эякулята) пациенту с целью ощелачивания мочи и минимизации ее токсического воздействия на сперматозоиды можно рекомендовать выпить стакан воды, в котором предварительно растворена 1 столовая ложка пищевой соды[175].
- У бесплодных мужчин с анэякуляцией, РЭ и отсутствием жизнеспособных сперматозоидов в посткоитальной моче рекомендуется использовать в программах ВРТ по согласованию с врачом акушером-гинекологом сперматозоиды, полученные хирургическим способом методами ПЕСА, ТЕСА, ТЕСЕ или МЕСА. Методы ПЕСА, ТЕСА, ТЕСЕ или МЕСА следует выполнять только тогда, когда возможна криоконсервация гамет (сперматозоидов) – [174, 176].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
Комментарии: у бесплодных мужчин с анэякуляцией вследствие повреждения спинного мозга для преодоления проблемы бесплодия можно использовать в программах ВРТ сперматозоиды, полученные при электростимуляции и/или вибростимуляции. Эти методы предназначены преимущественно для пациентов с сохраненной дугой рефлекса, а также участков спинного мозга на уровне S2-S4 и T10-T12. Оптимальными кандидатами являются мужчины с поражением спинного мозга выше сегмента T10: у 88% из них пенильная вибростимуляция может привести к получению сперматозоидов, в то время как в остальных случаях ее успех не превышает 15%. Электростимуляция эякуляции применяется по аналогичным показаниям и позволяет успешно получить сперматозоиды у 97-100% мужчин с анэякуляцией вследствие повреждения спинного мозга. При применении методов виброэякуляции и электроэякуляции необходимо помнить о риске развития представляющего угрозу жизни синдрома автономной дисрефлексии [177, 178, 179, 180].
5. Лечение бесплодия у мужчин с необструктивной азооспермией
Необструктивная азооспермия (НОА) является следствием тестикулярной недостаточности или нарушением функционирования гипоталамо-гипофизарно-гонадной системы. При НОА, обусловленной гипогонадотропным гипогонадизмом, возможно консервативное лечение (см. п. 3.1).
- При НОА у пациентов с гипер- и нормогонадотропным гипогонадизмом рекомендуется для лечения бесплодия использовать по согласованию с врачом акушером-гинекологом в программах ВРТ для ИКСИ сперматозоиды, полученные хирургическим способом – ТЕСЕ или микро-ТЕСЕ [181].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: вероятность получения у мужчин с НОА сперматозоидов хирургическим путем при открытой биопсии яичка (НМУ – Биопсия яичка) при TEСЕ или микроТЕСЕ (с применением 6-25-кратного оптического увеличения) составляет примерно 50%, следует брать образцы из нескольких участков яичка. Результаты сравнения эффективности применения микро-ТЕСЕ и стандартной ТЕСЕ при НОА, в том числе и у пациентов с синдромом Клайнфельтера оказались противоречивыми [181, 182, 183, 184], выбор способа получения сперматозоидов осуществляется врачом-урологом в зависимости от индивидуальных особенностей пациента. У пациентов с генетически обусловленными формами бесплодия при решении вопроса о проведении ТЕСЕ и микро-ТЕСЕ следует учитывать результаты генетического обследования и заключение врача генетика о возможности получения сперматозоидов, пригодных для лечения с применением ВРТ. Негативный прогноз в отношении получения сперматозоидов у мужчин с 46,ХХ-тестикулярной формой нарушения формирования пола (синдром «46,ХХ-мужчина»), при делеции всего локуса AZF (AZFa+b+c), при полных делециях региона AZFa и делециях целиком захватывающих его ген DBY, полных делециях региона AZFb и полных делециях AZFb+, а также при некоторых хромосомных аномалиях, например, у пациентов с полисомией по половым хромосомам, с гомологичными робертсоновскими транслокациями, Х-аутосомными транслокациями и др. [86].
Супружеская пара должна быть информирована о возможностях преимплантационного генетического тестирования полученных в результате применения ВРТ эмбрионов для оценки рисков рождения ребенка с генетическими дефектами [185].
Биопсийный (операционный) материал яичка необходимо направить на патолого-анатомическое исследование. Размер биоптата около 3х3х3 мм или длиной 5-10 мм позволяет обеспечить наличие достаточного количества семенных канальцев для адекватной оценки сперматогенеза. Ткань не следует сдавливать щипцами, поскольку это может нарушить ее сохранность и затруднить корректную морфологическую оценку семенных канальцев. С целью фиксации биоптатов яичка рекомендовано использовать фиксатор Боуэна, использование 10% формалина не рекомендуется ввиду возникновения деформации ткани, что затрудняет оценку сперматогенного эпителия. По результатам микроскопического исследования окрашенных гематоксилином и эозином препаратов формируют заключение (нормальный сперматогенез, гиалинизация канальцев, сииндром наличия только клеток Сертоли, остановка созревания, гипосперматогенез, смешанная атрофия), при необходимости проведения дифференциальной диагностики с карциномой in situ могут быть проведены иммуногистохимические исследования [186, 187, 188, 189].
6. Эмпирическое лечение, направленное на улучшение репродуктивной функции мужчин
Мужчинам, у которых в ходе обследования были выявлены снижающие фертильность заболевания, показано лечение, направленное на восстановление способности к зачатию. Антибиотикотерапия при инфекционно-воспалительных процессах в половых железах у бесплодных мужчин способна улучшать качественные характеристики сперматозоидов, но данные по восстановлению при этом фертильности неубедительны [216, 217, 218].
Для эмпирического лечения (т.е. лечения, начатого на основе клинического "обоснованного предположения" при отсутствии полного понимания этиопатогенеза), направленного на улучшение репродуктивной функции мужчин, исследователями предложено применение различных препаратов: гонадотропинов, селективных модуляторов эстрогеновых рецепторов, ингибиторов ароматазы, полипептидов семенников крупного рогатого скота, простаты экстракта в комбинации с цинка аргинил-глицинатом (АТХ группа: G04BX «Другие препараты, применяемые в урологии»), в том числе средств, обладающих свойствами антиоксидантов (АТХ аминокислоты и их производные, метаболические средства, Витамины А, Е, Препараты цинка, селена и др.).
Несмотря на то, что многим исследователям удалось получить результаты, подтверждающие достоверные улучшения показателей репродуктивной функции, частоты наступления беременности и рождения детей от пациентов, получавших лечение, по сравнению аналогичными показателями мужчин из контрольных групп, однако, авторы других аналогичных работ не смогли эти результаты воспроизвести. Эти противоречия, отсутствие данных и/или различия мнений в отношении фармакокинетики, выбора оптимальных дозировок и режимов применения лекарственных средств, а также высокие значения показателя числа больных, которых необходимо пролечить, чтобы получить рождение одного ребенка, в настоящее время ограничивают возможности формулировки клинических рекомендаций и определение типовых моделей пациентов для их назначения.
Анализ специалистов Кокрановской группы, основанный на изучении результатов исследований применения антиоксидантов, а также продуктов питания с высоким содержанием полиненасыщенных жирных кислот у мужчин с недостаточностью репродуктивной функции позволил выявить доказательства положительного влияния терапии на вероятность наступление клинической беременности (OR 1,89, 95% CI 1,45–2,47, P <0,00001, 20 рандомизированных клинических исследований, 1706 мужчин) и рождения ребенка (OR 1,43, 95% доверительный интервал (CI) 1,07–1,91, P = 0,02, 12 рандомизированных клинических исследований, 1283 мужчины), однако, эти выводы не были подтверждены другими авторами, поэтому в настоящее время нельзя дать убедительных рекомендаций по их назначению в качестве эмпирической терапии, и решение об их применении следует принимать в каждом случае индивидуально с учетом клинического состояния пациента, всех аспектов состояния репродуктивной функции обоих супругов и личного опыта врача.
В качестве предикторов эффективности лечения авторы опубликованных работ предлагали использовать оценку уровней фолликулостимулирующего гормона и общего тестостерона в сыворотке крови, а также активных форм кислорода и ФДС [190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 213, 214, 215].
- С целью улучшения репродуктивной функции рекомендовано информировать мужчин о необходимости соблюдения здорового образа жизни, направленного на поддержание физической активности и снижение воздействия на организм вредных факторов окружающей среды – стресса, высоких температур, источников излучения, поллютантов содержащихся в атмосферном воздухе, воде и продуктах питания, (тяжелых металлов – мышьяка, свинца, и др., органических соединений – бисфенола А, и др), необходимости соблюдения сбалансированной диеты богатой омега-3-полиненасыщенными жирными кислотами и витаминами, с употреблением рыбы, мяса птицы, овощей, фруктов, нормализации массы тела, отказа от курения, ограничения употребления алкоголя и посещения бани (сауны) [24, 219, 220, 221, 222, 223, 224, 225, 226].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
- При недостаточности репродуктивной функции с целью увеличения числа и подвижности сперматозоидов и повышения вероятности зачатия естественным путем в качестве эмпирической терапии рекомендуется рассмотреть возможность терапии фоллитропином-альфа** в дозе 75-150 ME три раза в неделю или менотропинами в дозе 75-150 ME 3 раза в неделю, в том числе и в комбинации с гонадотропином хорионическим** в дозе 100-2000 МЕ два раза в неделю в течение 3-6 месяцев. Решение о применении рекомендуется принимать в каждом случае индивидуально. [234, 235, 236, 237, 238]
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 1)
Комментарий: лечение с применением препаратов с гонадотропным эффектом может способствовать повышению концентрации и подвижности сперматозоидов, снижению степени ФДС, а также повышению частоты наступления беременности, которая наступала в среднем у одной из 10-18 партнерш пролеченных мужчин [234, 235, 236, 237, 238]. У пациентов с нормальным уровнем гонадотропинов и необструктивной азооспермией эмпирическая терапия повышает вероятность получения сперматозоидов при биопсии яичка [239].
- При недостаточности репродуктивной функции с целью увеличения числа и подвижности сперматозоидов и повышения вероятности зачатия естественным путем в качестве эмпирической терапии рекомендуется рассмотреть возможность терапии кломифеном** по 25-50 мг через день/ежедневно в течение 3-6 месяцев. Решение о применении кломифена** с целью эмпирической терапии, направленной на улучшение репродуктивной функции, рекомендуется принимать в каждом случае индивидуально [192, 209, 210].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1)
Комментарии: кломифен** – синтетический стимулятор продукции гонадотропинов, избирательно модулирующий рецепторы эстрогена. Мета-анализ данных, полученных из одиннадцати РКИ, показал, что селективные модуляторы рецепторов эстрогена могут способствовать повышению уровней ФСГ и тестостерона, повысить число и подвижность сперматозоидов, а также частоту наступления беременности, которая наступала в среднем у одной из 10 партнерш мужчин, получавших кломифен** [209]. Схожие результаты были подтверждены в последнем обновленном метаанализе шестнадцати исследований [197], однако, в предыдущем метаанализе не удалось обнаружить какой-либо связи между применением кломифена** и вероятностью зачатия [210], что, возможно, указывает на необходимость проведения лечения у отобранных больных. Результаты исследований показали, что к прогностически благоприятным признакам терапии кломифеном** можно отнести низкий уровень ЛГ (<6 мМЕ/мл) и объем яичек более 14 см3 [232], а неблагоприятными можно считать повышенный уровень ФСГ, объем яичек менее 10 см3, ИМТ более 35 кг/мг2 и концентрацию сперматозоидов менее 5x106/мл [233].
- При недостаточности репродуктивной функции у пациентов с соотношением уровней общего тестостерона (в нг/дл) и Е2 (пг/мл) в сыворотке крови <10, в качестве эмпирической терапии рекомендуется рассмотреть возможность терапии #летрозолом 2,5 мг в день или #анастрозолом** 1 мг в день в течение 3 мес, с целью увеличения числа и подвижности сперматозоидов и повышения вероятности зачатия естественным путем. [240, 241]
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарии: положительное влияние на состояние репродуктивной функции мужчин было более заметным у пациентов с избыточной массой тела и ожирением, а также показателями соотношения тестостерон (нг/дл) /эстрадиол (пг/мл) ˂10. Принимая во внимание важную роль эстрогенов в процессе сперматогенеза, при использовании #летрозола и #анастрозола** целесообразно на фоне лечения контролировать гормональный статус и не допускать снижения уровеня эстрадиола, при необходимости уменьшить дозировку. Частота наступления беременности была изучена в двух исследованиях и составила 1 из 5 и 1 из 14 партнерш пролеченных мужчин соответственно [242, 243, 244].
- При недостаточности репродуктивной функции с целью увеличения числа и подвижности сперматозоидов и повышения вероятности зачатия естественным путем в качестве эмпирической терапии рекомендовано рассмотреть возможность внутримышечного курсового введения полипептидов семенников крупного рогатого скота в дозировке 5 мг 1 раз в неделю 10 недель [206, 207, 211, 212].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарии: данные о фармакокинетике полипептидов семенников крупного рогатого скота отсутствуют. Опубликованы данные клинического исследования, подтверждающего положительные эффекты полипептидов семенников на параметры эякулята, ретроспективный анализ, проведеный в период от 1 до 9 мес. после завершения терапии показал, что по сравнению с группой плацебо, зачатия чаще добивались пары, в которых мучины получали лекарство (13 из 42 (30,95%) и 17 из 34 (50%) пар соответственно). Перед назначением полипептидов семенников должно быть проведено тщательное обследование пациента, включающее исследование уровней фолликулостимулирующего гормона, лютеинизирующего гормона в сыворотке крови, уровней общего тестостерона и простатспецифического антигена общего и свободного в крови. Решение о применении полипептидов семенников крупного рогатого скота в качестве эмпирической терапии для улучшения репродуктивной функции рекомендуется принимать в каждом случае индивидуально [206, 207, 211, 212].
Медицинская реабилитация
Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Специфическая реабилитация не предусмотрена.
Госпитализация
Организация оказания медицинской помощи
Показания для плановой госпитализации (поступления в дневной стационар):
Проведение оперативного вмешательства (ПЕСА, ТЕСА, ТЕСЕ, микро-ТЕСЕ, МЕСА) с целью получения сперматозоидов хирургическим путем для последующего применения в программах ВРТ и криоконсервации сперматозоидов
Показания для экстренной госпитализации: нет
Показания к выписке пациента из стационара:
Завершение оперативного вмешательства (ПЕСА, ТЕСА, ТЕСЕ, микро-ТЕСЕ, МЕСА) с целью получения сперматозоидов хирургическим путем для последующего применения в программах ВРТ и криоконсервации гамет (сперматозоидов).
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Ключевым аспектом сохранения репродуктивного здоровья мужчины является своевременность выявления заболеваний и всесторонняя оценка мужского здоровья. Часто мужское бесплодие выявляется у мужчин, которые не предъявляли каких-либо жалоб со стороны репродуктивной системы. Поэтому проведение активной и многоступенчатой профилактической работы со стороны системы здравоохранения имеет важное значение.
- Рекомендована диспансеризация, направленная на оценку репродуктивного здоровья мужчин в возрасте 18-49 лет, с целью выявления признаков и факторов риска заболеваний или состояний, способных негативно повлиять на репродуктивную функцию [227].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: в число мероприятий, направленных на улучшение здоровья взрослого населения репродуктивного возраста, входит оценка репродуктивного здоровья.
Соответствующий перечень исследований и других медицинских вмешательств был закреплен в Программе государственных гарантий бесплатного оказания гражданам медицинской помощи на 2024 год и на плановый период 2025 и 2026 годов, утвержденной Постановлением Правительства Российской Федерации от 28.12.2023 №2353 (далее – Программа) [72].
Для мужчин в возрасте 18-49 лет поэтапно и одновременно с прохождением профилактического осмотра или диспансеризации организуется проведение диспансеризации, направленной на оценку их репродуктивного здоровья, с целью выявления признаков и факторов риска заболеваний или состояний, способных негативно повлиять на репродуктивную функцию.
Диспансеризация проводится в два этапа.
Первый этап диспансеризации мужчин по оценке репродуктивного здоровья включает диспансерный прием (осмотр, консультация) врача-уролога (при его отсутствии – диспансерный прием (осмотр, консультация) врача-хирурга, прошедшего подготовку по вопросам репродуктивного здоровья у мужчин).
Второй этап проводится по результатам первого этапа в целях дополнительного обследования и уточнения диагноза заболевания (состояния). При наличии показаний в рамках второго этапа проводятся:
1) спермограмма;
2) при превышении уровня лейкоцитов результатам спермограммы рекомендовано микробиологическое (культуральное) исследование эякулята на аэробные и факультативно-анаэробные условно-патогенные микроорганизмы с целью исключения инфекций репродуктивных органов, а также
3) проведение лабораторных исследований в целях выявления возбудителей инфекционных заболеваний органов малого таза методом ПЦР, указанных в разделе 2.3 «Лабораторные диагностические исследования»;
4) УЗИ предстательной железы и УЗИ органов мошонки;
5) Прием (осмотр, консультация) врача-уролога повторный или прием (осмотр, консультация) врача-хирурга повторный.
В зависимости от результатов осмотра вводятся 3 группы репродуктивного здоровья [72]:
- I группа репродуктивного здоровья – репродуктивно здоровые мужчины.
К первой группе относятся мужчины, у которых не установлены заболевания репродуктивной системы и отсутствуют факторы риска их развития.
- II группа репродуктивного здоровья – риск развития репродуктивных нарушений.
Ко второй группе здоровья относятся мужчины, у которых не установлены заболевания репродуктивной системы, но имеются факторы риска их развития:
1) избыточная масса тела (ИМТ ⩾25,0 кг/м2) при окружности талии 94 см или ожирение (ИМТ ⩾30 кг/м2);
2) перенесенные ранее инфекции, передаваемые половым путем (хламидиоз, трихомониаз, гонорея, уреаплазменная/микоплазменная инфекция, вирус папилломы человека);
3) перенесенные воспалительные заболевания мужских половых желез (простатит, эпидидимит, эпидидимоорхит);
4) перенесенный в детстве эпидемический паротит;
5) варикоцеле в анамнезе или в настоящее время, включая состояние после оперативного лечения;
6) заболевания эндокринной системы (сахарный диабет, гипо- и гипертиреоз).
- III группа репродуктивного здоровья – имеются репродуктивные нарушения.
К третьей группе здоровья относятся мужчины, имеющие заболевания репродуктивной системы или доказанное нарушение фертильности:
1) мужское бесплодие;
2) признаки нарушения репродуктивной функции по результатам спермограммы;
3) первичный и вторичный гипогонадизм (снижение уровня тестостерона) в настоящее время и в анамнезе;
4) задержка полового развития;
5) врожденные аномалии (пороки развития) мужских половых органов (включая крипторхизм, перекрут яичка, гипоспадию) в настоящее время или в анамнезе, в том числе после оперативного лечения;
6) нарушение репродуктивной функции после перенесенного лечения по поводу онкологических или аутоиммунных заболеваний (применение глюкокортикоидов и/или противоопухолевых препаратов (цитостатиков), химиотерапия по поводу опухолей любой локализации, хирургическое лечение или лучевая терапия по поводу опухолей яичек, предстательной железы, полового члена, прямой кишки).
Мужчины I группы репродуктивного здоровья проходят диспансеризацию в установленном порядке.
Мужчины II группы репродуктивного здоровья в течение 6 месяцев направляются на диспансерный прием (осмотр, консультацию) врача-уролога в медицинскую организацию (поликлинику) по месту жительства для более детального обследования и устранения факторов риска. Дальнейшее оказание медицинской помощи осуществляется в соответствии с клиническими рекомендациями и Порядком оказания медицинской помощи взрослому населению по профилю «урология», утвержденным Приказом Минздрава России от 12.11.2012 №907н.
Мужчины, имеющие ожирение (ИМТ 30-40 кг/м2) и избыточную массу тела (ИМТ 25-29,9 кг/м2) (при окружности талии более 102 см) направляются для углубленного профилактического консультирования и дальнейшего диспансерного наблюдения в Центр здоровья.
Мужчины, перенесшие ранее инфекции, передаваемые половым путем (хламидиоз, трихомониаз, гонорея, уреаплазменная/микоплазменная инфекция, вирус папилломы человека) направляются для углубленного профилактического консультирования в Центр здоровья.
Пациенты III группы здоровья в течение 1 месяца направляются к врачу-урологу регионального Центра охраны здоровья семьи и репродукции, либо (при его отсутствии) к врачу-урологу отделения репродуктивного здоровья Перинатального центра, либо (при его отсутствии) к врачу-урологу центра вспомогательных репродуктивных технологий, либо врчу-урологу областной больницы, получившему дополнительное образование (имеющему практический опыт) в области андрологии/диагностики и лечения заболеваний мужской репродуктивной системы.
- Мужчинам перед снижающим репродуктивную функцию лечением – оперативным вмешательством, химио- и лучевой терапией и др. рекомендуется криоконсервация сперматозоидов (НМУ – Криоконсервация гамет (ооцитов, сперматозоидов)) с целью сохранения фертильности и обеспечения последующей реализации репродуктивной функции и преодоления бесплодия в паре с применением ВМИ или ВРТ по согласованию с врачом акушером-гинекологом [228].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
Комментарии: эякулят для криоконсервации получают путем мастурбации, при азооспермии и отсутствии жизнеспособных или подвижных сперматозоидов в эякуляте сперматозоиды для криоконсервации могут быть получены хирургическим путем при онко-TEСE до начала гонадотоксического лечения [229, 230].
Информация
Источники и литература
-
Клинические рекомендации Всероссийского общества урологов
- Клинические рекомендации Всероссийского общества урологов - 1. Zegers-Hochschild F, Adamson GD, Dyer S, Racowsky C, de Mouzon J, Sokol R, et al. The International Glossary on Infertility and Fertility Care, 2017. Fertil Steril. 2017;108(3):393-406. doi: 10.1016/j.fertnstert.2017.06.005. 2. Корнеев И.А., Аполихин О.И., Бабенко А.Ю., Боголюбов С.В., Божедомов В.А., Виноградов И.В. и др. (Рабочая группа по разработке российских клинических рекомендаций по мужскому бесплодию). Клинические рекомендации по мужскому бесплодию: дискуссионные вопросы и необходимость достижения междисциплинарного консенсуса. Урология. 2024;1:143-152. doi: 10.18565/urology.2024.1.143-152. 3. Schlegel PN, Sigman M, Collura B, De Jonge CJ, Eisenberg ML, Lamb DJ, et al. Diagnosis and Treatment of Infertility in Men: AUA/ASRM Guideline Part I. J Urol. 2021;205(1):36-43. doi: 10.1097/JU.0000000000001521. 4. Colaco S, Sakkas D. Paternal factors contributing to embryo quality. J Assist Reprod Genet. 2018;35(11):1953-1968. doi: 10.1007/s10815-018-1304-4. 5. Klimczak AM, Patel DP, Hotaling JM, Scott RT Jr. Role of the sperm, oocyte, and embryo in recurrent pregnancy loss. Fertility and sterility. 2021;115(3):533-537. doi: 10.1016/j.fertnstert.2020.12.005. 6. Li J, Luo L, Diao J, Li Y, Zhang S, Chen L, et al. Male sperm quality and risk of recurrent spontaneous abortion in Chinese couples: A systematic review and meta-analysis. Medicine (Baltimore). 2021;100(10):e24828. doi:10.1097/MD.0000000000024828. 7. Service CA, Puri D, Al Azzawi S, Hsieh TC, Patel DP. The impact of obesity and metabolic health on male fertility: a systematic review. Fertil Steril. 2023;120(6):1098-1111. doi: 10.1016/j.fertnstert.2023.10.017. 8. WHO, WHO Manual for the Standardized Investigation and Diagnosis of the Infertile Couple. Cambridge: Cambridge University Press, 2000. 9. Gül M, Russo GI, Kandil H, Boitrelle F, Saleh R, Chung E, et al. Male Infertility: New Developments, Current Challenges, and Future Directions. World J Mens Health. 2024;42(3):502-517. doi: 10.5534/wjmh.230232. 10. Andrology. 3rd ed. E. Nieschlag, H.M. Behre, S. Nieschlag (eds). Berlin, 2010. 11. Barratt CLR, Björndahl L, De Jonge CJ, Lamb DJ, Osorio Martini F, McLachlan R, et al. The diagnosis of male infertility: an analysis of the evidence to support the development of global WHO guidance-challenges and future research opportunities. Hum Reprod Update. 2017;23(6):660-680. doi: 10.1093/humupd/dmx021. 12. Kaltsas A, Moustakli E, Zikopoulos A, Georgiou I, Dimitriadis F, Symeonidis EN, et al. Impact of Advanced Paternal Age on Fertility and Risks of Genetic Disorders in Offspring. Genes (Basel). 2023;14(2):486. doi: 10.3390/genes14020486. 13. Murugesu S, Kasaven LS, Petrie A, Vaseekaran A, Jones BP, Bracewell-Milnes T, et al. Does advanced paternal age affect outcomes following assisted reproductive technology? A systematic review and meta-analysis. Reprod Biomed Online. 2022;45(2):283-331. doi: 10.1016/j.rbmo.2022.03.031. 14. Agarwal A, Majzoub A, Baskaran S, Panner Selvam MK, Cho CL, Henkel R, et al. Sperm DNA Fragmentation: A New Guideline for Clinicians. World J Mens Health. 2020;38(4):412-471. doi: 10.5534/wjmh.200128. 15. Esteves SC, Roque M, Bradley CK, Garrido N. Reproductive outcomes of testicular versus ejaculated sperm for intracytoplasmic sperm injection among men with high levels of DNA fragmentation in semen: systematic review and meta-analysis. Fertil Steril. 2017;108(3):456-467.e1. doi:10.1016/j.fertnstert.2017.06.018. 16. Robinson L, Gallos ID, Conner SJ, Rajkhowa M, Miller D, Lewis S, et al. The effect of sperm DNA fragmentation on miscarriage rates: a systematic review and meta-analysis. Hum Reprod. 2012;27(10):2908-2917. doi: 10.1093/humrep/des261. 17. Aitken RJ. DNA damage in human spermatozoa; important contributor to mutagenesis in the offspring. Transl Androl Urol. 2017;6(4):S761-S764. doi:10.21037/tau.2017.09.13. 18. Salonia A, Bettocchi C, Capogrosso P, Carvalho J, Corona G, Hatzichristodoulou G, et al. EAU Guidelines on Sexual and Reproductive Health. ©European Association of Urology. 2024. P. 151-155, 188. https://uroweb.org/guidelines/sexual-and-reproductive-health 19. Agarwal A, Parekh N, Panner Selvam MK, Henkel R, Shah R, Homa ST, et al. Male Oxidative Stress Infertility (MOSI): Proposed Terminology and Clinical Practice Guidelines for Management of Idiopathic Male Infertility. World J Mens Health. 2019;37(3):296-312. doi: 10.5534/wjmh.190055. 20. Infertility prevalence estimates, 1990–2021. Geneva: World Health Organization; 2023. Licence: CC BY-NC-SA 3.0 IGO. 21. Лебедев Г.С., Голубев Н.А., Шадеркин И.А., Шадеркина В.А., Аполихин О.И., Сивков А.В., Комарова В.А. Мужское бесплодие в Российской Федерации: статистические данные за 2000-2018 годы. Экспериментальная и клиническая урология. 2019;4:4-12. doi: 10.29188/2222-8543-2019-11-4-4-12. 22. Levine H, Jørgensen N, Martino-Andrade A, Mendiola J, Weksler-Derri D, Jolles M, et al. Temporal trends in sperm count: a systematic review and meta-regression analysis of samples collected globally in the 20th and 21st centuries. Hum Reprod Update. 2023;29(2):157-176. doi:10.1093/humupd/dmac035. 23. Корнеев И.А. Сравнительная характеристика параметров эякулята мужчин, обратившихся в центр репродуктивной медицины с 2016 по 2022 г. Урологические ведомости. 2023;13(1):23-29. doi: 10.17816/uroved296569. 24. Szabó A, Váncsa S, Hegyi P, Váradi A, Forintos A, Filipov T, et al. Lifestyle-, environmental-, and additional health factors associated with an increased sperm DNA fragmentation: a systematic review and meta-analysis. Reprod Biol Endocrinol. 2023;21(1):5. doi: 10.1186/s12958-023-01054-0. 25. Male Infertility: Contemporary Clinical Approaches, Andrology, ART and Antioxidants / S.J. Parekattil, S.C. Esteves, A. Agarwal (Eds.) 2nd Ed. Springer Nature Switzerland AG, 2021, 891 p. 26. Диагностика и лечение в схемах и алгоритмах: пособие для врачей / под. ред. А.А. Камалова. М.: Научно-методический организационный медицинский центр, 2024. 184 с. 27. Diagnostic evaluation of the infertile female: a committee opinion. Practice Committee of the American Society for Reproductive Medicine. Fertil Steril. 2015;103(6): e44-50. doi: 10.1016/j.fertnstert.2015.03.019. 28. American College of Obstetricians and Gynecologists Committee on Gynecologic Practice and Practice Committee. Female age-related fertility decline. Committee Opinion No. 589. Fertil Steril. 2014;101(3):633-634. doi: 10.1016/j.fertnstert.2013.12.032. 29. Gamidov SI, Ovchinnikov RI, Popova AYu, Naumov NP, Gasanov NG. Role of male infertility in assisted reproductive technology programs (a literature review). Angrology and genital surgery. 2017;18(3):28-36. In Russian. (Гамидов С.И., Овчинников Р.И., Попова А.Ю., Наумов, Н.П., Гасанов Н.Г. Роль мужского фактора бесплодия в программе вспомогательных репродуктивных технологий (обзор литературы). Андрология и генитальная хирургия. 2017;18(3):28-36). doi: 10.17650/2070-9781-2017-18-3-28-36. 30. Mazzilli R., Rucci C., Vaiarelli A., Cimadomo D., Ubaldi F.M., Foresta C. et al. Male factor infertility and assisted reproductive technologies: indications, minimum access criteria and outcomes. J Endocrinol Invest. 2023;46(6):1079-1085. doi: 10.1007/s40618-022-02000-4. 31. Kamischke A, Cordes T, Nieschlag E. The diagnostic of male infertility-an important part of reproductive medicine. Ther Umsch. 2009;66(12):789-795. doi: 10.1024/0040-5930.66.12.789. 32. Pierik FH, Van Ginneken AM, Dohle GR, Vreeburg JT, Weber RF. The advantages of standardized evaluation of male infertility. Int J Androl. 2000;23(6):340-346. doi: 10.1046/j.1365-2605.2000.00250.x. 33. Корнеев И.А., Зассеев Р.Д., Исакова Э.В. и др. Оказание медицинской помощи с применением вспомогательных репродуктивных технологий у мужчин: обзор клинических рекомендаций и алгоритм маршрутизации пациентов. Проблемы репродукции. 2018;24(4):59-65. 34. ICD-11 for Mortality and Morbidity Statistics https://icd.who.int/browse/2024-01/mms/en#753457327 35. Patel AS, Leong JY, Ramasamy R. Prediction of male infertility by the World Health Organization laboratory manual for assessment of semen analysis: A systematic review. Arab J Urol. 2017;16(1):96-102. doi:10.1016/j.aju.2017.10.005. 36. Божедомов В.А., Корнеев И.А., Липатова Н.А., Божедомова Г.Е., Камарина Р.А. и др. Референтные показатели базового анализа эякулята фертильных мужчин: российские региональные особенности (многоцентровое поперечное ретроспективное исследование). Урология. 2023;5:48-56. doi: 10.18565/urology.2023.5.48-56. 37. Lo Giudice A, Asmundo MG, Cimino S, Cocci A, Falcone M, Capece M, et al. Effects of long and short ejaculatory abstinence on sperm parameters: a meta-analysis of randomized-controlled trials. Front Endocrinol (Lausanne). 2024;15:1373426. doi: 10.3389/fendo.2024.1373426. 38. Comar VA, Petersen CG, Mauri AL, Mattila M, Vagnini LD, Renzi A, et al. Influence of the abstinence period on human sperm quality: analysis of 2,458 semen samples. JBRA Assist Reprod. 2017;21(4):306-312. doi: 10.5935/1518-0557.20170052. 39. Wilcox AJ, Weinberg CR, Baird DD. Timing of sexual intercourse in relation to ovulation. Effects on the probability of conception, survival of the pregnancy, and sex of the baby. N Engl J Med. 1995;333(23):1517-1521. doi: 10.1056/NEJM199512073332301. 40. Wilcox AJ, Dunson D, Baird DD. The timing of the "fertile window" in the menstrual cycle: day specific estimates from a prospective study. BMJ. 2000;321(7271):1259-1262. doi: 10.1136/bmj.321.7271.1259. 41. WHO laboratory manual for the examination and processing of human semen, sixth edition. Geneva: World Health Organization; 2021. Licence: CC BY-NC-SA 3.0 IGO2021. 42. Coban O, Serdarogullari M, Onar Sekerci Z, Bilgin EM, Serakinci N. Evaluation of the impact of sperm morphology on embryo aneuploidy rates in a donor oocyte program. Syst Biol Reprod Med. 2018;64(3):169-173. doi:10.1080/19396368.2018.1428384. 43. Sachdeva K, Upadhyay D, Neri JG, Varghese MM, Singh K, Albuz FK, et al. Semen Quality is Associated with Sperm Aneuploidy and DNA Fragmentation in the United Arab Emirates Population. Genet Test Mol Biomarkers. 2020;24(4):195-203. doi: 10.1089/gtmb.2019.0180. 44. Gupta S, Sharma R, Agarwal A, Boitrelle F, Finelli R, Farkouh A, et al. Antisperm Antibody Testing: A Comprehensive Review of Its Role in the Management of Immunological Male Infertility and Results of a Global Survey of Clinical Practices. World J Mens Health. 2022;40(3):380-398. doi: 10.5534/wjmh.210164. 45. Agarwal A, Finelli R, Selvam MKP, Leisegang K, Majzoub A, Tadros N, et al. Global Survey of Reproductive Specialists to Determine the Clinical Utility of Oxidative Stress Testing and Antioxidant Use in Male Infertility. World J Mens Health. 2021;39(3):470-488. doi: 10.5534/wjmh.210025. 46. Cissen M, Wely MV, Scholten I, Mansell S, Bruin JP, Mol BW, et al. Measuring Sperm DNA Fragmentation and Clinical Outcomes of Medically Assisted Reproduction: A Systematic Review and Meta-Analysis. PLoS One. 2016;11(11):e0165125. doi: 10.1371/journal.pone.0165125. 47. Oleszczuk K, Giwercman A, Bungum M. Intra-individual variation of the sperm chromatin structure assay DNA fragmentation index in men from infertile couples. Hum Reprod. 2011;26(12):3244-3248. doi: 10.1093/humrep/der328. 48. Божедомов В.А., Лоран О.Б., Сухих Г.Т. Этиология и патогенез мужского аутоиммунного бесплодия. Часть 1 и 2. Андрология и генитальная хирургия. 2001;1:72-87. 49. Garcia PC, Rubio EM, Pereira OCM. Antisperm antibodies in infertile men and their correlation with seminal parameters. Reprod Med Biol. 2007;6:33-38. doi: 10.1111/j.1447-0578.2007.00162.x. 50. Cui D, Han G, Shang Y, Liu C, Xia L, Li L, Yi S. Antisperm antibodies in infertile men and their effect on semen parameters: a systematic review and meta-analysis. Clin Chim Acta. 2015;444:29-36. doi: 10.1016/j.cca.2015.01.033. 51. Barbonetti A, Castellini C, D'Andrea S, Cordeschi G, Santucci R, Francavilla S, Francavilla F. Prevalence of anti-sperm antibodies and relationship of degree of sperm auto-immunization to semen parameters and post-coital test outcome: a retrospective analysis of over 10 000 men. Hum Reprod. 2019;34:834-841. doi: 10.1093/humrep/dez030. 52. Barbonetti A, Castellini C, D'Andrea S, Minaldi E, Totaro M, Francavilla S, Francavilla F. Relationship between natural and intrauterine insemination-assisted live births and the degree of sperm autoimmunisation. Hum Reprod. 2020;35(6):1288-1295. doi: 10.1093/humrep/deaa070. 53. Leushuis E, van der Steeg JW, Steures P, Repping S, Schols W, van der Veen F, et al. Immunoglobulin G antisperm antibodies and prediction of spontaneous pregnancy. Fertil Steril. 2009;92:1659-1665. doi: 10.1016/j.fertnstert.2008.08.082. 54. Zini A, Fahmy N, Belzile E, Ciampi A, Al-Hathal N, Kotb A. Antisperm antibodies are not associated with pregnancy rates after IVF and ICSI: systematic review and meta-analysis. Hum Reprod. 2011;26(6):1288-1295. doi: 10.1093/humrep/der074. 55. Muratori M, Marchiani S, Tamburrino L, Baldi E. Sperm DNA Fragmentation: Mechanisms of Origin. Adv Exp Med Biol. 2019;1166:75-85. doi: 10.1007/978-3-030-21664-1_5. 56. Agarwal A, Farkouh A, Saleh R, Abdel-Meguid Hamoda TA, Harraz AM, Kavoussi P, et al. Global Andrology Forum. Controversy and consensus on indications for sperm DNA fragmentation testing in male infertility: a global survey, current guidelines, and expert recommendations. World J Mens Health. 2023;41:575-602. doi: 10.5534/wjmh.220282. 57. Farkouh A, Agarwal A, Hamoda TAA, Kavoussi P, Saleh R, Zini A, et al. Global Andrology Forum. Controversy and consensus on the management of elevated sperm DNA fragmentation in male infertility: a global survey, current guidelines, and expert recommendations. World J Mens Health. 2023;41(4):809-847. doi: 10.5534/wjmh.230008. 58. Kang YN, Hsiao YW, Chen CY, Wu CC. Testicular sperm is superior to ejaculated sperm for ICSI in cryptozoospermia: An update systematic review and meta-analysis. Sci Rep. 2018;8(1):7874. doi: 10.1038/s41598-018-26280-0. 59. Agarwal A, Farkouh A, Saleh R, Hamoda TAA, Salvio G, Boitrelle F, et al. Technical Aspects and Clinical Limitations of Sperm DNA Fragmentation Testing in Male Infertility: A Global Survey, Current Guidelines, and Expert Recommendations. World J Mens Health. 2024;42(1):202-215. doi: 10.5534/wjmh.230076. 60. Li Z, Wang L, Cai J, Huang H. Correlation of sperm DNA damage with IVF and ICSI outcomes: a systematic review and meta-analysis. J Assist Reprod Genet. 2006;23(9-10):367-376. doi: 10.1007/s10815-006-9066-9. 61. Ribas-Maynou J, Yeste M, Becerra-Tomás N, Aston KI, James ER, Salas-Huetos A. Clinical implications of sperm DNA damage in IVF and ICSI: updated systematic review and meta-analysis. Biol Rev Camb Philos Soc. 2021;96(4):1284-1300. doi: 10.1111/brv.12700. 62. Osman A, Alsomait H, Seshadri S, El-Toukhy T, Khalaf Y. The effect of sperm DNA fragmentation on live birth rate after IVF or ICSI: a systematic review and meta-analysis. Reprod Biomed Online. 2015;30(2):120-127. doi: 10.1016/j.rbmo.2014.10.018. 63. Kaneko S, Okada Y. Revalidation of DNA Fragmentation Analyses for Human Sperm-Measurement Principles, Comparative Standards, Calibration Curve, Required Sensitivity, and Eligibility Criteria for Test Sperm. Biology (Basel). 2024;13(7):484. doi: 10.3390/biology13070484. 64. Zhao G, Jiang X, Zheng Y, Bai H, Jiang Z, Cheng S, Li D. Outcomes comparison of testicular versus ejaculated sperm for intracytoplasmic sperm injection in infertile men with high DNA fragmentation: updated systematic review and meta-analysis. Transl Androl Urol. 2023;12(12):1785-1802. doi: 10.21037/tau-23-415. 65. ГОСТ Р ИСО 23162-2023, Исследование качества спермы базовое. Требования и методы исследований Доступно: https://protect.gost.ru/document1.aspx?control=31&baseC=6&page=1&month=1&year=-1&search=&id=253692
Информация
Список сокращений
АТХ группа – анатомо-терапевтически-химическая группа
ВИЧ – вирус иммунодефицита человека
ВМИ – внутриматочная инсеминация (внутриматочное введение спермы мужа (партнера) или донора)
ВРТ – вспомогательные репродуктивные технологии
ВОЗ – Всемирная Организация Здравоохранения
ДНК – дезоксирибонуклеиновая кислота
ИКСИ – инъекция сперматозоида в цитоплазму ооцита
ИМТ – индекс массы тела
ЛГ – лютеинизирующий гормон
МЕСА – микрохирургическая экстракция сперматозоидов из придатка яичка (A11.21.002 Биопсия яичка, придатка яичка и семенного канатика)
МикроТЕСЕ – микрохирургическая экстракция сперматозоидов из яичка
МКБ 10 – международная классификация болезней 10-го пересмотра
НОА – необструктивная азооспермия
НМУ – номенклатура медицинских услуг
ОА – обструктивная азооспермия
Онко-ТЕСЕ – онкотестикулярная экстракция сперматозоидов
ПЕСА – чрескожная аспирация сперматозоидов из придатка яичка (A11.21.002 Биопсия яичка, придатка яичка и семенного канатика)
ПГТ – преимплантационное генетическое тестирование (A10.20.001)
ПГТ-А – ПГТ на анеуплоидии (А10.20.001.001 Преимплантационное генетическое исследование на анеуплоидии)
ПГТ-М – ПГТ на моногенные заболевания (А10.20.001.002 Преимплантационное генетическое исследование на моногенные заболевания)
ПГТ-СП – ПГТ на хромосомные структурные перестройки (А10.20.001.003 Преимплантационное генетическое исследование на структурные хромосомные перестройки)
ПРЭ – перенос размороженного эмбриона(ов) в полость матки (A11.20.030.001 Внутриматочное введение криоконсервированного эмбриона)
ПЦР – полимеразная цепная реакция
РЭ – ретроградная эякуляция
ТЕСА – чрескожная аспирация сперматозоидов из яичка (пункция яичка)
ТЕСЕ – экстракция сперматозоидов из яичка (биопсия яичка)
ТРУЗИ – трансректальное ультразвуковое исследование
УЗИ – ультразвуковое исследование
ФДС – фрагментация ДНК сперматозоидов
ФСГ – фолликулостимулирующий гормон
ЭКО – экстракорпоральное оплодотворение
AZF – (azoospermia factor), фактор азооспермии
CFTR – (cystic fibrosis transmembrane conductance regulator) – белок, участвующий в транспорте ионов хлора через мембрану клетки, мутации в гене CFTR приводят к возникновению системного наследственного аутосомно-рецессивного заболевания муковисцидоз
MAR-test – смешанная антиглобулиновая реакция, тест на антиспермальные антитела
Термины и определения
Аспермия – отсутствие эякулята (или ретроградная эякуляция).
Аспирация сперматозоидов из придатка яичка (ПЕСА) или аспирационная биопсия яичка придатка – хирургическое вмешательство, включающее аспирацию иглой придатка яичка с целью получения сперматозоидов.
Аспирация сперматозоидов из яичка (ТЕСА) или аспирационная биопсия яичка – хирургическое вмешательство, включающее аспирацию иглой яичка с целью получения сперматозоидов.
Астенозооспермия – процент прогрессивно-подвижных сперматозоидов ниже референсных значений.
Азооспермия – сперматозоиды в эякуляте отсутствуют (о наличии азооспермии можно судить после оценки центрифугированного осадка эякулята).
Бесплодие – заболевание, характеризующееся невозможностью достичь клинической беременности после 12 месяцев регулярной половой жизни без контрацепции вследствие нарушения способности субъекта к репродукции, либо индивидуальной, либо совместно с его/ее партнером. Вмешательства по поводу бесплодия могут быть начаты и ранее 1 года, основываясь на данных медицинского, сексуального и репродуктивного анамнеза, возраста, данных физикального обследования и диагностических тестов.
Бесплодие – это заболевание, которое характеризуется наличием препятствия к реализации репродуктивной функции.
Внутриматочная инсеминация (ВМИ) или внутриматочное введение спермы мужа (партнера) или донора – процедура, во время которой обработанную в лабораторных условиях сперму вводят в полость матки с целью достижения беременности
Вспомогательные репродуктивные технологии (ВРТ) – методы лечения бесплодия, при применении которых отдельные или все этапы зачатия и раннего развития эмбрионов осуществляются вне материнского организма (в том числе с использованием донорских и (или) криоконсервированных половых клеток, тканей репродуктивных органов и эмбрионов), а также суррогатное материнство (определение в соответствие со ст.55 Федерального Закона от 21.11.2011 №323-ФЗ (ред. от 25.12.2023) «Об основах охраны здоровья граждан в Российской Федерации»).
Вторичное бесплодие – состояние, при котором в прошлом от мужчины наступали беременности, однако в течение года регулярной половой жизни без контрацепции зачатие не произошло
Выкидыш (самопроизвольный аборт) – самопроизвольное прерывание беременности (изгнание или экстракция эмбриона/плода) до 22 недель беременности.
Женское бесплодие, связанное с мужскими факторами – бесплодие, связанное с нарушением репродуктивной функции у мужчины
Криоконсервация – процесс замораживания для сохранения биологического материала (гамет, зигот, эмбрионов на стадии дробления, бластоцист, тканей гонад) при экстремально низких температурах с целью его сохранения
Криптозооспермия – сперматозоиды отсутствуют в нативном препарате, но присутствуют в осадке эякулята.
Лейкоспермия (лейкоцитоспермия, пиоспермия) – присутствие лейкоцитов в эякуляте выше референсных значений.
Микрохирургическая экстракция сперматозоидов придатка яичка (МЕСА) – вид биопсии яичка придатка, хирургическое вмешательство, включающее получения сперматозоидов придатка яичка под микроскопическим контролем.
Микрохирургическая экстракция сперматозоида из яичка (микроТЕСЕ) – вид биопсии яичка, хирургическое вмешательство, включающее визуализацию семенных канальцев яичка и экстракцию их под микроскопическим контролем с применением 6-25-кратного оптического увеличения с целью получения сперматозоидов.
Мужское бесплодие – нарушение репродуктивной функции мужчин, приводящее к невозможности зачатия
Некрозооспермия – низкий процент живых и высокий процент неподвижных сперматозоидов в эякуляте.
Нормозооспермия – общее число сперматозоидов и процент прогрессивно-подвижных и морфологически нормальных сперматозоидов равно или выше референсных значений.
Олигозооспермия – общее число сперматозоидов ниже референсных значений.
Онко-TEСE – онкотестикулярная экстракция сперматозоидов из яичек, ТЕСЕ до начала гонадотоксического лечения
Перенос эмбриона(ов) (внутриматочное введение эмбриона) – введение в полость матки эмбриона(ов) на любой стадии его(их) развития с 1-го по 7-й день после ЭКО или ИКСИ, или размороженного(ых) эмбриона(ов)
Первичное бесплодие – состояние, при котором от мужчины не было ни одной беременности, несмотря на регулярную половую жизнь в течение года без применения контрацептивных средств.
Преимплантационное генетическое тестирование (A10.20.001) – анализ ДНК эмбрионов (на стадии дробления или бластоцисты) для определения генетических аномалий. Он включает преимплантационное генетическое исследование на анеуплоидии – А10.20.001.001 (ПГТ-А), преимплантационное генетическое исследование на моногенные заболевания – А10.20.001.002 (ПГТ-М), преимплантационное генетическое исследование на структурные хромосомные перестройки – А10.20.001.003 (ПГТ-СП).
Преконцепционная (прегравидарная) подготовка у мужчин – комплекс диагностических и лечебно-профилактических мероприятий, направленных на оптимизацию состояния мужской репродуктивной функции
Привычный выкидыш (ПВ, невынашивание беременности) – наличие у женщины 2-х и более клинических потерь беременности в сроках до 22 недель.
Репродуктивная функция (фертильность) это способность организма производить жизнеспособное потомство, у мужчин она определяется состоянием органов половой системы, обеспечивающих формирование сперматозоидов и их доставку, параметрами эякулята, функциональными характеристиками сперматозоидов и качеством содержащегося в них генетического материала, необходимых для оплодотворения яйцеклетки и развития эмбриона.
Тератозооспермия – процент морфологически нормальных сперматозоидов ниже референсных значений.
Экстракция сперматозоидов из яичка (ТЕСЕ) – вид биопсии яичка, хирургическое вмешательство, включающее экстракцию ткани яичка с целью получения сперматозоидов.
Экстракорпоральное оплодотворение (ЭКО) – последовательность манипуляций, включающая экстракорпоральное оплодотворение ооцитов (включает традиционную инсеминацию in vitro и инъекцию сперматозоида в цитоплазму ооцита (ИКСИ),
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Дополнительная информация отсутствует.
Критерии оценки качества медицинской помощи
|
№
|
Критерии качества
|
Оценка выполнения (да/нет)
|
|
1
|
У мужчины с жалобами на бесплодие собран анамнез и проведено физикальное обследование
|
Да/нет
|
|
2
|
У мужчины с жалобами на бесплодие выполнено базовое исследование эякулята (спермограмма), включая определение объема эякулята, концентрации сперматозоидов, общего числа сперматозоидов, долей подвижных сперматозоидов (включая доли сперматозоидов с медленной и быстрой поступательной подвижностью), доли нормальных форм сперматозоидов и концентрации круглых клеток, а при значении доли подвижных сперматозоидов менее 40% – определение доли живых сперматозоидов
|
Да/нет
|
|
3
|
Пациентам с азооспермией и олигозооспермией выполнено исследование уровня фолликулостимулирующего гормона (ФСГ) в сыворотке крови и исследование уровня общего тестостерона в крови
|
Да/нет
|
|
4
|
Пациентам с азооспермией и концентрацией сперматозоидов менее <10 млн/мл) выполнено цитогенетическое исследование (кариотип)
|
Да/нет
|
|
5
|
Пациентам с азооспермией и концентрацией сперматозоидов менее 5 млн/мл выполнено молекулярно-генетическое исследование микроделеции локуса AZF Y-хромосомы (НМУ – молекулярно-генетическое исследование микроделеций в Y хромосоме в крови)
|
Да/нет
|
|
6
|
Пациентам с врожденным одно- и двусторонним отсутствием семявыносящих протоков выполнено молекулярно-генетическое исследование мутаций в гене CFTR (муковисцидоз) в крови
|
Да/нет
|
|
7
|
Пациентам с азооспермией и низким объемом эякулята выполнено ТРУЗИ (НМУ Ультразвуковое исследование предстательной железы трансректальное)
|
Да/нет
|
|
8
|
У бесплодных мужчин с азооспермией извлечение сперматозоидов хирургическим путем методами ПЕСА, ТЕСА, ТЕСЕ, микро-ТЕСЕ, МЕСА с целью их применения с использованием ВРТ выполнено в условиях, позволяющих произвести криоконсервацию сперматозоидов
|
Да/нет
|
|
9
|
Мужчинам даны рекомендации по преконцепционной (прегравидарной) подготовке при планировании естественного зачатия и перед лечением жены (партнерши) с применением ВМИ и ВРТ
|
Да/нет
|
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
1. Аполихин Олег Иванович, д.м.н., профессор, член-корреспондент РАН, директор Научно-исследовательского института урологии и интервенционной радиологии им. Н.А. Лопаткина – филиала Федерального государственного бюджетного учреждения Национальный медицинский исследовательский центр радиологии» Министерства здравоохранения Российской Федерации. Конфликт интересов отсутствует
2. Бабенко Алина Юрьевна., д.м.н., гл.н.с., руководитель НИЛ диабетологии института эндокринологии, профессор кафедры внутренних болезней института медицинского образования НМИЦ им. В.А. Алмазова. Конфликт интересов отсутствует
3. Боголюбов Сергей Владимирович, к.м.н., доцент, ведущий научный сотрудник отделения ВРТ Государственного научного центра Российской Федерации ФГБУ "Национальный медицинский исследовательский центр эндокринологии" Министерства здравоохранения РФ, директор андрологической группы клиники NGC, Москва. Конфликт интересов отсутствует
4. Божедомов Владимир Александрович, д.м.н., профессор кафедры урологии и андрологии факультета фундаментальной медицины ФГБУ ВО «Московский государственный университет имени М.В. Ломоносова», ведущий научный сотрудник ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени акад. В.И.Кулакова» Министерства здравоохранения Российской Федерации, научный руководитель по андрологии и репродукции ФГБУ «Поликлиника №3» Управления делами президента Российской Федерации. Конфликт интересов отсутствует
5. Виноградов Игорь Владимирович, д.м.н., профессор председатель МОО «Лига специалистов мужской репродукции», научный руководитель научно-практического центра «Репродуктивной и регенеративной медицины». Конфликт интересов отсутствует
6. Газимиев Магомед-С Алхазурович, д.м.н., профессор, Директор Научно-технологического парка биомедицины, заместитель директора Института урологии и репродуктивного здоровья человека ФГАОУ ВО Первый МГМУ имени И.М.Сеченова Минздрава России (Сеченовский Университет). Конфликт интересов отсутствует
7. Гамидов Сафар Исраилович, д.м.н., профессор кафедры АГПиР ФПО ПМГМУ им. И.М. Сеченова, заведующий отделением андрологии и урологии ФГБУ "Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова" МЗ РФ. Конфликт интересов отсутствует
8. Гвасалия Бадри Роинович, д.м.н., профессор кафедры урологии Российского университета медицины, МЗ РФ, Москва. Конфликт интересов отсутствует
9. Гребенкин Евгений Валерьевич, к.м.н, врач-патологоанатом ГБУЗ ММНКЦ им. С.П. Боткина ДЗМ; старший преподаватель кафедры фундаментальной медицины ФГАОУ ВО «Национальный исследовательский ядерный университет «МИФИ», Москва. Конфликт интересов отсутствует
10. Епанчинцева Елена Александровна, к.м.н., с.н.с. лаборатории эндокринологии ФГБНУ «Федеральный исследовательский центр фундаментальной и трансляционной медицины», доцент кафедры урологии ФГБОУ ВО НГМУ Минздрава России, врач-эндокринолог "Новосибирский центр репродуктивной медицины" группа компаний "Мать и дитя". Конфликт интересов отсутствует
11. Ефремов Евгений Александрович, д.м.н., профессор кафедры урологии, андрологии и онкоурологии ФДПО ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России. Конфликт интересов отсутствует
12. Жуков Олег Борисович, Руководитель урологического направления АО "Европейский Медицинский Центр", доцент кафедры эндоурологии ФПК медицинских работников ФГАОУ ВО РУДН. Конфликт интересов отсутствует
13. Камалов Армаис Альбертович, профессор, доктор медицинских наук, академик РАН, заведующий кафедрой урологии и андрологии ФФМ МГУ имени М.В. Ломоносова. Конфликт интересов отсутствует
14. Коган Михаил Иосифович – заслуженный деятель науки РФ, доктор медицинских наук, профессор, заведующий кафедрой урологии и репродуктивного здоровья человека с курсом детской урологии-андрологии РостГМУ. Конфликт интересов отсутствует
15. Корнеев Игорь Алексеевич, д.м.н., профессор, кафедра урологии ФГБОУВО ПСПбГМУ им. акад. И.П. Павлова, медицинский директор Международного центра репродуктивной медицины. Конфликт интересов отсутствует
16. Красняк Степан Сергеевич, в.н.с. отдела андрологии и репродукции человека НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина, ответственный секретарь Профильной комиссии Минздрава России по репродуктивному здоровью, к.м.н. Конфликт интересов отсутствует
17. Моисеева Ирина Валерьевна, зав. отд. ВРТ ГБУЗ "МЦ Династия", главный внештатный специалист МЗ РФ в ПФО и Самарской области по репродуктивному здоровью женщин, к.м.н. Конфликт интересов отсутствует
18. Овчинников Руслан Игоревич, Директор Департамента развития андрологии, Руководитель отделения андрологии и урологии, Центр репродуктивной медицины "СкайФерт", Москва, к.м.н.. член Правления ассоциации «Аспект» Российского общества урологов, к.м.н Конфликт интересов отсутствует
19. Петрищев Владлен Станиславович, Медико-генетический центр «НоваКлиник», г. Москва, врач уролог-андролог, научный руководитель по андрологии. Конфликт интересов отсутствует
20. Пушкарь Дмитрий Юрьевич, академик РАН, профессор, доктор медицинских наук Заведующий кафедрой урологии Российского университета медицины, Конфликт интересов отсутствует
21. Рогозин Дмитрий Сергеевич доцент кафедры общей хирургии ЮУГМУ, к.м.н, Главный врач клиники репродукции «ДНК», г.Челябинск. Конфликт интересов отсутствует
22. Савзиханов Руслан Темирханович, доцент кафедры урологии Дагестанского государственного медицинского Университета, главный врач медицинского центра Family. Конфликт интересов отсутствует
23. Харчилава Реваз Ревазович, к.м.н., директор Учебного центра врачебной практики «Praxi Medica» ФГАОУ ВО Первый МГМУ им.И.М. Сченова. Конфликт интересов отсутствует.
24. Черных Вячеслав Борисович, заведующий лабораторией генетики нарушений репродукции ФГБНУ «Медико-генетический научный центр им. академика Н.П. Бочкова», профессор кафедры общей и медицинской генетики Медико-биологического факультета ГБОУ ВПО “Российский национальный исследовательский медицинский университет имени Н.И. Пирогова” Минздрава России. Конфликт интересов отсутствует
25. Шурыгина Оксана Викторовна, заведующая лабораторией ВРТ Центра лечения бесплодия Медицинской компании ИДК, доктор медицинских наук, профессор кафедры гистологии и эмбриологии человека Самарского государственного медицинского университета доцент кафедры гистологии и эмбриологии ГБОУВПО Самарский Государственный Медицинский Университет. Конфликт интересов отсутствует
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
- Врач-уролог
- Врач-акушер-гинеколог
- Врач-эндокринолог
- Врач-генетик
- Врач клинической и лабораторной диагностики
- Эмбриолог
- Студенты медицинских ВУЗов, ординаторы, аспиранты
Таблица 1.
Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
|
УДД
|
Расшифровка
|
|
1
|
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
|
|
2
|
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
|
|
3
|
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая
|
|
5
|
Имеется лишь обоснование механизма действия или мнение экспертов
|
Таблица 2.
Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
|
УДД
|
Расшифровка
|
|
1
|
Систематический обзор РКИ с применением мета-анализа
|
|
2
|
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа
|
|
3
|
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль»
|
|
5
|
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
|
Таблица 3.
Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
|
УУР
|
Расшифровка
|
|
A
|
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
|
|
B
|
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
|
|
C
|
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
|
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
-
Приказ Минздрава России от 31.07.2020 № 803н "О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению" (Зарегистрировано в Минюсте России 19.10.2020 № 60457)
-
Женское бесплодие Клинические рекомендации (2024 г)
-
Привычный выкидыш. Клинические рекомендации (2022 г)
-
Письмо Министерства здравоохранения Российской Федерации от 8 апреля 2024 г. № 17-6/И/2-6434 О направлении методических рекомендаций по диспансеризации мужчин и женщин репродуктивного возраста с целью оценки репродуктивного здоровья
Приложение Б. Алгоритмы действий врача
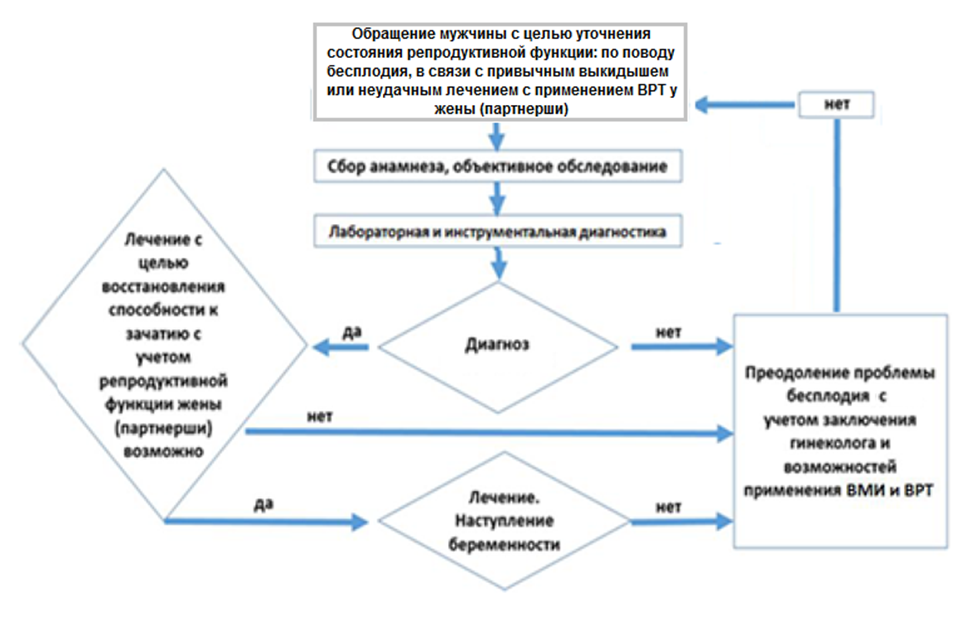
Приложение В. Информация для пациента
Что такое мужское бесплодие?
О бесплодии в паре говорят, когда женщина в сексуально активной и не использующей контрацепцию паре не получает желаемой беременности в течение года. Если причина, по которой зачатие не происходит, кроется в мужчине, говорят о нарушении мужской репродуктивной функции – мужском бесплодии, однако, чаще бесплодие у пары является следствием недостаточности репродуктивной функции мужчины и женщины по отношению друг к другу. В связи с этим целью обследования мужчины при бесплодии является выявление заболеваний, патологических состояний, а также факторов окружающей среды и образа жизни, негативно влияющих на состояние репродуктивной функции с целью их устранения. Обследование мужчине и женщине следует проводить одновременно, после его завершения составляют план лечения с целью нормализации репродуктивной функции, это лечение может быть медикаментозным или оперативным, а в тех случаях, когда причина бесплодия остается неясной или назначение лечения для преодоления проблемы бесплодия в браке невозможно, можно использовать лечение с применением вспомогательных репродуктивных технологий.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Шкалы оценки, вопросники и другие оценочные инструменты не требуются
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.