Миастения гравис: протокол диагностики и лечения
 Версия: Клинические протоколы 2024 (Узбекистан)
Версия: Клинические протоколы 2024 (Узбекистан)
Myasthenia gravis (G70.0), Myasthenia gravis и другие нарушения нервно-мышечного синапса (G70), Врожденная или приобретенная миастения (G70.2), Другие миастенические синдромы при опухолевом поражении (C00-D48+) (G73.2*), Другие нарушения нервно-мышечного синапса (G70.8), Миастенические синдромы при других болезнях, классифицированных в других рубриках (G73.3*), Миастенические синдромы при эндокринных болезнях (G73.0*), Нарушение нервно-мышечного синапса неуточненное (G70.9), Токсические нарушения нервно-мышечного синапса (G70.1)
Неврология, Неврология детская
Общая информация
Краткое описание
Приложение
к приказу № 401
от «25» декабря 2024 года
Министра Здравоохранения Республики Узбекистан
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ УЗБЕКИСТАН ТАШКЕНТСКИЙ ПЕДИАТРИЧЕСКИЙ МЕДИЦИНСКИЙ ИНСТИТУТ
НАЦИОНАЛЬНЫЕ КЛИНИЧЕСКИЕ ПРОТОКОЛЫ ПО НОЗОЛОГИИ «МИАСТЕНИЯ ГРАВИС»
НАЦИОНАЛЬНЫЕ КЛИНИЧЕСКИЕ ПРОТОКОЛЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ ПО НОЗОЛОГИИ « МИАСТЕНИЯ ГРАВИС»
Вводная часть
Дата разработки и пересмотра протокола: 2024 год, дата пересмотра 2027 г. или по мере появления новых ключевых доказательств. Все поправки к представленным рекомендациям будут опубликованы в соответствующих документах.
Ответственное учреждение по разработке данного клинического протокола и стандарта: Ташкентский педиатрический медицинский институт
Ответственное учреждение по разработке данного клинического протокола и стандарта: Ташкентский педиатрический медицинский институт
Введение
Термины
-
Состояние - изменения организма, возникающие в связи с воздействием патогенных и (или) физиологических факторов и требующие оказания медицинской помощи;
-
Инструментальная диагностика – диагностика с использованием для обследования больного различных приборов, аппаратов и инструментов.
-
Лабораторная диагностика — совокупность методов, направленных на анализ исследуемого материала с помощью различного специализированного оборудования.
-
Миастенический криз — это внезапно развившееся критическое состояние у больных М, которое свидетельствует не только о количественном, но и о качественном изменении характера процесса. Патогенез криза связан не только с уменьшением плотности холинорецепторов постсинаптической мембраны вследствие комплемент-опосредованного их разрушения, но и с изменением функционального состояния оставшихся рецепторов и ионных каналов.
-
Холинергический криз — это состояние, имеющее особый механизм развития, обусловленный избыточной активацией никотиновых и мускариновых холинорецепторов вследствие передозировки антихолинестеразными препаратами.
-
Смешанный криз - это самый тяжелый вариант витальных нарушений у больных М., при котором больной нуждается в немедленном приеме антихолинэстеразных препаратов, а с другой – он не переносит эти препараты, и состояние его ухудшается на фоне их приема.
-
Уровень достоверности доказательств – отражает степень уверенности в том, что найденный эффект от применения медицинского вмешательства является истинным.
-
Уровень убедительности рекомендаций – отражает не только степень уверенности в достоверности эффекта вмешательства, но и степень уверенности в том, что следование рекомендациям принесет больше пользы, чем вреда в конкретной ситуации.
Кодирование по МКБ-10
| G70 | Myasthenia gravis и другие нарушения нервно- мышечного синапса |
| G70.0 | Myastenia gravis |
| G70.1 | Токсические нарушения нервно-мышечного синапса |
| G70.2 | Врожденная или приобретенная миастения |
| G70.8 | Другие нарушения нервно-мышечного синапса |
| G70.9 | Нарушение нервно-мышечного синапса неуточненное |
| G73 | Поражения нервно-мышечного синапса и мышц при болезнях, классифицированных в других рубриках |
| G73.0 | Миастенические синдромы при эндокринных болезнях |
| G73.2 | Другие миастенические синдромы при опухолевом поражении (C00-D48) |
| G73.3 | Миастенические синдромы при других болезнях, классифицированных в других рубриках |
| https://mkb-10.com/index.php?pid=5292 | |
Определения
https://www.ninds.nih.gov/health-information/disorders/myasthenia-gravis
Нервно-мышечные заболевания — большая группа болезней, при которых отмечается поражение мышечной ткани, нервно-мышечного синапса, периферических нервов, передних рогов спинного мозга. Наиболее распространенными нервно- мышечными заболеваниями являются миопатия, миотония, миастения.
Миастения (М), myasthenia gravis, болезнь Эрба-Гольдфлама - классическое, аутоиммунное заболевание, клинические проявления которого в виде слабости и патологической мышечной утомляемости обусловлены явлениями аутоагрессии с образованием антител, направленных к различным антигенным мишеням периферического нейромоторного аппарата.
Миастенический синдром Ламберта-Итона (СЛИ) — заболевание с поражением пресинаптических окончаний мотонейронов. Оно характеризуется хронической перемежающейся мышечной слабостью в проксимальных мышцах конечностей. Больные испытывают сложности при ходьбе, им трудно подниматься по лестнице, вставать со стула. Больные, страдающие СЛИ, могут отмечать некоторое нарастание мышечной силы после физических упражнений.
Миастенический криз — внезапное резкое ухудшение состояния больного миастенией с выраженной мышечной слабостью, нарушением дыхания и глотания, часто приводящее к летальному исходу.
Классификация
Классификация
https://en.wikipedia.org/wiki/Myasthenia_gravis#Subgroup_classification
По характеру течения:
-
миастенические эпизоды (однократный или ремитирующее течение);
-
миастенические состояния (т.е. стационарное течение);
-
прогрессирующее течение;
-
злокачественная форма.
По локализации
Локальные (ограниченные) процессы:
-
глазные;
-
бульбарные;
-
лицевые;
-
краниальные;
-
туловищные.
Генерализованные процессы:
-
генерализованные без бульбарных нарушений;
-
генерализованные и генерализованные с нарушениями дыхания.
По степени тяжести двигательных расстройств:
-
легкая;
-
средней тяжести;
-
тяжелая.
По степени компенсации двигательных нарушений на фоне АХЭР препаратов:
-
полная;
-
достаточная;
-
недостаточная (плохая).
В зависимости от динамики клинической картины выделяют несколько форм миастении:
-
миастенические эпизоды – представляющие из себя преходящие двигательные расстройства с полным восстановлением функции вне эпизода.
-
миастеническое состояние – форма миастении, при которой клиника сохраняется на протяжении многих лет без изменений.
-
прогрессирующая форма – форма миастении, при которой клинические проявления необратимо прогрессируют, без эпизодов восстановления сниженных двигательных функций.
-
злокачественная форма – форма миастении, остро начинающаяся и неуклонно прогрессирующая весьма быстрыми темпами с неуклонным нарушением функций нервно- мышечного аппарата.
Этиология и патогенез
Этиология и патогенез.
https://www.msdmanuals.com/ru/professional/неврологические-расстройства/заболевания-периферической-нервной-системы-и-мотонейрона/миастения-гравис
Этиология и патогенез Миастении.
Аутоиммунное заболевание нервно-мышечного соединения (NMJ), вызываемое антителами, которые атакуют компоненты постсинаптической мембраны, нарушают нервно-мышечную передачу и приводят к слабости и переутомлению скелетных мышц. Это может быть генерализовано или локализовано в определенных группах мышц, а вовлечение бульбарных и дыхательных мышц может представлять угрозу для жизни. Патогенез миастении зависит от мишени и изотипа аутоантител. Большинство случаев вызвано антителами к иммуноглобулинам (Ig) G1 и IgG3 к ацетилхолиновому рецептору (AChR). Они вызывают повреждение, опосредованное комплементом, и увеличивают скорость циркуляции AChR, причем оба механизма вызывают потерю AChR из постсинаптической мембраны. Вилочковая железа поражена у многих пациентов, и существуют экспериментальные и генетические подходы для понимания недостаточности иммунной толерантности к AChR. У части пациентов без антител к AChR присутствуют антитела к мышечно-специфической киназе (MuSK) или родственным белкам, таким как агрин и белок 4, связанный с рецепторами липопротеинов низкой плотности (LRP4). Антитела MuSK, преимущественно IgG4, вызывают дезинтеграцию нервно- мышечного соединения, нарушая физиологическую функцию MuSK по поддержанию синапсов и адаптации. Здесь мы обсуждаем, как знания о структуре и функции нервно- мышечных соединений помогли понять механизмы действия антител AChR и MuSK. Миастения остается парадигмой для состояний, опосредованных аутоантителами, и эти наблюдения показывают, как много еще предстоит узнать о синаптической функции и патологических механизмах. Миастения не относится к наследственным заболеваниям, ее этиология установлена не полностью. У 60–70% больных находят изменения вилочковой железы в виде опухоли или гиперплазии. В основе заболевания лежит нарушение нервно- мышечной передачи, что подтверждается комплексом фармакологических воздействий и современными морфологическими исследованиями. Согласно аутоиммунной теории, патологически измененная вилочковая железа вырабатывает специфические антитела против холинорецепторов, что вызывает конкурентный блок синаптической проводимости. Важную роль играют нарушение синтеза ацетилхолина в результате дефекта активности ферментов и недостаточная чувствительность холинергических рецепторов концевой пластинки. В сыворотке больных миастенией можно обнаружить антитела к скелетным мышцам и эпителиальным клеткам вилочковой железы. В итоге нарушение нервно- мышечной передачи происходит из-за уменьшения числа холинергических рецепторов концевой пластинки синапсов и/или их недостаточной чувствительности к ацетилхолину или нарушения синтеза ацетилхолина вследствие дефицита специфических ферментов, особенно при аутоиммунном дефиците. Обнаруживаемый высокий титр антител к белку ацетилхолиновых рецепторов часто коррелирует с тяжестью заболевания.
Этиология и патогенез миастенического синдрома
Прием лекарственных средств (ЛС) всегда связан с риском возникновения побочных эффектов. Согласно данным статистики частота возникновения побочного действия ЛС у госпитализированных больных составляет 10-20%, более того, у 5% причиной госпитализации являются именно тяжелые проявления побочного действия, к которым относится и мышечная слабость [1]. Поначалу незамечаемые эпизоды мышечной слабости вследствие приема ЛС могут быть проявлением начинающейся миастении или манифестацией ее субклинической формы, а также миастенического синдрома (МС) вследствие обратимого изменения передачи нервно-мышечного сигнала.
Клинические симптомы миастении в 15% случаев представлены локальными формами: глазной, глоточно-лицевой, скелетно-мышечной. Глазная миастения считается доброкачественной формой, поскольку не представляет угрозы для жизни больных и проявляется только птозом, диплопией или косоглазием. Глоточно-лицевая форма характеризуется расстройством глотания, жевания, осиплостью голоса или его исчезновением после разговора. При скелетно-мышечной миастении поражаются мышцы той или иной части туловища. В 85% случаев встречается генерализованная форма миастении, объединяющая симптомы всех локальных форм с присоединением слабости дыхательной мускулатуры и угрожающего жизни миастенического криза, когда необходима интубация с искусственной вентиляцией легких (ИВЛ).
Частота развития миастении при приеме Б-пеницилламина составляет от 1 до 7% [4]. Клиническая картина в большинстве случаев ограничивается диплопией и птозом. Предполагается, что Б-пеницилламин, ковалентно связываясь с двумя субъединицами АХР (а и у), приводит к уменьшению их количества и образованию смешанных дисульфидов [5].
При МС происходит нарушение проведения нервного импульса вследствие следующих механизмов:
Клинические симптомы миастении в 15% случаев представлены локальными формами: глазной, глоточно-лицевой, скелетно-мышечной. Глазная миастения считается доброкачественной формой, поскольку не представляет угрозы для жизни больных и проявляется только птозом, диплопией или косоглазием. Глоточно-лицевая форма характеризуется расстройством глотания, жевания, осиплостью голоса или его исчезновением после разговора. При скелетно-мышечной миастении поражаются мышцы той или иной части туловища. В 85% случаев встречается генерализованная форма миастении, объединяющая симптомы всех локальных форм с присоединением слабости дыхательной мускулатуры и угрожающего жизни миастенического криза, когда необходима интубация с искусственной вентиляцией легких (ИВЛ).
Частота развития миастении при приеме Б-пеницилламина составляет от 1 до 7% [4]. Клиническая картина в большинстве случаев ограничивается диплопией и птозом. Предполагается, что Б-пеницилламин, ковалентно связываясь с двумя субъединицами АХР (а и у), приводит к уменьшению их количества и образованию смешанных дисульфидов [5].
При МС происходит нарушение проведения нервного импульса вследствие следующих механизмов:
- пресинаптического (ингибирование секреции ацетилхолина (АХ) и блокада поглощения кальция);
- постсинаптического (блокада постсинаптических ацетилхолиновых рецепторов (АХР) или ингибирование распространения импульса в концевой пластинке двигательного нерва из-за прерывания постсинаптического потока ионов);
- комбинированного (пре- и постсинаптического)
Согласно многочисленным наблюдениям, наиболее часто провоцировали обострение или даже дебют миастении и миастенического синдрома Б-пеницилламин, альфа-интерферон, кортикостероиды и некоторые антибиотики.
Эпидемиология
Эпидемиология
https://www.orpha.net/en/disease/detail/589?name=Myasthenia%20gravis&mode=name
Эпидемиология Миастении Миастения относится к орфанным заболеваниям и входит в международный перечень редких болезней. Согласно данным исследований заболеваемость миастенией варьировала от 0,22 до 2,8 на 100 тыс. населения в год, распространенность – от 2,17 до 32,0 на 100 тыс. населения
Миастения может дебютировать в любом возрасте, начиная с раннего детства и заканчивая глубокой старостью. Средний возраст начала болезни у женщин - 26 лет, у мужчин - 31 год. Соотношение мужчин и женщин среди заболевших составляет 1:3.
Количество пациентов с миастенией в Узбекистане: в настоящее время введется единый реестр пациентов с миастенией. Наибольшее количество обратившихся зарегистрировано в Бухарской, Ферганской, Наманганской, областях и в г. Ташкенте.
Эпидемиология Миастении Миастения относится к орфанным заболеваниям и входит в международный перечень редких болезней. Согласно данным исследований заболеваемость миастенией варьировала от 0,22 до 2,8 на 100 тыс. населения в год, распространенность – от 2,17 до 32,0 на 100 тыс. населения
Миастения может дебютировать в любом возрасте, начиная с раннего детства и заканчивая глубокой старостью. Средний возраст начала болезни у женщин - 26 лет, у мужчин - 31 год. Соотношение мужчин и женщин среди заболевших составляет 1:3.
Количество пациентов с миастенией в Узбекистане: в настоящее время введется единый реестр пациентов с миастенией. Наибольшее количество обратившихся зарегистрировано в Бухарской, Ферганской, Наманганской, областях и в г. Ташкенте.
Эпидемиология миастенического синдрома
Чаще всего лекарственная миастения связан с применением Ряд лекарств, таких как ингибиторы контрольных точек иммунитета, пеницилламин, ингибиторы тирозинкиназы и интерфероны, могут индуцировать de novo MG путем изменения механизмов иммунного гомеостаза, которые предотвращают возникновение аутоиммунных заболеваний, таких как MG. Другие лекарственные средства, особенно определенные антибиотики, антиаритмические средства, анестетики и нервно-мышечные блокаторы, оказывают вредное воздействие на нервно-мышечную передачу, приводя к усилению слабости при MG или MG-подобных симптомах у пациентов, не принимающих MG, причем последние обычно возникают при медицинских обстоятельствах, таких как почечная недостаточность.
Прием лекарственных средств (ЛС) всегда связан с риском возникновения побочных эффектов. Согласно данным статистики частота возникновения побочного действия ЛС у госпитализированных больных составляет 10-20%, более того, у 5% причиной госпитализации являются именно тяжелые проявления побочного действия, к которым относится и мышечная слабость [1]. Поначалу незамечаемые эпизоды мышечной слабости вследствие приема ЛС могут быть проявлением начинающейся миастении или манифестацией ее субклинической формы, а также миастенического синдрома (МС) вследствие обратимого изменения передачи нервно-мышечного сигнала.
Клиническая картина
Cимптомы, течение
Клиническая картина
https://rarediseases.org/rare-diseases/myasthenia-gravis/
Клиническая картина Миастении
Для миастении характерна слабость мышц и необычная мышечная утомляемость, усиливающаяся на фоне физических нагрузок и уменьшающаяся после отдыха или приема антихолинэстеразных препаратов. Течение болезни хроническое с периодическими обострениями и возможным развитием кризов.
При миастении могут наблюдаться следующие нарушения:
При миастении могут наблюдаться следующие нарушения:
-
глазодвигательные;
-
бульбарные (нарушение функции черепных нервов);
-
слабость мышц (жевательных, экстраокулярных, мимических, дыхательных, мышц шеи, туловища и конечностей).
Заболевание чаще всего начинается с глазных симптомов (птоза и диплопии). Птоз (необычно низкое положение верхнего века по отношению к глазному яблоку вследствие его опущения) в разные периоды времени может наблюдаться то с одной, то с другой стороны. Диплопия (двоение) при миастении усиливается при зрительной и физической нагрузке, ярком освещении, во второй половине дня, более выражена при взгляде вдаль (два одинаковых предмета на улице, раздвоение дороги, ступенек, два телевизора, и т.д.).
Затем присоединяется слабость проксимальных отделов мышц конечностей (трудно подняться по лестнице, встать со стула, поднять руки вверх). Кроме того, усиливается птоз на фоне физической нагрузки (феномен генерализации мышечной слабости). У пациента может наблюдаться маскообразное лицо с отсутствием морщин и бедной мимикой, с опущением век.
Во время улыбки поднимается лишь верхняя губа, в то же время нижняя губа и углы рта остаются неподвижными.
На фоне продолжительного разговора голос приобретает гнусавый оттенок, появляется дизартрия, больной с трудом выговаривает буквы Р, Ш, С (феномен патологической мышечной утомляемости). После отдыха эти явления проходят. Во время приема пищи присутствует слабость жевательных мышц (иногда вплоть до отвисания нижней челюсти). Больные могут поддерживать челюсть и помогать себе при жевании рукой. Мимическая слабость проявляется при повторном зажмуривании, при надувании щек.
Слабость мышц конечностей может быть изолированной или сочетаться со слабостью мускулатуры другой локализации. Типично преобладание слабости разгибателей над сгибателями (например, трехглавой мышцы плеча над двуглавой), усиление слабости при нагрузке, что чревато риском падения при попытке пойти быстрее, подъеме по лестнице и т.п. У больных пожилого возраста можно наблюдать согнутую позу за счет слабости мышц спины, свисающую голову за счет слабости мышц шеи.
Дыхательные расстройства при миастении характеризуются затруднением вдоха, ослаблением кашлевого толчка.
При бульбарных нарушениях существуют проблемы с глотанием (поперхивание, попадание жидкой пищи в носовые ходы), наблюдаются гнусавость и речевые нарушения. По мере прогрессирования миастении пациент может полностью потерять способность глотать и разговаривать. Бульбарные нарушения усиливаются при речевой, общей физической нагрузке, во время еды.
У 10-15% пациентов могут наблюдаться кризы:
У 10-15% пациентов могут наблюдаться кризы:
-
миастенический криз, который возникает при недостаточном лечении антихолинэстеразными препаратами и требует интубации пациента вследствие дыхательных нарушений;
-
холинергический криз, развивающийся на фоне передозировки антихолинэстеразных препаратов;
-
смешанные кризы.
Клиническая картина миастенического синдрома
К ним относят синдромы, клинические проявления которых схожи с проявлениями миастении, имеется нарушение нервно-мышечной передачи на уровне синапса, но иного генеза, чем при миастении. Условно миастенические синдромы можно разделить на приобретенные и врожденные (конгенитальные). Первые развиваются в результате действия различных внешних причин (новообразования, отравления ботулотоксином и др.), вторые обусловлены генетической патологией.
Приобретённые миастенические синдромы.
Синдром Ламберта—Итона Наиболее распространенный приобретенный миастенический синдром — это синдром Ламберта—Итона. Впервые он описан у больного с бронхогенным раком легкого и считался специфическим для мелкоклеточной легочной карциномы. В дальнейшем этот синдром выявлен и при других новообразованиях и даже при их отсутствии. Встречается с частотой 1 на 100 000 населения, чаще болеют мужчины. Возраст заболевших колеблется от 17 до 75 лет, но этот синдром может развиться и раньше (в литературе имеются описания заболевших в возрасте 14 лет). Характерны повышенная утомляемость, в основном, проксимальных отделов конечностей, причем в большей степени страдают мышцы ног и тазового пояса. Глазодвигательные нарушения развиваются редко, иногда может быть транзиторная диплопия (у 40% больных). Нехарактерно нарушение дыхания. Часто встречаются дистальные симметричные сенсорные нейропатии. Глубокие сухожильно-надкостничные рефлексы, как правило, снижены или отсутствуют; их можно вызвать при повторных ударах неврологического молоточка по сухожилию или после короткого максимального сокращения исследуемых мышц. При синдроме Ламберта—Итона обычно развивается дисфункция вегетативной нервной системы: снижается саливация, слезоотделение, развивается ортостатическая гипотензия и др. Характерная особенность этого синдрома — феномен «врабатывания»: увеличение мышечной силы в процессе кратковременной физической нагрузки (возникает за счет активации ранее не функционировавших синапсов). Длительная же нагрузка, лихорадка, жаркая погода ухудшают самочувствие больных. Антихолиэстеразные препараты менее эффективны при лечении, чем средства, облегчающие выделение ацетилхолина из пресинаптических везикул (3,4 диаминопиридин). Относительным эффектом обладают иммунодепрессанты (преднизолон, циклоспорин). Миастенические синдромы могут также развиваться при дифтерии, интоксикации ботулотоксином, приеме аминогликозидов (редко).
Врождённые миастенические синдромы (ВМС) По современным представлениям, ВМС — наследственные заболевания, обусловленные нарушением нервно-мышечной передачи. Основа данной патологии — генетический дефект белков, экспрессированных в нервно- мышечных синапсах. ВМС по месту первичного дефекта разделяют на пресинаптические, синаптические и постсинаптические. У 3/4 больных с ВМС выявляют постсинаптические нарушения, у 16% — недостаточность ацетилхолинэстеразы концевой пластинки, у 8% — пресинаптические нарушения (Engel A.G. et al., 2003).
Конгенитальная миастения с эпизодическим апноэ (семейная детская миастения). Заболевание с аутосомно-рецессивным путем передачи. В основе — снижение ресинтеза ацетилхолина или уменьшение его обратного захвата в пресинаптических окончаниях. Проявляется сразу после рождения или в раннем возрасте периодически возникающими приступами апноэ. Характерно частичное или полное восстановление дыхания после каждого эпизода. В период между эпизодами ребенок практически здоров (иногда могут быть нетяжелые миастенические проявления по типу непостоянного птоза). С возрастом частота эпизодов уменьшается. При осмотре видимых изменений мышц нет, их объем нормальный. Глубокие рефлексы сохранены. Электромиография выявляет декремент М-ответа на частоте от 2 до 3 Герц (только в пораженных мышцах). Эффективны ингибиторы холинэстеразы (прозерин, калимин и др.), иногда хороший эффект оказывает 3,4-диаминопиридин. Уменьшение числа синаптических везикул и снижение количественного освобождения ацетилхолина. Синдром, проявляющийся сразу после рождения птозом, слабостью бульбарной мускулатуры и мышц конечностей. У части больных могут быть ограничены движения глазных яблок. Электрофизиологическое исследование выявляет декремент амплитуды мышечного ответа. Эффективно использование ингибиторов холинэстеразы.
Дефицит ацетилхолинэстеразы конечной пластины. Миастенический синдром с аутосомно-рецессивным путем передачи (мутация гена на хромосоме 3р25). Проявляется в возрасте до двух лет задержкой моторного развития, слабостью дыхательных, глазодвигательных, мимических мышц, проксимальных отделов конечностей. Глубокие рефлексы нормальные или несколько угнетены. Характерно снижение реакции зрачков на свет. В дальнейшем у лиц, достигших пожилого возраста, может развиваться сколиоз. ЭМГ выявляет декремент на частоте 2 Герца. Лечение не разработано; ингибиторы холинэстеразы неэффективны.
Синдром медленных каналов ацетилхолиновых рецепторов. Наследуется аутосомно- доминантно. Первые проявления могут появляться как у детей раннего возраста, так и у взрослых. Как правило, развиваются глазодвигательные нарушения (вплоть до офтальмоплегии), слабость шейных мышц и разгибателей предплечья. Руки страдают в большей степени, чем ноги. Двигательные нарушения медленно прогрессируют. Повторяющаяся электростимуляция нерва демонстрирует декремент амплитуды ответа в пораженных мышцах. Антихолинстеразные препараты мало эффективны.
Конгенитальная миастения с эпизодическим апноэ (семейная детская миастения). Заболевание с аутосомно-рецессивным путем передачи. В основе — снижение ресинтеза ацетилхолина или уменьшение его обратного захвата в пресинаптических окончаниях. Проявляется сразу после рождения или в раннем возрасте периодически возникающими приступами апноэ. Характерно частичное или полное восстановление дыхания после каждого эпизода. В период между эпизодами ребенок практически здоров (иногда могут быть нетяжелые миастенические проявления по типу непостоянного птоза). С возрастом частота эпизодов уменьшается. При осмотре видимых изменений мышц нет, их объем нормальный. Глубокие рефлексы сохранены. Электромиография выявляет декремент М-ответа на частоте от 2 до 3 Герц (только в пораженных мышцах). Эффективны ингибиторы холинэстеразы (прозерин, калимин и др.), иногда хороший эффект оказывает 3,4-диаминопиридин. Уменьшение числа синаптических везикул и снижение количественного освобождения ацетилхолина. Синдром, проявляющийся сразу после рождения птозом, слабостью бульбарной мускулатуры и мышц конечностей. У части больных могут быть ограничены движения глазных яблок. Электрофизиологическое исследование выявляет декремент амплитуды мышечного ответа. Эффективно использование ингибиторов холинэстеразы.
Дефицит ацетилхолинэстеразы конечной пластины. Миастенический синдром с аутосомно-рецессивным путем передачи (мутация гена на хромосоме 3р25). Проявляется в возрасте до двух лет задержкой моторного развития, слабостью дыхательных, глазодвигательных, мимических мышц, проксимальных отделов конечностей. Глубокие рефлексы нормальные или несколько угнетены. Характерно снижение реакции зрачков на свет. В дальнейшем у лиц, достигших пожилого возраста, может развиваться сколиоз. ЭМГ выявляет декремент на частоте 2 Герца. Лечение не разработано; ингибиторы холинэстеразы неэффективны.
Синдром медленных каналов ацетилхолиновых рецепторов. Наследуется аутосомно- доминантно. Первые проявления могут появляться как у детей раннего возраста, так и у взрослых. Как правило, развиваются глазодвигательные нарушения (вплоть до офтальмоплегии), слабость шейных мышц и разгибателей предплечья. Руки страдают в большей степени, чем ноги. Двигательные нарушения медленно прогрессируют. Повторяющаяся электростимуляция нерва демонстрирует декремент амплитуды ответа в пораженных мышцах. Антихолинстеразные препараты мало эффективны.
Дефицит ацетилхолиновых рецепторов с укороченным временем открытия каналов. Синдром с рецессивным путем передачи. Начинается в возрасте до 2-х лет, чаще наблюдается у мальчиков. Проявляется слабостью мышц лица, глазодвигательными нарушениями; у части больных развивается генерализованная слабость. Течение обычно доброкачественное, хотя слабость может сохраняться и во взрослом периоде. При исследовании декремент выявляется в мышцах лица. Для лечения используются ингибиторы холинэстеразы и 3,4 диаминопиридин.
Нарушение взаимодействия между ацетилхолином и ацетилхолиновыми рецепторами (синдром быстрого канала вследствие сниженного сродства). Аутосомно-рецессивный синдром, проявлящийся с рождения генерализованной мышечной слабостью. Электромиография выявляет декремент М-ответа. Улучшение наступает при использовании 3,4-диаминопиридина; возможен эффект при использовании ингибиторов холинэстеразы (калимин). Нарушение взаимодействия между ацетилхолином и ацетилхолиновыми рецепторами (синдром быстрого канала вследствие патологии входных ворот). Этот синдром также с аутосомно-рецессивным путем передачи. Проявляется с момента рождения нарушением работы глазодвигательных мышц. Позже, в течение первых лет жизни, присоединяется слабость и повышенная утомляемость мышц лица, туловища и конечностей. Может развиваться слабость мышц, сгибающих шею. При лечении используется сочетание 3,4-диаминопиридина и местинона (калимина).
Синдром быстрого канала со сниженной возможностью открытия каналов ацетилхолиновых рецепторов. Аутосомно-рецессивный синдром. Проявляется, начиная с рождения, диффузной мышечной слабостью и дыхательными нарушениями. Стимуляционная электромиография выявляет декремент от 25 до 50%. В ответ на введение калимина наступает лишь частичное восстановление мышечной силы. Семейная конечностно-поясная миастения. Характерно аутосомнорецессивное наследование, хотя возможны и спорадические случаи. Первые симптомы проявляются в детском и подростковом возрасте. Страдают конечности и мышцы плечевого и тазового пояса. Глазодвигательные мышцы остаются интактными. Иногда эта форма сопровождается патологией со стороны сердца и развитием контрактур. Повторная ритмичная стимуляция всегда выявляет декремент. Хороший эффект оказывают ингибиторы холинэстеразы. Снижение числа ацетилхолиновых рецепторов. Наиболее часто встречающийся миастенический синдром, обычно с рецессивным путем наследования. Может протекать с различной выраженностью миастенических расстройств. Легкая форма. Основной симптом — двухсторонний птоз, не достигающий, как правило, выраженной степени. Развитие ребенка соответствует возрасту. У детей старшего возраста может быть некоторая моторная неловкость, затруднен бег. Характерна повышенная чувствительность к препаратам, ухудшающим нервно- мышечную передачу (реланиум, дифенин и др.). Среднетяжелая форма. Проявляется на первом году жизни глазодвигательными нарушениями (иногда до степени офтальмопареза) и диффузной мышечной слабостью и утомляемостью, обычно нерезко выраженными. Тяжелая форма. Признаки болезни проявляются уже с момента рождения. Страдают глазодвигательные, бульбарные, дыхательные группы мышц, поражаются также мышцы конечностей и туловища. Часто бывают дыхательные нарушения. Ребенок отстает в моторном развитии. Обращают на себя внимание атрофии и гипотрофии мышц при нормальных или слегка сниженных сухожильнонадкостничных рефлексах. В дальнейшем у части детей может развиваться сколиоз.
Нарушение взаимодействия между ацетилхолином и ацетилхолиновыми рецепторами (синдром быстрого канала вследствие сниженного сродства). Аутосомно-рецессивный синдром, проявлящийся с рождения генерализованной мышечной слабостью. Электромиография выявляет декремент М-ответа. Улучшение наступает при использовании 3,4-диаминопиридина; возможен эффект при использовании ингибиторов холинэстеразы (калимин). Нарушение взаимодействия между ацетилхолином и ацетилхолиновыми рецепторами (синдром быстрого канала вследствие патологии входных ворот). Этот синдром также с аутосомно-рецессивным путем передачи. Проявляется с момента рождения нарушением работы глазодвигательных мышц. Позже, в течение первых лет жизни, присоединяется слабость и повышенная утомляемость мышц лица, туловища и конечностей. Может развиваться слабость мышц, сгибающих шею. При лечении используется сочетание 3,4-диаминопиридина и местинона (калимина).
Синдром быстрого канала со сниженной возможностью открытия каналов ацетилхолиновых рецепторов. Аутосомно-рецессивный синдром. Проявляется, начиная с рождения, диффузной мышечной слабостью и дыхательными нарушениями. Стимуляционная электромиография выявляет декремент от 25 до 50%. В ответ на введение калимина наступает лишь частичное восстановление мышечной силы. Семейная конечностно-поясная миастения. Характерно аутосомнорецессивное наследование, хотя возможны и спорадические случаи. Первые симптомы проявляются в детском и подростковом возрасте. Страдают конечности и мышцы плечевого и тазового пояса. Глазодвигательные мышцы остаются интактными. Иногда эта форма сопровождается патологией со стороны сердца и развитием контрактур. Повторная ритмичная стимуляция всегда выявляет декремент. Хороший эффект оказывают ингибиторы холинэстеразы. Снижение числа ацетилхолиновых рецепторов. Наиболее часто встречающийся миастенический синдром, обычно с рецессивным путем наследования. Может протекать с различной выраженностью миастенических расстройств. Легкая форма. Основной симптом — двухсторонний птоз, не достигающий, как правило, выраженной степени. Развитие ребенка соответствует возрасту. У детей старшего возраста может быть некоторая моторная неловкость, затруднен бег. Характерна повышенная чувствительность к препаратам, ухудшающим нервно- мышечную передачу (реланиум, дифенин и др.). Среднетяжелая форма. Проявляется на первом году жизни глазодвигательными нарушениями (иногда до степени офтальмопареза) и диффузной мышечной слабостью и утомляемостью, обычно нерезко выраженными. Тяжелая форма. Признаки болезни проявляются уже с момента рождения. Страдают глазодвигательные, бульбарные, дыхательные группы мышц, поражаются также мышцы конечностей и туловища. Часто бывают дыхательные нарушения. Ребенок отстает в моторном развитии. Обращают на себя внимание атрофии и гипотрофии мышц при нормальных или слегка сниженных сухожильнонадкостничных рефлексах. В дальнейшем у части детей может развиваться сколиоз.
Конгенитальный миастенический синдром, подобный синдрому Ламберта—Итона. Проявляет себя с момента рождения выраженной гипотонией, слабостью рук и ног. Характерны также бульбарные нарушения. В дальнейшем наступает задержка не только моторного, но и психического развития. Выявляется интересный электрофизиологический феномен: быстрая стимуляция вызывает повышение амплитуды М-ответа на пятый импульс (подобно миастеническому синдрому Ламберта—Итона), медленная стимуляция приводит к падению амплитуды. Использование 3,4-диаминопиридина приводит к улучшению нервно-мышечной проводимости (по данным ЭНМГ), но, к сожалению, дает лишь небольшой клинический эффект. Конгенитальная миастения с мальформациями лица. Редкий синдром, описанный у лиц еврейской национальности, проживающих на территории Ирака и Ирана. Проявляется птозом без нарушения подвижности глазных яблок, слабостью мышц лица, дизартрией, слабостью жевания. Все это сопровождается врожденными аномалиями развития лица: нижнечелюстной прогнатизм, высокое готическое небо, удлиненные размеры лицевого черепа. Течение данного синдрома стационарное и доброкачественное.
Миастенический криз. Холинергический криз
При миастении могут наступать внезапные и резкие ухудшения нервномышечной передачи с выраженной мышечной слабостью вплоть до обездвиженности. Эта так называемые кризы, обусловленные ухудшением течения миастении (тогда это называется миастенический криз) или приемом больших доз АХЭ препаратов (холинэргический криз). Иногда один криз может сочетать в себе признаки миастенического и холинэргического. Выделяют генерализованные (легкие и тяжелые) и парциальные миастенические кризы. Легкий генерализованный миастенический криз. Проявляется внезапно наступившей мышечной слабостью, не достигающей, однако, выраженной степени. Сознание сохранено, нарушения дыхательной и сердечной деятельности незначительны. Газовый состав крови не изменен. Артериальное давление стабильно. Тяжелый генерализованный миастенический криз. Характеризуется внезапной и быстрой выраженной слабостью мышц туловища и конечностей, прогрессирующими бульбарными и дыхательными нарушениями. В ряде случаев наступает угнетение сознания. При не оказанной во время помощи возможен летальный исход. Анализ причин летальных исходов при миастеническом кризе показывает определяющую роль коморбидных заболеваний: сахарный диабет, ожирение артериальная гипертензия, кардиопатология (Блинов Д.А. и др., 2012). Парциальный миастенический криз. Изолированно нарушается только дыхательная или сердечная деятельность. Протекает в виде трех вариантов.
Миастенический криз. Холинергический криз
При миастении могут наступать внезапные и резкие ухудшения нервномышечной передачи с выраженной мышечной слабостью вплоть до обездвиженности. Эта так называемые кризы, обусловленные ухудшением течения миастении (тогда это называется миастенический криз) или приемом больших доз АХЭ препаратов (холинэргический криз). Иногда один криз может сочетать в себе признаки миастенического и холинэргического. Выделяют генерализованные (легкие и тяжелые) и парциальные миастенические кризы. Легкий генерализованный миастенический криз. Проявляется внезапно наступившей мышечной слабостью, не достигающей, однако, выраженной степени. Сознание сохранено, нарушения дыхательной и сердечной деятельности незначительны. Газовый состав крови не изменен. Артериальное давление стабильно. Тяжелый генерализованный миастенический криз. Характеризуется внезапной и быстрой выраженной слабостью мышц туловища и конечностей, прогрессирующими бульбарными и дыхательными нарушениями. В ряде случаев наступает угнетение сознания. При не оказанной во время помощи возможен летальный исход. Анализ причин летальных исходов при миастеническом кризе показывает определяющую роль коморбидных заболеваний: сахарный диабет, ожирение артериальная гипертензия, кардиопатология (Блинов Д.А. и др., 2012). Парциальный миастенический криз. Изолированно нарушается только дыхательная или сердечная деятельность. Протекает в виде трех вариантов.
1. Миастенический сердечный криз. Развивается, в основном, в ночное время. Внезапно возникает тахикардия, давящее чувство в области груди. Падает артериальное давление, при дальнейшем развитии возможна остановка сердца.
2. Парциальный дыхательный криз, вызванный поражением межреберных мышц и диафрагмы. Проявляется нарастающими признаками дыхательной недостаточности вследствие слабости дыхательной мускулатуры.
3. Парциальный дыхательный криз, вызванный бульбарными нарушениями. Поражаются мышцы гортани и глотки, возникает закупорка верхних дыхательных путей слизью и слюной, сужение голосовой щели. Дыхательные нарушения при этом носят вторичный характер.
Холинэргический криз встречается значительно реже (в среднем, у 1% больных миастенией). Его развитие связано, в основном, с передозировкой ингибиторов холинэстеразы. Он тоже проявляется нарастающей мышечной слабостью, бульбарными и дыхательными нарушениями, но темп развития его медленнее по сравнению с миастеническим. В силу того, что антихолинэстеразные препараты действуют еще и на мускарин- и никотин чувствительные рецепторы, холинэргический криз имеет ряд признаков, позволяющих отличить его от миастенического: — мускариновые эффекты: схваткообразные боли в животе, усиление бронхиальной секреции, повышенное слезо- и слюнотечения, тошнота, диарея; — никотиновые эффекты: фибрилярные и фасцикулярные подергивания мышц, судороги. Все это может сопровождаться сильным психомоторным возбуждением. Кризы являются грозным и опасным осложнением миастении, их развитие может привести к смерти больного.
Диагностика
Диагностика
https://www.sciencedirect.com/science/article/abs/pii/S2387020623002942
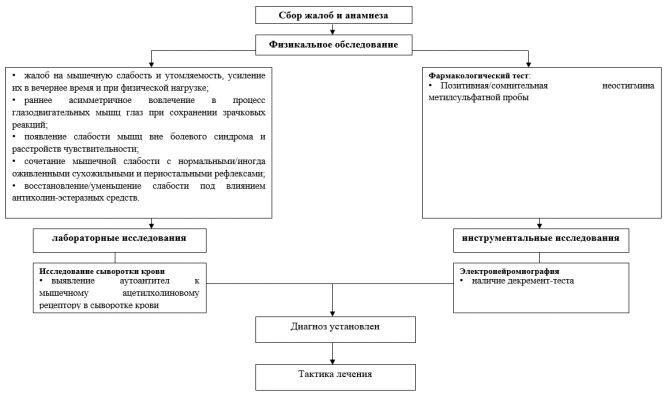
Жалобы и анамнез
-
Рекомендовано получить данные о наличии или отсутствии в ближайшем прошлом кратковременных эпизодов слабости и утомляемости, полностью или частично регрессировавших самопроизвольно или на фоне неспецифического лечения. В 90% случаев эти эпизоды связаны с вовлечением экстраокулярной мускулатуры и проявлялись диплопией и птозом век. Значительно реже это эпизоды бульбарных расстройств или слабости туловищной мускулатуры.
|
Уровень убедительности – С (уровень достоверности – 3)
|
Рекомендовано получить данные о наличие или отсутствие у родственников нервно-мышечных, аутоиммунных и онкологических заболеваний
|
|
Уровень убедительности – С (уровень достоверности – 3)
|
Рекомендовано получить данные о наличие или отсутствие признаков опухоли переднего средостения, выявленных при рентгенографии, КТ или МРТ.
|
|
Уровень убедительности – С (уровень достоверности – 3)
|
Комментарии: однако, сам факт наличия образования в средостении никоим образом не свидетельствует о наличии М и не может являться критерием диагностики
|
Физикальное обследование
-
Рекомендовано использование для оценки степени выраженности двигательных расстройств шкалу, предложенную Szobor A. (1976)
|
Уровень убедительности – A (уровень достоверности – 2а)
|
Рекомендовано для объективной оценки тяжести клинических проявлений миастении использование количественной шкалы (QMGS), предложенной Barohn R.J. et al., (1998)
|
Комментарии: удобство настоящей шкалы состоит в том, что, несмотря на значительную субъективность оценки степени снижения мышечной силы она не требует значительных временных затрат и легко воспроизводима одним и тем же исследователем при проведении функциональных (физическая нагрузка) и фармакологических (введение неостигмина метилсульфата) проб. Использование этой шкалы позволяет выявить преимущественность поражения отдельных мышечных групп у больных с различными клиническими формами миастении. К существенным недостаткам шкалы относится невозможность объективной оценки степени выраженности глазодвигательных, бульбарных и дыхательных нарушений.
Комментарии: существенным преимуществом QMGS (количественная шкала оценки тяжести миастении) является большая объективность оценки выраженности двигательных расстройств, которая не зависит от силы исследователя. Применение этой шкалы позволяет оценить важный клинический симптом – мышечную утомляемость. Безусловно, оценка слабости мимической мускулатуры и нарушений речи не лишена элементов субъективизма, тем не менее, совокупность получаемой клинической информации достаточно высока. Недостатком данной шкалы является невозможность оценки преимущественности поражения отдельных мышечных групп и значительно большее время необходимое для проведения рекомендуемых тестов.
|
Уровень убедительности – B (уровень достоверности – 3)
|
Рекомендовано применение оценочной шкалы MGFA, предложенной Barohn R.J., (1996)
|
Комментарии: Существенным достоинством MGFA (американская ассоциация по изучению миастении) является возможность анализа выраженности двигательных расстройств с оценкой преимущественности и степени вовлечения в патологический процесс экстраокулярной, бульбарной и туловищной мускулатуры. К числу недостатков наиболее целесообразно отнести отсутствие информации о степени возможной компенсации на фоне введения антихолинэстеразных препаратов. Вместе с тем следует подчеркнуть, что использование шкалы существенно облегчает формулировку диагноза. Например, Миастения (1) – Миастения, глазная форма, или Миастения (3А) – Миастения, генерализованная форма средней степени тяжести с преимущественным поражением мышц туловища и конечностей.
Лабораторная диагностика
|
Уровень убедительности – A (уровень достоверности – 1b)
|
Рекомендовано исследования сыворотки крови для определения уровня аутоантител к АХР (РИА)
|
|
Уровень убедительности – A (уровень достоверности – 2b)
|
Рекомендовано изучение уровня аутоантител к титин- белку (ИФА)
|
Комментарии: наиболее показательно у больных М сочетающейся с тимомой, у которых повышение этого показателя отмечено в 78% случаев, также как у больных с поздним началом М без тимомы (84%). У больных с ранним началом М без тимомы при длительном и тяжелом течении заболевания увеличение уровня антител к титин-белку отмечено в 41% случаев.
|
Уровень убедительности – A (уровень достоверности – 2b)
|
Рекомендовано для больных миастенией, сочетающейся с тимомой, исследование уровня антител к рианодиновым рецепторам (RyR) саркоплазматического ретикулума.
|
Комментарии: увеличение титра антител к рианодиновым рецепторам выявляется у 35% больных и свидетельствует о тяжести течения миастении.
|
Уровень убедительности – A (достоверности – 2а)
|
Рекомендовано исследование аутоантител к мышечной специфической тирозинкиназе – MusK (РИА)
|
Комментарии: исследование показательно у 40-50% больных с серонегативной миастенией
Инструментальная диагностика
|
Уровень убедительности – A (достоверности – 1а)
|
Рекомендовано исследование нервно-мышечной передачи, определяемое посредством электрофизиологического исследования изменений вызванных электрических ответов мышцы (М-ответов) при ее непрямой супрамаксимальной стимуляции различными частотами – повторная стимуляция или так называемый декремент-тест
|
Комментарии: многообразие клинических форм М и других заболеваний нервно- мышечного синапса, избирательность и неравномерность вовлечения в патологический процесс различных мышечных групп не предполагает понятия «стандартная для исследования мышца». Нельзя при «кранио-бульбарной» форме М исследовать клинически не пораженную дельтовидную мышцу, а по отсутствию нарушений нервно-мышечной передачи в круговой мышце глаза, которая относится к мимическим, а не к экстраокулярным мышцам – исключить глазную форму болезни – это приведет к диагностическим ошибкам. Между тем, точное выявление клинически пораженной мышцы и ее исследование, позволяет поставить правильный диагноз. В то же время, для объективизации нарушений нервно-мышечной передачи важно не только уметь правильно выбрать мышцу и владеть методикой ее тестирования, необходимо знать и основные электрофизиологические параметры нервно-мышечной передачи в норме и при различных формах патологии синапса.
|
Уровень убедительности – A (достоверности – 2а)
|
Рекомендовано проведение КТ переднего средостения
|
Иная диагностика
|
Уровень убедительности – A (достоверности – 1а)
|
Рекомендовано проведение пробы с введением антихолинэстеразных препаратов
|
Комментарии: неостигмина метилсульфата 1,5 мл 0,05% раствора или галантамина в дозе 10 мг вводят подкожно или при весе больного 50-60 кг, в дозе 2,0 мл или 20 мг при весе 60-80 кг соответственно и 2,5 мл или 30 мг при весе от 80 до 100 кг. У детей доза препаратов составляет 1,0 мл или 5 мг соответственно. При возникновении мускариновых эффектов антихолинэстеразных препаратов после оценки эффективности теста вводят с атропин в дозе 0,2–0,5 мл 0,1% раствора. Оценка теста проводится в интервале от 40 минут до 1,5 часов после введения препарата.
Изучение эффективности пробы с введением антихолинэстеразных препаратов показало, что полная компенсация двигательных нарушений выявляется только у 15% больных М. Необходимо обратить внимание, что полная компенсация предполагает восстановление силы мышцы до нормальных значений (5 баллов), независимо от степени ее исходного снижения. У большинства больных М (75%), реакция на введение неостигмина метилсульфата была неполной, т.е. сопровождалась увеличением силы мышцы на 2-3 балла, но не достигала 5 баллов. Частичная компенсация характеризовалась увеличением силы на 1 балл в отдельных мышцах, тогда как в других тестируемых мышцах не изменялась.
При проведении и оценке фармакологического теста решающее значение имеет доза вводимого препарата, поскольку только при введении адекватных доз правомочна та или иная оценка эффективности пробы.
В основе оценки лежит изменение выраженности клинических симптомов. При полной и неполной компенсации двигательных нарушений проба оценивается как позитивная. При частичной компенсации – сомнительная, при отсутствии – негативная.
Важно подчеркнуть то обстоятельство, что фармакологический тест с введением антихолинэстеразных препаратов является одним из наиболее значимых критериев диагностики М.
Диагностика острых состояний (кризов) при миастении
-
отдельные периоды течения М могут возникать внезапные нарушения витальных функций, называемые "кризами". Эти состояния наблюдаются у 10-15% больных миастенией. Различают миастенический и холинергический кризы. Имеющиеся диагностические трудности их дифференциации обусловлены тем обстоятельством, что чаще всего они развиваются параллельно в виде смешанного криза. Несмотря на сходство клинической картины миастенического и холинергического кризов, патогенетические механизмы их развития отличаются и соответственно, лечение этих состояний требует разных подходов.
Дифференциация кризов при М базируется на оценке эффективности пробы с введением адекватной дозы неостигмина метилсульфата:
-
При миастеническом кризе проба позитивная, причем полная компенсация двигательного дефекта по нашим данным отмечается у 12%, а неполная - у 88% больных.
-
При холинергическом кризе проба негативная, однако, у 13% больных может наблюдаться частичная компенсация.
-
Наиболее часто (в 80% случаев) частичная компенсация наблюдается при смешанном характере криза, а в 20% случаев отмечается неполная компенсация.
Дифференциальный диагноз
Дифференциальная диагностика
Теоретически дифференциальный диагноз М очень сложен, поскольку существует много заболеваний, при которых может иметь место поражение мышц иннервируемых черепными нервами, а также слабость мышц туловища и конечностей. С другой стороны, клиническая дифференциация М не вызывает трудностей, поскольку для подтверждения диагноза существуют фармакологический, электрофизиологический и иммунологический критерии.
Наиболее часто ошибочная постановка диагноза М связана с наличием птоза и различной степенью выраженности глазодвигательных расстройств. Следует отметить, что постановка диагноза глазной формы М вызывает наибольшие трудности. Это связано с тем, что клинические проявления нарушения функции экстраокулярной мускулатуры могут быть выражены минимально, реакция на введение неостигмина метилсульфата недостаточной, патологии нервно-мышечной передачи при исследовании не экстраокулярных, а анатомически наиболее близких мимических мышц не выявляется, а антитела альфа субъединице АХР могут выявляться только в 30- 50% случаев. В ряду дифференциальной диагностики могут быть следующие болезни, проявляющиеся поражением экстраокулярной мускулатуры: эндокринная офтальмопатия, совокупность синдромов, определяемых как «офтальмоплегия плюс», окулофарингеальная мышечная дистрофия, рассеянный склероз, синдром Фишера и др.
Бульбарные проявления М следует дифференцировать с сосудистыми и опухолевыми поражениями мозга, где главным отличием является выраженность общемозговых симптомов, а также отсутствие динамичности симптомов и реакции на введение антихолинэстеразных препаратов.
Иногда значительные трудности дифференциации может представлять боковой амиотрофический склероз (БАС) в некоторых случаях которого могут отмечаться не только большинство клинических симптомов М, но и наличие нарушений нервно- мышечной передачи и реакции на введение антихолинэстеразных препаратов. В таких случаях только ЭМГ исследование позволяет выявить признаки денервации и реиннервации, а также наличие большого числа потенциалов фасцикуляций, характерных для БАС.
Дыхательные расстройства и кризы при М следует дифференцировать с острыми демиелинизирующими невропатиями типа Гийена-Барре, при которых имеет место арефлексия, нарушение состава спинномозговой жидкости, отсутствие нарушений нервно- мышечной передачи и реакции на введение антихолинэстеразных препаратов.
Слабость мышц туловища и конечностей у больных М дифференцируют с различными формами врожденных и приобретенных миопатий. Миопатический процесс, как правило, характеризуется иным, отличным от миастении, характером распределения двигательных расстройств: отсутствием (за редким исключением) признаков поражения экстраокулярной и бульбарной мускулатуры, дыхательных нарушений; чаще сопровождается снижением или отсутствием сухожильных рефлексов, наличием различной степени выраженности мышечных атрофий.
Клинические симптомы, напоминающие М, могут встречаться и при других формах нарушения нервно-мышечной передачи, таких как синдром Ламберта-Итона и ботулизм. Причем если для синдрома Ламберта-Итона не типичны эктраокулярные, бульбарные и дыхательные нарушения, то именно они составляют основное клиническое ядро ботулизма. Характерные для синдрома Ламберта-Итона слабость и утомляемость мышц туловища и конечностей при ботулизме выявляются относительно редко. Для обеих форм характерна гипо- или арефлексия. Эффект от введения антихолинэстеразных препаратов при синдроме Ламберта-Итона – минимальный, при ботулизме – отсутствует. Нарушения нервно-мышечной передачи характеризуются снижением исходной амплитуды М-ответа и ее существенным увеличением в процессе высокочастотной стимуляции (инкремент) или после максимального произвольного усилия.
Бульбарные проявления М следует дифференцировать с сосудистыми и опухолевыми поражениями мозга, где главным отличием является выраженность общемозговых симптомов, а также отсутствие динамичности симптомов и реакции на введение антихолинэстеразных препаратов.
Иногда значительные трудности дифференциации может представлять боковой амиотрофический склероз (БАС) в некоторых случаях которого могут отмечаться не только большинство клинических симптомов М, но и наличие нарушений нервно- мышечной передачи и реакции на введение антихолинэстеразных препаратов. В таких случаях только ЭМГ исследование позволяет выявить признаки денервации и реиннервации, а также наличие большого числа потенциалов фасцикуляций, характерных для БАС.
Дыхательные расстройства и кризы при М следует дифференцировать с острыми демиелинизирующими невропатиями типа Гийена-Барре, при которых имеет место арефлексия, нарушение состава спинномозговой жидкости, отсутствие нарушений нервно- мышечной передачи и реакции на введение антихолинэстеразных препаратов.
Слабость мышц туловища и конечностей у больных М дифференцируют с различными формами врожденных и приобретенных миопатий. Миопатический процесс, как правило, характеризуется иным, отличным от миастении, характером распределения двигательных расстройств: отсутствием (за редким исключением) признаков поражения экстраокулярной и бульбарной мускулатуры, дыхательных нарушений; чаще сопровождается снижением или отсутствием сухожильных рефлексов, наличием различной степени выраженности мышечных атрофий.
Клинические симптомы, напоминающие М, могут встречаться и при других формах нарушения нервно-мышечной передачи, таких как синдром Ламберта-Итона и ботулизм. Причем если для синдрома Ламберта-Итона не типичны эктраокулярные, бульбарные и дыхательные нарушения, то именно они составляют основное клиническое ядро ботулизма. Характерные для синдрома Ламберта-Итона слабость и утомляемость мышц туловища и конечностей при ботулизме выявляются относительно редко. Для обеих форм характерна гипо- или арефлексия. Эффект от введения антихолинэстеразных препаратов при синдроме Ламберта-Итона – минимальный, при ботулизме – отсутствует. Нарушения нервно-мышечной передачи характеризуются снижением исходной амплитуды М-ответа и ее существенным увеличением в процессе высокочастотной стимуляции (инкремент) или после максимального произвольного усилия.
Таким образом, главным и основным отличием, при дифференциации всех клинических проявлений М от других форм патологии, является отсутствие динамичности симптомов и реакции на введение антихолинэстеразных препаратов.
Клиническое обследование должно выявить главный признак заболевания — патологическую утомляемость мышц, нарастающую во второй половине дня.
Для подтверждения диагноза используют миастенические пробы, фармакологические тесты, электромиографию, сцинтиграфию вилочковой железы.
Миастенические пробы
Окулопальпебральный симптом Лобзина В.С.: пациент следит за движениями неврологического молоточка и при этом с одной или с обеих сторон начинают опускаться веки.
Феномен Мэри Уокер при генерализованной миастении: пациент вытягивает руки вперед и сжимает пальцы в кулаки, отмечается развитие одностороннего или двустороннего птоза. Можно попросить ребенка моргать с усилием или пристально смотреть на точку, поднятую выше уровня глаз. Это способствует выявлению патологической утомляемости глазных мышц. Для оценки состояния мышц конечностей ребенку следует сжимать и разжимать кисти рук, приседать без помощи рук. Быстрое нарастание слабости конечностей на 2 и более баллов расценивается как положительная проба на миастению. В тех случаях, когда ребенок не может четко сформулировать свои жалобы (двоение, усиление патологической утомляемости мышц после физической нагрузки и др.), не умеет читать или еще не разговаривает, учитываются данные возможной повышенной утомляемости на основании рассказов родственников и людей, имеющих постоянный или длительный контакт с этими детьми.
Механические тесты, направленные на выявление патологической мышечной слабости у детей младшего возраста: — проба на двоение: ребенка с предполагаемым двоением просят взять игрушку. Затем просят рассматривать цветные картинки, находящиеся вблизи и вдалеке от него. Через некоторое время вновь предлагают взять игрушку. При возникновении (усилении) двоения, ребенок не может сразу взять ее (промахивается); — проба на отнимание игрушки: попытка забрать у ребенка прижатую к груди игрушку вызывает его сопротивление. Резкое уменьшение мышечного сопротивления при третьей- четвертой попытке расценивается как повышенная утомляемость мышц рук.
Фармакологические тесты: Пробы с антихолинэстеразными препаратами. Ингибируя холинэстеразу, они увеличивают количество ацетилхолина в синаптической щели, что приводит к возбуждению большего количества постсинаптических рецепторов и облегчает передачу нервного импульса. Используются для этого ингибиторы холинэстеразы короткого действия (прозерин). Прозериновая проба с оценкой силы и утомляемости пораженных мышц проводится до и спустя 30 минут после подкожного введения 0,05% раствора прозерина в разовой возрастной дозировке (табл. 4.2). Таблица 4.2. Дозировка прозерина для проведения миастенического теста (Шалькевич Л.В., 2007) Возраст Доза 0,05% р-ра прозерина
Новорожденные и дети грудного возраста 0,018 мл/кг
1–5 лет 0,016 мл/кг
6–10 лет 0,014 мл/кг
11–14 лет 0,012 мл/кг
взрослые 1,5–2 мл
Оценка результатов пробы:
- резко положительная (++++) — исчезают все миастенические симптомы;
- положительная проба (+++) — остаются только отдельные симптомы;
- слабоположительная проба (++) — уменьшается выраженность миастенических симптомов;
- сомнительная прозериновая проба (+) — степень выраженности проявлений миастении изменяется незначительно;
- отрицательная прозериновая проба — клиническая симптоматика не изменяется после введения прозерина.
1, 2 ,3 результаты — подтверждают диагноз миастении
Электрофизиологические исследования. Электрофизиологические исследования при миастении проводятся с целью выявления феномена «миастенической реакции», заключающейся в прогрессирующем снижении амплитуды мышечного сокращения при стимуляции нерва. В настоящее время у детей используют глобальную электромиографию, согласно которой после физической нагрузки отмечается значительное снижение амплитуды, уменьшение времени электроактивности, снижение частоты токов действия. Для уточнения характера патологии тимуса у больных миастенией изучают не только функциональную активность тимуса, но и проводят томографию переднего средостения, пневмомедиастинографию, компьютерную томографию грудной клетки. Известно, что у 8–15% больных миастенией диагностируют опухоль тимуса — тимому, характеризующуюся быстрым развитием заболевания с преимущественным поражением мышц, осуществляющих акт глотания, мимических мышц. Наряду с оценкой иммунного статуса, определяют показатели антител к АХР, которые у большинства больных повышены. Клиническое значение имеет определение антител не только к взрослому типу АХР, но и к фетальному P (Shi Q. еt al., 2012). При локализованных формах миастении эти показатели и электрофизиологически данные могут быть не изменены, поэтому дифференциальный диагноз локализованных форм миастении достаточно сложен.
Диагностический алгоритм:

Лечение
Лечение
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6690491/
Препараты (действующие вещества), применяющиеся при лечении
|
Азатиоприн (Azathioprine)
|
|
Атропин (Atropine)
|
|
Галантамин (Galantamine)
|
|
Декстроза (Dextrose)
|
|
Иммуноглобулин человеческий нормальный (Human normal immunoglobulin)
|
|
Калия хлорид (Potassium chloride)
|
|
Микофеноловая кислота (Микофенолата мофетил) (Mycophenolic acid (Mycophenolate mofetil))
|
|
Неостигмина метилсульфат (Neostigmine methylsulfate)
|
|
Оротовая кислота (Orotic acid)
|
|
Пиридостигмина бромид (Pyridostigmine)
|
|
Преднизолон (Prednisolone)
|
|
Спиронолактон (Spironolactone)
|
|
Циклоспорин (Cyclosporine)
|
|
Циклофосфамид (Cyclophosphamide)
|
Лечение (амбулатория)
Лечение (амбулатория)
https://npcpn.ru/doc/2024/Klinicheskie_rekomendatsii_miastenia_2024.pdf
Лечение на амбулаторном уровне
Тактика лечения:
Тактика лечения миастении определяются такими направлениями:
- компенсация нервно-мышечной передачи (препараты калия, систематический прием антихолинэстеразных препаратов);
- коррекция аутоиммунных нарушений (глюкокортикоидных препаратов, цитостатиков и плазмафереза);
- влияние на вилочковую железу.
Немедикаментозное лечение:
Режим:
- противопоказаны чрезмерные физические нагрузки, инсоляции.
Диета:
- Диетический стол №10 по Певзнеру, режим питания: 4-5 раз в день; срок назначения: пожизненно.
Медикаментозное лечение:
В основу стратегии лекарственной терапии миастении положены следующие принципы:
- этапность лечебных мероприятий;
- сочетания компенсирующей, патогенетической и неспецифической терапии. Учёт фазы течения заболевания (хроническая/острая (кризы)).
NB! Противопоказаны лекарственные препараты, содержащие магний/хинин; нельзя употреблять миорелаксанты, транквилизаторы, нейролептики, мочегонные препараты, аминогликозиды, фторхинолины, тетрациклин.
Первый этап
Компенсирующая терапия предполагает назначение следующих препаратов:
Антихолинэстеразные средства (отличаются они в основном длительностью действия).
Антихолинэстеразные средства (отличаются они в основном длительностью действия).
|
Препарат и его синонимы
|
Лекарственная форма
|
Начало дейтсвия, минуты
|
Продолжительность действия, часы
|
|
Неостигмина метилсульфат
|
Таблетки по 15мг, 0,05% раствор по 1мл (0,5мг) в ампулах
|
20-40 |
2-4 |
|
Пиридостигмина бромид
|
Таблетки по 60мг, 0, 5% раствор по 1мл (5мг) в ампулах
|
60
|
4-6
|
| Галантамина гидрохлорид | Растворы 0,1%, 0,25%:, 0,5% по 1мл в ампулах | 60 | 8-12 |
Иньекционная форма неостигмина метилсульфат используется для оказания быстрого действия. Принцип дозирования – следующая доза принимается за 30 минут до окончания действия предыдущей. При переводе больных на парентеральное введение препаратов учитывается, что 1 таблетка пиридостигмина бромида (60 мг) равноценна 1 мл 0,05% раствора неостигмина метилсульфат. В некоторых ситуациях (mensis, инфекции, ремиссия) – чувствительность к АХЭ препаратам повышается. В этом случае доза препаратов уменьшается. Больных нужно обучать коррегировать дозу индивидуально в зависимости от течения болезни.
Уровень убедительности рекомендации В (Уровень достоверности доказательств - 1).
Комментарий: начальная доза пиридостигмина бромида 30 мг до 4 раз в сутки на протяжении 2-4 дней. При нормальной переносимости и отсутствии побочных явлений разовую дозу увеличивают до 60 мг с кратностью приема до 4 раз в сутки на протяжение 5 дней. При необходимости можно увеличивать разовую дозу до 90 мг – до 4 приемов в сутки. Разовая доза пиридостигмина бромида при необходимости может быть увеличена до 120 мг, но при этом увеличивается риск развития побочных эффектов. Передозировка АХЭП может привести к снижению эффективности препарата и ухудшению течения миастении вплоть до развития холинергического криза, поэтому подбирая режим приема АХЭП следует регулярно мониторить М- и Н-холинергические побочные эффекты (дискомфорт и боли в живот, диарея, ринорея, бронхорея, снижение АД, мышечные подергивания, крампи и др.) и при их появлении и, тем более, нарастании - своевременно корректировать терапию, уменьшая дозировку или кратность приемов. Оптимальной является доза, обеспечивающая баланс между отчетливым клиническим улучшением и минимальными холинергическими эффектами.
Относительные противопоказания к применению АХЭП:
Относительные противопоказания к применению АХЭП:
- бронхиальная астма;
- тяжелый атеросклероз;
- ИБС, стенокардия;
- эпилепсия.
Препараты калия. Препараты калия улучшают синтез ацетилхолина и синаптическую передачу, пролонгируют действие АХЭП. Они показаны на всех этапах лечения. У больных с локальными формами заболевания и при стабильной длительной ремиссии их применяют в виде монотерапии, в других случаях – в составе комбинированного лечения. Назначают калия оротат (после регистрации в РК) в таблетках по 0,5 г 3 раза в сут; калия хлорид в порошке или таблетках по 0,5 – 1 г или 1 г или по 50 мл 4% раствора (10 мл 10% раствора) внутрь 2–3 раза в сут.
Противопоказания для использования больших доз калия - полная поперечная блокада проводящей системы сердца, нарушение выделительной функции почек. Калийсберегающие диуретики. Применяют, в частности, спиронолактон в таблетках по 25 мг 3—4 раза в день.
Спиронолактон противопоказан при мастопатии, гинекомастии, беременности, атриовентиркулярной блокаде и почечной недостаточности.
Второй этап
Лечение глюкокортикоидами назначается:
- при недостаточной эффективности препаратов, используемых на первом этапе;
- для создания своеобразного запаса прочности в компенсации миастенических расстройств перед подготовкой к операции (тимэктомии);
- больным миастенией с витальными нарушениями;
- при дебюте заболевания с бульбарных нарушений.
Применяемые чаще схемы – прием ГКС ежедневно или через день. Дозу преднизолона (метилпреднизолона) подбирают индивидуально, ориентируясь на тяжесть состояния больного. В среднем она составляет 1 мг/кг/сут., но не менее 50 мг. Преднизолон 1 таблетка – 5 мг. При выраженном обострении назначают 60-150 мг/сутки утром ежедневно, через 5-7 дней (до терапевтического эффекта) переходят на схему через день. С больших доз следует уходить быстро. Эффект оценивают через 6-8 приёмов. В первые несколько дней некоторые пациенты могут отмечать эпизоды ухудшения состояния в виде нарастания мышечной слабости и утомляемости. Возможно, эти эпизоды связаны с прямым действием глюкокортикоидов на процессы освобождения синаптического медиатора и десенситизацией рецепторов. Это обстоятельство обусловливает необходимость временного уменьшения дозы антихолинэстеразных препаратов. По мере достижения эффекта и улучшения состояния больных дозу преднизолона постепенно уменьшают до поддерживающей. Длительно применяется поддерживающая доза через день 20-30 мг в сутки, возможно в течение нескольких месяцев или даже лет. При ухудшении состояния доза может быть увеличена. Используется так же ступенчатая схема приема ГКС. В разработанной схеме предлагается увеличение начальной дозы препарата до 25-30 мг в один прием утром. Каждый последующий прием гормонов увеличивается на 25-30 мг до достижения максимальной дозы 100 мг.
Уровень убедительности рекомендации В (Уровень достоверности доказательств - 1).
Третий этап
Третий этап
При недостаточной эффективности глюкокортикоидов/развитии выраженных побочных эффектов целесообразно назначение цитостатических препаратов.
- Азатиоприн можно использовать в качестве монотерапии/в сочетании с глюкокортикоидами, если они не оказывают достаточного эффекта/если из-за побочных эффектов необходимо снижение их дозы. Азатиоприн назначают перорально ежедневно по 50 мг/cyт с последующим увеличением дозы до 150-200 мг/cyт.
Уровень убедительности рекомендации C. (Уровень достоверности доказательств - 3).
- Микофенолата мофетил назначают в дополнение к глюкокортикоидам в случаях, когда необходимо снижение их дозы. Микофенолата мофетил назначают перорально ежедневно по 2 г/cyт с последующей коррекцией дозы в зависимости от эффективности лечения.
Уровень убедительности рекомендации С (Уровень достоверности доказательств - 4).
- Циклоспорин успешно применяют при лечении тяжёлых форм миастении в случаях резистентности к другим препаратам. Препарат назначают перорально в дозе 3 мг/кг. При отсутствии токсических реакций дозу можно увеличить до 5 мг/кг 2 раза в день. После достижения стойкого терапевтического эффекта дозу циклоспорина можно снизить до минимальной поддерживающей.
Уровень убедительности рекомендации С (Уровень достоверности доказательств - 4).
- Циклофосфамид используют при отсутствии эффекта от других иммунодепрессантов как в виде монотерапии, так и в сочетании с азатиоприном. Препарат вводят внутримышечно ежедневно в дозе 200 мг/через день в дозе 400 мг. Терапию начинают в условиях стационара, и только убедившись в хорошей переносимости препарата, можно переводить больных на амбулаторное лечение.
NB! Следует отметить, что беременность не является противопоказанием к назначению основных препаратов лечения миастении. На время беременности желательно воздержаться от поддерживающей гормональной терапии, сеансов плазмафереза, использования больших доз калийсодержащих препаратов. Также следует строго придерживаться особых подходов терапии других заболеваний. Существует перечень препаратов, которые нельзя использовать при миастении.
Применение лекарств при миастении
|
Группа лекарственных препаратов
|
Препараты, усиливающие мышечную слабость
|
Безопасные препараты
|
|
Антибактериальные препараты |
Стрептомицин, гентамицин и др., аминогликозиды, полимиксин В, колистин, тетрациклин, линкомицин, клиндамицин, пенициллин, ампициллин, ципрфлоксацин, сульфаниламиды
|
Цефалоспорины, хлорамфеникол, рифампицин, нитрофураны, налидиксовая к-та, изониазид
|
|
Антиэпилептические препараты
|
Триметин, дифенин, барбитураты, карбамазепин, бензодиазепины в высокой дозе
|
Препараты вальпроевой к- ты, примидон*
|
|
Гормональные препараты |
Кортикостероиды, препараты АКТГ, оральные контрацептивы, окситоцин, гормоны щитовидной железы
|
– |
|
Кардиологические препараты |
В-блокаторы, хинидин, лидокаин, новокаинамид, антагонисты кальция, ганглиоблокаторы, гуанетедин
|
Дигоксин, метилдопа, спиронолактон, триамтерен
|
|
Анальгетики, противовоспалительные препараты
|
Производные морфина, хинин, хлорохин, D-пеницилламин,
|
Ацетилсалициловая к-та, НПВП, соли золота
|
|
Другие препараты |
Миорелаксанты, соли магния, йосодержащие контрастирующие средства, анатациды, слабительные, в/в токолитики
|
|
Алгоритм действий при неотложных ситуациях:
Кризы при миастении:
- миастенические
- холинергические
- смешанные.
Характеристика симптомов при миастеническом и холинергическом кризах
|
Симптомы
|
При миастеническом кризе
|
При холинергическом кризе
|
|
Величина зрачков
|
широкие
|
узкие; парез аккомодации
|
|
Пульс
|
тахикардия
|
брадикардия
|
|
Артериальное давление
|
Нормально или нерезко снижено
|
быстро резко снижается
|
|
Мышечные фасцикуляции
|
не характерны
|
резко выражены
|
|
Боли в животе; бурная перистальтика кишечника; понос; рвота
|
не наблюдаются
|
резко выражены
|
|
Одышка, афония, невозможность отхаркивания содержимого ротоглотки
|
очень характерны
|
не характерны
|
Важнейший метод дифференциации кризов при миастении - оценка эффективности пробы с введением адекватной дозы антихолинэстеразного препарата:
- при миастеническом кризе проба позитивная;
- при холинергическом кризе проба негативная, возможна частичная компенсация;
- при смешанном характере криза наиболее часто отмечают частичную/ неполную компенсацию.
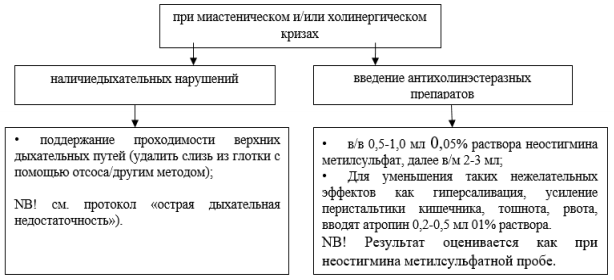
Алгоритм действий при миастеническом и/или холинергическом кризах
Другие виды лечения:
При хорошей эффективности препаратов первого этапа, но сохраняющихся лёгких бульбарных нарушениях на фоне отмены пиридостигмина бромида показано проведение тимэктомии.
Показания к тимэктомии у взрослых:
- опухоль вилочковой железы (тимома);
- вовлечение в процесс краниобульбарной мускулатуры;
- прогрессирующее течение миастении.
Показания к тимэктомии у детей:
- генерализованная форма миастении;
- прогрессирование заболевания при плохой лекарственной компенсации нарушенных функций.
Противопоказания к тимэктомии:
- тяжёлые соматические заболевания;
- острая фаза миастении (выраженные некомпенсированные бульбарные нарушения, а также нахождение больного в кризе);
- пациенты длительно страдающих миастенией при стабильном её течении, а также при локальной глазной форме миастении.
NB! Результатом операции могут стать полное клиническое выздоровление (эффект А), стойкая ремиссия при значительном уменьшении дозы антихолинэстеразных препаратов (эффект В), значительное улучшение состояния на фоне сохранения потребности в антихолинэстеразных препаратах (эффект С), отсутствие улучшения (эффект D).
Показания для консультации специалистов:
- консультация торакального хирурга – установление/исключения объемного образования средостения (тимома);
- консультация терапевта – установление/исключение терапевтического заболевания, онкопатологии внутренних органов (артериальная гипертензия, злокачественное новообразование, пневмония);
- консультация эндокринолога – установление/исключение заболевания щитовидной железы;
- консультация онколога – установления онкологического заболевания, проявлении паранеопластического синдрома.
- консультация офтальмолога – осмотр глазного дна для исключения патологии глаза, признаков внутричерепной гипертензии, застоя дисков зрительных нервов.
Индикаторы эффективности лечения:
- стойкая/частичная ремиссия на фоне приема медикаментозных средств/без них у больных миастенией.
Лечение (скорая помощь)
Лечение (скорая помощь)
Лечение на этапе скорой неотложной помощи
Медикаментозное лечение
Алгоритм экстренных мероприятий при любом варианте кризов:
- купирование нарушений дыхания: санация ротоглотки и трахеобронхиального дерева во избежание аспирационного трахеобронхита и пневмонии;
- интубация трахеи или перевод на ИВЛ — в зависимости от степени тяжести состояния больного.
- назначение антибактериальной терапии (класс цефалоспоринов) с учетом высокого риска возникновения аспирационной пневмонии.
- адекватное энтеральное или — при бульбарных нарушениях — парентеральное питание.
Алгоритм экстренных мероприятий при миастеническом кризе:
- неостигмина метилсульфат в/в по 1–2 мл 0,05% раствора; при необходимости 2–3 раза в сутки.
- иммуноглобулин в/в в суточной дозе 400 мг.
- при неэффективности перечисленных мероприятий дополнительно назначается преднизолон в суточной дозе 100 мг.
- для купирования возбуждения — в/в или в/м 1 мл 0,5% раствора галоперидола (до 20 мг/сут).
Алгоритм экстренных мероприятий при холинергическом кризе:
- немедленная отмена антихолинэстеразных препаратов.
- внутримышечное или подкожное – в зависимости от тяжести состояния больного – введение 0,5–1,0 мл 0,1% раствора атропина. Инъекции могут при необходимости повторяться с интервалом в 1–2 ч до появления сухости во рту.
Лечение (стационар)
Лечение (стационар)
Лечение на стационарном уровне
Тактика лечения:
На стационарном этапе в карте наблюдения за пациентом (история болезни) ежедневно отмечаются показатели гемодинамики (А/Д, пульс, ЧСС), оценивается дыхание и ЧДД, в неврологическом статусе определяется динамика синдрома патологической мышечной утомляемости, отмечается проводимая коррекция и переносимость медикаментозной терапии, уровень компенсации мышечной слабости после приема антихолинэстезаного препарата.
На стационарном этапе в карте наблюдения за пациентом (история болезни) ежедневно отмечаются показатели гемодинамики (А/Д, пульс, ЧСС), оценивается дыхание и ЧДД, в неврологическом статусе определяется динамика синдрома патологической мышечной утомляемости, отмечается проводимая коррекция и переносимость медикаментозной терапии, уровень компенсации мышечной слабости после приема антихолинэстезаного препарата.
Немедикаментозное лечение:
Режим:
- противопоказаны чрезмерные физические нагрузки, инсоляции.
Диета:
- Диетический стол №10 по Певзнеру, режим питания: 4-5 раз в день; срок назначения: пожизненно.
Искусственная вентиляция лёгких
В качестве первого мероприятия предполагает необходимость адекватного дыхания с помощью принудительной ИВЛ.
Показания к переводу на ИВЛ:
Показания к переводу на ИВЛ:
- нарушение ритма дыхания;
- цианоз;
- возбуждение;
- потеря сознания;
- участие вспомогательной мускулатуры;
-
изменение величины зрачков отсутствие реакции на введение АХЭ препаратов.
Перевод пациента на самостоятельное дыхание после ИВЛ:
- отсутствия цианоза;
- тахипноэ;
- тахикардии;
- сохранности мышечного тонуса;
- достаточного дыхательного объёма (>300 мл), p.Oz более 80 мм рт.ст. при дыхании смесью с 50% кислорода;
- способности больного создать разрежение вдоха не менее 20 см вод.ст., полного восстановления сознания.
NB! В период проведения искусственной вентиляции полностью исключается введение антихолинэстеразных препаратов, проводится интенсивное лечение интеркуррентных заболеваний и патогенетическое лечение миастении.
NB! Введение АХЭП и использование ИВЛ одновременно недопустимо.
NB! Через 16-24 часа после начала ИВЛ, при условии ликвидации клинических черт холинергического или смешанного кризов, следует провести пробу с введением АХЭП (неостигмина метилсульфат) с учетом начала действия препарата и отключить от аппарата ИВЛ (не экстубируя!), затем оценить эффективность самостоятельного дыхания. Если в течение 1,5-2 часов больной самостоятельно дышит, процедуру повторить в течение суток 3-4 раза с АХЭП. В случае положительного результата больного экстубируют. Убедившись в возможности адекватного дыхания, перевести больного на прием пероральных антихолинэстеразных препаратов.
Если функция дыхания остается недостаточной и эффект от введения АХЭП непродолжительный, больного подключают к аппарату ИВЛ. До следующих суток неостигмина метилсульфат не вводить! Вышеуказанные действия повторить на следующие сутки. Если в течение 3-4 суток не наблюдается положительного эффекта (самостоятельное дыхание) больному необходимо наложить трахеостому для исключения пролежня трахеи. По мере восстановления жизненно важных функций дыхания и глотания больного отключают от аппарата ИВЛ и назначают прием АХЭП.
Медикаментозное лечение:
Лечение миастенических кризов должно быть направлено на компенсацию нарушений нервно-мышечной передачи и коррекцию иммунных расстройств.
Иммуноглобулины G:
-
общепринятым режимом терапии считают короткие 5-дневные курсы внутривенного введения препарата Человеческий Ig в доза 400 мг/кг ежедневно. В среднем клинический эффект отмечается на 4 день терапии и продолжается в течение 50-100 дней.
Антихолинэстеразные препараты:
- чаще применяют парентеральное введение. Применение АХЭп в количестве диагностической пробы показаны при любой форме криза (наиболее эффективно их введение при миастеническом кризе). Неостигмина метилсульфат вводится п/к от 1,5 до 2,5 мл, для уменьшения нежелательных эффектов вводят атропин 0,2-0,5 мл 01% раствора. Результат оценивается как при неостигмина метилсульфатной пробе.
При назначении антихолинэстеразных препаратов должен соблюдаться определенный временной режим: применение каждой последующей дозы не чаще, чем через 3-4 часа для неостигмина метилсульфат и 5-6 часов для пиридостигмина бромида, в связи с опасностью возникновения холинергической интоксикации. В период максимальной выраженности клинических симптомов криза целесообразно парентеральное введение антихолинэстеразных препаратов. Препарат вводят под кожу, а при остановке дыхания внутривенно в дозе 20 мг при весе больного до 80 кг, в дозе 30 мг при весе более 80 кг. Для уменьшения нежелательных мускариновых эффектов антихолинэстеразных препаратов их вводят с атропином в виде 0,2 – 0,5 мл 0,1% раствора.
Своевременно и в правильной дозировке произведенное введение антихолинэстеразных препаратов, как правило, помогает восстановлению функции дыхания и бульбарной мускулатуры. По мере достижения стабильного клинического эффекта, восстановления жизненно важных функций дыхания и глотания, вместо парентерального введения назначается прием препаратов внутрь. Для определения времени приема последующих доз пероральных препаратов следует ориентироваться на длительность и эффективность действия применяемой дозы. Вместе с тем необходимо помнить, что в различных состояниях длительность и эффективность действия каждого препарата может меняться.
Нейромидин (ипидакрин):
Препарат из группы антихолинэстеразных средств, способствующий улучшению нервно- мышечной передачи. Применяется для усиления эффекта антихолинэстеразных препаратов и улучшения общей мышечной активности. Назначается в дозировке 10-20 мг 2-3 раза в сутки. Вводится внутримышечно или перорально, в зависимости от клинического состояния пациента и переносимости терапии.
Уровень убедительности рекомендации С (Уровень достоверности доказательств – 2b).
Медиаторн (прозерин):
Антихолинэстеразное средство, используемое для улучшения передачи нервных импульсов при миастении. Эффективен при любых формах миастенического криза. Вводится подкожно или внутримышечно в дозировке 1-2 мл 0,05% раствора 1-2 раза в сутки. Препарат требует соблюдения точных интервалов между введениями для предотвращения холинергической интоксикации.
Уровень убедительности рекомендации B (Уровень достоверности доказательств – 1b).
Семакс:
Ноотропное средство с выраженным нейропротекторным эффектом, улучшающее когнитивные функции и устойчивость нервной системы. Применяется интраназально по 1- 2 капли 0,1% раствора 2-3 раза в сутки. Используется в комплексе с основной терапией для повышения эффективности лечения миастении.
Уровень убедительности рекомендации С (Уровень достоверности доказательств – 3).
Церебролизин:
Препарат с выраженным нейротрофическим и нейропротекторным действием, способствующий улучшению метаболических процессов в головном мозге. Церебролизин оказывает положительное влияние на нейрональные функции, улучшает когнитивные способности и поддерживает нейропластичность. Препарат вводится внутривенно, в дозировке 10-30 мл (в зависимости от тяжести состояния пациента), курсом 10-20 дней. Рекомендуется к применению при выраженных когнитивных нарушениях и нейродегенеративных заболеваниях, а также в качестве вспомогательного средства в комплексной терапии миастении.
Уровень убедительности рекомендации С (Уровень достоверности доказательств – 3).
Цитофлавин:
Комплексный метаболический препарат, оказывающий антиоксидантное, нейропротекторное и ангиопротекторное действие. Цитофлавин улучшает энергообеспечение клеток головного мозга, повышает их устойчивость к гипоксии и улучшает мозговое кровообращение. Препарат вводится внутривенно капельно по 10 мл на 200 мл 5% раствора глюкозы или физиологического раствора, курс лечения составляет 10 дней. Применяется в комплексной терапии для восстановления когнитивных функций и улучшения нейронального метаболизма при миастении и других неврологических нарушениях.
Уровень убедительности рекомендации С (Уровень достоверности доказательств – 3).
Пирацетам:
Ноотропное средство, оказывающее положительное влияние на метаболические процессы в головном мозге. Пирацетам улучшает микроциркуляцию, повышает устойчивость нервных клеток к гипоксии и оказывает антиагрегантное действие. Препарат применяется внутрь в дозировке 1,2-4,8 г в сутки, разделённой на 2-3 приёма, или внутривенно капельно в дозе 4-8 г в сутки в острых состояниях. Применение Пирацетама в комплексной терапии миастении способствует улучшению когнитивных функций и восстановлению нейрональной активности.
Ноотропное средство, оказывающее положительное влияние на метаболические процессы в головном мозге. Пирацетам улучшает микроциркуляцию, повышает устойчивость нервных клеток к гипоксии и оказывает антиагрегантное действие. Препарат применяется внутрь в дозировке 1,2-4,8 г в сутки, разделённой на 2-3 приёма, или внутривенно капельно в дозе 4-8 г в сутки в острых состояниях. Применение Пирацетама в комплексной терапии миастении способствует улучшению когнитивных функций и восстановлению нейрональной активности.
Уровень убедительности рекомендации С (Уровень достоверности доказательств – 2b).
Цитиколин является нейропротектором с положительным влиянием на церебральный метаболизм, что может быть полезно при лечении неврологических осложнений миастении гравис. Препарат способствует восстановлению поврежденных мембран клеток, ингибирует действие фосфолипаз, препятствует избыточному образованию свободных радикалов. При миастенических кризах цитиколин вводится внутривенно капельно в дозе 1000 мг в сутки, растворенный в 500 мл 0,9% раствора натрия хлорида или 5% раствора глюкозы. Курс лечения составляет 10-14 дней. После стабилизации состояния возможен переход на пероральный прием препарата в дозе 500-2000 мг в сутки, разделенной на 2-3 приема. Побочные эффекты: редко наблюдаются головная боль, головокружение, аллергические реакции.
Уровень убедительности рекомендации С (Уровень достоверности доказательств – 3).
Левокарнитин является природным метаболитом, играющим важную роль в энергетическом обмене. Его применение может быть полезно при миастении гравис для улучшения энергетического обеспечения мышечной ткани и снижения мышечной утомляемости. Препарат участвует в процессе переноса длинноцепочечных жирных кислот в митохондрии для последующего их окисления и образования энергии. При миастенических кризах левокарнитин вводится внутривенно капельно в дозе 1000 мг (10 мл) 1-2 раза в сутки, разведенный в 200 мл 0,9% раствора натрия хлорида. Курс лечения составляет 10-14 дней. После стабилизации состояния возможен переход на пероральный прием препарата в виде раствора для приема внутрь в дозе 1500-3000 мг в сутки, разделенной на 2-3 приема. Побочные эффекты: редко наблюдаются диспепсические явления (тошнота, рвота, диарея), миастения (парадоксальная реакция), гиперактивность.
Уровень убедительности рекомендации С (Уровень достоверности доказательств – 2b).
Глюкокортикостероидные препараты.
В период развития кризов наиболее эффективным является метод “пульстерапии” - внутривенного введения больших доз преднизолона (1000 - 2000 мг), который является одним из вариантов хронотерапевтической регуляции стимуляции тропных гормонов гипофизарно-диенцефально-надпочечниковой системы. После проведения “пульстерапии” рекомендуется использовать ежедневный прием преднизолона в неравных дозах, например, один день 100 мг, другой день 50 мг. По мере улучшения состояния больных они переводятся на прием преднизолона по схеме через день. Для этого постепенно уменьшается доза препарата в день приема меньшей дозы по 5 мг на прием. Необходимо отметить следующее обстоятельство: нередко развитие кризов (особенно холинергических и смешанных) при миастении иногда совпадает с проведением “пульстерапии” или началом назначения высоких доз преднизолона. Это обстоятельство диктует необходимость осторожного назначения или изменения дозы преднизолона у больных миастенией.
Введение хлористого калия. Обычно назначается хлорид калия по 1,0 г 3 раза в сутки. При миастенических кризах хлорид калия вводят внутривенно (70 мл 4% раствора) на 400 мл 5% раствора глюкозы капельно медленно (со скоростью 20-30 капель в минуту) с уколом 4 - 7 ед. инсулина короткого действия в конце капельницы.
Спиронолактон является антагонистом минералкортикоидного гормона альдостерона, необходимого для регуляции обмена электролитов в организме. Способность спиронолактона задерживать калий в клетках служит основанием для широкого его применения при лечении миастении. Препарат принимают внутрь в дозе 0,025 – 0,05 г 3-4 раза в день. Побочные явления: в отдельных случаях тошнота, головокружение, сонливость, кожные сыпи, обратимая форма гинекомастии.
Профилактика пневмонии (не применять аминогликозиды).
Проведение симптоматической терапии.
Проведение симптоматической терапии.
Специальный уход.
Некоторые лекарственные препараты могут сами по себе провоцировать обострение миастении (смотрите таблицу 2).
Некоторые лекарственные препараты могут сами по себе провоцировать обострение миастении (смотрите таблицу 2).
Перечень основных диагностических мероприятий:
- Определение электролитов крови
- Проведение неостигмина метилсульфатной пробы
- ЭНМГ
- КТ/МРТ органов средостения
- ЭКГ
- Проведение неостигмина метилсульфатной пробы
- ЭНМГ
- КТ/МРТ органов средостения
- ЭКГ
Перечень дополнительных диагностических мероприятий:
- Определение гормонов щитовидной железы
- Определение уровня КФК
- МРТ головного мозга – для проведения дифференциального диагноза миастении заболеваниями, при которых локализация патологического процесса определяется стволе мозга: стволовым энцефалитом, опухолью ствола головного мозга, нарушением мозгового кровообращения в системе вертебрально-базилярных сосудов;
- УЗИ щитовидной железы – для исключения патологии щитовидной железы (обязательно надо проводить при подозрении на миастению. И тиреотоксикоз, и гипотиреоз могут усиливать слабость при миастении).
- КТ/МРТ органов грудной клетки, брюшной полости, органов малога таза.
- УЗИ органов брюшной полости, малого таза.
- глазное дно
- Определение уровня КФК
- МРТ головного мозга – для проведения дифференциального диагноза миастении заболеваниями, при которых локализация патологического процесса определяется стволе мозга: стволовым энцефалитом, опухолью ствола головного мозга, нарушением мозгового кровообращения в системе вертебрально-базилярных сосудов;
- УЗИ щитовидной железы – для исключения патологии щитовидной железы (обязательно надо проводить при подозрении на миастению. И тиреотоксикоз, и гипотиреоз могут усиливать слабость при миастении).
- КТ/МРТ органов грудной клетки, брюшной полости, органов малога таза.
- УЗИ органов брюшной полости, малого таза.
- глазное дно
Госпитализация
Организация медицинской помощи
Показания для госпитализации в медицинскую организацию:
1) Миастенический криз
2) Обострение заболевания с ухудшением состояния
3) Нарушение глотания
4) Нарушение функции дыхания
Плановая госпитализация
1) Введение препаратов человеческого иммуноглобулина, экулизумаба, равулизумаба, ритуксимаба, а также проведение плазмафереза проводится в условиях стационара.
2) Начало терапии ГКС у пациентов, имеющих тяжелое течение миастении с бульбарными и дыхательными нарушениями в связи с возможным первоначальным ухудшением состоянием на фоне ГКС.
2) Начало терапии ГКС у пациентов, имеющих тяжелое течение миастении с бульбарными и дыхательными нарушениями в связи с возможным первоначальным ухудшением состоянием на фоне ГКС.
Экстренная госпитализация
1) Наличие нарастающих бульбарных и дыхательных нарушений, являющихся потенциальной угрозой для развития криза.
2) Кризовое течение миастении
2) Кризовое течение миастении
Показания к выписке пациента из медицинской организации
Стабилизация состояния пациента с устойчивым восстановлением функции дыхания и бульбарных нарушений
Профилактика
Профилактические мероприятия:
Первичная профилактика:
Постоянное лечение и регулярное посещение врача невролога является обязательным для больного миастенией, только так можно добиться улучшений и повысить качество жизни. Но также очень важно придерживаться следующих рекомендаций:
Постоянное лечение и регулярное посещение врача невролога является обязательным для больного миастенией, только так можно добиться улучшений и повысить качество жизни. Но также очень важно придерживаться следующих рекомендаций:
- нельзя загорать;
- нельзя заниматься тяжелым физическим трудом;
- избегать утомляемости и больше отдыхать;
- нельзя производить лечение самостоятельно или принимать лекарственные травы;
- нельзя употреблять лекарственные препараты, содержащие магний или хинин;
- нельзя употреблять миорелаксанты, транквилизаторы, нейролептики, мочегонные препараты, аминогликозиды, фторхинолины, тетрациклин.
Вторичная профилактика направлена на профилактику осложнений:
- тенденция к нарастанию веса требует систематического использования ограничения калорийности употребляемой пищи, в особенности углеводов;
-
тенденция к снижению толерантности к углеводам и периодическое повышение сахара в крови, требует назначения препаратов, способствующих увеличению толерантности к углеводам, нормализации перекисного окисления липидов и сокращению переносимости к углеводным нагрузкам.
Мониторинг состояния пациента:
- оценка жизнеобеспечивающих функций – дыхания, гемодинамики;
- оценка неврологического статуса для выявления и мониторинга динамичности мышечной слабости и реакции на введение антихолинэстеразных препаратов (полная, неполная частичная компенсация, проба позитивная, сомнительная, негативная).
Информация
Источники и литература
-
Клинические протоколы, руководства, рекомендации Министерства здравоохранения Республики Узбекистан 2024
- Клинические протоколы, руководства, рекомендации Министерства здравоохранения Республики Узбекистан 2024 - 1. Ветшев П.С., Ипполитов Л.И., Меркулова Д.М., Животов В.А. Хирургическое лечение тимом у больных генерализованной миастенией // Хирургия. – 2003. – №10. – С.15-20. ссылка 2. Ветшев П.С., Санадзе А.Г., Сиднев Д.В. Животов В.А. Антитела к титину у больных с миастенической и не миастенической тимомой // Хирургия. – 2007. – №6. – С.42-48. ссылка 3. Ланцова В.Б., Сепп Е.К. Иммунобиохимические особенности IgG антител при миастении // Бюл. Эксперим. биол. и мед. – 2002. – Т. 133. – №6. – С.678-680. ссылка 4. Санадзе А.Г., Сиднев Д.В., Гехт Б.М., Хлебникова Н.Н., Чугунова Н.А., Щербакова Н.И. Антитела к ацетилхолиновому рецептору в диагностике миастении и других форм, связанных с патологией нервно-мышечной передачи. Неврологический журнал. – М.: Медицина. – 2003. – Т.8. – Приложение.1. – С.19-20. ссылка 5. Санадзе А.Г. Миастения и миастенические синдромы. М. Литера, 2012. –250 с. ссылка 6. Сиднев Д.В., Санадзе А.Г., Щербакова Н.И., Давыдова Т.В., Гильванова О.В., Галкина О.И., Кононенко Ю.В. Антитела к мышцам (антититиновые антитела) в диагностике миастении, сочетающейся с тимомой // Неврологический журнал. – Т.8. – Приложение 1. – 2003. – С.21-23. ссылка 7. Сиднев Д.В., Карганов М.Ю., Щербакова Н.И., Алчинова И.Б., Санадзе А.Г. Антитела к ацетилхолиновому рецептору у больных с различными клиническими формами миастении и миастеническим синдромом Ламберта-Итона // Журнал неврологии и психиатрии имени С.С. Корсакова. – 2006. – Т.106. – №1. – С.55-58. ссылка 8. Aarli J.A., Stefansson K., Marton L., Wollmann R.L. Patient with myasthenia gravis and thymoma have in their sera IgG autoantibodies against titin // Clin. Exp. Immunol. – 1990. – V.82. – №.2. – P.284-288. ссылка 9. Aarli J., Skeie G., Mygland A., Gilhus N. Muscle striation antibodies in myasthenia gravis. Diagnostic and functional significance // Ann. N.Y. Acad. Sci. – 1998. – V. 841. – P.505-515. ссылка 10. Aarli J.A. Titin, thymoma, and myasthenia gravis. // Arch. Neurol. – 2001. – Jun. – V.8. – №.6. – P.869-870. ссылка 11. Aarli J.A., Romi F., Skeie N.G. Myasthenia Gravis in Individuals over 40 //– 2003. – V.998. – P.424-431. ссылка 12. Barohn RJ, McIntire D, Herbelin L, Wolfe GI, Nations S, Bryan WW. Reliability testing of the quantitative myasthenia gravis score // Ann. N.Y. Acad. Sci. – 1998. – V.841. – P.769-772. ссылка 13. Beekman R., Kuks J.B., Oosterhuis H.J. MG: diagnosis and follow-up of 100 consecutive patients // Neurol. – 1983. – V.244. – №.2. – P.112-118. ссылка 14. Buckley C., Newsom – Davis J., Willcox N., Vincent A. Do titin and cytokine antibodies in MG patients predict thymoma or thymoma recurrence? // J. Neurology. – 2001. – V.57. – №9. – P.1579-1582. ссылка 15. Carlson B., Wallin J., Pirskanen R. et al. Different HLA DR-DQ assosiations in subgroups of idiopathic Myasthenia Gravis// Immunogenetics. – 1990. – V.31. – P.285- 290. ссылка 16. Chen X.J., Qiao J., Xiao B.G., Lu C.Z. The significance of titin antibodies in myasthenia gravis-correlation with thymoma and severity of myasthenia gravis. // Neurol. – 2004. – Aug. – V. 251. – №.8. – P.1006-1011. ссылка 17. Dhall G., Ginsburg H.B., Bodenstein L., Fefferman N.R., Greco M.A., Chang M.W., Gardner S. Thymoma in children: report of two cases and review of literature // J Pediatr Hematol Oncol. – 2004. – V.26. – №10. – P.681-685. ссылка 18. Evoli A., Batocchi A.P., Tonali P. A. Practical guide to the recognition and management of Myasthenia gravis // J. Drugs. - 1996. – V.52. – №.5. – P.662-670. ссылка 19. Janossy G., Bofill M., Tredosiewicz L. Cellular differentiation of lymphoid subpopulations and their microinviron // In: The Human Thymus / Ed. H.K. M?ullerHermelink. – 1986. – Berlin. - Springer Verlag. – 1986. – P.89-127. ссылка 20. Kondo K, Monden Y. Myasthenia gravis appearing after thymectomy for thymoma // Eur. Cardiothorac. Surg. – 2005. –V. 28. – P. 22-25. ссылка 21. Kuks J.B., Limburg P.C., Horst G., Oosterhuis H.J. Antibodies to skeletal muscle in myastrenia gravis. Prevalence in non-thymoma patiens // J. Neurol. Sci. – 1993. – V.120. – P.78-81. ссылка 22. Kusner L.L., Mygland A., Kaminski H.J. Ryanodine receptor gene expression thymomas // Muscle & Nerve. – 1998. – V.21. – №10. – P.1299-1303. ссылка 23. Labiet S., Kolmerer B. Titin: giant proteins in charge of muscle ultrastructure and elasticity // J. Sci.1995. – V.270. – P.293-296. ссылка 24. Lennon V.A., Ermilov L.G., Szurszewski J.H., Vernino S. Immunization with neuronal nicotinic acetylcholine receptor induces neurological autoimmune disease // J. Clin. Invest. - 2003. – V.111. – P.907-913. ссылка 25. Lindstrom J., Lambert E.H. Content of acetylcholine receptor and antibodies bound to receptor to myasthenia gravis, experimental autoimmune myasthenia gravis and EatonLambert syndrome // Neurol. (Minneap.). – 1978. – V.28. – P.130-138. ссылка 26. Lindstrom J. Nicotinic Acetylcholine receptors in Health and Disease // Molecular Neurobiology. – 1997. – V.15. – №2. – Р.193-222. ссылка 27. Lindstrom J. Acetylcholine receptor and myasthenia // Muscle & Nerve. – 2000. – №23. – P.453-477. ссылка 28. Luebke E., Freiburg A., Skeie G.O., Kolmerer B., Labeit S., Aarli J.A., Gilhus N.E. Striational autoantibodies in miasthenia gravis patients recognize I-band titin epitopes // J. Neuroimmunol. – 1988. – V.81. – №1-2. – P.98-108. ссылка 29. Marx A., Osborne M., Tzartos S., Geuder K., Shalke B., Nix W., Kirchner T., MullerHermelink H. // A striational muscle antigen and myasthenia gravis- associated thymomas share an acetylcholine receptor epitope // Dev. Immunol. – 1992. – V.2. – P.77-83. ссылка 30. Suresh A. B., Asuncion R. M. D. Myasthenia Gravis // StatPearls Publishing/ — 2020. ссылка 31. Bardhan M., Dogra H., Samanta D. Neonatal Myasthenia Gravis // StatPearls Publishing. — 2020. ссылка 32. Finnis M. F., Jayawant S. Juvenile Myasthenia Gravis: A Paediatric Perspective // Autoimmune Dis. — 2011: 404101. ссылка 33. Sharma S., Lal V., Prabhakar S., Agarwal R. Clinical profile and outcome of myasthenic crisis in a tertiary care hospital: A prospective study // Ann Indian Acad Neurol. — 2013; 16 (2): 203-207. ссылка
Информация
Список авторов:
- Маджидова Ё.Н.. - д.м.н., профессор, заведующая кафедрой неврологии, детской неварологии с мед.генетикой ТашПМИ; Узбекистан, г. Ташкент
- Азимова Н.М.. - к.м.н., доцент кафедры неврологии, детской неварологии с мед.генетикой ТашПМИ; Узбекистан, г. Ташкент
- Абдусаттарова Г.Ш. -ассистент кафедры неврологии детской неварологии с мед.генетикой ТашПМИ; Узбекистан, г. Ташкент
- Рахимбаева Г.С. – профессор, заведующая кафедрой неврологии ТМА; Узбекистан, г. Ташкент
- Ким И.Г. – заведующая отделением неврологии 7 городской больницы, главный невролог города Ташкент; Узбекистан, г. Ташкент.
Рецензенты:
-
Кайшибаева Г.С. – зам. Председатель общества неврологов Казахстана, к.м.н. (PhD), директор института неврологии и нейрореабилитации имени Смагула Кайшибаева; Казахстан
-
Абдуллаева Н.Н. – д.м.н., профессор кафедры неврологии СамГМУ; Узбекистан, г. Самарканд
Клинический протокол обсужден и рекомендован к утверждению путем достижения неформального консенсуса на заключительном Совещании рабочей группы с участием профессорско-преподавательского состава высших учебных заведений, членов ассоциации неврологов Узбекистана, организаторов здравоохранения, врачей региональных учреждений.
Руководитель рабочей группы- Маджидова Ё.Н.. - д.м.н., профессор, заведующая кафедрой неврологии, детской неварологии с мед.генетикой ТашПМИ
Клинический протокол рассмотрен и утвержден Ученым Советом Ташкентского педиатрического медицингского института 202 года
Председатель Ученого Совета – Ректор ТашПМИ д.м.н., профессор Б.Т. Даминов
Данный клинический протокол и стандарт был разработан при организационной и методической поддержки под руководством заместителя министра д.м.н., Ф.Шарипова, Начальника управления медицинского страхования Ш.Алмарданова, начальника отдела разработки и внедрения клинических протоколов и стандартов Ш.Нуримовой, Главным специалистом отдела Г.Джумаевой, ведущим специолистам отдела Н. Рахимовой.
Список сокращений:
АХР – ацетилхолиновые рецепторы
КТ – компьютерная томография
МРТ – магнитно-резонансная томография
РИА – радиоиммунный анализ
ИФА – иммуноферментный анализ
АД – артериальное давление
ЧД – частота дыхания
КОС – кислотно-основное состояние
ГОМК – гамма-окси-масляная кислота
ЖЕЛ – жизненная емкость легких
МОВ – минимальный объем вдоха
ДО – дыхательный объем
БАС – боковой амиотрофический склероз
ИВЛ – искусственная вентиляция легких
М – миастения
ЭМГ – электромиография
Ig – иммуноглобулин
КТ – компьютерная томография
МРТ – магнитно-резонансная томография
РИА – радиоиммунный анализ
ИФА – иммуноферментный анализ
АД – артериальное давление
ЧД – частота дыхания
КОС – кислотно-основное состояние
ГОМК – гамма-окси-масляная кислота
ЖЕЛ – жизненная емкость легких
МОВ – минимальный объем вдоха
ДО – дыхательный объем
БАС – боковой амиотрофический склероз
ИВЛ – искусственная вентиляция легких
М – миастения
ЭМГ – электромиография
Ig – иммуноглобулин
Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
|
УДД
|
Расшифровка
|
|
1
|
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
|
|
2 |
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
|
|
3 |
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая
|
|
5
|
Имеется лишь обоснование механизма действия или мнение экспертов
|
Шкала оценки уровней достоверности доказательств (УДД) для профилактических, лечебных, реабилитационных вмешательств
|
УДД
|
Расшифровка
|
|
1
|
Систематический обзор РКИ с применением мета-анализа
|
|
2
|
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа
|
|
3
|
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль»
|
|
5
|
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
|
Шкала оценки уровней убедительности рекомендаций (УУР) для профилактических, диагностических, лечебных, реабилитационных вмешательств
|
УУР
|
Расшифровка
|
|
A |
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
|
|
B |
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
|
|
C |
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
|
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.