Иммуноглобулин А-нефропатия
IgA-нефропатия
 Версия: Клинические протоколы КР 2025 (Кыргызстан)
Версия: Клинические протоколы КР 2025 (Кыргызстан)
Рецидивирующая и устойчивая гематурия (N02), Рецидивирующая и устойчивая гематурия. Болезнь плотного осадка (N02.6), Рецидивирующая и устойчивая гематурия. Диффузный мезангиальный пролиферативный гломерулонефрит (N02.3), Рецидивирующая и устойчивая гематурия. Диффузный мезангиокапиллярный гломерулонефрит (N02.5), Рецидивирующая и устойчивая гематурия. Диффузный мембранозный гломерулонефрит (N02.2), Рецидивирующая и устойчивая гематурия. Диффузный серповидный гломерулонефрит (N02.7), Рецидивирующая и устойчивая гематурия. Диффузный эндокапиллярный пролиферативный гломерулонефрит (N02.4), Рецидивирующая и устойчивая гематурия. Другие изменения (N02.8), Рецидивирующая и устойчивая гематурия. Незначительные гломерулярные нарушения (N02.0), Рецидивирующая и устойчивая гематурия. Неуточненное изменение (N02.9), Рецидивирующая и устойчивая гематурия. Очаговые и сегментарные гломерулярные повреждения (N02.1)
Нефрология, Нефрология детская
Общая информация
Краткое описание
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ КЫРГЫЗСКОЙ РЕСПУБЛИКИ НАЦИОНАЛЬНЫЙ ЦЕНТР КАРДИОЛОГИИ И ТЕРАПИИ ИМЕНИ АКАДЕМИКА МИРСАИДА МИРРАХИМОВА
КЫРГЫЗСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ ИНСТИТУТ ПЕРЕПОДГОТОВКИ И ПОВЫШЕНИЯ КВАЛИФИКАЦИИ ИМЕНИ С. Б. ДАНИЯРОВА
НАУЧНОЕ ОБЩЕСТВО НЕФРОЛОГОВ КЫРГЫЗСКОЙ РЕСПУБЛИКИ
Клиническое руководство «Иммуноглобулин А нефропатия» для всех уровней здравоохранения
Клиническая проблема Иммуноглобулин А нефропатия (ИГАН)
Название документа
Клиническое руководство по диагностике и лечению пациентов с Иммуноглобулин А нефропатией.
Разработано для специалистов всех уровней здравоохранения.
Разработано для специалистов всех уровней здравоохранения.
Этапы оказания помощи
Для всех уровней организации здравоохранения, отделений нефрологии.
Цель создания клинического руководства
Внедрение и организация системы единого подхода по диагностике, лечению и ведению больных с Иммуноглобулин А нефропатией, основанного на международных клинических руководствах высокого методологического качества и адаптированных к местным условиям.
Целевые группы
Врачи первичного, вторичного, третичного уровня здравоохранения, врачи отделения нефрологии, реаниматологи, врачи других специальностей; организаторы здравоохранения; специалисты, контролирующие качество оказания медицинской помощи (ФОМС).
Клиническое руководство применимо к пациентам с Иммуноглобулин А нефропатией, подтвержденной нефробиопсией.
Дата создания: Январь 2025 г
Клиническое руководство применимо к пациентам с Иммуноглобулин А нефропатией, подтвержденной нефробиопсией.
Дата создания: Январь 2025 г
Цели и задачи руководства
Цель: Повышение знаний, умений и навыков врачей/медицинских работников всех специальностей в оказании качественной квалифицированной медицинской помощи больным с Иммуноглобулин А нефропатией в независимости от возраста, на всех уровнях здравоохранения Кыргызской Республики (КР) с учетом имеющихся доказательств.
Задачи:
1. Внедрение в практику единых научно-обоснованных клинико-лабораторных критериев диагностики Иммуноглобулин А нефропатии у взрослых и детей на всех уровнях организаций здравоохранения КР.
2. Внедрение в практику научно-обоснованных принципов и подходов в лечении и ведении больных с Иммуноглобулин А нефропатией в не зависимости от возраста, на всех уровнях здравоохранения КР.
3. Применение единого алгоритма действий на всех уровнях оказания медицинской помощи пациентам с Иммуноглобулин А нефропатией для:
● своевременной диагностики заболевания;
● правильного квалифицированного ведения и лечения болезни в зависимости от формы.
4. Снижение риска развития и прогрессирования осложнений у пациентов с Иммуноглобулин А нефропатией.
2. Внедрение в практику научно-обоснованных принципов и подходов в лечении и ведении больных с Иммуноглобулин А нефропатией в не зависимости от возраста, на всех уровнях здравоохранения КР.
3. Применение единого алгоритма действий на всех уровнях оказания медицинской помощи пациентам с Иммуноглобулин А нефропатией для:
● своевременной диагностики заболевания;
● правильного квалифицированного ведения и лечения болезни в зависимости от формы.
4. Снижение риска развития и прогрессирования осложнений у пациентов с Иммуноглобулин А нефропатией.
Целевая группа руководства
Клиническое руководство рекомендуется использовать для диагностики и оказания квалифицированной качественной помощи пациентам с Иммуноглобулин А нефропатией у взрослых и детей.
Клиническое руководство разработано для медицинских работников всех уровней ОЗ КР, принимающих участие в ведении, диагностике и лечении пациентов с Иммуноглобулин А нефропатией в независимости от возрастной группы.
Ожидаемые результаты применения клинического руководства:
- Улучшение качества диагностики будет способствовать своевременному выявлению, следовательно, и лечению пациентов с Иммуноглобулин А нефропатией;
- Рациональное лечение и своевременная диагностика будут способствовать сокращению осложнений и летальности.
Клиническое руководство разработано для медицинских работников всех уровней ОЗ КР, принимающих участие в ведении, диагностике и лечении пациентов с Иммуноглобулин А нефропатией в независимости от возрастной группы.
Ожидаемые результаты применения клинического руководства:
- Улучшение качества диагностики будет способствовать своевременному выявлению, следовательно, и лечению пациентов с Иммуноглобулин А нефропатией;
- Рациональное лечение и своевременная диагностика будут способствовать сокращению осложнений и летальности.
Определение
Иммуноглобулин А нефропатия – наиболее распространенная форма первичного поражения клубочков почек. Впервые она была описана парижским врачом J. Berger в 1968 г. как доброкачественная рецидивирующая гематурия, проявляющаяся отложением IgА и IgG преимущественно в мезангии и в меньшей степени по ходу гломерулярной базальной мембраны (ГБМ)[1]
Кодирование по международной классификации болезней 10-пересмотра (МКБ10).
Класс XIV: Болезни мочеполовой системы Блок N00-N08: Гломерулярные болезни
N02: Рецидивирующая и устойчивая гематурия
N 02.0 - Незначительные гломерулярные нарушения
N 02.1 - Очаговые и сегментарные гломерулярные повреждения
N 02.2 - Диффузный мембранозный гломерулонефрит
N 02.3 - Диффузный мезангиальный пролиферативный гломерулонефрит
N 02.4 - Диффузный эндокапиллярный пролиферативный гломерулонефрит
N 02.5 - Диффузный мезангиокапиллярный гломерулонефрит
N 02.6 - Болезнь плотного осадка
N 02.7 - Диффузный серповидный гломерулонефрит
N 02.8 - Другие изменения
N 02.9 - Неуточненное изменение
N 02.1 - Очаговые и сегментарные гломерулярные повреждения
N 02.2 - Диффузный мембранозный гломерулонефрит
N 02.3 - Диффузный мезангиальный пролиферативный гломерулонефрит
N 02.4 - Диффузный эндокапиллярный пролиферативный гломерулонефрит
N 02.5 - Диффузный мезангиокапиллярный гломерулонефрит
N 02.6 - Болезнь плотного осадка
N 02.7 - Диффузный серповидный гломерулонефрит
N 02.8 - Другие изменения
N 02.9 - Неуточненное изменение
Классификация
Классификация
Оксфордская классификация Иммуноглобулин А нефропатии, 2009 г.
|
Признак
|
Индекс
|
Описание
|
|
Выраженность мезангиальной пролиферации
|
М0
М1 |
Менее 50% клубочков
50% и более |
|
Выраженность эндокапилярной пролиферации
|
Е0
Е1 |
Отсутствует
Есть |
|
Наличие сегментарного гломерулосклероза или адгезии петель капилляров к капсуле клубочка
|
S0 S1
|
Нет
Указывает на наличие |
|
Выраженность тубулярной атрофии/интерстициального фиброза
|
Т0
Т1 Т2 |
Менее чем 25%
26-50% кортикальной зоны Более 50% кортикальной зоны |
|
Наличие клеточных или фиброзно- клеточных полулуний
|
С0 С1
С2 |
Нет
Менее 25% клубочков Более 25% клубочков |
Примеры использования:
Оксфордская классификация Иммуноглобулин А нефропатии применяется при формулировке диагноза, учитывая данные, полученные при нефробиопсии.
Пример формулировки диагноза: Ig A нефропатия. Мезангиопролиферативный гломерулонефрит М1Е0S0Т0.
Этиология и патогенез
Этиология
В настоящее время Иммуноглобулин А нефропатия расценивается как полиэтиологическое заболевание. Причинами заболевания могут быть как вирусные (респираторные, ЦМВ, вирус Эбштейна–Барр, гепатиты В и С, герпес, вирус Коксаки), так и другие инфекции, а также пищевые и эндогенные антигены, вакцины, глютен, микотоксин.
Для Иммуноглобулин А нефропатии характерен высокий уровень генетической сложности. Большое значение имеет наличие аллелей, связанных с повышенной восприимчивостью к развитию нефропатии. Предрасположенность к Иммуноглобулин А нефропатии может быть обусловлена носительством определенных локусов системы HLA, в частности, для семейных форм идентифицированы локусы 6q22–23 (IGAN1), 4q26–31 (IGAN2) и 17q12–22 (IGAN3) [5,7]. Уточняется роль других возможных генов-кандидатов.
Для Иммуноглобулин А нефропатии характерен высокий уровень генетической сложности. Большое значение имеет наличие аллелей, связанных с повышенной восприимчивостью к развитию нефропатии. Предрасположенность к Иммуноглобулин А нефропатии может быть обусловлена носительством определенных локусов системы HLA, в частности, для семейных форм идентифицированы локусы 6q22–23 (IGAN1), 4q26–31 (IGAN2) и 17q12–22 (IGAN3) [5,7]. Уточняется роль других возможных генов-кандидатов.
ПАТОГЕНЕЗ ИММУНОГЛОБУЛИН А НЕФРОПАТИИ
Звенья патогенеза Иммуноглобулин А нефропатии связаны с гипотезой четырех ударов и влиянием окружающей среды. Для развития клинически значимого заболевания должно произойти последовательность из четырех событий (Приложение 1).
Гипотеза четырех ударов:
Удар 1 – увеличение в крови количества молекул IgA1 со сниженным O-галактозилированием шарнирной области IgA1 (Gd-IgA1), предположительное место синтезирование Gd-IgA1 в слизистой.
Удар 2 – производство аутоантител IgG и IgA, которые распознают Gd-IgA1.
Удар 3 – формирование циркулирующих иммунных комплексов, содержащих аутоантитела IgG и IgA, связанные с Gd-IgA1
Удар 4 – отложение циркулирующих иммунных комплексов в мезангии клубочков, вызывающее повреждение почек.
Факторы окружающей среды:
Определенные факторы окружающей среды также могут способствовать патогенезу Иммуноглобулин А нефропатии:
Гипотеза четырех ударов:
Удар 1 – увеличение в крови количества молекул IgA1 со сниженным O-галактозилированием шарнирной области IgA1 (Gd-IgA1), предположительное место синтезирование Gd-IgA1 в слизистой.
Удар 2 – производство аутоантител IgG и IgA, которые распознают Gd-IgA1.
Удар 3 – формирование циркулирующих иммунных комплексов, содержащих аутоантитела IgG и IgA, связанные с Gd-IgA1
Удар 4 – отложение циркулирующих иммунных комплексов в мезангии клубочков, вызывающее повреждение почек.
Факторы окружающей среды:
Определенные факторы окружающей среды также могут способствовать патогенезу Иммуноглобулин А нефропатии:
-
Инфекции. Провокация макрогематурии инфекцией слизистой оболочки у пациентов с Иммуноглобулин А нефропатией привела к мнению, что мезангиальное отложение IgA может быть вызвано инфекцией.
-
Экзогенные антигены слизистой оболочки – Иммуноглобулин А нефропатия может возникать в результате нарушения регуляции реакции IgA слизистой оболочки на пищевые антигены (и, возможно, антигены дыхательных путей), учитывая редкую связь между Иммуноглобулин А нефропатией и целиакией и воспалительными заболеваниями кишечника. Реакция IgA слизистой оболочки на несколько пероральных антигенов, в том числе содержащихся в пищевых продуктах и вакцинах, увеличивается у пациентов с Иммуноглобулин А нефропатией по сравнению с реакциями у здоровых людей.
-
Кишечный микробиом. Микробиом кишечника находится в постоянной связи с лимфоидными тканями, связанными с кишечником (mucosal-associated lymphoid tissues - MALT), модулируя реакцию IgA слизистой оболочки для поддержания микроокружения слизистой оболочки, поддающегося микробиоте. Вполне возможно, что дисбиоз слизистой оболочки кишечника может быть одним из факторов, ответственных за нарушение регуляции синтеза IgA слизистой оболочки и увеличение циркулирующего Gd-IgA1 в Иммуноглобулин А нефропатии.
-
Генетическая предрасположенность. Хотя Иммуноглобулин А нефропатия считается спорадическим заболеванием, в США (в восточном Кентукки) и других странах были описаны редкие семейные случаи. Доступные генетические исследования показывают, что Иммуноглобулин А нефропатия представляет собой генетически гетерогенную структуру, которая не имеет классического менделевского наследования, приписываемого одному локусу гена, но представляет собой сложное полигенное заболевание, вероятно, включающее как главный комплекс гистосовместимости (ГКГC), так и аллели восприимчивости, не относящиеся к ГКГС(1-3)
Гистологические особенности
Патогномоничным признаком Иммуноглобулин А нефропатии является наличие мезангиальных отложений IgA, которые обнаруживаются с помощью иммунофлуоресцентной микроскопии.
-
IgA – иммунофлуоресцентная микроскопия демонстрирует доминантные или кодоминантные мезангиальные отложения IgA, либо отдельно, либо с IgG или IgM, либо с IgG и IgM [4]. Отложения IgA в субэндотелиальной стенке капилляров также могут присутствовать у трети пациентов, что связано с более высокой гистологической активностью (повышением мезангиальной и эндокапиллярной гиперклеточности) и худшим исходом для почек. Кодепозиция IgG наблюдается примерно в трети случаев и, как сообщается, является независимым фактором риска неблагоприятного исхода заболевания почек. Также наблюдалось мезангиальное отложение секреторного IgA. Результаты иммунофлуоресценции при Иммуноглобулин А нефропатии неотличимы от таковых при IgA-васкулите (пурпура Шенлейна-Геноха) и нефрите [5-8].
-
Комплемент. Клубочковое отложение компонента комплемента C3 обнаруживается более чем в 90 процентах случаев [9]. C1q почти всегда отсутствует, что означает, что комплемент активируется альтернативными и/или лектиновыми путями. Часто можно обнаружить отложения компонентов альтернативного пути, пропердина и фактора H. Клубочковое отложение белка 5, связанного с фактором комплемента H (CFHR5), положительного регулятора альтернативного пути, наблюдалось чаще у пациентов с прогрессирующей Иммуноглобулин А нефропатией по сравнению с теми, у кого заболевание не прогрессировало. Наличие мезангиальных отложений C4d, свидетельствующих об активации лектинового пути в отсутствие C1q, было идентифицировано как фактор риска худших отдаленных результатов лечения почек при Иммуноглобулин А нефропатии [10].
Световая микроскопия.
Основные результаты световой микроскопии — мезангиальная гиперклеточность и расширение матрикса — обычно фокальные [11].
Хотя мезангиальное отложение IgA при Иммуноглобулин А нефропатии является диффузным и глобальным, существует значительная гетерогенность патологической реакции на это отложение, которая может быть фокальной (с вовлечением менее 50 процентов клубочков) и сегментарной. У пациентов с Иммуноглобулин А нефропатией и быстро ухудшающейся функцией почек часто наблюдается сегментарный некроз с образованием полулуний или без него, что соответствует продолжающемуся «капилляриту» [8].
Хотя мезангиальное отложение IgA при Иммуноглобулин А нефропатии является диффузным и глобальным, существует значительная гетерогенность патологической реакции на это отложение, которая может быть фокальной (с вовлечением менее 50 процентов клубочков) и сегментарной. У пациентов с Иммуноглобулин А нефропатией и быстро ухудшающейся функцией почек часто наблюдается сегментарный некроз с образованием полулуний или без него, что соответствует продолжающемуся «капилляриту» [8].
Электронная микроскопия.
Электронная микроскопия обычно выявляет электронно-плотные депозиты, которые в основном ограничены мезангием (которые находятся за пределами мезангиальных клеток в мезангиальных пространствах), но могут также встречаться в субэндотелиальном и субэпителиальном пространствах
Количество и размер этих отложений обычно хорошо коррелируют с тяжестью изменений, наблюдаемых при световой микроскопии [11]. У некоторых пациентов с Иммуноглобулин А нефропатией наблюдается сопутствующее диффузное истончение базальной мембраны клубочков, которое неотличимо от нефропатии тонкой базальной мембраны [13, 14]. Анализ последовательности экзома пациентов с Иммуноглобулин А нефропатией и заболеванием тонкой базальной мембраны выявил диагностические варианты генов COL4A3 / COL4A4 / COL4A5 в трети случаев [15].
Международная сеть IgA-нефропатии в сотрудничестве с Обществом патологии почек в 2009 году разработала Оксфордскую классификацию гистологических переменных почек MEST, которые независимо предсказывают исход почечного заболевания у пациентов с Иммуноглобулин А нефропатией. Схема Оксфордской классификации впоследствии была подтверждена в нескольких когортах и уточнена для клинического использования как у взрослых, так и у детей с Иммуноглобулин А нефропатией. Основываясь на этой работе каждый результат биопсии с Иммуноглобулин А нефропатией должен включать числовые оценки, основанные на наличии или отсутствии следующих пяти переменных (MEST-C)
Количество и размер этих отложений обычно хорошо коррелируют с тяжестью изменений, наблюдаемых при световой микроскопии [11]. У некоторых пациентов с Иммуноглобулин А нефропатией наблюдается сопутствующее диффузное истончение базальной мембраны клубочков, которое неотличимо от нефропатии тонкой базальной мембраны [13, 14]. Анализ последовательности экзома пациентов с Иммуноглобулин А нефропатией и заболеванием тонкой базальной мембраны выявил диагностические варианты генов COL4A3 / COL4A4 / COL4A5 в трети случаев [15].
Международная сеть IgA-нефропатии в сотрудничестве с Обществом патологии почек в 2009 году разработала Оксфордскую классификацию гистологических переменных почек MEST, которые независимо предсказывают исход почечного заболевания у пациентов с Иммуноглобулин А нефропатией. Схема Оксфордской классификации впоследствии была подтверждена в нескольких когортах и уточнена для клинического использования как у взрослых, так и у детей с Иммуноглобулин А нефропатией. Основываясь на этой работе каждый результат биопсии с Иммуноглобулин А нефропатией должен включать числовые оценки, основанные на наличии или отсутствии следующих пяти переменных (MEST-C)
Эпидемиология
Эпидемиология
В мире частота выявления Иммуноглобулин А нефропатии колеблется в широких пределах – от 4,7 до 52 % и составляет 5 случаев на 100 000 населения в год, варьируя в зависимости от географического региона: в Европе и США на эту форму гломерулонефрита (ГН) приходится от 39,4 до 60,0 % больных, в Австралии – до 46,5 %, в Азии – 67,5 % (первое место занимает Сингапур – 52 %), в Японии – 46 %, в Северной Индии – 10,37 %, в Южной Америке – 0,7 %, в странах Центральной и Южной Африки – 2–3,8 %. Среди форм ГН, явившихся причиной ТХПН у жителей Австралии и Новой Зеландии, ведущее положение занимает Иммуноглобулин А нефропатия – 28 %. В 15 % случаев она приводит к ТХПН в течение 15 лет.[1] У 20–30 % взрослых больных через 20 лет после постановки диагноза Имунноглобулин А нефропатии развивается ХПН, а у 11 % детей – через 15 лет. Чаще развивается у представителей азиатской и европеоидной рас. Среди пациентов у 33 % выявляется только моноинфекция, а у 67 % – смешанная. Иммуноглобулин А нефропатия может начинаться в любом возрасте, однако пик заболеваемости приходится на второе и третье десятилетия жизни[3]. Мужчины заболевают, в среднем, в 2 раза чаще, чем женщины. Иммуноглобулин А нефропатия в 35–50% случаев рецидивирует в трансплантате; выживаемость трансплантата выше, чем при других болезнях почек [3].
Дебют в детском и подростковом возрасте часто приводит к переходу в хронический нефрит и отдаленному ухудшению прогноза. Большинство пациентов с Иммуноглобулин А нефропатией, которым требуется заместительная почечная терапия, — это молодые люди, у которых заболевание, возможно, развилось в детстве.[2]
По Кыргызской Республике за 2022 год частота встречаемости Иммуноглобулин А нефропатии среди пациентов, которым была произведена нефробиопсия, составляет 24,7%, средний возраст которых составил 33 года. По половому признаку превалирует мужской пол- 51%, по отношению к женскому-49%.
Факторы и группы риска
Факторы риска прогрессирования заболевания
Хотя первоначально считалось, что Иммуноглобулин А нефропатия имеет доброкачественное течение, в настоящее время признано, что медленное прогрессирование до ТХПН происходит у 25–30% пациентов в течение 20–25 лет. У остальных пациентов наступает стойкая клиническая ремиссия.
1. Протеинурия выше 1 г/сутки. Несколько обсервационных исследований документально подтвердили важность величины протеинурии и ее персистенции на фоне Иммуноглобулин А нефропатии. Скорость прогрессирования очень низкая среди пациентов, с протеинурией менее 1 г/сутки, и высокая среди пациентов, с протеинурией более 3–3,5 г/сут.
Артериальная гипертензия. При наличии на момент постановки диагноза гипертонии или значительного повышения АД у взрослых (например, с 100/60 до 130/80 мм рт. ст.) и предгипертензии (менее 95 перцентили систолического и диастолического давления от 1 года до 13 лет, АД 120-129/80 старше 13 лет прогнозируется более неблагоприятный исход. (Приложение 5)
2. Снижение СКФ. Снижение СКФ, проявляющееся повышенной концентрацией креатинина в сыворотке или более низкой рСКФ при постановке диагноза или в течение заболевания, связано с более неблагоприятным прогнозом для почек .
3. Гематурия. Исследования, оценивающие связь между гематурией и прогрессированием заболевания, дали противоречивые результаты. Исследования с длительным наблюдением за гематурией, показали связь между стойкой микроскопической гематурией и более высоким риском прогрессирования заболевания.
4. Гистологические предикторы прогрессирования. Наличие гистологических изменений:
-
полулуния;
-
иммунные отложения в капиллярных петлях в дополнение к мезангиальным отложениям;
-
гломерулосклероз;
-
канальцевая атрофия;
-
интерстициальный фиброз;
-
поражение сосудов.
Пересмотренная Оксфордская классификация Иммуноглобулин А нефропатии используется для оценки биопсий почек на основе пяти гистологических переменных: (см. Оксфордская классификация). Каждая из этих переменных индивидуально предсказывает исход заболевания почек, независимо от клинических данных .
Другие потенциально модифицируемые факторы риска прогрессирования заболевания включают ожирение, гипертриглицеридемию и гиперурикемию, курение и другие сопутствующие заболевания почек.
Клиническая картина
Cимптомы, течение
Клинические особенности
Клинические проявления. У пациентов с Иммуноглобулин А нефропатией может наблюдаться широкий спектр клинических проявлений: от бессимптомной микроскопической гематурии до БПГН [16].
-
Макрогематурия. Примерно у 40–50% наблюдаются один или повторяющиеся эпизоды макрогематурии, часто сопровождающие инфекцию верхних дыхательных путей.
-
Микрогематурия с протеинурией или без нее. Еще у 30–40% наблюдается микроскопическая гематурия с незначительной протеинурией, которые случайно выявляются при обычном осмотре или во время диагностической оценки ХБП [17-19]. У данной категории пациентов течение заболевания имеет неопределенную продолжительность. При микроскопии мочи дисморфные эритроциты и, в частности, акантоциты мочи считаются индикатором патологии клубочков [18]. Макрогематурия в конечном итоге возникает у 20–25 % этих пациентов.
-
Нефротический синдром или БПГН. Менее 10% имеют либо нефротический синдром, либо острый БПГН, характеризующийся отеками, гипертензией и нарушением функции почек, в сочетании с гематурией. Изредка Иммуноглобулин А нефропатия может проявляться злокачественной гипертензией.
-
Острое повреждение почек (ОПП). В редких случаях у пациентов развивается ОПП с олигурией или без нее. Это может быть связано с Иммуноглобулин А нефропатией с полулуниями или макрогематурией, приводящей к окклюзии канальцев и/или повреждению эритроцитами. Последнее обычно является обратимым явлением, хотя может произойти неполное восстановление функции почек [16]. При наличии Иммуноглобулин А нефропатии с полулуниями будет наблюдаться увеличение абсолютного количества дисморфных эритроцитов, выделяемых с мочой, что обычно составляет не менее 50% всех видимых эритроцитов.
Различают следующие варианты клинического течения Иммуноглобулин А нефропатии:
-
Классический с повторными эпизодами макрогематурии (синфарингитная гематурия) (30– 50% больных):
-
чаще развивается у молодых лиц;
-
характерно острое начало с эпизода макрогематурии, возникает на фоне инфекционного заболевания (обычно респираторной, реже мочевой, кишечной инфекции и т.д.) одновременно или в первые 2–3 дня болезни и сохраняется от нескольких часов до нескольких дней;
-
выявляется моча бурого цвета;
-
могут отмечаться боли в поясничной области;
-
наличие сгустков крови в моче не характерно;
-
при микроскопическом исследовании осадка мочи обнаруживают дисморфные эритроциты, эритроцитарные цилиндры;
-
выявляется протеинурия (ПУ);
-
возможно обратимое нарушение функции почек;
-
отмечается транзиторная артериальная гипертония (АГ);
-
в промежутках между эпизодами макрогематурии сохраняется персистирующая микрогематурия или наблюдается полная нормализация анализов мочи (до следующего эпизода).
-
-
Бессимптомный (у 30–40% больных):
-
чаще развивается у лиц после 40 лет;
-
при обследовании выявляют персистирующую микрогематурию в сочетании с ПУ и/или в сочетании АГ.
-
-
Атипичные формы протекают с клинической картиной, в большей степени сходной с другими вариантами гломерулярного повреждения – болезнь минимальных изменений с IgA- депозитами в мезангии; ОПП, ассоциированное с эпизодами макрогематурии; быстропрогрессирующий ГН с полулуниями и депозитами IgA в мезангии.
Сопутствующие состояния
Иммуноглобулин А нефропатия может быть связана с другими состояниями [16]. Вероятность случайного обнаружения мезангиальных IgA отложений в сочетании с другими распространенными заболеваниями относительно высока.
1. Хроническое заболевание печени. Отложение мезангиального IgA, связанное с хроническим заболеванием печени, особенно алкогольным циррозом печени, является наиболее распространенной формой вторичной Иммуноглобулин А нефропатией [23, 24]. Это также может произойти при хроническом заболевании печени, вызванном другими причинами, включая гепатиты B и C [21], а у детей - при терминальной стадии заболевания печени, главным образом из-за дефицита альфа-1-антитрипсина или атрезии желчных путей. Несмотря на частоту гломерулярных отложений IgA при запущенном заболевании печени, у большинства взрослых клинические признаки заболевания клубочков отсутствуют, в то время как у одной трети детей может наблюдаться бессимптомная микроскопическая гематурия или протеинурия. Нарушения мочеиспускания, которые могут наблюдаться у детей, обычно проходят после успешной трансплантации печени . Считается, что нарушение удаления IgA-содержащих комплексов клетками Купфера в печени предрасполагает к отложению IgA в почках. Наблюдение о том, что IgA также может откладываться в коже и печеночных синусоидах, согласуется с этой гипотезой . Как и в случае первичной Иммуноглобулин А нефропатии, полимерный IgA1, по-видимому, является доминирующей депонируемой изоформой IgA, хотя есть некоторые свидетельства совместного отложения IgA2.
2. Целиакия: Отложение IgA в клубочках часто встречается при целиакии, примерно у трети пациентов. Как и при заболевании печени, у подавляющего большинства больных нет клинических проявлений заболевания почек, возможно, в связи с отсутствием связанной с этим активации комплемента. Прием глиадина при этом заболевании приводит к образованию антител IgA против глиадина с последующим отложением иммунных комплексов глиадин- антиглиадин в клубочках. Это может произойти у пациентов как с явной целиакией, так и у пациентов, у которых нет симптомов, кроме атрофии слизистой оболочки при биопсии кишечника. Однако отложение глиадина не может быть продемонстрировано в клубочках, что позволяет предположить, что глютен может действовать путем увеличения кишечной проницаемости и усиления абсорбции других пищевых антигенов. Введение безглютеновой диеты у пациентов с циркулирующими антителами к глиадину в большинстве случаев приводит к временному, но неустойчивому снижению микроскопической гематурии и протеинурии и не влияет на долгосрочную выживаемость почек.
3. ВИЧ-инфекция: Коллапсирующий вариант фокально-сегментарного гломерулосклероза (ФСГС) является классической гломерулопатией, наблюдаемой при ВИЧ-инфекции. Иммуноглобулин А нефропатия так же встречается при ВИЧ-инфекции. У пациентов с Иммуноглобулин А нефропатией при ВИЧ-инфекции наблюдается макро- или микроскопическая гематурия и бессимптомная протеинурия. Предрасполагающим фактором Иммуноглобулин А нефропатии при ВИЧ является поликлональное повышение уровня IgA в сыворотке крови. Иногда при ВИЧ, ассоциированном Иммуноглобулин А нефропатией идиотипические антитела IgA, а также IgG или IgM против ВИЧ, могут обнаруживаться как в крови, так и в почках. Распространенность отложений IgA у пациентов, инфицированных ВИЧ, не определена.
4. Моноклональная гаммапатия почечного значения (МГ): Это группа заболеваний, при которых моноклональный белок вызывает поражение почек, но без признаков явного гематологического злокачественного новообразования. При МГ отложение моноклональных IgA происходит реже по сравнению с IgG. Описаны два подтипа гломерулопатий: болезнь отложения альфа-тяжелых цепей и IgA-пролиферативный гломерулонефрит с отложениями моноклональных иммуноглобулинов (IgA-PGNMID), который имеет общие клинические и патологические особенности с IgG-PGNMID. Различие между этими состояниями и Иммуноглобулин А нефропатией, где откладываются поликлональные IgA, важно, поскольку IgA-ассоциированный МГ может реагировать на терапию, направленную на клонирование.
5. Клубочковые заболевания: Иммуноглобулин А нефропатия может возникать в сочетании с другими гломерулярными заболеваниями:
- Болезнь минимальных изменений (БМИ). У некоторых пациентов с Иммуноглобулин А нефропатией наблюдается острое начало нефротического синдрома, при котором при биопсии почки наблюдается лишь легкая мезангиальная пролиферация, а наиболее заметным признаком является диффузное сглаживание ножек подоцитов, подобное тому, которое наблюдается при болезни минимальных изменений . Это проявление чаще встречается у детей [4]. Механизм, лежащий в основе этой ассоциации, не ясен, и отложения IgA могут представлять собой случайное явление [13.
- Гранулематоз с полиангиитом – Иммуноглобулин А нефропатия была описана у пациентов с гранулематозом с полиангиитом, находившихся в клинической ремиссии после начальной иммуносупрессивной терапии. У этих пациентов наблюдались повторные инфекции верхних дыхательных путей (возможно, отчасти из-за иммуносупрессии) и появление гематурии, но без явного рецидива системного васкулита или повышения титров антинейтрофильных цитоплазматических антител.
6. Другие состояния: Иммуноглобулин А нефропатия нечасто ассоциируется с рядом других заболеваний, включая герпетиформный дерматит, серонегативный артрит (особенно анкилозирующий спондилит), мелкоклеточную карциному, лимфомы (Ходжкина и Т- клеточные), грибовидный микоз, диссеминированный туберкулез, облитерирующий бронхиолит и воспалительные заболевания кишечника (болезнь Крона и язвенный колит).
Диагностика
Диагностика
Когда подозревать Иммуноглобулин А нефропатию.
Учитывая диапазон клинических проявлений у пациентов с Иммуноглобулин А нефропатией, диагноз следует заподозрить у любого пациента, у которого наблюдается один или несколько из следующих клинических признаков:
Учитывая диапазон клинических проявлений у пациентов с Иммуноглобулин А нефропатией, диагноз следует заподозрить у любого пациента, у которого наблюдается один или несколько из следующих клинических признаков:
-
Один или несколько эпизодов макрогематурии, особенно если они сопровождаются инфекцией верхних дыхательных путей.
-
Стойкая микроскопическая гематурия с протеинурией или без нее.
-
Медленно прогрессирующее нарушение функции почек.
При подозрении на Иммуноглобулин А нефропатию, при наличии ярко выраженных симптомов, следует начать нефропротективную терапию иАПФ или БРА (см. раздел лечение) и направить пациента к нефрологу.
Принципы диагностики:
-
Иммуноглобулин А нефропатия может быть диагностирована только с помощью нефробиопсии.
-
Стратификация производится по шкале MEST-C (мезангиальная [M] и эндокапиллярная [E] гиперклеточность, сегментарный склероз [S], интерстициальный фиброз/атрофия канальцев [T] и полулуния [C]) в соответствии с пересмотренной Оксфордской классификацией 2009 года [80].
-
Диагностические биомаркеры Иммуноглобулин А нефропатии в сыворотке или моче отсутствуют.
-
Всех пациентов с Иммуноглобулин А нефропатией необходимо обследовать для выявления вторичных причин.
Показания для нефробиопсии при подозрении на Иммуноглобулин А нефропатию:
- микро и/или макрогематурия и стойкая протеинурия ≥500 мг/сутки;
- повышенная концентрация креатинина в сыворотке;
- в ряде стран показанием к нефробиопсии является сохраняющаяся стойкая микроскопическая гематурия с сохранной функцией почек и без протеинурии.
Лечение
Терапия первичной IgA-нефропатии
Цели терапии
Предотвращение прогрессирования заболевания до ТХПН. В отличие от многих других форм заболеваний клубочков, достижение этой цели осуществляется в первую очередь за счет неиммуносупрессивных стратегий (нефропротективная терапия), без применения иммуносупрессивной терапии. Однако некоторым пациентам с высоким риском прогрессирования заболевания, а также пациентам с вариантными формами Иммуноглобулин А нефропатии может потребоваться иммуносупрессивная терапия (ИСТ).
Снижение протеинурии. Мы стремимся к снижению протеинурии до уровня менее 1 г/сут и если возможно, достигаем протеинурии менее 0,5 г/сут у всех взрослых пациентов с ИГАН. Важно отметить, что снижение протеинурии до <1 г/день считается достоверным показателем улучшения результатов лечения почек у пациентов с Иммуноглобулин А нефропатией.
Улучшение мочевого осадка. Мы стремимся к разрешению микроскопической гематурии у всех пациентов с Иммуноглобулин А нефропатией, поскольку стойкая гематурия связана с прогрессированием заболевания, а разрешение гематурии связано с улучшением результатов лечения почек.
Подход к начальной терапии первичной IgA-нефропатии, заключается в следующем:
I. Оценить результаты биопсии почки пациента (выполненной не позднее двух лет назад) с Иммуноглобулин А нефропатией по MEST-C шкале по Оксфордской классификации.
С клиническими факторами риска прогрессирования заболевания (Н: протеинурия ≥1 г/день), наличие активных пролиферативных поражений (т. е. более высокие баллы M и/или E) или наличие полулуний (более высокий балл C) может быть показанием к более агрессивному лечению.
Пациенты с более длительным течением заболевания, имеющие большой процент слерозирования (т.е. с более высокими показателями Т) с меньшей вероятностью будут реагировать на иммуносупрессивную терапию.
II. Оценить риск прогрессирования заболевания у пациента с помощью Международного инструмента прогнозирования Иммуноглобулин А нефропатии International IgAN Prediction Tool (IIgAN-PT, 2018). Инструмент использует клинические и гистопатологические маркеры во время биопсии MEST-C для прогнозирования риска 50%-го снижения рСКФ или развития терминальной почечной недостаточности у пациентов с Иммуноглобулин А нефропатией. Калькулятор доступен для использования в онлайн формате или в виде мобильного приложения на Calculate by QxMD https://qxmd.com/calculate/calculator_499?_branch_match_id=656546875419766679 на основе следующих переменных на момент биопсия почки:
Снижение протеинурии. Мы стремимся к снижению протеинурии до уровня менее 1 г/сут и если возможно, достигаем протеинурии менее 0,5 г/сут у всех взрослых пациентов с ИГАН. Важно отметить, что снижение протеинурии до <1 г/день считается достоверным показателем улучшения результатов лечения почек у пациентов с Иммуноглобулин А нефропатией.
Улучшение мочевого осадка. Мы стремимся к разрешению микроскопической гематурии у всех пациентов с Иммуноглобулин А нефропатией, поскольку стойкая гематурия связана с прогрессированием заболевания, а разрешение гематурии связано с улучшением результатов лечения почек.
Подход к начальной терапии первичной IgA-нефропатии, заключается в следующем:
I. Оценить результаты биопсии почки пациента (выполненной не позднее двух лет назад) с Иммуноглобулин А нефропатией по MEST-C шкале по Оксфордской классификации.
С клиническими факторами риска прогрессирования заболевания (Н: протеинурия ≥1 г/день), наличие активных пролиферативных поражений (т. е. более высокие баллы M и/или E) или наличие полулуний (более высокий балл C) может быть показанием к более агрессивному лечению.
Пациенты с более длительным течением заболевания, имеющие большой процент слерозирования (т.е. с более высокими показателями Т) с меньшей вероятностью будут реагировать на иммуносупрессивную терапию.
II. Оценить риск прогрессирования заболевания у пациента с помощью Международного инструмента прогнозирования Иммуноглобулин А нефропатии International IgAN Prediction Tool (IIgAN-PT, 2018). Инструмент использует клинические и гистопатологические маркеры во время биопсии MEST-C для прогнозирования риска 50%-го снижения рСКФ или развития терминальной почечной недостаточности у пациентов с Иммуноглобулин А нефропатией. Калькулятор доступен для использования в онлайн формате или в виде мобильного приложения на Calculate by QxMD https://qxmd.com/calculate/calculator_499?_branch_match_id=656546875419766679 на основе следующих переменных на момент биопсия почки:
- Расчетная СКФ
- Артериальное давление
- Протеинурия
- Возраст
- Раса/этническая принадлежность (белый, японец, китаец или другой)
- Предыдущее применение ингибиторов ангиотензинпревращающего фермента (иАПФ) или блокаторов рецепторов ангиотензина (БРА)
- Оксфордская классификация гистологических показателей Иммуноглобулин А нефропатии MEST
- Использование иммуносупрессивных средств вовремя или до биопсии.
IIgAN-PT был обновлен (также доступен для использования в Интернете ), чтобы можно было провести аналогичную оценку риска через один или два года после биопсии почки https://reference.medscape.com/calculator/839/international-igan-prediction-tool-post-biopsy- adults [ 68].
IIgAN-PT был модифицирован для детей с Иммуноглобулин А нефропатитей , у которых течение болезни отличается от взрослых. В детской практике наблюдается первоначальное повышение рСКФ, которое может длиться до нескольких лет, затем отмечается резкое снижение функции почек, как у взрослых . В отличие от взрослых у детей пятилетний риск рассчитан на 30% снижения рСКФ или ТХПН, тогда как у взрослых риск 50% https://qxmd.com/calculate/calculator_713/international-igan-prediction-tool-at-biopsy-pediatrics
С помощью IIgAN-PT оценивается риск прогрессирования заболевания у пациента и определяется основная тактика терапии. Исходя из следующих показателей:
1. Средний риск. Пациенты с протеинурией <1 г/день после 3-6 месяцев оптимизированной поддерживающей терапии считаются подверженными более низкому риску прогрессирования заболевания. Такие пациенты, как правило, не должны получать иммуносупрессивную терапию. Необходимо продолжить нефропротективную терапию иАПФ или БРА в течение длительного времени, при этом необходимо проводить динамический контроль.
IIgAN-PT был модифицирован для детей с Иммуноглобулин А нефропатитей , у которых течение болезни отличается от взрослых. В детской практике наблюдается первоначальное повышение рСКФ, которое может длиться до нескольких лет, затем отмечается резкое снижение функции почек, как у взрослых . В отличие от взрослых у детей пятилетний риск рассчитан на 30% снижения рСКФ или ТХПН, тогда как у взрослых риск 50% https://qxmd.com/calculate/calculator_713/international-igan-prediction-tool-at-biopsy-pediatrics
С помощью IIgAN-PT оценивается риск прогрессирования заболевания у пациента и определяется основная тактика терапии. Исходя из следующих показателей:
1. Средний риск. Пациенты с протеинурией <1 г/день после 3-6 месяцев оптимизированной поддерживающей терапии считаются подверженными более низкому риску прогрессирования заболевания. Такие пациенты, как правило, не должны получать иммуносупрессивную терапию. Необходимо продолжить нефропротективную терапию иАПФ или БРА в течение длительного времени, при этом необходимо проводить динамический контроль.
При протеинурии <1 г/день, микроскопической гематурии, а также активном воспалении, согласно Оксфордской классификации по нефробиопсии необходима иммуносупрессивная терапия.
2. Высокий риск. Пациенты с протеинурией ≥1 г/день, несмотря на оптимизированную поддерживающую терапию в течение как минимум 3-6 месяцев, считаются подверженными высокому риску прогрессирования заболевания. Пациенты с протеинурией ≥2 г/день подвергаются «очень высокому риску» прогрессирования заболевания.
Пациентам с высоким или очень высоким риском следует начать иммуносупрессивную терапию с нефропротекцией.
III. Инициирование и оптимизация поддерживающей терапии, состоит из:
1. КОНТРОЛЯ АРТЕРИАЛЬНОГО ДАВЛЕНИЯ
|
В
|
Рекомендуется для стандартизированного амбулаторного измерения АД (СМАД) вместо обычного измерения АД в организации здравоохранения для лечения высокого АД у взрослых
|
- Осциллометрическое устройство АД может быть предпочтительнее ручного устройства АД для стандартизированного амбулаторного (поликлинического) измерения АД; однако стандартизация делает упор на адекватную подготовку к измерению АД, а не на тип оборудования.
- Автоматизированное амбулаторное(поликлиническое) измерение АД (СМАД), как с участием, так и без присутствия врача, может быть предпочтительным методом стандартизированного измерения амбулаторного (поликлинического) АД.
- Осциллометрические устройства можно использовать для измерения АД у пациентов с фибрилляцией предсердий.
- Рекомендуется контролировать АД один раз в год с помощью СМАД и каждые 3–6 месяцев с помощью стандартизированного аускультативного амбулаторного (поликлинического) АД у детей с ХБП.
- У детей с высоким АД и ХБП, когда СМАД недоступно, разумным подходом является ручное аускультативное измерение амбулаторного (поликлинического) АД, полученное в стандартизированных условиях, основанных на протоколе, с целью достижения САД и ДАД <90-го перцентиля для возраста, пола и роста нормальных детей.
- Детям в возрасте ≥3 лет без факторов риска или состояний, связанных с гипертензией, измеряйте АД во время ежегодных посещений врача.
- Детям любого возраста с факторами риска гипертонии измеряйте АД при каждом обращении к врачу.
Данный принципы терапии не применим к некоторым формам IgA-нефропатии:
- Депозиты IgA при болезни минимальных измененияй
- IgA-нефрит с острым повреждением почек
- IgA-нефрит с быстропрогрессирующим гломерулонефритом
- IgA васкулиту
- IgA-нефропатии, вторичной по отношению к:
- Вирусным инфекциям (ВИЧ, гепатиты)
- Воспалительным заболеваниями кишечника - Аутоиммунным заболеваниям
- Циррозу
- Постинфекционному ГН
НЕФРОПРОТЕКТИВНАЯ ТЕРАПИЯ
Лечение первичной Иммуноглобулин А нефропатии фокусируется на нефропротективной терапии включая в это понятие достижение и ведение пациента на оптимальных целевых показателях АД (Приложение 5), с параллельным снижением протеинурии при ингибировании ренин-ангиотензиновой системы.
|
С
|
У пациентов с диагнозом Иммуноглобулин А нефропатия рекомендуется проводить неиммуносупрессивную нефропротективную терапию по показаниям и в объеме, предусмотренном рекомендациями по ХБП, для снижения протеинурии и темпов прогрессирования болезни, предупреждения и лечения осложнений дисфункции почек[1]
|
|
В
|
Блокада РААС должна применяться вне зависимости от наличия гипертензии если у пациента имеется протеинурия >0,5 г/сутки, во всех возрастных категориях
|
Ингибирование ангиотензина
|
А
|
У пациентов с Иммуноглобулин А нефропатией и протеинурией >0,5 г/сутки рекомендуется лечение ингибиторами ангиотензин-превращающего фермента (иАПФ) или блокаторами рецепторов ангиотензина-II (БРА) – для снижения протеинурии и темпов прогрессирования болезни.[1]
|
У пациентов с изначально нормальным АД следует начать с минимальной дозы внутрь: лизиноприла от 2,5 до 10 мг один раз в день или лозартана от 25 до 50 мг один раз в день с постепенным повышением (например, каждые две-четыре недели) доведя до максимально переносимой, в течение как минимум 3-х месяцев. Важен тщательный мониторинг таких пациентов, постановка на учет, ежеквартальный мониторинг лабораторных показателей протеинурии и креатинина сыворотки крови, поскольку они могут быть более склонны к осложнениям, связанным с уменьшением объема жидкости (например, из-за жары или болезни), и могут подвергаться риску развития ОПП. Более высокие начальные дозы могут быть подходящими для пациентов с исходной гипертензией.
Информация по дозировкам у детей представлена в приложении 8.
Среди пациентов, не достигающих цели по снижению протеинурии с помощью иАПФ или БРА в максимально рекомендуемой дозе в течение как минимум 3-х месяцев и при отсутствии достижения целевых значений АД (Приложение 5) следует добавить другие нефропротективные и гипотензивные препараты (см. ниже).
Основные показания к экстренной госпитализации в стационар пациентов с Иммуноглобулин А нефропатией:
1) Развитие или подозрение на развитие ОПП (снижение темпов диуреза <0,5 мл/кг/час в течение >6 часов или повышение креатинина крови >50% от исходного за 7 дней или повышение креатинина крови на >26 мкмоль/л за 48 часов;
2) быстропрогрессирующее снижение СКФ и/или повышение уровня креатинина крови (на >50% в течение 3 месяцев);
3) острый нефритический синдром;
4) водно-электролитные нарушения и ацидоз (потеря жидкости и гиповолемия, гиперкалиемия, гипокалиемия, гипонатриемия, метаболический ацидоз, декомпенсированный);
5) любое из следующих осложнений, требующее экстренной терапии, включая начало диализа:
- нарушение функций центральной нервной системы; серозиты;
- декомпенсация метаболического ацидоза; гиперкалиемия; неконтролируемая
- гипергидратация (анасарка, отек легких) и артериальная гипертензия; тяжелая
- белково-энергетическая недостаточность;
6) резистентная к амбулаторному лечению артериальная гипертензия (включая гипертензивный криз);
7) впервые выявленное снижение СКФ <30 мл/мин/1,73 м2[1].
2) быстропрогрессирующее снижение СКФ и/или повышение уровня креатинина крови (на >50% в течение 3 месяцев);
3) острый нефритический синдром;
4) водно-электролитные нарушения и ацидоз (потеря жидкости и гиповолемия, гиперкалиемия, гипокалиемия, гипонатриемия, метаболический ацидоз, декомпенсированный);
5) любое из следующих осложнений, требующее экстренной терапии, включая начало диализа:
- нарушение функций центральной нервной системы; серозиты;
- декомпенсация метаболического ацидоза; гиперкалиемия; неконтролируемая
- гипергидратация (анасарка, отек легких) и артериальная гипертензия; тяжелая
- белково-энергетическая недостаточность;
6) резистентная к амбулаторному лечению артериальная гипертензия (включая гипертензивный криз);
7) впервые выявленное снижение СКФ <30 мл/мин/1,73 м2[1].
Ингибиторы S GLT2
Пациенты с Иммуноглобулин А нефропатией и протеинурией должны получать лечение иSGLT2.
|
D
|
Пациентам со стойкой протеинурией ≥500 мг/день, несмотря на лечение максимально переносимой дозой иАПФ или БРА в течение как минимум 3 -х месяцев следует начать терапию и SGLT2 (дапаглифлозин 10 мг в день или эмпаглифлозин 10 мг в день в течение как минимум 3-х месяцев).
|
Двойные антагонисты рецепторов ангиотензина эндотелина
Спарсентан может быть использован как альтернативный вариант снижения протеинурии у пациентов с Иммуноглобулин А нефропатией, у которых имеется персистирующая протеинурия ≥1 г/день, несмотря на оптимальное лечение иАПФ или БРА и и SGLT2 в течение как минимум 3-х месяцев. При этом при применении спарсентана, следует отменить иАПФ или БРА.
Гидроксихлорохин
|
В
|
У пациентов с первичной Иммуноглобулин А нефропатией и протеинурией >1 г/сутки (несмотря на проводимую и адекватную неиммуносупрессивную ренопротективную терапию) при отсутствии быстропрогрессирующего нефритического синдрома и противопоказаний рекомендуется рассмотреть лечение гидроксихлорохином для снижения протеинурии и индукции ремиссии болезни
|
Гидроксихлорохин следует назначать в течение 6 месяцев в следующих режимах:
- 200 мг перорально два раза в день для рСКФ >60 мл/мин/1,73 м2,
- 100 мг перорально 3 раза в день для пациентов с рСКФ от 45 до 59 мл/мин/1,73 м2,
- 100 мг перорально два раза в день для пациентов с рСКФ от 30 до 44мл/мин/1,73 м2.
Дозу препарата следует снизить до 100 мг в день для пациентов со снижением рСКФ на >25% или до <30 мл/мин/1,73 м2[1].
Целевые показатели артериального давления у взрослых
|
В
|
Рекомендуется проводить лечение взрослых с высоким АД и ХБП с достижением целевого систолического артериального давления (САД) <120 мм рт. ст., при его переносимости, с использованием стандартного амбулаторного (поликлинического) измерения АД
|
Необходимо строго контролировать АД для достижения целевых показателей АД у детей, включая применение антигипертензивной терапии у детей с ХБП. Строгий контроль АД снижает скорость прогрессирования ХБП у детей.
Для педиатрической популяции целевые показатели среднесуточного артериального давления (САД) (рассчитанные как ДАД + 1/3 × пульсовое давление) зависят от возраста (Приложение 7).
Для педиатрической популяции целевые показатели среднесуточного артериального давления (САД) (рассчитанные как ДАД + 1/3 × пульсовое давление) зависят от возраста (Приложение 7).
ЛЕЧЕНИЕ ДИСЛИПИДЕМИИ (ЕСЛИ ПРИСУТСТВУЕТ)
К средствам, корригирующим дислипидемию, относятся статины, эзетимиб, фибраты, другие гиполипидемические средства (эзетимиб, омега-3 триглицериды, включая другие эфиры и кислоты (омега-3 ПНЖК), алирокумаб, эволокумаб, инклисиран). Режим дозирования и группа препарата подбирается индивидуально в зависимости от степени дислипидемии, факторов риска развития осложнений, сопутствующих заболеваний.
Ограниченная роль рыбьего жира
Рыбий жир в рамках поддерживающей терапии не назначается всем пациентам с Иммуноглобулин А нефропатией. Рыбий жир можно применять у пациентов с высоким риском прогрессирования заболевания. Рыбий жир может оказывать благоприятное воздействие на сердечно-сосудистую систему и лечение дислипидемии.
МОДИФИКАЦИЯ ОБРАЗА ЖИЗНИ, включает:
Диету:
- Диетические рекомендации разрабатываются индивидуально с учетом особенностей течения заболевания у конкретного больного в соответствии с рекомендациями по лечению ХБП.
- Ограничивается потребление соли до 2-х граммов в сутки
|
C
|
Рекомендовано потребление натрия <2 г натрия в день (или <90 ммоль натрия в день, или <5 г хлорида натрия в день) у пациентов с высоким АД и ХБП
|
- Низкоаллергенная диета (ограничение глютена, мяса, молока) не замедляет прогрессирования заболевания, но может быть предложена при сочетании Иммуноглобулин А нефропатии с целиакией.
- По мере снижения функции почек при отсутствии противопоказаний ограничивают потребление белка с пищей: до 0,6 г/кг массы тела/сут при СКФ ниже 60 мл/мин/1,73 м2 (при условии применения кетоаналогов аминокислот).
- Больным с ожирением, гиперлипидемией, снижением толерантности к углеводам лимитируют употребление животных жиров и легко усваиваемых углеводов.
- Отказ от курения и употребления алкоголя.
Физическая активность
|
C
|
Выполнять физическую активность умеренной интенсивности в течение совокупной продолжительности не менее 150 минут в неделю или до уровня, совместимого с их сердечно-сосудистой и физической толерантностью [1]
|
Санация очагов инфекции
|
В
|
У пациентов с первичной иммуноглобулин А нефропатией рекомендуется провести лечение клинически значимого инфекционного и/или аутоиммунного воспаления слизистых любой локализации для снижения активности патологического процесса в клубочках и индукции ремиссии болезни. [8,9]
|
|
С
|
Предлагается не проводить плановую тонзиллэктомию при Иммуноглобулин А нефропатии. [1]
|
Чаще Иммуноглобулин А нефропатия ассоциирована с хроническим рецидивирующим или прогрессирующим воспалением слизистых респираторного и желудочно-кишечного трактов. Тонзиллэктомия может быть предложена отдельным больным с частыми рецидивами Иммуноглобулин А нефропатии на фоне обострений хронического тонзиллита, при котором не эффективны консервативные мероприятия.
Иммуносупрессивная терапия (ИСТ) у пациентов из группы высокого риска
|
А
|
У пациентов с первичной Иммуноглобулин А неропатией и персистирующей протеинурией >1 г/сутки, несмотря на проводимую адекватную неиммуносупрессивную ренопротективную терапию в течение 3 месяцев, при отсутствии быстропрогрессирующего нефритического синдрома, мы рекомендуем лечение глюкокортикоидами для индукции ремиссии болезни и снижения темпов ее прогрессирования[1-5]
|
Пациентам с наличием признаков тяжелого и необратимого поражения функции почек (рСКФ <30 мл/мин/1,73 м2 в течение >3 месяцев, малые размеры почек, признаки тяжелого поражения почек в биоптате: интерстициальный фиброз, тубулярная атрофия или гломерулосклероз) не назначается ИСТ. Поскольку ИСТ не имеет эффективности у таких пациентов. В этом случае необходимо продолжить нефропротективную терапию и начать подготовку к заместительной почечной терапии.
Системные глюкокортикоиды
Кортикостероидов (КС) при Иммуноглобулин А нефропатии следует назначать с особой осторожностью.
Назначения ГКС следует избегать у пациентов с:
• рСКФ <30 мл/мин на 1,73 м2,
• диабетом,
• ожирением (определяемым как индекс массы тела >30 кг/м2),
• латентными инфекциями (например, вирусными гепатитами или туберкулезом),
• вторичным заболевание (например, при циррозе печени),
• активной пептической язвой,
• неконтролируемым психическим заболеванием
• тяжелым остеопорозом.
Назначения ГКС следует избегать у пациентов с:
• рСКФ <30 мл/мин на 1,73 м2,
• диабетом,
• ожирением (определяемым как индекс массы тела >30 кг/м2),
• латентными инфекциями (например, вирусными гепатитами или туберкулезом),
• вторичным заболевание (например, при циррозе печени),
• активной пептической язвой,
• неконтролируемым психическим заболеванием
• тяжелым остеопорозом.
|
С
|
Рекомендуется, чтобы лечение глюкокортикоидами у пациентов с Иммуноглобулин А нефропатией, сопровождалось поддерживающей профилактической терапией, направленной на предупреждение пневмоцитной пневмонии, развития и прогрессирования остеопороза и поражения желудочно- кишечного тракта в соответствии с действующими рекомендациями [10]
|
|
С
|
У пациентов с диагнозом первичной Иммуноглобулин А нефропатией, которым запланировано проведение ИСТ, мы рекомендуем вакцинацию против пневмококка для снижения рисков инфекционных осложнений [12]
|
Выбор режима
Необходимо продолжить терапию ГКС в течение шести месяцев. В большинстве схем (Приложение 6) начальную дозу КС поддерживают в течение как минимум двух месяцев, после чего дозу снижают в течение четырех месяцев. Если у пациента появляются признаки первоначального ответа на лечение: снижение протеинурии на ≥ 25%, а также улучшение функции почек КС. Если первоначальный ответ на лечение не наблюдается через два месяца, постепенное снижение дозы следует подбирать индивидуально с учетом реакции пациента, риска прогрессирования заболевания и переносимости режима.
Альтернативы глюкокортикоидам
Для пациентов, которые не могут переносить или не хотят принимать КС альтернативными вариантами начальной ИСТ являются TRF-будесонид и ММФ.
Будесонид целевого высвобождения.
Пероральная форма глюкокортикоида будесонида (TRF-будесонид) была разработана для высвобождения препарата в дистальном отделе подвздошной кишки, где расположено большинство пейеровых бляшек. Предполагается, что В-лимфоциты слизистой оболочки, локализованные в пейеровых бляшках, являются источником продукции слабо галактозилированного иммуноглобулина А1.
Микофенолата мофетил
|
А
|
У пациентов с первичной Иммуноглобулин А нефропатией и протеинурией >1 г/сутки, рСКФ >30 мл/мин/1,73м2 и наличием пролиферативных изменений (мезангиальной пролиферации и/или полулуний), но без признаков быстропрогрессирующего нефритического синдрома рекомендуется рассмотреть комбинированное применение глюкокортикоидов и микофенолата мофетила для снижения протеинурии, индукции ремиссии и снижения риска прогрессирования [1,10]
|
ММФ является альтернативным вариантом для пациентов из группы высокого риска, которые не могут переносить или не хотят принимать пероральные КС. Если применяется терапия ММФ, в таком случае начальная доза составляет 500 мг два раза в день с последующим титрованием дозы до 1000 мг два раза в день в течение нескольких недель в зависимости от переносимости. Первоначально терапия длится в течение четырех-шести месяцев. В случае ухудшения рСКФ или нарастания протеинурии за период терапии, мы прекращаем лечение. В случает улучшения или отсутствия нарастания рСКФ и протеинурии, мы продолжаем лечение в течение одного года, а затем снижаем дозу (например, на 250 мг каждые две недели или на 500 мг каждый месяц) до прекращения лечения.
Другие схемы
|
В
|
У пациентов с диагнозом первичной или вторичной Иммуноглобулин А нефропатией с быстропрогрессирующим нефритическим синдромом на фоне выраженной пролиферативной активности и/или и клеточных полулуний по данным патолого- анатомического исследования биопсийного материала, рекомендуется проведение комбинированной ИСТ глюкокортикоидами в сочетании с циклофосфамидом для индукции ремиссии болезни и снижения темпов ее прогрессирования[13]
|
Дополнительная терапия
- Тонзиллэктомия. Тонзиллит связан с гематурией и протеинурией при Иммуноглобулин А нефропатии. Было высказано предположение, что миндалины являются источником аномальных IgA, которые образуют иммунные комплексы и откладываются в клубочках. Однако, за исключением таких пациентов, которым требуется тонзиллэктомия по обычным причинам, имеющиеся данные свидетельствуют о том, что тонзиллэктомия не должна выполняться в рутинном порядке у большинства пациентов с Иммуноглобулин А нефропатией.
- Другие вмешательства. Другие вмешательства, которые оценивались у пациентов с Иммуноглорбулин А нефропатией, включают диету с низким содержанием антигенов, безглютеновую диету, внутривенное введение иммуноглобулина и другие препараты, такие как аналоги витамина D, фенитоин , антиагреганты и даназол, но данные ограничены.
Мониторинг и модификация терапии.
Все пациенты, получающие лечение от первичной Иммуноглобулин А нефропатии, должны находиться под тщательным наблюдением на предмет клинического ответа на терапию. Необходимо контролировать сывороточный креатинин и рСКФ, суточную протеинурию, оценку гематурии каждые два-три месяца.
Пациенты, получающие ИСТ. У пациентов из группы высокого риска, получающих ИСТ (чаще всего пероральные КС), определяется клинический ответ на лечение через четыре- шесть месяцев терапии с модифицированием лечения следующим образом:
Пациенты, получающие ИСТ. У пациентов из группы высокого риска, получающих ИСТ (чаще всего пероральные КС), определяется клинический ответ на лечение через четыре- шесть месяцев терапии с модифицированием лечения следующим образом:
- Если у пациента протеинурия <1 г/день и стабильная или улучшенная функция почек, мы продолжаем снижать дозу КС до полного прекращения терапиии КС через шесть месяцев. Таким пациентам следует продолжать меры поддерживающей терапии в течение неопределенного времени, если нет противопоказаний. В случает, если у пациента сохраняется стойкая протеинурия >0,5 г/день и гематурия (т. е. >10 эритроцитов [RBC]/поле высокого разрешения), возможно присоединение терапии ММФ в дозировке от 500 до 1000 мг два раза в день в течение четырех-шести месяцев,
- Если у пациента сохраняется протеинурия ≥1 г/день, но протеинурия снизилась на ≥50 процентов от максимального значения, а функция почек стабильна или улучшена, мы продолжаем снижать дозу КС до полной отмены КС через шесть месяцев. Хотя такие пациенты не достигли цели по снижению протеинурии, дополнительная терапия КС вряд ли принесет пользу. Меры поддерживающей терапии следует продолжать в течение неопределенного времени, если нет противопоказаний, и пациентов следует наблюдать на предмет признаков нарастания протеинурии.
- Если у пациента наблюдается стойкая протеинурия ≥1 г/день без снижения протеинурии на ≥50 процентов от его максимального значения или у пациента ухудшается функция почек, мы назначаем четырех-шестимесячную терапию ММФ в дозе 500–1000 мг два раза в день с полной отменой КС либо в сочетании с низкими дозами КС на время терапии ММФ, хотя убедительных доказательств в поддержку этого подхода нет.
Пациенты, не получающие ИСТ. У пациентов, получающих только поддерживающую терапию, у которых наблюдается увеличение протеинурии >50 процентов и >1 г/день или устойчивое повышение уровня креатинина в сыворотке, превышающее ожидаемое от применения иАПФ или БРА. Мы проводим биопсию почки, чтобы оценить необходимость более агрессивной терапии.
Лечение атипичных форм Иммуноглобулин А нефропатии
Иммуноглобулин А нефропатия в сочетании с болезнью минимальных изменений
|
В
|
У пациентов с НС и выявленными при биопсии признаками болезни минимальных изменений (БМИ) с мезангиальными депозитами IgA рекомендуется проводить лечение в соответствии с рекомендациями для БМИ [1]
|
Для пациентов с Иммуноглобулин А нефропатией с выраженной БМИ предлагается терапия КС, используется схема терапии для пациентов с первичной БМИ. Эти пациенты отличаются от других пациентов с Иммуноглобулин А нефропатий, поскольку при электронной микроскопии у них наблюдается обширное сглаживание отростков ножки подоцитов и только мезангиальные электронно-плотные отложения.
Существует подгруппа пациентов с Иммуноглобулин А нефропатией, характеризующаяся острым началом нефротического синдрома, небольшой гематурией или ее отсутствием, сохранной функцией почек, минимальными изменениями клубочков при световой микроскопии и диффузным сращением отростков подоцитов. У этих пациентов гистологические данные характерны для БМИ. У них на фоне терапии КС быстро наступает ремиссия, также таким пациентам часто требуются другие иммунодепрессанты при часто рецидивирующей протеинурии. Со временем мезангиальные отложения IgA часто исчезают или значительно уменьшаются. Вполне возможно, что у этих пациентов имеется БМИ и что наличие отложений IgA не связано с этим.
Иммуноглобулин А нефропатия с макрогематурией и ассоциированной с ней ОПП
У пациентов с подтвержденной Иммуноглобулин А нефропатией при развитии ОПП, ассоциированной с макрогематурией, целесообразно провести повторную биопсию почки, если через 5 дней после начала снижения почечной функции не наступает улучшение.
|
С
|
Предлагается проводить поддерживающую терапию ОПП при Иммуноглобулин А нефропатии, если при биопсии, выполненной во время эпизода макрогематурии, имеются только признаки острого канальцевого некроза с эритроцитарными цилиндрами в просвете канальцев[18,19]
|
ОПП может возникать во время эпизодов макрогематурии у пациентов с Иммуноглобулин А нефропатией. У таких пациентов немедленное лечение должно быть сосредоточено на поддерживающей терапии ОПП. Если нет четких доказательств обратного развития ОПП в течение максимум одной недели, следует провести биопсию почки, чтобы исключить возможность БПГН, которая может проявляться аналогичным образом, но имеет другой прогноз и требует немедленной терапии.
Биопсия почки у пациентов с Иммуноглобулин А нефропатией и ОПП выявляет мезангиальную пролиферацию и сегментарные полулуния в небольшой части клубочков (обычно менее 25%). Этих данных недостаточно, чтобы объяснить ОПП, которое приписывают обструкции канальцев эритроцитарными цилиндрами. Наиболее частым гистологическим поражением является острый тубулярный некроз, который может быть вызван железом, высвобождаемым из лизированных эритроцитов в канальцах, возможно, действующим через локальную генерацию токсичных свободных радикалов кислорода.
Биопсия почки у пациентов с Иммуноглобулин А нефропатией и ОПП выявляет мезангиальную пролиферацию и сегментарные полулуния в небольшой части клубочков (обычно менее 25%). Этих данных недостаточно, чтобы объяснить ОПП, которое приписывают обструкции канальцев эритроцитарными цилиндрами. Наиболее частым гистологическим поражением является острый тубулярный некроз, который может быть вызван железом, высвобождаемым из лизированных эритроцитов в канальцах, возможно, действующим через локальную генерацию токсичных свободных радикалов кислорода.
Иммуноглобулин А нефропатия с полулуниями
|
D
|
При Иммуноглобулин А нефропатии с быстропрогрессирующим ухудшением функции почек и выявлением в биоптате полулуний более чем в 50% клубочков предлагается лечение КС и циклофосфамидом по схеме, аналогичной схеме лечения АНЦА васкулитов[16]
|
Для установления диагноза необходима нефробиопсия, которая обычно выявляет мезангиальную и эндокапиллярную гиперклеточность и высокую долю клубочков с полулуниями с участками очагового некроза. Однако, наличие полулуний в биоптате почки при отсутствии снижения рСКФ не указывает на диагноз Иммуноглобулин А нефропатии с БПГН. Аналогичным образом, снижение рСКФ при отсутствии полулуний при биопсии не следует рассматривать как БПГН.
Пульс терапия при БПГН:
Метилпреднизолон внутривенно с последующим переводом на пероральный прием преднизолона, внутривенного или перорального введения циклофосфамида и/или плазмафереза, хотя польза от плазмафереза является спорной. КС могут действовать в этом случае, уменьшая острое воспалительное повреждение, а не корректируя факторы, ответственные за выработку и отложение IgA . Прогноз БПГН у пациентов с Иммуноглобулин А нефропатией обычно неблагоприятный.
Беременные пациенты. Беременность обычно хорошо переносится пациентками с Иммуноглобулин А нефропанией и нормальной или почти нормальной СКФ. Как и при большинстве других ХБП, риск ухудшения заболевания почек во время беременности повышен у женщин с исходной СКФ ниже 70 мл/мин, неконтролируемой гипертензией или тяжелыми артериолярными и тубулоинтерстициальными заболеваниями по данным биопсии почки.
Беременные пациенты. Беременность обычно хорошо переносится пациентками с Иммуноглобулин А нефропанией и нормальной или почти нормальной СКФ. Как и при большинстве других ХБП, риск ухудшения заболевания почек во время беременности повышен у женщин с исходной СКФ ниже 70 мл/мин, неконтролируемой гипертензией или тяжелыми артериолярными и тубулоинтерстициальными заболеваниями по данным биопсии почки.
Вторичная Иммуноглобулин А нефропатия
Вторичную Иммуноглобулин А нефропатию связывают с различными клиническими состояниями, включая цирроз печени и другие формы тяжелых заболеваний печени, целиакию, ВИЧ-инфекцию и другие заболевания. Оптимальный подход к лечению этих форм вторичной Иммуноглобулин А нефропатии не установлен. В целом терапия должна быть направлена на основное первичное заболевание. При определенных состояниях, таких как целиакия и воспалительные заболевания кишечника, лечение основного заболевания приводило к улучшению нарушений мочеиспускания (например, протеинурии и микроскопической гематурии) или клиренсу мезангиальных отложений IgA.
Прогноз
Прогноз
Пациенты с Иммуноглобулин А нефропатией с низким риском прогрессирования (с протеинурией менее 0,5 г/день) имеют благоприятный прогноз.
Среди пациентов, у которых развивается явная протеинурия и/или повышенная концентрация креатинина в сыворотке, через 10 лет прогрессирование до ТХПН составляет примерно от 15 – 25% и через 20 лет от 20 - 30%.
Скорость прогрессирования обычно медленная: СКФ часто падает всего на 1–3 мл/мин в год, причем это изменение не связано с повышением концентрации креатинина в сыворотке в краткосрочной перспективе. Таким образом, стабильная и нормальная концентрация креатинина в сыворотке не обязательно указывает на стабилизацию заболевания.
Что следует учитывать при лечении пациентов с Иммуноглобулин А нефропатией и высоким риском прогрессирования ХБП несмотря на максимальную поддерживающую терапию.
Среди пациентов, у которых развивается явная протеинурия и/или повышенная концентрация креатинина в сыворотке, через 10 лет прогрессирование до ТХПН составляет примерно от 15 – 25% и через 20 лет от 20 - 30%.
Скорость прогрессирования обычно медленная: СКФ часто падает всего на 1–3 мл/мин в год, причем это изменение не связано с повышением концентрации креатинина в сыворотке в краткосрочной перспективе. Таким образом, стабильная и нормальная концентрация креатинина в сыворотке не обязательно указывает на стабилизацию заболевания.
Что следует учитывать при лечении пациентов с Иммуноглобулин А нефропатией и высоким риском прогрессирования ХБП несмотря на максимальную поддерживающую терапию.
-
Высокий риск прогрессирования при Иммуноглобулин А нефропатии в настоящее время определяется как протеинурия >0,75-1 г/сут, которая сохраняется, несмотря на проведение оптимальной поддерживающей терапии в течение ≥90 дней.
-
Иммуносупрессивные препараты следует рассматривать как вариант лечения только у тех пациентов с Иммуноглобулин А нефропатией, у которых сохраняется высокий риск прогрессирования ХБП несмотря на максимальную поддерживающую терапию.
-
Ввиду сохраняющейся неопределенности в отношении безопасности и эффективности существующих вариантов ИСТ, всем пациентам, у которых сохраняется высокий риск прогрессирования ХБП несмотря на максимальную поддерживающую терапию, должна быть предоставлена возможность участия в клинических исследованиях.
-
Со всеми пациентами, у которых рассматривается возможность иммуносупрессии, следует подробно обсудить риски и преимущества применения каждого препарата, указывая на то, что побочные эффекты лечения наиболее вероятны у пациентов с низкой рСКФ.
Информация
Источники и литература
-
Клинические протоколы Министерства здравоохранения Кыргызской Республики
- Клинические протоколы Министерства здравоохранения Кыргызской Республики - 1. Клинические рекомендации. Гломерулярные болезни: иммуноглобулин А-нефропатия. Россия 2021 год. https://rusnephrology.org/wp 2. Wyatt R.J., Kritchevsky S.B., Woodford S.Y., Miller P.M., Roy S., Holland N.H., Jackson E., Bishof N.A. IgA Nephropathy: Long-Term Prognosis for Pediatric Patients. J. Pediatr. 1995;127:913–919. doi: 10.1016/S0022-3476(95)70027-7. [PubMed] [CrossRef] [Google Scholar] a. [Ref list] ]. 3. Kidney Disease: Improving Global Outcomes (KDIGO) Glomerulonephritis Work Group. KDIGO Clinical Practice Guideline for Glomerulonephritis. Kidney Int Suppl 2012;2:139-274. https://kdigo.org/wp-content/uploads/2017/02/KDIGO-2012-GN- Guideline-English.pdf 4. Нефрология. Клинические рекомендации. По ред. Шилов ЕМ, Смирнов АВ, Козловская НЛ. ГОЭТАР-Медиа, 2016 5. Bellur SS, Troyanov S, Cook HT, et al. Immunostaining findings in IgA nephropathy: correlation with histology and clinical outcome in the Oxford classification patient cohort. Nephrol Dial Transplant 2011; 26:2533. 6. Shin DH, Lim BJ, Han IM, et al. Glomerular IgG deposition predicts renal outcome in patients with IgA nephropathy. Mod Pathol 2016; 29:743. 7. Medjeral-Thomas NR, Troldborg A, Constantinou N, et al. Progressive IgA Nephropathy Is Associated With Low Circulating Mannan-Binding Lectin-Associated Serine Protease-3 (MASP- 3) and Increased Glomerular Factor H-Related Protein-5 (FHR5) Deposition. Kidney Int Rep 2018; 3:426. 8. Yuan X, Su Q, Wang H, et al. Genetic Variants of the COL4A3 , COL4A4 , and COL4A5 Genes Contribute to Thinned Glomerular Basement Membrane Lesions in Sporadic IgA Nephropathy Patients. J Am Soc Nephrol 2023; 34:132. 9. Alexander S, Varughese S, Franklin R, et al. Epidemiology, baseline characteristics and risk of progression in the first South-Asian prospective longitudinal observational IgA nephropathy cohort. Kidney Int Rep 2021; 6:414. 10. Vignon M, Cohen C, Faguer S, et al. The clinicopathologic characteristics of kidney diseases related to monotypic IgA deposits. Kidney Int 2017; 91:720. 11. https://www.cochranelibrary.com/es/cdsr/doi/10.1002/14651858.CD005590.pub3/full/ru 12. Shima Y, Nakanishi K, Sato M, et al. IgA nephropathy with presentation of nephrotic syndrome at onset in children. Pediatr Nephrol 2017; 32:457. 13. Pitcher D, Braddon F, Hendry B, et al. Long-Term Outcomes in IgA Nephropathy. Clin J Am Soc Nephrol 2023; 18:727. 14. Yamamoto R, Nagasawa Y, Shoji T, et al. Cigarette smoking and progression of IgA nephropathy. Am J Kidney Dis 2010; 56:313. 15. Barbour SJ, Coppo R, Zhang H, et al. Application of the International IgA Nephropathy Prediction Tool one or two years post-biopsy. Kidney Int 2022; 102:160. 16. Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 Clinical Practice Guideline for the Management of Glomerular Diseases. Kidney Int 2021; 100:S1. 17. Heerspink HJL, Stefánsson BV, Correa-Rotter R, et al. Dapagliflozin in Patients with Chronic Kidney Disease. N Engl J Med 2020; 383:1436. 18. Kohan DE, Barton M. Endothelin and endothelin antagonists in chronic kidney disease. Kidney Int 2014; 86:896. 19. КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ДИАГНОСТИКЕ И ЛЕЧЕНИЮ IgA- НЕФРОПАТИИ, 2015 год. 20. Ambruzs JM, Walker PD, Larsen CP. The histopathologic spectrum of kidney biopsies in patients with inflammatory bowel disease. Clin J Am Soc Nephrol 2014; 9:265. 21. https://kdigo.org/wp-content/uploads/2022/12/Russian-Translation-KDIGO-2021-Glomerular- Diseases-Guideline.pdf 22. https://www.uptodate.com/contents/chronic-kidney-disease-in-children-overview-of- management/abstract/53-55
Информация
Адрес для переписки:
Кыргызская Республика,
г. Бишкек ул. Тоголок Молдо 3.
720040,
тел: 996312 625690, e-mail: dinaralievna@gmail.com
г. Бишкек ул. Тоголок Молдо 3.
720040,
тел: 996312 625690, e-mail: dinaralievna@gmail.com
|
e-mail: karys2002@mail.ru
Главный внештатный нефролог МЗ КР. д.м.н., профессор Калиев Р.Р. |
e-mail: dinaralievna@gmail.com Заведующая отделением нефрологии
НЦКТ к.м.н., с.н.с. Айыпова Д.А. |
|
Список сокращений
|
|
IgA Н- Иммуноглобулин А нефропатия
|
|
IgА - Иммуноглобулин А
|
|
IgG - Иммуноглобулин G
|
|
IgM - Иммуноглобулин М
|
|
АД – артериальное давление
|
|
БМИ – болезнь минимальных изменений
|
|
БРА - блокаторы рецепторов ангиотензина II
|
|
ИСТ - иммуносупрессивная терапия
|
|
МЗПГН – мезангиопролиферативный гломерулонефрит
|
|
ММФ - микофенолата мофетил
|
|
иАПФ - ингибиторы ангиотензин превращающего фермента
|
|
ОПП – острое почечное повреждение
|
|
СКФ - Скорость клубочковой фильтрации
|
|
СМАД – Суточный мониторинг артериального давления
|
|
ТМА - Тромботическая микроангиопатия
|
|
ТХПН – терминальная хроническая почечная недостаточность
|
|
ФСГС – фокально – сегментарный гломерулосклероз
|
|
ХБП – хроническая болезнь почек
|
|
КС- Кортикостероиды
|
|
ГН-гломерулонефрит
|
|
ЦМВ-Цитомегаловирус
|
|
ГКГС- главный комплекс гистосовместимости
|
|
Gd-IgA1- галактозодефицитный иммуноглобулин А1
|
|
БПГН- Быстропрогрессирующий гломерулонефрит
|
|
РААС- Ренин-ангиотензин-альдостероновая система
|
Термины и определения
Быстропрогрессирующий гломерулонефрит (БПГН) - снижение расчетной скорости клубочковой фильтрации (рСКФ) ≥50% в течение 3-х месяцев или менее на фоне персистирования протеинурии, гематурии и активного/некротизирующего воспаления клубочков.
Иммуноглобулин А нефропатия - хроническая гломерулярная болезнь, связанная с воспалительным поражением почечных клубочков, опосредованным депозитами иммунных комплексов, содержащих аберрантный секреторный иммуноглобулин А и приводящая к развитию необратимых фиброплатических изменений органа.
Нефритический синдром - симптомокомплекс, представленный изменениями мочевого осадка (гематурией и/или цилиндрурией) в сочетании с умеренной протеинурией (<3,5 г/сут/1,73 м2) и экстраренальными симптомами - отеками (нефритическими), артериальной гипертензией, дисфункцией почек (может быть острым, хроническим, подострым (быстропрогрессирующим))
Иммуноглобулин А нефропатия - хроническая гломерулярная болезнь, связанная с воспалительным поражением почечных клубочков, опосредованным депозитами иммунных комплексов, содержащих аберрантный секреторный иммуноглобулин А и приводящая к развитию необратимых фиброплатических изменений органа.
Нефритический синдром - симптомокомплекс, представленный изменениями мочевого осадка (гематурией и/или цилиндрурией) в сочетании с умеренной протеинурией (<3,5 г/сут/1,73 м2) и экстраренальными симптомами - отеками (нефритическими), артериальной гипертензией, дисфункцией почек (может быть острым, хроническим, подострым (быстропрогрессирующим))
Нефротический синдром - симптомокомплекс, обусловленный нарушением гломерулярной базальной мембраны с развитием массивной (нефротической) протеинурии, критериями которого являются: протеинурия >3,5 г/сут/1,73 м2, гипоальбуминемия (альбумин в крови <30 г/л), гиперхолестеринемия.
Острое повреждение почек (ОПП) - патологическое состояние, развивающееся в результате непосредственного острого воздействия ренальных и/или экстраренальных повреждающих факторов, продолжающееся до 7-ми суток и характеризующееся быстрым (часы-дни) развитием признаков повреждения или дисфункции почек различной степени выраженности. Поскольку острое повреждение почечной паренхимы может быть обусловлено не только ренальными (почечными), но также преренальными и постренальными факторами, англоязычному термину «acute kidney injury» соответствует перевод «острое повреждение почек». Термин «острое почечное повреждение», который возник по аналогии с термином «острая почечная недостаточность, не отражает смысла и положений теоретической концепции KDIGO и не рекомендуется к использованию.
Скорость клубочковой (гломерулярной) фильтрации (СКФ) - это количество миллилитров плазмы крови, профильтровавшейся во всех клубочках почек за одну минуту. Величина скорости клубочковой фильтрации выражается в мл/мин, определяется величинами почечного плазматока, фильтрационного давления, фильтрационной поверхности и зависит от массы действующих нефронов. Используется, как интегральный показатель функционального состояния почек и стандартизуется на площадь поверхности тела.
Терминальная почечная недостаточность (ТХПН) -это патологическое состояние, характеризующееся величиной скорости клубочковой фильтрации менее 15 мл/мин/1,73 м2, что соответствует 5-й стадии хронической болезни почек. Хроническая болезнь почек - это персистирующее в течение трех или более месяцев поражение органа вследствие действия различных этиологических факторов, анатомической основой которого является процесс замещения нормальных анатомических структур фиброзом, приводящий к его дисфункции.
Ответственные за содержание клинического руководства
|
Калиев Рысбек
Рысмамбетович |
Профессор, д.м.н., главный внештатный нефролог МЗ КР
|
|
Айыпова Динара Аалыевна
|
К.м.н., заведующая отделением нефрологии НЦКТ, старший научный сотрудник
|
|
Будайчиева Асель Бекташевна
|
К.м.н., заместитель директора по научной работе НЦКТ, старший научный сотрудник
|
|
Кулубаев Султан Абдыкадырович
|
Младший научный сотрудник отделения нефрологии НЦКТ
|
|
Благодатских Татьяна Владимировна
|
Младший научный сотрудник отделения нефрологии НЦКТ
|
|
Касмалиева Айжан Жаныбековна
|
Младший научный сотрудник отделения нефрологии НЦКТ
|
|
Татенова Салтанат Асаевна
|
Младший научный сотрудник отделения нефрологии НЦКТ
|
|
Омурбекова Таалайгуль Бектенбековна
|
Младший научный сотрудник отделения нефрологии НЦКТ
|
Ответственные за клиническое содержание по стационарному ведению больных у детей и новорожденных
|
Бейшебаева Назира
Адылбековна |
К.м.н., заведующая отделением нефрологии НЦОМиД
|
|
Туганбаев Нурлан Айылчиевич
|
Внештатный главный гемодиализный врач МЗ КР
|
|
Методологическая поддержка
|
|
|
Саадакбаева Г.А.
|
Врач-эксперт отдела доказательной медицины и медицинских технологий ЦРЗиМТ
|
Стратегия поиска информации
Рабочей мультидисциплинарной группой было принято решение о создании клинического руководства по ведению пациентов с Иммуноглобулин А нефропатией, путем адаптирования уже разработанных международных клинических руководств высокого методологического качества, основанных на принципах доказательной медицины для всех уровней здравоохранения Кыргызской Республики.
Описание процесса поиска и оценки существующих клинических руководств по диагностике и лечению иммуноглобулин А нефропатии
Ключевые поисковые слова и построение запроса
Основными поисковыми словами для построения запроса стали: Иммуноглобулин А нефропатия (IgA-нефропатия (IgAN)), лечение нефропатий, гематурия клинический протокол/руководство (Clinical Practice Guideline). По данным ключевым словам, был проведен прямой поиск – только по одному слову и сочетанию, а также перекрестный поиск – по нескольким словам одновременно. В этом случае использовались как ключевые, так и второстепенные слова: этиология (etiology), патогенез (pathogenesis), лечение (treatment). Методика прямого и перекрестного поиска проводилась для того, чтобы найти максимальный объем информации по текущей теме. Поиск клинических руководств по ведению больных с Иммуноглобулин А нефропатией осуществлялся в международных доступных электронных базах данных в сети Интернет.
Перечень интернет ресурсов для поиска руководств
|
Название ресурса
|
Адрес в сети интернет
|
|
Национальная ассоциация нефрологов России
|
https://rusnephrology.org/
|
|
International Society of Nephrology
|
|
|
European Renal Association- European Dialysis and
Transplant Association |
|
|
Kidney Disease: Improving Global Outcomes
|
https://kdigo.org/
|
В итоге поиска было найдено 3 клинических руководства.
Найденные клинические руководства были оценены рабочей группой по методологии AGREE II.
Найденные клинические руководства были оценены рабочей группой по методологии AGREE II.
Критерии включения/исключения
В качестве опорных клинических руководств выбраны только те, которые были написаны с применением подходов доказательной медицины и посвящены ведению, диагностике и лечению больных с Иммуноглобулин А нефропатией и сопутствующих состояний на всех уровнях здравоохранения, в связи с обновлением данных по диагностике и лечению. Были установлены языковые ограничения, так как рабочая группа имела возможность изучать источники литературы только на английском и русском языках.
Оценка найденных клинических рекомендаций и доказательств
В результате проведенного поиска было найдено 3 обновленных клинических руководства по диагностике, лечению и ведению больных с Иммуноглобулин А нефропатией, которые содержали необходимую информацию, соответствующую задаче рабочей группы. За основу для адаптации были приняты руководства KDIGO.
|
№
|
Название руководства
|
Качество
|
Новизна
|
Применимость
|
Варианты действий
|
|
1
|
Гломерулярные болезни: иммуноглобулин А- нефропатия.
Протокол ассоциации нефрологов РФ, 2021,2015г, диагностика, лечение. |
++
|
++
|
+++
|
Рекомендации по Иммуноглобулин А нефропатии доступные на русском языке
|
|
2
|
KDIGO 2021 Clinical practice guideline for the management of glomerular diseases
|
+++
|
++
|
+++
|
Даны рекомендации по лечению Иммуноглобулин А нефропатии
|
|
3
|
International Society of Nephrology
|
+++
|
+++
|
+++
|
Даны рекомендации по диагностики Иммуноглобулин А нефропатии
|
Дополнительный поиск клинических рекомендаций проводился с использованием англоязычных библиографических ресурсов Medline (через PubMedhttps://www.ncbi.nlm.nih.gov/pubmed), в базе данных Cochrane Library (http://www.cochranelibrary.com/).
Шкала уровней доказательности и градации рекомендаций
В связи с тем, что на сегодняшний день появились отдельные доказательства по различным вмешательствам (диагностике, лечению и ведению) Иммуноглобулин А нефропатии, основные клинические рекомендации представлены на основании рекомендаций выбранных международных руководств, которые были приняты за основу группой разработчиков клинического руководства при обсуждении (с использованием метода Делфи).
Все ключевые рекомендации в клиническом руководстве выделены в рамки-боксы. Ключевые рекомендации с представлением их уровни доказательности и убедительности были адаптированы по шкале SIGN-50 на 4 уровня A, B, C, D.
Все ключевые рекомендации в клиническом руководстве выделены в рамки-боксы. Ключевые рекомендации с представлением их уровни доказательности и убедительности были адаптированы по шкале SIGN-50 на 4 уровня A, B, C, D.
|
А
|
Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты
|
|
В
|
Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с не высоким (+) риском систематической ошибки
|
|
С
|
Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+)
|
|
D
|
Описание серии случаев или неконтролируемое исследование, или мнение экспертов
|
Приложение 1.
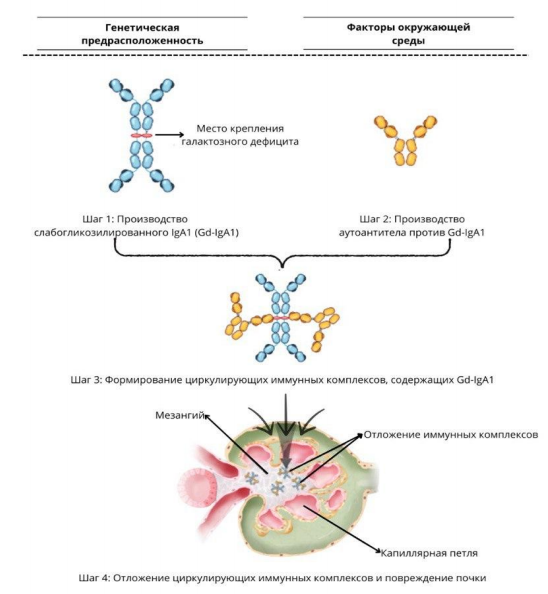
Приложение 2.
Иммунофлуоресцентная микроскопия
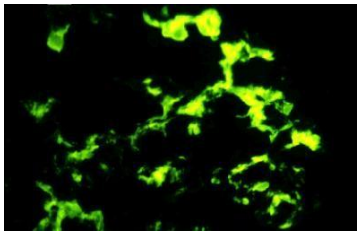
Приложение 3.
Электронная микроскопия
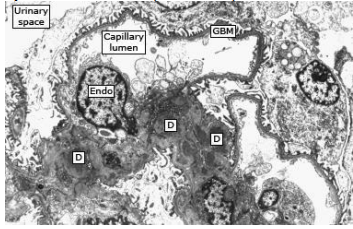
Приложение 4.
Световая микроскопия
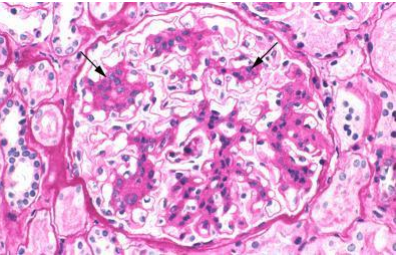

Приложение 2.
Иммунофлуоресцентная микроскопия

Приложение 3.
Электронная микроскопия

Приложение 4.
Световая микроскопия

Приложение 5.
Целевое артериальное давление в соответствии с исходным риском сердечно- сосудистых заболеваний и методом измерения артериального давления.
Целевое артериальное давление в соответствии с исходным риском сердечно- сосудистых заболеваний и методом измерения артериального давления.
|
|
Повседневное/обычное офисное артериальное давление (ручное или осциллометрическое
измерение без надлежащей подготовки или техники пациента) * |
AOBPM, стандартизированное офисное артериальное давление, дневное СМАД или домашнее артериальное давление
|
|
Население повышенного риска Δ
|
||
Расчетный 10-летний риск развития сердечно-сосудистых заболеваний ≥10% ¥
|
от 125 до 130/<80
|
от 120 до 125/<80
|
|
Низкий риск ‡
|
||
|
Ни один из вышеперечисленных факторов риска
|
от 130 до 139/<90
|
от 125 до 135/<90
|
Целевые показатели артериального давления у детей с заболеванием почек
|
Возраст
|
Целевые цели АД
|
|
Офисное измерение АД*
|
|
|
Дети <13 лет
|
Систолическое и диастолическое АД <90- го процентиля для возраста, пола и роста ¶
|
|
Дети ≥13 лет
|
АД ≤120/80 мм рт. ст.
|
|
СМАД
|
|
|
Все возраста
|
Среднесуточное артериальное АД <50 -го процентиля на основе нормативных данных СМАД для возраста, пола и роста.
|
Примечание: АД: артериальное давление; СМАД: амбулаторный мониторинг артериального давления.
* Значения АД основаны на аускультативных измерениях в офисе с использованием анероидных сфигмоманометров и манжеты соответствующего размера и ее расположения.
¶ Нормативные значения АД основаны на пересмотренных рекомендациях Американской академии педиатрии 2017 года по скринингу и лечению высокого АД у детей и подростков.
¶ Нормативные значения АД основаны на пересмотренных рекомендациях Американской академии педиатрии 2017 года по скринингу и лечению высокого АД у детей и подростков.
<50-го перцентиль с учетом возраста, пола и роста это целевое значение среднесуточного артериального давление (САД) у детей с ХБП по СМАД (2C).
Приложение 6.
Дозировка и продолжительность терапии глюкокортикоидами у взрослых пациентов с IgA- нефропатией
|
Глюкокортикоид |
Начальная доза
|
Продолжительность начальной дозы
|
Коррекция
|
Общая продолжительность терапии глюкокортикоидами
|
|
Метилпреднизолон (IV)
и Преднизолон/пред низолон (перорально) |
Метилпреднизолон 1 г внутривенно в течение 3 дней в начале 1, 3 и 5 месяцев.
и Преднизолон или преднизолон 0,5 мг/кг перорально через день в остальные дни |
6 месяцев
|
Нет
|
6 месяцев
|
|
Преднизолон
|
1 мг/кг перорально в день (максимальная доза: 75 мг/день)
|
2 месяца
|
Снижайте суточную дозу на 0,2 мг/кг каждый месяц в течение 4 месяцев.
|
6 месяцев
|
|
Преднизолон
|
0,8–1 мг/кг перорально в день
|
2 месяца
|
Уменьшите суточную дозу на 5– 10 мг каждые 2
недели в течение ≥4 месяцев. |
от 6 до 8 месяцев
|
|
Метилпреднизоло н
|
0,4 мг/кг перорально один раз в день (округляется до ближайших 4 мг;
максимальная доза: 32 мг/день) |
2 месяца
|
Снижать суточную дозу на 4 мг каждый месяц в течение ≥4 месяцев.
|
от 6 до 9 месяцев
|
|
Форма будесонида с целевым высвобождением (TRF-будесонид) Δ◊
|
16 мг перорально ежедневно
|
9 месяцев
|
Уменьшите дозу до 8 мг один раз в день в течение 2 недель, затем прекратите
|
9 месяцев и 2 недели
|
Приложение 7.
Оценка артериального давления у детей
Оценка артериального давления у детей [Американская академия педиатрии, 2017 г.]
Оценка артериального давления у детей
Оценка артериального давления у детей [Американская академия педиатрии, 2017 г.]
|
Показатели
|
АД для детей от 1 года до 13 дет
|
АД для детей ≥13лет
|
|
Нормальное АД
|
Систолическое и диастолическое АД <90- го перцентиля
|
Систолическое АД <120 и
диастолическое АД <80 мм рт.ст. |
|
Повышенное АД (предгипертензия)
|
Систолическое и диастолическое АД от ≥90- го перцентиля до <95- го перцентиля или от 120/80 мм рт.ст. до <95 -го перцентиля (в зависимости от того, что ниже)
|
Систолическое АД от 120 до 129 и диастолическое АД <80 мм рт. ст.
|
|
Артериальная гипертензия 1 стадии
|
Систолическое и диастолическое АД от
≥95- го перцентиля до <95 -го перцентиля +12 мм рт. ст. или от 130/80 до 139/89 мм рт. ст. (в зависимости от того, что ниже) |
от 130/80 до 139/89 мм рт. ст.
|
|
Артериальная гипертензия 2 стадии
|
Систолическое и диастолическое АД ≥95- го перцентиля +12 мм рт.ст. или ≥140/90 мм рт.ст. (в зависимости от того, что ниже)
|
≥140/90 мм рт.ст.
|
[Pediatrics, Vol. 140, doi: 10.1542/peds.2017-1904]
Факторы риска гипертонии у детей <3 лет
|
Проверьте время посещения врача у детей с учетом следующих симптомов:
|
|
Перинатальные факторы риска:
|
|
Рецидивирующая инфекция мочевыводящих путей, гематурия или протеинурия
|
|
Заболевание почек или урологические пороки развития
|
|
Семейный анамнез врожденного заболевания почек
|
|
Трансплантация паренхиматозных органов или гемопоэтических клеток
|
|
Злокачественное новообразование или другое системное заболевание, связанное с гипертензией (например, нейрофиброматоз, комплекс туберозного склероза, серповидно-клеточная анемия)
|
|
Лечение препаратами, которые, как известно, повышают артериальное давление (например, кофеин, нестероидные противовоспалительные препараты, глюкокортикоиды)
|
|
Признаки повышенного внутричерепного давления
|
Факторы риска гипертонии у детей возраст ≥3 лет
|
Проверяйте АД при всех осмотрах у детей при наличии следующих признаков:
|
|
Ожирение
|
|
Диабет 1 или 2 типа
|
|
Болезнь почек
|
|
Обструкция или коарктация дуги аорты в анамнезе
|
|
Лечение или прием препаратов, повышающих артериальное давление:
|
[Flynn JT, Kaelber DC, Baker-Smith CM и др. Клиническое практическое руководство по скринингу и лечению повышенного кровяного давления у детей и подростков. Педиатрия 2017]
Приложение 8.
Антигипертензивные препараты для амбулаторного лечения хронической артериальной гипертензии у новорожденных, детей и подростков
|
Лекарство
|
Возраст
|
Начальная
пероральная доза |
Максимальная
пероральная доза в день |
Интервал дозирования
|
Составы
|
|
Ингибиторы АПФ Противопоказания: Беременность, ангионевротический отек.
Частые побочные эффекты: кашель, головная боль, головокружение, астения. Тяжелые побочные эффекты: гиперкалиемия, острое повреждение почек, ангионевротический отек, токсичность для плода. |
|||||
|
Беназеприл
|
≥6 лет*
|
0,2 мг/кг в
сутки (до 10 мг в сутки) |
0,6 мг/кг (до 40 мг)
|
Ежедневно
|
Таблетка: 5, 10,
20, 40 мг Экстемпоральная жидкость: 2 мг/мл. |
|
Каптоприл
¶ |
Младенцы
|
0,05 мг/кг на
дозу |
6 мг/кг
|
Ежедневно до
4 раз в день |
Таблетки: 12,5,
25, 50, 100 мг Экстемпоральная жидкость: 1 мг/мл. |
|
Дети
|
0,5 мг/кг на дозу
|
6 мг/кг
|
Три раза в день
|
||
|
Эналаприл
|
≥1 месяца*
|
0,08 мг/кг в сутки (до 5 мг в сутки)
|
0,6 мг/кг (до 40 мг)
|
Ежедневно- два раза в день
|
Таблетка: 2,5, 5,
10, 20 мг Раствор: 1 мг/мл. |
|
Фозинопри л
|
≥6 лет
|
0,1 мг/кг в сутки (до 5 мг в сутки)
|
40 мг
|
Ежедневно.
|
Таблетка: 10, 20,
40 мг |
|
<50 кг
|
|||||
|
≥50 кг*
|
5 мг в день
|
40 мг
|
|||
|
Лизинопри л
|
≥6 лет*
|
0,07 мг/кг в сутки (до 5 мг в сутки)
|
0,6 мг/кг (до 40 мг)
|
Ежедневно
|
Таблетка: 2,5, 5,
10, 20, 30, 40 мг Раствор: 1 мг/мл. |
|
Рамиприл ¶
|
NA
|
1,6 мг/м 2 в
день |
6 мг/м 2
|
Ежедневно
|
Капсула: 1,25, 2,5,
5, 10 мг |
|
Квинаприл
|
NA
|
5 мг в день
|
80 мг
|
Ежедневно
|
Таблетка: 5, 10,
20, 40 мг |
|
БРА
Противопоказания: Беременность. Частые побочные эффекты: Головная боль, головокружение. Тяжелые побочные эффекты: гиперкалиемия, острое повреждение почек, токсичность для плода. |
|||||
|
Кандесарта н
|
от 1 до 5 лет*
|
0,02 мг/кг в сутки (до 4 мг в сутки)
|
0,4 мг/кг (до 16 мг)
|
Ежедневно- два раза в день.
|
Таблетка: 4, 8, 16, 32 мг.
Экстемпоральная жидкость: 1 мг/мл. |
|
≥6 лет*
|
|||||
|
<50 кг
|
4 мг в день
|
16 мг
|
|||
|
≥50 кг
|
8 мг в день
|
32 мг
|
|||
|
Ирбесартан
|
от 6 до 12 лет
|
75 мг в день
|
150 мг
|
Ежедневно
|
Таблетки: 75, 150, 300 мг
|
|
≥13 лет
|
150 мг в день
|
300 мг
|
|||
|
Лозартан
|
≥6 лет*
|
0,7 мг/кг (до 50 мг)
|
1,4 мг/кг (до 100 мг)
|
Ежедневно
|
Таблетка: 25, 50, 100 мг
Экстемпоральная жидкость: 2,5 мг/мл. |
|
Олмесарта н
|
≥6 лет*
|
НП
|
НП
|
Ежедневно
|
Таблетка: 5, 20, 40 мг.
Экстемпоральная жидкость: 2 мг/мл. |
|
<35 кг
|
10 мг
|
20 мг
|
|||
|
≥35 кг
|
20 мг
|
40 мг
|
|||
|
Валсартан
|
≥1 года*
|
1,3 мг/кг (до 40 мг)
|
2,7 мг/кг (до 160 мг)
|
Ежедневно
|
Таблетка: 40, 80, 160, 320 мг
Экстемпоральная жидкость: 4 мг/мл. |
Примечание: АПФ: ангиотензинпревращающий фермент; НП - неприменимо; БРА: блокатор рецепторов ангиотензина.
* Педиатрическая маркировка FDA.
¶ Доза в течение 24 часов не должна превышать обычную максимальную суточную дозу для взрослых.
* Педиатрическая маркировка FDA.
¶ Доза в течение 24 часов не должна превышать обычную максимальную суточную дозу для взрослых.
Приложение 9.
Информация для пациента
Иммуноглобулин А-нефропатия (IgAN) – хроническое поражение почек, вызванное отложением в них «неправильных» иммуноглобулинов, приводящее к необратимым изменениям в органе, снижению функции почек.
Причины: В значительной доле случаев заболевание возникает после перенесенных инфекций (ангина, простуда, инфекции желудочно-кишечного тракта и др.), во время которых организм увеличивает выработку иммуноглобулинов, предназначенных для борьбы с возбудителем. Основная проблема состоит в том, что образующиеся в слизистых оболочках иммуноглобулины являются «неправильными» и, вместо выделения на поверхность слизистых, попадают в кровь, а затем в почки, вызывая их воспаление. Иммуноглобулин А нефропатия может развиваться также на фоне других аутоиммунных заболеваний (например, саркоидоз, псориаз и др.) – в этом случае заболевание является вторичным.
Осложнения: Отсутствие лечения заболевания может привести к полной утрате функции почек, сроки наступления которой определяются особенностями течения болезни в каждом конкретном случае. По мере снижения функции почек в организме развивается целый ряд изменений со стороны других органов и систем, что влияет на качество и продолжительность жизни, требует наблюдении и соответствующего лечения, включая проведение диализа.
Диагностика должна включать целый ряд вмешательств, направленных на: а) подтверждение диагноза болезни; б) уточнение степени повреждения почек; в) выявление воспалительных изменений слизистых оболочек и других заболеваний, которые способствуют развитию и прогрессированию иммуноглобулин А нефропатии (см. выше). Единственным способом подтверждения диагноза иммуноглобулин А нефропатии, оценки прогноза заболевания, выбора оптимального лечения является выполнение биопсии почки и проведение специальных микроскопических исследований образца почек.
Биопсия почки – это рутинная диагностическая процедура, осуществляемая методом прокола через кожу с целью забора 2-3 небольших образов ткани почки (длиной 5-10 мм, шириной менее 1 мм) для последующего проведения исследований под микроскопом.
Процедуру делают под местной анестезией в положении пациента лежа на животе. Под контролем ультразвукового аппарата специальная игла через прокол в коже проводится к почке, осуществляется пункция почки с получением необходимых образов ткани.
После процедуры в течение суток необходимо соблюдать постельный режим для того, чтобы в местах пункции образовался тромб.
Риски проведения в основном связаны с возможностью кровотечения из почки и образования околопочечной гематомы (скопления крови). В подавляющем большинстве случаев такие гематомы не представляет существенной угрозы и проходят самостоятельно. В редких случаях (примерно 1 на 500-1000 процедур) может потребоваться переливание крови или хирургическое вмешательство для прекращения кровотечения. Для того, чтобы минимизировать риски кровотечений, перед проведением процедуры проводят исследования свертываемости крови, которое в момент вмешательства должно быть нормальным. В подавляющем большинстве случаев польза от получения важной информации о заболевании почек, которая определяет прогноз и объем лечения, значительно перевешивает потенциальные риски осложнений биопсии.
Причины: В значительной доле случаев заболевание возникает после перенесенных инфекций (ангина, простуда, инфекции желудочно-кишечного тракта и др.), во время которых организм увеличивает выработку иммуноглобулинов, предназначенных для борьбы с возбудителем. Основная проблема состоит в том, что образующиеся в слизистых оболочках иммуноглобулины являются «неправильными» и, вместо выделения на поверхность слизистых, попадают в кровь, а затем в почки, вызывая их воспаление. Иммуноглобулин А нефропатия может развиваться также на фоне других аутоиммунных заболеваний (например, саркоидоз, псориаз и др.) – в этом случае заболевание является вторичным.
Осложнения: Отсутствие лечения заболевания может привести к полной утрате функции почек, сроки наступления которой определяются особенностями течения болезни в каждом конкретном случае. По мере снижения функции почек в организме развивается целый ряд изменений со стороны других органов и систем, что влияет на качество и продолжительность жизни, требует наблюдении и соответствующего лечения, включая проведение диализа.
Диагностика должна включать целый ряд вмешательств, направленных на: а) подтверждение диагноза болезни; б) уточнение степени повреждения почек; в) выявление воспалительных изменений слизистых оболочек и других заболеваний, которые способствуют развитию и прогрессированию иммуноглобулин А нефропатии (см. выше). Единственным способом подтверждения диагноза иммуноглобулин А нефропатии, оценки прогноза заболевания, выбора оптимального лечения является выполнение биопсии почки и проведение специальных микроскопических исследований образца почек.
Биопсия почки – это рутинная диагностическая процедура, осуществляемая методом прокола через кожу с целью забора 2-3 небольших образов ткани почки (длиной 5-10 мм, шириной менее 1 мм) для последующего проведения исследований под микроскопом.
Процедуру делают под местной анестезией в положении пациента лежа на животе. Под контролем ультразвукового аппарата специальная игла через прокол в коже проводится к почке, осуществляется пункция почки с получением необходимых образов ткани.
После процедуры в течение суток необходимо соблюдать постельный режим для того, чтобы в местах пункции образовался тромб.
Риски проведения в основном связаны с возможностью кровотечения из почки и образования околопочечной гематомы (скопления крови). В подавляющем большинстве случаев такие гематомы не представляет существенной угрозы и проходят самостоятельно. В редких случаях (примерно 1 на 500-1000 процедур) может потребоваться переливание крови или хирургическое вмешательство для прекращения кровотечения. Для того, чтобы минимизировать риски кровотечений, перед проведением процедуры проводят исследования свертываемости крови, которое в момент вмешательства должно быть нормальным. В подавляющем большинстве случаев польза от получения важной информации о заболевании почек, которая определяет прогноз и объем лечения, значительно перевешивает потенциальные риски осложнений биопсии.
Лечение иммуноглобулин А нефропатии должно быть проведено под контролем врача- нефролога. Перед началом лечения врача-нефрологу и пациенту следует обсудить предложенное лечение, чтобы четко понимать ожидаемую пользу от него и знать вероятные побочные эффекты. Иммуноглобулин А нефропатия является частным вариантом т.н. «хронической болезни почек», поэтому общие подходы к лечению патологии почек применимы также и для пациентов с иммуноглобулин А нефропатией.
В случае неблагоприятного течения Иммуноглобулин А нефропатии ее лечение может потребовать и специфических подходов, которые включают назначение лекарств, подавляющих неправильные иммунные реакции, а также выполнение тонзиллэктомии (оперативное вмешательство, суть которого заключается в удалении небных миндалин). Применение лекарственных препаратов, подавляющих неправильные иммунные реакции, имеет положительные эффекты в виде существенного снижения активности болезни и торможения снижения функции почек, но также имеет и ряд побочных эффектов.
Баланс пользы-риска при назначении лечения должен быть определен врачом-нефрологом в каждом случае индивидуально, а пациент должен получить об этом полную информацию, прежде, чем дать согласие на проведение лечения. Одним из моментов лечения иммуноглобулин А нефропатии является выполнение тонзиллэктомии (см. выше).
Наличие очагов воспаления в миндалинах может негативно влиять на прогрессирование болезни, напротив, их удаление вместе с другим лечением может остановить развитие болезни. Тонзиллэктомию проводит в условиях стационара врач-оториноларинголог под местным или общим наркозом. Реабилитация после нее в большинстве случаев проходит с минимальным количеством осложнений.
В случае неблагоприятного течения Иммуноглобулин А нефропатии ее лечение может потребовать и специфических подходов, которые включают назначение лекарств, подавляющих неправильные иммунные реакции, а также выполнение тонзиллэктомии (оперативное вмешательство, суть которого заключается в удалении небных миндалин). Применение лекарственных препаратов, подавляющих неправильные иммунные реакции, имеет положительные эффекты в виде существенного снижения активности болезни и торможения снижения функции почек, но также имеет и ряд побочных эффектов.
Баланс пользы-риска при назначении лечения должен быть определен врачом-нефрологом в каждом случае индивидуально, а пациент должен получить об этом полную информацию, прежде, чем дать согласие на проведение лечения. Одним из моментов лечения иммуноглобулин А нефропатии является выполнение тонзиллэктомии (см. выше).
Наличие очагов воспаления в миндалинах может негативно влиять на прогрессирование болезни, напротив, их удаление вместе с другим лечением может остановить развитие болезни. Тонзиллэктомию проводит в условиях стационара врач-оториноларинголог под местным или общим наркозом. Реабилитация после нее в большинстве случаев проходит с минимальным количеством осложнений.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.