Единственный желудочек сердца
 Версия: Клинические рекомендации РФ 2025 (Россия)
Версия: Клинические рекомендации РФ 2025 (Россия)
Удвоение входного отверстия желудочка (Q20.4)
Врожденные заболевания, Кардиохирургия, Кардиохирургия детская
Общая информация
Краткое описание
Разработчик клинической рекомендации
Ассоциация сердечно-сосудистых хирургов России,
Всероссийская общественная организация "Ассоциация детских кардиологов России",
Общероссийская общественная организация содействия развитию лучевой диагностики и терапии "Российское общество рентгенологов и радиологов"
Всероссийская общественная организация "Ассоциация детских кардиологов России",
Общероссийская общественная организация содействия развитию лучевой диагностики и терапии "Российское общество рентгенологов и радиологов"
Одобрено Научно-практическим Советом Минздрава России
Клинические рекомендации
Единственный желудочек сердца
Год утверждения (частота пересмотра): 2025
Пересмотр не позднее: 2027
ID: 44_3
Возрастная категория: Взрослые, Дети
Определение заболевания или состояния (группы заболеваний или состояний)
Единственный желудочек сердца (ЕЖ) – врожденный порок сердца (ВПС), характеризующийся нарушением предсердно-желудочковой связи, когда полости предсердий через митральный и трехстворчатый клапаны соединяются лишь с одним, хорошо развитым доминирующим желудочком. При этом кровообращение в малом и большом кругах осуществляется параллельно, а не последовательно, как в норме [1-3].
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
В соответствии с Международной классификацией болезней 10-го пересмотра –Врожденные аномалии (пороки развития) сердечных камер и соединений (Q20):
Q20.4 – Удвоение входного отверстия желудочка (Общий желудочек. Трехкамерное сердце. Единственный желудочек).
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
ЕЖ характеризуют при помощи классификации К. Van Praagh и соавт. (1964), за основу которой принято анатомическое строение желудочковой камеры и расположение магистральных сосудов [4] либо системы, предложенной R.H. Anderson и соавт. (1975) и характеризующей последовательность расположения камер сердца [6]. Согласно мнению К. Van Praagh, внутренняя архитектоника ЕЖ может иметь строение:
- левого желудочка;
- правого желудочка;
- левого и правого желудочков;
- выходного отдела правого желудочка, или неопределенное строение.
В один или общий желудочек открываются трехстворчатый и митральный клапаны, или общий атриовентрикулярный клапан.
При каждом анатомическом варианте расположение магистральных сосудов может быть:
- нормальным (I тип);
- аорта может быть расположена справа по отношению к легочному стволу (II тип);
- аорта может быть расположена слева по отношению к легочному стволу (III тип);
- обратное нормальному положение магистральных сосудов (IV тип).
Указанные варианты могут встречаться в условиях нормального, обратного и неопределенного расположения внутренних органов. Недостатком классификации К. Van Praagh является исключение из нее атрезии митрального и трехстворчатого клапанов. Система R.H. Anderson аналогично подчеркивает характер соединений предсердий и желудочков, утверждая, что объединяющим критерием одножелудочкового сердца является то, что соединение предсердий происходит только с одним желудочком, тогда как второй желудочек, если он присутствует, будет резко недоразвит [6,7]. При этом факт отсутствия одного атрио-вентрикулярного соединения позволяет рассматривать сердце с атрезией трехстворчатого клапана как одножелудочковое [6,7].
По данным Базы данных ВПС и Европейской Ассоциации Кардиоторакальной хирургии ЕЖ включает [5]:
- двуприточный левый желудочек;
- двуприточный правый желудочек;
- сердце с отсутствием одного атриовентрикулярного соединения (атрезия митрального клапана, атрезия трехстворчатого клапана);
- сердце с общим атриовентрикулярным клапаном и только одним полностью развитым желудочком (несбалансированный общий атриовентрикулярный канал);
- сердце только с одним полностью развитым желудочком и синдромом гетеротаксии;
- другие редкие формы одножелудочковых сердец, которые не входят в одну из указанных категорий.
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Предрасполагающими факторами формирования ЕЖ, как и прочих ВПС, являются следующие:
1) хромосомные нарушения – 5%;
2) мутация одного гена – 2-3%;
3) факторы среды (алкоголизм родителей, краснуха, лекарственные препараты и др.) – 1-2%;
4) полигенно-мультифакториальное наследование – 90%.
1) хромосомные нарушения – 5%;
2) мутация одного гена – 2-3%;
3) факторы среды (алкоголизм родителей, краснуха, лекарственные препараты и др.) – 1-2%;
4) полигенно-мультифакториальное наследование – 90%.
Считалось, что указанные причины приводят к агенезии межжелудочковой перегородки, с которой связывали возникновение ЕЖ. Однако исследования, проведенные R. Van Praagh [4], показали, что данный механизм не является универсальным, так как представляет лишь один из вариантов возникновения ЕЖ, а с точки зрения эмбриологического развития и анатомии этот порок чаще возникает тогда, когда происходит задержка развития одного или обоих желудочков сердца. Для понимания механизмов развития различных анатомических вариантов ЕЖ следует вспомнить некоторые аспекты нормального эмбриогенеза сердца. В ранней стадии развития сердца оба предсердия сообщаются с первичным желудочком, который в свою очередь сообщается с артериальным бульбусом, дающим начало артериальному стволу. Из первичного желудочка образуется левый желудочек (ЛЖ), из синусной части артериального бульбуса – приточный и основной отделы правого желудочка (ПЖ), а из конусной части — выходные тракты обоих желудочков. Следовательно, задержка развития синусной части артериального бульбуса приведет к отсутствию ПЖ, а единственная желудочковая камера приобретает строение левого желудочка. В таких случаях от ПЖ остается только выходная (инфундибулярная) камера – «выпускник», от которого, как правило, отходит тот сосуд, который должен отходить от ПЖ: при нормальном расположении магистральных сосудов — легочная артерия (ЛА), а при транспозиции магистральных артерий (ТМА) – аорта (Ао). При задержке развития первичного желудочка единственная желудочковая камера имеет строение ПЖ, а магистральные сосуды независимо от типа их взаимоотношения отходят от выходной камеры. При задержке развития первичного желудочка, синусной части артериального бульбуса и агенезии межжелудочковой перегородки единственная желудочковая полость аналогична по своему внутреннему строению выходному отделу ПЖ [1].
Особенности гемодинамических нарушений при ЕЖ определяются смешиванием потоков оксигенированной крови из легочных вен (насыщение кислородом – 95-100%) и неоксигенированной крови из системных вен (насыщение кислородом – 55-60%) в одной камере, что приводит к той или иной степени артериальной гипоксемии. При равном легочном и системном кровотоке результирующая оксигенация составит 75-80%. При возрастании легочного кровотока возрастает и системное насыщение. В свою очередь, объем кровотока через малый и большой круги кровообращения (при отсутствии анатомических сужений) определяется относительной резистентностью соответствующих сосудов. При постоянно интенсивном легочном кровотоке быстро развивается объемная перегрузка ЕЖ, обеспечивающего как системное, так и легочное кровообращение. В результате развивается застойная сердечная недостаточность (СН), желудочек теряет способность изгонять кровь против высокого системного сопротивления, и все бо́льшая часть крови рециркулирует через легочные сосуды. Длительное существование усиленного легочного кровотока приводит к изменениям в легочных сосудах вплоть до склеротических и повышению легочного сосудистого сопротивления (легочная гипертензия). В случае сопутствующего стеноза ЛА наблюдается снижение соотношения легочного и системного кровотока ниже 1,0, что приводит к значительному снижению системного насыщения, однако СН менее выражена.
При отхождении аорты от рудиментарной желудочковой камеры на пути кровотока из системного желудочка в аорту имеется так называемое бульбовентрикулярное отверстие, представляющее собой по сути дефект межжелудочковой перегородки (ДМЖП). Со временем происходит нарастание обструкции на уровне БВО (субаортальный стеноз), что затрудняет системный кровоток. В ряде наблюдений имеются одновременно препятствия на пути и системного и легочного кровотока.
В поддержании адекватной гемодинамики как малого, так и большого кругов кровообращения важную роль может играть открытый артериальный проток (дуктус-зависимые состояния) [3].
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Частота ЕЖ составляет около 0,13/1000 новорожденных, среди всех ВПС – 2,5%, среди «критических» ВПС – 5,5%, в течение первого года жизни без лечения смертность составляет 75% [1,5]. Наиболее частый вариант – двуприточный ЛЖ с ТМА [1].
Прогноз естественного течения ЕЖ неблагоприятный: без операции на первом году жизни умирают 55-67%, а к 10 годам – до 90% детей [2].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клиническая симптоматика определяется объемной перегрузкой сердца и легочной гипертензией у пациентов без сопутствующего стеноза ЛА и выраженной гипоксемией – у пациентов со стенозом ЛА.
В случае обедненного легочного кровотока с момента рождения или вскоре после него развивается цианоз. Насыщение крови кислородом составляет 70-80%. Цианоз усиливается при нагрузке (движение, плач, кормление), в том числе, по мере увеличения возраста и роста ребенка. У 10-15% пациентов отмечают одышечно-цианотические приступы; характер их такой же, как при тетраде Фалло (приступы обусловлены спазмом выводного отдела ПЖ, ограничивающими поступление крови в ЛА). Таким образом, большинство пациентов с ЕЖ находятся в тяжелом состоянии, обусловленном, в первую очередь, хронической артериальной гипоксемией. Избыточный легочный кровоток при ЕЖ встречается значительно реже. Цианоз у таких пациентов в раннем детском возрасте часто отсутствует или нерезко выражен. Нарастание цианоза у пациентов старшего детского возраста обычно связано с прогрессирующим уменьшением легочного кровотока в результате развития морфологических изменений в артериальных сосудах легких, обусловленных чрезмерным кровотоком.
У большинства пациентов присутствует одышка. В случае обедненного легочного кровотока она имеет место и в покое, также усиливаясь при нагрузке. В случае избыточного легочного кровотока одышка нередко сочетается с признаками СН, выраженной в большей или меньшей степени (от чрезмерной потливости и тахикардии до гепатомегалии, отеков, асцита и/или гидроторакса).
Постепенно происходит изменение дистальных фаланг пальцев рук по типу «барабанных палочек» и «часовых стекол», что обусловлено хронической артериальной гипоксемией. Описанные изменения фаланг пальцев кистей чаще распространены у детей, переживших двухлетний возраст, но иногда могут развиваются уже в 3-4 месяца.
В случае сопутствующих субаортального стеноза, гипоплазии дуги аорты или коарктации аорты быстро могут развиваться и прогрессировать симптомы недостаточной перфузии органов и тканей, вплоть до шока. Пациенты с одновременной обструкцией системного и легочного кровотока, как правило, нежизнеспособны.
Помимо специфической клинической картины, около 70% пациентов имеют отставание в физическом развитии, а также сколиоз.
При аускультации легких возможно выслушивание застойных хрипов, что характерно для избыточного легочного кровотока и развития СН. Картина аускультации сердца определяется, в первую очередь, наличием и степенью выраженности обструкции на уровне БВО и/или легочного ствола. Над областью сердца выслушивается систолический шум, причем у пациентов без стеноза ЛА он максимально выражен в 3-4 межреберьи. Происхождение систолического шума может быть обусловлено либо прохождением крови из системного желудочка (СЖ) через БВО в камеру-выпускник и далее – в аорту. При стенозе ЛА шум носит грубый характер и максимально выражен над основанием сердца, соответственно уровню стеноза. Систолический шум на верхушке соответствует недостаточности атриовентрикулярного клапана. Следует помнить, что ЕЖ часто сочетается с аномалиями положения сердца, которые меняют локализацию шумов [1-3,8-11].
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза:
- Данные объективного исследования: цианоз, признаки недостаточности кровообращения;
- Данные эхокардиографии / ангиокардиографии: отсутствие межжелудочковой перегородки, наличие атрио-вентрикулярных клапанов, открывающихся в ЕЖ, наличие камеры-выпускника (рудиментарного желудочка) и отходящим от нее магистральным сосудом.
1. Жалобы и анамнез
- При расспросе пациента (или их родственников в случае маленьких детей) с подозрением на единственный желудочек сердца рекомендуется определить время появления цианоза, наличия или отсутствия его прогрессирования, а также расспросить о наличии и характере одышки для верификации диагноза и оценке общего состояния [1-3,8-11].
(УУР С, УДД 5)
- При сборе анамнеза и жалоб у пациентов с подозрением на единственный желудочек сердца, для оценки степени выраженности недостаточности кровообращения (НК), рекомендуется оценить у пациента (или его родственников) наличие и характер потливости [1-3,8-12].
(УУР С, УДД 5)
2. Физикальное обследование
- Всем пациентам с подозрением на единственный желудочек сердца рекомендуется прием (осмотр, консультация) врача-детского кардиолога и/или врача кардиолога, и/или врача сердечно-сосудистого хирурга для уточнения диагноза [1-3,8-11].
(УУР С, УДД 5)
- Во время физикального обследования у пациентов с подозрением на единственный желудочек сердца рекомендуется оценить признаки хронической артериальной гипоксемии (симптом «барабанных палочек», «часовых стекол») [1-3,8-11].
(УУР С, УДД 5)
- Для косвенной оценки соотношения легочного и системного кровотока, а также тяжести состояния пациента, во время физикального обследования у пациентов с подозрением на единственный желудочек сердца, рекомендуется определить уровень системной оксигенации (насыщение крови кислородом) путем пульсоксиметрии [1-3,8-11].
(УУР С, УДД 5)
- Во время физикального обследования у пациентов с подозрением на единственный желудочек сердца, для оценки степени выраженности НК и тяжести состояния пациента, рекомендуется оценить характер и частоту дыхания [1-3,8-12].
(УУР С, УДД 5)
Комментарии: При осмотре дыхание пациента может быть физиологическим, с умеренным (втяжение межреберных промежутков) и выраженным (одышка) вовлечением вспомогательной мускулатуры.
- Во время физикального обследования у пациентов с подозрением на единственный желудочек сердца, рекомендуется аускультация легких для выявления наличия или отсутствия застойных хрипов [1-3,8-11].
(УУР С, УДД 5)
- Во время физикального обследования у пациентов с подозрением на единственный желудочек сердца, для определения характера шумов и косвенной оценки состояния легочного кровотока, рекомендуется выполнить аускультацию сердца (см. пункт 1.6) [1-3,8-12].
(УУР С, УДД 5)
- Во время физикального обследования у пациентов с подозрением на единственный желудочек сердца, рекомендуется пальпация живота для выявления наличия или отсутствия гепатомегалии [1-3,8-11].
(УУР С, УДД 5)
- Пациентам детского возраста с подозрением на ЕЖ рекомендовано для быстрой оценки степени выраженности НК использовать модифицированную шкалу оценки выраженности недостаточности кровообращения и функционального состояния у детей по Ross R.D. [12] (Приложение Г1).
(УУР С, УДД 5)
3. Лабораторные диагностические исследования
Специфической лабораторной диагностики единственного желудочка сердца нет.
- Всем пациентам с единственным желудочком сердца рекомендуется проведение общего (клинического) анализа мочи и общего (клинического) анализа крови с исследованием уровня гемоглобина в крови и оценкой гематокрита, исследованием уровня эритроцитов, лейкоцитов, тромбоцитов в крови, исследованием скорости оседания эритроцитов в рамках первичного обследования, при поступлении в стационар, в т.ч. для оперативного лечения, в процессе динамического наблюдения не менее 1 раза в год, а также в послеоперационном периоде при необходимости [1-3,8-11,79].
(УУР С, УДД 5)
- Всем пациентам с единственным желудочком сердца рекомендуется проведение анализа крови биохимического общетерапевтического (исследование уровня калия, натрия, хлоридов, глюкозы, креатинина, общего белка, альбумина, мочевины, общего и связанного (конъюгированного) билирубина, железа в сыворотке крови определение активности аспартатаминотрансферазы и аланинаминотрансферазы в крови) для оценки почечной и печеночной функции в рамках первичного обследования, при поступлении в стационар, в т.ч. для оперативного лечения, в процессе динамического наблюдения не менее 1 раза в год, а также в послеоперационном периоде при необходимости [1-3,13-16,77,78,79].
(УУР С, УДД 5)
- Всем пациентам с единственным желудочком сердца рекомендуется исследование кислотно-основного состояния и газов крови (рН, ВЕ, рСО2, рО2, SatO2, уровня лактата (исследование уровня молочной кислоты в крови) - анализ капиллярной/артериальной/венозной проб) с целью оценки тяжести гипоксемии и степени выраженности метаболических нарушений [1-3,8-11,79].
(УУР С, УДД 5)
- На этапе обследования, в т.ч. перед оперативным вмешательством, всем пациентам с единственным желудочком сердца рекомендуется исследование коагулограммы (ориентировочное исследование системы гемостаза) (оценка активированного частичного тромбопластинового времени, определение международного нормализованного отношения (МНО), исследование уровня фибриногена в крови) с целью исключения врожденных и приобретенных нарушений в системе свертывания крови, прогноза послеоперационных тромбозов и кровотечений, а также для оценки эффективности последующей (послеоперационной) тромбопрофилактики [8,17-20,37,80-82].
(УУР С, УДД 5)
Комментарии: На сегодняшний день известным фактом является наличие исходных аномалий свертывающей системы крови у пациентов с одножелудочковой гемодинамикой. При наличии у больного в предоперационном периоде геморрагического синдрома и/или лабораторных признаков нарушения свертывания крови, оперативное вмешательство целесообразно отсрочить до установления причины этих нарушений и их устранения.
- Всем пациентам с единственным желудочком сердца, которым после оперативного лечения проводится тромбопрофилактика препаратами нефракционированного или низкомолекулярного гепарина, рекомендуется лабораторный контроль эффективности применения лекарственных препаратов [37,80,82,83].
(УУР В, УДД 3)
Комментарии: При применении нефракционированного гепарина рекомендуется определение АЧТВ (оптимальный диапазон значений у взрослых – 40-60 с, у детей - 60-85 сек) и анти-Xа активности (исследование уровня гепарина в крови - оптимальный диапазон - 0,35-0,7). При применении препаратов низкомолекулярного гепарина рекомендуется определение анти-Xа активности (исследование уровня гепарина в крови: оптимальный диапазон - 0,5-1,0) [37,80,82,83].
- Всем пациентам с единственным желудочком сердца, поступающим в стационар для оперативного лечения рекомендуется определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови; определение антител к вирусу гепатита C (Hepatitis C virus) в крови; определение антител к бледной трепонеме (Treponema pallidum) в крови; определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV-1) в крови; определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-2 (Human immunodeficiency virus HIV-2) в крови для исключения ассоциации с ВИЧ-инфекцией, гепатитом и сифилисом [2,8,11,84].
(УУР С, УДД 5)
- Всем пациентам с единственным желудочком сердца, поступающим в профильный стационар для оперативного лечения порока, которым предполагается переливание донорской крови и(или) ее компонентов, рекомендуется определение основных групп по системе AB0, определение антигена D системы Резус (резус-фактор), определение фенотипа по антигенам C, c, E, e, Cw, K, k и определение антиэритроцитарных антител [2,8,11,85,86].
(УУР С, УДД 5)
4. Инструментальные диагностические исследования
- На этапе обследования, в т.ч. перед оперативным вмешательством, всем пациентам рекомендуется регистрация электрокардиограммы (ЭКГ) для исключения нарушений ритма и проводимости, а также ишемии миокарда [1-3,8-11,21].
(УУР С, УДД 4)
Комментарии: Наиболее закономерным является отклонение электрической оси сердца вправо (у более 70% пациентов) с признаками гипертрофии ПЖ (у более 94% пациентов). У 50% пациентов отмечаются также признаки гипертрофии ЛЖ. Характерными для ЕЖ являются высоковольтная ЭКГ в грудных отведениях, за исключением V1, преобладание зубцов S над зубцами R или равнозначные комплексы RS. У пациентов с ТМА может отмечаться отсутствие зубцов Q в левых и наличие их в правых грудных отведениях. Для пациентов с ЕЖ в значительной степени характерны нарушения проводимости и ритма различного характера.
- На этапе обследования, в т.ч. перед оперативным вмешательством, всем пациентам с ЕЖ рекомендуется выполнение прицельной рентгенографии органов грудной клетки с целью оценки размеров и конфигурации сердца, оценки состояния малого круга кровообращения, а также определения участков гипо- или гипервентиляции легких [1-3,8-11].
(УУР С, УДД 5)
Комментарии: У всех пациентов с ЕЖ, независимо от расположения магистральных артерий, наблюдается расширение тени сердца в поперечнике. В большей степени оно выражено у пациентов с увеличенным легочным кровотоком. Нередко имеют место признаки увеличения ПЖ, реже – левого. У всех пациентов имеет место увеличение правого предсердия. У пациентов с необструктивным легочным кровотоком наблюдается усиление легочного рисунка и расширение корней легких. В периферических отделах легочный рисунок представлен узкими артериальными сосудами, также отмечается симптом «ампутации» крупных артериальных ветвей (картина высокой легочной гипертензии). У пациентов с нормальным расположением магистральных артерий или расположении их, как при полной транспозиции со стенозом ЛА, в передне-задней проекции, в области второй дуги, отмечается западение, аналогичное тому, которое обычно имеет место при тетраде Фалло. При корригированной ТМА левый контур сердца не дифференцируется на первую и вторую дуги и представлен непрерывной, слегка выпуклой или прямой тенью, что связано с левосторонним расположением восходящей Ао. При этом у пациентов со стенозом ЛА по левому контуру сердца определяется выбухание третьей дуги, обусловленное расположением в этой области корня Ао и камеры-выпускника.
- Эхокардиография (ЭхоКГ) рекомендуется всем пациентам с подозрением на ЕЖ как ведущий метод диагностики, позволяющий установить окончательный диагноз [1-3,8-11].
(УУР С, УДД 5)
Комментарии: Регистрируется отсутствие межжелудочковой перегородки и наличие атрио-вентрикулярных клапанов, открывающихся в ЕЖ. Удается определить камеру-выпускник и отходящий от нее магистральный сосуд. При нормальном расположении магистральных артерий определяется митрально-аортальное соединение, при ТМА – митрально-легочное. При проведении ЭхоКГ необходимо обратить внимание на следующие моменты: 1) оценка морфологии ЕЖ (левая или правая), его объема и сократительной функции, положение рудиментарного желудочка; 2) положение магистральных артерий, их размеры, анатомия полулунных клапанов; 3) при дискордантном положении магистральных артерий – размеры БВО и соотношение его с кольцом аортального клапана; 4) анатомия АВ клапанов, степень их недостаточности/стеноза; 5) размеры межпредсердного сообщения (МПС), открытого артериального протока (ОАП), направление сброса через них; 6) наличие сопутствующих пороков (коарктация Ао, перерыв дуги Ао, аномальный дренаж системных и легочных вен).
- Компьютерная томография (КТ) сердца с контрастированием рекомендуется пациентам с подозрением на ЕЖ в критическом состоянии перед оперативным вмешательством [8-11,14,22].
(УУР С, УДД 5)
Комментарии: Помимо уточнения диагноза, КТ сердца и сосудов с контрастированием позволяет оценить индексы развития легочных артерий (Nakata, McGoon, Reddy), а также легочно-венозного индекса.
- Рекомендуется выполнение магнитно-резонансной томографии (МРТ) сердца с контрастированием и МРТ сердца и магистральных сосудов пациентам при сложных врожденных пороках сердца (ВПС) для определения тактики и сроков хирургического вмешательства и при рутинном обследовании после операции, срок и кратность проведения определяется в индивидуальном порядке (3-5 лет) в зависимости от данных ЭхоКГ при ежегодном наблюдении для получения объемных данных сердца, определения функции желудочков и объема регургитации [8-11,14].
(УУР С, УДД 5)
Комментарии: МРТ сердца, является наиболее точным методом оценки функции сердца и методом, визуализирующим фиброз миокарда. МРТ сердца в настоящее время рассматривается как «золотой стандарт» визуализации для оценки функции камер сердца. МРТ является уникальным методом, позволяющим при использовании контрастирования неинвазивно оценить очаговый и диффузный фиброз миокарда.
- Рекомендуется проведение ангиокардиографии (АКГ) (чрезвенозной катетеризации сердца, зондирования камер сердца, катетеризации аорты) пациентам с ЕЖ в случаях необходимости [1,8,10,11,23]:
- уточнения диагноза при недостаточности данных, полученных в ходе ЭхоКГ, КТ и/или МРТ;
- оценки размеров легочных артерий;
- оценки наличия дополнительных источников кровоснабжения легких (аорто-легочные, артерио-венозные или вено-венозные коллатерали);
- определения легочно-сосудистого сопротивления;
- выявления обструкции кровотока по венозным и артериальным сосудам;
- коронароангиографии, при наличии ишемических изменений выявленных другими методами.
(УУР С, УДД 5)
Комментарии: Обследование включает измерение давления и насыщения кислородом в ЛА (наибольшее значение имеет оценка среднего давления), Ао, предсердиях, СЖ, определение легочного и системного кровотока, легочного сосудистого сопротивления (ЛСС). ЛСС – показатель, производный от давления в ЛА, оценивающий возможности легочных артерий отвечать на увеличение объема. В большинстве случаев операции, выполняемые с целью коррекции ЕЖ, направлены на увеличение легочного кровотока, поэтому определение давления в ЛА и ЛСС – важные моменты лечебно-диагностического поиска, влияющие на выбор последующей хирургической тактики. Ангиокардиография позволяет оценить анатомию магистральных артерий, гипертрофию миокарда. Для решения вопроса о выборе метода хирургического лечения чрезвычайно важна вентрикулография. Она позволяет создать представление о величине БВО, объеме полости гипоплазированного желудочка, тяжести легочного стеноза, состоятельности АВ клапанов, характере расположения магистральных артерий. При введении контраста в ЕЖ, независимо от наличия или отсутствия стеноза ЛА, определяется большая полость желудочка, занимающая практически всю область сердечной тени как в передне-задней, так и в боковой проекции. Значительно чаще в ЕЖ обнаруживаются гладкие внутренние контуры, что соответствует архитектонике левого желудочка, реже – грубая трабекулярность, свойственная правому желудочку. В соответствии с номенклатурой медицинских услуг исследование включает: катетеризация аорты, ангиографию легочной артерии избирательную, ангиографию легочной артерии и ее ветвей, зондирование камер сердца, флебографию верхней полой вены, флебографию нижней полой вены, вентрикулографию сердца, коронарографию (у отдельной категории пациентов в соответствии с текстом рекомендации).
5. Иные диагностические исследования
- Перед выпиской из стационара всем пациентам с целью контроля после выполненного оперативного вмешательства рекомендуется выполнить регистрацию электрокардиограммы [24,25].
(УУР С, УДД 5)
- Перед выпиской из стационара всем пациентам с целью контроля после выполненного оперативного вмешательства рекомендуется выполнить эхокардиографию [24,25].
(УУР С, УДД 5)
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
1. Консервативное лечение
Консервативные мероприятия направлены на регулирование резистентности легочных или системных сосудов.
- У новорожденных с резко обедненным легочным кровотоком рекомендуется применение простагландинов для поддержания проходимости ОАП [3,26,27].
(УУР С, УДД 5)
Комментарии: Среди препаратов наиболее распространено применение #алпростадила** (применение у детей вне зарегистрированной инструкции). Препарат вводится внутривенно, как правило, в условиях отделения реанимации. Начальная доза составляет 0,02 мкг/кг/мин с возможностью увеличения до 0,05-0,1 мкг/кг/мин, поддерживающая доза – 0,002 мкг/кг/мин [25]. Срок терапии определяется индивидуально.
- Рекомендуется применение диуретиков, с целью лечения СН, осложняющей течение ЕЖ, в том числе, – при отсутствии отечного синдрома [3,28-31].
(УУР С, УДД 5)
Комментарий: Наиболее часто применяются возрастные дозировки #фуросемида** (противопоказано применение таблетированной лекарственной формы у детей до 3-х лет), доза у детей – внутривенно 0,5-2 мг/кг или per os 1-2 мг/кг каждые 6-12 часов [29,31]; #спиронолактона**, доза у детей – 1-4 мг/кг/сутки [30,31].
- В ранние сроки после системно-легочного анастомоза (СЛА), а также после гемодинамической коррекции (двунаправленный кавопульмональный анастомоз (ДКПА) или операции Фонтена) (см. пункт 3.2.1) пациентам рекомендуется проведение тромбопрофилактики препаратами низкомолекулярного или нефракционированного гепарина [20,32-37,80,82,83].
(УУР В, УДД 3)
Комментарии: Тромбоэмболические осложнения занимают одно из ведущих мест в структуре как ранней, так и отдаленной смертности после гемодинамической коррекции. С одной стороны, после операций «обхода» правых отделов сердца создаются условия для уменьшения скорости и изменения фазности кровотока, с другой стороны, доказанным фактом является активация и повреждение эндотелия. Совокупность указанных причин повышает вероятность тромбозов после операции, риск которых возрастает у пациентов с эпизодами тромбозов в анамнезе, тромбофилиями, инфекционными осложнениями, полиорганной недостаточностью [80].
Тромбопрофилактика нефракционированным гепарином натрия** должна быть инициирована болюсом, который у взрослых составляет 80 Ед/кг, у детей – 75 Ед/кг с последующей внутривенной инфузией со скоростью: у детей младше 1 года – 28 Ед/кг/ч, у детей старше 1 года – 20 Ед/кг/ч, у взрослых - 18 Ед/кг/ч. Коррекция дозы производится на основании результатов лабораторных исследований (см. п 2.3, приложение А3) [37].
Тромбопрофилактика препаратами низкомолекулярного гепарина проводится из расчета: #эноксипарин** (off-label у детей до 18 лет) у детей младше 2 месяцев – 0,75 мг/кг, у детей старше 2 месяцев – 0,5 мг/кг, у взрослых – 20 мг через 12 часов подкожно, дальтепарин** – у детей от 1 месяца до 2 лет 150 Ед/кг, от 2 до 8 лет – 125 Ед/кг, старше 8 лет – 100 Ед/кг, у взрослых – 2500 Ед через 12 часов подкожно. Фондапаринукс** может применяться у детей старше 1 года в дозе 0,1 мг/кг, у взрослых 2,5 мг в сутки подкожно. Коррекция дозы производится на основании результатов лабораторных исследований (см. п 2.3) [37,80,82,83].
- Рекомендуется контроль уровня тромбоцитов крови у пациентов в случае применения гепарина натрия** свыше 5 суток с целью исключения гепарин-индуцированной тромбоцитопении [35-37].
(УУР С, УДД 5)
Комментарии: контроль уровня тромбоцитов крови оптимально выполнять с частотой 1 раз в три дня [35-37].
- Пациентам с единственным желудочком сердца после СЛА рекомендуется тромбопрофилактика [37,80,82,83].
(УУР А, УДД 3)
Комментарии: в раннем послеоперационном периоде тромбопрофилактика должна осуществляться препаратами нефракционированного или низкомолекулярного гепарина (см. выше), а в дальнейшем – ацетилсалициловой кислотой** в дозе 1-5 мг/кг [37].
- Пациентам с единственным желудочком сердца после выполнения ДКПА или операции Фонтена рекомендуется пожизненная тромбопрофилактика [20,32,35-38,80,82,83,87].
(УУР А, УДД 3)
Комментарии: в раннем послеоперационном периоде тромбопрофилактика должна осуществляться препаратами нефракционированного или низкомолекулярного гепарина (см. выше), а в дальнейшем – антагонистами витамина К с начальной дозы 0,2 мг/кг с дальнейшей коррекцией дозы под контролем МНО (оптимальный диапазон – 2,0-3,0) [37] или #ривароксабаном** (off-label у детей до 18 лет) в дозе 0,2-0,3 мг/кг/сут под контролем анти-Xа-активности (исследование уровня гепарина в крови: оптимальный диапазон – 0,5-1,0) [87].
2. Хирургическое лечение
Хирургическая коррекция ЕЖ носит паллиативный (одножелудочковый) характер. Выбор той или иной паллиативной операции зависит в основном от состояния кровотока в малом круге кровообращения.
Этап хирургического лечения
Основные цели данного этапа – максимально сбалансировать системный и легочный кровоток, обеспечить беспрепятственное смешивание крови на уровне предсердий, обеспечить необструктивный выход из СЖ [1].
Среди паллиативных операций выделяют следующие:
- Процедура Рашкинда (баллонная атриосептостомия) рекомендуется в качестве неотложной меры помощи у новорожденных при наличии рестриктивного МПС у пациентов с гемодинамикой, зависящей от размеров МПС, в т.ч. при обструкции на уровне атриовентиркулярных клапанов [1-3,8].
(УУР С, УДД 5)
Комментарии: Под рестриктивным МПС понимается наличие сообщения на уровне предсердий, при котором существует разность давлений между правым и левым предсердиями. В этом случае может иметь место сопротивление кровотоку на уровне данного МПС.
- Суживание ЛА (операция Muller) и перевязка ОАП (при его наличии) рекомендуется в периоде новорожденности при резко увеличенном легочном кровотоке с целью ограничения легочного кровотока и «защиты» малого круга кровообращения от развития склеротических изменений [1,2,8,10,11,23,33,35].
(УУР С, УДД 5)
Комментарии: Избыточный легочный кровоток способствует развитию тяжелой СН и высокой легочной гипертензии. Указанные вмешательства выполняются в возрасте до 6 мес. жизни либо позднее, после оценки ЛСС.
- Рекомендуется создание СЛА (создание анастомоза между подключичной артерией и легочной артерией) у пациентов в периоде новорожденности при насыщении крови кислородом менее 70-75% [1,2,8,10,11,23,33,35].
(УУР С, УДД 5)
Комментарии: Выраженная гипоксемия часто характерна для тяжелого стеноза ЛА (нередко при ОАП-зависимом легочном кровотоке). Предпочтительное выполнение СЛА – в возрасте до 3-х месяцев.
Гемодинамическая коррекция
Следующим этапом выполняется так называемая «гемодинамическая» (одножелудочковая) коррекция, заключающаяся в создании тотального кавопульмонального анастомоза (синоним: «полный обход» правого сердца). Цель данного этапа – снижения преднагрузки СЖ и увеличение системной оксигенации [2,8].
- В качестве первого этапа гемодинамической коррекции у детей рекомендуется выполнение ДКПА (создание кавопульмонального анастомоза) [1,2,8,10,11,23].
(УУР С, УДД 5)
Комментарии: ДКПА заключается в создании анастомоза «конец в бок» между верхней полой веной (ВПВ) и соответствующей главной ветвью ЛА. Предпочтительное выполнение – в возрасте от 4-х мес до 1 года. В большинстве случаев после ДКПА насыщение крови кислородом устанавливается в пределах 80%. В качестве альтернативы ДКПА может выступать операция Hemi-Fontan – создание широкого анастомоза между ВПВ, ПП и легочной артерией. Последний вариант предпочтителен, если в качестве ТКПА планируется латеральный тоннель.
- В качестве второго (заключительного) этапа гемодинамической коррекции у детей рекомендуется выполнение анастомоза между нижней полой веной (НПВ) и ЛА (создание кавопульмонального анастомоза) [1,2,8,10,11,23].
(УУР С, УДД 5)
Комментарии: Выполнение одномоментного тотального кавопульмонального анастомоза сопровождалось высокой летальностью, поэтому было предложено разделить операцию на 2 самостоятельных этапа. Данная тактика позволила существенно улучшить результаты гемодинамической коррекции. Наиболее распространенной в настоящее время модификацией операции Фонтена является использование сосудистого протеза (протез кровеносного сосуда синтетический***), имплантированного непосредственно между НПВ и ЛА (модификация экстракардиального кондуита). В качестве альтернативы данной методике (например, при синдроме гетеротаксии и аномалиях венозного возврата) может выступать тотальный кавопульмональный анастомоз в модификации латерального тоннеля. Для снижения риска операции Фонтена нередко она дополняется фенестрацией между системой кавопульмонального тракта и предсердием.
-
Рекомендуется соблюдение следующих возрастных критериев при планировании гемодинамической коррекции [41-47]:
- для ДКПА – не менее 4 мес.;
- для операции Фонтена – не менее 2-х лет.
(УУР C, УДД 4)
Комментарии: Ранний возраст на сегодняшний день не является фактором, препятствующим выполнению ДКПА, тем не менее до настоящего времени оптимальные сроки операции не определены. Одни авторы рекомендуют ДКПА до 6 месяцев, объясняя это пользой от ранней «разгрузки» СЖ, но не ранее 3 месяцев [19-21,23], другие считают оптимальным его создание в промежутке от 6 месяцев до 2 лет, что связывают с максимальным приростом насыщения крови кислородом после процедуры в данной возрастной группе [25,26]. Сомнения, связанные с выполнением операции до 3 месяцев, оправданны и связаны с более высоким ЛСС у таких детей, возможным повышением частоты осложнений и летальности, неуверенностью в адекватном росте легочных артерий после операции и риском неблагоприятного влияния процедуры на мозговое кровообращение [41,43-45,47]. «Возраст» выполнения операции Фонтена так же оспаривается. Одни авторы склоняются к выполнению данного этапа в более старшем возрасте, объясняя это ограниченным «сроком службы» нефизиологичного одножелудочкового кровообращения и неизбежной его декомпенсацией. При этом основными показаниями к операции выступают такие факторы, как прогрессирование системной гипоксемии и снижение толерантности к физической нагрузке. Другие же, наоборот, стараются перейти к тотальному кавопульмональному анастомозу в более ранние сроки, объясняя подобную тактику пользой от уже упомянутого раннего снижения преднагрузки СЖ [41,43]. Средний оптимальный возраст для операции Фонтена в модификации ЭКК – 3-4 года при весе более 15 кг., что как правило позволяет разместить в грудной клетке ребенка протез оптимального размера (18-20 мм). Для латерального тоннеля возраст и масса пациента важны не в той же мере, так как при данной модификации не используется протез.
-
Рекомендуется соблюдение критериев адекватного развития легочного артериального русла у пациентов при планировании гемодинамической коррекции [48-50]:
- индекс Nakata ≥ 200 мм2/м2;
- индекс McGoon ≥ 1,5;
- индекс Reddy ≥ 90 мм2/м2.
(УУР C, УДД 4)
Комментарии: Несмотря на вышеуказанные ориентировочные показатели развития легочного артериального русла считается, что небольшие размеры ЛА (индексы Nakata ≤ 100 мм2/м2 и McGoon ≤ 1,2) не оказывают значимого влияния на ранние результаты гемодинамической коррекции [48]. Как известно, размеры ЛА могут зависеть от количества крови, притекающей к ним [49], поэтому абсолютные их значения, возможно, и не самый важный фактор риска [50]. Очевидно, что более важным фактором может являться функциональная способность ЛА отвечать на увеличение кровотока в легкие после операции, выражающаяся в ЛСС (см. пункт 2.4).
Для достижения наиболее оптимальных результатов операции рекомендуется выполнение гемодинамической коррекции у пациентов с сопоставимыми размерами полых вен и легочных артерий [2,8,23].
(УУР С, УДД 5)
-
При планировании гемодинамической коррекции у пациентов рекомендуется придерживаться следующих значений показателей гемодинамики малого круга кровообращения [2,8,23]:
- среднее давление в ЛА ≤ 15 мм рт.ст;
- легочное сосудистое сопротивление ≤ 4 Ед/м2;
(УУР С, УДД 5)
- У пациентов с выраженной АВ недостаточностью (более 2 степени) рекомендуется ее коррекция до гемодинамической коррекции или на ее этапах [2,8,23].
(УУР С, УДД 5)
Комментарии: Допустимой и не требующей коррекции степенью АВ недостаточности считается умеренная (1-2).
- Пациентам с субаортальной обструкцией, встречающейся при сопутствующем дискордантном (не от тождественного желудочка) отхождении Ао, рекомендуется устранение обструкции на этапах гемодинамической коррекции [2,8,23,51,52].
(УУР C, УДД 4)
Комментарии: Показания к коррекции субаортальной обструкции определяются наличием градиента систолического давления между СЖ и Ао, рестриктивного ДМЖП (признак рестриктивности ДМЖП – площадь сечения дефекта менее 2 см2/м2), соотношения диаметров ДМЖП и фиброзного кольца аортального клапана. Хирургическая тактика заключается либо в расширении ДМЖП, либо в выполнении процедуры Damus-Kaye-Stansel одновременно с гемодинамической коррекцией. После расширения ДМЖП нередко отмечены АВ блокады 3 степени, ввиду чего выполнение операции Damus-Kaye-Stansel, при соблюдении показаний, предпочтительно. Одним из ключевых критериев возможности выполнения операции Damus-Kaye-Stansel является сохранение компетентности клапана ЛА.
-
Выполнение гемодинамической коррекции рекомендуется при следующих значениях показателей сократительной функции сердца у пациентов [2,8,23,53]:
- фракция выброса > 55%;
- конечно-диастолическое давления ≤ 12 мм рт.ст.
(УУР C, УДД 5)
Комментарии: Косвенным признаком компрометирования сократительной функции СЖ является индекс его конечно-диастолического объема (мл/м2). В ряде работ отмечена связь исходного увеличения конечно-диастолического объема СЖ и угнетения его сократительной функции в послеоперационном периоде.
- При планировании гемодинамической коррекции у пациентов рекомендуется оценка дополнительных источников легочного кровотока (ДИЛК; синоним: гибридный легочный кровоток) [2,8,22].
(УУР С, УДД 5)
Комментарии: ДИЛК могут быть оценены в ходе КТ органов грудной полости с внутривенным болюсным контрастированием, ангиографии грудной аорты ретроградной, катетеризации аорты. При выполнении ДКПА решение о сохранении или устранении ДИЛК в каждом случае носит индивидуальный характер. ДИЛК на этапе ДКПА может быть сохранен при тенденции к снижению насыщения крови кислородом менее 80% и стабильных показателей центральной гемодинамики (среднее давление в ЛА ≤ 15 мм рт. ст., отсутствие прогрессирующей гипотонии). Оценка показателей проводится непосредственно после ДКПА, в условиях концентрации кислорода во вдыхаемой смеси в пределах 21-30%. При увеличении насыщения крови кислородом свыше 90% выполняется пробное пережатие дополнительных источников, руководствуясь далее уровнем насыщения крови кислородом (целевое значение 80-90%). При сохраняющейся необходимости сохранения гибридного легочного кровотока предпочтение отдается антеградному источнику (легочный ствол). В ряде ситуаций, в основном по причине устьевых стенозов той или иной ветви ЛА, возможно сохранение одновременно двух источников легочного кровотока – антеградного и СЛА или ОАП дистальнее места стеноза ЛА.
- У ряда пациентов со сложными ВПС и высоким риском операции Фонтена, в силу тех или иных анатомо-гемодинамических факторов, возможно рекомендовать выполнение различных паллиативных вмешательств: суживание легочной артерии, системно-легочное шунтирование или ДКПА с ДИЛК (СЛА, аксиллярный артериовенозный анастомоз) в качестве «окончательного» этапа гемодинамической коррекции или «моста» к пересадке сердца [2,3,8,10,11,23,54].
(УУР С, УДД 5)
- Сохранение ДИЛК на этапе операции Фонтена нередко приводит к венозной гипертензии и развитию НК, поэтому рекомендуется устранение ДИЛК (при наличии) всем пациентам на этапе операции Фонтена [2,8,23].
(УУР С, УДД 5)
Комментарии: в качестве ДИЛК могут выступать аорто-легочные коллатеральные артерии, функционирующие системно-легочные анастомозы, антеградный легочный кровоток. Аорто-легочные коллатеральные артерии устраняют перед операцией Фонтена в ходе ангиографии грудной аорты ретроградной, катетеризации аорты. Системно-легочные анастомозы, антеградный легочный кровоток устраняются посредством лигирования анастомозов, легочного ствола во время операции Фонтена.
- Для достижения наиболее оптимальных результатов операции при планировании гемодинамической коррекции рекомендуется оценка состояния венозного системного и легочного оттока у пациентов [2,8,23].
(УУР С, УДД 5)
Комментарии: В случае обнаружения препятствий на пути венозного оттока хирургическая тактика определяется индивидуально. Наиболее частыми причинами обструкции венозного оттока являются аномальный дренаж легочных вен, стенозы устьев легочных вен, рестриктивное МПС.
- Для достижения наиболее оптимальных результатов гемодинамической коррекции рекомендуется устранение факторов, способствующих обструкции венозного оттока на любом этапе при его выявлении [2,8,23].
(УУР С, УДД 5)
- Выполнение первичного ДКПА рекомендуется у пациентов без критического стеноза ЛА и ОАП-зависимого легочного кровотока с уровнем системного насыщения > 70-75%, без избыточного легочного кровотока (среднее давление в легочной артерии < 15 мм рт. ст.) [2,8,23].
(УУР С, УДД 5)
- При значимых локальных стенозах ветвей ЛА пациентам рекомендуется коррекция стенозов эндоваскулярными методами (транслюминальная баллонная ангиопластика легочных артерий и/или стентирование легочных артерий) или при помощи открытых операций (иссечение стеноза легочной артерии) одномоментно с этапами гемодинамической коррекции [2].
(УУР С, УДД 5)
Комментарии: В случае эндоваскулярных методов коррекции стенозов ветвей ЛА необходим строгий контроль состояния проходимости главных бронхов.
- При планировании заключительного этапа гемодинамической коррекции пациентам с пограничными размерами ЛА (индекс Nakata ≤ 200 мм2/м2), повышенном среднем давлении в ЛА (15-18 мм рт. ст.), низком легочно-венозном индексе (< 200 мм2/м2) рекомендуется воздержаться от операции Фонтена [2,8,22,23].
(УУР С, УДД 5)
Комментарии: В пограничных ситуациях следует рассмотреть возможность создания ДИЛК (например, СЛА, аксиллярного артериовенозного анастомоза).
- Не рекомендуется выполнение операции Фонтена пациентам при склеротических изменениях сосудов легких и выраженной дисфункции СЖ, а так же при поражениях паренхимы печени с признаками венозного застоя [1,42-44].
(УУР C, УДД 5)
Комментарии: Объективными критериями состояния сосудов легких являются среднее ДЛА и ЛСС, функции системного желудочка – фракция выброса, конечно-диастолическое давление, индекс конечно-дистолического объема.
- Трансплантация сердца рекомендуется пациентам при тяжелой дисфункции СЖ [8,23,33,35,55-57].
(УУР С, УДД 4)
Послеоперационные осложнения
Наиболее частыми ранними осложнениями после гемодинамической коррекции являются неврологические нарушения, дыхательная недостаточность, венозная гипертензия и синдром верхней полой вены, повышенная транссудация, нарушение лимфоотока [44,46,58].
- Для снижения риска послеоперационных осложнений рекомендуется ранняя (1-е сутки после операции) экстубация пациентов после гемодинамической коррекции [59-64].
(УУР C, УДД 4)
Комментарии: Основные осложнения нередко связывают с повышением венозного давления в кавопульмональном тракте, что в свою очередь может быть обусловлено колебанием ЛСС в раннем послеоперационном периоде и недостаточной компенсацией легочного кровообращения к увеличению кровотока. Искусственная вентиляция легких повышает внутригрудное давление и замедляет венозный возврат по системным венам, что является дополнительным фактором повышения венозного давления.
Среди отдаленных осложнений после гемодинамической коррекции наиболее важными являются венозная гипертензия, нарушения ритма сердца, белково-дефицитная энтеропатия, печеночная дисфункция, тромбоэмболические осложнения [2,8].
Венозная гипертензия является основной причиной развития и прогрессирования НК (гепатомегалии, асцита, гидроторакса, периферических отеков, цианоза) в средне-отдаленные сроки после операции Фонтена. К факторам, повышающим вероятность развития венозной гипертензии, относятся стенозы ЛА, ДИЛК, недостаточность АВ клапана, стенозы полых вен или сосудистого протеза между НПВ и ЛА (например, вследствие «перероста» протеза), развитие венозных коллатералей, дисфункция СЖ, белково-дефицитная энтеропатия (БДЭП), ТЭО, печеночной недостаточности [2].
- Рекомендуется устранение локальных стенозов ЛА (транслюминальная баллонная ангиопластика легочных артерий и/или стентирование легочных артерий, и/или иссечение стеноза легочной артерии) в случае их развития у пациентов после тех или иных этапов гемодинамической коррекции [2,10,11,23].
(УУР С, УДД 5)
Комментарии: В большинстве случаев их устранение возможно эндоваскулярным способом.
- Рекомендуется эндоваскулярное устранение ДИЛК в случае их реканализации или развития после ДКПА или операции Фонтена при стойких признаках НК [2,10,11,23].
(УУР С, УДД 5)
Комментарии: Аорто-легочные коллатеральные артерии могут быть не диагностированы до операции или же развиваться в ранние или отдаленные сроки после неё. Реканализация ствола ЛА может происходить спустя 1-2 года после операции (положение справедливо для случаев, где легочный ствол был перевязан интраоперационно, и неактуально для пациентов с сопутствующей атрезией легочной артерии).
- При прогрессировании недостаточности АВ клапана более, чем умеренной степени пациентам рекомендуется проведение корригирующей операции [2,10,11,23].
(УУР С, УДД 5)
Комментарии: Коррекция недостаточности АВ клапана может быть выполнена как отдельная процедура, так и одновременно с операцией Фонтена. В ряде случаев это осложнение возникает в отдаленном послеоперационном периоде вследствие перенесенного инфекционного эндокардита или дилатации фиброзного кольца клапана в результате прогрессирующей дисфункции СЖ.
- После операции Фонтена в модификации ЭКК пациентам рекомендуется операция по замене сосудистого протеза в случае развития венозной гипертензии вследствие недостаточного размера кондуита относительно роста и развития пациента [2,10,11,23].
(УУР С, УДД 5)
- Для увеличения насыщения крови кислородом в случае развития венозных коллатералей после ДКПА пациентам рекомендуется их эмболизация (эмболизация вено-венозных фистул) [2,10,11,23].
(УУР С, УДД 5)
Комментарии: При отсутствии таких факторов, как выраженная недостаточность АВ клапанов, остаточные стенозы ЛА и повышенное давление в малом круге кровообращения результаты операции ДКПА хорошие. Однако по мере роста пациента происходит постепенно снижение насыщения артериальной крови кислородом, что обусловлено возрастным уменьшением доли венозного возврата по системе ВПВ, а также развитием легочных артериовенозных фистул. Прогрессирующий цианоз в отдаленные сроки после операции ДКПА может быть связан также с развитием коллатеральных сосудов между системами верхней и нижней полых вен, обусловленным разницей давления между ними, приводящей к сбросу крови из ВПВ в НПВ и уменьшению легочного кровотока. Гемодинамическими причинами этого осложнения также могут быть обструкция легочного кровотока на различных уровнях, повышение ЛСС, дисфункция СЖ или АВ клапанов, тромбоз полых вен и другие факторы, приводящие к повышению венозного давления. По данным A. Magee и соавт. венозные коллатеральные сосуды развиваются в 31% случаев после операции ДКПА. Наиболее часто в роли коллатеральных сосудов выступают непарная и полунепарная вены, а также вены перикарда и передней грудной стенки. Эмболизация венозных коллатералей является эффективным методом повышения насыщения крови кислородом в случаях, когда риск выполнения операции Фонтена повышен.
- Рекомендуется трансплантация сердца пациентам при выраженной дисфункции СЖ, рефрактерной к консервативной терапии [2].
(УУР С, УДД 5)
Комментарии: Дисфункция СЖ может быть обусловлена как его морфологией, так и исходной тяжестью порока или перенесенными инфекционными заболеваниями (в т.ч. миокардитом) в послеоперационном периоде [6].
- Пациентам рекомендуется немедленная госпитализация в стационар при подозрении на БДЭП [2,55,56].
(УУР С, УДД 3)
Комментарии: Под термином «белок-дефицитная энтеропатия» подразумевается состояние, характеризующееся нарушением всасывания белка в тонком кишечнике. Частота этого осложнения составляет в среднем 3,8%. Сроки развития БДЭП составляют от 1 месяца до 16 лет (в среднем 2,7 года), при этом у одной трети пациентов осложнение развивается в сроки свыше 5 лет после операции. Причины развития БДЭП после операции Фонтена до сих пор изучены не полностью. Одним из вероятных механизмов является развитие лимфангиоэктазий в органах брюшной полости, в том числе и в кишечнике в результате постоянно повышенного венозного и лимфатического давления после операции Фонтена. Клинически БДЭП проявляется гипоальбуминемией, и как следствие этого, отеками, асцитом, плевральной транссудацией или хилотораксом, иммунодефицитом и гипокальциемией. На поздних стадиях развития большинство проявлений этого осложнения соответствует клинической картине НК. Методом ранней диагностики БДЭП является определение уровня фекального α1-антитрипсина, концентрация которого при БДЭП существенно повышается. Прогноз в случае развития БДЭП, как правило, неблагоприятный. В большинстве работ отмечается высокая летальность среди этих пациентов. Если в течение 5 лет с момента развития осложнения выживаемость составляет около 60%, то через 10 лет остаются в живых менее 20% пациентов.
Медицинская реабилитация
Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
- Пациентам с ЕЖ после любого из этапов хирургической коррекции рекомендуется в течение 3-х последующих месяцев жизни избегать тракционных нагрузок на верхние конечности [66].
(УДД 5, УУР С)
Комментарии: Целесообразно избегать чрезмерных физических нагрузок (импульсивные, силовые игры, быстрый бег, поднятие тяжестей), особенно следует избегать избыточной нагрузки на пояс верхних конечностей (способствует правильному срастанию грудины).
- Всем пациентам с ЕЖ после каждого этапа хирургического лечения рекомендуется выполнение реабилитационных мероприятий длительностью не менее 6 недель в рамках индивидуальной схемы [66].
(УДД 5, УУР С)
Комментарии: прохождение реабилитации в большинстве случаев возможно на дому при условии периодического контроля состояния пациента педиатром по месту жительства (1 раз в 2-3 недели). Оптимальная длительность реабилитационного периода составляет 10-12 недель. Если реабилитация неэффективна, требуется подбор индивидуальной программы или частый контроль профильного специалиста, то необходимо рассмотреть вопрос об отправке пациента в специализированный реабилитационный центр.
- В рамках реабилитационного становления, в сроки до 3-х месяцев после хирургического лечения ЕЖ пациентам рекомендуется ограничение по употреблению жидкости [66].
(УУР С, УДД 5)
Комментарии: Употребление жидкости (особенно в течение первого месяца после операции) регламентируется как 60-80% от суточного потребления.
- Всем пациентам с ЕЖ после каждого этапа хирургического лечения рекомендуется подбор индивидуального оптимального режима физической активности на этапе амбулаторного наблюдения [66].
(УДД 5, УУР С)
Госпитализация
Организация оказания медицинской помощи
Показания для плановой госпитализации:
- Отсутствие признаков нарастания НК и стабильный функциональный статус пациента (I-II функциональный класс) без тенденции к ухудшению в течение 6-12 мес после СЛА, в течение не менее 12 мес – после этапной гемодинамической коррекции (для оценки у взрослых пациентов применяется классификация сердечной недостаточности Нью-Иоркской ассоциации сердца (NYHA), для оценки у детей – классификация Ross (приложение Г);
- Стабильное насыщение крови кислородом без тенденции к снижению.
- Плановое хирургическое лечение.
Показания для экстренной госпитализации:
- Ухудшение функционального статуса пациента с прогрессированием признаков НК в течение последних 2-4 недель или дней (для оценки у взрослых пациентов применяется классификация сердечной недостаточности Нью-Иоркской ассоциации сердца (NYHA), для оценки у детей – классификация Ross (приложение Г));
- Прогрессирование снижения насыщение крови кислородом менее 80% в течение последних 2-4 недель или дней;
- Подозрение на развитие у пациента БДЭП.
Показания к выписке пациента из стационара:
-
После консервативного лечения:
- Уменьшение клинических проявлений НК;
- Увеличение насыщения крови кислородом.
-
После этапного хирургического лечения:
- Системно-легочный анастомоз / процедура Рашкинда – увеличение насыщения крови кислородом / устранение рестриктивного МПС;
- Этапная гемодинамическая коррекция – снижение преднагрузки (уменьшение конечно-диастолического объема) СЖ, увеличение насыщения крови кислородом.
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- Рекомендуется пожизненное наблюдение врача-кардиолога/ врача-детского кардиолога в рамках диспансерного наблюдения с обследованием пациентов после различных этапов коррекции ЕЖ в специализированных центрах не реже 1 раза в 6-12 мес [23,66].
(УУР С, УДД 5)
- Всем женщинам репродуктивного возраста, перенесшим операцию Фонтена, рекомендуется полное обследование с обязательной ЭхоКГ перед планированием беременности [66].
(УУР С, УДД 5)
- В отдаленные сроки после операции Фонтена возможно развитие печеночной дисфункции, поэтому не реже 1 раза в 6-12 мес. пациентам после операции Фонтена рекомендуется контроль таких биохимических показателей крови как общего белка (исследование уровня общего белка в крови), альбумина (исследование уровня альбумина в крови), АСТ (определение активности аспартатаминотрансферазы в крови), АЛТ (определение активности аланинаминотрансферазы в крови), билирубина (исследование уровня общего билирубина в крови, исследование уровня билирубина связанного (конъюгированного) в крови и исследование уровня билирубина свободного (неконъюгированного) в крови) [2,67].
(УУР С, УДД 5)
- Для оценки сократительной функции сердца, компетентности АВ клапанов, характера кровотока по СЛА, ДКПА и/или ЭКК, а также с целью исключения гидроторакса/гидроперикарда всем пациентам после различных этапов коррекции ЕЖ рекомендуется проведение ЭхоКГ в течение первого месяца после выписки, далее – не реже 1 раза в 6-12 мес [23,66].
(УУР С, УДД 5)
- При недостаточных данных, необходимых для оценки характера показателей кровообращения и полученных в ходе ЭхоКГ после СЛА или этапной гемодинамической коррекции (в т.ч. при планировании следующего этапа) пациентам рекомендуется проведение АКГ с зондированием камер сердца, сроки которого определяются индивидуально [10,11,23].
(УУР С, УДД 5)
Комментарии: После СЛА исследование проводится в сроки от 6 до 12 мес, после ДКПА – не менее, чем через 12 мес. Основные цели АКГ в указанные сроки – оценка возможности выполнения следующего этапа хирургического лечения, в случае его невозможности – оценка функции СЛА и/или ДКПА, степени развития легочного артериального русла. После операции Фонтена необходимость АКГ обусловлена, в первую очередь, необходимостью тех или иных эндоваскулярных вмешательств (диллатации или стентирования легочных артерий при их стенозировании, устранения ДИЛК, закрытия фенестрации между ЭКК и предсердием), при этом сроки АКГ четко не регламентированы. В соответствии с номенклатурой медицинских услуг исследование может включать: катетеризацию аорты, ангиографию легочной артерии избирательную, ангиографию легочной артерии и ее ветвей, зондирование камер сердца, флебографию верхней полой вены, флебографию нижней полой вены, вентрикулографию сердца.
- Всем пациентам с единственным желудочком сердца, получающим антитромботическую терапию, рекомендуется не реже 1 раза в 1 месяц выполнение коагулограммы (ориентировочное исследование системы гемостаза) [37,80,82,83,87].
(УУР А, УДД 3)
Комментарии: Среди лабораторных данных важную информацию могут предоставить оценка общего (клинического) анализа крови (исследование уровня общего гемоглобина в крови, исследование уровня тромбоцитов крови), исследование агрегации тромбоцитов (для пациентов, получающих ацетилсалициловую кислоту**), МНО (для пациентов, получающих варфарин**), анти-Ха-активность (исследование уровня гепарина в крови. Для пациентов, получающих #ривароксабан**).
- Рекомендуется применение антибактериальных препаратов системного действия (пенициллины широкого спектра действия, другие бета-лактамные антибактериальные препараты) у пациентов с ЕЖ после различных этапов хирургического лечения, в связи с опасностью инфекционного эндокардита [2,3,10,11,23].
(УУР С, УДД 5)
Комментарии: Антибиотикопрофилактика назначается в случае необходимости амбулаторных хирургических вмешательств, экстракции зубов и пр.
Информация
Информация
Список сокращений
АВ – атриовентрикулярный
АКГ – ангиокардиография (чрезвенозная катетеризация сердца, зондирование камер сердца)
Ао – аорта
АЧТВ – активированное частичное тромбопластиновое время
БВО – бульбо-вентрикулярное отверстие
БДЭП – белково-дефицитная энтеропатия
ВПВ – верхняя полая вена
ВПС – врожденный порок сердца
ДИЛК – дополнительный источник легочного кровотока
ДКПА – двунаправленный кавопульмональный анастомоз
ДМЖП – дефект межжелудочковой перегородки
ЕЖ – единственный желудочек
КТ – компьютерная томография
ЛА – легочная артерия
ЛСС – легочное сосудистое сопротивление
ЛЖ – левый желудочек
МНО – международное нормализованное отношение
МПС – межпредсердное сообщение
МРТ – магнитно-резонансная томография
НК – недостаточность кровообращения
НПВ – нижняя полая вена
НПВП – нестероидные противовоспалительные препараты
ОАП – открытый артериальный проток
ПЖ – правый желудочек
РКИ – рандомизированное контролируемое исследование
СЖ – системный желудочек
СЛА – системно-легочный анастомоз
СН – сердечная недостаточность
ТМА – транспозиция магистральных артерий
ТЭО – тромбоэмболические осложнения
ЭКГ – электрокардиография
ЭКК – экстракардиальный кондуит (протез кровеносных сосудов синтетический)
ЭхоКГ – эхокардиография
Термины и определения
Индекс Nakata (синоним: легочно-артериальный индекс) – отношение суммарной площади поперечного сечения правой и левой легочных артерий к площади поверхности тела.
Индекс McGoon – отношение суммы диаметров легочных артерий у места их деления к диаметру нисходящей аорты.
Индекс Reddy (синоним: нижнедолевой легочно-артериальный индекс) – отношение суммы площадей поперечного сечения нижнедолевых ветвей правой и левой легочных артерий к площади поверхности тела.
«Критические» врожденные пороки сердца – состояния, характеризующиеся острым дефицитом сердечного выброса, быстрым прогрессированием сердечной недостаточности, кислородным голоданием тканей с развитием декомпенсированного метаболического ацидоза и нарушением функции жизненно важных органов [1].
Компьютерная томография – неинвазивный метод лучевой диагностики, позволяющий получить серию послойных субмиллиметровых аксиальных изображений органов и структур тела человека, основанный на измерении и сложной компьютерной обработке разности ослабления рентгеновского излучения различными по плотности тканями; для улучшения дифференцировки органов друг от друга, а также нормальных и патологических структур. Применяются различные методики контрастного усиления/контрастирования, с использованием йодсодержащих рентгеноконтрастных препаратов. Для визуализации структур сердечно-сосудистой системы применяют КТ-ангиографию – методику внутривенного болюсного введения рентгеноконтрастного препарата в кровоток с помощью системы внутрисосудистого введения контрастного вещества, с установленной скоростью и временем введения препарата. На основе полученных данных посредством компьютерной постобработки с 3D-реконструкцией строится трехмерная модель сердца и сосудов.
Легочно-венозный индекс – отношение сумм поперечного сечения легочных вен к площади поверхности тела.
Магнитно-резонансная томография – неинвазивный метод получения томографических медицинских изображений без ионизирующего излучения для исследования внутренних органов и тканей, основанный на явлении ядерного магнитного резонанса и на измерении электромагнитного отклика атомных ядер, находящихся в сильном постоянном магнитном поле, в ответ на возбуждение их определенным сочетанием электромагнитных волн; такими ядрами являются ядра атомов водорода, присутствующие в теле человека в составе воды и других веществ. МР-ангиография – метод получения изображения просвета сосудов при помощи магнитно-резонансного томографа. Метод позволяет оценивать как анатомические, так и функциональные особенности кровотока. МР-ангиография основана на отличии сигнала от перемещающихся протонов (крови) от окружающих неподвижных тканей, что позволяет получать изображения сосудов без использования каких-либо контрастных средств – бесконтрастная ангиография (например: фазово-контрастная МР-ангиография). В ряде случаев применяется внутривенное болюсное контрастирование с использованием контрастных препаратов на основе парамагнетиков (гадолиний).
Процедура Рашкинда (синоним: баллонная атриосептостомия) – эндоваскулярная операция, заключающаяся в проведении катетера с расширительным баллоном в овальное окно межпредсердной перегородки и последующей дилатации межпредсердного сообщения.
Рестриктивный – создающий препятствие кровотоку.
Транссудация – состояние, характеризующееся длительным поступлением жидкости из серозный полостей.
Эхокардиография – метод ультразвукового исследования, направленный на исследование морфологических и функциональных изменений сердца, его клапанного аппарата и магистральных сосудов.
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
При подозрении на патологию трахео-бронхиального дерева до операции необходимо обследовать пациента у врача-пульмонолога [68].
Критерии оценки качества медицинской помощи
Критерии оценки качества первичной медико-санитарной помощи взрослым и детям при единственном желудочке сердца (коды по МКБ - 10: Q20.4)
|
№ п/п
|
Критерии оценки качества
|
Оценка выполнения
|
|---|---|---|
|
1.
|
Выполнен прием (осмотр, консультация) врача-детского кардиолога первичный и/или прием (осмотр, консультация) врача-кардиолога первичный, и/или прием (осмотр, консультация) врача-сердечно-сосудистого хирурга первичный (при установлении диагноза)
|
Да/Нет
|
|
2.
|
Выполнен диспансерный прием (осмотр, консультация) врача-детского кардиолога или диспансерный прием (осмотр, консультация) врача-кардиолога
|
Да/Нет
|
|
3.
|
Выполнена регистрация электрокардиограммы (при установлении диагноза и/или при диспансерном наблюдении)
|
Да/Нет
|
|
4.
|
Выполнена прицельная рентгенография органов грудной клетки (при установлении диагноза и/или при диспансерном наблюдении)
|
Да/Нет
|
|
5.
|
Выполнена эхокардиография (при установлении диагноза и/или при диспансерном наблюдении)
|
Да/Нет
|
Критерии оценки качества специализированной медицинской помощи взрослым и детям при единственном желудочке сердца (коды по МКБ - 10: Q20.4)
|
№ п/п
|
Критерии оценки качества
|
Оценка выполнения
|
|---|---|---|
|
1.
|
Выполнена пульсоксиметрия
|
Да/Нет
|
|
2.
|
Выполнена регистрация электрокардиограммы (при планировании хирургического лечения и при выписке из стационара)
|
Да/Нет
|
|
3.
|
Выполнена прицельная рентгенография органов грудной клетки (при планировании хирургического лечения
|
Да/Нет
|
|
4.
|
Выполнена эхокардиография (при планировании хирургического лечения и при выписке из стационара)
|
Да/Нет
|
|
5.
|
Выполнена компьютерная томография сердца с контрастированием и/или магнитно-резонансная томография сердца с контрастированием (при недостаточной информативности данных эхокардиографии, при отсутствии медицинских противопоказаний)
|
Да/Нет
|
|
6.
|
Выполнено зондирование камер сердца и/или чрезвенозная катетеризация сердца (при отсутствии медицинских противопоказаний)
|
Да/Нет
|
|
.
|
Выполнено хирургическое лечение (при условии операбельности пациента)
|
Да/Нет
|
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
-
Барышникова И.Ю., к.м.н. (Москва; Общероссийская общественная организация содействия развитию лучевой диагностики и терапии «Российское общество рентгенологов и радиологов»).
-
Бокерия Л.А., академик РАН (Москва; Ассоциация сердечно-сосудистых хирургов России, Американская Ассоциации торакальных хирургов, Европейское общество грудных и сердечно-сосудистых хирургов, Сербская Академия наук).
-
Белов В.А. д.м.н. (Калининград).
-
Борисков М.В. д.м.н. (Краснодар).
-
Горбатиков К.В. д.м.н. (Тюмень).
-
Горбатых Ю.Н. д.м.н. (Новосибирск).
-
Горбачевский С.В. д.м.н. (Москва).
-
Гущин Д.К., к.м.н. (Москва).
-
Дорофеев Алексей Владимирович, к.м.н. (Москва) Общероссийская общественная организация содействия развитию лучевой диагностики и терапии «Российское общество рентгенологов и радиологов».
-
Зеленикин М.А. д.м.н. (Москва; Ассоциация сердечно-сосудистых хирургов России).
-
Зеленикин М.М. д.м.н. (Москва; Ассоциация сердечно-сосудистых хирургов России).
-
Иванов А.С. д.м.н. (Москва; Ассоциация сердечно-сосудистых хирургов России).
-
Калашников С.В., к.м.н. (Москва; Ассоциация сердечно-сосудистых хирургов России).
-
Ким А.И. д.м.н. (Москва; Ассоциация сердечно-сосудистых хирургов России)
-
Кокшенев И.В. д.м.н. (Москва).
-
Кривощеков Е.В. д.м.н. (Калининград; Ассоциация сердечно-сосудистых хирургов России, Европейская ассоциация кардиоторакальных хирургов, Всемирное Общество детской и врожденной хирургии сердца).
-
Купряшов А.А. д.м.н. (Москва).
-
Мовсесян Р.Р. член-корреспондент РАН (С-Петербург; Ассоциация сердечно-сосудистых хирургов России, Ассоциация детских кардиологов России, Европейская ассоциация кардиоторакальных хирургов, Американское общество торакальных хирургов).
-
Петрушенко Д.Ю. к.м.н. (Казань).
-
Плотников М.В. к.м.н. (Астрахань).
-
Подзолков В.П. академик РАН (Москва; Ассоциация сердечно-сосудистых хирургов России, Европейская ассоциация кардиоторакальных хирургов).
-
Синельников Ю.А. д.м.н. (Пермь; Европейская ассоциация сердечно-сосудистых хирургов).
-
Синицын В.Е., д.м.н. (Москва; Общероссийская общественная организация содействия развитию лучевой диагностики и терапии «Российское общество рентгенологов и радиологов»).
-
Шаталов К.В. д.м.н. (Москва; Ассоциация сердечно-сосудистых хирургов России, Европейской Ассоциации кардио-торакальных хирургов, Международного общества кардио-торакальных хирургов, Американское общество торакальных хирургов).
-
Юрлов И.А., к.м.н. (Москва; Ассоциация сердечно-сосудистых хирургов России).
-
Юрпольская Л.А., д.м.н. (Москва; Общероссийская общественная организация содействия развитию лучевой диагностики и терапии «Российское общество рентгенологов и радиологов»).
Все члены Рабочей группы подтвердили отсутствие финансовой поддержки/конфликта интересов.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
-
врач – детский кардиолог;
-
врач – кардиолог;
-
врач общей практики (семейный врач);
-
врач – педиатр;
-
врач по лечебной физкультуре;
-
врач по медицинской реабилитации;
-
врач по рентгено-эндоваскулярной диагностике и лечению;
-
врач по спортивной медицине;
-
врач приемного отделения;
-
врач – сердечно-сосудистый хирург;
-
врач скорой медицинской помощи;
-
врач – терапевт;
-
врач ультразвуковой диагностики;
-
врач – рентгенолог;
-
врач функциональной диагностики;
-
врач – неонатолог;
-
врач анестезиолог – реаниматолог.
В ходе разработки КР использована обновленная система шкал УДД и УУР для лечебных, реабилитационных, профилактических вмешательств и диагностических вмешательств (Таблицы 1-3), введенная в 2018 г. ФГБУ ЦЭККМП Минздрава РФ.
Таблица 1.
Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств).
|
УДД
|
Расшифровка
|
|---|---|
|
1
|
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
|
|
2
|
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований с применением метаанализа
|
|
3
|
Исследования без последовательного контроля референсным методом, или исследования с референсным методом, не являющимся независимым от исследуемого метода, или нерандомизированные сравнительные исследования, в том числе когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая
|
|
5
|
Имеется лишь обоснование механизма действия или мнение экспертов
|
Таблица 2.
Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, лечебных, реабилитационных вмешательств).
|
УДД
|
Расшифровка
|
|---|---|
|
1
|
Систематический обзор РКИ с применением метаанализа
|
|
2
|
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением метаанализа
|
|
3
|
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль»
|
|
5
|
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
|
Таблица 3.
Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, диагностических, лечебных, реабилитационных вмешательств).
|
УУР
|
Расшифровка
|
|---|---|
|
A
|
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
|
|
B
|
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
|
|
C
|
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
|
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
-
Об основах охраны здоровья граждан в Российской Федерации (21.11.2011 № 323-ФЗ (ред. от 28.12.2024))
-
Порядок оказания медицинской помощи больным с сердечно-сосудистыми заболеваниями (Приказ Минздрава России от 15.11.2012 № 918н (ред. от 21.02.2020))
-
Приказ Минздрава России от 9 июня 2020 года № 560н (ред. от 18.02.2021) «Об утверждении Правил проведения рентгенологических исследований»
-
Приказ Минздрава России от 08.06.2020 № 557н «Об утверждении Правил проведения ультразвуковых исследований».
Мониторинг и коррекция дозы нефракционированного гепарина [80]

Технология выполнения трансторакальной эхокардиографии
Важные показатели при анализе и интерпретации полученных изображений:
Проведение трансторакальной ЭхоКГ
Эхокардиография, выполненная согласно сегментарному подходу, имеет первостепенное значение в описании сердечной анатомии, функции и гемодиамики у пациентов с ЕЖС [70,71].
Согласно сегментарному подходу следует определить:
-
впадение системных и легочных вен, их расположение и размеры предсердий;
-
анатомию и функцию атриовентрикулярных клапанов;
-
морфологию единственного желудочка, расположение и размер бульбовентрикулярного окна и камеры выпускника;
-
определить отхождение, взаиморасположение магистральных артерий, анатомию и функцию полулунных клапанов. Исключить коарктацию аорты.
Учитывая вариативность анатомии ЕЖС для эхокардиографической диагностики применяют все доступы проекции и режимы сканирования с учетом анатомических ориентиров структур сердца.
Определение расположения и места впадения системных вены и легочных вен, способствует оценке формирования сердца (нормально-, право – или лево сформированное), а при едином предсердии и тип изомеризма.
Изменение атрио-вентрикулярных клапанов оценивают по состоянию створок (утолщение, сращение, количество, строению подклапанного аппарата (при наличии)) и диаметру фиброзного кольца.
Унивентрикулярная гемодинамика предполагает соединение общего атриовентрикулярного клапана или двух АВ клапанов с доминантным или единственным желудочком (одно – или двуприточный ЕЖС). В обоих случаях один желудочек нормального или увеличенного размера, а другой гипоплазирован, отсутствует приточная часть. Возможно определить морфологию основного желудочка (правый или левый) или, в некоторых случаях, неопределенная, что означает отсутствие развития межжелудочковой перегородки. Следует определить размеры и функцию основного желудочка.
Желудочково-артериальное соединение является конкордантным, когда аорта берет начало от левого желудочка, а легочная артерия — от правого, или дискордантным, когда аорта берет начало от правого желудочка, а легочная артерия — от левого желудочка. Двойное отхождение наблюдается, когда более полутора магистральных артерий отходят от желудочка. Состояние, когда от сердца отходит только одна проходимая магистральная артерия, называется одноотточным ЕЖС. Изменение полулунных клапанов также оценивают по состоянию створок (утолщение, сращение, количество, атрезия) и диаметру фиброзного кольца. Степень гипоплазии аортального клапана, различных отделов аорты; ствола и ветвей ЛА оценивают по стандартизированной оценке (z-score). Значения z-score менее (-)2,0- (-)2,5 являются критерием гипоплазии [72].
Трехмерная эхокардиография при получении оптимального изображения позволяет детально изучить анатомию и функцию ЕЖ, также атриовентрикулярных клапанов или общего АВ-клапана и подклапанного аппарата, более точно рассчитать объемы и линейные размеры полостей сердца.
Для верификации магистральных артерий необходимо визуализировать бифуркацию ветвей легочной артерии или устья коронарных артерий. На уровне полулунных клапанов в проекции по короткой оси определяют взаиморасположение магистральных артерий: расположение аорты спереди и справа от ЛА; аорты спереди и слева от ЛА; аорта справа и прилежит к ЛА «бок-о-бок». Тщательное исследование анатомии и гемодинамики притока в ЕЖС и оттока в большой и малый круги кровообращения является очень важным для определения тактики и масштаба хирургического вмешательства.
ДМПП может быть ресктриктивным, поэтому важно обеспечить беспрепятственный возврат крови из легочных вен или из полых вен, в зависимости от вариантной анатомии. Дефект межпредсердной перегородки (открытое овальное окно) оценивают из субкостального доступа в проекции по длинной оси предсердий в режиме цветного допплеровского картирования. Рестриктивность дефекта межпредсердной перегородки определяется эхокардиографическим измерением размера межпредсердного сообщения и среднего градиента давления.
Открытый артериальный проток оценивают из супрастернального или высокого левого парастернального доступов в проекциях по короткой оси [73]. Оптимальным считается получение ультразвукового среза вдоль левой ветви ЛА. Диаметр ОАП измеряют в В-режиме по внутреннему контуру протока в самом узком месте. При «плохом ультразвуковом окне» измерение проводят в режиме цветного допплеровского картирования. В этом же режиме оценивают и направление сброса крови по ОАП.
Бульбо-вентрикулярное окно является рестриктивным при его диаметре меньше диаметра нормального для росто-весового показателя ребенка аортального клапана.
Эхокардиография в послеоперационном периоде.
-
детальная оценка размера и функции системного желудочка.
Оценка систолической функции ЕЖС в рамках фракции выброса и/или фракции укорочения системного желудочка при оценке методами Тейхольца и Симпсона имеют ограничения при неэллипсоидной геометрии системного желудочка, гиповолемии, тяжелой митральной регургитации и др. Для исключения систолической дисфункции системного ЖС при наличии возможности рекомендуется переходить на другие методики ее оценки: тканевая допплерография, трехмерная эхокардиография, методика speckle tracking [70,74].
-
стеноз/недостаточность атрио-вентрикулярных клапанов
-
динамику роста ЛА и ее ветвей, диаметр межпредсерного сообщения
Эхокардиография после наложения СЛА
В режиме цветного допплера картируют кровоток по наложенному анастомозу в двух местах: в области брахиоцефальной артерии и при впадении в легочную артерию.
Эхокардиография после стентирования ОАП
Положение стента и кровоток в нем оценивают из супрастернального или высокого левого парастернального доступов в проекциях по короткой оси. Обструкция кровотоку может возникать в центре, в проксимальном или дистальном отделах стента. Режим цветного допплеровского картирования и непрерывно-волнового допплера позволяют точно определить обструкцию, но уровень обструкции удается не всегда.
Эхокардиографическая оценка ДМПП
При ЕЖС и рестриктивном ДМПП может быть два вида вмешательства на гибридном этапе – стентирование ДМПП и процедура Рашкинда. В обоих случаях следует в динамике оценивать скорость кровотока через дефект, так как кроме явной обструкции, по мере роста возможно развитие несоответствия размера дефекта и объема протекающей крови (гемодинамическая рестрикция). Так же косвенно о наличии высокого давления в левом предсердии может свидетельствовать увеличение скорости ретроградного потока в легочных венах.
Эхокардиография после операции Muller
Оценивают расположение манжеты на легочной артерии (исключают ее смещение) и измеряют градиент систолического давления за местом сужения, который соотносят с систолическим артериальным давлением. Также следует отразить ЧСС, при которой выполнено ЭхоКГ исследование.
Эхокардиография после операции Damus-Key-Stensel
Обязательно оценивают размер соустья между легочной артерией и восходящей аортой, градиент систолического давления, а также функцию СЛА.
Эхокардиография после ДКПА и Фонтена
Соединение верхней полой вены и ПЛА – анастамоз Гленна может быть самостоятельным или быть в составе тотального кавапульмонального соединения при операции Фонтена. Есть также пациенты с двусторонними ВПВ, каждый из которых связан с ипсилатеральной легочной артерией. Лучший эхокардиографический доступ супрастернальный или высокий парастернальный справа (и слева при наличии левой ВПВ). Оценивают кровоток по анастомозу между ВПВ и ЛА в режимах цветного допплеровского картирования (со сниженным пределом Найквиста для лучшей визуализации) и импульсно-волновом [75]. Визуализируют ламинарный низкоскоростной непрерывный поток с небольшой зависимостью от фаз дыхания.
Скорость кровотока по кондуиту из НПВ к ЛА не должна превышать 20-30 см/с.
Скорость кровотока на фенестрации кондуита из НПВ к ЛА более 1,8 м/с является признаком легочной гипертензии [76].
Приложение Б. Алгоритмы действий врача
Приложение Б1. Алгоритм ведения пациентов в возрасте до 3 месяцев с ЕЖ
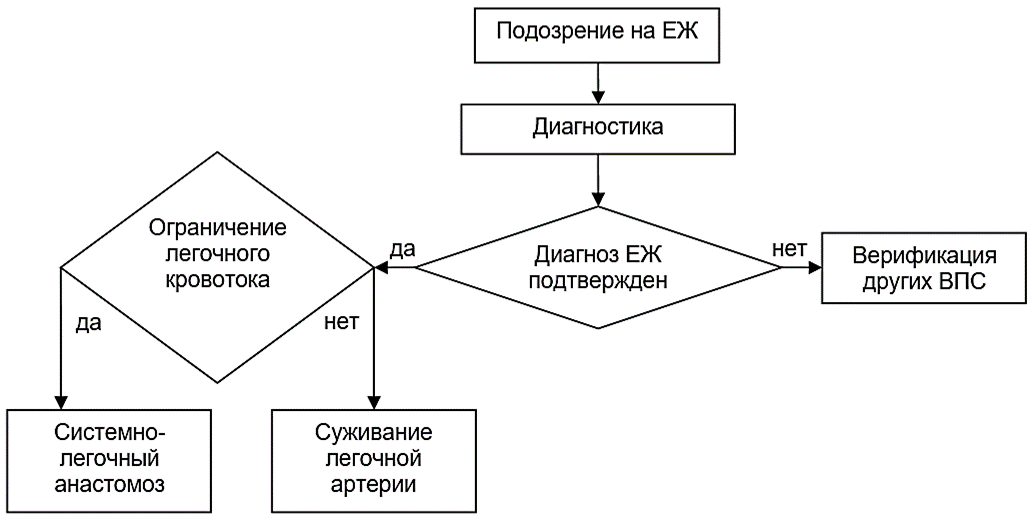

Приложение Б2. Алгоритм ведения пациентов в возрасте старше 4 месяцев с ЕЖ
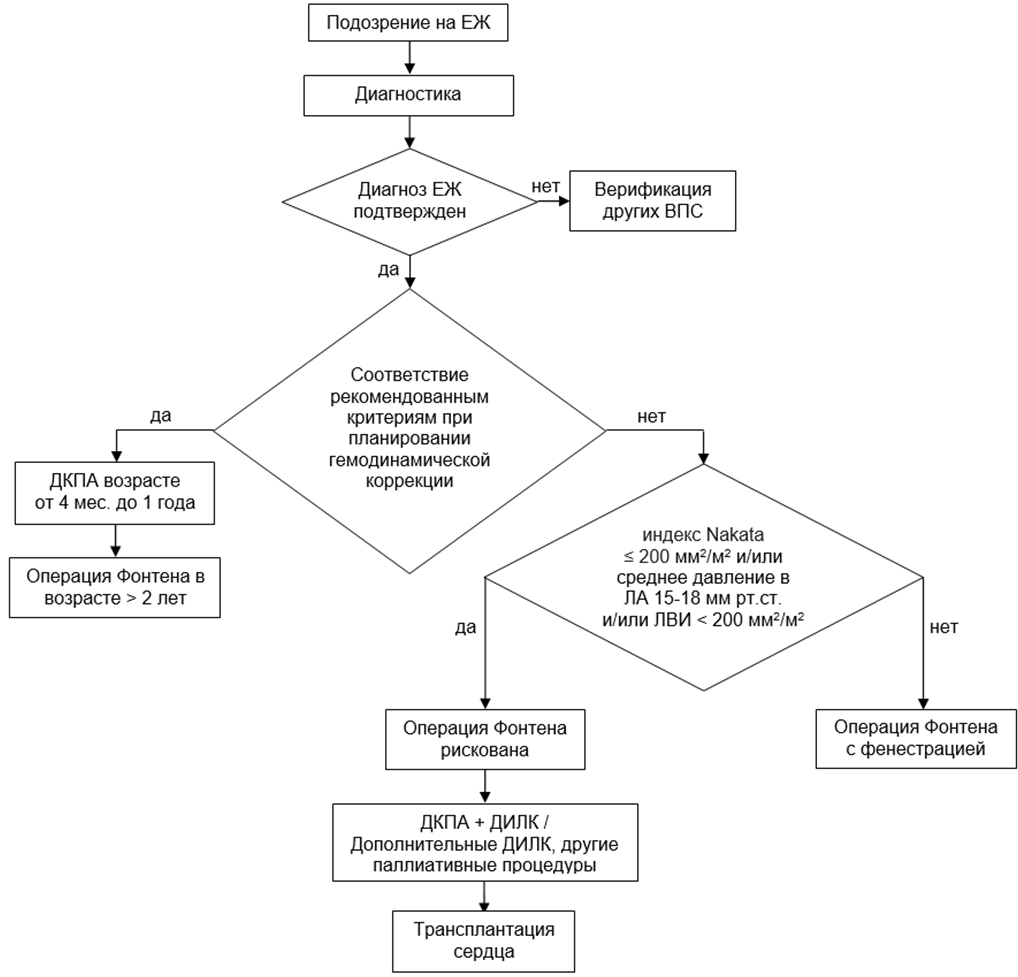

Приложение Б3. Схема использования лучевых и инструментальных методов диагностики при подозрении и ведении пациентов с ЕЖ
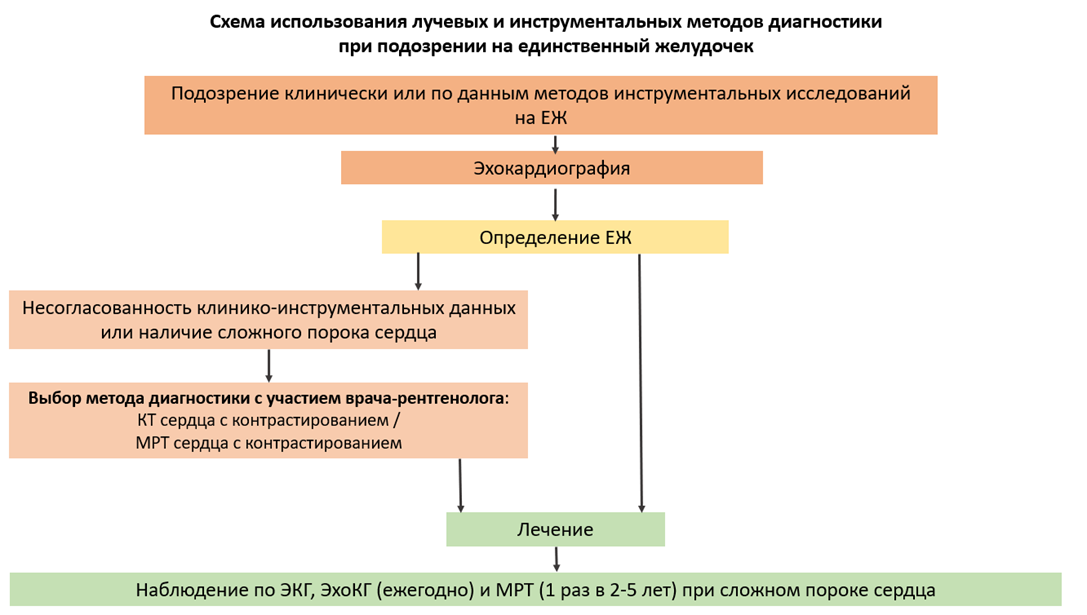
Приложение В. Информация для пациента
При ЕЖ в сердце есть оба нормально развитых предсердия, но открываются они в единую желудочковую камеру (общий желудочек). В подавляющем большинстве случаев общий желудочек имеет анатомическое устройство либо левого, либо правого, а второй (недоразвитый) желудочек остается в виде маленькой камеры, соединенный с «главным» желудочком через дефект межжелудочковой перегородки (при ЕЖ этот дефект нередко называют бульбо-вентрикулярным окном). Ао и ЛА (магистральные сосуды) могут отходить как от главного (общего) желудочка, так и от недоразвитого, который называют «камерой-выпускником».
Потоки крови смешиваются в общей камере, при этом желудочек работает с удвоенной нагрузкой, что, в конечном счете, приводит к постепенному утолщению его мышечных стенок и при длительном существовании – к сердечной недостаточности (неспособности к адекватной функции). После рождения, если нет сопутствующего стеноза легочной артерии, увеличенный объем крови из желудочка поступает в легкие, это может привести к сердечной недостаточности и легочной гипертензии (поражение сосудов легких, приводящее к их утолщению вследствие избыточного кровотока). К симптомам сердечной недостаточности относятся одышка (частое, затрудненное дыхание), усиливающаяся после нагрузки (у взрослого – после ходьбы, у ребенка – на фоне активных игр, кормления), снижение толерантности к физической нагрузке (затруднение к выполнению ранее привычных нагрузок, например, – бег, подъем на этаж, ходьба и пр.), увеличение объема живота (вследствие увеличения печени и/или появления свободной жидкости в брюшной полости), потливость (сначала после нагрузки, при прогрессировании – и в покое). В случаях же, когда имеется дополнительное препятствие кровотоку в малый круг – развивается цианоз (синюшность), при длительном существовании которого дети, как правило, отстают в развитии (вследствие кислородного голодания организма).
При ЕЖ необходима своевременная хирургическая помощь, чтобы предупредить возможные осложнения (легочная гипертензия, сердечная недостаточность). Если диагноз установлен тотчас после рождения и имеет место избыточный легочный кровоток (т.е. без стеноза легочной артерии), то ребенку может быть показано суживание ЛА (операция Мюллера) уже в первый месяц жизни, чтобы предупредить развитие легочной гипертензии. В случае же стеноза ЛА при ЕЖ выполняется системно-легочный анастомоз, позволяющий улучшить легочный кровоток и уменьшающий выраженность цианоза. Через несколько месяцев, желательно в течение первого года жизни, следует выполнить анастомоз между ВПВ и ЛА (двунаправленный кавопульмональный анастомоз), направив венозную кровь от верхней половины тела непосредственно в оба легких (от сюда и название – двунаправленный). Цели данного этапа: 1) так как кровь от верхней половины тела поступает в легкие, минуя сердце, то осуществляется «разгрузка» желудочка, что предохраняет его от возможного развития сердечной недостаточности в будущем; 2) одновременно происходит увеличение легочного кровотока и повышение насыщения крови кислородом, т.е. уменьшается цианоз. Вышесказанное способствует улучшению состояния ребенка, качества его жизни. В ряде ситуаций ДКПА выполняется первично (без предшествующего системно-легочного анастомоза) в возрасте до года (но не ранее 4 мес.), что определяется кардиологом и кардиохирургом, постоянно наблюдающих ребенка.
И, наконец, последним этапом становится операция Фонтена, после которой уже вся венозная кровь направляется в легочные сосуды. При этом используется синтетический сосудистый протез. Данный этап называется «операция Фонтена в модификации экстракардиального кондуита». Обычно эта операция выполняется в возрасте старше 2-х лет. И если ранее потоки венозной и артериальной крови смешивались, что обуславливало ту или иную степень цианоза, то теперь эти потоки разделены. Ребенок розовеет. Операцию Фонтена можно делать и позднее (в 4 и более лет), но надолго откладывать не стоит.
Описанный принцип хирургического лечения не излечивает порок, он облегчает состояние пациента путем оптимизации кровообращения в условиях сложной внутрисердечной анатомии [67].
После выписки из специализированного центра следует строго соблюдать предписания, указанные в выписных документах (выписной эпикриз). Наблюдение у кардиолога по месту жительства – не реже 1 раза в 6 мес, строго соблюдая его предписания и назначения. Наблюдение кардиолога в специализированном центре – не реже 1 раза в 12 мес. Необходимо строго соблюдать режим по ограничению употребления жидкости, особенно в первый месяц после операции. Изменение схем и доз тех или иных лекарственных препаратов, а также назначение дополнительных или альтернативных лекарственных препаратов осуществляет только лечащий врач. При возникновении побочных эффектов от приема лекарственных препаратов необходимо в максимально быстрые сроки обсудить это с лечащим врачом. Следует избегать чрезмерных физических нагрузок. При любых инвазивных манипуляциях (стоматологические, косметологические, прочие процедуры, предполагающие или несущие риск нарушения целостности кожных покровов и слизистых) обязательно проводить антибактериальное прикрытие для профилактики возникновения инфекционного эндокардита. Случаи предполагаемых инвазивных манипуляций обязательно согласуются с кардиологом, ведущим наблюдение за пациентом по месту жительства. При возникновении или резком прогрессировании следующих симптомов в максимально короткие сроки необходима внеочередная консультация кардиолога: утомляемость, одышка, цианоз, отеки, увеличение объема живота, аритмии, потери сознания, неврологический дефицит (потеря зрения, слуха, речи, онемение конечности, парезы и параличи, в т.ч. кратковременные), острые респираторные заболевания, лихорадка неясного генеза.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. В настоящих КР используется следующая шкала:
Название на русском языке: Модифицированная шкала оценки выраженности недостаточности кровообращения и функционального состояния у детей по Ross R.D.
Оригинальное название: Modified Ross score.
Источник: Ross R.D. The Ross classification for heart failure in children after 25 years: a review and an age-stratified revision. Pediatr. Cardiol. 2012; 33 (8): 1295-300. DOI: 10.1007/s00246-012-0306-8.
Тип: шкала оценки.
Назначение: определение выраженности недостаточности кровообращения и функционального класса у детей.
Содержание шкалы:

Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.