Диагностика и лечение злокачественных новообразований: Рак щитовидной железы
 Версия: Клинические протоколы 2006-2019 (Беларусь)
Версия: Клинические протоколы 2006-2019 (Беларусь)
Злокачественное новообразование щитовидной железы (C73)
Онкология
Общая информация
Краткое описание
ПОСТАНОВЛЕНИЕ
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ
РЕСПУБЛИКИ БЕЛАРУСЬ
6 июля 2018 г. № 60
Об утверждении клинического протокола «Алгоритмы диагностики и лечения злокачественных новообразований»
На основании подпункта 8.3 пункта 8 Положения о Министерстве здравоохранения Республики Беларусь, утвержденного постановлением Совета Министров Республики Беларусь от 28 октября 2011 г. № 1446 «О некоторых вопросах Министерства здравоохранения и мерах по реализации Указа Президента Республики Беларусь от 11 августа 2011 г. № 360», Министерство здравоохранения Республики Беларусь
ПОСТАНОВЛЯЕТ:
1. Утвердить прилагаемый клинический протокол «Алгоритмы диагностики и лечения злокачественных новообразований».
2. Начальникам главных управлений по здравоохранению областных исполнительных комитетов, председателю комитета по здравоохранению Минского городского исполнительного комитета, руководителям государственных организаций, подчиненных Министерству здравоохранения Республики Беларусь, обеспечить проведение диагностики, лечение и профилактику заболеваний в соответствии с клиническим протоколом.
3. Настоящее постановление вступает в силу после его официального опубликования.
Министр В.А.Малашко
УТВЕРЖДЕНО
Постановление
Министерства здравоохранения
Республики Беларусь
06.07.2018 № 60
КЛИНИЧЕСКИЙ ПРОТОКОЛ «Алгоритмы диагностики и лечения злокачественных новообразований»
ГЛАВА 37
РАК ЩИТОВИДНОЙ ЖЕЛЕЗЫ (С73)
На территории Республики Беларусь встречаются две этиопатогенетические формы рака щитовидной железы – спорадическая и радиогенная. Последняя из них обусловлена инкорпорацией изотопов йода, выделившихся в большом количестве вследствие Чернобыльской аварии («техногенный» рак), либо ассоциирована с последствиями наружного облучения по поводу злокачественных новообразований, не связанных со щитовидной железой («ятрогенный» или пост-терапевтический рак).
Классификация
ГЛАВА 1
ОБЩИЕ СВЕДЕНИЯ О TNM КЛАССИФИКАЦИИ
Система TNM для классификации злокачественных опухолей была разработана французом Р. Denoix в 1943–1952 гг. В 1953 г. Комитет по номенклатуре опухолей и статистике, организованный UICC, и Международная комиссия по стадированию рака достигли соглашения по классификации анатомической распространенности опухолей на основе системы TNM. В 1954 г. Международный противораковый союз (UICC) создает Комитет по клинической классификации и прикладной статистике, который в 1958 г. публикует первые рекомендации по клинической классификации рака молочной железы и гортани.
В результате многолетней деятельности Комитета в 1968 г. издается первая редакция TNM классификация злокачественных опухолей. По мере разработки классификации для новых локализаций опухолей и уточнения более ранних рекомендаций в 1974, 1978, 1987, 1997, 2002 и 2009 гг. публикуются 2-я, 3-я, 4-я, 5-я, 6-я и 7-я редакции.
Настоящая (8-я) редакция правил классификации и стадирования полностью соответствуют 8-й редакции руководства по стадированию рака и одобрена всеми национальными TNM комитетами.
В данном руководстве используются морфологические формы злокачественных новообразований в соответствии с классификацией МКБ-О-3, адаптированной под МКБ-10 (проставление кодов врачом-патологом в морфологическом заключении обязательно).
UICC признает необходимость постоянства TNM классификации в течение определенного периода времени, необходимого для накопления данных. Поэтому классификация не должна изменяться до тех пор, пока не будут сделаны крупные достижения в диагностике и лечении злокачественных опухолей, требующие пересмотра настоящей классификации.
Общие правила системы TNM.
TNM система для описания анатомической распространенности болезни основывается на оценке 3 компонентов:
Т – распространение первичной опухоли;
N – отсутствие или наличие метастазов в регионарных лимфатических узлах и степень их поражения;
М – отсутствие или наличие отдаленных метастазов.
К этим трем компонентам добавляются цифры, указывающие на распространенность злокачественного процесса:
Т0, Т1, Т2, Т3, Т4; N0, N1, N2, N3; M0, M1.
В действительности система является «стенографическим» описанием распространенности злокачественной опухоли.
Общие правила классификации, применяемые для опухолей всех локализаций, следующие:
Для каждой локализации имеются две классификации:
Клиническая классификация, обозначаемая TNM (или cTNM). Она основывается на результатах обследования до лечения. Эти данные получают при врачебном осмотре, лучевой диагностике, эндоскопии, биопсии, хирургическом диагностическом вмешательстве и других методах обследования.
Патологическая классификация, обозначаемая pTNM. Она основана на данных обследования до лечения, дополненных или измененных в результате хирургического вмешательства и морфологического исследования. Гистологическая оценка первичной опухоли включает резецированную опухоль или биопсию, позволяющую оценить наивысшую Т категорию. Гистологическая оценка регионарных лимфатических узлов включает исследование удаленных узлов в количестве, адекватном для установления отсутствия метастазов в регионарных лимфатических узлах (pN0) и достаточном для оценки наиболее высокой pN категории. Отдаленные метастазы должны быть подтверждены при микроскопическом исследовании (рМ).
После обозначения Т, N, М и/или рТ, pN и рМ категорий они могут группироваться по стадиям. TNM классификация и стадии, установленные однажды, должны оставаться неизменными в медицинских документах. Клиническая стадия служит основой для выбора лечения, тогда как патологическая стадия обеспечивает наиболее точные данные для оценки прогноза и расчета конечных результатов.
При сомнении в правильности оценки Т, N или М категории должно быть выбрано меньшее значение категории, (т.е. меньшее распространение опухоли).
В случае множественных опухолевых очагов в органе должна классифицироваться опухоль с более высокой Т категорией, а в скобках указываться множественность (т) или количество опухолей, например: Т2(т) или Т1(5). При одновременном поражении парных органов каждая опухоль должна классифицироваться отдельно. При опухолях печени, яичников и фаллопиевой трубы множественные очаги поражения являются критерием Т классификации.
Выявление второй опухоли в одном органе в течение 2 месяцев с момента выявления первой нужно расценивать как синхронное поражение.
TNM категории и стадия могут подразделяться или объединяться для клинических и научных целей (например, любые Т, N или М могут быть разбиты на подгруппы). Однако рекомендованные основные обозначения не должны изменяться.
Анатомические области и локализации.
Локализации в этой классификации обозначаются кодовым номером Международной классификации онкологических болезней.
TNM/pTNM классификация.
Используются следующие общие определения:
Т/рТ – первичная опухоль:
TX/рTX – первичная опухоль не может быть оценена;
Т0/рТ0 – нет доказательств первичной опухоли;
Tis/pTis – рак «in situ»;
Т1/рТ1, Т2/рТ2, ТЗ/рТЗ, Т4/рТ4 – размер или местное распространение опухоли в порядке увеличения.
N/pN – регионарные лимфатические узлы:
Nx/pNx – регионарные лимфатические узлы не могут быть оценены;
N0/pN0 – отсутствуют метастазы в регионарных лимфоузлах;
Nl/pNl, N2/pN2, N3/pN3 – возрастающее поражение регионарных лимфатических узлов.
Непосредственное распространение первичной опухоли на лимфатические узлы классифицируется как метастазы в лимфатических узлах. Метастаз в любом лимфоузле, не относящемся к регионарному, расценивается как отдаленный метастаз.
Опухолевый узел в области регионарных лимфатических узлов, не имеющий гистологических признаков лимфоузла, классифицируется как метастаз в регионарном лимфатическом узле, если имеет форму и ровный контур лимфатического узла. Опухолевый узел с неровным контуром классифицируется в рТ категории.
Когда размер является критерием pN классификации, производится измерение метастатического очага, а не всего лимфатического узла.
Случаи с микрометастазами, когда размеры метастазов не превышают 0,2 см, могут обозначаться добавлением «(mi)», например: pNl(mi) или pN2(mi).
М/рМ – отдаленные метастазы:
МХ/рМХ – отдаленные метастазы не могут быть оценены;
М0/рМ0 – нет отдаленных метастазов;
М1/рМ1 – имеются отдаленные метастазы;
Категория М может быть в дальнейшем специфицирована в соответствии со следующими обозначениями (таблица 1.1):
Таблица 1.1
| Легкие | PUL | Костный мозг | MAR |
| Кости | OSS | Плевра | PLE |
| Печень | HEP | Брюшина | PER |
| Головной мозг | BRA | Надпочечники | ADR |
| Лимфоузлы | LYM | Кожа | SKI |
| Другие | ОТН |
Подразделения TNM
Главные категории в классификации могут иметь подразделения, придающие критерию большую специфичность (например; Tla, lb или N2a, 2b).
Сигнальный лимфоузел
Это первый лимфоузел, получающий лимфу из первичной опухоли. Если в нем имеется метастаз, то и другие лимфоузлы могут быть поражены. Если этот лимфоузел не поражен, то и наличие метастазов в других узлах маловероятно. Иногда встречаются более одного сигнальных лимфоузлов.
При оценке сигнального лимфоузла применяются следующие определения:
Главные категории в классификации могут иметь подразделения, придающие критерию большую специфичность (например; Tla, lb или N2a, 2b).
Сигнальный лимфоузел
Это первый лимфоузел, получающий лимфу из первичной опухоли. Если в нем имеется метастаз, то и другие лимфоузлы могут быть поражены. Если этот лимфоузел не поражен, то и наличие метастазов в других узлах маловероятно. Иногда встречаются более одного сигнальных лимфоузлов.
При оценке сигнального лимфоузла применяются следующие определения:
- pNX(sn) – сигнальный узел не может быть оценен; pN0(sn) – нет поражения сигнального узла;
- pN1(sn) – есть поражение сигнального узла.
Отдельные опухолевые клетки
Отдельные опухолевые клетки (ITC) представляют собой единичные опухолевые клетки или маленькие кластеры клеток не более 0,2 мм в наибольшем измерении. ITC обычно не демонстрируют метастатической активности (пролиферацию или реакцию стромы) или инвазии стенок сосудистого или лимфатического синуса. Случаи с ITC в лимфатических узлах или отдаленных органах и тканях должны классифицироваться как N0 или М0 соответственно.
Это же применимо и к случаям, когда наличие опухолевых клеток или их компонентов подтверждается неморфологическими исследованиями, такими как проточная морфометрия или анализ ДНК.
Случаи с ITC должны анализироваться отдельно.
Классификация ITC:
- pN0 – гистологически не выявляются метастазы в регионарных лимфатических узлах, не проводились исследования по выявлению ITC;
- pN0(i-) – гистологически нет метастазов в регионарных лимфатических узлах, негативные морфологические данные по выявлению ITC;
- pN0(i+) – гистологически нет метастазов в регионарных лимфатических узлах, позитивные морфологические данные по выявлению ITC;
- pN0(mol-) – гистологически нет метастазов в регионарных лимфатических узлах, негативные неморфологические данные по выявлению ITC;
- pN0 (mol+) – гистологически нет метастазов в регионарных лимфатических узлах, неморфологическими методами выявляются ITC.
При исследовании ITC в сигнальном лимфоузле к обозначениям выше приведенной классификации в скобках указывается «(sn)», например: pN0(i+) (sn).
Отдельные опухолевые клетки, выявленные в костном мозгу морфологическими методами, классифицируются аналогично схеме для N, например: pM0(i+), а неморфологическими – pM0(mol+).
Гистопатологическая дифференцировка.
Это стадирование позволяет оценить степень агрессивности опухолей некоторых гистологических типов и может влиять на прогноз и выбор лечения.
Для большинства локализаций выделяется 4 степени дифференцировки опухолей:
- G1 – хорошо дифференцированные;
- G2 – умеренно дифференцированные;
- G3 – низко дифференцированные;
- G4 – недифференцированные.
При наличии различных степеней дифференцировки в опухоли указывается наименее благоприятная степень.
Саркомы костей и мягких тканей классифицируется также с использованием градаций «высокая степень» и «низкая степень» дифференцировки.
Для некоторых форм рака (молочной железы, тела матки, печени) рекомендуются специальные системы стадирования по степеням.
Дополнительные дескрипторы
Для идентификации особых случаев в TNM/pTNM используются символы m, у, r, а.
Хотя они не влияют на группировку по стадиям, но указывают опухоли, которые должны анализироваться отдельно:
- m – используется для обозначения множественных опухолей одной локализации;
- у – в тех случаях, когда классификация приводится в течение или после проведения комбинированного (многокомпонентного) лечения, cTNM или pTNM категория обозначается префиксом «у», например: ycTNM или ypTNM. При оценке распространения опухоли до начала комбинированного лечения символ «у» не исключается;
- r – рецидив опухоли после радикального лечения при классификации обозначается префиксом «r» (rcTNM или rpTNM);
- а – применяется для обозначения классификации опухолей, впервые выявленных при аутопсии.
Необязательные дескрипторы.
L – инвазия лимфатических сосудов
Классифицируется как LX, L0 и L1.
V – инвазия вен
Классифицируется как VX, VO, VI (микроскопическая инвазия) и V2 (макроскопическая инвазия). Макроскопическое вовлечение стенки вены при отсутствии опухоли в просвете сосуда классифицируется как V2.
С-фактор
С-фактор или «фактор надежности» отражает достоверность классификации с учетом использованных методов диагностики. Его использование не является обязательным.
Определения С-фактора:
- С1 – данные стандартных диагностических методов (осмотр, пальпация, рентгенологическое исследование, эндоскопическое исследование),
- С2 – данные, полученные при использовании специальных диагностических методов (рентгенологическое исследование в специальных проекциях, томография, компьютерная томография, ультразвуковое исследование, лимфография, ангиография, сцинтиграфия, магнитно-резонансная томография, ПЭТ/КТ, эндоскопия, биопсия, цитологическое исследование);
- С3 – данные хирургического диагностического вмешательства, включая биопсию и цитологическое исследование;
- С4 – данные, полученные после радикальной операции и гистологического исследования удаленного препарата;
- С5 – данные патологоанатомического вскрытия.
Степени С-фактора могут использоваться при описании категорий Т, N и М (например: Т3С2, N2C1, М0С2).
Клиническая классификация TNM соответствует CI, С2 и С3 степеням, тогда как pTNM эквивалентна С4.
Классификация остаточных опухолей (R)
TNM/pTNM классификация описывает анатомическую распространенность опухоли без рассмотрения вопросов лечения. R-классификация описывает статус опухоли после лечения. Она отражает эффект лечения и является прогностическим фактором. При R- классификации оценивается не только первичная опухоль, но и остающиеся отдаленные метастазы.
Эта классификация может применяться после хирургического лечения, лучевой или химиотерапии, а также после комбинированного лечения. После консервативного лечения остаточная опухоль оценивается клиническими методами. После хирургического лечения R-классификация требует тесного сотрудничества хирурга и морфолога.
Случаи с макроскопически определяемой остаточной опухолью (R2) могут подразделяться на R2a (без микроскопического подтверждения) и R2b (микроскопически подтвержденные).
R0 группа может включать пациентов как с М0, так и с Ml. В последнем случае отдаленные метастазы, как и первичная опухоль, должны быть полностью удалены. Трудности с R-классификацией могут возникнуть при удалении опухоли по частям, а не «en blok». В таких случаях уместна категория RX.
Наличие микроскопически определяемой инвазивной опухоли по линии резекции классифицируется как R1, а в случае неинвазивной карциномы – R1 (is).
Группировка по стадиям.
Комбинация всех значений дескрипторов TNM позволяет получить 24 категории TNM, описывающие распространенность опухоли. Для табличного представления данных и анализа эти категории объединяются в ограниченное количество групп – стадий. Каждая стадия более или менее однородна по прогнозу и критерию выживаемости относящихся к ней пациентов.
Карцинома «in situ» относится к стадии 0, а опухоли с отдаленными метастазами – к стадии IV (за исключением некоторых локализаций, например, папиллярного и фолликулярного рака щитовидной железы).
Для патологической стадии необходимо морфологическое исследование достаточного количества тканей, позволяющее оценить наибольшее значение Т и N. Если же имеется морфологическое подтверждение отдаленных метастазов, то и классификация (рМ1) и стадия являются патологическими.
Термин «стадия» употребляется только для комбинаций Т, N, М или рТ, pN или рМ категорий. Необходимо избегать выражений типа «Т стадия» или «N стадия»
РАК ЩИТОВИДНОЙ ЖЕЛЕЗЫ (С73)
37.1. Классификация рака щитовидной железы.
В щитовидной железе могут возникать различные по биологическим свойствам опухоли, развивающиеся преимущественно из клеток фолликулярного эпителия (табл. 37.2). Значительно реже встречаются опухоли другого происхождения.
Таблица 37.2. Гистологические варианты рака щитовидной железы
|
Рак
|
Варианты
|
|
Папиллярный рак (папиллярная аденокарцинома) 8260/3
|
Фолликулярный; макрофолликулярный; онкоцитарный; светлоклеточный; «мезонефороидный» (hobnail); диффузно-склеротический; высококлеточный; столбчатоклеточный; солидный; крибриформный (крибриформно-морулярный); папиллярный с фасциитоподобной стромой;
папиллярный с инсулярным компонентом; папиллярный с плоскоклеточной или мукоэпидермоидной карциномой; папиллярный с веретеноклеточной и гигантоклеточной карциномой; папиллярный рак в комбинации с медуллярной карциномой; папиллярная микрокарцинома
|
|
Фолликулярный рак 8330/3
|
Микроинвазивный (только с инвазией капсулы или с инвазией капсулы и единичных кровеносных сосудов); макроинвазивный (без капсулы); ангиоинвазивный (более 4 мелких кровеносных сосудов в капсуле опухоли и/или инвазия крупных кровеносных сосудов за пределами капсулы опухоли). По клеточному составу может быть типичным, онкоцитарным или светлоклеточным, смешанным
|
|
Плохо дифференцированный рак 8337/3, 8332/3
|
Микроинвазивный; макроинвазивный; инсулярный; солидно-трабекулярный
|
|
Недифференцированный (анапластический) рак 8020/3
|
Веретеноклеточный; гигантоклеточный; полиморфноклеточный; сквамозный
|
|
Рак, ассоциированный с пороками развития и плоскоклеточной метаплазией
|
Плоскоклеточный (8070/3), мукоэпидермоидный (8430/3), склерозирующий мукоэпидермоидный рак с эозинофилами (8430/3), слизистый (8480/3), веретеноклеточный эпителиальная опухоль с тимической дифференцировкой (SETTLE, 8588/3), рак с тимической дифференцировкой (CASTLE, 8593/3)
|
|
Медуллярный рак 8345/3
|
Классический (с амилоидозом стромы, продукцией кальцитонина), атипический (повышен уровень кальцитонина в крови, но в клетках опухоли кальцитонин не экспрессируется)
|
|
Смешанная медуллярно-
фолликулярная карцинома
(MMFCC) 8346/3
|
Клетки опухоли приблизительно в равной пропорции экспрессируют кальцитонин и тиреоглобулин
|
В практической деятельности необходимо руководствоваться данными о клинико-морфологических особенностях папиллярного рака щитовидной железы, который классифицируется по:
- размеру: до 10 мм (микрокарцинома) и свыше 10 мм (≥11 мм)
- макроскопической характеристике: узловые (моно- и мульти-) и диффузные
- наличию капсулы: инкапсулированные/ полуинкапсулированные /растущие экспансивно инвазивные
- архитектонике: мономорфные (папиллярные, фолликулярные, солидные/трабекулярные, крибриформные), смешанного строения (любые комбинации)
- окраске цитоплазмы опухолевых клеток: оксифильные, светлые, типичные (цитоплазма не выражена)
- ядерно-цитоплазматическому соотношению: типичные (крупные ядра овоидной или неправильной формы, цитоплазма плохо различима), высокие (объем оксифильной цитоплазмы в 2–3 раза превышает размер ядра, базальная локализация ядер), столбчатые (с субнуклеарной вакуолизацией, стратификация ядер), из клеток Гюртле, из клеток, имеющих форму обойного гвоздя («мезонефроидные»)
По клиническому течению:
неагрессивные – инкапсулированный фолликулярный вариант (неинвазивная фолликулярная опухоль с клетками папиллярного рака – NIFTP), макрофолликулярный вариант, папиллярная микрокарцинома как случайная находка («инсиденталома»), любые другие гистологические варианты интратиреоидного папиллярного рака без инвазии лимфатических/кровеносных сосудов (в том числе при отсутствии перитуморозных и/или интратиреоидных псаммомных телец), крибриформный (крибриформно-морулярный);
агрессивные/потенциально агрессивные: любые варианты папиллярного рака с минимальным и/или видимым невооруженным взглядом экстратиреоидным распространением, диффузно-склеротический; высоко- или столбчатоклеточный; солидный; мезонефроидный, папиллярный с фасциитоподобной стромой; папиллярный с инсулярным компонентом; папиллярный в сочетании с плоскоклеточной или мукоэпидермоидной карциномой; папиллярный в сочетании с веретеноклеточной и/ или гигантоклеточной карциномой
37.4. Классификация TNM (UICC, 8 редакция)
Классификация применима только для рака, диагноз которого должен быть подтвержден результатами морфологического исследования:
37.4.1. T1- первичная опухоль:
TX – недостаточно данных для оценки первичной опухоли;
Т0 – первичная опухоль не определяется;
Т1 – опухоль до (< ) 20 мм в наибольшем измерении, ограниченная тканью щитовидной железы;
T1a – опухоль до (< ) 10 мм в наибольшем измерении;
T1b – опухоль >10 мм, но <21 мм в наибольшем измерении;
Т2 – опухоль от 21 до 40 мм в наибольшем измерении, ограниченная тканью щитовидной железы;
T3 – опухоль размером>4 см в наибольшем измерении, ограниченная тканью щитовидной железы, либо опухоль любого размера с минимальным экстратиреоидным распространением на претиреоидные мышцы – Грудино-подъязычную (sternohyoideus), Грудино-щитовидную (sternothyroideus), лопаточно-подъязычную (omohyoideus);
T3a – опухоль размером>4 см в наибольшем измерении, ограниченная тканью щитовидной железы
T3b – опухоль любого размера с минимальным экстратиреоидным распространением на претиреоидные мышцы – Грудино-подъязычную (sternohyoideus), Грудино-щитовидную (sternothyroideus), лопаточно-подъязычную (omohyoideus);
T4а – опухоль распространяется за пределы капсулы щитовидной железы с инвазией возвратного нерва, трахеи, глотки, пищевода, подкожно-жировой клетчатки;
T4b – опухоль инфильтрирует предпозвоночную фасцию, сосуды средостения или окружает сонную артерию.
Примечание:
1 Категория рака in situ (pTis) при раке щитовидной железы не выделяется. Все категории T могут подразделяться на (s) – солитарный рак и (m) – многофокусный (больше одного опухолевого узла одинакового или разного гистологического строения в пределах одной нозологической формы рака). При сочетании двух и более органотипических карцином разных нозологических форм употребляется термин «первично-множественный рак». Анапластическая (недифференцированная) карцинома всегда соответствует категории Т4.
37.4.2. N – регионарные лимфатические узлы:
NX – недостаточно данных для оценки регионарных лимфатических узлов; N0 – нет признаков метастатического поражения регионарных лимфатических узлов;
N1 – имеется поражение регионарных лимфатических узлов метастазами;
N1a – вовлечение лимфатических узлов уровня VI;
N1b – метастатическое поражение (одностороннее, двустороннее или контралатеральное) подчелюстных, латеральных, ретрофарингеальных лимфатических узлов;
pTN – гистологическое подтверждение распространения рака щитовидной железы.
37.4.3. Регионарными считаются семь Групп лимфатических узлов, соответствующих семи уровням оттока лимфы:
I. Подчелюстные и подбородочные лимфатические узлы.
II. Верхние яремные лимфатические узлы (по ходу сосудисто-нервного пучка шеи выше бифуркации общей сонной артерии или подъязычной кости).
III. Средние яремные лимфатические узлы (между краем лестнично-подъязычной мышцы и бифуркацией общей сонной артерии).
IV. Нижние яремные лимфатические узлы (от края лестнично-подъязычной мышцы до ключицы).
V. Лимфатические узлы заднего треугольника шеи.
VI. Претрахеальные, паратрахеальные, преларингиальные, претиреоидные и крикотиреоидные лимфатические узлы.
VII. Верхние (upper/superior) медиастинальные лимфатические узлы.
Лимфатические узлы VI уровня носят название «центральные», лимфатические узлы II, III, IV, V уровней называются «латеральные».
37.4.4. M – отдаленные метастазы:
M0 – метастазы в отдаленных органах не определяются;
M1 – отдаленные метастазы установлены
37.4.5. Группировка рака щитовидной железы по стадиям, помимо категорий TNM, учитывает гистологическое строение опухоли и возраст пациентов. При первично-множественном раке (например, медуллярном и папиллярном) каждая карцинома классифицируется отдельно (табл. 37.6).
Таблица 37.6. Группировка рака щитовидной железы по стадиям
|
Папиллярный или фолликулярный рак (возраст пациентов до 55 лет)
|
|||
|
Стадия I
|
Любая T
|
Любая N
|
M0
|
|
Стадия II
|
Любая T
|
Любая N
|
M1
|
|
Папиллярный или фолликулярный рак (возраст пациентов 55 лет и более)
|
|||
|
Стадия I
|
T1a, T1b, T2
|
N0
|
M0
|
|
Стадия II
|
T3
|
N0
|
M0
|
|
T1, T2, T3
|
N1
|
M0
|
|
|
Стадия III
|
T4a
|
N0/ N1
|
M0
|
|
Стадия IVa
|
T4b
|
N0/ N1
|
M0
|
|
Стадия IVb
|
Любая T
|
N0/ N1
|
M1
|
|
Медуллярный рак
|
|||
|
Стадия I
|
T1a, T1b
|
N0
|
M0
|
|
Стадия II
|
T2, T3
|
N0
|
M0
|
|
Стадия III
|
T1, T2, T3
|
N1a
|
M0
|
|
Стадия IVa
|
T1, T2, T3
|
N1b
|
M0
|
|
T4a
|
N0/N1
|
M0
|
|
|
Стадия IVb
|
T4b
|
N0/N1
|
M0
|
|
Стадия IVc
|
Любая T
|
N0/N1
|
M1
|
|
Анапластический (недифференцированный) рак
|
|||
|
Стадия IVa
|
T1, T2, T3a
|
N0
|
M0
|
|
Стадия IVb
|
T1, T2, T3a
|
N1
|
M0
|
|
T3b, T4a, T4b
|
N0/ N1
|
M0
|
|
|
Стадия IVc
|
Любая T
|
N0/ N1
|
M1
|
Эпидемиология
Таблица 37.1. Основные статистические показатели (С73 – щитовидная железа) по данным Белорусского канцер-регистра
|
Показатель
|
Число
|
|
|
2011
|
2016
|
|
|
Число вновь выявленных случаев заболевания
|
1159
|
1255
|
|
Заболеваемость на 100 000 населения (грубый интенсивный показатель)
|
12,2
|
13,2
|
|
Диагноз установлен в I стадии заболевания (% к вновь выявленным случаям)
|
61,9
|
67,1
|
|
Диагноз установлен в II стадии заболевания (% к вновь выявленным случаям)
|
5,6
|
2,6
|
|
Диагноз установлен в III стадии заболевания (% к вновь выявленным случаям)
|
21,3
|
20
|
|
Диагноз установлен в IV стадии заболевания (% к вновь выявленным случаям)
|
11,2
|
10,3
|
|
Прожили менее года с момента установления диагноза из числа заболевших в предыдущем году (одногодичная летальность в %)
|
2,2
|
2
|
|
Умерло от злокачественных новообразований
|
52
|
43
|
|
Смертность на 100 000 населения Грубый интенсивный показатель
|
0,5
|
0,5
|
|
Отношение смертности к заболеваемости в % (интенсивные показатели)
|
4,1
|
3,8
|
|
Число пациентов, состоящих на учете на конец года
|
16470
|
20172
|
|
Из них состоящих на учете 5 и более лет, %
|
68,3
|
72,9
|
Начиная с 2000 г. структура рака щитовидной железы остается практически неизменной: 95–97 % папиллярный рак и 2,5–3,0 % медуллярный рак.
Остальные формы тиреоидной карциномы наблюдаются в единичных случаях. Среди пациентов, страдающих папиллярным раком щитовидной железы, опухоли размером до 10 мм (микрокарциномы) выявляются в 54–57 % наблюдений. При папиллярном раке высокие показатели продолжительности жизни достигаются не только у пациентов с новообразованиями небольших размеров, но и в наблюдениях с местно-распространенным, локально-регионарным и диссеминированным процессом. Так, 25-летняя причинно-специфическая выживаемость этой формы карциномы в возрасте до 60 лет составляет около 95 %.
В противоположность выше сказанному, медиана времени жизни при анапластическом раке составляет всего 3–4 месяца. Наблюдаемая выживаемость у пациентов, страдающих медуллярным или плохо дифференцированным раком, сопоставима между собой и зависит от размера опухоли, состояния регионарных лимфатических узлов, местного распространения, возраста и наличия клинических симптомов заболевания. Следует также отметить, что ни наружное облучение, ни химиотерапия достоверно не влияют на продолжительность жизни пациентов, у которых диагностирован плохо дифференцированный или анапластический рак.
Соотношение заболеваемости/смертности для всех форм рака щитовидной железы без возрастных ограничений отображены на рисунке 37.1.
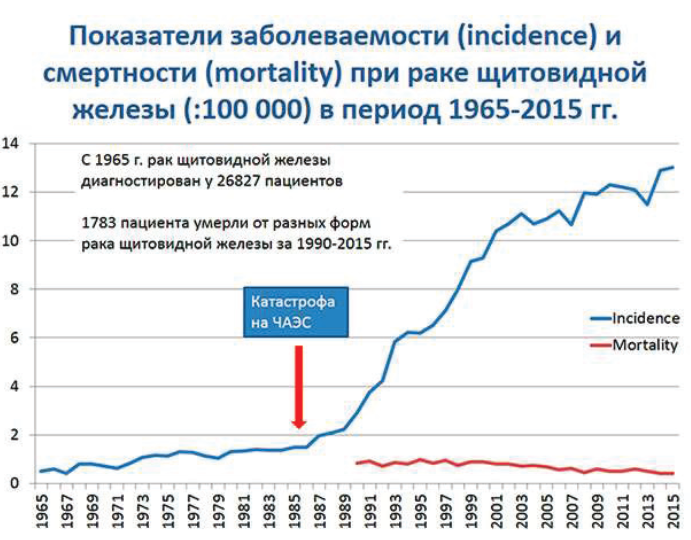
Рисунок 37.1 – Рак щитовидной железы в РБ (заболеваемость и смертность) в период 1965–2015 гг.
Клиническая картина
Cимптомы, течение
37.3. Наследственные опухолевые синдромы
Наследственная предрасположенность характерна для МРЩЖ, составляя от 20 до 30 % всех выявленных случаев. Заболевание может проявляться самостоятельной патологией – семейная форма МРЩЖ, либо встречаться в составе наследственных синдромов МЭН: МЭН2А или МЭН2В (таблица 37.5). Реже речь может идти о наследственной природе заболевания при папиллярном и фолликулярном РЩЖ (в 3–7 % случаев). Данные формы опухолей также могут быть как изолированной патологией, так и являться составляющей ряда наследственных синдромов – Гарднера, Коудена, Пейтца-Егерса и др.
Таблица 37.5. Синдромы, ассоциированные с наследственным РЩЖ
|
Синдром
|
Ген
|
Основные клинические проявления
|
|
Наследственный медуллярный РЩЖ
|
RET
|
Медуллярный РЩЖ
|
|
МЭН 2А (синдром Сиппла)
|
RET
|
Медуллярный РЩЖ
Феохромоцитома надпочечников
Гиперплазия паращитовидных желез
|
|
МЭН 2В (синдром Горлина)
|
RET
|
Медуллярный РЩЖ
Феохромоцитома надпочечников
Нейрофиброматоз слизистых оболочек/ЖКТ
Марфаноидные изменения тела
Пороки развития скелета
Поражение глаз
|
|
Синдром Гарднера
|
АРС
|
Диффузный полипоз кишечника с развитием доброкачественных/злокачественных опухолей ЖКТ
РЩЖ, крибриформный вариант
Рак желчного пузыря/протоков
Доброкачественные опухоли кожи/мягких тканей/костей (остеомы, фиброматоз и т.п.)
|
|
Синдром Коудена
|
PTEN
|
Множественные гамартомы ЖКТ
РЩЖ
Рак молочной железы
Поражение кожи/слизистых оболочек
Доброкачественные опухоли органов репродуктивной системы
Макроцефалия/задержка умственного развития
|
|
Синдром Пейтца-Егерса
|
STK11
|
Гамартомы ЖКТ
Меланиновая пигментация кожи/слизистых
РЩЖ
Злокачественные опухоли ЖКТ/органов репродуктивной системы/поджелудочной железы
|
|
Карни-комплекс
|
PRKAR1A
|
Поражение кожи/слизистых оболочек (лентигиноз, миксомы, голубые и эпителиоидные невусы)
Миксомы сердца
Первичная пигментная нодулярная надпочечниковая дисплазия
(ППННД)
Сертолиомы
Соматотропинома
Опухоли молочной железы
РЩЖ/множественный узловой зоб
Псаммозные меланотические шванномы
Остеохондромикома
|
Диагностика
37.2. Диагностика
37.2.1. Дооперационный диагноз устанавливается на основании клинических проявлений заболевания, результатах УЗИ и тонкоигольной биопсии опухоли под контролем УЗИ. Помимо этого, к числу обязательных диагностических методов исследования относят рентгенографию органов Грудной клетки в двух проекциях с томографией шеи и средостения, а также ларингоскопию.
37.2.2. Среди клинических признаков злокачественности узла щитовидной железы учитываются анамнестические данные (контакт с источником облучения – лучевое лечение, проживание на территориях, подвергшихся радионуклидной контаминации, медуллярный или папиллярный рак у близких родственников, быстрый рост узла), результаты объективного осмотра (плотная консистенция опухоли, фиксация к окружающим тканям, шейная лимфаденопатия, дисфагия, паралич голосовых связок), а также УЗ-характеристики. Существенную помощь в диагностике оказывает оценка состояния регионарных лимфатических узлов: их уплотнение и спаянность с окружающим тканями.
37.2.3. Результаты ультразвукового исследования с целью стратификации риска злокачественности и определения показаний к проведению ТАБ необходимо формулировать в соответствии с международной системой TIRADS (таблица 37.3).
Таблица 37.3. Интерпретация результатов ультразвукового исследования
|
Категория TIRADS
|
Значение
|
Риск развития рака
|
Тактика в отношении ТАБ
|
|
TIRADS 1:
|
патологии не выявлено
|
0 %
|
Не показана
|
|
TIRADS 2:
|
доброкачественное образование
|
0 %
|
Не показана
|
|
TIRADS 3:
|
вероятно доброкачественное образование
|
<5 %
|
Показана при размере узла ≥20 мм
|
|
TIRADS 4A:
|
неопределенный потенциал злокачественности
|
5-10 %
|
Показана при размере узла ≥10 мм
|
|
TIRADS 4B:
|
подозрительное к злокачественному процессу
|
10–80 %
|
Пунктируются все узлы вне зависимости от размера
|
|
TIRADS 5:
|
соответствует злокачественному процессу
|
>80 %
|
37.2.4. Результаты цитологического исследования по материалу тонкоигольной биопсии необходимо формулировать в соответствии с международной терминологией:
Таблица 37.4. Результаты цитологического исследования
|
Диагноз
|
Значение
|
Риск развития рака
|
|
Бетесда 1
|
материала недостаточно для диагностики (материал не информативен по причине малого количества клеток в аспирате)
|
1–4 %
|
|
Бетесда-2
|
доброкачественная опухоль/опухолеподобное заболевание
|
0–3 %
|
|
Бетесда-3 AUS/FLUS
|
клеточная атипия неопределенного потенциала злокачественности (атипия, атипическая пролиферация фолликулярных клеток или клеток Гюртле/ фолликулярные пролифераты неопределенного злокачественного потенциала
|
5–15 %
|
|
Бетесда-4 SFN/FN
|
подозрение на фолликулярную опухоль/опухоли из оксифильных1 клеток либо фолликулярная опухоль (опухоль из оксифильных клеток)
|
15-30 %
|
|
Бетесда-5 SFM
|
подозрение на рак (папиллярному, медуллярному и т.п.)
|
60–75 %
|
|
Бетесда-6
|
Рак (указать, по возможности, гистологическую форму).
|
|
Примечание: оксифильная клетка также носит название онкоцит, клетка Ашкенази, клетка Гюртле.
37.2.5. При выявлении у пациента узлового образования щитовидной железы показано определение уровня тиреотропного гормона (ТТГ). При обоснованном подозрении к медуллярной карциноме необходима оценка базального уровня кальцитонина крови, что по значимости превосходит результаты тонкоигольной аспирационной биопсии (ТАБ).
37.2.6. По индивидуальным показаниям производится эзофагография (эзофагоскопия), бронхоскопия, компьютерная (магнитно-резонансная) томография шеи и средостения, пункционная, трепанационная или эксцизионная биопсия увеличенных лимфатических узлов шеи и образования в щитовидной железе, остеосцинтиграфия, сцинтиграфия щитовидной железы, рентгенография костей, УЗИ органов брюшной полости и забрюшинного пространства, ангиография, флебография.
37.2.7. При недостаточном для оценки количестве клеток ТАБ повторяют, исходя из клинической ситуации. Повторную биопсию в сроки до 3 месяцев необходимо проводить и в случаях диагностики опухоли неопределенного потенциала злокачественности (AUS/FLUS, FN/SFN, SPC или SMC), особенно, при наличии клинических и ультрасонографических признаков рака. Следует избегать ситуации, при которой окончательный диагноз устанавливается во время операции. В качестве дополнительных критериев для постановки диагноза могут быть использованы характеристики молекулярных маркеров (генетические мутации и перестройки): BRAF, TERT, RET/PTC, PAX8/PPARγ.
37.2.8. Интраоперационная диагностика включает прицельную пункционную биопсию, изготовление мазков-отпечатков с опухоли и срочное гистологическое исследование удаленной ткани.
37.2.9. Окончательный диагноз и распространение рака щитовидной железы устанавливается по результатам морфологического изучения удаленного препарата и может корректироваться с учетом сцинтиграфии тела с 131I.
Молекулярно-генетическое тестирование мутаций в протоонкогене RET (5, 8, 10, 11, 13–16 экзоны) рекомендовано всем пациентам с впервые диагностированным медуллярным раком щитовидной железы (МРЩЖ) для своевременной диагностики наследственных синдромов множественных эндокринных неоплазий (МЭН2А и МЭН2В). Проведение молекулярно-генетического тестирования мутаций в протоонкогене RET рекомендовано родственникам пациентов с установленным диагнозом множественных эндокринных неоплазий (МЭН) МЭН 2А/семейный МРЩЖ и МЭН 2В.
Лечение
37.5. Лечение
Основной метод лечения пациентов состоит в выполнении оперативных вмешательств в сочетании с курсами радиойодтерапии и супрессивной или заместительной гормонотерапией левотироксином, а также дистанционной гамма-терапии и полихимиотерапии по индивидуальным показаниям. В большинстве наблюдений такой подход приводит к излечению пациентов.
37.5.1. Хирургическое лечение
Показание к хирургическому лечению – морфологически верифицированный рак или обоснованное результатами ультрасонографии и ТАБ подозрение к этому заболеванию. Все операции по поводу рака щитовидной железы должны выполняться под эндотрахеальным наркозом, экстракапсулярно. Выбор хирургического доступа осуществляется с учетом объема вмешательства и его возможных косметических последствий.
Хирургическое лечение анапластического рака щитовидной железы не целесообразно. После морфологической верификации дальнейшее лечение проводится с учетом распространенности опухолевого процесса.
При невозможности проведения радикального хирургического вмешательства иные варианты лечения определяются консилиумом.
Объем операции на щитовидной железе:
У пациентов с доказанным папиллярным, фолликулярным, медуллярным и плохо дифференцированным раком и распространением опухоли
T1-4N0-1M0-1 производится экстрафасциальная тиреоидэктомия.
При солитарной папиллярной микрокарциноме размером 5 мм и менее (Т1аN0M0) допускается выполнение гемитиреоидэктомии. Возможен вариант видеоассистированной операции.
Объем операции на регионарных лимфатических узлах:
С учетом клинической и морфологической информации выполняется либо лечебное (при доказанном метастатическом поражении), либо профилактическое фасциально-футлярное удаление регионарных лимфатических узлов.
Классификация операций на регионарных лимфатических узлах
Радикальная шейная диссекция (операция Крайла) показана при множественных метастазах в лимфатических узлах с вовлечением в опухолевый процесс внутренней яремной вены. В блок удаляемых тканей включают Грудино-ключично-сосцевидную мышцу, внутреннюю яремную вену, добавочный нерв, подчелюстную слюнную железу и нижний полюс околоушной слюнной железы, жировую клетчатку с лимфатическими узлами в пределах следующих Границ:
- спереди – laminasuperficialisfasciaecervicalis,
- сзади – laminaprevertevralisfasciaecervicalis (оба фасциальных листка должны быть стенками удаленного препарата),
- снизу – ключица,
- латерально – край трапециевидной мышцы,
- сверху – нижний полюс околоушной слюнной железы,
- медиально – срединная линия шеи.
Модифицированная радикальная шейная диссекция. В классическом варианте при этой операции не иссекается внутренняя яремная вена, добавочный нерв и Грудино-ключично-сосцевидная мышца. Клетчатка и лимфатические узлы I – V уровней удаляются в пределах Границ, как при операции Крайла. Модифицированная шейная диссекция при раке щитовидной железы обладает такой же степенью радикальности, как операция Крайла. Это вмешательство может выполняться на обеих сторонах шеи и обычно хорошо переносится пациентами.
Селективная шейная диссекция предполагает выборочное удаление одной или нескольких Групп лимфатических узлов. Принято выделять верхний, латеральный, заднелатеральный и передний варианты этой операции.
При верхней диссекции удалению подлежат лимфатические узлы I, II и III уровней. Операция включает иссечение клетчатки в подчелюстном и подбородочном треугольнике шеи, верхние и средние яремные лимфоузлы с фасцией, покрывающей медиальную и заднюю поверхность Грудино-ключично-сосцевидной мышцы. Во время операции сохраняются внутренняя яремная вена и добавочный нерв.
Латеральная диссекция включает иссечение клетчатки с лимфатическими узлами II, III и IV уровней по ходу сосудисто-нервного пучка. Это вмешательство может выполняться с превентивной целью на обеих сторонах шеи.
Заднелатеральная диссекция включает объем латерального варианта с дополнительным удалением затылочных, постаурикулярных и добавочных лимфатических узлов.
Передняя (центральная по отношению к щитовидной железе) диссекция выполняется от подъязычной кости сверху до края рукоятки Грудины снизу. Латеральными Границами операции считаются сонные артерии. Данный вариант вмешательства следует выполнять с большой тщательностью, так как с жировой клетчаткой и лимфатическими узлами могут быть удалены паращитовидные железы, что приводит к постоянному гипопаратиреозу.
Медиастинальная лимфодиссекция. Данная методика предполагает вертикальную стернотомию до уровня середины тела Грудины, мобилизацию, удаление или частичную резекцию тимуса. Иссекается клетчатка переднего средостения, расположенная позади вилочковой железы на перикарде, вдоль плечеголовных сосудов, позади верхней полой вены. Удалению подлежат верхние паратрахеальные, верхние медиастинальные, трахеобронхиальные и подаортальные лимфатические узлы.
Расширенная шейная диссекция предполагает включение в блок удаляемых тканей лимфатических узлов и тканевых структур, которые не входят в стандартную радикальную диссекцию, например, подъязычный нерв, сонная артерия, лестничная мышца, ретрофарингеальные лимфоузлы.
Объем операции на регионарных лимфатических узлах при дифференцированном раке:
Центральную шейную лимфодиссекцию (уровень VI) проводят у всех пациентов вне зависимости от размеров первичного очага, гистологической структуры опухоли и состояния лимфатических узлов шеи.
Профилактическая селективная ипсилатеральная лимфодиссекция (уровни III и IV) показана при папиллярном раке щитовидной железы с распространением T1-4N0M0-1и локализации опухолевого очага в одной доле.
При локализации рака в перешейке или на Границе с перешейком, в обеих долях щитовидной железы, а также при наличии метастазов в лимфатических узлах VI уровня (T1-4N0-1aM0-1) обязательно выполнение профилактической селективной билатеральной лимфодиссекции (уровни III и IV).
При наличии микрометастазов в лимфатических узлах клетчатки шеи III–IV уровней, выявленных по результатам послеоперационного морфологического исследования, дальнейшее определение лечебной тактики зависит от данных радиойоддиагностики. При накоплении радиофармпрепарата в оставшихся лимфатических узлах предпочтительно выполнение повторного хирургического вмешательства.
Радикальная или радикальная модифицированная лимфодиссекция (уровни I–VI) выполняется у пациентов с множественным метастатическим поражением латеральных глубоких лимфатических узлов шеи и при вовлечении в опухолевый процесс мышц шеи и внутренней яремной вены (T1-4N1bM0-1). При этом профилактическая селективная лимфодиссекция (уровни III и IV) на контрлатеральной стороне обязательна.
Объем операции на регионарных лимфатических узлах при медуллярном или плохо дифференцированном раке:
При медуллярном или плохо дифференцированном раке с распространением (T1-4 N0-1a M0), наряду с удалением лимфоузлов VI уровня, показано выполнение двусторонней латеральной селективной лимфодиссекции (уровни II, III и IV). В случае выявления метастазов в глубоких латеральных лимфатических узлах шеи требуется расширение объема операции до радикальной модифицированной лимфодиссекции (уровни I–VI) на стороне поражения с профилактической латеральной селективной лимфодиссекцией (уровни II, III и IV) на контралатеральной стороне.
Медиастинальную лимфодиссекцию применяют при наличии метастазов в лимфатических узлах VI–VII уровней. Возможен вариант видеоассистированной операции.
Нерадикальными считаются интракапсулярные операции и любые другие оперативные вмешательства, выполненные без фасциально-футлярного удаления регионарных лимфатических узлов шеи.
Если карцинома щитовидной железы выявлена морфологически только на послеоперационном этапе, пациенту показано повторное хирургическое вмешательство в радикальном объеме. Исключения допустимы:
При интратиреоидной неметастазирующей солитарной папиллярной микрокарциноме (T1aN0M0) с учетом отсутствия агрессивного варианта папиллярного рака, без инвазии лимфатических и/или кровеносных сосудов, и когда нет интратиреоидной диссеминации псаммомными тельцами.
При инкапсулированном фолликулярном варианте папиллярного рака (NIFTP), а также в случаях минимально инвазивного фолликулярного рака.
37.6. Радиойодтерапия (терапия 131I) в лечении рака щитовидной железы
Радиойодтерапия (РЙТ) относится к селективной лучевой терапии, обеспечивающей быстрое завершение абляции резидуальной тиреоидной ткани, своевременное диагностирование и эффективное лечение возможного метастатического процесса. Радиойодтерапия применяется после хирургического лечения пациентов с дифференцированным раком щитовидной железы (ДРЩЖ). Обязательным условием для проведения данного вида терапии является способность патологического очага накапливать 131I.
37.6.1. Показания к применению РЙТ:
- абляция резидуальной ткани щитовидной железы;
- абляция резидуальных карцином в ложе железы, лимфатических узлах и рецидивов рака щитовидной железы;
- лечение отдаленных радиойодпозитивных метастазов.
37.6.2. Радиойодтерапия с профилактической целью (абляция остатков тиреоидной ткани) проводится пациентам, относящимся к промежуточной и высокой Группам риска возникновения рецидива (таблица 37.7).
Таблица 37.7. Стратификация пациентов всех возрастов по Группам риска рецидива
|
Низкий риск
|
Промежуточный риск
|
Высокий риск
|
|
Папиллярный рак: интратиреоидный рак, размер первичного очага Т1- 3N0M0; неагрессивный вариант гистологического строения, инкапсулированный фолликулярный рак Т1-3 с инвазией капсулы опухоли либо единичных (4) кровеносных сосудов; отсутствие накопления радиофарпрепарата за пределами ложа щитовидной железы
|
Папиллярный рак: опухоли любого размера с минимальным экстратиреоидным распространением
либо интратиреоидный рак
размерами 1–4 см, агрессивный вариант гистологического строения; сN1 либо микрометастазы в лимфатических узлах шеи при сN0,
либо макрометастазы без образования конгломератов; накопление радиофарпрепарата за пределами ложа щитовидной железы
|
Папиллярный и фолликулярный рак: макроскопическое
прорастание за пределы капсулы щитовидной железы;
N1 с образованием
конгломератов; М1; фолликулярный рак с инвазией
крупных кровеносных сосудов за пределами капсулы опухоли
и/или более 4 фокусов инвазии кровеносных сосудов капсулы
опухоли
|
37.6.3. Противопоказания к применению РЙТ:
- беременность, лактация;
- общее тяжелое состояние пациента, обусловленное основным и/или сопутствующими заболеваниями (индекс Карновского, менее 40);
- гипо-, апластическое состояние костного мозга;
- заболевания печени, почек (почечная, печеночная недостаточность);
- острая язвенная болезнь желудка и двенадцатиперстной кишки;
- туберкулез легких в активной фазе при наличии отдаленных метастазов в легких;
- неконтролируемое поведение при психических заболеваниях;
- инфекционные заболевания;
- распад опухоли с угрозой кровотечения;
- показатели крови: уровень: гемоглобина менее 80 г/дл, лейкоциты менее 3,0*1000/микролитр и тромбоциты менее 100*1000/микролитр, не купирующиеся медикаментозно.
37.6.3.1. Пациентам низкой Группы риска профилактические курсы радиойодтерапии не показаны.
37.6.3.2. Обязательные требования к применению данного метода лечения:
Объем предшествующей операции – тиреоидэктомия;
Уровень ТТГ в крови должен быть больше 25 мМЕ/л при отмене гормональной терапии (приема левотироксина) на 4 недели до введения 131I или путем применения рекомбинантного человеческого ТТГ в соответствии с инструкцией по использованию;
Проведение радиойодтеста (непосредственно перед лечением 131I).
37.6.3.3. При назначении первого профилактического (абляционного) курса радиойодтерапии, значения активности 131I на курс определяются возрастом, массой тела пациента и результатом радиойодтеста.
37.6.3.3.1. Радиойодтест выполняется после введения диагностической активности 5,6–10MБ 131I. Если через 24 часа в области шеи накапливается более 10 % радиофармпрепарата, то требуется обсуждение возможности повторного хирургического вмешательства. Для расчета активности 131I для первого курса радиойодтерапии следует ориентироваться на данные таблицы 37.8.
Таблица 37.8. Расчет активности 131I в ГБк на первый курс терапии в зависимости от результатов радиойодтеста
|
Процент накопления 131I
|
Категория пациентов
|
|
|
Взрослые (ГБк)
|
Дети (МБк на кг
массы тела)
|
|
|
<5 %
|
2-3
|
52
|
|
5–10 %
|
1-2
|
25
|
|
10–20 %
|
Не более 1
|
15
|
37.6.3.3.2. Радиойодтест с последующим первым профилактическим курсом радиойодтерапии проводится через 4 недели после проведенного хирургического лечения.
37.6.3.3.3. Повторные профилактические курсы лечения 131I, для абляции резидуальной ткани, повторятся с периодичностью от 8 до 12 месяцев с последовательным повышением активности не менее чем на 30 % от предшествующего курса, но не более 5,5ГБк.
37.6.4. Радиойодтерапия резидуальных карцином в ложе железы, метастазов в регионарных лимфатических узлах, рецидивов и отдаленных метастазов начинается с введения при первом курсе лечения: для взрослых 3–4 ГБк, для детей (до 18 лет включительно) не менее 50 МБк на кг массы тела.
37.6.4.1. Повторные курсы радиойодтерапии с указанной целью осуществляются каждые 6–8 месяцев с последовательным увеличением активности на курс не менее чем на 30 %. Максимальная активность на введение для взрослых 7,5 ГБк и не более 100 МБк 131I на кг массы тела для детей.
37.6.4.2. При достижении суммарной (кумулятивной) активности 131I с терапевтической целью 37 ГБк для взрослых и 18 ГБк для детей проведение каждого последующего курса решается консилиумом, с регистрацией показателей: динамики картины включения 131I в метастазах, рентгенологических данных о состоянии очагов поражения и легочной паренхимы, динамики уровня ТГ в гипотиреозе, показателей функции внешнего дыхания и общего анализа крови.
37.6.4.3. Изменение тактики, вводимых активностей, длительности между курсами, привлечение ДЛТ, ПХТ и средств, стимулирующих повышение дифференцировки опухолевых структур, осуществляется консилиумом индивидуально для каждого случая.
37.6.5. Перед каждым курсом радиойодтерапии проводится подготовка включающая:
определение уровня ТТГ и ТГ в сыворотке крови; общие анализы крови и мочи; биохимический анализ крови с определением уровней белка, мочевины, билирубина, кальция и фосфора; ультразвуковое исследование области шеи и региональных лимфатических узлов; рентгенографию органов Грудной клетки (1 раз в течении года); исследование функции внешнего дыхания; электрокардиографическое исследование; консультацию гинеколога (исключение беременности).
37.6.5.1. Дополнительные исследования у пациентов при наличии отдаленных метастазов: КТ или МРТ области поражения/зоны интереса; остеосцинтиграфия; по решению консилиума при снижении радиойодпозитивности патологических очагов проводятся ПЭТ/КТ, а при необходимости исследовать экспрессию рецепторов соматостатина в патологических очагах ОФЭКТ/КТ с Tectrotyd – Tc99m.
37.6.6. При отсутствии накопления 131I в опухоли, регионарных и/или отдаленных метастазах радиойодтерапия не проводится.
37.6.7. Контроль за эффективностью радиойодтерапии обеспечивается:
1. Выполнением посттерапевтической сцинтиграфии всего тела с целью выявления очагов накопления 131I в теле пациента. Исследование выполняется при достижении мощности экспозиционной дозы в 3 мкЗв в час на расстоянии 1 метра от пациента (3–8 день от введения радиофармпрепарата).
2. Оценкой изменений, выявленных при рентгенологическом и сонографическом исследовании органов и тканей;
3. Значениями уровня ТГ в сыворотке крови и динамикой их изменений.
37.6.7.1. Отсутствие на посттерапевтической сцинтиграмме признаков характерных для резидуальной ткани, рецидива опухоли или метастазов рака указывает на достижения эффекта и дальнейшие курсы радиойодтерапии не показаны. Таким пациентам показано проведение контрольной радиойоддиагностики с 300–400 МБк;
37.6.8. Контрольная радиойоддиагностика проводится пациентам у которых по результатам предшествующей радиойодтерапии достигнута абляция радиойодпозитивных патологических очагов. Выполняется сцинтиграфия всего тела через 24–48 часов от введения 300–400 МБк 131I. Требования к подготовке и обследованию пациентов перед контрольной радиойоддиагностикой не отличаются от таковых перед курсами радиойодтерапии.
37.6.8.1. Первая радиойоддиагностика, не зависимо от возраста, выполняется пациентам: не имевших отдаленных метастазов через 24 месяца, с ранее диссеминированным процессом через 12 месяцев. При отсутствии радиойодпозитивных признаков рецидива последующие аналогичные исследования проводятся с интервалом 36 и 24 месяца соответственно.
37.6.8.2. При выявлении прогрессирования заболевания решение о проведении курсов радиойодтерапии принимает консилиум.
37.6.8.3. Отсутствие на сцинтиграммах радиойодпозитивных патологических включений указывает на ремиссию процесса. При отсутствии радиойодпозитивных включений в течении 10 лет после проведенного хирургического вмешательства дальнейшее проведение контрольных радиойоддиагностик не показано.
37.6.9. После проведения радиойодтерапии и радиойоддиагностики необходимо использовать методы контрацепции для предотвращения беременности: мужчинам в течении 6 месяцев, женщинам в течении 12 месяцев.
37.7. Дистанционная лучевая терапия
Применение дистанционной лучевой терапии (ДЛТ) ограничено в связи с низкой чувствительностью папиллярного и фолликулярного рака щитовидной железы к данному виду лечения. Применение ДЛТ оправдано наличием опухолевых очагов, не накапливающих радиоактивный йод и хирургически нерезектабельных. В качестве паллиативного лечения ДТЛ может быть применена при болевом синдроме (сдавлении трахеи, спинного мозга). Как дополнительный метод лечения ДЛТ используется при неоперабельных случаях плоходифференцированного, медуллярного, анапластического рака.
37.8. Химиотерапия
В настоящее время нет доказательств эффективности системной химиотерапии при папиллярном, фолликулярном и плоходифференцированном раке щитовидной железы.
37.8.1. Лечение местно-распространенного анапластического рака щитовидной железы:
Доксорубицин 20 мг/м2, еженедельно
Доксорубицин 60 мг/м2, 1 раз в 3 недели
Цисплатин 35 мг/м2, еженедельно
Паклитаксел 30–60 мг/м2, еженедельно
Комбинация: Паклитаксел 50 мг/м2 + карбоплатин AUC 2, еженедельно.
Предпочтительно использовать еженедельные режимы введения в сочетании с лучевой терапией.
37.8.2. Лечение метастатического анапластического рака щитовидной железы:
Монотерапия:
Доксорубицин 20 мг/м2, еженедельно
Доксорубицин 60–75 мг/м2, 1 раз в 3 недели
Паклитаксел 60–90 мг/м2, еженедельно
Паклитаксел 60–90 мг/м2, еженедельно
Паклитаксел 175–200 мг/м2, 1 раз в 3 недели
Комбинированные режимы:
Паклитаксел 60–100 мг/м2 + карбоплатин AUC 2, еженедельно
Паклитаксел 135–175 мг/м2 + карбоплатин AUC 5–6, 1 раз в 3 недели
Доцетаксел 60 мг/м2 + доксорубицин 60 мг/м2, 1 раз в 3 недели
37.8.3. Метастатический медуллярный рак щитовидной железы:
Доксорубицин, 5-FU, дакарбазин
При метастатическом поражении костей необходимо использование бисфосфонатов.
При радиойоднегативном дифференцированном раке щитовидной железы вопрос о применении мультикиназных ингибиторов решается индивидуально, консилиумом специалистов, на основании клинико-морфологических данных и результатов молекулярно-генетических исследований (таблица 37.9).
Таблица 37.9. Типичные ассоциации между молекулярно-генотипическими аномалиями и разновидностями рака щитовидной железы
|
Генетическая мутация
|
Морфологический вариант карциномы
|
|
RET/PTC 1
|
Классический и диффузно-склеротический варианты папиллярного рака (в том числе – наблюдения карцином, индуцированных радиацией)
|
|
RET/PTC 3
|
Солидный вариант папиллярного рака (в том числе наблюдения карцином, индуцированных радиацией)
|
|
RAS, PAX8-PPARγ
|
Фолликулярный рак, фолликулярный вариант папиллярного рака (преимущественно не инвазивный тип), плохо дифференцированный рак, анапластический рак
|
|
ALK-fusions
|
Плохо дифференцированный рак, анапластический рак
|
|
BRAF V600E
|
Преимущественно классический, оксифильноклеточный или высококлеточный папиллярный рак
|
|
PI3K/AKT
|
Фолликулярный рак, плохо дифференцированный рак, анапластический рак
|
|
APC, beta-catenin
|
Крибриформный (крибриформно-морулярный) вариант папиллярного рака
|
|
TERT
|
Папиллярный рак (часто встречается при высококлеточном и оксифильноклеточном вариантах), как правило, агрессивного клинического поведения, плохо дифференцированный рак, анапластический рак
|
|
PTEN
|
Плохо дифференцированный рак, анапластический рак
|
7.9. Супрессивная терапия левотироксином
Применяется как компонент комплексного лечения пациентов с ДРЩЖ после хирургического лечения с целью подавления секреции ТТГ супрафизиологическими дозами экзогенного левотироксина. ТТГ – фактор роста клеток папиллярного и фолликулярного рака щитовидной железы. Подавление секреции этого гормона уменьшает риск рецидива в тиреоидной ткани и снижает вероятность отдаленных метастазов.
Супрессивная терапия показана пациентам с доказанной опухолевой персистенцией ДРЩЖ. Целевое значение ТТГ 0,1 мМЕ/л при нормальных значениях св.Т4.
37.9.1. Супрессивная гормонотерапия показана при ДРЩЖ независимо от объема произведенной операции. Для достижения эффекта левотироксин назначается в следующих дозах:
от 2,0 мкг на 1 кг массы у детей и подростков;
от 1,5 мкг на 1 кг массы у взрослых.
В последующем начальная доза препарата корректируется для достижения целевых уровней супрессии ТТГ.
37.9.2. Контроль ТТГ и коррекция дозы левотироксина должно осуществляться каждые 3 месяца в течение первого года после операции. В последующие сроки – не реже 2 раз в год.
37.9.3. Пациентам с высоким риском рецидива заболевания при проведении супрессивной терапии показан целевой уровень ТТГ не выше 0,1мМЕ/л. При промежуточном риске 0,1–0,5 мМЕ/л, при низком риске допустимы уровни 0,5–2,0мМЕ/л.
37.9.4. Продолжительность супрессивной терапии левотироксином устанавливается индивидуально: перевод пациентов с супрессивной на заместительную терапию левотироксином может быть произведен у пациентов из Группы низкого и промежуточного риска развития рецидива заболевания, если в течение 5 лет после окончания лечения не было прогрессирования заболевания.
37.10. Заместительная гормональная терапия
Применяется у пациентов с карциномой щитовидной железы в послеоперационном периоде независимо от гистологической формы опухоли и объема произведенной операции с целью устранения гипотиреоза левотироксином в физиологических дозах.
37.10.1. Показания:
Пациентам с МРЩЖ: заместительная терапия левотироксином с целевым диапазоном уровня ТТГ в пределах от 0,5 до 2,0мМЕ/л.
Пациентам с ДРЩЖ при наличии факторов клинического риска развития побочных эффектов супрессивной терапии левотироксином (пациенты с сердечно-сосудистыми заболеваниями – нарушениями ритма сердца, артериальной гипертензией, ишемической болезнью сердца, при риске или наличии транзиторных ишемических атак и инсультов, с сопутствующими заболеваниями (хроническая болезнь почек), постменопауза у женщин, андрогенный дефицит у мужчин, остеопороз;
37.10.2. При заместительной гормонотерапии уровень ТТГ в крови должен находиться в пределах 0,3–2,0 мМЕ/л.
Рекомендуемая доза: 1,5 мкг на кг веса для взрослых, 2 мкг на кг массы для детей. Контроль уровня ТТГ в крови – 1 раз в 6 месяцев.
Заместительная терапия у пациентов с карциномой щитовидной железы проводится пожизненно.
37.11. Наблюдение пациентов
Начальная стратификация у пациентов, страдающих папиллярным раком, проводится на основании дооперационных данных, интраоперационной оценки (распространение опухоли за пределы капсулы щитовидной железы, резектабельность) и результатов послеоперационного морфологического, инструментальных и лабораторных исследований. Так, если уровень нестимулированного тиреоглобулина (ТГ) через 4–6 недель после полного удаления щитовидной железы не достигает 0,2 нг/мл, а уровень ТТГ-стимулированного тиреоглобулина не превышает 2нг/мл, нет признаков активности 131I в ложе щитовидной железы и за его пределами, то такой пациент находится в состоянии ремиссии. При наличии тиреоглобулина в крови выше указанных значений и/или активности 131I в ложе щитовидной железы и за его пределами пациент не считается излеченным (персистенция заболевания, на фоне которой может произойти прогрессирование – обнаружение очагов опухоли во внутренних органах и костях скелета после завершения абляции остатков щитовидной железы). Рецидивом заболевания называется вновь обнаруженный (после всех исследований, результаты которых указывают на отсутствие опухоли в организме) опухолевый очаг (очаги), о возникновении которого свидетельствуют результаты инструментальных и лабораторных исследований (УЗИ, КТ, МРТ, ПЭТ, сцинтиграфия всего тела с использование 131I).
Наиболее высокочувствительным методом динамического наблюдения является определение ТГ специфического высокочувствительного маркера ДРЩЖ. Присутствие в крови антител к тиреоглобулину (АТ-ТГ) может стать причиной ложноотрицательного результата исследования ТГ. С диагностической точки зрения гораздо более значимым фактором является вираж АТ-ТГ. Нестимулированный уровень ТГ более 2,0 нг/мл является показанием к дальнейшему обследованию. Выявление виража АТ-ТГ после проведенного радикального лечения рассматривается как возможный показатель персистенции опухоли. Оптимальным для стимуляция ТГ является использование рекомбинантного человеческого тиреотропного гормона гипофиза. О стойкой ремиссии (клиническом излечении) говорят при неопределяемых уровнях ТГ и АТ-ТГ на фоне стимуляции уровня ТТГ.
Пациентам с ДРЩЖ после проведенного лечения определение ТТГ, ТГ, Т4 свободного и АТ-ТГ на фоне супрессивной или заместительной терапии, УЗИ-контроль органов шеи показаны каждые 6 мес. Рентген-контроль органов Грудной клетки 1 раз в год. Пациентам со стойкой ремиссией после 5 лет наблюдения выполняется контрольное обследование 1 раз в год.
Пациентам с медуллярной карциномой после тиреоидэктомии уровень опухолевых маркеров – кальцитонина и РЭА – необходимо исследовать каждые 3 мес. в первый год после операции и каждые 6 мес. в последующий период наблюдения. Основным критерием биохимической ремиссии считается базальный уровень кальцитонина менее 10 пг/мл, который при стимуляции глюконатом кальция увеличивается не более чем в два раза. Помимо исследования уровня кальцитонина, каждые 6 мес. пациентам необходимо выполнение УЗИ органов шеи, органов брюшной полости, рентген-контроль органов Грудной клетки, при необходимости КТ-исследование.
Наблюдение следует проводить в течение всей жизни пациента в специализированном медицинском учреждении.
Профилактика
Профилактическая тиреоидэктомия
Ведущим методом профилактики наследственного медуллярного рака щитовидной железы на сегодняшний день остаются своевременные профилактические хирургические подходы. Генетический тест на точковые мутации протоонкогена RET следует проводить всем пациентам с впервые диагностированным медуллярным раком щитовидной железы (МРЩЖ), а также родственникам (детям и взрослым) этих пациентов.
Основная цель профилактической тиреоидэктомии – предотвращение развития злокачественной опухоли и ее метастазирования. Кроме того, тиреоидэктомия, выполненная до метастатического поражения лимфатических узлов, позволяет избежать проведения центральной лимфодиссекции, которая ассоциирована с более высоким риском гипопаратиреоза и повреждения возвратных гортанных нервов. Оптимальные сроки выполнения профилактической тиреоидэктомии определяются на основании статуса мутации RET (сведения о поврежденном кодоне), возраста пациента.
Профилактическая (превентивная) тиреоидэктомия до 2 лет рекомендуется при диагностировании синдрома МЭН-2В и на основании выявления мутаций в протоонкогене RET: в кодонах 883 или 918; комбинации гетерозигот V804M + E805K, V804M + Y806C или V804M + S904C.
Профилактическая (превентивная) тиреоидэктомия в возрасте до 5 лет рекомендуется: при диагностировании синдрома МЭН-2А или семейного МРЩЖ при выявлении мутаций в протоонкогене RET в кодонах 609, 611, 618, 620, 630, 634. Проведение профилактической тиреоидэктомии может быть отсрочено при выявлении мутаций в протоонкогене RET в кодонах 768, 790, 791, 804 и 891, но при этом требуется динамическое наблюдение за пациентом.
Ввиду сложности выполнения экстрафасциальной тиреоидэктомии у детей в раннем возрасте необходимо проводить такое лечение только в специализированном центре.
Обоснованных рекомендаций по проведению профилактического хирургического лечения рака щитовидной железы, развивающегося в составе других наследуемых заболеваний (папиллярный рак крибриформного строения при поли позе толстого кишечника, синдромах Гарднера и Турко, фолликулярный рак при синдроме Каудена и комплексе Карни), пока не выработано. Тем не менее, при обнаружении в щитовидной железе папиллярного рака крибриформного (крибриформно-морулярного) строения пациента необходимо обследовать на наличие герминативной мутации гена APC. Ткань удаленной опухоли исследуется при помощи моноклональных антител APC, β-catenin, p53, пациенту рекомендуется выполнить колоноскопию и рентгенографию костей черепа, поскольку именно в этой части скелета чаще всего обнаруживается остеома.
Информация
Источники и литература
-
Постановления и приказы Министерства здравоохранения Республики Беларусь об утверждении клинических протоколов 2006-2019
- Постановления и приказы Министерства здравоохранения Республики Беларусь об утверждении клинических протоколов 2006-2019 -
-
www.minzdrav.gov.by
- www.minzdrav.gov.by -
Информация
ГЛАВА 2
ОЦЕНКА ОБЩЕГО СОСТОЯНИЯ ОНКОЛОГИЧЕСКОГО ПАЦИЕНТА
Общее состояние онкологического пациента (Performance status) рекомендовано оценивать по индексу Карновского (0–100 баллов) или шкале ECOG (0–4 балла) (таблицы 2.1, 2.2).
Таблица 2.1. Индекс Карновского
Таблица 2.1. Индекс Карновского
|
Нормальная физическая активность, пациент не нуждается в специальном уходе
|
100 баллов | Состояние нормальное, нет жалоб и симптомов заболевания |
| 90 баллов | Нормальная активность сохранена, но имеются незначительные симптомы заболевания | |
| 80 баллов | Нормальная активность возможна при дополнительных усилиях, при умеренно выраженных симптомах заболевания | |
|
Ограничение нормальной активности при сохранении полной независимости пациента
|
70 баллов | Пациент обслуживает себя самостоятельно, но не способен к нормальной деятельности или работе |
| 60 баллов | Пациент иногда нуждается в помощи, но в основном обслуживает себя сам | |
| 50 баллов | Пациенту часто требуется помощь и медицинское обслуживание | |
|
Пациент не может обслуживать себя самостоятельно, необходим уход или госпитализация
|
40 баллов | Большую часть времени пациент проводит в постели, необходим специальный уход и посторонняя помощь |
| 30 баллов | Пациент прикован к постели, показана госпитализация, хотя терминальное состояние не обязательно | |
| 20 баллов | Сильные проявления болезни, необходима госпитализация и поддерживающая терапия | |
| 10 баллов | Умирающий пациент, быстрое прогрессирование заболевания | |
| 0 баллов | Смерть |
Таблица 2.2. Оценка статуса пациента по шкале ECOG
| Оценка | |
| 0 | Пациент полностью активен, способен выполнять все, как и до заболевания (90–100 баллов по шкале Карновского) |
| 1 | Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу, 70–80 баллов по шкале Карновского) |
| 2 | Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50 % времени бодрствования проводит активно – в вертикальном положении (50–60 баллов по шкале Карновского) |
| 3 | Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50 % времени бодрствования (30–40 баллов по шкале Карновского) |
| 4 | Пациент, совершенно не способен к самообслуживанию, прикован к креслу или постели (10–20 баллов по шкале Карновского) |
Приложение
ТАБЛИЦЫ СООТВЕТСТВИЯ «СТАДИЯ-TNM» ДЛЯ РЯДА ЛОКАЛИЗАЦИЙ: ТОНКИЙ КИШЕЧНИК, АМПУЛА ФАТЕРОВА СОСКА, ТИМОМА, МЕЗОТЕЛИОМА ПЛЕВРЫ, КАРЦИНОМА МЕРКЕЛЯ КОЖИ, КОРА НАДПОЧЕЧНИКА
ТОНКИЙ КИШЕЧНИК C17
Таблица 1. Группировка по стадиям
| Стадия 0 | Tis | N0 | M0 |
| Стадия I | Т1, Т2 | N0 | M0 |
| Стадия IIА | Т3 | N0 | M0 |
| Стадия IIB | T4 | N0 | M0 |
| Стадия IIIA | Любая Т | N1 | M0 |
| Стадия IIIB | Любая Т | N2 | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
АМПУЛА ФАТЕРОВА СОСКА C24.1
Таблица 2. Группировка по стадиям
| Стадия 0 | Tis | N0 | M0 |
| Стадия IA | Т1a | N0 | M0 |
| Стадия IB | Т1b, Т2 | N0 | M0 |
| Стадия IIА | Т3a | N0 | M0 |
| Стадия IIB | Т3b | N0 | M0 |
| Стадия IIIA | Т1a, Т1b, Т2, T3 | N1 | M0 |
| Стадия IIIB | Т4 | Любая N | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
ТИМОМА C37, C38.1-3
Таблица 3. Группировка по стадиям
| Стадия I | T1 | N0 | M0 |
| Стадия II | T2 | N0 | M0 |
| Стадия IIIА | T3 | N0 | M0 |
| Стадия IIIB | T4 | N0 | M0 |
| Стадия IVA | Любая Т |
N1
N0, N1
|
M0
M1A
|
| Стадия IVB | Любая Т | Любая N | M1B |
МЕЗОТЕЛИОМА ПЛЕВРЫ C45.0
Таблица 4. Группировка по стадиям
| Стадия IA | T1 | N0 | M0 |
| Стадия IB | T2, T3 | N0 | M0 |
| Стадия II | T1, T2 | N1 | M0 |
| Стадия IIIА | T3 | N1 | M0 |
| Стадия IIIB | T1, T2, T3, T4 |
N1 Любая N |
M0 |
| Стадия IV | Любая Т | Любая N | M1 |
КАРЦИНОМА МЕРКЕЛЯ C44, C63.2
Таблица 5а. Группировка по стадиям клиническая
| Стадия 0 | Tis | N0 | M0 |
| Стадия I | Т1 | N0 | M0 |
| Стадия IIА | T2, Т3 | N0 | M0 |
| Стадия IIB | Т4 | N0 | M0 |
| Стадия III | Любая Т | N1, N2, N3 | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
Таблица 5б. Группировка по стадиям патоморфологическая
| Стадия 0 | Tis | N0 | M0 |
| Стадия I | Т1 | N0 | M0 |
| Стадия IIА | Т2, T3 | N0 | M0 |
| Стадия IIB | Т4 | N0 | M0 |
| Стадия IIIA |
Т0
Т1, Т2, T3, Т4
|
N1b
N1a
|
M0 |
| Стадия IIIB | Любая Т | N1, N2, N3 | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
КОРА НАДПОЧЕЧНИКА C74.0
Таблица 6. Группировка по стадиям
| Стадия I | Т1 | N0 | M0 |
| Стадия II | Т2 | N0 | M0 |
| Стадия III |
Т1, T2
Т3, T4
|
N1
N0, N1
|
M0 |
| Стадия IV | Любая Т | Любая N | M1 |
Под редакцией
д-р мед. наук, проф. О.Г.Суконко,
д-р мед. наук, проф., член-корр. НАН Беларуси С.А.Красный
Авторский коллектив:
Антоненкова Нина Н., д.м.н., доц.;
Ануфреенок И.В., к.м.н.;
Артемова Н.А., д.м.н., доц.;
Баранов А.Ю., к.м.н.;
Баранов Е.В., к.м.н.;
Бармотько М.А.;
Грачев Ю.Н., к.м.н.;
Демешко П.Д., д.м.н.;
Демидчик Ю.Е., д.м.н., проф.;
Дзюбан В.П.;
Доломанова Е.В.;
Дубровский А.Ч., к.м.н.;
Евмененко А.А.;
Ермаков Н.Б., к.м.н.;
Жаврид Э.А., д.м.н., проф.;
Жарков В.В, д.м.н., проф.;
Жиляева Е.П.;
Жуковец А.Г., к.м.н.;
Зеленкевич И.А., к.м.н.;
Ильин И.А., к.м.н.;
Караник В.С., к.м.н.;
Карман А.В., к.м.н., доц.;
Киселев П.Г., к.м.н.;
Клименко Д.П.;
Колядич Г.И., к.м.н.;
Кондратович В.А.;
Котов А.А., к.м.н.;
Кохнюк В.Т., д.м.н., проф.;
Красный С.А., д.м.н., проф.;
Крутилина Н.И., д.м.н., проф.;
Курченков А.Н., к.м.н.;
Курчин В.П., д.м.н.;
Левин Л.Ф.;
Леонова Т.А.;
Мавричев А.С., д.м.н., проф.;
Мавричев С.А., к.м.н.;
Малькевич В.Т., д.м.н., доц.;
Маньковская С.В.;
Матылевич О.П., к.м.н.;
Минайло И.И., к.м.н.;
Минич А.А., к.м.н.;
Моисеев П.И., к.м.н.;
Набебина Т.И., к.м.н.;
Науменко Л.В., к.м.н.;
Океанов А.Е., д.м.н., проф.;
Пархоменко Л.Б., к.м.н., доц.;
Петрушенко Ю.И.;
Писаренко А.М.;
Поляков С.Л., к.м.н.;
Портянко А.С., д.м.н., доц.;
Прохорова В.И., д.м.н., проф.;
Ребеко И.В., к.м.н.;
Ревтович М.Ю., к.м.н.;
Ролевич А.И., д.м.н.;
Рындин А.А.;
Рябчевский А.Н.;
Синайко В.В., к.м.н.;
Субоч Е.И., к.м.н.;
Суколинская Е.В., к.м.н.;
Суконко О.Г., д.м.н., проф.;
Суслова В.А., к.м.н.;
Тризна Н.М., к.м.н.;
Фридман М.В., д.м.н.;
Шаповал Е.В., д.м.н.;
Шмак А.И., д.м.н.
Список сокращений:
CTV – клинический объем облучения
GTV – определяемый объем опухоли
ICD – Международная классификация болезней
ITC – отдельные опухолевые клетки
PTV – планируемый объем облучения
UICC – Международный противораковый союз
АЛТ – аланинаминотрансфераза
АСТ – аспартатаминотрансфераза
АЧТВ – активированное частичное тромбопластиновое время
ВАТС – видео-ассистированной тораскопии
ВОЗ – Всемирная организация здравоохранения
ВПЧ – вирус папилломы человека
ВЯВ – внутренняя яремная вена;
ГИСО – гастроинтенстинальные стромальные опухоли
ГПДР – гастропанкреатодуоденальная резекция
ГЦР – гепатоцеллюлярный рак
ЖКТ – желудочно-кишечный тракт
ИГХ – иммуногистохимическое исследование
ИОУЗИ – интраоперационное УЗИ
КТ – компьютерная томография
ЛДГ – лактатдегидрогеназа
МНО – международное нормализованное отношение
МРТ – магнитно-резонансная томография
МСКТ – многослойная компьютерная томография
ОГК – органы Грудной клетки
ПВ – протромбиновое время
ПЖ – поджелудочная железа
ПЭТ – позитронно-эмиссионная томография
РЖП – рак желчного пузыря
РОД – разовая облучающая доза
РПК – рак прямой кишки
РПХГ – ретроградная панкреатохолангиография
СОД – суммарная облучающая доза
ТВ – тромбиновое время
ТДПЭ – тотальная дуоденопанкреатэктомия
УЗИ – ультразвуковое исследование
ФВД – функция внешнего дыхания
ФДГ – фтордезоксиглюкоза
ФЭГДС – фиброгастродуоденоскопия
ХЦР – холангиоцеллюлярного рака
ЦНС – центральная нервная система
ЧЧХГ – чрескожная чреспеченочная холангиография
ЧЭИ – чрескожная этаноловая инъекция
ЩФ – щелочная фосфатаза
ЭВВ – эмболизация воротной вены
ЭКГ – электрокардиограмма
ЭУЗИ – эндоскопическое ультразвуковое исследование
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.