Диагностика и лечение детей с онкологическими заболеваниями
 Версия: Клинические протоколы 2022 (Беларусь)
Версия: Клинические протоколы 2022 (Беларусь)
Общая информация
Краткое описание
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ
РЕСПУБЛИКИ БЕЛАРУСЬ
5 декабря 2022 г. № 113
Об утверждении клинического протокола
На основании абзаца девятого части первой статьи 1 Закона Республики Беларусь от 18 июня 1993 г. № 2435-XII «О здравоохранении», подпункта 8.3 пункта 8 и подпункта 9.1 пункта 9 Положения о Министерстве здравоохранения Республики Беларусь, утвержденного постановлением Совета Министров Республики Беларусь от 28 октября 2011 г. № 1446, Министерство здравоохранения Республики Беларусь
ПОСТАНОВЛЯЕТ:
1. Утвердить клинический протокол «Диагностика и лечение детей с онкологическими и гематологическими заболеваниями» (прилагается).
2. Признать утратившим силу приказ Министерства здравоохранения Республики Беларусь от 13 января 2012 г. № 38 «Об утверждении некоторых клинических протоколов и признании утратившим силу отдельного структурного элемента приказа Министерства здравоохранения Республики Беларусь от 27 сентября 2005 г. № 549».
3. Настоящее постановление вступает в силу после его официального опубликования.
Министр Д.Л.Пиневич
СОГЛАСОВАНО
Государственный пограничный комитет Республики Беларусь
Комитет государственной безопасности Республики Беларусь
Министерство внутренних дел Республики Беларусь
Министерство обороны Республики Беларусь
Министерство по чрезвычайным ситуациям Республики Беларусь
Национальная академия наук Беларуси
Управление делами Президента Республики Беларусь
Брестский областной исполнительный комитет
Витебский областной исполнительный комитет
Гомельский областной исполнительный комитет
Гродненский областной исполнительный комитет
Минский городской исполнительный комитет
Минский областной исполнительный комитет
Могилевский областной исполнительный комитет
УТВЕРЖДЕНО
Постановление
Республики Беларусь
05.12.2022 № 113
КЛИНИЧЕСКИЙ ПРОТОКОЛ
«Диагностика и лечение детей с онкологическими и гематологическими заболеваниями»
ГЛАВА 1 ОБЩИЕ ПОЛОЖЕНИЯ
1. Настоящий клинический протокол устанавливает общие требования к объемам медицинской помощи, оказываемой с целью диагностики и лечения в стационарных и амбулаторных условиях пациентам в возрасте 0–18 лет с онкологическими и гематологическими заболеваниями (далее, если не указано иное, - дети) и пациентам в возрасте 18–30 лет с некоторыми онкологическими заболеваниями: в возрасте 18–29 лет с впервые выявленным острым лимфобластным лейкозом (далее – ОЛЛ); в возрасте 18–21 год с впервые выявленными опухолями костей (остеогенная саркома, саркома Юинга), лимфомами (Ходжкина и неходжкинскими (далее – НХЛ)), острым миелобластным лейкозом (далее – ОМЛ), герминоклеточными опухолями; в возрасте 22–30 лет с герминогенными опухолями яичка (группа неблагоприятного прогноза, рецидив заболевания) (далее, если не указано иное, – молодые взрослые).
2. Требования настоящего клинического протокола являются обязательными для юридических лиц и индивидуальных предпринимателей, осуществляющих медицинскую деятельность в порядке, установленном законодательством о здравоохранении.
3. Для целей настоящего клинического протокола используются основные термины и их определения в значениях, установленных Законом Республики Беларусь «О здравоохранении», Законом Республики Беларусь от 19 ноября 1993 г. № 2570-XII «О правах ребенка», а также следующие термины и определения:
- изолированный костномозговой рецидив – костный мозг (далее – КМ) содержит >25 % лимфобластов при отсутствии экстрамедуллярных очагов;
- комбинированный костномозговой рецидив – КМ содержит >25 % лимфобластов и имеется не менее одного экстрамедуллярного очага ОЛЛ;
- миелодиспластический синдром (далее – МДС) с кольцевыми сидеробластами (далее – КС) и линейной (однолинейной) дисплазией – вариант МДС, для которого характерна анемия, чаще нормо- или макроцитарного характера. Диагностически значимым является обнаружение КС в КМ в 15 % и более клеток красного ряда, вне зависимости от наличия мутации гена SF3B1, а при ее наличии диагностически значимым является обнаружение 5 % и более КС, без увеличения процента бластных клеток в периферической крови (<1 %) и КМ (<5 %), без абсолютного моноцитоза в периферической крови, при этом дисплазия выявляется в клетках красного ряда более чем в 10 %, в гранулоцитарном и мегакариоцитарном ростках – менее чем в 10 %;
- МДС с КС и мультилинейной дисплазией – вариант МДС, для которого характерна цитопения любой степени выраженности. Диагностически значимым является обнаружение КС в КМ в 15 % и более клеток красного ряда, вне зависимости от наличия мутации гена SF3B1, а при ее наличии диагностически значимым является обнаружение 5 % и более КС, без увеличения процента бластных клеток в периферической крови (<1 %) и КМ (<5 %), без абсолютного моноцитоза в периферической крови, при этом дисплазия выявляется в клетках эритроидного, гранулоцитарного и (или) мегакариоцитарного ростков более чем в 10 %;
- синдром лизиса опухоли (далее – СЛО) – комплекс метаболических расстройств в результате массивного распада опухолевых клеток и высвобождения в плазму и периферические ткани внутриклеточного содержимого и метаболитов;
- тестикулярный рецидив – одно- или двухстороннее безболезненное увеличение яичек с инфильтрацией лейкемическими клетками, подтвержденное биопсией.
4. Госпитализация детей с онкологическими и гематологическими заболеваниями осуществляется в порядке, установленном Министерством здравоохранения.
Классификация
5. В настоящем клиническом протоколе для классификации злокачественных новообразований (далее – ЗНО) используется система TNM (Т – лат. tumor – опухоль, N – лат. nodus – узел, М – лат. metastasis – метастазы) и морфологические формы ЗНО в соответствии с Международной классификацией онкологических болезней третьего пересмотра (далее – МКБ-О-3), адаптированной под Международную статистическую классификацию болезней и проблем, связанных со здоровьем, десятого пересмотра (далее – МКБ-10).
TNM – клиническая классификация, используемая для описания анатомической распространенности болезни, которая основывается на результатах обследования до лечения и оценке всех трех компонентов.
рTNM – патологическая классификация, основанная на данных обследования до лечения, дополненных или измененных в результате хирургического вмешательства и морфологического исследования.
Т/рТ – распространение первичной опухоли:
Тх/рТх – первичная опухоль не может быть оценена;
Т0/рТ0 – нет доказательств первичной опухоли;
Tis/р Tis – рак «in situ»;
Т1/рТ1, Т2/рТ2, Т3/рТ3, Т4/рТ4 – размер и местное распространение опухоли в порядке увеличения.
N/pN – отсутствие или наличие метастазов в регионарных лимфатических узлах (далее – ЛУ) и степень их поражения:
Nx/р Nx – регионарные ЛУ не могут быть оценены;
N0/р Nx0 – отсутствуют метастазы в регионарных ЛУ;
N1/pN1, N2/pN2, N3/pN3 – возрастающее поражение ЛУ.
Непосредственное распространение первичной опухоли на ЛУ классифицируются как метастазы в ЛУ. Метастаз в любом ЛУ, не относящемся к регионарному, расценивается как отдаленный метастаз.
М/рМ – отсутствие или наличие отдаленных метастазов:
Мх/рМх – отдаленные метастазы не могут быть оценены;
М0/рМ0 – нет отдаленных метастазов;
М1/рМ1 – имеются отдаленные метастазы.
6. Гистопатологическая дифференцировка позволяет оценить степень агрессивности опухолей некоторых гистологических типов и может влиять на прогноз и выбор лечения:
G1 – хорошо дифференцированные опухоли;
G2 – умеренно дифференцированные опухоли;
G3 – низкодифференцированные опухоли;
G4 – недифференцированные опухоли.
7. Группировка по стадиям предусматривает комбинацию всех значений дескрипторов и позволяет получить полное описание распространенности опухоли. Для табличного представления данных и анализа эти категории объединяются в ограниченное количество групп – стадий. Каждая стадия более или менее однородна по прогнозу и критерию выживаемости относящихся к ней пациентов. Для патологической стадии необходимо морфологическое исследование достаточного количества тканей, позволяющее оценить наибольшее значение Т и N. Термин «стадия» употребляется только для комбинаций Т, N, M или рТ, pN, pM категорий.
8. В соответствии с рекомендациями Всемирной организации здравоохранения (далее – ВОЗ) разработана Международная классификация ЗНО у детей, обновленная в 2005 г. (International Classification of Childhood Cancer-3 (далее – ICCC-3)), базирующаяся на гистологическом типе новообразования, основанном на локализации первичной опухоли. ICCC-3 включает в себя все ЗНО, а также незлокачественные интракраниальные и интраспинальные опухоли.
9. Диагностические группы ICCC-3:
I. Лейкозы, миелопролиферативные и миелодиспластические заболевания.
II. Лимфомы и ретикулоэндотелиальные новообразования.
III. Центральная нервная система (далее – ЦНС) и различные внутричерепные и интраспинальные новообразования.
IV. Нейробластома и другие опухоли периферических нервных клеток.
V. Ретинобластома.
VI. Опухоли почек.
VII. Опухоли печени.
VIII. Злокачественные опухоли костей.
IX. Мягкотканные и другие внекостные саркомы.
X. Опухоли зародышевых клеток, трофобластические опухоли и новообразования гонад.
XI. Другие ЗНО эпителия и злокачественные меланомы.
XII. Другие и неуточненные ЗНО.
Диагностика
20. Первичный диагостический комплекс: для всех нозологических форм заболеваний в состав первичного диагностического комплекса будут входить следующие обязательные обследования:
20.1. клиническое обследование ребенка (далее – блок А):
анамнез: социальный (семейный), жизни, аллергологический, фармакологический, трансфузионный, прививочный, перенесенных заболеваний и оперативных вмешательств;
антропометрия – при поступлении;
медицинкий осмотр, измерение МТ, температуры тела, оценка диуреза, стула, частоты сердечных сокращений, частоты дыханий, измерение артериального давления (далее – АД);
медицинский осмотр врача – детского невролога;
20.2. лабораторное исследование (далее – блок Б):
ОАК – эритроциты, гемоглобин, гематокрит, тромбоциты, лейкоциты и лейкоцитарная формула, скорость оседания эритроцитов (далее – СОЭ);
общий анализ мочи (далее – ОАМ);
БИК – общий билирубин, глюкоза, мочевина, креатинин, общий белок, альбумин, АлАТ, АсАТ, СРБ, электролиты (калий, натрий, кальций, магний), лактатдегидрогеназа (далее – ЛДГ);
коагулограмма – активированное частичное тромбиновое время (далее – АЧТВ), активность протромбинового комплекса (по Квику), протромбиновое время (далее – ПВ), тромбиновое время (далее – ТВ), международное нормализованное отношение (далее – МНО), фибриноген;
определение групп крови по системам АВ0 и резус-принадлежности;
определение антител к вирусу иммунодефицита человека (далее – ВИЧ) в крови;
анализ крови на сифилис (реакция микропреципитации);
определение антигенов и антител к вирусу гепатита В, С (HbsAg, a/HCV);
20.3. функционально-инструментальное исследование (далее – блок В):
электрокардиограмма (далее – ЭКГ);
УЗИ органов брюшной полости (далее – ОБП);
эхокардиография (далее – Эхо-КГ).
Специфические методы диагностики, необходимые для каждой конкретной нозологической формы заболевания, перечислены в описаниях, характеризующих данную нозологическую форму.
Лечение
10. Сопроводительная терапия является комплексом дополнительных медицинских мероприятий, проводимых при лечении (химиотерапия, лучевая терапия (далее – ЛТ), хирургическое лечение) ЗНО. К задачам, стоящим перед сопроводительной терапией, относятся:
защита органов и тканей от токсического воздействия противоопухолевых лекарственных средств (далее – ЛС) и их метаболитов;
поддержание гомеостаза и основного обмена;
обеспечение функционирования всех жизненно важных систем организма, медицинская профилактика инфекций;
коррекция осложнений основного заболевания и осложнений, вызванных химиотерапией.
11. В настоящем клиническом протоколе необходимо строгое соблюдение принципов инфузионной терапии, которые зависят от применяемой химиотерапии. Пациентам со ЗНО в первые дни (недели) терапии обязательно рекомендуется проведение терапевтических мероприятий, направленных на медицинскую профилактику СЛО. Степень риска развития СЛО зависит от инициальной массы опухоли, состояния пациента на момент начала химиотерапии и индивидуальных особенностей метаболизма. К важнейшим мерам медицинской профилактики СЛО относятся адекватная гидратация, защелачивание мочи, предупреждение и коррекция гиперурикемии, а также борьба с электролитными нарушениями. Стандартной нагрузкой является гидратация 3000 мл/м2, а у детей массой тела (далее – МТ) менее 10 кг – 200 мл/кг жидкости в сутки. Базисный раствор для инфузии состоит из раствора глюкозы 5 % и раствора хлорида натрия 0,9 % в соотношении 1:1. Инициальная инфузия – без калия. Однако в дальнейшем должна проводиться коррекция электролитов в соответствии с данными биохимического исследования крови (далее – БИК). Во время инфузионной терапии необходимо обеспечивать диурез на уровне 100–250 мл/м2/час. Учитывая более низкую растворимость мочевой кислоты в кислой среде, необходимо обеспечить поддержание нейтрального или слабощелочного рН мочи. Для этого к постоянной инфузии (или 100–200 ммоль/м2/сут параллельной инфузии) добавляется 60 ммоль бикарбоната натрия на литр инфузии (60 мл раствора бикарбоната натрия 7,5 % либо 100–120 мл раствора бикарбоната натрия 4 %). Регулирование необходимого объема бикарбоната натрия осуществляется соответственно уровню pH мочи. При инфузионной терапии необходимо контролировать количество выделенной мочи:
количество выделенной мочи = количество введенной жидкости – потери с дыханием.
Для этого проводится контрольное взвешивание 1–2 раза в сутки. При недостаточном мочевыведении вводится фуросемид, раствор для внутривенного и внутримышечного введения 10 мг/мл, ампула 2 мл, из расчета 1–10 мг/кг в сутки внутривенно капельно или струйно.
14. Эмпирическая антимикробная терапия фебрильной нейтропении (в зависимости от наличия факторов риска пациенты делятся на 2 группы риска развития тяжелых инфекций в установленном Министерством здравоохранения порядке: пациенты группы высокого риска (далее – HRG) должны быть госпитализированы в стационар для проведения эмпирической антимикробной терапии; пациенты с низким уровнем риска (группа низкого риска) могут быть кандидатами для пероральной эмпирической терапии, в том числе, в амбулаторных условиях):
14.1. общие принципы терапии:
14.1.1. назначение антибактериальной терапии по возможности проводится в течение 60 минут после манифестации фебрильной нейтропении (отсроченное назначение антибактериальной терапии сопровождается ухудшением исходов и увеличением длительности госпитализации);
14.1.2. при выборе эмпирической антибактериальной терапии рассматриваются следующие аспекты:
группа риска;
аллергологический и фармакологический анамнезы;
наличие дисфункции органов;
применение химиотерапии у данного пациента;
предшествующая антибактериальная терапия;
колонизация резистентными бактериями (если возможно проводить микробиологический скрининг в организации здравоохранения) (например, метил-резистентный золотистый стафилококк (далее – MRSA), ванкомицин-резистентный энтерококк, бактерии, производящие бета-лактамазы расширенного спектра действия (далее – ESBL), в том числе, карбапенемаза-продуцирующие штаммы Klebsiella pneumoniae);
14.1.3. эмпирическая антибактериальная терапия должна быть эффективной против широкого спектра потенциальных возбудителей. Для пациентов с установленной локализацией инфекции, которые перестали лихорадить на стартовой терапии, антибактериальная терапия может быть изменена с отменой ЛС широкого спектра и назначением подходящих для данной инфекции ЛС с узким спектром активности;
14.1.4. стартовую терапию фебрильной нейтропении пациентам группы низкого риска рекомендуется проводить b-лактамным антибиотиком широкого спектра (например, амоксициллин/клавуланат, цефепим);
14.1.5. стартовую терапию фебрильной нейтропении пациентам HRG рекомендуется проводить b-лактамным антибиотиком широкого спектра с антипсевдомонадной активностью: цефалоспорин (например, цефепим), карбапенем (например, меропенем) или пиперациллин/тазобактам. Выявление колонизации резистентными бактериями предполагает назначение антибиотика (комбинации ЛС), к которым данные бактерии проявляют чувствительность.
Медицинскими показаниями для эмпирической терапии ЛС, активными в отношении грамположительных микроорганизмов, являются:
гипотензия; документированная пневмония;
подозрение на инфекцию области установки центрального венозного катетера;
инфекция кожи и мягких тканей;
документированная колонизация MRSA;
выделение грамположительного микроорганизма из гемокультуры; мукозит III–IV степени;
инфекции, вызванные пенициллин-резистентными стрептококками в анамнезе; проведенная интенсивная химиотерапия, ассоциированная с высоким риском
развития инфекции, вызванной грамположительными микроорганизмами;
14.1.6. рекомендуемые ЛС для фебрильной нейтропении:
амоксициллин/клавуланат внутрь (таблетка: 250 мг/125 мг, 500 мг/125 мг, 875 мг/125 мг; порошок для приготовления суспензии (готовая суспензия – 5 мл): 125 мг/31,25 мг, 250 мг/62,5 мг, 200 мг/28,5 мг, 400 мг/57 мг):
для детей с МТ >40 кг – 250–500 мг 2–3 раза в день или 875 мг 2 раза в день, внутрь. Максимальная доза для пациентов старше 18 лет 1750 мг/сутки в пересчете на амоксициллин;
для детей с МТ <40 кг: 25–45 мг/кг/сутки в пересчете на амоксициллин, дозы приведены в приложении 1.
Для лечения детей в возрасте до 6 лет или с МТ менее 25 кг предпочтительно использовать суспензию амоксициллина/клавуланата. Для лечения детей от 6 до 12 лет оптимальной лекарственной формой являются таблетки 625 мг, принимаемые 2 раза в день. Клинические данные о применении лекарственных форм ЛС амоксициллин/клавуланат с соотношением активных компонентов 4:1 в дозах выше 40 мг/10 мг/кг/сутки для лечения детей в возрасте до 2 лет отсутствуют;
амоксициллин/клавуланат внутривенно (порошок для приготовления раствора для внутривенного введения 500 мг/100 мг, 1000 мг/200 мг):
для детей старше 12 лет с МТ более 40 кг раствор для инфузий вводят из расчета 1000 мг/200 мг через каждые 8 часов;
дети с МТ менее 40 кг, младше 3 месяцев с МТ менее 4 кг раствор для инфузий вводят из расчета 25 мг/5 мг/кг через каждые 12 часов;
детям старше 3 месяцев раствор для инфузий вводят из расчета 25 мг/5 мг/кг через каждые 8 часов.
Пациентам с нарушением функции почек дозу амоксициллина/клавуланата для приема внутрь и для внутривенного введения корректируют согласно инструкции по медицинскому применению (листку вкладышу);
цефепим (порошок для приготовления раствора для внутривенного и внутримышечного введения 1000 мг или 500 мг во флаконах) – для детей старше 2 месяцев раствор для инфузий вводят внутривенно капельно путем инфузии 50 мг/кг 3 раза в день через каждые 8 часов (не более 6 г/сут). Доза цефепима для пациентов с нарушением функции почек корректируется согласно инструкции по медицинскому применению (листку вкладышу);
меропенем (порошок для приготовления раствора для внутривенного введения 1000 мг или 500 мг во флаконах) – для детей старше 3 месяцев раствор для инфузий вводят внутривенно капельно путем инфузии:
40 мг/кг 3 раза в день через каждые 8 часов (не более 6 г/сут). При инфекциях, вызванных микроорганизмами с потенциально повышенными значениями минимальной ингибирующей концентрации (далее – МИК) с целью оптимизации фармакокинетических и (или) фармакодинамических параметров следует рассмотреть возможность продленной инфузии в течение 3–4 часов. Доза меропенема для пациентов с нарушением функции почек корректируется согласно инструкции по медицинскому применению (листку вкладышу);
пиперациллин/тазобактам (порошок для приготовления раствора для внутривенного введения 2000 мг + 250 мг или 4000 мг + 500 мг во флаконах):
для детей старше 2 лет:
с МТ <50 кг раствор для инфузий вводят внутривенно капельно путем инфузии 80 мг/кг по пиперациллину 4 раза в день через каждые 6 часов;
с МТ >50 кг раствор для инфузий вводят внутривенно капельно путем инфузии 4000 мг пиперациллина 4 раза в день через каждые 6 часов (максимальная суточная доза по пиперациллину составляет 16 г). Этот режим направлен на оптимизацию уровня ЛС для микроорганизмов, которые могут иметь повышенные МИК. Доза пиперациллин/тазобактама для пациентов с нарушением функции почек корректируется согласно инструкции по медицинскому применению (листку вкладышу).
Если предполагается применение карбапенемов, следует предпочесть меропенем ввиду риска развития судорог при применении имипенема/циластатина. Эртапенем не рекомендуется в качестве эмпирической терапии ввиду заведомо отсутствующей активности в отношении P.aeruginosa и A.baumannii. Дорипенем* не рекомендуется детям младше 18 лет ввиду отсутствия данных о его эффективности и безопасности у данной категории пациентов.
Дополнительные антимикробные ЛС могут быть добавлены к стартовой терапии на основании клинических проявлений, предполагаемой резистентности к антимикробным ЛС или для терапии осложнений. Так, при наличии симптомов со стороны брюшной полости, таких как боль в животе или кровь в стуле, к стартовой терапии следует добавить метронидазол (раствор для инфузий 500 мг/100 мл) – детям старше 12 лет и молодым взрослым при анаэробных инфекциях раствор для инфузий вводят внутривенно капельно путем инфузии 500 мг 3 раза в день через каждые 8 часов со скоростью 5 мл/мин. Максимальная суточная доза метронидазола – 4000 мг. Для пациентов с выраженными нарушениями функции почек (клиренс креатинина менее 30 мл/мин) и (или) печени суточная доза метронидазола до 1000 мг (кратность приема 2 раза); если стартовая терапия не перекрывает анаэробный спектр (комбинация карбапенема с метронидазолом нерациональна, так как карбапенемы перекрывают спектр анаэробной активности метронидазола).
При подозрении на инфекцию, вызванную MRSA, к терапии следует добавить ванкомицин (порошок для приготовления раствора для внутривенного введения 1000 мг или 500 мг во флаконах) – раствор для инфузий вводят внутривенно капельно путем инфузии:
для молодых взрослых 500 мг 4 раза в день через каждые 6 часов или 1000 мг 2 раза в день через каждые 12 часов. ЛС вводят в виде медленной внутривенной инфузии со скоростью не более 10 мг/мин в течение 60 минут или более. Максимальная суточная доза составляет 2000 мг;
для новорожденных до 7 дней жизни начальная доза составляет 15 мг/кг, затем 10 мг/кг 2 раза в день через каждые 12 часов;
детям до 1 месяца необходимо вводить по 10 мг/кг МТ 3 раза в день через каждые 8 часов;
для детей от 1 месяца и старше рекомендуемая доза составляет 40 мг/кг МТ в сутки, разделенная на индивидуальные введения через каждые 6 часов. Инфузия проводится в течение 60 мин или более. Максимальная однократная доза для ребенка составляет 15 мг/кг МТ, максимальная суточная доза составляет 60 мг/кг МТ. Для пациентов с почечной недостаточностью необходимо индивидуально подбирать дозу. Начальная доза должна составлять 15 мг/кг МТ, далее интервал между дозированием определяется в соответствии с клиренсом креатинина.
Ванкомицин или тейкопланин не рекомендуется рутинно включать в стартовую эмпирическую терапию фебрильной нейтропении. Их следует назначать для дополнительного перекрытия грамположительных микроорганизмов;
14.2. колонизация ESBL-продуцирующими бактериями (выявление носительства цефепим-резистентных энтеробактерий (выделение из любого локуса в течение предшествовавших 90 суток) на фоне фебрильной нейтропении, обусловливает необходимость проведения стартовой эмпирической терапии у данных пациентов карбапенемом (предпочтительно меропенемом). При выявлении карбапенем-резистентных штаммов терапия проводится другим ЛС или комбинацией ЛС в соответствии с их антибиотикочувствительностью. Как правило, альтернативными ЛС для терапии инфекций, вызванных карбапенем-резистентными штаммами, могут служить амикацин, колистин, фторхинолоны (левофлоксацин*) (для пациентов старше 18 лет или off lable, если сохранена чувствительность только к левофлоксацину*), фосфомицин (при инфекциях мочевыводящих путей), цефтазидим/авибактам* (для пациентов старше 18 лет или off lable, если сохранена чувствительность только к цефтазидим/авибактаму*), а также комбинация карбапенемов (эртапенем и дорипенем*); в редких случаях при жизнеугрожающих инфекциях и резистентности ко всем другим антибиотикам – тигециклин*):
амикацин (порошок для приготовления раствора для внутривенного и внутримышечного введения 1000 мг во флаконах): раствор для инфузий вводят внутривенно капельно путем инфузии за 60–120 мин 15–20 мг/кг/сутки 2–3 раза в день, не более 1,5 г; длительность терапии не более 7 дней);
колистин (порошок для приготовления раствора для внутривенного введения и ингаляций 2 000 000 МЕ колистиметата натрия во флаконах): раствор для инфузий вводят внутривенно капельно путем инфузии за 30–60 минут:
дети с МТ <40 кг 75000–150000 МЕ/кг/сутки 3 раза в день через каждые 8 часов;
дети с МТ >40 кг – режим дозирования соответствует режиму дозирования у молодых взрослых, рекомендуемая поддерживающая суточная доза 9 000 000 ME 2–3 раза в день через каждые 12–8 часов соответственно. Для пациентов в критическом состоянии нагрузочная доза должна составлять 9 000 000 ME (максимальная поддерживающая доза – до 12 млн МЕ/сутки).
В случае выявления у детей со ЗНО возбудителя с минимальной подавляющей концентрацией более 0,75 мг/л применяется режим непрерывного круглосуточного внутривенного введения с постоянной скоростью суточной дозы 75000–100000 МЕ/кг под контролем концентрации колистиметата и колистина в крови, а также при непрерывном мониторировании функции почек (определение уровня мочевины, креатинина и клиренса по эндогенному креатинину (далее – КЭК) ежедневно).
Также возможно введение колистина ингаляционно:
молодым взрослым и детям от 2 лет назначают в дозе 1000000–2000000 ME 2–3 раза в день (до 6000000 ME в сутки);
детям до 2 лет колистат назначают в дозе 500000–1000000 ME 2 раза в день (до 2 000 000 ME в сутки);
левофлоксацин* у детей (таблетки, покрытые пленочной оболочкой, по 250 мг и 500 мг, раствор для инфузий 500 мг/100 мл во флаконах) принимают внутрь при нормальной или умеренно сниженной функцией почек (клиренс креатинина >50 мл/мин):
дети в возрасте <5 лет 10 мг/кг/сутки 1–2 раза в день через каждые 24 часа или 12 часов соответственно;
дети в возрасте старше 5 лет 20 мг/кг/сутки 1–2 раза в день через каждые 24 часа или 12 часов соответственно;
раствор для инфузий вводят внутривенно капельно путем инфузии за 60–90 минут: дети в возрасте 6 месяцев – 5 лет – 8–10 мг/кг/доза (не более 250 мг) 2 раза в день через каждые 12 часов;
дети в возрасте >5 лет – 10 мг/кг/доза 1 раз в день, не более 750 мг/сутки.
Дозу левофлоксацина* для пациентов с нарушением функции почек корректируют согласно инструкции по медицинскому применению (листку вкладышу). При нарушении функции печени не требуется коррекция режима дозирования, поскольку левофлоксацин* метаболизируется в печени в незначительной степени и экскретируется в основном почками;
фосфомицин (порошок для приготовления раствора для приема внутрь 3000 мг в пакетах): содержимое пакета растворяют в 150–200 мл воды и принимают раствор внутрь непосредственно после приготовления дети старше 12 лет в суточной дозе 3000 мг;
цефтазидим/авибактам* у детей (порошок для приготовления концентрата для приготовления раствора для инфузий 2000 мг/500 мг во флаконах): раствор для инфузий вводят внутривенно капельно путем инфузии в течении 2 часов пациентам с клиренсом креатинина >50 мл/мин 2000 мг цефтазидима* и 500 мг авибактама* в 100 мл раствора декстрозы 5 % 3 раза в день через каждые 8 часов. Максимальная доза 6000 мг/сутки цефтазидима* и 1500 мг/сутки авибактама*. Максимальная разовая доза 2000 мг цефтазидима* и 500 мг авибактама*.
Применение цефтазидима/авибактама* у детей с рассчитанным клиренсом креатинина >50 мл/мин/1,73 м2:
дети 3–6 месяцев: 40 мг/кг/10 мг/кг каждые 8 часов путем инфузии в течение 2 часов;
дети от 6 месяцев до 18 лет: 50 мг/кг/12,5 мг/кг каждые 8 часов путем инфузии в течение 2 часов. Максимальная разовая доза 2000 мг и 500 мг авибактама.
При проведении гемодиализа ЛС следует вводить после окончания сеанса; эртапенем (лиофизат для приготовления раствора для внутривенного и внутримышечного введения 1000 мг во флаконах): вводится внутримышечно (на растворе лидокаина 1–2 %) или раствор для инфузий вводят внутривенно капельно путем инфузии в течение 30 минут:
дети от 3 месяцев до 12 лет: 15 мг/кг в сутки 2 раза в день через каждые 12 часов, но не более 1 г в день;
дети старше 12 лет: 1000 мг 1 раз в день;
дорипенем* (порошок для приготовления раствора для инфузий 500 мг во флаконах): раствор для инфузий вводят внутривенно капельно путем инфузии у пациентов старше 18 лет в дозе 500 мг 3 раза в день через каждые 8 часов. Дозу дорипенема* для пациентов с нарушением функции почек корректируют согласно инструкции по медицинскому применению (листку вкладышу);
тигециклин* (лиофизат для приготовления раствора для внутривенных инфузий 50 мг во флаконах): раствор для инфузий вводят внутривенно капельно путем инфузии в течение 30–60 мин:
пациенты старше 18 лет начальная доза составляет 100 мг, далее 50 мг 2 раза в день через каждые 12 часов.
Пациентам с тяжелой печеночной недостаточностью (класс С по шкале Чайлд-Пью) после введения начальной дозы тигециклина* 100 мг в последующем его назначают по 25 мг 2 раза в день через каждые 12 часов.
Пациенты с легкими и среднетяжелыми нарушениями функции печени (классы А и В по шкале Чайлд-Пью), пациенты с почечной недостаточностью и пациенты, находящиеся на гемодиализе, не требуют коррекции дозы тигециклина*.
Применение тигециклина* у детей: раствор для инфузий вводят внутривенно капельно путем инфузии в течение 30–60 мин:
дети от 8 лет до 11 лет – 1,2 мг/кг 2 раза в день (через каждые 12 часов) (максимальная разовая доза 50 мг);
дети от 12 до 17 лет – 50 мг 2 раза в день (через каждые 12 часов);
14.3. посев крови на стерильность для верификации инфекции кровотока: медицинским показанием для исследования крови на стерильность является подозрение на инфекцию кровотока. Кроме того, крайне важно выполнять посевы крови у пациентов с установленным или подозреваемым сепсисом, менингитом, остеомиелитом, артритом, эндокардитом, перитонитом, пневмонией и лихорадкой неуточненной этиологии (особенно при фебрильной нейтропении).
При подозрении на инфекцию кровотока или общем тяжелом состоянии пациента первые посевы крови необходимо производить до начала антибактерильной терапии независимо от наличия или отсутствия лихорадки. Лихорадка при заборе крови на бактериологическое исследование не является ни чувствительным, ни специфичным признаком наличия бактериемии. Необязательны посевы крови у лихорадящего пациента с очевидными причинами лихорадки (респираторная вирусная инфекция, трансфузионная реакция, ранний послеоперационный период). Обязательны посевы крови у лихорадящего пациента в нейтропении.
Обнаружение микроорганизма во флаконе с кровью, взятой из центрального венозного катетера, на два и более часа ранее, чем во флаконе с кровью, взятой из отдельной пункции периферической вены, является доказательством катетер-ассоциированной инфекции кровотока (далее – КАИК) (при одновременном посеве из центрального венозного катетера и периферической вены).
Наиболее часто фунгемию вызывают дрожжевые грибы рода Candida. Длительность выделения дрожжевых грибов (при наличии фунгемии) с момента забора крови на бактериологическое исследование – 2–7 дней. Отрицательный ответ регистрируется не ранее, чем через 14 дней (с учетом длительности выделения и ростовых свойств плесневых грибов). Выделение из крови плесневых грибов, кроме рода Fusarium, свидетельствует о контаминации материала и требует повторного исследования;
14.4. медицинские показания для удаления центрального венозного катетера:
КАИК, вызванная Candida spp., Mycobacteria spp., S.aureus, P.aeruginosa, Acinetobakter, E.coli;
сохраняющаяся положительная гемокультура через 72 часа после старта антибактериальной терапии вне зависимости от возбудителя (коагулазанегативные стафилококки, энтерококки, стрептококки группы viridans, Corynebacterium spp., Bacillus spp.) в отсутствии других установленных источников инфекции;
ухудшение состояния пациента, вследствие предполагаемой КАИК, несмотря на 48–72 часа адекватной антибактериальной терапии;
осложненная КАИК (септический тромбоз, эндокардит, возможная диссеминация – остеомиелит);
распространенный целлюлит вокруг места стояния центрального венозного катетера (больше 2 см у детей и молодых взрослых) или по ходу подкожного тоннеля имплантируемого катетера;
рецидивирующая КАИК после завершения курса антибактериальной терапии;
14.5. изменение стартовой терапии. После начала стартовой антимикробной терапии следует проводить медицинское наблюдение за состоянием пациентов. Не следует изменять эмпирическую антибактериальную терапию только на основании персистирующей лихорадки. Изменение режима терапии может быть произведено по медицинским показаниям:
изменение клинического статуса или витальных параметров (ментальный статус, стабильность гемодинамики, наличие дыхательной недостаточности);
выделение микроорганизма из крови;
клинически или микробиологически документированная инфекция; развитие признаков локализованной инфекции;
стойкая лихорадка в течение более четырех дней;
рецидив лихорадки после первоначального ответа на терапию в виде афебрильного периода;
14.6. антибактериальная терапия, основанная на уровне прокальцитонина (далее – РСТ). Определение РСТ рекомендовано с учетом возможностей каждой конкретной организации здравоохранения. РСТ является предиктором бактериемии. РСТ может помочь в принятии решения об отмене антибактериальной терапии, поскольку коррелирует с репликацией бактерий. Существуют другие потенциальные причины повышенного уровня РСТ:
кардиоторакальные и абдоминальные оперативные вмешательства;
кардиогенный шок;
механическая травма;
тяжелые ожоги;
полиорганная недостаточность;
тепловой удар;
панкреатит;
хроническая почечная недостаточность;
медуллярный рак щитовидной железы;
немелкоклеточный рак легкого;
терапия моноклональными и поликлональными ЛС.
В зависимости от длительности клинических проявлений инфекционного процесса принимается решение об определении уровня РСТ:
если длительность не превышает 12 часов, назначается эмпирическая антибактериальная терапия по медицинским показаниям с контролем уровня РСТ через 12–24 часа;
если длительность более 12 часов, определение уровня РСТ производится незамедлительно.
При уровне РСТ:
<0,1 – бактериальную инфекцию можно считать исключенной, антибактериальная терапия не целесообразна;
0,1–0,24 – бактериальная инфекция маловероятна, антибактериальная терапия не показана, за исключением локализованных инфекций. Локализованные инфекции включают в себя документированные инфекции, имеющие установленную локализацию и согласно текущим рекомендациям требующие длительной терапии и (или) хирургической санации: перитонит, медиастинит, менингит, остеомиелит, эндокардит, перипротезная инфекция, другие;
0,25–0,49 – вероятна локализованная бактериальная инфекция. Проводится эмпирическая антибактериальная терапия согласно данным скрининга;
0,5–0,99 – вероятна инфекция кровотока. Эмпирическая антибактериальная терапия проводится согласно данным скрининга.
Проводится повторное клиническое и лабораторно-инструментальное обследование, в том числе, посев крови на стерильность;
1,0–9,9 – вероятен сепсис. Проводится эскалационная антибактериальная терапия, ЛС группы карбапенемов в комбинации с гликопептидами (или согласно данным скрининга). Консультация врача-анестезиолога-реаниматолога детского проводится по медицинским показаниям;
>10 – вероятен септический шок. Проводится деэскалационная антибактериальная терапия ЛС группы карбапенемов в комбинации с гликопептидами и (или) колистином (или согласно данным скрининга). Необходима консультация врача-анестезиолога-реаниматолога детского, следует рассмотреть необходимость перевода в отделение анестезиологии и реаниматологии, проводится мониторинг витальных функций.
У пациентов с инициальным уровнем РСТ более 0,25, а также у всех пациентов с сохраняющимися признаками инфекции, вне зависимости от инициального уровня РСТ проводится повторное определение уровня РСТ через 48 часов.
Тактика оценки РСТ в динамике через 48 часов:
значение показателя менее 0,1 предполагает отмену антибактериальной терапии;
значение показателя 0,1–0,24 или снижение >80 % от максимально определяемого у пациента предполагают отмену антибактериальной терапии, за исключением локализованных инфекций;
снижение показателя <80 % от максимально определяемого у пациента предполагает продолжение выбранной антибактериальной терапии;
рост или стабилизация показателя на прежнем уровне предполагает проведение дополнительных клинико-лабораторно-инструментальных обследований, коррекцию антибактериальной терапии согласно полученным результатам. При отсутствии новых данных – эмпирическое расширение спектра антибактериальной терапии.
Определение РСТ в динамике через 48 часов проводится до указанных выше результатов, позволяющих отменить антибактериальную терапию;
14.7. критерии отмены антибактериальной терапии: отсутствие лихорадки не менее 48 часов; отсутствие признаков локализованной инфекции;
стабильное клиническое состояние (нет дисфункции органов); длительность внутривенной антибактериальной терапии не менее 72 часов;
абсолютное число нейтрофилов (далее – АЧН) >500 для пациентов с ОМЛ, индукция и рецидивы ОЛЛ, реципиенты ТГСК;
нормализация до 0,1–0,24 или снижение уровня РСТ >80 % от максимального значения за инфекционный эпизод (при наличии возможности определения уровня РСТ в данной организации здравоохранения).
16. Нутритивный скрининг и мониторинг:
всем пациентам, получающим лечение в стационаре по поводу онкогематологического заболевания, при поступлении в стационар и далее от 1 до 4 раз в месяц (в зависимости от конкретной клинической ситуации и особенностей проводимого лечения) рекомендуется проводить нутритивный скрининг с целью выявления белково-энергетической недостаточности (далее – БЭН), либо риска ее развития.
Нутритивный скрининг заключается в первичной, а затем регулярной оценке нутритивного статуса и риска развития БЭН, в том числе скрытой, у каждого пациента, с момента поступления в стационар.
Первичный нутритивный скрининг проводится с помощью оценки антропометрических показателей, либо с использованием стандартных шкал и утилит (оценка физического развития по программе ВОЗ Антро и ВОЗ Антро Плюс, инструкция Министерства здравоохранения Республики Беларусь от 10 апреля 2009 г. № 18-1208 «Центильные характеристики антропометрических и лабораторных показателей у детей в современный период») для проведения нутритивного скрининга. Основными антропометрическими параметрами для оценки нутритивного статуса являются: МТ, рост, индекс МТ (далее – ИМТ), окружность плеча нерабочей руки, толщина кожно-жировой складки над трицепсом, вычисление окружности мышц плеча. Оценка нутритивного статуса изложена согласно приложению 5.
Пациентам с онкогематологическими заболеваниями и выявленными нутритивными нарушениями при скрининге с помощью специальных шкал, либо в результате антропометрии рекомендуется более детальное обследование нутритивного статуса: анализ фактического питания, оценка тканевого состава тела, оценка лабораторных показателей, а также детальный физикальный медицинский осмотр на предмет выявления нутритивно-метаболических нарушений.
Всем пациентам с БЭН или высоким риском ее развития (независимо от нутритивного статуса) рекомендуется проведение нутритивной поддержки (далее – НП). Первой формой НП должно являться диетологическое консультирование с последующей коррекцией основного рациона и возможным назначением дополнительно лечебных питательных смесей. При выборе формы, метода, вида и объема НП необходимо руководствоваться принципом индивидуального подхода – сообразно клинической ситуации и логике.
Расчет энергии основного обмена производится методом непрямой калориметрии, при невозможности проведения непрямой калориметрии энергия основного обмена рассчитывается по формуле Schofield (ккал/в день):
мальчики:
0–3 года: (0,167 х МТ в кг) + (15,174 х рост в см) – 617,6; 3–10 лет: (19,59 х МТ в кг) + (1,303 х рост в см) + 414,9; 10–18 лет: (16,25 х МТ в кг) + (1,372 х рост в см) + 515,5;
девочки:
0–3 года: (16,252 х МТ в кг) + (10,232 х рост в см) – 413,5; 3–10 лет: (16,969 х МТ в кг) + (1,618 х рост в см) + 371,2; 10–18 лет: (8,365 х МТ в кг) + (4,65 х рост в см) + 200.
Для расчета действительного расхода энергии (далее – ДРЭ) используются конверсионные коэффициенты. В период адаптации для расчета ДРЭ выбирается один ведущий конверсионный коэффициент. В зависимости от текущей ситуации (тяжесть состояния, режим пребывания, температурный фактор, процент дефицита МТ) конверсионный коэффициент выбирается индивидуально в диапазоне 1,1–1,5.
ДРЭ = ЭОО х КК,
где ЭОО – энергия основного обмена;
КК – конверсионный коэффициент.
У детей с хронической БЭН и длительным дефицитом поступления нутриентов, реальная потребность в нутриентах может оказаться ниже расчетной по стандартным формулам (с учетом коэффициентов) поэтому вопрос о снижении поступления нутриентов может решаться индивидуально и будет отличаться от расчетных величин.
Энтеральное питание является приоритетным при выборе метода НП: оно является наиболее физиологичным, обеспечивая внутрипросветную трофику слизистой оболочки ЖКТ препятствует микробной транслокации из просвета кишечника в кровь, является экономически более выгодным, чем парентеральное питание. Выбор метода энтерального питания определяется сохранностью глотательной функции, а также функциональным состоянием ЖКТ: отсутствие аппетита, нежелание принимать пищу и смеси для энтерального питания, нарушение глотательной функции. Невозможность восполнения потребности в нутриентах внутрь и энергии является медицинским показанием для проведения энтерального питания через назогастральный питательный зонд. Наличие патологических состояний, при которых пациент не должен принимать пищу естественным путем (острый панкреатит, стеноз выходного отдела желудка, высокие проксимальные свищи) – в этих случаях показана реализация энтерального питания через назоеюнальный зонд. При необходимости проведения зондового питания продолжительностью более 6 недель, а также при невозможности адекватной алиментации другими методами энтерального питания, при отсутствии медицинских противопоказаний показано выполнение гастростомии.
В случае, когда на начальных этапах НП выявляется необходимость длительного проведения энтерального питания и прогнозируется риск развития нутритивной недостаточности (в том числе при проведении химиолучевого лечения), либо при наличии у ребенка тяжелой хронической БЭН с высоким риском ее усугубления в дальнейшем, возможно превентивное наложение гастростомы, минуя этап зондового питания. Преимущественным и, желательно, единственным питательным субстратом, вводимым в гастростому должны являться специализированные питательные смеси.
Выбор режима введения энтерального питания определяется конкретной клинической ситуацией, состоянием ЖКТ. В зависимости от клинического состояния используется болюсный или капельный (непрерывное или сеансовое введение) режим введения питательной смеси. Начинать энтеральное питание истощенным пациентам рекомендуется с изокалорической полимерной смеси с последующим переходом на гиперкалорийную (под контролем переносимости ЖКТ). При наличии явлений мальабсорбции следует рассмотреть вопрос о назначении полуэлементной или олигомерной смеси.
Всем пациентам, которым невозможно обеспечить расчетную нутритивную потребность энтеральным путем, рекомендуется назначение парентерального питания. Потребность в парентеральном введении аминокислот рассчитывается индивидуально и зависит от возраста пациента, клинического статуса, количества поступающего белка энтеральным путем.
Парентеральное поступление липидов должно быть ограничено до максимума 4 г/кг/сутки у доношенных и недоношенных детей и 3 г/кг/сутки у детей старше 10 лет. Введение липидов нужно начинать с меньших доз, за 3–4 дня наращивая объем до расчетных значений. В процессе парентерального питания необходим постоянный мониторинг уровня триглицеридов в плазме крови и уменьшение введения липидов при необходимости. Уровень триглицеридов не должен превышать 250 мг/дл (2,8 ммоль/л) для новорожденных и 400 мг/дл (4,5 ммоль/л) для детей старше 10 лет. Потребность в парентеральном введении глюкозы рассчитывается индивидуально и зависит от возраста пациента, клинического статуса, количества поступающих углеводов энтеральным путем. Введение глюкозы нужно начинать с меньших объемов, за 3–4 дня наращивая объем до расчетных значений под контролем уровня гликемии.
Частичное парентеральное питание проводят 10–40 % декстрозой из расчета 0,5 г/кг в час, растворами аминокислот из расчета 0,12–0,25 г/кг в сутки (по азоту).
Всем пациентам, получающим НП, рекомендуется нутритивный мониторинг, который может включать антропометрию, анализ тканевого состава тела, лабораторные показатели (БИК, копрологическое исследование).
При организации и проведении лечебного питания при БЭН руководствуются утвержденными клиническими протоколами.
19. ЛС, назначаемые off label, ЛС, включенные в перечень орфанных (редких) заболеваний и ЛС, согласно приказу Министерства здравоохранения Республики Беларусь от 2 сентября 2022 г. № 1153 «Об орфанных (редких) заболеваниях и лекарственных препаратах» и ЛС, приобретаемые за счет собственных средств пациента или его законных представителей, средств юридических лиц и иных источников, не запрещенных законодательством для лечения детей с онкологическими и гематологичекими заболеваниями приведены в приложении 7;
при назначении ЛС off label проводится врачебный консилиум о необходимости назначения данного ЛС, обязательно оформляется письменное согласие пациента (законного представителя пациента) на использование данного ЛС;
протонная терапия, сцинтиграфия с МИБГ меченным I123 и I131 МИБГ терапия, доказавшие свою эффективность, включены в международные протоколы лечения. Рассмотрение вопроса о необходимости направления граждан Республики Беларусь за пределы республики для получения медицинской помощи осуществляется комиссией по направлению граждан Республики Беларусь за пределы республики для получения медицинской помощи при Министерстве здравоохранения в порядке, установленном Советом Министров Республики Беларусь.
21. Алгоритм расчета доз:
за основу берется терапевтическая доза 1 м2 поверхности тела;
в зависимости от возраста пациента доза рассчитывается по схеме: дети младше 6 месяцев – 2/3 от расчетной дозы; дети в возрасте 6 и более месяцев, но менее 12 месяцев – 3/4 расчетной дозы; дети в возрасте 12 месяцев и старше – полная терапевтическая доза.
22. Шифр по МКБ-10 – С81 ОЛЛ у пациентов старше 1 года:
22.1. классификация:
морфологическая классификация ОЛЛ приводится в приложении 8;
иммунофенотипическая классификация ОЛЛ приводится в приложении 9;
22.2. стратификация детей старше 1 года с ОЛЛ на группы риска:
ОЛЛ из В-клеток предшественников:
группа стандартного риска (далее – SRG) (все критерии обязательны):
возраст пациента <15 лет;
инициальные лейкоциты <30 х 109 /л;
инициальный размер селезенки <4 см;
первичный статус ЦНС I или II описан в подпункте 22.3 настоящего пункта;
отсутствие транслокации t(4;11);
отсутствие транслокации t(9;22);
ремиссия на 36 день индукционной терапии;
группа промежуточного риска (далее – ImRG) (хотя бы один из критериев ImRG + ремиссия на 36 день индукционной терапии):
возраст пациента >15 лет;
инициальные лейкоциты >30 х 109 /л;
инициальный размер селезенки >4 см;
первичный статус ЦНС I или II или III описан в подпункте 22.3 настоящего пункта;
наличие транслокации t(4;11);
наличие транслокации t(9;22);
HRG:
все пациенты, не достигшие клинико-гематологической ремиссии на 36 день индукционной терапии (отсутствие молекулярной ремиссии не является основанием для перевода в HRG;
ОЛЛ из Т – клеток предшественников:
группа SRG:
иммунофенотипические маркеры CD1a+TCR–;
Т – II иммунофенотип;
инициальные лейкоциты <500 х 109 /л;
инициальный размер селезенки <4 см;
первичный статус ЦНС I или II описан в подпункте 22.3 настоящего пункта;
на 8 день индукционной терапии в ОАК <1000 бластных клеток/мкл;
на 15 день индукционной терапии в КМ <30 % бластных клеток;
ремиссия на 36 день индукционной терапии;
наличие всех критериев обязательно;
ImRG:
иммунофенотипические маркеры CD1a+TCR+;
иммунофенотипические маркеры CD1a– TCR–;
T – I или IV иммунофенотип;
инициальные лейкоциты >500 х 109 /л;
инициальный размер селезенки >4 см;
первичный статус ЦНС I или II или III описан в подпункте 22.3 настоящего пункта;
на 8 день индукционной терапии в ОАК >1000 бластных клеток/мкл;
на 15 день индукционной в КМ <30 % бластных клеток;
ремиссия на 36 день индукционной терапии;
наличие хотя бы одного из критериев:
иммунофенотипические маркеры CD1a+TCR+, иммунофенотипические маркеры CD1a – TCR–, T – IV иммунофенотип, инициальные лейкоциты >500 х 109 /л, инициальный размер селезенки >4 см, первичный статус ЦНС III, на 8 день индукционной терапии в ОАК >1000 бластных клеток/мкл + все остальные;
HRG:
иммунофенотипические маркеры CD1a – TCR+;
на 15 день индукционной терапии в КМ >30 % бластных клеток;
отсутствие ремиссии на 36 день индукционной терапии;
необходимо наличие хотя бы одного из критериев;
22.3. определение первичного статуса ЦНС:
ЦНС I – нетравматическая пункция, <10 эритроцитов/мкл в спинномозговой жидкости (далее – СМЖ), отсутствие бластных клеток;
ЦНС II – нетравматическая пункция, <10 лейкоцитов/мкл в СМЖ, бластные клетки после цитоцентрафугирования;
ЦНС III – нетравматическая пункция, >10 лейкоцитов/мкл в СМЖ, бластные клетки после цитоцентрафугирования;
TPL+(положительная) – травматическая пункция, наличие бластных клеток;
TPL-(отрицательная) – травматическая пункция, бластные клетки отсутствуют.
Инициальным поражением ЦНС считается:
наличие любого количества бластных клеток при цитологическом исследовании ликвора;
цитоз ликвора свыше 5 клеток в 1 мкл ликвора требует проведения исследования цитопрепарата, приготовленного на цитоцентрефуге для определения наличия опухолевых бластов;
в случае травматической люмбальной пункции (далее – ЛП) при одновременном присутствии лейкемических бластов в периферической крови, пациент расценивается как пациент с инициальным поражением ЦНС;
наличие патологических образований в веществе головного и (или) спинного мозга и (или) в мозговых оболочках по данным МРТ или далее КТ;
поражение черепно-мозговых нервов даже при отсутствии бластных клеток в ликворе или патологических образований по данным МРТ или КТ.
На 36 день индукционной терапии определяется статус ремиссии:
проводится костно-мозговая пункция (далее – КМП);
исследование минимальной остаточной болезни (далее – МОБ);
осуществляется контроль зон первичного поражения КТ органов грудной клетки (далее – ОГК) при инициальном расширении средостения;
КТ или МРТ головного и (или) спинного мозга при инициальном наличии патологических образований;
контроль клинических симптомов (размер селезенки при пальпации в см от края реберной дуги);
22.4. критерии оценки ответа на лечение:
полная ремиссия (далее – ПР) считается достигнутой при следующих условиях:
отсутствие клинических признаков болезни;
наличие <5 % бластных клеток в при нормальной или немного сниженной клеточности;
отсутствие экстрамедуллярного поражения.
При сниженных показателях периферической крови и (или) клеточности КМ на 36 день, повторная оценка статуса ремиссии проводится на 43 день по результатам КМП.
Пациенты, не достигшие клинико-гематологической ремиссии на 36 (43 в случае гипорегенераторной картины в КМ на 36 день) день индукционной терапии, переводятся в HRG и в дальнейшем получают лечение курсами химиотерапии высокого риска (далее – курс HR), нуждаются в поиске родственного или неродственного донора с последующей ТГСК в терапии первой линии;
22.5. условия для начала химиотерапии после достижения ремиссии:
22.5.1. условия начала индукции ремиссии SRG:
отсутствие тяжелых инфекционных очагов (Common Terminology Criteria for Adverse Events, version 5.0, November 27,2017 (далее – CTCAE, v5.0) или полный контроль инфекции (за исключением особых ситуаций с жизнеугрожающими состояниями, связанными с большой массой опухоли и (или) высоким лейкоцитозом, требующими безотлагательного начала терапии).
ЛП с диагностической и (или) лечебной целью на любом этапе терапии выполняются при уровне тромбоцитов >40 х 109 /л. После выполнения ЛП пациент находится на функциональной кровати в положении Тределенбурга (на животе с опущенным головным концом под углом 45°) минимум 2 часа. Первая диагностическая ЛП выполняется у детей под общей анастезией;
22.5.2. условия начала консолидирующей терапии SRG:
ПР;
удовлетворительное общее состояние;
отсутствие тяжелой (CTCAE, v5.0) инфекции;
лейкоциты более 2,0 х 109 /л;
гранулоциты более 0,5 х 109 /л;
тромбоциты более 50 х 109 /л;
уровень общего билирубина менее 40 мкмоль/л (аспарагиназа и меркаптопурин при уровне общего билирубина >40 мкмоль/л отменяются! терапия консолидации прерывается);
22.5.3. условия начала реиндукции SRG:
удовлетворительное общее состояние;
отсутствие тяжелой (CTCAE, v5.0) инфекции;
отсутствие признаков тяжелой (CTCAE, v5.0) периферической и вегетативной нейропатии;
лейкоциты более 2,0 х 109 /л;
гранулоциты более 0,5 х 109 /л;
тромбоциты более 50 х 109 /л;
22.5.4. условия начала индукционной терапии ImRG:
отсутствие тяжелой (CTCAE, v5.0) инфекции или полный контроль инфекции (за исключением особых ситуаций с жизнеугрожающими состояниями, связанными с большой массой опухоли и (или) высоким лейкоцитозом, требующими безотлагательного начала терапии);
22.5.5. условия начала консолидирующей терапии ImRG и реиндукционной терапии такие же как для SRG;
22.5.6. условия проведения антрациклинов (даунорубицин, рубомицин):
хорошее общее самочувствие;
отсутствие признаков инфекции;
удовлетворительная сократительная способность миокарда левого желудочка по данным Эхо-КГ;
лейкоциты более 2,0 х 109 /л; гранулоциты более 0,75 х 109 /л;
22.5.7. принципы проведения терапии курсами HR:
стабильное состояние ребенка перед их началом – пациент должен быть активен, самостоятельно есть, иметь хорошее состояние слизистых оболочек и регулярный стул, должны полностью отсутствовать очаги инфекции;
реализация терапии должна проводиться так быстро, насколько это возможно, соблюдение временных интервалов между курсами является особенно важным для первых трех терапевтических элементов;
временной интервал между курсами HR должен находиться в пределах 2 недель (считая от 6-го дня предшествующего курса). При этом, инициально курсы F1 и F2 должны рассматриваться как единый терапевтический элемент F1–F2 и его длительность не должна превышать 21 дня;
редукция доз не предусматривается (за исключением решений, принятых совместно с руководством исследования), в случае необходимости возможен сдвиг проведения конкретного элемента по времени или полный отказ от конкретного медикамента;
перерасчет площади поверхности тела пациента перед началом каждого курса HR должен производиться заново;
временные промежутки между элементами определяются не столько выходом из аплазии, сколько общим состоянием пациентов и объективно регистрируемой органной токсичностью;
запрещается начало нового курса HR при наличии поражений слизистых, тяжелой инфекции, серьезной органной токсичности;
22.5.8. условия начала курса HR:
удовлетворительное общее состояние и отсутствие инфекции;
креатинин и клиренс креатинина в пределах возрастной нормы;
АлАТ и (или) АсАТ менее 5 возрастных норм, билирубин менее трех возрастных норм;
ПВ менее 1,6 от верхней границы возрастной нормы, фибриноген и антитромбин III более 0,75 от нижней границы возрастной нормы;
стабильный рост гранулоцитов и тромбоцитов; гранулоциты более 0,2 х 109 /л (решающим является количество гранулоцитов, а не общее количество лейкоцитов); тромбоциты более 50 х 109 /л;
22.5.9. условия проведения курса с клофарабином:
асептический режим;
терапия деконтаминации (противирусная и антибактериальная);
полное отсутствие очагов инфекции;
контрольная КТ или МРТ для исключения грибкового поражения легких, печени, селезенки, придаточных пазух, других;
стабильное состояние пациента;
противогрибковая профилактическая терапия;
22.5.10. условия начала поддерживающей терапии (далее – ПТ):
ПР;
удовлетворительное общее состояние;
отсутствие тяжелой инфекции;
лейкоциты более 2,0 х 109 /л;
гранулоциты более 0,5 х 109 /л;
тромбоциты более 50 х 109 /л;
22.6. первичный диагностический комплекс при ОЛЛ включает блок А, блок Б, блок В и специализированные диагностические мероприятия, необходимые для постановки диагноза:
забор КМ для цитологического исследования (КМ аспирируется из 2–3 анатомических точек);
забор КМ для цитохимического исследования (окраска мазков на миелопероксидазу, гликоген (PAS), α-нафтил-ацетатэстеразу (неспецифическую эстеразу) с тестом на ингибирование фторидом натрия);
забор КМ для иммунофенотипического исследования (далее – ИФТ);
забор КМ для молекулярно-генетического исследования;
ЛП с приготовлением цитостатиков;
КТ ОГК при невозможности ее выполнения – рентгенография ОГК в прямой и правой боковой проекции;
проведение КТ или МРТ головного мозга с контрастным усилением или без (при наличии лейкоцитоза свыше 50 тыс. в мкл, либо неврологических симптомов);
УЗИ яичек или органов малого таза (далее – ОМТ) у девочек (яичники);
медицинский осмотр врача-офтальмолога (по медицинским показаниям);
22.7. на этапах терапии необходимые исследования выполняются в следующем порядке:
блок А (за исключением медицинского осмотра врача – детского невролога) – перед каждым терапевтическим элементом обязательно, медицинский осмотр лечащего врача ежедневно в стационаре, в дни парентерального введения цитостатиков на дневном стационаре и поликлинике, далее по медицинским показаниям;
ОАК, БИК, ОАМ, коагулограмма – перед каждым терапевтическим элементом, далее по медицинским показаниям;
на ПТ – ОАК еженедельно, БИК – ежемесячно;
забор КМ для цитологического исследования, для ИФТ, для молекулярногенетического исследования с целью определения МОБ – на +15, +36, индукции до момента регистрации ремиссии, далее по медицинским показаниям;
после ТГСК на +30, +60, +100, +190, +280, +365 дни; перед ПТ;
ЛП с приготовлением цитостатиков – +8, +15, +22, +29, +36 дни индукции;
+43, +57, +71,+85, +141, +197 дни консолидации;
1 день курса HR1 и курса HR2, 5 день курса HR3;
31 и 38 дни 2 фазы, протокола II;
на курсах реиндукции при проведении ПТ;
КТ ОГК при невозможности ее выполнения – рентгенография ОГК в прямой и правой боковой проекции – +36 день индукции при наличии первоначальных изменений; далее по медицинским показаниям;
КТ или МРТ головного мозга с контрастным усилением или без – 36 день индукции при наличии первоначальных изменений, далее по медицинским показаниям;
УЗИ ОБП – +36 день индукции; далее по медицинским показаниям;
Эхо-КГ и ЭКГ – перед введением антрациклинов; далее по медицинским показаниям;
определение уровня содержания метотрексата (при проведении терапии курсами HR) в крови – 42-й, 48-й и 54-й час от начала введения;
всем пациентам HRG HLA – типирование и инициация поиска донора должны проводиться сразу после стратификации пациентов в эту группу риска.
Любые другие исследования лабораторные и инструментальные, а также консультации узких специалистов выполняются на любом этапе терапии при наличии медицинских показаний;
22.8. лечебные мероприятия:
основными критериями для выработки лечебной тактики и объема терапии являются: возраст пациента, результаты ИФТ бластных клеток, цитогенетического и молекулярно-генетического исследований, инициальный уровень лейкоцитов в ОАК, размер селезенки, статус ЦНС, ответ на ПХТ, оцениваемый на 8, 15 и 36 дни индукционной терапии по количеству бластных клеток в ОАК, КМ и определение МОБ на 36 день индукции;
осуществляется комплексное лечение с использованием системной ПХТ, ЛТ, у пациентов HRG проводится ТГСК в терапии первой линии;
все пациенты младше 15 лет SRG и ImRG получают индукцию ремиссии, 3 консолидации и ПТ. Пациенты >15 лет ImRG получают индукцию ремиссии, 6 консолидаций и ПТ;
пациенты ImRG с ОЛЛ из В-клеток предшественников в возрасте >10 лет и <5 лет получают дополнительно краниальное облучение в суммарной облучающей дозе (далее – СОД) 12 Гр. Однако при наличии у них t(12;21) краниальное облучение не проводится. Также ЛТ получают пациенты старше 3 лет с ОЛЛ из В-клеток предшественников с инициальным гиперлейкоцитозом, наличием t(4;11) или t(9;22), а также все пациенты старше 1 года с инициальным поражением ЦНС (статус ЦНС III);
всем пациентам HRG после достижения ремиссии в рамках высокодозной химиотерапии (далее – ВДХТ) в максимально короткие сроки проводится аллоТГСК любого типа (в зависимости от доступности доноров и технических возможностей) в терапии первой линии;
22.9. терапия SRG:
22.9.1. индукционная ПХТ (36 дней):
- дексаметазон – 6 мг/м2 , внутрь, 1–29 день, с последующим снижением к 36 дню. Стартовая доза дексаметазона в зависимости от уровня инициального лейкоцитоза: при лейкоцитах 50–100 х 109 – 1,5 мг/м2 , при лейкоцитах 100–250 х 109 – 1 мг/м2 , при лейкоцитах более 250 х 109 – 0,5 мг/м2 . Полная терапевтическая доза дексаметазона должна быть достигнута не позднее 5–7 дней циторедуктивной фазы;
- винкристин – 1,5 мг/м2 (макс 2 мг), внутривенно струйно медленно на 8, 15, 22, 29, 36 дни;
- даунорубицин – 45 мг/м2 , внутривенно капельно путем 6-часовой на 8 (для пациентов SRG, ImRG и HRG) и 22 дни (для пациентов ImRG и HRG; для пациентов SRG только при наличии более 10 % бластных клеток в КМ на +15 день индукции;
- метотрексат, цитарабин, преднизолон эндолюмбально в дни 1, 8, 15, 22, 29, 36 согласно возрасту:
>1 года <2 лет – метотрексат – 8 мг, цитарабин – 20 мг, преднизолон – 6 мг;
>2 лет <3 лет – метотрексат – 10 мг, цитарабин – 26 мг, преднизолон – 8 мг;
>3 лет – метотрексат – 12 мг, цитарабин – 30 мг, преднизолон – 10 мг;
22.9.2. консолидирующая терапия:
состоит из 3 фаз, каждая фаза представляет собой 6-ти недельную терапию меркаптопурином, метотрексатом и аспарагиназой с последующей 2-недельной реиндукцией, включающей винкристин, дексаметазон или метилпреднизолон. Дни введений выбирает сам лечащий врач – наиболее удобные дни на протяжении текущей недели, главное – соблюдение недельных интервалов между ЛС;
консолидация 1 (55 дней):
меркаптопурин – 50 мг/м2, внутрь в 1 прием (18:00) 42 дня;
метотрексат – 30 мг/м2, внутримышечно, 1 раз в неделю, № 6;
аспарагиназа E. coli – 5000 ЕД/м2, внутривенно или внутримышечно, 1 раз в неделю, № 6;
винкристин – 1,5 мг/м2 (макс. 2 мг), внутривенно, 141, 148 дни;
дексаметазон – 6 мг/м2, внутрь в 2 приема 13 дней;
метотрексат, цитозар, преднизолон эндолюмбально в дни 43, 57, 71, 85, дозы приводятся в подпункте 22.9.1 настоящего пункта;
консолидация 2 (55 дней):
меркаптопурин – стартовая доза 50 мг/м2 внутрь в 1 прием (18:00) 42 дня;
метотрексат – стартовая доза 30 мг/м2, внутримышечно, 1 раз в неделю, № 6;
аспарагиназа E. coli – 5000 ЕД/м2, внутривенно или внутримышечно, 1 раз в неделю, № 6;
винкристин – 1,5 мг/м2 (макс. 2 мг), внутривенно, 141, 148 дни;
дексаметазон – 6 мг/м2, внутрь в 2 приема 13 дней;
метотрексат, цитозар, преднизолон эндолюмбально в день 141, дозы приводятся в подпункте 22.9.1 настоящего пункта;
консолидация 3 (55 дней):
меркаптопурин – стартовая доза 50 мг/м2 внутрь в 1 прием (18:00) 42 дня;
метотрексат – стартовая доза 30 мг/м2, внутримышечно, 1 раз в неделю, № 6;
аспарагиназа E. coli – 5000 ЕД/м2, внутривенно или внутримышечно, 1 раз в неделю, № 6;
винкристин – 1,5 мг/м2 (макс. 2 мг), внутривенно струйно медленно, 197, 204 дни;
дексаметазон – 6 мг/м2, внутрь в 2 приема 13 дней;
метотрексат, цитозар, преднизолон эндолюмбально в день 197, дозы приводятся в подпункте 22.9.1 настоящего пункта;
22.10. терапия ImRG:
22.10.1. индукционная ПХТ (36 дней):
- дексаметазон – 6 мг/м2, внутрь в 2 приема 36 дней или метилпреднизолон – 60 мг/м2, внутрь в 2 приема 36 дней, стартовая доза наращивается постепенно в зависимости от уровня лейкоцитов и приведена в подпункте 22.9.1 настоящего пункта;
- винкристин – 1,5 мг/м2 (макс. 2 мг), внутривенно, 8, 15, 22, 29, 36 дни;
- пэгаспаргаза – 1000 ЕД/м2 внутривенно, № 1 в любой день с 3 по 21 день;
- даунорубицин – 45 г/м2, внутривенно, 8 день, 22 день;
- иматиниб – 300 мг/м2/сутки, внутрь, начиная с 15 дня индукции для пациентов с t(9;22);
- меркаптопурин – 60 мг/м2, внутрь в 1 прием с 43 дня по 71 день (28 дней);
- циклофосфан – 1000 мг/м2, внутривенно, 43, 71 дни;
- цитарабин – 75 мг/м2/сутки, внутривенно № 4 курса по 4 дня (45–48 дни; 52–55 дни;
- 59–62 дни; 66–69 дни);
- метотрексат, цитарабин, преднизолон эндолюмбально в дни 1, 8, 15, 22, 29, 36, дозы приводятся в подпункте 22.9.1 настоящего пункта.
Пациенты с инициальным гиперлейкоцитозом получают пегаспаргазу на этапе индукции ремиссии однократно в промежутке с 5 дня по 7 день.
Все пациенты с t(9;22) получают на всех этапах лечения, начиная с 15 дня индукции, ингибитор тирозинкиназ иматиниб. Контроль молекулярно-генетической ремиссии осуществляется дополнительно на 84 день терапии, при необходимости – на 141 день терапии и (или) в любые другие дни терапии. Пациентам, не достигшим ремиссии, решается вопрос о переводе на терапию ингибиторами BCR/ABL1 тирозинкиназы (далее – ИТК) II или III поколения.
Пациенты >15 лет получают дексаметазон или метилпреднизолон в зависимости от рандомизации исследовательского центра (дексаметазон – 6 мг/м2 внутрь в 2 приема 36 дней или метилпреднизолон – 60 мг/м2 внутрь в 2 приема).
Пациенты ImRG с ОЛЛ из Т – предшественников после выхода в ремиссию на 36 день индукции получают 2 фазу индукции ремиссии протокол Ib+ с 43 дня по 71 день. Эти пациенты получают дополнительно 2 интратекальных введения тремя химиопрепаратами в 52 и 66-й дни лечения.
Пациенты с инициальным ЦНС III статусом Т-ОЛЛ протокол Ib+ на этапе индукции не получают.
Консолидирующая терапия состоит из 3-х фаз. Каждая фаза представляет собой 6-недельную терапию меркаптопурином, метотрексатом и аспарагиназой с последующей 2-недельной реиндукцией, включающей винкристин, дексаметазон или метилпреднизолон. Дни введений выбирает сам лечащий врач – наиболее удобные дни на протяжении текущей недели, главное – соблюдение недельных интервалов между ЛС;
22.10.2. консолидация 1 (55 дней):
- меркаптопурин – стартовая доза 50 мг/м2 внутрь в 1 прием (18:00) 42 дня;
- метотрексат – стартовая доза 30 мг/м2 внутримышечно 1 раз в неделю № 6;
- аспарагиназа E. coli – 10000 ЕД/м2 внутривенно или внутримышечно 1 раз в неделю № 6;
- винкристин – 1,5 мг/м2 (макс. 2 мг) внутривенно 141, 148 дни;
- дексаметазон – 6 мг/м2 внутрь в 2 приема 13 дней или метилпреднизолон – 60 мг/м2 внутрь в 2 приема 13 дней;
- даунорубицин – 30 мг/м2 внутривенно 44, 58 дни;
- бортезомиб* – 1,3 мг/м2 внутривенно 85, 89, 92, 96 дни и 141, 145, 148, 152, 197, 201, 204, 208 дни;
- метотрексат, цитарабин, преднизолон эндолюмбально в дни 43, 57, 71, 85, дозы приводятся в подпункте 22.9.1 настоящего пункта;
консолидация 2 (55 дней):
- меркаптопурин – стартовая доза 50 мг/м2 внутрь в 1 прием (18:00) 42 дня;
- метотрексат – стартовая доза 30 мг/м2 внутримышечно 1 раз в неделю № 6;
- аспарагиназа E. coli – 10000 ЕД/м2 внутривенно или внутримышечно 1 раз в неделю № 6;
- винкристин – 1,5 мг/м2 (макс. 2 мг) внутривенно 141, 148 дни;
- дексаметазон – 6 мг/м2 внутрь в 2 приема 13 дней или метилпреднизолон – 60 мг/м2 внутрь в 2 приема 13 дней;
- даунорубицин – 30 мг/м2 внутривенно 107, 121 дни;
- бортезомиб* – 1,3 мг/м2 внутривенно 141, 145, 148, 152 дни;
- метотрексат, цитарабин, преднизолон эндолюмбально в дни 99, 113, 127, 141, дозы приводятся в подпункте 22.9.1 настоящего пункта;
консолидация 3 (55 дней):
- меркаптопурин – стартовая доза 50 мг/м2 внутрь в 1 прием (18:00) 42 дня;
- метотрексат – стартовая доза 30 мг/м2 внутримышечно 1 раз в неделю, № 6;
- аспарагиназа E. coli – 10000 ЕД/м2 внутривенно или внутримышечно 1 раз в неделю № 6;
- винкристин – 1,5 мг/м2 (макс. 2 мг) внутривенно 141, 148 дни;
- дексаметазон – 6 мг/м2 внутрь в 2 приема 13 дней или метилпреднизолон – 60 мг/м2 внутрь в 2 приема 13 дней;
- даунорубицин – 30 мг/м2 внутривенно 163 дни;
- бортезомиб* – 1,3 мг/м2 внутривенно 197, 201, 204, 208 дни;
- метотрексат, цитарабин, преднизолон эндолюмбально в дни 155, 169, 183, 197, дозы приводятся в подпункте 22.9.1 настоящего пункта.
Пациенты >15 лет вместо 3 получают 6 консолидаций. Доза аспарагиназы E. coli у этих пациентов снижена до 5000 ЕД/м2 внутривенно или внутримышечно 1 раз в неделю.
Даунорубицин – 30 мг/м2 внутривенно получают по 1 введению на каждой консолидации (кроме 6-ой) № 5, в первый день реиндукций.
Пациенты с инициальным поражением ЦНС (статус ЦНС III) В-ОЛЛ и t(4;11) бортезомиб* на этапах консолидаций не получают;
22.11. терапия HRG:
- пациенты HRG по окончании индукции получают курсы ПХТ F1 и F2. Далее, в зависимости от статуса ремиссии и иммунологической принадлежности бластных клеток (не Т-ОЛЛ или Т-ОЛЛ), различные курсы интенсивной химиотерапии, в ряде случаев терапию с включением неларабина*;
- в ряде случаев первичным пациентам (при невозможности проведения стандартной терапии) или пациентам HRG решением врачебного консилиума может быть предложена терапия ЛС блинатумомаб, представляющим из себя моноклональное биспецифическое антитело анти – CD19. Всем пациентам HRG после достижения ремиссии в рамках химиотерапии высокого риска в максимально короткие сроки облигатно показана ТГСК любого типа (в зависимости от доступности доноров и от технических возможностей);
22.11.1. курс F1:
метилпреднизолон – 80 мг/м2 внутрь или внутривенно в 3 приема 5 дней;
винкристин – 1,5 мг/м2 (макс. 2 мг) внутривенно в 1, 6 дни;
пегаспаргаза – 1000 ЕД/м2 внутривенно в день 4;
метотрексат – 5000 мг/м2 24 часовая инфузия в день 1 (1/10 дозы вводится за 1/2 часа, 9/10 дозы – за 23 и 1/2 часа);
кальция фолинат – 15 мг/м2 внутривенно на 42-й, 48-й и 54-й часы инфузии;
контроль уровня метотрексата в крови на 42 и 48 час от начала введения метотрексата, при нарушении выведения метотрексата уровни продолжают контролировать каждые 6 часов до его безопасного значения – 0,25 ммоль/л. В случае нарушения выведения метотрексата коррекция дозы кальция фолината осуществляется по схеме: уровень метотрексата 0,25–1 ммоль/л – доза лейковорина 15 мг/м2 внутривенно, уровень метотрексата >1–<2 ммоль/л – доза лейковорина 30 мг/м2 внутривенно, уровень метотрексата >2–<3 ммоль/л – доза лейковорина 45 мг/м2 внутривенно, уровень метотрексата >3–<4 ммоль/л – доза лейковорина 60 мг/м2 внутривенно, уровень метотрексата >4–<5 ммоль/л – доза лейковорина 75 мг/м2 внутривенно;
метотрексат, цитарабин, преднизолон эндолюмбально в 1 день, дозы приводятся в подпункте 22.9.1 настоящего пункта;
22.11.2. курс F2:
метилпреднизолон – 80 мг/м2 внутрь или внутривенно в 3 приема 5 дней;
винкристин – 1,5 мг/м2 (максимально 2 мг) внутривенно в день 1;
пегаспаргаза – 1000 ЕД/м2 внутривенно в день 4;
цитарабин – 2000 мг/м2 каждые 12 часов в виде 3-часовой инфузии внутривенно в дни 1, 2 (4 введения с интервалом в 12 часов);
сопроводительная терапия для медицинской профилактики кератоконъюнктивита на фоне введения циторабина – глазные капли содержащие дексаметазон каждые 3 часа, для медицинской профилактики нейротоксичности – пиридоксин – 150 мг/м2 внутривенно струйно перед каждой инфузией цитарабина;
метотрексат, цитарабин, преднизолон эндолюмбально в 5 день, дозы приводятся в подпункте 22.9.1 настоящего пункта.
Сопроводительная терапия колониестимулирующим фактором (далее – КСФ) после окончания курса HR:
все пациенты HRG после окончания каждого курса HR получают КСФ только в случае развития серьезной инфекции, поскольку необоснованное применение КСФ может увеличивать риск рецидива. В случае инфекции лечение КСФ должно проводиться в дозе 5 мкг/кг в день подкожно или, как исключение, в виде 4-часовой внутривенной инфузии. Терапия КСФ должна проводиться до того момента, пока количество нейтрофильных гранулоцитов не превысит 3000/м3. Это связано с тем, что после преждевременного прекращения терапии КСФ уровень гранулоцитов часто вновь резко снижается;
22.11.3. курс HR1:
метилпреднизолон – 80 мг/м2 внутрь или внутривенно в 3 приема 5 дней;
винкристин – 1,5 мг/м2 (макс. 2 мг) внутривенно в 1, 6 день;
пегаспаргаза – 1000 ЕД/м2 внутривенно в день 6;
цитарабин – 2000 мг/м2 каждые 12 часов, внутривенно в день 5. Сопроводительная терапия для медицинской профилактики кератоконъюнктивита на фоне введения циторабина описана в подпункте 22.11.2 настоящего пункта;
циклофосфан – 200 мг/м2 внутривенно в день 2, на 3 и 4 день 200 мг/м2 внутривенно 2 раза в день. Диурез и медицинская профилактика цистита: инфузия 3000 мл/м2 в течение 24 часа. Месна внутривенно 70 мг/м2 внутривенно перед инфузией циклофосфана, а также на 4 и 8 час после введения ЛС;
метотрексат – 5000 мг/м2 24 часовая инфузия в день 1;
кальция фолинат – 15 мг/м2 внутривенно на 42-й, 48-й и 54-й часы инфузии;
контроль за выведением метотрексата приведен в подпункте 22.11.1 настоящего пункта;
метотрексат, цитарабин, преднизолон эндолюмбально в день 1, дозы приводятся в подпункте 22.9.1 настоящего пункта;
22.11.4. курс HR2:
метилпреднизолон – 80 мг/м2 внутрь или внутривенно в 3 приема 5 дней;
винкристин – 1,5 мг/м2 (макс. 2 мг) внутривенно в 1, 6 день;
пегаспаргаза – 1000 ЕД/м2 внутривенно в день 6;
даунорубицин – 30 мг/м2 внутривенно за 24 часа в день 5 (перед введением даунорубицина – ЭКГ и Эхо-КГ);
ифосфамид – 800 мг/м2 внутривенно в течение 1 часа, день 2, 3 и 4 (5 введений с интервалом 12 часов). Диурез и медицинская профилактика цистита: инфузия 3000 мл/м2 в течение 24 часов. Месна – 400 мг/м2 внутривенно перед инфузией циклофосфана, а также на 4 и 8 час после введения ЛС;
метотрексат – 5000 мг/м2 24 часовая инфузия в день 1;
кальция фолинат – 15 мг/м2 внутривенно на 42-й, 48-й и 54-й часы инфузии, контроль за выведением метотрексата приведен в подпункте 22.11.1 настоящего пункта;
метотрексат, цитарабин, преднизолон эндолюмбально в 1 день и в день 5 при ЦНС II, дозы приводятся в подпункте 22.9.1 настоящего пункта;
22.11.5. курс HR5:
клофарабин – 52 мг/м2 (для пациентов младше 30 лет) и 40 мг (для пациентов 30 лет и старше) внутривенно за 2 часа в дни 1–5;
циклофосфан – 300 мг/м2 внутривенно за 1 час, дни 1–5 (5 введений с интервалом в 24 часа). Сопроводительная терапия как в курсе HR1 приведена в подпункте 22.11.3 настоящего пункта;
этопозид – 100 мг/м2 внутривенно за 2 часа в дни 3–5;
метилпреднизолон – 80 мг/м2 внутрь или внутривенно в 3 приема в дни 1–3;
метотрексат, цитарабин, преднизолон эндолюмбально в 6 день, дозы приводятся в подпункте 22.9.1 настоящего пункта;
22.11.6. курс HR6:
метилпреднизолон – 80 мг/м2 внутрь или внутривенно в 3 приема 5 дней;
пегаспаргаза – 1000 ЕД/м2 внутривенно в день 6;
цитарабин – 300 мг/м2 каждые 12 часов внутривенно в 3, 4, 5 день (всего 6 введений);
циклофосфан – 200 мг/м2 внутривенно в 1, 2, 3, 4, 5 день;
неларабин* – 1400 мг/м2 внутривенно в 1, 3, 5 день;
22.11.7. курс HR7:
клофарабин – 52 мг/м2 (для пациентов младше 30 лет) и 40 мг/м2 (для пациентов 30 лет и старше) внутривенно за 2 часа, дни 1–5;
цитарабин – 1 г/м2 внутривенно в виде 3-часовой инфузии в дни 1–5 (5 введений с интервалом 24 часа);
идарубицин – 8 мг/м2 внутривенно за 6 часов в дни 3–5 (перед первым введением идарубицина – ЭКГ и Эхо-КГ);
метотрексат, цитарабин, преднизолон эндолюмбально в 6 день, дозы приводятся в подпункте 22.9.1 настоящего пункта;
22.12. ЛТ:
ЛТ получают:
пациенты >10 лет и <15 лет с В-ОЛЛ, кроме пациентов с t(12;21) в этой возрастной категории;
пациенты с В-ОЛЛ и инициальным гиперлейкоцитозом в возрастной категории >3 лет;
все пациенты с t(4;11) t(9;22) >3 лет;
все пациенты с инициальным статусом ЦНС III старше 1 года;
пациенты >15 лет и статусом ЦНС III получают ЛТ после 3-х консолидаций.
Во время ЛТ пациенты получают меркаптопурин внутрь и 2 дополнительные ЛП с введением химиопрепаратов.
Доза ЛТ зависит от возраста пациента:
от 1 года до 3 лет – 8 Гр;
в возрасте >3 лет – 12 Гр.
После ЛТ пациентам больше не вводится метотрексат интратекально;
22.13. ПТ:
ПТ начинается с 31 недели лечения и продолжается до достижения общей длительности лечения 2 года.
Исключение составляют пациенты с Т-ОЛЛ, получающие дополнительный протоколIb+ в индукции и пациенты с В-ОЛЛ >15 лет. Для первой категории пациентов ПТ начинается с 35 недели и длится до 70 недель, для второй – начинается с 55 недели и длится до 50 недель.
ПТ состоит из 6 недельных курсов (по 42 дня) меркаптопурина внутрь и внутримышечного введения метотрексата 1 раз в неделю, с последующей 2-недельной реиндукцией (дексаметазон или метилпреднизолон внутрь и 2 внутривенных введения винкристина) с одним эндолюмбальным введением трех ЛС на первых трех реиндукциях.
Пациенты, получающие ЛТ, начинают введение метотрексата на ПТ с 33 недели терапии, после окончания ЛТ.
23. Шифр по МКБ-10 – С91.0 ОЛЛ у пациентов до 1 года:
23.1. морфологическая классификация ОЛЛ: аналогична морфологической классификации ОЛЛ у пациентов старше 1 года и приводится в приложении 15;
23.2. иммунофенотипическая классификация ОЛЛ: аналогична классификации ОЛЛ у пациентов старше 1 года;
23.3. определение первичного статуса ЦНС:
- наличие любого количества бластных клеток при цитологическом исследовании;
- в случае травматической ЛП при одновременном присутствии лейкемических бластов в периферической крови пациент расценивается как пациент с инициальным поражением ЦНС;
- наличие патологических образований в веществе головного мозга и (или) в мозговых оболочках по данным МРТ головного мозга, проведенной с контрастированием;
- поражение черепно-мозговых нервов даже при отсутствии бластных клеток в ликворе или патологических образований по данным МРТ головного мозга;
23.4. стратификация пациентов до 1 года с ОЛЛ на группы риска:
в SRG входят пациенты с неперестроенным геном КМТ2А;
в ImRG входят пациенты с реарранжировкой гена КМТ2А без поражения ЦНС;
в HRG входят пациенты с реарранжировкой гена КМТ2А и с поражением ЦНС;
23.5. критерии ответа на терапию:
ПР:
отсутствие клинических признаков болезни;
содержание <5 % бластных клеток при нормальной или немного сниженной клеточности КМ на 36-й день;
отсутствие экстрамедуллярного поражения;
отсутствие при терапевтической ЛП на 29 день бластных клеток в ликворе.
Дополнительные критерии клинико-гематологической ремиссии:
лейкоциты периферической крови >2 х 109/л;
тромбоциты периферической крови >50 х 109/л;
23.6. план терапии в зависимости от группы риска:
SRG – индукция ремиссии: 36 дней дексаметазон, 5 еженедельных введений винкристина, 2 введения; даунорубицина на 8-й и 22-й дни, однократное введение пегаспаргазы на 5–7–21-й день и 6 еженедельных эндолюмбальных введений трех ЛС (метотрексат, цитарабин, дексаметазон). Дальнейшая терапия в этой терапевтической группе зависит от статуса ремиссии, уровня МОБ на 36-й день терапии. МОБ-негативные пациенты получают консолидирующую терапию объеме 3 консолидаций с курсами реиндукции и ПТ. МОБ-позитивные пациенты получают курс блинатумомаба и ТГСК;
ImRG – индукция ремиссии: 36 дней дексаметазон, 5 еженедельных введений винкристина, 2 введения даунорубицина на 8–1 и 22–1 дни, однократное введение пегаспаргазы на 5–7–21 день и 6 еженедельных эндолюмбальных введений трех ЛС (метотрексат, цитарабин, дексаметазон). Дальнейшая терапия в этой терапевтической группе зависит от статуса ремиссии, уровня МОБ на 36-й день терапии. Пациенты, достигшие молекулярной ремиссии, получают консолидирующую терапию объеме 3 консолидаций с курсами реиндукции и ПТ. Пациенты, не достигшие молекулярной ремиссии, получают курс HR1. Дальнейшая терапия зависит от статуса ремиссии после курс HR1. Пациенты, не достигшие молекулярной ремиссии, получают курс блинотумомаба и ТГСК, пациенты достигшие молекулярной ремиссии, получают курс HR2 и курс HR3, протокол II и ПТ;
HRG – индукция ремиссии: 36 дней дексаметазон, 5 еженедельных введений винкристина, 2 введения даунорубицина на 8-й и 22-й дни, однократное введение пегаспаргазы на 5–7–21 день и 6 еженедельных эндолюмбальных введений трех ЛС (метотрексат, цитарабин, дексаметазон). Дальнейшая терапия в этой терапевтической группе не зависит от статуса ремиссии на 36-й день терапии. Все пациенты получают курс HR1, курс блинатумомаба и ТГСК (при условии морфологической ремиссии).
Блинатумомаб получают пациенты:
HRG;
SRG МОБ-позитивные на 36-й день и на 85 день терапии.
ТГСК получают пациенты:
HRG;
SRG МОБ-позитивные на 36-й день терапии;
ImRG МОБ-позитивные и на 36-й, и на 85-й день терапии.
Условия проведения ТГСК:
удовлетворительный соматический статус пациента;
клинико-гематологическая ремиссия с МОБ не более 10–4;
наличие источника гемопоэтических стволовых клеток;
23.7. алгоритм расчета доз:
за основу берется терапевтическая доза 1 м2 поверхности тела. В зависимости от возраста пациента доза рассчитывается по схеме: дети младше 6 месяцев – 2/3 от расчетной дозы; дети в возрасте 6 и более месяцев, но менее 12 месяцев – 3/4 от расчетной дозы; дети в возрасте 12 месяцев и старше – полная терапевтическая доза;
23.8. дозы ЛС, вводимых эндолюмбально, в зависимости от возраста пациента:
<1 года: метотрексат – 6 мг, цитарабин – 20 мг, дексаметазон – 1 мг;
>1 года: метотрексат – 8 мг, цитарабин – 30 мг, дексаметазон – 1 мг;
23.9. условия начала химиотерапии:
23.9.1. условия начала консолидации:
МОБ-негативная, клинико-гематологическая ремиссия;
удовлетворительное общее состояние;
отсутствие тяжелой инфекции;
лейкоциты более 2.5 х 109/л;
гранулоциты более 0,75 х 109/л;
тромбоциты более 70 х 109/л;
билирубина менее 40 мкмоль/л;
23.9.2. условия начала реиндукции:
удовлетворительное общее состояние пациента;
отсутствие тяжелой инфекции;
отсутствие признаков тяжелой периферической нейропатии;
лейкоциты более 2.5 х 109/л;
гранулоциты более 0,5 х 109/л;
тромбоциты более 70 х 109/л;
23.9.3. условия начала курса HR1:
удовлетворительное общее состояние пациента;
отсутствие тяжелой инфекции;
отсутствие признаков тяжелой периферической нейропатии;
лейкоциты более 2.5 х 109/л;
тромбоциты более 70 х 109/л;
билирубин менее 40 мкмоль/л;
АлАТ и (или) АсАТ не более 5 норма;
кроме тех случаев, когда не достигнута морфологическая ремиссия;
23.9.4. условия начала курса HR2:
удовлетворительное общее состояние пациента;
отсутствие тяжелой инфекции;
отсутствие признаков тяжелой периферической нейропатии;
лейкоциты более 2,5 х 109/л;
тромбоциты более 70 х 109/л;
билирубин менее 40 мкмоль/л;
АлАТ и (или) АсАТ не более 5 норма;
23.9.5. условия для начала протокола II – IDA:
клинико-гематологическая ремиссия и МОБ-негативная ремиссия;
удовлетворительное общее состояние пациента;
отсутствие тяжелых инфекций и органной токсичности;
лейкоциты >2,5 х 109/л;
тромбоциты >70 х 109/л;
билирубин <40 мкмоль/л. Пегаспаргазу и меркаптопурин при концентрации общего билирубина 40 мкмоль/л и более не назначают;
фибриноген более 0.5 г/л;
активность АлАТ и (или) АсАТ и гамма-глютамин транспептидаза (далее – ГГТП) 5 возрастных норм;
23.9.6. условия начала 2 фазы протокола II:
удовлетворительное общее состояние пациента;
отсутствие тяжелых инфекций и органной токсичности;
лейкоциты >2,5 х 109/л;
тромбоциты >50 х 109/л;
гранулоциты >0,5 х 109/л;
23.9.7. условия начала ПТ:
клинико-гематологическая ремиссия и МОБ-негативная ремиссия;
удовлетворительное общее состояние пациента;
отсутствие тяжелых инфекций и органной токсичности;
лейкоциты >2,5 х 109/л;
тромбоциты >100 х 109/л;
23.10. первичный диагностический комплекс, а также обследования на этапах терапии соответствуют обследованиям пациентов с ОЛЛ старше 1 года за исключением тайминга оценки МОБ:
ТН0 – момент постановки диагноза до начала специфического лечения: оценивается опухоль – ассоциированный иммунофенотип и производятся определения типа химерного гена (при его наличии) и разработка условий проведения полимеразной цепной реакции (далее – ПЦР) для мониторинга химерного транскриптата;
ТН1 – 15-й день индукционной терапии, ИФТ КМ для всех пациентов, цитогенетическое исследование ПЦР для пациентов с перестроенным геном КМТ2А;
ТН2 – 36-й день индукции, ИФТ КМ для всех пациентов, цитогенетическое исследование ПЦР для пациентов с перестроенным геном КМТ2А;
ТН3 – 85-й терапии для пациентов, получающих терапию консолидации, или восстановление кроветворения после курса HR1 для пациентов для блоковой интенсификации. Проводится ИФТ КМ для всех пациентов, цитогенетическое исследование ПЦР для пациентов с перестроенным геном КМТ2А;
ТН4 – перед ПТ для пациентов, получающих химиотерапию.
Дополнительные точки мониторинга для пациентов HRG (МФТ и ПЦР КМ): после курса HR1, после курса блинатумомаба, после ТГСК на +30, +60, +100, +190, +280, +365 дни.
Дополнительные точки мониторинга для пациентов ImRG: курсы, перед протоколом II – IDA, перед началом ПТ;
23.11. коррекция доз меркаптопурина и метотрексата в зависимости от количества лейкоцитов на ПТ:
количество лейкоцитов менее 1000 х 109/л – доза меркаптопурина и метотрексата – 0 %;
количество лейкоцитов от 1000 х 109/л до 2000 х 109/л – доза меркаптопурина и метотрексата – 50 %;
количество лейкоцитов от 2000 х 109/л до 3000 х 109/л – доза меркаптопурина и метотрексата – 100 %;
количество лейкоцитов более 3000 х 109/л – доза меркаптопурина и метотрексата – 150 %;
количество лимфоцитов менее 300/мкл – доза меркаптопурина и метотрексата – 50 %;
23.12. индукционная терапия ЛС:
- дексаметазон – 6 мг/м2 в 2 приема внутрь или внутривенно с коррекцией дозы по возрасту до 28-го дня включительно. С 29-го дня начинается постепенное снижение дозы дексаметазона: 29–31 дни – 3 мг/м2, 32–34 дни – 1,5 мг/м2, 35–36 дни – 0,75 мг/м2 с последующей полной отменой. Стартовая доза дексаметазона в зависимости от уровня инициального лейкоцитоза: при лейкоцитозе более 100 х 109/л начать с 1/10 дозы. Полная терапевтическая доза дексаметазона должна быть достигнута при клинической переносимости не позднее 5–7 дня циторедуктивной фазы;
- винкристин – 1,5 мг/м2 (макс 2 мг) внутривенно струйно медленно на 8, 15, 22, 29, 36 дни;
- даунорубицин – 45 мг/м2 внутривенно капельно за 6 часов на 8 и 22 дни;
- пегаспаргаза – 1000 МЕ/м2 внутривенно капельно за 2 часа на 5–7 дни (в зависимости от клинического состояния);
- метотрексат, цитарабин, дексаметазон эндолюмбально еженедельно 1, 8, 15, 22, 29, 36 дни, дозы приводятся в подпункте 23.8 настоящего пункта;
23.13. терапия низкодозовой консолидацией для пациентов SRG и ImRG, которые достигли МОБ-негативной ремиссии на 36-й день терапии:
- консолидирующая терапия состоит из трех курсов I, II и III (длительность каждого курса 55 дней):
- меркаптопурин – стартовая доза 50 мг/м2 внутрь в 1 прием (18:00) 42 дня;
- метотрексат – стартовая доза 30 мг/м2 внутривенно струйно 1 раз в неделю № 6. Обязательным условием проведения терапии консолидации является своевременная коррекция доз меркаптопурина и метотрексата в зависимости от количества лейкоцитов в ОАК, описана в подпункте 22.12 пункта 22 настоящего клинического протокола;
- пегаспаргаза – 1000 МЕ/м2 внутривенно капельно в течение 1–2 часов, на 44, 58, 72, 100, 114, 128, 156, 163 и 184 дни консолидации, через 1 сутки после введения метотрексата;
- даунорубицин – 30 мг/м2 внутривенно капельно в течение 6 часов на 44, 65 и 100 дни;
- метотрексат, цитарабин, дексаметазон в возрастной дозировке эндолюмбально на консолидации каждые 2 недели, дозы приводятся в подпункте 23.8 настоящего пункта;
23.14. курс реиндукции:
- дексаметазон – 6 мг/м2 внутрь или внутривенно ежедневно на протяжении 10 дней с последующей быстрой отменой за 3 дня на 85–98, 141–154, 197–210 дни. Суточная доза ЛС распределяется на 2–3 приема с интервалом 8–12 часов;
-винкристин – 1,5 мг/м2 (макс 2 мг) внутривенно струйно 1 раз в неделю в 1, 8 дни реиндукции, 85, 92, 141, 148, 197, 204 дни.
Метотрексат, цитарабин, дексаметазон в возрастной дозировке эндолюмбально проводят в 1 день курсов реиндукции, дозы приводятся в подпункте 23.8 настоящего пункта;
23.15. курсы HR:
23.15.1. курс HR1 получают следующие группы пациентов:
- пациенты SRG, которые не достигли МОБ-негативной ремиссии на 36 день терапии;
- пациенты ImRG, которые не достигли МОБ-негативной ремиссии на 36 день терапии;
- все пациенты HRG.
Курс HR1:
- дексаметазон – 20 мг/м2, внутрь или внутривенно за 2 введения, каждые 12 часов, ежедневно на протяжении 5 дней;
- винкристин – 1,5 мг/м2 (макс. 2 мг), внутривенно, струйно в 1 и 6 дни курса;
- метотрексат высокодозный – 5000 мг/м2 внутривенно за 24 часа в 1 день. Порядок введения и сопроводительная терапия описаны в подпункте 22.11.1 пункта 22 настоящего клинического протокола;
- цитарабин – 2000 мг/м2 внутривенно в виде 3-часовой инфузии за 2 введения, в день 5. Сопроводительная терапия для медицинской профилактики кератоконъюнктивита на фоне введения циторабина описана в подпункте 22.11.2 пункта 22 настоящего клинического протокола. Коррекция доз цитарабина в соответствии с возрастом: менее 3 месяцев – 20 % от рассчитанной дозы, 4–5 месяцев – 30 %, 5–7 месяцев – 40 %, 8–10 месяцев – 50 %, 11–13 месяцев – 60 %, 14–16 месяцев – 70 %, 17–19 месяцев – 80 %;
- пегаспаргаза – 1000 МЕ/м2, внутривенно за 1–2 часа в день 6;
- метотрексат, цитарабин, дексаметазон эндолюмбально в 1 день курса, дозы приводятся в подпункте 23.8 настоящего пункта;
23.15.2. курс HR2 и курс HR3 получают пациенты: ImRG, не достигшие МОБ-негативной ремиссии на 36 день терапии, но МОБ-негативные, ПЦР – негативные на 85 день терапии.
Курс HR2:
- дексаметазон – 20 мг/м2 внутрь или внутривенно за 2 введения, каждые 12 часов ежедневно на протяжении 5 дней;
- винкристин – 1,5 мг/м2 (макс. 2 мг) внутривенно в 1 и 6 дни курса;
- метотрексат высокодозный – 5000 мг/м2, условия введения такие же как в курсе HR1;
- ифосфамид – 400 мг/м2 внутривенно капельно в течение 1 часа, с 1 по 5 день курса месна – 150 мг/м2 внутривенно на 0, 4, 8 час от начала инфузии ифосфамида;
- даунорубицин – 30 мг/м2 внутривенно за 24 часа в день 5;
- пегаспаргаза – 1000 МЕ/м2 внутривенно капельно за 1–2 часа на 6 день;
- метотрексат, цитарабин, дексаметазона эндолюмбально в 1 день курса, дозы приводятся в подпункте 23.8 настоящего пункта.
Курс HR3:
- дексаметазон – 20 мг/м2 внутрь или внутривенно в 2–3 приема с 1 по 5 день;
- пегаспаргаза – 1000 МЕ/м2 внутривенно капельно за 1–2 часа на 6 день;
- цитарабин – 2000 мг/м2 каждые 12 часов внутривенно капельно в течение 3 часов, 2 раза в сутки, всего 4 введения, в дни 1 и 2. Медицинская профилактика керотоконьюнктивита и нейротоксичности, расчет доз в зависимости от возраста такие же как в курсе HR1;
- метотрексат, цитарабин. дексаметазон в возрастной дозировке эндолюмбально в 5 день курса, дозы приводятся в подпункте 23.8 настоящего пункта;
23.15.3. протокол II – IDA:
1 фаза протокола II – IDA:
- дексаметазон – 6 мг/м2 ежедневно с 1 по 15 дни внутрь в 2–3 приема. С 16 дня начинается постепенное снижение дозы дексаметазона с последующей полной отменой к 22 дню;
- винкристин – 1,5 мг/м2 внутривенно струйно в дни 1, 8, 15, 22;
- идарубицин – 6 мг/м2 внутривенно за 1 час в дни 1, 8, 15, 22;
- пегаспаргаза – 1000 МЕ/м2 внутривенно за 1–2 часа в дни 1, 12;
- метотрексат, цитарабин, дексаметазон в возрастной дозировке эндолюмбально в 1, 15 дни фазы I, дозы приводятся в подпункте 23.8 настоящего пункта.
2 фаза протокола II – IDA:
- меркаптопурин – 60 мг/м2 внутрь ежедневно с 20 по 49 дни в один прием в 18:00;
- циклофосфан – 1000 мг/м2 внутривенно капельно за 1 час в день 29. Диурез и медицинская профилактика цистита: инфузия 3000 мл/м2 в течение 24 часов. Месна – 400 мг/м2 внутривенно перед инфузией циклофосфана, а также на 4 и 8 час после введения ЛС;
- цитарабин – 75 мг/м2 внутривенно струйно в дни 31–34, включительно – 1 курс, в дни 38–41, включительно – 2 курс;
- метотрексат, цитарабин, дексаметазон в возрастной дозировке эндолюмбально в день каждого цитарабинового курса, дозы приводятся в подпункте 23.8 настоящего пункта;
23.15.4. блинатумомаб назначается 24-часовой непрерывной инфузией в дозе 5 мкг/м2/сутки до 8 дня, затем 15 мкг/м2/сутки до 28 дня.
Премедикация перед началом инфузии и перед повышением дозы: дексаметазон – 10 мг/м2 внутривенно;
23.15.5. кондиционирование перед ТГСК, и манипуляции с трансплантатом и медицинская профилактика РТПХ зависят от типа донора;
23.15.6. ПТ проводится до достижения 2-летнего срока от начала лечения:
меркаптопурин – 50 мг/м2 внутрь в один прием;
метотрексат – 30 мг/м2 внутримышечно 1 раз в неделю.
Обязательным условием проведения ПТ является своевременная коррекция доз меркаптопурина и метотрексата в зависимости от количества лейкоцитов в ОАК.
24. Шифр по МКБ-10 – С91.0 Рецидив ОЛЛ:
24.1. терапевтические группы:
S1 терапевтическая группа – пациенты с поздними изолированными внекостномозговыми рецидивами Т- и В-ОЛЛ;
S2 терапевтическая группа – пациенты с очень ранним и ранним изолированным внекостномозговым рецидивом Т- и В-ОЛЛ, пациенты с ранним и поздним комбинированным костномозговым рецидивом В-ОЛЛ, пациенты с поздним изолированным рецидивом В-ОЛЛ;
S3,S4,S5 В-ОЛЛ терапевтическая группа – пациенты с ранним изолированным костномозговым рецидивом, с очень ранним комбинированным костномозговым рецидивом, с первично-рефрактерным В-ОЛЛ;
S4 Т-ОЛЛ терапевтическая группа – пациенты с очень ранним, ранним и поздним изолированным костномозговым рецидивом, пациенты с очень ранним, ранним и поздним комбинированным костномозговым рецидивом Т-ОЛЛ.
Признаки поражения ЦНС, такие же как у пациентов первичным ОЛЛ старше 1 года и приведены в подпункте 22.3 пункта 22 настоящего клинического протокола. Рецидивы других локализаций – любые другие подозрительные проявления, такие как инфильтрация, отечность, наличие жидкости или локальные поражения. обнаруживаются соответствующими методами и должны подтверждаться биопсией. Образцы биопсии должны исследоваться морфологическими, молекулярно-биологическими методами и ИФТ;
24.2. виды ответа на лечение:
костномозговая ремиссия – репрезентативный аспират КМ содержит менее 5 % лимфобластов при удовлетворительной клеточности и признаках регенерации нормального гемопоэза;
частичная костномозговая ремиссия – бласты в КМ составляют >5 % и <25 %;
аплазия КМ – репрезентативный аспират КМ содержит только отдельные ядерные клетки (преимущественно лимфоциты) без признаков регенерации нормального гемопоэза, независимо от цитологического обнаружения резидуальных лейкемических клеток;
ПР – репрезентативный аспират КМ содержит менее 5 % лимфобластов при удовлетворительной клеточности и признаках регенерации нормального гемопоэза, и отсутствуют признаки продолжающейся персистенции лейкемических клеток в экстрамедуллярных очагах по данным цитологических, гистопатологических, радиологических и клинических методов обследования (определение лейкемических клеток ниже порога цитологической детекции с использованием молекулярных методов или проточной цитометрии совместимо с определением ПР;
24.3. условия для начала курсов химиотерапии:
нейтрофилы >0,5 х 109/л;
тромбоциты >80 х 109/л;
отсутствие системной или очаговой инфекции;
удовлетворительное состояние пациента;
фракция выброса >50 % по данным Эхо-КГ;
24.4. первичный диагностический комплекс: соответствует комплексу для пациентов с ОЛЛ старше года.
Дополнительно по медицинским показаниям могут выполняться следующие исследования:
- медицинский осмотр врача-офтальмолога, врача-оториноларинголога;
- МРТ головного мозга (при нейролейкозе);
- МРТ спинного мозга (при нейролейкозе);
- КТ ОГК, придаточных пазух носа, ОБП;
- определение антител класса IgM и IgG к цитомегаловирусу (далее – ЦМВ);
- лекарственная чувствительность лимфоцитарных клеток человека к цитостатикам;
- человеческие лейкоцитарные антигены (далее – HLA) – типирование пациента и членов его семьи (при наличии медицинских показаний к ТГСК).
Диагностические исследования на этапах терапии соответствуют исследованиям для пациентов с ОЛЛ старше года;
24.5. лечебные мероприятия:
24.5.1. пациенты S1 терапевтической группы получают:
- циторедуктивную профазу дексаметазоном;
- два индукционных курса ПХТ F1, F2;
- далее протокол II – IDA;
- курсы ПХТ R1, R2, R1;
- в случае ЦНС рецидива пациент получает дополнительное эндолюмбальное введение на день 6 курсов F1 (если бласты определяются в день 1 курс F1) и, как правило, на день 5 каждого курса R2, а также на день 8 протокола II – IDA;
- в случае тестикулярного рецидива при поражении яичек – выполняется орхэктомия в начале лечения или в течение лечения. Если клинически пораженное яичко не удалено, должно выполняться его облучение в СОД 24 Гр. В случае одностороннего клинического поражения яичка выполняется биопсия контралатерального яичка во время орхэктомии. В случае отрицательного результата биопсии непораженное яичко должно быть профилактически облучено в СОД 15 Гр. Если биопсия не выполнена или она положительная, клинически непораженное яичко облучается в СОД 1 Гр. При орхэктомии должен имплантироваться тестикулярный протез. ЛТ проводится только при изолированных ЦНС рецидивах в виде краниоспинального облучения в СОД 18 Гр;
- далее все пациенты получают ПТ в течение 12 месяцев.
Циторедуктивная профаза:
дексаметазон – 6 мг/м2 внутрь 1–5 дни.
Курс F1:
- дексаметазон – 20 мг/м2 внутрь – 15 дни;
- винкристин – 1,5 мг/м2 (макс. 2 мг) внутривенно струйно 1 и 6 дни;
- метотрексат – 1000 мг/м2 внутривенно за 36 часов в 1 день;
- кальция фолинат – 15 мг/м2 внутривенно на 42, 48, 54 час от начала введения метотрексата;
- пегаспаргаза – 1000 ЕД/м2 внутривенно капельно за 2 часа, 4 день;
- метотрексат, цитарабин, преднизолон эндолюмбально в 1 день курса (при ЦНС рецидиве дополнительно на 6 день курса), дозы приводятся в подпункте 22.9.1 пункта 22 настоящего клинического протокола.
Курс F2:
- дексаметазон – 20 мг/м2 внутрь 1–5 дни;
- винкристин – 1,5 мг/м2 (макс. 2 мг) внутривенно струйно в 1 день;
- цитарабин – 3000 мг/м2 внутривенно за 3 часа каждые 12 часов (всего 4 введения), 1, 2 дни курса. Сопроводительная терапия для медицинской профилактики кератоконъюнктивита на фоне введения циторабина описана в подпункте 22.11.2 пункта 22 настоящего клинического протокола;
- пегаспаргаза – 1000 ЕД/м2 внутривенно капельно за 2 часа, 4 день;
- метотрексат, цитарабин, преднизолон эндолюмбально, 5 день курса, дозы приводятся в подпункте 22.9.1 пункта 22 настоящего клинического протокола.
Протокол II – IDA:
1 фаза:
- дексаметазон – 6 мг/м2 внутрь 1–14 дни, с последующей ступенчатой отменой в дни с 15 по 23;
- винкристин – 1,5 мг/м2 (макс. 2 мг) внутривенно струйно 1, 8, 15, 22 дни;
- идарубицин – 6 мг/м2 внутривенно капельно за 6 часов, 1, 8, 15, 22 дни;
- пегаспаргаза – 1000 ЕД/м2 внутривенно капельно за 2 часа, 1, 11 дни;
- метотрексат, цитарабин, преднизолон эндолюмбально 1 и 15 дни курса (при ЦНС рецидиве дополнительно на 8 день курса), дозы приводятся в подпункте 22.9.1 пункта 22 настоящего клинического протокола;
2 фаза:
- меркаптопурин – 60 мг/м2 внутрь с 29 по 43 день;
- циклофосфамид – 1000 мг/м2 внутривенно 29 день;
- месна – 400 мг/м2 внутривенно струйно на 0,4,8 часы от введения циклофосфамида;
- цитарабин – 75 мг/м2 внутривенно струйно 31–34 и 38–41 дни;
- метотрексат, цитарабин, преднизолон эндолюмбально в 31 и 38 дни, дозы приводятся в подпункте 22.9.1 пункта 22 настоящего клинического протокола.
Курс R1:
- дексаметазон – 20 мг/м2 внутрь 1–5 дни;
- дексаметазон – 10 мг/м2 внутрь 6 день;
- меркаптопурин – 100 мг/м2 внутрь 1–5 дни;
- винкристин – 1,5 мг/м2 (макс. 2 мг) внутривенно струйно (за 1 час до начала метотрексата) 1 и 6 дни;
- метотрексат – 1000 мг/м2 внутривенно за 36 часов, 1 день;
- кальция фолинат – 15 мг/м2 внутривенно на 42, 48, 54 час от начала введения метотрексата;
- метотрексат, цитарабин, преднизолон эндолюмбально в 1 день, дозы приводятся в подпункте 22.9.1 пункта 22 настоящего клинического протокола;
- цитарабин – 2000 мг/м2 внутривенно капельно за 3 часа каждые 12 часов (всего 2 введения), 5 день; сопроводительная терапия для медицинской профилактики кератоконъюнктивита на фоне введения циторабина описана в подпункте 22.11.2 пункта 22 настоящего клинического протокола;
- пегаспаргаза – 1000 ЕД/м2 внутривенно за 2 часа, 6 день.
Курс R2:
- дексаметазон – 20 мг/м2 внутрь 1–5 дни;
- дексаметазон – 10 мг/м2 внутрь 6 день;
- меркаптопурин – 100 мг/м2 внутрь1–5 дни;
- винкристин – 3 мг/м2 внутривенно струйнов 1 день;
- метотрексат – 1000 мг/м2 внутривенно за 36 часов в 1 день;
- кальция фолинат – 15 мг/м2 внутривенно на 42, 48, 54 час от начала введения метотрексата;
- метотрексат, цитарабин, преднизолон эндолюмбально в 1 день (при ЦНС рецидиве дополнительно на 5 день), дозы приводятся в подпункте 25.1 пункта 25 настоящего клинического протокола;
- ифосфамид – 400 мг/м2 внутривенно за 1 час в 1–5 дни;
- месна – 200 мг/м2 внутривенно струйно на 0,4,8 часы от введения ифосфамида;
- даунорубицин – 35 мг/м2 внутривенно за 24 часа на 5 день;
- пегаспаргаза – 1000 ЕД/м2 внутривенно за 2 часа в 6 день.
ПТ:
- меркаптопурин – 50 мг/м2 внутрь ежедневно;
- метотрексат – 20 мг/м2 внутрь 1 раз в неделю;
24.5.2. пациенты S2 терапевтической группы получают:
циторедуктивную профазу дексаметазоном;
2 индукционных курса F1, F2.
В дальнейшем терапия зависит от уровня МОБ, измеряемой ИФТ и (или) молекулярно-биологическим методами.
При достижении МОБ-негативной ремиссии (уровень <10–3) после курса F2 дальнейшая терапия состоит в назначении протокола II – IDA и затем пяти курсов R, начиная с R1 (R1/R2/R1/R2/R1).
Схемы курсов F1, F2, R1, R2, протокола II – IDA для пациентов S1 терапевтической группы, описаны в подпункте 24.5.1 настоящего пункта.
Локальное лечение в случае тестикулярного рецидива описано в подпункте 24.5.1 настоящего пункта для пациентов S1 терапевтической группы.
ЛТ для пациентов с изолированными костномозговыми рецидивами: облучение нейрокраниума и верхних трех шейных сегментов в СОД 12 Гр.
ЛТ для пациентов с комбинированными костномозговыми рецидивами: облучение черепа и верхних трех шейных сегментов в СОД 18 Гр.
Если предыдущая доза облучения составила 18 Гр (15 Гр у детей в возрасте младше 2 лет), доза облучения уменьшается до 15 Гр. Если интервал после первого курса ЛТ короче 24 месяцев и предыдущая доза облучения составила 15 Гр (12 Гр для детей младше 2 лет), доза облучения уменьшается до 15 Гр.
Далее – ПТ в течение 24 месяцев. Схема ПТ описана для пациентов S1 терапевтической группы в подпункте 24.5.1 настоящего пункта.
При положительном результате МОБ (уровень >10–3) после курса F2 пациент получает протокол II – IDA с повторным контролем МОБ. При уровне МОБ <10–3 пациент далее получает курсы R1,R2 и аллоТГСК.
Схемы курсов R1, R2, протокола II – IDA описаны для пациентов S1 терапевтической группы в подпункте 24.5.1 настоящего пункта.
При уровне МОБ >10–3 после протокола II – IDA пациент получает блинатумомаб (с предварительным аферезом аутолимфоцитов) и последующую аллоТГСК. Количество курсов блинатумомаба (1–2) зависит от скорости достижения уровня МОБ <10–3.
Курс блинатумомаба (28 дней) назначается круглосуточной непрерывной инфузией в течение 28 дней детям, МТ до 45 кг – 5 мкг/м2/сутки до 8 дня, затем 15 мкг/м2/сутки до 28 дня. Детям МТ больше 45 кг – 9 мкг/сутки до 8 дня и 28 кг/сутки до 28 дня.
Блинатумомаб назначается еженедельными инфузиями аутолимфоцитов (№ 4);
24.5.3. терапия пациентов S3, S4, S5 В-ОЛЛ терапевтической группы:
аферез аутолимфоцитов;
циторедуктивная фаза метилпреднизолоном – 60 мг/м2 внутрь или внутривенно в дни 1–5;
курс FLAI:
флударабин* – 30 мг/м2 внутривенно 1–5 дни;
цитарабин – 1000 мг/м2 внутривенно 1–5 дни;
идарубицин – 8 мг/м2 внутривенно 2–4 дни;
преднизолон – 60 мг/м2 внутрь 1–5 дни;
метотрексат, цитарабин, преднизолон эндолюмбально в 6 день, дозы приводятся в подпункте 22.9.1 пункта 22 настоящего клинического протокола;
или курс CLOFI:
клофарабин – 52 мг/м2 внутривенно 1–5 дни;
цитарабин – 1000 мг/м2 внутривенно 1–5 дни;
идарубицин – 8 мг/м2 внутривенно 2–4 дни;
преднизолон – 60 мг/м2 внутрь 1–5 дни;
метотрексат, цитарабин, преднизолон эндолюмбально в 6 день, дозы приводятся в подпункте 22.9.1 пункта 22 настоящего клинического протокола.
Измерение уровня МОБ ИФТ или молекулярно-генетическим методом.
Курс блинатумомаба (28 дней) с еженедельными инфузиями аутолимфоцитов (№ 4). Схема назначения блинатумомаба описана для пациентов S2 терапевтической группы в подпункте 24.5.2 настоящего пункта.
Повторное измерение уровня МОБ ИФТ или молекулярно-генетическим методом.
При уровне МОБ >10–3 проводится второй курс блинатумомаба с еженедельными инфузиями аутолимфоцитов (№ 4).
Очередное измерение уровня МОБ. При уровне МОБ >10–3 – переход на индивидуальный план терапии. При МОБ <10–3 – проведение аллоТГСК.
Дополнительные методы терапии: для пациентов старше 18 лет по решению врачебного консилиума может быть использовано ЛС инотузумаб озогамицин** (вместо блинатумомаба). Вместо блинатумомаба по решению врачебного консилиума может быть проведена CAR-T терапия;
24.5.4. терапия пациентов S4 Т-ОЛЛ терапевтической группы:
пациенты стратифицируются по иммунофенотипу на 2 группы:
ранний Т-ОЛЛ (Т I–II);
поздний Т-ОЛЛ (Т III–IV).
Группа раннего Т-ОЛЛ:
протокол N (1 фаза – 22 дня):
пегаспаргаза – 1000 ЕД/м2 внутривенно за 2 часа 1, 15 дни;
идарубицин – 6 мг/м2 внутривенно капельно за 6 часов, 1, 8, 15, 22 дни;
бортезомиб* – 1,3 мг/м2 внутривенно струйно 1, 4, 8, 11 дни;
винорелбин* – 25 мг/м2 внутривенно струйно 1, 8, 15, 22 дни;
преднизолон – 60 мг/м2 внутрь 1–8 и с 15 по 21 дни с последующей быстрой отменой;
метотрексат, цитарабин, преднизолон в возрастной дозировке эндолюмбально в 1, 8, 15, 22 дни, дозы приводятся в подпункте 22.9.1 пункта 22 настоящего клинического протокола;
курс CLOFI описан в подпункте 24.5.3 настоящего пункта;
дополнительно: по решению врачебного консилиума может быть использован вместо клофорабина неларабин*;
курс FLA:
флударабин* – 30 мг/м2 внутривенно 1–5 дни;
цитарабин – 1000 мг/м2 внутривенно 1–5 дни;
преднизолон – 60 мг/м2 внутрь 1–5 дни;
метотрексат, цитарабин, преднизолон в возрастной дозировке эндолюмбально на 6 день, дозы приводятся в подпункте 22.9.1 пункта 22 настоящего клинического протокола.
Группа позднего Т-ОЛЛ:
протокол N (1 фаза до 11 дня):
пегаспаргаза – 1000 ЕД/м2 внутривенно за 2 часа день 1;
идарубицин – 6 мг/м2 внутривенно капельно за 6 часов 1, 8 дни;
бортезомиб* – 1,3 мг/м2 внутривенно струйно 1, 4, 8, 11 дни;
винорелбин* – 25 мг/м2 внутривенно струйно 1, 8 дни;
преднизолон – 60 мг/м2 внутрь 1–8 дни с последующей быстрой отменой;
метотрексат, цитарабин, преднизолон в возрастной дозировке эндолюмбально в 1, 8 дни, дозы приводятся в подпункте 22.9.1 пункта 22 настоящего клинического протокола;
курс CLOFI описан в подпункте 24.5.3 настоящего пункта.
Измерение уровня МОБ ИФТ или молекулярно-биологическим методом. При уровне МОБ >10–3 – переход на индивидуальный план терапии. При МОБ <10–3 – проведение аллоТГСК.
Пациенты с рецидивом Ph+ОЛЛ получают терапию согласно плана для их терапевтической группы (S2–S5). К лечению (на весь период) добавляется иматиниб 300 мг/м2 в сутки внутрь либо нилотиниб* 240 мг/м2 в сутки внутрь (в зависимости от наличия мутации). Дополнительно при наличии медицинских показаний по решению врачебного консилиума может использоваться дазатиниб***.
25.1. ФАБ классификация ОМЛ приведена в приложении 10. Иммунологические маркеры, характерные для разных морфоцитохимических вариантов ОМЛ приведены в приложении 11.
Стратификация на группы риска:
25.2. критерии оценки ответа на лечение:
25.3. условия для начала курса химиотерапии и ЛТ после достижения ремиссии:
25.4. первичный диагностический комплекс для ОМЛ: соответствует первичному при ОЛЛ и описан в подпункте 22.6 пункта 22 настоящего клинического протокола.
Дополнительно к этому КТ (МРТ) головного мозга при установлении диагноза (детям до 2 лет).
Для пациентов ImRG и HRG HLA – типирование (по первому классу) пациента, родителей, сиблингов.
Для пациентов IMRG – определение экспрессии KIR-рецепторов у гаплоидентичного донора для определения аллореактивности.
На этапах терапии необходимые исследования выполняются в следующем порядке:
25.5. лечебные мероприятия:
25.5.1. ОМЛ, SRG с inv 16:
индукционная терапия для пациентов с inv(16):
консолидация ремиссии I для пациентов с inv(16):
консолидация ремиссии III для пациентов с inv (16):
После окончания консолидации III (не ранее, чем через 1 месяц) с соблюдением критериев для начала проводится краниальное облучение СОД 18 Гр.
Во время ЛТ на 0(1) день вводится эндолюмбально цитарабин в возрастной дозе (согласно индукционной терапии);
25.5.2. ОМЛ, SRG без inv16:
фаза 2:
консолидация ремиссии I:
- сопроводительная терапия для медицинской профилактики кератоконъюнктивита на фоне введения циторабина описана в подпункте 22.11.2 пункта 22 настоящего клинического протокола;
консолидация ремиссии II:
консолидация ремиссии III:
25.5.3. ОМЛ, ImRG, кроме пациентов с (t 9;11):
индукционная терапия:
фаза 1:
фаза 2:
консолидация ремиссии I:
консолидация ремиссии II:
консолидация ремиссии III:
25.5.4. ОМЛ, ImRG, пациенты с (t 9;11):
индукционная терапия:
фаза 1:
фаза2:
консолидация ремиссии I:
консолидация ремиссии II:
Дополнительно: перевод в HRG с проведением ТГСК при отсутствии морфологической ремиссии после проведения индукционной терапии (двух фаз);
25.5.5. ОМЛ, HRG:
фаза 1:
фаза 2:
Количество получаемых курсов консолидации зависит от уровня МОБ, определяемой методом проточной цитометрии после проведения двойной индукции:
консолидация ремиссии I:
Пациенты с мутацией FLT3 после окончания двух курсов индукции получают сорафениб** 400 мг/м2/сутки внутрь. Пациенты получают 21-дневные курсы сорафениба** после каждого курса ПХТ, а также ПТ после ТГСК начиная с +30 суток до 3 лет.
При отсутствии сорафениба** пациенты получают другие ингибиторы тирозинкиназ.
Режимы кондиционирования перед ТГСК зависят от типа донора и включают:
При резистентных формах ОМЛ пациентам показано проведение индивидуальных схем ПХТ согласно решению врачебного консилиума.
Схемы могут включать следующие ЛС: венетоклакс*, децитабин**, вориностат*, 5-азацитидин, клофарабин, этопозид, тиотепа*, мидостаурин**;
25.5.6. рецидив ОМЛ:
Всем пациентам после двух индукционных курсов показано выполнение аллоТГСК от идентичного или гаплоидентичного донора (родственного или неродственного). При отсутствии возможности проведения аллоТГСК на данном этапе показано проведение дальнейшей ПХТ – консолидация высокой или низкой интенсивности (в зависимости от состояния пациента). При наличии идентичного донора и технической возможности проведения аллоТГСК – немедленное проведение трансплантации;
консолидация высокой интенсивности:
консолидация низкой интенсивности:
При резистентных формах ОМЛ пациентам показано проведение индивидуальных схем ПХТ согласно решению врачебного консилиума (согласно HRG).
26. Шифр по МКБ-10 – С92.4 ОПЛ:
26.1. классификация ОПЛ описана в приложении 12;
26.2. стратификация на группы риска:
Критерии определения инициальной группы риска для пациентов ОПЛ на основании инициальных анализов периферической крови:
Показатели числа тромбоцитов и коагулограммы определяют риск тяжелых ранних осложнений и смерти от геморрагического синдрома. Окончательное определение группы риска проводится по результатам исследования транскрипта (состояние МОБ) перед началом ПТ;
26.3. критерии оценки ответа на лечение:
Резистентность определяется как наличие >5 % лейкемических промиелоцитов на 45 день от начала терапии;
26.4. условия для начала курсов ПХТ и ЛТ после достижения ремиссии:
На этапах терапии необходимые исследования выполняются в следующем порядке:
Любые другие исследования лабораторные и интрументальные, а также консультации узких специалистов выполняются на любом этапе терапии при наличии медицинских показаний;
26.6. лечебные мероприятия:
консолидация ремиссии (начало при восстановлении ОАК после индукции):
интенсификация ремиссии:
ЦНС терапия:
Дозы эндолюмбальных цитостатиков:
ПТ:
Доза меркаптопурина и метотрексата модифицируется на 25–50 % в зависимости от количества лейкоцитов;
дополнительная терапия:
отсутствие молекулярной ремиссии после курса интенсификации:
27. Шифр по МКБ-10 – С92.1 Хронический миелоидный лейкоз:
27.1. классификация:
27.2. критерии диагностики фазы ХМЛ (рекомендации European Leukemia Net, 2006 г.):
27.3. обязательными диагностическими мероприятиями при установлении диагноза являются:
27.5. дополнительными диагностическими мероприятиями (по медицинским показаниям) являются:
27.6. общие принципы лечения:
Стандартом лечения является терапия ИТК.
Решение о проведении ТГСК пациентам с впервые установленным диагнозом ХФ ХМЛ должно приниматься с учетом следующих факторов: доступности непрерывного лечения ИТК, наличия сопутствующей патологии, наличия возможности регулярного мониторинга эффективности терапии ИТК и возможности адекватного ведения пациента в посттрансплантационном периоде.
Критерии ответа на лечение:
Варианты ответа на лечение иматинибом приведены в приложении 13;
ХФ:
ФА:
БК:
27.8. дополнительные лечебные мероприятия:
28. Шифр по МКБ-10 – D46 МДС:
28.1. сравнительная характеристика МДС у молодых взрослых и детей представлена согласно приложению 14.
ПР – состояние кроветворной ткани, при котором гемоглобин >110,0 г/л, нейтрофилы >1,0 х 10/л, бластные клетки отсутствуют, тромбоциты >100,0 х 10/л, бластные клетки в КМ <5 %, возможна персистирующая дисплазия.
Прогрессия заболевания – увеличение количества бластных клеток более чем на 50 % и переход из первоначального варианта МДС в более продвинутый, при этом в анализах крови может отмечаться снижение показателей на 50 % от максимальных значений и снижение гемоглобина более чем на 20 г/л, появление трансфузионной зависимости. При стабильных показателях бластных клеток усугубление цитопении также является признаком прогрессии заболевания.
Рецидив после ПР – увеличение количества бластных клеток >5 %; снижение на 50 % и более числа тромбоцитов и нейтрофилов от максимальных значений во время ремиссии; снижение показателей гемоглобина на 15 г/л и более, появление трансфузионной зависимости от эритроцитсодержащих компонентов.
Стабилизация – отсутствие частичной ремиссии (далее – ЧР), но нет признаков прогрессирования в течение более 8 недель. Трансформация или прогрессия – в ХМЛ констатируется при обнаружении в пунктате КМ или периферической крови более 20 % бластных клеток.
Цитогенетическая ремиссия – это полная клинико-гематологическая ремиссия, при этом цитогенетическими методами не выявляются исходные аномалии кариотипа; кариотип должен быть нормальным. Уменьшение количества клеток с хромосомными нарушениями минимум на 50 % оценивается как ЧЦО.
ЧР – те же критерии, что и для ПР, однако бластные клетки в КМ составляют более 5 %;
28.2. ключевые факторы, лежащие в основе развития МДС у детей:
28.3. классификация МДС у детей (ВОЗ, 2016 г.):
МДС. Низкий риск:
МДС. Высокий риск:
28.4. критерии постановки диагноза:
рефрактерная цитопения детского возраста:
РАИБ:
Диагноз МДС устанавливается на основании следующих критериев:
необходимые критерии:
решающие критерии:
Диагноз устанавливается при наличии всех необходимых критериев и не менее чем 1 из решающих критериев. При отсутствии решающих критериев подтверждением диагноза МДС может служить любой из дополнительных критериев.
Дополнительные критерии:
28.5. дифференциальная диагностика:
28.6. обязательными диагностическими мероприятиями при установлении диагноза являются:
28.7. дополнительными диагностическими мероприятиями (по медицинским показаниям) являются:
28.8. обязательные лечебные мероприятия:
28.9. дополнительные лечебные мероприятия:
Некоторые пациенты с предшествующим МДС и количеством бластных клеток от 20 до 29 % в действительности демонстрируют клиническое течение, более похожее на МДС, чем на ОМЛ.
29.1. гистологическая классификация (классификация опухолей лимфоидной ткани ВОЗ, 2016 г.):
29.2. стадирование:
Экстралимфатическое (экстранодальное) проявление – поражение нелимфатических структур и тканей, обозначается символом Е.
Классификация по стадиям (TNM, 8-е издание):
При установлении окончательного диагноза обязательно указываются стадия, морфологический вариант опухоли, перечисляются все зоны лимфатического поражения, зона массивного поражения (bulky disease), наличие или отсутствие В – симптомов, вовлечение селезенки и экстранодальных областей;
29.4. оценка эффективности терапии:
29.5. критерии для начала курса ПХТ:
29.6. диагностика:
Дополнительно при наличии медицинских показаний могут выполняться следующие исследования и консультации: оценка функции внешнего дыхания; гормонального статуса; УЗИ щитовидной железы; исследование уровня креатинина в моче; МРТ с болюсным внутривенным контрастным усилением; тест на наличие беременности, если женщина находится в детородном возрасте; консультации узких специалистов; основная панель ИГХ может дополняться антителами к антигенам CD45, CD23, CD10, ОСТ – 2, ВОВ – 1, ЕМА, bcl – 6, ALK, CD79a, CD3, MUM1, CD68, CD57 и др.
На этапах терапии выполняются следующие диагностические мероприятия:
терапевтическая группа 2 (далее – ТГ-2):
терапевтическая группа 3 (далее – ТГ-3):
терапевтическая HRG:
29.7. обязательные лечебные мероприятия:
Дополнительные лечебные мероприятия: криоконсервация спермы мальчиков постпубертатного возраста перед началом химиотерапии;
Дополнительные лечебные мероприятия:
ЛТ на зоны поражения в СОД 20 Гр.
Дополнительные лечебные мероприятия:
терапевтическая HRG – IVA или B стадия:
ABVD:
Перерыв между курсами 2 недели. Начало следующего курса на 29-й день после начала предшествующего курса лечения.
После проведения 4-х курсов ПХТ выполняется ПЭТ-КТ с 18 – ФДГ: при критерии DS 4–5 проводится еще 2 курса ПХТ по схеме BEACOPP – escalated. При критерии DS 1,2,3 проводится 2 курса ПХТ по схеме ABVD.
ЛТ на зоны поражения в СОД 20 Гр. (+10 Гр локально на остаточную опухоль при DS4,5 по данным ПЭТ после окончания этапа ПХТ).
Дополнительные лечебные мероприятия: по медицинским показаниям, по решению врачебного консилиума может использоваться протонная ЛТ;
29.8. лимфома Ходжкина. Рецидив. Первично резистентное течение (пациенты, не достигшие ПР после терапии первой линии или с прогрессированием в ходе лечения):
Диагностические исследования на этапах терапии описаны в подпункте 29.6 настоящего пункта согласно терапевтической группе:
29.8.1. обязательные лечебные мероприятия:
IEP:
Перерыв между курсами 2 недели. Начало следующего курса на 22-й день после начала предшествующего курса лечения;
ВДХТ перед аутоТГСК по схеме BEAM, CEAM:
При первично-резистентном течении лимфомы Ходжкина, рецидиве после аутоТГСК может проводиться ПХТ по схеме ВВ:
Пациентам с первично-резистентным течением лимфомы Ходжкина, неблагоприятным прогнозом, после аутоТГСК проводится ПТ брентуксимаб ведотином в режиме 1,8 мг/кг внутривенно каждые 3 недели. Всего 6 введений.
При рецидиве после аутоТГСК, в качестве «терапии спасения» может проводиться ПХТ по схемам IGEV, ICE:
IGEV:
Интервал между курсами 3 недели;
ICE:
ЛТ на зоны поражения в СОД 20 Гр;
30. Шифры по МКБ-10: С82–85 Неходжкинская лимфома:
30.1. классификация:
30.1.1. основные варианты НХЛ у пациентов детского возраста:
В-клеточные:
30.1.2. стадирование проводится в соответствии с пересмотренной международной системой стадирования НХЛ у детей:
стадия I: одиночная опухоль, кроме локализации в средостении и брюшной полости (N-nodal, ЛУ; EN – extranodal, экстанодальная; B – bone, кость или S – skin, кожа: EN-B, EN-S);
стадия II: одиночная экстранодальная опухоль с вовлечением региональных ЛУ; две зоны ЛУ по одну сторону от диафрагмы; первичная опухоль ЖКТ (обычно в илеоцекальной области) с или без вовлечения региональных мезентериальных ЛУ, полностью удаленная (при наличии асцита с атипичными клетками или при распространении опухоли на соседние структуры и органы расценивать как стадия III);
стадия III: >две экстранодальные опухоли (включая EN-B или EN-S) выше и (или) ниже диафрагмы; >две зоны ЛУ по обе стороны от диафрагмы; все внутригрудные опухоли (поражение органов средостения, парамедиастинальных структур, легких, плевры, тимуса); внутрибрюшные и забрюшинные опухоли, в том числе с поражением печени, селезенки, почек и (или) яичников, независимо от степени резекции (за исключением первичной опухоли ЖКТ (обычно в илеоцекальной области) с или без вовлечения региональных мезентериальных ЛУ, полностью удаленной); любая параспинальная или эпидуральная опухоль, независимо от наличия и локализации других очагов; одиночный очаг в кости при наличии другого экстранодального очага и (или) вовлечении отдаленных ЛУ;
стадия IV: опухоль любой локализации при наличии признаков поражения ЦНС (стадия IV ЦНС), КМ (стадия IV КМ), или сочетанного поражения (стадия IV КМ+ЦНС), выявленных традиционными методами диагностики;
Поражение КМ: морфологически >5 % бластов или обнаружение лимфомных клеток в КМ. При обнаружении опухолевых клеток в КМ и (или) ПК только методами ПЦР/FISH (минимальная диссеминированная болезнь (далее – МДБ) положительная) стадия IV не выставляется. При выявлении в КМ более 25 % опухолевых клеток (лимфобластов в случаях НХЛ из предшественников) заболевание определяется как ОЛЛ, при морфологии L3 (по ФАБ классификации) как В – клеточный острый лейкоз (В-ОЛ или лейкоз Беркитта).
Инициальное поражение ЦНС диагностируется при следующих показателях: бласты или клетки лимфомы в СМЖ (цитологически);
образования в головном мозге и (или) в мозговой оболочке по данным КТ (МРТ); парезы и (или) параличи черепно-мозговых нервов даже при отсутствии опухолевых клеток в ликворе и внутримозговых образований по данным КТ и (или) МРТ; поражение глаз и зрительных нервов;
30.1.3. группы риска:
группы риска для лимфобластных НХЛ:
30.2. критерии ответа:
30.2.1. критерии достижения ремиссии при лечении лимфобластной лимфомы из Т- и В-предшественников:
30.2.2. критерии определения ответа для зрелоклеточных В-НХЛ/В-ОЛ:
Тактика оценки эффекта терапии: после 2-го курса; после 4-го курса; после 6-го курса;
30.3. условия для начала курса химиотерапии:
При отсутствии этих условий пациент переходит в HRG: отсутствие тяжелой инфекции; нормальный уровень креатинина крови; лейкоциты не менее 2,0 х 109/л, гранулоциты не менее 0,5 х 109/л, тромбоциты не менее 50 х 109/л.
Протокол М: отсутствие тяжелой инфекции; нормальный КЭК; АлАТ и (или) АсАТ не превышают 5 нормальных значений, билирубин не превышает 3 нормальных значений; лейкоциты не менее 1,5 х 109/л, гранулоциты не менее 0,5 х 109/л, тромбоциты не менее 50 х 109/л.
Любой HR: отсутствие тяжелой инфекции; нормальный уровень креатинина крови; АлАТ и (или) АсАТ не более нормальных значений, билирубин не более 3 нормальных значений; гранулоциты не менее 2,0 х 109/л.
30.4. НХЛ из В или Т-клеток-предшественников, III и IV стадии, ImRG:
Дополнительно по медицинским показаниям могут быть назначены: КТ и (или) МРТ головного мозга и спинного мозга; эзофагогастродуоденоскопия (далее – ЭГДС); колоноскопия; медицинские осмотры узких специалистов (медицинский осмотр врача- отоларинголога, врача – стоматолога детского, врача-офтальмолога), молекулярно- биологическое исследование препаратов КМ при поражении КМ; ПЭТ-КТ с 18 – ФДГ;
на этапах терапии проводятся следующие исследования:
30.5. обязательные лечебные мероприятия при НХЛ из В/Т-клеток- предшественников, 3 и 4 стадии, ImRG:
- винкристин – 1,5 мг/м2 (макс. 2 мг), внутривенно, 8, 15, 22, 29 дни;
30.6. НХЛ из В/Т-клеток-предшественников, 1–4 стадии, SRG, ImRG, HRG. ПТ:
30.6.1. диагностические исследования на ПТ:
дополнительные:
30.6.2. ПТ начинается через 2 недели после окончания протокола II, продолжительность до 24 месяцев от начала протокола I (около 18 месяцев после окончания протокола II):
Доза ЛС зависит от числа лейкоцитов крови:
30.7. НХЛ из В/Т-клеток-предшественников, HRG:
30.7.1. первичный диагностический комплекс:
Условия для начала любого курса HR:
курс HR 1:
метотрексат, цитарабин, преднизолон эндолюмбально через 2 часа после начала введения метотрексата внутривенно в зависимости от возраста:
курс HR2:
курс HR3:
30.7.3. НХЛ из В/Т-клеток-предшественников, 1 и 2 стадии, SRG:
30.8. B-НХЛ:
30.8.1. B-НХЛ, I стадия и II резецированная (далее – R) стадия. 1 группа риска:
обязательные лечебные мероприятия:
30.8.2. B-НХЛ II нерезецированная стадия вне зависимости от ЛДГ, 3 стадия (при увеличении ЛДГ не более чем в 2 раза от нормы). 2 группа риска:
обязательные лечебные мероприятия:
курс А1:
Ритуксимаб* (375 мг/м2 внутривенно за 6 часов) на 14 день после первого введения, вне зависимости от лабораторных показателей;
курс В1:
курс А2:
курс В 2:
Курсы АА, ВВ, СС, ICE и кондиционирование описаны в подпункте 30.8.3 настоящего пункта;
30.8.3. B-НХЛ (кроме первичной медиастинальной В-крупноклеточной лимфомы). Стадия 3 (при увеличении ЛДГ более чем в 2 раза от нормы), стадия 4. В-ОЛЛ с экстрамедуллярными очагами. 3 группа риска:
обследование на этапах терапии:
обязательные лечебные мероприятия – 3 группа риска:
При наличии образования в головном мозге показана имплантация резервуара Оммайя после 1 курса А1 или позже;
При отсутствии резервуара Оммайя – метотрексат, цитарабин, преднизолон вводятся эндолюмбально на 2, 4, 6 день по 1/3 стандартной возрастной дозы;
курс АА:
курс ВВ:
курс СС:
курс ICE:
кондиционирование:
Лечение рецидивирующей или рефрактерной агрессивной зрелой В-клеточной НХЛ представляет сложную проблему, несмотря на использование терапии второй линии (R-ICE, R-VICI), повторную ремиссию удается получить у немногих пациентов, как правило, очень краткосрочную. В случае неэффективности терапии второй линии, может быть рассмотрен вопрос о назначении врачебным консилиумом экспериментальной иммунотерапии (Car-t-терапия, NK-клеточная терапия). При достижении ремиссии – ТГСК;
30.8.4. В-ОЛЛ без экстрамедуллярных поражений:
обязательные лечебные мероприятия:
30.9. первичная медиастинальная В-крупноклеточная лимфома, диффузная В-крупноклеточная лимфома серой зоны средостения:
обязательные лечебные мероприятия:
R-EPOCH:
При отсутствии серьезных осложнений протокол предполагает повышение доз цитостатиков в последующих курсах:
В случае неэффективности терапии второй линии, может быть рассмотрен вопрос врачебным консилиумом о назначении экспериментальной иммунотерапии (CAR-T- клеточная терапия, NK-клеточная терапия, ингибиторы иммунных контрольных точек);
30.10. анапластическая крупноклеточная (Т/О-клеточная) лимфома:
30.10.1. анапластическая крупноклеточная (Т/О-клеточная) лимфома группа низкого риска (опухоль полностью удалена):
курс АМ:
курс ВМ:
30.10.2. анапластическая крупноклеточная (Т/О-клеточная) лимфома. ImRG (стадия I–III при отсутствии критериев высокого риска):
обследования на этапах терапии те же (группа низкого риска) за исключением:
ImRG:
30.10.3. анапластическая крупноклеточная лимфома. Изолированное поражение кожи:
обязательные лечебные мероприятия:
30.10.4. анапластическая крупноклеточная лимфома. HRG (отличный от классического гистологический вариант и (или) CD8+, IV стадия, NPM/ALK в КМ или крови >10 копий/104 ABL). NPM/ALK – рекомбинантный белок:
курс brentBB:
курс лок brentAA:
анапластическая крупноклеточная лимфома с инициальным поражением ЦНС:
интратекально или интравентрикулярно: на курсах ААz и ВВz введение метотрексата и преднизолона в 1, 2, 3, 4 дни, цитарабина на 5 сутки;
при отсутствии резервуара Оммайя:
Рецидивы заболевания чувствительны к повторной ПХТ (ICM, СС, CVA, ICE, винбластин) с последующей ТГСК при достижении ремиссии. В случае отсутствия ответа на 2-ю линию терапии, невозможности проведения интенсивной ПХТ, может быть рассмотрен вопрос о назначении врачебным консилиумом таргетной терапии (антиСД30 антитела (брентуксимаб ведотин), ингибиторы ALK (кризотиниб, алектиниб).
31. Шифры по МКБ-10: С71.0–71.9 Низкозлокачественные глиомы:
31.1. гистологическая классификация опухолей ЦНС:
другие астроцитарные опухоли:
нейрональные и смешанные нейронально-глиальные опухоли:
диффузные астроцитарные и олигодендроглиальные опухоли:
31.2. критерии оценки ответа на лечение:
31.3. условия для начала курса химиотерапии и ЛТ:
31.4. обязательные диагностические мероприятия при установлении диагноза:
31.5. обязательные диагностические мероприятия перед курсом химиотерапии или ЛТ:
диагностический комплекс включает блок А (за исключением анамнеза), блок Б (за исключением коагулограммы (назначается по медицинским показаниям), определение антител к ВИЧ в крови, комплекса исследований для диагностики сифилиса, определение антигенов и антител к вирусу гепатита В, С (HbsAg, a/HBcor tot, a/HCV), блок В (за исключением УЗИ ОБП и сердца, которые выполняются по медицинским показаниям) и специализированные диагностические мероприятия:
31.6. дополнительные диагностические мероприятия (по медицинским показаниям):
лабораторные исследования:
инструментальные методы обследования:
31.7. обязательные лечебные мероприятия:
общие принципы лечения:
системная ПХТ:
консолидация:
локальная ЛТ:
31.8. дополнительные лечебные мероприятия:
32. Шифры по МКБ-10: С71.0–71.9 Медуллобластома. Пинеобластома. Эпендимома:
32.1. гистологическая классификация опухолей нервной системы (ВОЗ, 2016 г.):
32.2. классификация по Chang (применима для медуллобластомы):
32.3. критерии ответа:
32.4. условия для начала курса химиотерапии и ЛТ:
32.6. обязательные диагностические мероприятия перед курсом химиотерапии или ЛТ:
32.7. дополнительные диагностические мероприятия (по медицинским показаниям):
лабораторные исследования:
инструментальные методы обследования:
32.8. обязательные лечебные мероприятия:
общие принципы лечения:
метотрексат – 8 мг эндолюмбально или интравентрикулярно в 1 день (только пациентам с десмопластической и десмопластической с выраженной нодулярностью медуллобластоме). Перерыв 14 дней;
Перерыв между циклами SKK 21 день;
Перерыв между модифицированными циклами SKK 21 день;
цикл интенсивной индукции:
курс ПХТ карбоплатин/этопозид, 96-часовая инфузия:
32.9. дополнительные лечебные мероприятия:
33. Шифры по МКБ-10: С71.0–71.9 Анапластическая астроцитома. Глиобластома:
33.1. гистологическая классификация опухолей нервной системы (ВОЗ, 2016 г.):
33.2. критерии ответа:
33.3. условия для начала курса химиотерапии и ЛТ:
33.4. обязательные диагностические мероприятия при установлении диагноза:
33.5. обязательные диагностические мероприятия перед курсом химиотерапии или ЛТ:
33.6. дополнительные диагностические мероприятия (по медицинским показаниям):
33.7. обязательные лечебные мероприятия:
общие принципы лечения:
системная ПХТ:
цикл ПХТ SKK включает 4 курса ПХТ:
кальция фолинат – 15 мг/м2 внутривенно струйно каждые 6 часов 6 раз старт с 42 часа от начала инфузии метотрексата. Перерыв 14 дней;
метотрексат – 8 мг эндолюмбально или интравентрикулярно в 1 день (только пациентам с десмопластической и десмопластической с выраженной нодулярностью медуллобластоме).
Перерыв между циклами SKK 21 день;
33.8. дополнительные лечебные мероприятия:
34. Шифры по МКБ-10: С38, С47, С48, С74, С76 Нейробластома. Ганглионейробластома:
34.1. классификация по стадиям:
Мультифокальная первичная опухоль (т.е. билатеральная надпочечниковая первичная опухоль) должна стадироваться в соответствии с наибольшим распространением болезни, как определено выше и следовать с сабскриптом «М» (т.е. стадия 3 м);
международная система стадирования при нейробластоме, основанная на анализе факторов риска при визуализации (INRGSS):
34.2. терапевтические группы риска при нейробластоме:
34.3. критерии оценки ответа на терапию у пациентов с нейробластомой представлены согласно приложению 15;
34.4. условия для начала курсов химиотерапии:
Если эти критерии не были достигнуты, начало курса ПХТ откладывается. Если задержка превышает 7 дней или имеет место течение инфекционного эпизода >III степени тяжести (шкала CTSAE 5.0) дозы ЛС в последующем цикле модифицируются;
34.5. нейробластома. Ганглионейробластома. Группа медицинского наблюдения (низкий риск):
первичный диагностический комплекс блок А, к блоку Б добавляется:
дополнительно по медицинским показаниям:
Другие исследования могут быть отложены, если ребенок в хорошем клиническом состоянии, но должны быть выполнены в возрасте 3 месяцев в случае сохранения объемного образования перед какой-либо противоопухолевой терапией;
обследование на этапах терапии:
обязательные лечебные мероприятия:
дополнительные лечебные мероприятия:
Расчет доз ЛС для новорожденных и детей младшего возраста (дети младше 12 месяцев и дети с МТ <10 кг):
Интервал между первым днем 1 курса и первым днем последующего курсами составляет 21 день.
Число таких курсов ПХТ может быть до 4. После проведения курса ПХТ оценивается состояние ребенка. При установлении контроля над симптомами, пациент продолжает медицинское наблюдение до 2-летнего возраста (при возрасте на момент диагностики менее 1 года) или 12 месяцев при возрасте на момент диагностики 1 год и более. Пациентам старше 18 месяцев с установленным диагнозом нейробластомы 1–3, 4S стадий при констатации трансформации в 4 стадию показано проведение интенсивной ПХТ в рамках рекомендаций для пациентов HRG;
34.6. нейробластома. Группа среднего риска:
обследования на этапах терапии:
обязательные лечебные мероприятия:
Начало каждого курса ПХТ на 21 день от предыдущего курса.
Решение вопроса об объеме повторной операции. Объем операции (биопсия, резекция, тотальная резекция) зависит от степени хирургического риска для ребенка и может быть выполнена после 4–6 курса ПХТ.
Цель операции – удаление опухоли и оценка посттерапевтического патоморфоза в опухолевой ткани.
Затем проводится 4 курса ПХТ N 7;
Степень активности определяется: по данным постоперационного патоморфоза, наличии активной специфической ткани, по данным сцинтиграфии с МИБГ меченым I123, увеличение размеров опухоли по КТ или МРТ;
34.7. нейробластома. HRG и группа ультравысокого риска:
Второй цикл ТВД будет вводиться в той же дозе 21–28 дней с начала первого цикла при условии, что:
Младенцам и детям с МТ ниже 12 кг химиопрепараты должны дозироваться в соответствии с их МТ в кг вместо площади поверхности тела (м2) в соответствии с известной формулой 30 кг = 1 м2:
У грудных детей МТ <5 кг рекомендуется снизить дозу в 1/3 раза.
В качестве иммунотерапии после ТКМ решением врачебного консилиума может быть назначен:
При рецидиве локальном у пациента из группы медицинского наблюдения рассматривается программа терапии по промежуточной группе риска. При рецидиве у пациента из ImRG, либо рецидиве/прогрессии заболевания из высокой группы риска рассматривается следующий поход к лечению.
Терапия второй линии 2 курса N8 и 2 курса ICE. При наличии ответа – операция по удалению остаточной опухоли, I131 МИБГ терапия (при наличии технической возможности, активной остаточной опухоли и заготовленной ПСК), далее повторная аутоТГСК.
При отсутствии ответа или прогрессии болезни – паллиативная терапия:
По решению врачебного консилиума на второй и третьей линиях терапии возможно назначение следующих курсов терапии: сиролимус* 3 мг/м2 – 1 день, 1 мг/м2 внутрь дни 2–4, дазатиниб*** 2 мг/кг внутрь 1–4 день; иринотекан 50 мг/м2 внутривенно – 5 дней, темозоламид 150 мг/м2 внутрь 5 дней.
Хирургическое лечение и ЛТ рассматривается в индивидуальном порядке.
35. Шифр по МКБ-10 – С69.2 Злокачественное новообразование сетчатки (ретинобластома (далее – РБ):
35.1. классификация:
при возникновении билатеральных опухолей поражение каждого глаза классифицируется отдельно. Классификация не применима при полной спонтанной регрессии опухоли.
TNM:
35.2. гистологические факторы риска:
35.3. критерии ответа на лечение:
35.4. обязательные диагностические мероприятия при установлении диагноза:
35.5. обязательные диагностические мероприятия перед курсом химиотерапии:
35.6. дополнительные диагностические мероприятия (по медицинским показаниям):
лабораторные исследования:
инструментальные методы обследования:
35.7. обязательные лечебные мероприятия:
Критерии проведения локальной терапии интраокулярной РБ приведены согласно приложению 16.
Общие принципы лечения:
Забор гемопоэтических стволовых клеток осуществляется после 1 курса интенсивной ПХТ;
системная ПХТ:
дети в возрасте от 1 до 2 месяцев:
дети в возрасте от 2 до 12 месяцев:
дети в возрасте старше года:
курс химиотерапии 2 препарата интенсив:
CADO:
интраартериальная химиотерапия глазничной артерии:
35.8. дополнительные лечебные мероприятия:
ВДХТ проводится только при наличии гематогенной диссеминации или метастазов в ЦНС. После проведения высокодозной ПХТ проводится ТГСК. Сбор ПСК осуществляется во время проведения индукционной ПХТ. В том случае, если было поражение КМ, то КМП выполняется перед каждым последующим циклом химиотерапии. Забор ПСК осуществляется после проведения 2 курсов химиотерапии от момента выявления КМП свободной от атипичных клеток. Например, после проведения 1 курса индукционной ПХТ, перед вторым курсом в выполненной КМП нет атипичных клеток, следовательно забор ПСК будет выполнен спустя еще 2 курса химиотерапии, при этом после каждого курса будет осуществляться контрольная КМП. При лептоменингиальном распространении не имеет значения, на каком этапе индукционной химиотерапии будет осуществлен забор ПСК.
Тиотепа* – 300 мг/м2 внутривенно капельно путем часовой инфузии 4–6 дни;
При лептоменингиальном распространении в качестве паллиативной терапии применяют интратекальное введение ЛС (метотрексат, гидрокортизон, топотекан*) и краниоспинальное облучение СОД 30 Гр.
Топотекан* – 0,3–0,4 мг интратекально 2 раза в неделю.
36. Шифр по МКБ-10 – С64 Злокачественное новообразование почки, кроме почечной лоханки (нефробластома):
36.1. стадирование:
I стадия:
II стадия:
III стадия:
IV стадия:
V стадия:
36.2. гистологические варианты (определяются после хирургического вмешательства):
без предоперационной химиотерапии:
с предоперационной химиотерапией:
36.3. условия для начала курса химиотерапии и ЛТ:
36.4. обязательными диагностическими мероприятиями при установлении диагноза:
первичный диагностический комплекс включает блок А, блок Б, блок В и специализированные диагностические мероприятия, необходимые для постановки диагноза:
36.5. обязательные диагностические мероприятия перед курсом химиотерапии:
36.6. обязательные диагностические мероприятия перед хирургическим вмешательством:
диагностический комплекс включает блок А (за исключением анамнеза), блок Б (определение антител к ВИЧ в крови, комплекса исследований для диагностики сифилиса, определение антигенов и антител к вирусу гепатита В, С (HbsAg, a/HBcor tot, a/HCV), блок В и специализированные диагностические мероприятия:
36.7. дополнительные диагностические мероприятия (по медицинским показаниям):
лабораторные исследования:
инструментальные методы обследования:
36.8. обязательные лечебные мероприятия:
общие принципы лечения:
системная химиотерапия:
режим АВД:
режим ВР – 1:
курс 1 химиотерапии CyD:
курс 2 химиотерапии карбоплатин и этопозид:
курс химиотерапии ICE:
курс химиотерапии CyCE:
ВДХТ:
монотерапия:
ЛТ:
37. Шифры по МКБ-10: С22.0 Печеночноклеточный рак (гепатоцеллюлярный рак).
37.1. морфологическая структура опухоли:
37.2. стадирование:
При определении распространенности местного процесса, необходимо учитывать: поражение нижней полой вены и печеночных вен (V = Vena Cava and/or Main Tributaries (Caval Attachements));
При стадировании выделяют:
Все пациенты с гепатоцеллюлярным раком относятся в HRG;
37.3. оценка динамики процесса во время проведения предоперационной ПХТ:
стабилизация заболевания: редукция <50 % или увеличение <25 % от первоначального объема опухоли для всех известных очагов, снижение уровня АФП <1 log изначального уровня. Иногда не происходит существенного изменения объема опухоли, однако, уровень АФП уменьшается;
Р(%) = (V1 – V2 * 100 %) / V1,
37.4. критерии оценки радикальности операции:
37.5. исследование гистологического материала опухоли после ее резекции включает определение:
выраженности лечебного патоморфоза опухоли с определением жизнеспособных опухолевых клеток в гистотопографических срезах по A. G. Huvos: I степень – незначительное или полное отсутствие эффекта; II степень – от 50 до 95 % ткани опухоли некротизировано; III степень более 95 % опухоли некротизировано, встречаются лишь небольшие фокусы жизнеспособной опухолевой ткани; IV степень отсутствие жизнеспособной опухолевой ткани;
37.6. условия для начала курса химиотерапии:
37.7. обязательные диагностические мероприятия при установлении диагноза:
37.8. обязательные диагностические мероприятия перед курсом химиотерапии:
37.10. дополнительные диагностические мероприятия (по медицинским показаниям):
лабораторные исследования:
инструментальные методы обследования:
37.11. обязательные лечебные мероприятия:
общие принципы лечения:
системная химиотерапия:
CDDP:
PLADO:
CARBO+DOXO:
37.12. дополнительные лечебные мероприятия:
38. Шифры по МКБ-10: C40–С41 Остеосаркома:
38.1. классификация:
регионарные ЛУ (N):
отдаленные метастазы (М):
ВОЗ классификация остеосарком:
Выделяют локализованный (местнораспространенный) вариант остеосаркомы в 80 % случаев, диссеминированный (первичный метастатический) вариант – в 20 % случаев;
38.2. обязательные диагностические мероприятия при установлении диагноза:
первичный диагностический комплекс включает блок А, блок Б, блок В и специализированные диагностические мероприятия, необходимые для постановки диагноза:
38.3. обязательные диагностические мероприятия перед курсом химиотерапии:
диагностический комплекс включает блок А (за исключением анамнеза), блок Б (за исключением определения антител к ВИЧ в крови, комплекса исследований для диагностики сифилиса, определения антигенов и антител к вирусу гепатита В, С (HbsAg, a/HBcor tot, a/HCV), блок В (за исключением УЗИ ОБП и сердца, которые выполняются по медицинским показаниям) и специализированные диагностические мероприятия:
38.5. дополнительные диагностические мероприятия (по медицинским показаниям):
лабораторные исследования:
инструментальные методы обследования:
38.6. обязательные лечебные мероприятия:
общие принципы лечения:
системная химиотерапия:
38.7. дополнительные лечебные мероприятия:
39. Шифры по МКБ-10: С40–С41 Опухоли семейства саркомы Юинга:
39.1. классификация:
Классификация осуществляется с учетом категорий Т, N и M:
Настоящая классификация основана на рекомендациях 8-го издания Американского Общества Клинических Онкологов (AJCO).
При оценке критерия Т необходимо понимать об условности его применения для пациентов младше 7 лет вследствие существенной разницы в размерах детского и взрослого туловища. К примеру, размер 8 см в наибольшем измерении классифицируется как Т1 (минимальное значение) статус для молодого взрослого пациента, однако для годовалого ребенка данное распространение будет являться очень значительным.
Регионарные ЛУ.
Т – первичная опухоль:
позвоночник:
Пораженные опухолью ЛУ (N1 статус) классифицируют пациента в IVB стадию распространения опухолевого процесса при опухолях семейства саркомы Юинга костной ткани, однако при мягкотканной локализации новообразования статус любая T N1 M0 классифицируется как IIIB стадия;
M – отдаленные метастазы:
Группировка по стадиям опухолей семейства саркомы Юинга костной ткани приведена согласно приложению 18.
Экстраоссальные опухоли семейства саркомы Юинга туловища, конечностей и забрюшинного пространства:
экстраоссальные опухоли семейства саркомы Юинга головы и шеи:
Пораженные опухолью ЛУ (N1 статус) классифицируют пациента в IVB стадию распространения опухолевого процесса при опухолях семейства саркомы Юинга костной ткани, однако при мягкотканной локализации новообразования статус любая T N1 M0 классифицируется как IIIB стадия;
M – отдаленные метастазы:
Требования к определению категорий рТ, pN соответствуют требованиям к определению категорий Т и N. рМ – отдаленные метастазы, подтвержденные микроскопически.
39.2. критерии для начала курса ПХТ:
39.3. обязательные диагностические мероприятия при установлении диагноза:
первичный диагностический комплекс включает блок А, блок Б, блок В и специализированные диагностические мероприятия, необходимые для постановки диагноза:
39.4. обязательные диагностические мероприятия перед курсом химиотерапии:
диагностический комплекс включает блок А (за исключением анамнеза), блок Б (за исключением коагулограммы (назначается по медицинским показаниям), определение антител к ВИЧ в крови, комплекса исследований для диагностики сифилиса, определение антигенов и антител к вирусу гепатита В, С (HbsAg, a/HBcor tot, a/HCV), блок В (за исключением УЗИ ОБП и сердца, которые выполняются по медицинским показаниям) и специализированные диагностические мероприятия:
39.5. обязательные диагностические мероприятия перед хирургическим вмешательством:
диагностический комплекс включает блок А (за исключением анамнеза), блок Б (за исключением определение антител к ВИЧ в крови, комплекса исследований для диагностики сифилиса, определение антигенов и антител к вирусу гепатита В, С (HbsAg, a/HBcor tot, a/HCV), блок В (за исключением УЗИ ОБП и сердца, которые выполняются по медицинским показаниям) и специализированные диагностические мероприятия:
39.6. дополнительные диагностические мероприятия (по медицинским показаниям):
лабораторные исследования:
инструментальные методы обследования:
39.7. обязательные лечебные мероприятия:
общие принципы лечения:
С целью усиления противоопухолевого эффекта индивидуально рассматривается возможность использования золендроновой кислоты. У пациентов с доказанными метастатическими очагами в ЛУ, костях, КМ, головном мозге и др. необходимо стремиться к проведению ЛТ на все известные опухолевые очаги при отсутствии возможности их хирургического удаления;
системная химиотерапия:
39.8. дополнительные лечебные мероприятия:
40.1. стадирование:
стадирование по TNM:
Требования к определению категорий рТ, pN соответствуют требованиям к определению категорий Т и N. рМ – отдаленные метастазы, подтвержденные микроскопически.
Группировка по стадиям РМС приведена согласно приложению 20;
40.2. гистологическая классификация:
Благоприятный прогноз: ботриоидная (гроздевидная) РМС, возникающая в слизистой оболочке полых органов, веретеноклеточная РМС.
Промежуточный прогноз: эмбриональная РМС.
Неблагоприятный прогноз: альвеолярная и солидная (недифференцированная);
40.3. локализация:
40.4. размер опухоли и возраст:
40.5. распределение на группы риска:
группа низкого риска:
группа очень высокого риска: альвеолярная РМС и N1;
40.6. критерии для начала курса ПХТ:
40.7. обязательные диагностические мероприятия при установлении диагноза:
первичный диагностический комплекс включает блок А, блок Б, блок В и специализированные диагностические мероприятия, необходимые для постановки диагноза:
40.9. обязательные диагностические мероприятия перед хирургическим вмешательством:
40.10. дополнительные диагностические мероприятия (по медицинским показаниям):
40.11. обязательные лечебные мероприятия:
общие принципы лечения:
группа низкого риска (субгруппа А); SRG (субгруппа В); SRG (субгруппы C и D):
HRG (субгруппы Е, F и G):
группа очень высокого риска:
группа с IV клинической стадией заболевания (крайне неблагоприятная прогностическая группа):
системная химиотерапия:
40.12. дополнительные лечебные мероприятия:
при рецидиве проводится системная химиотерапия с ЛС:
41. Нерабдоидные саркомы мягких тканей, шифры по МКБ-10:
41.1. группа нерабдоидных сарком мягких тканей:
41.2. морфологическая классификация (ВОЗ, 2017 г.):
41.3. TNM:
саркомы мягких тканей туловища, конечностей и забрюшинного пространства:
саркомы мягких тканей головы и шеи:
pTNM патогистологическая классификация:
41.4. стадирование по системе IRS:
41.5. степень злокачественности сарком мягких тканей у детей (Pediatric Oncology Group):
41.6. критерии для начала курса ПХТ:
41.7. обязательные диагностические мероприятия при установлении диагноза:
41.8. обязательные диагностические мероприятия перед курсом химиотерапии:
41.9. обязательные диагностические мероприятия перед хирургическим вмешательством:
для агрессивного фиброматоза (десмоидные опухоли):
41.11. обязательные лечебные мероприятия:
общие принципы лечения:
ЛТ:
системная химиотерапия:
не использовать ифосфамид у пациентов до 1 месяца; в возрасте 1–3 месяца и МТ <5 кг – 50 мг/кг 2 дня; >3 месяцев <1 год МТ >5 кг но <10 кг – 50 мг/кг 2 дня.
41.12. дополнительные лечебные мероприятия:
42. Шифры по МКБ-10: С56 Злокачественное новообразование яичника, экстракраниальные герминогенные опухоли любой локализации. С62 Злокачественное новообразование яичка:
42.1. классификация:
42.2. стадирование:
опухоли яичка:
42.3. прогностическая классификация герминогенных опухолей Международной объединенной группы по герминогенному раку (IGCCCG):
благоприятный прогноз (56 % пациентов, 92 % 5-летняя общая выживаемость):
42.4. экстрагонадные локализации герминогенных опухолей:
стадирование герминогенных опухолей экстрагонадной локализации, POG/CCG:
42.5. оценка ответа на проведенное лечение:
проводится по данным радиологического обследования (КТ, МРТ, при необходимости ПЭТ/КТ) после 2 и 4 курса ПХТ, по данным лабораторного обследования (онкомаркеры крови) перед каждым курсом ПХТ:
42.6. критерии для начала курса ПХТ:
42.7. обязательные диагностические мероприятия при установлении диагноза:
первичный диагностический комплекс включает блок А, блок Б, блок В и специализированные диагностические мероприятия, необходимые для постановки диагноза:
42.8. обязательные диагностические мероприятия перед курсом химиотерапии:
42.9. обязательные диагностические мероприятия перед хирургическим вмешательством:
диагностический комплекс включает блок А (за исключением анамнеза), блок Б (за исключением определения антител к ВИЧ в крови, комплекса исследований для диагностики сифилиса, определения антигенов и антител к вирусу гепатита В, С (HbsAg, a/HBcor tot, a/HCV), блок В:
Через 7 дней после орхифуникулэктомии рекомендовано исследование уровня АФП и ХГТ;
42.10. дополнительные диагностические мероприятия (по медицинским показаниям):
42.11. обязательные лечебные мероприятия:
общие принципы лечения:
герминогенные опухоли экстрагонадной локализации:
опухоли яичек (<16 лет):
опухоли яичек (>16 лет):
семиномы:
несеминомы:
промежуточный прогноз – 4 курса BEP; неблагоприятный прогноз – 4 курса BEP. При замедленном снижении онкомаркеров после 2 курсов BEP – переход на 2-ю линию терапии 1–2 курса TIP. После окончания этапа химиотерапии проведение хирургического удаления остаточных образований;
курс химиотерапии РЕ:
42.12. дополнительные лечебные мероприятия:
43. Шифр по МКБ-10 – С71 Злокачественное новообразование головного мозга (интракраниальные герминогенные опухоли):
43.1. гистологическая классификация герминогенных интракраниальных опухолей:
43.2. группы герминогенных интракраниальных опухолей по уровню секреции онкомаркеров (АФП, ХГТ):
43.3. группы герминогенных интракраниальных опухолей по распространенности процесса:
43.4. группы риска для негерминогенных интракраниальных опухолей:
При типичной локализации опухоли по данным КТ, а также по повышенному уровню опухолевых маркеров в сыворотке крови и ликворе гистологическая верификация диагноза не требуется.
В случае бифокального поражения (шишковидная железа и супраселлярная область) и отрицательных уровнях опухолевых маркеров в сыворотке крови и ликворе подозревается герминома и гистологическая верификация диагноза не требуется;
43.5. критерии для начала курса ПХТ:
43.6. обязательные диагностические мероприятия при установлении диагноза:
первичный диагностический комплекс включает блок А, блок Б, блок В и специализированные диагностические мероприятия, необходимые для постановки диагноза:
43.7. обязательные диагностические мероприятия перед курсом химиотерапии:
диагностический комплекс включает блок А (за исключением анамнеза), блок Б (за исключением коагулограммы (назначается по медицинским показаниям), определение антител к ВИЧ в крови, комплекса исследований для диагностики сифилиса, определение антигенов и антител к вирусу гепатита В, С (HbsAg, a/HBcor tot, a/HCV), блок В (за исключением УЗИ ОБП и сердца, которые выполняются по медицинским показаниям) и специализированные диагностические мероприятия:
43.8. дополнительные диагностические мероприятия (по медицинским показаниям):
43.9. обязательные лечебные мероприятия:
неметастатическая опухоль:
метастатическая форма:
Перерыв между курсами 3–4 недели;
43.10. дополнительные лечебные мероприятия:
Медицинская реабилитация
всем пациентам с ЗНО на всех этапах терапии заболевания, а также после завершения лечения рекомендуется медицинская реабилитация. При организации и проведении медицинской реабилитации руководствуются утвержденными Министерством здравоохранения клиническими протоколами.
Медицинским показанием для проведения медицинской реабилитации является необходимость проведения комплекса медицинских услуг, направленных на восстановление нормальной жизнедеятельности организма пациента, нарушенной в результате заболевания.
Медицинская реабилитация проводится в стационарных условиях и в отделении дневного пребывания. Этап ранней медицинской реабилитации может проводится в остром периоде и раннем восстановительном периоде заболевания согласно медицинским показаниям, противопоказаниям.
Медицинская реабилитация пациентов носит комплексный характер, охватывая не только медицинские, но и социально-психологические аспекты адаптации пациента к нормальной жизни. Такая реабилитация требует, кроме медицинской помощи, обязательного участия психологов.
Диагностику характера и степени нарушения функций органов и систем организма, приводящих к ограничению его жизнедеятельности, уровень реабилитационного потенциала осуществляет врач-реабилитолог (лечащий врач) перед началом курса медицинской реабилитации.
Программы медицинской реабилитации разрабатываются индивидуально в зависимости от выявленных осложнений лекарственного лечения, сопутствующей патологии, социальных и психологических проблем. При проведении медицинской реабилитации применяются методы лечебной физкультуры, эрготерапии, массажа, физиотерапии, рефлексотерапии, голосо-речевой терапии, диетотерапии, ЛС.
По окончании курса медицинской реабилитации оценивается эффективность проведенной медицинской реабилитации по изменению степени выраженности функциональных нарушений, а также по изменению характера и степени выраженности ограничений жизнедеятельности.
Фармакотерапию назначают в соответствии с настоящим клиническим протоколом, с учетом всех индивидуальных особенностей пациента, тяжести заболевания, наличия сопутствующей патологии клинико-фармакологической характеристики ЛС. При этом необходимо учитывать аллергологический фармакологический анамнез согласно приложению 6.
Профилактика
12. Медицинская профилактика рвоты проводится с применением антагонистов серотониновых 5-НТ3-рецепторов за 30–60 минут до начала химиотерапии и далее – по медицинским показаниям. Критерием эффективности противорвотной терапии является полное отсутствие (полный контроль) тошноты и рвоты в течении острого и отстроченного периода.
Антагонисты серотониновых 5-НТ3-рецепторов:
ондансетрон 0,45 мг/кг в сутки в 3 приема внутривенно струйно или внутрь (таблетки 4 мг, 8 мг – кратность приема 2 раза в сутки);
гранисетрон 0,04 мг/кг в сутки (но не более 3 мг) внутривенно струйно медленно однократно. Применяется у детей старше 2 лет. Детям старше 12 лет 1 мг внутрь (таблетки 1 мг – кратность и длительность приема устанавливается индивидуально). Молодым взрослым внутрь разовая доза – 1 мг (таблетки 1 мг – кратность и длительность приема устанавливается индивидуально), внутривенно капельно разовая доза – 3 мг, внутривенно струйно (медленно, не менее 30 секунд) разовая доза – 1 мг. Максимальная доза 9 мг/сутки;
трописетрон 0,2 мг/кг в сутки (максимальная суточная доза 5 мг) внутривенно струйно или внутрь (капсулы 5 мг – 1 раз в сутки). Применяется у детей старше 2 лет.
Кратность и длительность применения данных ЛС устанавливается индивидуально.
13. Трансфузии крови и ее компонентов проводят: лечащий либо дежурный врач, врач-трансфузиолог, во время операции – врач-анестезиолог-реаниматолог детский или врач-детский хирург, не участвующие в операции или проведении обезболивания. В исключительных случаях во время операции трансфузию крови и ее компонентов может проводить врач-специалист другого профиля, включенный приказом руководителя в список лиц, допущенных к проведению гемотрансфузий в данной организации здравоохранения.
Во всех случаях, исключая пневмонию и дыхательную недостаточность, трансфузию эритроцитов необходимо проводить при содержании гемоглобина ниже 70 г/л и гематокрите менее 0,3 или при наличии клинических симптомов анемического синдрома (сонливость, тахикардия, одышка) из расчета дозы эритроцитов – 10–15 мл/кг. При развитии инфекции трансфузия эритроцитов проводится при снижении уровня гемоглобина ниже 100 г/л. Для новорожденных и детей до 1 года трансфузия эритроцитов проводится в соответствии с возрастными нормами содержания гемоглобина. Доза эритроцитов в этом случае рассчитывается индивидуально и зависит от исходного уровня гемоглобина.
Трансфузия тромбоцитов при отсутствии осложнений программного лечения проводится при снижении уровня тромбоцитов ниже 10–20 х 109/л. Количество переливаемых тромбоцитов составляет 1 доза на 10 кг МТ (4–6 доз на 1,5 м2 площади поверхности тела), при этом в 1 дозе должно содержаться 0,5–0,7 х 1011 тромбоцитов. При необходимости выполнения инвазивных манипуляций трансфузия тромбоцитов проводится в случае, если уровень тромбоцитов менее 50 х 109/л. Используются тромбоциты, полученные от одного донора путем тромбоцитафереза на специальных сепараторах. Использование для пациентов с онкологическими и гематологическими заболеваниями тромбоцитов, полученных от многих доноров, является недопустимым, так риск осложнений резко возрастает.
Трансфузия гранулоцитов показана при соблюдении всех ниже перечисленных условий:
нейтропении менее 0,5 х 109/л у пациентов при ЗНО (шифр по МКБ-10 – С00–С80), в том числе лимфоидной, кроветворной и родственных им тканей (шифр по МКБ-10 – С81–С97), апластических анемиях (шифр по МКБ-10 – D61), после трансплантации гемопоэтических стволовых клеток (далее – ТГСК) (другие пересаженные органы и ткани (КМ, кишечник, поджелудочная железа; шифр по МКБ-10 – Z94.8);
наличии тяжелого инфекционного осложнения невирусной природы с рефрактерностью к антибактериальной и антимикотической терапии в течение не менее 48 часов;
прогнозируемой длительности нейтропении более 5–10 дней;
неэффективной стимуляции гемопоэза гранулоцитарно-колоние стимулирующими факторами.
Гранулоциты перед переливанием необходимо подвергнуть предварительному облучению в дозе 25–30 Гр.
Трансфузия свежезамороженной плазмы проводится при нарушении гемостаза из расчета 10 мл/кг.
Все компоненты крови для потенциальных реципиентов ТГСК, пациентов с апластической анемией, пациентов в посттрансплантационном периоде должны быть патогенредуцированны, лейкодеплецированы и облучены в дозе 25 Гр.
Трансфузия альбумина производится при гипоальбуминемии ниже 30 г/л. Доза рассчитывается индивидуально, с учетом концентрации используемого раствора. В педиатрической практике альбумин 10 % назначается в дозе 3 мл/кг МТ. У детей дозу ЛС устанавливают индивидуально, с учетом медицинского показания, клинического состояния и МТ пациента. Для коррекции тяжелой гипоальбуминемии (сепсис, глубокие нарушения белковосинтетической функции печени) доза альбумина рассчитывается по формуле
альбумин 10 %, мл = (40 – Х) х МТ/2;
альбумин 20 %, мл = (40 – Х) х МТ/4,
где Х – содержание альбумина в крови г/л, МТ – масса тела, кг. ЛС можно применять у пациентов, находящихся на гемодиализе.
15.1. международные критерии доказанности ИГИ у иммунокомпрометированных пациентов включают в себя возможные, вероятные и доказанные ИГИ:
возможная ИГИ – пациент относится к группе риска, имеет факторы риска и клинические признаки инфекции, но все микробиологически исследования отрицательные или не проводились;
вероятная ИГИ – пациент относится к группе риска и имеет факторы риска (АЧН <500/мкл более 10 дней, терапия глюкокортикостероидами (далее – ГКС), Т-клеточными иммуносупрессантами, антибактериальными ЛС широкого спектра действия), а также у пациента есть клинические признаки инфекции и присутствие грибковых элементов при микроскопии и (или) высев культуры из потенциально стерильного локуса или позитивные серологические исследования (например, положительный галактоманнановый тест на аспергиллез);
доказанная ИГИ – пациент имеет клинические признаки ИГИ, а также микроскопически выявлены грибковые структуры и (или) получен рост культуры грибов из стерильного локуса.
Проведение первичной лекарственной противогрибковой медицинской профилактики рекомендовано только у пациентов групп риска развития ИГИ:
HRG(>10 %) включает пациентов с ОМЛ, рецидивами острых лейкозов и реципиентов аллогенной ТГСК (далее – аллоТГСК);
группа низкого риска (<5 %) включает пациентов с ОЛЛ, НХЛ и реципиентов аутологичной ТГСК (далее – аутоТГСК);
группа спорадически возникающих ИГИ включает пациентов детского возраста с солидными опухолями (в том числе опухолями мозга) и лимфомами Ходжкина.
Вторичная медицинская профилактика ИГИ проводится после перенесенной вероятной или доказанной грибковой инфекции и направлена на предотвращение рецидива инфекционного заболевания. Проводится вторичная медицинская профилактика ЛС, действующим на гриб, вызвавший заболевание первично. ЛС назначается в профилактической дозе на период нейтропении АЧН <500/мкл или иммуносупрессивной терапии (далее – ИСТ).
Противогрибковые стратегии включают в себя медицинскую профилактику, эмпирическую, упреждающую противогрибковую терапию и этиотропное лечение установленной ИГИ;
15.2. первичная лекарственная медицинская профилактика инфекций, вызываемых дрожжевыми грибами, проводится согласно определенным Министерством здравоохранения медицинским показаниям;
15.3. первичная лекарственная медицинская профилактика инфекций, вызываемых плесневыми грибами:
первичная медицинская профилактика инфекций, вызываемых плесневыми грибами, проводится у следующих пациентов:
реципиентов аллоТГСК;
с ОМЛ и проходящих терапию согласно протоколам лечения ОМЛ (кроме острых промиелоцитарных лейкозов (далее – ОПЛ);
с рецидивами острых лейкозов, нейробластомы; с резистентными лейкозами;
с хронической гранулематозной болезнью.
Рекомендации по первичной лекарственной медицинской профилактике инфекций, вызываемых плесневыми грибами приведены в приложении 2.
При развитии у реципиентов ТГСК реакции трансплантат против хозяина (далее – РТПХ) >2 степени – флуконазол отменяется, а инициируется медицинская профилактика инфекций, вызываемых плесневыми грибами.
При наличии аллергических реакций или индивидуальной лекарственной непереносимости противогрибковых ЛС, медицинская профилактика проводится ЛС, не имеющим перекрестной реактивности, с учетом возрастных ограничений.
При появлении признаков ИГИ (вероятная, возможная, доказанная) противогрибковая медицинская профилактика отменяется и назначается лечение;
15.4. противогрибковая терапия:
если лихорадка возникла и сохраняется более 4 суток на фоне антибактериальной терапии рекомендовано:
ежедневный тщательный медицинский осмотр пациента;
забор крови на бактериологическое исследование для верификации фунгемии; бактериологические посевы из всех предполагаемых локусов инфекции.
Проведение обследования (в том числе визуализирующие методы исследования – компьютерная томография (далее – КТ), магнитно-резонансная томография (далее – МРТ), ультразвуковое исследование (далее – УЗИ) на предмет новых очагов инфекции или прогрессирования инфекции в уже установленных; посевы и (или) биопсия и (или) дренирование прогрессирующих очагов инфекции, бактериологическое и вирусологическое исследование крови; пересмотр антибактериальной терапии на предмет адекватности спектра и режима дозирования; рассмотрение необходимости эмпирической противогрибковой терапии.
Эмпирическая противогрибковая терапия рекомендована при возможной грибковой инфекции. Если пациент относится к HRG и получает медицинскую профилактику грибковых инфекций – рекомендуется менять способ введения противогрибкового ЛС приема внутрь на внутривенный, по возможности измерять остаточную сывороточную концентрацию (при медицинской профилактике азолами) и, только убедившись в ее неэффективности, менять группу противогрибковых ЛС с назначением в лечебной дозе. В случае подозрения на инвазивную дрожжевую инфекцию рекомендовано с эмпирической целью назначать эхинокандины (микафингин, анидулафунгин, каспофунгин). В остальных случаях – амфотерицин В (предпочтительна липидная форма из-за меньшей нефротоксичности).
Медицинскими показаниями для эмпирической терапии эхинокандинами являются: низкий КЭК;
экстракорпоральная детоксикация; признаки КАИК;
полное парентеральное питание;
колонизация желудочно-кишечного тракта (далее – ЖКТ) дрожжевыми грибами; мукозит III–IV степени;
наличие признаков гепатолиенального кандидоза;
очаговые изменения в легких, по данным визуализирующих методов исследования при негативном результате определения галактоманнана (антигена грибов) в крови и (или) в бронхо-альвеолярном лаваже (учитывая возможность определения галактоманнана в организации здравоохранения).
Альтернативным средством для эмпирической терапии является амфотерицин В (липидная форма).
При наличии очаговых изменений в легких, по данным визуализирующих методов исследования, рекомендовано рассмотреть целесообразность определения галактоманнана (антигена грибов) в крови и (или) в бронхо-альвеолярном лаваже.
При позитивном результате определения галактоманнана проводится упреждающая терапия вориконазолом.
Дозы противогрибковых ЛС для терапии грибковых инфекций у иммунокомпрометированных пациентов приведены в приложении 3.
При эффективности эмпирическая противогрибковая терапия продолжается до нормализации состояния пациента. При неэффективности – должна быть отменена через 5–7 дней. В обоих случаях диагностический поиск необходимо продолжить для установления причины лихорадки или подтверждения диагноза.
Упреждающая терапия направлена на лечение вероятной грибковой инфекции. Подразумевает назначение ЛС, обладающего чувствительностью потенциального возбудителя заболевания.
Выбор ЛС для терапии в зависимости от этиологии заболевания указан согласно приложению 4.
ЛС выбора для терапии инвазивного аспергиллеза являются: вориконазол и изавуконазол* у детей (в форме лиофилизата для приготовления раствора для инфузий 200 мг. Нагрузочная доза составляет 200 мг 3 раза в день в течение 2 дней, затем 200 мг один раз в день внутривенно). При лечении грибковой инфекции азолами рекомендовано проведение терапевтического лекарственного мониторинга (далее – ТЛМ), если это возможно в конкретной организации здравоохранения (применение изавуконазола* не требует ТЛМ). Альтернативными ЛС для терапии инвазивного аспергиллеза являются: посаконазол, амфотерицин В (липидная форма), изавуконазол*.
ЛС выбора для терапии мукормикоза является амфотерицин В (липидная форма). Альтернативными ЛС являются: посаконазол, изавуконазол*. При терапии мукормикоза приоритетом является хирургическая санация пораженных тканей.
ЛС выбора для терапии инвазивного кандидоза и кандидемии являются эхинокандины. Альтернативные ЛС – флуконазол, амфотерицин В (липидная форма). При фунгемии, вызванной дрожжевыми грибами, необходимо удаление и (или) замена всех искусственных устройств (сосудистых катетеров, зондов, дренажей и т.д.). При инвазивном кандидозе или кандидемии приемлемо назначение эхинокандинов на 10 дней с последующим переходом на терапию флуконазолом в лечебной дозе в случае клинически стабильного состояния пациента.
ЛС выбора для терапии фузариоза являются: посаконазол, амфотерицин В (липидная форма). Альтернативными ЛС являются: вориконазол, изавуконазол*.
При эффективности упреждающая противогрибковая терапия продолжается до исчезновения очагов и (или) признаков инфекции. Далее на период нейтропении проводится вторичная медицинская профилактика. При неэффективности (ухудшение по данным визуализирующих методов исследования, клинически) – должна быть отменена не позже, чем через 14 дней. Диагностический поиск необходимо продолжить для установления диагноза и этиологического фактора.
Целенаправленная противогрибковая терапия назначается при доказанной грибковой инфекции. Учитывается вид выделенных возбудителей, определяется чувствительность к противогрибковым ЛС. Терапия проводится ЛС, к которому чувствителен in vitro выделенный гриб, в лечебной дозе.
Комбинированная противогрибковая терапия рекомендована в случаях доказанной аспергиллезной инфекции, вызванной штаммами, резистентными к одной или нескольким группам противогрибковых ЛС, а также в случаях инфекции, вызванной грибами рода Fusarium.
Целенаправленная терапия продолжается до исчезновения патологических очагов грибковой инфекции;
15.5. контроль противогрибковой терапии: ежедневный контроль общего состояния пациента;
контроль лабораторных показателей – общий анализ крови (далее – ОАК) не менее 1 раза в неделю, БИК (калий, магний, общий белок, мочевина, креатинин, аланинаминотрансфераза (далее – АлАТ), аспартатаминотрансфераза (далее – АсАТ), общий билирубин, С-реактивный белок (далее – СРБ) не менее 2 раз в неделю;
при терапии амфотерицином В (рекомендовано назначение липидных форм из-за меньшей нефротоксичности) производится контроль скорости клубочковой фильтрации (далее – СКФ) почек или КЭК не менее 2 раз в неделю. Если клиренс креатинина прогрессивно снижается на фоне терапии амфотерицином В, рекомендовано рассмотреть вопрос о смене группы противогрибкового ЛС;
контроль динамики изменений уровня сывороточного галактоманана (при наличие возможности в организации здравоохранения) при условии его позитивности в начале заболевания (до назначения противогрибковой терапии) с целью оценки ответа на проводимое лечение;
контроль КТ пораженного органа проводится при стабилизации или улучшении клинического состояния по необходимости (не ранее, чем через 7 дней от предыдущего исследования). Для мониторинга ответа на терапию рекомендовано выполнение КТ пораженного органа не чаще 1 раза в 1–2 недели. Увеличение очага в объеме на фоне выхода из нейтропении (АЧН >500/мкл) не свидетельствует об отрицательной динамике грибковой инфекции. В данном случае необходим контроль КТ еще через 7 дней. При прогрессивном ухудшении клинического состояния пациента контроль КТ может быть выполнен в любые сроки.
Плановый контроль КТ (после исчезновения патологических очагов грибковой инфекции) не проводится.
В оценке динамики грибкового патологического процесса данные визуализирующих методов исследования (КТ, МРТ,УЗИ) имеют приоритет над серологическими методами.
всем пациентам с установленным диагнозом ЗНО на фоне проведения полихимиотерапии (далее – ПХТ) рекомендовно проведение профилактических мероприятий:
медицинская профилактика инфекции Pneumocystis carinii – ко-тримоксазол (сульфаметоксазол + триметоприм) (таблетки 400 мг + 80 мг) внутрь 5 мг/кг в расчете на триметоприм 2 раза в день через каждые 12 часов 2–3 дня в неделю;
дезинфекция кожи – ежедневное мытье под душем или обтирание водным раствором хлоргексидина, обработка мацераций и повреждений раствором бриллиантовой зелени;
ежедневная дезинфекция места пребывания пациента с помощью дезрастворов, бактерицидных ламп, при наличии агранулоцитоза – ежедневная смена постельного и нательного белья;
личная гигиена родителей и посетителей, мытье рук персонала при входе в палату к пациенту;
Информация
Источники и литература
-
Постановления и приказы Министерства здравоохранения Республики Беларусь об утверждении клинических протоколов 2022
- Постановления и приказы Министерства здравоохранения Республики Беларусь об утверждении клинических протоколов 2022 -
-
www.minzdrav.gov.by
- www.minzdrav.gov.by -
Информация
Антибактериальные ЛС
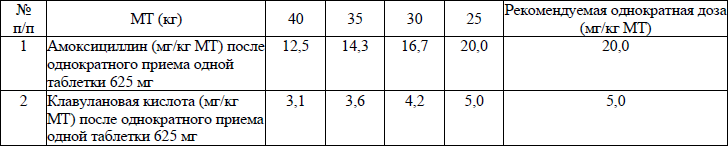
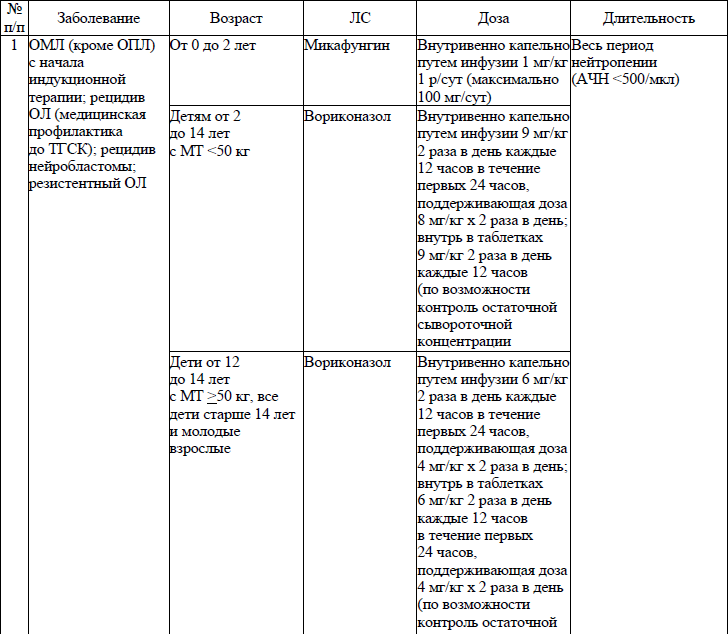
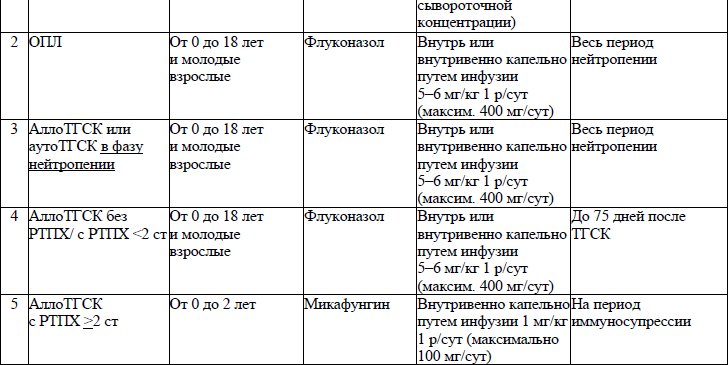
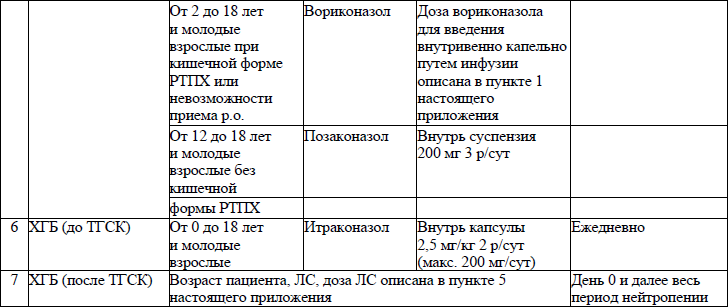
Дозы противогрибковых ЛС для терапии грибковых инфекций у иммунокомпрометированных пациентов
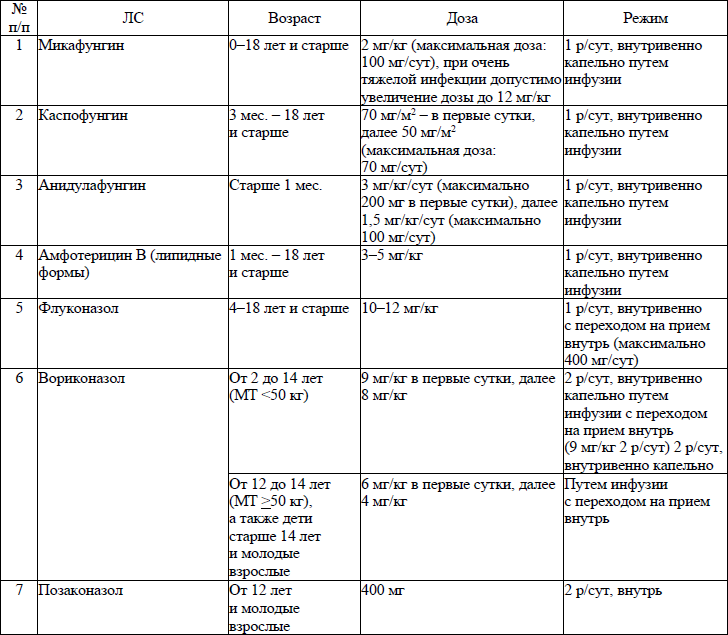
Выбор ЛС для терапии в зависимости от этиологии заболевания
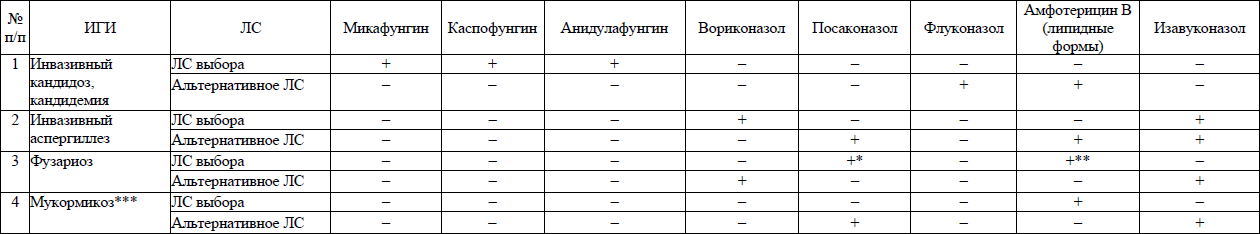
* Инициальная терапия только парентеральной формой, допустим переход на прием внутрь в качестве ступенчатой терапии.
** В терапии первой линии возможно применение комбинации вориконазола с амфотерицинов В (липидные формы).
*** При терапии мукормикоза необходимо рассмотреть возможность хирургической санации пораженных тканей.
Классификация БЭН с учетом данных антропометрии
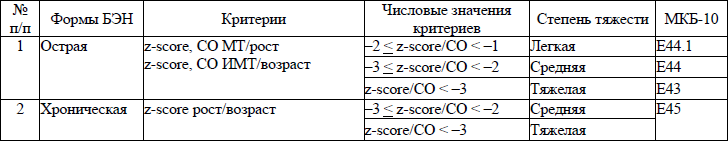
Противоопухолевые ЛС
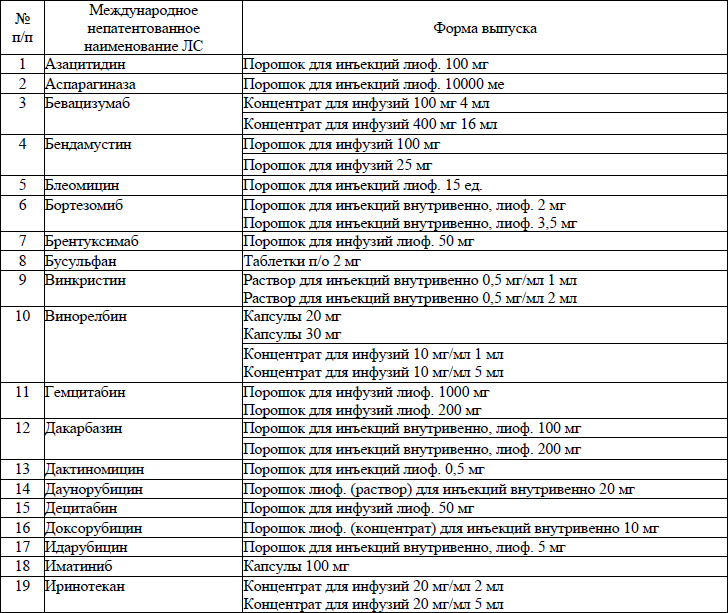

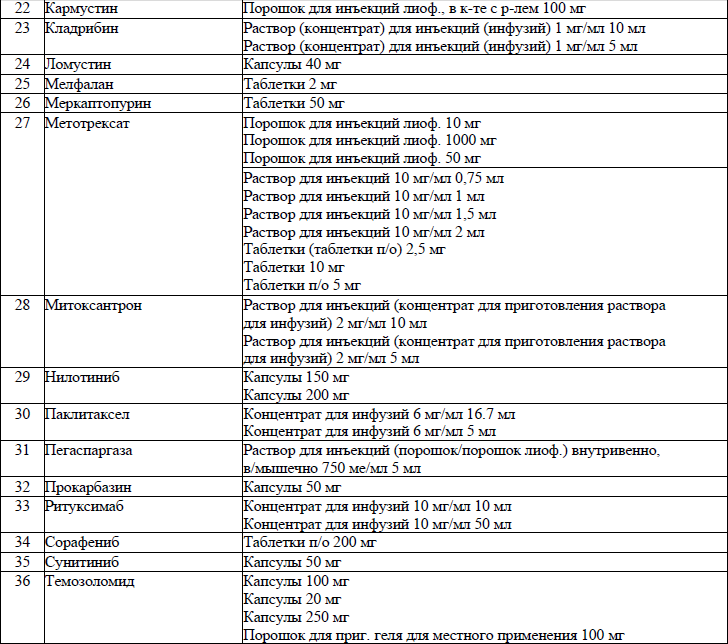
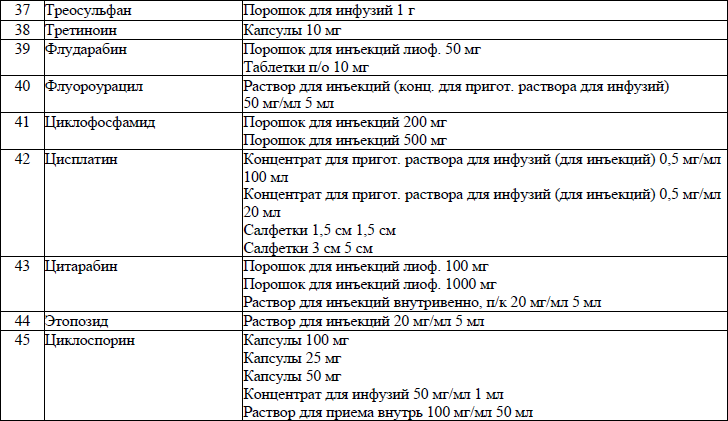
Приложение 7
ЛС, назначаемые off label и орфанные ЛС, назначаемые для лечения детей с онкологическими и гематологичекими заболеваниями
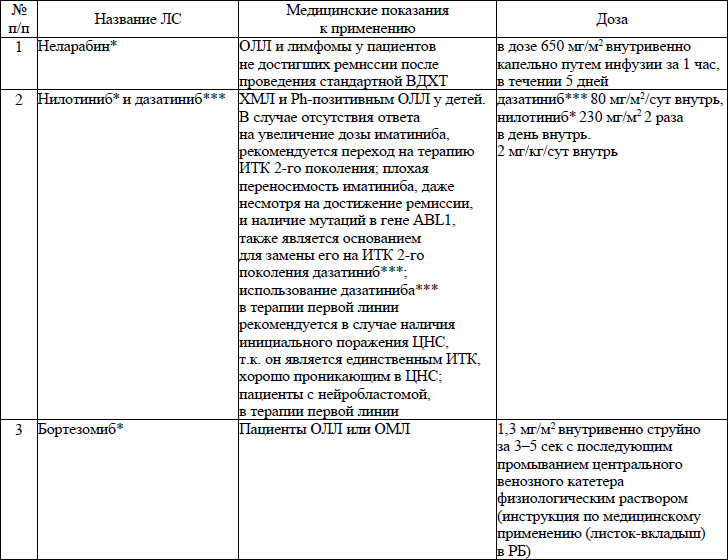
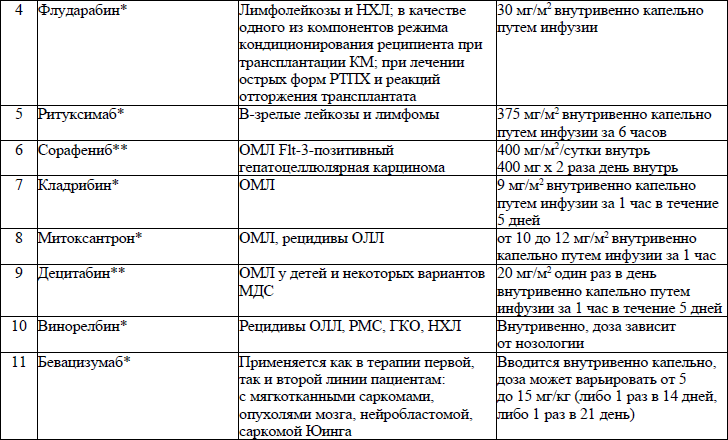
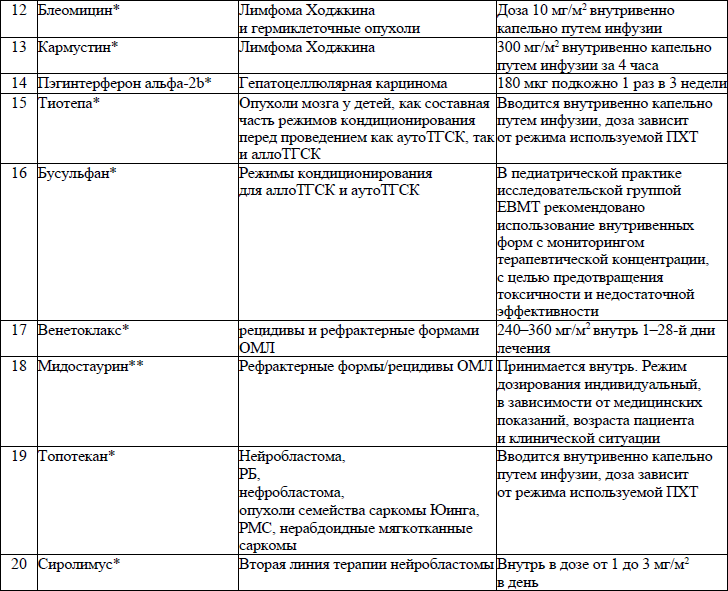

* ЛС, применяемые off label у детей и (или) незарегистрированные в Республике Беларусь.
** ЛС, включенные в перечень орфанных (редких) заболеваний и ЛС, согласно приказа Министерства здравоохранения Республики Беларусь от 2 сентября 2022 г. № 1153.
*** За счет собственных средств пациента или его законных представителей, средств юридических лиц и иных источников, не запрещенных законодательством.
Приложение 8
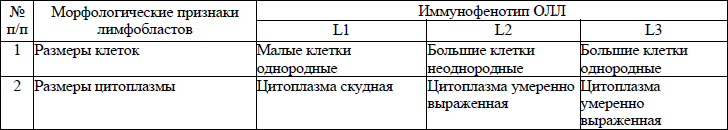
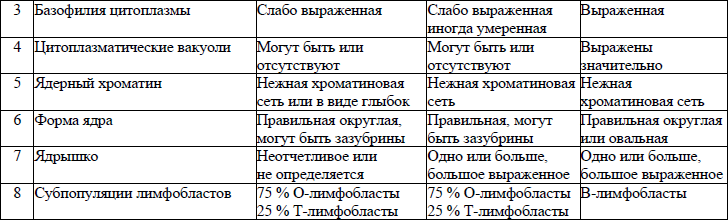
Классификация ОЛЛ
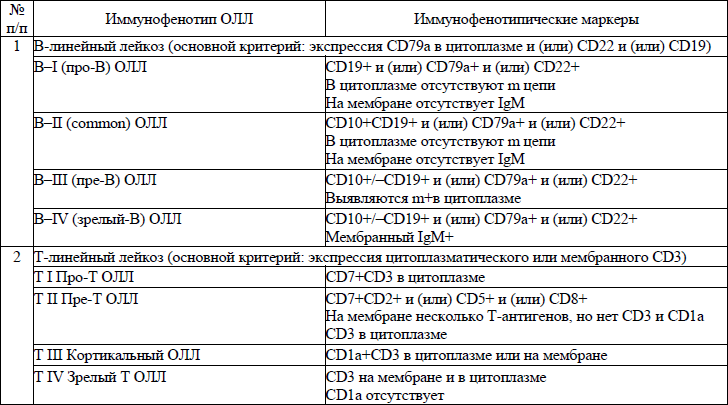

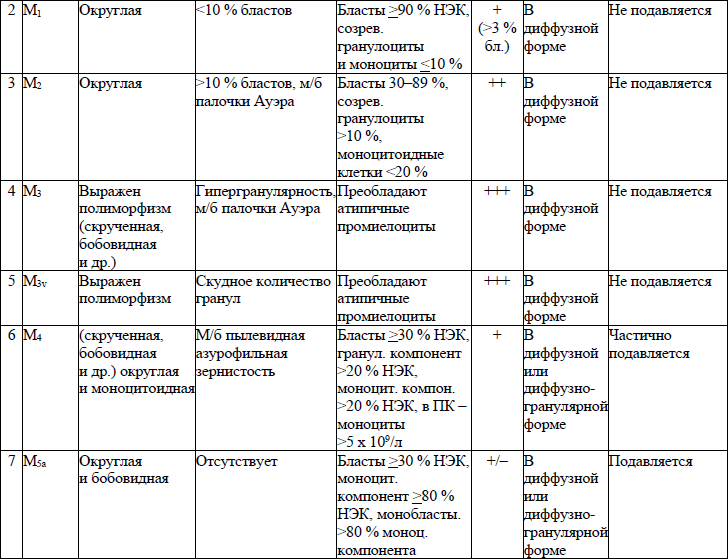
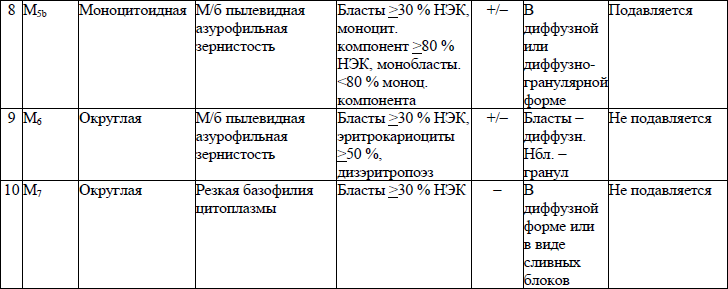
Иммунологические маркеры, характерные для разных морфоцитохимических вариантов ОМЛ
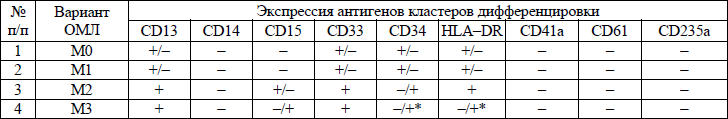
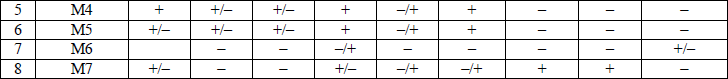
Классификация ОПЛ
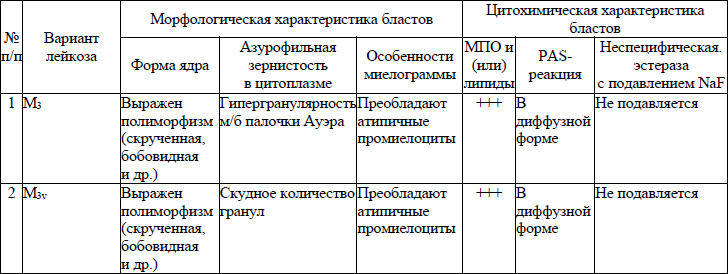
Варианты ответа на лечение иматинибом
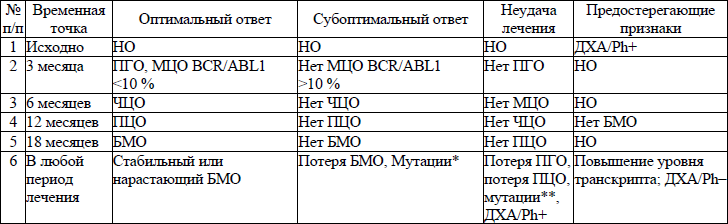
* Мутации киназного домена BCR/ABL1 с сохранением чувствительности к иматинибу.
** Мутации киназного домена BCR/ABL1, придающие низкую чувствительность к иматинибу.
Примечание. НО – не определяется.
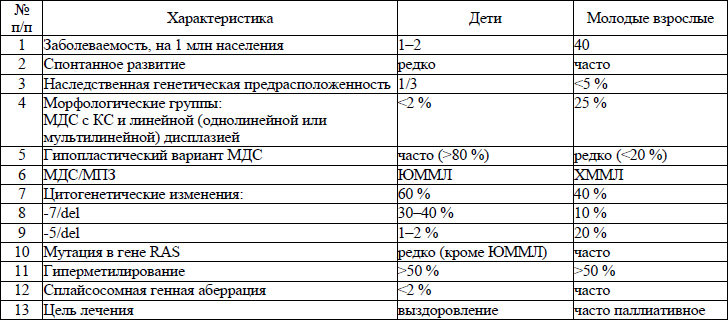
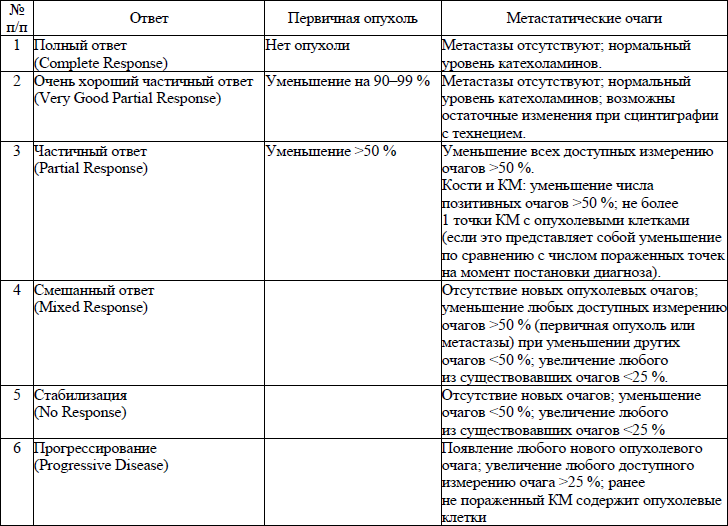
Критерии проведения локальной терапии интраокулярной РБ
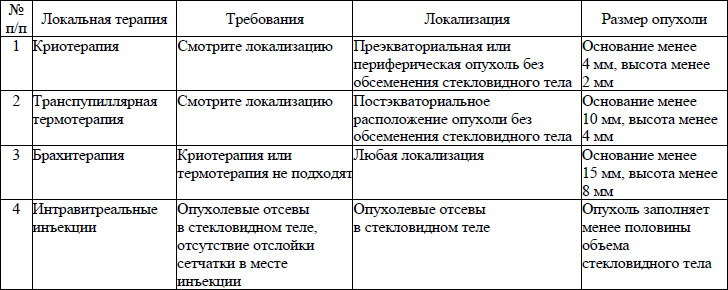
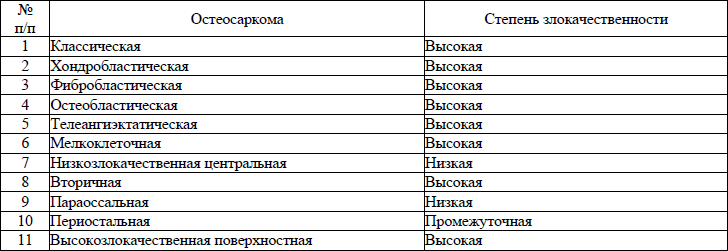
Группировка по стадиям опухолей семейства саркомы Юинга костной ткани
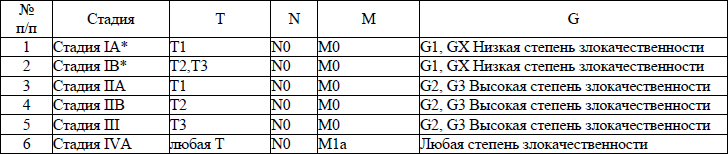
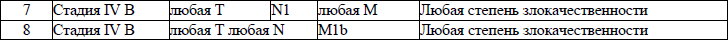
* Первая стадия (IA и IB) не применима для опухолей семейства саркомы Юинга, вследствие того, что опухоли семейства саркомы Юинга всегда классифицируются как новообразования высокой степени злокачественности (G3).
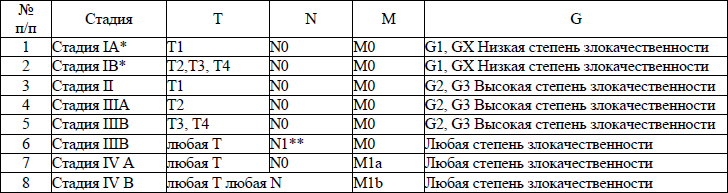
* Первая стадия (IA и IB) не применима для опухолей семейства саркомы Юинга, вследствие того, что опухоли семейства саркомы Юинга всегда классифицируются как новообразования высокой степени злокачественности (G3).
**Пораженные опухолью у пациента ЛУ (N1 статус) классифицируют в IVВ стадию распространения опухолевого процесса при опухолях семейства саркомы Юинга костной ткани, однако при мягкотканной локализации новообразования статус любая T N1 M0 классифицируется как IIIВ стадия.
Приложение 20
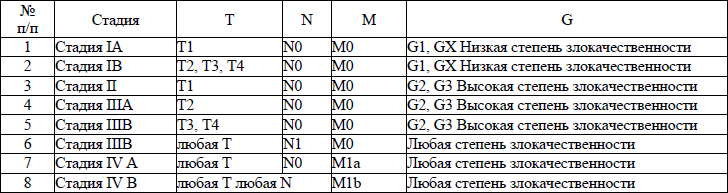
Группировка по стадиям сарком мягких тканей*
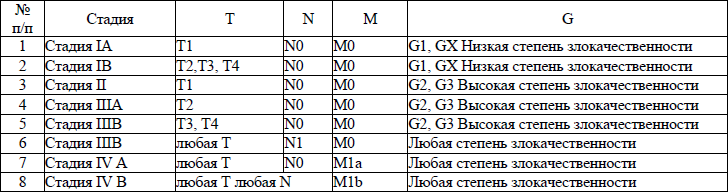
* Для сарком мягких тканей головы и шеи стадия не устанавливается.
Приложение 22
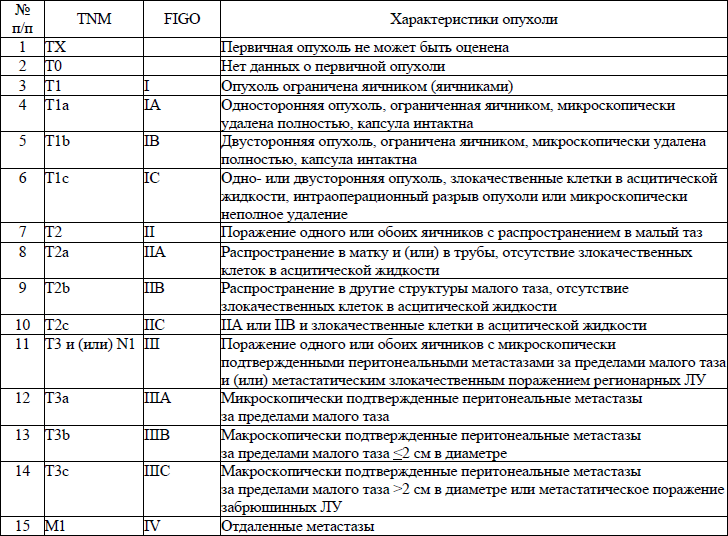
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.