Гемофилия А и В: протокол медицинской профилактики и реабилитации
 Версия: Клинические протоколы 2024 (Узбекистан)
Версия: Клинические протоколы 2024 (Узбекистан)
Наследственный дефицит фактора IX (D67), Наследственный дефицит фактора VIII (D66)
Гематология, Гематология детская
Общая информация
Краткое описание
Приложение
к приказу № 107
от 29 марта 2024 года
Министерства здравоохранения Республики Узбекистан
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ УЗБЕКИСТАН
ЦЕНТР ДЕТСКОЙ ГЕМАТОЛОГИИ, ОНКОЛОГИИ И КЛИНИЧЕСКОЙ ИММУНОЛОГИИ
НАЦИОНАЛЬНЫЕ КЛИНИЧЕСКИЕ ПРОТОКОЛЫ ПО НОЗОЛОГИИ «ГЕМОФИЛИИ А и Б»
НАЦИОНАЛЬНЫЙ КЛИНИЧЕСКИЙ ПРОТОКОЛ ПРОФИЛАКТИКИ И РЕАБИЛИТАЦИИ ПО НОЗОЛОГИИ «ГЕМОФИЛИИ А и Б»
Коды МКБ-10/11:
|
МКБ-10:
|
|
|
D66.0
|
Наследственный дефицит фактора VIII
|
|
D67.0
|
Наследственный дефицит фактора IX
|
|
Скачать (ссылка с МКБ): https://mkb-10.com/index.php?pid=1456
|
|
Дата разработки/пересмотра протокола:
2023/2026 год.
Пользователи протокола: гематологи, терапевты, педиатры, врачи общей практики, врачи скорой помощи, хирурги, стоматологи, урологи, нейрохирурги, травматологи- ортопеды, физиотерапревты, сосудистые хирурги, трансфузиологи, медицинские сестры и специалисты по профилю жалоб и симптомов.
При наличии клинических признаков у пациента врач любой смежной специальности обязан направить больного к гематологу. При любом длительном кровотечении, независимо от его локализации (из пуповины и при кефалогематомах у новорожденных, при удалении зубов и оперативных вмешательствах у взрослых и пр.) должно возникать подозрение на гемофилию и необходимо проводить ее диагностику путем проверки показателей коагулограммы: АЧТВ, % факторов свертывания крови и др. показатели при необходимости установления диагноза.
Категория пациентов: пациенты с гемофилией А и В, взрослые, дети.
Введение:
Распространенность гемофилии в общем популяции составляет 1:10 000 населения. Гемофилия А (ГА) встречается чаще, чем гемофилия В (ГВ), и составляет 80– 85% общего числа случаев. Подавляющее большинство больных гемофилией – мужчины. Известны единичные случаи гемофилии у женщин при наследовании гена одновременно от отца (больной гемофилией) и от матери (носитель гена), либо у женщины с мутацией гена на одной хромосоме, когда ген на другой не активен (болезнь Шерешевского-Тёрнера и др.). У некоторых женщин, являющихся носительницами мутаций генов FVIII или FIX, также могут быть клинические проявления гемофилии [1].
Профилактическая терапия – необходимое условие сохранения физического и психологического здоровья пациентов с тяжелой и среднетяжелой гемофилией А и В. Профилактика заключается в систематическом применении факторов свертывания крови или эмицизумаба (последний только для пациентов с тяжелой формой гемофилии А) с целью предотвращения кровотечений и развития гемофилической артропатии. Профилактическая терапия, которая начинается при отсутствии признаков повреждения суставов, до трехлетнего возраста и, хотя бы, до второго эпизода гемартроза называется первичной.
Профилактическое введение любого препарата лучше проводить утром, чтобы максимальная активность фактора в крови была в период наибольшей активности. Протокол проведения профилактической терапии должен быть индивидуальным, насколько это возможно, в зависимости от возраста, венозного доступа, фенотипа кровотечений, активности фактора, коморбидности, социальной активности пациента и особенностей фармакокинетической кривой.
В некоторых случаях (при повышенном травматизме, индивидуальных особенностях фармакокинетики в отсутствие ингибитора к FVIII) возможно применение более высоких доз факторов свертывания крови (B02BD по АТХ классификации) для профилактического лечения.
В некоторых случаях (при повышенном травматизме, индивидуальных особенностях фармакокинетики в отсутствие ингибитора к FVIII) возможно применение более высоких доз факторов свертывания крови (B02BD по АТХ классификации) для профилактического лечения.
Классификация
Виды профилактики или реабилитации:
-
Медико-генетическое консультирование
-
Профилактика гемартрозов и других кровотечений
-
Хирургическая и изотопная синовэктомия (иссечение синовиальной оболочки суставов)
-
Организация раннего введения антигемофилических препаратов на дому
-
В наиболее тяжелых случаях показано систематическое профилактическое введение концентрата факторов свертывания
-
При хирургическом вмешательстве желательна консультация гематолога и введение недостающих факторов свертывания крови до развития кровотечения.
-
Физиотерапия
Диагностика
ДИАГНОСТИЧЕСКИЕ МЕРОПРИЯТИЯ С УКАЗАНИЕМ УРОВНЯ МЕДИЦИНСКОЙ ПРОФИЛАКТИКИ ИЛИ РЕАБИЛИТАЦИИ:
Пациентам с подозрением на гемофилию, а также пациентам с верифицированной гемофилией при каждом визите к врачу-гематологу рекомендовано выполнение коагулограммы (ориентировочного исследования системы гемостаза), с обязательным включением следующих параметров: активированное частичное тромбопластиновое время (АЧТВ), определение протромбинового (тромбопластинового) времени в крови или в плазме, определение тромбинового времени в крови, исследование уровня фибриногена в крови для контроля состояния свертывающей системы крови [1,3,6].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: для гемофилии характерно изолированное увеличение АЧТВ, при сохранении других показателей в пределах нормальных значений. Необходимо иметь в виду, что при проведении скрининга у пациентов с легкой формой гемофилии возможны нормальные значения АЧТВ.
Для экстренного контроля эффективности терапии необходимо использование теста АЧТВ (необходимо получить нормальные или субнормальные значения), однако эти данные не позволяют дифференцировать значения активности выше 30-50% и не отражают прямой корреляции с активностью факторов VIII и IX.
Пациентам с подозрением на гемофилию, рекомендовано выполнение общего (клинического) анализа крови и исследование уровня тромбоцитов в крови для контроля показателей крови [1,3,6].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Основные диагностические мероприятия:
- снижение активности FVIII/FIX ниже 50%;
- наличие ингибитора
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Дополнительные диагностические мероприятия:
- отсутствие приобретенных коагулопатий;
- наличие мутаций генов FVIII или FIX.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: для гемофилии характерно изолированное увеличение АЧТВ, при сохранении других показателей в пределах нормальных значений. Необходимо иметь в виду, что при проведении скрининга у пациентов с легкой формой гемофилии возможны нормальные значения АЧТВ.
Для экстренного контроля эффективности терапии необходимо использование теста АЧТВ (необходимо получить нормальные или субнормальные значения), однако эти данные не позволяют дифференцировать значения активности выше 30-50% и не отражают прямой корреляции с активностью факторов VIII и IX.
Пациентам с подозрением на гемофилию, рекомендовано выполнение общего (клинического) анализа крови и исследование уровня тромбоцитов в крови для контроля показателей крови [1,3,6].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Основные диагностические мероприятия:
- снижение активности FVIII/FIX ниже 50%;
- наличие ингибитора
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Дополнительные диагностические мероприятия:
- отсутствие приобретенных коагулопатий;
- наличие мутаций генов FVIII или FIX.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Медицинская реабилитация
Методы и процедуры реабилитации:
Пациентам с гемофилией с поражением элементов опорно-двигательного аппарата рекомендовано долгосрочное лечение повреждений суставов и мышц, и функциональная реабилитация, а также санаторно-курортное лечение с целью предотвращения прогрессирования нарушений опорно-двигательного аппарата и улучшения их ортопедического статуса [24]. Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Цель реабилитации:
-
полное или частичное восстановление нарушенных и (или) компенсация утраченных функций пораженного органа или системы;
-
поддержание функций организма в процессе завершения остро развившегося патологического процесса;
-
предупреждение, ранняя диагностика и коррекция возможных нарушений функций поврежденных органов или систем организма;
-
предупреждение и снижение степени возможной инвалидности;
-
улучшение качества жизни;
-
сохранение работоспособности пациента;
-
социальная интеграция пациента в общество.
Критерии для определения этапа и объема реабилитационных процедур (международные шкалы согласно Международной классификации функционирования, ограничений жизнедеятельности и здоровья).
Каждые 6-12 месяцев у пациентов следует оценивать:
• Состояние костно-мышечной системы: клинические показатели измерять ежегодно, а радиологические показатели, как указано;
• Использование концентратов факторов свёртываемости крови;
• Развитие ингибиторов: выполнять скрининг-тесты на ингибиторы, как указано выше;
• Инфекции, связанные с переливанием крови (если это применимо): оценивать наличие ВИЧ, вирусов гепатита C и B, и других инфекций, если они обнаружены;
• Качество жизни.
Каждые 6-12 месяцев у пациентов следует оценивать:
• Состояние костно-мышечной системы: клинические показатели измерять ежегодно, а радиологические показатели, как указано;
• Использование концентратов факторов свёртываемости крови;
• Развитие ингибиторов: выполнять скрининг-тесты на ингибиторы, как указано выше;
• Инфекции, связанные с переливанием крови (если это применимо): оценивать наличие ВИЧ, вирусов гепатита C и B, и других инфекций, если они обнаружены;
• Качество жизни.
ЭТАПЫ И ОБЪЕМЫ РЕАБИЛИТАЦИИ
Пациенты с гемофилией должны наблюдаться группой специалистов различного профиля, включающей врача-гематолога, врача-педиатра, врача-травматолога- ортопеда, врача стоматолога, врача-физиотерапевта, врача ЛФК, медицинского психолога, имеющих опыт работы с больными гемофилией [1,24]. Осмотр пациентов врачом-гематологом, врачом-травмотологом-ортопедом и врачом стоматологом должен проводиться не менее 2-х раз в год; остальными специалистами - по необходимости. Целесообразно проведение диспансеризации пациентов 1 раз в год в специализированном центре нарушений гемостаза, если центр располагает достаточной клинико-лабораторной базой [1,6].
Диспансерное наблюдение за пациентами с гемофилией включает: Динамический мониторинг состояния пациента с оценкой наличия нежелательных явлений при проведении заместительной терапии: появление ингибитора к фактору свертывания крови, индивидуальная непереносимость препарата, вирусная контаминация, изменения психологического или социального статуса пациента, оценка состояния периферической венозной системы.
Диспансерное наблюдение за пациентами с гемофилией включает: Динамический мониторинг состояния пациента с оценкой наличия нежелательных явлений при проведении заместительной терапии: появление ингибитора к фактору свертывания крови, индивидуальная непереносимость препарата, вирусная контаминация, изменения психологического или социального статуса пациента, оценка состояния периферической венозной системы.
Лечение осложнений гемофилии: коррекция дефицита железа, ингибиторов. Выявление сопутствующих заболеваний, особенно заболеваний зубов, полости рта, ЖКТ, ЛОР-органов, патологии сердечно-сосудистой системы и др. и направление к профильным специалистам. Всех пациентов с гемофилией рекомендовано регистрировать и наблюдать в специализированном центре либо в гематологическом стационаре при многопрофилильеой клинике (по возможности) [1,3]. Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: у пациентов или врачей, к которым они обращаются, круглосуточно должна быть возможность контакта с врачом-гематологом, имеющим опыт лечения больных с нарушениями гемостаза.
Комментарии: у пациентов или врачей, к которым они обращаются, круглосуточно должна быть возможность контакта с врачом-гематологом, имеющим опыт лечения больных с нарушениями гемостаза.
ТАКТИКА МЕДИЦИНСКОЙ ПРОФИЛАКТИКИ ИЛИ РЕАБИЛИТАЦИИ С УКАЗАНИЕМ УРОВНЯ:
Основные профилактические или реабилитационные мероприятия с указанием уровня доказательности
- Для пациентов с тяжелой формой гемофилии А рекомендовано проведение профилактического лечения эмицизумабом**: нагрузочная доза 3 мг/кг массы тела - 4 введения с интервалом в 7 дней, с последующим регулярным введением препарата в дозе 1,5 мг/кг 1 раз в неделю или 3 мг/кг массы тела 1 раз в 2 недели [34].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии: эмицизумаб** представляет собой биспецифичное гуманизированное моноклональноее антитело, связывающее активированный FIX c FX и восполняющее функции активированного FVIII. На действие эмицизумаба** не влияет концентрация FVIII и наличие ингибитора к нему. Решение вопроса о применении эмицизумаба** принимается лечащим врачом с учетом дополнительных факторов (венозного доступа, клинического течения заболевания, наличия артропатии, комплаентности и коморбидности пациента). Возможно применение у пациентов любого возраста. Эмицизумаб** вводится подкожно, выбор места для инъекции следует ограничить рекомендованными участками: область живота, верхняя часть наружной поверхности плеча и бедро. При возникновении кровотечения при проведении профилактики эмицизумабом** необходимо дополнительное введение фактора свертывания крови VIII** (предпочтительно)/октоког альфа**/мороктоког альфа**/симоктоког альфа (фактор свертывания крови VIII человеческий рекомбинантный)**/туроктоког альфа в стандартных дозировках.
Дополнительные профилактические и реабилитационные мероприятия с указанием уровня доказательности.
Дополнительные профилактические и реабилитационные мероприятия с указанием уровня доказательности.
- Реабилитационные мероприятия и ЛФК целесообразно начинать после прекращения болевого синдрома, учитывая локальный статус места повреждения. Если пациент не получает постоянное профилактическое лечение, после купирования кровотечения показана кратковременная профилактика, особенно на время реабилитации. Пункции сустава с аспирацией содержимого показаны при: гемартрозе с болевым синдромом, при наличии большого объема крови в полости сустава, при признаках развития гнойного артрита, развитии на фоне гемартроза нервно-мышечных нарушений.
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
- Пациентам с гемофилией с поражением элементов опорно-двигательного аппарата рекомендовано долгосрочное лечение повреждений суставов и мышц, и функциональная реабилитация, а также санаторно-курортное лечение с целью предотвращения прогрессирования нарушений опорно-двигательного аппарата и улучшения их ортопедического статуса [24].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: основным клиническим проявлением гемофилии являются рецидивирующие кровоизлияния в суставы, что необратимо приводит к развитию деформирующей артропатии и хронического синовита у этих пациентов.
Комментарии: основным клиническим проявлением гемофилии являются рецидивирующие кровоизлияния в суставы, что необратимо приводит к развитию деформирующей артропатии и хронического синовита у этих пациентов.
- Поражение опорно-двигательного аппарата существенно лимитирует социальную адаптированность пациентов, ухудшает их качество жизни. Лечение можно проводить в санаторно-курортных организациях в климатической зоне проживания пациента, а также на бальнеологических курортах. Разработка реабилитационных мероприятий должна проводиться совместно специалистами по реабилитации, курортологии и врачами-гематологами, имеющими опыт лечения пациентов с нарушениями свертывания крови.
Возможны такие виды терапии как:
- школа психологической профилактики для пациентов и родственников;
- воздействие ультразвуком при заболеваниях суставов;
- лекарственный ультрафонофорез при заболеваниях суставов;
- электрофорез лекарственных препаратов при заболеваниях суставов;
- воздействие высокочастотными электромагнитными полями (индуктотермия);
- воздействие электрическим полем ультравысокой частоты (ЭП УВЧ);
- воздействие переменным магнитным полем (ПеМП).
Профилактика
Принципы проведения общественных профилактических мероприятий и ндивидуальной профилактики:
Всем пациентам с тяжелой формой гемофилии и/или с тяжелым клиническим фенотипом заболевания рекомендовано проведение первичной профилактики с целью предотвращения развития гемофилической артропатии и инвалидизации пациентов [4,11]. Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Пациентам с частыми повторяющимися кровоизлияниями в суставы (особенно пациентам, имеющим суставы-мишени) рекомендовано проведение вторичной или третичной профилактики [20,27]. Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Рекомендуемым режимом профилактики является [7,20,22,24,28–32]: пациентам с ГА – инфузия фактора свертывания крови VIII** (плазматического фактора свертывания крови VIII) / мороктоког альфа**, симоктоког альфа (фактор свертывания крови VIII человеческий рекомбинантный)**, туроктоког альфа в дозе 25-40 МЕ/кг 1 раз в 2 дня или 3 раза в неделю; инфузия октокога альфа** у детей младше 6 лет в дозе 20- 50 МЕ/кг 3-4 раза в неделю, для пациентов 6 лет и старше 25-40 МЕ/кг 1 раз в 2 дня или 3 раза в неделю, инфузия лоноктокога альфа у детей младше 12 лет в дозе 30-50 МЕ/кг 2-3 раза в неделю, для пациентов 12 лет и старше 20-50 МЕ/кг 2-3 раза в неделю; инфузия эфмороктокога альфа** в дозе 50 МЕ/кг с 3-5 дневным интервалом, доза и кратность введения может быть скорректирована на основе ответа пациента в диапазоне от 25 до 65 МЕ/кг; инфузия руриоктокога альфа пэгол у детей младше 12 лет в дозе 55 МЕ/кг 2 раза в неделю, для пациентов 12 лет и старше 40-50 МЕ/кг 2 раза в неделю. Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Пациентам с ГВ – инфузия фактора свертывания крови IX** в дозе 25-40 МЕ/кг 1 раз в 3 дня или 2 раза в неделю; инфузия нонаког альфа** 40-50 МЕ/кг 1 раз в 3-4 дня (нонаког альфа для детей до 6 лет – 2 инфузии в неделю, 33-87 МЕ/кг [32]), инфузия албутрепенонаког альфа в дозе 35-50 МЕ/кг один раз в неделю. Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Пациентам с частыми повторяющимися кровоизлияниями в суставы (особенно пациентам, имеющим суставы-мишени) рекомендовано проведение вторичной или третичной профилактики [20,27]. Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Рекомендуемым режимом профилактики является [7,20,22,24,28–32]: пациентам с ГА – инфузия фактора свертывания крови VIII** (плазматического фактора свертывания крови VIII) / мороктоког альфа**, симоктоког альфа (фактор свертывания крови VIII человеческий рекомбинантный)**, туроктоког альфа в дозе 25-40 МЕ/кг 1 раз в 2 дня или 3 раза в неделю; инфузия октокога альфа** у детей младше 6 лет в дозе 20- 50 МЕ/кг 3-4 раза в неделю, для пациентов 6 лет и старше 25-40 МЕ/кг 1 раз в 2 дня или 3 раза в неделю, инфузия лоноктокога альфа у детей младше 12 лет в дозе 30-50 МЕ/кг 2-3 раза в неделю, для пациентов 12 лет и старше 20-50 МЕ/кг 2-3 раза в неделю; инфузия эфмороктокога альфа** в дозе 50 МЕ/кг с 3-5 дневным интервалом, доза и кратность введения может быть скорректирована на основе ответа пациента в диапазоне от 25 до 65 МЕ/кг; инфузия руриоктокога альфа пэгол у детей младше 12 лет в дозе 55 МЕ/кг 2 раза в неделю, для пациентов 12 лет и старше 40-50 МЕ/кг 2 раза в неделю. Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Пациентам с ГВ – инфузия фактора свертывания крови IX** в дозе 25-40 МЕ/кг 1 раз в 3 дня или 2 раза в неделю; инфузия нонаког альфа** 40-50 МЕ/кг 1 раз в 3-4 дня (нонаког альфа для детей до 6 лет – 2 инфузии в неделю, 33-87 МЕ/кг [32]), инфузия албутрепенонаког альфа в дозе 35-50 МЕ/кг один раз в неделю. Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Методы и процедуры профилактики:
Профилактическая терапия не устраняет уже развившееся повреждение сустава, но уменьшает частоту кровотечений и может замедлить прогрессирование артропатии и улучшить качество жизни.
Целью лечения в «профилактическом режиме» является поддержание уровня фактора VIII и IX в плазме более 2%, уменьшение частоты кровотечений и кровоизлияний, предотвращение или уменьшение прогрессирования артропатий, улучшение качества жизни [2]. Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Первичная профилактика – регулярно продолжающееся лечение применяется у детей с тяжелой формой гемофилии А и В. Оптимальное возраст пациента для начала профилактического лечения 1-2 года: до проявления клинических симптомов заболевания (первичная профилактика, детерминированная возрастом) или независимо от возраста у больных, имеющих не более чем одно суставное кровотечение (первичная профилактика, детерминированная первым кровотечением). Первичная профилактика назначается на срок не менее 6 мес. с возможностью последующей пролонгации без ограничений.
Скрининг - Так как заболевание является генетически детерминированным, то косвенно, профилактическим мероприятием можно считать осведомленность пациента о возможном развитии заболевания у него или его потомства. С этой целью реализуется соответствующая диагностика.
Пренатальная диагностика обычно предлагается тогда, когда в случае идентификации плода c гемофилией, будет рассматриваться прерывание беременности. Однако, её могут проводить и для того, чтобы помочь семье подготовиться и спланировать роды. При родах плода с гемофилией лучше избегать родоразрешающей операции. [20]
Пол плода можно определить, используя диагностику методом полимеразной цепной реакции (ПЦР), характерной для хромосомы Y на плазме / сыворотке крови матери после 7-9 недель беременности или ультразвуковое исследование, начиная с 11 недели беременности.
Анализ проб хорионических ворсинок (CVS) или биопсия является основным методом пренатальной диагностики, и лучше всего его проводить между 9 и 14 неделями беременности. Биопсия, проводимая в более ранние сроки, повышает риск осложнений, включая ненормальное развитие конечностей плода. (Уровень доказательства А)
Анализ проб хорионических ворсинок (CVS) или биопсия является основным методом пренатальной диагностики, и лучше всего его проводить между 9 и 14 неделями беременности. Биопсия, проводимая в более ранние сроки, повышает риск осложнений, включая ненормальное развитие конечностей плода. (Уровень доказательства А)
Вторичная профилактика - регулярное продолжающееся лечение, назначаемое больным в возрасте после 2х лет или после 2х и более кровоизлияний в сустав, до начала задокументированного поражения суставов. Вторичную профилактику проводят в амбулаторных условиях многопрофильной клиники, или в поликлинических условиях гематологического центра (Уровень доказательства А)
Третичная профилактика регулярное продолжающееся лечение, назначаемое после документированного (физический осмотр, рентгенография суставов) поражения суставов.
Детям младшего возраста инициация профилактического режима лечения проводится факторами свертывания крови VIII или IX в дозе/кг 50 МЕ 1 раз в неделю. В дальнейшем, в случае отсутствия контроля над кровотечениями, формирования хорошего сосудистого доступа переход на введение препаратов по 30 МЕ/кг 2 раза в неделю. С последующим режимом введения, при необходимости, по 25 МЕ/кг 3 раза в неделю [10] (уровень доказательности D).
Проведение профилактического режима терапии требует лабораторного контроля на предмет ингибитора к факторам свертывания: первые 20 введений препарата- лабораторный контроль после каждых 5 введений, последующие 21-50 введений- контроль ингибитора после каждых 10 введений, далее- один раз в 6 месяцев до 150 введений препаратов факторов свертывания VIII/IX(уровень доказательности D).
Факторы свертывания крови VIII или IX взрослым пациентам вводятся в дозе 15- 40 МЕ/кг массы тела, для поддержания уровня дефицитного фактора не менее 2 %. Кратность введения -2- 3 раза в неделю при гемофилии А и 2 раза в неделю при гемофилии В. Подбор дозы препаратов факторов свертывания зависит от возраста пациента, венозного доступа, фенотипа кровотечений, активности, индивидуальной фармакокинетики.
При осуществлении самостоятельного введения факторов свертывания крови пациентами в амбулаторной карте делаются соответствующие записи и отметки и прикрепляется лист «Протокола внутривенного введения факторов свертывания крови».
Профилактическое лечение у пациентов с ингибиторной формой гемофилии, высокореагирующих, которым невозможно проведение индукции иммунной толерантности, имеющим более 4х спонтанных гемартрозов в год или других спонтанных кровоизлияний, должно осуществляться одним из следующих препаратов шунтирующего действия:
-эптаког альфа в дозе 90-120 мкг/кг веса каждый день либо через день;
-антиингибиторный коагулянтный комплекс (активированный комплекс II, VII, IX, X) 50- 85 МЕ/кг веса 3 раза в неделю. [3-5]
Возможно проведение краткосрочной профилактики для прерывания геморрагических рецидивов. Длительность данной терапии составляет 4 – 8 недель (уровень доказательности D).
Причинами недостаточно эффективной заместительной профилактической терапии могут быть: развитие ингибитора к фактору свертывания крови, назначение недостаточной дозы и/ или кратности введения, несоблюдение режима введения и дозировок пациентом и родителями, индивидуальные особенности пациента, требующие применения более высоких доз или более частого введения препарата.
Решение о повышении дозы или кратности введения препарата при профилактической терапии должно быть принято, если имеются объективные клинические или лабораторные данные о ее неэффективности.
Таблица 1.
Виды профилактики при гемофилии
|
Вид
|
Описание
|
|
Первичная
|
Регулярное проведение заместительной терапии. Начинается при отсутствии признаков повреждения суставов, до трехлетнего возраста и хотя бы до второго эпизода гемартроза
|
|
Вторичная
|
Регулярное проведение заместительной терапии. Начинается после двух или более гемартрозов до появления признаков повреждения суставов
|
|
Третичная
|
Регулярное проведение заместительной терапии. Начинается при подтверждении повреждения суставов. Может быть начато в любом возрасте
|
|
Периодическая
|
Введение концентратов факторов с целью предотвращения кровотечений не более 45 недель в год
|
Показания к проведению 3-х видов профилактики и к реабилитации (конкретизируются соответственно профилю).
Профилактическая терапия не устраняет уже развившееся повреждение сустава, но уменьшает частоту кровотечений и может замедлить прогрессирование артропатии и улучшить качество жизни. Показаниями для проведения постоянной профилактической заместительной терапии факторами свертывания крови (B02BD по АТХ классификации) являются: тяжелая форма гемофилии, среднетяжелая форма гемофилии при развитии хотя бы одного эпизода гемартроза или выраженных геморрагических проявлений другой локализации. Пациентам с активностью фактора >= 5% постоянное или длительное профилактическое лечение необходимо при повторных кровоизлияниях в суставы, появлении признаков синовиита или артропатии, выраженных геморрагических проявлениях, требующих частых введений факторов свертывания крови.
Для оценки эффективности и решения о необходимости коррекции режима профилактики рекомендовано контролировать клинически и лабораторно проводимую профилактическую терапию. При клиническом контроле, решение о недостаточной эффективности профилактической заместительной терапии принимается в случаях: более 2-х эпизодов спонтанных гемартрозов в год, появления признаков хронического синовиита или прогрессировании артропатии, возникновения жизнеугрожающих кровотечений.
Критерии для определения проведения видов профилактики (согласно международным стандартам, данным основанных доказательной медицины):
- Всем пациентам с тяжелой формой гемофилии и/или с тяжелым клиническим фенотипом заболевания рекомендовано проведение первичной профилактики с целью предотвращения развития гемофилической артропатии и инвалидизации пациентов [4, 11]. Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
- Пациентам с частыми повторяющимися кровоизлияниями в суставы (особенно пациентам, имеющим суставы-мишени) рекомендовано проведение вторичной или третичной профилактики [20, 27]. Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
ИНДИКАТОРЫ ЭФФЕКТИВНОСТИ ПРОФИЛАКТИЧЕСКИХ И РЕАБИЛИТАЦИОННЫХ МЕРОПРИЯТИЙ
Профилактическая терапия должна контролироваться клинически и лабораторно. При клиническом контроле, решение о недостаточной эффективности профилактической заместительной терапии принимается в случаях:
• более 2 эпизодов спонтанных гемартрозов в год;
• появления признаков хронического синовита или артропатии;
• выраженных спонтанных геморрагических проявлениях другой локализации;
Лабораторный контроль заключается в анализе остаточной активности фактора перед следующим введением (не ниже 1%), анализа наличия ингибитора, и по-возможности построения фармакокинетической кривой в течение 3 – 5 дней.
• более 2 эпизодов спонтанных гемартрозов в год;
• появления признаков хронического синовита или артропатии;
• выраженных спонтанных геморрагических проявлениях другой локализации;
Лабораторный контроль заключается в анализе остаточной активности фактора перед следующим введением (не ниже 1%), анализа наличия ингибитора, и по-возможности построения фармакокинетической кривой в течение 3 – 5 дней.
Критерии ответа на терапию:
достижение индикаторов эффективности терапии.
Информация
Источники и литература
-
Клинические протоколы, руководства, рекомендации Министерства здравоохранения Республики Узбекистан 2024
- Клинические протоколы, руководства, рекомендации Министерства здравоохранения Республики Узбекистан 2024 - 1. World Federation of Hemophilia /Guidelines for the management of hemophilia, 2 edition. Montréal, Québec, Canada : Blackwell Publishing Ltd., 2012. DOI: 10.1111/j.1365- 2516.2022.02909.x.. 2. Алгоритм ведения больных гемофилией. Утвержден Экспертным Советом Министерства здравоохранения Республики Казахстан No 22 от 11.10. 2021. 3. Scottish Intercollegiate Guidelines Network (SIGN). SIGN 50: a guideline developer’s handbook. Edinburgh: SIGN (SIGN publication no. 50). [October 2019]. Available from URL: http://www.sign.ac.uk. Edinburgh : б.н., 2019. 4. Jul 29, 2022 — № 1446, Министерство здравоохранения Республики Беларусь. ПОСТАНОВЛЯЕТ: 1. Утвердить: клинический протокол «Оказание медицинской. 5. Srivastava A, Santagostino E, Dougall A, Kitchen S et al. World Federation of Hemophilia. WFH Guidelines for the Management of Hemophilia, 3rd edition. Haemophilia. 2020;26(Suppl 6):1–158. Santagostino E, Dougall A, Jackson M, Khair K et al. Comprehensive Care of Hemophilia. Haemophilia. 2020;26(Suppl 6):19-34 6. Acquired haemophilia A . Dr. Helen CHAN Man Hong. October 2021 г., Specialist in Haematology & Haematological Oncology. 7. Thrombin generation and whole blood viscoelastic assays in the management of hemophilia: current state of art and future perspectives. Guy Young, Benny Sørensen, Yesim Dargaud, Claude Negrier, Kathleen Brummel-Ziedins and Nigel S. Key. 2019 г., Blood. 8. Зозуля Н. и соавт. Протокол ведения больных «Гемофилия». Москва : Проблемы стандартизации в здравоохранении., 2023 г., Т. 1. 9. Aspects of current management: orthopaedic surgery in haemophilia. 2012, Rodriguez-Merchan EC. 18, 2018 : б.н., Haemophilia, Т. 1, стр. 8 -16. 10. Toward optimal therapy for inhibitors in hemophilia. Christine L. Kempton and Shannon L.Meeks. 364-371., 2019 : The American Society of Hematology Education program. 11. Inhibitor eradication with rituximab in haemophilia: where do we stand. Franchini M, Mannucci PM. 165, Jun 2018 г., Br J Haematol, Т. 6, стр. 600. 12. Optimal treatment strategies for hemophilia: achievements and limitations of current prophylactic regimens. J, Oldenburg. 125, 2021 г., Blood, Т. 13. 13. Risk stratification for inhibitor development at first treatment for severe haemophilia A: a tool for clinical practice. P. C. Ter Avest,* K. Fischer,* M. E. Mancuso, E. Santagostino, V. J. Yuste,§ H. M. Van Den Berg * And J. G. Van Der Bom*. Hemostasys and Trombosys. 2022 14. Guideline on the selection and use of therapeutic products to treat haemophilia and other hereditary bleeding disorders. D. KEELING,* C. TAIT_ and M. MAKRIS . 14, 2018 г., Haemophilia, стр. 671-684. 15. Treatment-related risk factors of inhibitor development in previously untreated patients with hemophilia A: the CANAL cohort study for the CANAL Study group From the Van Cre. Samantha C. Gouw, Johanna G. van der Bom, and H. Marijke van den Berg. 2017 г., Blood. 16. Scientific Working Group Quality of life and Symptoms guidelines. б.м. : European hematology Association 2023. 17. Inhibitors Prevalence, Causes and Diagnosis Owaidah King Faisal Specialist Hospital and RC Saudi Arabia . M., Tarek. March 2022 г., Hemophilia. 18. A randomized comparison of bypassing agents in hemophilia complicated by an inhibitor the FEIBA NоvoSeven Comparative Study. Astermark J. Donfield SM, DiMichele D.M. et.al. . 2, 2017 г., Blood, Т. 109, стр. 546 - 545. 19. How I treat imhibitors in haemophilia. Makris M., Hay C.R.M., Gringeri A., Doirons R. . 18, 2022 г., Haemophilia, стр. 48-53. 20. Pregnancy in carriers of hemophilia. Chi C, Lee CA, Shiltagh N, Khan A, Pollard D, Kadir RA. . 14, 2018 г., Haemophilia, Т. 1, стр. 56 - 54. 21. Switching treatments in haemophilia: is there a risk of inhibitor development Angelo Bianchi . 94, European Journal of Haematology , стр. (284–289), 2023.
Информация
Список основных авторов, дополнительного коллектива авторов:
Полатова Ж.Ш. - д.м.н., профессор, директор Центра детской гематологии, онкологии и клинической иммунологии (ЦДГОКИ)
Махмудова А.Д. - д.м.н., заместитель директора по научной работе Республиканский научно-практический медицинский центр гематологии (РНПМЦГ) МЗ РУз; Узбекистан, г. Ташкент
Махамадалиева Г.З. к.м.н., главный гематолог Республики Узбекистан заведующий отделение трансплантации, Республиканский научно-практический медицинский центр гематологии (РНПМЦГ) МЗ РУз; Узбекистан, г. Ташкент
Бергер И.В. - к.м.н., заместитель главного врача, Республиканский научно-практический медицинский центр гематологии (РНПМЦГ) МЗ РУз; Узбекистан, г. Ташкент
Ибрагимова С. З. - д.м.н., заведующая 1-й онкогематологией Центра детской гематологии, онкологии и клинической иммунологии (ЦДГОКИ)
Еримбетова И. О. - заведующая 3-й онкогематологией Центра детской гематологии, онкологии и клинической иммунологии (ЦДГОКИ)
Арипова Н.В. - заведующая 2-й онкогематологией Центра детской гематологии, онкологии и клинической иммунологии (ЦДГОКИ)
Бабаханова Н.Н. – к.м.н., врач-гематолог 1-й онкогематологии Центра детской гематологии, онкологии и клинической иммунологии (ЦДГОКИ)
Ризаева Ф.А. – к.м.н., врач-гематолог 1-й онкогематологии Центра детской гематологии, онкологии и клинической иммунологии (ЦДГОКИ)
Нигматов Х.К. – врач-гематолог 3-й онкогематологии Центра детской гематологии, онкологии и клинической иммунологии (ЦДГОКИ)
Хадиев Р.К. - врач-гематолог 1-й онкогематологии Центра детской гематологии, онкологии и клинической иммунологии (ЦДГОКИ)
Абдуллаев М.М. - врач-гематолог 2-й онкогематологии Центра детской гематологии, онкологии и клинической иммунологии (ЦДГОКИ)
Якубова А.К. – заведующая дневным отделением Центра детской гематологии, онкологии и клинической иммунологии (ЦДГОКИ)
Абдурахманова Н.Н. – врач-трансфузиолог Центра детской гематологии, онкологии и клинической иммунологии (ЦДГОКИ)
Маматкулова Д.Ф. – к.м.н., врач-гематолог консултативной поликлиники Центра детской гематологии, онкологии и клинической иммунологии (ЦДГОКИ)
Киличева Г.Х. – к.м.н., врач физиотерапевт при РСНПМЦ Гематологии
Иноятов Х.П. – к.м.н., доцент кафедры гематологии и трансфузиологии «Центр развития профессиональной квалификации медицинских работников при” МЗ РУз
Садиев З.Р. – детский гематолог, главный специалист Самаркандской области, заведующий отделенеием онкогематологии Детского Многопрофильного Медицинского Центра МЗ РУз
Рахматова Н.Н. - детский гематолог, главный специалист Бухарской области, заведующий отделенеием онкогематологии Детского Многопрофильного Медицинского Центра МЗ РУз
Игамбердиева М. З. - детский гематолог, главный специалист Андижанской области, заведующий отделением онкогематологии Детского Многопрофильного Медицинского Центра МЗ РУз; Узбекистан;
Рецензенты:
1. Сулейманова Д.Н. – профессор, д.м.н., заведующая центром анемии при РСНПМЦ Гематологии
2. Hegine Khachatryan – PhD, MD Hemophilia and Thrombophilia center, MOH Armenia
Когда были проведены обсуждения: Ученый Совет был проведен 23 февраля 2024 года, заседание рабочей группы № 2.
Киличева Г.Х. – к.м.н., врач физиотерапевт при РСНПМЦ Гематологии
Иноятов Х.П. – к.м.н., доцент кафедры гематологии и трансфузиологии «Центр развития профессиональной квалификации медицинских работников при” МЗ РУз
Садиев З.Р. – детский гематолог, главный специалист Самаркандской области, заведующий отделенеием онкогематологии Детского Многопрофильного Медицинского Центра МЗ РУз
Рахматова Н.Н. - детский гематолог, главный специалист Бухарской области, заведующий отделенеием онкогематологии Детского Многопрофильного Медицинского Центра МЗ РУз
Игамбердиева М. З. - детский гематолог, главный специалист Андижанской области, заведующий отделением онкогематологии Детского Многопрофильного Медицинского Центра МЗ РУз; Узбекистан;
Рецензенты:
1. Сулейманова Д.Н. – профессор, д.м.н., заведующая центром анемии при РСНПМЦ Гематологии
2. Hegine Khachatryan – PhD, MD Hemophilia and Thrombophilia center, MOH Armenia
Когда были проведены обсуждения: Ученый Совет был проведен 23 февраля 2024 года, заседание рабочей группы № 2.
Сокращения, используемые в протоколе:
АГ – артериальная гипертензия
АД – артериальное давление
АЛат – аланинаминотрансфераза
АСат – аспартатаминотрансфераза
ВЕ – Бетезда единица
ИИТ – индукция иммунной толерантности
ИФА – иммуноферментный анализ
КТ – компьютерная томография
ОАК – общий анализ крови
ОАМ – общий анализ мочи
ПЦР – полемеразная цепная реакция
СОЭ – скорость оседания эритроцитов
УЗИ – ультрзвуковое исследование
ФГДС – фиброгастродуоденоскопия
ЧД – частота дыхания
ЧСС – частота сердечных сокращений
ЭКГ – электрокардиография
ЭхоКГ – эхокардиография
ЯМРТ – ядерно-магнитная резонансная томография
Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
АД – артериальное давление
АЛат – аланинаминотрансфераза
АСат – аспартатаминотрансфераза
ВЕ – Бетезда единица
ИИТ – индукция иммунной толерантности
ИФА – иммуноферментный анализ
КТ – компьютерная томография
ОАК – общий анализ крови
ОАМ – общий анализ мочи
ПЦР – полемеразная цепная реакция
СОЭ – скорость оседания эритроцитов
УЗИ – ультрзвуковое исследование
ФГДС – фиброгастродуоденоскопия
ЧД – частота дыхания
ЧСС – частота сердечных сокращений
ЭКГ – электрокардиография
ЭхоКГ – эхокардиография
ЯМРТ – ядерно-магнитная резонансная томография
Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
|
УДД
|
Расшифровка
|
|
1 |
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
|
|
2 |
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинич. исследований, с применением мета-анализа
|
|
3 |
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая
|
|
5
|
Имеется лишь обоснование механизма действия или мнение экспертов
|
Шкала оценки уровней достоверности доказательств (УДД) для профилактических, лечебных, реабилитационных вмешательств
|
УДД
|
Расшифровка
|
|
1
|
Систематический обзор РКИ с применением мета-анализа
|
|
2
|
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа
|
|
3
|
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль»
|
|
5
|
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
|
Шкала оценки уровней убедительности рекомендаций (УУР) для профилактических, диагностических, лечебных, реабилитационных вмешательств
|
УУР
|
Расшифровка
|
|
A |
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
|
|
B |
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
|
|
C |
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
|
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ПРОТОКОЛА:
У авторов протоколов отсутствует конфликт интересов;
Данные экспертов (специалистов республики и зарубежных стран) Обзоры мета-анализов, рандомизированных проспективных контролируемых перекрестных клинических исследований.
• Обзоры опубликованных исследований случай-контроль или когортных исследований.
• Систематические обзоры с таблицами доказательств.;
Пересмотр протокола рекомендован через 5 лет после его разработки или при наличии новых методов с уровнем доказательности);
Данные экспертов (специалистов республики и зарубежных стран) Обзоры мета-анализов, рандомизированных проспективных контролируемых перекрестных клинических исследований.
• Обзоры опубликованных исследований случай-контроль или когортных исследований.
• Систематические обзоры с таблицами доказательств.;
Пересмотр протокола рекомендован через 5 лет после его разработки или при наличии новых методов с уровнем доказательности);
Приложение 1
Основные осложнения гемофилии [1, 6, 8, 9].
1.Осложнения со стороны костно – суставной системы:
Наиболее вероятными участками кровоизлияний являются кровоизлияния в суставы и мышцы конечностей. У ребёнка с тяжёлой гемофилией, первый гемартроз, как правило, происходит, когда ребёнок начинает ползать и ходить; обычно в возрасте до двух лет, но иногда позже. При неадекватном лечении, повторяющиеся кровоизлияния приводят к прогрессирующему ухудшению состояния суставов и мышц, к резкой потере функциональности из-за потери подвижности, мышечной атрофии, боли и деформации суставов, и контрактур в течение первых-вторых десяти лет жизни.
Синовит обусловлен постоянным воспалительным процессом после гемартрозов в области синовиальной оболочки, которая в последствии гипертрофируется.
Хроническая гемофилическая артропатия:
Хроническая гемофилическая артропатия может развиться в любое время, начиная со второго десятилетия жизни (и иногда раньше), в зависимости от тяжести кровоизлияния и его лечения. Обусловлен попаданием крови на хрящевую ткань сустава во время гемартроза и усиливается при не проходящем хроническом синовите и повторяющемся гемартрозе, приводя к необратимому поражению сустава. При продолжающейся потери хрящевой ткани развивается прогрессивный артрит, который, включает: вторичные контрактуры мягких тканей атрофию мышц ангулярные деформации.
Деформация может также усугубляться контрактурой, следующей за мышечными кровоизлияниями или невропатией. Стадии артропатии определяются рентгенологически (см. таблицу рентгенологические стадии гемофилической артропатии).
У больных гемофилией переломы встречаются не часто, возможно из-за более низкой способности к передвижению и более низкой интенсивности физической активности. Однако больной с гемофилической артропатией может рисковать получить переломы вокруг суставов со значительной потерей амплитуды подвижности и в костях с остеопорозом.
Деформация может также усугубляться контрактурой, следующей за мышечными кровоизлияниями или невропатией. Стадии артропатии определяются рентгенологически (см. таблицу рентгенологические стадии гемофилической артропатии).
У больных гемофилией переломы встречаются не часто, возможно из-за более низкой способности к передвижению и более низкой интенсивности физической активности. Однако больной с гемофилической артропатией может рисковать получить переломы вокруг суставов со значительной потерей амплитуды подвижности и в костях с остеопорозом.
1. Псевдоопухоли:
Псевдоопухоль – это потенциально угрожающее жизни состояние, уникальное для гемофилии, которое происходит в результате неадекватного лечения кровоизлияний в мягкие ткани, обычно в мышцы, прилегающие к кости, которые могут быть непосредственно поражены. Они чаще всего наблюдаются в длинной трубчатой кости или тазу. При отсутствии лечения Псевдоопухоль может достичь огромных размеров, оказывая давление на нервно-сосудистые структуры и приводя к патологическим переломам. В коже может образоваться свищ, развивается из гематом, патогномонична только для тяжелой формы гемофилии.
процессе развития Псевдоопухоли выделяют три фазы:
1- начальная или обратимая, характеризующаяся формированием вокруг гематомы грануляционного вала, продолжается в среднем около 6 месяцев. На этом этапе возможно спонтанное самоизлечение (детский тип Псевдоопухоли) и регресс на фоне шестинедельного курса заместительной терапии препаратами факторов свертывания.
2- фаза необратимых изменений, характеризуется полным замещением грануляционной фазы зрелой фиброзной, представляет собой ложную геморрагическую кисту, заполненную кровяным детритом и некротическими массами.
3- фаза осложнений зависит от локализации патологического процесса (например, дислокация магистральных сосудов, почек, органов брюшной полости, разрушение крыла подвздошной кости, прорыв наружу через некротизированную капсулу и мягкие ткани и т.д.)
процессе развития Псевдоопухоли выделяют три фазы:
1- начальная или обратимая, характеризующаяся формированием вокруг гематомы грануляционного вала, продолжается в среднем около 6 месяцев. На этом этапе возможно спонтанное самоизлечение (детский тип Псевдоопухоли) и регресс на фоне шестинедельного курса заместительной терапии препаратами факторов свертывания.
2- фаза необратимых изменений, характеризуется полным замещением грануляционной фазы зрелой фиброзной, представляет собой ложную геморрагическую кисту, заполненную кровяным детритом и некротическими массами.
3- фаза осложнений зависит от локализации патологического процесса (например, дислокация магистральных сосудов, почек, органов брюшной полости, разрушение крыла подвздошной кости, прорыв наружу через некротизированную капсулу и мягкие ткани и т.д.)
3. Ингибиторная форма:
«Ингибиторы» при гемофилии относятся к антителам иммуноглобулина (IgG), которые нейтрализуют факторы свёртывания. В настоящее время, когда концентраты факторов свёртывания подвергаются соответствующей вирусной инактивации, ингибиторы факторов FVIII и FIX считаются самыми сильными осложнениями при лечении гемофилии. Развитие ингибитора зависит от наличия генетических и негенетических факторов (возраст начала заместительной терапии, интенсивность лечения, тяжелые кровотечения, оперативные вмешательства) [10].
Присутствие нового ингибитора следует подозревать у любого больного, который клинически не отвечает на лечение факторами свёртывания, особенно, если он прежде отвечал на такое лечение. В этой ситуации, шансы на возврат к норме и период полувыведения перелитого фактора свёртывания сильно снижаются. Ингибиторы чаще встречаются у больных с тяжелыми формами гемофилии по сравнению с больными с умеренной или легкой формами гемофилии. Кумулятивная частота (т.е. риск в течение жизни) развития ингибитора при тяжелой гемофилии типа А находится в диапазоне 20- 30% и приблизительно 5-10% при умеренной и легкой форме заболевания [11].
В развитых странах при тяжелой форме гемофилии типа А ингибитор в среднем развивается к 3 годам жизни и раньше. При умеренной и легкой гемофилии типа А, ингибитор развивается ближе к 30 годам, и часто наблюдается при интенсивном лечении фактором FVIII во время хирургической операции [1,10,11,12,13]. При тяжелой гемофилии ингибиторы не меняют локализацию, частоту или тяжесть кровоизлияния. При умеренной или легкой гемофилии ингибиторы могут нейтрализовать эндогенно синтезируемый фактор FVIII, при этом фактически преобразуя фенотип больного в тяжелый.
Проявления кровоизлияний при умеренной / легкой гемофилии, осложнённых ингибиторами, чаще напоминают проявления наблюдаемые у больных с приобретенной гемофилией типа А (из-за аутоантител фактора FVIII с большим преобладанием кровоизлияний подкожных, в слизистую оболочку, урогенитальных и желудочно-кишечных. Следовательно, риск сильных осложнений или даже смертельного исхода от кровоизлияния у этих больных может быть значительным.
Присутствие нового ингибитора следует подозревать у любого больного, который клинически не отвечает на лечение факторами свёртывания, особенно, если он прежде отвечал на такое лечение. В этой ситуации, шансы на возврат к норме и период полувыведения перелитого фактора свёртывания сильно снижаются. Ингибиторы чаще встречаются у больных с тяжелыми формами гемофилии по сравнению с больными с умеренной или легкой формами гемофилии. Кумулятивная частота (т.е. риск в течение жизни) развития ингибитора при тяжелой гемофилии типа А находится в диапазоне 20- 30% и приблизительно 5-10% при умеренной и легкой форме заболевания [11].
В развитых странах при тяжелой форме гемофилии типа А ингибитор в среднем развивается к 3 годам жизни и раньше. При умеренной и легкой гемофилии типа А, ингибитор развивается ближе к 30 годам, и часто наблюдается при интенсивном лечении фактором FVIII во время хирургической операции [1,10,11,12,13]. При тяжелой гемофилии ингибиторы не меняют локализацию, частоту или тяжесть кровоизлияния. При умеренной или легкой гемофилии ингибиторы могут нейтрализовать эндогенно синтезируемый фактор FVIII, при этом фактически преобразуя фенотип больного в тяжелый.
Проявления кровоизлияний при умеренной / легкой гемофилии, осложнённых ингибиторами, чаще напоминают проявления наблюдаемые у больных с приобретенной гемофилией типа А (из-за аутоантител фактора FVIII с большим преобладанием кровоизлияний подкожных, в слизистую оболочку, урогенитальных и желудочно-кишечных. Следовательно, риск сильных осложнений или даже смертельного исхода от кровоизлияния у этих больных может быть значительным.
Ингибиторы намного реже встречаются при гемофилии B и имеют место у менее 5% пораженных больных.
Во всех случаях, ингибиторы затрудняют лечение гемофилии заместительными концентратами факторов. Поэтому больные, находящиеся на терапии фактором свёртывания, должны проходить скрининговые тесты на развитие ингибитора [19].
Детям скрининг на ингибиторы следует проводить один раз каждые 5 дней лечения фактором до 20 дней лечения, каждые 10 дней лечения фактором между 21 и 50 днём лечения, и, по крайней мере, два раза в год в течение 150 дней лечения. Для взрослых с более чем 150 днями лечения фактором, помимо 6-12 месячной оценки, любое отсутствие реакции на заместительную терапию концентратов адекватного фактора у ранее реагирующих больных является показанием для оценки на наличие ингибитора [15].
Измерение ингибитора следует также проводить у всех больных, которые интенсивно лечились в течение более пяти дней, в течение четырёх недель с момента последнего вливания. Ингибиторы следует также оценивать перед хирургической операцией или если тесты на возвращение к норме не такие как ожидаются, и когда в послеоперационный период клиническая реакция на лечение кровоизлияния ниже оптимальной. [16]
Низкореагирующий ингибитор определяется как уровень ингибитора, который постоянно удерживается < 5 ЕБ/мл, в то время как высокореагирующий ингибитора определяется по уровню ≥ 5 ЕБ/мл.
Высокореагирующие (см понятие в разделе лабораторной диагностики) ингибиторы имеет тенденцию не исчезать. Если их не лечить в течение долгого времени, то уровни титров могут упасть и даже стать не обнаруживаемыми, но при этом повторное лечение отдельными продуктами фактора через три-пять дней может дать повторную анамнестическую реакцию. [17]
Некоторые ингибиторы с низким титром имеют транзиторную форму, исчезая в течение шести месяцев первоначального документирования, несмотря на недавние антигенное лечение концентратами фактора.
Ингибиторы с очень низкими титрами могут не обнаруживаться тестом на ингибиторы Бетезда, но могут быть обнаружены ввиду низкого уровня возврата к норме и / или укороченного периода полувыведения (T-1/2) после введения фактора свёртывания.
У почти 50% больных с гемофилией В с ингибиторами могут развиваться сильные аллергические реакции, включая анафилаксию, на введение фактора FIX. Такие реакции могут быть первым симптомом развития ингибитора.
Во всех случаях, ингибиторы затрудняют лечение гемофилии заместительными концентратами факторов. Поэтому больные, находящиеся на терапии фактором свёртывания, должны проходить скрининговые тесты на развитие ингибитора [19].
Детям скрининг на ингибиторы следует проводить один раз каждые 5 дней лечения фактором до 20 дней лечения, каждые 10 дней лечения фактором между 21 и 50 днём лечения, и, по крайней мере, два раза в год в течение 150 дней лечения. Для взрослых с более чем 150 днями лечения фактором, помимо 6-12 месячной оценки, любое отсутствие реакции на заместительную терапию концентратов адекватного фактора у ранее реагирующих больных является показанием для оценки на наличие ингибитора [15].
Измерение ингибитора следует также проводить у всех больных, которые интенсивно лечились в течение более пяти дней, в течение четырёх недель с момента последнего вливания. Ингибиторы следует также оценивать перед хирургической операцией или если тесты на возвращение к норме не такие как ожидаются, и когда в послеоперационный период клиническая реакция на лечение кровоизлияния ниже оптимальной. [16]
Низкореагирующий ингибитор определяется как уровень ингибитора, который постоянно удерживается < 5 ЕБ/мл, в то время как высокореагирующий ингибитора определяется по уровню ≥ 5 ЕБ/мл.
Высокореагирующие (см понятие в разделе лабораторной диагностики) ингибиторы имеет тенденцию не исчезать. Если их не лечить в течение долгого времени, то уровни титров могут упасть и даже стать не обнаруживаемыми, но при этом повторное лечение отдельными продуктами фактора через три-пять дней может дать повторную анамнестическую реакцию. [17]
Некоторые ингибиторы с низким титром имеют транзиторную форму, исчезая в течение шести месяцев первоначального документирования, несмотря на недавние антигенное лечение концентратами фактора.
Ингибиторы с очень низкими титрами могут не обнаруживаться тестом на ингибиторы Бетезда, но могут быть обнаружены ввиду низкого уровня возврата к норме и / или укороченного периода полувыведения (T-1/2) после введения фактора свёртывания.
У почти 50% больных с гемофилией В с ингибиторами могут развиваться сильные аллергические реакции, включая анафилаксию, на введение фактора FIX. Такие реакции могут быть первым симптомом развития ингибитора.
4. Осложнения, возникающие из-за инфекций, передающихся при переливаниях крови, и других инфекций:
Появление и передача инфекций ВИЧ, вируса гепатита B и вируса гепатита C через продукты факторов свёртывания привело к высокой смертности больных гемофилией в 1980-ые годы и в начале 1990-х годов [1]. Многие исследования, проведённые во всём мире, указывают на то, что передача инфекций ВИЧ, вируса гепатита B и вируса гепатита C через концентраты фактора почти полностью устранена.
В настоящее время, при проведении адекватной заместительной терапии препаратами факторами свертывания крови имеется возможность терапии данных инфекций, которые рассмотрены в соответствующих разделах настоящего протокола.[21]
В настоящее время, при проведении адекватной заместительной терапии препаратами факторами свертывания крови имеется возможность терапии данных инфекций, которые рассмотрены в соответствующих разделах настоящего протокола.[21]
Приложение 2
Другие виды лечения, оказываемые при возникновении некоторых распространенных видов кровотечений [2,3]:
Острый гемартроз.
Целью лечения острого гемартроза является остановка кровоизлияния в кратчайшие сроки. Желательно это сделать, сразу же после того, как больной ощутит «ауру», чем после наступления явного отека и боли
В случае развития острого гемартроза необходимо предпринять следующие действия:
- Ввести препарат фактора свертывания крови VIII\IX (в зависимости от типа гемофилии) в дозе 20-30 МЕ/кг веса больного. В случае отсутствия полного регресса патологической симптоматики через 12 часов повторить введение препарата
- Защитить пораженный сустав от статической нагрузки массы тела не менее чем на 24–48 ч, в том числе поддержка костылями и фиксаторами.
- Пораженная конечность должна быть полностью расслаблена в наиболее комфортном для нее положении, что способствует ускорению рассасывания отека.
- Холод способствует уменьшению отека, предупреждает дальнейшее
кровотечение и облегчает боль. Необходимо использовать криопакеты сразу же после появления первых симптомов кровотечения. Криотерапию следует применять по 10–15 мин каждые 2 часа и не допускать контакта хладагента с кожей во избежание термической травмы.
- Компрессия снижает отечность, следовательно, и боль. Целесообразно применять эластичные бинты или фиксаторы, однако следует помнить, что
слишком тугая давящая повязка может вызвать дополнительные повреждения ткани. Желательно не допускать складок при наложении повязок и не оставлять их на ночь.
- Возвышенное положение конечности снижает приток крови и способствует оттоку крови из поврежденной области. Приподнимать конечность следует выше уровня сердца, освободив ее от сдавливающей повязки, на 20 минут, возвращая в исходное положение на 20.
- Защитить пораженный сустав от статической нагрузки массы тела не менее чем на 24–48 ч, в том числе поддержка костылями и фиксаторами.
- Пораженная конечность должна быть полностью расслаблена в наиболее комфортном для нее положении, что способствует ускорению рассасывания отека.
- Холод способствует уменьшению отека, предупреждает дальнейшее
кровотечение и облегчает боль. Необходимо использовать криопакеты сразу же после появления первых симптомов кровотечения. Криотерапию следует применять по 10–15 мин каждые 2 часа и не допускать контакта хладагента с кожей во избежание термической травмы.
- Компрессия снижает отечность, следовательно, и боль. Целесообразно применять эластичные бинты или фиксаторы, однако следует помнить, что
слишком тугая давящая повязка может вызвать дополнительные повреждения ткани. Желательно не допускать складок при наложении повязок и не оставлять их на ночь.
- Возвышенное положение конечности снижает приток крови и способствует оттоку крови из поврежденной области. Приподнимать конечность следует выше уровня сердца, освободив ее от сдавливающей повязки, на 20 минут, возвращая в исходное положение на 20.
Мышечные кровоизлияния: могут произойти в любой мышце тела, обычно из- за прямого удара или внезапного растяжения.
Мышечное кровоизлияние определяется как эпизод кровоизлияния в мышцу, определённое клинически и / или с помощью визуализирующих исследований, обычно связанный с болью и / или опуханием и ухудшением функциональности, например, хромотой из-за кровоизлияния в заднюю часть голени [1].
Раннее распознание и соответствующее лечение мышечных кровоизлияний важно для предупреждения стойкой контрактуры мышц, повторного кровоизлияния и образования псевдоопухолей.
Места мышечных кровоизлияний, которые связаны с повреждением нервно- сосудистого пучка, таких как глубокие группы мышц-сгибателей в конечностях, потребуют немедленного лечения, чтобы предупредить стойкое повреждение и потерю функциональности.
Эти группы включают:
-
подвздошно-поясничную мышцу (риск феморально-кожного, бедренного и феморального паралича)
-
верхне-задние и глубокие задние отделы низа ноги (риск повреждения заднего большеберцового и глубокого малоберцового нерва)
-
группу мышц-сгибателей предплечья (риск ишемической контрактуры Фолькмана)
-
Кровоизлияние может также иметь место в поверхностных мышцах, таких как двуглавая мышца, задние мышцы бедра (трицепс голени), икроножная мышца, четырёхглавая мышца и ягодичные мышцы.
-
Симптомы мышечного кровоизлияния:
-
Ноющая боль в мышце
-
Удерживание конечности в положении комфорта Сильная боль при растягивании мышцы
-
Боль при активном сокращении мышцы
-
Напряжение и болезненность при пальпации, и возможное опухание
Поднять фактор больного как можно скорее, желательно, когда больной почувствует первые признаки дискомфорта или после травмы. Если есть повреждение нервно-сосудистого пучка, поддерживать уровень от пяти до семи дней или дольше, как показывают симптомы. Дать покой повреждённой части и приподнять конечность. На мышцу в положении комфорта наложить шину и довести конечность до положения функциональности, насколько позволит боль.
Если это помогает, вокруг мышцы на 15-20 минут каждый час можно прикладывать холодные пакеты / пакеты со льдом. Лёд не должен быть в прямом контакте с кожей. В случае кровоизлияний в критические места, вызывающие синдром сдавливания, и если требуется длительная реабилитация, часто необходимы неоднократные вливания в течение двух-трёх дней или намного дольше. Больного следует непрерывно наблюдать на случай повреждения нервно-сосудистого пучка; в таких случаях может потребоваться фасциотомия.
Поскольку мышечные кровоизлияния могут привести к значительной потере крови, если необходимо, следует проверять и корректировать уровень гемоглобина.
Физиотерапию следует начинать как можно скорее при уменьшении боли и проводить её постепенно для восстановления полной длины, силы и функциональности мышцы.
Во время этого процесса разумно лечение фактором, кроме тех случаев, когда физиотерапевт имеет опыт в лечении гемофилии. Для этого может потребоваться периодическое наложение гипса или шин. Если был повреждён нерв, то потребуется поддерживающая повязка. Усиливающая боль во время физиотерапии может означать повторное кровоизлияние и должна регулярно подвергаться оценке.
Кровоизлияние в подвздошную-поясничную область.
У этого типа мышечного кровоизлияния уникальное проявление. Признаки могут включать боль внизу живота, в паху, и / или в пояснице и боль при растягивании, но не при вращении, тазобедренного сустава. При этом в средней части бедра может наблюдаться парестезия и другие признаки сдавливания феморального нерва, такие как потеря коленного рефлекса и слабость в четырёхглавой мышце.
Симптомы могут быть похожими на острый аппендицит, включая положительные симптомы Щеткина-Блюмберга.
Срочно поднять уровень фактора больного. Поддерживать уровень от пяти до семи дней или дольше в зависимости от симптомов
Госпитализировать больного для наблюдения и контроля боли. Придерживаться строго постельного режима. Ходьба с костылями не разрешается, поскольку для ходьбы требуется сокращение мышц
Ограничить активность больного до исчезновения боли и улучшения разгибания бедра. Программа физиотерапии с тщательным наблюдением – ключ к восстановлению полной активности и функциональности и предупреждению повторного кровоизлияния. До возврата к полной активности рекомендуется восстановление полного разгибания бедра. При сохранении остаточного нервномышечного дефицита может потребоваться дополнительная ортопедическая поддержка.
Симптомы могут быть похожими на острый аппендицит, включая положительные симптомы Щеткина-Блюмберга.
Срочно поднять уровень фактора больного. Поддерживать уровень от пяти до семи дней или дольше в зависимости от симптомов
Госпитализировать больного для наблюдения и контроля боли. Придерживаться строго постельного режима. Ходьба с костылями не разрешается, поскольку для ходьбы требуется сокращение мышц
Ограничить активность больного до исчезновения боли и улучшения разгибания бедра. Программа физиотерапии с тщательным наблюдением – ключ к восстановлению полной активности и функциональности и предупреждению повторного кровоизлияния. До возврата к полной активности рекомендуется восстановление полного разгибания бедра. При сохранении остаточного нервномышечного дефицита может потребоваться дополнительная ортопедическая поддержка.
Почечное кровотечение.
Следует назначить полный постельный режим, интенсивную гидратацию (3000 мл воды на 1 кв. метр площади тела) в течение 48 часов, ввести препараты факторов свертывания крови в дозе 20-25 МЕ/кг веса больного. Не использовать антифибринолитики.
При отсутствии клинического улучшения в течение 2х суток, либо рецидивирующего характера кровотечения необходима консультация уролога для исключения патологии мочевыводящих путей.
минут. [2] [3] [4] [5] [6] [7]
При отсутствии клинического улучшения в течение 2х суток, либо рецидивирующего характера кровотечения необходима консультация уролога для исключения патологии мочевыводящих путей.
минут. [2] [3] [4] [5] [6] [7]
Кровоизлияние в брюшную полость:
Острое кровоизлияние в брюшную полость, включая кровоизлияния в забрюшинное пространство, может проявляться болью в животе и вздутием живота и может ошибочно принято за инфекционные и другие заболевания, требующие хирургического вмешательства. Оно может также проявляться в виде паралитической непроходимости кишечника. Могут потребоваться соответствующие рентгенологические исследования. Немедленно поднять уровень фактора пациента. Поддерживать уровни фактора, до тех пор, пока не будет выяснена этиологии, затем лечить при консультации со специалистом.
Кровоизлияние в головной мозг и центральную нервную систему.
Это состояние, представляющее опасность для жизни и требующее срочной медицинской помощи. Сначала провести лечение, затем оценку.
Все посттравматические черепно-мозговые травмы, подтверждённые или подозреваемые, как и серьёзные головные боли должны рассматриваться как внутричерепные кровоизлияния. Не ждать появления последующих симптомов, лабораторной или рентгенологической оценки.
Когда происходит значительная травма или имеют место подобные симптомы, немедленно поднять уровень фактора больного. Дальнейшие дозы будут зависеть от результатов визуализирующих исследований. Уровень фактора поддерживать до тех пор, пока не будет определена этиология. Если кровоизлияние подтверждено, поддерживать адекватный уровень фактора в течение 10-14 дней.
Все посттравматические черепно-мозговые травмы, подтверждённые или подозреваемые, как и серьёзные головные боли должны рассматриваться как внутричерепные кровоизлияния. Не ждать появления последующих симптомов, лабораторной или рентгенологической оценки.
Когда происходит значительная травма или имеют место подобные симптомы, немедленно поднять уровень фактора больного. Дальнейшие дозы будут зависеть от результатов визуализирующих исследований. Уровень фактора поддерживать до тех пор, пока не будет определена этиология. Если кровоизлияние подтверждено, поддерживать адекватный уровень фактора в течение 10-14 дней.
Внутричерепные кровоизлияния могут быть показанием для долгосрочной вторичной профилактики (от трёх до шести месяцев), особенно, если наблюдается относительно высокий риск повторного эпизода (например, в присутствие ВИЧ инфекции). Требуется немедленная медицинская оценка и госпитализация.
Следует выполнить компьютерную томографию или магнитно-резонансное исследование мозга. На ранних стадиях следует пройти консультацию невролога. Сильные головные боли могут также быть признаком менингита у больных с ослабленным иммунитетом.
Следует выполнить компьютерную томографию или магнитно-резонансное исследование мозга. На ранних стадиях следует пройти консультацию невролога. Сильные головные боли могут также быть признаком менингита у больных с ослабленным иммунитетом.
Кровоизлияния в горло и шею.
Состояние, угрожающее жизни и требующее срочной медицинской помощи, поскольку может привести к нарушению проходимости дыхательных путей.
Сначала провести лечение, затем оценку. В случае значительной травмы или появления симптомов немедленно поднять уровень фактора больного. Поддерживайте уровни фактора до исчезновения симптомов. Ранняя госпитализация в хирургическое или гематологическое отделения. Для предупреждения кровоизлияния у больных с сильным тонзиллитом, показано лечение фактором в дополнение к лечению бактериальными культурами и соответствующими антибиотиками.
Сначала провести лечение, затем оценку. В случае значительной травмы или появления симптомов немедленно поднять уровень фактора больного. Поддерживайте уровни фактора до исчезновения симптомов. Ранняя госпитализация в хирургическое или гематологическое отделения. Для предупреждения кровоизлияния у больных с сильным тонзиллитом, показано лечение фактором в дополнение к лечению бактериальными культурами и соответствующими антибиотиками.
Острые кровоизлияния в ЖКТ.
Немедленно поднять уровень фактора больного, Поддерживать уровень фактора до остановки кровоизлияния и определения этиологии. Острые желудочно-кишечные кровоизлияния могут проявляться в виде гематомезиса (кровавой рвоты), кровавого или дёгтеобразного стула.
При признаках кровоизлияния в ЖКТ и /или острого кровоизлияния в брюшную полость потребуется медицинская оценка и возможно госпитализация.
Следует регулярно наблюдать уровень гемоглобина. По мере необходимости лечить шок или анемию, лечить источник кровоизлияния: В качестве вспомогательной терапии можно использовать ЭАК или транексамовую кислоту для больных с дефицитом фактора FVIII и больных с дефицитом фактора FIX, которые не получают лечения концентратами протромбинового комплекса.
При признаках кровоизлияния в ЖКТ и /или острого кровоизлияния в брюшную полость потребуется медицинская оценка и возможно госпитализация.
Следует регулярно наблюдать уровень гемоглобина. По мере необходимости лечить шок или анемию, лечить источник кровоизлияния: В качестве вспомогательной терапии можно использовать ЭАК или транексамовую кислоту для больных с дефицитом фактора FVIII и больных с дефицитом фактора FIX, которые не получают лечения концентратами протромбинового комплекса.
Носовые кровотечения:
Наклонить голову больного вперёд, чтобы он не глотал кровь и попросить его мягко выдыхать мелкие сгустки. В течение 10-20 минут следует придавливать марлю, смоченную в ледяной воде, к передней мягкой части носа. Антигистаминные препараты и лекарства от заложенности носа полезны для кровотечений, характерных для аллергий, инфекций верхних дыхательных путей и сезонных изменений. Если кровотечения продолжительные или происходят часто, провести оценку на наличие анемии и применить соответствующее лечение. Полезно местное прикладывание марли, смоченной ЭАК или транексамовой кислотой. Если кровотечение не проходит или повторяется, проконсультируйтесь с отоларингологом. Для контроля кровотечение может потребоваться передняя и задняя тампонада носа. Носовые кровотечение часто можно предупредить, повышая влажность в окружающей среде, нанося гели (например, вазелин или капли солевого раствора /гель) на слизистую оболочку носа для сохранения влажности, или применяя солевой спрей.
Особенности лечебной тактики у беременных [9]
В своем большинстве средний уровень фактора свёртывания крови у носителей гемофилии составляет 50% уровня здорового человека.
Во втором и третьем триместрах уровень фактора свёртывания FVIII обычно повышается до нормального диапазона. В связи с чем у носителей активность фактора следует измерять во время третьего триместра для того, чтобы принять решения о необходимости введении фактора свертывания крови во время родов (уровень доказательности С). В случае активности дефицитного фактора ниже 50%, необходимо в родах проводить заместительную терапию препаратом фактора свёртывания (уровень доказательности С)
Путь родоразрешения у носителей с нормальным плодом следует выбирать согласно акушерским показаниям. Во избежание риска кровотечений, роды младенцев с известной или подозреваемой гемофилией должны проходить атравматично независимо от того, происходят ли роды через естественные пути или кесаревым сечением (уровень доказательности С).
Во втором и третьем триместрах уровень фактора свёртывания FVIII обычно повышается до нормального диапазона. В связи с чем у носителей активность фактора следует измерять во время третьего триместра для того, чтобы принять решения о необходимости введении фактора свертывания крови во время родов (уровень доказательности С). В случае активности дефицитного фактора ниже 50%, необходимо в родах проводить заместительную терапию препаратом фактора свёртывания (уровень доказательности С)
Путь родоразрешения у носителей с нормальным плодом следует выбирать согласно акушерским показаниям. Во избежание риска кровотечений, роды младенцев с известной или подозреваемой гемофилией должны проходить атравматично независимо от того, происходят ли роды через естественные пути или кесаревым сечением (уровень доказательности С).
При влагалищных родах следует избегать использования акушерских щипцов и вакуумной экстракции, а также других инвазивных процедур по отношению к плоду (взятие проб крови с черепа и установка скальповых электродов на кожу черепа плода внутриутробно).
Лечение ингибиторной формы:
Остановка кровотечения при ингибиторной форме:
При гемофилии, осложненной развитием ингибирующих антител, низкореагирующим, расчет разовой дозы препарата фактора свертывания крови производится по формуле:
При гемофилии, осложненной развитием ингибирующих антител, низкореагирующим, расчет разовой дозы препарата фактора свертывания крови производится по формуле:
Y = (М х L х 0,5) + (40 х М х Т)
где
Y - доза фактора свертывания крови для однократного введения (МЕ); M - масса тела больного, кг;
L - процент желаемого уровня фактора в плазме пациента (см таблицу 5) «Процент желаемого уровня фактора и длительность терапии геморрагического эпизода»);
P - исходный уровень фактора у больного до введения препарата. Т- титр антигена
Купирование кровотечения или кровоизлияния у пациентов с ингибиторной формой гемофилии А высокореагирующим производится посредством введения одного из препаратов шунтирующего действия:
-антиингибиторный коагулянтный комплекс (активированный комплекс II, VII, IX, X) 50- 100 МЕ/кг веса каждые 8-12 часов (не более 200 МЕ/ сутки).
Клиническая эффективность обоих препаратов практически одинакова, составляет около 80% [2]. Однако имеет место индивидуальная эффективность одного из препаратов у 1/3 пациентов[3,4].
Купирование кровотечения у пациентов с ингибиторной формой гемофилии В производится посредством введения
Y - доза фактора свертывания крови для однократного введения (МЕ); M - масса тела больного, кг;
L - процент желаемого уровня фактора в плазме пациента (см таблицу 5) «Процент желаемого уровня фактора и длительность терапии геморрагического эпизода»);
P - исходный уровень фактора у больного до введения препарата. Т- титр антигена
Купирование кровотечения или кровоизлияния у пациентов с ингибиторной формой гемофилии А высокореагирующим производится посредством введения одного из препаратов шунтирующего действия:
-антиингибиторный коагулянтный комплекс (активированный комплекс II, VII, IX, X) 50- 100 МЕ/кг веса каждые 8-12 часов (не более 200 МЕ/ сутки).
Клиническая эффективность обоих препаратов практически одинакова, составляет около 80% [2]. Однако имеет место индивидуальная эффективность одного из препаратов у 1/3 пациентов[3,4].
Купирование кровотечения у пациентов с ингибиторной формой гемофилии В производится посредством введения
Лечение ингибиторной формы
У пациентов с ингибиторной формой гемофилии А элиминация ингибитора возможна при проведении терапии индукции иммунной толерантности (ИИТ) (уровень доказательности доказательств В). Оптимальные сроки начала ИИТ – сразу после выявления ингибитора, в случае титра ингибитора между 5 и 10 ВЕ.
Однако сроки лимитируются следующими факторами: комплаентностью пациента, состоянием венозного доступа, титром ингибитора, лабораторным контролем терапии (доступностью диагностики вышеперечисленных лабораторных тестов).
Эффективность ИИТ у пациентов с гемофилией А составляет 70%, с гемофилией В-30% [3]. Предикторами эффективности ИИТ являются: молодой возраст, титр ингибитора на начало ИИТ менее 10 ВЕ, максимальный пик ингибитора менее 200 ВЕ, менее 5 лет между диагностированием ингибитора и началом ИИТ, генетические мутации. В случае если титр выше указанного значения, рекомендуется прекратить инфузии фактора VIII и контролировать титр ингибитора до момента его снижения. (Уровень доказательности В). Сохранение высокого титра ингибитора, не смотря на элиминацию фактора VIII, не является противопоказанием к ИИТ. При проведении ИИТ предпочтение отдается плазменным концентратам фактора VIII, содержащим фактор Виллебранда.
Однако сроки лимитируются следующими факторами: комплаентностью пациента, состоянием венозного доступа, титром ингибитора, лабораторным контролем терапии (доступностью диагностики вышеперечисленных лабораторных тестов).
Эффективность ИИТ у пациентов с гемофилией А составляет 70%, с гемофилией В-30% [3]. Предикторами эффективности ИИТ являются: молодой возраст, титр ингибитора на начало ИИТ менее 10 ВЕ, максимальный пик ингибитора менее 200 ВЕ, менее 5 лет между диагностированием ингибитора и началом ИИТ, генетические мутации. В случае если титр выше указанного значения, рекомендуется прекратить инфузии фактора VIII и контролировать титр ингибитора до момента его снижения. (Уровень доказательности В). Сохранение высокого титра ингибитора, не смотря на элиминацию фактора VIII, не является противопоказанием к ИИТ. При проведении ИИТ предпочтение отдается плазменным концентратам фактора VIII, содержащим фактор Виллебранда.
(Уровень доказательности С).
Для пациентов с высокореагирующим ингибитором, не зависимо от титра ингибитора на момент начала ИИТ рекомендована начальная схема 100 – 150 МЕ/кг каждые 12 часов. [5]
Для пациентов с низкореагирующим ингибитором рекомендовано начинать ИИТ по схеме 50 – 100 МЕ/кг каждый второй день. Если после начала ИИТ титр ингибитора поднимется выше 5 – 7 БЕ необходимо перевести пациента на лечение по схеме, рекомендованной для ИИТ у пациентов с высокореагирующим ингибитором. Снижение дозы и кратности введения препарата начинается после получения лабораторных данных об элиминации ингибитора (титр ингибитора - менее 0,6 БЕ, нормализация теста восстановления и периода полувыведения).
Снижение проводится постепенно с постоянным лабораторным контролем. При этом каждое снижение дозы или кратности возможно только после получения лабораторных данных об отсутствии ингибитора. После достижения дозы в 30 – 50 МЕ/кг 1 раз в 2 дня необходимо продолжить терапию по этой схеме постоянно.
Отмена профилактического лечения часто приводит к рецидиву ингибитора. При проведении ИИТ не допустимо менять препарат концентрата ф. VIII, поскольку, это значительно ухудшает прогноз терапии.
При проведении процедуры ИИТ необходимо избегать любых воздействий и препаратов, стимулирующих иммунные реакции, в том числе вакцинации, применения препаратов интерферона и других видов иммунотерапии. Рецидивы кровоизлияний ухудшают прогноз ИИТ, поэтому у пациентов с частыми гемартрозами и массивными гематомами мягких тканей в курсе ИИТ показано проведение профилактического лечения шунтирующими препаратами до снижения титра ингибитора менее 1 БЕ. Если в течение 8 – 12 месяцев не происходит снижения титра ингибитора, рекомендовано прекратить ИИТ, перевести пациента на терапию шунтирующими препаратами. В дальнейшем, после снижения титра ингибитора возможно повторить ИИТ с использованием другого препарата [3-6] в сочетании с иммунносупрессивной терапией.
Для пациентов с высокореагирующим ингибитором, не зависимо от титра ингибитора на момент начала ИИТ рекомендована начальная схема 100 – 150 МЕ/кг каждые 12 часов. [5]
Для пациентов с низкореагирующим ингибитором рекомендовано начинать ИИТ по схеме 50 – 100 МЕ/кг каждый второй день. Если после начала ИИТ титр ингибитора поднимется выше 5 – 7 БЕ необходимо перевести пациента на лечение по схеме, рекомендованной для ИИТ у пациентов с высокореагирующим ингибитором. Снижение дозы и кратности введения препарата начинается после получения лабораторных данных об элиминации ингибитора (титр ингибитора - менее 0,6 БЕ, нормализация теста восстановления и периода полувыведения).
Снижение проводится постепенно с постоянным лабораторным контролем. При этом каждое снижение дозы или кратности возможно только после получения лабораторных данных об отсутствии ингибитора. После достижения дозы в 30 – 50 МЕ/кг 1 раз в 2 дня необходимо продолжить терапию по этой схеме постоянно.
Отмена профилактического лечения часто приводит к рецидиву ингибитора. При проведении ИИТ не допустимо менять препарат концентрата ф. VIII, поскольку, это значительно ухудшает прогноз терапии.
При проведении процедуры ИИТ необходимо избегать любых воздействий и препаратов, стимулирующих иммунные реакции, в том числе вакцинации, применения препаратов интерферона и других видов иммунотерапии. Рецидивы кровоизлияний ухудшают прогноз ИИТ, поэтому у пациентов с частыми гемартрозами и массивными гематомами мягких тканей в курсе ИИТ показано проведение профилактического лечения шунтирующими препаратами до снижения титра ингибитора менее 1 БЕ. Если в течение 8 – 12 месяцев не происходит снижения титра ингибитора, рекомендовано прекратить ИИТ, перевести пациента на терапию шунтирующими препаратами. В дальнейшем, после снижения титра ингибитора возможно повторить ИИТ с использованием другого препарата [3-6] в сочетании с иммунносупрессивной терапией.
Таблица 14.
Принципы лечения острого гемартроза у пациентов с гемофилией А
Принципы лечения острого гемартроза у пациентов с гемофилией А
|
Заместительная терапия
|
25–40 МЕ/кг фактора свёртывания крови VIII
50 МЕ/кг при тяжелом или посттравматическом гемартрозе |
|
Иммобилизация
|
Обычно требуется 2-3 инъекции каждые 12 часов (гемофилия А) или 18 часов (гемофилия В)
Без кольцевого пластыря |
|
Освобождение от весовой нагрузки
|
Необходима в острой фазе
|
|
Лед/ криотерапия
|
Лед прикладывается только на 5-15 минут в течение первых 6 часов. Избегать любого прямого контакта с кожей
|
|
Рентгено- логические
исследования |
Редко, за исключением случаев травм
|
|
Обезболивание
|
Парацетамол (с осторожностью при гепатите С), опиоиды, селективные НПВП ЦОГ-2
|
|
Аспирация сустава
|
Тяжелый и напряженный гемартроз после коррекции дефицита коагуляции, в условиях строгой дезинфекции и только в первые 24 часа. При легком гемартрозе не проводится
|
|
Реабилитация
|
Ранний срок начала в целях предотвращения утраты функциональности
|
Сокращения: FVIII – фактор свертывания крови VIII; ЦОГ – циклооксигеназа; НПВС – нестероидные противовоспалительные препараты.
Приложение 3
ПРИОБРЕТЕННАЯ ГЕМОФИЛИЯ
Приложение 3
ПРИОБРЕТЕННАЯ ГЕМОФИЛИЯ
Дифференциальная лабораторная диагностика приобретенной гемофилии
|
Патологическое состояние, терапия Pathological condition, therapy
|
Изменение лабораторных показателей Changes of laboratory parameters
|
Дополнительные лабораторные исследования и диагностические критерии Additional laboratory tests and diagnostic criteria
|
|
Приобретенная гемофилия Acquired hemophilia
|
Удлинение АЧТВ Снижение активности FVIII Тест смешивания по АЧТВ — нет коррекции (ИЦА > 15 %) Ингибитор FVIII > 0,6 БЕ/мл Снижение активности FIX, FXI и FXIIin vitro (при высоком титре ингибитора FVIII) Prolongation of Aptt Reduced FVIII activity APTT mixing test — no correction (ICA > 15 %) FVIII inhibitor > 0.6 BU/mL Reduced FIX, FXI, FXII activity in vitro (with a high duration of action of the FVIII inhibitor)
|
Семейный анамнез не отягощен Болеют мужчины и женщины Недлительный анамнез по кровоточивости Хромогенный метод определения активности FVIII и титра ингибитора к нему (снижает эффект ВА на результаты тестов) Лабораторная методика с предварительным разведением плазмы больного буферным раствором (снижение действия высокого титра ингибитора FVIII на активность FIX, FXI и FXII) Non-burdened familial history Affects both men and women Not a long history of bleeding Chromogenic method for determining the activity of FVIII and the titer of an inhibitor to it (reduces the effect of LA on test scores) Laboratory technique with preliminary dilution of the patient’s plasma with a buffer solution (reducing the effect of a high titer of a FVIII inhibitor on the activity of FIX, FXI and FXII)
|
|
Наследственная гемофилия А Hereditary hemophilia A
|
Удлинение АЧТВ Снижение активности FVIII Тест смешивания по АЧТВ — есть коррекция (ИЦА ≤ 15 %) Отсутствует ингибитор FIII < 0,6 БЕ/мл Prolongation of aPTT Reduced FVIII activity APTT mixing test — correction (ICA ≤ 15 %) FVIII inhibitor > 0.6 BU/mL
|
Семейный анамнез отягощен Чаще болеют мужчины Длительный анамнез по кровоточивости Burdened familial history Men get sick more often Long history of bleeding
|
|
Наследственная гемофилия А, ингибиторная форма Hereditary hemophilia A, inhibitory form
|
Удлинение АЧТВ Снижение активности FVIII Тест смешивания по АЧТВ — нет коррекции (ИЦА > 15 %) Ингибитор FVIII > 0,6 БЕ/мл Prolongation of aPTT Reduced FVIII activity APTT mixing test — no correction (ICA > 15 %) FVIII inhibitor > 0.6 BU/mL
|
Семейный анамнез отягощен Чаще болеют мужчины Длительный анамнез по кровоточивости Клиническое ухудшение и неэффективность заместительной терапии Burdened familial history Men get sick more often Long history of bleeding Clinical deterioration and failure of replacement therapy
|
|
Болезнь фон Виллебранда или приобретенный синдром фон Виллебранда von Willebrand disease or acquired von Willebrand syndrome
|
Удлинение АЧТВ Снижение активности FVIII, Снижение активности vWF:Ag и vWF:Rco (зависит от типа болезни фон Виллебранда) Prolongation of aPTT Reduced FVIII activity Reduced vWF:Ag and vWF:Rco activity (depending on the type of von Willebrand disease)
|
RIPA — ристоцетининдуцированная агрегация тромбоцитов vWF:FVIIIB — FVIII связывающая активность vWF vWF:CB — коллагенсвязывающая активность vWF Мультимерный анализ vWF RIPA — ristocetin-induced platelet aggregation vWF:FVIIIB — vWF: FVIII binding activity vWF:CB — vWF: collagenbinding activity vWF multimeric analysis
|
|
АФС APS
|
Удлинение АЧТВ Тест смешивания по АЧТВ — нет коррекции (ИЦА > 15 %) ВА «положительный»: может искажать результат определения активности FVIII в клоттинговых тестах Prolongation of aPTT APTT mixing test — no correction (ICA > 15 %) LA “positive”: distorts the result of determining the activity of FVIII in clotting tests
|
АЧТВ-реагент, чувствительный к эффекту ВА Тесты с разбавленным ядом гадюки Рассела (dRVVT Screen / dRVVT Confirm) и кварцевым активатором (SCT Screen / SCT Confirm) Антифосфолипидные антитела к кардиолипину IgM / IgG и бета-2- гликопротеину I IgM / IgG aPPT-reagent sensitive to the effect of LA The dilute Russell viper venom tests (dRVVT Screen / dRVVT Confirm) and quartz activator tests (SCT Screen / SCT Confirm) Antiphospholipid antibodies to anti-cardiolipin antibodies IgM / IgG and anti-β2 - glycoprotein I IgM / IgG
|
|
Дефицит факторов внутреннего пути: Дефицит FIX Дефицит FXI Дефицит FXII Deficiency of intrinsic pathway factors: FIX deficiency FXI deficiency FXII deficiency
|
Изолированное удлинение АЧТВ Снижение активности FIX Снижение активности FXI Снижение активности FXII Isolated aPTT prolongation Reduced FIX activity Reduced FXI activity Reduced FXII activity
|
Отмечается снижение активности FIX, FXI и FXII in vitro (при высоком титре ингибитора FVIII) Reduced FIX, FXI, FXII activity in vitro (with a high duration of action of the FVIII inhibitor)
|
|
Непрямые антикоагулянты (антагонисты витамина К) Indirect anticoagulant (vitamin K antagonists)
|
Влияние на ПВ (МНО) выражено сильнее, чем на АЧТВ (отмечается при передозировке препарата) Effect on PT (INR) often stronger than on aPTT (in case of drug overdose)
|
Определение ПВ (МНО) Определение активности витамин К-зависимых факторов (FII, FVII, FIX и FX) Determination of PT (INR) Determination of the activity of Vitamin K dependent factors (FII, FVII, FIX и FX)
|
|
Нефракционированный гепарин Unfractionated heparin
|
Удлинение АЧТВ Действует как «быстродействующий» ингибитор в тестах смешивания по АЧТВ — нет коррекции (ИЦА > 15 %) Prolongation of aPTT Acts as «fast acting» inhibitor in APTT mixing test — no correction (ICA > 15 %)
|
Определение тромбинового времени Определение анти-FХа активности для подтверждения или исключения действия антикоагулянтов Determination of thrombin time Anti-FXa assay to confirm or exclude anticoagulant drug action
|
|
Низкомолекулярный гепарин Low molecular weight heparin
|
Удлинение АЧТВ (отмечается при передозировке препарата) Prolongation of aPTT
|
Определение анти-FХа активности для подтверждения или исключения действия антикоагулянтов Отменить препарат и повторить исследование Anti-FXa assay to confirm or exclude anticoagulant drug action Withdraw drug and repeat testing
|
|
Прямые ингибиторы FХа Direct FXa inhibitors
|
Удлинение АЧТВ Prolongation of aPTT
|
Определение анти-FХа активности для подтверждения или исключения действия антикоагулянтов Влияние на ПВ выражено сильнее, чем на АЧТВ Отменить препарат и повторить исследование Anti-FXa assay to confirm or exclude anticoagulant drug action Effect on PT often stronger than on aPTT Withdraw drug and repeat testing
|
|
Прямые ингибиторы тромбина Direct thrombin inhibitors
|
Удлинение АЧТВ Prolongation of aPTT (in case of drug overdose)
|
Влияние на АЧТВ выражено сильнее, чем на ПВ Определение тромбинового времени Отменить препарат и повторить исследование Effect on aPTT often stronger than on prothrombin time Determination of thrombin time Withdraw drug and repeat testing
|
Примечание: МНО — международное нормализованное отношение, vWF:Ag — антиген фактора фон Виллебранда, vWF:Rco — ристоцетин-кофакторная активность фактора фон Виллебранда, RIPA — ристоцетин-индуцированная агрегация тромбоцитов, vWF:FVIIIB — фактор VIII-связывающая активность фактора фон Виллебранда, vWF:CB — коллагенсвязывающая активность фактора фон Виллебранда, dRVVT Screen/dRVVT Confirm — время свертывания с разбавленным ядом гадюки Рассела Скрининг/Подтверждение, SCT Screen/SCT Confirm — время свертывания с кварцевым активатором Скрининг/Подтверждение, ВА — волчаночный антикоагулянт.
Приложение 4
Образец протокола проведения заместительной /гемостатической терапии факторами свертывания крови в домашних условиях
Приложение 4
Образец протокола проведения заместительной /гемостатической терапии факторами свертывания крови в домашних условиях
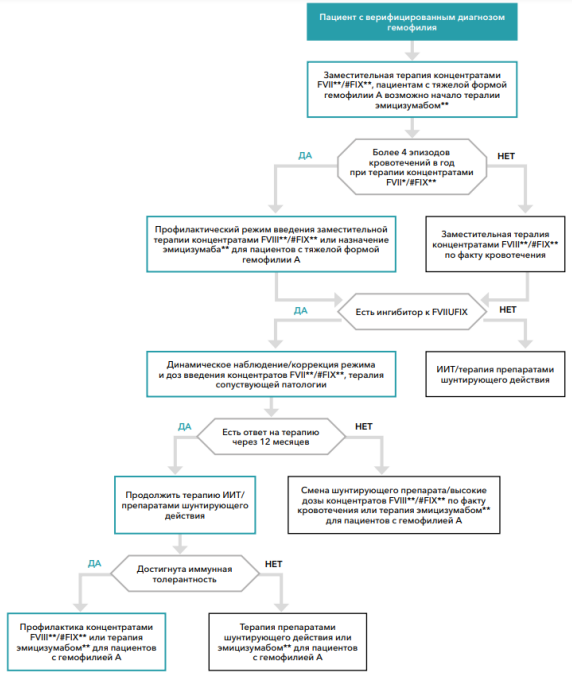
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.