Врожденный подклапанный стеноз аорты
 Версия: Клинические рекомендации РФ 2025 (Россия)
Версия: Клинические рекомендации РФ 2025 (Россия)
Врожденный субаортальный стеноз (Q24.4)
Врожденные заболевания, Кардиология детская, Кардиохирургия детская, Педиатрия
Общая информация
Краткое описание
Разработчик клинической рекомендации
Ассоциация сердечно-сосудистых хирургов России,
Всероссийская общественная организация "Ассоциация детских кардиологов России",
Общероссийская общественная организация содействия развитию лучевой диагностики и терапии
"Российское общество рентгенологов и радиологов",
Национальная ассоциация экспертов по санаторно-курортному лечению
Всероссийская общественная организация "Ассоциация детских кардиологов России",
Общероссийская общественная организация содействия развитию лучевой диагностики и терапии
"Российское общество рентгенологов и радиологов",
Национальная ассоциация экспертов по санаторно-курортному лечению
Одобрено Научно-практическим Советом Минздрава России
Клинические рекомендации
Врожденный подклапанный стеноз аорты
Год утверждения (частота пересмотра): 2025
Пересмотр не позднее: 2027
ID: 745_2
Возрастная категория: Дети
Определение заболевания или состояния (группы заболеваний или состояний)
Врожденный подклапанный стеноз аорты (ПСА) – характеризующийся препятствием току крови, располагающемся в субаортальном пространстве.
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Другие врожденные аномалии [пороки развития] сердца (Q24):
Q24.4 – Врожденный субаортальный стеноз.
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
Классификации ПСА основаны на морфологическом субстрате стеноза и ангиографической картине, а также степени выраженности гемодинамических нарушений.
Классификация врожденного ПСА по В.Н. Гетманскому [10]:
- Мембранозно-диафрагмальный;
- Валикообразный;
- Фибромускульный;
- Туннелевидный.
Более развернутый анатомический характер носит классификация, предложенная R.Freedom и соавт. (1996) [27]. Данная классификация включает следующие типы стеноза:
а) дискретная фиброзная мембрана;
б) фиброзно-мышечный туннель;
в) аномальное прикрепление хордального аппарата МК к межжелудочковой перегородке;
г) ДМЖП с дискретной субаортальной мембраной;
д) субаортальная обструкция, обусловленная смещением инфундибулярной перегородки кзади;
е) подклапанный стеноз аорты, обусловленный гипертрофической кардиомиопатией.
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Анатомическим субстратом врожденного ПСА могут являться как изменения структур подклапанного пространства АоК, так и аномалии развития расположенных рядом анатомических образований, в частности, МК. При мембранозно-диафрагмальном типе ПСА обструкция может быть вызвана наличием в ВОЛЖ циркулярной фиброзной мембраны с одним или несколькими отверстиями, или же фиброзной серповидной складки, стенозирующей выводной тракт ЛЖ. Размер отверстия в мембране может составлять от 0,5 до 1,5 см. Как правило, мембрана располагается непосредственно под ФК АоК или чуть ниже, и может крепиться вдоль основания передней створки МК и к межжелудочковой перегородке под некоронарной или правой коронарной створками [2-4].
Для валикообразного типа ПСА характерно валикообразное фиброзное утолщение, локализующееся на 0,5-2 см ниже АоК и циркулярно охватывающее ВОЛЖ. Фибромускульный тип ПСА представляет собой фиброзно-мышечный «воротник», располагающийся на 1-3 см ниже клапана Ао, имеющий контакт с передней створкой МК и охватывающий ВОЛЖ циркулярно или же в виде полулунного валика. Сужение при данном типе ПСА может носить протяженный характер и достигать 2-3 см. Достаточно часто данный тип стеноза сочетается с гипоплазией ФК АоК и фиброзным изменением створок клапана.
Туннелевидная форма врожденного ПСА по своей сути является крайней степенью выраженности выше обозначенной анатомической формы порока. Данный тип стеноза характеризуется резкой гипертрофией мышц выводного тракта ЛЖ, приводящей к образованию фиброзно-мышечного тоннеля достаточно большой протяженности (от 1 до 3 см) [2-4]. Просвет тоннеля может быть значительно сужен за счет резко утолщенных фиброзных наложений, распространяющихся от ФК АоК к передней створке МК и вдоль париетальной и септальной стенок ЛЖ. Миокард ЛЖ обычно концентрически гипертрофирован. Субэндокардиальная ишемия и фиброз встречаются также, как и при врожденном КСА [5,6]. В ряде случае может наблюдаться чрезмерная гипертрофия межжелудочковой перегородки (по сравнению с утолщением задней стенки ЛЖ) и гистологически дезориентировка мышечных волокон [7,8]. Наличие выраженной гипертрофии ЛЖ при данной обструкции ВОЛЖ в ряде клинических ситуаций диктует необходимость дифференцировки этого типа врожденного ПСА с гипертрофической кардиомиопатией с нарушением оттока из ЛЖ, что имеет большое значение для определения тактики лечения.
Различные аномалии МК также могут привести к стенозу выводного отдела ЛЖ. К таким аномалиям относят [9]:
– аномальное прикрепление передней створки МК непосредственно или посредством измененных хорд к межжелудочковой перегородке;
– дополнительная ткань на МК, которая выбухает в субаортальное пространство и образует препятствие;
– изолированное расщепление передней створки МК с дополнительными хордами, внедряющимися в межжелудочковую перегородку;
– парашютообразная деформация МК.
Подклапанный аортальный стеноз может формироваться в динамике после коррекции некоторых пороков сердца (ДМЖП, двойном отхождении магистральных сосудов от правого желудочка и др.). Вследствие изменения геометрии выходного тракта левого желудочка возможно появление турбулентного потока, который воздействует на межжелудочковую перегородку, что может привести к формированию ПСА [62].
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Согласно данным литературы доля врожденного ПСА среди всех ВПС составляет 1-1,5%, а среди всех обструктивных поражений ВОЛЖ – от 10 до 31,2% [2,5,10-15]. Потребность в хирургической коррекции врожденного ПСА в РФ составляет 0,59% со средней летальностью 1,06% среди всех операций по поводу ВПС [16]
Отмечено более частое (в 1,5-2 раза) развитие субаортального стеноза у мужчин [2,11,17]. ПСА сочетается с другими пороками сердца в 20-88 % случаев [2,5,6,18-22]. Из сопутствующих ВПС чаще всего отмечается сочетание ПСА с двустворчатым АоК, КСА, коарктацией Ао, ОАП, ДМЖП, тетрадой Фалло, полной формой атриовентрикулярной коммуникации [2,5,6,18-21]. В половине случаев диагностированного ПСА имеет место прогрессирующая недостаточность АоК, обусловленная нарушениями гемодинамики при наличии порока [23-25]. Это обусловлено тем, что высокоскоростная струя крови, протекающая через стеноз, травмирует аортальный клапан. Снижение диастолического давления в аорте при аортальной регургитации снижает коронарную перфузию. Это снижение коронарной перфузии и увеличение потребности левого желудочка в кислороде делает миокард левого желудочка склонным к ишемическому повреждению.
Кроме того, врожденный ПСА может являться составляющим компонентом синдрома Shone [26].
Врожденный ПСА в изолированной форме редко встречается в периоде новорожденности и у грудных детей, а клинические симптомы чаще проявляются в возрасте старше 1 года. Скорость прогрессирования подклапанного аортального стеноза вариабельна и непредсказуема у детей, в то время как у взрослых она прогрессирует медленно. Свидетельством редкой встречаемости изолированного врожденного ПСА у новорожденных и детей первого года жизни является крайне малое количество операций, выполняемых по поводу его устранения в данной возрастной группе [27-29].
В более старшем детском возрасте и даже у взрослых изолированный врожденный ПСА может протекать достаточно длительно без клинических проявлений [2,31,32]. У пациентов старше 30 лет врожденный ПСА также встречается редко. Считается, что выживание после этого времени без хирургического вмешательства является нечастым или, что повреждение постепенно приобретает внешний вид гипертрофической обструктивной кардиомиопатии с миокардиальной недостаточностью [3,33,34].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Небольшое число наблюдений ПСА в грудном возрасте и увеличение количества больных в возрасте старше года указывают на прогрессирующий характер заболевания, однако, темп прогрессирования стеноза у разных пациентов отличается.
При отсутствии лечения прогрессирование заболевания может привести к гипертрофии ЛЖ, аритмии, АН, эндокардиту, внезапной сердечной смерти. Клиническая картина в раннем детском возрасте в большинстве случаев «маскируется» сопутствующим ВПС. Очень часто ПСА обнаруживается при обследовании по поводу сопутствующих ВПС. В 25% случаях ПСА протекает бессимптомно.
Основными жалобами являются: одышка, повышенная утомляемость, потливость, отставание в развитии. У больных старшего возраста появляются такие симптомы, как: синкопальные состояния, обусловленные уменьшением церебральной перфузии; боли в сердце, обусловленные относительной коронарной недостаточностью; застойная сердечная недостаточность.
Данные симптомы встречаются у пациентов с умеренной или тяжелой степенью обструкции ВОЛЖ и ГСД между ЛЖ/Ао более 50 мм.рт.ст. Однако, в большинстве случаев клиническая картина отсутствует, даже не смотря на значительный ГСД между ЛЖ/Ао.
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Диагноз ПСА верифицируется на основании сбора анамнеза у родителей пациентов и/или самих пациентов (в зависимости от возраста), клинических проявлений порока, а также инструментальных методов исследования. Диагноз может быть поставлен врачом – детским кардиологом на основе жалоб и исследований (ЭКГ и ЭхоКГ) в амбулаторных условиях.
Основополагающим в диагностике ПСА является обнаружение гемодинамически значимого сужения выходного отдела левого желудочка (ВОЛЖ). Наиболее приемлемой гемодинамической классификацией степени стеноза ВОЛЖ является градация, основанная на величинах максимального ГСД ЛЖ/Ао. Согласно этой классификации, все пациенты могут быть распределены на 3 клинические группы [10]:
- Минимальный подклапанный стеноз аорты – ГСД ЛЖ/Ао до 30 мм рт.ст.;
- Умеренный подклапанный стеноз аорты – ГСД ЛЖ/Ао – 30-50 мм рт.ст.;
- Тяжелый подклапанный стеноз аорты – ГСД ЛЖ/Ао > 50 мм рт.ст.
1. Жалобы и анамнез
- На этапе диагностики рекомендуется сбор анамнеза и жалоб у всех пациентов (родителей пациентов) с подозрением на ПСА [2,3,5,6,10-12].
(УУР С, УДД 4)
- При сборе анамнеза и жалоб рекомендуется расспросить родителей пациента о наличии у ребенка повышенной утомляемости, одышки (особенно при физической активности), приступах сердцебиения, возникновении синкопальных состояний с целью оценки степени тяжести состояния пациента [2,5,6,10-12].
(УУР С, УДД 4)
Комментарии: как уже было сказано выше ПСА достаточно редко проявляется у детей в возрасте до года. Как правило, в этой возрастной группе порок является сопутствующей кардиальной патологией, и клиника порока определяется «доминирующим» ВПС (ДМЖП, аномалии МК, атриовентрикулярная коммуникация). В более старшем детском возрасте и даже у взрослых изолированный врожденный ПСА может протекать достаточно длительно без клинических проявлений [2,5,6,10-12]. Одним из плохих прогностических признаков течения порока является наличие в анамнезе приступов потери сознания. При выраженной обструкции при физической нагрузке сердечный выброс снижается, что приводит к снижению артериального давления и церебральной перфузии, пресинкопальным и синкопальным состояниям. У детей обмороки и предобморочные состояния встречаются редко. Чаще причиной синкопальных состояний являются нарушения ритма сердца. Снижение коронарной перфузии в сочетании с увеличением потребности в кислороде при нагрузке вызывает стенокардию у 25% пациентов с симптомами обструкции выходного тракта левого желудочка. Возникновение обморочных состояний является абсолютным показанием к хирургической коррекции порока.
2. Физикальное обследование
- Рекомендуется всем пациентам с подозрением на ПСА проведение приема (осмотра, консультации) врача-детского кардиолога первичного и/или приема (осмотра, консультации) врача-сердечно-сосудистого хирурга первичного с целью установления диагноза [2,5,6,10-12].
(УУР С, УДД 5)
- Рекомендуется во время физикального обследования проводить пальпацию и перкуссию области сердца и сосудов шеи с целью выявления дополнительных признаков порока [2,5,6,10-12].
(УУР С, УДД 4)
Комментарии: При обследовании пациентов может отмечаться перкуторное расширение границ сердца влево вследствие гипертрофии ЛЖ, а при пальпации определяется разлитой верхушечный толчок. В ряде случаев на основании сердца пальпаторно определяется систолическое дрожание, передающееся в яремную ямку и по ходу сонных артерий.
- Рекомендуется во время физикального обследования проводить аускультацию сердца и сонных артерий с целью оценки степени выраженности ПСА [2,5,6,10-12].
(УУР С, УДД 4)
Комментарии: Аускультативная картина врожденного ПСА характеризуется: 1) наличием грубого систолического шума с максимумом во II-III межреберье справа и иррадиацией в сонные артерии, иногда вдоль левого края грудины к верхушке сердца; Продолжительность шума прямо пропорциональна степени обструкции. 2) присутствием у части пациентов диастолического шума регургитации на АоК. 3) Отсутствием при изолированном подклапанном аортальном стенозе щелчка изгнания, что является важным отличительным признаком от шума при стенозе аортального клапана.
3. Лабораторные диагностические исследования
У пациентов с ПСА лабораторная диагностика не имеет специфичности.
- Всем пациентам с ПСА рекомендуется проведение общего (клинического) анализа мочи и общего (клинического) анализа крови с исследованием уровня общего гемоглобина в крови и оценкой гематокрита, исследованием уровня эритроцитов, лейкоцитов, тромбоцитов в крови, исследованием скорости оседания эритроцитов в рамках первичного обследования, при поступлении в стационар, в т.ч. для оперативного лечения, в процессе динамического наблюдения не менее 1 раза в год, а также в послеоперационном периоде [2,43,44,63].
(УУР C, УДД 5)
Комментарии: Проведение общего (клинического) анализа крови всем пациентам с ПСА при диспансерном наблюдении и перед проведением хирургического лечения важно с позиции выявления анемии и ее своевременной коррекции. У пациентов со средним объемом эритроцитов менее 80 фл целесообразно исследование уровня железа, трансферрина сыворотки крови, ферритина в крови, и обшей железосвязываюшей способности сыворотки с целью своевременной коррекции железодефицитных состояний. У пациентов со средним объемом эритроцитов более 100 фл целесообразно определение уровня витамина B12 (цианокобаламин) в крови и исследование уровня фолиевой кислоты в сыворотки крови с целью своевременной коррекции B12- или фолиеводефицитных состояний. Указанные выше состояния способны негативно отразиться на клинико-функциональном статусе и характере течения заболевания пациента, а также результатах оперативного лечения [63-65].
- Рекомендуется проведение анализа крови биохимического общетерапевтического (исследование уровня калия, натрия, хлоридов, глюкозы, креатинина, общего белка, альбумина, мочевины, общего и связанного (конъюгированного) билирубина, мочевой кислоты в крови, железа в сыворотке крови определение активности аспартатаминотрансферазы и аланинаминотрансферазы в крови) для оценки почечной и печеночной функции всем пациентам с ПСА в рамках первичного обследования, при поступлении в стационар, в т.ч. для оперативного лечения, в процессе динамического наблюдения не менее 1 раза в год, а также в послеоперационном периоде [2,38,43,44,63].
(УУР С, УДД 5)
- Рекомендуется исследование уровня N-терминального фрагмента натрийуретического пропептида мозгового (NT-proBNP) в крови всем пациентам с ПСА в рамках первичного обследования в т.ч. перед оперативным вмешательством, в процессе динамического наблюдения не менее 1 раза в год при условии наличия сердечной недостаточности, а также в послеоперационном периоде при необходимости (при сохраняющихся признаках сердечной недостаточности) [65-72].
(УУР С, УДД 4)
- Рекомендуется всем пациентам с ПСА, поступающим в стационар для оперативного лечения выполнение коагулограммы (ориентировочное исследование системы гемостаза) (оценка активированного частичного тромбопластинового времени, определение международного нормализованного отношения, исследование уровня фибриногена крови) с целью исключения врожденных и приобретенных нарушений в системе свертывания крови, прогноза послеоперационных тромбозов и кровотечений [50,73-75].
(УУР С, УДД 5)
Комментарии: при наличии лабораторных признаков нарушения системы гемостаза хирургическое вмешательство разумно отсрочить до момента выявления причин данных нарушений и их устранения.
- Всем пациентам с ПСА, которым после оперативного лечения проводится тромбопрофилактика препаратами нефракционированного или низкомолекулярного гепарина (антитромботические средства; группа гепарина), рекомендуется лабораторный контроль за терапией лекарственными препаратами (прямыми антикоагулянтами) [50,74,76,77].
(УУР В, УДД 3)
Комментарии: При применении нефракционированного гепарина натрия** (препаратов из группы гепарина) необходимо определение АЧТВ (оптимальный диапазон значений у взрослых – 40-60 с, у детей – 60-85 сек) и исследование уровня гепарина в крови (анти-Xа активности) (оптимальный диапазон – 0,35-0,7). До момента достижения оптимального диапазона их определение производят через 4 часа после каждого изменения скорости инфузии. После достижения оптимального диапазона – 1 раз в 12 часов (см. приложение А3). При применении препаратов низкомолекулярного гепарина (группа гепарина) необходимо исследование уровня гепарина в крови (определение анти-Xа активности) (оптимальный диапазон – 0,5-1,0). До достижения оптимального диапазона ее определение производят через 3-4 часа после каждой инъекции, после достижения оптимального диапазона при стабильном клинико-лабораторном состоянии пациента мониторинг не требуется [50,74,76,77].
- Рекомендуется всем пациентам с ПСА, поступающим в стационар для оперативного лечения, определение основных групп крови по системе AB0, антигена D системы Резус (резус-фактор), определение фенотипа по антигенам C, c, E, e, Cw, K, k и определение антиэритроцитарных антител [79].
(УУР С, УДД 5)
- Рекомендуется всем пациентам с ПСА, поступающим в стационар для оперативного лечения определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови; определение антител к вирусу гепатита C (Hepatitis C virus) в крови; определение антител к бледной трепонеме (Treponema pallidum) в крови; определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV-1) в крови; определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-2 (Human immunodeficiency virus HIV-2) в крови для исключения ассоциации с ВИЧ-инфекцией, гепатитом и сифилисом [29,38,49].
(УУР С, УДД 5)
4. Инструментальные диагностические исследования
- Рекомендуется всем пациентам с подозрением на ПСА регистрация электрокардиограммы с целью выявления нарушений ритма сердца, а также признаков перегрузки различных отделов сердца [2,5,6,10-12].
(УУР С, УДД 5)
Комментарии: ЭКГ при незначительно или умеренно гемодинамически выраженном ПСА может быть не изменена. При наличии гемодинамически значимого подклапанного сужения Ао появляются признаки перегрузки и гипертрофии левых отделов сердца. Кроме этого могут быть выявлены нарушения ритма сердца.
- Рекомендуется всем пациентам с ПСА при выполнении прицельной рентгенографии органов грудной клетки по клиническим показаниям обращать внимание на размеры конфигурации сердца и состояние малого круга кровообращения [2,5,6,10-12].
(УУР С, УДД 5)
Комментарии: Рентгенологическая картина врожденного ПСА характеризуется усилением легочного рисунка и увеличением размеров левых отделов сердца (при наличии гемодинамически значимого подклапанного сужения) и не имеет специфических признаков, за исключением отсутствия при нем расширения восходящей Ао.
- Рекомендуется всем пациентам с подозрением на наличие ПСА выполнение эхокардиографии [2,4-6,10-12,15,18-20,31-33].
(УУР С, УДД 4)
Комментарии: Выполнение эхокардиографического исследования пациентам с подозрением на ПСА позволяет определить морфологическую форму порока и оценить степень выраженности стеноза, а также выявить сопутствующую кардиальную патологию. Основными позициями для визуализации ВОЛЖ являются: левая парастернальная позиция в проекции по длинной оси ЛЖ, апикальная 5-ти камерная позиция, а также субкостальный доступ в проекции по длинной оси ВОЛЖ. При выполнении ЭХО-КГ исследования определяют морфологию и степень обструкции, размеры ВОЛЖ и ФК АоК, восходящей Ао, функцию ЛЖ и сопутствующие ВПС. При определении степени стеноза ВОЛЖ оценивается пиковый и средний градиент давления. Обязательно производят оценку степени гипертрофии миокарда ЛЖ и состояния эндокарда – наличие/отсутствие фиброэластоза.
Степень субаортального стеноза может быть недооценена или переоценена при наличии ДМЖП, так как шунтирование крови через дефект может искажать истинный градиент давления между ЛЖ и Ао.
Проведение чреспищеводной эхокардиографии в диагностических целях иногда может быть полезно у пациентов с узким акустическим окном, когда результаты трансторакального исследования неудовлетворительны. В некоторых случаях гипертрофированная межжелудочковая перегородка, может скрывать наличие субаортальной мембраны. В таких случаях чреспищеводная эхокардиография может быть использована для точной диагностики субаортальной мембраны и позволяет отличить подклапанный аортальный стеноз от гипертрофированной межжелудочковой перегородки [81].
- Рекомендуется пациентам с диагностированным ПСА и значением максимального градиента систолического давления между ЛЖ и Ао менее 50 мм рт.ст. в сочетании с симптомами одышки и утомляемости проведение ЭхоКГ с физической нагрузкой [2,5,6,11,12].
(УУР С, УДД 5)
Комментарии: Проведение теста с физической нагрузкой может зафиксировать увеличение градиента систолического давления между ЛЖ и Ао, что может привести к изменению тактики ведения пациента.
- Рекомендуется пациентам с ПСА в критическом состоянии и/или в рамках подготовки к оперативному лечению выполнить компьютерную томографию сердца с контрастированием [2,37].
(УУР С, УДД 5)
Комментарии: Выполнение компьютерной томографии сердца с контрастированием применяется в качестве дополнения к эхокардиографии, а также в качестве альтернативы инвазивным методам исследования для уточнения морфологии порока, оптимизации хирургической техники, а также для трехмерного моделирования предстоящей операции. Проведение КТ диагностики показано для уточнения анатомии у пациентов с многокомпонентной обструкцией левых камер сердца, улучшения визуализации и 3D реконструкции восходящей аорты, дуги и перешейка аорты. Также проведение КТ показано у пациентов с ПСА после коррекции других пороков сердца. Приоритетное значение томографических методик у детей заключается в превосходном пространственном разрешении экстракардиальных структур [36,37].
- Выполнение ретроградной катетеризации левых отделов сердца и левой вентрикулографии сердца рекомендуется пациентам с ПСА в сочетании с другими кардиальными пороками при недостаточности данных ЭхоКГ или данных компьютерной томографии сердца с контрастированием [2,5,6,10-12,35].
(УУР С, УДД 5)
Комментарии: При изолированном подклапанном стенозе катетеризация не является рутинным методом обследования. Выполнение ретроградной катетеризации левых отделов сердца и левой вентрикулографии может быть полезно при наличии нескольких уровней обструкции для уточнения локализации и преимущественного уровня обструкции ВОЛЖ, определения гемодинамических параметров стеноза, степени аортальной регургитации, для исключения значительного поражения коронарных артерий [82]. Ангиографическая картина врожденного ПСА характеризуется наличием в подклапанном пространстве дефектов заполнения в виде поперечного тяжа, или светлой полосы, располагающейся по всей окружности ВОЛЖ, или же тубулярного сужения с неравномерными краевыми дефектами наполнения. Нередко при валикообразном и фибромускульном типе ПСА визуализируется подклапанный карман, так называемый «второй желудочек» – пространство, расположенное между клапаном Ао и суживающим субстратом. Абсолютным признаком наличия врожденного ПСА является обнаружение ГСД между ЛЖ и подклапанным пространством [2,10-12,35].
5. Иные диагностические исследования
- Рекомендуется перед выпиской из стационара всем пациентам с целью контроля после выполненного оперативного вмешательства выполнить регистрацию электрокардиограммы с целью выявления возникших нарушений ритма сердца [2,5,6,10-12].
(УУР С, УДД 5)
- Рекомендуется перед выпиской из стационара всем пациентам с целью контроля после выполненного оперативного вмешательства выполнить ЭхоКГ [2,5,6,10-12].
(УУР С, УДД 5)
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
1. Консервативное лечение
- В раннем послеоперационном периоде после хирургического лечения ПСА у пациентов высокого риска тромбоза рекомендуется проведение тромбопрофилактики препаратами низкомолекулярного или нефракционированного гепарина (антитромботические средства; группа гепарина) [50,74,76,77].
(УУР В, УДД 3)
Комментарии: К группе высокого риска тромбозов относятся пациенты с эпизодами тромбозов в анамнезе, тромбофилиями, инфекционными осложнениями, сердечной и полиорганной недостаточностью [74].
Тромбопрофилактика гепарином натрия** должна быть инициирована болюсом, который у взрослых составляет 80 Ед/кг, у детей – 75 Ед/кг с последующей внутривенной инфузией со скоростью: у детей младше 1 года – 28 Ед/кг/ч, у детей старше 1 года – 20 Ед/кг/ч (противопоказание – новорожденные, в особенности недоношенные или имеющие низкую массу тела (в связи с наличием в составе препарата бензилового спирта, который может вызвать токсические и анафилактоидные реакции у младенцев и детей до 3 лет)). Коррекция дозы производится на основании результатов лабораторных исследований (см. п 2.3, приложение А3) [76].
Тромбопрофилактика препаратами низкомолекулярного гепарина (группа гепарина) проводится из расчета: #эноксапарин натрия** (off-label у детей до 18 лет) у детей младше 2 месяцев – 0,75 мг/кг, у детей старше 2 месяцев – 0,5 мг/кг через 12 часов подкожно, #далтепарин натрия – у детей от 1 месяца до 2 лет 150 Ед/кг, от 2 до 8 лет – 125 Ед/кг, старше 8 лет – 100 Ед/кг, через 12 часов подкожно. #Фондапаринукс натрия может применяться у детей старше 1 года (off-label у детей до 17 лет) в дозе 0,1 мг/кг, у взрослых 2,5 мг в сутки подкожно. Коррекция дозы производится на основании результатов лабораторных исследований (см. п 2.3) [50,74,76,77].
- Пациентам с ПСА после выполнения коррекции порока с протезированием аортального клапана рекомендуется пожизненная тромбопрофилактика [50,54,64,74,76,77].
(УУР B, УДД 3)
Комментарии: В раннем послеоперационном периоде тромбопрофилактика должна осуществляться препаратами нефракционированного или низкомолекулярного гепарина (антитромботические средства; группа гепарина) (см. выше). В дальнейшем выбор метода тромбопрофилактики зависит от типа протеза клапана. После имплантации механического протеза (протез аортального клапана механический двустворчатый***) показано применение антагонистов витамина К (варфарин** назначается у детей старше 3-х лет с начальной дозы 0,2 мг/кг в сутки и дальнейшей ее коррекцией под контролем МНО (первый контроль через 3 дня после начала приема варфарина**, далее ежедневно до достижения устойчивых целевых значений на протяжении не менее одной недели, после чего 1-2 раза в неделю). Оптимальный диапазон МНО составляет 2,0-3,0 [50]. После имплантации биологического клапана (биопротез сердечного аортального клапана***) при отсутствии у пациента факторов риска тромбозов на протяжении 3 месяцев показан прием антагонисты витамина К (оптимальное МНО – 2,0-3,0), а в дальнейшем – #ацетилсалициловая кислота** в дозе 1-5 мг/кг (противопоказание в роли антиагреганта – детский возраст) [50,76]. У пациентов высокого риска тромбозов после имплантации биологического клапана (биопротез сердечного аортального клапана***) показан постоянный прием антагонистов витамина К (оптимальное МНО – 2,0-3,0 [50].
2. Хирургическое лечение
- Пациентам с врожденным ПСА рекомендуется хирургическое вмешательство при максимальном значении пикового градиента систолического давления между ЛЖ и Ао – 50 мм рт.ст. и более или значении среднего градиента систолического давления между ЛЖ и Ао – 30 мм рт.ст. и более, полученных при допплеровском эхокардиографическом исследовании [2,5,6,10-12].
(УУР С, УДД 5)
- Пациентам с врожденным ПСА при наличии обмороков, симптомов стенокардии рекомендуется рассмотреть хирургическое вмешательство в качестве опции выбора даже при значении пикового градиента систолического давления между ЛЖ и Ао менее 50 мм рт.ст. и значении среднего градиента систолического давления между ЛЖ и Ао менее 30 мм рт.ст. [83-85].
(УУР С, УДД 5)
- Пациентам с врожденным ПСА, сочетающимся с прогрессирующей аортальной регургитацией от умеренной к выраженной и увеличением размеров ЛЖ, рекомендуется хирургическое вмешательство при максимальном значении пикового градиента систолического давления между ЛЖ и Ао менее 50 мм рт.ст. и среднем значении градиента систолического давления между ЛЖ и Ао ниже 30 мм рт.ст. [2,5,6,10-12,24,25].
(УУР С, УДД 5)
- Бессимптомным пациентам с врожденным ПСА при наличии изменений сегмента ST в покое и при нагрузке, прогрессировании гипертрофии левого желудочка рекомендуется рассмотреть хирургическое вмешательство в качестве опции выбора даже при значении пикового градиента систолического давления между ЛЖ и Ао менее 50 мм рт.ст. и значении среднего градиента систолического давления между ЛЖ и Ао менее 30 мм рт.ст. [83-86].
(УУР С, УДД 5)
- Хирургическое лечение врожденного ПСА рекомендуется пациентам при максимальном градиенте систолического давления между ЛЖ и Ао менее 50 мм рт.ст. и среднем градиенте давления менее 30 мм рт.ст. в случае прогрессирующей от умеренной к выраженной регургитации на МК [2,5,6,10-12].
(УУР С, УДД 5)
- Пациентам с врожденным ПСА в случае снижения фракции выброса левого желудочка менее 50% рекомендуется рассмотреть хирургическое вмешательство в качестве опции выбора даже при максимальном градиенте систолического давления между ЛЖ и Ао менее 50 мм рт.ст. и значении среднего градиента систолического давления между ЛЖ и Ао менее 30 мм рт.ст. [2,5,6,10-12,87].
(УУР С, УДД 5)
- Для хирургического лечения дискретного субаортального стеноза рекомендуется выполнение операции иссечения подаортальной мембраны или миоэктомии (иссечение подаортальной фиброзной мембраны в условиях искусственного кровообращения, миэктомия по Морроу (Morrow) в условиях искусственного кровообращения) [2,5,10,14,17,38-40].
(УУР С, УДД 4)
Комментарии: Потенциальными осложнениями подобных хирургических вмешательств являются: травмы АоК или МК, развитие нарушений ритма сердца в виде атриовентрикулярной блокады 3 степени, появление ятрогенного ДМЖП. Однако, при соблюдении всех правил техники выполнения вмешательства риск возникновения таких осложнений может быть сведен к минимуму. Выживаемость в 15-летний срок после операции составляет от 85 до 95% среди больных, оперированных по поводу дискретного субаортального стеноза [23,40].
- При наличии тоннельной формы субаортального стеноза без вовлечения в патологический процесс АоК и отсутствии гипоплазии его ФК пациентам рекомендуется выполнение модифицированной операции Konno (операция Коно (Коnо) в условиях искусственного кровообращения) без протезирования АоК [2,5,6,10,40,41,42].
(УУР С, УДД 4)
- Пациентам c диагностированным ПСА и сопутствующей гемодинамически значимой аортальной регургитацией и/или стенозом и гипоплазией ФК АоК рекомендуется выполнение операций типа Ross-Konno, Konno-Rastan [2,5,6,10,21,40,42].
(УУР С, УДД 5)
3. Эндоваскулярные вмешательства
- При некоторых видах дискретных стенозов подклапанного пространства (изолированной тонкой дискретной мембране толщиной не более 3 мм) рекомендуется рассмотреть в качестве альтернативы открытому хирургическому вмешательству – возможность выполнения транслюминальной баллонной дилатации ПСА (транслюминальная баллонная вальвулопластика клапанного стеноза аорты) [46].
(УУР С, УДД 4)
Комментарии: По данным некоторых авторов [De Lezo J.S. с соавт., 2011], альтернативой открытому хирургическому вмешательству является баллонная дилатация ПСА (транслюминальная баллонная вальвулопластика клапанного стеноза аорты). В исследовании представлены результаты лечения ПСА путем баллонной дилатации у 76 пациентов в возрасте на момент операции от 2 до 67 лет (в среднем 19±16 лет), из них 39 пациентов были детьми, 17 пациентов – подростками и 20 пациентов – взрослыми. В 77% случаях отмечались хорошие непосредственные и отдаленные результаты: снижение ГСД между ЛЖ/Ао, частоты рестенозов, отсутствие повторных вмешательств. Ограничением к использованию данной методики, по мнению авторов, является морфологический субстрат ПСА, который должен быть представлен изолированной тонкой дискретной мембраной толщиной не более 3 мм [46].
4. Иное лечение
Нет
Медицинская реабилитация
Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
- Рекомендуется пациентам с ПСА модификация образа жизни для повышения физической активности с целью первичной профилактики сердечно-сосудистых факторов риска (артериальной гипертензии, ожирения, сахарного диабета), а также для интеграции в нормальную социальную жизнь, за исключением детей со сложным ПСА или другими факторами риска (наличие кардиостимулятора (электрокардиостимулятор имплантируемый двухкамерный, частотно-адаптивный***), кардиовертер-дефибрилятор (кардиовертер-дефибриллятор имплантируемый двухкамерный***; кардиовертер-дефибриллятор имплантируемый трехкамерный (бивентрикулярный)***), каналопатии и др.) [91-100].
(УУР C, УДД 4)
Комментарий: Благодаря внедрению усовершенствованных хирургических и интервенционных методов, в том числе периоперационной интенсивной терапии, выживаемость детей с ВПС заметно улучшилась за последние десятилетия, что привело к увеличению числа доживших до взрослого возраста [92]. По мере взросления пациентов с ВПС на здоровье их сердца могут дополнительно влиять приобретенные сердечно-сосудистые факторы риска (например, артериальная гипертензия, ожирение, диабет), обычно встречающиеся в общей популяции, что увеличивает риск метаболических заболеваний, инсульта и ишемической болезни сердца [93,94]. Известно, что развитие атеросклеротических и метаболических заболеваний, проявляющихся во взрослом возрасте, обычно начинается уже в раннем детстве. Известно, что детское ожирение и малоподвижный образ жизни являются основными способствующими факторами [95]. Это подчеркивает необходимость первичной профилактики, поэтому необходимы вмешательства в образ жизни для повышения физической активности (ФА) детей с ВПС, поскольку физическая активность незаменима для физического, эмоционального и психосоциального развития детей [96–100].
- Детям с легкой степенью ПСА рекомендуется ежедневная физическая активность, определенная ВОЗ на уровне > 60 минут, без ограничений, а также участие во всех видах развлекательных/соревновательных видов спорта с обязательной оценкой тяжести КСА не реже одного раза в год [58,102].
(УУР С, УДД 5)
- Детям с умеренной степенью ПСА рекомендуется ежедневная физическая активность средней и низкой интенсивности, а также занятия динамическими и статическими видами спорта низкой и средней интенсивности, за исключением соревновательных видов спорта, если нагрузочное тестирование демонстрирует удовлетворительную толерантность к физической нагрузке [58,102].
(УУР С, УДД 5)
- Детям с тяжелым ПСА рекомендуется занятия только низкоинтенсивными динамическими и статическими видами спорта и физической активностью в зависимости от симптомов и результатов нагрузочного теста, с исключением соревновательных видов спорта [102].
(УУР С, УДД 5)
- Рекомендуется в течение 6 месяцев после выполнения хирургической коррекции ПСА в условиях искусственного кровообращения (иссечение подаортальной фиброзной мембраны в условиях искусственного кровообращения; миэктомия по Морроу (Morrow) в условиях искусственного кровообращения; операция Коно (Коnо) в условиях искусственного кровообращения) пациенту с осложнённым течением послеоперационного периода (НК, инфекционные осложнения, повторные хирургические вмешательства в течение одной госпитализации) направление в специализированные санаторно-курортные учреждения кардиологического профиля, детские реабилитационные центры для проведения медицинской реабилитации, включающей климатотерапию, бальнеотерапию, физиотерапевтические и кинезиологические методы лечения [47,57].
(УУР С, УДД 5)
Комментарии: После коррекции ПСА могут встречаться следующие состояния:
- Резидуальный гемодинамически значимый ГСД ЛЖ/Ао;
- Рецидив обструкции подклапанного пространства;
- Развитие и/или прогрессирование аортальной регургитации на фоне естественного течения порока или вследствие повреждения АоК при иссечении стеноза ВОЛЖ [23-25];
- Развитие и/или прогрессирование митральной регургитации на фоне естественного течения порока или вследствие повреждения МК при хирургической коррекции ПСА [23-25];
- Образование ятрогенного ДМЖП при иссечении подклапанной обструкции;
- Развитие нарушений ритма сердца в виде атриовентрикулярной блокады 3 ст., приводящее, в свою очередь, к необходимости имплантации электрокардиостимулятора (электрокардиостимулятор имплантируемый двухкамерный, частотно-адаптивный***).
- Развитие протез-зависимых осложнений (эндокардит, тромбоз, системные эмболии, парапротезная регургитация или окклюзия, связанная с развитием паннуса) – при имплантации механических протезов (протез аортального клапана механический двустворчатый***) во время аортовентрикулопластики (операция Коно (Коnо) в условиях искусственного кровообращения) [2,5,6,10,12,38,41,42];
- Дилатация неоаортального клапана с развитием гемодинамически значимой регургитации после выполнения операции Ross;
- Стеноз/окклюзия неолегочного ствола после выполнения операции Ross;
- Развитие ишемии миокарда, обусловленное окклюзией/перегибом реимплантированных коронарных артерий при операции Ross;
- Развитие нарушений ритма сердца, в ряде случаев приводящее к внезапной сердечной смерти [1,4,57].
- Рекомендуется ограничить физическую нагрузку всем пациентам в течение трех месяцев с момента выписки из стационара в случае хирургического лечения порока [47].
(УУР С, УДД 5)
Комментарий: интенсивные физические нагрузки, соревновательные нагрузки исключены в течение 6 месяцев после оперативного лечения. Дальнейшее ограничение активности зависит от степени остаточных гемодинамических нарушений. Ограничения физической активности сохраняются более 6 месяцев при: 1) Клинически значимой резидуальной обструкции выходного тракта левого желудочка (пиковый градиент ЛЖ/Ао более 50 мм рт. ст.); 2) Выраженной гипертрофии миокарда левого желудочка; 3) Клинически значимых желудочковых или наджелудочковых аритмиях; 4) Более чем легкой аортальной регургитации [86].
- Рекомендуется включение детей с ПСА после хирургического лечения в программы кардиореабилитации аэробных и резистивных тренировок [57-59].
(УУР В, УДД 3)
- Рекомендуется направление на санаторно-курортное лечение детей с ПСА до II степени без нарушения гемодинамики, без прогностически значимых нарушений сердечного ритма и проводимости [60,61].
(УУР С, УДД 5)
Комментарий: на климатических и бальнеологических курортах проводится комплексное санаторно-курортное лечение, включающее: гелиовоздействие (А20.30.021), воздействие климатом (А20.30.012), ванны суховоздушные (А20.30.022), ванны местные (2-4 камерные) лечебные (А20.30.009).
Госпитализация
Организация оказания медицинской помощи
Показания для госпитализации в медицинскую организацию:
1) наличие симптомов сердечной недостаточности;
2) плановое оперативное лечение ПСА, в том числе и в сочетании с другими внутри- и внесердечными аномалиями;
3) коррекция показателей свертывающей системы крови при необходимости выполнения хирургических манипуляций/вмешательств у пациентов с имплантированными в аортальную позицию механическими протезами клапанов сердца
Показания для экстренной госпитализации:
1) ухудшение функционального статуса пациента в связи с прогрессированием симптомов недостаточности кровообращения, нарушениями ритма сердца;
2) развитие кровотечений у пациентов с имплантированными протезами;
3) острая дисфункция/тромбоз протеза;
4) развитие острой коронарной недостаточности (после операции Ross-Konno);
5) развитие дисфункции ЛЖ;
6) инфекционный эндокардит.
Показания к выписке пациента из медицинской организации:
1) отсутствие значимого ГСД ЛЖ/Ао ВОЛЖ или имплантированном протезе клапане;
2) отсутствие/компенсация симптомов недостаточности кровообращения;
3) отсутствие гемодинамически значимых нарушений ритма сердца;
4) подобранная антикоагулянтная терапия (при наличии имплантированных протезов).
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- Рекомендуется диспансерное наблюдение врача-детского кардиолога (диспансерный прием (осмотр, консультация) врача-детского кардиолога) всем оперированным или неоперированным пациентам с диагностированным ПСА [2,5,6,10,12,47].
(УУР С, УДД 5)
- Детям и подросткам со средним допплеровским градиентом менее 30 мм рт.ст. с отсутствием гипертрофии левого желудочка и симптомов рекомендуется диспансерное наблюдение без хирургического вмешательства [84,88-89].
(УУР С, УДД 4)
- Пациентам с умеренной и тяжелой степенью выраженности ПСА согласно гемодинамической классификации не рекомендуются интенсивные физические нагрузки, соревновательные нагрузки [2,5,6,10,12,47].
(УУР С, УДД 5)
- Неоперированным асимптомным пациентам с диагностированным ПСА и значением пикового градиента систолического давления между ЛЖ и Ао 30-50 мм рт.ст., без признаков гипертрофии ЛЖ или гемодинамически значимой регургитации на АоК рекомендуется выполнение планового обследования (ЭКГ, ЭхоКГ) 1 раз в год [6,10,12,47].
(УУР С, УДД 5)
Комментарии: Младенцы и дети раннего возраста должны наблюдаться чаще (каждые 3-6 месяцев), чтобы понять скорость прогрессирования, поскольку подклапанный аортальный стеноз является прогрессирующим заболеванием.
Основной целью плановых ежегодных осмотров является контроль нарастания степени стеноза, развития или прогрессирования аортальной регургитации и оценки систолической функции ЛЖ.
- Пациентам с ПСА после хирургического лечения рекомендуется осмотр врача-детского кардиолога (диспансерный прием (осмотр, консультация) врача-детского кардиолога) с частотой не менее 1 раза в 7 дней в течение первого месяца после коррекции порока [47].
(УУР С, УДД 5)
- Пациентам с ПСА после хирургического лечения рекомендуется осмотр врача-детского кардиолога с частотой не менее 1 раза в 3 месяца в течение 2-12 месяцев после коррекции порока [47].
(УУР С, УДД 5)
- Пациентам с ПСА после хирургической коррекции рекомендуется проведение динамического (1 раз в год при стабильном клиническом состоянии) эхокардиографического обследования или выполнение дополнительных ЭхоКГ исследований при необходимости [2,5,6,10,12].
(УУР С, УДД 5)
Комментарии: При проведении эхокардиографического исследования следует обращать внимание на анатомию выходного отдела левого желудочка, наличие препятствий кровотоку и градиент ЛЖ/Ао, функцию «нео» аортального клапана и состояние кондуита между правым желудочком и легочной артерией, (при операции Ross-Konno), функцию имплантированного протеза после операции Konno-Rastan (подвижность запирательных элементов, наличие на них тромботических наложений, величина пикового и среднего градиента систолического давления на протезе, наличие парапротезных фистул); морфо-функциональные параметры желудочков; наличие регургитации на АоК; величину остаточного градиента систолического давления между ЛЖ и Ао.
Пациенты с протезами клапана (протез аортального клапана механический двустворчатый***) после операции аортовентрикулопластики (операция Коно (Коnо) в условиях искусственного кровообращения) являются кандидатами на выполнение повторных операций по замене протеза в связи с развитием в процессе роста несоответствия диаметра протеза и объема крови проходящей через него.
При выполнении операции Ross-Konno пациенты в последующем являются кандидатами на выполнение повторных операций по замене кондуита (ксенотрансплантат сосудистый***), имплантированного между правым желудочком и легочной артерией, а также вмешательств на «нео» аортальном клапане вследствие его возможной дисфункции.
- Пациентам с имплантированным в аортальную позицию протезом (протез аортального клапана механический двустворчатый***) рекомендуется пожизненный пероральный прием непрямых антикоагулянтов (антагонистов витамина К) (#варфарин** для младенцев в среднем необходима доза 0,33 мг/кг/сут и 0,09 мг/кг/сут для подростков чтоб достичь целевого МНО 2,0-3,0) с последующим титрованием дозы при постоянном мониторинге показателей свертывающей системы крови: МНО (первый контроль через 3 дня после начала приема #варфарина**, далее ежедневно до достижения устойчивых целевых значений на протяжении не менее одной недели, после чего 1-2 раза в неделю) [2,5,6,10,12,47,50-54,76,90].
(УУР С, УДД 5)
Комментарии: При пероральном приеме антитромботических средств следует ориентироваться на значения МНО от 2,0 до 3,0 у пациентов низкого риска и на значения МНО 2,5-3,5 у пациентов высокого риска. К группе высокого риска относятся пациенты с сопутсвующими 1) фибрилляцией предсердий, 2) снижением систолической функции левого желудочка, 3) эпизодами тромбоэмболий в анамнезе 4) подтвержденной гиперкоагуляцией. Необходимо производить коррекцию принимаемой пациентом дозы препарата в зависимости от массы тела (при росте ребенка), и сопутствующих состояний (лихорадка, обезвоживание). Необходимо соблюдать диету с ограничением приема продуктов содержащих высокий уровень витамина К (майонез, соевое масло, шпинат, разные виды капусты (китайская, сарептская, листовая, кудрявая, а также квашеная капуста), брюссельская капуста, брокколи, одуванчик (листья), разные виды салата, зелень петрушки, спаржа, лук репчатый (дымка и шалот), свекла, горчица, репа, цикорий, а также грейпфрут и грейпфрутовый сок, клюквенный сок, зеленый чай, манго, рыбий жир, авокадо (в больших количествах)). Необходимо контролировать прием медикаментозных средств, влияющих на уровень #варфарина** в крови (список препаратов, которые усиливают или ослабляют действие #варфарина** довольно обширный (более 182 препаратов). Необходимо обращать внимание на раздел «лекарственные взаимодействия» в аннотациях к медикаментам. Если там указан #варфарин**, то обязательно через 5 дней после начала приема препарата необходимо проверить МНО, чтобы при необходимости скорректировать дозу #варфарина**).
При необходимости выполнения различных плановых хирургических вмешательств (абдоминальных, полостных, ортопедических, нейрохирургических) необходима отмена непрямых антикоагулянтов (антагониста витамина К) на срок не менее 5 суток и перевод пациента на антикоагулянтную терапию препаратами группы низкомолекулярных гепаринов (группа гепарина) в лечебной дозе (введение 2 р/сут) или при невозможности применения низкомолекулярного гепарина (#гепарин натрия**) в дозе 200 Ед/кг/сут, вводимых парентерально. Контроль эффективности и безопасности проводимой антикоагулянтной терапии #гепарином натрия** осуществлять по уровню АЧТВ, добиваясь его удлинения в 1,5-2 раза. При необходимости проведения срочного оперативного вмешательства возможно применение витамина К (менадиона натрия бисульфит**) подкожно в дозе 0,5-2 мг, что снижает МНО менее 2,0 в течение 12-24 часов. При проведении подготовки необходимо проводить антикоагулянтную терапию низкомолекулярными гепаринами или #гепарином натрия**. Длительность перерыва в приеме непрямых антикоагулянтов (антагонистов витамина K) определяется конкретной клинической ситуацией. При отсутствии признаков послеоперационного кровотечения (после выполненного вмешательства) через 6-12 часов возможно назначение непрямых антикоагулянтов (антагонисты витамина K) и отмена #гепарина натрия** при достижении показателя МНО более 2,0 [50-54,76,90].
- Пациентам с ПСА после операции Росса-Конно рекомендуется пероральный прием непрямых антикоагулянтов (антагонистов витамина К) (#варфарин** в средней дозе 0,09 мг/кг/сут для подростков и 0,33 мг/кг/сут для младенцев) в течение 6 мес. с последующим переходом на антиагреганты [52,54, 76,90].
(УУР C, УДД 5)
Комментарии: При приеме антитромботических средств необходимо ориентироваться на значения МНО в пределах значений 2-3. В качестве антиагрегантной терапии в последующем используются #ацетилсалициловая кислота** (off-label у детей до 15 лет) в дозе 3-5 мг/кг/сутки (не более 325 мг/сутки) или #клопидогрел** (off-label у детей до 18 лет) в дозе 0,2-0,5 мг/кг/сутки [49,50,52,54].
- При наблюдении пациентов после хирургического или чрезкожного вмешательства рекомендуется профилактика инфекционного эндокардита в течение 6 месяцев [48].
(УУР C, УДД 5)
Комментарии: При любом типе врождённого порока сердца при коррекции которого использовались синтетические материалы/протезы (протез аортального клапана механический двустворчатый***), при наличии показаний осуществляется профилактика бактериального эндокардита в течение 6 месяцев после операции или пожизненно, если сохраняются резидуальные шунты и регургитация на клапанах. Профилактика бактериального эндокардита проводится при хирургических процедурах в ротовой полости и/или верхних дыхательных путях, сопровождающихся повреждением слизистой оболочки (экстракция зуба, манипуляции в периапикальной зоне зуба и т.д.). Профилактика инфекционного эндокардита заключается в приёме внутрь за 30-60 минут до процедуры амоксициллина** в дозе 50 мг/кг, (при аллергии на бензилпенициллин** или ампициллин** используется #клиндамицин**(off-label у детей до 12-ти лет) в дозе 20 мг/кг [90,103].
Информация
Источники и литература
-
Клинические рекомендации Ассоциации детских кардиологов России
- Клинические рекомендации Ассоциации детских кардиологов России - 1. Андреева Н. С., Реброва О. Ю., Зорин Н. А., др. Системы оценки достоверности научных доказательств и убедительности рекомендаций: сравнительная характеристика и перспективы унификации. Медицинские технологии. Оценка и выбор 2012; 4: 10–24. 2. Шаталов К.В., Арнаутова И.В. Обструкция выхода из левого желудочка / Детская кардиохирургия. Руководство для врачей. Под редакцией Л.А. Бокерия, К.В. Шаталова. – М.: НЦССХ им. А.Н. Бакулева; 2016. – С. 444 – 482. 3. Katz, N.M. Discrete membranous subaortic stenosis. Report of 31 patients, review of the literature, and delineation of management / Katz N.M., Buckley M.J., Liberthson R.R. // Circulation. – 1977;56:1034. 4. Krueger, S.K. Echocardiography in discrete subaortic stenosis / Krueger S.K., French J.W., Forker A.D. et al. // Circulation. – 1979;59:506. 5. Зиньковский, М.Ф Врожденные пороки сердца / М.Ф. Зиньковский под редакцией А.Ф. Возианова. – Киев. 2010. – С. 738-790. 6. Бондаренко, И. Э. Хирургическое лечение врожденного стеноза аорты: дисс. ... докт.мед. наук / И.Э. Бондаренко – М., 2003. 7. Bloom KR, Meyer RA, Bove KE. The association of fixed and dynamic left ventricular outflow obstruction. Am Heart J., 1975, v.89, p.586-593. 8. Maron BJ., Redwood DR., Roberts WC. et al. Tunnel subaortic stenosis – left ventricular outflow tract obstruction prodused by fibromuscular tubular narrowing. Circulation, 1976, v.54, p.404-416. 9. Mac Lean LD., Culligan JA., Kane DJ. Subaortic stenosis due to accessoty tissue on the mitral valve. J.Thorac. Cardiovasc. Surg., 1963, v.45, p.382-386. 10. Гетманский, В.Н. Современные подходы к хирургическому лечению врожденного стеноза аорты и полученные результаты / Гетманский, В.Н. // Дис. докт. мед. наук, Москва, 1984. 11. Банкл, Г. Аортальный стеноз / Банкл Г. // В кн.: Врожденные пороки сердца и крупных сосудов. Москва, «Медицина». – 1980. – C. 157-167. 12. Белоусов, Ю.В. Врожденный стеноз аорты / Белоусов Ю.В., Охотин И.К., Романов Э.М. // В кн.: Операции на открытом сердце. Горький. – 1979. – C. 105-117. 13. Reis, R.L. Congenital fixed subaortic stenosis. An anatomical classification and correlations with operative results / Reis R.L., Peterson LM., Mason DT. et al. // Circulation. – 1971. – V. 43-44, Suppl. I, p.11-18. 14. Kelly, DT. Discrete subaortic stenosis / Kelly D.T., Wulfsberg E., Rowe R.D. // Circulation. – 1972. – v.46, p.309-314. 15. Gutgessel, H.P. Internal consistency of echocardiographic estimates of the severity of left ventricular outflow obstruction / Gutgessel H.P., Smith D., McDaniel N.L. // J. Am. Soc. Echo. – 1989;2:88. 16. Бокерия Л.А., Гудкова Р.Г. Сердечно-сосудистая хирургия – 2015. Болезни и врожденные аномалии системы кровообращения. М.: НЦССХ им. А.Н.Бакулева; 2016. 208 с. 17. Newfeld, EA. Discrete subvalvular aortic stenosis in children / Newfeld EA., Muster AJ., Paul MH. et al. // Am J Cardiol.. – 1976;38:53-61. 18. Chung, K.J. Combined discrete subaortic stenosis and ventricular septal defect in infants and children / Chung K.J., Fulton D.R., Kriedberg M.B., Payne D.D., Cleveland R.J. // Am. J. Cardiol. – 1984;53:1429. 19. Vogel, M. Ventricular septal defect and subaortic stenosis / Vogel M., Freedom R.M., Brand A., Trusler G.A., Williams W.G., Rowe R.D. // Am. J. Cardiol. – 1983;52:1258-1263. 20. Shore, D.F. Left ventricular outflow tract obstruction coexisting with ventricular septal defect / Shore D.F., Smallborn J., Stark J., Lincoln C., De Leval M.R. //Br. Heart. – 1982;48:421. 21. Schneeweiss, A. Discrete subaortic stenosis associated with congenital valvular aortic stenosis / Schneeweiss A., Motro M., Shem-Tov A., Blieden L.C., Newfeld H.N. // Am Heart J. – 1983;106:55. 22. Castaneda, A.R. Cardiac surgery of the neonate and infant / Castaneda A.R., Jonas R.A., Mayer J.E., Hanley F.L. // Saunders Company, Philadelphia. – 1994.- p.506. 23. Coleman, D.M. Postoperative follow-up of fibromuscular subaortic stenosis / Coleman D.M., Smallhorn J.F., MeCrindle B.W., Williams W.G., Freedom R.M. // J. Am. Coll. Cardiol. – 1994;24:1558-64. 24. Feigl, A. Involvement of the aortic valve cusps in discrete subaortic stenosis / Feigl A., Lucas R.V.Jr., Edwards J.E. // Pediatr. Cardiol. – 1984;5:185-90. 25. Motro, M. Correlation of distance from subaortic membrane to base of the right aortic valve cusp and the development of aortic regurgitation in mild discrete subaortic stenosis / Motro M., Schneeweiss A., Shem-Tov A. et al. // Am. J. Cardiol. – 1989;64:395-6. 26. Shone, J.D. The development complex of «parachute mitral valve», supravalvular mitral ring of left atrium, subaortic stenosis and coarctation of the aorta / Shone J.D., Seller R.D., Anderson R.C. et al. //Am. J. Cardiol. – 1963;11:714. 27. Freedom RM., Dische MR., Rowe RD. Pathologic anatomy of subaortic stenosis and atresia in the first year of life. Am J Cardiol., 1977, v.39, p.1035-1044. 28. Somerville J., Stone S., Ross D. Fate of patients with fixed subaortic stenosis after surgical removal. Br Heart J., 1980, v.43, p.629-647. 29. Somerville J. Aortic stenosis and incompetance. In 'Pediatric Cardiology', vol 2 (Anderson RH, Macartney FJ, Shinebourne EA, and Tynan M, Eds), p.977. Churchill Livingstone, Edinburgh, 1987. 30. Pyle RL., Patterson DF., Chacko S. The genetics and pathology of discrete subaortic stenosis in the Newfoundland dog. Am Heart J., 1976, v.92, p.324-334. 31. Choi JY., Sullivan ID. Fixed subaortic stenosis: anatomical spectrum and nature of progression. Br Heart J., 1991, v.65, p.280-286. 32. Leichter D., Sullivan I., Gersony W. "Acquired" Discrete Subvalvular Aortic Stenosis: Natural History and Hemodynamics. J Am Coll Cardiol., 1989, v.14, p.1539-1544. 33. Vogt, J. Discrete Subaortic Stenosis: the value of cross-sectional echocardiography in evaluation different types of obstruction / Vogt J., Rupprath G., de Vivie R., Beuren A.J. // Ped. Cardiol. – 1983. – Vol. 4, №4. – 253-258. 34. Wright, G.B. Fixed subaortic stenosis in the young: medical and surgical course in 83 patients / Wright G.B., Keane J.F. et al. // Am. J. Cardiol. – 1983; 52:830-8. 35. Эндоваскулярная и минимально инвазивная хирургия сердца и сосудов у детей / Под ред. Л.А. Бокерия, Б.Г. Алекяна, В.П. Подзолкова. – М.: Изд-во НЦССХ им. А.Н. Бакулева, РАМН, 1999. –280 С. 36. Azevedo CF, Nigri M, Higuchi ML, Pomerantzeff PM, Spina GS, Sampaio RO, Tarasoutchi F, Grinberg M, Rochitte CE. Prognostic significance of myocardial fibrosis quantification by histopathology and magnetic resonance imaging in patients with severe aortic valve disease. J Am Coll Cardiol. 2010;56:278–287. 37. Goldstein SA, Evangelista А, Abbara S, Arai А, Asch FM., Badano LP et al. Multimodality imaging of diseases of the thoracic aorta in adults: from the American society of echocardiography and the European association of cardiovascular imaging endorsed by the Society of cardiovascular computed tomography and Society for cardiovascular magnetic resonance. J Am Soc Echocardiogr. 2015;28:119-82. 38. Kouchoukos N.T., Blackstone E.H., Hanley F.L., Kirklin J.K. Kirklin/Barratt-Boyes cardiac surgery: morphology, diagnostic criteria, natural history, techniques, results, and indications. – 4th ed. Philadelphia: Elsevier; 2013. 39. Morrow AG., Brockenbrough EC. Surgical treatment of idiopathic hypertrophic subaortic stenosis. Technic and hemodynamic results of subaortic ventriculomyotomy. Ann. Surg., 1961, v.154, p.181-186., 40. Stellin, J. Late results after resection of discrete and tunnel subaortic stenosis / Stellin J., Mazzucco A., Borrolotti U. et al. // Eur. J. Cardiothorac. Surg. – 1989;3:235. 41. Rastan, H. Results of aortoventriculoplasty in 21 consecutive patients with left ventricular outhflow tract obstruction / Rastan H., Abu-Aishah N. et al. // J. Thorac. Cardiovasc. Surg. – 1978;75:659. 42. Kirklin, J.W. Cardiac Surgery (second edition) / Kirklin, J.W., Barratt-Boyes B.G. // Churchill Livingstone Inc. – 1993. – 1212-1224. 43. Рыбка М.М., Хинчагов Д.Я., Мумладзе К.В., Лобачева Г.В., Ведерникова Л.В. Под ред. Л.А. Бокерия. Протоколы анестезиологического обеспечения кардиохирургических операций, выполняемых у новорожденных и детей. Методические рекомендации. М.: НЦССХ им. А.Н. Бакулева РАМН; 2014. 44. Рыбка М.М., Хинчагов Д.Я. Под ред. Л.А. Бокерия. Протоколы анестезиологического обеспечения кардиохирургических операций, выполняемых при ишемической болезни сердца, патологии клапанного аппарата, нарушениях ритма, гипертрофической кардиомиопатии, аневризмах восходящего отдела аорты у пациентов различных возрастных групп. Методические рекомендации. М.: НЦССХ им. А.Н. Бакулева РАМН; 2015. 45. Рыбка М.М., Хинчагов Д.Я., Мумладзе К.В., Никулкина Е.С. Под ред. Л.А. Бокерия. Протоколы анестезиологического обеспечения рентгенэндоваскулярных и диагностических процедур, выполняемых у кардиохирургических пациентов различных возрастных групп. Методические рекомендации. М.: НЦССХ им. А.Н. Бакулева РАМН; 2018. 46. De Lezo, J.S. Long-Term Outcome of Patients With Isolated Thin Discrete Subaortic Stenosis Treated by Balloon Dilation A 25-Year Study. / J.S. De Lezo, M. Romero J., Segura M., Pan, J.S. de Lezo, D. Pavlovic, F. Mazuelos, M. Delgado, D. Mesa // Circulation. - 2011. - № 124. - P. 1461-1468. 47. Подзолков В.П., Кассирский Г.И. (ред.). Реабилитация больных после хирургического лечения врожденных пороков сердца. М.: НЦССХ им. А.Н. Бакулева; 2015. 48. Habib G., Lancellotti P., Antunes M.J. et al. 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC) Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J Volume 36, Issue 44, 21 November 2015, Pages 3075–3128. 49. Jochen Weil. // Guidelines for the Management of Congenital Heart Diseases in Childhood and Adolescence. Cardiology in the Young. 2017: 27(Suppl. 3): S1–S105. 50. Giglia T., Massicotte M., Tweddell J. et al. Prevention and Treatment of Thrombosis in Pediatric and Congenital Heart Disease: A Scientific Statement From the American Heart Association. Circulation.2013; 128:2622-2703. 51. Василевская, И.В. Отдаленные результаты операций протезирования митрального клапана в раннем детском возрасте/ Василевская И.В. // Дис. канд. мед. наук, Москва, 2012. 52. Туманян М. Р., Абрамян М. А., Гуласарян Р. С., Котова А. Н., Трунина И. И. Протезирование клапанов сердца и антикоагулянтная терапия у детей первого года жизни. Детские болезни сердца и сосудов. 2011; (1): 29-31. 53. Бокерия Л. А., Ким А. И., Шаталов К. В., Абдувохидов Б. У., Василевская А. В., Рогова Т. В., Болтабаев И. И. Протезирование митрального клапана у детей раннего возраста. Детские болезни сердца и сосудов. 2011; (1): 4-8. 54. Salem, D. N. Antithrombotic Therapy in Valvular Heart Disease / D. N. Salem, D. H. Daudelin, H. J. Levine et al. // Chest – 2001. – Vol. 119. – P. 207–219. 55. Wyman W., Lai, Geva, T., Shirali G.S. et al. Guidelines and standards for performance of a paediatric echocardiogram: a report from the Task Force of the Paediatric Council of the American Society of Echocardiography. J Am Soc Echocardiogr 2006; 19: 1413–1430. 56. Kleinert S., Geva T.. Echocardiographicmorphometry and geometry of the left ventricular outflow tract in fixed subaortic stenosis. J Am Coll Cardiol 1993; 22:1501–1508. 57. Gierat-Haponiuk K. et al. Effect of complex cardiac rehabilitation on physical activity and quality of life during long-term follow-up after surgical correction of congenital heart disease //Kardiologia Polska (Polish Heart Journal). – 2015. – Т. 73. – №. 4. – С. 267-273. 58. Takken T. et al. Recommendations for physical activity, recreation sport, and exercise training in paediatric patients with congenital heart disease: a report from the Exercise, Basic & Translational Research Section of the European Association of Cardiovascular Prevention and Rehabilitation, the European Congenital Heart and Lung Exercise Group, and the Association for European Paediatric Cardiology //European journal of preventive cardiology. – 2012. – Т. 19. – №. 5. – С. 1034-1065. 59. Tikkanen A. U. etal. Paediatric cardiac rehabilitation in congenital heart disease: a systematic review //Cardiology in the young. – 2012. – Т. 22. – №. 3. – С. 241-250. 60. Физическая и реабилитационная медицина. Национальное руководство. Краткое издание // Под ред. Г.Н.Пономаренко. М.: ГЭОТАР-Медиа, 2017. – 512 с. / Глава 21. Хан М.А., Куянцева Л.В. Заболевания сердечно-сосудистой системы. ‒ С. 447-452. 61. Санаторно-курортное лечение: научно-практическое руководство для врачей / под ред. А.Д. Фесюна. –Том 1. Основы санаторно-курортного лечения. - М.: ООО "Реновация", 2022. – С. 496. 62. Jahangiri M, Nicholson IA, del Nido PJ, Mayer JE, Jonas RA. Surgical management of complex and tunnel-like subaortic stenosis. Eur J Cardiothorac Surg. 2000 Jun;17(6):637-42. 63. Baumgartner H, De Backer J, Babu-Narayan SV, Budts W, Chessa M, Diller GP, Lung B, Kluin J, Lang IM, Meijboom F, Moons P, Mulder BJM, Oechslin E, Roos-Hesselink JW, Schwerzmann M, Sondergaard L, Zeppenfeld K; ESC Scientific Document Group. 2020 ESC Guidelines for the management of adult congenital heart disease. Eur Heart J. 2021 Feb 11;42(6):563-645. 64. Диагностика и лечение периоперационной анемии и дефицита железа у хирургических пациентов: методическое руководство / коллектив авторов; ред. акад. РАН В.Н. Серов. – Чебоксары: ИД «Среда», 2021. – 60 с. 65. McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Böhm M, Burri H, Butler J, Čelutkienė J, Chioncel O, Cleland JGF, Coats AJS, Crespo-Leiro MG, Farmakis D, Gilard M, Heymans S, Hoes AW, Jaarsma T, Jankowska EA, Lainscak M, Lam CSP, Lyon AR, McMurray JJV, Mebazaa A, Mindham R, Muneretto C, Francesco Piepoli M, Price S, Rosano GMC, Ruschitzka F, Kathrine Skibelund A; ESC Scientific Document Group. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). With the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail. 2022;24(1):4-131 66. Roberts E, Ludman AJ, Dworzynski K, Al-Mohammad A, Cowie MR, McMurray JJ, Mant J; NICE Guideline Development Group for Acute Heart Failure. The diagnostic accuracy of the natriuretic peptides in heart failure: systematic review and diagnostic meta-analysis in the acute care setting. BMJ. 2015 Mar 4;350:h910. 67. Zaphiriou A, Robb S, Murray-Thomas T, Mendez G, Fox K, McDonagh T, Hardman SM, Dargie HJ, Cowie MR. The diagnostic accuracy of plasma BNP and NTproBNP in patients referred from primary care with suspected heart failure: results of the UK natriuretic peptide study. Eur J Heart Fail. 2005 Jun;7(4):537-41. 68. Fuat A, Murphy JJ, Hungin AP, Curry J, Mehrzad AA, Hetherington A, Johnston JI, Smellie WS, Duffy V, Cawley P. The diagnostic accuracy and utility of a B-type natriuretic peptide test in a community population of patients with suspected heart failure. Br J Gen Pract. 2006 May;56(526):327-33. 69. Yamamoto K, Burnett JC Jr, Bermudez EA, Jougasaki M, Bailey KR, Redfield MM. Clinical criteria and biochemical markers for the detection of systolic dysfunction. J Card Fail. 2000 Sep;6(3):194-200.
Информация
Список сокращений
АКГ – ангиокардиография (ретроградная катетеризация левых отделов сердца; панаортография);
Ао – аорта;
АоК – аортальный клапан;
ВОЛЖ – выводной отдел левого желудочка сердца;
ВПС – врожденный порок сердца;
ГСД ЛЖ/Ао – градиент систолического давления между левым желудочком и аортой;
ДМЖП – дефект межжелудочковой перегородки;
КГ – коронарография;
ПСА – подклапанный стеноз аорты;
КТ – компьютерная томография;
ЛЖ – левый желудочек;
МК – митральный клапан;
МРТ – магнитно-резонансная томография;
ОАП – открытый артериальный проток;
ФВ – фракция выброса;
ФК – фиброзное кольцо;
ЭКГ – электрокардиография (регистрация электрокардиограммы; расшифровка, описание и интерпретация электрокардиографических данных);
Эхо-КГ – эхокардиография.
Термины и определения
Катетеризация сердца (ретроградная катетеризация левых отделов сердца; панаортография) – инвазивная процедура, проводимая с лечебными или диагностическими целями при патологии сердечно-сосудистой системы путем введения катетеров (катетер ангиографический) в полость сердца или просвет магистральных сосудов.
Градиент систолического давления между ЛЖ и Ао – допплер-эхокардиографический показатель, отражающий градиент давления меду полостями, основанный на измерении скорости кровотока через аортальный клапан и характеризующий степень стеноза.
Компьютерная томография (КТ) – неинвазивный метод лучевой диагностики, позволяющий получить серию послойных субмиллиметровых аксиальных изображений органов и структур тела человека, основанный на измерении и сложной компьютерной обработке разности ослабления рентгеновского излучения различными по плотности тканями; для улучшения дифференцировки органов друг от друга, а также нормальных и патологических структур. Применяются различные методики контрастного усиления/контрастирования, с использованием рентгеноконтрастных средств, содержащих йод. Для визуализации структур сердечно-сосудистой системы применяют КТ-ангиографию (компьютерная томография сердца с контрастированием) – методику внутривенного болюсного введения контрастного средства в кровоток с помощью системы внутрисосудистого введения контрастного средства, с установленной скоростью и временем введения препарата. На основе полученных данных посредством компьютерной постобработки с 3D-реконструкцией строится трехмерная модель сердца и сосудов.
Синдром Shone – ВПС, характеризующийся соединением хорд МК в один тяж, прикрепляющийся к одной сосочковой мышце; надклапанным митральным стенозом, сочетающимся с комбинированным стенозом Ао, а также нередко и коарктацией аорты.
Мембранэктомия (иссечение подаортальной фиброзной мембраны в условиях искусственного кровообращения) – операция иссечения подаортальной мембраны.
Миоэктомия (миэктомия по Морроу (Morrow) в условиях искусственного кровообращения) – операция устранения ПСА путем резекции гипертрофированной части межжелудочковой перегородки.
Модифицированная операция Konno (операция Коно (Коnо) в условиях искусственного кровообращения) – без протезирования АоК, применяется при наличии тоннельной формы субаортального стеноза без вовлечения в патологический процесс АоК и отсутствии гипоплазии его ФК.
Уровень достоверности доказательств (УДД) – степень уверенности в том, что найденный эффект от применения медицинского вмешательства является истинным [1].
Уровень убедительности рекомендаций (УУР) – степень уверенности в достоверности эффекта вмешательства и в том, что следование рекомендациям принесет больше пользы, чем вреда в конкретной ситуации [1].
Эхокардиография – метод ультразвукового исследования, направленный на исследование морфологических и функциональных изменений сердца и его клапанного аппарата.
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Оперированный врожденный ПСА может рецидивировать. Т.о. удаление субаортальной мембраны в детстве не предотвращает ее повторное появление, а также появление и/или прогрессирование регургитации на АоК в будущем. Это явление встречается приблизительно у 20% больных в течение 10 лет после операции. Помимо этого, аортальная регургитация может возникнуть после удаления субаортальной мембраны.
После операции Росса-Конно пациенты составляют группу риска развития аутотрансплантатной дилатации с прогрессирующей «нео» аортальной регургитацией, окклюзии и/или регургитации «нео» легочного ствола, а иногда и ишемии миокарда и/или инфаркта, связанного с окклюзией или перегибом проксимальных коронарных артерий.
Результаты устранения врожденного ПСА по данным различных клиник определяются анатомической формой обструкции, видом выполненного вмешательства и возрастом пациента. Так, летальность при выполнении операции мембранэктомии или иссечения фиброзно-мышечного валика приближается к нулю [2,5,6]. Осложнениями выполнения данных операций могут явиться: 1) возникновение ятрогенного ДМЖП; 2) повреждение проводящей системы сердца с развитием атриовентрикулярной блокады 3 степени; 3) развитие выраженной регургитации на аортальном и митральном клапанах. Однако, при соблюдении всех правил техники выполнения вмешательства риск возникновения таких осложнений может быть сведен к минимуму.
Выполнение более сложных реконструктивных операций на ВОЛЖ сопровождается увеличением показателя летальности до 2-3% [39,41]. Фактором риска при этом является младшая возрастная группа пациентов ввиду тяжести обструкции, требующей расширенного вмешательства. Летальность при использовании операций расширенных аортовентрикулопластик по типу Rastan-Konno может достигать 8-34% [40], особенно если пациентами являются дети раннего возраста. Выживаемость в 15-летний срок после операции составляет от 85 до 95% среди больных, оперированных по поводу дискретного субаортального стеноза [21,39].
Необходимость в выполнении повторных операций обусловлена, как правило, дисфункцией имплантированных протезов на фоне активного роста ребенка.
Критерии оценки качества медицинской помощи
Критерии оценки качества первичной медико-санитарной помощи детям при врожденном подклапанном стенозе аорты (коды по МКБ - 10: Q24.4)
|
№ п/п
|
Критерии оценки качества
|
Оценка выполнения
|
|
1.
|
Выполнен прием (осмотр, консультация) врача-детского кардиолога первичный и/или врача-сердечно-сосудистого хирурга первичный (при установлении диагноза)
|
Да/Нет
|
|
2.
|
Выполнен диспансерный прием (осмотр, консультация) врача-кардиолога или диспансерный прием (осмотр, консультация) врача-детского кардиолога
|
Да/Нет
|
|
3.
|
Выполнена регистрация электрокардиограммы (при установлении диагноза и/или при диспансерном наблюдении)
|
Да/Нет
|
|
4.
|
Выполнена прицельная рентгенография органов грудной клетки (при установлении диагноза и при планировании хирургического лечения)
|
Да/Нет
|
|
5.
|
Выполнена эхокардиография (при установлении диагноза и/или при диспансерном наблюдении)
|
Да/Нет
|
|
6.
|
Выполнена компьютерная томография сердца с контрастированием (при недостаточной информативности данных эхокардиографии, при отсутствии медицинских противопоказаний)
|
Да/Нет
|
|
7.
|
Выполнено лечение #варфарином** (пациентам с имплантированным в аортальную позицию механическим протезом (протез аортального клапана механический двустворчатый***), при отсутствии медицинских противопоказаний)
|
Да/Нет
|
Критерии оценки качества специализированной медицинской помощи детям при врожденном подклапанном стенозе аорты (коды по МКБ - 10: Q24.4)
|
№ п/п
|
Критерии оценки качества
|
Оценка выполнения
|
|
1.
|
Выполнена регистрация электрокардиограммы (при планировании хирургического лечения и при выписке из стационара)
|
Да/Нет
|
|
2.
|
Выполнена прицельная рентгенография органов грудной клетки (при установлении диагноза и при планировании хирургического лечения)
|
Да/Нет
|
|
3.
|
Выполнена эхокардиография (при планировании хирургического лечения и при выписке из стационара)
|
Да/Нет
|
|
4.
|
Выполнена компьютерная томография сердца с контрастированием (при недостаточной информативности данных эхокардиографии, при отсутствии медицинских противопоказаний)
|
Да/Нет
|
|
5.
|
Выполнена ретроградная катетеризация левых отделов сердца и/или вентрикулография сердца и/или панаортографии с коронарографией (при выраженном и резком подаортальном стенозе, при отсутствии медицинских противопоказаний)
|
Да/Нет
|
|
6.
|
Выполнено хирургическое лечение (при выраженном и резком подаортальном стенозе) (при условии операбельности пациента)
|
Да/Нет
|
|
7.
|
Выполнено лечение #варфарином (пациентам с имплантированным в аортальную позицию механическим протезом (протез аортального клапана механический двустворчатый***), при отсутствии медицинских противопоказаний)
|
Да/Нет
|
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
-
Авраменко А.А., (Самара)
-
Апханова Т.В., д.м.н., «Национальная ассоциация экспертов по санаторно-курортному лечению» (Москва)
-
Арнаутова И.В., д.м.н., "Ассоциация сердечно-сосудистых хирургов России", (Москва)
-
Богданов В.Н., (Челябинск)
-
Бокерия Л.А., академик РАН, "Ассоциация сердечно-сосудистых хирургов России", (Москва)
-
Борисков М.В., д.м.н., (Краснодар)
-
Борисова Н.А., "Российское научное общество специалистов по рентгенэндоваскулярной диагностике и лечению", (Санкт-Петербург)
-
Горбатиков К.В., д.м.н., (Тюмень)
-
Горбатых Ю.Н., д.м.н., (Новосибирск)
-
Калашников С.В., к.м.н., (Москва)
-
Ким А.И., д.м.н., "Ассоциация сердечно-сосудистых хирургов России", (Москва)
-
Ковалёв И.А., д.м.н., "Ассоциация детских кардиологов России", (Москва)
-
Кончугова Т.В., д.м.н., «Национальная ассоциация экспертов по санаторно-курортному лечению» (Москва)
-
Кривощеков Е.В., д.м.н., (Томск)
-
Купряшов А.А., д.м.н., (Москва)
-
Левченко Е.Г., д.м.н. (Москва)
-
Ляпунова А.А., к.м.н (Санкт-Петербург)
-
Мовсесян Р.Р., д.м.н., "Ассоциация сердечно-сосудистых хирургов России", (Санкт-Петербург)
-
Плотников М.В., к.м.н., (Астрахань)
-
Пурсанов М.Г., д.м.н., (Москва)
-
Синельников Ю.С., д.м.н., (Пермь)
-
Трунина И. И., д.м.н., "Ассоциация детских кардиологов России", (Москва)
-
Шаталов К.В., д.м.н., "Ассоциация сердечно-сосудистых хирургов России", (Москва)
-
Барышникова И.Ю., к.м.н. (Москва) Общероссийская общественная организация содействия развитию лучевой диагностики и терапии «Российское общество рентгенологов и радиологов»
-
Синицын В.Е., д.м.н., профессор (Москва) Общероссийская общественная организация содействия развитию лучевой диагностики и терапии «Российское общество рентгенологов и радиологов»
Конфликт интересов отсутствует.
Все члены Рабочей группы подтвердили отсутствие финансовой поддержки/конфликта интересов, о которых необходимо сообщить.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
-
Врач-детский кардиолог
-
Врач-кардиолог
-
Врач-сердечно-сосудистый хирург
-
Врач ультразвуковой диагностики
-
Врач-педиатр
-
Врач по рентгенэндоваскулярной диагностике и лечению
-
Врач-рентгенолог
-
Врач функциональной диагностики
-
Врач- неонатолог
В ходе разработки КР использованы новая система шкал УДД и УУР для лечебных, реабилитационных, профилактических вмешательств и диагностических вмешательств (Таблицы 1, 2 и 3), введенная в 2018 г. ФГБУ ЦЭККМП Минздрава РФ.
Таблица 1.
Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств).
|
УДД
|
Расшифровка
|
|
1
|
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
|
|
2
|
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований с применением метаанализа
|
|
3
|
Исследования без последовательного контроля референсным методом, или исследования с референсным методом, не являющимся независимым от исследуемого метода, или нерандомизированные сравнительные исследования, в том числе когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая
|
|
5
|
Имеется лишь обоснование механизма действия или мнение экспертов
|
Таблица 2.
Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, лечебных, реабилитационных вмешательств)
|
УДД
|
Расшифровка
|
|
1
|
Систематический обзор РКИ с применением метаанализа
|
|
2
|
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением метаанализа
|
|
3
|
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль»
|
|
5
|
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
|
Таблица 3.
Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, диагностических, лечебных, реабилитационных вмешательств)
|
УУР
|
Расшифровка
|
|
A
|
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
|
|
B
|
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
|
|
C
|
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
|
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
-
Об основах охраны здоровья граждан в Российской Федерации (ФЗ №323 от 21.11.2011)
-
Порядок оказания медицинской помощи больным с сердечно-сосудистыми заболеваниями (Приказ Минздрава России №918н от 15.11.2012)
-
Приказ Минздрава России №560н от 9 июня 2020 года «Об утверждении Правил проведения рентгенологических исследований»
-
Приказ Минздрава России от 08.06.2020 №557н "Об утверждении Правил проведения ультразвуковых исследований"
Технология выполнения трансторакальной эхокардиографии
Обзорная ЭхоКГ для исключения сочетанного ВПС, оценки размеров и сократительной функции сердца, функциональной состоятельности клапанов (митрального и аортального). Измерение конечного диастолического размера левого желудочка (ЛЖ) и количественную оценку сократительной функции ЛЖ определяют в М-режиме из левого парастернального доступа в проекции по длинной оси ЛЖ или короткой оси ЛЖ на уровне конца створок митрального клапана (МК), которые будут служить ориентиром для постановки курсора – перпендикулярно линии смыкания створок МК. Измерения производят от задней поверхности межжелудочковой перегородки до передней поверхности задней стенки ЛЖ. Визуальная оценка ЛЖ: из апикальной четырехмерной позиции в сравнении с правыми отделами. В апикальном доступе проекции 4х и 2х камер возможна оценка объемов и систолической функции методом Simpson. Левый парастернальный доступ: по длинной оси оценка диаметра фиброзного кольца (ФК) аортального клапана, и размеры корня и восходящей аорты. В этих режимах и проекциях в диастолу измеряют толщину межжелудочковой перегородки и нижне-боковой стенки ЛЖ. Утолщение стенок ЛЖ считают при значении относительной толщины стенок (сумма толщин МЖП и НБСЛЖ отнесенная к конечно-диастолическому размеру ЛЖ) более 0.42 55].
Выводной отдел левого желудочка. Целью ЭхоКГ оценки подклапанного стеноза аорты является всесторонне охарактеризовать морфологические особенности обструктивного поражения, оценить тяжесть гемодинамических изменений и выявить сопутствующие аномалии. Морфологическим субстратом обструкции выходного тракта левого желудочка может явиться несколько патологий [56].
1) Дискретная «мембрана». В проекции по длинной оси ЛЖ визуализируется линейный эхо-сигнал, расположенный в ВОЛЖ на некотором расстоянии от створок аортального клапана или плотно прилегающий, как правило, к правой коронарной створке. Отток ЛЖ характеризуется более крутым углом между МЖП и корнем аорты (аорто-септальный угол), возможно некоторое удлинение митрально-аортального контакта.
2) Субаортальный стеноз «туннельного типа». При ЭхоКГ исследовании визуализируется длинный сегмент сужения ВОЛЖ, как правило сформированный утолщенными измененными фиброзно-мышечными стенками ЛЖ с вовлечением в патологический процесс обструкции добавочной переднебоковой папиллярной мышцы и гипертрофированной МЖП.
3) Отклонение назад конусной перегородки при сочетании с другими ВПС может вызывать подаортальную обструкцию. Обычно это происходит при перерыве дуги аорты, коарктации аорты с ДМЖП и гипоплазией аортального клапана и восходящей аорты.
4) Мышечная обструкция ВОЛЖ в конце систолы за счет утолщенной МЖП при гипертрофической кардиомиопатии.
Эхокардиографическая оценка тяжести подклапанного стеноза аорты основывается на анатомических и гемодинамических показателях. Измерение минимального размера потока производят в конце систолы и для локализации уровня сужения применяют режим цветного допплеровского картирования с оптимальными настройками предела Найквиста. Этот метод дает размер в одном сечении и для более качественной анатомической оценки степени сужения возможно применение трехмерной ЭхоКГ (целесообразно использовать у подростков и взрослых, поскольку эта методика имеет технические ограничения в получении информативных эхокардиограмм у новорожденных и грудных детей вследствие высокой ЧСС и низкой частоты кадров). При проведении чреспищеводной ЭхоКГ необходимо учитывать ограничения производителя по весу ребенка (согласно инструкции).
Гемодинамическая оценка подклапанного стеноза аорты основывается на измерении максимальной скорости кровотока за местом сужения. Для получения оптимальных допплеровских кривых возможно использовать любые доступы и проекции по длинной оси ЛЖ, но обязательно следовать правилу: угол расхождения потока крови через суженное место и ультразвуковыми лучами не должен превышать 15-20%. Если имеется многоуровневая обструкции ВОЛЖ, то для определения максимального сужения рекомендуется применение импульсно-волнового и непрерывно-волнового допплера. Мышечная подаортальная обструкция сопровождается увеличением доплеровской скорости в позднюю систолу приводя к асимметричной форме допплеровской кривой (форма «турецкой сабли»).
Мониторинг и коррекция дозы нефракционированного гепарина (#гепарина натрия**) [74,76]


Приложение Б. Алгоритмы действий врача
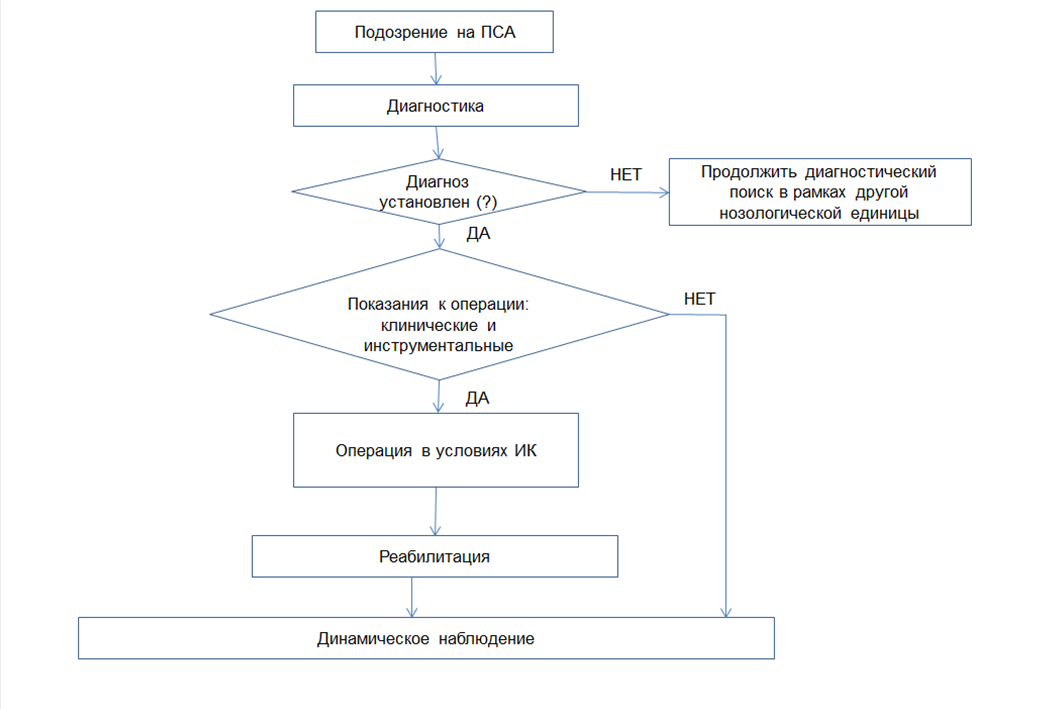

Схема использования лучевых и инструментальных методов диагностики при врожденном подклапанном стенозе аорты
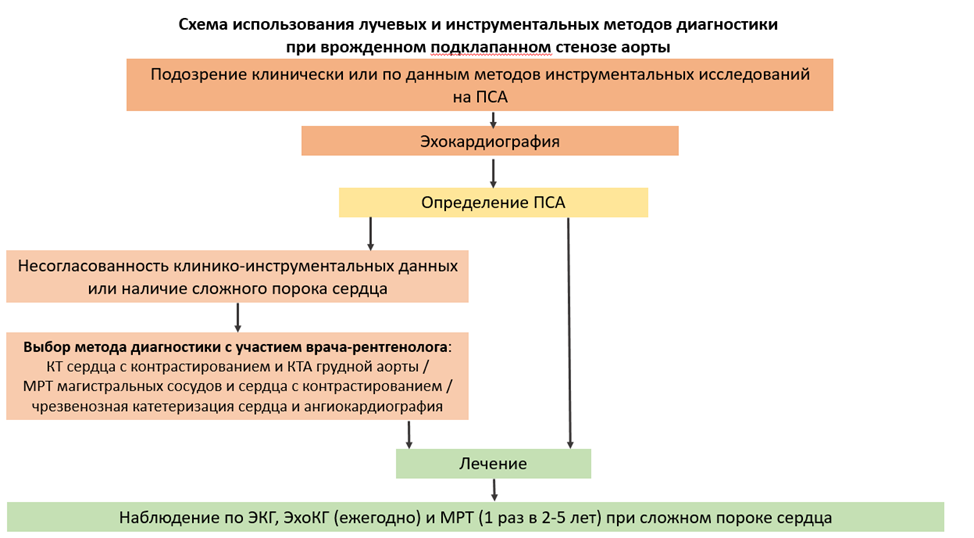
Приложение В. Информация для пациента
Наиболее частым морфологическим субстратом подаортальной обструкции, требующей хирургической коррекции в раннем детском возрасте, является фиброзная или фиброзно-мышечная мембрана – 79% случаев. Диффузная форма подаортального стеноза у 13% пациентов представлена мышечным валиком, а в 8% случаев туннелевидным сужением подклапанного пространства за счет выраженной гипертрофии межжелудочковой перегородки.
При отсутствии хирургического лечения прогрессирование заболевания может привести к гипертрофии левого желудочка (ЛЖ), аритмии, недостаточности аортального клапана (АК), эндокардиту, внезапной сердечной смерти.
Пациенты, имеющие обструкцию по типу мембраны, имеют более благоприятное течение по сравнению с пациентами, имеющими протяженное (тоннелевидное) сужение выводного отдела ЛЖ.
Летальность при хирургической коррекции простых форм близка к нулю, в то время, как коррекция сложных форм порока по типу туннеля характеризуется увеличением показателя летальности. По данным источников мировой литературы послеоперационная летальность составляет: при простой форме – 0,7%, а при сложной форме – 2,3%.
Согласно данным литературы наиболее частыми осложнениями в послеоперационном периоде являются нарушение сердечного ритма, повреждение аорты и/или митрального клапана, ятрогенный ДМЖП.
Несмотря на хорошие непосредственные результаты хирургического вмешательства у большинства пациентов с ПСА, риск рецидива и повторного хирургического вмешательства остается высоким. При этом коррекция сложных форм порока (протяженные сужения выводного отдела ЛЖ) характеризуется большим числом рестенозов и реопераций.
Больным с подклапанным стенозом аорты в отдаленные сроки после коррекции рекомендуется выполнение Эхо-КГ минимум один раз в год. При выполнении исследования оценивается: 1) функция аортального клапана и состояние кондуита (про операции Rosso-Konno); 2) функция имплантированного протеза при операциях Konno-Rastan (подвижность запирательных элементов, наличие на них тромботических наложений, величина пикового ГСД, наличие парапротезных фистул); 3) морфо-функциональное состояние желудочков; 4) наличие регургитации на аортальном клапане; 5) величину остаточного ГСД между ЛЖ/Ао.
При наличии имплантированного в аортальную позицию механического протеза и приеме антитромботических препаратов крайне важным является контроль показателей свертывающей системы крови с целью избежания, как тромбоэмболий, так и кровотечений
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Нет.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.