Бронхолегочная дисплазия, возникшая в перинатальном периоде
 Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Бронхолегочная дисплазия, возникшая в перинатальном периоде (P27.1)
Неонатология, Педиатрия, Пульмонология детская, Реаниматология
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «28» июня 2024 года
Протокол №210
КЛИНИЧЕСКИЙ ПРОТОКОЛ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
БРОНХОЛЕГОЧНАЯ ДИСПЛАЗИЯ, ВОЗНИКШАЯ В ПЕРИНАТАЛЬНОМ ПЕРИОДЕ
Бронхолегочная дисплазия – это полиэтиологическое хроническое заболевание морфологически незрелых легких, развивающееся у новорожденных, главным образом глубоко недоношенных детей, в результате интенсивной терапии респираторного дистресс-синдрома и/или пневмонии [1,2].
Код(ы) МКБ-10:
Бронхолегочная дисплазия – это полиэтиологическое хроническое заболевание морфологически незрелых легких, развивающееся у новорожденных, главным образом глубоко недоношенных детей, в результате интенсивной терапии респираторного дистресс-синдрома и/или пневмонии [1,2].
ВВОДНАЯ ЧАСТЬ
Код(ы) МКБ-10:
| P27.1 Бронхолегочная дисплазия, возникшая в перинатальном периоде |
| Осложнения БЛД: |
| J96.1 Хроническая дыхательная недостаточность |
| J96.0 Острая дыхательная недостаточность |
| I27.2 Другая легочная гипертензия вторичная |
| I27.9 Легочное сердце [cor pulmonale] хроническое |
| I15.8 Другая вторичная гипертензия (соответствует диагнозу «системная артериальная гипертензия») |
| Е44.1 Легкая белково-энергетическая недостаточность |
Дата разработки/пересмотра протокола: 2015 год (пересмотр 2023 год).
Категория пациентов: новорожденные, дети раннего возраста до 3-х лет.
Шкала уровня доказательности:
Оценка на степень доказательности приводимых рекомендаций
Пользователи протокола: неонатологи, анестезиологи-реаниматологи, пульмонологи, кардиологи, педиатры, кардиохирурги, врачи общей практики.
Категория пациентов: новорожденные, дети раннего возраста до 3-х лет.
Шкала уровня доказательности:
Оценка на степень доказательности приводимых рекомендаций
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| В |
Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортное или исследований случай- контроль с очень низким риском систематической ошибки или РКИ с не высоким
(+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию.
|
| С |
Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+).
Результаты, которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++или+), результаты которых не могут быть непосредственно распространены на соответствующую популяцию.
|
| D | Описание серии случаев тили неконтролируемое исследование, или мнение экспертов. |
Классификация
Клиническая классификация [3,4]:
БЛД подразделяется по форме (БЛД недоношенных (классическая и новая формы) и БЛД доношенных), тяжести и периоду болезни (обострение, ремиссия).
Классическая форма развивается у пациентов в результате тяжелого поражения легких кислородом, давлением, объемом при проведении ИВЛ с «жесткими» режимами и высокими концентрациями кислорода.
Новая форма развивается у детей с гестационным возрастом менее 32 недель без предварительного респираторного заболевания, формируется, несмотря на отсутствие жестких режимов вентиляции и характеризуется нарушением роста и развития альвеол и сосудов малого круга кровообращения. Гистологическая картина данной формы БЛД характеризуется уменьшением числа и размеров альвеол, сниженным числом капилляров (незавершенность процессов альвеологенеза и ангиогенеза) и минимальными фиброзными изменениями.
БЛД доношенных, формируется на фоне САМ, сепсиса, нозокомиальной пневмонии, пролонгированной ИВЛ, проводимой в связи с хирургическими вмешательствами, ПЛГН. Бронхолегочная дисплазия доношенных развивается у детей, рожденных в срок, клинически и рентгенологически сходна с классической формой БЛД недоношенных.
По тяжести БЛД подразделяется на легкую, среднетяжелую и тяжелую (таблица 1).
Таблица 1. Классификация БЛД [5].
Тяжесть и прогноз БЛД определяет степень кислородозависимости, оцененная в 36 недель. постконцептуального возраста (ПКВ – возраст, суммирующий срок гестации и срок постнатальной жизни в неделях) у детей, родившихся с гестационным возрастом менее 32 недель, на 56 день жизни у детей с гестационным возрастом более 32 недель или при выписке, если она наступит раньше (УД-1А).
| Степень тяжести БЛД | Диагностические критерии, определяющие БЛД | |
| Гестационный возраст | ||
| ˂ 32 недель | ≥32 недель | |
| Время и условия оценки | ||
| С 36 недель постконцептуального периода, до выписки домой при первичном поступлении | С 28 до 56 дней постнатального периода до выписки домой при первичном поступлении | |
| Оксигенотерапия> 21% более 28 дней* | ||
| Легкая БЛД | Дыхание комнатным воздухом до 36 недель постконцептуального периода, при первичной выписке |
Дыхание комнатным воздухом до 56 дней
постнатального периода при первичной выписке
|
| Среднетяжелая БЛД |
Потребность в кислороде ˂ 30% до 36 недель постконцептуального периода при первичной
выписке
|
Потребность в кислороде ˂ 30% до 56 дней постнатального периода при первичной выписке |
| Тяжелая БЛД | Потребность в кислороде ≥30% и/или РРV, NCPAP до 36 недель постконцептуального периода, при первичной выписке | Потребность в кислороде ≥30% и/или РРV, NCPAP до 56 дней постнатального периода, при первичной выписке |
Примечание: *за 1 сутки лечения принимают кислородотерапию, продолжающуюся не менее 12 час.
**PPV (positive pressure ventilation) ─ вентиляция под положительным давлением.
***NCPAP (nose continuous positive airway pressure) – положительное давление в дыхательных путях через носовые канюли.
Использование приведенных критериев позволяет снизить частоту диагностики тяжелых форм заболевания и продолжительность кислородотерапии.
Физиологическое определение БЛД:
В ряде случаев точная градация младенцев по степени тяжести БЛД затруднена из-за отсутствия фактических объективных данных о потребности в кислороде. Поэтому было предложено физиологическое определение БЛД [5], согласно которому диагноз БЛД правомочен у ребенка, который в 36 недель ПКВ нуждается в дыхательной поддержке с положительным давлением или дополнительной оксигенации (О2>30% во вдыхаемой смеси) для поддержания значений SаO2 в пределах 90-96% (УД-В).
Если при дыхании комнатным воздухом в течение, по крайней мере, 30 мин значения SаO2 поддерживаются в пределах 89-90%, то ребенок расценивается как не нуждающийся в кислородотерапии и диагноз БЛД не ставится (УД-В).
Использование приведенных критериев позволяет снизить частоту диагностики тяжелых форм заболевания и продолжительность кислородотерапии.
Осложнения БЛД: хроническая дыхательная недостаточность, острая дыхательная недостаточность на фоне хронической, ателектаз, легочная гипертензия, легочное сердце, системная артериальная гипертензия, недостаточность кровообращения, гипотрофия.
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ
Диагностические критерии
Жалобы и анамнез
Доминирующие факторы риска развития БЛД:
низкая масса тела при рождении (<1500г);
гестационный возраст (<32 недель);
тяжелое течение респираторного дистресс-синдрома;
ИВЛ более 3 суток с FiO2>0,5 и пиковое давление вдоха PIP>30 см вод. ст., NCPAP, другие методы респираторной терапии новорожденных;
высокие концентрации кислорода в дыхательной смеси - более 30-50%;;
курение во время беременности, хорионамнионит у матери, колонизация и инфекция респираторного тракта недоношенных новорожденных, вызванная уреаплазмой, цитомегаловирусом, бактериями, врожденная, ИВЛ-ассоциированная пневмония, сепсис, генерализованные грибковые инфекции; синдромы «утечки воздуха» (пневмоторакс, интерстициальная эмфизема легких, пневмомедиастинум);
отек легких в результате избыточного объема инфузионной терапии, нарушения выведения жидкости, гемодинамически значимого открытого артериального протока;
недостаточная энергетическая ценность питания и повышенная энергетическая потребность у детей, находящихся на ИВЛ, гиповитаминозы, низкие темпы роста, гастроэзофагеальный рефлюкс;
генетическая предрасположенность;
белая раса;
мужской пол [6-20].
Диагностический алгоритм:
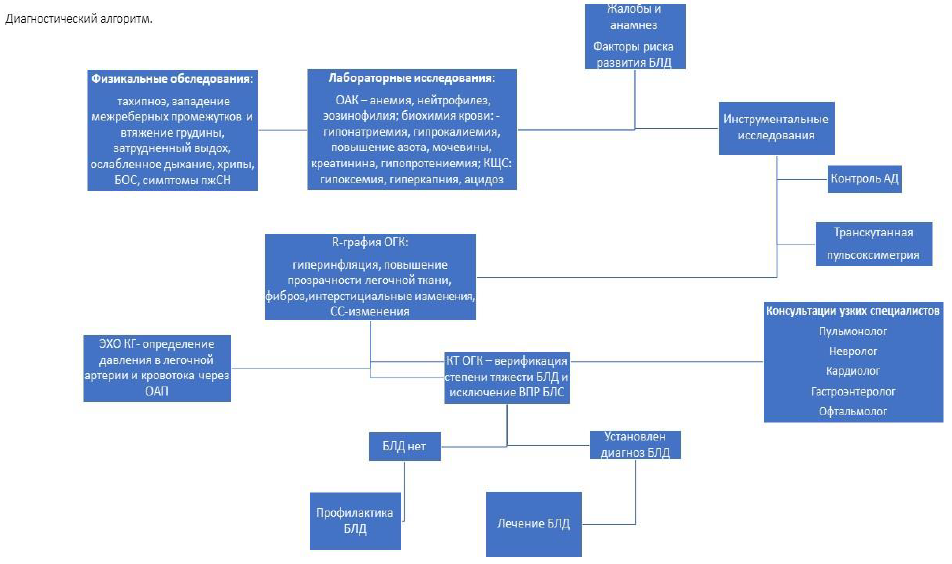
Физикальное обследование [3,4,23,24] (УД-В):
Грудная клетка эмфизематозно вздута, тахипноэ, одышка, с западением межреберных промежутков и втяжением грудины, симптом «качелей», затрудненный удлиненный выдох.
Аускультативная картина: ослабление дыхания и крепитация, свистящие, мелкопузырчатые хрипы.
Бронхообструктивный синдром: эпизоды падения сатурации кислорода крови, клинически сопровождающиеся свистящими хрипами, ослабленным дыханием, затруднением вдоха и выдоха, ригидностью грудной клетки.
Симптомы правожелудочковой сердечной недостаточности (кардиомегалия, тахикардия, гепатоспленомегалия, шум трикуспидальной регургитации).
Кормление является большой нагрузкой и сопровождается срыгиванием, усилением дыхательной недостаточности и снижением показателей сатурации.
NB! Клиническая картина новой формы БЛД характеризуется длительной кислородозависимостью и, в то же время, сравнительно редким возникновением БОС. Тогда как БЛД доношенных часто протекает с длительными, стойкими, резистентными к терапии бронхообструктивными эпизодами.
Основные:
Лабораторные исследования [3,4,25,26]:
Основные:
ОАК (анемия, нейтрофиллез, эозинофилия);
Биохимические анализы крови (гипонатриемия, гипокалиемия, гипохлоремия, повышение азота, мочевины и креатинина (результат ограничения введения жидкости), гипопротениемия);
КОС (гипоксемия, гиперкапния, ацидоз, ctO2, p50).
Основные:
Таблица 2. Рентгенологическая шкала оценки степени тяжести БЛД по A. Greenough и соавт. [26,27] (УД-C).
Таблица 3 - Рентгенологическая шкала оценки степени тяжести БЛД у детей*
ЭхоКГ (определение давления в легочной артерии и кровотока через ОАП); (УД-1С).
Дополнительные:
Инструментальные исследования:
Основные:
Транскутанная пульсоксиметрия (УД-1С) - для мониторинга оксигенации. Дети с высокой легочной гипертензией и длительно кислородозависимые нуждаются в пролонгированной пульсоксиметрии.[46]
У кислородозависимых младенцев с БЛД возможны эпизоды десатурации и гипоксии при стрессе, энтеральном кормлении, чрезмерном возбуждении, бронхоспазме.
Контроль артериального давления (УД-1С) - рекомендуется как на стационарном этапе, так и при каждом амбулаторном визите пациента в связи с возможностью такого осложнения БЛД как системная артериальная гипертензия.
Рентгенография органов грудной клетки в 2-х проекциях - гиперинфляция, повышение прозрачности легочной ткани, фиброз/интерстициальные изменения, сердечно - сосудистые изменения (таблица - 2,3); (УД- 1С)
Рентгенография грудной клетки необходима для выявления и оценки выраженности вздутия легочной ткани, фиброзных, интерстициальных и кистозных изменений.
Таблица 2. Рентгенологическая шкала оценки степени тяжести БЛД по A. Greenough и соавт. [26,27] (УД-C).
| Проявление | 0 | 1 | 2 | 3 | 4 |
| Вздутие* |
˂ 14
|
14-16 | ˃ 16 | ||
|
Фиброз/интерстициальные изменения**
|
нет | 1 зона | 2 зоны | 3 зоны | 4 зоны |
| Кистозные изменения*** | нет | Маленькие |
Множественные/большие
|
Примечание:
* Число задних отрезков ребер выше диафрагмы билатерально.
** Фокальные области линейной или узловой плотности в пределах зоны (1/2 легкого с каждой стороны).
***Прозрачные интрапаренхиматозные поражения с четким контуром.
Таблица 3 - Рентгенологическая шкала оценки степени тяжести БЛД у детей*
|
Признак
|
Балл | *Уменьшение суммы баллов происходит, преимущественно, за счет снижения гиперинфляции и распространённости фиброзных проявлений | |
|
-
|
0-1 | 2 | 3 |
| Степень пневматизации лёгочной ткани | Умеренное повышение | Повышение, неравномерность | Резкое повышение, неравномерность, буллы |
| Архитектоника лёгочного рисунка по долям лёгких | Обеднён,не деформирован | Обеднён, умеренно деформирован, интерстиций подчёркнут | Резко обеднён, на периферии деформирован |
| Перибронхиальные изменения лёгочной ткани | Незначительные | Умеренные, просветы бронхов сужены | Выраженные, просветы деформированы |
| Распространённость пневмофиброза | Отсутствует | Невыраженный, единичные спайки | Грубый фиброз с признаками объёмного уменьшения сегментов, множественные транспульмональные тяжи |
|
СС изменения: лёгочная гипертензия, кардиомегалии
|
Отсутствует | Умеренная лёгочная гипертензия, может быть кардиомегалия | Выраженная кардиомегалия или гипертрофия правого желудочка, лёгочная гипертензия |
| Результат оценки степени тяжести БЛД | Лёгкая 1 – 5 баллов | Среднетяжёлая 6 – 10 баллов | Тяжёлая 11 – 15 баллов |
*Уменьшение суммы баллов происходит, преимущественно, за счет снижения гиперинфляции и распространённости фиброзных проявлений. Вместе с тем, рентгенологические изменения при проведении ВРКТ в той или иной степени остаются у всех больных с БЛД до 2-х-летнего возраста и далее, независимо от степени тяжести заболевания.
ЭхоКГ (определение давления в легочной артерии и кровотока через ОАП); (УД-1С).
ЭХОКГ позволяет выявить признаки перегрузки, гипертрофии правых отделов сердца, при осложнении БЛД легочной гипертензией, однако, имеет недостаточные чувствительность и положительную прогностическую ценность для выявления гипертрофии ПЖ как маркера ЛГ, и поэтому не должна использоваться в качестве метода скрининга развития ЛГ (УД-2C). [46]
Рекомендовано проведение допплер-эхокардиографии с определением кровотока через открытый артериальный проток и для диагностики ЛГ [1,2]. (УД-2С).
Комментарии: для скрининга ЛГ необходимо проведение ЭхоКГ каждому пациенту со среднетяжелой/тяжелой БЛД в 36 недель постконцептуального возраста, то есть нуждающемуся в этом возрасте в кислородотерапии [28,29].
Критерием наличия ЛГ при БЛД является повышение среднего давления в легочной артерии выше 25 мм рт. ст. при индексе резистентности легочных сосудов >3.0 единиц Вуда (WU)·м2 для ситуации двух желудочкового кровообращения [29].
Дополнительные:
Высокоразрешающая компьютерная томография органов грудной клетки.
Цель: верификация степени тяжести БЛД и исключение врожденных пороков развития бронхолегочной системы). (УД-1С) [6]. Для объективизации данных ВРКТ-исследований в настоящее время применяется рентгенологическая шкала балльной оценки степени тяжести БЛД (табл.3).
ВРКТ необходима: при проведении дифференциальной диагностики с другими бронхолегочными заболеваниями, например, ИЗЛ; при повторных пневмотораксах; при задержке клинического выздоровления и персистенции респираторных симптомов, не объяснимых тяжестью БЛД; при необходимости верификации хронического заболевания легких в исходе БЛД, например, при подозрении на развитие облитерирующего бронхиолита; для исключения врожденных пороков развития легких.
Показания для консультации узких специалистов:
Пульмонолог – при наличии патологии со стороны дыхательной системы;
Невролог – при наличии сопутствующей патологии со стороны ЦНС;
Кардиолог – при наличии ВПС и/или персистирующей легочной гипертензии, кардиоваскулярных расстройств;
Гастроэнтеролог – при наличии сопутствующей белково-энергетической недостаточности;
Офтальмолог – при наличии сопутствующей ретинопатии недоношенных.
Диагностический алгоритм:

Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований
[3,4,25,26].
|
Диагноз
|
Обоснование для дифференциальной диагностики | Обследования | Критерии исключения диагноза |
| Респираторный дистресс-синдром |
Дыхательная недостаточность после родов, экспираторный стридор, цианоз, тахипноэ, одышка, в первые 6 ч после родов, у 50–80% недоношенных с ГВ <28 недель, с массой тела <1000 г
|
Рентгенография органов грудной клетки (УЗИ легких)
|
Диффузная сетчатость легочного рисунка, воздушная бронхограмма, «белые легкие». (консолидация) |
| Интерстициальная эмфизема легких | Симптомы дыхательной недостаточности у ребенка, находящегося на ИВЛ, первые дни жизни, У 30–40% недоношенных (ГВ <28 недель, масса тела <1200 г), получающих ИВЛ с положительным давлением | Рентгенография органов грудной клетки (УЗИ легких) |
Линейная форма (неразветвленные тени длиной 3–8 мм, шириной 2 мм)
Кистозноподобная форма, Степени:
I –пузырьки газа до 1 мм, II – до 2 мм, III – более 2 мм, буллезная трансформация
|
| Пневмония | Тахипноэ, одышка, влажные хрипы, гипотермия | Рентгенография органов грудной клетки (УЗИ легких) | Очаговые инфильтративные тени, усиление легочного рисунка (консолидация) |
| Синдром аспирации мекония | Тяжелая асфиксия, мекониальные околоплодные воды, бледность/ цианоз, одышка, хрипы, возникает в первые сутки жизни у доношенных и переношенных новорожденных |
Рентгенография органов грудной клетки (УЗИ легких)
|
Двусторонние инфильтраты, участки эмфиземы, «снежная буря», пневмоторакс и пневмомедиастинум (20– 40%), консолидация.
|
| Врожденная лобарная эмфизема |
Тахипноэ, одышка, кашель, цианоз, ослабление дыхания и вздутие грудной клетки над областью поражения, хрипы
|
Рентгенография органов грудной клетки (УЗИ легких) | Перерастянутый сегмент или доля легкого (левая верхняя доля – 43%, правая верхняя доля – 20%), компрессия рядом расположенных участков, смещение средостения |
| Синдром Вильсона-Микити | Тахипноэ, одышка, хрипы, кислородо- зависимость, приступы апноэ, 7–35-й день жизни, редкое заболевание недоношенных детей с ГВ <32 нед, массой тела <1500 | Рентгенография органов грудной клетки (УЗИ легких) |
Неравномерность вентиляции, грубые лентообразные уплотнения, буллы, особенно в верхних отделах легкого (В-линии)
|
| Хроническая легочная недостаточность недоношенных | Апноэ, тахипноэ, возможна брадикардия, кислородозависимость с FiO2 30–40%, редкое заболевание недоношенных детей с ГВ <28 недель, с массой тела<1200 г, симптомы с первых дней жизни |
Рентгенография органов грудной клетки (УЗИ легких)
|
Диффузная неотчетливость, «дымка», «туман» (признаки альвеолярного отека) без кистозных изменений (отек).
|
| Врожденная кистозная аденоматоидная мальформация легких | Асцит у плода (71%), клиника РДС после рождения, у 2/3 младенцев нет клинических проявлений, врожденное редкое заболевание | Рентгенография органов грудной клетки (УЗИ легких) | Кистозные образования вместо нормальной структуры легких, обычно односторонние (80%), смещение средостения в противоположную (87%) сторону |
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ: нет.
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ
Цели лечения БЛД ― минимизация повреждения легких, предупреждение гипоксемии, купирование интерстициального отека легких, воспаления, бронхиальной обструкции, поддержание роста и стимуляция репарации легких, профилактика РСВ инфекции и развития тяжелого обструктивного бронхиолита.
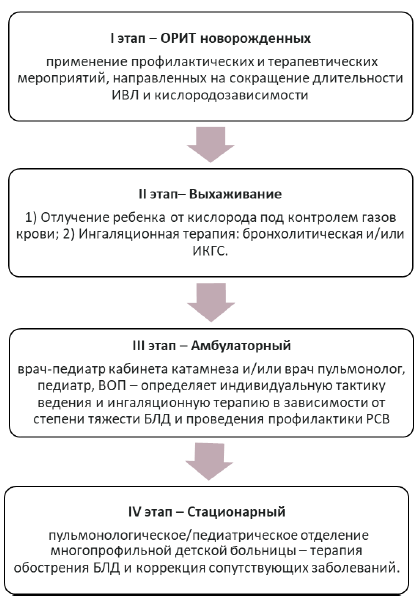
Маршрутизация пациента
После установления диагноза БЛД медицинская помощь оказывается на следующих этапах:
Респираторная поддержка:

Немедикаментозное лечение
Питание:
Обеспечение достаточной калорийности питания - 140-150 ккал/кг в сутки.
Парентеральная дотация - введение аминокислот из расчета белка 3-3,5 г/кг в сутки и жировых эмульсий из расчета 2-3 г/кг в сутки, витаминов и нутриентов.
Потребность в жидкости до достижения массы тела 2000 грамм― 130-150 мл/кг/сут, уменьшается к концу первого года жизни (100 мл/кг/сут).
Грудное молоко - основное питание недоношенного новорожденного. Контроль за прибавкой массы тела по шкалам – Fenton T.R., (2013) и таблицам CDC. Обогатители грудного молока назначаются по показаниям, с учетом нутритивного статуса ребенка (масса ребенка по таблице Fenton менее 25 перцентиля, с учетом скорректированного возраста, БЭН ― дефицит массы тела более 10%, дефицит массы по отношению к росту в сочетании с лабораторными признаками дефицита белка, витаминов и нутриентов, анемии, остеопении).
Респираторная поддержка:
Контроль оксигенации. У недоношенных детей, получающих кислород, целевой диапазон SatO2 рекомендуется поддерживать в пределах 90-95% [31] (УД- 2B). Обычно SatO2 в пределах от 90 до 95% гарантирует уровень РаО2 больше 45 и меньше 100 мм.рт.ст. После введения сурфактанта рекомендуется избегать гипероксического пика посредством быстрого снижения FiO2.
Следует избегать колебаний SatO2 в постнатальном периоде [36] (УД-2С)
Ранний СPAP/методика LISA: рекомендуется применение тактики раннего начала проведения СРАР и селективного введения сурфактанта у недоношенных детей с РДС, т.к. это снижает необходимость интубации, а также риск смертельного исхода и/или развития БЛД [33-35]. (УД-1С).
Искусственная вентиляция легких. Продолжительность ИВЛ и дыхательные объемы рекомендуется минимизировать для того, чтобы максимально снизить повреждающее действие на легкие. (УД-1В).
При прекращении ИВЛ рекомендуется допустить некоторую степень гиперкапнии, при рН выше 7,22. (УД-1В). Рекомендуется избегать гипокапнии, так как она связана с повышенным риском развития БЛД и перивентрикулярной лейкомаляции [36]. (УД-2В). Применение методики малоинвазивного введения сурфактанта для профилактики РДС новорожденных, а также снижения частоты проведения ИВЛ и формирования БЛД. [3,4,36,46,47].
Медикаментозное лечение:
- Кофеин цитрат (3мл) в/в 20 мг/кг – в первые сутки жизни (доза насыщения), 5-10мг/кг – поддерживающая доза (при частоте сердечных сокращений более 180 уд/мин снизить поддерживающую дозу кофеина с 10 до 5 мг/кг. Способ применения: в/в в виде в виде контролируемой внутривенной инфузии при помощи шприцевого инфузомата или другого прибора для дозированной инфузии. Поддерживающая доза 5 мг/кг тела может быть введена внутрь (через рот) при помощи назогастрального зонда каждые 24 ч. Не применяют в/м, п/к, интратекально, а также в виде внутрибрюшинной инъекции. Следует применять только в неонатологическом отделении, которое оснащено соответствующим оборудованием, обеспечивающим тактику ведения больных и мониторинг. Кофеин отменяют полностью при достижении пациентом ПКВ 33-35 недель при отсутствии апноэ [53].
- Фуросемид 0,5‑1 мг/кг/сут внутривенно, или 2 мг/кг/сут внутрь, разделив дозу на 1‑3 раза.
- Спиронолактон 2-4 мг/кг/сут внутрь в два приема (во второй половине дня).
Показания к назначению диуретиков: чрезмерная прибавка массы тела; сердечная недостаточность; рецидивирующий отек легких; эхокардиографические признаки диастолической дисфункции левого желудочка.
Системные глюкокортикостероиды [38-40] (УД-А).
- Глюкокортикостероиды применяют у детей старше 14 суток, зависимых от ИВЛ (FiO2 >0,5; среднее давление в дыхательных путях MAP >7-10 см вод. ст.; высокое PIP) в течение более 7 суток при неудачных попытках экстубации, рентгенологических признаках, свидетельствующих о снижении прозрачности легочной ткани вследствие стойкого интерстициального отека; находящихся на ИВЛ в 36 недель ПКВ или нуждающихся в респираторной поддержке в 40 недель ПКВ. Оценка эффективности терапии дексаметазоном проводится на 3-и сутки от начала лечения. В случае снижения FiO2, снижения PIP введение дексаметазона продолжается по данной схеме. При отсутствии в течение первых трех дней эффекта от введения дексаметазона на 4-й день доза препарата увеличивается до 0,3 мг/кг/сут на 3 дня (4-6-й день), далее проводится снижение дозы ― 0,15 мг/кг/сут (7-9-й день), 10-й день ― 0,1 мг/кг/сут, Суточная доза дексаметазона вводится в два приема.
Возможность повторного курса дексаметазона обсуждается в случае, если ребенок реинтубирован или у него отмечается отсутствие эффекта от первого курса.
Противопоказанием к назначению дексаметазона является наличие инфекционного процесса, любая стадия некротизирующего энтероколита.
Ингаляционные кортикостероиды:
- Рекомендованы у детей при тяжелом течении БЛД, при классической форме БЛД, при наличии респираторных симптомов (одышка, хрипы), при осложнении БЛД легочной гипертензией, при развитии у ребенка с БЛД бронхиальной астмы, облитерирующего бронхиолита [1,2].
- ИГКС могут ускорять экстубацию у некоторых пациентов. Будесонид относится к препаратам «off-label» у новорожденных, разрешен у детей с возраста 3 месяца жизни. Его назначение младенцам с БЛД возможно решением врачебной комиссии с информированного согласия родителей в дозе 250-500 мкг/сут однократно либо при наличии бронхиальной обструкции в 2 ингаляции (Сила рекомендации 1; уровень доказательств C) [44-47,53].
Иммунопрофилактика РСВ – инфекции у недоношенных, детей с БЛД и детей высокого риска ее тяжелого течения:
Профилактика тяжелой инфекции нижних дыхательных путей, вызванной респираторным синцитиальным вирусом (РСВ), у детей с высоким риском заражения РСВ и со следующими показателями: дети в возрасте до 6 месяцев, рожденные на 35-й недели беременности или ранее; дети в возрасте до 2 лет, которым требовалось лечение по поводу бронхолегочной дисплазии в течение последних 6 месяцев; дети в возрасте до 2 лет с гемодинамически значимыми врожденными пороками сердца.
Паливизумаб применяется для пассивной иммунопрофилактики РСВ-инфекции у детей. Вводится препарат внутримышечно, предпочтительно в наружную боковую область бедра в стандартных асептических условиях. Разовая доза препарата составляет 15 мг/кг массы тела (пример: масса тела 3000,0 грамм умножить на 15 мг - доза введения- 45 мг или 0,9 мл или 1 флакон 50 мг/мл). Схема применения: 5 инъекций препарата (1 раз в месяц), проводимых с интервалом 30±5 дней в течение сезонного подъема заболеваемости, вызываемой РСВ (с октября-декабря до марта-апреля).
Рекомендовано начинать иммунопрофилактику РСВ-инфекции в стационаре (родовспомогательное учреждение) за 2-3 дня до выписки новорожденного (1-ая инъекция). Предпочтительно, чтобы первая инъекция была произведена до начала периода подъема заболеваемости [49-51] (Сила рекомендации 2; уровень доказательств А).
Количество инъекций – пять, 1 раз в месяц, в дозе 15 мг/кг массы тела.
Последующие 4 введения препарата проводятся на амбулаторном этапе – в кабинетах катамнеза (процедурном кабинете при соблюдении всех санитарно-гигиенических правил). Контроль за пациентом и запись в карточку форма 112у.
Перечень основных лекарственных средств (имеющих 100% вероятность применения):
Дальнейшее ведение
Таблица 5.1 – Частота осмотров пульмонологом детей с БЛД
Таблица 5.2 -Необходимые исследования у детей с БЛД на амбулаторном этапе
Перечень основных лекарственных средств (имеющих 100% вероятность применения):
|
Фармакотерапевтическая группа
|
МНН лекарственного средства | Способ применения | Уровень доказательности |
|
Метилксантины
|
Кофеин-цитрат | в/в 20 мг/кг – в первые сутки жизни (доза насыщения), 5-10мг/кг – поддерживающая доза | 1А |
| Системные глюкокортикостероиды | Дексаметазон | в/в: 0,15 мг/кг в сутки – с 1 по 3 день; 0,1 мг/кг в сутки – с 4 по 6 день; 0,05 мг/кг в сутки – с 7 по 8 сутки; 0,02 мг/кг в сутки – с 9-10–е сутки | 1А |
| Ингаляционные глюкокортикостероиды | Будесонид | 250-500 мкг/сут однократно либо при наличии бронхиальной обструкции в 2 ингаляции | 1С |
|
Диуретики
|
Фуросемид раствор 1%-1,0 | 0,5-1,0 мг/кг 1-2 раза в сутки в/в | С |
Перечень дополнительных лекарственных средств (менее 100 % вероятности применения):
| Фармакотерапевтическая группа | МНН лекарственного средства | Способ применения | Уровень доказательности |
| Иммуноглобулины специфические | Паливизумаб |
Разовая доза препарата составляет 15 мг/кг массы тела, в/м, однократно, перед выпиской из стационара (первая доза). Последующие 4 введения препарата проводятся на амбулаторном этапе – 1 раз в месяц, в дозе 15 мг/кг массы тела. |
2А |
| Диуретик | Спиронолактон | 2-4 мг/кг/сут внутрь в два приема (во второй половине дня) | С |
Хирургическое вмешательство: нет.
Дальнейшее ведение
Сопровождение на амбулаторном уровне:
Динамический учет и наблюдение ребенка по месту жительства у педиатра кабинета катамнеза и пульмонолога (таблица 5.1 и 5.2).
Врач-педиатр кабинета катамнеза и/или врач пульмонолог, ВОП – определяют индивидуальную тактику ведения за пациентом с БЛД и назначают ингаляционную терапию в зависимости от степени тяжести БЛД и проведение профилактики РСВ-инфекции.
Таблица 5.1 – Частота осмотров пульмонологом детей с БЛД
| Тяжесть БЛД | Возраст | |
|
до 1 года
|
до 3 лет | |
| Легкая | 1 раз в 3–6 мес | по необходимости |
| Среднетяжелая/тяжелая |
ежемесячно
|
1 раз в 3–6 мес |
Таблица 5.2 -Необходимые исследования у детей с БЛД на амбулаторном этапе
|
Исследования
|
Частота | Комментарии |
|
Общий клинический анализ крови
|
1 раз в 6 месяцев | Чаще у детей с анемией недоношенных |
| Пульсоксиметрия, определение газов крови | По показаниям | При обострениях заболевания, при персистирующих симптомах ХДН у детей с тяжелой БЛД при каждом визите |
| Рентгенография органов грудной клетки | 1 раз в 6–12 месяцев | Проводится при выписке, обострениях заболевания, в возрасте 6–12 месяцев у детей с тяжелой БЛД, далее ежегодно до достижения 3-летнего возраста при среднетяжелой, тяжелой БЛД |
| Электрокардиография | 1 раз в 6 месяцев | Чаще при развитии легочной гипертензии и для контроля ее терапии |
|
ЭХОКГ с определением
давления в легочной артерии
|
1 раз в 3–6 месяцев | |
|
Измерение артериального
давления
|
1 раз в 3–6 месяцев | Для исключения артериальной гипертензии при каждом визите |
|
Бронхофонография с
бронхолитической пробой
|
1 раз в год |
При задержке клинического выздоровления или возобновлении рецидивов бронхиальной обструкции после периода их отсутствия, клинико-анамнестических признаках ее атопического генеза
|
| Аллергологическое обследование | По показаниям |
Профилактические мероприятия (профилактика осложнений, первичная профилактика для уровня ПМСП, с указанием факторов риска):
минимизация повреждения легких;
предупреждение гипоксемии;
предупреждение легочной гипертензии;
купирование интерстициального отека, воспаления, бронхиальной обструкции;
поддержание роста и стимуляции репарации легких.
профилактика вирусных инфекций:
- профилактика обострений БЛД состоит в предотвращении или минимизации проявлений вирусных и/или бактериальных инфекций нижних дыхательных путей, из которых наиболее частой до 90% является респираторно-синцитиальная вирусная инфекция [48].
-рекомендуется сезонная пассивная иммунопрофилактика РСВ-инфекции у детей с БЛД, инициация в стационаре перед выпиской новорожденного (Сила рекомендации 2; уровень доказательств А) (смотри выше раздел Медикаментозное лечение).
Индикаторы эффективности лечения и безопасности методов диагностики и лечения, описанных в протоколе:
уменьшение или купирование симптомов дыхательной недостаточности и бронхообструктивного синдрома, уменьшение кислородозависимости, повышение уровня сатурации, повышение качества жизни, прибавка в массе тела, снижение проявлений вирусных инфекций и госпитализации с тяжелым обструктивным бронхиолитом.
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ:
Показания для плановой госпитализации – нет.
Показания для экстренной госпитализации
В родовспомогательное учреждение 3 уровня регионализации (согласно приказу МЗ по регионализации перинатальной помощи):
недоношенные дети с массой тела при рождении менее 1500 грамм;
кислородозависимые дети;
дети, находящиеся на ИВЛ (инвазивной и неинвазивной).
В медицинскую организацию педиатрического (пульмонологического) профиля:
дети с обострением БЛД: дыхательная недостаточность (SpO2 менее 90%, частота дыхания более 60 в минуту, кислородозависимость), обструктивный синдром.
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2023
- 1) Hines D., Modi N., Lee S.K., et al. Scoping review shows wide variation in the definitions of bronchopulmonary dysplasia in preterm infants and calls for a consensus. Acta Paediatr. 2017; 106 (3): 366-374. 2) Duijts L, van Meel ER, Moschino L, et al. European Respiratory Society guideline on long-term management of children with bronchopulmonary dysplasia. Eur Respir J 2020; 55: 1900788 [https://doi.org/10.1183/13993003.00788-2019]. 3) Guidelines for Acute Care of the Neonate Edition 31, 2023–2024 Updated: August 2023. 4) Meissner HC. The beginning of a new era in RSV control. Pediatrics. 2022; doi: 10.1542/peds.2023-0638172023 American Academy of Pediatrics. Downloaded from http://publications.aap.org/pediatrics/article-pdf/doi/10.1542/peds.2023-063817/1528585/peds_2023063817.pdf byguest. 5) Хиггинс Р.Д., Джоб А.Х., Косо-Томас М. и др. Бронхолегочная дисплазия: сводное резюме семинара. Неонатология: новости, мнения, обучение. 2019; 7 (1): 71-82. 6) Brener Dik P.H., Niño Gualdron Y.M., Galletti M.F., et al. Bronchopulmonary dysplasia: incidence and risk factors. Arch Argent Pediatr. 2017; 115(5): 476-482. 7) Clyman R.I., Hills N.K., Liebowitz M., Johng S. Relationship between Duration of Infant Exposure to a Moderate-to-Large Patent Ductus Arteriosus Shunt and the Risk of Developing Bronchopulmonary Dysplasia or Death Before 36 Weeks. Am J Perinatol. 2019; 10. DOI: 10.1055/s-0039-1697672. 8) Hermansen C.L., Mahajan A. Newborn Respiratory Distress. Am Fam Physician. 2015; 92 (11): 994-1002. 9) Jung E., Lee B.S. Late-Onset Sepsis as a Risk Factor for Bronchopulmonary Dysplasia in Extremely Low Birth Weight Infants: A Nationwide Cohort Study Sci Rep. 2019; 9(1): 15448. 10) Keszler M., Sant’Anna G. Mechanical Ventilation and Bronchopulmonary Dysplasia. Clin Perinatol. 2015; 42(4): 781-96. 11) Kiciński P., Kęsiak M., Nowiczewski M., et al. Bronchopulmonary dysplasia in very and extremely low birth weight infants ― analysis of selected risk factors. Pol Merkur Lekarski. 2017; 42(248): 71-75. 12) McEvoy C.T., Spindel E.R. Pulmonary Effects of Maternal Smoking on the Fetus and Child: Effects on Lung Development, Respiratory Morbidities, and Life Long Lung Health. Paediatr Respir Rev. 2017; 21: 27–33. 13) Morrow L.A., Wagner B.D., Ingram D.A., et al.Antenatal Determinants of Bronchopulmonary Dysplasia and Late Respiratory Disease in Preterm Infants. Am J Respir Crit Care Med. 2017; 196(3): 364–374. 14) Pammi M., Lal C.V., Wagner B.D., et al. Airway Microbiome and Development of Bronchopulmonary Dysplasia in Preterm Infants: A Systematic Review. J. Pediatr. 2019; 204:126-133. 15) Sabatelli D., Milet B., Mena P., Domínguez A. Growth restriction increases the risk of bronchopulmonary dysplasia, death, and sepsis in twins of 30 weeks or less of gestation. Rev Chil Pediatr. 2019; 90(1): 36-43. 16) Thekkeveedu R.K., Guaman M.C., Shivanna B. Bronchopulmonary dysplasia: A Review of Pathogenesis and Pathophysiology. Respir Med. 2017; 132: 170–177. 17) Voynow J.A. “New” bronchopulmonary dysplasia and chronic lung disease. Paediatr Respir Rev. 2017; 24: 17-18. 18) Wang J., Dong W. Oxidative stress and bronchopulmonary dysplasia. Gene. 2018; 678: 177-183. 19) Willis K.A., Weems M.F. Hemodynamically significant patent ductus arteriosus and the development of bronchopulmonary dysplasia. Congenit Heart Dis. 2019; 14(1): 27-32. 20) Yu K.-H., Li J., Snyder M., et al. The genetic predisposition to bronchopulmonary dysplasia. Curr Opin Pediatr. 2016; 28(3): 318–323. 21) Респираторный дистресс у новорожденных / под ред. М.В. Фомичева. М.: МЕДпресс-информ, 2017: 504. 22) Aldana-Aguirre J.C., Pinto M., Featherstone R.M., Kumar M. Less invasive surfactant administration versus intubation for surfactant delivery in preterm infants with respiratory distress syndrome: a systematic review and meta-analysis. Arch Dis Child Fetal Neonatal Ed. 2017; 102 (1): F17-23. 23) Овсянников Д.Ю., Дегтяррева Е.А. Легочная гипертензия и легочное сердце – осложнения бронхолегочной дисплазии. // Вопросы диагностики в педиатрии. – 2013. – т.5 (4. –с.5-13). 24) Sweet DG, Carnielli V, Greisen G, Hallman M, et al. European consensus guidelines on the management of neonatal respiratory distress syndrome in preterm infants – 2013 update. Neonatology 2013; 103:353-68. 25) Duijts L., van Meel E.R., Moschino L., et al. European Respiratory Society guideline on long-term management of children with bronchopulmonary dysplasia. Eur Respir J 2020; 55: 1900788. 26) Michael Z., Spyropoulos F., Ghanta S., Christou H. Bronchopulmonary Dysplasia: An Update of Current Pharmacologic Therapies and New Approaches. Clin Med Insights Pediatr. 2018 Dec 11; 12:1179556518817322. 27) Onland W., Offringa M., van Kaam A. Late (≥ 7 days) inhalation corticosteroids to reduce bronchopulmonary dysplasia in preterm infants. Cochrane Database Syst Rev. 2017 Aug 24;8:CD002311. 28) Shinwell E.S., Portnov I., Meerpohl J.J., et al. Inhaled Corticosteroids for Bronchopulmonary Dysplasia: A Meta-analysis. Pediatrics. 2016; 138(6). pii: e20162511. 29) Межинский С.С., Карпова А.Л., Мостовой А.В. и др. Обзор Европейских согласительных рекомендаций по ведению новорожденных с респираторным дистресс-синдромом ― 2019. Неонатология: новости, мнения, обучение. 2019; 7 (3): 46-58. 30) Овсянников Д.Ю., Бойцова Е.В., Давыдова И.В. и др. Бронхолегочная дисплазия: от Норсвея до наших дней. Под ред. Д.Ю. Овсянникова. М.: РУДН, 2016: 384. 31) Давыдова И.В, Намазова-Баранова Л.С., Яцык Г.В. и др. Профилактические стратегии на этапах формирования и течения бронхолегочной дисплазии. Педиатрическая фармакология. 2014; 11(2): 34-40. 32) Игнатьева В.И., Авксентьева М. В., Реброва О.Ю. и др. Клинико- экономический анализ результатов программы иммунопрофилактики РСВ-инфекции в эпидемический сезон 2012/2013 гг. в Москве. Педиатрическая фармакология. 2013; 10 (6): 17-26. 33) Общая характеристика лекарственного препарата паливизумаб, дата пересмотра текста инструкции - 21. 07.2022 г., №N054446 (100 мг/мл), №N054447 (50 мг/мл). 34) Бронхолегочная дисплазия. Под редакцией Овсянникова Д.Ю, Геппе Н.А., Малахов А.Б., Дегтярева.М.В:2020.https://pulmodeti.ru/wp-content/uploads/BLD- Klin_Rukovod_2020_Nestle_BLOK_NEW.pdf. 35) Clinical pathophysiology of the respiratory system in preterm infants Ovsyannikov D.Yu., Kravchuk D.A., Nikolaeva D.Yu.Neonatology: News, Opinions, Training. 2018; 6 (3): 74–98. 36) Ovsyannikov D.Yu.. Akhvlediani S.D. Nutritional disorders and nutritional support for children with bronchopulmonary dysplasia. Neonatologiya: novosti, mneniya, obuchenie [Neonatology: News, Opinions, Training]. 2016; 1 (11): 55–73. 37) Abman S.H., Collaco J.M., Shepherd E.G., Keszler M., et al. Interdisciplinary care of children with severe bronchopulmonary dysplasia. J Pediatr. 2017; 181: 12–28. 38) Функциональная диагностика и клиническая респираторная патофизиология бронхолегочной дисплазии: от младенцев до взрослых. Под редакцией У.Г. Фурмана, Д.Ю. Овсянникова.2020. Москва-Пермь. Стр165. 39) Ведение детей с бронхолегочной дисплазией. А.А. Баранов1, 2, Л.С. Намазова-Баранова1, 2, 3, Н.Н. Володин4, И.В. Давыдова1, 3, Д.Ю. Овсянников5, Д.О. Иванов6, Е.В. Бойцова7, Г.В. Яцык1, А.Г. Антонов8, О.В. Ионов8, А.Ю. Рындин8, В.А. Гребенников2, И.Г. Солдатова2, А.И. Чубарова. Клинические рекомендации. Педиатрическая фармакология/2016/ том13/№4. 40) Бронхолегочная дисплазия. Клинический протокол. 2021. 41) Davidson LM, Berkelhamer SK. Bronchopulmonary Dysplasia: Chronic Lung Disease of Infancy and Long-Term Pulmonary Outcomes. J Clin Med. 2017 Jan 6;6(1):4. doi: 10.3390/jcm6010004. 42) Charles E, Hunt KA, Harris C, Hickey A, Greenough A. Small for gestational age and extremely low birth weight infant outcomes. J Perinat Med. 2019 Feb 25;47(2):247-251. doi: 10.1515/jpm-2018-0295. 43) Баранов А.А., Намазова-Баранова Л.С., Беляева И.А. и др. Иммунопрофилактика инфекционных болезней у недоношенных детей // Педиатрическая фармакология. 2018. № 15 (5). С. 376–389. 44) Narayan O, Bentley A, Mowbray K, et al. Updated cost-effectiveness analysis of palivizumab (Synagis) for the prophylaxis of respiratory syncytial virus in infant populations in the UK. J Med Econ. 2020 Dec;23(12):1640-1652. doi: 10.1080/13696998.2020.1836923. 45) Charkaluk ML, Rousseau J, Dehouck-Vallois M, et al. Occurrence and severity of acute respiratory infections during the first year among very preterm infants: an Epipage-2 cohort analysis. Eur J Pediatr. 2021 Jun;180(6):1833-1840. doi: 10.1007/s00431-021- 03956-w. 46) Muehlbacher, T.; Bassler, D.; Bryant, M.B. Evidence for the Management of Bronchopulmonary Dysplasia in Very Preterm Infants. Children 2021; 8:298. https://doi.org/10.3390/children8040298 47) Shinwell E.S., Portnov I., Meerpohl J.J., et al. Inhaled Corticosteroids for Bronchopulmonary Dysplasia: A Meta-analysis. Pediatrics. 2016; 138(6). pii: e20162511. doi: 10.1542/peds.2016-2511. 48) Filippone M., Nardo D., Bonadies L., et al. Update on Postnatal Corticosteroids to Prevent or Treat Bronchopulmonary Dysplasia. Am J Perinatol. 2019;36(S 02):S58-S62. doi: 10.1055/s-0039-1691802. 49) 7. Behnke J, Lemyre B, Czernik C, Zimmer KP, Ehrhardt H, Waitz M: Non-invasive ventilation in neonatology. Dtsch Arztebl Int 2019; 116: 177–83. DOI: 10.3238/arztebl.2019.0177 50) Chen C, Weng H, Zhang X, et al. Low-Dose Vitamin D Protects Hyperoxia-Induced Bronchopulmonary Dysplasia by Inhibiting Neutrophil Extracellular Traps. Front Pediatr. 2020 Jul 3;8: 335.doi: 10.3389/fped.2020.00335. 51) . Klevebro S, Westin V, Stoltz Sjöström E, et al. Early energy and protein intakes and associations with growth, BPD, and ROP in extremely preterm infants. Clin Nutr. 2019 Jun;38(3):1289-1295. doi: 10.1016/j.clnu.2018.05.012. 52) Starr MC, Boohaker L, Eldredge LC, Menon S, et al. Acute Kidney Injury and Bronchopulmonary Dysplasia in Premature Neonates Born Less than 32 Weeks' Gestation. Am J Perinatol. 2020 Feb;37(3):341-348. doi: 10.1055/s-0039-3400311.
Информация
Сокращения, используемые в протоколе:
|
CDC
|
Centers for Disease Control and Prevention |
| FiO2 | Fraction of inspired oxygen – фракция кислорода во вдыхаемой смеси |
| LISA | Less invasive surfactant administration – методика малоинвазивного введения сурфактанта |
|
MAP
|
Mean airway pressure |
|
NCPAP
|
Nose continuous positive airway pressure (постоянное положительное давление в дыхательных путях с использованием носовых канюль) |
|
NICHD
|
Национальный Институт детского здоровья и развития человека |
| PIP | Peak inspiratory pressure - положительное давление на вдохе |
|
PPV
|
Positive pressure ventilation-вентиляция под положительным давлением |
|
SatO2
|
peripheral saturation O2 |
|
БЛД
|
Бронхолегочная дисплазия |
| БОС | Бронхообструктивный синдром |
| БЭН | Белково-энергетическая недостаточность |
| ВОП | Врач общей практики |
|
ВПС
|
Врожденные пороки сердца |
| ВРКТ | Высокоразрешающая компьютерная томография |
| ГВ | Грудное вскармливание |
| ИВЛ | Искусственная вентиляция легких |
| ИГКС | Ингаляционные глюкокортикостероиды |
| ИЗЛ | Интерстициальное заболевание легких |
|
КЩС
|
Кислотно-щелочное состояние |
| ЛГ | Легочная гипертензия |
| ОАК | Общий анализ крови |
| ОАП | Открытый артериальный проток |
| ПЖ | Правый желудочек |
| ПКВ | Постконцептуальный возраст |
|
ПЛГН
|
Персистирующая легочная гипертензия у новорожденных |
| ПМСП | Первичная медико-санитарная помощь |
| РаО2 | Парциальное напряжение кислорода |
|
РДС
|
Респираторный дистресс-синдром |
| РРV | Positive pressure ventilation (вентиляция под положительным давлением) |
|
РСВ
|
Респираторно-синцитиальный вирус |
| САМ | Синдром аспирации мекония |
| СРАР | Continious Positive Airway Pressure |
| ХДН | Хроническая дыхательная недостаточность |
| ЦНС | Центральная нервная система |
| ЭхоКГ | Эхокардиография |
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ВНЕДРЕНИЯ ПРОТОКОЛА.
Список разработчиков протокола с указанием квалификационных данных:
1) Жубанышева Карлыгаш Биржановна – доктор медицинских наук, профессор, заведующая кафедрой неонатологии АО «Казахстанско-Российский Медицинский Университет», президент РОО «Ассоциация неонатологов и специалистов детской медицины», главный внештатный неонатолог и педиатр г.Алматы.
2) Качурина Дилара Радиковна – доктор медицинских наук, доцент кафедры неонатологии АО «Казахстанско-Российский Медицинский Университет».
3) Тортаева Гульнара Сагиевна – кандидат медицинских наук, заведующая отделением выхаживания недоношенных новорожденных КФ «UMC» Центр материнства и детства, г. Астана.
4) Сенбаева Роза Жакановна – доктор медицинских наук, профессор, АО «Национальный научный центр материнства и детства», врач-неонатолог, главный научный сотрудник отдела науки и менеджмента.
5) Абдуллаева Гульбан Махметжановна – кандидат медицинских наук, доцент кафедры пропедевтики детских болезней НАО «Казахский национальный медицинский университет им. С.Д. Асфендиярова», неонатолог, педиатр высшей категории.
6) Ахмадьяр Нуржамал Садыр-кызы – доктор медицинских наук, профессор, заведующая кафедрой клинической фармакологии НАО «Медицинский университет Астана», врач - клинический фармаколог высшей категории.
Указание на отсутствие конфликта интересов: нет.
Рецензенты:
1) Овсянников Дмитрий Юрьевич, доктор медицинских наук, заведующий кафедрой педиатрии ФГАОУ ВО РУДН, врач-пульмонолог ГБУЗ «ДИКБ № 6 ДЗМ», врач-пульмонолог ГБУЗ «Морозовская ДГКБ ДЗМ», Москва, РФ.
2) Малахов Александр Борисович, доктор медицинских наук, профессор кафедры детских болезней Клинического института детского здоровья им. Н.Ф. Филатова, председатель правления ООО «Педиатрическое респираторное общество», главный внештатный детский пульмонолог ДЗ г. Москва, гл. внештатный детский пульмонолог МЗ МО, руководитель отдела педиатрии ГБУЗ МО «НИИ клинический институт детства» МЗ МО.
3) Моренко Марина Алексеевна, доктор медицинских наук, заведующая кафедрой детских болезней №1, профессор НАО «Медицинский университет Астана», главный внештатный детский иммунолог и аллерголог МЗ РК.
4) Карин Бектурган Тыныбаевич, ассистент кафедры неонатологии МУА «Астана», гл. внештатный неонатолог МЗ РК.
Условия пересмотра протокола: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.