Бронхиальная астма
 Версия: Клинические протоколы 2024 (Узбекистан)
Версия: Клинические протоколы 2024 (Узбекистан)
Астма (J45), Астматический статус [status asthmaticus] (J46)
Аллергология, Аллергология детская, Иммунология, Педиатрия, Пульмонология, Пульмонология детская
Общая информация
Краткое описание
Приложение 1 к приказу № 290
от «9» сентября 2024 года
Министерства здравоохранения Республики Узбекистан
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ УЗБЕКИСТАН
РЕСПУБЛИКАНСКИЙ СПЕЦИАЛИЗИРОВАННЫЙ НАУЧНО-ПРАКТИЧЕСКИЙ МЕДИЦИНСКИЙ ЦЕНТР АЛЛЕРГОЛОГИИ и КЛИНИЧЕСКОЙ ИММУНОЛОГИИ
НАЦИОНАЛЬНЫЕ КЛИНИЧЕСКИЕ ПРОТОКОЛЫ ПО НОЗОЛОГИИ «БРОНХИАЛЬНАЯ АСТМА»
Вводная часть
Код(ы) МКБ-10:
|
Код
|
Название
|
|
J45
|
Астма
|
|
J45.0
|
Астма с преобладанием аллергического компонента.
|
|
J45.1
|
Неаллергическая астма
|
|
J45.8
|
Смешанная астма
|
|
J45.9
|
Астма неуточненная
|
|
J46
|
Астматический статус
|
|
Скачать (ссылка с МКБ)
|
Дата разработки и пересмотра протокола: 2024 год, дата пересмотра 2026 г. или по мере появления новых ключевых доказательств. Все поправки к представленным рекомендациям будут опубликованы в соответствующих документах.
Категория пациентов
Больные, дети и взрослые, с подозрением на бронхиальную астму и с установленным диагнозом бронхиальная астма.
Больные, дети и взрослые, с подозрением на бронхиальную астму и с установленным диагнозом бронхиальная астма.
Целевая группа протокола
-
врач-акушер-гинеколог;
-
врач-аллерголог-иммунолог;
-
врач-анестезиолог-реаниматолог;
-
врач-гастроэнтеролог;
-
врач-генетик;
-
врач-дерматовенеролог;
-
врач-детский хирург;
-
врач-лабораторный генетик;
-
врач-неонатолог;
-
врач общей практики (семейный врач);
-
врач-ортодонт;
-
врач-оториноларинголог;
-
врач-педиатр;
-
врач-педиатр городской (районный);
-
врач-педиатр участковый;
-
врач-пластический хирург;
-
врач по гигиене детей и подростков;
-
врач по гигиене труда;
-
врач по общей гигиене;
-
врач приемного отделения;
-
врач скорой медицинской помощи;
-
врач-стоматолог;
-
врач-стоматолог детский;
-
врач-стоматолог-ортопед;
-
врач-стоматолог-терапевт;
-
врач-стоматолог-хирург;
-
врач-терапевт;
-
врач-терапевт подростковый;
-
врач-терапевт участковый;
-
врач-терапевт участковый цехового врачебного участка;
-
врач-трансфузиолог;
-
врач функциональной диагностики;
-
врач-хирург;
-
врач-челюстно-лицевой хирург;
-
врач-эндоскопист;
ВВЕДЕНИЕ
Бронхиальная астма ( БА)
В настоящем протоколе, предназначенном для специалистов, оказывающих помощь больным с БА, приведены доступные к настоящему дню клинические доказательства, моменты надлежащей практики, а также мнения экспертов. Была проведена адаптация к местным условиям, были учтены особенности доступности лекарственных препаратов к применению у больных с БА.
Основным требованием при разработке протокола, включившего данные, основанные на лучшем мировом опыте, было использование материалов лучших руководств по данной теме , а также методологии строго отбора научных данных при формировании рекомендаций как Российская ассоциация аллергологов и клинических иммунологов (РААКИ) , Белорусская ассоциация аллергологов и клинических иммунологов (БААКА), Европейская академия аллергологов и клинических иммунологов (ЕAACI) , Всемирная аллергологическая организация (WAO).
Основным требованием при разработке протокола, включившего данные, основанные на лучшем мировом опыте, было использование материалов лучших руководств по данной теме , а также методологии строго отбора научных данных при формировании рекомендаций как Российская ассоциация аллергологов и клинических иммунологов (РААКИ) , Белорусская ассоциация аллергологов и клинических иммунологов (БААКА), Европейская академия аллергологов и клинических иммунологов (ЕAACI) , Всемирная аллергологическая организация (WAO).
Определение
Бронхиальная астма (БА) — является гетерогенным заболеванием, характеризующимся хроническим воспалением дыхательных путей, наличием респираторных симптомов, таких как свистящие хрипы, одышка, заложенность в груди и кашель, которые варьируют по времени и интенсивности, и проявляются вместе с вариабельной обструкцией дыхательных путей.
Пациентам с БА при необходимости может быть оказана медицинская помощь любого вида, условия, формы, предусмотренная законодательством Республики Узбекистан.
Диагностику и ведение пациентов с БА осуществляют: врач-аллерголог-иммунолог и/или врач-пульмонолог, также – врач-терапевт или врач-педиатр или врач общей практики (семейный врач), при необходимости осуществляется консультация/проводится лечение врачами других специальностей.
В рамках оказания первичной врачебной медико-санитарной помощи врачи терапевты участковые, врачи-педиатры участковые, врачи общей практики (семейные врачи) при выявлении у пациентов симптомов или признаков бронхиальной астмы направляют пациента в медицинскую организацию пульмонологического или аллергологического профиля или в кабинет врача пульмонолога и/или аллерголога иммунолога для оказания ему первичной специализированной медико-санитарной помощи, а также осуществляют оказание медицинской помощи в соответствии с рекомендациями врача пульмонолога или врача аллерголога-иммунолога. При невозможности оказания медицинской помощи в рамках первичной специализированной медико-санитарной помощи и наличии медицинских показаний пациенту может быть оказана скорая, в том числе, скорая специализированная медицинская помощь, пациент может быть направлен в медицинскую организацию, оказывающую специализированную медицинскую помощь. Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-пульмонологами и/или врачами аллергологами-иммунологами в условиях круглосуточного или дневного стационара.
При осуществлении наблюдения пациентов с БА в амбулаторных условиях следует придерживаться следующей кратности осмотров: в плановом порядке – спустя 1-3 мес от начала лечения и в дальнейшем каждые 3-12 мес в зависимости от ситуации. Во время планового осмотра проводится оценка контроля над симптомами БА, факторов риска развития обострения заболевания. Уменьшение выраженности симптомов и улучшение функции легких начинается уже через несколько дней от начала лечения. Полный эффект может быть достигнут только через 3-4 месяца. В случае тяжелого течения или при длительном отсутствии адекватной терапии БА для достижения контроля может потребоваться больше времени. После обострения БА следует назначить контрольный осмотр в течение 1 недели. Далее пациент наблюдается регулярно в течение нескольких недель, пока не будет достигнут хороший контроль симптомов и наилучшие индивидуальные показатели легочной функции. Дети дошкольного возраста должны быть осмотрены через 1-2 дня после выписки из стационара, и, далее еще раз в течение 1-2 мес или по необходимости.
Пациентам с БА при необходимости может быть оказана медицинская помощь любого вида, условия, формы, предусмотренная законодательством Республики Узбекистан.
Диагностику и ведение пациентов с БА осуществляют: врач-аллерголог-иммунолог и/или врач-пульмонолог, также – врач-терапевт или врач-педиатр или врач общей практики (семейный врач), при необходимости осуществляется консультация/проводится лечение врачами других специальностей.
В рамках оказания первичной врачебной медико-санитарной помощи врачи терапевты участковые, врачи-педиатры участковые, врачи общей практики (семейные врачи) при выявлении у пациентов симптомов или признаков бронхиальной астмы направляют пациента в медицинскую организацию пульмонологического или аллергологического профиля или в кабинет врача пульмонолога и/или аллерголога иммунолога для оказания ему первичной специализированной медико-санитарной помощи, а также осуществляют оказание медицинской помощи в соответствии с рекомендациями врача пульмонолога или врача аллерголога-иммунолога. При невозможности оказания медицинской помощи в рамках первичной специализированной медико-санитарной помощи и наличии медицинских показаний пациенту может быть оказана скорая, в том числе, скорая специализированная медицинская помощь, пациент может быть направлен в медицинскую организацию, оказывающую специализированную медицинскую помощь. Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-пульмонологами и/или врачами аллергологами-иммунологами в условиях круглосуточного или дневного стационара.
При осуществлении наблюдения пациентов с БА в амбулаторных условиях следует придерживаться следующей кратности осмотров: в плановом порядке – спустя 1-3 мес от начала лечения и в дальнейшем каждые 3-12 мес в зависимости от ситуации. Во время планового осмотра проводится оценка контроля над симптомами БА, факторов риска развития обострения заболевания. Уменьшение выраженности симптомов и улучшение функции легких начинается уже через несколько дней от начала лечения. Полный эффект может быть достигнут только через 3-4 месяца. В случае тяжелого течения или при длительном отсутствии адекватной терапии БА для достижения контроля может потребоваться больше времени. После обострения БА следует назначить контрольный осмотр в течение 1 недели. Далее пациент наблюдается регулярно в течение нескольких недель, пока не будет достигнут хороший контроль симптомов и наилучшие индивидуальные показатели легочной функции. Дети дошкольного возраста должны быть осмотрены через 1-2 дня после выписки из стационара, и, далее еще раз в течение 1-2 мес или по необходимости.
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
https://raaci.ru/education/clinic_recomendations/1065.html
А. По степени тяжести:
У пациентов с впервые выявленной БА (для пациентов, не принимающих ингаляционные или системные кортикостероиды) классификация по степени тяжести проводится на основании клинической картины (Табл. 1).
У пациентов с впервые выявленной БА (для пациентов, не принимающих ингаляционные или системные кортикостероиды) классификация по степени тяжести проводится на основании клинической картины (Табл. 1).
Таблица 1. Классификация впервые выявленной БА по степени тяжести.
|
Характеристики* |
Интермиттирующая БА |
Легкая персистирующая БА
|
Персистирующая БА средней тяжести
|
Тяжелая персистирующая БА
|
|
Дневные симптомы |
Реже 1 раза в неделю |
Чаще 1 раза в неделю, но реже 1 раза в день
|
Ежедневные симптомы; Ежедневное использование КДБА
|
Ежедневные симптомы; Ограничение физической активности;
|
|
Ночные симптомы
|
Не чаще 2-х раз в месяц
|
Не чаще 2-х раз в месяц
|
Ночные симптомы чаще 1 раза в неделю;
|
Частые ночные симптомы;
|
|
Обострения |
Обострения короткие |
Обострения могут снижать физическую активность и нарушать сон
|
Обострения могут приводить к ограничению физической активности и нарушению сна
|
Частые обострения |
|
Функциональные
показатели |
ОФВ1 или ПСВ ≥ 80% от должного; |
ОФВ1 или ПСВ ≥ 80% от должного;
|
ОФВ1 или ПСВ 60—80% от должного;
|
ОФВ1 или ПСВ
≤60% от должного; |
|
Суточная лабильность ПСВ |
Суточная лабильность ПСВ или
ОФВ1 < 20%. |
Суточная лабильность ПСВ или ОФВ1 20—30%.
|
Суточная лабильность ПСВ или ОФВ1 > 30%.
|
Суточная лабильность ПСВ или ОФВ1 > 30%.
|
*Примечание: достаточно наличия одного из перечисленных критериев тяжести соответствующей группы, чтобы отнести пациента к данной степени тяжести.
Тяжесть БА у пациентов, получающих лечение, оценивается ретроспективно, исходя из необходимого для контроля симптомов и обострений объема терапии (Табл. 2).
Таблица 2. Классификация БА по степени тяжести у пациентов, уже получающих базисное лечение (для пациентов, принимающих ингаляционные или системные кортикостероиды)
|
Степень тяжести
|
Определение (ступень терапии)
|
Получаемое лечение
|
|
Легкая БА |
Астма, которая хорошо контролируется терапией ступени 1 и 2
|
Низкие дозы ИГКС-ДДБА по потребности или низкие дозы ИГКС или АЛТР
|
|
БА
средней степени тяжести |
Астма, которая хорошо контролируется терапией ступени 3 |
Низкие дозы ИГКС/ДДБА |
|
Тяжелая БА* |
Астма, требующая терапии ступени 4 и 5, для того чтобы сохранить контроль, или БА, которая остается неконтролируемой, несмотря на эту терапию (ступень 5).
|
Средние или высокие дозы ИГКС/ДДБА, тиотропия бромид**, или фиксированная комбинация ИГКС/ДДБА/ДДАХ, таргетная терапия и/или СГКС
|
Оценку можно проводить после 3-4 месяцев комплексной терапии, направленной на контроль заболевания, и, по возможности, после попытки снизить интенсивность терапии для определения ее минимального уровня, эффективного у данного пациента. Поскольку течение БА крайне вариабельно, степень тяжести заболевания может меняться на протяжении месяцев и лет.
Тяжелую БА необходимо отличать от термина «трудная для лечения БА». Единственным отличием этих понятий является то, что трудная для лечения БА не достигает контроля из- за модифицируемых факторов, таких как неправильная техника ингаляции, плохая приверженность лечению, курение, сопутствующие заболевания или из-за неправильного диагноза [1-4].
Поэтому, прежде чем будет рассмотрен диагноз тяжелой БА, необходимо исключить наиболее частые причины плохого контроля БА:
-
плохая техника ингаляции (до 80% больных);
-
низкая приверженность лечению (до 50% больных);
-
неправильный диагноз БА;
-
сопутствующие заболевания и состояния;
-
продолжающийся контакт с триггером (аллерген при подтвержденной сенсибилизации, профессиональныйтриггер).
|
*Диагноз тяжелой БА считается обоснованным после 3-4 месяцев полноценного лечения, соответствующего 4-5 ступеням, при адекватной технике ингаляции, соблюдении рекомендаций врача (должной приверженности лечению), устранении подтвержденных триггеров (домашних, наружных, профессиональных и т.п.), компенсации сопутствующих заболеваний, способных утяжелить течение БА1
|
По уровню контроля выделяют:
-
контролируемую;
-
частично контролируемую;
-
неконтролируемую БА.
При оценке контроля необходимо учитывать не только клинические проявления БА, но и возможные будущие риски (обострения, ухудшение функции легких, побочные эффекты препаратов).
Таблица 3. Уровни контроля БА
|
А. Контроль симптомов астмы
|
Уровень контроля
|
|||
|
За последние 4 недели
у пациента отмечались: |
|
Хорошо контролируемая |
Частично контролируемая |
Неконтролируемая |
|
Дневные симптомы чаще, чем 2 раза в неделю
|
ДА☐ НЕТ☐ |
Ничего из перечисленного |
1-2 из перечисленного |
3-4 из перечисленного |
|
Ночные пробуждения из- за БА
|
ДА☐ НЕТ☐
|
|||
|
Потребность в препарате для купирования симптомов чаще, чем 2 раза в неделю
|
ДА☐ НЕТ☐ |
|||
|
Любое ограничение активности из-за БА
|
ДА☐ НЕТ☐ |
|||
|
В. Факторы риска для неблагоприятных исходов:
|
||||
|
Оценивать факторы риска с момента постановки диагноза и периодически, особенно у пациентов с обострениями.
Функция легких не учитывается при оценке контроля симптомов (но снижение ОФВ1 учитывается как фактор риска обострений). Измерять функцию легких в начале терапии, через 3-6 месяцев лечения препаратами длительного контроля с целью определения лучшего персонального ОФВ1 пациента, и периодически для оценки риска. |
||||
|
Потенциально модифицируемые независимые факторы риска обострений БА:
Другие важные независимые факторы риска обострений:
|
Наличие одного или более из этих факторов повышает риск обострений*, **даже если симптомы хорошо контролируются
|
|
Факторы риска для развития фиксированной обструкции дыхательных путей
|
|
|
Факторы риска для развития нежелательных побочных эффектов лекарств
|
|
|
*При любом обострении необходимо рассмотрение поддерживающей терапии с целью оценки ее адекватности
**По определению, неделя с обострением – это неделя неконтролируемой БА |
|
Этиология и патогенез
Этиология бронхиальной астмы
https://raaci.ru/education/clinic_recomendations/1065.html
Причины, по которым возникает бронхиальная астма, до конца не изучены. Считается, что в развитии болезни задействован комплекс факторов: генетические нарушения, воздействие аллергенов и других раздражителей, в том числе табачного дыма.
Так, если у человека есть родственники с астмой, то риск заболеть выше. За это ответственны более 100 генов, регулирующих воспаление и врождённый иммунитет, среди них гены FCER1B, ORMDL3, HLA-DRB1, HLA-DQB1, ADRB2. Если в них есть ошибки, то вероятность развития астмы увеличивается. Однако наследственная предрасположенность не означает, что у человека точно будет астма. Чтобы заболевание стартовало, необходимо воздействие факторов окружающей среды.
Факторы окружающей среды, влияющие на развитие астмы:
Так, если у человека есть родственники с астмой, то риск заболеть выше. За это ответственны более 100 генов, регулирующих воспаление и врождённый иммунитет, среди них гены FCER1B, ORMDL3, HLA-DRB1, HLA-DQB1, ADRB2. Если в них есть ошибки, то вероятность развития астмы увеличивается. Однако наследственная предрасположенность не означает, что у человека точно будет астма. Чтобы заболевание стартовало, необходимо воздействие факторов окружающей среды.
Факторы окружающей среды, влияющие на развитие астмы:
-
аллергены: клещи домашней пыли, шерсть, слюна или выделения домашних животных, тараканов, споры некоторых грибов, пыльца растений и другие;
-
вирусные инфекции;
-
профессиональные вредности, например контакт с отходами промышленной и древесной отрасли;
-
вредные раздражители: диоксиды серы и азота, продукты сгорания дизельного топлива, табачный дым;
-
особенности питания: избыток продуктов высокой степени обработки (колбас, консервов, кондитерских изделий) и жирной пищи, дефицит овощей и фруктов, а также источников омега-3 в рационе (содержится в жирных сортах рыб, растительных маслах, орехах).
Распространённые пусковые факторы астмы:
- пылевые клещи, которые живут практически в каждом доме и питаются крошечными чешуйками кожи и волос, оставшимися на подушках, мягкой мебели, игрушках;
- плесень — чаще всего вырастает в тёмных и влажных местах: на стенах ванной комнаты, около раковины на кухне, на стенах в подвале;
- аллергены тараканов (моча и экскременты вредителей) и домашних животных (шерсть, слюна, выделения);
- табачный дым — в нём содержится более 250 различных химических веществ, которые могут раздражать дыхательные пути: бензол, винилхлорид, мышьяк и другие;
- пыльца — чаще всего её концентрация в воздухе повышена с февраля по сентябрь;
- холодный воздух;
- некоторые лекарства — нестероидные противовоспалительные средства и бета- адреноблокаторы, которые применяют для контроля артериального давления;
- пищевые аллергены: моллюски, соя, яйца, пшеница, орехи и другие;
- высокоинтенсивная физическая активность, при которой сбивается дыхание;
- стресс;
- гастроэзофагеальный рефлюкс — состояние, при котором содержимое желудка попадает в пищевод.
- гастроэзофагеальный рефлюкс — состояние, при котором содержимое желудка попадает в пищевод.
Патогенез бронхиальной астмы
Патогенез: Патогенез бронхиальной астмы определяется клинико-патогенетическим вариантом.
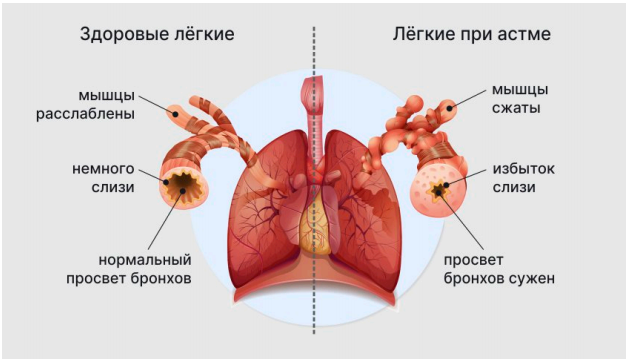

Патогенез атопической бронхиальной астмы. В иммунологической фазе под влиянием неинфекционного аллергена (пыльца растений, растительные и животные белки, лекарственные средства) в условиях врожденного или приобретенного дефицита Т- супрессорной функции В-лимфоцитами продуцируются реагиновые IgE-антитела, которые фиксируются на тучных клетках. В патохимической стадии при повторном контакте с аллергеном происходит его связывание с иммуноглобулином Е на поверхности тучных клеток слизистой оболочки бронхов, агрегация мембранных IgE-рецепторов, дегрануляция тучных клеток - активный секреторный процесс (экзоцитоз) с выделением медиаторов, не сопровождающийся повреждением и гибелью клетки. Выделяются следующие медиаторы: обладающие бронхоспастическим и вазоактивным эффектом (гистамин; лейкотриены LTA4, LTB4, LTC4, LTD4; медленно действующая субстанция, основными компонентами которой являются LTC4 и LTD4; калликреин-подобное вещество, простагландины F2a, G2, D2, тромбоксан А2); обладающие хемотаксическим действием (эозинофильный и нейтрофильные хемотаксические факторы); протеолитические ферменты; лизосомальные ферменты; фактор активации тромбоцитов. В патофизиологической стадии под влиянием медиаторов развивается гиперреактивность бронхов, что проявляется бронхоспазмом, отеком слизистой оболочки бронхов, гиперкринией и дискринией - гиперсекрецией слизи и повышением ее вязкости. Развитию гиперреактивности бронхов способствует врожденный или приобретенный недостаток в бронхах фермента аденилциклазы. В дальнейшем формируется условно-рефлекторный механизм бронхиальной астмы.
Патогенез инфекционно-зависимой бронхиальной астмы. В патогенезе инфекционно- зависимого варианта БА участвуют следующие механизмы:
- гиперчувствительность замедленного типа, основная роль в развитии которой принадлежит Т-лимфоцитам. При повторных контактах с инфекционным аллергеном они гиперсенсибилизируются и приводят к выделению медиаторов замедленного действия: факторов хемотаксиса нейтрофи-лов, эозинофилов, лимфотоксина, фактора агрегации тромбоцитов. Медиаторы замедленного действия вызывают в клетках-мишенях (тучные клетки, базофилы, макрофаги) освобождение простагландинов (PgD2, F2a), лейкотриенов (LNC4, LND4, LNE4) и др., вследствие чего развивается бронхоспазм. Кроме того, вокруг бронха формируется воспалительный инфильтрат, содержащий нейтрофилы, лимфоциты, эозинофилы. Этот инфильтрат является источником медиаторов немедленного типа (лейкотриены, гистамин), вызывающих спазм бронха и его воспаление. Из гранул эозинофилов выделяются также белки, повреждающие непосредственно мерцательный эпителий бронхов, что затрудняет эвакуацию мокроты;
- аллергическая реакция немедленного типа с образованием реагина IgE (аналогично атопической астме). Развивается редко, на ранних стадиях инфекционно-зависимой БА, главным образом при грибковой и нейссериальной астме;
- неиммунологические реакции - повреждение токсинами надпочечников и снижение глюкокортикоиднои функции, нарушение функции мерцательного эпителия и понижение активности р2-адренорецепторов.
Патогенез дисгормонального варианта бронхиальной астмы. В патогенезе четко участвуют гормональные факторы. Наиболее изучены нарушения глюкокортикоиднои функции и функции половых желез. Глюкокортикоидная недостаточность развивается преимущественно вследствие длительного лечения глюкокортикоидами, инфекционно- токсических влияний на надпочечники и способствует формированию гиперактивности тучных клеток, повышению уровня гистамина и PgF2a в крови и развитию бронхоспазма. Дизовариальные расстройства проявляются гиперэстрогенизмом и гипопрогестеронемией. Гиперэстрогенизм повышает активность транскортина, который связывает гидрокортизон крови и усугубляет надпочечниковую недостаточность, снижает активность р2- адренорецепторов. Гипопрогестеронемия понижает активность р2-адренорецепторов и способствует бронхоспазму.
Патогенез аутоиммунного варианта бронхиальной астмы.Этот вариант является этапом дальнейшего прогрессирования и усугубления течения атопической и инфекционно- зависимой БА. К патогенетическим механизмам этих форм присоединяются аутоиммунные реакции. При атопической БА выявляются аутоантитела (антиядерные, противолегочные, к гладким мышцам бронхов, к р-адренорецепторам мышц бронхов). Формирование иммунных комплексов (аутоантиген + аутоантитело) ведет к иммунокомплексному повреждению бронхов и р-адренергической блокаде.
Патогенез нервно-психического варианта бронхиальной астмы. Этот вариант, как и другие, может быть ведущим на определенных этапах болезни. Основные патогенетические механизмы следующие. Психоэмоциональные стрессы непосредственно влияют на тонус бронхов, так как при этом развивается повышенная чувствительность бронхов к гистамину и ацетилхолину. Кроме того, эмоциональное напряжение вызывает гипервентиляцию, стимуляцию ирритативных рецепторов бронхов внезапным глубоким вдохом, кашлем, смехом, плачем, что ведет к рефлекторному спазму бронхов.
Патогенез холинергического варианта бронхиальной астмы. Основной патогенетический механизм - выраженная ваготония, что приводит к возбуждению ацетилхолиновых рецепторов и спазму преимущественно крупных и средних бронхов, а также к гиперсекреции слизистых и серозных желез трахеи и бронхов.
Это неиммунологическая бронхиальная астма, она связана не с первичными иммунологическими, эндокринными, нервно-психическими нарушениями, а с врожденной гиперреактивностью бронхов. В развитии гиперреактивности бронхов имеет значение увеличение межэпителиальных промежутков (это способствует прохождению через них различных химических раздражителей из воздуха, вызывающих дегрануляцию тучных клеток) и чрезвычайно выраженная реактивность бронхиальных ирритационных рецепторов, реагирующих сокращением бронха на воздействие холодного воздуха, табачного дыма и т. д.
"Астма от физического усилия" возникает вследствие повышенной чувствительности тучных клеток, альвеолярных макрофагов, слизеобразующих желез и гладких мышц бронхов к различным воздействиям. При интенсивном физическом усилии развивается гипервентиляция, в результате чего происходит испарение влаги бронхов, их охлаждение и дегрануляция тучных клеток, выделение медиаторов аллергии и воспаления, что ведет к спазму и отеку бронхов.
В основе "аспириновой астмы" лежит нарушение метаболизма арахидоновой кислоты под влиянием аспирина и других нестероидных противовоспалительных средств. После их приема из арахидоновой кислоты мембраны клеток вследствие активации 5-липооксигеназного пути образуются лейкотриены, вызывающие бронхоспазм. Одновременно угнетается циклооксигеназный путь метаболизма арахидоновой кислоты, что ведет к уменьшению образования PgE (расширяет бронхи) и увеличению - PgF2a (суживает бронхи). "Аспириновую астму" вызывают аспирин, нестероидные противовоспалительные средства (индометацин, бруфен, вольтарен и др.), баралгин, антастман, теофедрин, а также продукты, содержащие салициловую кислоту (огурцы, цитрусовые, томаты, различные ягоды) или желтые красители (тартразин)
Патогенез нервно-психического варианта бронхиальной астмы. Этот вариант, как и другие, может быть ведущим на определенных этапах болезни. Основные патогенетические механизмы следующие. Психоэмоциональные стрессы непосредственно влияют на тонус бронхов, так как при этом развивается повышенная чувствительность бронхов к гистамину и ацетилхолину. Кроме того, эмоциональное напряжение вызывает гипервентиляцию, стимуляцию ирритативных рецепторов бронхов внезапным глубоким вдохом, кашлем, смехом, плачем, что ведет к рефлекторному спазму бронхов.
Патогенез холинергического варианта бронхиальной астмы. Основной патогенетический механизм - выраженная ваготония, что приводит к возбуждению ацетилхолиновых рецепторов и спазму преимущественно крупных и средних бронхов, а также к гиперсекреции слизистых и серозных желез трахеи и бронхов.
Это неиммунологическая бронхиальная астма, она связана не с первичными иммунологическими, эндокринными, нервно-психическими нарушениями, а с врожденной гиперреактивностью бронхов. В развитии гиперреактивности бронхов имеет значение увеличение межэпителиальных промежутков (это способствует прохождению через них различных химических раздражителей из воздуха, вызывающих дегрануляцию тучных клеток) и чрезвычайно выраженная реактивность бронхиальных ирритационных рецепторов, реагирующих сокращением бронха на воздействие холодного воздуха, табачного дыма и т. д.
"Астма от физического усилия" возникает вследствие повышенной чувствительности тучных клеток, альвеолярных макрофагов, слизеобразующих желез и гладких мышц бронхов к различным воздействиям. При интенсивном физическом усилии развивается гипервентиляция, в результате чего происходит испарение влаги бронхов, их охлаждение и дегрануляция тучных клеток, выделение медиаторов аллергии и воспаления, что ведет к спазму и отеку бронхов.
В основе "аспириновой астмы" лежит нарушение метаболизма арахидоновой кислоты под влиянием аспирина и других нестероидных противовоспалительных средств. После их приема из арахидоновой кислоты мембраны клеток вследствие активации 5-липооксигеназного пути образуются лейкотриены, вызывающие бронхоспазм. Одновременно угнетается циклооксигеназный путь метаболизма арахидоновой кислоты, что ведет к уменьшению образования PgE (расширяет бронхи) и увеличению - PgF2a (суживает бронхи). "Аспириновую астму" вызывают аспирин, нестероидные противовоспалительные средства (индометацин, бруфен, вольтарен и др.), баралгин, антастман, теофедрин, а также продукты, содержащие салициловую кислоту (огурцы, цитрусовые, томаты, различные ягоды) или желтые красители (тартразин)
Клиническая картина
Cимптомы, течение
Клиника бронхиальной астмы
https://raaci.ru/education/clinic_recomendations/1065.html
Таблица 4. Клинические признаки, увеличивающие и уменьшающие вероятность наличия БА
|
Клинические признаки, повышающие вероятность наличия БА
|
Клинические признаки, уменьшающие вероятность наличия БА
|
|
|
Примечание. ПСВ – пиковая скорость выдоха; ОФВ1 – объем форсированного выдоха за 1 сек
-
Для оценки контроля БА рекомендуется использовать вопросник по контролю над астмой (ACQ-5) и тест по контродю над астмой (АСТ)
Фенотипы БА [1-6]:
-
Аллергическая БА - часто начинается в детстве, связана с наличием других аллергических заболеваний (атопический дерматит, аллергический ринит, пищевая аллергия) у пациента или родственников. Для этого фенотипа характерно эозинофильное воспаление дыхательных путей. Пациенты с фенотипом аллергической БА обычно хорошо отвечают на терапию ингаляционными глюкокортикостероидами (ИГКС). • Неаллергическая БА: Часть пациентов имеют астму, не связанную с аллергией. Клеточный профиль воспаления дыхательных путей может быть эозинофильным, нейтрофильным, смешанным или малогранулоцитарным. Пациенты с неаллергической астмой часто демонстрируют меньший ответ на терапию ИГКС.
-
Аспириновая БА: выделяют в отдельный фенотип, при наличии гиперчувствительности к ацетилсалициловой кислоте и другим нестероидным противовоспалительным препаратам, сопровождающейся приступами удушья и полипозным риносинуситом.
-
БА с поздним дебютом: возникает во взрослом возрасте, чаще у женщин, с тенденцией к неаллергическому фенотипу, требуют более высоких доз ИГКС или, являются относительно рефрактерными к терапии ингаляционными ГКС.
-
БА с фиксированной обструкцией дыхательных путей: У ряда пациентов с длительным стажем болезни развивается персистирующая или неполностью обратимая обструкция вследствие ремоделирования дыхательных путей. характеризуется соотношением ОФВ1/ФЖЕЛ менее 0,7 после адекватной бронходилятации (сальбутамол 400 мкг), при отсутствии или исключении диагноза ХОБЛ у данного пациента.
-
БА у больных с ожирением: пациенты с ожирением и БА часто имеют выраженные респираторные симптомы, не связанные с эозинофильным воспалением.
Обострения БА представляют собой эпизоды нарастающей одышки, кашля, свистящих хрипов, или заложенности в грудной клетке, требующие изменений обычного режима терапии. Для обострения БА характерно снижение ПСВ и ОФВ1.
Таблица 5. Степени тяжести обострений БА
|
Умеренно тяжелое (средней степени тяжести) обострение астмы |
Один из следующих критериев:
|
|
Тяжелое обострение астмы |
Один из следующих критериев:
|
|
Жизнеугрожающая астма |
Один из следующих критериев:
|
|
Астма, близкая к фатальной
|
|
Для того, чтобы отнести пациента к более тяжелой категории достаточно наличие хотя бы одного из соответствующих критериев.
Астматический статус определяется как не купирующийся приступ бронхиальной астмы длительностью 6 часов и более с развитием резистентности к симпатомиметическим препаратам, нарушением дренажной функции бронхов и возникновением гипоксемии и гиперкапнии [4,50] В современных классификациях термин «астматический статус» соответствует критериям и эквивалентен понятиям «жизнеугрожающая БА» и «БА, близкая к фатальной» [26].
Диагностика
Диагностические критерии бронхиальной астмы
Диагноз бронхиальной астмы у детей является клиническим. Он основан на наблюдении за больным и оценке симптомов при исключении других причин бронхиальной обструкции
Таблица 6. Диагностические критерии для постановки впервые выявленной БА [1, 18]
Таблица 6. Диагностические критерии для постановки впервые выявленной БА [1, 18]
|
Анамнез заболевания
|
|
|
Критерии
|
Данные, подтверждающие диагноз
|
|
Свистящее дыхание
Одышка
Кашель
Чувство скованности в груди |
- Имеется 2 и более симптомов
- Отмечается изменение симптомов с течением времени, а также вариабельность по интенсивности - Симптомы часто ухудшаются в ночное время или при нагрузках - Симптомы чаще провоцируются физнагрузкой, смехом, аллергенами, холодным воздухом, вирусной инфекцией |
|
Наличие подтвержденной обструкции
|
|
|
Документальное подтверждение нарушения скорости выдоха
|
На фоне снижения ОФВ1 наблюдается снижение ОФВ1/ФЖЕЛ относительно нижней границы нормы
|
|
Положительная проба с бронхолитиком |
Прирост ОФВ1>12% и >200 мл (достовернее ОВФ1>15% и 400 мл). До теста не использовать КДБА≥4ч, ДДБА двухкратного применения 24 ч, ДДБА однократного приема 36 ч
|
|
Вариабельность показателей ПСВ, измеряемого 2 раза в день в течение 2 недель
|
Среднесуточная вариабельность ПСВ>10% |
|
Улучшение функции легких после 4-х недель противовоспалительной терапии
|
Прирост ОФВ1> 12% или >200 мл или ПСВ>20% по сравнению с исходным уровнем
|
|
Положительный тест с физической нагрузкой
|
Снижение ОФВ1>10% и >200 мл от исходного уровня
|
|
Положительный бронхопровокационный тест
|
Снижение показателя ОФВ1 на 20% при стандартных дозах метахолина
|
|
Вариабельность показателей спирографии между приемами
|
Колебания ОФВ1>12% или >200 мл между приемами, необходимо исключить случаи респираторной инфекции
|
Таблица 7. Диагностические критерии, подтверждающие БА на фоне получаемого лечения [1, 18]
|
Критерии
|
Данные, подтверждающие диагноз
|
|
Вариабельность респираторных симптомов и наличие обструкции
|
Подтверждение диагноза БА. Оценка уровня контроля и пересмотр базисной терапии
|
|
Вариабельность респираторных симптомов, но без наличия обструкции |
Повторить спирографию после отмены бронходилататора (4 ч КДБА, 24 ч для двухкратного применения ГКС-ДДБА, 36 ч для ГКС-ДДБА один раз в сутки) или во время приступа.
Если ОФВ1>70% от ожидаемого: проведите бронхопровокационный тест. Если результат отрицательный, рассмотрите переход на ступень ниже базисной терапии и пересмотреть через 2-4 недели Если ОФВ1<70% от ожидаемого: перейти на следующую ступень терапии с контролем через 3 месяца (повторить спирографию и оценить симптомы) |
|
Наличие респираторных симптомов, нормальная функция легких и отсутствие обструкции
|
Провести спирографию с бронхолитиком, также после отмены бронходилататора. Если показатели в норме, рассмотреть альтернативный диагноз.
Рассмотреть переход на ступень ниже Если симптомы возобновились и снижается функция легких: астма подтверждается. Перейти на следующую ступень до предыдущей наименьшей эффективной дозы Если нет изменений в симптомах или функции легких на самых низких дозах базисной терапии: отменить базисную терапию и наблюдать за пациентов в течение последующих 12 месяцев |
|
Постоянная нехватка воздуха и постоянная обструкция |
Рассмотреть переход на следующую ступень сроком на 3 месяца, затем повторно оценить функцию легких и симптомы
Если нет ответа на терапию, возобновить предыдущее лечение и направить пациента на дообследование. Рассмотреть вероятность астма-ХОБЛ оверлап синдрома |
Диагностика в разные возрастные периоды
|
Дети первых двух лет жизни
|
|
Дети 2-5 лет
|
|
Дети 6 - 12 лет
|
|
Подростки старше 12 лет
|
Клинически в период обострения бронхиальной астмы у детей определяется навязчивый сухой или малопродуктивный кашель (иногда до рвоты), экспираторная одышка, диффузные сухие свистящие хрипы в грудной клетке на фоне неравномерного ослабленного дыхания, вздутие грудной клетки, коробочный оттенок перкуторного звука. Шумное свистящее дыхание слышно на расстоянии. Симптомы могут усиливаться ночью или в предутренние часы. Клиническая симптоматика бронхиальной астмы меняется в течение суток. Следует обсудить весь набор симптомов за последние 3-4 месяца, обратив особое внимание на те, которые беспокоили в течение 2 предшествующих недель. Свистящее дыхание должно быть подтверждено врачом, поскольку родители могут неправильно интерпретировать звуки, издаваемые их ребенком при дыхании.
Жалобы и анамнез:
Жалобы при БА:
• хрипы, одышка, кашель, стеснение в груди, особенно более одного симптома;
• симптомы часто усиливаются ночью или рано утром;
• симптомы меняются со временем и по интенсивности;
• симптомы вызваны вирусными инфекциями (простудой), физическими упражнениями, воздействием аллергенов, изменениями погоды, смехом или раздражителями, такими как выхлопные газы автомобилей, дым или сильные запахи.
Для оценки контроля БА у пациентов рекомендуется использовать тест по контролю над астмой (АСТ) (Приложение 1).
Комментарии: проведение повторной оценки контроля БА требуется не позже, чем через 3 месяца от начала терапии.
• хрипы, одышка, кашель, стеснение в груди, особенно более одного симптома;
• симптомы часто усиливаются ночью или рано утром;
• симптомы меняются со временем и по интенсивности;
• симптомы вызваны вирусными инфекциями (простудой), физическими упражнениями, воздействием аллергенов, изменениями погоды, смехом или раздражителями, такими как выхлопные газы автомобилей, дым или сильные запахи.
Для оценки контроля БА у пациентов рекомендуется использовать тест по контролю над астмой (АСТ) (Приложение 1).
Комментарии: проведение повторной оценки контроля БА требуется не позже, чем через 3 месяца от начала терапии.
Физикальное обследование:
-
Наиболее часто при БА выявляют свистящие хрипы, которые у ряда пациентов выслушиваются только во время форсированного выдоха.
-
В связи с вариабельностью проявлений БА изменения со стороны дыхательной системы при физикальном обследовании могут отсутствовать, что не исключает диагноза астмы.
-
Хрипы могут также отсутствовать и во время тяжелых обострений астмы из-за сильно уменьшенного воздушного потока (так называемое «немое легкое»), но в такие периоды обычно присутствуют другие признаки дыхательной недостаточности.
-
Обследование верхних дыхательных путей может выявить признаки аллергического ринита или полипозных изменений пазух носа.
Крепитация и хрипы на вдохе, а также односторонняя симптоматика не являются признаками астмы.
NB! Отсутствие симптомов не исключает диагноз БА.
Лабораторная диагностика.
https://raaci.ru/education/clinic_recomendations/1065.html
|
VC
|
Общий анализ крови: рекомендуется как при первичной диагностике, так и в динамике для определения и контроля эозинофильного воспаления по уровню количества эозинофилов (в % и абсолютных значениях). Однако повышение количества эозинофилов является непостоянным неспецифическим маркером, но в ряде случаев может быть ассоциирован с целесообразностью и ожидаемой эффективностью применения различных групп препаратов (анти-ИЛ-5 и других). Формула для подсчета эозинофилов крови: количество эозинофилов крови = 10
× X × Y, где Х- количество лейкоцитов ×109 / л, Y - содержание эозинофилов в %.; Эозинофильный катионный белок (ЕСР), триптаза, обнаружение сенсибилизированных лимфоцитов, базофилов – дополнительные методы подтверждения наличия аллергического процесса. Общий анализ мокроты: повышенное количество эозинофилов (не всегда). Повышение эозинофилов в мокроте ≥3% рассматривается как критерий эозинофильного воспаления дыхательных путей. Эозинофилия крови и мокроты является фактором риска развития обострений и необратимой бронхиальной обструкции при БА. Аллергодиагностика: повышенный уровень общего IgЕ, обнаружение специфических IgE к различным аллергенам (пыльцевым, бытовым, эпидермальным, инфекционным, инсектным, пищевым, лекарственным, профессиональным и др.) в сыворотке крови – степень повышения вариативна, но может быть ассоциирована с целесообразностью и ожидаемой эффективностью применения различных методов лечения (АСИТ, анти-IgE и др.) Обнаружение одного или тем более нескольких характерных изменений в лабораторных тестах повышает достоверность диагноза БА, однако отрицательные результаты данных исследований не исключают вероятность присутствия БА, также обнаружение специфических IgE к различным аллергенам рекомендуется проводить однократно при уточнении генеза. |
|
VC
|
Спирометрия является предпочтительным начальным исследованием для оценки наличия и тяжести обструкции дыхательных путей. Повторные исследования функции легких часто более информативны, чем единичное обследование.
Нормальные показатели спирометрии (или пикфлоуметрии) не исключают диагноза БА! Результат спирометрии обязательно должен включать график «поток-обьем», а также признаки достаточной воспроизводимости, длительности форсированного выдоха, плато. Всем пациентам с подозрением на БА рекомендуется выполнять бронходилатационный тест для определения степени обратимости обструкции под влиянием бронхорасширяющих препаратов. Основными критериями диагностики БА являются [1]: - наличие обструктивных изменений скорости потока различной степени выраженности (снижение ОФВ1 ниже 80% с или без одновременного снижения ФЖЕЛ, ПСВ, Индекса Тиффно, СОС25-27); - лабильность показателей в течение времени (в динамике); - положительный бронходилатационный тест (проба на реверсивность, проба с бронхолитиком): прирост ОФВ1≥12% и при этом абсолютный прирост составляет 200 мл и более после ингаляции 200-400 мкг сальбутамола. При нормальных показателях ФВД, а также при проведении спирометрии на фоне терапии и/или приема бронхолитиков (особенно КДБА в течение 4 часов, ДДБА в течение последних 15 часов) прирост показателей может отсутствовать, что тем не менее не является исключающим БА фактором. В этих случаях рекомендован суточный мониторинг ПСВ. При нормальных показателях ФВД, а также при проведении спирометрии на фоне терапии и/или приема бронхолитиков (особенно КДБА в течение 4 часов, ДДБА в течение последних 15 часов) прирост показателей может отсутствовать, что тем не менее не является исключающим БА фактором. В этих случаях рекомендован суточный мониторинг ПСВ. |
Пикфлоуметрия – определение пиковой скорости выдоха (ПСВ). Регистрируется лучший показатель после 3 попыток выполнения форсированного маневра с паузой, не превышающей 2 сек после вдоха. Маневр выполняется сидя или стоя. Прирост ПСВ после ингаляции бронхолитика на 60 л/мин (или на величину ≥20%ПСВ, измеренной до ингаляции бронхолитика) либо изменение ПСВ в течение суток более чем на 10% указывают на наличие БА.
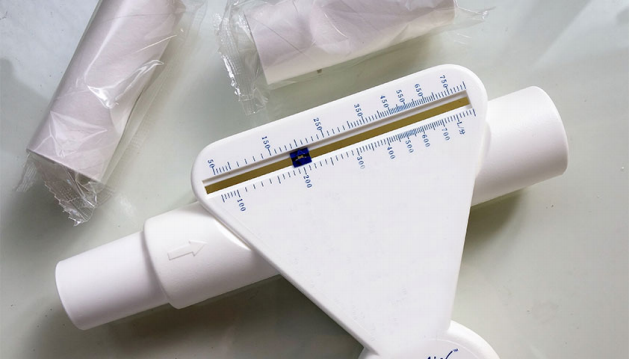
Мониторирование ПСВ: у пациентов с клиническими симптомами БА, у которых нет возможности провести спирометрию или дополнительные диагностические тесты рекомендуется использовать множественные измерения ПСВ, выполняемые в течение по меньшей мере 2-х недель для подтверждения вариабельности скорости воздушного потока. Вариабельность ПСВ рассчитывается как разница между максимальным и минимальным показателем по отношению к среднему суточному показателю ПСВ в процентах. У пациентов с типичными респираторными симптомами выявление повышенной средней суточной вариабельности ПСВ (>10% у взрослых) подтверждает диагноз БА.
- Результаты мониторинга ПСВ должны интерпретироваться с учетом клинической ситуации, поскольку вариабельность ПСВ может быть повышена при заболеваниях, с которыми чаще всего проводится дифференциальная диагностика БА.
- Частая регистрация ПСВ на рабочем месте и вне работы важна при подозрении на наличие профессиональной астмы у пациента.
Проба с физической нагрузкой – снижение ОФВ1 на 10% и 200 мл или более является признаком БА. Пациентам с подозрением на т.н. «астму физического усилия», рекомендуется проведение бронхоконстрикторного теста с физической нагрузкой для исключения бронхоспазма, вызванного охлаждением и высушиванием слизистой дыхательных путей при физической нагрузке.
У пациентов с показателями спирометрии в пределах нормы следует провести дополнительное исследование для выявления бронхиальной гиперреактивности (БГР). Эти тесты достаточно чувствительны, поэтому нормальные результаты, полученные при их проведении, могут служить подтверждением отсутствия БА.
Провокационные ингаляционные пробы с метахолином проводятся при исходном значении ОФВ1≥80%, в условиях специализированного кабинета/стационара. В связи с риском развития угрожающего жизни бронхоспазма для широкого использования не рекомендуются. Ответ на БГР рассчитывается в виде концентрации (или дозы) провокационного агента, вызывающих 20% падение показателя ОФВ1 (ПК20 или ПД20) с использованием линейной интерполяции логарифма концентрации кривой доза-ответ.
- Частая регистрация ПСВ на рабочем месте и вне работы важна при подозрении на наличие профессиональной астмы у пациента.
Проба с физической нагрузкой – снижение ОФВ1 на 10% и 200 мл или более является признаком БА. Пациентам с подозрением на т.н. «астму физического усилия», рекомендуется проведение бронхоконстрикторного теста с физической нагрузкой для исключения бронхоспазма, вызванного охлаждением и высушиванием слизистой дыхательных путей при физической нагрузке.
У пациентов с показателями спирометрии в пределах нормы следует провести дополнительное исследование для выявления бронхиальной гиперреактивности (БГР). Эти тесты достаточно чувствительны, поэтому нормальные результаты, полученные при их проведении, могут служить подтверждением отсутствия БА.
Провокационные ингаляционные пробы с метахолином проводятся при исходном значении ОФВ1≥80%, в условиях специализированного кабинета/стационара. В связи с риском развития угрожающего жизни бронхоспазма для широкого использования не рекомендуются. Ответ на БГР рассчитывается в виде концентрации (или дозы) провокационного агента, вызывающих 20% падение показателя ОФВ1 (ПК20 или ПД20) с использованием линейной интерполяции логарифма концентрации кривой доза-ответ.
Другие применяемые бронхоконстрикторные тесты – с непрямыми провокационными агентами (маннитол, тест с физической нагрузкой, выявленным аллергеном). Положительный ответ на эти стимулы (т.е. падение ОФВ1 более, чем на 15%) – специфический индикатор БА. Однако эти тесты менее специфичны, чем исследования с метахолином и гистамином, особенно у пациентов, получающих антиастматическую терапию [19].
Другие методы диагностики:
-
В качестве дополнительного маркера аллергического воспаления при БА рекомендуется исследовать фракцию оксида азота в выдыхаемом воздухе (FENO) (Табл. 6) [23]. Показатель FeNO (оксид азота в выдыхаемом воздухе) в основном ассоциирован с уровнем эозинофилов в крови и/или мокроты, т.к. отражает активность Т2 воспалительного ответа, он повышен при эозинофильной БА и ассоциируется с хорошим краткосрочным ответом на ИГКС. Однако уровень FENO не является критерием для постановки или исключения диагноза БА, т.к. также повышен при эозинофильном бронхите, атопии и аллергическом рините, снижен у курильщиков, вовремя бронхоспазма и ранней фазы аллергической реакции. Нормальные значения FENO, особенно в момент, когда симптоматика отсутствует, не исключают диагноз БА.
Таблица 8. Методы оценки воспаления дыхательных путей: [12, 26]
|
Тест |
Норма |
Валидность
|
|
|
Чувствительность
|
Специфичность
|
||
|
Метахолиновая ПК20
|
>8 мг/мл
|
Высокая
|
Умеренная
|
|
Физическая нагрузка
|
Падение ОФВ1
>10% от исходн. значений |
Умеренная
|
Высокая
|
|
FENО
|
<25 ppb
|
Высокая#
|
Средняя
|
|
Эозинофилы крови*
|
<4%
|
Высокая#
|
Средняя
|
|
Эозинофилы в мокроте
|
<2%
|
Высокая#
|
Средняя
|
|
Вариабельность ПСВ (% от максимума)
|
<8**
<20%*** |
Низкая
|
Средняя
|
Примечание. ПК20 – провокационная концентрация метахолина, вызывающая 20% падение ОФВ1; # у нелеченных пациентов; **при двухкратном измерении в течение суток; ***при более чем четырехкратных измерениях.
Дополнительным методом подтверждения наличия БА (до окончательной формулировки диагноза) является оценка эффективности пробного лечения: критерием, говорящим о наличии БА, является значительное улучшение ФВД после 4-недельного курса базисной терапии – прирост ОФВ1≥12% или ≥200 мл от первоначальных показателей (или ПСВ>20%). [26]
Кожные пробы с различными аллергенами могут проводиться самостоятельно или вместе с лабораторным определением специфических IgE. Наличие положительного кожного теста или положительного специфического IgE, однако, не означает, что именно этот аллерген вызывает симптомы астмы. Положительные результаты тестов обязательно сопоставляются с симптомами БА и данными анамнеза. Кожные пробы должны проводиться вне обострения БА и сопутствующих патологий, а также вне приема системных ГКС, антигистаминных, антилейкотриеновых средств, бета-адреноблокаторов и т.п.
Дополнительным методом подтверждения наличия БА (до окончательной формулировки диагноза) является оценка эффективности пробного лечения: критерием, говорящим о наличии БА, является значительное улучшение ФВД после 4-недельного курса базисной терапии – прирост ОФВ1≥12% или ≥200 мл от первоначальных показателей (или ПСВ>20%). [26]
Кожные пробы с различными аллергенами могут проводиться самостоятельно или вместе с лабораторным определением специфических IgE. Наличие положительного кожного теста или положительного специфического IgE, однако, не означает, что именно этот аллерген вызывает симптомы астмы. Положительные результаты тестов обязательно сопоставляются с симптомами БА и данными анамнеза. Кожные пробы должны проводиться вне обострения БА и сопутствующих патологий, а также вне приема системных ГКС, антигистаминных, антилейкотриеновых средств, бета-адреноблокаторов и т.п.
рентгенологическое исследование органов грудной клетки для дифференциальной диагностики с другими заболеваниями, оценки степени поражения различных органов и систем при тяжелых системных реакциях, для выявления сопутствующих заболеваний, которые могут имитировать и утяжелять течение основного заболевания;
УЗИ органов брюшной полости и малого таза и др. показано для дифференциальной диагностики с другими заболеваниями, оценки степени поражения различных органов и систем при тяжелых системных реакциях, для выявления сопутствующих заболеваний, которые могут имитировать и утяжелять течение основного заболевания.
Показания для консультации специалистов:
https://raaci.ru/education/clinic_recomendations/1065.html
• консультация аллерголога-иммунолога;
• консультация кардиолога (для выявления сопутствующих БСК);
• консультация невролога (с целью выявления сопутствующей неврологической патологии);
• консультация оториноларинголога (с целью выявления сопутствующей патологии ЛОР- органов);
• консультация гастроэнтеролога (с целью выявления сопутствующей патологии органов пищеварения.
Формулировка диагноза у больного бронхиальной астмой
При формулировке диагноза у больного с бронхиальной астмой рекомендуется следующая последовательность: этиология, форма и степень тяжести с указанием кода по МКБ-10.
Примеры формулировки диагноза.
Бронхиальная астма алллергическая форма, 3 ступень средней степени тяжести контролируемое течение. Аллергический ринит круглогодичный, легкое течение. Сенсибилизация к аллергенам клещей домашней пыли. МКБ J 45.0
Бронхиальная астма неаллергическая, эозинофильная, 4 ступень тяжёлой степени тяжести частично контролируемое течение. Риносинусит полипозный рецидивирующий. Непереносимость нестероидных противовоспалительных препаратов («аспириновая триада»). МКБ-10 J 45.8
Бронхиальная астма аллергическая форма, средней степени тяжести, обострение средней степени тяжести. Аллергический ринит, сезонный, тяжелое течение. Сенсибилизация к пыльцевым аллергенам (деревья). МКБ- 10 J 45.0
Примеры формулировки диагноза.
Бронхиальная астма алллергическая форма, 3 ступень средней степени тяжести контролируемое течение. Аллергический ринит круглогодичный, легкое течение. Сенсибилизация к аллергенам клещей домашней пыли. МКБ J 45.0
Бронхиальная астма неаллергическая, эозинофильная, 4 ступень тяжёлой степени тяжести частично контролируемое течение. Риносинусит полипозный рецидивирующий. Непереносимость нестероидных противовоспалительных препаратов («аспириновая триада»). МКБ-10 J 45.8
Бронхиальная астма аллергическая форма, средней степени тяжести, обострение средней степени тяжести. Аллергический ринит, сезонный, тяжелое течение. Сенсибилизация к пыльцевым аллергенам (деревья). МКБ- 10 J 45.0
Бронхиальная астма неаллергическая форма, тяжелое течение; обострение, тяжелое; астматический статус, компенсированная стадия. Ожирение II ст. МКБ -10 J 45.8
Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований [1,26]
Дифференциальная диагностика БА у взрослых
Проводят со следующими заболеваниями и состояниями в зависимости от наличия или отсутствия бронхиальной обструкции, определяемой как ОФВ1/ФЖЕЛ <0,7 до применения бронхолитика:
Отсутствие бронхиальной обструкции:
-
синдром хронического кашля;
-
гипервентиляционный синдром;
-
синдром дисфункции голосовых связок;
-
ГЭРБ (гастроэзофагеальная рефлюксная болезнь);
-
риниты;
-
заболевания сердца, тромбоэмболии легочных артерий;
-
легочный фиброз.
Наличие бронхиальной обструкции:
-
ХОБЛ;
-
бронхоэктазы;
-
инородное тело;
-
облитерирующий бронхиолит;
-
стеноз крупных дыхательных путей;
-
рак легких;
-
саркоидоз.
Таблица 9. Дифференциальный диагноз при уточнении диагноза БА:
|
Диагноз |
Обоснование
для дифференциальной диагностики |
Методы обследования |
Критерии исключения альтернативного диагноза
|
|
ХОБЛ, Asthma- COPD overlap |
Сходность симптоматики, частые обострения, неполный эффект от терапии, возраст пациента старше 40 лет, курение в анамнезе, признаки бронхита и гиперинфляции на рентгенограмме и КТ |
Спирометрия с пробой с бронхолитиком, мониторинг пикфлоуметрии, анализ мокроты, специфическая аллергодиагностика in vitro / in vivo |
Начало заболевания ранее 20 лет, отсутствие анамнеза длительного курения или воздействия патогенных частиц. Симптомы ухудшаются ночью или утром, связаны с контактом с аллергенами или неспецифическим и раздражителями Симптомы варьируют в течение суток или недель
Семейный или личный отягощенный аллергоанамнез. Установленный ранее диагноз Астмы.
ФВД может быть нормальной в межприступном периоде или сильно варьировать с течением времени Наличие сенсибилизации к различным аллергенам, влияние которых анамнестически связано с астмой. Эозинофилия мокроты. |
|
Поражения ВДП (синдром хронического кашля при поражении ВДП, дисфункция голосовых связок, инородные тела, полипоз и т.п.)
|
Инспираторная одышка или чувство нехватки воздуха, превалирование кашля над обструктивными изменениями, характерный
анамнез |
Риноскопия, ларингоскопия, бронхоскопия, рентген и/или КТ придаточных пазух носа, грудной клетки, консультация ЛОР- врача
|
Отсутствие поражения ВДП характерное для данных заболеваний, заключение ЛОР- врача, исключающее данные патологии.
|
|
Гастроэзофагеальный рефлюкс |
Наличие гастроэзофагеальной симптоматики, анамнеза язвенной болезни желудка, эрозивного гастрита и т.п.
Отсутствие эффекта от бронхолитической терапии. |
ФГДС, суточное мониторирование рН |
Нормальные или почти нормальные показатели ФГДС, отрицательные пробы на НР. Отсутствие эффекта от антирефлюксной терапии.
|
|
Аллергический бронхолегочный аспергиллез |
Частые обострения, недостаточный эффект от терапии, присоединение кровохарканья |
Аллергодиагностика in vitro, анализ мокроты, бронхоскопия с анализом смывов, рентгенография легких |
Отсутствие высоких титров общего IgE и специфических IgE и IgE к Aspergillus spp. Отсутствие признаков грибковой контаминации в мокроте и смывах. Отсутствие эффекта от противогрибковой терапии.
|
|
Бронхоэктазы |
Частые обострения, большое количество мокроты, особенно слизисто-гнойной, прогрессирующее течение, недостаточный эффект от терапии |
Рентгенография и КТ легких, бронхоскопия, анализы мокроты |
Отсутствие характерных признаков бронхоэктазов при имидж-диагностике, бронхоскопии, диффузное поражение нижних дыхательных путей.
Эозинофильный характер воспаления. |
|
Интерстициальные поражения легких (фиброзирующие заболевания, поражения легких при ревматологических патологиях и т.п.) |
Прогрессирующее течение, превалирование симптомов дыхательной недостаточности, полиорганное поражение, высокие показатели СОЭ и ревмопроб, отсутствие эффекта от терапии
|
ОАК,
Ревмопробы: СРБ, ревмофактор, АСЛО. рентгенография и КТ легких, бронхоскопия, анализы мокроты, биопсия легких, консультация ревматолога |
Отрицательные данные обследования, заключение ревматолога, исключающее данные патологии. |
|
Туберкулез легких, различные формы |
Длительный кашель, кровохарканье, нарастающее истощение пациента, перенесенный ТВС в анамнезе, контакт с больными туберкулезом, характерный социальный статус пациента, очаговые изменений на ФГ, отсутствие эффекта от терапии.
|
Рентгенография и КТ легких, диаскин тест, мокрота на БК, консультация фтизиатра |
Отрицательные данные обследования на туберкулез легких, заключение фтизиатра, исключающее туберкулез легких.
|
|
Опухоли легких (центральные и периферические)
|
Пожилой возраст пациента, длительный кашель, кровохарканье, нарастающее истощение пациента, высокие показатели СОЭ, отсутствие эффекта от терапии
|
ОАК,
рентгенография и КТ легких, бронхоскопия, анализы мокроты, биопсия, консультация онколога |
Отрицательные данные обследования на новообразования легких, заключение онколога, исключающее опухоль легких
|
|
Побочные действия лекарственных средств |
Зависимость астматической симптоматики, ее совпадение с приемом различных групп препаратов (ингибиторы АПФ, бета-блокаторы и т.п.)
|
Консультация кардиолога, пробное лечение с элиминацией провоцирующих факторов. |
Отсутствие изменений в астматической симптоматике после отмены данных групп препаратов.
|
Лечение (амбулатория)
Тактика лечения на амбулаторном уровне:
https://raaci.ru/education/clinic_recomendations/1065.html
Целью лечения БА является достижение и поддержание контроля над клиническими признаками заболевания, купирование воспаления дыхательных путей, предотвращение обострений и будущих рисков. Минимизация рисков будущих обострений БА, фиксированной обструкции дыхательных путей и нежелательных побочных эффектов терапии.
У каждого пациента с БА рекомендуется оценивать контроль симптомов, риск развития обострений, необратимой бронхиальной обструкции и побочных эффектов лекарств.
Целью лечения БА является достижение и поддержание контроля над клиническими признаками заболевания, купирование воспаления дыхательных путей, предотвращение обострений и будущих рисков. Минимизация рисков будущих обострений БА, фиксированной обструкции дыхательных путей и нежелательных побочных эффектов терапии.
У каждого пациента с БА рекомендуется оценивать контроль симптомов, риск развития обострений, необратимой бронхиальной обструкции и побочных эффектов лекарств.
Немедикаментозное лечение:
Обучение пациентов и членов их семей является обязательным. Цель обучения: обеспечить пациента необходимой информацией, научить поддержанию контроля, правильному использованию ингаляционных устройств, различию между базисными и неотложными препаратами, когда обращаться за медицинской помощью, как мониторировать свое состояние.
Гипоаллергенная элиминационная диета с исключением определенных продуктов назначается при доказанной сенсибилизации к данным продуктам.
Исключить контакт с причинным аллергеном, влияние неспецифических раздражителей (профессиональной вредности, поллютантов, резких запахов и др.). Отказ от курения (как активного, так и пассивного).
Нестероидные противовоспалительные средства противопоказаны при наличии связи ухудшения БА с назначением данных средств.
Для улучшения дренажной функции и санации бронхиального дерева применяют массаж, дыхательные упражнения, виброакустические воздействия и др.
Методы нетрадиционной и альтернативной медицин. В связи с отсутствием доказательств положительного эффекта на течение заболевания и улучшение функции легких у пациентов с БА не рекомендуется применение таких методов как иглоукалывание, китайская медицина, гомеопатия, гипноз, техники релаксации, применение ионизаторов воздуха [1-3, 26].
Медикаментозное лечение:
Существуют следующие виды медикаментозной терапии БА:
-
регулярная, контролирующая (базисная): применяется длительно; препараты уменьшают воспаление в дыхательных путях, способствуют контролю симптомов, уменьшают риск обострений;
-
симптоматическая (скорая помощь): применяется по необходимости, облегчает острые симптомы.
Выбор медикаментозного лечения зависит от тяжести астмы до назначения терапии и текущего контроля БА при уже проводимой терапии. Рекомендуется использовать ступенчатый подход в выборе объема терапии. На каждой ступени терапии пациенты могут использовать препараты неотложной помощи (бронхолитики короткого и длительного действия (только формотерол).
Комбинированные препараты, содержащие формотерол (ИГКС-формотерол) могут использоваться в режиме «единого ингалятора» (доступно для дозировок 4,5/80 и 4,5/160 мкг) с возможностью применения как контролирующего, так и для купирования симптомов (УД А).
Важную роль имеет способ доставки ингаляционного препарата в дыхательные пути, обоснованный выбор устройства доставки, в зависимости от клинической ситуации, предполагаемой силы вдоха и предпочтений пациента, и типа ингалятора, обучение пациента адекватной технике использования является обязательным компонентом назначения терапии. Наибольшие трудности пациенты испытывают при использовании дозированных аэрозольных ингаляторов (ДАИ), меньшие – порошковых (ПИ), мягких туманных ингаляторов (mist soft inhaler) или небулайзерных форм (при обострении).
В настоящее время всем пациентам с БА рекомендуется применять противовоспалительную терапию (низкие дозы ИГКС) симптоматически или регулярно для снижения риска тяжелых обострений БА. ИГКС можно применять либо на ежедневной основе в качестве базисной терапии, либо симптоматически при легкой БА в виде фиксированной комбинации низких доз ИГКС-формотерол по потребности.
Монотерапия КДБА более не рекомендуется [1], показано назначение ИГКС при каждом применении КДБА, что позволяет повысить эффективность терапии и снизить частоту применения КДБА. Чрезмерное использование КДБА является небезопасным: выдача ≥3 ингаляторов КДБА в год увеличивает риск обострений БА. Применение ≥12 ингаляторов КДБА в год связано с повышенным риском смерти по причине БА [48, 50]
Ступенчатая терапия БА [1, 2, 26]
Дальнейшее лечение БА рекомендуется проводить по ступенчатому принципу (Приложение 2) с усилением или уменьшением медикаментозной терапии в зависимости от ее эффективности и клинической картины. При неэффективности терапии необходимо переходить на более высокую ступень, но прежде необходимо исключить неучтенное влияние неправильной техники ингаляции, воздействия аллергенов и факторов риска, возможность неправильной постановки диагноза.
Снижение ступени возможно при достижении контроля БА, но не ранее чем через 3 месяца после достижения контроля и низком риске обострений (см.таблица 4). Полная отмена ИГКС не рекомендуется.
Снижение ступени возможно при достижении контроля БА, но не ранее чем через 3 месяца после достижения контроля и низком риске обострений (см.таблица 4). Полная отмена ИГКС не рекомендуется.
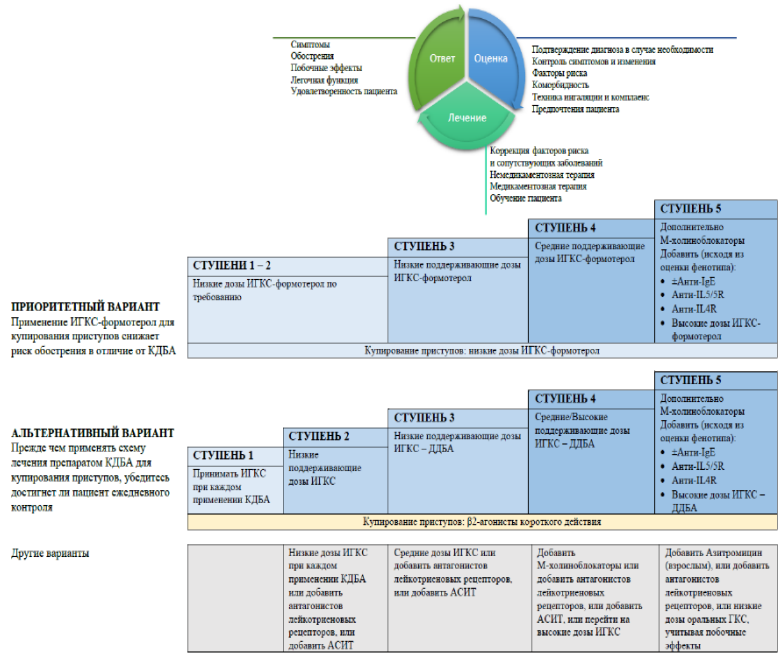
СТУПЕНЬ 1 (интермиттирующая БА, обострение меньше 2-х раз в месяц и отсутствие факторов риска):
Приоритетный вариант. Низкие дозы ИГКС-формотерол по требованию в виде однократной ингаляции. Максимально рекомендуемая суточная доза Будесонид/Формотерол соответствует суммарной дозе формотерола 54 мкг.
Альтернативный вариант. При каждом применении КДБА принимать ИГКС-формотерол
СТУПЕНЬ 2 (обычно соответствует легкой персистирующей астме).
Приоритетный вариант (взрослые). Рекомендовано применение низких доз ИГКС- формотерол для купирования симптомов Астмы. Дозировка будесонид/формотерол составляет однократную ингаляцию, соответствующую 160/4,5 мкг, принимаемую для купирования симптомов. Максимально рекомендуемая доза Будесонид/Формотерол в течение дня соответствует 54 мкг Формотерола. Взрослым ранее не принимающих препараты рекомендовано ежедневное применение комбинированного препарата ИГКС – ДДБА.
Альтернативный вариант. Ежедневное применение низких доз ИГКС, при обострении симптомов в дополнение применяется КДБА.
Другие варианты. Применение низких доз ИКГС при каждом применении КДБА. АЛР наименее эффективны при обострении, чем ИГКС. Перед назначением врач должен рассмотреть все риски и преимущества, а также проинформировать пациента о возможных психоневрологических побочных эффектах.
СТУПЕНЬ 3 (обычно соответствует среднетяжелой персистирующей БА). Приоритетный вариант. Применение низких доз ИГКС-формотерол (Будесонид/Формотерол или Бекламетазон/Формотерол) как поддерживающая терапия, так и по потребности (MART терапия). Максимально рекомендуемая суточная доза Формотерола составляет 54 мкг в сочетании Будесонид/Формотерол и 36 мкг в сочетании Беклометазон/Формотерол.
Альтернативный вариант. Поддерживающая терапия ИГКС-ДДБА (Флутиказон пропионат/Формотерол, Будесонид/Формотерол, Мометазон/Формотерол, Мометазон/Индакатерол, Флутиказона фуроат/Вилантерол, Флутиказона пропионат/Сальметерол, Бекламетазон/Формотерол) применение КДБА по потребности. Комбинированные препараты.
Другие варианты. Рассмотреть возможность проведения сублингвальной АСИТ, пациентам с недостаточным контролем Астмы и страдающим Аллергическим ринитом (см. раздел Другие виды лечения). Другой вариант терапии, увеличение ИГКС до средних доз либо низкие дозы ИГКС в сочетании с антагонистами лейкотриеновых рецепторов или с низкими дозами Теофиллина.
СТУПЕНЬ 4 (обычно соответствует тяжелой персистирующей БА).
Приоритетный вариант. Поддерживающая терапия и купирование симптомов Астмы достигается средними дозами ИГКС-Формотерол (MART-терапия), при этом максимально допустимая доза Формотерола в течение для составляет 54 мкг для Будесонид/Формотерола и 36 мкг для Бекламетазон/Формотерола.
Альтернативный вариант. Применение средних или высоких доз ИГКС-ДДБА в качестве поддерживающей терапии и КДБА для купирования обострений применяется в случае, если MART терапия недоступна или пациент контролирует симптомы Астмы на текущей терапии.
Другие варианты. При стойком неконтролируемом течении Астмы на фоне применения высоких доз ИГКС-ДДБА дополнительно назначаются Антагонисты мускариновых рецепторов (М-холиноблокаторы), для пациентов старше 18 лет возможно применение комбинированных препаратов. Рассмотреть возможность проведения сублингвальной АСИТ, пациентам с недостаточным контролем Астмы и страдающим Аллергическим ринитом (см. раздел Другие виды лечения). Другим вариантом лечения для пациентов, находящихся на высоких или средних дозах ИГКС, является дополнительное применение Антагонистов лейкотриеновых рецепторов или низкие дозы теофиллина.
СТУПЕНЬ 5 (тяжелая, неконтролируемая БА на фоне терапии ступени 4, но с сохраняющимися ежедневными симптомами и частыми обострениями). Требуется добавление дополнительных препаратов – тиотропия в виде мягкого туманного ингалятора (mist soft inhaler) и/или пероральных ГКС в минимальных эффективных дозировках (пациент должен быть информирован о риске развития нежелательных эффектов). При среднетяжелой или тяжелой астме с аллергическим генезом, не контролируемой комбинацией других препаратов (включая высокие дозы ИГКС или пероральные ГКС), целесообразно применение дополнительной терапии (таргетной, биологической).
Альтернативный вариант. Ежедневное применение низких доз ИГКС, при обострении симптомов в дополнение применяется КДБА.
Другие варианты. Применение низких доз ИКГС при каждом применении КДБА. АЛР наименее эффективны при обострении, чем ИГКС. Перед назначением врач должен рассмотреть все риски и преимущества, а также проинформировать пациента о возможных психоневрологических побочных эффектах.
СТУПЕНЬ 3 (обычно соответствует среднетяжелой персистирующей БА). Приоритетный вариант. Применение низких доз ИГКС-формотерол (Будесонид/Формотерол или Бекламетазон/Формотерол) как поддерживающая терапия, так и по потребности (MART терапия). Максимально рекомендуемая суточная доза Формотерола составляет 54 мкг в сочетании Будесонид/Формотерол и 36 мкг в сочетании Беклометазон/Формотерол.
Альтернативный вариант. Поддерживающая терапия ИГКС-ДДБА (Флутиказон пропионат/Формотерол, Будесонид/Формотерол, Мометазон/Формотерол, Мометазон/Индакатерол, Флутиказона фуроат/Вилантерол, Флутиказона пропионат/Сальметерол, Бекламетазон/Формотерол) применение КДБА по потребности. Комбинированные препараты.
Другие варианты. Рассмотреть возможность проведения сублингвальной АСИТ, пациентам с недостаточным контролем Астмы и страдающим Аллергическим ринитом (см. раздел Другие виды лечения). Другой вариант терапии, увеличение ИГКС до средних доз либо низкие дозы ИГКС в сочетании с антагонистами лейкотриеновых рецепторов или с низкими дозами Теофиллина.
СТУПЕНЬ 4 (обычно соответствует тяжелой персистирующей БА).
Приоритетный вариант. Поддерживающая терапия и купирование симптомов Астмы достигается средними дозами ИГКС-Формотерол (MART-терапия), при этом максимально допустимая доза Формотерола в течение для составляет 54 мкг для Будесонид/Формотерола и 36 мкг для Бекламетазон/Формотерола.
Альтернативный вариант. Применение средних или высоких доз ИГКС-ДДБА в качестве поддерживающей терапии и КДБА для купирования обострений применяется в случае, если MART терапия недоступна или пациент контролирует симптомы Астмы на текущей терапии.
Другие варианты. При стойком неконтролируемом течении Астмы на фоне применения высоких доз ИГКС-ДДБА дополнительно назначаются Антагонисты мускариновых рецепторов (М-холиноблокаторы), для пациентов старше 18 лет возможно применение комбинированных препаратов. Рассмотреть возможность проведения сублингвальной АСИТ, пациентам с недостаточным контролем Астмы и страдающим Аллергическим ринитом (см. раздел Другие виды лечения). Другим вариантом лечения для пациентов, находящихся на высоких или средних дозах ИГКС, является дополнительное применение Антагонистов лейкотриеновых рецепторов или низкие дозы теофиллина.
СТУПЕНЬ 5 (тяжелая, неконтролируемая БА на фоне терапии ступени 4, но с сохраняющимися ежедневными симптомами и частыми обострениями). Требуется добавление дополнительных препаратов – тиотропия в виде мягкого туманного ингалятора (mist soft inhaler) и/или пероральных ГКС в минимальных эффективных дозировках (пациент должен быть информирован о риске развития нежелательных эффектов). При среднетяжелой или тяжелой астме с аллергическим генезом, не контролируемой комбинацией других препаратов (включая высокие дозы ИГКС или пероральные ГКС), целесообразно применение дополнительной терапии (таргетной, биологической).
Биологическая терапия БА [1, 2, 26, 37, 39-42]
Тяжелая бронхиальная астма (ТБА) характеризуется невозможностью достижения контроля над заболеванием даже при использовании максимальных рекомендованных доз стандартных лекарственных препаратов или возможностью его достижения только при использовании максимальных доз, включая регулярное применение оральных/системных глюкокортикостероидов.
Таргетная биологическая терапия БА рассматривается как дополнительная терапия для пациентов с Т2-фенотипом с биомаркерами аллергического или эозинофильного воспаления.
Препараты таргетной биологической терапии назначаются к применению пациентам, с подтвержденным диагнозом тяжелая бронхиальная астма при неэффективности базисной терапии высокими дозами ИГКС в течение не менее 6 месяцев, при применении частых курсов СГКС (таблетки, инфузии) в течение 2 и более раз в год, при максимальной элиминации причинозначимого аллергена и провоцирующих факторов (активное и пассивное курение, побочное действие препаратов, профессиональные факторы риска), при соблюдении адекватной техники ингаляции и высокой приверженности терапии.
Выбор конкретного препарата, дозы, кратности приема, продолжительности курса, а также продолжение терапии и переход с одного препарата на другой для таргетной биологической терапии у конкретного пациента решается решением региональной или республиканской экспертной мультидисциплинарной комиссии по таргетной терапии тяжелой бронхиальной астмы.
Анти ИЛ-5/ИЛ-5R (бенрализумаб) [2, 41, 42] (УД B)
Механизм действия: бенрализумаб связывается с альфа-субъединицей рецептора к интерлейкину-5 (ИЛ-5Rα). По сравнению с другими анти-ИЛ-5-препаратами бенрализумаб действует направленно на циркулирующие эффекторные клетки, а также на эозинофилы и базофилы легочной ткани и не только селективно ингибирует привлечение, активацию и мобилизацию эозинофилов, но также способствует исчезновению эозинофилов из циркулирующей крови, костного мозга и тканей-мишеней, особенно из дыхательных путей и легких у пациентов с БА, что значительно уменьшает эозинофильное воспаление.
Критерии применения
Бенрализумаб представляет собой моноклональное антитело, направленное против рецептора ИЛ-5 альфа, в качестве дополнительной терапии у пациентов с тяжелой астмой и эозинофильным фенотипом (количество эозинофилов в периферической крови ≥150 клеток/ мкл). Следует учесть, что ранее существовавшие гельминтные инфекции, такие как эхинококк, стронгилоидоз и т.п., следует лечить до начала лечения бенрализумабом.
Не требует индивидуального дозирования, назначается подкожно 1 раз в 4 недели первые 3 инъекции, а затем 1 раз в 8 недель. Если инъекция пропущена в запланированное время, следует ее выполнить как можно быстрее; двойная доза в связи с пропуском не может быть назначена
Предикторы ответа на анти-ИЛ5/ИЛ5R терапию:
- высокие уровни эозинофилов крови (строгий предиктор)
- высокая частота обострений
- начало астмы во взрослом возрасте
- назальный полипоз
- прием пероральных ГКС в качестве базисной терапии.
Продолжительность терапии - минимум 4 месяца с последующей оценкой ответа. Применение бенрализумаба позволяет большинству пациентов достичь отмены либо снижения дозы сГКС до физиологичной 5мг (в случае НН) [48,49]
Анти IgE терапия (омализумаб). [1, 2, 39] (УД В)
Механизм действия – связывание свободных IgE и препятствование его взаимодействию с рецепторами тучных клеток, базофилов и других участников аллергического воспаления 1- го типа [39].
Критерии применения
Омализумаб показан пациентам с тяжелой IgE зависимой бронхиальной астмой, концентрацией общего IgE от 30 до 1500 МЕ/мл, при наличии подтвержденной сенсибилизации к круглогодичным аллергенам (клещи домашней пыли, перхоть и шерсть животных, плесень и др.)
Препарат дозируется индивидуально, в зависимости от массы тела пациента и исходного уровня общего IgE, назначается в виде подкожных инъекций 1 раз в 2–4 нед.
Предикторы хорошего ответа на анти IgE терапию:
-
сенсибилизация по данным кожных прик-тестов или специфических IgE
-
уровень общего IgE и масса тела пациента находятся в рамках возможного режима дозирования
-
обострения за предшествующий год
Продолжительность терапии - минимум 4 месяца с последующей оценкой ответа.
Анти-ТСЛП /TSLP (тезепелумаб)* [1, 2, 44-47] (УД В)
Механизм действия: Тезепелумаб* представляет собой моноклональное антитело (IgG2λ), направленное против тимусного стромального лимфопоэтина (ТСЛП), предотвращая его взаимодействие с рецептором ТСЛП. При бронхиальной астме, как аллергические, так и неаллергические триггеры индуцируют продукцию ТСЛП. Блокирование ТСЛП с помощью тезепелумаба* снижает широкий спектр биомаркеров и цитокинов, связанных с воспалением дыхательных путей (например, эозинофилы в крови, подслизистые эозинофилы дыхательных путей, IgE, FeNO, IL-5 и IL-13).
Критерии применения Тезепелумаба
Тезепелумаб применяется для дополнительной поддерживающей терапии у пациентов с тяжелой астмой. Минимальный исходный уровень эозинофилов в крови или FeNO не требуется.
Рекомендуемая доза тезепелумаба* составляет 210 мг подкожно каждые 4 недели.
Предикторы ответа на ТСЛП-терапию:
-
высокие уровни эозинофилов крови +++
-
высокие уровни FeNO +++
Тезепелумаб* предназначен для длительного лечения. Решение о продолжении терапии должно быть принято коллегиально не реже одного раза в год в зависимости от уровня контроля астмы у пациента.
Моноклональное антитело к IL-4Рα (дупилумаб)* [1, 2, 51-53]
Механизм действия: Дупилумаб ингибирует передачу сигналов как от IL-4, так и от IL-13; начальная доза – 400 или 600 мг, затем – 200 или 300 мг подкожно 1 раз в 2 нед.) рекомендуется пациентам в возрасте 12 лет и старше с эозинофильным фенотипом БА у пациентов с гормонозависимой БА, получающих сГКС.
Критерии применения
Дупилумаб возможен к применению в качестве дополнительной терапии у пациентов с гормонозависимой тяжелой астмой и эозинофильным фенотипом (количество эозинофилов в периферической крови ≥150 клеток/мкл). Следует учесть, что необходимо исключить гельминтные инфекции, такие как эхинококк, стронгилоидоз и т.п. как причину эозинофилии, а их лечение закончить до принятия решения о его назначении
*В соответствии с правилами применения незарегистрированных ЛС.
Другие виды лечения:
Аллерген-специфическая иммунотерапия (АСИТ) – сублингвальная (SLIT) или подкожная (SCIT*) является одним из методов лечения БА, особенно в сочетании с аллергическим ринитом и сенсибилизацией к клещам домашней пыли, к эпителию и шерсти животных, к спорам плесневым грибкам (УД В). АСИТ назначается и контролируется аллергологом. [1]
Показания к АСИТ:
-
IgE-зависимая форма, подтвержденная положительными результатами кожных аллерготестов и/или повышенным содержанием специфических IgE в сыворотке крови;
-
доказанная взаимосвязь выявленной сенсибилизации к аллергену и клинических проявлений заболевания;
-
пациенты с легкой и среднетяжелой бронхиальной астмой (контролируемой или частично контролируемой), при этом показатели ОФВ1>70% на фоне базисной терапии. Показатели спирографии ПСВ и ОФВ1 контролируются весь период проведения АСИТ, базисная терапия БА продолжается в должном объеме и корректируется лечащим врачом;
-
неконтролируемая БА при невозможности полной элиминации аллергенов по разным причинам.
Лечение БА в сочетании с АР: нелеченный АР способен ухудшать течение БА (УД А), своевременное лечение АР способно снижать частоту и выраженность обострений БА, особенно при персистирующем, круглогодичном АР с сенсибилизацией к бытовым аллергенам, сопутствующим полипозом носа [33, 44]. Используются топические назальные глюкокортикостероиды и другие препараты. [20, 26].
Вакцинация: снижает риск развития инфекций при БА (например, гриппа, УД D), но не снижает уровень тяжести обострений астмы (УД А) [1]. Вакцинация от пневмококковой инфекции имеет потенциальные положительные эффекты, особенно у пожилых (УД D) [1,25].
Вакцины против COVID-19 должны вводиться в медицинских учреждениях, где может быть оказана экстренная помощь в случае развития анафилаксии. Вакцины не должны применяться у людей с известной аллергией к полиэтиленгликолю или другим компонентам вакцин. [1]
Применение витамина Д: недостаток витамина Д может привести к нарушению легочной функции, учащению обострений и снижению эффекта ИГКС [43]. Применение витамина Д способствует улучшению контроля астмы и снижению риска обострений.
Основные мероприятия по лечению обострений включают (в порядке их назначения и в зависимости от тяжести обострений) повторные ингаляции бронхолитиков быстрого действия, раннее применение системных ГКС, добавление или увеличение доз ИГКС, кислородотерапию.
Целями лечения являются как можно более быстрое устранение бронхиальной обструкции и гипоксемии и предотвращение дальнейших рецидивов.
Параллельно с началом терапии проводится оценка тяжести обострения БА (таблица 5). На амбулаторном этапе возможно добиться купирования симптомов умеренно тяжелого (средней степени тяжести) обострение астмы. Обострение астмы тяжелой степени, жизнеугрожающей и астмы близкой к фатальной требует экстренной госпитализации.
− обострение БА легкой или средней степени тяжести: (одышка при разговоре, говорит отдельными фразами, дистанционные хрипы, ЧСС 100-120, ПСВ 60-80%, SpO2 91-95%) сальбутамол 0,5-1,0 мл или ипратропия бромид/фенотерола гидробромид 15-60 кап ч/з небулайзер+будесонид-суспензия ч/з небулайзер 1000-2000 мкг (1-2 небулы). При отсутствии эффекта через 20 мин повторить ингаляцию бронхолитика. В течение первого часа возможно проведение 3–х ингаляций с интервалом 20 минут. При недостаточном эффекте дополнительно преднизолон 20-30 мг per os, в/в 60-90 мг. При улучшении состояния (ПСВ>80% от должного или индивидуально лучшего значения) и сохранении данного состояния в течение 3-4 часов, пациент не нуждается в дополнительных назначениях и госпитализации. При отсутствии эффекта от проводимых мероприятий в течение одного часа необходима срочная госпитализация (Рис.2-3).
Таблица 9. Перечень основных лекарственных средств (имеющих 100% вероятность применения):
Параллельно с началом терапии проводится оценка тяжести обострения БА (таблица 5). На амбулаторном этапе возможно добиться купирования симптомов умеренно тяжелого (средней степени тяжести) обострение астмы. Обострение астмы тяжелой степени, жизнеугрожающей и астмы близкой к фатальной требует экстренной госпитализации.
− обострение БА легкой или средней степени тяжести: (одышка при разговоре, говорит отдельными фразами, дистанционные хрипы, ЧСС 100-120, ПСВ 60-80%, SpO2 91-95%) сальбутамол 0,5-1,0 мл или ипратропия бромид/фенотерола гидробромид 15-60 кап ч/з небулайзер+будесонид-суспензия ч/з небулайзер 1000-2000 мкг (1-2 небулы). При отсутствии эффекта через 20 мин повторить ингаляцию бронхолитика. В течение первого часа возможно проведение 3–х ингаляций с интервалом 20 минут. При недостаточном эффекте дополнительно преднизолон 20-30 мг per os, в/в 60-90 мг. При улучшении состояния (ПСВ>80% от должного или индивидуально лучшего значения) и сохранении данного состояния в течение 3-4 часов, пациент не нуждается в дополнительных назначениях и госпитализации. При отсутствии эффекта от проводимых мероприятий в течение одного часа необходима срочная госпитализация (Рис.2-3).
Таблица 9. Перечень основных лекарственных средств (имеющих 100% вероятность применения):
|
Фармакотерапевтическая группа
|
Международное непатентованное наименование ЛС
|
Способ применения |
УД |
|
Ингаляционные глюкокортикоиды (иГКС) |
будесонид |
Суспензия для ингаляций, Дозированная (для небулайзера) 0.250, 0.500 мг
|
А |
|
будесонид
|
ДАИ 200 мкг
|
А
|
|
|
флутиказон
|
ДАИ, 50, 125, 250 мкг
|
А
|
|
|
циклезонид
|
ДАИ, 80, 160 мкг
|
А
|
|
|
беклометазон
|
ДАИ, 100, 250 мкг
|
А
|
|
|
иГКС в комбинации с формотеролом |
формотерол/ будесонид
|
ДАИ, 4.5/80, 4.5/160,
6/200 мкг |
А
|
|
формотерол/ будесонид |
ДПИ (порошок для ингаляций дозированный) 4.5/80, 4.5/160, 9/320 мкг
|
А |
|
|
Антагонисты лейкотриеновых рецепторов
|
монтелукаст
|
Таблетки 4, 5, 10 мг
|
А
|
|
Глюкокортикоиды |
преднизолон
|
Таблетки, 5 мг
|
А
|
|
метилпреднизолон
|
Таблетки, 4, 16 мг
|
А
|
|
|
преднизолон
|
Ампулы, 30 мг/мл
|
А
|
|
| дексаметазон | Ампулы, 4 мг/мл | А |
Таблица 10. Перечень дополнительных лекарственных средств (менее 100% вероятности применения):
|
Лекарственная группа |
Международное непатентованное наименование ЛС
|
Способ применения |
УД |
|
Глюкокортикоиды |
Метилпреднизолон |
Порошок для приготовления инъекций, 250 мг
|
В |
|
Селективные бета-2 - адреномиметики |
Сальбутамол
|
ДАИ, 100 мкг
|
А
|
|
Сальбутамол |
Раствор для ингаляций (через небулайзер, 5 мг/мл)
|
А |
|
|
КДБА в сочетании с антихолинергическими средствами |
Фенотерол/ ипратропий
|
ДАИ, 50/21 мкг
|
А
|
|
Фенотерол/ ипратропий
|
Раствор для небулайзера, 25/12.5 мг/мл
|
А |
|
|
Длительно действующие В2- агонисты в комбинации иГКС |
Сальметерол/ Флутиказон
|
ДАИ, 25/50, 25/125, 25/250 мкг
|
А
|
|
Сальметерол/ Флутиказон |
ДПИ (порошок для ингаляций дозированный) 50/100, 50/250, 50/500 мкг
|
А |
|
|
Вилантерол/ Флутиказон |
ДПИ (порошок для ингаляций дозированный) 22/92, 22/184 мкг
|
А |
|
|
Формотерол/ беклометазон |
ДПИ (порошок для ингаляций дозированный) 6/100 мкг
|
А |
|
|
Антихолинергические средства |
Тиотропия бромид |
Раствор для ингаляций в 2.5 мкг/доза
|
А
|
|
Порошок для ингаляций, 18 мкг/доза
|
В |
||
|
Адрено- и допаминомиметики
|
Эпинефрин
|
Ампулы, 0.18%
|
А
|
|
Назальные кортикостероиды |
Мометазон
|
Назальный спрей, 50 мкг
|
В
|
|
Беклометазон
|
Назальный спрей, 50 мкг
|
В
|
|
|
Флутиказон |
Назальный спрей, 27.5, 50 Мкг
|
В |
|
|
Моноклональные антитела, связывающие свободный IgE
|
Омализумаб |
Порошок для приготовления инъекций, 150 мг
|
В |
|
Моноклональные антитела к рецептору интерлейкина 5
|
Бенрализумаб |
раствор для подкожного введения, 30 мг/1 мл
|
В |
|
Моноклональные антитела к IL- 4Рα
|
Дупилумаб* |
Раствор для подкожного введения 150 мг/мл, 175 мг/мл
|
В |
|
Моноклональные антитела к тимусному стромальному лимфопоэтину
|
Тезепелумаб* |
Раствор для подкожного введения, 210 мг, 110 мг/1 мл
|
В |
* ЛС незарегистрированные на территории РУз.
Хирургическое лечение
Не проводится
Лечение (стационар)
Тактика лечения на стационарном уровне:
Карта наблюдения пациента, маршрутизация пациента.
Пациент с тяжелым обострением БА госпитализируется в стационар с обязательным наличием и возможностью перевода в ОРИТ. Поступает в пульмонологическое, аллергологическое или терапевтическое (соматическое) отделение. Особого внимания заслуживают пациенты со следующими факторами, связанными с высоким риском смерти от БА [1,2]:
- наличие в анамнезе жизнеугрожающего обострения БА;
- наличие в анамнезе эпизода ИВЛ по поводу обострения БА;
- наличие в анамнезе пневмоторакса или пневмомедиастинума;
- госпитализация по поводу обострения БА в течение последнего года;
- психологические проблемы (отрицание заболевания, снижение перцепции (восприятия) одышки, панические атаки, склонность к передозировке лекарственных средств);
- недавнее резкое уменьшение дозы или полное прекращение приема ГКС;
- низкий комплаенс к терапии.
Пациенты с жизнеугрожающим обострением БА нуждаются в госпитализации непосредственно в ОРИТ, основные показания: слабые респираторные усилия, «немое легкое», цианоз, брадикардия или гипотензия, спутанность сознания или кома. При стабилизации состояния пациент переводится в профильное отделение.
Немедикаментозное лечение:
Гипоаллергенная элиминационная диета.
Режим. Максимальное ограничение контакта с потенциальными аллергенами, влияния неспецифических раздражителей (хлорсодержащих антисептиков, бытовой химии, поллютантов, резких запахов, холодного или перегретого воздуха, чрезмерной влажности и др.) Стимуляция отказа от курения (как активного, так и пассивного).
Кислородотерапия:
Задачей кислородотерапии при обострении БА является поддержание SpО2 в пределах 93- 95%. Для коррекция гипоксемии используется кислород с потоком 1- 4 л/мин через носовые канюли (уров.доказат. В). При недостижении РаО2 выше 60 мм рт.ст. необходимо рассмотреть другие причины гипоксемии (ателектаз доли/легкого вследствие закупорки бронхов густой вязкой слизью, пневмоторакс, легочная эмболия).
Медикаментозное лечение обострений БА:
Начинает проводиться сразу при обращении пациента на любом этапе (амбулаторный, ПМСП, скорая и неотложная помощь, приемный покой, стационар).
Основные мероприятия по лечению обострений включают (в порядке их назначения и в зависимости от тяжести обострений) повторные ингаляции бронхолитиков быстрого действия, раннее применение системных ГКС, добавление или увеличение доз ИГКС, кислородотерапию.
Целями лечения являются как можно более быстрое устранение бронхиальной обструкции и гипоксемии и предотвращение дальнейших рецидивов.
Основные мероприятия по лечению обострений включают (в порядке их назначения и в зависимости от тяжести обострений) повторные ингаляции бронхолитиков быстрого действия, раннее применение системных ГКС, добавление или увеличение доз ИГКС, кислородотерапию.
Целями лечения являются как можно более быстрое устранение бронхиальной обструкции и гипоксемии и предотвращение дальнейших рецидивов.
− Умеренно тяжелое (средней степени тяжести) обострение БА: (одышка при разговоре, говорит отдельными фразами, дистанционные хрипы, ЧСС 100-120, ПСВ 60-80%, SpO2 91- 95%) начало терапии в амбулаторных условиях или на этапе скорой помощи при отсутствии эффекта от проводимых мероприятий в течение одного часа проводится экстренная госпитализация и дальнейшее ведение по алгоритму, аналогично тяжелому обострению БА (Рис.2,3).
− Обострение БА тяжелой степени тяжести: (одышка в покое, разговор отдельными словами, ЧДД>30, возбужден, ЧСС>120, ПСВ<60% или <100 л/мин, цианоз, SpO2<90%) сальбутамол или ипратропия бромид/фенотерола гидробромид в тех же дозах + будесонид- суспензия ч/з небулайзер 1000-2000 мкг (1-2 небулы), плюс преднизолон 30-60 мг per os, или 90-150 мг в/в (при невозможности принять внутрь). На фоне начатой терапии пациент срочно госпитализируется, при необходимости в отделение интенсивной терапии, при транспортировке продолжается ингаляционная терапия β2-агонистами короткого действия и ИГКС через небулайзер, кислородотерапия под контролем пульсоксиметрии для достижения SpO2>90%. В стационаре состояние постоянно мониторируется (ПСВ, SpO2, газы артериальной крови и при необходимости другие исследования) каждые 1-2 часа с последующей корректировкой назначений. При ПСВ 60-80% от должного продолжается кислородотерапия, ингаляции β2-агониста и антихолинергического препарата (каждые 60 мин), пероральные ГКС. При достижении стабильного улучшения в течение 3-4 часов возможна выписка на амбулаторное лечение с увеличением дозы ИГКС в 2-4 раза и добавлением других базисных препаратов (по ступенчатой терапии).
− При отсутствии улучшения или дальнейшем ухудшении состояния – перевод пациента в отделение реанимации: продолжение вышеуказанной терапии, перевод на внутривенное введение ГКС, при необходимости интубация и ИВЛ (ПСВ<30%, РаО2<60 мм рт ст, РаСО2>45 мм рт ст) (Рис.3).
− Жизнеугрожающее состояние: (нарушение сознания, парадоксальное торакодиафрагмальное дыхание, брадикардия, отсутствие свистов при аускультации) сальбутамол или ипратропия бромид/фенотерола гидробромид в тех же дозах и будесонид- суспензия ч/з небулайзер 1000-2000 мкг (1-2 небул) + преднизолон в/в 90-150 мг. Остальная тактика как при тяжелом обострении БА (Рис.2,3).
− Обострение БА тяжелой степени тяжести: (одышка в покое, разговор отдельными словами, ЧДД>30, возбужден, ЧСС>120, ПСВ<60% или <100 л/мин, цианоз, SpO2<90%) сальбутамол или ипратропия бромид/фенотерола гидробромид в тех же дозах + будесонид- суспензия ч/з небулайзер 1000-2000 мкг (1-2 небулы), плюс преднизолон 30-60 мг per os, или 90-150 мг в/в (при невозможности принять внутрь). На фоне начатой терапии пациент срочно госпитализируется, при необходимости в отделение интенсивной терапии, при транспортировке продолжается ингаляционная терапия β2-агонистами короткого действия и ИГКС через небулайзер, кислородотерапия под контролем пульсоксиметрии для достижения SpO2>90%. В стационаре состояние постоянно мониторируется (ПСВ, SpO2, газы артериальной крови и при необходимости другие исследования) каждые 1-2 часа с последующей корректировкой назначений. При ПСВ 60-80% от должного продолжается кислородотерапия, ингаляции β2-агониста и антихолинергического препарата (каждые 60 мин), пероральные ГКС. При достижении стабильного улучшения в течение 3-4 часов возможна выписка на амбулаторное лечение с увеличением дозы ИГКС в 2-4 раза и добавлением других базисных препаратов (по ступенчатой терапии).
− При отсутствии улучшения или дальнейшем ухудшении состояния – перевод пациента в отделение реанимации: продолжение вышеуказанной терапии, перевод на внутривенное введение ГКС, при необходимости интубация и ИВЛ (ПСВ<30%, РаО2<60 мм рт ст, РаСО2>45 мм рт ст) (Рис.3).
− Жизнеугрожающее состояние: (нарушение сознания, парадоксальное торакодиафрагмальное дыхание, брадикардия, отсутствие свистов при аускультации) сальбутамол или ипратропия бромид/фенотерола гидробромид в тех же дозах и будесонид- суспензия ч/з небулайзер 1000-2000 мкг (1-2 небул) + преднизолон в/в 90-150 мг. Остальная тактика как при тяжелом обострении БА (Рис.2,3).
Ингаляционные КДБА
Ингаляционные КДБА - являются препаратами первой линии при обострении БА (УД А). При использовании небулайзера используют однократные дозы сальбутамола 2.5 мг на 1 ингаляцию. При тяжелом обострении БА рекомендована схема терапии: в 1-й час терапии проводится 3 ингаляции по 2.5 мг каждые 20 минут, затем ингаляции проводят каждый час до значимого улучшения состояния, после чего возможно назначение препарата каждые 4- 5 часов. Однократная доза сальбутамола при использовании ДАИ со спейсером может составлять 400 мг, кратность введения аналогично при использовании небулайзера.
Ингаляционные антихолинергические препараты.
При обострении БА добавление ипратропиума бромида (в дозе 500 мкг каждые 4- 6 часов, возможно и более частое использование каждые 2-4 часа) в комбинации с β2-агонистом короткого действия обеспечивает более выраженный бронхорасширяющий эффект, сопровождается снижением частоты госпитализаций (УД A) и более выраженным улучшением ПСВ и ОФВ1 (УД B).
Ингаляционные ГКС
Эффективность ИГКС, назначаемых при помощи ДАИ+спейсер или небулайзера, не уступает системным ГКС (УД B), и может их превосходить по безопасности и скорости наступления положительных эффектов. При назначении ИГКС с небулайзерным введением (будесонид суспензия) эффект наступает более быстро (УД B). Дозировка ИГКС варьирует в широких пределах до 2000 мкг/сутки.
Системные глюкокортикостероиды
Внутривенный и пероральный пути введения ГКС одинаково эффективны при обострении БА. Оральный путь приема ГКС предпочтителен в связи с более быстрым началом действия, более эффективен и дешевле, чем инъекционные формы [48,49]. Внутривенные ГКС могут быть введены только пациентам, не способным принять препарат внутрь: наличие рвоты, выраженная одышка, требуется неинвазивная вентиляция или интубация. Адекватными дозами оральных ГКС являются: дневные дозы, эквивалентные 40-50 мг преднизолона в виде однократной утренней дозы или 200 мг гидрокортизона в разделенных дозах (УД B). Курс системных ГКС в течение 5-7 дней имеет эффективность не ниже 10- 14-дневного курса (УД B). Нет необходимости в постепенном снижении дозы оральных ГКС в течение нескольких дней (УД B).
Внутривенный аминофиллин и теофиллин не должны использоваться при лечении обострений астмы ввиду их низкой эффективности и профиля безопасности, а также большей эффективности и относительной безопасности КДБА. [1, 26]. Применение внутривенного аминофиллина связано с тяжелыми и потенциально фатальными побочными реакциями, особенно у пациентов, уже получавших теофиллин с замедленным высвобождением. У взрослых с тяжелыми обострениями астмы дополнительное лечение аминофиллином не улучшает результаты по сравнению с КДБА.
Внутривенный аминофиллин и теофиллин не должны использоваться при лечении обострений астмы ввиду их низкой эффективности и профиля безопасности, а также большей эффективности и относительной безопасности КДБА. [1, 26]. Применение внутривенного аминофиллина связано с тяжелыми и потенциально фатальными побочными реакциями, особенно у пациентов, уже получавших теофиллин с замедленным высвобождением. У взрослых с тяжелыми обострениями астмы дополнительное лечение аминофиллином не улучшает результаты по сравнению с КДБА.
Адреналин.
Подкожное или внутримышечное введение адреналина может потребоваться при неотложном лечении сопутствующей анафилаксии или ангионевротического отека (УД С); этот препарат не является стандартным средством для лечения обострения БА.
Магния сульфат.
Пациентам с тяжелым обострением БА, рефрактерным к назначению КДБА, рекомендуется назначение магния сульфата (УД В). На фоне терапии магния сульфатом (2 г в/в в течение 20 мин однократно) показано уменьшение продолжительности госпитализации у пациентов с БА, включая пациентов с ОФВ1<25-30% от должн. на момент поступления, у которых нет ответа на начальное лечение и имеется стойкая гипоксемия. Следует соблюдать осторожность при назначении магния пациентам со снижением функции почек.
Гелий-кислородная терапия
Терапию гелиоксом рекомендуется рассматривать в качестве дополнения к медикаментозной терапии у пациентов с тяжелым обострением БА, не ответивших на стандартное лечение (УД С).
Антилейкотриеновые препараты (АЛР).
Данных о пользе применения антилейкотриеновых препаратов при обострении БА мало. (УД С).
Антибиотики (не рекомендуются)
Антибиотики не показаны при лечении обострения астмы, если нет убедительных доказательств легочной инфекции (например, лихорадка или гнойная мокрота, или рентгенологические доказательства пневмонии) и/или гнойного синусита.
Неинвазивная вентиляция легких.
Показана пациентам с обострением БА, имеющим тяжелое диспное, гиперкапнию, клинические признаки повышенной работы дыхательной мускулатуры, однако без признаков утомления, без нарушения уровня сознания (оглушение или кома) (УД B).
Искусственная вентиляция легких (ИВЛ).
Проводится в условиях ОРИТ. Проведение ИВЛ требуется больным с обострением БА, когда все другие виды консервативной терапии оказались неэффективными (УД B).
Тяжелая артериальная гипоксемия, рефрактерная к высоким потокам кислорода, является абсолютным показанием к ИВЛ (УД С). Ориентирами при назначении вентиляции легких являются клинические признаки: признаки чрезмерной работы дыхания и утомления дыхательной мускулатуры, тахипноэ, общее истощение, усталость, сонливость больного (маркеры гипоксии головного мозга), так как в данной ситуации существует высокий риск быстрого и неожиданного развития остановки дыхания.
Абсолютные показания к респираторной поддержке ИВЛ:
- остановка дыхания;
- нарушение сознания (сопор, кома);
- нестабильная гемодинамика (САД<70 мм.рт.ст., ЧСС<50 в мин или >160 в мин);
- общее утомление, истощение больного;
- утомление дыхательных мышц;
- рефрактерная гипоксемия (РаО2<60 мм.рт.ст., при FiO2 >60).
Тяжелая артериальная гипоксемия, рефрактерная к высоким потокам кислорода, является абсолютным показанием к ИВЛ (УД С). Ориентирами при назначении вентиляции легких являются клинические признаки: признаки чрезмерной работы дыхания и утомления дыхательной мускулатуры, тахипноэ, общее истощение, усталость, сонливость больного (маркеры гипоксии головного мозга), так как в данной ситуации существует высокий риск быстрого и неожиданного развития остановки дыхания.
Абсолютные показания к респираторной поддержке ИВЛ:
- остановка дыхания;
- нарушение сознания (сопор, кома);
- нестабильная гемодинамика (САД<70 мм.рт.ст., ЧСС<50 в мин или >160 в мин);
- общее утомление, истощение больного;
- утомление дыхательных мышц;
- рефрактерная гипоксемия (РаО2<60 мм.рт.ст., при FiO2 >60).
Хирургическое лечение
Не проводится
Показания к выписке пациента из стационара
https://raaci.ru/education/clinic_recomendations/1065.html
Рекомендации по выписке пациентов из стационара:
Пациентов, у которых достигнут контроль симптомов заболевания и достигнуто повышение ПСВ>80% от лучшего или расчетного результата рекомендуется выписать [1,2]. Пациентов с БА, у которых показатели функции легких (ПСВ и др.) после лечения не достигли нормы, рекомендуется выписать при условии, что им будет обеспечено адекватное медицинское наблюдение в амбулаторных условиях и есть уверенность, что они будут выполнять врачебные рекомендации [1-3].
После купирования обострения, необходимо достижения стабильного контроля непосредственно под динамическим наблюдением врача пульмонолога или аллерголога или врача ПМСП для подбора и коррекции объема необходимой поддерживающей терапии с периодическим мониторингом состояния.
Необходимо установить, какие факторы вызвали обострение и принять меры по избеганию воздействия с ними. Следует пересмотреть объем контролирующей терапии и обеспечить пациента письменным руководством. Пациента и членов его семьи необходимо информировать об обращении к врачу первичного звена или специалисту по лечению БА в течение 24 ч после выписки с целью обеспечения терапии до достижения контроля заболевания.
Рекомендации по выписке пациентов из стационара:
Пациентов, у которых достигнут контроль симптомов заболевания и достигнуто повышение ПСВ>80% от лучшего или расчетного результата рекомендуется выписать [1,2]. Пациентов с БА, у которых показатели функции легких (ПСВ и др.) после лечения не достигли нормы, рекомендуется выписать при условии, что им будет обеспечено адекватное медицинское наблюдение в амбулаторных условиях и есть уверенность, что они будут выполнять врачебные рекомендации [1-3].
После купирования обострения, необходимо достижения стабильного контроля непосредственно под динамическим наблюдением врача пульмонолога или аллерголога или врача ПМСП для подбора и коррекции объема необходимой поддерживающей терапии с периодическим мониторингом состояния.
Необходимо установить, какие факторы вызвали обострение и принять меры по избеганию воздействия с ними. Следует пересмотреть объем контролирующей терапии и обеспечить пациента письменным руководством. Пациента и членов его семьи необходимо информировать об обращении к врачу первичного звена или специалисту по лечению БА в течение 24 ч после выписки с целью обеспечения терапии до достижения контроля заболевания.
Индикаторы эффективности лечения:
- достижение контроля;
- снижение ступени терапии
- снижение частоты потребности в скорой и неотложной помощи, госпитализациях;
- снижение длительности и степени нетрудоспособности
- снижение потребности в препаратах для купирования приступов удушья, повышение качества жизни.
Медицинская реабилитация
Реабилитация
https://www.who.int/ru/news-room/fact-sheets/detail/rehabilitation
Реабилитация определяется как «комплекс мероприятий, направленных на восстановление функциональных возможностей человека и снижение уровня инвалидности у лиц с нарушениями здоровья с учетом условий их проживания».
Другими словами, реабилитация направлена на то, чтобы помочь детям, взрослым или пожилым людям быть как можно более автономными в повседневной жизни и дать им возможность получать образование, работать и заниматься досугом, а также выполнять важные социальные функции, такие как забота о семье. В этих целях с человеком и его семьей проводится работа по лечению сопутствующих заболеваний и устранению их симптомов, изменению условий проживания для более полного удовлетворения их потребностей с использованием ассистивных технологий, обучения навыкам оказания самопомощи и адаптации задач, с тем чтобы они могли выполняться более безопасно и без посторонней помощи. Эти стратегии, осуществляемые в комплексе, могут помочь человеку преодолеть трудности, связанные с когнитивными нарушениями, расстройствами зрения и слуха, трудностями в коммуникации, приеме пищи или передвижении.
На том или ином этапе жизни услуги по реабилитации могут оказаться необходимыми любому человеку в результате травмы, хирургического вмешательства, заболевания или иных нарушений здоровья, а также в силу возрастного снижения функциональных возможностей. Услуги по реабилитации в высокой степени индивидуальны, и это означает, что выбор мер вмешательства должен осуществляться с учетом целей и предпочтений пациента. Услуги по реабилитации могут предоставляться в самых разных условиях – в стационарном учреждении, поликлинике, при проведении амбулаторной физиотерапии и трудотерапии, а также в общественных местах, на дому, в школах или по месту работы.
В оказании реабилитационных услуг участвуют работники здравоохранения самого разного профиля, в том числе физиотерапевты, специалисты по трудотерапии, логопеды и аудиологи, ортотисты и протезисты, клинические психологи, врачи-реабилитологи и медицинские сестры. Важную роль в реабилитации могут играть также многие другие медицинские работники, такие как врачи общего профиля, хирурги и работники общественного здравоохранения.
Реабилитация определяется как «комплекс мероприятий, направленных на восстановление функциональных возможностей человека и снижение уровня инвалидности у лиц с нарушениями здоровья с учетом условий их проживания».
Другими словами, реабилитация направлена на то, чтобы помочь детям, взрослым или пожилым людям быть как можно более автономными в повседневной жизни и дать им возможность получать образование, работать и заниматься досугом, а также выполнять важные социальные функции, такие как забота о семье. В этих целях с человеком и его семьей проводится работа по лечению сопутствующих заболеваний и устранению их симптомов, изменению условий проживания для более полного удовлетворения их потребностей с использованием ассистивных технологий, обучения навыкам оказания самопомощи и адаптации задач, с тем чтобы они могли выполняться более безопасно и без посторонней помощи. Эти стратегии, осуществляемые в комплексе, могут помочь человеку преодолеть трудности, связанные с когнитивными нарушениями, расстройствами зрения и слуха, трудностями в коммуникации, приеме пищи или передвижении.
На том или ином этапе жизни услуги по реабилитации могут оказаться необходимыми любому человеку в результате травмы, хирургического вмешательства, заболевания или иных нарушений здоровья, а также в силу возрастного снижения функциональных возможностей. Услуги по реабилитации в высокой степени индивидуальны, и это означает, что выбор мер вмешательства должен осуществляться с учетом целей и предпочтений пациента. Услуги по реабилитации могут предоставляться в самых разных условиях – в стационарном учреждении, поликлинике, при проведении амбулаторной физиотерапии и трудотерапии, а также в общественных местах, на дому, в школах или по месту работы.
В оказании реабилитационных услуг участвуют работники здравоохранения самого разного профиля, в том числе физиотерапевты, специалисты по трудотерапии, логопеды и аудиологи, ортотисты и протезисты, клинические психологи, врачи-реабилитологи и медицинские сестры. Важную роль в реабилитации могут играть также многие другие медицинские работники, такие как врачи общего профиля, хирурги и работники общественного здравоохранения.
Госпитализация
Показания к госпитализации
Показания для госпитализации в стационар:
-
Неконтролируемая БА средней и тяжелой степени при неэффективности амбулаторной терапии.
-
Проведение начальных инъекций таргетной биологической терапии и последующих инъекций биологической терапии (при наличии в анамнезе острых аллергических реакций или других факторов повышенного риска).
-
Проведение специфического обследования in vivo (бронхопровокационное тестирование, аллерген-специфическое ингаляционное тестирование, тестирование с аллергенами in vivo) при невозможности осуществления данных манипуляций в амбулаторных условиях.
Показания для экстренной госпитализации:
-
умеренно тяжелое обострение БА с отсутствием эффекта от проводимой терапии в амбулаторных условиях;
-
тяжелое обострение БА (жизнеугрожающая астма / астма, близкая к фатальной);
-
астматический статус.
Показания для госпитализации в медицинскую организацию:
-
Диагностика БА/проведение дифференциальной диагностики, проведение бронхоконстрикторных тестов (в том числе, с физической нагрузкой, с применением лекарственных средств), подбор терапии (при необходимости).
-
Недостаточная эффективность терапии, проводимой в амбулаторных условиях, в том числе при обострении, в том числе отсутствие ответа на лечение или прогрессивное ухудшение симптомов в течение часа от начальной терапии, направленной на купирование обострения.
-
Тяжелое и/или угрожающее жизни обострение БА с признаками дыхательной недостаточности.
-
Проведение терапии ГИБП (плановая) в условиях дневного стационара, в условиях стационара с круглосуточным наблюдением (в отсутствии необходимости динамического наблюдения при введении ГИБП лечение может осуществляться в амбулаторных условиях).
-
Необходимость проведения ускоренного курса аллерген-специфической иммунотерапии в условиях элиминации аллергена (плановая).
Показания к выписке пациента из медицинской организации:
-
Достижение контроля или частичного контроля над симптомами (например, достигнуто уменьшение частоты приступов удушья не чаще чем 1 раз в день и отсутствие приступов удушья ночью на момент выписки из стационара).
-
Достигнуто увеличение ПСВ и ОФВ1 ≥80% от индивидуального лучшего или расчетного показателя на момент выписки из стационара.
-
Отсутствие признаков острой дыхательной недостаточности.
-
Завершение периода наблюдения после введения ГИБП.
-
Завершение курса аллерген-специфической иммунотерапии.
Остальные критерии возможной выписки пациента из стационара:
-
Пациентов с БА, у которых показатели функции легких (ПСВ и др.) после лечения не достигли нормы, рекомендуется выписать при условии, что им будет обеспечено адекватное медицинское наблюдение в амбулаторных условиях и есть уверенность, что они будут выполнять врачебные рекомендации.
-
Если ОФВ1 или ПСВ после лечения составляет 40-60% от должных величин, пациент может быть выписан, но с учетом факторов риска и возможности организации дальнейшего лечения в амбулаторных условиях.
-
Критерием выписки из стационара ребенка 5 лет и младше является его стабильное состояние (например, он должен вставать с постели, не иметь проблем с приемом пищи, быть активным) Экспертиза по назначению таргетной терапии (препаратами ГИБП) для пациентов с бронхиальной астмой осуществляется с проведением врачебного консилиума.
Алгоритм обследования пациента с подозрением на БА
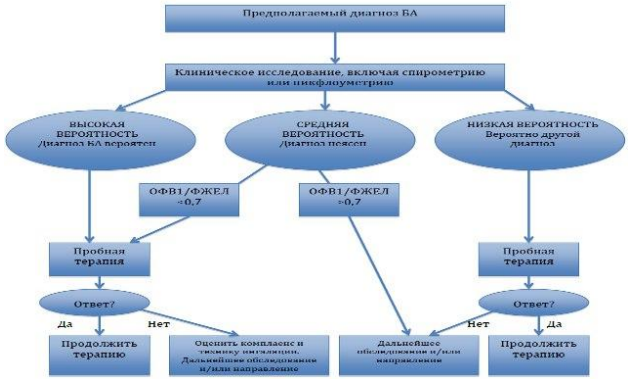
Профилактика
Профилактика бронхиальной астмы.
Профила́ктика (др.-греч. prophylaktikos — предохранительный) — комплекс различного рода мероприятий, направленных на предупреждение какого-либо явления и/или устранение факторов риска.
Профилактическое здравоохранение (профилактическая медицина или профилактика) подразумевает под собой комплекс мер, направленных на предотвращение развития заболеваний, в отличие от их лечения болезней.
Подобно тому, как здоровье охватывает различные физические и психические состояния, так и на болезнь и нетрудоспособность влияют факторы окружающей среды, генетическая предрасположенность, возбудители заболеваний и образ жизни. Здоровье, болезнь и нетрудоспособность — это динамические процессы, которые развиваются еще до того, как индивиды понимают, что они поражены.
Профилактика заболеваний базируется на мероприятиях, которые могут быть классифицированы как первичные, вторичные и третичные меры профилактики.
Профилактические мероприятия — важнейшая составляющая системы здравоохранения, направленная на формирование у населения медико-социальной активности и мотивации на здоровый образ жизни.
https://raaci.ru/education/clinic_recomendations/1065.html
В зависимости от состояния здоровья, наличия факторов риска заболевания или выраженной патологии можно рассмотреть 3 вида профилактики.
Первичная профилактика — система мер предупреждения возникновения и воздействия факторов риска развития заболеваний (дезинсекция, вакцинация, рациональный режим труда и отдыха, рациональное качественное питание, физическая активность, охрана окружающей среды). Ряд мероприятий первичной профилактики может осуществляться в масштабах государства. Предотвращение болезней и создание хорошего самочувствия продлевает продолжительность нашей жизни. Мероприятия по укреплению здоровья не нацелены на конкретное заболевание или состояние, а способствуют укреплению здоровья. С другой стороны, особая защита нацелена на тип или группу заболеваний и дополняет цели укрепления здоровья.
Основные принципы первичной профилактики: 1) непрерывность профилактических мероприятий (на протяжении всей жизни, начиная ещё в антенатальном периоде); 2) дифференцированный характер профилактических мероприятий; 3) массовость профилактики; 4) научность профилактики; 5) комплексность профилактических мер (участие в профилактике лечебных учреждений, органов власти, общественных организаций, населения)
Вторичная профилактика — комплекс мероприятий, направленных на устранение выраженных факторов риска, которые при определенных условиях (стресс, ослабление иммунитета, чрезмерные нагрузки на любые другие функциональные системы организма) могут привести к возникновению, обострению и рецидиву заболевания. Наиболее эффективным методом вторичной профилактики является диспансеризация как комплексный метод раннего выявления заболеваний, динамического наблюдения, направленного лечения, рационального последовательного оздоровления.
Подобно тому, как здоровье охватывает различные физические и психические состояния, так и на болезнь и нетрудоспособность влияют факторы окружающей среды, генетическая предрасположенность, возбудители заболеваний и образ жизни. Здоровье, болезнь и нетрудоспособность — это динамические процессы, которые развиваются еще до того, как индивиды понимают, что они поражены.
Профилактика заболеваний базируется на мероприятиях, которые могут быть классифицированы как первичные, вторичные и третичные меры профилактики.
Профилактические мероприятия — важнейшая составляющая системы здравоохранения, направленная на формирование у населения медико-социальной активности и мотивации на здоровый образ жизни.
https://raaci.ru/education/clinic_recomendations/1065.html
В зависимости от состояния здоровья, наличия факторов риска заболевания или выраженной патологии можно рассмотреть 3 вида профилактики.
Первичная профилактика — система мер предупреждения возникновения и воздействия факторов риска развития заболеваний (дезинсекция, вакцинация, рациональный режим труда и отдыха, рациональное качественное питание, физическая активность, охрана окружающей среды). Ряд мероприятий первичной профилактики может осуществляться в масштабах государства. Предотвращение болезней и создание хорошего самочувствия продлевает продолжительность нашей жизни. Мероприятия по укреплению здоровья не нацелены на конкретное заболевание или состояние, а способствуют укреплению здоровья. С другой стороны, особая защита нацелена на тип или группу заболеваний и дополняет цели укрепления здоровья.
Основные принципы первичной профилактики: 1) непрерывность профилактических мероприятий (на протяжении всей жизни, начиная ещё в антенатальном периоде); 2) дифференцированный характер профилактических мероприятий; 3) массовость профилактики; 4) научность профилактики; 5) комплексность профилактических мер (участие в профилактике лечебных учреждений, органов власти, общественных организаций, населения)
Вторичная профилактика — комплекс мероприятий, направленных на устранение выраженных факторов риска, которые при определенных условиях (стресс, ослабление иммунитета, чрезмерные нагрузки на любые другие функциональные системы организма) могут привести к возникновению, обострению и рецидиву заболевания. Наиболее эффективным методом вторичной профилактики является диспансеризация как комплексный метод раннего выявления заболеваний, динамического наблюдения, направленного лечения, рационального последовательного оздоровления.
Некоторые специалисты-профилактологи предлагают термин «третичная профилактика» как комплекс мероприятий по реабилитации больных, утративших возможность полноценной жизнедеятельности. Третичная профилактика имеет целью социальную (формирование уверенности в собственной социальной пригодности), трудовую (возможность восстановления трудовых навыков), психологическую (восстановление поведенческой активности) и медицинскую (восстановление функций органов и систем организма) реабилитацию
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики https://raaci.ru/education/clinic_recomendations/1065.html
Комментарий: Сбор анамнеза и жалоб чаще всего возможен после стабилизации состояния и играет важную роль для постановки диагноза БА, определения причины его развития и профилактики обострений.
Первичная профилактика астмы
Предусматривает меры по предупреждению астмы у здоровых людей. По сути дела основное направление первичной профилактики астмы заключается в предупреждении развития аллергии и хронических болезней дыхательных путей. Меры первичной профилактики астмы несколько различаются у детей и взрослых. Наиболее частой формой астмы у детей является атопическая астма, которая напрямую связана с другими формами аллергии. При этом в развитии аллергии у детей основную роль играет неправильное питание в первые годы жизни и неблагоприятные условия жизни.
Профилактические меры астмы (и аллергии) у детей включают:
- Грудное вскармливание новорожденных и детей первого года жизни. Грудное молоко благоприятно влияет на развитие иммунной системы организма и способствует формированию нормальной микрофлоры кишечника.
- Своевременное введение вспомогательного питания также является мерой профилактики астмы и аллергии. Современные рекомендации по кормлению детей первого года жизни предусматривают введение вспомогательного питания не ранее чем на 6 месяце первого года жизни.
- Обеспечение благоприятных условий жизни ребенка – это тоже важный метод профилактики астмы и аллергии. Показано, что дети, контактирующие с табачным дымом или раздражающими химическими веществами, гораздо чаще страдают аллергией и чаще заболевают бронхиальной астмой.
- Своевременное введение вспомогательного питания также является мерой профилактики астмы и аллергии. Современные рекомендации по кормлению детей первого года жизни предусматривают введение вспомогательного питания не ранее чем на 6 месяце первого года жизни.
- Обеспечение благоприятных условий жизни ребенка – это тоже важный метод профилактики астмы и аллергии. Показано, что дети, контактирующие с табачным дымом или раздражающими химическими веществами, гораздо чаще страдают аллергией и чаще заболевают бронхиальной астмой.
- Профилактика хронических заболеваний дыхательных органов у детей заключается в своевременном обнаружении и правильном лечении бронхита, синуситов, тонзиллита, аденоидов.
Первичная профилактика астмы у взрослых.
У взрослых наиболее распространенной причиной бронхиальной астмы являются хронические заболевания дыхательных путей и длительный контакт с раздражающими веществами (табачный дым, химические вещества на месте работы). Ввиду этого методы профилактики бронхиальной астмы у взрослых сводятся к устранению раздражающих факторов и лечению хронических болезней дыхательных органов.
Вторичная профилактика астмы включает меры по профилактике болезни у пациентов на стадии предастмы, но еще не болеющих астмой. Категория пациентов для проведения вторичной профилактики астмы подбирается по следующим критериям:
- Лица, родственники которых уже болеют бронхиальной астмой;
- Наличие различных аллергических болезней (пищевая аллергия, атопический дерматит, аллергический ринит, экзема и пр.);
Вторичная профилактика астмы включает меры по профилактике болезни у пациентов на стадии предастмы, но еще не болеющих астмой. Категория пациентов для проведения вторичной профилактики астмы подбирается по следующим критериям:
- Лица, родственники которых уже болеют бронхиальной астмой;
- Наличие различных аллергических болезней (пищевая аллергия, атопический дерматит, аллергический ринит, экзема и пр.);
Третичная профилактика астмы
Третичная профилактика астмы применяется для уменьшения тяжести течения и предупреждения обострений болезни у пациентов, которые уже болеют бронхиальной астмой. Основной метод профилактики астмы на этом этапе заключается в исключении контакта пациента с аллергеном, вызывающим приступ астмы (элиминационный режим). Для качественного проведения элиминационного режима необходимо знать, какой именно аллерген (или группа аллергенов) вызывают приступы астмы у больного. Наиболее распространенными аллергенами являются домашняя пыль, тараканы, микроклещи, шерсть домашних животных, плесневые грибки, некоторые виды пищи, пыльца растений.
Для предотвращения контакта организма больного с этими аллергенами необходимо соблюдать определенные санитарно-гигиенические правила:
- В помещении, в котором проживает больной необходимо проводить регулярную влажную уборку (1-2 раза в неделю), сам больной на время уборки должен покинуть помещение;
- Из помещения, в котором проживает больной астмой должны быть удалены все ковры и мягкая мебель, а также другие предметы, в которых может накапливаться пыль. Также из комнаты больного следует унести комнатные растения;
- Постельное белье больного нужно стирать каждую неделю в горячей воде (60 0С) с хозяйственным мылом;
Для предотвращения контакта организма больного с этими аллергенами необходимо соблюдать определенные санитарно-гигиенические правила:
- В помещении, в котором проживает больной необходимо проводить регулярную влажную уборку (1-2 раза в неделю), сам больной на время уборки должен покинуть помещение;
- Из помещения, в котором проживает больной астмой должны быть удалены все ковры и мягкая мебель, а также другие предметы, в которых может накапливаться пыль. Также из комнаты больного следует унести комнатные растения;
- Постельное белье больного нужно стирать каждую неделю в горячей воде (60 0С) с хозяйственным мылом;
- Для подушек и матрацев больного нужно использовать специальные пыленепроницаемые чехлы;
- В комнату больного нельзя допускать домашних животных;
- Целесообразно провести меры по борьбе с тараканами и другими насекомыми;
- Из пищевого рациона больного следует исключить все продукты вызывающие аллергию. Правильно спланированные и выполненные меры по профилактике бронхиальной астмы являются эффективным средством предотвращения и лечения этой болезни.
- В комнату больного нельзя допускать домашних животных;
- Целесообразно провести меры по борьбе с тараканами и другими насекомыми;
- Из пищевого рациона больного следует исключить все продукты вызывающие аллергию. Правильно спланированные и выполненные меры по профилактике бронхиальной астмы являются эффективным средством предотвращения и лечения этой болезни.
Информация
Источники и литература
-
Клинические протоколы, руководства, рекомендации Министерства здравоохранения Республики Узбекистан 2024
- Клинические протоколы, руководства, рекомендации Министерства здравоохранения Республики Узбекистан 2024 - 1. Jesse, Russell Аспириновая бронхиальная астма / Jesse Russell. - М.: VSD, 2022. - 529 c. 2. А.Тюрин, Н. Бронхиальная астма у детей / Н. А.Тюрин. - М.: Медицина, 2023. - 234 c. 3. Авдеев, С.Н. Бронхиальная астма в таблицах и схемах: моногр. / С.Н. Авдеев. - М.: Атмосфера, 2018. - 223 c. 4. Айткужина, Б. Бронхиальная астма / Б. Айткужина. - Москва: ИЛ, 2017. - 413 c. 5. Балаболкин, Иван Иванович Бронхиальная астма у детей / Балаболкин Иван Иванович. - М.: Медицина, 2022. - 282 c. 6. Балаболкин, Иван Иванович Бронхиальная астма у детей / Балаболкин Иван Иванович. - М.: Медицинское Информационное Агентство (МИА), 2022. - 813 c. 7. Баур, К. Бронхиальная астма и хроническая обструктивная болезнь легких / К. Баур. - М.: ГЭОТАР-Медиа, 2019. - 332 c. 8. Болевич, С. Б. Бронхиальная астма и свободнорадикальные процессы (патогенетические, клинические и терапевтические аспекты) / С.Б. Болевич. - М.: Медицина, 2019. - 256 c. 9. Болотовский, Г. В. Бронхиальная астма / Г.В. Болотовский. - М.: Омега, 2019. - 176 c. 10. Бронхиальная астма. - М.: АСТ, Сова, Кладезь, 2023. - 128 c. 11. Бронхиальная астма. - М.: Медицина, 2023. - 464 c. 12. Бронхиальная астма. - М.: Слог, 2023. - 160 c. 13. Булатов, П. К. Бронхиальная астма / П.К. Булатов. - М.: Медицина, 2021. - 326 c. 14. Булгакова, Виля БРОНХИАЛЬНАЯ АСТМА И РЕСПИРАТОРНЫЕ ИНФЕКЦИИ У ДЕТЕЙ: моногр. / Виля Булгакова. - М.: LAP Lambert Academic Publishing, 2022. - 292 c. 15. Звягинцева, С. Г. Бронхиальная астма у детей / С.Г. Звягинцева. - М.: Государственное издательство медицинской литературы, 2022. - 208 c. 16. Коган, Б. Б. Бронхиальная астма / Б.Б. Коган. - М.: Государственное издательство медицинской литературы, 2021. - 354 c. 17. Ломако, Л. Бронхиальная астма у детей / Л. Ломако, Л. Должникова. - М.: Беларусь, 2019. - 932 c. 18. Минкаилов, К.О. Бронхиальная астма и аллергические заболевания: моногр. / К.О. Минкаилов. - М.: Медицина, 2020. - 106 c. 19. Назаров, А.А. Атопическая бронхиальная астма: моногр. / А.А. Назаров. - М.: Ибн Сины, 2021. - 307 c. 20. Немцов, В. И. Бронхиальная астма: моногр. / В.И. Немцов. - М.: Диля, 2018. - 160 c. 21. О., Козлова und А. Жестков Бронхиальная астма в сочетании с аллергическим ринитом / О. Козлова und А. Жестков. - М.: LAP Lambert Academic Publishing, 2017. - 120 c. 22. Сергеева, К. М. Бронхиальная астма у детей: моногр. / К.М. Сергеева, Е.П. Успенская. - М.: Медицина, 2018. - 264 c. 23. Фадеев, П.А. Бронхиальная астма: моногр. / П.А. Фадеев. - М.: Книга по Требованию, 2017. - 160 c. 24. Фадеев, Павел Александрович Бронхиальная астма / Фадеев Павел Александрович. - М.: Мир и Образование, 2017. - 299 c. 25. Федосеев, Г. Б. Бронхиальная астма / Г.Б. Федосеев, Г.П. Хлопотова. - М.: Медицина, 2022. - 276 c. 26. Чучалин, А. Г. Бронхиальная астма / А.Г. Чучалин. - М.: Медицина, 2020. - 160 c. 27. Юренев, П. Н. Бронхиальная астма: моногр. / П.Н. Юренев, Н.И. Семенович, А.Г. Чучалин. - М.: Медицина, 2017. - 154 c. 28. Ненашева Н.М. Клинические фенотипы атопической бронхиальной астмы: диагностика и лечение. Palmarium Academic Publishing, 2012, 319с. (n.d.). Retrieved February 9, 2024, from https://bookmix.ru/book.phtml?id=2271191 29. Chung, K. F., Wenzel, S. E., Brozek, J. L., Bush, A., Castro, M., Sterk, P. J., Adcock, I. M.,Bateman, E. D., Bel, E. H., Bleecker, E. R., Boulet, L. P., Brightling, C., Chanez, P., Dahlen, S. E., Djukanovic, R., Frey, U., Gaga, M., Gibson, P., Hamid, Q., … Teague, W. G. (2014). International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma. The European Respiratory Journal, 43(2), 343–373. https://doi.org/10.1183/09031936.00202013 30. GINA Main Report 2023 Front Cove. Global Strategy for Asthma Management and Prevention, Global Initiative for Asthma (GINA) 2023. [Электронный ресурс], 10.06.2023. URL: http://www.ginasthma.org/. 31. Barnes, P. J., Szefler, S. J., Reddel, H. K., & Chipps, B. E. (2019). Symptoms and perception of airway obstruction in asthmatic patients: Clinical implications for use of reliever medications. The Journal of Allergy and Clinical Immunology, 144(5), 1180– 1186. https://doi.org/10.1016/J.JACI.2019.06.040 32. Killian, K. J., Watson, R., Otis, J., St. Amand, T. A., & O’Byrne, P. M. (2000). Symptom perception during acute bronchoconstriction. American Journal of Respiratory and Critical Care Medicine, 162(2 Pt 1), 490–496. https://doi.org/10.1164/AJRCCM.162.2.9905079 33. Louis, R., Satia, I., Ojanguren, I., Schleich, F., Bonini, M., Tonia, T., Rigau, D., Brinke, A. ten, Buhl, R., Loukides, S., Kocks, J. W. H., Boulet, L. P., Bourdin, A., Coleman, C., Needham, K., Thomas, M., Idzko, M., Papi, A., Porsbjerg, C., … Usmani, O. S. (2022). European Respiratory Society Guidelines for the Diagnosis of Asthma in Adults. The European Respiratory Journal, 60(3). https://doi.org/10.1183/13993003.01585-2021 34. Вишнева Е. А., Намазова-Баранова Л. С., Селимзянова Л. Р., Алексеева А. А., Новик Г. А., Эфендиева К. Е., Левина Ю. Г., Добрынина Е. А. Актуальная тактика ведения детей с бронхиальной астмой // Педиатрическая фармакология. 2017. № 14 (6). С. 443– 458. https://doi.org/10.15690/pf.v14i6.1828 35. Bush, A. (2018). Management of asthma in children. Minerva Pediatrica, 70(5), 444–457. https://doi.org/10.23736/S0026-4946.18.05351-3 36. Price, D. B., Rigazio, A., Campbell, J. D., Bleecker, E. R., Corrigan, C. J., Thomas, M., Wenzel, S. E., Wilson, A. M., Small, M. B., Gopalan, G., Ashton, V. L., Burden, A., Hillyer, E. V., Kerkhof, M., & Pavord, I. D. (2015). Blood eosinophil count and prospective annual asthma disease burden: a UK cohort study. The Lancet. Respiratory Medicine, 3(11), 849–858. https://doi.org/10.1016/S2213-2600(15)00367-7 37. Kerkhof, M., Tran, T. N., Berge, M. van den, Brusselle, G. G., Gopalan, G., Jones, R. C. M., Kocks, J. W. H., Menzies-Gow, A., Nuevo, J., Pavord, I. D., Rastogi, S., & Price, D. B. (2018). Association between blood eosinophil count and risk of readmission for patients with asthma: Historical cohort study. PloS One, 13(7). https://doi.org/10.1371/JOURNAL.PONE.0201143 38. Xepapadaki, P., Adachi, Y., Pozo Beltrán, C. F., El-Sayed, Z. A., Gómez, R. M., Hossny, E., Filipovic, I., Le Souef, P., Morais-Almeida, M., Miligkos, M., Nieto, A., Phipatanakul, W., Pitrez, P. M., Wang, J. Y., Wong, G. W. K., & Papadopoulos, N. G. (2022). Utility of biomarkers in the diagnosis and monitoring of asthmatic children. The World Allergy Organization Journal, 16(1). https://doi.org/10.1016/J.WAOJOU.2022.100727 39. Bonato, M., Bazzan, E., Snijders, D., Turato, G., Biondini, D., Tinè, M., Cosio, M. G., Barbato, A., Saetta, M., & Baraldo, S. (2020). Blood eosinophils relate to atopy and not to tissue eosinophils in wheezing children. Allergy, 75(6), 1497–1501. https://doi.org/10.1111/ALL.14170 40. Diagnosis and Management of Difficult-to-treat & Severe Asthma - Global Initiative for Asthma - GINA. (n.d.). Retrieved February 9, 2024, from https://ginasthma.org/severeasthma/ 41. Barcellos, V. A., dos Santos, V. C. H., Moreira, M. Â. F., & Dalcin, P. de T. R. (2023). Asthma control and sputum eosinophils in adult patients: a cross-sectional study in southern Brazil. Scientific Reports, 13(1). https://doi.org/10.1038/S41598-023-48381-1 42. Atkinson, C. E., Schworer, S. A., Matthews, K., Mills, K., Neighbors, K., Burbank, A. J., & Hernandez, M. L. (2022). Omalizumab is associated with improved asthma outcomes in children and adolescents with serum immunoglobulin E above dosing guidelines. The Journal of Allergy and Clinical Immunology. In Practice, 10(10), 2756-2757.e1. 43. Hew, M., Gillman, A., Sutherland, M., Wark, P., Bowden, J., Guo, M., Reddel, H. K., Jenkins, C., Marks, G. B., Thien, F., Rimmer, J., Katsoulotos, G. P., Cook, M., Yang, I., Katelaris, C., Bowler, S., Langton, D., Wright, C., Bint, M., … Gibson, P. G. (2016). Real-life effectiveness of omalizumab in severe allergic asthma above the recommended dosing range criteria. Clinical and Experimental Allergy: Journal of the British Society for Allergy and Clinical Immunology, 46(11),1407–1415. https://doi.org/10.1111/CEA.12774 44. Louis, R., Satia, I., Ojanguren, I., Schleich, F., Bonini, M., Tonia, T., Rigau, D., Brinke, A. ten, Buhl, R., Loukides, S., Kocks, J. W. H., Boulet, L. P., Bourdin, A., Coleman, C., Needham, K., Thomas, M., Idzko, M., Papi, A., Porsbjerg, C., … Usmani, O. S. (2022). European Respiratory Society Guidelines for the Diagnosis of Asthma in Adults. The European Respiratory Journal, 60(3). https://doi.org/10.1183/13993003.01585-2021 45. Azad, M. B., Chan-Yeung, M., Chan, E. S., Dytnerski, A. M., Kozyrskyj, A. L., Ramsey, C., & Becker, A. B. (2016). Wheezing Patterns in Early Childhood and the Risk of Respiratory and Allergic Disease in Adolescence. JAMA Pediatrics, 170(4), 393–395. https://doi.org/10.1001/JAMAPEDIATRICS.2015.4127 46. Федеральные клинические рекомендации. Первичные иммунодефициты с преимущественной недостаточностью синтеза антител. РААКИ. Национальная Ассоциация Экспертов в области Первичных Иммунодефицитов. 2024г. Retrieved February 9, 2024, https://cr.minzdrav.gov.ru/schema/735_1 47. Чучалин А.Г. Болезни, ассоциированные с иммуноглобулином G. Терапевтический архив. 2018. Т. 90. №3. c.4-9. https://doi.org/10.18093/0869-0189-2017-27-3-311-319 48. Gallucci, M., Carbonara, P., Pacilli, A. M. G., di Palmo, E., Ricci, G., & Nava, S. (2019). Use of Symptoms Scores, Spirometry, and Other Pulmonary Function Testing for Asthma Monitoring. Frontiers in Pediatrics, 7(MAR). https://doi.org/10.3389/FPED.2019.00054 49. Спирометрия. Федеральные методические рекомендации. Российское респираторное общество. Российская ассоциация специалистов функциональной диагностики. Российское научное медицинское общество терапевтов. 2023 г. 64с. https://spulmo.ru/upload/kr/Spirometria_2023.pdf?t=1 50. Каменева М.Ю., Черняк А.В., Айсанов З.Р., Авдеев С.Н., Бабак С.Л., Белевский А.С., Берестень Н.Ф., Калманова Е.Н., Малявин А.Г., Перельман Ю.М., Приходько А.Г., Стручков П.В., Чикина С.Ю., Чушкин М.И. Спирометрия: методическое руководство по проведению исследования и интерпретации результатов. Пульмонология. 2023; 33 (3): 307–340. https://doi.org/10.18093/08690189-2023-33-3-307-340 51. Shipp, C. L., Gergen, P. J., Gern, J. E., Matsui, E. C., & Guilbert, T. W. (2023). Asthma Management in Children. The Journal of Allergy and Clinical Immunology. In Practice, 11(1), 9–18. https://doi.org/10.1016/J.JAIP.2022.10.031 52. Martin, J., Townshend, J., & Brodlie, M. (2022). Diagnosis and management of asthma in children. BMJ Paediatrics Open, 6(1). https://doi.org/10.1136/BMJPO-2021-001277 53. Gaillard, E. A., Kuehni, C. E., Turner, S., Goutaki, M., Holden, K. A., de Jong, C. C. M., Lex, C., Lo, D. K. H., Lucas, J. S., Midulla, F., Mozun, R., Piacentini, G., Rigau, D., Rottier, B., Thomas, M., Tonia, T., Usemann, J., Yilmaz, O., Zacharasiewicz, A., & Moeller, A. (2021). European Respiratory Society clinical practice guidelines for the diagnosis of asthma in children aged 5-16 years. The European Respiratory Journal, 58(5). https://doi.org/10.1183/13993003.04173-2020 54. Mishra, A., Ugra, D., & Kumar, U. (2020). Study of spirometry parameters in suspected asthmatic children in a tertiary care hospital. International Journal of Contemporary Pediatrics, 7(5), 1023. https://doi.org/10.18203/2349-3291.IJCP20201631
Информация
Список основных авторов, дополнительного коллектива авторов:
-
Разикова И.С. - д.м.н., профессор, директор РСНПМЦАКИ
-
Дустбабаева Н. Д доцент, Центра развития профессиональной квалификации медицинских работников , к.м.н,
-
Айдарова Н.П - заместитель директора по научной работе РСНПМЦАКИ,PhD
-
Кузиев Г. Э - заместитель директора по лечебной работе РСНПМЦАКИ,
-
Ишмухаммедова Ш. Б - заведующая отделом аллергологии РСНПМЦАКИ
-
Қудратуллаева Б. Т - заведующая отделом аллергологии РСНПМЦАКИ
-
Байбекова В.Ф – ученый секретарь РСНПМЦАКИ
-
Акромов А. Т - врач аллерголог РСНПМЦАКИ
-
Хасанова.Ф.Р - врач аллерголог РСНПМЦАКИ
-
Тураев Н. Т - врач аллерголог РСНПМЦАКИ
Рецензенты:
-
Ирсалиева Ф.Х Профессор, кафедры аллергологии, клинической иммунологии и сестринского дела , д.м.н
-
Мавлянова Ш. З Профессор, Республиканский Центр Дерматовенерологии и косметологии, д.м.н
Внешняя экспертная оценка:
Фомина Дарья Сергеевна Руководитель Московского городского научно-практического центра аллергологии и иммунологии, врач аллерголог-иммунолог высшей квалификационной категории, к.м.н, главный внештатный аллерголог-иммунолог доцент кафедры клинической иммунологии и аллергологии ФГАОУ ВО Первого МГМУ им. И.М. Сеченова.
Клинический протокол обсужден и рекомендован к утверждению путем достижения неформального консенсуса на заключительном Совещании рабочей группы с участием профессорско-преподавательского состава высших учебных заведений, организаторов здравоохранения (директор РНСАЦ и их заместителей), врачей региональных учреждений системы аллергологии в онлайн-формате 06 ноябрь 2023 г., протокол №7.
Клинический протокол рассмотрен и утвержден Ученым Республиканский научно специализированный аллергологического центра 28 ноября 2023 г., протокол №8
Список сокращений
Список сокращений
|
ECP
|
Эозинофильный катионный белок
|
|
FENO
|
фракция оксида азота в выдыхаемом воздухе
|
|
GINA
|
Глобальная стратегия менеджмента и профилактики астмы (Global Initiative for Asthma
|
|
IgE
|
иммуноглобулин Е
|
|
SpO2
|
насыщение гемоглобина кислородом (сатурация кислорода)
|
|
АЛР
|
антилейкотриеновые препараты
|
|
АПФ
|
Ангиотензинпревращающий фермент
|
|
АСИТ
|
аллерген-специфическая иммунологическая терапия
|
|
АР
|
аллергический ринит
|
|
БА
|
бронхиальная астма
|
|
БК
|
бациллы Коха (микобактерии туберкулеза)
|
|
ГКС
|
глюкокортикостероиды
|
|
ДАИ
|
дозированный аэрозольный ингалятор (pMDI)
|
|
ДДБА
|
длительно действующие бета-2-агонисты
|
|
ДПИ
|
дозированный порошковый ингалятор
|
|
ИГКС
|
ингаляционный глюкокортикостероид
|
|
ИЛ-5
|
Интерлейкин 5
|
|
ИЛ-5R
|
Рецептор к интерлейкину 5
|
|
ИЛ-4
|
Интерлейкин 4
|
|
ИЛ-13
|
Интерлейкин 13
|
|
КДБА
|
бета-2-агонисты короткого действия
|
|
НН
|
недостаточность надпочечников
|
|
КТ
|
компьютерная томография
|
|
ОАК
|
общий анализ крови
|
|
ОРИТ
|
отделение реанимации и интенсивной терапии
|
|
ОФВ1
|
объем форсированного выдоха за 1 секунду
|
|
ПМСП
|
первичная медико-санитарная помощь
|
|
ПСВ
|
пиковая скорость выдоха
|
|
РаО2
|
парциальное напряжение кислорода
|
|
РаСО2
|
парциальное напряжение углекислого газа
|
|
СЗП
|
стационар-замещающая помощь
|
|
СНМП
|
скорая и неотложная медицинская помощь
|
|
СГКС
|
Системный глюкокортикостероид
|
|
ТСЛП/ TSLP
|
тимусный стромальный лимфопоэтин
|
|
УД
|
уровень доказательства
|
|
ФВД
|
функция внешнего дыхания
|
|
ФГ
|
флюорография
|
|
ФГДС
|
фиброгастродуоденоскопия
|
|
ФЖЕЛ
|
форсированная жизненная емкость легких
|
|
ХОБЛ
|
хроническая обструктивная болезнь легких
|
|
ЧДД
|
частота дыхательных движений
|
|
ЧСС
|
частота сердечных сокращений
|
Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
|
УДД
|
Расшифровка
|
|
1
|
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
|
|
2 |
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
|
|
3 |
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая
|
|
5
|
Имеется лишь обоснование механизма действия или мнение экспертов
|
Шкала оценки уровней достоверности доказательств (УДД) для профилактических, лечебных, реабилитационных вмешательств
|
УДД
|
Расшифровка
|
|
1
|
Систематический обзор РКИ с применением мета-анализа
|
|
2
|
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа
|
|
3
|
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль»
|
|
5
|
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
|
Шкала оценки уровней убедительности рекомендаций (УУР) для профилактических, диагностических, лечебных, реабилитационных вмешательств
|
УУР
|
Расшифровка
|
|
A
|
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
|
| В | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
| С | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Приложение 1. Информация для пациентов
https://raaci.ru/dat/pdf/bronchial astma.pdf
https://raaci.ru/dat/pdf/bronchial astma.pdf
Бронхиальная астма – хроническое воспалительное заболевание с преимущественным поражением бронхов, которое проявляется приступами удушья, одышкой (в большинстве случаев с затруднением выдоха) и кашлем. Бронхиальная астма – очень распространенное заболевание, которым страдают примерно 300 миллионов человек в мире.
В основе заболевание лежит утолщение, отек и спазм стенок бронхов, а также чрезмерная секреция вязкого бронхиального секрета, который затрудняет прохождение воздуха по дыхательным путям. Во время приступа бронхиальной астмы в легкие поступает меньше воздуха, его прохождение затрудняется во время выдоха, что приводит к приступу удушья Бронхиальная астма является хроническим заболеванием, течение которого можно контролировать.
Лечение бронхиальной астмы должно быть непрерывным, не следует отменять его самостоятельно, даже если Ваше самочувствие удовлетворительное! Помните, что у Вас не возникнет зависимости от препаратов даже в случае их приема на протяжение многих лет!
При условии правильного лечения бронхиальной астмы:
- Нет необходимости в регулярном применении препаратов, которые расширяют бронхи (сальбутамол, венталин, атровент, беротек, беродуал и др.), то есть течение заболевания можно контролировать.
- Нет необходимости в госпитализации.
- Нет ограничений физической активности – пациент ведет полноценную жизнь, даже может заниматься спортом, женщины с бронхиальной астмой могут рожать.
При неправильном лечении бронхиальной астмы:
- Периодически возникает потребность в применении бронходилататоров во время возникновения приступов бронхиальной астмы, причем эта потребность постоянно возрастает.
- Есть ограничения физической активности (в тяжелых случаях назначают группу инвалидности).
- Точные причины возникновения бронхиальной астмы не установлены, однако существует целый перечень факторов, которые могут вызывать бронхоспазм.
Пациенты с предрасположенностью к бронхиальной астме должны знать, какие факторы могут вызвать бронхоспазм. Среди них могут быть:
- Шерсть животных, перья птиц. Не держите дома домашних животных и птиц. Сигаретный дым. Не курите и не позволяйте курить в Вашем присутствии.
- Сильные и резкие запахи. Не пользуйтесь гигиеническими средствами, которые имеют выраженный парфюмерный запах.
- Профессиональные факторы, например контакт с аэрозолями, химическими веществами, лаками и красками.
- Домашняя пыль. В Вашем помещении не должно быть ковров. Поскольку пыль накапливается в одеялах и простынях, их нужно часто стирать в очень горячей воде. Целесообразно на подушки и матрацы специальные пыленепроницаемые чехлы. Во время уборки следует пользоваться марлевой маской.
- Некоторые лекарственные средства, например ацетилсалициловая кислота, бета- адреноблокаторы.
- Некоторые продукты и пищевые добавки: натрия глутамат, консерванты, морепродукты, орехи.
- Инфекционные заболевания, особенно острые респираторные вирусные инфекции. Ежегодная вакцинация против гриппа - только после консультации со своим лечащим врачом.
- Тяжелые физические нагрузки, особенно в холодную погоду. Эмоциональная перегрузка.
- Чаще всего для лечения бронхиальной астмы назначают аэрозольные и порошковые ингаляторы.
Больным бронхиальной астмой назначают две группы ингаляторов:
Профилактические препараты для ежедневного применения с целью предупреждения приступов бронхиальной астмы: ингаляционные глюкокортикостероиды (флутиказон, будесонид, бекламетазон), кромоны (кромогликат и недокромил). Эти лекарственные средства действуют на основные патогенетические механизмы бронхиальной астмы – воспаление и повышенную чувствительность дыхательных путей. Если Вы по назначению врача пользуетесь гормональным ингалятором, после ингаляции следует обязательно прополоскать ротовую полость и горло водой или слабым раствором соды. Это предупреждает развитие грибковой инфекции: стоматита, ангины. Не используйте препараты этой группы для купирования приступа бронхиальной астмы!
Препараты, которые расширяют бронхи (сальбутамол, фенотерол, салметерол, формотерол, ипратропия бромид, тиотропия бромид). Большинство из них начинают действовать через 1-2 минуты, поэтому их можно применять для прекращения приступа бронхиальной астмы.
Помните, что для эффективного использования ингалятора следует придерживаться следующих правил:
Снимите колпачок ингалятора и на протяжении 2-3 секунд энергично встряхивайте ингалятор. Во время ингаляции дно баллончика должно быть направлено к верху.
Встаньте. Немного наклоните голову назад. Откройте рот. Медленно сделайте глубокий вдох.
Обхватите мундштук губами. Начинайте вдыхать одновременно с резким нажимом на верхнюю часть ингалятора. Продолжайте вдох на протяжении 5-7 секунд.
Закройте рот, задержите дыхание на 10 секунд. После этого осторожно выдохните воздух через нос. При необходимости в еще одной ингаляции сделайте ее через 1 минуту.
При возможности пользуйтесь спейсером. Это специальный резервуар, который облегчает использование ингалятора (аэрозоль сначала подается в спейсер, а потом вдыхается через мундштук или лицевую маску).незапная тяжелая аллергическая реакция системы защиты организма от болезней (иммунной системы).
Для лучшего контроля течения бронхиальной астмы пользуйтесь пикфлоуметром и ведите специальный дневник для записи показателей пикфлоуметрии. Пикфлоуметр – это специальный прибор, который позволяет измерять скорость воздушного потока во время выдоха. Пикфлоуметрия позволяет подобрать индивидуальную схему лечения, контролировать Ваше состояние и эффективность лечения. Обязательно покажите Вашему врачу результаты пикфлоуметрии во время планового визита или в случае госпитализации.
Установите указатель устройства до конца вниз (на нулевую отметку).
Встаньте. Сделайте глубокий вдох открытым ртом. Держите пикфлоуметр в одной руке, не размещайте пальцы на цифровой шкале.
Обхватите мундштук губами, выдохните как можно сильнее и быстрее. Во время выдоха показатель поднимется вверх и остановиться.
Запишите число, возле которого остановился указатель, на специальном графике. Установите показатель пикфлоуметра на нулевой отметке и повторите измерение еще два раза. Отметьте наилучший из трех показателей. Повторяйте процедуру не менее двух раз в день – утром и вечером.
Самопомощь в случае приступа бронхиальной астмы:
Помните, что для эффективного использования ингалятора следует придерживаться следующих правил:
Снимите колпачок ингалятора и на протяжении 2-3 секунд энергично встряхивайте ингалятор. Во время ингаляции дно баллончика должно быть направлено к верху.
Встаньте. Немного наклоните голову назад. Откройте рот. Медленно сделайте глубокий вдох.
Обхватите мундштук губами. Начинайте вдыхать одновременно с резким нажимом на верхнюю часть ингалятора. Продолжайте вдох на протяжении 5-7 секунд.
Закройте рот, задержите дыхание на 10 секунд. После этого осторожно выдохните воздух через нос. При необходимости в еще одной ингаляции сделайте ее через 1 минуту.
При возможности пользуйтесь спейсером. Это специальный резервуар, который облегчает использование ингалятора (аэрозоль сначала подается в спейсер, а потом вдыхается через мундштук или лицевую маску).незапная тяжелая аллергическая реакция системы защиты организма от болезней (иммунной системы).
Для лучшего контроля течения бронхиальной астмы пользуйтесь пикфлоуметром и ведите специальный дневник для записи показателей пикфлоуметрии. Пикфлоуметр – это специальный прибор, который позволяет измерять скорость воздушного потока во время выдоха. Пикфлоуметрия позволяет подобрать индивидуальную схему лечения, контролировать Ваше состояние и эффективность лечения. Обязательно покажите Вашему врачу результаты пикфлоуметрии во время планового визита или в случае госпитализации.
Установите указатель устройства до конца вниз (на нулевую отметку).
Встаньте. Сделайте глубокий вдох открытым ртом. Держите пикфлоуметр в одной руке, не размещайте пальцы на цифровой шкале.
Обхватите мундштук губами, выдохните как можно сильнее и быстрее. Во время выдоха показатель поднимется вверх и остановиться.
Запишите число, возле которого остановился указатель, на специальном графике. Установите показатель пикфлоуметра на нулевой отметке и повторите измерение еще два раза. Отметьте наилучший из трех показателей. Повторяйте процедуру не менее двух раз в день – утром и вечером.
Самопомощь в случае приступа бронхиальной астмы:
Прекратите физические нагрузки, сядьте.
При возможности прекратите контакт с фактором, который спровоцировал приступ, откройте окно для обеспечения доступа свежего воздуха.
Воспользуйтесь ингалятором с препаратом, который расширяет бронхи. Максимальное количество ингаляций и возможность самостоятельно принимать преднизолон в таблетках во время приступа целесообразно обсудить с врачом.
Оставайтесь в покое на протяжении 1 часа.
Немедленно обратитесь за медицинской помощью в случае:
Сохранения или усиления удушья после двух ингаляций препарата, который расширяет бронхи.
Усиление одышки, кашля и появления чувства скованности в грудной клетке. Затруднение речи (возможность проговаривать некоторые слова, а не предложения). Сонливость или спутанное сознание.
Посинение ногтей или губ.
Очень частый пульс (более 100 ударов в минуту).
Втягивание кожи в межреберных промежутках и возле шеи во время вдоха.
Всегда носите с собой ингалятор с препаратом, который расширяет бронхи, и следите за тем, чтобы он был полным!
При возможности прекратите контакт с фактором, который спровоцировал приступ, откройте окно для обеспечения доступа свежего воздуха.
Воспользуйтесь ингалятором с препаратом, который расширяет бронхи. Максимальное количество ингаляций и возможность самостоятельно принимать преднизолон в таблетках во время приступа целесообразно обсудить с врачом.
Оставайтесь в покое на протяжении 1 часа.
Немедленно обратитесь за медицинской помощью в случае:
Сохранения или усиления удушья после двух ингаляций препарата, который расширяет бронхи.
Усиление одышки, кашля и появления чувства скованности в грудной клетке. Затруднение речи (возможность проговаривать некоторые слова, а не предложения). Сонливость или спутанное сознание.
Посинение ногтей или губ.
Очень частый пульс (более 100 ударов в минуту).
Втягивание кожи в межреберных промежутках и возле шеи во время вдоха.
Всегда носите с собой ингалятор с препаратом, который расширяет бронхи, и следите за тем, чтобы он был полным!
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.