Аллогенная трансплантация костного мозга
 Версия: Клинические протоколы МЗ РК - 2025 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2025 (Казахстан)
Общая информация
Краткое описание
КЛИНИЧЕСКИЙ ПРОТОКОЛ МЕДИЦИНСКОГО ВМЕШАТЕЛЬСТВА
Аллогенная трансплантация костного мозга (гемопоэтических стволовых клеток) – процедура, которая восстанавливает кроветворение после миелотоксичного воздействия высоких доз химиопрепаратов или ионизирующего облучения (кондиционирования) с использованием гемопоэтических стволовых клеток от полностью (по HLA) совместимого родственного или неродственного донора [1].
ВВОДНАЯ ЧАСТЬ
Дата разработки/пересмотра протокола: 2015 год (пересмотр 2025 г).
Категория пациентов: взрослые.
Код(ы) МКБ:10, МКБ-11
|
МКБ -10
|
|
| Код | Название |
|
D 45.0
|
Истинная полицитемия |
|
D 47.3
|
Эссенциальная (геморрагическая) тромбоцитемия |
|
D 47.1
|
Хроническая миелопролиферативная болезнь |
|
D59.5
|
Пароксизмальная ночная гемоглобинурия |
|
D 61.3
|
Идиопатическая апластическая анемия |
|
D 61.9
|
Апластическая анемия неуточненная |
|
С 81
|
Лимфома Ходжкина |
|
С 81.0
|
Лимфома Ходжкина, лимфоидное преобладание |
|
С 81.1
|
Лимфома Ходжкина, нодулярный склероз |
|
С 81.2
|
Лимфома Ходжкина, смешанно-клеточный вариант |
|
С 81.3
|
Лимфома Ходжкина, лимфоидное истощение |
|
С 81.7
|
Другие формы Лимфома Ходжкина |
|
С81.9
|
Лимфома Ходжкина неуточненная |
|
С83.0
|
Диффузная неходжкинская лимфома, мелкоклеточная |
|
С83.3
|
Диффузная неходжкинская лимфома крупноклеточная |
|
С83.4
|
Диффузная неходжкинская лимфома иммунобластная |
|
С83.5
|
Диффузная неходжкинская лимфома лимфобластная |
|
С83.6
|
Диффузная неходжкинская лимфома недифференцированная |
|
С83.7
|
Лимфома Беркитта |
|
С83.8
|
Другие типы неходжкинских лимфом |
|
С83.9
|
Диффузная неходжкинская лимфома неуточненная |
|
С84.0
|
Грибовидный микоз |
|
С84.1
|
Синдром Сезари |
|
С84.4
|
Периферическая Т-клеточная лимфома |
|
С84.5
|
Другие и неуточненные Т- клеточные лимфомы |
|
С84.6
|
Анапластическая крупноклеточная лимфома АЛК+ |
|
С84.7
|
Анапластическая крупноклеточная лимфома АЛК- |
|
С86.0
|
Экстранодальная NK/Т-клеточная лимфома, назальный тип |
|
С86.1
|
Гепатолиенальная Т-клеточная лимфома |
|
С86.2
|
Т-клеточная лимфома ассоциированная с энтеропатией |
|
C86.5
|
Ангиоиммунобластная Т-клеточная лимфома |
|
С88.9
|
Злокачественные иммунопролиферативные болезни, неуточненные |
|
С 90
|
Множественная миелома и злокачественные плазмоклеточные новообразования |
|
С 90.0
|
– множественная миелома |
|
С 90.1
|
– плазмоклеточный лейкоз |
|
С 90.1
|
– плазмоцитома экстрамедуллярная |
|
C 91.0
|
Острый лимфобластный лейкоз |
|
С 92.0
|
Острый миелобластный лейкоз |
|
С 92.1
|
Хронический миелолейкоз |
| МКБ-11 | |
|
2A20.4
|
Истинная полицитемия |
| 2A20-2A22 | Миелопролиферативные новообразования |
|
2A20
|
Нетучноклеточные миелопролиферативные новообразования |
|
2A20.0
|
Хронический миелолейкоз, BCR-ABL1-позитивный |
|
2A20.00
|
Хронический миелолейкоз с бластным кризом |
|
2A20.01
|
Хронический миелолейкоз позитивный по филадельфийской хромосоме (Ph1) |
|
2A20.02
|
Хронический миелолейкоз с транслокацией t (9:22) (q34;q11) |
|
2A20.03
|
Моноцитарный лейкоз типа Негели |
|
2A20.0Y
|
Другой уточненный хронический миелолейкоз, BCR-ABL1-позитивный |
|
2A20.0Z
|
Хронический миелолейкоз, BCR-ABL1-позитивный, неуточненный |
|
2A20.1
|
Хронический нейтрофильный лейкоз |
|
2A20.2
|
Первичный миелофиброз |
|
2A20.3
|
Хронический эозинофильный лейкоз, не классифицированный в других рубриках |
|
3B63.1
|
Эссенциальная (геморрагическая) тромбоцитемия |
|
3A21.0
|
Пароксизмальная ночная гемоглобинурия |
|
3A70.12
|
Идиопатическая апластическая анемия |
|
3A70.Z
|
Апластическая анемия неуточненная |
|
XH1B20
|
Острый лейкоз, не уточненный иначе |
|
XH37U0
|
Острый бифенотипический лейкоз |
|
XH2H98
|
Острый билинейный лейкоз |
|
XH3VV7
|
Острый лейкоз неопределенного линейного происхождения |
|
XH97B7
|
Острый лейкоз со смешанным фенотипом с t(9;22)(q34;q11.2); BCR-ABL1 |
|
XH2S51
|
Острый лейкоз со смешанным фенотипом с t(v;11q23); MLL реаранжировкой |
|
XH1928
|
Острый лейкоз со смешанным фенотипом, В/миелоидный, не уточненный иначе |
|
XH4YB5
|
Острый лейкоз со смешанным фенотипом, Т/миелоидный, не уточненный иначе |
|
XH43N4
|
Острый эритроидный лейкоз |
|
XH4M02
|
Острый миелоидный лейкоз с биаллельной мутацией CEBPA |
|
XH74W8
|
Острый миелидный лейкоз с мутацией NPM1 |
|
XH9Y46
|
Острый миелоидный лейкоз с t(6;9)(p23;q34); DEK-NUP214 |
|
XH78Y4
|
Острый миеломоноцитарный лейкоз |
|
XH2KE3
|
Острый миелоидный лейкоз с inv(3)(q21;q26.2) или t(3.3)(q21;q26.2); RPN1-EVI1 |
|
XH7MR1
|
Острый базофильный лейкоз |
|
XH3PA4
|
Острый миелоидный лейкоз с эозинофилией |
|
XH90G0
|
Острый миелидный лейкоз с минимальной дифференцировкой |
|
XH5AH8
|
Острый миелоидный лейкоз без созревания |
|
XH1XJ9
|
Острый миелоидный лейкоз с созреванием |
|
XH9NE2
|
Острый моноцитарный лейкоз |
|
XH1K97
|
Острый монобластный и моноцитарный лейкоз |
|
XH64R4
|
Острый миелоидный лейкоз с чертами миелоидсплазии |
|
XH3CX5
|
Острый миелоидный лейкоз, t(8;21)(q22;q22) |
|
XH1E41
|
Острый миелоидный лейкоз, 11q23 аномалии |
|
XH4750
|
Острый мегакариобластный лейкоз |
|
XH16K4
|
Острый миелоидный лейкоз (мегакариобластный) с t(1;22)(p13;q13); RBM15-MKL1 |
|
XH6Z50
|
Ассоциированный с лечением острый миелоидный лейкоз, связанный с алкилирующими препаратами |
|
XH4EJ0
|
Ассоциированный с лечением острый миелоидный лейкоз, связанный с эпиподофиллотоксином |
|
XH3L40
|
Миелоидная саркома |
|
XH1075
|
Острый панмиелоз с миелофиброзом |
|
XH6FZ7
|
Острый миелидный лейкоз с BCR-ABL1 |
|
XH1EK4
|
Острый миелоидный лейкоз с мутированным RUNX1 |
|
2A60
|
Острые миелоидные лейкозы и родственные опухоли из клеток-предшественников |
|
2A60.5
|
Опухоль из бластных плазмоцитоидных дендритных клеток |
|
2В33.3
|
Лимфоидный лейкоз, не классифицированный острый лимфобластный лейкоз. |
| XH5J37 | Лимфобластный лейкоз из клеток-предшественников, NOS Острый лимфобластный лейкоз, NOS (без специфических характеристик). |
|
2A90.5
|
Т-клеточная лимфома или лейкоз взрослых, ассоциированная с Т-клеточным лимфотропным вирусом типа 1. Т-клеточный острый лимфобластный лейкоз. |
|
2A85.6
|
Лимфома Беркитта, включая лейкоз Беркитта.
Острый лимфобластный лейкоз типа Беркитта.
|
|
XH8F29
|
Ранний острый лимфобластный лейкоз с предшественниками Т-клеток. |
|
XH8NN2
|
Беркиттоподобная лимфома с аберрацией 11q.
Острый лимфобластный лейкоз, зрелый В-клеточный тип.
|
|
2А85.5
|
Лимфома из клеток мантии |
|
2А81
|
Диффузные крупноклеточные В-клеточные лимфомы |
|
2А81.0
|
Первичная медиастинальная В-крупноклеточная лимфома |
|
2А81.1
|
Внутрисосудистая В-крупноклеточная лимфома |
|
2А81.2
|
Плазмобластная лимфома |
|
2А81.3
|
Лимфоматоидный гранулематоз |
|
2А81.4
|
Крупно-В-клеточная лимфома, богатая Т-клетками/гистиоцитами |
|
2А81.5
|
Первичная диффузная В-крупноклеточная лимфома центральной нервной системы |
|
2А81.6
|
Вирус Эпштейна-Барр-положительная диффузная В-крупноклеточная лимфома пожилых людей |
|
2А81.7
|
Диффузная В-крупноклеточная лимфома, ассоциированная с хроническим воспалением |
|
2А81.8
|
ALK-положительная В-крупноклеточная лимфома |
|
2А81.9
|
Первичная выпотная лимфома |
| 2А81.А | Первичная кожная диффузная В-крупноклеточная лимфома, тип «нижних конечностей» |
|
2A81.Y
|
Другие уточненные диффузные В-крупноклеточные лимфомы |
|
2A81.Z
|
Диффузная В-крупноклеточная лимфома, не уточненная |
|
2А90
|
Зрелая Т-клеточная лимфома, определенные типы, узловая или системная |
|
2А90.0
|
Т-клеточный пролимфоцитарный лейкоз |
|
2А90.1
|
Т-клеточный крупнозернистый лимфоцитарный лейкоз |
|
2А90.2
|
Хронические лимфопролиферативные заболевания NK-клеток |
|
2А90.3
|
Агрессивный NK-клеточный лейкоз |
|
2А90.4
|
Системная вирус-позитивная Т-клеточная лимфома Эпштейна-Барр у детей |
| 2А90.5 | Т-клеточная лимфома или лейкемия взрослых, ассоциированная с Т-клеточным лимфотропным вирусом типа 1 человека |
|
2А90.6
|
Экстранодальная NK/T-клеточная лимфома назального типа |
|
2А90.7
|
Ассоциированная с энтеропатией Т-клеточная лимфом |
|
2А90.8
|
Гепатоспленическая Т-клеточная лимфома |
|
2А90.9
|
Ангиоиммунобластная Т-клеточная лимфома |
|
2А90.А
|
Анапластическая крупноклеточная лимфома, ALK-положительная |
|
2А90.Б
|
Анапластическая крупноклеточная лимфома, ALK-отрицательная |
|
2А90.С
|
Периферическая Т-клеточная лимфома, не уточненная иначе |
|
2B02
|
Синдром Сезари |
|
2B30
|
Лимфома Ходжкина |
|
2B30.0
|
Нодулярный тип лимфоидного преобладания лимфомы Ходжкина |
|
2B30.1
|
Классическая лимфома Ходжкина |
|
2B30.10
|
Нодулярный склероз классической лимфомы Ходжкина |
|
2B30.12
|
Смешанно-клеточный вариант (классической) лимфомы Ходжкина |
|
2B30.13
|
Лимфоидное истощение (классической) лимфомы Ходжкина |
|
2B30.11
|
Лимфоцитарная (Lymphocyte-rich – богатая лимфоцитами) (классическая) лимфома Ходжкина |
|
2B30.1Z
|
Другие формы (классической) лимфомы Ходжкина
Классическая лимфома Ходжкина неуточненного типа
|
|
2B30.Z
|
Лимфома Ходжкина неуточненная |
|
2A83
|
Плазмоклеточные опухоли |
|
2A83.0
|
Моноклональная гаммапатия неопределенного значения |
|
2A83.1
|
Плазмоклеточная миелома (ранее множественная миелома) |
|
2A83.2
|
Солитарная плазмоцитома |
|
2A83.3
|
Экстрамедуллярная плазмоцитома |
|
2A83.4
|
Плазмоклеточная лейкемия |
|
2A83.5
|
Болезнь отложения моноклональных иммуноглобулинов |
|
2A83.Y
|
Другие уточненные множественная миелома и плазмоклеточные опухоли |
|
2A83.Z
|
Плазмоклеточная опухоль, неуточненная |
|
2A84
|
Болезнь тяжелых цепей или злокачественные иммунопролиферативные заболевания |
Лечение
Цель проведения процедуры/вмешательства:
Показания к процедуре/вмешательству [2]:
|
Заболевание
|
Статус заболевания | Тип трансплантации | |||
| Аллогенный полностью совместимый родственный донор | Аллогенный полностью совместимый неродственный донор | Альтернативный/ гаплоидентичный донор | Аутологичная | ||
| ОМЛ | 1-я ремиссия (благоприятный риск и МРБ -) | GNR/II | GNR/II | GNR/II | CO/I |
| 1-я ремиссия (благоприятный риск и МРБ +) | S/II | CO/II | CO/II | GNR/II | |
| 1-я ремиссия (промежуточный риск) | S/II | CO/II | CO/II | CO/I | |
| 1-я ремиссия (высокий риск) | S/II | S/II | S/II | GNR/I | |
| 2-я ремиссия | S/II | S/II | S/II | CO/II | |
| ОПЛ 2-я молекулярная ремиссия | S/II | CO/II | GNR/III | S/II | |
| Рецидив/рефрактерная форма | CO/II | CO/II | CO/II | GNR/III | |
| ОЛЛ | Ph(-) 1-я ремиссия (стандартный риск и МРБ -) | GNR/II | GNR/II | GNR/III | CO/II |
| Ph(-) 1-я ремиссия (стандартный риск и МРБ +) | S/II | CO/II | CO/II | GNR/II | |
| Ph(-) 1-я ремиссия (высокий риск) | S/II | S/II | CO/II | GNR/II | |
| Ph(+) 1-я ремиссия (МРБ -) | S/II | S/II | CO/II | CO/III | |
| Ph(+) 1-я ремиссия (МРБ +) | S/II | S/II | S/II | GNR/II | |
| 2-я ремиссия | S/II | S/II | S/II | GNR/II | |
| Рецидив/рефрактерная форма | CO/II | CO/II | CO/II | GNR/III | |
| ХМЛ | 1я хроническая фаза, с неудачей терапии 2-3 линии ИТК | S/II | S/II | CO/III | GNR/II |
| Фаза аксселерации, бластный криз или > 1хр.фазы | S/II | S/II | CO/II | GNR/III | |
| Миелофиброз | Первичный или вторичный МФ с промежуточным риском-2 или высоким риском по шкале DIPSS | S/II | S/II | S/III | GNR/III |
| МДС | Очень низкий и низкий риск по IPSS-R | CO/II | CO/II | CO/II | GNR/III |
| Промежуточный риск без дополнительных факторов риска IPSS-R | CO/II | CO/II | CO/II | CO/II | |
| Промежуточный риск с дополнительными факторами риска IPSS-R | S/II | S/II | S/II | GNR/III | |
| Высокий, очень высокий риск IPSS-R | S/II | S/II | S/II | ||
| Вторичный ОМЛ в первой или второй ремиссии | S/II | S/II | |||
| ХМЛЛ | ХММЛ-2 или МП-ХММЛ | S/II | S/II | S/II | GNR/III |
| ХММЛ-0 или ХММЛ-1 с дополнительными факторами риска | S/II | S/II | S/II | GNR/III | |
| ХЛЛ | Высокий риск заболевания, рефрактерного или рецидивирующего после одной линии предшествующей терапии (за исключением трансформации Рихтера) | CO/II | CO/II | GNR/III | GNR/III |
| Трансформация Рихтера | S/II | S/II | S/II | GNR/III | |
| ДВККЛ | ПР-1 (промежуточный/высокий риск по IPI в момент установки диагноза) | GNR/III | GNR/III | GNR/III | CO/II |
| Неподтвержденный рецидив | GNR | GNR | GNR | GNR | |
| Химиочувствительный ранний рецидив, ≥ПР2 | CO/II | CO/II | DIII | CO/I | |
| Химиочувствительный поздний рецидив, ≥ПР2 | CO/II | CO/II | DIII | S/II | |
| Химиочувствительный рецидив после аутоТГСК | CO/II | CO/II | CO/III | GNR/III | |
| Рефрактерное заболевание | CO/II | CO/II | CO/III | GNR/I | |
| Первичная лимфома ЦНС | GNR/III | GNR/III | GNR/III | S/II | |
| ФЛ | ПР1, не трансформированная | GNR/III | GNR/III | GNR/III | GNR/II |
| ПР1, трансформированная в лимфому высокой степени | GNR/III | GNR/III | GNR/III | CO/III | |
| Химиочувствительный рецидив ≥ПР2 | CO/III | CO/III | GNR/III | S/II | |
| ≥ПР2 рецидив после аутоТГСК | S/II | S/II | DIII | GNR/III | |
| Рефрактерное заболевание | CO/II | CO/II | CO/III | GNR/III | |
| МКЛ | ПР1 | GNR/III | GNR/III | GNR/III | S/I |
| ПР/ЧР>1, без предществующей аутоТГСК | CO/II | CO/II | D/III | CO/II | |
| ПР/ЧР>1, после аутоТГСК | CO/II | CO/II | CO/III | GNR/II | |
| Рефрактерное заболевание | CO/II | CO/II | CO/III | GNR/II | |
| ПТКЛ | Группа высокого риска | CO/II | CO/II | DIII | GNR/III |
| ПР1 | CO/II | CO/II | GNR/III | CO/II | |
| Химиочувствительный рецидив, ≥ПР2 | S/II | S/II | CO/III | CO/II | |
| Рефрактерное заболевание | CO/II | CO/II | CO/III | GNR/III | |
| Первичные кожные ПТКЛ | EORTC/ISCL I-II ст, ранняя | GNR/III | GNR/III | GNR/III | GNR/III |
| EORTC/ISCL IIB-IV ст, продвинутые | CO/III | CO/III | D/III | GNR/III | |
| ЛХ | ПР1 | GNR/III | GNR/III | GNR/III | GNR/I |
| Химиочувствительный рецидив, без предшествующей АутоТГСК | D/III | D/III | GNR/III | S/I | |
| Химиочувствительный рецидив, с предшествующей АутоТГСК | S/II | S/II | S/II | CO/III | |
| Рефрактерность | D/II | D/II | D/III | CO/III | |
| ММ | 1-я ремиссия, стандартный риск | CO/II | CO/II | GNR/III | S/I |
| 1-я ремиссия, высокий риск | S/III | S/III | CO/II | S/I | |
| Химиочувствительный рецидив, с предшествующей АутоТГСК | CO/II | CO/II | CO/II | S/II | |
| АА и АА/ПНГ | Первично диагностированная | S/II | CO/II | GNR/III | - |
| Рецидив/рефрактерная форма | S/II | S/II | CO/II | - | |
| Гемолитическая ПНГ | - | GNR/II | GNR/II | GNR/II | - |
| Категории | |
| Стандарт терапии - S | Показания достаточно четко определены, а результаты более благоприятны (или превосходят) чем методы лечения без трансплантации. Очевидно, что определение показания как "стандарта терапии" не означает, что ТГСК обязательно является оптимальной терапией для данного пациента во всех клинических обстоятельствах. Трансплантация может выполняться в специализированном центре, имеющем опыт ТГСК и соответствующую инфраструктуру. |
| Клиническая опция - CO | Показания, при которых результаты небольших групп пациентов показывают эффективность и приемлемую токсичность процедуры ТГСК, но подтверждающие рандомизированные исследования отсутствуют, часто из-за небольшого количества пациентов. Широкий спектр доступных методов трансплантации в сочетании с различными факторами, такими как возраст и сопутствующие заболевания пациента, затрудняет интерпретацию этих данных. Наша текущая интерпретация существующих данных по показаниям, отнесенным к этой категории, подтверждает, что ТГСК является ценным вариантом для отдельных пациентов после тщательного обсуждения рисков и преимуществ с пациентом, но что для групп пациентов ценность ТГСК требует дальнейшей оценки. Трансплантация по показаниям под этим разделом должна выполняться в специализированном центре с большим опытом в области ТГСК и соответствующей инфраструктурой |
| Разработка - D | Показания, когда опыт ограничен и необходимы дополнительные исследования для определения роли ТГСК. Такая трансплантация должна выполняться в рамках клинического протокола, обычно выполняемого трансплантационными отделениями с признанным опытом в лечении этого конкретного заболевания или этого типа ТГСК. Протоколы трансплантации "D" должны быть одобрены местными комитетами по этике исследований и должны соответствовать действующим международным стандартам. Редкие показания, когда официальные клинические исследования невозможны, должны проводиться в рамках структурированного анализа реестра, в идеале – неинтервенционного/наблюдательного исследования EBMT. Центры, выполняющие трансплантацию этой категории, должны соответствовать стандартам JACIE. |
| Обычно не рекомендовано - GNR | Включает в себя различные клинические сценарии, в которых использование ТГСК не может быть рекомендовано для обеспечения клинической пользы для пациента, включая ранние стадии заболевания, когда результаты традиционного лечения обычно не оправдывают дополнительный риск ТГСК, очень поздние формы заболевания, при которых шанс на успех настолько мал, что не оправдывает риски для пациента и донора, а также при показаниях, при которых метод трансплантации может быть не соответствовать характеристикам заболевания. Категоризация как "GNR" не исключает того, что центры, обладающие особым опытом в отношении определенного заболевания, могут исследовать ТГСК в таких ситуациях. |
| Уровень доказательности в отношении определенной категории | |
| I | Данные как минимум одного хорошо проведенного рандомизированного исследования. |
| II | Данные по крайней мере одного хорошо спланированного клинического исследования без рандомизации. Когортное или аналитические исследования «случай-контроль» (предпочтительнее более чем из 1-го центра), потрясающие результаты неконтролируемых экспериментов. |
| III | Данные мнений от уважаемых авторитетов, основанные на клиническом опыте, описательных исследованиях или отчетах экспертных комитетов. |
а) Гепатолиенальная Т-клеточная лимфома;
б) Т-пролимфоцитарный лейкоз;
в) АККЛ АЛК- с перестройкой ТР63;
г) АИБЛ в сочетании с миелодисплазией;
д) NK-ТКЛ генерализованные стадии или экстраназальный тип;
е) ПТКЛ GATA-3+ и/или р53;
ж) Синдром Сезари.
!NB Оценка трансплантационного риска проводится не более чем за 10 дней до начала предтрансплантационного кондиционирования.
Таблица-1. Расчет трансплантационного риска по шкале EBMT
|
Факторы риска
|
Характеристика факторов риска | Баллы |
| Возраст | 20 лет | 0 |
| 20—40 лет | 1 | |
| 40 лет | 2 | |
| Статус заболевания1 | Ранний | 0 |
| Промежуточный | 1 | |
| Развернутый | 2 | |
| Время от постановки диагноза до TГCK2 | < 12- ти мес | 0 |
| ≥ 12-ти мес | 1 | |
| Донор | НLА-идентичный сиблинг | 0 |
| Неродственный донор | 1 | |
| Пол донора и реципиента | Донор — женщина, реципиент — мужчина | 1 |
| Другие сочетания | 0 | |
|
1 Не применяется у пациентов с АА.
Ранний — острый лейкоз в ПР1; МДС в ПPl или без предшествующего лечения; ХМЛ в 1-й хронической фазе; HXJI нелеченая или в ПР1; ММ нелеченая или в ПР1.
Промежуточный — острый лейкоз в ПР2; ХМЛ за исключением хронической фазы 1 и БК; МДС в ПР2 или ЧР; НХЛ в ПР2, ЧР или стабилизация заболевания; ММ в ПР2, ЧР или стабилизация заболевания.
Поздняя — острый лейкоз в других стадиях кроме ПР1 и ПР2; ХМЛ в БK; МДС во всех других стадиях; НХЛ во всех других стадиях; ММ во всех других стадиях.
2 Не применяется у пациентов в ПР 1.
|
||
Таблица-2. 5-ти летняя летальность (%) связанная с трансплантацией согласно шкале риска EBMT
| Баллы | 0 | 1 | 2 | 3 | 4 | 5 | 6-7 |
| ОМЛ | 14 | 20 | 25 | 30 | 36 | 40 | 41 |
| ОЛЛ | 15 | 23 | 24 | 30 | 40 | 47 | 53 |
| ХМЛ | 15 | 22 | 30 | 38 | 45 | 52 | 55 |
| АА | 18 | 26 | 40 | 49 | 52 | - | - |
| МДС | 25 | 28 | 30 | 35 | 38 | 46 | 50 |
| ММ | - | - | 29 | 35 | 40 | 42 | 52 |
| НХЛ | 15 | 24 | 28 | 30 | 34 | 36 | 38 |
Таблица-3. Вероятность (%) общей выживаемости через 5 лет с применением шкалы риска EBMT
| Баллы | 0 | 1 | 2 | 3 | 4 | 5 | 6-7 |
| ОМЛ | 68 | 59 | 52 | 38 | 30 | 23 | 18 |
| ОЛЛ | 66 | 52 | 43 | 38 | 22 | 16 | 14 |
| ХМЛ | 76 | 72 | 60 | 51 | 39 | 26 | 14 |
| АА | 81 | 72 | 60 | 49 | 45 | - | - |
| МДС | 56 | 52 | 46 | 40 | 35 | 28 | 25 |
| ММ | - | - | 48 | 40 | 36 | 22 | 17 |
| НХЛ | 75 | 59 | 50 | 48 | 43 | 40 | 38 |
|
Коморбидность/определение
|
Баллы |
| Возраст ≥ 40 лет | 1 |
|
Аритмия
Мерцательная аритмия, трепетание предсердий, синдром слабости синусового узла или желудочковые аритмии
|
1 |
|
Сердечный
Ишемическая болезнь сердца, застойная сердечная недостаточность, ИМ, ФВ ≤50%
|
1 |
|
Воспалительное заболевание кишечника
Болезнь Крона или язвенный колит, потребовавшие лечения
|
1 |
|
Диабет
Необходимость приема инсулина или пероральных противодиабетических препаратов в течение 4 недель до трансплантации гемопоэтических стволовых клеток
|
1 |
|
Цереброваскулярный
ЦВН или ТИА или церебральный тромбоз
|
1 |
|
Психиатрический
Депрессия, тревожность или другие состояния, требующие постоянного лечения (не по требованию)
|
1 |
|
Печень
Хронический гепатит, повышенный билирубин <1,5 × ВНЗ или АСТ/АЛТ <2,5 × ВНЗ
Предыдущая инфекция HBV или HCV
|
1 |
|
Ожирение
ИМТ >35 кг/м 2
|
1 |
|
Предыдущая инфекция
Инфекция при поступлении, требующая продолжения лечения после 0 дня
|
1 |
|
Легкое
DLCO и/или ОФВ1 66–80% или минимальная стрессовая одышка
|
2 |
|
Ревматология
Системная красная волчанка, ревматоидный артрит, полимиозит, ревматическая полимиалгия, заболевание соединительной ткани
|
2 |
|
язвенная болезнь
Эндоскопическая или рентгенологическая диагностика (не учитывается, если есть только рефлюкс или гастрит)
|
2 |
|
Почечный
Креатинин >176 мкмоль/л, диализ или предыдущая трансплантация почки
|
2 |
|
Предыдущая опухоль 1
Неоплазия в какой-то момент (исключая немеланомные опухоли кожи)
|
3 |
|
Сердечный клапан
Диагностировано (кроме пролапса митрального клапана)
|
3 |
|
Тяжелая легочная
DLCO и/или ОФВ1 ≤ %, одышка в покое или при оксигенотерапии дома
|
3 |
|
Тяжелое заболевание печени
Билирубин ≥0,5 при ВН или АСТ или АЛТ ≥0,5 при ВН или циррозе
|
3 |
Перечень основных (обязательных) диагностических мероприятий.
Для выбора режима кондиционирования и профилактики РТПХ, определения необходимости их модификации, а также для определения объемов сопутствующей и сопроводительной терапии необходимо выполнить следующие диагностические исследования:
3. Коагулограмма (АЧТВ, ПВ, МНО, ПТИ, фибриноген, АТ-3, Д-димер);
4. Определение группы крови по системам АВО и резус-фактора; Фенотип эритроцитов;
5. Общий анализ мочи;
6. Определение СКФ;
7. Определение маркеров вирусного гепатита В и С методом ИФА или ИХЛ;
8. ВИЧ-инфекции (HIVAg/Anti-HIV) методом ИФА;
9. ПЦР на вирусные гепатиты В и С (качественно, при выявлении - количественно);
10. Вирус Эбштейна-Барр, герпес 1-2 типа, цитомегаловирус методом ПЦР (качественно, при выявлении - количественно);
11. Комплекс серологических реакций на сифилис;
12. Определение уровня ProBNP;
13. Электрокардиография;
14. Эхокардиография;
15. Ультразвуковое исследование органов брюшной полости и почек;
16. Ультразвуковая доплерография сосудов почек;
17. Рентгенография придаточных пазух носа;
18. Ортопантомограмма;
19. Компьютерная томография грудного сегмента;
20. Спирография;
NB! Специфические исследования в зависимости от нозологии - для определения статуса основного заболевания;
Обследование донора:
ОАК, группа крови, резус-фактор c фенотипом эритроцитов, ИФА на вирусы гепатита В и С, Микрореакция, ИФА на ВИЧ ПЦР на цитомегаловирус. Для доноров старше 45 лет: ЭКГ, ЭхоКГ. («Об утверждении правил обязательного конфиденциального медицинского обследования на наличие ВИЧ-инфекции», Приказ МЗ РК от 27 ноября 2020 года № ҚР ДСМ-211/2020).
Наличие у донора вирусных гепатитов В или С не является абсолютным противопоказанием для проведения ТКМ. Об утверждении перечня инфекционных заболеваний, при которых разрешается трансплантация органов (части органа) и (или) тканей (части ткани) от донора. Приказ и.о. Министра здравоохранения Республики Казахстан от 30 октября 2020 года № ҚР ДСМ-171/2020. Зарегистрирован в Министерстве юстиции Республики Казахстан 2 ноября 2020 года № 21573.
В таких случаях, необходимо оценить соотношение риска инфицирования и риска основного заболевания для реципиента. При проведении ТКМ от донора с гепатитом С, реципиенту, с целью снижения риска развития веноокклюзионной болезни, рекомендуется проводить кондиционирование в режиме NMA или RIC.
1. Гистологическое исследование биоптата (образования и/или лимфоузел, гребень подвздошной кости);
2. Исследование спинномозговой жидкости (при наличии нейролейкоза в анамнезе);
3. Аспергиллезный антиген;
4. Для женщин фертильного возраста - тест на беременность, экспресс-методом в моче (результат действителен в течении 7 дней), определение ХГЧ;
5. Компьютерная томография с или без контрастирования органов и тканей;
6. ПЭТ/КТ всего тела;
7. Для женщин – УЗИ ОМТ;
8. УЗИ периферических лимфоузлов, плевральной полости;
9. ФГДС;
10. Бронхоскопия с исследованием БАЛ на инфекции вызванные бактериями, вирусами, грибами;
11. Колоноскопия;
12. УЗДГ сосудов различных локализаций;
13. Холтеровское исследование. 14.Суточное мониторирование артериального давления.
Требования к проведению процедуры/вмешательства:
Требования к оснащению: Аллогенная ТКМ проводится в условиях отделения трансплантации костного мозга или центре, оснащенном в соответствии с требованиями «Об утверждении правил определения и перечня видов высокотехнологичной медицинской помощи, а также критерии, согласно которым виды высокотехнологичной медицинской помощи переходят в перечень услуг специализированной медицинской помощи» Приказ МЗ РК от 16 октября 2020 года № ҚР ДСМ-134/2020.
Требования к соблюдению мер безопасности:
Меры безопасности и противоэпидемический режим согласно Санитарных правил «Санитарно-эпидемиологические требования к объектам здравоохранения», утвержденным приказом МЗ РК от 11 августа 2020 года № ҚР ДСМ -96/2020. Использование НЕРА-фильтров (High-efficiency particulate air) снижает риск развития инфекций, вызванных плесневыми грибами рода Aspergillus [5,6].
Обследование реципиента проводиться в соответствии с перечнем обязательных лабораторно-инструментальных исследований, указанных выше (пункт 2.4). Консультации соответствующих узких специалистов при наличии хронических очагов инфекций и/или сопутствующих заболеваний, для проведения санации хронических очагов инфекции и коррекции терапии при необходимости. При отсутствии противопоказаний проводиться собрание трансплантационной комиссии, в присутствии пациента, его донора и ближайших родственников. Проводится беседа о возможных рисках, осложнениях и исходах, связанных с лечением. Пациент должен подписать информированное согласие на проведение трансплантации костного мозга. При наличии нескольких совместимых родственных доноров, выбор проводится с учетом следующих параметров (в порядке убывания приоритетности) [7].
Методика проведения вмешательства.
Выбор источника ГСК.
Для проведения аллоТКМ в качестве источника ГСК может использоваться костный мозг, периферические ГСК или их комбинация.
| Количество клеток CD34+ | Аутологичная трансплантация | Аллогенная трансплантация |
| Минимальное количество клеток CD34+ на одну трансплантацию (источник костный мозг) | 2*106CD34+ клеток/кг веса реципиента | 2*106CD34+ клеток/кг веса реципиента |
| Минимальное количество клеток CD34+ на одну трансплантацию (источник периферическая кровь) | 2*106CD34+ клеток/кг веса реципиента | 4*106CD34+ клеток/кг веса реципиента |
| Оптимальное количество клеток CD34+ на одну трансплантацию (источник периферическая кровь) | 2.5–5*106CD34+ клеток/кг веса реципиента1 | 5–8*106CD34+ клеток/кг веса реципиента1 |
| 1 или выше, если предполагается дальнейший процессинг | ||
Инфузия ГСК проводится в День-0. При использовании микст-трансплантата (периферические и костно-мозговые ГСК) возможно проведение инфузии ГСК в разные дни (Д0 и Д+1).
Перед инфузией клеточного продукта необходимо убедиться, что выполнены следующие условия:
Принципы кондиционирования.
Трансплантацию костного мозга от клеточной терапии отличает приживление введенных клеток. Для обеспечения приживления необходимы два условия – супрессия иммуной системы реципиента и подготовка плацдарма для донорского кроветворения.
Выполнение данных условий обеспечивает кондиционирование (от англ. Conditioning - обработка; англ. condition - состояние; лат. conditio – условие), под которым понимают подготовительный курс перед введением ГСК, который может включать химиотерапию, лучевую терапию в некоторых случаях в комбинации с иммуносупрессивными препаратами, направленный на очищение костного мозга от донорского кроветворения и препятствующий отторжению трансплантата.
Помимо данных функций кондиционирование также способствует элиминации минимальной остаточной болезни или в случае проведения ТКМ у пациентов вне ремиссии обеспечивает редукцию опухоли или избыточной клеточности костного мозга при талассемии, миелопролиферативных заболеваний.
Препараты для профилактики РТПХ также оказывают угнетающее влияние на иммунную систему реципиента и препятствуют отторжению донорских ГСК, они не рассматриваются как компонент предтрансплантационного кондиционирования. Режим кондиционирования обеспечивает достижение трех целей:
По степени миелотоксического действия режимы кондицинирования разделяют на миелоаблативные, пониженной интенсивности и немиелоабластивные.
Рабочие определения интенсивности режимов кондиционирования.
|
Режим кондиционирования
|
Определение |
| MAC | После кондиционирования в течение 1-3 недель развивается глубокая панцитопения и миелоаблация. Панцитопения длительная, как правило необратимая, и в большинстве случаев со смертельным исходом, если не происходит приживления ГСК и восстановления кроветворения |
| NMA | Режим кондиционирования, после которого цитопения не глубокая и не продолжительная и кроветворение может восстановиться при отсутствии поддержки ГСК. |
| RIC | Режим, который не может быть отнесен к MAC или NMA. |
Кондиционирование на основе треосульфана может использоваться для неопухолевых заболеваний, идиопатического миелофиброза, рефрактерными неходжкинскими лимфомами. Наиболее часто треосульфан используется в комбинации с флударабином при миелодиспластическом синдроме и ОМЛ у пациентов, которым не может быть проведено более токсичное кондиционирование.
Бендамустин может использоваться для предтрансплантационного кондиционирования в комбинации с мелфаланом при множественной миеломе или флударабином и ритуксимабом (BFR) при лимфомах. Внутривенный бусульфан в сравнении с пероральной формой менее токсичен: ниже риск развития венооклюзионной болезни и меньше летальность, связанная с трансплантацией.
Классические режимы кондиционирования
| MAC: BU/Cy (Peter J. Tutschka) | |||||||||||
| Название препарата | Доза | Способ введения | Д-8 | Д-7 | Д-6 | Д-5 | Д-4 | Д-3 | Д-2 | Д-1 | Д0 ТКМ |
| Бусульфан | 4 мг/кг/сут | С Д-8 по Д-5, разделить на 4 приема 06.00, 12.00, 18.00, 24.00, внутрь |
+ + + + |
+ + + + |
+ + + + |
+ + + + |
|||||
| Циклофосфамид | 60 мг/кг/сут | Д-3, Д-2; развести в 1000 мл физиологического раствора; в/в инфузия, в течение 2-3 часов, начало введения не ранее чем ч/з 36ч после Бусульфана | + | + | |||||||
| Месна | 120 мг/кг/сут | Д-3, Д-2 в/в инфузия, начать за 3 часа до циклофосфамида, в течение 24-часовая инфузия | + | + | |||||||
| С целью профилактики судорог: Леветирацетам 500-1000 мг*2р/сут - начало приема за 24ч до Бусульфана, завершение приема через 24ч от последнего приема Бусульфана | |||||||||||
| RIC:Flu/BU (Shimon Slavin) | ||||||||||
| Название препарата | Доза | Способ введения | Д-7 | Д-6 | Д-5 | Д-4 | Д-3 | Д-2 | Д-1 | Д0 ТКМ |
| Флударабин | 30 мг/ м2/ сут | С Д-7 по Д-2, развести в 200-250 мл физиологического раствора; в/в инфузия, в течение 30 мин | + | + | + | + | + | + | ||
| Бусульфан | 4 мг/кг/сут | С Д-7 по Д-4, разделить на 4 приема: 06.00, 12.00, 18.00, 24.00, внутрь |
+ + + + |
+ + + + |
+ + + + |
+ + + + |
||||
| С целью профилактики судорог: Леветирацетам 500-1000 мг*2 р/сут - начало приема за 24 ч до Бусульфана, завершение приема через 24ч от последнего приема Бусульфана. | ||||||||||
| RIC: Flu/BU(в/в) | ||||||||||
| Название препарата | Доза | Способ введения | Д-7 | Д-6 | Д-5 | Д-4 | Д-3 | Д-2 | Д-1 | Д0 ТКМ |
| Флударабин | 30 мг/ м2/ сут | С Д-7 по Д-2, развести в 200-250 мл физиологического раствора, в/в инфузия, в течение 30 мин | + | + | + | + | + | + | ||
| Бусульфан | 0,4 мг/кг/сут | -6Д на физиологическм растворе; в/в за 3ч*1р/сут | + | |||||||
| Бусульфан | 0,8 мг/кг/сут | С -5Д по -3Д на физиологическом растворе; в/в за 3ч*1р/сут | + | + | + | |||||
| С целью профилактики судорог: Леветирацетам 500-1000 мг*2 р/сут - начало приема за 24ч до Бусульфана, завершение приема через 24ч от последнего приема Бусульфана. | ||||||||||
| NMA:Flu/Cy/ATG | ||||||||
| Название препарата | Доза | Способ введения | Д-5 | Д-4 | Д-3 | Д-2 | Д-1 | Д0 ТКМ |
| Флударабин | 30 мг/м2/сут | С Д-5 по Д-2, развести в 200-250 мл физиологического раствора; в/в инфузия, в течение 30 мин | + | + | + | + | ||
| Циклофосфамид | 30 мг/кг/сут | С Д-5 по Д-2, развести в 400-500 мл физиологического раствора; в/в инфузия, в течение 1 часа | + | + | + | + | ||
| rATG | 2.5 мг/кг/сут | С Д-5 по Д-2, развести в 400-500мл физиологического раствора; в/в инфузия, в течение 12 часов | + | + | ||||
| RIC: Flu/Mel | ||||||||||
| Название препарата | Доза | Способ введения | Д-7 | Д-6 | Д-5 | Д-4 | Д-3 | Д-2 | Д-1 | Д0 ТКМ |
| Флударабин | 30 мг/м2/сут | С Д-6 по Д-2, развести в 200-250 мл, физиологического раствора; в/в инфузия, в течение 30 мин | + | + | + | + | + | + | ||
|
Мелфалан*
|
140 мг/м2/сут | На -2Д, развести в 200-250 мл физиологического раствора; в/в инфузия, в течение 30 минут | + | |||||||
| *возможно введение мелфалана за 2 дня (на -3Д и -2Д) | ||||||||||
| RIC: Flu/Treo48гр/m2/Mel | ||||||||||
| Название препарата | Доза | Способ введения | Д-7 | Д-6 | Д-5 | Д-4 | Д-3 | Д-2 | Д-1 | Д0 ТКМ |
| Флударабин | 30 мг/м2/сут | С Д-7 по Д-3, развести в 200-250 мл физиологического раствора; в/в инфузия, в течение 30 мин | + | + | + | + | + | |||
|
Треосульфан
|
16 г/м2/сут | С Д-5 по Д-3; развести в 400-500 мл физиологического раствора; в/в инфузия, в течение 1 часа | + | + | + | |||||
|
Мелфалан
|
140 мг/м2/сут | Д-2; развести в 200-250 мл физиологического раствора; в/в инфузия, в течение 30 минут | + | |||||||
| RIC: Flu/Treo 48гр/m2 | |||||||||
| Название препарата | Доза | Способ введения | Д-6 | Д-5 | Д-4 | Д-3 | Д-2 | Д-1 | Д0 ТКМ |
| Флударабин | 30 мг/м2/сут | С Д-6 по Д-2, развести в 200-250 мл физиологического раствора; в/в инфузия, в течение 30 мин | + | + | + | + | + | ||
| Треосульфан | 16 г/м2/сут | С Д-4 по Д-2; развести 400-500 мл физиологического раствора; в/в инфузия, в течение 1 часа | + | + | + | ||||
| RIC: Treo48гр/m2 | |||||||
| Название препарата | Доза | Способ введения | Д-4 | Д-3 | Д-2 | Д-1 | Д0 ТКМ |
| Треосульфан | 16 г/м2/сут | С Д-4 по Д-2; развести в 400-500 мл физиологического раствора; в/в инфузия, в течение 1 часа | + | + | + | ||
| может применяться коморбидных пациентов с ОМЛ, МДС | |||||||
| NMA: Flag/Ida | ||||||||||
| Название препарата | Доза | Способ введения | Д-7 | Д-6 | Д-5 | Д-4 | Д-3 | Д-2 | Д-1 | Д0 ТКМ |
| Флударабин | 30 мг/м2/сут | С Д-6 по Д-2, развести в 200-250 мл физиологического раствора; в/в инфузия, в течение 30 мин | + | + | + | + | + | |||
|
Филграстим
|
300 мкг/сут | С Д-7 до восстановления; п/к | + | + | + | + | + | + | + | + |
|
Идарубицин
|
10 мг/м2/сут | Д-6, Д-4, Д-2; развести в 50 мл физиологического раствора; в/в инфузия, в течение 15 мин, ч/з 2 часа после флударабина | + | + | + | |||||
|
Цитарабин
|
2г/м2*2 р/сут | С Д-6 по Д-2; развести в 400-500 мл физиологического раствора; в/в инфузия, в течение 3 часов, ч/з 4 часа после флударабина | + | + | + | + | + | |||
| NMA: Flu/Treo 30гр/m2 | |||||||||
| Название препарата | Доза | Способ введения | Д-6 | Д-5 | Д-4 | Д-3 | Д-2 | Д-1 | Д0 ТКМ |
| Флударабин | 30 мг/м2/сут | С Д-6 по Д-2, развести в 200-250 мл физиологического раствора; в/в инфузия, в течение 30 мин | + | + | + | + | + | ||
| Треосульфан | 10 гр/м2/сут | С Д-4 по Д-2; развести в 400-500 мл физиологического раствора; в/в инфузия, в течение 1 часа | + | + | + | ||||
| NMA: Treo 30гр/m2 | |||||||
| Название препарата | Доза | Способ введения | Д-4 | Д-3 | Д-2 | Д-1 | Д0 ТКМ |
| Треосульфан | 10 г/м2/сут | С Д-4 по Д-2; развести в 400-500 мл физиологического раствора; в/в инфузия, в течение 1 часа | + | + | + | ||
| может применяться для коморбидных пациентов с ОМЛ, МДС | |||||||
| RIC: BFR (для неходжкинских лимфом) | ||||||||||||
| Название препарата | Доза | Способ введения | Д-13 | Д-12 Д-7 | Д-6 | Д-5 | Д-4 | Д-3 | Д-2 | Д-1 | Д0 ТКМ | Д+1 |
|
Ритуксимаб
|
375 мг/ м2/сут | Д-13, в/в инфузия. Начальная скорость 1мл/ч – максимальная 10мл/ч | + | |||||||||
| Ритуксимаб | 1000 мг/ м2/сут | Д-1 и Д+1, Начальная скорость 1мл/ч – максимальная 10мл/ч | + | + | ||||||||
| Флударабин | 30 мг/м2/сут | С Д-5 по Д-3, развести 200-250мл физиологического раствора; в/в инфузия, в течение 30 мин | + | + | + | |||||||
|
Бендамустин
|
70 мг/м2/сут* | С Д-5 по Д-3, развести в 200-250 мл физиологического раствора; в/в инфузия, в течение 1 часа | + | + | + | |||||||
| *Доза бендамустина может варьироваться: 70, 90, 110 или 130 мг/м2/сут, в зависимости от степени токсичности | ||||||||||||
| МАС: Be/Mel (для множественной миеломы) | ||||||
| Название препарата | Доза | Способ введения | Д-3 | Д-2 | Д-1 | Д0 ТКМ |
|
Бендамустин
|
125 мг/м2/сут | Д-3, развести в 200-250 мл физиологического раствора; в/в инфузия, в течение 1 часа | + | |||
|
Бендамустин
|
100 мг/м2/сут | Д-2, развести в 200-250 мл физиологического раствора; в/в инфузия, в течение 1 часа | + | |||
|
Мелфалан
|
100 мг/м2/сут | Д-3 и Д-2; развести в 200-250 мл физиологического раствора; в/в инфузия, в течение 30 минут | + | + | ||
| RIC: GIAC («Пекинский протокол») | |||||||||||||
| Название препарата | Доза | Способ введения | Д-10 | Д-9 | Д-8 | Д-7 | Д-6 | Д-5 | Д-4 | Д-3 | Д-2 | Д-1 | Д0 ТКМ |
|
Цитарабин
|
4г/м2/сут | Д-10, Д-9; развести в 400-500 мл физиологического раствора; в/в инфузия, в течение 3 часов | + | + | |||||||||
|
Бусульфан
|
4мг/кг/сут | С Д-8 по Д-6, разделить на 4 приема: 06.00, 12.00, 18.00, 24.00, внутрь |
+ + + + |
+ + + + |
+ + + + |
||||||||
| Циклофосфамид | 30мг/кг/сут | Д-5, Д-4, развести в 500 мл физиологического раствора; в/в инфузия, в течение 1 часа, в течение 1 часа, не ранее, чем ч/з 24ч после бусульфана. | + | + | |||||||||
|
Месна
|
30мг/кг/сут | Д-5, Д-4, развести в 500 мл 5% глюкозы, в/в инфузия, начать за 1 час до циклофосфамида, в течение 24 часов | + | + | |||||||||
|
Кармустин
|
250мг/м2/сут | Д-3 развести в 200-250 мл 5% глюкозы инфузия, в течение 1 часа | + | ||||||||||
|
rATG
|
2,5 мг/кг/сут | С Д-5 по Д-2, развести в 400-500 мл 0,9% физиологического раствора; (4 мг/мл), в/в инфузия, в течение 12 часов | + | + | + | + | |||||||
| С целью профилактики судорог: Леветирацетам 500-1000 мг*2 р/сут - начало приема за 24ч до Бусульфана, завершение приема через 24ч от последнего приема Бусульфана | |||||||||||||
| RIC: Flu/Be | |||||||
| Название препарата | Доза | Способ введения | Д-4 | Д-3 | Д-2 | Д-1 | Д0 ТКМ |
|
Флударабин
|
30 мг/м2/сут | С Д-4 по Д-2, развести в 200-250 мл физиологического раствора; в/в инфузия, в течение 30 мин | + | + | + | ||
|
Бендамустин
|
130мг/м2/сут |
С Д-4 по Д-2; развести в
200-250 мл физиологического раствора; в/в инфузия, в течение 1 часа
|
+ | + | + | ||
| NMA: Flu/Cy/TBI (для лимфом) | |||||||||
| Название препарата | Доза | Способ введения | Д-6 | Д-5 | Д-4 | Д-3 | Д-2 | Д-1 | Д0 ТКМ |
| Флударабин | 30 мг/м2/сут | С Д-6 по Д-2, развести 200-250 мл физиологического раствора; в/в инфузия, в течение 30 мин | + | + | + | + | + | ||
|
Циклофосфамид
|
60 мг/кг/сут | Д-6, Д-5; развести в 400-500 мл физиологического раствора; в/в инфузия | + | + | |||||
|
Месна
|
120 мг/кг/сут | Д-6, Д-5 начать за 3 часа до циклофосфамида, в течение 24 часов | + | + | |||||
|
TBI
|
200 cGy | Д-1, 7 cGy в минуту | + | ||||||
| NMA: Cy/TBI (для лимфом) | |||||||
| Название препарата | Доза | Способ введения | Д-4 | Д-3 | Д-2 | Д-1 | Д0 ТКМ |
|
Циклофосфамид
|
14,5 мг/кг/сут | Д-4, Д-3; развести в 400-500 мл физиологического раствора; в/в инфузия, в течение 1 часа | + | + | |||
|
Месна
|
14,5 мг/кг/сут | Д-4, Д-3, начать за 3 часа до циклофосфамида, в течении 24 часов | + | + | |||
|
TBI
|
200 cGy | Д-1, 7 cGy в минуту | + | ||||
| NMA: Flu/TBI (для лимфом) | |||||||||
| Название препарата | Доза | Способ введения | Д-6 | Д-5 | Д-4 | Д-3 | Д-2 | Д-1 | Д0 ТКМ |
| Флударабин | 30 мг/м2/сут | С Д-6 по Д-2, развести в 200-250 мл физиологического раствора; в/в инфузия, в течение 30 мин | + | + | + | + | + | ||
|
TBI
|
200 cGy | Д-1, 7 cGy в минуту | + | ||||||
| NMA: TBI (для лимфомы) | |||
| Название препарата | Доза | Способ введения | Д0 ТКМ |
|
TBI
|
2 Gy | Д0, 7 cGy в минуту | + |
| Данный режим применяется в исключительных случаях химиорезистентных форм, ранее имевших чувствительность к лучевой терапии. | |||
| NMA: Thio/Cy(для лимфомы) | ||||||||
| Название препарата | Доза | Способ введения | Д-5 | Д-4 | Д-3 | Д-2 | Д-1 | Д0 ТКМ |
|
Тиотепа
|
5 мг/кг/сут | Д-5, развести в 400-500 мл физиологического раствора; в/в инфузия, в течение 30 мин | + | + | ||||
|
Циклофосфамид
|
50 мг/кг/сут | Д-3, Д-2; развести в 1000 мл физиологического раствора; в/в инфузия, в течение 2-3 часов | + | + | ||||
|
Месна
|
100 мг/кг/сут | Д-3, Д-2 начать за 3 часа до циклофосфамида, в течении 24 часов | + | + | ||||
Профилактика РТПХ
Потенциально опасным для жизни осложнением аллогенной трансплантации гемопоэтических клеток (алло-ТГСК) является реакция «трансплантат против хозяина» (РТПХ), которая возникает, когда Т-клетки реципиента распознают антигены хозяина на здоровых тканях [8].
Профилактика РТПХ основана на применении ингибиторов кальциневрина (CNI) c кратковременным курсом метотрексата после MAC и комбинации с ± Микофеноловая кислота (Микофенолата мофетил) после RIC Циклоспорин/МТХ+/- MMF или Такролимус/МТХ+/- MMF для профилактики оРТПХ [9,10].
Таблица-6. Стандартная профилактика РТПХ
| Циклоспорин (CsA) | Такролимус (TAC) | Метотрексат (MТХ) | Микофеноловая кислота (MMF) | |
| Доза | 3 мг/кг/день в/в с -1Д и до приживления, далее per оs | 0,03мг/кг/день с -1Д и до приживления, далее per оs | 15 мг/м2 день +1 10 мг/м2 день +3, +6, +11 | С -1Д по +30Д 30мг/кг/день per оs в 2-3 приема |
| Коррекция дозы | Целевая доза для достижения уровня в плазме 150–200 нг/мл; корректируется в зависимости от функции почек | Целевая доза для достижения уровня в плазме 5-15 нг/мл; корректируется в зависимости от функции почек | На +11Д введение может быть отменено при развитии мукозита III/IV степени | Окончание приема проводится одномоментно. В случае развития тяжелого мукозита и невозможности перорального приема препаратов, возможен перевод на внутривенное введение |
Коррекция дозы CsA/ТAC:
• нагрузочная доза не корригируется, за исключением достижения токсической концентрации;
• при снижении уровня креатинина до нормы, доза CsA/ТAC увеличивается на 25% с учетом концентрации препарата в крови;
• при повышении уровня концентрации циклоспорина в крови выше целевого уровня прием CsA прекращается на 24-48ч и возобновляется в дозе редуцированной на 50%, после нормализации концентрации препарата в крови;
• при повышении уровня концентрации такролимуса в крови до 30 нг/мл, доза препарата редуцируется на 50%;
• при повышении уровня концентрации такролимуса в крови >30 нг/мл прием ТAC прекращается на 24-48ч и возобновляется в дозе редуцированной на 50%, после нормализации концентрации препарата в крови;
Мониторинг концентрации CsA/ТAC:
• уровень CsA/ТAC мониторируется 2 раза в неделю;
• если концентрация CsA/ТAC ниже терапевтической (целевой), доза эскалируется на 25%;
• если необходимо увеличить дозу CsA>150%, изменяется кратность введения с 2 до 4 р/сут;
• при использовании CsA/ТAC необходимо мониторировать уровень магния в сыворотке крови.
Смена ТAC и CsA: При необходимости замены CsA на ТАС и наоборот, отменяют введение стартового препарата и через 24 часа начинается введение заменяющего препарата, при условии, что концентрация стартового препарата в крови не превышает терапевтическую.
Метотрексат 15 мг/м2 в день +1, 10 мг/м2 в дни +3,+6, +11 в\в струйно.
Введение кальция фолинат/натрия фолинат: Введение начинается через 24 часа от введения Метотрексата. Вводится по 15 мг струйно каждые 6 часов. Закончить введение необходимо за 12 часов до следующего введения метотрексата.
Лекарственное взаимодействие:
Препараты, значительно повышающие концентрацию CsA/ТAC в крови: противогрибковые средства (кетоконазол, флуконазол, итраконазол, вориконазол, клотримазол); макролидные антибиотики (эритромицин, кларитромицин, джозамицин); ингибиторы ВИЧ протеаз (ритонавир); нифедипин, никардипин, дилтиазем, верапамил, даназол; этинилэстрадиол; омепразол; нефазодон.При данной комбинации может потребоваться снижение дозы CsA/ТAC.
Потенциальные ингибиторы CsA/ТAC: бромокриптин, кортизон, дапсон, эрготамин, гестоден, лидокаин, мефенитоин, миконаз
о
мидазолам, нилвадипин, норэтинодрон, хинидин, тамоксифен, (триацетил)олеандомицин; рифампицин, фенитоин, зверобой (Hypericum perforatum), карбамазепин, метамизол, изониазид.
CsA/ТAC потенциально способен снизить клиренс фенобарбитала, гормональных контрацептивов и антипирина.
Одновременное применение CsA/ТAC с препаратами, обладающими нефро- или нейротоксичностью (например, аминогликозиды, ингибиторы гиразы, ванкомицин, ко-тримоксазол, НПВС, ганцикловир, ацикловир), может способствовать усилению этих эффектов.
CsA/ТAC может способствовать развитию или усиливать гиперкалиемию (следует избегать одновременного применения калия или калийсберегающих диуретиков в высоких дозах).
Длительность применения препаратов.
• при развитии гематологического рецидива, все иммуносупрессивные препараты отменяются немедленно;
• при развитии молекулярного рецидива, иммуносупрессивная терапия отменяется в течение 2-4 недель.
Циклофосфамид.
Классическая балтиморская профилактика РТПХ с посттрансплантационным циклофосфамидом (PTCY) включает: ЦФ 50 мг/кг в дни +3 и +4 с последующим введением CNI/MMF с дня +5. Альтернативная схема, используемая в некоторых центрах, включает PTCY, проводимую в дни +3 и +5, с ранним введением CsA/ТАС в день -1 или 0 с последующим введением MMF с дня +1 [11].
PTCY все чаще используется при гаплоидентичных и полностью совместимых родственных ТКМ, как и предполагалось, приводит к снижению частоты РТПХ, особенно хронической. Эти результаты были подтверждены двумя рандомизированными исследованиями 3фазы, проведенными BMT CTN. В первом из них (BMT CTN 1301) PTCY вводился в виде отдельного препарата после схемы MAC с использованием КМ в качестве источника стволовых клеток. В сравнении со схемой TAC + MTX наблюдалась аналогичная частота тяжелой РТПХ и ОВ при использовании только PTCY. В рандомизированном исследовании 3фазы, BMT CTN 1703 сравнивались режимы профилактики PTCY + MMF + TAC и TAC + MTX после аллогенной ТКМ с использованием режима кондиционирования RIC и периферические ГСК. Результаты показали значительное снижение острой и хронической РТПХ при использовании PTCY + TAC + MMF без увеличения риска рецидива или смерти. Не было различий ни в частоте рецидивов/прогрессирования через 1 год, ни в частоте выживаемости через 1 год [12,13].
PTCY также применяется с антитимоцитарным глобулином в качестве профилактики РТПХ в условиях гаплоидентичной трансплантации [14].
Циклофосфамид 50мг/кг вводится в Д+3, Д+4 (или +3Д и +5Д в альтернативной схеме) на 500мл-1000мл физиологического раствора; в/в за 2 часа.
С целью профилактики геморрагического цистита вводиться Месна в 2 раза больше от дозы циклофосфамида. 24-часовая инфузия, начиная за 3 часа перед введением циклофосфамида, заканчивая через 24 часа после окончания введения.
Антитимоцитарный глобулин [14,15,16].
Антитимоцитарный глобулин представляют собой поликлональные сыворотки, полученные при иммунизации кроликов либо против тимоцитов человека, либо против клеточной линии «Jurkat» соответственно. Механизм действия известен лишь частично и включает истощение Т- и В-клеток, ингибирование миграции воспалительных клеток и дендритных клеток, сохранение компартмента T-регуляторных клеток.
Антитимоцитарный глобулин (кроличий) [17,18] вводится в течение 3 дней до трансплантации в дозе 2.5 мг/кг на введение (суммарная доза 7.5 мг/кг). Крайне желательно, чтобы дни введения не совпадали с днями приема бусульфана, например в -2 и -1 дни. Разводится на 500 мл физиологического раствора. Кожная проба при использовании кроличего антитимоцитарного голбулина не проводится. Введение препарата идет параллельно с введением метилпреднизолона в суммарной дозе 2-3 мг/кг (но не более 250мг/сут). Началу инфузии АТГ предшествует в/в болюсное введение 30мг метилпреднизолона с последующей 13-ти часовой инфузией оставшийся суточной дозы метилпреднизолона.
Препарат разводится на 500 мл физиологического раствора. В случае отрицательной кожной пробы проводится 12- часовая инфузия с премедикацией 1 мг/кг метилпреднизолона в\в капельно перед началом введения и через 6 часов после начала введения. В случае положительной кожной пробы доза метилпреднизолона увеличивается до 2 мг/кг. В случае развития аллергической реакции на фоне введения введение препарата останавливается и вводится 2 мг/кг метилпреднизолона. Инфузия возобновляется с удлинением времени введения до 18 часов после разрешения симптомов аллергии.
Сиролимус (SIR) [19,20]: Используется в комбинации с такролимусом или циклоспорином. Дозировка: 2–4 мг/день, целевой уровень в плазме: 5–15 нг/мл. Обычно применяется в течение 3–6 месяцев после трансплантации. Постепенная отмена начинается после стабилизации состояния пациента и отсутствия признаков РТПХ.
Трансфузионная поддержка
Все готовые компоненты крови (эритроцитарная взвесь, концентраты тромбоцитов, трансфузии гранулоцитов) подлежат облучению [21]. Рекомендуется, облучение не менее 25 Гр и не более 50 Гр для всех компонентов крови. (Европейский комитет (частичное соглашение) по переливанию крови) [22]. Пациентам, перенесшим ТКМ, необходимо переливать облученные продукты крови (не менее чем за 2 недели до сбора стволовых клеток при ауто- и начиная с кондиционирования при алло-ТГСК) [21].
Таблица-7. Показания к проведению трансфузий компонентами крови.
|
Абсолютные показания к переливанию концентрата тромбоцитов
|
Абсолютные показания к переливанию эритроцитарной взвеси [23,24] |
| Уровень тромбоцитов ≤10*109/л – пациентам без кровотечений и лихорадки для профилактики кровотечения | Гемоглобин 70–80 г/л для взрослых пациентов со стабильной гемодинамикойа |
| Уровень тромбоцитов ≤20*109/л - пациентам с активным кровотечением, лихорадочными состояниями или активными инфекциями | |
| Уровень тромбоцитов ≤20*109/л (или даже выше 20) - в случае специфической токсичности, связанной с трансплантацией, которая может увеличить риск кровотечения (острая РТПХ, мукозит, геморрагический цистит или диффузное альвеолярное кровотечение), на основании тщательного клинического наблюдения, может быть оправданным. |
а Ограничительный порог переливания эритроцитарной взвеси 80г/л рекомендуется пациентам с существующими сердечно-сосудистыми заболеваниями.
Около 40–50% реципиентов АллоТКМ и доноров не соответствуют по ABO. В посттрансплантационном периоде изменение группы крови и циркуляция алло-агглютининов реципиента приводит к определенным сложностям при проведении трансфузий.
Таблица-8. Трансфузионная поддержка при АВО-несовместимой ТКМ
| I фазаa | II фаза III фазаa | |||||||
| ABO несовместимость | Реципиент | Донор | Все компоненты | ЭВ | Тромбоциты | Плазма | ||
| Выборb | Первый выбор | Второй выборb | Первый выбор | Второй выбор | ||||
| Большая | О | А | Реципиент | О | А | AB, B, O | А | АВ |
| О | В | Реципиент | О | В | AB, A, O | В | АВ | |
| Малая | О | АВ | Реципиент | О | AB | A, B, O | AB | - |
| А | АВ | Реципиент | A, O | AB | A, B, O | AB | - | |
| В | АВ | Реципиент | B, O | AB | B, A, O | AB | - | |
| А | О | Реципиент | О | Ac | AB, B, O | А | AB | |
| В | О | Реципиент | О | Bc | AB, A, O | В | АВ | |
| Двунаправленная | АВ | О | Реципиент | О | ABc | A, B, O | AB | - |
| АВ | А | Реципиент | A, O | ABc | A, B, O | AB | - | |
| АВ | В | Реципиент | B, O | ABc | B, A, O | AB | - | |
| А | В | Реципиент | О | AB | B, A, O | AB | - | |
| В | А | Реципиент | О | AB | A, B, O | AB | - | |
Большая или двунаправленная ABO-несовместимая ТГСК может вызвать приобретенную чистую эритроцитарную аплазию (ПЧКА), задержку приживления и повышенную зависимость от трансфузии эритроцитов. Наивысший риск, в случае О группы у реципиента с высоким титром анти-А изоагглютининов с донором группы А [25,26]. Диагноз ПЧКА, устанавливается на сроке +2 месяца после алло-ТГСК, после исключения вирусных инфекций (парвовирус В19, герпесвирусы), рецидива заболевания, лекарственной токсичности, дефицита железа, фолатов, витамина В12. Наиболее часто развивается при большой несовместимости по системе AB0 реципиента и донора после алло-ТГСК в 30% случаев большой несовместимости.
Если спонтанной ремиссии не происходит и антидонорские изоагглютинины сохраняются, используются различные методы лечения для удаления изоагглютининов, для снижения их продукции или для стимуляции эритропоэза. При выборе метода терапии рекомендуется учитывать риск развития рецидива основного заболевания, наличие реакции «трансплантат против хозяина» (РТПХ), гипофункции трансплантата [26,27].
Ранние осложнения.
Высокие дозы химиопрепаратов и ионизирующего облучения, применяемые в режиме кондиционирования, оказывают влияние на все органы и ткани реципиента, вызывая ранние и поздние (вторичные) осложнения. Инициирующим фактором которых, является повреждение эндотелия, вследствие воздействия химиопрепаратов и/или ионизирующего облучения. Данные осложнения развиваются в течение 30 – 60 дней после проведения ТКМ, имеют клинические особенности, но четкие диагностические критерии отсутствуют. Повреждение эндотелия, также играет роль в развитии РТПХ.
Геморрагический цистит (ГЦ).
Тяжелое осложнение раннего посттрансплантационного периода, ассоциированное с инфекционными заболеваниями и/или применением высоких доз ЦФ. В зависимости от времени возникновения после ТКМ, определяется как ранний и поздний. Ранний ГЦ обычно возникает во время или в течение 48 часов после окончания режима кондиционирования и является результатом прямого токсического воздействия метаболитов ЛС и радиотерапии на слизистую оболочку мочевого пузыря. Поздний ГЦ обычно начинается примерно во время приживления нейтрофилов (2–4 недели) вплоть до второго-третьего месяца после ТКМ. Основным клиническим проявлением геморрагического цистита является гематурия, которая может протекать бессимптомно или с выраженной симптоматикой цистита.
С целью предупреждения раннего геморрагического цистита, при включении высоких доз ЦФ в режим кондиционирования и/или профилактики РТПХ, необходимо использовать гипергидратацию и Месну, в дозе 2 раза превышающей дозу ЦФ (соотношение 2:1) в виде 24-часовой инфузии. Введение урометиксана должно быть начато за 3 часа до инфузии ЦФ. Основным фактором риска позднего ГЦ является инфицирование полиомавирусом BK (BKPyV), тогда как другие вирусы, такие как аденовирус, цитомегаловирус и полиомавирус-JC, встречаются редко [28, 29]. Легкая или умеренная бессимптомная вирурия BKPyV наблюдается у 5–10% здоровых людей, особенно пожилых и беременных женщин, тогда как высокая вирурия BKPyV обнаруживается у 50–60% пациентов, перенесших аллогенную ТКМ из-за состояния тяжелой иммуносупрессии.
Вирурия BKPyV развивается более чем у 50% аллогенных ТКМ, но явная клиническая картина ГЦ возникает примерно у 20% пациентов, поскольку на ее возникновение влияют несколько факторов, связанных с пациентом или трансплантацией:
Дополнительно: необходимо исключить другие инфекционные и неинфекционные причины ГЦ. Выявление признаков воспаления мочевого пузыря (отек и утолщение стенки мочевого пузыря), а также наличие внутрипузырных сгустков или обструкцию мочевыводящих путей методами инструментальной диагностики (УЗИ, КТ).
Лечение геморрагического цистита.
Адекватная гидратация – 3 л/м2/сут, в сочетании с интенсивной поддержкой концентратом тромбоцитов. Непрерывное орошение мочевого пузыря физиологическим раствором (трансуретрально). Применение прокоагулянтов противопоказано, так как, они способствуют образованию сгустков в мочевом пузыре.
Мезенхимальные стромальные клетки (МСК) [35] представляют собой новейшее инновационное лечение, опробованное для ГЦ. МСК обладают потенциалом стимулировать процесс восстановления тканей и оказывать иммуномодулирующее и противовоспалительное действие. МСК вводиться внутривенно, медианная доза клеток составила 1,0 (диапазон 0,7-2)x10(6)/кг.
Согласно данному исследованию, у пяти пациентов тяжелый геморрагический цистит был полностью купирован после инфузии МСК. Отсутствие макрогематурии констатировано в среднем через 3 (1-14) дня.
Плазма обогащенная тромбоцитами (ПОТ) [38,39], также известная как аутологичный тромбоцитарный гель, представляет собой суспензию собственных тромбоцитов пациента в плазме, не содержащую лейкоцитов. Различные факторы роста, секретируемые тромбоцитами, присутствующими в ПОТ [такие как тромбоцитарный фактор роста (PDGF), сосудистый эндотелиальный фактор роста (VEGF) и трансформирующий фактор роста-β (TGF-β)], и плазменные белки (такие как фибрин и фибронектин) предположительно ускоряют восстановление в различных тканях организма. При неэффективности консервативных мер, возможно использование селективной эмболизации артерий мочевого пузыря, катетеризацию обоих мочеточников, с выключением мочевого пузыря, наложение эпицистостомы, при не эффективности всех лечебных мероприятий как крайняя мера – цистэктомия.
Синдром синусоидальной обструкции/Веноокклюзионная болезнь печени [40,41]. Синдром синусоидальной обструкции (СОС), также известный как веноокклюзионная болезнь (ВОБ) — это опасное для жизни осложнение, возникающее после ТКМ. Клинические проявления включают гепатомегалию, гепаталгию, задержку жидкости с асцитом, увеличение веса, рефрактерную к переливанию тромбоцитопению и желтуху. ВОБ обычно постепенно разрешается в течение нескольких недель; тем не менее, у пациентов с тяжелой формой уровень смертности очень высок (>80%). Общая заболеваемость СОС/ВОБ у взрослых может быть оценена примерно в 5–15%, но она значительно варьируется в зависимости от наличия факторов риска и интенсивности режима кондиционирования.
Таблица-9. Немодифицируемые и модифицируемые факторы риска СОС/ВОБ (взрослые)
| Немодифицируемые факторы риска (жирным шрифтом выделены факторы риска с самым высоким отношением) |
|
Вторая ТГСК
Продвинутые стадии заболевания (больше второй полной ремиссии или рецидива)
Первичная диагностика иммунодефицита
Генетические факторы (полиморфизм GSTM1, аллель C282Y и гаплотип MTHFR 677CC/1298CC)
Пациенты старшего возраста
Высокий уровень трансаминаз
Индекс Карновского ниже 90%
Метаболический синдром
Женщина принимающие норэтистерон
Терапия с гемтузумаб озогамицин или инотузумаб озогамицин в анамнезе
Гепатотоксичные препараты
Перегрузка железом (>1.000 нг/мл)
Билирубин в сыворотке > 60мкмоль/л
Трансаминазы >2.5 норм
Существующее заболевание печени: фиброз печени, цирроз, и активный вирусный гепатит
Облучение брюшной полости или печени
|
| Модифицируемые факторы риска и рекомендуемые профилактические меры |
|
Кондиционирование:
Высокодозные (миелоаблативные) режимы
Пероральный или высокие дозы бусульфана
Высокие дозы треосульфана
Режимы основанные на высоких TBI
Донор:
Неродственный донор
Донор с HLA-mismatch
Профилактика РТПХ:
Сиролимус + метотрексат + такролимус
Метотрексат + циклоспорин или такролимус
Трансплантация без деплеции Т-клеток
Питание:
Использование парентерального питания
|
|
Вероятная
|
Клиническая | Доказанная |
|
Должно присутствовать 2 из нижеперечисленных критериев:
– Билирубин ≥35мкмоль/л
– Гепаталгия
– Прибавка в весе >5%
– Асцит
– Признаки ВОБ по УЗИ и/или эластографии
|
Билирубин ≥2 мкмоль/л и 2 из нижеперечисленных критериев:
– Болезненная гепатомегалия
– Прибавка в весе >5%
– Асцит
|
Гистологически доказанная ССО/ВОБ или гемодинамически доказанная ВОБ: градиент давления в печеночных венах ≥10 mmHg |
|
Время начала
|
Время начала | |
| В первые 21Д от ТГСК: классическая ВОБ | >21Д от ТГСК: поздняя ВОБ | |
Таблица-11. Градация степени тяжести ВОБ [44,45].
|
Легкаяa
|
Средняяa | Тяжелая | Очень тяжелая—ПОНb | |
| Время с момента появления клинических симптомов ВОБ |
>7 дней
|
5–7 дней | ≤4 дней | Любое время |
| Билирубин (мкмоль/л) |
≥35 and<52
|
≥52 and<85,5 | ≥85,5 and<136,7 | ≥136,7 |
| Динамика билирубина | Удвоение в течении 48ч | |||
| Трансаминазы |
≤2 × норм
|
>2 и ≤5 × норм |
>5 и ≤8 × норм
|
>8 × норм |
| Прибавка в весе | ≥5% | ≥10% | ||
| Функция почек (креатинемия) | Исходный уровень при трансплантации | <1.5 × от исходного уровня | ≥1.5 и <2 × от исходного уровня | ≥2 × от исходного уровня или СПОНb |
a При наличии 2 и более факторов риска СОС/ВОД пациенты должны относиться к высшей группе риска.
b Пациенты с полиорганной недостаточностью должны быть классифицированы как очень тяжелые. Полиорганная недостаточность определяется как поражение ≥2 органов по шкале SOFA с показателем ≥2 или увеличение ≥2 или дисфункция органа для пациентов с поражением основного органа.
Важно оценить тяжесть СОС/ВОБ при постановке диагноза; тем не менее, у некоторых пациентов СОС/ВОБ ухудшается, и мы должны четко указывать, когда мы назначаем степень тяжести СОС/ВОБ, принимаем ли мы во внимание тяжесть при постановке диагноза или общую наивысшую степень тяжести, независимо от времени оценки.
Профилактика ВОБ. Рекомендуется введение урсодезоксихолевой кислоты в дозе 12мг/кг/сут с начала кондиционирования до +90 дня после трансплантации [46].
Лечение ВОБ. Дефибротид остается единственным средством для лечения тяжелой формы СОС/ВОБ и должен быть начат как можно скорее у таких пациентов, а также у пациентов с ВОБ средней тяжести [47]. Дефибротид назначают в дозе 25 мг/кг/день в течение не менее 14–21 дня и до исчезновения всех симптомов ВОБ [48].
Синдром приживления (СП) [49]. Этот синдром также называют: имплантационным синдромом капиллярной утечки; синдромом аутоагрессии; респираторным дистрессом приживления; асептическим септическим шоком и аутологичной РТПХ. Развивается в результате эндотелиальной дисфункции, вызванной массивным выбросом активированных лейкоцитов и провоспалительных цитокинов во время сложного процесса приживления, а также всеми факторами, которые повреждают эндотелий во время кондиционирования.
Факторы риска: повышенная клеточность, использование G-CSF/GM-CSF, или использование ДМСО (при аутоТГСК). Уровень СРБ>60 мг/л (обычно до 100–150 мг/л) в начале лихорадки имеет отличную положительную и отрицательную прогностическую ценность (90% и 90% соответственно) и служит для мониторинга ответа на лечение. При аллоТГСК, явления аллореактивности, использование ингибиторов кальциневрина и повышенный риск инфекций требуют широкой дифференциальной диагностики. Поэтому при подозрении целесообразно использовать диагностические критерии Spitzer которые намного строже и требуют отсутствия гистологических изменений РТПХ, чтобы избежать возможной путаницы с ранней оРТПХ.
Таблица-12. Диагностические критерии синдрома приживления
Б – большие критерии
м – малые критерии
[1] Без сердечной недостаточности, тромбоэмболии или инфекции.
[2] Без гистологических данных острой РТПХ
| Автор | Spitzer [50] | Maiolino et al.[51] | Grant et al.[52] |
| Клинические критерии | 3Б или 2Б + ≥1м | 1Б + 1м | 2 Б или 1Б + ≥2м |
| Часы до/после приживления (П) | 96 < П < 96 | 24 < П < любое, после | 96 < П< 24 |
| Неинфекционная лихорадка | Б | Б | Б |
| Сыпь >25% поверхности тела | Б [2] | м | Б |
| Отек легких/гипоксия [1] | Б | м | м |
| Набор веса >2.5% от исходного | м | м (>3% от исходного) | м |
| Печеночная/почечная дисфункция | м | - | - |
| Энцефалопатия | м | - | - |
| Диарея (≥2 эпизодов) | - | м |
м |
Лечение синдрома приживления.
1. Отмена колониестимулирующих факторов. Забор анализов на бак.посевы крови, зева и прямой кишки. Начать АБТ широкого спектра.
2. Через 48ч, оценить эффект от AБТ и результаты культур, и не отменяя AБТ, начать метилпреднизолон 1 мг/кг каждые 12ч внутривенно (×3 дня) и постепенно снижать дозу в течение недели. Задержка начала лечения может привести к полиорганной недостаточности.
При раннем лечении стероидами быстрое разрешение картины наблюдается в >90% случаев (уровни СРБ являются хорошими индикаторами ответа). Если нет быстрого улучшения, необходимо рассмотреть другие диагнозы. В редких случаях наблюдаются рецидивы при прекращении приема стероидов.
Синдром предприживления: в отличии от СП, развивается раньше приживления примерно на +7Д, за 10-11 дней до приживления. Лечение аналогично СП [53].
Синдром капиллярной утечки [54].
Идиопатический системный капиллярный синдром был описан у здоровых пациентов, у которых наблюдался эпизодический кризис гипотонии/гипоперфузии, гипоальбуминемии и тяжелого генерализованного отека (болезнь Кларксона). Очень похожие эпизоды также были описаны после введения ИЛ-2, ИЛ-4, ФНО-α, ГМ-КСФ и Г-КСФ и в контексте ТГСК.
Лечение симптоматическое, использование ГКС. Отмена колониестимулирующих факторов.
Тромботическая микроангиопатия, ассоциированная с ТКМ [55,56,57].
ТА-ТМА является редким, но довольно серьезным осложнением ТКМ, проявляется у 20-30% реципиентов. ТМА является многофакторным заболеванием, при котором, генерализованная дисфункция эндотелия приводит к микроангиопатической гемолитической анемии, с активацией тромбоцитов и образованием тромбов в микроциркуляторном русле. Эти процессы вызывают повреждение конечных органов и имеют неблагоприятные исходы, особенно при повреждении почек. Выраженность ТМА может варьировать от умеренной (самоограничивающейся формы) до неконтролируемой молниеносной болезни с летальным исходом. Причины неоднородности заболевания неизвестны. Полиорганное поражение, как правило, проявляется в виде легочной гипертензии, полисерозита, повреждения желудочно-кишечного тракта, повреждения центральной нервной системы и почек.
Таблица-13. Диагностические критерии ТА-ТМА [58]
| Консенсусные диагностические критерии TA-TMА | |
| 1. Гистологическое подтверждение ЛЮБОГО органа ИЛИ | |
| 2. Клинический диагноз. Диагностические критерии ≥4/7 из нижеперечисленных в течении 14 дней в двух последовательных временных точках | |
| Анемияa |
Определяется как одно из следующих: 1. Невозможность достижения независимости от трансфузий крови, несмотря на доказательства приживления нейтрофилов 2. Снижение гемоглобина от исходного уровня на 10 г/л 3. Появление зависимости от трансфузий Исключить другие причины анемии, такие как АИГА и ПККА |
| Тромбоцитопенияa |
Определяется как одно из следующих: 1. Отсутствие приживления тромбоцитов 2. Потребность в переливании тромбоцитов выше ожидаемого 3. Рефрактерность к переливанию тромбоцитов 4. Снижение на 50% от исходного количества тромбоцитов после полного тромбоцитарного приживления |
| Повышенный уровень ЛДГ | Выше верхней границы нормы для данного возраста |
| Шизоциты | Присутствие |
| Артериальная гипертензия | Систолическое АД ≥140 мм.рт.ст или диастолическое АД ≥90 мм.рт.ст |
| Повышенный уровень sC5b-9 | Выше верхней границы нормы |
| Протеинурия | ≥1 мг/мг соотношения белка в моче к креатинину |
Таблица-14. Стратификация риска ТМА [58].
| Международная консенсусная стратификация риска в модификации Jodele et al., | |
| Стандартный риск TA-TMA | Высокий риск TA-TMA |
|
– Повышенный ЛДГ <2x верхних границ нормы – Отношение белка к креатинину в моче <1 mg/mg – I стадия острого повреждения почек KDIGO – Нормальный уровень C5b-9 |
– Повышенный ЛДГ ≥ 2× верхних границ нормы* – Отношение белка к креатинину в моче ≥1 mg/mg – дисфункция любого органа развившаяся в рамках ТМА (кроме I стадия острого повреждения почек KDIGO) – Повышенный уровень C5b-9 в сыворотке (> верхней границы нормы) – Сопутствующая острая РТПХ II-IV степени * – Сопутствующая системная инфекция (бактериальная или вирусная)* |
Таблица-15. Лечение ТА- ТМА [58]
| Поддерживающая терапия и терапия направленная на лечение ТА-ТМА |
|
• Трансфузионная поддержка.
• Прекратить воздействие возбудителей, если это возможно.
• Модифицировать иммуносупрессию, если по оценки «риск/польза» польза превышает риск (в плане развития острой РТПХ).
• Лечение РТПХ, инфекции.
• Агрессивное лечение гипертонии.
• Мониторинг на предмет повреждения органов.
• Питание, витаминная поддержка (витамины D, C).
|
|
Блокаторы комплемента с зарегистрированным клиническим эффектом:
• Экулизумаб (блокатор C5): наиболее перспективный таргетный препарат для лечения опосредованного комплементом ТА-ТМА высокого риска у детей и взрослых, демонстрирующий повышение выживаемости до 70% при ТА-ТМА высокого риска и восстановление функции органов у выживших [59]. Препарат вводиться в дозе 900мг/сут в/в за 1час капельно 1 раз в неделю (1-2 введения) далее по 600мг/сут 1раз в неделю до разрешения клинической и лабораторной симптоматики.
Комплемент-блокирующие агенты, которые в настоящее время изучаются в клинических исследованиях для TA-TMA:
• Равулизумаб (C5 ингибитор).
Терапевтический плазмообмен (ТПО) при TA-TMA: достижение ответа описано при раннем применении ТПО. Является альтернативным методом для пациентов при отсутствии ингибиторов системы комплемента. У пациентов с антителами к фактору H сообщалось о случаях ответа в сочетании с ритуксимабом. • Ритуксимаб: Сообщается о 12/15 ответах на ритуксимаб (375мг/м2/сут) [60]. |
Синдром идиопатической пневмонии (СИП).
Это распространенное альвеолярное повреждение диагностируется при отсутствии активной инфекции нижних дыхательных путей, сердечной или почечной дисфункции и ятрогенной перегрузки жидкостью [61]. Синдром идиопатической пневмонии является неинфекционным повреждением легких после ТГСК, вследствие токсического режима кондиционирования, иммунологического клеточно-опосредованного повреждения (при АллоТГСК) и действия воспалительных цитокинов [62,63]. В настоящее время частота СИП составляет <10% от алло-ТГСК (7% после MAC с TBI ≥12 Гр; 2% после RIC у взрослых).
Обычно развивается в течение первых 120 дней после ТКМ, может наблюдаться между 21 и 180 днями, но встречается редко.
Таблица-16. Диагностические критерии СИП. Для установления диагноза СИП должны присутствовать все следующие критерии:
| 1. Доказательства обширного альвеолярного повреждения: |
|
(a) Диффузные инфильтраты на рентгенограммах грудной клетки или КТ (b) Симптомы и признаки пневмонии (кашель, одышка, тахипноэ, хрипы) (c) Доказательства аномальной физиологии легких Увеличение разницы между альвеолярным и артериальным кислородом; необходимость в дополнительной кислородотерапии Новые или возросшие рестриктивные нарушения функции легких |
| 2. Отсутствие активной инфекции нижних дыхательных путей на основании: |
|
(a) БАЛ отрицательный на наличие значимых бактериальных патогенов, включая кислотоустойчивые бациллы, виды Nocardia и Legionella (b) БАЛ отрицательный на патогенные не бактериальные микроорганизмы: Рутинное культивирование бактерий, грибков и КУБ, а также культивирование во флаконах с оболочкой для выявления ЦМВ ПЦР на респираторные вирусы и ЦМВ Цитология на наличие включений ЦМВ, грибков и Pneumocystis jirovecii (c) Другие организмы/тесты, которые также следует учитывать: ПЦР на метапневмовирус человека, риновирус, коронавирус и HHV6 ПЦР на хламидии, микоплазмы и аспергиллы. Сыворотка и жидкость БАЛ для видов Aspergillus, сывороточный бета-D-глюкан. |
| 3. Отсутствие сердечной дисфункции, острой почечной недостаточности или ятрогенной перегрузки жидкостью как этиологии легочной дисфункции |
Таблица-17. Лечение, прогноз СИП
| Поддерживающие меры |
Дополнительная O2 терапия Неинвазивная [high-flow nasal O2, CPAP] или при необходимости инвазивная (механическая) респираторная поддержка Эмпирическая антибактериальная терапия широкого спектра Строгий контроль баланса жидкости/гемофильтрации |
| Специфическое лечение |
Повреждение легких при СИП может происходить двумя путями: зависимым от ФНО-альфа/ЛПС и зависимым от ИЛ6/ИЛ17 определяющими опции лечения [62,64,65]: • Метилпреднизолон ≤ 2 мг/кг/день; если нет четкого ответа, рассмотрите возможность как можно скорее: • Анти-ФНОα: этанерцепт 0,4 мг/кг два раза в неделю (максимум 8 доз) + системные стероиды (2 мг/кг/день). • Другие препараты проходящие исследования: –MoAb anti-IL6: тоцилизумаб |
| Прогноз | Несмотря на успехи в диагностике и терапии, смертность от СИП у взрослых остается высокой [63]. |
Диффузное альвеолярное кровотечение [66].
Диффузное альвеолярное кровотечение (ДАК) является следствием повреждения базальной мембраны альвеолярных капилляров. Может быть неинфекционной или инфекционной этиологии. Возникает у 2–14% реципиентов. Клинические проявления: Обычно наблюдается в течение первого месяца после ТКМ (в среднем 23 дня от ТКМ), чаще в период до приживления; однако позднее начало тоже встречается, примерно в 42% случаев.
Клинические проявления такие же, как при СИП. Выраженное кровохарканье встречается редко [67].
Факторы риска: Более высокая заболеваемость наблюдается после TBI и высокодозной ЦФ.
Диагностика: диагноз устанавливается на основании результатов БАЛ: прогрессирующее увеличение количества крови в аликвотах жидкости БАЛ по крайней мере в трех сегментарных бронхах, что указывает на наличие крови в альвеолах (или 20% макрофагов, нагруженных гемосидерином, хотя их отсутствие не исключает диагноз, поскольку может пройти 72 часа, прежде чем кровь появится).
Таблица-18. Лечение, прогноз ДАК.
| Лечение | – Высокие дозы метилпреднизолона 250–500 мг каждые 6 часов × 5 дней с последующим снижением, однако общий ответ на это лечение низкий даже при сочетании с аминокапроновой кислотой [68]. |
| Прогноз |
– Плохой: общая смертность достигает 85% к 100-му дню. Менее 15% пациентов умирают в результате прямого диффузного альвеолярного кровотечения (ДАК), однако частое развитие ПОН увеличивает смертность до >60% (30% при ауто- и 70% при алло-ТГСК)[66]. – Прогноз при ДАК, возникающем после ауто-ТГСК, лучше |
Поздние неинфекционные легочные осложнения (LONIPC) - определяемые как, возникающие более чем через 100 дней после трансплантации, встречаются у 20% реципиентов алло-ТГСК, включающие различные клинические состояния, среди которых наиболее частыми являются синдром облитерирующего бронхиолита (СОБ) и диффузная интерстициальная болезнь легких (ИБЛ).
Таблица-19. Синдром облитерирующего бронхиолита (СОБ)
| Время и частота развития |
Начало после трансплантации: 6–24 месяца. Частота: 3–11%. |
| Клинические проявления |
–Одышка, непродуктивный кашель и хрипы. –Может протекать бессимптомно, требуя планового наблюдения за функцией легких для раннего выявления (исходный уровень до трансплантации, затем каждые 3 месяца в течение первого года после ТГСК и у пациентов, у которых развивается внелегочная хрРТПХ; тщательный мониторинг спирометрии после респираторной вирусной инфекции) [69] Более чем 90% пациентов с СОБ наблюдается более или менее выраженная хроническая РТПХ в других локализаций. |
| Диагностика |
Хроническая РТПХ в других локализаций + нарушение функции легких (NIH консенсус) [70,71]. –Впервые выявленный обструктивный дефект вентиляции с воздушной ловушкой (соотношение ОФВ1/ЖЕЛ < 0,7 или пятый процентиль от должного; ОФВ1 < 75% от должного со снижением на ≥10% от исходного уровня; остаточный объем > 120% от должного) без реакции на бронходилататоры. • Окончательное (не обязательно): гистологическое подтверждение с помощью видеоассистированной торакоскопической хирургии (обструктивный бронхиолит). |
| КТ легких Прогноз |
Требуется для исключения других причин (аномалии легочной паренхимы должны указывать либо на альтернативный, либо на дополнительный диагноз). Картина констриктивного бронхиолита с ослаблением мозаики, бронхоэктазов, утолщения бронхиальной стенки и задержки воздуха при экспираторной КТb Было обнаружено, что бронхиальные нарушения через 3 месяца после трансплантации являются предикторами СОБ. Oбщая выживаемость: 65–79% через 2 года и 74% через 5 лет в последних исследованиях При раннем начале после ТГСК прогноз хуже Смертность связана с респираторной недостаточностью, обострением респираторных заболеваний [72,73] |
b более чем у 30% пациентов при предтрансплантационной КТ легких выявляется воздушная ловушка, что ограничивает ценность экспираторной КТ грудной клетки в диагностике посттрансплантационного СОБ.
Последний консенсус NIH не требует биопсии легких; диагноз хронической легочной РТПХ ставится только на основании данных о функции легких. Таким образом, мы говорим о СОБ, а не о констриктивном бронхиолите, который требует гистологического подтверждения.
Лечение СОБ. Важно взвесить соотношение пользы и риска перед началом любого лечения, особенно кортикостероидов, которые, как известно, малоэффективны при СОБ. ОФВ1 чаще всего резко снижается, прежде чем стабилизироваться на более или менее выраженном уровне. Вторичное снижение функции легких с течением времени часто связано с инфекционными обострениями. В этом контексте обсуждается конечная точка оценки эффективности любого лечения СОБ: стабилизация или улучшение функции легких [72].
Только ингаляционный будесонид/формотерол продемонстрировал улучшение ОФВ1 при впервые выявленном умеренном или тяжелом СОБ в двойном слепом плацебо-контролируемом рандомизированном исследовании [74].
Лечение будесонид/формотеролом проводиться в дозе: 800 мкг будесонида + 24 мкг формотерола в фиксированной комбинации два раза в день. Далее через 1 месяц, проводиться оценка функции легких.
Ответ на лечение оценивается как положительный в случае: увеличение ОФВ1 по крайней мере на 200 мл и 12% по сравнению с исходными значениями. При достижении ответа на лечение, проводиться поддерживающая терапия: в дозе 400 мкг будесонида плюс 12 мкг формотерола 2 раза в день в течение еще 6 месяцев [74].
Диффузная интерстициальная болезнь легких (Диффузная ИБЛ).
В отличие от СОБ, интерстициальная болезнь легких может возникнуть в любое время после трансплантации.
Диагностика ИБЛ основывается на визуализации, показывающей наличие паренхиматозных затемнений в легких при отсутствии инфекции. На основании КТ легких ИБЛ можно разделить на три типа: организующаяся пневмония (OП, 37%), плевропаренхиматозный фиброэластоз (ППФЭ, 13%) и неопределенный (50%). Плевропаренхиматозный фиброэластоз возникает через несколько лет после трансплантации [73,75].
Клиническая картина может быть острой, подострой или хронической; в четверти случаев диагноз ставится в реанимации.
Специфическими факторами риска развития ИБЛ являются предшествующее облучение грудной клетки и отсутствие иммуносупрессивной терапии на момент возникновения ИБЛ [73].
В контексте ИБЛ полная оценка функции легких (включая объемы легких и диффузионная способность легких карбона моноксида) полезна для оценки тяжести дисфункции легких и мониторинга эффективности лечения. Сочетание ИБЛ и СОБ, встречается в 25% случаев ИБЛ.
Неприживление трансплантата, отторжение трансплантата, гипофункция трансплантанта [76].
Приживление (или гематологическое восстановление) включает: восстановление нейтрофилов, определяемое как первый из трех последовательных дней с абсолютным числом нейтрофилов ≥0,5 × 109/л, и восстановление тромбоцитов, определяемое как число тромбоцитов ≥20 × 109/л при отсутствии переливания тромбоцитов в течение 7 последовательных дней.
Полный донорский химеризм: ≥95% клеток имеют донорского происхождения.
Смешанный донорский химеризм - соотношение 5–94,9% донорских клеток в миелоидном и лимфоидном компартментах.
Таблица-20. Критерии неприживление трансплантата, отторжение трансплантата, гипофункция трансплантанта, EBMT 2024.
| Первичная несостоятельность трансплантата (Первичное неприживление) (Primary graft failure, GF) | АЧН <0,5 × 109/л к +30Д с сопутствующей панцитопенией и уровнем донорского химеризма <5%. |
| Вторичная недостаточность трансплантата (Secondary GF) | Ухудшение гемопоэтической функции (снижение уровня гемоглобина, тромбоцитов или нейтрофилов) после первоначального успешного приживления, требующее поддерживающей терапии (переливания крови/тромбоцитов, факторы роста). Подтверждается снижением донорского химеризма. |
| Неудовлетворительная функция трансплантата (Poor graft function) | Постоянная зависимость от переливаний крови/тромбоцитов или факторов роста при отсутствии других причин (рецидив заболевания, инфекции, токсичность препаратов). Донорский химеризм сохраняется в целевом диапазоне. |
| Отторжение трансплантата | Полная потеря донорских клеток опосредовано иммунным ответом реципиента против трансплантата. |
Частота отторжения трансплантата составляет <3–5% в при ауто- и алло-ТГСК, но увеличивается до 20% при гаплоидентичной ТГСК. Прогноз неблагоприятный, большинство пациентов умирают из-за инфекции или кровотечения. ОВ в течение 3–5 лет после постановки диагноза отторжения, в диапазоне 20–30%.
7. Использование Г-КСФ: связано со снижением риска первичного неприживления по сравнению с отсутствием факторов роста.
2. Г-КСФ для стимуляции нейтрофилов - 5 мкг/кг/сут х10 дней или до повышения уровня нейтрофилов ≥3 х109/л, +2 следующих дня.
3. Агонисты рецепторов тромбопоэтина (Элтромбопаг) - стандартная начальная доза — 50 мг/сутки перорально.
4. Инфузия CD34+ клеток (Boost инфузия). Четких рекомендаций когда ее следует проводить нет. Но, вероятно, через 2–3 месяца после неудачного применения первоначальных мер. С или без дополнительной иммуносупрессией: hАТG 20-30 мг/кг, 12-часовая инфузия, 1-2 введения или тимоглобулин 1,5-2,5мг/кг/сут 12-часовая инфузия, 1-2 введения [78].
Профилактическая инфузия донорских лимфоцитов (Pro-DLI) применяется у пациентов с высоким риском рецидива, но на стадии, когда нет никаких признаков основного заболевания. Обычно профилактическое введение лимфоцитов назначается, с +90 или +100 дня после трансплантации, при условии, что пациент не принимает иммуносупрессию и не имеет признаков РТПХ в течение 1 месяца. Дозы CD3+, используемые для первой инфузии, зависят от типа донора и времени и варьируются от 1×105/кг реципиента до 1 × 106/кг реципиента[79,81, 82].
Превентивная инфузия донорских лимфоцитов (Pre-DLI) проводиться в случае сохраняющейся минимальной резидуальной болезни (МРБ) или при первых признаках рецидива, таких как позитивность МРБ или снижения донорского химеризма. Для сохраняющейся MРБ используются те же начальные дозы клеток, что и для профилактической DLI, с последующими повторными DLI с интервалом в 4–12 недель, используя схему увеличения дозы и увеличивая дозировку клеток в пять-десять раз при каждой инфузии. В качестве альтернативного метода, используются в пять-десять раз более высокие начальные дозы клеток по сравнению с профилактикой. Всего проводиться от 3-х до 4-х DLI, а последующие инфузии в основном берутся из того же афереза, что и первый, но замораживаются в ранее запланированных дозировках. При возникновении РТПХ после DLI останавливается. При повторном появлении позитивного MРБ или смешанного химеризма, время проведения DLI зависит от возникновения этих обстоятельств [83,84].
При рецидиве обязательно сочетание DLI с химиотерапией, и дозы клеток, используемые в этой ситуации, обычно на порядок выше, чем при профилактической или превентивной DLI (1*107/кг). Повторные DLI могут рассматриваться после рецидивов, основываясь, например, на положительности MРБ через 6–8 недель после DLI [85,86].
Таблица-21. Сроки и дозировка профилактических и превентивных DLI.
| Первая доза | МРБ | Неродственный донор | Альтернативный донор, в т.ч гапло-донор | Количество DLI | |
| Pro-DLI |
ч/з 3 мес от ТГСК
|
1*105/кг | 1*105/кг | 1*105/кг | 1-3b |
| ч/з 6 меса от ТГСК (группа высокого риска) | 1*106/кг | 1*106/кг | 5*105/кг | ||
| Pre-DLI | 3 мес | 1-5*105/кг | 1*105/кг | 1*105/кг | 1-4с |
| 6 мес | 1-3*106/кг | 1*106/кг | 5*105/кг | ||
| Рецидив | После ХТ | 1*107/кг | 1*107/кг | 1*106/кг | 1-4d |
Диагностика, профилактика и лечение инфекционных осложнений
Профилактика и лечение цитомегаловирусной инфекции (ЦМВИ).
Пациентам алло-ТГСК рекомендовано еженедельно определять на наличие ЦМВ, в течение первых 3 месяцев после ТГСК методом ПЦР.
Пациенты с РТПХ и пациенты с подтвержденной репликацией ЦМВ должны находиться под более длительным наблюдением.
Если возможно, для пациента с сероотрицательным статусом ЦМВ следует выбрать донора, сероотрицательного по ЦМВ. Следует использовать безопасные по ЦМВ продукты крови. Все реципиенты, имеющие риск развития ЦМВ-инфекции после ТКМ (т.е. ЦМВ-серопозитивные реципиенты, ЦМВ-серонегативные реципиенты, получающие ГСК от ЦМВ-серопозитивных доноров), должны получать профилактическую терапию.
Лечение ЦМВИ. Различают реактивацию цитомегаловирусной инфекции и ЦМВ болезнь. К реактивации относят случаи выявления антигенов или нуклеиновых кислот цитомегаловируса (обычно методом количественной ПЦР) без клинических проявлений. Для диагностики ЦМВ болезни обязательно определение органного вовлечения методами, отличными от ПЦР.
Профилактика и лечение инфекции, вызванной вирусом Эпштейн-Барра.
Антивирусная профилактика ЭБВ не имеет доказанной эффективности. Все пациенты и доноры алло-ТГСК должны необходимо определять антитела к ЭБВ перед ТГСК. Поскольку ЭБВ-ПТЛЗ после трансплантации обычно имеет донорское происхождение и ЭБВ может передаваться с трансплантатом, риск ЭБВ-ПТЛЗ выше, если донор серопозитивен. Анти-CD20 моноклональные антитела используются для предотвращения реактивации вируса Эпштейна-Барр у пациентов из группы высокого риска.
Лечение ЭБВ: Большинство случаев реактивации ВЭБ протекают субклинически и не требуют терапии. Противовирусная терапия не эффективна. Превентивная терапия антителами к CD-20 является одним из вариантов снижения риска развития ЭБВ-ПТЛЗ.
Посттрансплантационное лимфопролиферативное заболевание (ПТЛЗ) [90] - Посттрансплантационные лимфопролиферативные заболевания (ПТЛЗ) представляют собой гетерогенную группу лимфопролиферативных заболеваний, которые возникают в условиях трансплантации и являются результатом неконтролируемой неопластической пролиферации лимфоидных или плазматических клеток в контексте внешней иммуносупрессии после трансплантации. ПТЛЗ в условиях ТГСК в основном вызваны латентным вирусом Эпштейна-Барр (ВЭБ, ВГЧ-4), принадлежащим к семейству герпесвирусов.
ВЭБ ассоциируется с развитием различных заболеваний, которые можно разделить на первичные синдромы, опухоли, связанные с ВЭБ, и посттрансплантационное заболевания, связанные с ВЭБ: ПТЛЗ и другие заболевания органов-мишеней (энцефалит/миелит, пневмонит, гепатит или гемофагоцитарный лимфогистиоцитоз).
Первичная ЭБВ инфекция - вирус ЭБ обнаруживается (нуклеиновая кислота или серологически) у человека, не инфицированного ранее ЭБВ.
Рецидивирующая ЭБВ инфекция (ранее: латентная инфекция) диагностируется путем обнаружения ДНК ВЭБ в крови у ранее инфицированного человека.
ПТЛЗ или посттрансплантационное заболевание органа-мишени, ассоциированное с ЭБВ, может быть диагностирован на вероятном или доказанном уровне:
Подтвержденное заболевание диагностируется в случае наличия симптомов и/или признаков со стороны пораженного органа вместе с обнаружением РНК, кодируемой ЭБВ, методом гибридизации in situ (EBER-ISH) в образце ткани (иммуногистохимия белков ЭБВ имеет хорошую специфичность, но более низкую чувствительность; эти белки по-разному экспрессируются в биоптатах ПТЛЗ).
В классификации ВОЗ лимфоидных злокачественных новообразований 2022 года ПТЛЗ больше не указаны и определяются как лимфопролиферативные заболевания, связанные с иммунодефицитом.
Клинические проявления. Лимфаденопатия и лихорадка являются наиболее распространенными симптомами. Редкие проявления ПТЛЗ, связанные с вирусом Эпштейна-Барр (ЭБВ), также называемые поражением органов-мишеней ЭБВ, включают энцефалит/миелит, пневмонит, гепатит и гемофагоцитарный лимфогистиоцитоз.
Диагностика ПТЛЗ.
• Мониторинг ЭБВ-ДНК-виремии: серийное количественное измерение вирусной нагрузки ЭБВ после трансплантации в настоящее время является методом выбора для раннего выявления и мониторинга прогрессирования и ответа на лечение ЭБВ-ПТЛЗ. У пациентов с отрицательным результатом на ДНК-ЭБВ частота скрининга должна составлять 1 раз в неделю, в то время как у пациентов с растущей ДНК-ЭБВ-виремией может быть рассмотрен более частый отбор проб, поскольку расчетное время удвоения для ЭБВ может быть всего 56ч.
• Скрининг следует продолжать не менее 4 месяцев у пациентов с высоким риском. Более длительный мониторинг рекомендуется у пациентов с плохим восстановлением Т-клеток, с тяжелой РТПХ, после гапло-ТГСК, с использованием деплеции Т-лимфоцитов, после кондиционирования с помощью ATG/алемтузумаба или у тех, у кого произошла ранняя реактивация ЭБВ.
• ПЭТ-визуализация: По определению, ПТЛЗ является неопластической лимфопролиферацией. Злокачественные лимфомы обладают способностью метаболизировать 18F-фтордезоксиглюкозу (ФДГ), которая используется при ПЭТ-визуализации. В большинстве случаев ПТЛЗ имеет ФДГ-зависимую гистологию; таким образом, ФДГ-ПЭТ является важным диагностическим инструментом для этого заболевания.
• Гистологическое исследование: Обнаружение вирусных антигенов или гибридизация in situ для транскриптов EBER (ЭБВ-кодируемой РНК).
Имеющиеся в настоящее время данные не позволяют определить однозначное пороговое значение ДНК-ЭБВ для диагностики ЭБВ-ПТЛЗ или других заболеваний органов-мишеней, вызванных ЭБВ, у пациентов после ТГСК.
Профилактика и Лечение ПТЛЗ. Терапевтические подходы, применяемые для профилактики и лечения ЭБВ-ПТЛЗ, включают введение ритуксимаба, снижение иммуносупрессии, DLI и химиотерапии, в то время как другие методы имеют лишь историческую ценность.
Превентивная терапия (упреждающая терапия) – это лекарственная или клеточная терапия (цитотоксические Т-лимфоциты ЭБВ), назначаемая пациенту с ДНК-ЭБВ-виремией с целью профилактики ЭБВ-ПТЛЗ.
Основной метод превентивной терапии включает: Ритуксимаб 375мг/м2/сут в/в 1 раз в неделю до отрицательного результата ДНК-ЭБВ виремии. Обычно достаточно 1–2 доз ритуксимаба [91].
Ритуксимаб следует сочетать со снижением иммуносупрессивной терапии, если это возможно. Противопоказанием для снижения ИСТ является тяжелая, неконтролируемая острая или хроническая РТПХ. Такой подход может иметь дополнительное преимущество от введения ритуксимаба, поскольку ритуксимаб, возможно, снижает риск острой/хронической РТПХ.
Лечение ВПГ. Ацикловир внутривенно 250 мг/м2 или 5 мг/кг каждые 8 часов в течение 7–10 дней является терапией выбора при тяжелом поражении слизистых оболочек или внутренних органов, вызванном вирусом простого герпеса.
Ацикловир от 200мг до 400мг*5р/день перорально, Валацикловир 500мг*2р/день или Фамцикловир 500мг*2р/день в течение 10 дней рассматриваются как альтернативы при менее серьезных проявлениях заболевания ВПГ.
При пневмонии, менингите и энцефалите, вызванных вирусом герпеса, рекомендуется внутривенное введение Ацикловира в дозе 500 мг/м2 или 10 мг/кг каждые 8 часов в течение не менее 14–21 дня.
Резистентность встречается примерно у 5–15% пациентов и обусловлена мутацией в тимидинкиназе ВПГ. Фоскарнет или цидофовир являются препаратами второй линии.
Профилактика, лечение гриппа.
Наиболее важной профилактической мерой является ежегодная вакцинация инактивированной вакциной против гриппа, желательно через 6 месяцев после ТГСК.
Стандартная терапия заключается в применении ингибиторов нейраминидазы, в основном осельтамивира 75мг*2р/сут в течении 5-10-дней или занамивира 5 мг*2 раза/сут. Суточная доза - 10-20 мг в течении 5-10-дней. Терапию следует назначать как можно скорее в ходе болезни: в течение первых 2-х суток с момента развития симптомов заболевания гриппом.
HBsAg (или ДНК-HBV)-позитивные доноры:
Донор HBsAg (+) передает HBV реципиенту в 22–44% случаев. Рекомендуется противовирусная терапия донора и, если возможно, противовирусная профилактика реципиента. Можно рассмотреть добавление иммуноглобулина против гепатита В. Предварительная вакцинация реципиента перед ТГСК, если это возможно, может снизить передачу HBV от донора. Если у донора обнаружен гепатит В (методом количественного анализа ПЦР – ДНК ВГВ), рекомендуется: Проведение противовирусного лечения донору, по крайней мере, в течение 4 недель, или до получения отрицательного анализа ПЦР.
HBsAg (или ДНК-HBV)-положительные доноры.
Донор HBsAg (+) передает HBV реципиенту в 22–44% случаев. Рекомендуется противовирусная терапия донора и, если возможно, противовирусная профилактика реципиента. Можно рассмотреть добавление иммуноглобулина против гепатита В. Предварительная вакцинация реципиента перед ТГСК, если это возможно, может снизить передачу HBV от донора.
Лечение вирусного гепатита В.
У кандидатов на ТГСК с хроническим гепатитом, подтвержденным биопсией или положительным результатом теста на HBsAg или высоким уровнем ДНК- HBV, процедуру трансплантации следует по возможности отложить, а противовирусную терапию следует проводить в течение 3–6 месяцев до подготовки.
Лечение пациентов с острым или хроническим гепатитом В должно проводиться совместно с гепатологом.
Инфекция, вызванная ВГС, не исключает ТСГК, но возможное наличие фиброза печени или наличие цирроза и гипертонии у пациентов с РНК ВГС (+) необходимо оценивать до трансплантации. Фиброз печени является фактором риска ВОБ и токсичности лекарственных препаратов. Тем не менее, инфекция ВГС не влияет на 10-летнюю выживаемость.
В случаях спонтанной или вызванной лечением элиминации вируса антитела к ВГС сохраняются пожизненно при отсутствии РНК ВГС. Пациенты, которые успешно элиминировали ВГС в прошлом, не подвержены риску реактивации при иммуносупрессивной терапии, но возможно повторное инфицирование ВГС.
У инфицированных пациентов рекомендуется проводить тщательный мониторинг показателей функции печени и РНК-ВГС.
Вакцины от вируса гепатита С не существует, поэтому профилактика заражения зависит от снижения риска контакта с вирусом в медицинских учреждениях и отказа от личных практик, связанных с риском передачи инфекции (небезопасный секс, инъекционные наркотики, татуировки, иглоукалывание и пирсинг и т.д).
У пациентов с положительным результатом теста на РНК ВГС и значительным фиброзом печени следует рассмотреть возможность применения ССО-щадящих схем лечения.
Наличие положительного результата теста на РНК ВГС у реципиента не является противопоказанием к трансплантации гемопоэтических стволовых клеток, однако следует рассмотреть возможность проведения противовирусной терапии, если это возможно, чтобы отложить трансплантацию гемопоэтических стволовых клеток и завершить курс лечения.
Если донор РНК-ВГС-положительный, инфекция будет передана реципиенту во всех случаях. РНК-ВГС-положительный донор может быть рассмотрен, если другие варианты донорства считаются неподходящими. В этом случае донор должен быть быстро обследован гепатологом, и следует рассмотреть лечение противовирусными препаратами прямого действия.
Лечение вирусного гепатита С.
Противовирусное лечение следует рассматривать для всех пациентов с положительным результатом анализа крови на РНК вируса гепатита С. ВГС можно лечить одновременно с химиотерапией, если лечение гематологического злокачественного заболевания является неотложным, после консультации с экспертом-гепатологом. Если возможно, все пациенты с положительным результатом анализа крови на РНК вируса гепатита С должны пройти лечение до трансплантации.
Профилактика грибковых инфекций [96].
Обновленные рекомендации ECIL относительно фармакологической противогрибковой профилактики зависят от фазы:
Во время (нейтропенической) фазы, предшествующей приживлению:
1. Флуконазол (400 мг/день) по-прежнему рекомендуется для центров с низкой частотой плесневых инфекций (т. е. ниже 5%). Оптимальная продолжительность профилактики флуконазолом специфически не определена.
2. Итраконазол 200 мг внутривенно каждые 24 часа, затем пероральный раствор 200 мг каждые 12 часов. Однако токсичность препарата и переносимость ограничивает его полезность в качестве профилактического средства.
3. Микафунгин 50 мг внутривенно каждые 24 часа.
4. Позаконазол во время фазы, предшествующей приживлению, препарату (пероральный раствор или гастрорезистентная таблетка 200 мг каждые 8 часов или внутривенно 300 мг каждые 24 часа после нагрузочной дозы 300 мг каждые 12 часов в первый день).
5. Вориконазол 400 мг/день после нагрузки не продемонстрировал разницы в выживаемости без грибков, общей выживаемости, частоте ИФД, инвазивного аспергиллеза, эмпирическом использовании противогрибковых препаратов и токсичности по сравнению с флуконазолом.
Профилактика пневмоцистной пневмонии.
1.Триметоприм/сульфаметоксазол 960мг два-три раза в неделю, является препаратом выбора для первичной профилактики пневмоцистной пневмонии. Назначается в течение всего периода риска до ≥6 месяцев и до тех пор, пока продолжается иммуносупрессия. Все другие препараты, включая аэрозольный или внутривенный пентамидин, атовакуон и дапсон, считаются альтернативами второй линии, когда триметоприм/сульфаметоксазол плохо переносится или противопоказан.
При данной стратегии руководство ECIL рекомендуют использовать Каспофунгин 50 мг/день, после 70 мг в первый день в качестве ударной дозы или липосомальный амфотерицин В дозе 3мг/кг.
Показания к превентивному назначению противогрибковых препаратов - наличие лихорадки и пневмонии, которая на фоне применения адекватных антибиотиков увеличивается в объеме, либо появляются новые очаги в легочной ткани, а исследования БАЛ оказываются неинформативны у больных с длительной нейтропенией (10 дней и более) или неконтролируемой РТПХ. В этих случаях нельзя исключить наличие инвазивного аспергиллеза, и препаратами выбора являются антимикотики, используемые для лечения инвазивного аспергиллеза — это изавуконазол или вориконазол, назначаемые в первые дни лечения внутривенно.
Гиалогифомикоз представляет собой гетерогенную группу грибов, включая (но не ограничиваясь) виды Fusarium, Scedosporium, Acremonium и Scopulariopsis. Клинические проявления варьируются от колонизации до локализованных инфекций и острого инвазивного и/или диссеминированного заболевания. Терапия первой линии фузариоза должна включать: Вориконазол и хирургическую обработку, где это возможно; (за исключением Lomentospora prolificans, ранее названного S. prolificans, для которого в настоящее время нет стандартного лечения) [103].
Диагностика и лечение инфекции кровотока [104,105].
Клинические проявления инфекционных осложнений у пациентов с нейтропенией и получающих иммуносупрессивную терапию, в особенности ГКС, могут быть стертыми. Лихорадка является наиболее частым системным проявлением инфекционных осложнений. Кроме того, при отсутствии нейтрофилов, которые отвечают за большинство клинических признаков или симптомов во время локализованной бактериальной инфекции (образование абсцесса, выраженные инфильтраты в легких, пиурия и т. д.), лихорадка часто является единственным симптомом, присутствующим и в этих случаях.
Однако, поскольку инфекция, вызванная грамотрицательными бактериями, может привести к быстрому ухудшению клинического состояния и смерти, эту возможность всегда следует учитывать и начинать соответствующую эмпирическую антибактериальную терапию, ожидая результатов, указывающих на истинную причину лихорадки или отсутствие инфекции кровотока.
Фебрильная нейтропения (ФН) – повышение температуры тела более 38 С продолжительностью более 1 часа у пациентов с абсолютным числом нейтрофилов менее 0,5х109/л или ожидаемым снижением в течение ближайших 48 часов. Фебрильная нейтропения является синонимом нейтропенического сепсиса. У пациентов пожилого возраста и пациентов, получающих ГКС септическая инфекция может протекать с нормальной температурой тела или субфебрилитетом.
Необходимо исключить связь повышения температуры с неинфекционными факторами (трансфузия компонентов крови, введение колониестимулирующих факторов).
Повышение маркеров воспаления (СРБ, прокальцитонин) без инфекционного очага, нейтропения при сохранении нормотермии не являются показанием для назначения антибактериальной терапии.
СРБ, прокальцитонин неспецифичны и могут повышаться как при инфекционных, так и при неинфекционных осложнениях после ТКМ. При фебрильной нейтропении в раннюю фазу после ТКМ всем пациентам должен быть незамедлительно назначен бета-лактамный антибиотик с антисинегнойной активностью.
Инициальный режим антибактериальной терапии зависит от тяжести состояния пациента (стратегия эскалации или деэскалации) и локальных микробиологических данных по наиболее распространенным патогенам и их чувствительности.
В отличие от деэскалации при использовании стратегии эскалации в спектр назначаемых антибактериальных препаратов не входят резистентные грамположительные микроорганизмы (MRSA, VRE), не проводится комбинации с аминогликозидами или фторхинолонами и используются β-лактамы, отличные от карбапенемов.
а. Колонизации резистентным бактериальным штаммом.
b. Предшествующей инфекции, вызванной резистентным бактериальным штаммом.
c. Местной эпидемиологии с высокой частотой инфекций, вызванных резистентными патогенами.
d. Длительное пребывание в отделении интенсивной терапии (ОИТ).
e. Использование антибиотиков широкого спектра действия в анамнезе.
f. Наличие хронических заболеваний (Пациенты с хроническими заболеваниями, такими как хроническая обструктивная болезнь легких (ХОБЛ) или хроническая почечная недостаточность, могут быть более подвержены резистентным инфекциям).
В зависимости от факторов риска и других признаков проводится выбор стратегии инициального режима антибактериальной терапии [104, 106, 107].
Таблица-22. Стратегия инициальной антибактериальной терапии
| Стратегия | Эскалация | Дэскалация |
| Определение | Эмперическое лечение активное в отношении восприимчивых Enterobacteriaceae and P. aeruginosa |
Начинать с эмпирического охвата бактерий с множественной лекарственной устойчивостью, особенно грамотрицательной флоры, который позднее (через 72–96 ч) сокращается (деэскалируется), если патоген с множественной лекарственной устойчивостью не изолирован, т. е: • Выделен восприимчивый штамм • Нет микробиологических результатов |
| Обычно используемые антибиотики: | Монотерапия антисинегнойными цефалоспоринами (цефепим, цефтазидим) или пиперациллином-тазобактамом |
• Карбапенемы или новая комбинация β-лактама/ингибитора β-лактама (например, цефтолозана/тазобактам или Цефтазидима и ингибитор b-лактамазы) для охвата продуцентов ESBL и некоторых резистентных штаммов (MRGN). Например: • β-лактамные АБ + аминогликозиды • β-лактамные АБ + покрытие резистентных грамположительных микроорганизмов Оптимальный выбор будет зависеть от колонизирующего штамма MDR или местной эпидемиологии. |
Модификация стартового режима терапии проводится через 24-72 часа после начала лечения, в зависимости от полученных микробиологических данных и состояния пациента:
При выявлении резистентных грамотрицательных бактерий [108,109]:
Смена антибактериальной терапии:
Де-эскалация терапии: Если состояние пациента улучшается, и результаты микробиологических тестов указывают на чувствительность к более узкому спектру антибиотиков, терапия должна быть де-эскалирована. Это означает переход от комбинации антибиотиков к монотерапии или использование антибиотиков с более узким спектром действия. Пример де-эскалации: Переход с комбинации меропенема и амикацина на монотерапию цефепимом (2 г каждые 8 часов), если выявлен чувствительный штамм Enterobacteriaceae.
Диагностика и лечение реакции трансплантат против хозяина (РТПХ).
Таблица-23. Современная классификация острой и хронической РТПХ. EBMT 2024.
| Классификация | Дни после ТГСК | Черты оРТПХ | Черты хрРТПХ |
| Острая РТПХ | |||
| – Классическая | <100 дней | Да | Нет |
| – Персиситирующая, реккурентная или позднее начало | >100 дней | Да | Нет |
| Хроническая РТПХ | |||
| – Классическая | Нет ограничений по времени | Нет | Да |
| – Overlap синдром | Нет ограничений по времени | Да | Да |
Рисунок-1. Органы мишени при острой РТПХ.
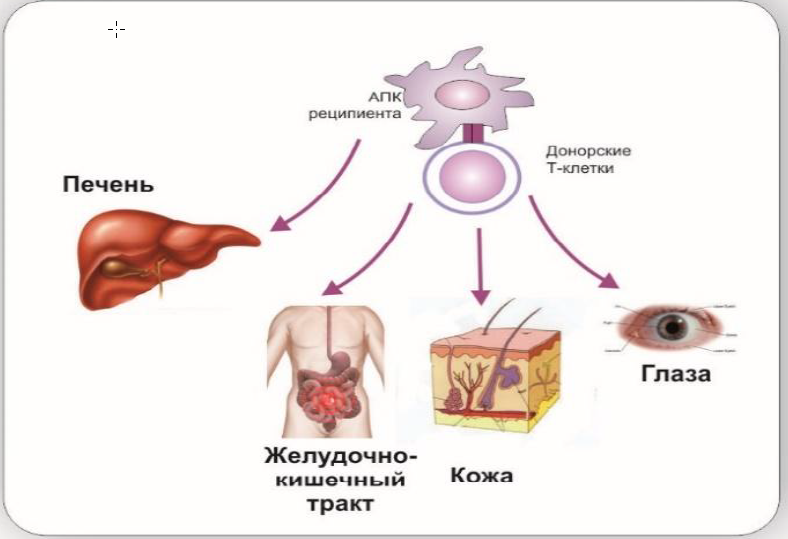
Grade — степень тяжести РТПХ
| Стадирование острой РТПХ (according to Harris et al. 2016) [113] | ||||
| Стадия (stage)* | Кожа (только активная эритема) | Печень (билирубин) | Верхние отделы ЖКТ | Нижние отделы ЖКТ (количество стула/день) |
| 0 | Отсутствие активной (эритематозной) сыпи РТПХ | <35 мкмоль/л | Отсутствие или периодическая тошнота, рвота или анорексия | <500 мл/день или <3 эпизодов/день |
| 1 |
Макулопапулезная сыпь <25% поверхности тела
|
35-52,9 мкмоль/л | Постоянная тошнота, рвота или анорексия | 500–999 мл/день или 3–4 эпизода/день |
| 2 |
Макулопапулезная сыпь 25–50% поверхности тела
|
53-102,5 мкмоль/л | - | 1000–1500 мл/день или 5–7 эпизода/день |
| 3 | Макулопапулезная сыпь >50% поверхности тела | 103–257 мкмоль/л | - | >1500 мл/день или >7 эпизодов/день |
| 4 | Генерализованная эритродерма (>50% поверхности тела) плюс буллезные образования и десквамация >5% поверхности тела | >257 мкмоль/л | - |
Сильная боль в животе с кишечной непроходимостью или без нее, или обильно кровянистый стул (независимо от объема стула) |
Таблица-25. Общая клиническая классификация степени тяжести (на основе наиболее тяжелого поражения органов-мишеней) острой РТПХ
|
Grade
|
Описание |
| 0 | Нет стадии 1–4 любого органа |
| I | Кожа стадии 1–2 без поражения печени, верхнего или нижнего отдела ЖКТ. |
| II | Сыпь стадии 3 и/или печень стадии 1 и/или верхний отдел ЖКТ стадии 1 и/или нижний отдел ЖКТ стадии 1. |
| III | Печень стадии 2–3 и/или нижний отдел ЖКТ стадии 2–3, с кожей стадии 0–3 и/или верхний отдел ЖКТ стадии 0–1. |
| IV | Кожа стадии 4, печень или нижний отдел ЖКТ стадии 4, с верхним отделом ЖКТ стадии 0–1. |
Таблица-26. Клинические проявления острой РТПХ
| Орган | Клиническая манифестация |
| Кожа |
Эритематозная макулопапулезная сыпь, часто изначально поражающая ладони и подошвы.
Может прогрессировать, охватывая всю поверхность тела и с зудом и/или болезненностью. В тяжелых случаях могут образовываться буллы, приводящие к десквамации.
|
| Печень |
Холестаз с выраженной желтухой или без нее Сравнительно преобладает нарушение холестатических ферментов, чем трансаминаз. |
| ЖКТ |
Верхние отделы: анорексия, тошнота и рвота. Нижние отделы: диарея, обычно зеленая и водянистая; в тяжелых случаях диарея содержит свежую кровь и слизистую и сопровождается спазмами в животе и иногда паралитической непроходимостью кишечника. |
Таблица-27. Гистопатологические данные острой РТПХ
| Орган | Гистопатологические признаки |
| Кожа |
Диагностическим признаком является лихеноидная инфильтрация верхней дермы и нижнего эпидермиса с вакуолизацией, дистрофией и отдельными некрозами клеток базального слоя эпидермиса. Grade I: вакуолизация эпидермальных базальных клеток. Grade II: наличие отдельных некротических кератиноцитов. Grade III: сливающиеся области некроза кератиноцитов, образующие буллы. Grade IV: слущивание эпидермиса. |
| Печень |
Наиболее постоянным гистологическим признаком является повреждение небольших желчных протоков, которое обычно наблюдается в сочетании с холестазом и редко встречается при других осложнениях ТГСК. Клетки желчного эпителия имеют увеличенные гиперхромные ядра или маленькие пикнотические ядра и вакуолизированную цитоплазму. Перипортальный и среднезональный гепатоцеллюлярный некроз и минимальные лимфоцитарные инфильтраты в портальном тракте Хотя существует гистологическая классификация гистологии печени, она не имеет доказанной прогностической ценности. |
| ЖКТ |
«Взрывающиеся крипты», внутри которых происходит некроз отдельных эпителиальных клеток на периферии крипт, в результате чего остаются фрагменты ядерного и цитоплазматического мусора Grade I: некроз отдельных клеток. Grade II: потеря отдельных крипт. Grade III: потеря двух или более смежных крипт с изъязвлением. Grade IV: оголение эпителия. |
Таблица-28. Алгоритм лечения острой РТПХ [113, 114, 115,117].
|
Орган/Система
|
Препараты первой линии | Доза и кратность | Критерии оценки ответа | Критерии смены терапии | Критерии отмены терапии |
| Кожа (легкая форма, Grade I) | Топические кортикостероиды (бетаметазон, мометазон, клобетазол). | Наносить тонким слоем 1–2 раза в день. | Уменьшение эритемы, зуда, шелушения. | Отсутствие улучшения через 7–10 дней или прогрессирование симптомов. | Полное исчезновение симптомов. |
| Топические ингибиторы кальциневрина(такролимус мазь 0,03% или 0,1%, пимекролимус крем). | Наносить тонким слоем 2 раза в день. | Уменьшение воспаления и зуда. | Отсутствие улучшения через 2–4 недели. | Полное исчезновение симптомов. | |
| Кожа (умеренная и тяжелая форма, Grade II–IV) | Системные кортикостероиды (метилпреднизолон 2 мг/кг/день). | Внутривенно или перорально в два приема. | Уменьшение эритемы, зуда, шелушения. | Отсутствие улучшения через 3–5 дней или прогрессирование симптомов. | Полное исчезновение симптомов. |
| Комбинация с ингибиторами кальциневрина (циклоспорин 3–5 мг/кг/день или такролимус 0,03–0,05 мг/кг/день). | в 2 приема п/о или в/в суточно. | Улучшение симптомов кожи. | Отсутствие улучшения через 7–10 дней. | Полное исчезновение симптомов. | |
| Комбинация с микофенолата мофетилом (MMF) (15–30 мг/кг/день). | в 2-3 приема п/о. | Улучшение симптомов кожи. | Отсутствие улучшения через 7–10 дней. | Полное исчезновение симптомов. | |
| Слизистые | Топические кортикостероиды (гидрокортизоновая мазь 1%, бетаметазон гель). | Наносить на слизистые 2–3 раза в день. | Уменьшение боли, заживление язв. | Отсутствие улучшения через 7–10 дней. | Полное заживление слизистых. |
| Топические анестетики (лидокаин гель 2%, бензокаин спрей). | Наносить по мере необходимости, но не чаще 3–4 раз в день. | Уменьшение боли. | Отсутствие улучшения через 3–5 дней. | Полное исчезновение боли. | |
| Топические антисептики (хлоргексидин 0,05%, мирамистин). | Полоскать или наносить 2–3 раза в день. | Профилактика вторичной инфекции. | Появление признаков инфекции (нагноение, лихорадка). | Полное заживление слизистых. | |
| Печень | Системные кортикостероиды (метилпреднизолон 2мг/кг/день). | Внутривенно или перорально в два приема | Снижение уровня билирубина, улучшение функции печени. | Отсутствие улучшения через 3–5 дней или прогрессирование симптомов. | Нормализация уровня билирубина и функции печени. |
| Комбинация с ингибиторами кальциневрина(циклоспорин 3–5 мг/кг/день или такролимус 0,03–0,05 мг/кг/день). | 2 приема п/о или в/в суточно. | Улучшение функции печени. | Отсутствие улучшения через 7–10 дней. | Нормализация уровня билирубина и функции печени. | |
| ЖКТ | Системные кортикостероиды (метилпреднизолон 2мг/кг/день). | Внутривенно или перорально в два приема. | Уменьшение диареи, болей в животе, улучшение аппетита. | Отсутствие улучшения через 3–5 дней или прогрессирование симптомов. | Полное исчезновение симптомов. |
| Будесонид (9 мг/день перорально). | в 3 приема в форме капсул с замедленным высвобождением | Уменьшение диареи, болей в животе. | Отсутствие улучшения через 2–4 недели. | Полное исчезновение симптомов. | |
| Резистентные формы (все системы) | Руксолитиниб (10 мг*2 раза в день). | Перорально | Улучшение симптомов кожи, печени, ЖКТ. | Отсутствие ответа через 28 дней. | Достижение полного ответа. |
| Экстракорпоральная фотоферез | 2 раза в неделю. | Улучшение симптомов кожи, печени, ЖКТ. | Отсутствие улучшения через 4–6 недель. | Достижение контроля симптомов. | |
| Мезенхимальные стромальные клетки | 1–2 млн клеток/кг внутривенно 1–2 дозы с интервалом в 1 неделю. | Улучшение симптомов кожи, печени, ЖКТ. | Отсутствие ответа через 4 недели. | Достижение контроля симптомов. |
Трансплантация фекальной аллогенной микробиоты (ФМТ) у 81 пациента с СР острой РТПХ желудочно-кишечного тракта привело к общей частоте ответа 56%, включая 37% ПО в среднем после трех доз, и привело к увеличению ОВ у пациентов, ответивших на лечение.
Хроническая РТПХ (хрРТПХ) является наиболее значимой причиной поздней заболеваемости и последующей смертности (приблизительно 25%) после алло-ТГСК не связанной с рецидивом.
Патофизиология хрРТПХ отличается от оРТПХ и в основном характеризуется нарушением механизмов иммунной толерантности, влияющих на врожденный и адаптивный иммунитет. Как аутореактивные, так и аллореактивные донорские Т- и В-клетки играют роль [117].
Другие патофизиологические факторы это косвенные представления аллоантигенов через антиген-презентирующие донорские клетки и механизмы хронического воспаления с последующим образованием рубцов и фиброза. Одним из важных аспектов патофизиологии РТПХ является изменчивость восстановления иммунитета, которая связана с возрастом и зависит от функции тимуса и гормонов [118].
Рисунок-3. Органы мишени при хронической РТПХ.
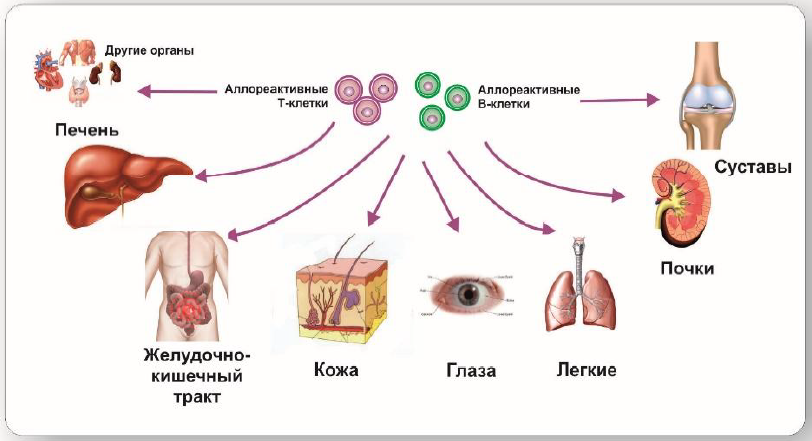
Клинические проявления хронической РТПХ.
Хроническая РТПХ обычно начинается между 3 месяца – 2 годами после ТГСК, но возможно и более раннее начало (не менее 1 месяца после трансплантации). В то время как вовлечение систем органов, указанных ниже, рассматривается как классическая хроническая РТПХ, определяемая NIH, почти любой другой орган может быть потенциально поражен атипичными формами хронической РТПХ или атипичные проявления могут вовлекать органы, которые в противном случае рассматриваются как классические проявления хронической РТПХ (рестриктивные формы легочной хронической РТПХ). Наиболее частыми проявлениями являются иммуноопосредованные цитопении, полисерозит, почечные проявления, вовлечение центральной и периферической нервной системы, ревматологические, включая миозит, и аутоиммунный тиреоидит [119].
Таблица-29. Симптомы хронической РТПХ (NIH Consensus Conference, 2014)
| Орган или локализация | Диагностические | Возможные | Не диагностические | Общие с острой РТПХ |
| Кожа | Пойкилодерма Лихеноидные изменения Локализованная склеродерма Склеротический лихен | Депигментация Паппулосквамозные очаги | Потливость Ихтиоз Фолликулярный кератоз Гипопигментация Гиперпигментация |
Эритема Макулопапуллезная сыпь Зуд |
| Ногти | Дистрофия Продольная исчерченность Продольная исчерченность, слоистость, повышенная ломкость, Онихолиз Pterygium unguis Потеря ногтя (обычно симметричная, затрагивающая большинство ногтей) | |||
| Волосы на голове и теле | Появление очагов рубцовой и нерубцовой аллопеции (после восстановления волосистого покрова, нарушенного химиотерапией) Выпадение волос на теле | Истончение, тусклость, повышенная жесткость волос и гнездная алопеция (не объяснимые эндокринными или другими причинами) Преждевременная седина | ||
| Слизистая ротовой полости | Лихеноидные изменения |
Ксеростомия Мукоцеле Атрофия слизистой Изъязвление псевдомембраны |
Гингивит Мукозит Эритема Боль |
|
| Глаза | - |
Появление сухости, ощущения песка в глазах, болезненности СКК Рубцовый конъюнктивит Сливные поля перфорирующей кератопатии |
Фотофобия Периорбитальная гиперпигментация Блефарит (эритема или отечность) |
- |
|
Половые органы Женщины Мужчины |
Лихеноидные изменения Склеротический лихен |
Эрозии Трещины |
- | - |
| Атрофический вагинит или слипание половых губ и клитора | Язвы | - | - | |
| Фимоз, рубцовые изменения или стеноз уретры, мочеискускательного отверстия | - | - | - | |
| ЖКТ | Пищеводная мембрана Стриктуры или стеноз в верхней или средней трети пищевода | - | Недостаточность экзокринной функции поджелудочной железы |
Анорексия Тошнота Рвота Диарея Потеря веса Задержка роста у детей Общий билирубин, ЩФ более 2х норм АЛТ более 2х норм |
| Легкие | Облитерирующий бронхиолит, диагностированный с использованием биопсии Синдром облитерирующего бронхиолита (может быть связан с РТПХ если имеются признаки хронической РТПХ других органов) | Эмфизема и бронхоэктазы по данным КТ грудного сегмента | Криптогенная организующаяся пневмония \Рестриктивное заболевание легких | - |
| Мышцы, фасции, суставы |
Фасциит Вторичные контрактуры или тугоподвижность |
Миозит или полимиозит |
Отек Мышечные судороги Артралгии или артриты |
- |
| Кровь и иммунная система | - | - |
Тромбоцитопения Эозинофилия Лимфопения Гипо- или гипергаммаглобулинемия Аутоантитела (ИТП, аутоиммунная гемолитическая анемия) Феномен Рейно Перикардиальный или плевральный выпот Нефротический синдром Myasteniagravis Нарушения проводимости сердца или кардиомиопатия |
- |
Диагностика хронической РТПХ.
ХрРТПХ диагностируется на основе симптомов хрРТПХ восьми органов, лабораторных показателей (для печеночных проявлений) и функционального теста легких. Каждый орган оценивается по шкале от 0 до 3. Общая тяжесть хрРТПХ классифицируется как легкая, умеренная или тяжелая на основе этой органоспецифической градации (количество органов и тяжесть). Общая тяжесть рассчитывается на основе количества пораженных органов и тяжести их поражения.
Таблица-30. Общая тяжесть хронической РТПХ, EBMT 2024
|
Общая тяжесть
|
Легкая | Умеренная | Тяжелая |
| Количество вовлеченных органов | 1-2 |
>3
|
>3 |
| Тяжесть вовлеченных органов | Легкая (за исключением легких) | Легкая-умеренная (только легкие – легкой степени) | Тяжелая (умеренное или тяжелое поражение легких) |
Таблица-31. Хроническая РТПХ, степени органного поражения (NIH Consensus Conference, 2014)
| Симптомы | Баллы | |||
| Общее состояние по ECOG | 0 баллов | 1 балл | 2 балла | 3-4 балла |
|
Кожа Учитываемые признаки хр.РТПХ: Макулопапуллезная сыпь/эритема Лихеноидноподобные изменения Признаки склероза Папуллосквамозные очаги или ихтиоз фолликулярный кератоз |
Нет вовлечения | 1-18% поверхности тела | 19-50% поверхности тела | >50% поверхности тела |
|
Гиперпигментация Гипопигментация Пойкилодерма Тяжелый или генерализованный зуд Поражение волос Поражение ногтей |
Нет признаков склероза | Небольшие признаки склеродермии, нет пахидермы (кожа собирается в складку) | Выраженные признаки склеродермии Пахидерма (не собирается в складку) Неподвижная Ульцерация | |
|
Слизистая ротовой полости Лихеноидноподобные изменения присутствуют: ДА НЕТ |
Нет симптомов | Небольшие симптомы, но без значимого ограничения приема пищи и жидкости | Умеренные симптомы с частичным ограничением приема пищи и жидкости | Тяжелые симптомы и выраженные признаки заболевания при объективном осмотре с ограничением приема пищи и жидкости |
|
Глаза Сухой кератоконъюктивит (СКК), подтверждённый офтальмологом: ДА НЕТ Не обследовался |
Нет симптомов | Легкие проявления симптомов «сухого глаза» не нарушающие повседневную активность (использование глазных капель £3 раз в день) | Умеренные проявления симптомов «сухого глаза» частично нарушающие повседневную активность (использование глазных капель >3 раз в день или использование силиконовых обтураторов) | Тяжелые симптомы «сухого глаза» со значимым нарушением повседневной активности (специальные очки для уменьшения боли) ИЛИ пациент не может работать из-за глазных симптомов ИЛИ потеря зрения в связи с СКК |
|
ЖКТ Феномен «пищеводных мембран» / проксимальная стриктура или кольцо Дисфагия Анорексия Тошнота Рвота Диарея Потеря веса³ 5% Отсутствие прибавки в весе |
Нет симптомов | Симптомы без существенной потери веса (<5%) | Симптомы связанные с незначительной или умеренной потерей веса (5-15%) ИЛИ умеренная диарея без значимого нарушения повседневной активности | Симптомы, ассоциируются с значимой потерей массы тела (более 15%), необходима нутритивная поддержка ИЛИ дилатация пищевода ИЛИ тяжелая диарея со значимым нарушением повседневной активности |
| Печень | Нормальный общий билирубин или АЛТ и ЩФ менее 3х норм | Нормальный уровень общего билирубина с АЛТ 3-5 норм или ЩФ³ 3 норм | Повышение общего билирубина, но менее 51,3 мкмоль/л ИЛИ АЛТ > 5 норм | Повышение общего билирубина более 51,3 мкмоль/л |
| Легкие | ОФВ1³80% | ОФВ1 60-79% | ОФВ1 40-59% | ОФВ1 39% |
|
Суставы и фасции P-ROM баллы: Плечевые суставы (1-7):______ Локтевые суставы (1-7):_____ Суставы запястья/пальцев (1-7): ________ Коленные суставы (1-7): ______ |
Нет симптомов | Умеренное напряжение и подвижности в конечностях И отсутствие ограничения повседневной активности | Напряжение в конечностях ИЛИ суставные контрактуры, фасциит, умеренное снижение объема движений И незначительное или умеренное ограничение повседневной активности | Контрактуры с значимым ограничением объема движений И значимое ограничение повседневной активности (неспособность одеть обувь, застегнуть пуговицы и т.п.) |
|
Половая система Не исследовалась Сексуальная активность Есть Нет |
Нет симптомов | Незначительные симптомы, возможен дискомфорт при гинекологическом осмотре | Умеренные симптомы и возможны симптомы и дискомфорт при гинекологическом осмотре | Выраженные симптомы |
| Прочие изменения, связанные с хронической РТПХ (баллы от 0 до 3) | |||||
| Симптом/ осложнение | Баллы | Симптом/ осложнение | Баллы | Симптом/ осложнение | Баллы |
| Асцит (серозит) | Myasthenia gravis | Эозинофилия более 500 кл/мкл | |||
| Перикардиальный выпот | Периферическая нейтропатия | Тромбоцитопения менее 100 тыс/мкл | |||
| Плевральный выпот | Полимиозит | Другие симптомы | |||
| Нефротический синдром | Потеря более 5% веса без ЖКТ симптомов | ||||
Лечение Хронической РТПХ.
Таблица-32. Терапия первой линии хронической РТПХ [118,120,121]
| Лекарство | Рекомендации | Побочные эффекты >25% пациентов | Частота ответа | Комментарии | |
| Оценка | Доказанность | ||||
| ГКС | А | I | Остеопороз, остеонекроз, СД | ~30 до 50% ПО | Основной препарат; стратегии по сокращению его использования из-за ПЭ очень важны |
| Ингибиторы кальциневрина+стероиды | C-1 | II | Нефротокчичность, гипертензия | ~30 до 50% RC | Снижает использование стероидов, снижает частоту возникновения остеонекроза |
| Ритуксимаб+стероиды/ингибиторы кальциневрина | C-1 | III-1 | Высокий риск поздних инфекционных осложнений | ~75% | Рандомизированных исследований мало |
| Сиролимус+ГКС | C-1 | II | Гиперхолестериенмия, цитопения | ~50% | Одинаковая эффективность по сравнению с комбинацией с ингибиторами кальциневрина |
| MMF + ингибиторы кальциневрина/ГКС | D | II | Побочные эффекты со стороны ЖКТ, инфекция |
Не повышает эффективность по сравнению с ингибиторами кальциневрина и ГКС, повышает риск рецидива |
|
Поскольку легкая форма хрРТПХ не нарушает функции органов, следует рассмотреть возможность использования топической ИС (топические стероиды, топические ингибиторы кальциневрина или фототерапия). Если это невозможно, рекомендуется лечение ГКС в начальной дозе 0,5–1 мг/кг массы тела/день. Топическая ИСТ может использоваться в дополнение к системной ИСТ для повышения эффективности или для снижения системной ИСТ, но не имеет системной эффективности.
При умеренной или тяжелой форме хрРТПХ следует использовать системное лечение ГКС в начальной дозе 1 мг/кг массы тела в день. В отдельных случаях можно использовать более низкие дозы 0,5–1 мг/кг. Сочетание стероидов с ингибиторами кальциневрина (CsA или TAC) особенно заслуживает рассмотрения при тяжелой форме хрРТПХ. Ритуксимаб в первой линии лечения хрРТПХ в сочетании со стероидами и ингибиторами кальциневрина, согласно исследованиям демонстрирует повышенную частоту ответа так же как и повышенный риск поздних инфекционных осложнений и замедленного восстановления B-клеток. Сиролимус также можно комбинировать с преднизоном, демонстрируя идентичную частоту ответа по сравнению с ингибиторами кальциневрина.
Если симптомы прогрессируют в течение первых 4 недель терапии 1-й линии или улучшения симптомов не происходит в течение 8–12 недель, следует начать терапию второй линии.
Таблица-33. Вторая линия терапии хронической РТПХ [122,123]
| Препарат | Рекомендации | Частота ответа | Побочные эффекты у >25% пациентов | Комментарии | |
| Степень | Доказательность | ||||
| Стероиды | В | III-1 | остепороз, остеонекроз, диабет | Основной препарат; стратегии по сокращению его применения очень важны ввиду побочных эффектов препарата | |
| Руксолитиниб | C-1 | II | ~50% | Инфекция, цитопения | Одобрено FDA и EMA во второй линии |
| Ибрутиниб | C-1 | III-1 | ~50 до 75% ~16 до 25% ПО | Синяки, инфекция, диарея | Одобрено FDA во второй линии |
| Фотоферез | C-1 | II | ~60 до 70% ~30% ПО | Инфекции ЦВК | Требуется венозный доступ, стероидсберегающий эффект, хорошая переносимость |
| Ингибиторы- mTOR(сиролимус, эверолимус) | C-1 | III-1 |
~60% ~20% ПО |
ТМА, гиперлипидемия, цитопения | Повышенный риск ТМА при сочетании с ингибиторами кальциневрина |
| MMF | C-1 | III-1 |
~50% ~10% ПО |
Побочные эффекты со стороны ЖКТ, инфекция (вирусные) и высокий риск рецидива | Стероидсберегающая активность |
| Ингибиторы кальциневрина | C-1 | III-1 | n.a. | Нефротоксичность, гипертензия | Снижает использование стероидов, требуется регулярный контроль уровня в крови |
| Белумосудил (ингибитор ROCK2) | C-2 | III-1 | ~75% | Гепатотоксичность | Одобрено FDA в третий линии |
| MTX | C-2 | III-1 |
~50% ~10 to 20% ПО |
Цитопения, мукозит | Наилучшие результаты при слизисто-кожной хронической РТПХ, снижает использование стероидов, противопоказан при наличии плеврального выпота или асцита |
| Иксазомиб | C-2 | III-2 | ~40% | Тошнота, инфекция, цитопения | Оценено при продвинутых стадиях хр.РТПХ |
| ВД- стероидов | C-2 | III-2 | 50–75% (только ЧО) | Инфекция | Быстрый контроль хронической РТПХ |
| Тотальное облучение л/у | C-2 | III-2 |
~50% ~25% ПО |
Цитопения | Лучшие результаты при фасциите и кожно-слизистой хронической РТПХ |
| Абатацепт | C-2 | III-1 | ~45% | Инфекция дыхательных путей | Наилучшие результаты при легочной и слизисто-кожной хронической РТПХ |
| Гидроксихлорахин | C-2 | III-2 |
~25% ~10% ПО |
Побочные эффекты со стороны ЖКТ | Лучшие результаты при кожно-слизистой и печеночной РТПХ |
| Ритуксимаб | C-2 | II |
~50% ~10% ПО |
Риск инфекция | Эффективен при проявлениях, связанных с аутоантителами и склеродермоидным поражением кожи |
| Иматиниб | C-2 | III-1 |
~50% ~20% ПО |
Задержка жидкости | Эффективность продемонстрирована в основном при склеродермоидной хронической РТПХ и облитерирующем бронхиолите. |
| Помалидомид | C-2 | III-1 | ~60% | Цитопения | Оценено только при поздней стадии хронической РТПХ |
| Ретиноиды | C-3 | III-2 | ~60% (только ЧО) | Кожная токсичность, гиперлипидемия | Эффективен при склеродермоидном поражении кожи |
| Тоцилозумаб | C-3 | III-2 | цитопения, отсутствие реакции острой фазы | Эффективен при склерозировании поражений кожи | |
| МСК | C-4 | III-2 | ~50% | нет | Требуется повторные введения |
| Этанерцепт | C-4 | III-3 | n.a. | Риск инфекций |
Может использоваться для лечения смешанной острой и хронической РТПХ или легочных или желудочно-кишечных проявлений хронической РТПХ |
В целом, не следует комбинировать более трех ИС препаратов, поскольку комбинации большего количества препаратов часто не приводят к повышению эффективности, но приводят к значительному повышению риска побочных эффектов и инфекций. Из-за существенной токсичности длительного лечения стероидами стратегии снижения дозы очень важны. Поскольку пока нет предикторов ответа на один агент у отдельных пациентов, выбор агента зависит в основном от профилей побочных эффектов, доступности, включая статус одобрения, доказательств, биологии заболевания, истории болезни пациентов. Частота ответа на конкретные агенты колеблется от 20 до 70%.
Схема приема Руксолитиниба при хронической РТПХ.
Препарат назначается в дозе 10мг*2р/сут внутрь. Первичная оценка ответа на 28 сутки. Лечение продолжительностью минимум 6 циклов (28-и дневных) или до неприемлемой токсичности или до прогрессии хронической РТПХ.
Следует приложить все усилия для использования минимальной дозы кортикостероидов, достаточной для контроля проявлений хронической РТПХ.
Рекомендуется постепенное снижение дозы кортикостероидов через 2 недели после достижения полного или частичного ответа. Если во время постепенного снижения дозы произойдет обострение, лечение следует продолжать не менее 3 месяцев, прежде чем пытаться возобновить постепенное снижение дозы.
После отмены системных кортикостероидов и документально подтвержденной полной или частичной регрессии, начиная с 1-го дня 7-го цикла, допускается снижение дозы на 25% в месяц.
Снижение дозы Руксолитиниба позволено только после отмены системных кортикостероидов и документально подтвержденной полной или частичной ремиссии. Начиная с 1-го дня 7-го цикла, можно начать снижение дозы на 50% каждые 2 месяца (56 дней). Начальное снижение дозы составляет 5 мг перорально 2 раза в день. При достижении стойкого ответа на хроническую РТПХ (т.е. без ухудшения признаков и симптомов хронической РТПХ) пациенту дополнительно снижают дозу на 50% до 5 мг перорально 1 раз в день в течение еще 2 месяцев (56 дней) перед отменой.
Прием препаратов, показавших свою неэффективность, следует прекратить.
Основные индикаторы эффективности:
Алгоритм наблюдения за химеризмом после АллоТГСК
| Цель | Пациенты | Клеточные популяции | Метод | Временные промежутки |
| Оценка приживления | Все | T, NK-клетки периферической крови | STR-ПЦР | С 15-го дня гаплоТГСК 1 раз в 14 дней до констатации полного химеризма |
| Пунктат костного мозга | STR-ПЦР | 30-й день после гаплоТГСК | ||
| РТПХ | Все | T -клетки | STR-ПЦР | 1 раз в 14 дней до констатации полного химеризма |
| Наблюдение после констатации полного химеризма | Пациенты с незлокачественными заболеваниями | Периферическая кровь или костный мозг | STR-ПЦР | 90-й, 180-й, 365-й дни после гаплоТГСК |
| Наблюдение после констатации полного химеризма | Пациенты с злокачественными заболеваниями системы крови с наличием маркера МОБ до аллоТГСК | Периферическая кровь | STR-ПЦР | Ежемесячно в течении 1-го года после гаплоТГСК. 1 раз в 3 месяца в течении второго года |
| Пунктат костного мозга | STR-ПЦР | 1 раз в 3 месяца в течении года после гаплоТГСК | ||
| Пациенты с злокачественными заболеваниями системы крови без маркера МОБa до аллоТГСК | Периферическая кровь | qПЦР | Ежемесячно в течении 1-го года после гаплоТГСК. 1 раз в 3 месяца в течении второго года | |
| Пунктат костного мозга | qПЦР | 1 раз в 3 месяца в течении года после гаплоТГСК |
a Высокая чувствительность метода оценки химеризма позволяет проводить мониторинг МОБ, используя этот метод, однако в любом образце крови или костного мозга всегда будет присутствовать некоторое количество клеток самого пациента (например, клетки эпителия), что затрудняет интерпретацию результатов исследования у пациентов без других маркеров МОБ.
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2025
- 1) Appelbaum FR. The history and future of hematopoietic cell transplantation. In: Forman SJ, Negrin RS, Antin JH, Appelbaum FR, eds. Thomas' Hematopoietic Cell Transplantation. 6th ed. Wiley-Blackwell; 2020:1-8. 2) Snowden, J.A., Sánchez-Ortega, I., Corbacioglu, S. et al. Indications for haematopoietic cell transplantation for haematological diseases, solid tumours and immune disorders: current practice in Europe, 2022. Bone Marrow Transplant 57, 1217–1239 https:// doi:10.1038/s41409-022-01691-w 3) Протоколы трансплантации аллогенных гемопоэтических стволовых клеток. Под редакцией академика РАН В.Г Савченко. НМИЦ Гематологии, Москва 2020г. 4) Pavlu J, Labopin M, Zoellner AK, et al. Allogeneic hematopoietic cell transplantation for primary refractory acute lymphoblastic leukemia: a report from the acute leukemia working party of the EBMT. Cancer. 2017;123:1965–70. doi:10.1002/cncr.30604 5) Rasheed, W., Niederwieser, D.W., Aljurf, M. (2024). The HCT Unit. In: Sureda, A., Corbacioglu, S., Greco, R., Kröger, N., Carreras, E. (eds) The EBMT Handbook. Springer, Cham. https://doi.org/10.1007/978-3-031-44080-9_4 6) M. Crysandt, I. Yakoub-Agha, P. Reiß, S. Theisen, G. Silling, P. Glatte, E. Nelles, S. Lemmen, T.H. Brümmendorf, U. Kontny, E. Jost, “How to build an allogeneic hematopoietic cell transplant unit in 2016: Proposal for a practical framework”, Current Research in Translational Medicine, Volume 65, Issue 4, 2017, Pages 149-154 doi: 10.1016/j.retram.2017.10.003 7) Ayuk, F., Balduzzi, A., Worel, N. (2024). Donor Selection for Adults and Pediatrics. In: Sureda, A., Corbacioglu, S., Greco, R., Kröger, N., Carreras, E. (eds) The EBMT Handbook. Springer, Cham. https://doi.org/10.1007/978-3-031-44080-9_12 8) Boelens, J.J. et al. (2024). GVHD Prophylaxis. In: Sureda, A., Corbacioglu, S., Greco, R., Kröger, N., Carreras, E. (eds) The EBMT Handbook. Springer, Cham. https://doi.org/10.1007/978-3-031-44080-9_26 9) Zeiser R, Blazar BR. Acute graft-versus-host disease. N Engl J Med. 2018;378(6):586. doi: 10.1056/NEJMc1716969 10) Hill, G. R., Betts, B. C., Tkachev, V., Kean, L. S., & Blazar, B. R. Current concepts and advances in graft-versus-host disease immunology. Annual Review of Immunology, 39, 19–49, 2021. doi: 10.1146/annurev-immunol-102119-073227 11) Ruggeri A, Labopin M, Battipaglia G, Chiusolo P, Tischer J, Diez-Martin JL, et al. Timing of post-transplantation cyclophosphamide administration in haploidentical transplantation: a comparative study on behalf of the acute leukemia working Party of the European Society for Blood and Marrow Transplantation. Biol Blood Marrow Transplant. 2020;26(10):1915–22. doi.org/10.1016/j.bbmt.2020.06.026 12) Bolaños-Meade J, Reshef R, Fraser R, Fei M, Abhyankar S, Al-Kadhimi Z, et al. Three prophylaxis regimens (tacrolimus, mycophenolate mofetil, and cyclophos-phamide; tacrolimus, methotrexate, and bortezomib; or tacrolimus, methotrexate, and maraviroc) versus tacrolimus and methotrexate for prevention of graft-versus-host disease with haemopoietic cell transplantation with reduced-intensity conditioning: a randomised phase 2 trial with a non-randomised contemporaneous control group (BMT CTN 1203). Lancet Haematol. 2019;6(3):e132–43. DOI: 10.1016/S2352-3026(18)30221-7 13) Holtan SG, Hamadani M, Wu J, AL Malki MM, Runaas L, Elmariah H, et al. Post-transplant cyclophosphamide, tacrolimus, and mycophenolate mofetil as the new standard for graft-versus-host disease (GVHD) prophylaxis in reduced intensity conditioning: results from phase III BMT CTN 1703. Blood. 2022;140(Supplement 2):LBA-4 https://doi.org/10.1182/blood-2022-171463 14) Battipaglia G, Labopin M, Blaise D, Diez-Martin JL, Bazarbachi A, Vitek A, et al. Impact of the addition of antithymocyte globulin to post-transplantation cyclo-phosphamide in haploidentical transplantation with peripheral blood compared to post-transplantation cyclophosphamide alone in acute myelogenous leukemia: a retrospective study on behalf of the acute leukemia working Party of the European Society for Blood and Marrow Transplantation. Transplant Cell Ther. 2022;28(9):587.e1–7 DOI: 10.1016/j.jtct.2022.06.006 15) Bonifazi F, Solano C, Wolschke C, Sessa M, Patriarca F, Zallio F, et al. Acute GVHD prophylaxis plus ATLG after myeloablative allogeneic haemopoietic peripheral blood stem-cell transplantation from HLA-identical siblings in patients with acute myeloid leukaemia in remission: final results of quality of life and long-term outcome analysis of a phase 3 randomised study. Lancet Haematol. 2019;6(2):e89–99. DOI: 10.1016/S2352-3026(18)30214-X 16) Chang YJ, Wu DP, Lai YR, Liu QF, Sun YQ, Hu J, et al. Antithymocyte globulin for matched sibling donor transplantation in patients with hematologic malignancies: a multicenter, open-label, randomized controlled study. J Clin Oncol. 2020;38(29):3367–76. DOI: 10.1200/JCO.20.00150 17) Cho BS, Min GJ, Park SS, Yoon SY, Park S, Jeon YW, et al. Low-dose thymoglobulin for prevention of chronic graft-versus-host disease in transplantation from an HLA-matched sibling donor. Am J Hematol. 2021;96(11):1441–9. DOI:10.1002/ajh.26320 18) Bonifazi F, Rubio MT, Bacigalupo A, Boelens JJ, Finke J, Greinix H, et al. Rabbit ATG/ATLG in preventing graft-versus-host disease after allogeneic stem cell transplantation: consensus-based recommendations by an international expert panel. Bone Marrow Transplant. 2020;55(6):1093–102. DOI: 10.1038/s41409-020-0792-x 19) Kornblit B, Storer BE, Andersen NS, Maris MB, Chauncey TR, Petersdorf EW, et al. Sirolimus with CSP and MMF as GVHD prophylaxis for allogeneic transplantation with HLA antigen-mismatched donors. Blood. 2020;136(13):1499–506. DOI: 10.1182/blood.2020005338 20) Sandmaier BM, Kornblit B, Storer BE, Olesen G, Maris MB, Langston AA, et al. Addition of sirolimus to standard cyclosporine plus mycophenolate mofetil-based graft-versus-host disease prophylaxis for patients after unrelated non-myeloablative haemopoietic stem cell transplantation: a multicentre, randomised, phase 3 trial. Lancet Haematol. 2019;6(8):e409–18. DOI: 10.1016/S2352-3026(19)30088-2 21) Kopolovic I, Ostro J, Tsubota H, et al. A systematic review of transfusion-associated graft-versus-host disease. Blood. 2015;126:406–14. DOI: 10.1182/blood-2015-01-620872 22) European Committee (Partial Agreement) on Blood Transfusion (CD-P-TS). Guide to the preparation, use and quality assurance of blood components. 21st ed. EDQM; 2023. 23) Carson JL, Guyatt G, Heddle NM, et al. Clinical practice guidelines from the AABB: red blood cell transfusion thresholds and storage. JAMA. 2016; DOI: 10.1001/jama.2016.9185 24) Carson JL, Stanworth SJ, Dennis JA, Trivella M, Roubinian N, Fergusson DA, Triulzi D, Doree C, Hebert PC. Transfusion thresholds for guiding red blood cell transfusion. Cochrane Database SystRev. 2021; https://doi.org/10.1002/14651858.CD002042.pub5 25) Worel N. ABO-mismatched allogeneic hematopoietic stem cell transplantation. Transfus Med Hemother. 2016;43:3–12. DOI: 10.1159/000441507 26) Marco-Ayala J, Gomez-Segui I, Sanz G, Solves P. Pure red cell aplasia after major or bidirectional ABO incompatible hematopoietic stem cell transplantation: to treat or not to treat, that is the question. Bone Marrow Transplant. 2021;56:769–78. DOI: 10.1038/s41409-020-01124-6 27) Balasubramanian S.K. et al. Rational management approach to pure red cell aplasia // Haematologica. 2018. Vol. 103, № 2 https://doi.org/10.3324/haematol.2017.175810 28) Hirsch HH, Pergam SA. Human adenovirus, polyomavirus, and parvovirus infections in patients undergoing hematopoietic stem-cell transplantation. In: Forman SJ, Nagrin RS, Antin H, Appelbaum FR, editors. Thomas’ hematopoietic cell transplantation. 5th ed. Hoboken: Wiley; 2016. p. 1090–104. https://doi.org/10.1002/9781118416426.ch93 29) Cesaro S, Dalianis T, Hanssen Rinaldo C, et al. ECIL guidelines for the prevention, diagnosis and treatment of BK polyomavirus-associated haemorrhagic cystitis in haematopoietic stem cell transplant recipients. J Antimicrob Chemother. 2018;73:12–21 DOI: 10.1093/jac/dkx324 30) Cesaro S, Hirsch HH, Faraci M, et al. Cidofovir for BK virus-associated hemorrhagic cystitis: a retrospective study. Clin Infect Dis. 2009;49:233–40. DOI: 10.1086/599829 31) Ganguly N, Clough LA, Dubois LK, et al. Low-dose cidofovir in the treatment of symptomatic BK virus infection in patients undergoing allogeneic hematopoietic stem cell transplantation: a retrospective analysis of an algorithmic approach. Transpl Infect Dis. 2010;12:406–11. DOI: 10.1111/j.1399-3062.2010.00513.x 32) Bridges B, Donegan S, Badros A. Cidofovir bladder instillation for the treatment of BK hemorrhagic cystitis after allogeneic stem cell transplantation. Am J Hematol. 2006;81:535–7. DOI: 10.1002/ajh.20567 33) Chen XC, Liu T, Li JJ et al. Efficacy and safety of leflunomide for the treatment of BK virus-associated hemorrhagic cystitis in allogeneic hematopoietic stem cell transplantation recipients Acta Haematol 2013; 130: 52–6. DOI: 10.1159/000345852 34) Park YH, Lim JH, Yi HG, et al. BK virus hemorrhagic cystitis following allogeneic stem cell transplantation: clinical characteristics and utility of leflunomide treatment. Turk J Haematol 2016; 33: 223–230 DOI: 10.4274/Tjh.2015.0131 35) Ringden O, Uzunel M, Sundberg B, et al. Tissue repair using allogeneic mesenchymal stem cells for hemorrhagic cystitis, pneumomediastinum and perforated colon. Leukemia. 2007;21:2271–6. DOI: 10.1038/sj.leu.2404833 36) Tirindelli MC, Flammia GP, Bove P, et al. Fibrin glue therapy for severe hemorrhagic cystitis after allogeneic hematopoietic stem cell transplantation. Biol Blood Marrow Transplant. 2014; 20:16 12–7. DOI: 10.1016/j.bbmt.2014.06.018 37) Bove P, Iacovelli V, Tirindelli MC, et al. Endoscopic intravesical fibrin glue application in the treatment of refractory hemorrhagic radiation cystitis: a single cohort pilot study. J Endourol 2019; 33: 93–98 DOI: 10.1089/end.2018.0028 38) Masieri L, Sessa F, Mari A, et al. Intravesical application of platelet-rich plasma in patients with persistent haemorrhagic cystitis after hematopoietic stem cell transplantation: a single centre preliminary experience. Int Urol Nephrol 2019; 51: 1715–1720. DOI: 10.1007/s11255-019-02223-0 39) Aditya Jandial, Kundan Mishra, Rajeev Sandal and Kamal Kant Sahu Management of BK virus-associated haemorrhagic cystitis in allogeneic stem cell transplant recipients Ther Adv Infectious Dis 2021, Vol. 8: 1–13 DOI: 10.1177/2049936121991377 40) Mohty M, Malard F, Abecassis M, et al. Sinusoidal obstruction syndrome/veno-occlusive disease: current situation and perspectives-a position statement from the European Society for Blood and Marrow Transplantation (EBMT). Bone Marrow Transplant. 2015;50:781–9 DOI: 10.1038/bmt.2015.52 41) Richardson PG, Riches ML, Kernan NA, et al. Phase 3 trial of defibrotide for the treatment of severe veno-occlusive disease and multi-organ failure. Blood. 2016;127:1656–65. DOI: 10.1182/blood-2015-10-676924 42) Mohty M, Malard F, Alaskar AS, et al. Diagnosis and severity criteria for sinusoidal obstruction syndrome/veno-occlusive disease in adult patients: a refined classification from the European society for blood and marrow transplantation (EBMT). Bone Marrow Transplant. 2023;58:749. https://doi.org/10.1038/s41409-023-01992-8. 43) Gressens SB, Cazals-Hatem D, Lloyd V, et al. Hepatic venous pressure gradient in sinusoidal obstruction syndrome: diagnostic value and link with histological lesions. JHEP Rep. 2022;4:100558 DOI: 10.1016/j.jhepr.2022.100558 44) Yoon JH, Yoo KH, Sung KW, et al. Validation of treatment outcomes according to revised severity criteria from European Society for Blood and Marrow Transplantation (EBMT) for sinusoidal obstruction syndrome/veno-occlusive disease (SOS/VOD). Bone Marrow Transplant. 2019;54:1361–8. DOI: 10.1038/s41409-019-0492-6 45) Yoon JH, Min GJ, Park SS, et al. Incidence and risk factors of hepatic veno-occlusive disease/sinusoidal obstruction syndrome after allogeneic hematopoietic cell transplantation in adults with prophylactic ursodiol and intravenous heparin or prostaglandin E1. Bone Marrow Transplant. 2021;56:1603–13. DOI: 10.1038/s41409-021-01215-y 46) Ruutu T, Juvonen E, Remberger M, et al. Improved survival with ursodeoxycholic acid prophylaxis in allogeneic stem cell transplantation: long-term follow-up of a randomized study. Biol Blood Marrow Transplant. 2014;20:135–8. DOI: 10.1016/j.bbmt.2013.10.014 47) Mohty M, Malard F, Abecasis M, et al. Prophylactic, preemptive, and curative treatment for sinusoidal obstruction syndrome/veno-occlusive disease in adult patients: a position statement from an international expert group. Bone Marrow Transplant. 2020;55:485–95. DOI: 10.1038/s41409-019-0705-z 48) Kernan NA, Grupp S, Smith AR, et al. Final results from a defibrotide treatment-IND study for patients with hepatic veno-occlusive disease/sinusoidal obstruction syndrome. Br J Haematol. 2018;181:816–27. DOI: 10.1111/bjh.15267 49) Carreras E. Barcelona endothelium team. Vascular endothelial syndromes after HCT: 2020 update. Bone Marrow Transplant. 2020;55:1885–7. DOI: 10.1038/s41409-020-0852-2 50) Spitzer TR. Engraftment syndrome following hematopoietic stem cell transplantation. Bone Marrow Transplant. 2001;27:893–8. DOI: 10.1038/sj.bmt.1703015
Информация
Перечень дополнительных лекарственных средств (имеющих менее 100% вероятность применения):
|
Лекарственная группа
|
Лекарственные средства | Способ применения | Уровень доказательности |
| Цитостатическое средство | Бусульфан* | внутрь | А |
| Цитостатическое средство | Бендамустин | внутривенно | А |
| Цитостатическое средство | Идарубицин | внутривенно | А |
| Цитостатическое средство | Кармустин* | внутривенно | А |
| Цитостатическое средство | Мелфалан | внутривенно | А |
| Цитостатическое средство | Метотрексат | внутривенно | А |
| Цитостатическое средство | Треосульфан* | внутривенно | А |
| Цитостатическое средство | Тиотепа* | внутривенно | А |
| Цитостатическое средство | Флударабин | внутривенно | А |
| Цитостатическое средство | Цитарабин* | внутривенно | А |
| Цитостатическое средство | Циклофосфамид | внутривенно | А |
| Иммунодепрессивное средство | Антитимоцитарный иммуноглобулин (кроличий) | внутривенно | А |
| Иммунодепрессивное средство | Антитимоцитарный иммуноглобулин (лошадиный) | внутривенно | А |
| Иммунодепрессивное средство | Микофеноловая кислота | внутрь | А |
| Иммунодепрессивное средство | Сиролимус* | внутривенно | А |
| Иммунодепрессивное средство, ингибитор кальциневрина | Такролимус | внутривенно, внутрь | А |
| Иммунодепрессивное средство, ингибитор кальциневрина | Циклоспорин | внутрь | А |
| Противоопухолевое и иммуномодулирующее средство (антитела моноклональные) | Ритуксимаб | внутривенно | А |
| Антидот антагонистов фолиевой кислоты | Кальция фолинат | внутривенно | А |
| Антидот антагонистов фолиевой кислоты | Натрия фолинат | внутривенно | А |
| Противосудорожное средство | Леветирацетам | внутрь | А |
|
Антидот акролеина
|
Месна | внутривенно | А |
| Стимулятор лейкопоэза | Филграстим | внутривенно, п/к | А |
| Противовирусное средство | Ацикловир | внутривенно, внутрь | А |
| Полиеновый макроциклический антибиотик с противогрибковой активностью | Амфотерицин В | внутривенно | В |
| Антибиотик группы монобактам | Азтреонам* | внутривенно | А |
|
Блокатор ко-стимуляции T-лимфоцитов
|
Абатацепт * | внутривенно | С |
|
Глюкокортикостероид для местного применения
|
Будесонид | внутрь | А |
| Глюкокортикостероид для местного применения | Бетаметазон | наружно | А |
| Селективный иммунодепрессант. ингибитор Rho-ассоциированной протеинкиназы | Белумосудил * | внутривенно | В |
| Противовирусное средство, L-валиловый эфир ганцикловира | Валганцикловир | внутрь | А |
| Противовирусное средство группы аналогов нуклеозидов | Валацикловир | внутрь | А |
|
Противогрибковый препарат, производное триазола
|
Вориконазол | внутривенно, внутрь | А |
|
Антибиотик группы гликопептидов.
|
Ванкомицин | внутривенно, внутрь | А |
|
Противовирусное средство
|
Ганцикловир | внутривенно | А |
|
Противомалярийное средство
|
Гидроксихлорахин | внутрь | С |
|
Гепатопротективный препарат
|
Дефибротид* | внутривенно | А |
|
Противовирусное средство ингибитор нейраминидазы
|
Занамивир | ингаляционно | А |
|
Синтетическое противогрибковое средство, производное триазола.
|
Итраконазол | внутрь | А |
|
Противогрибковое средство из группы триазолов
|
Изавуконазол* | внутривенно, внутрь | А |
|
Противоопухолевое средство, низкомолекулярный ингибитор тирозинкиназы Брутона
|
Ибрутиниб | внутрь | В |
|
Противоопухолевое средство, обратимый ингибитор протеасом
|
Иксазомиб | внутрь | В |
|
Противоопухолевое средство, ингибитор протеинтирозинкиназы
|
Иматиниб | внутрь | А |
|
Противогрибковое средство, группы эхинокандинов
|
Каспофунгин | внутривенно | А |
|
Глюкокортикостероид для наружного применения
|
Клобетазол | мазь для наружного применения 0.05% | А |
|
Иммунодесрессивное средство, иммуномодулятор
|
Лефлуномид | внутрь | В |
|
Противовирусное средство
|
Летермовир* | внутрь | В |
| Противовирусное средство, нуклеозидный ингибитор обратной транскриптазы |
Ламивудин
|
внутрь | В |
|
Глюкокортикостероид
|
Метилпреднизолон | внутривенно, внутрь | А |
|
Противовирусный препарат из класса анти-цитомегаловирусных
|
Марибавир | внутрь | А |
|
Противогрибковое средство, производное эхинокандина
|
Микафунгин | внутривенно | А |
|
Антибиотик группы карбапенемов
|
Меропенем | внутривенно | А |
| Антибиотик группы карбапенемов в комбинации с ингибитором сериновых бета-лактамаз класса А и класса С | Меропенем-ваборбактам* | внутривенно | А |
|
Глюкокортикостероид для местного применения
|
Мометазон | наружно, ингаляционно | А |
|
Противовирусное средство, селективный ингибитор нейраминидазы
|
Осельтамивир | внутрь | А |
|
Противогрибковое средство производное триазола
|
Позаконазол | внутрь | А |
| Антибиотик группы пенициллинов широкого спектра действия с ингибитором бета-лактамаз | Пиперациллин/тазобактам | внутривенно | А |
| Дерматотропные средства |
Пимекролимус
|
наружно | В |
|
Иммуномодулятор с противоопухолевой активностью
|
Помалидомид | внутрь | В |
|
Селективный иммунодепрессант ингибитор С5
|
Равулизумаб | внутривенно | А |
|
Противоопухолевые средства, селективный ингибитор JAK-киназ
|
Руксолитиниб | внутрь | А |
|
Иммунодепрессивное, моноклональное антитело к человеческому рецептору ИЛ-6
|
Тоцилизумаб | внутривенно | В |
|
Противовирусное средство, нуклеотидный ингибитор обратной транскриптазы.
|
Тенофовир дизопроксил | внутрь | А |
|
Антибактериальный сульфаниламидный препарат
|
Триметоприм/сульфаметоксазол | внутрь, внутривенно | А |
|
Иммунодепрессивное средство, ингибитор кальциневрина
|
Такролимус | наружно | А |
|
Гепатопротекторное средство
|
Урсодезоксихолевая кислота | внутрь | В |
|
Противовирусное средство.
|
Фамцикловир | внутрь | А |
|
Противовирусное средство
|
Фоскарнет* | внутривенно | С |
|
Противовирусное средство
|
Цидофавир* | внутривенно | С |
|
Антибактериальное средство, цефалоспорин в комбинации
|
Цефтазидим и ингибитор бета-лактамазы | внутривенно | А |
|
Антибактериальное средство, цефалоспориного ряда
|
Цефдиторен* | внутрь | А |
|
Антибактериальное средство, цефалоспориного ряда в комбинации
|
Цефтолозан-тазобактам* | внутривенно | А |
|
Селективный иммунодепрессант ингибитор С5
|
Экулизумаб | внутривенно | В |
|
Иммунодепрессивное средство ингибитор ФНО
|
Этанерцепт | подкожно | В |
|
Стимулятор тромбопоэза
|
Элтромбопаг | внутрь | В |
|
Противовирусное средство ингибирующее обратную транскриптазу вируса гепатита B.
|
Энтекавир | внутрь | А |
Сокращения, используемые в протоколе:
|
АллоТКМ
|
Аллогенная трансплантация костного мозга |
|
АЛТ
|
Аланинаминотрансфераза |
|
АСТ
|
Аспартатаминотрансфераза |
|
АутоТКМ
|
Аутологичная трансплантация костного мозга |
|
АЧТВ
|
Активированное частичное тромбопластиновое время |
|
АТ-3
|
Антитромбин-3 |
|
АА
|
Апластическая анемия |
|
АЧН
|
Абсолютное число нейтрофилов |
|
БАЛ
|
Бронхоальвеолярный лаваж |
|
БК
|
Бластный криз |
|
ВОЗ
|
Всемирная организация здравоохранения |
|
ВОБ
|
Веноокклюзионная болезнь |
|
ВИЧ
|
Вирус иммунодефицита человека |
|
ВПВ
|
Верхняя полая вена |
|
ВПГ
|
Вирус простого герпеса |
|
ВДХТ
|
Высокодозная химиотерапия |
|
ВЭБ
|
Вирус Эбштейн Барра |
|
ВГЧ
|
Вирус герпеса человека |
|
ГГТП
|
Гаммаглютамилтранспептидаза |
|
Гр
|
Грей |
|
ГСК
|
Гемопоэтические стволовые клетки |
|
Г-КСФ
|
Гранулоцитарный колониестимулирующий фактор |
|
ГМ-КСФ
|
Гранулоцитарно-моноцитарнный колониестимулирующий фактор |
|
ГЦ
|
Геморрагический цистит |
|
ГКС
|
Глюкокортикостероиды |
|
ДАК
|
Диффузное альвеолярное кровотечение |
|
ДНК
|
Дезоксирибонуклеиновая кислота |
|
ДВККЛ
|
Диффузная В-крупноклеточная лимфома |
|
ДСА
|
Донорспецифические антитела |
|
Ед
|
Единица измерения |
|
ЖКТ
|
Желудочно-кишечный тракт |
|
ИБЛ
|
Интерстициальная болезнь легких |
|
ИФА
|
Иммунноферментный анализ |
|
ИФТ
|
Иммунофенотипирование |
|
ИХЛ
|
Иммуноемилюминисценция |
|
ИГХ
|
Иммуногистохимия |
|
ИМТ
|
Индекс массы тела |
|
ИЛ
|
Интерлейкин |
|
ИСТ
|
Иммуносупрессивная терапия |
|
КП
|
Клинический протокол |
|
КТ
|
Компьютерная томография |
|
КЩС
|
Кислотно-щелочное состояние |
|
КМ
|
Костный мозг |
|
ЛХ
|
Лимфома Ходжкина |
|
ЛДГ
|
Лактатдегидрогеназа |
|
ЛБ
|
Лимфома Беркитта |
|
ЛТ
|
Лучевая терапия |
|
ЛПЗ
|
Лимфопролиферативное заболевание |
|
ЛЖ
|
Левый желудочек |
|
ЛС
|
Лекарственное средство |
|
Мг
|
Миллиграмм |
|
МДС
|
Миелодиспластический синдром |
|
МЕ
|
Международная единица |
|
МКБ
|
Международная классификация болезней |
|
МКЛ
|
Мантийноклеточная лимфома |
|
Мл
|
Миллилитр |
|
ММ
|
Множественная миелома |
|
МНО
|
Международное нормализованное отношение |
|
МРТ
|
Магнитно-резонансная томография |
|
MРБ
|
Минимальная резидуальная болезнь |
|
МСК
|
Мезенхимальные стромальные клетки |
|
МПН
|
Миелопролиферативное новообразование |
|
НХЛ
|
Неходжкинская лимфома |
|
НПВС
|
Нестероидное противовоспалительное средство |
|
ОАК
|
Общий анализ крови |
|
ОГК
|
Органы грудной клетки |
|
ОБП
|
Органы брюшной полости |
|
ОЛЛ
|
Острый лимфобластный лейкоз |
|
ОМТ
|
Органы малого таза |
|
ОМЛ
|
Острый миелобластный лейкоз |
|
ОВ
|
Общая выживаемость |
|
ОИТ
|
Отделение интенсивной терапии |
|
ПКТ
|
Прокальцитонин |
|
ПХТ
|
Полихимиотерапия |
|
ПОТ
|
Плазма обогащенная тромбоцитами |
|
ПОН
|
Полиорганная недостаточность |
|
ПО
|
Полный ответ |
|
ПР
|
Полная ремиссия |
|
ПЦР
|
Полимеразная цепная реакция |
|
ПЭТ/КТ
|
Позитронно-эммисионная томография/компьютерная томография |
|
ПВ
|
Протромбиновое время |
|
ПТИ
|
Протромбиновый индекс |
|
ПТКЛ
|
Периферическая Т-клеточная лимфома |
|
ПМ-ДВККЛ
|
Первична медиастинальная диффузная В-крупноклеточная лимфома |
|
ПНГ
|
Пароксизмальная ночная гемоглобинурия |
|
ПЧКА
|
Парциальная чистая красноклеточная (эритроцитарная) аплазия |
|
ППФЭ
|
Плевропаренхиматозный фиброэластоз |
|
ПТЛЗ
|
Посттрансплантационное лимфопролиферативное заболевание |
|
РКИ
|
Рандомизированное клиническое исследование |
|
РТПХ
|
Реакция трансплантат против хозяина |
|
РНК
|
Рибонуклеиновая кислота |
|
СМЖ
|
Спинно-мозговая жидкость |
|
СОЭ
|
Скорость оседания эритроцитов |
|
СКФ
|
Скорость клубочковой фильтрации |
|
ССС
|
Сердечно-сосудистая система |
|
СН
|
Сердечная недостаточность |
|
СРБ
|
С-реактивный белок |
|
СЗП
|
Свежезамороженная плазма |
|
СОС
|
Синдром синусоидальной обструкции |
|
СП
|
Синдром приживления |
|
СПОН
|
Синдром полиорганной недостаточности |
|
СИП
|
Cиндром идиопатической пневмонии |
|
СОБ
|
Синдром облитерирующего бронхиолита |
|
СВЦ
|
Синдром высвобождения цитокинов |
|
ТГСК
|
Трансплантация гемопоэтических стволовых клеток |
|
ТКМ
|
Трансплантация костного мозга |
|
Т-ЛЛ
|
Т-лимфобластная лимфома |
|
ТИА
|
Транзиторная ишемическая атака |
|
ТА-ТМА
|
Трансплантат ассоциированная тромботическая микроангиопатия |
|
УД
|
Уровень доказательности |
|
УЗДГ
|
Ультразвуковая доплерография |
|
УЗИ
|
Ультразвуковое исследование |
|
ФГДС
|
Фиброгастродуоденоскопия |
|
ФДГ
|
Фтордезоксиглюкоза |
|
ФЛ
|
Фолликулярная лимфома |
|
ФВ
|
Фракция выброса |
|
ФНО
|
Фактор некроза опухоли |
|
ФН
|
Фебрильная нейтропения |
|
ХЛЛ
|
Хронический лимфоцитарный лейкоз |
|
ХМЛ
|
Хронический миелоидный лейкоз |
|
ХММЛ
|
Хронический миеломоноцитарный лейкоз |
|
ХТ
|
Химиотерапия |
|
ЦНС
|
Центральная нервная система |
|
ЦВН
|
Церебро-васкулярная недостаточность |
|
ЦВК
|
Центральный венозный катетер |
|
ЦМВ
|
Цитомегаловирус |
|
ЦМВИ
|
Цитомегаловирусная инфекция |
|
ПЦП
|
Пневмоцистная пневмония |
|
ЧО
|
Частичный ответ |
|
ЭКГ
|
Электрокардиография |
|
ЭХО-КГ
|
Эхокардиография |
|
ЭБВ
|
Эбштейн Барр вирус |
|
ХГЧ
|
Хорионгонадотропин человека |
|
ХОБЛ
|
Хроническая обструктивная болезнь легких |
|
ЯМРТ
|
Ядерно-магнитная резонансная томография |
|
Ara-C
|
Цитарабин |
|
ATG
|
Antithymocyte globulin |
|
BKPyV
|
полиомавирус BK |
|
CALGB
|
Cаncer and Leukemia Group B |
|
CD
|
Differentiation cluster |
|
СО
|
Clinical option |
|
CNI
|
Сalcineurin inhibitors |
|
CPAP
|
Constant Positive Airway Pressure |
|
CsA
|
Сyclosporine |
|
D
|
Developmental |
|
DLI
|
Donor lymphocyte infusion |
|
EBMT
|
European Group for blood and Marrow |
|
ECOG
|
Eastern Cooperative Oncology Group |
|
ECIL
|
European Conference on Infections in Leukemia |
|
EBER
|
Epstein — Barr virus-encoded small RNAs |
|
EORTC
|
European Organisation for Research and Treatment of Cancer |
|
ESBL
|
Extended-Spectrum Beta-Lactamase |
|
EMA
|
European Medicines Agency |
|
FISH
|
Fluorescence in situ hybridization |
|
FDA
|
Food and Drug Administration |
|
GNR
|
Generally not recommend |
|
GF
|
Graft failure |
|
HLA
|
Human leukocyte antigen (Система лейкоцитарных антигенов человека) |
|
HBV
|
Hepatites |
|
HIV
|
Human immunodeficiency virus |
|
hАТG
|
Equine antithymocyte globulin |
|
IFRT
|
Involved-field radiation therapy |
|
JACIE
|
Joint Accreditation Committee of the ISCT and the EBMT |
|
KDIGO
|
Kidney Disease Improving Global Outcomes |
|
LONIPC
|
Late-onset noninfectious pulmonary complications |
|
MAC
|
Myeloablative conditioning |
|
MASP
|
Mannan-binding lectin associated serine protease |
|
MoAb
|
Мonoclonal antibody |
|
MFI
|
Mean fluorescence intensity |
|
MRSA
|
Methicillin-resistant Staphylococcus aureus |
|
MRGN
|
Multidrug-resistant Gram-negative |
|
MMF
|
Mycophenolate mofetil |
|
NCCN
|
National comprehensive cancer network |
|
NOS
|
Not otherwise specified |
|
NMA
|
Non-myeloablative |
|
NIH
|
National Institutes of Health |
|
ProBNP
|
N-terminal fragment of brain natriuretic peptide |
|
PTCY
|
Post-transplant cyclophosphamide |
|
PDGF
|
Platelet-derived growth factor |
|
RIC
|
Reduced intensity conditioning |
|
S
|
Standard |
|
TRM
|
Тreatment-related mortality |
|
TBI
|
Total body irradiation |
|
TGF-β
|
Transforming growth factor beta |
|
TAC
|
Тacrolimus |
|
VEGF
|
Vascular endothelial growth factor |
|
VRE
|
Vancomycin-resistant Enterococci |
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.