Эндоваскулярное лечение ишемического инсульта в острейшем периоде
 Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Закупорка и стеноз прецеребральных артерий, не приводящие к инфаркту мозга (I65), Закупорка и стеноз церебральных артерий, не приводящие к инфаркту мозга (I66), Инфаркт мозга (I63), Преходящие транзиторные церебральные ишемические приступы [атаки] и родственные синдромы (G45), Сосудистые мозговые синдромы при цереброваскулярных болезнях (I60-I67+)(G46)
Нейрохирургия
Общая информация
Краткое описание
Одобрено
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «01» июня 2023 года
Протокол №182
Протокол №182
КЛИНИЧЕСКИЙ ПРОТОКОЛ МЕДИЦИНСКОГО ВМЕШАТЕЛЬСТВА
ЭНДОВАСКУЛЯРНОЕ ЛЕЧЕНИЕ ИШЕМИЧЕСКОГО ИНСУЛЬТА В ОСТРЕЙШЕМ ПЕРИОДЕ
Эндоваскулярное лечение ишемического инсульта в острейшем периоде – эффективный комплекс рентгенэндоваскулярных методов лечения, направленный на механическое восстановление кровотока (с помощью различных устройств ретриверов и аспирационных катетеров) или восстановление кровотока с помощью внутриартериального селективного тромболизиса в экстра-, интракраниальных артериях у пациентов в пределах до 24 часов от начала симптомов острого ишемического инсульта (УД – A).
Коды МКБ-10:
ВВОДНАЯ ЧАСТЬ
Коды МКБ-10:
I63 – Инфаркт мозга
I65 – Закупорка и стеноз прецеребральных артерий, не приводящие к инфаркту мозга
I66 – Закупорка и стеноз церебральных артерий, не приводящие к инфаркту мозга
G45 – Преходящие транзиторные церебральные ишемические приступы и родственные синдромы
G46 – Сосудистые мозговые синдромы при цереброваскулярных болезнях
Сокращения, используемые в протоколе:


Категория пациентов: взрослые.
Шкала уровня доказательности:

Дата разработки и пересмотра протокола: (пересмотр 2015 года) 2022 год.
Сокращения, используемые в протоколе:


Пользователи протокола: нейрохирурги, радиологи, интервенционные радиологи, неврологи.
Категория пациентов: взрослые.
Шкала уровня доказательности:

Классификация
Клиническая классификация: нет.
Диагностика
Перечень основных и дополнительных диагностических мероприятий:
Основные (обязательные) диагностические мероприятия:
общий анализ крови для исключения тяжелой сопутствующей патологии, особенно таких заболеваний, как анемии, тромбоцитопении, лейкоцитопении, воспалительные заболевания;
общий анализ мочи для исключения сахарного диабета, нарушений функций почек;
биохимический анализ крови: глюкоза крови, креатинин, мочевина необходим для исключения сахарного диабета, нарушений функций почек;
коагулограмма (ПВ, фибриноген, АЧТВ, тромбиновое время, определение времени свертываемости крови, ПТИ) для оценки системы гемостаза, для исключения нарушений свертывающей системы крови;
группа крови и резус фактор;
ЭКГ для диагностики заболеваний сердца;
КТ и, или МРТ головного мозга.
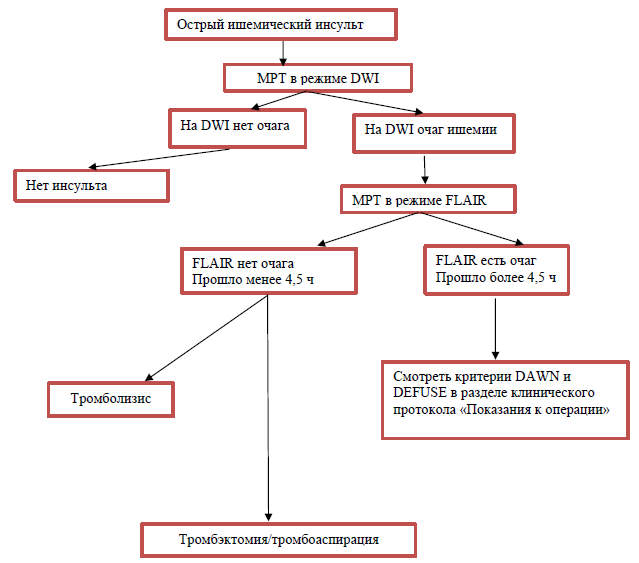
КТ для уточнения диагноза и исключения геморрагического процесса в головном мозге. МРТ необходимо выполнить в режиме T1, T2, Flair, DWI при отсутствии точных данных о времени начала инсульта. При обнаружении на МРТ несоответствия «MR-mismatch» между положительным DWI и отрицательным FLAIR – является временным индикатором, информирующим о начале ишемии менее 4-5 часов, что является показанием для проведения тромболизиса или тромбэктомии;
селективная церебральная ангиография стандарт диагностики состояния сосудов: окклюзии, стенозы, АВМ, аневризмы.
Дополнительные диагностические мероприятия:
биохимический анализ крови: общий белок, билирубин общий, билирубин прямой, АЛАТ, АСАТ, холестерин, триглицериды, ЛПНП, ЛПВП для выявления дислипидемии, диспротеинемии, для исключения патологии печени, сердца, скелетной мускулатуры;
анализ крови на ВИЧ для исключения ВИЧ-инфекции;
анализ крови на маркеры гепатитов В и С для исключения гепатита В или С;
МНО для оценки системы гемостаза, для исключения нарушений свертывающей системы крови;
МРА для оценки состояния сосудов, анатомических и функциональных особенностей кровотока;
КТА для оценки состояния сосудов, анатомических и функциональных особенностей кровотока;
КТ – перфузия для исследования особенностей кровотока, оценки степени нарушения кровотока в мозговых тканях и дифференциации областей необратимого и обратимого повреждения нервных тканей, определения объема очага инфаркта и пенумбры;
МР – перфузия для исследования особенностей кровотока, оценки степени нарушения кровотока в мозговых тканях и дифференциации областей необратимого и обратимого повреждения нервных тканей, определения объема очага инфаркта и пенумбры;
КФК МВ-фракция для ранней диагностики инфаркта миокарда;
тропониновый тест для ранней диагностики инфаркта миокарда;
люмбальная пункция с исследованием ликвора для диагностики состава спинномозговой жидкости, исключения нейроинфекции, геморрагического компонента;
ФГДС по показаниям: диагностика язвы двенадцатиперстной кишки или желудка, диагностика гастрита, дуоденита, эзофагита, при расстройствах глотания, ранняя диагностика рака желудка, внутренних кровотечений;
рентгенография или КТ органов грудной клетки для исключения патологии органов грудной клетки, например, пневмонии и др. заболеваний
ЭхоКГ при подозрении на кардиальную эмболию и при наличии кардиальной патологии в анамнезе;
ЭЭГ при наличии судорожного синдрома;
холтеровское суточное мониторирование ЭКГ при кардиальной патологии;
УЗИ грудной клетки, брюшной полости почек для диагностики заболеваний желудочно-кишечного тракта, особенно если таковые имеются в анамнезе;
УЗИ сосудов (ТКДГ, дуплексное сканирование, триплексное сканирование интра- и экстрацеребральных артерий) для определения атеросклеротических изменений шейных и интракраниальных сосудов, при подозрении на сдавление опухолью, наличие аневризм, стенозов магистральных артерий, наличие ишемического инсульта в анамнезе;
консультация узкого специалиста при наличии сопутствующей патологии внутренних органов или систем в стадии обострения и/или декомпенсации.
тест на агрегацию тромбоцитов для диагностической оценки чрезмерного кровотечения или повышенной кровоточивости, оценки функции тромбоцитов, мониторинг функции тромбоцитов перед сложными хирургическими операциями, при терапии антиагрегантными препаратами: клопидогрель, тикагрелор.
Лечение
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Цель проведения процедуры и вмешательства [1,2,3,4,5,6] (УД-А):
быстрое и полноценное устранение острой окклюзии прецеребральных и церебральных артерий;
быстрое и полноценное восстановление мозгового кровотока;
быстрое и полноценное восстановление перфузии мозга;
уменьшение/устранение ишемических повреждений мозга в пораженном бассейне артерии.
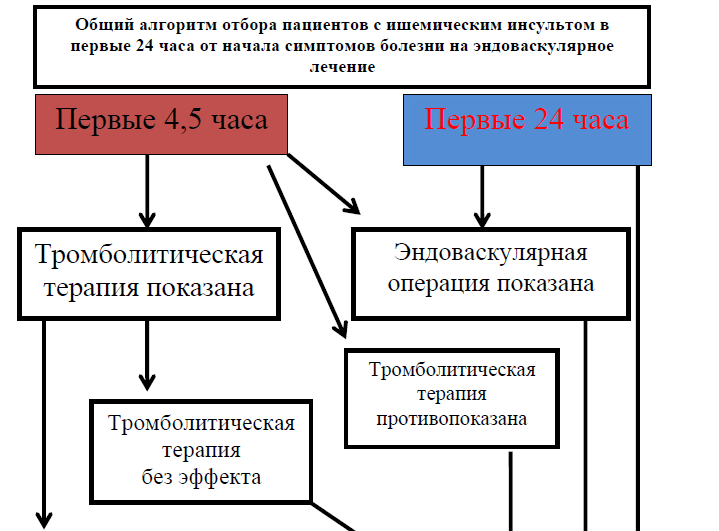
А) Если от начала возникновения симптомов прошло менее 6 часов, то необходимо учитывать следующие критерии для тромбэктомии:
Показания для проведения процедуры/вмешательства:
Показания к эндоваскулярному лечению зависят от прошедшего времени от начала симптомов инсульта.
А) Если от начала возникновения симптомов прошло менее 6 часов, то необходимо учитывать следующие критерии для тромбэктомии:
оценка mRS до инсульта от 0 до 1;
КТА/ МРА/ СЦА: лучевая верификация «проксимальной» окклюзии крупной церебральной артерии (ВСА, М1-М2 сегменты СМА, А1-А2 сегменты передней мозговой артерии, позвоночная артерия, базиллярная артерия, Р1-Р2 сегменты задней мозговой артерии) [1,2,3,4] (УД – А);
возраст ≥ 18 лет;
оценка NIHSS [7,8] ≥ 6; (приложение 1);
ASPECTS [9,10,11] ≥ 6; (УД – А).
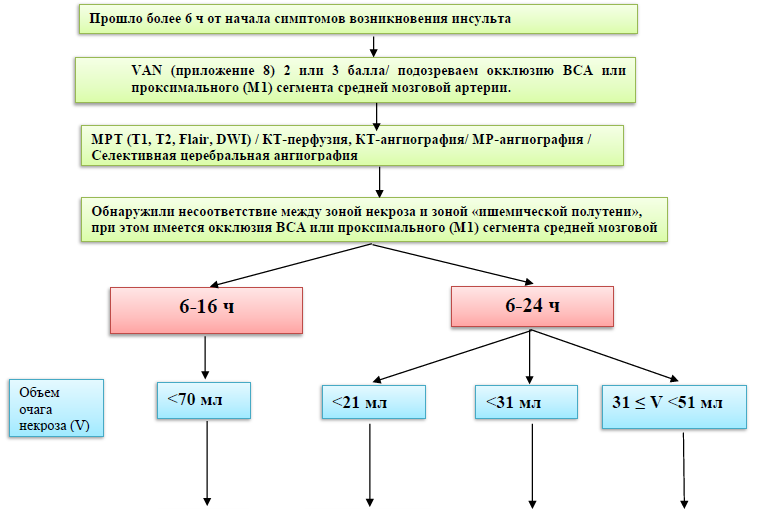
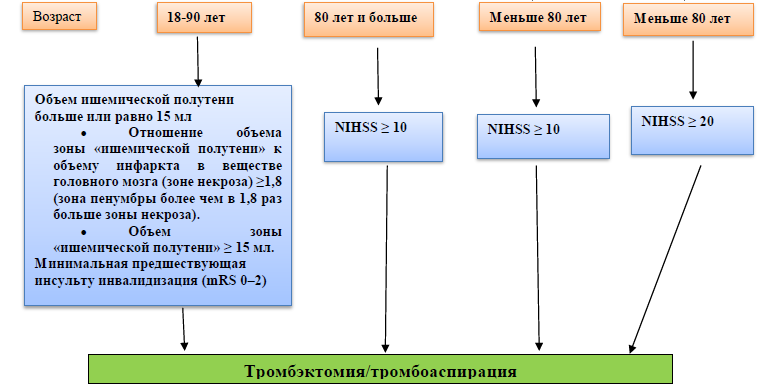
Б) Если от начала возникновения симптомов прошло более 6 часов, но менее 24 часов, то необходимо учитывать критерии исследований: DAWN и DEFUSE 3 [12,13]:
Критерии включения в исследование DEFUSE 3 (6–16 часовое «терапевтическое окно»):
окклюзия ВСА или проксимального (М1) сегмента СМА. Возраст 18-90 лет;
исходный объем инфаркта в веществе головного мозга (зона некроза) менее 70 мл;
отношение объема зоны «ишемической полутени» к объему инфаркта в веществе головного мозга (зоне некроза) ≥1,8 (зона пенумбры более чем в 1,8 раз больше зоны некроза);
объем зоны «ишемической полутени» ≥ 15 мл;
минимальная предшествующая инсульту инвалидизация (mRS 0–2) [13].
Критерии включения в исследование DAWN (6–24 часовое «терапевтическое окно»):
окклюзия ВСА или проксимального (М1) сегмента СМА;
значительное несоответствие между объемом очага инфаркта и тяжестью неврологического дефицита;
для лиц 80 лет и старше: по шкале NIHSS 10 баллов и более и объем очага инфаркта менее 21 мл;
для лиц моложе 80 лет: по шкале NIHSS 10 баллов и более и объем очага инфаркта менее 31 мл;
для лиц моложе 80 лет: по шкале NIHSS 20 баллов и более и объем очага инфаркта от 31 мл до 51 мл [12].
Если у пациента возникла окклюзия крупного сосуда ВСА, М1-М2 сегменты СМА, А1-А2 сегменты передней мозговой артерии, позвоночная артерия, базиллярная артерия, Р1-Р2 сегменты задней мозговой артерии, выявленная в промежутке до 4,5 часов от начала заболевания, и он подходит под критерии проведения тромболитической терапии и эндоваскулярного лечения, то сначала может быть проведена тромболитическая терапия. В случае неэффективности тромболитической терапии проводится механическая тромбэктомия [14,15,16]. Если имеется возможность провести пациенту сразу механическую тромбэктомию, то целесообразно в этом случае проведение эндоваскулярного лечения без предварительной тромболитической терапии [17].
Механическая тромбэктомия (УД-А).
Б) Если от начала возникновения симптомов прошло более 6 часов, но менее 24 часов, то необходимо учитывать критерии исследований: DAWN и DEFUSE 3 [12,13]:
Критерии включения в исследование DEFUSE 3 (6–16 часовое «терапевтическое окно»):
окклюзия ВСА или проксимального (М1) сегмента СМА. Возраст 18-90 лет;
исходный объем инфаркта в веществе головного мозга (зона некроза) менее 70 мл;
отношение объема зоны «ишемической полутени» к объему инфаркта в веществе головного мозга (зоне некроза) ≥1,8 (зона пенумбры более чем в 1,8 раз больше зоны некроза);
объем зоны «ишемической полутени» ≥ 15 мл;
минимальная предшествующая инсульту инвалидизация (mRS 0–2) [13].
Критерии включения в исследование DAWN (6–24 часовое «терапевтическое окно»):
окклюзия ВСА или проксимального (М1) сегмента СМА;
значительное несоответствие между объемом очага инфаркта и тяжестью неврологического дефицита;
для лиц 80 лет и старше: по шкале NIHSS 10 баллов и более и объем очага инфаркта менее 21 мл;
для лиц моложе 80 лет: по шкале NIHSS 10 баллов и более и объем очага инфаркта менее 31 мл;
для лиц моложе 80 лет: по шкале NIHSS 20 баллов и более и объем очага инфаркта от 31 мл до 51 мл [12].
Если у пациента возникла окклюзия крупного сосуда ВСА, М1-М2 сегменты СМА, А1-А2 сегменты передней мозговой артерии, позвоночная артерия, базиллярная артерия, Р1-Р2 сегменты задней мозговой артерии, выявленная в промежутке до 4,5 часов от начала заболевания, и он подходит под критерии проведения тромболитической терапии и эндоваскулярного лечения, то сначала может быть проведена тромболитическая терапия. В случае неэффективности тромболитической терапии проводится механическая тромбэктомия [14,15,16]. Если имеется возможность провести пациенту сразу механическую тромбэктомию, то целесообразно в этом случае проведение эндоваскулярного лечения без предварительной тромболитической терапии [17].
Противопоказания к процедуре/вмешательству:
аллергия к препаратам йода (контрастный препарат);
отсутствие внутрисосудистого доступа (окклюзия подвздошных, бедренных, подключичных, лучевых артерий);
сепсис;
злокачественные опухоли любой локализации в 4 стадии;
соматическая патология в стадии декомпенсации;
коагулопатии, в том числе ДВС-синдром.
Требования к проведению процедуры/вмешательства:
меры безопасности и противоэпидемический режим согласно санитарным правилам «Санитарно-эпидемиологические требования к объектам здравоохранения» Приказ Министра здравоохранения Республики Казахстан от 11 августа 2020 года № ҚР ДСМ-96/2020. Зарегистрирован в Министерстве юстиции Республики Казахстан 12 августа 2020 года № 21080;
приказу Министра национальной экономики Республики Казахстан от 27 февраля 2015 года № 155 Об утверждении гигиенических нормативов "Санитарно-эпидемиологические требования к обеспечению радиационной безопасности". Зарегистрирован в Министерстве юстиции Республики Казахстан 10 апреля 2015 года №10671;
доступность специализированной ангиографической операционной в период терапевтического окна (до 24 часов от начала заболевания, учитывая шкалу ASPECTS 6-10 баллов);
решение о выполнении внутрисосудистого вмешательства при ишемическом инсульте должно приниматься совместно командой специалистов, включающей невролога/нейрохирурга, интервенционного радиолога/радиолога [1,2,3,4,5,6] (УД-С);
эндоваскулярная тромбэктомия и/или тромбоаспирация должна выполняться специально подготовленным специалистом, обладающим опытом выполнения эндоваскулярных вмешательств на экстракраниальных и интракраниальных сосудах [1,2,3,4,5,6] (УД-B);
проведение внутривенной тромболитической терапии не должно приводить к задержке выполнения эндоваскулярной тромбэктомии и/или тромбоаспирации (при наличии показаний к ней) [1,2,3,4,5,6] (УД-А);
выполнение механической тромбэктомии и/или тромбоаспирации при ишемическом инсульте, вызванном окклюзией крупной экстра или интракраниальной артерии (ВСА, М1-М2 сегменты СМА, А1-А2 сегменты передней мозговой артерии, P1-P2 сегменты задней мозговой артерии, ПА или базилярная артерия) рекомендуется в течение 6 часов от возникновения симптомов, в том числе в дополнении к внутривенной тромболитической терапии (проведенной в течение 4,5 часов от начала ИИ) [1,2,3,4,5,6] (УД-А);
выполнение механической тромбэкстракция и/или тромбоаспирации при ишемическом инсульте, вызванном окклюзией крупной артерии в передних отделах артериального круга большого мозга (ВСА, М1 сегмент СМА) рекомендуется в промежуток времени от 6 до 24 часов от начала возникновения симптомов, в том числе в дополнении к внутривенной тромболитической терапии (проведенной в течение 4,5 часов от начала ИИ) [1,2,3,4,5,6](УД-А) (приложение 3);
при противопоказаниях к проведению внутривенной тромболитической терапии, пациенту с ишемическим инсультом, вызванным окклюзией крупной артерии (ВСА, М1-М2 сегменты СМА, А1-А2 сегменты передней мозговой артерии, P1-P2 сегменты задней мозговой артерии, ПА, базилярная артерии) в качестве метода лечения рекомендуется механическая тромбэктомия и/или тромбоаспирация [1,2,3,4,5,6] (УД-А); Механическая тромбэктомия и/или тромбоаспирация может быть также проведена и после системной тромболитической терапии в случае ее неэффективности, а именно сохраняющейся окклюзии крупных сосудов (ВСА, М1-М2 сегменты СМА, А1-А2 сегменты передней мозговой артерии, P1-P2 сегменты задней мозговой артерии, ПА, базилярная артерии);
при интраоперационном выявлении критического стеноза крупных артерий (ВСА, ПА, базилярная артерия, М1 сегменты СМА, А1 сегменты передней мозговой артерии) возможна установка внутрисосудистых стентов на фоне антиагрегантной терапии;
эндоваскулярная тромбэктомия путем механической тромбэкстракции выполняется стент-ретриверами (УД-А). Устройства для эндоваскулярной тромбэктомии могут использоваться по усмотрению выполняющего вмешательство специалиста, если они обеспечивают быструю, полную и безопасную реваскуляризацию в бассейне пораженной артерии [1,2,3,4,5,6] (УД-С);
эндоваскулярная тромбэктомия путем аспирации тромба выполняется специальными катетерами 4-6 френч (УД-А). Катетеры для эндоваскулярной тромбоаспирации могут использоваться по усмотрению выполняющего вмешательство специалиста, если они обеспечивают быструю, полную и безопасную реваскуляризацию в бассейне пораженной артерии [1,2,3,4,5,6] (УД-С);
не отмечено различий в безопасности и качестве эндоваскулярного лечения при общей анестезии и седации [18], таким образом выбор метода анестезии для проведения эндоваскулярного вмешательства при ишемическом инсульте осуществляется индивидуально при этом необходимо избегать увеличения времени до тромбэктомии и/или тромбоаспирации (подготовка и введение в общую анестезию должно выполняться в максимально короткие сроки) [1,2,3,4,5,6] (УД-C); у пациентов, которые подвергаются механической тромбэктомии, разумно поддерживать АД ≤180/105 мм рт. ст. вовремя и в течение 24 часов после процедуры [1,2,3,4,5,6,19] (УД-D). Во время самой процедуры тромбэктомии следует избегать падения артериального давления (УД-D); при неизвестном времени начала возникновения симптомов ишемического инсульта, рекомендуется придерживаться алгоритма (приложение 4).
Требования к оснащению:
рентген-операционная или ангиографический кабинет с предоперационной, пультовой, комнатой технического оснащения. Возможность работы операционной в режиме 24 часа в сутки 7 дней в неделю;
в операционной: операционный стол, операционная бестеневая лампа манипуляционный стол для стерильных инструментов, шкаф для медикаментов, расходные материалы для СЦА и эндоваскулярных интервенционных операций, манжеты высокого давления для непрерывной подачи физиологического раствора в катетер,
рентген-защита: рентген защитные фартуки, рентген защитные очки, индивидуальные дозиметры для персонала операционной;
рентгеновский аппарат: ангиографическая установка с консолями и мониторами изображения, мониторинг жизненно важных параметров пациента, процессорами обработки изображения, архивации информации.
аппарат искусственной вентиляции легких, централизованная подача кислорода, дефибриллятор, медицинский отсос, набор для интубации трахеи, шкаф с медикаментами (анафилактический шок), манипуляционный анестезиологический столик, шприцевые инфузионные насосы, дефибриллятор;
функционирующие КТ/МРТ кабинеты или ангиографические установки с функцией КТ.
Требования к подготовке пациента:
подготовка паховой области;
положение пациента на операционном столе на спине;
обеспечение венозного доступа;
стандартная для рентгенохирургических пациентов подготовка операционного поля антисептиком.
Механическая тромбэктомия [1,4]:
Аспирация тромбов [1,4]:
Стентирование [1,4]:
Ангиопластика [1,4]:
Внутриартериальный тромболизис [1,4]:
Методика проведения процедуры (вмешательства) [1,2,3,4,5,6,14,19,20,21,22].
Эндоваскулярное лечение ишемического инсульта в острейшем периоде можно разделить на следующие виды операций (название операции по МКБ-9):
Механическая тромбэктомия [1,4]:
эндоваскулярное удаление обструкции сосудов головы и шеи
Аспирация тромбов [1,4]:
эндоваскулярное удаление обструкции сосудов головы и шеи
Стентирование [1,4]:
чрезкожная имплантация стентов во внутричерепные артерии
чрескожная установка стентов в каротидную артерию
чрезкожная установка других стентов для экстракраниальных артерий
эндоваскулярное стентирование сосудов головы и шеи
Ангиопластика [1,4]:
чрескожная ангиопластика или атерэктомия интракраниальных сосудов
эндоваскулярная баллонная ангиопластика сосудов
Внутриартериальный тромболизис [1,4]:
эндоваскулярное удаление обструкции сосудов головы и шеи
другие эндоваскулярные процедуры на других сосудах
Эндоваскулярные вмешательства на экстракраниальных и интракраниальных сосудах условно делятся на следующие этапы:
начальный диагностический этап - СЦА;
основной этап – непосредственно вмешательство на пораженных артериях (механическая тромбэктомия, тромбоаспирация, селективный внутриартериальный тромболизис, ангиопластика, стентирование);
контрольный диагностический этап – СЦА, КТ-головного мозга (на аппаратах с функцией КТ).
Начальный диагностический этап:
Положение пациента на столе на спине. Пациент подключается к монитору жизненных функций (частота сердечных сокращений, артериальное давление, по необходимости ЭКГ, инвазивное измерение артериального давления, т.д.), в вену устанавливается периферический катетер для инфузий. Выбор метода анестезии для проведения эндоваскулярного вмешательства при ишемическом инсульте осуществляется индивидуально, т.к. нет различий в безопасности и качестве эндоваскулярного лечения при общей анестезии и седации [18]. В случаях с аллергией ко всем местным анестетикам – пункция сосуда может выполняться без анестезии. Обработка операционного поля антисептиками. Выполняется пункция бедренной артерии (по показаниям лучевая, сонная артерии) иглой, далее по методу Сельдингера устанавливается интродьюсер. По интрадьюсеру проводится диагностический и направительный катетеры в область дуги аорты и далее в ее ветви (брахиоцефальный ствол, правая и левая подключичные и ПА, общие, ВСА), последовательно вводится рентгеноконтрастное вещество (приложение 5). Обязательным условием нейроинтервенционных вмешательств является использование промывной системы высокого давления, также в промывную систему возможно добавления нимодипина из расчета 3 мг на 1 литр физиологического раствора с целью профилактики вазоспазма (приложение 5). При наличии верифицированных на КТА/МРА данных о пораженной артерии, катетер устанавливается непосредственного в целевой экстракраниальной артерии. Под рентгеноскопическим и рентгенографическим контролем вводятся рентгеноконтрастные вещества в различных проекциях полипозиционно – контрастируются артерии, капилляры, вены. Проводится оценка полученных данных. Затем направительный катетер устанавливается в целевом сосуде.
Основной этап:
Далее по направительному катетеру заводится микроинструментарий (микропроводники, микрокатетеры), который подводится непосредственно к области патологии экстракраниальных или интракраниальных сосудов. Выполняются вмешательства на области патологии сосуда.
Механическая тромбэктомия (УД-А).
Механическая тромбэктомия стент-ретриверами [1,2,3,4,5,6,20,21,22,23] (УД-А).
Направительный катетер устанавливается в экстракраниальном отделе ВСА или ПА. Под ангиографическим и рентгеноскопическим контролем в область окклюзии крупной церебральной артерии (ВСА, М1-М2 сегменты СМА, А1-А2 сегменты передней мозговой артерии, ПА, базиллярная артерия, Р1-Р2 сегменты задней мозговой артерии) и далее через окклюзированный участок – тромб, по микропроводнику проводится микрокатетер для доставки стентов, подсоединенный к Y-коннектору. Выполняется суперселективная ангиография – уточняется локализация микрокатетера к отношению к тромбированному участку артерии, дистальный бассейн, исключается перфорация артерии. По микрокатетеру заводится внутрисосудистый стент- ретривер. Стент- ретривер раскрывается на уровне тромба, удерживается на уровне тромба не менее 1 минуты для пенетрации тромба через ячейки стента. Выполняется ангиография из направительного катетера – оценивается захват тромба стентом, степень временной реканализации. Стент-ретривер удаляется в раскрытом виде, в сопровождении аспирации крови (до 30 мл) из направительного катетера шприцем 20 мл. При применении направительного катетера двухпросветного с окклюзионным баллоном – баллон раздувается в просвете ВСА при удалении стента и тромба, с целью остановки антеградного тока крови, профилактики эмболии новых территорий. При сохранении окклюзии артерии, рекомендовано выполнение до 5 этапов удаления тромба.
Механическая тромбэктомия аспирационными катетерами [1,2,3,4,5,6,24] (УД-С). Данный вид механической тромбэктомии отличается от тромбэктомии стент- ретриверами тем, что в область окклюзии крупной церебральной артерии (ВСА, М1-М2 сегменты СМА, А1-А2 сегменты передней мозговой артерии, P1-P2 сегменты задней мозговой артерии, ПА, базилярная артерия) устанавливается направительный катетер для дистального доступа, катетер через участок тромба далее не проводится. Выполняется аспирация тромба при помощи аспирационной помпы или шприца 20 мл. Достигается аспирационное удаление тромба из просвета артерии в большинстве клинических случаев. В случаях, когда тромб обтурирует дистальный просвет катетера, применяется техника ADAPT– катетер для дистального доступа удаляется вместе с тромбом, в сопровождении аспирации крови (до 30 мл) из направительного катетера шприцем 20 мл.
Селективный тромболизис [1,2,3,4,5,6,22,25,26,27](УД-С).
Комбинация механической тромбэктомии стент-ретривером с аспирационными катетерами [1,2,3,4,5,6,24] (УД-А).
Особенностью данной комбинации механической тромбэктомии является доставка микрокатетера и стент-ретривера в область окклюзии крупной церебральной артерии по направительному катетеру для дистального доступа, установленного перед участком окклюзии. При данной методике аспирация крови при удалении стент-ретривера с тромбом выполняется из направительного катетера непосредственно в области окклюзии артерии, достигается максимальный эффект тромбэктомии при минимальном риске эмболии новой территории.
Селективный тромболизис [1,2,3,4,5,6,22,25,26,27](УД-С).
Селективный тромболизис может применяется как самостоятельное вмешательство при отсутствии возможности выполнения механической тромбэктомии и отсутствии противопоказаний к тромболитической терапии. В комбинации с механической тромбэктомией в основном используется при дистальной миграции тромбов.
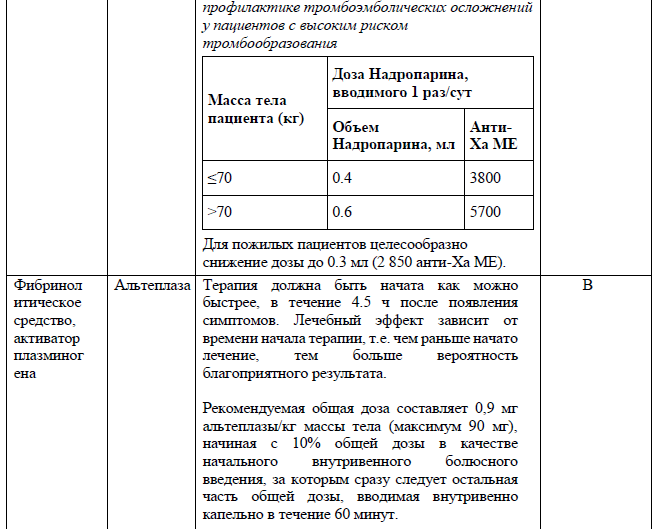
С тромболитической целью интраартериально через направительный катетер или микрокатетер вводится болюсно альтеплаза (приложение 5) в дозе 2-5 мг. Суперселективная ангиография через направительный катетер или микрокатетер может выполняться через регулярные промежутки времени для оценки степени лизиса сгустка и корректировки дозировки и объема тромболитического агента. При отсутствии желаемого лизиса тромба дополнительно может быть введено еще 2-5 мг альтеплазы. Если происходит частичное растворение сгустка, микрокатетер может быть продвинут непосредственно к области тромба, где выполняется дополнительный тромболизис с введением дополнительно 2-5 мг альтеплазы. Целесообразно продвижение микрокатетера к более дистальным ветвям внутричерепных артерий до сегментов M2-М3, так чтобы большая часть тромболитического агента попадала в закупоренный сосуд, а не смывалась преимущественно в соседние открытые кровеносные сосуды. Цель состоит в том, чтобы добиться реканализации с минимальным количеством тромболитических агентов и снизить риск кровотечения. После 2-5 болюсных интраартериальных иньекций тромболитического препарата, оставшуюся дозу альтеплазы можно ввести внутривенно в течение 40 минут. При этом общая доза введенной в\а и в\в альтеплазы не должна превышать 0.9 мг/кг.
Ангиопластика и/или стентирование стенозов и окклюзий экстракраниальных и интракраниальных артерий [1,2,3,4,5,6,28] (УД-С).
Данный вид вмешательства применяется при ишемическом инсульте на фоне диссекции артерии, атеросклеротической бляшке. При критическом стенозе и окклюзии экстракраниальных артерий, также неэффективной механической тромбэктомии на фоне атеросклеротической бляшки интракраниальной артерии, выполняется баллонная ангиопластика пораженного сегмента артерии. Через участок стеноза и окклюзии проводится микропроводник, в случае окклюзии артерии применяется микрокатетер для направленного прохождения микропроводника, выполняется замена на баллонный катетер – диаметр баллона выбирается на 0,25-0,5 мм меньше истинного диаметра артерии.
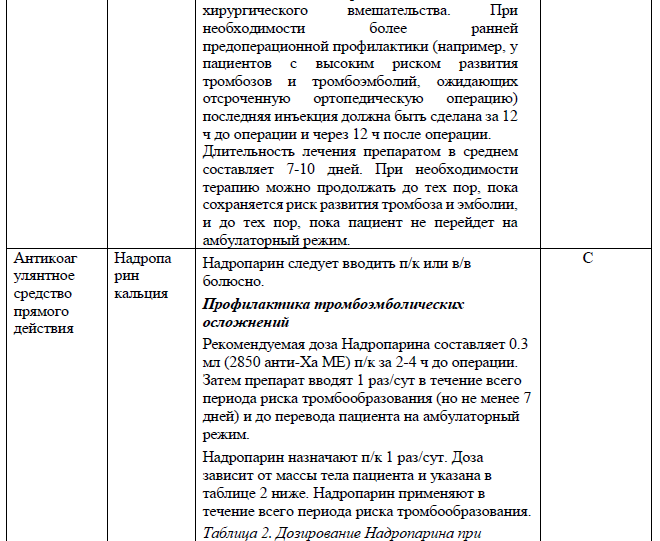
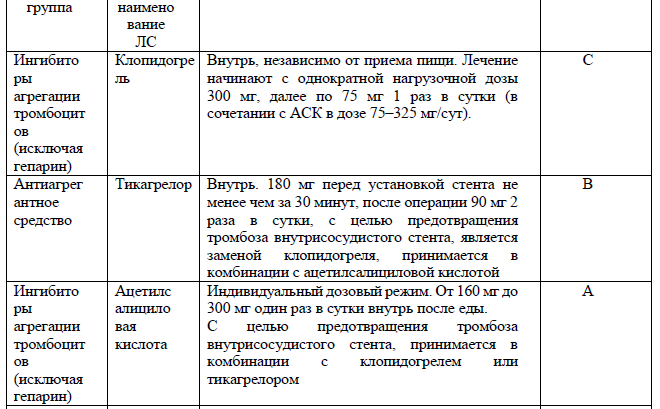
При большей степени остаточного стеноза, риске реокклюзии артерии – принимается решение о стентировании артерии. Стент устанавливается на уровне поражения артерии и должен адекватно прилегать к стенке артерии. При стентировании ВСА используются системы защиты от дистальной эмболии. При необходимости установки стента проводится подготовка – внутрь вводится ацетилсалициловая кислота до 500 мг, внутривенно вводится гепарин 5000 Ед. (приложение 5). Принимается решение о назначении клопидогреля или тикагрелора (приложение 5). В послеоперационном периоде назначается нефракционированный или низкомолекулярный гепарин (приложение 5).
Контрольный диагностический этап
Проводится контрольная СЦА в прямой и боковой проекциях, полученные ангиограммы сравниваются с ангиограммами полученными в начальном этапе. По окончании операции – микроинструментарий извлекается из направительного катетера. Катетеры, интродьюсер удаляются, на область пункции артерии накладывается стерильная повязка, проводится мануальная компрессия артерии в области пункции до достижения гемостаза (от 5 минут и более), по достижении гемостаза накладывается давящая повязка. При наличии закрывающих устройств в области пункции артерии
– процедура выполняется согласно инструкции устройства. В случае установки стентов и необходимости повторной операции, контроля артериального давления с применением инвазивных датчиков, интрадъюсер фиксируется и накладывается асептическая повязка.
Индикаторы эффективности процедуры/вмешательства:
реваскуляризация бассейна окклюзированной артерии mTICI 2b-3 балла (приложение 6) [29];
регресс неврологического дефицита, уменьшение баллов по шкале NIHSS в сравнении с исходным состоянием;
достижение mRS 0-2 балла на момент выписки пациента и на 90-сутки после операции (приложение 7) [30,31,32].
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2023
- 1) Powers WJ, Rabinstein AA, Ackerson T, Adeoye OM, Bambakidis NC, Becker K, Biller J, Brown M, Demaerschalk BM, Hoh B, Jauch EC, Kidwell CS, Leslie-Mazwi TM, Ovbiagele B, Scott PA, Sheth KN, Southerland AM, Summers DV, Tirschwell DL. Guidelines for the Early Management of Patients With Acute Ischemic Stroke: 2019 Update to the 2018 Guidelines for the Early Management of Acute Ischemic Stroke: A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association. Stroke. 2019 Dec;50(12):e344-e418. doi: 10.1161/STR.0000000000000211. Epub 2019 Oct 30. Erratum in: Stroke. 2019 Dec;50(12):e440-e441. PMID: 31662037. 2) Turc G, Bhogal P, Fischer U, Khatri P, Lobotesis K, Mazighi M, Schellinger PD, Toni D, de Vries J, White P, Fiehler J. European Stroke Organisation (ESO) - European Society for Minimally Invasive Neurological Therapy (ESMINT) Guidelines on Mechanical Thrombectomy in Acute Ischaemic StrokeEndorsed by Stroke Alliance for Europe (SAFE). Eur Stroke J. 2019 Mar;4(1):6-12. doi: 10.1177/2396987319832140. Epub 2019 Feb 26. PMID: 31165090; PMCID: PMC6533858. 3) Boulanger JM, Lindsay MP, Gubitz G, Smith EE, Stotts G, Foley N, Bhogal S, Boyle K, Braun L, Goddard T, Heran M, Kanya-Forster N, Lang E, Lavoie P, McClelland M, O'Kelly C, Pageau P, Pettersen J, Purvis H, Shamy M, Tampieri D, vanAdel B, Verbeek R, Blacquiere D, Casaubon L, Ferguson D, Hegedus Y, Jacquin GJ, Kelly M, Kamal N, Linkewich B, Lum C, Mann B, Milot G, Newcommon N, Poirier P, Simpkin W, Snieder E, Trivedi A, Whelan R, Eustace M, Smitko E, Butcher K. Canadian Stroke Best Practice Recommendations for Acute Stroke Management: Prehospital, Emergency Department, and Acute Inpatient Stroke Care, 6th Edition, Update 2018. Int J Stroke. 2018 Dec;13(9):949-984. doi: 10.1177/1747493018786616. Epub 2018 Jul 18. PMID: 30021503. 4) Клинические рекомендации: Ишемический инсульт и транзиторная ишемическая атака у взрослых / Всероссийское общество неврологов, Национальная ассоциация по борьбе с инсультом, Ассоциация нейрохирургов России, МОО Объединение нейроанестезиологов и нейрореаниматологов, Союз реабилитологов России М., 2020. 5) Berkhemer, O.A., et al. A randomized trial of intraarterial treatment for acute ischemic stroke. N Engl J Med. 2015 Jan 1;372(1):11-20. 6) Goyal, M., et al. Randomized assessment of rapid endovascular treatment of ischemic stroke. N Engl J Med. 2015 Mar 12;372(11):1019-1030. 7) Шкала инсульта Национального института здоровья NIHSS (National Institutes of Health Stroke Scale, Brott T., Adams H.P., 1989). 8) Heldner, M.R., et al. National Institutes of Health stroke scale score and vessel occlusion in 2152 patients with acute ischemic stroke. Stroke. 2013 Apr;44(4):1153-1157. 9) Demchuk, A.M.; Coutts, S.B. Alberta Stroke Program Early CT Score in acute stroke triage. Neuroimaging clinics of North America. 2005 May;15(2):409-419, xii. 10) Marks, M.P., et al. Evaluation of early computed tomographic findings in acute ischemic stroke. Stroke. 1999 Feb;30(2):389-392. 11) Srinivasan, A., et al. State-of-the-art imaging of acute stroke. Radiographics. 2006 Oct;26Suppl 1:S75-95. 12) Nogueira RG, Jadhav AP, Haussen DC, Bonafe A, Budzik RF, Bhuva P, Yavagal DR, Ribo M, Cognard C, Hanel RA, Sila CA, Hassan AE, Millan M, Levy EI, Mitchell P, Chen M, English JD, Shah QA, Silver FL, Pereira VM, Mehta BP, Baxter BW, Abraham MG, Cardona P, Veznedaroglu E, Hellinger FR, Feng L, Kirmani JF, Lopes DK, Jankowitz BT, Frankel MR, Costalat V, Vora NA, Yoo AJ, Malik AM, Furlan AJ, Rubiera M, Aghaebrahim A, Olivot JM, Tekle WG, Shields R, Graves T, Lewis RJ, Smith WS, Liebeskind DS, Saver JL, Jovin TG; DAWN Trial Investigators. Thrombectomy 6 to 24 Hours after Stroke with a Mismatch between Deficit and Infarct. N Engl J Med. 2018 Jan 4;378(1):11-21. doi: 10.1056/NEJMoa1706442. Epub 2017 Nov 11. PMID: 29129157. 13) Albers GW, Marks MP, Kemp S, Christensen S, Tsai JP, Ortega-Gutierrez S, McTaggart RA, Torbey MT, Kim-Tenser M, Leslie-Mazwi T, Sarraj A, Kasner SE, Ansari SA, Yeatts SD, Hamilton S, Mlynash M, Heit JJ, Zaharchuk G, Kim S, Carrozzella J, Palesch YY, Demchuk AM, Bammer R, Lavori PW, Broderick JP, Lansberg MG; DEFUSE 3 Investigators. Thrombectomy for Stroke at 6 to 16 Hours with Selection by Perfusion Imaging. N Engl J Med. 2018 Feb 22;378(8):708-718. doi: 10.1056/NEJMoa1713973. Epub 2018 Jan 24. PMID: 29364767; PMCID: PMC6590673. 14) Zi W, Qiu Z, Li F, et al. Effect of Endovascular Treatment Alone vs Intravenous Alteplase Plus Endovascular Treatment on Functional Independence in Patients With Acute Ischemic Stroke: The DEVT Randomized Clinical Trial. JAMA. 2021;325(3):234–243. doi:10.1001/jama.2020.23523 15) Treurniet KM, LeCouffe NE, Kappelhof M, Emmer BJ, van Es ACGM, Boiten J, Lycklama GJ, Keizer K, Yo LSF, Lingsma HF, van Zwam WH, de Ridder I, van Oostenbrugge RJ, van der Lugt A, Dippel DWJ, Coutinho JM, Roos YBWEM, Majoie CBLM; MR CLEAN-NO IV Investigators. MR CLEAN-NO IV: intravenous treatment followed by endovascular treatment versus direct endovascular treatment for acute ischemic stroke caused by a proximal intracranial occlusion-study protocol for a randomized clinical trial. Trials. 2021 Feb 15;22(1):141. doi: 10.1186/s13063-021-05063-5. PMID: 33588908; PMCID: PMC7885482. 16) Meyer L, Stracke CP, Jungi N, Wallocha M, Broocks G, Sporns PB, Maegerlein C, Dorn F, Zimmermann H, Naziri W, Abdullayev N, Kabbasch C, Behme D, Jamous A, Maus V, Fischer S, Möhlenbruch M, Weyland CS, Langner S, Meila D, Miszczuk M, Siebert E, Lowens S, Krause LU, Yeo LLL, Tan BY, Anil G, Gory B, Galván J, Arteaga MS, Navia P, Raz E, Shapiro M, Arnberg F, Zelenák K, Martinez-Galdamez M, Fischer U, Kastrup A, Roth C, Papanagiotou P, Kemmling A, Gralla J, Psychogios MN, Andersson T, Chapot R, Fiehler J, Kaesmacher J, Hanning U. Thrombectomy for Primary Distal Posterior Cerebral Artery Occlusion Stroke: The TOPMOST Study. JAMA Neurol. 2021 Apr 1;78(4):434-444. doi: 10.1001/jamaneurol.2021.0001. PMID: 33616642; PMCID: PMC7900924. 17) Yang P, Zhang Y, Zhang L, Zhang Y, Treurniet KM, Chen W, Peng Y, Han H, Wang J, Wang S, Yin C, Liu S, Wang P, Fang Q, Shi H, Yang J, Wen C, Li C, Jiang C, Sun J, Yue X, Lou M, Zhang M, Shu H, Sun D, Liang H, Li T, Guo F, Ke K, Yuan H, Wang G, Yang W, Shi H, Li T, Li Z, Xing P, Zhang P, Zhou Y, Wang H, Xu Y, Huang Q, Wu T, Zhao R, Li Q, Fang Y, Wang L, Lu J, Li Y, Fu J, Zhong X, Wang Y, Wang L, Goyal M, Dippel DWJ, Hong B, Deng B, Roos YBWEM, Majoie CBLM, Liu J; DIRECT-MT Investigators. Endovascular Thrombectomy with or without Intravenous Alteplase in Acute Stroke. N Engl J Med. 2020 May 21;382(21):1981-1993. doi: 10.1056/NEJMoa2001123. Epub 2020 May 6. PMID: 32374959. 18) Sørensen LH, Speiser L, Karabegovic S, Yoo AJ, Rasmussen M, Sørensen KE, Simonsen CZ. Safety and quality of endovascular therapy under general anesthesia and conscious sedation are comparable: results from the GOLIATH trial. J Neurointerv Surg. 2019 Nov;11(11):1070-1072. doi: 10.1136/neurintsurg-2019-014712. Epub 2019 Mar 29. PMID: 30926686. 19) Kleindorfer DO, Towfighi A, Chaturvedi S, Cockroft KM, Gutierrez J, Lombardi-Hill D, Kamel H, Kernan WN, Kittner SJ, Leira EC, Lennon O, Meschia JF, Nguyen TN, Pollak PM, Santangeli P, Sharrief AZ, Smith SC Jr, Turan TN, Williams LS. 2021 Guideline for the Prevention of Stroke in Patients With Stroke and Transient Ischemic Attack: A Guideline From the American Heart Association/American Stroke Association. Stroke. 2021 May 24:STR0000000000000375. doi: 10.1161/STR.0000000000000375. Epub ahead of print. PMID: 34024117. 20) Saver, J.L., et al. Solitaire flow restoration device versus the Merci Retriever in patients with acute ischaemic stroke (SWIFT): a randomised, parallel-group, non- inferiority trial. Lancet. 2012 Oct 6;380(9849):1241-1249. 21) Nogueira, R.G., et al. Trevo versus Merci retrievers for thrombectomyrevascularisation of large vessel occlusions in acute ischaemic stroke (TREVO 2): a randomised trial. Lancet. 2012 Oct 6;380(9849):1231-1240. 22) Saver, J.L., et al. Stent-Retriever Thrombectomy after Intravenous t-PA vs. t-PA Alone in Stroke. N Engl J Med. 2015 Apr 17. 23) Jovin, T.G., et al. Thrombectomy within 8 Hours after Symptom Onset in Ischemic Stroke. N Engl J Med. 2015 Apr 17. 24) Turk, A.S., et al. Initial clinical experience with the ADAPT technique: a direct aspiration first pass technique for stroke thrombectomy. Journal of neurointerventional surgery. 2014 Apr 1;6(3):231-237. 25) Abou-Chebl A. Intra-arterial therapy for acute ischemic stroke. Neurotherapeutics. 2011 Jul;8(3):400-13. doi: 10.1007/s13311-011-0059-8. PMID: 21717263; PMCID: PMC3250276. 26) Higashida RT, Furlan AJ, Roberts H, Tomsick T, Connors B, Barr J, Dillon W, Warach S, Broderick J, Tilley B, Sacks D; Technology Assessment Committee of the American Society of Interventional and Therapeutic Neuroradiology; Technology Assessment Committee of the Society of Interventional Radiology. Trial design and reporting standards for intra-arterial cerebral thrombolysis for acute ischemic stroke. Stroke. 2003 Aug;34(8):e109-37. doi: 10.1161/01.STR.0000082721.62796.09. Epub 2003 Jul 17. Erratum in: Stroke. 2003 Nov;34(11):2774. PMID: 12869717. 27) Shaltoni HM, Albright KC, Gonzales NR, Weir RU, Khaja AM, Sugg RM, Campbell MS 3rd, Cacayorin ED, Grotta JC, Noser EA. Is intra-arterial thrombolysis safe after full-dose intravenous recombinant tissue plasminogen activator for acute ischemic stroke? Stroke. 2007 Jan;38(1):80-4. doi: 10.1161/01.STR.0000251720.25337.b0. Epub 2006 Nov 22. PMID: 17122433. 28) Kappelhof, M., et al. Intra-arterial treatment of patients with acute ischemic stroke and internal carotid artery occlusion: a literature review. Journal of neurointerventional surgery. 2015 Jan;7(1):8-15. 29) Higashida RT, Furlan AJ, Roberts H, et al. Trial design and reporting standards for intra-arterial cerebral thrombolysis for acute ischemic stroke. Stroke 2003;34:e109 –137 30) Rankin J. “Cerebral vascular accidents in patients over the age of 60.” Scott Med J 1957;2:200-15 31) Bonita R, Beaglehole R. “Modification of Rankin Scale: Recovery of motor function after stroke.” Stroke 1988 Dec;19(12):1497-1500 32) Van Swieten JC, Koudstaal PJ, Visser MC, Schouten HJ, van Gijn J. “Interobserver agreement for the assessment of handicap in stroke patients.” Stroke 1988;19(5):604-7 33) Birnbaum L, Wampler D, Shadman A, de Leonni Stanonik M, Patterson M, Kidd E, Tovar J, Garza A, Blanchard B, Slesnick L, Blanchette A, Miramontes D. Paramedic utilization of Vision, Aphasia, Neglect (VAN) stroke severity scale in the prehospital setting predicts emergent large vessel occlusion stroke. J Neurointerv Surg. 2021 Jun;13(6):505-508. doi: 10.1136/neurintsurg-2020-016054. Epub 2020 Jul 1. PMID: 32611621. 34) Navalkele D, Vahidy F, Kendrick S, Traylor A, Haydel M, Drury S, Martin-Schild S. Vision, Aphasia, Neglect Assessment for Large Vessel Occlusion Stroke. J Stroke Cerebrovasc Dis. 2020 Jan;29(1):104478. doi: 10.1016/j.jstrokecerebrovasdis.2019.104478. Epub 2019 Nov 6. PMID: 31704124. 35) Teleb MS, Ver Hage A, Carter J, Jayaraman MV, McTaggart RA. Stroke vision, aphasia, neglect (VAN) assessment-a novel emergent large vessel occlusion screening tool: pilot study and comparison with current clinical severity indices. J Neurointerv Surg. 2017 Feb;9(2):122-126. doi: 10.1136/neurintsurg-2015-012131. Epub 2016 Feb 17. PMID: 26891627; PMCID: PMC5284468.
Информация
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ВНЕДРЕНИЯ ПРОТОКОЛА
Список разработчиков с указанием квалификационных данных:
1) Адильбеков Ержан Боранбаевич – нейрохирург высшей квалификационной категории, MBA, PhDr, директор Республиканского координационного центра по проблемам инсульта, АО «Национальный центр нейрохирургии», профессор АО «Национального центра нейрохирургии», член ОО «Казахской ассоциации нейрохирургов», член президиума Общества доказательной неврологии Российской Федерации, член ESO Европейской ассоциации инсульта.
2) Махамбетов Ербол Таргынулы – нейрохирург высшей квалификационной категории, заведующий отделением сосудистой и функциональной нейрохирургии АО «Национальный центр нейрохирургии», кандидат медицинских наук, Ассоциированный профессор, Лауреат государственной премии Республики Казахстан, Председатель секции сосудистой нейрохирургии ОО «Казахской ассоциации нейрохирургов»;
3) Калиев Асылбек Бактбекович – нейрохирург высшей квалификационной категории отделения сосудистой и функциональной нейрохирургии АО «Национальный центр нейрохирургии», начальник отдела госпитального менеджмента, PhD, член ОО «Казахской ассоциации нейрохирургов»;
4) Суров Владимир Константинович – клинический фармацевт, главный специалист группы клинической фармакологии АО «Национальный центр нейрохирургии», магистр по специальности «Фармация», член Ассоциации клинических фармакологов и фармацевтов Республики Казахстан, член Европейской ассоциации клинических фармакологов и терапевтов, имеет лицензию Генерального фармацевтического Совета Великобритании.
5) Медуханова Сабина Гарафовна – врач невролог, магистр общественного здравоохранения (JMPH), главный специалист Республиканского координационного центра по проблемам инсульта, АО «Национальный центр нейрохирургии», полноправный член РОО «Казахстанской ассоциация менеджеров здравоохранения», член Европейской ассоциации по инсульту (European Stroke Organization).
Конфликт интересов: отсутствует.
Рецензенты:
1) Бирючков Михаил Юрьевич – доктор медицинских наук, НАО «Западно-Казахстанский медицинский университет имени Марата Оспанова», руководитель кафедры нейрохирургии с курсом травматологии, главный внештатный нейрохирург Управления здравоохранения по Актюбинской области, врач-нейрохирург высшей категории;
2) Махамбаев Габит Джандильдинович – кандидат медицинских наук, КГП «Многопрофильная больница имени профессора Х.Ж. Макажанова», руководитель центра нейрохирургии и неврологии главный внештатный нейрохирург Управления здравоохранения по Карагандинской области, врач-нейрохирург высшей категории, интервенционный радиолог.
Условия пересмотра протокола: через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности).
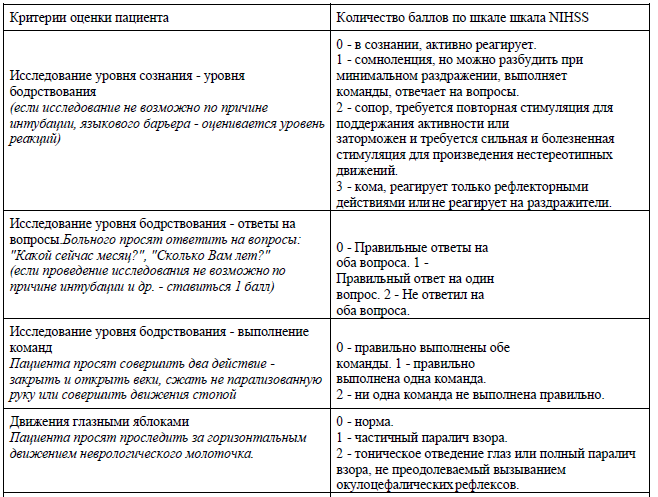
Приложение 1
Шкала инсульта Национального института здоровья (Шкала NIHSS).

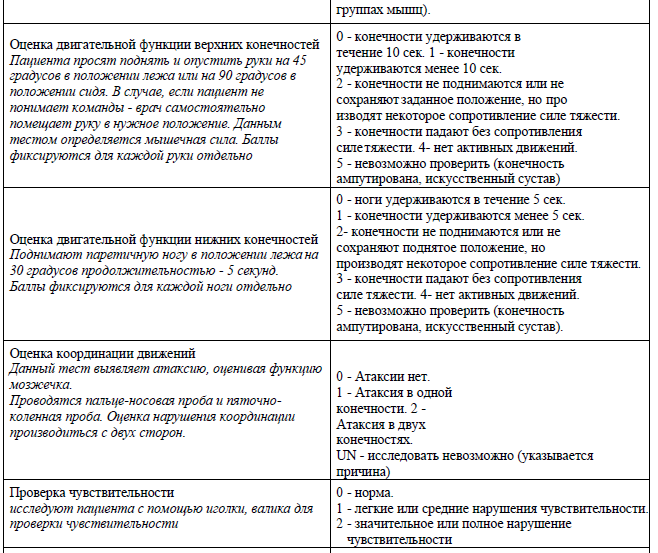

Приложение 2

Приложение 3
Алгоритм отбора пациентов с ишемическим инсультом в сроки от 6 до 24 часов от начала симптомов болезни на эндоваскулярное лечение.
Приложение 4
Алгоритм диагностических исследований для отбора на эндоваскулярное лечение пациентов, у которых неизвестно время начала симптомов
Приложение 5
Перечень основных лекарственных средств (имеющих 100% вероятность применения)







Приложение 6
Модифицированная шкала восстановления перфузии при ишемическом инсульте (mTICI).

Приложение 7
Шкала mRS (Модифицированная шкала Рэнкина, UKTIA StudyGroup, 1988).
0 – нет симптомов.
1 – отсутствие существенных нарушений жизнедеятельности, несмотря на наличие некоторых симптомов болезни; пациент способен выполнять все обычные повседневные обязанности.
2 – легкое нарушение жизнедеятельности; пациент неспособен выполнять некоторые прежние обязанности, но справляется с собственными делами без посторонней помощи.
3 – умеренное нарушение жизнедеятельности; потребность в некоторой помощи, но ходит самостоятельно.
4 – выраженное нарушение жизнедеятельности; неспособен ходить без посторонней помощи, справляться со своими физическими потребностями без посторонней помощи.
5 – грубое нарушение жизнедеятельности; прикован к постели, недержание кала и мочи, потребность в постоянной помощи медицинского персонала.
6 – смерть пациента.
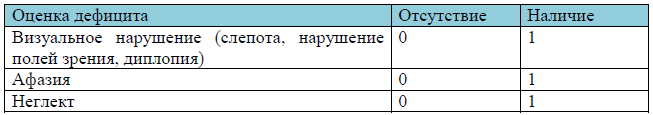
Существует оценочная шкала VAN [33,34,35] (визуализация, афазия, неглект), которая позволяет в процессе оценки неврологического дефицита заподозрить окклюзию крупной церебральной артерии. Наличие у пациента 2 баллов по данной шкале считается положительным результатом и является показанием к проведению КТА или КТ-перфузии или МРТ с целью верификации окклюзии церебрального сосуда и решения вопроса о тромбэктомии. Оценка дефицита по шкале VAN рассчитывается на основе наличия визуального нарушения (слепота, нарушение полей зрения, диплопия, 0 — 1 балл), афазии (0 — 1 балл) и неглекта (0 — 1 балл).
Приложение 8
Существует оценочная шкала VAN [33,34,35] (визуализация, афазия, неглект), которая позволяет в процессе оценки неврологического дефицита заподозрить окклюзию крупной церебральной артерии. Наличие у пациента 2 баллов по данной шкале считается положительным результатом и является показанием к проведению КТА или КТ-перфузии или МРТ с целью верификации окклюзии церебрального сосуда и решения вопроса о тромбэктомии. Оценка дефицита по шкале VAN рассчитывается на основе наличия визуального нарушения (слепота, нарушение полей зрения, диплопия, 0 — 1 балл), афазии (0 — 1 балл) и неглекта (0 — 1 балл).

Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.