Хронический лимфолейкоз
 Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Общая информация
Краткое описание
Одобрен
КЛИНИЧЕСКИЙ ПРОТОКОЛ ПО ДИАГНОСТИКЕ И ЛЕЧЕНИЮ
Хронический лимфоцитарный лейкоз – опухолевое заболевание системы крови, характеризующееся пролиферацией и накоплением в крови, костном мозге и лимфоидных органах морфологически зрелых и иммунологически некомпетентных В-лимфоцитов, имеющих характерный иммунофенотип (CD19+/СD5+/ CD23+/CD20dim+/ CD79βdim+).) [1].
Код(ы) МКБ-10:
| МКБ-10 | |
|
Код
|
Название |
| С91.1 | Хронический лимфоцитарный лейкоз |
Дата разработки/пересмотра протокола: 2015 год (пересмотр 2022 год).
Категория пациентов: взрослые.
Шкала уровня доказательности [1]:
| А | Высококачественный мета-анализ, систематический обзор рандомизированных клинических исследований (РКИ) или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или Неконтролируемое исследование или Мнение экспертов |
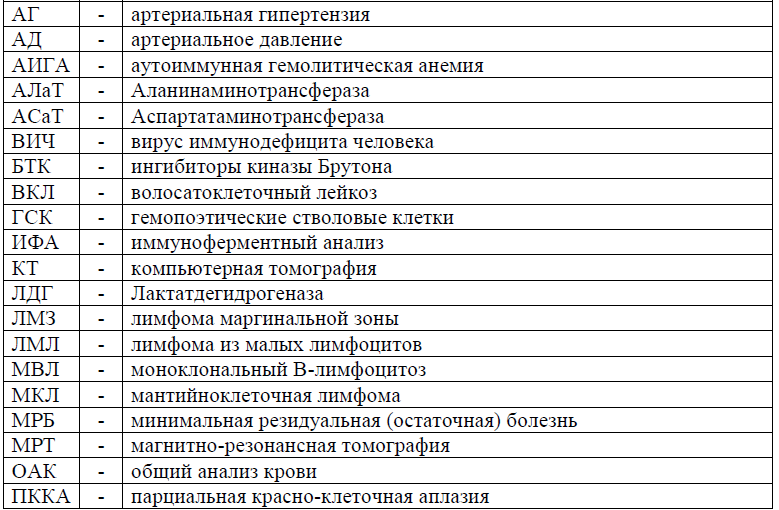
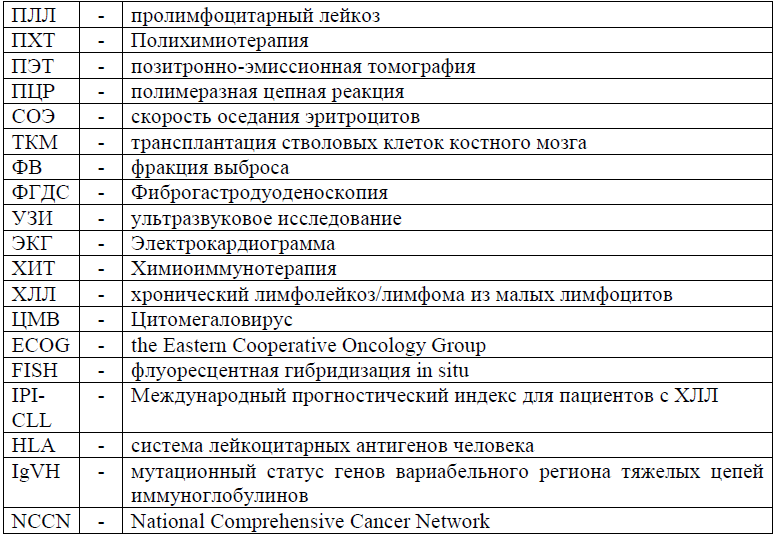
Сокращения, используемые в протоколе:
Классификация
Классификация
Таблица 1. Классификация стадий ХЛЛ по K. Rai. [2].
|
Стадия
|
Характеристика | Прогноз | Медиана выживаемости |
| 0 | Только лимфоцитоз более 15 × 109/л в крови, более 40 % в костном мозге | Хороший | Такая же, как в популяции |
| I | Лимфоцитоз + увеличение лимфатических узлов | Промежуточный | 9 лет |
| II | Лимфоцитоз + спленомегалия и/или гепатомегалия независимо от увеличения лимфатических узлов | Промежуточный | 6 лет |
| III | Лимфоцитоз + гемоглобин менее 100 г/л независимо от увеличения лимфатических узлов и органов | Плохой | 1,5 года |
| IV | Лимфоцитоз + тромбоциты менее 100×109/л независимо от наличия анемии, увеличения лимфатических узлов и органов | Плохой | 1,5 года |
Таблица 2. Классификация стадий ХЛЛ по J. Binet [2].
|
Стадия
|
Характеристика | Медиана выживаемости |
| А | Гемоглобин более 100 г/л, тромбоцитов более 100- 109/л, увеличение лимфатических узлов в 1—2 об-ластях* | Такая же, как в популяции |
| В | Гемоглобин более 100 г/л, тромбоцитов более 100 • 109/л, увеличение лимфатических узлов в трех и более областях | 7 лет |
| С | Гемоглобин менее 100 г/л, тромбоцитов менее 100 • 109/л при любом количестве зон с увеличенными лимфатическими узлами и независимо от увеличения органов | 2 года |
Области лимфатических узлов включают:
Таблица 3. Международный прогностический индекс для пациентов с ХЛЛ (IPI-CLL) [3].
|
Показатель
|
Количество баллов | |
| Возраст более 65 лет | 1 | |
| Клиническая стадия по Binet B-C или по Rai I-IV | 1 | |
| Уровень β2-микроглобулина в сыворотке более 3,5 мг/л (мкг/мл) | 2 | |
| Немутированные IgHV | 2 | |
| Делеция 17р (FISH) и/или мутации TP53 (секвенирование) | 4 | |
| Интерпретация | ||
| Баллы IPI-CLL | Риск | 5 летняя выживаемость |
| 0-1 | Низкий риск | 93,2% |
| 2-3 | Промежуточный риск | 79,3% |
| 4-6 | Высокий риск | 63,3% |
| 7-10 | Очень высокий риск | 23,3% |
Расчет IPI-CLL можно провести с использованием калькулятора (https://www.mdcalc.com/international-prognostic-index-chronic-lymphocytic-leukemia-cll-ipi).
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ
Диагностические критерии [1-3]:
Жалобы и анамнез
Клинические симптомы и признаки:
Физикальное обследование:
Объем дополнительных лабораторных и инструментальных исследований определяется гематологом в зависимости от этапа обследования и клинической картины.
Диагностический алгоритм:
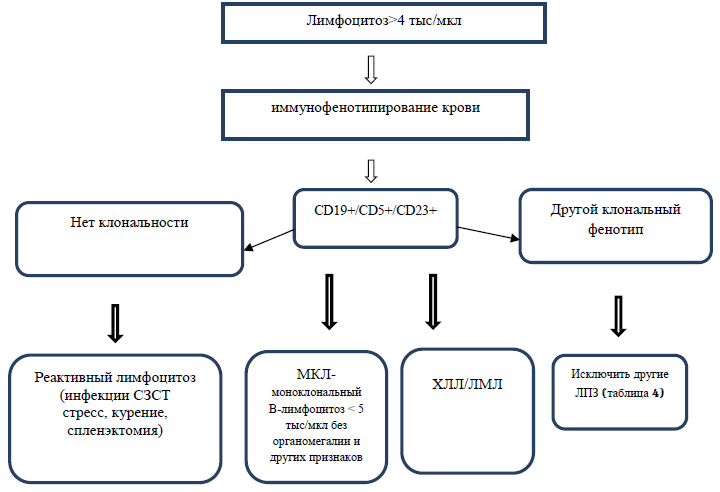
Показания для консультации специалистов:
Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований (таблица 4) [5]
|
Диагноз
|
Обоснование для дифференциальной диагностики | Обследования | Критерии исключения диагноза |
| Моноклональный В-клеточный лимфоцитоз | Лимофицитоз в крови, характерный иммунофенотип (коэкспрессия СD5 и СD23) | ОАК, иммунофенотипирование | Клональный лимфоцитоз менее 5х109/л, отсутствие симптомов |
| Лимфома из малых лимфоцитов | Лимофицитоз в крови, характерный иммунофенотип (коэкспрессия СD5 и СD23) | ОАК, иммунофенотипирование крови, цитологическое исследование костного мозга, морфологическое исследование лимфоузла или биопсия других тканей с иммуногистохимическим исследованием | Клональный лимфоцитоз в крови менее 5х109/л, отсутствие лимфоцитоза в костном мозге, морфологически-малые узкоцитоплазменные лимфоциты с комковатым хроматином, без отчетливых ядрышек. с характерным иммунофенотипом |
| Волосатоклеточный лейкоз [6] | Лимофицитоз в крови, панцитопения, спленомегалия |
Общий анализ крови, цитологическое, гистологическое исследование костного мозга, определение иммунофенотипа лимфоцитов крови или костного мозга методом проточной цитометрии, иммуногистохимическое исследование костного мозга или биоптата селезенки;
Цитогенетика/FISH
|
Панцитопения, моноцитопения, наличие клеток с ворсинчатой цитоплазмой.
При проточной цитометрии выявляются сильная экспрессия CD19, CD20, CD22, CD79a, отсутствие экспрессии CD5, СD10, CD23, CD43 и экспрессия типичных для ВКЛ CD11c, CD25, CD103, FMC7, CD123, CD200.
Наличие мутации BRAFV600E |
| Лимфоплазмоцитарная лимфома [7] |
лимфоаденопатия, спленомегалия
анемия, тромбоцитопения
|
Иммунохимическое исследование сыворотки крови и мочи; миелограмма, иммунофенотипирование Цитологическое, гистологическое исследование биопсийного материала; иммуногистохимическое исследование | Наличие моноклонального белка IgM в сыворотке по данным иммунофиксации (вне зависимости от уровня концентрации) Инфильтрация костного мозга малыми лимфоцитами, плазмоцитоидными и плазматическими клетками (диффузная, интерстициальная или нодулярная) Экспрессия CD19+, CD20+, sIgM+. Отсутствие CD5 и CD23, высокое содержание slg и CD20, присутствие цитоплазматических иммуноглобулинов используются для дифференциальной диагностики с ХЛЛ. |
| Лимфома из клеток зоны мантии [8] | Лимофицитоз в крови, лимфоаденопатия, спленомегалия |
Цитологическое, гистологическое, иммуногистохимическое исследование биопсийного материала;
Цитогенетика/FISH миелограмма, иммунофенотипирование костного мозга
|
Гистология: малый лимфоцит, с ядром неправильной формы (расщепленные, зазубренные ядра) и средних размеров ободком бледной или слабобазофильной цитоплазмы. Хроматин ядра мелкоглыбчатый, в цитологических препаратах препаратах-отпечатках обычно встречаются единичные клетки с ровным, «шагреневым», мелкозернистым рисунком. В то же время в значительном числе случаев клетки опухоли могут соответствовать малым лимфоцитам. Характерный иммунофенотип: CD20+, CD5+/CD43+, Cyclin D1+, BCL- 2+, CD3-, CD23- (редкие случаи могут экспрессировать CD10, CD23, BCL-6). Цитогенетические изменения характеризуются наличием транслокации t(ll;14)(ql3;q32) |
| Фолликулярная лимфома [9] | Лимофицитоз в крови, лимфоаденопатия, спленомегалия |
Цитологическое, гистологическое, иммуногистохимическое исследование биопсийного материала;
Цитогенетика/FISH миелограмма, иммунофенотипирование костного мозга
|
Гистологическая картина лимфоузла характеризуется нодулярным или фолликулярным типом роста опухолевых клеток. Иммунофенотип: CD20+, CD10+/-, BCL-2+, BCL-6+, CD3-, CD5-, CD23-/+, cyclin D1-. В редких случаях может быть BCL-2-негативна. Наличие транслокации t(14;18) |
| Лимфома из клеток маргинальной зоны [10] | Лимофицитоз в крови, лимфоаденопатия, спленомегалия | Цитологическое, гистологическое, иммуногистохимическое исследование биопсийного материала миелограмма, иммунофенотипирование костного мозга | иммунофенотипГистологически ЛМЗ представляет собой В-клеточную лимфому с нодулярным, интрафолликулярным, маргинальным, диффузным, внутрисинусным типами роста. Клеточный состав полиморфный: встречаются клетки типа малых лимфоцитов, центроцитоподобные, лимфоидные клетки с признаками плазмоцитарной дифференцировки, зрелые плазматические клетки, разрозненно расположенные крупные клетки с морфологией центробластов и иммунобластов; при экстранодальной локализации нередко присутствуют скопления опухолевых клеток с морфологией моноцитоидных В-клеток. Клетки несут В-клеточные антигены (CD19, CD20, CD22, CD79a) и являются CD5 и CDl0-негативными. Иммунофенотипические исследования обычно проводятся для подтверждения опухоли и исключения В-ХЛЛ (CD5+) |
Лечение (амбулатория)
Показания к началу терапии необходимо оценивать критически. Бессимптомная гипогаммаглобулинемия и наличие моноклональной секреции сами по себе не являются показаниями к лечению. Выявление маркеров отрицательного прогноза, в том числе делеции 17p и немутированного мутационного статуса IgVH генов НЕ является показанием к началу терапии. При аутоиммунных осложнениях (гемолитическая анемия, тромбоцитопения) если нет дополнительных показаний к началу терапии ХЛЛ, проводится лечение по протоколам лечения аутоиммунной гемолитической анемии и аутоиммунной тромбоцитопении.
Немедикаментозное лечение:
Режим: общеохранительный;
Диета: стол №15 (общая).
На амбулаторном этапе возможно проведение следующих схем химиотерапии [30]:
Лечение осложнений проводится с учетом действующих протоколов диагностики и лечения
Перечень основных лекарственных средств (имеющих 100% вероятность применения) [11]
|
Лекарственная
группа
|
Международное
непатентованное
наименование ЛС
|
Способ
применения
|
Уровень
доказательности
|
|
Антинеопластические и иммуносупрессивные лекарственные средства Таргетные препараты |
флударабин | внутрь | А [11] |
| хлорамбуцил | перорально | А [11] | |
| ибрутиниб | перорально | А [11] | |
| акалабрутиниб | перорально | А [11] | |
| венотоклакс | перорально | А [11] |
Перечень дополнительных лекарственных средств (менее 100% вероятности применения).*
|
Фармакотерапевтическая группа
|
Международное непатентованное наименование ЛС | Способ применения | Уровень доказательности |
| Лекарственные средства, ослабляющие токсическое действие противоопухолевых препаратов | Аллопуринол | Внутрь | В[11] |
Хирургическое вмешательство: по показаниям – биопсия лимфоузла
После окончания курсовой химиотерапии , а также в процессе непрерывной терапии пациенты находятся на динамическом учёте и наблюдаются у гематолога по месту жительства в течение всей жизни.
Контрольное обследование проводится каждые 3-12 месяцев зависимости от динамики заболевания, но не реже 1 раза в год. Контрольное исследование включает объективный осмотр пациента, включая осмотр и пальпацию лимфатических узлов, печени и селезенки, исследование общего анализ крови с тромбоцитами, УЗИ периферических лимфатических узлов, печени и селезенки 1 раз в год, по показаниям - чаще.
Индикаторы эффективности лечения. Оценку ответа следует проводить как минимум через 2 месяца после достижения пациентом максимального ответа или согласно протоколу (в этом случае нет необходимости прерывать терапию для оценки ответа). Максимальный ответ может быть определен как фаза лечения, в которой никакого дополнительного улучшения не наблюдается в течение по крайней мере 2 месяцев терапии.
Оценка ответа на лечение* (Международная рабочая группа по ХЛЛ [1,11]
|
Параметр
|
Полный ответ | Частичный ответ | Прогрессия заболевания | Стабилизация заболевания |
| Группа А | ||||
| Лимфоаденопатия | Не ≥1,5 см** | Уменьшение ≥50% (от исходного) | Увеличение ≥50% от исходного или от достигнутого ответа | Изменения размеров от -49% до +49% |
| Размеры печени и/или селезенки | Нормальные размеры печени; размеры селезенки <13 см† | Уменьшение ≥50% (от исходного) | Увеличение ≥50% от исходного или от достигнутого ответа | Изменения размеров от -49% до +49% |
| Конституциональные симптомы | Нет | Любые | Любые | Любые |
| Циркулирующие В-лимфоциты | Нормальные | Снижение ≥50% от исходного | Повышение более ≥50% от исходного | Изменения от -49% до +49% |
| Группа В | ||||
| Тромбоциты | ≥100 х109/л | ≥100 х109/л или повышение ≥50% от исходного | Снижение ≥50% от исходного вторичного ХЛЛ? | Изменения от -49% до +49% |
| Гемоглобин | ≥110 г/л (без трансфузий и без введения эритропоэтина) | ≥110 г/л или повышение ≥50% от исходного | Уменьшение ≥20 г/л от исходного вторичного ХЛЛ? | Повышение < 110 г/л, или < 50% от исходного, или снижение < 20 г/л |
| Костный мозг | Нормоклеточный, нет В-клеток, нет В-лимф.узлов | Представлена В-клетками, или В-лимф.узлами, или не представлено | Повышение В-клеток ≥50% при нескольких исследованиях | Нет изменений в КМ |
| Нейтрофилы без факторов роста | ≥1,5 х109/л | ≥1,5 х109/л или >50% выше исходного | - | - |
Лечение (стационар)
Тактика лечения пациента определяется с учетом совокупного анализа следующих данных:
По итогам полученных данных определяется выбор терапии в отношении конкретного пациента.
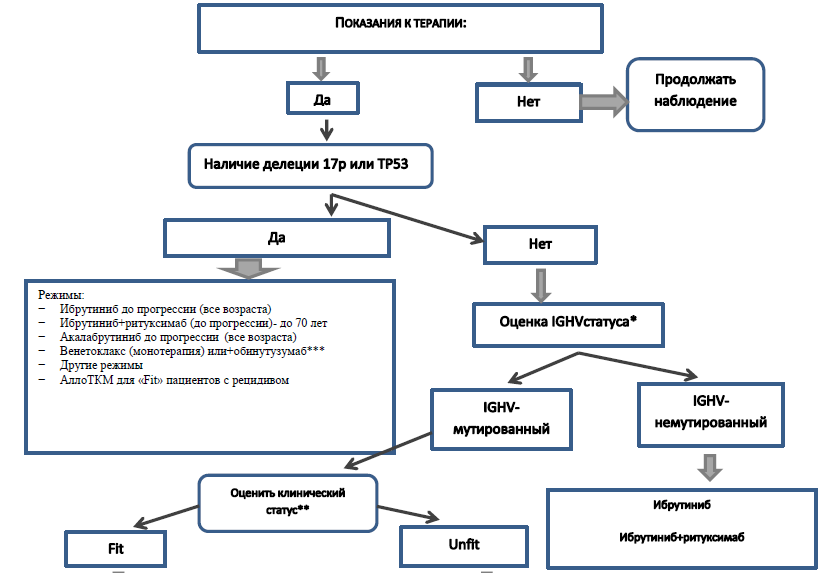
Алгоритм терапии 1 линии у пациентов с ХЛЛ [12].
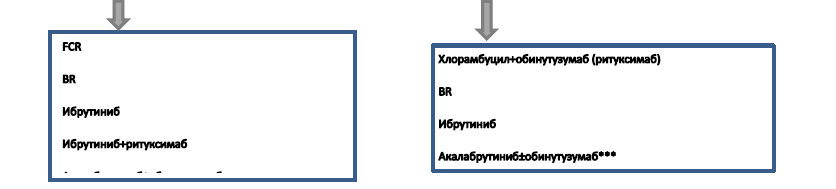
Немедикаментозное лечение:
Режим: общеохранительный;
Диета: стол №15 (общий).
Первая линия терапии. Согласно алгоритму перед началом терапии необходимо провести исследование FISH на делецию 17p и мутацию TP53. В зависимости от результатов исследования пациентов можно разделить на 2 группы:
I) Группа с делецией 17р/ТР53 мутацией (группа очень высокого риска). Перед 1 линией терапии мутация TP53 обнаружена у 5–10% пациентов, в 4% случаев- делеция хромосомы 17p (FISH). Пациенты этой группы характеризуются значительно худшим ответом на стандартную терапию, меньшей продолжительностью ответа и меньшей общей выживаемостью пациентов [13]. Аллогенная трансплантация гемопоэтических клеток (HCT) может рассматриваться как вариант для более молодых / здоровых пациентов с рецидивом заболевания.
II) Группа без делеции 17р/ТР53 мутации. В этой группе рекомендовано исследование IGHV и оценка пригодности пациента (fit или unfit). Распределение пациентов на «пригодность» определяется обычно решением врача. Рекомендуемые индексы коморбидности не имеют достаточной доказательной базы. Обычно при наличии одного из следующих показателей (CIRS> 6 [21]), клиренс креатинина (CrCl) <70 мл / мин, значительный печеночная недостаточность (класс В или С по шкале Чайлд-Пью и ECOG 2 и выше [22]) пациенты считаются «unfit» («непригодными») для интенсивных курсов химиоиммунотерапии.
● Пациенты с мутированным статусом IGHV (группа стандартного риска). У пациентов со статусом «Fit» могут применяться программы химиотерапии с достижением стойких и длительных ремиссий, схожих с результатами терапии таргентными препаратами. Программа FCR (Флударабин + Циклофосфамид + Ритуксимаб) является более эффективной [УД-I,A] [23], но и более токсичной по сравнению с BR (Бендамустин +Ритуксимаб) в этой группе. Они являются приемлемой альтернативой для более молодых пациентов с IGHV-мутированным ХЛЛ без del 17p и без мутации TP53, которые готовы пройти более интенсивную терапию с возможностью долгосрочного контроля заболевания без терапии.
● Пациенты с мутированным статусом IGHV «Unfit»: Рекомендуются назначение таргентных препаратов, в случае химиотерапии - менее токсичные курсы. Для этой группы рекомендована, в первую очередь, поддерживающая помощь, направленная на сохранение качества жизни, профилактику инфекций, трансфузионная поддержка компонентами крови.
Рецидивы и резистентные ХЛЛ.
Рефрактерность определяется как неудача лечения или как прогрессия в течение 6 месяцев после последней дозы терапии.
Многие пациенты с рецидивирующим, но бессимптомным ХЛЛ могут находиться под наблюдением без терапии в течение определенного периода времени.
Алгоритм терапии рецидивов /резистентных форм ХЛЛ представлен в Приложении 2.
Ингибиторы фосфоинозитид-3'-киназы (PI3K) дельта (PI3K) (иделалисиб)
[28]1 рекомендованы для пациентов с рецидивирующим / рефрактерным ХЛЛ, ранее получавших ингибиторы БТК и венетоклакс. Иделалисиб - пероральный препарат, применяемый в качестве непрерывной терапии, который показал активность у пациентов с рецидивирующим или рефрактерным ХЛЛ. Применение может быть ограничено токсичностью [29]. Могут наблюдаться летальные и / или серьезные токсические эффекты, включая оппортунистические инфекции, диарею или колит, кожные реакции и пневмонит.
________________
1 *В соответствии с правилами применения незарегистрированных ЛС.
Таблица 1. Основные схемы терапии ХЛЛ в различных клинических группах (УД- В) [2].
|
Группа пациентов
|
Первая линия терапии | Терапия при рецидиве/рефрактерности |
| Пациенты с del 17p/TP53 |
Предпочтительные режимы:
Ибрутиниб
Акалабрутиниб±обинутузумаб
Венетоклакс+ обинутузумаб
Другие рекомендуемые режимы: Алемтузумаб± ритуксимаб; Высокие дозы Метилпреднизолона (HDMP)±Ритуксимаб |
Предпочтительные режимы:
Ибрутиниб (категория 1);
Акалабрутиниб (категория 1);
Венетоклакс+ритуксимаб (категория 1);
Венетоклакс
Другие рекомендуемые режимы:
Алемтузумаб± ритуксимаб;
Высокие дозы Метилпреднизолона (HDMP)±Ритуксимаб
Иделалисиб*1 ±ритуксимаб
Леналидомид ± ритуксимаб
|
|
Пациенты «Unfit» без del17p/TP53
(старше 65 лет или моложе со значительной коморбидностью)
|
Предпочтительные режимы:
Ибрутиниб (категория 1)
Акалабрутиниб±обинутузумаб (категория 1)
Венетоклакс+ обинутузумаб (категория 1)
Другие рекомендуемые режимы:
Бендамустин (70 мг/м2 в 1 цикле с эскалацией до 90 мг/м2 при переносимости) +Ритуксимаб (BR);
Хлорамбуцил +Ритуксимаб; Высокие дозы Метилпреднизолона (HDMP)±Ритуксимаб (категория3); FCR lite
Ибрутиниб+обинутузумаб (категория 2В)
Хлорамбуцил (категория 3)
Ритуксимаб (категория 3)
|
Предпочтительные режимы:
Ибрутиниб (категория 1);
Акалабрутиниб (категория 1);
Венетоклакс+ритуксимаб(категория 1);
Другие рекомендуемые рехимы: Хлорамбуцил +Ритуксимаб Иделизиб±ритуксимаб
Леналидомид ± ритуксимаб; Венетоклакс Бендамустин+ритуксимаб
Высокие дозы Метилпреднизолона (HDMP)±Ритуксимаб Ритуксимаб |
|
Пациенты «Fit» без del17p/TP53
моложе 65 лет и без значительной коморбидности
|
Предпочтительные режимы:
Ибрутиниб (категория 1)
Акалабрутиниб±обинутузумаб (категория 1)
Венетоклакс+ обинутузумаб (категория 1)
Другие рекомендуемые режимы:
Бендамустин + антиCD20 антитела (ритуксимаб)
Флударабин+Циклофосфамид+Ритуксимаб (FCR)
Ибрутиниб+ритуксимаб (категория 2В)
Флударабин+Ритуксимаб (FR) (категория3);
Высокие дозы Метилпреднизолона (HDMP)±Ритуксимаб (категория3);
|
Предпочтительные режимы:
Акалабрутиниб
Ибрутиниб;
Венетоклакс+ритуксимаб
Другие рекомендуемые режимы:
Бендамустин+Ритуксимаб (BR)
Флударабин+Циклофосфамид+Ритуксимаб (FCR);
Иделалисиб±ритуксимаб
Леналидомид ± ритуксимаб
Венетоклакс
Высокие дозы Метилпреднизолона (HDMP)±Ритуксимаб
Алемтузумаб± ритуксимаб;
Высокие дозы Метилпреднизолона±Ритуксимаб
|
Таблица 2. Основные схемы терапии ХЛЛ ( с указанием доз препаратов и режима терапии) [30].
|
Препараты
|
Режим введения |
| BТК-ингибитор содержащие курсы | |
| Монотерапия ибрутинибом | 420 мг/сут ( 3 x 140-мг в капсулах) 1 раз в сутки до прогрессирования или токсичности |
|
Ибрутиниб + ритуксимаб
Лечение возобновляется на 29 день, всего 6 циклов
|
- Ибрутиниб 420 мг/сут (три капсулы) внутрь, 1 раз в день, ежедневно до прогрессирования или неприемлемой токсичности
- Ритуксимаб - 375 мг/м 2 в 1-й день цикла 1, затем 500 мг/м 2 в 1-й день (каждые 28 дней) циклов со 2 по 6 циклов
|
| Ибрутиниб + BR |
Ибрутиниб – 420 мг/сут (3 капсулы) внутрь 1 раз в день ежедневно в течение всего курса и далее (после завершения циклов BR) – до прогрессирования или развития неприемлемой токсичности.
•#Бендамустин – 90 мг/м2 (70 мг\м2)1 в/в кап., дни 2–3 цикла 1; дни 1, 2 циклов 2–6. •Ритуксимаб – 375 мг/м2 в/в кап., день 1 цикла 1; 500 мг/м2 в/в кап. или 1400 мг п/к, день 1 циклов 2–6.
Лечение возобновляется на 29-й день., всего 6 циклов.
|
| Монотерапия акалабрутинибом | Акалабрутиниб 100 мг (1 капсула) 2 раза в день ежедневно |
| Венетоклакс-содержащие курсы | |
| Монотерапия венетоклаксом | Венетоклакс – 20 мг/сут (нед. 1), 50 мг/сут (нед. 2), 100 мг/сут (нед. 3), 200 мг/сут (нед. 4), 400 мг/сут (нед. 5 и далее), до прогрессирования или развития непереносимой токсичности. |
| Венетоклакс + ритуксимаб |
•Венетоклакс – 20 мг/сут (нед. 1), 50 мг/сут (нед. 2), 100 мг/сут (нед. 3), 200 мг/сут (нед. 4), 400 мг/сут (нед. 5 и далее), прием в течение 24 мес. начиная с 1-го дня 1-го цикла лечения ритуксимабом.
• Ритуксимаб – 375 мг/м2 в/в кап. через 1 нед. после достижения дозы венетоклакса 400 мг/сут, далее – 500 мг/м2 в/в кап. или 1400 мг п/к ежемесячно, всего 6 введений.
|
| Венетоклакс + обинутузумаб** [31] |
Обинутузумаб – Цикл 1: 100 мг в 1-й день, затем 900 мг во 2-й день ( или 1000 мг в 1-й день), а затем 1000 мг еженедельно в 2 приема (8-й и 15-й дни); цикл лечения 28 дней (венетоклакс начат на 22-й день 1-го цикла).
Циклы со 2 по 6: 1000 мг в 1-й день каждые 28 дней, 5 доз (продолжать прием венетоклакса до конца 12-го цикла).
• #Венетоклакс – 20 мг/сут, дни 22–28 цикла 1; 50 мг/сут дни 1–7 цикла 2; 100 мг/сут дни 8–14 цикла 2; 200 мг/сут дни 15–21 цикла 2; 400 мг/сут дни 22–28 цикла 2, далее 400 мг/сут в течение 12 мес.
|
| Иделалисиб /Иделалисиб+Ритуксимаб[32] |
Хронический лимфолейкоз, рецидив: внутрь: 150 мг два раза в день перорально до прогрессирования заболевания или неприемлемой токсичности/ Пропущенные дозы: Если доза пропущена менее чем на 6 часов, введите пропущенную дозу как можно скорее и введите следующую дозу в обычное время. Если > 6 часов, пропустите пропущенную дозу и возобновите терапию со следующей запланированной дозой.
Ритуксимаб вводили внутривенно в дозе 375 мг/м2 в 1-й день недели 0 и в дозе 500 мг/м2 в 1-й день недель 2, 4, 6, 8, 12, 16 и 20, всего восемь инфузий.
|
| Химиоиммунотерапия | |
| Монотерапия хлорамбуцилом |
10 мг/м2/сут внутрь х 7 дней
2 мг/сут ежедневно до курсовой дозы 300-350 мг, далее поддерживающая терапия 10-15 мг 1-2 раза в месяц
Хлорамбуцил : 0,5 мг/кг в дни 1 и 15 каждые 28 дней в течение 6 циклов (Goede 2014).
|
| Хлорамбуцил-обинутузумаб [21] 2 |
Хлорамбуцил : 0,5 мг/кг в дни 1 и 15 каждые 28 дней в течение 6 циклов (Goede 2014).
Обинутузумаб: Цикл 1: 100 мг в 1-й день, затем 900 мг во 2-й день, а затем 1000 мг в неделю в 2 приема (8-й и 15-й дни); цикл лечения 28 дней.
Циклы со 2 по 6: 1000 мг в 1-й день каждые 28 дней, 5 доз.
|
|
Хлорамбуцил + Преднизолон
1 раз в 2 недели
|
- Хлорамбуцил 30 мг/м2 внутрь – 1 день
- Преднизолон 80 мг внутрь 1-5 дни
|
|
Хлорамбуцил+ритуксимаб2
Лечение возобновляется на 29 день
|
- Хлорамбуцили10 мг/м2 внутрь, дни 1 – 7 каждые 28 дней, в течение 6-12 циклов
- Ритуксимаб [33] 1 цикл - 375 мг/м2 в/в кап., день 1, последующие циклы - 500 мг/м2 в/в кап., день 1
ИЛИ
Хлорамбуцил (1 мг/кг на 28-дневный цикл в течение 8 циклов) плюс ритуксимаб (375 мг/м2 на первый курс и 500 мг/м2 на последующие циклы до 6-го цикла) [34]
|
| Монотерапия бендамустином | 100 мг/м2 в/в в течение 30 мин внутривенно: в дни 1 и 2 28-дневного цикла лечения (в качестве монотерапии) до 6 циклов (Knauf 2009; Knauf 2012). |
| Монотерапия ритуксимабом | 375 мг/м2 в/в 1 раз в неделю №4, повторять каждые 6 месяцев х 4 курса |
|
Бендамустин+Ритуксимаб (BR) [35]2
1 раз в 4 недели Х 6 курсов
|
-Бендамустин 90 мг/м2 ( 70 мг\м2)1 в/в в течение 30 мин 1-2 дни 1 раз в месяц Х 6 курсов
-Ритуксимаб- 375 мг/м2 в/в в 1 день 1го курса, 500 мг/м2 в/в в 1 день 2-6 курсов
в/в : 375 мг/м 2 за день до бендамустина в цикле 1, затем 500 мг/м 2 в день 1 (каждые 28 дней) циклов со 2 по 6 (в комбинации с бендамустином)
|
|
R-CD
Лечение возобновляется на 29 день
|
- Ритуксимаб 1 цикл - 375 мг/м2 в/в кап., день 1, последующие циклы - 500 мг/м2 в/в кап., день 1
- Циклофосфамид 750 мг/м2 в/в кап., день 1
- Дексаметазон 12 мг в/в или внутрь, дни 1 - 7
|
|
Флударабин+Циклофосфамид+Ритуксимаб2
1 раз в 4 недели Х 6 курсов (FCR)
|
- Ритуксимаб 1 цикл - 375 мг/м2 в/в кап. день 1(за день до флударабина/циклофосфамида в цикле 1), затем 500 мг/м 2 в день 1 (каждые 28 дней) циклы со 2 по 6
- Флударабин 25 мг/м2 в/в 1-3 дни или 40 мг/м2 внутрь, дни 1 – 3 (в циклах 2-6; в цикле 1: дни 2-4)
- Циклофосфамид 250 мг/м2 в/в кап., дни 1 – 3 (в циклах 2-6; в цикле 1: дни 2-4)
|
|
Флударабин+Циклофосфамид+Ритуксимаб (FCR-lite)
Лечение возобновляется на 29 день
|
Ритуксимаб 1 цикл - 375 мг/м2 в/в кап., день 1, последующие циклы - 500 мг/м2 в/в кап., день 1
- Флударабин 12 мг/м2 в/в или 20 мг/м2 перорально в 1-3 дни
- Циклофосфамид** 150 мг/м2 в\в или внутрь, дни 1 – 3 |
| Циклофосфамид + Винкристин + Преднизолон (СVP) 1 раз в 3 недели до 18 месяцев |
Циклофосфамид 300 мг/м2 внутрь 1-5 дни
Винкристин 1,4 мг/м2 (max 2 мг) в/в 1 день
Преднизолон 100 мг/м2 внутрь 1-5 дни
|
|
R-HDMP
Проводят 3 курса
|
- Ритуксимаб 375 мг/м2 в/в кап., дни 1, 8, 15, 22
- Метилпреднизолон 1 г/м2 в/в кап., дни 1 - 3
Лечение возобновляется на 29 день
|
Примечания:
Таблица 1. Сопроводительная терапия (уровень доказательности В) [2].
|
Проблема
|
Варианты решения |
| Рецидивирующие инфекции, требующие назначения внутривенных антибиотиков или госпитализации |
Антимикробная профилактика не рекомендуется для пациентов с ХЛЛ, которые не получают активной терапии или которые получают алкилирующий агент.
Пациентам с пониженным уровнем IgG (<5 г/л) и рецидивирующими серьезными инфекциями, несмотря на как минимум 3 месяца профилактической антибактериальной терапии, должна быть предложена заместительная терапия иммуноглобулином ежемесячно 0,3-0,5 г/кг (уровень IV).
|
| Антимикробная профилактика |
При терапии на основе пуриновых аналогов и/или алемтузамабом необходима профилактика инфекций, связанных с вирусом простого герпеса (Ацикловир или аналоги) и пневмоцистной пневмонии (Сульфаметоксазол/Триметоприм или аналоги); при лечении иделалисибом – профилактика пневмоцистной пневмонии. При комбинации моноклонального антитела против CD20 и метилпреднизолона в высоких дозах, рекомендуется пневмоцистная и противовирусная во время терапии и в течение двух месяцев после прекращения лечения [37]. При лечении Алемтузумабом, иделалисибом высок риск реактивации цитомегаловирусной инфекции. Лечение возможно только при условии мониторирования CMV виремии с использованием количественной ПЦР каждые 1-3 недели. Профилактика проводится Ганцикловиром (в/в или перорально). |
| Аутоиммунные цитопении |
Аутоиммунная гемолитическая анемия является противопоказанием к использованию Флударабина.
При необъяснимой изолированной тромбоцитопении для исключения её иммунного характера рекомендовано проведение цитологическое исследование костного мозга.
При подозрении на парциальную красно-клеточную аплазию показано исследование костного мозга на парвовирус В19, исследование на ЦМВ, вирус Эпштейна-Барр.
Лечение аутоиммунных цитопений проводится по протоколам лечения аутоиммунной гемолитической анемии, иммунной тромбоцитопении.
|
| Вакцинация |
Всем пациентам с ХЛЛ должна быть предложена вакцинация против сезонного гриппа (1 раз в год) и пневмококковой инфекции (1 раз в 5 лет). Ежегодная вакцинация от гриппа может проводится пациентам не ранее чем через 6 месяцев после завершения терапии Ритуксимабом, Алемтузумабом или пуриновыми аналогами при условии В-клеточного восстановления.
Вакцинация от гепатита В при наличии В-клеточной деплеции не проводится.
Избегать вакцинации любыми живыми вакцинами, включая Herpes Zoster.
Вакцинация COVID 19 [38] не противопоказана при ХЛЛ, если у них нет противопоказаний к какому-либо компоненту конкретной вакцины. Их следует проинформировать о возможности недостаточного иммунного ответа и необходимости продолжать следовать всем текущим рекомендациям по защите от COVID-19. Это особенно важно для людей с активным ХЛЛ, тех, кто активно получает терапию моноклональными антителами к CD20, ингибиторы БТК.
|
Консолидация и поддерживающая терапия.
Перечень основных лекарственных средств (имеющих 100% вероятность применения)
|
Лекарственная
группа
|
Международное
непатентованное
наименование ЛС
|
Способ
применения
|
Уровень
доказательности
|
| Антинеопластические и иммуносупрессивные лекарственные средства | Флударабин | внутрь, внутривенно | А[11] |
| Циклофосфамид | внутривенно | А[11] | |
| Бендамустин | внутривенно | А[11] | |
| Хлорамбуцил | перорально | А[11] | |
| Винкристин | внутривенно | С[11] | |
| Леналидомид | внутрь | С[11] | |
| Таргетные препараты | Ибрутиниб | перорально | А[11] |
| Акалабрутиниб | перорально | А[11] | |
| Венетоклакс | перорально | А[11] | |
| Ритуксимаб | внутривенно | А[11] | |
| Обинутузумаб | внутривенно | А[11] | |
| Иделалисиб* | внутрь | А[11] | |
| Глюкокортикостероиды | Преднизолон | внутрь, внутривенно | С[11] |
| Метилпреднизолон | внутрь, внутривенно | С[11] | |
| Дексаметазон | внутривенное | С[11] | |
| Лекарственные средства, ослабляющие токсическое действие химиопрепаратов | Ондасетрон | внутривенно, внутрь | В[11] |
| Аллопуринол | внутрь | В[11] |
*В соответствии с правилами применения незарегистрированных ЛС.
При отсутствии декомпенсированных заболеваний сердечно-сосудистой системы и легких показаниями для профилактической трансфузии эритроцитов при хронических анемиях могут быть уровни гемоглобина:
|
Возраст (лет)
|
Триггерный уровень Hb (г/л) |
|
<25
|
35-45 |
|
25-50
|
40-50 |
|
50-70
|
55 |
| >70 | 60 |
Концентрат тромбоцитов (УД-D):
Пациенты с МНО ≥2.0 (при нейрохирургических вмешательствах ≥1.5) рассматриваются как кандидаты для трансфузии СЗП при планировании инвазивных процедур.
Трансплантация костного мозга занимает ограниченное место в лечении ХЛЛ.
Индикаторы эффективности лечения:
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ
Показания для плановой госпитализации:
Показания для экстренной госпитализации:
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2023
- 1) Michael Hallek, Bruce D. Cheson, Daniel Catovsky et al. iwCLL guidelines for diagnosis, indications for treatment, response assessment, and supportive management of CLL/Blood (2018) 131 (25): 2745-2760. 2) NCCN Guidelines for Chronic Lymphocytic Leukemia/ Small Lymphocytic Lymphoma V.1.2022- September, 2021 3) International CLL-IPI working group. An international prognostic index for patietns with chronic lymphocytic leukaemia (CLL-IPI): a meta-analysis of individual patient data. Lancet Oncol. 2016; 17(6): 779 - 790. 4) Städler N, Shang A, Bosch F, et al. A systematic review and network meta-analysis to evaluate the comparative efficacy of interventions for unfit patients with chronic lymphocytic leukemia. Adv Ther. 2016;33(10):1814-1830. 5) Общие принципы диагностики лимфом. Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний. Демина Е.А. и др. Под ред. И.В. Поддубной, В.Г. Савченко. 2018; с. 9–27 6) Nilima Parry-Jones et al. Guideline for diagnosis and management of hairy cell leukaemia (HCL) and hairy cell variant (HCL-V)/B.J.of haematology.- Volume191, Issue5, December 2020.- Pages 730-737 7) NCCN Guidelines for Waldenström Macroglobulinemia/Lymphoplasmacytic Lymphoma V.2.2022.-December 7, 2021 8) В.И. Воробьев, Г.С. Тумян, Н.А. Фалалеева, В.В. Птушкин и др. Лимфома из клеток мантии. Клинические рекомендации. Современная Онкология. 2020; 22 (3): 6–23. 9) Бабичева Л. Г. И соавт. Фолликулярная лимфома/клинические рекомендациию-2020, стр.9-14 10) E. Zucca et al., Marginal zone lymphomas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up Annals of Oncology.- volume 31, issue 1, p17-29, january 01, 2020 11) NCCN Guidelines: Chronic Lymphocytic Leukemia/Small Lymphocytic Lymphoma, Version 3.20, 2023 12) Kanti R Rai, Stephan Stilgenbauer Selection of initial therapy for symptomatic or advanced chronic lymphocytic leukemia/Uptodate.- Aug 02, 2021. 13) H Döhner 1, S Stilgenbauer, A Benner , et al. Genomic aberrations and survival in chronic lymphocytic leukemia/N Engl J Med.- 2000 Dec 28;343(26):1910-6. doi: 10.1056/NEJM200012283432602. 14) Shanafelt TD, Wang XV, Kay NE, et al. Ibrutinib-rituximab or chemoimmunotherapy for chronic lymphocytic leukemia./N Engl J Med. 2019; 381: 432-443 Engl J Med. 2019;381(5):432. 15) Jennifer A. Woyach, Amy S. Ruppert, Nyla A. Heerema et al.Ibrutinib Regimens versus Chemoimmunotherapy in Older Patients with Untreated CLL/ N Engl J Med 2018; 379:2517-2528 16) Shanafelt T, Wang XV, Kay NE, et al. Ibrutinib & rituximab improves progression free and overall survival relative to FCR in younger patients with previously untreated chronic lymphocytic leukemia (abstract LBA 4). Blood 2018. 17) Sharman JP, Egyed M, Jurczak W, Skarbnik A, et al. Acalabrutinib with or without obinutuzumab versus chlorambucil and obinutuzmab for treatment-naive chronic lymphocytic leukaemia (ELEVATE TN): a randomised, controlled, phase 3 trial. Lancet. 2020 Apr 18;395(10232):1278-1291. doi: 10.1016/S0140-6736(20)30262-2. Erratum in: Lancet. 2020 May 30;395(10238):1694. PMID: 32305093; PMCID: PMC8151619. 18) Jeff P. Sharman et al. Acalabrutinib with or without obinutuzumab versus chlorambucil and obinututzumab in treatment-naïve chronic lymphocytic leukemia: (ELEVATE TN): a randomised, controlled, phase 3 trial. Lancet 2020; 395: 1278–91. 19) Byrd JC, Hillmen P, Ghia P, et al. Acalabrutinib Versus Ibrutinib in Previously Treated Chronic Lymphocytic Leukemia: Results of the First Randomized Phase III Trial. J Clin Oncol 2021; 39:3441. 20) Fischer K.Al-Sawaf O.Bahlo J.et al. Venetoclax and obinutuzumab in patients with CLL and coexisting conditions/N Engl J Med. 2019; 380: 2225-2236 21) Goede V, Fischer K, Busch R, et al. Obinutuzumab plus chlorambucil in patients with CLL and coexisting conditions. N Engl J Med 2014; 370:1101. 22) C. Owen,, A.S. Gerrie, V. Banerji et al. Guideline Canadian evidence-based guideline for the first-line treatment of chronic lymphocytic leukemia / Curr Oncol.-. 2018 Oct;25(5):e461-e474 23) Hallek M.Fischer K.Fingerle-Rowson G.et al.Addition of rituximab to fludarabine and cyclophosphamide in patients with chronic lymphocytic leukemia: a randomised, open-label, phase III trial./Lancet. 2010; 376: 1164-1174 24) Eichhorst B, Fink AM, Bahlo J et al. First-line chemoimmunotherapy with bendamustine and rituximab versus fludarabine, cyclophosphamide, and rituximab in patients with advanced chronic lymphocytic leukaemia (CLL10): an international, open-label, randomised, phase 3, non-inferiority trial. Lancet Oncol. 2016 Jul;17(7):928-942. doi: 10.1016/S1470-2045(16)30051-1. Epub 2016 May 20. PMID: 27216274. 25) Emelie Curovic Rotbain, Henrik Frederiksen, Henrik Hjalgrim et al. IGHV mutational status and outcome for patients with chronic lymphocytic leukemia upon treatment: a Danish nationwide population-based study/Haematologica.- Vol. 105 No. 6 (2020): June, 2020 26) Kanti R Rai, MDStephan Stilgenbauer, MD Treatment of relapsed or refractory chronic lymphocytic leukemia/Uptodate.- Apr 29, 2022. 27) Jones J.A.Mato A.R.Wierda W.G.et al.Venetoclax for chronic lymphocytic leukaemia progressing after ibrutinib: an interim analysis of a multicentre, open-label, phase 2 trial.Lancet Oncol. 2018; 19: 65-75 28) Furman R.R.Sharman J.P.Coutre S.E.et al.Idelalisib and rituximab in relapsed chronic lymphocytic leukemia/N Engl J Med. 2014; 370: 997-1007 29) Brown JR, Byrd JC, Coutre SE et al. Idelalisib, an inhibitor of phosphatidylinositol 3-kinase p110δ, for relapsed/refractory chronic lymphocytic leukemia.Blood. 2014 May;123(22):3390-7. Epub 2014 Mar 10. 30) Chronic lymphocytic leukemia/Small lymphocytic lymphoma/NCCN-Version 2.2020-08.10.2019 31) Kirsten Fischer, M.D., Othman Al-Sawaf, M.D., Jasmin Bahlo et al. Venetoclax and Obinutuzumab in Patients with CLL and Coexisting Conditions/ June 6, 2019/N Engl J Med 2019; 380:2225-2236DOI: 10.1056/NEJMoa1815281 32) Sharman JP, Coutre SE, Furman RR et al. Final Results of a Randomized, Phase III Study of Rituximab With or Without Idelalisib Followed by Open-Label Idelalisib in Patients With Relapsed Chronic Lymphocytic Leukemia. J Clin Oncol. 2019 Jun 1;37(16):1391-1402. doi: 10.1200/JCO.18.01460. Epub 2019 Apr 17. PMID: 30995176. 33) Hainsworth JD, Litchy S, Barton JH, et al. Single-agent rituximab as first-line and maintenance treatment for patients with chronic lymphocytic leukemia or small lymphocytic lymphoma: a phase II trial of the Minnie Pearl Cancer Research Network. J Clin Oncol. 2003; 21: 1746 - 1751. 34) Mediterr J Hematol Infect Dis. 2013 May 2;5(1):e2013031. doi: 10.4084/MJHID.2013.031. Print 2013. 35) Kirsten Fischer , Paula Cramer , Raymonde Busch et al. Bendamustine in Combination With Rituximab for Previously Untreated Patients With Chronic Lymphocytic Leukemia: A Multicenter Phase II Trial of the German Chronic Lymphocytic Leukemia Study Group/DOI: 10.1200/JCO.2011.39.2688 Journal of Clinical Oncology 30, no. 26 (September 10, 2012) 3209-3216. 36) Dogliotti, I.; Ragaini, S.; Vassallo, F.; Boccellato, E.; De Luca, G.; Perutelli, F.; Boccomini, C.; Clerico, M.; Botto, B.; Grimaldi, D.; et al. Real Life Use of Bendamustine in Elderly Patients with Lymphoid Neoplasia. J. Pers. Med. 2021, 11, 249. https://doi.org/10.3390/jpm 11040249 37) Castro JE, James DF, Sandoval-Sus JD, Jain S, Bole J, Rassenti L, Kipps TJ. 38) Rituximab in combination with high-dose methylprednisolone for the treatment of chronic lymphocytic leukemia/Leukemia. 2009 Oct;23(10):1779-89. Epub 2009 Aug 20. 39) Кислова М.И., Петренко А.А., Костинов М.П., Никитин Е.А. Вакцинопрофилактика у больных с хроническим лимфолейкозом. Эпидемиология и Вакцинопрофилактика. 2021;20(3):91-106. https://doi.org/10.31631/2073-3046-2021-20-3-91-106 40) Lew TE, Lin VS, Cliff ER et al. Outcomes of patients with CLL sequentially resistant to both BCL2 and BTK inhibition/Blood Adv. 2021;5(20):4054. Schuh, A. H., Parry‐Jones, N. , Appleby, N. et al. (2018), Guideline for the treatment of chronic lymphocytic leukaemia. Br J Haematol, 182: 344-359. doi:10.1111/bjh.15460 41) Chronic lymphocytic leukaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology, Volume 32, Issue1, 2021, https://doi.org/10.1016/j.annonc.2020.09.019
Информация
Список разработчиков протокола с указанием квалификационных данных:
Указание на отсутствие конфликта интересов: нет.
Рецензенты:
Рамазанова Райгуль Муханбетовна – доктор медицинских наук, профессор кафедры внутренних болезней, НАО «Казахский национальный медицинский университет им. С.Д.Асфендиярова», Президент ОФ « Казахстанское профессиональное общество онкогематологов», гематолог.
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
ШКАЛА ОЦЕНКИ ОБЩЕГО СОСТОЯНИЯ ПАЦИЕНТА ECOG
| Больной полностью активен, способен выполнять все, как и до заболевания | 0 |
| Больной неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу) | 1 |
| Больной лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени проводит активно - в вертикальном положении. | 2 |
| Больной способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования | 3 |
| Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели | 4 |
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.