Хронический гепатит В у взрослых
 Версия: Клинические протоколы МЗ РК - 2025 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2025 (Казахстан)
Общая информация
Краткое описание
КЛИНИЧЕСКИЙ ПРОТОКОЛ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Хронический вирусный гепатит B — это воспаление печени с некротическими и фибротическими изменениями различной степени тяжести, вследствие персистенции вируса гепатита В, подтверждающегося определением в сыворотке крови HBsAg ≥ 6 месяцев [1].
| Код | Название |
| B 18.1 | Хронический гепатит В без дельта агента |
| B 18.0 | Хронический гепатит В с дельта агентом |
Дата разработки/пересмотра протокола: 2018 год (пересмотр 2019 г./2025 год).
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+), результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов |
Классификация
1. Классификация ХГВ по фазам инфекции:
3. По степени активности воспаления:
Факторы и группы риска
Прогрессирование ХВГ и развитие ГЦК [5,6,8].
ХВГ может прогрессировать до цирроза печени и его осложнений; приводить к развитию ГЦК на любой стадии заболевания. Риск развития ГЦК повышается при наличии одного или нескольких отягощающих факторов (УД – А):
Шкала mPAGE-B (Modified, Platelets, Age, Gender–Hepatocellular Carcinoma) - это прогностическая модель, разработанная для оценки риска развития ГЦК у пациентов с ХГВ, особенно получающих противовирусную терапию на основе аналогов нуклеозидов/нуклеотидов (АН).
Ассоциированные заболевания.
Диагностика
Таблица 1. Степень биохимической активности гепатита [18].
|
Степень активности
|
АЛТ (АСТ) |
|
Минимальная
|
<ВГН |
|
Пограничная
|
1-2 ВГН |
|
Слабовыраженная
|
2-5 ВГН |
|
Умеренная
|
5-15 ВГН |
|
Выраженная
|
> 15 ВГН |
|
Массивная
|
> 10000Ед/л |
Таблица 2. Интерпретация результатов VCTE [14]
| Стадия фиброза по METAVIR | Результаты VCTE | |
| АЛТ/АСТ в пределах нормы | АЛТ/АСТ > 5 ВГН | |
| F0 – F1 | 2,0-5,5 кПА | 2,5-6,0 кПА |
| F2 | 5,6-8,5 кПА | 6,1-9,0 кПА |
| F3 | 8,6-10,9 кПА | 9,1-12,0 кПА |
| F4 | > 11,0 (11-14) кПА | > 12,0 кПА |
Таблица 3. Морфологическая диагностика степени некровоспалительной активности гепатита [38]
|
Диагноз гистологический
|
METAVIR | Knodell (IV) | Ishak |
| ХГ минимальной активности | А1 | 0-3 | 0-3 |
| ХГ слабовыраженной активности | А1 | 4-5 | 4-6 |
| ХГ умеренной активности | А2 | 6-9 | 7-9 |
| ХГ выраженной активности | А3 | 10-12 | 10-15 |
| ХГ выраженной активности с мостовидными некрозами | А3 | 13-18 | 16-18 |
Таблица 4. Морфологическая диагностика стадии заболевания печени (выраженности фиброза) [38]
|
Стадия фиброза
|
METAVIR | Knodell (IV) | Ishak |
| Нет фиброза | F0 | 0 | 0 |
| Портальный фиброз нескольких портальных трактов | F1 | 1 | 1 |
| Портальный фиброз большинства портальных трактов | F1 | 1 | 2 |
| Несколько мостовидных фиброзных септ | F2 | 3 | 3 |
| Много мостовидных фиброзных септ | F3 | 3 | 4 |
| Неполный цирроз | F4 | 4 | 5 |
| Полностью сформировавшийся цирроз | F4 | 4 | 6 |
Схема 1. Алгоритм диагностики ХГВ
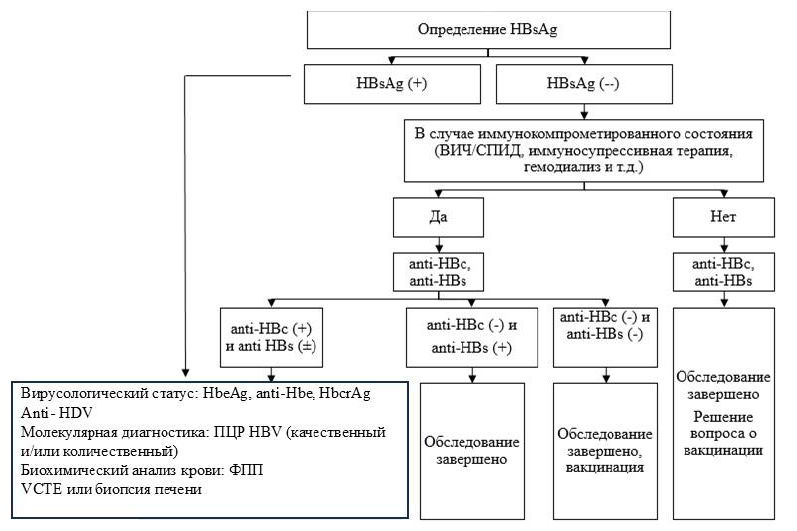
Дифференциальный диагноз
Таблица 5. Дифференциальный диагноз ХГВ
|
Диагноз
|
Обоснование для дифференциальной диагностики | Обследование | Критерии диагноза |
| ОВГ | Клинико-лабораторные симптомы гепатита | anti-HAV IgM; HBsAg, HBeAg, anti-HBs, anti-HBe, anti-HBc /IgM, anti-НВс /IgG, anti-HDV IgM, anti-HDV total, anti-HЕV IgM, anti-HCV; ПЦР: HCV РНК, HBV ДНК, РНК HDV, ДНК HEV в крови и стуле | Эпиданамнез, длительность заболевания < 6 месяцев, (+) маркеры ВГ, (+) ПЦР |
| ХВС | Клинико-лабораторные симптомы гепатита | anti-HCV, ПЦР: HCV РНК | HCV РНК > 6 месяцев |
| МАСБП | Клинико-лабораторные симптомы гепатита | Объем талии, АСТ, АЛТ, ГГТП, ЩФ, глюкоза, инсулин, липидограмма, УЗИ ОБП, мониторинг АД, ЭКГ | Метаболический синдром, стеатоз по УЗИ, (--) маркеры ВГ |
| Алкогольная болезень печени | Клинико-лабораторные симптомы гепатита | АСТ, АЛТ, ГГТП, ЩФ, УЗИ ОБП, анамнез, опросники CAGE, AUDIT | Злоупотребление алкоголем в анамнезе, другие проявления алкоголизма, повышение активности ГГТП, АСТ, соотношения АСТ/АЛТ >1, макроцитоз, В12- фолиево-дефицитная анемия, гистологическая картина |
| АИГ | Клинико-лабораторные симптомы гепатита | АСТ, АЛТ, ГГТП, ЩФ, УЗИ ОБП, биопсия печени, анамнез, аутоантитела (AMA-M2, ANA, anti-LKM-1, anti-SLA), биопсия печени | Аутоантитела (++), цитолиз при нормальной активности ЩФ, ГГТП, характерная гистологическая картина |
| Лекарственное повреждение печени | Клинико-лабораторные симптомы гепатита | Связь с приемом гепатотоксичных препаратов, RUCAM и другие валидизированные шкалы, генетические исследования, биопсия печени | Применение гепатотоксичных препаратов в анамнезе, генетическая предрасположенность, характерная гистологическая картина |
| Гемохроматоз | Клинико-лабораторные симптомы гепатита | Железо, ферритин в крови, генетические исследования, биопсия печени | Повышение сывороточного железа и ферритина, подтверждение при генетическом исследовании, наличие сидероза |
| Болезнь Вильсона | Клинико-лабораторные симптомы гепатита | Содержание меди в крови и моче, церулоплазмин, осмотр офтальмолога, невропатолога, биопсия печени | Неврологические нарушения, повышенное содержание меди, снижение церулоплазмина, наличие колец Кайзера-Флейшера, положительная окраска на медь в гистологическом материале |
Лечение (амбулатория)
Компоненты лечения:
Основу лечения ХГВ составляет противовирусная терапия (ПВТ)
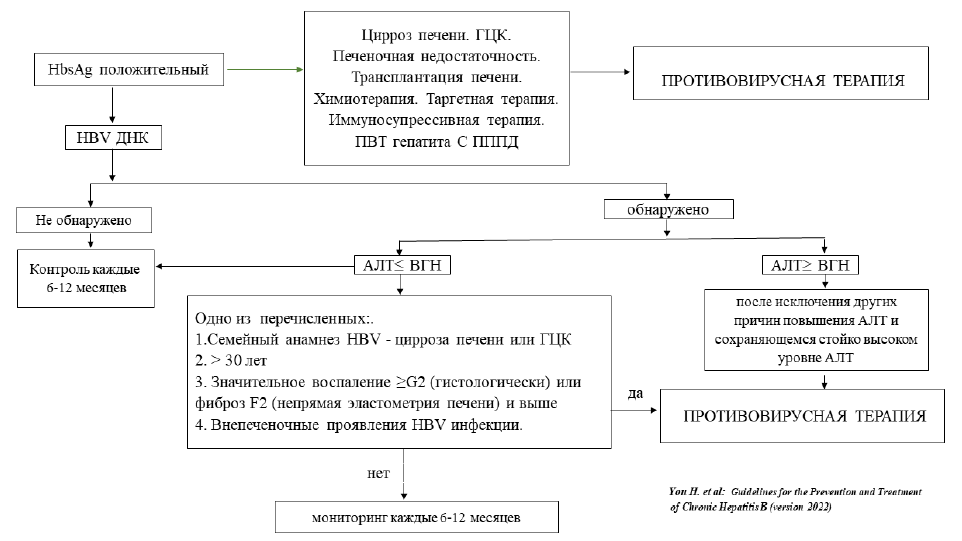
Таблица 6. Основные стратегии ПВТ ХГВ [5,9]
|
Препарат
|
Пегинтерферон альфа-2a | АН |
|
Путь введения
|
Подкожно | Внутрь |
|
Длительность
|
48 недель | Неопределенная / Завершение до достижения стоп-точек у отдельных категорий пациентов |
| Переносимость | Может быть - неудовлетворительная | Хорошая |
| Безопасность при длительном применении | Возможны побочные явления (психические, неврологические, эндокринные нарушения) | Крайне редкие побочные явления (в отношении функции почек, состояния костей для некоторых АН) |
| Противопоказания | Декомпенсированные заболевания печени | Практически нет (в случаях ХБП – подбор дозы в зависимости от СКФ) |
| Стратегия | Индукция длительного иммунного контроля посредством фиксированного курса лечения | Остановка гепатита и прогрессирования заболевания путем ингибирования репликации вируса |
| Уровень вирусной супрессии | Умеренный (различные виды ответа) | Универсально высокий |
| Эффект на потерю HBeAg | Умеренный, в зависимости от исходных характеристик | Низкий в первые годы, увеличивается во время длительной терапии |
| Эффект на потерю HBsAg | Различный, в зависимости от исходных характеристик (в целом, выше по сравнению с АН) | Низкий: медленно возрастает по мере лечения у HBeAg-позитивных пациентов, обычно очень низкий у HBeAg-негативных пациентов |
| Риск рецидива после завершения терапии | Низкий при наличии УВО на 6-12 месяце после лечения | Средний, если проводится консолидирующая терапия после HBeAg-сероконверсии |
| Ранние стоп-точки (правила остановки терапии) | Есть | Нет |
| Риск развития резистентности вируса | Нет | Минимальный или отсутствует |
| Возможность применения при беременности | Нет | Имеется (TDF) |
Таблица 7. Список лекарственных средств, одобренных для лечения ХГВ, и режим дозирования [5,9]
|
МНН
|
Режим дозировки |
| Пегинтерферон альфа-2a | 180 мкг еженедельно подкожно |
| Тенофовир дизопроксил фумарат (TDF) | 300 мг в сутки внутрь |
| Тенофовир алафенамид фумарат (TAF) | 25 мг в сутки внутрь |
| Энтекавир (ETV) | 0,5 мг в сутки внутрь |
Таблица 8. Выбор режима терапии ХГВ
|
Категории пациентов
|
Предпочтительные препараты |
| Пациенты молодого и среднего возраста без ЦП, женщины, желающие вылечиться перед беременностью | Пегинтерферон альфа-2a |
| Декомпенсированный ЦП | АН |
| Трансплантация печени | АН |
| Патология почек (СКФ <60 мл / мин / 1,73 м2; альбуминурия > 30 мг / 24 ч или умеренная протеинурия; снижение фосфатов <2,5 мг / дл; пациенты на гемодиализе) | TAF, ETV |
| Патология костной ткани (длительное использование стероидов или других лекарственных препаратов, снижающих плотность костной ткани; переломы костей в анамнезе; остеопороз) | TAF, ETV |
| Беременность, женщины детородного возраста, планирующие беременность в ближайшее время | TDF |
| Паст-инфекция / оккультный гепатит до и вовремя проведения иммуносупрессивной терапии, химиотерапии | АН |
| ВГD | Пег-ИНФ |
| ВИЧ-коинфекция | АН |
Таблица 9. Мониторинг во время ПВТ
|
Исследование
|
Пегинтерферон альфа-2a | АН (аналог нуклеоз(т)ида) |
| ОАК | 1 раз в 1-2 недели в первый месяц, далее каждые 4 недели | 1 раз в 24 недели у пациентов без ЦП, каждые12 недель у пациентов с ЦП |
| АЛТ, АСТ, билирубин, альбумин, МНО | 1 раз в 4 недели | 1 раз в 24 недели у пациентов без ЦП, каждые 12 недель у пациентов с ЦП |
| Креатинин/клиренс креатинина, мочевина | 1 раз в 12 недель | У пациентов с высоким риском почечных осложнений* – каждые 4 недели в первые 3 месяца, далее каждые 12 недель до конца первого года лечения, далее - каждые 24-48 недель (при отсутствии ухудшения). При клиренсе креатинина менее 60 мл/мин или уровне фосфатов сыворотки менее 2 мг/дл целесообразна более частая оценка |
| Фосфаты | - | |
| ТТГ, глюкоза | 1 раз в 12 недель | - |
| HBV DNA | На 12, 24 и 48 неделях ПВТ и через 24 и 48 недель после ее окончания | 1 раз в 12 недель для подтверждения ВО и далее каждые 24-48 недели во время ПВТ и после ее прекращения (при фиксированном курсе) |
| Осмотр глазного дна | 1 раз в 12 недель | - |
| НBeAg / anti-HBe (у исходно HBeAg-позитивных пациентов) | На 24 и 48 неделях ПВТ и через 24 и 48 недель после ее окончания | Каждые 24 недели во время ПВТ и после ее прекращения (при фиксированном курсе) |
| HBsAg / anti-HBs |
1 раз в 48 недель
1) у HBeAg-позитивных пациентов: после сероконверсии HBeAg и получении отрицательного результата HBV ДНК в результатете ПВТ;
2) у HBeAg-негативных пациентов: при достижении отрицательного HBV ДНК в результатете ПВТ
|
1 раз в 48 недель
1) у HBeAg-позитивных пациентов: после сероконверсии HBeAg и получении отрицательного результата HBV ДНК в результатете ПВТ;
2) у HBeAg-негативных пациентов: при достижении отрицательного HBV ДНК в результатете ПВТ. |
| VCTE | 1 раз в 24- 48 недель. Пациентам со стабильным состояние 96 недель | 1 раз в 48- 96 недель |
| Другие (в зависимости от сопутствующих заболеваний и побочных явлений) | По показаниям | По показаниям |
*Декомпенсированный ЦП, клиренс креатинина менее 60 мл/мин, плохоконтролируемая артериальная гипертензия, протеинурия, неконтролируемый сахарный диабет, активный гломерулонефрит, сопутствующая терапия нефротоксичными препаратами, трансплантация солидного органа.
Таблица 10. Вирусологический ответ
|
Препараты
|
Виды ВО | Определение |
| Пегинтерферон альфа-2a | Вирусологический ответ | Концентрация HBV ДНК < 2000 МЕ/мл (оценивается на 6 месяце терапии) |
| Отсутствие вирусологического ответа | Концентрация HBV ДНК > 2000 МЕ/мл (оценивается на 6 месяце терапии) | |
| Устойчивый вирусологический ответ | Уровень HBV ДНК < 2000 МЕ/мл спустя 12 месяцев после прекращения лечения | |
| Полный ответ | Устойчивый вирусологический ответ после ПВТ в сочетании с клиренсом HBsAg | |
| АН | Вирусологический ответ | Отсутствие (неопределяемый уровень) HBV ДНК по данным высокочувствительной ПЦР |
| Первичное отсутствие ответа | Снижение концентрации HBV ДНК < 1 log10 МЕ/мл от первоначального через 3 месяца после начала терапии; основная причина – резистентность | |
| Частичный вирусологический ответ | Снижение уровня ДНК HBV > 1 log10 МЕ/мл при наличии определяемой HBV ДНК спустя по крайней мере 12 месяцев после начала терапии | |
| Вирусологический рецидив | Подтвержденное повышение уровня HBV ДНК > 1 log10 МЕ/мл по сравнению с наименьшим уровнем ДНК HBV, достигнутым на фоне лечения; основные причины – низкая приверженность к лечению и резистентность вируса | |
| Устойчивый вирусологический ответ | Сохранение уровня HBV ДНК < 2000 МЕ/мл спустя по крайней мере 12 месяцев после прекращения ПВТ | |
| Резистентность | Селекция мутантных штаммов HBV с заменами аминокислот в обратной транскриптазе, которые приводят к снижению чувствительности вируса к АН |
Таблица 11. Тактика при неудаче ПВТ
|
Препараты
|
Период | Показатели неэффективности | Тактика | |
| HBeAg-позитивные пациенты | HBeAg-негативные пациенты | |||
| Пегинтерферон альфа-2a | 12 (24) неделя ПВТ | HBsAg > 20 000 МЕ/мл или не снижается и HBV ДНК не снижается или снижается менее чем на 2 log10 МЕ/мл | HBsAg не снижается и HBV ДНК не снижается или снижается менее чем на 2 log10 МЕ/мл | Рассмотреть вопрос об отмене Пег-ИФН (особенно при генотипе D HBV) и назначении АН |
| 48 неделя (окончание) ПВТ и период последующего наблюдения | Определяется HBeAg или HBV ДНК > 2000 МЕ/мл | HBV ДНК > 2000 МЕ/мл | Рассмотреть вопрос о назначении АН | |
| АН | 12 неделя ПВТ | Первичное отсутствие ответа |
-Оценить приверженность к терапии и правильность приема препарата
-При отсутствии нарушений режима ПВТ желательно провести генотипирование штаммов HBV для выявления возможных мутаций
-Назначить АН в соответствиис профилем резистентности
|
|
| 24 неделя ПВТ | Частичный вирусологический ответ |
-Оценить приверженность к терапии и правильность приема препарата
-Назначить АН в соответствии с профилем резистентности
|
||
| Любой период ПВТ | Вирусологический рецидив |
-Оценить приверженность к терапии и правильность приема препарата (нарушения режима терапии особенно вероятны у пациентов, впервые получающих АН
-Назначить АН в соответствии с профилем резистентности
-При резистентности ко многим препаратам целесообразны генотипирование вируса и применение комбинации аналогов нуклеозидов и нуклеотидов (предпочтительно тенофовира)
|
||
| АН/ Пегинтерферон альфа-2a | Любой период после ПВТ (при ограниченном по времени курсе) | Рецидив | =Возобновить прием АН | |
Таблица 12. Препараты используемые при HDV
|
Тактика
|
Дозировка | Длительность | Мониторинг: |
| Пегинтерферон альфа-2a | 180 мкг 1 раз в неделю | Не менее 48 недель |
ОАК каждые 1-2 недели.
АЛТ, АСТ, билирубин, МНО каждые 4 недели.
Креатинин мочевина, ТТГ каждые 12 недель.
HDV RNA каждые 12-24 недели.
HbsAg, HBV DNA 12-24 недели.
VCTE Каждые 24- 48 недель. Пациентам со стабильным состояние 96 недель.
|
Пациенты с коинфекцией HCV [3-7]:
Схема 1. Тактика ведения пациентов с ВГВ-инфекцией, получающих ИСТ [3-7, 31, 33, 34]:
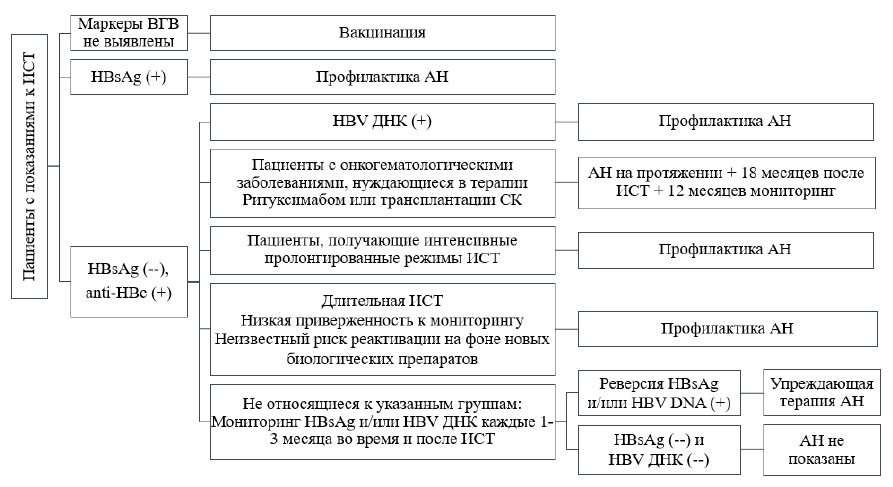
Таблица 13. Градация рисков реактивации у HBsAg (+) пациентов
|
Уровень риска
|
Лекарственные средства (ЛС) | Тактика |
|
Высокий ≥ 10%
|
• Трансплантация стволовых клеток
• Анти-моноклональные ЛС
• ГКС от 20 мг в сутки и срок более 4 недель
• Локорегиональная терапия при ГЦК
• Анти-ТНФ (с высоким потенцирующим эффектом)
|
Назначение АН во время терапии + 12 мес. после отмены ЛС |
| Средний от 1% до 10% |
• Системная химиотерапия
• ГКС 10-20 мг в сутки
• Анти-ТНФ (с меньшим потенцирующим эффектом)
• Циклоспорин
|
Назначение АН во время терапии + 12 мес. после отмены ЛС |
| Низкий < 1% |
• Тиопурины
• Метотрексат
• Короткий курс ГКС низкими дозами
|
Мониторинг каждые 3 месяца |
Таблица 14. Градация рисков реактивации у HBsAg (–) aHBcore (+) ДНК(-) пациентов.
|
Уровень риска
|
Лекарственные средства (ЛС) | Тактика |
|
Высокий ≥ 10%
|
• Трансплантация стволовых клеток
• Анти-моноклональные ЛС
|
Назначение АН во время терапии + 12 мес. после отмены ЛС |
| Средний от 1% до 10% |
• Системная химиотерапия
• ГКС > 20 мг в сутки
• Анти-ТНФ (с высоким потенцирующим эффектом)
|
Назначение АН во время терапии + 12 мес. после отмены ЛС / Мониторинг каждые 3 месяца |
| Низкий < 1% |
• Тиопурины
• Метотрексат
• Умеренные и низкие дозы ГКС
|
Мониторинг каждые 3 месяца |
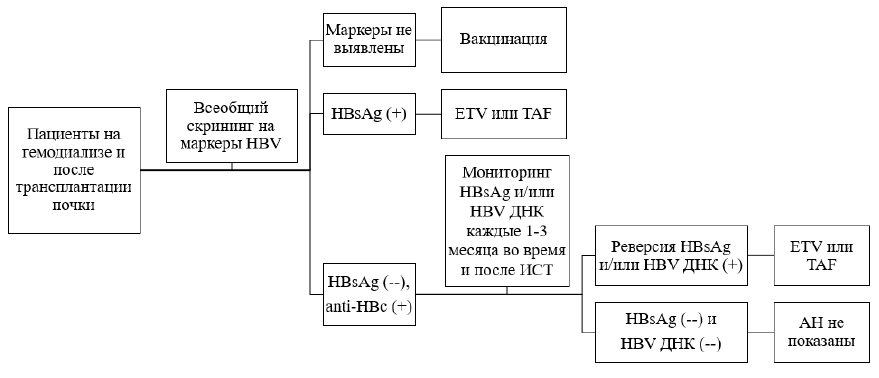
Схема 2. Терапевтическая тактика у реципиентов почки и пациентов на гемодиализе с ВГВ-инфекцией [3-7]:
Медицинская помощь женщинам, планирующим беременность, а также беременным с хронической ВГВ-инфекцией, основывается на следующих общих положениях (УД – А):
• Тактика у женщин с хронической ВГВ-инфекцией, планирующих беременность, заключается в следующем:
- При отсутствии показаний к противовирусной терапии пациентка подлежит динамическому наблюдению.
- В случае отсутствия активного заболевания печени и стадии менее F3 возможна отсрочка терапии до рождения ребенка.
- У женщин детородного возраста без тяжелого фиброза, планирующих беременность в ближайшее время, ПВТ целесообразно отложить до рождения ребенка.
- При наличии активного заболевания печени со стадией F3 и выше (тяжелом фиброзе и компенсированном ЦП) у женщин, которые согласны отложить запланированную беременность, возможно рассмотреть курсовое лечение Пег-ИФН, при этом следует помнить о необходимости эффективной контрацепции во время лечения. Другой опцией, особенно в случае планирования беременности в ближайшее время, показана терапия TDF, которую рекомендуется продолжать во время наступившей беременности и после нее.
• Тактика у беременных с хронической ВГВ-инфекцией, не получавших ПВТ, заключается в следующем:
- При отсутствии показаний к противовирусной терапии и вирусной нагрузке HBV ДНК менее 200 000 МЕ/мл пациентка подлежит динамическому наблюдению; в случае отсутствия тяжелого фиброза (F3) или ЦП и вирусной нагрузке HBV ДНК менее 200 000 МЕ/мл возможна отсрочка терапии до рождения ребенка.
- В случае отсутствия активного заболевания печени, отсутствия тяжелого фиброза (F3) или ЦП, но вирусной нагрузке HBV ДНК > 200 000 МЕ/мл (или HBsAg >4 log10 МЕ/мл), показана профилактическая терапия TDF, которая должна быть начата на 24-28 неделе гестации и продолжена до 12 недели после родов; в дальнейшем необходимость в ПВТ определяется по общим показаниям.
- В случае наличия активного заболевания печени с тяжелым фиброзом или ЦП показана стандартная ПВТ с использованием TDF; по общим показаниям терапию продолжают после родов.
• Тактика у женщин с беременностью, наступившей во время ПВТ по поводу ХГВ:
- В случаях, когда пациентка во время беременности продолжает принимать назначенные ранее противовирусные препараты, показания к терапии ВГВ-инфекции должны быть тщательно пересмотрены.
- В случае отсутствия тяжелого фиброза или цирроза и вирусной нагрузки HBV ДНК менее 200 000 МЕ/мл строгих показаний для продолжения противовирусной терапии нет и пациентка подлежит динамическому наблюдению.
- У беременных, принимающих TDF по поводу активного заболевания печени, тяжелого фиброза (F3) или ЦП, данная терапия должна быть продолжена во время беременности и по общим показаниям - после родов.
- В случае применения по поводу активного заболевания печени, тяжелого фиброза (F3) или ЦП ранее назначенных противовирусных препаратов, противопоказанных при беременности, пациентку следует проинформировать о возможных рисках влияния данных препаратов на плод; в дальнейшем при сохранении беременности их следует заменить на TDF; по общим показаниям терапию продолжают после родов.
Таблица 15. Перечень основных лекарственных средств на амбулаторном уровне [5, 6, 9].
|
№
|
Международное непатентованное наименование ЛС | Способ применения | Кратность применения | Длительность применения | УД |
| 1 | Тенофовир дизопроксил (TDF) | 300 мг внутрь | 1 раз в сутки | Длительно | А |
| 2 | Энтекавир (ETV) | 0.5мг, 1мг внутрь | 1 раз в сутки | Длительно | А |
| 3 | Тенофовир алафенамид (TAF) | 25 мг внутрь | 1 раз в сутки | Длительно | А |
| 4 | Пегинтерферон альфа-2a |
180 мкг / 0,5 мл
Подкожно
|
1 раз в 7 дней | Не менее 48 недель | А |
Таблица 16. Перечень дополнительных лекарственных средств на амбулаторном уровне
| № | Международное непатентованное наименование ЛС | Способ применения | Кратность применения | Длительность применения | УД |
| 1 | Урсодезоксихолевая кислота | 250мг, 300 мг, 450 мг, 500 мг внутрь | 1-3 раза в сутки | По показаниям | В |
Таблица 17. Динамическое наблюдение за пациентами с ХГВ [5, 9].
| Минимальный перечень исследований | Стадия заболевания | |
| F0-F3 | F4/ЦП | |
| Общий анализ крови с подсчетом тромбоцитов | 1 раз в 12 месяцев | 1 раз в 6 месяцев |
| Функциональные пробы печени (АЛТ, АСТ, билирубин, креатинин, альбумин, МНО) | 1 раз в 12 месяцев | 1 раз в 3 месяца |
| АФП | 1 раз в 12 месяцев | 1 раз в 3 месяца |
| УЗИ органов брюшной полости | 1 раз в 12 месяцев | 1 раз в 6 месяцев |
| ПЦР: HBV ДНК | 1 раз в 12 месяцев | 1 раз в 12 месяцев |
| anti-HDV | Минимум 1 раз в течение заболевания | |
| VCTE | Ежегодно | - |
| ЭГДС | - | При отсутствии ВРВ пищевода, желудка при исходном исследовании – каждые 1-2 года (обязательно при показателях VCTE > 20 кПа и одновременном снижении количества тромбоцитов менее 150 000/мкл), альтернатива фактор Виллебранда, при наличии варикозно расширенных вен пищевода, желудка – 1 раз в 6-12 месяцев. |
| Другие исследования | - | Исследования, проводимые при ЦП по показаниям |
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ
Тактика обследования и лечения на стационарном уровне, в целом, соответствует амбулаторному уровню.
Немедикаментозное лечение: смотреть Амбулаторный уровень.
Медикаментозное лечение: смотреть Амбулаторный уровень.
Перечень основных лекарственных средств: смотреть Амбулаторный уровень (таблица 15).
Перечень дополнительных лекарственных средств: представлен в таблице 18.
Таблица 18. Перечень дополнительных лекарственных средств на стационарном уровне.
|
№
|
Международное непатентованное наименование ЛС | Способ применения | Кратность применения | Длительность применения | УД |
| 1 | Урсодезоксихолевая кислота | 250мг, 300 мг, 450 мг, 500 мг внутрь | 1-3 раза в сутки | По показаниям | В |
| 2 | Вакцина против гепатита B, антиген очищенный | 10 мкг 0,5 мл/доза и 20 мкг 1,0 мл/доза в/м | 1,3,6 месяц | - | А |
| 3 |
Иммуноглобулин
против гепатита B
|
200 МЕ/0,4 мл в/м | Однократно | По показаниям | А |
Хирургическое вмешательство.
Хирургическое лечение может потребоваться пациентам с ВГВ-ассоциированным ЦП, терминальным заболеванием печени, ГЦК, и включает эндоскопические и другие малоинвазивные манипуляции при осложнениях ЦП и ГЦК, а также трансплантацию печени при наличии показаний согласно соответствующим протоколам диагностики и лечения.
Дальнейшее ведение: смотреть Амбулаторный уровень (таблица 18).
Индикаторы эффективности лечения [3-7, 15, 18-20]:
Госпитализация
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2025
- 1) Mauss S, Berg T, Rockstroh J, Sarrazin C, Wedemeyer H, editors. Hepatology: A Clinical Textbook. 2018. 2) Pyrsopoulos NT. Hepatitis B Clinical Presentation. Medscape. Updated Aug 01, 2018. Available from: https://emedicine.medscape.com/article/177632-clinical. 3) World Health Organization. Guidelines for the prevention, diagnosis, care and treatment for people with chronic hepatitis B infection: executive summary. Infect Dis Immun. 2024 Jul;4(3):103–105. https://doi.org/10.1097/ID9.0000000000000128. 4) Feld JJ, Janssen HLA, Abbas Z, Elewaut A, Ferenci P, Isakov V, et al. World Gastroenterology Organisation global guideline: Hepatitis B. J Clin Gastroenterol. 2016;50(9):691-703. Available from: https://doi.org/10.1097/MCG.0000000000000647. 5) EASL Clinical Practice Guidelines on the management of hepatitis B virus infection. J Hepatol. 2025;83(2):502-583. Available from: https://doi.org/10.1016/j.jhep.2025.03.018. 6) Terrault NA, Lok ASF, McMahon BJ, Chang KM, Hwang JP, Jonas MM, et al. Update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 hepatitis B guidance. Hepatology. 2018;67(4):1560-1599. Available from: https://doi.org/10.1002/hep.29800. 7) Tang LSY, Covert E, Wilson E, Kottilil S. Chronic hepatitis B infection: a review. JAMA. 2018;319(17):1802-1813. Available from: https://doi.org/10.1001/jama.2018.3795. 8) Sangro B, European Association for the Study of the Liver, et al. EASL Clinical Practice Guidelines on the management of hepatocellular carcinoma. J Hepatol. 2024;82(2):315-374. Available from: https://doi.org/10.1016/j.jhep.2024.08.028. 9) You H, Wang F, Li T, Xu X, Sun Y, Nan Y, et al. Guidelines for the Prevention and Treatment of Chronic Hepatitis B (version 2022). J Clin Transl Hepatol. 2023;11(6):1101-1150. doi: 10.14218/JCTH.2023.00320. 10) Mazzaro C, Adinolfi LE, Pozzato G, Nevola R, Zanier A, Serraino D, et al. Extrahepatic Manifestations of Chronic HBV Infection and the Role of Antiviral Therapy. J Clin Med. 2022 Oct 23;11(21):6247. doi: 10.3390/jcm11216247. 11) European Association for the Study of the Liver; Asociacion Latinoamericana para el Estudio del Higado. EASL-ALEH Clinical Practice Guidelines: Non-invasive tests for evaluation of liver disease severity and prognosis. J Hepatol. 2015 Jul;63(1):237–264. Available from: https://doi.org/10.1016/j.jhep.2015.04.006. 12) WHO Guidelines on hepatitis B and C testing. Feb 2017: http://apps.who.int/iris/bitstream/handle/10665/254621/9789241549981-eng.pdf?sequence=1. 13) Amini A, Varsaneux O, Kelly H, Tang W, Chen W, et al. Diagnostic accuracy of tests to detect hepatitis B surface antigen: a systematic review of the literature and meta-analysis. BMC Infect Dis. 2017 Nov 1;17(Suppl 1):698. Available from: https://doi.org/10.1186/s12879-017-2764-0. 14) Lim JK, Flamm SL, Singh S, Falck-Ytter Y. American Gastroenterological Association Institute Guideline on the Role of Elastography in the Evaluation of Liver Fibrosis. Gastroenterology. 2017 May;152(6):1536–1543. Available from: https://doi.org/10.1053/j.gastro.2017.03.003. 15) Facciorusso A, Garcia Perdomo HA, Muscatiello N, Buccino RV, Wong VW, Singh S. Systematic review with meta-analysis: change in liver stiffness during anti-viral therapy in patients with hepatitis B. Dig Liver Dis. 2018 Aug;50(8):787–794. from: https://doi.org/10.1016/j.dld.2018.03.004. 16) Ridola L, Del Cioppo S. Advancing hepatic recompensation: Baveno VII criteria and therapeutic innovations in liver cirrhosis management. World J Gastroenterol. 2024 Jun 21;30(23):2954–2958. Available from: https://doi.org/10.3748/wjg.v30.i23.2954. 17) Moctezuma Velázquez C, Abraldes JG. Non-invasive diagnosis of esophageal varices after Baveno VI. Turk J Gastroenterol. 2017 May;28(3):159–165. doi: 10.5152/tjg.2017.16744. 18) Kwo PY, Cohen SM, Lim JK. ACG Clinical Guideline: Evaluation of Abnormal Liver Chemistries. Am J Gastroenterol. 2017;112(1):18-35. doi:10.1038/ajg.2016.517. 19) Allweiss L, Dandri M. The role of cccDNA in HBV maintenance. Viruses. 2017 Jun;9(6):156. Available from: https://doi.org/10.3390/v9060156. 20) Xing T, Xu H, Cao L, Ye M. HBeAg seroconversion in HBeAg-positive chronic hepatitis B patients receiving long-term nucleos(t)ide analog treatment: a systematic review and network meta-analysis. PLoS One. 2017 Jan 20;12(1):e0169444. Available from: https://doi.org/10.1371/journal.pone.0169444. 21) Kennedy OJ, Roderick P, Buchanan R, Fallowfield JA, et al. Coffee, including caffeinated and decaffeinated coffee, and the risk of hepatocellular carcinoma: a systematic review and dose-response meta-analysis. BMJ Open. 2017 May 9;7(5):e013739. Available from: https://doi.org/10.1136/bmjopen-2016-013739 . 22) Yurdaydın C, Tabak F. Diagnosis, management and treatment of hepatitis delta virus infection: Turkey 2017 Clinical Practice Guidelines. Turk J Gastroenterol. 2017;28(Suppl 2):S84–S89. Available from: https://doi.org/10.5152/tjg.2017.17035. 23) Lutterkort GL, Wranke A, Hengst J, Yurdaydin C, et al. Viral dominance patterns in chronic hepatitis delta determine early response to interferon alpha therapy. J Viral Hepat. 2018 Nov;25(11):1384–1394.. Available from: https://doi.org/10.1111/jvh.12971. 24) EASL Clinical Practice Guidelines on hepatitis delta virus. Brunetto, Maurizia Rossana et al. Journal of Hepatology, Volume 79, Issue 2, 433 – 460 DOI: 10.1016/j.jhep.2023.05.001. 25) Jiang XW, Ye JZ, Li YT, Li LJ. Hepatitis B reactivation in patients receiving direct-acting antiviral therapy or interferon-based therapy for hepatitis C: a systematic review and meta-analysis. World J Gastroenterol. 2018 Jul 28;24(28):3181–3191. Available from: https://doi.org/10.3748/wjg.v24.i28.3181. 26) APASL Clinical Practice Guideline on the Management of Hepatitis B: A 2015 Update. Hepatol Int. 2015;9(4):549–563. Available from: https://doi.org/10.1007/s12072-015-9675-4. 27) Song A, Wang X, Lu J, Jin Y, Ma L, Hu Z, et al. Durability of hepatitis B surface antigen seroclearance and subsequent risk for hepatocellular carcinoma: A meta-analysis. J Viral Hepat. 2021;28(4):601–612. https://doi.org/10.1111/jvh.13471. 28) Campbell C, Wang T, McNaughton AL, Barnes E, Matthews PC. Risk factors for the development of hepatocellular carcinoma (HCC) in chronic hepatitis B virus (HBV) infection: a systematic review and meta-analysis. J Viral Hepat. 2021;28(3):493–507. https://doi.org/10.1111/jvh.13452. 29) Siemieniuk RA, Foroutan F, Mirza R, Mah Ming J, et al. Antiretroviral therapy for pregnant women living with HIV or hepatitis B: a systematic review and meta-analysis. BMJ Open. 2017 Sep 11;7(9):e019022. Available from: https://doi.org/10.1136/bmjopen-2017-019022. 30) Wu J, Yin F, Zhou X. Efficacy of nucleoside analogues for hepatitis B virus-related liver failure: a network meta-analysis. Acta Pharm. 2018 Mar 1;68(1):19–30. Available from: https://doi.org/10.2478/acph-2018-0003. 31) Loomba R, Liang TJ. Hepatitis B reactivation associated with immune suppressive and biological modifier therapies: current concepts, management strategies, and future directions. Gastroenterology. 2017 May;152(6):1297–1309. Available from: https://doi.org/10.1053/j.gastro.2017.01.021. 32) Kumar, M., Abbas, Z., Azami, M., Belopolskaya, M., Dokmeci, A. K., Ghazinyan, H., Jia, J., Jindal, A., Lee, H. C., Lei, W., Lim, S. G., Liu, C. J., Li, Q., al Mahtab, M., Muljono, D. H., Niriella, M. A., Omata, M., Payawal, D. A., Sarin, S. K., .Zhou, Y. H. (2022). Asian Pacific association for the study of liver (APASL) guidelines: hepatitis B virus in pregnancy. Hepatology International, 16(2), 211–253. https://doi.org/10.1007/s12072-021-10285-5. 33) Su YC, Lin PC, Yu HC, Wu CC. Antiviral prophylaxis during chemotherapy or immunosuppressive drug therapy to prevent HBV reactivation in patients with resolved HBV infection: a systematic review and meta-analysis. Eur J Clin Pharmacol. 2018 Sep;74(9):1111–1119. Available from: https://doi.org/10.1007/s00228-018-2475-4. 34) Wu YT, Li X, Liu ZL, Xu Z, Dai W, Zhang K, et al. Hepatitis B virus reactivation and antiviral prophylaxis during lung cancer chemotherapy: a systematic review and meta-analysis. PLoS One. 2017 Jun 22;12(6):e0179680. doi: 10.1371/journal.pone.0179680. 35) Eke AC, Eleje GU, Eke UA, Xia Y, Liu J. Hepatitis B immunoglobulin during pregnancy for prevention of mother-to-child transmission of hepatitis B virus. Cochrane Database Syst Rev. 2017 Feb 11;(2):CD008545. doi: 10.1002/14651858.CD008545.pub2. 36) Hyun MH, Lee YS, Kim JH, Je JH, Yoo YJ, Yeon JE, et al. Systematic review with meta-analysis: the efficacy and safety of tenofovir to prevent mother-to-child transmission of hepatitis B virus. Aliment Pharmacol Ther. 2017 Jun;45(12):1493–1505. doi: 10.1111/apt.14068. 37) Whitford K, Liu B, Micallef J, Yin JK, Macartney K, Van Damme P, Kaldor JM. Long-term impact of infant immunization on hepatitis B prevalence: a systematic review and meta-analysis. Bull World Health Organ. 2018 Jul 1;96(7):484–497. doi: 10.2471/BLT.17.205153. 38) Neuberger J, Patel J, Caldwell H, Davies S, Hebditch V, Hollywood C, Hubscher S, Karkhanis S, Lester W, Roslund N, West R, Wyatt JI, Heydtmann M. Guidelines on the use of liver biopsy in clinical practice from the British Society of Gastroenterology, the Royal College of Radiologists and the Royal College of Pathology. Gut. 2020;69(8):1382-1403. https://doi.org/10.1136/gutjnl-2020-321299.
Информация
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ПРОТОКОЛА
Сокращения, используемые в протоколе:
|
АЛТ
|
аланиновая аминотрансфераза |
| АН | аналоги нуклеозидов/нуклеотидов |
| АСТ | аспарагиновая аминотрансфераза |
| АФП | альфа-фетопротеин |
|
ВГВ
|
вирусный гепатит B |
| ВГН | верхняя граница нормы |
| ВГС | вирусный гепатит С |
| ВГD | вирусный гепатит D |
| ВИЧ | вирус иммунодефицита человека |
| ВО | вирусологический ответ |
| ВРВ | варикозно расширенные вены |
|
ГГТП
|
гамма-глутамилтранспептидаза |
| ГЦК | гепатоцеллюлярная карцинома |
| ДНК | дезоксирибонуклеиновая кислота |
|
ИМТ
|
индекс массы тела |
| ИГА | индекс гистологической активности |
| ИСТ | иммуносупресивная терапия |
| ИФА | иммуноферментный анализ |
| ИХЛ | иммунохемолюминесцентный анализ |
|
КТ
|
компьютерная томография |
| ЛЖВ | лица, живущие с ВИЧ |
|
ЛУИН
|
лица, употребляющие инъекционные наркотики |
| МЕ | международная единица |
| МНО | международное нормализованное отношение |
| МРТ | магнитно-резонансная томография |
| МРХПГ | магнитно-резонансная холангиопанкреатиграфия |
|
ОБП
|
органы брюшной полости |
| ОГВ | острый гепатит В |
| ПППД | противовирусные препараты прямого действия |
| ПБП | пункционная биопсия печени |
| ПВ | протромбиновое время |
| ПВТ | противовирусная терапия |
| ПЕГ-ИНФ | Пегинтерферон альфа-2a |
| ПЦР | полимеразная цепная реакция |
| РНК | рибонуклеиновая кислота |
|
СКФ
|
скорость клубочковой фильтрации |
| ТП | трансплантация печени |
| ТТГ | тиреотропный гормон |
| УВО | устойчивый вирусологический ответ |
| УЗИ | ультразвуковое исследование |
| УЗДГ | ультразвуковая допплерография |
|
ХБП
|
хроническая болезнь почек |
| ХГ | хронический гепатит |
| ХГВ | хронический гепатит В |
| ХГD | хронический гепатит D |
| ХГС | хронический гепатит C |
| ЦП | цирроз печени |
| ЩФ | щелочная фосфатаза |
|
ЭГДС
|
эзофагогастродуоденоскопия |
| ЭКГ | электрокардиограмма |
| УД | уровень доказательности |
|
AASLD
|
Американская ассоциация по изучению болезней печени |
| APASL | Азиатско-Тихоокеанская ассоциация по изучению печени |
| ANA | антинуклеарные антитела |
| AMA | антимитохондриальные антитела |
| APRI | индекс соотношения АСТ к числу тромбоцитов |
|
anti-HAV
|
антитела к вирусу гепатита A |
| anti-HBs | антитела к поверхностному антигену вируса гепатита В |
| anti-HBe | антитела к e-антигену вируса гепатита B |
| anti-HBc | антитела к ядерному антигену вируса гепатита В |
| anti-HCV | антитела к вирусу гепатита C |
| anti-HDV | антитела к вирусу гепатита D |
| anti-HEV | антитела к вирусу гепатита Е |
| anti-HIV | антитела к вирусу иммунодефицита человека |
|
EASL
|
Европейская ассоциация по изучению печени |
| ETV | энтакавир |
|
F
|
фиброз |
| HAV | вирус гепатита А |
| HBV | вирус гепатита В |
| HCV | вирус гепатита С |
| HDV | вирус гепатита D |
| HEV | вирус гепатита Е |
|
HBcAg
|
ядерный (сердцевинный) антиген гепатита В |
| HBeAg | экскретируемый антиген вируса гепатита В |
| HBsAg | поверхностный антиген вируса гепатита В |
| HbcrAg | антиген, связанный с core-белками вируса гепатита B |
|
HIV
|
вирус иммунодефицита человека |
| IgG | иммуноглобулин G |
| IgM | иммуноглобулин M |
| LBx | биопсия печени |
|
MELD
|
модель конечной стадии заболевания печени |
|
NICE
|
Национальный институт здоровья и лучшей практики |
| TAF | тенофовир алафенамид фумарат |
| TDF | тенофовир дизопроксил фумарат |
| VCTE | Вибрационноө контролируемая транзиентная эластография |
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.