Хронический вирусный гепатит B у взрослых
 Версия: Клинические рекомендации РФ 2024 (Россия)
Версия: Клинические рекомендации РФ 2024 (Россия)
Общая информация
Краткое описание
Разработчик клинической рекомендации
Российское общество по изучению печени
Национальная ассоциация специалистов по инфекционным болезням имени академика В. И. Покровского (НАСИБ)
Одобрено Научно-практическим Советом Минздрава России
Хронический вирусный гепатит B
Пересмотр не позднее: 2026
Специальность: Инфекционные болезни
ID: 900_1
Статус применения: Применяется
Определение заболевания или состояния (группы заболеваний или состояний)
Хроническая инфекция, вызываемая вирусом гепатита B (HBV- hepatitis B virus), может протекать как с развитием воспаления в ткани печени (гепатита), так и без признаков некровоспалительных изменений. В связи с этим, в настоящее время в в международной классификации используется два термина: хроническая HBV-инфекции, при отсутствие клинико-лабороаторных признаков некровоспалителения в ткани печени, и хронический вирусный гепатит В (ХВГВ), при наличии таковых [1]. Учитывая, что данные состояния являются фазами единого патологического процесса, в статистической номенклатуре используется термин ХВГВ [2].
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
B18.1 - Хронический вирусный гепатит В без дельта-агента
Применявшийся ранее код Z22.5 для носителей вирусного гепатита был исключен из последнего пересмотра МКБ-10
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
1. По фазам инфекционного процесса:
Хроническая HBeAg-позитивная инфекция (ранее - фаза иммунной толерантности)
Хронический HBeAg-позитивный гепатит (ранее - фаза иммунного клиренса)
Хроническая HBeAg-негативная инфекция (ранее - фаза иммунного контроля)
Хронический HBeAg-негативный гепатит (ранее - фаза реактивации)
HBsAg – негативная фаза (скрытая HBV-инфекция)
2. По степени выраженности клинических проявлений:
Клинико-лабораторная реактивация на доцирротических стадиях
Обострение на фоне цирроза печени
3. По стадиям фиброза:
0 – без фиброза;
1 – слабовыраженный фиброз;
2 – умеренный фиброз;
3 – выраженный фиброз;
4 – цирроз печени.
4. По степени активности воспаления в ткани печени:
-
минимальная;
-
слабовыраженная;
-
умеренная;
-
выраженная.
5. По наличию осложнений (на стадии цирроза печени):
-
без осложнений;
-
с наличием осложнений.
Хроническая HBV-инфекция имеет 5 фаз [1]. Их различают по наличию активного воспалительного процесса в печени (ХВГВ, если он есть, и HBV-инфекция, если его нет) и признаков репликации вируса, что определяется по наличию в крови HBeAg.
Первая фаза получила название HBeAg-положительная HBV-инфекция. Как можно понять из названия, в эту фазу вирус активно размножается (вирусная нагрузка очень высокая и HBeAg выявляется в крови), но макроорганизм на него практически не реагирует, что проявляется отсутствием признаков гепатита (нормальная активность АЛТ крови, нет или минимальные некровоспалительные изменения в биоптате печени). В предыдущей классификации эта фаза имела название "иммунологическая толерантность", то есть отсутствие реакции иммунной системы на вирус, что влечет за собой его активное размножение в сохранной печени, так как сам возбудитель не имеет цитопатического эффекта. Пациенты не имеют каких-либо признаков заболевания, но крайне заразны ввиду высокой концентрации возбудителя в биосредах. Эта фаза особенно длительная у инфицированных при рождении и детей.
Со временем иммунная система начинает реагировать на возбудителя, повреждая инфицированные гепатоциты, что приводит к развитию воспаления и фиброза в печени, повышению активности АЛТ в крови и появлению иных клинических и лабораторных признаков гепатита. Однако вирус еще продолжает активно размножаться, что выражается в достаточно высокой вирусной нагрузке, правда, меньшей, чем в первой фазе. Данная фаза - HBeAg-положительный ХВГB. Ее исход зависит от способности иммунной системы взять под контроль репликацию вируса. Если ей это удается, воспаление в печени купируется, но возбудитель продолжает персистировать как микрохромосомы кзкДНК и интегрированный в геном гепатоцитов. Эта фаза получила название HBeAg-отрицательная HBV-инфекция. Для нее характерна минимальная или нулевая вирусная нагрузка, нормальная активность АЛТ в крови, минимальные некровоспалительные изменения в биоптате печени или их отсутствие, но возможно наличие фиброза различной степени выраженности как результат активного воспаления в течение предыдущей фазы. Вместо HBeAg в этой фазе в крови выявляются анти-HBe, то есть происходит сероконверсия по HBeAg. Ввиду отсутствия выраженного патологического процесса в печени, риск прогрессирования заболевания в цирроз печени (ЦП) и развития гепатоцеллюлярной карцинома (ГЦК) на этой фазе минимальный. При этом у 1–3% таких пациентов в год спонтанно происходит элиминация HBsAg из крови с появлением анти-HBs антител (сероконверсия по HBsAg) или без этого. В ряде случаев, однако, имеет место реактивация инфекции с повторным развитием ХВГВ.
Если же иммунная система не в состоянии полностью подавить репликацию HBV, воспаление в печени персистирует, но вирусная нагрузка уменьшается и также происходит сероконверсия по HBeAg. Эта фаза получила название HBeAg-отрицательный ХВГВ. Обычно у данных пациентов имеются мутации в геноме вируса, которые снижают или выключают экспрессию HBeAg, то есть HBeAg-отрицательность в данном случае может быть обусловлена не столько активностью иммунной системы, столько мутациями самого вируса.
У незначительного числа пациентов с хронической HBV-инфекцией, как правило, как исход HBeAg-отрицательный HBV-инфекции наблюдается элиминация HBsAg из крови (фаза HBsAg-отрицательная HBV-инфекция) с появлением анти-HBs или без HBs-сероконверсии. Этой фазе соответствует глубокое угнетение, но не элиминация HBV-инфекции, ни HBeAg, ни ДНК HBV в крови не определяются, но обычно в биоптате печени можно выявить вирусную кзкДНК. Воспалительный процесс в печени обычно минимальный, АЛТ в норме, но возможно сохранение фиброза, развившегося в исходе активности заболевания на предыдущих стадиях. Прогноз в данном случае определяется стадией фиброза. Если ЦП уже развился, то сохраняется повышенный риск появления ГЦК, если нет, то вероятность прогрессирования заболевания в ЦП и ГЦК минимальная. Однако при иммуносупрессии возможна реактивация инфекции и возврат HBsAg [31, 73, 107-110, 113, 116, 126, 183].
Дифференциальная диагностика фаз хронической HBV-инфекции представлена в таблице 1.
Таблица 1. Дифференциальная диагностика фаз хронической HBV-инфекции
|
|
HBeAg-положительные |
HBeAg-отрицательные |
HBsAg-отрицательная HBV-инфекция |
||
|---|---|---|---|---|---|
|
HBV-инфекция |
ХВГВ |
HBV-инфекция |
ХВГВ |
||
|
HBsAg |
+++ |
+++/++ |
+ |
++ |
- |
|
HBeAg |
+ |
+ |
- |
- |
- |
|
ДНК HBV, МЕ/мл |
>10.000.000 |
10.000-10.000.000 |
< 2000 |
>2.000 |
< 200 |
|
АЛТ |
Норма |
Повышена |
Норма |
Повышена всегда или периодически |
Норма |
|
Некровоспалительные изменения в биоптате печени |
Минимальные или их нет |
Выраженные |
Минимальные или их нет |
Выраженные |
Минимальные или их нет |
Отдельно выделяют ЦП и ГЦК в исходе ХВГВ.
Поскольку HDV (hepatitis D virus - вирус гепатита D) способен размножаться только при наличии HBV, ко- и суперинфекцию HDV рассматривают как варианты HBV-инфекции [89].
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Возбудителем ХВГВ является HBV, который представляет собой небольшой гепатотропный ДНК-вирус, относящийся к семейству Hepadnaviridae. Снаружи он покрыт липидной оболочкой, в которую встроен HBsAg (HBV surface antigen - поверхностный антиген вируса гепатита В). Оболочка окружает сердцевину-нуклеокапсид (core), включающую HBcAg (HBV core antigen - вирусный ядерный (сердцевинный) антиген). Внутри нуклеокапсида находится вирусная полимераза и вирусный геном, особенность которого состоит в том, что он представлен двойной цепью ДНК, одна из которых короче другой [3-5].
HBV способен интегрироваться в геном человека, что определяет его длительное персистирование и затрудняет эрадикацию данного инфекционного агента. Человек является единственным естественным хозяином для HBV [3-5]. В организме человека HBV сначала неспецифически прикрепляется к гепарансульфату, находящемуся на клеточной мембране гепатоцита, после чего создаются условия для взаимодействия HBsAg с трансмембранным белком гепатоцита NTCP (sodium-taurocholate cotransporting polypeptide — полипептид, совместно переносящий натрий и таурохолат), который является рецептором для вируса, определяя его гепатотропность. Далее происходит эндоцитоз вируса [8-11]. Мембрана эндосомы сливается с оболочкой вируса, освобождая в цитозоль нуклеокапсид, который далее траспортируется моторной системой микротрубочек гепатоцита к его ядру. Там нуклеокапсид освобождает вирусную ДНК, от которой отсоединяется ковалентно связанная с ней вирусная полимераза. Она достраивает меньшую из цепей ДНК вируса и ковалентно замыкает обе цепи, формируя ковалентно замкнутую кольцевидную ДНК (кзкДНК), которая служит матрицей для образования вирусных белков и прегеномной РНК. КзкДНК покрывается гистонами и негистонными белками, становясь своеобразной дополнительной микрохромосомой в ядре гепатоцита, где их может быть несколько десятков копий. КзкДНК весьма стабильна и может существовать довольно долго, также обеспечивая персистирование инфекции [12].
Часть молекул ДНК вируса встраивается в хромосомы гепатоцита в виде интегрированной ДНК, что может способствовать канцерогенезу.
РНК-полимераза II гепатоцита осуществляет транкрипцию информационных РНК белков HBV, а также прегеномной РНК вируса, которые переправляются в цитоплазму гепатоцита, где прегеномная РНК вируса связывается с вирусной полимеразой и HBcAg, формируя незрелый нуклеокапсид. Внутри незрелого нуклекапсида вирусная полимераза по матрице прегеномной РНК сначала образует полную (-) ДНК цепь, а затем, используя уже последнюю как матрицу, - неполную (+) ДНК цепь, формируя таким образом зрелый капсид, который возвращается в ядро для пополнения пула кзкДНК вируса или отправляется в эндоплазматическую сеть, чтобы, покрывшись липидной оболочкой с HBsAg, покинуть клетку [13]. При этом HBsAg образуется с большим избытком, его молекулы формируют агрегаты, которые также частично выделяются в кровь.
HBsAg в виде указанных агрегатов и как компонент вирусной оболочки присутствует в крови пациентов с первых недель инфицирования (за несколько недель до появления клинических и биохимических признаков заболевания) и до полного угнетения транскрипции вирусного генома. При благоприятном течении острого гепатита В это наблюдается в течение не более 6 месяцев заболевания. Если HBsAg персистирует в крови более 6 месяцев, это свидетельствует о развитии хронической HBV-инфекции [14].
В отличие от HBsAg, HBcAg не секретируется гепатоцитами и практически отсутствует в крови пациентов, но, тем не менее, организм вырабатывает антитела против данного антигена. Анти-HBc являются самыми первыми антителами, которые образуются в ответ на HBV-инфекцию: их можно обнаружить начиная с первого месяца после появления HBsAg в крови. В отличие от антител против других вирусных антигенов (HBsAg и HBeAg), они вырабатываются, как правило, у всех пациентов. Так как в вакцине для профилактики вирусного гепатита В** содержится только HBsAg, в ответ на ее введение вырабатываются только антитела против HBsAg. Инфицирование HBV практически всегда сопровождается образованием анти-HBc, которые не вырабатываются в ответ на вакцинацию, причем эти антитела сохраняются в крови на протяжении многих лет даже после элиминации HBsAg и вирусной ДНК из крови, поэтому наличие этих антител в крови является надежным маркером имевшегося контакта организма с НBV. В случае отсутствия стерилизационного ответа может происходить реактивация НBV-инфекции при развитии приобретенного иммунодефицита или лекарственной иммуносупрессии, что диктует необходимость обследовать таких пациентов на анти-HBc [14, 110, 159].
Помимо структурных белков вирусный геном кодирует также экскреторный антиген HBeAg, точная функция которого пока не установлена, но показано, что его содержание в крови является показателем активности репликации вирусного генома. Элиминация этого антигена из крови, особенно с последующим появлением анти-HBe (HBe-сероконверсия), является показателем снижения активности вируса и заразности пациента [14].
Выделяют 10 генотипов HBV (A-J), различных по последовательности генома на 8% и более. Генотипы А и D широко распространены в Африке, Европе, России и Индии, генотипы B и С - в Азии [1,5].
ХВГВ, вызванный вирусом генотипов С и D, имеет больший риск прогрессирования, чем вызванный генотипом А [15]. Частота ремиссии после сероконверсии по HBeAg, а также спонтанной элиминации HBsAg выше у пациентов с генотипом А по сравнению с генотипами C и D [16-17, 136]. Ответ на терапию интерферонами зависит от генотипа, в отличие от ответа на применение противовирусных препаратов прямого действия (нуклеозидов и нуклеотидов – ингибиторов обратной транскриптазы (см.3.3).
Так как вирусная полимераза при создании генома новых вирионов часто ошибается, вирус довольно активно мутирует и со временем у одного инфицированного в организме образуется несколько генетически различных квазивидов возбудителя [18, 143, 167].
Сам вирус не оказывает цитопатического эффекта и повреждение гепатоцитов при инфекции в основном обусловлено не самим вирусом, а реакцией на него иммунной системы. В зависимости от ее выраженности возможны следующие исходы HBV-инфекции. Если она адекватная и своевременная, происходит элиминация циркулирующих в крови вирусов и угнетение их репликации в гепатоцитах, что приводит к выздоровлению после острой инфекции. Если иммунный ответ слишком выраженный и/или несвоевременный, это приводит к массивной гибели гепатоцитов и развитию острого фульминантного гепатита В, достаточно часто со смертельным исходом [135]. В случае замедленного или неполноценного иммунного ответа, в том числе за счет истощения функции NK-звена, происходит хронизация инфекции [14, 137].
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
По оценкам ВОЗ, в 2019 г. в мире насчитывалось 296 млн. больных хроническим гепатитом В [19]. В настоящее время за счет активного внедрения вакцинации наблюдается некоторое снижение заболеваемости [20].
Заболеваемость ХВГВ на территории РФ в 2000–2009 гг. стабилизировалась на уровне 14,0-16,0 на 100 тыс. населения. С 2010 г. наметилась тенденция к снижению заболеваемости ХВГВ в Российской Федерации. В 2018 г. выявлено 13615 новых случаев ХВГВ, показатель заболеваемости составил 9,28 на 100 тыс. населения. В 2019 г. в России заболеваемость ХВГВ существенно снизилась и составила 8,6 на 100 тыс. населения. Отмечается возможное влияние пандемии COVID-19 на показатель заболеваемости ХВГB вследствие недостаточного выявления новых случаев заболевания: так в 2020 и 2021 году заболеваемость ХВГВ составила 4,36 и 5,1 на 100 тыс. населения, а в 2022 году данный показатель составил 8,3 на 100 тыс. населения. В 2023 году показатель заболеваемости составил 8,4 на 100 тыс. населения. Эпидемический процесс, проявляющийся хроническими формами инфекции, играет ведущую роль в поддержании непрерывности процесса. Заболеваемость ХВГВ приближается в некоторых регионах к 1000 на 100000, т. е. составляет около 1% численности всего населения. Наиболее высокие уровни наблюдаются в самой активной социальной возрастной группе 30-39 лет [21].
HBV весьма устойчив во внешней среде: при комнатной температуре он сохраняется 3 месяцев, в холодильнике - 6 месяцев, в высушенной плазме - 25 лет [22].
Источником инфекции является человек. Хотя вирус можно выявить практически из всех биологических жидкостей зараженного, реальную эпидемиологическую опасность представляют только кровь и сперма. В естественных условиях инфекция передается половым путем, при бытовых контактах ран с инфицированной кровью и вертикально, преимущественно при родах [14].
Инфицирующая доза возбудителя весьма мала, поэтому возможна передача через невидимые невооруженным глазом микрокапли крови, попавшие на микроскопические раны кожи и слизистых оболочек, например, при использовании общих расчесок, мочалок и прочих гигиенических предметов.
При вагинальном сексе основным фактором риска выступает травматизация половых путей женщины и половых органов мужчины. Поскольку прямая кишка не приспособлена для сексуальных сношений, при анальном сексе риск ее травматизации довольно высок, что предопределяет более высокий риск инфицирования при таких контактах. Риск инфицирования при поцелуе крайне низок, но оно возможно при попадании крови из кровоточащих десен инфицированного на ранки слизистой оболочки ротовой полости партнера.
Риск перинатального инфицирования без проведения профилактики составляет 85–90% для HBeAg-положительных матерей и 30% для HBeAg-отрицательных [23]. Инфицирование плода внутри матки происходит редко. Как правило, заражение имеет место в результате попадания крови матери в ранки плода при их травмировании в процессе прохождении последнего по родовым путям [14]. Кесарево сечение снижает риск инфицирования более чем на треть [24]. Хотя HBsAg выявляется в грудном молоке, при проведении двойной профилактики передачи возбудителя новорожденным (см. 3.10) грудное вскармливание считается безопасным [25].
Кроме того, вирус может передаваться при многократном использовании инструментов для внутривенного введения наркотиков, медицинских манипуляциях, бытовом или косметологическом травмировании слизистых оболочек и кожи [14]. По данным Центра по контролю и профилактике заболеваний США, среди инфицированных HBV 38% имели множественные гетеросексуальные связи, 11% - анальные гомосексуальные контакты, 15% использовали внутривенные психоактивные вещества, у 12% в анамнезе было оперативное вмешательство, у 4% - чрескожные процедуры (татуаж, пирсинг и прочее), 2% имели длительный бытовой контакт с инфицированным, менее 1% - гемодиализ или переливания крови, около 1% были медицинскими работниками [26].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
У большинства пациентов заболевание протекает бессимптомно и выявляется или при обследовании в рамках предоперационной или предгоспитализационной подготовки или по поводу диспепсических явлений, как правило, не связанных прямо с наличием ХВГВ. От времени инфицирования до установления диагноза может пройти несколько лет. Достаточно часто заболевание проявляется астеновегетативным синдромом, который выражается в слабости, выраженной утомляемости, нервозности, сниженной работоспособности. В ряде случаев первым проявлением заболевания являются иммунологически обусловленные внепеченочные состояния: артрит и артралгии, миозит, миокардит, перикардит, интерстициальные заболевания легких, гломерулонефрит, тубулоинтерстициальный нефрит, синдром Шегрена, узелковый полиартериит и другие васкулиты, анемия, панцитопения, полинейропатия, криоглобулинемия. Облегчает диагностику появление желтухи, что является нечастым проявлением заболевания. У достаточного числа пациентов диагноз устанавливается только после манифестации осложнений ЦП: кровотечения из варикозно расширенных вен пищевода и развития асцита [74].
При физикальном осмотре при отсутствии желтухи патологических знаков может не выявляться вообще, или же они могут ограничиться только незначительной гепатомегалией [19].
У нелеченых пациентов с ХВГВ риск развития ЦП в течение 5 лет составляет 10–20%, при ЦП риск декомпенсации в течение 5 лет - 20% [31, 32], риск развития ГЦК при ЦП составляет 2-5% за год [27, 31]. Следует помнить, что ГЦК может развиться и у пациентов, получающих эффективную терапию [28]. К факторам риска развития ГЦК при HBV-инфекции относят: наличие ЦП, выраженный и длительный воспалительный процесс в печени, старший возраст, мужской пол, генетическую предрасположенность (ГЦК в семейном анамнезе), активное курение, сочетанное поражение печени (алкоголь, другие гепатотропные вирусы, ВИЧ-инфекция, сахарный диабет и другие), высокие вирусная нагрузка и содержание HBsAg в крови, генотип С вируса, его мутации [1, 28, 32, 138].
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза заболевания/состояния:
Диагноз хронической HBV-инфекции устанавливается на основании выявления в крови пациента HBsAg в течение не менее 6 месяцев наблюдения. Отсутствие HBV ДНК при наличии HBsAg не исключает HBV инфекции.
Лица с отрицательными результатами на HBsAg, ДНК HBV и анти-HBs, но с положительным результатом на анти-HBc условно считаются не имеющими HBV-инфекции и излеченными от нее, однако возможно сохранение кзкДНК возбудителя в гепатоцитах, что создает вероятность реактивации заболевания при угнетении иммунной системы, в том числе ятрогенной.
-
Рекомендовано скрининговое серологическое обследование на HBsAg групп людей с высоким риском заражения [1],[2] [6, 7, 9, 10, 18, 21, 22, 26, 41, 47, 48]:
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: к данному контингенту относятся:
-
Беременные женщины (в I и III триместрах беременности);
-
Реципиенты крови и ее компонентов, органов и тканей (при подозрении на инфицирование HBV и в течение 6 месяцев после переливания компонентов крови);
-
Персонал медицинских организаций (при приеме на работу и далее 1 раз в год, дополнительно – по показаниям);
-
Пациенты центров и отделений гемодиализа, пересадки почки, сердечно-сосудистой и легочной хирургии, гематологии (при поступлении и при необходимости по клиническим и эпидемиологическим показаниям);
-
Пациенты перед поступлением на плановые хирургические вмешательства, перед проведением химиотерапии (не ранее 30 дней до поступления или начала терапии);
-
Пациенты с хроническими заболеваниями, в том числе с поражением печени (в процессе первичного клинико-лабораторного обследования, дополнительно – по показаниям);
-
Пациенты наркологических и кожно-венерологических диспансеров, кабинетов, стационаров, исключая пациентов с дерматомикозами и чесоткой (при постановке на учет и далее не реже 1 раза в год, дополнительно – по показаниям);
-
Опекаемые и персонал учреждений с круглосуточным пребыванием детей или взрослых (при поступлении и далее не реже 1 раза в год, дополнительно – по показаниям);
-
Контактные лица в очагах острого и хронического гепатита В (не реже 1 раза в год; через 6 месяцев после разобщения или выздоровления (смерти) пациента с ХВГВ);
-
Лица, относящиеся к группам риска по заражению HBV (потребители инъекционных наркотиков и их половые партнеры; лица, оказывающие услуги сексуального характера, и их половые партнеры; лица с большим количеством случайных половых партнеров);
-
Лица, находящиеся в местах лишения свободы (при поступлении в учреждение, дополнительно – по показаниям);
-
Доноры крови (ее компонентов), органов и тканей, спермы (при каждой донации или каждом взятии донорского материала);
-
Дети в возрасте до 12 месяцев, рожденные от инфицированных ВГВ матерей (в возрасте 2, 6 (при отсутствии ДНК HBV в возрасте 2 месяца) и 12 месяцев);
-
Пациенты с иммунодефицитом (пациенты с онкологическими заболеваниями, пациенты на гемодиализе, пациенты на лечении иммунодепрессантами и др.);
-
Пациенты, имеющие заболевание печени неясной этиологии (в процессе первичного клинико-лабораторного обследования).
-
Исследование крови на определение антител классов к ядерному антигену (HBcAg) вируса гепатита B (Hepatitis B virus) в крови и определение антител к поверхностному антигену (HBsAg) вируса гепатита B (Hepatitis B virus) в крови рекомендовано всем пациента, которым планируется любая иммуносупрессивная терапия
__________________________________________________________________
[1] Методические указания МУ3.1.2792–10 «Эпидемиологический надзор за гепатитом В», Москва, - 2011,- с. 48.
[2] СанПиН 3.3686–21 "Санитарно-эпидемиологические требования по профилактике инфекционных болезней" VII. Профилактика вирусных гепатитов В и С (Зарегистрировано в Минюсте России 15.02.2021 N 62500)
1. Жалобы и анамнез
Не существует жалоб, специфических для хронической HBV-инфекции. Заболевание как правило, протекает бессимптомно или под маской астено-вегетативного синдрома и может манифестировать с осложнений ЦП (асцит, кровотечение из варикозно расширенных вен пищевода, печеночная энцефалопатия) [74, 134].
2. Физикальное обследование
Физикальный осмотр может не выявить каких-либо изменений. Возможно наличие желтухи, гепатомегалии и признаков ЦП (асцит, "печеночные ладони", варикозное расширение вен брюшной стенки, отеки, спленомегалия) [74, 134].
3. Лабораторные диагностические исследования
3.1. На этапе постановки диагноза:
-
Рекомендуется всем пациентам с подозрением на ХВГВ выполнение общего (клинического) анализа крови с дифференцированным подсчетом лейкоцитов (лейкоцитарная формула) и уровня тромбоцитов в крови для своевременного выявления осложнений и неотложных состояний и в комплексной оценке степени тяжести заболевания [22, 119, 131, 133, 134].
Уровень убедительности рекомендаций C (уровень достоверности доказательств –5).
Комментарии: выполняется для определения уровня гемоглобина, эритроцитов, тромбоцитов пациента, а также для выявления общих воспалительных реакций.
-
Рекомендовано проведение общего (клинического) анализ мочи пациентам с подозрением на ХВГВ во время первичного обследования для выявления признаков нарушения пигментного обмена и сопутствующей бактериальной инфекции мочевыводящих путей [1, 22, 119, 131, 133, 134].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: для не осложненной формы вирусного гепатита характерны изменение цвета мочи, повышение уробилиногена и желчных пигментов.
-
Рекомендовано выполнение анализа крови биохимического общетерапевтического (исследование уровня общего билирубина, уровня свободного и связанного билирубина, определение активности аланинаминотрансферазы и аспартатаминотрансферазы (АЛТ, АСТ), гамма-глютамилтрансферазы (ГГТ), щелочной фосфатазы (ЩФ)) всем пациентам с подозрением на ХВГВ для оценки наличия и активности синдромов нарушения пигментного обмена, цитолиза и холестаза [1, 22, 119, 131, 133, 134].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
-
Рекомендуется всем пациентам с подозрением на ХВГВ исследование уровня альбумина в крови для выявления снижения белково-синтетической функции печени [1, 22, 119, 131, 133, 134].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: характерна диспротеинемия.
-
Рекомендуется пациентам с ХВГВ при наличии геморрагического синдрома выполнение коагулограммы (ориентировочного исследования системы гемостаза): определение времени свертывания нестабилизированной крови или рекальцификации плазмы, времени кровотечения, протромбинового (тромбопластинового) времени в крови или в плазме, тромбинового времени в крови, ПТИ и МНО для оказания своевременной помощи [1, 22, 119, 131, 133, 134].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: при наличии геморрагического синдрома выявляется снижение фибриногена и факторов свертывания: II, V, VII, VIII, IX, X, снижение протромбинового времени, удлинение периода свертывания крови, снижение ПТИ.
-
Рекомендовано всем пациентам с подозрением на ХВГВ определение антигена (HBsAg) вируса гепатита B (Hepatitis B virus) в крови, качественное исследование, антигена (HbeAg) вируса гепатита B (Hepatitis B virus) в крови, определение антител к e-антигену (anti-HBe) вируса гепатита B (Hepatitis B virus) в крови, определение антител класса M и класса G к ядерному антигену (anti-HBc IgM) вируса гепатита B (Hepatitis B virus) в крови в крови для исключения HBV-инфекции [21, 131, 132, 133].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: HBV является весьма распространенной причиной гепатита, поэтому при выявлении повышения активности АЛТ данную инфекцию следует исключить одной из первых. HBsAg - один из самых ранних маркеров HBV-инфекции и положителен на всех ее фазах кроме скрытой HBs-инфекции, при которой не наблюдается активного поражения печени. HBsAg появляется в крови обычно через 4-6 мес. после инфицирования и до увеличения активности АЛТ в крови. Данное исследование недорого и широко доступно [21].
Для фазы скрытой HBV-инфекции при которой HBsAg в крови не определяется, характерно отсутствие активного процесса в печени, что практически исключает HBV-инфекцию как причину гепатита [139, 140].
-
Рекомендуется у всех лиц с наличием HВsAg в крови определение антител к вирусу гепатита D (Hepatitis D virus) в крови (anti-ВГD) независимо от уровня ДНК вируса гепатита B (ДНК ВГВ), активности аспартатаминотрансферазы и аланинаминотрансферазы в крови, наличия симптомов [60, 68-70, 71].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: к лицам с высоким риском заражения ВГD относятся:
-
пациенты с острой и хронической ВГВ-инфекцией;
-
потребители инъекционных наркотиков и их половые партнеры;
-
лица, оказывающие услуги сексуального характера, и их половые партнеры;
-
лица с большим количеством случайных половых партнеров;
-
мужчины, практикующие секс с мужчинами;
-
члены семьи и лица, проживающие в постоянном контакте с пациентом;
-
лица, мигрировавшие из эндемичных регионов по ВГD;
-
контактные лица в очагах острого и хронического гепатита D;
-
реципиенты крови и ее компонентов, органов и тканей;
-
пациенты центров и отделений гемодиализа, пересадки почки, сердечно-сосудистой и легочной хирургии, гематологии;
-
персонал медицинских организаций;
-
лица, находящиеся в местах лишения свободы;
-
пациенты с иммунодефицитом (ВИЧ-инфекцией, онкологическими заболеваниями, получающие лечение гемодиализом, иммунодепрессантами, др.);
-
дети в возрасте до 12 месяцев, рожденные от матерей, инфицированных ВГВ [68, 60, 70, 71].
- Рекомендовано всем пациентам с повышением активности АЛТ в крови определение антигена (HBsAg) вируса гепатита В(Hepatitis В virus) в крови с целью выявления лиц, инфицированных вирусом гепатита В (Hepatitis В virus) [132,133].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
-
Не рекомендовано первичное молекулярно-биологическое исследование крови на вирус гепатита B (Hepatitis B virus) всем пациентам с повышением активности АЛТ в крови для ранней диагностики ХВГВ, хотя ДНК HBV появляется в крови на 1-3 нед. раньше HBsAg, но определение этого маркера значительно дороже и при развитии гепатита практически всегда вместе с ДНК HBV в крови присутствует HBsAg [14, 134].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
- При выявлении HBsAg рекомендуется провести комплекс лабораторных исследований крови для определения фазы заболевания (определение ДНК вируса гепатита B (Hepatitis B virus) в крови методом ПЦР, количественное исследование, определение антител к e-антигену (anti-HBe) вируса гепатита B (Hepatitis B virus) в крови, определение антигена (HBeAg) вируса гепатита B (Hepatitis B virus) в крови (качественно) [1, 22, 119, 131, 133, 134].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Тактика ведения пациента зависит от фазы заболевания и состояния печени [133].
- Пациентам с иммунологически обусловленными внепеченочными заболеваниями (артрит или артралгии неясного генеза, миозит, миокардит, перикардит, интерстициальные заболевания легких, гломерулонефрит, тубулоинтерстициальный нефрит, синдром Шегрена, узелковый полиартериит, кожные васкулиты, анемия и панцитопения неясного генеза, полинейропатия, криоглобулинемия и прочие) рекомендуется рассмотреть вопрос об определении антигена (HBsAg) вируса гепатита В (Hepatitis В virus) в крови, качественное исследование, даже при нормальной активности АЛТ в крови для подтверждения этиологической причины [132,133].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: В ряде случаев HBV-инфекция манифестирует с указанных выше внепеченочных проявлений даже при отсутствии биохимических маркеров поражения печени [21].
-
Учитывая общность путей передачи, всем пациентам при выявлении HBsAg также рекомендуются скрининговые исследования на определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) и ВИЧ – 2 (Human immunodeficiency virus HIV 2) в крови; определение суммарных антител классов M и G (anti-HCV IgG и anti-HCV IgM) к вирусу гепатита C (Hepatitis C virus) в крови; определение антител класса M (anti-HDV IgM) к вирусу гепатита D (Hepatitis D virus) в крови и определение антител класса G (anti-HDV IgG) к вирусу гепатита D (Hepatitis D virus) в крови для выявления ко-инфицирования, так как сочетанное течение инфекционных заболеваний ухудшает прогноз и влияет на тактику ведения (см. 3.7-3.9) [22, 88, 90, 131, 133, 134].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
-
При выявлении HBsAg также рекомендуется выполнить обнаружение антител класса G (anti-HAV IgG) к вирусу гепатита A (Hepatitis A virus) в крови для исключения паст-инфекции гепатита А. При отсутствии последних выполнить вакцинацию от гепатита А, так как совместное инфицирование ухудшает прогноз [1, 22, 119, 131, 133, 134].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
-
Рекомендовано исследование уровня альфа-фетопротеина в сыворотке крови пациентам с ХВГВ всем пациентам с выраженным фиброзом и циррозом печени для диагностики ГЦК [22, 119, 131, 133, 134].
Уровень убедительности рекомендаций C (уровень достоверности доказательств –5)
Комментарий: риск развития ГЦК на стадии цирроза составляет приблизительно 1–5% в год. Вероятность смертельного исхода в течение первого года после постановки диагноза у пациентов с ГЦК составляет 33% [74, 134].
3.2. На этапе проведения ПВТ:
-
Рекомендуется выполнение общего (клинического) анализа крови с дифференцированным подсчётом лейкоцитов (лейкоцитарной формулы) и уровня тромбоцитов в крови пациентам с ХВГВ, получающим ПВТ через 3 месяца, 6 месяцев, 12 месяцев и далее в раз в год для исключения возможных нежелательных явлений ПВТ [1, 22, 60, 119, 131, 133, 134, 141, 142].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: возможно развитие нейтропении, анемии, тромбоцитопении. Показатели клинического анализа приведены в Приложении А3.
-
Рекомендовано проведение анализа крови биохимического общетерапевтического (исследование уровня общего билирубина, определение активности АЛТ, АСТ, ГГТ ЩФ, глюкозы, креатинина, общего белка, альбумина), протромбинового индекса, пациентам с ХВГВ, получающим ПВТ через 3 месяца, 6 месяцев, 12 месяцев и далее в раз в год для исключения возможных нежелательных явлений ПВТ [22, 60, 119, 131, 133, 134, 141, 142].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: выполняется для определения увеличения активности АЛТ, что позволяет оценить наличие и активность синдромов цитолиза. Показатели анализа крови биохимического общетерапевтического приведены в Приложении А3.
-
Рекомендовано определение ДНК вируса гепатита B (Hepatitis B virus) в крови методом ПЦР, качественное исследование, количественное исследование и определение антигена (HBsAg) вируса гепатита B (Hepatitis B virus) в крови, количественное исследование пациентам с ХВГВ, получающим ПВТ с целью контроля эффективности терапии [1, 22, 60, 119, 131, 133, 134, 141, 142].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарий: при проведении ПВТ с использованием нуклеотидов и нуклеозидов-ингибиторов обратной транскриптазы, необходимо проводить данное исследование через 6 месяцев, 12 месяцев, далее 1 раз в год до окончания лечения.
Критерием отмены или коррекции терапии в связи с ее неэффективностью является отсутствие какого-либо снижения HBsAg в крови и снижение вирусной нагрузки HBV менее, чем на 2log от исходного уровня к 12 неделе ПВТ.
Показатели представлены в Приложении А3.
3.4. На этапе диспансерного наблюдения:
-
Рекомендовано проведение анализа крови биохимического общетерапевтического (исследование уровня общего билирубина, определение активности АЛТ, АСТ, ГГТ ЩФ, креатинина, общего белка, альбумина в крови), ПТИ 1 раз в три месяца в первый год диспансерного наблюдения, далее 1 раз в год пациентам с ХВГВ, завершившим ПВТ, с целью контроля эффективности терапии [22, 60, 119, 131, 133, 134, 145].
Комментарии: при необходимости кратность исследования может быть увеличена.
-
Рекомендовано 1 раз в год выполнять определение ДНК вируса гепатита B (Hepatitis B virus) в крови методом ПЦР, качественное исследование пациентам с ХВГВ, получившим ПВТ и достигшим авиремии, с целью контроля эффективности терапии и исключения рецидива [79, 133, 141, 145].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
-
Рекомендовано 1 раз в год определение антигена (HBsAg) вируса гепатита B (Hepatitis B virus) в крови, качественное исследование, HBsAg-негативным пациентам с ХВГВ, получившим ПВТ, с целью контроля эффективности терапии и исключения рецидива [132, 133, 145].
Уровень убедительности рекомендаций C (уровень достоверности доказательств –5)
-
Рекомендовано 1 раз в год проводить исследование уровня альфа-фетопротеина в сыворотке крови пациентам с наличием HBsAg и циррозом для исключения ГЦК [27, 119, 132, 133, 145].
Уровень убедительности рекомендаций С (уровень достоверности доказательств –5)
Комментарий: риск развития ГЦК на стадии цирроза составляет приблизительно 1-5% в год. Вероятность смертельного исхода в течение первого года после постановки диагноза у пациентов с ГЦК составляет 33% [27, 28, 119].
4. Инструментальные диагностические исследования
-
Пациентам с хронической HBV-инфекцией рекомендуется проводить ультразвуковое исследование органов брюшной полости (комплексное) для своевременной диагностики ГЦК 1 раз в год, кратность УЗИ при циррозе печени раз в 3-6 месяцев. [27, 28, 29, 119, 34, 58, 59, 134].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: ЦП и ГЦК при HBV-инфекции могут протекать бессимптомно и выявляться только по данным УЗИ. Наличие ЦП является независим показанием для начала терапии. Несмотря на то, что прием противовирусных препаратов прямого действия приводит к значительному снижению риска развития ГЦК, он все равно остается выше среднего по популяции, что требует проведения периодического скрининга в объеме, определяемом клиническими рекомендациями по профилактике и лечению ГЦК.
-
Проведение КТ и МРТ печени при начальном обследовании пациентов с HBV-инфекцией не рекомендовано, но может быть проведено при обнаружении в печени очагового образования по результатам УЗИ для уточнения его природы [28, 29, 119].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: УЗИ печени в состоянии выявить признаки портальной гипертензии (асцит, расширение вен портальной системы, спленомегалия). КТ и МРТ не имеют в этом значимых преимуществ перед УЗИ, но значительно дороже. УЗИ печени также способно выявить ГЦК в большинстве случаев и является основным методом скрининга данного заболевания. При выявлении в печени образований следует руководствоваться имеющимися клиническими рекомендациями по диагностике и лечению образований печени [29, 119].
-
Рекомендуется пациентам ультразвуковое исследование органов брюшной полости (комплексное) для оценки стадии заболевания, выявления очаговых образований в печени не реже 1 раза в 4-6 месяцев [132, 133, 134].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
-
Рекомендовано пациентам с циррозом использование в качестве метода скрининга МРТ органов брюшной полости с внутривенным введением гепатотропного контрастного препарата для своевременной диагностики ГЦК [119, 134]
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Частота обнаружения опухолей печени диаметром менее 1,0 см, точность диагностики и дифференциальная диагностика ГЦР увеличивается при использовании МРТ с парамагнитным контрастным средством, гадоксетовой кислотой** [185-188,214].
-
Рекомендовано пациентам с HBV-инфекцией при отсутствии лабораторно-инструментальных данных, свидетельствующих о наличии ЦП, провести динамическую эластометрию печени (транзиентную, точечную или двумерную сдвиговолновую) для неинвазивной оценки выраженности фиброза печени [133, 119, 134, 77, 192, 193, 194,196].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: эластометрия печени должна быть выполнена на валидизированном аппарате.
-
Рекомендовано при отсутствии возможности провести эластометрию использование комплексных расчетных тестов (расчет индексов фиброза: ФиброТест, Актитест ФиброМакс,АРRI, FIB-4)) на основе лабораторных маркеров фиброза для неинвазивной оценки выраженности фиброза печени [163,184,194,195,197,198]. См. Приложение Г
Для ФиброТеста, APRI, FIB-4 уровень убедительности рекомендаций В (уровень достоверности доказательств – 1)
Для актитеста, ФиброМакса уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: даже при сохранной функции печени и отсутствии признаков портальной гипертензии по УЗИ может иметь место морфологическая картина ЦП, что является независимым показанием для инициации терапии HBV-инфекции. У ряда пациентов возможно сочетание HBV-инфекции с другими заболеваниями, приводящими к развитию портальной гипертензии или печеночной недостаточности. В данном случае следует провести неинвазивную оценку выраженности фиброза печени для дифференциальной диагностики этих состояний от ЦП [1].
-
Рекомендовано выполнение эзофагогастродуоденоскопии (ЭГДС) всем пациентам с тяжелым фиброзом и циррозом, а также с клиническими признаками нарушений функций печени, абдоминальным болевым синдромом, рвотой «кофейной гущей» с целью выявления портальной гипертензии и уточнения характера повреждения слизистой пищевода, желудка, двенадцатиперстной кишки [1, 22, 60, 119, 131, 133].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: эзофагогастродуоденоскопия выполняется для диагностики степени варикозного расширения вен пищевода, а также для лигирования варикозно расширенных вен пищевода при кровотечении или его профилактики у пациентов с циррозом печени. Эзофагогастродуоденоскопия при не тяжелом общем состоянии пациента, рекомендуется проводить амбулаторно с использованием местной апликационной анестезии. Возможно проведение процедуры в условиях седации, что требует предварительной консультации и сопровождения врача-анестезиолога-реаниматолога.
-
У пациентов, принимающих ТДФ**, рекомендуется ежегодно проводить ультразвуковую денситометрию, рентгеноденситометрию. Данные исследования также следует провести, если планируется назначение этого препарата [1, 42, 56, 163].
Уровень убедительности рекомендаций В (уровень достоверности доказательств -2).
Комментарии: Прием только ТДФ**, в отличие от энтекавира** и ТАФ**, сопряжен со значимой потерей минеральной плотности костей, что может приводить к остеопении и остеопорозу.
5. Иные диагностические исследования
-
Рекомендуются перед проведением противовирусной терапии и во время проведения терапии при возникновении осложнений приём (осмотр, консультация) смежных специалистов – врача-эндокринолога, врача-офтальмолога, врача-психиатра, врача-гастроэнтеролога пациентам с наличием показаний для планирования ПВТ с использованием интерферонов и для купирования нежелательных явлений [1, 22, 60, 119, 131, 133].
Уровень убедительности рекомендаций С (уровень достоверности доказательств -5).
-
Рекомендовано проведение биопсии печени пациентам с противоречивыми данными неинвазивных методов диагностики фиброза печени для выявления степени активности воспаления, стадии фиброза, а также наличия ГЦК, НАЖБП, других наследственных и метаболических заболеваний, инфекционных поражений, вызванных другими возбудителями [22, 60, 119, 131, 132, 133].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: биопсия печени является инвазивной процедурой со значимым риском развития осложнений, поэтому ее следует проводить только в случае, если другие методы исследования дали противоречащие результаты и ее данные необходимы для определения тактики ведения [134, 161].
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Первичная цель лечения - улучшение качества жизни и прогноза пациентов с HBV-инфекцией. Основной суррогатной целью является снижение вирусной нагрузки до неопределяемой. Также желательна элиминация из крови HBsAg и HBeAg (при его наличии) и нормализация активности АЛТ в крови.
Показано, что высокий уровень репликации вируса, показателем которого выступает вирусная нагрузка, является самым сильным предиктором развития ЦП и ГЦК при HBV-инфекции, определяя прогноз [29-35].
Элиминация HBeAg с сероконверсией или без нее не является оптимальным биомаркером успешной терапии, так как после ее прекращения достаточно часто наблюдается повторное появление HBeAg в крови [37].
Элиминация HBsAg («функциональный ответ» [36]) — показатель успешной терапии, но она происходит редко: менее чем у 10% пациентов. Повторное появление HBsAg в крови происходит крайне редко и, как правило, свидетельствует об угнетении иммунной системы [38-39]. У пациентов, ставших HBsAg-отрицательными, риск развития ГЦК значительно снижается, но все же остается около 0,5% в год [40].
Снижение вирусной нагрузки до неопределяемой, как правило, сопровождается нормализацией активности АЛТ в крови, стиханием некровоспалительных процессов в печени и замедлением прогрессирования фиброза [41]. Если этого не происходит, следует провести поиск дополнительного фактора, приводящего к ее поражению (алкоголь, другой гепатотропный вирус, нарушение обмена липидов и прочие).
К сожалению, в современных условиях добиться окончательного излечения от хронической HBV-инфекции практически невозможно из-за интеграции вируса в геном гепатоцитов и существования в ядре. Гипотетическая элиминация кзкДНК получила название «полного ответа, а удаление и интегрированной в геном человека ДНК вируса - «стерилизационного ответа» [36].
-
Рекомендовано пациентам с хронической HBV-инфекцией оценить показания к началу противовирусной терапии и выбрать режим [1, 133, 134].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
1. Консервативное лечение
1.1 Показания к началу антивирусной терапии (Алгоритм 1)
-
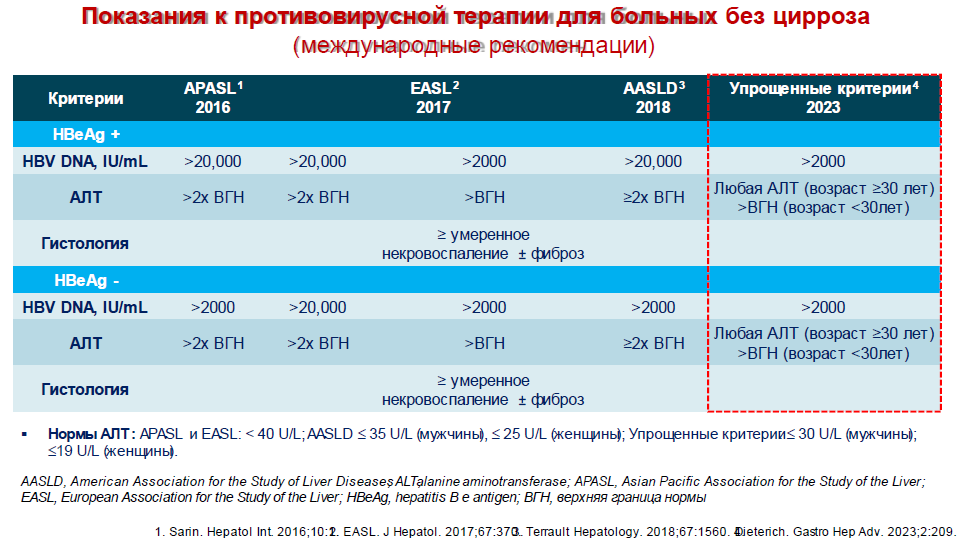
При хронической HBV-инфекции рекомендуется начать антивирусную терапию при:
-
ХВГВ (вирусная нагрузка более 2000 МЕ/мл, повышение активности АЛТ в крови и/или индекс гистологической активности некровоспалительных процессов в печени 6 и более по Knodell или А2-3 по METAVIR (приложение Г3);
-
ЦП при любой определяемой вирусной нагрузке независимо от активности АЛТ в крови [1, 133, 134].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: поскольку излечение от хронической HBV-инфекции современными средствами практически невозможно, целью лечения при ХВГВ является снижение риска развития ЦП и ГЦК. У пациетов с ЦП целью лечения является снижение риска декомпенсации заболевания. [1].
-
Рекомендовано рассмотреть начало антивирусной терапии следующим группам пациентов:
-
при HBeAg-положительной HBV-инфекции (вирусная нагрузка более 2000 МЕ/мл, нормальная активность АЛТ в крови выше 30 ед/л для мужчин и 19 ед/л для женщин, наличие HBeAg в крови) у лиц старше 30 лет [133, 134];
-
при хронической HBV-инфекции (активность АЛТ в крови в норме) и отягощенном семейном анамнезе по ЦП и ГЦК; [134]
-
при хронической HBV-инфекции (активность АЛТ в крови в норме) и подозрении на внепеченочные ее проявления (узелковый полиартериит и другой васкулит, гломерулонефрит, и другие).
-
при хронической HBV-инфекции (активность АЛТ в крови в норме) при вирусной нагрузке более 2000 МЕ/мл в сочетании с фиброзом F2-3.
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: в ряде случаев можно назначить терапию HBV-инфекции и без признаков поражения печени. Так, HBeAg-положительная HBV-инфекция у лиц старше 30 лет достаточно часто со временем приводит к развитию HBeAg-положительного ХВГВ, а у лиц с отягощенным семейным анамнезом по ЦП и ГЦК повышен риск развития ЦП и ГЦК даже при отсутствии данных за активный патологический процесс в печени. Также разумно рассмотреть применение антивирусной терапии при подозрении на внепеченочные проявления HBV-инфекции независимо от выраженности поражения самой печени. Антивирусную терапию также можно рассмотреть у пациентов без признаков активного гепатита, но имеющих значимую вирусную нагрузку (более 2000 МЕ/мл) и значимый фиброз печени (F2-3) [1].
-
Не рекомендуется назначать противовирусную терапию пациентам с HBV инфекцией без признаков гепатита, выраженного фиброза (менее F2) и ЦП за исключением описанных выше случаев. Данным пациентам рекомендуется проводить динамическое наблюдение для своевременного выявления показаний для инициации терапии (развитие гепатита и/или ЦП) [133, 134].
-
Периодичность диспансерных осмотров зависит от фазы заболевания и вирусной нагрузки (Приложение А3. Таблица Обследование пациентов с HBV-инфекцией, которым не показана терапия)
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: риск прогрессирования HBV-инфекции у пациентов без гепатита и ЦП крайне мал, поэтому назначение антивирусной терапии в этих случаях значимо не влияет на прогноз и не рекомендовано. Однако со временем у них возможно возобновление воспалительного процесса в печени (рост активности АЛТ в крови) и постепенное прогрессирование фиброза вплоть до развития ЦП, что является показанием для назначения антивирусной терапии. Чтобы своевременно выявлять таких лиц необходимо периодическое определение активности АЛТ в крови и проведение неинвазивных тестов оценки фиброза печени. Частота обследования зависит от фазы инфекции и вирусной нагрузки, то есть активности репликации вируса, поскольку риск реактивации инфекции напрямую взаимосвязан с этим. Она максимальна при активной репликации вируса (то есть у HBeAg-положительных пациентов) и минимальна - при незначительной (у HBeAg-отрицательных пациентов с крайне низкой вирусной нагрузкой) [107-109].
- Не рекомендовано назначение противовирусной терапии и динамическое наблюдение пациентам с признаками перенесенной HBV-инфекции (положительный тест на анти-HBc антитела), но не имеющим в крови ни ДНК вируса, ни анти-HBsAg [133, 134]. Пациентам с положительным тестом на анти-HBc антитела, но не имеющим в крови ни ДНК вируса, ни HBsAg, ни анти-HBs антител, рекомендовано динамическое наблюдение с ежегодным определением HBsAg.
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
- Рекомендовано пациентам с признаками перенесенной HBV-инфекции при развитии у них естественного или ятрогенного иммунодефицита (прием H02AB глюкокортикоидов, L04A иммунодепрессантов) в зависимости от ситуации проводить диспансерный прием (осмотр, консультация) врача-инфекциониста или назначить профилактическую терапию с целью раннего выявления или предотвращения реактивации инфекции (см. 7.1 [72, 87, 110, 214].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: пациенты, у которых HBsAg перестает определяться в крови, имеют крайне низкий риск спонтанной реактивации инфекции, поэтому им не показано лечение. Однако снижение функции иммунной системы, вызванное как заболеванием, так и ятрогенно, может привести к реактивации возбудителя [72, 87, 214].
1.2 Терапия нуклеотидами и нуклеозидами - ингибиторами обратной транскриптазы
-
Не рекомендуется использовать нуклеотиды и нуклеозиды - ингибиторы обратной транскриптазы с низким порогом резистентности: ламивудин** у пациентов с ХВГВ, учитывая быстрое развитие к ним резистентности [63, 64].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
-
При наличии показаний к началу терапии (см. 3.1.1) рекомендуется использовать нуклеотиды и нуклеозиды - ингибиторы обратной транскриптазы с высоким порогом резистентности:
1) энтекавир** (натощак: не менее чем через 2 ч после еды или не позднее чем за 2 ч до следующего приема пищи) в дозе 0,5 мг 1 р/д для большинства пациентов и 1 мг 1 р/д при декомпенсированном ЦП или наличии резистентности вируса к ламивудину** у пациентов с опытом предшествующей терапии данным препаратом; пациенты, не получавшие ранее нуклеозидные и нуклеотидные перпараты с СКФ 30- 49 мл/мин получают указанные дозы раз в 2 дня, 10-29 мл/мин - раз в 3 дня, менее 10 мл/мин или находящиеся на заместительной почечной терапии - 1 раз в неделю [77, 121 ,122, 123, 135, 148].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
или
2) Тенофовир** (ТДФ**): 300 мг 1 р/д одновременно с приемом пищи, не разжевывая принимают таблетку целиком, запивая водой; при СКФ 30-49 мл/мин - 300 мг 1 раз в 2 дня, при СКФ 10-29 мл/мин у лиц на заместительной почечной терапии - раз в неделю после проведения процедуры диализа [50, 53, 43, 124, 179].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
или
3) Тенофовира алафенамид** (ТАФ**) 25 мг 1 р/д одновременно с приемом пищи, не разжевывая, принимают таблетку целиком, запивая водой; при СКФ более 15 мл/мин, а также у лиц на заместительной почечной терапии коррекция дозы не требуется; противопоказан лицам с СКФ менее 15 мл/мин, не получающих заместительной почечной терапии [41,43,50, 55,199].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
-
Не рекомендуется использовать Тенофовир** в форме Тенофовир дизопроксил фумарат (Тенофовир** (ТДФ**) у лиц с высоким риском почечных осложнений и при остеопорозе и остеопении (см. ниже) [30, 41, 50, 125,165].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
Комментарии:
Тенофовира алафенамид** и тенофовир** более предпочтительны, чем энтекавир**, у пациентов с опытом предшествующей терапии нуклеотидами и нуклеозидами - ингибиторами обратной транскриптазы.
Тенофовира алафенамид** и энтекавир** более предпочтительны, чем тенофовир**, у следующих категорий пациентов: возраст> 60 лет; постоянное применение анаболических стероидов (Anabolic Steroids) или других препаратов, которые могут способствовать снижению плотности костной ткани; переломы в анамнезе; Переломы костей по причине хрупкости костной ткани в анамнезе; остеопороз; расчетная скорость клубочковой фильтрации <60 мл/мин/1,73 м2; альбуминурия >30 мг/24 часа или умеренная следовая протеинурия; низкий уровень фосфата (<2,5 мг/дл); гемодиализ [45, 46, 49, 55, 54, 58, 165].
Коррекция дозы энтекавира** требуется при расчетной скорости клубочковой фильтрации <50 мл/мин.
Назначается длительно, до элиминации HBsAg, не менее 3 лет (функционального ответа).
При использовании всех схем ПВТ идеальным результатом лечения следует считать элиминацию HBsAg независимо от появления анти-HBs (функциональный ответ). В таком случае терапию нуклеотидами и нуклеозидами - ингибиторами обратной транскриптазы следует прекратить. Кроме того, возможно прекращение ПВТ нуклеотидами и нуклеозидами - ингибиторами обратной транскриптазы у пациентов с ХВГВ (с выявляемым HBеAg) на доцирротических стадиях при сероконверсии по HBеAg и отсутствии репликации ВГВ как минимум в течение 12 месяцев после исчезновения HBеAg. Также вопрос о прекращении ПВТ нуклеотидами и нуклеозидами - ингибиторами обратной транскриптазы может быть рассмотрен для пациентов с ХВГВ (с неопределяемым HBеAg) без цирроза печени при условии длительного (более 3 лет) подавления репликации ВГВ и обеспечения адекватного мониторинга реактивации HBV-инфекции [98, 99].
При HBeAg-положительном ХВГВ применение энтекавира** на протяжении 5 лет приводит к частичному функциональному ответу у 99% и сероконверсии по HBeAg у 53% пациентов. При использовании ТДФ** у таких же пациентов ответ был получен у 97%, ответ по HBeAg - у 49%, по HBsAg - у 10%, биохимический - у 73% пациентов. При лечении ТАФ** в течение 2 лет ответ определялся у 75% пациентов, ответ по HBeAg - у 22%, по HBsAg - у 1%, биохимический – у 75% [29, 41-43].
При HBeAg-отрицательном ХВГВ применение энтекавира** на протяжении 5 лет приводит к ответу у 98% и биохимическому - у 95%. Для ТДФ** у таких же пациентов на протяжении 3 и 8 лет терапии показатели, следующие: ответ у 92-100% и 99%, биохимический - у 75% и 88%. Ответ по HBsAg при лечении HBeAg-отрицательного ХВГВ энтекавиром** и ТДФ** достигается в <1% случаев и то при длительном их приеме (8 лет и более). При применении ТАФ** в течение 2 лет ответ развивается у 90% пациентов, ответ по HBsAg - у <1% [44-56].
Длительный прием указанных препаратов приводит к снижению выраженности некровоспалительных процессов печени, регрессу фиброза печени (в том числе на стадии ЦП), улучшает течение и прогноз при декомпенсированном ЦП, уменьшает потребность в трансплантации печени и риск развития ГЦК [29, 52-56].
-
Рекомендовано пациентам при наличии остеопении или остеопороза использовать энтекавир** или ТАФ**[125,200].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
Комментарии: к подобным пациентам приравнены длительно получающие глюкокортикоиды и имеющие возраст более 60 лет.
-
При развитии остеопении или остеопороза на фоне лечения ТДФ** рекомендуется замена его на энтекавир** при отсутствии резистентности к ламивудину** или на ТАФ** при его наличии [125].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
-
Рекомендуется пациентам, имеющим высокий риск почечных осложнений, назначать энтекавир** или ТАФ**, но не ТДФ**. При развитии нефротоксичности у пациентов, принимающих ТДФ**, его рекомендуется заменить на энтекавир** при отсутствии резистентности к ламивудину** или на ТАФ** при его наличии [1, 42-43, 55-57].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии: к таким случаям относятся: пациенты с СКФ менее 60 мл/мин, неконтролируемой артериальной гипертензией, протеинурией, неконтролируемым сахарным диабетом, гломерулонефритом, гипофосфатемией, при приеме нефротоксических препаратов и после трансплантации органов.
Энтекавир** и ТАФ** относятся к препаратам с минимальным риском нефротоксичности и контроль функции почек при их приеме не требуется. Исключения составляют пациенты с высоким риском развития почечных осложнений, которым данный мониторинг показан скорее по их сопутствующему заболеванию. В отличие от них ТДФ** имеет более высокий нефротоксический потенциал, поэтому контроль функции почек (СКФ и Исследование уровня неорганического фосфора в крови показан каждые 3 мес. во время первого года терапии и каждые 6 мес., далее, всем пациентам, принимающим ТДФ**, и лицам с высоким риском почечных осложнений, принимающим энтекавир** и ТАФ** [42-43, 55-57, 80].
- Рекомендуется проводить пациентам с ХВГВ терапию противовирусными препаратами прямого действия длительно на протяжении многих лет до появления показаний (стоп-правил) для ее отмены (Алгоритм 2) [37, 60-63, 119, 160]:
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
-
Реактивация происходит, как правило, в первые три месяца после отмены терапии, поэтому рекомендуется определение активности АЛТ и, при ее повышении, определение ДНК вируса гепатита В (Hepatitis B virus) в крови методом ПЦР, качественное исследование и определение ДНК вируса гепатита В (Hepatitis B virus) в крови методом ПЦР, количественное исследование, а у HBeAg-положительных пациентов на момент начала терапии еще и определение антигена (HbeAg) вируса гепатита B (Hepatitis B virus) в крови ежемесячно в первые три месяца наблюдения, далее каждые три месяца в первый год и далее каждые шесть месяцев длительно с целью раннего выявления реактивации инфекции. Учитывая то, что у примерно 20% пациентов после отмены терапии препаратами прямого действия через 2-3 года может наступить сероконверсия по HBsAg, рекомендовано определение в периоде наблюдения HBsAg ежегодно [127]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
Комментарии: прием противовирусных препаратов прямого действия редко приводит к элиминации HBsAg из крови (менее 10% при HBeAg-положительной инфекции и менее 1% при HBeAg-отрицательной), однако, сероконверсия по HBsAg сопровождается крайне низким риском реактивации инфекции после прекращения приема препарата. Сероконверсия по HBeAg происходит значительно чаще (примерно у половины пациентов), но после отмены препаратов в течение первых 3 лет у 10% наблюдается серореверсия (возврат HBeAg в кровь), а у половины вирусная нагрузка становится выше 20000 МЕ/мл (если она ниже, это считается приемлемой вирусологической ремиссией) [60]. В связи с этим нет единого мнения относительно тактики ведения пациентов со стабильной (более 1 года) HBeAg-сероконверсией: часть экспертов считает, что терапию можно отменить, но при этом проводить тщательный мониторинг пациентов, другие настаивают на продолжении терапии до элиминации HBsAg [1]. Аналогичная проблема имеет место и после отмены терапии при достижении длительной неопределяемой вирусной нагрузки у HBeAg-отрицательных пациентов: в течение 3 лет у половины пациентов она становится выше 2000 МЕ/мл [37]. Возврат вирусной активности у HBeAg-отрицательных пациентов происходит обычно в течение первых шести месяцев после отмены противовирусных препаратов прямого действия: первой растет вирусная нагрузка, затем с отставанием в несколько месяцев увеличивается содержание HBsAg и активность АЛТ в крови [61-63].
-
Рекомендовано пациентам после достижения устойчивого вирусологического ответа прекращение ПВТ (определить как снижение уровня ДНК ВГВ ниже 2000 МЕ/мл – через 3 месяца для безинтерфероновых режимов и сохраняющееся не менее 12 месяцев после прекращения лечения. Потеря HBsAg рассматривается как оптимальная конечная точка лечения, называемая "функциональным излечением", но это редко достигается [18, 47, 48, 49, 83].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарий: Общепринятые критерии отмены терапии с использованием НА:
- Пациенты с HBeAg «+» ХВГВ без цирроза печени, у которых достигнута стабильная сероконверсия HBeAg и отрицательный ДНК HBV, получившие консолидирующую терапию в течении шести месяцев, а лучше года.
- пациенты с HBeAg «-» ХВГВ при достижении сероконверсии по HBsAg и у которых ДНК HBV в сыворотке крови не обнаруживается в трех исследованиях крови взятой с интервалом в 6 месяцев
- у отдельных пациентов с HBeAg «-» ХВГВ, не страдающих циррозом печени, у которых достигнута длительная (~3 года) вирусологическая супрессия под действием НА, может быть рассмотрена отмена терапии в том случае, если гарантировано обеспечение тщательного мониторинга с контролем АЛаТ и ДНК HBV, как минимум в течение года после прекращения лечения [18, 62, 63, 83, 129,192]
-
Рекомендовано при возврате вирусной ДНК в кровь и увеличении активности АЛТ в крови после отмены противовирусных препаратов прямого действия у HBeAg-отрицательных пациентов возобновить лечение, если:
-
наблюдается увеличение в крови содержания прямого билирубина в двух взятых подряд пробах;
-
протромбиновое время удлиняется не менее, чем на 2 сек. по сравнению с показателями на момент отмены терапии в двух взятых подряд пробах;
-
в двух взятых подряд пробах активность АЛТ в 10 раз и более превышает верхний предел нормы;
-
активность АЛТ в 5-10 раз выше верхней границы нормы на протяжении не менее 1 мес.
-
активность АЛТ в 2-5 раз выше верхней границы нормы на протяжении не менее 3 мес.
-
активность АЛТ в 1,1-1,9 выше верхней границы нормы на протяжении не менее 12 мес. без снижения концентрации HBsAg в крови;
- вирусная нагрузка более 2000 МЕ/мл на протяжении 12 мес. без снижения концентрации HBsAg в крови.
В остальных случаях следует проводить динамическое наблюдение за активностью АЛТ в крови и определение ДНК вируса гепатита B (Hepatitis B virus) методом ПЦР (количественное исследование), определяя их раз в 3 мес. [61-63, 127].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: после отмены противовирусных препаратов прямого действия у HBeAg-отрицательных пациентов довольно часто наблюдается реактивация инфекции, которая, как правило, происходит в течение первых месяцев. Возврат вирусной активности может быть благоприятным или неблагоприятным. В первом случае он является свидетельством активации иммунной системы и может привести к самостоятельному клиренсу HBsAg - самой желаемой из достижимых целей лечения HBV-инфекции. Во втором случае он приводит к развитию активного гепатита без значимых перспектив элиминации HBsAg. В связи с этим актуально различить эти случаи, для чего и были предложены указанные выше критерии. В пользу неблагоприятной реактивации может свидетельствовать снижение функции печени, проявляющееся в гипербилирубинемии и/или гипокоагуляции, слишком активная (активность АЛТ более 10 верхних границ норм) или длительная (более 3 мес. при активности АЛТ в 2-5 верхних границ норм или более 1 мес. при активности АЛТ в 5-10 верхних границ норм) воспалительная реакция печени. В данном случае требуется повторное назначение противовирусных препаратов прямого действия по общим правилам, и терапия проводится до элиминации HBsAg из крови. Если же воспалительный процесс не сильно выражен (активность АЛТ в крови менее 10 верхних границ норм), не сопровождается развитием печеночной недостаточности и быстро самостоятельно купируется, лечение не показано, так в этом случае нет опасности для пациента, но имеется возможность достижения оптимальной цели терапии - элиминации HBsAg. Лечение также следует возобновить, если воспалительный процесс минимален (АЛТ = 1-2 верхние границы нормы), но персистирует длительно (более 12 мес.) или длительно (более 12 мес.) имеется значимая вирусная нагрузка (более 2000 МЕ/мл) даже без признаков гепатита. Таким образом, прекращение терапии после длительной вирусной супрессии у HBeAg-отрицательных пациентов приводит к следующим результатам: функциональный ответ (элиминация HBsAg у пациентов в течение первых 2-3 лет) - у 20%, частичный функциональный ответ (неопределяемая вирусная нагрузка при персистировании HBsAg в крови) - у 20-30%, потребность в длительной терапии - 40%, промежуточные случаи (нет вирусной супрессии, но критерии возобновления терапии не выполнены) - 10-20% [61-63, 87, 192].
-
При серореверсии по HBeAg после отмены противовирусных препаратов прямого действия рекомендуется возобновить терапию. Как правило, используют тот же препарат, который применяли для достижения сероконверсии по HBeAg [61-63,87].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
-
Рекомендовано при отсутствии ответа, частичном вирусологическом ответе и вирусологическом прорыве во время терапии в первую очередь проверить насколько пациент следует рекомендациям врача. Если приверженность не вызывает сомнений, алгоритм действия, следующий (Алгоритм 3):
-
при отсутствии ответа или вирусологическом прорыве рекомендуется заменить препарат согласно Таблице Смена препарата при развитии резистентности к нему в приложении А3 [64].
-
при частичном ответе: при приеме препаратов с высоким барьером резистентности (энтекавир**, ТАФ** и ТДФ**) рекомендуется оценить динамику снижения вирусной нагрузки: при положительной динамике (вирусная нагрузка прогрессивно снижается) препарат оставляют, при выходе на плато (изменения вирусной нагрузки незначительные) препарат заменяют согласно Таблице Смена препарата при развитии резистентности к нему в приложении А3 [64].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Применение современных противовирусных препаратов системного действия в большинстве случаев приводит к вирусологическому ответу - неопределяемой вирусной нагрузке при использовании высокочувствительного метода с пределом обнаружения равном 10 МЕ/мл через 12 мес. после начала терапии. Если он не достигается, то наиболее вероятной причиной является недостаточная приверженность пациента терапии. Если она исключена, то тактика зависит от динамики вирусной нагрузки: если через 3 месяца от начала терапии она не уменьшилась в 10 раз или более (отсутствие ответа), производят замену препарата; если же она уменьшается более, чем в 10 раз через 3 месяца., но не достигает неопределяемого уровня через 12 месяцев (частичный ответ), то, при применении препаратов с низким барьером резистентности, предполагается ее развитие, что предопределяет замену препарата, а при использовании препаратов с высоким барьером резистентности изучается динамика вирусной нагрузки. Если она продолжает неуклонно снижаться, полагают, что резистентность не развилась, а недостаточный эффект связан со слишком высокой вирусной нагрузкой, поэтому рекомендуется продолжить терапию. Если же снижения вирусной нагрузки не происходит, это является свидетельством развития резистентности и требует замены препарата [64]. Рецидив виремии после достижения неопределяемой вирусной нагрузки или увеличение вирусной нагрузки в более чем 10 раз с минимального ее уровня (вирусологический прорыв) также является проявлением резистентности вируса к препарату и требует его замены [64, 79].
1.4 Патогенетическая терапия
-
Рекомендуется проведение базисной патогенетической терапии всем пациентам не зависимо от тяжести течения заболевания для улучшения качества жизни пациента [1, 22, 119, 132, 134].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: базисная патогенетическая терапия включает в себя щадящий режим и диету. Из рациона исключают жареные, копченые, маринованные блюда, тугоплавкие жиры (свинина, баранина). Категорически запрещается алкоголь в любых видах. Ограничение соли до 5 г/сут. пациентам с циррозом.
Организация дистического лечебного питания пациентов с хроническим вирусным гепатитом В при стациопарном лечении в медицинских организациях проводится в соответствии с приказами Министерства здравоохранения Российской Федерации от 5 августа 2003 г. №330 «О мерах по совершенствованию лечебного цитания в лечебно- профилактических учреждениях Российской Федерации», от 21 июня 2013 г. № 395н «Об утверждении норм лечебного питания» и от 23 сентября 2020 г. № 1008н «Об утверждении порядка обеспечения пациентов лечебным питанием».
-
Рекомендуется назначение адеметионина** и/или урсодезоксихолевой кислоты**, пациентам с ХВГВ при наличии синдрома холестаза [65,71,111, 112, 128,201,203].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: адеметионин** - рекомендуемая доза составляет 5-12 мг/кг/сут внутривенно или внутримышечно. При необходимости поддерживающей терапии рекомендуется продолжить прием препарата в виде таблеток в дозе 800 – 1600 мг/ сутки (2–4 таблетки) на протяжении 2-4 недель; препараты урсодезоксихолевой кислоты** – суточная доза 10–15 мг/кг в 2-3 приема. Длительность лечения ‒ 6–12 месяцев и более) [111,128]
-
Рекомендовано назначение фиксированной комбинации инозин + меглюмин + метионин + никотинамид + янтарная кислота** пациентам с ХВГВ при наличии внутрипеченочного холестаза с целью улучшения функциональной активности клеток печени [206, 207]
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 3)
Комментарии: вводится внутривенно капельно в дозе 400 мл/сут 1 раз в день в течение 10 дней.
-
Рекомендуется назначение орнитина и/или рифаксимина и/или лактулозы** пациентам с ХВГВ при развитии энцефалопатии [51, 52, 54, 66, 170, 171,204, 205,210,212]
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии: орнитин вводится внутривенно капельно в дозе 20 г. предварительно разведенного в 500 мл инфузионного раствора 1 раз в день в течение 10 дней, также он назначается перорально по 1-2 пакетика (3-6 г гранулята внутрь (после еды),, предварительно растворенного в 200 мл воды 2-3 раза в сутки (суточная доза 6,9,12,18 г) и/ или рифаксимин назначается внутрь по 400 мг каждые 8 ч 7 дней или 550 мг 2 раза в сутки 6 месяцев.. Лактулоза** назначается начальная доза 30-45 мл в сутки, затем индивидуально - внутрь до достижения целевой частоты стула 4-5 раз в сутки.
-
Рекомендуется пациентам с ХВГВ и суб- и декомпенсированным циррозом печени для коррекции синдрома портальной гипертензии назначать диуретическую терапию [120, 132, 134].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: калийсберегающие диуретики (антагонисты альдостерона): спиронолактон** назначается по 100 – 400 мг/сутки (доза подбирается индивидуально). В случае недостаточности эффекта альдостерона антагонистов показано дополнительное введение сульфонамидов-
– фуросемид** в начальной дозе 20 – 40 мг/сутки или торасемид 5 – 20 мг/сутки.
-
Рекомендуется проведение инфузионно-дезинтоксикационной терапии, включающей парентеральные формы вышеперечисленных патогенетических лекарственных средств при клинико-лабораторных признаках обострения ХВГВ, требующего госпитализации пациента [1, 22, 119, 132, 134].
Комментарии: инфузионная терапия: 800 – 1200 мл 5% раствора декстрозы** внутривенно капельно, меглюмина натрия сукцинат**- со скоростью до 90 капель/мин (1–4,5 мл/мин) — 400–800 мл/сут. (Средняя суточная доза -10 мл/кг. Курс терапии – до 11 дней). Объем и длительность зависит от степени тяжести пациента [208, 209]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Пациентам с ХВГВ и циррозом печени при развитии бактериальных осложнений (спонтанный бактериальный перитонит) лечения, а также первичная и вторичная профилактика их возникновения проводится по соответствующим данным осложнениям клиническим рекомендациям.
2. Хирургическое лечение
-
При наличии стойких признаков декомпенсации функции печени рекомендуется проведение трансплантации печени [1, 22, 105, 119, 132, 134, 166].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарий: дообследование проводится в соответствии с протоколом ведения пациентов из листа ожидания в трансплантологическом центре.
-
При наличии варикозного расширения вен пищевода рекомендовано рассмотреть возможность выполнения эндоскопического лигирования варикозных расширений пищевода [1, 22, 119, 132, 134].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарий: лигирование варикозно расширенных вен пищевода выполняется как с целью профилактики кровотечения, так и с целью его купирования.
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Лечение особых групп пациентов
1. Противовирусная терапия пациентов с реактивацией HBV-инфекции
Реактивация HBV-инфекции, как правило, наблюдается при развитии различных иммунодефицитных состояний: посттрансплантационной иммуносупрессии, длительной терапии глюкокортикоидами и ингибиторами фактора некроза опухолей альфа (ФНО-альфа), у пациентов с онкогематологической и лимфопролиферативной патологией, у ВИЧ-инфицированных на любых стадиях инфекционного процесса при развитии СПИДа, а также у пациентов с хроническим микст гепатитом В+С на фоне ПВТ HCV-инфекции препаратами с прямым механизмом действия.
Реактивация HBV-инфекции чаще отмечается у HBsAg-позитивных, чем у HBsAg-негативных/anti-HBc-позитивных пациентов. Однако, перед началом иммуносупрессивной терапии всем пациентам необходим скрининг на анти-HBc, поскольку возможна реактивация HBV-инфекции у HBsAg-негативных/анти-HBc-позитивных лиц. Таких пациентов также относят к группе риска по реактивации ВГВ. Реактивация ВГВ – абсолютное показание для немедленного назначения НА ингибиторов. Всем пациентам перед началом иммуносупрессивной терапии необходимо определение антител к поверхностному антигену (HBsAg) в крови и антител к ядерному антигену (HBcAg) вируса гепатита B (Hepatitis B virus) в крови для исключения оккультной HBV-инфекции. Пациентам из групп риска целесообразно проводить профилактическую ПВТ перед назначением иммуносупрессантов и продолжать ее минимум до полного восстановления иммунной системы под контролем репликативной активности ВГВ и уровня АЛТ.
-
Рекомендовано пациентам с наличием HBsAg назначать противовирусные препараты прямого действия в качестве упреждающей терапии на всем протяжении курса иммуносупрессии, вне зависимости от уровня ДНК ВГВ, и в течение 12 мес. после прекращения терапии [67, 154, 155].
Уровень убедительности рекомендаций С (уровень достоверности доказательств –5)
Комментарии: рекомендуется назначать противовирусные препараты прямого действия с высокой противовирусной активностью и высоким барьером развития резистентности: энтекавир** (0,5 мг/сут) для пациентов, получающих ПВТ впервые, и 1 мг/сут для пациентов, ранее получавших терапию ламивудином** или тенофовир** (300 мг/сут). Лицам с положительными анти-HBc должно быть выполнено определение ДНК вируса гепатита В (Нepatitis B virus) в крови методом ПЦР, качественное исследование. При выявлении в сыворотке крови ДНК HBV необходимо начинать курс ПВТ с применением противовирусных препаратов прямого действия с высокой противовирусной активностью и высоким барьером развития резистентности. При неопределяемом уровне ДНК ВГВ, независимо от статуса по анти-HBs, всех пациентов, получающих химио- и/или иммуносупресивную терапию, необходимо тщательно мониторировать. Так, в течение первого месяца химио- или иммуносупрессивной терапии определение активности АЛТ в крови выполняют еженедельно, затем 1 раз в месяц. Определение ДНК вируса гепатита B (Hepatitis B virus) в крови методом ПЦР, количественное исследование - через 4 и 12 недель от начала лечения, затем - каждые 3 месяца ПВТ[30, 67, 119].
2. Этиотропная терапия и профилактика хронического гепатита В в посттрансплантационном периоде.
Эффективную профилактику HBV инфекции после ортотопической трансплантации печени (ОТП) определяет достаточное эффективное защитное количество анти-HBs (не менее 500 мМЕ/мл вскоре после ОТП и не менее 100 мМЕ/мл в отдаленные сроки). Наличие анти-HBs может быть обеспечено двумя путями: введением иммуноглобулина человека против гепатита B (HBIG) или активной иммунизацией (вакцинацией).
Другой возможностью предотвратить острую инфекцию трансплантата, связанную с репликацией ГВ после ОТП, является назначение противовирусных препаратов прямого действия.
-
Рекомендовано применение иммуноглобулина человека против гепатита B в комбинации с энтекавиром** или тенофовиром** (последние два назначаются еще на стадии листа ожидания трансплантации) у пациентов, перенесших ОТП по поводу цирротической стадии хронического гепатита B (D) для лечения возвратной инфекции ГВ [78, 81–83, 153].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
Комментарии: для сведения к минимуму риска возвратной инфекции ГВ после ОТП необходимо обеспечение уровня анти-HBs более 500 мМЕ/мл в течение 1-ой недели, более 250 мМЕ/мл с 2 по 12 неделю и поддержание в дальнейшем уровня более 100 мМЕ/мл. В настоящее время применяется назначение внутривенного введения высоких доз иммуноглобулина человека против гепатита B (HBIG) в сочетании с противовирусными препаратами прямого действия. HBIG начинают вводить внутривенно во время беспеченочного периода операции в дозе 10000 МЕ, продолжают введение ежедневно в течение первой недели по 2000 МЕ, затем – 1 раз в 2 недели в течение 6 -12 месяцев (и более) после ОТП в дозах 500 - 2000 МЕ. Дозу HBIG в эти сроки следует определять индивидуально, под контролем содержания анти-HBs в крови. Возможно прекращение введения HBIG после 2-х лет применения с последующей монотерапией противовирусными препаратами прямого действия.
3. Противовирусная терапия пациентов с ХВГВ на стадии декомпенсированного цирроза печени
-
Рекомендовано всех пациентов с ХВГВ на стадиях декомпенсированного цирроза печени рассматривать как кандидатов на трансплантацию печени и включать их в лист ожидания трансплантации печени [1, 78, 83, 130, 131, 176].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
-
Всем пациентам с HBV-ассоциированным декомпенсированным ЦП рекомендуется немедленно начать противовирусную терапию (с коррекцией по СКФ как было описано выше при почечной недостаточности и учетом завышенного веса за счет избыточной жидкости при асците): энтекавиром** 1 мг в сутки пожизненно или ТАФ** 25 мг в сутки пожизненно [1, 75-77, 130, 131].
Энтекавир** Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2).
ТАФ** Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
-
Не рекомендовано использование других противовирусных препаратов прямого действия, кроме энтекавира** и ТАФ**, противопоказано назначение интерферонов пациентам с суб- и декомпенсированным циррозом печени в исходе ХВГВ [1, 75-78, 134].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
-
Рекомендовано проводить противовирусную терапию пациентов с ХВГВ на стадиях декомпенсированного цирроза печени под наблюдением медицинского персонала специализированных медицинских центров, имеющих опыт работы с такими пациентами. Основная цель – тщательный мониторинг нежелательных явлений (лактоацидоз, почечная недостаточность), а также индивидуальной переносимости прямых противовирусных препаратов [1,75-77, 78, 134].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
4. Противовирусная терапия пациентов с коинфекцией ВИЧ/ХВГВ
-
Рекомендовано начинать АРТ пациентам с коинфекцией ВИЧ/ХВГВ незамедлительно и независимо от содержания СD 4 лимфоцитов в связи с высоким риском развития цирроза печени и/или гепатоцеллюлярного рака [84, 85].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
-
Рекомендовано пациентам с коинфекцией ВИЧ/ХВГВ назначать АРТ терапию, включающую в свой состав тенофовир** [84, 85, 86].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Прекращение приема тенофовира** у данных пациентов крайне нежелательно ввиду высокого риска реактивации HBV-инфекции. При этом следует помнить, что восстановление иммунного ответа на фоне эффективной антиретровирусной терапии может привести к декомпенсации ЦП из-за активации иммунного ответа против HBV, что требует тщательного наблюдения за пациентами с ЦП и низким содержанием CD4+-клеток в крови [84-86].
5. Противовирусная терапия пациентов с коинфекцией ХВГС/ХВГВ
-
Рекомендовано пациентам с коинфекцией ХВГС/ХВГВ в связи риском возможной реактивации HBV-инфекции на фоне подавления репликации ВГС противовирусными препаратами прямого действия при наличии показаний к ПВТ ХВГВ назначать противовирусные препараты прямого действия на общих основаниях [90–96, 153].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
-
Рекомендовано пациентам с ХВГС/ХВГВ, не имеющим показаний к назначению нуклеозидов и нуклеотидов - ингибиторов обратной транскриптазы при HBV-моноинфекции, но планирующимся на ПВТ ХВГС противовирусными препаратами прямого действия, назначать на весь период ПВТ ХВГС и 12 недель после нее энтекавир**, тенофовир** или тенофовира алафенамид** с целью профилактики реактивации HBV-инфекции [91 - 96].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
-
Рекомендовано пациентам с ХВГС с подозрением на скрытое течение HBV-инфекции весь период ПВТ ХВГС назначить противовирусные препараты прямого действия и 12 недель после нее проводить определение антител к поверхностному антигену (HBsAg) вируса гепатита В (Нepatitis B virus) в крови и определение ДНК вируса гепатита В (Нepatitis B virus) в крови методом ПЦР качественное и количественное исследование. В случае повышения активности АЛТ в крови выполнять исследования крови для определения антител к поверхностному антигену (HBsAg) вируса гепатита В (Нepatitis B virus) в крови и определение ДНК вируса гепатита В (Нepatitis B virus) в крови методом ПЦР качественное и количественное исследование [90 - 96].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
6. Противовирусная терапия пациентов с коинфекцией ХВГВ/ХВГД
Лечение, согласно клиническим рекомендациям: Хронический вирусный гепатит D (ХВГD) у взрослых
7. Противовирусная терапия беременных пациенток с ХВГВ
-
Рекомендован скрининг на определение антигена (HBsAg) вируса гепатита B (Hepatitis B virus) в крови в первом триместре беременности [100, 173].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
-
Не рекомендовано при планировании беременности у женщин с ХВГВ и ранними стадиями фиброза (F1-2 по METAVIR) назначать терапию противовирусными препаратами прямого действия [97-99,173].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
-
Рекомендовано беременным с ХВГВ и стадиями фиброза F3-4 по METAVIR назначать ПВТ тенофовиром** [97-99,173].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
-
Рекомендовано беременным с ХВГВ, которые уже получают ПВТ противовирусными препаратами прямого действия, продолжить терапию тенофовиром**, энтекавиром**, другие противовирусные препараты прямого действия должны быть заменены на тенофовир** [97-99, 106, 124, 135, 144, 149].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
-
Рекомендовано всем беременным женщинам с высокой репликативной активностью ВГВ (с уровнем ДНК ВГВ выше 200000 МЕ/мл или уровнем HBsAg, превышающим 4 log10МЕ/мл) назначить ТДФ** на 24-28-й неделях беременности и проводить данную терапию в соответствии с настоящими рекомендациями до выполнения «стоп-правил» (алгоритм 2) [104, 169, 173].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: при вирусной нагрузке у матери меньше 20000 МЕ/мл риск перинатального инфицирования ребенка, получившего стандартные меры профилактики (иммуноглобулин человека против гепатита В одновременно с вакциной для профилактики вирусного гепатита В**), не превышает 1%. При вирусной нагрузке 200000 МЕ/мл он составляет 2,6%, при 2000000 МЕ/мл - 6,6%, а начиная с 20000000 МЕ/мл - более 15%. Применение тенофовира** у матерей с вирусной нагрузкой более 10000000 МЕ/мл позволило снизить риск инфицирования новорожденных с 20% до 2% (всем новорожденным проводилась стандартная двойная профилактика). Таким образом, у матерей с низкой вирусной нагрузкой риск перинатальной передачи возбудителя при проведении двойной профилактики достаточно мал, поэтому профилактическое лечение матери не показано. При высокой же вирусной нагрузкой, риск, даже несмотря на проведение двойной профилактики, весьма велик, поэтому таким пациенткам следует назначить тенофовир**[97-104]. Не рекомендовано отменять препараты после родов из-за возможного развития обострения ХВГВ, как правило, не тяжелое и самостоятельно купируемое, но не желательное [23, 172,110576,177,179].
-
Не рекомендовано запрещать грудное вскармливание женщинам с HBsAg, как получающим ПВТ #тенофовиром** (300 мг 1 раз в сутки), так и ее не получающим [25, 97-99, 173, 176, 177].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
Комментарии: Данные о секреции тенофовира** в грудное молоко и его влиянии на развитие новорожденного ограничены, поэтому инструкцией к применению грудное вскармливание на фоне продолжающейся после родов химиотерапии не рекомендуется. Тем не менее, для женщин, принимающих тенофовир**, рекомендуется предоставлять информацию об отсутствии точных данных о безопасности препарата при кормлении грудью и преимуществах грудного вскармливания, чтобы пациентка сама могла сделать осознанный выбор [174]. Эта рекомендация основана на данных, что у ВИЧ инфицированных женщин, получающих тенофовир**, секреция метаболита препарата с молоком незначительная и составляет 0,03 % от рекомендуемой суточной дозы препарата для детей [175].
7. Противовирусная терапия работников здравоохранения с ХВГВ
- В связи с тем, что на территории РФ не существует нормативного акта, запрещающего медработникам с диагнозом "гепатит B или С" осуществлять свою трудовую деятельность по специальности (допуск к работе решается на врачебной комиссии в профильном медицинском учреждении по лечению инфекционных заболеваний в каждом случае индивидуально)[1],[2] работникам здравоохранения, больным ХВГВ, выполняющим инвазивные медицинские манипуляции, предусматривающие контакт с биологическими жидкостями пациентов, рекомендовано назначать ПВТ нуклеозидами и нуклеотидами - ингибиторами обратной транскриптазы при уровне репликации HBV ДНК более 200 Ме/мл с целью снижения риска внутрибольничного инфицирования [156, 157, 158].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
8. Противовирусная терапия пациентов с ХВГВ и ХБП, находящихся на диализе или после трансплантации почки
-
Рекомендовано всем пациентам с ХБП, находящимся на диализе или перенесшим операцию по трансплантации почек выполнять определение антигена (HBsAg) вируса гепатита B (Hepatitis B virus) в крови (качественное исследование), определение антител класса М к ядерному антигену (anti-HBc IgM) вируса гепатита B (Hepatitis B virus) в крови и определение антител класса G к ядерному антигену (anti-HBcIgG) вируса гепатита B (Hepatitis B virus) в крови [178, 180, 182].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
-
Рекомендовано пациентам с ХБП с ХВГВ, находящимся на диализе, назначать ПВТ энтекавиром** или тенофовиром алафенамидом** [178, 179, 180].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
-
Рекомендовано всем пациентам с ХБП с ХВГВ после трансплантации почки назначать ПВТ энтекавиром **или тенофовиром** [144, 146, 147, 178, 179, 180].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
-
Рекомендовано пациентам с ХБП с подозрением на скрытое течение HBV-инфекции (отсутствие HBsAg, наличие анти-HBc) проводить мониторинг реактивации HBV-инфекции в объеме определения активности АЛТ не реже 1 раза в месяц, при ее повышении выполнять определение антигена (HBsAg) вируса гепатита В (Hepatitis В virus) в крови, качественное исследование и определение ДНК вируса гепатита В (Hepatitis В virus) в крови методом ПЦР, качественное исследование [139, 140, 180-182].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
9. Противовирусная терапия пациентов с ХВГВ и внепеченочными проявлениями
-
Рекомендовано пациентам с ХВГВ и внепеченочными проявлениями (васкулит, полиартрит, другими видами артралгий, периферическая полинейропатия, гломерулонефрит) при наличии репликации ВГВ назначать терапию противовирусными препаратами прямого действия даже при нормальной активности АЛТ в крови [105, 111, 113-115,117,158].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
-
Не рекомендовано пациентам с ХВГВ и внепеченочными проявлениями назначать ПВТ интерферонами [117-119].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: при наличии гломерулонефрита, васкулита, артрита/артралгии, периферической полинейропатии пациентам следует определять антитела к поверхностному антигену (HBsAg) вируса гепатита В (Hepatitis B virus)в крови, так как данные состояния могут быть первыми и единственными проявлениями HBV-инфекции. Использование интерферонов при этих состояниях в ряде случаев ухудшает течение иммунологически опосредованного заболевания, поэтому не рекомендовано. К сожалению, четких рекомендаций по иммуносупрессивной терапии иммунологически опосредованных осложнений HBV-инфекции пока нет, но применение иммунодепрессантов и глюкокортикоидов совместно с противовирусными препаратами прямого действия не противопоказано [117-119].
Факторы, наличие которых увеличивает риск развития печеночной недостаточности и летального исхода [1, 22, 119, 132, 133,134,135]:
-
цирроз печени;
-
микст-инфицирование гепатотропными вирусами и вирусом иммунодефицита человека;
-
соматическая патология – язвенная болезнь, сахарный диабет, заболевания крови;
-
инфекция – одонтогенная, тонзилогенная, туберкулез;
-
алкоголизм, наркомания и токсикомания;
-
лекарственные токсические гепатиты;
-
иммунодефицитные состояния;
-
алиментарная дистрофия, несбалансированное питание;
-
трансплантация печени
Отрицательно влияют на исход ПВТ [1, 22, 119, 132, 133,134,135]:
-
Нарушение пациентом режима приема противовирусных препаратов прямого действия;
-
Присоединение нежелательных явлений, требующих проведения медикаментозной коррекции или прерывания курса ПВТ.
[1] Часть 4 статьи 213 ТК РФ Государственная экспертиза условий труда
[2] Приложение №2 к Приказу Минздрава России от 28.02.21 № 29н
Медицинская реабилитация
Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
В настоящее время реабилитационные мероприятия не разработаны.
Госпитализация
Организация оказания медицинской помощи
Пациенты с ХВГВ должны находиться под наблюдением врача-инфекциониста и врача-гастроэнтеролога.
Показания для экстренной госпитализации [1, 22, 119, 132, 133,134].
-
кровотечения;
-
боли в животе;
-
появление желтухи;
-
головная боль с нарушением сознания;
-
развитие острой печеночной недостаточности.
Показания для плановой госпитализации [1, 22, 119, 132,133, 134].
-
начало ПВТ ХВГВ;
-
побочные эффекты в результате ПВТ ХВГВ;
-
длительно удерживающаяся гипертермия;
-
обострение хронических заболеваний;
-
снижение гематологических показателей ниже допустимых;
-
выполнение пункционной биопсии печени (по необходимости);
-
тяжелые внепеченочные проявления ХВГВ;
-
декомпенсированный / субкомпенсированный цирроз печени в исходе ХВГВ.
Выписка из стационара производится по клиническим показаниям [1, 22, 119, 132, 133,134].
Форма помощи
Несмотря на планирование проведения диагностических и лечебных мероприятий пациентам при хроническом гепатите В, помощь носит неотложный характер. Отсрочка начала противовирусной терапии или нарушение сроков проведения этапов лечения приводит к снижению показателей общей и безрецидивной выживаемости у этих пациентов и утяжеляет прогноз у конкретного пациента.
Условия оказания медицинских услуг
Проведения диагностических мероприятий на этапе постановки диагноза и в период противовирусной терапии может осуществляться в условиях специализированного инфекционного стационара в амбулаторном режиме или режиме дневного стационара. В случае развития значимых нежелательных явлений пациент переводится (направляется) на стационарное лечение.
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
1. Диспансерное наблюдение
-
После окончания ПВТ рекомендуется динамическое наблюдение врача-инфекциониста медицинской организации по месту жительства или в территориальном специализированном центре. Частота и объём обследования зависит от варианта достигнутого ответа на проведенную противовирусную терапию и описана в разделе 2.3.4. 1 раз в год пациентам с ХВГВ и 1 раз в полгода пациентам с ЦП [1, 22, 119, 132, 134].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
2. Профилактика
Профилактика ГВ должна проводиться комплексно в отношении источников вируса, путей и факторов передачи, а также восприимчивого населения, включая лиц групп риска [1],[2] [1, 22, 119, 102, 134].
2.1 Профилактика специфическая
-
Рекомендовано проведение плановой вакцинации против вирусного гепатита В рамках национального календаря профилактических прививок всем гражданам с целью предупреждения развития заболевания [1, 22, 119, 132, 134, 145, 168].
Уровень убедительности рекомендаций В (уровень достоверности доказательств –2).
Комментарии: Стандартная схема вакцинации от гепатита В: 0-1-6 месяцев. Первую прививку делают еще в роддоме, вторую – по достижению месячного возраста, а третью – не раньше, чем через 5 месяцев (на 6 месяце жизни). Такая же схема используются для прививания детей старшего возраста и взрослых (вторую инъекцию) делают через месяц после первого, а третий – через 5 месяцев). Основной принцип – придерживаться установленного интервала между прививками.
Детей из группы риска (мать болеет любой клинической форой HBV-инфекции, мать перенесла ОГВ в третьем триместре беременности, мать не обследована во время беременности, в семье есть больной гепатитом, ребенок из неблагополучной семьи) прививают по другой схеме: 0-1-2-12 месяцев.
-
Рекомендовано применение вакцины для профилактики гепатита В рекомбинантной, содержащей S, pre-S1и pre-S2 антигены, адсорбированной** взрослым старше 18 лет для активной профилактики инфекции, вызванной вирусом гепатита В [189-191].
Уровень убедительности рекомендаций В (уровень достоверности доказательств –2).
Коментарии. Индуцирует сероконверсию у пациентов групп высокого риска и лиц «не отвечающих» на иммунизацию конвенциональными вакцинами, а также пациентов с коморбидностью, включая терминальную почечную недостаточность и у иммунокомпроментированных лиц [189-191].
-
Рекомендована экстренная профилактика вакцинами для профилактики вирусного гепатита В** в случае, если контакт с вирусом (с кровью, половой, бытовой) уже мог иметь место [1, 22, 119, 132, 134, 142, 168, 169].
Уровень убедительности рекомендаций В (уровень достоверности доказательств –2).
Комментарии: экстренная профилактика рекомендована лицам с повышенным риском инфицирования гепатитом В:
-
лицам, не привитым ранее против гепатита В или лицам, у которых вакцинация не закончена, или в случае, когда уровень HBs-антител ниже защитного (<10 МЕ/л), после случайных заражений в результате контакта с инфицированным материалом (при инъекциях, стоматологических манипуляциях, переливании крови, попаданиях брызг инфицированного материала в рот или глаза и т.п.), иммуноглобулин человека против гепатита В . В зависимости от характера контакта, вводят из расчета не менее 500 МЕ (10 мл), как можно раньше после контакта (по возможности в течение 24-72 ч.). Одновременно (в этот же день) следует начать вакцинацию против гепатита В по схеме 0-1-2-12 мес. или продолжить начатый курс;
-
лицам, относящимся к группам высокого риска инфицирования вирусом гепатита В (пациенты центров хронического гемодиализа, пациенты, страдающие различными заболеваниями, которые по жизненным показаниям получают частые трансфузии крови и ее препаратов, контактные в очагах гепатита В и др.), не привитым против гепатита В, иммуноглобулин человека против гепатита В вводят до начала процедуры - гемодиализа, переливания крови и ее препаратов и др.; однократно вводят 8-12 МЕ (0,16-0,24 мл/кг), максимально 500 МЕ (10 мл) каждые 2 месяца до формирования сероконверсии после вакцинации. Одновременно с введением иммуноглобулина человека против гепатита В следует начать курс вакцинации против гепатита В по укороченной схеме - 3 аппликации вакцины с интервалом 1 месяц. Через 12 месяцев после начала иммунизации вводится 4-я дополнительная доза вакцины для профилактики вирусного гепатита В**. Первая доза вакцины для профилактики вирусного гепатита В** вводится одновременно с иммуноглобулином человека против гепатита В, но в разные участки тела [80-82].
-
Рекомендовано пациентам с ХВГВ проведение вакцинации против вирусного гепатита А пациентам с отсутствием в крови антител к ВГА для предотвращения микст-инфицирования [1, 22, 119, 132, 133, 134].
Уровень убедительности рекомендаций С (уровень достоверности доказательств –5).
Комментарии: проводится с помощью вакцин для профилактики вирусного гепатита А**, которые представляют собой инактивированный вирус ГА, адсорбированный на гидроокиси алюминия. Почти у 100% людей в течение одного месяца после введения одной дозы вакцины развиваются защитные уровни антител к вирусу. Даже в случае воздействия вируса одна доза вакцины способна защитить провакцинированного человека, если ее аппликация проведена в течение двух недель после контакта с вирусом. Для формирования длительного и устойчивого иммунитета (20 и более лет) производители рекомендуют вводить две дозы вакцины с интервалом от 6 месяцев до 6 лет. Как правило, схема вакцинации включает в себя две внутримышечные инъекции. Некоторые производители вакцин для профилактики вирусного гепатита А** предлагают считать второе введение вакцины не составной частью схемы вакцинации, а бустерным введением препарата, определяющим длительное сохранение анти-ВГА у привитого.
2.2 Профилактика неспецифическая
-
Рекомендуется активное выявление источников инфекции (обследование лиц, подверженных повышенному риску инфицирования и/или имеющие особую эпидемиологическую значимость) [3],[4] [1, 22, 119, 132, 133, 134]. (См. п.2)
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
-
Рекомендована профилактика искусственного механизма передачи (переливание крови только по жизненным показаниям, обоснованность инвазивных методов обследования, использовании одноразового инструментария, строгое соблюдение режимов обработки медицинского инструментария и оборудования, использование защитных средств медработниками) [1, 22, 119, 132, 133, 134, 184, 162].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
-
Рекомендуется лечение пациентов с острыми и хроническими формами вирусного гепатита B, направленное на полную эрадикацию возбудителя [1, 22, 119, 132, 133, 134, 173].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
[1] Методические указания МУ3.1.2792–10 «Эпидемиологический надзор за гепатитом В», Москва,- 2011,- с. 48.
[2] СанПиН 3.3686–21 "Санитарно-эпидемиологические требования по профилактике инфекционных болезней" VII. Профилактика вирусных гепатитов В и С (Зарегистрировано в Минюсте России 15.02.2021 N 62500)
[3] Методические указания МУ3.1.2792–10 «Эпидемиологический надзор за гепатитом В», Москва, - 2011,- с. 48.
[4] СанПиН 3.3686–21 "Санитарно-эпидемиологические требования по профилактике инфекционных болезней" VII. Профилактика вирусных гепатитов В и С (Зарегистрировано в Минюсте России 15.02.2021 N 62500)
Информация
Источники и литература
-
Клинические рекомендации Национальной ассоциации специалистов по инфекционным болезням имени академика В. И. Покровского (НАСИБ)
- 1. Schweitzer A.. Estimations of worldwide prevalence of chronic hepatitis B virus infection: A systematic review of data published between 1965 and 2013. Lancet. 2015; 386: 1546-1555 2. The International Statistical Classification of Diseases and Related Health Problems. 10th revision (ICD-10).Seeger C, Mason WS. Molecular biology of hepatitis B virus infection. Virology 2015;479–480:672–686. 3. Tong S, Revill P. Overview of hepatitis B viral replication and genetic variability. J Hepatol 2016;64:S4–S16. 4. Karayiannis P. Hepatitis B virus: virology, molecular biology, life cycle and intrahepatic spread. Hepatol Int. 2017;11(6):500-508. 5. Sureau C, Salisse J A conformational heparan sulfate binding site essential to infectivity overlaps with the conserved hepatitis B virus a-determinant. Hepatology (Baltimore, MD) 2013: 57(3):985–994. 6. Lindblom A, Fransson LA. Endothelial heparan sulphate: compositional analysis and comparison of chains from different proteoglycan populations. Glycoconj. J. 1990; 7: 545–62. 7. Yan H, Zhong G, Xu G, et al. Sodium taurocholate cotransporting polypeptide is a functional receptor for human hepatitis B and D virus. Elife. 2012;1:e00049. 8. Watashi K, Urban S, Li W, Wakita T. NTCP and beyond: opening the door to unveil hepatitis B virus entry. Int J Mol Sci. 2014;15(2):2892-905. 9. Bouezzedine F, Fardel O, Gripon P. Interleukin 6 inhibits HBV entry through NTCP down regulation. Virology 2015; 481: 34–42. 10. Hosel M, Quasdorff M, Wiegmann K et al. Not interferon, but interleukin‐6 controls early gene expression in hepatitis B virus infection. Hepatology 2009; 50: 1773–82. 11. Hayes CN, Zhang Y, Makokha GN, Hasan MZ, Omokoko MD, Chayama K. Early events in hepatitis B virus infection: From the cell surface to the nucleus. J Gastroenterol Hepatol. 2016;31(2):302-9. 12. Hu J, Liu K. Complete and Incomplete Hepatitis B Virus Particles: Formation, Function, and Application. Viruses. 2017;9(3):е56. 13. Zakim and Boyer’s hepatology : a textbook of liver disease / [edited by] Arun J. Sanyal, Thomas D. Boyer, Norah A. Terrault, Keith D. Lindor. 7th edition. Philadelphia, Elsevier, 2018, 1072 р. 14. Lin, Chih-Lin; Kao, Jia-Horng Hepatitis B virus genotypes: Clinical relevance and therapeutic implications. Curr Hepatitis Rep. 2013; 12:124-32. 15. Sanchez-Tapias JM, Costa J, Mas A, et al. Influence of hepatitis B virus genotype on the long-term outcome of chronic hepatitis B in western patients. Gastroenterology 2002; 123:1848-56. 16. Yuen MF, Wong DK, Sablon E, et al. HBsAg seroclearance in chronic hepatitis B in the Chinese: virological, histological, and clinical aspects. Hepatology 2004; 39:1694-701 17. Tong S, Revill P. Overview of hepatitis B viral replication and genetic variability. J Hepatol 2016;64:S4–S16. 18. World Health Organization. Global Hepatitis Report 2017. Geneva: 2017. 19. World Health Organization. Global progress report_HIV_viral hepatitis_STI_2021 / World Health Organization. – 2021. – 108 p. 20. Эсауленко Е.В., Лялина Л.В., Трифонова Г.Ф., Семенов А.В., Бушманова А.Д., Скворода В.В., Иванова Н.В., Чуланов В.П., Пименов Н.Н., Комарова С.В. Вирусные гепатиты в Российской Федерации. Аналитический обзор / Санкт-Петербург, 2018. Том Выпуск 11. 21. Болезни печени : руководство для врачей / С. Д. Подымова. — 5-е изд. — Москва : ООО "Медицинское информационное агентство" , 2018 г. — 984 с. 22. Stevens CE, Beasley RP, Tsui J, et al: Vertical transmission of hepatitis B antigen in Taiwan. N Engl J Med 292:771–774, 1975. 23. Chang MS, Gavini S, Andrade PC, et al: Caesarean section to prevent transmission of hepatitis B: a meta-analysis. Can J Gastroenterol Hepatol 28:439–444, 2014. 24. de Martino M, Appendino C, Resti M, et al: Should hepatitis B surface antigen positive mothers breast feed? Arch Dis Child 60:972–974, 1985. 25. Wasley A, Grytdal S, Gallagher K, Centers for Disease Control and Prevention (CDC): Surveillance for acute viral hepatitis—United States, 2006. MMWR Surveill Summ 57:1, 2008. 26. Raffetti E, Fattovich G, Donato F. Incidence of hepatocellular carcinoma in untreated subjects with chronic hepatitis B: a systematic review and meta-analysis. Liver Int 2016;36:123 9–1251. 27. Varbobitis I, Papatheodoridis GV. The assessment of hepatocellular carcinoma risk in patients with chronic hepatitis B under antiviral therapy. Clin Mol Hepatol 2016;22:319 –326. 28. Su T-H, Hu T-H, Chen C-YC-L, Huang Y-HY-W, Chuang W-L, Lin C-LC-C, et al. Four-year entecavir therapy reduces hepatocellular carcinoma, cirrhotic events and mortality in chronic hepatitis B patients. Liver Int 2016;36:1755–1764. 29. Lampertico P, Invernizzi F, Viganò M, Loglio A, Mangia G, Facchetti F, et al.The long-term benefits of nucleos(t)ide analogs in compensated HBV cirrhotic patients with no or small esophageal varices: A 12-year prospec-tive cohort study. J Hepatol 2015;63:111 8–1125. 30. Kim WR, Loomba R, Berg T, Aguilar Schall RE, Yee LJ, Dinh PV, et al. Impact of long-term tenofovir disoproxil fumarate on incidence of hepatocellular carcinoma in patients with chronic hepatitis B. Cancer 2015;121:3631–3638. 31. Coffin CS, Rezaeeaval M, Pang JX, Alcantara L, Klein P, Burak KW, et al. The incidence of hepatocellular carcinoma is redu ced in patients with chronic hepatitis B on long -term nucleos(t)ide analogue therapy. Aliment Pharmacol Ther 2014;40:1262–1269. 32. Hosaka T, Suzuki F, Kobayashi MM, Seko Y, Kawamura Y, Sezaki H, et al.Long-term entecavir treatment reduces hepatocellular carcinoma incidence in patients with hepatitis B virus infection. Hepatology 2013;58:98–107. 33. Su T-H, Hu T-H, Chen C-Y, Huang Y-H, Chuang W-L, Lin C-L, et al. Four-year entecavir therapy reduces hepatocellular carcinoma, cirrhotic events and mortality in chronic hepatitis B patients. Liver Int 2016;36:1755–1764. 34. Wu C-Y, Lin J-T, Ho HJ, Su C-W, Lee T-Y, Wang S-Y, et al. Association of nucleos(t)ide analogue therapy with reduced risk of hepatocellular carcinoma in patients with chronic hepatitis B: a nationwide cohort study. Gastroenterology 2014;147:143–151. 35. Durantel D, Zoulim F. New antiviral targets for innovative treatment concepts for hepatitis B virus and hepatitis delta virus. J Hepatol. 2016;64(1 Suppl):S117-S131. 36. Papatheodoridis G, Vlachogiann akos I, Cholongita s E, Wursthorn K, Thomadakis C, Touloumi G, et al. Discontinuation of oral antivirals in chronic hepatitis B: A systematic review. Hepatology 2016;63:1481–1492. 37. Seto W-K, Cheung K-S, Wong DK-H, Huang F-Y, Fung J, Liu KS-H, et al. Hepatitis B surface antigen seroclearance during nucleoside analogue therapy: surface antigen kinetics, outcomes, and durability. J Gastroenterol 2016;51:487–495. 38. Perrillo RP, Martin P, Lok AS. Preventing hepatitis B reactivation due to immunosuppressive drug treatments. JAMA 2015;313:1617-8. 39. Liu J, Yang H-I, Lee M-H, Lu S-N, Jen C-L, Batrla -Utermann R, et al. Spontaneous seroclearance of hepatitis B seromarkers and subsequen t risk of hepatocellular carcinoma. Gut 2014;63:1648–1657. 40. Arends P, Sonneveld MJ, Zoutend ijk R, Carey I, Brow n A, Fasano M, et al.Entecavir treatment does not eliminate the risk of hepatocellular carcinoma in chronic hepatitis B: Limited role for risk scores in Caucasians. Gut 2015;64:1289–95. 41. Agarwal K, Fung S, Seto WK, Lim YS, Gane E, Jansse n HL, et al. A phase 3 study comparing tenofovir alafenamide (TAF) to tenofovir disoproxil fumarate (TDF) in patients with HBeAg-posit ive, chronic hepatitis B (CHB): efficacy and safety results at week 96. J Hepatol 2017;66:S478. 42. Chan HL, Fung S, Seto WK, Chuang W-L, Chen C-Y, Kim HJ, et al. Tenofovir alafenamide vs.tenofovir disoproxil fumarate for the treatmen t of HBeAg-positive chronic hepatitis B virus infection: a randomised, double-blind, phase 3, non-inferiority trial. Lancet Gastroenterol Hepatol 2016;1:185–95.
Информация
Список сокращений
CD4 - молекула кластера дифференцировки 4
HAV - вирус гепатита А (hepatitis А virus)
HBcAg - HBV core antigen, ядерный (сердцевинный) антиген HBV
HBeAg - HBV e antigen, экскретируемый антиген HBV
HBsAg - HBV surface antigen, поверхностный антиген HBV
HBV- вирус гепатита В (hepatitis B virus)
HCV- вирус гепатита С (hepatitis С virus)
HDV - вирус гепатита D (hepatitis D virus)
АЛТ - аланинаминотрансфераза
АСТ - аспартатаминотрансфераза
Вир. нагрузка - вирусная нагрузка
ВИЧ - вирус иммунодефицита человека
ГГТ - гамма-глютамилтрансфераза
ГЦК - гепатоцеллюлярный рак
ДНК - дезоксирибонуклеиновая кислота
кзкДНК - ковалентно замкнутая кольцевая ДНК
КТ - компьютерная томография
МЕ - международная единица
МРТ - магнитно-резонансная томография
НА - нуклеотиды и нуклеозиды – ингибиторы обратной транскриптазы
ПТИ - протромбиновый индекс
РНК - рибонуклеиновая кислота
СКФ - скорость клубочковой фильтрации
ТАФ** - тенофовира алафенамид**
ТДФ** - тенофовир**
УЗИ - ультразвуковое исследование
ХВГВ - хронический вирусный гепатит В
ЦП - цирроз печени
ЩФ - щелочная фосфатаза
Термины и определения
Биохимический ответ – нормализация активности АЛТ в крови.
Вирусная нагрузка – количество вирусной ДНК в крови.
Вирусологический прорыв – 10-кратное возрастание вирусной нагрузки в сыворотке от ее минимального уровня, достигнутого во время лечения у пациента с начальным вирусологическим ответом.
Вирусная супрессия (вирусологический ответ на лечении НА) - неопределяемый уровень ДНК HBV в крови.
Гепатит – воспаление печени, критерием которого выступает повышение активности АЛТ в крови и/или наличие некровоспалительных изменений в биоптате печени.
Гистологический ответ – уменьшение некровоспалительной активности не менее чем на 2 пункта по гистологическим шкалам активности гепатита без увеличения фиброза.
Двойная профилактика – введение иммуноглобулина человека против гепатита В и вакцины для профилактики вирусного гепатита В** новорожденным от HBsAg-положительных матерей для профилактики перинатального инфицирования.
Отсутствие ответа – снижение вирусной нагрузки ДНК HBV менее чем на один log10 (менее чем в 10 раз) от исходной через 3 месяца терапии НА
Полный ответ – отсутствие кзкДНК по результатам исследования гепатибиоптата методом ПЦР (в рутинной клинической практике не оценивается).
Стерилизационный ответ – исчезновение интегрированной в геном ДНК HBV (в рутинной клинической практике не оценивается).
Сероконверсия – исчезновение из крови HBsAg и появление антител к нему.
Серореверсия – повторное появление в крови HBsAg после ранее достигнутой сероконверсии.
Стоп-правила – критерии прекращения терапии.
Функциональный ответ – устойчивый клиренс HBsAg с HBs-сероконверсией или без нее и неопределяемая ДНК HBV в крови после курса лечения.
Цитопатический эффект – гибель или иное повреждение инфицированных вирусом клеток.
Критерии оценки качества медицинской помощи
|
№
|
Критерии качества |
Оценка выполнения (да/нет) |
|---|---|---|
|
На этапе постановки диагноза |
||
|
1 |
Выполнен общий (клинический) анализ крови с дифференцированным подсчётом лейкоцитов (лейкоцитарной формулы) |
Да/нет |
|
2 |
Выполнен анализ крови биохимический общетерапевтический (исследование уровня общего билирубина, уровня свободного и связанного билирубина, определение активности аланинаминотрансферазы и аспартатаминотрансферазы (АЛТ, АСТ), гамма-глютамилтрансферазы (ГГТ), щелочной фосфатазы (ЩФ) |
Да/нет |
|
3 |
Выполнена при наличии геморрагического синдрома коагулограмма (ориентировочного исследования системы гемостаза):; определение времени свертывания нестабилизированной крови или рекальцификации плазмы, времени кровотечения, протромбинового (тромбопластинового) времени в крови или в плазме, тромбинового времени в крови, ПТИ и МНО |
Да/нет
|
|
4 |
Выполнено исследование уровня общего белка в крови и исследование уровня альбумина в крови |
|
|
5 |
Выполнен общий (клинический) анализ мочи |
Да/нет |
|
6 |
Выполнено определение антигена (HBsAg) вируса гепатита B (Hepatitis B virus) в крови (качественное исследование), антигена (HbeAg) вируса гепатита B (Hepatitis B virus) в крови, определение антител к e-антигену (anti-HBe) вируса гепатита B (Hepatitis B virus) в крови, определение антител классов к ядерному антигену (HBcAg) вируса гепатита B (Hepatitis B virus) в крови, определение антител класса M к ядерному антигену (anti-HBc IgM) вируса гепатита B (Hepatitis B virus) в крови |
Да/нет |
|
6 |
Выполнены скрининговые исследования всем пациентам при выявлении HBsAg: определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) и ВИЧ – 2 (Human immunodeficiency virus HIV 2) в крови; определение суммарных антител классов M и G (anti-HCV IgG и anti-HCV IgM) к вирусу гепатита C (Hepatitis C virus) в крови; |
Да/нет
|
|
7 |
Выполнено всем пациентам с наличием HВsAg в крови определение антител к вирусу гепатита D (Hepatitis D virus) в крови независимо от уровня ДНК вируса гепатита B (ДНК ВГВ), активности аспартатаминотрансферазы и аланинаминотрансферазы в крови, наличия симптомов |
Да/нет |
|
8 |
Выполнено для определения фазы заболевания (определение ДНК вируса гепатита B (Hepatitis B virus) в крови методом ПЦР, количественное исследование, определение антител к e-антигену (anti-HBe) вируса гепатита B (Hepatitis B virus) в крови, определение антигена (HBeAg) вируса гепатита B (Hepatitis B virus) в крови (качественно) |
Да/нет |
|
9 |
Выполнено обнаружение антител класса G (anti-HAV IgG) к вирусу гепатита A (Hepatitis A virus) в крови для исключения паст-инфекции гепатита А. |
Да/нет |
|
10 |
Выполнено ультразвуковое исследование органов брюшной полости (комплексное) |
Да/нет |
|
11 |
Выполнена эластометрия печени при отсутствии лабораторно-инструментальных данных, свидетельствующих о наличии ЦП |
Да/нет |
|
12 |
Выполнено при отсутствии возможности провести эластометрию использование комплексных расчетных тестов (расчет индексов фиброза: ФиброТест, Актитест ФиброМакс, АРRI, FIB-4) |
Да/нет |
|
13 |
Выполнено исследование уровня альфа-фетопротеина в сыворотке крови пациентам с выраженным фиброзом печени для диагностики ЦП и ГЦК |
Да/нет |
|
14 |
Выполнена эзофагогастродуоденоскопия (ЭГДС) пациентам с тяжелым фиброзом и циррозом, а также с клиническими признаками нарушений функций печени, абдоминальным болевым синдромом, рвотой «кофейной гущей» |
Да/нет |
|
15 |
Определены показания к началу антивирусной терапии и выбран режим |
Да/нет |
|
На этапе проведения ПВТ |
||
|
1 |
Выполнено проведение общего (клинического) анализа крови с дифференцированным подсчётом лейкоцитов (лейкоцитарной формулы) и уровня тромбоцитов в крови пациентам с ХВГВ, получающим ПВТ через 3 месяца, 6 месяцев, 12 месяцев и далее 1 раз в год для исключения возможных нежелательных явлений ПВТ. |
Да/нет |
|
2 |
Выполнено проведение биохимического общетерапевтического анализа крови (исследование уровня общего билирубина, определение активности АЛТ, АСТ, ГГТ ЩФ, глюкозы, креатинина, общего белка, альбумина),протромбинового индекса, пациентам с ХВГВ, получающим ПВТ через 3 месяца, 6 месяцев, 12 месяцев и далее 1 раз в год для исключения возможных нежелательных явлений ПВТ. |
Да/нет
|
|
3 |
Рекомендовано определение ДНК вируса гепатита B (Hepatitis B virus) в крови методом ПЦР, качественное исследование, количественное исследование и определение антигена (HBsAg) вируса гепатита B (Hepatitis B virus) в крови, количественное исследование пациентам с ХВГВ, получающим ПВТ с целью контроля эффективности терапии |
Да/нет |
|
5 |
Выполнено у пациентов при планировании назначения ТДФ**, ультразвуковая денситометрия, рентгеноденситометрия. С дальнейшим контролем ежегодно. |
|
|
На этапе диспансерного наблюдения |
||
|
1 |
Выполнено проведение анализа крови биохимического общетерапевтического (исследование уровня общего билирубина, определение активности АЛТ, АСТ, ГГТ ЩФ, креатинина, общего белка, альбумина в крови), ПТИ 1 раз в три месяца в первый год диспансерного наблюдения, далее 1 раз в год пациентам с ХВГВ, завершившим ПВТ |
Да/нет |
|
2 |
Выполнено 1 раз в год определение ДНК вируса гепатита B (Hepatitis B virus) в крови методом ПЦР, качественное исследование пациентам с ХВГВ, получившим ПВТ |
Да/нет |
|
3 |
Выполнено 1 раз в год определение антигена (HBsAg) вируса гепатита B (Hepatitis B virus) в кровикачественное исследование, пациентам с ХВГВ, получившим ПВТ |
Да/нет |
|
4 |
Выполнено 1 раз в год исследование уровня альфа-фетопротеина в сыворотке крови пациентам с наличием HBsAg для исключения ГЦК |
Да/нет |
|
5 |
Выполнена ежегодно у пациентов получающих ТДФ**, ультразвуковая денситометрия, рентгеноденситометрия. |
Да/нет |
|
6 |
Выполнено ультразвуковое исследование органов брюшной полости (комплексное) для оценки стадии заболевания, выявления очаговых образований в печени не реже 1 раза в 4-6 месяцев |
Да/нет |
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
-
Абдурахманов Д.Т. – д.м.н., профессор кафедры внутренних, профессиональных болезней и ревматологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет).
-
Бацких С.Н. – д.м.н., ведущий научный сотрудник Центра диагностики и лечения заболеваний печени Московского клинического научно-практического центра им.А.С.Логинова ДЗМ
-
Жаркова М. С. – к.м.н., заведующая отделением гепатологии Клиники пропедевтики внутренних болезней, гастроэнтерологии и гепатологии им. В.Х. Василенко ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет).
-
Жданов К.В., член – корр. РАН, д.м.н., профессор, заслуженный деятель науки РФ, директор ФГБУ ДНКЦИБ ФМБА России, главный внештатный специалист по инфекционным болезням комитета по здравоохранению Санкт-Петербурга.
-
Ивашкин В. Т.– д.м.н. профессор, академик РАН, Президент Российской гастроэнтерологической ассоциации и Российского общества по изучению печени, заведующий кафедрой пропедевтики внутренних болезней, гастроэнтерологии и гепатологии ФГАОУ Первый Московский государственный медицинский университет им. И.М. Сеченова (Сеченовский университет) Минздрава РФ, заслуженный врач РФ, заслуженный деятель науки РФ, лауреат премии Правительства РФ в области науки и техники в 2007 г., в области образования в 2013 г.
-
Козлов К.В., д.м.н. профессор кафедры инфекционных болезней (с курсом медицинской паразитологии и тропических заболеваний) Федерального государственного бюджетного военного образовательного учреждения высшего образования «Военно-медицинская академия им. С. М. Кирова» Министерства обороны Российской Федерации;
-
Масленников Р.В. -. к.м.н., ассистент кафедры пропедевтики внутренних болезней, гастроэнтерологии и гепатологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет).
-
Новак К.Е. - к.м.н., доцент, доцент кафедры инфекционных болезней взрослых и эпидемиологии Федерального государственного бюджетного образовательного учреждения высшего образования «Санкт-Петербургский государственный педиатрический медицинский университет» Министерства здравоохранения Российской Федерации
-
Прийма Е.Н. - к.м.н., ассистент кафедры инфекционных болезней взрослых и эпидемиологии Федерального государственного бюджетного образовательного учреждения высшего образования «Санкт-Петербургский государственный педиатрический медицинский университет» Министерства здравоохранения Российской Федерации
-
Сагалова О. И .- д.м.н. профессор, профессор кафедры инфекционных болезней Федерального государственного бюджетного образовательного учреждения высшего образования «Южно-Уральский государственный медицинский университет» Министерства здравоохранения Российской Федерации, заведующая инфекционным отделением клиники ФГБОУ ВО ЮУГМУ Минздрава России
-
Сукачев В.С. – к.м.н., старший преподаватель кафедры инфекционных болезней (с курсом медицинской паразитологии и тропических заболеваний) Федерального государственного бюджетного военного образовательного учреждения высшего образования «Военно-медицинская академия им. С. М. Кирова» Министерства обороны Российской Федерации;
-
Сюткин В.Е., д.м.н, профессор кафедры хирургии с курсами онкохирургии, эндоскопии, хирургической патологии, клинической трансплантологии и органного донорства ИППО ФГБУ ГНЦ ФМБЦ им. А.И. Бурназяна ФМБА России; ведущий научный сотрудник отделения трансплантации печени ГБУЗ «НИИ скорой помощи им.Н.В. Склифосовского ДЗМ
-
Тихонов И. Н. - член Российского общества по изучению печени, ассистент кафедры пропедевтики внутренних болезней, гастроэнтерологии и гепатологии, врач-гастроэнтеролог отделения гепатологии Клиники пропедевтики внутренних болезней, гастроэнтерологии и гепатологии им. В.Х. Василенко ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет).
-
Чуланов В. П. – д.м.н., профессор, заместитель директора по науке и инновационному развитию ФГБУ НМИЦ ФПИ Минздрава России, профессор кафедры инфекционных болезней ФГАОУ ВО Первого МГМУ им. И.М. Сеченова, главный внештатный специалист Минздрава России по инфекционным болезням;
-
Шептулин А. А. – д.м.н., профессор, профессор кафедры пропедевтики внутренних болезней гастроэнтерологии и гепатологии, ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России
-
Широкова Е. Н. – д.м.н., профессор, профессор кафедры пропедевтики внутренних болезней лечебного факультета ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России, заведующая научно-исследовательским отделом «Инновационной терапии» НИЦ Первого МГМУ им. И.М. Сеченова
-
Эсауленко Е.В., д.м.н., профессор, заведующая кафедрой инфекционных болезней взрослых и эпидемиологии Федерального государственного бюджетного образовательного учреждения высшего образования «Санкт-Петербургский государственный педиатрический медицинский университет» Министерства здравоохранения Российской Федерации;
Все члены рабочей группы являются членами Национальной ассоциации специалистов по инфекционным болезням имени академика В.И. Покровского или членами Российского общества по изучению печени.
Конфликт интересов отсутствует.
Приложение А2. Методология разработки клинических рекомендаций
Предлагаемые рекомендации имеют своей целью довести до практических врачей современные представления об этиологии и патогенезе HBV-инфекции, познакомить с применяющимся в настоящее время алгоритмами ее диагностики и лечения.
-
Врач-инфекционист;
-
Врач-терапевт;
-
Врач-гастроэнтеролог;
-
Врач общей практики (семейный врач);
-
Студенты медицинских ВУЗов, ординаторы, аспиранты (адъюнкты).
В данных клинических рекомендациях все сведения ранжированы по уровню достоверности (доказательности) в зависимости от количества и качества исследований по данной проблеме.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
|
УДД |
Расшифровка |
|---|---|
|
1 |
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
|
2 |
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
|
3 |
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая |
|
5 |
Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 2. Уровни достоверности доказательств с указанием использованной классификации уровней достоверности доказательств (УДД)
|
УДД |
Расшифровка |
|---|---|
|
1. |
Систематический обзор рандомизированных клинических исследований с применением мета-анализа |
|
2. |
Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
|
3. |
Нерандомизированные сравнительные исследования, в том числе когортные исследования |
|
4. |
Несравнительные исследования, описание клинического случая или серии случаев, исследование «случай-контроль» |
|
5. |
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение эксперта |
Таблица 3. Уровни убедительности рекомендаций (УУР) с указанием использованной классификации уровней убедительности рекомендаций
|
УУР |
Расшифровка |
|---|---|
|
А |
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
|
В |
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
|
С |
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Данные клинические МЗ разработаны с учетом следующих нормативно-правовых документов:
-
Федеральный закон от 17 сентября 1998г. №157-ФЗ «Об иммунопрофилактике инфекционных заболеваний»
-
Федеральный закон Российской Федерации от 29 ноября 2010г. №326-ФЗ «Об обязательном медицинском страховании в Российской Федерации».
-
Федеральный закон от 21 ноября 2011г. №323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации».
-
Приказ Минздравсоцразвития России от 9 августа 2005г. №494 «О порядке применения лекарственных средств у больных по жизненным показаниям».
-
Приказ Минздравсоцразвития России от 27 декабря 2011г. №1664н «Об утверждении номенклатуры медицинских услуг».
-
Приказ Минздравсоцразвития России от 31 января 2012г. № 69н «Об утверждении Порядка оказания медицинской помощи взрослым больным при инфекционных заболеваниях».
-
Приказ Минздрава России от 20 декабря 2012г. №1183н «Об утверждении Номенклатуры должностей медицинских работников и фармацевтических работников»
-
Приказ Минздрава России от 07 октября 2015г. №700н «О номенклатуре специальностей специалистов, имеющих высшее медицинское и фармацевтическое образование».
-
Приказ Минздрава России от 17 декабря 2015г. № 1024н «О классификации и критериях, используемых при осуществлении медико-социальной экспертизы граждан федеральными государственными учреждениями медико-социальной экспертизы».
-
Приказ Минздрава России от 10 мая 2017г. №203н «Об утверждении критериев оценки качества медицинской помощи».
-
Методические указания «МУ 3.1.2792-10. 3.1. Профилактика инфекционных болезней. Эпидемиологический надзор за гепатитом В (утв. Главным государственным санитарным врачом РФ 20.12.2010).
-
Санитарные правила и нормы СанПиН 3.3686-21 «Санитарно-эпидемиологические требования по профилактике инфекционных болезней» (утв. Постановлением Главного государственного санитарного врача РФ от 28 января 2021 г. № 4.
-
Приказ Минздрава России от 09.11.2012 N 786н "Об утверждении стандарта специализированной медицинской помощи при хроническом вирусном гепатите B"
-
"Трудовой кодекс Российской Федерации" от 30.12.2001 N 197-ФЗ (ред. от 14.02.2024) Статья 213. Государственная экспертиза условий труда.
-
Приказ Минздрава России от 28.01.2021 N 29н (ред. от 01.02.2022) "Об утверждении Порядка проведения обязательных предварительных и периодических медицинских осмотров работников, предусмотренных частью четвертой статьи 213 Трудового кодекса Российской Федерации, перечня медицинских противопоказаний к осуществлению работ с вредными и (или) опасными производственными факторами, а также работам, при выполнении которых проводятся обязательные предварительные и периодические медицинские осмотры"
-
«Приказ Министерства здравоохранения Российской Федерации от 5 августа 2003 .г No330 «О мерах по совершенствоватию лечебного питания в лечебно-профилактических учреждениях Российской Федерации».
-
Приказ Министерства здравоохранения Российской Федерации от 21 июня 2013 г. No 395п «Об утверждении порм лечебного питания».
- Приказ Министерства здравоохранения Российской Федерации и от 23 сентября 2020 .T N° 1008н «Об утверждении порядка обеспечения пациентов лечебным питанием».»
Обследование пациентов с HBV-инфекцией, которым не показана терапия
|
Группа пациентов |
АЛТ |
Вирусная нагрузка |
Фиброз печени |
|---|---|---|---|
|
HBeAg (+) |
2-4 раза в год |
1-2 раза в год |
1 раз в год |
|
HBeAg(-), вир. нагрузка ≥2000МЕ/мл* |
2-4 раза в год** |
1 раз в год |
|
|
HBeAg(-), вир. нагрузка <2000МЕ/мл |
1-2 раза в год |
1 раз в 2-3 года*** |
|
* при отсутствии отрицательной динамики в течение 3 лет можно перейти на режим наблюдения как у лиц с вирусной нагрузкой <2000 МЕ/мл.
** 4 раза в первый год и 2 раза в последующие года.
*** Более редко, если содержание HBsAg менее 1000 МЕ/мл, и чаще, если оно выше данной цифры [1].
Смена препарата при развитии резистентности к нему
|
Препарат |
Группа пациентов |
Действие |
|---|---|---|
|
Энтекавир** Тенофовир**
|
Все пациенты |
Замена на тенофовир** |
|
Не леченые ламивудином** |
Замена на энтекавир** |
|
|
Резистентные к ламивудину** |
Добавить энтекавир** |
|
|
Множественная резистентность |
Все пациенты |
Заменить на комбинацию энтекавир** + тенофовир** |
Критерии токсичности
Для оценки непосредственных осложнений ПВТ в наших клинических рекомендациях мы руководствовались критериями токсичности, предложенными Международным Обществом Детских Онкологов (SIOP) и представленными в табл. П3.
Таблица – Критерии токсичности
|
Показатель |
0 степень |
1 степень |
2 степень |
3 степень |
4 степень |
|---|---|---|---|---|---|
|
Нефротоксичность |
|||||
|
Мочевина крови |
1,25 N* |
1,26-2,5 N |
2,6-5 N |
5,1-10 N |
>10N |
|
Креатинин крови |
N |
< 1,5 N |
1,5-3 N |
3,1-6 N |
> 6N |
|
Протеинурия |
нет |
<3 г/л |
3-10 г/л |
> 10 г/л |
нефротоксич. синдром |
|
Гематурия |
нет |
кровь в моче микроскопически |
кровь в моче макроскопически |
сгустки крови |
требуется переливание препаратов крови |
|
Гепатотоксичность |
|||||
|
Билирубин |
1,25 N |
1,26-2,25 N |
2,6-5 N |
5,1-10 N |
10 N |
|
Трансаминазы |
1,25 N |
1,26-2,5 N |
2,6-5 N |
5,1-10 N |
10 N |
|
Щелочная фосфатаза |
1,25 N |
1,26-2,5 N |
2,6-5 N |
5,1-10 N |
10 N |
|
Функция легких |
|
|
|
|
|
|
Жизненная емкость, снижение на |
норма |
10-20% |
21-35% |
35-50% |
>50% |
|
pO2, артериальная |
>90 |
80-89 |
65-79 |
50-64 |
<49 |
|
Функциональные признаки |
норма |
тахипное |
одышка |
Одышка при нормальной активности требуется О2 |
ИВЛ |
|
Гастроинтестинальная токсичность |
|||||
|
Стоматит (состояние слизистых обл. рта) |
нет |
Раздражение, гиперемия |
гиперемия/воспаление, изъязвления, возможность принимать твердую пищу |
язвы, возможность принимать только жидкую пищу |
питание peros не представляется возможным |
|
Тошнота и рвота |
нет |
тошнота |
рвота 2-5 раз |
Рвота 6-10 раз |
неукротимая рвота более 10 раз |
|
Задержка стула |
нет |
Незначительная |
задержка стула до 48 часов |
признаки динамической непроходимости 96 часов, ответ на стимуляцию в течение 72 часов |
динамическая непроходимость 96 часов |
|
Боли в животе |
нет |
Не требуют лечения |
Умеренные, терапия |
Выраженные, терапия |
Госпитализация, седация |
|
Диарея |
нет |
преходящая, менее 2 раз/день |
Более 2 раз/день |
Нестерпимая требующая коррекции |
геморрагическая обезвоживание |
|
Нейротоксичность |
|||||
|
Изменение психики и поведения |
возбуждение |
преходящая вялость |
сонливость (менее 50% дневного времени) |
сонливость (более 50% дневного времени) |
кома |
|
Периферические неврологические расстройства |
нет |
Парастезии и понижение сухожильных рефлексов |
Тяжелые парестезии и легкая мышечная слабость |
Парастезии и/или значительная утрата движения |
паралич |
|
Мозжечковые нарушения |
нет |
Легкая дискоординация |
Интенционный тремор, дисметрия, скандированная речь, нистагм |
двигательная атаксия |
мозжечковый некроз |
|
Общемозговые |
нет |
Ступор/возбуждение |
сопор |
Судороги, психоз (галлюцинации) |
Кома, судороги |
|
Боли (связанные только с введением цитостатиков) по шкале боли 0-10 |
нет 0 |
до 2 баллов |
3-5 баллов |
6-9 баллов |
некупирующаяся 10 баллов |
|
Сердечно-сосудистая токсичность |
|||||
|
Ритм |
N |
Асимптоматическое, транзиторное нарушение |
возвратное, персистирующее нарушение |
нарушение ритма, требующее коррекции |
гипотензия, желудочковая тахикардия. фибрилляция |
|
Перикардит |
|
Асимптомат. Выпот |
перикардит |
дренирование |
тампонада |
|
Фракция укорочения (ЭХО-КГ) |
30 |
24-30 |
20-24 |
20 |
- |
|
АД систолическое |
N |
10 |
20 |
30 |
40 |
|
АД диастолическое |
N |
5 |
10 |
15 |
20 |
|
Кожная токсичность |
|||||
|
Реакции и поражение кожи |
нет |
эритема |
сухое шелушение кожи |
мокнущие сыпи |
эксфолиативный дерматит, некрозы |
|
Выпадение волос |
нет |
минимальное облысение |
умеренное очаговое облысение |
полное обратимое облысение |
необратимая алопеция |
|
Геморрагический синдром |
|||||
|
|
нет |
петехии |
умеренная кровопотеря, требующая 1-2 трансфузии за курс |
большая кровопотеря, требующая 3-4 трансфузии |
4 и более трансфузии |
|
Температура тела |
|||||
|
|
N |
38 C |
38-40 С24 часа |
Выше 40С 24 часа |
40С более 24 часов |
|
Гематологическая токсичность |
|||||
|
Лейкоциты, х109/л Тромбоциты, х109/л Гемоглобин, гр/дл |
>4,0 норма норма |
3,0-3,9 75,0-норма 10,0-норма |
2,0-2,9 50,0-74,9 8,0-10,0 |
1,0-1,9 25,0-49,9 6,5-7,9 |
<1,0 <25,0 < 6,5 |
*N-нормальное значение показателя, принятое в лаборатории лечебного учреждения
|
Путь введения |
Подкожные инъекции |
Перорально |
|---|---|---|
|
Длительность лечения |
48 недель |
Длительно, даже после угасания определения HBsAg (прекращение лечения НА спустя несколько лет может быть обоснованно в некоторых конкретных случаях) |
|
Толерантность |
Низкая |
Высокая |
|
Безопасность при длительном применении |
Очень редко описаны случаи неблагоприятных событий (психиатрических, неврологических, эндокринологических) |
Вероятно, отсутствуют (не уточнено для некоторых заболевания почек и костей, для части НА) |
|
Действие |
Создание длительного устойчивого иммунитета, как итог лечения |
Остановка прогрессирования гепатита и цирроза, путем ингибирования вирусной репликации |
|
Противопоказания |
Множество (включая: декомпенсированное заболевание, ко-морбидные состояния и др.) |
Нет (исходя из показателей СКФ) |
|
Вирусная нагрузка |
Под надзором (от нее зависит вводимая доза) |
Высокая универсальность |
|
Влияние на HBeAg и переход его на подпороговый уровень |
Под надзором. Зависит от изначальных показателей |
В первый год низкая, в дальнейшем надзор усиливается в течение лечения |
|
Влияние на HBsAg и переход его на подпороговый уровень |
Вариабельно. Зависит от стартовых показателей (суммарно выше, чем у НА) |
Низкий. Постепенно усиливается по ходу лечения HBsAg(+)пациентов, обычно крайне низок для HBeAg(-) пациентов |
|
Риск рецидива после прерывания проводимого лечения |
Низкий, для тех, у кого отмена наступила через 6-12 месяцев от начала лечения |
Требуется усиление надзора за пациентами после сероконвекции HBeAg Строгий надзор за HBeAg(-) пациентами |
|
Проблемы ранней отмены |
Да |
Нет |
|
Риск развития резистентности |
Нет |
От минимальной к отсутствию |
Схема мониторинга лабораторных показателей при проведении ПВТ с использованием аналогов нуклеоз(т)идов
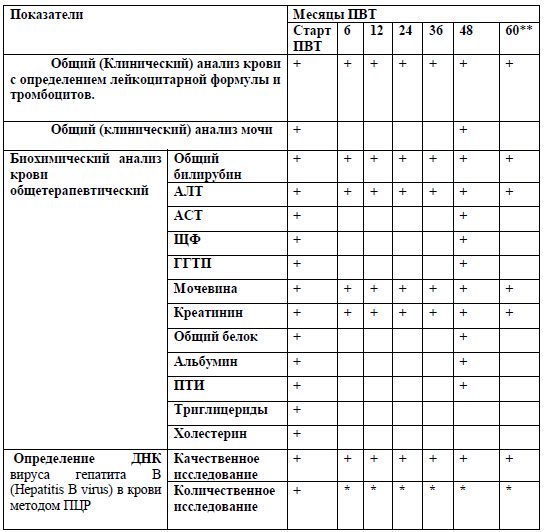
* при положительном качественном исследовании
** в случае завершения ПВТ Определение ДНК вируса гепатита B (Hepatitis B virus) в крови методом ПЦР, качественное исследование (Определение ДНК вируса гепатита B (Hepatitis B virus) в крови методом ПЦР, количественное исследование) и Определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови качественно (количественно) выполняются через 3 и 6 месяцев.
Приложение Б. Алгоритмы действий врача
Алгоритм 1. Алгоритм отбора пациентов для назначения терапии хронической HBV-инфекции
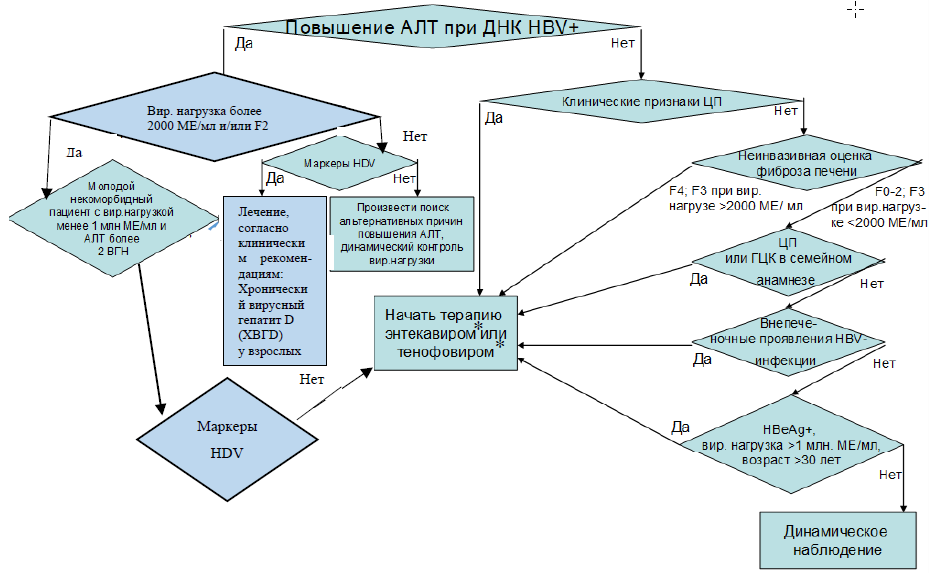
Алгоритм 2. Условия прекращения терапии противовирусными препаратами прямого действия (стоп-правила)
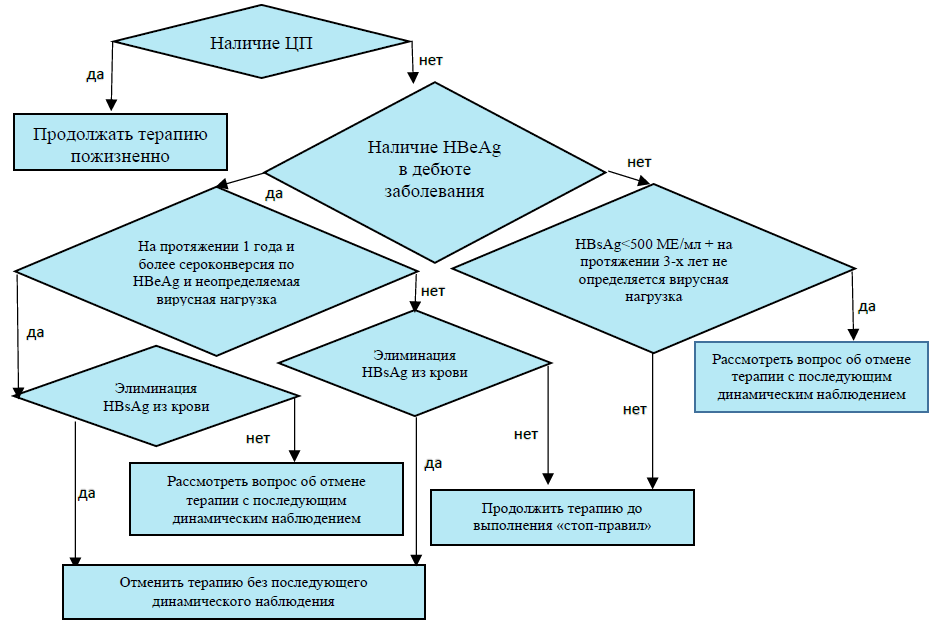
Алгоритм 3. Действия при неэффективности терапии
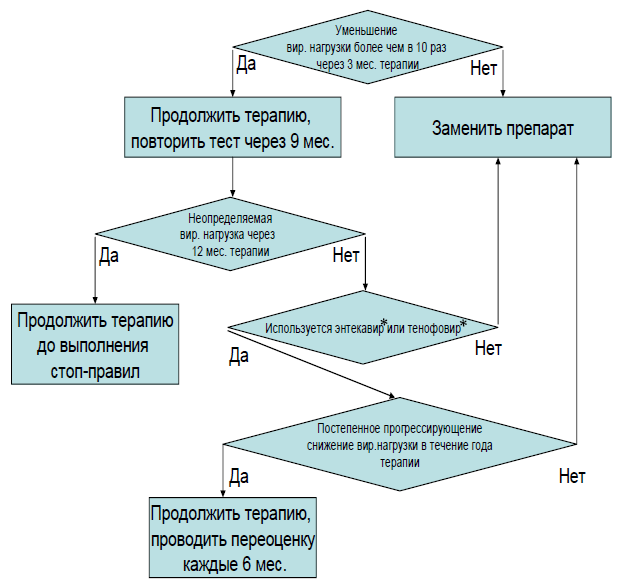
Алгоритм 4. Условия прекращения терапии препаратами интерферона (стоп-правила)
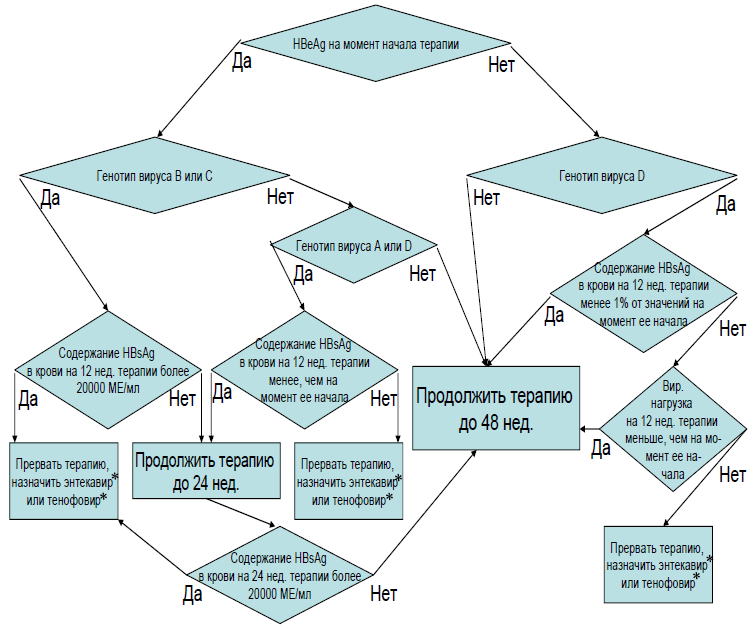
Приложение В. Информация для пациента
Уважаемый пациент! Вы инфицированы вирусом гепатита В (HBV - hepatitis B virus). К сожалению, даже современными средствами невозможно полностью излечиться от него, но они позволяют взять заболевания под контроль, что снижает риск развития цирроза и рака печени. Не все случаи заболевания следует лечить. В ряде случаев болезнь имеет крайне низкую активность и за ней следует только наблюдать. Необходимость и объем терапии определит Ваш лечащий врач. Он же назначит перечень необходимых исследований и их периодичность. Вам не следует самостоятельно отменять или заменять препараты, даже если Вы чувствуете себя лучше и считаете себя здоровым человеком. Болезнь может длительное время протекать скрытно. По всем появляющимся вопросам обращайтесь к лечащему врачу.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Оценка степени тяжести цирроза печени по шкале Child-Pugh
Наименование: Шкала оценки степени тяжести цирроза печени по Чайлд-Пью
(Child-Pugh classification)
Источник (официальный сайт разработчиков, публикация с валидацией):
Child CG, Turcotte JG (1964). "Surgery and portal hypertension". In Child CG (ed.). The liver
and portal hypertension. Philadelphia: Saunders. pp. 50–64
Pugh RN, Murray-Lyon IM, Dawson JL, Pietroni MC, Williams R (1973). "Transection of the
oesophagus for bleeding oesophageal varices". The British Journal of Surgery. 60 (8): 646–9.
doi:10.1002/bjs.1800600817. PMID 4541913
Тип: шкала оценки
Назначение: шкала оценки степени тяжести цирроза печени
Содержание:
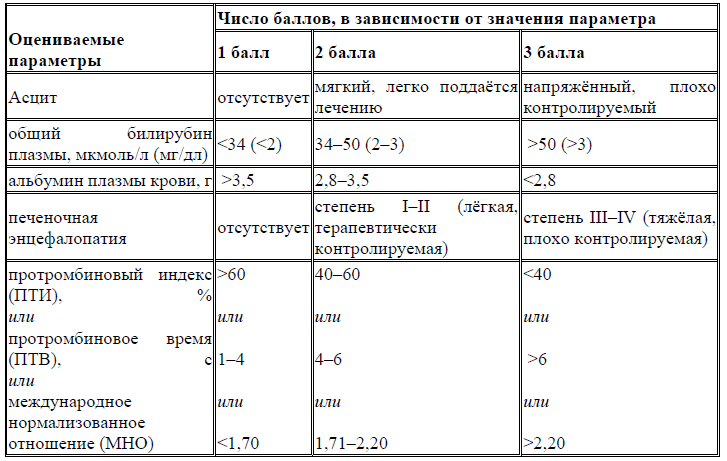
Баллы выставляются в зависимости от значения каждого из параметров от 1 до 3, после чего суммируются.
Ключ:
класс А (Child A): 5 – 6 баллов
класс B (Child B): 7 – 9 баллов
класс C (Child C): 10 – 15 баллов
Оценка выживаемости пациентов с циррозом печени на основе классификации по шкале Child-Pugh
Существуют разные оценки выживаемости больных циррозом печени. В частности, следующие:
|
Класс по Child-Pugh |
Баллы |
Годичная выживаемость, % |
Двухлетняя выживаемость, % |
|---|---|---|---|
|
A |
5–6 |
100 |
85 |
|
B |
7–9 |
81 |
57 |
|
C |
10–15 |
45 |
35 |
Приложение Г2. Стадии фиброза печени по шкале METAVIR
Название: Шкала METAVIR
Источник: Shiha G., Zalata K. Ishak versus METAVIR: terminology, convertibility and
correlation with laboratory changes in chronic hepatitis C. Liver biopsy. 2011, 10, 155-170.
Тип: Шкала
Содержание и ключ (интерпретация):
|
F0 |
Фиброз отсутствует |
|---|---|
|
F1 |
Звездчатое расширение портальных трактов без образования септ |
|
F2 |
Расширение портальных трактов с единичными портопортальными септами |
|
F3 |
Многочисленные портоцентральные септы без цирроза |
|
F4 |
Цирроз |
Приложение Г3. Стадии фиброза печени по шкале Knodell
Наименование: Стадии фиброза печени по шкале Knodell
Источник: E M Brunt. Grading and staging the histopathological lesions of chronic hepatitis: the Knodell histology activity index and beyond. Hepatology. 2000 Jan;31(1):241-6. doi: 10.1002/hep.510310136.
Тип: шкала
Содержание и ключ (интерпретация):
Оценка фиброза проводится в баллах от 0 до 4:
-
0 баллов — фиброз отсутствует;
-
1 балл — фиброз и расширение портальных трактов — слабовыраженный фиброз;
-
3 балла — порто-портальные и/или портоцентральные септы — выраженный фиброз (предцирроз);
-
4 балла — цирроз.
|
показатели |
баллы |
||
|---|---|---|---|
|
I |
Перипортальные и мостовидные некрозы |
||
|
а |
отсутствуют |
0 |
|
|
b |
слабо выраженные ступенчатые некрозы (до 50% периферии портальных трактов) |
1 |
|
|
c |
умеренные ступенчатые некрозы (до 50% периферии портальных трактов) |
3 |
|
|
d |
выраженные ступенчатые некрозы (свыше 50% портальных трактов) |
4 |
|
|
e |
умеренные ступенчатые некрозы и мостовидные некрозы |
5 |
|
|
f |
Выраженные ступенчатые некрозы и мостовидные некрозы |
6 |
|
|
g |
Мультибулярные некрозы |
10 |
|
|
II |
Внутридольеовая дегенерация и очаговые некрозы |
||
|
a |
нет |
0 |
|
|
b |
слабо выраженные (балонная дегенерация или фокусы некроза в 1/3 долек |
1 |
|
|
c |
умеренные (вовлечено 1/3 – 2/3 портальных трактов) |
3 |
|
|
d |
выраженные (вовлеченобольше 2/3 долек печени) |
4 |
|
|
III |
Портальное воспаление |
||
|
a |
отсутствует |
0 |
|
|
b |
Слабое (клетки воспалительного инфильтрата встречаются в 1/3 трактов) |
1 |
|
|
c |
Умеренное (воспалительная инфильтрация в 1/3-2/3 портальных трактов |
3 |
|
|
d |
Выраженное (обильная инфильтрация более 2/3 портальных трактов |
4 |
|
|
IV |
Фиброз |
||
|
a |
отсутствует |
0 |
|
|
b |
фиброз портальных трактов |
1 |
|
|
c |
мостовидный фиброз (порто-портальный или порто-центральный) |
3 |
|
|
d |
цирроз |
4 |
|
Приложение Г4. Расчет индекса фиброза FIB-4
Наименование: Расчет индекса фиброза FIB-4
Источник: Yen Y. H. et al. APRI and FIB-4 in the evaluation of liver fibrosis in chronic hepatitis C patients stratified by AST level//PloS one. - 2018. - Т. 13. - N 6. - С. e0199760.
Тип: индекс
Содержание: расчетная формула и шкала оценки индекса фиброза
Расчетная формула: FIB−4=Возраст (лет))*АСТ/тромбоциты ( 9 10 /л) * √АЛТ Возраст - возраст пациента (лет)
АСТ - значение аспарагиновой аминотрансферазы пациента
Тромбоциты (9 10 /л) - число тромбоцитов пациента в 1 л крови √АЛТ - квадратный корень значения АЛТ пациента
Ключ (интерпретация):
|
FIB-4 |
Вывод |
Шкала оценки |
|---|---|---|
|
>3,25 |
F3-F4 |
METAVIR |
|
<1,45 |
F0-F2 |
METAVIR |
|
1,45-3,25 |
Сомнительный результат |
|
Приложение Г5. Расчет индекса фиброза APRI
Источник: Yen Y.H. et al. APRI and FIB-4 in the evaluation of liver fibrosis in chronic hepatitis C patients stratified by AST level. PloS one. 2018, 13 (6), e0199760.
Тип: Индекс
Содержание: Расчетная формула
APRI = (АСТ / (ВГН АСТ)) * 100 / тромбоциты (109/л)
АСТ - значение аспартатаминотрансферазы пациента
ВГН АСТ - верхняя граница нормы АСТ
Тромбоциты (109/л) - число тромбоцитов пациента в 1 л крови
Ключ (интерпретация):
|
Значение APRI |
Вывод |
Шкала оценки |
|---|---|---|
|
> 2,0 |
F4 |
METAVIR |
|
≥1,5 |
F3-F4 |
METAVIR |
|
0,5 - 1,5 |
Сомнительный результат |
|
|
< 0,5 |
F0-F2 |
METAVIR |
Приложение Г6. Расчет индекса фиброза ФиброМакс
Наименование: индекс фиброза ФиброМакс
Источник: Morra R, Munteanu M, Imbert-Bismut F. et al. FibroMAX: towards a new universal biomarker of liver disease? 2007.- Review. Sep;7(5):481-90. doi: 10.1586/14737159.7.5.481.
Halfon P, Munteanu M, Poynard T. FibroTest-ActiTest as a non-invasive marker of liver fibrosis. Gastroenterol Clin Biol. 2008 Sep;32(6 Suppl 1):22-39. doi: 10.1016/S0399-8320(08)73991–5
Тип: лабораторно-расчетный метод
Содержание: комплексный неинвазивный метод оценки фиброза, стеатоза и воспалительных изменений в печени. Тест состоит из 2 расчётных алгоритмов и выполняется по результатам математической обработки шести биохимических показателей крови:Альфа-2-макроглобулин, Аполипопротеин А1,Аланинаминотрансфераза,Билирубин
Гамма-глутаминтранспептидаза, Гаптоглобин. Также результат ФиброМакса включает значения ФиброТеста, СтеатоТеста и при наличии соответствующих факторов риска АктиТеста (при вирусном гепатите С и В), НэшТеста (при ожирении, сахарном диабете) и ЭшТеста (при злоупотреблении алкоголем).
Ключ (интерпретация): Все результаты теста находятся в пределах от нуля до единицы. Показатель зависит от тяжести заболевания (уровня активности).
Результаты переведены в систему METAVIR:
|
|
|
Методы неинвазивной оценки |
||||
|---|---|---|---|---|---|---|
|
показатель |
значения |
показатель |
референсные знчения |
|||
|
ФиброТест |
F0 — F4 |
α-2-макроглобулин |
0,33 до 2,5 г/л. |
|||
|
АктиТест |
А0 – А3 |
Аполипопротеин А1 |
1,01 — 2,23 г/л |
|||
|
НэшТест |
N0 — N2 |
Общий билирубин |
3,4– 17,1 мкмоль/л |
|||
|
ЭшТест |
Н0 — Н3 |
Гамма-ГТ |
55 Ед/л |
|||
|
Биометрические показатели |
Глюкоза натощак |
3,3ммоль/л,а верхняя-5,5 ммоль/л |
||||
|
возраст |
пол |
вес |
Рост |
|||
Приложение Г7. Малоинвазивный метод диагностики фиброза в печени ФиброТест
Наименование: Метод ФиброТест (FibroTest)
Источник: Salkic NN, Jovanovic P, Hauser G, Brcic M. FibroTest/Fibrosure for significant liver fibrosis and cirrhosis in chronic hepatitis B: a meta-analysis. J Gastroenterol. 2014 Jun;109(6):796-809. doi: 10.1038/ajg.2014.21. Epub 2014 Feb 18.
Тип: лабораторно-расчетный метод
Содержание: малоинвазивный метод диагностики фиброза печени (патологии, при которой нормальные ткани органа заменяются рубцовыми). В качестве материала для исследования используется кровь из вены. Тест ФиброТест состоит из 2 расчётных алгоритмов и выполняется по результатам математической обработки шести биохимических показателей крови: альфа2 макроглобулин, гаптоглобин, аполипопротеин А1, ГГТ (гамма глютамилтрансфераза), общий билирубин и АЛТ (аланин аминотрансфераза). Результаты математической обработки полученные в ходе анализа позволяют судить о степени патологических изменений в печени.
Ключ (интерпретация):
Оценка результата проводится в зависимости от степени тяжести заболевания по шкале от 0 до 4 и обозначается буквой F.
|
Оценка результата |
Маркировка, указывающая на степень тяжести заболевания |
||
|---|---|---|---|
|
F0 |
заболевание отсутствует |
голубая |
изменения отсутствуют |
|
F1 |
присутствуют симптомы портального фиброза без наличия септ |
зеленая |
минимальная степень |
|
F2 |
портальный вид фиброза с единичными септами |
оранжевая |
умеренная степень |
|
F3 |
выявлено множество септ |
||
|
F4 |
диагностирован цирроз |
красная |
выраженная патология |
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.