Хроническая болезнь почек у детей
 Версия: Клинические рекомендации РФ 2025 (Россия)
Версия: Клинические рекомендации РФ 2025 (Россия)
Общая информация
Краткое описание
Союз педиатров России
Российское трансплантологическое общество
Творческое объединение детских нефрологов
Столичная ассоциация врачей-нефрологов
Национальная ассоциация экспертов по санаторно-курортному лечению
Одобрено Научно-практическим Советом Минздрава России
Клинические рекомендации
Хроническая болезнь почек
Пересмотр не позднее: 2027
Возрастная категория: Дети
Определение заболевания или состояния (группы заболеваний или состояний)
Хроническая болезнь почек (ХБП) – стойкие нарушения функции почек, продолжающиеся в течение 3-х месяцев и более, определяемые как структурные и/или функциональные изменения с различной степенью снижения клиренсной функции [1].
Хронические заболевания почек, независимо от этиологии, имеют общие механизмы прогрессирования и требуют определенных терапевтических усилий, направленных на отдаление наступления терминальной стадии ХБП.
Рекомендации по определению и классификации ХБП были введены Национальным фондом почек (NKF) и инициативной группой по качеству исходов заболеваний почек (KDOQI) в 2002 году и впоследствии были приняты с небольшими изменениями международной группой рекомендаций по улучшению глобальных исходов почечных заболеваний (KDIGO) с адаптацией в 2012 году (см. раздел диагностика).
ХБП может проявляться разнообразными симптомами и синдромами. Максимальное увеличение длительности жизни пациента после развития терминальной стадии ХБП определяется не только возможностями диализной терапии, но и сохранностью общего физического и соматического состояния ребенка.
Для обозначения нарушений нутритивного статуса используют термин «белково-энергетическая недостаточность» (БЭН) – недостаток энергии и нутриентов питания для обеспечения потребностей физического развития ребенка (malnutrition – в англоязычной литературе) [2, 3].
Задержка развития (failure to thrive) – термин, используемый для описания детей, которые растут не так, как ожидалось. Диагностика БЭН (malnutrition) основана на антропометрических измерениях, а недостаточное питание (undernutrition) определяется как дисбаланс между потребностями в питательных веществах и их потреблением или доставкой, что в свою очередь приводит к дефициту энергии, белка или питательных микроэлементов, который может отрицательно сказаться на росте и развитии [4].
Развитие ХБП в детском возрасте оказывает негативный эффект на линейный рост костей и нередко приводит к выраженной задержке конечного роста у пациентов. Задержка роста увеличивается со стадией ХБП [5].
Анемия при ХБП – результат нисходящих сигналов, возникающих из-за дисрегуляции системы гипоксия-индуцибельного фактора – пролил-4-гидроксилаза (HIF-PHD), последствиями которых являются уменьшение продукции эритропоэтина (ЭПО), изменение обмена железа (Fe) и снижение гемоглобина (Hb). Нефрогенная анемия закономерно осложняет течение ХБП, которая чаще диагностируется при снижении СКФ до 40-60 мл/мин/1,73м2, хотя может быть выявлена на более ранних стадиях заболевания [6, 7]. Анемия связана с неблагоприятными исходами, плохим качеством жизни и сниженными нейрокогнитивными способностями у пациентов с ХБП [8].
По мере того, как прогрессирует ХБП со снижением СКФ до 50% от нормы, метаболический ацидоз приводит к снижению роста и усилению катаболизма белка за счет реабсорбции отфильтрованного бикарбоната, снижения синтеза аммиака, снижения выведения титруемой кислоты и закисления канальцевой жидкости. Хронический метаболический ацидоз приводит к изменениям ионного состава, резорбции и отложению костной ткани, замедлению эффектов гормона роста. При ацидозе подавляется синтез 1,25 (OH)2D в почках, что в сочетании с остаточным фосфатом и гипокальциемией в конечном итоге приводит к вторичному гиперпаратиреозу [9].
Рабочая группа KDIGO рекомендовала в 2006 году термин «минеральные и костные нарушения при ХБП (МКН-ХБП)» для описания системной патологии, включающей один или несколько диагностически значимых компонентов: нарушение метаболизма кальция, фосфора, паратиреоидного гормона (ПТГ), фактора роста фибробластов 23 (FGF23), витамина D с клиническими проявлениями патологии костной ткани (низкий рост, снижение минерализации костей и нарушение целостности кости) и экстраскелетной кальцификацией. Ранее применяемый термин “почечная остеодистрофия” относится только к описанию костной патологии, возникающей как осложнение ХБП, и основан на оценке данных биопсии кости. Биопсия в настоящее время не используется для верификации патологии костной ткани при ХПН.
Кардиоваскулярная болезнь (КВБ) при ХБП – это прогрессирующее поражение сердечно-сосудистой системы, обусловленное воздействием комплекса факторов, связанных с ХБП. КВБ является основной причиной сокращения продолжительности жизни в этой группе больных. Кардиоваскулярные осложнения являются причиной смерти детей и подростков с ХБП 5 ст. в 25-32% случаев [10, 11, 12].
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
В Международной статистической классификации болезней (МКБ) 10 внесены соответствующие изменения, касающиеся замены устаревшего термина «хроническая почечная недостаточность» на термин «хроническая болезнь почек» (код N l8.1), а также кодирования ХБП. В настоящее время для обозначения стадий ХБП следует использовать коды N18.1 – N18.5 и N18.9
N18.1 – Хроническая болезнь почек, стадия 1
N18.2 – Хроническая болезнь почек, стадия 2
N18.3 – Хроническая болезнь почек, стадия 3 (3а и 3б стадии)
N18.4 – Хроническая болезнь почек, стадия 4
N18.5 – Хроническая болезнь почек, стадия 5
N18.9 – Хроническая болезнь почек с неуточненной стадией
Коды для уточнения этиологии ХБП:
N39.1 – Стойкая протеинурия неуточненная
Q60.0 – Агенезия почки односторонняя
Q60.3 – Гипоплазия почки односторонняя
Q63.1 – Слившаяся, дольчатая и подковообразная почка
Q61.4 – Дисплазия почки
Q63.0 – Добавочная почка
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
Критерии диагностики и определения стадий ХБП у детей адаптированы в 2012 году KDIGO [6]. Критерии ХБП представлены в Таблице 1.
Таблица 1. Критерии определения ХБП (если оба сохраняются более 3-х месяцев).
| Маркеры повреждения почек (1 и более) |
Альбуминурия (скорость экскреции альбумина с мочой ≥30 мг/сут; отношение Ал/Кр мочи ≥30 мг/г [≥3 мг/ммоль])
Изменения осадка мочи (изолированная микрогематурия с нарушением морфологии эритроцитов (анизоцитоз) при повреждении базальной мембраны клубочков; эритроцитарные цилиндры при пролиферативных формах гломерулонефритов, лейкоцитарные цилиндры при пиелонефрите или интерстициальном нефрите; овальные жировые тельца или жировые цилиндры при протеинурии; гранулярные цилиндры и клетки почечного канальцевого эпителия при многих паренхиматозных заболеваниях (неспецифические признаки))
Электролитные и другие нарушения вследствие канальцевой дисфункции (почечный канальцевый ацидоз, нефрогенный почечный несахарный диабет, синдром Фанкони, цистиноз,и др.)
Гистологические изменения
Структурные нарушения при визуализирующих методах исследования (УЗИ, КТ и МРТ с контрастным усилением или без, изотопные методы, ангиография)
Трансплантация почки в анамнезе
|
|
Снижение СКФ |
СКФ <60 мл/мин/1,73 м2 (категории СКФ С3а-С5). СКФ <15 мл/мин/1,73 м2 (С5) расценивают как почечная недостаточность |
Снижение СКФ можно выявить с помощью современных формул для расчета СКФ на основании сывороточного креатинина и/или цистатина С .
Следует подчеркнуть, что критерий «продолжительность >3 месяцев» не применим к новорожденным или младенцам в возрасте ≤3 месяцев так же, как и критерий «СКФ <60 мл/мин/1,73 м2» не применим к детям в возрасте <2 лет, у которых следует применять значения, соответствующие возрасту. Общий белок в моче / экскреция альбумина с мочой выше пределов нормальных значений для соответствующего возраста может быть заменен на альбуминурию ≥30 мг/24ч. Все электролитные нарушения у детей должны рассматриваться с точки зрения возрастных норм.
Важность классификации ХБП заключается в следующих преимуществах: ее корреляция с такими исходами, как прогрессирование заболевания, риск сердечно-сосудистых заболеваний и смертность от всех причин; и возможность терапевтических вмешательств на ранних стадиях болезни для замедления ее прогрессирования и улучшения качества жизни и выживаемости [6, 63, 64, 65]. На начальном этапе необходимо оценить наличие маркеров почечного повреждения, а в дальнейшем определить стадию ХБП по СКФ и степень альбуминурии/протеинурии.
Прогрессирование ХБП определяется на основании величины СКФ (стадия С) и уровня альбуминурии (стадия А) (Таблица 2, Таблица 3). Уровень СКФ определяется на основании концентрации креатинина и/или цистатина С в сыворотке. Уровень альбуминурии определяется на основании соотношения альбумин/креатинин в разовой порции мочи или суточной экскреции альбумина с мочой. Полный диагноз ХБП содержит название заболевания почек (причину ХБП, если известна) вместе с назначенной соответствующей стадией С и альбуминурии.
Таблица 2. Категории (стадии) СКФ при ХБП [6].
|
Категория СКФ |
СКФ мл/мин/1,73м2 |
Определение |
|---|---|---|
|
С1 |
≥90 |
Нормальная или повышенная |
|
С2 |
60-89 |
Незначительно сниженная |
|
С3а |
45-59 |
Умеренно сниженная |
|
С3в |
30-44 |
Существенно сниженная |
|
С4 |
15-29 |
Резко сниженная |
|
С5 |
<15 |
Терминальная почечная недостаточность |
Принимая во внимание результаты крупномасштабных исследований с доказательной базой у взрослых пациентов, данное разделение по стадиям ХБП применимо у пациентов старше 2 лет.
Таблица 3. Категории (стадии) альбуминурии при ХБП [6].
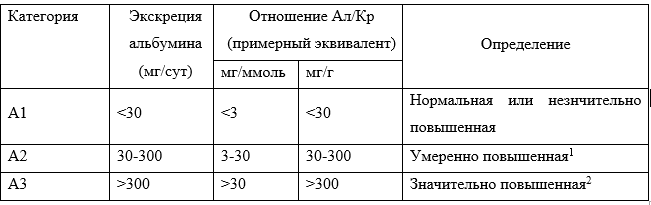
Примечание: Ал/Кр – альбумин/креатинин.
1 - Относительно уровня, характерного для взрослых молодого возраста.
2 - Включая нефротический синдром (экскреция альбумина обычно >2200 мг/сут [отношение Ал/Кр >2220 мг/г; >220 мг/ммоль]).
Обзор, проведенный M. Murton et al., включал десять наблюдательных исследований с участием от 3033 до 46949 человек, проведенных в США, Китае, Франции, Италии и Испании. Наиболее частым исходом была распространенность ХБП 3-5 ст., варьирующая от 2% до 17%. Большинство пациентов были с нормальным уровнем альбуминурии, со значительно повышенной – 0,4–3,2%. Преимущественное большинство пациентов были отнесены в группы низкого или умеренного риска прогрессирования ХБП. Согласно рекомендациям KDIGO 2012 в группу высокого риска отнесено 0,9–5,6%, очень высокого риска – 0,3–4,8% участников исследования [66].
2 SD – как резко сниженную СКФ [6].
Таблица 4. Клиренс 51Сr-EDTA у здоровых детей в возрасте до 2 лет [67].
|
Возраст (месяцы) |
Среднее значение СКФ±SD (мл/мин/1,73м2) |
|---|---|
|
≤1,2 |
52,0±9,0 |
|
1,2-3,6 |
61,7±14,3 |
|
3,6-7,9 |
71,7±13,9 |
|
7,9-12 |
82,6±17,3 |
|
12-18 |
91,5±17,8 |
|
18-24 |
94,5±18,1 |
|
>24 |
104,4±19,9 |
При повышенном потреблении белка с пищей, инфекции мочевых путей, лихорадке, тяжелой физической нагрузке за предшествующие 24 часа, приеме ряда лекарственных средств, менструации и др. состояний может отмечаться транзиторная альбуминурия [68].
Тяжесть БЭН (легкая, умеренная или тяжелая) может быть определена путем нанесения z-балла (стандартное отклонение [SD] от среднего) для каждого из этих антропометрических значений (таблица 5) [69].
Таблица 5. Показатели БЭН, если доступны результаты одного наблюдения.
|
Показатель |
Легкая БЭН |
Умеренная БЭН |
Тяжелая БЭН |
|---|---|---|---|
|
Масса тела/рост, z-оценка |
От -1 до -1,9z |
От -2 до -2,9 z |
-3z или ниже |
|
ИМТ для соответствующего возраста, z-оценка |
От -1 до -1,9z |
От -2 до -2,9 z |
-3z или ниже |
|
Длина/рост для соответствующего возраста, z-оценка |
Нет данных |
Нет данных |
-3z или ниже |
|
Окружность плеча в средней трети |
От -1 до -1,9z |
От -2 до -2,9 z |
-3z или ниже |
БЭН определяется по продолжительности (острая, <3 месяцев; хроническая,> 3 месяцев) и степени тяжести (легкая, умеренная, тяжелая). У пациента с хроническим заболеванием и хронической БЭН, может присоединиться острая БЭН при интеркуррентном инфекционном заболевании, хирургическом вмешательстве или «обострении» заболевания.
Классификация КВБ в целом у детей не разработана, однако имеется классификация отдельных ее проявлений (АГ, недостаточности кровообращения) (Таблица 6, 7, 8).
Таблица 6. Классификация АГ [70].
|
Категория АД |
0-15 лет, перцентили САД и/или ДАД |
≥16 лет САД и/или ДАД, мм рт. ст. |
|---|---|---|
|
Нормальное |
<90-го перцентиля |
<130/85 |
|
Высокое нормальное |
От 90-го до 95-го перцентиля |
130-139/85-89 |
|
Гипертензия |
>95-го перцентиля |
>140/90 |
|
Гипертензия 1 степени |
От 90 до 95-го перцентиля + 5 мм рт. ст. |
140-159/90-99 |
|
Гипертензия 2 степени |
> 95-го перцентиля + 5 мм рт. ст. |
>160/100 |
|
Изолированная систолическая гипертензия |
САД >95-го перцентиля и ДАД < 90-го перцентиля |
>140/<90 |
Таблица 7. Классификация сердечной недостаточности у детей по Н.А.Белоконь (1987) [71].
|
Стадия |
Левожелудочковая недостаточность |
Правожелудочковая недостаточность |
|---|---|---|
|
I |
Сердечная недостаточность отсутствует в покое и появляется после нагрузки в виде одышки и тахикардии |
|
|
IIA |
ЧСС увеличена на 15-30% в 1 мин. ЧДД увеличена на 30-50% |
Печень выступает на 2-3 см из-под края реберной дуги |
|
IIB |
ЧСС увеличено на 30-50% в 1 мин. ЧДД увеличено на 50-70% Возможен акроцианоз, навязчивый кашель, мелкопузырчатые хрипы |
Печень выступает на 3-5 см из-под края реберной дуги, возможна пастозность, набухание шейных вен |
|
III |
ЧСС увеличено на 50-60% в 1 мин. ЧДД увеличено на 70-100% Клиническая картина предотека легких |
Гепатомегалия, отечный синдром, гидроперикард, асцит |
Таблица 8. Классификация функциональных классов хронической сердечной недостаточности по Ross R.D [71, 73].
|
Класс |
Интерпретация |
|---|---|
|
I |
Нет симптомов |
|
II |
Небольшое тахипноэ или потливость при кормлении у грудных детей. Диспноэ при нагрузке у старших детей |
|
III |
Выраженное тахипноэ или потливость при кормлении у грудных детей. Удлиненное время кормления. Задержка роста вследствие сердечной недостаточности. Выраженное диспноэ при нагрузке у старших детей. |
|
IV |
В покое имеются такие симптомы как тахипноэ, втяжение мышц, «хрюканье», потливость |
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Хотя концепция ХБП у детей аналогична концепции у взрослых, педиатрическая ХБП имеет некоторые особенности, меньше доказательств и много факторов, которые до конца не изучены.
В детском возрасте основной причиной ХБП являются врожденные заболевания почек. Причины детской ХБП также зависят от возраста и страны проживания. Наиболее частыми этиологическими факторами неонатальной ХБП являются: гипоплазия / дисплазия почек, клапан задней уретры и другие врожденные аномалии почек и мочевыводящих путей. Другая этиология включает поликистоз почек, кортикальный некроз и тромбоз почечных сосудов [13]. Антенатальные детерминанты ВАРМС разнообразны и включают мутации в генах, ответственных за нормальный нефрогенез. Крупные когортные исследования показывают, что варианты числа копий, геномные мутации или мутации de novo могут объяснить до одной трети всех случаев ВАРМС [108]. Доказано влияние изменений окружающей среды матери и плода, обструкция в нормально развивающихся мочевыводящих путях [318, 319, 320].
Почки и пути оттока мочи начинают формироваться на 3-й недели внутриутробного развития и заканчиваются на 36-й. Поэтому чувствительность к факторам риска окружающей среды, которые влияют, нарушая развитие на протяжении всей беременности очень высокая [320, 321].
Наиболее частыми причинами развития ХБП в Италии и странах Северной Америки по данным регистра NAPRTCS (North American Pediatric Renal Transplant Cooperative Study) являются:
-
Врожденные аномалии почек и мочевых путей (ВАРМС), которые составляют 60% случаев ХБП у детей. Гломерулярные причины составляют от 10-20% детей с ХБП в зависимости от географического положения. Поражение клубочкового аппарата в основном встречается у детей старше 12 лет, что составляет 45% случаев пациентов с ХБП в Соединенных Штатах Америки, где наиболее частым гломерулярным заболеванием остается фокальный сегментарный гломерулосклероз (ФСГС), встречающийся в 9% у детей европеоидной расы и в 1/3 случаев среди афроамериканцев-подростков. Также причинами ХБП у детей могут быть гемолитико-уремический синдром, вторичные гломерулярные заболевания (например: системный волчаночный нефрит). В отличие от взрослых диабетическая нефропатия и гипертония являются редкими причинами ХБП у детей.
-
Другие заболевания составляют 20-30% всех случаев ХБП у детей и включают в себя: генетически детерминированную патологию (цистиноз, оксалоз, наследственный нефрит), интерстициальный нефрит [14, 15].
В ряде случаев этиология ХБП остается нераспознанной. Ожирение у детей – новая проблема во всем мире. Недавние исследования идентифицировали раннее нарушение функции почек и риск развития ХБП у детей с избыточной массой тела [16, 17]. Кроме того, младенцы с низкой массой тела при рождении и маловесные для гестационного возраста имеют повышенный риск развития терминальной стадии ХБП в подростковом возрасте [18, 19]. По мере роста проблемы детского ожирения и старения населения с низкой массой тела при рождении мировое сообщество может столкнуться с потенциальным сдвигом в эпидемиологии детской ХБП.
Терминальная стадия ХБП. Гломерулярные нарушения составляют большую долю основных причин у детей с терминальной стадией болезни почек (ESKD). Это связано с быстрой скоростью прогрессирования ХБП у пациентов с нарушениями клубочковой функции в сравнении с больными, имеющими негломерулярные причины.
Согласно ежегодному отчету системы данных почек США (USRDS) за 2017 год, основными причинами ХПН у пациентов в возрасте от 0 до 21 лет в 2011-2015 годах, как и в предыдущие годы, были врожденные аномалии почек и мочевыводящих путей (ВАРМС, 22%), первичные гломерулярные заболевания (21,8%), кистозные/наследственные/врожденные нарушения (12,5%) и вторичные гломерулярные заболевания/васкулиты (10,7%). Наиболее частые индивидуальные диагнозы, связанные с терминальной стадией ХБП у детей, включали очаговый сегментарный гломерулосклероз (11,6%), гипоплазию / дисплазию почек (10%), врожденные обструктивные уропатии (9,7%) и системную красную волчанку (6,3%) [20].
Неадекватное питание – хорошо известная причина плохого роста у детей с ХБП. БЭН ассоциируется с прогрессированием уремических симптомов, приводит к белково-энергетическому истощению и увеличению летальности у этой категории пациентов. В исследовании CS Wong et al. продемонстрировано, что для каждого стандартного отклонения z-score снижения роста у детей с ХБП по сравнению со здоровыми детьми, риск смерти повышается на 14% [21].
БЭН ассоциируется не только с повышением риска госпитализации и смертности у детей, но также со снижением эластичности артерий с потенциальным риском кардиоваскулярной патологии и снижением концентрации 25-ОН витамина Д. Большие исследования, такие как, Kidney Disease Outcomes Quality Initiative (KDOQI) рекомендуют проведение ранней, интенсивной нутритивной поддержки у детей с ХБП. Ряд исследований у младенцев с ХБП показали значительное увеличение скорости роста при обеспечении адекватной энергетической ценности питания, что обеспечивалось кормлением через назогастральный зонд или гастростому. Таким образом, обеспечение адекватного питания является одним из важнейших аспектов лечения ребенка с хронической болезнью почек.
БЭН, связанная с заболеванием, имеет несколько возможных механизмов: снижение потребления пищи, повышение потребности в нутриентах, увеличение потерь нутриентов и нарушение их использования организмом. Важная роль в развитии БЭН, связанной с заболеванием, принадлежит воспалению. Воспаление рассматривается в новом качестве, так как может являться причиной БЭН, а также вносить вклад как один из механизмов формирования БЭН. Воспаление может влиять на аппетит и нарушать усвоение нутриентов, итоговый эффект зависит от того, является ли воспаление острым (классическое воспаление) или вялотекущим хроническим (метавоспаление) [22].
Причины БЭН у детей с ХБП:
-
Плохой аппетит, может быть связан с изменениями вкусовых ощущений, приемом большого количества лекарств, предпочтением воды у детей с полиурией; повышением циркулирующих цитокинов, таких как лептин, ФНО-á (фактор некроза опухоли á), IL-1 (интерлейкин-1) и -6, которые действуют через гипоталамус, влияя на аппетит и чувство сытости.
-
Рвота, связанная с гастро-эзофагальным рефлюксом и задержкой опорожнения желудка в связи со снижением клиренса полипептидных гормонов.
-
Нарушение абсорбции нутриентов питания, связанное с уремическим повреждением интестинального эпителия и нарушением микробиома.
-
Присоединение острой БЭН в связи с эпизодами интеркуррентных инфекций, хирургических вмешательств и т.д.
-
Ассоциированные коморбидные состояния, влияющие на питание [3, 23].
Анемия – частое осложнение у детей с ХБП, возникновение и тяжесть которого которого увеличивается по мере прогрессирования заболевания. Анемия связана с развитием осложнений, включая увеличение частоты госпитализации и смертности, а также прогрессирования факторов риска сердечно-сосудистых заболеваний, таких как как гипертрофия левого желудочка (ГЛЖ) [24, 25].
Основной причиной анемии является нарушение образования эритропоэтина (ЭПО) перитубулярными фибробластами коркового слоя почек [26].
Причинами анемии при ХБП у детей также являются:
-
Железодефицитный эритропоэз (абсолютный дефицит Fe, функциональный дефицит Fe, нарушение метаболизма Fe).
-
Воспаление и блокирование железа гепсидином.
-
Хронические потери крови (частые венепункции, потери в гемодиализном контуре, потери через ЖКТ, менструальные потери).
-
Уремия и оксидативный стресс.
-
Гиперпаратиреоз и миелофиброз.
-
Дефицитные состояния (витамин В12, фолиевая кислота, карнитин, витамин С).
-
Лекарственные средства (ингибиторы ангиотензин превращающего фермента (иАПФ), неприверженность к терапии анемии, лекарственная токсичность, красноклеточная аплазия костного мозга).
Среди механизмов развития анемии при ХБП описан гепсидин-опосредованный, который блокирует доступность железа для эритропоэза на различных этапах, от абсорбции железа энтероцитами до высвобождения депонированного железа в костном мозге [27].
Циркулирующий ЭПО регулирует пролиферацию эритроидного ростка, действует как фактор роста, способствующий созреванию эритроцитов. Первичный стимул для экспрессии ЭПО - гипоксия, образование ЭПО повышается гипоксия-индуцибельным фактором транскрипции, который контролирует ген ЭПО. Образование ЭПО при ХБП снижается как за счет разрушения перитубулярных фибробластов и нарушения регуляции почечного кислород - чувствительного механизма, так и за счет нарушения тубулярной реабсорбции натрия в дистальных канальцах при снижении СКФ, которое является сигналом для подавления образования ЭПО. Уровень ЭПО у пациентов с ХБП обычно нормальный или незначительно увеличенный, но у пациентов с нормальной функцией почек и анемией уровень ЭПО повышается от 10 до 100 раз [28].
Развитие ХБП в детском возрасте может привести к выраженной задержке конечного роста у пациентов. Установлено, что при ХБП 3в-5 ст. отставание в росте имеет 50% детей. При нелеченной ХБП, обусловленной врожденной патологией, задержка роста может наблюдаться уже в течение первых двух лет жизни, так как период младенчества характеризуется наиболее высокой скоростью роста. Здоровые младенцы достигают 50% ростового потенциала к двум годам жизни, таким образом, ХБП в раннем возрасте может оказать важное влияние на конечный рост. В период с 3 до 10 лет у здоровых детей наблюдается приблизительно постоянная скорость роста 5-7 см/год. Это, главным образом, зависит от гормона роста (ГР) и гормонов щитовидной железы. За 2-3 года до пубертата скорость роста падает непропорционально у больных с ХБП. Начало пубертатного ростового скачка задерживается, а его амплитуда снижается, приводя к дальнейшей потере ростового потенциала.
Причины задержки роста могут быть разнообразными:
-
генетические факторы (рост родителей, пол, синдромы),
-
недоношенность,
-
физическое развитие, не соответствующее гестационному возрасту,
-
необходимость в интенсивной терапии при рождении,
-
сопутствующие заболевания (системная патология, генетические синдромы: Шимке, Барде-Бидля и Галлоуэя-Моуата),
-
лечение глюкокортикоидами.
Также факторами, влияющими на процессы роста, являются: дефицит белка и калорий, водно-электролитные потери при полиурии и сольтеряющих состояниях, метаболический ацидоз, анемия, МКН-ХБП и резистентность к гормонам, опосредующим рост ребенка [29, 30, 31, 32].
Анаболический эффект ГР на уровне тканей реализуется через инсулиноподобный фактор роста 1 (ИФР-1). ХБП – это состояние нечувствительности к ГР, которое характеризуется дефицитом функционального ИФР-1 из-за снижения экспрессии рецептора ГР в органах-мишенях, таких как печень, и нарушения передачи сигналов рецептора ГР через Янус-киназу 2, являющейся сигнальным преобразователем и активатором пути транскрипции 5 из-за индуцированного воспалением супрессора экспрессии передачи сигналов цитокинов и повышенной способности ИФР в условиях избытка ИФР-связывающих белков [33]. Снижение гипоталамического высвобождения гонадотропин-рилизинг гормона при уремии связано с факторами ингибирования – ангиотензин II и лечение глюкокортикоидами, что может привести к снижению циркулирующего биоактивного лютеинизирующего гормона, гипогонадизму и снижению роста в пубертатном периоде. В начале половой зрелости профиль ГР/ИФР-1 активизируется увеличением секреции половых гормонов – эстрогенов и тестостерона у девочек и мальчиков, соответственно. Начало половой зрелости задерживается у подростков с ХБП, пиковая скорость роста отсрочена приблизительно на 2,5 года. Пубертатный скачок роста запаздывает, уменьшается и связанная с ним скорость роста, что обусловлено сокращением времени ростового скачка. Пубертатное увеличение роста у детей с ХБП составляет приблизительно 65% от пубертатного скачка роста у здоровых детей [34]. Следовательно, отставание в росте при ХБП обусловлено, главным образом, подавлением роста в 2-х периодах: младенческом (когда рост зависит в основном от факторов питания) и пубертатном (зависимом от половых гормонов).
Ключевым фактором формирования и прогрессирования МКН-ХБП является развитие нефросклероза за счет снижения количества функционирующих нефронов. Результат этих изменений: снижение экскреции фосфора с мочой, повышение уровня фосфатемии и повышение продукции фактора роста фибробластов 23 (FGF23); снижение синтеза активной формы витамина D (кальцитриола), снижение концентрации кальция крови, повышение паратиреоидного гормона (ПТГ). Повышение уровня фосфора и снижение кальция крови – ключевые пусковые факторы изменения гомеостаза костной ткани при ХБП. Паратиреоидный гормон является центральным и ведущим в механизме регуляции уровня кальция в организме: нормокальциемия важна для обеспечения нормальных витальных функций (прежде всего сердечно-сосудистой и центральной нервной систем). Длительная гиперфункция паращитовидной железы приводит к ее гипертрофии и гиперплазии с формированием аденомы. Непрерывная стимуляция костного обмена на фоне гиперпаратиреоза ведет к нарушению моделирования структуры кости, нарушению ее прочности с последующим формированием деформаций и переломов. Помимо патологических изменений костной ткани при вторичном нефрогенном гиперпаратиреозе развивается такое патологическое состояние, как кальцификация сосудистых стенок, структур миокарда и различных мягкотканных структур [35].
Современная концепция патогенеза МКН-ХБП включает в себя также сравнительно новые биомаркеры, регуляторы и механизмы, такие как: фактор роста фибробластов 23 (FGF23) – один из самых ранних биомаркеров; пептид, секретируемый остеокластами и остеобластами, который регулирует метаболизм фосфатов и витамина D, напрямую ингибирует секрецию ПТГ; рецепторы FGF23; Klotho (трансмембранный белок, необходимый для активации рецептора FGF23 в органах-мишенях: почка и паращитовидная железа); рецептор витамина D (VDR); кальций-чувствительный рецептор (CaSR); склеростин; субкарбоксилированный остеокальцин. Проведенные исследования у детей и взрослых показали повышенный уровень FGF23 в сыворотке крови и повышенную экспрессию FGF23 в костях на ранних стадиях ХБП, когда уровень фосфора, кальций и ПТГ остаются еще в пределах нормы [36, 37, 38, 39, 40]. FGF23 можно считать чувствительным скрининговым тестом для выявления МКН-ХБП на ранних этапах. Дефицит кальцитриола также стимулирует секрецию ПТГ через активацию VDR в паращитовидных железах и косвенно способствует развитию гипокальциемии, которая является еще одним сильным стимулом для секреции ПТГ [41, 42]. Снижение концентрации кальция в сыворотке также мощный стимул для секреции ПТГ, что, связано со сниженной экспрессией CaSR в клетках паращитовидных желез [43]. Стойкая гипореактивность VDR и снижение экспрессии CaSR приводят к гиперплазии паращитовидных желез и развитию третичного гиперпаратиреоза [44].
Патофизиологические аспекты МКН-ХБП представлены сложным каскадом событий, включающих взаимодействия почки, паращитовидной железы, кости, кишечника, сердечно-сосудистой системы.
Специфические аспекты костного метаболизма у детей включают не только непрерывное костное ремоделирование, сочетающее процессы остеобластические и резорбтивные, но и непрерывный высокодинамичный процесс продольного роста скелета до закрытия ростовой пластинки, что существенно усложняет понимание минерального и костного гомеостаза у ребенка с ХБП. Нарушение роста ребенка – одно из основных проявлений МКН-ХБП. При этом достижение нормального конечного роста является серьезной проблемой для каждого пациента с ХБП.
В развитии КВБ у детей с ХБП играют роль как традиционные факторы риска, так и факторы, обусловленные снижением почечной функции. К первым относятся артериальная гипертензия, гиподинамия, ожирение, гипер- и дислипидемия, нарушения углеводного обмена; ко вторым – активация РААС, нарушения фосфорно-кальциевого обмена, хроническое воспаление, эндотелиальная дисфункция, оксидативный стресс, гиперволемия вследствие задержки натрия и воды, анемия [12, 45].
Основным фактором прогрессирования ХБП и КВБ является артериальная гипертензия. АГ возникает вследствие повышения сосудистого тонуса (чему способствует активация РААС, оксидативный стресс, провоспалительные цитокины, провоцирующие эндотелиальную дисфункцию) и увеличения ОЦК (к чему приводит задержка натрия и воды, обусловленная заболеванием почек и/или активацией РААС).
Нарушения фосфорно-кальциевого обмена при ХБП (гиперпаратиреоз, гиперфосфатемия, повышение уровня FGF23, остеокальцина, а также снижение активности ингибиторов кальцификации) помимо нарушения структуры костной ткани способствуют ремоделированию сосудистой стенки: утолщению интимы-медии, фиброзу, а затем кальцинозу мышечного слоя стенки артерий (в том числе коронарных), гипертрофии и кальцинозу миокарда ЛЖ. В результате ремоделирования снижается эластичность артерий и их способность смягчать пульсовые колебания скорости кровотока, повышается их жесткость (stiffness), увеличивается скорость распространения пульсовой волны [46]. Нарастание периферического сосудистого сопротивления усугубляет АГ, которая в свою очередь приводит к дальнейшей перестройке мышечного слоя артерий и прогрессированию гипертрофии миокарда.
Гипертрофия миокарда ассоциирована со снижением плотности капилляров, что способствует ишемии. Ишемия провоцирует апоптоз миокардиоцитов, накопление межклеточного матрикса и фиброз миокарда, что, в свою очередь, усугубляет ишемию. Гипертрофии и фиброзу миокарда способствует также повышенный уровень ангиотензина II и альдостерона [47].
По мере прогрессирования ХБП вышеуказанные нарушения усугубляются, достигая максимальной выраженности на диализной стадии. Длительное, синергическое воздействие факторов риска приводят к выраженной гипертрофии и/или дилатации ЛЖ, диастолической, а затем и систолической дисфункции. Возникает недостаточность кровообращения, значительно возрастает риск нарушений сердечного ритма, ишемических атак, которые в итоге могут стать причиной смерти ребенка с ХБП 5 ст. [12, 46].
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
В литературе данные о распространенности ХБП среди детей немногочисленны. Истинная частота ХБП в детском возрасте не известна, может достигать 1% в детской популяции [48]. Неонатальная ХБП встречается примерно у 1 из 10 000 живорожденных, тогда как частота терминальной стадии в этом возрасте составляет около 7,1 на миллион возрастного населения [13]. В различных странах мира ХБП варьирует от 2 до 16 на 1 млн. детского населения/год. Большая часть детей остается без диагноза до взрослого возраста. По данным национальных регистров: частота детей, нуждающихся в ЗПТ от 9-10 новых случаев на млн. детского населения в год (Великобритания, Австралия и Новая Зеландия) до 15 – в США [15, 49, 50].
12591 детей с поправкой на возраст, пол и расовую / этническую принадлежность. Средний возраст детей с ХБП соответствовал 6 (1-13) годам. Частота встречаемости у детей до 1 года составила 20,2%, в возрасте 1-3 лет – 17,8%, 4-6- лет – 12,0%, 7-10 лет – 14,8%, 11-14 лет – 15,2%, 15-17 лет – 19,9%. При этом ХБП 1-2 ст. диагностирована у 20,0% пациентов, ХБП 3а и 3б ст. – у 9,1% и 4,0%, ХБП 4 ст. – в 1,5% случаев, ХБП 5 ст. (без диализа) – 0,7%. В 64,7% случаев диагностирована ХБП с неуточненной стадией [51].
Распространенность ХБП у детей в странах Европейского Союза колеблется от 55–60 до 70–75 случаев на миллион населения в Испании и Италии, в зависимости от клинического определения ХБП, которое использовалось в каждом исследовании [15]. Между тем, в странах Ближнего Востока (Кувейт) и Юго-Восточной Азии (Бруней-Даруссалам) распространенность ХБП значительно выше и составляет 329 и 736 случаев на миллион населения [15, 52]. По данным Сербского педиатрического регистра распространенность ХБП 2–5 ст. составляет 96,1 случаев на миллион населения [53]. Высокая распространенность ХБП в странах Ближнего Востока и Юго-Восточной Азии может быть объяснена большим количеством наследственных заболеваний в одной семье.
Развитие терминальной стадии ХБП в детском возрасте было стабильным в течение последних 30 лет во всем мире, но распространенность увеличивалась вместе с частотой случаев диализа и реципиентов почечного трансплантата [8, 54].
Распространенность и заболеваемость ХБП 1-4 ст. у детей РФ не установлена. Распространенность ХБП 5Д составляет 20,2:1000 000 населения. На 31.12.2015 г. в РФ было зарегистрировано 626 детей, получающих ЗПТ (перитонеальный диализ (ПД), гемодиализ (ГД), трансплантация почки (ТП)): на ГД – 6,06 пациентов/млн. детского населения, для ПД – 5,0 пациентов/млн., для трансплантации почки – 9,13 пациента/млн. [55].
Выявление и регистрация международных данных об эпидемиологии детской ХБП является сложной задачей. Сообщаемое количество детей с ХБП, вероятно, занижено, поскольку ранние стадии заболевания обычно протекают бессимптомно. Кроме того, может иметь место неполное предоставление данных из-за дефицита медицинских услуг в районах с ограниченными ресурсами. В результате трудно сравнивать показатели детской ХБП во всем мире из-за разнообразия доступных ресурсов здравоохранения как для ухода за детьми с ХБП, так и для отслеживания и сбора точных популяционных данных и использования различных описаний. Кроме того, опубликованная информация часто основана на отчетах из крупных справочных центров, и неясно, действительно ли эти данные отражают популяционные риски.
Популяционные оценки умеренной и тяжелой ХБП или терминальной стадии почечной недостаточности у детей, которым требуется заместительная почечная терапия (ЗПТ), рассчитывались по средней годовой заболеваемости на миллион возрастного населения и варьировали следующим образом:
-
Европа – 11,9 случаев.
-
Латинская Америка – от 2,8 до 15,8 случаев.
-
В странах Африки к югу от Сахары, где ресурсы здравоохранения наиболее ограничены, был отмечен самый низкий опубликованный уровень ХБП по результатам одноцентровых исследований и колебался от 1 до 3 случаев.
Представленные данные по распространению ХБП, требующей использования ЗПТ, варьирует из-за разного уровня доступности ЗПТ для детей в странах, представивших отчеты: Новая Зеландия – 18 случаев, США – 15,5, Западная Европа и Австралия – 9,5, Россия – <4 случаев.
Подводя итоги исследований, изучающих распространенность ХБП у госпитализированных детей (от 0,3 до 1 случая на 10 000 детей), а также результатов нескольких популяционных исследований, которые выявляют более высокую распространенность ХБП (от 1 до 10 случаев на 1000 детей), в настоящее время общее число детей и подростков, страдающих ХБП 2–5-й стадий, во всём мире превышает 2 миллиона случаев ХБП при общей численности детского населения в 2 миллиарда человек [322].
Расовые, половые и возрастные различия. Данные реестра Североамериканских педиатрических исследований почек и совместных исследований (NAPRTCS) и реестра диализа и трансплантации Австралии и Новой Зеландии сообщили о повышенном риске ХБП у этнических меньшинств.
В Северной Америке частота ХБП у афроамериканцев в два-три раза выше, чем у детей европеоидной расы. В Австралии и Новой Зеландии дети коренной национальности (например, аборигены и маори) имеют более высокий риск ОПП и некоторых типов ХБП. Показатели терминальной стадии ХБП среди коренного населения по сравнению с некоренным населением аналогичны в возрасте до 14 лет, но значительно возрастают после 15 лет.
У афроамериканцев генотип аполипопротеина L1 (APOL1) может объяснять повышенный риск ХБП. Генотип высокого риска для APOL1 (гомозиготный по аллелям риска «G1» или «G2» или гетерозиготности соединения G1G2) связан с повышенным риском развития гломерулярной болезни, особенно фокально-сегментарного гломерулосклероза (ФСГС), по сравнению с таковыми с генотип низкого риска (имеющий 0 или 1 аллель риска). В объединенном анализе Хронической болезни почек у детей (CKiD) и Сети исследований нефротического синдрома (NEPTUNE) 104 детей с гломерулярной болезнью и афроамериканским происхождением, дети с генотипом высокого риска испытали более быстрое снижение функции почек с течением времени по сравнению с группой детей с генотипом низкого риска.
Заболеваемость и распространенность ХБП у детей выше у лиц мужского пола. Повышенный риск ХБП у мужчин связан с более высокой частотой врожденных аномалий почек и мочевыводящих путей (ВАРМС), включая обструктивную уропатию, дисплазию почек, гипоплазию почек и синдром сливового живота.
Пациенты с ХБП обращаются за помощью в детстве. В базе данных хронической почечной недостаточности (CRI) NAPRTCS, которая содержит сведения о более 7000 пациентов с ХБП, возрастное распределение на момент выявления ХБП было следующим: <12 месяцев – 15%, от 12 до 23 месяцев – 5,2%, от 2 до 6 лет – 15,7%, от 6 до 13 лет – 32,1%, от 13 до 18 лет – 28,3%, от 18 до 21 года – 3,7%.
ХБП является исходом любого почечного и внепочечного заболевания, а формирование ХБП происходит в рамках патогенеза предшествующего заболевания.
Частота БЭН среди детей с ХБП 5 ст. широко распространена и варьирует от 20 до 80%. Это патологическое состояние ведет к потере мышечной массы, жировой массы, замедлению роста со снижением величины конечного роста [56]. Приблизительно у 40% детей с терминальной стадией ХБП имеют меньший конечный рост (ниже третьего перцентиля) по сравнению со здоровыми людьми того же возраста и пола контрольной группы [57, 58].
Данные многоцентровых исследований показывают, что у 73% детей с ХБП 3 ст., 87% – 4 ст., и 93% – 5 ст. диагностируется анемия (NAPRTCS) [59].
Нарушение роста, встречающееся у 35% детей с ХБП 2-4 ст. является наиболее трудной для лечения и самой серьезной психологической проблемой [5]. По данным J. Harambat et al., 43% пациентов с терминальной стадией почечной недостаточности (ESRD) в детстве не достигают нормального роста взрослого человека [58]. Более того, реальное назначение соматропина** детям с задержкой роста с ХБП невелико [60]. По данным регистра CKiD у детей с низким ростом до трансплантации время выживания трансплантата после трансплантации почки на 40% меньше [61].
Артериальная гипертензия (АГ) регистрируется, в зависимости от стадии, у 40-80% детей с ХБП, с максимальной распространенностью среди пациентов на ЗПТ. В этой же популяции чаще всего выявляются такие маркеры кардиоваскулярной болезни, как гипертрофия миокарда ЛЖ (до 92%), утолщение интимы-медии внутренней сонной артерии (до 89%), кальцификация коронарных артерий (до 20%) [10, 12, 46].
По данным Европейского общества детской нефрологии и Европейской почечной ассоциации – Европейской ассоциации диализа и трансплантологии (ESPN / ERA-EDTA), распространенность педиатрической ЗПТ в 2012 году в Европе составила 27,9 случаев на миллион населения [62].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клинические проявления ХБП зависят от характера заболевания (без поражения клубочков или на фоне гломерулярного заболевания) и наличия либо тяжести почечной недостаточности. Пациенты могут иметь дисморфические особенности или физические проявления, представляющие особенности генетических нарушений, которые связаны с аномалиями почек и ХБП (например, наследственный нефрит и цистиноз).
ХБП должна быть заподозрена у любого ребенка с:
-
ХБП в семейном анамнезе
-
перенесенным ранее ОПП
-
анемией неясного происхождения
-
сывороточным креатинином выше возрастной нормы
-
полиурией и никтурией
-
низким удельным весом мочи
-
персистирующей протеинурией
-
двусторонней патологией почек при антенатальном УЗИ /при ИМС
-
артериальной гипертензией
-
деформациями костей
-
отставанием в росте
Факторами риска ХБП могут быть:
-
перенесенный ранее острый пиелонефрит, ГУС, ПМР
-
эпизод нарушения гемодинамики при обширных хирургических вмешательствах ранее перенесенной ожоговой болезни
-
малая масса тела при рождении и недоношенность
-
ребенок от очень молодой матери / в позднем возрасте, когда у женщины имеется накопленная соматическая патология
-
миелодисплазия / травма пояснично-крестцового отдела позвоночника (при нарушении иннервации органов)
Негломерулярные причины ХБП влияют на тубулоинтерстициальное пространство и в основном состоят из ВАРМС и кистозных заболеваний почек. Примерно 60% детских случаев ХБП вызваны врожденными аномалиями. Как правило, ХБП в этой популяции будет ассоциироваться с малозаметными признаками дисфункции почек на ранней стадии и чаще всего выявляется с помощью визуализации, включая обычное дородовое ультразвуковое исследование, которое выявляет структурные аномалии.
Полиурия, может быть ранней находкой, поскольку многие ВАРМС (например, обструктивная уропатия, двусторонняя дисплазия почек), наследственные заболевания (например, нефронофтиз) и тубулоинтерстициальные расстройства связаны со сниженной концентрационной способностью (например, несахарный почечный диабет). В этих условиях нарушение концентрирующей способности почек обычно предшествует значительному снижению СКФ. Такие пациенты подвержены высокому риску ОПП с острым эпизодом обезвоживания, которое может возникнуть при гастроэнтерите.
Повышение концентрации креатинина в сыворотке с возрастом. Следует подчеркнуть, что пациенты со spina bifida, параличом нижних конечностей или другими заболеваниями, связанными со снижением мышечной массы, могут иметь риск недостаточной диагностики ХБП из-за более низкого уровня креатинина, который завышает значения СКФ.
Плохой рост при ХБП связан с недостаточным питанием, электролитными нарушениями, тубулярным ацидозом и ХБП-МКН.
Дети с гломерулярным заболеванием, являющимся причиной ХБП, часто имеют более выраженные признаки и симптомы заболевания почек:
-
моча цвета чая / цвета «кока-колы» может быть лидирующим симптомом. Появление эритроцитов в моче может указывать на гломерулонефрит. В других случаях микроскопическая гематурия может быть случайной находкой.
-
протеинурия является тесно связанным биомаркером ХБП и может быть признаком основного заболевания клубочков или дисфункции канальцев. Стойкое (≥3 месяцев) повышенное выведение белка с мочой свидетельствует о ХБП.
-
отечный синдром может быть вторичным по отношению к протеинурии нефротического уровня.
-
повышение концентрации креатинина в сыворотке крови с течением времени.
-
артериальная гипертензия.
-
симптомокомплексы специфических проявлений, связанные со вторичным гломерулонефритом, который влияет на функцию почек и приводит к ХБП, например, волчаночный нефрит или гранулематоз с полиангиитом. Клинические проявления могут включать лихорадку, артралгии/ артрит, сыпь и / или легочные симптомы и др.
Клинические данные различаются в зависимости от тяжести дисфункции почек (см. раздел «Диагностика заболевания»):
На ранних стадиях ХБП (С1 и С2) заболевание часто протекает бессимптомно, если нет признаков и/или симптомов, которые являются прямым результатом основных структурных аномалий почек или системных заболеваний с поражением почек. Пациенты, не имеющие симптомов, могут быть идентифицированы по повышенному креатинину сыворотки в зависимости от возраста, отклонениям в анализе мочи (протеинурия, гематурия или нарушение концентрационной способности почек) или выявлению заболевания почек с помощью визуализирующих исследований, включая пренатальное ультразвуковое исследование. У пациентов могут быть признаки анемии и дефицита витамина D. В этот период есть возможность вылечить любую обратимую причину дисфункции почек и предотвратить или замедлить прогрессирование хронического заболевания почек. Начинается просветительская работа, чтобы ребенок и семья могли понять и реализовать меры по предотвращению факторов риска, которые могут ускорить прогрессирование ХБП (например, отказ от нефротоксических препаратов, рецидивирующие инфекции, обезвоживание, ожирение и курение у подростков), и включить меры (например, строгий контроль АД и / или снижение протеинурии), которые могут замедлить процесс.
ХБП легкой и средней степени тяжести (С3a и С3b). У детей, которые прогрессируют до стадий G3a и G3b, могут начаться осложнения, связанные с ХБП. К ним относятся: появление отеков, электролитные нарушения, анемия, АГ, дислипидемия, эндокринные нарушения, нарушение роста, минеральные и костные нарушения и снижение клиренса веществ, обычно выводимых из организма почками (уремия). У таких пациентов лечение сосредоточено на профилактике и лечении этих осложнений. Кроме того, следует избегать факторов риска, описанных выше, для замедления прогрессирования ХБП.
Тяжелая ХБП и терминальная стадия почечной недостаточности (С4 и С5). Пациентов, у которых продолжается прогрессирующее заболевание, необходимо выявлять заблаговременно до того момента, когда потребуется ЗПТ, чтобы обеспечить адекватную подготовку и обучение как пациента, так и его семьи. Подготовка к ЗПТ обычно начинается с ХБП 4 ст., когда СКФ падает ниже 30 мл / мин на 1,73 м2.
Осложнения ХБП
Клиническими проявлениями БЭН являются: неадекватная масса тела на скорректированный возраст, плоская кривая массы тела (недостаточная скорость набора массы тела), неадекватная скорость роста, неадекватное соотношение массы тела к росту, неадекватный индекс массы тела (ИМТ), задержка развития.
Анемия проявляется рядом симптомов, которые трудно дифференцировать от симптомов уремии. Часто пациент обращается к врачу в связи с симптомами анемии, не зная о заболевании почек (бледность кожных покровов и слизистых оболочек). Клиническими проявлениями анемии при ХБП являются: утомляемость, сонливость, мышечная слабость, одышка, боли в сердце, сердцебиение, тахикардия, повышенная чувствительность к холоду, потеря аппетита, снижение половой функции, дисменорея, нарушение памяти и концентрации.
Основными клиническими проявлениями МКН-ХБП являются: рахитоподобная деформация скелета у детей разных возрастных категорий; чаще это прогрессирующее О-образное или Х-образное искривление нижних конечностей; утолщение метафизарных зон (подобие «рахитических браслетов»); нарушение походки, особенно при заинтересованности тазобедренных суставов («утиная походка»); боли в костях при движении; повторные переломы; эпифизеолизы костей в крупных и средних суставах; нарушение темпов роста ребенка; разрушение костной эмали и потеря зубов, нарушение порядка и темпа прорезывания зубов; признаки трофических нарушений других придатков кожи (сухие, ломкие, плохо растущие волосы и ногти); снижение мышечной силы в руках и ногах; спазмы в икроножных мышцах, карпальный спазм; афебрильные тонические судороги; специфические признаки кожной кальцификации (депозиты кристаллов кальция), ангулярный склерит и выявление депозитов кристаллов кальция в склере.
Клинические проявления КВБ у детей с ХБП зачастую скудные. АГ при постепенном развитии протекает, как правило, бессимптомно и выявляется только при измерении АД. При резком, внезапном повышении АД (гипертоническом кризе) может отмечаться головная боль, головокружение, тошнота и рвота, нарушения зрения (пелена, «мушки» перед глазами), чувство страха, судороги, нарушение сознания. Может отмечаться дискомфорт, чувство перебоев в области сердца, обусловленные нарушениями сердечного ритма с развитием тахикардии, экстрасистолии.
При прогрессировании ХБП и КВБ, развитии вторичной кардиомиопатии, снижении сократимости миокарда ЛЖ присоединяются симптомы недостаточности кровообращения: вялость, утомляемость, снижение толерантности к физическим нагрузкам, потливость, одышка. У детей грудного возраста НК может проявляться беспокойством, вялостью, трудностями при вскармливании, анорексией, рвотой.
Боли в области сердца у детей с ХБП бывают редко, но могут возникать как проявление ишемии миокарда (например, при кальцинозе коронарных артерий).
У детей с ХБП 5 ст., получающих ЗПТ, может наблюдаться внезапное ухудшение состояния, связанное с перегрузкой сердца и декомпенсацией на фоне явной или скрытой гипергидратации: беспокойство, нарастающая одышка, тахикардия, глухость сердечных тонов, «ритм галопа» при аускультации сердца, крепитация в легких. При несвоевременном оказании помощи может развиться альвеолярный отек легких с летальным исходом.
При этом гипергидратация у детей с ХБП 5Д ст. редко проявляется очевидными, распространенными отеками. Чаще отмечается пастозность век, лица и голеней, прибавка массы тела, которую иногда (особенно у детей раннего возраста) трактуют как физиологическую прибавку массы тела.
При физикальном обследовании у ребенка на фоне симптомов ХБП (отставание в росте и физическом развитии, бледность или специфическая пигментация кожи, костные деформации и т.д.) можно выявить симптомы, обусловленные АГ, кардиопатией, недостаточностью кровообращения: тахипноэ или одышку с втяжением уступчивых мест грудной клетки, «сердечный горб»; перкуторно – расширение границ относительной сердечной тупости; аускультативно – изменение звучности тонов сердца (ослабление I тона, акцент II тона на аорте), добавочный 3-й тон («ритм галопа», свидетельствующий об объемной перегрузке сердца), функциональные шумы над областью сердца, тахикардию, экстрасистолию. При тонометрии можно выявить повышенный уровень АД.
Дети с ХБП 5 ст. входят в группу риска по развитию жизнеугрожающих нарушений сердечного ритма (фибрилляции желудочков, асистолии), которые проявляются внезапной бледностью, цианозом, потерей сознания, и требуют реанимационных мероприятий.
Неврологические нарушения включают в себя различные симптомы от судорог и тяжелой умственной отсталости до более тонких нарушений, приводящих к плохой успеваемости в школе. Дети с ХБП имеют более низкие показатели исполнительной функции, вербальной и зрительной памяти, быструю утомляемость по сравнению с населением в целом.
Дети, находящиеся на диализе, имеют более низкие показатели когнитивных функций, чем дети с более легкой формой ХБП. Эта связь может быть частично объяснена влиянием уремии на познание и развитие нервной системы. Кроме того, к осложнениям ХБП относится уремия, включающая в себя такие проявления, как анорексия, тошнота, рвота и другие симптомы. На фоне уремии может возникнуть дисфункция тромбоцитов, перикардит и уремическое кровотечение. Без адекватного лечения уремия может привести к судорогам, коме, летальному исходу.
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Диагноз ХБП устанавливается при наличии структурного или функционального повреждения почек, сохраняющихся в течение, как минимум, трех месяцев. Для постановки диагноза ХБП, по данным KDIGO, необходимо соответствие одному из следующих критериев [6]:
-
СКФ менее 60 мл/мин/1,73м2 в течение 3 месяцев и более независимо от других маркеров ХБП; Hаличие маркеров почечного повреждения, таких как протеинурия/альбуминурия (альбумин/креатинин сыворотки >30 мг/г, стойкие изменения в осадке мочи, изменения почек по данным лучевых методов исследования, патоморфологические изменения по данным биопсии почки.
1. Жалобы и анамнез
См. раздел «Клиническая картина». При сборе жалоб и анамнеза следует обратить внимание на изменение активности ребенка, переносимости физических нагрузок, снижение аппетита, изменение «пищевого» поведения, повторную рвоту, эпизоды головных болей, головокружения, мышечной слабости, болей в костях, в области сердца, одышки, потери сознания или судорог. Необходим детальный анализ пищевого, пренатального и семейного анамнеза; оценка количества, качества и регулярности приема пищи; получение информации относительно сроков начала задержки роста. У всех пациентов с ХБП 4-5 ст. (особенно получающих ЗПТ) необходимо собирать сведения об объеме выпитой и выделенной жидкости, включая диурез и объем ультрафильтрации во время процедур диализа, а также о динамике массы тела.
-
Рекомендуется прием (осмотр, консультация) врача-нефролога первичный всем пациентам с факторами риска ХБП при постановке диагноза с целью своевременного установления диагноза и проведения терапии, направленной на сохранение почечной функции [121, 72].
(УУР С; УДД 5)
Комментарий: факторы риска ХБП см. в подразделе «Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)».
2. Физикальное обследование
При физикальном обследовании ребенка с ХБП следует обратить внимание на следующие показатели:
- Физическое развитие ребенка (масса тела, длина тела/рост, окружность головы).
- Толщина кожной складки.
- Окружность средней трети плеча.
- Цвет кожного покрова (бледность, цианоз, пигментация).
- Наличие отеков.
- Наличие деформаций скелета.
- Видимые изменения области сердца («сердечный горб», пульсация).
- Частота и ритм дыхания, наличие одышки с участием вспомогательных мышц и втяжений уступчивых мест грудной клетки.
- Границы относительной сердечной тупости (перкуторно).
- Характер дыхания при аускультации легких.
- Звучность сердечных тонов, наличие аритмии или «ритма галопа», шумов при аускультации сердца.
3. Лабораторные диагностические исследования
-
Рекомендуется всем пациентам с ХБП исследование кислотно-основного состояния и газов крови с целью диагностики нарушений кислотно-основного состояния крови, контроля в динамике [74].
(УУР С; УДД 4)
Комментарий: Частота исследований в динамике определяется клинической ситуацией. Нарушение кислотно-основного состояния крови проявляется метаболическим ацидозом, который прогрессирует при снижении СКФ. У детей на поздних стадиях ХБП развивается метаболический ацидоз с высокой анионной разницей, когда способность почек выводить органические кислоты становится ограниченной. Когда циркулирующие буферы истощаются, кость начинает накапливать избыточные ионы водорода, что приводит к высвобождению кальция из кости. Если не корригировать ацидоз, может развиться остеопенияс задержкой роста, а также повыситься риск вторичного гиперпаратиреоза и прогрессирования ХБП [75]. Метаболический ацидоз при ХБП может способствовать развитию гиперкалиемии, способствовать катаболизму белков и отрицательно влиять на метаболизм в мышцах, стимулировать воспаление и повышать инсулинорезистентность [76]. Текущие руководства KDOQI и KDIGO рекомендуют поддерживать уровень бикарбоната в сыворотке крови у пациентов с ХБП на уровне 22 мэкв/л или выше (20 мэкв/л для детей младше 2 лет) [4, 6].
-
Рекомендуется всем пациентам проведение Общего (клинического) анализа крови развернутого с исследованием эритроцитарных индексов (средний объем эритроцита [MCV] (Определение размеров эритроцитов), среднее содержание Hb в эритроците [MCH], средняя концентрация гемоглобина в эритроцитарной массе [MCHC] (Определение среднего содержания и средней концентрации гемоглобина в эритроцитах)), Исследование уровня лейкоцитов в крови, Дифференцированный подсчет лейкоцитов (лейкоцитарная формула), Исследование скорости оседания эритроцитов (СОЭ), селективно - Исследование уровня ретикулоцитов в крови с целью диагностики анемии при ХБП, контроля в динамике, в т. ч. лечения [77, 78, 79].
(УУР С; УДД 5)
Комментарий: Исследование уровня ретикулоцитов в крови проводится детям с анемией и получающим лечение препаратами группы «Другие антианемические препараты» (эритропоэтины), для контроля эффективности (см. соответствующие клинические рекомендации).
Частота исследований в динамике определяется клинической ситуацией. Для диагностики анемии в детстве используются возрастные значения гемоглобина по данным ВОЗ (см. приложение А3.16). Подробно анемия при ХБП рассматривается отдельно (см. Клинические рекомендации Анемия при хронической болезни почек) [79].
-
Рекомендуется у детей с ХБП без установленного диагноза анемии уровень Hb (Исследование уровня общего гемоглобина в крови) контролировать не реже 1 раза в год у пациентов с ХБП 3 ст., не реже 2-х раз в год у пациентов ХБП 4-5 ст. с целью своевременного выявления анемии [121].
(УУР C; УДД 5)
Комментарий: обычно не реже 1 раза в 3 месяца у тех, кто нуждается в диализе. Частота измерения Hb может определяться клинической ситуацией у пациентов с ХБП.
-
Рекомендуется диагностировать анемию у детей с ХБП, если концентрация Hb ниже 110 г/л у детей от полугода до 5 лет, ниже 115 г/л у детей 5-12 лет и ниже 120 г/л у детей 12-15 лет с целью своевременной коррекции [77].
(УУР С; УДД 5)
Комментарий: У детей без установленного диагноза анемии уровень Hb должен измеряться не реже 1 раза в год у пациентов с ХБП 3 стадии, не реже 2 раз в год у пациентов с 4-5 стадиями ХБП и не реже 1 раза в 3 месяца у пациентов на ЗПТ. Уровень Hb следует чаще измерять по клиническим показаниям и у детей с диагностированной анемией при ХБП. Анемия диагностируется у детей с ХБП, если концентрация Hb ниже 110 г/л у детей от полугода до 5 лет, ниже 115 г/л у детей 5-12 лет и ниже 120 г/л у детей 12-15 лет.
Контроль уровня Hb следует проводить один раз в неделю при подборе дозы ЭСС и переводе с эпоэтина бета** на дарбэпоэтин альфа**, затем один раз в 2 недели, но не реже одного раза в месяц.
У пациентов с преддиализными стадиями ХБП, контроль уровня Hb на фоне поддерживающего лечения ЭСС следует проводить не реже одного раза в 3 месяца. У пациентов, которым проводится гемодиализ, уровень Hb на фоне поддерживающего лечения ЭСС следует проводить не реже одного раза в месяц.
-
Рекомендуется пациентам с ХБП и анемией определить ее причину, независимо от стадии ХБП или потребности в ЗПТ, если уровень Hb составляет <110 г/л (<105 г/л у детей <2 лет) или при развитии симптомов, связанных с анемией (Исследование ферритина крови, Определение коэффициента насыщения трансферрина железом (TSAT), Исследование уровня витамина В12 (цианокобаламин) в крови, Исследование фолиевой кислоты в сыворотке крови) с целью диагностики/дифференциальной диагностики и лечения [80, 323, 324, 346 ].
(УУР C; УДД 5)
Комментарий: Анемия у детей с ХБП может быть обусловлена не только с дефицитом ЭПО. Ферритин сыворотки отражает запасы железа в организме, и его необходимо поддерживать между 100 и 500 мкг/л. Однако это острофазовый белок, поэтому результаты сложно интерпретировать на фоне инфекционного процесса. Рекомендуется одновременно проводить исследование уровня C-реактивного белка в сыворотке крови. Насыщение трансферрина отражает количество железа, доступного для эритропоэза и должно быть >20%. Абсолютный дефицит железа – это общее снижение запасов железа в организме, определяемое при снижении ферритина сыворотки <100 мкг/л. Метаболизм железа нарушается у пациентов с ХБП, в частности, из-за повышенного уровня гепсидина (гормона печени, который предотвращает выход железа из клеток за счет связывания с экспортером железа, ферропортином) [81]. Избыток гепсидина подавляет абсорбцию железа и приводит к секвестрации железа в макрофагах и гепатоцитах, что приводит к функциональному дефициту железа при ХБП [82]. При функциональном дефиците существует потребность в большем количестве железа для поддержания синтеза Hb, чем может высвободиться из депо. Функциональный дефицит железа диагностируется на основании уровня ферритина сыворотки (>100мкг/л), TSAT (<15-20%), количество гипохромных эритроцитов (>5-10% при норме <2,5%). Данные исследования необходимы для оценки статуса обмена железа, диагностики его дефицита и прогнозирования эритропоэтического ответа на терапию железом.
При интерпретации уровня ферритина следует помнить, что данный показатель повышается при воспалительном процессе. Поскольку ферритин является острофазным белком, диагностическое значение следует оцениваться отлично от пациентов, не страдающих хроническим заболеванием почек.
Насыщение трансферрина (TSAT) рассчитывается по формуле:
TSAT = Fe (мкмоль/л) / 2 × трансферрин (мкмоль/л) (%)
Дефицит фолатов и витамина В12 – нечастая, но важная корректируемая причина анемии, обычно сочетающейся с макроцитозом, у пациентов с ХБП.
-
Рекомендуется всем пациентам с ХБП/признаками ХБП проведение анализа крови биохимического общетерапевтического (Исследование уровня креатинина в крови, Исследование уровня мочевины в крови, Исследование уровня холестерина в крови, Исследование уровня триглицеридов в крови, Исследование уровня холестерина липопротеинов высокой плотности в крови, Исследование уровня липопротеинов в крови, Исследование уровня холестерина липопротеинов низкой плотности, Исследование уровня фосфолипидов в крови, Исследование уровня калия в крови, Исследование уровня натрия в крови, Исследование уровня общего кальция в крови, Исследование уровня неорганического фосфора в крови, Определение активности щелочной фосфатазы [78].
(УУР С; УДД 5)
Исследование уровня общего белка в крови [88].
(УУР С; УДД 4)
Исследование уровня альбумина в крови [87].
(УУР В; УДД 3)
Исследование уровня мочевой кислоты в крови [89, 325].
(УУР С; УДД 4)
Исследование уровня общего билирубина. Исследование уровня билирубина связанного (конъюгированного) в крови, Исследование уровня билирубина свободного (неконъюгированного) в крови [86, 325, 326].
(УУР В; УДД 3)
Определение активности аспартатаминотрансферазы в крови, определение активности аланинаминотрансферазы в крови [83, 327, 328, 329].
(УУР С; УДД 5)
Исследование уровня хлора в крови [4, 330].
(УУР С; УДД 4)
Исследование уровня глюкозы в крови [89].
(УУР С; УДД 4)
Исследование уровня С-реактивного белка в крови [84, 90].
(УУР В; УДД 2)
Для оценки степени выраженности азотемии, выявления электролитных нарушений, нарушений белкового обмена, обмена железа, кальций-фосфорного обмена, гиперлипидемии с целью диагностики прогрессирования почечного процесса, осложнений ХБП, контроля в динамике в процессе лечения [4, 78, 83, 84, 85, 86, 87, 88, 89, 90].
(УУР С; УДД 5)
Комментарий: Частота исследований в динамике определяется клинической ситуацией. Мочевина и креатинин сыворотки крови обычно используются в качестве маркеров почечной дисфункции, но накопление уремических токсинов лишь частично коррелирует со СКФ у детей с ХБП [91]. Термин «азотемия» используется для обозначения присутствия «уремических токсинов», тогда как термин «уремия» обычно относится к клиническим проявлениям азотемии. ХБП часто связана с нарушениями минерального и костного обмена, которые могут проявляться изменением метаболизма кальция и фосфора [92]. Уровень общего белка и альбумина могут быть снижены как проявления нарушений нутритивного статуса, так и течения хронического заболевания почек, приведшей к ХБП. В настоящее время альбумин и преальбумин больше не считаются значимыми биомаркерами для диагностики БЭН. Негативные отклонения белков острой фазы, таких как альбумин, преальбумин и трансферрин, не отражают изменений нутритивного статуса и зависят от выраженности воспаления, водно-электролитного баланса и других факторов. Из-за потери массы нефронов ХБП часто приводит к неадекватной почечной экскреции калия. Гиперкалиемия является общепризнанным фактором риска аритмий и остановки сердца и предсказуемо ведет к более высокой смертности [93, 94]. Повышение концентрации СРБ в крови при ХБП может свидетельствовать о течении инфекционного процесса и поражении миокарда. Однако остается неизвестным, влияет ли дислипидемия у детей с ХБП на сердечно-сосудистую заболеваемость и смертность. KDIGO рекомендует диетические меры и контроль массы тела в качестве первой линии лечения дислипидемии у детей. Из-за очень ограниченного количества доступных данных не рекомендуется использовать гиполипидемические средства (статины) у детей с ХБП в возрасте до 10 лет [95].
-
Рекомендуется всем пациентам с ХБП/признаками (угрозой) ХБП оценивать СКФ на основе сывороточного креатинина и переменной роста по «прикроватной» («bedside») формуле Шварца (2009) и формуле Шварца-Лиона (2012) с целью диагностики или мониторинга ХБП, а также оценки прогноза в клинической практике [6, 96, 97, 98, 99, 100, 101, 102].
(УУР В; УДД 3)
Комментарий: СКФ является показателем функции почек и определяется как количество плазмы, фильтруемой почками в течение определенного периода времени (обычно одной минуты). Здоровые дети младше 2 лет имеют физиологически более низкую СКФ. СКФ равна сумме скоростей фильтрации всех функционирующих нефронов и, следовательно, коррелирует с количеством функционирующих нефронов. Здоровые почки обладают значительным резервом для поддержания адекватной СКФ в различных физиологических условиях. Обладая огромным биологическим преимуществом, функциональный «избыток» нефронов затрудняет клиническую оценку ранних стадий ХБП. Это связано с тем, что непораженные нефроны способны компенсировать поврежденные нефроны. Может возникнуть гипертрофия оставшихся нефронов, что приведет к частичному восстановлению СКФ. Следовательно, нет линейной корреляции между потерей нефронов и потерей СКФ [103, 104]. Секреция канальцевого креатинина увеличивается при снижении СКФ. Следовательно, клиренс креатинина может завышать СКФ у детей с ХБП. Другие ограничения сывороточного креатинина как маркера функции почек включают его зависимость от мышечной массы и физической активности. Многие физиологические вещества и лекарства мешают анализу креатинина [105].
Традиционно используемая формула Шварца (1976) и Кунахана-Баррата, (1976) которая рассчитывалась на основе креатинина, измеренного нестандартизированным методом Яффе, приводит к завышению значений рСКФ. Использование в оригинальной формуле Шварца (1976) креатинина, измеренного с помощью методик, стандартизированных по тандемной масс-спектрометрии с изотопным разбавлением – IDMS (isotope dilution mass spectrometry) приводит к завышению истинной СКФ на 20-40% [107].
Для исключения неточностей при оценке СКФ следует использовать «Bedside» (прикроватная) формулы Шварца на основании значений креатинина крови, измеренного энзиматическим методом и стандартизированным по IDMS [96, 97]:
рСКФ = 36,5 × Ht / Crp (7),
где Ht – рост (см), Crp – концентрация креатинина в сыворотке крови (мкмоль/л).
V. De Souza et al. в 2012 г. «прикроватная» формула Шварца была модифицирована, получив название Шварца-Лиона (Schwartz–Lyon, формула 10) [99].
рСКФ = k × Ht / Crp,
где k – возрастной коэффициент пересчета (для девочек всех возрастов и мальчиков <13 лет – 32,5; для мальчиков ≥13 лет – 36,5), Ht – рост (см), Crp – концентрация креатинина сыворотки крови (мкмоль/л).
«Прикроватная» формула Шварца и формула Шварца-Лиона валидированы в педиатрической популяции с ХБП 2-4 ст., а эффективность этих уравнений у здоровых детей неизвестна.
Следует подчеркнуть, что лабораторное измерение концентрации основных эндогенных маркеров СКФ должно быть стандартизировано для креатинина по IDMS [98, 108].
Если определение креатинина крови осуществляется стандартизированным методом Яффе, необходимо помнить о псевдохромогенах (глюкозе, билирубине, ряде других бета-лактамных антибактериальных препаратов (цефалоспоринов 1-го поколения, цефалоспоринов 2-го поколения, цефалоспоринов 3-го поколения, цефалосполринов 4-го поколения) и др.), которые могут искажать его истинные значения. Существенные ошибки в измерении креатинина могут быть в липемической и гемолизированной сыворотке, поэтому ни энзиматический метод, ни реакция Яффе не должны использоваться в данной ситуации [109].
Кратность исследований определяется клинической ситуацией.
-
Рекомендуется селективное, при возможности, исследование уровня цистатина С в крови в качестве подтверждающих тестов, если СКФ по уровню креатинина в сыворотке крови дает менее точный результат с целью дополнительной диагностики / мониторинга ХБП и оценки прогноза в клинической практике [96, 97, 108].
(УУР С; УДД 4)
Комментарий: Сывороточный цистатин С – один из наиболее широко используемых альтернативных биомаркеров для оценки СКФ. Цистатин С, в отличие от креатинина, продуцируется всеми ядросодержащими клетками и не зависит от мышечной массы. Формулы на основе цистатина С особенно полезны для детей с пониженной мышечной массой. Для исключения неточностей при оценке СКФ рекомендуется использование CKiD формулу, включающую значения цистатина С (измеренного с помощью турбодиметрического метода) и азота мочевины [95, 97]:
рСКФ = 39,1 × [Ht/Crp]0,516 × [1,8/Cys С]0,294 × [30/BUN]0,169 × [1,099]* × [Ht/1,4]0,188,
где Ht – рост (м), Crp – концентрация креатинина сыворотки крови (мг/дл), Cys С – цистатин С (мг/л), BUN – азот мочевины (мг/дл), * – используется только для мальчиков.
Также GJ Schwartz et al. (2012) разработали однофакторное уравнение расчета СКФ на основе цистатина С [101]. Данная формула имеет высокую точность:
рСКФ = 70,69 × Cys С -0,931 (11),
где Cys С – цистатин С (мг/л).
Следует подчеркнуть, что лабораторное измерение концентрации основных эндогенных маркеров СКФ должно быть стандартизировано: для цистатина С по IFCС (International Federation of Clinic Chemistry – стандартизированного калибратора ERMDA471) [98, 108].
GJ Schwartz et al. установили рСКФцис может быть менее точной только при одной переменной, объясняющей аномальные выбросы показателей расчетной, при большой массе тела. Расовые различия, высокое АД, уровень альбумина и применение глюкокортикоидов не влияют на уровень рСКФ на основе цистатина С [101].
Коэффициенты перевода единиц измерения из метрической системы в международную систему единиц (СИ) – в приложении А3.14.
В 2021 году C.B. Pierce и соавт., используя базу пациентов исследования CKiD, рассчитали новую формулу – CKiD U25 (CKiD under 25), которую представили в двух вариантах: на основе креатинина и цистатина С [331, 332].
CKiD U25 на основе креатинина:
рСКФ = k × (рост (м) / Scr)
Постоянный коэффициент для лиц мужского пола: k = 41,8
Постоянный коэффициент для лиц женского пола: k = 37,6
Возраст-зависимый коэффициент для лиц мужского пола:
1 – <12 лет: k = 39,0 × 1,008(возраст – 12)
12 – <18 лет: k = 39,0 × 1,045(возраст – 12)
18 – <25 лет: k = 50,8
Возраст-зависимый коэффициент для лиц женского пола:
1 – <12 лет: k = 36,1 × 1,008(возраст – 12)
12 – <18 лет: k = 36,1 × 1,023(возраст – 12)
18 – <25 лет: k = 41,4
Scr – концентрация креатинина в сыворотке крови (мг/дл)
Для расчета использовать соответствующий калькулятор СКФ (https://qxmd.com/calculate/calculator_822/ckid-u25-egfr-calculator;https://kidney.wiki/gfr-calculator/), в котором допустимо введение значения креатинина в мг/дл или мкмоль/л.
CKiD U25 на основе цистатина С:
рСКФ = k × (1 / CysC)
Постоянный коэффициент для лиц мужского пола: k = 81,9
Постоянный коэффициент для лиц женского пола: k = 74,9
Возраст-зависимый коэффициент для лиц мужского пола:
1 – <15 лет: k = 87,2 × 1,011(возраст – 15)
15 – <18 лет: k = 87,2 × 0,960(возраст – 15)
18 – <25 лет: k = 77,1
Возраст-зависимый коэффициент для лиц женского пола:
1 – <12 лет: k = 79,9 × 1,004(возраст – 12)
12 – <18 лет: k = 79,9 × 0,974(возраст – 12)
18 – <25 лет: k = 68,3
CysC – концентрация цистатина С в сыворотке крови (мг/л)
Для расчета использовать соответствующий калькулятор СКФ (см. выше).
Формулу CKiD U25 рационально использовать у детей и подростков с ХБП (возраст 1-25 лет), а также у молодых взрослых до 25 лет с дебютом ХБП до 18 лет. При этом формула не рекомендована для оценки СКФ у здоровых лиц [333].
Особенности оценки СКФ у детей раннего возраста
СКФ у новорожденного увеличивается с возрастом, что обусловлено изменениями гемодинамики в постнатальном периоде, продолжающимся нефрогенезом у недоношенных новорожденных, становлением фильтрационной функции почек к 2-м годам. В настоящее время в качестве наиболее приемлемой формулой для доношенных новорожденных предлагается формула Смитс (рСКФСмитс) на основе формулы Шварца с коэффициентом равным 0,31 при исследовании креатинина в мг/дл (27,4 – в мкмоль/л [ТА2]) [334].
-
Рекомендуется всем детям со СКФ <60 мл/мин/1,73 м2 (или снижением СКФ более чем на 1 стандартное отклонение от ожидаемого значения для соответствующего возраста и пола) или с признаками поражения почек изучение анамнеза, предыдущих показателей функции почек, проведение анализа клинической ситуации с целью установления причины (причин) заболевания почек [6, 110].
(УУР С; УДД 5)
Комментарий: анализ клинической ситуации включает данные о внутриутробном развитии, лекарственных воздействиях на плод или на мать, генетических нарушениях, аномалиях развития органов, результаты физикального обследования, лабораторные показатели во внутриутробном и постнатальном периодах (включая анализ амниотической жидкости (исследование амниотической жидкости – наиболее часто проводятся: цитогенетическое исследование амниотической жидкости», хромосомный микроматричный анализ амниотической жидкости, биохимический анализ амниотической жидкости)), результаты визуализирующих исследований в пре- и постнатальном периоде, а также данные патоморфологических исследований, в том числе плода и плаценты.
-
Рекомендуется проведение общего (клинического) анализа мочи всем пациентам с ХБП и в динамике с целью количественной оценки белка, ориентировочной оценке воспаления по характеру изменений в мочевом осадке [78].
(УУР С; УДД 5)
Комментарий: частота исследования при динамическом наблюдении определяется клиническим течением заболевания.
-
Рекомендуется установить выраженность альбуминурии (Определение количества белка в суточной моче) в соответствии с известными критериями ХБП (раздел Классификация заболевания) для стратификации риска прогрессирования ХБП [6, 110].
(УУР С; УДД 5)
Комментарий: категория альбуминурии служит важным предиктором исхода. Для всех категорий СКФ показано ступенчатое увеличение риска при повышении выраженности альбуминурии, при этом какого-либо четкого установленного порогового значения нет.
Однако у детей с ХБП при обнаружении любой патологической экскреции белка с мочой независимо от маркеров необходимо учитывать различие показателей в зависимости от возраста, пола, стадии полового развития и/или размера тела (роста, массы тела, ИМТ), возможность преобладания скорее канальцевой, чем гломерулярной протеинурии в зависимости от предсуществующего заболевания. Также у детей с ХБП можно ориентироваться на протеинурию вместо альбуминурии.
У новорожденных и детей раннего возраста допускаются более высокая как гломерулярная, так и канальцевая протеинурия из-за незрелости проксимальных канальцев, отвечающих за реабсорбцию белков. Приблизительные эквиваленты для отношений Ал/Кр и ОБ/Кр в моче у детей близки, но не идентичны значениям, приводимым для взрослых. Диапазоны нормальных значений варьируют. A. S. Brem (1981) предложил считать приемлемым уровень протеинурии в пределах 6-8 мг/м2/ч или >240 мг/м2/сут. У детей <6 месяцев; нормальные значения альбуминурии для этого возраста неизвестны [111].
Нормальные уровни суточной экскреции белка у детей в возрасте 6-24 месяцев составляют <4 мг/м2/ч (<150 мг/м2/сут) при исследовании суточной мочи, в то время как в первой пробе утренней мочи нормальным считается уровень ОБ/Кр <500 мг/г (<50 мг/ммоль). У детей старше 24 месяцев эти значения составляют <4 мг/м2/ч (<150 мг/м2/сут) в суточной моче, ОБ/Кр <200 мг/г (<20 мг/ммоль) в первой порции утренней мочи, или Ал/Кр <30 мг/г (<3 мг/ммоль) в первой порции утренней мочи. В любой возрастной группе общая потеря белка с мочой >40 мг/м2/ч (>3 г/1,73 м2 /сут) считается протеинурией нефротического уровня; значения 4-40 мг/м2/ч отражают патологическую, но не «нефротическую» потерю белка [112, 113, 319].
У детей в возрасте >24 месяцев для определения категории «протеинурии» можно использовать уровни, рекомендованные в руководствах для взрослых, за исключением постуральной потери гломерулярных белков (альбумина), т. е. ортостатической протеинурии, наблюдающейся у 2-5% подростков [114, 115].
Взаимосвязь между категориями альбуминурии и протеинурии представлена в приложении А3.15.
-
Рекомендуется чаще контролировать СКФ и альбуминурию у пациентов с высоким риском прогрессирования ХБП и/или, когда результаты измерения должны учитываться при назначении терапии для оценки скорости прогрессирования и эффективности проводимого лечения [6, 110].
(УУР С; УДД 5)
-
Рекомендуется всех пациентов с ХБП рассматривать как пациентов с повышенным риском развития ОПП с целью принятия своевременных мер по предупреждению развития ОПП при интеркуррентных заболеваниях или при проведении исследований и процедур, сопровождающихся повышенным риском ОПП [6, 110].
(УУР С; УДД 5)
Комментарий: ХБП признана фактором риска развития ОПП из-за эпидемиологической ассоциации между ними [116, 117]. ХБП является мощным предиктором ОПП при воздействии контрастных средств, проведении крупных хирургических вмешательств, а также при других медицинских состояниях [118, 119, 120]. При ведении пациентов с ХБП и повышенным риском ОПП на фоне интеркуррентных заболеваний или при проведении исследований и процедур, сопровождающихся повышенным риском ОПП, необходимо следовать рекомендациям, подробно описанным в Клинических практических рекомендациях KDIGO по ОПП [6, 110].
-
Рекомендуется исследование уровня общего кальция в крови/ исследование уровня ионизированного кальция в крови, исследование уровня неорганического фосфора в крови, определение активности щелочной фосфатазы в крови, исследование уровня паратиреоидного гормона в крови у всех детей с ХБП, начиная со 2 стадии, для диагностики МКН-ХБП, оценки в динамике и контроля лечения [122].
(УУР C; УДД 5)
Комментарий: У пациентов с ХБП, получающих лечение от МКН-ХБП, или у которых выявлены биохимические отклонения, целесообразно увеличить частоту измерений для отслеживания тенденций, эффективности лечения и побочных эффектов. Патогенез МКН-ХБП все еще далек от полного понимания. Известно, что субклинические изменения костных и минеральных биомаркеров могут быть обнаружены на очень ранней стадии развития ХБП (на стадии С2), до падения уровня кальцитриола [123, 124]. Одним из таких ранних событий является повышение уровня FGF23, фосфатонина, продуцируемого остеоцитами, который усиливает выведение фосфата почками. Роль повышенного уровня FGF23 на ранних стадиях ХБП может быть защитной, поскольку он, вероятно, помогает отсрочить развитие гиперфосфатемии. Однако постепенное снижение количества функционирующих нефронов и дефицит Klotho, корецептора FGF23, в конечном итоге подавляют фосфатурический эффект. Таким образом, FGF23. способствует раннему патогенезу вторичного гиперпаратиреоза до развития минеральных аномалий в сыворотке крови [125]. Гиперфосфатемия обычно развивается на 4 стадии ХБП и стимулирует функцию паращитовидных желез, что способствует вторичному гиперпаратиреозу. Чистый эффект этих системных изменений в сочетании с текущими методами лечения может парадоксальным образом привести либо к чрезмерной резорбции кости, либо к образованию кости. Однако в случаях явного увеличения костной массы прочность костей все же снижается, потому что отложенные костные коллагеновые волокна являются незрелыми [126].
-
Рекомендуется у пациентов с ХБП С3a – С3b ст. мониторинг исследования уровня общего кальция в крови/исследования уровня ионизированного кальция в крови, исследования уровня неорганического фосфора в крови, каждые 6–12 месяцев; а для ПТГ на основе исходного уровня и прогрессирования ХБП. При ХБП С4 ст. оценивать уровень сывороточного кальция и неорганического фосфора каждые 3–6 месяцев, для ПТГ каждые 6–12 месяцев. При ХБП С5 ст. (включая С5D) мониторировать уровень сывороточного кальция и неорганического фосфора каждые 1–3 месяца; для ПТГ каждые 3–6 месяцев. При ХБП С4 – С5D ст. определять активность щелочной фосфатазы в крови каждые 12 месяцев или чаще при повышенном уровне ПТГ для оценки в динамике МКН-ХБП и контроля лечения [122].
(УУР С; УДД 5)
-
Рекомендуется пациентам с ХБП С3a – С5D ст. определять уровень 25 (OH) D (Исследование уровня 25-ОН витамина Д в крови) с целью обнаружения недостаточности/дефицита витамина D, с повторным тестированием показателя на основе исходных значений и терапевтических вмешательств [122].
(УУР С; УДД 5)
Комментарий: FGF-23 усугубляет дефицит 1,25 (OH) 2 -витамина D, напрямую ингибируя экспрессию гена 1α-гидроксилазы через активацию сигнального пути ERK1/2 [127]. Концентрация 25 (OH) 2 -витамина D в сыворотке крови должна быть выше 30 нг / мл на всех стадиях ХБП [128].
-
Не рекомендуется определение основных метаболических маркеров обмена костной ткани (остеокальцина и бета-телопептидов коллагена) у пациентов с ХБП для выявления МКН-ХБП [129, 130].
(УУР С; УДД 5)
Комментарий: Эти показатели более значимы для определения эффективности терапии минерально-костных нарушений.
-
Рекомендуется пациентам с ХБП измерять уровни гормонов щитовидной железы, включая сывороточный ТТГ (Исследование уровня тиреотропного гормона (ТТГ) в крови) и свободный Т3 (Исследование уровня свободного трийодтиронина (СТ3) в крови), а также исследование уровня инсулиноподобного ростового фактора I в крови (ИФР-1) до начала терапии Соматропином** (рекомбинантный гормон роста рГР) [131].
(УУР С; УДД 5)
Комментарии: Частота исследований в динамике определяется клинической ситуацией. Гипотиреоз и дефицит гормона роста могут вызывать задержку роста у детей, независимо от лежащей в основе ХБП.
4. Инструментальные диагностические исследования
-
Рекомендуется ультразвуковое исследование почек, дуплексное сканирование артерий почек, ультразвуковое исследование мочевого пузыря всем пациентам с подозрением или диагностированной ХБП с целью диагностики патологических изменений, контроля в динамике, в т.ч. лечения [6].
(УУР С; УДД 5)
Комментарий: Частота исследований в динамике определяется клинической ситуацией. Ультразвуковое исследование почек позволяет установить их размеры, положение, особенности строения, оценить состояние паренхимы и ЧЛС почек, выраженность нефросклероза, а также заподозрить сосудистые аномалии, которые могут быть причиной вазоренальной гипертензии (стеноз почечной артерии, тромбоз магистральных почечных сосудов). Дуплексное сканирование артерий почек оценивает состояние ренального кровотока. Пренатальная ультразвуковая диагностика может выявить новорожденных с риском развития ХБП, особенно если есть аномалии обеих почек.
При ультразвуковом исследовании следует сравнить измеренную длину каждой почки с нормативными значениями, соответствующими возрасту. Размер почек меньше нормы указывает на уменьшение массы почек из-за ВАРМС (например, гипоплазию почек), медленный рост или потерю почечной паренхимы, связанную с основным заболеванием или травмой.
Также могут быть обнаружены такие аномалии как: односторонняя агенезия почки, слившаяся, дольчатая и подковообразная почка, дисплазия почки, добавочная почка.
Дети с врожденной единственной почкой подвержены риску снижения СКФ. Факторы риска снижения СКФ для единственной почки включают дополнительные аномалии почек и мочевыводящих путей и длину почки, не соответствующую ожидаемой компенсаторной гипертрофии.
-
Не рекомендуется проведение обзорной рентгенографии почек, экскреторной урографии, магнитно-резонансной томографии (МРТ), компьютерной томографии (КТ) или изотопных методов исследования с целью первичной диагностики или скрининга ХБП [6].
(УУР С; УДД 5)
Комментарий: Обзорная рентгенография почек обладает низкой информативностью в отношении выявления изменений паренхимы органа. Контрастные исследования при необходимости следует проводить после оценки функции почек для применения мер профилактики осложнений этих процедур.
-
Не рекомендуется у пациентов с ХБП проведение исследований с внутрисосудистым введением контрастных средств, применение которых может быть причиной повреждения почек. Решение об использовании такой диагностики должно быть принято на индивидуальной основе с учетом пользы результатов исследования для пациента и потенциальных почечных рисков [6, 133].
(УУР С; УДД 5)
Комментарий: У пациентов с ХБП при диагностике, связанной с использованием контрастных средств, следует тщательно взвешивать риск развития острого нарушения функции почек с диагностической ценностью исследования и его возможным влиянием на тактику лечения для снижения рисков неблагоприятных почечных эффектов такого вида исследований.
-
Рекомендуется измерение артериального давления на периферических артериях у всех детей с ХБП при каждом визите к врачу-педиатру/врачу общей практики (семейному врачу) или к врачу-нефрологу [6, 132].
(УУР С; УДД 5)
Комментарий: подробно информация об измерении АД у детей при артериальной гипертензии изложена в клинических рекомендациях по артериальной гипертензии у детей.
-
Рекомендуется проведение суточного мониторирования артериального давления (СМАД) с помощью переносных мониторов АД (Регистратор амбулаторный для мониторинга артериального давления, Регистратор амбулаторный для мониторинга артериального давления с определением аритмии) пациентам старше 5 лет с ХБП 4-5 ст. 1 раз в 6-12 мес. и детям с ХБП 1-3 ст. при выявлении эпизодов подъема АД и/или изменений сердца (гипертрофии миокарда, расширения аорты) по данным эхокардиографии [46, 134, 335].
(УУР С; УДД 5)
Комментарий: Детям младше 5 лет проведение СМАД затруднено, поскольку они не могут спокойно переносить процедуры частых автоматических измерений АД. СМАД позволяет выявить маскированную АГ, гипертензию «белого халата», нарушения суточного ритма АД («non-dipper»), а также уточнить степень артериальной гипертензии, оценить эффективность антигипертензивной терапии. При интерпретации результатов СМАД оценивают средние величины САД и ДАД за сутки, в дневное и ночное время. Их значения оцениваются с учетом пола, возраста и роста по процентильным таблицам, разработанным на основании обследования выборки здоровых детей от 5 до 16 лет [70, 135].
Помимо средних значений САД и ДАД, при СМАД оценивают максимальные и минимальные значения АД в разные периоды суток, показатели «нагрузки давлением» - индекс времени гипертензии, вариабельность АД, степень ночного снижения АД, величину и скорость утреннего подъема АД, длительность гипотонических эпизодов.
Следует учесть, что в настоящее время нет справочных данных для детей ростом менее 120 см, что затрудняет интерпретацию результатов. Данные по центильному распределению АД у детей при разовых измерениях и при СМАД см. в приложении 1 [46].
См. клинические рекомендации по артериальной гипертензии у детей.
-
Рекомендуется проведение электрокардиографии (ЭКГ) (Регистрация электрокардиограммы, Расшифровка, описание и интерпретация электрокардиографических данных) всем детям с ХБП 3-5 ст. для регистрации электрической активности сердечной мышцы, диагностики нарушений сердечного ритма, выявления ишемии, изменений метаболического характера (гиперкалиемия) [136, 336].
(УУР С; УДД 3)
Комментарий: У детей с ХБП 3 ст. целесообразно выполнять ЭКГ 1 раз в 6 мес., у детей с ХБП 4-5 ст. – каждые 3 мес., а при необходимости (наличие симптомов аритмии, экстрасистолии, АГ, недостаточности кровообращения) чаще. См. клинические рекомендации по артериальной гипертензии у детей.
-
Рекомендуется проведение холтеровского мониторирования сердечного ритма в течение суток детям с ХБП 3-5 ст. с признаками нарушения ритма по данным физикального обследования и/или рутинной ЭКГ с целью верификации характера и выраженности нарушений сердечного ритма и проводимости, выявить эпизоды ишемии миокарда [137, 138].
(УУР С; УДД 4)
Комментарий: Частота проведения холтеровского мониторирования сердечного ритма определяется клинической ситуацией. См. клинические рекомендации по артериальной гипертензии у детей.
-
Рекомендуется проведение эхокардиографии (Эхо-КГ) пациентам с ХБП каждые 6-12 мес., а при необходимости (резистентная к терапии АГ, клинические признаки НК, выявление изменений сердца по данным ранее проведенной Эхо-КГ) каждые 3 мес. или чаще, в зависимости от клинической ситуации, для выявления структурной патологии сердца [138].
(УУР С; УДД 5)
Комментарий: Эхо-КГ позволяет выявить: гипертрофию миокарда (утолщение МЖП, ЗСЛЖ, увеличение индекса массы миокарда ЛЖ), нарушение ДФЛЖ; нарушение механики расслабления миокарда, дилатацию ЛЖ, снижение сократительной способности миокарда, изменения аорты (расширение, уплотнение стенок), легочную гипертензию, изменения коронарных артерий (уплотнение стенок, кальцификаты в стенках КА), недостаточность клапанов сердца, гидроперикард. Снижение глобальной сократимости миокарда диагностируют при фракции выброса менее 55%, фракции укорочения менее 35%. При Эхо-КГ возможно выявить признаки кальцификации сосудистой стенки, клапанов и папиллярных мышц миокарда.
-
Рекомендуется проведение рентгенографии легких/рентгенографии легких цифровой у пациентов с ХБП при ухудшении состояния ребенка, появлении одышки с целью оценки размеров сердца, состояния легочной ткани (признаки отека легких), выявления наличия жидкости в плевральных полостях [139, 140].
(УУР С; УДД 5)
Комментарий: Частота исследований, в том числе, в процессе динамического наблюдения – в зависимости от клинической ситуации.
-
Рекомендуется проведение рентгенографии конечностей (рентгенография верхней конечности, рентгенография нижней конечности) у пациентов с ХБП при признаках костно-минеральных нарушений [131].
(УУР С; УДД 5)
Комментарий: Рентгенологическими признаками МКН-ХБП является расширение Лоозеровских зон (горизонтальные зоны просветления в длинных трубчатых костях), нарушение структур метафизов трубчатых костей; эпифизеолизы («соскальзавание» эпифиза с диафиза); переломы самой разной локализации, повторные и спонтанные переломы (нередко без болевого синдрома). У детей с ХБП 5 ст. находящихся на диализе в течение нескольких лет, можно выявить кальцификацию магистральных артерий конечностей. Кальцифицированные артерии визуализируются на рентгенограмме в виде рентген-позитивных тяжей неравномерной плотности.
(УУР С; УДД 5)
-
Рекомендуется проведение биоимпедансной спектроскопии (Определение процентного соотношения воды, мышечной и жировой ткани с помощью биоимпедансметра) (анализатор состава тела биоэлектрический) пациентам старше 2-х лет с ХБП 4-5 ст. при подозрении на скрытые отеки, при резистентной к терапии артериальной гипертензии, для определения «сухой массы тела» у пациентов на диализе [142, 337].
(УУР В; УДД 3)
Комментарий: Современные биоимпендансметры (анализаторы состава тела биоэлектрические) позволяют определить тощую массу тела, массу жировой ткани, объем неклеточной и внутриклеточной жидкости, избыток внеклеточной жидкости. Трактовать результаты биоимпедансометрии следует с учетом клинической симптоматики (динамика массы тела ребенка, АД, состояние подкожной клетчатки и т.д.). В условиях отсутствия других неинвазивных методов определения гипергидратации, применимых в клинической практике, биоимпедансная спектроскопия является полезным дополнением к клиническому обследованию пациента с ХБП. Ограничения метода указаны в инструкции к биоимпедансометру. Относительным противопоказанием служит возраст ребенка младше 2-х лет и масса тела менее 10 кг [337].
-
Рекомендуется проведение Компьютерной томографии головного мозга, и/или Магнитно-резонансной томографии головного мозга при кризовом течении АГ, возникновении судорог или очаговых неврологических симптомов у пациентов с ХБП для исключения нарушения мозгового кровообращения, ишемического или геморрагического инсульта [143, 144, 145, 146].
(УУР C; УДД 5)
Комментарий: Детям до 5-ти лет для проведения этих процедур, как правило, требуется медикаментозная седация, что несколько ограничивает их применение. Наркоз – по показаниям.
-
Рекомендуется пациентам с АГ при ХБП проведение фундоскопии (офтальмоскопия/биомикрофотография глазного дна с использованием фундус-камеры) для выявления гипертонической ретинопатии и оценки ее выраженности, а также осложнений АГ (кровоизлияние в сетчатку / стекловидное тело, отслойку сетчатки) [147, 148].
(УУР В; УДД 3)
Комментарий: Прием (осмотр, консультацию) врача-офтальмолога следует проводить не реже 1 раза в год у детей в стабильном состоянии, а также при развитии гипертонического криза, нарушениях зрения. См. клинические рекомендации по артериальной гипертензии.
5. Иные диагностические исследования
Иные методы исследования.
-
Рекомендуется пациентам с ХБП измерение массы тела, длины тела/роста, толщины кожной складки (пликометрия), окружности средней трети плеча с целью диагностики БЭН [149].
(УРР С; УДД 5)
Комментарий: Обеспечение сбалансированного питания является одним из важнейших аспектов лечения ребенка с ХБП. БЭН ассоциируется с прогрессированием уремических симптомов, приводит к белково-энергетическому истощению и увеличению летальности у этой категории пациентов. У детей в возрасте до 2 лет измеряется длина тела в положении лежа на спине, у детей старше 2-х лет и подростков рост измеряется в положении стоя. Если ребенок не может стоять, то возможно измерение в положении лежа.
-
Рекомендуется пациентам с ХБП измерение массы тела, длины тела (до 2 лет)/рост (от 2 лет), SDS роста, скорости роста, SDS скорости роста, расчет с целью диагностики задержки роста [149].
(УРР С; УДД 5)
Комментарий: эти антропометрические параметры необходимо измерять регулярно и наносить на графики роста, соответствующие полу, возрасту ребенка (с коррекцией у недоношенных) [149]. Дети с признаками задержки роста, сопутствующими заболеваниями (поражение ЦНС, сердца, печени), с нарушением состояния здоровья, изменением рациона питания, могут потребовать более частого обследования [4, 150, 151]. SDS – коэффициент стандартного отклонения, являющийся интегральным показателем, применяемым для оценки соответствия индивидуального роста ребенка референсным для соответствующего возраста и пола данным. SDS демонстрирует сколько стандартных (сигмальных) отклонений составляет разница между средним арифметическим и измеренным значением. Расчет SDS производится по формуле:
SDS роста = (х-Х)/SD,
где х – рост, Х – средний рост для хронологического возраста и пола, SD – стандартное отклонение роста для данного хронологического возраста и пола.
SDS=-2 соответствует 3-ей перцентили, SDS=0 соответствует 50-ой перцентили, SDS=+2 соответствует 97-ей перцентили.
Анализ скорости роста позволяет выявить отклонение от кривой роста в ранние сроки. Для оценки скорости роста необходимо располагать данными как минимум двух точных измерений. Для минимизации погрешностей расчетов предпочтительнее, чтобы интервал между измерениями был не менее 6 месяцев. Скорость роста рассчитывается по формуле:
Скорость роста (см/год) = (рост 2 – рост 1) / (хронологический возраст 2 – хронологический возраст 1)
Скорость роста и рост следует сравнивать со стандартизованными диаграммами роста [131].
-
Рекомендуется пациентам с ХБП, имеющим задержку роста, оценить потенциал роста путем расчета генетической целевой высоты на основе роста родителей и степени открытости эпифиза левого запястья при рентгенографии [129].
(УРР C; УДД 5)
Комментарий: Расчет целевой генетической высоты проводится по формуле Таннера для девочек (уравнение 1) и для мальчиков (уравнение 2):

Оценка степени открытости эпифиза левого запястья на рентгенографическом изображении является стандартным подходом к оценке потенциала роста ребенка [152].
-
Рекомендуется у пациентов с ХБП измерять эуволемическую («сухую») массу тела для оценки нутритивного статуса с коррекцией веса [153].
(УУР С; УДД 5)
Комментарий: данную рекомендацию следует выполнять в случаях, если ребенок находится на диализе или страдает нефротическим синдромом. Важным моментом для оценки состояния питания у детей с ХБП, особенно на диализе, является оценка эуволемической или «сухой» массы тела, то есть истинной массы тела ребенка. У большого числа детей с заболеваниями почек, когда имеется олигурия или анурия, при нефротическом синдроме имеется гипергидратация. В то же время, у детей с полиурией и потерей натрия с мочой, актуальная масса тела может быть ниже эуволемической. Рекомендации по частоте измерений представлены в приложении [153].
-
Рекомендуется всем пациентам в возрасте до 2-3 лет с ХБП измерение окружности головы с целью комплексной оценки адекватности нутритивного статуса [141].
(УУР С; УДД 4)
Комментарий: Уменьшение окружности головы может указывать на хроническое неадекватное питание в отсутствие других заболеваний, которые могут это объяснить. Состояния, которые вызывают макроцефалию (например, гидроцефалия) ограничивают значимость окружности головы как маркера нутритивного статуса [153].
-
Рекомендуется пациентам с ХБП использовать графики и таблицы, рекомендованные ВОЗ, для оценки антропометрических показателей с целью оценки физического развития и нутритивного статуса [149].
(УУР С; УДД 5)
Комментарий: При оценке роста и массы тела у детей должны быть учтены коморбидные состояния, которые нарушают линейный рост (например, детский церебральный паралич), для детей с генетическими или метаболическими заболеваниями используются специфические нормативы физического развития (например, синдром Дауна). У детей до 2-х лет, прибавка массы тела должна оцениваться в граммах ежедневно (см. приложение А3.3). В идеале дети с ХБП должны прибавлять массу тела с обычной скоростью. Однако, у детей с нарушением линейного роста, прибавка массы тела должна оцениваться пропорционально к росту [149].
-
Рекомендуется пациентам с ХБП вычислять индекс массы тела (ИМТ) для детей старше 2-х лет и массо-ростовой показатель у детей младше 2-х лет с целью оценки физического развития и нутритивного статуса [21].
(УУР C; УДД 4)
Комментарий: Несмотря на ограничивающие факторы, ИМТ или массо-ростовой показатель для детей до 2-х лет, остается основным показателем БЭН или ожирения у детей с ХБП. У детей на диализе как с высоким, так и с низким ИМТ повышается риск смертности, хотя механизм его не ясен [21].
ИМТ = масса тела (кг) / рост (м) 2
-
Рекомендуется пациентам с ХБП рассчитывать средний рост родителей и отмечать значение в виде центиля для оценки потенциала роста [153].
(УУР С; УДД 5)
-
Рекомендуется у недоношенных детей с ХБП отмечать массу тела, длину и массо-ростовой показатель для гестационного возраста и хронологического возраста: если ребенок рожден на сроке 32-37 недель – в течение первого года жизни, если до 32 недель гестации, то в течение 2-х лет с целью оценки физического развития и нутритивного статуса [153].
(УУР С; УДД 5)
-
Рекомендуется при оценке питания руководствоваться тяжестью ХБП и проблемами питания, включая отклонение параметров роста, избыточное или недостаточное потребление пищи, низкое качество диеты, гастроинтестинальные симптомы и отклонения биохимических показателей с целью формирования адекватного индивидуального подхода к коррекции нутритивного статуса [153, 154].
(УУР С; УДД 5)
-
Рекомендуется пациентам с ХБП оценка аппетита для определения необходимости дополнительного питания, если не удовлетворяются нутритивные потребности [153].
(УУР С; УДД 5)
-
Рекомендуется пациентам с ХБП ведение пищевого дневника минимум в течение 3-х дней для получения точной информации о питании [153, 154].
(УУР С; УДД 4)
Комментарий: Данные исследования CKiD (Chronic Kidney Disease in Children) показали, что дети с ХБП потребляют много пищи с высоким содержанием «пустых калорий»: фаст-фуд, чипсы и другие «снэки». Даже если дети употребляют в достаточном количестве макронутриенты, то микроэлементов в пище не хватает [154].
-
Рекомендуется проведение нефробиопсии (биопсия почки, патолого-анатомическое исследование биопсийного (операционного) материала почек) с морфологическими исследованиями препарата у пациентов с ХБП со стойкой протеинурией и/или гематурией, а также необъяснимом при клиническом исследовании снижении СКФ при отсутствии противопоказаний с целью определения причины поражения органа, оценки прогноза и выбора лечения [155, 156, 157, 316, 317].
(УУР В; УДД 3)
Комментарий: Проведение биопсии почки с морфологическими исследованиями препарата является стандартным методом диагностики разнообразных диффузных поражений органа, включающих иммунные, сосудистые, диабетические. Прижизненные морфологические данные также необходимы для определения адекватной этиотропной и патогенетической терапии с целью купирования активности патологического процесса, торможения прогрессирования и предупреждения неблагоприятных исходов ХБП. Нефробиопсия у пациентов с ХБП, независимо от возраста и СКФ, является безопасной и необходимой для постановки правильного диагноза и начала правильной терапии.
-
У пациентов с ХБП не рекомендуется рутинное проведение тестирования минеральной плотности кости (МПК) (рентгеноденситометрии) в связи с отсутствием показаний. При наличии технической возможности рентгеноденситометрия может быть проведена у пациентов с выраженными отклонениями лабораторных показателей (сывороточного уровня кальция, неорганического фосфата, паратиреоидного гормона) в рамках рекомендаций по остеопении/остеопорозу для оценки риска перелома [6, 110, 131].
(УУР С; УДД 5)
Комментарий: Своевременная диагностика костной патологии при МКН-ХБП у детей имеет очень важное значение. Выявление структурных изменений костной ткани до развития эпифизеолиза/перелома и проведение коррекции терапии – важная задача для врача-нефролога и врача-травматолога-ортопеда-специалиста в области метаболической болезни кости. Почечная остеодистрофия определяется как изменение качества костей у пациентов с ХБП, которое классифицируется на основе 3-х гистологических характеристик: метаболизм кости, минерализация и объем. В настоящее время инвазивный метод исследования минеральной плотности кости с успехом может быть заменен на метод двухэнергетической рентгеновской абсорбциометрии (рентгеноденситометрия). Метод обладает высокой точностью, минимальной лучевой нагрузкой, что позволяет проводить повторные сканирования для оценки скорости потери костной массы и риска переломов или для оценки восстановления костной массы на фоне терапии. Проведено 4 проспективных когортных исследований, которые продемонстрировали, что измерение МПК с помощью рентгеноденситометрии может прогнозировать риски переломов костей у пациентов с МКН-ХБП. Рабочая группа KDOQI (2017) также отмечает, что данный метод не может определить тип костного обмена (высокообменная болезнь кости/фиброзный остеит или адинамическая болезнь кости) [6, 110]. Для ответа на этот вопрос необходимо соотнести клинические, лабораторные данные и результаты рентгеноденситометрии.
Метод рентгеноденситометрии в педиатрической практике проходит первые этапы исследований. Руководство KDIGO не дает пока конкретных рекомендаций для детей, признавая, что нет достаточного количества исследований, изучающих связь данных рентгеноденситометрии, характеристик минеральной плотности кости и переломов у детей и подростков с МКН-ХБП.
Одно проспективное исследование с участием детей с ХБП на 2-5D стадиях выявило, что более низкая минеральная плотность коркового слоя кости ассоциирована с высоким риском переломов.
-
Рекомендуется рассмотреть у пациентов с ХБП 3-5D ст. выполнение биопсии кости с патолого-анатомическим исследованием биопсийного (операционного) материала костной ткани, если нет определенности и однозначности в характере костной патологии (например, при формировании «бурой опухоли» и необходимости исключения злокачественного опухолевого процесса) [6, 110, 158].
(УУР С; УДД 5)
Комментарий: В этой ситуации данные биопсии кости повлияют на лечебный процесс. Биопсию кости следует также рассмотреть у пациентов с необъяснимыми переломами, рефрактерной гиперкальциемией, подозрением на остеомаляцию, атипичным ответом на стандартные методы лечения повышенного ПТГ или прогрессирующим снижением минеральной плотности кости, несмотря на стандартную терапию. Р.Evenepoel et al. в 2017 году представлена обновленная информация о роли биопсии кости в ведении пациентов с МКН-ХБП. Золотым стандартом диагностики и специальной классификации почечной остеодистрофии остается (количественный) гистоморфометрический анализ биопсии кости. Данное исследование дает представление о метаболизме и минерализации костей. Поэтому биопсия кости может помочь в профилактике и лечении остеодистрофии и его последствий [158, 159]. В остальных случаях биопсия кости не требуется для диагностики патологии кости у пациента с известными МКН при ХБП и высоким риском переломов. При этом клиницист должен быть уверен в своей способности диагностировать патологию кости неинвазивно.
-
Рекомендуется детям с ХБП, имеющим задержку роста, перед началом терапии Соматропином** исследование глазного дна (Офтальмоскопия/Осмотр периферии глазного дна с использованием трехзеркальной линзы Гольдмана/ Биомикрофотография глазного дна с использованием фундус-камеры/ Биомикроскопия глазного дна) с целью исключения внутричерепной гипертензии [160, 338].
(УУР С; УДД 5)
Комментарий: Косвенным признаком внутричерепной гипертензии является отек диска зрительного нерва по данным осмотра глазного дна. Внутричерепная гипертензия может прогрессировать при терапии Соматропином**.
-
Рекомендуется детям с ХБП, имеющим задержку роста, перед началом терапии Соматропином** оценить пубертатный статус по Таннеру с целью выявления отклонений, своевременной диагностики их причин и определения тактики терапии [131].
(УУР С; УДД 5)
Комментарий: Оценку стадий пубертата следует проводить у пациентов старше 10 лет. Задержка полового созревания и уменьшение всплесков пубертатного роста являются характерными признаками длительной ХБП и, вероятно, являются результатом сниженного высвобождения гипоталамического гонадотропин-рилизинг-гормона и снижения циркулирующих уровней биоактивного лютеинизирующего гормона из-за связанных с ХБП факторов ингибирования, таких как ангиотензин II [161]. Оценка полового статуса (по Таннеру) позволяет определить отставание в половом развитии. Задержка пубертата при отставании в росте может быть как конституциональной (при конституциональной задержке роста и пубертата), так и патологической (при гипогонадизме), требующей дополнительного обследования. Пациенты с задержкой полового созревания должны быть направлены к детскому эндокринологу для полного обследования.
5. Иные диагностические исследования
-
Рекомендовано ведение пациентов с ХБП мультидисциплинарной командой специалистов в связи с множественными проявлениями заболевания [325, 148, 369, 370, 371].
(УУР С; УДД 5)
Комментарии: прием (осмотр, консультация) врача-нефролога первичный и повторные, врача-педиатра/врача общей практики (семейного врача), врача-детского эндокринолога, врача-детского кардиолога, при необходимости - врача-детского хирурга (специализирующегося по трансплантологии), медицинского психолога, врача-клинического фармаколога, врача-диетолога, врача-детского онколога – гематолога.
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
1. Консервативное лечение
Лечение ХБП включает в себя лечение основного первичного заболевания почек, благодаря которому возможно предотвратить или замедлить прогрессирование заболевания, а также известных осложнений при ХБП.
1.1. Питание при ХБП
1.1.1 Общие положения
Задачами питания ребенка с ХБП являются: контроль симптомов и предупреждение осложнений, особенно уремии (водно-электролитный и кислотно-щелочной баланс) и минеральных и костных нарушений (таким образом откладывая необходимость ЗПТ); обеспечение оптимального роста ребенка (приложение А3.1); сохранение резидуальной функции почек.
-
Рекомендуется пациентам грудного возраста с ХБП проводить естественное вскармливание как наиболее оптимальный и предпочтительный метод питания [162].
(УУР С; УДД 5)
Комментарий: Грудное молоко – уникальный источник питания, созданный для младенцев, включая детей с ХБП 2-5 ст., так как для их почек очень важна низкая осмотическая нагрузка.
-
Рекомендуется пациентам грудного возраста с ХБП предпочтение отдавать адаптированным молочным смесям с преобладанием сывороточного белка при невозможности /недоступности грудного вскармливания в адекватном объеме [162].
(УУР С; УДД 5)
Комментарий: Адаптированные молочные смеси с преобладанием сывороточного белка имеют белковый и электролитный компонент ближе к грудному молоку, чем казеиновые формулы и предпочтительнее на 1-м году жизни. Не показано использование смесей на основе сои до 12 месяцев жизни из-за высокого содержания фитоэстрогенов.
-
Рекомендуется пациентам с ХБП добавлять фортификатор (обогатитель грудного молока) в грудное молоко или адаптированную молочную смесь, если младенцу необходимо ограничение жидкости или увеличение энергетической ценности питания [162].
(УУР С; УДД 5)
Комментарий: Если необходимо ограничить объем жидкости или, когда нормальный объем пищи вызывает рвоту или имеется гастро-эзофагеальный рефлюкс (ГЭР), сухая адаптированная смесь может растворяться в меньшем объеме воды. Большинство стандартных молочных смесей имеет концентрацию 13%, то есть 13 граммов сухой смеси на 100 мл воды, обеспечивая калорийность около 67 ккал и 1,3 г белка на 100 мл. Концентрацию смеси можно увеличивать на 1-3% в день, вплоть до 20%, т.е. 20 г сухой смеси на 100 мл воды в зависимости от индивидуальной переносимости ребенка. Сухую молочную смесь можно добавлять к грудному молоку в концентрации 3-6% (т.е. 3-6 г сухой смеси на 100 мл грудного молока), таким образом увеличивая энергетическую ценность до 1 ккал/мл. У недоношенных младенцев может использоваться фортификатор грудного молока.
-
Рекомендуется пациентам с ХБП увеличивать концентрированность питания и добавок постепенно в соответствии с переносимостью с целью достижения адекватного нутритивного статуса и предотвращения нежелательных явлений со стороны желудочно-кишечного тракта [162].
(УУР С; УДД 5)
Комментарий: Концентрация молочной смеси должна увеличиваться постепенно, чтобы обеспечить толерантность к повышению осмоляльности, которая может вызывать диарею, рвоту, ГЭР. Следует обращать внимание на повышение осмотической нагрузки на почки, что может приводить к избытку фосфора, калия и других минералов и электролитов. Альтернативой добавления сухой адаптированной смеси к грудному молоку может быть добавление белкового компонента и/или других источников энергии (полимеры глюкозы, жировые эмульсии) для обеспечения пациент-ориентированного профиля белка и энергии, с добавлением витаминов и минералов если необходимо.
-
Рекомендуется детям с ХБП вводить в рацион более густые продукты прикорма согласно рекомендациям для здоровых детей с постепенным разнообразием текстуры и вкуса с целью формирования навыка пережевывания пищи [162].
(УУР С; УДД 5)
Комментарий: Всем детям необходимо придерживаться здоровой, сбалансированной диеты с широким выбором блюд и учетом возможных диетических ограничений. Необходимо проводить просвещение семьи относительно выбора более здоровой пищи во время введения прикорма, чтобы влиять на формирование пищевых предпочтений.
-
Рекомендуется пероральное питание у детей с ХБП как предпочтительный способ кормления с целью сохранения функций жевания и глотания [162].
(УУР С; УДД 5)
Комментарий: Новорожденные и дети раннего возраста с ХБП 2–5D могут отказываться от перорального питания. В то же время зондовое кормление способствует развитию проблем с жеванием и глотанием, отказу от еды, паническим атакам и слабому развитию оральной моторики. Желательна оральная стимуляция, даже если пероральный прием ограничен, чтобы предотвратить развитие отвращения к еде. Поэтому важным аспектом нутритивной поддержки является как собственно обеспечение питанием, так и формирование пищевого поведения.
-
Рекомендуется использовать 24-часовой период для оценки диеты или оценки трехдневного пищевого дневника, детей с ХБП 2-5D ст. с целью определения основных источников питания в комплексной оценке нутритивного статуса [4].
(УУР С; УДД 5)
-
Рекомендуется пациентам с ХБП срочное вмешательство, если диагностировано снижение весового центиля с целью улучшения нутритивного статуса ребенка [4].
(УУР С; УДД 5)
Комментарий: Пероральная коррекция питания должна проводиться у детей с неадекватным диетическим потреблением нутриентов, после выявления причин снижения потребления и возможной медикаментозной коррекции. Самый быстрый рост наблюдается в первый год жизни и отсутствие прибавки в массе тела - сигнал к вмешательству. Если прибавка в массе тела отсутствует всего 2 недели в первые 3 месяца жизни, то теряется 1 центиль. Если в течение 4 недель, то 2 центиля. В 6-месячном возрасте к потере 1 центиля приведет 3-х недельное отсутствие прибавки массы, в 9 месяцев 1 центиль теряется после 4 недель статичной массы тела.
У детей 1-го года жизни с ХБП более чувствительными маркерами являются измерение массы тела и/или окружности головы, тогда как измерения длины/роста часто неточны (оценка физического развития представлена в приложении А3.1, параметры и частота оценки нутритивного статуса у детей с ХБП 3Б-5Д стадиями представлены в приложении А3.2).
Первым шагом при плохой прибавке массы тела является поиск возможной причины снижения объема приема пищи и ее коррекция. Например, проблема ГЭР/рвота (загустители питания, альгинаты, антациды, блокаторы H2-гистаминовых рецепторов, ингибиторы протонного насоса, стимуляторы моторики желудочно-кишечного тракта), ацидоз, гиперволемия, АГ или неадекватный диализ. Дети с ХБП могут иметь нарушение вкусовых и обонятельных ощущений.
1.1.2 Энергия
-
Рекомендуется потребление энергии у детей с ХБП 2-5D ст, соответствующее здоровым детям того же хронологического возраста [162]. У детей с ХБП, вероятно, такие же энергозатраты в состоянии покоя, как и у здоровых детей, и общая потребность в энергии должна находиться в пределах нормы [325].
(УУР С; УДД 5)
Комментарий: Неадекватное поступление энергии из небелковых источников приводит к использованию белка рациона для образования энергии вместо роста, что также приводит к гиперкалиемии.
-
Рекомендуется более высокое потребление энергии (SDI - Suggested Dietary Intake) чтобы обеспечить оптимальный рост у детей с субоптимальным набором массы тела и линейным ростом [162].
(УУР С; УДД 5)
Комментарий: Для достижения оптимального потребления калорий может понадобиться пероральная или энтеральная нутритивная поддержка. Энтеральное питание показано и младенцам, и детям, когда оральное потребление является неадекватным для поддержания роста и должно начинаться, как только скорость роста становится ниже нормы (см. приложение А3.3).
-
Рекомендуется при ХБП у детей с избыточной массой тела и ожирением, снизить потребление энергии до достижения соответствующей прибавки массы тела [162].
(УУР С; УДД 5)
Комментарий: Дети на перитонеальном диализе (ПД) адсорбируют глюкозу во время экспозиции диализата, что дает дополнительную энергию 10 ккал/кг/сут.
1.1.3 Белок
-
Рекомендуется целевое потребление белка у детей с ХБП 2-5D ст. по верхней границе SDI (Suggested Dietary Intake) для обеспечения оптимального роста [162].
(УУР С; УДД 5)
Комментарий: Рекомендуется более высокое потребление белка относительно рекомендованного потребления нутриента (reference nutrient intake - RNI) (см. приложение А3.12, А3.13). Нижняя граница рекомендованного потребления белка является тем безопасным минимумом, ниже которого нельзя уменьшать потребление белка.
-
Рекомендуется рассмотреть возможность увеличения потребления белка детьми на диализе, т.к. может быть выше SDI у недиализного пациента с учетом потерь белка на диализе [162].
(УУР С; УДД 5)
-
Рекомендуется у детей с ХБП при постоянно высоком уровне мочевины, коррекция потребления белка в сторону более низкого SDI после исключения других причин высокого уровня мочевины [23, 162].
(УУР С; УДД 5)
Комментарий: При снижении СКФ <25 мл/мин/1,73м2 необходимо снизить потребление белка до RNI. KDOQI рекомендует 100-140% потребления белка при ХБП 3 ст., 100-120% при ХБП 4-5 ст. (см. приложение А3.12) [162, 325].
Целевой уровень мочевины должен составлять <20 ммоль/л для младенцев и детей до 10 лет и <30 ммоль/л для детей старше 10 лет с нормальным альбумином сыворотки крови [23].
1.1.3 Калий
У пациентов с ХПБ следует контролировать уровень калия, так как почки ответственны за выведение калия, поступающего с пищей. Гиперкалиемия определяется как уровень К+ в сыворотке крови >5 ммоль/л для детей и подростков (>5,5 ммоль/л для новорожденных) и гипокалиемия <3,5 ммоль/л. Большинство пациентов с дискалиемией не имеют никаких симптомов, но при тяжелой гиперкалиемии могут развиваться фатальные сердечные аритмии. Гиперкалиемия обычно не возникает до тех пор, пока СКФ не снижается <10% от нормы.
Возможные причины гиперкалиемии:
-
недостаточное потребление энергии;
-
антигипертензивные препараты и антагонисты альдостерона, ингибиторы АПФ;
-
высокое потребление калия с пищей;
-
ацидоз;
-
адекватный контроль уровня калия в плазме обычно достигается за счет улучшения потребления энергии, ограничения продуктов с очень высоким содержанием калия.
Фуросемид** (в форме для парентерального введения – без ограничений по возрасту, в форме таблеток – разрешен по инструкции детям с 3 лет) с целью коррекции гиперкалиемиии следует использовать с осторожностью, снижение объема циркулирующей крови (ОЦК) может дестабилизировать функцию почек и привести к развитию ОПП на ХБП.
У небольшой группы детей с ХБП может наблюдаться стойкая гипокалиемия, обычно в результате наследственных или приобретенных заболеваний почечных канальцев.
Основными источниками калия для младенцев является грудное молоко или молочная смесь, для детей и подростков – молоко, картофель, овощи, крупы, фрукты, мясо. Пищевые добавки, содержащие соли калия, способствуют увеличению его потребления.
Травматический сбор крови и гемолиз эритроцитов – наиболее частая причина лабораторных отчетов о повышенном уровне калия у детей. Интерпретация сывороточного калия у детей должна основываться на возрастных нормативных пределах. Дети младшего возраста и младенцы имеют физиологически более высокий уровень калия в сыворотке крови.
-
Рекомендуется оценить потребление калия у пациентов с ХБП с дискалиемией, т.к. гиперкалиемия у этих пациентов может усугубляться при неправильном употреблении и обработке пищи [163].
(УУР С; УДД 5)
Комментарий: У детей KDOQI рекомендует ограничить потребление калия до 40-120 мг/кг/день для младенцев и детей младшего возраста и 30-40 мг/кг/день для детей старшего возраста [4]. Кроме того, семьи должны быть осведомлены о методах приготовления пищи, которые могут снизить содержание калия в еде, таких как очистка от кожуры, нарезание кубиками и предварительное замачивание богатых калием овощей, а также отказ от бульона [163].
Калий содержится во всех типах продуктов питания. Способы приготовления пищи, такие как измельчение, варка, приготовление в микроволновой печи, могут значительно снизить концентрацию калия. Согласно проведенным исследованиям, в возрасте от 18 месяцев до 18 лет, основным источником калия являются молоко и молочные продукты, крахмалистые корни и клубни, такие как картофель, зерновые, фрукты и мясо. Большинство продуктов, «готовых к употреблению» содержат добавки солей К+. Продукты с добавлением солей калия могут содержать добавки на основе фосфатов, например, мясные продукты, выпечка, сыры. Содержание калия в продуктах питания показано в приложениях А3.4, А3.5, А3.6.
-
Рекомендуется у пациентов с ХБП, получающих ЗПТ, устранить причины дискалиемии, не связанные с диетой, за счет коррекции диализа [93, 164].
(УУР С; УДД 5)
-
Рекомендуется у детей с ХБП проведение экстренного медицинского вмешательства и прекращения приема всех источников калия из лекарственных препаратов, парентеральных жидкостей, молочных смесей и продуктов питания при развитии тяжелой гиперкалиемии [93, 94, 164].
(УУР С; УДД 5)
Комментарий: Гиперкалиемия является общепризнанным фактором риска аритмий и остановки сердца, и предсказуемо ведет к более высокой смертности [93, 94, 164].
Гиперкалиемия - возможный побочный эффект некоторых лекарств, используемых при ХБП, включая ингибиторы АПФ и антагонисты рецепторов ангиотензина II, калийсберегающие диуретики, ингибиторы кальциневрина и простагландины [165]. Необходимо учитывать, что у детей с ХБП прекращение приема ингибиторов АПФ может быть связано с ускорением снижения функции почек [339].
Лечение гиперкалиемии см. в приложении А3.20. При уровне калия >7,5 ммоль/л показано проведение диализа.
-
Рекомендуется селективное применение препаратов, содержащих калий-связывающие смолы у пациентов с ХБП и тяжелой или среднетяжелой гиперкалиемией. В т. ч., пациентам грудного возраста - если недоступна молочная смесь с низким содержанием калия [4, 163, 315, 341].
(УУР С; УДД 5)
Комментарий: В педиатрической практике обычно применяется кеоксалат (активное вещество: сульфонат полистирола натрия – ионнообменная смола, высвобождающая ионы натрия и заменяющая ими ионы калия). Кеоксалат (биологически активная добавка) используется в соответствии с инструкцией к биологически активной добавке.
При уровне калия <5 ммоль/л препараты следует отменить. При уровне калия >5 ммоль/л следует возобновить.
Если препарат нельзя давать перорально, доза может быть введена ректально, в количестве пероральной, разведенной в тех же пропорциях. Однако особая осторожность требуется при ректальном назначении детям и новорожденным, т.к. избыточная доза или неадекватное разведение могут приводить к задержке катионообменной обменной смолы в кишечнике. Риск желудочно-кишечного кровотечения или некроза толстой кишки подразумевает, что особое внимание должно уделяться в случаях назначения недоношенным детям или новорожденным с низкой массой тела, угрожаемых по некротическому энтероколиту [166].
-
Рекомендуется проведение немедленного медицинского вмешательства с внутривенной инфузией препаратов калия при опасной для жизни тяжелой гипокалиемии с терапевтической целью [4, 164].
(УУР C; УДД 5)
-
Рекомендуется пересмотреть и скорректировать лекарственные назначения, снижающие калий, и режим диализа детям с ХБП при гипер-или гипокалиемиии с целью достижения приемлемого уровня калия в крови [164].
(УУР С; УДД 5)
1.1.4 Кальций и фосфор
Адекватное потребление кальция (Са) и фосфора (Р) – важная часть лечения ХБП у детей [167]. Низкое потребление кальция или фосфора приводит к нарушению минерализации костей, развитию минерально-костных нарушений, ассоциированных с ХБП (МКН-ХБП). Однако избыточное поступление Са и Р, также опасно и может способствовать развитию нефрокальциноза и кальцификации сосудов [168].
Основными диетическими источниками Са для детей являются молоко, молочные продукты, грудное молоко и детские молочные смеси. Основными диетическими источниками фосфора для детей являются молоко (включая молочные продукты, грудное молоко и готовые детские смеси), злаки и крупы, а также мясо и мясные продукты (приложение А3.7). Неорганический P, добавляемый в некоторые продукты (полуфабрикаты), может значительно увеличить потребление фосфора.
-
Рекомендуется использовать 24-часовой период для быстрого определения основных источников Ca и P, включая добавки P в обработанные пищевые продукты для здоровых детей и детей с ХБП 2-5D ст. [4].
(УУР С; УДД 5)
-
Рекомендуется проведение оценки трехдневного пищевого дневника для получения подробной информации об общем потреблении Ca и P, включая диетические источники, пищевые добавки, диализат и лекарства, в том числе препараты для лечения гиперкалиемии и гиперфосфатемии (фосфат-биндеры) [4, 163].
(УУР С; УДД 5)
-
Рекомендуется у пациентов с ХБП соблюдать пищевой рацион, чтобы общее потребление кальция с пищей и лекарствами, включая препараты для лечения гиперкалиемии и гиперфосфатемии, были в пределах SDI или не более чем в два раза превышали SDI, кроме исключительных обстоятельств [4, 163].
(УУР С; УДД 5)
Комментарий: В особых случаях, например, у младенцев с ХБП или у детей с выраженным остеопорозом, при тщательном контроле возможно более высокое потребление кальция.
-
Рекомендуется пациентам с ХБП скорректировать потребление Ca и P для поддержания их уровня в пределах нормы, соответствующей возрасту, без ущерба для питания [4, 163].
(УУР С; УДД 5)
Комментарий: Изменения в терапии должны основываться на серийных результатах, с интеграцией сывороточного Ca, P, ПТГ, ЩФ и 25(ОН) витамина D и его аналогов.
-
Рекомендуется для детей с ХБП, у которых есть гиперфосфатемия или гиперпаратиреоз, требующие ограничения фосфора в диете использовать нижний предел SDI с целью Поддержания уровня фосфора в крови в пределах приемлемых значений [4, 163].
(УУР С; УДД 5)
Комментарий: Следует ограничить вклад фосфата фосфатных добавок. Использование препараты для лечения гиперкалиемии и гиперфосфатемии требуется для дальнейшего контроля уровней P и ПТГ в дополнение ограничениям в диете.
-
Рекомендуется у детей с ХБП со стойкой гипокальциемией или высоким уровнем ПТГ потребление кальция выше 200% от SDI для кальция в течение коротких периодов времени и под тщательным медицинским наблюдением [4, 163].
(УУР С; УДД 5)
Комментарий: Кальций может поступать при приеме препаратов кальция вместе с витамином D и его аналогами (обычно как в нативной, так и в активной форме), а также из других источников кальция, таких как диализат с высоким содержанием кальция.
-
Рекомендуется детям с ХБП с устойчивой гипофосфатемией увеличить потребление фосфора с пищей с целью достижения приемлемого уровня фосфора в крови [4, 163].
(УУР С; УДД 5)
Комментарий: Некоторым пациентам могут потребоваться добавки P, в случае интенсивного диализа или высоких потерь P с мочой.
-
Рекомендуется у детей с ХБП со стойкой гиперкальциемией от легкой до умеренной степени тяжести поэтапно снижать или прекращать прием препаратов кальция, препаратов для лечения гиперкалиемии и гиперфосфатемии в состав которых входит кальций, а также препаратов нативного и активного витамина D и его аналогов и назначение диализата с низким содержанием кальция [129].
(УУР С; УДД 5)
Комментарий: Может потребоваться временное снижение содержания Са в рационе без ущерба для адекватного питания. Требуется регулярная переоценка, особенно когда потребление Ca ниже SDI.
Следует избегать положительного баланса кальция сверх того, что необходимо растущему ребенку (ограничение дозы препаратов для лечения гиперкалиемии и гиперфосфатемии на основе кальция, своевременное введение некальциевых препаратов для лечения гиперкалиемии и гиперфосфатемии, например, #cевеламер** (0,4-1,6 г) [169, 342]) для предотвращения кальцификации сосудов [92].
1.1.5 Натрий и бикарбонат
Требования к потреблению натрия (Na), воды и бикарбоната зависят от заболевания, ставшего причиной ХБП. Детям с дисплазией почек и CАCUT обычно необходима дотация Na, бикарбоната и воды. Это связано выраженностью тубулярных нарушений, приводящих к снижению реабсорбции Na, бикарбоната и воды. Для таких детей характерна полиурия и полидипсия, они склонны к эпизодам декомпенсации с развитием гиповолемии и ОПП, если не получают дотации Na, бикарбоната и не имеют свободного доступа к воде. Больше всего теряют электролиты дети с тубулопатиями, особенно с цистинозом; поддержание адекватного уровня Na и бикарбоната может быть трудным.
При ХБП 4-5 ст., как правило, необходимо ограничение соли. Истощение запасов Na приводит к хронической гиповолемии и способствует плохому росту; гипонатриемия не является признаком недостаточности Na [170]. Чрезмерное ограничение соли чревато риском стимуляции ренинальдостероновой системы, выработки катехоламинов и развития дислипидемии [171].
Дети раннего возраста, находящиеся на перитонеальном диализе (ПД), могут терять повышенное количество натрия с мочой и диализатом и нуждаются в дотации Na.
Дети с ХБП вследствие гломерулопатий, как правило, задерживают Na и воду, что способствует развитию АГ. Таким детям следует соблюдать диету без добавления соли, а также исключить употребление полуфабрикатов, фаст-фуда, снэков [325].
-
Рекомендуется детям с ХБП на фоне первичных гломерулярных заболеваний или при олигурии ограничить потребление натрия менее 1500 мг/сут. (3750 мг соли) для снижения рисков развития отеков и артериальной гипертензии при отсутствии противопоказаний, например таких, как сольтеряющие тубулоинтерстициальные нефропатии, лица с гипотензией при отсутствии сердечной недостаточности, или лица, предрасположенные к гиповолемии [4].
(УУР С; УДД 5)
-
Рекомендуется коррекция метаболического ацидоза (до уровня бикарбоната в сыворотке ≥22 мЭкв/л) с назначением натрия гидрокарбоната** у детей с ХБП [5, 138].
(УУР С; УДД 5)
Комментарий: следует учесть, что источником бикарбоната могут быть также диализные растворы на основе HCO3 или натрия лактата раствор сложный (калия хлорид + кальция хлорид + натрия хлорид + натрия лактат)**. При сохранении метаболического ацидоза у ребенка на диализной терапии следует индивидуально оценить его причину (адекватность дозы диализа, диета, высокие потери бикарбоната с мочой).
Почки играют важную роль в поддержании кислотно-щелочного баланса за счет экскреции ионов водорода, реабсорбции отфильтрованного бикарбоната и генерации новых ионов бикарбоната и других буферов. ХБП может влиять на все компоненты, участвующие в почечной регуляции кислотно-щелочного баланса, что приводит к метаболическому ацидозу. Симптомы метаболического ацидоза не являются специфическими. Стимуляция дыхательного центра в стволе мозга приводит к гипервентиляции для компенсации ацидоза путем элиминации CO2. В результате у пациентов может наблюдаться различная по степени выраженности одышка. Кроме того, у больных могут отмечаться боли в груди, тахикардия, головная боль, спутанность сознания, слабость, боли в костях, снижение аппетита, тошнота и рвота [172]. Помимо потерь бикарбоната с мочой, может наблюдаться неспособность подкисления мочи. Заместительная терапия натрия гидрокарбонатом** проводится в начальной дозе 1 ммоль/кг/сут разделенные на два-четыре приема. Более точный расчет необходимого количества натрия гидрокарбоната** производится по формуле Мелленгаарда–Аструпа:
HCO3- (ммоль) = BE х 0,3 х m (масса тела пациента в кг),
при этом 1 мл 8,4% раствора равен 1 ммоль.
Применение натрия гидрокарбоната** требует мониторинга кислотно-щелочного и общего состояния пациента [173].
1.1.6 Витамины
Для пациентов с ХБП характерен дефицит микроэлементов в питании [174]. Получены данные о дефиците аскорбиновой кислоты, тиамина (В1), пиридоксина (В6), фолиевой кислоты [343, 344].
-
Рекомендуется пациентам с ХБП 2-5D стадии применение препаратов групп: A11AA03 Поливитамины в комбинации с другими минералами (включая полиминералы) и/или A11AA04 Поливитамины в комбинации с микроэлементами и/или A11BA B05XC или прием витаминно-минеральных комплексов (биологически активные добавки, содержащие действующие вещества тиамина гидрохлорид или пиридоксина гидрохлорид) с целью коррекции дефицита витаминов [4, 345, 378].
(УУР С; УДД 5)
-
Рекомендуется детям с ХБП 5D стадии: коррекция дефицита витамина В1 (#тиамина**): 10–25 мг/день парентерально в течение 1–2 недель, затем 5 мг перорально в течение 6 недель [378].
(УУР С; УДД 5)
-
Рекомендуется детям с ХБП 5D стадии: коррекция дефицита витамина В6 (#пиридоксин**): 5–25 мг/день перорального #пиридоксина** в течение 3 недель, затем 2,5–5 мг/день перорально в виде поливитаминов [378].
(УУР С; УДД 5)
-
Рекомендуется пациентам коррекция дефицита фолиевой кислоты у детей до 1 года с ХБП 5 ст: #фолиевой кислота** 0,1 мг/кг/день перорально ежедневно; у детей: старше 1 года - 1,0 мг перорально ежедневно (до восполнения дефицита), затем поддерживающая доза от 0,1 до 0,5 мг в сутки [4, 345, 346, 348].
(УУР С; УДД 5)
Комментарий: фолиевая кислота теряется с диализатом. Поэтому для коррекции гипергомоцистеинемии, развивающейся на этом фоне, требуется применение #фолиевой кислоты**. Тем не менее, дефицит фолиевой кислоты отмечается и у детей с ХБП, не находящихся на диализе [378].
Может проводиться коррекция в зависимости от уровня гомоцистеина и/или фолиевой кислоты в крови (до поддержания уровня фолиевой кислоты в крови >5 нг/мл, но не выше верхней границы нормы).
-
Рекомендуется пациентам с ХБП вне зависимости от стадии дотация цианокобаламина** (режим дозирования – в соответствии с инструкцией) при состояниях, сопровождающихся дефицитом B12 с целью коррекции его дефицита [346].
(УУР С; УДД 4)
-
Рекомендуется селективное применение диетической коррекции жирорастворимых витаминов A, D, E и K пациентам с ХБП 2-5 ст. с целью коррекции возможного дефицита [4].
(УУР С; УДД 5)
Комментарий: У пациентов с нарушением функции почек наблюдается высокий уровень ретинола в крови, что возможно связано с сочетанием снижения клубочковой фильтрации комплекса ретинол-ретинол-связывающий белок, снижения преобразования ретинола в ретиноевую кислоту и накопления ретинол-связывающего белка. Повышение уровня ретинола наблюдается у детей с ХБП 3-5D и коррелирует с гиперкальциемией [347].
1.1.7 Энтеральное питание
-
Рекомендовано рассмотреть в индивидуальном порядке назначение энтерального питания детям с ХБП 2-5 ст. при нарушении нутритивного статуса с целью его коррекции [176, 177].
(УУР С; УДД 5)
Комментарии:
Энтеральное питание может осуществляться через назогастральный зонд (Установка назогастрального зонда) или через гастростому (Гастростомия, Гастростомия с использованием видеоэндоскопических технологий, Лапароскопическая гастростомия)
Хотя назогастральный зонд устанавливается на короткое время, большинство семей предпочитает его гастростоме, которую не видно под одеждой. Рвота может иметь решающее значение в предпочтении гастростомии.
Назогастральный зонд (НЗГ)
Преимущества:
- Метод выбора у детей с массой тела <4 кг.
- Установить зонд просто, и семья легко обучается.
- Риск перитонита у детей на перитонеальном диализе (ПД) отсутствует.
Недостатки:
- Ухудшение качества жизни ребенка и семьи из-за необходимости частых замен зонда.
- Препятствует развитию оро-моторных навыков, вызывая дальнейшие проблемы с развитием речи и глотанием.
- Внешний вид ребенка изменен, окружающие замечают «больного ребенка».
- Риск перфорации пищевода или желудка (редко).
- Повышается риск гастроэзофагеального рефлюкса, рвоты и аспирации из-за открытого нижнего сфинктера пищевода.
Транспилорический (назоеюнальный) зонд
Зонд для кормления можно продвинуть за пределы желудка в двенадцатиперстную или тощую кишку, чтобы попытаться уменьшить рвоту. Но: зонд легко перемещается и требуют рентгенографического контроля, а также вмешательства под общей анестезией для переустановки зонд нельзя использовать для болюсного кормления, только для длительного непрерывного кормления.
Гастростомия
Установка гастростомы может быть выполнена чрескожным эндоскопическим способом, чрескожным радиологическим, чрескожным лапароскопическим способом, а также открытым способом. Каким бы ни был тип расположения, место выхода гастростомической трубки ограничено левым верхним квадрантом живота или средней линией из-за анатомии желудка. Таким образом, катетеры для ПД не следует размещать в левом верхнем квадранте у детей, которым в последующем понадобится установка гастростомы [178].
НГЗ предпочтителен для краткосрочного энтерального питания.
Для длительного энтерального питания предпочтительна гастростомия.
Устройство для длительного энтерального питания должно определяться совместно с родителями/опекунами.
Наибольшего эффекта в плане улучшения физического развития от агрессивной нутритивной поддержки ожидается в возрасте до 2-х лет, когда рост целиком зависит от питания [179]. Улучшение роста наблюдалось в большинстве исследований у детей до 2-х лет. В крупном исследовании 153 младенцев на ПД, рост был лучше у детей с гастростомой по сравнению с питанием через НГЗ [180]. В исследовании 40 детей с ХБП 3-5D стадий с гастростомой (77,5% младше 5 лет; средняя продолжительность питания через гастростому составила 5,32 лет) средний показатель SDS роста увеличился до нормального диапазона (с -2,29 до -1,85), статистически значимо увеличились показатели SDS массы тела, SDS соотношения масса тела/рост и SDS ИМТ. Ни у одного из детей не развилось ожирение [348].
1.2. Анемия при ХБП
Лечения анемии при ХБП ассоциировано с замедлением прогрессирования ХБП, уменьшением гипертрофии левого желудочка, улучшением качества жизни и снижением частоты госпитализаций, снижением потребности в гемотрансфузии, а, следовательно, риска инфицирования и сенсибилизации лейкоцитарным антигеном (HLA) [181].
Назначение препаратов железа и препараты группы «другие антианемические препараты», обладающих эритропоэзстимулирующими свойствами (ЭСС) позволяет повысить уровень Hb у большинства пациентов с ХБП. Лечение анемии при ХБП включает также коррекцию прочих устранимых причин снижения Hb, например, дефицита витамина В12 и фолиевой кислоты, лечение воспалительного процесса.
Подробно терапия анемии при ХБП рассматривается отдельно (см. Клинические рекомендации "Анемия при хронической болезни почек") [79].
Целевые показатели гемоглобина у взрослых и детей с ХБП, получающих поддерживающую терапию ЭСС представлены в приложении А3.17.
1.3. Лечение кардиоваскулярной болезни при ХБП
Причиной высокой смертности и низкой продолжительности жизни больных с ХБП является именно поражение сердечно-сосудистой системы. Поэтому терапия ХБП в целом направлена на профилактику и замедление прогрессирования КВБ. Основным фактором прогрессирования поражения почек и сердечно-сосудистой системы при ХБП является АГ. С уровнем АД ассоциированы такие маркеры КВБ, как толщина интимы-медии и скорость пульсовой волны [46, 182, 311, 335]. Показано, что достижение уровня АД ниже 90-го перцентиля ассоциировано с замедлением прогрессирования ХБП у детей как с гломерулярными, так и с негломерулярными заболеваниями почек [182]. Достижение уровня АД (при офисном измерении) ниже 50-го перцентиля препятствует развитию гипертрофии миокарда левого желудочка, т.е. замедляет прогрессирование КВБ [349].
Учитывая комплексный патогенез КВБ у пациентов с ХБП, адекватная коррекция таких проявлений ХБП, как анемия, БЭН, минерально-костные нарушения также имеет большое значение для профилактики КВБ. Соответственно, принципы терапии КВБ при ХБП:
Коррекция артериальной гипертензии и гиперволемии.
Адекватная коррекция нарушений фосфорно-кальциевого обмена. Избегать гиперкальциемии, гиперфосфатемии, длительного применения высоких доз активных форм витамина Д и его аналогов.
Достижение целевого уровня Hb.
Достаточное питание.
Адекватный диализ.
Как можно более ранняя трансплантация почки.
1.3.1 Лечение артериальной гипертензии у детей с ХБП
Целями лечения АГ у больных с ХБП являются замедление прогрессирования поражения почек, предотвращение поражения органов-мишеней (сердца, головного мозга, глаз), предотвращение острых осложнений АГ (гипертонического криза, острой левожелудочковой недостаточности, нарушения мозгового кровообращения) и, в итоге, улучшение выживаемости и качества жизни пациентов.
Задача антигипертензивной терапии – снижение АД до уровня ниже 90-го перцентиля для данного пола, возраста и роста. В Европейских рекомендациях по лечению АГ у детей [135] в качестве целевого для детей с ХБП рекомендуется уровень АД ниже 75-го перцентиля у пациентов с непротеинурическими заболеваниями почек и ниже 50-го перцентиля у пациентов с протеинурическими заболеваниями. В многоцентровом исследовании HOT-KID (2023) было показано, что в группе детей с более интенсивной коррекцией АГ (целевой уровень АД <40 перцентиля при офисном измерении) индекс толщины миокарда ЛЖ был ниже, чем в группе детей с целевым АД <70 перцентиля. Таким образом, снижение АД до уровня <50 перцентиля представляется целесообразным для предотвращения прогрессирования КВБ. Однако на практике достижение этого уровня АД, особенно у детей с ХБП 5 ст., может потребовать применения нескольких антигипертензивных средств в высоких дозах, что сопряжено с риском побочных явлений антигипертензивной терапии. Согласно рекомендациям KDIGO по лечению ХБП (2024), целевым уровнем САД для детей и подростков с ХБП является 50-75 перцентиль [325].
Подробно о терапии АГ при ХБП у детей см. клинические рекомендации по артериальной гипертензии у детей и подростков.
1.3.1.1 Особенности лечения ХБП на фоне АГ
Гипергидратация и объемная перегрузка сосудистого русла вносит существенный вклад в патогенез АГ у детей с ХБП, особенно на 4-5 ст. Причиной гипергидратации при ХБП является избыточное по сравнению с физиологическим потребление натрия в условиях его сниженного выведения и последующая задержка воды. Первыми мерами по коррекции АГ у детей с ХБП должны быть контроль потребления натрия и воды и достижение «сухой массы тела» у диализных пациентов. Меры по ограничению потребления натрия особенно важны для пациентов с отеками (при нефротическом синдроме, гломерулонефритах) и для диализных пациентов с олигоанурией, у которых баланс жидкости полностью зависит от объема ультрафильтрации при процедурах ГД или ПД.
-
Рекомендуется всем детям с ХБП и отеками и/или олигоанурией соблюдать диету с содержанием натрия, не превышающим физиологическую потребность (в зависимости от возраста 200-1300 мг/сут. с целью уменьшения/предотвращения прогрессирования гипергидратации [183].
(УУР С; УДД 5)
Комментарий: У детей с ХБП без нарушения натрийуреза потребление натрия не должно превышать максимальное для данного возраста (см. приложение А3.10, А3.11) [294].
-
Не рекомендуется ограничивать потребление натрия детям с ХБП и сольтеряющими состояниями (синдром Барттера, синдром Гиттельмана, псевдогипоальдостеронизм I типа и т.д.) с целью предотвращения усугубления минеральных нарушений [49, 138, 170, 184, 185].
(УУР С; УДД 5)
Комментарий: Массовая доля натрия в поваренной соли - 40%, т.е. ежедневное потребление натрия составляет 3000-4000 мг/сут., помимо содержащегося в продуктах питания. Поскольку основное количество натрия поступает в пищу при ее приготовлении (солении, использовании вкусовых добавок, консервантов и т.п.), уменьшить содержание натрия в рационе можно следующими мерами:
- Полностью исключить соленья, консервы, копчености, колбасные изделия, полуфабрикаты, продукты фаст-фуда, снэки (чипсы, сухарики и т.п.). Ограничить потребление хлеба, особенно ржаного.
- Пищу готовят без соли. Продукты животного происхождения (мясо, рыба, молоко, яйца) содержат достаточно натрия для удовлетворения потребности. Возможно досаливание еды в тарелке, при этом количество поваренной соли не должно превышать 1-2 г/сут.
При соблюдении диеты с низким содержанием соли уменьшается жажда, пациент легче переносит ограничения питьевого режима. Постепенное снижение содержания натрия в организме приводит к сокращению объема внеклеточной жидкости, снижению ОЦК, что облегчает контроль АГ [186].
Детям с сольтеряющими состояниями ограничение натрия в диете противопоказано, поскольку может спровоцировать гипонатриемию, дегидратацию, а при длительном применении – задержку роста [170].
-
Рекомендуется контролировать объем выпитой и выделенной жидкости пациентам с ХБП с целью оценки наличия/объема задержки жидкости, а также для коррекции нутритивной поддержки [4, 187]. При сложностях с учетом диуреза (у маленьких детей, не контролирующих мочеиспускания, у пациентов со стомами, у больных с анурией) для контроля водного баланса рекомендуется ежедневное взвешивание.
(УУР В; УДД 2)
Комментарий: Обычно у детей с 5 ст. ХБП диурез контролируется ежедневно. Однако оценить баланс жидкости только по учету выпитой жидкости, диуреза и объема ультрафильтрации не всегда возможно, поскольку значительный объем жидкости употребляется с пищей (фрукты, овощи, каши, супы и т.п.), часть воды выделяется перспирацией и т.д. Ежедневное взвешивание ребенка с ХБП позволяет заподозрить гипергидратацию (при избыточной ежедневной прибавке массы тела). Детям на ПД целесообразно контролировать массу тела ежедневно, на ГД – перед каждой процедурой диализа, с целью соответствующей адаптации режима диализа, позволяющей обеспечить адекватную ультрафильтацию.
-
Рекомендуется проводить биоимпедансную спектроскопию/определение процентного соотношения воды, мышечной и жировой ткани с помощью биоимпедансметра пациентам старше 2-х лет с ХБП 5 ст. ежемесячно, с целью оценки динамики массы тела и объема экстрацеллюлярной жидкости [188, 337].
(УУР B; УДД 3)
Комментарий: Регулярное проведение биоимпедансометрии позволяет дифференцировать физиологическую прибавку мышечной и жировой массы от прибавки массы тела, связанной с увеличением объема экстрацеллюлярной жидкости. Приемы адаптации режима ПД и процедур ГД с целью увеличения ультрафильтрации изложены в соответствующем разделе.
-
Рекомендуется элиминация традиционных модифицируемых факторов риска у подростков с ХБП и АГ: отказ от курения, профилактику гиподинамии (умеренную физическую нагрузку), нормализацию избыточной массы тела, в соответствии с клиническими рекомендациями по диагностике, лечению и профилактике АГ у детей и подростков [70].
(УУР С; УДД 5)
Комментарий: Детям и подросткам с ХБП 3-5 ст. следует избегать редукционных диет с резким ограничением калорийности, приводящих к быстрому похуданию. Несбалансированное питание может спровоцировать электролитные расстройства, усиленный катаболизм – рост азотемии. В то же время, у детей избыточная масса тела сама по себе не является достоверно значимым фактором прогрессирования ХБП [61]. В исследованиях у взрослых пациентов показана лучшая выживаемость диализных пациентов с ожирением по сравнению с больными с нормальной массой тела, то есть у диализных пациентов достаточная жировая и мышечная масса является прогностически благоприятным фактором [189]. По нашим наблюдениям, диализные пациенты с дефицитом массы тела, с недостаточно развитой подкожной клетчаткой хуже переносят как дегидратацию, так и гипергидратацию, вероятно, вследствие отсутствия резервов для перераспределения экстрацеллюлярной жидкости. Даже минимальная гипергидратация у них приводит к повышению АД вследствие увеличения ОЦК.
У детей с ХБП и АГ медикаментозная терапия назначается одновременно с немедикаментозными методами коррекции АГ согласно клиническим рекомендациям по артериальной гипертензии у детей и подростков. Препаратами выбора для детей с ХБП 1-3 и 5д стадий являются иАПФ/БРА в максимально переносимой дозе вследствие их нефро- и кардиопротективного действия [335]. Назначаются под контролем АД, уровня калиемии и СКФ.
При остром подъеме АД у детей и подростков резко возрастает риск поражения органов-мишеней: нарушения мозгового кровообращения, отека мозга, поражения белого вещества (синдром задней обратимой энцефалопатии, или PRES-синдром); кровоизлияния в сетчатку; нарушения коронарного кровообращения, острой левожелудочковой недостаточности. В случае гипертонического криза терапия должна быть назначена безотлагательно. В то же время, у пациентов с длительно существующей АГ быстрая (в течение нескольких часов) нормализация АД также может привести к нарушению мозгового и коронарного кровообращения.
Целью лечения гипертонического криза является контролируемое снижение АД до безопасного уровня для предотвращения осложнений.
Подробно о терапии АГ при ХБП у детей см. клинические рекомендации по артериальной гипертензии у детей и подростков.
1.3.2 Лечение сердечной недостаточности у детей с ХБП
В подавляющем большинстве случаев сердечная недостаточность у детей с ХБП является следствием гипергидратации и неконтролируемой АГ. При этом и избыток внеклеточной жидкости, и снижение сократимости миокарда поначалу компенсированы и практически бессимптомны. Однако при нарастании гипергидратации и/или АГ наступает декомпенсация с развитием острой левожелудочковой недостаточности и отека легких. Следовательно, основной мерой профилактики и лечения сердечной недостаточности у детей с ХБП является поддержание нормогидратации и нормотензии. Контролируемых исследований по терапии СН у детей с ХБП не проводилось, доказательная база отсутствует. Рекомендации по терапии СН у детей с ХБП основаны на экстраполяции результатов исследований, проведенных у взрослых больных с ХБП и КВБ, и на мнении экспертов и, в основном, проводятся по общим принципам терапии сердечной недостаточности у детей [47, 71, 135].
-
Рекомендуется назначать низконатриевую диету детям с ХБП и сердечной недостаточностью с целью предупреждения/уменьшения гиперволемии [135].
(УУР С; УДД 5)
Комментарий: Меры по ограничению потребления натрия с пищей изложены выше.
-
Рекомендуется у диализных пациентов с сердечной недостаточностью проводить мероприятия по скорейшему купированию гипергидратации с целью снижения риска сердечно-сосудистых осложнений [135].
(УУР C; УДД 5)
Комментарий:
- Детям на ПД круглосуточно проводить обмены диализного раствора с повышенной концентрацией глюкозы и укороченной экспозицией (1-2 часа) Интенсивный ПД проводят до достижения нормогидратации и разрешения симптомов отека легких. После стабилизации состояния ребенок может быть переведен на прежний режим ПД с ежедневным контролем массы тела и объема ультрафильтрации.
- Детям на ГД обеспечить постепенное достижение «сухой массы тела». Следует отдать предпочтение продолженным методам (продолженному вено-венозному ГД или ГДФ), поскольку они оказывают менее выраженные гемодинамические эффекты, чем интермиттирующий ГД, и обеспечивают постепенную, длительную ультрафильтрацию. При отсутствии возможности проведения продолженных процедур, предпочтительнее ежедневные процедуры ГД с ограниченной ультрафильтрацией. У пациентов с сердечной недостаточностью и гипергидратацией следует избегать одномоментно высоких объемов ультрафильтрации (более 3% от массы тела), поскольку резкое снижение ОЦК может вызвать коллапс, падение коронарного кровотока и острую ишемию миокарда
Для определения «сухой массы тела» и целевого объема ультрафильтрации диализным пациентам с сердечной недостаточностью целесообразно проведение биоимпедансометрии (см. выше).
Антигипертензивная терапия пациентам с ХБП и сердечной недостаточностью проводится по вышеизложенным принципам.
Эффективный контроль АГ крайне важен для детей с сердечной недостаточностью. Препаратами выбора являются иАПФ/Антагонисты рецепторов ангиотензина II (подробнее - см. Клинические рекомендации по артериальной гипертензии у детей и подростков). Ингибиторы АПФ/Антагонисты рецепторов ангиотензина II противопоказаны при ХБП 4 ст. (СКФ <30 мл/мин), но могут применяться на диализной стадии ХБП. Выбор иАПФ/БРА в качестве первой линии антигипертензивной терапии при ХБП и сердечной недостаточности обусловлен как их нефропротективными, так и кардиопротективными свойствами (иАПФ/БРА замедляют процессы ремоделирования сосудистой стенки и гипертрофии миокарда при ХБП) [335, 350].
-
Рекомендуется применять диуретики пациентам с ХБП 1-4 стадии при сердечной недостаточности на фоне артериальной гипертензии и с целью купирования гипергидратации [138].
(УУР C; УДД 5)
Комментарий: назначение диуретиков варьирует в зависимости от стадии ХБП. Антагонист альдостерона (спиронолактон**) может применяться у детей на 1-3 ст ХБП с тщательным контролем уровня калия в крови (по инструкции – противопоказан детям младше 3 лет). При ХБП 4-5 ст его применение не показано из-за высокого риска гиперкалиемии. Противопоказано сочетание спиронолактона** с иАПФ/Антагонистами рецепторов ангиотензина II.
Тиазидные диуретики (гидрохлоротиазид**) при сердечной недостаточности целесообразно назначать детям с ХБП 1-3 ст, НК IIA, умеренной гипергидратацией (разрешен по инструкции детям с 3 лет). Тиазидные диуретики могут применяться в сочетании с иАПФ/Антагонисты рецепторов ангиотензина II. При снижении СКФ <30 мл/мин тиазидные диуретики неэффективны.
«Петлевые диуретики» (фуросемид**) (как правило, парентерально) показаны детям с НК IIБ-III, задержкой жидкости, отеками на любой стадии ХБП. С целью скорейшего купирования гипергидратации, фуросемид** может применяться на диализной стадии ХБП у больных с остаточной функцией почек, в дополнение к проведению интенсивного ПД или ГД. Длительный прием фуросемида** может спровоцировать гипокалиемию, которая особенно нежелательна на фоне применения дигоксина**.
При применении «петлевых» и тиазидных диуретиков у пациента с сердечной недостаточностью и ХБП следует регулярно (не менее 2-х раз в неделю до стабилизации состояния) контролировать уровень калия и натрия в сыворотке крови. При развитии гипонатриемии, гипокалиемии показана коррекция дозы диуретика и назначение дотации калия перорально или внутривенно.
-
Рекомендуется использовать у пациентов с ХБП и с HK IIБ-III ст. препараты, обладающие инотропным действием, при значительном снижении сократительной способности миокарда (фракция выброса ЛЖ по данным Эхо-КГ <40%) в соответствии с клиническими рекомендациями по хронической сердечной недостаточности у детей [190].
(УУР С; УДД 5)
Комментарий: Лечение - см клинические рекомендации "Хроническая сердечная недостаточность у детей".
Адренергические и дофаминергические средства (Негликозидные инотропные препараты быстрого действия: (например, добутамин** и др.) используют при острой декомпенсации кровообращения с резким снижением сердечного выброса, падением АД. Назначаются врачом-анестезиологом-реаниматологом, вводятся путем длительной медленной инфузии в условиях палаты интенсивной терапии, под постоянным мониторным контролем АД и ЭКГ.
Добутамин** стимулирует бета1-адренорецепторы миокарда и вызывает положительный инотропный эффект. Умеренно увеличивает ЧСС, ударный и минутный объем сердца, снижает ОПСС и сосудистое сопротивление в малом круге кровообращения. Системное АД существенно не понижается. Увеличивает коронарный кровоток, способствует улучшению снабжения миокарда кислородом, уменьшает давление наполнения желудочков сердца. Эффект развивается через 1–2 мин и достигает максимума через 10 мин.
При острой НК добутамин** назначается в дозе 5-10 мкг/кг/мин. Добутамин** метаболизируется в печени, уменьшения дозы у детей со снижением функции почек не требуется. Детям назначается с осторожностью, при непрерывном мониторировании витальных функций в условиях ОРИТ.
1.4. Минерально-костные нарушения при ХБП
Целью терапии МКН-ХБП является как профилактика, так и лечение вторичного гиперпаратиреоза (ВГПТ), приводящего к нарушениям структуры кости и тяжелым последствиям со стороны сердечно-сосудистой системы. При этом следует помнить о возможности развития адинамической болезни кости, возникающей в результате некорректного и/или чрезмерного лечения гиперпаратиреоза. Адекватная терапия включает коррекцию высокого уровня фосфора при поддержании нормального уровня кальция в сыворотке крови, восполнение потребности витамина D и коррекция аномального уровня ПТГ.
-
Рекомендуется у пациентов с ХБП 3-5Д стадии (реже у пациентов с ХБП 2 стадии) с гиперфосфатемией проводить лечение, обеспечивающее достижение целевого/нормального уровня P, в соответствии с референсными пределами для конкретной лаборатории с целью снижения рисков неблагоприятных клинических последствий [191].
(УУР С; УДД 5)
Комментарий: Рекомендация основана на результатах крупных метаанализов во взрослой популяции, которые указывают на повышение смертности от сердечно-сосудистых событий при превышении концентраций P сыворотки крови выше верхней границы референсных значений (>1,48 ммоль/л) [192]. Следует помнить о том, что нормальный уровень фосфата в сыворотке крови варьирует в разные периоды детства (см. приложение А3.18): самый высокий у младенцев до трех месяцев, затем постепенно снижается с ростом ребенка [193]. Для достижения целевого уровня фосфата в сыворотке крови существуют два основных пути: диетическое ограничение фосфора и использование фосфат-связывающих веществ - Препаратов для лечения гиперкалиемии и гиперфосфатемии (фосфат-биндеров). Для определения наиболее эффективной тактики снижения уровня фосфора следует учитывать следующее: функциональные возможности почек, способность экскреции Р; количество Р, поступающее с питанием и лекарствами; наличие БЭН; необходимость парентерального питания; выраженность метаболического ацидоза; эффективность процедур заместительной почечной терапии и возможности интенсификации диализной терапии; концентрацию (избыток или недостаток) витамина D; правильность приема препаратов для снижения уровня Р (Препаратов для лечения гиперкалиемии и гиперфосфатемии); тяжесть клинических проявлений ВГПТ и чувствительность костной ткани к интактному ПТГ.
-
Рекомендуется пациентам с ХБП уменьшить пищевой фосфор до возрастной нормы (DRI), когда концентрация ПТГ в сыворотке крови превышает целевой диапазон для стадии ХБП, а уровень фосфата в сыворотке крови находится в пределах нормы [4].
(УУР С; УДД 5)
Комментарий: потребность в пищевом фосфоре – в приложениях А3.8, А3.9, референсный предел концентрации фосфора в сыворотке крови – в приложении А3.18, целевой диапазон ПТГ, фосфора и кальция для стадий ХБП представлен в приложении А3.19.
У детей с повышением и ПТГ, и уровня фосфата в сыворотке крови пищевой фосфор должен быть дополнительно ограничен до 80% DRI [194] при сохранении адекватного потребления белка (см. приложение А3.12, А3.13). На фоне гипофосфатной диеты необходим контроль уровня фосфора в сыворотке крови не реже, чем 1 раз в 3 месяца при ХБП 3-4 стадии и ежемесячно при ХБП 5 ст.
Ограничение фосфора в пище может привести к снижению фосфора без применения препаратов для лечения гиперфосфатемии (Препаратов для лечения гиперкалиемии и гиперфосфатемии). Помимо пищевого органического фосфора (белки растительного и животного происхождения - Таблица в приложении А3.7) не следует забывать об ограничении потребления неорганического фосфора, содержащегося в пищевых добавках (антиоксиданты: E338-E343, E442, E450-E452, эмульгаторы: E544-E545). Процент их абсорбции в кишечнике составляет 80-100%. Об эффективности такого подхода свидетельствуют данные нескольких РКИ [195, 196, 197]. Органический фосфор на растительной основе имеет низкую биодоступность 20-40%, P животного происхождения имеет уровень биодоступности 40-70%.
Продукты питания с низким содержанием фосфора позволяют частично компенсировать потребность и создают положительный баланс фосфора в организме без значительного риска развития БЭН. При коррекции потребления пищевого фосфора при ХБП 3-4 стадии учитывается степень снижения экскреции фосфора (P) почками в зависимости от СКФ: на 30 мг Р/сут на каждые 10 мл/мин/1,73 м2 при СКФ 70-40 мл/мин/1,73 м2; на 100 мг Р/сут на каждые 10 мл/мин/1,73 м2 при СКФ <40 мл/мин/1,73 м2.
Следует избегать снижения уровня фосфатов в сыворотке крови ниже рекомендуемого уровня, так как гипофосфатемия может иметь негативные последствия для процесса минерализации кости и линейного роста пациента, приводит к значительным нарушениям КОС и основного обмена [194, 195, 196, 197].
-
Рекомендуется пациентам с ХБП 3-5 ст. умеренное ограничение потребления фосфора с пищей для контроля уровня фосфора в сыворотке крови [4, 110].
(УУР С; УДД 5)
Комментарий: Эффективность данного подхода подтверждена мета-анализом рандомизированного клинического исследования (взрослые пациенты). Достоверный положительный эффект достигается при выполнении рекомендаций в течении минимум 4-х месяцев. Врач-нефролог самостоятельно или совместно с врачом-диетологом предоставляют пациенту и его родителям необходимые знания и навыки для обеспечения правильного питания, профилактики и лечения гиперфосфатемии [198, 199, 200, 201, 202].
-
Рекомендуется пациентам с додиализной и диализной стадией ХБП назначение препаратов, обладающих фосфат-связывающим эффектом - Препараты для лечения гиперкалиемии и гиперфосфатемии (фосфат-биндеров), когда диетические меры недостаточно эффективны для контроля сывороточного уровня фосфора и/или ПТГ [195, 203, 204].
(УУР C; УДД 5)
Комментарий: Учитывая, что функция Препаратов для лечения гиперкалиемии и гиперфосфатемии (фосфат-связывающих препаратов/биндеров) заключается в предотвращении всасывания фосфора с пищей, все препараты для лечения гиперфосфатемии следует принимать за 10–15 минут до или во время еды (см. приложение А3.21). Поскольку их способность связывать фосфаты ограничена, есть необходимость соблюдать также диетические предписания по ограничению пищевого фосфора.
Самыми доступными в этой группе препаратов являются препараты кальция. Применяется карбонат кальция и ацетат кальция (в РФ зарегистрированы как биологически активные добавки) [129].
При назначении препаратов кальция следует учитывать, что общее потребление элементарного кальция (включая пищевой кальций) не должно превышать 200% DRI (суточной потребности), не более 2500 мг/сут. для подростков и молодых взрослых [194].
Препараты кальция (Кальций-содержащие фосфат-биндеры) не должны использоваться в качестве монотерапии у пациентов с гиперкальциемией. Для этой группы пациентов предпочтительны Препараты для лечения гиперкалиемии и гиперфосфатемии («не кальций-содержащие» биндеры), например севеламер** (начальная доза 121±50 мг/кг/сут. до 163 ± 46 мг/кг/сут.) (назначение в педиатрической практике разрешено в форме порошка для приготовления суспензии для приема внутрь с возраста 6 лет, или если площадь поверхности тела более 0,75 м2) [205, 342].
Препараты алюминия (алюминий-содержащие фосфат-биндеры) не следует использовать при ХБП из-за их токсичности, связанной с алюминием, а также потому, что цитрат кальция увеличивает абсорбцию алюминия. Препараты магния (фосфат-биндеры на основе магния также имеют ограниченное применение из-за риска гипермагниемии, гиперкалиемии и диареи [204]. Препараты для лечения гиперкалиемии и гиперфосфатемии (фосфат-биндеры, содержащие лантана карбонат и препараты железа) до настоящего времени широко не использовались в педиатрической практике. В настоящее время продолжаются многоцентровые исследования этих препаратов.
-
Рекомендуется пациентам с ХБП терапия с назначения нативного витамина D и его аналогов (#эргокальциферол или #колекальциферол**) при ХБП 2–5D ст., когда уровни 25(OH)D в сыворотке крови ниже 30 нг/мл (дозировки см. в приложении А3.22) [4, 128, 204, 351].
(УУР С; УДД 5)
Комментарий: Дефицит витамина D выявляется у большинства детей с ХБП и способствует дальнейшему прогрессированию ХБП. Определение статуса витамина D (см. приложение А3.22) и терапия нативным витамином D и его аналогами и/или активными формами витамина D (см. приложение А3.23) в случае его дефицита играют важную роль в успехе терапии МКН-ХБП.
Терапия витамином D и его аналогами разделена на 2 этапа: 1-й - интенсивное восстановление концентрации витамина D (продолжительность до 3 месяцев под контролем 25(OH)D); 2-й - поддерживающая фаза. Лечение витамином D и его аналогами следует прекратить или уменьшить дозу, когда концентрация 25(OH)D превышает 48-50 нг/мл) и/или в случае гиперкальциемии.
-
Рекомендуется у пациентов с ХБП 3-5D ст. и признаками ВГПТ корректировать недостаточность или дефицит 25(ОН)D в крови назначением #колекальциферола** до назначения активных форм витамина D и его аналогов (альфакальцидол**, #кальцитриол**) (применяется у детей с 10 лет в основном при почечно-печеночной недостаточности в начальной дозе 1 мкг х 3 раза в неделю, затем доза повышается на 0,5 мкг, если уровень фосфора в крови и кальция в крови менее 6,5 и 10 мкг/дл соответственно, далее – ежедневно 0.45 ± 0.15 мкг или 15,1 нг 3.5 нг/кг), парикальцитол**(капсулы для детей с 10 лет для профилактики и лечения вторичного гиперпаратиреоза, развивающегося при ХБП 3 и 4 стадии. Хроническая болезнь почек 5 стадии) с целью снижения интактного ПТГ [129, 223, 352, 353].
(УУР А; УДД 2)
Комментарий: Физиологической основой для использования #колекальциферола** на первом этапе коррекции ВПТГ (или в сочетании с активными формами витамина D и его аналогов) является его 1-альфа-гидроксилазная активность в экстраренальных клетках, что дает возможность периферического превращения 25(ОН)D в кальцитриол. Применение #колекальциферола** снижает уровень иПТГ при незначительном изменении уровня кальция и фосфора в сыворотке крови.
Следует проводить энтеральную дотацию витамина D у детей с ХБП в зависимости от степени дефицита сывороточного 25(OH)D: при тяжелом дефиците витамина D (менее 5 нг/мл) — доза витамина D 8000 МЕ/сут 4 недели, затем 4000 МЕ/сут в течение 2 месяцев. При дефиците витамина D 5-15 пг/мл — доза витамина D 4000 МЕ/сут 3 месяца. При уровне сывороточного 25(OH)D (16-30 нг/мл) — доза витамина D 2000 МЕ ежедневно не менее 3 месяцев. После определения концентрации витамина D (в динамике) – определение тактики дальнейшей коррекции дефицита витамина D (приложение А3.22) [4].
Для коррекции ВГПТ при недостаточности (20-29 нг/мл) и дефиците (<20 нг/мл) витамина D необходимо достижение концентрации 30-50 нг/мл [209]. Лечение колекальциферолом** следует прекратить, если концентрация 25(ОН)D в сыворотке превышает >50 нг/мл и/или, когда уровень общего кальция в сыворотке превышает 10,5 мг/дл (2,62 ммоль/л).
Коэффициенты перевода единиц измерения из метрической системы в международную систему единиц (СИ) – в приложении А 3.14.
-
Рекомендуется пациентам с ХБП 3-5D стадии с уровнем иПТГ выше целевых значений и нормальной концентрацией 25(ОН)D и при отсутствии противопоказаний с целью коррекции ВГПТ назначить стартовую терапию активными метаболитами витамина D и его аналогами (альфакальцидолом** (режим дозирования в соответствии с инструкцией), #кальцитриолом** (детям с массой тела <10 кг – 0,05 мкг через день, с массой тела 10-20 кг – 0,1 - 0.15 мкг ежедневно, с массой тела >20 кг – 0,25 мкг ежедневно [129].
(УУР С; УДД 5)
или
-
#парикальцитолом**(off label до 18 лет в виде раствора для внутривенного введения и до 10 лет в лекарственной форме капсулы). Капсулы - назначаются детям с 10 лет с ХБП 3-4 ст: - стартовая доза 1 мкг/сут. 3 раза в неделю, но не чаще, чем 1 раз в 2 дня). Доза подбирается индивидуально с учетом уровня иПТГ (целевой уровень иПТГ для детей с ХБП 3 ст. 35-69 пг/мл, с ХБП 4 ст. 70-110 пг/мл), сывороточных концентраций кальция и фосфора [210]. Внутривенно #парикальцитол** вводится только пациентам с ХБП 5D ст. после проведения сеанса ГД по жизненным показаниям (off label) в стартовой дозе 0,04 мкг/кг, если исходный уровень паратиреоидного гормона в крови <500 нг/л или 0,08 мкг/кг, если исходный уровень паратиреоидного гормона в крови >500 нг/л. Дозу увеличивают на 0,04 мкг/кг каждые 2 недели до тех пор, пока уровень-ПТГ не снизился на 30% по сравнению с исходным или до достижения уровня кальция более 11 мг/дл (>2,74 ммоль/л) или кальций-фосфорное произведение (Ca x P) более 75 мг2/дл2 (>6,04 ммоль2/л2) [206].
(УУР С; УДД 5)
Комментарий: Лечение указанными препаратами при ХБП 3-5D стадии, связано со снижением фатальных кардиоваскулярных событий [211, 212, 213, 214, 215]. Лечение любым из указанных препаратов сопряжено с более известными рисками развития гиперкальциемии, что следует учитывать при выборе этих препаратов (не назначaть при гиперкальциемии) и при мониторировании эффекта терапии. В целом, #парикальцитол** и #кальцитриол** не имеют существенных различий по влиянию на концентрации Ca, P, активность ЩФ, нежелательных явлений (исследования проводились у взрослых пациентов на диализе [216, 217, 218].
Активные формы витамина D и его аналоги (#кальцитриол**(детям с массой тела <10 кг – 0,05 мкг через день, с массой тела 10-20 кг – 0,1 - 0,15 мкг ежедневно, с массой тела >20 кг – 0,25 мкг ежедневно [129], альфакальцидол**), следует вводить, когда уровень ПТГ превышает целевое значение, а уровень 25(OH)D в сыворотке превышает 30 нг/мл, при отсутствии гиперкальциемии и гиперфосфатемии [206]. Активные формы витамина D и его аналогов доказали свою эффективность в контроле уровня ПТГ. Нет объективных доказательств, подтверждающих выбор одного из других. Есть указания, что более селективные препараты витамина D и его аналогов (альфакальцидол**) а также #парикальцитол** (противопоказан по Инструкции детям до 10 лет в лекарственной форме капсулы и до 18 лет в виде раствора для внутривенного введения) обычно предпочтительны для пациентов с гиперкальциемией на фоне приема #кальцитриола**. Следует использовать самую низкую дозу для достижения целевых концентраций иПТГ и поддержания нормокальциемии. После начала терапии уровни кальция и фосфора в сыворотке следует измерять не реже одного раза в месяц (первые 3 месяца), далее - не реже одного раза в три месяца. Достижение целевого значения иПТГ в сыворотке крови детей с МКН-ХБП является один из основных направлений в консервативной терапии ХБП.
Терапевтический алгоритм, описанный выше (ограничение пищевого фосфора, Препараты для лечения гиперкалиемии и гиперфосфатемии (фосфат-биндеры), препараты кальция а также витамина D и его аналогов, #парикальцитола**) не всегда эффективен для снижения концентрации иПТГ. У отдельных пациентов со стойким гиперпаратиреозом, следует рассмотреть возможность применения прочих препаратов, снижающих уровень иПТГ. #Цинакальцет** (off label в детском возрасте; небольшое количество исследований показывают эффективность препарата у детей; в различных исследованиях применялись следующие дозы #цинакальцета**: инициация - 0,18-0,5 мг/кг/сут., максимальные 0,25-4,2 мк/кг/сут.). #Цинакальцет** увеличивает чувствительность кальций-рецепторов паращитовидной железы, что приводит к подавлению секреции ПТГ. У детей опыт применения препарата ещё невелик, но имеющиеся уже данные свидетельствуют о его эффективности в снижении уровня ПТГ. Однако, риск развития гипокальциемии на фоне терапии #цинакальцетом** требует продолжение исследования безопасности препарата [219, 354].
-
Рекомендуется у пациентов с ХБП избегать уровня иПТГ ниже целевого диапазона с целью профилактики развития адинамической болезни кости [220, 221].
(УУР С; УДД 5)
Комментарий: Низкие уровни иПТГ (ниже «целевого уровня») в сыворотке крови могут привести к развитию адинамической болезни кости, которая развивается из-за угнетения остеокластов и остеобластов, снижения скорости образования остеоида. Адинамическая болезнь может привести к диффузному снижению минерализации, кальцификации сосудов, выраженной задержке роста, патологическим переломам. При адинамической болезни кости уровень иПТГ ниже целевого, нормальная активность ЩФ, Са и Р нормальные или повышены. Основными лечебными мероприятиями являются снижение дозы или отмена витамина D и его аналогов до нормализации уровня иПТГ. Возможно применение #кальцитриола** по 35 нг/кг 2 р./нед. [222]. Начальная доза #кальцитриола** во время прерывистой терапии #кальцитриолом** составляла 1,0 мкг 3 раза в неделю, дозу увеличивали на 0,5 мкг, если уровни фосфора и кальция в сыворотке были ниже 6,5 мг/дл (2,09 ммоль/л) и 10 мг/дл (2,5 ммоль/л) соответственно [223].
-
Рекомендуется пациентам с ХБП 5D консервативные методы лечения сочетать с повышением элиминации фосфора за счет увеличения длительности и/или частоты процедур заместительной почечной терапии (гемодиализ, перитонеальный диализа) с целью достижения целевого уровня P и минимизации количества препаратов для лечения гиперфосфатемии [191].
(УУР С; УДД 5)
Комментарий: У пациентов с ХБП 5Д ст. диализ имеет главное значение в контроле концентрации фосфора в сыворотке крови (Исследование уровня неорганического фосфора в крови). После стандартного 4-часового ГД количество выведенного из организма фосфора почти соответствует его суточному потреблению с пищей. Выведение фосфора посредством методов заместительной почечной терапии существенно для нормализации концентрации фосфора в крови и для контроля перегрузки организма фосфатами. Увеличение интенсивности диализа (в большей степени за счет его продолжительности) является основным шагом в коррекции гиперфосфатемии у пациентов, зависимых от заместительной почечной терапии [224, 225, 226].
-
Не рекомендуется рутинное назначение препаратов для лечения гиперкалиемии и гиперфосфатемии у пациентов с МКН-ХБП так как в большинстве случаев достаточно адекватной компенсации немедикаментозными методами [227].
(УУР С; УДД 5)
Комментарий: Нецелесообразно широкое применение различных групп препаратов для лечения гиперкалиемии и гиперфосфатемии у пациентов ХБП 3-5 стадии. Первым этапом следует использовать все возможности немедикаментозной коррекции (адекватная диета, дозированные физические нагрузки, непрерывный контроль за прогрессированием ХБП). Ограничение применения препаратов для лечения гиперкалиемии и гиперфосфатемии, содержащих кальций, продиктовано представлениями о неблагоприятных последствиях перегрузки кальцием в отношении метаболизма костной ткани и сердечно-сосудистой системы, высокого риска кальцифилаксии [192]. Вопрос безопасности препаратов для лечения гиперкалиемии и гиперфосфатемии при МКН-ХБП остается не вполне определенным, что не позволяет рекомендовать широкое применение препаратов, корригирующих уровень фосфора в рутинной практике. В случае высокого риска прогрессирования кальцификации и возникновения сердечно-сосудистых событий применение препаратов для лечения гиперкалиемии и гиперфосфатемии, не содержащих в своем составе кальций, более оправдано [228, 229].
-
Рекомендуется пациентам с МКН-ХБП медикаментозное лечение гиперфосфатемии препаратами, не содержащими кальций, при стойкой гиперфосфатемии при невозможности или неадекватности диетической коррекции фосфора и при нормальном или повышенном уровне кальция в сыворотке крови [227].
(УУР С; УДД 5)
Комментарий: При применении препаратов-биндеров для лечения гиперфосфатемии кишечная абсорбция P снижается не более чем на 200-300 мг/сутки, что не обеспечивает нейтральный баланс фосфора без ограничения его в диете и элиминации при проведении заместительной почечной терапии у пациентов с ХБП 5 ст.
-
Рекомендуется у пациентов с додиализной стадией ХБП считать целевыми значения циркулирующего интактного паратиреоидного гормона в пределах до 50%-го превышения верхней границы нормы (норма 10-65 пг/мл) с целью оценки рисков развития и прогрессирования осложнений МКН-ХБП и своевременной терапевтической коррекции [233, 234, 235, 236].
(УУР С; УДД 5)
Комментарий: В ряде когортных исследований продемонстрировано, что повышение иПТГ выше нормы у пациентов с ХБП 3-5 ст., связано с рисками неблагоприятных событий. При постоянном приросте иПТГ >2-х норм целесообразно начинать корригирующую метаболическую терапию.
-
Рекомендуется у пациентов с ХБП 5D ст. проводить лечение ВГПТ при стойком более чем 4-кратном повышении концентрации иПТГ (>260-300 пг/мл) с целью достижения целевых концентраций иПТГ для этой категории пациентов (в интервале 2-4-х кратного превышения верхней границы нормы (130-260 пг/мл)) для предупреждения клинических осложнений ВГПТ и снижения риска фатальных событий [227, 230, 231].
(УУР С; УДД 5)
Комментарий: В цитируемом исследовании продемонстрирована тенденция к увеличению рисков фатальных событий при увеличении концентрации иПТГ в диапазоне 250-600 пг/мл. Во всех анализируемых исследованиях максимальные риски смерти отмечены при иПТГ >600 пг/мл. Таким образом, очевидно, что лечение ВГПТ следует начинать при стойком повышении иПТГ >250-300 пг/мл, стараясь предупредить его повышение до уровня >600 пг/мл.
Существенная доля случаев запоздалого назначения терапии при ориентировке на более широкий диапазон нормы (о+т 2 до 9 норм по рекомендациям KDIGO) связана с более выраженными осложнениями ВГПТ и повышением смертности, а также снижением ответа на терапию из-за необратимых изменений околощитовидных желез [237, 238].
-
Рекомендуется у пациентов с ХБП 5D ст. с гиперкальциемией проводить лечение, направленное на достижение нормального уровня общего и ионизированного Ca в крови, для снижения рисков неблагоприятных событий. У пациентов, получающих заместительную почечную терапию есть дополнительная возможность коррекции гиперкальциемии с применением диализных растворов с низким содержанием кальция [35].
(УУР С; УДД 5)
Комментарий: Необходимость коррекции гиперкальциемии обусловлена существенным повышением рисков фатальных событий.
-
Рекомендуется у пациентов с ХБП 3-5D ст. с гипокальциемией проводить ее коррекцию только при наличии клинических симптомов, связанных со снижением уровня общего кальция в крови для снижения риска неблагоприятных клинических последствий. Не рекомендуется проводить терапию бессимптомной гипокальциемии [35].
(УУР С; УДД 5)
Комментарий: Легкая гипокальциемия при ХБП 3-5D стадии чаще бессимптомная, не связана с повышенными рисками фатальных исходов и ассоциирована со снижением общей смертности [239]. Следует провести лечение, направленное на коррекцию выраженной и симптоматической гипокальциемии для предотвращения неблагоприятных последствий (прогрессирования ВГПТ и остеодистрофии, нарушения внутрисердечной проводимости/увеличение интервала QTc).
-
Рекомендуется у пациентов с ХБП 5D ст. с персистирующим уровнем иПТГ >600 пг/мл на фоне комплексной медикаментозной терапии в сочетании с гиперкальцемией, кальцифилаксией, гиперфосфатемией, развитием фиброзного остеита, внескелетной кальцификацией выполнение паратиреоидэктомии с целью снижения риска фатальных событий и улучшения выживаемости [232].
(УУР С; УДД 4)
Комментарий: Следует отметить, что данная клиническая ситуация крайне редкая в педиатрической практике. В наблюдательных исследованиях (около 25000 пациентов ХБП с ВГПТ, взрослая когорта) показано существенное снижение смертности после паратиреоидэктомии (на 30%) в сравнении с медикаментозной терапией, включая прочие препараты, регулирующие фосфорно-кальциевый обмен [240, 241].
-
Рекомендуется пациентам с ХБП после трансплантации почки рассмотреть возможность лечения витамином D и его аналогами (например, #кальцитриолом** (детям с массой тела <10 кг – 0,05 мкг через день, с массой тела 10-20 кг – 0,1 - 0,15 мкг ежедневно, с массой тела >20 кг – 0,25 мкг ежедневно [129] или #альфакальцидолом** 0,25 мкг/сут. перорально [242]).
(УУР С; УДД 5)
Комментарий: У пациентов с ХБП продолжение коррекции МКН-ХБП под контролем основных биохимических параметров (Исследование уровня общего кальция в крови, Исследование уровня неорганического фосфора в крови, Определение активности щелочной фосфатазы в крови, Исследование уровня паратиреоидного гормона в крови, Исследование уровня 25-ОН витамина Д в крови) после проведенной трансплантации почки необходимо как минимум в течение 12 месяцев. Недостаточно данных для назначения лечения спустя 12 месяцев после трансплантации почки. Безопасность #деносумаба**, бифосфонатов остается областью исследований [243, 244].
-
Не рекомендуется рутинное проведение радикальной ортопедической коррекции пациентов со сформированными деформациями костей у детей с ХБП до нормализации биохимических параметров, характеризующих минерализацию костной ткани [220, 221].
(УУР С; УДД 5)
Комментарий: не следует проводить радикальную ортопедическую коррекцию в раннем периоде после проведения трансплантации почки у детей с длительным этапом МКН (переломы, ложные суставы, последствия эпифизиолизов, значительная деформация длинных трубчатых костей ног) при диализзависимой ХБП.
Длительно сохраняющиеся нарушения костной плотности у ребенка с функционирующим трансплантатом и некомпенсированными биохимическими показателями МКН-ХБП приводят к неблагоприятному результату оперативного лечения.
-
Рекомендуется посильная физическая активность пациентам с ХБП в связи с ее положительным эффектом на костную ткань [6, 110, 245].
(УУР С; УДД 5)
Комментарий: Применяются: лечебная физкультура, ношение ортезов, оздоровительный массаж, плавание) и метаболическая коррекция по показаниям.
Данные мероприятия проводятся, в том числе, в течение 2-3 лет после трансплантации почки.
Это обеспечивает нормализацию минеральной плотности кости и благоприятный отдаленный результат оперативной ортопедической коррекции. Необходимо проведение дополнительного многоцентрового исследования минеральной плотности костной ткани у детей после трансплантации почки в раннем и отдаленном периоде.
Базовые Рекомендации KDIGO/2017 для врачей-нефрологов и специалистов других профилей, осуществляющих наблюдение и лечение пациентов с МКН-ХБП, представляют практический инструмент для объективности принятия клинических решений и оказания высококачественной помощи. Большинство рекомендаций руководства находятся на уровне "мы предлагаем" и подтверждаются "низким" уровнем доказательности. Это прежде всего подчеркивает наличие потенциальных важных проблем и возможности поиска путей для их решения.
1.5. Терапия при задержке роста у детей с ХБП
Терапия задержки роста у пациентов с ХБП складывается из коррекции нарушений питания, метаболического ацидоза, анемии, минерало-костных нарушений, обеспечения адекватной дозы диализа и лечения соматропином**. Прежде чем рассматривать терапию соматропином**, необходимо оценить роль всех перечисленных выше факторов, ограничивающих рост, которые должны подвергаться адекватному контролю.
-
Рекомендуется пациентам с ХБП перед началом терапии соматропином** определить скорость роста с расчетом как минимум за 6 месяцев, сравнивая рост и скорость роста со стандартизированными графиками роста. Для оценки и выявления факторов, ограничивающих рост, исследование уровня креатинина, рСКФ, мочевины, альбумина, общего и ионизированного кальция, неорганического фосфора, определение активности щелочной фосфатазы в крови, бикарбонат (Исследование уровня буферных веществ в крови), исследование уровня паратиреоидного гормона, 25-OH витамина Д, инсулиноподобного ростового фактора I в крови (ИФР-1), уровня глюкозы в крови, гликированного гемоглобина в крови, концентрацию гормонов, характеризующих функцию щитовидной железы (исследование уровня тиреотропного гормона (ТТГ) и свободного трийодтиронина (СТ3) в крови), провести осмотр глазного дна (офтальмоскопия/осмотр периферии глазного дна с использованием трехзеркальной линзы Гольдмана/ Биомикрофотография глазного дна с использованием фундус-камеры/ Биомикроскопия глазного дна), рентгенографию левого запястья (Рентгенография лучезапястного сустава), а также оценить пубертатный статус по Таннеру [131].
(УУР С; УДД 5)
-
Рекомендуется при выборе терапии соматропином** учитывать возраст, первичное заболевание почек, системные нарушения, стадию ХБП, адекватность диализа (для пациентов на диализе), функцию трансплантата и терапию кортикостероидами системного действия (у детей после трансплантации) [131]. Предлагается лечить детей с ХБП независимо от СКФ, если основной причиной является дистальный канальцевый ацидоз, синдром Фанкони, синдром Барттера, а также цистиноз [355].
(УУР С; УДД 5)
-
Не рекомендуется терапия соматропином** у пациентов с ХБП, обусловленной системными заболеваниями, генетическими синдромами (синдром Шимке, синдром Барде-Бидля и синдром Галлоуэя-Моуата), неконтролируемым сахарным диабетом и в случае известной гиперчувствительности к препарату [131, 246].
(УУР С; УДД 5)
Комментарий: среди пациентов этой группы не проводились рандомизированные клинические исследования, поэтому эффективность и безопасность соматропина** у пациентов с этими состояниями не оценивались. Сопутствующие или предшествующие злокачественные новообразования в анамнезе являются также противопоказанием к терапии соматропином**.
-
Не рекомендуется пациентам с ХБП терапия соматропином** при закрытых зонах роста, тяжелом вторичном гиперпаратиреозе (ПТГ>500 пг/мл), пролиферативной или тяжелой непролиферативной диабетической ретинопатии, в течение первого года после трансплантации почки и у пациентов с оcтрым критическим заболеванием и активным злокачественным новообразованием [131, 247, 248, 249].
(УУР С; УДД 5)
Комментарий: тяжелый вторичный гиперпаратиреоз (то есть, характеризующийся уровнем интактного ПТГ в сыворотке крови >500 пг/мл или повышением в девять раз выше нормального диапазона) связан с замедленным продольным ростом и повышенным риском эпифизеолиза головок бедренных костей у детей с ХБП [247, 248].
-
Рекомендуется у детей с ХБП 3-5 ст., в том числе находящихся на ЗПТ, в возрасте старше 6 месяцев проведение терапии соматропином**, если у них имеется стойкая задержка роста, определяемая как рост ниже третьего процентиля для возраста и пола и скорость роста ниже 25-го процентиля после того, как будут должным образом рассмотрены другие потенциально излечимые факторы риска задержки роста и при условии, что у ребенка есть потенциал роста [131]. Рекомендуется начинать терапию гормоном роста у пациентов с ХБП в период полового созревания только в том случае, если костный возраст отстает более чем на 1 год [355].
(УУР С; УДД 5)
Комментарий: Скорость роста ниже 25-го процентиля для возраста и пола указывает на прогрессирующую задержку роста у ребенка с низким ростом (то есть ниже третьего процентиля или с показателем стандартного отклонения роста (SDS) ниже -1,88). Любое снижение скорости роста во время этой фазы может привести к серьезной задержке роста и потенциально необратимой потере потенциала роста [250]. В рекомендациях KDOQI по управлению питанием у детей с ХБП рекомендуется незамедлительно начинать терапию соматропином**, если в течение 3 месяцев после начала оптимизации питания не было индуцировано наверстывающего роста [251].
-
Рекомендуется у детей с ХБП 3-5 ст., в том числе находящихся на ЗПТ, старше 6 месяцев проведение терапии соматропином**, если у них рост находится между третьим и десятым процентилем, но сохраняется низкая скорость роста (ниже двадцать пятого процентиля) при наличии других потенциально поддающихся лечению факторов риска нарушения роста, которые должны быть рассмотрены [131].
(УУР С; УДД 5)
Комментарий: Ответ на лечение соматропином**значительно ослаблен у детей на диализе по сравнению с детьми с более ранними стадиями ХБП, независимо от метода диализа, скорее всего, из-за более высокой степени нечувствительности к терапии [252, 253].
-
Рекомендуется детям с ХБП, перенесшим трансплантацию почки и имеющим стойкую задержку роста, определяемую как рост ниже третьего процентиля для возраста и пола и скорость роста ниже двадцать пятого процентиля, терапия соматропином** через 1 год после трансплантации в случаях, когда ребенок не растет и иммуносупрессия без кортикостероидов системного действия не является возможным вариантом [131].
(УУР С; УДД 5)
Комментарий: Метаанализ пяти рандомизированных клинических исследований по результатам роста с использованием протоколов минимизации кортикостероидов системного действия показал значительное увеличение SDS роста в группе, где стероидная терапия была отменена (средняя разница 0,38; 95% ДИ 0,07–0,68), особенно в течение первого года после отмены (среднее значение разница 0,22; 95% ДИ 0,10–0,35), и у пациентов препубертатного периода (средняя разница 0,60; 95% ДИ 0,21–0,98) []. По данным метаанализа пациенты, получавшие терапию соматропином**, имели значительно более высокую скорость роста через 1 год после начала терапии, чем контрольная группа, со средней разницей SDS роста 0,68 (95% ДИ 0,25–1.11) [255]. Средняя разница в изменении SDS роста в группах сравнения составила 0,52 (95% ДИ 0,37–0,68), а ответ роста на терапию соматропином** был лучше у детей младше 10 лет, чем у пациентов старшего возраста [256].
-
Рекомендуется пациентам с ХБП по показаниям терапия соматропином** в дозе 0,045–0,05 мг/кг в день (эквивалент 28-30 МЕ/м2 в неделю) путем подкожных инъекций вечером [131].
(УУР С; УДД 5)
Комментарий: Метаанализ 2012 года показал, что по сравнению с пациентами, получавшими 14 МЕ/м2 в неделю, пациенты, которым использовалась доза соматропина** 28 МЕ/м2 в неделю увеличили рост на 1,18 см в год (95% ДИ 0,52–1,84). Скорость роста на 1,48 выше (95% ДИ 0,03–2,93) SDS скорости роста после 1 года лечения [257]. Для имитации физиологического циркадного ритма эндогенной секреции ГР рекомендуются вечерние инъекции. Сторону инъекции следует менять ежедневно, чтобы избежать липоатрофии.
У детей в препубертатном возрасте с тяжёлой терминальной стадией ХБП и после трансплантации почки метаанализ, включающий 16 рандомизированных контролируемых исследований (809 пациентов), показал, что через 1 год терапии пациенты, получавшие соматропин**, были выше (+ 0,91 SDS) и росли быстрее (+ 3,88 см/год), чем пациенты, не получавшие лечение. Ожидаемый прирост после 2–5 лет оптимального лечения составляет 7,4 см у мальчиков и 7 см у девочек [355].
-
Рекомендуется оценить приверженность пациента с ХБП к терапии соматропином**, включая исследование уровня инсулиноподобного ростового фактора I (IGF1) в крови, измерение дозировки соматропина** с поправкой на массу тела через 3, 6 и 12 месяцев первый год, а затем, как минимум, каждые 6 месяцев и оценку факторов питания и метаболизма, рекомендованные до начала терапии соматропином**. Если скорость роста в первый год лечения составляет менее 2 см в год по сравнению с исходным уровнем [131] необходимо пересмотреть проведение лечения. В случае положительной динамики роста и отсутствия побочных эффектов лечение следует продолжать до тех пор, пока скорость роста не снизится ниже 2 см в год, когда дальнейший рост костей не ожидается [375].
(УУР С; УДД 5)
Комментарий: Следует рассмотреть возможность прекращения терапии соматропином** у пациентов, которые не реагируют должным образом на лечение в течение как минимум 6 месяцев. Необходимо исключить несоблюдение ежедневных подкожных инъекций или несоответствие дозировки соматропина** массе тела человека. Факторы, ограничивающие рост, связанные с ХБП (питание, метаболический ацидоз, МКН-ХБП), также должны быть адекватно рассмотрены у пациентов, не отвечающих на лечение.
-
Рекомендуется отмена терапии соматропином** у пациентов с ХБП при закрытии зон роста, во время трансплантации почки, при возникновении внутричерепной гипертензии, со стойким тяжелым вторичным гиперпаратиреозом, необъяснимым снижением расчетной СКФ, а также при отсутствии ответа на лечение, несмотря на оптимальный контроль питания и метаболизма и достижении своего генетического целевого роста [131].
(УУР С; УДД 5)
Комментарий: При наличии постоянной головной боли или рвоты важно прекратить терапию и исключить внутричерепную гипертензию. При наличии боли в паху, внутренней поверхности бедра или колена, а также при изменении походки необходимо прекратить терапию и провести обследование для исключения эпифизиолиза. Стимуляция продольного роста может проводиться у детей до закрытия эпифизарных зон роста. Во время трансплантации почки лечение соматропином** должно быть прекращено у всех пациентов. Терапия соматропином**должна быть остановлена при достижении пациентом своего генетического целевого процентиля роста. В исследовании RN Fine et al. у 22 пациентов, у которых была отменена терапия соматропином** из-за достижения целевого процентиля роста, только у 27% отмена привела к поддержанию SDS роста, в 73% случаев отмечалось заметное снижение скорости роста, которые впоследствии потребовали возобновления терапии соматропином** [258]. В качестве альтернативы, доза соматропина**может быть уменьшена, когда пациент достигает своего генетического целевого процентиля роста, но результаты, связанные с этим подходом, систематически не изучались [131, 355].
1.6 Заместительная почечная терапия
При снижении расчетной СКФ менее 30 мл / мин на 1,73 м2 (4 стадия ХБП), необходима подготовка к заместительной почечной терапии (ЗПТ) [1]. Семье и, при необходимости, ребенку следует предоставить информацию, касающуюся трансплантации почки, перитонеального диализа (ПД) и гемодиализа (ГД).
Частота и распространенность ЗПТ в педиатрической практике значительно меньше, чем у взрослых. С этим связано, что большинство исследований проводилось у взрослых и необходимо адаптировать эти полученные данные в педиатрические рекомендации.
-
Рекомендуется у пациентов с ХБП С5 решить вопрос об оптимальных сроках планового начала ЗПТ на основе комплексного динамического анализа клинических признаков дисфункции почек с учетом уровня СКФ с целью предупреждения развития жизнеугрожающих осложнений терминальной почечной недостаточности [6, 110].
(УУР С; УДД 5)
Комментарий: Баланс между преимуществами и рисками начала ЗПТ должен быть оценен на основании динамической клинической оценки не только уремических жалоб, но и других потенциально жизнеугрожающих осложнений ХБП С5 (нарушений функций центральной нервной системы (ЦНС) (энцефалопатия/когнитивные нарушения), серозитов, декомпенсации метаболического ацидоза, гиперкалиемии, неконтролируемой гипергидратации (анасарка, отек легких) и АГ, тяжелой БЭН), а также с учетом предпочтений пациента, высказанных на основе полученной медицинской информации. Симптомы уремии неспецифичны и могут быть неочевидными клинически, а некоторые пациенты могут адаптироваться к низким уровням СКФ без четко выраженных жалоб, поэтому при определении сроков начала диализа у пациентов с ХБП С5, очевидно, следует мониторировать и оценивать динамику СКФ. Решение о начале ЗПТ не следует основывать только на значении рСКФ, поскольку у пациентов с ХБП С5 на уровень креатинина в крови в значительной степени влияет точность измерений независимо от метода оценки функции почек, мышечная масса, степень гидратации и другие многочисленные факторы. Многие пациенты с ХБП С5 имеют дефицит мышечной массы за счет влияния возраста и коморбидности, гипергидратированы, а, следовательно, сравнительно низкий уровень креатинина крови и более высокие значения рСКФ, не соответствующие реальным. Оптимальный уровень рСКФ для начала ЗПТ остается неизвестным, однако явные и прогрессирующие симптомы уремии появляются у большинства пациентов при рСКФ 6-8 мл/мин/1,73 м2. Таким образом, клиническое мониторирование прогрессии потенциально жизнеугрожающих осложнений ХБП С5 (отмеченных выше), их комплексная оценка врачом-нефрологом с учетом значений рСКФ критически важны для определения сроков оптимального начала диализа.
-
Рекомендуется у детей с ХБП С5 принимать решение о выборе вида модальности поддерживающего диализного лечения с учетом медицинских показаний и противопоказаний, социальных условий и предпочтений пациента на основе максимально возможного информирования о преимуществах и ограничениях каждого из видов диализа с целью персонификации и улучшения исходов ЗПТ [6, 49, 110].
(УУР С; УДД 5)
Комментарий: Каждый из методов имеет известные преимущества и ограничения. Интегративный подход к ЗПТ предполагает персонификацию выбора конкретного метода (ГД, ГДФ, ПД) в зависимости от клинических и социальных условий, предпочтений пациента. Как следствие в медицинской организации должны быть доступны все разновидности ЗПТ –ГД, ГДФ и ПД [167].
-
Рекомендуется у детей с ХБП С5 начинать лечение ПД или ГД в оптимальных условиях: в плановом порядке при плановой госпитализации, не связанной с осложнениями уремии (если последнее применимо к локальной практике), с предшествующим наблюдением врача-нефролога и использованием постоянного диализного доступа для предупреждения развития жизнеугрожающих осложнений терминальной почечной недостаточности и инициации ЗПТ по экстренным показаниям, улучшения клинических исходов и снижения расходов на лечение [6, 49, 110].
(УУР С; УДД 5)
Комментарий: Заранее запланированное начало ГД или ПД в амбулаторном режиме (или в ходе госпитализации по иным, не связанным с осложнениями ХБП С5 показаниям) после минимум 3-месячного наблюдения врача-нефролога и наличие постоянного диализного доступа следует считать критериями оптимального начала ЗПТ. Дополнительным критерием может быть совпадение метода диализа при инициации ЗПТ с таковым через 90 дней лечения. К субоптимальному (экстренному, незапланированному) началу диализа следует относить все случаи, в которых ЗПТ начинают в стационаре в связи с развитием жизнеугрожающих осложнений ХБП С5 у пациента с наличием или отсутствием постоянного сосудистого доступа, как правило, в отсутствие регулярного наблюдения врача-нефролога. Имеющиеся данные позволяют считать, что использование концепции оптимального начала при определении сроков инициации ЗПТ на практике более целесообразно, нежели «позднего»/«раннего», базирующейся на более высоких или низких значениях рСКФ. Более низкие расходы на лечение при оптимальном начале ЗПТ являются дополнительным аргументом рекомендации.
ПД – это наиболее распространенный метод диализа, используемый для лечения педиатрических пациентов с терминальной стадией почечной недостаточности, особенно у детей младше пяти лет [1-3].
ХПД обладает рядом преимуществ перед гемодиализом для детей:
- Менее ограниченная диета, включая потребление жидкости, потому что ПД проводится ежедневно. Это особенно полезно для младенцев, у которых питание полностью или в основном зависит от жидкой диеты.
- Терапия проводится дома, что позволяет регулярно посещать школу и участвовать в других обычных детских занятиях.
- Отсутствие необходимости в сосудистом доступе и связанных с ним техническими сложностями и рисками (повторные венепункции, кровотечение, бактериемия и т.д.)
Основными недостатками метода являются возможное несоблюдение пациентом /законным представителем режима терапии и риск инфекций, связанных с ПД, таких как инфекции места выхода катетера / туннеля и перитонит [259, 260, 261, 262].
2. Хирургическое лечение
2.1 Трансплантация почки
-
Рекомендовано рассмотреть превентивную трансплантацию почки у пациентов с высокой степенью ХБП с целью обеспечения почечной функции [49].
(УУР С; УДД 5)
-
Рекомендуется трансплантация почки детям с терминальной стадией хронической почечной недостаточности в качестве приоритетного вида заместительной почечной терапии. При достижении 3-4 стадии хронической болезни почек дальнейшее лечение пациента должно обсуждаться с привлечением врача-детского хирурга (со специализацией по трансплантологии) [263, 264, 265, 266].
(УУР С; УДД 4)
Комментарий: На сегодняшний день трансплантация почки считается наилучшим методом заместительной почечной терапии у взрослых. Однако на протяжении многих лет результаты трансплантация почки у детей существенно отличались в связи с высокой частотой развития хирургических и иммунологических осложнений, что выражалось в более низкой выживаемости реципиентов и трансплантатов. За последние 15 лет произошел огромный прорыв в улучшении результатов детской трансплантации почки. В настоящее время пятилетняя выживаемость трансплантированных почек в детском возрасте составляет 83% и 71% при трансплантации почки от живого и посмертного доноров. Кроме этого, хорошо известно, что результаты превентивной (додиализной) трансплантации почки у детей достоверно превосходят аналогичные показатели трансплантации почки после начала диализной терапии. Таким образом, трансплантация почки должна рассматриваться как предпочтительный вариант заместительной почечной терапии во всех возможных случаях.
-
Рекомендуется выполнять трансплантацию почки детям в специализированных медицинских центрах, имеющих в своем штате подготовленных врачей-хирургов, врачей-анестезиологов-реаниматологов, врачей-нефрологов (детских), а также медицинских психологов и социальных работников с целью достижения оптимальных результатов терапии [267].
(УУР С; УДД 5)
Комментарий: Накопленный опыт свидетельствует, что на протяжении последних лет результаты трансплантации почки у детей превосходят аналогичные показатели у взрослых реципиентов. Это обусловлено несколькими причинами, которые включают в себя тщательную подготовку реципиента к трансплантации, прецизионную хирургическую технику, лучшее качество донорского органа, использование эффективной иммуносупрессивной терапии, хорошее понимание особенностей фармакокинетики иммунодепрессантов у детей. Использование современных протоколов иммуносупрессивной терапии привело к достоверному снижению острого отторжения. В 1980 г. частота острого отторжения в первый год после трансплантации почки наблюдалась в 55% случаев, тогда как в последние годы она не превышает 10-15%. Перечисленные факторы имеют кумулятивный эффект в центрах, выполняющих ежегодно более 30-40 педиатрических трансплантаций и имеющих всю необходимую инфраструктуру.
-
Рекомендовано выполнение трансплантации почки детям в превентивном порядке до начала диализной терапии с целью достижения оптимальных результатов терапии [268].
(УУР С; УДД 4)
Комментарий: Наилучшим вариантом является додиализная (превентивная) трансплантация почки от живого родственного донора, учитывая плановый характер оперативного вмешательства, хороший уровень гистосовместимости между донором и реципиентом и минимальный срок консервации органа. По данным проведенного исследования, пациенты, получавшие диализ до трансплантации, имели более высокий риск утраты функции трансплантата (коэффициент риска 1,32; 95% доверительный интервал (ДИ): 1,10-1,56) и более высокий риск смерти (коэффициент риска 1,69; 95% ДИ: 1,22-2,33), по сравнению с пациентами, которым была выполнена превентивная трансплантация почки. У детей, находившихся на диализе больше 1 года, риск утраты функции трансплантата был на 52% выше, а у детей, находившихся на диализе более 1,5 лет, риск смерти был на 89% выше, по сравнению с детьми, которым была проведена превентивная трансплантация, вне зависимости от источника донорского органа.
-
Рекомендовано распределять органы от посмертного донора в первую очередь пациентам детского возраста при отсутствии у них потенциального родственного донора с целью сокращения длительность ожидания у детей [269].
(УУР С; УДД 5)
Комментарий: Распределение органов от посмертных доноров с приоритетом для реципиентов детского возраста является мировой практикой. По данным организации Eurotransplant, формирование отдельного листа ожидания для детей совместно с приоритетным распределением позволяет сократить длительность ожидания органа от посмертного донора у детей в 2,5 раза по сравнению с взрослыми реципиентами.
-
Рекомендована трансплантация почки после предварительной подготовки (определение содержания антител к антигенам групп крови, проведения одного или нескольких сеансов плазмообмена (терапевтического)) детям от живого родственного донора, несовместимого по группе крови (АВ0-несовместимая трансплантация почки), как аналогичная трансплантация почки от АВ0-совместимого родственного донора в связи с сопоставимостью результатов [270, 271].
(УУР С; УДД 4)
Комментарий: Результаты трансплантации почки от АВ0-несовместимого живого родственного донора сопоставимы и достоверно превосходят как результаты трансплантации от посмертного донора, так и результаты лечения другими методами заместительной почечной терапии.
-
Не рекомендована трансплантация почки детям, имеющим данные клинические состояния:
Онкологические заболевания;
Инфекции;
Декомпенсированные коморбидные состояния;
Несоблюдение медицинских рекомендаций;
Психические расстройства;
При диагностированной оксалурии 1 типа до трансплантации печени или ее фрагментов (трансплантация почки может быть выполнена после трансплантации печени или ее фрагментов) в связи с высоковероятным отсутствием эффекта или неблагоприятными исходами [272].
(УУР С; УДД 5)
-
К относительным противопоказаниям для трансплантации почки рекомендовано относить острое инфекционное заболевание или обострение хронической инфекции, опухоль Вильмса в анамнезе или другие заболевания (декомпенсация сахарного диабета, высокая активность СКВ и т.д.) в связи с высоким риском осложнений [273, 274, 275, 276, 277, 278].
(УУР С; УДД 5)
Комментарии: Относительные противопоказания к трансплантации почки носят временный характер, потенциально поддаются лечению или требуют определенного периода наблюдения.
Ранее несовместимость по ABO и наличие цитотоксических антилимфоцитарных антител против донора были противопоказаниями к трансплантации; однако последующие достижения с использованием специальных протоколов позволили проводить такую трансплантацию в центрах, обладающих большим опытом трансплантации, а также специализированной инфраструктурой.
Дети с онкологическим заболеванием в анамнезе могут рассматриваться как потенциальные реципиенты почечного трансплантата только при наличии убедительных доказательств отсутствия риска рецидива онкологического заболевания на момент трансплантации.
Вирус иммунодефицита человека (ВИЧ) традиционно считался абсолютным противопоказанием к трансплантации. Однако улучшение долгосрочного прогноза для пациентов с ВИЧ-инфекцией побудило многие программы трансплантации пересмотреть свою политику в отношении исключения пациентов с ВИЧ-инфекцией. Несколько исследований продемонстрировали сопоставимые результаты лечения пациентов и трансплантатов у ВИЧ-инфицированных и ВИЧ-неинфицированных пациентов, перенесших трансплантацию почки после начала мощной антиретровирусной терапии (АРТ).
Выживаемость пациентов в течение одного и трех лет составила 95% и 88% соответственно; выживаемость трансплантата - 90% и 74% соответственно. Выживаемость пациентов и трансплантата в течение четырех лет оставалась стабильной и составляла 89% и 69% соответственно.
Некоторые системные заболевания являются относительными противопоказаниями к трансплантации почки. К ним относятся системные заболевания, которые могли вызвать почечную недостаточность (например, антинейтрофильные цитоплазматические антитела (ANCA)-ассоциированные васкулиты или системная красная волчанка). Трансплантация возможна в период ремиссии заболевания (не менее 6 месяцев).
При наличии у пациента волчаночного нефрита приоритетным методом заместительной почечной терапии является трансплантация почки.
Выраженный гиперпаратиреоз (с уровнем паратгормона более 1000 пг/мл) является относительным противопоказанием, требующим комплексного лечения. По достижении целевого уровня паратгормона (менее 700 пг/мл) возможно выполнение трансплантации почки.
-
Рекомендовано окончание плановой вакцинации, согласно национальному календарю – до выполнения трансплантации почки с целью достижения максимальной эффективности вакцинации, обеспечения иммунной защиты в до- и посттрнсплантационном периоде и предотвращения возможных нежелательных эффектов вакцинации у иммунокомпроментированных пациентов [279, 280, 281].
(УУР С; УДД 5)
Комментарий: Внедрение рутинных детских прививок резко снизило заболеваемость и смертность от инфекции.
Однако вакцины могут быть неэффективны, если их вводить иммунокомпроментированным пациентам. Поэтому решающее значение имеют усилия по полной иммунизации детей до трансплантации. Поскольку дети с терминальной стадией заболевания почек часто имеют неоптимальный иммунный ответ и сниженную продолжительность иммунитета, могут потребоваться более высокие начальные дозы, дополнительные дозы и мониторинг титра антител с помощью бустерных доз вакцин. В период после трансплантации не рекомендуется введение живых вакцин, поэтому крайне важно проследить, чтобы все подходящие вакцины были сделаны до операции по пересадке.
Что касается вакцин (живых ослабленных), рекомендуется подождать минимум 4 недели между введением вакцины и трансплантацией, учитывая теоретический риск развития заболевания от вакцинного штамма [280].
Прививки вакцинами (неживыми) могут быть сделаны после того, как иммуносупрессивная терапия достигнет низких поддерживающих доз, обычно в сроки от 6 до 12 месяцев после трансплантации.
-
Рекомендовано выполнение реконструктивных и санационных хирургических вмешательств на органах мочеполовой и других систем до трансплантации почки. В случае отсутствия клинических проявлений инфекции или по другим показаниям рекомендована одно- или двусторонняя нефрэктомия (Радикальная нефрэктомия, Лапароскопическая нефрэктомия, Нефрэктомия с тромбэктомией из нижней полой вены, Роботассистированная нефрэктомия) собственных почек одномоментно с трансплантацией почки с целью минимизации инфекционных осложнений [282, 283, 284, 286].
(УУР С; УДД 5)
Комментарий: Причиной почечной недостаточности у детей в большинстве случаев является врожденная аномалия строения мочевыводящих путей. Не так давно дети с врожденными аномалиями нижних мочевыводящих путей или с дисфункцией мочевого пузыря было исключены из программ трансплантации почки, поскольку они считались реципиентами с очень высоким риском инфекционных осложнений и утраты функции. За последние несколько десятилетий было доказано, что аугментационная цистопластика с созданием резервуара низкого давления улучшает отдаленную выживаемость почечного трансплантата. По результатам исследований частота возникновения урологических осложнений после урологических реконструкций не отличается от таковой в общей популяции с нормальной функцией мочевыводящих путей.
У пациентов с задним уретральным клапаном может потребоваться эпицистостомия в раннем возрасте для декомпрессии дисфункционального мочевого пузыря. Эпицистостома может сохраняться в течение многих месяцев после трансплантации. Детям с небольшой емкостью мочевого пузыря может потребоваться увеличение мочевого пузыря при помощи кондуита из сегмента подвздошной кишки. Помимо этого, часто используют аппендикс для создания постоянной стомы, позволяющей проводить чистую периодическую катетеризацию.
Наиболее частыми осложнениями при аугментационной цистопластике и отводе мочи через постоянную стому являются бактериурия и инфекции мочевыводящих путей, которые обычно не приводят к потере трансплантата при правильном лечении антибиотиками.
-
Рекомендовано проведение психосоциальной оценки ребенка и его родителей на предмет приверженности (комплаентности) к предполагаемой терапии на всех этапах заместительной почечной терапии, и особенно после трансплантации почки, поскольку хорошо известно, что несоблюдение медицинских рекомендаций сопряжено с высоким риском развития осложнений и утраты функции почечного трансплантата [287, 288].
(УУР С; УДД 4)
Комментарий: В долгосрочной перспективе значительное количество потерь трансплантата происходит из-за несоблюдения медицинских рекомендаций. Существует ряд профилактических мероприятий, которые могут улучшить соблюдение детьми и их родителями медицинских рекомендаций: непрерывное образование, индивидуальная медицинская информация и психологическая помощь. Перевод детей при их взрослении для дальнейшего наблюдения в учреждение для взрослых связан с теоретически высоким риском потери трансплантата из-за несоблюдения режима лечения. Рекомендуются выполнение комплекса простых и эффективных мер, направленных на повышение приверженности к лечению: ранняя подготовка к переводу и чередование амбулаторных посещений педиатрического и взрослого нефрологического отделений.
В прошлом клинические исследования, касающиеся приверженности к лечению, были сосредоточены только на соблюдении режима приема лекарственных препаратов. Однако в настоящее время признается, что приверженность к лечению (комплаентность) является более широким понятием, в дополнение к приему назначенных лекарств.
-
Рекомендован тщательный лабораторный мониторинг концентраций иммунодепрессантов (Исследование уровня лекарственных препаратов в крови/Исследование уровня лекарственных препаратов в крови методом тандемной масс-спектрометрии) на всех этапах лечения для подбора адекватной дозы препарата, в связи с существенным отличием метаболизма препаратов для иммуносупрессивной терапии у детей по сравнению с взрослой популяцией. Рекомендовано руководствоваться Национальными рекомендациями по лекарственному мониторингу и взаимозаменяемости оригинальных и генерических иммунодепрессантов с узким терапевтическим окном в случае наблюдения высокой вариабельности концентраций иммуносупрессивных препаратов [289].
(УУР С; УДД 4)
Комментарий: Есть несколько аргументов в пользу индивидуального фармакокинетического профиля у детей. Это связано с увеличенным объемом распределения лекарственных веществ у маленьких детей, а также с изменением метаболизма лекарств в кишечнике, печени и почечном трансплантате. Данное обстоятельство часто сопровождается нестабильностью концентраций иммунодепрессантов и требует более частого лабораторного контроля по сравнению со взрослой популяцией.
-
Рекомендовано после трансплантации оставлять детей под тщательным медицинским наблюдением подготовленных специалистов врачей-нефрологов (детских) для профилактики различных осложнений, обусловленных проведением иммуносупрессивной терапии (различные инфекции, лимфопролиферативные заболевания, гастроинтестинальные расстройства и т.д.), а также рецидивом первичного заболевания почек (ФСГС, а-ГУС, и т.д.) в трансплантате [290, 291, 292].
(УУР С; УДД 4)
Комментарий: Реципиентам трансплантата почки требуется пожизненная иммуносупрессивная терапия для поддержания стабильной функции трансплантата. Однако длительный прием иммунодепрессантов может сопровождаться развитием специфических побочных эффектов, связанных с подавлением иммунной системы, как, например, повышенный риск инфекций и злокачественных новообразований.
В 5-15% случаев рецидив первичного заболевания является причиной дисфункции почечного трансплантата у детей-реципиентов почки [291].
Среди гломерулярных заболеваний, которые могут рецидивировать в трансплантате, наиболее часто встречается фокальный сегментарный гломерулярный склероз (ФСГС). Общий риск рецидива нефротического синдрома после трансплантации оценивается примерно в 30%. ФСГС является наиболее частой причиной потери трансплантата из-за рецидива заболевания. Риск рецидива при ФСГС у детей выше, чем у взрослых. Рецидив ФСГС чаще всего возникает в течение первых нескольких дней после трансплантации. У пациентов, у которых первый трансплантат был потерян из-за рецидива заболевания, частота рецидивов в последующем трансплантате составляет приблизительно 80% [292].
3. Иное лечение
Не предусмотрено.
Медицинская реабилитация
Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Ренальная реабилитация (РР) — это скоординированные действия, направленные на оптимизацию физического, психологического и социального функционирования детей с ХБП, снижающие инвалидизацию и смертность. РР включает пять основных компонентов: физические упражнения, диету и контроль водного баланса, медикаментозную терапию, обучение пациентов, психологическое консультирование [356].
Дети с ХБП чаще демонстрируют отсутствие физической активности, снижение физической работоспособности, а также более низкое качество жизни [357, 358, 359].
-
Рекомендуется детям с ХБП повышение физической активности с целью улучшения функциональных возможностей и качества жизни [360].
(УУР В; УДД 2)
Комментарий 1. Дети с ХБП физически менее активны по сравнению со своими здоровыми сверстниками. Следует подчеркнуть, что отсутствие физической активности возникает уже на ранних стадиях заболевания и постепенно усугубляется по мере прогрессирования ХБП. Отмечается значительное снижение мышечной силы, физической работоспособности и кардиореспираторной выносливости у педиатрических пациентов с ХБП. Физическая активность должна быть адаптирована и индивидуализирована в соответствии с потребностями и возможностями детей, страдающих ХБП [376].
Комментарий 2. У детей с ХБП низкая физическая активность обусловлена не только детренированностью, но и истощением скелетных мышц, связанным с воздействием уремического ацидоза, белково-энергетической недостаточностью и терапией глюкокортикостероидами [377].
Повышение физической активности связано с улучшением способности и возможностей выполнять повседневные действия, а также с улучшением качества жизни, связанного со здоровьем, и увеличением продолжительности жизни у пациентов с ХБП. Поэтому всем пациентам с ХБП рекомендуется регулярно заниматься физическими упражнениями.
-
Рекомендуется назначение лечебной физкультуры при заболеваниях почек и мочевыделительного тракта, включающей умеренно интенсивные аэробные упражнения, силовые тренировки и тренировки на равновесие детям с ХБП в стадии ремиссии основного заболевания для улучшения физической формы, повышения повседневной и школьной активности [360].
(УУР В; УДД 2)
Комментарий 1. Предлагается пациентам с додиализными стадиями ХБП заниматься физическими упражнениями с умеренной нагрузкой (аэробные упражнения умеренной интенсивности, силовые тренировки и тренировки на равновесие, комплексы лечебной физкультуры) по 30 минут в большинство дней недели или по 45 мин 3 раза в неделю [361, 362, 363].
Комментарий 2. Детям, получающим программный гемодиализ, предлагается заниматься физическими упражнениями с умеренной нагрузкой (упражнения на растяжку мышц и изометрические упражнения) по 40 мин не менее 3 раз в неделю, что может повысить физическую выносливость и значительно улучшить качество жизни. При этом стоит отметить, что детям, находящимся на гемодиализе, необходимы хорошо организованные программы, охватывающие все физические и психологические аспекты, с разумным распределением времени и повышенным вниманием со стороны медицинских работников [364]. Следует подчеркнуть необходимость семейного подхода и слаженного сотрудничества между ребенком, родителями и медицинскими работниками для обеспечения максимального положительного эффекта [359].
-
Рекомендовано селективное проведение комплексного санаторно-курортного лечения детей с ХБП 1-3 ст., включающее климатотерапию, бальнеотерапию, терренкуры с целью предотвращения прогрессирования на ранних стадиях ХБП, снижения риска развития осложнений, улучшения качества жизни при различных стадиях ХБП [365].
(УУР С; УДД 5)
Комментарий 1. Санаторно-курортное лечение детей с ХБП 1-3 стадии проводится в климатических с приморским и пустынным климатом, климато-бальнеологических и грязевых санаториях [365]. Санаторно-курортное лечение целесообразно проводить в теплое время года на протяжении 3–5 месяцев с мая по сентябрь включительно [366]. Выбор физического фактора, локализации, дозы и продолжительности процедур дает возможность целенаправленно влиять на состояние иммунной системы, почечной гемодинамики, функциональное состояние верхних и нижних мочевых путей, что предотвращает прогрессирование ХБП.
Комментарий 2. Климатотерапия включает аэро-, гелио-, талассотерапию и направлена на улучшение нейрогуморальной регуляции организма и мочевыделительной системы, на нормализацию сопротивляемости организма и повышение его устойчивости к неблагоприятным факторам внешней среды [367].
Комментарий 3. Среди бальнеологических факторов в терапии больных ХБП 1-3 стадии в исходе хронического пиелонефрита используются углекислые, хлоридные натриевые, йодобромные и радоновые ванны, что способствует нормализации кровообращения, особенно венозного, в области малого таза, и уменьшает прогрессирование воспалительного процесса в мочевых путях. Бальнеотерапия назначается в стадии ремиссии не ранее, чем через три месяца после обострения. Также применяется питье минеральных вод малой и средней минерализации. Их терапевтический эффект связан с изменением рН мочи, что создает неблагоприятные условия для развития патогенной микрофлоры. В комплексе санаторно-курортных мероприятий необходимо присутствие лечебной физкультуры, терренкуров [366].
Комментарий 4. В основе реабилитации пациентов с ХБП на фоне хронического гломерулонефрита лежит климатотерапия. При ХБП в исходе нефротического синдрома наиболее подходящими являются климатические курорты пустынь, а также приморские курорты без резких колебаний суточной температуры. Сухой и жаркий воздух этих курортов способствует усилению потоотделения и выделению промежуточных продуктов азотистого обмена, нормализации водного баланса [365]. Возможен прием сидячих или общих хлоридных натриевых ванн (концентрацией 20 г/л); жемчужных, морских с температурой воды 37–38 °С, через день, всего 8–10 ванн [374]. Санаторно-курортное лечение противопоказано при высокой протеинурии (свыше 4 г/сут.), выраженной гипопротеинемии (ниже 60 г/л), сочетающихся с множественными отеками. Летняя жара противопоказана больным с ХБП в исходе гематурического варианта гломерулонефрита. Им подходят курорты степной зоны средней полосы России [365].
Комментарий 5. Начиная с 3-й стадии ХБП целью санаторно-курортного лечения становится снижение риска развития осложнений, улучшение качества жизни и ее продолжительности. Таким пациентам необходим строго индивидуальный подход и подбор оптимальных условий санаторно-курортного лечения. У пациентов с ХБП продвинутых стадий возможно проведение термотерапии. Термотерапия — лечение дозированными аэрогипертермическими ваннами в условиях климатрона, где моделируются основные параметры сухого и жаркого пустынного климата.
Комментарий 6. Пациентов с диализной стадией ХБП или после трансплантации почки, направляют на курорты, оборудованные диализными центрами.
Прогноз
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
В ретроспективном когортном исследовании пациентов со 2–4 стадиями ХБП было обнаружено, что у детей с гломерулярной болезнью быстрее развивается терминальная стадия, чем у детей с врожденной аномалией развития органов мочевой системы (ВАРМС) [299].
Согласно отчету NAPRTCS самые маленькие педиатрические пациенты имеют худшую выживаемость через 12, 24 и 36 месяцев после начала диализа [14]. Вероятность пятилетней выживаемости составляет 89% для пациентов, начинающих лечение терминальной стадии ХБП, а уровень смертности в 30 раз выше, чем у здоровых детей. Наиболее частой причиной среди детей является сердечно-легочная смерть, за которой следует инфекция [15, 300].
Гипертония и протеинурия являются независимыми факторами риска прогрессирования ХБП. Установлено, что снижение рСКФ на 10% обратно пропорционально увеличению на 14% соотношения белок / креатинин в моче, независимо от причины ХБП [301].
Также факторами, влияющими на прогрессирование ХБП являются: первичное заболевание, возраст, пол, расовые / генетические факторы, урологические проблемы, низкая масса тела при рождении и социальное происхождение. Недоношенные новорожденные подвержены высокому риску неонатального ОПП, которое может еще больше снизить количество нефронов и усилить прогрессирование ХБП [302]. Так, согласно многоцентровому ретроспективному когортному исследованию установлено, что частота неонатальной ОПП составляет 48% у тех, кто родился до 29 недель беременности [303]. По данным исследования норвежского реестра, проведенного с 1967 по 2004 год, относительный риск развития терминальной стадии ХБП для детей с массой тела при рождении <10 процентиля, составляет 1,7 [18]. Крупное национальное исследование на основе реестра, в котором участвовало более 20000 человек, родившихся с 1924 по 1944 год и отслеживавшееся до самой смерти, показало, что как недоношенность, так и малый вес при рождении были связаны с повышенным риском ХБП с младенцами, родившимися до 34 недели беременности, риск развития ХБП в 2,6 раза выше [304]. Среди группы подростков, рожденных недоношенными, младенцы с низкой массой тела в 1,4 раза чаще имели микроальбуминурию и снижение СКФ, а у тех, у кого также была задержка внутриутробного развития, альбуминурия увеличивалась в 2,4 раза [305, 306].
По данным результатов исследования CKiD анализ когорты выявил ежегодное снижение СКФ на -4,2%; медиана снижения СКФ составила -1,8 мл/мин/1,73 м2 (интерквартильный размах от -6,6 до 1,6); это можно выразить как медиану абсолютного снижения СКФ, равную -4,3 мл/мин/1,73 м2 (интерквартильный размах от -11,9 до 1,1) и -1,5 мл/мин/1,73 м2 (интерквартильный размах от -5,0 до 1,8) [74].
Согласно исследованиям, основанным на данных реестра, установлено, что факторами риска смертности среди детей с почечной недостаточностью, получающих ЗПТ, являются молодой возраст, женский пол, неевропейская раса, этиология заболевания почек, не связанная с ВАРМС, анемия, гипоальбуминемия и значения скорости клубочковой фильтрации в начале диализа [307].
В группе негломерулярных заболеваний факторами, влияющими на прогрессирование ХБП, являются: соотношение белок / креатинин в моче> 2 мг/мг, гипоальбуминемия, повышенное АД, дислипидемия, мужской пол и анемия [87, 301].
Известно также, что половое созревание ассоциировано с ухудшение функции почек у пациентов с ХБП. Данные проекта ItalKid продемонстрировали, что вероятность ЗПТ составляла 9,4% в течение первого десятилетия жизни и 51,8% в течение второго десятилетия. На кривой выживаемости почек в период полового созревания наблюдался явный перелом с последующим снижением после полового созревания как у мужчин, так и у женщин [308].
Ожидаемая продолжительность жизни для ребенка <14 лет с ХБП 5 ст. (в США) – 21,7 лет на диализе и 57,8 лет с почечным трансплантатом при средней продолжительности жизни в популяции 72,4 года. Летальность на 1-м году после трансплантации в 15 раз выше, чем в нормальной популяции у лиц 16-21 лет и в 130 раз выше у детей 0-4 лет на момент трансплантации. Двадцатилетняя выживаемость детей на ЗПТ составляет 83%, у детей <1 года – 76%, 2-5 лет – 81%, 6-18 лет – 85%. Основными причинами смерти на ЗПТ являются: сердечно-сосудистая патология (30%) и инфекции (20%). Злокачественные новообразования служат причиной летального исхода у 14% пациентов после трансплантации, у большинства спустя более 10 лет [50, 309].
Госпитализация
Организация оказания медицинской помощи
Пациентам с ХБП, в зависимости от необходимости, может быть оказана медицинская помощь любого вида, условия, формы, предусмотренных законодательством Российской Федерации.
Пациенты должны состоять на диспансерном учете, получая первичную медико-санитарную помощь в амбулаторно-поликлинических условиях. Основным условием оказания помощи пациенту с ХБП должно быть обеспечение постоянного наблюдения, получение противорецидивного лечения и своевременная госпитализация.
Ребенок наблюдается врачом-педиатром/врачом общей практики (семейным врачом), врачом-нефрологом, при наличии урологической патологии - врачом-урологом (со специализацией по детской урологии-андрологии)/врачом-детским урологом-андрологом, с участием, при необходимости, врача-диетолога, врача-генетика, врача-детского онколога-гематолога, врача-травматолога-ортопеда, врача-кардиолога детского, врача-офтальмолога, врача-стоматолога, врача-диетолога, врача-детского хирурга, врача-оториноларинголога, и врачей других специальностей при необходимости.
Показания для госпитализации в медицинскую организацию детей с ХБП 3-5 ст.
-
Анорексия, тошнота, рвота (не связанные с интеркуррентной инфекцией).
-
Анемия (Нb менее 80 г/л).
-
Наличие симптомов и признаков анемической гипоксии даже при более высоких показателях концентрации Hb.
-
Кризовое течение АГ.
-
Аритмии, боли в области сердца.
-
Снижение толерантности к физическим нагрузкам, утомляемость, одышка (при отсутствии симптомов бронхообструктивного синдрома).
-
Избыточная прибавка массы тела, нарастающие отеки.
-
Боли в конечностях, позвоночнике (спонтанные и при физической нагрузке).
Показания к выписке пациента из медицинской организации
-
Стабильное состояние, хорошее самочувствие.
-
Отсутствие гипергидратации.
-
Удовлетворительный контроль АД (<90-го перцентиля).
-
Компенсация анемии, минерально-костных нарушений.
Организация диетического питания пациентов при стационарном лечении в медицинских организациях проводится в соответствии с Приложением 3 приказа Минздрава России от 23.09.2020 № 1008н «Об утверждении порядка обеспечения пациентов лечебным питанием»
Подготовка пациента к переходу во взрослую нефрологическую службу является вопросом его безопасности и соблюдения прав пациента, что предупреждает возможные осложнения во время перевода его во взрослый мир.
Образовательные программы для пациента (с учетом его возраста) и членов семьи, взаимодействие врачей-нефрологов педиатрической и взрослой служб при осуществлении процесса передачи подросшего пациента, поддержка семьи – важные составляющие успешного перехода.
Структурирование этапов перехода способствует сохранению стабильности в течении ХБП.
Адаптирована следующая многоэтапная модель перехода (сходная с протоколом перехода по Raina R. et al. (2022) [372].
I-й этап: педиатрический (самый продолжительный по времени). Возраст 13-17 лет.
1. Обучить пациента при активном участии членов семьи пониманию болезни и навыкам самоконтроля, самоуправления.
2. Воспитать приверженность к лечению, соблюдению режима и диеты, приему препаратов (профилактика подростковых рисков).
3. Поддерживать социальную функцию - продолжать образование.
4. Помочь приобрести пациентам навыки самостоятельного общения с медицинским персоналом.
II-й этап: предпереходный (самый короткий по времени). Возраст 17-18 лет.
1. Подготовить переводной эпикриз с уточнением активности воспалительного процесса у пациента с ХБП, наличия осложнения и сопутствующих заболеваний. Подготовить рекомендации по лечению на ближайшую перспективу. Обеспечить консультации узких специалистов.
III этап: непосредственный перевод пациента во взрослую нефрологическую службу здравоохранения. Возраст 18 лет.
1. Обеспечить преемственность в лечении, адаптацию подростка с ХБП к новой социальной среде и без активного участия членов семьи.
2. В течение 1 года совместное, при необходимости, планирование тактики ведения подростка детской и взрослой службой.
После перехода подростка во взрослю систему здравоохранения родители исключаются из ключевых игроков команды. Однако могут возникнуть ситуации, связанные с течением заболевания и психосоциальными особенностями пациента, когда поддержка родителей необходима и после перехода [373].
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
1. Профилактика
1.1 Вакцинация детей с ХБП
Одним из компонентов профилактики является защита от инфекционных заболеваний, которые могут привести прогрессированию ХБП, и являются жизнеугрожающими у пациентов, находящихся на диализе, либо перенесших трансплантацию почки.
Все вакцины следует вводить детям с ХБП согласно национальному календарю профилактических прививок, при этом живые аттенуированные вакцины (вакцины) не следует вводить детям с иммунодефицитным состоянием [6, 110, 297].
-
Не рекомендуется введение Вакцины для профилактики гриппа (живой)**, либо Вакцины для профилактики ветряной оспы (живой, аттенуированной)** детям с нефротическим синдромом или тем, кто получает иммуносупрессивную терапию после трансплантации почки. После введения живой аттенуированной вакцины необходим обязательный минимальный период ожидания в четыре недели до использования иммуносупрессии для трансплантации почки [297].
(УУР С; УДД 5)
-
Рекомендуется проведение вакцинации против пневмококковой инфекции всем детям с ХБП с целью предупреждения тяжелой инфекции, вызванной данным возбудителем [297].
(УУР С; УДД 5)
-
Рекомендуется в обязательном порядке проведение вакцинации против гепатита B всем детям с ХБП или находящимся на диализе с целью предупреждения развития вирусного гепатита В [297].
(УУР С; УДД 5)
-
Рекомендовано рассмотреть предпочтительное проведение вакцинации против вируса папилломы человека (ВПЧ) до трансплантации почки в связи с имеющимися ограниченными данными о менее выраженном иммунном ответе у реципиентов трансплантата почки [297].
(УУР С; УДД 5)
-
Не рекомендовано введение вакцины для профилактики ветряной оспы (живая, аттенуированная)** детям с ХБП и тяжелым иммунодефицитом, в т. ч., детям, получающим высокие дозы кортикостероидов системного действия [297].
(УУР С; УДД 5)
Комментарий: В идеале вакцину вводят в виде двухдозовой схемы, когда ребенок получает низкие дозы кортикостероидов системного действия (например, менее 2 мг/кг массы тела через день) или кортикостероидная терапия не проводится.
-
Рекомендовано проведение вакцинации против туберкулезной инфекции, если не была проведена в соответствии с национальным календарем профилактических прививок детям с ХБП до трансплантации почки [297].
(УУР С; УДД 5)
1.2 Способы предотвращения или снижения прогрессирования ХБП
-
Рекомендована терапия основного заболевания, лежащего в основе ХБП (например, коррекция обструктивных уропатий, иммуносупрессивная терапия при нефротическом синдроме и т.д.) с целью предупреждения прогрессирования ХБП [297].
(УУР С; УДД 5)
-
Рекомендовано поддержание адекватного нутритивного статуса, проведение своевременной диагностики и коррекции дефицита железа, минерально-костных нарушений, своевременное начало диализа с целью поддержания адекватного качества жизни пациентов [6, 110, 297].
(УУР С; УДД 5)
Комментарии: У детей с ХБП заместительная почечная терапия (ЗПТ) обычно необходима, когда скорость клубочковой фильтрации (СКФ) падает ниже 15 мл/мин на 1,73 м² (стадия G5 ХБП, почечная недостаточность) и в некоторых случаях до этого. Таким образом, как только расчетная СКФ снижается до <30 мл / мин на 1,73 м² (стадия G4), пора начинать подготовку ребенка и семьи к заместительной почечной терапии (ЗПТ/KRT) [3]. Семья и пациент должны получить информацию о сроках и выборе ЗПТ (трансплантация почки, перитонеальный диализ или гемодиализ).
-
Рекомендовано оценивать риск развития ХБП у детей, родившихся недоношенными, включая анализ истории рождения, течения неонатального периода и состояния здоровья детей с целью своевременной диагностики и своевременного принятия мер по коррекции ХБП [297, 298].
(УУР С; УДД 5)
Комментарии: врачи-педиатры и врачи-неонатологи, наблюдающие недоношенных детей, должны быть настороженными в плане возможной дисфункции почек у этой категории лиц.
-
Рекомендовано избегать факторов риска последующего повреждения почек у детей с ХБП - эпизоды острого повреждения почек могут привести к более быстрому ухудшению функции почек у детей с ХБП [297].
(УУР С; УДД 5)
Комментарии: Снижение перфузии почек или введение нефротоксических агентов – два распространенных состояния, которые могут привести к дальнейшему повреждению почек у детей с ХБП.
-
Рекомендовано избегать острых эпизодов гипоперфузии почек с целью предупреждения прогрессирования ХБП [297].
(УУР С; УДД 5)
Комментарии: Подгруппа детей с ХБП имеет нарушение канальцевой реабсорбции натрия (потери соли) и способности концентрировать мочу, что увеличивает риск гиповолемии и гипоперфузии при незначительных заболеваниях. Пациентов из группы риска следует выявлять в начале интеркуррентного заболевания, связанного с гиповолемией или гипотонией, чтобы обеспечить восполнение запасов жидкости до значительного снижения кровотока в почках.
Гипоперфузия почек вызывается гипотензией (например, септическим шоком), приемом препаратов, снижающих перфузию почек (таких как нестероидные противовоспалительные и противоревматические препараты, ингибиторы АПФ и антагонисты рецепторов ангиотензина II), и снижением объема циркулирующей крови из-за рвоты, диареи, применения диуретиков, ожогов, серьезных операций (например, кардиохирургических операций, выполненных при искусственном кровообращении, ортопедических операций на позвоночнике) и / или кровотечений.
-
Рекомендовано избегать приема препаратов, обладающих нефротоксическим действием с целью предупреждения прогрессирования ХБП [297].
(УУР С; УДД 5)
Комментарии: К таким препаратам относятся многие нестероидные противовоспалительные и противоревматические препараты, диагностические препараты (например, рентгеноконтрастные средства), аминогликозиды, амфотерицин B**, циклоспорин** и такролимус**. Следует избегать приема таких лекарств или применять их с осторожностью у пациентов с хронической болезнью почек, под контролем мониторинга терапевтического уровня лекарств (Исследование уровня лекарственных препаратов в крови, Исследование уровня лекарственных препаратов в крови методом тандемной масс-спектрометрии).
Некоторые препараты или их составляющие, такие как Ко-тримоксазол [Сульфаметоксазол+Триметоприм]**, ципрофлоксацин**, приводят к повышению уровня креатинина в крови, но не повышают уровень азота мочевины крови (АМК), поскольку они влияют либо на канальцевую секрецию креатинина, либо на результат лабораторного анализа креатинина (они не влияют напрямую на функцию почек).
-
Рекомендовано детям с ХБП назначение ингибиторов АПФ или антагонистов рецепторов ангиотензина II с нефропротективной целью (с проведением соответствующего мониторинга (см. комментарии) [325, 368].
(УУР С; УДД 5)
Комментарии:
Показаниями считаются:
- высокое артериальное давление (>=90-й процентиль)
и/или
- значительная протеинурия/альбуминурия
-
соотношение белка в моче к креатинину ≥ 0,5 мг/мг или 50 мг/ммоль,
-
соотношение альбумина к креатинину ≥ 0,3 мг/мг или 30 мг/ммоль.
Назначение в зависимости от стадии ХБП:
- При ХБП 1–3ст: назначить как можно раньше, применять длительно.
- При ХБП 4 и 5 ст:
-
пациенты, которые уже принимают ингибиторы АПФ или антагонисты рецепторов ангиотензина II - продолжить лечение, при условии хорошей переносимости,
-
пациенты, которые не принимают ингибиторы АПФ или антагонисты рецепторов ангиотензина II: рассмотреть старт терапии с тщательным мониторингом.
Практические аспекты:
- начало лечения с использованием максимальной одобренной дозы, которая переносится пациентом,
- контроль измерения артериального давления на периферических артериях, исследования уровня креатинина в крови, исследования уровня калия в крови - в течение 2–4 недель после начала или увеличения дозы ингибиторов АПФ или антагонистов рецепторов ангиотензина II в зависимости от СКФ и уровня калия в крови,
- гиперкалиемию, связанную с использованием ингибиторов АПФ или антагонистов рецепторов ангиотензина II, как правило, можно контролировать мерами по снижению уровня калия в крови, а не снижением дозы или прекращением лечения этими препаратами,
- терапию ингибиторами АПФ или антагонистами рецепторов ангиотензина II следует продолжать если уровень креатинина в крови не повышается более чем на 30% в течение 4 недель после начала лечения или увеличения дозы,
- рассмотреть возможность снижения дозы или прекращения приема ингибиторов АПФ или антагонистов рецепторов ангиотензина II в условиях симптоматической гипотензии или неконтролируемой гиперкалиемии, несмотря на медикаментозное лечение, или для уменьшения уремических симптомов при лечении почечной недостаточности (расчетная скорость клубочковой фильтрации [СКФ] <15 мл/мин на 1,73 м2),
- не следует комбинировать ингибиторы АПФ или антагонисты рецепторов ангиотензина II [325, 368].
Чаще терапию начинают с ингибитора АПФ, поскольку имеется больше данных о безопасности и эффективности этого класса препаратов у детей по сравнению с БРА: Например, #эналаприл** 0,08 мг/кг в день (максимум 5 мг/день), которая титруется до максимальной дозы 0,6 мг/кг в день (максимум 40 мг/день) по уровню АД пациента и результатов лабораторных тестов (например, уровню сывороточного калия).
У пациентов, с непереносимостью иАПФ (например, кашель), возможно применение БРА, например, #лозартана** в начальной дозе 0,7 мг/кг в день (максимум 50 мг/день), которая титруется до максимальной дозы 1,4 мг/кг в день (максимум 100 мг/день) [138, 325, 368].
Тератогенный потенциал этих препаратов у женщин детородного возраста также следует обсуждать с девочками-подростками пубертатного возраста, когда рассматривается вопрос о назначении ингибитора АПФ или БРА [138].
-
Рекомендовано поддерживать уровень АД в пределах целевых значений, в том числе, с помощью антигипертензивной терапии, с целью замедления прогрессирования ХБП у детей [297].
(УУР С; УДД 5)
Комментарии: Самым действенным методом, способствующим замедлению прогрессирования почечных функций, является контроль АД и использование при необходимости антигипертензивной терапии у детей с ХБП, основываясь на доказательствах того, что строгий контроль АД снижает скорость прогрессирования ХБП у детей.
См. клинические рекомендации по артериальной гипертензии у детей и подростков.
-
Для детей, которым требуется антигипертензивная терапия, рекомендовано отдавать предпочтение использованию ингибиторов АПФ или антагонистов рецепторов ангиотензина II в соответствии с клиническими рекомендациями по ведению детей с артериальной гипертензией [297, 335].
(УУР С; УДД 5)
Комментарии: Имеются убедительные доказательства того, что эти агенты обладают большей нефропротективной способностью, чем Гипотензивные препараты в комбинации с диуретиками, в замедлении прогрессирования ХБП (контролируя АД, а также снижая протеинурию даже у детей с ХБП 3-5 ст.).
Блокада ангиотензина с использованием ингибиторов АПФ или антагонистов рецепторов ангиотензина II также может замедлять прогрессирование ХБП у пациентов с наследственным нефритом без повышенного АД за счет снижения протеинурии.
-
Не рекомендовано назначение низкобелковой диеты при ХБП у детей, т.к. её применение не показало преимущества в замедлении прогрессировании заболевания почек у детей [297].
(УУР С; УДД 5)
Комментарии: В настоящее время в педиатрической практике детям с ХБП назначается суточная норма белка, соответствующая возрасту.
Существует предположение, что гиперурикемия, которая возникает из-за снижения экскреции уратов с мочой, способствует прогрессированию ХБП, частично за счет снижения перфузии почек, а также за счет стимуляции пролиферации афферентных клеток гладких мышц артериол. Однако рекомендаций по мониторингу мочевой кислоты в сыворотке крови у детей с ХБП нет.
2. Диспансерное наблюдение пожизненное и включает в себя:
-
Рекомендовано диспансерное наблюдение пациентов с ХБП с целью контроля почечных функций, профилактики развития осложнений и своевременной коррекции терапии [325, 148, 369, 370, 371].
(УУР С; УДД 5)
Комментарии:
Прием (осмотр, консультация) специалистов:
-
Врач-педиатр/врач общей практики (семейный врач) 1 раз в месяц.
-
Врач-нефролог 1 раз в 2-3 месяца.
-
Врач- стоматолог детский 1 раз в 6 месяцев.
-
Врач-офтальмолог 1 раз в год.
-
Врач-оториноларинголог 1 раз в год.
-
Врач-генетик при необходимости (при тубулопатиях и гломерулонефритах в составе генетического синдрома).
Лабораторные исследования:
-
общий (клинический) анализ мочи (1 раз в месяц и по показаниям);
-
общий (клинический) анализ крови развернутый (частота – по показаниям);
-
анализ крови биохимический общетерапевтический (1 раз в 3 месяца и по показаниям);
-
исследование кислотно-основного состояния и газов крови (1 раз в 3 месяца и по показаниям);
-
исследование уровня паратиреоидного гормона в крови (1 раз в 3 месяца и по показаниям);
-
исследование уровня 25-ОН витамина Д в крови (1 раз в 3-6 месяцев);
-
гормоны, характеризующие функцию щитовидной железы (Исследование уровня тиреотропного гормона (ТТГ) в крови, исследование уровня свободного трийодтиронина (СТ3) в крови) (1 раз в 3-6 месяцев и по показаниям);
-
исследование уровня инсулиноподобного ростового фактора I в крови (при задержке роста и терапии соматропином** (рекомбинантным гормоном роста));
Инструментальные методы исследования:
-
ультразвуковое исследование органов мочевой системы (Ультразвуковое исследование почек, Ультразвуковое исследование мочеточников, Ультразвуковое исследование мочевого пузыря) 1 раз в 6 мес. и по показаниям.
Информация
Источники и литература
-
Клинические рекомендации Союза педиатров России
- 1. NKF KDOQI Guidelines. National Kidney Foundation; 2002. KDOQI Clinical Practice Guidelines for Chronic Kidney Disease: Evaluation, Classification, and Stratification. 2. Руководство по клиническому питанию. Под ред. Луфта В. М., Багненко С. Ф., Щербука Ю. А. СПб, 2010. 428 с. 3. Iorember FM. Malnutrition in Chronic Kidney Disease. Front Pediatr. 2018 Jun 20;6:161. doi: 10.3389/fped.2018.00161. PMID: 29974043; PMCID: PMC6019478 4. KDOQI Work Group. KDOQI Clinical Practice Guideline for Nutrition in Children with CKD: 2008 update. Executive summary. Am J Kidney Dis. 2009 Mar;53(3 Suppl 2):S11-104. doi: 10.1053/j.ajkd.2008.11.017. PMID: 19231749 5. Rodig NM, McDermott KC, Schneider MF, et al. Growth in children with chronic kidney disease: a report from the Chronic Kidney Disease in Children Study. Pediatr Nephrol. 2014 Oct;29(10):1987-95. doi: 10.1007/s00467-014-2812-9. Epub 2014 Apr 12. PMID: 24728472; PMCID: PMC4470271 6. Stevens PE, Levin A; Kidney Disease: Improving Global Outcomes Chronic Kidney Disease Guideline Development Work Group Members. Evaluation and management of chronic kidney disease: synopsis of the kidney disease: improving global outcomes 2012 clinical practice guideline. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney inter., Suppl. 2013; 3: 1–150 7. Айтбаев К.А., Муркамилов И.Т., Фомин В.В. Нефрогенная анемия: новые физиологические подходы к терапии на основе имитации гипоксических ответов / Альманах клинической медицины. 2017 Ноябрь; 45 (7): 565–574. doi: 10.18786/2072-0505-2017-45-7-565-574 8. Wong CJ, Moxey-Mims M, Jerry-Fluker J, Warady BA, Furth SL. CKiD (CKD in children) prospective cohort study: a review of current findings. Am J Kidney Dis. 2012 Dec;60(6):1002-11. doi: 10.1053/j.ajkd.2012.07.018. Epub 2012 Sep 28. PMID: 23022429; PMCID: PMC3496011 9. Clinical Pediatric Nephrology, ed 2. Informa Healthcare, 2007 10. Chesnaye N C, Schaefer F, Groothoff J W et al. Mortality risk in European children with end-stage renal disease on dialysis Kidney International (2016) 89, 1355–1362 11. USDRDS, Annual Report 2020 Annual Data Report // End Stage Renal Disease // 7: ESRD among Children and Adolescent 12. Mitsnefes ММ. Cardiovascular Disease in Children with Chronic Kidney Disease. J Am Soc Nephrol 23: 578–585, 2012 13. Misurac J. Chronic kidney disease in the neonate: etiologies, management, and outcomes. Semin Fetal Neonatal Med. 2017 Apr;22(2):98-103. doi: 10.1016/j.siny.2016.09.003. Epub 2016 Oct 10. PMID: 27733241 14. NAPRTCS, North American Pediatric Renal Trials and Collaborative Studies: 2011 Annual Dialysis Report, 2011 15. Harambat J, van Stralen KJ, Kim JJ, Tizard EJ. Epidemiology of chronic kidney disease in children. Pediatr Nephrol. 2012 Mar;27(3):363-73. doi: 10.1007/s00467-011-1939-1. Epub 2011 Jun 29. Erratum in: Pediatr Nephrol. 2012 Mar;27(3):507. PMID: 21713524; PMCID: PMC3264851 16. Xiao N, Jenkins TM, Nehus E, et al; Teen-LABS Consortium. Kidney function in severely obese adolescents undergoing bariatric surgery. Obesity (Silver Spring). 2014 Nov;22(11):2319-25. doi: 10.1002/oby.20870. PMID: 25376399; PMCID: PMC4225641 17. Ding W, Cheung WW, Mak RH: Impact of obesity on kidney function and blood pressure in children. World J Nephrol 2015;4: 223–229 18. Vikse BE, Irgens LM, Leivestad T, et al. Low birth weight increases risk for end-stage renal disease. J Am Soc Nephrol. 2008 Jan;19(1):151-7. doi: 10.1681/ASN.2007020252. Epub 2007 Dec 5. PMID: 18057216; PMCID: PMC2391041 19. Carmody JB, Charlton JR: Short-term gestation, long-term risk: prematurity and chronic kidney disease. Pediatrics 2013; 131: 1168– 1179 20. USRDS. Annual data report. Chapter 7: ESRD among Children, Adolescents, and Young Adults. 2017 21. Wong CS, Gipson DS, Gillen DL, et al. Anthropometric measures and risk of death in children with end-stage renal disease. Am J Kidney Dis. 2000 Oct;36(4):811-9. doi: 10.1053/ajkd.2000.17674. PMID: 11007685 22. Mehta NM, Corkins MR, Lyman B, et al; American Society for Parenteral and Enteral Nutrition Board of Directors. Defining pediatric malnutrition: a paradigm shift toward etiology-related definitions. JPEN J Parenter Enteral Nutr. 2013 Jul;37(4):460-81. doi: 10.1177/0148607113479972. Epub 2013 Mar 25. PMID: 23528324 23. Rees L., Bockenhauer D.,Webb N. J.A., Punaro M.G. Oxford specialist Handbooks in paediatrics. Paediatric Nephrology. Third edition. PP 737 24. Gerson A, Hwang W, Fiorenza J, et al. Anemia and health-related quality of life in adolescents with chronic kidney disease. Am J Kidney Dis. 2004 Dec;44(6):1017-23. doi: 10.1053/j.ajkd.2004.08.024. PMID: 15558522 25. Perlman RL, Finkelstein FO, Liu L, et al. Quality of life in chronic kidney disease (CKD): a crosssectional analysis in the Renal Research Institute-CKD study. American journal of kidney diseases. 2005;45(4):658–666. [PubMed: 15806468] 26. Jelkmann W. Regulation of erythropoietin production. J Physiol. 2011 Mar 15;589(Pt 6):1251-8. doi: 10.1113/jphysiol.2010.195057. Epub 2010 Nov 15. PMID: 21078592; PMCID: PMC3082088 27. Atkinson MA, White CT. Hepcidin in anemia of chronic kidney disease: review for the pediatric nephrologist. Pediatr Nephrol. 2012 Jan;27(1):33-40. doi: 10.1007/s00467-011-1832-y. Epub 2011 Mar 13. PMID: 21400189 28. Anemia in chronic kidney disease. Clinical Pediatric Nephrology,Third Ed. Edited By Kher KK, Schnaper HW, Greenbaum LA.CRC Press is an imprint of the Taylor & Francis Group,pp. 627-638 29. Mekahli D, Shaw V, Ledermann SE, Rees L. Long-term outcome of infants with severe chronic kidney disease. Clin J Am Soc Nephrol. 2010 Jan;5(1):10-7. doi: 10.2215/CJN.05600809. Epub 2009 Nov 12. PMID: 19965538; PMCID: PMC2801655 30. Greenbaum LA, Muñoz A, Schneider MF, et al. The association between abnormal birth history and growth in children with CKD. Clin J Am Soc Nephrol. 2011 Jan;6(1):14-21. doi: 10.2215/CJN.08481109. Epub 2010 Oct 28. PMID: 21030583; PMCID: PMC3022235 31. Cetin I, Mandò C, Calabrese S. Maternal predictors of intrauterine growth restriction. Curr Opin Clin Nutr Metab Care. 2013 May;16(3):310-9. doi: 10.1097/MCO.0b013e32835e8d9c. PMID: 23385473 32. Karlberg J, Schaefer F, Hennicke M, et al. Early age-dependent growth impairment in chronic renal failure. European Study Group for Nutritional Treatment of Chronic Renal Failure in Childhood. Pediatr Nephrol. 1996 Jun;10(3):283-7. doi: 10.1007/BF00866761. PMID: 8792391 33. Tönshoff, B., Kiepe, D., Ciarmatori, S. Growth hormone/insulin-like growth factor system in children with chronic renal failure. Pediatr. Nephrol. 20, 279–289 (2005) 34. Haffner D, Schaefer F, Nissel R, et al. Effect of growth hormone treatment on the adult height of children with chronic renal failure. German Study Group for Growth Hormone Treatment in Chronic Renal Failure. N Engl J Med. 2000 Sep 28;343(13):923-30. doi: 10.1056/NEJM200009283431304. PMID: 11006368 35. Isakova T, Nickolas TL, Denburg M, et al. KDOQI US Commentary on the 2017 KDIGO Clinical Practice Guideline Update for the Diagnosis, Evaluation, Prevention, and Treatment of Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD). Am J Kidney Dis. 2017 Dec;70(6):737-751. 36. Bacchetta J, Dubourg L, Harambat J, et al. The influence of glomerular filtration rate and age on fibroblast growth factor 23 serum levels in pediatric chronic kidney disease. J Clin Endocrinol Metab. 2010 Apr;95(4):1741-8. doi: 10.1210/jc.2009-1576. Epub 2010 Feb 15. PMID: 20157196 37. van Husen M, Fischer AK, Lehnhardt A, et al. Fibroblast growth factor 23 and bone metabolism in children with chronic kidney disease. Kidney Int. 2010 Jul;78(2):200-6. doi: 10.1038/ki.2010.107. Epub 2010 Apr 21. PMID: 20407479 38. Sinha MD, Turner C, Dalton RN, et al. Investigating FGF-23 concentrations and its relationship with declining renal function in paediatric patients with pre-dialysis CKD Stages 3-5. Nephrol Dial Transplant. 2012 Dec;27(12):4361-8. doi: 10.1093/ndt/gfs109. Epub 2012 Apr 23. PMID: 22529162 39. Portale AA, Wolf M, Jüppner H, et al. Disordered FGF23 and mineral metabolism in children with CKD. Clin J Am Soc Nephrol. 2014 Feb;9(2):344-53. doi: 10.2215/CJN.05840513. Epub 2013 Dec 5. PMID: 24311704; PMCID: PMC3913243 40. Isakova T, Cai X, Lee J, et al; CRIC Study Investigators. Longitudinal Evolution of Markers of Mineral Metabolism in Patients With CKD: The Chronic Renal Insufficiency Cohort (CRIC) Study. Am J Kidney Dis. 2020 Feb;75(2):235-244. doi: 10.1053/j.ajkd.2019.07.022. Epub 2019 Oct 23. PMID: 31668375; PMCID: PMC7012684 41. Hsu CH, Patel SR, Young EW, Vanholder R (1994) The biological action of calcitriol in renal failure. Kidney Int 46:605–612 42. Goodman WG, Quarles LD (2007) Development and progression of secondary hyperparathyroidism in chronic kidney disease: Lessons from molecular genetics. Kidney Int 74:276–288 43. Martín-Salvago M, Villar-Rodríguez JL, Palma-Alvarez A, et al. Decreased expression of calcium receptor in parathyroid tissue in patients with hyperparathyroidism secondary to chronic renal failure. Endocr Pathol. 2003 Spring;14(1):61-70. doi: 10.1385/ep:14:1:61. PMID: 12746564 44. Lewis R. Mineral and bone disorders in chronic kidney disease: new insights into mechanism and management. Ann Clin Biochem. 2012 Sep;49(Pt 5):432-40. doi: 10.1258/acb.2012.012004. Epub 2012 Jul 17. PMID: 22807503 45. Tian J, Niu L, An X. Cardiovascular risks in chronic kidney disease pediatric patients. Exp Ther Med. 2017 Nov;14(5):4615-4619. doi: 10.3892/etm.2017.5117. Epub 2017 Sep 15. PMID: 29201159 46. Azukaitis K, Jankauskiene A, Schaefer F, Shroff R. Pathophysiology and consequences of arterial stiffness in children with chronic kidney disease. Pediatr Nephrol. 2021 Jul;36(7):1683-1695. doi: 10.1007/s00467-020-04732-y. Epub 2020 Sep 7. PMID: 32894349 47. Segall L, Nistor I, Covic A. Heart failure in patients with chronic kidney disease: a systematic integrative review. Biomed Res Int. 2014;2014:937398. doi: 10.1155/2014/937398. Epub 2014 May 15. PMID: 24959595; PMCID: PMC4052068 48. Soylemezoglu O, Duzova A, Yalçinkaya F, Arinsoy T, Süleymanlar G. Chronic renal disease in children aged 5-18 years: a population-based survey in Turkey, the CREDIT-C study. Nephrol Dial Transplant. 2012 Oct;27 Suppl 3:iii146-51. doi: 10.1093/ndt/gfs366. PMID: 23115139. 49. Kaspar CD, Bholah R, Bunchman TE. A Review of Pediatric Chronic Kidney Disease. Blood Purif. 2016;41(1-3):211-7. doi: 10.1159/000441737. Epub 2016 Jan 15. PMID: 26766175 50. Chesnaye NC, van Stralen KJ, Bonthuis M, et al. Survival in children requiring chronic renal replacement therapy. Pediatr Nephrol. 2018 Apr;33(4):585-594. doi: 10.1007/s00467-017-3681-9. Epub 2017 May 15. PMID: 28508132; PMCID: PMC5859702
Информация
Список сокращений
АД – артериальное давление
АГ – артериальная гипертензия
АГС – антигипертензивные средства
аГУС – атипичный гемолитико-уремический синдром
АТХ – анатомо-терапевтическо-химическая классификация лекарственных препаратов
БЭН – белково-энергетическая недостаточность
ВАРМС – врожденная аномалия развития мочевой системы
ВГПТ – вторичный гиперпаратиреоз
ВОЗ – Всемирная Организация Здравоохранения
ГД – гемодиализ
ГДФ – гемодиафильтрация
ГЛЖ – гипертрофия левого желудочка
ГР – гормон роста
ГУС – гемолитико-уремический синдром
ГЭР – гастроэзофагальный рефлюкс
ДАД – диастолическое артериальное давление
ДФЛЖ – диастолическая функция левого желудочка
ЗПТ – заместительная почечная терапия
иАПФ – ингибиторы ангиотензин-превращающего фермента (АТХ классификация: «Ингибиторы АПФ»)
ИВ – индекс времени
иПТГ – интактный паратиреоидный гормон (наименование услуги для определения показателя в крови согласно Приказу Минздрава России от 13.10.2017 № 804н: «Исследование уровня паратиреоидного гормона в крови»)
ИМТ – индекс массы тела
ИФР-1 – инсулиноподобный фактор роста 1
ЗР – задержка развития
КВБ – кардиоваскулярная болезнь
КТ – компьютерная томография
ЛЖ – левый желудочек
МКН – минерально-костные нарушения
МКН-ХБП – минерало-костные нарушения, ассоциированные с хронической болезнью почек
МПК – минеральная плотность кости
МРТ – магнитно-резонансная томография
НГЗ – назогастральный зонд
НК – недостаточность кровообращения
ОПП – острое повреждение почек
ОЦК – объем циркулирующей крови
ПД – перитонеальный диализ
ПМР – пузырно-мочеточниковый рефлюкс
ПТА – посттрансплантационная анемия
ПТГ – паратиреоидный гормон
ПТЭ – паратиреоидэктомия
МПК – минеральная плотность кости
РААС – ренин-ангиотензин-альдостероновая система
САД – систолическое артериальное давление
СКФ – скорость клубочковой фильтрации
СМАД – суточное мониторирование артериального давления
СН – сердечная недостаточность
СНП – суточная норма потребления
ССС – сердечно-сосудистая система
УЗИ – ультразвуковое исследование
ФНО-α – фактор некроза опухоли-α
ФСГС – фокальный сегментарный гломерулосклероз
ХБП – хроническая болезнь почки
ЭКГ – электрокардиография
ЭПО – эритропоэтин
ЭСС – эритропоэз-стимулирующие средства (АТХ классификация: «Другие антианемические препараты»)
Эхо-КГ – эхокардиография
Ca – кальций
ВАРМС – врожденные аномалии мочевой системы (CAKUT – Congenital Anomalies of the Kidneys and Urinary Tracts (врожденные аномалии почек и мочевых путей))
CaSR – кальций-чувствительный рецептор
CKiD – Хроническая болезнь почек у детей (Chronic Kidney Disease in Children)
DRI – Dietary reference intake – рекомендуемое потребление белка
FGF-23 – фактор роста фибробластов 23
IDMS – тандемная масс-спектрометрия с изотопным разбавлением (isotope dilution mass spectrometry)
IL – интерлейкин
К – калий (наименование услуги для определения показателя в крови согласно Приказу Минздрава России от 13.10.2017 № 804н: «Исследование уровня калия в крови»)
KDOQI – инициативная группа по качеству исходов заболеваний почек (Kidney Disease Outcomes Quality Initiative)
KDIGO – Kidney Disease Improving Global Outcomes – Инициатива по улучшению глобальных исходов заболеваний почек
Klotho – трансмембранный белок, необходимый для активации рецептора FGF23
Na – натрий (наименование услуги при определении показателя в крови согласно Приказу Минздрава России от 13.10.2017 № 804н: «Исследование уровня натрия в крови»)
NAPRTCS – North American Pediatric Renal Transplant Cooperative Study – Североамериканский педиатрический регистр исследований заболеваний почек и совместных исследований
NKF – национальный фонд почек
P – фосфор (фосфаты) (наименование услуги при определении показателя в крови согласно Приказу Минздрава России от 13.10.2017 № 804н: «Исследование уровня неорганического фосфора в крови»)
Hb – гемоглобин (наименование услуги при определении показателя в крови согласно Приказу Минздрава России от 13.10.2017 № 804н: «Исследование уровня общего гемоглобина в крови»)
HIF-PHD – гипоксия-индуцибельный фактор – пролил-4-гидроксилаза (hypoxia-inducible factor - prolyl-4-hydroxylase domain)
HL – верхняя граница целевого уровня (High Level)
RNI – рекомендованное потребление нутриента
SD – стандартное отклонение
SDS – коэффициент стандартного отклонения (Standart Deviation Score)
SDI – Suggested Dietary Intake – рекомендуемая диета
TSAT – коэффициент насыщения трансферрина железом (наименование услуги при определении показателя согласно Приказу Минздрава России от 13.10.2017 № 804н: «Исследование насыщения трансферрина железом»)
VDR – рецептор витамина D
Термины и определения
Артериальная гипертензия – АД, превышающее 95-й перцентиль для данного пола и возраста при 3-х визитах к врачу.
Адинамическая болезнь скелета – состояние, характеризующееся снижением объема и минерализации кости параллельно со снижением костеобразования.
Белково-энергетическая недостаточность – недостаток энергии и нутриентов питания для обеспечения потребностей физического развития ребенка (mainutrition – в англоязычной литературе).
Внекостная кальцификация – отложение фосфатов и кальция в форме гидроксиапатита в коже, мышцах, сосудистой стенке, внутренних органах, вокруг суставов.
Вторичный гиперпаратиреоз – вторичная гиперфункция и гиперплазия паращитовидных желез, развивающаяся на фоне прогрессирующего уменьшения массы действующих нефронов при хронической болезни почек, вследствие гиперфосфатемии, увеличения фактора роста фибробластов 23, дефицита кальцитриола, гипокальциемии.
Гипертонический криз – внезапное повышение АД >30% от обычного уровня, сопровождающееся клинической симптоматикой.
Гипертензия белого халата – повышение АД при измерении в медицинском учреждении, нормальный уровень АД дома, в спокойной обстановке (ИВ при СМАД <25%).
Задержка развития – термин, используемый для описания детей, физическое развитие которых, в первую очередь рост, ниже ожидаемого (failure to thrive – в англоязычной литературе).
Заместительная почечная терапия – комплекс специализированных методов замещения функций почек (гемодиализ, перитонеальный диализ, трансплантация почки). Трансплантация почки позволяет восстановить весь спектр утраченных функций почек.
Кардиоваскулярная болезнь при ХБП – прогрессирующее поражение сердечно-сосудистой системы вследствие воздействия комплекса факторов, ассоциированных с ХБП.
Маскированная АГ – нормальный уровень АД при измерении в медицинском учреждении, но подъемы АД дома (по данным СМАД или регулярных «домашних» измерений АД.
Минеральные и костные нарушения при ХБП – синдром системной патологии, включающий лабораторные отклонения в минерально-костном метаболизме, костные аномалии, эктопическую кальцификацию, сопутствующие ХБП.
«Non-dipper» – отсутствие снижения среднего САД и ДАД ночью во время сна (норма – 10-20%).
Нутритивный (трофологический) статус – это комплекс клинических, антропометрических и лабораторных показателей, характеризующих количественное соотношение мышечной и жировой массы тела пациента. Также употребляется термин «питательный статус» / «состояние питания».
Острое повреждение почек (ОПП) – острое, потенциально обратимое изменение в почечной паренхиме, сопровождающееся снижением функции почек различной степени. Термин, общепринятый в настоящее время вместо устаревшего – острая почечная недостаточность (ОПН). Последнее предложение по своей сути неверное, так как термины ОПП и ОПН не являются синонимами. Международные критерии консенсуса для ОПП предназначены для описания трех уровней почечной недостаточности (риск, травмы, недостаточность) и двух клинических исходов (потеря почечной функции и терминальная стадия).
Паратиреоидэктомия – хирургический метод лечения гиперпаратиреоза при ХБП.
Перитонеальный диализ – метод заместительной почечной терапии, основанный на принципе диффузионного обмена, фильтрационного и конвекционного переноса через «перитонеальную мембрану» (брюшину) низко- и среднемолекулярных, в т. ч, белковых субстанций, а также жидкости из крови в диализирующий раствор, находящийся в полости брюшины.
Перитонеальный диализ с использованием автоматизированных технологий (автоматизированный перитонеальный диализ) – метод перитонеального диализа, который осуществляется с помощью специальных аппаратов (циклеров для перитонеального диализа), обеспечивающих введение и выведение диализного раствора без участия пациента. Циклер по заданной врачом программе осуществляет автоматические циклы замены раствора в брюшной полости.
Постоянный амбулаторный перитонеальный диализ – метод перитонеального диализа, в котором замена диализирующего раствора в брюшной полости (несколько раз в сутки) проводится самостоятельно больным в амбулаторных условиях (в домашних условиях).
Резистентная АГ – уровень АД выше целевых значений, несмотря на прием 3-х и более АГС (в оптимальных дозах), один из которых – диуретик.
Сердечная недостаточность – синдром, развивающийся вследствие структурного или функционального повреждения миокарда, приводящего к снижению насосной функции сердца.
«Сухая масса тела» – масса тела пациента в состоянии нормогидратации; у пациентов на гемодиализе – минимальная масса тела, при которй еще нет симптомов гиповолемии (падение АД, судороги мышц конечностей, боли в животе).
Критерии оценки качества медицинской помощи
Критерии оценки качества первичной медико-санитарной помощи детям при хронической болезни почек
|
№ п/п |
Критерии оценки качества |
Оценка выполнения |
|---|---|---|
|
1. |
Выполнен общий (клинический) анализ мочи, исследование альбумина в моче и исследование белка в моче |
Да/Нет |
|
2. |
Выполнено ультразвуковое исследование почек и дуплексное сканирование артерий почек |
Да/Нет |
|
3. |
Выполнен прием (консультация) врача-нефролога лечебно-диагностический первичный и/или прием (консультация) врача-педиатра лечебно-диагностический первичный с измерением массы тела, измерением длины тела) |
Да/Нет |
|
4. |
Выполнен общий (клинический) анализ крови расширенный |
Да/Нет |
|
5. |
Выполнен исследование креатинина в крови, исследование мочевины в крови, исследование мочевой кислоты в крови, исследование общего белка, исследование альбумина в крови, исследование щелочной фосфатазы в крови, исследование активности альфа-амилазы в крови, исследование глюкозы в крови, исследование С-реактивного белка в крови, исследование активности аспартатаминотрансферазы в крови, исследование активности аланинаминотрансферазы в крови, исследование калия в крови, исследование натрия в крови, исследование хлора в крови, исследование общего кальций в крови, исследование неорганического фосфора в крови, исследование железа в крови, исследование общего холестерина в крови, исследование триглицеридов в крови, исследование холестерина липопротеинов высокой плотности в крови, исследование холестерина липопротеинов низкой плотности расчетным методом |
Да/Нет |
|
6. |
Выполнено исследование паратиреоидного гормона в крови (при ХБП стадии C2- С5Д – 1 раз в 3 мес.) |
Да/Нет |
|
7. |
Выполнена регистрация электрокардиограммы |
Да/Нет |
|
8. |
Назначено суточное мониторирование артериального давления пациентам старше 5 лет с ХБП 4-5 ст. 1 раз в 6-12 мес. и детям с ХБП 1-3 ст. при выявлении эпизодов подъема АД и/или изменений сердца (гипертрофии миокарда, расширения аорты) по данным эхокардиографии |
Да/Нет |
|
9. |
Выполнена эхокардиография трансторакальная |
Да/Нет |
|
10. |
Выполнен прием (консультация) врача-офтальмолога лечебно-диагностический первичный и офтальмоскопия |
Да/Нет |
Критерии оценки качества специализированной медицинской помощи детям при хронической болезни почек
|
№ п/п |
Критерии оценки качества |
Оценка выполнения |
|---|---|---|
|
1. |
Выполнен общий (клинический) анализ мочи, исследование альбумина в моче и определение белка в моче |
Да/Нет |
|
2. |
Выполнено ультразвуковое исследование почек и дуплексное сканирование артерий почек |
Да/Нет |
|
3. |
Выполнен общий (клинический) анализ крови расширенный |
Да/Нет |
|
4. |
Выполнено исследование креатинина в крови, исследование мочевины в крови, исследование мочевой кислоты в крови, исследование общего белка, исследование альбумина в крови, исследование щелочной фосфатазы в крови, исследование активности альфа-амилазы в крови, исследование глюкозы в крови, исследование С-реактивного белка в крови, исследование активности аспартатаминотрансферазы в крови, исследование активности аланинаминотрансферазы в крови, исследование калия в крови, исследование натрия в крови, исследование хлора в крови, исследование общего кальций в крови, исследование неорганического фосфора в крови, исследование железа в крови, исследование общего холестерина в крови, исследование триглицеридов в крови, исследование холестерина липопротеинов высокой плотности в крови, исследование холестерина липопротеинов низкой плотности расчетным методом |
Да/Нет |
|
5. |
Выполнено исследование паратиреоидного гормона в крови (при ХБП стадии C2- С5Д – 1 раз в 3 мес.) |
Да/Нет |
|
6. |
Выполнена регистрация электрокардиограммы |
Да/Нет |
|
7. |
Выполнено суточное мониторирование артериального давления пациентам старше 5 лет с ХБП 4-5 ст. 1 раз в 6-12 мес. и детям с ХБП 1-3 ст. при выявлении эпизодов подъема АД и/или изменений сердца (гипертрофии миокарда, расширения аорты) по данным эхокардиографии |
Да/Нет |
|
8. |
Выполнена эхокардиография трансторакальная |
Да/Нет |
|
9. |
Выполнен прием (консультация) врача-офтальмолога лечебно-диагностический первичный и офтальмоскопия |
Да/Нет |
|
10. |
Выполнен ежедневный осмотр врачом-нефрологом с наблюдением и уходом среднего и младшего медицинского персонала на нефрологических койках в стационарных условиях или ежедневный осмотр врачом-педиатром с наблюдением и уходом среднего и младшего медицинского персонала в стационарных условиях и прием (консультация) врача-нефролога лечебно-диагностический первичный |
Да/Нет |
|
11. |
Выполнено исследование кислотно-основного состояния и газов крови (при ХБП С3-С5) |
Да/Нет |
|
12. |
Выполнена рентгенография верхней конечности и/или рентгенография нижней конечности (при признаках костно-минеральных нарушений у пациентов с ХБП стадии С3-С5D) |
Да/Нет |
|
13. |
Выполнено исследование тиреотропного гормона (ТТГ) в крови и исследование соматомедина A (инсулиноподобного фактора роста II)в крови (при задержке роста, перед началом лечением соматропином** ) |
Да/Нет |
|
14. |
Выполнен перитонеальный диализ или гемодиализ, или гемодиализ интермиттирующий высокопоточный, или гемодиализ интермиттирующий низкопоточный, или гемодиализ интермиттирующий продленный, или гемодиализ с селективной плазмофильтрацией и адсорбцией, или гемодиализ продолжительный (при ХБП стадии C5Д) |
Да/Нет |
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
Эмирова Х. М. – д.м.н., профессор кафедры педиатрии ФГБОУ ВО Российского университета медицины Минздрава России; врач-нефролог Центра гравитационной хирургии крови и гемодиализа ГБУЗ «Детская городская клиническая больница св. Владимира» ДЗМ, член РДО.
Абасеева Т. Ю. – к.м.н., доцент кафедры педиатрии ФГБОУ ВО Российского университета медицины Минздрава России; врач-нефролог Центра гравитационной хирургии крови и гемодиализа ГБУЗ «Детская городская клиническая больница св. Владимира» ДЗМ, член РДО.
Апханова Т. В. – главный научный сотрудник отдела физиотерапии и рефлексотерапии ФГБУ «Национальный медицинский исследовательский центр реабилитации и курортологии» Минздрава России, д.м.н., член Национальной ассоциации экспертов по санаторно-курортному лечению.
Баранов А. А. – акад. РАН, профессор, д.м.н.; почетный президент Союза педиатров России, советник руководителя НИИ педиатрии и охраны здоровья детей НКЦ № 2 ФГБНУ «РНЦХ им акад. Б.В.Петровского» , профессор кафедры педиатрии и детской ревматологии ФГАОУ «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет), главный внештатный специалист педиатр Минздрава России.
Вишнёва Е. А. – д.м.н., профессор РАН, заместитель руководителя НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им. акад. Б.В.Петровского», профессор кафедры факультетской педиатрии Института материнства и детства ФГАОУ ВО «РНИМУ им. Н.И. Пирогова» (Пироговский Университет) Минздрава России, член Союза педиатров России.
Гаджиева П. М. – к.м.н., врач-педиатр, врач-нефролог, врач-иммунолог отделения педиатрической трансплантации ФГБУ "НМИЦ ТИО им. ак. В.И.Шумакова" Минздрава России.
Генералова Г. А. – к.м.н., доцент кафедры педиатрии им. Г.Н.Сперанского ФГБОУ ДПО Российская медицинская академия непрерывного последипломного образования МЗ РФ, врач-нефролог Центра гравитационной хирургии крови и гемодиализа ГБУЗ «Детская городская клиническая больница св. Владимира» ДЗМ, член ТОДН.
Жариков А. А. – врач-хирург ФГБУ "НМИЦ ТИО им. ак. В. И. Шумакова" Минздрава России.
Калюжная Т. А. – к.м.н., ведущий научный сотрудник отдела разработки научных подходов к иммунизации пациентов с отклонениями в состоянии здоровья и хроническими болезнями, врач-педиатр НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им. акад. Б.В.Петровского», доцент кафедры факультетской педиатрии Института материнства и детства ФГАОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России (Пироговский Университет), член Союза педиатров России.
Карасева М. С. – врач-педиатр, член Союза педиатров России.
Карапитьян А. Р. –, врач-хирург ФГБУ "НМИЦ ТИО им. ак. В. И. Шумакова" Минздрава России.
Кончугова Т. В. – главный научный сотрудник отдела физиотерапии и рефлексотерапии ФГБУ «НМИЦ РК» Минздрава России, д.м.н., проф., член национальной ассоциации экспертов по санаторно-курортному лечению
Лупан И. Н. – к.м.н., доцент кафедры педиатрии и неонатологии Института дополнительного профессионального образования Южно-Уральского государственного медицинского университета, главный внештатный детский специалист нефролог Министерства здравоохранения Челябинской области, член ТОДН, член Союза педиатров России.
Маргиева Т. В. – к.м.н., главный специалист Методического центра аккредитации специалистов ФГАОУ ВО «Первый МГМУ им.И.М.Сеченова» Минздрава России (Сеченовский Университет), врач-нефролог, член Союза педиатров России.
Макарова Т. П. – д.м.н., профессор кафедры госпитальной педиатрии ФГБОУ ВО Казанского государственного медицинского университета Минздрава России, член ТОДН, член Союза педиатров России.
Кварацхелия М. В. – доцент кафедры ФГБОУ ВО Российского университета медицины Минздрава России, врач-нефролог ГБУЗ ДГКБ св. Владимира
Шилова М. М. – к.м.н., доцент кафедры пропедевтики детских болезней ИМДФГАОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России (Пироговский Университет)
Мстиславская С. А. – к.м.н., доцент кафедры педиатрии ФГБОУ ВО Российского университета медицины Минздрава России; врач-нефролог Центра гравитационной хирургии крови и гемодиализа ГБУЗ «Детская городская клиническая больница св. Владимира» ДЗМ.
Музуров А. Л. – к.м.н., доцент кафедры анестезиологии, реаниматологии и токсикологии детского возраста ФГБОУ ДПО Российская медицинская академия непрерывного последипломного образования МЗ РФ, врач анестезиолог-реаниматолог, заведующим Центром гравитационной хирургии крови и гемодиализа, ГБУЗ «Детская городская клиническая больница св. Владимира» ДЗМ, член ТОДН
Панкратенко Т. Е. – к.м.н., доцент кафедры трансплантологии, нефрологии и искусственных органов ГБУЗ МО МОНИКИ им. М.Ф.Владимирского, врач-нефролог Центра гравитационной хирургии крови и гемодиализа ГБУЗ «Детская городская клиническая больница св. Владимира» ДЗМ, член РДО.
Орлова О. М. – к.м.н., ассистент кафедры педиатрии ФГБОУ ВО Российского университета медицины Минздрава России; врач-нефролог Центра гравитационной хирургии крови и гемодиализа ГБУЗ «Детская городская клиническая больница св. Владимира» ДЗМ.
Петросян Э. К. – д.м.н., профессор кафедры госпитальной педиатрии им. академика В.А. Таболина педиатрического факультета РНИМУ им. Н.И. Пирогова, заведующая отделением нефрологии РДКБ.
Попа А. В. – доцент кафедры ФГБОУ ВО Российского университета медицины Минздрава России.
Приходина Л. С. – д.м.н., заведующая отделом наследственных и приобретенных болезней почек имени профессора М.С. Игнатовой ОСП НИКИ педиатрии и детской хирургии им. академика Ю. Е. Вельтищева ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет), профессор кафедры педиатрии имени академика Г.Н.Сперанского ФГБОУ ДПО РМАНПО Минздрава России, Президент Творческого объединения нефрологов.
Румянцев А. Л. – к.м.н., заведующий отделением диализа ГБУЗ “Детская городская клиническая больница им. Н.Ф.Филатова” ДЗМ, член РДО, ITPA, IPNA, ESPN, AST, ERA.
Намазова-Баранова Л. С. .– акад. РАН, профессор, д.м.н., президент Союза педиатров России; паст-президент EPA/UNEPSA; руководитель НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им. акад. Б.В.Петровского», заведующая кафедрой факультетской педиатрии Института материнства и детства ФГАОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России (Пироговский Университет), главный внештатный детский специалист по профилактической медицине Минздрава России.
Сайдулаев Д. А. – к.м.н., заведующий хирургическим отделением №1 ФГБУ "НМИЦ ТИО им. ак. В. И. Шумакова" Минздрава России
Селимзянова Л. Р. – к.м.н., заведующая отделом стандартизации и изучения основ доказательной медицины НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им. акад. Б.В.Петровского», доцент кафедры педиатрии и детской ревматологии ФГАОУ «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет), доцент кафедры факультетской педиатрии Института материнства и детства ФГАОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России (Пироговский Университет), член Союза педиатров России.
Седашкина О. А. – к.м.н., доцент кафедры факультетской педиатрии ФГБОУ ВО «Самарский государственный медицинский университет» Министерства здравоохранения Российской Федерации, врач-нефролог ГБУЗ Самарская областная клиническая больница имени В.Д. Середавина, лауреат Губернской премии в области науки и техники, член Союза педиатров России, член ТОДН, член РДО.
Федосеенко М. В. – к.м.н., заведующая отделом разработки научных подходов к иммунизации пациентов с отклонениями в состоянии здоровья и хроническими болезнями, ведущий научный сотрудник, врач-педиатр НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им. акад. Б.В.Петровского», доцент кафедры факультетской педиатрии Института материнства и детства ФГАОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России (Пироговский Университет), член Союза педиатров России.
Цыгин А. Н. – д.м.н., профессор, заведующий нефрологическим отделением НМИЦ здоровья детей, профессор кафедры нефрологии НОИ Клинической медицины им. Н.А.Семашко Российского университета медицины, МОО «Творческое объединение детских нефрологов».
Конфликт интересов: Авторы подтверждают отсутствие финансовой поддержки/конфликта интересов, который необходимо обнародовать.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
-
Врачи-нефрологи;
-
Врачи-педиатры;
-
Врачи общей врачебной практики (семейные врачи);
-
Врачи-диетологи;
-
Врачи-анестезиологи-реаниматологи;
-
Врачи-кардиологи;
-
Врачи-детские кардиологи;
-
Врачи-детские хирурги;
-
Врачи-урологи;
-
Врачи-детские урологи-андрологи;
-
Врачи- патологоанатомы;
-
Врачи-клинические фармакологи;
-
Студенты медицинских ВУЗов;
-
Обучающиеся в ординатуре и аспирантуре.
Методы, использованные для сбора/селекции доказательств:
-поиск в электронных базах данных.
Методы, использованные для анализа доказательств:
-обзоры опубликованных мета-анализов;
-системные обзоры с таблицами доказательств.
Методы, использованные для формулирования рекомендаций:
-Консенсус экспертов.
-Оценка значимости в соответствии с рейтинговой схемой.
Сила и качество рекомендаций в соответствии с проведенным анализом доказательств (табл. П1, П2) приведены в тексте.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД)для методов диагностики (диагностических вмешательств)
|
УДД |
Расшифровка |
|---|---|
|
1 |
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
|
2 |
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
|
3 |
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая |
|
5 |
Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД)для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
|
УДД |
Расшифровка |
|---|---|
|
1 |
Систематический обзор РКИ с применением мета-анализа |
|
2 |
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа |
|
3 |
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
|
5 |
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 3. Шкала оценки уровней убедительности рекомендаций(УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
|
УУР |
Расшифровка |
|---|---|
|
A |
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
|
B |
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
|
C |
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Порядки оказания медицинской помощи:
-
Приказ Министерства здравоохранения и социального развития РФ от 16 апреля 2012 г. № 366н "Об утверждении Порядка оказания педиатрической помощи".
-
Информация о лекарственных препаратах: Государственный реестр лекарственных средств: https://grls.rosminzdrav.ru
-
Федеральный закон от 21 ноября 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» (Собрание законодательства Российской Федерации, 2011 г., № 48, ст. 6724);
-
Международная классификация болезней, травм и состояний, влияющих на здоровье (МКБ – 10);
-
Приказ МЗ РФ от от 2 мая 2023 г. № 205н «Об утверждении номенклатуры должностей медицинских работников и фармацевтических работников».
-
Приказ МЗ РФ от 23 июля 2010 г. № 541н "Единый квалификационный справочник должностей руководителей, специалистов и служащих" раздел "Квалификационные характеристики должностей работников в сфере здравоохранения".
-
Федеральный закон от 25.12.2018 № 489 489-ФЗ «О внесении изменений в статью 40 Федерального закона "Об обязательном медицинском страховании в Российской Федерации" и Федеральный закон "Об основах охраны здоровья граждан в Российской Федерации" по вопросам клинических рекомендаций».
-
Приказ Минздрава России № 103н от 28.02.2019 г. «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации».
-
Приказ Минздрава России от 13.10.2017 № 804н "Об утверждении номенклатуры медицинских услуг".
-
Приказ Министерства здравоохранения РФ от 14 января 2019 г. № 4н «Об утверждении порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения».
-
Медицинские противопоказания к проведению профилактических прививок препаратами национального календаря прививок: Методические указания.—М.: Федеральный центр госсанэпиднадзора Минздрава России, 2002.— 16 с.
-
«Методические рекомендации по выявлению, расследованию и профилактике побочных проявлений после иммунизации».
Основные нормативно-правовые акты, регулирующие оказание паллиативной медицинской помощи:
-
Федеральный закон "О внесении изменений в Федеральный закон "Об основах охраны здоровья граждан в Российской Федерации" по вопросам оказания паллиативной медицинской помощи" от 06.03.2019 № 18-ФЗ.
-
Приказ Минздрава России № 345н, Минтруда России от 31.05.2019 № 372н «Об утверждении положения об организации оказания паллиативной медицинской помощи, включая порядок взаимодействия медицинских организаций, организаций социального обслуживания и общественных объединений, иных некоммерческих организаций, осуществляющих свою деятельность в сфере охраны здоровья».
-
Приказ Минздрава России № 348н от 31 мая 2019 года «Об утверждении перечня медицинских изделий, предназначенных для поддержания органов и систем организма человека, предоставляемых для использования на дому».
-
Приказ Минздрава России № 505н от 10 июля 2019 года «Об утверждении Порядка передачи от медицинской организации пациенту (его законному представителю) медицинских изделий, предназначенных для поддержания функций органов и систем организма человека, для использования на дому при оказании паллиативной медицинской помощи».
-
Приказ МЗ РФ № 831 от 3 октября 2019 года «Об утверждении ведомственной целевой программы «Развитие системы оказания паллиативной медицинской помощи».
Для кодирования этиологического фактора (болезни, приведшей к развитию ХБП) или состояний, ассоциированных с ХБП с указанием «Фоновое состояние» или «Осложнение» следует использовать соответствующие коды МКБ-10.
В случаях подготовки к заместительной почечной терапии (ЗПТ)необходимо применять коды Z49.0-Z49.2.
Z49.0 – Подготовительные процедуры для проведения диализа (сосудистый доступ для гемодиализа, перитонеальный катетер) при
ХБП: N18 (N18.4; 18.5)
Z49.1 – Экстракорпоральный диализ (гемодиализ, гемодиафильтрация)
Z49.2 – Другой вид диализа (перитонеальный диализ)
Z99.2 – Зависимость от почечного диализа (код используется для пациентов, длительно находящихся на заместительной почечной терапии) Соответствующие коды МКБ-10 применяются для кодирования осложнений ХБП и ассоциированных состояний:
D63.8 – Анемия при других хронических болезнях, классифицированных в других рубриках
Е21.1 – Вторичный гиперпаратиреоз, не классифицированный в других рубриках
Е43 – Тяжелая белково-энергетическая недостаточность
Е44.0 – Умеренная белково-энергетическая недостаточность
Е44.1 – Легкая белково-энергетическая недостаточность
Е45 – Задержка развития, обусловленная белково-энергетической недостаточностью.
Алиментарная: низкорослость (карликовость), задержка роста.
Задержка физического развития вследствие недостаточности питания.
E46 – Белково-энергетическая недостаточность неуточненная
Е83.3 – Нарушение обмена фосфора
Е83.5 – Нарушение обмена кальция
Е83.8 – Другие нарушения минерального обмена
Е87.2 – Ацидоз
Е87.5 – Гиперкалиемия
Е89.2 – Гипопаратиреоз, возникший после медицинских процедур
I15.1 – Гипертензия при других заболеваниях почек
I43.8 – Кардиомиопатия при других болезнях, классифицированных в других рубриках
N25.0 – Почечная остеодистрофия
N39.1 – Стойкая протеинурия неуточненная
Q60.0 – Агенезия почки односторонняя
Q60.3 – Гипоплазия почки односторонняя
Q63.1 – Слившаяся, дольчатая и подковообразная почка
Q61.4 – Дисплазия почки
Q63.0 – Добавочная почка
Примеры диагнозов:
Примеры формулировки диагноза у пациентов с ХБП в возрасте 3 мес – 2-х лет жизни:
-
Аутосомно-рецессивная поликистозная болезнь: поликистоз почек и печени. ХБП с умеренным снижением СКФ. Вторичная артериальная гипертензия, 2 ст.
-
Врожденная аномалия мочевых путей и почек (ВАМП): гипоплазия левой почки. ХБП с нормальной СКФ.
-
ВАМП: дисгенезия проксимальных канальцев. Врожденная ХБП, терминальная стадия.
-
Врожденный нефротический синдром финского типа. ХБП с резко сниженной СКФ.
в возрасте старше 2-х лет:
-
Киста правой почки. ХБП С1.
-
ВАМП: пузырно-мочеточниковый рефлюкс слева 3 ст. ХБП С1А1. Состояние после эндоскопической коррекции (12.02.2018).
-
Хронический гломерулонефрит (морфологически: фокально-сегментарный гломерулосклероз), нефротический синдром. ХБП С3аА3.
-
Хронический гломерулонефрит (морфологически: IgА-нефропатия), рецидивирующая синфарингеальная гематурия. ХБП С1А1. ВАМП: гипопластическая дисплазия обеих почек. ХБП С5Д (программный гемодиализ с 14.02.2010).
-
Хронический гломерулонефрит (морфологически: фокально-сегментарный гломерулосклероз). ХБП С5. Аллотрансплантация почки от родственного донора от 15.06.2011. ХБП С3аА3Т. STEC-ГУС, тяжелой степени В (2012 г.). ХБП С3бА2. Вторичная артериальная гипертензия, 2 ст.
Приложение А3.1 Оценка физического развития детей
[Петеркова В.А., Нагаева Е.В., Ширяева Е.Ю. Методические рекомендации «Оценка физического развития детей и подростков» ФГБУ «НМИЦ Эндокринологии», 2017г., Москва, 98с].
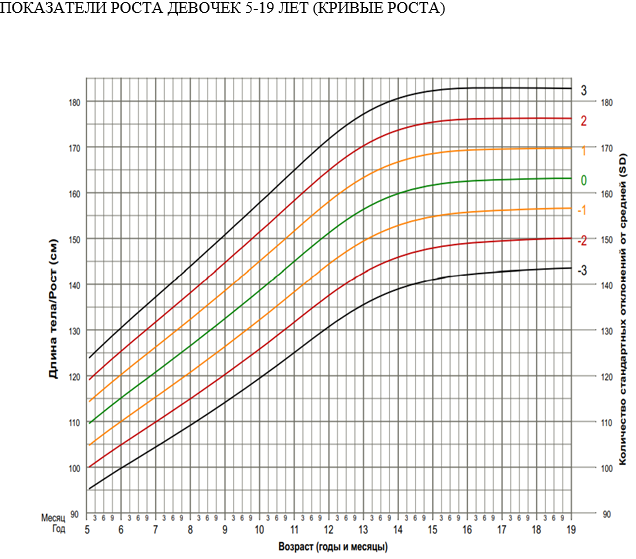
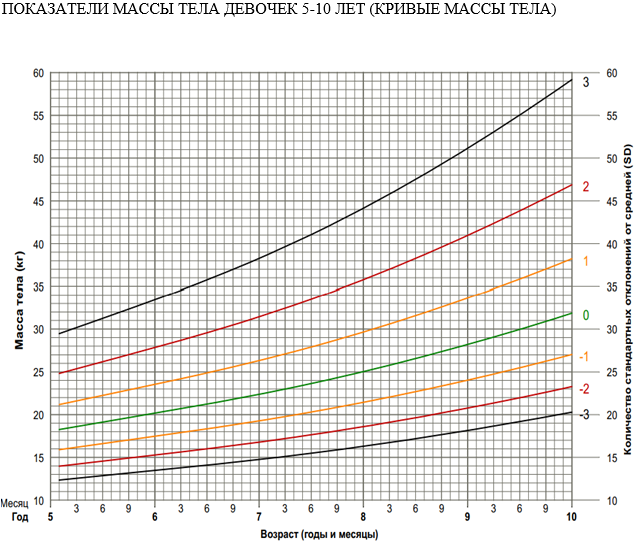
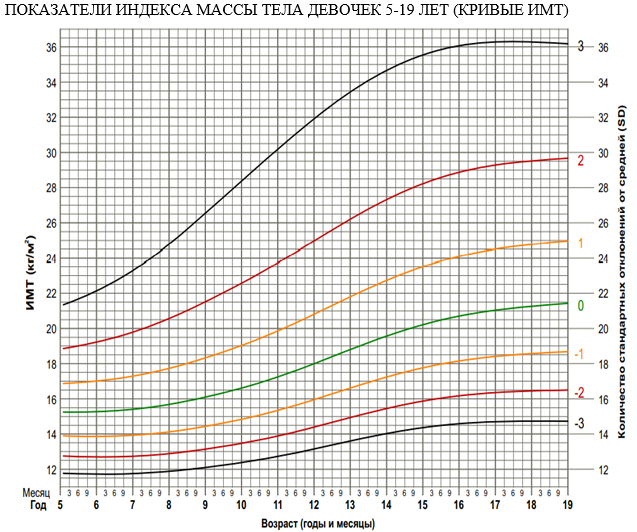
Приложение А3.2 Параметры и частота оценки нутритивного статуса у детей с ХБП 3Б-5Д стадии. Антропометрические измерения [293]
Приложение А3.3 Ожидаемая ежедневная прибавка массы тела по возрасту (г) [293]
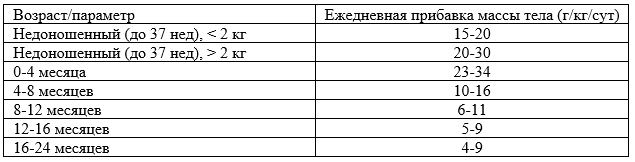
Приложение А3.4 Содержание калия во фруктах
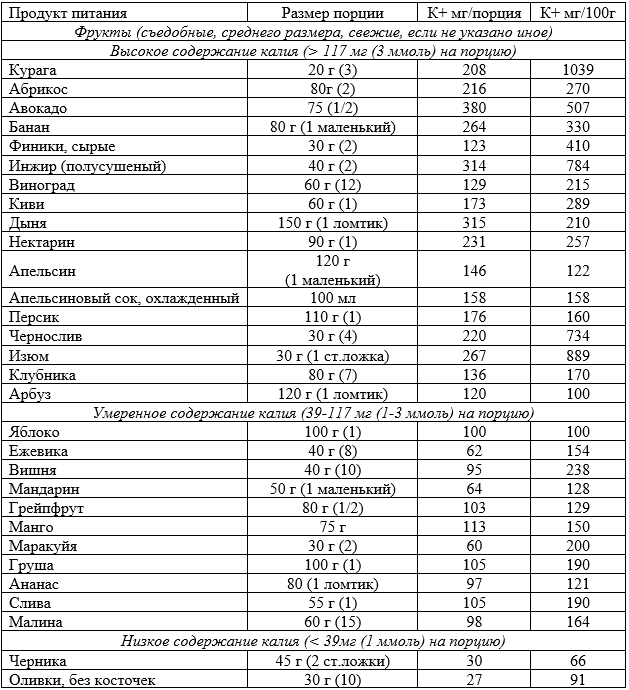
Приложение А3.5 Содержание калия в овощах и бобовых
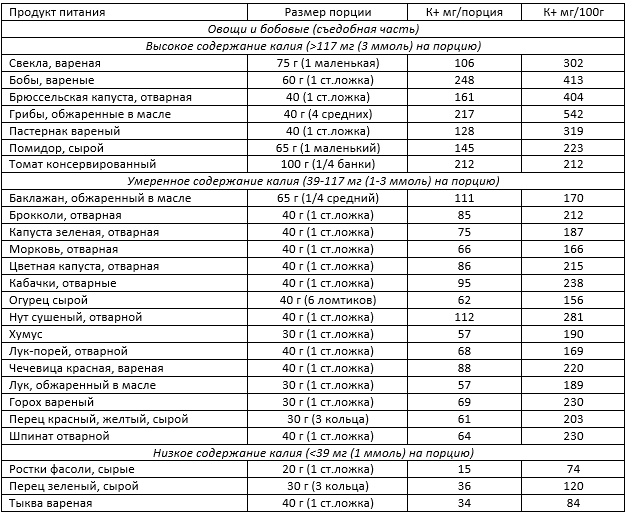
Приложение А3.6 Содержание калия в других группах продуктов
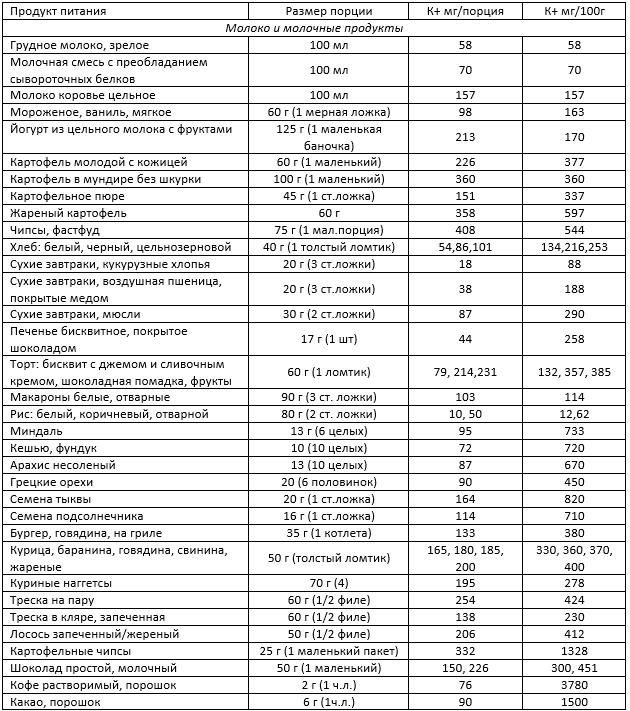
Приложение А3.7 Содержание фосфора в основных продуктах питания
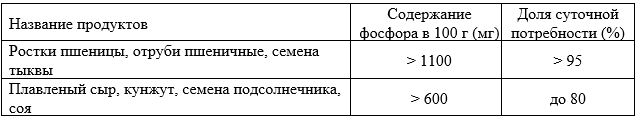
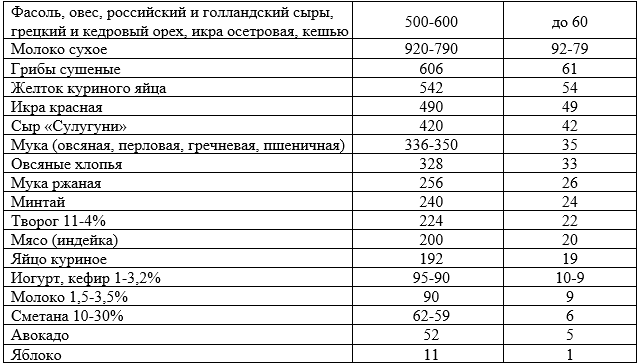
Приложение А3.8 SDI (рекомендуемое диетическое потребление) кальция и фосфата у детей с ХБП 2-5D ст. [221]
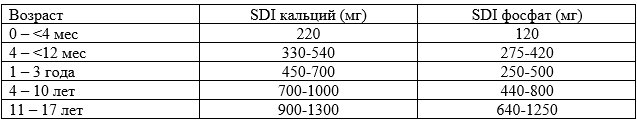
Приложение А3.9 Рекомендуемое потребление фосфора для детей с ХБП [178]
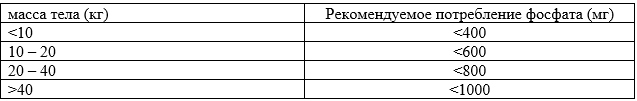
Приложение А3.10 Рекомендации по потреблению натрия для детей в зависимости от возраста (KDIGO, 2024)

Приложение А3.11 Рекомендуемое суточное потребление калия для детей с ХБП [178]
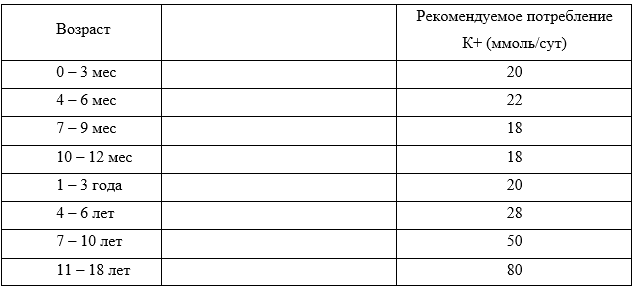
Приложение А3.12 Потребность в белке у детей с ХБП (DRI) [4]
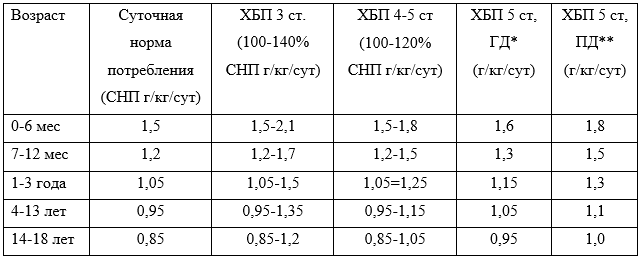
*СНП+0,1 г/кг/сут для восполнения потерь на ГД (гемодиализе)
** СНП+0,15+0,3 г/кг/сут для восполнения потерь на ПД (перитонеальном диализе)
Приложение А3.13 Потребность в энергии и белке для младенцев, детей и подростков от 0 до 18 лет с ХБП 2-5D ст стадии [162]
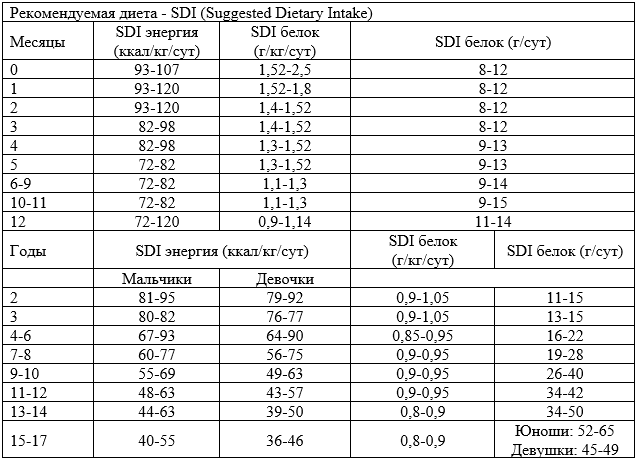
Приложение А3.14 Коэффициенты перевода единиц измерения из метрической системы в международную систему единиц (СИ) [6]
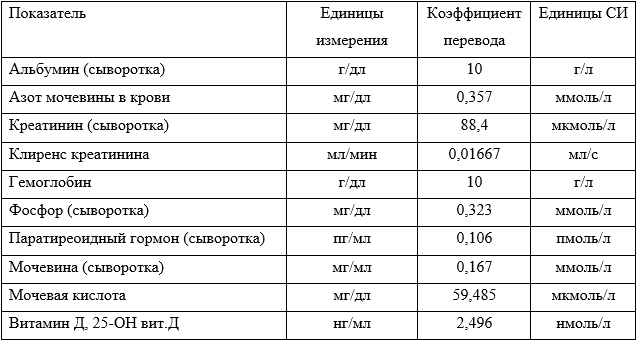
Примечание: единица измерения х коэффициент перевода = единица СИ
Приложение А3.15 Взаимосвязь между категориями альбуминурии и протеинурии [6, 110]
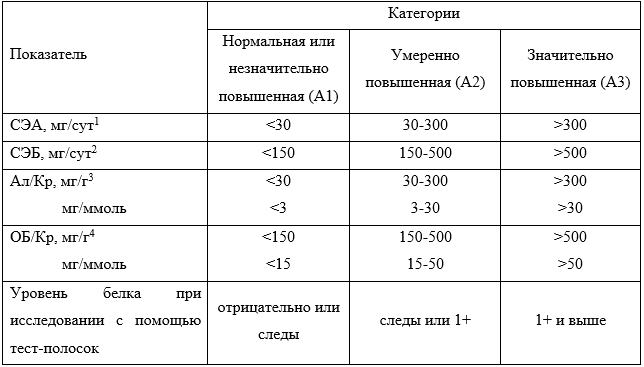
1 – суточная экскреция альбумина
2 – суточная экскреция белка
3 – альбумин/креатинин
4 – общий белок/креатинин
Приложение А3.16 Пороговые значения гемоглобина для диагностики анемии по данным Всемирной Организации здравоохранения (ВОЗ)
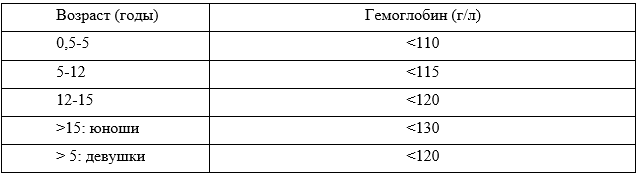
Приложение А3.17 Целевые показатели гемоглобина у взрослых и детей с ХБП, получающих поддерживающую терапию препаратами группы «Другие антианемические препараты» (эритропоэтины) [295, 296]
1 гемоглобин
Приложение А3.18 Референсные значения уровней неорганического фосфора и общего кальция в крови у детей
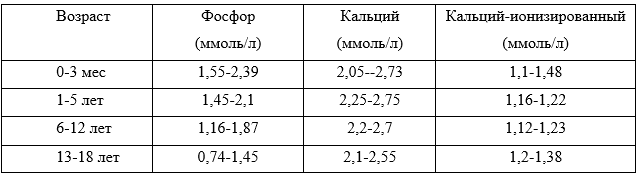
Приложение А3.19 Целевое значение ПТГ, общего кальция и неорганического фосфора в сыворотке крови в зависимости от стадии ХБП
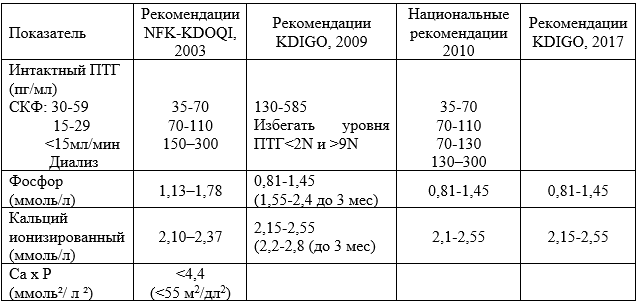
Са корригированный (ммоль/л) = Са общий + 0,02 ммоль × (40– A[г/л]);
Са корригированный (мг/дл) = Са общий + 0,8 ммоль × (4 – A [г/дл])
Приложение А3.20 Консервативное лечение гиперкалиемии [138, 315, 341]
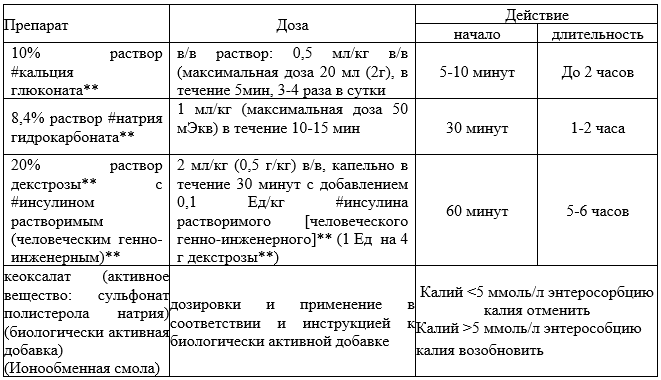
Приложение А3.21 Лекарственные средства, обладающие фосфат-связывающими свойствами [4, 129, 162]
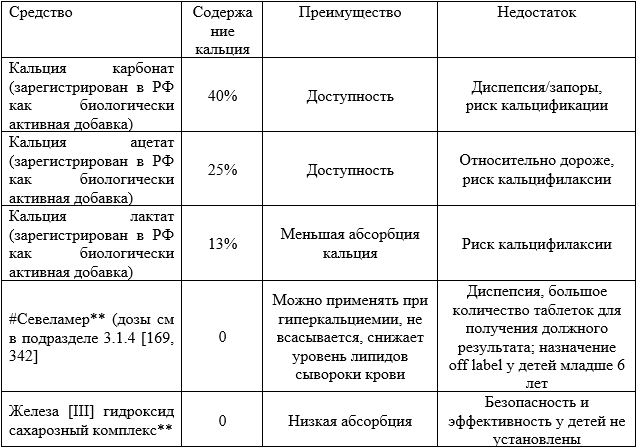
Приложение А3.22 Статус витамина D и его аналогов [4, 129, 310]
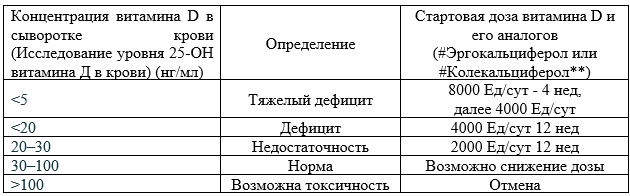
Приложение А3.23 Формы витамина D и его аналогов, прочих антипаратиреоидных препаратов, применяющихся при ХБП у детей [129, 206, 210, 223, 310, 352, 353]
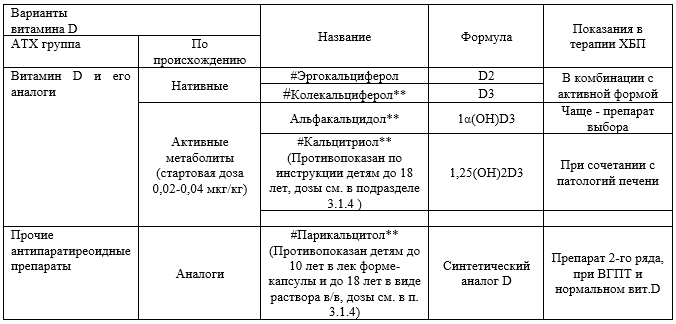
Приложение А3.24 Расшифровка примечаний
** – лекарственный препарат, входящий в Распоряжение Правительства РФ от 12.10.2019 № 2406-р (с изменениями) «Об утверждении перечня жизненно необходимых и важнейших лекарственных препаратов, а также перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи»;
# – применение лекарственного препарата в соответствии с показателями (характеристиками), не указанными в инструкции по его применению (off-label), осуществляется согласно ФЗ №323-ФЗ от 21.11.2011г. (с изменениями) при условии подписанного информированного добровольного согласия, а в случае необходимости, по решению врачебной комиссии.
Приложение Б. Алгоритмы действий врача
Приложение Б1. Алгоритм диагностики ХБП у детей
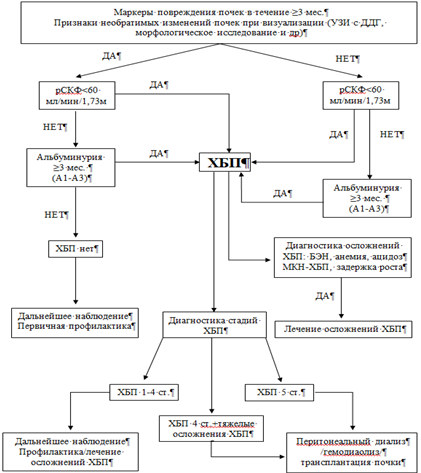
Приложение В. Информация для пациента
Хроническая болезнь почек – состояние, при котором почки не выполняют в полном объеме свои функции. В норме почки фильтруют кровь и удаляют из нее шлаки, лишние соли и воду.
При хронической болезни почек почки постепенно теряют способность к этой фильтрации. Со временем почки могут совсем перестать выполнять свои функции.
Поэтому чрезвычайно важно проведение мероприятий для замедления прогрессирования хронической болезни почек.
Хроническая болезнь почек может изначально никак себя не проявлять. При прогрессировании болезни могут появиться отеки на ногах, чувство усталости, повышаться артериальное давление, нарушения в костной ткани
О том, что необходимо делать расскажет врач-нефролог. Необходимо обязательно четко соблюдать его рекомендации, например:
Принимать препараты от артериальной гипертонии, если они назначены в той дозе и том режиме, который прописан доктором.
При возникновении побочных реакций – обязательно сообщить врачу.
Избегать приема ряда лекарственных препаратов, в том числе, некоторых лекарств, обладающих обезболивающим и жаропонижающим эффектом (например, ибупрофен**). Обязательно советуйтесь с лечащим врачом если планируете лечение любыми препаратами.
В случае если почки совсем перестают работать существует несколько подходов к лечению:
- гемодиализ;
- перитонеальный диализ;
- трансплантация почки.
Каждый из методов имеет свои преимущества и недостатки. Перед принятием решения – посоветуйтесь с лечащим врачом чтобы выбрать оптимальный вариант лечения.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Не применяются.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.