Фибрилляция предсердий: диагностика и лечение
 Версия: Клинические протоколы КР 2024 (Кыргызстан)
Версия: Клинические протоколы КР 2024 (Кыргызстан)
Общая информация
Краткое описание
ДИАГНОСТИКА И ЛЕЧЕНИЕ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ
Классификация
В зависимости от частоты ритма желудочков во время бодрствования различают:
В зависимости от уровня физической активности, степени эмоционального напряжения, а также под действием лекарственных препаратов и ряда других факторов, влияющих на функциональные характеристики АВ узла, обычно наблюдаются обратимые переходы одного варианта ФП в другой.
Современная классификация выделяет 5 типов ФП, из которых последние 4 обозначают еще и как формы клинического течения: (1) впервые диагностированная (выявленная), (2) пароксизмальная, (3) персистирующая, (4) длительно персистирующая и (5) постоянная или хроническая.
ФП традиционно также подразделяют на клапанное и неклапанное. Под клапанной подразумевают ФП у больных с искусственными клапанами сердца или ревматическим пороком сердца (преимущественно митральный стеноз). Все остальные варианты расцениваются как неклапанное МП.
Термином «идиопатическое» ФП обозначают случаи аритмии, которые возникают у лиц без органического заболевания сердца.
Этиология и патогенез
В ряде случаев ФП возникает у лиц молодого возраста без сопутствующего заболевания сердца (так называемое идиопатическое мерцание или «lone atrial fibrillation»). Распространенность идиопатического ФП составляет по данным разных авторов от 1,6 до 30%. В недавно опубликованном исследовании EORP-AF [5] отутствие явного структурного заболевания сердца было документировано лишь у 6% больных с ФП.
В большинстве случаев ФП ассоциируется с различными сердечно-сосудистыми заболеваниями, которые создают субстрат для сохранения аритмии.
Риск развития ФП увеличивается с возрастом, что, возможно, является следствием возрастной потери и изоляции миокарда предсердий и сопутствующих нарушений проводимости.
Артериальная гипертония – это фактор риска встречаемости впервые диагностированного ФП и его осложнений, таких как инсульт и системные тромбоэмболии.
Сердечная недостаточность II-IV функционального класса по NYHA наблюдается у 30% больных с ФП, а ФП – у 30-40% пациентов с сердечной недостаточностью. При этом сердечная недостаточность может быть как следствием ФП (например, декомпенсация сердечной недостаточности при остром развитии ФП), так и причиной аритмии (из-за увеличения давления в предсердиях и перегрузки объемом, вторичной дисфункции клапанов сердца и хронической активации нейрогуморальных систем).
Поражение клапанов сердца обнаруживают примерно у 30% больных с ФП. Растяжение левого предсердия и связанное с ним ФП – это раннее проявление митрального стеноза и/или регургитации. ФП развивается также на более поздних стадиях пороков аортального клапана. В прошлом “ревматическое ФП” встречалось часто, однако в настоящее время ее диагностируют относительно редко.
Первичные кардиомиопатии, в том числе первичные нарушения электрических процессов в сердце, сопровождаются повышением риска развития ФП, особенно у молодых людей. У 10% больных с ФП обнаруживают относительно редкие первичные кардиомиопатии. У небольшой части пациентов с “идиопатическим” ФП выявляются мутации, ассоциирующиеся с “электрическими” кардиомиопатиями.
Дефект межпредсердной перегородки ассоциируется с развитием ФП у 10-15% больных. Эта связь имеет важное клиническое значение для антитромботической терапии у пациентов с данным пороком сердца и перенесенными инсультом или транзиторной ишемической атакой.
Коронарной болезнью сердца страдают, по крайней мере, 20% больных с ФП. При этом остается не ясным, предрасполагает ли неосложненная КБС к возникновению ФП (за счет ишемии предсердий) и как ФП взаимодействует с коронарной перфузией.
Нарушение функции щитовидной железы может быть единственной причиной ФП и способствовать развитию ее осложнений. В последних эпидемиологических исследованиях гипертиреоз или гипотиреоз у больных с ФП диагностировали достаточно редко, однако субклиническая дисфункция щитовидной железы также может вносить вклад в развитие аритмии.
Избыточная масса тела и ожирение наблюдается у 25% больных с ФП. В крупном немецком регистре индекс массы тела у таких пациентов составил в среднем 27,5 кг/м2.
Сахарный диабет, требующий лечения, отмечается у 20% пациентов с ФП и может способствовать поражению предсердий.
Апноэ во время сна, особенно в сочетании с артериальной гипертонией, сахарным диабетом и структурным заболеванием сердца, может быть патогенетическим фактором ФП, поскольку апноэ вызывает увеличение давления в предсердиях и их размера или изменение состояния вегетативной нервной системы.
Хроническая болезнь почек отмечается у 10-15% больных с ФП. Почечная недостаточность может повысить риск сердечно-сосудистых осложнений, связанных с ФП, хотя данные контролируемых исследований ограничены.
В подавляющем большинстве случаев (95%) пусковым фактором (триггером) ФП является патологическая электрическая активность в устьях легочных вен. Электрофизиологическими механизмами подобной очаговой активности является триггерная активность или повторный вход возбуждения (reentry) в мышечных волокнах, выстилающих устья легочных вен в местах их впадений в предсердия.
Быстро функционирующие предсердные очаги патологического автоматизма чаще всего располагаются в верхних легочных венах, в правом предсердии, верхней полой вене или коронарном синусе. Очаговая природа ФП имеет большое значение у больных с пароксизмальной формой, поскольку аблация аритмогенных очагов может полностью излечивать аритмию.
Многоволновая теория предполагает фракционирование фронтов возбуждения по мере продвижения по предсердиям с формированием дочерних петель риэнтри. Число волн зависит от рефрактерного периода, массы и скорости проведения в различных участках предсердий. Предсердия большой массы, с коротким рефрактерным периодом, замедленным проведением импульса предрасполагают к существованию большого количества волн, способствуя сохранению ФП.
Аритмогенный субстрат ФП представляет собой структурно и функционально изменённый (ремоделированный) миокард предсердий, обеспечивающий стойкое самостоятельное поддержание ФП. Под ремоделированием понимают совокупность патологических процессов, возникающих в предсердиях в ответ на возникновение ФП или/и в результате действия других этиологических факторов. Ремоделирование начинается с нарушения ионных клеточных механизмов формирования импульса и заканчивается структурно-функциональной деградацией предсердного миокарда и атриомегалией. Основными структурными изменениями миокарда предсердий, предрасполагающими к возникновению субстрата ФП, являются фиброз, воспаление, апоптоз и гипертрофия кардиомиоцитов. Функциональные нарушения в предсердном миокарде включают в себя возникновение неоднородности скоростей проведения импульсов в разных направлениях, а также дисперсию процессов реполяризации в предсердном миокарде. Прогрессирование ФП и резистентность аритмии к лекарственному и интервенционному лечению, как правило, определяется выраженностью процессов ремоделирования предсердий [21-22].
Предсердия играют важную роль в диастолическом наполнении желудочков. По этой причине потеря сократимости предсердий и отсутствие активной предсердной систолы может приводить к значимому снижению сердечного выброса, особенно у больных с исходной диастолической дисфункцией левого желудочка, артериальной гипертензией, митральным стенозом, гипертрофической или рестриктивной кардиомиопатией.
Колебания интервала R-R во время ФП также сопровождаются нарушениями гемодинамики. В эксперименте показано, что при полной а-в блокаде сердечный выброс снижается примерно на 9% при нерегулярной желудочковой стимуляции по сравнению с регулярным навязанным ритмом. Кроме того, митральная регургитация наблюдалась только при нерегулярном желудочковом ритме. В клинических исследованиях установлено, что изменения силы сердечных сокращений от цикла к циклу связаны с интервалом между сокращениями желудочков.
Постоянно частый ритм в предсердиях ухудшает и без того нарушенную предсердную функцию и в ряде случаев приводит к возникновению так называемой «индуцированной тахикардией предсердной кардиомиопатии». Очень высокий темп желудочков во время ФП (особенно выше 150 уд/мин) может вызывать острую сердечную недостаточность с гипотонией и соотвествующими симптомами (одышку, пре- и синкопе, возникновение или усиление коронарной недостаточности и др.) При возникновении подобной ситуации требуется проведение экстренной кардиоверсии. Важно помнить, что сердечная недостаточность в ряде случаев является первым проявлением ФП, т.е. быть следствием, а не причиной аритмии, и контроль ЧСС в такой ситуации приводит к улучшению систолической функции левого желудочка.
Тромб при ФП возникает чаще всего в ушке левого предсердия и его не удается увидеть с помощью обычной трансторокальной эхокардиографии (ЭХОКГ). Существенную помощь в этих случаях может оказать чреспищеводная ЭХОКГ, применение которой значительно повышает выявляемость тромбов в левом предсердии.
Основными факторами, ответственными за возникновение тромбов в предсердиях при ФП являются следующие:
Эпидемиология
ФП может долго оставаться не диагностированной (бессимптомное ФП), а многие больные с ФП никогда не госпитализируются в стационар. Соответственно, истинная распространенность ФП в общей популяции, скорее всего, приближается к 2%. У мужчин ФП развивается чаще, чем у женщин.
Эпидемиологических данных о распространенности ФП в Кыргызской Республике, к сожалению, нет. Экстраполируя данные вышеперечисленных исследований, можно полагать, что в Кыргызстане ФП страдает от 60 до 120 тысяч человек.
ФП увеличивает риск инсульта в 5 раз (а при наличии клапанного порока – в 17 раз) и обуславливает возникновение каждого шестого инсульта. Частота ишемических инсультов при ФП неревматического генеза составляет 5% в год.
Клиническая картина
Cимптомы, течение
ФП является причиной трети всех госпитализаций по поводу нарушений ритма сердца. Основные причины госпитализаций при ФП – необходимость неотложного купирования ФП в связи с тягостной симптоматикой, реже – в связи с острой гемодинамической нестабильностью, острый коронарный синдром, появление и нарастание сердечной недостаточности, тромбоэмболические осложнения. ФП сопряжена с двукратным возрастанием риска смерти, прежде всего кардиальной, независимо от наличия других факторов риска [8].
| Класс EHRA | Описание |
| I | ФП не вызывает симптомов |
| IIа | Нормальная повседневная деятельность не нарушается от симптомов, связанных с ФП |
| IIb | Умеренно выраженные проявления – ощущения, связанные с ФП, беспокоят пациента, но нормальная повседневная деятельность не нарушается |
| III | Выраженные клинические проявления – нормальная повседневная активность нарушается из-за симптомов, вызванных ФП |
| IV | Инвалидизирующие клинические проявления. Нормальная повседневная активность невозможна |
Диагностика
Жалобы
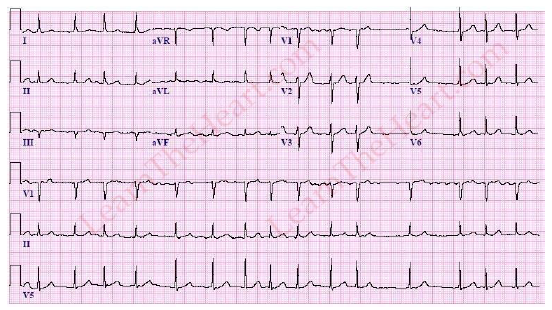
Нередко для подтверждения диагноза пароксизмальной ФП требуется длительное мониторирование ЭКГ (от 24 ч до 7 дней) (табл.4), использование портативных ЭКГ-регистраторов с возможностью передачи ЭКГ по телефону, а также имплантируемые регистраторы ЭКГ с «петлевой памятью». Для постановки диагноза необходима регистрация эпизода аритмии, продолжительностью более 30 секунд. Программная стимуляция предсердий в условиях ЭФИ для подтверждения диагноза ФП не проводится в силу низкой чувствительности и специфичности метода в отношении воспроизводимости клинически значимой ФП [10].
Таблица 4. Рекомендации по диагностике и скринингу ФП
|
Рекомендации
|
Класс | Уровень |
| Для верификации диагноза ФП необходимо документирование аритмии с помощью ЭКГ | I | B |
| Целенаправленный скрининг для выявления ФП путем пальпаторной оценки пульса или регистрации ЭКГ рекомендуется у людей старше 65 лет | I | B |
| У пациентов, перенесших ТИА или ишемический инсульт, рекомендуется скрининг с помощью регистрации кратковременной ЭКГ с последующим мониторированием ЭКГ в течение как минимум 72 ч для выявления ФП | I | B |
| Рекомендуется изучение диагностической информации электрокардиостимуляторов (ЭКС) и имплантированных кардиовертеров-дефибрилляторов (ИКД) на регулярной основе для выявления эпизодов частого предсердного ритма. Пациентам с эпизодами частого предсердного ритма необходимо подтверждение диагноза ФП посредством регистрации ЭКГ/мониторирования ЭКГ перед назначением лечения по поводу ФП | I | B |
| Пациентам, перенесшим ишемический инсульт, целесообразно мониторирование ЭКГ с использованием неинвазивных мониторов или имплантируемых петлевых регистраторов для выявления бессимптомной ФП | IIa | B |
| Систематический ЭКГ скрининг для выявления ФП, может быть использован у пациентов с высоким риском инсульта или старше 75 лет | IIb | B |
Регистрация ЭКГ в момент жалоб больного на неритмичное сердцебиение рекомендуется для уточнения предполагаемого, но неустановленного диагноза ФП. Изменение интервалов ЭКГ и их динамика имеют большое значение при оценке безопасности медикаментозной антиаритмической терапии.
У всех больных целесообразно определение функции щитовидной железы (обычно измеряют сывороточный уровень тиреотропного гормона), электролитов сыворотки крови, выполнение развернутого общего анализа крови, определение уровня креатинина в сыворотке крови, АД, а также признаков сахарного диабета (обычно определяют глюкозу крови натощак). Липидный профиль, включающий общий холестерин (ОХ), холестерин липопротеинов высокой плотности (ХС ЛПВП), холестерин липопротеинов низкой плотности (ХС ЛПНП) и триглицериды (ТГ), должны быть определены у всех пациентов с подозрением на КБС. Определение АСЛО, С-реактивного белка рекомендуется у пациентов с клапанным МП, выявленным по данным ЭХОКГ. При диагностировании ФП с целью назначения антикоагулянтной терапии необходимо определение уровня ПТИ и МНО.
В отдельных случаях может быть оценена функция печени.
Трансторакальная эхокардиография рекомендуется у всех пациентов для выявления структурной патологии сердца (клапанные пороки) и оценки толщины миокарда, размера полости и систолической функции левого желудочка (ЛЖ), размера предсердий, функции правых отделов сердца. Чреспищеводная эхокардиография используется для более детальной оценки клапанного аппарата сердца для исключения интракардиального тромбоза (особенно ушка левого предсердия) перед кардиоверсией [11].
Мультиспиральная компьютерная томография (МСКТ) сердца с контрастированием целесообразна для оценки анатомии лёгочных вен перед планируемым инвазивным вмешательством (катетерной аблацией – см. ниже). Данный метод также позволяет дать оценку анатомии и атеросклеротических поражений коронарных артерий, обнаружить тромбы в полостях или ушках предсердий [1].
В целях исключения перенесённого ишемического инсульта, с учётом клинических проявлений, изменений в неврологическом статусе, может быть целесообразна МРТ головного мозга.
Рекомендации по первичному обследованию больных ФП представлены в таблице 5.
Таблица 5. Рекомендации по первичному обследованию пациентов с ФП
|
Рекомендации
|
Класс | Уровень |
| Полное обследование, включая тщательный сбор анамнеза, клиническое обследование и диагностику сопутствующих заболеваний рекомендуется у всех пациентов с ФП, особенно у пациентов с впервые выявленной аритмией и у больных, у кого отмечается резкая отрицательная динамика в виде увеличения частоты рецидивирования приступов и их продолжительности | I | C |
| Трансторакальная эхокардиография рекомендуется у всех пациентов с ФП для исключения/подтверждения структурного заболевания сердца, выявления систолической дисфункции ЛЖ, обусловленной ФП, а также для оценки размеров камер сердца 49 | I | C |
| Для уточнения возможной причины развития ФП целесообразны общеклинический анализ крови (исключение острого воспалительного процесса), биохимический анализ крови (оценка функции почек и электролитных нарушений), определение сывороточной концентрации тиреотропного гормона (исключение тиреотоксикоза) | I | C |
| Оценка функции почек по уровню креатинина сыворотки и клиренса креатинина рекомендуется у всех пациентов с ФП для выявления болезни почек и коррекции доз лекарственных препаратов | I | А |
| Для всех пациентов с ФП, получающих новые оральные антикоагулянты, целесообразна ежегодная оценка функции почек для выявления развития или оценки прогрессирования хронической болезни почек I | IIa | В |
| Амбулаторное мониторирование ЭКГ целесообазно для уточнения связи клинических проявлений с пароксизмами ФП. Также оно рекомендуется для оценки эффективности и безопасности медикаментозной антиаритмической и урежающей ритм терапии; | IIa | С |
| Тщательный опрос для выявления клинических симптомов и, при необходимости, обследование для подтверждения/исключения синдрома обструктивного апноэ/гипопноэ сна должно проводиться у всех пациентов с ФП | IIa | В |
Лечение
В случае установления потенциально обратимой причины ФП (например, выявление электролитных нарушений, обнаружение пороков клапанов сердца и др.), устранение этой причины может способствовать восстановлению синусового ритма и предупреждению рецидивов ФП в дальнейшем (табл.6).
Таблица 6. Рекомендации по этиотропному лечению фибрилляции предсердий
|
Рекомендации
|
Класс | Уровень |
| У пациентов с ФП, развившейся на фоне тиреотоксикоза, коррекция тиреоидного статуса способствует снижению частоты сердечных сокращений на фоне аритмии и восстановлению синусового ритма | I | В |
| Коррекция гипоксемии и ацидоза должна рассматриваться в качестве начального лечения у пациентов с ФП, развившейся на фоне острого или обострения хронического заболевания легких | IIa | C |
| У пациентов с ожирением и ФП меры по снижению массы целесообразны для уменьшения выраженности симптомов и частоты рецидивов ФП | IIa | В |
| Лечение обструктивного апноэ сна целесообразно для предупреждения рецидивов ФП | IIa | В |
| Ранняя оперативная коррекция порока митрального клапана целесообразна при тяжелой митральной регургитации, сохранной функции ЛЖ и впервые выявленной ФП, даже при отсутствии симптомов, особенно, если возможна пластика клапана | IIa | C |
| Митральная вальвулотомия целесообразна у пациентов с тяжелым митральным стенозом, подходящей анатомией и впервые выявленной ФП | IIa | C |
Риск инсульта считается низким у больных ФП, не набравших ни одного балла по шкале CHA2 DS2 -VASc. Эти пациенты не нуждаются в антикоагулянтной терапии (АКТ).
В целом, пользу от назначения антикоагулянтной терапии можно ожидать при наличии 1 балла у мужчин и 2-х баллов у женщин. Однако в исследования, доказавшие эффективность антикоагулянтов (АКГ) у больных ФП, включали больных с более высоким риском инсульта, поэтому в настоящее время мы располагаем строгими доказательствами эффективности АКТ для мужчин с суммой баллов ≥2, а для женщин ≥3.
Среди потенциальных факторов риска инсульта для пациентов мужского пола, имеющих 1 балл, и женщин, имеющих 2 балла, в настоящее время изучается роль биомаркеров (высокочувствительных тропонинов T и I и N-концевого предшественника мозгового натрийуретического пептида) в качестве дополнительных факторов риска инсульта.
Таблица 7. Шкала CHA2 DS2 -VASc для оценки риска инсульта и системных эмболий у больных ФП
|
Факторы риска
|
Баллы |
| «С» Хроническая сердечная недостаточность/дисфункция левого желудочка | 1 |
| «H» Артериальная гипертония | 1 |
| «А» Возраст ≥75 лет | 2 |
| «D» Диабет | 1 |
| «S» Ишемический инсульт/транзиторная ишемическая атака/системные эмболии в анамнезе | 2 |
| «VASc» Сосудистое заболевание (инфаркт миокарда в анамнезе, атеросклероз периферических артерий нижних конечностей, атеросклеротическая бляшка в аорте) | 1 |
| Возраст 65-74 года | 1 |
| Женский пол | 1 |
Таблица 8. План обследования больного перед назначением антикоагулянтной терапии
|
Обязательные исследования
|
Дополнительные исследования |
| 1. Общий анализ крови (уровень гемоглобина, эритроцитов, тромбоцитов). | 1. Эзофагогастродуоденоскопия, при необходимости колоноскопия |
| 2. Биохимический анализ крови (гепатоспецифические ферменты, креатинин, мочевина, общий белок). | 2. УЗИ почек в случае выявления эритроцитурии |
| 3. Коагулограмма (протромбин с расчетом МНО, АЧТВ) | 3. Компьютерная томография и/или магнитно-резонансная томография для больных, недавно перенесших инсульт, а также при выраженном остаточном неврологическом дефиците с целью исключения геморрагического инсульта и сосудистых мальформаций |
| 4. Анализ кала на скрытую кровь (как скрининг кровопотери через ЖКТ). | 4. Осмотр гинеколога |
| 5. Общий анализ мочи (для исключения эритроцитурии) | 5. Осмотр окулиста (для исключения геморрагических осложнений на сетчатке глаза) |
АЧТВ – активированное частичное тромбопластиновое время
2.2.1. Антиагреганты
Ацетилсалициловая кислота
Убедительные доказательства были получены в шести рандомизированных клинических исследованиях [AFASAK-1, SPAF-1, BAATAF, SPINAF, EAFT и CAFA], объединенный метаанализ которых [15] выявил снижение относительного риска инсульта на 2/3, а риск смерти на 1/4 по сравнению с плацебо или назначением АСК.
Механизм действия АВК связан с угнетением образования в печени четырёх витамин К зависимых факторов свёртывания крови, что в итоге результируется уменьшением образования тромбина – ключевого фермента свёртывания крови.
Однако наличие узкого терапевтического окна, необходимость мониторирования и трудности с поддержанием Международного Нормализованного Отношения (МНО) в терапевтическом диапазоне ограничивают применение варфарина в широкой клинической практике. В последнее время повысились требования к адекватности антикоагуляции, создаваемой варфарином. Показатель TTR, отражающий долю (%) измерений МНО, попавших в терапевтический диапазон, должен составлять не менее 70%.
Если требуется быстрое достижение антикоагулянтного эффекта, в частности у больных с высоким риском тромбоэмболических осложнений (перенесенные ранее инсульт/ТИА, наличие внутрисердечных тромбов, биопротезы клапанов или митральный стеноз), варфарин должен быть назначен одновременно с гепарином и применяться вместе как минимум в течение 4 суток. Гепарин может быть отменен только если уровень МНО достигнет целевого значения (2,0-3,0). Последующее изменение дозы варфарина происходит в зависимости от уровня МНО.
Коррекция дозы варфарина проводится с учетом уровня необходимой гипокоагуляции. У стационарных больных МНО обычно определяется ежедневно до достижения целевого уровня МНО (2,0-3,0), сохраняемого в течение 2 последовательных дней, затем 2 или 3 раза в неделю в течение 1–2 недели. После подбора индивидуальной дозы варфарина контроль МНО можно осуществлять 1 раз в месяц. Настоящие рекомендации позволяют удлинить период между изменениями МНО у больного, находящегося длительно на постоянной дозе варфарина и не имеющего колебаний МНО до 1 раза в 6 недель. Исключение составляют ситуации, когда сопутствующая терапия или другие заболевания могут повлиять на эффективность антикоагулянтов. Необходимо стремиться к поддержанию МНО в целевом диапазоне 2,0-3,0 у всех, в том числе у пожилых пациентов. Принятые ранее безопасными значения равные 1,6-2,2 для пожилых больных в настоящее время считаются неоправданно низкими в связи с двукратным увеличением риска инсульта при значениях МНО <2,0.
К более низким значениям МНО (2,0-2,5) следует стремиться при приеме варфарина в комбинации с антитромбоцитарными препаратами (ацетилсалициловая кислота или клопидогрел) или при возобновлении терапии после кровотечения.
Говорить об истинной резистентности к варфарину возможно, если доза варфарина ≥20 мг в сутки не приводит к достижению целевых значений МНО. Число таких случаев по литературным данным среди больных, принимающих варфарин, не превышает 1%. Практические врачи часто боятся увеличивать дозу варфарина более 7,5 мг, что является неоправданным, поскольку риск кровотечений не зависит напрямую от величины дозы варфарина, а обусловлен наличием потенциальных источников кровотечений и чрезмерной гипокоагуляцией. Более опасными в отношении развития геморрагических осложнений являются пациенты, которым для достижения целевых значений МНО требуются небольшие дозы варфарина (не более 2,5 мг), что связано с генетически обусловленным нарушением метаболизма варфарина.
Однако, если препарат, влияющий на метаболизм варфарина, заменить нечем, то назначить его можно. В этом случае необходимо проконтролировать МНО через 3-5 дней после начала терапии и при необходимости изменить дозу варфарина. Важно помнить, что ряд биологически активных добавок может взаимодействовать с варфарином, поэтому во избежание риска развития чрезмерной гипокоагуляции их лучше их избегать. Принимать поливитамины можно, за исключением препаратов, содержащих большую дозу витамина К (в РФ такие препараты не зарегистрированы).
Однократное употребление большого количества алкоголя усиливает действие варфарина и повышает риск геморрагических осложнений. Хроническое употребление алкоголя наоборот снижает антикоагулянтный эффект. В связи с этим пациенту, принимающему варфарин, лучше воздерживаться от употребления алкоголя.
Таблица 9. Межлекарственные взаимодействия варфарина
|
Усиливают действие варфарина
|
Ослабляют действие варфарина |
|
Антибиотики
Пенициллины, цефалоспорины 2-3-го поколения, монолактамы, эритромицин
Тетрациклин, метронидазол
|
Седативные и противосудорожные
барбитураты
карбамезепин
|
|
Кардиологические препараты
Амиодарон, пропафенон, хинидин
Дизопирамид
|
|
| Нестероидные противовоспалительные средства |
Цитостатики
Азатиоприн, циклоспорин
|
| Анаболические стероиды | |
|
Гастроэнтерологические препараты
Циметидин, омепразол
|
Гастроэнтерологические препараты
Сукральфат, антациды
|
|
Изониазид
Ловастатин
|
Рифампицин |
| Аллопуринол | |
|
Биологически активные добавки
Гинко Билоба, экстракт чеснока, дягиль, экстракт папаи, витамин Е, дьяволов коготь (входит в состав БАД для лечения артрита), шалфей краснокорневищный (входит в состав Болюсов Хуато), зверобой
|
Биологически активные добавки
Женьшень, Коэнзим Q10
|
Пищевые взаимодействия варфарина
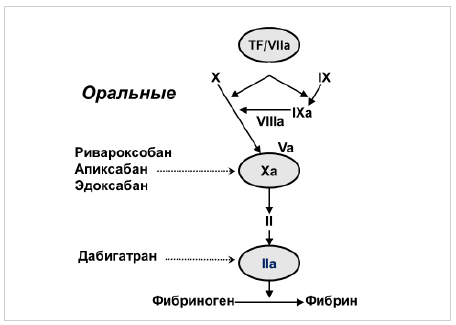
Все прямые ПАКГ отличаются от АВК быстротой наступления (около двух часов) предсказуемого антикоагулянтного эффекта, близким периодом полувыведения в крови (около 12 часов), фиксированной дозой и отсутствием необходимости в рутинном лабораторном контроле. У всех прямых ПАКГ имеется почечный путь выведения из организма, наиболее выраженный у дабигатрана (до 80%). По этой причине всем пациентам, которым предполагается назначение данной группы препаратов, обязательно исходное определение клиренса креатинина по формуле Кокрофта-Голта:
Дозы прямых ПАКГ зависят от клиренса креатинина (табл.10):
Таблица 10. Дозы прямых ПАКГ при нарушении функции почек
|
СКФ
|
Дабигатран |
Ривароксабан
|
Эдоксабан | Апиксабан |
| >60 мл/мин | 150 мг 2раза/день | 20 мг 1 раз/день | 60 мг 1 раз/день | 5 мг х 2 раза/день |
| 59-30 мл/мин | 110 мг 2раза/день | 15 мг 1 раз/день | 30 мг 1 раз/день | 2,5 мг х 2 раза/день |
| <30 мл/мин | Нельзя | 15 мг 1 раз/день* | 30 мг 1 раз/день* | 2,5 мг х 2 раза/день* |
| <15 мл/мин | Нельзя | Нельзя | Нельзя | Нельзя |
| Диализ | Нельзя | Нельзя | Нельзя | Нельзя |
| * - применять с осторожностью | ||||
Дабигатрана этаксилат (далее дабигатран) был сравнён с варфарином в исследовании RE-LY [18], ривароксабан - ROCKET-AF [19], апиксабан - ARISTOTLE [20], а эдоксабан – ENGAGE AF-TIMI 48 [20] и именно результаты этих исследований легли в основу существующих рекомендаций по антитромботической терапии у больных ФП. При наличии особенностей у каждого прямого ПАКГ, все четыре препарата в исследованиях 3 фазы продемонстрировали общие черты, заключающиеся, как минимум, в сравнимой с варфарином эффективности в отношении профилактики инсульта и тромбоэмболий, лучшей безопасности в виде снижения риска геморрагических инсультов и в наличии тенденции к снижению общей смертности. Следует подчеркнуть, что дизайн исследований предусматривал сравнение с варфарином, а между собой прямые ПАКГ не сравнивались, что не дает возможности утверждать о преимуществах какого-либо из них.
Анализ структуры больших кровотечений показал, что обе дозы дабигатрана, ривароксабан, апиксабан и эдоксабан имеют преимущества перед варфарином в отношении снижения частоты развития внутричерепных кровотечений, т.е. данное преимущество отмечается у всех прямых ПАКГ. Тем не менее, у больных, получавших дабигатран в дозе 150 мг х 2р и ривароксабан, отмечено больше кровотечений из желудочно-кишечного тракта по сравнению с варфарином.
Ривароксабан по механизму действия является пероральным прямым ингибитором фактора Х. Ривароксабан имеет высокую биодоступность (60–80%) и достигает пика концентрации в плазме примерно через 3 часа после приема. Существует доказательство того, что ривароксабан может связываться с фактором не только Ха, но и Vа (протромбиназным комплексом). Это является одним из клинических преимуществ препарата по сравнению с гепарином, имеющим слишком большую молекулярную массу, чтобы блокировать фактор Ха в составе протромбиназного комплекса. В отличие от дабигатрана на всасывание данного прапарата рН кишечной среды не влияет. Период полужизни ривароксабана составляет около 5–9 часов у пациентов с нормальной функцией почек и печени. Более высокие уровни ривароксабана могут определяться у пациентов с нарушением почечной и печеночной функций, т. к. одна треть препарата выводится почками и около двух третей метаболизируется в печени, в первую очередь через систему цитохрома P450.
Действие ривароксобана при МП изучалось в исследовании ROCKET AF [19], в котором у 14 264 пациентов с МП сравнивалась эффективность ривароксабана (1 раз в сутки) и варфарина в профилактике инсультов. По результатам исследования ривароксабан оказался эффективнее варфарина в снижении развития инсульта (1,70 % в сравнении с 2,15 %, p=0,015). Кроме того, у пациентов при приеме ривароксабана наблюдалось существенно меньше случаев геморрагического инсульта (0,26 % в сравнении с 0,44 %, p=0,024), одного из наиболее тяжелых видов инсульта. По основному показателю безопасности — клинически значимому малому кровотечению — ривароксабан показал схожие с варфарином результаты (14,91 % в сравнении с 14,52 %, p=0,442). Показатели серьезного кровотечения также были схожими в группах ривароксабана и варфарина (3,60 % в сравнении с 3,45 %, p=0,576).
Важно отметить, что у пациентов, принимавших ривароксабан, реже наблюдались внутричерепное кровоизлияние (0,49 % в сравнении с 0,74 %, p=0,019), кровотечение в жизненно важный орган (0,82 % в сравнении с 1,18 %, p=0,007) и смерть в связи с кровотечением (0,24 % в сравнении с 0,48 %, p=0,003), чем у пациентов, принимавших варфарин.
Апиксабан является другим представителем ингибиторов фактора Ха. Влияние апиксабана на частоту возникновения инсульта и других тромбоэмболических осложнений при фибрилляции предсердий оценено в исследовании ARISTOTLE [20].
Данное масштабное исследование включало 18201 пациент с фибрилляцией предсердий и не менее чем одним дополнительным фактором риска инсульта. Пациенты были рандомизированы в группы, принимавших апиксабан (в дозе 5 мг 2 раза в сутки) или варфарин (целевое МНО - 2,0-3,0). В результате проведенного исследования обнаружилось, что апиксабан не только не менее эффективен, чем варфарин, но и превосходит его, снижая риск инсульта или системной эмболии на 21% и риск «больших» кровотечений на 31%.
Ключевые положения по вопросам профилактики инсульта у больных фибрилляцией предсердий:
Так, в исследовании I.Nuotio и соавт [25] частота тромбоэмболических осложнений при кардиоверсии, проведенной в первые 12 часов без антикоагулянтов, составила 0,3%, а в промежутках 12-24 часа и 24-48 часов – по 1,1% (р=0,004). Даже у пациентов низкого риска инсульта (CHA2 DS2 -VASc 0-1) были зарегистрированы тромбоэмболические осложнения – при кардиоверсии в первые 12 часов с частотой 0,2%, в интервале 12-24 часа – 0,4%, 24-48 часов – 0,9% (для различий между группами р=0,06).
В ретроспективном анализе FinCV [23] частота развития инсульта во время кардиоверсии у пациентов с величиной индекса CHA2 DS2 -VASc≤1 и продолжительностью эпизода ФП менее 48 часов, не получивших антикоагулянты, составила 0,4% (10 случаев на 2772 пациентов); в то время как у получавших антикоагулянты инсультов не было. Исходя из представленных данных, любая КВ должна проводиться на фоне антикоагулянтной поддержки.
Первый – назначение антикоагулянтной терапии как минимум на 3 недели до КВ и на 4 недели после нее. На этот срок антикоагулянты назначаются независимо от риска инсульта и системной тромбоэмболии по шкале CHA2 DS2 -VASc и метода восстановления синусового ритма (электрического или медикаментозного). Используются пероральные антикоагулянты (ПАКГ или варфарин). Крайне важно убедиться, что в течение всего периода лечения обеспечивается оптимальный уровень антикоагуляции. У принимающих варфарин пациентов МНО должно находиться в целевом диапазоне 2,0-3,0. Получающие пероральные ПАКГ пациенты должны быть подробно расспрошены о приверженности к лечению, их ответы следует фиксировать в медицинской документации.
Если возникают сомнения в отношении приверженности к лечению, то перед кардиоверсией следует выполнить ЧП-ЭхоКГ, даже если формально предшествующая терапия ППАКГ была длительной (≥3 недель) [26].
В ситуации, когда пациент не получал ранее антикоагулянты, либо прервал их прием, антикоагулянт должен быть назначен заново. Варфарин назначается одновременно с парентеральным введением низкомолекулярного или нефракционированного гепарина в дозах, рекомендованных для лечения венозного тромбоза (например, эноксапарин 1 мг/кг массы тела 2 раза в день, НФГ – 450 Ед/кг массы тела в сутки на 2-3 введения подкожно). Совместный приём гепарина и варфарина продолжается не менее 5 суток до тех пор, пока МНО в двух последовательных измерениях не достигнет значений ≥2. После этого гепарин отменяют, продолжают лечение варфарином.
По имеющимся на сегодня данным (субанализы исследований RE-LY, ROCKET-AF, ARISTOTLE, ENGAGEAF-TIMI 48, а также исследования X-VeRT, ENSUREAF, EMANATE) варфарин и ППАКГ сопоставимы по эффективности в отношении предотвращения системных эмболий во время кардиоверсии [27].
При этом прямые ПАКГ имеют преимущество в виде большей предсказуемости действия, отсутствия потери времени на подбор дозы препарата. Даже в специализированных антикоагулянтных клиниках время до кардиоверсии у «наивных» в отношении антикоагулянтов пациентов, которым были назначены прямой ПАКГ, на 20-30% ниже, чем у больных, получавших варфарин. В среднем, с учетом данных разных клиник, время, затраченное на подбор адекватной дозы варфарина до кардиоверсии, может затягиваться до 12 недель. Таким образом, выбор прямого ПАКГ может сократить время ожидания процедуры, делает возможным четко планировать дату ее проведения, что, в свою очередь, снизит психоэмоциональную нагрузку на пациента.
При отсутствии тромбов в полости и ушке ЛП может быть выполнена КВ. Отсутствие тромбов до кардиоверсии не отменяет необходимости проведения антикоагулянтной терапии до, во время и после восстановления ритма, поскольку тромб может сформироваться вновь в условиях «оглушения» миокарда ЛП. Для обеспечения адекватной антикоагуляции во время кардиоверсии может быть назначен варфарин (минимум за 5 суток до планируемой кардиоверсии; процедура должна проводиться на фоне МНО в диапазоне 2,0-3,0), прямые ПАКГ (хотя бы одна доза не менее чем за 4 часа до кардиоверсии), а также НФГ в виде внутривенной инфузии или НМГ в виде подкожных инъекций в дозах, применяемых для лечения венозного тромбоза [29].
Если тромб в ЛП сформировался на фоне предшествующей антикоагулянтной терапии, следует оценить ее адекватность (время пребывания МНО в целевом диапазоне для варфарина, приверженность к лечению для прямых ПАКГ). По результатам некоторых исследований, оптимальных результатов в отношении растворения тромба удается достичь при использовании НМГ (эноксапарин в дозе 1 мг/кг массы тела 2 раза в день подкожно). По истечении повторного периода лечения (не менее 10-14 дней при использовании эноксапарина) повторяют ЧП-ЭХОКГ [30].
Вопрос о необходимости проведения ЧПЭХОКГ перед кардиоверсией после адекватной трехнедельной антикоагуляции, остается открытым. Формально эта манипуляция не является необходимой. Однако есть данные, что при таком обследовании тромб ушка ЛП выявляется в 6% случаев [31]. Важно, что в указанном исследовании тромб в ушке ЛП выявлялся через 3 недели адекватной антикоагулянтной терапии только у пациентов со сниженной функцией ЛЖ (ФВ ЛЖ Ж <40%), у всех этих пациентов индекс CHA2DS2-VASc был ≥5. У этой категории пациентов частота тромбоза ушка ЛП, несмотря на лечение, составляла 17,9%. Вероятно, при наличии возможности выполнить ЧПЭХОКГ перед кардиоверсией, в особенности плановой, это следует сделать, в первую очередь – у пациентов с высоким риском тромбоэмболических осложнений.
У пациентов с пароксизмом ФП и нестабильной гемодинамикой или острой ишемией миокарда, вызванной пароксизмом, вне зависимости от его длительности начало антикоагулянтной терапии не должно задерживать проведения экстренной кардиоверсии. В этом случае целесообразно внутривенно ввести парентеральные антикоагулянты (НФГ или НМГ), а в дальнейшем осуществить переход на пероральные антикоагулянты [1]. Тем не менее, следует отметить, что специальных клинических исследований, посвященных поиску оптимальной стратегии антикоагуляции в этой ситуации, не проводилось. После проведения кардиоверсии антикоагулянтную терапию продолжают в течение 4 недель. По истечении этого срока оценивают необходимость дальнейшей длительной антикоагулянтной терапии на основании стратификации риска тромбоэмболических осложнений по шкале CHA2 DS2 -VASc. При высоком риске тромбоэмболий (CHA2 DS2 -VASc ≥1 у мужчин и ≥2 у женщин) антикоагулянтную терапию продолжают неопределенно долго (пожизненно) даже в случае сохранения синусового ритма после кардиоверсии, при низком риске антикоагулянтны можно отменить [2].
Как мы уже писали выше, некоторый риск тромбоэмболических осложнений присутствует и в случае относительно малой продолжительности эпизода ФП. Поэтому у пациентов с очень высоким риском тромбоэмболических осложнений, сниженной ФВ ЛЖ, при сомнениях в комплаентности, по-видимому, оправдано проведение ЧПЭХОКГ перед кардиоверсией даже при длительности пароксизма ФП менее 48 часов. Целесообразно разработать стандартный протокол проведения кардиоверсии в каждой конкретной клинике с учетом ее оснащенности, технических возможностей и опыта персонала, и придерживаться этого протокола в дальнейшем.
Алгоритм антикоагулянтной профилактики не зависит от способа восстановления синусового ритма – медикаментозного или электрического.
Пациентам с имплантированными устройствами для окклюзии ушка ЛП, изоляцией ушка ЛП хирургическими способами перед КВ предпочтительно выполнять ЧПЭХОКГ. Это связано с тем, что у перенесших эти процедуры пациентов может сохраняться соустье между полостью ЛП и его ушком. Наличие резидуального потока крови может значительно повышать риск тромбоэмболических осложнений (даже в большей степени, чем до процедуры изоляции УЛП), особенно если пациенты не получают антикоагулянтной терапии. Кроме того, при ЧПЭХОКГ нередко выявляется бессимптомный тромб на поверхности окклюдера, который также может быть причиной системных эмболий при кардиоверсии [34].
Таблица 11. Профилактика тромбоэмболических осложнений при кардиоверсии
|
Рекомендация
|
Класс | Уровень |
| В случае планирования кардиоверсии всем пациентам, которые не получают антикоагулянты длительно, необходимо как можно быстрее начать терапию НМГ, НФГ (в дозах, одобренных для лечения венозного тромбоза) или ППАКГ | IIa | В |
| Если длительность эпизода ФП составляет 48 часов и более, либо если продолжительность эпизода нарушения ритма неизвестна, длительность антикоагулянтной терапии перед кардиоверсией должна составлять не менее 3 недель. С этой целью следует использовать пероральные антикоагулянты – варфарин (МНО 2,0-3,0), апиксабан, дабигатран или ривароксабан. Начало терапии варфарином должно сочетаться с лечением НФГ или НМГ до достижения МНО целевого диапазона (не менее 5 суток). Антикоагулянтная терапия показана независимо от значения индекса CHA2DS2-VASc и метода восстановления синусового ритма (медикаментозного или электрического) | I | В |
| Если планируется ранняя кардиоверсия пациенту с эпизодом ФП менее 48 часов, который не получает антикоагулянтную терапию, необходимо как можно быстрее начать введение НФГ или НМГ (в дозах, одобренных для лечения венозного тромбоза) | I | С |
| Если у пациента, который не получает антикоагулянтную терапию, есть показания к экстренной кардиоверсии в связи с гемодинамической нестабильностью или острой ишемией миокарда, следует как можно быстрее начать введение НФГ или НМГ (в дозах, одобренных для лечения венозного тромбоза) | I | С |
| После проведения любой кардиоверсии длительность антикоагулянтной терапии должна составлять не менее 4 недель. Если исходно назначались НФГ или НМГ, целесообразно перевести пациента на пероральные антикоагулянты. | I | В |
| По истечении 4 недель после кардиоверсии следует принять решение о необходимости постоянной антикоагулянтной терапии, основываясь на риске инсульта (индекс CHA2DS2-VASc). У больных с факторами риска инсульта терапию пероральными антикоагулянтами следует продолжать пожизненно, даже в случае стойкого сохранения синусового ритма после кардиоверсии | I | В |
| При кардиоверсии у пациентов с трепетанием предсердий схема антикоагуляции аналогична таковой у пациентов с ФП | I | С |
| Альтернативой длительной антикоагуляции перед кардиоверсией служит исключение наличия тромба в левом предсердии и его ушке с помощью чреспищеводной эхокардиографии на фоне предварительно созданного терапевтического уровня антикоагуляции | I | В |
| Если при чреспищеводной эхокардиографии выявлен тромб в левом предсердии, кардиоверсию выполнять нельзя. Следует продлить антикоагулянтную терапию как минимум на 3 недели | I | С |
| Если при повторной чреспищеводной эхокардиографии тромб не выявляется, следует провести кардиоверсию и продолжить антикоагулянтную терапию еще как минимум 4 недели | I | С |
| Если при повторной чреспищеводной эхокардиографии сохраняется тромб, кардиоверсию выполнять нельзя. Следует рассмотреть вопрос об альтернативной тактике лечения (контроле частоты сердечных сокращений) | I | С |
| Ранняя кардиоверсия у пациента с эпизодом ФП менее 48 часов может быть выполнена без проведения ЧП-ЭХОКГ | IIa | В |
| Прямые пероральные антикоагулянты (апиксабан, дабигатран, ривароксабан, эдоксабан) не могут быть использованы для антикоагулянтной поддержки кардиоверсии у пациентов с механическим протезом клапана сердца (уровень доказательности В) или митральным стенозом умеренно тяжелой или тяжелой степени (уровень доказательности С) |
III
|
B/C |
Повышение эффективности изоляции УЛП достигается за счет внедрения в практику специальных устройств, например – атравматичных клипс ArtiClip (Atricure, WestChester, OH, USA), которые могут использоваться как при хирургическом вмешательстве на открытом сердце, так и при миниинвазивных торакоскопических вмешательствах. Также для резекции УЛП могут использоваться хирургические степплеры (например, EndoGIA, Medtronic, USA) [37]. Чаще всего они применяются при комбинированном торакоскопическом вмешательстве – изоляции легочных вен и резекции УЛП.
Имплантация окклюдера может быть рассмотрена при наличии противопоказаний к длительной антикоагулянтной терапии у пациентов с ФП и высоким риском тромбоэмболических осложнений [2] (табл.12).
Таблица 12. Показания к имплантации устройств, окклюзирующих ушко левого предсердия у пациентов с ФП
|
Невозможность длительной антикоагулянтной терапии
|
|
| Высокий риск кровотечений | |
| Анамнез большого кровотечения, причины которого не могут быть устранены (на фоне антикоагулянтной терапии или без нее) |
Например:
• внутричерепные кровоизлияния
• кровотечения в жизненно важные органы (спинной мозг, полость перикарда, глазное яблоко и т.п.)
• иные большие кровотечения (чаще всего желудочно-кишечные)
|
| Высокий риск кровотечения в связи с наличием сопутствующих заболеваний |
Например:
• диффузная амилоидная ангиопатия интракраниальных артерий
• ангиодисплазия в кишечнике
• тяжелая почечная недостаточность/гемодиализ
• ряд заболеваний крови, характеризующихся повышенным риском кровотечения
|
| Невозможность назначения пероральных антикоагулянтов по иным причинам (не связанным с повышенным риском кровотечений) | |
|
Например:
• непереносимость препаратов
• документированная низкая приверженность к лечению, несмотря на все необходимые разъяснения со стороны врача
• документированная вариабельность МНО у пациента, который может принимать только АВК (несмотря на коррекцию потенциальных причин колебания МНО)
• профессии высокого риска, связанные с большой вероятностью травматизации
• выбор пациента
|
|
Окклюдер является инородным телом, на поверхности которого могут формироваться тромбы. До момента эндотелизации устройства пациенту следует получать антитромботическое лечение.
После имплантации устройства ACP Amulet назначают комбинацию аспирина 75 мг и клопидогрела 75 мг на срок от 3 до 6 месяцев с дальнейшим переходом на монотерапию анти- агрегантом [40].
Независимо от типа устройства, через 45 суток от момента имплантации для оценки позиционирования устройства, степени окклюзии УЛП, величины краевого потока, наличия тромба на поверхности устройства проводят контрольную ЧП-ЭхоКГ. В случае спорных результатов ЧП-ЭхоКГ можно выполнить МСКТ с контрастированием, которая позволяет уточнить величину краевого потока, а также определить степень эндотелизации устройства для решения вопроса об оптимальных сроках отмены антикоагулянтов. При выявлении тромба или большой величины краевого потока целесообразно продлить проводимую антитромботическую терапию. Вероятность наличия тромба на поверхности окклюдера говорит о том, что перед выполнением кардиоверсии у таких пациентов следует проводить ЧП-ЭхоКГ.
Таблица 13. Окклюзия и изоляция ушка левого предсердия
|
Рекомендации
|
Класс | Уровень |
| После выполнения хирургической изоляции или окклюзии ушка ЛП пациенту с ФП и высоким риском инсульта следует продолжать прием антикоагулянтов | I | В |
| Окклюзия УЛП может рассматриваться как метод профилактики инсульта у пациентов с ФП, имеющих противопоказания к длительной антикоагулянтной терапии (например, больные с анамнезом жизнеугрожающих кровотечений, причину которых невозможно устранить) | IIb | В |
| Хирургическая окклюзия или изоляция УЛП может рассматриваться как метод профилактики инсульта у пациентов с ФП, которым планируется кардиохирургическое вмешательство | IIb | В |
| Хирургическая окклюзия или изоляция УЛП может рассматриваться как метод профилактики инсульта у пациентов, которым планируется торакоскопическая операция по поводу ФП | IIb | В |
Для оценки риска кровотечений у больных ФП предлагались разные шкалы, среди которых наиболее известна шкала HAS-BLED (табл. 14) [44].
Высокие значения риска кровотечения не должны приводить к отмене ОАК, поскольку чистая клиническая польза от ОАК у этих пациентов превышает риск кровотечения. Тем не менее формальная оценка риска кровотечения у пациентов, принимающих ОАК, позволяет акцентировать внимание на модифицируемых факторах риска кровотечения, которые должны контролироваться и (пере)оцениваться при каждом визите и выявлять пациентов высокого риска с немодифицируемыми факторами риска кровотечения, которых следует ориентировать на ранние (например, через 4 нед., а не через 4-6 мес.) и частые клинические осмотры [45]. Выявление пациентов с высоким риском кровотечения также необходимо при определении стратегии антитромботической терапии в отдельных группах пациентов с ФП, например, перенесших чрескожное коронарное вмешательство (ЧКВ). Основная задача врача перед назначением АКТ – скорректировать модифицируемые факторы риска, а при наличии не модифицируемых факторов – выбрать наиболее безопасный антикоагулянт (табл. 15).
Перед назначением любого антитромботического препарата необходимо оценить потенциальные источники кровотечений. Особое внимание стоит обращать на наличие эрозивно-язвенного поражения желудочно-кишечного тракта (ЖКТ), мочекаменной болезни и воспалительных заболеваний мочеполовой системы, хронического геморроя, злокачественных новообразований, миомы матки, аневризмы аорты и ее ветвей, включая интракраниальные артерии и т.п. (план обследования перед назначением АКТ указан в таблице 21). В сложных случаях решение о назначении антитромботических препаратов должно приниматься консилиумом специалистов заинтересованных специальностей.
Таблица 14. Шкала оценки риска кровотечений HAS-BLEED
|
Буква*
|
Клиническая характеристика# | Число баллов |
|
H
|
Гипертония | 1 |
|
A
|
Нарушение функции печени или почек (по 1 баллу) | 1 или 2 |
|
S
|
Инсульт | 1 |
|
B
|
Кровотечение | 1 |
|
L
|
Лабильное МНО | 1 |
|
E
|
Возраст >65 лет | 1 |
|
D
|
Лекарства или алкоголь (по 1 баллу) | 1 или 2 |
| Максимум 9 баллов | ||
Таблица 15. Факторы риска кровотечений у больных фибрилляцией предсердий, получающих антикоагулянты [138]
| Модифицируемые факторы риска |
| Артериальная гипертония (особенно если САД >160 мм рт. ст.) |
| Лабильное МНО или время пребывания МНО в целевом диапазоне менее 60% (для принимающих антагонисты витамина К (АВК)) |
| Сопутствующий прием препаратов, повышающих риск кровотечения (антиагреганты или НПВС) |
| Злоупотребление алкоголем (≥8 порций в неделю) |
| Частично модифицируемые факторы риска |
|
Анемия
|
| Нарушенная функция почек |
| Нарушенная функция печени |
| Снижение числа тромбоцитов или нарушение их функции |
| Не модифицируемые факторы риска |
|
Возраст (>65 лет), (≥75 лет)*
|
| Большое кровотечение в анамнезе |
| Инсульт в анамнезе |
|
Почечная патология, требующая диализа, либо трансплантация почки
|
| Цирроз печени |
| Злокачественное новообразование |
| Генетические факторы |
|
Биомаркеры – факторы риска кровотечений
|
| Высокочувствительный тропонин |
| Фактор роста и дифференцировки 15 |
| Уровень креатинина сыворотки/расчетное значение клиренса креатинина |
В исследовании mAFA-II проспективный динамический мониторинг и переоценка риска с использованием шкалы HAS-BLED (вместе с комплексным ведением на основе приложений) были ассоциированы с меньшим количеством серьезных кровотечений, коррекцией модифицируемых факторов риска кровотечения и повышенной приверженностью к терапии ОАК. Напротив, частота кровотечений была выше, а прием ОАК в целом снизился на 25% в группе обычной тактики ведения при сравнении исходно и через 12 месяцев [46].
Таблица 16. Минимизация риска кровотечений на фоне антикоагулянтной терапии.
|
Рекомендация
|
Класс | Уровень |
| Контроль уровня артериального давления у больных с артериальной гипертонией позволяет снизить риск кровотечений | IIa | В |
| В случае назначения дабигатрана пациентам старше 75 лет с целью снижения риска кровотечений может быть рассмотрена меньшая доза препарата (110 мг х 2 раза в день) | IIb | В |
| У пациентов с высоким риском желудочно-кишечного кровотечения необходимо отдавать предпочтение АВК или другим ППАКГ по сравнению с дабигатраном 150 мг 2 раза в сутки, ривароксабаном 20 мг 1 раз в сутки или эдоксабаном 60 мг 1 раз в сутки | IIb | В |
| Необходимо обсуждать отказ от употребления алкоголя с больными, получающими терапию пероральными антикоагулянтами. В случае необходимости следует предложить лечение | IIa | С |
| «Терапия моста» с использованием НФГ или НМГ должна быть назначена пациентам с ФП и механическим клапаном сердца на время проведения инвазивного вмешательства, требующего отмены варфарина | I | С |
| Решение о целесообразности «терапии моста» у пациентов с ФП без механических клапанов сердца должно основываться на соотношении риска тромбоэмболии и кровотечения, а также на длительности периода отмены варфарина | I | В |
| Рутинное определение генетически обусловленной чувствительности к варфарину не рекомендовано | III | В |
2.5.1. Лечение кровотечений, возникших на фоне приема пероральных антикоагулянтов
Таблица 17. Определение типа кровотечений, предусмотренное регистром GARFIELD-AF
| Большие геморрагические осложнения |
Явное кровотечение, сопровождающееся хотя бы одним из ниже перечисленного:
• снижением гемоглобина на ≥2 г/дл или
• потребностью в гемотрансфузии ≥2 доз крови
• имеющее клинически значимую локализацию (внутричерепное, внутриспинальное, внутриглазное, тампонада сердца, внутрисуставное, внутримышечное с развитием синдрома сдавления, ретроперитонеальное)
• фатальное
|
| Небольшие клинически значимые геморрагические осложнения | Явное кровотечение, не достигшее критериев «большого», но потребовавшее медицинского вмешательства, изменения врачом схемы лечения или сопровождавшееся болью, дискомфортом или изменением привычной активности пациента |
| Малые геморрагические осложнения |
Все другие кровотечения, не соответствующие критериям
«больших» и «небольших клинически значимых»
|
Следует подчеркнуть, что частота больших кровотечений на фоне АКТ по данным последних лет не превышает 2-5% в год, при этом надо отметить, что частота кровотечений по данным клинических исследований, как правило, ниже таковых при использовании тех же антитромботических препаратов в реальной клинической практике. Однако априорно высокий риск кровотечений не должен быть единственным основанием для отказа от антикоагулянтов у больных ФП высокого риска.
В случае возникновения кровотечений на терапии пероральными антикоагулянтами необходимо выявить источник кровотечения, уточнить давность его существования и оценить тяжесть кровотечения. Также необходимо уточнить время последнего приёма антикоагулянта и оценить наличие других факторов, повышающих риск кровотечения (сопутствующая терапия, хроническая болезнь почек, злоупотребление алкоголем) и сопутствующую терапию.
В основе лечения любого кровотечения лежит поиск и устранение его источника. В случае острого кровотечения речь может идти о хирургическом или эндоскопическом гемостазе, механической компрессии сосуда. В случае большого кровотечения часто требуется восстановить показатели гемодинамики путём возмещения объема жидкости, реже – применения инотропной поддержки. Гемотрансфузию не следует проводить без критической необходимости.
Оптимальным способом нейтрализации действия АВК является парентеральное введение или пероральный прием витамина К1, которого в Кыргызстане нет. Доступный препарат Викасол является предшественником витамина К2, действие которого наступает очень медленно, поэтому введение Викасола для лечения острого кровотечения на фоне АВК не эффективно. Пероральный прием фитоменадион делает больного резистентным к действию непрямых антикоагулянтов в течение 7-10 дней и поэтому не должен использоваться в данных клинических ситуациях.
Показано, что прием 50 г активированного угля снижает всасывание дабигатрана (если он был принят не более 2 часов назад) и, возможно, ривароксабана и апиксабана (если они были приняты не более 4-6 часов назад). Элиминацию дабигатрана можно в значительной степени увеличить путем проведения гемодиализа. Если антикоагулянт был принят недавно, или подозревается передозировка ППАКГ, может быть проведено промывание желудка.
Тяжелые кровотечения, в том числе требующие экстренного хирургического вмешательства, требуют прекращения действия антикоагулянтов. В настоящее время одобрены к применению два препарата – специфический антидот к дабигатрану идаруцизумаб и андексанет альфа, являющийся специфическим антагонистом ингибиторов Ха фактора. Рекомендованный режим дозирования идаруцизумаба – два болюса или две последовательные инфузии по 2,5 г препарата. Также на этапе клинических испытаний находится еще один специфический антагонист ингибиторов Xa фактора – цирапарантаг.
Таблица 18. Ведение пациентов с кровотечениями на фоне антикоагулянтной терапии
|
Рекомендация
|
Класс | Уровень |
| Идаруцизумаб следует ввести пациенту, принимающему дабигатран, в случае жизнеугрожающего кровотечения или потребности в экстренном хирургическом вмешательстве | I | В |
| Возобновление антикоагулянтов после эпизода кровотечения представляется целесообразным у большинства пациентов. Подобное решение, основанное на сопоставлении риска и тяжести повторного кровотечения и тромбоэмболий, должно приниматься мультидисциплинарной командой. Консилиуму следует оценить все возможности антикоагулянтного лечения и прочих вмешательств для профилактики инсульта, определить тактику максимальной коррекции факторов риска кровотечений и инсульта | IIa | В |
| Пациентам с ФП, имеющим симптомы острого серьезного тяжелого кровотечения, рекомендовано прервать терапию пероральными АКГ до устранения причины кровотечения | I | С |
К категории высокого риска рецидива кровотечений относят внутричерепное или жизнеугрожающие экстракраниальные кровотечения, возникшие без видимых провоцирующих факторов (например, травма, инвазивное вмешательство, артериальная гипертония, передозировка антитромботических препаратов), когда какие-либо методы лечения невозможны либо неэффективны или источник кровотечения найден, но неустраним. Пациенты с очень высоким риском тромбоза и одновременным очень высоким риском повторных кровотечений наиболее сложны и требуют индивидуального коллегиального принятия решения мультидисциплинарной командой. Тем не менее, если риск тромбоза выше риска повторного кровотечения, антитромботический препарат отменять не следует. К категории пациентов с высоким/ очень высоким риском ишемического инсульта относятся пациенты ФП с индексом CHA2 DS2 -VASc≥4, больные с механическими протезами клапанов сердца или устройствами для вспомогательного кровообращения.
В случае сопоставимого риска тромбоза и кровотечения антитромботический препарат можно отменить лишь на короткий период времени до стабилизации состояния пациента. Если риск кровотечения выше вероятности ишемических осложнений, нужно отменить препарат до стабилизации состояния пациента, а в дальнейшем – обдумать снижение числа и/или дозы длительно принимаемых антитромботических препаратов. Ниже рассмотрены наиболее распространенные в клинической практике частные случаи в соответствии с рекомендациями экспертов рабочей группы по тромбозам Европейского общества Кардиологов [49].
Тройная антитромботическая терапия после экстракраниального кровотечения
Следует отметить, что крупные клинические исследования не показали преимуществ какой-либо из этих стратегий в отношении продолжительности жизни и сердечно-сосудистых осложнений - исследования AFFIRM [50] и AF-CHF [51]. Вместе с тем, с накоплением фактических данных такой подход может измениться. Замечено, что конечные точки при тактике контроля ЧСС и контроля ритма сопоставимы при среднесрочном наблюдении (до 5-6 лет). При более продолжительных сроках (8 и более лет) наблюдения становится явной преимущество тактики контроля ритма над тактикой контроля ЧСС [52, 53]. Выбор стратегии лечения ФП определяется индивидуально, в зависимости от характера течения аритмии, степени выраженности клинических проявлений, наличия сопутствующих заболеваний, переносимости различных групп препаратов и при обязательном учёте мнения лечащего врача и предпочтения пациента.
Антиаритмические препараты I класса (пропафенон, флекаинид, этацизин) не применяются для контроля частоты желудочкового ритма. Соталол не следует применять только для контроля ЧСС, однако его отрицательный хронотропный эффект может быть полезным при возникновении рецидива МП на фоне применения этого препарата для контроля ритма сердца.
В случае неэффективности других лекарственных препаратов, применяемых для контроля ЧСС, а также в случае ФП у пациентов с сердечной недостаточностью и сниженной фракцией выброса левого желудочка возможно применение амиодарона (необходимо учитывать возможность восстановления синусового ритма, а также вероятность развития побочных эффектов препарата в случае длительного приёма).
Таблица 19. Рекомендации по тактике контроля частоты сердечных сокращений с использованием лекарственных препаратов
|
Рекомендации
|
Класс | Уровень |
| Бета-блокаторы, дигоксин, дилтиазем, или верапамил рекомендуются для контроля ЧСС при ФП у пациентов с ФВ ЛЖ ≥40%. | I | В |
| Бета-адреноблокаторы и/или дигоксин рекомендуются для контроля ЧСС при ФП у пациентов с фракцией выброса (ФВ) ЛЖ <40%. | I | В |
| В качестве начальной цели рекомендуется снижение частоты пульса в состоянии покоя <110 уд/мин.; дальнейшее снижение ЧСС целесообразно при плохой переносимости аритмии и/или снижении ФВЛЖ, развитии клинических проявлений застойной сердечной недостаточности | IIa | В |
| Комбинированная терапия (включающая различные препараты, влияющие на ЧСС) целесообразна, если при использовании одного лекарственного препарата целевых значений ЧСС достичь не удаётся | IIa | В |
| У пациентов с нестабильной гемодинамикой или значительно сниженной ФВ ЛЖ возможно применение амиодарона для контроля ЧСС при оказании неотложной помощи | IIb | В |
| У пациентов с постоянной формой ФП (т.е. тем, кому не планируется восстановление синусового ритма), антиаритмические препараты I и III классов не должны постоянно использоваться с целью контроля ЧСС | III | А |
| Верапамил, дилтиазем и дигоксин при внутривенном введении противопоказаны при пароксизмах ФП у больных синдромом ВПУ, поскольку они могут улучшать проведение по пучку Кента | III | А |
Таблица 20. Средства для контроля частоты сердечных сокращений
| Внутривенно | Поддерживающая доза | |
| Атенолол | - | 25-100 мг один раз в день |
| Бисопролол | - | 2,5-10 мг один раз в день |
| Карведилол | - | 3,125-25мг два раза в день |
| Метопролол | 2,5-5 мг болюсно в течение 2 минут; до 3 доз | 100-200 мг один раз в день (пролонг. форма) |
| Пропранолол |
0,15 мг/кг в течение 1 мин
|
10-40 мг три раза в день |
| Эсмолол | 50-200 мкг/кг/мин | - |
| Верапамил | 0,15 мг/кг в течение 2 мин | 40-80 мг три раза в день |
| Дилтиазем | 0,25 мг/кг в течение 2 мин | 60 мг три раза в день |
| Дигоксин | 0,5-1 мг | 0,125-0,5 мг один раз в день |
| Амиодарон | 5 мг/кг в течение 1ч, поддерживающая доза 50 мг/ч | 100-200 мг один раз в день |
Следует отметить, что в последних клинических рекомендациях Американской ассоциации сердца/Американской коллегии кардиологов [3] есть указания на возможность внутривенного применения магния для урежения темпа желудочковых сокращений при ФП.
В относительно редких случаях неконтролируемой тахисистолии, сопровождающейся развитием прогрессирующей сердечной и/или коронарной недостаточности или сохранении этих проявлений, несмотря на обеспечение адекватного урежения частоты желудочковых сокращений, может возникать необходимость в восстановлении синусового ритма по жизненным показаниям, несмотря на длительность аритмии более 48 часов и отсутствие адекватной антикоагулянтной терапии.
Многие пароксизмы ФП могут купироваться самостоятельно в течение нескольких часов, поэтому при обращении пациента с недавно возникшим пароксизмом и отсутствии у него гемодинамической нестабильности, первоначальное применение препаратов, урежающих частоту сокращений желудочков, будет способствовать улучшению состояния пациента и может позволить избежать необходимости медикаментозной или электрической кардиоверсии. Поскольку одним из факторов, провоцирующих ФП, является нарушение электролитного баланса (например, вследствие кишечной инфекции, алкогольного отравления или применения диуретических препаратов), на данном этапе может быть целесообразным внутривенное введение препаратов калия (при отсутствии противопоказаний — тяжёлой почечной недостаточности, гиперкалемии и др.).
Купирование затяжных пароксизмов ФП (длительностью более 48 ч.) и восстановление синусового ритма при персистирующей форме заболевания должно проводиться на фоне адекватной антикоагулянтной терапии (предшествующий приём не менее 3-х недель, либо необходимо исключение наличия тромбов в полостях и ушке по данным чреспищеводного эхокардиографического исследования). После восстановления синусового ритма существует риск формирования тромбов denovo на фоне временного нарушения функции предсердий (феномен «оглушенного предсердия»), в связи с чем все пациенты должны получать антикоагулянтную терапию не менее 4-х недель, независимо от риска кардиоэмболических осложнений по шкале CHA2 DS2 -Vasc.
При длительности ФП более 48 часов и отсутствии адекватной антикоагулянтной терапии в течение последних 3 недель, перед восстановлением синусового ритма с помощью ЭКВ, для исключения внутрипредсердного тромбоза необходимо предварительное проведение чреспищеводной эхокардиографии. В случае развития асистолии или брадикардии после ЭКВ может возникнуть необходимость в проведении эндокардиальной или наружной кардиостимуляции.
Успех ЭКВ заключается в прекращении ФП, что подтверждается наличием по крайней мере двух последовательных зубцов Р после нанесения электрического разряда. Имеющиеся данные указывают на преимущества наружных дефибрилляторов с двухфазным (биполярным) импульсом разряда, требующим для достижения эффекта меньшего количества энергии (обычно не более 150-200 Дж) по сравнению с монофазным (монополярным) импульсом, при котором энергия разряда может достигать 360 Дж. Применение биполярных импульсов различных видов, по сравнению с монополярными, привело к увеличению успеха ЭКВ персистирующего МП в среднем с 83 до 94%.
Проведение ЭКВ требует нанесения электрического импульса, синхронизированного с комплексом QRS, чтобы не допустить попадания разряда в «уязвимый период» сердечного цикла. Такое попадание сопряжено с высокой вероятностью развития фибрилляции желудочков. Синхронизация снижает вероятность фибрилляции желудочков, но не исключает ее полностью.
Применение ЭИТ на фоне поддерживающей антиаритмической терапии (чаще всего, антиаритмическими препаратами III класса) повышает эффективность процедуры и снижает риск рецидивов ФП после восстановления синусового ритма.
Эффективность большинства антиаритмических препаратов, используемых для медикаментозной кардиоверсии, уступает эффективности ЭИТ, однако при этом способе не требуется применение наркоза/седации. Выбор препарата должен осуществляться с учётом возможных противопоказаний и побочных эффектов препарата, сведений об эффективности препаратов в купировании предшествующих пароксизмов, информации о принимаемых пациентом лекарственных препаратах. Используемый для купирования препарат также обладает предотвращающим аритмию действием в отношении возможных ранних рецидивов. Используемые для купирования антиаритмические препараты могут способствовать трансформации ФП в ТП, что может сопровождаться повышением частоты желудочковых сокращений и ухудшением состояния пациента (вплоть до развития гемодинамической нестабильности), в связи с чем процедуру медикаментозной кардиоверсии предпочтительно проводить в условиях блока интенсивной терапии.
Прокаинамид (новокаинамид), препарат IA класса, чаще всего применяется в качестве препарата для купирования пароксизмов ФП [3]. Несмотря на давность его использования, крупных клинических испытаний его эффективности и безопасности не было. Препарат противопоказан при наличии структурного заболевания сердца, тяжёлых нарушениях проводимости. Среди побочных эффектов следует отметить снижение АД, риск желудочкового аритмогенного действия. Имеются сведения о снижении эффективности при увеличении длительности времени купируемого пароксизма.
Пропафенон, препарат IC класса, при внутривенном введении обладает высокой эффективностью в купировании пароксизмов ФП и достаточно быстрым действием (как правило, пароксизмы купируются в течение 30 минут - 2 ч. после введения препарата). Пероральный приём пропафенона в дозе 450 мг также эффективно купирует пароксизмы ФП, но в течение более длительного времени (обычно в течение 2-6 ч.). Такой способ применения пропафенона получил название «таблетка в кармане». Учитывая более высокий риск побочных эффектов препарата при приёме в большей дозе, применение стратегии «таблетка в кармане» рекомендуется только в том случае, если безопасность приёма большой дозы препарата была ранее оценена в условиях стационара. Пропафенон противопоказан больным КБС и пациентам со структурным заболеванием сердца. В связи с бета-блокирующим действием у пациентов с тяжёлой бронхиальной астмой в редких случаях может провоцировать бронхоспазмы. Может вызывать трансформацию ФП в ТП, что может сопровождаться повышением ЧСС и ухудшением состояния больного.
Внутривенная инфузия амиодарона, препарата III класса, также высоко эффективна (до 90% при пароксизмах, длительностью не более 48 часов) в восстановлении синусового ритма, но купирование происходит на несколько часов позднее, чем при введении прокаинамида или пропафенона. Препарат обеспечивает снижение частоты сокращений желудочков во время пароксизма ФП, данный эффект развивается быстрее.
При пароксизмах ФП или ТП с проведением по пучку Кента, не сопровождающихся гемодинамической нестабильностью, внутривенное введение прокаинамида может быть использовано для купирования аритмии. Кроме того, угнетая проведение по добавочному пути проведения, этот препарат снижает ЧСС во время пароксизма, что также способствует улучшению состояния больного.
Поскольку верапамил, дилтиазем и дигоксин при внутривенном введении могут улучшать проведение по пучку Кента, данные препараты противопоказаны при пароксизмах ФП у больных синдромом ВПУ.
Таблица 21. Рекомендации по восстановлению синусового ритма
|
Рекомендации
|
Класс | Уровень |
| Электрическая кардиоверсия рекомендуется для восстановления синусового ритма у больных с острой гемодинамической нестабильностью | I | В |
| Восстановление синусового ритма (посредством ЭИТ или медикаментозной кардиоверсии) рекомендуется у пациентов с пароксизмальной, персистирующей или длительно персистирующей формами ФП, при наличии клинических проявлений, как часть стратегии контроля ритма | I | В |
| У пациентов без КБС или структурной патологии сердца для фармакологической кардиоверсии непродолжительных пароксизмов ФП рекомендуется пропафенон | I | А |
| За исключением ФП, сопровождающейся гемодинамической нестабильностью, при выборе между ЭИТ и медикаментозной кардиоверсией следует руководствоваться предпочтениями пациента и врача | IIIa | С |
| Предварительное лечение амиодароном, соталолом или пропафеноном следует рассматривать для повышения эффективности электрической кардиоверсии и профилактики рецидивов ФП | IIa | В |
| У отдельных пациентов с непродолжительным (до 48 часов) пароксизмом ФП и без сопутствующего структурного заболевания сердца или ИБС для восстановления синусового ритма целесообразен однократный пероральный приём пропафенона в дозе 450-600 мг или флекаинида 200-300 мг (подход «таблетка в кармане») при условии предварительной оценки безопасности такого лечения под контролем ЭКГ в условиях стационара | IIa | В |
| У больных с ИБС и/или структурным заболеванием сердца для медикаментозной кардиоверсии ФП рекомендуется амиодарон | I | А |
Таблица 22. Лекарственные средства, предназначенные для медикаментозной кардиоверсии у больных с недавно развившимся приступом ФП, и их дозы
|
Препарат
|
Доза | Последующая доза | Риски и осложнения |
| Амиодарон | 5 мг/кг в/в в течение 1ч | 50 мг/ч | Флебит, гипотония. Снижает частоту ритма желудочков сердца. Отсроченное во времени восстановление синусового ритма. |
| Прокаинамид | 500-1000 мг однократно в/в медленно (20-30 мг/мин) | Замедляет АВ- и внутри-желудочковую проводимость, может вызвать полиморфную желудочковую тахикардию типа tdp, фибрилляцию желудочков, асистолию. | |
| Пропафенон | 2 мг/кг в/в в течение 10 мин или 450-600 мг внутрь | Нельзя назначать пациентам с выраженным структурным заболеванием сердца. Может вызвать удлинение QRS. Несколько снижает частоту ритма желудочков, но может вызвать ее увеличение вследствие трансформации в трепетание предсердий с проведением 1:1. | |
| Флекаинид | 2 мг/кг в/в в течение 10 мин или 200-300мг внутрь | Не применяется | Нельзя назначать пациентам с выраженным структурным заболеванием сердца. Вызывает удлинение продолжительности QRS и, соответственно, интервала QT. Может повышать частоту ритма желудочков вследствие трансформации в трепетание предсердий с проведением 1:1. |
Эффективность соталола и метопролола в плане купирования МП не превышает 13%. Сообщений об эффективности атенолола, карведилола, бисопролола, пропранолола, тимолола или эсмолола не опубликовано.
Дигоксин как средство устранения МП не эффективен. В исследовании с участием 239 больных с МП длительностью менее 7 дней частота восстановления синусового ритма через 16 ч составила 46% в группе плацебо и 51% в группе применения дигоксина. В двух других исследованиях с участием 40 и 82 пациентов, частота восстановления синусового ритма (плацебо и дигоксин) составила 40% против 47% и 14% против 32%, соответственно.
Соталол по эффективности в профилактике рецидивов МП оказался сопоставимым с комбинацией хинидина и верапамила в фиксированных дозах, но уступал амиодарону. В исследовании SAFE-T эффективность соталола и амиодарона в профилактике приступов МП была сопоставимой у больных с коронарной болезнью сердца (р=0,53) [55]. Аритмогенное действие соталола связано с удлинением интервала Q-T и/или брадикардией. Необходимо тщательное мониторирование длительности интервала Q-T и патологических зубцов TU. Если интервал Q-T увеличивается более 500 мсек, следует отменить соталол или снизить его дозу. Риск аритмогенного действия повышен у женщин, пациентов с выраженной гипертрофией ЛЖ, тяжелой брадикардией, желудочковыми аритмиями, дисфункцией почек, гипокалиемией или гипомагниемией.
Этацизин — антиаритмический препарат фенотиазинового ряда, блокатор быстрых Na-каналов (IС класс по классификации E.M.Vaughan–Williams). Обладает также свойствами кальциевого блокатора [57]. Применяется для сохранения синусового ритма при пароксизмальном и персистирующем МП. При приеме внутрь достигает максимума концентрации через 2,5-3 часа, длительность действия составляет около 6-9 часов, что требует не менее, чем трехкратного в сутки приема препарата.
Эффективность этацизина при пароксизмальной и персистирующей МП изучалась в основном в открытых не плацебо-контролируемых, иногда параллельных исследованиях, и достигала 68% [58, 59]. Этацизин может быть использован для лечения пациентов без органического заболевания сердца и у больных с артериальной гипертонией без гипертрофии левого желудочка. Не должен назначаться при острых формах коронарной болезни сердца, хронической сердечной недостаточности, артериальной гипертонии с гипертрофией левого желудочка в связи с риском проаритмического действия. Обладает умеренным холинолитическим эффектом. Возможное проаритмическое действие: угнетение внутрипредсердного, атрио-вентрикулярного и внутрижелудочкового проведения возбуждения, желудочковые тахиаритмии, включая, фибрилляцию желудочков. Наиболее частые побочные действия – головокружение, головная боль, расстройства зрения.
Аллапенин - антиаритмический препарат IС класса, блокатор быстрых Na-каналов [60]. Препарат может быть использован для лечения пациентов без структурного заболевания сердца и у пациентов с АГ без выраженной (≤14 мм) гипертрофии миокарда ЛЖ. Не должен назначаться при КБС, клинически значимой ХСН, АГ с выраженной гипертрофией ЛЖ (>14 мм) в связи с риском проаритмического действия. Угнетает атриовентрикулярное и внутрижелудочковое проведение возбуждения, что требует контроля за длительностью интервала P-Q и QRS. Как и другие ААП IC-класса, способен вызвать трансформацию ФП в ТП. Наиболее частые побочные действия — головокружение, головная боль, нарушение фиксации взора.
Единственным препаратом, разрешённым к применению с целью профилактики рецидивов ФП у больных сердечной недостаточностью, является амиодарон [1, 2]. В остальных случаях амиодарон не должен использоваться в качестве препарата первого выбора вследствие значительного количества несердечных побочных эффектов.
ААП могут способствовать усугублению нарушений проводимости сердца и оказывать проаритмическое действие даже у пациентов, не имеющих противопоказаний к их применению. Вот почему при назначении медикаментозной антиаритмической терапии обязательно должен проводиться контроль эффективности и безопасности лечения, включающий серийный контроль ЭКГ в первые сутки лечения и, желательно, холтеровского мониторирования ЭКГ.
Рекомендации по проведению поддерживающей антиаритмической терапии представлены в таблицах 23 и 24.
Таблица 23. Рекомендации по предупреждению рецидивов фибрилляции предсердий с использованием антиаритмических препаратов
|
Рекомендации
|
Класс | Уровень |
| Выбор ААП должен быть тщательным, учитывающим наличие сопутствующих заболеваний, риск побочных эффектов препаратов и предпочтения пациента | I | А |
| Аллапенин, пропафенон, флекаинид, этацизин или соталол рекомендуются для предупреждения рецидивов ФП у пациентов без структурного заболевания сердца | I | А |
| Дронедарон рекомендуется для длительного контроля ритма у пациентов с ФП c нормальной или слегка нарушенной (но стабильной) функцией ЛЖ | I | А |
| Амиодарон рекомендуется для предупреждения рецидивов ФП у пациентов с сердечной недостаточностью | I | В |
| Амиодарон является более эффективным в предотвращении рецидивов ФП, чем другие ААП, но обладает внесердечными побочными эффектами, риск развития которых увеличивается по мере увеличения дозы препарата и сроков его приёма. По этой причине другие ААП и интервенционное лечение ФП следует рассматривать в первую очередь | IIa | С |
| Пациенты, принимающие поддерживающую антиаритмическую терапию, должны проходить периодическое обследование с целью оценки безопасности проводимого лечения | IIa | С |
| Для оценки безопасности лечения в первые сутки приёма антиаритмической терапии рекомендуется серийный контроль ЭКГ с оценкой длительности интервалов P-Q, QRS и Q-T, предпочтительно также проведение холтеровского мониторирования ЭКГ на 2-3 сутки лечения | IIa | В |
| Имплантация ЭКС и назначение поддерживающей антиаритмической терапии целесообразно у пациентов с рецидивирующим течением ФП, сопровождающейся выраженными клиническими проявлениями, при наличии дисфункции синусового узла или нарушении предсердно-желудочкового проведения, при наличии противопоказаний или отказу от интервенционного лечения ФП | IIa | В |
| Проведение поддерживающей антиаритмической терапии в «слепом периоде» (90 дней) после интервенционного лечения ФП целесообразно для поддержания синусового ритма в связи с высоким риском ранних рецидивов ФП | IIa | В |
| Поддерживающая антиаритмическая терапия противопоказана пациентам со значимой дисфункцией синусового или АВ узлов (без постоянного ЭКС), удлинением интервала QT (>480мс для ААП III класса) | III (вред) | С |
Таблица 24. Препараты и их дозы для поддерживающего лечения при МП
|
Форма выпуска
|
Максимальная суточная доза | Рекомендуемые дозы | |
|
Амиодарон
|
таб. 200 мг | 1200 мг | 200 мг один раз в день |
|
Аллапенин
|
таб. 25 мг | 200 мг | 25-50 мг х 3 раза в день |
|
Дронедарон
|
таб.400 мг | 800 мг | 400 мг х 2 раза в день |
|
Пропафенон
|
таб. 150 мг | 900 мг | 150 мг х 3 раза в день |
|
Соталол
|
таб. 80 и 160 мг | 320 мг | 80 мг х 2 раза в день |
|
Флекаинид
|
таб. 100 мг | 300 мг | 50-100 мг х 2 раза в день |
|
Этацизин
|
таб. 50 мг | 150 мг | 25 мг х 3-4 раза в день |
Таблица 25. Рекомендации по использованию неантиаритмических препаратов с целью предупреждения рецидивов фибрилляции предсердий
|
Рекомендации
|
Класс | Уровень |
| Ингибиторы АПФ, БРА и бета-блокаторы целесообразны для профилактики ФП у пациентов с сердечной недостаточностью и сниженной фракцией выброса левого желудочка | IIa | А |
| Ингибиторы АПФ или БРА целесообразны для профилактики ФП у пациентов с гипертонической болезнью, особенно при гипертрофии левого желудочка | IIa | В |
| Лечение ингибиторами АПФ или БРА может рассматриваться у больных с ФП, рецидивирующей после кардиоверсии или на фоне приёма ААП | IIb | В |
| Ингибиторы АПФ или БРА не рекомендуются для предупреждения рецидивов ФП у больных без сопутствующих заболеваний сердечно-сосудистой системы (гипертонической болезни, постинфарктного кардиосклероза, сердечной недостаточности) | III (вред) | В |
Альдостерон участвует в возникновении и сохранении ФП (64). Данные РКИ показали, что антагонисты МКР снижают количество новых случаев предсердных аритмий у пациентов с СН с низкой ФВ ЛЖ параллельно с улучшением других сердечно-сосудистых исходов (65). Положительное влияние антагонистов МКР было также показано у пациентов с СН с сохраненной ФВ ЛЖ. Роль антагонистов МКР в качестве предшествующей терапии в стратегии контроля ритма у пациентов с СН и ФП не выяснены. Поскольку ФП является маркером тяжести СН, положительный антиаритмический эффект может быть обусловлен косвенно за счет улучшения СН.
При пароксизмальной форме ФП использование как радиочастотной энергии, так и криоаблации в сравнительном исследовании «FIRE and ICE» демонстрирует одинаковую эффективность – около 65% случаев сохранения синусового ритма без использования антиаритмических средств в течение года после вмешательства [73]. В случае рецидива ФП, что в большинстве случаев связано с неполной изоляцией легочных вен или отсроченным восстановлением проведения триггерной активности из лёгочных вен в левое предсердие, может быть выполнена повторная катетерная изоляция устьев легочных вен. Это повышает суммарную эффективность в сохранении синусового ритма до 80% и более. Больным с персистирующей формой ФП в качестве первого катетерного вмешательства (радиочастотного или криоаблации) также рекомендуется изоляция легочных вен [68].
Эффективность катетерной аблации наиболее высока у лиц моложе 65 лет, без признаков органического поражения сердца, гипертонической болезни и апноэ сна, имеющих нормальный или незначительно увеличенный, объем левого предсердия. У этих пациентов катетерная аблация может рассматриваться в качестве первого этапа противоаритмического лечения. Эффективность вмешательства у таких категорий больных может превышать 80%.
Рекомендации по катетерной и хирургической аблации при ФП обобщены в таблицах 26 и 27.
В периоперационном периоде и не менее 3 месяцев после вмешательства всем больным, даже в случае отсутствия рецидивов ФП, должна проводиться антикоагулянтная терапия. Перед принятием решения об инвазивном вмешательстве пациент должен получить полную и достоверную информацию о пользе, рисках и альтернативных возможностях лечения ФП.
У больных с ФП, направляемых на хирургическое лечение сердечной патологии (замена клапанов, аортокоронарное шунтирование и др.), в качестве дополнительного вмешательства «на открытом сердце» может выполняться т.н. операция «Лабиринт», предполагающая хирургическую изоляцию лёгочных вен и фрагментацию миокарда обоих предсердий при помощи т.н. техники «разреза и шва», или интраоперационная аблация с использованием специальных биполярных радиочастотных катетеров или специальных катетеров для внутрисердечных криотермических воздействий (см. табл. 27). Хирургические методы лечения ФП позволяют обеспечивать более надежный контроль ритма при персистирующей и длительно персистирующей ФП (в 70-90% случаев в отдаленной перспективе) по сравнению с традиционными катетерными вмешательствами. В то же время, интраоперационные вмешательства сопряжены с более высоким риском осложнений (до 6-10%).
Таблица 26. Рекомендации по катетерной и хирургической аблациипри ФП
|
Рекомендации
|
Класс | Уровень |
| Катетерная аблация показана при симптомной пароксизмальной ФП, резистентной к 1 или более ААП I или III класса | I | А |
| Катетерная аблация целесообразна при симптомной персистирующей ФП, резистентной к 1 или более ААП I или III класса | IIa | В |
| Катетерная аблация целесообразна у больных с сердечной недостаточностью и сопутствующей ФП | IIb | В |
| Катетерная аблация может рассматриваться при симптомной длительно персистирующей (>1 года) ФП | IIb | С |
| Аблация «субстрата ФП» (линейная аблация, аблация CAFE – комплексных фрагментированных электрограмм, ганглиев ЛП) могут расматриваться в качестве дополнительных этапов катетерной аблации | IIb | В |
| Катетерная аблация может рассматриваться при бессимптомном течении пароксизмальной и персистирующей ФП | IIb | С |
Таблица 27. Рекомендации по хирургической аблации
|
Рекомендации
|
Класс | Уровень |
| Хирургическая аблация показана при операциях на «открытом сердце», т.к. протезирование митрального клапана, аортокоронарное шунтирование и др. при неэффективности антиаритмическких препаратов | I | В |
| Хирургическая аблация целесообразна при персистирующей и длительно персистирующей ФП в отсутствие иных показаний для операции на «открытом сердце» при неэффективности предшествующих 1 или более внутрисердечных катетерных аблаций | IIa | В |
| Хирургическая аблация может рассматриваться при пароксизмальной ФП в отсутствие иных показаний для операции на «открытом сердце» при неэффективности предшествующих 1 или более внутрисердечных катетерных аблаций | IIb | В |
Аблация АВ соединения обоснована, когда контроль за частотой сердечных сокращений при ФП не достижим с использованием препаратов, оказывающих влияние на предсердно-желудочковую проводимость. Аблация АВ соединения может выполняться при любом варианте клинического течения ФП, но наиболее часто проводится при постоянной (перманентной) форме ФП, т.е. в тех случаях, когда сохранение синусового ритма невозможно или признано нецелесообразным.
Имплантируемый ЭКС должен быть наделен частотно-адаптивной функцией. Однокамерная стимуляция желудочков в режиме VVIR применяется при постоянной форме ФП, двухкамерная стимуляция предсердий и желудочков (DDDR) – у пациентов с периодами синусового ритма. Решение о необходимости имплантации ресинхронизурующего устройства или автоматического кардиовертера-дефибриллятора определяется наличием соответствующих дополнительных показаний (табл. 28).
Таблица 28. Рекомендации по аблации атриовентрикулярного соединения больных с фибрилляцией предсердий для контроля ЧСС
|
Рекомендации
|
Класс | Уровень |
| Целесообразность аблации АВ узла для контроля ЧСС следует рассматривать, если частота желудочкового ритма не контролируется лекарственными средствамии, не удается предупредить рецидивы ФП с помощью антиаритмических препаратов, или последние вызывают серьезные побочные эффекты, а катетерная или хирургическая аблация ФП не показана, оказалась неэффективной или ее возможность была отвергнута | IIa | В |
| Аблация АВ узла целесообразна у больных с постоянной ФП и показаниями к ресинхронизации сердца (сердечная недостаточность III-IV функциональных классов по NYHA, несмотря на оптимальную медикаментозную терапию, при величине ФВЛЖ≤35% и продолжительности комплекса QRS≥130мс) | IIa | В |
| Целесообразность аблации АВ узла следует рассматривать у больных, резистентных к ресинхронизирующей терапии, у которых высокая ЧСС при ФП не позволяет проводить эффективную бивентрикулярную стимуляцию, а амиодарон неэффективен или противопоказан | IIa | В |
| Аблация АВ узла целесообразна у пациентов с любой формой ФП, резко сниженной функцией ЛЖ (ФВ≤35%) и тяжелой сердечной недостаточностью (III-IV функциональный класс по NYHA). После аблации АВ узла следует рассмотреть целесообразность бивентрикулярной стимуляции | IIa | С |
| Аблация АВ узла может рассматриваться для контроля ЧСС у пациентов с предполагаемой аритмогенной кардиомиопатией, невозможностью контроля частоты желудочковых сокращений лекарственными средствами, если аблация триггеров/ субстрата ФП не показана, оказалась неэффективной или невозможной | IIb | С |
| Целесообразность аблации АВ узла с последующей ресинхронизацией может быть рассмотрена у больных спостоянной ФП, фракцией выброса ЛЖ≤35% и сердечной недостаточностью I-II функциональных классов по NYHA на фоне оптимальной лекарственной терапии по контролю ЧСС, если медикаментозное лечение недостаточно эффективно или вызывает побочные реакции | IIb | С |
| Катетерная аблация АВ узла не показана без предшествующих попыток медикаментозного лечения с целью контроля ЧСС или катетерной аблации ФП с целью поддержания синусового ритма | III | С |
Если аблация проводится на фоне терапии варфарином, МНО в день вмешательства должно составлять 2,0-2,5. Результаты исследований VENTURE-AF [76], RECIRCUIT [77], AXAFA-AFNET 5 [78] и ELIMINATE-AF [79] указывают на то, что аблация может быть также выполнена на фоне лечения прямыми ПАКГ. Последний прием препарата должен произойти не менее чем за 12 часов до вмешательства. Непосредственно во время аблации следует вводить НФГ с удлинением АЧТВ в 1,5-2 раза.
Следует помнить, что на фоне терапии прямыми ПАКГ для достижения целевых значений АЧТВ доза гепарина и время от момента его введения могут быть больше (что обусловлено прямым взаимодействием между прямыми ПАКГ и тестом для определения АЧТВ). По окончании процедуры целесообразно ввести протамина сульфат. Возобновить терапию прямыми ПАКГ можно через 3-5 часов после удаления интродьюсера при условии адекватного гемостаза и отсутствия признаков гемоперикарда.
Следует отметить, что проведение аблации без отмены пероральных антикоагулянтов – оптимальная тактика, минимизирующая риск тромбомэмболий и кровотечений (в том числе, по сравнению с тактикой «терапии моста») [80].
После аблации пероральные антикоагулянты следует принимать минимум в течение 2 месяцев. В дальнейшем необходимость в приеме антикоагулянтов определяется стандартным алгоритмом для пациентов с ФП исходя из значений индекса CHA2DS2-VASc независимо от успешности аблации, т.е. проведение аблации у пациента с высоким риском тромбоэмболических осложнений не отменяет необходимости принимать антикоагулянты [77]. Это обусловлено тем, что эффективность аблаций в среднем не превышает 70%, зачастую ФП приобретает бессимптомное течение, что не исключает вероятности развития инсульта или системной тромбоэмболии. Если пациент настаивает на отмене антикоагулянтов вследствие отсутствия симптомной ФП, следует провести многосуточное мониторирование ЭКГ для исключения рецидива ФП.
ТП относится к предсердным тахикардиям, обусловленным циркуляцией волны возбуждения по топографически обширному контуру (т.н. «макро-риэнтри»), как правило, вокруг крупных анатомических структур в правом или левом предсердии. В зависимости от топографии макро-риэнтри аритмии выделяют два основных вида ТП:
При типичном ТП циркуляция импульса происходит вокруг кольца трикуспидального клапана. Характерной особенностью данного типа ТП является обязательное повторное прохождение волны возбуждения по так называемому «кавотрикуспидальному истмусу» (КТИ) – области правого предсердия между местом впадения в него нижней полой вены и фиброзным кольцом трикуспидального клапана, что послужило основанием называть типичное ТП «истмус-зависимым». При наиболее частом варианте типичного ТП волна ре-энтри вокруг трикуспидального клапана распространяется против часовой стрелки (при взгляде из правого желудочка). При более редком варианте типичного ТП волна возбуждения распространяется в обратном направлении – т.е. по часовой стрелке.
Из-за высокой частоты предсердной импульсации, которая, как правило, превышает уровень “точки Венкебаха“ АВ-узла, ТП практически всегда протекает с АВ-блокадой II степени и определённой, нередко меняющейся кратностью предсердно-желудочкового проведения. При постоянной кратности АВ-проведения говорят о правильной форме ТП (рис. 7), при непостоянной кратности – о неправильной форме ТП (рис. 8).
В зависимости от частоты ритма желудочков выделяют нормосистолический вариант ТП (средняя частота в диапазоне от 60 до 100 в минуту), брадисистолический вариант ТП (частота менее 60 в минуту) и тахисистолический варианты ТП (частота более 100 в минуту).
Возникновение ТП является следствием нарушения процессов проведения электрического возбуждения по миокарду правого или левого предсердия, вызванного, в свою очередь, различными патологическими процессами, создающими условия для стойкой циркуляции электрического импульса по большой петле повторного входа возбуждения (макрори-энтри).
На ЭКГ трепетание предсердий представляет собой правильный высокоамплитудный предсердный ритм с высокой частотой (обычно от 250 до 400 в минуту) и отсутствием чёткой изоэлектрической линии между предсердными комплексами (волнами F) хотя бы в одном ЭКГ-отведении.
Ведущим электрокардиографическим признаком типичного ТП являются “пилообразные” предсердные волны «F» с наибольшей амплитудой в отведениях II, III и aVF, а также с отсутствием изолинии между ними в этих или других отведениях ЭКГ. Важно отметить, что при частом варианте циркуляции импульсов вокруг трикуспидального клапана – по направлению «против часовой стрелки», волны F в отведениях II, III и aVF – отрицательные (рис. 7), при редком варианте циркуляции импульса в направлении «по часовой стрелке» – они положительные в этих же ЭКГ отведениях (см. рис. 8).
Рисунок 7. Атипичное трепетание предсердий, неправильная форма с частотой предсердной импульсации FF=300 в минуту и проведением на желудочки 2:1 и 3:1.
Спонтанные пароксизмы ТП инициируются предсердными экстрасистолами, а при проведении ЭФИ они могут быть индуцированы и прекращены электрическими стимулами.
Трепетание предсердий (как и фибрилляция предсердий) по характеру течения подразделяется на пароксизмальную, персистирующую или постоянную форму. Клинические проявления ТП зависят от частоты ритма желудочков и тяжести основной сердечной патологии и аналогичны выше описанным для предсердных тахикардий.
При длительности ТП (как и ФП) свыше 48 часов у пациентов увеличивается вероятность тромбообразования в предсердиях (прежде всего в ушке левого предсердия), что создаёт угрозу развития тромбоэмболических осложнений. При наличии сопутствующих факторов риска тромбоэмболических осложнений (по шкале CHADS2-VASC2) этим больным показана длительная терапия непрямыми антикоагулянтами. Вопросы профилактики тромбоэмболических осложнений у больных с ФП и ТП подробно представлены в соответствующем разделе данных рекомендаций.
Для купирования приступов ТП используют внутривенное введение прокаинамида, пропафенона, соталола или амиодарона, а также чреспищеводную электростимуляцию предсердий. В случаях, когда ТП сопровождается выраженными нарушениями гемодинамики (артериальная гипотензия, острая коронарная или сердечная недостаточность), методом выбора для прекращения аритмии является неотложная электрическая кардиоверсия.
Электрическая кардиоверсия также используется в плановом порядке при неэффективности попыток медикаментозного восстановления ритма сердца. При продолжительности эпизода ТП более 48 часов восстановление синусового ритма требует профилактики развития «нормализационных» тромбоэмболических осложнений. Используемые с этой целью профилактические подходы аналогичны применяемым при фибрилляции предсердий.
В целях снижения частоты ритма желудочков при тахисистолическом варианте ТП используются бета-адреноблокаторы, дигоксин и их комбинация, а также верапамил, которые в острых ситуациях используются внутривенно, а также внутрь, с целью длительного обеспечения контроля частоты работы сердца.
Аблация кавотрикуспидального перешейка при истмус-зависимых ТП (по часовой стрелке или против часовой стрелки) позволяет предотвращать рецидивы ТП у 90-95% больных [82]. Эта процедура эффективно снижает рецидивы ФП у отдельных пациентов и поможет избежать ненужных госпитализаций [83].
Рекомендации по лечению трепетания предсердий представлены в таблице 29.
Таблица 29. Рекомендации по профилактике и лечению трепетания предсердий (ТП)
|
Рекомендации
|
Класс | Уровень |
| Для пациентов с трепетанием предсердий рекомендуется антитромботическая терапия с тем же профилем риска, что используется для ФП | I | А |
| Аблация кавотрикуспидального перешейка в лечении типичного ТП рекомендуется для пациентов с неэффективной антиаритмической лекарственной терапией или в качестве первой линии лечения с учетом предпочтений пациента | I | В |
| Учащающую стимуляцию предсердий при трепетании следует рассматривать как альтернативу электрической кардиоверсии при наличии в лечебном учреждении соответствующей аппаратуры и опыта | IIa | В |
| Если ТП было зарегистрировано до аблации ФП, целесообразно выполение одномоментной катетерной аблации кавотрикуспидального перешейка и катетерной аблации ФП | IIa | С |
Пациенты с предвозбуждением желудочков и ФП/ТП имеют повышенный риск ускоренного проведения через ДПП, приводящий к высокой частоте сокращения желудочков, с потенциальной вероятностью трансформации ФП/ТП в фибрилляцию желудочков и развитию внезапной сердечной смерти (ВСС). Частота ВСС у больных с синдромом Вольфа-Паркинсона-Уайта составляет от 0,15 до 0,39% в течение 3-22 лет.
Целесообразность аблации должна обсуждаться у пациентов с синдромом ВПУ и высоким риском ФП, у спортсменов, занимающихся соревновательными видами спорта, а также у представителей опасных видов профессий, таких как водители общественного транспорта, пилоты и др.
1. Антитромботическая терапия у больных ФП и ишемическим инсультом или транзиторной ишемической атакой
У пациентов с противопоказанием к назначению антикоагулянтов в ранние сроки ишемического инсульта следует помнить о возможности назначения аспирина. В случае развития инсульта у больного, принимавшего антикоагулянты, следует оценить его приверженность к терапии антикоагулянтами в момент возникновения инсульта, и если инсульт развился вопреки адекватной терапии антикоагулянтом, его следует поменять. По мнению экспертов, у пациентов ФП, перенесших ишемический инсульт, назначение прямых ПАКГ имеет преимущество перед АВК или аспирином.
Таблица 30. Вторичная профилактика инсульта у больных ФП
|
Рекомендация
|
Класс | Уровень |
| Пациентам с ФП не рекомендуется назначение НФГ или НМГ сразу после ишемического инсульта | III | А |
| У больных ФП, перенесших ишемический инсульт или транзиторную ишемическую атаку на фоне антикоагулянтной терапии, должна быть оценена и оптимизирована приверженность терапии | IIa | С |
| У получающих антикоагулянты пациентов, перенесших умеренно тяжелый или тяжелый инсульт, следует прервать лечение АКГ на 3-12 дней (в зависимости от результатов оценки риска кровотечения и повторного инсульта мультидисциплинарной командой специалистов) | IIa | С |
| Больным ФП, перенесшим ишемический инсульт, следует рассмотреть вопрос о назначении аспирина в качестве препарата для вторичной профилактики до начала или возобновления терапии пероральными антикоагулянтами | IIa | В |
| Не рекомендуется проведение системного тромболизиса c использованием рекомбинантного тканевого активатора плазминогена, если МНО превышает 1,7 (или АЧТВ находится за пределами референсных значений у пациентов, получающих дабигатран) | III | С |
| Прямые ПАКГ являются более предпочтительными препаратами, чем АВК или аспирин, у пациентов с ФП, ранее перенесших инсульт | I | В |
| Назначение комбинированной терапии пероральными антикоагулянтами и антиагрегантами больным ФП после ишемического инсульта или ТИА не рекомендовано | III | В |
| После внутричерепного кровоизлияния у пациентов с ФП пероральные антикоагулянты могут быть возобновлены через 4-8 недель при условии устранения причины кровотечения и коррекции факторов риска | IIb | В |
Мнение экспертов, отраженное в последних европейских рекомендациях по лечению больных ФП [1-2], говорит о том, что после внутричерепного кровоизлияния АКТ у больного с ФП может быть возобновлена через 4-8 недель при наличии установленной причины кровотечения, или когда фактор риска, послуживший причиной кровотечения, можно лечить и контролировать.
Принимать решение о возобновлении антикоагулянтной терапии следует мультидисциплинарной командой, состоящей из неврологов, кардиологов, нейрохирургов и специалистов по нейровизуализации. Кроме того, необходимо информировать пациента и членов его семьи о риске и пользе от возобновления терапии антикоагулянтами. При выборе антикоагулянта разумно выбрать препарат, обладающий минимальным риском кровотечений. У пациентов с неклапанной ФП после перенесенного внутричерепного кровоизлияния прямые ПАКГ могут быть предпочтительнее АВК.
При возобновлении антикоагулянтной терапии у таких пациентов следует по возможности избегать комбинаций с антиагрегантами, у получающих АВК поддерживать уровень МНО в пределах 2-2,5, время пребывания МНО в терапевтическом диапазоне должно быть не менее 65-70%; прямые ПАКГ следует назначать в минимальных дозах, эффективных с точки зрения профилактики инсульта и системных эмболий. Следует тщательно контролировать уровень артериального давления, особенно у пациентов с локализацией кровоизлияния, типичной для гипертонической ангиопатии (базальные ганглии, таламус, ствол головного мозга). Также пациентам необходимо исключить прием алкоголя, который значительно увеличивает риск внутричерепного кровоизлияния.
Алгоритм принятия решения о возобновлении терапии антикоагулянтами после внутричерепного кровотечения, рекомендованный европейскими экспертами в 2016 году, представлен в Приложении Б, табл.5.
С целью снижения риска возникновения тромботических осложнений после ЧКВ, в том числе тромбоза стента, назначают двойную антитромбоцитарную терапию, включающую аспирин и блокатор P2Y12 рецепторов тромбоцитов.
Антитромбоцитарной терапии недостаточно для снижения риска инсульта у больных ФП, что является основанием для того, чтобы больному ФП, перенесшему ОКС или подвергнутому плановом ЧКВ, была назначена тройная антитромботическая терапии (табл.31). Результаты многочисленных метаанализов, объединивших пациентов с ФП, установили, что тройная антитромботическая терапия, состоящая из ацетилсалициловой кислоты, клопидогрела и пероральных антикоагулянтов, в 2-4 раза опаснее двойной антитромботической терапии в отношении риска крупных и фатальных кровотечений [87, 88]. У пациентов, получающих многокомпонентную антитромботическую терапию, фатальным бывает каждое десятое кровотечение, среди которых внутричерепные и желудочно-кишечные геморрагии встречаются почти с одинаковой частотой.
Празугрел и тикагрелор в составе тройной терапии не изучены, есть основания полагать, что более мощные антиагреганты потенциально более опасны в отношении риска кровотечений, и поэтому в составе тройной терапии рекомендован только клопидогрел [48.
Доза АВК в составе тройной антитромботической терапии должна быть минимально эффективной (МНО 2,0-2,5), а TTR (время пребывания МНО в целевом диапазоне) не менее 65- 70%.
До 2014 г. в составе тройной антитромботической терапии в качестве антикоагулянтного препарата рассматривался только варфарин. С 2014 г. применение прямых ПАКГ у пациентов с ФП, подвергнутых плановому ЧКВ, было официально допущено европейскими экспертами, а начиная с 2016 г. публикуются результаты рандомизированных исследований (PIONEER AF- PCI, REDUAL-PCI, AUGUSTUS), оценивающих безопасность различных стратегий применения прямых ПАКГ в составе много компонентной антитромботической терапии [89-91].
Таблица 31. Рекомендации по комбинированной терапии пероральными антикоагулянтами и антиагрегантами
|
Рекомендация
|
Класс | Уровень |
| После планового чрескожного коронарного вмешательства у больного с ФП и высоким риском инсульта следует рассмотреть назначение тройной антитромботической терапии (пероральные антикоагулянты в сочетании с аспирином и клопидогрелем), по крайней мере, на 1 месяц независимо от типа стента | IIa | В |
| У пациентов с ФП и высоким риском инсульта, которым проводится ЧКВ со стентированием вследствие ОКС (а также в иных клинических ситуациях, повышающих риск тромботических коронарных осложнений) следует рассмотреть назначение тройной антитромботической терапии (пероральные антикоагулянты в сочетании с аспирином и клопидогрелем) на срок 1-6 месяцев | IIa | С |
| Двойная терапия пероральными антикоагулянтами в сочетании с клопидогрелем 75 мг в сутки может быть рассмотрена как альтернатива начальной тройной антитромботической терапии в случае, когда риск геморрагических осложнений превышает риск ишемических осложнений | IIa | А |
|
Все пациенты, которым выполняется ЧКВ со стентированием, перипроцедурально должны получать аспирин и клопидогрел
|
I | С |
| У пациентов с ФП и показаниями к тройной антитромботической терапии варфарину следует предпочесть прямые ПАКГ | IIa | А |
| Если пациент получает АВК в комбинации с аспирином и клопидогрелом, МНО следует поддерживать в нижней части терапевтического диапазона, стремиться достичь ВТД>65% | IIa | В |
| Через 12 месяцев от события, послужившего основанием для назначения комбинированной антитромботической терапии, следует рассмотреть переход на монотерапию АКГ | IIa | В |
| Прямые ПАКГ в комбинации с аспирином и/или клопидогрелом следует назначать в минимальных дозах, одобренных для профилактики инсульта | IIa | С |
| Ривароксабан в комбинации с аспирином или клопидогрелом может быть назначен в дозе 15 мг/сутки | IIb | В |
| Дабигатран в комбинации с аспирином или клопидогрелом может быть назначен в дозе 110 мг 2 раза в сутки | IIb | В |
| Тикагрелор и прасугрел не рекомендуется использовать как часть тройной антитромботической терапии в комбинации с аспирином и АКГ | III | С |
Список сокращений: АВК – антагонисты витамина К, АКГ – антикоагулянты, ВТД – время в терапевтическом диапазоне, МНО – международное нормализованное отношение, НМГ – низкомолекулярный гепарин, НФГ – нефракционированный гепарин, ОКС – острый коронарный синдром, ПАКГ – пероральные антикоагулянты, УЛП – ушко левого предсердия ФП – фибрилляция предсердий, ЧКВ – чрескожное коронарное вмешательство, ЧП-ЭХОКГ – чреспищеводная эхокардиография
При использовании прямых ППАКГ в составе тройной антитромботической терапии следует выбирать минимальные дозы, подтвердившие свою эффективность в рандомизированных исследованиях, послуживших основанием для их применения. Дабигатран следует использовать в дозе 110 мг 2 раза в день пожилым пациентам, больным, получающим ингибиторы гликопротеина Р (например, верапамил), а также пациентам с высоким риском кровотечений; ривароксабан следует использовать в дозе 15 мг, особенно у пациентов с высоким риском кровотечений или клиренсом креатинина 30-49 мл/мин; апиксабан назначается в дозе 5 мг 2 раза в день, а у лиц, имеющих, по крайней мере, два из трех ниже перечисленных признаков (возраст ≥80 лет, масса тела ˂60 кг, клиренс креатинина ≥1,5 мг/дл (133 мкмоль/л)) – 2,5 мг 2 раза в день.
Алгоритм выбора стратегии многокомпонентной антитромботической терапии у больных с фибрилляцией предсердий после ОКС или перенесших плановое ЧКВ представлена в Приложении Б, табл.6 и 7.
Таблица 23. Рекомендации по периоду отмены ППАКГ при плановых инвазивных/ хирургических вмешательствах
| Дабигатран | Ривароксабан | Апиксабан | Эдоксабан | |||||
| Риск кровотечений | Низкий/стандартный | Высокий/большая хирургия | Низкий/стандартный | Высокий/большая хирургия | Низкий/стандартный | Высокий/большая хирургия | Низкий/стандартный | Высокий/большая хирургия |
| КК≥80 мл/мин | ≥24 часа | ≥48 часов | ≥24 часа | ≥48 часов | ≥24 часа | ≥48 часов | ≥24 часа | ≥48 часов |
|
КК 50-80
мл/мин
|
≥36 часов | ≥72 часов | ≥24 часов | ≥48 часов | ≥24 часов | ≥48 часов | ≥24 часов | ≥48 часов |
|
КК 30-50
мл/мин
|
≥48 часов | ≥96 часов | ≥24 часов | ≥48 часов | ≥24 часов | ≥48 часов | ≥24 часов | ≥48 часов |
|
КК 15-30
мл/мин
|
Не показан | ≥36 часов | ≥48 часов | ≥36 часов | ≥48 часов | ≥36 часов | ≥48 часов | |
| КК<15 мл/мин | Не показан | Не показан | Не показан | Не показан | ||||
После операции парентеральное введение антикоагулянтов можно возобновить, как только будет обеспечен стабильный гемостаз (оптимально в первые 24 ч после операции, но после крупных вмешательств и высоком риске кровотечений этот срок можно увеличить до 48-72 ч). При отсутствии кровотечения следует возобновить и прием антагониста витамина К в подобранной ранее дозе. Прекратить парентеральное введение антикоагулянтов можно не ранее, чем через 5 суток от возобновления приема антагонистов витамина К, и не ранее, чем два последовательных дня МНО будет находиться хотя бы на нижней границе терапевтического диапазона [1-2].
С учетом быстрого начала и предсказуемого временного интервала прекращения действия, прямые ПАКГ не требуют переходной терапии низкомолекулярными гепаринами [48]. Однако, с учетом риска периоперационных кровотечений, при хирургических вмешательствах, ППАКГ также должны быть отменены, при этом длительность отмены зависит от риска кровотечения во время хирургического вмешательства и от функционального состояния почек (см. алгоритм в таблице 23).
При наличии сомнений в прекращении антикоагулянтного эффекта прямых ПАКГ, могут быть использованы некоторые лабораторные тесты (АЧТВ или тромбиновое время в разведении для дабигатрана, или протромбиновое время и тест анти-Ха активности с хромогенными субстратами для ривароксабана и апиксабана).
Однако такая стратегия никогда не изучалась в клинических исследованиях и не может быть рекомендована для рутинного применения [48]. После операции прием новых пероральных антикоагулянтов можно возобновить сразу же после достижения эффективного гемостаза.
Медицинская реабилитация
Госпитализация
Показания для плановой госпитализации
Профилактика
Выраженность симптомов рекомендуется оценивать с использованием модифицированной шкалы EHRA. В плановое обследование пациентов с фибрилляцией предсердий в рамках диспансерных осмотров рекомендуется включать ЭКГ в 12 отведениях не реже 1 раза в год (для исключения проаритмогенного действия препаратов, выявления новых нарушений ритма и проводимости, ишемических изменений и признаков структурной патологии сердца), клинический анализ крови не реже 1 раза в год для исключения скрытых кровотечений, биохимический анализ крови с оценкой СКФ и электролитов не реже 1 раза в год для правильного дозирования лекарственных препаратов.
Пациентам, находящимся на терапии АВК, рекомендуется определять уровень МНО не менее 12 раз в год. По показаниям может быть проведено суточное или многосуточное мониторирование ЭКГ (с целью оценки эффективности терапии, выявления связи симптомов с эпизодами аритмии или диагностики других значимых нарушений ритма и проводимости), ЭхоКГ и другие обследования.
При ухудшении состояния или прогрессировании основного заболевания сердечно-сосудистой системы на фоне проводимого лечения пациентам с фибрилляцией предсердий рекомендована внеочередная консультация врача-кардиолога для решения вопроса об объеме обследования, коррекции терапии и целесообразности госпитализации в профильный стационар. Катетерная абляция ФП и/или ТП не меняет протокола диспансерного наблюдения у данной группы пациентов.
Информация
Источники и литература
-
Клинические протоколы, руководства, рекомендации Министерства здравоохранения Республики Узбекистан 2024
- 1. Голицын С.П., Панченко Е.П., Кропачева Е.С. и соавт. Евразийские клинические рекомендациии по диагностике и лечению фибрилляции предсердий. Евразийский Кардиологический Журнал. 2019; (4): 4-85. 2. Hindricks G., Potpara T., Dagres N. et al. ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association of Cardio-Thoracic Surgery (EACTS). Eur. Heart J. 2020; 00: 1-125. 3. Joglar J.A., Chung M.K., Armbruster A.L. et al. ACC/AHA/ACCP/HRS Guideline for the Diagnosis and Management of Atrial Fibrillation. Circulation. 2024; 149: e1–e156. 4. Stewart S., Hart C.L., Hole D.J., McMurray J.J. Population prevalence, incidence, and predictors of atrial fibrillation in the Renfrew/ Paisley study. Heart 2001; 86: 516–521. 5. Lip G.Y., Laroche C., Dan G.A. et al. 'Real-world' antithrombotic treatment in atrial fibrillation: the EURObservational Research Programme Atrial Fibrillation General Pilot survey. Europace 2014; 16 (3): 308-319. 6. Schotten U., Verheule S., Kirchhof P., Goette A. Pathophysiological mechanisms of atrial fibrillation — a translational appraisal. Physiol Rev. 2011; 91(1): 265-325. 7. Kirchhof P., Auricchio A., Bax J. et al. Outcome parameters for trials in atrial fibrillation: executive summary. Eur. Heart J. 2007; 28: 2803–2817. 8. Benjamin E., Wolf P., D’Agostino R. et al. Impact of atrial fibrillation on the risk of death: the Framingham Heart Study. Circulation 1998; 98: 946–952. 9. Andersson T., Magnuson A., Bryngelsson I.L. et al. All-cause mortality in 272,186 patients hospitalized with incident atrial fibrillation 1995-2008: a Swedish nationwide long-term casecontrol study. Eur. Heart J. 2013; 34: 1061–1067. 10. Hindricks G., Piorkowski C., Tanner H. et al. Perception of atrial fibrillation before and after radiofrequency catheter ablation: relevance of asymptomatic arrhythmia recurrence. Circulation 2005; 112: 307–313. 11. Bartel T., Erbel R., Acute Trial Investigators. Transoesophageal echocardiography for immediate and safe cardioversion in patients with atrial fibrillation. Eur. Heart J. 2001; 22: 2041–2044. 12. Leung D., Davidson P., Cranney G., Walsh W. Tromboembolic risks of left atrial thrombus detected by transesophageal echocardiogram. Amer. J. Cardiol. 1997; 79 (5): 626-629. 13. Rosamond W., Flegal K., Friday G. A report from the American Heart Association Statistics Committee and Stroke Statistics Subcommittee // Circulation 2007; 115 (5): e69–171. 14. Lip G.Y., Nieuwlaat R., Pisters R. et al. Refiing clinical risk stratifiation for predicting stroke and thromboembolism in atrial firillation using a novel risk factor-based approach: the Euro Heart Survey on atrial firillation. Chest 2010; 137: 263–272. 15. Hart R., Pearce L., Aguilar M. Meta-analysis: antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann. Intern. Med. 2007; 146: 857–867. 16. Connolly S., Eikelboom J., Joyner C. et al. Apixaban in Patients with Atrial Fibrillation. N. Engl. J. Med. 2011; 364(9): 806-817. 17. ACTIVE Writing Group of the ACTIVE Investigators. Clopidogrel plus aspirin versus oral anticoagulation for atrial fibrillation in the Atrial fibrillation Clopidogrel Trial with Irbesartan for prevention of Vascular Events (ACTIVE W): a randomised controlled trial. Lancet 2006; 367: 1903–1912 18. Connolly S., Ezekowitz M., Yusuf S. et al. Randomized Evaluation of Long-Term Anticoagulation Therapy Investigators. Newly identified events in the RE-LY trial. N. Engl. J. Med. 2010; 363: 1875–1876. 19. Patel M., Mahaffey K., Garg J. et al. ROCKET AF Investigators. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N. Engl. J. Med. 2011; 365: 883–891. 20. Granger C., Alexander J., McMurray J. et al., for the ARISTOTLE Committees and Investigators. Apixaban versus warfarin in patients with atrial fibrillation. N. Engl. J. Med. 2011; 365: 981–992. 21. Giugliano R., Ruff C., E. Braunwald E. et al. Edoxaban versus warfarin in patients with atrial fibrillation. N. Engl. J. Med. 2013; 369: 2093–2104. 22. Okumura K., Akao M., Yoshida T. et al. for the ELDERCARE-AF Committees and Investigators. Low-Dose Edoxaban in Very Elderly Patients with Atrial Fibrillation. N. Engl. J. Med. 2020; 383: 1735-1745. 23. Airaksinen K., Gronberg T., Nuotio I. et al. Thromboembolic complications after cardioversion of acute atrial fibrillation: the FinCV (Finnish CardioVersion) study. J. Amer. Coll. Cardiol. 2013; 62: 1187–1192. 24. Berger M., Schweitzer P. Timing of thromboembolic events after electrical cardioversion of atrial fibrillation or flutter: a retrospective analysis. Amer. J. Cardiol. 1998; 82(12): 1545-1547. 25. Nuotio I., Hartikainen J., Grönberg T. et al. Time to cardioversion for acute atrial fibrillation and thromboembolic complications. JAMA, 2014; 312(6): 647-649. 26. Heidbuchel H., Verhamme P., Alings M. et al. Updated European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist anticoagulants in patients with non-valvular atrial fibrillation. Europace, 2015; 17(10): 1467-1507. 27. Renda G., Zimarino M., Ricci F. et al. Efficacy and Safety of Non-Vitamin K Antagonist Oral Anticoagulants After Cardioversion for Nonvalvular Atrial Fibrillation. Amer. J. Med. 2016; 129(10): 1117-1123. 28. Weigner M., Thomas L., Patel U. et al. Early cardioversion of atrial fibrillation facilitated by transesophageal echocardiography: short-term safety and impact on maintenance of sinus rhythm at 1 year. Amer. J. Med. 2001; 110(9): 694-702. 29. Wu L., Chandrasekaran K., Friedman P. et a.l Safety of expedited anticoagulation in patients undergoing transesophageal echocardiographic-guided cardioversion. Amer. J. Med. 2006; 119(2): 142-146. 30. Jaber W., Prior D., Thamilarasan M. et al. Efficacy of anticoagulation in resolving left atrial and left atrial appendage thrombi: A transesophageal echocardiographic study. Amer. Heart J. 2000; 140(1): 150-156. 31. Barysienė J., Žebrauskaitė A., Petrikonytė D. et al. Findings of transoesophageal echocardiogram in appropriately anticoagulated patients with persistent atrial fibrillation prior to planned cardioversion. BMC Cardiovasc. Disord. 2017; 17(1): 67. 32. Weigner M., Caulfield T., Danias P. et al. Risk for clinical thromboembolism associated with conversion to sinus rhythm in patients with atrial fibrillation lasting less than 48 hours. Ann. Intern Med. 1997; 126(8): 615-620. 33. Ezekowitz M., Pollack C., Halperin J. et al Apixaban compared to heparin/vitamin K antagonist in patients with atrial fibrillation scheduled for cardioversion: the EMANATE trial. Eur. Heart J. 2018; 39(32): 2959-2971. 34. Fauchier L., Cinaud A., Brigadeau F. et al. Left Atrial Appendage Closure in Atrial Fibrillation. J. Amer. Coll. Cardiol. 2018; 72(22): 2806-2807. 35. Blackshear J.L., Odell J.A. Appendage obliteration to reduce stroke in cardiac surgical patients with atrial fibrillation. Ann. Thorac. Surg. 1996; 61: 755–759. 36. Chatterjee S., Alexander J., Pearson P., Feldman T. Left atrial appendage occlusion: lessons learned from surgical and transcatheter experiences. Ann. Thorac. Surg. 2011; 92, 2283–2292. 37. Blackshear J., Johnson W., Odell J. et al. Thoracoscopicextracardiac obliteration of the left atrial appendage for stroke risk reduction in atrial fibrillation. J. Amer. Coll. Cardiol. 2003; 42, 1249–1252. 38. Melduni R., Schaff H., Lee H-C. et al. Impact of left atrial appendage closure during cardiac surgery on the occurrence of early postoperative atrial fibrillation, stroke, and mortality: a propensity score-matched analysis of 10 633 patients. Circulation, 2017; 135: 366-378. 39. Holmes D., Doshi S., Kar S. et al. Left atrial appendage closure as an alternative to warfarin for stroke Prevention in atrial fibrillation: a patient-level meta-analysis. J. Amer. Coll. Cardiol. 2015; 65: 2614-2623. 40. Wang Y., Di Biase L., Hortonet R. al. Left atrial appendage studied by computed tomography to help planning for appendage closure device placement. J. Cardiovasc. Electrophysiol. 2010; 21, 973–982. 41. Tzikas A., Holmes D., Gafoor S. et al. Percutaneous left atrial appendage occlusion: the Munich consensus document on definitions, endpoints, and data collection requirements for clinical studies. Europace 2016; 19(1): 4–15. 42. Holmes D., Reddy V., Turi Z. et al. Percutaneous closure of the left atrial appendage versus warfarin therapy for prevention of stroke in patients with atrial fibrillation: a randomized non-inferiority trial. Lancet 2009; 374: 534–542. 43. Reddy V., Gibson D., Kar S. et al. Post-approval U.S. experience with left atrial appendage closure for stroke prevention in atrial fibrillation. J. Amer. Coll. Cardiol. 2017; 69: 253-261. 44. Pisters R., Lane D.A., Nieuwlaat R. et al. A novel user-friendly score (HAS-BLED) to assess 1-year risk of major bleeding in patients with atrial fibrillation: the Euro Heart Survey. Chest 2010; 138: 1093–1100. 45. Chao T., Lip G., Lin Y. et al. Incident risk factors and major bleeding in patients with atrial fibrillation treated with oral anticoagulants: a comparison of baseline, follow-up and Delta HAS-BLED scores with an approach focused on modifiable bleeding risk factors. Thromb. Haemost. 2018; 118: 768-777. 46. Guo Y., Lane D., Chen Y., Lip G.; mAF-App II Trial investigators. Regular bleeding risk assessment associated with reduction in bleeding outcomes: the mAFA-II randomized trial. Amer. J. Med. 2020: pii: S0002-9343(20)30274-6. 47. Kakkar A., Mueller I., Bassand J. et al. International longitudinal registry of patients with atrial fibrillation at risk of stroke: Global Anticoagulant Registry in the FIELD (GARFIELD). Amer. Heart J. 2012; 163(1): 13-19. 48. Steffel J, Collins R, Matthias Antz M. et al. The 2021 European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist oral anticoagulants in patients with atrial fibrillation. Europace 2021; 23(10): 1612-1676. 49. Halvorsen S., Storey R., Rocca B. et al. Management of antithrombotic therapy after bleeding in patients with coronary artery disease and/or atrial fibrillation: expert consensus paper of the European Society of Cardiology Working Group on Thrombosis, Eur. Heart J. 2017; 38 (19): 1455–1462. 50. AFFIRM Investigators. A comparison of rate control and rhythm control in patients with atrial firillation. N. Engl. J. Med. 2002; 347: 1825–1833.
Информация
Перечень сокращений
| Класс | Определение |
| Класс I | Данный метод лечения/диагностический подход должен быть использован, польза от его применения существенно превышает сопутствующие риски |
| Класс IIa | Применение данного метода лечения/диагностического подхода целесообразно, польза от его применения превышает сопутствующие риски |
| Класс IIb | Данный метод лечения/диагностический подход может быть использован в определённых ситуациях, польза от его применения превышает сопутствующие риски или сопоставима с ними |
| Класс III | Данный метод лечения/диагностический подход не должен быть использован, т.к. он не оказывает пользы или может причинить вред. |
| Уровень | Доказательная база |
| Уровень А | Доказательства получены в нескольких рандомизированных контролируемых исследованиях или мета-анализах этих исследований |
| Уровень В | Доказательства получены в одном рандомизированном контролируемом клиническом исследовании или крупных не рандомизированных исследованиях |
| Уровень С | В основе клинической рекомендации лежит мнение (соглашение) экспертов и/или результаты небольших исследований, данные регистров |
Критерии оценки качества медицинской помощи
|
№
|
Критерий качества | Класс | Уровень | Да/Нет |
| 1 | Выполнен осмотр врачом-кардиологом, выставлен диагноз с указанием формы ФП/ТП (впервые выявленная, пароксизмальная, персистирующая, длительно персистирующая, постоянная), варианта ФП — в зависимости от частоты сердечных сокращений (ЧСС) и тяжести клинических проявлений согласно модифицированной классификации EHRA | I | В | |
| 2 | Проведены электрокардиографические методы исследования (ЭКГ, холтеровское мониторирование ЭКГ) | I | В | |
| 3 | Выполнено трансторакальное эхокардиографическое исследование | I | С | |
| 4 | Выполнена оценка риска тромбоэмболических осложнений согласно шкале CHA2DS2-VASc у пациентов с неклапанной ФП/ТП | I | А | |
| 5 | Выполнен общий (клинический) анализ крови | - | А | |
| 6 | Выполнено биохимическое исследование с определением уровня калия и натрия, АСТ, АЛТ, билирубина и креатинина с расчетом клиренса креатинина по формуле Кокрофта — Голта; | I | А | |
| 7 | У пациентов с неклапанной ФП и высоким риском тромбоэмболических осложнений по шкале CHA2DS2-VASc (≥3 баллов у женщин и ≥2 баллов у мужчин) назначена антикоагулянтная терапия: ПОАК с обоснованием выбранной дозы или АВК с указанием необходимости подбора дозы под контролем МНО | I | А | |
| 8 | Пациентам с клапанной ФП (митральным стенозом средней или тяжелой степени или при наличии механических протезов клапанов сердца) назначена антикоагулянтная терапия АВК и даны рекомендации по контролю МНО в заданном диапазоне | I | В | |
| 9 | Выбрана и обсуждена с пациентом стратегия лечения ФП/ТП (контроль ритма или частоты) | - | А | |
| 10 | В случае выбора стратегии контроля ритма сделан выбор между медикаментозными и интервенционными методами лечения | I | В | |
| 11 | При выборе стратегии медикаментозного контроля ритма назначена антиаритмическая терапия в соответствии с инструкцией по применению лекарственного препарата для медицинского применения и фармакотерапевтической группой, а также с учетом способа введения и безопасности лекарственного средства | I | В | |
| 12 | В случае выбора стратегии контроля частоты сердечных сокращений назначена ритм-урежающая терапия в соответствии с инструкцией по применению лекарственного препарата для медицинского применения и фармакотерапевтической группой, а также с учетом способа введения и безопасности лекарственного средства | I | В | |
| 13 | При интервенционном лечении ФП интраоперационно достигнута электрическая изоляция устьев легочных вен | I | В |
Нерегулярность сердечных сокращений приводит к изменению тока крови, что, в свою очередь, может привести к образованию кровяных сгустков (тромбов) в предсердиях. Миграция тромбов с током крови в сосуды, кровоснабжающие головной мозг, приводит к развитию ишемического инсульта. Риск развития инсульта у пациентов с ФП/ТП в пять раз выше по сравнению с другими пациентами того же возраста без аритмии.
Ключевыми факторами предотвращения развития такого рода осложнений являются своевременное выявление аритмии и назначение адекватной медикаментозной терапии. С целью уменьшения рисков развития ишемического инсульта по решению врача пациенту может быть рекомендована терапия препаратами, способствующими разжижению крови, — антикоагулянтами. Согласно механизму действия данные препараты блокируют один из ферментов свертывающей системы крови и предотвращают образование тромба на самой ранней стадии.
В зависимости от формы аритмии пациентом и лечащим врачом может быть выбрана наиболее предпочтительная тактика лечения ФП/ТП: контроль ритма (прием препаратов, предотвращающих развитие приступов аритмии) или контроль частоты сердечных сокращений. При выборе последней индивидуально подбирается доза препарата, способствующая уменьшению частоты сердечных сокращений.
При неэффективности медикаментозной терапии широкое применение получили так называемые малоинвазивные хирургические техники лечения пациентов с ФП/ТП — радиочастотная или криобаллонная катетерная абляция, т.е. вмешательство, направленное на разрушение очагов, генерирующих «неправильные» электрические импульсы в предсердиях.
Вне зависимости от выбранной тактики лечения ежедневный регулярный прием антикоагулянтных и антиаритмических препаратов по показаниям является обязательным условием успешного лечения больных с ФП и ТП.
Для обновления и своевременного пересмотра клинического руководства по диагностике и лечению фибрилляции предсердий на всех уровнях оказания медицинской помощи была создана мультидисциплинарная рабочая группа (МДРГ) из специалистов разного профиля. Это было обусловлено следующими причинами:
Руководитель мультидисциплинарной рабочей группы
Ответственные исполнители за клиническое содержание руководства по разделам
Ответственные исполнители осуществляли систематизацию и обновление ключевых рекомендаций из выбранных международных клинических руководств путем адаптации, предоставили обобщенные данные по ссылкам для формирования клинического содержания обновленного руководства.
Оценка клинического содержания клинического руководства
В связи с актуальностью проблемы фибрилляции предсердий на сегодняшний день в мире разработано и обновлено большое количество разнообразных клинических руководств, консенсусов, стандартов и пр., посвященных диагностике, лечению и ведению больных с фибрилляции предсердий.
Рабочей мультидисциплинарной группой было принято решение о создании клинического руководства по диагностике и лечению фибрилляции предсердий путем адаптирования уже разработанных международных клинических руководств высокого методологического качества, основанных на принципах доказательной медицины для всех уровней здравоохранения Кыргызской Республики.
Критерии включения/исключения публикаций
Найденные электронные базы данных по клиническим руководствам и практическим рекомендациям
|
Страна и название ресурса
|
Интернет-адрес |
| Международная ассоциация | |
| Всемирная организация здравоохранения (World Health Organization, WHO) | www.who.int |
| Сайт по доказательной медицине EBM Guidelines | http://www.emb-guidelines.com |
| Guidelines International Network (G-I-N) | www.g-i-n.net |
| Америка | |
| Medscape | https://emedicine.medscape.com/article/2500114-guidelines |
| National Institute of Health (NIH) | https://guidelines.nih.gov/ |
| Cайт Американской Коллегии Кардиологов |
http://www.acc.org
https://www.ahajournals.org/doi/pdf/10.1161/CIR.0000000000000628
|
| Сайт Американской медицинской Ассоциации | http://www.ama-assn.org |
| Европа | |
| Сайт Европейского общества кардиологов | http://www.eurocardio.org |
| Сайт Европейского общества сердечного ритма | http://www.europace.org |
| Великобритания | |
| National Institute for Clinical Excellence (NICE) | https://www.nice.org.uk/covid-19 |
| BMJ Best Practice | https://bestpractice.bmj.com |
| SIGN | www.sign.ac.uk |
| Guidelines | https://www.guidelines.co.uk/?adredir=1 |
| Россия | |
| Сайт Всероссийского научного общества кардиологов | http://www.cardiosite.ru |
|
Название руководства
|
Качество | Новизна | Применимость | Варианты действий | |
| 1 | Евразийские клинические рекомендациии по диагностике и лечению фибрилляции предсердий. Евразийский Кардиологический Журнал. 2019; (4): 4-85. | ++ | ++ | ++ | Рекомендации по диагностике и лечение фибрилляции предсердий |
| 2 | ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association of Cardio-Thoracic Surgery (EACTS). Eur. Heart J. 2020; 00: 1-125. | +++ | +++ | ++ | Рекомендации по диагностике и лечение фибрилляции предсердий |
| 3 | ACC/AHA/ACCP/HRS Guideline for the Diagnosis and Management of Atrial Fibrillation. Circulation. 2024; 149: e1–e156. | +++ | ++++ | +++ | Рекомендации по диагностике и лечение фибрилляции предсердий |
| 4 | The 2021 European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist oral anticoagulants in patients with atrial fibrillation. Europace 2021; 23 (10): 1612-1676. | ++ | +++ | ++ | Рекомендации по профилактике тромбоэмболических осложнений при фибрилляции предсердий |
| 5 | 2024 European Heart Rhythm Association/Heart Rhythm Society/ Asia Pacific Heart Rhythm Society/ Latin American Heart Rhythm Society expert consensus statement on catheter and surgical ablation of atrial fibrillation. Europace 2024; 26: 1–107. | ++ | ++++ | +++ | Рекомендации по катетерной аблации при фибрилляции предсердий |
Клиническая проблема
Цель создания КР
Пользователи КР
Дата разработки:
Дата последующего рассмотрения КР
Адрес для переписки с рабочей группой
Таблица 1. Алгоритм назначения антикоагулянтов больным с ФП.
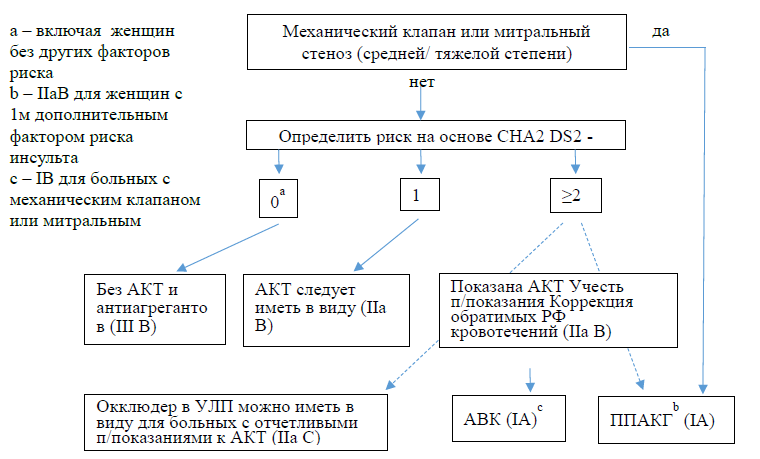
Таблица 2. Алгоритм антикоагулянтной поддержки у пациентов с ФП.
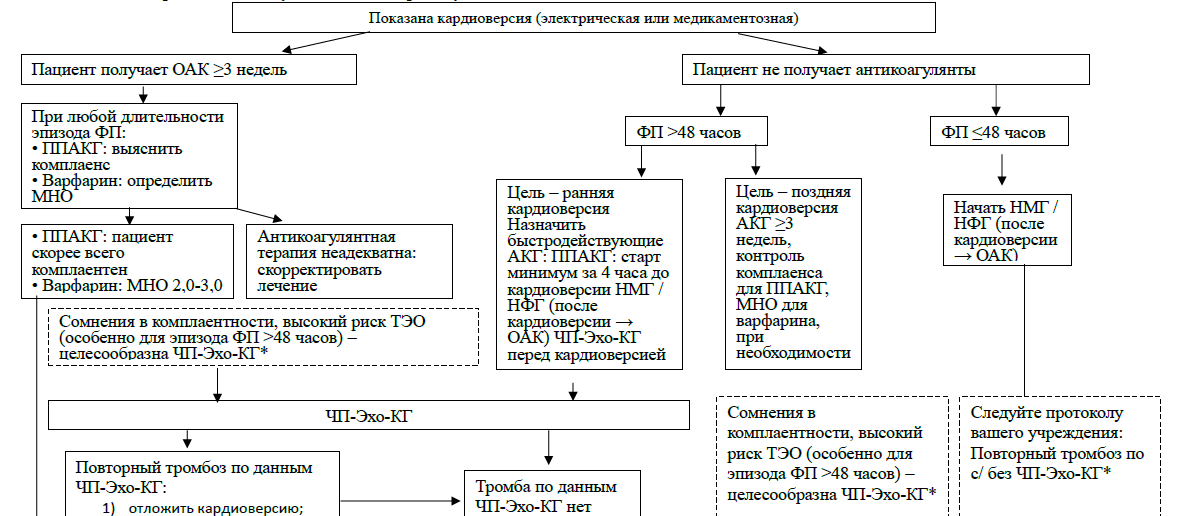
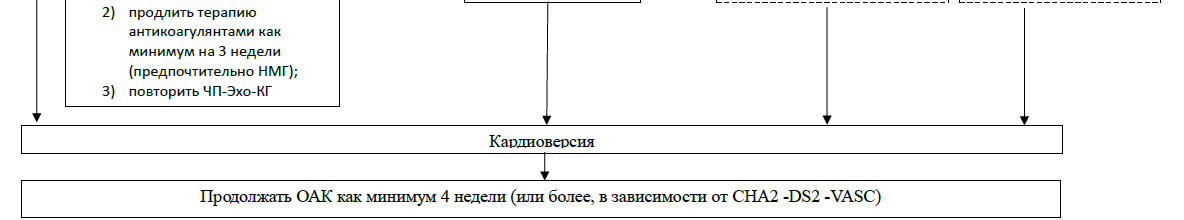
Таблица 3. Стратегия лечения больного ФП с активным кровотечением, возникшем на фоне приема пероральных антикоагулянтов
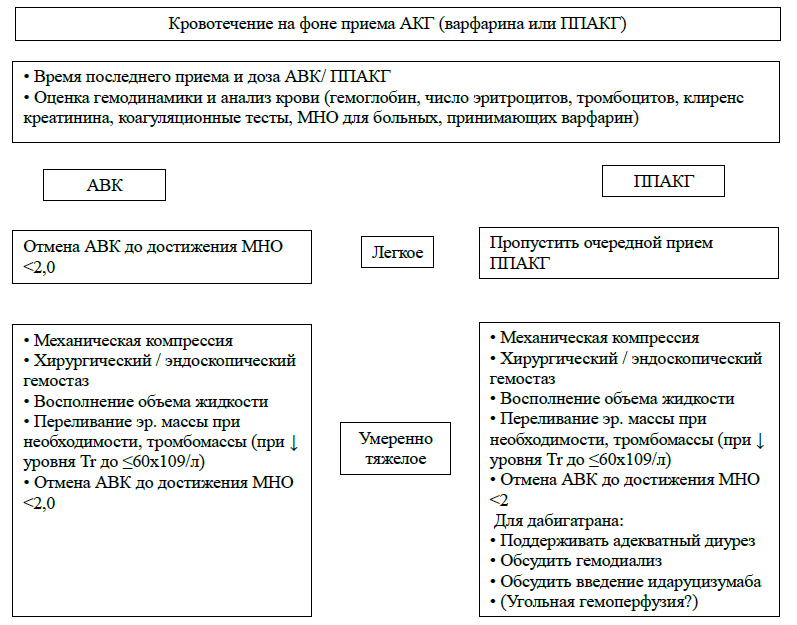
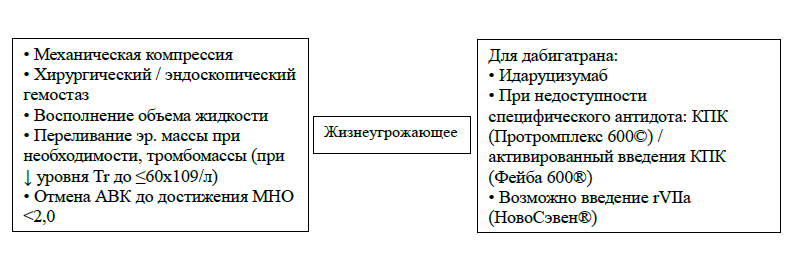
Таблица 4. Алгоритм начала или возобновления терапии пероральными антикоагулянтами у больных ФП и острым ишемическим инсультом или транзиторной ишемической атакой
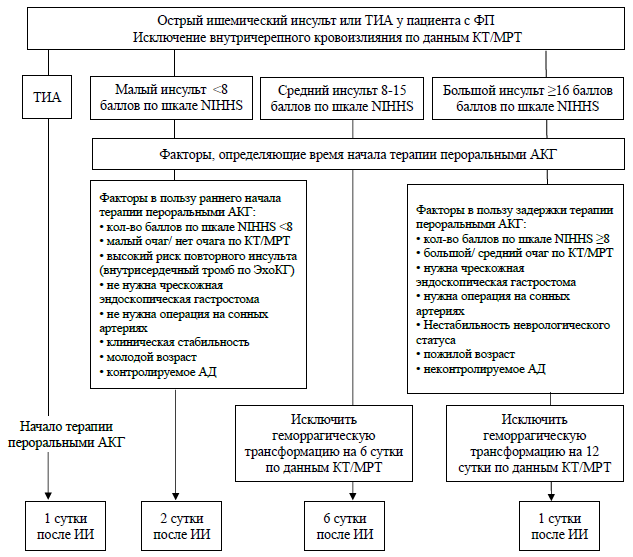
Таблица 5. Алгоритм принятия решения о возможности возобновления антикоагулянтной терапии у пациента, перенесшего внутричерепное кровоизлияние
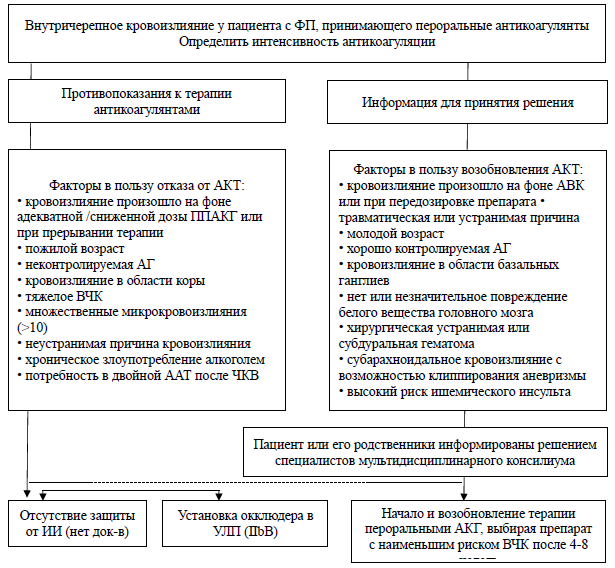
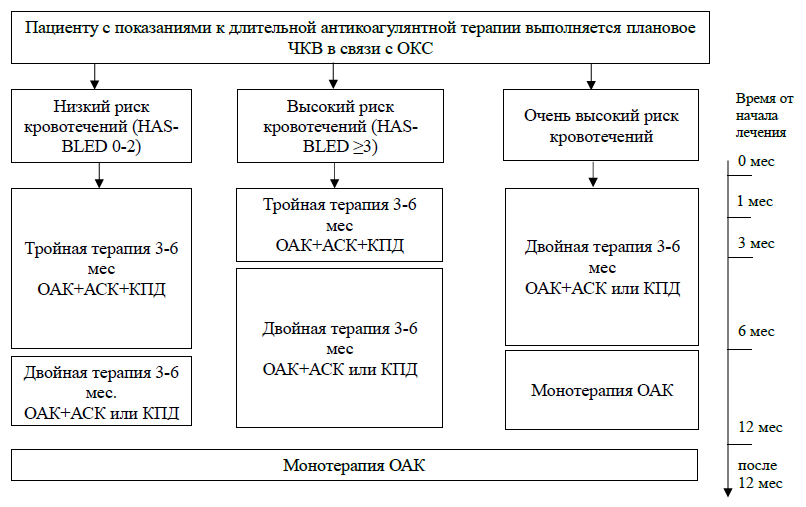
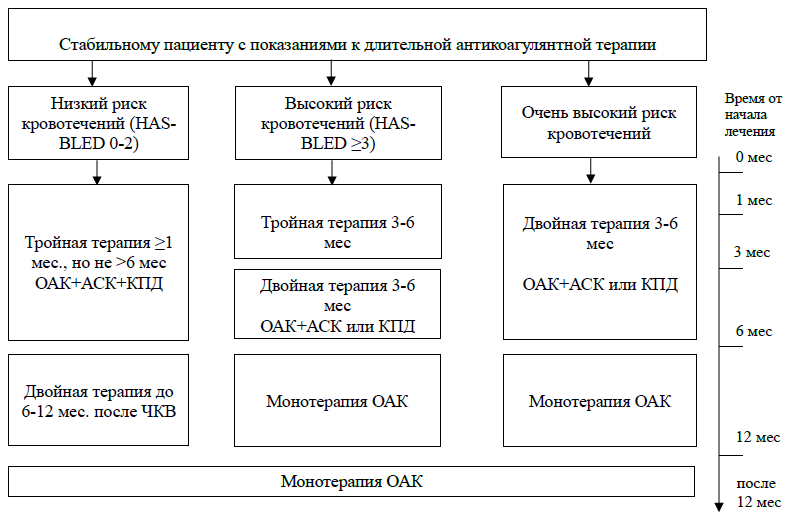
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.