Тромботические микроангиопатии: типичный и атипичный гемолитико-уремический синдромы
 Версия: Клинические протоколы МЗ РК - 2022 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2022 (Казахстан)
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «22» декабря 2022 года
Протокол №176
КЛИНИЧЕСКИЙ ПРОТОКОЛ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
ТРОМБОТИЧЕСКИЕ МИКРОАНГИОПАТИИ: ТИПИЧНЫЙ И АТИПИЧНЫЙ ГЕМОЛИТИКО-УРЕМИЧЕСКИЙ СИНДРОМЫ
Тромботическая микроангиопатия (ТМА) – группа заболеваний, характеризующаяся тромбоцитопенией, микроангиопатической гемолитической анемией (МАГА) и ишемическим повреждением органов, способствующим развитию полиорганной недостаточности. Типичный гемолитико-уремический синдром, атипичный гемолитико-уремический синдром и тромботическая тромбоцитопеническая пурпура (ТТП) составляют группу первичных ТМА.
Типичный гемолитико-уремический синдром (STEC-ГУС) – инфекционно-опосредованная форма ТМА, обусловленная повреждающим воздействием шига-токсина Escherichia coli (STEC) на эндотелий сосудов микроциркуляторного русла. Развивается как осложнение геморрагического колита после диарейного продромального периода с появлением МАГА, тромбоцитопении и формированием острого повреждения почек (ОПП). Развитие STEC-ГУС может наблюдаться в любом возрасте, однако преимущественно встречается у детей 6 мес – 5 лет, у которых является самой частой причиной ОПП. Заболеваемость среди взрослых составляет 0,5 на 100 000/год и носит чаще эпидемический характер [1].
Атипичный гемолитико-уремический синдром (аГУС) – хроническое системное заболевание, обусловленное мутацией генов регуляторов альтернативного пути комплемента, или, реже, антителами к фактору Н, что приводит к дисфункции каскада комплемента с ее неконтролируемой активацией по альтернативному пути и, в конечном итоге, к генерализованному тромбообразованию в сосудах микроциркуляторного русла. аГУС относится к группе ультраредких заболеваний. Развитие аГУС может наблюдаться у людей любого возраста, однако преимущественно встречается в детском и молодом возрасте [2]. аГУС является тяжело протекающим системным заболеванием с неблагоприятным прогнозом и высоким риском летального исхода.
- Морфологически ТМА представляет собой повреждение сосудов, характеризующееся отеком эндотелиальных клеток с их отслойкой от базальной мембраны (эндотелиоз), некрозом, деструкцией, расширением субэндотелиального пространства с образованием тромбов в просвете капилляров и артериол, содержащих тромбоциты и фибрин, что приводит к окклюзии просвета сосуда и ишемическому повреждению органов и тканей.
ВВОДНАЯ ЧАСТЬ
Код(ы) по МКБ-10 (таблица 1):
| Код | Название |
| М31.1 | Тромботическая микроангиопатия |
| D59.3 | Гемолитико-уремический синдром |
Дата разработки протокола: 2022 год.
Сокращения, используемые в протоколе – таблица 2:
| аГУС | атипичный гемолитико-уремический синдром |
| АФС | антифосфолипидный синдром |
| АЧТВ | активированное частичное тромбопластиновое время |
| ГУС | гемолитико-уремический синдром |
| ДВС | диссеминированное внутрисосудистое свертывание |
| ЖКТ | желудочно-кишечный тракт |
| ЗПТ | заместительная почечная терапия |
| ИП | инфузии свежезамороженной плазмы |
| КАФС | катастрофический антифосфолипидный синдром |
| КОС | кислотно-основное состояние |
| КФК | креатинфосфокиназа |
| КФК-МВ | МВ-изофермент креатинфосфокиназы |
| ЛДГ | лактатдегидрогеназа |
| МАГА | микроангиопатическая гемолитическая анемия |
| МАК | мембрано-атакующий комплекс |
| МНО | международное нормализованное отношение |
| ОЖГБ | острый жировой гепатоз беременных |
| ОПП | острое повреждение почек |
| ПВ | протромбиновое время |
| ПО | плазмообмен |
| ПТ | плазмотерапия |
| РКФМ | растворимые фибринмономерные комплексы |
| СЗП | свежезамороженная плазма |
| СКВ | системная красная волчанка |
| ТМА | тромботическая микроангиопатия |
| ТПН | терминальная почечная недостаточность |
| ТРУЗИ | трансректальное ультразвуковое исследование |
| ТТП | тромботическая тромбоцитопеническая пурпура |
| тХПН | терминальная стадия хронической почечной недостаточности |
| ФГДС | фиброгастродуоденоскопия |
| ЦНС | центральная нервная система |
| АDАМТS 13 | a disintegrin and metalloproteinase with a thrombospondin type 1 motif, member 13 |
| CFB | фактор B |
| CFH | фактор H |
| CFI | фактор I |
| Нb | гемоглобин |
| MCP | мембранный кофакторный протеин |
| STEC | shiga-toxin продуцирующая Esherihia Coli |
| THBD | тромбомодулин |
Пользователи протокола: нефролог, гематолог, гинеколог, невропатолог, гастроэнтеролог, кардиолог, реаниматолог, терапевт, педиатр, врач общей практики.
Категория пациентов: дети, взрослые.
Шкала уровня доказательности – таблица 3:
| A | Высококачественный мета-анализ, систематический обзор рандомизированных клинических исследований (РКИ) или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| B | Высококачественный (++) систематический обзор когортных исследований или исследований случай-контроль или Высококачественное (++) когортное исследование или исследования случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| C | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+), результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов |
Классификация
Классификация [1, 2]:
ТМА классифицируют на первичные и вторичные.
Первичные ТМА включают в себя:
1. Гемолитико-уремический синдром (ГУС);
2. Тромботическую тромбоцитопеническую пурпуру (ТТП).
ГУС подразделяют на:
1. Инфекционно-опосредованный, который, в свою очередь, классифицируют на:
- Типичный ГУС (STEC-ГУС по современной классификации), вызванный шига-токсин продуцирующими бактериями - энтерогеморрагической Е. coli (штамм О 157:Н7 и другие штаммы) и Shigella dysenteriae I типа;
- Steptococcus pneumonia-ассоциированный ГУС (SPA-ГУС) – ГУС, развитие которого обусловлено воздействием штаммов пневмококка, продуцирующих нейраминидазу;
аГУС может быть обусловлен генетическими дефектами системы комплемента или приобретённой аутоиммунной патологией:
1. Мутациями генов регуляторных белков и компонентов комплемента CFH (фактор H), MCP (мембранный кофакторный протеин), CFI (фактор I), THBD (тромбомодулин), CFB (фактор B), и C3;
2. Антителами к CFH.
аГУС также подразделяют на:
- семейный;
- спорадический.
Таблица 4. Мутации в генах комплемента при аГУС представлены в таблице [3]
| Мутации, обуславливающие дефекты в системе комплемента при аГУС | |||
| Поврежденный протеин | Ген | Механизм неконтролируемой активации комплемента | Частота, % |
| Фактор Н | CFH | Нарушено связывание с эндотелием, снижена активация С3b | 20-30 |
| Фактор HR1, R3 | СFHR1/3 | Появление анти-CFH антител | 6 |
| Мембранный кофакторный протеин | MCP (CD46) | Нарушена экспрессия на поверхности клеток, что снижает их защиту | 6 |
| Фактор I | CFI | Не функционирует как основной кофактор для остальных ингибиторов комплемента | 4-10 |
| Фактор B | CFB | Стабилизирует и активирует С3 конвертазу | 1-2 |
| Компонент С3 | C3 | Резистентный к инактивации С3 | 5-10 |
| Тромбомодулин | THBD | Снижение инактивации С3 | 5 |
| Мутация не идентифирована | Не идентифицирован | Не идентифицирован | 30-50 |
Таблица 5. Прогноз при аГУС в зависимости от вида мутаций в генах комплемента [2]
| Ген | Риск смерти или терминальной почечной недостаточности (ТПН) в момент острого эпизода или через год от дебюта | Риск рецидива | Риск смерти или ТПН через 3-5 лет от начала болезни | Риск рецидива после трансплантации почки |
| CFH | 50-70% | 50% | 75% | 75-90% |
| CFI | 50% | 10-30% | 50-60% | 45-80% |
| MCP | 0-6% | 70-90% | 6-38% | <20% |
| С3 | 60% | 50% | 75% | 40-70% |
| CFВ | 50% | 3/3 без ТПН | 75% | 100% |
| THBD | 50% | 30% | 54% | 1 больной |
| Анти-CFH-АТ | 30-40% | 40-60% | 35-60% | Выше у больных с высоким уровнем |
Развитие вторичных вариантов ТМА обусловлено следующими заболеваниями или состояниями:
1. Беременность и роды:
1.1 преэклампсия, эклампсия,
1.2 HELLP-синдром;
2. Аутоиммунные заболевания:
2.1 системная красная волчанка (СКВ),
2.2 системная склеродермия,
2.3 антифосфолипидный синдром (АФС): первичный, вторичный;
3. Злокачественные новообразования;
4. Инфекционные заболевания:
4.1 ВИЧ,
4.2 грипп H1N1;
5. Другие заболевания:
5.1 злокачественная артериальная гипертензия,
5.2 гломерулопатии;
6. Лекарственно-обусловленная ТМА, развитие которой наблюдается при терапии следующими лекарственными препаратами: хинин, интерфероны, ингибиторы кальциневрина (циклоспорин, такролимус), ингибиторы mTOR (сиролимус, эверолимус), противоопухолевые препараты (цисплатин, гемцитабин, митомицин, ингибиторы VEGF и тирозинкиназы: бевацизумаб, сунитиниб, сорафениб), оральные контрацептивы, валацикловир, клопидогрель, тиклопидин;
7. Ионизирующее излучение;
8. Трансплантация солидных органов и костного мозга.
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ [1, 2, 4, 9, 14]:
Диагностические критерии
Алгоритм диагностики STEC-ГУС/аГУС включает первоначальное установление факта наличия ТМА, с дальнейшим проведением дифференциальной диагностики между первичными и вторичными вариантами ТМА. В свою очередь, первичные варианты ТМА требуют проведения дифференциальной диагностики между STEC-ГУС, аГУС и ТТП.
Диагноз аГУС является диагнозом исключения и требует первоначального исключения других первичных и вторичных ТМА.
Жалобы:
При обследовании пациентов с подозрением на STEC-ГУС/аГУС следует обратить внимание на наличие следующих жалоб:
- тошнота, рвота, боли в животе, изменение характера стула (частый жидкий стул, иногда геморрагического характера);
- периферические и полостные отеки, уменьшение объема выделяемой мочи или отсутствие мочи, изменение цвета мочи;
- одышка;
- геморрагические высыпания на коже;
- головные боли, нарушение зрения разной выраженности (вплоть до полной слепоты);
- слабость, вялость, быстрая утомляемость, отсутствие аппетита, головокружение;
- психомоторное возбуждение или заторможенность, фокальные или генерализованные судороги, парез.
Анамнез:
Тщательный опрос, направленный на выявление наследственной предрасположенности и возможных триггеров острой ТМА (перенесенные инфекционные заболевания, в первую очередь, дыхательных путей и желудочно-кишечного тракта, акушерская патология, наличие системных и онкологических заболеваний, прием лекарственных препаратов, проведение вакцинации, состояние после трансплантации солидных органов и костного мозга). Обратить внимание, отмечались ли такие же эпизоды ранее в анамнезе и/или были ли случаи ТМА в семье (установленный диагноз заболевания у одного из родственников или наличие следующих вариантов - внезапная смерть родственника по неизвестной причине; нахождение родственника на заместительной почечной терапии в связи с развитием терминальной почечной недостаточности неясного генеза).
Физикальное обследование:
- оценка степени гидратации организма (жажда, степень влажности кожи, слизистых и языка, одышка, наличие отеков; потеря или прибавка массы тела; уровень ЦВД, АД, напряжение пульса, диурез);
- цвет кожи, слизистых оболочек, наличие высыпаний;
- термометрия;
- оценка состояния центральной нервной системы;
- оценка состояния легких;
- оценка сердечно-сосудистой системы (ЦВД, АД, ЧСС, напряжение пульса, пульсация на крупных сосудах, аускультативные данные, определение границ сердца);
- глазное дно;
- наличие гепатоспленомегалии;
- оценка диуреза (олигурия, анурия, полиурия, никтурия).
Продромальная фаза:
- общая слабость, немотивированная утомляемость, возможно повышение температуры тела, гриппоподобный синдром;
- диарея и/или тошнота и рвота, и/или боли в животе, и/или гастроэнтерит (диарея у 90–95% пациентов с STEC-ГУС, в 23-30% случаев при аГУС);
- через 1–2 дня в 70% случаев STEC-ГУС развивается гемоколит.
Период развернутой клинической картины:
- через 2-14 дней от начала заболевания ухудшается общее самочувствие, усиливаются слабость, вялость, снижается аппетит, появляется резкая бледность и/или иктеричность кожных покровов, пастозность периорбитальной области, лица и голеней;
- возможно появление петехиальной сыпи, экхимозов, носовых и желудочно-кишечных кровотечений;
- артериальная гипертензия, плохо поддающаяся гипотензивной терапии;
- при развитии ОПП наблюдается олиго/анурия;
- при сохраненном диурезе отмечается протеинурия, иногда массивная, вплоть до развития нефротического синдрома с анасаркой и выпотом в полостях (гидроторакс, гидроперикард, асцит). Возможно появление гематурии (микрогематурия/макрогематурия);
- возможно поражение ЦНС разной степени выраженности (вялость или психомоторное возбуждение, фокальные или генерализованные судороги, сопор, кома, корковая слепота, гемипарез, децеребрация с вовлечением ствола мозга);
- при развитии ТМА миокарда развивается дилатационная кардиомиопатия с признаками острой сердечной недостаточности. Около 3% пациентов с интрамиокардиальной ТМА демонстрируют развитие острого инфаркта миокарда с высоким риском внезапной смерти;
- легочная ТМА может стать причиной развития геморрагического альвеолита или острого респираторного дистресс-синдрома;
- нередко отмечается острый панкреатит вплоть до развития панкреонекроза;
- редким проявлением аГУС является поражение кожи с развитием обширных некротических очагов. Встречается также дигитальная ишемическая гангрена;
- примерно у 5% пациентов отмечается полиорганная недостаточность, связанная с диффузной ТМА с поражением ЦНС, ишемией миокарда, легочным кровотечением и дыхательной недостаточностью, панкреатитом, печеночным цитолитическим синдромом, желудочно-кишечным кровотечением.
Лабораторные исследования:
- общий анализ крови (анемия (МАГА – микроангиопатическая Кумбс-негативная гемолитическая анемия), тромбоцитопения (менее <150 × 109/л или снижение числа тромбоцитов более чем на 25% от исходного уровня), ретикулоцитоз (в редких случаях возможно развитие МАГА без тромбоцитопении));
- мазок периферической крови (наличие шизоцитоза (число шизоцитов в мазке периферической крови выше 0,1 %));
- биохимический анализ крови (повышенный уровень лактатдегидрогеназы (ЛДГ) и/или сниженный уровень гаптоглобина, гипербилирубинемия за счет непрямой фракции, при развитии острого повреждения почек повышение уровня креатинина, мочевины, электролитные нарушения (гиперкалиемия, гипонатриемия, гипокальциемия, гиперфосфатемия), гиперурикемия, при развитии нефротического синдрома гипопротеинемия, гипоальбуминемия, гипер-α2-глобулинемия, гиперхолестеринемия, гипертриглицеридемия);
- общий анализ мочи (протеинурия, возможно микро/макрогематурия);
- антиглобулиновый тест (отрицательная реакция Кумбса);
- оценка компонентов системы комплемента: сниженный показатель С3 при нормальном уровне С4 в крови отмечается не более чем у 50% пациентов с аГУС. Следовательно, нормальный уровень С3 не исключает диагноза аГУС. У пациентов с STEC-ГУС может наблюдаться снижение содержания С3 в крови, аналогично любой другой инфекции, а уровень С4 остается в пределах нормы.
Скрининг на STEC-инфекцию требуется проводить всем пациентам с признаками поражения ЖКТ.
Лабораторные исследования следует выполнить в первые сутки госпитализации пациента в стационар и до начала проведения антибактериальной терапии. Скрининг на STEC-ГУС включает в себя:
- посев кала для выявления культуры STEC (на среду MacConkey для E. coli O157:H7);
- определение шига-токсина в кале или ректальном мазке методом ПЦР;
- определение шига-токсина в сыворотке крови;
- определение в сыворотке крови АТ к липополисахариду наиболее распространенного в данном регионе серотипа E. coli.
Отрицательные результаты лабораторных исследований в рамках скрининга на STEC-ГУС считаются достоверными только при заборе материала до начала антибактериальной терапии.
Всем пациентам с клинико-лабораторными признаками ТМА необходимо определение активности ADAMTS-13 с целью исключения ТТП. Определение активности показателя выполняют до начала плазмотерапии (ПТ). При ТТП наблюдается снижение ADAMTS-13 до 5% и менее. У пациентов с STEC-ГУС, аГУС и вторичными формами ТМА уровень ADAMTS-13 всегда выше 10%. Следует учитывать, что снижение ADAMTS-13 может наблюдаться также при системных заболеваниях (СКВ, катастрофический АФС), ДВС-синдроме, септических состояниях.
В случаях отсутствия условий незамедлительного определения активности показателя ADAMTS-13 у пациента с тяжелым течением ТМА, следует учитывать положение, в соответствии с которым уровень креатинина сыворотки>150–200 мкмоль/л в сочетании с числом тромбоцитов > 30 000/1 мкл практически исключают диагноз ТТП и тяжелый дефицит ADAMTS13 [4].
Определение активности ADAMTS-13 проводится в специализированной лаборатории.
Инструментальные исследования:
- ЭКГ. Нарушения ритма и сердечной проводимости.
- УЗИ почек. Контуры почек сохранены на всем протяжении, ровные, четкие. Структуры дифференцированы. Пирамиды несколько увеличены в размерах, гипоэхогенные. Эхогенность кортикального слоя паренхимы повышена.
- Ультразвуковое дуплексное допплеровское сканирование сосудов почек. При проведении дупплексного допплеровского сканирования (ДДС) определяется резкое обеднение интраренального сосудистого рисунка, кровоток сохранен только в магистральных, сегментарных и иногда в единичных интерлобарных сосудах. Также отмечается резкое повышение резистивных характеристик артериального кровотока. При развитии кортикального некроза у основания пирамид на границе кортикального и медуллярного слоев паренхимы появляется неширокая (до 2-3 мм) зона повышенной эхогенности. При ДДС сосудистый рисунок в проекции кортикального слоя паренхимы не определяется.
- ЭхоКГ. При любой форме ГУС могут быть выявлены признаки гидроперикарда, артериальной гипертензии и специфических поражений, обусловленных тромбозами мелких и интрамиокардиальных сосудов при ТМА. Пациенты с аГУС, имеющие мутации CFH/CFB/С3, антиCFH-антитела подвержены риску развития сердечно-сосудистых осложнений.
- Рентгенография органов грудной клетки: скопление жидкости в плевральных полостях, отек легких.
- Осмотр глазного дна. При ТМА может развиться одностороннее или билатеральное повреждение органа зрения с отеком диска зрительного нерва, интраретинальными кровоизлияниями, мягкими ватообразными экссудатами, макулярным отеком. У пациентов с аГУС также могут быть обнаружены серозные ретинальные повреждения, витреальные и хориоидальные кровоизлияния, неоваскуляризация, оптическая атрофия, офтальмоплегия.
Показания для консультации специалистов:
- консультация ревматолога – при наличии признаков системного заболевания;
- консультация гематолога – для исключения болезней крови;
- консультация реаниматолога – ОПП, шок, другие неотложные состояния;
- консультация нефролога – ОПП, решение вопроса об экстракорпоральных методах очищения крови;
- консультация акушер-гинеколога – у беременных; при подозрении на гинекологическую патологию
- консультация офтальмолога – для оценки изменений глазного дна;
- консультация кардиолога – в случае тяжелой артериальной гипертензии, при наличии острых осложнений со стороны сердечно-сосудистой системы, при декомпенсации сердечно-сосудистых заболеваний;
- консультация невролога – при наличии неврологической симптоматики;
- консультация инфекциониста – при наличии инфекционных заболеваний;
- консультация клинического фармаколога – для коррекции дозировки и комбинации лекарственных средств, с учетом клиренса креатинина, при назначении лекарственных средств с узким терапевтическим индексом.
- консультация других узких специалистов – по показаниям.
Диагностический алгоритм (схема:)
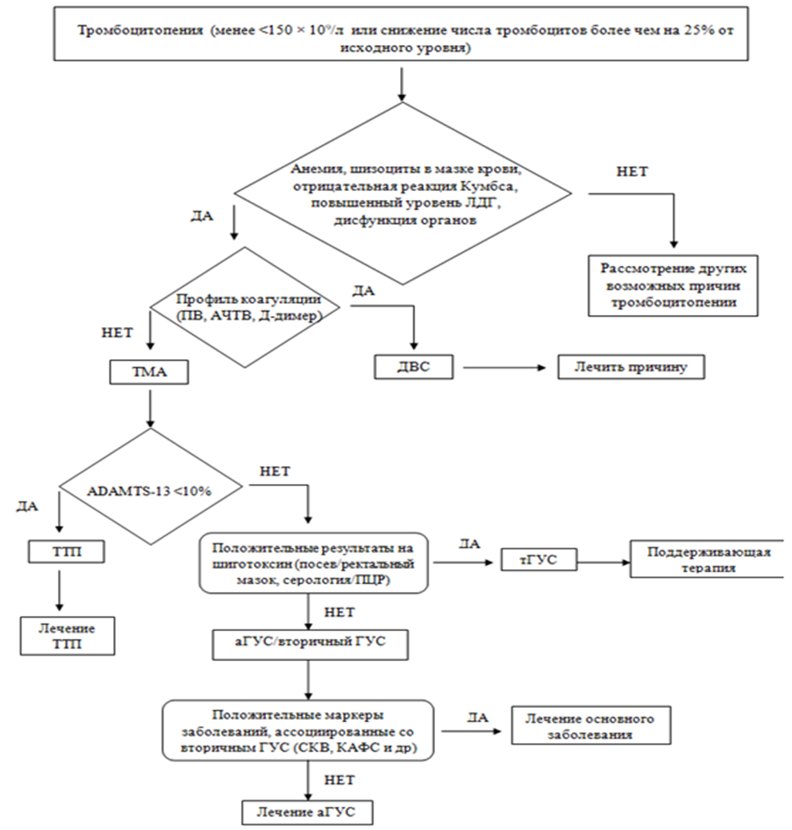
Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований [2, 5-8]:
Таблица 6. Дифференциальная диагностика ТМА [2]:
| Диагноз | Обоснование для дифференциальной диагностики | Обследования | Критерии исключения диагноза |
| Типичный ГУС | ТМА |
|
|
| аГУС | ТМА |
|
диагноз аГУС является диагнозом исключения; выявление других первичных и вторичных ТМА исключает аГУС |
| Наследственная или приобретенная ТТП | ТМА | определение активности ADAMTS-13, уровня антител к ADAMTS-13 | степень активности ADAMTS-13≥10%, отсутствие антител к ADAMTS-13 |
| Steptococcus pneumonia -ассоциированный ГУС (исключить у детей в возрасте до 5 лет) |
ТМА |
|
|
| Аутоиммунные заболевания (системная красная волчанка, антифосфолипидный синдром) |
Вторичный вариант ТМА |
анти-ДНК-антитела, антинуклеарные антитела, антикардиолипиновые антитела, анти-β2-ГП1-антитела, волчаночный антикоагулянт | отрицательные маркеры заболеваний, ассоциированных со вторичным ГУС |
| Метилмалоновая ацидурия (исключить у детей в возрасте до 6 месяцев) |
Вторичный вариант ТМА |
КОС, биохимический анализ крови, определение органических кислот, определение аминокислот в плазме, проведение молекулярно-генетического исследования с целью выявления мутаций в генах MUT, MMAA, MMAB, MCEE | отсутствие тяжелого метаболического ацидоза, кетоза, гиперглицинемии, гипераммониемии, гиперурикемии, гипергомоцистеинемии, гипогликемии/гипергликемии, повышения в крови уровня пропионилкарнитина, в некоторых случаях метилмалонилкарнитина и снижения содержания свободного карнитина, в моче отсутствие повышения концентрации метилмалоновой кислоты, 3-гидроксипропионовой, 3-гидрокси-n-валериановой, метиллимонной кислоты, гомоцистина, отсутствие мутации генов MUT, MMAA, MMAВ, ММАСНС, ММАDHC, MCEE |
|
ТМА в акушерской практике: Исключить “неакушерские” ТМА (ТТП, аГУС); Исключить ТМА, ассоциированные с беременностью (преэклампсия, HELLP-синдром) |
ТМА |
срок гестации на момент развития ТМА, ферменты печени, определение активности ADAMTS-13, оценка активности/динамики ТМА после родоразрешения |
см. таблицу 7 |
| ВИЧ | Вторичный вариант ТМА | иммунный блоттинг на ВИЧ-инфекцию | отрицательные результаты иммунного блоттинга на ВИЧ-инфекцию |
| ТМА на фоне злокачественных новообразований, химиотерапии (митомицин, блеомицин, цисплатин, ингибиторы VEGF), трансплантации, приема лекарственных препаратов (оральные контрацептивы, ингибиторы кальцийнейрина, тиклопидин, клопидогрель, интерферон, хинин) | Вторичные варианты ТМА |
сбор подробного анамнеза, в т.ч. с включением информации об употребляемых лекарственных препаратах; онкологический скрининг; |
отрицательные результаты диагностического поиска причин вторичных вариантов ТМА |
Таблица 7. Дифференциальная диагностика при ТМА в акушерской практике [5-8]:
| Преэклампсия | HELLP-синдром | ОЖГБ | ТТП | аГУС | |
| срок гестации на момент развития ТМА |
после 20 нед. |
после 20 нед. | III тр. | II-III тр. | После родов – 79% |
| Артериальная гипертензия | 100% | 80% | 25-50% | редко | 80-100% |
| Поражение ЦНС | нет | Нет | нет | да | ~50% |
| ОПП | 1% | 3-15% | 20-100% | 30-80% | 100% |
| Гемолитическая анемия | -/+ | +/++ | -/+ | ++/+++ | ++/+++ |
| Тромбоцитопения | -/+ | ++ | -/+ | ++/+++ | +/++ |
| Повышение АЛТ, АСТ | -/+ | ++ | +++ | -/+ | -/+ |
| Степень активности ADAMTS-13 | м.б. снижен | м.б. снижен | в норме | <5% | м.б. снижен |
| Редукция после родоразрешения | 2-3 дня | 1 нед | 1-2 дня | нет | нет |
Таблица 8. Обоснование дополнительных исследований
| Исследование | Обоснование |
| сывороточное железо, ферритин |
маркеры гемолиза; дифференциальная диагностика анемий; |
| ТВ, ПВ, МНО, АЧТВ, фибриноген, РКФМ, Д-димер, антитромбин III, протеин С, протеин S; | оценка профиля коагуляции; исключение синдрома диссеминированного внутрисосудистого свертывания (ДВС); исключение противопоказаний к антикоагулянтной терапии; |
|
С-реактивный белок (количественный анализ); прокальцитонин; пресепсин |
рекомендуется пациентам, имеющим признаки септического состояния, развития синдрома системной воспалительной реакции, синдрома полиорганной недостаточности; при симптомах тяжелых инфекционных, гнойно-воспалительных процессов различной локализации; при подозрении на развитие генерализованной бактериальной инфекции; при подозрении на присоединение вторичной бактериальной инфекции у пациентов с вирусными инфекциями, аллергическими, аутоиммунными заболеваниями; при назначении и мониторировании антибактериальной терапии |
| Кислотно-основное состояние крови | с целью диагностики нарушений кислотно-основного состояния крови, контроля показателей в динамике; |
|
ревматоидный фактор, антинуклеарные антитела (ANA), антитела к экстрагируемым ядерным антигенам (ENA), антинуклеарный фактор (АНФ) на культуре Hep2, антитела к двухспиральной ДНК (anti-dsDNA), антинейтрофильные цитоплазматические антитела (ANCA), антифосфолипидные антитела, волчаночный антикоагулянт, антитела к циклическому цитруллиновому пептиду |
cкрининг аутоиммунной патологии; |
| фракции комплемента С3, С4, СН50 |
скрининг на выявление дефектов системы комплемента; определение общей гемолитической способности комплемента (СН50) применяется для оценки эффективности блокады комплемента в случае неэффективности терапии Экулизумабом; Равулизумабом*; |
| паратиреоидный гормон | исключение минерально-костных нарушений; оценка показателя входит в дифференциальную диагностику между ОПП и ХБП; |
| мочевая кислота | гиперурикемия может наблюдаться как при ОПП, ХБП, так и при неопластических заболеваниях кроветворной и лимфатической систем; |
|
креатинфосфокиназа (КФК); МВ-изофермент креатинфосфокиназы (КФК-МВ); сердечные тропонины: I, T; |
скрининг повреждения клеток, обогащенных ферментом (сердечная мышца, скелетная мускулатура, головной мозг, щитовидная железа, легкие); диагностика поражения сердца при ТМА |
| липаза, амилаза | у всех пациентов с признаками дисфункции ЖКТ, независимо от формы ТМА, возможно поражение поджелудочной железы |
| определение активности факторов XI, X, IX, VIII, VII, V в сыворотке крови | рекомендуется пациентам с тромбоэмболией легочной артерии, инфарктом миокарда, геморрагическим инсультом и тромбозами другой локализации с целью исключения тромбофилии |
| гомоцистеин, витамин В12 и фолиевая кислота | при подозрении на дефицит кобаламина С |
| свободный гемоглобин в крови и в моче | маркеры гемолиза |
|
суточная альбуминурия/протеинурия или отношение альбумин/креатинин, протеин/креатинин; анализ мочи по Зимницкому; анализ мочи по Нечипоренко; проба Реберга; |
оценка функционального состояния почек |
| диагностика вирусных инфекций методом ПЦР, ИФА (вирус гриппа А, В, C, аденовирус, вируса Эпштейна-Барр, цитомегаловирус, энтеровирус, ротавирус, реовирус, астровирус, вируса Норволк) |
диагностика вирусных диарей рекомендуется пациентам с признаками поражения желудочно-кишечного тракта без диареи / с диареей, пациентам с катаральным синдромом без диареи / с диареей для диагностики комплемент-активирующего состояния при аГУС |
|
обнаружение пневмококка в биологических жидкостях (кровь, плевральный экссудат, спинномозговая жидкость) методом ПЦР; микробиологический посев крови на стерильность |
рекомендовано у пациентов с ТМА и поражением лёгких/развитием менингита, сепсиса для исключения/подтверждения SPA-ГУС; |
Панель генов, мутации которых ассоциированы с аГУС:
|
При аГУС рекомендовано проведение молекулярно-генетического исследования методом секвенирования нового поколения (NGS) и секвенирования по Сэнгеру для идентификации генетических мутаций, ассоциированных с развитием аГУС. Следует учитывать, что проведение генетического исследования не является обязательным для установления диагноза аГУС и для выбора тактики терапии. Проведение генетического исследования является целесообразным перед трансплантацией почки для определения риска рецидива заболевания и прогноза выживаемости почечного трансплантата, а также при развитии ГУС de novo после трансплантации и семейных случаях аГУС. |
|
Ауто-CFН-антитела |
Для исключения аГУС, развитие которого обусловлено антителами, рекомендуется исследование анти-CFH, особенно у детей, подростков и молодых взрослых. Необходимо подчеркнуть, что ауто-CFН-антитела, как правило, выявляются при наличии делеции релэйт-факторов CFHR1, CFHR3. |
| УЗИ брюшной полости, почек | рекомендуется всем пациентам с ТМА с целью скрининговой диагностики поражения полых и паренхиматозных органов; |
| УЗИ органов малого таза; ТРУЗИ | исключение новообразования при подозрении на неопластический процесс; |
| УЗИ плевральных полостей | определение объема плеврального выпота |
| УЗДГ сосудов почек | с целью диагностики патологических изменений |
| Электроэенцефалография | рекомендована при наличии неврологической симптоматики |
| ФГДС | исключение эрозивно-язвенного поражения желудочно-кишечного тракта ввиду высокого риска желудочно-кишечного кровотечения при использовании антикоагулянтов; исключение новообразования при подозрении на неопластический процесс; |
| Колоноскопия | исключение новообразования при подозрении на неопластический процесс; |
| КТ грудного сегмента, абдоминального сегмента, органов малого таза | при подозрении на системное заболевание с полиорганным поражением, при подозрении на неопластическую процесс |
| МРТ абдоминального сегмента, органов малого таза | при подозрении на системное заболевание с полиорганным поражением, при подозрении на неопластическую процесс |
| МРТ или КТ головного мозга | рекомендовано всем пациентам с признаками поражения центральной нервной системы при любой форме ТМА с целью оценки степени изменений в структуре мозга, состояния и проходимости сосудов головного мозга; |
| Пункционная биопсия почки |
Проведение биопсии почки не является обязательным для диагностики ТМА. Биопсия почки целесообразна для верификации диагноза в следующих случаях:
|
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМЭТАПЕ [1, 2, 4, 9, 14]:
Немедикаментозное лечение:
- соблюдение режима (устранение переохлаждений, стрессов, интенсивных физических нагрузок);
- соблюдение диеты, исключение погрешностей в питании; персонифицированный выбор стола должен быть основан на превалирующей клинической картине у каждого отдельного пациента;
- соблюдение правил предотвращения контаминации STEC.
Медикаментозное лечение: нет.
Хирургическое вмешательство: нет.
Дальнейшее ведение:
Пациенты с STEC-ГУС:
- Длительность динамического наблюдения после перенесенного STEC-ГУС должна составлять не менее 5 лет и зависит от тяжести перенесенного STEC-ГУС, наличия протеинурии, артериальной гипертензии и уровня скорости клубочковой фильтрации. Дважды в год рекомендуется проводить мониторинг общего анализа крови с тромбоцитами и контроль почечных функций (креатинин, оценка скорости клубочковой фильтрации). При достижении ХПН требуется проведение ее посиндромной терапии и решение вопроса о своевременном начале заместительной почечной терапии. Повторные госпитализации показаны в основном при прогрессировании почечной недостаточности.
Пациентыс аГУС:
- Ведение пациентов с аГУС осуществляется нефрологом.
- При стабильном состоянии пациента и хорошей переносимости Экулизумаба/Равулизумаба* плановое введение препарата может осуществляться в условиях дневного стационара.
- При рецидиве ТМА (анемия, тромбоцитопения, ухудшение почечных функций и появление признаков экстраренального поражения) показана незамедлительная госпитализация в стационар.
- Следующие лабораторные показатели следует мониторировать с частотой 1 раз в месяц, по мере достижения стабильной ремиссии - 1 раз в 3 мес., через 1 год - 1 раз в 6 месяцев:
- Общий анализ крови
- Биохимический анализ крови (креатинин, мочевая кислота, альбумин, ЛДГ)
- Оценка скорости клубочковой фильтрации
- Общий анализ мочи
- суточная альбуминурия/протеинурия или отношение альбумин/креатинин, протеин/креатинин;
- Наблюдение пациентов, получающих лечение Экулизумабом/Равулизумабом*, проводится 1 раз в месяц:
- Общий анализ крови
- Биохимический анализ крови (креатинин, ЛДГ)
- Оценка скорости клубочковой фильтрации
- Общий анализ мочи
- Контроль АД
- Мониторинг сопутствующих заболеваний при необходимости.
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ ЭТАПЕ [1, 2, 4, 9, 12, 14]:
Карта наблюдения пациента, маршрутизация пациента: нет.
ЛЕЧЕНИЕ STEC-ГУС
Цели лечения:
- купирование клинико-лабораторных проявлений ТМА;
- максимально возможное восстановление функции пораженных органов (в том числе предупреждение развития терминальной стадии почечной недостаточности).
Немедикаментозное лечение:
Режим: в зависимости от тяжести состояния пациента.
Диета: ограничение поваренной соли и жидкости (объём получаемой жидкости рассчитывают с учётом диуреза за предыдущий день + 300 мл) при достаточном калораже и содержании витаминов. При наличии отеков, особенно в период их нарастания, содержание поваренной соли в пище ограничивается до 0,2-0,3 г в сутки. Количество калорий и белка должно составить 100% от рекомендованной суточной потребности. Необходимость в парентеральном питании возникает в случае продолжающейся рвоты и/или диареи.
Медикаментозное лечение:
Всем пациентам с STEC-ГУС рекомендована коррекция нижеописанных состояний или проведение превентивных мер при отсутствии формирования последних:
1.гемодинамических нарушений; волемических расстройств; анемии; артериальной гипертензии; электролитного баланса; КОС;
2.профилактика нарушений нутриционного статуса;
3.профилактика и терапия гипоксически-ишемических поражений, в том числе головного мозга, профилактика судорожного синдрома.
Рекомендовано проведение антибактериальной терапии у пациентов с STEC-ГУС, проявляющимся в том числе ОПП, требующим проведения заместительной почечной терапии (ЗПТ), а также при наличии системной воспалительной реакции с признаками септического шока
Проведение плазмотерапии (ПТ) в режиме трансфузий свежезамороженной плазмы (СЗП) рекомендовано всем детям с тяжелым течением STEC-ГУС.
- При тяжелом течении STEC-ГУС наряду с МАГА, тромбоцитопенией и ОПП наблюдается анурия продолжительностью более суток или триада симптомов (МАГА, тромбоцитопения и ОПП) в сочетании с анурией, артериальной гипертензией и/или судорожным синдромом.
- Донорская СЗП в своем составе имеет полноценно функционирующие факторы системы свертывания, что коррегирует дефицит в системе гемостаза, а также компоненты фибринолитической системы.
- Рекомендуемый объем трансфузии СЗП составляет 10–40 мл/кг/сут. Выбор объема СЗП зависит от состояния сердечно-легочной деятельности.
Плазмообмен (ПО):
- Детям ПО проводят с объемом эксфузии 60-75 мл/кг/с с замещением адекватным объемом СЗП (1,5 ОЦП). Частота и продолжительность ПТ зависит от ее эффективности.
- ПО продолжают до стабильной нормализации числа тромбоцитов и прекращения гемолиза в течение не менее 2-3х дней (оценка проводится на основании ЛДГ).
Абсолютными противопоказаниями к ПО являются(независимо от возрастной категории)
:
- нестабильные гемодинамические показатели;
- сердечная недостаточность в стадии декомпенсации;
- инфузия симпатомиметиков в массивной дозе (допамин более 20мкг/кг/мин), инфузия вазопрессоров (норадреналин, адреналин, вазопрессин);
- кровотечение любой локализации;
- церебральный инсульт в острой стадии;
- отек легких;
- выраженное язвенное поражение ЖКТ.
Относительными противопоказаниями к ПО служат (независимо от возрастной категории):
- период новорожденности;
- анемия при содержании эритроцитов менее 3,0х1012/л, гемоглобина менее 75-90 г/л;
- гипофибриногенемия (уровень фибриногена менее 2,0 г/л);
- гипопротеинемия (содержание общего белка в крови менее 55 г/л);
- некорригированная гиповолемия.
Возможные осложнения ПО:
- гипотензия (требующая инфузионной терапии);
- гипокальциемия;
- аллергические реакции;
- тяжелая анемия;
- внутрисосудистный тромбоз;
- обструкция центральных вен;
- тромбоз катетера;
- катетерные инфекции.
Пациентам с любой формой ТМА, течение которой не осложнилось кровотечением, проведение трансфузий тромбоконцентрата нецелесообразно и не рекомендовано.
Трансфузии тромбоконцентрата могут усугубить течение STEC-ГУС, индуцировав новые эпизоды тромбообразования в сосудах микроциркуляторного русла.
Пациентам с STEC-ГУС, имеющим анемию тяжелой степени (Нв менее 75г/л), необходимо проводить ее коррекцию.
В остром периоде STEC-ГУС для коррекции анемии следует проводить трансфузии эритроцитарной массы/отмытых эритроцитов в расчетной дозе 10-15мл/кг. В периоде разрешения STEC-ГУС при сохраняющейся анемии, которая не обусловлена гемолизом, а вызвана другими причинами, рекомендуется проводить терапию эритропоэз-стимулирующими агентами короткого действия из расчета 100-150 МЕ/кг, кратность и частота введения которых зависит от уровня гемоглобина.
Наличие артериальной гипертензии требует проведения антигипертензивной терапии. Коррекция артериального давления проводится согласно клиническому протоколу диагностики и лечения «Артериальная гипертензия у детей и подростков».
Перечень основных лекарственных средств (имеющих 100% вероятность применения): нет.
Перечень дополнительных лекарственных средств (менее 100% вероятности применения) – таблица 9:
| Фармакотерапевтическая группа | Международное непатентованное наименование ЛС | Способ применения | Уровень доказательности |
| Препараты, влияющие на кроветворение и кровь. Прочие стимуляторы гемопоэза. Эритропоэтин | Эпоэтин альфа | п/к или в/в | B |
| Эпоэтин бета | п/к или в/в | B | |
| Эпоэтин зета | п/к или в/в | B |
Заместительная почечная терапия
Пациентам с STEC-ГУС и поражением почек с развитием ОПП необходимо решение вопроса о целесообразности проведения ЗПТ и вида ЗПТ. Выбор модальности диализа основывается на тяжести клинического состояния, степени метаболических нарушений, наличии противопоказаний к определенному методу диализа, возрасте ребенка и антропометрических показателях (рост, вес).
- Перитонеальный диализ применяется при следующих состояниях:
- «изолированное» ОПП;
- выраженные нарушения со стороны ЦНС;
- высокий риск геморрагических осложнений;
- выраженная недостаточность кровообращения;
- невозможность формирования сосудистого доступа.
- Продленная веновенозная гемодиафильтрация (ПВВВГДФ) рекомендована пациентам c выраженной гипергидратацией, развитием отека легких, мозга, гиперазотемией и нестабильными гемодинамическими показателями.
- Гемодиализ является методом выбора при лечении пациентов с сохранной гемодинамикой, гиперазотемией, гипергидратацией и при наличии противопоказаний к другим методам ЗПТ.
Хирургическое лечение при STEC-ГУС
Оперативное вмешательство может потребоваться при следующих патологических состояниях:
- некроз и перфорация кишечника
- вторичный стеноз кишечника
- выпадение прямой кишки
- перитонит
- инвагинация
Трансплантация почки при STEC-ГУС
Риск развития возвратного STEC-ГУС после трансплантации почки минимален. Трансплантация почки рекомендуется пациентам с терминальной стадией ХБП в исходе STEC-ГУС. Перед решением вопроса о трансплантации почки рекомендуется проведение молекулярно-генетического исследования с целью исключения аГУС. При STEC-ГУС родственная трансплантация почки не противопоказана.
ЛЕЧЕНИЕ ВЗРОСЛЫХ ПАЦИЕНТОВ С аГУС
Цели лечения аГУС:
- ингибирование неконтролируемой активации системы комплемента
- купирование клинико-лабораторных проявлений ТМА
- максимально возможное восстановление функции пораженных органов (в том числе предупреждение развития терминальной стадии почечной недостаточности)
Немедикаментозное лечение
Режим: в зависимости от тяжести состояния пациента.
Диета: Специализированная энтеральная диета в соответствии с клиническими проявлениями и тяжестью ОПП при достаточном калораже и содержании витаминов. Парентеральное питание рекомендовано при непереносимости энтерального питания. Адекватное обеспечение белком и калориями в соответствии с потребностями, выраженностью ОПП и проводимым методом заместительной почечной терапии.
Медикаментозное лечение аГУС включает в себя:
- Плазмотерапию;
- Терапию ингибитором комплемента (Экулизумаб; Равулизумаб*);
- Эритропоэз-стимулирующие агенты;
- Трансфузии эритроцитарной массы;
- Антигипертензивные препараты;
- Антибактериальную и противовирусную терапии (по показаниям).
Требуется выявление триггеров аГУС с последующим назначением терапии для их подавления
Особое значение имеет своевременная диагностика инфекционных заболеваний, предшествующих манифестации аГУС, с проведением рациональной антибактериальной терапии.
У всех взрослых пациентов как с впервые установленным диагнозом ТМА, так и рецидивом аГУС, терапией первой линии является плазмотерапия
(*не зарегистрирован на территории Республики Казахстан).
- ПТ может проводиться в режимах ПО или трансфузии свежезамороженной плазмы (ИП). Пациентам с предполагаемым диагнозом аГУС рекомендуется проводить плазмотерапию в виде трансфузий свежезамороженной плазмы только в случае невозможности немедленного начала ПО или его недоступности.
- При вероятном диагнозе аГУС ПО предпочтительнее начинать в первые сутки от момента госпитализации в стационар. ПО позволяет элиминировать функционально неполноценные эндогенные ингибиторы комплемента и, возможно, антитела к фактору Н.
- Режим ИП подразумевает введение пациенту донорской СЗП, которая в своем составе имеет полноценно функционирующие регуляторные белки системы комплемента, что восполняет дисфунцию каскада комплемента пациента, а также подавляет процесс тромбообразования за счет содержания в ней антикоагулянтов, компонентов фибринолитической системы и других компонентов плазмы, обладающих протеолитической активностью в отношении сверхкрупных мультимеров ф.В.
- Режим ПО имеет преимущество перед ИП, поскольку позволяет вводить большие объемы СЗП без риска перегрузки объемом, развития гиперволемии и гипергидратации, соответственно.
- Трансфузии СЗП проводят в объеме 30-40 мл/кг в 1-й день, в последующие дни объем СЗП составляет 10-20 мл/кг. Выбор объема СЗП зависит от состояния сердечно-легочной деятельности.
- В начале терапии рекомендовано провести 5 ежедневных сеансов ПО с объемом эксфузии 40мл/кг/с, при необходимости 60-75 мл/кг/с с замещением рациональным и адекватным объемом СЗП (1-1,5 расчетного объема плазмы). Далее принимается решение о дальнейшей тактике ведения пациента на основании характера ответа на плазмотерапию. Если наблюдается ответ на терапию, определяемый как рост числа тромбоцитов и снижение ЛДГ, плазмотерапию следует продолжить в прежнем режиме, проводя по 5 сеансов ПО в течение следующих 2-х недель, а затем – по 3 сеанса в неделю еще в течение 2-х недель. Критериями эффективности плазмотерапии служат нормализация числа тромбоцитов и прекращение гемолиза, о чем свидетельствует нормализация ЛДГ. Продолжительность лечения СЗП не определена, однако показанием к прекращению плазмотерапии является нормальное количество тромбоцитов и уровень ЛДГ в течение 2-х дней подряд.
- Рекомендуется прекратить лечение СЗП и начать патогенетическую комплемент-блокирующую терапию Экулизумабом/Равулизумаб* пациентам с подтвержденным аГУС с отсутствием ответа на плазмотерапию после 5 процедур полнообъемного ПО или пациентам, демонстрирующим плазмозависимость.
Абсолютными противопоказаниями к ПО являются:
- нестабильные гемодинамические показатели;
- сердечная недостаточность в стадии декомпенсации;
- инфузия симпатомиметиков в массивной дозе (допамин более 20мкг/кг/мин), инфузия вазопрессоров (норадреналин, адреналин, вазопрессин);
- профузное кровотечение любой локализации;
- церебральный инсульт в острой стадии;
- отек легких;
- выраженное язвенное поражение ЖКТ.
Относительными противопоказаниями к ПО являются:
- анемия при уровне эритроцитов менее 3,0х1012/л, гемоглобина менее 75-90 г/л;
- гипофибриногенемия (уровень фибриногена менее 2,0 г/л);
- гипопротеинемия (содержание общего белка в крови менее 55 г/л);
- некорригированная гиповолемия.
Возможные осложнения ПО:
- гипотензия (требующая инфузионной терапии);
- гипокальциемия;
- аллергические реакции;
- тяжелая анемия;
- внутрисосудистый тромбоз;
- обструкция центральных вен;
- тромбоз катетера;
- катетерные инфекции.
Пациентам с аГУС без выраженной тромбоцитопении (число тромбоцитов менее 20×109/л), течение которого не осложнилось кровотечением, проведение трансфузий тромбоконцентрата нецелесообразно.
Трансфузии тромбоконцентрата могут усугубить течение ТМА у пациентов с аГУС, индуцировов новые эпизоды тромбообразования в сосудах микроциркуляторного русла.
Пациентам с аГУС, имеющим анемию тяжелой степени (Нв менее 75г/л), необходимо проводить ее коррекцию
В остром периоде аГУС для коррекции анемии следует проводить трансфузии эритроцитарной массы, в периоде разрешения аГУС при сохраняющейся анемии, которая не обусловлена гемолизом, а вызвана другими причинами, рекомендуется проводить терапию эритропоэз-стимулирующими агентами короткого действия, кратность и частота введения которых зависит от уровня гемоглобина.
Наличие артериальной гипертензии у пациентов с аГУС требует проведения антигипертензивной терапии. Коррекция артериального давления проводится согласно клиническому протоколу диагностики и лечения «Артериальная гипертензия».
Экулизумаб/Равулизумаб* – препараты группы комплемент-ингибирующих антител взрослым пациентам с аГУС рекомендовано назначать в следующих случаях:
- неэффективность плазмотерапии;
- плазмозависимость;
- развитие осложнений во время проведения ПТ;
- рецидивирующее течение заболевания;
- семейный характер заболевания.
Режим терапии Экулизумабом/Равализумабом:
- Принимая во внимание повышенный риск развития менингококковой инфекции на фоне терапии препаратом Экулизумаб/Равализумаб, пациенты с аГУС за 2 недели до начала патогенетического лечения вышеуказанным препаратом должны быть вакцинированы против менингококковой инфекции преимущественно четырех-валентной менингококковой вакциной против серотипов возбудителя A,C,Y и W135.
- При необходимости экстренного начала трапии Экулизумабом/Равулизумабом* и невозможности соблюдения двухнедельного интервала больного вакцинируют одновременно со стартом комплементблокирующей терапии и с профилактической целью назначают антибактериальные препараты на срок не менее 2 недель. Рекомендуется проводить антибиотикопрофилактику препаратами, проникающими через гематоэнцефалический барьер: ципрофлоксацином, пенициллином или амоксициллином.
- В случаях отсутствия возможности вакцинации против менингококковой инфекции в момент начала терапии Экулизумабом/Равулизумабом* антибиотикопрофилактика может быть продлена на срок до нескольких месяцев в зависимости от времени вакцинации.
- Взрослым пациентам с аГУС терапия препаратом Экулизумаб проводится в стандартных дозировках без учета массы тела. В индукционной фазе Экулизумаб вводится в дозе 900 мг в виде внутривенной инфузии с частотой один раз в неделю в течение первых 4-х недель терапии (в общем, всего 4 инфузии). На 5-ой неделе терапии проводится внутривенная инфузия препарата в дозе 1200 мг, через 2 недели после которой начинается поддерживающая фаза терапии. В этой фазе Экулизумаб водится внутривенно в дозе 1200 мг один раз в две недели [2, 10, 11].
- Рекомендуемый режим дозирования у взрослых пациентов с аГУС для Равулизумаба* основан на массе тела пациента. Пациентам с массой тела от 40-59 кг показана нагрузочная доза 2400 мг (поддерживающая доза 3000 мг), пациентам от 60-99 кг 2700 мг (поддерживающая доза 3300 мг), пациентам с массой тела 100кг и больше 3000 мг (3600 мг), и через 2 недели после введения нагрузочной дозы следует начинать прием поддерживающих доз 1 раз в 8 недель в зависимости от массы тела. Поддерживающая терапия проводится один раз в 8 недель. [18]
- Взрослым пациентам, переходящим с Экулизумаба на Равулизумаб*, вводят нагрузочную дозу Равлизумаба через 2 недели после последней инфузии поддерживающей дозы Экулизумаба (или через 1 неделю после последней инфузии начальной дозы экулизумаба), а через 2 недели после введения нагрузочной дозы вводят поддерживающую дозу Равализумаба один раз в 8 недель в зависимости от массы тела. [18]
- Рекомендуемая поддерживающая доза Равлизумаба с помощью системы для подкожного введения составляет 490 мг один раз в неделю для взрослых пациентов c аГУС с массой тела более 40 кг. Доза Равулизумаба* 490 мг доставляется с помощью 2 систем доставки на теле. Каждая система доставки на теле состоит из 1 инъектора на теле и 1 предварительно заполненного картриджа, содержащего 245 мг равулизумаба*. График подкожного введения доз может иногда изменяться на ± 1 день от запланированного дня дозы, но последующую дозу следует вводить в соответствии с первоначальным графиком. В случае пропуска или частичного введения дозы Равулизумаба* подкожно пациент должен немедленно связаться со своим лечащим врачом. [18]
- Проведение ПТ на фоне терапии Экулизумабом требует введения дополнительной дозы препарата в связи с возможным удалением последнего из циркуляции (см. таблицы 14).
Таблица 10. Равулизумаба* для внутривенного (в/в) введения Информация по по началу лечения – пациентов с аГУС
| Пациенты | Нагрузочная доза Равулизумаба* в зависимости от массы тела | Время приема первой поддерживающей дозы Равулизумаба* 490 мг через Систему доставки Равулизумаба* для подкожного введения |
| В настоящее время не проходит лечение Экулизумабом или Равулизумабом* |
В начале лечения |
через 2 недели после введения нагрузочной дозы Равулизумаба* в/в |
| В настоящее время получает лечение Экулизумабом | Во время следующей запланированной дозы экулизумаба | через 2 недели после введения нагрузочной дозы Равулизумаба* в/в |
| В настоящее время проводится лечение Равулизумабом* через Система доставки Равулизумаба* для подкожного введения | Не применимо | Через 1 неделю после последней поддерживающей дозы Равулизумабом* через Систему доставки Равулизумаба* для подкожного введения |
Только для взрослых пациентов с аГУС
Таблица 11. Система доставки Равулизумаба* для подкожного введения. Информация по началу лечения — взрослых пациентов с аГУС[18]
| Пациенты | Нагрузочная доза Равулизумаба* в зависимости от массы тела | Время приема первой поддерживающей дозы Равулизумаба* 490 мг через Систему доставки Равулизумаба* для подкожного введения |
| В настоящее время не проходит лечение Равулизумабом* или Экулизумабом |
В начале лечения |
через 2 недели после введения нагрузочной дозы Равулизумаба* (в/в) |
| В настоящее время получает лечение Экулизумабом | Во время следующей запланированной дозы экулизумаба | через 2 недели после введения нагрузочной дозы Равулизумаба* в/в |
| В настоящее время проводится лечение Равулизумабом* внутривенным (в/в) введением | Не применимо | Через 8 недель после последней поддерживающей дозы Равулизумаба* в/в |
Смотри выше информацию для нагрузочной дозы Равулизумаба* для внутривенного введения в зависимости от массы тела у пациентов с массой тела ≥ 40 кг.
Длительность терапии
- Продолжительность лечения Экулизумабом/Равулизумабом* точно не установлена. В настоящее время считается, что терапия должна продолжаться пожизненно [1, 2, 4, 9, 14]. Однако есть данные, указывающие на возможность прекращения терапии у больных группы низкого риска после достижения ремиссии. К группе низкого риска относятся следующие пациенты:
- с изолированной мутацией в гене MCP;
- с наличием антител к фактору Н, в динамике имеющие отрицательные результаты анализов на данные антитела в течение продолжительного времени, и без дополнительных мутаций генов-регуляторов системы комплемента.
- Лечение у пациентов категории среднего риска может быть прекращено через 1 год стойкой ремиссии. При возникновении признаков рецидива заболевания лечение должно немедленно возобновляться. К категории средневысокого риска относятся следующие пациенты:
- c изолированной мутацией в гене фактора I;
- со стабильно низким уровнем антител к фактору Н и без дополнительных мутаций генов-регуляторов системы комплемента;
- c мутациями неясного клинического значения;
- без идентифицированных мутаций в генах системы комплемента.
- Терапия у пациентов группы высокого риска проводится пожизненно. К данной категории относятся следующие пациенты:
- с рецидивами аГУС в анамнезе;
- c cемейной формой аГУС;
- с мутациями CFH или при наличии гибридного гена CFH/CFHR1;
-с мутациями генов C3 и CFB, усиливающими их функции.
Лечение Экулизумабом/Равулизумабом* одинаково эффективно при всех генетических вариантах и также у пациентов без идентифицированных мутаций
В случае неэффективности терапии Экулизумабом с целью оценки эффективности блокады комплемента рекомендовано определение общей гемолитической способности комплемента (СН50). Уровень СН50 более 10% является индикатором неполной блокады комплемента и может наблюдаться в следующих случаях: индивидуальная недостаточность дозы (чаще в педиатрической популяции, однако возможно и у очень крупных взрослых пациентов), экскреция Экулизумаба с мочой при наличии у пациента массивной протеинурии на фоне нефротического синдрома, наличие генетического варианта С5 компонента, что препятствует связи с ним Экулизумаба, образование антител к Экулизумабу.
Перечень основных лекарственных средств (имеющих 100% вероятность применения): нет.
Перечень дополнительных лекарственных средств (менее 100% вероятности применения) – таблица 12:
| Фармакотерапевтическая группа | Международное непатентованное наименование ЛС | Способ применения | Уровень доказательности |
| Иммунодепрессивное средство | Экулизумаб//Равулизумаб* | в/в | B |
| Препараты, влияющие на кроветворение и кровь. Прочие стимуляторы гемопоэза. Эритропоэтин | Эпоэтин альфа | п/к или в/в | B |
| Эпоэтин бета | п/к или в/в | B | |
| Эпоэтин зета | п/к или в/в | B |
Заместительная почечная терапия
- Всем пациентам с аГУС и поражением почек с развитием ОПП необходимо решение вопроса о целесообразности проведения ЗПТ (гемодиализ, продленная веновенозная гемодиафильтрация). Выбор модальности диализа основывается на тяжести клинического состояния, степени метаболических нарушений и наличии противопоказаний к определенному методу диализа.
ЛЕЧЕНИЕ ДЕТЕЙ с аГУС
Целесообразным является назначениеПТ всем детям как с впервые установленным диагнозом ТМА, таки вероятным аГУС
- ПТ может проводиться в режимах трансфузий свежезамороженной плазмы (ИП) или ПО.
- При вероятном диагнозе аГУС ПО предпочтительнее начинать в первые сутки от момента госпитализации в стационар.
- Режим ПО имеет преимущество перед ИП, поскольку позволяет вводить большие объемы СЗП без риска перегрузки объемом, развития гиперволемии и гипергидратации, соответственно.
- Трансфузии СЗП проводят в объеме 10-40 мл/кг/сут. Выбор объема СЗП зависит от состояния сердечно-легочной деятельности
- ПО проводят с объемом эксфузии 60-75 мл/кг/с с замещением адекватным объемом СЗП (1,5 ОЦП). Частота и продолжительность ПТ не установлена и зависит от ее эффективности
- Терапия аГУС может включать комбинацию режимов ИП и ПО.
- ПО продолжают до стабильной нормализации числа тромбоцитов и прекращения гемолиза в течение не менее 2-3х дней (оценка проводится на основании ЛДГ).
Абсолютными противопоказаниями к ПО у детей являются:
- нестабильные гемодинамические показатели;
- сердечная недостаточность в стадии декомпенсации;
- инфузия симпатомиметиков в массивной дозе (допамин более 20мкг/кг/мин);
- инфузия вазопрессоров (норадреналин, адреналин, вазопрессин);
- профузное кровотечение любой локализации;
- церебральный инсульт в острой стадии;
- отек легких;
- выраженное язвенное поражение ЖКТ.
Относительными противопоказаниями к ПО у детей являются:
- период новорожденности
- анемия при уровне эритроцитов менее 3,0х1012/л, гемоглобина менее 75-90 г/л;
- гипофибриногенемия (уровень фибриногена менее 2,0 г/л);
- гипопротеинемия (содержание общего белка в крови менее 55 г/л);
- некорригированная гиповолемия.
Возможные осложнения ПО:
- гипотензия (требующая инфузионной терапии);
- гипокальциемия;
- аллергические реакции;
- тяжелая анемия;
- внутрисосудистый тромбоз;
- обструкция центральных вен;
- тромбоз катетера;
- катетерные инфекции.
Пациентам аГУС без выраженной тромбоцитопении (число тромбоцитов менее 20×109/л), течение которого не осложнилось кровотечением, проведение трансфузий тромбоконцентрата нецелесообразно.
Трансфузии тромбоконцентрата могут усугубить течение ТМА у детей с аГУС, индуцировов новые эпизоды тромбообразования в сосудах микроциркуляторного русла.
Детям с аГУС, имеющим анемию тяжелой степени (Нв менее 75 г/л), необходимо проводить ее коррекцию
В остром периоде аГУС для коррекции анемии следует проводить трансфузии эритроцитарной массы в расчетной дозе 10-15мл/кг. В периоде разрешения аГУС при сохраняющейся анемии, которая не обусловлена гемолизом, а вызвана другими причинами, рекомендуется проводить терапию эритропоэз-стимулирующими агентами короткого действия из расчета 100-150 МЕ/кг, кратность и частота введения которых зависит от уровня гемоглобина.
Наличие артериальной гипертензии у пациентов с аГУС требует проведения антигипертензивной терапии. Коррекция артериального давления проводится согласно клиническому протоколу диагностики и лечения «Артериальная гипертензия у детей и подростков».
У детей с установленным диагнозом аГУС, семейном его характере, при течении аГУС с экстраренальными проявлениями препаратом выбора является Экулизумаб/Равулизумаб*.
Принимая во внимание повышенный риск развития менингита на фоне терапии препаратом Экулизумаб/Равулизумаб*, педиатрические пациенты с аГУС за 2 недели до начала патогенетического лечения вышеуказанным препаратом должны быть вакцинированы против менингококковой инфекции преимущественно четырех-валентной менингококковой вакциной против серотипов возбудителя A,C,Y и W135, а также конъюгированной вакциной против Haemophilus influenzae type b и вакциной против Streptococcus pneumoniae.
При отсутствии возможности соблюдения 2-недельного интервала после вакцинации и до начала терапии Экулизумабом/Равулизумабом*, наряду с вакцинацией требуется назначение профилактической антибактериальной терапии, начиная с первого дня введения препарата и до 14 дней после вакцинации против инфекций, вызывающих развитие менингита. В случае наличия противопоказаний к вакцинации профилактическая антибактериальная терапия должна проводится в течение всего периода введения препарата. Антибактериальные препараты для системного использования применяются в соответствии с клиническими потребностями пациента на основании персональных и/или локальных данных чувствительности микроорганизмов.
Для пациентов до 18 лет доза Экулизумаба рассчитывается на основании массы тела по схеме, представленной в таблице ниже.
Таблица 13. Режим дозирования и кратность введения препарата Экулизумаб у пациентов с аГУС младше 18 лет [2, 9, 10, 11].
| Масса тела пациента | Индукционная фаза лечения | Поддерживающая фаза лечения |
| 40 кг и более | 900 мг в неделю x 4 дозы | 1200 мг на 5 неделе; затем 1200 мг каждые 2 недели |
| 30 - 39 кг | 600 мг в неделю - 2 дозы | 900 мг на 3 неделе; затем 900 мг каждые 2 недели |
| 20 - 29 кг | 600 мг в неделю - 2 дозы | 600 мг на 3 неделе; затем 600 мг каждые 2 недели |
| 10 - 19 кг | 600 мг в неделю - 1 доза | 300 мг на 2 неделе; затем 300 мг каждые 2 недели |
| 5 - 9 кг | 300 мг в неделю - 1 доза | 300 мг на 2 неделе; затем 300 мг каждые 3 недели |
Проведение ПТ на фоне терапии Экулизумабом требует введения дополнительной дозы препарата в связи с возможным удалением последнего из циркуляции
Таблица 14. Режим дозирования и кратность введения дополнительной дозы Экулизумаба на фоне плазмотерапии [9, 10, 11].
| Метод плазменной процедуры | Предыдущая доза экулизумаба | Дополнительная доза Экулизумаба после каждого сеанса плазменной процедуры | Время введения дополнительной дозы Экулизумаба |
| Плазмаферез (ПФ) или плазмообмен (ПО) | 300 мг | 300 мг на каждый ПФ/ПО | В течение 60 мин после каждого ПФ/ПО |
| ≥600 мг | 600 мг на каждый ПФ/ПО | ||
| Трансфузии СЗП | ≥300 мг | 300 мг на каждую единицу СЗП | За 60 мин до вливания каждой единицы СЗП |
Для десткого возраста доза Равулизумаба* рассчитывается на основании массы тела по схеме, представленной в таблице ниже.
Рекомендуемый режим дозирования у детей в возрасте 1 месяц и старше с массой тела 5 кг и менее 40 кг, включает введение нагрузочной дозы с последующим введением поддерживающей дозы. Через 2 недели после введения нагрузочной дозы следует начинать прием поддерживающих доз 1 раз в 4 или 8 недель в зависимости от массы тела. Допускается периодическое изменение графика введения в пределах 7 дней от запланированного дня инфузии (за исключением первой поддерживающей дозы); [18]
Таблица 15. Режим дозирования Равулизумаба* по массе тела — пацента с аГУС [18]
| Показание | Диапазон массы тела (кг) | Нагрузочная доза (мг) | Поддерживающая доза (мг) и интервал введения | |
| аГУС | От 5 до менее 10 | 600 | 300 | Один раз в 4 недели |
| От 10 до менее 20 | 600 | 600 | ||
| От 20 до менее 30 | 900 | 2100 | Один раз в 8 недель | |
| От 30 до менее 40 | 1200 | 2700 | ||
Длительность терапии
Продолжительность лечения экулизумабом/равализумабом точно не установлена. В настоящее время считается, что терапия должна продолжаться пожизненно [1, 2, 4, 9, 14]. Лечение аГУС Равулизумабом должно продолжаться не менее 6 месяцев. Из-за гетерогенного характера явлений аГУС и специфических для пациента факторов риска продолжительность лечения после первых 6 месяцев должна подбираться индивидуально [18]. Однако в ряде случаев при достижении стойкой ремиссии длительностью не менее 2х лет возможна отмена терапии с систематическим мониторингом активности заболевания. При появлении симптомов рецидива терапия в незамедлительном порядке должно быть возобновлена.
- Есть данные, указывающие на возможность прекращения терапии у больных группы низкого риска после достижения ремиссии. К группе низкого риска относятся следующие пациенты:
- с изолированной мутацией в гене MCP,
- с наличием антител к фактору Н, в динамике имеющие отрицательные результаты анализов на данные антитела в течение продолжительного времени, и без дополнительных мутаций генов-регуляторов системы комплемента.
- При отмене препарата рецидив аГУС с большой долей вероятности может развиться у пациентов с мутациями CFH, C3, THBD. В связи с этим в ряде случаев решение о целесообразности отмены препарата должно приниматься на основании выявленной генной мутации и степени риска рецидива аГУС, соответственно (см. подраздел «Длительность терапии» в разделе «Лечение взрослых пациентов с аГУС»).
У пациентов с аГУС, обусловленным антителами к CFH, помимо Экулизумаба/Равализумаба* рекомендовано рассмотрение вопроса о применении иммуносупрессивных препаратов. Имеются данные, указывающие на положительные изменения в отношении гематологических показателей, функционального состояния почек, снижения титра антител к CFH при проведении ПТ в комбинации с циклофосфамидом в режиме пульс-терапии, доза которого составляет 0,5г/1,73м2, глюкокортикостероидами и ритуксимабом.
В случае неэффективности терапии Экулизумабом с целью оценки эффективности блокады комплемента рекомендовано определение общей гемолитической способности комплемента (СН50). Уровень СН50 более 10% является индикатором неполной блокады комплемента и может наблюдаться в следующих случаях: индивидуальная недостаточность дозы (чаще в педиатрической популяции, однако возможно и у очень крупных взрослых пациентов), экскреция Экулизумаба с мочой при наличии у пациента массивной протеинурии на фоне нефротического синдрома, наличие генетического варианта С5 компонента, что препятствует связи с ним Экулизумаба, образование антител к Экулизумабу.
Перечень основных лекарственных средств (имеющих 100% вероятность применения): нет.
Перечень дополнительных лекарственных средств (менее 100% вероятности применения) – таблица 16:
| Фармакотерапевтическая группа | Международное непатентованное наименование ЛС | Способ применения | Уровень доказательности |
| Иммунодепрессивное средство | Экулизумаб/Равулизумаб* | в/в | B |
| Препараты, влияющие на кроветворение и кровь. Прочие стимуляторы гемопоэза. Эритропоэтин | Эпоэтин альфа | п/к или в/в | B |
| Эпоэтин бета | п/к или в/в | B | |
| Эпоэтин зета | п/к или в/в | B |
При развитии диализ-зависимого ОПП у пациентов с аГУС рекомендовано определить показания к выбору вида ЗПТ
(перитонеальный диализ, гемодиализ, продленная веновенозная гемодиафильтрация). Выбор модальности диализа основывается на тяжести клинического состояния, степени метаболических нарушений, наличии противопоказаний к определенному методу диализа, возрасте ребенка и антропометрических показателях (рост, вес).
- Перитонеальный диализ применяется при следующих состояниях:
- «изолированное» ОПП;
- выраженные нарушения со стороны ЦНС;
- высокий риск геморрагических осложнений;
- выраженная недостаточность кровообращения;
- невозможность формирования сосудистого доступа.
- Продленная веновенозная гемодиафильтрация рекомендована пациентам c выраженной гипергидратацией, развитием отека легких, мозга, гиперазотемией и нестабильными гемодинамическими показателями.
- Гемодиализ является методом выбора при лечении пациентов с сохранной гемодинамикой, гиперазотемией, гипергидратацией и при наличии противопоказаний к другим методам ЗПТ.
Хирургическое вмешательство при аГУС
Трансплантация почки у пациентов с аГУС
- Трансплантация почки может быть проведена у пациентов с терминальной стадией хронической почечной недостаточности (тХПН) в исходе аГУС не ранее чем через 12 мес. после начала ЗПТ и не имеющих клинических проявлений экстраренальной ТМА.
- Не рекомендуется проведение родственной трансплантации почки. Однако в некоторых случаях она может быть проведена, если идентифицированная мутация гена системы комплемента, ответственная за развитие аГУС у пациента (потенциального реципиента), не обнаруживается у потенциального донора. Необходимо максимально осведомить донора и реципиента о развитии возможных осложнений трансплантации. При условии отсутствия идентификации мутаций, ответственных за развитие аГУС, как у реципиента, так и у донора, рекомендуется воздержаться от проведения родственной трансплантации.
- Перед включением пациента с аГУС в «Лист ожидания» трансплантации почки необходимо выполнить генетическое исследование и определение в динамике титра антител к фактору H, что позволит провести оценку риска рецидива заболевания после трансплантации.
К группе низкого риска относятся следующие пациенты:
- с изолированной мутацией в гене MCP;
- с наличием антител к фактору Н, в динамике имеющие отрицательные результаты анализов на данные антитела в течение продолжительного времени, и без дополнительных мутаций генов-регуляторов системы комплемента.
К категории средневысокого риска относятся следующие пациенты:
- c изолированной мутацией в гене фактора I;
- со стабильно низким уровнем антител к фактору Н и без дополнительных мутаций генов-регуляторов системы комплемента;
- c мутациями неясного клинического значения;
- без идентифицированных мутаций в генах системы комплемента.
К категории высокого риска относятся следующие пациенты:
- с рецидивами аГУС в анамнезе;
- c cемейной формой аГУС;
- с мутациями CFH или при наличии гибридного гена CFH/CFHR1;
- с мутациями генов C3 и CFB, усиливающими их функции.
При трансплантации почки факторами, cпособствующими развитию рецидива аГУС, являются:
- тяжелое ишемически-реперфузионное повреждение трансплантата;
- высокие концентрации в крови ингибиторов кальциневрина (циклоспорин, такролимус);
- эпизоды острого отторжения трансплантата, особенно антитело- опосредованного;
- вирусные инфекции (цитомегаловирусная инфекция и другие герпес-вирусные инфекции, вирусы гриппа, BK-инфекция, инфекция, вызванная парвовирусом B19, инфекционные гастроэнтериты и др.).
Профилактика рецидива аГУС после трансплантации почки
- После трансплантации почки пациентам с низким риском рецидива аГУС специальная профилактика может не проводиться.
- Пациентам со средним риском рецидива необходима профилактика рецидива аГУС, которая может осуществляться как проведением профилактического ПО, так и более предпочтительным профилактическим введением экулизумаба/равулизумаба*.
- Выбор между ПО и экулизумабом/равулизумабом* основывается на доступности экулизумаба, наличии адекватного сосудистого доступа и переносимости донорской плазмы.
- При выборе проведения превентивного ПО последний проводится в следующем режиме: 1 сеанс ПО непосредственно перед операцией, 1 инфузия СЗП во время трансплантации, ежедневные сеансы ПО после операции не менее 5 дней с последующим постепенным уменьшением количества сеансов (5 дней в неделю в течение 2 недель, далее 3 сеанса в неделю в течение 2 недель и т.д.).
- У пациентов со средним риском рецидива через 12 месяцев после трансплантации при отсутствии признаков даже субклинического рецидива может быть предпринята попытка отмены экулизумаба/равулизумаба* или, по крайней мере, увеличения интервалов между его введениями (снижения частоты введения препарата).
- Пациентам группы высокого риска развития рецидива настоятельно рекомендовано проведение профилактической терапии экулизумабом/равулизумабом*. Введение экулизумаба должна быть начато до трансплантации – первая инфузия препарата в дозе 900 мг у взрослых не позднее чем за 1 час до реперфузии донорской почки (у пациентов, ожидающих ургентную трансплантацию или трансплантацию от живого донора, профилактика может быть начата за несколько недель). Второе введение экулизумаба в дозе 900 мг обязательно в первые сутки после трансплантации почки. Последующие введения препарата осуществляются с частотой 1 раз в неделю (900 мг у взрослых) с переходом на режим 1 раз в 2 недели (1200 мг). Терапия экулизумабом может быть проведена в течение всего периода функционирования трансплантата. Равулизумаб* назначается согласно схеме основанной на массе тела.
- С целью предупреждения развития рецидива аГУС рекомендуется избегать высоких концентраций в крови реципиентов ингибиторов кальциневрина – циклоспорина и такролимуса.
- Применение невысоких доз ингибиторов кальциневрина предпочтительнее использованию ингибиторов mTOR.
- Пациентам с аГУС после трансплантации почки рекомендуется проводить профилактику цитомегаловирусной инфекции и пневмоцистоза по существующим клиническим протоколам.
- После трансплантации почки рекомендовано проведение ежегодной вакцинации против сезонного гриппа при условии использования только инактивированных вакцин.
- В рамках подготовки к трансплантации почки и профилактическому введению экулизумаба/равулизумаба* и у детей, и у взрослых необходимо проведение вакцинации против менингококковой, пневмококковой инфекции и инфекции, вызванной гемофильной палочкой, при условии что пациент ранее не был вакцинирован.
Диагностика и лечение рецидива аГУС после трансплантации почки
- При любой дисфункции почечного трансплантата у пациентов с аГУС рекомендуется исключение ТМА на основании оценки количества тромбоцитов, уровня гаптоглобина, ЛДГ и оценки мазка крови для выявления шизоцитов.
- Дисфункция трансплантата является показанием к проведению его биопсии даже при отсутствии лабораторных признаков МАГА.
- Терапией первой линии при рецидиве аГУС после трансплантации почки является экулизумаб/равулизумаб*.
- Лечение экулизумабом/равулизумабом при рецидиве аГУС должно быть начато незамедлительно, поскольку только при раннем лечении (до 4 недель от начала рецидива) позможно наиболее полное восстановление функции трансплантата. Не установлена оптимальная продолжительность лечения рецидива (требуется проведение дальнейших исследований), однако у пациентов с группы высокого риска рецидива терапия экулизумабом/равулизумабом может быть проведена в течение всего периода функционирования трансплантата.
- В период ожидания поставки препарата должен проводиться ПО с объемом эксфузии 40-60 мл/кг массы тела пациента с замещением адекватным объемом СЗП.
Дальнейшее ведение [1, 2, 4, 9, 12, 14]:
Пациенты с STEC-ГУС
В большинстве случаев в течение менее чем 1 - 2 недель отмечается нормализация гематологических показателей, нормализация диуреза с тенденцией к восстановлению почечных функций. Однако у 10% детей в течение 4 месяцев наблюдается развитие терминальной стадии ХПН.
Длительность динамического наблюдения после перенесенного STEC-ГУС должна составлять не менее 5 лет и зависит от тяжести перенесенного STEC-ГУС, наличия протеинурии, артериальной гипертензии и уровня скорости клубочковой фильтрации. Дважды в год рекомендуется проводить мониторинг общего анализа крови с тромбоцитами и контроль почечных функций (креатинин, оценка скорости клубочковой фильтрации). При достижении ХПН требуется проведение ее посиндромной терапии и решение вопроса о своевременном начале заместительной почечной терапии. Повторные госпитализации показаны в основном при прогрессировании почечной недостаточности.
Пациенты с аГУС
Требуется систематический мониторинг пациентов с аГУС нефрологом и специалистами другого профиля такими, как неврологи, гастроэнтерологи, гематологи и другими. При стабильном состоянии пациента и хорошей переносимости экулизумаба/равулизумаба* плановое введение препарата может осуществляться в условиях дневного стационара.
Рекомендовано проведение всех вакцинаций, включая сезонные, за исключением живых аттенуированных вакцин. Однако отмечены отдельные эпизоды рецидива болезни после вакцинаций. Тем не менее, потенциальная польза последних существенно превалирует над возможным риском в соотношении риск-польза.
При рецидиве ТМА (анемия, тромбоцитопения, ухудшение почечных функций и появление признаков экстраренального поражения) показана незамедлительная госпитализация в стационар.
Индикаторы эффективности лечения:
Критерии эффективности терапии Экулизумабом/Равулизумаба* при аГУС:
- нормализация числа тромбоцитов;
- прекращение гемолиза (оценка проводится на основании ЛДГ);
- улучшение функции почек.
Ожидаемые целевые эффекты от терапии Экулизумабом/Равулизумаба* при аГУС:
- существенное снижение риска летального исхода;
- индукция гематологической ремиссии и ее поддержание;
- отсутствие необходимости в проведении плазмотерапии;
- улучшение функционального состояния почек.
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ [1, 2]:
Все пациенты должны быть госпитализированы в многопрофильные стационары с отделением реанимации и интенсивной терапии, оснащенным аппаратурой для экстракорпорального очищения крови.
Показания для плановой госпитализации:
- проведение патогенетической комплемент-блокирующей терапии при нежизнеугрожающих вариантах течения заболевания;
- проведение клинико-диагностического поиска причины неэффективности комплемент-блокирующей терапии при нежизнеугрожающем течении заболевания;
- необходимость выполнения нефробиопсии;
- проведение планового повторного введения Экулизумаба/Равулизумаба* при нежизнеугрожающем течении заболевания.
Показания для экстренной госпитализации:
- Пациенты с признаками ТМА и развитием жизнеугрожающих проявлений заболевания – острого повреждения почек с необходимостью в проведении заместительной почечной терапии, острой сердечной и дыхательной недостаточности, тяжелого поражения желудочно-кишечного тракта, центральной нервной системы, органа зрения, гемолитической анемии, геморрагического синдрома с целью первичной диагностики, проведения плазмотерапии и/или комплементблокирующей терапии.
- Необходимость экстренного начала комплемент-блокирующей терапии у пациентов с рецидивом острой ТМА.
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2022
- Козловская, Н.Л., Эмирова, Х.М., Панкратенко, Т.Е., Зверев Д.В., Музуров, А.Л., Генералова Г.А., Абасеева Т.Ю. 2014. Проект клинических рекомендаций по диагностике и лечению типичного гемолитико-уремического синдрома. 2. Козловская, Н.Л., Прокопенко, Е.И., Эмирова, Х.М., Серикова С.Ю. 2015. Клинические рекомендации по диагностике и лечению атипичного гемолитико-уремического синдрома. Нефрология и диализ, 17, 3: 242-264. 3. Мельник, А.А. 2019. Лабораторная диагностика тромботической микроангиопатии. Новости медицины и фармации, 8, 695. 4. Saha, M., McDaniel, J.K., Zheng, X.L. 2017. Thrombotic thrombocytopenic purpura: pathogenesis, diagnosis and potential novel therapeutics. J Thromb Haemost, 15(10):1889-1900. doi: 10.1111/jth.13764. 5. Козловская, Н.Л. 2015. Тромботические микроангиопатии в акушерской практике. Первый пленум правления Ассоциации акушерских анестезиологов-реаниматологов. Москва. https://www.arfpoint.ru/wp-content/uploads/2016/03/Kozlovskaya_Akusherskaya-TMA.pdf 6. Ganesan, C., Maynard, S.E. 2011. Acute kidney injury in pregnancy: the thrombotic microangiopathies. J Nephrol., 24(5): 554-63. doi: 10.5301/JN.2011.6250. 7. Machado, S., Figueiredo, N., Borges, A., São José Pais, M., Freitas, L., Moura, P., Campos, M. 2012. Acute kidney injury in pregnancy: a clinical challenge. J Nephrol, 25(1):19-30. doi: 10.5301/jn.5000013. 8. Fakhouri, F., Vercel, C., Frémeaux-Bacchi, V. 2012. Obstetric nephrology: AKI and thrombotic microangiopathies in pregnancy. Clin J Am Soc Nephrol., 7(12): 2100-6. doi: 10.2215/CJN.13121211. 9. Loirat, C., Fakhouri, F., Ariceta, G., Besbas, N., Bitzan, M., Bjerre, A., Coppo, R., Emma, F., Johnson, S., Karpman, D., Landau, D., Langman, C.B., Lapeyraque, A.L., Licht, C., Nester, C., Pecoraro, C., Riedl, M., van de Kar NC, Van de Walle J, Vivarelli M, Frémeaux-Bacchi V. 2015. HUS International. An international consensus approach to the management of atypical hemolytic uremic syndrome in children. Pediatr Nephrol., 31(1):15-39. doi: 10.1007/s00467-015-3076-8. 10. European Medicines Agency. Soliris (eculizumab): EU summary of product characteristics. https://www.ema.europa.eu/en/documents/product-information/soliris-epar-product-information_en.pdf 11. U.S. Food and Drug Administration. Dosing and administration guide, 2014. Soliris (eculizumab): US prescribing information. https://www.fda.gov/media/79369/download 12. Goodship, T.H., Cook, H.T., Fakhouri, F., Fervenza, F.C., Frémeaux-Bacchi, V., Kavanagh, D., Nester, C.M., Noris, M., Pickering, M.C., Rodríguez de Córdoba, S., Roumenina, L.T., Sethi, S., Smith, R,J. 2017. Atypical hemolytic uremic syndrome and C3 glomerulopathy: conclusions from a "Kidney Disease: Improving Global Outcomes" (KDIGO) Controversies Conference. Kidney Int., 91(3):539-551. doi: 10.1016/j.kint.2016.10.005. 13. Sampedro Lopez A, Dominguez Moro B, Baltar Martin JM, Garcia Mon- teavaro C, Barbon Garcia JJ. 2017. Ocular involvement in atypical hemolytic uremic syndrome. Arch Soc Esp Oftalmol, 92(12): 594-597. https://doi.org/10.1016/j.oftal.2017.02.007 14. Taylor, C.M., Machin, S., Wigmore, S.J., Goodship, T.H; working party from the Renal Association, the British Committee for Standards in Haematology and the British Transplantation Society. 2010. Clinical practice guidelines for the management of atypical haemolytic uraemic syndrome in the United Kingdom. Br J Haematol., 148(1):37-47. doi: 10.1111/j.1365-2141.2009.07916.x. 15. Wijnsma KL, Duineveld C, Wetzels JFM, van de Kar NCAJ. 2019. Eculizumab in atypical hemolytic uremic syndrome: strategies toward restrictive use. Pediatr Nephrol., 34(11): 2261-2277. doi: 10.1007/s00467-018-4091-3. 16. Каабак, М.М., Молчанова, Е.А., Нестеренко, И.В. и др. 2018. Резолюция Междисциплинарного совета экспертов. Трансплантация почки у пациентов с атипичным гемолитико-уремическим синдромом: клинические и организационно-методические аспекты ведения пациентов. Нефрология, 3: 8-14. doi: 10.18565/nephrology.2018.3.8-14 17. Резолюция Междисциплинарного совета экспертов по профилактике тяжелых инфекций у пациентов с генетическими нарушениями регуляции системы комплемента, получающих терапию экулизумабом. Эпидемиология и вакцинопрофилактика, 2017; 1(92): 51-55. 18. FDA - HIGHLIGHTS OF PRESCRIBING INFORMATION (ULTOMIRIS). (2022). [online] Available at: https://www.accessdata.fda.gov/drugsatfda_docs/label/2022/761108s021lbl.pdf [Accessed 19 Aug. 2022].
Информация
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ПРОТОКОЛА
Список разработчиков протокола:
- Туганбекова Салтанат Кенесовна – доктор медицинских наук, профессор «Национальный научный медицинский центр», заведующий кафедрой «Внутренних болезней №4» НАО «Медицинский Университет Астана», председатель РОО «Нефрологов, врачей диализа и трансплантологов Казахстана», главный внештатный нефролог (взрослый, детский) Министерства здравоохранения Республики Казахстан.
- Кабулбаев Кайрат Абдуллаулы – доктор медицинских наук, профессор кафедры нефрологии НАО «Казахский Национальный медицинский университет имени С.Д. Асфендиярова», консультант-нефролог АО «Научно-исследовательский институт кардиологии и внутренних болезней», член «International Society of Nephrology», РОО «Нефрологов, врачей диализа и трансплантологов Казахстана».
- Гайпов Абдужаппар Эркинович – кандидат медицинских наук, врач нефролог высшей категории, ассистент профессор кафедры медицины, директор программы резидентуры по терапии Школы Медицины Назарбаев Университета
- Карабаева Айгуль Жумартовна – доктор медицинских наук, ассоциированный профессор, нефролог высшей категории, профессор кафедры «Общей врачебной практики» НУО Казахстанско-Российского медицинского университета.
- Жумадилов Агзам Шаймарданович – доктор медицинских наук, профессор, председатель правления «Казахское общество анестезиологов и реаниматологов», главный внештатный анестезиолог-реаниматолог министерства здравоохранения Республики Казахстан.
- Рахимжанова Салтанат Сагындыковна – старший ординатор отделения «Нефрологии и диализа» Корпоративного фонда «UMC», нефролог высшей категории.
- Таурбекова Бинура Ернуровна – врач нефролог, магистр медицинских наук, «Национальный научный медицинский центр», докторант PhD в области молекулярной медицины Школа медицины Назарбаев университета.
- Макалкина Лариса Геннадиевна – кандидат медицинских наук, PhD, MD, доцент кафедры клинической фармакологии НАО «Медицинский университет Астана», Вице-Президент РОО «Ассоциация клинических фармакологов и фармацевтов», главный внештатный клинический фармаколог Министерства здравоохранения Республики Казахстан.
Указание на отсутствие конфликта интересов: нет.
Рецензент(ы):
- Козловская Наталья Львовна – доктор медицинских наук, профессор, руководитель центра помощи беременным с патологией почек государственного бюджетного учреждения здравоохранения «Городская клиническая больница №20 им.А.К.Ерамишанцева ДЗМ», профессор кафедры внутренних болезней с курсом кардиологии и функциональной диагностики им. акад. В.С. Моисеева медицинского института федерального государственного автономного образовательного учреждения высшего образования «Российский университет дружбы народов», Российская Федерация.
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.