Скрининг рака шейки матки, диагностика и тактика ведения интраэпителиальной цервикальной неоплазии
 Версия: Клинические протоколы 2024 (Узбекистан)
Версия: Клинические протоколы 2024 (Узбекистан)
Дисплазия шейки матки (N87), Дисплазия шейки матки неуточненная (N87.9), Резко выраженная дисплазия шейки матки, не классифицированная в других рубриках (N87.2), Слабовыраженная дисплазия шейки матки (N87.0), Умеренная дисплазия шейки матки (N87.1)
Акушерство и гинекология
Общая информация
Краткое описание
Приложение к приказу № 401
от «25» декабря 2024 года
Министра Здравоохранения Республики Узбекистан
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ УЗБЕКИСТАН
РЕСПУБЛИКАНСКИЙ СПЕЦИАЛИЗИРОВАННЫЙ НАУЧНО-ПРАКТИЧЕСКИЙ МЕДИЦИНСКИЙ ЦЕНТР ЗДОРОВЬЯ МАТЕРИ И РЕБЁНКА
НАЦИОНАЛЬНЫЙ КЛИНИЧЕСКИЙ ПРОТОКОЛ
«СКРИНИНГ РАКА ШЕЙКИ МАТКИ, ДИАГНОСТИКА И ТАКТИКА ВЕДЕНИЯ ИНТРАЭПИТЕЛИАЛЬНОЙ ЦЕРВИКАЛЬНОЙ НЕОПЛАЗИИ»
Вводная часть
НАЦИОНАЛЬНЫЙ КЛИНИЧЕСКИЙ ПРОТОКОЛ
«СКРИНИНГ РАКА ШЕЙКИ МАТКИ, ДИАГНОСТИКА И ТАКТИКА ВЕДЕНИЯ ИНТРАЭПИТЕЛИАЛЬНОЙ ЦЕРВИКАЛЬНОЙ НЕОПЛАЗИИ»
Вводная часть
Коды по МКБ-10:
|
N87
|
Дисплазия шейки матки (цервикальная интраэпителиальная неоплазия), исключена карцинома in situ шейки матки (D06).
|
|
N87.0
|
Слабая цервикальная дисплазия, цервикальная интраэпителиальная неоплазия I степени (CIN I), низкая степень плоскоклеточных интраэпителиальных поражений (LSIL).
|
|
N87.1
|
Умеренная цервикальная дисплазия, включена цервикальная интраэпителиальная неоплазия II степени (CIN II).
|
|
N87.2
|
Выраженная цервикальная дисплазия, не включенная в другие уточненные группы болезней, исключена цервикальная интраэпителиальная неоплазия III степени (CIN III) с и без указания на выраженную дисплазию и карциному in situ шейки матки (D06).
|
|
N87.9
|
Цервикальная дисплазия неуточненная.
|
Коды по МКБ-11:
|
GA15.7
|
Плоскоклеточное интраэпителиальное поражение шейки матки низкой степени.
|
|
2E66.2
|
Интраэпителиальное плоскоклеточное поражение шейки матки высокой степени: цервикальная интраэпителиальная неоплазия II степени, цервикальная; интраэпителиальная неоплазия III степени.
|
|
QA09.4
|
Специальное скрининговое обследование с целью выявления новообразования шейки матки – скрининг неоплазии шейки матки.
|
Дата разработки и пересмотра протокола: 2024 год, дата пересмотра 2029 г. или по мере появления новых ключевых доказательств. Все поправки к представленным рекомендациям будут опубликованы в соответствующих документах.
Ответственное учреждение по разработке данного клинического протокола: Республиканский специализированный научно-практический медицинский центр охраны здоровья матери и ребенка.
Цель протокола: предоставить медицинским работникам современные научно обоснованные данные и рекомендации, основанные на доказательствах для разработки и внедрения системы организованного скрининга рака шейки матки, лечения предраковых заболеваний шейки матки в Республике Узбекистан.
Категории пациентов: женщины в возрастном диапазоне 30-65 лет.
Пользователи клинического протокола: семейные врачи; врачи акушеры-гинекологи; врачи онкологи; врачи лабораторной диагностики; организаторы здравоохранения; студенты медицинских ВУЗов; клинические ординаторы; магистранты; докторанты; преподаватели медицинских ВУЗов; женщины, члены их семей и лица, осуществляющие уход.
Категории пациентов: женщины в возрастном диапазоне 30-65 лет.
Пользователи клинического протокола: семейные врачи; врачи акушеры-гинекологи; врачи онкологи; врачи лабораторной диагностики; организаторы здравоохранения; студенты медицинских ВУЗов; клинические ординаторы; магистранты; докторанты; преподаватели медицинских ВУЗов; женщины, члены их семей и лица, осуществляющие уход.
Основная часть
Введение.
Основной патологией шейки матки, опасной для жизни женщины, является рак шейки матки (РШМ). Все диагностические методы и методики обследования шейки матки разрабатывались для ранней и дифференциальной диагностики именно этого заболевания и его облигатного предрака.
Во всем мире рак шейки матки является вторым по распространенности видом рака среди женщин после рака молочной железы. По прогнозам, за период с 2018 по 2030 г. среднегодовая заболеваемость раком шейки матки возрастет с 570 000 до 700 000, а среднегодовая смертность увеличится с 311 000 до 400 000 случаев.
Более 85% заболевших – молодые и малообразованные женщины, живущие в беднейших странах мира. Многие из них также имеют малолетних детей, выживание которых впоследствии осложняется из-за преждевременной смерти матери.
Девять из 10 смертей от рака шейки матки во всем мире произошли в странах с низким и средним уровнем дохода. Кроме того, у ВИЧ-инфицированных женщин вероятность развития рака шейки матки в шесть раз выше, чем у ВИЧ-отрицательных женщин.
В мире порядка 90% новых случаев заболевания и смерти по причине рака шейки матки в 2020 г. имело место в странах с низким и средним уровнем дохода. Это подтверждает сохраняющуюся высокую заболеваемость и смертность, несмотря на то, что рак шейки матки является в значительной мере предотвратимым заболеванием. Основная причина этому – отсутствие программ профилактики РШМ путем раннего выявления и лечения предраковых заболеваний и ранних стадий РШМ. Без эффективных программ скрининга рака шейки матки с обязательным лечением предраковых заболеваний шейки матки, заболевание обычно выявляют на поздних стадиях, когда слишком поздно проводить эффективное лечение, а смертность, в связи с этим высока.
Раку шейки матки на протяжении нескольких лет, иногда и десятилетий предшествуют цервикальные интраэпителиальные неоплазии. За столь длительный период они могут быть выявлены и излечены до развития инвазивного рака несложными органосохраняющими эксцизиями.
Во всем мире рак шейки матки является вторым по распространенности видом рака среди женщин после рака молочной железы. По прогнозам, за период с 2018 по 2030 г. среднегодовая заболеваемость раком шейки матки возрастет с 570 000 до 700 000, а среднегодовая смертность увеличится с 311 000 до 400 000 случаев.
Более 85% заболевших – молодые и малообразованные женщины, живущие в беднейших странах мира. Многие из них также имеют малолетних детей, выживание которых впоследствии осложняется из-за преждевременной смерти матери.
Девять из 10 смертей от рака шейки матки во всем мире произошли в странах с низким и средним уровнем дохода. Кроме того, у ВИЧ-инфицированных женщин вероятность развития рака шейки матки в шесть раз выше, чем у ВИЧ-отрицательных женщин.
В мире порядка 90% новых случаев заболевания и смерти по причине рака шейки матки в 2020 г. имело место в странах с низким и средним уровнем дохода. Это подтверждает сохраняющуюся высокую заболеваемость и смертность, несмотря на то, что рак шейки матки является в значительной мере предотвратимым заболеванием. Основная причина этому – отсутствие программ профилактики РШМ путем раннего выявления и лечения предраковых заболеваний и ранних стадий РШМ. Без эффективных программ скрининга рака шейки матки с обязательным лечением предраковых заболеваний шейки матки, заболевание обычно выявляют на поздних стадиях, когда слишком поздно проводить эффективное лечение, а смертность, в связи с этим высока.
Раку шейки матки на протяжении нескольких лет, иногда и десятилетий предшествуют цервикальные интраэпителиальные неоплазии. За столь длительный период они могут быть выявлены и излечены до развития инвазивного рака несложными органосохраняющими эксцизиями.
РШМ – злокачественное новообразование эпителия шейки матки, идеально соответствующее требованиям к заболеваниям, подлежащим высокоэффективному и экономически целесообразному скринингу: большая распространенность и социальная значимость, визуальность формы, длительный период предрака с возможностью ранней диагностики и высокоэффективного лечения с сохранением фертильности, наличие достаточно чувствительных и специфичных тестов.
По данным ВОЗ за последние 30 лет показатели заболеваемости раком шейки матки и смертности по причине РШМ значительно снизились в странах, чей социальный и экономический статус улучшился. Это главным образом является результатом внедрения эффективного цитологического скрининга, а также своевременного лечения предраковых заболеваний и рака шейки матки ранних стадий.
https://unitaid.org/assets/Cervical_ Cancer_Technology-landscape-2019.pdf
Сравнительно недавно программы цитологического скрининга в некоторых стали дополняться новыми тестами, такими как определение вируса папилломы человека (ВПЧ) высоко онкогенного типа. Как известно, персистирующая папилломавирусная инфекция является причиной почти всех видов рака шейки матки. Длительный период между инфицированием и развитием рака шейки матки позволяет скринингу быть эффективным в снижении как заболеваемости, так и смертности от рака шейки матки.
В определённый момент жизни ВПЧ заражается большинство сексуально активных женщин и мужчин, иногда неоднократно. У более 90% зараженных инфекция в течение 2 лет самостоятельно элиминируется без какого-либо лечения.
Несмотря на печальную статистику по цервикальному раку, возможно, самое трагичное в этом заболевании заключается в том, что нам уже известно, как предотвратить подавляющее большинство случаев, и тем не менее, рак шейки матки по-прежнему является причиной значительного числа заболевших и умерших в мире.
Имеются веские доказательства того, что эффективно организованные программы скрининга могут предотвратить до 80% случаев цервикального рака. Польза таких программ была убедительно продемонстрирована в Финляндии, Великобритании и некоторых других странах, где такие программы были внедрены. https://publications.iarc.fr/Book-And-Report-Series/Iarc-Handbooks-Of-Cancer-Prevention/Cervix- Cancer-Screening-2005
Объединенная глобальная программа ООН по профилактике и контролю рака шейки матки провела свою первую миссию в Узбекистане с 23 по 26 октября 2017 года. Узбекистан был выбран ВОЗ в регионе Европы для участия в первом этапе Глобальной совместной программы ООН по профилактике и контролю рака шейки матки.
Глобальная стратегия соответствует международным документам, в которых право на здоровье закрепляется как одно из прав человека (Резолюция, принятая Советом по правам человека 26 сентября 2019 г. – A/HRC/RES/42/16 «Право каждого человека на наивысший достижимый уровень физического и психического здоровья»), а также в Повестке дня в области устойчивого развития на период до 2030 г. и ее всеобъемлющему принципу, согласно которому никто не должен быть оставлен без внимания. https://undocs.org/ru/A/HRC/RES/42/16020
В соответствии с этой стратегией рекомендуется применять комплексный подход к профилактике рака шейки матки и борьбе с ним с целью достижения показателя заболеваемости 4 случая на 100 000 женщин в год к 2030 г. В целях достижения этого порогового значения разработана программа «90–70–90», подразумевающая следующие критерии её выполнения:
По данным ВОЗ за последние 30 лет показатели заболеваемости раком шейки матки и смертности по причине РШМ значительно снизились в странах, чей социальный и экономический статус улучшился. Это главным образом является результатом внедрения эффективного цитологического скрининга, а также своевременного лечения предраковых заболеваний и рака шейки матки ранних стадий.
https://unitaid.org/assets/Cervical_ Cancer_Technology-landscape-2019.pdf
Сравнительно недавно программы цитологического скрининга в некоторых стали дополняться новыми тестами, такими как определение вируса папилломы человека (ВПЧ) высоко онкогенного типа. Как известно, персистирующая папилломавирусная инфекция является причиной почти всех видов рака шейки матки. Длительный период между инфицированием и развитием рака шейки матки позволяет скринингу быть эффективным в снижении как заболеваемости, так и смертности от рака шейки матки.
В определённый момент жизни ВПЧ заражается большинство сексуально активных женщин и мужчин, иногда неоднократно. У более 90% зараженных инфекция в течение 2 лет самостоятельно элиминируется без какого-либо лечения.
Несмотря на печальную статистику по цервикальному раку, возможно, самое трагичное в этом заболевании заключается в том, что нам уже известно, как предотвратить подавляющее большинство случаев, и тем не менее, рак шейки матки по-прежнему является причиной значительного числа заболевших и умерших в мире.
Имеются веские доказательства того, что эффективно организованные программы скрининга могут предотвратить до 80% случаев цервикального рака. Польза таких программ была убедительно продемонстрирована в Финляндии, Великобритании и некоторых других странах, где такие программы были внедрены. https://publications.iarc.fr/Book-And-Report-Series/Iarc-Handbooks-Of-Cancer-Prevention/Cervix- Cancer-Screening-2005
Объединенная глобальная программа ООН по профилактике и контролю рака шейки матки провела свою первую миссию в Узбекистане с 23 по 26 октября 2017 года. Узбекистан был выбран ВОЗ в регионе Европы для участия в первом этапе Глобальной совместной программы ООН по профилактике и контролю рака шейки матки.
Глобальная стратегия соответствует международным документам, в которых право на здоровье закрепляется как одно из прав человека (Резолюция, принятая Советом по правам человека 26 сентября 2019 г. – A/HRC/RES/42/16 «Право каждого человека на наивысший достижимый уровень физического и психического здоровья»), а также в Повестке дня в области устойчивого развития на период до 2030 г. и ее всеобъемлющему принципу, согласно которому никто не должен быть оставлен без внимания. https://undocs.org/ru/A/HRC/RES/42/16020
В соответствии с этой стратегией рекомендуется применять комплексный подход к профилактике рака шейки матки и борьбе с ним с целью достижения показателя заболеваемости 4 случая на 100 000 женщин в год к 2030 г. В целях достижения этого порогового значения разработана программа «90–70–90», подразумевающая следующие критерии её выполнения:
- 90% девочек к 15 годам должны быть вакцинированы от ВПЧ;
- 70% женщин должны пройти скрининг на основе высокоэффективного теста в возрасте 35 лет и затем в возрасте 45 лет;
- обеспечение лечением 90% женщин с предраком и инвазивным раком шейки матки.
Если эти цели будут достигнуты, то к 2030 году удастся избежать 300 000 смертей от рака шейки матки. И далее в результате достижения целевых показателей «90-70-90» к 2030 г.
62 миллиона смертей от рака шейки матки будет предотвращено к 2120 году.
https://gco.iarc.who.int/media/globocan/factsheets/cancers/23-cervix-uteri-fact-sheet.pdf
https://apps.who.int/iris/handle/10665/104174
http://gco.iarc.fr/
https://unitaid.org/assets/Cervical_ Cancer_Technology-landscape-2019.pdf
Определения.
Цервикальные интраэпителиальные неоплазии (Cervical Intraepithelial Neoplasia – CIN) – это группа заболеваний, характеризующихся нарушением созревания, дифференцировки и стратификации многослойного плоского эпителия. CIN трех степеней инициируются персистирующей инфекцией, вызванной вирусами папилломы человека высокого канцерогенного риска (ВПЧ ВКР), которая поддерживает прогрессию повреждений до инвазии. CIN I характеризуется высокой вероятностью регрессии и не относится к предраку шейки матки, небольшая часть CIN I переходит в CIN II-III – истинные предраковые поражения. Возможно развитие CIN II-III без формирования CIN I.
LSIL – low-grade squamous intraepithelial lesions – плоскоклеточное интраэпителиальное поражение низкой степени. LSIL включает койлоцитоз, CIN I и кондиломы шейки матки
HSIL – high grade squamous intraepithelial lesions – плоскоклеточное интраэпителиальное поражение высокой степени HSIL включают CIN II (умеренную дисплазию) и CIN III (тяжелую дисплазию и преинвазивный рак (CIS)). HSIL относится к облигатному предраку шейки матки.
LSIL – low-grade squamous intraepithelial lesions – плоскоклеточное интраэпителиальное поражение низкой степени. LSIL включает койлоцитоз, CIN I и кондиломы шейки матки
HSIL – high grade squamous intraepithelial lesions – плоскоклеточное интраэпителиальное поражение высокой степени HSIL включают CIN II (умеренную дисплазию) и CIN III (тяжелую дисплазию и преинвазивный рак (CIS)). HSIL относится к облигатному предраку шейки матки.
Классификация
Классификация заболевания или состояния.
В диагностике патологии шейки матки используются цитология цервикальных мазков, расширенная кольпоскопия и гистологическое исследование биоптатов шейки матки. В настоящее время общепринятой цитологической классификацией заболеваний шейки матки является является Классификация Бетесда (Terminology Bethesda System, TBS)
https://www.rcrm.by/upload/science/posob_doctor/2021-12.pdf
https://iris.who.int/bitstream/handle/10665/144785/9789241548953_eng.pdf?sequence=1
Основные категории классификации Bethesda System:
https://www.rcrm.by/upload/science/posob_doctor/2021-12.pdf
https://iris.who.int/bitstream/handle/10665/144785/9789241548953_eng.pdf?sequence=1
Основные категории классификации Bethesda System:
Для оценки плоского эпителия шейки матки:
- NILM – negative for intraepithelial lesion or malignancy – интраэпителиальные поражения и злокачественные процессы отсутствуют;
- ASC – atypical scuamous cells – плоскоклеточные клетки сподозрением на атипию;
- ASC-US – atypical scuamous cells undetermined significance – плоскоклеточные атипичные клетки неопределённого значения (клеточные изменения, которые более значимы, чем реактивные, но количественно или качественно недостаточны для установления диагноза CIN);
- ASC-H – atypical scuamous cells cannot exclude HSIL – атипичные клетки плоского эпителия, не позволяющие исключить HSIL (категория, занимающая среднее положение между ASC-US и HSIL);
- LSIL – low-grade squamous intraepithelial lesions – плоскоклеточное интраэпителиальное поражение низкой степени. LSIL включает койлоцитоз (ВПЧ инфекцию), CIN I (слабую дисплазию) и кондиломы шейки матки;
- HSIL – high grade squamous intraepithelial lesions – плоскоклеточное интраэпителиальное поражение высокой степени. HSIL включают CIN II (умеренную дисплазию), CIN III (тяжелую дисплазию) и преинвазивный рак (CIS);
- CIS – carcinoma in situ - инвазивная плоскоклеточная карцинома.
Для оценки железистого эпителия шейки матки:
- AGC – atypical glandular cells of favor neoplastic – железистые клеткис подозрением на атипию;
- AGC-US – atypical glandular cells of undetermined significance – атипические железистые клетки неясного значения;
- AIS – endocervical adenocarcinoma in situ – эндоцервикальная аденокарцинома in situ;
- Adenocarcinoma – аденокарцинома.
Выдача заключения цитологического исследования в соответствии сданной системой позволяет:
- стандартизировать формат цитологических заключений и лучшего понимания сущности предрака;
- выделение категорий ASC-US/ASC-H для плоского эпителия и AGC-US/AGC для железистого дает возможность повысить диагностическую чувствительность цитологического скрининга.
https://www.rcrm.by/upload/science/posob_doctor/2021-12.pdf
Классификации Бетесда предшествовала классификации Папаниколау, которая в настоящее время не используется в диагностике интраэпителиальной дисплазии слизистой шейки матки:
1-й класс – нормальная цитологическая картина (отрицательный результат);
2-й класс – изменение морфологии клеток, которое обусловлено воспалением во влагалище и (или) шейке матки;
3-й класс – единичные клетки с аномалией ядер и цитоплазмы (подозрение на злокачественное новообразование);
4-й класс – отдельные клетки с явными признаками озлокачествления.
В таблице 1 представлено соотношение классификаций предраковых поражений шейки матки.
Таблица 1. Соотношение классификаций предраковых поражений шейки матки
| Система Папаниколау | Описательная система ВОЗ | CIN | Терминологическая система Бетесда |
| Класс 1 (норма) | Отсутствие злокачественных клеток | Отсутствие неопластических изменений | Норма |
|
Класс 2 (метаплазия эпителия, воспалительный тип) |
Атипия, связанная с воспалением | Реактивные измененияклеток ASC: ASCUS; ASC - Н | |
| Класс 3 ("дискариоз") | Слабая дисплазия |
CIN I, койлоцитоз |
LSIL |
| Умеренная дисплазия | CIN II | HSIL | |
| Класс 4 (клетки, подозрительные на ракили карцинома in situ) | Тяжелая дисплазия | CIN III | |
| Карцинома in situ | |||
| Класс 5 (рак) | Инвазивная карцинома | Карцинома | Карцинома |
Для верификации диагноза рекомендовано проведение биопсии шейки матки с гистологическим исследованием биоптата после жидкостной цитологии и расширенной кольпоскопии.
Согласно Международной гистологической классификации ВОЗ 2014 г.
плоскоклеточные интраэпителиальные поражения (SIL) подразделяют на:
- CIN I – внутриэпителиальное поражение плоского эпителия легкой степени;
- CIN II- III – внутриэпителиальное поражение плоского эпителия высокой степени.
https://iris.who.int/bitstream/handle/10665/144785/9789241548953_eng.pdf?sequence=1
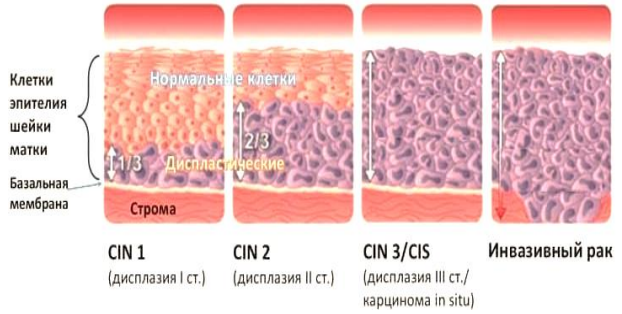
Гистологическая классификация R. M. Richart (1968) в зависимости от глубины поражения поверхностного клеточного слоя шейки матки:
Гистологическая классификация R. M. Richart (1968) в зависимости от глубины поражения поверхностного клеточного слоя шейки матки:
- CIN I (дисплазия слабой степени) – признаки папилломавирусной инфекции (койлоцитоз и дискератоз). Поражение до 1/3 толщины клеточного пласта;
- CIN II (дисплазия средней степени) – поражена 1/2 толщины клеточного слоя;
- CIN III (дисплазия тяжелой степени и преинвазивный рак) – поражение занимает более 2/3 клеточного слоя или всю его толщину, но инвазия в подлежащую строму отсутствует.
Этиология и патогенез
Этиология и патогенез заболевания или состояния.
Главным этиологическим фактором развития CIN и РШМ является вирус папилломы человека высокоонкогенного типа (ВПЧ). На сегодняшний день известны и диагностируются следующие типы ВПЧ - 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68. Длительный период между инфицированием и развитием рака шейки матки позволяет организованному скринингу быть эффективным в снижении как заболеваемости, так и смертности от рака шейки матки. ВПЧ представляют собой широко распространённую и вариабельную группу вирусов, поражающих эпителий кожи и слизистых оболочек и обладающих онкогенным потенциалом (рисунок 1).
Пути передачи и инфицирование ВПЧ:
- Половой путь. Инфицирование ВПЧ происходит при генитально-генитальном половом акте, мануально-генитальном и орально-генитальном половом контактах.
- Вертикальный путь. Доказана повышенная чувствительность эпителия шейки матки к ВПЧ в период беременности.
- Бытовой путь. Возможна передача вируса через нижнее белье, хирургические перчатки, хирургический инструментарий для биопсии и другие предметы, обсемененные ВПЧ. Медперсонал может инфицироваться ВПЧ во время лазерной деструкции генитальных бородавок, вдыхая образующийся дым.
Рисунок 1. Вирус папилломы человека
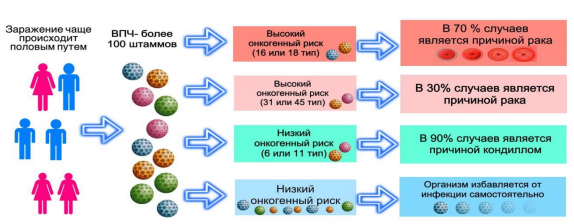

Инкубационный период составляет от 1 до 6 месяцев, максимальное содержание вируса в пораженных тканях обнаруживается на 6-м месяце. ВПЧ ВКР поражает полипотентные стволовые и амплифицирующиеся клетки под цилиндрическим эпителием эктопии, в формирующейся зоне трансформации с ее верхней границей – переходной зоной, а также в расположенном выше канале и эндоцервикальных криптах.
Под влиянием ранних генов вируса физиологический процесс метаплазии приобретает аномальный характер за счет чрезмерной пролиферации незрелых клеток и формирования неоваскулярной сети для трофического обеспечения растущей массы неопластических клеток. Аномальные клетки, соответственно тяжести их генетических повреждений и степени неоплазии, занимают от трети до всей толщины эпителиального пласта, кучно расположены в межакантотических пространствах, окруженных сосудистой сетью. Эта сосудистая сеть, «точечно» определяющаяся в верхушках сосочков или в виде горизонтально расположенных сосудов, окружающих массы незрелых клеток, является морфологическим субстратом аномальных кольпоскопических картин (АКК), таких как ацетобелый эпителий (АБЭ) различной толщины, нежная или грубая мозаика и пунктуация, сосочки, гребни, пласты.
https://apps.who.int/iris/handle/10665/104174
http://gco.iarc.fr/
https://unitaid.org/assets/Cervical_ Cancer_Technology-landscape-2019.pdf
Течение папилломавирусной инфекции
Формы ВПЧ-инфекции вариабельны и подразделяются на:
-
клиническую – видима невооруженным глазом;
-
субклиническую – выявляется только при кольпоскопии, цитологическом или гистологическом обследовании;
-
латентную – отсутствие морфологических отклонений при обнаружении ДНК ВПЧ.
ВПЧ может по-разному воздействовать на эпителий: способствовать возникновению доброкачественных образований (папиллом, кондилом) или объединению ДНК ВПЧ с геном клетки, что приводит к дисплазии различной степени (неоплазии) и в дальнейшем к раку (чаще всего в зоне трансформации шейки матки).
Характерно скрытое течение заболевания, при котором зачастую отсутствуют клинические проявления. В 30% случаев выявления ВПЧ и характерные изменения при цитологическом исследовании нередко разрешаются самостоятельно в течение 6-12 месяцев (преходящая или латентная инфекция), не оставляя повреждений или наличия ВПЧ-инфекции (рисунок 2).
Рисунок 2. Течение папилломавирусной инфекции.
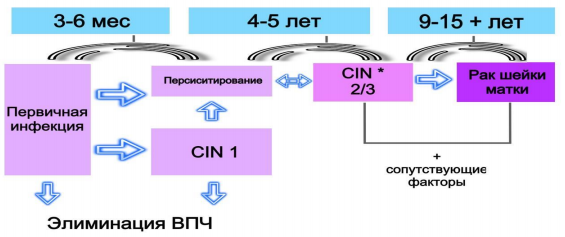
Длительная персистенция ВПЧ (более 2-х лет) является основным фактором прогрессирования неоплазий. Доказан переход от нормального эпителия к внутриэпителиальному раку через зоны диспластического эпителия. Эти зоны изменений не только сочетаются друг с другом, но также являются различными стадиями постепенного ступенчатого неопластического процесса.
Неопластические изменения возникают как в многослойном плоском эпителии влагалищной части шейки матки, так и на участках плоскоклеточной метаплазии слизистой оболочки в зоне трансформации и в цервикальном канале, а затем распространяются на влагалищную часть. Дисплазия может развиваться одновременно на нескольких участках шейки матки (рисунок 3). При этом нередко возможно сосуществование разныхстепеней неоплазии у одной пациентки.
Рисунок 3. Этапы развития дисплазии шейки матки
Эпидемиология
Эпидемиология.
Каждую минуту в мире умирает одна женщина по причине рака шейки матки. 85% заболевших приходится на развивающиеся страны. Показатели заболеваемости и смертности неуклонно растут.
В Узбекистане в 2017 г. выявлено 1556 случаев рака шейки матки, и умерло по причине РШМ 994 женщины, в 2021 г. выявлено 1827 случаев рака шейки матки, умерло 1103 женщин. По прогнозам к 2030 году количество заболеваний достигнет 2100 случаев, смертей – 1300 в год.
В Узбекистане в 2017 г. выявлено 1556 случаев рака шейки матки, и умерло по причине РШМ 994 женщины, в 2021 г. выявлено 1827 случаев рака шейки матки, умерло 1103 женщин. По прогнозам к 2030 году количество заболеваний достигнет 2100 случаев, смертей – 1300 в год.
Факторы и группы риска
К факторам, провоцирующим развитие ВПЧ-инфекции и РШМ относятся:
- ранее начало половой жизни,
- наличие нескольких половых партнеров,
- инфекции, передаваемые половым путём,
- многочисленные роды,
- эндогенные факторы (снижение иммунитета, авитаминоз),
- пролонгированный прием комбинированных оральных контрацептивов ВПЧ- позитивными женщинами
- курение, злоупотребление алкоголем. https://apps.who.int/iris/handle/10665/104174 http://gco.iarc.fr/
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния.
У подавляющего большинства пациенток с CIN I-III отсутствуют клинические проявления (бессимптомное течение). Крайне редко встречаются «контактные» кровянистые выделения из половых путей.
https://apps.who.int/iris/handle/10665/104174 http://gco.iarc.fr/
https://apps.who.int/iris/handle/10665/104174 http://gco.iarc.fr/
Диагностика
Диагностика интраэпителиальной неоплазии многослойного плоского эпителия слизистой шейки матки.
Критерии установления диагноза:
Методами диагностики заболеваний шейки матки являются:
-
осмотр шейки матки в зеркалах,
-
цитологическое исследование,
-
ПЦР ДНК ВПЧ,
-
расширенная кольпоскопия,
-
биопсия шейки матки
-
гистологическое исследование биопсийного материала шейки матки – проводится для верификации диагноза.
Жалобы и анамнез.
Оценка жалоб и общего состояния проводятся при каждом визите.
|
С
|
Рекомендуется всем женщинам проведение анализа анамнестических данных с целью выявления факторов риска развития CIN
|
-
Факторами риска развития CIN являются:
-
раннее начало половой жизни,
-
большое число и частая смена половых партнеров,
-
курение,
-
сопутствующие половые инфекции,
-
большое количество беременностей и родов,
-
наличие иммунокомпрометирующих заболеваний (гепатита B, С, ВИЧ),
-
иммуносупрессивная терапия,
-
длительный прием комбинированных оральных контрацептивов.
Необходимо уточнить возраст сексуального дебюта, число половых партнеров. При «контактных» кровянистых выделениях из половых путей уточнить их длительность, наличие в анамнезе хирургических вмешательств на шейке матки, ВПЧ инфекции, оценить результаты ранее проведенного цервикального скрининга. CIN I/II/III, включая преинвазивный рак шейки матки (CIS), не имеют патогномоничных клинических проявлений и диагностируются только морфологическими методами.
https://pubmed.ncbi.nlm.nih.gov/25984847/
https://iris.who.int/bitstream/handle/10665/144785/9789241548953_eng.pdf?sequence=1
Сбор анамнеза.
Сбор анамнеза должен включать следующие данные:
-
наличие жалоб (редко встречаются «контактные» кровянистые выделения из половых путей, наличие и характер болей, и др.),
-
возраст,
-
наличие профессиональных вредностей,
-
наличие вредных привычек (курение, алкоголь, наркотические вещества),
-
семейный анамнез (указание на наличие у родственников 1-й линии таких заболеваний как, сахарный диабет, тромбоэмболические осложнения (ТЭО), гипертоническая болезнь, психические заболевания, акушерские и перинатальные осложнения),
-
характер менструаций (возраст менархе, длительность и регулярность менструальногоцикла, продолжительность и объем менструального кровотечения, болезненность),
-
характер половой жизни: в каком возрасте началась, какой брак по счету, его продолжительность, особенности сексуальной жизни (либидо, оргазм, частота половых контактов, болезненность полового акта – диспареуния), количество половых партнеров;
-
предшествующие методы контрацепции;
-
акушерский анамнез (число беременностей и родов в анамнезе и их исход, наличие осложнений беременности, родов и/или абортов, весоростовые показатели и состояние здоровья рожденных детей, способ достижения беременности – самопроизвольная беременность или беременность в результате ВРТ),
-
перенесенные и имеющиеся гинекологические заболевания, оперативные вмешательства на органах малого таза,
Физикальное обследование.
|
С
|
Рекомендуется всем пациенткам проведение осмотра влагалища и шейки матки в зеркалах с целью выявления патологии шейки матки
|
Визуальный метод не позволяет определить интраэпителиальные поражения шейки матки. Для установления окончательного диагноза требуется цитологическое исследование мазков с экзо- и эндоцервикса, ВПЧ-тестирование, кольпоскопия, биопсия шейки матки с гистологическим исследованием биопсийного материала.
https://iris.who.int/bitstream/handle/10665/144785/9789241548953_eng.pdf?sequence=1
Лабораторные диагностические исследования.
|
А
|
Рекомендуется проведение цитологического исследования мазка шейки матки всем женщинам в возрасте от 21 до 65 лет с интервалом в 3 года с целью выявления CIN
|
Цитологическое исследование мазков с экзо- и эндоцервикса с использованием различных методов окраски исторически является первым и основным инструментом скрининга, несмотря на недостаточно высокую чувствительность данного метода для выявления CIN II + (чувствительность – 68,9%, специфичность – 97,2%).
Следует учитывать низкую воспроизводимость результатов повторных мазков, взятых течение 1,5 месяца после первичных. Рекомендован пересмотр аномальных мазков.
Около 10% традиционных цитологических мазков являются неадекватными, что связано с неправильной техникой забора материала и приготовления препарата.
Жидкостная цитология (liquid-based cytology) является более эффективной для выявления CIN, прежде, всего ввиду многократного уменьшения числа неадекватных мазков.
Кроме того, жидкостная цитология является более эффективной для выявления неоплазий. Методика позволяет уменьшить количество артефактов, связанных с высушиванием образцов, дает возможность избежать загрязнения проб эритроцитами и воспалительным экссудатом, что многократно уменьшает число неадекватных мазков.
Рекомендуется проведение цитологического исследования с шейки матки всем женщинам в возрасте от 21 до 65 лет с интервалом в 3 года.
При цитологическом исследовании наиболее важными диагностическими признаками являются: выявление клеточного и ядерного полиморфизма, выраженная анизохромия цитоплазмы, высокий ядерно-цитоплазматический индекс, неравномерное, грубое распределение хроматина в клетках, увеличение числа ядрышек, обнаружение фигур митотического деления.
Недостатком цитологического метода исследования является невозможность установления признаков инфильтративного роста в связи с отсутствием в цитологическом материале тканевого субстрата, это ограничивает диагностические пределы метода. Сложности цитологической диагностики связаны с тем, что поражение нередко носит множественный характер. Зачастую легкая степень дисплазии имеет тенденцию к распространению по направлению к периферии, тогда как CIS и инвазивный рак шейки матки преимущественно располагаются центрально.
Поскольку инфицирование ВПЧ играет ключевую роль в развитии РШМ ведущую роль в диагностике папилломавирусной инфекции (ПВИ) занимают молекулярно-биологические методы, направленные на обнаружение частиц ДНК вируса папилломы.
https://pubmed.ncbi.nlm.nih.gov/27598026/
https://pubmed.ncbi.nlm.nih.gov/31714325/
https://iris.who.int/bitstream/handle/10665/144785/9789241548953_eng.pdf?sequence=1
При цитологическом исследовании наиболее важными диагностическими признаками являются: выявление клеточного и ядерного полиморфизма, выраженная анизохромия цитоплазмы, высокий ядерно-цитоплазматический индекс, неравномерное, грубое распределение хроматина в клетках, увеличение числа ядрышек, обнаружение фигур митотического деления.
Недостатком цитологического метода исследования является невозможность установления признаков инфильтративного роста в связи с отсутствием в цитологическом материале тканевого субстрата, это ограничивает диагностические пределы метода. Сложности цитологической диагностики связаны с тем, что поражение нередко носит множественный характер. Зачастую легкая степень дисплазии имеет тенденцию к распространению по направлению к периферии, тогда как CIS и инвазивный рак шейки матки преимущественно располагаются центрально.
Поскольку инфицирование ВПЧ играет ключевую роль в развитии РШМ ведущую роль в диагностике папилломавирусной инфекции (ПВИ) занимают молекулярно-биологические методы, направленные на обнаружение частиц ДНК вируса папилломы.
https://pubmed.ncbi.nlm.nih.gov/27598026/
https://pubmed.ncbi.nlm.nih.gov/31714325/
https://iris.who.int/bitstream/handle/10665/144785/9789241548953_eng.pdf?sequence=1
Виды ВПЧ – тестов.
1. Полимеразная цепная реакция (ПЦР) – многократное копирование определенного участка вирусной ДНК типоспецифическими и видоспецифическими праймерами – качественное определение ВПЧ ВКР с типированием вируса. Рекомендуется исследование 10-14-21 типов ВПЧ ВКР.
2. RT (real-time) PCR – ПЦР в реальном времени – оценивается вирусная нагрузка в логарифмах, дифференцируются клинически значимые количества ВПЧ с рисками присутствия неоплазии от малозначимых, соответствующих транзиторной и разрешившейся ВПЧ-инфекции.
3. Качественные ДНК ПЦР-тесты на 14 типов ВПЧ ВКР с частичным генотипированием особо «опасных» типов ВПЧ (16 и 18 типов и остальных). Разработаны и применяются тест системы, которые позволяют выполнить идентификацию генов ВПЧ 16, 18, 31, 45, 51, 52 и 59 типов, остальные типы ВПЧ ВКР определяются в двух группах: 33, 56, 58, 66 и 35, 39, 68.
4. Тест двойного гибридного захвата (Hybrid Capture II – HC2) = ВПЧ Digene-тест. Тест основан на гибридизации участков ДНК ВПЧ ВКР с РНК-зондами, улавливаемых антителами с флюоресцентной меткой. При позитивном результате указывается клинически значимая концентрация 14 типов ВПЧ ВКР, в копиях ДНК ВПЧ на 1 мл образца. Отрицательный результаттеста практически исключает присутствие CIN II-III.
5. Тесты на основе обнаружения РНК ВПЧ: PreTect HPV-Proofer (амплификация мРНК Е6/Е7 пяти типов ВПЧ высокого риска (16, 18, 31, 33 и 45)) и Aptima (Gen-Probe) основан на целевом захвате и гибридизации мРНК Е7для выявления экспрессии мРНК 14 типов ВПЧ ВКР с частичным генотипированием.
2. RT (real-time) PCR – ПЦР в реальном времени – оценивается вирусная нагрузка в логарифмах, дифференцируются клинически значимые количества ВПЧ с рисками присутствия неоплазии от малозначимых, соответствующих транзиторной и разрешившейся ВПЧ-инфекции.
3. Качественные ДНК ПЦР-тесты на 14 типов ВПЧ ВКР с частичным генотипированием особо «опасных» типов ВПЧ (16 и 18 типов и остальных). Разработаны и применяются тест системы, которые позволяют выполнить идентификацию генов ВПЧ 16, 18, 31, 45, 51, 52 и 59 типов, остальные типы ВПЧ ВКР определяются в двух группах: 33, 56, 58, 66 и 35, 39, 68.
4. Тест двойного гибридного захвата (Hybrid Capture II – HC2) = ВПЧ Digene-тест. Тест основан на гибридизации участков ДНК ВПЧ ВКР с РНК-зондами, улавливаемых антителами с флюоресцентной меткой. При позитивном результате указывается клинически значимая концентрация 14 типов ВПЧ ВКР, в копиях ДНК ВПЧ на 1 мл образца. Отрицательный результаттеста практически исключает присутствие CIN II-III.
5. Тесты на основе обнаружения РНК ВПЧ: PreTect HPV-Proofer (амплификация мРНК Е6/Е7 пяти типов ВПЧ высокого риска (16, 18, 31, 33 и 45)) и Aptima (Gen-Probe) основан на целевом захвате и гибридизации мРНК Е7для выявления экспрессии мРНК 14 типов ВПЧ ВКР с частичным генотипированием.
|
А
|
Рекомендуется выполнить молекулярно-биологическое исследование отделяемого из цервикального канала на вирус папилломы человека (Papilloma virus) на всю группу ВПЧ ВКР (не менее 12 типов) всем женщинам в возрасте от 30 до 65 лет с целью выявления группы риска предрака и РШМ
|
|
А
|
Рекомендуется выполнить молекулярно-биологическое исследование отделяемого из цервикального канала на вирус папилломы человека (Papilloma virus) с целью выявления риска РШМ в качестве скринингового метода у всех женщин старше 30 лет каждые 5 лет (у ВПЧ негативных женщин) и ежегодно у ВПЧ позитивных женщин
|
|
А
|
ВПЧ-тестирование целесообразно проводить всем женщинам в качестве скринингового метода с 30 лет в сочетании с цитологическим исследованием цервикального образца (co-test)
|
|
А
|
Рекомендуется выполнить молекулярно-биологическое исследование отделяемого из цервикального канала на вирус папилломы человека (Papilloma virus) пациенткам с цитологическим заключением ASCUS, ASC-H, LSIL, HSIL вне зависимости от возраста
|
https://pubmed.ncbi.nlm.nih.gov/27598026/
https://pubmed.ncbi.nlm.nih.gov/28146625/
https://iris.who.int/bitstream/handle/10665/144785/9789241548953_eng.pdf?sequence=1
https://pubmed.ncbi.nlm.nih.gov/28146625/
https://iris.who.int/bitstream/handle/10665/144785/9789241548953_eng.pdf?sequence=1
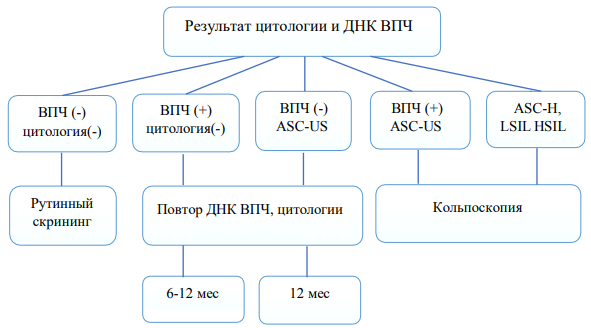
ВПЧ-тестирование рекомендуется выполнять:
● в качестве скринингового метода всем женщинам в возрасте от 30 до 65 лет с целью выявления группы риска предрака и РШМ;
● в качестве скринингового метода всем женщинам старше 30 лет каждые 5 лет у ВПЧ негативных женщин и ежегодно у ВПЧ позитивных;
● для разработки тактики ведения и разрешения сомнительных результатов цитологического исследования (ASC-US, ASC-H, LSIL);
● для мониторинга после лечения CIN II–III (рисунок 4)
● в качестве скринингового метода всем женщинам в возрасте от 30 до 65 лет с целью выявления группы риска предрака и РШМ;
● в качестве скринингового метода всем женщинам старше 30 лет каждые 5 лет у ВПЧ негативных женщин и ежегодно у ВПЧ позитивных;
● для разработки тактики ведения и разрешения сомнительных результатов цитологического исследования (ASC-US, ASC-H, LSIL);
● для мониторинга после лечения CIN II–III (рисунок 4)
В мире существуют и применяются различные методы организованного скрининга. Это использование ПАП теста, ПАП тест с сортировкой ПЦР ДНК ВПЧ, ПЦР ДНК ВПЧ с последующей кольпоскопией, ПЦР ДНК ВПЧ с сортировкой при помощи ПАП теста.
https://pubmed.ncbi.nlm.nih.gov/31714325/
https://www.who.int/publications/i/item/9789240031593
https://journals.lww.com/greenjournal/abstract/2016/01000/practice_bulletin_no_157_cervical_cancer.49.aspx
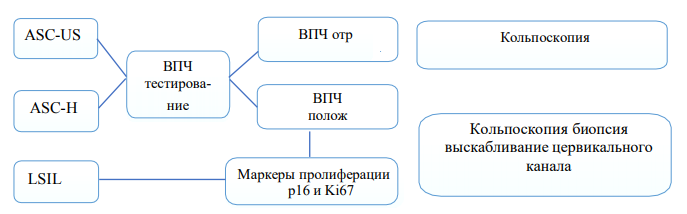
Рисунок 4. Использование ВПЧ теста совместно с цитологией для скрининга патологии шейки матки.
Целесообразно проведение генотипирования и определение вирусной нагрузки для оценки риска прогрессирования CIN до инвазии, а также для выбора тактики ведения и контроля эффективности лечения.
Аномальные результаты цитологии – ASCUS на фоне присутствия ДНК ВПЧ, а также ASC- H, LSIL, HSIL с без ДНК ВПЧ являются показанием для проведения кольпоскопии, по результатам которой определяется необходимость биопсии шейки матки. Кольпоскопия также показана всем инфицированным ВПЧ 16 и/или 18 типов, независимо от результатов цитологии. Диагноз и степень тяжести CIN устанавливаются только на основании гистологического исследования. Результаты цитологического исследования не всегда совпадают с гистологическим диагнозом.
|
А
|
Рекомендуется выполнить расширенную кольпоскопию для выявления измененных участков шейки матки (при визуальных изменениях шейки матки, при аномалиях в мазках от ASCUS и более, при положительном тесте на ВПЧ ВКР), а также с целью выбора места и метода биопсии шейки матки для верификации диагноза
|
|
А
|
Рекомендуется выполнить прицельную (при необходимости мультифокальную) кольпоскопически направленную биопсию шейки матки (punch-биопсия) с последующим гистологическим исследованием биопсийного (операционного) материала шейки матки пациенткам с цитологическим заключением ASCUS, ASC-H, LSIL при наличии ВПЧ ВКР и аномальной кольпоскопической картине для подтверждения диагноза.
|
Поскольку у одной пациентки возможно наличие CIN разной степени тяжести, постановка диагноза на основании ограниченных биоптатов может быть затруднена.
Проведение мультифокальной точечной биопсии шейки матки (punch-биопсия) возможно под кольпоскопическим контролем только у молодых женщин.
|
А
|
При результатах цитологии HSIL рекомендуется выполнить прицельную биопсию или эксцизию зоны трансформации шейки матки (в зависимости от результатов кольпоскопии) с последующим выскабливанием цервикального канала при 2-3 типе зоны трансформации и последующим гистологическим исследованием биопсийного материала шейки матки для верификации диагноза.
|
|
А
|
При результатах цитологии HSIL у женщин старше 50 лет и/или с зоной трансформации 2-3 типа рекомендуется проведение конизации шейки матки с обязательным выскабливанием остатка цервикального канала шейки матки и гистологическим исследованием биопсийного материала шейки матки для верификации диагноза
|
|
А
|
Рекомендуется для дифференциальной диагностики степени тяжести поражения шейки матки выполнить определение индекса пролиферативной активности экспрессии p16/Ki67 в ходе имунноцитохимического (ИЦХ) или р16 в ходе иммуногистохимического (ИГХ) исследований (при наличии возможности)
|
Иммугистохимическое исследование является дополнительным морфологическим методом. Положительная экспрессия р16 и Ki67 при ASCUS, ASC-H и LSIL предполагает большую вероятность наличия HSIL.
Рисунок 5. Определение маркеров пролиферации в зависимости от результата цитологического исследования.
https://pubmed.ncbi.nlm.nih.gov/30811902/
https://iris.who.int/bitstream/handle/10665/144785/9789241548953_eng.pdf?sequence=1
Лечение
Методы лечения цервикальной интраэпителиальной неоплазии.
|
A
|
Рекомендуется динамическое наблюдение c использованием цитологического исследования шейки матки 1 раз в 6 месяцев в течение 18-24 месяцев при LSIL (с целью раннего выявления прогрессирования)
|
У молодых и/или планирующих беременность пациенток с морфологически подтвержденным диагнозом LSIL (признаки ВПЧ инфекции, койлоцитоз, CIN I) предпочтительна выжидательная тактика c динамическим наблюдением за состоянием шейки матки в течение 18-24 месяцев в виде цитологического контроля 1 раз в 6 месяцев и ВПЧ- тестирования 1 раз в 12 месяцев.
|
А
|
Рекомендуется наблюдение пациенток после хирургического лечения HSIL с проведением цитологического исследования микропрепарата шейки матки и молекулярно-биологического исследования, отделяемого из цервикального канала на вирус папилломы человека (Papilloma virus) для раннего выявления рецидива
|
Первый co-test (цитологическое исследование и ВПЧ – тестирование) целесообразно выполнить через 3 месяца после хирургического лечения, затем каждые 6 месяцев в течение 2 лет, затем ежегодно в течение 20 лет. В случае подозрения на остаточное поражение (рецидив) рекомендована расширенная кольпоскопия и реконизация с патологоанатомическим исследованием, консультация врача-онколога (по показаниям). Для лечения рецидива CIN II/III предпочтительным методом является конизация, в некоторых случаях возможна гистерэктомия.
|
А
|
Рекомендовано динамическое наблюдение при LSIL c использованием цитологического исследования микропрепарата шейки матки 1 раз в 6 месяцев в течение 18-24 месяцев для раннего выявления рецидива заболевания
|
У молодых и/или планирующих беременность пациенток с гистологически подтвержденным диагнозом LSIL (признаки ВПЧ инфекции, койлоцитоз, CIN I) предпочтительна выжидательная тактика c динамическим наблюдением за состоянием шейки матки в течение 18-24 месяцев в виде цитологического контроля 1 раз в 6 месяцев и молекулярно-биологическое исследования отделяемого из цервикального канала на вирус папилломы человека (Papilloma virus) 1 раз в 12 месяцев. При отсутствии регрессии LSIL через 18-24 месяцев рекомендуется хирургическое лечение. После хирургического лечения LSIL через 3-6-12 месяцев проводится исследование шейки матки при помощи метода жидкостой цитологии и ВПЧ-тестирование.
После хирургического лечения HSIL через 3-6-12-18-24 месяцев проводится исследование шейки матки при помощи метода жидкостой цитологии и ВПЧ-тестирование.
Первый co-test (цитологическое исследование и ВПЧ – тестирование) целесообразно выполнить через 3 месяца после хирургического лечения, затем каждые 6 месяцев в течение 2 лет, затем ежегодно в течение 20 лет.
Хирургическое лечение рекомендуется в случае отсутствия регрессии через 18-24 месяцев
Первый co-test (цитологическое исследование и ВПЧ – тестирование) целесообразно выполнить через 3 месяца после хирургического лечения, затем каждые 6 месяцев в течение 2 лет, затем ежегодно в течение 20 лет.
Хирургическое лечение рекомендуется в случае отсутствия регрессии через 18-24 месяцев
|
С
|
Рекомендуется деструктивное или эксцизионное лечение (в зависимости от типа ЗТ) при сохранении поражений, соответствующих CIN I более 18-24 месяцев с целью профилактики прогрессирования
|
Деструкция возможна только при I типе ЗТ, когда визуализируется вся ЗТ с переходной зоной, у женщин до 35 лет, с отсутствием аномалий в мазках из цервикального канала, с минимальными рисками поражения эндоцервикальных крипт, при соответствии результатов цитологического, кольпоскопического и патологоанатомического исследований.
В остальных случаях и при сохранении CIN I даже в возрасте моложе 24 лет показана эксцизия.
|
A
|
Проводить петлевую эксцизию ЗТ рекомендуется женщинам старше 40 лет CIN I в биоптате эктоцервикса в связи с риском синхронных тяжелых поражений, скрытых в канале, вследствие длительной персистенции ВПЧ ВКР
|
|
А
|
Рекомендуется проводить хирургическое лечение при HSIL (CIN II, CIN III) – электроэксцизию шейки матки или конизацию в зависимости от типа ЗТ с последующим выскабливанием цервикального канала с целью исключения злокачественного процесса
|
При эксцизии необходимо иссечь всю ЗТ с переходной зоной и частью вышележащих эндоцервикальных крипт.
При ЗТ 1 типа, располагающейся полностью на эктоцервиксе, независимо от размера, глубина иссечения должна быть не менее 7 мм.
При ЗТ 2 типа глубина иссечения увеличивается до 10 мм.
При затруднении полноценной визуализации стыка МПЭ и ЦЭ (частично визуализируется или не визуализируется) и при наличии эндоцервикального компонента глубина иссечения не должна быть менее 15 мм – конизация.
У женщин до 25 лет с диагнозом CIN II в биоптате при р16- негативном результате ИГХ допустимо динамическое наблюдение с использованием цитологического контроля, ВПЧ- тестирования и кольпоскопии 1раз в 6 месяцев в течение 2 лет.
В случае отсутствие регресса, перейти к активной тактике (эксцизия шейки матки). У пациенток с диагнозом CIN II в биоптате при р16-позитивном результате ИГХ рекомендована безотлагательная эксцизия шейки матки.
|
С
|
Рекомендуются деструктивные методы только для CIN I с целью лечения заболевания
|
Условиями для методов деструкции (радиоволновая терапия шейки матки, аргоноплазменная деструкция, криодеструкция шейки матки, лазерная вапоризация шейки матки) являются:
-
полная визуализация зоны трансформации (I тип ЗТ – поражения ограничены эктоцервиксом); отсутствие кольпоскопических признаков поражения эктоцервикальных желез с погружением АБЭ в них;
-
отсутствие данных о вовлечении эндоцервикса в патологический процесс;
-
отсутствие хирургического лечения шейки матки в анамнезе; отсутствие расхождений между данными цитологического, кольпоскопического и патологоанатомического исследований.
|
А |
Рекомендуется при CIN III направлять пациенток к врачу- онкологу/акушеру- гинекологу или в специализированные гинекологические центры для выполнения конизации шейки матки с последующим выскабливанием цервикального канала и по показаниям - полости матки (сопутствующая патология эндометрия)
|
При гистологическом подтверждении диагноза и отсутствии опухолевых клеток в краях резекции и соскобе из оставшейся части цервикального канала проведенный объем хирургического вмешательства считается адекватным.
Если в краях резекции шейки матки или соскобе из оставшейся части цервикального канала обнаруживается HSIL, рекомендован цитологический, кольпоскопический и ВПЧ контроль через 2-4 месяца.
При наличии аномальных результатов цитологии и/или аномальной кольпоскопической картины и/или позитивном ВПЧ с сохранением вирусной нагрузки показана повторная конизация, в некоторых случаях возможно проведение гистерэктомии.
Пациентки после надвлагалищной ампутации матки наблюдаются по стандартной схеме в зависимости от возраста. При выявлении заболеваний шейки матки (CIN II/CIN III) оперативное лечение целесообразно проводить в стационарах 3 группы (стационары, оказывающие специализированную, в том числе высокотехнологичную, медицинскую помощь, разрабатывающие новые методы диагностики и лечения гинекологической патологии) в связи с изменениями топографо-анатомических взаимоотношений и возможными интраоперационными осложнениями. http://www.who.int/reproductivehealth/publications/cancers/9789241505260/en/
https://iris.who.int/bitstream/handle/10665/144785/9789241548953_eng.pdf?sequence=1
Не рекоменловано:
|
В |
Не рекомендуется применять локально средства, влияющие на тканевой обмен, содержащие алоэ, облепихи масло, масло шиповника и др., в связи с возможным усилением пролиферативных процессов и повышением риска возникновения CIN 1
|
Эти препараты могут способствовать усилению пролиферативных процессов и возникновению CIN.
|
А
|
Не рекомендуется медикаментозное лечение плоскоклеточных интраэпителиальных поражений в качестве самостоятельного метода
|
Лечение иммуномодуляторами продуктивного компонента ВПЧ-инфекции, инициирующей и поддерживающей прогрессию CIN патогенетически оправдано лишь в дополнение к эксцизии. В исследованиях с низким уровнем доказательности показан ряд положительных результатов в отношении суппозиториев на основе дииндолилметана, инозина пранобекса, гистидил-глицил-валил-серил-глицил-гистидил- глицил-глутаминил- гистидил-глицил-валил-гистидил-глицина и некоторых других препаратов.
Криодеструкция.
Криотерапия удаляет патологические участки на шейке матки путем их замораживания.
Это очень простая процедура и занимает не более 15 минут, выполняется амбулаторно. Эффект достигается аппликацией на шейку матки высокоохлажденного металлического диска с использованием двуокиси углерода или азота.
Диск прикладывается к шейке матки дважды по 3 минуты с пятиминутным интервалом. Необходима постоянная подачи газа во время процедуры. Криотерапия высоко эффективна при лечении небольших по размеру поражений, но при больших поражениях ее эффективность снижается менее 80%. В связи с очень небольшим количеством болевых рецепторов на шейке матки процедура протекает безболезненно, либо с незначительными болевыми ощущениями. Можно не использовать анестезию.
Данная процедура не является диагностической, поскольку не позволяет получить биоптат шейки матки.
Критерии отбора для криодеструкции:
Диск прикладывается к шейке матки дважды по 3 минуты с пятиминутным интервалом. Необходима постоянная подачи газа во время процедуры. Криотерапия высоко эффективна при лечении небольших по размеру поражений, но при больших поражениях ее эффективность снижается менее 80%. В связи с очень небольшим количеством болевых рецепторов на шейке матки процедура протекает безболезненно, либо с незначительными болевыми ощущениями. Можно не использовать анестезию.
Данная процедура не является диагностической, поскольку не позволяет получить биоптат шейки матки.
Критерии отбора для криодеструкции:
-
положительный Пап-тест
-
размеры поражений достаточны для охвата их насадкой криодеструктора, не более 2 мм от ее краев
-
поражение хорошо визуализируется и не переходит на цервикальный канал и стенки вагины
Критерии исключения для криодеструкции:
-
наличие или подозрение на железистую дисплазию, инвазивный рак шейки матки
-
поражение выступает за пределы крионасадки более чем на 2 мм
-
беременность
-
острое или подострое воспаление органов малого таза
-
менструация
Радиоволновая эксцизия зоны трансформации, конизация.
Метод представляет собой удаление патологически измененной ткани шейки тонкой петлей/парусом. Необходим радиоволновой источник со специальными насадками.
Цель – удаление патологически измененной ткани и подлежащей зоны трансформации. Удаленная ткань с шейки матки позволит персоналу лаборатории оценить глубину и характер поражения шейки матки. Поэтому данная процедура называется лечебно- диагностической. Преимуществом данной процедуры является возможность использования местной анестезии в амбулаторных условиях. Эффект достигается более чем в 90% случаях предраковых поражений шейки матки.
Критерии отбора для радиоволновой эксцизии зоны трансформации:
Цель – удаление патологически измененной ткани и подлежащей зоны трансформации. Удаленная ткань с шейки матки позволит персоналу лаборатории оценить глубину и характер поражения шейки матки. Поэтому данная процедура называется лечебно- диагностической. Преимуществом данной процедуры является возможность использования местной анестезии в амбулаторных условиях. Эффект достигается более чем в 90% случаях предраковых поражений шейки матки.
Критерии отбора для радиоволновой эксцизии зоны трансформации:
-
положительный Пап-тест
Критерии исключения для радиоволновой эксцизии зоны трансформации:
-
наличие или подозрение на инвазивный рак шейки матки, железистую дисплазию
-
беременность
-
острое или подострое воспаление органов малого таза
-
менструация
Электроэксцизия.
Электроэксцизия, или так называемая широкая электроэксцизия зоны трансформации представляет собой удаление патологически измененной ткани шейки тонкой высоконагретой петлей. Необходимисточник высокочастотный электрохирургический со специальными насадками. Цель – удаление патологически измененной ткани и подлежащей зоны трансформации. Удаленная ткань позволитперсоналу лаборатории оценить глубину и характер поражения шейки матки. Поэтому данная процедура называется лечебно- диагностической. Преимуществом данной процедуры является возможность использования местной анестезии в амбулаторных условиях. Эффект достигается более чем в 90% случаях предраковыхпоражений шейки матки. Неудачи в лечении (персистенция в сроки 6 или 12 месяцев) регистрируются менее чем у 10% женщин.
Критерии отбора для электроэксцизии:
-
положительный Пап-тест
-
образование, поражающее цервикальный канал не более чем на 1 см
Критерии исключения для электроэксцизии:
-
подозрение на инвазивный рак или железистую дисплазию
-
поражения, распространяющиеся на глубину более 1 см цервикального канала, или когда верхняя и нижняя границы поражения не видимы
-
острое воспаление шейки либо органов малого таза (необходимо проведение лечения воспаления)
-
беременность или срок после родов менее 12 недель
-
кровотечение
Ножевая конизация.
Ножевая конизация – процедура удаления конусообразного участка шейки, включающее часть экто- и эндоцервикса. Конизациярекомендована для лечения дисплазии, когда не доступно или невозможно лечение в амбулаторных условиях и для исключенияинвазивного рака шейки матки.
Это большее оперативное вмешательство включающее удаление большой части шейки матки скальпелем и обычно проводится под общей или региональной (спинальной, эпидуральной) анестезией. Занимает менее 1 часа. Пациент может быть отпущен домой в тот же день или на следующий день в виду возможных осложнений. Объемконизации определяется, прежде всего, размером и характером поражения шейки матки. Желание женщины иметь детей должно приниматься во внимание, так как конизация может вызвать стеноз цервикального канала. Удаленная ткань полностью направляется на гистологическое исследование.
Критерии отбора для ножевой конизации:
Это большее оперативное вмешательство включающее удаление большой части шейки матки скальпелем и обычно проводится под общей или региональной (спинальной, эпидуральной) анестезией. Занимает менее 1 часа. Пациент может быть отпущен домой в тот же день или на следующий день в виду возможных осложнений. Объемконизации определяется, прежде всего, размером и характером поражения шейки матки. Желание женщины иметь детей должно приниматься во внимание, так как конизация может вызвать стеноз цервикального канала. Удаленная ткань полностью направляется на гистологическое исследование.
Критерии отбора для ножевой конизации:
-
подозрение на микроинвазивную карциному
-
неоплазия железистого эпителия цервикального канала
-
положительные находки после кюретажа
-
отсутствие условий для выполнения ЭЭК
-
нет противопоказаний к анестезии
Критерии исключения для ножевой конизации:
-
острые воспалительные заболевания органов малого таза
-
беременность или со времени родов прошло менее 12 недель
-
подозрение на инвазивный рак
Возможные осложнения: кровотечение, обострение хронических воспалительных заболеваний гениталий. Кровотечения связаны обычно с местным воспалением и наряду с кровоостанавливающей терапией необходимо проведение антибактериальной терапии. http://www.who.int/reproductivehealth/publications/cancers/9789241505260/en/
https://iris.who.int/bitstream/handle/10665/144785/9789241548953_eng.pdf?sequence=1
Тактика ведения женщин после деструктивного лечения.
Через 2 недели после лечения женщина должна придти на контрольный осмотр. Женщина, которая не вернулась за результатом гистологии, должна быть найдена и направлена на консультацию к гинекологу.
Контрольный осмотр должен включать следующие обязательные мероприятия:
Контрольный осмотр должен включать следующие обязательные мероприятия:
- гинекологический осмотр – следует убедиться, что заживление идет нормально;
- необходимо вынести заключение о необходимости постоянного наблюдения;
- обсуждение результатов гистологического исследования и разработка дальнейшей тактики ведения.
Если пораженный участок был полностью удален, то женщине необходимо вернуться для осмотра через 3, 6 и 12 месяцев. В случаях положительных краев резекции (для дисплазий) необходимо довести до сведения женщины о необходимости более частого посещения врача и дополнительного лечения.
Посещения в сроки 3, 6 и 12 месяцев после лечения должны включать:
-
ЖЦ, ПЦР ДНК ВПЧ
-
кольпоскопию
-
биопсию при наличии рецидива процесса.
При отсутствии патологии в первые контрольные два визита, женщины, прошедшие лечение по поводу CIN 2, могут продолжать участвовать в скрининговой программе в соответствии с установленным планом.
Пациентки, прошедшие лечение по поводу CIN 3, должны ежегодно на протяжении 5 лет подвергаться повторному обследованию и после этого могут возвратиться к обычному скринингу. Если поражение прогрессирует либо персистирует – необходимо безотлагательное дополнительное лечение.
Особые случаи.
-
Зона трансформации не видна. Если кольпоскопия не удовлетворительна, должен быть проведен кюретаж цервикального канала. Если это невозможно, женщина направляется на радиоволновую хирургию или электроэксцизию и ножевую конизацию. Это очень важно, если результаты теста выявили поражение высокой степени.
-
Женщина в постменопаузе. У многих женщин в постменопаузе зона трансформации недоступна и если адекватный кюретаж не выполним, должна выполняться ножевая конизация или радиоволновая конизация.
-
Диагностика и лечение ВИЧ-положительных женщин проводится в том же объеме и по показаниям какдля всех остальных женщин.
Наблюдение
Пациентка должна вернуться к вам через 2-3 недели за результатом гистологии. Опции по лечению зависят от тяжести поражения и распространенности патологии на шейке матки и должны быть обсуждены с женщиной.
Госпитализация
Организация оказания медицинской помощи
Пациентки с цервикальной интраэпителиальной неоплазией наблюдаются в кабинетах онко-контроля учреждений первичной медико-санитарной помощи.
Показания для госпитализации:
- ножевая конизация шейки матки с диагностическим выскабливанием цервикального канала и слизистой полости матки;
- эксцизия шейки матки (при невозможности проведения в амбулаторных условиях, например, поражение шейки матки до сводов, предельное укорочение шейки матки, тяжелая соматическая патология, при отказе от выполнения процедуры под местной анестезией и т.д.).
Алгоритм организованного скрининга на предраковые заболевания и рак шейки матки в Узбекистане
- Вид скрининга: популяционный;
- Метод скрининга: ПЦР ДНК ВПЧ из шейки матки с сортировочным методом при помощи цитологического исследования мазка (жидкостная цитология) с окраской по методу Папаниколау;
- Интервал: 1 раз в 10 лет;
- Целевая группа: женщины 30-50 лет, не состоящие на диспансерном учете по поводу рака шейки матки;
- Интерпретация результатов цитологического исследования по Терминологической системе Бетесда (2001);
- Период действия программы – постоянно;
- Цель скрининга – выявление предраковых заболеваний шейки матки и рака шейки матки с последующим их лечением;
- Ожидаемые результаты – снижение заболеваемости и смертности от рака шейки матки.
Критерии включения в список для прохождения скрининга рака шейки матки:
|
Возрастной диапазон |
Подлежат скринингу | Не подлежат скринингу |
| 30, 40, 50 лет |
|
|
Схема проведения организованного скрининга рака шейки матки в Узбекистане

Информация
Источники и литература
-
Клинические протоколы, руководства, рекомендации Министерства здравоохранения Республики Узбекистан 2024
- Клинические протоколы, руководства, рекомендации Министерства здравоохранения Республики Узбекистан 2024 -
Информация
Руководители рабочей группы:
| № | Ф.И.О. | Должность | Место работы |
| 1 |
Надырханова Н.С. |
Директор, д.м.н. | РСНПМЦЗМиР |
| 2 | Алиева Д.А. | Заведующая научно- консультатитвной поликлиникой «Семья и брак», д.м.н., профессор | РСНПМЦЗМиР |
| 3 | Фазылова Ф.А. | Начальник Главного управления охраны материнства и детства, к.м.н. | Министерство здравоохранения Республики Узбекистан |
Список составителей:
| № | Ф.И.О. | Должность | Место работы |
| 1 | Асатова М.Ю. | акушер-гинеколог, д.м.н., профессор | ЦРПКМР |
| 2 | Нишанова Ф.П. | акушер-гинеколог, к.м.н. | РСНПМЦЗМиР |
| 3 | Иргашева С.У. | акушер-гинеколог, д.м.н. | РСНПМЦЗМиР |
| 4 | Агабабян Л.Р. | акушер-гинеколог, к.м.н, и.о. профессора | СамГМУ |
| 5 | Абдураимов Т.Ф. | акушер-гинеколог | РСНПМЦЗМиР |
| 6 | Ахмедова М.О. | акушер-гинеколог | РСНПМЦЗМиР |
| 7 | Мирзаева Ю.К. | акушер-гинеколог | РСНПМЦЗМиР |
| 8 | Икрамова Ш.Х. | акушер-гинеколог | РСНПМЦЗМиР |
Рецензенты:
| № | Ф.И.О. | Должность | Место работы |
| 1 | Юсупов У.Ю. | Д.м.н., профессор | РСНПМЦЗМиР |
| 2 | Каттаходжаева М.Х. | Заведующая кафедрой, д.м.н. профессор | Ташкентский государственный стоматологический институт, кафедра акушерства и гинекологии |
РСНПМЦЗМиР – Республиканский специализированный научно-практический медицинский центр здоровья матери и ребёнка
ЦРПКМР – Центр развития профессиональной квалификации медицинских работников
СамГМУ – Самаркандский государственный медицинский университет
Клинический протокол обсужден и рекомендован к утверждению путем достижения неформального консенсуса на заключительном Совещании рабочей группы с участием профессорско-преподавательского состава высших учебных заведений, членов ассоциации акушеров-гинекологов Узбекистана, организаторов здравоохранения (директоров филиалов ГУ РСНПМЦЗМиР и их заместителей), врачей региональных учреждений системы родовспоможения в онлайн-формате « 6 » _ декабря_ 2024 г., протокол №1. Руководитель рабочей группы - д.м.н. Надырханова Н.С., директор ГУ «РСНПМЦЗМиР».
Клинический протокол рассмотрен и утвержден Ученым Советом Республиканского Специализированного Научно-Практического Медицинского Центра здоровья матери и ребенка» « 17 » декабря 2024 г., протокол № 15
ЦРПКМР – Центр развития профессиональной квалификации медицинских работников
СамГМУ – Самаркандский государственный медицинский университет
Клинический протокол обсужден и рекомендован к утверждению путем достижения неформального консенсуса на заключительном Совещании рабочей группы с участием профессорско-преподавательского состава высших учебных заведений, членов ассоциации акушеров-гинекологов Узбекистана, организаторов здравоохранения (директоров филиалов ГУ РСНПМЦЗМиР и их заместителей), врачей региональных учреждений системы родовспоможения в онлайн-формате « 6 » _ декабря_ 2024 г., протокол №1. Руководитель рабочей группы - д.м.н. Надырханова Н.С., директор ГУ «РСНПМЦЗМиР».
Клинический протокол рассмотрен и утвержден Ученым Советом Республиканского Специализированного Научно-Практического Медицинского Центра здоровья матери и ребенка» « 17 » декабря 2024 г., протокол № 15
Внешняя экспертная оценка:
| № | Ф.И.О. | Должность | Место работы |
| 1 | Зароченцева Н.В. | Заместитель директора по научной работе д.м.н., профессор Российской академии наук, д.м.н. профессор | ГБУЗ МО «Московский областной научно-исследовательский институт акушерства и гинекологии им. акад. В.И. Краснопольского» (Москва, Российская Федерация) |
Список сокращений
| AGS | atypical glandular cells - атипические железистые клетки |
| ASC-H | atypical squamous cells cannot exclude HSIL – атипические клетки плоского эпителия, нельзя исключить тяжелое поражение |
| ASCUS | atypical squamous cells of undetermined significance – атипические клетки плоского эпителия неясного значения |
| CIN | cervical intraepithelial neoplasia - цервикальная интраэпителиальная неоплазия |
| CIN II + | CIN II, CIN III, рак шейки матки |
| CIS | carcinoma in situ |
| HSIL | high-grade squamous intraepithelial lesions– плоскоклеточное интраэпителиальное поражение высокой степени |
| LEEP | loop electrosurgical excision procedure – петлевая электрохирургическая эксцизионная процедура |
| LLETZ | large loop excision of the transformation zone – большая петлевая эксцизия зоны трансформации |
| LSIL | low-grade squamous intraepithelial lesions– плоскоклеточное интраэпителиальное поражение низкой степени |
| NILM | negative for intraepithelial lesion or malignancy – отсутствие интраэпителиальных поражений |
| SIL | squamous intraepithelial lesions – плоскоклеточное интраэпителиальное поражение |
| VIA | визуальная инспекция шейки матки после обработки уксусной кислотой |
| АБЭ | ацетобелый эпителий |
| АКК | аномальная кольпоскопическая картина |
| ВПЧ | вирус папилломы человека |
| ВПЧ ВКР | вирус папилломы человека высокого канцерогенного риска |
| ВРТ | вспомогательные репродуктивные технологии |
| ДНК | дезоксирибонуклеиновая кислота |
| ДЭК | диатермоэлектрокоагуляция |
| ЖЦ | жидкостная цитология |
| ЗТ | зона трансформации |
| ИППП | инфекции, передаваемые половым путем |
| ИЦН | истмико-цервикальная недостаточность |
| КОК | комбинированные оральные контрацептивы |
| КС | кольпоскопия |
| МПЭ | многослойный плоский эпителий |
| ПЦР | полимеразная цепная реакция |
| РШМ | рак шейки матки |
| ТЭО | тромбоэмболические осложнения |
| ЦИН | цервикальная интраэпителиальная неоплазия |
| ЦЭ | цилиндрический эпителий |
| РВХ - конизация | радиоволновая хирургическая конизация шейки матки |
Приверженность рекомендациям протокола:
В протоколе представлены рекомендации общего характера, разработанные на основе имеющихся на момент публикации доказательств.
Если в практической деятельности принимается решение отойти от рекомендаций данного протокола, то врачи-клиницисты должны задокументировать в истории болезни пациента следующие данные:
Если в практической деятельности принимается решение отойти от рекомендаций данного протокола, то врачи-клиницисты должны задокументировать в истории болезни пациента следующие данные:
- кем принято такое решение;
- подробное обоснование решения отхода от протокола;
- какие рекомендации по ведению пациента были приняты.
Рекомендации не охватывают все элементы клинической практики, это означает, что врачи должны обсуждать с пациентами индивидуальную тактику ведения, принимая во внимание потребности пациента, придерживаясь принципа уважительного конфиденциального общения. Это включает:
- Использование услуг переводчика в случае необходимости;
- Консультирование пациента и получение информированного согласия на ту или иную манипуляцию или тактику введения;
- Обеспечение ухода в рамках требований законодательства и соблюдения стандартов профессионального поведения;
- Документирование любой тактики ведения и ухода в соответствии с общими и местными требованиями.
Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств):
| УУР | Расшифровка |
| A | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
| B | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
| C | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Приложения.
Методология разработки протокола.
Национальный клинический протокол разработан в соответствии с требованиями Указа Президента Республики Узбекистан №5590 «О комплексных мерах по совершенствованию системы здравоохранения Республики Узбекистан» от 7.12.2018 г. и приказа Министерства здравоохранения Республики Узбекистан № 52 «Об утверждении методологии разработки, утверждения, и внедрения в медицинскую практику национальных/ локальных клинических протоколов и стандартов» от 23.02.2024 г.
В разработке протокола принимали участие специалисты акушеры-гинекологи ГУ «Республиканский специализированный научно-практический медицинский центр здоровья матери и ребенка» и его региональных филиалов, Центра развития профессиональной квалификации медицинских работников, Республиканского перинатального центра, Ташкентской медицинской академии.
Создание данного протокола продиктовано медицинской значимостью проблемы, различиями в подходах в медицинской практике, существованием большого количества современных источников доказательств эффективности вмешательств.
Конфликт интересов: перед началом работы по созданию данного протокола все члены рабочей группы заполнили письменное Уведомление о конфликте интересов. Никто из членов авторского коллектива не имел коммерческой заинтересованности или другого конфликта интересов с фармацевтическими компаниями или другими организациями, производящими продукцию для применения в клинической практике по теме данного протокола.
Вовлечение заинтересованных сторон: при разработке руководящих принципов протокола и рекомендаций запрошены и учтены мнения целевой группы населения (пациентов и членов их семей), включая медицинские (польза для здоровья, побочные эффекты и риски вмешательств), этические, культурные, религиозные аспекты. Запрос мнений осуществлялся путем неформального интервью женщин в профильных отделениях ГУ РСНПМЦЗМиР.
Сбор, обобщение и критическая оценка доказательств.
Методы, использованные для сбора доказательств: поиск в электронных базах данных, библиотечные ресурсы. В качестве основных источников информации использовались клинические руководства медицинских сообществ и других профильных организаций разных стран на английском и русском языках за период 2013-2023 гг, приоритетными при разработке протокола явились данные последних 5 лет (с 2018 г.). В процессе разработки протокола не использовались учебники и монографии как источники с низким качеством доказательств или отсутствием таковых. Систематический поиск основных источников данных включал следующие базы данных:
В разработке протокола принимали участие специалисты акушеры-гинекологи ГУ «Республиканский специализированный научно-практический медицинский центр здоровья матери и ребенка» и его региональных филиалов, Центра развития профессиональной квалификации медицинских работников, Республиканского перинатального центра, Ташкентской медицинской академии.
Создание данного протокола продиктовано медицинской значимостью проблемы, различиями в подходах в медицинской практике, существованием большого количества современных источников доказательств эффективности вмешательств.
Конфликт интересов: перед началом работы по созданию данного протокола все члены рабочей группы заполнили письменное Уведомление о конфликте интересов. Никто из членов авторского коллектива не имел коммерческой заинтересованности или другого конфликта интересов с фармацевтическими компаниями или другими организациями, производящими продукцию для применения в клинической практике по теме данного протокола.
Вовлечение заинтересованных сторон: при разработке руководящих принципов протокола и рекомендаций запрошены и учтены мнения целевой группы населения (пациентов и членов их семей), включая медицинские (польза для здоровья, побочные эффекты и риски вмешательств), этические, культурные, религиозные аспекты. Запрос мнений осуществлялся путем неформального интервью женщин в профильных отделениях ГУ РСНПМЦЗМиР.
Сбор, обобщение и критическая оценка доказательств.
Методы, использованные для сбора доказательств: поиск в электронных базах данных, библиотечные ресурсы. В качестве основных источников информации использовались клинические руководства медицинских сообществ и других профильных организаций разных стран на английском и русском языках за период 2013-2023 гг, приоритетными при разработке протокола явились данные последних 5 лет (с 2018 г.). В процессе разработки протокола не использовались учебники и монографии как источники с низким качеством доказательств или отсутствием таковых. Систематический поиск основных источников данных включал следующие базы данных:
- World Health Organization - https://www.who.int/ru
- Society of Obstetricians and Gynecologists of Canada (SOGS) - http://sogc.medical.org
- National Institute for Clinical Excellence (NICE) - http://www.nice.org.uk
- Royal College of Obstetricians and Gynecologists (RCOG) - http://www.rcog.org.uk
- Australian National Health and Medical Research Council (NHMRC) - http://www.health.gov.au
- New Zealand Guidelines Group (NZGG) - http://www.nzgg.org.nz
- Health professionals in Queensland public and private maternity and neonatal services - Guidelines@health.qld.gov.au
- International Federation of Gynaecology and Obstetrics - https://www.figo.org/
- Российское общество акушеров-гинекологов (РОАГ) - https://roag- portal.ru/clinical_recommendations
В качестве исходного документа для заимствования и адаптации рекомендаций использовались несколько клинических руководств из разных стран.
В случаях, когда в найденных и оцененных клинических руководствах отсутствовали требуемые рекомендации или они были описаны недостаточно/неполно, не подкреплялись доказательствами, противоречили друг другу, были неприменимы в местных условиях или устарели проводился дополнительный поиск рандомизированных контролируемых испытаний, систематических обзоров, мета-анализов, когортных исследований в базах данных:
http://www.cochrane.org,
http://www.bestevidence.com,
http://www.ncbi.nlm.nih.gov/PubMed,
http://www.bmj.com,
http://www.medmir.com,
http://www.medscape.com,
http://www.nlm.nih.gov и др.
Проведена критическая оценка качества найденных источников с учетом современности клинических руководств, методологии их разработки, ранжирования рекомендаций по уровням достоверности доказательств и убедительности/силы, применимости к местным условиям оказания медицинской помощи.
Описание методов для формулирования рекомендаций. Окончательные рекомендации протокола формулировались путем заимствования части рекомендаций из нескольких клинических руководств в изначальной редакции без изменений, адаптации части рекомендаций клинических руководств к местным условиям, разработки рекомендаций на основе дополнительного поиска литературы. Рекомендации с низким качеством доказательств и не применимые в местных условиях исключались. Заимствованные из клинических руководств рекомендации принимались с тем уровнем доказательности, с каким они были опубликованы изначально. В случае, если авторами зарубежных клинических руководств использовались другие шкалы уровней доказательности, то они (если это возможно) переводились в систему GRADE. В случаях, когда встречались одинаковые рекомендации в разных клинических руководствах, но с разным уровнем доказательности, рабочая группа включала в протокол ту рекомендацию, которая была сформулирована на основе более убедительных научных данных.
Протокол документально рецензирован внутренними и внешними экспертами. В случае, если доказательная база рекомендаций была более весома, чем мнение рецензента/эксперта, или более приемлема для применения в условиях целевого звена здравоохранения, члены рабочей группы, оставляли за собой право отклонить предложения рецензентов.
При формировании окончательной редации протокола проект протокола был представлен для обсуждения широкому кругу специалистов из числа профессорско-преподавательского состава высших учебных заведений, членов ассоциации акушеров-гинекологов Узбекистана, организаторов здравоохранения (директора региональных филиалов ГУ РСНПМЦЗМиР и их заместители), врачей региональных учреждений системы родовспоможения. Проект протокола для обсуждения был доступен на официальном сайте ГУ РСНПМЦЗМиР https://akusherstvo.uz// Отзывы принимались по электронной почте с заполнением стандартного Листа отзывов. Заключительное обсуждение проекта протокола и формирование окончательной его редакции проводилось в онлайн формате с участием рабочей группы, рецензентов, эксперта ВОЗ и широкого круга заинтересованных специалистов путем достижения неформального консенсуса.
В рекомендациях данного клинического протокола все сведения ранжированы по уровню убедительности рекомендаций (УУР) в зависимости от количества и качества исследований по данной проблеме.
http://www.bestevidence.com,
http://www.ncbi.nlm.nih.gov/PubMed,
http://www.bmj.com,
http://www.medmir.com,
http://www.medscape.com,
http://www.nlm.nih.gov и др.
Проведена критическая оценка качества найденных источников с учетом современности клинических руководств, методологии их разработки, ранжирования рекомендаций по уровням достоверности доказательств и убедительности/силы, применимости к местным условиям оказания медицинской помощи.
Описание методов для формулирования рекомендаций. Окончательные рекомендации протокола формулировались путем заимствования части рекомендаций из нескольких клинических руководств в изначальной редакции без изменений, адаптации части рекомендаций клинических руководств к местным условиям, разработки рекомендаций на основе дополнительного поиска литературы. Рекомендации с низким качеством доказательств и не применимые в местных условиях исключались. Заимствованные из клинических руководств рекомендации принимались с тем уровнем доказательности, с каким они были опубликованы изначально. В случае, если авторами зарубежных клинических руководств использовались другие шкалы уровней доказательности, то они (если это возможно) переводились в систему GRADE. В случаях, когда встречались одинаковые рекомендации в разных клинических руководствах, но с разным уровнем доказательности, рабочая группа включала в протокол ту рекомендацию, которая была сформулирована на основе более убедительных научных данных.
Протокол документально рецензирован внутренними и внешними экспертами. В случае, если доказательная база рекомендаций была более весома, чем мнение рецензента/эксперта, или более приемлема для применения в условиях целевого звена здравоохранения, члены рабочей группы, оставляли за собой право отклонить предложения рецензентов.
При формировании окончательной редации протокола проект протокола был представлен для обсуждения широкому кругу специалистов из числа профессорско-преподавательского состава высших учебных заведений, членов ассоциации акушеров-гинекологов Узбекистана, организаторов здравоохранения (директора региональных филиалов ГУ РСНПМЦЗМиР и их заместители), врачей региональных учреждений системы родовспоможения. Проект протокола для обсуждения был доступен на официальном сайте ГУ РСНПМЦЗМиР https://akusherstvo.uz// Отзывы принимались по электронной почте с заполнением стандартного Листа отзывов. Заключительное обсуждение проекта протокола и формирование окончательной его редакции проводилось в онлайн формате с участием рабочей группы, рецензентов, эксперта ВОЗ и широкого круга заинтересованных специалистов путем достижения неформального консенсуса.
В рекомендациях данного клинического протокола все сведения ранжированы по уровню убедительности рекомендаций (УУР) в зависимости от количества и качества исследований по данной проблеме.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.