Системная радионуклидная терапия костных метастазов радиофармацевтическим препаратом самарием-153
СРНТ c самарий [153Sm]
 Версия: Клинические протоколы МЗ РК - 2024 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2024 (Казахстан)
Злокачественное новообразование бронхов и легкого (C34), Злокачественное новообразование молочной железы (C50), Злокачественное новообразование предстательной железы (C61), Злокачественное новообразование щитовидной железы (C73)
Онкология, Ядерная медицина
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «01» июля 2025 года
Протокол №234
КЛИНИЧЕСКИЙ ПРОТОКОЛ МЕДИЦИНСКОГО ВМЕШАТЕЛЬСТВА
СИСТЕМНАЯ РАДИОНУКЛИДНАЯ ТЕРАПИЯ КОСТНЫХ МЕТАСТАЗОВ РАДИОФАРМАЦЕВТИЧЕСКИМ ПРЕПАРАТОМ САМАРИЕМ-153
СРНТ c самарий [153Sm] – один из методов паллиативного лечения костных метастазов различных злокачественных новообразований, основанный на избирательном накоплении метастатической тканью радиоизотопа [1,2].
РФП с ¹⁵³Sm обладают [3]:
• β-излучением со средней линейной передачей энергии в 220 КэВ;
• Средним диапазоном излучения в мягких тканях – до 0.33 см;
• γ-излучением с фотопиком в 103 КэВ;
• Периодом полураспада – 46.3 часа.
Код(ы) МКБ-10:
Дата разработки и пересмотра протокола: 2024 год.
ВВОДНАЯ ЧАСТЬ
Код(ы) МКБ-10:
|
Код
|
Название |
|
C34
|
Злокачественное новообразование бронхов и легкого |
| C50 | Злокачественное новообразование молочной железы |
| С61 | Злокачественное новообразование предстательной железы |
| С73 | Злокачественное новообразование щитовидной железы |
Дата разработки и пересмотра протокола: 2024 год.
Пользователи протокола: онкологи (урологи, маммологи, химиотерапевты), врачи ядерной медицины.
Категория пациентов: взрослые.
Сокращения, используемые в протоколе:
¹⁵³Sm – изотоп самария-153
⁹⁹ᵐTc – изотоп технеция-99m
АЧТВ – активированное частичное тромбопластиновое время
ВАШ – визуально-аналоговая шкала оценки боли
Зв – зиверт
КТ – компьютерная томография
КэВ – килоэлектронвольт
МБк – мегабеккерель
МНО – международное нормализованное отношение
МРТ – магниторезонансная томография
ОСГ – остеосцинтиграфия
ОФЭКТ – однофотонная эмиссионная компьютерная томография
ПК – персональный компьютер
РФП – радиофармпрепарат
СРНТ – системная радионуклидная терапия
ССС – сердечно-сосудистая система
ЭКГ – электрокардиография
ЭХО-КГ – эхокардиография
мкЗв/час – микрозиверт в час
Шкала уровня доказательности:
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или случай-контроль исследований; или высококачественное (++) когортное или случай-контроль исследование с очень низким риском систематической ошибки; или РКИ с невысоким (+) риском систематической ошибки; результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или случай-контроль исследование; или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+), результаты которых могут быть распространены на соответствующую популяцию; или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев, неконтролируемое исследование, или мнение экспертов. |
Лечение
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Цель проведения процедуры/вмешательства:
1) Повысить эффективность паллиативного лечения больных с костными метастазами [4–14];
2) Стойкое подавление болевого синдрома [4,5,11,15,16,16–18];
3) Снижение потребности в анальгетиках [5,8,19];
4) Повышение качества жизни пациентов [5,7,12,17,20,21];
5) Повторно проводимые курсы CРНТ, комбинированные и сочетанные схемы применения РФП позволяют тормозить прогрессирование костных метастазов и увеличивать выживаемость пациентов [2,5,6,8,11,12,19,21–26].
Показания и противопоказания к процедуре/ вмешательству:
Показания к процедуре/ вмешательству: [11,19,27,28]
• Множественные метастазы в кости;
• Болевой синдром, в том числе резистентный к наркотическим анальгетикам;
• Прогрессирование костных метастазов на фоне лечения.
Противопоказания к процедуре/вмешательству:
Абсолютные противопоказания: [19,25,27]
• Беременность;
• Лактация.
Относительные противопоказания: [19]
• снижение показателей крови:
- уровень тромбоцитов ниже 100 × 10⁹/л;
- уровень лейкоцитов ниже 2,5 × 10⁹/л.
• тяжелое общее состояние пациента, статус активности по Карновскому – менее 60 баллов, ожидаемая продолжительность жизни менее 4 недель.
• тяжелая коагулопатия:
- фибриноген менее 1,0 г/л;
- МНО и/или АЧТВ более 1,5 от нормы;
- гипокоагуляция на тромбоэластографии.
• угроза возникновения патологического перелома позвонков с компрессией спинного мозга.
• быстрое развитие внекостных метастазов (например, метастазы печени, легких, головного мозга и т.п.).
• одновременно проводимая миелосупрессивная терапия.
• острые психические расстройства.
• дети до 18 лет, за исключением ситуаций, когда лечебный эффект превышает риск, связанный с воздействием радиоактивного излучения.
Перечень основных и дополнительных диагностических мероприятий [19].
• общий анализ крови (определение уровня гемоглобина, эритроцитов, лейкоцитов, тромбоцитов с целю оценки состояния костного мозга), СОЭ (с целью исключения воспалительного процесса); критерии в пределах референтных значений;
• общий анализ мочи (определение удельного веса, белка в моче, количества лейкоцитов, эритроцитов с целью оценки функционального состояния мочевыделительной системы); критерии в пределах референтных значений;
• биохимический анализ крови (общий белок, мочевина, креатинин, общий и прямой билирубин, ЛДГ, АЛТ, АСТ, щелочная фосфатаза с целью функциональной оценки почек и печени, ионизированный кальций с целю определения послеоперационной гипокальциемии); критерии в пределах референтных значений;
• коагулограмма (протромбиновое время, протромбиновый индекс, МНО, АЧТВ, Клаусс-фибриноген с целью функциональной оценки свертывающей и противосвертывающей систем крови); критерии в пределах референтных значений;
• ЭКГ с целью с целью исключения сердечно-сосудистой патологии, в частности аритмии;
• рентгенография органов грудной клетки с целью исключения сопутствующей острой легочной патологии и метастатического поражения легких;
• МРТ / КТ вовлеченных анатомических зон с целью определения наличия остеобластических или смешанных форм костных метастазов [19,28,29];
• ОСГ всего тела с остеотропными диагностическими препаратами на основе ⁹⁹ᵐTc с целью исследования активного накопления в метастазах и оценки эффективности лечения [19,22];
• мультиспиральная КТ позвоночника (при подозрении на угрозу или наличие патологического перелома позвоночника);
• консультация терапевта с целью, оценки общего соматического статуса;
• консультация онколога (уролога, маммолога) с кратким заключением об анамнезе пациента, направляемого на СРНТ, данных объективного осмотра, проводимых ранее лечебно-диагностических процедурах;
• консультация кардиолога/аритмолога (при наличии сопутствующих заболеваний со стороны ССС).
Перечень дополнительных диагностических мероприятий
• ЭХО-КГ (по показаниям, при наличии сопутствующей патологии ССС);
• ультразвуковое исследование органов брюшной полости и забрюшинного пространство по показаниям с целью исключения сопутствующей патологии желудочно-кишечного тракта;
• фиброгастродуоденоскопия с целью исключения эрозивного или язвенного процесса в пищеводе или желудке с целью предотвращения кровотечения в процессе лечения;
• консультация узких специалистов (при наличии сопутствующих заболеваний).
Требования к проведению процедуры/вмешательства:
Госпитализация проводится в специализированное отделение Центра ядерной медицины в соответствии с Приказом Министра здравоохранения Республики Казахстан от 24 марта 2022 года № ҚР- ДСМ-27 Об утверждении Стандарта оказания медицинской помощи в стационарных условиях в Республике Казахстан (Зарегистрирован в Министерстве юстиции Республики Казахстан 25 марта 2022 года № 27218); Приказом Министра здравоохранения Республики Казахстан от 25 августа 2022 года № ҚР ДСМ-90 Об утверждении Санитарных правил "Санитарно-эпидемиологические требования к радиационно-опасным объектам" (Зарегистрирован в Министерстве юстиции Республики Казахстан 26 августа 2022 года № 29292); Приказом Министра здравоохранения Республики Казахстан от 2 августа 2022 года № ҚР ДСМ-71 Об утверждении гигиенических нормативов к обеспечению радиационной безопасности (Зарегистрирован в Министерстве юстиции Республики Казахстан 3 августа 2022 года № 29012).
Для пациентов с метастатическим раком молочной железы и кастрат-резистентным метастатическим раком предстательной железы заключение мультидисциплинарной группы с предоставлением выписного эпикриза (анамнез пациента, данных объективного осмотра, проводимых ранее лечебно-диагностических процедурах);
Оснащение:
• компьютер с программным обеспечением обработки данных;
• ламинарный шкаф;
• свинцовые контейнеры;
Оборудование для контроля радиационной обстановки помещений, персонала и пациента:
• Стационарная система измерения мощности дозы пациента с возможностью калибровки под радионуклиды ¹⁵³Sm. Наличие программного обеспечения позволяющее отображать на мониторе ПК в режиме реального времени мощность дозы излучения от пациента;
• Измеритель-сигнализатор с многоканальной стационарной системой, предназначенный для проведения контроля радиационной обстановки на территории радиационно-опасных объектов и помещений («активные» палаты). Наличие звуковой и световой сигнализации превышения рабочих и аварийных пороговых уровней для каждого блока детектирования, программное обеспечение позволяющее отображать на мониторе ПК текущую радиационную обстановку на контролируемом участке;
• Термолюминесцентный индивидуальный дозиметр накопительного типа, диапазон измерения: от 20 мкЗв до 10 Зв, диапазон энергий фотонного излучения в соответствии с используем радионуклидом (¹⁵³Sm);
• Дозиметр индивидуальный гамма-излучения для непрерывного измерения мощности эквивалентной дозы от 0.1 мкЗв/ч до 100 мЗв/ч; и эквивалентной дозы от 1,0 мкЗв до 25 Зв; диапазон энергий фотонного излучения в соответствии с используем радионуклидом (¹⁵³Sm);
• Дозиметр гамма и рентгеновского излучения импульсный, диапазон измерений излучения: от 0,1 мкЗв/ч до 10 Зв/ч, диапазон энергий излучения в соответствии с используем радионуклидом (¹⁵³Sm);
• Дозиметр-радиометр для измерения плотности потока бета-частиц с загрязненных поверхностей, диапазон измерения плотности потока бета-частиц: от 6 до 106 мин⁻¹ × см⁻², диапазон энергий бета-частиц в соответствии с используем радионуклидом (¹⁵³Sm);
• Радиометр для измерения суммарной бета-активности счетных образцов на основе аэрозольных аналитических фильтров типа АФА, диапазон измерения суммарной активности: от 0,1 до 104 Бк (бета-канал), диапазон энергий в соответствии с используем радионуклидом (¹⁵³Sm);
• Пункт радиометрического контроля - установка контроля поверхностного загрязнения персонала для измерений поверхностной активности гамма-излучающих радионуклидов;
• Свинцовые контейнеры;
• Средства индивидуальной защиты и органов дыхания для персонала;
• Фартук рентгенозащитный;
• Шапочка рентгенозащитная;
• Воротник рентгенозащитный;
• Очки рентгенозащитные;
• Ширма рентгенозащитная;
• Комплект средств ликвидации последствий аварии.
Для проведения сцинтиграфии всего тела:
• ОФЭКТ/КТ, рабочая врачебная станция, программа на СВТ, коллиматор низкой энергии.
Специальное оборудование для отделений радионуклидной терапии:
• система сбора, хранения жидких радиоактивных отходов (специальная канализация): - бак для агрессивных сред (бак для жидких радиоактивных отходов жизнедеятельности пациентов для выдержки до требуемой активности); - вакуумная насосная станция (для создания отрицательного давления для специальной канализации);
• специальная вентиляция;
• специальная прачечная;
• система дистанционного бесконтактного видеонаблюдения за пациентом в каждой «активной» палате;
• система обратной связи медицинского работника с каждым пациентом и с кнопкой экстренного вызова.
Оснащение для радиофармацевта для фасовки:
• Вытяжной защитный шкаф с манипулятором для фасовки РФП;
• Дозкалибратор;
• Набор химической посуды для фасовки раствора РФП с ¹⁵³Sm для СРНТ;
• РФП раствор самарий [153Sm] для СРНТ.
Подготовка пациентов к процедуре: Специальной подготовки не требуется. Специальной диеты или ограничений в приеме пищи не требуется. В день введения рекомендуется употреблять больше жидкости (на 1,0–1,5 литра в сутки больше, чем обычно) для улучшения выведения несвязанного препарата естественным путём [27,30,31].
Критерии эффективности СРНТ болевого синдрома [5]:
Проведение процедуры.
Подготовка пациентов к процедуре: Специальной подготовки не требуется. Специальной диеты или ограничений в приеме пищи не требуется. В день введения рекомендуется употреблять больше жидкости (на 1,0–1,5 литра в сутки больше, чем обычно) для улучшения выведения несвязанного препарата естественным путём [27,30,31].
Расчет стандартной активности РФП:
• Раствор следует вводить внутривенно медленно. Стандартная доза для пациента составляет 18,5 МБк - 37 МБк на 1 кг веса [18,19,32,33,37]. После введения препарата пациент должен выпить жидкость в объеме 100 мл на 10 кг веса. При невозможности перорального потребления жидкости следует обеспечить водную нагрузку путём внутривенного введения 20-30 мл/кг физиологического раствора в течение 4-6 часов, при отсутствии противопоказаний со стороны ССС для адекватного выведения РФП через мочевыделительную систему [30].
Расчет вводимого объема препарата производится следующим образом:
• Стерильным шприцом отмеряется 1 мл РФП и проводится измерение объемной активности препарата на дозкалибраторе (объемной активностью препарата называется активность изотопа ¹⁵³Sm в 1 мл препарата).
• Расчет объема препарата, который необходимо ввести пациенту зависит от веса пациента и рассчитывается с использованием следующей формулы. Например:
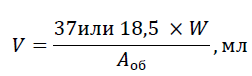
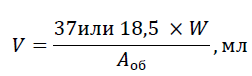
где:
• V – объем препарата для введения в мл,
• W – вес пациента в кг,
• Аоб – активность во флаконе в МБк.
Раствор для инъекций самарий [153Sm] вводится внутривенно однократно. Допустимый интервал между повторным введением от 8 недель [19].
Раствор для инъекций самарий [153Sm] вводится внутривенно однократно. Допустимый интервал между повторным введением от 8 недель [19].
Фасовка РФП для СРНТ:
Фасовка РФП с самарий [153Sm] осуществляется радиофармацевтом в процедурном кабинете, в вытяжном шкафу:
1. Набрать в асептических условиях, через резиновую пробку, шприцем раствор ¹⁵³Sm требуемой активности;
2. Произвести измерение активности шприца на дозкалибраторе;
3. Значение набранной активности заносят в протокол;
4. Промаркировать шприц для передачи процедурной медицинской сестре;
5. На готовый шприц надеть защитную свинцовую насадку и поместить в защитный контейнер;
6. Промаркировать контейнер со шприцем для передачи процедурной медицинской сестре;
7. Радиофармацевт передает расфасованный РФП с ¹⁵³Sm медицинской сестре.
Рекомендации после проведения СРНТ: Мониторинг клинического состояния с целью оценки паллиативного эффекта рекомендовано проводить начиная со 2 недели, с последующей оценкой через 1,5 и 3 месяца от момента введения РФП [4,12,21,34,35]. Осуществляется подробная консультация врачом. Для определения динамики костных метастазов повторное сканирование костей скелета с ⁹⁹ᵐTc выполняется через 1,5 и 3 месяца от начала лечения. При позитивном ответе на первое введение 153Sm, повторное введение проводится не ранее чем 2 месяца после применения [19].
• Беременность:
Рекомендации после проведения СРНТ: Мониторинг клинического состояния с целью оценки паллиативного эффекта рекомендовано проводить начиная со 2 недели, с последующей оценкой через 1,5 и 3 месяца от момента введения РФП [4,12,21,34,35]. Осуществляется подробная консультация врачом. Для определения динамики костных метастазов повторное сканирование костей скелета с ⁹⁹ᵐTc выполняется через 1,5 и 3 месяца от начала лечения. При позитивном ответе на первое введение 153Sm, повторное введение проводится не ранее чем 2 месяца после применения [19].
Меры предосторожности после СРНТ [27,30]:
• Контакты:
- необходимо избегать тесного контакта с детьми и беременными женщинами в течение 14 дней после получения СРНТ;
- необходимо избегать контакта со взрослыми в течение 5 дней после получения СРНТ: контакт не должен превышать 1 часа, при контакте необходимо соблюдать дистанцию не менее 2 метров;
- необходимо исключить путешествия на самолете и длительные переезды на автомобиле в течение первых 48 часов после СРНТ;
• Беременность:
- необходимо избегать половых контактов в течение 7 дней;
- беременность противопоказана после СРНТ в течение 1 года;
- лактация противопоказана после СРНТ в течение 14 дней;
• Личная гигиена:
• Личная гигиена:
- пациентам следует рекомендовать соблюдать строгие правила гигиены, чтобы избежать заражения групп риска, пользующихся одним и тем же туалетом;
- пациентов следует предупредить о том, что им следует избегать загрязнения нижнего белья или мест вокруг унитазов в течение 1 недели после инъекции;
- сильно загрязненную одежду следует стирать отдельно;
- после мочеиспускания рекомендуется двойной смыв в туалете;
- пациентам следует мыть руки после мочеиспускания;
- в случае загрязнения мочой пациентам следует обильно мыть руки холодной водой, не применяя механических средств очистки кожи (щётки, вехотки, скрабы);
- мужчинам рекомендуется мочиться в сидячем положении;
- поскольку выведение ¹⁵³Sm с мочой происходит быстро и происходит преимущественно в течение первых 8–12 часов после инъекции, в этот первый период следует соблюдать особую осторожность в отношении загрязнения мочи;
Индикаторы эффективности процедуры [4–6,8,9,12,17,22]:
• уменьшение болевого синдрома по данным вербальной описательной шкалы (verbal descriptor scale, VDS), числовой рейтинговой шкалы оценки боли (numeric rating scale, NRS), визуально-аналоговой шкалы боли (visual analogue scale, VAS);
• улучшение качества жизни по шкале Карновского и функционального статуса по шкале Eastern Cooperative Oncology Group (ECOG);
• снижение потребления анальгетиков, в том числе наркотических, и общей потребности в них;
• торможение прогрессирования костных метастазов по данным КТ, МРТ, ОСГ (снижение накопления в метастазах диагностических остеотропных РФП) [11];
• увеличение выживаемости пациентов при применении повторных курсов CРНТ, комбинированных схем введения РФП c ¹⁵³Sm с другими методами терапии костных метастазов [6,8,11,12,19,21,22,35,36].
|
Ответ
|
Оценка ВАШ | Потребность в анальгетиках |
| Полный ответ | 0 баллов (отсутствие боли) |
без увеличения потребления анальгетиков;
уменьшение потребления анальгетиков на 25% от основного курса или полный отказ от потребления анальгетиков.
|
| Частичный ответ | уменьшение боли не менее 2 баллов относительно исходной оценки |
без увеличения потребления анальгетиков;
уменьшение потребления анальгетиков на 25% от основного курса без увеличения интенсивности боли.
|
| Прогрессирование / отсутствие ответа | усиление боли на 2 и более баллов относительно исходной оценки |
стабильное потребление анальгетиков;
или увеличение потребления анальгетиков на 25% и более от основного курса.
|
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2024
- 1) van Dodewaard‑de Jong JMVD, Oprea‑Lager DE, Hooft L, de Klerk JM, Bloemendal HJ, Verheul HM, Hoekstra OS, van den Eertwegh AJ. Radiopharmaceuticals for palliation of bone pain in patients with castration-resistant prostate cancer metastatic to bone: a systematic review. Eur Urol. 2016;70(3):416–26. doi:10.1016/j.eururo.2015.09.005. 2) Nindra U, Lin P, Becker T, Roberts TL, Chua W. Current state of theranostics in metastatic castrate‑resistant prostate cancer. J Med Imaging Radiat Oncol. 2024 Apr 17:e13658. doi:10.1111/1754-9485.13658. 3) Bouzekraoui Y, Bentayeb F, Asmi H, Bonutti F. Comparison of image quality of different radionuclides technetium‑99m, samarium‑153, and iodine‑123. Indian J Nucl Med. 2019;34(3):201. doi:10.4103/ijnm.ijnm_42_19. 4) Correa‑González L, Arteaga de Murphy C, Pichardo‑Romero P, Pedraza‑López M, Moreno‑García C, Correa‑Hernández L. 153Sm‑EDTMP for pain relief of bone metastases from prostate and breast cancer and other malignancies. Arch Med Res. 2014;45(4):301–8. doi:10.1016/j.arcmed.2014.03.006. 5) Tsoucalas G, Sarafianou E, Galanos A, et al. Samarium‑153 Sm‑EDTMP as an equivalent variant to pharmaceutical analgesic treatment. J BUON. 2014;19(4):1083–91. 6) Thapa P, Nikam D, Das T, Sonawane G, Agarwal JP, Basu S. Clinical efficacy and safety comparison of 177Lu‑EDTMP with 153Sm‑EDTMP on an equidose basis in patients with painful skeletal metastases. J Nucl Med. 2015;56(10):1513–19. doi:10.2967/jnumed.115.155762. 7) Solodyannikova O, Danilenko V, Sukach G. Analgesic effect of various radiopharmaceuticals in the complex treatment of metastatic bone disease. Probl Radiac Med Radiobiol. 2021;26:562–72. doi:10.33145/2304-8336-2021-26-562-572. 8) Kolesnikov‑Gauthier H, Lemoine N, Tresch‑Bruneel E, Olivier A, Oudoux A, Penel N. Efficacy and safety of 153Sm‑EDTMP as treatment of painful bone metastasis: a large single‑center study. Support Care Cancer. 2018;26(3):751–8. doi:10.1007/s00520-017-3885-3. 9) Gallicchio R, Giacomobono S, Nardelli A, et al. Palliative treatment of bone metastases with samarium‑153 EDTMP at onset of pain. J Bone Miner Metab. 2014;32(4):434–40. doi:10.1007/s00774-013-0507-0. 10) Guerra Liberal FDC, Tavares AAS, Tavares JMRS. Comparative analysis of 11 different radioisotopes for palliative treatment of bone metastases by computational methods. Med Phys. 2014;41(11)– doi:10.1118/1.4897240. 11) Wilky BA, Loeb DM. Beyond palliation: therapeutic applications of 153Samarium‑EDTMP. Clin Exp Pharmacol. 2013;3(3): doi:10.4172/2161-1459.1000131. 12) Barai S, Gambhir S, Rastogi N, Mandani A, Siddegowda M. Effects of low‑dose capecitabine on Samarium‑153‑EDTMP therapy for painful bone metastases. Indian J Nucl Med. 2015;30(2):111. doi:10.4103/0972-3919.152955. 13) Rasulova N, Lyubshin V, Arybzhanov D, Sagdullaev Sh, Krylov V, Khodjibekov M. Optimal timing of bisphosphonate administration in combination with samarium‑153 oxabifore in the treatment of painful metastatic bone disease. World J Nucl Med. 2013;12(1):14. doi:10.4103/1450-1147.113939. 14) Liberal FDCG, Tavares AAS, Tavares JMRS. Computational modeling of radiobiological effects in bone metastases for different radionuclides. Int J Radiat Biol. 2017;93(6):627–36. doi:10.1080/09553002.2017.1294274. 15) D’angelo G, Sciuto R, Salvatori M, et al. Targeted “bone‑seeking” radiopharmaceuticals for palliative treatment of bone metastases: a systematic review and meta‑analysis. Q J Nucl Med Mol Imaging. 2012;56(6):538–43. 16) Barai S, Gambhir S, Rastogi N. Analgesic effect of combination therapy of samarium‑153‑EDTMP and estramustine in prostate cancer patients with skeletal metastasis. Intern Med J. 2016;46(1):40 17) Ayati N, Aryana K, Jalilian A, et al. Treatment efficacy of 153Sm‑EDTMP for painful bone metastasis. Asia Oceania J Nucl Med Biol. 2013;1(1):27. doi:10.7508/AOJNMB.2013.01.006 18) Sharma S, Singh B, Koul A, Mittal BR. Comparative therapeutic efficacy of 153Sm‑EDTMP and 177Lu‑EDTMP for bone pain palliation in patients with skeletal metastases: patients’ pain score analysis and personalized dosimetry. Front Med. 2017;4(May):46. doi:10.3389/fmed.2017.00046. 19) Handkiewicz‑Junak D, Poeppel TD, Bodei L, et al. EANM guidelines for radionuclide therapy of bone metastases with beta‑emitting radionuclides. Eur J Nucl Med Mol Imaging. 2018;45(5):846–59. doi:10.1007/s00259-017-3900-4. 20) Rubini G, Nicoletti A, Rubini D, Asabella AN. Radiometabolic treatment of bone‑metastasizing cancer: from 186rhenium to 223radium. Cancer Biother Radiopharm. 2014;29(1):1–11. doi:10.1089/cbr.2013.1549. 21) Taheri M, Azizmohammadi Z, Ansari M, et al. 153Sm‑EDTMP and 177Lu‑EDTMP are equally safe and effective in pain palliation from skeletal metastases. Nuklearmedizin. 2018;57(5):174–80. 22) Alavi M, Khajeh‑Rahimi F, Yousefnia H, et al. 177Lu/153Sm‑EDTMP cocktail: a novel palliative treatment for patients with bone metastases. Cancer Biother Radiopharm. 2019;34(5):280–7. doi:10.1089/cbr.2018.2683. 23) El‑Amm J, Freeman A, Patel N, Aragon‑Ching JB. Bone‑targeted therapies in metastatic castration‑resistant prostate cancer: evolving paradigms. Prostate Cancer. 2013;2013:210686. doi:10.1155/2013/210686. 24) Autio KA, Pandit‑Taskar N, Carrasquillo JA, et al. Repetitively dosed docetaxel and 153Samarium‑EDTMP as an anti‑tumor strategy for metastatic castration‑resistant prostate cancer. Cancer. 2013;119(17):3186–94. doi:10.1002/cncr.28103. 25) Крылов ВВ, Кочетова ТЮ. Новые возможности радионуклидной терапии при метастазах в кости. Всероссийская научно‑практическая конференция «Новые технологии в клинической медицине»; 2015. Available from: http://www.palliamed.ru/files/download/file601.html. 26) Влодарчик Ш., Расулова Н., Арыбжанов Д. и др. Оценка эффективности лечения костных метастазов самарием‑153 оксабиформ в сочетании с бисфосфонатами и при монорежиме с помощью полуколичественного анализа остеосцинтиграмм // Креативная хирургия и онкология. – 2014. – № 1–2. – С. 32–38. 27) Белозерова МС, Кочетова ТЮ, Крылов ВВ. Практические рекомендации по радионуклидной терапии при метастазах в кости. Злокачественные опухоли. 2016;(спецвыпуск 4):506–12. 28) Baczyk M, Milecki P, Pisarek M, Gut P, Antczak A, Hrab M. A prospective randomized trial: a comparison of the analgesic effect and toxicity of 153Sm radioisotope treatment in monotherapy and combined therapy including local external beam radiotherapy among metastatic castrate‑resistant prostate cancer (mCRPC) patients with painful bone metastases. Neoplasma. 2013;60(3):328–33. doi:10.4149/neo_2013_044. 29) Kairemo K, Rasulova N, Suslaviciute J, Alanko T. Radionuclide treatment with 153Sm‑EDTMP is effective for the palliation of bone pain in the context of extensive bone marrow metastases: a case report. Asia Oceania J Nucl Med Biol. 2014;2(2):131–4. 30) Parlak Y, Gümüser G, Sayit E. Samarium‑153 therapy for prostate cancer: the evaluation of urine activity, staff exposure and dose rate from patients. Radiat Protect Dosimetry. 2015;163(4):468–72. doi:10.1093/rpd/ncu237. 31) Tan HY, Yeong CH, Wong YH, et al. Neutron‑activated theranostic radionuclides for nuclear medicine. Nucl Med Biol. 2020;90–91:55–68. doi:10.1016/j.nucmedbio.2020.09.005. 32) Van Nuland M, Ververs TF, Lam MGEH. Dosing therapeutic radiopharmaceuticals in obese patients. Int J Mol Sci. 2022;23(2):818. doi:10.3390/ijms23020818. 33) Loebe T, Hettwig B, Fischer HW. Detection of long‑lived europium‑152 in samarium‑153‑lexidronam. Appl Radiat Isot. 2014;94:40–3. doi:10.1016/j.apradiso.2014.06.017. 34) Małkowski B, Maruszak M, Dudek A, Wędrowski M, Szefer J. The influence of Sm‑153 therapy on bone marrow function. Contemp Oncol (Pozn). 2016;20(5):385–8. doi:10.5114/wo.2016.64598. 35) Valicenti RK, Pugh SL, Trabulsi EJ, et al. First report of NRG Oncology/Radiation Therapy Oncology Group 0622: a phase II trial of samarium‑153 followed by salvage prostatic fossa irradiation in high‑risk clinically nonmetastatic prostate cancer after radical prostatectomy. Int J Radiat Oncol Biol Phys. 2018;100(3):695–701. doi:10.1016/j.ijrobp.2017.11.024. 36) Heery CR, Madan RA, Stein MN, et al. Samarium‑153‑EDTMP with or without vaccine in metastatic castration‑resistant prostate cancer: a randomized phase II trial. Oncotarget. 2016;7(42):69014–23. doi:10.18632/oncotarget.10883. 37) Sinzinger H, Weiss K, Hiltunen J. Background, reasons and benefits using the Vienna protocol for the treatment of painful bone recurrences with 153Samarium‑EDTMP. Manuscript received April 21, 2009; revised June 2, 2009; accepted June 9, 2009.
Информация
Организационные аспекты внедрения протокола:
Список разработчиков протокола с указанием квалификационных данных:
1) Танатаров Саят Замамбекович - доктор медицинских наук, профессор, директор КГП на ПХВ «Центр ядерной медицины и онкологии» Управления здравоохранения области Абай;
2) Атантаева Баян Жумагазыевна - кандидат медицинских наук, заместитель директора по ядерной медицине и стратегическому планированию КГП на ПХВ «Центр ядерной медицины и онкологии» Управления здравоохранения области Абай;
3) Пак Лаура Алексеевна - доктор PhD, ассоциированный профессор, старший ординатор отделения радионуклидной терапии ТОО «Национальный научный онкологический центр»;
4) Тулеутаева Райхан Есенжановна - кандидат медицинских наук, профессор Российской академии естествознания, заведующая кафедрой фармакологии имени, доктор медицинских наук, профессор М.Н. Мусина, НАО «Медицинский университет Семей»;
5) Есболатова Назигуль Сайлаубайкызы – заведующая отделением радионуклидной терапии КГП на ПХВ «Центр ядерной медицины и онкологии» Управления здравоохранения области Абай;
6) Адильбаев Даурен Нурланович – руководитель службы радиационной безопасности КГП на ПХВ «Центр ядерной медицины и онкологии» Управления здравоохранения области Абай;
7) Сарсекеев Асет Шакирович – заведующий отделением производства и обеспечения радиофармацевтических лекарственных препаратов КГП на ПХВ «Центр ядерной медицины и онкологии» Управления здравоохранения области Абай.
Указание на отсутствие конфликта интересов: отсутствуют.
Рецензенты:
1) Даутов Таирхан Бекполатович – доктор медицинских наук, заведующий отделением радиологии и ядерной медицины Корпоративного фонда «University Medical Center» Центр сердца, Вице‑президент Казахстанского радиологического общества, главный внештатный специалист по лучевой диагностике и интервенционной радиологии Министерства здравоохранения Республики Казахстан.
2) Кайдарова Диляра Радиковна – доктор медицинских наук, профессор, академик НАН РК, Первый проректор НАО «Казахский национальный медицинский университет имени С.Д. Асфендиярова», главный внештатный онколог Министерства здравоохранения Республики Казахстан.
Указание условий пересмотра протокола: пересмотр не реже 1 раза в 5 лет и не чаще 1 раза в 3 года при наличии новых методов диагностики и лечения с уровнем доказательности.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.