Синдром короткой кишки и кишечная недостаточность
 Версия: Клинические протоколы МЗ РК - 2024 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2024 (Казахстан)
Общая информация
Краткое описание
КЛИНИЧЕСКИЙ ПРОТОКОЛ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Кишечная недостаточность – снижение функции кишечника ниже минимума, необходимого для всасывания макронутриентов и/или воды и электролитов, так что для поддержания здоровья и/или роста требуется их внутривенное введение [6].
Недостаточность питания (нутритивная недостаточность) – это гетерогенный синдромокомплекс, который может быть обусловлен как тотальным или парциальным дефицитом поступающих в организм различных питательных веществ относительно его фактической потребности, так и нарушенной их ассимиляцией в сочетании с повышенными тратами, что сопровождается стойкими изменениями трофического гомеостаза, а также структурными (снижение клеточной массы), и метаболическими нарушениями, приводящими к снижению функциональных резервов организма и ухудшению клинических исходов заболевания [1,3].
Код(ы) МКБ-10, МКБ-11
| Код МКБ-10 | Код МКБ-11 | Наименование заболеваний и состояний |
| K90.9 | Нарушение всасывания в кишечнике неуточненное | |
| DA96.0Y | Другие уточненные мальабсорбции кишечника | |
| DA96.Y | Другая указанная мальабсорбция кишечника или белковая потеря энтеропатии | |
| DA96.Z | Кишечная мальабсорбция или белковая потеря энтеропатии, неуказанная | |
| K91.2 | Нарушение всасывания после хирургического вмешательства, не классифицированное в других рубриках | |
| K91.8 | Другие нарушения органов пищеварения после медицинских процедур, не классифицированные в других рубриках | |
| DA92.Z | Другие приобретенные анатомические изменения тонкой кишки, неуточненные | |
| DA90 | Неконструктивные аномалии развития тонкого кишечника | |
| DA90.0 | Синдромная диарея | |
| DA90.1 | Врожденный дефект кишечного тракта | |
| DA97 | Некоторые сосудистые нарушения тонкой кишки |
Дата разработки и пересмотра протокола: 2024 год.
Категория пациентов: взрослые, дети.
Шкала уровня доказательности
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+), результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
Классификация
Таблица 1. Классификация по патофизиологическому механизму протяженно-сти оставшиеся кишки [11]
| Проксимальный (верхнетонкокишечный) | Дистальный (нижнетонкокишечный) |
|
Нарушение гидролиза и всасывания большинства нутриентов
|
Нарушение всасывания воды, электролитов, витамина В12 и желчных кислот
|
|
Преимущественно гипоабсорбционно-
осмотическая диарея
|
Преимущественно секреторно-
экссудативная диарея
|
| По степени компенсации: компенсированный (резекция <50%), субкомпенсированный (50–80%), декоменсированный (резекция >80%) | |
По остаточному (функционирующему) сегменту тонкой кишки и наличию толстой кишки [4,6]. Для определения СКК обычно используется оставшаяся длина и секция кишечника (если она известна). Оптимально длину остаточной кишки измеряют во время операции по антибрыжеечному краю нерастянутой кишки, от дуоденоеюнального изгиба до илеоцекального перехода, места любого тонкокишечно-ободочного анастомоза или до концевой стомы:
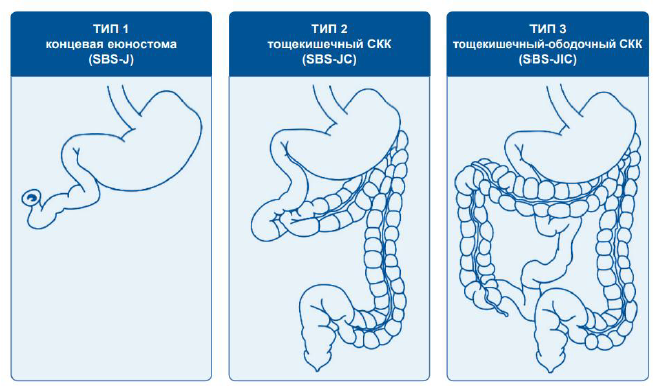
Рисунок 1. Типы анатомии кишечника при синдроме короткой кишки [4]
Таблица 2. Функциональная классификация КН: на основании критериев начала, метаболических процессов и ожидаемого исхода [5,9]
|
Подтип
|
Длительность | Проявления |
| Тип I | <28 дней | Тяжелая диарея, ограниченное всасывание. Необходима полная поддержка питательными веществами и жидкостью при парентеральном питании. Острое, кратковременное и обычно самокупирующееся состояние, которое часто встречается в периоперационных условиях или в связи с критическим заболеванием |
| Тип II | от 4-х недель до 1 года | Улучшение всасывания питательных веществ. Длительное острое состояние, часто у метаболически нестабильных пациентов, требующее комплексного многопрофильного лечения и внутривенной поддержки с постепенным уменьшением парентерального питания |
| Тип III | Более 1-го года | Хроническое состояние у метаболически стабильных пациентов, нуждающихся во внутривенной поддержке; может быть обратимым или необратимым. При обратимом состоянии максимальная адаптация кишечника; ПП отменяют или сокращают до нескольких раз в неделю |
Таблица 3. Этиологическая классификация СКК у детей:
| Патогенетический механизм | Патология |
| Пренатальное заболевание: |
• Атрезия кишечника
• Атрезия тощей кишки типа «яблочной кожуры»
• Гастрошизис
|
| Постнатальное заболевание: |
• Некротизирующий энтероколит
• Заворот средней кишки
• Сосудистый тромбоз
• Опухоли
• Травматизм
|
| Врожденные энтеропатии: |
• Болезнь включения микроворсинок / атрофия микроворсинок
• Кишечная эпителиальная дисплазия/туфтинговая энтеропатия
• Синдромная диарея/трикогепатоэнтеральный синдром
|
| Нервно-мышечные заболевания кишечника: |
• Синдром хронической кишечной псевдонепроходимости
• Невропатия
• Миопатия
• Мезенхимопатия
|
| Врожденное отсутствие вегетативных сплетений Мейснера и Ауэрбаха (аганглиоз) в стенке кишечника | Болезнь Гиршпрунга длинного сегмента/тотальный или субтотальный аганглиоз |
Клиническая картина
Cимптомы, течение
Пациенты с СКК испытывают ряд симптомов, включая диарею, дефицит питательных веществ, нарушения электролитного баланса, обезвоживание, недоедание и потерю веса [8,10].
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ
Диагностические критерии.
Жалобы и симптомы. Общие симптомы синдрома короткой кишки могут включать:
СКК-КН может быть результатом широкого спектра причин, что приводит к очень неоднородной популяции пациентов с различной анатомией кишечника, сопутствующими заболеваниями и клиническими потребностями [9]:
Таблица 4. Основные причины СКК-КН [9]
| Патология | Патофизиологический механизм |
| Мезентериальная ишемия | Острое или хроническое состояние, вызванное нарушением кровоснабжения кишечника |
| Болезнь Крона | Хроническое заболевание, вызывающее воспаление слизистой оболочки пищеварительного тракта |
| Лучевой энтерит | Раздражение и воспаление кишечника во время или после лучевой терапии брюшной полости, прямой кишки или таза |
| Хирургические осложнения | Обширная резекция тонкой кишки с уменьшением всасывательной поверхности кишечника |
| Семейный полипоз | Редкое наследственное заболевание, при котором образуются полипы в толстой и прямой кишке. При отсутствии терапии возможна малигнизация полипов |
| Заворот толстой кишки | Перекручивание толстой кишки вокруг оси, приводящее к кишечной непроходимости и, сопровождающееся выраженным нарушением кровообращения |
| Пороки развития кишечника | Врожденные аномалии желудочно-кишечного тракта, обычно проявляющиеся в неонатальном периоде или раннем младенчестве |
| Некротизирующий энтероколит | Воспаление и отмирание кишечной ткани, что может привести к перфорации и вытеканию содержимого кишечника в брюшную полость |
Основные лабораторные исследования:
Основные инструментальные исследования:
Дополнительные инструментальные исследования:
Для оценки функции переваривания и всасывания могут использоваться следующие неинвазивные тесты и инструментальные методы:
Помимо неинвазивных тестов, оценка функций переваривания, всасывания и секреции в детской практике производится на основании:
Диагностический алгоритм (схема представлена на рисунке 2)
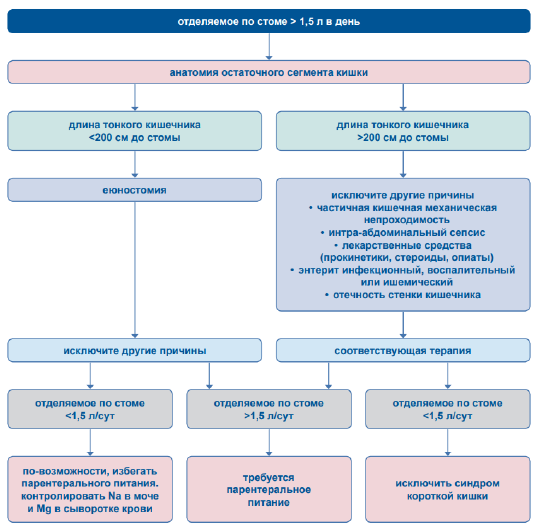
Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований
представлены на рисунке 2 (раздел Диагностика) и в таблице 5 [8,18,20]
Таблица 5. Дифференциальный диагноз и обоснование дополнительных исследований
| Диагноз | Обоснование для диф. диагностики | Обследования | Критерии подтверждения диагноза |
| Болезнь Гиршпрунга с расширением тонкой кишки | Отсутствие выделения мекония в течение 48 часов после родов | Аноректальная манометрия, данные лучевых методов обследования, аспирационной или щипковой биопсии с захватом подслизистого слоя дистально суженного сегмента, ИГХ на кальретинин | Клиническая картина, данные анамнеза и исследований, включая гистологию: отсутствие ганглиозных клеток в мышечно-кишечном и подслизистом сплетениях кишечника |
| Тотальный аганглиоз толстого кишечника (синдром Зульцера-Вильсона) | Отсутствие выделения мекония в течение 48 часов после родов, метеоризм, запоры. | Лапаротомия: полнослойная ректальной биопсия. Гистохимические исследования на ацетилхолинэстеразу. | Клиническая картина, данные анамнеза и исследований, включая гистологию: (отсутствие ганглиозных клеток) по всей толстой кишке у новорожденных (глубоконедоношенных). |
| Врожденная тафтинговая энтеропатия | Диарея, задержка физического роста и развития | Лабораторные и генетические тесты, эндоскопия верхних отделов желудочно-кишечного тракта с биопсией. | Клиническая картина, длительная водянистая диарея. ЭГДС, гистологические признаки, включая атрофию ворсинок, гиперплазию крипт и очаговые эпителиальные пучки. Мутации в генах EPCAM и SPINT2. |
| Мезентериальная ишемия (острая, хроническая) | Абдоминальная боль, не коррелирующая с результатами обследования |
КТ-ангиография
Катетерная ангиография
|
лактатдегидрогеназа и D-лактат на поздних стадиях, признаки инфаркта сегментов кишечника |
| Целиакия | Классические симптомы – вздутие, утомляемость, диарея, потеря веса (у детей – задержка роста и развития); нетипичные симптомы – запор, метеоризм, абдоминальная боль | Генетические и серологические тесты (антитела к тканевой трансглютаминазе IgA и IgG, при высоких титрах - антитела к эндомизию), эндоскопия верхних отделов ЖКТ с множественными биопсиями | Гистологические критерии в соответствии с классификацией по Marsh- Oberhuber |
| Болезнь Крона | Абдоминальная боль, нарушение моторики кишечника, потеря веса, примесь крови в стуле | Фекальный кальпротектин, острофазовые показатели, данные эндоскопии + биопсии и лучевой диагностики (УЗИ кишечника, МР энтерография) | Характерная макро и микроскопическая картина; возможны внекишечные проявления |
Лечение (амбулатория)
Основные принципы лечения СКК [9,17]:
Питание при СКК.
Таблица 6. Диетические рекомендации при синдроме короткого кишечника
| Основные рекомендации |
• Пациенты должны потреблять 6-8 небольших приемов пищи или закусок в день и начинать с 3-дневной диеты.
• Подберите диету для пациента и наметьте, что он может есть
• Больные должны хорошо пережевывать пищу
|
| Белки |
• Пациенты должны употреблять высококачественные белки с каждым приемом пищи, включая перекусы (20-30% от общего количества калорий)
|
| Углеводы |
• 50-60% от общего количества калорий; рекомендуется прием сложных углеводов (например, макароны, рис, картофель, хлеб)
• Ограничить простые сахара и сахарные спирты как в продуктах питания, так и в жидкостях; не нужно избегать приема лактозы, поскольку возможно отсутствие непереносимости
• Не принимать напитки для дополнительного питания
|
| Жиры |
• Ограничить жир до <30% у пациентов с оставшимся сегментом толстой кишки; может потребоваться дополнительное ограничение у пациентов без толстой кишки
• Включить в рацион масла с незаменимыми жирными кислотами (например, подсолнечное, соевое, ореховое)
|
| Оксалаты |
• Ограничить прием в случае сохранной толстой кишки, обеспечить адекватный диурез
|
| Жидкость |
• Подумайте о растворах для пероральной регидратации
• У некоторых пациентов может потребоваться вынужденное ограничение перорального потребления жидкости и введение жидкости внутривенно
• У пациентов с еюностомой следует ограничивать пероральное потребление гипотонических (вода, чай, кофе или алкоголь) и гипертонических напитков (фруктовые соки, кола, минеральные воды)
|
| Соль |
• Увеличение потребления соли у пациентов без толстой кишки; продолжать обычный прием у пациентов с толстой кишкой
|
| Клетчатка |
• Поощряйте потребление растворимой клетчатки (из продуктов питания) у пациентов с сегментом толстой кишки.
|
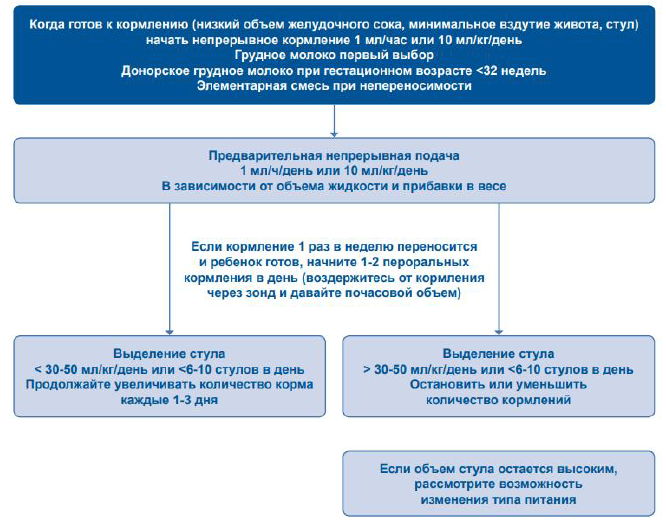
Показаниями к домашнему парентеральному питанию (рисунок 4, таблица 7) являются состояния, приводящие к невозможности обеспечить организм необходимыми нутриентами за счет приема пищи или использования технологий энтерального питания [41]. Наиболее частой причиной является формирование хронической кишечной недостаточности.
Для длительного парентерального питания используются наиболее безопасные венозные доступы (подключичная или внутренняя яремная вена):
Лечение (стационар)
Выделяют следующие этапы лечения СКК с КН [3]:
Основные компоненты лечения после установления диагноза СКК:
Питание при СКК. Несмотря на то, что существуют основные принципы диетотерапии, применимые ко всем пациентам с СКК, адаптация диеты к оставшейся анатомии кишечника каждого пациента и объяснение пациенту важности модификаций диеты и жидкостного баланса имеют важное значение для оптимизации приверженности и успешных результатов. Периодическая оценка и корректировка диеты, особенно в период адаптации, имеют решающее значение для постоянного успеха (рисунки 4, 6) [4,13].
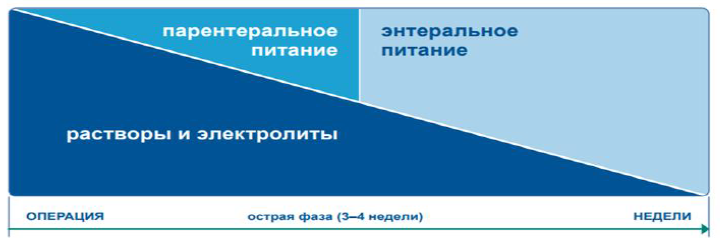
Рисунок 4. Схематическое изображение менеджмента острой фазы СКК [25].
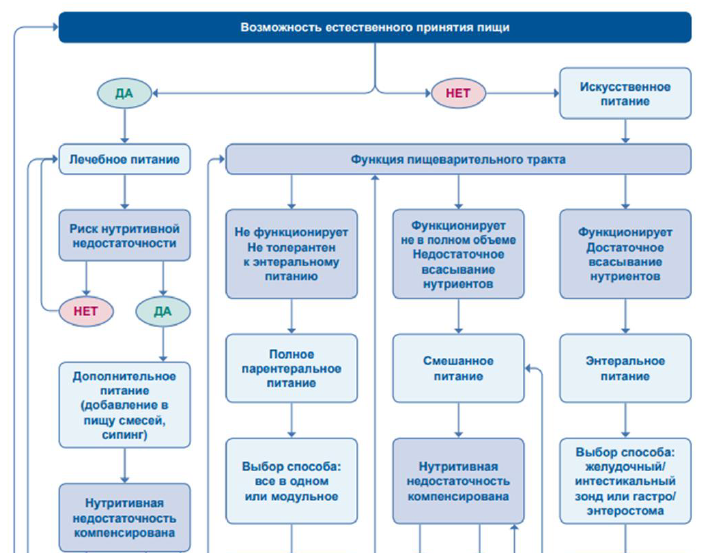
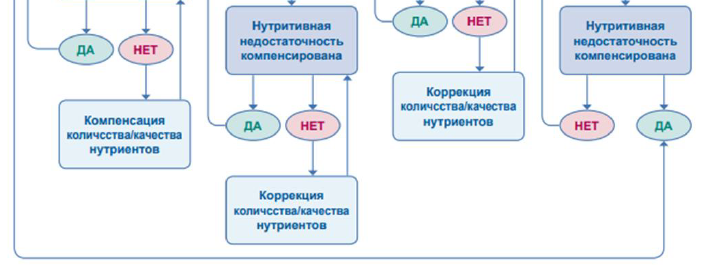
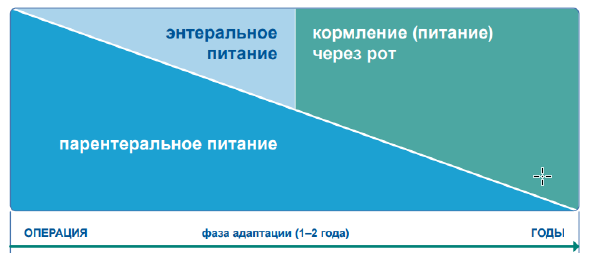
Первоначальное лечение пациентов с СКК-КН включает послеоперационную стабилизацию с помощью режима внутривенного введения жидкостей, макроэлементов, микроэлементов и электролитов [1-5,59]. После стабилизации состояния пациента программы кишечной реабилитации должны быть индивидуализированы в зависимости от функциональной способности оставшейся части кишечника, конкретных потребностей в питательных веществах и предпочтений пациента, рисунки 4, 6, таблица 7 [13].
Во всех случаях продолжающейся редукции массы тела более 10% от исходной её величины и (или) развития гипопротеинемии менее 55-60 г/л (гипоальбуминемии менее 25-30 г/л) на фоне стойко сохраняющейся ки-шечной диспепсии следует рассмотреть вопрос о необходимости назначения дополнительного или полного парентерального питания.
Таблица 7. Рекомендации по определению потребности жидкости и электролитам при парентеральном питании у взрослых [4, 20, 21]
|
/кг/день*
|
/день* | |
| Вода | 25–35 мл | 1500–2500 мл |
| Натрий | 1,0–1,5 ммоль | 60–150 ммоль |
| Калий | 1.0–1.5 ммоль | 40–100 ммоль |
| Хлориды | 1.0–1.5 ммоль | |
| Фосфаты | 0,3–0,5 ммоль | 10–30; 25 ммоль |
| Магний | 0,1–0,15 ммоль | 4–12; 10 ммоль |
| Кальций | 0,1–0,15 ммоль | 2,5–7,5; 10 ммоль |
*Может потребоваться корректировка с учетом основного заболевания, клинического случая, медикаментозного лечения и перорального приема.
4. Костные осложнения:
Рефидинг-синдром (синдром возобновления питания) это потенциально опасное для жизни состояние, которое может возникнуть при быстром возобновлении питания у людей, длительное время находящихся в состоянии голодания или значительного недоедания. Профилактика рефидинг-синдрома является ключевым аспектом в ведении таких пациентов.
2. Медленное и постепенное начало питания:
3. Тщательный мониторинг:
4. Постепенное увеличение калоража:
Основные принципы профилактики рефидинг- синдрома у детей:
Тедуглутид, относящийся к первой линии терапии (таблица 8), рекомбинантный человеческий аналог GLP-2, оказывает ряд кишечнотрофических эффектов, включая замедление опорожнения желудка, снижение желудочной секреции, усиление кишечного и портального кровотока и стимуляцию роста эпителия желудочно-кишечного тракта [8].
Критерии и условия для назначения Тедуглутида [34,35]:
Перед назначением тедуглутида:
Таблица 8. Основные лекарственные средства
| Фармакотерапевтическая группа | МНН ЛС | Способ применения | УД |
| Препарат для лечения заболеваний желудочно-кишечного тракта и нарушений обмена веществ | Тедуглутид* | В виде подкожной инъекции по 0.05 мг/кг массы тела 1 раз в сутки ежедневно, при этом суточная доза уменьшается вдвое у пациентов с умеренным или выраженным снижением функции почек. Если риск превышает пользу, лечение следует прекратить. | А [25,26, 32-35] |
| Системы (контейнеры) для парентерального питания «все в одном» для центральной и периферической вены | Полное парентеральное питание (ППП) обеспечивает суточную потребность в пище. ППП может применяться в больнице или дома. Поскольку растворы ППП гиперосмолярны и могут вызвать тромбоз периферических вен, для их введения обычно требуется центральный венозный катетер | А [7,8,14,38, 41] | |
В адъювантной терапии в период наибольшей кишечной адаптации, являются антисекреторные и прокинетические средства. Они часто необходимы для контроля гиперсекреции желудка и диареи большого объема (таблица 9).
Таблица 9. Дополнительные лекарственные средства [19-25, 39]
| Фармакотерапевтическая группа | МНН ЛС | Способ применения | УД | |
| Гормон роста, производное соматостатина | Октреотид | 50-100 мкг подкожно 3 раза в день, за 30 мин до еды | А [1] | |
| Антисекреторные препараты | Ингибиторы протоновой помпы |
Омепразол
Лансопразол
Пантопразол
Эзомепразол
Рабепразол
|
20-40 (15-30) мг внутривенно или перорально | С |
| Антидиарейные препараты | Противодиарейный симптоматический препарат | Лоперамид |
4-16 мг в день внутрь
При острой диарее детям старше 5 лет назначают в начальной дозе 2 мг, затем по 2 мг после каждого акта дефекации; максимальная суточная доза - 8 мг
При хронической диарее детям старше 5 лет лоперамид назначают в суточной дозе 30 кап или по 2 мг.
|
А |
| Глюкокортикостероиды | Будесонид | 3 мг 3 раза в день, внутрь | В | |
| Противодиарейные препараты с адсорбирующим действием или Адсорбирующие кишечные препараты другие | Диосмектит | 4 г внутрь, 2-3 раза в день | С | |
| Антибактериальные препараты для коррекции синдрома избыточного бактериального роста | Рифаксимин |
200 мг по 2 таб 3 раза в день или 550 мг 2 раза в день, внутрь (7-14 дней)
Не применяется в детском возрасте
|
В | |
| Антибактериальные препараты для коррекции синдрома избыточного бактериального роста | Метронидазол | 250 мг 3 раза в день, внутрь (7-14 дней) | ||
| Ципрофлоксацин | Внутрь 500 мг 2 раза в день, (7-14 дней) | В | ||
| Триметоприм-сульфаметоксазол | Внутрь взрослым - 40-60 мг 1 раз/сут; максимальная суточная доза - 100 мг. Для детей старше 1 года - 2-3 мг/кг 1 раз/сут. | С | ||
| Противоэпилептические средства | Габапентин | Внутрь 250–300 мг | С | |
|
Противорвотные средства
|
Метоклопрамид |
Внутримышечно или медленно внутривенно.
Взрослым и подросткам старше 14 лет: 10 мг 3-4 раза в сутки.
Дети от 3 до 14 лет: терапевтическая доза составляет 0.1 мг /кг массы тела, максимальная суточная доза составляет 0.5 мг/кг массы тела
|
В | |
| Ондансетрон |
Внутримышечно или внутривенно путем разовой медленной инъекции или инфузии.
Взрослым однократную дозу 8–32 мг вводят в/в медленно
Детям можно назначать одноразово в/в в дозе 5 мг/м2
Выбор режима дозирования устанавливают индивидуально в зависимости от степени выраженности эметогенного эффекта
|
|||
| Гепатопротектор | Урсодеоксихолевая кислота | Внутрь 250 или 300 мг – суточная доза 5-10 мг/кг веса в зависимости от клинической ситуации | С | |
| Водорастворимые и жирорастворимые витаминные препараты | Витамины группы В, А, Д, Е, К | Пероральное и парентеральное (внутримышечное, внутривенное) введение витаминных препаратов | А | |
|
Полиферментные препараты
|
Панкреатин | 1000 липазных единиц/кг на каждый прием пищи для детей в возрасте до 4 лет, и 500 липазных единиц/кг во время приема пищи для детей старше 4 лет и взрослых; вместе с основным приемом пищи до 40000 ЕД липазы, а во время приема легкой закуски - половина индивидуальной дозы. | С | |
| Смеси для энтерального питания | Полуэлементные и полимерные стандартные смеси для энтерального питания | Внутрь или через зонд (назальные зонды – назогастральные, назоеюнальные, чрезкожные гастростмические или гастроеюностомические); выбор пути введения и дозы зависит от конкретной клинической ситуации | ||
Показания к трансплантации кишечника:
Таблица 10. Виды оперативных вмешательств в детской практике
|
Сужение сечения кишки
|
Тэйпирование |
| Торможение пассажа по тонкому кишечнику | Антиперистальтический сегмент тонкой кишки |
| Интерпозиция толстой кишки | |
| Кишечные клапаны | |
| Увеличение всасывающей поверхности кишечника | Серозные «заплатки» |
| Трансплантация слизистой | |
| Трансплантация кишечника | |
| Удлинение тонкой кишки | Операция Bianchi (продольное удлинение и зауживание кишки, Longitudinal Intestinal Lengthening and Tailoring, LILT) |
| Последовательная поперечная энтеропластика (STEP) |
2. Нутриционная стабильность и адекватная нутритивная поддержка:
Послеоперационное ведение стомированных пациентов осуществляется хирургами/колопроктологами совместно с медицинским персоналом поликлиники (хиругическая медицинская сестра/брат, имеющие соответствующую подготовку по уходу за стомой, а также психологами, работниками социальных служб, реабилитологами медикосоциальной экспертизы [39].
Послеоперационный этап включает в себя:
На данном этапе проводятся следующие мероприятия:
План последующего наблюдения:
Социальная поддержка и условия для домашнего ухода:
Таблица 11. Причины осложнений при СКК [6,7]
| Связанные с центральным венозным катетером |
• Инфекционное заболевание
• Окклюзия
• Повреждение катетера
• Тромбоз центральной вены
|
| Связанные с парентеральным питанием |
• Печеночные (стеатоз, холестаз, фиброз, цирроз)
• Билиарные осложнения (конкременты)
|
| Осложнения, связанные с анатомией кишечника |
• Диарея вследствие малабсорбции
• Нарушение питания
• Водно-электролитные нарушения
• Дефицит микроэлементов
• Дефицит незаменимых жирных кислот
• Избыточный бактериальный рост в тонкой кишке
• D-лактат ацидоз
• Оксалатная нефропатия
• Почечная дисфункция
• Метаболическое заболевание костей
• Кислотная пептическая болезнь
• Анастомотическое изъязвление/стриктура
|
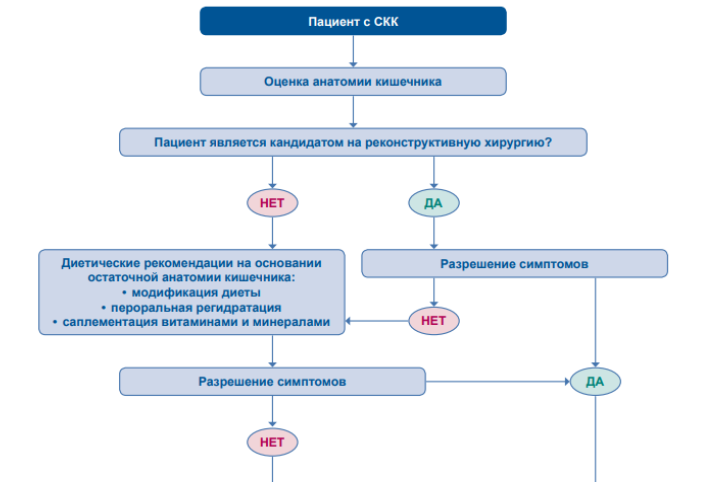
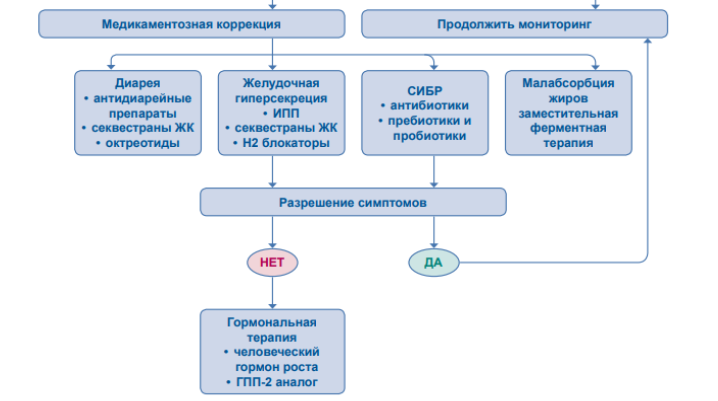
Рисунок 7. Алгоритм ведения пациентов с СКК [20].
Таблица 12. Сроки развития осложнений [8]
| Ближайшие (до 2 месяцев) | Отдаленные (более 2 месяцев) |
|
• Водно-электролитные нарушения (гиповолемия, дисэлектролитемия)
• Желудочная гиперсекреция и эрозивно-язвенные поражения гастродуоденальной слизистой
• Прогрессирующая полинутрентная недостаточность (быстрая потеря массы тела, саркопения, гипопротеинемия, анемия, органная дистрофия, иммуносупрессия)
• Инфекции
|
• Холелитиаз (холестериновые камни)
• Гипероксалатурия и нефролитиаз
• Прогрессирующее истощение, полиорганная дистрофия, утрата работоспособности
• D-лактат ацидоз
• Рецидивирующие инфекции
• Фиброз печени
• Астено-депрессивный синдром
• Спаечная болезнь
|

Рисунок 8. Специализированный центр Синдрома короткой кишки и кишеч-ной недостаточности и реабилитации [43]
Таблица 13. Чек-лист мониторинга пациентов с Синдромом короткой кишки.
| Пункты чек-листа | В условиях отделения реанимации и интенсивной терапии | В условиях стационара /амбулаторно |
| Обучение питанию | Обучение и подкрепление по мере совершенствования диеты в больнице | Усиливайте и корректируйте диету по мере адаптации кишечника |
| Лабораторные данные |
- ОАК и биохимия крови, включая магний – ежеденевный контроль
- Функциональные тесты печени - дважды в неделю
- Базовый уровень витаминов и микроэлементов (A, E, 125-ОН-витамин Д, фолаты, B-12, железо, цинк, медь и селен) перед выпиской
|
Еженедельная комплексная метаболическая панель, включая магний до его стабилизации, затем ежемесячно.
Ежегодный контроль уровня витаминов и микроэлементов
|
| Контроль веса и приема/выделения1 | Ежедневный контроль веса и приема/выделения |
Еженедельный контроль веса.
Контроль данных приема/выделения один раз в неделю, до тех пор, до стабилизации, затем ежемесячно (чаще, если меняется медикаментозная терапия или статус пациента)
|
| Лекарственные препараты |
Противомоторные агенты.
ИПП или Н2-блокаторы
Мультивитаминные и минеральные добавки
|
Противомоторные агенты.
ИПП или Н2-блокаторы.
Мультивитаминные и минеральные добавки.
Возможно замещение ферментов поджелудочной железы или применение секвестрантов желчных кислот. Введение урсодезоксихолевой кислоты может быть полезным при заболеваниях печени, ассоциированных с ПП.
|
| Нутритивная поддержка |
При энтеральном питании, уточнение типа зонда и энтеральной формулы. При парентеральном питании, уточнение типа катетера, положения кончика катетера и формулы.
Обратите внимание на любые дополнительные внутривенные жидкости.
|
Необходимо обращать внимание на любые изменениях в энтеральных или парентеральных смесях
Заболевание печени, вызванное полным ПП, можно свести к минимуму, вводя высокие калории энтерально, избегая перекармливания, используя смешанное «топливо» (менее 30% жира), предотвращая специфический дефицит питательных веществ, леча бактериальный рост и предотвращая рецидивирующий сепсис.
|
| Профилактика сепсиса, ассоциированного с тромбозом катетера | Попытка стерилизации катетера перед удалением, если инфекции вызваны коагулазонегативными стафилококками и грамотрицательными бактериями. | |
| Частота мониторинга | Ежедневно | Еженедельно до стабилизации, затем снизить частоту (под контролем нутритивного статуса) |
| Другое |
Знайте точную послеоперационную кишечную анатомию.
Перед выпиской передача данных по долгосрочному
План наблюдения врачу первичной медико-санитарной помощи.
|
Следите за адаптацией кишечника и по мере возможности вносите изменения в план мониторинга
Скрининг заболеваний костей и анемии
|
| 1Соотношение объема орального, энтерального и парентерального приема жидкостей и объема выделенной мочи, стула и дренажной жидкости | ||
Индикаторы эффективности лечения:
Таблица 14. Индикаторы качества пациент-ориентированного подхода оказания помощи при СКК [39].
| Индикатор | Описание |
| Организация помощи | Наличие специально обученного медицинского персонала (медицинских сестер) |
| Обеспечение преемственности между стационарным и амбулаторным звеньями оказания помощи | |
| Своевременный мониторинг, госпитализация по показаниям | |
| Повышение осведомлённости пациентов и специалистов | Наличие образовательных программ для пациентов, специалистов |
| Нутритивный статус | Набор веса пациента |
|
Осложнения
1) Снижение частоты обструкции, инфицирования катетеров
2) Снижение частоты госпитализаций
|
1) Обеспечение катетерами
2) Утилизация использованных катетеров
|
| Качество жизни | Улучшение качества жизни (включая социальный, психологический аспекты) |
Госпитализация
Решение о госпитализации всегда принимается врачом, основываясь на оценке тяжести состояния пациента, анамнеза, клинических данных, лабораторных показателей и доступных ресурсов. Пациенты с СКК часто требуют междисциплинарного подхода с участием гастроэнтерологов, диетологов, хирургов, инфекционистов и других специалистов [5,17].
1) показания для плановой (ускоренной) госпитализации:
2. Тяжелая нутритивная недостаточность (мальнутриция):
3. Необходимость специализированного диагностического или хирургического вмешательства:
2. Осложнения, связанные с центральным венозным доступом (при парентеральном питании):
3. Другие осложнения СКК:
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2024
- 1. K.Iyer, J.K.DiBaise, А.Rubio-Tapia. AGA Clinical Practice Update on Management of Short Bowel Syndrome: Expert Review. Clinical Gastroenterology and Hepatology, 2022. - 20. Р.2185–2194 2. L.Pironi, J.Arends et al. ESPEN practical guideline: Clinical nutrition in chronic in-testinal failure. Clinical Nutrition, 2021. - 40, 5196e5220 3. Ю. В. Аверьянова, И. М. Батыршин, А. Е. Демко с соавт. Клинические рекомен-дации Северо-Западной ассоциации парентерального и энтерального питания, Межрегиональной ассоциации по неотложной хирургии, Российской гастроэнтеро-логической ассоциации, Союза реабилитологов России и Российского трансплан-тационного общества по диагностике и лечению синдрома короткой кишки с ки-шечной недостаточностью у взрослых. Рос журн гастроэнтерол гепатол колопрок-тол, - 2022. – 32 (1) 4. K.Goral, P.Matras, M.Skrzypek. Nutritional management of short bowel syndrome in adult patients. European Journalof Medical Technologies, 2018. – 4 (21). – Р.1-9 5. B Guillen, NS Atherton. Short Bowel Syndrome. StatPearls, 2022 6. P.Allan, S.Lal. Intestinal failure: a review. F1000Research 2018, 7 7. O.Goulet, E.A.Nader, B.Pigneur, C.Lambe. Short Bowel Syndrome as the Leading Cause of Intestinal Failure in Early Life: Some Insights into the Management. Рediatr Gastroenterol Hepatol Nutr, 2019. – 22 (4). Р.303-329 8. J.Bering, J.K.DiBais. Short bowel syndrome: Complications and management. Nutr. Clin. Pract, 2023. – 38. Р.S46–S58 9. L.Pironi, J.Arends, J.Baxter et al. ESPEN endorsed recommendations. Definition and classification of intestinal failure in adults. Clinical Nutrition, 2015. – 34. Р.171. e180 10. S.Lakkasani, D.Seth, I.Khokhar et al. Concise review on short bowel syndrome: Eti-ology, pathophysiology, and management. World J Clin Cases, 2022. – 6. 10 (31). Р.11273–11282. 11. A.Verbiest, P.Bekker Jeppesen, F.Joly et al. The Role of a Colon-in-Continuity in Short Bowel Syndrome. Nutrients, 2023. – 15 (3). – Р.628. 12. A.Catapano, G.Trinchese, F.Cimmino et al. Impedance Analysis to Evaluate Nutri-tional Status in Physiological and Pathological Conditions. Nutrients, 2023. – 15 (10). Р .2264. 13. J.T.Grainger, Y.Maeda, S.C.Donnelly, C.J.Vaizey. Assessment and management of patients with intestinal failure: a multidisciplinary approach. Clin Exp Gastroenterol, 2018. – 11. Р. 233–241. 14. A.Kesari, J.Y. Noel. Nutritional Assessment. StatPearls Publishing, Treasure Island, 2022 15. E.Reber, F.Gomes, M.F.Vasiloglou et al. Nutritional Risk Screening and Assessment. J Clin Med, 2019. – 8 (7). Р.1065. 16. C.Caporilli, G.Giannì, F.Grassi, and S.Esposito. An Overview of Short-Bowel Syn-drome in Pediatric Patients: Focus on Clinical Management and Prevention of Complica-tions. Nutrients, 2023. – 15 (10). Р. 2341. 17. M.T.Siddiqui, W.Al-Yaman, A.Singh and D.F.Kirby. Short-Bowel Syndrome: Epi-demiology, Hospitalization Trends, In-Hospital Mortality, and Healthcare Utilization. JPEN J Parenter Enteral Nutr, 2021. – 45 (7). Р.1441–1455. 18. A.Aksan, K.Farrag, I.Blumenstein et al. Chronic intestinal failure and short bowel syndrome in Crohn’s disease. World J Gastroenterol, - 2021. 27 (24). Р. 3440–3465. 19. T.Kato, Y.Nakano, F.Yamane, R.Ohta and C.Sano. Consideration of Intestinal Fail-ure in Cases of De-Adaptation of Short Bowel Syndrome: A Case Report and Descriptive Review. Healthcare (Basel), 2021. – 9 (12). Р.1660. 20. S.M.Oke, J.M.Nightingale and S.M.Gabe. Mistakes in Short bowel and how to avoid them. UEG Education, 2018. Р.7–11. 21. X.Guan, D.Chen, Y.Xu. Clinical practice guidelines for nutritional assessment and monitoring of adult ICU patients in China. Journal of Intensive Medicine, 2024. – Vol.4, Issue 2. P.137-159В. 22. М.Луфт. Синдром короткой кишки - проблемы лечения и возможные перспек-тивы. Санкт-Петербург, Доклад с XVI Межрегиональной научно-практической конференции "Искусственное питание и инфузионная терапия больных в медицине критических состояний" 21-22 апреля 2016 г. https://www.slideshare.net/rnw-aspen/ss-65851686 23. C.Cuerda, L.Pironi, J.Arends et al. ESPEN practical guideline: Clinical nutrition in chronic intestinal failure. Clinical Nutrition, 2021. Vol. 40, Issue 9. P.5196-5220 24. C.R.Parrish. Pediatric Short Bowel Syndrome: Nutritional Care. Practical gastroen-terology, 2021. - 23p. 25. S. Massironi et al. Understanding short bowel syndrome: Current status and future Perspectives. Digestive and Liver Disease, 2020. – 52. – Р.253–261 26. F.Bioletto, C.D’Eusebio, F.D.Merlo. Efficacy of Teduglutide for Parenteral Support Reduction in Patients with Short Bowel Syndrome: A Systematic Review and Meta-Anal-ysis. Nutrients, 2022. – 14. Р.796 27. Short bowel syndrome foundation. https://shortbowelfoundation.org/about/ 28. C.R.Parrish, The Clinician’s Toolkit for the Adult Short Bowel Patient Part II: Phar-macologic Interventions. Practical Gastroenterology, Nutrition issues in gastroenterol-ogy, serieas, 2022. - 223, p12-31, 29. A.Aksan, K.Farrag, I.Blumenstein et al. Chronic intestinal failure and short bowel syndrome in Crohn’s disease. World J Gastroenterol, 2021. – 27 (24). Р. 3429-3692 30. X.Gao, L.Zhang, S.Wang et al. Prevalence, Risk Factors, and Complications of Cholelithiasis in Adults With Short Bowel Syndrome: A Longitudinal Cohort Study. Front. Nutr., 2021. Sec. Clinical Nutrition 31. E.Belcher, D.Mercer, B.P.Raphael et al. Management of short-bowel syndrome: A survey of unmet educational needs among healthcare providers. J Parenter Enteral Nutr, 2022. – 46. Р. 1839–1846 32. Harpain F, Schlager L, Hütterer E, Dawoud C, Kirchnawy S, Stift J, Krotka P, Stift A. Teduglutide in short bowel syndrome patients: A way back to normal life? JPEN J Parenter Enteral Nutr, 2022. – 46 (2). Р.300-309. 33. European Medicines Agency. Committee for Medicinal Products for Human Use. As-sessment Report: Revestive. Available at: http://www.ema.europa.eu/docs/en_GB/docu-ment_library/EPAR_-_Public_assessment_report/human/002345/WC500132928.pdf [Last accessed 01/03/2017]. 34. K.Chen, F.Mu, J.Xie et al. Impact of Teduglutide on Quality of Life Among Patients With Short Bowel Syndrome and Intestinal Failure. Journal of Parenteral and Enteral Nu-trition, 2020. – 44 (1). Р.119-28. 35. M.Schoeler, T.Klag, J.Wendler et al. GLP-2 analog teduglutide significantly reduces need for parenteral nutrition and stool frequency in a real-life setting. Therap Adv Gas-troenterol, 2018. - 11:1756284818793343. 36. L.Billiauws, M.Thomas, J.Le-Beyec-Le-Bihan, F.Joly. Intestinal adaptation in short bowel syndrome. What is new? Nutrición Hospitalaria, 2018. - vol. 35, no. 3, pp. 731-737 37. R.Eçaa, E.Barbosa. Short bowel syndrome: Treatment options. J.Сoloproct, 2016. - 3 6(4): 262–272 38. B.Bielawska, J.P.Allard. Parenteral Nutrition and Intestinal Failure. Nutrients, 2017. 9 (5). – Р.466. 39. F.J.Vílchez-López, L.Larrán-Escandón, J.M.García-Almeida. Evidence-based rec-ommendations of the Andalusian Group for Nutrition Reflection and Investigation (GA-RIN) for the management of adult patients with short bowel syndrome. Nutr Hosp, 2021. – 38 (6). Р.1287-1303 40. J.L.Muff, F.Sokolovski, Z.Walsh-Korb et al. Surgical Treatment of Short Bowel Syn-drome—The Past, the Present and the Future, a Descriptive Review of the Literature. Children (Basel), 2022. – 9 (7). – Р.1024. 41. D.Kovacevich, M.Corrigan, V.M.Ross, L.McKeever et al. American Society for Par-enteral and Enteral Nutrition Guidelines for the Selection and Care of Central Venous Access Devices for Adult Home Parenteral Nutrition Administration. JPEN J Parenter Enteral Nutr, 2019. 43 (1). Р.15–31. 42. D.F.Mercer. Surgical considerations in the management of short bowel syndrome. Nutr. Clin. Pract, 2023. – 38. Р.S88–S97 43. G.E.Gondolesi, M.Doeyo, C.E.Lic, F.Lobos, S.Rubio, C.Rumbo, et al. Results of Sur-gical and Medical Rehabilitation for Adult Patients With Type III Intestinal Failure in a Comprehensive Unit Today: Building a New Model to Predict Parenteral Nutrition Inde-pendency. JPEN J Parenter Enteral Nutr, 2020. 44 (4). Р.703–713 44. И.Н.Лейдерман, А.И.Ярошецкий, Е.А.Кокарев, В.А.Мазурок. Парентеральное питание: вопросы и ответы. Руководство для врачей. СПб «Онли-Пресс», 2016. - 192 с. 45. В.В. Бояринцев, М.А. Евсеев. Метаболизм и нутритивная поддержка хирурги-ческого пациента: Руководство для врачей—СПб.: Онли-Пресс, 2017.—260 с. 46. O.Goulet, E.A.Nader, B.Pigneur and C.Lambe. Short Bowel Syndrome as the Lead-ing Cause of Intestinal Failure in Early Life: Some Insights into the Management. Pediatr Gastroenterol Hepatol Nutr. 2019. – 22 (4). - 303-329. 47. D.Wendel, R.Kay, E.Walsh, S.Horslen. Pediatric Short Bowel Syndrome: Nutritional Care. Practical gastroent. Nutrition issues in gastroenterology series,2021. - 206 48. Ю.В.Аверьянова, Л.Вессель, Ю.В.Ерпулева с соавт. Лечение детей с синдромом короткого кишечника. М. Федеральные клинические рекомендации, 2014. – 35 с. 49. Standards of care provision for patients with intestinal failure. https://star-ship.org.nz/health-professionals 50. J.Carter, J.Bettag, S.Morfin et all. Gut Microbiota Modulation of Short Bowel Syn-drome and the Gut–Brain Axis. Nutrients, 2023. – 15 (11). Р.2581 51. J.Lykstad, S.Sharma. Biochemistry, Water Soluble Vitamins. StatPearls, 2023. 52. S.Machigashira, T.Kaji, S.Onishi, W.Yamada. The protective effect of fish oil lipid emulsions on intestinal failure-associated liver disease in a rat model of short-bowel syn-drome. Pediatric Surgery International, 2018. – 34 (1). 53. F.A.Rochling. Intravenous Lipid Emulsions in the Prevention and Treatment of Liver Disease in Intestinal Failure. Nutrients, 2021. – 13 (3). Р. 895 54. L.Aghakhani, S.J.Masoumi. Effects of Glutamine, Growth Hormone and Modified Diet in Short Bowel Syndrome: A Systematic Review. Int J Nutr Sci, 2019. - 4(1). Р.2-8
Информация
Список разработчиков протокола с указанием квалификационных данных:
Указание на конфликт интересов. Авторы заявили отсутствие конфликта интересов при разработке данного клинического протокола диагностики и лечения.
2) Шарипова Майра Набимуратовна – доктор медицинских наук, детский гастроэнтеролог, заведующая сектора патенто-информационной и доказательной медицины АО «Научный центр педиатрии и детской хирургии».
Указание условий пересмотра протокола: пересмотр не реже 1 раза в 5 лет и не чаще 1 раза в 3 года при наличии новых методов диагностики и лечения с уровнем доказательности.
Оценка пациента перед трансплантацией кишечника
| Сведения из медицинской карты | Анализ медицинского и хирургического анамнеза, получаемая терапия, документации текущее энтеральное и парентеральное питание |
| Анамнез и осмотр | Тщательное физикальное исследование и изучение анамнеза |
| Лабораторные исследования | Группа крови и резус фактор |
| Тканевое типирование (HLA) | |
| Предсуществующие антитела (PRA) | |
| Серология (CMV IgGandIgM, EBV IgGandIgM, HIV, HCV, HBeAg, HBsAg, HBsAb) | |
| ОАК, биохимический анализ, факторы воспаления | |
| Визуализационные исследования | Рентгенограмма грудной клетки |
| Допплеровское исследование печени | |
| УЗИ вен верхних и нижних конечностей | |
| Исследования желудка и кишечника | |
| Рентгенография с барием | |
| КТ живота и таза | |
| Эндоскопия | ЭГДС |
| Колоноскопия | |
| Исследование пассажа по ЖКТ | Пищеводно – желудочное |
| Тонкокишечное | |
| Толстокишечное | |
|
Печень
|
Биопсия печени |
| Кардиологическая оценка | ЭКГ |
| Эхо-КГ | |
| Стресс-тест и/или катетеризация сердца, если пациент старше 50 лет, факторы риска (полное парентеральное питание, сахарный диабет) | |
| Нефрологическая оценка | УЗИ почек |
| Суточный клиренс креатинина | |
| Дополнительные осмотры | Невролога |
| Инфекциониста | |
| Анестезиолога-реаниматолога | |
| Нутрициолога | |
| Пульмонолога | |
| Диспансеризация | Стоматолог |
| Маммография | |
| Мазок на онкоцитологию с шейки матки (Папаниколау) | |
| Вакцинация | |
| Гепатит A | |
| Гепатит B | |
| Пневмогруппа | |
| SARS-nCoV-2 | |
| Мультидисциплинарная оценка | Хирург-трансплантолог, хирург, гастроэнтеролог, нутрициолог |
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.