Саркомы мягких тканей
 Версия: Клинические рекомендации РФ 2025 (Россия)
Версия: Клинические рекомендации РФ 2025 (Россия)
Злокачественное новообразование других типов соединительной и мягких тканей (C49), Новообразования неопределенного или неизвестного характера периферических нервов и вегетативной нервной системы (D48.2), Новообразования неопределенного или неизвестного характера соединительной и других мягких тканей (D48.1)
Онкология
Общая информация
Краткое описание
Разработчик клинической рекомендации
Ассоциация онкологов России,
Общероссийская общественная организация «Российское общество клинической онкологии»,
Автономная некоммерческая организация "Восточно-Европейская группа по изучению сарком"
Общероссийская общественная организация «Российское общество клинической онкологии»,
Автономная некоммерческая организация "Восточно-Европейская группа по изучению сарком"
Одобрено Научно-практическим Советом Минздрава России
Клинические рекомендации
Саркомы мягких тканей
Год утверждения (частота пересмотра): 2025
Пересмотр не позднее: 2027
ID: 515_3
Возрастная категория: Взрослые
Определение заболевания или состояния (группы заболеваний или состояний)
Саркомы мягких тканей (СМТ) – это опухоли соединительной ткани – опухоли связок, сухожилий, мышц и жировой ткани, происходящие из примитивной мезодермы. В эту группу также включены опухоли из клеток примитивной эктодермы (шваннома) и эндотелиальных клеток, выстилающих сосуды. Эта разнородная группа опухолей объединена вместе из-за схожести морфологической картины, и клинических проявлений. Саркомы висцеральных органов встречаются редко, в почках, предстательной железе, легких и сердце. Отдельно рассматриваются саркомы молочной железы и матки. В диагностике, классификации и выборе тактики лечения определяющую роль играют микроскопическая картина, степень злокачественности и, в некоторых случаях, органная принадлежность. Но следует понимать, что если речь идет о лейомиосаркоме, то вероятнее всего опухоль возникла из гладкой мускулатуры, в то время как синовиальная саркома обычно не возникает из синовиальной капсулы суставов.
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
По Международной статистической классификации болезней и проблем, связанных со здоровьем (далее – МКБ-10) такие опухоли классифицируются в соответствии с органом первичного происхождения, например, саркома забрюшинного пространства будет иметь код С48, саркома молочной железы – С50 [29].
C49 Злокачественное новообразование других типов соединительной и мягких тканей
С49.0 Соединительной и мягких тканей головы, лица и шеи
С49.1 Соединительной и мягких тканей верхней конечности, включая область плечевого пояса
С49.2 Соединительной и мягких тканей нижней конечности, включая тазобедренную область
С49.3 Соединительной и мягких тканей грудной клетки
С49.4 Соединительной и мягких тканей живота
С49.5 Соединительной и мягких тканей таза
С49.6 Соединительной и мягких тканей туловища неуточненной локализации
С49.8 Поражение соединительной и мягких тканей, выходящее за пределы одной и более вышеуказанных локализаций
С49.9 Соединительной и мягких тканей неуточненной локализации
Все новообразования, имеющие неопределённый или неуточнённый характер (код D48 по МКБ-10), рассматриваются как потенциально злокачественные. Такие пациенты должны напрвляться к онкологам в специализированные (в том числе федеральные) центры. Обследование и лечение в профильном учреждении сводят к минимуму вероятность диагностических ошибок и позволяют вовремя начать правильную терапию.
Таким образом, пациенты с кодом D48 направляются в федеральные онкологические центры, чтобы обеспечить наиболее точную диагностику и адекватное лечение с учётом потенциального риска развития или обнаружения злокачественных свойств опухоли.
D48 Новообразование неопределенного или неизвестного характера других и неуточненных локализаций
D48.1 Соединительной и других мягких тканей
Исключено:
соединительной ткани молочной железы (D48.6)
хрящей:
- гортани (D38.0)
- носа (D38.5)
- суставов (D48.0)
D48.2 Периферических нервов и вегетативной нервной системы
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
Международная гистологическая классификация
Международная гистологическая классификация сарком мягких тканей (классификация Всемирной организации здравоохранения (далее – ВОЗ), 5-е издание, 2020 г.) [233]:
|
Адипоцитарные опухоли:
|
|
|---|---|
|
Промежуточные (местноагрессивные)
|
|
|
8850/1
|
Атипичная липоматозная опухоль
|
|
Злокачественные адипоцитарные опухоли
|
|
|
8851/3
|
Липосаркома, высокодифференцированная, БДУ
Липомоподобная липосаркома
Воспалительная липосаркома
Склерозирующая липосаркома
|
|
8852/3
|
Миксоидная липосаркома
|
|
8858/3
|
Дедифференцированная липосаркома
|
|
8854/3
|
Плеоморфная липосаркома
Эпителиоидная липосаркома
|
|
8855/3
|
Смешанная липосаркома
|
|
8859/3
|
Миксоидная плеоморфная липосаркома
|
|
Фибробластические/миофибробластические опухоли:
|
|
|
Промежуточные (местноагрессивные)
|
|
|
8815/0
|
Солитарная фиброзная опухоль, доброкачественная
|
|
8813/1
|
Фиброматоз ладонно-подошвенного типа
|
|
8821/1
|
Фиброматоз десмоидного типа
Экстраабдоминальный десмоид
|
|
8822/1
|
Абдоминальный фиброматоз
|
|
8851/1
|
Липофиброматоз
|
|
8834/1
|
Гигантоклеточная фибробластома
|
|
Промежуточные (редко метастазирующие)
|
|
|
8832/1
|
Дерматофибросаркома выбухающая, БДУ
8833/1 Пигментная дерматофибросаркома выбухающая
8832/3 Дерматофибросаркома выбухающая, фибросаркоматозная
Миксоидная дерматофибросаркома выбухающая
Дерматофибросаркома выбухающая с миоидной дифференцировкой
Бляшковидная дерматофибросаркома выбухающая
|
|
8815/1
|
Солитарная фиброзная опухоль, БДУ
Жирообразующая (липоматозная) солитарная фиброзная опухоль
Гигантоклеточная солитарная фиброзная опухоль
|
|
8825/1
|
Воспалительная миофибробластическая опухоль
Эпителиоидная воспалительная миофибробластическая саркома
|
|
8825/3
|
Миофибробластическая саркома
|
|
8810/1
|
Поверхностная CD34-положительная фибробластическая опухоль
|
|
8811/1
|
Миксовоспалительная фибробластическая саркома
|
|
8814/3
|
Инфантильная фибросаркома
|
|
Злокачественные
|
|
|
8815/3
|
Солитарная фиброзная опухоль, злокачественная
|
|
8810/3
|
Фибросаркома БДУ
|
|
8811/3
|
Миксофибросаркома
Эпителиоидная миксофибросаркома
|
|
8840/3
|
Низкодифференцированная фибромиксоидная саркома
|
|
8840/3
|
Склерозирующая эпителиоидная фибросаркома
|
|
Фиброгистиоцитарные опухоли:
|
|
|
Доброкачественные
|
|
|
9252/0
|
Теносиновиальная гигантоклеточная опухоль, БДУ
9252/1 Теносиновиальная гигантоклеточная опухоль, диффузная
|
|
Промежуточные (редко метастазирующие)
|
|
|
8835/1
|
Плексиформная фиброгистиоцитарная опухоль
|
|
9251/1
|
Гигантоклеточная опухоль мягких тканей
|
|
Злокачественные
|
|
|
9252/3
|
Злокачественная теносиновиальная гигантоклеточная опухоль
|
|
Cосудистые опухоли
|
|
|
Промежуточные (местноагрессивные)
|
|
|
9130/1
|
Капошиформная гемангиоэндотелиома
|
|
Промежуточные (редко метастазирующие)
|
|
|
9136/1
|
Сетчатая гемангиоэндотелиома
|
|
9135/1
|
Папиллярная интралимфатическая ангиоэндотелиома
|
|
9136/1
|
Сложная гемангиоэндотелиома
Нейроэндокринная сложная гемангиоэндотелиома
|
|
9140/3
|
Саркома Капоши
Классическая индолентная саркома Капоши
Эндемичная африканская саркома Капоши
СПИД-ассоциированная саркома Капоши
Ятрогенная саркома Капоши
|
|
9138/1
|
Псевдомиогенная (эпителиоидная саркома-подобная) гемангиоэндотелиома
|
|
Злокачественные
|
|
|
9133/3
|
Эпителиоидная гемангиоэндотелиома, БДУ
Эпителиоидная гемангиоэндотелиома с слиянием WWTR1-CAMTA1,
Эпителиоидная гемангиоэндотелиома с слиянием YAP1-TFE3
|
|
9120/3
|
Ангиосаркома
|
|
Перицитные (периваскулярные) опухоли
|
|
|
Злокачественные
|
|
|
8711/3
|
Гломусная опухоль, злокачественная
|
|
Опухоли гладкой мышечной ткани
|
|
|
Доброкачественные и промежуточные
|
|
|
8890/0
|
Лейомиома БДУ
|
|
8897/1
|
Гладкомышечная опухоль с неопределенным злокачественным потенциалом
|
|
Злокачественные
|
|
|
8890/3
|
Лейомиосаркома БДУ
|
|
Опухоли скелетной мышечной ткани
|
|
|
Злокачественные
|
|
|
8910/3
|
Эмбриональная рабдомиосаркома, БДУ
Эмбриональная рабдомиосаркома, плеоморфная
|
|
8920/3
|
Альвеолярная рабдомиосаркома
|
|
8901/3
|
Плеоморфная рабдомиосаркома, БДУ
|
|
8912/3
|
Веретеноклеточная рабдомиосаркома
Врожденная веретеноклеточная рабдомиосаркома с перестройками VGLL2/NCOA2/CITED2
Веретеноклеточная/склерозирующая рабдомиосаркома с мутацией MYOD1
Внутрикостная веретеноклеточная рабдомиосаркома (с перестройками TFCP2/NCOA2)
|
|
8921/3
|
Эктомезенхимома
|
|
Опухоли хрящевой и костной ткани
|
|
|
Злокачественные
|
|
|
9180/3
|
Остеосаркома, внескелетная
|
|
Опухоли оболочек периферических нервов
|
|
|
Злокачественные
|
|
|
9540/3
|
Злокачественная опухоль оболочки периферического нерва, БДУ
9542/3 Злокачественная опухоль оболочки периферического нерва, эпителиоидная
|
|
9540/3
|
Злокачественная меланотическая опухоль оболочки нерва
|
|
9580/3
|
Гранулярноклеточная опухоль, злокачественная
|
|
9571/3
|
Перинеуриома, злокачественная
|
|
Опухоли с неясной дифференцировкой
|
|
|
Промежуточные (местноагрессивные)
|
|
|
8811/1
|
Гемосидеротическая фибролипоматозная опухоль
|
|
8860/1
|
Ангиомиолипома, эпителиоидная
|
|
Промежуточные (редко метастазирующие)
|
|
|
8830/1
|
Атипичная фиброксантома
|
|
8836/1
|
Ангиоматоидная фиброзная гистиоцитома
|
|
8842/0
|
Оссифицирующая фибромиксоидная опухоль, БДУ
|
|
8940/0
|
Смешанная опухоль, БДУ
|
|
8940/3
|
Смешанная опухоль, злокачественная, БДУ
|
|
8982/0
|
Миоэпителиома БДУ
|
|
Злокачественные
|
|
|
8990/3
|
Фосфатурическая мезенхимальная опухоль, злокачественная
NTRK-перестроенная веретеноклеточная опухоль (возникщая)
|
|
9040/3
|
Синовиальная саркома NOS
9041/3 Синовиальная саркома, веретеноклеточная
9043/3 Синовиальная саркома, двухфазная
Синовиальная саркома, слабодифференцированная
|
|
8804/3
|
Эпителиоидная саркома
Проксимальная или крупноклеточная эпителиоидная саркома
Классическая эпителиоидная саркома
|
|
9581/3
|
Альвеолярная мягкотканная саркома
|
|
9044/3
|
Светлоклеточная саркома NOS
|
|
9231/3
|
Внескелетная миксоидная хондросаркома
|
|
8806/3
|
Десмопластическая мелкокруглоклеточная опухоль
|
|
8963/3
|
Рабдоидная опухоль NOS
|
|
8714/3
|
Периваскулярная эпителиоидная опухоль, злокачественная
|
|
9137/3
|
Интимальная саркома
|
|
8842/3
|
Оссифицирующая фибромиксоидная опухоль, злокачественная
|
|
8982/3
|
Миоэпителиальная карцинома
|
|
8805/3
|
Недифференцированная саркома
|
|
8801/3
|
Веретеноклеточная саркома, недифференцированная
|
|
8802/3
|
Плеоморфная саркома, недифференцированная
|
|
8803/3
|
Круглоклеточная саркома, недифференцированная
|
|
Недифференцированные мелкокруглоклеточные саркомы костей и мягких тканей
|
|
|
9364/3
|
Саркома Юинга
|
|
9366/3
|
Круглоклеточная саркома с EWSR1-не-ETS слияниям
|
|
9367/3
|
CIC-перестроенная саркома
|
|
9368/3
|
Саркома с генетическими изменениями BCOR
|
Стадирование
Рабочая, утвержденная в 2010г. (AJCC, 7th ed 2010) TNM-классификация построена на основании размеров и глубины расположения опухоли относительно поверхностной фасции для сарком конечностей (а – поверхностно расположенные; b – прорастающие фасцию и все опухоли брюшной полости, полости таза, грудной клетки и забрюшинного пространства):
T – Первичная опухоль:
T1 – Опухоль менее 5 см в диаметре
T1a – Поверхностная опухоль
T1b – Глубокая опухоль
T2 – Опухоль более 5 см в диаметре
T2a – Поверхностная опухоль
T2b – Глубокая опухоль
N – поражение регионарных лимфатических узлов:
N0 – Нет гистологически верифицированных пораженных лимфоузлов
N1 – Метастазы в регионарные лимфоузлы
M – Отдаленные метастазы:
M0 – Нет отдаленных метастазов
M1 – Есть отдаленные метастазы
Группировка по стадиям
Стадия I
T1a, bN0 M0, G1-2 (G1 по 3-ступенчатой системе)
T2a, bN0 M0, G1-2 (G1 3-ступенчатой системе)
Стадия II
T1a, 1bN0 M0, G3-4 (G2-3-ступенчатой системе)
T2aN0 M0, G3-4 (G2-3-ступенчатой системе)
Стадия III
T2b N0 M0, G3-4 (G3-3-ступенчатой системе)
T любая N1 M0 (G любая)
Стадия IV
T любая N любая M1, Любая G
В настоящее время готова 8-ая редакция классификации. Изменения коснулись размерам первичной опухоли в зависимости от локализации.
Ниже приводится 8-ая версия 2017г. (AJCC, 8th ed 2017) классификация сарком мягких тканей (за исключением GIST) [182]:
Саркомы мягких тканей туловища и конечностей
T – Первичная опухоль
Tx Размеры первичной опухоли невозможно определить
T0 – Первичная опухоль не определяется
T1 – < 5 см в наибольшем измерении
T2 – > 5 см до 10 см в наибольшем измерении
T3 – Опухоль более 10 см, но меньше 15 см в наибольшем измерении
T4 – опухоль более 15 см в наибольшем измерении
N – поражение регионарных лимфатических узлов:
N0 – Нет гистологически верифицированных пораженных лимфоузлов
N1 – Метастазы в регионарные лимфоузлы
M – Отдаленные метастазы:
M0 – Нет отдаленных метастазов
M1 – Есть отдаленные метастазы
Группировка по стадиям
Стадия I
T1 N0 M0 G1, Gx
Стадия IB
T2 N0 M0 G1, Gx
T3 N0 M0, G1, Gx
T4 N0 M0 G1, Gx
Стадия II
T1 N0 M0, G2, G3
Стадия III A
T2 N0 M0 G2, G3
Стадия IIIB
T3 N0 M0 G2, G3
T4 N0 M0 G2, G3
Стадия IV
Любой T N1 M0 Любой G
Любой T Любой N M1 Любой G
Саркомы мягких тканей брюшной полости, грудной полости и висцеральных органов
T – Первичная опухоль
T-x Размеры первичной опухоли невозможно определить
T1 – ограничено органом
T2 – опухоль выходит за пределы органа
T2a – прорастает серозу или висцеральную брюшину
T2b – распространяется за серозу
T3 – переходит на соседний орган
T4 – мультифокальный рост
T4a – 2 зоны поражения
T4b – 3-5 зон поражения
T4c – более 5 зон поражения
N – поражение регионарных лимфатических узлов:
N0 – Нет гистологически верифицированных пораженных лимфоузлов
N1 – Метастазы в регионарные лимфоузлы
M – Отдаленные метастазы:
M0 – Нет отдаленных метастазов
M1 – Есть отдаленные метастазы
Стадия
В настоящее время нет рекомендаций по распределению по стадиям
Саркомы мягких тканей головы и шеи
T – Первичная опухоль
Tx – Размеры первичной опухоли невозможно определить
T1 – < 2 см в наибольшем измерении
T2 – > 2 см до 4 см в наибольшем измерении
T3 – Опухоль более 4 см
T4 – опухоль с распространением на соседние органы/структуры
T4a – распространение на орбиту, основание черепа/дуру, лицевой скелет и т.д.
T4b – распространение на головной мозг, сонную артерию, превертебральные мышцы или периневральный рост в центральную нервную систему
N – поражение регионарных лимфатических узлов:
N0 – Нет гистологически верифицированных пораженных лимфоузлов
N1 – Метастазы в регионарные лимфоузлы
M – Отдаленные метастазы:
M0 – Нет отдаленных метастазов
M1 – Есть отдаленные метастазы
Группировка по стадиям
Это новая классификация, требуется набор данных для правильного распределения по стадиям.
Комментарии: 8 TNM классификацию следует считать единственной и рабочей после утверждения ее русифицированной версии профессиональными сообществами и регуляторными органами.
Определение степени злокачественности.
Данный параметр наиболее точно характеризирует тот или иной подтип сарком мягких тканей. Имеет определяющую прогноз болезни роль. Естественно, данный фактор играет важнейшую роль в определении объема лечения.
Степень злокачественности является также одним из 3-х факторов, определяющих стадию заболевания. Наиболее широко представлена классификация AJCC, в которой гистопатологическая градация опухоли (G) включена в рамки традиционной системы стадирования «TNM» (tumor-node-metastases). Степени распространения первичной опухоли Т1 (< 5 см) и Т2 (≥ 5 см) градуированы на «а» и «b» в зависимости от расположения новообразования относительно мышечной фасции («а» – опухоль располагается поверхностно, над фасцией; «b» – опухоль располагается глубоко под фасцией или вовлекает ее). Учтено состояние регионарных лимфатических узлов (N0 – интактные узлы, N1 – метастазы в регионарные лимфатические узлы). Выделены 4 степени дифференцировки опухоли: G1 – высокодифференцированные, G2 – умеренно дифференцированные, G3 и G4 – низко- или недифференцированные саркомы. Однако в ряде научных исследований авторы рассматривают три – G1, G2, G3 (G3+G4) а нередко и две G HI (G3+G4) и Glow (G1+G2) гистопатологические градации, обозначая их как низко- и высокозлокачественные опухоли.
Единых морфологических критериев оценки степени злокачественности сарком мягких тканей в настоящее время нет. Наиболее распространены две системы гистопатологической градации опухолей:
1) NCI (Национальный Институт Рака США));
2) FNCLCC (Federation Nationale des Center de Lutte Contrele Cancer Sarcoma Group) или, как её ещё обозначают в англоязычной литературе, FFCC (French Federation of Cancer Centeres – Французская федерация онкологических центров) [30].
Первая учитывает гистологический тип опухоли, её локализацию и количество некрозов; в определенных ситуациях во внимание принимается клеточность опухоли, ядерный плеоморфизм и митотический индекс. Вторая, в свою очередь, основана на расчете трех основных параметров сарком: дифференцировки опухоли, её митотической активности и количества некрозов. Ретроспективное сравнение этих двух систем показало, что система FNCLCC позволяет более точно предсказать развитие отдаленных метастазов и смерть пациентов от проявлений заболевания. Степень злокачественности сарком мягких тканей по этому методу определяется по сумме следующих трех показателей:
1) дифференцировка опухоли:
1 балл – саркомы близкие по строению к нормальной ткани, например, высокодифференцированная липосаркома;
2 балла – саркомы, у которых возможно определение гистологического типа, например, бифазная синовиальная саркома;
3 балла – эмбриональные саркомы, недифференцированные саркомы и саркомы неопределенного типа;
2) количество митозов:
1 балл – 0-9 в 10 полях (поле 0,1734 мм2);
2 балла – 10-19 в 10 полях;
3 балла – более 20 в 10 полях;
3) количество некротизированных опухолевых клеток:
0 баллов – нет некрозов;
2 балла – некроз менее 50% опухолевых клеток
3 балла – некроз более 50% опухолевых клеток
Общая сумма всех трех показателей, составляющая 2-3 балла, соответствует G1, 4-5 баллов – G2, 6-8 баллов – G3.
Частота митозов, морфологическая характеристика клеточного ядра, клеточность, клеточная анаплазия или полиморфизм и наличие некрозов являются наиболее важными факторами для выставления степени злокачественности. Установление степени злокачественности является субъективной процедурой, поэтому некоторые патоморфологи предпочитают классифицировать саркомы на 2 типа: high-grade или low-grade. Крайне важную роль в дифференциальной диагностике СМТ играет иммуногистохимический метод, который должен выполняться во всех случаях, когда заподозрена мезенхимальная опухоль.
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Не существует единого этиологического фактора для развития сарком мягких тканей. Генетическая предрасположенность играет роль в некоторых случаях.
Часто наблюдаются озлокачествление узлов при нейрофиброматозе (болезнь фон Рикленгаузена). Это аутосомно-доминантное заболевание, характеризующееся наличием множественных нейрофибром, гигантских невусов и неврином. На фоне нейрофиброматоза часто возникают: опухоль из оболочек перифеических нервов – нейрофибросаркома (10-15%), злокачественная неврилемома (5%) [20].
Лимфостаз повышает риск развития некоторых форм сарком мягких тканей. В частности синдром Стьюарта Тревеса ангиосаркома на фоне постмастэктомического отека верхней конечности описан у женщин после лечения рака молочной железы [21,22].
Воздействие известных канцерогенов на развитие сарком мягких тканей изучено недостаточно. Следует отметить возможность возникновения сарком мягких тканей после проведенной лучевой терапии. Радиоиндуцированные саркомы возникают через 6-30 и более лет после проведенного облучения (медиана 10 лет). Общая доза облучения, режим фракционирования и вид радиации влияют на заболеваемость. Алкилирующие агенты (циклофосфамид** и т.п.) в комбинации с лучевой терапией также увеличивают риск возникновения вторичных злокачественных новообразований [23,24].
Саркома Капоши возникшая на фоне вируса герпеса 8 типа у пациентов с ВИЧ инфекцией имеет агрессивное течение как при классическом, так и при африканском варианте проявления [25,26].
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
В 2023 г. в Российской Федерации саркомами мягких тканей заболело всего 3214 человек [27]. В 2023 г. грубый показатель заболеваемости (оба пола) составил 2,52 на 100 000 населения (прирост за 10 лет «-9,75%»), стандартизованный – 1,47 на 100 000 населения (прирост за 10 лет «-14,32%»). Кумулятивный риск развития сарком мягких тканей составил 0,15% [27].
В 2018 г. от сарком мягких тканей в России умерло 1477 мужчин и 1479 женщин. Грубый показатель смертности (оба пола) – 2,02 на 100 000 населения, стандартизованный – 1,42 на 100 000 населения (1,40 у женщин и 1,48 у мужчин) [27].
В 2023 г. было зарегистрировано следующее распределение заболевших по стадиям: стадия I-II – 55,5%, стадия III – 24,3%, стадия IV – 16,2%. Среди впервые заболевших активно заболевание выявлено у 12,3%. Летальность на 1-м году составила 18,4% [28]. Под наблюдением на конец 2023 г. состояли 31429 пациентов (21,4 на 100 000 населения), из них 5 лет и более наблюдались 21486 пациентов. Индекс накопления контингентов составил 11,2, а летальность – 4,0% [28].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Большинство пациентов предъявляют жалобы на бессимптомное опухолевое образование. Симптоматика появляется вследствие запущенного процесса, как результат поражения жизненно важных структур. Нарушение функции конечности, боль при сдавлении нервных структур, отеки как результат сдавления крупных венозных сосудом, лимфатические отеки, воспаление, распад и т.д. не являются симптомами для постановки диагноза и лишь результатом давно существующей проблемы.
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Современная правильная визуализация опухоли в совокупности с гистологическим исследованием является важным фактором, определяющим стадирование и объем и тактику лечения первичных, рецидивных и метастатических сарком мягких тканей. Под визуализацией следует понимать целую плеяду параметров: определение размеров, топики, связи с окружающими структурами, сосудами, степени кровоснабжения, наличия зон некрозом, результат проведенной терапии, наличие картины лечебного некроза. Для получения ответов на все эти вопросы следует использовать весь арсенал современной диагностики в онкологии.
Критерии установления диагноза/состояния:
- данные анамнеза
- данные физикального обследования
- данные патолого-анатомического исследования биопсийного (операционного) материала.
- В случае подозрения на наличие саркомы мягких тканей настоятельно рекомендуется направить пациента в медицинскую организацию онкологического профиля, специализирующуюся на диагностике и лечении данного заболевания [173].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
1. Жалобы и анамнез
- Рекомендуется сбор жалоб и анамнеза у пациента с целью выявления факторов риска и факторов, которые могут повлиять на выбор тактики лечения, методов диагностики и вторичной профилактики [172].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: чаще всего пациент обращается с жалобой на то, что появилась «припухлость», боль, отек в различных анатомических зонах, деформация мягких тканей, ограничение объемов движения в близлежащем суставе. При сборе анамнеза важна информация людей из близкого круга общения (семья, родственники), последние могут выявить рост опухоли в анатомических зонах, недоступных для визуального контроля пациентом. Уточняется начало развития заболевания, наличие болевого синдрома, изменения функции, оценивают влияние клинических проявлений на качество жизни пациента. Фиксируется наличие иммуносупрессии, вирусной инфекции, радиотерапии в анамнезе. Фиксируются также возможные симптомы генетически обусловленной патологии в семье.
2. Физикальное обследование
- Рекомендуется при физикальном обследовании пациента с подозрением на СМТ оценить состояние пораженной области, проверить функцию работы сустава, исключить риск развития патологического перелома, оценить периферические лимфоузлы [172,173].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарий: существует значительная вариация и неопределенность в отношении диагностической точности физикального обследования, частота ошибок при физикальном обследовании достаточно высока, для обеспечения точной диагностики злокачественных новообразований необходимо также использовать другие методы диагностики.
- Рекомендуется включить в осмотр пальпацию регионарных лимфатических узлов у пациентов с подозрением на злокачественное новообразование мягких тканей с целью исключения метастатического поражения регионарных лимфатических узлов [172,173].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: необходимо отметить, что пальпация лимфатических узлов у пациентов не исключает необходимость проведения ультразвукового исследования (УЗИ) лимфатических узлов у пациентов с установленным диагнозом, так как физикальное обследование лимфатических узлов не обладает достаточной точностью.
- Рекомендуется по результатам анализа жалоб, анамнеза и данных физикального обследования на приеме принять решение о целесообразности инвазивной диагностики (биопсии) новообразования с целью морфологической верификации диагноза и составления дальнейшего плана обследования и лечения [172,173].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
3. Лабораторные диагностические исследования
- Не рекомендуется проводить лабораторную диагностику до морфологического подтверждения диагноза. Если интеркуррентная патология или общее состояние пациента требует проведения лабораторных исследований для безопасного проведения биопсии, то необходимые исследования проводятся [172,173].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
- Пациентам с подтвержденным диагнозом СМТ при подготовке к проведению дальнейшего этапа лечения рекомендуется выполнять общий клинический и биохимический общетерапевтический анализы крови, также коагулограммы (ориентировочное исследование системы гемостаза) в целях оценки прогноза заболевания и планирования алгоритма лечения [174,175,176,177,178,180].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
Комментарии: также в рамках подбора оптимального алгоритма лечения пациента с установленным диагнозом необходима лабораторная диагностика в объеме, позволяющем выявить противопоказания к различным видам терапии.
4. Инструментальные диагностические исследования
Обнаруженное при пальпации опухолевое образование требует дальнейшего диагностического поиска, т.е. уточнения анатомической локализации с помощью УЗИ, КТ и МРТ, причем последний метод является наиболее информативным. Каждая из методик имеет свои преимущества и недостатки и их сочетание дает полноценную картину визуализации.
При проведении МРТ вовлечение в опухолевый процесс сосудов и нервов визуализируется в 80% случаев, при использовании КТ только в 60%. Диагностические возможности МРТ превосходят КТ, за исключением случаев поражения костных структур и ткани легкого. Полученная при МРТ информация о состоянии магистральных сосудов оказывается достаточно полной, что позволяет избежать проведения агиографии. Помимо сведений о первичной опухоли, МРТ позволяет дать правильную оценку состояния регионарных лимфатических узлов и с большой степенью достоверности высказать мнение о возможном их метастатическом поражении.
- Рекомендуется при первом обращении пациента с жалобами на наличие образования в мягких тканях или при подозрении на СМТ выполнить ультразвуковое исследование мягких тканей зоны поражения, при наличии признаков новообразования выполнить пункционную биопсию [172,173].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется всем пациентам после гистологической верификации проводить инструментальные диагностические мероприятия (включая лучевую диагностику) в полном объеме вне зависимости от стадии заболевания, в том числе рентгеновскую компьютерную томографию для опухолей брюшной полости и забрюшинного пространства и магнитно-резонансную томографию для опухолей конечностей, туловища, области головы и шеи [39-44,98,172,173].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: все нижеперечисленные исследования могут быть использованы в процессе диагностики и терапии СМТ:
— Компьютерная томография (органов брюшной полости и забрюшинного пространства, органов грудной полости, органов таза у мужчин или органов малого таза у женщин), при необходимости возможно использование контрастного усиления.
— Магнитно-резонансная томография (органов грудной клетки, мягких тканей, органов малого таза, органов брюшной полости, верхней конечности, нижней конечности, шеи или мягких тканей головы), при необходимости возможно использование контрастного усиления.
— Динамическая МРТ, диффузно взвешенная МРТ, МР-спектроскопия – по показаниям, согласно решению консилиума.
— Ультразвуковое исследование мягких тканей зоны поражения (+ цветовое допплеровское картирование).
— Ангиография, по показаниям, согласно решению консилиума (артерии верхней конечности, бедренной артерии, внутренней сонной артерии, грудной аорты, легочной артерии, наружной сонной артерии, общей сонной артерии, позвоночной артерии или сонной артерии), или компьютерно-томографическая ангиография (одной анатомической области, сосудов верхних конечностей, сосудов нижних конечностей, сосудов таза или одной зоны).
— Радиоизотопное исследование костей скелета для миксоидных липосарком (наиболее часто из всех сарком метастазируют в кости). Сцинтиграфия с 201Tl-хлоридом, 67Ga-цитратом и 99mTc-технетрилом.
— МРТ головного мозга (при невозможности КТ) для альвеолярной саркомы мягких тканей и гемангиоперицитомы (наиболее часто выявляется поражение головного мозга).
— Позитронно-эмиссионная томография, совмещеннная с компьютерной томографией с туморотропными РФП (ПЭТ и ПЭТ/КТ) – по показаниям [39,40,41,42,43,44].
- Рекомендуется с целью оценки распространённости опухолевого процесса пациентам с клинической стадией III-IV после установления диагноза выполнять для оценки состояния органов грудной клетки, брюшной полости и малого таза – компьютерную томографию (далее – КТ) органов грудной клетки, брюшной полости и малого таза. Внутривенное контрастирование следует проводить во всех случаях, если не выявлены противопоказания к введению йодсодержащих контрастирующих препаратов – в этом случае КТ с в/в контрастированием допускается заменить на МРТ с в/в контрастированием. Альтернативной может быть позитронно-эмиссионная томография, совмещеннная с компьютерной томографией с туморотропными РФП (далее – ПЭТ/КТ) в режиме «все тело» [39-43,172,173].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств– 5).
- Рекомендуется для исключения метастатического поражения головного мозга у пациентов с альвеолярной саркомой мягких тканей, гемангиоперицитомой/солитарной фиброзной опухолью выполнять МРТ головного мозга с в/в контрастированием, за исключением случаев, когда проведение МРТ противопоказано, – в таких случаях исследование может быть заменено на КТ головного мозга с в/в контрастирование [44,173].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: в случае невозможности выполнить МРТ головного мозга с в/в контрастированием допускается выполнить КТ головного мозга с в/в контрастированием [45].
- Рекомендуется всем пациентам с СМТ при подозрении на метастатическое поражение костей скелета вне зависимости от клинической стадии выполнять сцинтиграфию костей всего тела (остеосцинтиграфию) или ПЭТ-КТ после установления диагноза [179].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2).
- Рекомендуется после установления диагноза выполнить биопсию очагов метастазирования под контролем УЗИ или КТ при подозрении на метастазы по данным КТ или МРТ в случаях, когда их подтверждение принципиально меняет тактику лечения [172,173].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется во всех случаях с подозрением на СМТ выполнение биопсии опухолей, опухолеподобных образований мягких тканей с целью верификации диагноза, на основании патолого-анатомического заключения определяется дальнейшая тактика лечения [46,172,173].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: биопсия должна выполняться под контролем сертифицированного врача-онколога, врача-травматолога-ортопеда или хирурга. Предпочтительным способом получения опухолевой ткани для патоморфологического исследования является толстоигольная биопсия. Открытая (инцизионная) биопсия выполняется в тех случаях, когда толстоигольная биопсия невозможна. Возможно использование эндоскопической техники при локализациях процесса в полости малого таза, грудной клетке или в брюшной полости.
5. Иные диагностические исследования
Гистологическая верификация/гистологический диагноз
-
Рекомендуется выполнение до начала лечения патолого-анатомического исследования биопсийного материала для верификации диагноза во всех случаях подозрения СМТ с фиксацией в заключении следующих данных:
- гистологический подтип (с указанием набора иммуногистохимических тестов);
- определение индекса пролиферативной активности экспрессии Ki-67 иммуногистохимическим методом;
- определение степени злокачественности (с указанием использованной системы градации G) [45,46].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: цитологическое исследование не используется рутинно для определения гистологического подтипа СМТ [31]. Патоанатомическое исследование должно проводится врач-патологоанатомом, имеющим опыт работы в мультидисциплинарной команде по лечению сарком. При условии отсутствия у врача-патологоанатома опыта работы/стажировки/обучения в крупной референтной лаборатории необходимо организовать «второе мнение».
-
Рекомендуется выполнение патолого-анатомического исследования биопсийного (операционного) материала (хирургически удаленного опухолевого препарата) с отражением в заключении необходимых характеристик для определения стадии заболевания и прогноза:
- Орган, локализация
- Размеры макропрепарата
- Состояние окружающих структур, их связь с опухолью
- Гистологический подтип (с указанием набора иммуногистохимических тестов);
- определение индекса пролиферативной активности экспрессии Ki-67 иммуногистохимическим методом;
- определение степени злокачественности (с указанием использованной системы градации G);
- указание митотической активности, степени выраженности зон некроза.
- Состояние краев, с указанием всех зон. Расстояние опухоли от хирургического края
- Тип тестирования: Световая микроскопия, электронная микроскопия, иммуногистохимическое исследование, маркеры, статус, молекулярно-генетическое исследование [45,46].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Роль молекулярно-генетических исследований в дифференциальной диагностике сарком мягких тканей
Иммуногистохимическое исследование является обязательным для первого этапа установки/дифференциальной диагностики отдельных подтипов сарком мягких тканей.
Необходимость молекулярно-генетических исследований в дифференциальной диагностике сарком мягких тканей определяется врачом-патологанатомом.
- Рекомендуется проводить молекулярно-генетическое исследование транслокации t(X;18) в биопсийном (операционном) материале для дифференциальной диагностики: синовиальной саркомы, опухолей семейства Юинга [32,33,34,35,36,37,38].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
Комментарии: для дифференциальной диагностики некоторых подтипов сарком мягких тканей, таких как саркомы семейства Юинга/ПНЭТ, синовиальная саркома, миксоидная липосаркома, альвеолярная саркома, светлоклеточная саркома необходимо использовать (необходимость определяется патоморфологом после ИГХ исследования) цитогенетический анализ для изучения специфических транслокаций/транскрипций. Необходимость изучения молекулярно-генетического профиля для дифференциальной диагностики вышеуказанных подтипов обусловлена принципиально разными подходами к терапии этих форм сарком мягких тканей. Выявление химерных транскриптов SSX1/SSX2 при специфической транслокации 18 хромосомы t(X;18)(p11;q11) встречается при синовиальной саркоме. EWSR1 – опухолей семейства Юинга/ПНЭТ, мелкокруглоклеточной десмопластической саркомы [32,33,34,35,36,37,38]. Определение специфических транслокаций/транскрипций имеет важное значение и в лекарственной терапии. Цитогенетический анализ в ближайшем будущем позволит расширить возможности таргетной индивидуализированной терапии в лечении различных подтипов сарком мягких тканей [222].
- Рекомендуется проводить молекулярно-генетическое исследование транслокации t(12;16) в биопсийном (операционном) материале для дифференциальной диагностики миксоидной круглоклеточной липосаркомы [32,33,34,35,36,37,38,188].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
Коментарии: реаранжировка гена FUS-CHOP является аберрантным транскрипционным регулятором, влияющим на дифференцировку адипоцитов, стимулирующим их пролиферацию и опухолевую трансформацию – слияние генов CHOP и TLS с синтезом белка FUS-CHOP [32,33,34,35,36,37,38,188,222].
- Рекомендуется проводить молекулярно-генетическое исследование с целью изучения транскрипционного фактора ASPL-TFE3 (транслокация 17 хромосомы t(X;17)(p11;q25) для дифференциальной диагностики альвеолярной саркомы [32,33,34,35,36,37,38,222].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств –3).
- Рекомендуется проводить молекулярно-генетическое исследование транслокации t(12;22) в биопсийном (операционном) материале для дифференциальной диагностики светлоклеточной саркомы [32,33,34,35,36,37,38,222].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
- Рекомендуется проводить молекулярно-генетическое исследование с целью определить PAX3/FOXO1 или PAX7::FOXO1 (транслокация t(2;13)(q35;q14) или t(1;13)(p36;q14) для дифференциальной диагностики альвеолярной рабдомиосаркомы [233].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется проводить молекулярно-генетическое исследование с целью определить WWTR1/CAMTA1 и/или YAP1/TFE3 (транслокация t(1;3)(p36;q25) и/или t(X;11)(p11.23;q22.1) для дифференциальной диагностики эпителиоидной гемангиоэндотелиомы [233].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется проводить молекулярно-генетическое исследование с целью определить NTRK 1, 2 или 3 для дифференциальной диагностики NTRK-веретеноклеточной саркомы [233].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
-
Рекомендуется определять тактику лечения в зависимости от возраста пациента, стадии заболевания, размера и локализации опухоли, морфологии и степени дифференцировки опухоли и дальнейшее лечение пациентов с СМТ осуществлять междисциплинарной командой с привлечением ряда специалистов: врача-патологоанатома, радиолога, врача-хирурга, радиотерапевта, врача-онколога и, если необходимо, детского онколога, в крупных медицинских организациях, специализирующихся на данном заболевании, для обеспечения комплексного подхода, в том числе с применением телемедицинских технологий [5,172,173].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
1. Хирургическое лечение
-
Рекомендуется выполнять хирургическое вмешательство при местно-распространенных саркомах мягких тканей низкой степени злокачественности и опухолей G2-3 размером < 5 см. Также оперативное вмешательство является обязательным этапом многокомпонентной терапии высокозлокачественных местно-распространенных сарком [5,43,95,99,105,225].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: широкое иссечение опухоли в пределах здоровых тканей, с учетом принципов футлярности и зональности является стандартом хирургического вмешательства. Один сантиметр отступа от новообразования считается минимальным, удаление опухоли в мышечной фасции или муфте подразумевает край > 1-5 см. Край может быть минимальным в случае стойкого анатомического барьера, такого как мышечная фасция или надкостница, сухожильный конец мышцы. Краевое иссечение может рассматриваться, в исключительных случаях. Границы резекции – основной метод оценки качества хирургического пособия. Определяется совместно хирургом и гистологом. Зону и тракт биопсии необходимо включить в объем окончательной хирургии [95].
-
Рекомендуется обязательное изучение микроскопического края резекции согласно интраоперационной маркировки краев препарата [3,43,95,99,225].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: наличие микроскопически положительного края является показанием для реиссечение и/или проведения послеоперационной лучевой терапии. Разметка ложа опухоли хирургом должна выполняться для определения полей последующей радиотерапии. Широкие органосохраняющие операции с пред- и/или послеоперационной лучевой терапией дают хорошие результаты при высокодифференцированных саркомах конечностей.
-
Рекомендуется обсуждать целесообразность проведение внутритканевой или интраоперационной лучевой терапии в отдельных клинических случаях [4,21,190]. Лечение возможно в специализированных онкоортопедических клиниках.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Рекомендуется выполнение калечащих операций (ампутации, экзартикуляции и др.) только в тех случаях, когда достигнуть радикальности R0 (R1) технически невозможно [43,95].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
Рекомендуется всем пациентам выполнять предоперационное планирование объема предстоящего хирургического вмешательства. В частности, границы удаляемых тканей, уровни резекции мышц, костей, сосудов, нервов. Это позволяет увеличить частоту радикальных вмешательств, запланировать объем пластического этапа реконструкции опорных, покровных тканей [1,43,95].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: выполнение радикальной хирургии в лечении первичных сарком мягких тканей позволяет снизить процент локальных рецидивов до 15%. Требования к радикальной хирургии подразумевают выполнение различного объема вмешательств, таких как удаление одного или двух мышечно-фасциальных футляров, резекция магистрального сосудистого пучка, резекция костных структур, обширные резекции грудной и брюшной стенки, резекции структур позвоночного столба, резекции костей таза и т.д. Каждое вмешательство необходимо запланировать заранее с участием онкоортопеда, нейрохирурга, пластического хирурга, микрохирурга, абдоминального и торакального хирургов, радиолога, химиотерапевта. Весь объем онкоортопедичесого хирургического пособия возможен только в крупных саркомных центрах.
-
Рекомендуется применение длительной антибактериальной профилактики (цефалоспорины I и II поколения) послеоперационных инфекционных осложнений (5-7 дней) после хирургических вмешательств, сопряженных с высоким риском инфекционных осложнений [185,186,187].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
Комментарии: удаление большого массива тканей, требующего реконструктивно-пластического этапа. Кровопотеря больше 1000 мл, длительное дренирование раны, предшествующие курсы химиотерапии, радиотерапия являются факторами риска возникновения инфекционных осложнений > 12-15%. По мнению различных авторов обязательное применение антибиотиков до 5-7 дней после хирургического вмешательства может уменьшить риск осложнений. [186,187]. Отдельной группой рассматриваются пациенты после имплантации металлических конструкций, синтетических материалов (пластика сосудов, сеткой или пластинами). В случаях высокого риска развития инфекционных осложнений у пациентов, которым выполнены операции с установкой имплантов, рекомендовано проводить профилактическую антибактериальную терапию высокого риска [185]. Факторами риска являются высокозлокачественные опухоли, глубокое расположение опухоли, иммуносупрессия от неоадъювантной химиотерапии, предшествующая лучевая терапия, неадекватная антибиотикопрофилактика, прием кортикостероидов, большая раневая поверхность, продолжительное время операции (более 3х часов), массивная кровопотеря более 0,5 ОЦК, вторичное заживление раны, некрозы кожи, дополнительные хирургические манипуляции, сопутствующие заболевания (анемия, сахарный диабет и т.д.)
2. Лучевая терапия
Различные варианты радиотерапии
1. Лучевая терапия с модулированной интенсивностью (IMRT)
-
Рекомендуется применение конформной дистанционной лучевой терапии, в том числе IMRT, IGRT, ViMAT, стереотаксической ЛТ, как метода первого выбора во всех случаях, когда планируется лучевая терапия как этап послеоперационного или комбинированного лечения пациентов с СМТ [48].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 2).
Комментарии: при сравнении результатов брахиотерапии и IMRT (Лучевая терапия с модулированной интенсивностью) на основании рандомизированного исследования показано снижение частоты локальных рецидивов при IMRT (8%/17%) при схожих остальных результатах отдаленного контроля.
2. Брахиотерапия.
-
Рекомендуется использовать брахиотерапию в тех случаях, когда получение уровня радикальности R0 сомнительно или есть положительный край при срочной микроскопии R1 [47].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: метод возможен при наличии технических возможностей, рекомендован для использования в медицинских организациях, специализирующихся на оказании медицинской помощи пациентам со злокачественными новообразованиями костно-мышечной системы при наличии в них необходимого оборудования и обученного персонала (врача-хирурга, врача-радиолога, медицинского физика).
3. Интраоперационная лучевая терапия
-
Рекомендуется при локализации опухоли в сложных анатомических зонах (суставы, нервные сплетения) и при необходимости таргетной радиотерапии определенных зон в ране использовать предоперационную лучевую терапию [207,223,224,225].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
Комментарии: использование интраоперационной внутритканевой лучевой терапии возможно в клиниках, укомплектованных необходимым оборудованием и при наличии специально обученного персонала. Показания для применения данного вида терапии требует решения в специализированных онкоортопедических клиниках, на консилиуме с участием онкоортопеда, радиолога и химиотерапевта. При отсутствии возможности использования предоперационной IMRT+IORT рекомендуется предоперационная дистанционная лучевая терапия со стандартным фракционированием пациентам с высокозлокачественными саркомами с целью уменьшения объема операции (органосохранной) с последующим продолжением в виде послеоперационной терапии [48,207].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Рекомендуется пациентам с местно-распространенными СМТ применение лучевой терапии в пред- и послеоперационном периодах в целях повышения эффективности лечения [4,18,47,48,49,172].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарий: целесообразность использования предоперационной радиотерапии необходимо определить в специализированных онкоортопедических клиниках, на консилиуме с участием онкоортопеда, радиолога и химиотерапевта. Курсы индукционной химиотерапии следует начинать до лучевой терапии. Режим предоперационной лучевой терапии (фракции, интервалы, сроки, и т.д.) необходимо определить в условиях онкоортопедических клиник.
Использование послеоперационной дистанционной радиотеорапии (технологии 3-D и интенсивно модулированная (IMRT) лучевая терапия). Облучение ложа удаленой опухоли (низкозлокачественные СМТ) согласно интраоперационной маркировки – отступ от краев 2-3 см РОД=1,8-2 Гр, СОД=50 Гр. При положительном крае удаленной опухоли СОД=65-70Гр.
Облучение ложа опухоли удаленной опухоли согласно интраоперационной маркировки (высокозлокачественные СМТ) – отступ от краев опухоли 5 см РОД=1,8-2Гр, СОД=50Гр. Далее локально (буст) на ложе опухоли до 10-26 Гр в зависимости от статуса края резекции (отрицательный – 10-16 Гр, 16-18 Гр – минимальная остаточная опухоль, 20-26 Гр – положительный) [172].
-
Рекомендуется для высокозлокачественных местнораспространенных и/или метастатических сарком использование протонной терапии для повышения эффективности лечения за счет подведения более высоких доз излучения к опухоли и снижения токсичности и риска развития вторичных радиоиндуцированных опухолей [181].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: опубликованные данные об эффективности протонной терапии в лечении сарком мягких тканей основаны на малочисленных наблюдениях (серии 8 пациентов). Лечение может быть рекомендовано решением консилиума, при наличии технических возможностей для проведения терапии.
3. Химиотерапия
Системное лечение диссеминированных сарком мягких тканей может включать цитотоксическую химиотерапию, таргетную терапию и/или иммунотерапию. При лечении диссеминированных СМТ возможно применение как монохимиотерапии, так и комбинированной химиотерапии. Вопрос о выборе оптимального режима химиотерапии для начала (или продолжения) лечения в значительной степени зависит от спектра активности химиопрепаратов в отношении подтипа СМТ. В ходе лечения пациенты, как правило, успевают получить все доступные препараты, однако полные эффекты достигаются редко. Выбор терапии должен основываться на конечных целях, как показано ниже, при этом особое внимание следует уделять гистологическому подтипу и соматическому статусу пациента.
1. Неоадъювантная химиотерапия
-
Рекомендуется проводить неоадъювантную химиотерапию пациентам с местно распространенными саркомами мягких тканей G3 II-III стадии в тех случаях, когда запланировано органосохраняющее хирургическое лечение [2,6,10,97].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: предоперационный этап лечения позволяет получить возможность оценить ответ опухоли на полученное лечение и при необходимости изменить схему лечения. У пациентов с незначительным ответом на предоперационную ХТ менее благоприятный прогноз в отношении получения долгосрочной эффективности и увеличения выживаемости. Поэтому им необходимо проводить операцию на более ранних этапах лечения либо использовать альтернативные режимы системного лечения, основываясь на клинических данных. [85] С помощью МРТ, ПЭТ/КТ, стала возможна ранняя оценка ответов на неоадъювантную химиотерапию.
-
Рекомендуется использовать для неоадъювантного режима комбинацию доксорубицин**+ифосфамид** в разных дозоинтервальных вариантах, доксорубицин** в монорежиме, комбинация VAC (Винкристин**+Доксорубицин**+Циклофосфамид**) или VAC/IE (Ифосфамид**+Этопозид**), комбинация GemTax (#Гемцитабин**+#Доцетаксел**), #паклитаксел** (в монорежиме, 80 мг/м2 в 1-й, 8-й, 15-й дни каждые 4 недели) для пациентов высокого риска с высокозлокачественными, чувствительными к стандартной химиотерапии подтипами – (указанные комбинированые режимы – см. ниже) [2,5,6,10,193].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
2. Адъювантная химиотерапия
-
Рекомендуется проводить адъювантную (профилактическую) химиотерапию высокозлокачественных сарком (G3) мягких тканей после этапа хирургического лечения (за исключением нечувствительных подтипов СМТ) [54,84,85,191,192].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств –2).
3. Изолированная перфузия/регионарная гипертермия с химиотерапией
-
Рекомендуется при неоперабельных опухолях применение изолированной гипертермической перфузии мелфаланом** или регионарная гипертермия с химиотерапией, если опухоль ограничена конечностью [97,183,184].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: показания определяются на консилиуме. Лечение следует проводить в специализированных онкоортопедических клиниках.
-
Рекомендуется при лечении местных рецидивов применять подходы аналогичные таковым при местно-распространенном процессе, использовать пред- и послеоперационную химиотерапию и лучевую [16].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
4. Химиотерапия при распространенном опухолевом процессе
-
Рекомендуется проведение химиотерапии, как основного метода лечения диссеминированного процесса при саркомах мягких тканей. [24,51,52,53,54,55,57,58,71,74,78,79].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 1).
Комментарии: наиболее часто используются доксорубицин**, ифосфамид**, дакарбазин**. Стандартом химиотерапии диссеминированных сарком мягких тканей первой линии является комбинированный режим доксорубицин** + ифосфамид**. Для пациентов старше 65 лет методом выбора является монотерапия антрациклинами. При общем хорошем состоянии комбинированная химиотерапия предпочтительнее, когда ожидается выраженный эффект со стороны опухоли (высокочувствительные к химиотерапии саркомы). Выбор терапии должен быть основан на ряде факторов, в первую очередь морфологическом строении опухоли. Необходимо учитывать локализацию процесса, возраст пациента, сроки и объемы ранее проведенного лечения [6]. Синовиальная саркома и миксоидная липосаркома являются наиболее чувствительными к химиотерапии: миксоидная липосаркома – к доксорубицину**, синовиальная саркома – к алкилирующим агентам, таким как ифосфамид**.
Лейомиосаркомы матки, эндометриальные стромальные саркомы, миксофибросаркомы, дедифференцированные липосаркомы, злокачественные опухоли оболочки периферических нервов имеют индивидуальную вариабельность чувствительности к химиотерапии. Объективные эффекты при этих опухолях возможны и при применении двухкомпонентных режимов антрациклин/трабектедин, антрациклин/ифосфамид** и #гемцитабин**/#доцетаксел** [142].
-
Рекомендуется использование хирургического пособия при единичных и солитарных очагах в легких после эффективной химиотерапии. Такой подход увеличивает выживаемость пациентов. Также применяется хирургический этап при множественных метастазах после длительного положительного эффекта химиотерапии для дифференциальной диагностики остаточной опухоли и посттерапевтическоого фиброза [198,199].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
Комментарии: отсутствуют данные о влиянии хирургического лечения внелегочных метастазов на отдаленные результаты. Целесообразность оперативных вмешательств при невлегочных метастазах требует обязательного обсуждения на консилиуме.
5. Препараты и режимы
-
Рекомендуется использовать комбинацию доксорубицин** + ифосфамид** – (AI) в разных дозоинтервальных режимах для лечения как терапия первой линии для первичных, рецидивных и метастатических сарком [70-72,139,140,141,194,195,196,217].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Комментарии: режимы AI
- HD AI:
Доксорубицин** по 25 мг/м2 в 1-3-й день в/в в виде 72-часовой непрерывной инфузии; (при показаниях возможно проведение редукции дозы доксорубицина** до 60 мг/м2 в 1 день в/в)
Ифосфамид** по 2500 мг/м2 в 1-й-4-й дни в/в на фоне месны** 1000 мг/м2 3 раза в день в 1-4 дни по схеме;
Эмпэгфилграсти**/пэгфилграстим в соответствии с инструкцией в 5-й день или филграстим 5 мкг/кг/сут п/к в соответствии с инструкцией в 5-14 дни;
Длительность цикла – 3 недели [194]
- AI:
Доксорубицин** 60мг/м2 в 1 день в/в
Ифосфамид** суммарная доза 7500 мг/м2, разовая доза 2500 мг/м2 в 1-3 дни в/в на фоне месны** 1000 мг/м2 3 раза в день в 1-3-й дни по схеме;
Длительность цикла – 3 недели [70,214,215]
Преимущество комбинации доксорубицина** с ифосфамидом** над монотерапией доксорубицином** было продемонстрировано в рандомизированных исследованиях [70]. Увеличение доз препаратов: доксорубицин** 75-90 мг/м2 и ифосфамид** 10 мг/м2 с поддержкой КСФ приводит к более высокой частоте полных регрессий (9%) и общих ответов (64%) [71] Рандомизированное исследование 3-й фазы по сравнению эффективности доксорубицина** 75 мг/м2 с комбинацией доксорубицина** 75 мг/м2 и ифосфамида** 10 г/м2 продемонстрировало статистически значимое увеличение выживаемости без прогрессирования (4,6 и 7,4 мес соответственно) [72]. Основываясь на этих данных, пациенты с саркомами мягких тканей моложе 65 лет и ECOG 0-2 получают лечение комбинацией HD AI с последующим хирургическим лечением, если это возможно [194].
-
Рекомендуется использовать комбинированные режимы с включением доксорубицина** при наличии противопоказаний для использования ифосфамида** или при прогрессировании после применения режимов, не содержащих доксорубицин** [7,9,139,140,197,209].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: рекомендованные комбинированные режимы:
- ADIC чаще используется для лейомиосарком:
Доксорубицин** 90 мг/м2 в виде 96-часовой инфузии в/в
Дакарбазин** 900 мг/м2 в виде 96-часовой инфузии, растворенный вместе с доксорубицином**
Филграстим** 5 мкг/кг/сут п/к в 5-14-й дни или Эмпэгфилграстим**/Пэгфилграстим в соответствии с инструкцией в 5-й день
Длительность цикла – 4 недели [209]
- доксорубицин + трабектедин для лейомиосарком:
Доксорубицин** 60-75 мг/м2 в 1 день в/в
#Трабектедин** 1,1 мг/м2 в виде 24-часовой инфузии
Эмпэгфилграстим**/пэгфилграстим в соответствии с инструкцией в 3-й день
Длительность цикла – 3 недели [234]
-
Рекомендуется использовать комбинацию #гемцитабин** + #доцетаксел** (GemTax) в разных дозоинтервальных режимах для лечения как терапия второй линии для первичных, рецидивных и метастатических сарком – следующий дозоинтервальный режим является стандартом GemTax: #гемцитабин** 900 мг/м2 в 1-й, 8-й дни + #доцетаксел** 100 мг/м2 в 8-й день + филграстим** 5 мкг/кг/сут п/к в 9-18-й дни (или эмпэгфилграстим**/пэгфилграстим в 9 день); цикл 21 день, что имеет доказанную эффективность при саркомах мягких тканей по данным рандомизированных исследований [6,54,56,57,75,76,195,196].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Комментарии: для пациентов, уже получавших химиотерапию с эпизодами гематологической токсичности 3-4 степени, после проведенное лучевой терапии на кости таза возможно проведение редукции доз #гемцитабина** до 675 мг/м2 в 1-й, 8-й дни и #доцетаксела** до 75 мг/м2, также на фоне колонистимулирующих факторов (КСФ) [231].
-
Рекомендуется использовать монохимиотерапию при наличии противопоказаний для применения комбинированного режима [7,9,209].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: рекомендованные схемы монохимиотерапии:
- доксорубицин** 60-75 мг/м2 в 1-й день; цикл 21 день [6,7,50,210,214,215,218,219]. Существует корреляция дозы доксорубицина** и эффекта лечения: доксорубицин** в дозах 25 мг/м2 позволяет достичь 12% эффектов, в дозах 60-75 мг/м2 демонстрирует частоту ответов 25-27% [50].
- ифосфамид** 1,6 г/м2/сут или 2 г/м2/сут – 2,5 г/м2/сут в течение 5 дней с месной** из расчета 120% от дозы ифосфамида** одновременно с ним. Существует корреляция дозы и эффекта лечения. (от 6 г/м2 до 8 г/м2 и 10 г/м2) [51]. Данные об эффективности высокодозного ифосфамида** были получены в двух последовательных проспективных исследованиях. 19%-45% эффектов в зависимости от дозы и скорости инфузии [6,52,204]. Монотерапия ифосфамидом** позволяет достичь тех же результатов в лечении СМТ, что и монотерапия доксорубицином**, с отсутствием статистически значимых отклонений во времени до прогрессирования (ВБП), общей выживаемости (ОВ) и частоты ответов. Высокодозный режим позволяет преодолеть резистентность, использовать ифосфамид** повторно, после стандартных доз [6,53,55,204].
-
Рекомендуется использовать пегилированную форму доксорубицина** (активное вещество – доксорубицин** гидрохлорид пегилированный липосомальный) 20 мг/м2 1 раз в 3 недели при распространенных формах саркомы Капоши [205,206,218,220].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: учитывая воспалительный характер заболевания, вирусную этиологию и повышенную заболеваемость у лиц с ослабленным иммунитетом, предположена высокая эффективность ингибиторов иммунных контрольных точек при лечении саркомы Капоши. В одногрупповом исследовании II фазы 17 пациентов с саркомой Капоши, получавших #пембролизумаб** 200 мг в/в 1 раз в 21 день, объективный уровень ответа составил 71%, включая полный ответ у двух пациентов (12%) [235]. С учетом этих данных во вторую и последующие линии при распространенных формах саркомы Капоши, или при наличии противопоказаний к применению пегилированной формы доксорубицина** рекомендовано применение #пембролизумаба**.
-
Рекомендуется #паклитаксел** в дозе 80 мг/м2 в 1-й, 8-й, 15-й дни каждые 4 недели при терапии местнораспространенных ангиосарком, в частности ассоциированных с синдромом Стюарта-Тривса, где была показана высокая эффективность [6,54,61,62,63]. Также возможно проведение терапии паклитакселом** во вторую и последующие линии при распространенных формах саркомы Капоши, или при наличии противопоказаний к применению пегилированной формы доксорубицина** [236,237].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: #паклитаксел** активен в отношении ангиосарком кожи головы и шеи, ретроспективный обзор 117 пациентов с метастатической ангиосаркомой продемонстрировал 53% общей эффективности (стабилизация 29,5%) [63].
-
Рекомендуется применение трабектедина в дозе 1,5 мг/м2 в виде 24-часовой инфузии каждые 3 недели во второй и более линии лечения липосарком, лейомиосарком, синовиальной, недифференцированной плеоморфной и экстраоссальной формы саркомы Юинга [64,65]. Также во вторую и более линии для большинства гистологических подтипов, за исключением липосарком и GIST, может быть использован пазопаниб** [83].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
Комментарии: трабектедин активен в отношении миксоидных липосарком и лейомиосарком во вторую и последующие линии. Имеются данные о эффективности препарата при синовиальной саркоме/семейства Юинга/ПНЭТ/недифференцированной плеоморферной саркоме. Контроль над ростом опухоли 62%, двухлетняя выживаемость 32%. [64,65,66].
-
Рекомендуется применение эрибулина** по схеме 1,4 мг/м2 в/в в 1,8 дни (интервал 21 день) во второй и более линии терапии липосарком [6,67,68,69].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 2).
Комментарии: эффективность эрибулина** при СМТ подтверждена в ходе 2 исследований II фазы и одного рандомизированного исследования III фазы у пациентов с неоперабельными и/или метастатическими СМТ [67,68,69]. Показано увеличение общей выживаемости до 13.5 месяцев (9.6 контроль) при липосаркоме. Препарат рекомендован во вторую и последующие линии лечения липосарком.
-
Рекомендуется использовать следующие режимы химиотерапии при лечении пациентов с экстраоссальной саркомой Юинга/ПНЭТ, рабдомиосаркомой – HD VAI, VAC/IE, #темозоламид** + #иринотекан** [192,193,211,221,226].
Комментарии: рекомендованные схемы:
- HD VAI:
Винкристин 2 мг в / в в 1-й день
Доксорубицин** – 25 мг/м2 в 1-3 день в/в в виде 72-часовой непрерывной инфузии (При показаниях возможно проведение редукции дозы доксорубицина** до 60 мг/м2 в 1-й день в/в);
Ифосфамид** 2500 мг/м2 в 1-й-4-й дни в/в на фоне месны** 1000мг/м2 3 раза в день в 1-4-й дни по схеме;
Филграстим** 5 мкг/кг/сут п/к в 5-й-14-й дни или эмпэгфилграстим**/пэгфилграстим в соответствии с инструкцией в 5-й день;
Длительность цикла – 21 день [211]
- альтернирующий режим VAC-IE:
VAC:
Винкристин** 2 мг в/в в 1-й;
Доксорубицин** 75 мг/м2 в/в в 1-й
Циклофосфамид** 1200 мг/м2 в/в в 1-й;
Филграстим** 5 мкг/кг/сут п/к в 2-й-11-ые дни или до восстановления уровня нейтрофилов (или эмпэгфилграстим**/пэгфилграстим в соответствии с инструкцией во 2-й день).
Длительность цикла – 14-21 дней.
IE:
Ифосфамид** 1800 мг/м2 в/в 1-й-5-й дни на фоне месны** 720 мг/м2 в/в 3 раза в день в 1-5-й дни по схеме;
Этопозид** 100 мг/м2 в 1-й-5-й дни. (СД 500 мг мг/м2)
Длительность цикла – 14-21 дней [193,211,221,226,232,77,78].
- #темозоломид** 100 мг/м2 в 1-5-й дни + #иринотекан** 40 мг/м2 (суммарная доза 200 мг/м2) в 1-5-й дни по 40 мг/м2 (при саркоме Юинга). Длительность цикла – 28 день [200].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: как режим первой линии для терапии экстраоссальной саркомы Юинга/ПНЭТ целесообразно использовать режим VAC/IE – альтернирующие курсы комбинаций циклофосфамида*, доксорубицина**, винкристина** и ифосфамида**, этопозида**.
Ифосфамид** и этопозид**. Комбинация ифосфамида** с этопозидом** позволяет достичь 40% частоты ответов и медианы времени до прогрессирования 8 мес [77]. Данная комбинация демонстрирует высокую активность в лечении мелкоклеточных сарком. Комбинация ифосфамида** с этопозидом** применяется в лечении сарком Юинга как самостоятельный режим, так и в альтернирующем режиме с винкристином**, доксорубицином** и циклофосфамидом** [78].
6. Таргетные препараты
-
Рекомендуется применение пазопаниба** в качестве второй и более линий для лечения большинства гистологических подтипов (за исключением липосарком и GIST), однако для химиорезистентных гистотипов (альвеолярная саркома мягких тканей, светлоклеточная саркома мягких тканей, солитарная фиброзная опухоль/гемангиоэндотелиома) должен применяться в первую линию лечения. Лечение до прогрессирования или развития непереносимой токсичности [6,83,96].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 2).
Комментарии: пазопаниб** относится к мультитирозинкиназным ингибиторам рецепторов VEGFR1, 2 и 3, PDGFRa и b, cKit. Рандомизированное многоцентровое двойное слепое исследование III фазы PALETTE доказало эффективность пазопаниба** по сравнению с плацебо у пациентов с распространенной СМТ (исключая GIST и липосаркомы), которые ранее получали химиотерапию. В группе пазопаниба** по сравнению с плацебо выявлено трехкратное увеличение выживаемости без прогрессирования (медиана ВБП 20 нед vs 7 нед; p < 0,0001), снижение риска развития прогрессирования на 65%. Эффективность пазопаниба** была более чем в два раза выше, чем в группе плацебо, и составила 73% (6% частичный ответ плюс 67% стабилизация) vs 38% (0% объективный ответ плюс 38% стабилизация) соответственно. В исследовании III было доказано, что пазопаниб** является эффективным препаратом для лечения сарком мягких тканей (исключая липосаркомы и GIST) в качестве 2-й и более линии терапии.
-
Рекомендуется для лечения дерматофибросарком и агрессивного фиброматоза применять #иматиниб** по 400 мг в день внутрь постоянно для случаев, которые не подлежат хирургическому лечению или имеют метастатическую форму болезни [201]. Лечение до прогрессирования или развития непереносимой токсичности.
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
-
Рекомендуется использовать #сунитиниб** 37,5 мг ежедневно внутрь в качестве > 3 линии в лечении СМТ, лечение до прогрессирования или развития непереносимой токсичности [146,212,213].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
Рекомендуется использовать #сорафениб** 400 мг два раза в день ежедневно внутрь в качестве > третьей линии в лечении СМТ, лечение до прогрессирования или развития непереносимой токсичности [80,167,168,169,170].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3).
Комментарии: Данные об активности #сорафениба** – мультитаргетноготирозинкиназного ингибитора, ингибирующего RAF-киназу и блокирующего внутриклеточную порцию рецепторов VEGF, позволяют рекомендовать препарат в качестве 4-5 линии терапии (при нечувствительных подтипах 2-3 линии) сарком
-
Рекомендуется использовать #регорафениб** по 160 мг 1 раз в день внутрь в 1-21 дни, далее 1 неделя перерыва (или по 80 мг в сутки внутрь – 1-я неделя, 120 мг в сутки внутрь – 2-я неделя, 160 мг в сутки внутрь – 3-я неделя, затем – 1 неделя перерыв), интервал 28 дней, в качестве > третьей линии в лечении СМТ, в частности при ангиосаркоме и лейомиосаркоме, лечение до прогрессирования или развития непереносимой токсичности. Эскалация дозы только при удовлетворительной переносимости [238].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
-
Рекомендуется использовать #палбоциклиб** по 200 мг 1 раз в сутки внутрь, интервал 21 дней, в качестве > третьей линии в лечении CDK-4-амплифицированной, высокодифференцированной или дедифференцированной липосаркомой [239]. Лечение до прогрессирования или развития непереносимой токсичности.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
7. Особенности терапии редких гистологических подтипов сарком мягких тканей
К этой группе опухолей относятся: воспалительная миофибробластическая опухоль (ВМФО), альвеолярная саркома мягких тканей АСМТ, солитарная фиброзная опухоль СФО, периваскулярная эндотелиоклеточная опухоль ПEKома и светлоклеточная саркома мягких тканей ССМТ. Данные опухоли являются самыми редкими из всех сарком, заболеваемость не превышает 1 случай на 1 000 000 населения в год, [41,147] и у всех имеются характерные генетические транслокации. Эти редкие гистологические подтипы характеризуются низкой чувствительностью к стандартной цитостатической химиотерапии, однако относительно понятный механизм онкогенеза открывает новые перспективы для таргетной терапии.
-
Рекомендуется использовать #кризотиниб** (250 мг 2 раза в день внутрь) в терапии первой линии для лечения воспалительной миофибробластической опухоли [149,150]. Лечение до прогрессирования или развития непереносимой токсичности.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: у большинства ВМФО выявляется повторяющаяся клональная аберрация с вовлечением локуса ALK на хромосоме 2р23 [148]. Относится к саркомам низкой степени злокачественности, локализующимся, как правило, в легком, брыжейке кишки, забрюшинно или в тазу у детей и подростков. Из препаратов таргетной терапии ингибитор ALK/MET #кризотиниб** является единственной эффективной терапевтической опцией для ВМФО.
-
Рекомендуется использовать пазопаниб** 800 мг 1 раз в день в лечении метастатической альвеолярной саркомы [203]. Лечение до прогрессирования или развития непереносимой токсичности.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: альвеолярная саркома мягких тканей поражает в основном молодых пациентов, характеризуется типичной морфологической картиной и наличием транслокации t(X;17)(p11;q25) [46]. Отличается полной резистентностью к стандартной цитостатической терапии. Описаны случаи эффективности таких антиангиогенных препаратов, как #интерферон-альфа**, #сунитиниб**, пазопаниб**.
Назначение интерферонов, сунитиниба** и стандартной цитостатической терапии требует персонализированного решения ввиду крайне редкой встречаемости данного подтипа.
-
Рекомендуется использовать #пембролизумаб** 200 мг в/в 1 раз в 21 день в лечении метастатической альвеолярной саркомы в качестве второй или последующей линии терапии в качестве монотерапии [239] или в комбинации с #акситинибом** по 5 мг ежедневно внутрь 2 раза в день [240,241]. Лечение до прогрессирования или развития непереносимой токсичности.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: в ряде исследований описаны выраженные ответы АСМТ на иммунотерапию. Даже в небольшой выборке из четырех пациентов у половины был частичный ответ, граничащий с полным ответом. В двух других случаях – стабилизация заболевания [241]. Описана эффективность комбинации #пембролизумаба** с #аксинитинибом** (ингибитор тирозинкиназ, 5 мг ежедневно внутрь два раза в день), 3-месячная выживаемость без прогрессирования (ВБП) составила 72,7%. Во всех случаях вывялена экспрессия PD-L1, которая, однако, не коррелировала с ВБП более 6 месяцев или достижением частичного ответа. [242]
-
Рекомендуется использовать пазопаниб** или комбинацию #темозоламида** 150 мг/м2 в 1-7 и 15-21 дни с #бевацизумабом** 5 мг/кг в/в в 8 и 22 дни, длительность курса 28 дней, в лечении метастатической или неоперабельной форме СФО [157-162].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
Комментарии: стандартом лечения СФО является радикальное хирургическое вмешательство. Использование стандартных режимов химиотерапии для диссеминированных форм не оправданно. Использование антрациклин-содержащих схем ввиду низкой эффективности [156]. В настоящее время описаны случаи эффективности комбинации #темозоламида** и #бевацизумаба**, #сорафениба**, #сунитиниба** и пазопаниба** [157-162]. Назначение #бевацизумаба**, #сорафениба**, #сунитиниба** и стандартной цитостатической терапии требует персонализированного решения ввиду крайне редкой встречаемости данного подтипа.
-
Рекомендуется использование #эверолимус** 10 мг в лечении неоперабельных форм злокачественных ПЕКом [189].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: злокачественные ПЕКомы могут локализоваться в любых анатомических зонах. Стандартом лечения локализованных процессов является широкое иссечение, однако опухоли могут местно рецидивировать и метастазировать. Использование стандартной терапии нецелесообразно ввиду отсутствия эффективности [163].
-
Рекомендуется использовать #сиролимус по схеме 2-3 мг в сутки, однократно ежедневно внутрь при прогрессировании диссеминированной ПЭКомы после терапии #эверолимусом**. При удовлетворительной переносимости – эскалация дозы #сиролимуса до 5 мг в сутки. Лечение до прогрессирования или развития непереносимой токсичности [243].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: по данным обзора литературы #сиролимус имеет лучшую эффективность (ЧОО 41%, мВБП 9 мес) по сравнении с #гемцитабином** (ЧОО 20%, мВБП 3.4 мес), антрациклинами (ЧОО 13%, мВБП 3.2 мес) или антиангиогенными препаратами (ЧОО 8.3%, мВБП 5.4 мес) у пациентов с диссеминированной ПЭКомой [243].
-
Рекомендуется использовать пазопаниб** или #сиролимус по схеме 2-3 мг в сутки, однократно ежедневно внутрь в качестве первой линии лечения эпителиоидной геменгиоэндотелиомы. При удовлетворительной переносимости – эскалация дозы #сиролимуса до 5 мг в сутки. Лечение до прогрессирования или развития непереносимой токсичности [244].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: у пациентов с эпителиоидной гемангиоэндотелимомой в крупнейшем ретроспективном исследовании с включением 38 пациентов лучшими ответами согласно RECIST были частичный ответ у 4 пациентов (10,8%) и стабилизация заболевания у 28 пациентов (75,7%). При медиане наблюдения в 41,5 месяца мВБП составила 13 мес, а медиана ОВ составила 18,8 мес. На основании полученных результатов терапиия #сиролимусом рекомендована при эпителиоидной гемангиоэндотелиоме [244].
-
Рекомендуется использовать #сунитиниб** 37,5 мг ежедневно или #сорафениб** 400 мг 2 раза в день или пазопаниб** по 800 мг ежедневно в лечении диссеминированного или неоперабельного процесса при светлоклеточной саркоме мягких тканей (ССМТ) [164,165,166].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: ССМТ относятся к редким саркомам мягких тканей, могут поражать любые анатомические зоны [46]. Стандартом лечения является широкое иссечение опухоли, ССМТ резистентна к стандартным дозам лучевой терапии.
8. Особенности терапии агрессивного фиброматоза.
Агрессивный фиброматоз относится к редким формам поражения мягких тканей. Тактика лечения всегда требует обсуждения на консилиуме. Необходимо проводить завершающее обследование и выбрать терапию в специализированных онкоортопедических клиниках онкологических учреждений федерального уровня, национальных медицинских центрах.
Комментарии: при локализации опухоли в мягких тканях передней брюшной стенки (абдоминальный десмоид) рекомендуется проведение хирургического лечения. При локализациях в анатомических зонах, где рост опухоли не может привести к быстрому появлению угрожающих осложнений (боли, нарушение функции, распад, выраженная неврологическая симптоматика) рекомендуется начать лечение с периода динамического наблюдения с МРТ/КТ контролем. При медленном росте опухоли рекомендуется использование нестероидных противовоспалительных средств (производные индолуксусной кислоты, производные фенилуксусной кислоты, оксиками, производные пропионовой кислоты, ингибиторов COX-2). Применение локальных методов в лечения (хирургическое вмешательство, абляция, радиотерапия с локальной гипертермией) рекомендуется при локализации в неблагоприятной анатомической зоне, а также росте опухоли. Хирургическое вмешательство рекомендуется выполнять согласно принятым в онкоортопедии принципам. Рекомендуется применение системного лекарственного лечения в случаях нерезектабельного опухолевого процесса, предполагаемого калечащего объема хирургического вмешательства, ранее проведенной лучевой терапии.
-
Рекомендуется применение #Иматиниба** 400 мг 1 раз в день в лечении мультицентричной формы агрессивного фиброматоза [208].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
Рекомендуется применение #пазопаниба** 800 мг 1 раз в день в лечении неоперабельной формы агрессивного фиброматоза [245-247].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3).
-
Рекомендуется применение #сорафениба** 400 мг 1 раз в день в лечении неоперабельной формы агрессивного фиброматоза [248,249].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
Рекомендуется применение #тамоксифена** 20-40 мг 1 раз в день в лечении неоперабельной формы агрессивного фиброматоза [250,251].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
Рекомендуется применение #Винорелбина** 60 мг/м2 капсула еженедельно (эскалация дозы до 80 мг/м2 при удовлетворительных показателях общеклинических анализов) + #метотрексат** 30 мг в/в 1 раз в 7 дней в/в [252,253]
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 3).
-
Рекомендуется применение #Винбластина** 10 мг/м2 в/в + #метотрексат** 30 мг/м2 в/в 1 раз в 7 дней [254,255].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 3).
-
Рекомендуется применение #Доксорубицина** 30 мг/м2/сут в 1, 2 день в/в + #дакарбазин** 250мг/м2/сут в/в в 1, 2, 3, 4 день с интервалом в 21 день. Филграстим** 5 мкг/кг/сут п/к в 5-й-12 й дни или до восстановления уровня нейтрофилов (или эмпэгфилграстим**/пэгфилграстим в соответствии с инструкцией в 5-й день) [256].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 3).
4. Обезболивание
Принципы обезболивания и оптимального выбора противоболевой терапии у пациентов с хроническим болевым синдромом соответствуют принципам обезболивания, изложенным в клинических рекомендации «Хронический болевой синдром у взрослых пациентов, нуждающихся в паллиативной медицинской помощи».
5. Сопроводительная терапия
Принципы лечения и профилактики тошноты и рвоты у пациентов соответствуют принципам, изложенным в методических рекомендациях «Профилактика и лечение тошноты и рвоты» [86].
Принципы лечения и профилактики костных осложнений у пациентов соответствуют принципам, изложенным в методических рекомендациях «Использование остеомодифицирующих агентов для профилактики и лечения патологии костной ткани при ЗНО» [87].
Принципы профилактики и лечения инфекционных осложнений и фебрильной нейтропении у пациентов соответствуют принципам, изложенным в методических рекомендациях «Лечение инфекционных осложнений фебрильной нейтропении и назначение КСФ» [88], Клиническим рекомендациям МЗ РФ «Приобретенные нейтропении».
Принципы профилактики и лечения гепатотоксичности у пациентов соответствуют принципам, изложенным в методических рекомендациях «Коррекция гепатотоксичности» [89].
Принципы профилактики и лечения сердечно-сосудистых осложнений у пациентов соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по коррекции кардиоваскулярной токсичности противоопухолевой лекарственной терапии» [90].
Принципы профилактики и лечения кожных осложнений у пациентов соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по лекарственному лечению дерматологических реакций у пациентов, получающих противоопухолевую лекарственную терапию» [92]
Принципы нутритивной поддержки у пациентов соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по нутритивной поддержке онкологических больных» [93].
Принципы профилактики и лечения нефротоксичности у пациентов соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по коррекции нефротоксичности противоопухолевых препаратов» [93].
Принципы профилактики и лечения тромбоэмболических осложнений у пациентов соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по профилактике тромбоэмболических осложнений у онкологических больных» [94].
Принципы профилактики и лечения последствий экстравазации лекарственных препаратов у пациентов соответствуют принципам, изложенным в методических рекомендациях «Рекомендации по лечению последствий экстравазации противоопухолевых препаратов» [99].
6. Диетотерапия
Информация отсутствует
Комментарии: к настоящему моменту не получены сколько-нибудь надежные сведения о влиянии пищевого поведения на риск заболеть СМТ или на риск рецидива или прогрессирования этого заболевания у лиц с уже установленным диагнозом.
Медицинская реабилитация
Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
В настоящее время для большинства видов медицинской реабилитации отсутствуют клинические исследования с участием пациентов с саркомами мягких тканей. Для данной группы пациентов применимы общие принципы реабилитации в ортопедии/травматологии. Рекомендуется также использовать принципы реабилитации, изложенные в клинических рекомендациях АОР «клинические рекомендации по реабилитации».
Госпитализация
Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 № 323-ФЗ (ред. от 25.05.2019) «Об основах охраны здоровья граждан в Российской Федерации» организуется и оказывается:
1) в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
2) в соответствии с порядком оказания помощи по профилю «онкология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3) на основе настоящих клинических рекомендаций;
4) с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При подозрении на СМТ у пациента или ее выявлении врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественного новообразования, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При подозрении СМТ или ее выявлении в ходе оказания скорой медицинской помощи пациентов переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, не должен превышать 14 календарных дней с даты гистологической верификации злокачественного новообразования или 14 календарных дней с даты установления предварительного диагноза злокачественного новообразования (в случае отсутствия медицинских показаний для проведения патолого-анатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациентам с онкологическими заболеваниями, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента. Согласно порядкам оказания медицинской помощи взрослому населению при онкологических заболеваниях, входящих в рубрики С40-С41, С45-С49, МКБ-10, врачу-онкологу онкологического диспансера (онкологической больницы) или иной медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, для определения лечебной тактики рекомендуется организовать проведение консультации или консилиума врачей, в том числе с применением телемедицинских технологий, в федеральных медицинских организаций (в национальных медицинских исследовательских центрах).
Показания для госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю «онкология» определяются консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов.
1. Показания для госпитализации
Показанием для госпитализации в медицинскую организацию в экстренной или неотложной форме является:
1) наличие осложнений, требующих оказания специализированной медицинской помощи в экстренной и неотложной форме;
2) наличие осложнений лечения (хирургическое вмешательство, лучевая терапия, лекарственная терапия и т.д.).
Показанием для госпитализации в медицинскую организацию в плановой форме является:
1) необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2) наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, лучевая терапия, в том числе контактная, дистанционная и другие виды лучевой терапии, лекарственная терапия и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
2. Показания для выписки
Показанием к выписке пациента из медицинской организации является:
1) завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при условиях отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2) отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
3) необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи. Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или данным предварительного осмотра пациента врачами специалистами медицинской организации, в которую планируется перевод.
3. Амбулаторные процедуры
Медицинские процедуры, которые могут быть оказаны в рамках первичной специализированной медицинской помощи (т.е. амбулаторно) под контролем врача-онколога:
1) трепан (толстоигольная) биопсия
2) получение мазков-отпечатков опухоли;
3) тонкоигольная аспирационная биопсия поверхностно-расположенных органов (лимфатических узлов, новообразований в мягких тканях);
4) core-биопсия поверхностно-расположенных органов (лимфатических узлов, новообразований в мягких тканях);
5) курсы химиотерапии, не требующих длительных инфузий и/или введения вспомогательных препаратов спустя 1-4-6 часов после инфузии
4. Показания для направления в другую медицинскую организацию
Показания для направления пациента в другую медицинскую организацию:
- исполнение клинических рекомендаций призвано максимально повысить качество оказываемой медицинской помощи пациентам в различных клинических ситуациях. Если в медицинской организации отсутствует возможность проводить рекомендуемый объем медицинской помощи (например, отсутствует возможность проведения биопсии с качественным патоморфологическим анализом), рекомендуется воспользоваться системой маршрутизации в другие медицинские организации, в том числе за пределы субъекта федерации, в том числе в федеральные центры, имеющие соответствующую оснащенность и кадры;
- клинические рекомендации не позволяют описать все многообразие реальной клинической практики и охватывают лишь наиболее частые и типовые клинические ситуации. Если практикующий врач или медицинская организация сталкивается с клинической ситуацией, не имеющей соответствующего отражения в настоящей клинической рекомендации (нетипичное течение болезни, необходимость начала противоопухолевой терапии при выявлении противопоказаний к ней, прогрессирование на фоне применения рекомендуемых видов лечения и т.д.), Рекомендуется воспользоваться системой телемедицинских консультаций или маршрутизации в национальные медицинские исследовательские центры для уточнения тактики лечения;
- выявление или обострение сопутствующей патологии, не относящейся к профилю онкологического учреждения, которая препятствует проведению данного этапа лечения (например, острый инфаркт миокарда, острое нарушение мозгового кровообращения и др.) требует маршрутизации в профильные медицинские организации.
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
График обследований пациентов с СМТ
-
Рекомендуется проводить динамический контроль – осмотры и обследования пациента раз в 3 месяца. Объем обследования (УЗИ зоны операции, брюшной полости, забрюшинного пространства, периферических лимфатических узлов; МРТ зоны операции, КТ органов грудной клетки) определяется после осмотра врача онколога/онкоортопеда. Интервал между контрольными обследованиями следует увеличить после 3-х лет наблюдения без возврата заболевания. Пациенты наблюдаются в течении длительного времени 5-10 лет [257].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Информация
Источники и литература
-
Клинические рекомендации Ассоциации онкологов России
- Клинические рекомендации Ассоциации онкологов России - 1. Алиев М.Д., Сушенцов Е.А. Cовременная онкоортопедия. Саркомы костей, мягких тканей и опухоли кожи. 2012 - №4. – стр. 3-10. 2. Горбунова В.А., Феденко А.А., Истомин И.А., Бохян Б.Ю., Губина Г.И. Высокодозный ифосфамид в комбинации с доксорубицином в лечении сарком мягких тканей. Саркомы костей, мягких тканей и опухоли кожи. 2010 - №1. – стр. 26-31 3. ТепляковВ.В., КарпенкоВ.Ю., Франк Г.А., Буланова А.А., Бондарев А.В., Дрошева И.В., Державин В.А., Бухаров А.В., Епифанова С.В. Влияние ширины края резекции на частоту локальных рецидивов при комбинированном и комплексном лечении пациентов саркомами мягких тканей. Саркомы костей, мягких тканей и опухоли кожи. 2009 - №1. – стр. 28-33 4. Зубарев А.Л. Кудрявцева Г.Т., Курильчик А.А., Курпешев О.К., Стародубцев А.Л. Комбинированное лечение распространенных сарком мягких тканей. . Саркомы костей, мягких тканей и опухоли кожи. 2010 - №2. – стр. 35-38 5. Pervaiz N., Colterjohn N., Farrokhyar F. et al. А systematic meta-analysis of randomized controlled trials of adjuvant chemotherapy for localized resectable soft-tissue sarcoma. Cancer. 2008; 113: 573-581. 6. Ravi V., Patel S., Benjamin R.S. Chemotherapy for Soft-Tissue Sarcomas. Oncology (Williston Park). 2015 Jan 15; 29 (1).. 7. Nielsen O.S., Dombernowsky P., Mouridsen H. et al. High-dose epirubicin is not an alternative to standard-dose doxorubicin in the treatment of advanced soft tissue sarcomas. A study of the EORTC Soft Tissue and Bone Sarcoma Group. Br. J. Cancer. 1999; 78: 1634–1639. 8. Mouridsen H.T., Bastholt L., Somers R. et al. Аdriamycin versus epirubicin in advanced soft tissue sarcomas. A randomized phase II/phase III study of the EORTC Soft Tissue and Bone Sarcoma Group. Eur. J. CancerClin. Oncol. 1987; 23: 1477–1483. 9. Lorigan P., Verweij J., Papai Z. et al. Phase III trial of two investigational schedules of ifosfamide compared with standard-dose doxorubicin in advanced or metastatic soft tissue sarcoma: a European Organization for Research and Treatment of Cancer Soft Tissue and Bone Sarcoma Group Study. J. Clin. Oncol. 2007; 25: 3144–3150. 10. Edmonson J.H., Ryan L.M., Blum R.H. et al. Randomized comparison of doxorubicin alone versus ifosfamide plus doxorubicin or mitomycin, doxorubicin, and cisplatin against advanced soft tissue sarcomas. J. Clin. Oncol. 1993; 11: 1269–75. 11. Antman K., Crowley J., Balcerzak S.P. et al. An intergroup phase III randomized study of doxorubicin and dacarbazine with or without ifosfamide and mesna in advanced soft tissue and bone sarcomas. J. Clin. Oncol. 1993; 11: 1276–85. 12. Alamanda VK, Crosby SN, Archer KR, et al. Predictors and clinical significance of local recurrence in extremity soft tissue sarcoma. Acta Oncol 2013;52:793-802. 13. Alamanda VK, Crosby SN, Archer KR, et al. Amputation for extremity soft tissue sarcoma does not increase overall survival: a retrospective cohort study. Eur J Surg Oncol 2012;38:1178-1183 14. O"Donnell PW, Griffin AM, Eward WC, et al. The effect of the setting of a positive surgical margin in soft tissue sarcoma. Cancer 2014;120:2866-2875. 15. Brady MS1, Gaynor JJ, Brennan MF. Radiation-associated sarcoma of bone and soft tissue. ArchSurg. 1992 Dec; 127(12):1379-85. 16. Peng PD, Hyder O, Mavros MN. et al. Management and recurrence patterns of desmoids tumors: a multi-institutional analysis of 211 patients. AnnSurgOncol. 2012 Dec;19(13):4036-42 17. Edmonson JH, Petersen IA, Shives TC. et al. Chemotherapy, irradiation, and surgery for function-preserving therapy of primary extremity soft tissue sarcomas: initial treatment with ifosfamide, mitomycin, doxorubicin, and cisplatin plus granulocyte macrophage-colony-stimulating factor. Cancer. 2002 Feb 1; 94 (3):786-92. 18. Al-Refaie WB1, Andtbacka RH, Ensor J. et al. Lymphadenectomy for isolated lymph node metastasis from extremity soft-tissue sarcomas. Cancer. 2008 Apr 15; 112 (8):1821-6. 19. Calvo FA1, Sole CV, Polo A. et al. Limb-sparing management with surgical resection, external-beam and intraoperative electron-beam radiation therapy boost for patients with primary soft tissue sarcoma of the extremity: a multicentric pooled analysis of long-term outcomes. StrahlentherOnkol. 2014 Oct; 190 (10):891-8. 20. Coffin C.M.1, Davis J.L., Borinstein S.C. Syndrome¬associated soft tissue tumors. Histopathology. 2014 Jan; 64 (1): 68–87. 21. Enzinger F.M., Weiss S.W. Soft Tissue Tumors. 5. St. Louis: Mosby. Angiosarcoma. 2008, p. 703–720. 22. Stewart F.W., Treves N. Lymphangiosarcoma in postmastectomy lymphedema; a report of six cases in elephantiasis chirurgica. Cancer. 1948; 1: 64–81. 23. Inoue Y.Z., Frassica F.J., Sim F.H., Unni K.K., Petersen I.A., McLeod R.A. Clinicopathologic features and treatment of postirradiation sarcoma of bone and soft tissue. J. Surg. Oncol. 2000; 75: 42–50. 24. Rubino C., Shamsaldin A., Lê M.G., Labbé M., Guinebretière J.M., Chavaudra J., de Vathaire F. Radiation dose and risk of soft tissue and bone sarcoma after breast cancer treatment. Breast Cancer Res. Treat. 2005; 89: 277–288. 25. Blauvelt A., Sei S., Cook P.M., Schulz T.F., Jeang K.T. Human herpesvirus 8 infection occurs following adolescence in the United States. J. Infect. Dis. 1997; 176: 771–774. 26. Martro E., Bulterys M., Stewart J.A., Spira T.J., Cannon M.J., Thacher T.D., Bruns R., Pellett P.E., Dollard S.C. Comparison of human herpesvirus 8 and epstein-barr virus seropositivity among children in areas endemic and non-endemic for kaposi’s sarcoma. J. Med. Virol. 2004; 72: 126–131. 27. Каприн АД, Старинский ВВ, Петрова ГВ (eds.): Злокачественные новообразования в России в 20123 году (заболеваемость и смертность). М.: МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» Минздрава России; 2023. 28. Каприн АД, Старинский ВВ, Петрова ГВ (eds.): Состояние онкологической помощи населению России в 2023 году. М.: МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» Минздрава России; 2023. 29. International Statistical Classification of Diseases and Related Health Problems 10th Revision [http://apps.who.int/classifications/icd10/browse/2016/en 30. Amin MB, Edge SB, Greene FL, et al. AJCC Cancer Staging Manual, 8th edition. New York: Springer; 2017 31. Fanburg-Smith J.C., Dal Cin P. Angiomatoid fibrous histiocytoma. In: C.D.M. Fletcher, Unni K.K., Mertens F., editors. World Health Organization Classification of Tumors: Pathology and Genetics of Tumors of Soft Tissue and Bone. Lyon, France: IARC Press. 2002. p. 194–195. In. Eds 32. Перельмутер В.М., Васильев Н.В., Таширева Л.А., Савенкова О.В., Кайгородова Е.В., Жамгарян Г.С. Экспрессионный профиль и молекулярно-генетический анализ синовиальной саркомы и саркомы Юинга/PNET Сибирский онкологический журнал. 2014;(2):19-23 33. Pérez-Mancera PA, Sánchez-García IUnderstanding mesenchymal cancer: the liposarcoma-associated FUS-DDIT3 fusion gene as a model.Semin Cancer Biol. 2005 Jun;15(3):206-14 34. Pérez-Losada J, Sánchez-Martín M, Rodríguez-García MA, Pérez-Mancera PA, Pintado B, Flores T, Battaner E, Sánchez-Garćia I Liposarcoma initiated by FUS/TLS-CHOP: the FUS/TLS domain plays a critical role in the pathogenesis of liposarcoma. Oncogene. 2000 Dec 7; 19(52):6015-22. 35. Todorov SS, Kit OI Current idea of the morphogenetic features of liposarcomas]. ArkhPatol. 2012 Nov-Dec; 74(6):61-3 36. Italiano A, Di Mauro I, Rapp J, Pierron G, Auger N, Alberti L, Chibon F, Escande F, Voegeli AC, Ghnassia JP, Keslair F, Laé M, Ranchère-Vince D, Terrier P, Baffert S, Coindre JM, Pedeutour FClinical effect of molecular methods in sarcoma diagnosis (GENSARC): a prospective, multicentre, observational study.Lancet Oncol. 2016 Apr;17(4):532-538. 37. Merkelbach-Bruse S, Wardelmann E, Künstlinger H, Büttner R, Schildhaus HU [Molecular methods in the diagnosis of sarcoma]. . Pathologe. 2011 Feb; 32(1):24-31 38. Asif A, Mushtaq S, Hassan U, Akhtar N, Hussain M, Azam M, Qazi R. Fluorescence in Situ Hybridization (FISH) for Differential Diagnosis of Soft Tissue Sarcomas Asian Pac J Cancer Prev. 2018 Mar 27; 19(3):655-660. Epub 2018 Mar 27 39. Asif A, Mushtaq S, Hassan U, Akhtar N, Hussain M, Azam M, Qazi R. Fluorescence in Situ Hybridization (FISH) for Differential Diagnosis of Soft Tissue Sarcomas Asian Pac J Cancer Prev. 2018 Mar 27; 19(3):655-660. 40. Pritchard DJ, Nascimento AG, Petersen IA. Local control of extra- abdominal desmoid tumors. J Bone Joint Surg Am 1996;78:848-854. 41. Tateishi U, Hosono A, Makimoto A, et al. Comparative study of FDG PET/CT and conventional imaging in the staging of rhabdomyosarcoma. Ann Nucl Med 2009;23:155-161. 42. Tateishi U, Hasegawa T, Beppu Y, et al. Prognostic significance of MRI findings in patients with myxoid-round cell liposarcoma. AJR Am J Roentgenol 2004;182:725-731. 43. Karakousis CP, Emrich LJ, Rao U, Khalil M. Limb salvage in soft tissue sarcomas with selective combination of modalities. Eur J Surg Oncol 1991;17:71-80. 44. Замогильная Янна Александровна- Современные методы лучевой диагностики в оценке эффекта предоперационной химиотерапии у больных с саркомами мягких тканей конечностей Диссертация на соискание ученой степени кандидата медицинских наук, Москва 2014г. 45. Suh CH, Jung SC, Kim KW, Pyo J: The detectability of brain metastases using contrast-enhanced spin-echo or gradient-echo images: a systematic review and meta-analysis. Journal ofneuro-oncology 2016, 129(2):363-371 46. Fletcher CDM, Bridge JA, Hogendoorn P, Mertens F. World Health Organization Classification of Tumours. Pathology and Genetics of Tumours of Soft Tissue and Bone, Fourth Edition. IARC, Lyon, 2013. 47. Alektiar KM, Leung D, Zelefsky MJ, et al. Adjuvant brachytherapy for primary high-grade soft tissue sarcoma of the extremity. Ann Surg Oncol 2002;9:48-56. 48. Alektiar KM, Brennan MF, Singer S. Local control comparison of adjuvant brachytherapy to intensity-modulated radiotherapy in primary high-grade sarcoma of the extremity. Cancer 2011;117:3229-3234 49. Wang D, Zhang Q, Eisenberg BL, et al. Significant reduction of late toxicities in patients with extremity sarcoma treated with image-guided radiation therapy to a reduced target volume: Results of Radiation Therapy Oncology Group RTOG-0630 Trial. J Clin Oncol 2015;33:2231- 2238. 50. O’Bryan R.M., Baker L.H., Gottlieb J.E. et al. Dose response evaluation of Adriamycin in human neoplasia. Cancer. 1977; 39: 1940–8 51. Benjamin R.S., Legha S.S., Patel S.R., Nicaise C. Single-agent ifosfamide studies in sarcomas of soft tissue and bone: the M.D. Anderson experience. CancerChemother. Pharmacol. 1993; 31 (Suppl 2): S174–9. 52. Patel S.R., Vadhan-Raj S., Papadopolous N. et al. High-dose ifosfamide in bone and soft tissue sarcomas: results of phase II and pilot studies--dose-response and schedule dependence. J. Clin. Oncol. 1997; 15: 2378–84 53. Lorigan P., Verweij J., Papai Z. et al. Phase III trial of two investigational schedules of ifosfamide compared with standard-dose doxorubicin in advanced or metastatic soft tissue sarcoma: a European Organisation for Research and Treatment of Cancer Soft Tissue and Bone Sarcoma Group Study. J. Clin. Oncol. 2007; 25: 3144–50 54. Феденко, Александр Александрович. Стратегия лекарственного лечения сарком мягких тканей: автореферат дис. ... доктора медицинских наук: 14.01.12 / Феденко Александр Александрович; [Место защиты: Рос. онкол. науч. центр им. Н.Н. Блохина РАМН]. - Москва, 2016. - 41 с 55. Le Cesne A., Antoine E., Spielmann M. et al. High-dose ifosfamide: circumvention of resistance to standard-dose ifosfamide in advanced soft tissue sarcomas. J. Clin. Oncol. 1995; 13: 1600–8 56. Patel S.R., Gandhi V., Jenkins J. et al. Phase II clinical investigation of gemcitabine in advanced soft tissue sarcomas and window evaluation of dose rate on gemcitabine triphosphate accumulation. J. Clin. Oncol. 2001; 19: 3483–9. 57. Stacchiotti S., Palassini E., Sanfilippo R. et al. Gemcitabine in advanced angiosarcoma: a retrospective case series analysis from the Italian Rare Cancer Network. Ann. Oncol. 2012; 23: 501–8 58. Gottlieb J.A., Benjamin R.S., Baker L.H. et al. Role of DTIC (NSC-45388) in the chemotherapy of sarcomas. Cancer Treat. Rep. 1976; 60: 199–203 59. Buesa J.M., Mouridsen H.T., van Oosterom A.T. et al. High-dose DTIC in advanced soft-tissue sarcomas in the adult. A phase II study of the E.O.R.T.C. Soft Tissue and Bone Sarcoma Group. Ann. Oncol. 1991; 2: 307–9 60. Garcia del Muro X., Lopez-Pousa A., Martin J. et al. A phase II trial of temozolomide as a 6-week, continuous, oral schedule in patients with advanced soft tissue sarcoma: a study by the Spanish Group for Research on Sarcomas. Cancer. 2005; 104: 1706–12. 61. Casper E.S., Waltzman R.J., Schwartz G.K. et al. Phase II trial of paclitaxel in patients with soft-tissue sarcoma. Cancer Invest. 1998; 16: 442–6 62. Fata F., O’Reilly E., Ilson D. et al. Paclitaxel in the treatment of patients with angiosarcoma of the scalp or face. Cancer. 1999; 86: 2034–7. 63. Italiano A., Cioffi A., Penel N. et al. Comparison of doxorubicin and weekly paclitaxel efficacy in metastatic angiosarcomas. Cancer. 2012; 118: 3330–6. 64. Demetri GD, Chawla SP, von Mehren M, et al. Efficacy and safety of trabectedin in patients with advanced or metastatic liposarcoma or leiomyosarcoma after failure of prior anthracyclines and ifosfamide: results of a randomized phase II study of two different schedules. J Clin Oncol 2009;27:4188-4196 65. Martin-Broto J, Pousa AL, de Las Penas R, et al. Randomized Phase II Study of Trabectedin and Doxorubicin Compared With Doxorubicin Alone as First-Line Treatment in Patients With Advanced Soft Tissue Sarcomas: A Spanish Group for Research on Sarcoma Study. J Clin Oncol 2016;34:2294-2302. 66. Gronchi A., Bui B.N., Bonvalot S. et al. Phase II clinical trial of neoadjuvant trabectedin in patients with advanced localized myxoid liposarcoma. Ann. Oncol. 2012; 23: 771–6. 67. Schöffski P, Ray-Coquard IL, Cioffi A, et al. Activity of eribulin mesylate in patients with soft-tissue sarcoma: a phase 2 study in four independent histological subtypes. Lancet Oncology 2011;12(11):1045-1052 68. Schöffski P, et al. Eribulin versus dacarbazine in previously treated patients with advanced liposarcoma or leiomyosarcoma: a randomised, open-label, multicentre, phase 3 trial. The Lancet. 2016; 69. Chawla S, et al. Subtype specific activity in liposarcoma (LPS) patients (pts) from a phase 3, open label, randomised study of eribulin (ERI) versus dacarbazine (DTIC) in patients with advanced LPS and leiomyosarcoma (LMS). American Society for Clinical Oncology annual meeting 2016; Abstract # 11037 70. Edmonson J.H., Ryan L.M., Blum R.H. et al. Randomized comparison of doxorubicin alone versus ifosfamide plus doxorubicin or mitomycin, doxorubicin, and cisplatin against advanced soft tissue sarcomas. J. Clin. Oncol. 1993; 11: 1269–75 71. Patel S.R., Vadhan-Raj S., Burgess M.A. et al. Results of two consecutive trials of dose-intensive chemotherapy with doxorubicin and ifosfamide in patients with sarcomas. Am. J. Clin. Oncol. 1998; 21: 317–21 72. Judson I., Verweij J., Gelderblom H. et al. Doxorubicin alone versus intensified doxorubicin plus ifosfamide for first-line treatment of advanced or metastatic soft-tissue sarcoma: a randomised controlled phase 3 trial. Lancet Oncol. 2014; 15: 415–23 73. Borden E.C., Amato D.A., Rosenbaum C., Enterline H.T., Shiraki M.J., Creech R.H., Lerner H.J., Carbone P.P. Randomized comparison of three adriamycin regimens for metastaticsofttissuesarcomas.J. Clin. Oncol. 1987 Jun; 5 (6): 840–50 74. Antman K.H., Ryan L., Elias A. et al. Response to ifosfamide and mesna: 124 previously treated patients with metastatic or unresectable sarcoma. J. Clin. Oncol. 1989; 7: 126–31 75. Hensley M.L., Maki R., Venkatraman E. et al. Gemcitabine and docetaxel in patients with unresectable leiomyosarcoma: results of a phase II trial. J. Clin. Oncol. 2002; 20: 2824–31.
Информация
Список сокращений
AJCC – Американский объединенный комитет по раку
Choi – Критерии ответа солидных опухолей на терапию
ECOG – Восточная объединенная группа онкологов
IMRT – Лучевая терапия с модулированной интенсивностью
IORT – интраоперационная лучевая терапия
RECIST – Критерии ответа солидных опухолей на терапию
АСМТ – альвеолярная саркома мягких тканей
в/в – внутривенный
ВМФО – воспалительная миофибропластическая опухоль
ВОЗ – Всемирная организация здравоохранения
КТ – компьютерная томография
ЛФК – лечебная физкультура
МКБ-10 – Международная классификация болезней 10-го пересмотра
МРТ – магнитно-резонансная томография
ПЕКома – периваскулярная эндотелиоклеточная опухоль
ПЭТ/КТ – Позитронно-эмиссионная томография, совмещеннная с компьютерной томографией с туморотропными РФП
СМТ – саркома мягких тканей
ССМТ – светлоклеточная саркома
СФО – солитарная фиброзная опухоль
УЗИ – ультразвуковое исследование
VAC – Винкристин**+Доксорубицин**+Циклофосфамид**
IE – Ифосфамид**+Этопозид**
GemTax – #Гемцитабин**+#Доцетаксел**
** – жизненно необходимые и важнейшие лекарственные препараты
# – препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл)
Термины и определения
Местно-распространенная саркома мягких тканей саркома мягких тканей любой стадии (до IV), которая занимает > 1 фасциального пространства (анатомической зоны), и/или распространяется на жизненно важные структуры.
На оценку резектабельности могут влиять такие факторы, как, соотношение с магистральными сосудами, костными структурам, нервными сплетениями, органами малого таза, брюшной полости, средостения и легких. Оценка резектабельности процесса весьма субъективна и может варьировать от учреждения к учреждению и от хирурга к хирургу
Открытая биопсия эксцизионная биопсия
Первично неоперабельная саркома мягких тканей – саркома мягких тканей I-III стадии, которая не может быть подвергнута радикальному хирургическому удалению R0.
Первично операбельная саркома мягких тканей – саркома мягких тканей I-III стадии, с поражением одного или > 1 фасциального футляра или одной или > 1 анатомических зон, которая (саркома) может быть подвергнута радикальному хирургическому удалению R0.
Радиологическая оценка ответа на лечение – оценка ответа на лечение с использованием результатов радиологических исследований (компьютерной томографии, магнитно-резонансной томографии, позитронно-эмиссионной томографии, рентгенографии и т.д.) в сравнении с результатами ранее проведенных радиологических исследований в соответствии с одной или несколькими системами оценки ответа (такими как RECIST или ВОЗ или Choi).
Трепанбиопсия – пункционная толстоигольная биопсия
Фасциальный футляр – термин из топографической анатомии. Анатомическая зона расположения мышц и разграниченная от таковых рядом или других структур отдельной фасцией.
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Критерии оценки качества медицинской помощи
|
№ п/п
|
Критерии качества
|
Оценка выполнения
|
|---|---|---|
|
1.
|
Выполнен осмотр врача-онколога со сбором жалоб и изложением течения основного заболевания
|
Да/Нет
|
|
2.
|
Выполнено УЗИ зоны поражения и регионарных лимфатических узлов
|
Да/Нет
|
|
3.
|
Выполнена КТ органов грудной клетки
|
Да/Нет
|
|
4.
|
Получено полное гистологическое заключение до начала специальной терапии
|
Да/Нет
|
|
5.
|
Выполнена предоперационная терапия (химиотерапия, лучевая терапия) в соответствии с рекомендациями
|
Да/Нет
|
|
6.
|
Выполнено хирургическое пособие согласно клиническим рекомендациям с обязательным указанием объема удаленных тканей, маркировки краев, отступов, удаленных жизненно важных структур, метода закрытия раны.
|
Да/Нет
|
|
7.
|
Даны рекомендации по проведению последующей адъювантной терапии у пациентов при наличии показаний.
|
Да/Нет
|
|
8.
|
Выполнено патолого-анатомическое исследование биопсийного (операционного) материала с указанием всех параметров согласно клиническим рекомендациям
|
Да/Нет
|
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
1) Алиев Мамед Джавадович, д.м.н., профессор, академик РАН, советник генерального директора ФГБУ «НМИЦ радиологии» Минздрава России, Президент «Восточно-европейской группы по изучению сарком»
2) Анисеня Илья Иванович, к.м.н., старший научный сотрудник НИИ онкологии Томского НИМЦ, эксперт «Восточно-европейской группы по изучению сарком»
3) Бухаров Артем Викторович, д.м.н., старший научный сотрудник ФГБУ «НМИЦ радиологии» Минздрава России
4) Бохян Бениамин Юрикович, к.м.н., старший научный сотрудник отделения опухолей опорно-двигательного аппарата НИИ КО ФГБУ «НМИЦ онкологии им. Н.Н. Блохина», координатор «Восточно-европейской группы по изучению сарком»
5) Валиев Аслан Камраддинович, д.м.н., руководитель отдела общей онкологии НИИ КО ФГБУ «НМИЦ онкологии им. Н.Н. Блохина», эксперт «Восточно-европейской группы по изучению сарком»
6) Гафтон Георгий Иванович, д.м.н., профессор, заведующий научным отделением-ведущий научный сотрудник ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, эксперт «Восточно-европейской группы по изучению сарком»
7) Егоренков Виталий Викторович, к.м.н., заместитель директора по медицинской части ГБУЗ «Санкт-Петербургский клинический научно-практический центр специализированных видов медицинской помощи (онкологический)», эксперт «Восточно-европейской группы по изучению сарком»
8) Жеравин Александр Александрович, к.м.н., руководитель центра онкологии и радиотерапии ФГБУ «НМИЦ им. акад. Е.Н. Мешалкина» Минздрава России, эксперт «Восточно-европейской группы по изучению сарком»
9) Иванов Станислав Михайлович, к.м.н., старший научный сотрудник радиологического отделения ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России
10) Курильчик Александр Александрович, к.м.н, ведущий научный сотрудник МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России, эксперт «Восточно-европейской группы по изучению сарком»
11) Сафин Ильдар Рафаилович, к.м.н., старший научный сотрудник ГАУЗ «Республиканский клинический онкологический диспансер МЗ РТ», эксперт «Восточно-европейской группы по изучению сарком»
12) Сушенцов Евгений Александрович, д.м.н., старший научный сотрудник отделения опухолей опорно-двигательного аппарата НИИ КО ФГБУ «НМИЦ онкологии им. Н.Н. Блохина», ученый секретарь «Восточно-европейской группы по изучению сарком»
13) Тарарыкова Анастасия Алексеевна, к.м.н., врач онколог отдела общей онкологии НИИ КО имени академика РАН и РАМН Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, эксперт «Восточно-европейской группы по изучению сарком».
14) Тепляков Валерий Вячеславович, д.м.н., профессор, заведующий отделением онкологической ортопедии комбинированных методов лечения ФГБУ "РНЦРР" Минздрава России, эксперт «Восточно-европейской группы по изучению сарком».
15) Феденко Александр Александрович, д.м.н., профессор, заведующий отделом лекарственного лечения опухолей МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии» Минздрава России, исполнительный директор «Восточно-европейской группы по изучению сарком».
Блок по организации медицинской помощи:
1) Невольских A.A., д.м.н., профессор, заместитель директора по лечебной работе МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России;
2) Хайлова Ж.В., к.м.н., главный врач клиники МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России.
3) Иванов С.А., д.м.н., профессор, член-корреспондент РАН, заслуженный врач РФ, директор МРНЦ им. А.Ф. Цыба — филиала ФГБУ «НМИЦ радиологии» Минздрава России, главный внештатный специалист-онколог ЦФО Минздрава России.
4) Геворкян Т.Г., заместитель директора по реализации федеральных проектов ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
5) Комаров Ю.И., к.м.н., заместитель директора по организационно-методической работе ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
Конфликта интересов нет.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
-
врачи-онкологи;
-
врачи-хирурги;
-
врачи-радиологи;
-
врачи-генетики;
-
врачи- травматологи-ортопеды;
-
врачи-акушеры-гинекологи
-
врачи-патологоанатомы;
-
студенты медицинских вузов, ординаторы и аспиранты.
Шкала оценки уровней достоверности доказательств для методов диагностики (диагностических вмешательств)
|
Уровень достоверности доказательств
|
Расшифровка
|
|---|---|
|
1
|
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
|
|
2
|
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
|
|
3
|
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая
|
|
5
|
Имеется лишь обоснование механизма действия или мнение экспертов
|
Шкала оценки уровней достоверности доказательств для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
|
Уровень достоверности доказательств
|
Расшифровка
|
|---|---|
|
1
|
Систематический обзор рандомизированных контролируемых исследований с применением метаанализа
|
|
2
|
Отдельные рандомизированные контролируемые исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных контролируемых исследований, с применением метаанализа
|
|
3
|
Нерандомизированные сравнительные исследования, в том числе когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай–контроль»
|
|
5
|
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
|
Шкала оценки уровней убедительности рекомендаций для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
|
Уровень убедительности рекомендаций
|
Расшифровка
|
|---|---|
|
A
|
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
|
|
B
|
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
|
|
C
|
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
|
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем 1 раз в 3 года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, при наличии обоснованных дополнений/замечаний к ранее утвержденным клиническим рекомендациям, но не чаще 1 раза в 6 мес.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Особенности оценки ответа опухоли на лечение
Различие между критериями WHO, RECIST 1.0 и RECIST 1.1
|
Оценка эффекта
|
WHO
|
RECIST 1.0*
|
RECIST 1.1*
|
Choi [136,137,138].
|
|---|---|---|---|---|
|
Полный ответ
|
Исчезновение всех очагов
|
Исчезновение всех очагов
|
Исчезновение всех очагов
|
Исчезновение всех очагов. Нет новых
|
|
Частичный ответ
|
Уменьшение площади поражения на > 50%
|
Уменьшение суммы max диаметров на > 30%
|
Уменьшение суммы max диаметров на > 30%
|
Уменьшение размеров опухоли > 10% либо уменьшение ее плотности > 10% Нет новых очагов
|
|
Стабилизация
|
Не ПО, ЧО и стабилизация
|
Не ПО, ЧО и стабилизация
|
Не ПО, ЧО и стабилизация
|
Нет соответствия с критериями ПО, ЧО или прогрессирование
|
|
Прогрессирование
|
Увеличение площади поражения > 25%
|
Увеличение наименьшей суммы на > 20% или появление новых
|
Увеличение наименьшей суммы в течение исследования на > 20% и увеличение минимум на 5 мм или появление новых очагов
|
Увеличение размеров > 10%. Появление новых очагов
|
*Комментарии – необходимо учитывать различия в методологии измерения контрольных очагов
Актуальные инструкции к лекарственным препаратам, упоминаемым в данных клинических рекомендациях, можно найти на сайте http://grls.rosminzdrav.ru.
Приложение Б. Алгоритмы действий врача
Схема 1. Блок-схема диагностики и лечения пациентов с саркомами мягких тканей
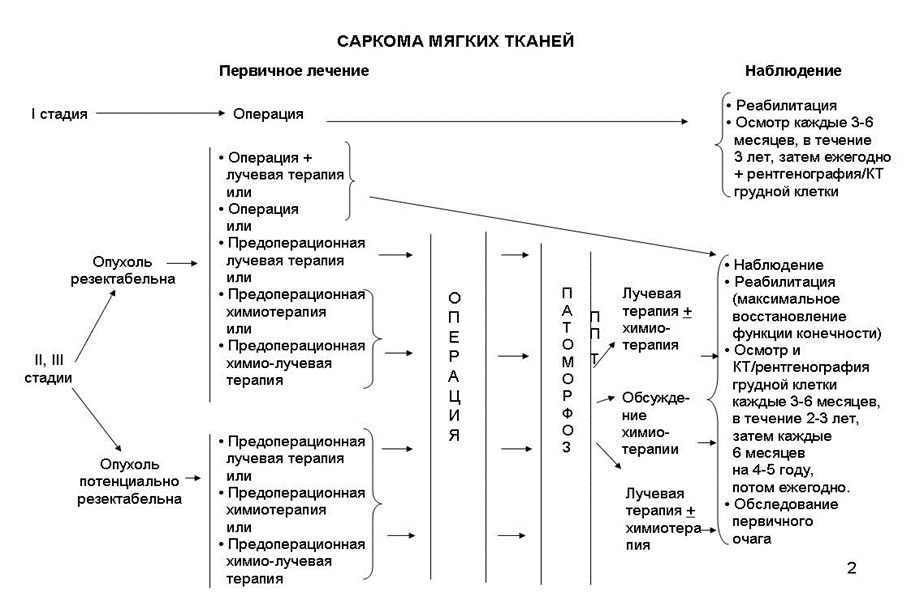
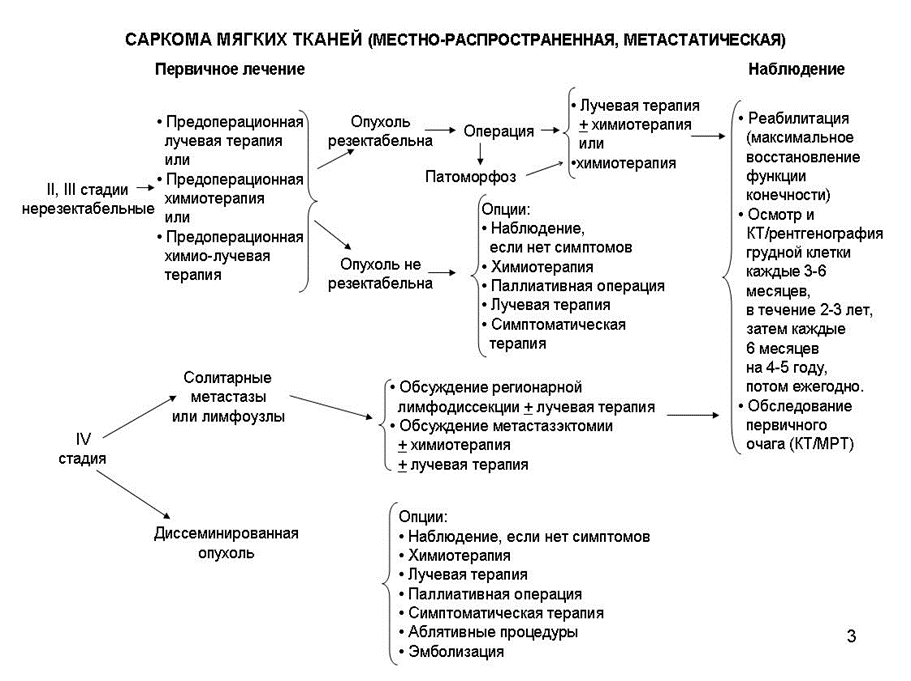
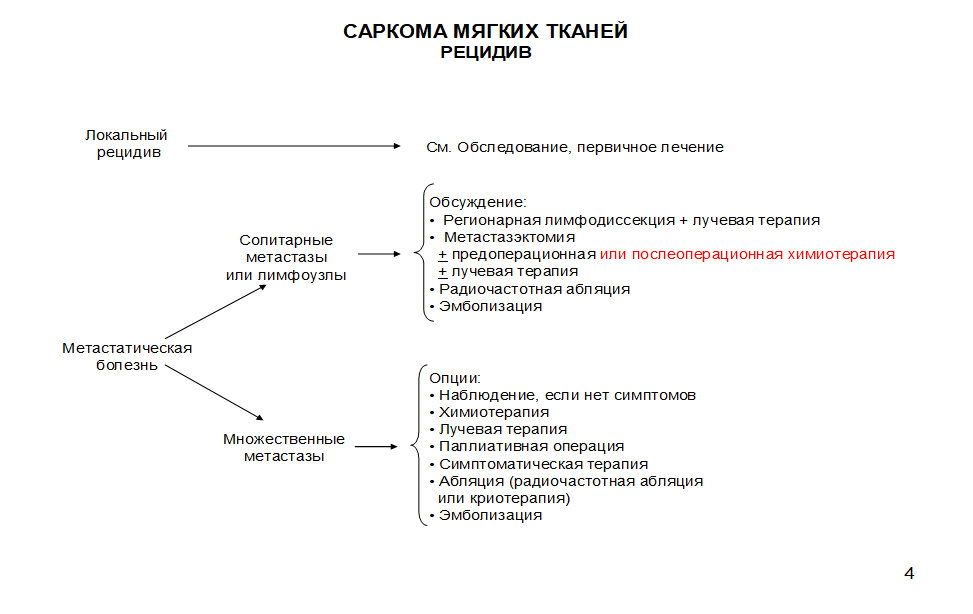
Приложение В. Информация для пациента
Рекомендации по самостоятельному выявлению сарком мягких тканей и первичной профилактике СМТ
Основное и первое проявление СМТ припухлость, отек или уплотнение. Чаще всего эти признаки первым обнаруживает сам пациент или его близкие. Отсутствие онкологической настороженности не допускает мысль у пациента о необходимости обращения к врачу. Самодиагностика от «жировика» до «миозита» дает время и возможность для роста СМТ. Обращение к врачу при появлении даже незначительного по размеру и бессимптомного уплотнения в коже, подкожной клетчатке или в мышцах позволит резко увеличить частоту выявления СМТ на ранних стадиях.
Обращение к врачам и исключение самолечения являются ключевым фактором первичной профилактики.
Рекомендации при осложнениях химиотерапии
При осложнениях химиотерапии необходимо связаться с врачом-онкологом (химиотерапевтом).
-
При повышении температуры тела до +38°C и выше начать прием антибиотиков в соответствии с назначением врача-онколога.
-
При стоматите:
-
диета – мягкая и не горячая пища;
-
часто (каждый час) полоскать полость рта отварами ромашки, коры дуба, шалфея, смазывать десна облепиховым (персиковым) маслом;
-
обрабатывать полость рта по рекомендации врача-онколога.
-
-
При диарее:
-
диета – исключить жирное, острое, копченое, сладкое, молочное, клетчатку. Можно употреблять нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье;
-
принимать лекарственные препараты в соответствии с назначением врача-онколога
-
-
При тошноте принимать лекарственные препараты в соответствии с назначением врача-онколога.
Информация для пациента после хирургического лечения
Своевременное взаимодействие с Вашим лечащим врачом и медицинской̆ сестрой по поводу состояния вашего здоровья является важной составляющей помощи медицинской команде в защите Вас в процессе лечения.
Возможны осложнения, связанные с проведенной операцией в период после выписки из стационара тоже. Любое изменение Вашего самочувствия, которые Вы связываете с перенесенной операцией, необходимо обсудить с хирургом или онкологом. Различные жалобы – боль, отек, гиперемия, гипертермия, нарушения чувствительности, нарушение функции суставов и т.д. – могут появиться и на поздние сроки после операции и требуют осмотра хирурга.
Осложнения, которые могут появиться у Вас, обычно возникают в первые 2 недели после операции, но могут появиться и позже.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG
Название на русском языке: Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG
Оригинальноеназвание: The Eastern Cooperative Oncology Group/World Health Organization Performance Status (ECOG/WHO PS)
Источник (официальный сайт разработчиков, публикация с валидацией): https://ecog-acrin.org/resources/ecog-performance-status [135]
Тип: шкала оценки
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т. д.).
Содержание:
|
Балл
|
Описание
|
|---|---|
|
0
|
Пациент полностью активен, способен выполнять все, как и до заболевания
|
|
1
|
Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу)
|
|
2
|
Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени бодрствования проводит активно – в вертикальном положении
|
|
3
|
Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования
|
|
4
|
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели
|
Ключ (интерпретация): приведен в самой шкале
Приложение Г2. Шкала Карновского
Название на русском языке: Шкала Карновского
Оригинальное название (если есть): KARNOFSKY PERFORMANCE STATUS
Источник (официальный сайт разработчиков, публикация с валидацией): [134]
Тип: шкала оценки
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т. д.).
Содержание (шаблон):
|
Шкала Карновского
|
|---|
|
100 – Состояние нормальное, жалоб нет
90 – Способен к нормальной деятельности, незначительные симптомы или признаки заболевания
|
|
80 – Нормальная активность с усилием, незначительные симптомы или признаки заболевания
70 – Обслуживает себя самостоятельно, не способен к нормальной деятельности или активной работе
|
|
60 – Нуждается порой в помощи, но способен сам удовлетворять большую часть своих потребностей
50 – Нуждается в значительной помощи и медицинском обслуживании
|
|
40 – Инвалид, нуждается в специальной помощи, в т.ч. медицинской
30 – Тяжелая инвалидность, показана госпитализация, хотя смерть непосредственно не угрожает
|
|
20 – Тяжелый пациент. Необходимы госпитализация и активное лечение
10 – Умирающий
|
|
0 – Смерть
|
Ключ (интерпретация): приведен в самой шкале
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.