Саркомы мягких тканей
 Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Злокачественное новообразование других типов соединительной и мягких тканей (C49), Злокачественное новообразование забрюшинного пространства и брюшины (C48), Злокачественное новообразование периферических нервов и вегетативной нервной системы (C47)
Онкология
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «08» сентября 2023 года
Протокол №189
КЛИНИЧЕСКИЙ ПРОТОКОЛ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
САРКОМЫ МЯГКИХ ТКАНЕЙ
Саркомы мягких тканей – группа наиболее злокачественных опухолей, возникающих во внескелетных мягких и соединительных тканях. Подобные опухоли объединяются в одну группу ввиду сходства их гистопатологических характеристик и клинических проявлений, а также течения опухолевого процесса [1-3].
Код (ы) МКБ 10:
Сокращения используемые в протоколе:
Пользователи протокола: онкологи, хирурги, врачи общей практики, терапевты, лучевые терапевты, химиотерапевты.
Категория пациентов: взрослые.
Шкала уровня доказательности:
Саркомы мягких тканей – группа наиболее злокачественных опухолей, возникающих во внескелетных мягких и соединительных тканях. Подобные опухоли объединяются в одну группу ввиду сходства их гистопатологических характеристик и клинических проявлений, а также течения опухолевого процесса [1-3].
ВВОДНАЯ ЧАСТЬ
Код (ы) МКБ 10:
| С 47.0 Злокачественное новообразование периферических нервов и вегетативной нервной системы головы, лица и шеи |
| С 47.1 Злокачественное новообразование периферических нервов и вегетативной нервной системы верхних конечностей |
|
С 47.2 Злокачественное новообразование периферических нервов и вегетативной нервной системы нижних конечностей
|
| С 47.3 Злокачественное новообразование периферических нервов и вегетативной нервной системы груди |
|
С 47.4 Злокачественное новообразование периферических нервов и вегетативной нервной системы живота
|
| С 47.5 Злокачественное новообразование периферических нервов и вегетативной нервной системы таза |
| С 47.6 Злокачественное новообразование периферических нервов и вегетативной нервной системы туловища |
| С 47.8 Комбинированное злокачественное новообразование периферических нервов и вегетативной нервной системы |
| С 47.9 Злокачественное новообразование периферических нервов и вегетативной нервной системы БДУ |
|
С 48.0 Забрюшинное пространство
|
| С 48.1 Особые отделы брюшины |
| С 48.2 Брюшина, БДУ |
| С 48.8 Комбинированное поражение забрюшинного пространства |
|
С 49 Злокачественной новообразование других типов соединительной и мягких тканей
|
| С 49.0 Соединительная ткань, подкожная жировая клетчатка, а также иные мягкие ткани головы и шеи |
| С 49.1 Соединительная ткань, подкожная жировая клетчатка, а также иные мягкие ткани верхних конечностей |
|
С 49.2 Соединительная ткань, подкожная жировая клетчатка, а также иные мягкие ткани нижних конечностей
|
| С 49.3 Соединительная ткань, подкожная жировая клетчатка, а также иные мягкие ткани груди |
|
С 49.4 Соединительная ткань, подкожная жировая клетчатка, а также иные мягкие ткани живота
|
| С 49.5 Соединительная ткань, подкожная жировая клетчатка, а также иные мягкие ткани таза |
| С 49.6 Соединительная ткань, подкожная жировая клетчатка, а также иные мягкие ткани туловища |
|
С 49.8 Комбинированное поражение соединительной ткани, подкожной жировой клетчатка и иных мягких тканей
|
| С 49.9 Соединительная ткань, подкожная жировая клетчатка, а также иные мягкие ткани, БДУ |
Дата разработки/пересмотра протокола: 2015 год (пересмотр 2022 г).
Сокращения используемые в протоколе:
КТ – компьютерно-томографическое исследование;
МРТ – магнитно-резонансная томография; УЗИ – ультразвуковое исследование;
СОД – суммарная очаговая доза;
ГР – Грей;
ЭКГ - электрокардиография;
УЗИ – ультразвуковое исследование;
ОГК – органов грудной клетки;
ОБП – органов брюшной полости;
МТС – метастаз(ы);
ПЭТ-КТ – позитронно-эмиссионная компьютерная томография ;
МИ – митотический индекс;
ПЗР – поля зрения;
НО – некроз опухоли;
СМТ – саркома мягких тканей;
TNM – аббревиатура (tumor, nodus, metestases)
AJCC – аббревиатура (American joint committee on cancer)
ЖКТ – желудочно-кишечный тракт
IMRT- intensity-modulated radiotherapy
VAC - vincristine, doxorubicin, cyclophosphan
VAC/IE - vincristine, doxorubicin, cyclophosphan/ etoposide, ifosfamide
ADIC – Adriamycin, dacarbazine
МAID – mesna, adriamycin, ifosfamide
VADRIAC - vincristine, doxorubicin, cyclophosphan
Пользователи протокола: онкологи, хирурги, врачи общей практики, терапевты, лучевые терапевты, химиотерапевты.
Категория пациентов: взрослые.
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с не высоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). Результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++или+), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование, или мнение экспертов. |
Классификация
Классификация [5]
Гистологические типы опухолей:
Альвеолярная саркома мягких тканей;
Высокодифференцированная липосаркома;
Дедифференцированная липосаркома;
Миксоидная липосаркома;
Плеоморфная липосаркома;
Миксоидная плеоморфная липосаркома;
Фиброматоз десмоидного типа (промежуточная форма с местно-агрессивным течение) ;
Дерматофибросаркома протуберанс (редкометастазирующая);
Cолитарная фиброзная опухоль (редкометастазирующая) ;
Воспалительная миофибробластическая опухоль (редкометастазирующая);
Миофибробластическая саркома;
Фибросаркома инфантильная;
Фибросаркома БДУ;
Миксофибросаркома;
Низкозлокачественная фибромиксодиная саркома;
Таблица 2. Международная классификация по системе TNM (VIII–й пересмотр, 2017 г. [4].
Таблица 3. Группировка по стадиям:
Склерозирующая эпителиоидная саркома;
Фиброгистиоцитарная опухоль (редкометастазирующая);
Гигантоклеточная опухоль теносиновиальная (редкометастазирующая);
Гигантоклеточная опухоль теносиновиальная (злокачественная);
Капошиподобная гемангиоэндотелиома (местно-агрессивная);
Ретиформная гемангиоэндотелиома (редкометастазирующая);
Папиллярная ангиоэндотелиома (редкометастазирующая);
Композитная гемангиоэндотелиома (редкометастазирующая);
Саркома Капоши (редкометастазирующая);
Эпителиоидная гемангиоэндотелиома;
Ангиосаркома;
Гломусная опухоль злокачественная;
Лейомиосаркома;
Эмбриональная рабдомиосаркома (плеоморфная, альвеолярная, эмбриональная плеоморфная, веретеноклеточная, склерозирующая);
Остеосаркома экстраскелетная;
Злокачественная опухоль из оболочек периферических нервов (эпителиоидная, меланотическая);
Синовиальная саркома (веретеноклеточная, бифазная, низкодифференцированная);
Эпителиоидная саркома;
Эпителиоидная альвеолярная саркома;
Светлоклеточная саркома;
Экстраскелетная миксоидная хондросаркома;
Десмопластическая мелко-круглоклеточная опухоль;
Рабдоидная опухоль;
Периваскулярная эпителиоидная опухоль;
Интимальная саркома;
Оссифицирующая фибромиксоидная опухоль;
Миоэпителиальная карцинома;
Недифференцированная саркома (веретеноклеточная, плеоморфная, круглоклеточная);
Саркома без дополнительных уточнений (БДУ).
Таблица 2. Международная классификация по системе TNM (VIII–й пересмотр, 2017 г. [4].
| Т |
Первичная опухоль
Тх первичная опухоль не может быть оценена
Саркомы конечностей и туловища:
T1 - Опухоль 5 см или менее в наибольшем измерении
T2 - Опухоль более 5 см, но не более 10 см в наибольшем размере
T3 - Опухоль более 10 см, но не более 15 см в наибольшем размере
T4 - Опухоль более 15 см в наибольшем размере
Саркомы забрюшинные:
T1 - Опухоль 5 см или менее в наибольшем размере
T2 - Опухоль более 5 см, но не более 10 см в наибольшем размере T3 - Опухоль более 10 см, но не более 15 см в наибольшем размере T4 Опухоль более 15 см в наибольшем размере
Саркомы головы и шеи:
T1 - Опухоль 2 см или менее в наибольшем размере
T2 - Опухоль более 2 см, но не более 4 см в наибольшем измерении
T3 - Опухоль более 4 см в наибольшем размере
T4a - Опухоль проникает в орбиту, основание черепа или твердую, центральные внутренние клетки, лицевой скелет и или крыловидные мышцы
T4b - Опухоль проникает в паренхиму головного мозга, закрывает сонную артерию, вторгается в предвертебральную мышцу или включает центральную нервную систему по периневральному распространению
Грудная клетка и брюшная полость:
T1 - Опухоль ограничивается одним органом
T2a - Опухоль распространяется на висцеральную брюшину
T2b - Опухоль с микроскопическим расширением за серозной
T3 - Опухоль прорастает в другой орган или макроскопическое расширение за серозной оболочкой
T4a - Мультифокальная опухоль, включающая не более двух узлов в одном органе
T4b - Мультифокальная опухоль, включающая более двух узлов, но не более 5 узлов
T4c - Мультифокальная опухоль, включающая более пяти узлов
|
| N |
Регионарные лимфатические узлы
Nх - региональные лимфатические узлы не могут быть оценены N0 нет метастазов в региональных лимфатических узлах
N1 - есть метастазы в региональных лимфатических узлах
|
| M |
Отдаленные метастазы
М0 - нет отдаленных метастазов
М1 - есть отдаленные метастазы
|
| МИ |
0-9 митозов на 10 ПЗР – 1 балл
10-19 митозов на 10 ПЗР – 2 балла
Более 20 митозов – 3 балла
|
| НО |
0 – нет некроза
Меньше 50% некроза опухоли
Больше 50% некроза опухоли
|
| G |
Гистологическая степень злокачественности
G x – степень злокачественности не может быть оценена
G1 Низкая
G2 Средняя
G3 Высокая
Показатель G складывается из трех параметров: дифференцировка, митотическая активность, степень некроза.
|
|
Примечание: внескелетную саркому Юинга и примитивную нейроэктодермальную опухоль классифицируют как опухоли высокой степени злокачественности. Если степень злокачественности не может быть оценена,
устанавливают низкую степень злокачественности.
|
|
Регионарные лимфатические узлы.
Регионарными лимфатическими узлами являются узлы, соответствующие локализации первичной опухоли. Поражение регионарных лимфатических узлов наблюдается редко и в случае, когда их состояние невозможно определить клинически или патологоанатомически, они классифицируются как N0 вместо NX или pNX.
Таблица 3. Группировка по стадиям:
| Стадия IA | T1 | N0 | M0 | G1, GX Low Grade |
| Стадия IB | T2, T3, T4 | N0 | M0 | G1, GX Low Grade |
| Стадия II | T1 | N0 | M0 | G2, G3 High Grade |
|
Стадия IIIA
|
T2 | N0 | M0 | G2, G3 High Grade |
|
Стадия IIIB
|
T3, T4 | N0 | M0 | G2, G3 High Grade |
|
Стадия IIIB
|
Любой T | N1* | M0 | Любая G |
| Стадия IV | Любой T | Любой N | M1 | Любая G |
AJCC классифицирует N1 как IV стадию для конечностей и поверхностных опухолей туловища.
R классификация:
Отсутствие или наличие остаточной опухоли после лечения описывается символом R;
RX – наличие остаточной опухоли не может быть оценено; R0 – нет остаточной опухоли;
R1 – микроскопическая остаточная опухоль; R2 – макроскопическая остаточная опухоль.
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Диагностические критерии постановки диагноза:
Жалобы: наличие опухолевого образования мягких тканей, увеличение периферических лимфатических узлов;
Анамнез: уточняется время появление опухоли и/или других симптомов, связанных с опухолью, проведенные диагностические и/или лечебные мероприятия;
Физикальный осмотр:
пальпация области локализации опухоли, определение размеров, плотности, подвижности, болезненности, вовлеченность соседних анатомических структур и регионов;
пальпация всех доступных групп лимфатических узлов (шейных, подмышечных, пахово-бедренных и др.).
Лабораторные исследования:
Цитологическое исследование (увеличение размеров клетки вплоть до гигантских, изменение формы и количества внутриклеточных элементов, увеличение размеров ядра, его контуров, разная степень зрелости ядра и других элементов клетки, изменение количества и формы ядрышек);
Гистологическое исследование (выраженный клеточный полиморфизм, увеличение размеров клеток, выраженная гипохромия, ядра крупные содержат одно или несколько ядрышек, имеются железистые структуры из раковых клеток в виде розеток, много клеток в состоянии митоза);
Иммуногистохимическое исследование биоптата и операционного материала для детального определния подтипа сарком;
Молекулярно-генетическое исследование микросателлитной нестабильности для определения возможности иммунотерапии.
Показания для консультации узких специалистов:
Диагностический алгоритм:
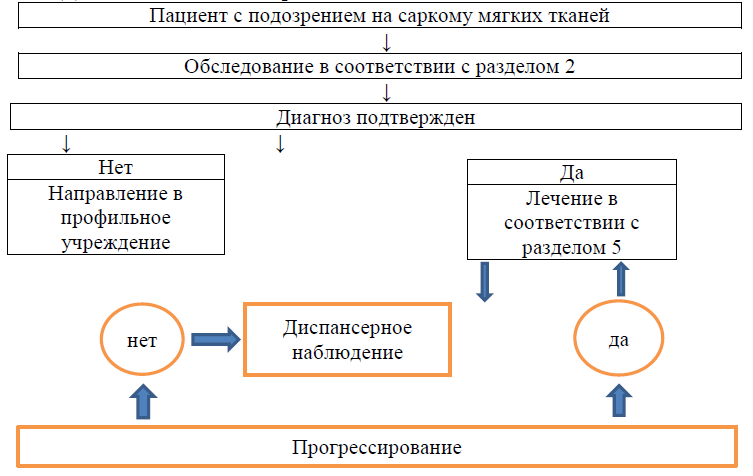
Инструментальные исследования:
УЗИ органов малого таза (при подозрении на опухоль малого таза, поиск пораженных лимфоузлов);
УЗИ органов брюшной полости и забрюшинного пространства (определение метастатических поражений органов брюшной полости и забрюшинного пространства);
компьютерная томография органов грудной клетки, брюшной полости и малого таза (оценка лимфатических узлов малого таза и забрюшинного пространства, органические изменения органов грудной клетки и органов брюшной полости);
магнитно-резонансная томография органов малого таза (признаки опухоли малого таза – нарушение функции органов малого таза, подозрение на сдавление магистральных сосудов извне);
магнитно-резонансная томография головного мозга (проводится в случае подозрения на наличие метастатического поражения головного мозга);
экскреторная урография (оценка положения, формы, размеров, контуров почек, функционального состояния почек, формы и контуров мочеточников и мочевого пузыря);
цистография (оценка формы, величины и положения мочевого пузыря, определения прорастания опухоли в мочевой пузырь и мочепузырного свища);
компьютерная томография органов грудной клетки, брюшной полости (обязательное определение метастатических поражений органов грудной клетки);
ПЭТ, ПЭК/КТ всего тела (для диагностики распространённости опухолевого процесса при саркоме мягких тканей или прогрессировании заболевания, либо для оценки динамики эффективности проведенного спец. лечения);
МРТ головного мозга (при невозможности КТ) для альвеолярной саркомы мягких тканей и гемангиоперицитомы (наиболее часто выявляется метастатическое поражение головного мозга).
Показания для консультации узких специалистов:
консультация маммолога (при наличии патологии со стороны молочных желез);
консультация кардиолога (при наличии сопутствующей патологии ССС);
консультация невропатолога (при сосудистых мозговых нарушениях, в том числе инсультах, травмах головного и спинного мозга, эпилепсии, миастении, нейроинфекционных заболеваниях, а также во всех случаях потери сознания);
консультация гастроэнтеролога (при наличии сопутствующей патологии органов ЖКТ в анамнезе);
консультация нейрохирурга (при наличии метастазов в головной мозг, позвоночник);
консультация торакального хирурга (при наличии метастазов в легких);
консультация эндокринолога (при наличии сопутствующей патологии эндокринных органов);
консультация фтизиатра (при подозрении на туберкулезный процесс или перенесенный туберкулезный процесс).
Диагностический алгоритм:


Дифференциальный диагноз
Дифференциальный диагноз [1,2]
|
Диагноз
|
Обоснование для дифференциальной диагностики | Обследования | Критерии исключения диагноза |
| Фиброма | Фибросаркома |
КТ или МРТ
УЗИ мягких тканей
Тонкоигольная или трепан биопсия
|
Отсутствие инфильтрации окружающих тканей
Подвижность опухоли
Отсутствие клеток опухоли в цитограмме или гистограмме
|
| Липома | Липосаркома |
КТ или МРТ
УЗИ мягких тканей
Тонкоигольная или трепан биопсия
|
Отсутствие инфильтрации окружающих тканей
Подвижность опухоли
Отсутствие клеток опухоли в цитограмме или гистограмме
|
| Гематома |
Рабдмиосаркома
Ангиосаркома
|
КТ или МРТ
УЗИ мягких тканей
Тонкоигольная или трепан биопсия
|
Отсутствие инфильтрации окружающих тканей
Подвижность опухоли
Отсутствие клеток опухоли в цитограмме или гистограмме
Отсутствие патологического кровоснабжения
|
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ
Проведение таргетной терапии при прогрессировании, пациентам, находящимся на диспансерном учете с установленным диагнозом. Применение таргетной терапии Иматинибом, Пазопанибом, Сунитинибом, Сорафенибом смотреть в Стационарном уровне, Обезболивающая и другая симптоматическая терапия по показаниям.
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ
Удаление опухоли мягких тканей и регионарных метастатически -пораженных лимфоузлов (при их наличии).
Удаление опухоли мягких тканей и регионарных метастатически -пораженных лимфоузлов (при их наличии).
Лечение по стадиям [5]:
IА стадия (T1а,Т1b N0,NX M0 Низкая степень злокачественности):
широкое иссечение опухоли в пределах анатомической зоны.
IB стадия (T2a, Т2b N0,NX M0 Низкая степень злокачественности):
хирургическое удаление опухоли (T2a - широкое иссечение, Т2b - радикальная операция) + курс послеоперационной лучевой терапии (необходимость определяется результатами окончательного гистологического исследования);
при местно-распространенной опухоли, когда невозможно выполнить на первом этапе радикальное хирургическое лечение, проводится курс предоперационной лучевой терапии;
с целью повышения эффективности неоадъювантного лечения при планировании органосохраняющего оперативного вмешательства в систему лечения включают методы регионарной химиотерапии (внутриартериальное введение химиопрепаратов);
при образовании обширного раневого дефекта после хирургического удаления опухоли, который невозможно устранить сведением краев раны, выполняется один из видов первичной пластики:
– свободным кожным лоскутом;
– местными тканями;
– комбинированная кожная пластика;
– пластика перемещенными островковыми лоскутами на сосудистых ножках, -аутотрансплантация комплексов тканей с использованием микрохирургической техники.
при невозможности выполнения органосохраняющего лечения, обусловленной местной распространенностью опухолевого процесса и неэффективностью неоадъювантного лечения, проводится ампутация конечности.
IIA стадия (Т1a,T1b N0,NX M0 Высокая степень злокачественности):
пред- или послеоперационная лучевая терапия + широкое иссечение опухоли;
при T1b проводится дополнительно 3–4 курса адъювантной полихимиотерапии;
при образовании обширного раневого дефекта после хирургического удаления опухоли, который невозможно устранить сведением краев раны, выполняется один из видов первичной пластики.
IIB стадия (T2a N0,NX M0 Высокая степень злокачественности), III стадия (T2b N0,NX M0 Высокая степень злокачественности):
пред- или послеоперационная лучевая терапия (предпочтение следует отдавать проведению лучевой терапии в условиях локальной СВЧ-гипертермии) + хирургическое удаление опухоли (T2a - широкое иссечение, Т2b - радикальная сохранная операция) + 3–4 курса адъювантной полихимиотерапии;
с целью повышения эффективности неоадъювантного лечения при планировании органосохраняющего оперативного вмешательства в систему лечения включают методы регионарной химиотерапии (в/венное или внутриартериальное введение химиопрепаратов);
при образовании обширного раневого дефекта, который невозможно устранить сведением краев раны, выполняется один из видов первичной пластики;
при невозможности выполнения органосохраняющего лечения в связи с местной распространенностью опухоли и отсутствием клинического эффекта после проведения неоадъювантного лечения проводится ампутация конечности.
IV стадия (любая T и N M1 любая степень злокачественности)
IV стадия (любая T N1 M0 Любая степень злокачественности):
комплексное лечение проводится по принципам лечения сарком мягких тканей I–III стадий с учетом степени дифференцировки опухоли и местного распространения опухолевого процесса;
хирургический компонент предусматривает, кроме вмешательства на первичном очаге (органосохраняющая или органоуносящая операция), типичную регионарную лимфодиссекцию, которая выполняется одномоментно с операцией на первичной опухоли (одноблочно или поэтапно) либо в отсроченном порядке (в зависимости от зоны поражения и общего состояния больного).
IV стадия (любая T и N M1 любая степень злокачественности)
проводится паллиативное и симптоматическое лечение по индивидуальным программам с включением полихимиотерапии и/или лучевой терапии.
хирургические вмешательства выполняются с целью уменьшения опухолевой массы или по санитарным показаниям (ампутация конечности).
Немедикаментозное лечение:
Карта наблюдения пациента, маршрутизация пациента
Все больные с саркомой мягких тканей после завершения лечения должны находиться под наблюдением врача онколога по месту прикрепления пациента.
В течение первых 2-х лет – каждые 3 месяца;
В течение третьего года – каждые 6 месяцев;
С 4го года – каждые 12 месяцев – ежегодно.
В объем контрольного обследования входят КТ зоны поражения первичным опухолевым процессом, КТ ОБП и КТ ОГК/ ПЭТ/КТ.
Немедикаментозное лечение:
Режим больного при проведении консервативного лечения – общий.
В ранний послеоперационный период – постельный или полупостельный (в зависимости от объема операции и сопутствующей патологии).
В послеоперационном периоде – палатный.
Диета стол - №15, после хирургического лечения – №1.
Виды лучевой терапии:
Лучевая терапия [8-10].
Виды лучевой терапии:
дистанционная лучевая терапия;
3D-конформное облучение;
модулированная по интенсивности лучевая терапия (IMRT);
томотерапия.
Показания к лучевой терапии:
Саркома мягких тканей является радиорезистентной злокачественной опухолью. При назначении лучевой терапии необходимо учитывать гистологическую структуру опухоли. Лучевая терапия используется в рамках комбинированного и комплексного лечения.
Применяется лучевая терапия с использованием глубокофокусной R-терапии, электронного пучка или Υ-терапии, как правило, в виде предоперационного или послеоперационного курса в СОД 50–70 Гр в режиме классического фракционирования. Выбор источника облучения и энергии электронного пучка определяется локализацией и глубиной залегания опухоли.
Для равномерного подведения дозы облучения ко всей заинтересованной зоне возможна конформная лучевая терапия, лучевая терапия (КФЛТ), с интенсивной модуляцией пучка (IMRT), применяются многопольные методики облучения с использованием приспособлений для формирования оптимальных дозных полей. Границы полей облучения должны превышать размеры опухоли на 3–4 см. При больших размерах опухоли и/или высокой степени злокачественности поле облучения должно включать до 10 см тканей проксимальнее и дистальнее границ опухоли. В этом случае после достижения СОД 45–50 Гр поле облучения сокращается до размеров опухоли.
При опухолях, локализующихся на конечностях, для снижения вероятности развития лучевого остеонекроза используются дополнительные косые поля, выходящие за пределы облучаемых тканей. В идеальном случае с целью уменьшения выраженности фиброза, контрактуры мышц и отека следует исключить из поля облучения до 1/3 окружности конечности. Минимальная ширина необлучаемых тканей должна составлять: на предплечье - 2 см, на голени - 3 см, на бедре - 4 см.
Противопоказаниями к проведению предоперационной лучевой терапии являются:
отсутствие морфологического подтверждения диагноза;
распад опухоли с угрозой кровотечения, общие противопоказания к лучевой терапии.
Послеоперационная лучевая терапия проводится при получении гистологического заключения о высокой степени злокачественности и мультицентрическом росте опухоли (если не проводилась предоперационная лучевая терапия), а также при условно радикальном или нерадикальном удалении опухоли. Начало проведения лучевой терапии - не позднее 4 недель после выполнения оперативного вмешательства.
Если предоперационная лучевая терапия не проводилась, в зону облучения включают ложе удаленной опухоли (границы отмечаются танталовыми скрепками во время операции), окружающие ткани с отступом от краев отсечения на 2 см и послеоперационный рубец (СОД 60 Гр). При наличии остаточной опухоли, которая должна быть маркирована титановыми скрепками во время операции, эта зона дополнительно локально облучается до СОД не менее 70 Гр.
В послеоперационном периоде возможно дополнительное использование брахитерапии в ложе опухоли. При самостоятельной брахитерапии рекомендуемая СОД 45 Гр, которая подводится в течение 4-6 дней.
При нерезектабельности опухоли проводится лучевая терапия по радикальной программе в СОД 70 Гр в режиме классического фракционирования.
Медикаментозное лечение [5,11-15]:
Системное лечение диссеминированных сарком мягких тканей может включать цитотоксическую химиотерапию и/или таргетную терапию. Цитотоксическая химиотерапия может продемонстрировать более высокие результаты, чем таргетная терапия, на неселективной популяции пациентов ввиду ограниченного присутствия молекулярной мишени. При лечении диссеминированных СМТ возможно применение как монохимиотерапии, так и комбинированной химиотерапии. Вопрос о выборе оптимального режима химиотерапии для начала (или продолжения) лечения в значительной степени зависит от спектра активности химиопрепаратов в отношении СМТ. В ходе лечения пациенты, как правило, успевают получить все доступные препараты, однако полные эффекты достигаются редко. Выбор терапии должен основываться на конечных целях, как показано ниже, при этом особое внимание следует уделять гистологическому подтипу и соматическому статусу пациента.
Рекомендуется проводить неоадъювантную химиотерапию пациентам с местно распространенными саркомами мягких тканей G3 II-III стадии в тех случаях, когда запланировано органосохраняющее хирургическое лечение.
Рекомендуется использовать для неоадъювантного режима комбинацию доксорубицин+ифосфамид в разных дозоинтервальных вариантах, доксорубицин в монорежиме, комбинация VAC (Винкристин +Доксорубицин+Циклофосфан) или VAC/IE (Ифосфамид+Этопозид), комбинация GemTax (Гемцитабин+Доцетаксел), паклитаксел (в монорежиме, 80 мг/м² в 1-й, 8-й, 15- й дни каждые 4 недели) для пациентов высокого риска с высокозлокачественными, чувствительными к стандартной химиотерапии подтипами – (указанные комбинированые режимы – см. ниже).
Рекомендуется проводить адъювантную (профилактическую) химиотерапию высокозлокачественных сарком (G3) мягких тканей после этапа хирургического лечения (за исключением нечувствительных подтипов СМТ). Рекомендуется использовать адъювантную химиотерапию при получении лечебного патоморфоза 3-4 степени. В остальных случаях при высокозлокачественных саркомах подтипов чувствительных к стандартной химиотерапии) обсудить проведение профилактической химиотерапии на консилиуме.
Рекомендуется проведение химиотерапии, как основного метода лечения диссеминированного процесса при мягкотканых саркомах. Наиболее часто используются доксорубицин, ифосфамид, дакарбазин. Стандартом химиотерапии диссеминированных сарком мягких тканей первой линии является комбинированный режим доксорубицин + ифосфамид. Для пациентов старше 65 лет методом выбора является монотерапия антрациклинами. При общем хорошем состоянии комбинированная химиотерапия предпочтительнее, когда ожидается выраженный эффект со стороны опухоли. Выбор терапии должен быть основан на ряде факторов, в первую очередь морфологическом строении опухоли. Необходимо учитывать локализацию процесса, возраст пациента, сроки и объемы ранее проведенного лечения.
Синовиальная саркома и миксоидная липосаркома являются наиболее чувствительными к химиотерапии: миксоидная липосаркома – к доксорубицину, синовиальная саркома – к алкилирующим агентам, таким как ифосфамид. Лейомиосаркомы матки, эндометриальные стромальные саркомы, миксофибросаркомы, дедифференцированные липосаркомы, злокачественные опухоли оболочки периферических нервов имеют индивидуальную вариабельность чувствительности к химиотерапии. Объективные эффекты при этих опухолях возможны и при применении двухкомпонентных режимов доксорубицин + ифосфамид и гемцитабин /доцетаксел.
Схемы лекарственной терапии сарком мягких тканей.
Монохимиотерапия:
Доксорубицин 60-75мг/м2 в/в 1р/3 недели Доксорубицин 30мг/м2 1-3й дни
Ифосфамид 5 мг/м2 в/в либо в/в инфузия в 1дн или 1,6-2,5г/м2/сут в течение 5 дней с месной из расчета 20% + 100% от дозы ифосфамида одновременно с ним
Гемцитабин 1200 мг/м2 за не менее 120 минут в 1-й и 8-й дни каждые 21день с фиксированной скоростью инфузии 9-10мг/м2/мин
Трабектидин 1,4 мг/м2 в виде 24-х часовой инфузии.
Эрибулин 1,4 мг/м2 в/в, в течение 2-5 минут 1,8-дни 21-дневного цикла.
Схемы полихимиотерапии:
Установка порт-системы.
1.AI
Доксорубицин 75 мг/м2 в/в в течение 72 часовая инфузия 1дн Ифосфамид 2,5г/м2г в/в 3 часовая инфузия 1-4-й день.
Месна 500мг/м2 в 1-й день вместе с ифосфамидом, далее 1500мг/м2 в/в 24-часовая инфузия в течение 4 дней.
Интервал 3 недели.
2. CyADIC
Циклофосфан 500 мг/м2 в/в 2 день.
Доксорубицин 50 мг/м2 в/в 1 день.
Дакарбазин 250 мг/м2 в/в 1-5 дни.
3. ADIC
Доксорубицин 90 мг/м2 в/в – 96 часовая инфузия.
Дакарбазин 900 мг/м2 в/в - 96-часовая инфузия, растворенный с доксорубцином интервал 3-4 недели.
4. МAID
Доксорубицин 60 мг/м2 в/в в течение 72 часовая инфузия.
Ифосфамид 2000 мг/м2г в/в 4х часовая инфузия 1-3-й дни; 6000мг/м2 – 72х часовая инфузия.
Месна общая доза 8000мг/м2 в 96-часовая инфузия.
Дакарбазин 900мг/м2 – 72часовая инфузия, растворенный вместе с доксорубицином. Интервал 3-4 недели.
5. GemTax
Гемцитабин – 900 мг/м2 в/в в 1-й, 8-й день, Доцетаксел – 100 мг/м2 в/в в 8-й день
Для пациентов ранее получавших химиотерапию, проводится редукция доз гемцитабина до 675мг/м2 в 1й и 8й дни и доцетаксел до 75мг/м2 8й день, также на фоне филграстима 5-15й дни п/к. Интервал 3 недели.
6. VAI
Винкристин 2мг в/в 1й день.
Доксорубицин 75 мг/м2 в/в в течение 72 часовая инфузия 1дн Ифосфамид 2,5г/м2г в/в 3 часовая инфузия 1-4-й дн.
Месна 500мг/м2 в 1-й день вместе с ифосфамидом, далее 1500мг/м2 в/в 24-часовая инфузия в течение 4 дней.
7. VADRIAC
Винкристин 1.5мг/м2 в/в 1,8,15й день в течение первых 2х курсов, далее только в 1й день.
Циклофосфан 600 мг/м2 в/в 1,2 дни.
Доксорубицин 60 мг/м2 в/в 48часовая инфузия интервал 3 недели.
Ифосфамид 1800мг/м2 в/в 1-5й дни, месна 1-5й дни Этопозид 100мг/м2 в/в 1-5й дни. Интервал 3 недели.
Иринотекан 40мг/м2 – 1-5й дни
Таргетная терапия:
Рекомендуется для лечения дерматофибросарком и агрессивного фиброматоза применять иматиниб по 400 мг в день внутрь постоянно.
Пазопаниб 800 мг 1р/день внутрь длительно (до прогрессирования). Пациентам с саркомами мягких тканей (кроме липосарком и GIST) при прогрессировании в течение 12 месяцев после начала неоадъювантной или адъювантной терапии, или предварительно получавших стандартную химиотерапию по поводу метастатической саркомы мягких тканей [1, В], [12].
Пазопаниб относится к мультитирозинкиназным ингибиторам рецепторов VEGFR1, 2 и 3, PDGFRa и b, cKit. Рандомизированное многоцентровое двойное слепое исследование III фазы PALETTE доказало эффективность пазопаниба по сравнению с плацебо у пациентов с распространенной СМТ (исключая GIST и липосаркомы), которые ранее получали химиотерапию. В группе пазопаниба по сравнению с плацебо выявлено трехкратное увеличение выживаемости без прогрессирования (медиана ВБП 20 нед против 7 нед; p<0,0001), снижение риска развития прогрессирования на 65%. Эффективность пазопаниба была более чем в два раза выше, чем в группе плацебо, и составила 73% (6% частичный ответ плюс 67% стабилизация) vs 38% (0% объективный ответ плюс 38% стабилизация) соответственно. В исследовании III было доказано, что пазопаниб является эффективным препаратом для лечения сарком мягких тканей (исключая липосаркомы и GIST) в качестве 2-й и более линии терапии.
Рекомендуется использовать Сунитиниб 37,5 мг ежедневно в качестве > 3 линии в лечении СМТ, контроль эффективности после 2 месяцев приема.
Рекомендуется использовать Сорафениб 400 мг два раза в день ежедневно в качестве > третьей линии в лечении СМТ, контроль эффективности после 2 месяцев приема.
Лекарственная терапия опухолей мягких тканей десмоидного типа (агрессивный фиброматоз):
Тамоксифен ± сулиндак
Тамоксифен
Метотрексат + винбластин
Доксорубицин
Иматиниб
Сорафениб
Метотрексат + винорельбин
Липосомальный доксорубицин
Отдельные редкие типы сарком мягких тканей нечувствительны к стандартным схемам химиотерапии и рекомендуется назначение таргетной терапии в 1й линии лечения и/или иммунотерапии.
Альвеолярная саркома
Сунитиниб
Пазопаниб
Пембролизумаб (NB! Показания для сарком мягких тканей в РК не зарегистрированы).
Перед назначением лекарственной терапии все пациенты должны быть обсуждены мультидисциплинарой группой специалистов. Антрациклиновые схемы рекомендованы в неоадъювантных и адъювантных режимах [13].
Перечень основных лекарственных средств (имеющих 100% вероятность применения):
Дерматофибросаркома/дерматофибросаркома выбухающая:
Иматиниб
При прогрессировании дерматофибросаркомы – проведение химиотерапии по стандартным схемам с использованием химиопрепаратов.
Перед назначением лекарственной терапии все пациенты должны быть обсуждены мультидисциплинарой группой специалистов. Антрациклиновые схемы рекомендованы в неоадъювантных и адъювантных режимах [13].
Перечень основных лекарственных средств (имеющих 100% вероятность применения):
| Лекарственная группа | Международное непатентованное наименование ЛС | Способ применения | Уровень доказательности |
| Химиопрепараты | Липосомальный доксорубицин | внутривенно | А |
| Доксорубицин | внутривенно | А | |
| Циклофосфан | внутривенно | А | |
| Цисплатин | внутривенно | А | |
| Ифосфамид | внутривенно | А | |
| Метотрексат | внутривенно | А | |
| Кальция фолинат | внутривенно | А | |
| Этопозид | внутривенно | А | |
| Винкристин | внутривенно | А | |
| Карбоплатин | внутривенно | А | |
| Месна | внутривенно | А | |
| Гемцитабин | внутривенно | А | |
| Доцетаксел | внутривенно | А | |
| Паклитаксел | внутривенно | А | |
| Блеомицин | внутривенно | А | |
| Трабектидин | внутривенно | А | |
| Топотекан | внутривенно | А | |
| Иринотекан | внутривенно | А | |
| Тамоксифен | внутривенно | А | |
| Эрибулин | внутривенно | В | |
| Дакарбазин | внутривенно | А | |
| Таргетные препараты | Пазопаниб | перорально | В |
| Иматиниб | перорально | В | |
| Сунитиниб | перорально | В | |
| Сорафениб | перорально | В | |
| Иммунопрепараты | Пембролизумаб | внутривенно | В |
| Иммуномодулятор | Филграстим | подкожно | А |
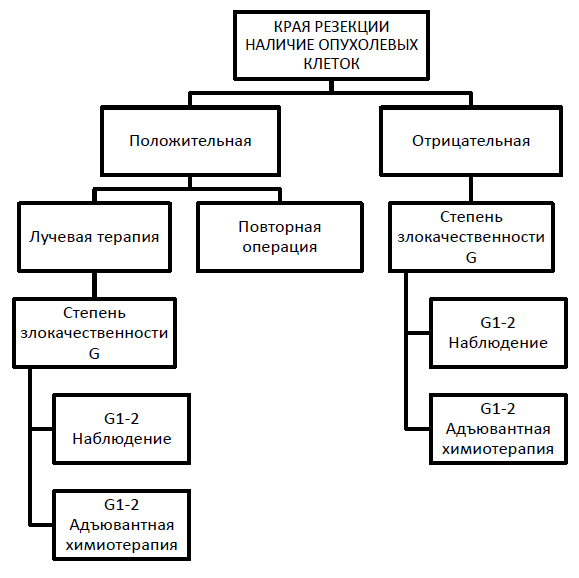
Хирургическое лечение [7]:
Широкое иссечение опухоли в пределах здоровых тканей, с учетом принципов футлярности и зональности является стандартом хирургического вмешательства. Один сантиметр отступа от новообразования считается минимальным, удаление опухоли в мышечной фасции или муфте подразумевает край >1- 5см. Край может быть минимальным в случае стойкого анатомического барьера, такого как мышечная фасция или надкостница, сухожильный конец мышцы. Краевое иссечение может рассматриваться, в исключительных случаях. Границы резекции – основной метод оценки качества хирургического пособия. Определяется совместно хирургом и гистологом. Зону и тракт биопсии необходимо включить в объем окончательной хирургии.
Рекомендуется обязательное изучение микроскопического края резекции согласно интраоперационной маркировки краев препарата.
Принципы оперативных вмешательств:
вместе с опухолью удаляется место предшествующей биопсии;
удаление саркомы производится без обнажения опухоли;
регионарные лимфатические узлы при отсутствии признаков их поражения не удаляются;
границы резекции тканей отмечаются металлическими скобками (для планирования послеоперационной лучевой терапии и при нерадикальном удалении опухоли).
Широкое иссечение. При этой операции опухоль удаляют в пределах анатомической зоны, в едином блоке с псевдокапсулой и отступя от видимого края опухоли на 4–6 см и более. Широкая местная резекция применяется при опухолях низкой степени злокачественности, поверхностных, располагающихся выше поверхностной фасции, в коже, подкожной клетчатке (небольшие фибросаркомы, липосаркомы, десмоиды, дерматофибросаркомы).
Радикальная операция. Эта операция предпринимается при глубоко располагающихся саркомах высокой степени злокачественности. Она предусматривает удаление опухоли и окружающих ее нормальных тканей с включением в единый блок фасций и неизмененных окружающих мышц, которые удаляются полностью с отсечением у места прикрепления. При необходимости производят резекцию сосудов, нервов, костей, прибегая одномоментно к соответствующим реконструктивным пластическим операциям на сосудах, нервах, костях, суставах. Органосохраняющие и функционально-щадящие хирургические вмешательства при местно-распространенных злокачественных опухолях мягких тканей конечностей выполняются исключительно в рамках комбинированного и комплексного лечения. Контроль радикальности оперативного вмешательства осуществляют путем срочного интраоперационного гистологического исследования краев отсечения опухоли от нормальных тканей.
Ампутации и экзартикуляции. Ампутация и экзартикуляция конечности показаны в случаях, когда выполнение радикальной сберегающей операции не представляется возможным из-за массивного поражения (вовлечение в опухолевый процесс суставов, костей, магистральных сосудов и нервов на большом протяжении) и/или при неэффективности курсов неоадъювантного лечения.
Противопоказания к органно-сохранным операциям:
Основные типы операций при саркомах мягких тканей
Простое иссечение используется исключительно в качестве этапа морфологической диагностики злокачественных опухолей.
Широкое иссечение. При этой операции опухоль удаляют в пределах анатомической зоны, в едином блоке с псевдокапсулой и отступя от видимого края опухоли на 4–6 см и более. Широкая местная резекция применяется при опухолях низкой степени злокачественности, поверхностных, располагающихся выше поверхностной фасции, в коже, подкожной клетчатке (небольшие фибросаркомы, липосаркомы, десмоиды, дерматофибросаркомы).
Эту операцию не выполняют при саркомах высокой степени злокачественности.
Радикальная операция. Эта операция предпринимается при глубоко располагающихся саркомах высокой степени злокачественности. Она предусматривает удаление опухоли и окружающих ее нормальных тканей с включением в единый блок фасций и неизмененных окружающих мышц, которые удаляются полностью с отсечением у места прикрепления. При необходимости производят резекцию сосудов, нервов, костей, прибегая одномоментно к соответствующим реконструктивным пластическим операциям на сосудах, нервах, костях, суставах. Органосохраняющие и функционально-щадящие хирургические вмешательства при местно-распространенных злокачественных опухолях мягких тканей конечностей выполняются исключительно в рамках комбинированного и комплексного лечения. Контроль радикальности оперативного вмешательства осуществляют путем срочного интраоперационного гистологического исследования краев отсечения опухоли от нормальных тканей.
Ампутации и экзартикуляции. Ампутация и экзартикуляция конечности показаны в случаях, когда выполнение радикальной сберегающей операции не представляется возможным из-за массивного поражения (вовлечение в опухолевый процесс суставов, костей, магистральных сосудов и нервов на большом протяжении) и/или при неэффективности курсов неоадъювантного лечения.
Противопоказания к органно-сохранным операциям:
вовлечение в опухолевый процесс основного сосудисто-нервного пучка;
патологические переломы;
инфицирование тканей в зоне опухоли;
обширное опухолевое поражение мышц.
Методы обследования:
Дальнейшее ведение.
Динамическое наблюдение за пролеченными больными:
в течение первого года после завершения лечения – 1 раз каждые 3 месяца; в течение второго года после завершения лечения – 1 раз каждые 6 месяцев; с третьего года после завершения лечения – 1 раз в год в течение 3 лет.
Методы обследования:
Локальный контроль - при каждом обследовании;
Пальпация регионарных лимфатических узлов - при каждом обследовании;
КТ органов грудной клетки каждые 3 месяца в течение 1го года, каждые 6 месяцев в течение 2го года, далее 1 раз в год до 5 лет;
ультразвуковое исследование органов брюшной полости – один раз в 6 месяцев (при первично-распространенных и метастатических опухолях);
Наблюдение онколога по месту жительства (осмотр зоны удаленной опухоли, пальпация периферических лимфоузлов);
УЗИ зон регионарного лимфооттока (1 раз в 3 месяца в течение 1 года наблюдения; 1 раз в 6 месяцев во 2й год наблюдения и 1 раз в год в 3й год).
Индикаторы эффективности лечения:
Индикаторы эффективности лечения:
объективные признаки регрессии опухоли, МТС;
УЗИ данные об отсутствии МТС и рецидива;
КТ данные об отсутствии отдаленных МТС;
удовлетворительные показатели крови, мочи, биохимии;
заживление послеоперационной раны;
относительно удовлетворительное состояние больного (-ой).
Критерии эффективности лечения:
Полный эффект – исчезновение всех очагов поражения на срок не менее 4х недель.
Частичный эффект – большее или равное 50% уменьшение всех или отдельных опухолей при отсутствии прогрессирования других очагов.
Стабилизация – (без изменений) уменьшение менее чем на 50% или увеличение менее чем на 25% при отсутствии новых очагов поражения.
Прогрессирование – увеличение размеров одной или более опухолей более 25% либо появление новых очагов поражения.
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ
Показания для плановой госпитализации:
пациенты с выявленной саркомой мягких тканей;
пациенты с подозрительными на саркому мягких тканей образованиями для гистологической верификации диагноза;
для проведение самостоятельной, неоадьювантной и/или послеоперационной (адъвантной) химиотерапии, таргетной терапии.
Показания для экстренной госпитализации: нет.
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2023
- 1) Siegel RL, Miller KD, Fuchs HE, Jemal A. Cancer statistics, 2022. CA Cancer J Clin 2022; 72:7-33. Available at: https://www.ncbi.nlm.nih.gov/pubmed/35020204. 2) Risk Factors for Soft Tissue Sarcomas. Available at: https://www.cancer.org/cancer/soft-tissue-sarcoma/causes-risksprevention/risk-factors.html. Accessed April 12, 2022. 3) TNM классификация злокачественных опухолей, 8-ой пересмотр, 2016 год. 4) NCCN Clinical Practice Guidelines in Oncology. Soft tissue sarcoma.Version 2. March, 2023. 5) Coens C, van der Graaf WT, Blay JY, et al. Health-related qualityof-life results from PALETTE: A randomized, double-blind, phase 3 trial of pazopanib versus placebo in patients with soft tissue sarcoma whose disease has progressed during or after prior chemotherapy-a European Organization for research and treatment of cancer soft tissue and bone sarcoma group global network study (EORTC 62072). Cancer 2018; 121:2933-2941. Available at: https://www.ncbi.nlm.nih.gov/pubmed/26033286. 6) Al-Refaie WB, Habermann EB, Jensen EH, et al. Surgery alone is adequate treatment for early stage soft tissue sarcoma of the extremity. Br J Surg 2018; 97:707-713. Available at: http://www.ncbi.nlm.nih.gov/pubmed/20235085. 7) Pohar S, Haq R, Liu L, et al. Adjuvant high-dose-rate and low-doserate brachytherapy with external beam radiation in soft tissue sarcoma: a comparison of outcomes. Brachytherapy 2017; 6:53-57. Available at: http://www.ncbi.nlm.nih.gov/pubmed/17284387. 8) Leibel SA, Fuks Z, Zelefsky MJ, et al. Intensity-modulated radiotherapy. Cancer J 2019;8:164-176. Available at: http://www.ncbi.nlm.nih.gov/pubmed/12004802. 9) Li XA, Chen X, Zhang Q, et al. Margin reduction from image guided radiation therapy for soft tissue sarcoma: Secondary analysis of Radiation Therapy Oncology Group 0630 results. Pract Radiat Oncol 2018; 6:e135-140. Available at: https://www.ncbi.nlm.nih.gov/pubmed/26852173. 10) ESMO/European Sarcoma Network Working Group. Soft tissue and visceral sarcomas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up//Annals of Oncology. – 2018. – Т. 23. – №. suppl_7. – С. vii92-vii99. 11) Le Cesne, Axel, et al. "Doxorubicin-based adjuvant chemotherapy in soft tissue sarcoma: pooled analysis of two STBSG-EORTC phase III clinical trials." Annals of Oncology 25.12 (2014): 2425-2432. 12) Tierney JF, Mosseri V, Stewart LA, et al. Adjuvant chemotherapy for soft-tissue sarcoma: review and meta-analysis of the published results of randomised clinical trials. Br J Cancer 2018; 72:469-475. Available at: http://www.ncbi.nlm.nih.gov/pubmed/7640234. 13) Frustaci S, De Paoli A, Bidoli E, et al. Ifosfamide in the adjuvant therapy of soft tissue sarcomas. Oncology 2018; 65 Suppl 2:80-84. Available at: http://www.ncbi.nlm.nih.gov/pubmed/14586155. 14) Bramwell VH, Anderson D, Charette ML, Sarcoma Disease Site Group. Doxorubicin-based chemotherapy for the palliative treatment of adult patients with locally advanced or metastatic soft tissue sarcoma. Cochrane Database Syst Rev 2020:CD003293. Available at: https://www.ncbi.nlm.nih.gov/pubmed/12917960.
Информация
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ВНЕДРЕНИЯ ПРОТОКОЛА
Список разработчиков протокола с указанием квалификационных данных:
1) Серикбаев Гани Амангельдыевич – врач - хирург, кандидат медицинских наук, руководитель центра опухолей костей, мягких тканей и кожи, Казахский Научно-исследовательский институт онкологии и радиологии.
2) Курманалиев Аль-Фараби Канатович – врач - химиотерапевт центра опухолей костей, мягких тканей и кожи, Казахский Научно-исследовательский институт онкологии и радиологии.
3) Тулеуова Дина Абдрасулловна – врач – хирург, кандидат медицинских наук центра опухолей костей, мягких тканей и кожи, Казахский Научно-исследовательский институт онкологии и радиологии.
4) Пысанова Жанат Умурзаковна – врач – хирург, докторант рHD, врач центра опухолей костей, мягких тканей и кожи, Казахский Научно-исследовательский институт онкологии и радиологии.
5) Ким Виктор Борисович, врач – радиолог, доктор медицинских наук, руководитель центра лучевой терапии Казахский Научно-исследовательский институт онкологии и радиологии.
6) Тлеугабылова Гульнар Акынгалиевна, врач – хирург, кандидат медицинских наук, доцент, заведующая кафедрой онкологии с курсом оперативной гинекологии НЦНО Professional.
7) Каримбаева Еркеш Мухтаровна – клинический фармаколог, руководитель отдела клинической фармации ГКП на ПХВ «Многопрофильный медицинский центр акимата города Нур-Султан».
Указание конфликта интересов: нет.
Рецензенты:
1) Мауленов Жаксылык Оразбаевич – врач-хирург, онколог высшей категории, директор ГКП на ПХВ «Городской онкологический центр» Управления Здравоохранения города Шымкент.
2) Турешева Алия Орынбековна – кандидат медицинских наук, химиотерапевт, заместитель главного врача ГКП на ПХВ «Алматинский онкологический центр».
Указание условий пересмотра клинического протокола: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.