Рецидив острого лимфобластного лейкоза у детей
 Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Острый лимфобластный лейкоз (C91.0)
Гематология детская, Онкогематология детская, Онкология детская, Педиатрия
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «13» марта 2025 года
Протокол №227
КЛИНИЧЕСКИЙ ПРОТОКОЛ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
ОСТРЫЙ ЛИМФОБЛАСТНЫЙ ЛЕЙКОЗ У ДЕТЕЙ (РЕЦИДИВ)
ОСТРЫЙ ЛИМФОБЛАСТНЫЙ ЛЕЙКОЗ У ДЕТЕЙ (РЕЦИДИВ)
ВВОДНАЯ ЧАСТЬ:
Код(ы) по МКБ-10:
С91.0 Острый лимфобластный лейкоз
Дата разработки протокола: 2016 год (пересмотр 2023 год).
Пользователи протокола: детские онкологи/гематологи, врачи общей практики, педиатры.
Категория пациентов: дети.
Определение[4, 7, 8]:
Острый лимфобластный лейкоз – это клональное злокачественное новообразование из клеток лимфоидных предшественников (лимфобласты), имеющих определенные генетические и иммунофенотипические характеристики.
Рецидив ОЛЛ – это вновь возникшее заболевание после первичной диагностики, лечения и достижения ремиссии ОЛ.
Рандомизация – отбор пациентов на химиотерапию с учетом стратегической группы риска пациента.
Ph-позитивный острый лимфобластный лейкоз – это группа, объединяющая несколько подтипов острых лимфобластных лейкозов, при которых обнаруживается филадельфийская хромосома Ph+ t(9;22)(q34;q11.2)/BCR::ABL1).
Полная ремиссия – это состояние кроветворной ткани, при котором в пунктате костного мозга обнаруживается 5% и менее бластных клеток при нормальном соотношении всех ростков кроветворения, при количестве нейтрофилов в периферической крови более 1,0 × 109/л, при количестве тромбоцитов более или равном 100 × 109/л, при отсутствии экстрамедуллярных очагов лейкемического роста. Констатация морфологически полной ремиссии (соответственно, оценка резистентности) осуществляется либо после первой фазы индукционной терапии, либо после второй. При отсутствии полной ремиссии после завершения двух этапов индукционной терапии регистрируется рефрактерная форма острого лимфобластного лейкоза. Полная ремиссия подразделяется на три основных типа: 1) цитогенетическая, 2) молекулярная, 3) с неполным восстановлением показателей периферической крови, когда число нейтрофилов менее 1,0 × 109/л, а тромбоцитов менее 10 × 109/л.
Резистентная (рефрактерная) форма – эта форма заболевания, которая констатируется при отсутствии полной ремиссии после завершения индукционной терапии.
Ранняя смерть – это смерть пациента в период индукционной терапии[4, 7, 8].
Минимальная остаточная болезнь, или минимальная измеримая болезнь – это небольшое количество опухолевых клеток, остающихся в организме после достижения ремиссии. Эти клетки являются основной причиной рецидивов болезни, поэтому консолидация и поддерживающая терапия после достижения ремиссии при лечении рецидива острого лейкоза направлена именно на уничтожение остатков опухолевых клеток.
Индукция – это период начального лечения (обычно 1–2 курса), целью которого является максимально быстрое и существенное сокращение опухолевой массы и достижение полной ремиссии.
Консолидация - второй этап терапии острых лейкозов – закрепление достигнутого противоопухолевого эффекта (разное количество, в зависимости от протокола). Задачей этого периода является по возможности еще большее уменьшение числа остающихся после индукции лейкемических клеток.
Поддерживающее лечение – это продолжение цитостатического воздействия в меньших дозах, чем в период индукции ремиссии, на возможно остающийся опухолевый клон.
Сокращения, используемые в протоколе:
АСТ – аспартатаминотрансфераза
АЛТ – аланинаминотрансфераза
АЧТВ – активированное частичное тромбопластиновое время
ВИЧ – вирус иммунодефицита человека
ВИЧ – вирус иммунодефицита человека
ВВИГ – внутривенный иммуноглобулин
В/В – внутривенно
В/В – внутривенно
ВПГ – вирус простого герпеса
ВЗН – вторичное злокачественное новообразование
ЖКТ – желудочно-кишечный тракт
ЖКТ – желудочно-кишечный тракт
ИГХ – иммуногистохимия
ИФА – иммуноферментный анализ
ИХЛ – иммунохемилюминесцентный метод
ИТ – инфузионная терапия
ИТ – инфузионная терапия
ИТК – Ингибитор тирозинкиназы
ИФТ – иммунофенотипирование
ИЭМ-ЦНС – Изолированное экстрамедуллярное поражение центральной нервной системы
КМ – костный мозг
КМП – костномозговая пункция
КТ – компьютерная томография
МДГ – мультидисциплинарная группа
МНН – международное наименование
МКБ – Международная классификация болезней
МНО – международное нормализованное отношение
МИБ - минимальная измеримая болезнь
МНО – международное нормализованное отношение
МИБ - минимальная измеримая болезнь
МОБ – минимальная остаточная болезнь
МРТ – магнитнорезонансная томография
ЛДГ – лактатдегидрогеназа
ЛС – лекарственные средства
ЛТ – лучевая терапия
СМП – спинномозговая пункция
СРБ – С-реактивный белок
ОЛЛ – острый лимфобластный лейкоз
ОЛЛР – острый лимфобластный лейкоз (рецидив)
ОАК – общий анализ крови
ОАК – общий анализ крови
ОТ-ПЦР – полимеразная цепная реакция с обратной транскрипцией
ППТ – площадь поверхности тела
ППТ – площадь поверхности тела
ПР – полная ремиссия
ПВ – протромбиновое время
ПТИ – протромбиновый индекс
ПХТ – полихимиотерапия
СОЭ – скорость оседания эритроцитов
СМЖ – спинномозговая жидкость
СКФ – скорость клубочковой фильтрации
ТГСК – трансплантация гемопоэтических стволовых клеток
ТОТ – тотальное облучение тела
ТОТ – тотальное облучение тела
УЗИ – ультразвуковое исследование
ФГДС – фиброгастродуоденоскопия
ЦВК – центральный венозный катетер
ЦНС – центральная нервная система
ЭМ – экстрамедуллярный
ЭхоКГ – эхокардиография
Э/л - эндолюмбально
Э/л - эндолюмбально
ЭКГ – электрокардиография
ARA-C – cytosine arabinoside / Цитарабин
BFM – Berlin-Frankfurt-Münster Study Group/ Международной исследовательской группы Берлин-Франкфурт-Мюнстер
BMP – bone marrow puncture/пункция костного мозга.
BLINA – blinatumomab / блинатумомаб
BLINA – blinatumomab / блинатумомаб
CAR-Т – chimeric antigen receptor /Рецептор химерного антигена
CD – cluster of differentiation/кластер дифференцировки
CMV – cytomegalovirus /Цитомегаловирусная инфекция
CCR – Complete continuous remission /Полная непрерывная ремиссия
CTCAE – Common Terminology Criteria for Adverse Events/ Общие терминологические критерии нежелательных явлений
CR – Complete remission / Полная ремиссия
DEXA – Dexametazon / Дексаметазон
DIR – Death in remission/ Смерть в стадии ремиссии
EBV – Epstein Barr virus / Вирус Эпштейн-Барр
EGIL – The European Group for the Immunological Characterization of Leukaemias/ Европейская группа по иммунологической характеристике лейкозов
EFS – event-free survival/ безсобытийная выживаемость
ECOG – Eastern Cooperative Oncology Group/ Восточная кооперативная онкологическая группа
EOI – end of induction/ в конце индукции
FAB – French-American British /Французско-американско-британские критерии
FISH – fluorescence in situ hybridization / Флуоресцентная гибридизация in situ
FLA(IDA) - Fludarabine (Idarubicin) / Флударабин (Идарубицин)
G-CSF – Granulocyte Colony Stimulating Factor / Гранулоцитарный колониестимулирующий фактор
ID – Induction death/ смерть в индукции
IEM-CNS – isolated extramedullary relapses with CNS involvement/изолированный экстрамедуллярный рецидив с поражением ЦНС
InO – Inotuzumab ozogamicin/ инотузумаб озогамицин
i.tx. – intrathecal therapy/интратекальная терапия
HLA – Human Leukocyte Antigens / Лейкоцитарный антиген человека
HLA-DR+ – Human Leukocyte Antigens DR +/Молекула главного комплекса гистосовместимости II класса
HR – high risk / высокий риск
LFU – Lost for observation/ Потерян для наблюдения
M1/2/3 – Cytological bone marrow status 1-3/цитологический статус КМ
МТХ – Methotrexat / Метотрексат
МТХ – Methotrexat / Метотрексат
MMD – Miss match donor / Несовместимый донор
MD – match donor / совместимый донор
MRD – minimal residual disease/минимальная измеримая болезнь
MUD – match unrelated donor/ неродственный донор
MSD – match sibling donor/ родственный донор
NaCl – sodium chloride/физиологический раствор
Na НСО3 – sodium bicarbonate/гидрокарбонат натрия
NOS – not otherwise specified / без специфических характеристик
NR – No response / Отсутствие ответа
OS – overall survival/общая выживаемость
Ph – филадельфийская хромосома
Pred – Prednisolone / Преднизолон
REL – Relaps / рецидив
RXT – Radio X therapy/лучевая терапия
SBT – Sequencing-based typing/исследование на основе секвенирования
SCT – Stem-cell transplantation/ трансплантация стволовых клеток
SC –Standard risk arm consolidation/ консолидация плеча стандартного риска
SR – standard risk / Стандартный риск
SSP – sequence-specific primer/ специфичный для последовательности праймер
SMN – Secondary malignancy/ вторичное злокачественное новообразование
TBI – Total body irradiation/ тотальное облучение тела
TdT – Terminal deoxynucleotidyl transferase/терминальная дезоксинуклеотидил трансфераза
TKI – Tyrosine kinase inhibitor/ ингибитор тирозинкиназы
TRD – Treatment-related death/Смерть, связанная с лечением
VHR - very high risk /очень высокий риск
TRD – Treatment-related death/Смерть, связанная с лечением
VHR - very high risk /очень высокий риск
Venet* - Venetoclax/ Венетоклакс
Шкала уровней доказательности[36] :
Шкала уровней доказательности[36] :
|
Уровни доказательности
|
Градации рекомендаций
|
|
|
Систематический обзор, клинические исследования, отдельное клиническое исследование
|
I
|
A
|
|
Систематический обзор когортных исследований, или отдельное когортное исследование
|
II
|
B
|
|
Исследование типа "случайконтроль" (отдельное, либо систематический обзор нескольких)
|
III
|
B
|
|
Описание серии случаев, низкокачественные когортные исследования
|
IV
|
C
|
|
Мнение экспертов без точной критической оценки
|
V
|
D
|
Классификация
Классификация
Классификация острого лимфобластного лейкоза (на основе пересмотренной классификации ВОЗ 2022, 5th edition)[5]
|
Новообразования из предшественников В-клеток
|
|
В-клеточный лимфобластный лейкоз/ лимфома
|
|
B-лимфобластный лейкоз/лимфома, NOS (без специфических характеристик, NOS – not otherwise specified)
|
|
В-клеточный лимфобластный лейкоз / лимфома с гипердиплоидией
|
|
В-клеточный лимфобластный лейкоз / лимфома с гиподиплоидией
|
|
В-клеточный лимфобластный лейкоз / лимфома с внутрихромосомной амплификацией хромосомы 21 (iAMP21)
|
|
B-лимфобластный лейкоз/лимфома со слиянием BCR::ABL1
|
|
B-лимфобластный лейкоз/лимфома с BCR::ABL1- like признаками
|
|
В-лимфобластный лейкоз/лимфома с реанжировкой KMT2A
|
|
B-лимфобластный лейкоз/лимфома со слиянием ETV6::RUNX1
|
|
B-лимфобластный лейкоз/лимфома с ETV6::RUNX1- like признаками
|
|
B-лимфобластный лейкоз/лимфома со слиянием TCF3::PBX1
|
|
В-лимфобластный лейкоз/лимфома со слиянием IGH::IL3
|
|
B-лимфобластный лейкоз/лимфома со слиянием TCF3::HLF
|
|
В-лимфобластный лейкоз/лимфома с другими определенными генетическими аномалиями
|
|
Новообразования из предшественников Т-клеток
|
|
Т- лимфобластный лейкоз / лимфома
|
|
Т-лимфобластный лейкоз/ лимфома, NOS (без специфических характеристик, NOS – not otherwise specified)
|
|
Ранний Т-лимфобластный лейкоз из предшественников / лимфома
|
|
Зрелые Т-клеточные и NK-клеточные новообразования
|
|
Зрелые Т-клеточные и NK-клеточные лейкозы
|
|
Т-пролимфоцитарный лейкоз
|
|
Т-крупногранулярный лимфоцитарный лейкоз
|
|
NK-крупногранулярный лимфоцитарный лейкоз
|
|
Синдром Сезари
|
|
Агрессивный NK-клеточный лейкоз
|
Иммунофенотипическая классификация ОЛЛ по EGIL (Европейская группа иммунодиагностики лейкозов) 1995[4,6,13]:
ОЛЛ В-клеточной линии (или не-Т-ОЛЛ):
|
ОЛЛ В-линии: CD19+ и/или CD79а+ и/или CD22+ цитоплазматический
Экспрессия не менее, чем двух из трёх пан-В-клеточных маркеров Большинство случаев антигенов ТdТ+ и HLA-DR+, зрелый В-ОЛЛ часто ТdТ (-) |
|
|
Про-В-ОЛЛ (ВI)
«Общий»-ОЛЛ (ВII) Пре-В-ОЛЛ (ВIII) Зрелый В-ОЛЛ (ВIV) |
Нет экспрессии других маркеров
CD10+ Цитоплазматический IgM+ Цитоплазматические или поверхностные каппа+ или лямбда+ |
ЛЛ Т-клеточной линии (или Т-ОЛЛ):
|
ОЛЛ Т-линии: CD3+ цитоплазматический или мембранный, большинство случаев: ТdТ+, HLA-DR-, CD34-, но эти маркёры не играют роли в диагностике и классификации
|
|
|
Про-Т-ОЛЛ (ТI)
|
CD7+
|
|
Пре-Т-ОЛЛ (ТII)
|
CD2+ и/или CD5+ и/илиCD8+
|
|
Кортикальный Т-ОЛЛ (ТIII)
|
CD1a+
|
|
Зрелый Т-ОЛЛ (ТIV)
|
CD3+ мембранный CD1a-
|
|
Альфа/бета+ Т-ОЛЛ (а)
|
Анти TCR альфа/бета+
|
|
Гамма/дельта+ Т-ОЛЛ (б)
|
Анти TCR гамма/дельта+
|
Недифференцируемый ОЛЛ (или не-Т, не-В-ОЛЛ).
|
Бластные клетки:
|
Классификация рецидивов ОЛЛ[1-7]:
-
изолированный рецидив КМ (≥10% лимфобластов в КМ при отсутствии экстрамедуллярного поражения);
-
комбинированный рецидив КМ (≥5% лимфобластов в КМ и по крайней мере одно экстрамедуллярное проявление ОЛЛ).
Классификация рецидивов по времени возникновения [1-7]:
|
Время возникновения
|
После установления первичного диагноза
|
После окончания первичной терапии*
|
|
Очень ранний
|
< 18 месяцев
|
< 6 месяцев
|
|
Ранний
|
≥ 18
|
< 6 месяцев
|
|
Поздний
|
≥ 6 месяцев
|
Классификация рецидивов по месту возникновения[1-7]:
|
КМ
|
M-1
(< 5% бластов) |
M-2
(≥ 5% и < 25% бластов) |
M-3
(≥ 25% бластов) |
|
|
Экстрамедуллярный
|
нет
|
Не рецидив ОЛЛ
|
требует строгого повторного контроля
|
изол. КМ
|
|
да
|
Изолированный ЭМ
|
комбинированный КМ / экстрамедуллярный
|
||
Классификация рецидива ОЛЛ по группам риска[1]
Для адекватной стратификации пациентов на терапевтические группы важно наличие данных времени, места рецидива, цитогенетики, молекулярной генетики, FISH, иммунофенотипирования.
Классификация рецидива ОЛЛ В-клеточной линии (или не-Т-ОЛЛ)
|
Группы риска
|
Критерии
|
|
Изолированное экстрамедуллярное поражение ЦНС (ИЭМ-ЦНС)
|
рецидивы с вовлечением ЦНС-3 стадии и бласты < 10% в костном мозге, независимо от времени рецидива. Вовлечение других участков ЭМ поражения, помимо ЦНС не исключает пациента из этой категории
|
|
Стандартный риск (SR)
|
поздние рецидивы, исключая пациентов с ИЭМ- ЦНС и пациентов с генетическим риском очень высокой группы риска
|
|
Высокий риск (HR)
|
ранние рецидивы, за исключением пациентов с ИЭМ-ЦНС и пациентов с генетическими особенностями очень высокой группы риска
|
|
Очень высокий риск (VHR)
|
очень ранние рецидивы и/или генетические особенности очень высокого риска: KMT2A::AFF1 t(4;11), E2A3::PBX1 (также называемый TCF3::PBX1) t(1;19), TCF3::HLF t(17;19) перестановки, гиподиплоидия (<44 хромосом), изменение TP53
|
Классификация рецидива ОЛЛ Т-клеточной линии
|
Группы риска
|
Критерии
|
|
T клеточный изолированный экстрамедуллярный ЦНС рецидив (TИЭМ-ЦНС)
|
рецидивы с вовлечением ЦНС-3 стадии и <5% бластов в костном мозге, независимо от времени рецидива.
Вовлечение других участков ЭМ поражения помимо ЦНС не исключают больного из этой категории. |
|
Т клеточный Высокий риск (Т-HR)
|
все другие Т клеточные рецидивы ОЛЛ
|
Стратификация лечения в зависимости от времени, места рецидива, генетики и иммунофенотипа ОЛЛ
|
Время рецидива
|
Иммунофенотип: предшественник В-клеток
|
|
|
Генетически не высокая группа риска
|
Генетически очень высокая группа
|
|
|
|
|
риска
|
||
|
|
ИЭМ-ЦНС (IEM- CNS)
|
Все другие
|
ИЭМ-ЦНС (IEM- CNS)
|
Все другие
|
|
Очень ранний
|
ИЭМ-ЦНС
(IEM-CNS) |
Очень высокий риск (VHR)
|
ИЭМ-ЦНС ветвь
(IEM-CNS) |
Очень высокий риск (VHR)
|
|
Ранний
|
ИЭМ-ЦНС
(IEM-CNS) |
Высокий риск
(HR) |
ИЭМ-ЦНС ветвь
(IEM-CNS) |
Очень высокий риск (VHR)
|
|
Поздний
|
ИЭМ-ЦНС
(IEM-CNS) |
Стандартный риск
(SR) |
ИЭМ-ЦНС ветвь
(IEM-CNS) |
Очень высокий риск (VHR)
|
|
Время рецидива
|
Иммунофенотип: предшественник Т-клеток
|
|||
|
|
ИЭМ-ЦНС (IEM- CNS)
|
Все другие
|
ИЭМ-ЦНС (IEM- CNS)
|
Все другие
|
|
Очень ранний
|
Т-ИЭМ-ЦНС
(T-IEM-CNS) |
Т-высокий риск (Т-HR)
|
Т-ИЭМ-ЦНС
(T-IEM-CNS) |
Т-высокий риск (Т-HR)
|
|
Ранний
|
Т-ИЭМ-ЦНС
(T-IEM-CNS) |
Т-высокий риск (Т-HR)
|
Т-ИЭМ-ЦНС
(T-IEM-CNS) |
Т-высокий риск (Т-HR)
|
|
Поздний
|
Т-ИЭМ-ЦНС
(T-IEM-CNS) |
Т-высокий риск (Т-HR)
|
Т-ИЭМ-ЦНС
(T-IEM-CNS) |
Т-высокий риск (Т-HR)
|
Генетические группы риска:
Генетические особенности очень высокой группы риска включают:
-
KMT2A::AFF1 fusion (слияние), t(4;11) (q21;q23)
-
TCF3::PBX1 (also called E2A3::PBX1) fusion (слияние), t(1;19) (q23;p13)
-
TCF3::HLF fusion (слияние), t(17;19) (q22;p13)
-
TP53 alterations (изменения)
-
hypodiploidy (< 44 chromosomes) / гиподиплоидия (<44 хромосом)
Лечение филадельфийских положительных рецидивов и пациентов со слиянием ABL-класса предлагается стратифицировать по риску в соответствии с их негенетическими особенностями (иммунофенотип, местоположение и время рецидива), но с добавлением ингибиторов тирозинкиназы к химиотерапии.
Классификация экстрамедуллярного рецидива по формам [1-7]
|
когда соотношение лейкоцитов/эритроцитов в СМЖ превышает соотношение в периферической крови более чем в 2 раза, предполагается поражение ЦНС 3.
в противном случае предполагается контаминация кровью.
|
|
Рецидив яичка
|
|
|
Другие экстрамедуллярные очаги рецидива
|
Следующие исследования органов «мишеней» (органов грудной клетки, брюшной полости, органов малого таза и лимфатических узлов):
|
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ.
Диагностические критерии [1-10]
Жалобы и анамнез:
Жалобы:
Жалобы:
- слабость;
- недомогание;
- повышение температуры тела;
- боли в костях и/или суставах;
- бледность;
- кровоточивость слизистых полости рта, носа, другие виды кровотечений;
- увеличение периферических лимфатических узлов;
- увеличение размеров живота;
- боли в животе;
- затрудненное носовое дыхание;
- одышка;
- головные боли, рвота, судороги (при нейролейкозе);
- одно – или двустороннее увеличение яичек, отсутствие болезненности при пальпации (при орхите).
Физикальное обследование:
Клиническая симптоматика развернутой стадии ОЛЛ:
-
гиперпластический: умеренное и безболезненное увеличение лимфоузлов, печени и селезёнки, увеличение миндалин, аденоидов, внутрибрюшных лимфоузлов и лимфоузлов средостения с симптомами сдавления, увеличение яичек у мальчиков, кожные лейкозные инфильтраты (лейкемиды) в виде красновато- синеватых бляшек. Возможно значительное увеличение почек в результате лейкемической инфильтрации, реже инфильтрация миокарда и выпотной перикардит при обструкции путей лимфооттока между эндокардом и эпикардом. Увеличение тимуса или лимфоузлов средостения характерно для рецидива Т-клеточного ОЛЛ, возможна лейкемическая инфильтрация лёгочной ткани или кровоизлияния в неё;
-
геморрагический: от мелкоточечных и мелкопятнистых одиночных высыпаний на коже и слизистых оболочках до обширных кровоизлияний и профузных кровотечений – носовых, маточных, желудочно-кишечных, почечных и других, вплоть до острых расстройств мозгового кровообращения;
-
анемический: слабость, вялость, головные боли, бледность кожных покровов, снижение аппетита;
-
интоксикационный: оссалгии и артралгии, инфекционные осложнения бактериального происхождения (включая пневмонии, сепсис, гнойные процессы), тяжёлые инфекционные осложнения вирусного и грибкового генеза. Лихорадка связана с наличием инфекции, у детей с глубокой нейтропенией;
Нутритивные проблемы на фоне проводимой химиотерапии:
-
снижение аппетита;
-
тошнота и рвота;
-
мукозиты слизистой ротовой полости;
-
извращение вкуса;
-
сухость в ротовой полости, вследствие снижения секреции;
-
мальабсорбции и диарее;
-
запоры;
-
отвращение к пище;
-
стероидная терапия.
Синдром острого лизиса опухоли возникает на фоне медикаментозного лечения (циторедуктивная предварительная фаза этапа индукции):
-
гиперкалиемия вследствие быстрого лизиса большого количества клеток, который приводит к преципитации в почечных канальцах и собирательных протоках;
-
тромбоз сосудов ЦНС с последующим кровоизлиянием;
-
легочный лейкостаз;
-
почечная недостаточность;
-
коагулопатия (гипокоагуляция).
Основные лабораторные исследования:
ОАК + лейкоформула ручным методом: анемия, тромбоцитопения, ускорение СОЭ, количество лейкоцитов может быть повышенным, сниженным или в норме, лимфоцитоз, бласты (бластные клетки обнаруживаются не всегда);
Коагулограмма (АЧТВ, ПВ, МНО, ПТИ, фибриноген, Д-димер, Антитромбин-3): без патологии/гиперкоагуляция или гипокоагуляция.
Биохимический анализ крови (общий белок, альбумин, мочевина, креатинин, натрий, калий, кальций, глюкоза, мочевая кислота, общий билирубин, прямой билирубин, ЛДГ, АСТ, АЛТ, СРБ, щелочная фосфотаза, амилаза):
Коагулограмма (АЧТВ, ПВ, МНО, ПТИ, фибриноген, Д-димер, Антитромбин-3): без патологии/гиперкоагуляция или гипокоагуляция.
Биохимический анализ крови (общий белок, альбумин, мочевина, креатинин, натрий, калий, кальций, глюкоза, мочевая кислота, общий билирубин, прямой билирубин, ЛДГ, АСТ, АЛТ, СРБ, щелочная фосфотаза, амилаза):
-
повышение/норма ЛДГ;
-
повышение/норма креатинина;
-
повышение/норма мочевины;
-
повышение общего билирубина, прямого билирубина, АЛТ и АСТ;
-
повышение/норма СРБ;
-
электролитные нарушения;
Бактериологические исследования крови, зева и носа с определением чувствительности: наличие или отсутствие бактериальной флоры.
Определение группы крови по системам АВО; Определение резус-фактора;
Определение маркеров вирусного гепатита А, В, С, Д, G методом ИФА или ИХЛ: положительный/отрицательный;
Определение ВИЧ-инфекции (HIVAg/anti-HIV) методом ИФА: положительный/отрицательный;
Определение вирусов CMV, EBV и вируса простого герпеса методом ИФА или ИХЛ: положительный/отрицательный;
Общий анализ мочи: определение плотности, рН мочи, протеинурии, гематурии, уратурии.
Цитологическое исследование пунктатов костного мозга:
-
изменение процентного соотношения костномозговых элементов и количество ядросодержащих клеток в сторону угнетения костномозговых элементов;
-
инфильтрация бластными клетками – от 25% до тотального замещения костного мозга опухолью.
ИФТ клеток костного мозга методом проточной цитометрии:
-
фенотип клеток опухолевой природы, вариации ОЛЛ;
-
Антигены, специфичные для В-лимфобластов – CD10+, CD19+, CD79а+, сCD22+, sCD22+, CD24+, РАХ+, TdT+, возможна экспрессия CD34+, CD20+;
-
Антигены, специфичные для Т-лимфобластов – CD1а+, CD2+, CD3+, CD4+,CD5+, CD7+, CD8+, CD34+.
Молекулярно-цитогенетический анализ методом флюоресцентной гибридизации in situ (FISH): наличие генетических нарушений (BCR::ABL, MLL/AF4, TEL/AML1, t(1;19)(q23;p13) TCF3/PBX1).
Цитогенетическое исследование (кариотип) метафаз в лейкемических клетках [1,2]:
-
гипердиплоидия – 47 – 65 хромосом без структурных аномалий;
-
гиподиплоидия – менее 44 хромосом;
Молекулярно-цитогенетический анализ (FISH)
-
t (9;22)(q34;q11); ген BCR::ABL (количественное или качественное), включая определение размера транскрипта (p190 по сравнению с p210);
-
t(12;22)(p13.2;q22.1); ETV6-RUNX1 (раньше TEL-AML1);
-
t(4;11) (q21;q23); MLL-AF4, KMT2A::AFF1 fusion;
-
перестойки гена KMT2At (1;19)(q23;p13.3), TCF3::PBX1 t(12;21)(p12;q22), ETV/CBFa;
-
TCF3::HLF fusion (слияние), t(17;19) (q22;p13);
-
TP53 alterations (изменение);
-
транслокация t(5;14) (q31;q32) – IGH-IL3.
Молекулярный анализ на МИБ (МОБ) – наличие остаточных лейкемических клеток у пациента. МОБ может проводиться методами: проточной цитометрии, кариотип костного мозга, FISH, ПЦР-МОБ или NGS-МОБ демострирующие лейкозно-специфические маркеры и называются МОБ тесты (MRD test(s). Порог чувствительности <1×10-4 (<0,01%) мононуклеарных клеток костного мозга.
Цитохимические исследования бластных клеток (для выявления специфических для различных бластов ферментов): положительная ШИК-реакция на гликоген, отрицательная реакция на липиды, пероксидазу, хлорацетат эстеразу.
Исследование СМЖ: > 5 лейкоцитов/µl, наличие лейкемических клеток после цитоцентрифугирования, повышенное давление спиномозговой жидкости, мутность спинномозговой жидкости.
Биохимическое исследование ликвора на количества белка, сахара и хлоридов: повышение белка, хлоридов.
HLA-типирование методами SSP и SBT (в целях подготовки пациента к пересадке костного мозга): наличие генов главного комплекса гистосовместимости по локусам А, В, С, DRB1, DQB1.
Дополнительные лабораторные исследования:
Определение маркеров вирусных гепатитов В и С методом ПЦР (качественный) (при положительных результатах исследования ИФА или ИХЛ): положительный/отрицательный.
Определение вирусов CMV, EBV и вируса простого герпеса методом ПЦР(при положительных результатах исследования ИФА или ИХЛ): положительный/ отрицательный.
Определение КЩС крови (показания: шоковое состояние пациента, сепсис): наличие ацидоза или алкалоза.
Биохимический анализ крови на определение прокальцитонина (показания: шоковое состояние пациента, сепсис): повышение уровня прокальцитонина.
Бактериологическое исследование СМЖ (при отсутствии бластных клеток, но повышение цитоза нелейкемодных клеток > 5): выделение микрофлоры (менингококк, пневмококки, гемофильные палочки, стрептококки, стафилококки, листерии, микобактерии туберкулеза).
Вирусологическое исследование спинномозговой жидкости (при отсутствии бластных клеток, но повышение цитоза нелейкемодных клеток > 5): выделение вирусной инфекции (ЦМВ, вирус простого герпеса и ЭБВ).
Определение фенотипа эритроцитов крови (для контроля наличия или отсутствия антител к эритроцитам) (показания: аллергическая реакция на компонент крови при трансфузии): выявление специфических антигенов, расположенных на поверхности эритроцита.
Исследование лейкоцитарных антител (показания: аллергические реакции на трансфузию тромбоцитов): процент сенсибилизации сыворотки HLA-антителами.
Гистологическое исследование биопсийного материала (показание: наличие опухолевидного образования): лейкемоидная инфильтрация по типу ОЛЛ.
Определение концентрации антибактериальных препаратов и химиопрепаратов в крови методом ИХЛ: ванкомицин (10 – 20 мкг/л), амикацин (15 – 25 мкг/мл), метотрексат (см.Таблицу 3), аспарагиназа (0,1 МЕ/мл).
Определение вирусов CMV, EBV и вируса простого герпеса методом ПЦР(при положительных результатах исследования ИФА или ИХЛ): положительный/ отрицательный.
Определение КЩС крови (показания: шоковое состояние пациента, сепсис): наличие ацидоза или алкалоза.
Биохимический анализ крови на определение прокальцитонина (показания: шоковое состояние пациента, сепсис): повышение уровня прокальцитонина.
Бактериологическое исследование СМЖ (при отсутствии бластных клеток, но повышение цитоза нелейкемодных клеток > 5): выделение микрофлоры (менингококк, пневмококки, гемофильные палочки, стрептококки, стафилококки, листерии, микобактерии туберкулеза).
Вирусологическое исследование спинномозговой жидкости (при отсутствии бластных клеток, но повышение цитоза нелейкемодных клеток > 5): выделение вирусной инфекции (ЦМВ, вирус простого герпеса и ЭБВ).
Определение фенотипа эритроцитов крови (для контроля наличия или отсутствия антител к эритроцитам) (показания: аллергическая реакция на компонент крови при трансфузии): выявление специфических антигенов, расположенных на поверхности эритроцита.
Исследование лейкоцитарных антител (показания: аллергические реакции на трансфузию тромбоцитов): процент сенсибилизации сыворотки HLA-антителами.
Гистологическое исследование биопсийного материала (показание: наличие опухолевидного образования): лейкемоидная инфильтрация по типу ОЛЛ.
Определение концентрации антибактериальных препаратов и химиопрепаратов в крови методом ИХЛ: ванкомицин (10 – 20 мкг/л), амикацин (15 – 25 мкг/мл), метотрексат (см.Таблицу 3), аспарагиназа (0,1 МЕ/мл).
Основные инструментальные исследования:
ЭКГ: (при поражении сердца лейкемической инфильтрацией и при терапии антрациклинами): наличие/отсутствие тахикардии, отклонения электрической оси сердца (ЭОС) вправо, признаки перегрузки обоих предсердий (двугорбый зубец Р во II отведении), нарушения процессов реполяризации в миокарде (отрицательные зубцы Т в отведениях II, III и AVf), увеличение продолжительности корригированного интервала QT);
ЭхоКГ: (показание: перикардит, пороки развития сердца): дилатация левого желудочка, левого и правого предсердий, регургитация на клапанах аорты, гипертрофия межжелудочковой перегородки и стенки правого желудочка, снижение сократительной способности миокарда левого желудочка, наличие/отсутствие небольшого выпота в полость перикарда.
УЗИ органов брюшной полости и забрюшинного пространства: наличие/отсутствие инфильтрации паренхиматозных органов, свободной жидкости в брюшной полости, норма/увеличение лимфоузлов брюшной полости;
УЗИ периферических лимфоузлов: норма/увеличение лимфоузлов;
УЗИ яичек, мошонки: норма/увеличение размеров яичек, наличие/отсутствие жидкости в мошонке;
УЗИ яичников, малого таза: норма/увеличение размеров яичников, наличие/отсутствие образования в малом тазу;
Рентгенография грудной клетки: норма/увеличение средостения, наличие/отсутствие выпотного плеврита, инфильтратов в легких.
Дополнительные инструментальные исследования
Рентгенография костей и суставов (показания: локальный болевой синдром): наличие/отсутствие деструкции в трубчатых костях, возле крупных суставов;
КТ брюшной полости (с контрастированием): наличие/отсутствие инфильтрации паренхиматозных органов, образований и свободной жидкости в брюшной полости, норма/увеличение лимфоузлов брюшной полости;
КТ грудной клетки без контрастирования (с целью исключения вирусной, бактериологической, грибковой пневмонии): интерстициальное поражение легких, аспергилез;
КТ органов грудной клетки с контрастированием (при подозрении объемного образования в грудной клетке брюшной полости): увеличение лимфоузлов грудной клетке, наличие образований и свободной жидкости в грудной клетки.
КТ костной системы с контрастированием (показания: локальный болевой синдром): деструкция костной ткани, наличие или отсутствие объемного образования.
МРТ брюшной полости и забрюшинного пространства с контрастированием (при выявлении объемного образования в брюшной полости и забрюшинном пространстве УЗИ методом): наличие/отсутствие опухолевидного образования.
МРТ головного мозга с контрастированием (с целью исключения солидных образований): инфильтрация головного мозга, наличие опухолевидного образования.
КТ брюшной полости (с контрастированием): наличие/отсутствие инфильтрации паренхиматозных органов, образований и свободной жидкости в брюшной полости, норма/увеличение лимфоузлов брюшной полости;
КТ грудной клетки без контрастирования (с целью исключения вирусной, бактериологической, грибковой пневмонии): интерстициальное поражение легких, аспергилез;
КТ органов грудной клетки с контрастированием (при подозрении объемного образования в грудной клетке брюшной полости): увеличение лимфоузлов грудной клетке, наличие образований и свободной жидкости в грудной клетки.
КТ костной системы с контрастированием (показания: локальный болевой синдром): деструкция костной ткани, наличие или отсутствие объемного образования.
МРТ брюшной полости и забрюшинного пространства с контрастированием (при выявлении объемного образования в брюшной полости и забрюшинном пространстве УЗИ методом): наличие/отсутствие опухолевидного образования.
МРТ головного мозга с контрастированием (с целью исключения солидных образований): инфильтрация головного мозга, наличие опухолевидного образования.
МРТ головного мозга без контрастирования (показания: острое нарушение мозгового кровообращения): наличие очагов кровоизлияния.
Показания для консультации специалистов:
-
консультация невролога – при возникновении головных болей, рвоты многократной, нарушения мозгового кровообращения по ишемическому (геморрагическому) типу, органическая энцефалопатия, предсудорожный, судорожный синдром;
-
консультация офтальмолога: при возникновении головных болей, рвоты многократной, нарушения мозгового кровообращения по ишемическому (геморрагическому) типу, органическая энцефалопатия, предсудорожный, судорожный синдром; при нарушении зрения, воспалительные заболевания глаз и придатков;
-
консультация нейрохирурга – при клинике нарушения мозгового кровообращения;
-
консультация отоларинголога – при массивном носовом кровотечении (для проведения передней или задней тампонады носа); для диагностики и лечения воспалительных заболеваний придаточных пазух носа и среднего уха;
-
консультация нефролога – при нефропатиях, развитии ОПП;
-
консультация детского гинеколога – метроррагии, меноррагии, консультация при назначении комбинированных оральных контрацептивов; для диагностики заболеваний репродуктивной системы;
-
консультация кардиолога – для коррекции/подбора базисной терапии при артериальной гипертензии, острой сердечной недостаточности, нарушения ритма сердечной деятельности;
-
консультация нефролога (эфферентолог) – для диагностики и лечения заболеваний почек;
-
консультация хирурга – для решения вопроса о биопсии лимфатического узла/ образования, при развитии хирургических осложнений на курсах химиотерапии, определение показаний для хирургических вмешательств;
-
консультация торакального хирурга – для определения показаний к биопсии легкого/образования средостения;
-
консультация реаниматолога – нарушение витальных функций;
-
консультация фтизиатра – диагностика туберкулеза;
-
консультация челюстно-лицевого хирурга – инфекционно- воспалительные заболевания зубо – челюстной системы.
NB! Консультации узких специалистов – по показаниям.
Показания для лечения рефрактерных форм ОЛЛР
(терапия спасения/Salvage options):
А) не -T-клеточный рецидив:
-
после HI блока: бласты в КМ ≥ 5%
-
после SI блока; любая физически или радиологически обнаруженная остаточная экстрамедуллярная лейкозная масса, подтвержденная биопсией, или в случае бластных клеток в ликворе.
-
после SC1 блока или HC1блока: МОБ ≥ 1% в КМ или любое ЭМ поражение, в случае бластных клеток в ликворе.
-
после более поздних временных точек: МОБ ≥ 0,1% в КМ.
-
Повторное появление МОБ ≥ 0,1% после предыдущего лечения/молекулярной ремиссии, любого нового или вновь появляющегося экстрамедуллярного поражения.
В) T-клеточный рецидив:
-
Т-ИЭМ-ЦНС ветвь (T-IEM CNS arm):
- если экстрамедуллярное поражение обнаружен на 29-й день индукции.
- МОБ ≥ 0,1% в КМ в любое время после SC1 блока.
- Т- клеточный рецидив группа высокого риска (T-HR arm):
- персистирующее или поражение ЦНС после индукции
- плохой ответ на первый курс NECTAR-VEN
- в случае повторного положительного МОБ после курса терапии.
Хотя МОБ ≥ 5% в КМ и/или цитоморфология M2/M3 после SI считаются неудачей лечения, не рекомендуется переходить к опциям восстановления после SI, так как следующий за ним блок SC1 практически еще один индукционный цикл. Таким образом, рекомендуемый момент времени для перехода к восстановлению вариант для пациентов со стандартной группой риска — после SC1 блока, если МОБ костного мозга ≥ 1%.
Решение о переходе к терапии спасения должен быть тщательно оценен лечащим врачом на консилиуме. Очень важно иметь убедительные доказательства остаточного лейкоза, прежде чем объявлять неэффективность лечения и отклонение от стандартных схем лечения. Рекомендуется подтвердить выводы дополнительными методами, в комбинации использовать морфологию, проточную цитометрию и, в идеале, дополнительные методы FISH, qPCR или NGS MRD.
Переход к иммунотерапии с использованием менее токсичного цикла может быть лучше, чем продолжение интенсивного лечения химиотерапией.
Диагностический алгоритм:
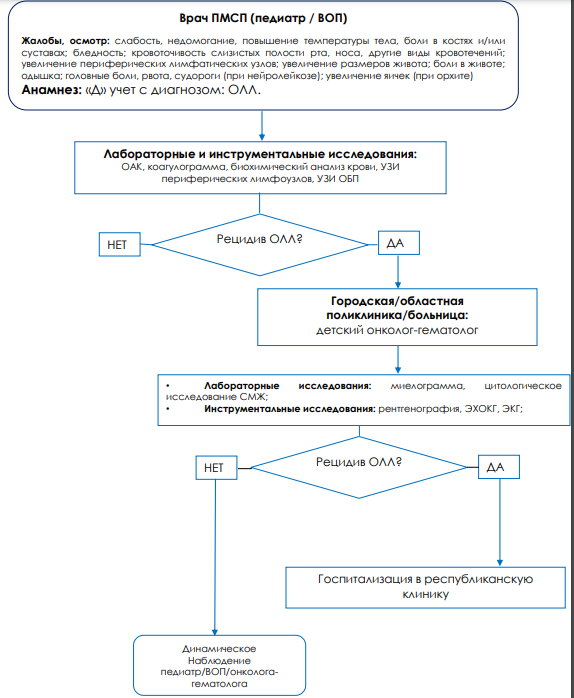
Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований[5,8]
|
Диагноз
|
Обоснование для дифференциальной диагностики
|
Обследования
|
Критерии исключения диагноза
|
|
Осложнение поддерживающей химиотерапии– цитопенический синдром
|
Анемический, геморрагический синдромы, симптомы интоксикации, инфеционные осложнения
|
Исследование миелограммы
|
Бластная метаплазия в КМ при рецидиве ОЛЛ
|
|
Миелодиспластически й синдром вторичный
|
Гиперпластический, анемический, геморрагический синдромы, симптомы интоксикации
|
Исследование миелограммы
|
При рецидиве ОЛЛ трансформация КМ на >25% бластными клетками. При МДС дисплазия ростков кроветворения, клеточный КМ при цитопении в периферическом анализе крови, бласты <25%
|
|
Инфекционный менингит
|
Рвота, судороги, положительные менингеальные знаки, повышение температуры
|
Исследование ликворограммы
|
При рецидиве ОЛЛ выраженный цитоз в ликворе, наличие бластных клеток в ликворе. При инфекционном менингите умеренный цитоз, плеоцитоз, бластных клеток нет
|
|
КТ или МРТ головного мозга
|
При рецидиве ОЛЛ даже при невыраженном цитозе в ликворе возможна опухолевая инфильтрация вещества головного мозга
|
||
|
Травматический или инфекционный орхит
|
Увеличение яичек
|
Биопсия яичек
|
Бластная инфильтрация яичек при рецидиве ОЛЛ
|
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ[4,8,29]:
Терапия направлена на недопущение повторного рецидива путем проведения длительной поддерживающей химиотерапии противоопухолевыми препаратами. Пациентам с установленным диагнозом поддерживающая химиотерапия меркаптопурином и метотрексатом, для пациентов с Ph+ ОЛЛ прием ингибиторов тирозинкиназ может проводиться в амбулаторных условиях, под контролем показателей общего анализа крови.
Немедикаментозное лечение:
Режим: общий.
Диета: с исключением острых, жирных, жареных блюд, в то же время, обогащенная белком.
Медикаментозное лечение:
Медикаментозное лечение на амбулаторном уровне включает:
-
поддерживающую химиотерапию;
-
сопроводительную терапию.
Поддерживающая химиотерапия начинается через 2 недели после окончания интенсивной терапии рецидива ОЛЛ и продолжается до достижения общей длительности лечения 2 года.
Критерии для начала поддерживающей терапии:
-
лейкоциты > 2,0 × 109/л;
-
нейтрофилы > 0,5 × 109/л;
-
тромбоциты > 80 × 109/л ;
-
клинический статус, позволяющий продолжить лечение (отсутствие инфекционных заболеваний).
Препараты выбора поддерживающней терапии:
-
меркаптопурин в дозе 50 мг/м2 поверхности тела в день внутрь (прием препарата по крайней мере через час после ужина с исключением молочных продуктов);
-
метотрексат в дозе 20 мг/м2 поверхности тела внутрь 1 раз в неделю, однократно.
-
При подтверждении диагноза Ph+ ОЛЛ показано назначение препаратов ИТК.
Химиотерапия меркаптопурином и метотрексатом корригируется в зависимости от уровней лейкоцитов, лимфоцитов и общего билирубина и трансаминаз крови, возникновения лихорадочных эпизодов.
Схема поддерживающей терапии
|
Показатели крови
|
Доза препаратов химиотерапии
(меркаптопурин, метотрексат) |
|
|
Уровень лейкоцитов
|
< 1,0 x 109/л
|
отмена
|
|
1 до 2 x 109/л
|
50% дозы
|
|
|
2 до 3 x 109/л
|
100% доза
|
|
|
> 3,0 x 109/л
|
150% дозы
|
|
|
Уровень лимфоцитов
|
< 0,3 x 109/л
|
50% дозы
|
|
Уровень тромбоцитов
|
< 80 x 109/л
|
отмена
|
Сопроводительная терапия
-
Антибактериальная терапия:
Показания к антибактериальной терапии:
-
количество нейтрофилов менее 0,5 × 10 9/л;
-
температура тела выше, чем 38,5.°
Препараты эмпирического выбора:
-
пенициллины (амоксициллин + клавулоновая кислота);
-
цефалоспорины (цефуроксим).
Далее выбор препаратов для антибактериальной терапии в зависимости от чувствительности бактериальной флоры.
В случае непереносимости пенициллинов и цефалоспоринов назначаются препараты группы фторхинолонов или аминогликозидов.
Оценка эффективности стартовой антибактериальной терапии проводится через 24 – 36 часов. Критерием эффективности является нормализация/снижения уровня и кратности лихорадки.
Антибактериальная терапия продолжается до разрешения нейтропении до 1,5 × 10 9/л.
Профилактика пневмоцистной пневмонии:
Всем пациентам с рецидивом ОЛЛ, получающим ПХТ, показана универсальная профилактика пневмоцистной пневмонии Сульфометоксазолом+триметопримом на протяжении всего периода лечения.
|
NB!
Препараты Метотрексат и Сульфометоксазол+триметоприм нельзя назначать в один день, так как их взаимодействие может вызвать длительную цитопению! |
-
Гепатопротекторная терапия назначается при 10-кратном повышении уровней трансаминаз крови и/или 3-кратном повышении уровня билирубина
Препараты выбора:
- урсодезоксихолевая кислота.
- Противогрибковая терапия
Показания: пациенты, получающие антибактериальную терапию.
Препараты выбора:
-
флуконазол;
-
вориконазол.
Перечень основных лекарственных средств [6]:
|
Фармакотерапевтическая группа
|
МНН лекарственного средства
|
Способ применения |
Уровень доказательности
|
||||
|
Противоопухолевый препарат, антиметаболиты
|
6-меркаптопурин
|
Через рот, 50 мг/м2, 1 раз в день, длительность 2 года
|
I В
|
||||
|
Противоопухолевый препарат
|
Метотрексат
|
20 мг/м2, через рот, 1 раз в неделю, курс – 2 года
|
I В
|
||||
|
Противоопухолевый препарат, ингибитор протеинтирозинкиназы
|
1-ая Иматиниб
|
линия
|
340 мг/м2/день (максимальная доза: 800 мг) внутрь.
|
I А
|
|||
|
2-я нилотиниб
|
линия
|
600
внутрь |
–
|
800
|
мг/сут
|
I А
|
|
|
3-я дазатиниб
|
линия
|
100
внутрь |
–
|
140
|
мг/сут
|
I А
|
|
|
NB! Препараты ИТК принимают длительно, без перерывов! При снижении показателей крови или развитии токсичности проводится коррекция дозы/перевод на другую линию терапии. Для оценки эффективности терапии проводится мониторинг гематологических, цитогенетических и молекулярно-генетических показателей. |
Перечень дополнительных лекарственных средств: Дополнительное медикаментозное лечение проводится соответственно клиническим протоколам лечения развившихся осложнений.
Хирургическое вмешательство:
нет.
Дальнейшее ведение:
Профилактические мероприятия: направлены на профилактику геморрагических осложнений, септического шока, анемического шока.
При условии сохранения ремиссии заболевания, после окончания поддерживающей терапии, пациенты находятся на «Д» учёте и наблюдаются у детского онколога-гематолога по месту жительства в течение 5 лет.
При условии сохранения ремиссии заболевания, после окончания поддерживающей терапии, пациенты находятся на «Д» учёте и наблюдаются у детского онколога-гематолога по месту жительства в течение 5 лет.
Периодичность лабораторных и инструментальных исследований, консультаций профильных специалистов во время проведения поддерживающей терапии:
-
Общий анализ крови с дифференцированным подсчетом лейкоцитов (лейкоцитарной формулы):
- до окончания поддерживающей терапии – 1 раз в неделю;
- после окончания поддерживающей терапии – 1 раз в месяц.
-
Биохимический анализ крови (общий белок, альбумин, мочевина, креатинин, натрий, калий, кальций, глюкоза, мочевая кислота, общий билирубин, прямой билирубин, ЛДГ, АСТ, АЛТ, СРБ, щелочная фосфотаза, амилаза):
- до окончания поддерживающей терапии – 1 раз в 3 месяца;
- после окончания поддерживающей терапии – 1 раз в 6 месяцев.
- Исследование миелограммы и СМЖ – при подозрении рецидива заболевания.
- Мониторинг МИБ (МОБ) (не чаще, чем каждые 3 месяца в течение года) у пациентов с полной молекулярной ремиссией.
-
УЗИ органов брюшной полости, малого таза и забрюшинного пространства:
- до окончания поддерживающей терапии – 1 раз в 3 месяца;
- после окончания поддерживающей терапии – 1 раз в 6 месяцев.
-
Консультация онколога – гематолога:
- до окончания поддерживающей терапии – 1 раз в 3 месяца;
- после окончания поддерживающей терапии – 1 раз в 6 месяцев.
Индикаторы эффективности лечения и безопасности методов диагностики и лечения, описанных в протоколе:
-
отсутствие интоксикации;
-
отсутствие геморрагического синдрома;
-
отсутствие гиперпластического синдрома;
-
стабильные показатели гемограммы (Нв >80 г/л, тромбоциты ³30´109/л).
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ:
Карта наблюдения пациента, маршрутизация пациента
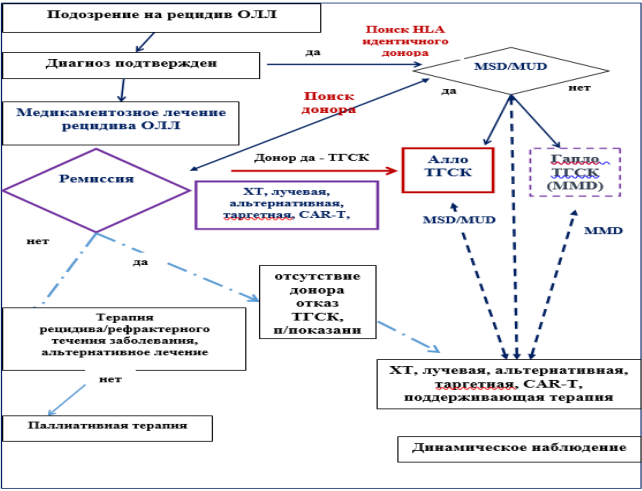
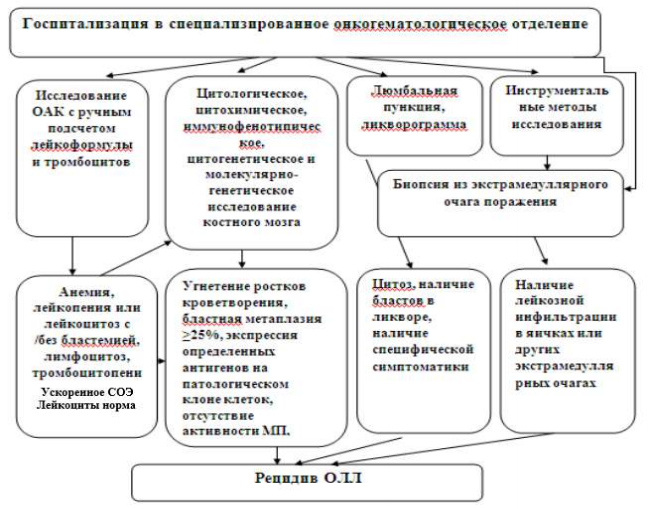
Рисунок 1. Диагностика рецидива
Немедикаментозное лечение:
Режим: палатный режим: I, II, III (в зависимости от тяжести состояния пациента согласно шкале ECOG) [1, 31, 32]:
Немедикаментозное лечение:
Режим: палатный режим: I, II, III (в зависимости от тяжести состояния пациента согласно шкале ECOG) [1, 31, 32]:
I — строгий постельный (3-4 балла): пациенту запрещается самостоятельные движения, в том числе смена положения в постели. Все гигиенические мероприятия, кормление осуществляется только с помощью медсестры. Лечебные и диагностические манипуляции проводятся в постели.
II — постельный (2-3 балла): назначается с целью повышения двигательной активности по мере улучшения состояния пациента. Разрешается самостоятельно или с помощью медицинского персонала выполнять ряд активных движений конечностями, принимать пищу, переворачиваться в постели, выполнять туалет, переходить в положение сидя, затем сидеть на краю кровати, свесив ноги, лёгкие гимнастические упражнения в постели под присмотром медсестры.
III — палатный (полупостельный) (0-1 баллов): назначается при показаниях к расширению двигательной активности пациента. Разрешаются сидеть, вставать, осторожно перемещаться в пределах палаты, самостоятельный уход в пределах палаты. Позволяется дозированная ходьба, подъем по лестнице, прогулки, полный уход за собой.
Таблица 1
Шкала ECOG /Шкала оценки общего состояния пациента Восточной объединенной онкологической группы [31, 32]
|
Баллы
|
Характеристика
|
|
0
|
Больной полностью активен, способен выполнять все, как и до заболевания (90 – 100 баллов по шкале Карновского)
|
|
1
|
Больной неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу, 70 – 80 баллов по шкале Карновского)
|
|
2
|
Больной способен к самообслуживанию, но не может выполнять работу.
Более 50% времени бодрствования проводит активно в вертикальном положении (50 – 60 баллов по шкале Карновского) |
|
3
|
Больной способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования (30 – 40 баллов по
шкале Карновского) |
|
4
|
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели (10 – 20 баллов по шкале Карновского)
|
|
5
|
Смерть
|
Питание[33, 34]:
Диета с исключением острых, жирных, жареных блюд, в то же время, обогащенная белком по тяжести состояния пациента.
Энтеральное, парентеральное и смешанное питание у детей:
В зависимости от состояния пациента (потеря массы тела более 10%, поражение средостения/объемное образование, дисфагия) рекомендуются энтеральное и/или парентеральное питание.
Энтеральное питание является предпочтительным способом нутритивной поддержки в виду следующих преимуществ:
Энтеральное питание является предпочтительным способом нутритивной поддержки в виду следующих преимуществ:
-
более физиологично;
-
обеспечивает поддержание структуры и функции кишечника;
-
уменьшает гиперметаболический ответ на повреждение;
-
уменьшает транслокацию бактерий и токсинов из кишечника.
Энтеральное питание проводится энергетическими и протеиновыми напитками (молочные йогурты, соки), индивидуально, с учетом энергетической потребности пациента (Таблица 2).
Таблица 2
Энергетическая потребность детей в зависимости от возраста
|
Возраст
|
0-6
мес. |
7-12
мес. |
1 год
|
от 2 до 3
лет |
от 3 до 7
лет |
от 7 до
11 лет |
от 11 до 14
лет |
От 14 до
18 лет |
|
Калораж (ккал в день)
|
115
ккал/кг /сут |
105
ккал/к г/сутк и |
1200
|
1400
|
1800
|
2100
|
мальчики –
2500; девочки – 2300 |
2900-
3100 ккал |
|
Белки (г в день)
|
0,6-1,5
г/кг/сутки |
36
|
42
|
54
|
63
|
мальчики –
75; девочки – 69 |
100
|
|
|
Жиры (г в день)
|
2-4 г/кг/сутки
(35-50% от общего калоража) |
40
|
47
|
60
|
70
|
мальчики –
83; девочки – 77 |
100
|
|
|
Углеводы
(г в день) |
2-7 г/кг/сутки
(40-60% от общего калоража) |
174
|
203
|
261
|
305
|
мальчики – 363 г
девочки – 334 |
500
|
|
Классификация смесей для энтерального питания:
-
полимерные: состоят из неизмененных белков, жиров и углеводов – при повышенных потребностях в белках и энергии или при необходимости ограничения жидкости;
-
олигомерные (полуэлементные): состоят из расщеплённых белков и простых углеводов и содержат масла средне цепочечных триглицеридов – при нарушениях функции ЖКТ;
-
смеси для определённых состояний, изготовленные с учётом потребностей конкретного пациента, страдающего тем или иным заболеванием (сахарный диабет, заболевания почек, печени, лёгких).
Пути введения энтерального питания:
-
орально (дробное питье смесей малыми порциями).
-
внутрижелудочно – назогастральный зонд (в случаях, когда питание через рот невозможно, но функция пищеварения сохранена адекватно, длительность курса определяется длительностью расстройств самостоятельного питания через рот);
-
гастростома.
Показания для гастростомы:
-
дисфагия ротоглоточная или пищеводная (нарушение или затруднение глотания) вследствие бульбарных/псевдобульбарных расстройств на фоне органического поражения центральной нервной системы, нейромышечных заболеваний, травм, опухолей головного мозга, нарушения сознания и комы и др.;
-
анатомические препятствия для прохождения пищи из ротовой полости в желудок (врожденные аномалии, атрезия или опухоли пищевода, опухоли шеи и средостения);
-
тяжелая нутритивная недостаточность;
-
риск развития тяжелых мукозитов с последующей невозможностью принимать пищу обычным путем;
-
необходимость в осуществлении энтерального кормления более 30 дней.
Абсолютные противопоказания для гастростомы:
-
тяжелые нарушения свертывания крови: (МНО > 1,5, АЧТВ > 50 сек.; тромбоциты < 50 ×109/л);
-
нестабильная гемодинамика, сепсис, тяжелый асцит, перитонит;
-
инфекционные процессы передней брюшной стенки, тяжелая портальная гипертензия с варикозным расширением вен пищевода и желудка, перитонеальный карциноматоз, интерпозиция внутренних органов (например, печени, кишечника);
-
перитонеальный диализ;
-
тотальная гастрэктомия в анамнезе;
-
обструкция выходного отверстия желудка или тяжелый гастропарез;
-
отсутствие информированного согласия ребенка или его законных представителей на проведение процедуры.
Относительные противопоказания для гастростомы:
-
ожирение высокой степени;
-
анатомические дефекты в результате предыдущей операции или воспаления;
-
выраженный сколиоз с невозможностью нахождения площадки для гастростомы и др.
Парентеральное питание показано при сохраняющейся рвоте, диарее на фоне энтерального питания.
Для парентерального питания используются жировые эмульсии, смеси аминокислот, углеводы.
Основными составляющими парентерального питания являются:
-
источники энергии: 10–20 % растворы углеводов, жировые эмульсии;
-
источники пластического материала: растворы кристаллических аминокислот;
-
поливитаминные комплексы для парентерального введения.
Смешанное питание
При недостаточной эффективности одного из этих методов (энтеральное и парентеральное) питания, не обеспечивающих более 60 % от потребности в энергии, пациентам назначается одновременно и энтеральное и парентеральное питание.
Медикаментозное лечение [1, 2,3]:
Перед началом лечения необходима диагностика нейролейкоза путем исследования СМЖ. При этом, игла из канала не удаляется, и если диагноз рецидива ОЛЛ однозначен по клиническим данным, то сразу же проводится интратекальное введение МТХ. Это заменит первую интратекальную терапию в день 1 недели протокола лечения.
Медикаментозное лечения рецидива ОЛЛ состоит из следующих последовательных этапов:
-
Циторедуктивная предварительная фаза;
-
Этап индукции, направленный на достижение состояния ремиссии заболевания.
-
Этап консолидации, цель которого заключается в закреплении достигнутого результата.
Этап консолидации включает:
- постиндукционную фазу;
- фазу собственно консолидации.
- фазу собственно консолидации.
-
Этап поддержания состояния ремиссии (Поддерживающая терапия).
После каждой фазы химиотерапии назначается перерыв сроком не более 3-х недель для восстановления гемопоэза. Продление интервалов во время лечения, особенно во время индукционной фазы, возможно только в случае возникновения жизни угрожающего осложнения. Протокол предусматривает возможность снижения дозы, необходимо учитывать индивидуальную переносимость химиотерапиии своих пациентов и при необходимости адаптировать протокол к индивидуальным требованиям.
Оценка терапии проводится после каждой фазы химиотерапии:
-
При первичном рефрактерном течении ОЛЛ рецидива следует немедленно рассмотреть возможность применения Схемы лечения рефрактерных форм ОЛЛР (терапия спасения) (FLAG±Ida, иммунотерапия) или альтернативного лечения (ALL-Rez BFM 2002) (см. Приложение 1). Решение принимает МДГ.
-
При условии достижения ремиссии и наличии донора выполняют аллогенную ТГСК.
-
При выявлении BCR::ABL пациенты переводятся на лечение по протоколу с использованием ингибиторов тирозинкиназ.
|
NB!
Во время лечения необходимо обеспечить контроль концентрации антибактериальных препаратов и химиопрепаратов: ванкомицин (10-20 мкг/л), амикацин (15-25 мкг/мл), (метотрексат (см.Таблицу 7), аспарагиназа (0,1 МЕ/мл). При превышении уровня рекомендуется отмена препарата! |
Сроки проведения оценки МОБ/МИБ во время терапии
МОБ количественно оценивается в определенные моменты времени во время лечения всех пациентов. Эти измерения имеют первостепенное значение для показания или предотвращения ТГСК, а также для определения вариантов терапии спасения.
|
Критерии оценки
|
Лабораторные признаки МИБ (МОБ)
|
|
Молекулярная ремиссия
|
Значение МИБ <10-4: это наименьший уровень, поддающийся количественной оценке при определении МИБ (МОБ) методом ОТ-ПЦР
|
|
Повторное появление МИБ
|
Реконверсия от отрицательного результата МИБ до появления положительного МИБ 10-4 (по крайней мере, один образец, собранный во время пост-консолидации) называется молекулярным повторным появлением. Повторное подтверждение настоятельно рекомендуется. Этот результат не соответствует условиям определения последующего рецидива
|
ЦИТОРЕДУКТИВНАЯ ПРЕДВАРИТЕЛЬНАЯ ФАЗА
Циторедуктивная предварительная фаза позволяет избежать в большинстве случаев синдром лизиса опухоли. Время, необходимое для предфазовой терапии, позволяет получить результаты диагностических исследований, таких как цитогенетика, молекулярная генетика.
Целью циторедуктивной предварительной фазы является:
Целью циторедуктивной предварительной фазы является:
-
снижение начальной массы лейкозных/опухолевых клеток:
-
дексаметазон в дозе 6 мг/м2/сутки в течение 5-7 дней (в засивимости от ответа на терапию) с целью снижения начальной массы лейкозных клеток.
-
У детей с большой массой лейкозных клеток и/или выраженной органомегалии (лейкоциты < 100 000/мкл (< 100 × 109/л)) сначала следует назначать уменьшенную (1-1,5 мг/м2/сутки) дозу в течение первых двух дней.
-
профилактика синдрома острого лизиса опухоли:
-
аллопуринол с целью профилактики синдрома острого лизиса опухоли.
-
Схема профилактики синдрома острого лизиса опухоли
|
Название лекарственного препатарат
|
Дозировка
|
Примечание
|
|
10 мг/кг в сутки в 2-3 приема каждые 8 ч (max – 500 мг/сутки) в течение 3 – 8 дней
|
Длительность курса зависит от клинического состояния (стабильность гемодинамики, отсутствие респираторных и ренальных нарушений), нормальные показатели электролитов крови, Лейкоциты ≤ 10 000.
|
|
Чередование 5% раствор глюкозы + 4% NaHCO3 с 0,9% раствором NaCl +4% NaHCO3 в соотношении 1 : 1
|
|
|
объем = 3000 – 5000 мл/м2/сутки;
|
||
|
NB! Старт инфузионной терапии проводится без добавления препаратов калия! Развитие гиперкалиемии при наличии адекватного диуреза невозможно! |
||
|
Контроль инфузионной терапии:
Количество выделенной мочи = количеству введенной жидкости - потери жидкости с дыханием
|
||
|
Расчет потери жидкости с дыханием = при гипертермии - 3 мл/кг/сут (10% физиологической потребности) на каждый градус выше 37,5О C. при одышке 10 мл/кг/сут на каждые 10 дыханий в минуту при частоте дыхания выше 25
|
||
Эффективность проводимой циторедуктивной предварительной фазы лечения обеспечивается путем мониторинга биохимических показателей крови и мочи и мониторинга гемодинамики.
При появлении осложнений проводится коррекционная терапия.
При появлении признаков острой почечной недостаточности и ее нарастании проводится терапия методом экстракорпоральной гемодиафильтрации (аппаратный гемодиализ). Описание других видов осложнений – в Приложении 2.
Коррекционная терапия
|
Осложнения
|
Мероприятия по
корректировке состояний |
Примечание
|
|
Гипопротеинемия
|
Альбумин 10 мл/кг в сутки
|
До нормализации показателя
|
|
Гиперурикемия (выше 320
мкмоль/л) |
Увеличить объем инфузии до 5 л/м2/сутки;
|
До нормализации показателя
|
|
Гиперкалиемия (K+ > 6 ммоль/л)
NB! При К+ более 6 ммоль/л показан гемодиализ! |
Подготовка пациента к гемодиализу: декстроза 1 г/кг + инсулин 0,3 Eд/кг, инфузией свыше 30 минут; |
Данное мероприятие приводит только к перераспределению K+ внутрь клетки, а через 2-4 часа уровень K+ возвращается к исходному.
Однако, это дает выигрыш во времени для подготовки к гемодиализу! |
|
Гиперфосфатемия (P++ > 1,5 mmol/l или 3 мг/100 мл)
|
|
До нормализации показателя
|
|
Гипокальциемия
|
|
Коррекция проводится только при появлении клинических
симптомов гипокальциемии (тетания, аритмия, судороги) и до их купирования! |
|
Гипомагнезиемия (менее 0,2 мэкв/кг)
|
25% раствор магнезии из расчета: 0,2 мл/кг
|
До нормализации показателя
|
|
Недостаточное мочевыведение (олигоурия, анурия))
|
Фуросемид 1-10 мг/кг в сутки внутривенно или инфузией
|
До появления положительного баланса жидкости
|
|
Защелачивание мочи (увеличение рН мочи более 7,0)
|
4% NaHCO3:
NaHCO3– 60 мл
NaHCO3– 100-120 мл;
|
До нормализации показателя
|
|
Стабилизировать рH мочи на уровне:
|
Однако, постоянно держать pH мочи на уровне 7,5 нельзя в связи с опасностью кристаллизации гипоксантина!
|
|
|
Нарушение гемодинамики: снижение АД
|
Допамин 3-5 мкг/кг/мин
|
До нормализации
АД |
|
Изменения ЭКГ при гиперкалиемии: удлинение интервала РQ, уменьшение вольтажа зубца Р, увеличение вольтажа зубца R, расширение комплекса QRS, высокий симметричный «пикообразный» зубец Т
|
|
До исчезновения признаков гиперкалиемии на ЭКГ
|
Критерии эффективности циторедуктивной предварительной фазы лечения:
-
клинические состояния (стабильность гемодинамики, отсутствие респираторных и ренальных нарушений);
-
нормальные показатели электролитов крови;
-
лейкоциты ≤ 10*109/л.
|
NB!
Если циторедуктивный эффект в течение 5 дней не наблюдается или болезнь прогрессирует, эта фаза может быть сокращена! |
По окончании циторедуктивной предварительной фазы необходимо определить стратегическую группу риска согласно разделу «Стратегические группы риска в зависимости от времени и места возникновения рецидива ОЛЛ».
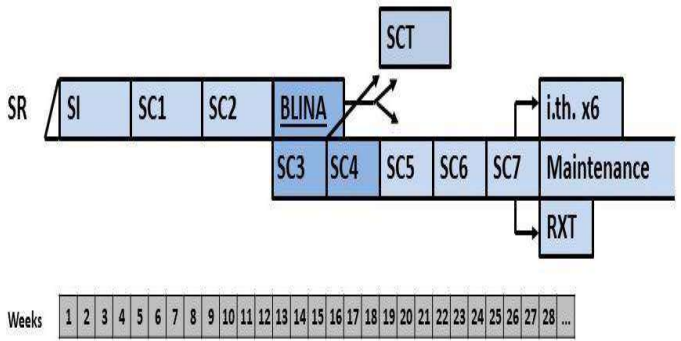
БЛОКИ ХИМИОТЕРАПИИ
|
NB!
Блоки химиотерапии проводятся на фоне сопутствующей гидратации из расчета 3000 мл/м2 /24 часа! |
Химиотерапевтические блоки включаются в каждый из этапов лечения (индукция, консолидация, поддерживающая терапия) в зависимости от стратегической группы риска.
Стратегическая группа риска не Т- клеточный вариант терапии ОЛЛР[1]
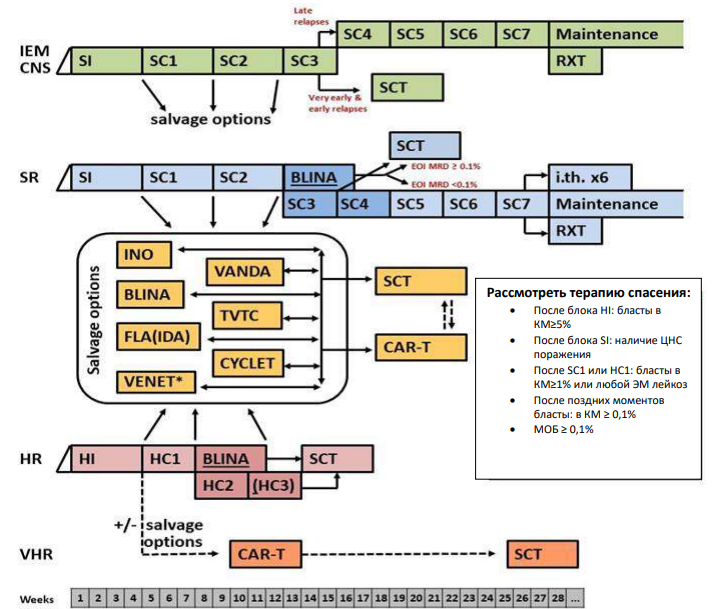
Примечание:
EOI MRD - МОБ в конце индукции. Salvage options – Терапия спасения. Late relapses – поздний рецидив.
Very early and early relapses – очень ранний и ранний рецидив.
Maintenance – поддерживающая терапия
i.tx. – интратекальная терапия
VANDA – название режима химиотерапии (Этопозид, Цитарабин, Митоксантрон, дексаметазон и аспарагиназа).
TVTC - название режима химиотерапии (Клофорабин, Топотекан, Тиотепа, Винорелбин).
CYCLET – название режима химиотерапии (Циклофосфамид, Клофарабин, Этопозид). Weeks – недели.
* Venetoclax (Венетоклакс) всегда назначают в сочетании с химиотерапией (множество вариантов).
Very early and early relapses – очень ранний и ранний рецидив.
Maintenance – поддерживающая терапия
i.tx. – интратекальная терапия
VANDA – название режима химиотерапии (Этопозид, Цитарабин, Митоксантрон, дексаметазон и аспарагиназа).
TVTC - название режима химиотерапии (Клофорабин, Топотекан, Тиотепа, Винорелбин).
CYCLET – название режима химиотерапии (Циклофосфамид, Клофарабин, Этопозид). Weeks – недели.
* Venetoclax (Венетоклакс) всегда назначают в сочетании с химиотерапией (множество вариантов).
Пациенты, распределенные в ветвь SR получают индукционную, консолидирующую и поддерживающую терапию.
Решение выбора тактики лечения принимается на консилиуме в составе онкологов-гематологов.
§1 Медикаментозное лечение пациентов группы SR не Т-клеточный вариант[1]
Примечание:
Maintenance – поддерживающая терапия
i.tx. – интратекальная терапия
i.tx. – интратекальная терапия
Химиотерапевтические блоки пациентов группы SR ветви
Этап индукции пациентов группы SR ветви
Этап индукции пациентов группы SR ветви
Индукцию SR в ветви следует проводить вовремя и независимо от показателей периферической крови. Раннее достижение ремиссии имеет приоритет и часто является важной предпосылкой для долгосрочного контроля инфекций. Количество тромбоцитов поддерживается на уровне от 15 до 20000 × 109/л при переливании тромбоцитов до достижения ремиссии.
Критерии для начала курса:
-
для начала 1-й и 3-й недель не требуется специфических показаний;
-
в случае почечной недостаточности (повышенный креатинин) следует избегать приема МТХ в дозе 1 г/м2, а индукцию следует начинать с 3-й недели.
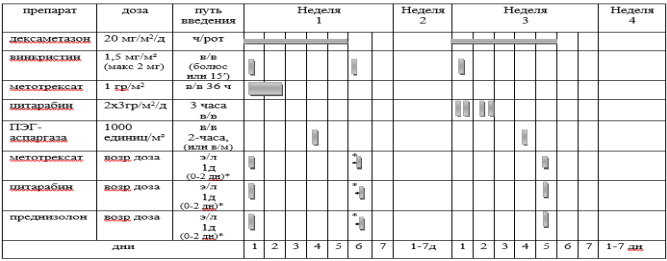
Курс SI (SR ветвь, индукция, неделя 1-4) [1]
|
Блоки химиотерапии проводятся на фоне сопутствующей гидратации из расчета 3000 мл/м2 /24 часа за 1 сутки до старта химиотерапии: NaCl 0,9% 3000 мл/ m 2 + 5% глюкоза3000 мл/ m 2 + KCl 30 ммоль/л (глюкоза + 0,9% NaCl) + NaHCO3 (гидрокарбонат натрия) 40 ммоль/л (глюкоза + 0,9% NaCl)
|
Интратекальная химиотерапия
Первая люмбальная пункция перед началом циторедуктивной фазы проводится под общим наркозом с целью снижения риска травматичности и механического заноса бластных клеток периферической крови в ЦНС.
|
NB!
Использовать готовые фармакологические формы метотрексата и цитарабина, предназначенные специально для люмбальной пункции! Использование препаратов из флаконов, предназначенных для проведения высокодозной химиотерапии, не рекомендуется из-за большого количества наполнителя (стабилизатора) и связанного с этим повышенного риска развития химического арахноидита. |
Адаптированные к возрасту дозы МТХ, ARA-C и Pred вводят в день 1 недели 1 и день 5 недели 3, непосредственно до или в течение 1 часа после начала инфузии МТХ.
Пациенты с поражением ЦНС получают дополнительную интратекальную инъекцию на 6-й день недели 1 и еженедельные дозы до тех пор, пока не будут получены два прозрачных образца спинномозговой жидкости.
Дозы интратекальной химиотерапии тремя препаратами:
Пациенты с поражением ЦНС получают дополнительную интратекальную инъекцию на 6-й день недели 1 и еженедельные дозы до тех пор, пока не будут получены два прозрачных образца спинномозговой жидкости.
Дозы интратекальной химиотерапии тремя препаратами:
|
Возраст (г.)
|
Метотрексат (мг)
|
Цитозар (мг)
|
Преднизолон (мг)
|
0,9% NaCl
(мл) |
|
< 1
|
6
|
16
|
4
|
1,5
|
|
1
|
8
|
20
|
6
|
2,0
|
|
2
|
10
|
26
|
8
|
2,5
|
|
>3
|
12
|
30
|
10
|
3,0
|
Техника проведения процедуры:
Первым вводить метотрексат, затем цитозар и преднизолон, каждый раз использовать шприцы на 5 мл. После введения иглы для спиномозговой пункции, сначала осторожно наполнить шприц спиномозговой жидкостью, насколько это возможно. После этого ввести содержимое шприца, непрерывно перемешивая (ввести 3 мл, аспирировать 2,5 мл, опять ввести 3 мл и т.д.). После этого без дальнейшей аспирации ликвора ввести 0,9% NaCl и достаньте иглу.
Все пациенты должны лежать в положении Тренделенбурга в течение 2 часов после люмбальной пункции.
Все пациенты должны лежать в положении Тренделенбурга в течение 2 часов после люмбальной пункции.
Проведение химиотерапии
|
Наименование ЛС
|
Применение ЛС
|
|
DEXA
|
Доза: 20 мг/м2 (макс. 40 мг/день)
Способ введения: перорально, разделенные на две суточные дозы Дни недели:
|
|
Винкристин
|
Доза: 1,5 мг/м2 (максимальная разовая доза 2 мг)
Способ введения: в виде 15-минутной короткой инфузии Дни недели: 1 и 6 дни первой недели; 1 день третьей недели. |
|
МТХ
|
Доза: 1 г/м2
Дни недели: первые два дня первой недели. Способ введения:
Управление токсичностью МТХ:
В обязательном порядке проводится параллельная инфузия к сопутствующей гидратации: начало вместе с МТХ (час 0), инфузия 48 часов: NaCl 0,9% 1500 мл/ m2 + 5% глюкоза 1500 мл/ m2 + 7,5% KCl 30 ммоль/л (5% глюкоза + 0,9% NaCl) + 4% NaHCO3 - 40 ммоль/л (5%глюкоза + 0,9%NaCl) Введение профилактической дозы кальция/натрия фолината: 15 мг/м2 на 48-ой и 54-ый час после начала приема МТХ. Контроль токсичности МТХ:
При pH < 6,0: NaHCO3 (гидрокарбонат натрия) 1 ммоль/кг в виде короткой инфузии до нормализации рН.
При задержке диуреза более 500 мл/m2:фуросемид 1 мг/кг, максимально 20 мг в/в до достижения положительного баланса жидкости.
Уровни МТХ в сыворотке измеряются через 36 и 48 часов после начала инфузии МТХ (Таблица 3 Контроль уровня токсичности метотрексата). При повышении уровня МТХ выше допустимых значений – проведение антидотной терапии (см. ниже Антидотная терапия МТХ).
Если:
<150 ммоль/л и/или отмечается значительное увеличение уровня креатинина:
инфузия 4500 мл/м2/сутки; гидробаланс, кислотно-щелочной баланс; определить уровень МТХ на 36 й час;
гидробаланс, кислотно-щелочной баланс.
|
|
ПЭГ-
аспарагиназа |
Доза: 1000 единиц/м2
Способ введения: в виде 2-часовой инфузии или внутримышечно; Дни недели:
NB!
В случае аллергической реакции на ПЭГ-аспарагиназу, последующее введение препарата отменяется.
Контроль лечения: количественное определение активности ПЭГ-аспарагиназы в сыворотке через 7 и 14 дней после каждого введения ПЭГ-аспарагиназы (норма активности – 0,1 МЕ/мл)
|
|
ARA-C
|
Доза: 3 г/м2
Способ введения:
Дни недели: в 1 – 2 дни третьей недели (всего 4 дозы).
Управление токсичностью препарата ARA-C:
|
Таблица 3
Форма «Контроль уровня токсичности метотрексата»
|
Часы
|
24
|
36
|
42
|
48
|
56
|
60
|
66
|
72
|
|
Ожидаемый
уровень МТХ |
<150
|
<3
|
<1
|
<0,4
|
<0,25
|
|
|
|
Антидотная терапия МТХ
Антидотная терапия МТХ проводится кальций/натрий фолинатом.
Если уровень метотрексата на 48-ой час выше, чем 0,5 ммоль/л, ожидается повышение токсичности препарата. Если уровень метотрексата на 48-ой час выше, чем 1,0 ммоль/л, рекомендуется увеличение дозы и количества введений кальций/натрий фолината в соответствии с Таблицей 4. Если уровень метотрексата на 48-ой час выше, чем 2 ммоль/л, дополнительно рекомендуется продолжить форсированный диурез с ощелачиванием. Измерение уровня метотрексата и соответствующее назначение кальций/натрий фолината продолжают с 6-ти часовыми интервалами, пока уровень метотрексата не опустится ниже 0,25 ммоль/л.
Таблица 4
Коррекция дозы кальция/натрия фолината в случае высокого уровня метотрексата на и после 42-го часа от начала инфузии метотрексата
Если уровень метотрексата на 48-ой час выше, чем 0,5 ммоль/л, ожидается повышение токсичности препарата. Если уровень метотрексата на 48-ой час выше, чем 1,0 ммоль/л, рекомендуется увеличение дозы и количества введений кальций/натрий фолината в соответствии с Таблицей 4. Если уровень метотрексата на 48-ой час выше, чем 2 ммоль/л, дополнительно рекомендуется продолжить форсированный диурез с ощелачиванием. Измерение уровня метотрексата и соответствующее назначение кальций/натрий фолината продолжают с 6-ти часовыми интервалами, пока уровень метотрексата не опустится ниже 0,25 ммоль/л.
Таблица 4
Коррекция дозы кальция/натрия фолината в случае высокого уровня метотрексата на и после 42-го часа от начала инфузии метотрексата
|
Уровень МТХ
|
Доза кальция/натрия фолината (коррекция проводится каждые 6 ч в зависимости от уровня МТХ)
|
|
0,25-1 ммоль/л
|
15 мг/m2
|
|
> 1,0-2,0 ммоль/л
|
40 мг/m2
|
|
> 2,0-3,0 ммоль/л
|
45 мг/m2
|
|
> 3,0-4,0 ммоль/л
|
60 мг/m2
|
|
> 4,0-5,0 ммоль/л
|
75 мг/m2
|
|
> 5,0 ммоль/л
|
кальций/натрий фолинат в/в каждые 6 часов мг = уровень МТХ (ммоль/л) * m (кг)
|
Оценка ответа на индукционную терапию
После проведения индукционной терапии оценивается ответ, основанный на цитологических критериях костного мозга и спинномозговой жидкости.
Критерии оценки ответа на индукционную терапию
|
Критерии оценки
|
Лабораторные признаки/ответ/Определение
|
|
|
Полная ремиссия
|
ПР/CR
|
|
|
Апластический КМ
|
M-0
|
Типичный аспират КМ с небольшим количеством ядерных клеток (в основном лимфоцитов, клеточность напоминает нормальный анализ крови при цитологическом анализе) без признаков регенерирующего нормального кроветворения и с остаточными лейкозными клетками <5%
|
|
ПР/CR КМ
|
M-1
|
Типичный образец аспирата КМ с менее чем 5% лимфобластов, удовлетворительной клеточностью и признаками регенерирующего нормального кроветворения
|
|
Частичный ответ/поражение КМ
|
M-2
|
КМ с ≥ 5% и <25% лимфобластных клеток независимо от клеточного содержания
|
|
Метапластический КМ
|
M-3
|
КМ с ≥ 25% лимфобластных клеток независимо от клеточного содержания
|
|
Нерепрезентативный КМ
|
|
Заметно сниженная клеточность, несмотря на признаки регенерации в периферической крови и дифференциальный подсчет ядерных клеток в КМ, в значительной степени соответствующий таковому в периферической крови.
Такой аспират КМ следует повторить, особенно когда терапевтические решения принимаются на основе результата |
Пациенты с M-3 классифицируются как рано не ответившие на лечение и оцениваются, как химиорезистентные и рекомендуется продолжить лечение по другому блоку химиотерапии – Альтернативное лечение (Приложение 1) или Лечение резистентых форм ОЛЛР.
Пациенты с M-1 или М-2 продолжают терапию и распределяются на соответствующую консолидирующую терапию с эпратузумабом или без него.
Критерии включения: наличие бластных клеток в КМ от 5 до 25% после блока индукции. Значение МИБ <10-4 при определении методом ОТ-ПЦР.
Пациентам с M-0 (апластический КМ с <5% лейкемических клеток) проводят контрольную пункцию костного мозга через 1 неделю. По результатам исследования КМ дальнейшее лечение назначается в соответствии со статусом M-1, М-2 или М-3.
Для детей с поражением костного мозга необходимо немедленно начать поиск HLA идентичного донора стволовых клеток. Пациентам, соответствующим критериям аллогенной трансплантации гемопоэтических стволовых клеток (см. КП ТГСК[31]) с совместимым донором, останавливают лечение и проводят ТГСК на 17 неделе после блока SС-3. Остальные пациенты должны продолжить соответствующую консолидирующую и поддерживающую терапию ветви A или B.
Пациентам с M-0 (апластический КМ с <5% лейкемических клеток) проводят контрольную пункцию костного мозга через 1 неделю. По результатам исследования КМ дальнейшее лечение назначается в соответствии со статусом M-1, М-2 или М-3.
Для детей с поражением костного мозга необходимо немедленно начать поиск HLA идентичного донора стволовых клеток. Пациентам, соответствующим критериям аллогенной трансплантации гемопоэтических стволовых клеток (см. КП ТГСК[31]) с совместимым донором, останавливают лечение и проводят ТГСК на 17 неделе после блока SС-3. Остальные пациенты должны продолжить соответствующую консолидирующую и поддерживающую терапию ветви A или B.
Показания к ТГСК:
-
любой ранний комбинированный рецидив;
-
изолированный экстрамедуллярный рецидив или пациенты без результата МИБ (МОБ);
-
все рецидивы Т-клеточного иммунофенотипа, независимо от локализации и времени рецидива;
-
резистентность к терапии в группе стандартного риска или при ИЭМ-ЦНС поражении;
-
стандартные показания к аллогенной ТГСК при рецидивах не Т-клеток:
Показания к аллогенной ТГСК при рецидивах с не Т-клеточным рецидивом
|
ТГСК донор
|
SR
|
HR/VHR
|
IEM-CNS
|
|||
|
MRD
хороший ответ |
MRD
плохой ответ |
MRD
нет ответа |
Все
|
Поздний*
|
Ранний и очень ранний
|
|
|
MD
|
Нет
|
Да
|
Да
|
Да
|
Нет
|
Да
|
|
MMD
|
Нет
|
Да
|
Да
|
Да
|
Нет
|
Да
|
Определение показаний и противопоказаний к ТГСК конкретному больному с установлением сроков принимается только консилиумом врачей, исходя из характера основного заболевания, степени функциональной недостаточности пораженных органов и тканей, наличия осложнений, сопутствующих заболеваний.
Этап постиндукции (ранняя консолидация)
Постиндукция состоит из курсов SС1 и SС2.
Пациенты отбираются для получения или не получения эпратузумаба в дополнение к SC1: при наличии эпратузумаба и оценке токсичности на проведенную прошедшую терапию.
SC1 начинается, когда суточное количество нейтрофилов достигает или превышает 0,5 × 109/л, если продолжение терапии не приведет к опасной для жизни ситуации. Дополнительным фактором в этом решении является результат аспирации костного мозга на 14-й день. При обнаружении стойкой лейкемической метаплазии лечение продолжают без промедления. При необходимости проводятся трансфузионная поддержка (Приложение 3). DEXA назначается непрерывно. Еженедельное введение винкристина/IDA должно выполняться вовремя с числом нейтрофилов не менее 0,5 × 109/л.
SC1 начинается, когда суточное количество нейтрофилов достигает или превышает 0,5 × 109/л, если продолжение терапии не приведет к опасной для жизни ситуации. Дополнительным фактором в этом решении является результат аспирации костного мозга на 14-й день. При обнаружении стойкой лейкемической метаплазии лечение продолжают без промедления. При необходимости проводятся трансфузионная поддержка (Приложение 3). DEXA назначается непрерывно. Еженедельное введение винкристина/IDA должно выполняться вовремя с числом нейтрофилов не менее 0,5 × 109/л.
Курс SC1 (SR, консолидация 1, неделя 5-8) [1]
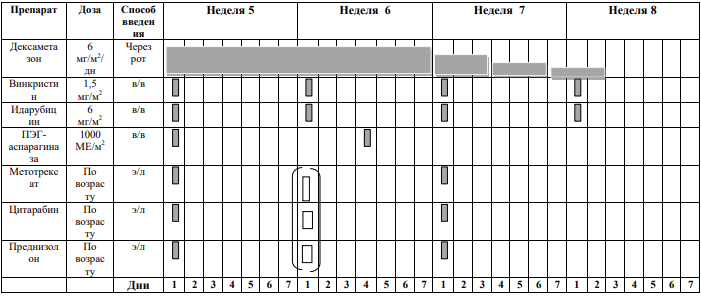
Интратекальная химиотерапия
Адаптированные к возрасту дозы МТХ, ARA-C и Pred вводят в день 1 недели 1 и день 5 недели 3, непосредственно до или в течение 1 часа после начала инфузии МТХ.
Пациенты с поражением ЦНС получают дополнительную интратекальную инъекцию на 6-й день недели 1 и еженедельные дозы до тех пор, пока не будут получены два прозрачных образца спинномозговой жидкости.
Дозы интратекальной химиотерапии тремя препаратами
|
Возраст
(г.) |
Метотрексат
(мг) |
Цитозар
(мг) |
Преднизолон
(мг) |
0,9% NaCl
(мл) |
|
< 1
|
6
|
16
|
4
|
1,5
|
|
1
|
8
|
20
|
6
|
2,0
|
|
2
|
10
|
26
|
8
|
2,5
|
|
>3
|
12
|
30
|
10
|
3,0
|
Техника проведения процедуры – аналогично процедуре в Курсе SIA.
Проведение химиотерапии
|
Наименование ЛС
|
Применение ЛС
|
|
DEXA
|
Начальная доза: 6 мг/м2 в день
Способ введения: перорально, разделенные на две дневные дозы Дни недели: 6 мг/м2 в день 14 дней непрерывно на 5-ой и 6-ой неделе, далее – постепенное снижение дозы до 3 мг/м2 в день в течение 3-х дней, следующие 3 дня – до 1,5 мг/м2 в день, последующие 3 дня – до 0,75мг/м2 в день |
|
Винкристин
|
Суточная доза: 1,5 мг/м2 (максимальная разовая доза 2 мг) Способ введения: в виде 15-минутной короткой инфузии Дни недели: в 1-й день недели на 5, 6, 7, 8 неделе лечения.
|
|
Идарубицин
|
Суточная доза: 6 мг/м2
Способ введения: в виде инфузии в течение 2 часов Дни недели: в 1-й день недели на 5, 6, 7, 8 неделе лечения. |
|
ПЭГ-
аспарагиназа |
Суточная доза: 1000 единиц/м2
Способ введения: в виде 2-часовой инфузии или внутримышечно; Дни недели: 1-й день на 5-ой неделе и 4-й день на 6 неделе. NB! В случае аллергической реакции на ПЭГ-аспарагиназу последующее введение препарата отменяется. Контроль лечения: количественное определение активности ПЭГ-аспарагиназы в сыворотке через 7 и 14 дней после каждого введения ПЭГ-аспарагиназы. (активность должна быть не менее 0,1 МЕ/мл) |
Курс SC2
Критерии для начала курса
Для начала 9 недели необходимы лейкоциты > 1,5×109/л, нейтрофилы > 0,5×109/л, тромбоциты > 80×109/л и стабильный клинический статус, позволяющий продолжить лечение.
Курсы ARA-C на 3-й день 9-й и 10-й недель назначаются независимо от анализа крови, если клинический статус позволяет продолжить лечение.
Только в случае явных инфекций следует прерывать лечение (в том числе 6-меркаптопурин).
Критерии для начала курса
Для начала 9 недели необходимы лейкоциты > 1,5×109/л, нейтрофилы > 0,5×109/л, тромбоциты > 80×109/л и стабильный клинический статус, позволяющий продолжить лечение.
Курсы ARA-C на 3-й день 9-й и 10-й недель назначаются независимо от анализа крови, если клинический статус позволяет продолжить лечение.
Только в случае явных инфекций следует прерывать лечение (в том числе 6-меркаптопурин).
Курс SC2 (SR, консолидация 2, неделя 9-12) [1]
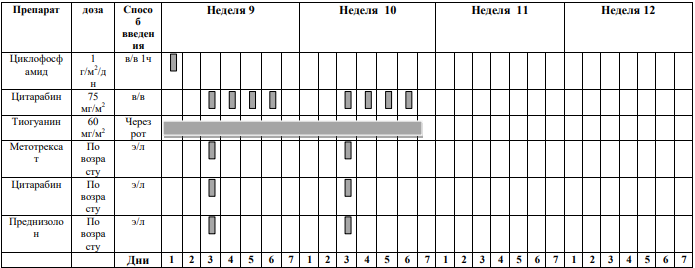
Диагностические показания:
Исследование КМ на 1-й день 9-й недели является обязательным для оценки цитологической ремиссии и МИБ (МОБ). Результаты не имеют отношения к стратификации лечения.
|
Блоки химиотерапии проводятся на фоне сопутствующей гидратации из расчета 3000 мл/м2 /24 часа за 1 сутки до старта химиотерапии:
NaCl 0,9% 3000 мл/ m 2 + 5% глюкоза3000 мл/ m 2 + 7,5% KCl 30 ммоль/л (5%глюкоза + 0,9%NaCl) + 4% NaHCO3 (гидрокарбонат натрия) 40 ммоль/л (5%глюкоза + 0,9%NaCl) |
Интратекальная химиотерапия
Адаптированные к возрасту дозы МТХ, ARA-C и Pred вводят на 3-й день 9-ой и 10-ой недели.
Дозы интратекальной химиотерапии тремя препаратами
Дозы интратекальной химиотерапии тремя препаратами
|
Возраст
(г.) |
Метотрексат
(мг) |
Цитозар
(мг) |
Преднизолон
(мг) |
0,9% NaCl
(ml) |
|
< 1
|
6
|
16
|
4
|
1,5
|
|
1
|
8
|
20
|
6
|
2,0
|
|
2
|
10
|
26
|
8
|
2,5
|
|
>3
|
12
|
30
|
10
|
3,0
|
Проведение химиотерапии
|
Наименование ЛС
|
Применение ЛС
|
|
Циклофосфамид
|
Доза: 1 г/м2.
Способ введения: в виде 1-часовой инфузии Дни недели: в 1-ый день 9-ой недели Антидот Месна вводится в дозе 400мг/м2 внутривенно до, а также через 4 и 8 часов после циклофосфамида. |
|
ARA-C
|
Доза: 75 мг/м2
Способ введения: в виде болюса внутривенно Дни недели: на 3-6 день 9 и 10 недель. |
|
6-меркаптопурин
|
Доза: 60 мг/м2
Способ введения: перорально Дни недели: в день 1-7 9-й и 10-й недель Дозы следует принимать не менее чем через час после ужина без молочных продуктов. |
Через 14 дней после последнего дня SC2 блока в ветви SR следует выбрать 3-й цикл консолидации или блок Блинатумомаб на 13-й неделе терапии.
Блок Блинатумомаб[1,38-40,61-63]
Блок Блинатумомаб предпочтительно назначать вместо циклов SC3 и SC4 для быстрого достижения эффекта ремиссии и снижения токсичности.
|
NB!
Перед курсом блинатумомаба обязательно проведение исследования КМ и оценка МОБ/МИБ! |
Критерии для начала и проведения курса:
-
срок: начало 12-й недели;
-
восстановление показателей крови (нейтрофилы ≥ 0,5 x 109/л, тромбоциты ≥ 50 x 109/л);
-
отсутствие дисфункции печени.
1-й курс блинатумомаба для пациентов весом до 45 кг[1]:
Один курс блинатумомаба состоит из 28 дней непрерывной внутривенной инфузии с последующим перерывом на 7 – 14 дней без лечения (всего 35 – 42 дня).
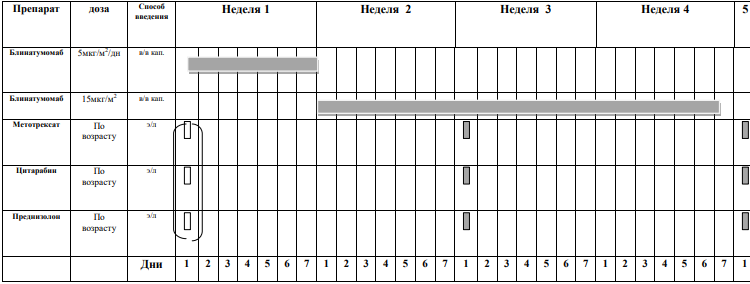
Интратекальная химиотерапия
С целью профилактики рецидива ОЛЛ в центральной нервной системе дозы метотрексата, цитарабина и преднизолона, адаптированные к возрасту, вводят на 15 и 28 дни инфузии блинатумомаба.
Сопроводительная терапия (управление токсичностью препарата)
-
дексаметазон 5 мг/м2 (но не более 20 мг) в/в за 30–60 минут до начала инфузии блинатумомаба(в 1 день первого цикла терапии);
-
парацетамол 10 мг/кг/день рекомендуется в течение первых 48 часов каждого цикла терапии перорально или внутривенно для снижения интоксикации.
Курс SC3, SC5 и SC7 (SR, консолидация 13-15, 19-21, 25-27 недели)
Пациентам с МИБ (МОБ) ≥ 10-3 (более 1 бластной клетки из 1000 мононуклеарных клеток) на 15-й неделе и пациентам с ранним изолированным экстрамедуллярным рецидивом необходимо проведение ТГСК после курса SC3 на 17 неделе.
Другие пациенты продолжают лечение до курса SC7 включительно. После чего на консилиуме решается вопрос о проведении облучения ЦНС (см. раздел Лучевая терапия).
Последующие блоки SC3, SC5 и SC7 проводятся через 21-дневный интервал, рассчитываемый с первого дня предыдущего блока. Блок SC3 начинается через 14 дней после последнего дня SC2. Более короткие интервалы возможны, но не обязательны.
Последующие блоки SC3, SC5 и SC7 проводятся через 21-дневный интервал, рассчитываемый с первого дня предыдущего блока. Блок SC3 начинается через 14 дней после последнего дня SC2. Более короткие интервалы возможны, но не обязательны.
Критерии для начала лечебных блоков SC3, SC5 и SC7:
Уровень лейкоцитов> 2,0 × 109/л, нейтрофилы > 0,5 × 109/л, тромбоциты > 80 × 109/л
В случае длительной (больше 21 дня) отсрочки лечения следует рассмотреть возможность снижения дозы в соответствии с конкретными рекомендациями, изложенными ниже. Необходимость переноса начала лечения следует рассматривать не реже чем через день.
В случае длительной (больше 21 дня) отсрочки лечения следует рассмотреть возможность снижения дозы в соответствии с конкретными рекомендациями, изложенными ниже. Необходимость переноса начала лечения следует рассматривать не реже чем через день.
Блоки SC3, SC5 и SC7[1]
Критерии для начала терапии
Для начала блока (13, 19 или 25 неделя) необходимы лейкоциты> 2,0 x 109/л, нейтрофилы > 0,5x109/л, тромбоциты> 80x109/л и клинический статус, позволяющий продолжить лечение. В случае длительной отсрочки лечения следует рассмотреть возможность снижения дозы в соответствии с конкретными рекомендациями. После курса SC3 на 17 неделе, при наличии показаний, назначается аллогенная ТГСК.
Курс SC3, SC5 и SC7 (SR, консолидация 13-15, 19-21, 25-27 недели) [1]
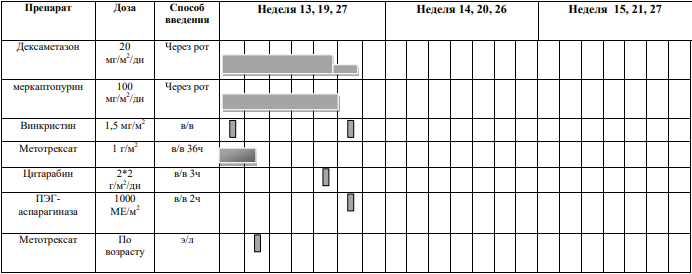
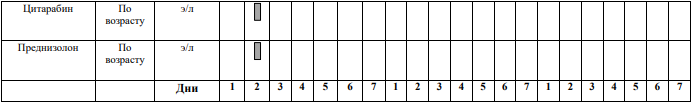
Диагностические показания
Аспират КМ на 1-й день 13-й недели является обязательным для оценки цитологической ремиссии и МИБ (МОБ). Если аллогенная ТГСК запланирована на 17-ю неделю (или 19-ю, если вводился блинатумомаб), исследование КМ проводится в контексте подготовки к ТГСК и может быть соответственно отложено. Перед курсами SC5 и SC7 (недели 19 и 27) Исследование костного мозга не предусматривается.
Аспират КМ на 1-й день 13-й недели является обязательным для оценки цитологической ремиссии и МИБ (МОБ). Если аллогенная ТГСК запланирована на 17-ю неделю (или 19-ю, если вводился блинатумомаб), исследование КМ проводится в контексте подготовки к ТГСК и может быть соответственно отложено. Перед курсами SC5 и SC7 (недели 19 и 27) Исследование костного мозга не предусматривается.
|
Блоки химиотерапии проводятся на фоне сопутствующей гидратации из расчета 3000 мл/м2 /24 часа за 1 сутки до старта химиотерапии: NaCl 0,9% 3000 мл/ m 2 + 5% глюкоза3000 мл/ m 2 + 7,5% KCl 30 ммоль/л (5%глюкоза + 0,9%NaCl) + 4% NaHCO3 (гидрокарбонат натрия) 40 ммоль/л (5%глюкоза + 0,9%NaCl)
|
Интратекальная химиотерапия
Адаптированные к возрасту дозы МТХ, ARA-C и Pred вводят на 2-й день каждого курса SCA3, 5 или 7, на 13, 19 и 27 неделе, после МТХ.
Дозы интратекальной химиотерапии тремя препаратами
Дозы интратекальной химиотерапии тремя препаратами
|
Возраст (г.)
|
Метотрексат (мг)
|
Цитозар (мг)
|
Преднизолон (мг)
|
0,9% NaCl
(ml) |
|
< 1
|
6
|
16
|
4
|
1,5
|
|
1
|
8
|
20
|
6
|
2,0
|
|
2
|
10
|
26
|
8
|
2,5
|
|
>3
|
12
|
30
|
10
|
3,0
|
Проведение химиотерапии
|
Наименование ЛС
|
Применение ЛС
|
|
DEXA
|
Доза: 20 мг/м2 (макс. не более 40 мг/день) и 10 мг/м2
Способ введения: перорально, разделенные на две суточные дозы Дни недели:
и 25 неделе;
25 неделе.
|
|
6 -
меркаптопурин |
Доза: 100 мг/м2
Способ введения: перорально Дни недели: в течение первых 5 дней каждого курса SC3, 5 или 7, недели 13, 19 и 25. Дозы следует принимать не менее чем через час после ужина без молочных продуктов. |
|
Винкристин
|
Доза: 1,5 мг/м2 (максимальная разовая доза 2 мг)
Способ введения: в виде 15-минутной короткой инфузии (или в виде болюса в/в) Дни недели: в 1-й и 6-ой день каждого курса SC3, 5, 7, недели 13, 19 и 25. |
|
МТХ
|
Доза: 1 г/м2
Дни недели: начиная с 1-го дня каждого курса SC3, 5 или 7, недели 13, 19 и 27. Способ введения:
Уровни МТХ в сыворотке измеряются через 36 и 48 часов после начала инфузии МТХ. В случае повышения уровней выше верхних пределов (>10 мкмоль/л через 36 часов и / или > 0,5 мкмоль/л через 48 часов) уровни МТХ в сыворотке измеряются каждые 6 часов до достижения уровня ниже 0,25 мкмоль/л.
Кальция/натрия фолинат в дозе 15 мг/м2 проводится через 48 и 54 часа после начала приема МТХ. Доза адаптирована к повышенным уровням МТХ в сыворотке в соответствии с рекомендациями. |
|
ARA-C
|
Доза: 2 г/м2
Способ введения:
|
|
|
Дни недели: на 5-й день (всего 2 дозы) каждого курса SCA3, 5 или 7, 13, 19 и 25 недели.
Управление токсичностью препарата ARA-C:
|
|
ПЭГ-
аспарагиназа |
Доза: 1000 ЕД/м2
Способ введения: в виде 2-часовой инфузии; Дни недели: на 6 день каждого курса SC3, 5 или 7, недели 13, 19 и 25 NB! В случае аллергической реакции на ПЭГ-аспарагиназу последующее введение препарата отменяется. Контроль лечения: количественное определение активности ПЭГ-аспарагиназы в сыворотке через 7 и 14 дней после каждого введения ПЭГ-аспарагиназы (норма активности – 0,1 МЕ/мл) |
Курс SC4 и SC6[1]
Критерии для начала курса
Для начала курса (16 или 22 неделя) необходимы лейкоциты >2,0 x 109/л, нейтрофилы > 0,5 x 109/л, тромбоциты > 80 x 109/л и клинический статус, позволяющий продолжить лечение. В случае длительной отсрочки лечения следует рассмотреть возможность снижения дозы в соответствии с рекомендациями ниже.
Курс SC4 и SC6 (SR, консолидация 4 и 6 недели 16-18, 22-24) [1]
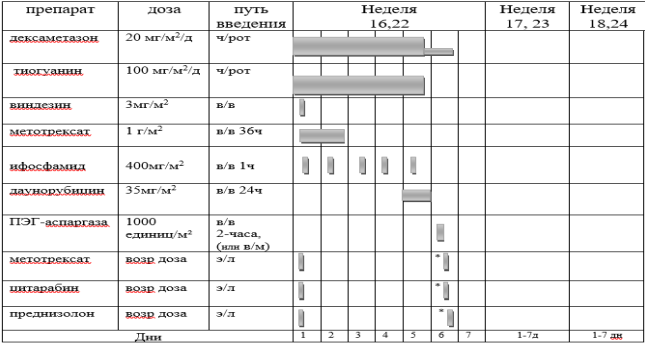
*Пациенты с поражением ЦНС получают дополнительную интратекальную инъекцию на 6-й день каждого курса SC4 или SC6, на 16-й и 22-й неделе.
Диагностические показания:
Исследование КМ на 1-й день 16-й недели является обязательным для оценки цитологической ремиссии и МИБ (МОБ), если аллогенная ТГСК не показана или ТГСК отложена. Перед курсами SC6 (22 неделя) исследование КМ не предусматривается.
|
Блоки химиотерапии проводятся на фоне сопутствующей гидратации из расчета 3000 мл/м2 /24 часа за 1 сутки до старта химиотерапии:
NaCl 0,9% 3000 мл/ m 2 + 5% глюкоза3000 мл/ m 2 + 7,5% KCl 30 ммоль/л (5%глюкоза + 0,9%NaCl) + 4% NaHCO3 (гидрокарбонат натрия) 40 ммоль/л (5%глюкоза + 0,9%NaCl) |
Интратекальная химиотерапия
Адаптированные к возрасту дозы МТХ, ARA-C и Pred вводят в 1 день каждого курса SC4, SC6, недели 16 и 22, непосредственно до или в течение 1 часа после начала инфузии МТХ.
Дозы интратекальной химиотерапии тремя препаратами
Дозы интратекальной химиотерапии тремя препаратами
|
Возраст
(г.) |
Метотрексат
(мг) |
Цитозар
(мг) |
Преднизолон
(мг) |
0,9% NaCl
(ml) |
|
< 1
|
6
|
16
|
4
|
1,5
|
|
1
|
8
|
20
|
6
|
2,0
|
|
2
|
10
|
26
|
8
|
2,5
|
|
>3
|
12
|
30
|
10
|
3,0
|
Проведение химиотерапии
|
Наименование ЛС
|
Применение ЛС
|
|
DEXA
|
Доза: 20 мг/м2 (макс. не более 40 мг/день) и 10 мг/м2 Способ введения: перорально, разделенные на две суточные дозы
Дни недели:
|
|
6 - меркаптопурин
|
Доза: 100 мг/м2
Способ введения: перорально Дни недели: в день 1-5 каждого SC4 или курс 6, недели 16 и 22. Дозы следует принимать не менее чем через час после ужина без молочных продуктов. |
|
Винбластин
|
Доза: 3 мг/м2
Способ введения: в виде 15-минутной короткой инфузии (или в виде болюса в/в) Дни недели: в 1 день каждого курса SC4 или 6, недели 16 и 22. Его можно заменить винкристином 1,5 мг/м2, если винбластин недоступен. |
|
МТХ
|
Доза: 1 г/м2
Дни недели: начиная с 1-го дня каждого курса SC4 или 6- го курса, на 16-й и 22-й неделе. Способ введения:
Уровни МТХ в сыворотке измеряются через 36 и 48 часов после начала инфузии МТХ. В случае повышения уровней выше верхних пределов (>10 мкмоль/л через 36 часов и / или > 0,5 мкмоль/л через 48 часов) уровни МТХ в сыворотке измеряются каждые 6 часов до достижения уровня ниже 0,25 мкмоль / л.
Кальция/натрия фолинат в дозе 15 мг/м2 проводится через 48 и 54 часа после начала приема МТХ. Доза адаптирована к повышенным уровням МТХ в сыворотке в соответствии с рекомендациями согласно Таблице 3
Контроль уровня токсичности МТХ. |
|
Ифосфамид
|
Доза: 400 мг/м2
Способ введения: в виде 1-часовой инфузии. Дни недели: с 1-го по 5-ый дни инфузии каждого SCA4 или курса 6, недели 16 и 22. Антидот уромитексан вводится в дозе 200 мг/м2 внутривенно до, а также через 4 и 8 часов после ифосфамида. |
|
Даунорубицин
|
Доза: 35 мг/м2
Способ введения: в виде 24-часовой инфузии Дни недели: на 5 день каждого SC4 или курс SC6 на 16 и 22 неделе. |
|
ПЭГ-аспарагиназа
|
Доза: 1000 ЕД/м2
Способ введения: в виде 2-часовой инфузии; Дни недели: на 6 день каждого SC4 или курс SC6, недели 16 и 22. Контроль лечения: количественное определение активности ПЭГ-аспарагиназы в сыворотке через 7 и 14 дней после каждого введения ПЭГ-аспарагиназы (норма активности – 0,1 МЕ/мл) NB! В случае аллергической реакции на ПЭГ-аспарагиназу, последующее введение препарата отменяется! |
Поддерживающая терапия ветви SR [1] для пациентов без поражения стадии ЦНС-3 (недели 28-131)
Общая структура
Поддерживающая терапия проводится с 28-й недели в общей сложности 104 недели (= 2 года). В начале поддерживающей терапии все пациенты без облучения ЦНС получают трехкратную интратекальную терапию один раз в 4 недели, всего 6 раз (амбулаторно по месту жительства или дневной стационар при стационаре республиканского уровня).
Перед началом поддерживающей терапии проводится исследование КМ на 1- ый день 28-ой недели. Необходимо убедиться в ремиссии основного заболевания.
Критерии для начала поддерживающей терапии:
Анализ крови:
Перед началом поддерживающей терапии проводится исследование КМ на 1- ый день 28-ой недели. Необходимо убедиться в ремиссии основного заболевания.
Критерии для начала поддерживающей терапии:
Анализ крови:
-
лейкоциты > 2,0 × 109/л;
-
нейтрофилы > 0,5 × 109/л;
-
тромбоциты > 80 × 109/л ;
-
клинический статус, позволяющий продолжить лечение (отсутствие инфекционных заболеваний).
Дозы интратекальной химиотерапии тремя препаратами.
|
Возраст (г.)
|
Метотрексат (мг)
|
Цитозар (мг)
|
Преднизолон (мг)
|
0,9% NaCl
(ml) |
|
< 1
|
6
|
16
|
4
|
1,5
|
|
1
|
8
|
20
|
6
|
2,0
|
|
2
|
10
|
26
|
8
|
2,5
|
|
>3
|
12
|
30
|
10
|
3,0
|
Препараты выбора поддерживающей терапии:
-
меркаптопурин в дозе 50 мг/м2 поверхности тела в день внутрь (прием препарата по крайней мере через час после ужина с исключением молочных продуктов);
-
метотрексат в дозе 20 мг/м2 поверхности тела внутрь 1 раз в неделю, однократно.
-
При подтверждении диагноза Ph+ ОЛЛ показано назначение препаратов ИТК.
Химиотерапия меркаптопурином и метотрексатом корригируется в зависимости от уровней лейкоцитов, лимфоцитов и общего билирубина и трансаминаз крови, возникновения лихорадочных эпизодов.
Схема поддерживающей терапии
|
Показатели крови
|
Доза препаратов химиотерапии (меркаптопурин,
метотрексат) |
|
|
Уровень лейкоцитов
|
< 1,0 x 109/л
|
отмена
|
|
1 до 2 x 109/л
|
50% дозы
|
|
|
2 до 3 x 109/л
|
100% доза
|
|
|
> 3,0 x 109/л
|
150% дозы
|
|
|
Уровень лимфоцитов
|
< 0,3 x 109/л
|
50% дозы
|
|
Уровень тромбоцитов
|
< 80 x 109/л
|
отмена
|
|
NB!
Передозировка меркаптопурина и метотрексата приводит к токсическому гепатиту! При 10-кратном повышении уровней трансаминаз крови и/или 3-кратном повышении уровня билирубина проводится:
NB! Обеспечить контроль уровней трансаминазы и билирубина крови каждые 3 месяца! |
|
NB!
Передозировка меркаптопурина и метотрексата приводит к угнетению кроветворения с последующим развитием инфекционных осложнений (метотрексатовый пульмонит)! |
Курс SM (группа поддерживающей терапии) [1]
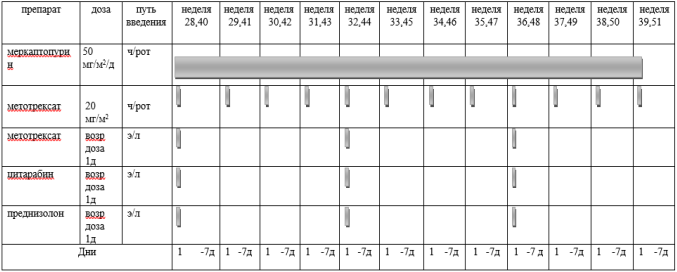
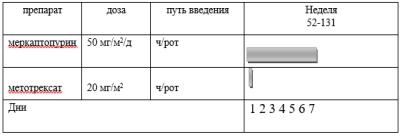
|
В конце поддерживающей терапии (после 131-й недели) курса SR может быть проведено исследование КМ, которое не является обязательной и может быть сделана по усмотрению онкогематолога для подтверждения цитологической ремиссии и оценки МИБ (МОБ).
|
Поддерживающая терапия ветви SR для пациентов с поражением стадии ЦНС-3 во время рецидива (недели 28-131) [1]
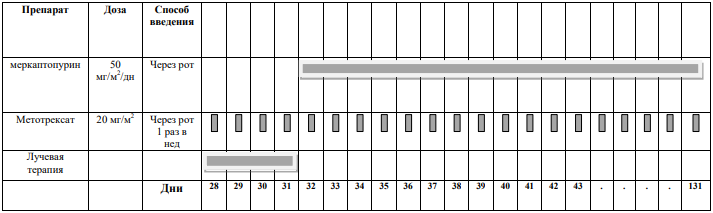
Общая структура
Поддерживающая терапия проводится с 28-й недели в общей сложности 104 недели (= 2 года).
Поддерживающая терапия 6-меркаптопурином начинается после завершения лучевой терапии. Его не используют вместе с лучевой терапией из-за увеличения риска опухолей ЦНС.
Критерии начала и химиотерапия поддерживающей терапии корригируется в зависимости от уровней лейкоцитов, лимфоцитов и общего билирубина и трансаминаз крови, возникновения лихорадочных эпизодов.
§2 МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ ПАЦИЕНТОВ ГРУППЫ не-Т клеточного варианта ОЛЛР группы высокого риска (НR) [1]
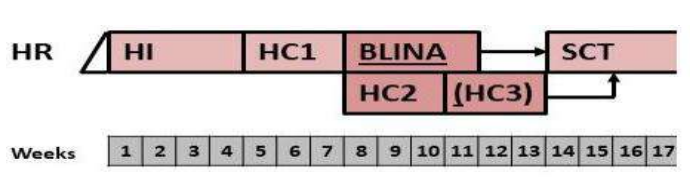
Курс терапии HR включает индукционную терапию (HI), консолидацию (HС1,2,3), Блинатумомаб, ТГСК.
Блинатумомаб имеет преимущество перед консолидирующей химиотерапией при высоком риске рецидива ОЛЛ. По этой причине блинатумомаб предпочтительнее блоков HC2 и HC3 в предыдущем протоколе.
Исключения, когда вместо блинатумомаба следует выбрать блоки HC2 и HC3:
-
для T-клеточных ОЛЛ или любых других случаев CD19neg;
-
в случае тяжелой токсичности блинатумомаба;
-
любые противопоказания к применению блинатумомаба (например, лейкоциты в СМЖ > 5/мкл или наблюдается инфильтрация ЦНС рентгенологически во время введения блинатумомаба).
Консолидация состоит из курса HC1 на 5-й неделе, за которым следует один курс блинатумомаба на 5-й неделе, 8-й неделе, затем ТГСК.
В случае коллегиального решения МДГ в пользу отказа от применения блинатумомаба консолидация состоит из курса HC1 на 5 неделе, курса HC2 на 8 неделе и курс HC3 на 11 неделе, затем ТГСК.
|
Блоки химиотерапии проводятся на фоне сопутствующей гидратации из расчета 3000 мл/м2 /24 часа за 1 сутки до старта химиотерапии: NaCl 0,9% 3000 мл/ m 2 + 5% глюкоза3000 мл/ m 2 +7,5% KCl 30 ммоль/л (5% глюкоза + 0,9% NaCl) + NaHCO3 (гидрокарбонат натрия) 40 ммоль/л (5% глюкоза + 0,9% NaCl)
|
Индукция
Индукция состоит из курса НI продолжительностью 4 недели.
Индукцию следует проводить вовремя и независимо от показателей периферической крови. Раннее достижение ремиссии имеет приоритет и часто является важной предпосылкой для долгосрочного контроля инфекций. Количество тромбоцитов поддерживается на уровне от 15 до 20 000 x 109/л при переливании тромбоцитов до достижения ремиссии. 5-я неделя начинается, когда позволяет состояние пациента.
Индукцию следует проводить вовремя и независимо от показателей периферической крови. Раннее достижение ремиссии имеет приоритет и часто является важной предпосылкой для долгосрочного контроля инфекций. Количество тромбоцитов поддерживается на уровне от 15 до 20 000 x 109/л при переливании тромбоцитов до достижения ремиссии. 5-я неделя начинается, когда позволяет состояние пациента.
Критерии для начала курса:
Для начала и продолжения курса до 5-й недели нет обязательных анализов крови или клинических условий. 5-я неделя начинается, как только клинический статус позволяет продолжить лечение.
Курс HI - (Ветвь HR не-Т клеточный вариант, индукция, 1-4 неделя) [1]
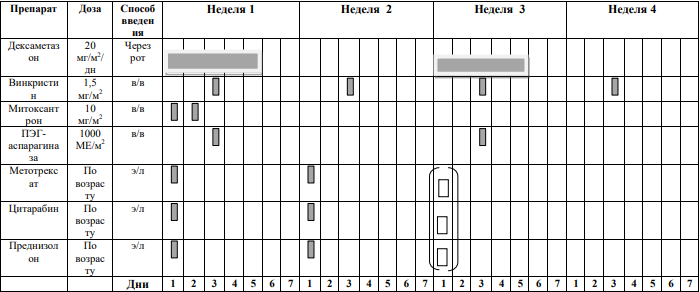
Курс HI - (Ветвь HR не-Т клеточный вариант, индукция, 1-4 неделя) [1]

Диагностические критерии:
МОБ – исследование КМ является обязательным в 1-й день 5-й недели.
Интратекальная химиотерапия
Дозу МТХ, адаптированную к возрасту, вводят в день 1 недель 1 и 2. Пациенты с заболеванием ЦНС на момент обращения должны получать еженедельные дозы до тех пор, пока не будут получены два прозрачных образца СМЖ.
Доза эндолюмбального введения Метотрексата, адаптированная к возрасту.
Доза эндолюмбального введения Метотрексата, адаптированная к возрасту.
|
Возраст
|
Метотрексат (мг)
|
0,9% NaCl (мл)
|
|
До 1 года
|
6
|
1,5
|
|
1 год
|
8
|
2
|
|
2 года
|
10
|
2,5
|
|
3 года и старше
|
12
|
3
|
Проведение химиотерапии
|
Наименование ЛС
|
Применение ЛС
|
||
|
DEXA
|
Начальная доза: 20 мг/м2 в день (максимум 40 мг/сут)
Способ введения: перорально, разделенные на две дневные дозы Дни недели:
|
||
|
Винкристин
|
Суточная доза: 1,5 мг/м2 (максимальная разовая доза 2 мг)
Способ введения: в виде 15-минутной короткой инфузии
|
||
|
Митоксантрон
|
Суточная доза: 10 мг/м2
Способ введения: в виде инфузии в течение 1 часа Дни недели: в 1-й и 2-й день недели 1. |
||
|
ПЭГ-
аспарагиназа |
Суточная доза: 1000 единиц/м2
Способ введения: в виде 2-часовой инфузии или внутримышечно; Дни недели: на 3-й день каждой недели 1 и 3. Контроль лечения: количественное определение активности ПЭГ-аспарагиназы в сыворотке через 7 и 14 дней после каждого введения ПЭГ-аспарагиназы. (активность должна быть 0,1 МЕ/мл). NB! В случае аллергической реакции на ПЭГаспарагиназу, последующее введение препарата отменяется! |
||
После восстановления результатов анализа крови определяют цитологическую ремиссию и статус МИБ (МОБ).
Этап консолидации
Начинается с 5-ой недели, как только клинический статус позволяет продолжить лечение.
Не-T клеточный вариант ОЛЛр группы высокого риска HC1 блок[1] (HR ветвь, 1й цикл консолидации, недели 5 – 7)
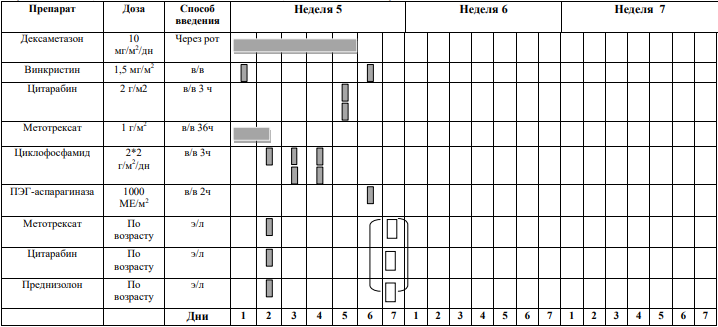
Диагностические мероприятия
Исследование костного мозга на 1-й день 5-й недели обязательна для оценки цитологической ремиссии и МИБ (МОБ). Лечение начинается при выявлении клеточности КМ. В случае нерепрезентативного или апластического КМ анализ следует повторить и соответственно отложить начало терапии.
Интратекальная химиотерапия
Адаптированные к возрасту дозы МТХ, ARA-C и Pred вводят в один из следующих дней: 0–2 (на выбор врача) 5 недели.
*Пациенты с поражением ЦНС получают дополнительную интратекальную инъекцию на 7-й день 5-й недели.
Дозы интратекальной химиотерапии тремя препаратами
Дозы интратекальной химиотерапии тремя препаратами
|
Возраст
(г.) |
Метотрексат
(мг) |
Цитозар
(мг) |
Преднизолон
(мг) |
0,9% NaCl
(мл) |
|
< 1
|
6
|
16
|
4
|
1,5
|
|
1
|
8
|
20
|
6
|
2,0
|
|
2
|
10
|
26
|
8
|
2,5
|
|
>3
|
12
|
30
|
10
|
3,0
|
Проведение химиотерапии
|
Наименование ЛС
|
Применение ЛС
|
|
DEXA
|
Доза: 10 мг/м²
Способ введения: перорально, разделенные на две дневные дозы Дни недели: в дни 1-6 недели 5. |
|
Винкристин
|
Доза: 1,5 мг/м2 (максимальная разовая доза 2 мг)
Способ введения: в виде 15-минутной короткой инфузии (или в виде болюса в/в) Дни недели: в 1 и 6 дни 5 – ой недели. |
|
HD ARA-C
|
Доза: 2 г/м2
Способ введения: в виде 3-часовой инфузии каждые 12 часов (всего 2 введения) Дни недели: 2 г/м2/доза на 5-й день 5-й недели. |
|
HD МТХ
|
Доза: 1 г/м2
Способ введения: в/в инфузия в течение 36 часов, начиная с 1-го дня пятой недели. 10% вводится в виде 30- минутного болюса, а остальные 90% - в виде непрерывной инфузии в течение 35,5 часов. Уровни МТХ в сыворотке измеряются через 36 часов и 48 часов после начала инфузии МТХ. Профилактическая терапия Кальций/натрий фолината в дозе 15 мг/м2 проводится через 48 и 54 часа после начала приема МТХ. Дозу необходимо адаптировать к повышенным уровням МТХ в сыворотке крови (см. Приложение 2). Дни недели: с 1-го дня, недели 5. |
|
Циклофосфамид
|
Доза: 200 мг/м2.
Способ введения: в виде 1-часовой инфузии каждые 12 часов на 2–4 дни (всего 5 доз). Дни недели: во 2-ой день курса один раз, на 3 и 4-ые дни * 2 раза в день, на 5-ой неделе
Антидот уромитексан вводится в дозе 70 мг/м2 до и через 4 и 8 часов после начала каждой инфузии циклофосфамида.
|
|
ПЭГ-аспарагиназа
|
Доза: 1000 ЕД/м2
Способ введения: в виде 2-часовой инфузии; Дни недели: на 6-й день, 5-й недели. Контроль лечения: количественное определение активности ПЭГ-аспарагиназы в сыворотке через 7 и 14 дней после каждого введения ПЭГ-аспарагиназы (норма активности – 0,1 МЕ/мл). NB! В случае аллергической реакции на ПЭГ-аспарагиназу, последующее введение препарата отменяется! |
Блок Блинатумомаб[1,38-40,61-63]
Блок Блинатумомаб (HR-ветвь, 2-й цикл консолидации) назначется вместо цикла HC2 и HC3.
|
NB! Перед курсом блинатумомаба обязательно проведение исследования КМ и оценка МОБ/МИБ!
|
Показания:CD19-позитивные лейкозные клетки >10% в последнем исследовании КМ, без поражения ЦНС.
Противопоказания: наличие бластов в СМЖ после HC1 блока (поскольку блинатумомаб не преодолевает гематоэнцефалический барьер).
Пациенты с CD19- пациентам с остаточным поражением ЦНС переводятся на курс HC2.
Критерии для начала и проведения курса:
-
срок: начало 8-й недели;
-
восстановление показателей крови (нейтрофилы ≥ 0,5 x 109/л, тромбоциты ≥ 50 x 109/л);
-
отсутствие дисфункции печени.
1-й курс блинатумомаба для пациентов весом до 45 кг[1]:
Один курс блинатумомаба состоит из 28 дней непрерывной внутривенной инфузии с последующим перерывом на 7 – 14 дней без лечения (всего 35 – 42 дня).
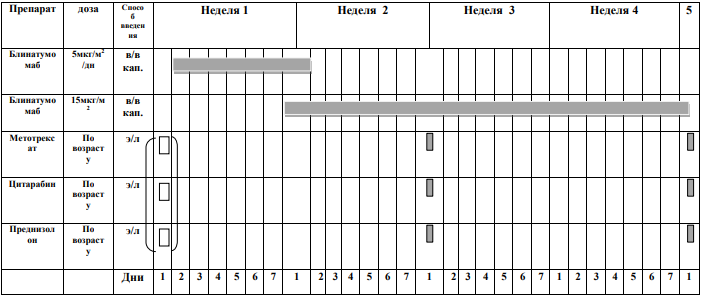
Интратекальная химиотерапия
С целью профилактики рецидива ОЛЛ в центральной нервной системе дозы метотрексата, цитарабина и преднизолона, адаптированные к возрасту, вводят на 15 и 28 дни инфузии блинатумомаба.
Сопроводительная терапия (управление токсичностью препарата)
-
дексаметазон 5 мг/м2 (но не более 20 мг) в/в за 30–60 минут до начала инфузии блинатумомаба(в 1 день первого цикла терапии);
-
парацетамол 10 мг/кг/день рекомендуется в течение первых 48 часов каждого цикла терапии перорально или внутривенно для снижения интоксикации.
Диагностические мероприятия
Исследование КМ и оценка экстрамедуллярных участков перед началом курса блинатумомаба - обязательно. Пациенты могут перейти к ТГСК после курсов Блинатумомаба, в зависимости от отрицательного результата МИБ и наличия донора.
Не-T клеточный вариант ОЛЛр группы высокого риска HC2 блок[1]
Данный блок назначется после блока HC1 в тех случаях, когда блинатумомаб противопоказан.
Схема блока: ветвь HR, 2-й цикл консолидации, 8 – 10 недели
Схема блока: ветвь HR, 2-й цикл консолидации, 8 – 10 недели
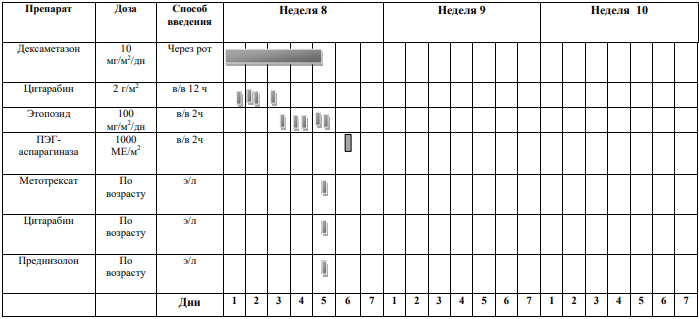
Критерии для начала
Для начала курса необходимо достижение уровня нейтрофилов ≥ 0,5×109/л, тромбоцитов ≥ 50×109/л и клинический статус, позволяющий продолжить лечение. В случае длительного перерыва лечения следует рассмотреть возможность снижения дозы в соответствии с конкретными рекомендациями, изложенными в рекомендации по снижению дозы (смотрите ниже).
Диагностические мероприятия:
Исследование КМ на 1-й день 8-й недели обязательна для оценки цитологической ремиссии и МИБ.
Подтверждением цитологической ремиссии является результат КМ: репрезентативный/клеточный КМ.
В случае нерепрезентативного или апластического костного мозга анализ следует повторить и соответственно отложить начало терапии.
Подтверждением цитологической ремиссии является результат КМ: репрезентативный/клеточный КМ.
В случае нерепрезентативного или апластического костного мозга анализ следует повторить и соответственно отложить начало терапии.
Интратекальная химиотерапия
Адаптированные к возрасту дозы МТХ, ARA-C и Pred вводят в 1-й день 8-й недели.
Дозы интратекальной химиотерапии тремя препаратами
Дозы интратекальной химиотерапии тремя препаратами
|
Возраст
(г.) |
Метотрексат
(мг) |
Цитозар
(мг) |
Преднизолон
(мг) |
0,9% NaCl
(ml) |
|
< 1
|
6
|
16
|
4
|
1,5
|
|
1
|
8
|
20
|
6
|
2,0
|
|
2
|
10
|
26
|
8
|
2,5
|
|
>3
|
12
|
30
|
10
|
3,0
|
Проведение химиотерапии
|
Наименование ЛС
|
Применение ЛС
|
|
|
DEXA
|
Доза: 10 мг/м²/сут (максимум 40 мг/сут)
Способ введения: перорально, разделенные на две дневные дозы Дни недели: в дни 1-6, недели 8. |
|
|
(HD) ARA-C
|
Доза: 2 г/м2
Способ введения: в виде 3-часовой инфузии каждые 12 часов (всего 4 приема) Дни недели: в дни 1-3, недели 8 Управление токсичностью: Профилактика конъюнктивита - глазные капли с дексаметазонтом каждые 6 часов во время приема и профилактика нейропатии витамином B6 в дозе 100 мг/м2 в/в, рекомендуется перед каждой дозой ARA-C. |
|
|
Этопозид
|
Доза: 100 мг/м2
Способ введения: в виде 4-часовой инфузии. Дни недели: в дни 3-5 (всего 5 доз) 8-й недели. Не следует вводить препарат менее 1 часа, так как это может привести к гипотонии. |
|
|
ПЭГ-аспарагиназа
|
Доза: 1000 ЕД/м2
Способ введения: в виде 2-часовой инфузии; Дни недели: на 6-й день, 5-й недели. Контроль лечения: количественное определение активности ПЭГ-аспарагиназы в сыворотке через 7 и 14 дней после каждого введения ПЭГ-аспарагиназы (норма активности – 0,1 МЕ/мл). |
|
|
NB!
В случае аллергической реакции на ПЭГ-аспарагиназу, последующее введение препарата отменяется! |
|
|
Не-T клеточный вариант ОЛЛр группы высокого риска HC3 блок[1]
Данный блок назначается после блока HC2 в тех случаях, когда блинатумомаб противопоказан.
(Группа HR, 3-й цикл консолидации, 11-13 недели)
Данный блок назначается после блока HC2 в тех случаях, когда блинатумомаб противопоказан.
(Группа HR, 3-й цикл консолидации, 11-13 недели)
Критерии для начала курса
Для начала курса необходимы уровень нейтрофилов ≥ 0,5 × 109/л, тромбоциты ≥ 50 × 109/л и клинический статус, позволяющий продолжить лечение.
В случае длительного перерыва в лечении следует рассмотреть возможность снижения дозы в соответствии с рекомендациями по снижению дозы (см ниже).
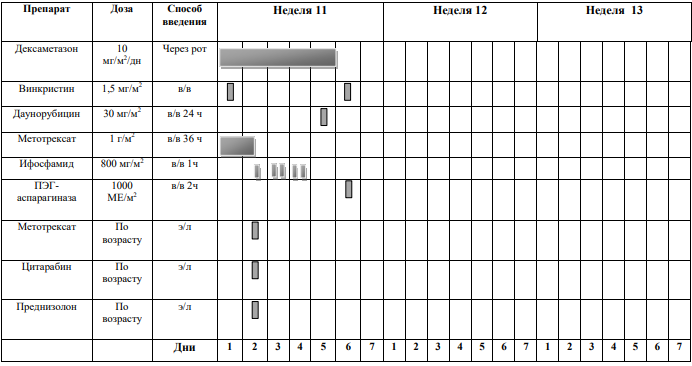
В случае длительного перерыва в лечении следует рассмотреть возможность снижения дозы в соответствии с рекомендациями по снижению дозы (см ниже).

Диагностические мероприятия
Исследования КМ на 1-й день 11-й недели обязательна для оценки цитологической ремиссии и ответа на МИБ. Результаты должны выявить клеточный КМ. В случае нерепрезентативного или апластического КМ анализ следует повторить и начать исследование, терапию соответственно отложить.
Интратекальная химиотерапия
Дозы МТХ, ARA-C и Pred, адаптированные к возрасту, вводят в один из следующих дней: 0–2 (оставлено на выбор врача) 11 недели.
Дозы интратекальной химиотерапии тремя препаратами
|
Возраст
(г.) |
Метотрексат
(мг) |
Цитозар
(мг) |
Преднизолон
(мг) |
0,9% NaCl
(ml) |
|
< 1
|
6
|
16
|
4
|
1,5
|
|
1
|
8
|
20
|
6
|
2,0
|
|
2
|
10
|
26
|
8
|
2,5
|
|
>3
|
12
|
30
|
10
|
3,0
|
Провдение химиотерапии
|
Наименование ЛС
|
Применение ЛС
|
|
DEXA
|
Доза: 10 мг/м²/сут (максимум 40 мг/сут)
Способ введения: перорально, разделенные на две дневные дозы Дни недели: в дни 1-6, недели 11. |
|
Винкристин
|
Доза: 1,5 мг/м2 (максимальная разовая доза 2 мг)
Способ введения: в виде 15-минутной короткой инфузии (или в виде болюса в/в) Дни недели: в дни 1 и 6, недели 11. |
|
Даунорубицин
|
Доза: 30 мг/м2
Способ введения: в виде 24-часовой инфузии Дни недели: на 5-й день 11-й недели. |
|
HD МТХ
|
Доза: 1 г/м2
Способ введения: в/в инфузия в течение 36 часов, начиная с 1-го дня пятой недели. 10% вводится в виде 30- минутного болюса, а остальные 90% - в виде непрерывной инфузии в течение 35,5 часов. Уровни МТХ в сыворотке измеряются через 36 часов и 48 часов после начала инфузии МТХ. Профилактическая терапия Кальций/натрий фолината в дозе 15 мг/м2 проводится через 48 и 54 часа после начала приема МТХ. Дозу необходимо адаптировать к повышенным уровням МТХ в сыворотке крови. (см. Приложение 2). Дни недели: с 1-го дня, недели 11 |
|
Ифосфамид
|
Доза: 800 мг/м2.
Способ введения: в виде 1-часовой инфузии каждые 12 часов Дни недели: на 2-ые, 3-е и 4-ые дни (всего 5 доз) недели 11. Месна в дозе 300 мг/м2 назначается до начала инфузии и через 4 и 8 часов после начала инфузии |
|
ПЭГ-аспарагиназа
|
Доза: 1000 ЕД/м2
Способ введения: в виде 2-часовой инфузии; Дни недели: на 6-й день, 5-й недели. |
|
|
|
NB!
В случае аллергической реакции на ПЭГ-аспарагиназу, последующее введение препарата отменяется. |
|
|
Контроль лечения: количественное определение активности ПЭГ-аспарагиназы в сыворотке через 7 и 14 дней после каждого введения ПЭГ-аспарагиназы (норма активности – 0,1 МЕ/мл).
|
||
После завершения HC3 блока терапии рекомендуется проведение ТГСК при наличии отрицательного результата МОБ и наличия совместимого донора.
Терапия ИЭМ-ЦНС при не-Tклеточном варианте[1]
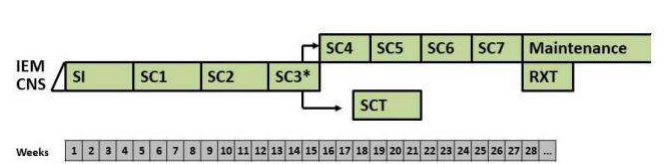
Примечание:
Maintenance – поддерживающая терапия
Пациенты, распределенные в ветвь ИЭМ-ЦНС получают индукционную, консолидирующую и поддерживающую терапию согласно рекомендаций раздела
«Лечение в группе стандартного риска» настоящего клинического протокола.
Критерии отбора на ТГСК при ИЭМ-ЦНС после блока SC3*:
-
очень ранние и ранние рецидивы ИЭМ-ЦНС не-Т-иммунофенотипа;
-
поздние рецидивы ИЭМ-ЦНС не-Т-иммунофенотипа со слабым ответом на терапию индукции (наличие экстрамедуллярного поражения, например, бластоз спинномозговой жидкости, эквивалентный ЦНС2, или МОБ костного мозга ≥ 0,1%).
Поздние рецидивы ИЭМ-ЦНС не-Т-иммунофенотипа с хорошим ответом на индукцию:
-
продолжить дальнейшие циклы консолидации до SC7;
-
далее рекомендована поддерживающая терапия краниальным облучением 18 Грей.
|
NB!
Во время поддерживающего лечения не проводится интратекальная химиотерапия! |
Циклы химиотерапии от SI до SC7 проводятся согласно рекомендаций раздела «Лечение в группе стандартного риска» настоящего клинического протокола.
Поддерживающая химиотерапия не-Т-клеточного варианта позднего ИЭМ- ЦНС[1]
Поддерживающая терапия проводится с 28-й недели в общей сложности 104 недели (2 года).
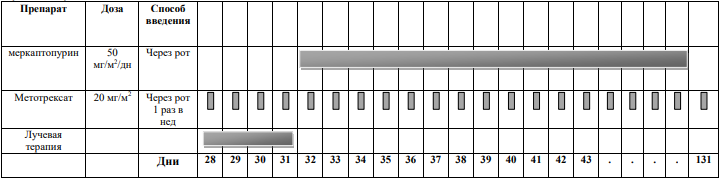
Терапевтическая краниальная лучевая терапия проводится в начале поддерживающего периода.
|
NB!
Пациентам, получившим курс терапевтической краниальной лучевой терапии, не проводится эндолюмбальное введение химиопрепаратом! |
Рекомендации касательно курсов поддерживающей терапии смотрите в разделе «Поддерживающая химиотерапия ветви SR для пациентов без ЦНС-3».
Рецидивы не-Т-клеточного варианта ИЭМ без вовлечения ЦНС[1]
Пациенты с рецидивами «B клеточный вариант ОЛЛ с ИЭМ без вовлечения ЦНС» (без статуса CNS3) лечение проводится в соответствии с группами SR, HR или VHR в зависимости от времени до рецидива и генетики, как и при комбинированном лечении рецидивов.
Очень высокая группа риска (VHR) не Т-клеточный вариант Очень высокий риск (VHR): рецидивы имеют неблагоприятный прогноз.
Варианты выбора терапии:
Очень высокая группа риска (VHR) не Т-клеточный вариант Очень высокий риск (VHR): рецидивы имеют неблагоприятный прогноз.
Варианты выбора терапии:
-
терапии спасения;
-
таргетные терапии;
-
терапия CAR-T-клетками;
-
ТГСК.
Тактика терапии определяется консилиумом МДГ.
§3 Медикаментозное лечение Т - клеточного варианта ОЛЛр (T-HR и T-IEM- CNS)[1].
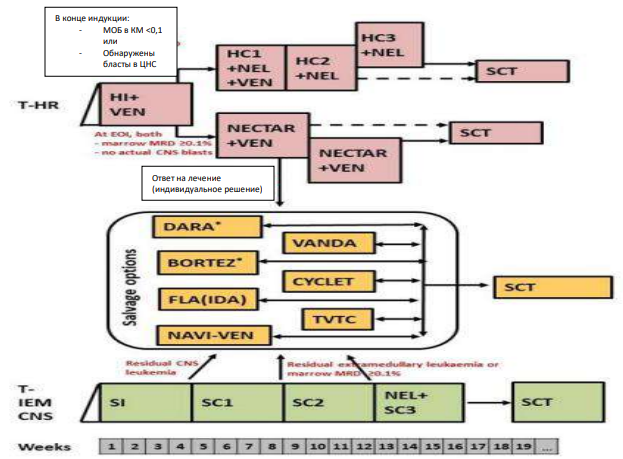
Примечание:
At EOI, both – marrow MRD ≥0,1% - no actual CNS blasts (в конце индукции – МОБ В КМ
≥0,1% и нет нейролейкоза).
Residual CNS – первичный нейролейкоз
Residual extramedullary leukaemia or marrow MRD ≥0,1% - первичная экстрамедуллярный лейкоз или МОБ в КМ ≥0,1%.
Блоки химиотерапии при Т - клеточном варианте ОЛЛр:
At EOI, both – marrow MRD ≥0,1% - no actual CNS blasts (в конце индукции – МОБ В КМ
≥0,1% и нет нейролейкоза).
Residual CNS – первичный нейролейкоз
Residual extramedullary leukaemia or marrow MRD ≥0,1% - первичная экстрамедуллярный лейкоз или МОБ в КМ ≥0,1%.
Блоки химиотерапии при Т - клеточном варианте ОЛЛр:
-
начинаются после Циторедуктивной предварительной фазы;
-
состоят из ветви группы высокого риска (T-HR) и ветвь с ИЭМ-ЦНС поражением (T-IEM-CNS);
-
курс неларабина в 1 – 5 дни химиотерапии;
-
блок консолидации НС следует начинать с 8-го дня химиотерапии.
Рекомендации касательно блока химиотерапии:
Неларабин рекомендован пациентам с рецидивом Т-ОЛЛ.
Комбинация неларабина с блоками консолидации НС является рекомендуемым и предпочтительным выбором для пациентов с нейролейкозом, так как неларабин проникает через гематоэнцефалический барьер.
Блоки консолидации HC содержат активные для ЦНС препараты, такие как дексаметазон, HD-ARA-C и HD-MTX.
Комбинация неларабина с блоками консолидации НС является рекомендуемым и предпочтительным выбором для пациентов с нейролейкозом, так как неларабин проникает через гематоэнцефалический барьер.
Блоки консолидации HC содержат активные для ЦНС препараты, такие как дексаметазон, HD-ARA-C и HD-MTX.
|
NB!
В случае проявления нейротоксичности, ЦНС-3 степени следует прервать лечение неларабином! |
|
NB!
Следует избегать сочетания неларабина с другими нейротоксичными средствами! |
|
NB!
Интратекальную химиотерапию нельзя назначать в дни приема неларабина или в предыдущий/последующий день! |
Ветвь группы высокого риска (T-HR) [1]
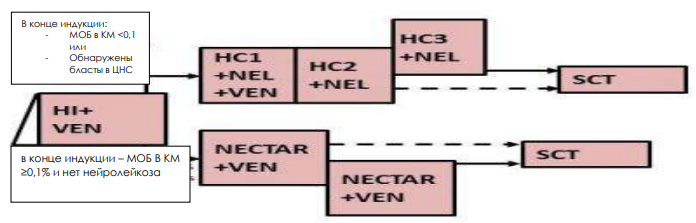
Пациенты с недостаточным ответом на индукцию (МОБ костного мозга ≥ 0,1%), но без поражения ЦНС рекомендуется блок NECTAR+VEN.
Для всех остальных пациентов рекомендованы циклы консолидации, используемые с добавлением венетоклакса и неларабина.
Решение о необходимости проведения таргетной терапии, альтернативной терапии спасения принимается консилиумом МДГ.
Схема лечения HI + VEN (HR ветвь, индукция, 1-4 недели) [1]
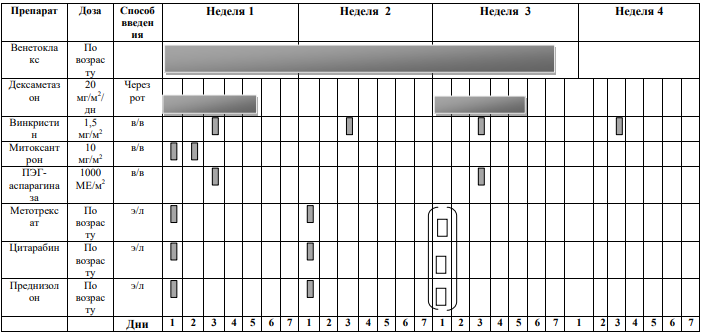
|
Все блоки химиотерапии проводятся на фоне сопутствующей гидратации из расчета 3000 мл/м2 /24 часа за 1 сутки до старта химиотерапии: NaCl 0,9% 3000 мл/ m 2 + 5% глюкоза3000 мл/ m 2 + 7,5% KCl 30 ммоль/л (5%глюкоза + 0,9%NaCl) + 4% NaHCO3 (гидрокарбонат натрия) 40 ммоль/л (5%глюкоза + 0,9%NaCl)
|
Критерии для начала терапии
Начало блока индукции проводится независимо от результатов лабораторных исследований (ОАК).
Решение о проведении Циторедуктивной предварительной фазы перед блоком индукции при наличии сопутствующего заболевания, осложнения или критической ситуации принимается консилиумом МДГ.
Начало блока индукции проводится независимо от результатов лабораторных исследований (ОАК).
Решение о проведении Циторедуктивной предварительной фазы перед блоком индукции при наличии сопутствующего заболевания, осложнения или критической ситуации принимается консилиумом МДГ.
Диагностические мероприятия
Исследование КМ (оценка МОБ) при постановке диагноза (день 0 недели 1). Контрольное исследование КМ выполняется в день 1 недели 3.
Интратекальная химиотерапия
Дозы МТХ, ARA-C и Pred, адаптированные к возрасту, вводятся:
-
в 1-й день на 1-й и 2-й недели;
-
в день 0 3-й недели: пациенты с поражением ЦНС получают дополнительные интратекальные инъекции еженедельно, пока не будут получены два образца СМЖ без лейкемии.
Дозы интратекальной химиотерапии тремя препаратами
|
Возраст (г.)
|
Метотрексат (мг)
|
Цитозар (мг)
|
Преднизолон (мг)
|
0,9% NaCl
(ml) |
|
< 1
|
6
|
16
|
4
|
1,5
|
|
1
|
8
|
20
|
6
|
2,0
|
|
2
|
10
|
26
|
8
|
2,5
|
|
>3
|
12
|
30
|
10
|
3,0
|
Проведение химиотерапии
| Наименование ЛС | Применение ЛС | ||||||||||||||||||||||
| DEXA |
Доза: 20 мг/м2
Способ введения: перорально, разделенные на две суточные дозы Дни недели:
|
||||||||||||||||||||||
|
Винкристин
|
Доза: 1,5 мг/м2 (максимальная разовая доза 2 мг)
Способ введения: в виде 15-минутной короткой инфузии (или в виде болюса в/в) Дни недели: на 3-й день 1-4 недель |
||||||||||||||||||||||
|
Митоксантрон
|
Доза:10 мг/м2
Способ введения: в виде 1-часовой инфузии Дни недели: в дни 1 и 2, в первую неделю. |
||||||||||||||||||||||
|
ПЭГ-
аспарагиназа |
Доза: 1000 ЕД/м2
Способ введения: в виде 2-часовой инфузии; Дни недели: на 3-й день в 1 и 3 неделю. NB! В случае аллергической реакции на ПЭГ-аспарагиназу, последующее введение препарата отменяется! Контроль лечения: количественное определение активности ПЭГ-аспарагиназы в сыворотке через 7 и 14 дней после каждого введения ПЭГ-аспарагиназы (норма активности – 0,1 МЕ/мл). |
||||||||||||||||||||||
|
Венетоклакс*
|
Доза:
Адаптация детских доз венетоклакса к взрослому эквиваленту 400 мг/день
Способ введения: через рот
Дни недели: в дни 1–21 недель 1–3 или в течение 21 дня подряд с момента начала приема препарата Управление токсичностью препарата: Избегать одновременной профилактики/терапии азолами, помимо венетоклакса. Выберите амфотерицин-В или эхинокандины. Также обратите внимание на повышенную абсорбцию измельченной таблетки венетоклакса. Если другого выхода нет и таблетки измельчаются, контролируйте уровень препарата или уменьшите общую суточную дозу. |
* применение согласно Приказу Министра здравоохранения Республики Казахстан от 15 декабря 2020 года № ҚР ДСМ-280/2020 «Об утверждении правил применения незарегистрированных в Республике Казахстан лекарственных средств и медицинских изделий для оказания медицинской помощи по жизненным показаниям конкретного пациента либо оказания медицинской помощи ограниченному контингенту пациентов с редкими (орфанными) заболеваниями и (или) состояниями»
После индукции оценивают ответ на терапию, оценивают цитологию костного мозга и МИБ (МОБ).
В случае сохранения MОБ ≥ 103 на 11 неделе необходимо проведение МДГ- консилиума для выбора тактики лечения.
У пациентов с M-0 повторят диагностику КM через 1 неделю.
Пациенты с M-1 или M-2 продолжают терапию, состоящую из курсов консолидации HC1 и HC2.
Пациентам, достигшим Ремиссии 2 (CR2), рекомендуется алло-ТГСК. Пациенты с M-3 классифицируются как «рано не ответившие на терапию».
Пациентам с цитологическим отсутствием ответа (M-3, персистирующая экстрамедуллярная болезнь) рекомендуется Альтернативное лечение (Приложение 1).
Консолидация
Консолидация состоит из курса HC1 на 5-й неделе и курса HC2 на 9-й неделе.
Третий курс консолидации HC3 – на 12-ой неделе.
Консолидационные курсы HR 1, 2 и 3 начинаются, как только количество нейтрофилов достигает 0,5×109/л, а количество тромбоцитов превышает 50×109/л, если продолжение терапии не приведет к опасному для жизни событию. Компоненты миелотоксического лечения можно сократить до 2/3 от оригинальной дозы, что позволит своевременно проводить терапию с оправданным риском.
Отсрочка терапии или корректировка по медицинским показаниям с обоснованием документируется в медицинской документации.
Третий курс консолидации HC3 – на 12-ой неделе.
Консолидационные курсы HR 1, 2 и 3 начинаются, как только количество нейтрофилов достигает 0,5×109/л, а количество тромбоцитов превышает 50×109/л, если продолжение терапии не приведет к опасному для жизни событию. Компоненты миелотоксического лечения можно сократить до 2/3 от оригинальной дозы, что позволит своевременно проводить терапию с оправданным риском.
Отсрочка терапии или корректировка по медицинским показаниям с обоснованием документируется в медицинской документации.
Схема лечения HC1 + VEN + NEL блок (HR ветвь, консолидация, 6-7 недели) [1]
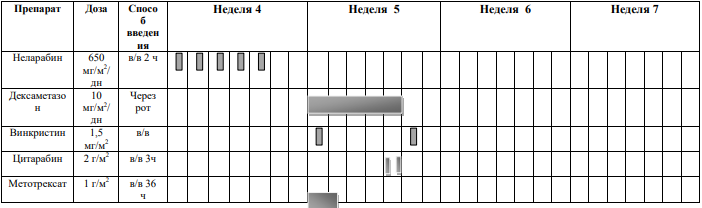
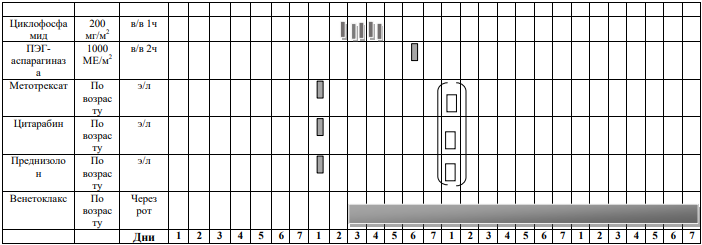
Диагностические мероприятия
Исследование костного мозга на 1-й день 5-й недели обязательна для оценки цитологической ремиссии и МИБ (МОБ). Лечение начинается при выявлении клеточности КМ.
В случае нерепрезентативного или апластического КМ анализ следует повторить и соответственно отложить начало терапии.
В случае хорошего ответа на MRD (< 0,1%) и отсутствия выявляемого заболевания ЦНС в конце индукции рекомендуется назначать Неларабин перед каждым блоком консолидации (HC1, HC2 и HC3), в комбинации с препаратом Венетоклакс в HC1 блоке.
В случае, если бласты ≥5% рекомендуется переход к терапии спасения.
Критерии для начала терапии Неларабином
Показания для начала курса неларабина:
-
нейтрофилы ≥0,5x109/л, тромбоциты ≥ 50 х 109/л;
-
мукозит менее 3 степени;
-
отсутствие существенной органной дисфункции.
Интратекальная химиотерапия
Адаптированные к возрасту дозы МТХ, ARA-C и Pred вводят в один из следующих дней: 0–2 (на выбор врача) 5 недели.
*Пациенты с поражением ЦНС получают дополнительную интратекальную инъекцию на 7-й день 5-й недели.
ПРИМЕЧАНИЕ. Интратекальную химиотерапию нельзя проводить между 1- м и 6-м днями лечения курса Неларабина. Считается, что он увеличивает риск тяжелых, даже опасных для жизни заболеваний центральной нервной системы.
*Пациенты с поражением ЦНС получают дополнительную интратекальную инъекцию на 7-й день 5-й недели.
ПРИМЕЧАНИЕ. Интратекальную химиотерапию нельзя проводить между 1- м и 6-м днями лечения курса Неларабина. Считается, что он увеличивает риск тяжелых, даже опасных для жизни заболеваний центральной нервной системы.
Дозы интратекальной химиотерапии тремя препаратами
|
Возраст
(г.) |
Метотрексат
(мг) |
Цитозар
(мг) |
Преднизолон
(мг) |
0,9% NaCl
(мл) |
|
< 1
|
6
|
16
|
4
|
1,5
|
|
1
|
8
|
20
|
6
|
2,0
|
|
2
|
10
|
26
|
8
|
2,5
|
|
>3
|
12
|
30
|
10
|
3,0
|
Проведение химиотерапии
|
Наименование ЛС
|
Применение ЛС
|
|
Неларабин*
|
Доза: 650 мг/м2
Способ введения: в виде 2-часовой инфузии в 1-5 дни 5-й недели (всего 5 доз). Не требуется гипергидратации. Дни недели: в дни 1-5 недели 5. |
|
DEXA
|
Доза: 10 мг/м²
Способ введения: перорально, разделенные на две дневные дозы Дни недели: в дни 1-5 недели 6. |
|
Винкристин
|
Доза: 1,5 мг/м2 (максимальная разовая доза 2 мг) Способ введения: в виде 15-минутной короткой инфузии (или в виде болюса в/в)
Дни недели: в 1 и 6 дни 6 – ой недели. |
|
HD ARA-C
|
Доза: 2 г/м2
Способ введения: в виде 3-часовой инфузии каждые 12 часов (всего 2 введения) Дни недели: 2 г/м2/доза на 5-й день 6-й недели. |
|
HD МТХ
|
Доза: 1 г/м2
Способ введения: в/в инфузия в течение 36 часов, начиная с 1-го дня 6-ой недели. 10% вводится в виде 30-минутного болюса, а остальные 90% - в виде непрерывной инфузии в течение 35,5 часов. Уровни МТХ в сыворотке измеряются через 36 часов и 48 часов после начала инфузии МТХ. Профилактическая терапия Кальций/натрий фолината в дозе 15 мг/м2 проводится через 48 и 54 часа после начала приема МТХ. Дозу необходимо адаптировать к повышенным уровням МТХ в сыворотке крови (см. Приложение 2). Дни недели: с 1-го дня, недели 6. |
|
Циклофосфамид
|
Доза: 200 мг/м2.
Способ введения: в виде 1-часовой инфузии каждые 12 часов на 2–4 дни (всего 5 доз). Дни недели: во 2-ой день курса один раз, на 3 и 4 – ые дни * 2 раза в день, на 6-ой неделе Антидот уромитексан вводится в дозе 70 мг/м2 до и через 4 и 8 часов после начала каждой инфузии циклофосфамида. |
||||||||||||||||||||||
|
ПЭГ-аспарагиназа
|
Доза: 1000 ЕД/м2
Способ введения: в виде 2-часовой инфузии; Дни недели: на 6-й день, 6-й недели. Контроль лечения: количественное определение активности ПЭГ-аспарагиназы в сыворотке через 7 и 14 дней после каждого введения ПЭГ-аспарагиназы (норма активности – 0,1 МЕ/мл). |
||||||||||||||||||||||
|
Венетоклакс*
|
Доза:
Адаптация детских доз венетоклакса к взрослому эквиваленту 400 мг/день
Способ введения: через рот
Дни недели: в дни 1–21 недель 1–3 или в течение 21 дня подряд с момента начала приема препарата Управление токсичностью препарата: Избегать одновременной профилактики/терапии азолами, помимо венетоклакса. Выберите амфотерицин-В или эхинокандины. Также обратите внимание на повышенную абсорбцию измельченной таблетки венетоклакса. Если другого выхода нет и таблетки измельчаются, контролируйте уровень препарата или уменьшите общую суточную дозу. |
* применение согласно Приказу Министра здравоохранения Республики Казахстан от 15 декабря 2020 года № ҚР ДСМ-280/2020 «Об утверждении правил применения незарегистрированных в Республике Казахстан лекарственных средств и медицинских изделий для оказания медицинской помощи по жизненным показаниям конкретного пациента либо оказания медицинской помощи ограниченному контингенту пациентов с редкими (орфанными) заболеваниями и (или) состояниями»
HC2 + NEL блок (HR ветвь, консолидация, 10-13 недели) [1]
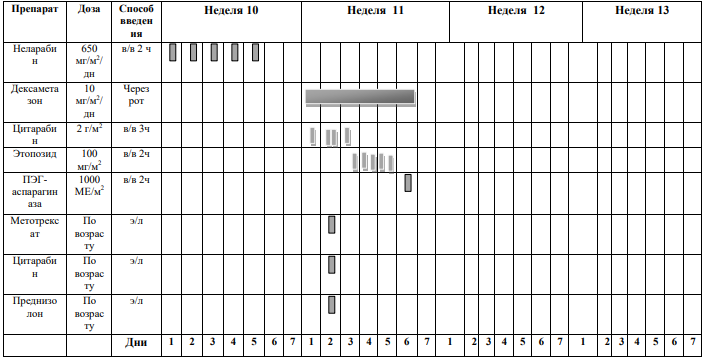
Диагностические мероприятия:
Исследование КМ на 1-й день 10-й недели обязательна для оценки цитологической ремиссии и МОБ.
Подтверждением цитологической ремиссии является результат КМ: репрезентативный/клеточный КМ. В случае нерепрезентативного или апластического костного мозга анализ следует повторить и соответственно отложить начало терапии.
Если в КМ выявлено ≥ 1% бластов после блока HC1 + VEN + NEL или любые остаточные экстрамедуллярные поражения, например обнаружены бласты в СМЖ, то вместо блока HC2 + NEL рассмотрите возможность альтернативной терапии на консилиуме.
Критерии для начала терапии Неларабином
Показания для начала курса неларабина:
-
нейтрофилы ≥0,5x109/л, тромбоциты ≥ 50 х 109/л;
-
мукозит менее 3 степени;
-
отсутствие существенной органной дисфункции.
Интратекальная химиотерапия
Адаптированные к возрасту дозы МТХ, ARA-C и Pred вводят в 1-й день 11-й недели. Пациенты с поражением ЦНС получают дополнительную интратекальную дозу инъекции на 7-й день 11-й недели.
Дозы интратекальной химиотерапии тремя препаратами
|
Возраст
(г.) |
Метотрексат
(мг) |
Цитозар
(мг) |
Преднизолон
(мг) |
0,9% NaCl
(ml) |
|
< 1
|
6
|
16
|
4
|
1,5
|
|
1
|
8
|
20
|
6
|
2,0
|
|
2
|
10
|
26
|
8
|
2,5
|
|
>3
|
12
|
30
|
10
|
3,0
|
|
NB!
Во избежание повышения нейротоксичности между тройной интратекальной терапией и лечением неларабина необходимо соблюдение интервала не менее 2 дней! |
Проведение химиотерапии
|
Наименование ЛС
|
Применение ЛС
|
|
Неларабин*
|
Доза: 650 мг/м2
Способ введения: в виде 2-часовой инфузии в 1-5 дни 5-й недели (всего 5 доз). Не требуется гипергидратации. Дни недели: в дни 1-5 недели 10. |
|
DEXA
|
Доза: 10 мг/м²/сут (максимум 40 мг/сут)
Способ введения: перорально, разделенные на две дневные дозы Дни недели: в дни 1-6, недели 11. |
|
(HD) ARA-C
|
Доза: 2 г/м2
Способ введения: в виде 3-часовой инфузии каждые 12 часов (всего 4 приема) Дни недели: в дни 1-3, недели 11 Управление токсичностью: Профилактика конъюнктивита - глазные капли с дексаметазонтом каждые 6 часов во время приема и профилактика нейропатии витамином B6 в дозе 100 мг/м2 в/в, рекомендуется перед каждой дозой ARA-C. |
|
Этопозид
|
Доза: 100 мг/м2
Способ введения: в виде 4-часовой инфузии. Дни недели: в дни 3-5 (всего 5 доз) 11-й недели. Не следует вводить препарат менее 1 часа, так как это может привести к гипотонии. |
|
ПЭГ-аспарагиназа
|
Доза: 1000 ЕД/м2
Способ введения: в виде 2-часовой инфузии; Дни недели: на 6-й день, 11-й недели. NB! В случае аллергической реакции на ПЭГ-аспарагиназу, последующее введение препарата отменяется. Контроль лечения: количественное определение активности ПЭГ-аспарагиназы в сыворотке через 7 и 14 дней после каждого введения ПЭГ-аспарагиназы (норма активности – 0,1 МЕ/мл). |
* применение согласно Приказу Министра здравоохранения Республики Казахстан от 15 декабря 2020 года № ҚР ДСМ-280/2020 «Об утверждении правил применения незарегистрированных в Республике Казахстан лекарственных средств и медицинских изделий для оказания медицинской помощи по жизненным показаниям конкретного пациента либо оказания медицинской помощи ограниченному контингенту пациентов с редкими (орфанными) заболеваниями и (или) состояниями»
В зависимости от отрицательного результата МОБ и наличия совместимого донора после блока HC2+NEL рекомендуется переход на ТГСК .
При отсутствии донора, рекомендуется продолжить блок HC3+ NEL.
При отсутствии отрицательного результата МОБ рекомендуется рассмотреть Альтернативную терапию решением консилиума МДГ.
В зависимости от отрицательного результата МОБ и наличия совместимого донора после блока HC2+NEL рекомендуется переход на ТГСК .
При отсутствии донора, рекомендуется продолжить блок HC3+ NEL.
При отсутствии отрицательного результата МОБ рекомендуется рассмотреть Альтернативную терапию решением консилиума МДГ.
HC3 + NEL блок (HR ветвь, консолидация, 14-17 недели) [1]
Схема лечения:
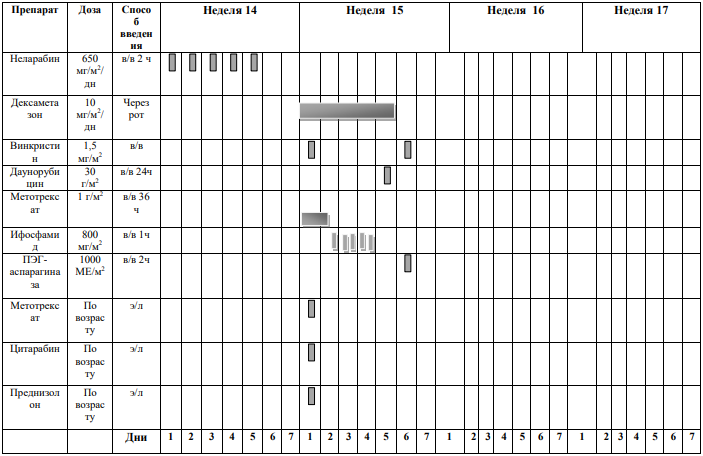

Диагностические мероприятия
Рекомендованы исследования КМ на 1-й день 14-й недели оценки цитологической ремиссии и ответа на МИБ.
Показание для начала HC3 + NEL блок: клеточный КМ.
В случае нерепрезентативного или апластического КМ терапию соответственно отложить до восстановления КМ.
Показание для начала HC3 + NEL блок: клеточный КМ.
В случае нерепрезентативного или апластического КМ терапию соответственно отложить до восстановления КМ.
Критерии для начала терапии Неларабином
Показания для начала курса неларабина:
-
нейтрофилы ≥0,5x109/л, тромбоциты ≥ 50 х 109/л;
-
мукозит менее 3 степени;
-
отсутствие существенной органной дисфункции.
В случае длительного перерыва в лечении следует рассмотреть возможность снижения дозы в соответствии с рекомендациями по снижению дозы (см ниже).
Интратекальная химиотерапия
Адаптированные к возрасту дозы МТХ, ARA-C и Pred вводят в 2-й день 15-й недели.
|
NB!
Во избежание повышения нейротоксичности между тройной интратекальной терапией и лечением неларабина необходимо соблюдение интервала не менее 2 дней! |
Дозы интратекальной химиотерапии тремя препаратами
|
Возраст
(г.) |
Метотрексат
(мг) |
Цитозар
(мг) |
Преднизолон
(мг) |
0,9% NaCl
(ml) |
|
< 1
|
6
|
16
|
4
|
1,5
|
|
1
|
8
|
20
|
6
|
2,0
|
|
2
|
10
|
26
|
8
|
2,5
|
|
>3
|
12
|
30
|
10
|
3,0
|
Проведение химиотерапии
|
Наименование ЛС
|
Применение ЛС
|
|
Неларабин*
|
Доза: 650 мг/м2
Способ введения: в виде 2-часовой инфузии в 1-5 дни 5- й недели (всего 5 доз). Не требуется гипергидратации. Дни недели: в дни 1-5 недели 14. |
|
DEXA
|
Доза: 10 мг/м²/сут (максимум 40 мг/сут)
Способ введения: перорально, разделенные на две дневные дозы Дни недели: в дни 1-6, недели 11. |
|
Винкристин
|
Доза: 1,5 мг/м2 (максимальная разовая доза 2 мг)
Способ введения: в виде 15-минутной короткой инфузии (или в виде болюса в/в) Дни недели: в дни 1 и 6, недели 11. |
|
Даунорубицин
|
Доза: 30 мг/м2
Способ введения: в виде 24-часовой инфузии Дни недели: на 5-й день 11-й недели. |
|
HD МТХ
|
Доза: 1 г/м2
Способ введения: в/в инфузия в течение 36 часов, начиная с 1-го дня пятой недели. 10% вводится в виде 30- минутного болюса, а остальные 90% - в виде непрерывной инфузии в течение 35,5 часов. Уровни МТХ в сыворотке измеряются через 36 часов и 48 часов после начала инфузии МТХ. Профилактическая терапия Кальций/натрий фолината в дозе 15 мг/м2 проводится через 48 и 54 часа после начала приема МТХ. Дозу необходимо адаптировать к повышенным уровням МТХ в сыворотке крови. (см. Приложение 2). Дни недели: с 1-го дня, недели 11 |
|
|
Ифосфамид
|
Доза: 800 мг/м2.
Способ введения: в виде 1-часовой инфузии каждые 12 часов Дни недели: на 2-ые, 3-е и 4-ые дни (всего 5 доз) недели 11. Месна в дозе 300 мг/м2 назначается до начала инфузии и через 4 и 8 часов после начала инфузии. |
|
|
ПЭГ-аспарагиназа
|
Доза: 1000 ЕД/м2
Способ введения: в виде 2-часовой инфузии; Дни недели: на 6-й день, 5-й недели. |
|
|
|
NB!
В случае аллергической реакции на ПЭГ-аспарагиназу, последующее введение препарата отменяется. |
|
|
Контроль лечения: количественное определение активности ПЭГ-аспарагиназы в сыворотке через 7 и 14 дней после каждого введения ПЭГ-аспарагиназы (норма активности – 0,1 МЕ/мл).
|
||
* применение согласно Приказу Министра здравоохранения Республики Казахстан от 15 декабря 2020 года № ҚР ДСМ-280/2020 «Об утверждении правил применения незарегистрированных в Республике Казахстан лекарственных средств и медицинских изделий для оказания медицинской помощи по жизненным показаниям конкретного пациента либо оказания медицинской помощи ограниченному контингенту пациентов с редкими (орфанными) заболеваниями и (или) состояниями».
После завершения HC3+NEL блока терапии рекомендуется проведение ТГСК при наличии отрицательного результата МОБ и наличия совместимого донора. В случае положительного результата МОБ, необходимо рассмотреть альтернативную терапию решением консилиума.
После завершения HC3+NEL блока терапии рекомендуется проведение ТГСК при наличии отрицательного результата МОБ и наличия совместимого донора. В случае положительного результата МОБ, необходимо рассмотреть альтернативную терапию решением консилиума.
NECTAR+ VEN блок (Т-HR ветвь) [1]
Блок NECTAR+VEN рекомендуется пациентам с плохим ответом на индукцию.
Показания для NECTAR+VEN:
Показания для NECTAR+VEN:
-
МОБ костного мозга ≥ 0,1%, но без поражения ЦНС
Схема лечения:
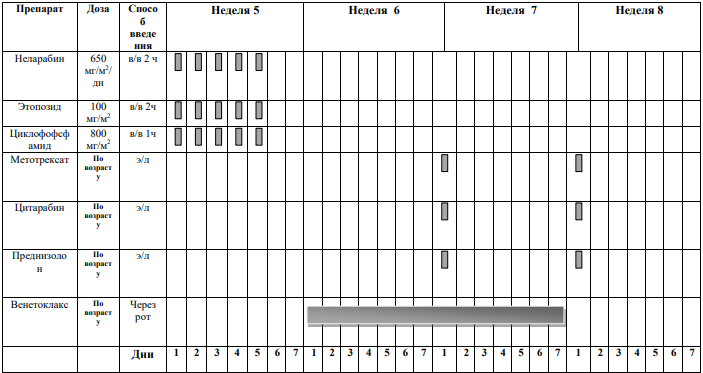
Критерии для начала терапии Неларабином
Показания для начала курса неларабина:
-
нейтрофилы ≥0,5x109/л, тромбоциты ≥ 50 х 109/л;
-
мукозит менее 3 степени;
-
отсутствие существенной органной дисфункции.
Интратекальная химиотерапия
Адаптированные к возрасту дозы МТХ, ARA-C и Pred вводят на 15-й и 22-й день (в 1-й день 7 недели и в 1-й день 8 недели).
Адаптированные к возрасту дозы МТХ, ARA-C и Pred вводят на 15-й и 22-й день (в 1-й день 7 недели и в 1-й день 8 недели).
|
NB!
Во избежание повышения нейротоксичности между тройной интратекальной терапией и лечением неларабина необходимо соблюдение интервала не менее 2 дней! |
Проведение химиотерапии
|
Наименование ЛС
|
Применение ЛС
|
||||||||||||||||||||||
|
Неларабин*
|
Доза: 650 мг/м2
Способ введения: в виде 2-часовой инфузии 5 дней подряд. Дни недели: в дни 1 – 5 недели 5. |
||||||||||||||||||||||
|
Этопозид
|
Доза: 100 мг/м2
Способ введения: в виде 2-х часовой инфузии 5 дней подряд. Дни недели: в дни 1 – 5 недели 5. Не следует вводить препарат менее 1 часа, так как это может привести к гипотонии. |
||||||||||||||||||||||
|
Циклофосфамид
|
Доза: 400 мг/м2.
Способ введения: в виде 1-часовой инфузии 5 дней подряд. Дни недели: в дни 1 – 5 недели 5. Антидот уромитексан вводится в дозе 200 мг/м2 до и через 4 и 8 часов после начала каждой инфузии циклофосфамида. |
||||||||||||||||||||||
|
Венетоклакс
|
Доза:
Адаптация детских доз венетоклакса к взрослому эквиваленту 400 мг/день
Способ введения: через рот Дни недели: в дни 1–21 недель 1–3 или в течение 21 дня подряд с момента начала приема препарата Управление токсичностью препарата: Избегать одновременной профилактики/терапии азолами, помимо венетоклакса. Выберите амфотерицин-В или эхинокандины. Также обратите внимание на повышенную абсорбцию измельченной таблетки венетоклакса. Если другого выхода нет и таблетки измельчаются, контролируйте уровень препарата или уменьшите общую суточную дозу. |
* применение согласно Приказу Министра здравоохранения Республики Казахстан от 15 декабря 2020 года № ҚР ДСМ-280/2020 «Об утверждении правил применения незарегистрированных в Республике Казахстан лекарственных средств и медицинских изделий для оказания медицинской помощи по жизненным показаниям конкретного пациента либо оказания медицинской помощи ограниченному контингенту пациентов с редкими (орфанными) заболеваниями и (или) состояниями»
Тактика лечения в зависимости от эффективности 1 цикла NECTAR + VEN:
|
Критерии оценки эффективности 1 цикла NECTAR + VEN
|
Уровень МОБ
|
Выбор тактики лечения
|
|
Хороший ответ
|
<0,1%
|
рекомендуется дополнительный один цикл NECTAR+VEN;
|
|
Достаточный ответ
|
0,1 – 10%
|
NECTAR+VEN;
|
|
Плохой ответ
|
выше 10%
|
Решение принимается консилиумом МДГ.
|
Медикаментозное лечение Т - клеточного варианта ОЛЛр блок T-IEM-CNS[1]
К изолированному экстрамедуллярному поражению ЦНС при Т-клеточном варианте ОЛЛР (Т-ИЭМ-ЦНС) относятся:
-
рецидивы с вовлечением ЦНС-3 стадии;
-
наличие бластов в КМ <5% (независимо от времени рецидива);
-
вовлечение других участков ЭМ поражения помимо ЦНС.
Независимо от времени возникновения рецидивы Т-клеточного варианта ИЭМ-ЦНС:
-
относятся к группе HR;
-
лечение завершается проведением ТГСК.
Пациентам с Т-клеточным ИЭМ-ЦНС с поражением ЦНС-3 стадии перед трансплантацией рекомендуется блок SC3+неларабин (в виду его хорошего проникновения в гемато-энцефалический барьер).
Схема лечения:
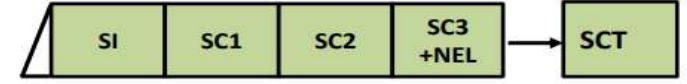
Критерии для начала терапии
Решение о проведении Циторедуктивной предварительной фазы перед блоком индукции при наличии сопутствующего заболевания, осложнения или критической ситуации принимается консилиумом МДГ.
Блоки лечения SI, SC1, SC2 идентичны блокам, применяемые при группах стандартного риска (SR, консолидация) при не-Т-клеточном варианте ОЛЛР.
SC3 + NEL блок (ветвь T-IEM-CNS) [1]
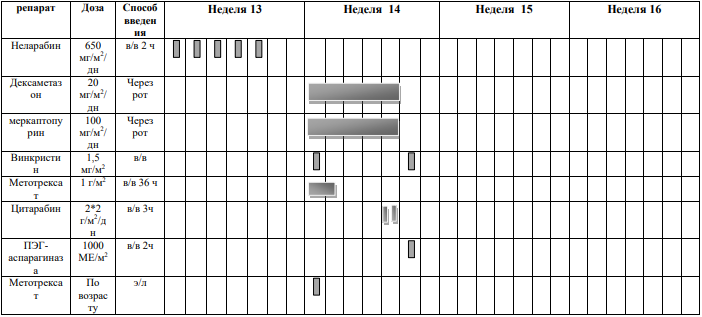
Критерии начала терапии
Критерии для начала терапии Неларабином
Показания для начала курса неларабина:
-
нейтрофилы ≥0,5x109/л, тромбоциты ≥ 50 х 109/л;
-
мукозит менее 3 степени;
-
отсутствие существенной органной дисфункции.
В случае отсрочки лечения следует рассмотреть возможность снижения дозы в соответствии с конкретными рекомендациями.
После блока SC3 + NEL назначается аллогенная ТГСК.
|
Блоки химиотерапии проводятся на фоне сопутствующей гидратации из расчета 3000 мл/м2 /24 часа за 1 сутки до старта химиотерапии: NaCl 0,9% 3000 мл/ m 2 + 5% глюкоза3000 мл/ m 2 + 7,5% KCl 30 ммоль/л (5%глюкоза + 0,9%NaCl) + 4% NaHCO3 (гидрокарбонат натрия) 40 ммоль/л (5%глюкоза + 0,9%NaCl)
|
Интратекальная химиотерапия
Адаптированные к возрасту дозы МТХ, ARA-C и Pred вводят на 2-й день блока после инфузии метотрексата.
Дозы интратекальной химиотерапии тремя препаратами
|
Возраст (г.)
|
Метотрексат (мг)
|
Цитозар (мг)
|
Преднизолон (мг)
|
0,9% NaCl
(ml) |
|
< 1
|
6
|
16
|
4
|
1,5
|
|
1
|
8
|
20
|
6
|
2,0
|
|
2
|
10
|
26
|
8
|
2,5
|
|
>3
|
12
|
30
|
10
|
3,0
|
Проведение химиотерапии
|
Наименование ЛС
|
Применение ЛС
|
|
Неларабин*
|
Доза: 650 мг/м2
Способ введения: в виде 2-часовой инфузии с 1-го по 5-й день. Дни недели: в дни 1-5 недели 5. |
|
DEXA
|
Доза: 20 мг/м2 (макс. не более 40 мг/день) и 10 мг/м2.
Способ введения: перорально, разделенные на две суточные дозы Дни недели:
|
|
6-меркаптопурин
|
Доза: 100 мг/м2
Способ введения: перорально Дни недели: в течение первых 5 дней блока SC3 + NEL. Дозы следует принимать не менее чем через час после ужина без молочных продуктов. |
|
Винкристин
|
Доза: 1,5 мг/м2 (максимальная разовая доза 2 мг)
Способ введения: в виде 15-минутной короткой инфузии (или в виде болюса в/в) Дни недели: в 1-й и 6-ой день блока SC3 + NEL. |
|
МТХ
|
Доза: 1 г/м2
Дни недели: с 1-го дня блока SC3 + NEL. Способ введения:
Уровни МТХ в сыворотке измеряются через 36 и 48 часов после начала инфузии МТХ. В случае повышения уровней выше верхних пределов (>10 мкмоль/л через 36 часов и / или > 0,5 мкмоль/л через 48 часов) уровни МТХ в сыворотке измеряются каждые 6 часов до достижения уровня ниже 0,25 мкмоль/л.
Кальция/натрия фолинат в дозе 15 мг/м2 проводится через 48 и 54 часа после начала приема МТХ. Доза адаптирована к повышенным уровням МТХ в сыворотке в соответствии с рекомендациями. |
|
ARA-C
|
Доза: 2 г/м2
Способ введения:
Дни недели: на 5-й день (всего 2 дозы) блока SC3 + NEL.
Управление токсичностью препарата ARA-C:
инфузией ARA-C.
|
|
ПЭГ-
аспарагиназа |
Доза: 1000 ЕД/м2
Способ введения: в виде 2-часовой инфузии; Дни недели: на 6 день блока SC3 + NEL NB! В случае аллергической реакции на ПЭГ-аспарагиназу последующее введение препарата отменяется. Контроль лечения: количественное определение активности ПЭГ-аспарагиназы в сыворотке через 7 и 14 дней после каждого введения ПЭГ-аспарагиназы (норма активности – 0,1 МЕ/мл) |
* применение согласно Приказу Министра здравоохранения Республики Казахстан от 15 декабря 2020 года № ҚР ДСМ-280/2020 «Об утверждении правил применения незарегистрированных в Республике Казахстан лекарственных средств и медицинских изделий для оказания медицинской помощи по жизненным показаниям конкретного пациента либо оказания медицинской помощи ограниченному контингенту пациентов с редкими (орфанными) заболеваниями и (или) состояниями»
Наличие Ph+ t(9;22)(q34;q11.2)/BCR::ABL1) (Филадельфийская хромосома)[1, 45- 47,51]
При наличии Ph+ t(9;22)(q34;q11.2)/BCR::ABL1) (Филадельфийская хромосома) в костном мозге, всем пациентам дополнительно назначается ингибитор тирозинкиназ одновременно и после стандартной терапии - Иматиниб.
|
Наименование ЛС
|
Применение ЛС
|
|
Иматиниб
|
Доза: 340 мг/м2/день (максимальная доза: 800 мг).
Способ введения: перорально Дни недели: ежедневно. Управление токсичностью препарата: Терапия назначается, когда количество периферических клеток восстановится до нейтрофилов ≥ 500/мкл и тромбоцитов ≥ 50000/мкл, а креатинин находится в пределах возрастной нормы, прямой билирубин ≤ 3-кратный верхний предел нормы, АСТ/АЛТ ≤ 10x нормальных показателей, и мукозит не больше 1 степени (в зависимости от того, что произойдет в динамике). Если начало терапии отложено на 2 недели из-за миелосупрессии, то приём Иматиниба следует приостановить. Примечание: доза > 600 мг/день, разделенная на два введения в день. Доза иматиниба пересчитывается каждые 12 недель или чаще на основе площади тела. Дозу можно округлить до ближайших 50 мг. В случае отсутствия ответа на увеличение дозы, рекомендуется переход на терапию ингибиторами протеинкиназ 2-го поколения (#дазатиниб** 80 мг/м2/сут, #нилотиниб** 230 мг/м2 2 раза в день). Кроме того, плохая переносимость иматиниба, даже несмотря на достижение ремиссии, и наличие мутаций в гене ABL1, также является основанием для замены его на ингибитор протеинкиназ 2-го поколения (#дазатиниб**). Использование #дазатиниба** в первой линии терапии рекомендуется в случае наличия инициального поражения ЦНС, т.к. он является единственным ингибитором протеинкиназ, хорошо проникающим в ЦНС . |
Интратекальная химиотерапия на поддерживающей терапии
Пациенты с облучением ЦНС на 1 неделе поддерживающей терапии не получают МТХ интратекально! Вместо этого они получают перорально МТХ в дозе 20 мг/м² на 4-й день этой недели.
|
Возраст
|
Метотрексат (мг)
|
0,9% NaCl (мл)
|
|
До 1 года
|
6
|
1,5
|
|
1 год
|
8
|
2
|
|
2 года
|
10
|
2,5
|
|
3 года и старше
|
12
|
3
|
Рекомендации по снижению дозы в группе стандартного риска SR
В зависимости от токсичности:
-
Снижение дозы применятся как определенное исключение в случае неприемлемой токсичности или значительной задержки лечения из-за нарушения переносимости лечения.
-
Необходимость снижения дозы оцениватся перед каждым элементом лечения. Дозу одного или нескольких цитотоксических препаратов можно уменьшить до 2/3 от запланированной по протоколу дозировки.
-
В случае тяжелой токсичности, связанной с МТХ, такой как мукозит, почечная недостаточность и неспособность элиминации, высокие дозы МТХ могут быть назначены при более короткой продолжительности инфузии – 24 часа, в более низкой дозе 500 мг/м2 или с ранее введенным кальций/натрий фолинатом в конечном итоге в более высоких (удвоенных) дозах.
-
В случае развития диабета, связанного с кортикостероидами, следует уменьшить дозу DEXA и проводить инфузионную терапию без глюкозы.
-
В случае осложнений, связанных с аспарагиназой, таких как тромбоз или панкреатит, применение аспарагиназы может быть отложено или даже отменено.
-
Для лекарств, считающихся стандартными, отклонения в пределах +/- 10% от точной дозы считаются клинически несущественными и не нарушением протокола.
-
Доза остальных препаратов должна быть рассчитана и соблюдаться максимально точно.
В зависимости от массы тела:
-
Масса тела менее 10 кг – дозы препарата рассчитываются для каждой фазы в соответствии с массой тела, а не с площадью поверхности тела, по следующей формуле:
Доза = Запланированная доза/м2 BSA x масса тела [кг] / 30
-
Ожирение – нет общих рекомендаций по снижению дозы. У отдельных пациентов дозовая адаптация может быть сделана из-за токсичности.
В зависимости от сопутствующей патологии:
-
Пациенты с синдромом Дауна – хуже переносят лечение, чем другие, имеют высокий уровень индукционной смертности. Следует рассмотреть уменьшение дозы в случае индивидуальной токсичности.
В зависимости от способа введения, несовместимости препаратов:
-
Способы перорального применения химиотерапевтических средств – при невозможности использования таблетированных форм, препараты должны быть расфасованы по индивидуальным порциям в растворимой жидкой форме (изготавливаются в аптеке рецептурного приготовления).
-
Несовместимость и взаимодействие лекарств – препараты могут быть заменены другими веществами, если это возможно. Решение о том, можно ли отказаться от приема лекарств или заменить их, должен принимать лечащий врач с учетом клинической ситуации конкретного пациента.
Прекращение лечения
Отстранение пациентов от лечения в следующих ситуациях:
-
Пациенты стандартного риска, не достигшие гематологической ремиссии (КМ ≥M2) после курса SC3;
-
Пациенты высокого риска с КМ М2 после курса HC2.
Медицинская организация (по заключению мультидисциплинарной комиссии/консилиума) может рекомендовать пациенту:
-
участие в клинических исследованиях новых препаратов;
-
продолжать соблюдение протокола или выбирать любое другое лечение (например, курсы, содержащие клофарабин или флударабин, терапию CAR-T- клетками или таргетную терапию) с лечебной целью или с целью паллиативного лечения.
ТГСК[35]
Все пациенты группы HR подлежат проведению ТГСК при наличии совместимого/частично/гаплосовместимого донора и выхода в ремиссию.
Аллогенная ТГСК выполняется согласно клиническому протоколу «ТГСК и у детей», одобренному Объединенной комиссией по качеству медицинских услуг Министерства здравоохранения Республики Казахстан от «15» сентября 2017 года Протокол № 27[31].
Лечение химиорезистентых форм ОЛЛР [1,41-44, 54-63]
Резистентные рецидивы ОЛЛ свидетельствуют об отсутствии чувствительности злокачественных клеток к стандартной химиотерапии.
Назначение резервных схем не вызывает длительной полной ремиссии у больных с ОЛЛР, тем не менее кратковременное достижение полной ремиссии позволяет подготовить пациента и выполнить аллоТГСК в благоприятной (ремиссия) стадии заболевания. Ниже приведены возможные методы терапии спасения и приведены некоторые аргументы в поддержку выбора среди этих вариантов. Выбор терапии спасения обсуждается и определяется МДГ.
Терапия спасения первого выбора при резидуальном лейкозе, при B-ОЛЛ[1]:
|
Критерии
|
Препараты выбора
|
|
Резидуальный лейкоз/МОБ > 25% (если
бласты CD22+) |
|
|
Резидуальный лейкоз/МОБ от 5 до 25%
|
|
|
Резидуальный лейкоз/МОБ < 5%
|
|
При недоступности терапии инотузумабом озогамицин и блинатумомабом выбором лечения является блок химиотерапии FLA-(IDA).
Терапия спасения первого выбора при резидуальном лейкозе, при Т-ОЛЛ:
Выбором лечения является блок химиотерапии FLA-(IDA).
Виды терапии спасения:
-
лечение моноклональными антителами –иммунотерапия;
-
резервные схемы химиотерапии при рефрактерных формах острых лимфобластных лейкозов (терапия спасения) [37-40]
Лечение моноклональными антителами –иммунотерапия
С целью снижения уровня МИБ перед ТГСК у пациентов с рецидивами В-ОЛЛ рекомендуются следующие препараты иммунотерапии:
-
блинатумомаб (моноклональные антитела CD19/CD3-);
-
инотузумаб озогамицин (моноклональные антитела к CD22).
Блинатумомаб [1,38-40,61-63]
Обоснование: Блинатумомаб имеет хорошую антилейкемическую активность, позволяющую после 2-х курсов достичь ремиссии и провести алло-ТГСК.
Критерии отбора пациентов:
-
пациентыс В-иммуновариантом после фазы индукции из группы стандартного риска с высоким уровнем МИБ (MОБ);
-
пациенты с В-иммуновариантом ОЛЛ из группы высокого риска и/или с крайне неблагоприятным прогнозом.
Блинатумомаб вводится в виде непрерывной внутривенной инфузии. Требуется центральная венозная линия доступа. Вводить с помощью программируемых, блокируемых и сигнализируемых насосов CADD.
Блинатумомаб вводят в виде непрерывной в/в инфузии, при постоянной скорости потока с использованием инфузионного насоса. Препарат вводится в течение 28 дней с перерывом между курсами 2 недели. Рекомендовано 2 – 4 курса терапии.
Блинатумомаб рекомендуется в качестве монотерапии.
Блинатумомаб вводят в виде непрерывной в/в инфузии, при постоянной скорости потока с использованием инфузионного насоса. Препарат вводится в течение 28 дней с перерывом между курсами 2 недели. Рекомендовано 2 – 4 курса терапии.
Блинатумомаб рекомендуется в качестве монотерапии.
|
NB!
Препарат не используется у пациентов с Т-линейным ОЛЛ, так как на Тлимфоцитах отсутствует антиген CD19! |
Критерии для начала и проведения курса Блинатумомабом:
-
восстановление показателей крови (нейтрофилы ≥ 0,5 x 109/л, тромбоциты ≥ 50 х 109/л);
-
мукозит менее 3 степени;
-
отсутствие существенных органных нарушений;
-
отсутствие клинически значимой патологии ЦНС, требующие лечения (например, нестабильная эпилепсия);
-
отсутствие острой или неконтролируемой хронической инфекции или другое сопутствующее заболевание, которое может усугубиться в результате лечения.
Для оценки эффективности курса Блинатумомабом проводятся следующие мероприятия:
|
Физикальное и неврологические обследование
|
Физикальное и неврологическое обследование ежедневно в течение первого дня. Большинство неврологических событий начинаются с продромальной фазы кинетическим тремором. Рекомендуется ежедневный мониторинг.
|
|
Общий анализ крови и биохимия (функция печени,
мочевина, креатинин, электролиты) |
Гемоглобин и тромбоциты могут значительно упасть во время первых дней инфузии.
Преходящее повышение уровня трансаминаз в течение первых нескольких дней инфузии. Рекомендация: контроль ОАК и биохимии 3 раза в первую неделю и еженедельно после курса. |
|
Исследование КМ в 1-й день
|
Всем пациентам
|
|
Исследование КМ в 15-й день
|
Только если MRD ³ 5% в начале курса
|
|
Исследование КМ в 29-й день
|
Обязательно только в том случае, если в каком-либо организме обнаружен резидуальный лейкоз.
В противном случае, необязательный. |
|
Анализ СМЖ с каждым интратекальным введением химиотерапии
|
Тройная интратекальная терапия по протоколу в зависимости от возраста.
Подсчет клеток спинномозговой жидкости, морфология. |
Схема терапии блинатумомабом
1-й курс блинатумомаба для пациентов весом до 45 кг[1].
|
Предфаза
|
|||
|
Блинатумомаб
|
5 мкг/м2/сут
|
В/в непрерывно в
течение 24 часов |
В течение 7 дней
|
|
Курс
|
|||
|
Блинатумомаб
|
15 мкг/м2/сут
|
В/в непрерывно в
течение 24 часов |
В течение 21 дня
|
Пациенты весом более 45 кг:
Для пациентов весом более 45 кг доза составляет 28 мкг/день.
Блинатумомаб следует начинать с дозы 9 мкг/день в течение первых 7 дней, а затем увеличивали до 28 мкг/день в течение 8-28 дней.
Наиболее частые побочные эффекты блинатумомаба:
-
синдром выброса цитокинов, который проявляется лихорадкой с ознобом, одышкой, чувством слабости и головокружением, отеками. Синдром высвобождения цитокинов представляет собой совокупность воспалительных симптомов, возникающих в результате воздействия Т-клеток. У многих пациентов симптомы выражены слабо и напоминают грипп с лихорадкой и миалгией. Однако, у некоторых пациентов наблюдается синдром серьезной воспалительной реакции, включающий синдром капиллярной утечки, гипотонию, отек легких, коагулопатию (ДВС-синдром), приводящая к полиорганной недостаточности; гипертермию, астению, головную боль, повышение АД, повышение общего билирубина и тошноту;
-
неврологические явления (головная боль, энцефалопатия, лeйкоэнцефалопатия, судороги, расстройства речи, нарушения сознания, в т.ч. спутанность сознания и дезориентацию, расстройства координации и равновесия);
-
инфекционные осложнения (сепсис, пневмонию, бактериемию, оппортунистические инфекции и инфекции в месте введения катетер);
-
снижение показателей общего анализа крови (лейкоцитов, тромбоцитов, эритроцитов и гемоглобина);
-
повышение ферментов печени (необходим мониторинг концентрации AЛT, ACT, ГГТ и общего билирубина в крови);
-
синдром лизиса опухоли (СЛО);
-
панкреатит.
|
NB!
Не промывайте линию инфузии центрального катетера во время капельного введения блинатумомаба! |
|
NB!
При введении через центральный катетер, блинатумомаб следует вводить через отдельный просвет катетера! |
Сопроводительная терапия при применении Блинатумомаб:
-
дексаметазон 5 мг/м2 (но не более 20 мг) в/в за 30–60 минут до начала инфузии блинатумомаба(в 1 день первого цикла терапии);
-
парацетамол 10 мг/кг/день рекомендуется в течение первых 48 часов каждого цикла терапии перорально или внутривенно для снижения интоксикации.
Интратекальная химиотерапия при применении Блинатумомаб:
С целью профилактики рецидива ОЛЛ в центральной нервной системе дозы метотрексата, цитарабина и преднизолона, адаптированные к возрасту, вводят на 15 и 28 дни инфузии блинатумомаба.
При рецидивах ЦНС3 также в 1-й день 1-й недели.
Рекомендуется следующий цикл начинать через 1 или 2 недели после окончания инфузии блинатумомаба, в зависимости от показателей крови пациента и функциональных проб печени.
При рецидивах ЦНС3 также в 1-й день 1-й недели.
Рекомендуется следующий цикл начинать через 1 или 2 недели после окончания инфузии блинатумомаба, в зависимости от показателей крови пациента и функциональных проб печени.
|
NB!
Обеспечить разведение Блинатумомаб согласно инструкции к препарату! |
Инотузумаб озогамицин [1,58,59]
Курс Инотузумаб озогамицина представляет собой внутривенное введение препарата один раз в неделю в течение трех недель.
Эффективная дозировка у детей: 1,8 мг/м2 на курс, состоящая из 0,8 мг/м2 на
-
й день, по 0,5 мг/м2 на 8-й и 15-й дни.
Количество курсов терапии может варьировать от одного до пяти – в зависимости от результатов лечения.
Критерии для начала и проведения курса:
-
восстановление показателей крови (нейтрофилы ≥ 0,5 x 109/л, тромбоциты ≥ 50 x 109/л);
-
мукозит менее 3 степени;
-
отсутствие существенной органной дисфункции;
-
общий билирубин ≤ 3 от общей нормы, если у пациента не подтвержден синдром Жильбера, АСТ/АЛАТ ≤ 10 от общей нормы;
-
отсутствие неконтролируемой инфекции;
-
отсутствие предшествующего синдрома синусоидальной обструкции.
|
NB!
Обеспечить разведение Инотузумаб озогамицин согласно инструкции к препарату! |
Сопроводительная терапия:
-
дексаметазон 5 мг/м2 за 30 – 60 минут до начала каждой инфузии инотузумаба;
-
парацетамол 15 мг/кг/доза за 30 – 60 минут до начала каждой инфузии инотузумаба;
-
хлорфенамин 0,15 мг/кг/доза за 30–60 минут до начала каждой инфузии инотузумаба.
Оценка эффективности терапии проводится по контрольной миелограмме на 21-й день, достижение негативного значения МИБ (< 10-4) по данным проточной цитометрии.
Наиболее частые побочные эффекты Инотузумаб озогамицина:
-
повышение температуры;
-
инфекционные осложнения;
-
повышение ферментов печени;
-
снижение показателей общего анализа крови.
Назначение лечения пациентам, которым впоследствии планируется проведение ТГСК, требует тщательного планирования, так как может развиться тяжелое поражение печени.
Резервные схемы химиотерапии при рефрактерных формах острых лимфобластных лейкозов (терапия спасения)[1,41-44, 54-63]
В качестве резервной схемы химиотерапии, индуцирующей ремиссии у больных с крайне неблагоприятным течением острых лейкозов, применяются флударабин-содержащие схемы FLAG и FLAG-Ida (флударабин, высокие дозы Ara-C, гранулоцитарный колониестимулирующий фактор (G-CSF) и c добавлением идарубицина или без него.
Эти стандартные химиотерапевтические подходы применимы как к ОЛЛ из В- клеточных предшественников, так и к T-ОЛЛ.
Данная химиотерапия направлена на уменьшение объема опухолевой массы до максимально возможного уровня комбинациями препаратов, обладающих минимальной органной токсичностью и позволяет пролонгировать ремиссию на время подготовки к выполнению аллоТГСК и поиска донора (родственного, неродственного).
Решение о выборе FLAG или FLAG-Ida основывается на сопутствующих заболеваниях пациента (кумулятивная доза антрациклинов и сердечная недостаточность) и заключении МДГ.
G-CSF вводили за 1 день до химиотерапии в течение 7 дней подряд и снова через 2 недели для ускорения восстановления нейтрофилов.
Восстановление кроветворения у пациентов после FLAG и FLAG-Ida наблюдается в среднем на 19-й день (диапазон 12–38 дней). Скорость восстановления гемопоэза коррелирует с количеством осложнений.
Эффективность индукционного лечения оценивается методом аспирации костного мозга после восстановления показателей крови: костномозговые бласты < 5%, отсутствие экстрамедуллярного заболевания, абсолютное количество нейтрофилов ≥ 1,0. × 10 9 /л и количество тромбоцитов ≥ 100 × 109/л.
Схема терапии:
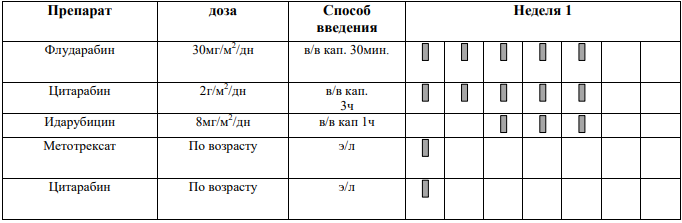

Интратекальная химиотерапия
Адаптированные к возрасту дозы МТХ, ARA-C и Pred вводят за день до химиотерапии.
Дозы интратекальной химиотерапии тремя препаратами
|
Возраст
(г.) |
Метотрексат
(мг) |
Цитозар
(мг) |
Преднизолон
(мг) |
0,9% NaCl
(ml) |
|
< 1
|
6
|
16
|
4
|
1,5
|
|
1
|
8
|
20
|
6
|
2,0
|
|
2
|
10
|
26
|
8
|
2,5
|
|
>3
|
12
|
30
|
10
|
3,0
|
Проведение химиотерапии
|
Наименование ЛС
|
Применение ЛС
|
|
G-CSF
|
Доза: 5–10 мкг/кг/сут.
Способ введения: подкожно. Дни: 0 – 6 дни. |
|
Флударабин
|
Доза: 30 мг/м2/сут.
Способ введения: в/в инфузия в течение 30 мин Дни недели: в дни 1-5 |
|
(HD) ARA-C
|
Доза: 2 г/ м2/сут.
Способ введения: в виде 4-часовой инфузии каждые 12 часов (через 4 часа от начала флударабина) Дни недели: в дни 1-5 Управление токсичностью: Профилактика конъюнктивита глазными каплями с дексаметазоном каждые 6 часов во время приема и профилактика нейропатии витамином B6 в дозе 100мг/м2 в/в, рекомендуется перед каждой дозой ARA-C. |
|
Идарубицин
|
Доза: 8 мг/м2/сут.
Способ введения: в/в инфузия в течение 30 мин Дни недели: в дни 3-5 |
Ожидаемые токсические осложнения после схемы FLAG ± Ida: постцитостатическая энтеропатия II–III степени, кардиомиопатия III степени, токсическая энцефалопатия II степени, флударабин-ассоциированный гемолиз.
На фоне нейтропении III–IV степени могут отмечаться инфекционные осложнения: пневмония, сепсис, инвазивный аспергиллез легких, фебрильная нейтропения.
Применение Бортезомиб[54,55]
Применяется в рамках таргетной терапии
Продолжительность терапии: Рекомендуемая начальная доза составляет 1.3 мг/м2 2 раза/нед. в течение 2 недель (дни 1, 4, 8 и 11), с последующим 10-дневным перерывом (дни 12 - 21). Цикл лечения составляет 21 день.
Продолжительность терапии: Рекомендуемая начальная доза составляет 1.3 мг/м2 2 раза/нед. в течение 2 недель (дни 1, 4, 8 и 11), с последующим 10-дневным перерывом (дни 12 - 21). Цикл лечения составляет 21 день.
CAR Т-клеточная терапия [48-50]
Одним из основных методов лечения пациентов с прогрессирующим В- клеточным вариантом ОЛЛР была адаптивная клеточная терапия для достижения эффекта «трансплантат против лейкоза» посредством аллогенной ТГСК или инфузии донорскими лимфоцитами, что в свою очередь приводит к значительному риску РТПХ. В настоящее время трансплантация костного мозга является единственным методом лечения рецидивов или резистетного В-ОЛЛ, но многие пациенты не могут являться кандидатами на трансплантацию из-за возраста или прогрессирования заболевания. Создание Т-клеток с химерным антигенным рецептором (CAR) для лечения ОЛЛ представляет собой значительный прогресс и показало значительно более высокую общую выживаемость по сравнению с существующими схемами. Пациенты, которые ранее трансплантированы из-за плохого статуса ремиссии, могут достичь полного ответа и рассматриваться на проведение ТКМ. Терапия CAR Т- клетками основана на генетическом манипулировании Т-клетками пациента с целью достижения ответа против лейкемического клеточного поверхностного антигена CD19. CAR Т-клеточная терапия была рекомендована для ускоренного одобрения консультативным комитетом FDA в июле 2017 г. и полностью одобрена FDA в августе 2017 г. для лечения пациентов в возрасте до 25 лет с резистетным или рецидивирующим B-ОЛЛ.
Рекомендации по снижению доз химиопрепаратов в группе высокого риска
-
Снижение доз химиотерапевтических перпаратов является исключением в случае неприемлемой токсичности или значительной задержки лечения из-за непереносимости лечения.
-
Необходимость снижения дозы следует оценивать перед каждым элементом лечения.
Дозу одного или нескольких цитотоксических препаратов можно уменьшить до 2/3 от запланированной по протоколу дозировки.
В случае тяжелой токсичности, связанной с МТХ, такой как мукозит, токсическое действие на печень, почечная недостаточность и нарушение элиминации, высокие дозы МТХ могут быть назначены с более короткой продолжительностью инфузии – 24 часа, при более низкой дозе 500 мг/м² и/или ранее назначение кальций/натрий фолината, в конечном итоге в более высоких (например, двойных) дозах.
В случае диабета, связанного с назначением кортикостероидов, следует уменьшить дозу DEXA и назначить инфузию без глюкозы.
В случае осложнений, связанных с аспарагиназой, таких как тромбоз или панкреатит, применение аспарагиназы может быть отложено или даже отменено.
Снижение доз для конкретных препаратов[1]:
Винкристин:
У пациентов с нарушением функции печени (прямой уровень билирубина в сыворотке> 3 мг / 100 мл (> 1 мкмоль/л) дозу винкристина следует уменьшить до 50%.
При появлении паралича следует прекратить прием винкристина, что особенно характерно для детей раннего возраста и в большинстве случаев обратимо после отмены.
Следует контролировать работу желудочнокишечного тракта и не допускать развития запора.
Возможно развитие гипертонии/гипотензии, а также легочной дисфункции (острая одышка и тяжелый бронхоспазм), в связи с этим необходимо контролировать артериальное давление, а также клинический статус пациентов.
Нейротоксические эффекты могут усиливаться при назначении винкристина с другими нейротоксическими препаратами, такими как Бортезомиб, при облучении спинного мозга и текущем неврологическом заболевании.
Комбинированная химиотерапия, включающая винкристин вместе с фенитоином, приводит к снижению уровня противосудорожного средства в крови и может увеличить судорожную активность.
Не рекомендуется одновременно назначение с противогрибковыми препаратами, ингибирующими метаболизм изоферментом цитохрома P450 в печени в связи с усилинием побочных нервно-мышечные эффектов (нейропатии).
Митоксантрон
Необходимы регулярные кардиологические исследования, особенно у пациентов с максимальной кумулятивной дозой антрациклинов или кумулятивной дозой митоксантрона ≥160 мг / м2.
Инфекции следует лечить до начала лечения митоксантроном, проявлять осторожность у пациентов с панцитопенией и тяжелой раневой инфекцией, необходим регулярный мониторинг гематологических параметров с возможным изменением дозы.
Тщательное наблюдение рекомендуется за пациентами с тяжелой печеночной недостаточностью, отеками, асцитом или плевральным выпотом.
Противопоказаниями к применению являются выраженная миелосупрессия и повышенная чувствительность к митоксантрону.
Тщательное наблюдение рекомендуется за пациентами с тяжелой печеночной недостаточностью, отеками, асцитом или плевральным выпотом.
Противопоказаниями к применению являются выраженная миелосупрессия и повышенная чувствительность к митоксантрону.
Метотрексат
МТХ в сочетании с нестероидными противовоспалительными препаратами может привести к миелосупрессии и токсичности для желудочно-кишечного тракта, а в высоких дозах – к повышенным и продолжительным уровням МТХ в сыворотке крови из-за снижения канальцевой секреции. Подобные эффекты могут наблюдаться при назначении ингибиторов протонной помпы. Пенициллин и ципрофлоксацин, могут снижать почечный клиренс МТХ. Другие пероральные антибиотики, такие как тетрациклин, хлорамфеникол и невсасывающиеся антибиотики широкого спектра действия, могут снижать кишечную абсорбцию или влиять на энтерогепатическое кровообращение, подавляя кишечную флору и метаболизм МТХ бактериями. Салицилаты, фенитоин, сульфаниламиды и фенилбутазон, могут усилить токсичность МТХ. При приеме в комбинации с ARA-C может увеличиваться риск неврологических побочных эффектов.
У пациентов с почечной недостаточностью МТХ следует снизить от 25% до 50% при клиренсе креатинина 20-50 мл/мин и не назначать его при клиренсе креатинина <20 мл/мин.
Коррекция дозы Метотрексата при почечной дисфункции
У пациентов с почечной недостаточностью МТХ следует снизить от 25% до 50% при клиренсе креатинина 20-50 мл/мин и не назначать его при клиренсе креатинина <20 мл/мин.
Коррекция дозы Метотрексата при почечной дисфункции
|
Клиренс креатинина
|
Уровень креатинина
|
Доза Метотрексата
|
|
-
|
132,6-176,8 мкмоль/л
|
Снижается на 25%
|
|
30-60 мл/мин
|
Более 176,8 мкмоль/л
|
Снижается на 50%
|
|
Менее 30 мл/мин
|
-
|
Препарат отменяется
|
Пациентам с текущим или предыдущим заболеванием печени необходимо тщательное наблюдение, при постоянном повышении уровней билирубина и АСТ – снижение дозы или прекращение приема МТХ.
Коррекция дозы Метотрексата при печеночной дисфункции
|
Уровень билирубина
|
Уровень АСТ
|
Дозировка метотрексата
|
|
50-80 мкмоль/л
|
Более 180 мл/дл
|
Снижается на 25%
|
|
Более 80 мкмоль/л
|
-
|
Препарат отменяется
|
Прекратить прием МТХ в случае возникновения диареи, рвоты или черного стула из-за риска геморрагического энтерита или смерти от перфорации кишечника. В случаях пневмонита необходимо прекратить прием МТХ. И провести рентген грудной клетки для диагностики пневмонии.
Из – за светочувствительности МТХ следует избегать воздействия солнечных лучей на флакон (прикрывать флакон от света).
Витаминные препараты или другие продукты, содержащие фолиевую кислоту или ее производные, могут снизить эффективность МТХ.
Если после первого курса HD-Mtx развиваются нейтротоксические осложнения или мукозит III-IV степени, то в последующем курсе доза препарата снижается на 25-50%.
Противопоказаниями для применения МТХ являются тяжелая печеночная недостаточность, тяжелая почечная недостаточность (клиренс креатинина <20 мл/мин), затруденность мочеиспускания, цистит, нарушение функции почек, печеночная недостаточность и острые инфекции, серьезные инфекции, такие как туберкулез и ВИЧ, язвы полости рта и известные активные язвы желудочно- кишечного тракта и уровень билирубина> 5 мг/дл (85,5 мкмоль/л).
Из – за светочувствительности МТХ следует избегать воздействия солнечных лучей на флакон (прикрывать флакон от света).
Витаминные препараты или другие продукты, содержащие фолиевую кислоту или ее производные, могут снизить эффективность МТХ.
Если после первого курса HD-Mtx развиваются нейтротоксические осложнения или мукозит III-IV степени, то в последующем курсе доза препарата снижается на 25-50%.
Противопоказаниями для применения МТХ являются тяжелая печеночная недостаточность, тяжелая почечная недостаточность (клиренс креатинина <20 мл/мин), затруденность мочеиспускания, цистит, нарушение функции почек, печеночная недостаточность и острые инфекции, серьезные инфекции, такие как туберкулез и ВИЧ, язвы полости рта и известные активные язвы желудочно- кишечного тракта и уровень билирубина> 5 мг/дл (85,5 мкмоль/л).
Циклофосфамид
Циклофосфамид следует снизить на 25% в случае печеночной недостаточности (уровень билирубина в сыворотке составляет 3-5 мг/дл (0,053-0,086 ммоль/л)).
При почечной недостаточности (СКФ <10 мл/мин) дозу следует снизить на 50%. Противопоказания такие же, как и для ифосфамида. Ифосфамид и циклофосфамид поддаются диализу в случае передозировки.
В сочетании с другими лекарственными средствами аллопуринол, азатиоприн, хлоралгидрат, циметидин, дисульфирам и ингибиторы протеаз, ингибиторы АПФ, тиазидные диуретики, зидовудин увеличивают цитотоксические метаболиты и могут привести к повышению токсичности циклофосфамида.
При почечной недостаточности (СКФ <10 мл/мин) дозу следует снизить на 50%. Противопоказания такие же, как и для ифосфамида. Ифосфамид и циклофосфамид поддаются диализу в случае передозировки.
В сочетании с другими лекарственными средствами аллопуринол, азатиоприн, хлоралгидрат, циметидин, дисульфирам и ингибиторы протеаз, ингибиторы АПФ, тиазидные диуретики, зидовудин увеличивают цитотоксические метаболиты и могут привести к повышению токсичности циклофосфамида.
Этопозид
Этопозид следует уменьшить до 75% дозы, если клиренс креатина составляет 15-50 мл/мин. Следует регулярно контролировать параметры почек и печени. Бактериальные инфекции следует лечить до начала терапии, проявлять особую осторожность при опоясывающем герпесе.
Цитарабин
Описана нейротоксичность высоких доз ARA-C, особенно при почечной или печеночной недостаточности. Поэтому следует регулярно контролировать функцию печени и почек. Возможен цитарабиновый синдром с лихорадкой, миалгией, болью в костях, иногда болью в груди, макулопапулезной сыпью, конъюнктивитом и недомоганием, обычно через 6-12 часов после приема препарата. При лечении или профилактике этого синдрома назначаются кортикостероиды.
Даунорубицин
Необходимо контролировать функцию печени и почек, перед началом терапии и во время лечения, мониторинг сердечной функции.
Даунорубицин следует снизить при печеночной недостаточности до 75% от нормальной дозы, если билирубин в сыворотке составляет 1,2-3 мг/дл (20,3-50,8 мкмоль/л, и до 50%, если билирубин в сыворотке> 3 мг / дл (> 50,8 мкмоль / л).
При почечной недостаточности (креатинин в сыворотке> 3 мг/дл (>265 мкмоль/л). Даунорибицин и другие антрациклины повышают риск кардиотоксичности.
Кумулятивная доза даунорубицина не должна превышать 500-600 мг/м2 для взрослых или 400 мг/м2 для пациентов, которые ранее получали лучевую терапию грудной клетки или ранее принимали другие потенциально кардиотоксические препараты.
В случае экстравазации инфузию следует прекратить и приподнять пораженную конечность.
Даунорубицин приводит к повышенному риску кровотечения в сочетании с аспирином, клопидогрелем, дипиридамолом и другими препаратами, ингибирующими агрегацию тромбоцитов.
Даунорубицин следует снизить при печеночной недостаточности до 75% от нормальной дозы, если билирубин в сыворотке составляет 1,2-3 мг/дл (20,3-50,8 мкмоль/л, и до 50%, если билирубин в сыворотке> 3 мг / дл (> 50,8 мкмоль / л).
При почечной недостаточности (креатинин в сыворотке> 3 мг/дл (>265 мкмоль/л). Даунорибицин и другие антрациклины повышают риск кардиотоксичности.
Кумулятивная доза даунорубицина не должна превышать 500-600 мг/м2 для взрослых или 400 мг/м2 для пациентов, которые ранее получали лучевую терапию грудной клетки или ранее принимали другие потенциально кардиотоксические препараты.
В случае экстравазации инфузию следует прекратить и приподнять пораженную конечность.
Даунорубицин приводит к повышенному риску кровотечения в сочетании с аспирином, клопидогрелем, дипиридамолом и другими препаратами, ингибирующими агрегацию тромбоцитов.
ПЭГ-аспарагиназа
При приеме ПЭГ-аспарагиназы могут возникнуть нарушения свертывания крови и панкреатит с гипергликемическим риском. Поэтому до начала введения необходим контроль следующих показателей:
-
Коагулограмма (уровень фибриногена, ПТИ);
-
Активность АЛТ, АСТ, панкреатической амилазы, уровень билирубина;
-
Уровень альбумина и глюкозы.
-
Развитие лейкопении (нейтропении) без признаков тяжёлой инфекции не является основанием для отказа от терапии ПЭГ-аспарагиназой или отмены препарата.
Введение ПЭГ-аспарагиназы должно быть приостановлено в следующих случаях:
-
в случае аллергической реакции;
-
при снижении протромбинового индекса ниже 70%;
-
при снижении фибриногена ниже 1,0 г/л;
-
при наличии геморрагического синдрома;
-
снижении уровня альбумина менее чем на 50% от исходного;
-
при наличии (развитиии) тромботических осложнений.
Мониторинг активности аспарагиназы и взаимодействия с другими препаратами[1]
Сывороточная активность аспарагиназы рекомендуется мониторировать через 2, 7 и 14 дней после назначения PEG-аспарагиназы (активность должна быть 0,1
МЕ/мл). Исследование активности аспарагиназы является обязательным из-за скрытой инактивации и ранней элиминации.
МТХ и ARA-C, введенные перед L-аспарагиназой, могут усилить эффект аспарагиназы, тогда как последующее введение ослабит эффект. В связи с этим, необходимо соблюдать интервалы введения.
Винкристин увеличивает токсичность и риск анафилактических реакций при одновременном применении или непосредственно перед аспарагиназой. Комбинация с преднизолоном увеличивает риск изменения параметров свертывания, например снижение фибриногена и антитромбина III.
МТХ и ARA-C, введенные перед L-аспарагиназой, могут усилить эффект аспарагиназы, тогда как последующее введение ослабит эффект. В связи с этим, необходимо соблюдать интервалы введения.
Винкристин увеличивает токсичность и риск анафилактических реакций при одновременном применении или непосредственно перед аспарагиназой. Комбинация с преднизолоном увеличивает риск изменения параметров свертывания, например снижение фибриногена и антитромбина III.
Масса тела менее 10 кг
В редких случаях с массой тела менее 10 кг при рецидиве ОЛЛ, дозы препарата рассчитываются в начале каждого блока в соответствии с массой тела, а не с ППТ (площадь поверхности тела) по следующей формуле:
Доза = запланированная доза/м2 BSA x масса тела [кг] / 30
Ожирение
Для пациентов с избыточной массой тела нет общих рекомендаций по снижению дозы. Для отдельных пациентов корректировка дозы в связи с токсичностью может производиться в соответствии с рекомендациями, приведенными в главе (Рекомендации по снижению дозы).
Для пациентов с избыточной массой тела нет общих рекомендаций по снижению дозы. Для отдельных пациентов корректировка дозы в связи с токсичностью может производиться в соответствии с рекомендациями, приведенными в главе (Рекомендации по снижению дозы).
ЛУЧЕВАЯ ТЕРАПИЯ[1]
ЛТ проводится при поражении ЦНС, яичек. В случае сохранения лейкемии в других экстрамедуллярных участках, таких как средостение, лимфатические узлы, кости, кожа или другие органы, может потребоваться местная ЛТ. ЛТ назначается перед или во время режима кондиционирования при алло-ТГСК у больных группы HR.
Пациенты с поражением ЦНС получают краниальное облучение в дозе 18 Грэй (Гр) и не получают интратекальную терапию во время поддерживающего лечения. Мальчики с рецидивом яичек получают лучевую терапию зоны поражения.
Пациенты с поражением ЦНС получают краниальное облучение в дозе 18 Грэй (Гр) и не получают интратекальную терапию во время поддерживающего лечения. Мальчики с рецидивом яичек получают лучевую терапию зоны поражения.
ЛТ у пациентов с рецидивом ЦНС
Пациентам с рецидивом ЦНС проводится облучение черепа и трех верхних шейных сегментов.
Пациентам с рецидивом ЦНС, не подходящим для аллогенной ТГСК, после завершения интенсивной химиотерапии проводят облучение черепа и трех верхних шейных сегментов в дозе, зависящей от группы лечения.
При изолированном рецидиве ЦНС проводится краниоспинальное облучение. Использование тиопуринов во время краниального облучения может предрасполагать к возникновению опухолей головного мозга: при облучении ЦНС тиопурины не используются.
Пациентам с рецидивом ЦНС, не подходящим для аллогенной ТГСК, после завершения интенсивной химиотерапии проводят облучение черепа и трех верхних шейных сегментов в дозе, зависящей от группы лечения.
При изолированном рецидиве ЦНС проводится краниоспинальное облучение. Использование тиопуринов во время краниального облучения может предрасполагать к возникновению опухолей головного мозга: при облучении ЦНС тиопурины не используются.
Детям в возрасте до 2 лет с заболеванием ЦНС на момент постановки диагноза ЛТ черепа не проводится (нарушение нейрокогнитивных функций).
Между возрастом 2 и 4 года, противопоказание к лучевой терапии относительное, лечащий врач должен взвесить пользу и токсичность, дальше принять решение. Пациенты, которые не могут получать лучевую терапию, могут либо лечиться CAR- T-клетками в случае показаний к аллогенной ТГСК, либо получать 12 доз интратекальной терапии каждые 4 недели во время поддерживающей терапии в соответствии с лечебной группой.
В зависимости от возраста пациента и совокупной дозы облучения во время начального лечения, доза, облучение ЦНС в дополнение к тотальному облучению тела во время режима кондиционирования для алло-ТГСК, должна быть увеличена до 18 Гр, дополнительно дается 6 Гр., без превышения общей кумулятивной дозы на область ЦНС 24 Гр.
Альтернативные схемы кондиционирования описаны в протоколах ТГСК. Пациентам, не получавшим тотальное облучение тела, будет проводиться облучение ЦНС в дозе 18 Гр в суточных долях от 1,5 до максимум 2,0 Гр.
Если предыдущее облучение превышало 18 Гр (15 Гр для детей в возрасте до двух лет), доза облучения снижается до 15 Гр.
Если интервал от первого курса лучевой терапии меньше 24 месяцев, а предыдущая доза облучения превышает 15 Гр (12 Гр для детей в возрасте до двух лет), дозу облучения следует снизить до 15 Гр.
Во время последующего наблюдения необходимы регулярные офтальмологические обследования для выявления и лечения катаракты своевременно.
Применение тиопуринов во время краниального облучения может предрасполагать к возникновение опухолей головного мозга. Поэтому тиопурины не используются при облучении ЦНС.
Противопоказание для проведения краниальной лучевой терапии:
Между возрастом 2 и 4 года, противопоказание к лучевой терапии относительное, лечащий врач должен взвесить пользу и токсичность, дальше принять решение. Пациенты, которые не могут получать лучевую терапию, могут либо лечиться CAR- T-клетками в случае показаний к аллогенной ТГСК, либо получать 12 доз интратекальной терапии каждые 4 недели во время поддерживающей терапии в соответствии с лечебной группой.
В зависимости от возраста пациента и совокупной дозы облучения во время начального лечения, доза, облучение ЦНС в дополнение к тотальному облучению тела во время режима кондиционирования для алло-ТГСК, должна быть увеличена до 18 Гр, дополнительно дается 6 Гр., без превышения общей кумулятивной дозы на область ЦНС 24 Гр.
Альтернативные схемы кондиционирования описаны в протоколах ТГСК. Пациентам, не получавшим тотальное облучение тела, будет проводиться облучение ЦНС в дозе 18 Гр в суточных долях от 1,5 до максимум 2,0 Гр.
Если предыдущее облучение превышало 18 Гр (15 Гр для детей в возрасте до двух лет), доза облучения снижается до 15 Гр.
Если интервал от первого курса лучевой терапии меньше 24 месяцев, а предыдущая доза облучения превышает 15 Гр (12 Гр для детей в возрасте до двух лет), дозу облучения следует снизить до 15 Гр.
Во время последующего наблюдения необходимы регулярные офтальмологические обследования для выявления и лечения катаракты своевременно.
Применение тиопуринов во время краниального облучения может предрасполагать к возникновение опухолей головного мозга. Поэтому тиопурины не используются при облучении ЦНС.
Противопоказание для проведения краниальной лучевой терапии:
-
возраста младше 3-х лет.
В случаях наличия противопоказания к данной терапии или отказа от данного лечения законных представителей пациента рекомендованы дополнительные тройные дозы интратекальной химиотерапии вовремя поддерживающей терапии.
ЛТ у пациентов с рецидивом яичка
Терапия рецидива яичка может быть с применением орхиэктомии и уменьшенного облучения контралатерального не вовлеченного яичка или включая облучение полной дозой обоих яичек по усмотрению лечащего центра. После дозы 24 Гр следует ожидать атрофии облученного яичка и отсутствия эндокринной функции. В случае алло-ТГСК орхиэктомию следует выполнять при поражении яичка (рецидив яичка) или во время ранней консолидации. В дополнение к облучению всего тела в дозе 12 Гр, необходимо дополнительно повысить дозу 6 Гр для клинически пораженных, но не удаленных яичек.
Варианты ЛТ:
Вариант 1: Орхиэктомия и уменьшение облучения контралатерального яичка:
В случае одностороннего клинического поражения во время процедуры орхиэктомии следует взять биопсию контралатерального яичка.
Если биопсия не показывает вовлечения, проводится местное облучение с дозой 15 Гр или кумулятивной дозой 18 Гр в контексте ТОТ.
Ожидается, что после этой дозы остаточная эндокринная функция будет достаточной и позволит спонтанно наступить половому созреванию.
Если при биопсии выявлено поражение контрлатерального яичка (наличие лейкемических клеток), то проводится удаление яичка.
Если не выполнена биопсия клинически не вовлеченного яичка, то следует облучить его дозой 18 Гр.
Поражение яичек, подтвержденное только ультразвуком без клинического увеличения, должно быть подтверждено биопсией и рассматриваться как клинически не вовлеченное яичко, пока не будет доказано обратное с помощью биопсии.
Вариант 2 (в случае поражения обоих яичек):
Мальчики с инфильтрацией яичек и не удаленными яичками при обращении получают местное облучение обоих яичек (независимо от стороны и степени поражения) с усилением 12 Гр дополнительно к ТОТ (кумулятивная доза 24 Гр).
В случае одностороннего клинического поражения во время процедуры орхиэктомии следует взять биопсию контралатерального яичка.
Если биопсия не показывает вовлечения, проводится местное облучение с дозой 15 Гр или кумулятивной дозой 18 Гр в контексте ТОТ.
Ожидается, что после этой дозы остаточная эндокринная функция будет достаточной и позволит спонтанно наступить половому созреванию.
Если при биопсии выявлено поражение контрлатерального яичка (наличие лейкемических клеток), то проводится удаление яичка.
Если не выполнена биопсия клинически не вовлеченного яичка, то следует облучить его дозой 18 Гр.
Поражение яичек, подтвержденное только ультразвуком без клинического увеличения, должно быть подтверждено биопсией и рассматриваться как клинически не вовлеченное яичко, пока не будет доказано обратное с помощью биопсии.
Вариант 2 (в случае поражения обоих яичек):
Мальчики с инфильтрацией яичек и не удаленными яичками при обращении получают местное облучение обоих яичек (независимо от стороны и степени поражения) с усилением 12 Гр дополнительно к ТОТ (кумулятивная доза 24 Гр).
Техника и доза облучения
ЛТ проводится с использованием высоэнергетических линейных ускорителей ковольтной техники. Должна быть обеспечена точная воспроизводимость ежедневного позиционирования (например, с использованием масок для иммобилизации).
Во время облучения ЦНС индивидуальные аттенюаторы защищают висцеральный череп и передние мягкие ткани шейного отдела.
В поле облучения должны быть включены ретроорбитальные пространства и основание черепа.
Если облучается весь нейроаксис, следует избегать перерывов в дозировках и перекрытия соседних полей, используя компенсацию дивергенции.
Из-за низкого фронтального основания черепа у детей до двух лет защита глазных линз (хрусталика) не всегда возможна. Следовательно, во время последующего наблюдения необходимы регулярные офтальмологические осмотры для своевременного выявления и лечения лучевой катаракты.
Особое внимание уделяется равномерному распределению дозы облучения.
Как правило, все поля облучаются на каждом сеансе.
Во время облучения ЦНС индивидуальные аттенюаторы защищают висцеральный череп и передние мягкие ткани шейного отдела.
В поле облучения должны быть включены ретроорбитальные пространства и основание черепа.
Если облучается весь нейроаксис, следует избегать перерывов в дозировках и перекрытия соседних полей, используя компенсацию дивергенции.
Из-за низкого фронтального основания черепа у детей до двух лет защита глазных линз (хрусталика) не всегда возможна. Следовательно, во время последующего наблюдения необходимы регулярные офтальмологические осмотры для своевременного выявления и лечения лучевой катаракты.
Особое внимание уделяется равномерному распределению дозы облучения.
Как правило, все поля облучаются на каждом сеансе.
Разовая фракция должна иметь минимальную дозу 1,5 Гр и максимальную дозу 2,0 Гр (1,8 Гр для детей в возрасте до 2 лет), и ее следует вводить 5 раз в неделю.
Чтобы свести к минимуму риск лейкоэнцефалопатии, облучение ЦНС начинают только после завершения интенсивной фазы лечения, то есть после последнего блока. В случае аллогенной ТГСК с режимом кондиционирования, содержащим ТОТ, в качестве дополнительного/boost (облучение высокой дозой) применяется облучение ЦНС.
Чтобы свести к минимуму риск лейкоэнцефалопатии, облучение ЦНС начинают только после завершения интенсивной фазы лечения, то есть после последнего блока. В случае аллогенной ТГСК с режимом кондиционирования, содержащим ТОТ, в качестве дополнительного/boost (облучение высокой дозой) применяется облучение ЦНС.
Другие формы локальной терапии нейролейкоза в случае невозможности проведения лучевой терапии
-
Интратекальная химиотерапия
Пациенты могут пройти интратекальную химиотерапию во время диагностической люмбальной пункции, если диагноз рецидива ОЛЛ уже подтвержден на тот момент.
График и доза интратекальной химиотерапии описаны в главах соответствующей лечебной группы.
График и доза интратекальной химиотерапии описаны в главах соответствующей лечебной группы.
-
Интенсивная интратекальная терапия у пациентов с поражением ЦНС
Пациенты с поражением ЦНС на момент постановки диагноза должны еженедельно получать интратекальную химиотерапию в соответствии с индивидуальной лечебной группой до тех пор, пока два последовательных результата СМЖ будут чистыми от бластных клеток.
Интервал между интратекальными инъекциями должен составлять не менее пяти дней. Тройная интратекальная химиотерапия назначается в зависимости от возраста.
Интервал между интратекальными инъекциями должен составлять не менее пяти дней. Тройная интратекальная химиотерапия назначается в зависимости от возраста.
Общие принципы управления токсичностью химиопрепаратов[1]
-
МТХ – нарушение всасывания
Уровень МТХ в сыворотке через 48 часов после начала инфузии МТХ обычно ниже 0,5 мкмоль/л.
В противном случае назначение кальций/натрий фолината продлевается с шестью часовыми интервалами сверх запланированных доз через 48 и 54 часа, пока уровень МТХ не упадет ниже 0,25 мкмоль/л.
Доза кальций/натрий фолината зависит от уровня МТХ и рассчитывается как 15 мг/м², противодействующая МТХ сыворотки до 1 мкмоль/л. Если уровень МТХ через 48 часов >2,0 мкмоль/л, дополнительно применяют щелочной диурез от 3 до 4,5 л/м2.
В противном случае назначение кальций/натрий фолината продлевается с шестью часовыми интервалами сверх запланированных доз через 48 и 54 часа, пока уровень МТХ не упадет ниже 0,25 мкмоль/л.
Доза кальций/натрий фолината зависит от уровня МТХ и рассчитывается как 15 мг/м², противодействующая МТХ сыворотки до 1 мкмоль/л. Если уровень МТХ через 48 часов >2,0 мкмоль/л, дополнительно применяют щелочной диурез от 3 до 4,5 л/м2.
Если уровень МТХ через 48 часов >5 мкмоль/л или в случаях выраженной непереносимости с сильной рвотой, диареей и неврологическими симптомами, следует рассмотреть возможность применения карбоксипептидазы.
Карбоксипептидаза приводит к ферментативному расщеплению МТХ.
Если снижение выведения МТХ очевидно через 36 часов (уровень МТХ >10 мкмоль/л), рекомендуется установить уровень МТХ в сыворотке через 42 часа. В этом случае введение кальций/натрий фолината должно быть скорректировано до дозы, эквивалентной дозе, рекомендованной схемой спасения, через 42 часа (15 мг/м² противодействуют МТХ сыворотки до 1 мкмоль/л).
Если значение >5 мкмоль / л, доза фолиевой кислоты рассчитывается по следующей формуле: кальций/натрий фолинат (мг) = МТХ в 42 часа (мкмоль / л) x масса тела (кг).
Карбоксипептидаза приводит к ферментативному расщеплению МТХ.
Если снижение выведения МТХ очевидно через 36 часов (уровень МТХ >10 мкмоль/л), рекомендуется установить уровень МТХ в сыворотке через 42 часа. В этом случае введение кальций/натрий фолината должно быть скорректировано до дозы, эквивалентной дозе, рекомендованной схемой спасения, через 42 часа (15 мг/м² противодействуют МТХ сыворотки до 1 мкмоль/л).
Если значение >5 мкмоль / л, доза фолиевой кислоты рассчитывается по следующей формуле: кальций/натрий фолинат (мг) = МТХ в 42 часа (мкмоль / л) x масса тела (кг).
-
Экстравазация группы антрациклинов или алкалоидов барвинка (винкристин, винбластина)
В случае экстравазации антрациклина экстравазат, а также тканевую жидкость и кровь следует сначала аспирировать, используя существующий венозный доступ, и, если возможно, разбавить путем закапывания физиологического раствора перед удалением сосудистой линии.
Прикладывать «холод» к месту введения препарата в течение нескольких дней.
В случае экстравазации алкалоида барвинка экстравазат, а также тканевую жидкость и кровь следует аспирировать через имеющийся венозный доступ.
Затем гиалуронидазу (150 единиц/мл NaCl 0,9%) следует ввести в эту область, используя существующий венозный доступ, прежде чем удалять ее. Впоследствии пораженная ткань может быть инфильтрирована подкожно с помощью нескольких небольших инъекций гиалуронидазы. Локальная область должна быть в тепле (в отличие от охлаждения, рекомендованного при экстравазации антрациклина).
Если некроз развивается, несмотря на местные меры, следует рассмотреть возможность раннего хирургического вмешательства.
События, связанные с комбинированной химиотерапией, являются нежелательными, но ожидаемыми:
Прикладывать «холод» к месту введения препарата в течение нескольких дней.
В случае экстравазации алкалоида барвинка экстравазат, а также тканевую жидкость и кровь следует аспирировать через имеющийся венозный доступ.
Затем гиалуронидазу (150 единиц/мл NaCl 0,9%) следует ввести в эту область, используя существующий венозный доступ, прежде чем удалять ее. Впоследствии пораженная ткань может быть инфильтрирована подкожно с помощью нескольких небольших инъекций гиалуронидазы. Локальная область должна быть в тепле (в отличие от охлаждения, рекомендованного при экстравазации антрациклина).
Если некроз развивается, несмотря на местные меры, следует рассмотреть возможность раннего хирургического вмешательства.
События, связанные с комбинированной химиотерапией, являются нежелательными, но ожидаемыми:
-
аллергические реакции
-
алопеция
-
кардиомиопатия
-
нарушение свертывания крови
-
синдром Кушинга
-
цистит
-
дерматопатия
-
сахарный диабет
-
диарея
-
утомляемость
-
фебрильная нейтропения
-
геморрагия
-
гепатопатия
-
инфекции
-
мукозит
-
миелосупрессия
-
тошнота / рвота / плохой аппетит
-
некрозы при паравазальной инъекции
-
запор
-
боль
-
панкреатопатия
-
паралитический подилеус
-
периферическая полинейропатия
-
почечная недостаточность
-
тромбоз
Побочное действие аспарагиназы
Токсичность препарата может быть связана с гиперчувствительностью.
Оценка гиперчувствительности проводится следующим образом:
Оценка гиперчувствительности проводится следующим образом:
-
степень – локальные реакции в месте инъекции в виде гиперемии кожи, отека или инфильтрации подкожно-жировой клетчатки диаметром менее 10 см и сохраняющиеся менее 24 часов на фоне терапии антигистаминными/глюкокортикоидными препаратами.
-
степень – уртикарная сыпь (крапивница), сохраняющаяся менее 24 часов на фоне терапии антигистаминными/глюкокортикоидными препаратами.
-
степень – бронхоспазм, отек Квинке.
-
степень – анафилаксия, гипотензия.
Гиперчувствительность 1 и 2 степени (локальная гиперемия кожи, крапивница) не является противопоказанием к продолжению терапии Аспарагиназой. Возможно её применение под прикрытием антигистаминных и стероидных препаратов либо рекомендуется в/в введение аспарагиназы с максимальной продолжительностью инфузии 24 часа с премедикацией антигистаминными или глюкокортикоидными препаратами (например, преднизолон в дозе 1 мг/кг).
Необходимо интенсивное наблюдение за пациентом в течение всего периода инфузии и 2 часа после ее окончания с приготовленными в шприцах растворами адреналина и преднизолона.
Гиперчувствительность 3 и 4 степени (т.е. развитие анафилаксии и/или отёка Квинке и/или бронхоспазма) – является противопоказанием к продолжению терапии аспарагиназой. Однако, возможна попытка замещения на альтернативный препарат. Решение о смене препарата Аспарагиназы принимается МДГ.
Развитие лейкопении (нейтропении) без признаков тяжёлой инфекции не является основанием для отмены аспарагиназы.
У части больных в период лечения аспарагиназой имеются изменения в коагулограмме и снижение альбумина. В большинстве случаев эти изменения не имеют терапевтических последствий. Тем не менее, контроль концентрации антитромбина III (АТ) и фибриногена должен проводиться перед каждым введением L-asp. Дефицит антитромбина III (АТ) требует предварительного введения концентрата человеческого антитромбина перед каждым введением аспарагиназы.
Алгоритм действий при выявлении изменений в коагулограмме:
-
Фибриноген > 0,8 г/л, АТ> 75% – никакой сопроводительной терапии не нужно
-
Фибриноген < 0,8 г/л – СЗП перед введением L-asp
-
АТ – 50 – 75% без тромботического анамнеза – никакой сопроводительной терапии не нужно. Контроль концентрации антитромбина после введения L-asp.
-
АТ – 30 – 50% без тромботического анамнеза – АТ (1 МЕ/кг = 2% в плазме; расчетный уровень 75%) перед введением L-asp и далее как обычно
-
АТ < 30% без тромботического анамнеза – АТ до введения L-asp и после; контроль 2 раза в неделю
-
Предшествующий тромбоз – АТ (1 МЕ/кг = 2% в плазме; расчетный уровень 100%)
Поддерживающая сопроводительная терапия[1,12,19,21-29]
Рекомендуется регулярная профилактика пневмоцистоза, антимикотическая, противоинфекционная профилактика.
Профилактика пневмоцистной инфекции:
Котримоксазол (Сульфаметоксазол + триметоприм), 2-3 мг/кг по триметоприму (10-15 мг/кг по сульфаметоксазолу) два раза в день 2 раза в неделю (например, в субботу и воскресенье). Препарат нельзя назначать в тот же день, что и МТХ. Котримоксазол может вызвать длительную цитопению. Если есть подозрение на это, прием препарата следует приостановить или отменить. В качестве альтернативы следует рассмотреть возможность ингаляции с пентамидином 300 мг один раз в месяц или дапсоном 4 мг/кг еженедельно.
Противогрибковая профилактика:
Суспензия амфотерицина B для местной (слизистая оболочка полости рта и верхних отделов желудочно-кишечного тракта) профилактики кандидоза:
|
Возраст (годы)
|
Амфотерицин В суспензия (мл/д)
|
|
≤1.5
|
4х1
|
|
1,5-2,99
|
4х1,5
|
|
≥ 3
|
4х2
|
Суспензию амфотерицина осторожно распределяют по всей слизистой оболочке рта и затем проглатывают. Если профилактика суспензией амфотерицина невозможна или если молочница становится очевидной, несмотря на профилактику, рекомендуется флуконазол (2-3мг/кг/сут). Контроль за печеночной токсичностью и возможной лекарственной устойчивостью.
Системная антимикотическая профилактика
В случае длительной аплазии может применяться системная противогрибковая профилактика.
Противорвотное лечение
Ондансетрон (две дозы по 5 мг/м2/день) рекомендуется при назначении высоких доз ARA-C, ифосфамида и циклофосфамида. Возможно назначение апрепитанта или дименгидрината, особенно у подростков.
Во время начального лечения очень раннего рецидива, при нейтропении, ниже 0,5x109/л и лихорадки выше 38,5 C необходимо назначение антибактериальных и, возможно, противогрибковых препаратов.
Во время начального лечения очень раннего рецидива, при нейтропении, ниже 0,5x109/л и лихорадки выше 38,5 C необходимо назначение антибактериальных и, возможно, противогрибковых препаратов.
Перечень основных лекарственных средств:
|
Фармакотерапевтическа я группа
|
МНН
лекарственного средства |
Способ применения
|
Уровень доказательно сти
|
|||||||||||||||||||||||||
|
Глюкокортикостероиды
|
Дексаметазон
|
перорально, 6 мг/м2/сут в 2 приёма (введения) в день
Курс согласно схемы |
IА[3,4,6,10,16]
|
|||||||||||||||||||||||||
|
Глюкокортикостероиды
|
Преднизолон
|
перорально, 60 мг/м2/сут Курс согласно схемы
Эндолюмбально в зависимости от возраста: < 1г. – 4 мг, 1год – 6 мг, 2г – 8 мг, старше 3-х лет – 10 мг. Внутривенно разовая доза 1 -2 мг/кг |
II В[3,4,6,10,16]
|
|||||||||||||||||||||||||
|
Противоопухолевые препараты
|
Винкристин
|
Внутривенно
1,5 мг/м2 (максимальная разовая доза 2 мг), кратность и длительность в соответствии со схемой протокола |
I В[3,4,6,10,16]
|
|||||||||||||||||||||||||
|
Противоопухолевые препараты
|
Венетоклакс*
|
Перорально
|
1 В [1,56,57]
|
|||||||||||||||||||||||||
|
Противоопухолевый антибиотик
|
Митоксантрон
|
Внутривенно капельно,
Разовая доза: 10 мг/м2 в виде 1- часовой инфузии. Длительность курса в соответствии со схемой протокола |
I А[3,4,6,10,16]
|
|||
|
Противоопухолевые препараты
|
ПЭГ-аспарагиназа
|
Внутривенно капельно Разовая доза: 1000 единиц/м2 в виде 2-часовой инфузии.
Длительность курса в соответствии со схемой протокола |
1 А[3,4,6,10,16]
|
|||
|
Противоопухолевые препараты
|
L-аспарагиназа
|
Внутривенно капельно
Разовая доза: 5000 единиц/м2 и 10000 единиц/м2 в виде часовой инфузии. Длительность курса в соответствии со схемой протокола |
1 А[3,4,6,10,16]
|
|||
|
Противоопухолевые препараты
|
Метотрексат
|
внутривенно, разовая доза:
1000 мг/м2 36 час. инфузия Эндолюмбально в зависимости от возраста: < 1г. – 6мг, 1год – 8мг, 2г – 10мг, старше 3-х лет – 12мг. Перорально 20 мг/м2, 1 раз в неделю. Длительность курса в соответствии со схемой протокола |
1 А [3,4,6,10,16]
|
|||
|
Противоопухолевые препараты
|
Неларабин*
|
Внутривенно капельно, разовая доза: 650 мг/м2 в виде 2-часовой инфузии. Длительность курса в соответствии со схемой протокола
|
2 В [1,52-53]
|
|||
|
Противоопухолевые препараты
|
Бортезомиб
|
Внутривенно, начальная доза составляет 1,3 мг/м2 2 раза/нед. в течение 2 недель (дни 1, 4, 8 и 11), с последующим 10-дневным перерывом (дни 12 - 21).
|
2 В [1,54,55]
|
|||
|
Противоопухолевые препараты,
Моноклональные антитела |
Блинатумомаб*
|
Внутривенно в течение 24 часов 5 мкг/м2/сут в течение 7 дней, далее 15 мкг/м2/сут в течение 21 дня
|
2 В[1,38-40,61-63]
|
|||
|
Противоопухолевые
препараты, Моноклональные антитела |
Инотузумаб
Озогамицин* |
Внутривенно, по схеме: 0,8 мг/м 2 в 1-й день, по 0,5 мг/м 2 – в 8-й и 15-й дни протокола
|
2 В[1,58,59]
|
|||
|
Противоопухолевые препараты
|
Цитарабин
|
Внутривенно 2 г/м2 в виде 3-часовой инфузии каждые 12 часов
Эндолюмбально в зависимости от возраста: < 1г. – 16мг, 1год – 20мг, 2г – 26мг, старше 3-х лет – 30мг. Длительность курса в соответствии со схемой протокола |
1 А[1,10,16]
|
|
Противоопухолевые препараты
|
Циклофосфамид
|
Внутривенно 200 мг/м2 в виде 1-часовой инфузии.
Длительность курса в соответствии со схемой протокола |
1 А[3,4,6,10,16]
|
|
Противоопухолевые препараты
|
Этопозид
|
Внутривенно 100 мг/м2 в виде 4-часовой инфузии.
Длительность курса в соответствии со схемой протокола |
2 А [3,4,6,10,16]
|
|
Противоопухолевые препараты
|
Даунорубицин
|
Внутривенно 30 мг/м2 в виде 24-часовой инфузии.
Длительность курса в соответствии со схемой протокола |
2 А[3,4,6,10,16]
|
|
Противоопухолевые препараты
|
Ифосфамид
|
Внутривенно 400 мг/м2 в виде 1-часовой инфузии .
Длительность курса в соответствии со схемой протокола |
1 А[3,4,6,10,16]
|
|
Противоопухолевые препараты
|
Идарубицин
|
Внутривенно 6 мг/м2 в виде инфузии в течение 2 часов.
Длительность курса в соответствии со схемой протокола |
1 А[3,4,6,10,16]
|
|
Противоопухолевые препараты
|
Флударабин |
Внутривенно 30 мг/м2 в виде инфузии в течение 30 минут.
Длительность курса в соответствии со схемой протокола |
1 А[3,4,6,10,16]
|
|
Противоопухолевые препараты
|
Иматиниб |
Перорально 340 мг/м2/день (максимальная доза: 800 мг).
Длительность курса в соответствии со схемой протокола |
1 А[1,45-47,51]
|
|
Антинеопластические препараты другие.
Протеинкиназы ингибиторы. |
Нилотиниб
|
Перорально 600-800мг/сут.
Длительность курса в соответствии со схемой протокола |
1 А[1,45-47]
|
|
Противоопухолевый препарат
|
Меркаптопурин
|
Перорально, 50 мг/м2/сут.
Длительность курса в соответствии со схемой протокола |
|
|
Антинеопластические препараты другие.
Протеинкиназы ингибиторы. |
Дазатиниб
|
Перорально 100-140мг/сут,
Длительность курса в соответствии со схемой протокола |
1 А[1,45-47]
|
|
Антидот
|
Уромитексан
|
Внутривенно 200 мг/м2 до, а также через 4 и 8 часов после ифосфамида.
Длительность курса в соответствии со схемой протокола |
1 А[3,4,6,10,16]
|
|
Антидот
|
Кальция фолинат
|
Внутривенно в разовой дозе 15 мг/м2 проводится через 48 и 54 часа после начала приема МТХ. Длительность курса в соответствии со схемой протокола
|
2В[3,4,6,10,16]
|
|
Антидот
|
Динатрия фолинат
|
Внутривенно в разовой дозе 15 мг/м2 проводится через 48 и 54 часа после начала приема МТХ . Длительность курса в соответствии со схемой протокола
|
2А[3,4,6,10,16]
|
|
Антидот
|
Пиридоксина
гидрохлорид 5% |
Внутривенно 100 мг/м2 перед каждой инфузией цитарабина.
|
2В[3,4,6,10,16]
|
|
Ингибиторы протонного насоса
|
эзомепразол |
Перорально, натощак, расчет в зависимости от веса:
При снижении СКФ ниже 30 мл/мин/1,73 м2 снизить текущую доза на 50%
|
2 В[65] |
* Согласно правилам применения незарегистрированных ЛС
**Витамин В6 используется как препарат, снижающий нейротоксическое действие высокодозного цитарабина, является обязательным сопроводительным компонентом по международному протоколу химиотерапии острого лейкоза и лимфом
**Витамин В6 используется как препарат, снижающий нейротоксическое действие высокодозного цитарабина, является обязательным сопроводительным компонентом по международному протоколу химиотерапии острого лейкоза и лимфом
Перечень дополнительных лекарственных средств
|
Фармакотерапевтическая
группа |
МНН лекарственного
средства |
Способ
применения |
Уровень
доказательности |
|
Колониестимулирующие факторы
|
Филграстим
|
Подкожно, 10 мкг на 1 кг веса 1 раз в день под контролем уровня лейкоцитов
|
2 В[3,4,6,10,16]
|
|
Колониестимулирующие факторы
|
Ленограстим
|
Внутривенно, подкожно, 10 мкг на 1 кг веса, 1 раз в день под контролем уровня лейкоцитов
|
2 В[3,4,6,10,16]
|
|
Противорвотные
|
Ондансетрон
|
Внутривенно, 5 мг/м2/день, за 10 – 15 до начала химиотерапии и при тошноте
|
2 В[65]
|
|
Противорвотные
|
Трописетрон
|
Внутривенно, 5 мг на 1 м2, при тошноте
|
2 В[65]
|
|
Допамин
|
Внутривенно 3-5 мкг/кг/мин
|
|
|
|
Противомикробное средство группы сульфаниламидов
|
Котримоксазол – Сульфаметоксазол+ триметоприм
|
Перорально, 3 раза в неделю (понедельник, вторник, среда) в один прием в дозе 5 мг/кг по триметоприму или 20 мг/кг по сульфаметоксазолу peros – в течение всего периода лечения обязательно.
|
2 А[65]
|
|
Иммуноглобулин
|
Иммуноглобулин G человеческий нормальный (содержание не менее 90%)
|
в/в капельно в течение 5-6 часов, из расчета 0,8- 1,0гр/кг
|
2 А[65]
|
|
Антибактериальные препараты группы цефалоспоринов III поколения
|
Цефтриаксон
|
в/в, из расчета суточной дозы 50 - 100 мг/кг/дн, длительность курса 10 дней
|
2 А [65]
|
|
Антибактериальные препараты из группы цефалоспоринов IV поколения
|
Цефепим
|
в/в, из расчета суточной дозы 50 - 100 мг/кг/дн, длительность курса 10 дней
|
2 А [65]
|
|
Антибактериальные препараты группы цефалоспоринов III поколения
|
Цефтазидим
|
в/в, из расчета суточной дозы 50- 100 мг/кг/дн, длительность курса 10 дней
|
2 А[65]
|
|
Антибактериальные препараты группы цефалоспоринов II поколения
|
Цефуроксим
|
в/в, из расчета суточной дозы 50- 100 мг/кг/дн, длительность курса 10 дней
|
2 А[65]
|
|
Антибактериальные препараты группы цефалоспоринов III поколения
|
Цефоперазон
|
в/в, из расчета суточной дозы 50- 100 мг/кг/дн, длительность курса 10 дней
|
2 В[65]
|
|
Антибактериальные
|
Цефоперазон и ингибитор
|
в/в, из расчета
|
2 В[65]
|
|
бета-лактамазы
|
суточной дозы 50- 100 мг/кг/дн, длительность курса 10 дней
|
|
|
|
Антибактериальные препараты, группы аминогликозидов широкого спектра действия.
|
Амикацин
|
в/в, из расчета 15мг/кг/дн, разделенный в 2 приема, длительность курса 15 дней
|
2А[65]
|
|
Антибактериальные препараты, группы аминогликозидов широкого спектра действия
|
Гентамицин
|
в/в, из расчета 5мг/кг/дн, разделенный в 2 приема, длительность курса 7 дней
|
2В [65]
|
|
Комбинированный антибактериальный препарат, гормональный,
|
Дексаметазон в комбинации с противоинфекционными препаратами
|
1-2 капли в конъюнктивальный мешок через каждые 4-6 часов. Курс: на период терапии
Цитозаром |
2В[65]
|
|
Антибактериальные средства системного действия; другие бета- лактамные антибактериальные
средства; карбапенемы |
Меропенем
|
в/в введения из расчета 20 мг/кг/дн, разделенный в 3
введения. Курс: 15 дней |
2 А [65]
|
|
Антибактериальные средства системного действия; другие бета- лактамные антибактериальные
средства; карбапенемы |
Эртапенем
|
в/в введения из расчета 20 мг/кг/дн, разделенный в 3
введения. Курс: 15 дней |
2В [65]
|
|
Антибактериальные средства системного действия; другие бета- лактамные антибактериальные
средства; карбапенемы |
Имипенем + циластатин
|
в/в введения из расчета 20 мг/кг/дн, разделенный в 4
введения. Курс: 15 дней |
2 А [65]
|
|
Антибактериальные препараты группы гликопептидов
|
Ванкомицин
|
в/в, из расчета 10 мг/кг/дн, разделенный в 4 введения. Курс: 15 дней
|
2 А [65]
|
|
Антибактериальные
препараты, Производные нафтиридина, хинолоны, фторхинолоны |
Ципрофлоксацин
|
в/в,из расчета 10 мг/кг/дн, разделенный в 2 введения. Курс: 15 дней
|
2В[65]
|
|
Антибактериальные препараты из группы фторхинолонов
|
Моксифлоксацин
|
в/в, из расчета 10мг/кг/дн, разделенный в 2 введения. Курс: 15 дней
|
2В [65]
|
|
Антибактериальные препараты широкого спектра действия из группы фторхинолонов
|
Левофлоксацин
|
в/в, из расчета 10мг/кг/дн, разделенный в 2 введения. Курс: 15 дней
|
2 А [65]
|
|
Антибактериальные препараты, Противопротозойное
средство |
Метронидазол
|
в/в, разовая доза 7,5 мг/кг, 3 введения. Курс: 15 дней
|
2 А [65]
|
|
Амоксициллин +
клавулановая кислота |
в/в, из расчета 40 мг/кг/дн, разделенный в 2 введения. Курс: 10 дней
|
2 А [65]
|
|
|
Антибактериальные препараты Комбинированный препарат амоксициллина и клавулановой кислоты -
ингибитора бета-лактамаз. |
Амоксициллин и ингибитор бета-лактамазы
|
в/в, из расчета 40 мг/кг/дн, разделенный в 2 введения. Курс: 10 дней
|
2 А [65]
|
|
Антибактериальные препараты, группы оксазолидинонов
|
Линезолид
|
в/в, из расчета 10мг/кг/дн, разделенный в 3 введения. Курс: 15 дней
|
2 А [65]
|
|
Антимикотические препараты
группы полиенов |
Нистатин
|
внутрь по 50 тыс.ЕД – 100 000 ЕД*2 – 3 р в дн. Курс: 10 дней
|
2 А [65]
|
|
Антимикотические препараты
|
Флуконазол
|
Профилактическая доза:
Перорально, внутривенно, из расчета 3-5 мг/кг/дн. Лечебная доза: Перорально, внутривенно, из расчета 6-12 мг/кг/дн Курс: 15 дней |
2 В [65]
|
|
Антимикотические препараты, производное триазола
|
Итраконазол
|
Перорально, из расчета 2,5 мг/кг/дн.
Курс: 15 дней |
2 В [65]
|
|
Противогрибковое средство, производное триазола
|
Вориконазол
|
в/в , перорально, из расчета 8мг/кг/дн
каждые 12 ч. Курс: 15 дней |
2 В [265]
|
|
Противогрибковое средство для системного применения
|
Каспофунгин
|
Перорально, внутривенно, из расчета 3-5 мг/кг/дн.
Курс: 15 дней |
2 В [65]
|
|
Противогрибковое средство, производное эхинокандина
|
Микафунгин
|
Перорально, внутривенно, из расчета 3-5 мг/кг/дн.
Курс: 15 дней |
2 В [65]
|
|
Противогрибковое средство, антибиотик группы полиено
|
Амфотерицин В
|
Внутривенно, из расчета 250 ЕД/кг массы тела.
Предварительно вводят 100 ЕД/кг (для определения индивидуальной переносимости). В дальнейшем при отсутствии побочных эффектов и при необходимости (при отсутствии эффекта) постепенно увеличить дозу до 1000 ЕД/кг |
2 В [65]
|
|
Позаконазол*
|
Перорально, в первый день лечения назначают 200 мг 1 раз/сут (вводная доза), затем по 100 мг 1 раз/сут в течение последующих 13 дней
|
2 В [65]
|
|
|
Противовирусные препараты, синтетический аналог пуринового нуклеозида
|
Ацикловир
|
Перорально,
Расчет дозы в зависимости от возраста:
Курс лечения составляет 10 дней
|
2 А [65]
|
|
Противовирусные препараты
|
Ганцикловир
|
Внутривенно, в разовой дозе 5 мг/кг массы тела с постоянной скоростью в течение 1 ч 2 раза в сутки; интервал между введениями — 12 ч (10 мг/кг/сут). Препарат применяют в течение 14–21 дня у больных с нормальной функцией почек.
|
2 В [65]
|
|
Противовирусный препарат
|
Осельтамивир
|
Перорально от 1 года до 8 лет при весе менее 15 кг по 30 мг, от 15 до 23 кг по 45 мг, от 23 до 40 кг по 60 мг, более 40 кг по 75 мг прием 1 раз в сутки в течение 5 дней
|
2 A[65]
|
|
Гепатопротекторы
|
Урсодезоксихолевая кислота
|
Перорально, из расчета 20 мг/кг/дн до нормализации печеноных проб
|
2 В[65]
|
|
Антисептики и дезинфицирующие
препараты. |
Хлоргексидин глюконат
|
Местно, для полоскания полости рта 2-3раза в день
|
2А[65]
|
|
Противорвотные средства
|
Метоклопрамид
|
Внутримышечно, внутривенно, перорально с 2 летнего возраста. Из расчета в зависимости от возраста:
|
2 В [65]
|
|
Гормональная терапия
|
Метилпреднизолон
|
в/в и через рот из расчета 1-2 мг/кг/дн. Курс: длительно до купирования «цитокинового штурма»
|
2 В[65]
|
|
Противоспалительные препараты
|
Парацетамол
|
Перорально, внутривенно, разовая доза: 10 мг/кг
|
2 А[65]
|
|
Противоспалительные препараты
|
Ибупрофен
|
Перорально, внутривенно, разовая доза: 10 мг/кг
|
2 А [65]
|
|
Наркотические анальгетики
|
Трамадол
|
Перорально, внутривенно, разовая доза: 10 мг/кг
|
2 А [65]
|
|
Наркотические анальгетики
|
Морфин
|
Перорально, внутримышечно, внутривенно, Назначается детям с 2 летнего возраста. Разовая доза – 0,05- 0,2 мг/кг массы тела. Однократная доза не должна превышать 15 мг.
|
2 А[65]
|
|
Наркотические анальгетики
|
Фентанил
|
Назначается детям с 2 летнего возраста Пластырь (исходная доза не должна превышать 25 мкг/ч). Внутримышечно, внутривенно.
Расчет разовой дозы в зависимости от возраста:
|
2 В [65]
|
|
10% Кальция глюконат
|
в/в, расчета разовой дозы 0,5 – 1,0 мл/кг, вводится в течение 5
– 15 минут |
2А[65] |
|
|
4% натрия гидрокарбонат
|
в/в, расчет разовой дозы в зависимости от веса: 1 ммоль/кг.
Вводится в течение 10 – 30 минут под контролем КОС крови |
2А[65] |
|
|
|
0,9% NaCL
(физиологический раствор) |
для разведения и растворения вводимых парентерально лекарственных препаратов
|
|
|
|
5% Глюкоза
|
для разведения и растворения вводимых парентерально
лекарственных препаратов |
|
|
Пищеварительное ферментное средство
|
Мультиферменты (липаза, протеаза и т.д.)
|
Перорально:
1000 липазных единиц/кг на каждый прием пищи для детей младше 4-х лет, и 500 липазных единиц/кг во время приема пищи для детей старше 4-х лет и старше. |
2 В[3,4,6,10,16]
|
|
Аллопуринол
|
Перорально, из расчета суточной дозы 10 мг/кг/дн, кратность 2 – 3 раза в сутки. Курс: до нормализации уровня лейкоциты
|
1 В[3,4,6,10,16.65]
|
|
|
Диуретики
|
Фуросемид
|
в/в, для экстренной коррекции гиперволемии, на короткий срок Начальная доза: болюсное введение 2-5 мг/кг (макс доза 200 мг)
При эффективности (купирование олигоанурии в течении 10 – 20 минут после введения!): продолжить непрерывное введение 0,1 – 0,3 мг/кг/час
При НЕэффективности (сохраняется олигоанурия): отменить! |
1А[24,65]
|
|
Плазмозамещающее средство
|
Альбумин человеческий
|
Внутривенно, расчет разовой дозы10 мл/кг веса. Курс: до нормализации уровня альбумина крови
|
2А[65]
|
NB!
Дополнительное медикаментозное лечение проводится соответственно протоколам лечения развившихся осложнений.
Дополнительное медикаментозное лечение проводится соответственно протоколам лечения развившихся осложнений.
Хирургическое вмешательство: По показаниям.
-
Установка постоянной центральной венозной магистрали – всем пациентам при поступлении на стационарное лечение (Приложение 4).
-
Орхиэктомия
Орхиэктомия – радикальная местная терапия клинически пораженного яичка, как альтернатива локальному облучению 24 Гр по усмотрению МДГ.
Цель проведения вмешательства – удаление пораженного лейкемоидной инфильтрацией яичка
Цель проведения вмешательства – удаление пораженного лейкемоидной инфильтрацией яичка
Показания для проведения вмешательства:
-
удаление клинически пораженного яичка;
-
биопсия не пораженного контралатерального яичка.
Противопоказания для проведения вмешательства:
-
отсутствие ремиссии;
отказ родителей от вмешательства.
Процедура выполняется в начале терапии до блока индукции, если клинические данные за поражение яичка однозначны, или во время курса терапии, если требуется гистопатологическое подтверждение. В этом случае уменьшение размера яичка можно использовать как индикатор ответа на терапию.
Во время орхиэктомии или по окончании химиотерапии следует имплантировать протез яичка. Гормональная дисфункция после орхиэктомии или облучения 24 Гр идентична. Косметический результат при орхиэктомии может быть лучше по сравнению с атрофией яичек после местного облучения 24 Гр. Субклиническое поражение клинически не пораженного контралатерального яичка должно быть исключено с помощью биопсии, если предполагается уменьшенное местное облучение с 15 Гр в не пораженном семеннике и 18 Гр в субклинически пораженном семеннике. В зависимости от результата проводится местное облучение в соответствии с инструкциями, приведенны в главе Лучевая терапия при рецидиве яичка.
Дальнейшее ведение:
Сопроводительная поддерживающая терапия в стационаре проводится согласно §1 и §2.
После выписки пациента проводится поддерживающая терапия в амбулаторных условиях согласно разделу 3.2 настоящего протокола.
При условии сохранения ремиссии заболевания, после окончания поддерживающей терапии, пациенты находятся на «Д» учёте и наблюдаются у гематолога по месту жительства в течение 5 лет.
После выписки пациента проводится поддерживающая терапия в амбулаторных условиях согласно разделу 3.2 настоящего протокола.
При условии сохранения ремиссии заболевания, после окончания поддерживающей терапии, пациенты находятся на «Д» учёте и наблюдаются у гематолога по месту жительства в течение 5 лет.
Индикаторы эффективности лечения[1]:
|
Статус ответа (индикатор)
|
Критерии для оценки ответа
|
|
Полная ремиссия |
- Отсутствие циркулирующих лимфобластов или экстрамедуллярных поражений;
- Отсутствие лимфаденопатии, спленомегалии, инфильтрации кожи/десен/мошонки/поражения ЦНС; - Трехлинейный гемопоэз и <5% бластов;
|
|
Полная ремиссия с неполным восстановлением анализа крови
|
Отвечает всем критериям полной ремиссии, за исключением количества тромбоцитов или абсолютного количества нейтрофилов.
NB! оценка МИБ не включена в морфологическую оценку, но обязательно должна быть оценена |
|
Рефрактерность заболевания
|
Невозможность достижения полного ответа после индукционного курса
|
|
Прогрессия заболевания
|
Увеличение как минимум на 25% абсолютного числа циркулирующих бластов или бластов костного мозга или развитие экстрамедуллярной болезни
|
|
Рецидив заболевания |
Повторное появление бластов в крови или костном мозге (> 5%) или в любом экстрамедуллярном участке после полной ремиссии
|
|
|
Критерии ответа при Нейролейкозе
|
|
Ремиссия |
достижение отсутствия лимфобластов в спинномозговой жидкости независимо от количества лейкоцитов; у пациентов с лейкоцитами
<5/мкл в спинномозговой жидкости с наличием лимфобластов или ≥5/мкл в спинномозговой жидкости с наличием лимфобластов на момент постановки диагноза. |
|
Рецидив ЦНС |
определение лейкоцитов ≥5/мкл в спинномозговой жидкости с наличием лимфобластов или клинических признаков лейкемии ЦНС, таких как паралич лицевого нерва, поражение мозга/глаз или гипоталамический синдром без других объяснений.
|
Критерии ответа при экстрамедуллярных поражениях:
-
УЗИ или КТ шеи/грудного сегмента/брюшного сегмента/органов малого таза с внутривенным контрастированием и ПЭТ/КТ по показаниям.
|
NB!
В случае аллергической реакции на ПЭГ- аспарагиназу, последующее введение препарата отменяется! |
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ:
Показания для плановой госпитализации:
-
выявленный рецидив острого лимфобластного лейкоза;
-
необходимость проведения очередного этапа терапии.
Показания для экстренной госпитализации:
-
любое ухудшение состояния пациента, развитие осложнений, требующих проведения экстренной терапии в условиях стационара (септические состояния, острый геморрагический синдром).
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2023
- Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2023 - 1) ALL-IC REL 2024 protocol. Current Best Practice Guidance for 1 st Relapse of Childhood Acute Lymphoblastic Leukemia Optimized for the ALL-IC Group Version: 13 th May 2024. 2) Childhood ALL 1st relapse guidance, ALL-IC study group, 2016 “ALL-IC REL 2016”. Janez Jazbec, Slovenia – chair, Dániel Erdélyi, Hungary, Juan Tordecilla, Chile, Marko Kavčič, Slovenia, Monica Makiya, Argentine, Sophia Polychronopoulou, Greece, Volkan Hazar, Turkey. 3) International collaborative treatment protocol for children and adolescents with acute lymphoblastic leukemia. AIEOP-BFM ALL 2017 4) Клинические рекомендации ―Детская гематология. Под редакцией А.Г. Румянцева, А.А. Масчана, Е.В. Жуковской. Москва, 2015, с.318-336. 5) The 5th edition of the World Health Organization Classification of Haematolymphoid Tumours: Lymphoid Neoplasms. Rita Alaggio, Catalina Amador, Ioannis Anagnostopoulos, Ayoma D. Attygalle, Iguaracyra Barreto de Oliveira Araujo, Emilio Berti, Govind Bhagat, Anita Maria Borges, Daniel Boyer, Mariarita Calaminici, Amy Chadburn, John K. C. Chan, Wah Cheuk, Wee-Joo Chng, John K. Choi, Shih-Sung Chuang, Sarah E. Coupland, Magdalena Czader, Sandeep S. Dave, Daphne de Jong, Ming- Qing Du, Kojo S. Elenitoba-Johnson, Judith Ferry, Julia Geyer, Wenbin Xiao Leukemia volume 36, pages1720–1748 (2022). 6) Уланова А.С., Кудрявцев А.В., Турабова А.Л., Григорьева Н.А., Турабов И.А., Рыков М.Ю. Иммунофенотипические и цитогенетические особенности острого лейкоза у детей Архангельской области: ретроспективное исследование // Сиб. Онкол. Ж. – 2021. – №20(2). – С. 13-21 https://doi.org/10.21294/1814-4861-2021-20-2- 13-21 7) Handbook of Pediatric Hematology and Oncology: Children`s Hospital and Research Center Oakland, 2nd Руководство по детской гематологии и онкологии SBN: 1119210747 ISBN-13(EAN): 9781119210740 страницы: 512 Дата издания: 14.05.2021 8) Махонова Л.А., Мякова С.А., Попа А.В., Тупицын Н.Н., Морозова О.В., Божьева М.Г., Слугин А.И., Валиев Т.Т., Гаврилова И.Е., Курдюков Б.В., Серебрякова И.Н., Беляева Е.С., Менткевич Г.Л. Современные подходы к диагностике и терапии лимфоидных опухолей у детей // Педиатрия. – 2019. – Т. 87(4). – С. 15-19 9) Buchanan, G.R. (1990). Diagnosis and management of relapse in acute lymphoblastic leukemia. Hematol Oncol Clin North Am, 4, 971-95. 10) International Study for Treatment of High Risk Childhood Relapsed ALL 2010. page 1-108, Protocol Version 2.2, Date 21. July 2017 Eudra-CT Number: 2012-000810-12 and Standard Risk Childhood Relapsed ALL 2010. page 1-113, Protocol Version 1.91, Date 12. 08 2016 Eudra-CT Number: 2012-000793-30 11) Gandemer V, Pochon C, Oger E, et al. Clinical value of pre-transplant minimal residual disease in childhood lymphoblastic leukaemia: the results of the French minimal residual disease-guided protocol. Br J Haematol. 2014; 165:392-401. 12) Приказ Министра здравоохранения Республики Казахстан от 20 октября 2020 года № ҚР ДСМ - 140/2020. Зарегистрирован в Министерстве юстиции Республики Казахстан 22 октября 2020 года № 21478 Об утверждении номенклатуры, правил заготовки, переработки, контроля качества, хранения, реализации крови, ее компонентов, а также правил переливания крови, ее компонентов. 13) Bene MC, Castoldi G, Knapp W, et al. Proposals for the immunological classification of acute leukemias. European Group for the Immunological Characterization of Leukemias (EGIL). Leukemia. 1995; 9:1783-1786. 14) Saha V, Revesz T, Mann G, at al. International Study for Treatment of High Risk Childhood Relapsed ALL 2010 A randomized Phase II Study Conducted by the Resistant Disease Committee of the International BFM Study Group Protocol Version 2.2, Date 21. July 2017. page 1 – 108 15) Saha V, Revesz T, Mann G, at al. International Study for Treatment of Standard Risk Childhood Relapsed ALL 2010 A randomized Phase III Study Conducted by the Resistant Disease Committee of the International BFM Study Group Protocol Version 1.91, Date 12.08.2016. page 1 – 113 16) Herold R, von Stackelberg A, Hartmann R, Eisenreich B, Henze G. Acute lymphoblastic leukemia-relapse study of the Berlin-Frankfurt-Munster Group (ALL-REZ BFM) experience: early treatment intensity makes the difference. J Clin Oncol. 2004;22:569-570; author reply 570-561. 17) Vora A, Goulden N, Mitchell C, et al. Augmented post-remission therapy for a minimal residual disease-defined high-risk subgroup of children and young people with clinical standard-risk and intermediate-risk acute lymphoblastic leukaemia (UKALL 2003): a randomised controlled trial. Lancet Oncol 2014; published online June 10. http://dx.doi.org/10.1016/S1470-2045(14)70243-8. 18) Протокол BFM 2012 Versions-Nr.15 02.04.2017 page 19) Lanzkowsky`S Manual Of Pediatric Hematology And Oncology.ISBN: 0128216719 ISBN-13(EAN): 9780128216712. Дата издания: 01.06.2021 Страницы: 788 20) Валиев Т.Т., Шервашидзе М.А., Осипова И.В., Бурлуцкая Т.И., Попова Н.А., Осмульская Н.С., Алескерова Г.А., Сабанцев С.Л., Гордеева З.С., Смирнов В.Ю., Побережная О.А., Юлдашева С.Н., Бабич И.А., Батманова Н.А., Варфоломеева С.Р. Протокол ALL-IC BFM 2002: результаты лечения острого лимфобластного лейкоза у детей в рамках многоцентрового клинического исследования // Клин. онкогематол. – 2022. – №15(2). – С. 119-129 https://cyberleninka.ru/article/n/protokol-all-ic-bfm-2002- rezultaty-lecheniya-ostrogo-limfoblastnogo-leykoza-u-detey-v-ramkah- mnogotsentrovogo-klinicheskogo 21) Jui-Yi Chen, I-Jung Tsai, Heng-Chih Pan, Hung-Wei Liao,Javier A. Neyra, Vin-Cent Wuu and Jeff S. Chueh. The Impact of Angiotensin-Converting Enzyme Inhibitors or Angiotensin II Receptor Blockers on Clinical Outcomes of Acute Kidney Disease Patients: A Systematic Review and Meta-Analysis. 22) Piotr Czarniak and Aleksandra Zurowska. Treatment Strategies to Prevent Renal Damage in Hypertensive Children. 23) Charlotte Hadtstein and Franz Schaefer. Hypertension in children with chronic kidney disease: pathophysiology and management 24) Hyperkalaemia – Emergency Management in Children, Children’s Health Queensland Hospital and Health Service, 22.09.2020. 25) Spyridon Graidis,Theodosios S. Papavramidis, and Maria Papaioannou.Vitamin D and Acute Kidney Injury: A Two-Way Causality Relation and a Predictive, Prognostic, and Therapeutic Role of Vitamin D. 26) Литвинов Д.В. et al. Лечение острого лимфобластного лейкоза у детей: современные возможности и нерешенные проблемы // Доктор.Ру. 2015. Vol. 10(111). P. 30–37. 27) Mandhaniya S. et al. Oral voriconazole versus intravenous low dose amphotericin B for primary antifungal prophylaxis in pediatric acute leukemia induction: A prospective, randomized, clinical study // J. Pediatr. Hematol. Oncol. 2011. Vol. 33, № 8. P. e333-41. 28) Fisher B.T. et al. Effect of Caspofungin vs Fluconazole Prophylaxis on Invasive Fungal Disease among Children and Young Adults with Acute Leukemia: A Randomized Clinical Trial // JAMA - J. Am. Med. Assoc. American Medical Association, 2019. Vol. 322, № 17. P. 1673–1681. 29) Румянцев А.Г., Масчан А.А., Самочатова Е.В. Сопроводительная терапия и контроль инфекций при гематологических и онкологических заболеваниях. 2009. 448 p. 30) О.Ю. Баранова, А.Д. Ширин. Современный взгляд на патогенез, диагностику и лечение отдельных редких вариантов острых лейкозов. Клиническая онкогематология. 2022;15(4):307–26. 31) Performance Status Assessment by Using ECOG (Eastern Cooperative Oncology Group) Score for Cancer Patients by Oncology Healthcare Professionals. Faisal Azam,a Muhammad Farooq Latif,b Ayesha Farooq,c Syed Hammad Tirmazy,b Saad AlShahrani,a Shahid Bashir,a and Nedal Bukharia,d. Case Rep Oncol 2019;12:728–736. DOI: 10.1159/000503095 Published online: September 25, 2019. 32) de Borja MT, Chow E, Bovett G, Davis L, Gillies C. The correlation among patients and health care professionals in assessing functional status using the karnofsky and eastern cooperative oncology group performance status scales. Support Cancer Ther. 2004 Oct;2(1):59–63. 33) ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО НУТРИТИВНОЙ ПОДДЕРЖКЕ ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ. Коллектив авторов: Сытов А.В., Лейдерман И.Н., Ломидзе С.В., Нехаев И.В., Хотеев А.Ж. DOI: 10.18027 / 2224-5057-2019-9-3s2-639- 647. 34) Gastrostomy Placement and Management in Children: A Single-Center Experience Grazia Di Leo, Paola Pascolo,* , Kamar Hamadeh, Andrea Trombetta, Sergio Ghirardo, Jurgen Schleef, Egidio Barbi and Daniela Codrich. Received: 28 May 2019; Accepted: 8 July 2019; Published: 10 July 2019 Abstract. 35) Аллогенная трансплантация гемопоэтических стволовых клеток у детей. Одобрен Объединенной комиссией по качеству медицинских услуг МЗ РК от «15» сентября 2017 года. 36) Андреева Н.С., Реброва О.Ю., Зорин Н.А., Авксентьева М.В., Омельяновский В.В. Системы оценки достоверности научных доказательств и убедительности рекомендаций: сравнительная характеристика и перспективы унификации. Медицинские технологии: оценка и выбор. 2012, № 4, стр. 10‒24. 37) International Study for Treatment of Standard Risk Childhood Relapsed ALL 2010., Protocol Version 1.8, Date 01.11.2012, Sta Eudra-CT Number: 2012-000793-30. 38) Phase I/Phase II Study of Blinatumomab in Pediatric Patients with Relapsed/Refractory Acute Lymphoblastic Leukemia / A. von Stackelberg, F. Locatelli, G. Zugmaier [et al.] // Journal of Clinical Oncology. – 2016 Dec. – Vol. 34, N 36. – P. 4381– 4389. 39) Применение блинатумомаба у детей с рецидивными и рефрактерными формами острого лимфобластного лейкоза у детей / Н.В. Мякова, А.А. Масчан, Ю.Ю. Дьяконова, Ю.Г. Абугова [и др.] // Вопросы гематологии/онкологии и иммунопатологии в педиатрии 2017. – Т. 16, № 4. – C. 7‒12. 40) Blinatumomab versus Chemotherapy for Advanced Acute Lymphoblastic Leukemia / H. Kantarjian, A. Stein, N. Gokbuget [et al.] // The new England Journal of Medicine. – 2017. – Vol. 376. – P. 836–47. 41) Nguyen K., Devidas M., Cheng S.C. et al. Factors influencing survival after relapse from acute lymphoblastic leukemia: A Children’s Oncology Group study. Leukemia 2008; 22: 2142–50. 42) Tavil B., Aytac S., Balci Y.I. et al. Fludarabine, cytarabine, granulocyte colony- stimulating factor, and idarubicin (FLAG-IDA) for the treatment of children with poor- prognosis acute leukemia: the Hacettepe experience. Pediatr. Hematol. Oncol. 2010; 27(7): 517–28. 43) Лечение рефрактерных форм острого лимфобластного лейкоза у детей и подростков: реиндукция ремиссии с последующей аллогенной трансплантацией гемопоэтических стволовых клеток / Е.В. Семенова, Н.В. Станчева, С.Н. Бондаренко, В.Н. Вавилов, Д.А. Багге, О.В. Паина, С.В. Разумова, А.С. Боровкова, Т.А. Быкова, А.А. Рац, Л.С. Зубаровская, Б.В. Афанасьев. // Клиническая онкогематология. - 2013. – Т. 6, № 1. стр 53-58. 44) FLAG/FLAG-IDA regimen for children with relapsed/refractory acute leukemia in the era of targeted novel therapies. Omima Mustafa 1, Khalid Abdalla 1, Aeshah A AlAzmi 2, Naglla Elimam 1, Mohammed Burhan Abrar 1, Wasil Jastaniah . J Oncol Pharm Pract. 2019 Dec;25(8):1831-1838. doi: 10.1177/1078155218817816. Epub 2018 Dec 5. 45) Shen S. et al. Effect of Dasatinib vs Imatinib in the Treatment of Pediatric Philadelphia Chromosome-Positive Acute Lymphoblastic Leukemia: A Randomized Clinical Trial // JAMA Oncology. American Medical Association, 2019. Vol. 6, № 3. P. 358–366. 46) Hijiya N. et al. Pharmacokinetics of nilotinib in pediatric patients with Philadelphia chromosome–positive chronic myeloid leukemia or acute lymphoblastic leukemia // Clin. Cancer Res. American Association for Cancer Research Inc., 2020. Vol. 26, № 4. P. 812– 820. 47) Short N.J. et al. Which tyrosine kinase inhibitor should we use to treat Philadelphia 50 chromosome-positive acute lymphoblastic leukemia? // Best Practice and Research: Clinical Haematology. Bailliere Tindall Ltd, 2017. Vol. 30, № 3. P. 193–200. 48) Shah NN, Lee DW, Yates B, et al. Long-Term Follow-Up of CD19-CAR T-Cell Therapy in Children and Young Adults With B-ALL. J Clin Oncol 2021;39:1650-1659. 49) Park JH, Riviere I, Gonen M, et al. Long-term follow-up of CD19 CAR therapy in acute lymphoblastic leukemia. N Engl J Med 2018;378:449-459. 50) Sheth VS, Gauthier J. Taming the beast: CRS and ICANS after CAR T-cell therapy for ALL. Bone Marrow Transplant 2021;56:552-566. 51) Ford M, Mauro M, Aftandilian C, Sakamoto KM, Hijiya N. Management of Chronic Myeloid Leukemia in Children and Young Adults. Curr Hematol Malig Rep. 2022 Oct;17(5):121-126. doi: 10.1007/s11899-022-00673-5. Epub 2022 Aug 3. PMID: 35920965; PMCID: PMC9499901. 52) Kadia TM, Gandhi V. Nelarabine in the treatment of pediatric and adult patients with T-cell acute lymphoblastic leukemia and lymphoma. Expert Rev Hematol. 2017 Jan;10(1):1-8. doi: 10.1080/17474086.2017.1262757. Epub 2016 Dec 8. PMID: 27869523; PMCID: PMC5578611. 53) Nelarabine: when and how to use in the treatment of T-cell acute lymphoblastic leukemia Shai Shimony,1,2 Daniel J. DeAngelo,1 and Marlise R. Luskin. Blood Adv (2024) 8 (1): 23–36. 54) Батманова Н.А., Шервашидзе М.А., Попа А.В. и др. Бортезомиб в программной терапии рецидивов и рефрактерных форм острого лимфобластного лейкоза у детей. Клиническая онкогематология. 2017;10(3):381–9. 55) August KJ, Guest EM, Lewing K, Hays JA, Gamis AS. Treatment of children with relapsed and refractory acute lymphoblastic leukemia with mitoxantrone, vincristine, pegaspargase, dexamethasone, and bortezomib. Pediatr Blood Cancer. 2020 Mar;67(3):e28062. doi: 10.1002/pbc.28062. Epub 2019 Nov 14. PMID: 31724803. 56) Masetti R, Baccelli F, Leardini D, Locatelli F. Venetoclax: a new player in the treatment of children with high-risk myeloid malignancies. Blood Adv. 2024 Jul 9;8(13):3583-3595. doi: 10.1182/bloodadvances.2023012041. PMID: 38701350; PMCID: PMC11319833. 57) Leśniak M, Lipniarska J, Majka P, Lejman M, Zawitkowska J. Recent Updates in Venetoclax Combination Therapies in Pediatric Hematological Malignancies. Int J Mol Sci. 2023 Nov 24;24(23):16708. doi: 10.3390/ijms242316708. PMID: 38069030; PMCID: PMC10706781. 58) Bhojwani D, Sposto R, Shah NN, Rodriguez V, Yuan C, Stetler-Stevenson M, O'Brien MM, McNeer JL, Quereshi A, Cabannes A, Schlegel P, Rossig C, Dalla-Pozza L, August K, Alexander S, Bourquin JP, Zwaan M, Raetz EA, Loh ML, Rheingold SR. Inotuzumab ozogamicin in pediatric patients with relapsed/refractory acute lymphoblastic leukemia. Leukemia. 2019 Apr;33(4):884-892. doi: 10.1038/s41375-018-0265-z. Epub 2018 Sep 28. Erratum in: Leukemia. 2019 Apr;33(4):1061-1062. doi: 10.1038/s41375-019- 0426-8. PMID: 30267011; PMCID: PMC6438769. 59) FDA approves inotuzumab ozogamicin for pediatric patients with acute lymphoblastic leukemia. U.S. Food and Drug Administration. March 6, 2024. Accessed March 6, 2024. 60) 2021 Relapsed ALL UK Guideline v1.3 (January 2022) Authors: David O’Connor, Denise Bonney, Michelle Cummins, Frederik van Delft, Sara Ghorashian, Christina Halsey, Rachael Hough, Vanessa McLelland, Caroline Osborne, Lamia Samrin-Balch, Anthony Moorman, John Moppett, Sujith Samarasinghe, Ajay Vora. 61) Blinatumomab in the Treatment of Pediatric B-Cell Acute Lymphoblastic Leukemia Patients: Real World Experience from Mexico, Victor Itaí Urbalejo Ceniceros, Gabriela Tavera Rodriguez, Omar Eduardo Fernandez Vargas, Gerardo Lopez Hernandez, Alberto Olaya Vargas, Haydeé del Pilar Salazar Rosales, Rosa María Nideshda Ramirez Uribe, María de Lourdes González Pedroza, Norma López-Santiago, Patricia Galindo Delgado, Julia Esther Colunga-Pedraza, Carolina Cruz Garcia, Yessica Torres Girón. Blood (2024) 144 (Supplement 1): 7795. 62) Gökbuget N, Dombret H, Bonifacio M, et al. Blinatumomab for minimal residual disease in adults with B-cell precursor acute lymphoblastic leukemia. Blood 2018;131:1522-31. Erratum in: Blood 2019;133:2625. 63) Aldoss I, Otoukesh S, Zhang J, et al. Extramedullary disease relapse and progression after blinatumomab therapy for treatment of acute lymphoblastic leukemia. Cancer 2022;128:529-35. 64) Paediatric Haematology & Oncology: Supportive Care Protocols. 5 th Edition version 1.0 (Mar 2023).
Информация
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ПРОТОКОЛА:
Список разработчиков:
- Манжуова Лязат Нурбапаевна – кандидат медицинских наук, детский онколог/гематолог, заместитель председателя правления по научной работе АО «Научный центр педиатрии и детской хирургии».
- Абдилова Гульнар Калденовна – кандидат медицинских наук, детский онколог/гематолог, врач высшей квалификационной категории руководитель центра детской онкологии и гематологии, АО «Научный центр педиатрии и детской хирургии».
- Омарова Кулян Омаровна – доктор медицинских наук, профессор, детский онколог/гематолог высшей категории, АО «Научный центр педиатрии и детской хирургии».
- Тулебаева Айгуль Баязитовна – кандидат медицинских наук, доцент кафедры «Детские болезни им. Барлыбаевой Н.А.» НАО КАЗНМУ им.С.Асфендиярова
- Ташенова Гульнара Талиповна – доктор медицинских наук, заведующая кафедрой «Детские болезни им. Барлыбаевой Н.А.» НАО КАЗНМУ им.С.Асфендиярова.
- Нургалиев Даир Жванышевич – профессор, доктор медицинских наук, детский онколог/гематолог, НАО «Медицинский университет Астана».
- Муканова Шолпан Насыровна, независимый медицинский эксперт, менеджер здравоохранения высшей категории, эксперт по методологии разработки клинических протоколов, начальник Отдела методологии и стандартизации бизнес процессов Департамента менеджмента качества КФ «UMC»;
- Баянова Миргуль Файзулиновна – кандидат медицинских наук, заведующая отделом клинико-генетической диагностики КАД лабораторной медицины, патологии и генетики КФ «UMC».
- Умирбекова Балжан Болатовна - детский онколог/гематолог, заведующая программой ТГСК КФ «UMC».
- Кушерова Гульшат Нурлыбековна – детский онколог/гематолог, врач программы ТГСК КФ «UMC».
- Жетимкаринова Гаухар – клинический фармаколог КФ «UMC».
Указание на отсутствие конфликта интересов: нет.
Данные рецензентов:
-
Балашов Дмитрий Николаевич – доктор медицинских наук, ведущий научный сотрудник отдела оптимизации лечения и профилактики осложнений трансплантации гемопоэтических стволовых клеток ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России (Москва), заведующий отделением трансплантации гемопоэтических стволовых клеток №2 ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России (Москва), врач гематолог.
-
Душимова Зауре Дмитриевна – кандидат медицинских наук, доцента кафедры фундаментальной медицины, заместитель директора Высшей школы медицины по научно-инновационой деятельности и международному сотрудничеству, факультет медицины и здравоохранения КазНУ им Аль-Фараби. Врач-гематолог высшей категории, врач-онколог.
Условия пересмотра протокола: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов лечения с уровнем доказательности.
Приложение 1
АЛЬТЕРНАТИВНОЕ ЛЕЧЕНИЕ[18]
При отсутствии достижения ремиссии после индукции или рефрактерной форме ОЛЛР возможно рассмотрение решения по началу альтернативной терапии, после решения консилиумом врачей (междисциплинарным советом), исходя из характера основного заболевания, степени функциональной недостаточности пораженных органов и тканей, наличия осложнений, сопутствующих заболеваний.
Схема лечения – ОЛЛ-РЕЦ BFM 2002
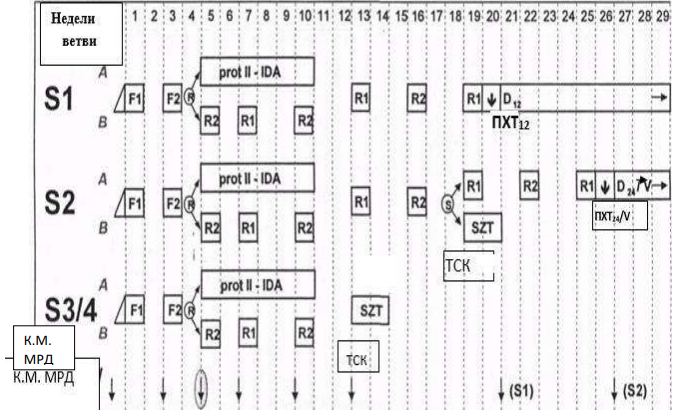
Примечание*:
R – рандомизация; локальное облучение;
ПХТ12 – поддерживающая химиотерапия 12 месяцев;s - стратификация; ТСК – трансплантация стволовых клеток;
ПХТ24 – поддерживающая химиотерапия 24 месяца;
V – реиндукционная пульс-терапия VP-16; F1, F2, R1, R2, Prot II – IDA – блоки химиотерапии;А, В – рандомизируемые группы;
КМП – костномозговая пункция;
МРБ – минимальная резидуальная болезнь-
Рисунок 9. Схема лечения ОЛЛ-РЕЦ BFM.
Таблица 1 – Блок F1 состоит из 6 дней:
В состав блока входят дексаметазон 1–5 дни, винкристин 1-й и 6-й дни, метотрксат 36 часовой инфузией – 1й день, ПЭГ-аспаргиназа – 4й день, эндолюмбальная терапия в возрастных дозировках – 1й день.
|
Препарат
|
Введение
|
Доза
|
Дни
|
|||||
|
Дексаметазон
|
per os
|
20 мг/м2
|
1
|
2
|
3
|
4
|
5
|
|
|
Винкристин
|
в/в
|
1,5 мг/м2
максимально 2мг |
1
|
|
|
|
|
6
|
|
Метотрексат
|
36 час. инфузия
|
1000 мг/м2
|
1
|
|
|
|
|
|
|
аспарагиназа*
|
6 час. инфузия
|
10000 Ед/м2
|
|
|
|
4
|
|
|
|
метотрексат!
|
эндолюмбально
|
в зависимости от
возраста |
1
|
|
|
|
|
|
|
цитарабин!
|
эндолюмбально
|
в зависимости от
возраста |
1
|
|
|
|
|
|
|
преднизолон!
|
эндолюмбально
|
в зависимости от
возраста |
1
|
|
|
|
|
|
* в случае аллергической реакции или инактивации выберите альтернативный препарат в соответствии с указаниями, указанными в протоколе.
|
NB!
При поражении ЦНС дополнительная доза интратекальной химиотерапии назначают на 6-й день! Интервал между интратекальными инъекциями должен составлять не менее пяти |
Таблица 2 - Блок F2 состоит из 5 дней:
В состав блока входят дексаметазон 1–5 дни, винкристин 1-й день, цитозар 1, 2 дни, ПЭГ-аспаргиназа – 4й день, эндолюмбальная терапия в возрастных дозировках – 6й день.
В состав блока входят дексаметазон 1–5 дни, винкристин 1-й день, цитозар 1, 2 дни, ПЭГ-аспаргиназа – 4й день, эндолюмбальная терапия в возрастных дозировках – 6й день.
|
Препарат
|
Введение
|
Доза
|
Дни
|
||||
|
Дексаметазон
|
через рот
|
20 мг/м2
|
1
|
2
|
3
|
4
|
5
|
|
Винкристин
|
в/в
|
1,5 мг/м2
максимально 2мг |
1
|
|
|
|
|
|
Цитарабин
|
3 час. инфузия
|
2 х 3000 мг/м2
|
1
|
2
|
|
|
|
|
аспарагиназа*
|
6 час. инфузия
|
10000Ед/м2
|
|
|
|
4
|
|
|
метотрексат!
|
эндолюмбально
|
в зависимости от возраста
|
|
|
|
|
5
|
|
цитарабин!
|
эндолюмбально
|
в зависимости от возраста
|
|
|
|
|
5
|
|
преднизолон!
|
эндолюмбально
|
в зависимости от возраста
|
|
|
|
|
5
|
* в случае аллергической реакции или инактивации выберите альтернативный препарат в соответствии с указаниями, указанными в протоколе.
|
NB!
При поражении ЦНС дополнительная доза интратекальной химиотерапии назначают на 1-й день! |
Таблица 3 - Блок R 2 состоит из 6 дней:
В состав блока входят дексаметазон 1–6 дни, винкристин – 1й день, ифосфамид – 1–5 дни, метотрексат 36 часовой инфузией – 1й день, даунорубицин 5й день, аспаргиназа – 6й день, эндолюмбальная терапия в возрастных дозировках –1й день. 6-меркаптопурин назначался через рот в дозе 100mg/m 2 поверхности тела с 1 по 5 день.
|
Препараты
|
введение
|
доза
|
дни
|
|||||
|
дексаметазон
|
через рот
|
20 мг/м2
|
1
|
2
|
3
|
|
5
|
|
|
меркаптопурин
|
через рот
|
100 мг/м2
|
|
|
3
|
4
|
5
|
|
|
винбластин
|
в/в
|
3 мг/м2
|
1
|
|
|
|
|
|
|
метотрексат
|
36 час. инфузия
|
1000 мг/м2
|
1
|
|
|
|
|
|
|
ифосфамид
|
1 час. инфузия
|
400 мг/м2/д
|
1
|
2
|
3
|
4
|
5
|
|
|
даунорубимицин
|
24 час. инфузия
|
35 мг/м2
|
|
|
|
|
5
|
|
|
аспарагиназа*
|
6 час. инфузия
|
10000 Ед/м2
|
|
|
|
|
|
6
|
|
метотрексат!
|
эндолюмбально
|
в зависимости
от возраста |
1
|
|
|
|
|
|
|
цитарабин!
|
эндолюмбально
|
в зависимости
от возраста |
1
|
|
|
|
|
|
|
преднизолон!
|
эндолюмбально
|
в зависимости
от возраста |
1
|
|
|
|
|
|
* в случае аллергической реакции или инактивации выберите альтернативный препарат в соответствии с указаниями, указанными в протоколе.
|
NB!
При поражении ЦНС дополнительная доза интратекальной химиотерапии назначают на 5-й день! |
Таблица 4 - Блок R 1 состоит из 6 дней:
В состав блока входят дексаметазон 1–6 дни, винкристин 1 и 6й дни, метотрксат 36 часовой инфузией 1-й день, цитозар – 5й день, ПЭГаспаргиназа – 6й день, эндолюмбальная терапия в возрастных дозировках 1й день, 6-меркаптопурин назначается через рот в дозе 100mg/m 2 поверхности тела с 1 по 5 день.
|
Препараты
|
Введение
|
Доза
|
Дни
|
||||||
|
Дексаметазон
|
через рот
|
20 мг/м2
|
1
|
2
|
3
|
4
|
5
|
|
|
|
меркаптопурин
|
через рот
|
100 мг/м2
|
1
|
2
|
3
|
4
|
5
|
|
|
|
Винкристин
|
в/в
|
1,5 мг/м2 максимально 2мг
|
1
|
|
|
|
|
6
|
|
|
Метотрексат
|
36 час. инфузия
|
1000 мг/м2
|
1
|
|
|
|
|
|
|
|
Цитарабин
|
3 час. инфузия
|
2000х2 мг/м2/д
|
|
|
|
|
5
|
|
|
|
аспарагиназа*
|
6 час. инфузия
|
10000 Ед/м2
|
|
|
|
|
|
6
|
|
|
метотрексат!
|
эндолюмбально
|
в зависимости от возраста
|
1
|
|
|
|
|
|
|
|
цитарабин!
|
эндолюмбально
|
в зависимости от возраста
|
1
|
|
|
|
|
|
|
|
преднизолон!
|
эндолюмбально
|
в зависимости от возраста
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
* в случае аллергической реакции или инактивации выберите альтернативный препарат в соответствии с указаниями, указанными в протоколе.
Таблица 5 Протокол II – IDA состоит из 42 дней
В состав входят следующие препараты: дексаметазон 1–22 дни, винкристин в 1,8.15,22 дни, Идарубицин в 1, 8, 15, 22 дни, ПЭГ-аспаргиназа 1, 12 дни, Циклофосфан назначается на протоколе II-IDA на 29 день, цитозар назначался с 31 дня по 34 и с 38 дня по 41 день, 6-меркаптопурин с 29–43 дни. Эндолюмбальная терапия – 1, 15, 31, 38 дни.
В состав входят следующие препараты: дексаметазон 1–22 дни, винкристин в 1,8.15,22 дни, Идарубицин в 1, 8, 15, 22 дни, ПЭГ-аспаргиназа 1, 12 дни, Циклофосфан назначается на протоколе II-IDA на 29 день, цитозар назначался с 31 дня по 34 и с 38 дня по 41 день, 6-меркаптопурин с 29–43 дни. Эндолюмбальная терапия – 1, 15, 31, 38 дни.
|
Препарат
|
Путь Введения
|
Доза
|
Дни
|
|
|||||||||||||||||||
|
дексаметазон
|
Через рот
|
6мг/м2/су
т |
1- 14
|
снижение
|
|||||||||||||||||||
|
винкристин
|
в/в
|
1,5
мг/м2/д максима льно 2мг |
1
|
|
8
|
|
15 |
|
22 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
идарубицин
|
6час.в/в инфузия
|
6 мг/м2/д
|
1
|
|
8 |
|
15
|
|
22
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
аспарагиназа*
|
6час.в/в инфузия
|
10.000
ЕД/м2 |
1
|
6
|
|
11
|
|
16
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
циклофосфамид
|
в/в инф узия
|
1 г/м2/
1 час |
|
|
|
|
|
|
|
|
29
|
|
|
|
|
|
|
|
|
|
|
|
|
|
цитарабин
|
в/в струйно
|
75 мг/м2/ день
|
|
|
|
|
|
|
|
|
|
|
31
|
32
|
33
|
34
|
|
|
|
38
|
39
|
40
|
|
|
6-
меркаптопурин |
внутрь
|
60
мг/м2/д |
|
|
|
|
|
|
|
|
29 по 43
|
||||||||||||
|
метотрексат!
|
э/л
|
в зависимо сти от возраста
|
1
|
|
|
|
15
|
|
|
|
|
|
31
|
|
|
|
|
|
|
38
|
|
|
|
|
цитарабин!
|
э/л
|
1
|
|
|
|
15
|
|
|
|
|
|
31
|
|
|
|
|
|
|
38
|
|
|
||
|
преднизолон!
|
э/л
|
1
|
|
|
|
15
|
|
|
|
|
|
31
|
|
|
|
|
|
|
38
|
|
|
||
|
* в случае аллергической реакции или инактивации выберите альтернативный препарат в соответствии с указаниями, указанными в протоколе.
!При поражении ЦНС дополнительная доза интратекальной химиотерапии назначают на 8-й день. |
|||||||||||||||||||||||
|
|
|||||||||||||||||||||||
Приложение 2
Осложнения ОЛЛР [1,7,55]
Профилактика и лечение специфических расстройств.
Гиперлейкоцитоз:
Следующие причины, связанные с гиперлейкоцитозом, представляют собой опасность для пациентов:
Осложнения ОЛЛР [1,7,55]
Профилактика и лечение специфических расстройств.
Гиперлейкоцитоз:
Следующие причины, связанные с гиперлейкоцитозом, представляют собой опасность для пациентов:
-
острый синдром распада опухоли, как вследствие спонтанного распада опухолевых клеток, так и вследствие начала циторедуктивной терапии;
-
лейкостаз в мелких сосудах и капиллярах, в особенности, в головном мозге и в лёгких;
-
геморрагические осложнения.
Опухоль в средостении с компрессией трахеи и синдромом верхней полой вены, наличие жидкости в перикарде
При наличии выраженной дыхательной недостаточности, кроме анализа крови, никакие другие инвазивные диагностические процедуры проводиться не должны.
Если имеется большое количество жидкости в плевральной полости, она должна быть под местной анестезией осторожно удалена. При критическом объёме жидкости в полости перикарда показано его дренирование. Жидкость, получаемая из дренажей, используется для цитологической диагностики.
Во всех этих ситуациях циторедуктивная терапия стероидными гормонами начинается немедленно.
Если респираторная симптоматика плохо купируется на фоне гормональной терапии, показано дополнительное введение циклофосфана 100 – 200 мг/м2/сут. Увеличение доз определяется клинической картиной.
Полная диагностика (КМП/СМП) проводится после стабилизации клинического состояния. Как правило, это становится возможным через день – два после начала циторедуктивной терапии.
Инициальная олиго/анурия
Инициальная олиго/анурия может быть обусловлена двумя различными состояниями: либо уратной нефропатией, либо обструкцией мочевыводящих путей. Дифференциальная диагностика этих состояний строится на основе УЗИ почек и мочевыводящих путей, определения уровней мочевины, креатинина и мочевой кислоты в крови.
При уже имеющейся гиперкалиемии (калий>5,6 ммоль/л) необходимо применение лактулёзы или других слабительных средств (предупреждение запоров), инфузия раствора глюкозы (1 г/кг) с добавлением инсулина (0,3 Eд/кг) в течение 30 минут до гемодиализа; при изменениях на ЭКГ – медленное внутривенное введение 10% глюконата кальция 0,5-1-2 мл/кг (опасность брадикардии!) и 4% NaHCO3 2 ммоль/кг. Необходимо немедленное начало гемодиализа. Если его проведение невозможно, тогда пациент должен немедленно быть переведён в клинику, где такая возможность имеется.
При уже имеющейся гиперкалиемии (калий>5,6 ммоль/л) необходимо применение лактулёзы или других слабительных средств (предупреждение запоров), инфузия раствора глюкозы (1 г/кг) с добавлением инсулина (0,3 Eд/кг) в течение 30 минут до гемодиализа; при изменениях на ЭКГ – медленное внутривенное введение 10% глюконата кальция 0,5-1-2 мл/кг (опасность брадикардии!) и 4% NaHCO3 2 ммоль/кг. Необходимо немедленное начало гемодиализа. Если его проведение невозможно, тогда пациент должен немедленно быть переведён в клинику, где такая возможность имеется.
Если причиной олиго/анурии является инфильтрация почек или обструкция мочевыводящих путей, то тогда одновременно с гемодиализом должна быть начата циторедуктивная терапия стероидными гормонами (дексаметазон или метилпреднизолон).
Если олиго/анурия связана только с уратной нефропатией без инфильтрации паренхимы почек или обструкции мочевыводящих путей, то начало циторедуктивной терапии откладывается до получения устойчивого и адекватного диуреза, снижения уровня мочевины, креатинина и мочевой кислоты.
- При олиго/анурии:
Отделение мочи менее 50 мл/м2 в час, несмотря на введение фуросемида 10 мг/кг в сутки и инфузионную терапию в объеме 130-200 мл/м2 в час. “Обычное” определение < 5 мл/м2 в час к данной ситуации не применимо. Быстрое возрастание особенно K+ при ожидании “выполнения” такого определения может привести к летальному исходу. Диурез оценивается вместе с объёмом реально вводимой жидкости.
- УЗИ: Обструкция мочевыводящих путей, Инфильтрация почек
- лаборатория: K+, Ca++, мочевая кислота, фосфат.
- моча: кристаллы уратов,Кристаллы фосфата кальция
- терапия: гемодиализ! самое позднее при подъёме K+ > 6 mmol/L.
-
Показания к гемодиализу
- K+ > 7 mmol/L или подъём > 6 mmol/L, несмотря на достаточную инфузионную терапию и диуретики;
- фосфат > 10 мг/100 мл (5 ммоль/л) или продукт Ca x P > 6,0 ммоль/л;
- отделение мочи менее 50 мл/м2 в час, несмотря на введение фуросемида 10 мг/кг в сутки и инфузионную терапию в объеме 130-200 мл/м2 в час;
- отделение мочи менее 50 мл/м2 в час, несмотря на введение фуросемида 10 мг/кг в сутки и инфузионную терапию в объеме 130-200 мл/м2 в час;
- двусторонняя высокая или полная обструкция мочевыводящих путей.
Тяжелые инфекции
Тяжёлые инфекции в диагностический и индукционный периоды, в связи с отсутствием нормального кроветворения и достаточного гранулоцитарного пула, могут принимать угрожающее для жизни течение с нарастанием гипотонии, прогрессированием интоксикации и, без применения экстренных адекватных мер, могут быстро привести больного к гибели.
Профилактика и лечение инфекционных осложнений
В момент постановки диагноза до начала химиотерапии рекомендуется:
-
бактериологическое исследование крови, стула, эксудатов, мазков с кожи и слизистых;
-
серологические (вирусологические) исследования на ВПГ, CMV, корь, EBV, гепатиты A, B, C, D, ВИЧ, кандиду, аспергиллы;
-
С-реактивный белок и/или прокальцитонин.
Мониторинг этих показателей крайне желателен в течение всего периода индукции (если есть возможность), а в дальнейшем по показаниям.
При росте трансаминаз необходимо провести следующие серологические (вирусологические) исследования с целью исключения вирусного поражения печени: CMV, EBV, Гепатиты A, B, C.
-
Котримоксазол (Сульфаметоксазол + триметоприм) 3 раза в неделю (понедельник, вторник, среда) в один прием в дозе 5 мг/кг по триметоприму или 20 мг/кг по сульфаметоксазолу per os – в течение всего периода лечения обязательно.
-
Уход за ротовой полостью: 6-10 раз в день полоскание полости рта дезинфицирующими растворами.
-
Тщательный, но щадящий уход за зубами и деснами; ограничение использования даже мягких зубных щёток; рекомендуется отдавать предпочтение ротовому душу; при тромбоцитопении или ранимых слизистых использование зубных щёток должно быть исключено, вместо этого необходима дополнительная обработка рта вяжущими средствами.
-
Профилактика запоров и пареза кишечника: возникновение запоров и пареза кишечника благоприятствует росту бактерий и грибов в толстом кишечнике и инвазии их в слизистые, особенно при повреждении последних цитостатиками. Следовательно, необходимо уделять самое пристальное внимание ежедневной дефекации и обеспечить у больного пластичный кал. При запорах: лактулоза per os (или другие слабительные препараты), если возможно - очистительная клизма.
-
Дезинфекция кожи: ежедневное мытье под душем или обтирание водным раствором хлоргексидина, обработка мацераций и повреждений раствором бриллиантовой зелени.
-
необходима ежедневная дезинфекция места пребывания больного с помощью дезрастворов, при наличии агранулоцитоза – ежедневная смена постельного и нательного белья.
-
обязательна личная гигиена родителей и посетителей, мытье рук персонала при входе в палату (бокс).
-
желательно наличие в палатах воздухоочистителей.
Лихорадкой у больного с нейтропенией (нейтрофилов < 500/мкл) считается однократное повышение базальной температуры тела > 38,50С или несколько подъемов (3 - 4 раза в сутки) до 380С. Принимая во внимание высокий риск фатального исхода у больного с инфекцией, лихорадку у такого пациента с нейтропенией, развившую в ходе миелосупрессивной полихимиотерапии, следует расценивать как наличие инфекции, что требует немедленного начала эмпирической антибактериальной терапии и проведения обследования с целью уточнения характера инфекции.
Диагностические мероприятия при лихорадке включают следующие обследования:
-
Осмотр места стояния катетера, оценка длительности его нахождения и его функционирования (проходимость в обе стороны и пр.)
-
определение содержания С-реактивного белка и/или прокальцитонина в динамике количественным методом;
-
многократные бактериологические исследования:
-
культура крови (аэробы, анаэробы, грибы), при этом забор крови производится из катетера и периферической вены,
-
мазки из ануса, носоглотки, иногда из поражений кожи,
-
моча из средней порции струи (количество и культура микроорганизмов, а также наличие Candida albicans),
-
копрокультура;
-
определение антител к ВПГ и цитомегаловирусу (Ig M);
-
выявление вирусов из различных мест повреждения, мочи, кала;
-
рентгенография грудной клетки, компъютерная томография лёгких и КТ и/или МРТ исследование органов брюшной полости, головного мозга и придаточных пазух для выявления очагов инфекции;
-
диагностическая люмбальная пункция (при необходимости).
Предложено много инициальных антибактериальных режимов, эффективность которых в целом идентична. Общие положения:
- стартовая комбинация должна включать бета-лактамный антибиотик широкого спектра с высокой «антисинегнойной» активностью в сочетании с амикацином.
- приемлемы следующие сочетания: цефтазидим+амикацин, тазоцин+амикацин или цефепим+амикацин; монотерапия, учитывая высокий риск поражения слизистых и бактериемии, должна быть редким исключением.
- при выборе стартовой комбинации антибиотиков необходимо учитывать: результаты повторных бактериологических исследований в данной клинике у других пациентов; длительность текущей нейтропении, предшествующий курс химиотерапии, инфекционный анамнез больного, предшествующие курсы антибиотиков и их эффективность;
- наряду с появлением лихорадки все остальные клинические данные: артериальная гипотензия, нестабильная гемодинамика ® немедленно карбопенемы (меропенем (или имипенем/циластатин)) +аминогликозид (амикацин) +ванкомицин;
- длительно стоящий ЦВК и лихорадка после его промывания и/или не просто лихорадка, а потрясающие ознобы ®ванкомицин уже в стартовой комбинации;
- клиника энтероколита с диареей: к инициальной комбинации – ванкомицин р.о. 20 мг/кг в сутки. Возможно назначение метронидазола (р.о. и/или в/в);
- тяжелый стоматит с воспалительными изменениями дёсен ® пенициллин, клиндамицин в сочетании с бета-лактамом или меропенем (имипенем);
- характерная сыпь и/или наличие друз грибов в моче и/или характерные очаги в печени и селезёнке при сонографии ®амфотерицин, вориконазол, каспофунгин, микафунгин;
- При инфекции мягких тканей (кроме промежности) рассмотреть вопрос о назначении линезолида.
Смена антибиотиков с учетом чувствительности выделенной флоры.
Адекватная инфузионная терапия с коррекцией электролитов и альбумина, заместительная терапия.
Эффективность стартовой антибактериальной терапии следует оценивать через 72 часа, однако всегда необходим повторный с интервалами 8-12 часов детальный осмотр такого больного с оценкой стабильности гемодинамики и степени интоксикации, появления новых инфекционных очагов. Антибактериальная терапия продолжается до разрешения нейтропении и полного разрешения всех инфекционных очагов.
При появлении признаков стоматита: к базовой терапии подключить дифлюкан (флюконазол) 4-5 мг/кг 1 раз в день через рот в течение 3-5 дней (в день введения винкристина не дается).
При появлении дефектов слизистой полости рта:
-
исключить использование зубных щёток;
-
при развитиии распространённого грибкового стоматита показана. системная терапия Амфотерицином В 1 мг/кг в течение 5-7 дней;
-
полоскание с обезболивающими растворами.
-
при подозрении на герпетическое поражение (сильные боли+гиперемия) - ацикловир 750 мг/м2 в день в три приёма в/в капельно в течение часа 5-7 дней.
-
при распространённом воспалении/некрозах периапикальных дёсен - противоанаэробные антибиотики (метронидазол, клиндамицин в комбинации с пиприлом).
При обоснованном подозрении или документации системной грибковой инфекции следует применить внутривенную терапию Амфотерицином В. Стартовая доза - 0,5 мг/кг в 1-ый день, на следующий день - полная терапевтическая доза - 1 мг/кг в день однократно. При применении Амфотерицина В необходимо контролировать функцию почек и делать биохимический анализ крови (электролиты, креатинин). Необходима постоянная коррекция калия до нормальных величин. Вовремя инфузии Амфотерицина В, а также в течение примерно 3-4 часов после инфузии могут наблюдаться реакции на введение препарата в виде лихорадки, потрясающего озноба, тахикардии, которые купируются промедолом и анальгетиками. При нарушении функции почек необходимо применять вориконазол, каспофунгин, микофунгин, позаконазол, итраконазол, липидные формы амфотерицина В.
При развитии симптомов пневмоцистной пневмонии (Pneumocystis carinii) (очень редко при проведении профилактики бисептолом), доза бисептола должна быть увеличена до 20 мг/кг/день по триметоприму в 2-4 введения/ день, в/в капельно.
Интерстициальное поражение легких или появление инфильтратов может быть вызвано также грибковой или кокковой инфекцией, легионеллой, микоплазмой. В соответствии с причиной инфекции назначается соответствующая антимикробная терапия.
При продолжительной нейтропении, появлении повторных эпизодов лихорадки и/или соответствующей симптоматике (например, при наличии глубоких язвенных поражений слизистой рта) необходимо учитывать возможность вирусной инфекции (Herpes Simplex, ветряная оспа, опоясывающий лишай). При наличии клинических проявлений назначается ацикловир 30 мг/кг в день в три приема внутривенно капельно за 1 час в течение 5 дней (минимально) до появления корочек на последних везикулах. В том случае, когда имеется значительное некротически- язвенное поражение слизистой полости рта и, пациент предъявляет жалобы на сильные боли во рту, отказывается из-за этого от приема пищи, необходимо обязательное обезболивание вплоть до применения наркотических анальгетиков.
Коррекция антимикробной терапии – по результатам микробиологических исследований.
При глубокой аплазии, риске развития септических осложнений пассивная иммунизация внутривенными иммуноглобулинами (ВВИГ).
Профилактика поражений ЖКТ:
Рекомендуется при проведении блоков ПХТ назначение: ингибиторы протонной помпы. В перерывах ПХТ антацидную терапию применять только при наличии клинических показаний.
Энтеральное и парентеральное питание у детей:
Поддержание хорошего нутритивного статуса является важной частью поддерживающей терапии у детей, получающих химиотерапию. Пациенты, получающие полный объем питания, хорошо переносят лечение. Причины нутритивных проблем у онкологических пациентов:
- снижение аппетита;
- тошнота и рвота;
- мукозиты слизистой ротовой полости;
- извращение вкуса;
- сухость в ротовой полости, вследствие снижения секреции;
- развитие мальабсорбции и диареи;
- запоры;
- отвращение к пище;
- стероидная терапия;
Питание проводится энергетическими и протеиновыми напитками (молочные йогурты, соки, витамины и минералы).
Энтеральное питание показано детям, которые потеряли больше 10% массы тела, также пациентам с большими опухолевыми «массами». Проводится через назогастральный зонд, при необходимости показана гастростомия. Преимущество энтерального питания, возможность продолжения кормления в домашних условиях, обученными родителями.
Применяются смеси для кормления, индивидуально, с учетом энергетической потребности пациента.
Парентеральное питание является вариантом выбора, ввиду длительного пребывания в стационаре и наличия центрального венозного доступа.
Выбор и назначение парентерального питания, проводится коллегиально с диетологами, реаниматологами и онкологами.
При развитии антибиотик ассоциированной диареи используются лактобактерии, бифидумбактерии. При упорной рвоте и тошноте показано применение противорвотных препаратов типа ондасетрон, трописетрон.
Поражения поджелудочной железы "аспарагиназный" панкреатит при применении L-аспарагиназы могут быть в виде нескольких клинических вариантов:
-
упорный выраженный болевой синдром в области живота часто опоясывающего характера, тошнота, рвота, проявления интоксикации;
-
повышение уровня амилазы крови/диастазы мочи (так называемый амилазосиндром);
-
патологические изменения на КТ/МРТ (метод выбора), представляющие собой прежде всего увеличение размеров поджелудочной железы отек и даже очаги некроза. При этом для верификации панкреатита ультразвуковое исследование в силу субъективности метода является абсолютно недостаточным и никак не может заменить проведение КТ и/или МРТ.
Развитие такого панкреатита является основанием для полной отмены терапии аспарагиназы.
Приложение 3
Трансфузионная поддержка[12]
Показания к проведению трансфузионной терапии определяются в первую очередь клиническими проявлениями индивидуально для каждого пациента с учетом возраста, сопутствующих заболеваний, переносимости химиотерапии и развития осложнений на предыдущих этапах лечения.
Лабораторные показатели для определения показаний имеют вспомогательное значение, в основном для оценки необходимости профилактичесиких трансфузий концентрата тромбоцитов.
Показания к трансфузиям также зависят от времени, после проведения курса химиотерапии – принимаются во внимание, прогнозируемое снижение показателей в ближайшие несколько дней.
Лабораторные показатели для определения показаний имеют вспомогательное значение, в основном для оценки необходимости профилактичесиких трансфузий концентрата тромбоцитов.
Показания к трансфузиям также зависят от времени, после проведения курса химиотерапии – принимаются во внимание, прогнозируемое снижение показателей в ближайшие несколько дней.
Эритроцитарная масса/взвесь (уровень доказательности D):
-
уровень гемоглобина не нужно повышать, пока обычные резервы и компенсационные механизмы достаточны для удовлетворения потребностей тканей в кислороде;
-
существует только одно показание для трансфузий эритроцитсодержащих сред при хронических анемиях – симптомная анемия (проявляющаяся тахикардией, одышкой, стенокардией, синкопе, de novo депрессией или элевацией ST);
-
уровень гемоглобина менее 30 г/л является абсолютным показанием для трансфузии эритроцитов;
-
при отсутствии декомпенсированных заболеваний сердечно-сосудистой системы и легких показаниями для профилактической трансфузии эритроцитов при хронических анемиях
Концентрат тромбоцитов (уровень доказательности D):
-
при снижении уровня тромбоцитов менее 10 х109/л или появлении геморрагических высыпаний на коже (петехии, синячки) проводится профилактическая трансфузия аферезных тромбоцитов.
-
профилактическая трансфузия аферезных тромбоцитов у пациентов с лихорадкой, пациентам, которым планируется инвазивное вмешательство, может проводиться при более высоком уровне - 10 х109/л.
-
при наличии геморрагического синдрома петехиально-пятнистого типа (носовые, десневые кровотечения, мено-, метроррагии, кровотечения других локализаций) трансфузия концентрата тромбоцитов проводится с лечебной целью.
Свежезамороженная плазма (уровень доказательности D):
-
трансфузии СЗП проводятся у пациентов с кровотечением или перед проведением инвазивных вмешательств;
-
пациенты с МНО ≥ 2.0 (при нейрохирургических вмешательствах ≥1.5) рассматриваются как кандидаты для трансфузии СЗП при планировании инвазивных процедур. При плановых вмешательствах возможно назначение не менее, чем за 3 дня до вмешательства фитоменадиона не менее 30 мг/сут внутривенно или внутрь.
Приложение 4
Установка постоянной центральной венозной магистрали
Постановка центрального венозного катетера проводится под общим наркозом у всех больных независимо от возраста, так как снижает риск травматизации и уменьшает негативное их влияние на психологическое состояние ребёнка. Исключением могут являться случаи, когда наркоз несет в себе опасность для жизни ребенка (например, при большой опухолевой массе в средостении).
Должны использоваться только центральные катетеры из нетромбогенных материалов (тефлон), для которых предусмотрено длительное время применения у больного (не менее 3-х месяцев) с возможностью туннелизирования. Другим преимуществом катетеров является наличие клеммы, действительно эффективно герметизирующей просвет катетера, что резко увеличивает качество его «промывки» и предотвращает даже малейший заброс крови и формирование биоплёнки.
Применение катетеров из полиэтилена в силу их высокой тромбогенности и риска развития катетерной инфекции запрещается. Длительное использование катетеров, исходно предназначенных для короткого применения (не более 1 месяца) крайне не рекомендуется.
Установка центрального венозного катетера должна производиться только в стерильных условиях (манипуляционный кабинет) и наиболее опытным анестезиологом.
Адекватный уход за катетером предполагает постоянный тренинг медперсонала. Основной принцип – соблюдение стерильности. Инфекции и тромбоз являются основными причинами потери катетеров, причём инфекция из внутреннего просвета катетера встречается чаще, чем инфекция места выхода катетера.
Должны использоваться только центральные катетеры из нетромбогенных материалов (тефлон), для которых предусмотрено длительное время применения у больного (не менее 3-х месяцев) с возможностью туннелизирования. Другим преимуществом катетеров является наличие клеммы, действительно эффективно герметизирующей просвет катетера, что резко увеличивает качество его «промывки» и предотвращает даже малейший заброс крови и формирование биоплёнки.
Применение катетеров из полиэтилена в силу их высокой тромбогенности и риска развития катетерной инфекции запрещается. Длительное использование катетеров, исходно предназначенных для короткого применения (не более 1 месяца) крайне не рекомендуется.
Установка центрального венозного катетера должна производиться только в стерильных условиях (манипуляционный кабинет) и наиболее опытным анестезиологом.
Адекватный уход за катетером предполагает постоянный тренинг медперсонала. Основной принцип – соблюдение стерильности. Инфекции и тромбоз являются основными причинами потери катетеров, причём инфекция из внутреннего просвета катетера встречается чаще, чем инфекция места выхода катетера.
Смена катетера по леске запрещается!
Особенности многолинейного ЦВК:
- использование специального рентгеноконтрастного гибкого атромбогенного силиконированного материала;
- установка кончика катетера в правое предсердие или на границе верхней полой вены и правого предсердия, что имеет большое значение при введении склерозантов;
- баллотирование кончика катетера с каждым сердечным циклом, что уменьшает контакт с эндотелием и вероятность развития тромботических осложнений;
- наличие более одного просвета, что позволяет одновременно вводить химически несовместимые медикаменты.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.