Реваскуляризация миокарда при остром коронарном синдроме с подъемом сегмента ST
Инфаркт миокарда с подъемом сегмента ST; Острый коронарный синдром с элевацией сегмента ST
 Версия: Клинические протоколы КР 2024 (Кыргызстан)
Версия: Клинические протоколы КР 2024 (Кыргызстан)
Острый инфаркт миокарда (I21), Повторный инфаркт миокарда (I22)
Кардиология, Неотложная медицина, Реаниматология
Общая информация
Краткое описание
Приложение 7
к приказу МЗКР №1342
от 25.12.2024 г.
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ КЫРГЫЗСКОЙ РЕСПУБЛИКИ
НАЦИОНАЛЬНЫЙ ЦЕНТР КАРДИОЛОГИИ И ТЕРАПИИ ИМЕНИ АКАДЕМИКА МИРСАИДА МИРРАХИМОВА ПРИ МЗ КР
АССОЦИАЦИЯ ВРАЧЕЙ ПО ВНУТРЕННЕЙ МЕДИЦИНЕ КР
РЕСПУБЛИКАНСКИЙ ЦЕНТР РАЗВИТИЯ ЗДРАВООХРАНЕНИЯ И ИНФОРМАЦИОННЫХ ТЕХНОЛОГИЙ КР
Клиническое руководство
Реваскуляризация миокарда при остром коронарном синдроме с подъемом сегмента ST
ВВЕДЕНИЕ
Острые коронарные синдромы и инфаркт миокарда.
Острые коронарные синдромы (ОКС) охватывают спектр состояний, включающих пациентов с недавними изменениями клинических симптомов и признаков, с изменениями или без изменений на 12- отведениях электрокардиограммы (ЭКГ), с резким повышением или без резкого повышения концентрации сердечного тропонина (сТн). Пациентам, поступающим с подозрением на ОКС, в конечном итоге, может быть поставлен диагноз острого инфаркта миокарда (ОИМ) или нестабильной стенокардии (НС). Пациенты с острой болью в грудной клетке и сохраняющимся >20 мин подъемом сегмента ST. Это состояние определено как ОКС с подъемом сегмента ST (OKCпST), который обычно характеризует полную окклюзию коронарной артерии. У большинства пациентов формируется инфаркт миокарда (ИМ) с подъемом сегмента ST (ИMПST). Первичная цель лечения — быстрая, полная и стойкая немедленная реперфузия путем первичной ангиопластики или фибринолитической терапии [1]. У пациентов с острой болью в грудной клетке без стойкого подъема сегмента ST на ЭКГ могут быть следующие изменения: преходящая элевация сегмента ST, стойкая или преходящая депрессия сегмента ST, инверсия зубца Т, сглаженность зубцов Т или псевдонормализация зубцов Т, кроме того, изменения на ЭКГ могут отсутствовать.
Универсальное определение ОИМ.
Острый ИМ определяется как некроз кардиомиоцитов, в клинической картине соотносящийся с острой ишемией миокарда [2]. Для постановки диагноза острого ИМ необходимо сочетание критериев, а именно обнаружение увеличения и/или уменьшения уровней сердечных биомаркеров, преимущественно высокочувствительного сердечного тропонина (вч-сТн), по крайней мере, на одно значение, превышающее 99 процентиль верхнего порога референсного значения при наличии одного из следующих критериев:
-
Симптомы ишемии.
-
Новые ишемические изменения на ЭКГ.
-
Появление патологических зубцов Q на ЭКГ.
-
Визуальные данные о новых или предполагаемых новых зонах потери жизнеспособного миокарда нарушений региональной сократительной способности стенки.
-
Внутрикоронарный тромбоз, выявляемый на ангиографии или при аутопсии.
ИМ тип 1
ИМ тип 1 характеризуется разрывом, изъязвлением, трещиной или эрозированием атеросклеротической бляшки, приводящим к тромбозу одной или нескольких коронарных артерий, вызывающим снижение кровотока и/или дистальной эмболизацией и последующему некрозу миокарда. У пациента может быть выраженный коронарный атеросклероз, но, в ряде случаев (5-20%), может быть, необструктивный коронарный атеросклероз или ангиографически нормальные коронарные артерии, особенно у женщин [2].
ИМ тип 2
ИМ тип 2 — это некроз миокарда, при котором состояние, отличное от нестабильности бляшки, вызывает дисбаланс между доставкой и потребностью миокарда в кислороде [2]. Механизмы включают в себя гипотензию, гипертензию, тахиаритмии, брадиаритмии, анемию, гипоксемию, а также, согласно определению, спазм коронарных артерий, спонтанную диссекцию коронарных артерий (СДКА), эмболию в коронарные артерии и микроваскулярное поражение [3].
ИМ 3–5 типов
Универсальное определение ИМ также включает ИМ тип 3 (ИМ, приведший смерти, когда определение биомаркеров не было возможно) и ИМ 4 и 5 типов (связанных с чрескожным коронарным вмешательством (ЧКВ) и коронарным шунтированием (КШ), соответственно).
Острый коронарный синдром (ОКС) является ведущей причиной смертности в большинстве стран. Особенно высокие показатели заболеваемости и смертности от ОКС на постсоветском пространстве, что делает проблему лечения ОКС не только медицинской, но и важной социально значимой в этих странах. В настоящее время мы являемся свидетелями явного прогресса в диагностике и лечении ОКС. Появились новые медикаментозные и инвазивные подходы. Значительно повысился процент восстановления коронарного кровотока с помощью высокотехнологичных методик – чрескожного коронарного вмешательства с имплантацией стента. Это привело к существенному улучшению результатов лечения. Правильная, основанная на последних научных достижениях, организация медицинской помощи больных с ОКС на всех этапах: догоспитальном, госпитальном и амбулаторном, - залог улучшения результатов лечения в краткосрочной и долгосрочной перспективе.
Острый коронарный синдром (ОКС) является ведущей причиной смертности в большинстве стран. Особенно высокие показатели заболеваемости и смертности от ОКС на постсоветском пространстве, что делает проблему лечения ОКС не только медицинской, но и важной социально значимой в этих странах. В настоящее время мы являемся свидетелями явного прогресса в диагностике и лечении ОКС. Появились новые медикаментозные и инвазивные подходы. Значительно повысился процент восстановления коронарного кровотока с помощью высокотехнологичных методик – чрескожного коронарного вмешательства с имплантацией стента. Это привело к существенному улучшению результатов лечения. Правильная, основанная на последних научных достижениях, организация медицинской помощи больных с ОКС на всех этапах: догоспитальном, госпитальном и амбулаторном, - залог улучшения результатов лечения в краткосрочной и долгосрочной перспективе.
Острый коронарный синдром (ОКС) включает в себя нестабильную стенокардию, острый инфаркт миокарда (с подъемом сегмента ST или без) и внезапную коронарную смерть (ВКС). Предполагается, что причиной развития ОКС чаще всего является острый тромбоз — как следствие трех различных морфологических состояний: разрыв атеросклеротической бляшки (АБ), эрозия бляшки и кальцификация. Кроме того, описано значительное количество случаев внезапной смерти без наличия острой тромботической окклюзии коронарных артерий. У таких пациентов причиной смерти является осложненная АБ в коронарном русле с такими последующими осложнениями, как жизнеугрожающие аритмии.
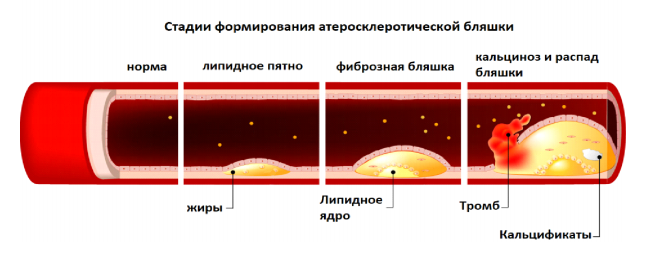

Рисунок 1.
Особенности кодирования заболевания по МКБ 10
Для унифицированного статистического учёта заболеваемости, причин обращений населения в медицинские учреждения всех ведомств и учета причин смерти разработана Международная классификация болезней 10-го пересмотра (МКБ-10). По данной классификации болезни, относятся к рубрикам I21, I22:
I21. Острый инфаркт миокарда
I21.0 Острый трансмуральный инфаркт передней стенки миокарда I21.1 Острый трансмуральный инфаркт нижней стенки миокарда
I21.2 Острый трансмуральный инфаркт миокарда других уточненных локализаций
I21.3 Острый трансмуральный инфаркт миокарда неуточненной локализации I21.4 Острый субэндокардиальный инфаркт миокарда
I21.9 Острый инфаркт миокарда неуточненный
I21.2 Острый трансмуральный инфаркт миокарда других уточненных локализаций
I21.3 Острый трансмуральный инфаркт миокарда неуточненной локализации I21.4 Острый субэндокардиальный инфаркт миокарда
I21.9 Острый инфаркт миокарда неуточненный
I22. Повторный инфаркт миокарда
I22.0 Повторный инфаркт передней стенки миокарда I22.1 Повторный инфаркт нижней стенки миокарда
I22.8 Повторный инфаркт миокарда другой уточненной локализации I22.9 Повторный инфаркт миокарда неуточненной локализации
I22.8 Повторный инфаркт миокарда другой уточненной локализации I22.9 Повторный инфаркт миокарда неуточненной локализации
Диагностика
ИНВАЗИВНЫЕ МЕТОДЫ ОБСЛЕДОВАНИЯ.
Общая информация.
1. Коронарная ангиография (КАГ, коронарография) — это инвазивное диагностическое исследование, выполняемое в условиях рентгенооперационной путем введения контрастного вещества в устья коронарных артерий под рентгенологическим контролем. Ее задача — точное, детальное определение анатомии коронарных артерий, выявление наличия, распространенности и выраженности обструкции просвета (т. е. стенозирующих поражений). Информация, получаемая в ходе исследования, позволяет определить анатомический вариант строения венечных артерий, идентифицировать наличие и степень обструкции их просвета, определить точную локализацию сужений, протяженность и диаметр просвета (неизмененный и в месте сужения) артерии, определить морфологический характер поражения, также можно установить наличие и степень выраженности коллатерального кровоснабжения. Результаты коронарографии позволяют верифицировать диагноз ИБС (или же исключить наличие обструктивного коронарного атеросклероза как ее морфологического субстрата), определить степень риска в соответствии с распространенностью, выраженностью и локализацией поражений и выбрать дальнейшую тактику лечения, в частности — показания к проведению процедур прямой реваскуляризации миокарда. В настоящее время коронарография может проводиться и как самостоятельное ангиографическое исследование, и как часть комплексного диагностического исследования, включающего методы оценки физиологической значимости сужений (измерение фракционного резерва коронарного кровотока — ФРКК), методы инвазивной внутрисосудистой визуализации (внутрисосудистое ультразвуковое исследование — ВСУЗИ, оптическая когерентная томография — ОКТ). Следует также помнить, что коронарография является инвазивным вмешательством и потенциально сопряжена с риском развития серьезных осложнений, хотя этот риск и сравнительно невысок: общая частота осложнений — менее 1.5%, летальность — менее 0,01%. С целью минимизации риска развития осложнений особое значение наряду с тщательным соблюдением методики имеют определение показаний к данному исследованию, оценка состояния и факторов, связанных как с выполнением коронарографии, так и с отказом от ее проведения.
2. Интракоронарная визуализация.
ВСУЗИ является одним из методов внутрисосудистой визуализации и имеет осевую разрешающую способность ~150 мкм. ВСУЗИ позволяет исследовать в реальном времени такие параметры, как диаметр артерии, площадь его поперечного сечения, состав и объем атеросклеротической бляшки. По сравнению с оптической когерентной томографией (ОКТ) ВСУЗИ имеет меньшее пространственное разрешение, но характеризуется большей глубиной проникновения и имеет преимущества при определении диаметра сосуда.
ОКТ является одним из методов внутрисосудистой визуализации и основано на использовании световых волн, его отличает большая осевая разрешающая способность по сравнению с ВСУЗИ (15 мкм и 150 мкм, соответственно). Недостатком ОКТ является необходимость полного отсутствия крови в сосуде при проведении исследования, а также низкая проникающая способность, которая ограничивает возможности метода в оценке размеров атеросклеротического поражения и диаметра артерии. Потенциальными областями применения внутрисосудистой визуализации как диагностического метода являются оценка значимости стеноза при его пограничных значениях по данным ангиографии, изучение морфологии поражения и состава атеросклеротической бляшки. Большинство данных клинических исследований касается использования методов внутрисосудистой визуализации для оптимизации результатов ЧКВ. Для оценки пограничных стенозов коронарных артерий в нескольких клинических исследованиях предпринята попытка определения порогового значения поперечного сечения артерии для суждения о гемодинамической значимости сужения. В одном из проспективных наблюдений установлена в целом слабая коррелятивная связь между минимальным поперечным сечением сосуда и показателем ФРК. Установленные пороговые значения поперечного сечения (<2,4; <2,7; и <3,6 мм2) зависят от референсного диаметра артерии (<3,0; 3,0-3,5 и >3,5 мм, соответственно). Для оценки гемодинамической значимости стеноза в большинстве случаев следует использовать показатель ФРК.
ОКТ является одним из методов внутрисосудистой визуализации и основано на использовании световых волн, его отличает большая осевая разрешающая способность по сравнению с ВСУЗИ (15 мкм и 150 мкм, соответственно). Недостатком ОКТ является необходимость полного отсутствия крови в сосуде при проведении исследования, а также низкая проникающая способность, которая ограничивает возможности метода в оценке размеров атеросклеротического поражения и диаметра артерии. Потенциальными областями применения внутрисосудистой визуализации как диагностического метода являются оценка значимости стеноза при его пограничных значениях по данным ангиографии, изучение морфологии поражения и состава атеросклеротической бляшки. Большинство данных клинических исследований касается использования методов внутрисосудистой визуализации для оптимизации результатов ЧКВ. Для оценки пограничных стенозов коронарных артерий в нескольких клинических исследованиях предпринята попытка определения порогового значения поперечного сечения артерии для суждения о гемодинамической значимости сужения. В одном из проспективных наблюдений установлена в целом слабая коррелятивная связь между минимальным поперечным сечением сосуда и показателем ФРК. Установленные пороговые значения поперечного сечения (<2,4; <2,7; и <3,6 мм2) зависят от референсного диаметра артерии (<3,0; 3,0-3,5 и >3,5 мм, соответственно). Для оценки гемодинамической значимости стеноза в большинстве случаев следует использовать показатель ФРК.
Стеноз ствола ЛКА является нередкой находкой при выполнении коронарографии, в то же время ангиографическая оценка значимости данного поражения представляет значительные трудности. В нескольких клинических исследованиях установлено преимущество ВСУЗИ перед визуальным анализом для оценки пограничных стенозов ствола ЛКА у больных с запланированными ЧКВ или операцией КШ. По данным многоцентрового проспективного исследования, реваскуляризация может быть отложена в случае минимальной площади просвета ствола ЛКА >6 мм2 и показана при значении данного показателя <6 мм. В другом исследовании установлено, что стратегия интервенции может быть отложена в случае минимальной площади просвета ствола ЛКА >7,5 мм. У пациентов из азиатского региона пороговый показатель минимальной площади просвета ствола ЛКА находится в диапазоне 4,5-4,8 мм2. Различие продиктовано меньшими размерами сердца у пациентов данной когорты. Сообщается, что ЧКВ под контролем ВСУЗИ снижает риск тромбоза стента/остановку кровотока по контролируемому сосуду через 12 мес. после ЧКВ по сравнению с ЧКВ под ангиографическим контролем в РКИ Intravascular Ultrasound Guided Drug Eluting Stents Implantation in “All-Comers” Coronary Lesions (ULTIMATE): 2,9% по сравнению с 5,4%, соответственно (ОР 0,53, 95% ДИ 0,31-0,90, P=0,019) [4]. Частота клинически контролируемой реваскуляризации целевого поражения или тромбоз стента были ниже при стратегии под контролем ВСУЗИ (1,2 vs 2,6%, относительный риск (RR) 0,46, 95% ДИ 0,211,03, P=0,05). Однако только 12% включенных пациентов имели ИМпST или OKCбпST, что являлось ограничением исследования [4].
ЧКВ под контролем ОКТ является безопасным методом и обеспечивает настолько же минимальную площадь стента, как и при ЧКВ под контролем ВСУЗИ. Кроме того, данные исследований доказывают, что ЧКВ под контролем ОКТ приводит к более высокому ФРК после ЧКВ по сравнению с ЧКВ под ангио-контролем среди пациентов с OKCбпST. Крупные исследования с достоверными конечными точками, однако, отсутствуют.
ОКТ — это диагностический инструмент для оценки СДКА, у пациентов с ИМ без обструкции коронарных артерий, эрозий и разрывов бляшек.
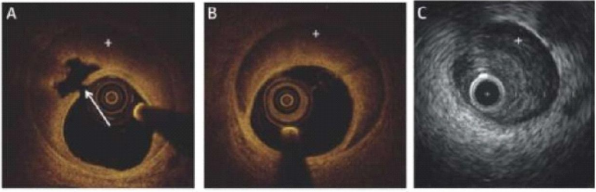
Рисунок 2.
Внутрисосудистая визуализация при СДКА. (А) ОКТ — картина СДКА. Стрелкой указан разрыв интимы КА и ИМГ (отмечена значком “+”); (В) ОКТ — картинка ИМГ без разрыва интимы КА. (С) ВСУЗИ — картина ИМГ.
Рекомендации по функциональному тестированию и внутрисосудистой визуализации для оценки поражения (ЕОК, 2018 г), [5].
Внутрисосудистая визуализация при СДКА. (А) ОКТ — картина СДКА. Стрелкой указан разрыв интимы КА и ИМГ (отмечена значком “+”); (В) ОКТ — картинка ИМГ без разрыва интимы КА. (С) ВСУЗИ — картина ИМГ.
Рекомендации по функциональному тестированию и внутрисосудистой визуализации для оценки поражения (ЕОК, 2018 г), [5].
| Рекомендации | Класс | Уровень |
| Когда нет данных за ишемию, рекомендуется измерение ФРК или измерение мРК для оценки гемодинамической значимости пограничных стенозов коронарных артерий. |
I |
A |
| ЧКВ под контролем ФРК целесообразно применять у пациентов со СИБС при многососудистом поражении. |
IIa |
B |
| ВСУЗИ следует применять для оценки тяжести поражения незащищенного ствола ЛКА [5]. | IIa | B |
3. Доступы для проведения коронарной ангиографии.
В настоящее время используются доступы: бедренный, лучевой, плечевой, локтевой, подмышечный. Чаще всего используются бедренный и лучевой доступы.
Трансфеморальный (бедренный) доступ.
Трансфеморальный (бедренный) доступ на протяжении более чем пяти десятилетий являлся основным при выполнении диагностических и лечебных рентгенэндоваскулярных вмешательств. Внедрение в клиническую практику способа выполнения селективной коронарографии с применением методики, описанной М. Judkins, и предложенных им катетеров в середине 60-х годов прошлого века привело практически к полному переходу на бедренный доступ при проведении данного исследования. Это было обусловлено простотой его осуществления и меньшей частотой осложнений в сравнении с брахиальным (плечевым) доступом с использованием обнажения артерии, применявшимся до этого для выполнения коронарографии по методике М. Sones. С момента проведения первой чрескожной транслюминальной баллонной ангиопластики коронарной артерии A. Gruentzig 16 сентября 1977 г. трансфеморальный доступ стал основным при выполнении чрескожных коронарных вмешательств (ЧКВ), и лишь уменьшение размеров инструментария позволило изменить подходы к выбору доступа для коронарографии и рентгенэндоваскулярных вмешательств на венечных артериях. Несмотря на то, что в настоящее время трансрадиальный (лучевой) доступ признан более предпочтительным как при выполнении коронарографии, так и при проведении чрескожных коронарных вмешательств, трансфеморальный доступ по-прежнему играет важнейшую роль при выполнении интервенционных процедур. Так, в ряде случаев выполнение вмешательства лучевым доступом не представляется возможным как из-за анатомических особенностей (малый диаметр, выраженная извитость артерий верхней конечности, поражения проксимальных сегментов брахиоцефальных артерий), так и из-за особенностей вмешательства (необходимость использования проводниковых катетеров большого диаметра при проведении комплексных процедур). В этом случае трансфеморальный доступ по-прежнему остается наиболее приемлемым для проведения повторных диагностических или лечебных рентгенэндоваскулярных вмешательств у больных ИБС.
Трансфеморальный (бедренный) доступ.
Трансфеморальный (бедренный) доступ на протяжении более чем пяти десятилетий являлся основным при выполнении диагностических и лечебных рентгенэндоваскулярных вмешательств. Внедрение в клиническую практику способа выполнения селективной коронарографии с применением методики, описанной М. Judkins, и предложенных им катетеров в середине 60-х годов прошлого века привело практически к полному переходу на бедренный доступ при проведении данного исследования. Это было обусловлено простотой его осуществления и меньшей частотой осложнений в сравнении с брахиальным (плечевым) доступом с использованием обнажения артерии, применявшимся до этого для выполнения коронарографии по методике М. Sones. С момента проведения первой чрескожной транслюминальной баллонной ангиопластики коронарной артерии A. Gruentzig 16 сентября 1977 г. трансфеморальный доступ стал основным при выполнении чрескожных коронарных вмешательств (ЧКВ), и лишь уменьшение размеров инструментария позволило изменить подходы к выбору доступа для коронарографии и рентгенэндоваскулярных вмешательств на венечных артериях. Несмотря на то, что в настоящее время трансрадиальный (лучевой) доступ признан более предпочтительным как при выполнении коронарографии, так и при проведении чрескожных коронарных вмешательств, трансфеморальный доступ по-прежнему играет важнейшую роль при выполнении интервенционных процедур. Так, в ряде случаев выполнение вмешательства лучевым доступом не представляется возможным как из-за анатомических особенностей (малый диаметр, выраженная извитость артерий верхней конечности, поражения проксимальных сегментов брахиоцефальных артерий), так и из-за особенностей вмешательства (необходимость использования проводниковых катетеров большого диаметра при проведении комплексных процедур). В этом случае трансфеморальный доступ по-прежнему остается наиболее приемлемым для проведения повторных диагностических или лечебных рентгенэндоваскулярных вмешательств у больных ИБС.
Выбор места для пункции бедренной артерии является одним из важнейших моментов. Для осуществления трансфеморального (бедренного) доступа выполняется пункция обшей бедренной артерии в паховой области. Непосредственно для осуществления доступа применяется пункционная методика, описанная S. Seldinger в 1953 г. Перед пункцией осуществляется инфильтрационная анестезия по примерному ходу пункции, наиболее часто используется 0,5% раствор новокаина в объеме 20 мл. До начала проведения анестезии необходимо выяснить, имеется ли у пациента непереносимость какого-либо препарата для местной анестезии, отмечались ли ранее какие- либо осложнения, аллергические реакции при проведении местной анестезии. По завершении исследования интродьюсер удаляется из артерии — либо сразу, либо (в зависимости от особенностей процедуры, введенной дозы гепарина, других факторов) в сроки от 30 мин до нескольких часов. Осуществляется гемостаз путем либо мануальной компрессии до полной остановки кровотечения, либо с применением различных устройств для гемостаза. При выполнении мануального гемостаза предпочтение должно отдаваться локальной компрессии по ходу артерии (несколько выше зоны пункции) без осуществления давления на широкую зону паховой области. Это приводит к минимизации болевых ощущений у пациента, позволяет точно контролировать адекватность гемостаза, избегать компрессии бедренной вены и нерва. Гемостаз осуществляется до полной остановки кровотечения из артерии. На место пункции накладывается давящая асептическая повязка, для профилактики возобновления кровотечения и формирования гематомы необходимо соблюдение постельного режима с ограничением движений конечностью, через которую выполнялся бедренный доступ. После процедуры пациенту рекомендуется строгий постельный режим в течение 24 часов. Возможно выполнение гемостаза путем компрессии с применением устройства Femostop; по сути, эта методика является разновидностью традиционной компрессии артерии, однако мнения в отношении ее эффективности противоречивы. Устройства для гемостаза были разработаны в середине 90-х годов прошлого века и стали активно применяться в клинической практике начиная с 2000-х годов. На сегодняшний день в арсенале имеется большое количество устройств для осуществления гемостаза после бедренного доступа. Их преимущества — уменьшение времени гемостаза, уменьшение сроков постельного режима и пребывания в клинике и обусловленный этим больший комфорт для пациента. Частота осложнений при проведении рентгенэндоваскулярных исследований и операций бедренным доступом колеблется в достаточно широких пределах и составляет 1 до 6%.
Основные осложнения и их частота при использовании бедренного сосудистого доступа:
| Осложнение | Частота, % |
| Кровотечение из зоны доступа | 2-3 |
| Подкожная гематома | 1-10 |
| Псевдоаневризма (ложная аневризма, пульсирующая гематома) | 1-6 |
| Забрюшинное (ретроперитонеальное) кровотечение | <1 |
| Артериовенозная фистула | <1 |
| Разрыв сосуда | <1 |
| Диссекция интимы, острая окклюзия артерии | <1 |
| Тромбоз артерии (дистальная эмболия) | <1 |
| Периваскулярный фиброз | 1-3 |
| Нарушение функции бедренного нерва | <1 |
| Венозный тромбоз | <1 |
| Инфекция | <1 |
Ряд факторов может повышать или, наоборот, снижать риск развития этих осложнений. Основными факторами риска, связанными с особенностями пациента и заболевания, воздействовать на которые не представляется возможным (немодифицируемые), являются: возраст (чем старше, тем выше риск осложнений), женский пол, избыточная масса тела, малая площадь поверхности тела (соответственно — малые размеры артерии), сахарный диабет, хроническая почечная недостаточность, атеросклероз аорты и артерий нижних конечностей, тромбоцитопения. Факторами риска, связанными с особенностями проведения вмешательства, т.е. модифицируемыми, являются: экстренный характер вмешательства, размер интродьюсера (чем больше, тем выше риск), неадекватная пункция (высокая или низкая), агрессивная антикоагулянтная терапия, применение гликопротеиновых IIb/IIIа-блокаторов, предшествующий тромболизис, длительное вмешательство, повторный характер вмешательства. Таким образом, каждый специалист по рентгенэндоваскулярной диагностике и лечению должен в совершенстве знать все этапы осуществления бедренного сосудистого доступа и уметь применять свои знания в клинической практике. Тщательное соблюдение всех этапов методики осуществления трансфеморального доступа является залогом успешного выполнения самых сложных рентгенэндоваскулярных вмешательств. Большинство осложнений, встречающихся при данном сосудистом доступе, напрямую обусловлено нарушениями и ошибками на каком-либо из этапов его обеспечения — при пункции, проведении инструментария, гемостазе. Несмотря на тренд к переходу на использование лучевого доступа, имеющего ряд существенных преимуществ, включая меньшую частоту сосудистых осложнений, умение использовать бедренный доступ является обязательным в практике врача по рентгенэндоваскулярной диагностике и лечению.
Радиальный доступ.
Первая неселективная коронарография с использованием артериотомии проксимального отдела лучевой артерии с последующим ее лигированием была выполнена в Швеции S. Radner в конце Второй мировой войны. Трансрадиальный доступ перестал применяться в клинической практике с началом широкого внедрения методики выполнения коронарографии трансфеморальным доступом по S. Seldinger, описанной в 1953 г. В последующем использование трансбрахиального и трансаксиллярного доступов для выполнения селективной коронарографии было впервые представлено Sones в 1959 и Ricket and Abrams в 1963 г. соответственно, а в 1964 г. Lucien Campeau вновь предложил использование трансрадиального доступа с использованием артериотомии проксимального отдела с последующим ушиванием. Лучевой доступ вновь был забыт и лишь после появления первых интродьюсеров в 1965 г. вновь повторно предложен L. Campeu в 1986–1989 гг. для выполнения коронарографии через дистальный отдел радиальной артерии с использованием иглы Potts-Cournand. В 1992 г. Ferdinand Kicmeneij предложил использование трансрадиального доступа с использованием дистального отдела артерии и коронарных проводниковых катетеров диаметром 6F. В последующие 3 года он впервые выполнил с применением лучевого доступа баллонную коронарную ангиопластику, стентирование с имплантацией стента Palmaz-Schatz и первую амбулаторную коронарную ангиопластику.
В это же время другие специалисты начали использование данной методики в Европе (Франция, Италия), Северной Америке (Канада) и Азии (Тайвань, Япония). Вследствие этого было выявлено значительное число технических и анатомических сложностей и особенностей выполнения коронарографии и ЧКВ трансрадиальным доступом, были описаны методические аспекты их преодоления. Эти сложности включали спазм, наличие извитости лучевой, плечевой и подключичной артерий, высокое (раннее) отхождение лучевой артерии, анатомические варианты дуги аорты (arteria lusoria) и др. Непрерывно возрастающий опыт специалистов и значительное усовершенствование инструментария позволили расширить показания к применению лучевого доступа практически при всех клинических и анатомических вариантах (острый инфаркт миокарда (ИМ), пациенты на фоне массивной антикоагулянтной терапии, бифуркационные поражения, поражения ствола левой коронарной артерии и др.) с использованием таких методик, как ротационная атерэктомия, аспирационная тромбэктомия и др. В последующем было продемонстрировано, что использование трансрадиального доступа в сравнении с традиционным трансфеморальным ассоциируется с уменьшением частоты сосудистых осложнений и себестоимости вмешательства, а также со значительным увеличением комфортности для пациентов. Большая продолжительность вмешательства и доза облучения, наблюдаемые на начальном этапе освоения методики, напрямую зависели от опыта специалиста. Значительное увеличение частоты использования лучевого доступа, отмечающееся в большом числе стран, обусловило проведение множества исследований, результаты которых продемонстрировали потенциальное снижение летальности в сравнении с бедренным доступом. Эти результаты напрямую коррелировали с опытом специалиста, выполнявшего вмешательства, особенно в группах пациентов с острым коронарным синдромом. Преимуществом доступа через дистальный отдел предплечья является двойное кровоснабжение кисти через локтевую и лучевую артерии, последняя из которых проходит над шиловидным отростком лучевой кости и не имеет близко расположенных крупных нервных стволов. Пункция лучевой артерии осуществляется на расстоянии примерно 15 мм проксимальнее шиловидного отростка лучевой кости.
Используется местная анестезия путем подкожного введения 1—2 мл лидокаина гидрохлорида. Вместо этого или же наряду с этой инъекцией может выполняться инъекция лидокаина по ходу артерии, при необходимости вместе с нитроглицерином для профилактики спазма. Пункция лучевой артерии может выполняться с использованием короткой полой иглы или с использованием периферического венозного катетера.
Осложнения лучевого доступа при ЧКВ:
| Вазоспазм |
| Перфорация артерии/гематома грудной стенки |
| Диссекции |
| Компартмент-синдром |
| Ложная аневризма |
| Окклюзия лучевой артерии |
Вазоспазм. После выполнения катетеризации трансрадиальным доступом развиваются функциональные изменения лучевой артерии, наблюдается снижение ее эндотелиально обусловленной вазодилатации и вазодилатации, вызываемой нитроглицерином, являющиеся обратимыми в сроки 3—4 нед. Гистологические изменения, такие как неоинтимальная гипертрофия, приводяшая к уменьшению диаметра просвета лучевой артерии, могут проявляться после осуществления трансрадиального доступа. Эти изменения ответственны за снижение частоты успеха повторных пункций и катетеризаций лучевой артерии и являются основанием к отказу от использования лучевой артерии в качестве аутоартериального кондуита при выполнении аортокоронарного шунтирования. Для успешного выполнения пункции должны быть соблюдены следующие условия: спокойное выполнение всех манипуляций, объяснение сути вмешательства и его этапов пациенту, успешное выполнение пункции с первой попытки, использование гидрофильных интродьюсеров, проведение нейролептаналгезии в случае затянувшегося выполнения вмешательства.
По рекомендациям Европейского общества кардиологов 2023г. [6]
| Рекомендации | Класс | Уровень |
| Использование радиального доступа рекомендуется для ЧКВ у всех пациентов с КБС, кроме случаев, когда вмешательство требует другого доступа. | I | A |
Комментарии:
- Использование радиального доступа является предпочтительным, поскольку снижает смертность и количество серьезных сердечно- сосудистых осложнений, а также увеличивает безопасность ЧКВ за счет снижения риска больших кровотечений и других сосудистых осложнений независимо от формы КБС.
- К случаям, когда вмешательство требует другого доступа, относят: малый диаметр лучевых артерий, окклюзии и извитость артерий верхних конечностей, использование инструментов больших диаметров (более 7 Френч).
- Перед пункцией лучевой артерии проводят тест Аллена на наличие коллатерального кровотока по ладонной дуге во избежание нарушения кровотока в области кисти при окклюзии лучевой артерии.
Техника выполнения теста Аллена:
- Тест Аллена - наиболее простой и достоверный способ оценки функционирования поверхностной (образованной преимущественно локтевой артерией) и глубокой (образованной преимущественно лучевой артерией) ладонных дуг. При использовании в качестве оперативного доступа одной из артерий предплечья, наличие функционирующих коллатералей к ней является обязательным, т.к. это защитит руку от ишемии в случае развития окклюзии артерии доступа, которая возникает в 3-10% случаев.
- Методика проведения теста Аллена: одновременно пережимаются лучевая артерия и локтевая артерия, пациент несколько раз сжимает кисть до возникновения бледности кожи (ишемия), после чего снимается компрессия с локтевой (прямой тест) или лучевой (обратный тест) артерии. При восстановлении нормального цвета кисти в течение 8–10 сек, вследствие «включения» коллатерального кровотока, проба считается положительной (нормальной), при сохранении бледности кожи (ишемии) - проба отрицательная.
Осложнения
ОСЛОЖНЕНИЯ ОСТРОГО ИНФАРКТА МИОКАРДА И ИХ ЛЕЧЕНИЕ.
1. Острая сердечная недостаточность (СН) и кардиогенный шок.
Острая ишемия миокарда, развивающаяся при ОИМ, лежит в основе патогенеза острой СН у большинства пациентов с кардиогенным шоком, подвергающимся ЧКВ. Механические осложнения, такие как разрыв папиллярных мышц с тяжелой митральной регургитацией (МР), дефект межжелудочковой перегородки или разрыв свободной стенки желудочка, являются дополнительными причинами острой СН.
В SHOCK (Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock) экстренная реваскуляризация с помощью ЧКВ или КШ у пациентов с кардиогенным шоком, осложнившим острый ИМ, улучшала выживаемость в отдаленном периоде в сравнении с начальной интенсивной медикаментозной терапией. Смертность от всех причин в течение 6 мес. была значительно ниже в группе реваскуляризации по сравнению с группой медикаментозной терапии (50,3% vs. 63,1%, RR 0,80, 95% ДИ 0,65-0,98, P=0,03). Субанализ данных SHOCK, сравнивший пациентов, подвергшихся КШ или ЧКВ, показал схожую выживаемость в обоих подгруппах. В группе КШ чаще встречались пациенты с СД (48,9% vs. 26,9%; Р=0,02), трехсосудистым поражением (80,4% vs. 60,3%; Р=0,03), и поражением ствола ЛКА (41,3% vs. 13,0%; Р=0,001). Данные этого нерандомизированного сравнения подразумевают, что выполнение КШ должно рассматриваться у пациентов с кардиогенным шоком, которые имеют подходящую анатомию, особенно когда успешное ЧКВ невозможно.
В SHOCK (Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock) экстренная реваскуляризация с помощью ЧКВ или КШ у пациентов с кардиогенным шоком, осложнившим острый ИМ, улучшала выживаемость в отдаленном периоде в сравнении с начальной интенсивной медикаментозной терапией. Смертность от всех причин в течение 6 мес. была значительно ниже в группе реваскуляризации по сравнению с группой медикаментозной терапии (50,3% vs. 63,1%, RR 0,80, 95% ДИ 0,65-0,98, P=0,03). Субанализ данных SHOCK, сравнивший пациентов, подвергшихся КШ или ЧКВ, показал схожую выживаемость в обоих подгруппах. В группе КШ чаще встречались пациенты с СД (48,9% vs. 26,9%; Р=0,02), трехсосудистым поражением (80,4% vs. 60,3%; Р=0,03), и поражением ствола ЛКА (41,3% vs. 13,0%; Р=0,001). Данные этого нерандомизированного сравнения подразумевают, что выполнение КШ должно рассматриваться у пациентов с кардиогенным шоком, которые имеют подходящую анатомию, особенно когда успешное ЧКВ невозможно.
Механическая поддержка кровообращения.
В настоящее время для кратковременной поддержки кровообращения используются: внутриаортальная баллонная контрапульсация (ВАБК), экстракорпоральная мембранная оксигенация (ЭКМО) и чрескожные вспомогательные устройства поддержки левого желудочка (чВУЛЖ). Применение кратковременной механической поддержки кровообращения может рассматриваться при рефрактерном кардиогенном шоке в зависимости от возраста пациента, коморбидного фона, неврологического статуса, а также перспективного прогноза выживания и качества жизни.
Внутриаортальная баллонная контрпульсация.
ВАБК — это недорогие, просто имплантируемые и удаляемые устройства, умеренно увеличивающие сердечный выброс, коронарную и церебральную перфузию, уменьшающие нагрузку на ЛЖ. В IABP- SHOCK II (Intraaortic Balloon Pump in Cardiogenic Shock II), включавшем 600 пациентов с кардиогенным шоком, осложнившим ИМ, применение ВАБК не снижало 30- дневную летальность и не продемонстрировало пользы в долгосрочной перспективе. Недавний Кохрейновский систематический обзор 7 исследований (790 пациентов) показал, что, несмотря на некоторое улучшение определенных параметров гемодинамики, ВАБК не дает преимуществ в выживании. Таким образом, рутинное использование ВАБК при кардиогенном шоке, осложнившим ИМ, не может быть рекомендовано.
Экстракорпоральная мембранная оксигенация.
Вено-артериальная ЭКМО (ВА-ЭКМО), также известная как экстракорпоральная поддержка жизни (ECLS), в ее нынешней форме представляет собой модифицированное экстракорпоральное кровообращение c сердечно-легочным шунтом. ЭКМО производит декомпрессию венозной системы, увеличивает коронарную, церебральную и периферическую перфузию, также обеспечивает дополнительную оксигенацию крови. В случае использования чрескожной техники имплантации ЭКМО не разгружает ЛЖ и увеличивает постнагрузку. Данные имеющихся обсервационных исследований демонстрируют лучшую выживаемость пациентов с остановкой кровообращения при использовании ЭКМО. В сравнении с ВАБК ЭКМО обеспечивает лучшую поддержку кровообращения. Более того, в метаанализе обсервационных исследований пациентов с кардиогенным шоком после ИМ было продемонстрировано 33-процентное улучшение 30-дневной выживаемости в сравнении с ВАБК (95%, ДИ 14-52%, P<0,001, необходимое количество для лечения (NNT) 13). Однако небольшое количество пациентов, участвовавших в анализе, и отсутствие рандомизации при распределении являются серьезными ограничениями в трактовке полученных результатов.
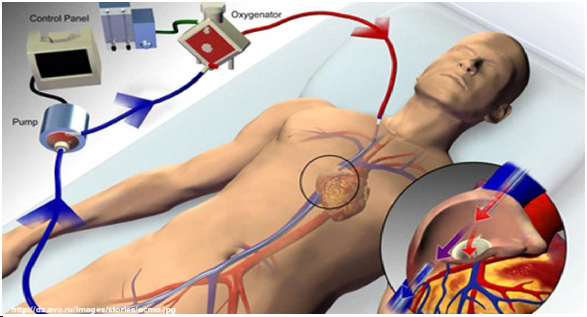
Рисунок 10.
| Рекомендации | Класс | Уровень |
| Экстренная коронарная ангиография рекомендована всем пациентам с острой СН или кардиогенным шоком вследствие ОКС. |
I |
B |
| Экстренное ЧКВ рекомендовано пациентам с кардиогенным шоком вследствие ОКС с или без подъема ST, вне зависимости от времени начала симптомов, если анатомия коронарного русла позволяет выполнить вмешательство. |
I |
B |
| Экстренное КШ рекомендовано пациентам с кардиогенным шоком, если анатомия коронарного русла не позволяет выполнить ЧКВ. |
I |
B |
| В случае нестабильной гемодинамики экстренная хирургическая или транскатетерная пластика механических осложнений ОКС рекомендована, при решении Кардиокомандой. |
I |
C |
| У некоторых пациентов с ОКС возможно использование кратковременной механической поддержки кровообращения, в зависимости от возраста пациента, сопутствующих заболеваний, неврологических функций и долгосрочного прогноза относительно качества и продолжительности жизни. |
IIb |
C |
| Рутинное использование ВАБК у пациентов с кардиогенным шоком вследствие ОКС не рекомендуется. |
III |
B |
2. Механические осложнения ИМ.
Разрыв свободной стенки левого желудочка (РССЛЖ) — самое опасное осложнение ИМ. Смертность при РССЛЖ превышает 99%. В основном, случаи успешного лечения РССЛЖ описаны у больных с псевдоаневризмой. Частота РССЛЖ в настоящее время, по данным крупных регистров, составляет около 1–3%. В то же время РССЛЖ является одной из основных причин смерти при ИМ, отвечая за 14–26% всех случаев летального исхода.
Основные факторы риска РССЛЖ:
- Отсутствие коронарного анамнеза, предшествующего ИМ.
- Максимальные значения КФК-MB >150 ЕД/л.
- Сохраняющаяся длительное время элевация сегмента ST.
- Распространение (рецидив) ИМ.
- К дополнительным факторам риска РССЛЖ относят возраст старше 70 лет, женский пол, переднюю локализацию ИМ, тяжелую АГ, СД.
Примерно у половины больных РССЛЖ происходит в первые 5 дней, у 90%
— в первые две недели. Условно РССЛЖ разделяют на ранние, произошедшие в первые 72 ч, и поздние — после 72 ч. Ранние РССЛЖ происходят в большинстве случаев внезапно, без предвестников, характеризуются одномоментным внезапным разрывом, чаще у больных с передней локализацией ИМ.
Поздние разрывы происходят, в основном, на фоне распространения (рецидива ИМ), не зависят от локализации ИМ, иногда такие разрывы не одномоментные, имеют клинические предвестники. Поздние разрывы редко происходят у больных с восстановленным коронарным кровотоком. При проведении первичного ЧКВ частота РССЛЖ ниже по сравнению с ТЛТ. Несмотря на минимальные шансы, успешная терапия возможна, но только при быстрой постановке диагноза и немедленном начале лечебных мероприятий. После подтверждения диагноза с помощью ЭхоКГ проводят перикардиоцентез, контролируя направление пункции ультразвуковым датчиком. Параллельно проводят сердечно-легочную реанимацию, включая введение жидкости, инотропных препаратов, ИВЛ, БИК. Все эти мероприятия являются подготовкой к экстренной операции, направленной на удаление некротизированного участка и восстановление целостности миокарда.
ПСЕВДОАНЕВРИЗМА.
Псевдоаневризма (ложная аневризма) — редкое осложнение ИМ, развивающееся в результате РССЛЖ. Псевдоаневризма ограничена рубцовой тканью сердца и прилегающим перикардом и может образоваться только при постепенном (подостром) разрыве, когда развивается очаговый адгезивный перикардит вокруг зоны будущего разрыва. Начало формирования псевдоаневризмы клинически проявляется как подострый разрыв. В дальнейшем ведущим синдромом становится сердечная недостаточность. Данное осложнение диагностируют с помощью ЭхоКГ, МРТ, контрастной вентрикулографии. При нижней локализации ИМ псевдоаневризма формируется в 2 раза чаще, чем при передней. Прогноз при естественном течении неблагоприятный, летальность достигает 50%. Во всех случаях показано хирургическое лечение.
РАЗРЫВ МЕЖЖЕЛУДОЧКОВОЙ ПЕРЕГОРОДКИ.
Разрыв межжелудочковой перегородки (РМЖП) происходит, в основном, в течение первых двух недель от начала ИМ. Максимальное количество РМЖП наблюдают в интервале с первого по пятый день. Место РМЖП зависит от локализации ИМ. РМЖП при переднем ИМ, в основном, — в области верхушки. При нижнем ИМ РМЖП чаще локализуется в базальной части перегородки. Разрыв происходит, в основном, на границе здорового и пораженного миокарда. До использования реперфузионной терапии РМЖП происходил примерно у 2% больных ИМ. При восстановлении коронарного кровотока частота РМЖП намного снизилась. По данным исследования
GUSTO-1 частота РМЖП при использовании ТЛТ составила 0,2%. Степень клинических проявлений РМЖП зависит, главным образом, от величины дефекта. Ведущий патофизиологический механизм РМЖП — сброс крови слева направо. РМЖП часто клинически манифестирует в виде гипотензии, прогрессирующей сердечной недостаточности, преимущественно правожелудочковой. Может возникать и быстро нарастать одышка, вплоть до картины альвеолярного отека легких. По левому краю грудины обычно выслушивается грубый пансистолический шум. Диагноз подтверждают с помощью ЭхоКГ с допплеровским цветным картированием, фиксирующим шунтирование крови слева направо. Реже для подтверждения диагноза используют плавающий баллонный катетер в легочной артерии. Для РМЖП характерно повышение ДЗЛА (V-волна) вследствие перегрузки объемом. При измерении насыщения кислородом крови в правом желудочке и в правом предсердии при РМЖП отличия превышают 5%. В ряде случаев постановке диагноза может помочь чреспищеводная ЭхоКГ. Лечение РМЖП хирургическое.
ОСТРАЯ МИТРАЛЬНАЯ РЕГУРГИТАЦИЯ.
При остром ИМ существует несколько причин митральной регургитации (МР): относительная митральная недостаточность в связи с дилатацией левого желудочка, дисфункция папиллярных мышц, разрыв папиллярных мышц или отрыв хорды митрального клапана. Основное клиническое проявление МР — левожелудочковая недостаточность. В тяжелых случаях развивается отек легких. При аускультации обычно выслушивают систолический шум, интенсивность которого не всегда коррелирует со степенью регургитации. Диагноз подтверждают с помощью ЭхоКГ. При умеренной МР больные могут быть гемодинамически и клинически стабильны. Умеренную митральную регургитацию (1–2 степени согласно эхокардиографическим критериям) наблюдают примерно у 15% больных ИМ, тяжелая митральная регургитация развивается у 3% больных. При развитии тяжелой регургитации прогноз без хирургической коррекции крайне неблагоприятный: месячная летальность составляет 30%, однолетняя — 52%. Больным с тяжелой митральной регургитацией показано хирургическое лечение: пластика митрального клапана (чаще при дилатации левого желудочка и относительной митральной недостаточности) или протезирование митрального клапана. Сроки проведения вмешательства зависят от клинической ситуации. Наиболее опасная причина острой МР — разрыв папиллярных мышц или отрыв хорд митрального клапана. Это осложнение является причиной примерно 5% смертей у больных ИМ.
ОСТРАЯ МИТРАЛЬНАЯ РЕГУРГИТАЦИЯ.
При остром ИМ существует несколько причин митральной регургитации (МР): относительная митральная недостаточность в связи с дилатацией левого желудочка, дисфункция папиллярных мышц, разрыв папиллярных мышц или отрыв хорды митрального клапана. Основное клиническое проявление МР — левожелудочковая недостаточность. В тяжелых случаях развивается отек легких. При аускультации обычно выслушивают систолический шум, интенсивность которого не всегда коррелирует со степенью регургитации. Диагноз подтверждают с помощью ЭхоКГ. При умеренной МР больные могут быть гемодинамически и клинически стабильны. Умеренную митральную регургитацию (1–2 степени согласно эхокардиографическим критериям) наблюдают примерно у 15% больных ИМ, тяжелая митральная регургитация развивается у 3% больных. При развитии тяжелой регургитации прогноз без хирургической коррекции крайне неблагоприятный: месячная летальность составляет 30%, однолетняя — 52%. Больным с тяжелой митральной регургитацией показано хирургическое лечение: пластика митрального клапана (чаще при дилатации левого желудочка и относительной митральной недостаточности) или протезирование митрального клапана. Сроки проведения вмешательства зависят от клинической ситуации. Наиболее опасная причина острой МР — разрыв папиллярных мышц или отрыв хорд митрального клапана. Это осложнение является причиной примерно 5% смертей у больных ИМ.
Клинически отрыв папиллярных мышц или хорд почти всегда проявляется тяжелой гипотензией и быстро развивающимся отеком легких. Обычно выслушивается грубый систолический шум. Диагноз подтверждают с помощью ЭхоКГ с цветным допплеровским картированием. Единственный способ лечения разрыва папиллярной мышцы или хорды — экстренное хирургическое вмешательство. Операционная летальность высока (20–25%), но без операции шансов выжить практически нет.
Рекомендации по лечению механических осложнений у больных с ИМпST.
Рекомендации по лечению механических осложнений у больных с ИМпST.
| Рекомендация | Класс | Уровень |
| Лечение разрыва свободной стенки ЛЖ заключается в немедленной пункции перикарда c последующем экстренным хирургическим вмешательством. |
I |
C |
| Рекомендуется проведение коронароангиографии пациентам с ранней постинфарктной стенокардией и рецидивом инфаркта миокарда для предотвращения распространения зоны инфаркта. |
I |
C |
| Лечение разрыва МЖП хирургическое: открытая операция или транскатетерное установка окклюдера. Способ и время вмешательства зависит от характера дефекта и состояния больного. При выраженном нарушении гемодинамики операция проводится по экстренным показаниям |
I |
C |
| Лечение острой митральной недостаточности хирургическое. Время вмешательства зависит от степени митральной регургитации и состояния больного. В большинстве случаев операция проводится по экстренным показаниям |
I |
C |
| В качестве временной меры для стабилизации состояния у больных с разрывом МЖП и острой митральной недостаточностью может быть использована внутриаортальная баллонная контрпульсация. |
I |
C |
ОСЛОЖНЕНИЯ ПРИ ЧРЕСКОЖНЫХ КОРОНАРНЫХ ВМЕШАТЕЛЬСТВАХ.
Категории осложнений ЧКВ:
- Смерть (связанная с процедурой, независимо от патогенеза).
- Инсульт.
- ИМ (связанный с процедурой, независимо от патогенеза).
- Ишемия, требующая экстренной операции аортокоронарного шунтирования (АКШ).
- Осложнения в зоне доступа.
- Контраст-индуцированная нефропатия.
- Продолжающееся кровотечение, требующее лечения.
- Прочие осложнения (такие как перфорация коронарной артерии и тампонада).
На сегодняшний день в мире существует достаточно большое количество классификаций осложнений, возникающих при ЧКВ, из которых классическим и наиболее распространенным является разделение осложнений на малые и большие.
«Малые» осложнения подразумевают возникновение таких нарушений гемодинамики и гомеостаза, которые не угрожают жизни пациента и могут быть устранены консервативно. К ним относят нарушения ритма сердца без влияния на гемодинамику, подкожную гематому в месте пункции артерии доступа, аллергические реакции на вводимые препараты и др.
«Большие» осложнения представляют собой состояния, развившиеся в результате выполнения ЧКВ, при которых появляется угроза для жизни пациента. Как правило, для устранения этих осложнений необходимо либо повторное эндоваскулярное вмешательство, либо экстренная хирургическая операция. К данной категории относят острую или угрожающую окклюзию коронарной артерии, острый или подострый тромбоз стента, отсутствие возобновления кровотока или замедленный отток (no-reflow), спазм коронарной артерии, перфорацию коронарной артерии или шунта, эмболизацию коронарной артерии фрагментами атеросклеротической бляшки или фрагментами инструментария для ангиопластики, дислокацию или эмболизацию коронарного стента, инсульт, повреждение периферических артерий и аорты.
К факторам риска осложнений ЧКВ относятся: пожилой возраст, срочность вмешательства, гемодинамическая нестабильность, сердечная недостаточность, почечная недостаточность, сахарный диабет, нарушения электролитного баланса, а также аритмии.
1. ОСЛОЖНЕНИЯ БЕДРЕННОГО ДОСТУПА ПРИ ЧКВ:
- Забрюшинное кровотечение.
- Ложная аневризма.
- АВ-фистула.
- Инфекция.
- Гематома.
- Нейропраксия.
- Ишемия нижней конечности (тромбоз или эмболия).
- Диссекция.
Профилактика осложнений бедренного доступа.
Для снижения частоты вышеописанных осложнений необходимо особое внимание уделять технике пункции. Следует избегать использования паховой складки в качестве анатомического ориентира. В случаях, когда определение поверхностных анатомических ориентиров затруднено, могут быть использованы костные ориентиры при флюороскопии или ультразвуковом исследовании. Целью такого исследования является определение места пункции общей бедренной артерии (ОБА) в зоне от 5 до 14 мм ниже центра бедренной кости, так как это в наибольшей степени снижает вероятность попадания кончика иглы в область бифуркации ОБА и изгиба нижней надчревной артерии. Кроме того, впоследствии это обеспечивает эффективную мануальную компрессию.
ЛЕЧЕНИЕ ОСЛОЖНЕНИЙ.
Острая ишемия нижних конечностей.
Тромбоз или эмболия бедренной артерии являются осложнениями, угрожающими жизнеспособности конечности. Появление любого из симптомов острой ее ишемии (отсутствие пульсации, бледность кожных покровов, боль, нарушение чувствительности в области стопы) является показанием для экстренной консультации сосудистого хирурга.
Гематома.
Наиболее частым осложнением бедренного доступа является гематома. Это объемное образование, пальпаторно определяемое в области пункции, следует отличать от экхимоза, который характеризуется депигментацией кожных покровов вследствие воздействия экстравазального скопления крови. Лечение заключается в мануальной компрессии данного образования. Ультразвуковое исследование (УЗИ) обязательно выполняется при сохранении дискомфорта или при аускультативно определяемом шуме в области пункции.
Забрюшинное кровотечение.
По данным современного крупного (>110 000 пациентов) ретроспективного анализа, забрюшинное кровотечение является редким осложнением ЧКВ (<1%). Наряду с развитием данного осложнения при высокой пункции бедренной артерии (выше середины головки бедренной кости), оно также может возникнуть при идеально выверенном месте пункции, за счет распространения крови по фасциальным пространствам. Забрюшинное кровотечение должно быть заподозрено при повторяющихся эпизодах гипотензии (в сочетании с брадикардией или тахикардией), боли в животе на стороне пункции. Эти симптомы чаще всего возникают в течение первых 3 ч с момента начала вмешательства.
Тромбоз или эмболия бедренной артерии являются осложнениями, угрожающими жизнеспособности конечности. Появление любого из симптомов острой ее ишемии (отсутствие пульсации, бледность кожных покровов, боль, нарушение чувствительности в области стопы) является показанием для экстренной консультации сосудистого хирурга.
Гематома.
Наиболее частым осложнением бедренного доступа является гематома. Это объемное образование, пальпаторно определяемое в области пункции, следует отличать от экхимоза, который характеризуется депигментацией кожных покровов вследствие воздействия экстравазального скопления крови. Лечение заключается в мануальной компрессии данного образования. Ультразвуковое исследование (УЗИ) обязательно выполняется при сохранении дискомфорта или при аускультативно определяемом шуме в области пункции.
Забрюшинное кровотечение.
По данным современного крупного (>110 000 пациентов) ретроспективного анализа, забрюшинное кровотечение является редким осложнением ЧКВ (<1%). Наряду с развитием данного осложнения при высокой пункции бедренной артерии (выше середины головки бедренной кости), оно также может возникнуть при идеально выверенном месте пункции, за счет распространения крови по фасциальным пространствам. Забрюшинное кровотечение должно быть заподозрено при повторяющихся эпизодах гипотензии (в сочетании с брадикардией или тахикардией), боли в животе на стороне пункции. Эти симптомы чаще всего возникают в течение первых 3 ч с момента начала вмешательства.
Лечение начинают с восполнения объема циркулирующей крови; и только в том случае, если состояние пациента стабильное, выполняется КТ- исследование органов таза и брюшной полости для подтверждения предполагаемого диагноза. В большинстве случаев (>90%) забрюшинных кровотечений проводится консервативное лечение; в этой группе больных смертность значительно выше (6%), в сравнении с пациентами без данного осложнения. Возврат клинических симптомов гиповолемии и/или ангиографические признаки продолжающегося экстравазального поступления контрастного вещества требуют проведения консилиума с привлечением хирурга для решения вопроса о ревизии области продолжающегося кровотечения либо оказании эндоваскулярного пособия в виде имплантации стент-графта с использованием в качестве доступа контралатеральной бедренной артерии.
Ложная аневризма бедренной артерии.
Ложные аневризмы (псевдоаневризмы) представляют собой сообщения между просветом артерии и адвентициальной или подкожной тканью. Их развитие чаще всего связано с пункцией ОБА ниже ее бифуркации и невозможностью впоследствии выполнить эффективную мануальную компрессию после удаления интродьюсера. При дуплексном ультразвуковом исследовании (УЗИ) ложные аневризмы характеризуются узкой шейкой в месте выхода из сосуда. Частота их возникновения составляет 1—2%. Мелкие псевдоаневризмы (диаметром <2 см) в 90% случаев закрываются спонтанно (т.е. нуждаются только в наблюдении), или же их можно закрыть путем ручной компрессии в течение 15—30 мин. Если псевдоаневризма увеличивается или сопровождается нарушениями гемодинамики, можно попытаться ввести в полость аневризмы тромбин под контролем ультразвука. Тромбин (1000 ед.) вводят через спинальную иглу 21G, введенную параллельно пучку ультразвукового датчика, с помощью туберкулинового шприца 1 мл. Если инъекция произведена правильно, псевдоаневризма исчезнет сразу. Если во время инъекции тромбина игла входит в главную артерию, возникает высокий риск развития острой ишемии нижней конечности. В случае, когда, несмотря на принятые меры, кровотечение продолжается, больного следует вернуть в рентгенооперационную и попытаться осуществить закрытие с помощью баллона диаметром 5—6 мм, проведенного с контралатеральной стороны и раздутого под низким давлением в месте экстравазации. Если и это не удается, следует рассмотреть возможность имплантации периферического стент- графта. Хирургическая операция, как правило, требуется редко.
Артериовенозные фистулы.
Артериовенозная фистула (АВ-фистула) редкое ятрогенное осложнение, частота которого при бедренном доступе составляет менее 1 %
По данным широкомасштабного проспективного анализа, факторами риска развития данного осложнения являются: пункция левой бедренной артерии (если хирург — правша), женский пол, антикоагулянтная терапия (варфарин и гепарин), артериальная гипертензия. Пункция ниже бифуркации ОБА может способствовать формированию анатомического субстрата для формирования АВ-фистулы, так как на данном уровне бедренная вена расположена кзади от поверхностной бедренной артерии. Более одной трети АВ-фистул закрываются спонтанно в течение первого года. Несмотря на наличие множества инвазивных методов лечения (например, имплантация стент- графта, открытая хирургии, оправданность первичного консервативного подхода в отношении данного осложнения (проведение мануальной компрессии и динамического УЗИ-контроля) подкреплена результатами множества наблюдений.
Неврологические осложнения, связанные с повреждением бедренного нерва, не относятся к жизнеугрожающим и, как правило, имеют хороший прогноз, но могут сопровождаться выраженной симптоматикой. Чаще всего они являются проявлением нейропраксии, вследствие чего хорошо поддаются лечению, однако продолжительность периода реабилитации различается в каждом конкретном случае и порой достигает 6 мес.
2. ОСЛОЖНЕНИЯ ЛУЧЕВОГО ДОСТУПА ПРИ ЧКВ:
- Компартмент-синдром
- Ложная аневризма.
- Перфорация артерии/гематома грудной стенки.
- Диссекции
- Вазоспазм.
- Окклюзия лучевой артерии
Компартмент-синдром.
В раннем послеоперационном периоде необходимо обязательное наблюдение за состоянием верхней конечности на предмет развития данного осложнения. Компартмент-синдром вызван нарастающим давлением в закрытом костно- фасциальном пространстве. Давление более 30 мм рт.ст. от диастолического артериального давления является достаточным для развития ишемии мышц предплечья. Патогномоничный симптом осложнения — боль во время пассивного растяжения мышц при сгибании верхней конечности в локтевом суставе. Правильное создание компрессии проксимальнее места пункции в случае любой локализации гематомы поможет в профилактике усугубления данного осложнения. Как и в случае бедренного доступа, появление любых симптомов неврологического дефицита является показанием к экстренной консультации сосудистого хирурга.
Ложная аневризма лучевой артерии.
Ложная аневризма является редким осложнением, возникающим при неадекватной компрессии лучевой артерии после окончания вмешательства. Подход к лечению аналогичен таковому при псевдоаневризмах бедренных артерий.
Перфорация, диссекция или повреждение лучевой артерии образуются вследствие агрессивных манипуляций проводником при прохождении извитостей и петли, повреждения кончиком катетера устья боковой ветви или во время введения контрастного вещества в ситуациях со сложностями проведения проводника и/или катетера.
Гематома возникает из-за перфорации или неадекватной компрессии и в случае увеличения размеров, может привести к развитию острой ишемии верхней конечности вследствие развития синдрома сдавления. В целях предупреждения синдрома сдавления устройство для компрессии места пункции должно быть установлено заново, на область гематомы необходимо наложить манжету или эластичный бинт.
Диссекции также могут развиваться вследствие агрессивных манипуляций проводником или катетером. Диссекция и перфорация сосудов предплечья проявляются внезапным дискомфортом во время вмешательства. Чаще всего происходит перфорация мелких ветвей сосудов в зоне предплечья или в подмышечной области. Установка длинного интродьюсера по проводнику, находящемуся в аорте, может позволить продолжить вмешательство, но зачастую дальнейшее использование данного доступа не представляется возможным. В случае повреждения сосудов в области предплечья необходимо внимательно наблюдать за пациентом на предмет развития компартмент- синдрома. В большинстве случаев диссекции являются ретроградными и разрешаются самостоятельно по завершении процедуры. Повреждение катетером цервикальных или грудных боковых ветвей может привести к развитию гематомы средостения. Все маневры катетером должны выполняться аккуратно, особенно в сложных анатомических ситуациях, при этом целесообразно использование гидрофильных проводников под контролем флюороскопии.
Выраженный спазм лучевой артерии.
Вазоспазм может возникнуть в любой зоне на всем протяжении лучевой, локтевой и подмышечной артерий при нахождении интродьюсера и катетера в просвете сосуда. При развитии тотального вазоспазма его ликвидация представляет собой нелегкую задачу. Седация, обезболивание и дополнительное введение нитратов и блокаторов кальциевых каналов могут способствовать его разрешению. В редких случаях может возникать необходимость в анестезиологическом пособии в виде проводниковой блокады или глубокой седации пациента для безопасного удаления катетера и интродьюсера без риска разрыва сосуда или выраженной болевой реакции.
Выраженный спазм лучевой артерии.
Вазоспазм может возникнуть в любой зоне на всем протяжении лучевой, локтевой и подмышечной артерий при нахождении интродьюсера и катетера в просвете сосуда. При развитии тотального вазоспазма его ликвидация представляет собой нелегкую задачу. Седация, обезболивание и дополнительное введение нитратов и блокаторов кальциевых каналов могут способствовать его разрешению. В редких случаях может возникать необходимость в анестезиологическом пособии в виде проводниковой блокады или глубокой седации пациента для безопасного удаления катетера и интродьюсера без риска разрыва сосуда или выраженной болевой реакции.
Окклюзия лучевой артерии в большинстве случаев асимптоматична. Имеются единичные публикации о развитии ишемии верхней конечности или ее ампутации. Если развитие окклюзии выявляется на ранних стадиях, ее можно предотвратить в большинстве случаев с помощью компрессии локтевой артерии. Определено несколько факторов риска развития окклюзии радиальной артерии: соотношение диаметров катетера и артерии >1, неадекватный режим антикоагулянтной терапии, большое время вмешательства или длительная компрессия с полной окклюзией артерии. Тем не менее риск острой ишемии или нарушения функции верхней конечности очень низок. Методика гемостаза с сохранением проходимости по артерии, когда инструментальная компрессия места пункции быстро позволяет сохранить резидуальный кровоток, приводит к уменьшению риска тромбоза. Случаи формирования ложной аневризмы лучевой артерии крайне редки и напрямую связаны с неадекватной компрессией. Ранняя диагностика и компрессия способны предотвратить данное осложнение. Развитие артериовенозной фистулы также является крайне редким осложнением, объем кровотока по ней, как правило, незначителен и не приводит к каким-либо неблагоприятным последствиям.
3. ОСЛОЖНЕНИЯ ВО ВРЕМЯ ВЫПОЛНЕНИЯ ЧРЕСКОЖНЫХ КОРОНАРНЫХ ВМЕШАТЕЛЬСТВ.
Во время выполнения ЧКВ могут возникнуть три основных осложнения:
- острая или угрожающая окклюзия коронарных артерий;
- перфорация коронарных артерий;
- потеря контроля над инструментарием (в том числе перелом и/или эмболизация).
Эти осложнения являются жизнеугрожающими и требуют системного подхода к диагностике и лечению.
Острая или угрожающая окклюзия коронарных артерий.
Остро возникшая окклюзия эпикардиальных венечных артерий является наиболее серьезным из распространенных осложнений во время ЧКВ. Окклюзия главных сосудов является наиболее грозным осложнением, однако более чем в 50% случаев ЧКВ сопряжено также с риском окклюзии боковых ветвей. Окклюзия боковых ветвей малого диаметра часто протекает бессимптомно и не является прогностически значимой.
Тактика лечения острой окклюзии коронарных артерий в случае нарушения гемодинамики или наличия электрокардиографических признаков стойкой ишемии миокарда четко определена и заключается в имплантации стента в зоне окклюзии. Следует отметить, что начатое в 1994 г. рандомизированное исследование, в рамках которого проводилось сравнение эффективности стентирования и баллонной ангиопластики у пациентов с угрозой возникновения или остро возникшей окклюзией коронарных артерий, так и не было завершено. Эффективность проверялась «на практике».
Основными причинами острой окклюзии эпикардиальных сосудов являются диссекция, ятрогенный тромбоз (источником которого является инструментарий, вводимый в просвет коронарных артерий), эмболизация элементами нативного тромба или атеросклеротической бляшки (последнее особенно часто происходит во время вмешательств на венозных шунтах), воздушная эмболия и спазм (в редких случаях).
Тактика лечения острой окклюзии коронарных артерий в случае нарушения гемодинамики или наличия электрокардиографических признаков стойкой ишемии миокарда четко определена и заключается в имплантации стента в зоне окклюзии. Следует отметить, что начатое в 1994 г. рандомизированное исследование, в рамках которого проводилось сравнение эффективности стентирования и баллонной ангиопластики у пациентов с угрозой возникновения или остро возникшей окклюзией коронарных артерий, так и не было завершено. Эффективность проверялась «на практике».
Основными причинами острой окклюзии эпикардиальных сосудов являются диссекция, ятрогенный тромбоз (источником которого является инструментарий, вводимый в просвет коронарных артерий), эмболизация элементами нативного тромба или атеросклеротической бляшки (последнее особенно часто происходит во время вмешательств на венозных шунтах), воздушная эмболия и спазм (в редких случаях).
ДИССЕКЦИЯ (РАССЛОЕНИЕ) АРТЕРИЙ.
Любой инструментарий, контактирующий с эндотелием сосудов, может вызвать его повреждение. Механическая дилатация артерии при помощи баллонного катетера или стента, а также использование debulking устройств, проводниковых катетеров и проводников сопряжены с риском повреждения атеросклеротической бляшки, расслоения интимы и локального повреждения медиального слоя артерии. В случае ангиопластики это является частью механизма вмешательства.
Диссекции могут отделять эндотелий от медиального слоя артерии. В зависимости от степени повреждения они могут также приводить к расслоению медиального слоя на различном протяжении, что часто сопровождается кровоизлиянием в атеросклеротическую бляшку и под ткани диссекции. Это с большой вероятностью может вызвать компрометацию кровотока в коронарных артериях путем механической обструкции. Снижение коронарного кровотока, как правило, приводит к активации тромбоцитов и образованию тромбов.
Диссекция во время ЧКВ обычно ограничивается нарушением коронарного кровотока дистальнее места повреждения эндотелия, но может также распространяться ретроградно с вовлечением устьев коронарных артерий и с переходом на аорту. Выраженная диссекция, при которой происходит нарушение антеградного кровотока, как правило, представлена сложной спиральной структурой, что может значительно затруднять доступ в истинный просвет коронарной артерии. По этой причине необходимо поддерживать безопасное положение проводника в дистальном коронарном русле, что является одним из основных технических навыков при выполнении ЧКВ. Диссекция может также возникнуть в аорте ниже диафрагмы или в месте периферического артериального доступа. Сама по себе она не является жизнеугрожающей и не угрожает жизнеспособности конечностей, так как скорости антеградного кровотока в аорте и периферических артериях достаточно для прижатия диссекции вплоть до полного ее разрешения. Тем не менее она должна быть диагностирована с последующим принятием решения о необходимости альтернативного доступа для продолжения ЧКВ.
Любой инструментарий, контактирующий с эндотелием сосудов, может вызвать его повреждение. Механическая дилатация артерии при помощи баллонного катетера или стента, а также использование debulking устройств, проводниковых катетеров и проводников сопряжены с риском повреждения атеросклеротической бляшки, расслоения интимы и локального повреждения медиального слоя артерии. В случае ангиопластики это является частью механизма вмешательства.
Диссекции могут отделять эндотелий от медиального слоя артерии. В зависимости от степени повреждения они могут также приводить к расслоению медиального слоя на различном протяжении, что часто сопровождается кровоизлиянием в атеросклеротическую бляшку и под ткани диссекции. Это с большой вероятностью может вызвать компрометацию кровотока в коронарных артериях путем механической обструкции. Снижение коронарного кровотока, как правило, приводит к активации тромбоцитов и образованию тромбов.
Диссекция во время ЧКВ обычно ограничивается нарушением коронарного кровотока дистальнее места повреждения эндотелия, но может также распространяться ретроградно с вовлечением устьев коронарных артерий и с переходом на аорту. Выраженная диссекция, при которой происходит нарушение антеградного кровотока, как правило, представлена сложной спиральной структурой, что может значительно затруднять доступ в истинный просвет коронарной артерии. По этой причине необходимо поддерживать безопасное положение проводника в дистальном коронарном русле, что является одним из основных технических навыков при выполнении ЧКВ. Диссекция может также возникнуть в аорте ниже диафрагмы или в месте периферического артериального доступа. Сама по себе она не является жизнеугрожающей и не угрожает жизнеспособности конечностей, так как скорости антеградного кровотока в аорте и периферических артериях достаточно для прижатия диссекции вплоть до полного ее разрешения. Тем не менее она должна быть диагностирована с последующим принятием решения о необходимости альтернативного доступа для продолжения ЧКВ.
ДИССЕКЦИЯ КОРОНАРНЫХ АРТЕРИЙ.
Ангиографически доказанная диссекция коронарных артерий возникает не более чем в 40% транслюминальных баллонных ангиопластик. Она может быть классифицирована по морфологии в соответствии с различными рисками развития острой окклюзии сосуда.
Диссекции типов А и В обладают клинически благоприятным течением и не связаны с отрицательным влиянием на исход вмешательства.
Классификация типов диссекций коронарных артерий Национального института сердца, легких и крови США (NHLBI):
| Тип диссекций |
Риск острой окклюзии сосуда, % |
Ангиографическая характеристика |
| А | <2 | Наличие рентгенонегативной области в просвете артерии во время введения контрастного вещества с минимальным присутствием контраста или его отсутствием после окончания инъекции |
| В | 2-4 | Параллельный ход или двойной просвет сосуда, разделенный рентгенонегативной областью во время введения контрастного вещества, с минимальным присутствием контраста или при его отсутствии после окончания инъекции |
| С | 10 |
Появление контрастного вещества за пределами контура сосуда достаточным контрастированием после окончания введения контраста |
| D | 30 | Наличие спирального внутрипросветного дефекта наполнения и задержки контрастного вещества в сосуде |
| Е | 9 | Появление нового устойчивого дефекта наполнения (определяется как тромбоз) |
| F | 69 | Расслоение, приведшее к тотальной окклюзии коронарной артерии с отсутствием антеградного кровотока (определяется как тромбоз) |
Расслоения типов C-F считаются значимыми и существенно повышают летальность в случае отсутствия соответствующего лечения.
В случае диссекции типов А и В, возможно, лучше всего остановить выбор на консервативном лечении и отложить вмешательство, если оно выполнялось в плановом порядке.
Диссекции типов С—F требуют стабилизации просвета артерии путем стентирования. При значительном повреждении проксимального сегмента ПМЖВ может возникнуть «ретроградная диссекция» с распространением на ствол ЛКА. Это осложнение обычно происходит из-за превышения диаметра баллона или баллонной дилатации с использованием высокого давления.
Тактика лечения в данном случае стентирование ЛКА с переходом в ПМЖВ и стентирование ОВ.
ДИССЕКЦИЯ УСТЬЕВ КОРОНАРНЫХ АРТЕРИЙ.
Диссекция устья коронарной артерии является экстренной ситуацией, которая не только угрожает кровотоку дистальнее места ее возникновения, но и сопровождается угрозой ретроградного распространения расслоения на восходящую аорту. Проекция LAO 30° или каудальная проекция («паук») может быть использована для оценки адекватного коаксиального положения катетера в устье ЛКА. Ятрогенная диссекция устья ствола ЛКА является редким, но критическим осложнением, которое может произойти на различных этапах как диагностической процедуры, так и ЧКВ. Осложнение не всегда диагностируется, потому что лоскут диссекции может поддерживаться кончиком проводникового катетера. Развитие ИМ с подъемом сегмента ST и/или гемодинамической нестабильности при несоответствии ангиографической картине по окончании вмешательства являются поводом для исключения данного осложнения. В крайне редких случаях может возникнуть окклюзия ствола ЛКА, которая чаще всего проявляется резким ухудшением гемодинамики и остановкой сердца. В таких ситуациях отмечается высокая смертность, что, в свою очередь, требует расширенной поддержки жизненно важных функций в условиях рентгенооперационной, когда возможна кратковременная попытка поиска истинного просвета артерии. Своевременный перевод в операционную для выполнения экстренной операции АКШ крайне важен, если ситуация не может быть разрешена эндоваскулярными методами.
ДИССЕКЦИЯ УСТЬЕВ КОРОНАРНЫХ АРТЕРИЙ.
Диссекция устья коронарной артерии является экстренной ситуацией, которая не только угрожает кровотоку дистальнее места ее возникновения, но и сопровождается угрозой ретроградного распространения расслоения на восходящую аорту. Проекция LAO 30° или каудальная проекция («паук») может быть использована для оценки адекватного коаксиального положения катетера в устье ЛКА. Ятрогенная диссекция устья ствола ЛКА является редким, но критическим осложнением, которое может произойти на различных этапах как диагностической процедуры, так и ЧКВ. Осложнение не всегда диагностируется, потому что лоскут диссекции может поддерживаться кончиком проводникового катетера. Развитие ИМ с подъемом сегмента ST и/или гемодинамической нестабильности при несоответствии ангиографической картине по окончании вмешательства являются поводом для исключения данного осложнения. В крайне редких случаях может возникнуть окклюзия ствола ЛКА, которая чаще всего проявляется резким ухудшением гемодинамики и остановкой сердца. В таких ситуациях отмечается высокая смертность, что, в свою очередь, требует расширенной поддержки жизненно важных функций в условиях рентгенооперационной, когда возможна кратковременная попытка поиска истинного просвета артерии. Своевременный перевод в операционную для выполнения экстренной операции АКШ крайне важен, если ситуация не может быть разрешена эндоваскулярными методами.
ДИССЕКЦИЯ АОРТЫ.
Диссекции аорты во время ЧКВ бывают распространенными и могут сопровождаться значительной аортальной регургитацией и/или тампонадой сердца.
Диссекции аорты во время ЧКВ бывают распространенными и могут сопровождаться значительной аортальной регургитацией и/или тампонадой сердца.
Классификация ятрогенных диссекций коронарных артерий с распространением на аорту:
| Диссекция | Описание |
| Тип 1 |
Вовлечение ипсилатерального синуса Вальсальвы |
|
Тип II |
Вовлечение синуса Вальсальвы с распространением на восходящую аорту <40 мм |
|
Тип III |
Вовлечение синуса Вальсальвы с распространением на восходящую аорту >40 мм |
Ятрогенное расслоение аорты может также возникнуть независимо от диссекции коронарных артерий. Основной причиной данного осложнения являются манипуляции катетером без проводника. Анализ регистра IRAD выявил тот факт, что показатель летальности от ятрогенной диссекции восходящей аорты (тип А по Стэнфорду) и нисходящей аорты (тип В по Стэнфорду) выше, чем от спонтанной диссекции (причем в последнем случае выше, чем в первом).
Данные исследований с 1993 года по сегодняшние дни позволяют сделать неоднозначный вывод о том, что все ятрогенные диссекции можно успешно вылечить путем имплантации стент-графта. В редких случаях может потребоваться хирургическое вмешательство при неэффективности или невозможности имплантации стента. Учитывая высокую смертность при экстренных кардиохирургических операциях, данное вмешательство следует рассматривать лишь в случае обширной диссекции, сопровождающейся гемодинамическими нарушениями.
ТРОМБОЗ КОРОНАРНЫХ АРТЕРИЙ.
Ятрогенный тромбоз коронарных артерий является жизнеугрожающим осложнением ЧКВ.
Профилактика ятрогенного тромбоза коронарных артерий:
- Стараться свести частоту повторного проведения устройств к минимуму.
- Протирать все извлекаемое оборудование перед повторным введением.
- Часто и тщательно промывать интродьюсер и катетеры.
- Вводить нефракционированный гепарин перед началом вмешательства.
- Поддерживать показатель ACT >250—400 с и проводите регулярный контроль.
- Использовать дозировку гепарина с поправкой на массу тела пациента.
Назначение аспирина и тиенопиридина является обязательным перед выполнением всех ЧКВ. При множественном поражении коронарных артерий и ОКС высокого риска (особенно в тех случаях, когда имеется подозрение на наличие тромба в просвете коронарных артерий при ангиографическом исследовании) использование дополнительно антагонистов гликопротеина Ilb/IIIa снижает частоту острой окклюзии сосудов. В большинстве случаев применяется антикоагулянтная терапия нефракционированными гепаринами, но она требует особого внимания к дозировке и показателю AСТ. Именно в этих случаях следует дополнительно применять антагонисты гликопротеина IIb/IIIa. Согласно рекомендациям, гепарина в дозировке 70—100 ЕД/кг достаточно для достижения значений показателя AСТ 250—300 (при использовании анализатора HemoTec) или 300–350 с (при использовании анализатора HemoChron) у пациентов, не получающих антагонисты гликопротеина IIb/IIIa. При приеме антагонистов гликопротеина Ilb/IIIa и гепарина в дозировке 50—70 ЕД/кг достижение значения показателя AСТ >200с считается достаточным.
Острый тромбоз, возникший в просвете коронарных артерий, или эмболия тромбами из просвета инструментов (находящихся в артериальном русле) должны быть заподозрены при отсутствии восстановления коронарного кровотока, несмотря на введение коронарных вазодилататоров. Степень антикоагуляции (AСТ) должна быть проверена и скорректирована как можно скорее, даже если при ангиографическом исследовании тромбоз визуально не определяется. При наличии видимого тромба и адекватной степени антикоагуляции следует рассмотреть необходимость интракоронарного введения антагонистов гликопротеина IIb/IIIa и использования аспирационных устройств. Если степень антикоагуляции не достигает оптимальных значений, болюсное внутриартериальное (или интракоронарное) введение нефракционированного гепарина является самым быстрым способом достижения необходимых значений.
При наличии яйцевидного дефекта контрастирования или персистирующего застоя контрастного вещества, локального тромба небольших размеров и нарушения кровотока может быть выполнена имплантация коронарного стента. Однако консервативного лечения с применением ингибиторов гликопротеина IIb/IIIa будет достаточно в том случае, если кровоток не нарушен. При наличии крупного тромба следует избегать выполнения лишь баллонной дилатации из-за риска фрагментации тромба, дистальной микроэмболизации и развития ангиографического феномена no-reflow. В такой ситуации рекомендовано выполнение аспирации тромба с помощью специальных устройств с последующей имплантацией коронарного стента.
При наличии яйцевидного дефекта контрастирования или персистирующего застоя контрастного вещества, локального тромба небольших размеров и нарушения кровотока может быть выполнена имплантация коронарного стента. Однако консервативного лечения с применением ингибиторов гликопротеина IIb/IIIa будет достаточно в том случае, если кровоток не нарушен. При наличии крупного тромба следует избегать выполнения лишь баллонной дилатации из-за риска фрагментации тромба, дистальной микроэмболизации и развития ангиографического феномена no-reflow. В такой ситуации рекомендовано выполнение аспирации тромба с помощью специальных устройств с последующей имплантацией коронарного стента.
КОРОНАРНЫЙ СПАЗМ.
Спазм коронарных артерий во время ЧКВ — это временное уменьшение просвета интактных или пораженных сегментов коронарных артерий более чем на 50%, что является обратимым состоянием и разрешается при введении нитратов.
Данное осложнение наиболее часто наблюдается у пациентов с ОКС и стенокардией Принцметала, но также может произойти у пациентов с ангиографически интактными коронарными артериями. Могут сыграть свою роль и этнические различия; так, азиатские пациенты более, чем европейские, склонны к развитию спазма. Механизм данного осложнения, вероятно, включает в себя эндотелиальную дисфункцию и гиперчувствительность гладкой мускулатуры средней оболочки сосудов к вазоконстрикторным стимулам. Как правило, вазоспазм затрагивает атеросклеротически измененные сегменты артерий, особенно при наличии в их просвете тромбов, однако также его проявления могут одновременно отмечаться и в неинфарктзависимых артериях. Локальное механическое воздействие, оказываемое при выполнении баллонной ангиопластики, стентирования или введения контрастного вещества, может вызвать аналогичный эффект. Выраженный спазм коронарных артерий, способный вызвать нарушение T1MI кровотока, может свидетельствовать о наличии сопутствующего повреждения сосуда (диссекции, тромбоза, перфорации). Как изолированное осложнение во время выполнения ЧКВ спазм чаще всего удается разрешить путем интракоронарного введения нитроглицерина. Его воздействие заключается в эндотелийнезависимой вазодилатации. Высокие дозы нитроглицерина или антагонистов кальциевых каналов могут быть использованы в случае стойкого спазма коронарных артерий с учетом гемодинамического статуса и сердечного ритма пациента. При интракоронарном болюсном введении нитратов важно продолжать непрерывное внутривенное вливание растворов.
ВОЗДУШНАЯ ЭМБОЛИЯ.
Воздушная эмболия коронарных артерий, несмотря на все меры по ее профилактике, остается довольно распространенным осложнением катетеризации коронарных артерий. Ретроспективные данные показывают, что основной причиной развития воздушной эмболии является недостаточное освоение техники вмешательств. У начинающих рентгенохирургов, особенно в течение первых месяцев обучения, данное осложнение происходит намного чаще, чем у более опытных специалистов Постановка диагноза весьма проста: при рентгеноскопии или ангиографии визуализируются рентгенонегативные пузыри, находящиеся в просвете коронарных артерий, что далее приводит к снижению TIMI кровотока. Клиническая картина воздушной эмболии зависит от объема введенного воздуха и наличия воздушной закупорки. Если воздушная закупорка произошла, то может потребоваться повышение системного артериального давления до 200 мм рт.ст. для смещения воздуха в венозное русло.
Профилактика заключается в крайне внимательном отношении к технике выполнения ЧКВ.
Лечение воздушной эмболии включает в себя подключение к системам жизнеобеспечения при нарушениях ритма сердца и увеличение концентрации и парциального давления кислорода в крови путем использования для дыхания маски с односторонним клапаном. Если, несмотря на вышеуказанные меры, состояние пациента ухудшается, необходимо увеличивать среднее артериальное давление при помощи вазопрессорной терапии или использовать ВАБК. В литературе представлены единичные случаи эффективного применения бужирования проводником и механической аспирации воздуха с целью его рассеивания и удаления. При большом объеме введенного воздуха и развитии стойкого нарушения коронарного кровотока могут потребоваться длительные реанимационные мероприятия с дополнительной поддержкой жизнеобеспечения. Необходимо помнить, что в таких случаях почти всегда происходит спонтанное восстановление кровотока в коронарных артериях.
ФЕНОМЕН ЗАМЕДЛЕННОГО ИЛИ ОТСУТСТВУЮЩЕГО (NO-REFLOW) КРОВОТОКА.
Феномены no-reflow и slow-reflow являются относительно малоизученными и плохо предсказуемыми осложнениями при ЧКВ, лимитирующими коронарный кровоток, несмотря на восстановление проходимости эпикардиальных сегментов коронарных сосудов. У 2% больных без острого инфаркта миокарда во время ЧКВ не удается восстановить нормальную миокардиальную перфузию (myocardial blush) вследствие микроваскулярной дисфункции и/или механической обструкции. Такое осложнение, которое является собственно феноменом slow- или no-reflow, возникает при отсутствии ангиографического подтверждения наличия внутрипросветных дефектов (диссекций) или дистальных эмболий. Развитие no-reflow сопровождается выраженными функциональными нарушениями со стороны сердца вследствие развивающейся миокардиальной ишемии в результате неадекватного дистального микроваскулярного кровотока и сниженной перфузии миокарда. Несмотря на проходимые эпикардиальные сегменты сосудистого русла, no- reflow сопровождается развитием стенокардитических болей и ишемическими изменениями сегмента ST на ЭКГ. Феномен no-reflow является негативным предиктором функционального восстановления и, несмотря на проводимое лечение, сопровождается развитием рецидивов острого коронарного синдрома (ОКС) с повышенной частотой смертности пациентов.
Понимание патофизиологических механизмов феномена «невосстановленного кровотока» является ключевым для разработки методов его предупреждения и лечения. Актуальным вопросом, которому необходимо уделять большее внимание, является диагностика no-reflow. Зачастую после успешной реканализации инфарктзависимой артерии наличие зоны «невосстановленного кровотока» является причиной неблагоприятного течения заболевания и прогноза для пациентов с ОИМ. По данным различных исследований, у больных с ОКС риск развития no-reflow составляет около 30%. Согласно результатам исследования, частота возникновения феномена «невосстановленного кровотока» может достигать 66%. Этот впечатляющий показатель еще раз подчеркивает необходимость активизации в изучении этой проблемы и своевременной верификации феномена no-reflow после первичного эндоваскулярного вмешательства. Клинически феномен no-reflow проявляется усугублением болевого синдрома, падением артериального давления, повторным подъемом сегмента ST, появлением или увеличением патологического зубца Q после процедуры реваскуляризации, — все это свидетельствует о прогрессирующем расширении зоны некроза, а также косвенно указывает на наличие феномена «невосстановленного кровотока».
Феномен no-reflow диагностируется при недостаточной миокардиальной перфузии (MBG 0–3) на фоне полностью восстановленного кровотока (TIMI 3). О неэффективной реперфузии может свидетельствовать снижение сегмента ST на протяжении 4 ч менее чем на 70%. Опираясь только на данные электрокардиограммы или клиники, нельзя сделать точных выводов, стала ли причиной тому неуспешная реваскуляризация (TIMI 0—2) или феномен no- reflow. В научных исследованиях для более точной диагностики феномена no- reflow используются различные методы визуализации миокарда (сцинтиграфия, контрастная эхокардиография, магнитно-резонансная томография с контрастированием, допплер-ультрасонографическое исследование коронарных артерий, позитронно-эмиссионная томография, интраваскулярная ультрасонография и пр.). К сожалению, для повседневной практики в стационарах эти методы пока недоступны.
Доказательная база лечения данного осложнения несостоятельна в результате небольших размеров выборки и недостаточного отбора пациентов с высоким риском развития феномена no-reflow. Небольшие рандомизированные исследования обычно демонстрируют положительные клинические результаты. Определенные предикторы развития феномена no-reflow могут быть использованы для выбора тактики лечения, особенно во время первичных ЧКВ. Профилактические и терапевтические подходы могут быть разделены на фармакологические и механические.
Потенциальные механизмы no-reflow:
- Дистальная эмболизация тромбами/микроэмболами.
- Дистальная эмболизация фрагментами атеросклеротической бляшки
- Воздушная эмболия.
- Гипотония.
- Дисфункция клеток эндотелия.
- Внутриклеточный и межклеточный отек, и интралюминальная гематома.
- Разрушение капилляров (у больных с ОИМ).
- Наличие шунта из большой подкожной вены или крупной ПКА при проведении атерэктомии (ротаблационной/направленной).
Предикторы дистальной эмболизации во время ЧКВ у пациентов с ОКС:
- Ангиографически определяется тромб протяженностью более 3 референсных диаметров сосуда.
- Тупая культя сосуда в области окклюзии.
- Наличие пристеночных тромбов проксимальнее окклюзии.
- Наличие флотирующего тромба проксимальнее окклюзии.
- Накопление контрастного вещества дистальнее обструкции.
- Референсный диаметр сосуда >4мм.
Прогностическая значимость практических методов диагностики феномена no-reflow:
- Нарушение кровотока по классификации TIMI (ОШ 3,2).
- Нарушение миокардиальной перфузии (myocardial blush grade) (ОШ 4,2).
- Нарушение миокардиальной перфузии по классификации TIMI (ОШ 1,9).
- Сохранение подъема сегмента ST на ЭКГ (>70%) (ОШ 2,5).
- Нарушение миокардиальной перфузии (myocardial blush grade) + сохранение подъема сегмента ST на ЭКГ (ОШ 8,2).
- Нарушение перфузии миокарда при контрастной ЭКГ (ОШ 10,7). ОШ- показатель вероятности смерти от кардиальных или от любых причин для различных факторов.
Профилактика и лечение феномена no-reflow.
Профилактика.
Профилактика.
Препараты, из которых самый известный и изученный — аденозин, продемонстрировали неоднозначные результаты профилактики синдрома no- reflow, но оказались эффективны в лечении во время его развития. В рекомендации Европейского общества кардиологов в отношении профилактики no-reflow включен только абциксимаб. Альтернативный препарат — никорандил — также может быть эффективным при его внутривенном введении.
Предупреждение феномена замедленного или отсутствующего (no-reflow) кровотока:
- Удаление фрагментов атеросклеротических бляшек со стенок аорты (выведение их из проводникового катетера после того, как он дойдет до корня аорты).
- Использование дистальных защитных устройств во время вмешательств на дегенеративных
При использовании ротаблатора:
—добавление нитроглицерина, верапамила и гепарина в промывочный раствор:
— правильная методика аблации.
— правильная методика аблации.
- Тромбоаспирация, тромбоэкстракция (при наличии тромба).
- У больных с ОКС (ОИМ, нестабильной стенокардией) — использование ингибиторов IIb/IIIа гликопротеиновых рецепторов тромбоцитов и недопущение перераскрытия стента.
- Адекватное активированное время свертывания крови.
- По показаниям — премедикация внутрикоронарным верапамилом, аденозином, нитропруссидом.
Лечение.
Внутрикоронарное введение таких препаратов как аденозин, верапамил, папаверин, натрия нитропруссид, абциксимаб, циклоспорин, эпинефрин и стрептокиназа успешно используется в качестве лечения при развитии синдрома no-reflow. Выбор лекарства осуществляется на основании клинических и гемодинамических параметров конкретного пациента. Важно отметить, что любой из препаратов должен быть введен как можно дистальнее в коронарное русло для обеспечения их специфического воздействия на микроциркуляцию. Персонал рентгенооперационной должен быть знаком хотя бы с одним изданных препаратов для того, чтобы быстро начать необходимое лечение. Локально согласованные протоколы являются наиболее практичным средством для обеспечения высокой скорости оказания помощи.
Аденозин является антагонистом пуриновых рецепторов. Он считается первым препаратом в данной группе из-за его сильных вазоактивных свойств, легкости применения и короткого периода полураспада. Употребление кофеина (в течение последних 24 ч) и длительная терапия эуфиллином могут снизить его эффективность. Бронхиальная астма заявлена производителем в качестве противопоказания к применению данного препарата, однако под строгим контролем и при постоянном мониторинге состояния пациента лекарство можно использовать путем его болюсного введения в условиях рентгенооперационной. Верапамил является антагонистом кальциевых каналов L-типа и оказывает действие как на гладкую мускулатуру сосудов, так и на проводимость сердца. С учетом этих особенностей, при использовании данного препарата необходимо все приготовить для обеспечения временной электрокардиостимуляции. Папаверин может быть успешно использован при развитии no-reflow, однако он удлиняет интервал QT, что делает его применение нежелательным в случае ОИМ. Немногочисленные данные рандомизированных исследований свидетельствуют о возможности внутрикоронарного введения стрептокиназы во время первичных ЧКВ [107]. Свою эффективность у пациентов со стойким синдромом no-reflow — во время как плановых, так и экстренных ЧКВ — показало также внутрикоронарное введение адреналина.
Аденозин является антагонистом пуриновых рецепторов. Он считается первым препаратом в данной группе из-за его сильных вазоактивных свойств, легкости применения и короткого периода полураспада. Употребление кофеина (в течение последних 24 ч) и длительная терапия эуфиллином могут снизить его эффективность. Бронхиальная астма заявлена производителем в качестве противопоказания к применению данного препарата, однако под строгим контролем и при постоянном мониторинге состояния пациента лекарство можно использовать путем его болюсного введения в условиях рентгенооперационной. Верапамил является антагонистом кальциевых каналов L-типа и оказывает действие как на гладкую мускулатуру сосудов, так и на проводимость сердца. С учетом этих особенностей, при использовании данного препарата необходимо все приготовить для обеспечения временной электрокардиостимуляции. Папаверин может быть успешно использован при развитии no-reflow, однако он удлиняет интервал QT, что делает его применение нежелательным в случае ОИМ. Немногочисленные данные рандомизированных исследований свидетельствуют о возможности внутрикоронарного введения стрептокиназы во время первичных ЧКВ [107]. Свою эффективность у пациентов со стойким синдромом no-reflow — во время как плановых, так и экстренных ЧКВ — показало также внутрикоронарное введение адреналина.
ПЕРФОРАЦИЯ КОРОНАРНЫХ АРТЕРИЙ.
Перфорация является нарушением анатомической целостности адвентициальной оболочки эпикардиальной артерии, ведущим к экстравазации крови либо в миокард, либо в полость перикарда или одну из камер сердца. Это может быть вызвано превышением допустимых размеров баллонов или стентов, разрывом баллона, агрессивной постдилатацией стента, применением лазера, ротаблации или выходом проводника за пределы просвета сосуда.
Факторы риска перфорации коронарной артерии:
- Превышение размера баллона (отношение баллон/артерия >1,1:1).
- Раздувание баллона высокого давления вне стента.
- Стентирование участка сосуда с большой разницей в диаметре между проксимальным и дистальным концами (конический сосуд).
- Стентирование состоявшихся перфораций после использования других устройств.
- Стентирование повреждений, через которые повторно проведены инструменты, после выраженной диссекции или острой окклюзии.
- Стентирование хронической тотальной окклюзии после нераспознанного субинти- мального хода проводника.
- Стентирование сосудов малого диаметра (<2,6 мм).
Ангиографическая классификация перфораций коронарных артерий:
| Тип | Характеристика |
| I | Экстравазальное скопление контрастного вещества без струйного поступления |
| II | Интраперикардиальное и интрамиокардиальное скопление контрастного вещества без струйного поступления |
| III | Активное струйное экстаравазальное поступление контрастного вещества (через отверстие >1 мм) |
| IV | Экстравазация в полости сердца |
| V | Дистальная перфорация |
Диагностика и лечение.
Перфорация коронарной артерии может протекать бессимптомно или иметь следующие проявления: боль (в груди, шее, горле), вазовагальные симптомы, гипотензия (с наличием тахикардии или без нее), желудочковые эктопии в сочетании с гипотонией. Рентгенологические признаки перфорации включают экстравазацию контрастного вещества, «странствующее» положение проводника, а при массивной тампонаде — симптом «мертвого сердца». Тактика лечения этого жизнеугрожающего осложнения основывается на ангиографической классификации перфораций и зависит от принадлежности к тому или иному ее типу. Перфорации I–IV типов отнесены к проксимальным и средним сегментам эпикардиальных артерий, в то время как V тип относится исключительно к перфорации дистальных сегментов или боковых ветвей.
Перфорации I и II типов обычно протекают благоприятно и требуют лишь дальнейшего наблюдения. В этом отношении особенно важно отличать интрамиокардиальную гематому, которая, в основном, характеризуется «доброкачественным» течением. Пациенты требуют тщательного динамического наблюдения в палате, а введение гепарина и антагонистов IIb/IIIa-рецепторов должно быть остановлено и по возможности прекращено полностью. Перфорации типа III, как правило, требуют выполнения пункции перикарда с целью забора жидкости из его полости для стабилизации параметров гемодинамики пациента и далее — выполнения стентирования покрытыми (политетрафторэтиленом или перикардом) стентами. При перфорации типа IV (первоначально называлась типом III с экстравазацией в полости сердца) часто применяется консервативный подход, так как она характеризуется кровотечением в камеры сердца и, как правило, закрывается спонтанно. Экстравазальное поступление крови в камеры сердца с низким давлением сопровождается развитием ишемии, что чаше всего требует имплантации стент-графта. При перфорации V типа может потребоваться эмболизация дистального русла, что реально осуществить с помощью множества различных материалов. Для этого могут применяться тромбогенные сосудистые спирали, поливиниловый спирт, кусок жировой ткани пациента, клей, тромбин или предварительно полученный аутологичный сгусток крови.
Перфорации I и II типов обычно протекают благоприятно и требуют лишь дальнейшего наблюдения. В этом отношении особенно важно отличать интрамиокардиальную гематому, которая, в основном, характеризуется «доброкачественным» течением. Пациенты требуют тщательного динамического наблюдения в палате, а введение гепарина и антагонистов IIb/IIIa-рецепторов должно быть остановлено и по возможности прекращено полностью. Перфорации типа III, как правило, требуют выполнения пункции перикарда с целью забора жидкости из его полости для стабилизации параметров гемодинамики пациента и далее — выполнения стентирования покрытыми (политетрафторэтиленом или перикардом) стентами. При перфорации типа IV (первоначально называлась типом III с экстравазацией в полости сердца) часто применяется консервативный подход, так как она характеризуется кровотечением в камеры сердца и, как правило, закрывается спонтанно. Экстравазальное поступление крови в камеры сердца с низким давлением сопровождается развитием ишемии, что чаше всего требует имплантации стент-графта. При перфорации V типа может потребоваться эмболизация дистального русла, что реально осуществить с помощью множества различных материалов. Для этого могут применяться тромбогенные сосудистые спирали, поливиниловый спирт, кусок жировой ткани пациента, клей, тромбин или предварительно полученный аутологичный сгусток крови.
Трансторакальная эхокардиография является крайне важным дополнением безопасного лечения перфорации коронарных артерий вне зависимости от типа осложнения. Визуализация полости перикарда в рентгенооперационной и затем в отделении строго рекомендуется для исключения продолжающегося кровотечения, что чаще происходит с дистальными перфорациями, при которых повторное кровотечение может развиться спустя несколько часов после развития осложнения.
Профилактика.
Профилактика заключается в предотвращении превышения диаметра баллона по отношению к артерии (> 1,1:1) и в аккуратных манипуляциях проводниками. Использование гидрофильных или жестких коронарных проводников (особенно — в окклюзированных сегментах при отсутствии дистального русла) является предрасполагающим фактором развития данных ситуаций. «Золотое» правило заключается в следующем: ангиопластика не должна выполняться, пока дистальное русло не будет визуализировано.
ПЕРФОРАЦИЯ КАМЕР СЕРДЦА.
Перфорация левого желудочка во время ЧКВ развивается очень редко, однако в литературе имеются описания случаев развития данного осложнения при выполнении левой вентрикулографии. Неправильное позиционирование катетера (даже с несколькими отверстиями) напротив стенки желудочка с инъекцией контрастного вещества под высоким давлением является наиболее распространенной его причиной. Более часто встречаются перфорации стенки правого желудочка с последующим развитием тампонады сердца.
МИГРАЦИЯ УСТРОЙСТВ И НАРУШЕНИЕ ИХ ЦЕЛОСТНОСТИ.
Данный вид осложнений во время ЧКВ возникает крайне редко, но к ним должен быть готов каждый практикующий эндоваскулярный хирург. Обычно эти осложнения возникают со следующими устройствами: стенты, фрагменты проводников и катетеров, внутрисосудистые спирали, а также любые диагностические устройства, используемые при выполнении ЧКВ. Несмотря на то что всегда существует вероятность нарушения внутренней конструкции самих устройств, основной причиной данного вида осложнений чаще всего являются небрежные ошибки или неправильная техника вмешательства.
Миграция стентов или иных устройств и их фрагментов может произойти как в просвете коронарной артерии или шунта, так и за пределами коронарного русла. Важно отметить, что при всех случаях миграции следует немедленно попытаться его удалить.
Миграция стентов или иных устройств и их фрагментов может произойти как в просвете коронарной артерии или шунта, так и за пределами коронарного русла. Важно отметить, что при всех случаях миграции следует немедленно попытаться его удалить.
ТРОМБОЗ СТЕНТА.
Хотя тромбоз стента встречается очень редко, особенно с момента появления СЛП нового поколения и ведения пациентов на ДАТТ , это может иметь разрушительные клинические последствия. Агрессивная ангиопластика баллоном высокого давления должна использоваться для коррекции стент- ассоциированных механических осложнений. Рекомендуется использование интракоронарной визуализации для обнаружения и модификации механических осложнений.
Хотя повторного стентирования у пациентов с тромбозом стента можно избежать, если при расширении баллона получены удовлетворительные результаты, для коррекции краевой диссекции и смежных поражений и достижения наилучших результатов может потребоваться новый стент. Нет никаких доказательств того, что после интервенции терапия пациентов с тромбозом стента должна отличаться от пациентов с тромбозом de novo, осложненным ИМпST.
АРИТМИИ.
Аритмии — распространенное осложнение во время выполнения ЧКВ. особенно — у пациентов с ОИМ с подъемом ST. Патогенез нарушений ритма в большинстве случаев представлен ишемией или реперфузией миокарда с сопутствующими вазовагальными реакциями (рефлекс Бецольда—Яриша). Во время выполнения ЧКВ прогноз у пациентов с жизнеугрожающими аритмиями благоприятный, по сравнению с теми больными, у которых аналогичное состояние развилось более чем за 48 ч до начала вмешательства. Аритмии во время ЧКВ не влияют на их отдаленные результаты.
Главные предикторы аритмий во время ЧКВ:
Главные предикторы аритмий во время ЧКВ:
- ЧКВ у пациентов с ОКС;
- ЧКВ на правой коронарной артерии;
- пациент не принимал бета-блокаторы до начала вмешательства. ЧКВ могут сопровождаться целым рядом изменений электрической активности сердца. Окклюзия коронарных артерий (патологическая или ятрогенная) нарушает рефрактерность кардиомиоцитов, приводит к удлинению интервала QT и замедлению проводимости, особенно — на границе ишемизированного и неишемизированного миокарда. Скачки уровня катехоламинов, вызванные вмешательством, а также острой ишемией миокарда, приводят к развитию постдеполяризации. Сочетание вышеописанных факторов создает все необходимые условия для развития тахикардий и брадиаритмий во время как окклюзии, так и реперфузии, поскольку восстановление проводимости, потенциалов действия кардиомицитов в ишемизированном миокарде происходит случайным неоднородным образом. Реперфузионные нарушения ритма возникают непосредственно после восстановления кровотока во время первичных ЧКВ; их возникновение ожидаемо и сопровождается низкой частотой развития жизнеугрожающих аритмий.
Реперфузионные аритмии при ЧКВ у пациентов с ОКС:
- Повышение частоты желудочковых экстрасистол (52%).
- Возникновение идиовентрикулярного ритма (33%).
- Непродолжительные эпизоды желудочковой тахикардии (5%).
- Фибрилляция предсердий (10%).
- Брадикардия (17%).
- Фибрилляция желудочков (2%).
- Отсутствие аритмий (24%).
К развитию жизнеугрожающих аритмий потенциально может привести введение контрастного вещества в коронарные артерии малого диаметра, такие как конусная ветвь. Также особое внимание требуется во время катетеризации устьев коронарных артерий.
При выполнении любых инвазивных вмешательств обязательным является наличие внешнего дефибриллятора в непосредственной близости. В случае ОКС, сопровождающегося рецидивирующими и/или стойкими желудочковыми тахиаритмиями, возможно применение ВАБК, которая может повысить ишемический порог во время выполнения реваскуляризации миокарда.
Для лечения брадиаритмий эффективны атропин (0,5—1,0 мг внутривенно каждые 3—5 мин до достижения максимальной дозы в 3 мг). При симптоматических брадикардиях, не реагирующих на атропин, требуется немедленная временная трансвенозная электрокардиостимуляция.
Для лечения брадиаритмий эффективны атропин (0,5—1,0 мг внутривенно каждые 3—5 мин до достижения максимальной дозы в 3 мг). При симптоматических брадикардиях, не реагирующих на атропин, требуется немедленная временная трансвенозная электрокардиостимуляция.
Желудочковые аритмии.
Наиболее часто развиваются преждевременные желудочковые сокращения, далее по частоте следуют желудочковые тахикардии и фибрилляция желудочков. Обычно эти аритмии развиваются после манипуляций катетером в камерах сердца или после проведения проводника в дистальные сегменты коронарного русла, введения (длительного, медленного) контраста в ПКА и продолжительной ишемии. Для лечения желудочковых аритмий могут применяться механические приемы (изменение положения катетера), антиаритмические препараты (лидокаин или амиодарон) или электрическая кардиоверсия. Для устранения желудочковой возбудимости может потребоваться поддержание системного и перфузионного давления с помощью дополнительного введения жидкости, уменьшения ишемии и замещения электролитов.
ИНСУЛЬТ.
Цереброваскулярные осложнения являются одними из самых тяжелых состояний, которые могут возникнуть во время ЧКВ. Частота их развития колеблется от 0,1 до 0,47%. В половине случаев данные осложнения представлены обширными инсультами. Показатель госпитальной летальности превышает 35%, а смертность в течение 1 года увеличивается в 10 раз. К сожалению, развития данных осложнений невозможно избежать полностью ввиду того, что факторы риска возникновения сердечно-сосудистых событий одинаковы для аорты, коронарных сосудов и сосудов головного мозга, а выполнение эндоваскулярных вмешательств неизбежно. Транскраниальная допплерография и магнитно-резонансная томография подтверждают, что во время ЧКВ, зачастую, происходит системная эмболизация. Тем не менее некоторые пациенты находятся в группе повышенного риска цереброваскулярных событий (пациенты женского пола, с заболеваниями почек, с ОИМ, пациенты старше 80 лет). Кроме того, характеристики выполняемой процедуры, по всей видимости, не менее важны (длительность процедуры, использование ВАБК, вмешательства на маммарокоронарных шунтах, множественная смена оборудования, использование катетеров большого диаметра и прохождение через аортальный клапан). Эндоваскулярные хирурги должны поддерживать контакт с пациентами во время вмешательств, а в конце операции оценивать наличие нарушений речи или признаков снижения внимания.
Чаще всего происходят ишемические инсульты вследствие нарушения антеградного кровотока. Причины данного осложнения различны: от эмболии элементами атеросклеротических бляшек и кальция с аортального клапана и дуги аорты до тромбоэмболии из просвета катетера и полости левого желудочка. Частота ишемических инсультов в бассейне позвоночной артерии значительно выше, чем принято считать; причиной является поток крови во время сердечного выброса, который направлен преимущественно в данный артериальный бассейн. Манипуляции катетером в просвете аорты и прохождение через кольцо аортального клапана имеют прямую связь с развитием цереброваскулярных осложнений, поэтому выполнение данных действий должно быть сведено к минимуму. В проспективном исследовании крови, полученной из просвета различных проводниковых катетеров, было установлено, что при первичном прохождении аорты значительное количество элементов атеросклеротических бляшек с ее стенок может попадать в просвет катетера с последующим их введением в просвет коронарных артерий. Таким образом, промывание катетера путем открытия У-коннектора и пуском обратного тока крови на протяжении минимум трех сердечных циклов может предотвратить эмболизацию коронарных артерий атеросклеротическими частицами во время введения контрастного вещества и проведения инструментов через просвет проводникового катетера.
Чаще всего происходят ишемические инсульты вследствие нарушения антеградного кровотока. Причины данного осложнения различны: от эмболии элементами атеросклеротических бляшек и кальция с аортального клапана и дуги аорты до тромбоэмболии из просвета катетера и полости левого желудочка. Частота ишемических инсультов в бассейне позвоночной артерии значительно выше, чем принято считать; причиной является поток крови во время сердечного выброса, который направлен преимущественно в данный артериальный бассейн. Манипуляции катетером в просвете аорты и прохождение через кольцо аортального клапана имеют прямую связь с развитием цереброваскулярных осложнений, поэтому выполнение данных действий должно быть сведено к минимуму. В проспективном исследовании крови, полученной из просвета различных проводниковых катетеров, было установлено, что при первичном прохождении аорты значительное количество элементов атеросклеротических бляшек с ее стенок может попадать в просвет катетера с последующим их введением в просвет коронарных артерий. Таким образом, промывание катетера путем открытия У-коннектора и пуском обратного тока крови на протяжении минимум трех сердечных циклов может предотвратить эмболизацию коронарных артерий атеросклеротическими частицами во время введения контрастного вещества и проведения инструментов через просвет проводникового катетера.
Лечение при появлении острой неврологической симптоматики должно быть направлено, в первую очередь, на исключение состояний, имитирующих данное осложнение (чаще — гипогликемия, гипоксия и гипотония, реже — эпилепсия и аллергическая реакция на контрастное вещество). В экстренном порядке необходимо выполнить диагностическое исследование сосудов головного мозга (КТ, МРТ или церебральная ангиография) для подтверждения ишемической этиологии и исключения геморрагического генеза осложнения, а также для оценки риска геморрагического преобразования очага поражения. Командный подход к лечению данного осложнения с решением вопроса о проведении тромболизиса чаще всего является наиболее доступной тактикой лечения в данной ситуации. Выполнение церебральной ангиографии в экстренном порядке рекомендовано некоторыми специалистами в качестве методики выбора ввиду сокращения времени от начала диагностики до начала лечения. После этого пациенту может быть назначена тромболитическая терапия с последующим внутривенным или внутриартериальным введением соответствующего препарата. Данное решение всегда должно приниматься совместно с местной неврологической командой, что в настоящее время доступно лишь в самых крупных многопрофильных центрах.
Причины изменения уровня сознания в периоперационном периоде:
- Гипоксия.
- Гипотония.
- Гипогликемия.
- Острое нарушение мозгового кровообращения (ОНМК) (выраженная дисфазия).
- Эпилептический приступ (редко).
- Введение препаратов (седативные средства и/ или опиоидные анальгетики).
- Реакция на контрастный препарат.
Важно, чтобы протокол диагностики и лечения этого редкого, но грозного осложнения был разработан и внедрен в каждом рентгенохирургическом отделении с учетом штата специалистов и инфраструктуры данного медицинского учреждения.
ЖИРОВАЯ ЭМБОЛИЯ.
Редкий вариант эмболии, который характеризуется высокой летальностью. По данным проспективного анализа пациентов, которым выполнялись диагностические процедуры и ЧКВ, данное осложнение имело частоту 0,67% (n=1786) и сопровождалось высокой летальностью (16%). Наличие легких бессимптомных форм этого синдрома объясняет более высокую частоту заболеваемости по данным патологоанатомических исследований. Сочетание синдрома жировой эмболии с эозинофилией (>500/мкл) и почечной недостаточностью после ЧКВ является неблагоприятным прогностическим фактором. Множественный логистический регрессионный анализ определил повышение С-реактивного белка (>1,0 мг/дл) в качестве сильнейшего независимого предиктора данного осложнения (ОШ 4,64). Профилактические меры в отношении данного осложнения недостаточно определены; тем не менее, важность воспаления в генезе этого синдрома расширяет научно- исследовательские возможности для использования статинов.
Особенности синдрома жировой эмболии после ЧКВ:
- Сетчатое ливедо*.
- Синдром Рейно*.
- Гангрена пальцев*.
- Почечная недостаточность.
- Эозинофилия.
* Необходимо для постановки диагноза
ИНФЕКЦИЯ.
Бактериемия чрезвычайно редко возникает во время выполнения ЧКВ; развитие специфической инфекции стента представлено лишь отдельными наблюдениями. Эти единичные сообщения свидетельствуют о том, что вышеупомянутое осложнение обычно возникает в течение 30 дней с момента вмешательства и проявляется лихорадкой и/или болью и дискомфортом за грудиной. Смертность при установленной инфекции стента может достигать 40%.
Еще одной потенциальной причиной инфекционных осложнений может являться высокая частота использования эндоваскулярных устройств закрытия пункционных отверстий. В одной из работ было показано, что инфицирование может привести к летальности до 6% и еще более высоким показателям смертности у пациентов, которым требовалось хирургическое вмешательство. В представленных случаях манифестация инфекционных осложнений отмечалась в течение первых 8 сут с момента выполнения ЧКВ. Соблюдение таких правил асептики и антисептики, как мытье рук и тщательная подготовка пациента, является неотъемлемой частью медицинской практики.
Лечение
ЧРЕСКОЖНОЕ КОРОНАРНОЕ ВМЕШАТЕЛЬСТВО.
Чрескожное коронарное вмешательство (стентирование) - малоинвазивная нехирургическая процедура, выполняемая для улучшения кровотока в одном или нескольких сегментах коронарного кровообращения. Реваскуляризация коронарных артерий при ЧКВ в первую очередь включает использование баллонной ангиопластики и интракоронарного стентирования стентами с лекарственным покрытием (СЛП).
1. Транслюминальная балонная ангиопластика (ТЛБАП) – операция, позволяющая восстановить кровоток в артериях сердца (коронарных артериях) путём проведения катетера с баллоном и последующем его раздуванием. Операция ТЛБАП сопровождалась высоким риском осложнений в виде повторного сужения сосуда – рестеноза, острых окклюзий. В современной эндоваскулярной хирургии ТЛБАП выполняется вместе с эндопротезированием венечных (коронарных) артерий, т. е. имплантацией стентов в коронарное русло.
Из истории: впервые транслюминальную баллонную ангиопластику стеноза нативной коронарной артерии выполнил A. Gruentzig 16 сентября 1977 г. Вторым рождением метода можно считать 1986 г., когда (J. Sigwart и J. Puel открыли эру стентирования венечных артерий, выполнив первые имплантации коронарных стентов в клинической практике. К началу XXI в. в мире ежегодно выполнялось более 1 млн рентгенэндоваскулярных вмешательств на коронарных артериях, причем более чем 70% случаев от общего числа всех вмешательств выполнялось стентирование коронарных артерий. Внедрение в 2000–2003 гг. в клиническую практику стентов с лекарственным антипролиферативным покрытием Cypher (лекарственное покрытие — сиролимус) и Taxus (лекарственное покрытие — паклитаксел) оказало огромное влияние на дальнейшее развитие рентгенэндоваскулярного лечения больных ИБС. Данные первых же исследований продемонстрировали существенное улучшение отдаленных результатов ЧКВ за счет 3-4 кратного уменьшения частоты рестенозирования в отдаленном периоде наблюдения у больных с самыми разными формами поражения венечного русла, что позволило существенно расширить показания к проведению интервенционного лечения.
2. Стент представляет собой металлический каркас, его имплантация в область сужения позволяет эффективно реализовать все перечисленные выше механизмы, в дополнение к которым он обеспечивает постоянную опорную функцию, оптимизируя просвет артерии за счет компрессии поврежденных участков атеромы и сосудистой стенки, полностью исключая эластический возврат сосудистой стенки. (Рис.3-4).

Рисунок 3.
Рисунок 4.
Стенты с лекарственным покрытием – это стент, из структур которого выделяется антипролиферативное вещество, препятствующее образованию неоинтимы и за счет этого способствующее замедлению повторного стенозирования.
Стенты с лекарственным покрытием – это стент, из структур которого выделяется антипролиферативное вещество, препятствующее образованию неоинтимы и за счет этого способствующее замедлению повторного стенозирования.
Из истории: Внедрение в клиническую практику в 2001–2003 гг. стентов с лекарственным антипролиферативным покрытием открыло новые перспективы в лечении больных с атеросклеротическим поражением венечного русла. На первом этапе наиболее широкое распространение получили два эндопротеза с антипролиферативным покрытием — стент Cypher (лекарственное покрытие — рапамицин) компании Cordis, Johnson&Johnson (США) и стент Taxus (лекарственное покрытие — паклитаксел) компании: Boston Scientific (США). Результаты первых же рандомизированных исследований свидетельствовали о высокой эффективности этих стентов для снижения частоты рестенозирования и повторных вмешательств в отдаленном периоде у больных ИБС.
Рапамицин (сиролимус) был одобрен FDA (Food and Drug Administration) в США в 1999г. Рапамицин относится по химическому составу к естественным макроциклическим лактонам, а по фармакологическим свойствам является цитостатиком — иммуносупрессором. Рапамицин предотвращает пролиферацию Т-лимфоцитов, а также пролиферацию и миграцию гладкомышечных клеток медии.
Паклитаксел (таксол) был первоначально выделен из коры тихоокеанского тиса. Это противоопухолевый препарат с мощным антипролиферативным действием, который в настоящее время используется при лечении опухолей молочной железы и яичников. Доклинические исследования (in vitro и in vivo) показали, что паклитаксел может предотвратить или уменьшить рестеноз. Исследования выявили последовательную зависимость роста гиперплазированной неоинтимы от выделяемой дозы препарата. В месте имплантированного стента, выделяющего препарат, происходит неполное заживление с небольшим количеством гладкомышечных клеток, устойчивым количеством макрофагов, плотным фибрином со следами коллагена и появляются признаки положительного ремоделирования стентированного сегмента. На седьмой день после имплантации стента, содержащего 200 мкг препарата, интимальный и медиальный слои сосудистой стенки уменьшаются в три раза по сравнению с контрольной группой. В отдаленном периоде через 6 мес в группе с цитостатиком объем гиперплазированной неоинтимы в два раза меньше.
Эверолимус — является производным сиролимуса (рапамицина) и имеет такой же механизм действия, как и сиролимус, обладает иммуносупрессивным и противоопухолевым действием.
Зотаролимус является иммунодепрессантом. Medtronic использует зотаролимус в качестве антипролиферативного агента в полимерном покрытии своих продуктов Endeavour и Resolute.
Биолимус А9 - высоколипофильное производное сиролимуса. Полимолочная кислота (ПМК) широко применяется в производстве медицинских изделий, в том числе в качестве системы доставки лекарств, протезных имплантов и биоматериалов для закрытия ран. ПМК и ее производные прошли множественные преклинические и клинические исследования на биосовместимость. Биораспадающийся полимер ПМК показал, что является безопасным при использовании у людей в качестве импланта и полимера, высвобождающего лекарственное вещество. В стентах, покрытых биолимусом А9, используется малое количество полимера. Это связано с тем, что полимер ПМК обладает способностью нести в себе высокую дозировку лекарства.
Полимер ПМК, несущий на себе Б А9 абсорбируется на протяжении 6-9 месяцев с поверхности стента. Активное фармакологическое вещество биолимус А9 было синтезировано с помощью химической модификации препарата рапамицин, обладает высокой липофильностью и способностью адсорбироваться в тканях. Являясь представителем семьи «лимус», это лекарство обладает свойством присоединяться к цитоплазматическим протеинам. Кроме того, он ингибирует клеточную пролиферацию и, как и другие «лимусы», связываясь с цитоплазматическими протеинами FKBP-12, блокирует клеточный цикл между фазами J1 и S. В результате, биолимус А9 ингибирует пролиферацию Т-лимфоцитов. Благодаря высокой липофильности и аблюминальному покрытию стентов, системное воздействие и попадание в кровоток биолимус А9 минимизировано.
Стенты с лекарственным покрытием, рекомендуемые для клинического применения в Европе на основании результатов рандомизированных клинических исследований с первичной конечной точкой.
|
Стенты с лекарственным покрытием
|
Металл |
Полимер |
Действующее вещество
|
|
Постоянное полимерное покрытие
|
|||
|
Promus Element
|
Платина-хром
|
РВМА, PVDF-HFP
|
Эверолимус
|
|
Resolute
|
Кобальт-хром
|
РВМА, РИМА, PVP, PVA
|
Зотаралимус
|
|
Xience
|
Кобальт-хром
|
РВМА. PVDF-HFP
|
Эверолимус
|
|
Биоабсорбируемое полимерное покрытие
|
|||
|
Biomatrix
|
Нержавеющая сталь
|
PDLLA
|
Биолимус А9
|
|
Nobori
|
Нержавеющая сталь
|
PDLLA
|
Биолимус А9
|
|
Yukon Choice PC
|
Нержавеющая сталь
|
PDLLA
|
Сиролимус
|
|
Orsiro
|
Кобальт-хром
|
PLLA
|
Сиролимус
|
|
Ultimaster
|
Кобальт-хром
|
PDLLA, PCL
|
Сиролимус
|
Стенты нового поколения с лекарственным покрытием отличаются повышенной безопасностью и эффективностью по сравнению с голыми металлическими стентами и стентами с лекарственным покрытием первого поколения. Норвежское исследование коронарных стентов (NORSTENT) - крупнейшее клиническое испытание, в котором сравнивались результаты лечения пациентов с использованием нового поколения стентов и без лекарственного покрытия, - показало, что первичная конечная точка - смерть или ИМ - была сопоставима в обеих группах лечения. В группе с лекарственным покрытием уменьшилось количество случаев повторной реваскуляризации и тромбоза стента. В исследованиях COMFORTABLE-AMI (Comparison of Biolimus Eluted from an Erodible Stent Coating With Bare Metal Stents in Acute ST-Elevation Myocardial Infarction) и EXAMINATION (Everolimus-Eluting Stents Versus Bare-Metal Stents in ST Segment Elevation Myocardial Infarction) также сообщалось о клиническом превосходстве стентов с лекарственным покрытием над голометаллическими стентами в плане более низкой частоты повторного инфаркта, реваскуляризации целевого поражения и тромбоза стента. Эти клинические преимущества сохранялись и при более длительном наблюдении.
3. Определение результата чрескожных коронарных вмешательств.
Результаты ЧКВ определяются с учетом успеха и осложнений при его выполнении, которые зависят как от особенностей самой процедуры, так и от анатомических и клинических факторов. В целом успешность рентгенэндоваскулярного вмешательства на венечных артериях может быть определена с помощью трех критериев: ангиографического успеха, успеха вмешательства и клинического успеха.
Ангиографический успех. Целью ЧКВ является устранение стенозирующего поражения коронарной артерии (стеноза-«мишени»), приводящее к улучшению кровоснабжения миокарда. Международные рекомендации по ведению больных ОИМ с подъемом ST рекомендуют ориентироваться на ангиографические градации степени восстановления коронарного кровотока - TIMI (Thrombolysis in Miocardial Infarction) и перфузии миокарда — MBG (Myocardial Blush Grade).
Ангиографический успех. Целью ЧКВ является устранение стенозирующего поражения коронарной артерии (стеноза-«мишени»), приводящее к улучшению кровоснабжения миокарда. Международные рекомендации по ведению больных ОИМ с подъемом ST рекомендуют ориентироваться на ангиографические градации степени восстановления коронарного кровотока - TIMI (Thrombolysis in Miocardial Infarction) и перфузии миокарда — MBG (Myocardial Blush Grade).
|
Степень кровотока
|
Характеристика
|
|
TIMI-0
|
Отсутствие перфузии — дистальнее места сужения или окклюзии нет антеградного кровотока (отсутствует контрастирование)
|
|
TIMI-I
|
Проникновение без перфузии — контрастное вещество проникает за область сужения, но «смывается» и не может полностью заполнить дистальный сегмент ИСА.
|
|
TIMI-II
|
Слабая перфузия — контрастное вещество проникает за зону сужения и заполняет дистальное русло артерии, однако скорость проникновения и скорость вымывания контраста значительно замедлены по сравнению с аналогичными показателями в кровоснабжаемых нестенозированными сосудами сопоставимых областях миокарда
|
|
TIMI-III
|
Полная перфузия — антеградный кровоток дистальнее стеноза, контрастирование сопоставимо по скорости заполнения и вымывания контрастного вещества сравнимых участков коронарного русла, кровоснабжаемых нестенозированными венечными артериями
|
|
MBG-0
|
отсутствие перфузии миокарда.
|
|
MBG- 1
|
перфузия регистрируется во время введения контраста, но немедленно исчезает после вымывания контраста из ствола коронарной артерии.
|
|
MBG-2
|
перфузия регистрируется во время введения контраста и на протяжении <3 сердечных сокращений после вымывания контраста из ствола коронарной артерии.
|
|
MBG-3
|
перфузия регистрируется во время введения контраста и на протяжении >3 сердечных сокращений после вымывания контраста из ствола коронарной артерий, но успевает исчезнуть до нового введения контрастного вещества.
|
|
MBG-4
|
перфузия отмечается на протяжении достаточно длительного периода времени и не успевает полностью исчезнуть до нового введения контрастного вещества.
|
Успех вмешательства (технический успех). ЧКВ признается удачным при достижении ангиографического успеха при устранении стеноза (-ов)-
«мишени» (-ей) и при отсутствии серьезных клинических осложнений на госпитальном этапе: летального исхода, острого ИМ, экстренной операции АКШ, острого нарушения мозгового кровообращения (ОНМК).
Клинический успех. Клинически успешной в непосредственном периоде наблюдения ЧКВ считается при достижении ангиографического (анатомического) успеха, при успешности процедуры (отсутствии серьезных осложнений) и устранении клинической симптоматики и объективных проявлений ишемии (либо при повышении нагрузочной толерантности как минимум на 2 или более функциональных класса (ФК) по классификации Канадского кардиологического общества — CCS).
4. Подготовка пациентов на ЧКВ.
Информирование пациента и информированное согласие.
Процесс получения информированного согласия требует предельной открытости. Пациент должен получить всю доступную современную информацию в неискаженном виде, включая данные доказательной медицины, а также правовые аспекты выполнения вмешательства. В разговоре с пациентом недопустимо применение непонятных ему терминов. Должны быть детально рассмотрены как непосредственный эффект вмешательства, как показатели риска и эффективности в долгосрочной перспективе, включая такие аспекты, как смертность, отсутствие приступов стенокардии, показатели качества жизни, потенциальная потребность в повторных вмешательствах, меры профилактики, а также неизученные вопросы, касающиеся каждой из стратегий лечения. Рекомендации основаны преимущественно на возможности лечебных вмешательств в предотвращении неблагоприятных событий, включая смерть, однако не меньшее значение следует придавать мнению пациента. Пациенту должна быть предоставлена в письменной форме информация о доказательной базе для проведения вмешательства, в случае необходимости пациент может воспользоваться помощью в процессе принятия решения. Пациенты должны иметь время на осмысление возможных компромиссных решений с учетом оценки результатов предполагаемого вмешательства. Кроме того, пациентам необходимо предоставить достаточно времени для обсуждения результатов обследования с лечащим врачом, а также для консультации с другими специалистами.
Процесс получения информированного согласия требует предельной открытости. Пациент должен получить всю доступную современную информацию в неискаженном виде, включая данные доказательной медицины, а также правовые аспекты выполнения вмешательства. В разговоре с пациентом недопустимо применение непонятных ему терминов. Должны быть детально рассмотрены как непосредственный эффект вмешательства, как показатели риска и эффективности в долгосрочной перспективе, включая такие аспекты, как смертность, отсутствие приступов стенокардии, показатели качества жизни, потенциальная потребность в повторных вмешательствах, меры профилактики, а также неизученные вопросы, касающиеся каждой из стратегий лечения. Рекомендации основаны преимущественно на возможности лечебных вмешательств в предотвращении неблагоприятных событий, включая смерть, однако не меньшее значение следует придавать мнению пациента. Пациенту должна быть предоставлена в письменной форме информация о доказательной базе для проведения вмешательства, в случае необходимости пациент может воспользоваться помощью в процессе принятия решения. Пациенты должны иметь время на осмысление возможных компромиссных решений с учетом оценки результатов предполагаемого вмешательства. Кроме того, пациентам необходимо предоставить достаточно времени для обсуждения результатов обследования с лечащим врачом, а также для консультации с другими специалистами.
Мультидисциплинарные подходы в принятии решений, информирование пациента и сроки выполнения реваскуляризации.
|
|
ОКС
|
|
|
||
|
Шок
|
ИМпST
|
OKCбпST
|
СИБС без показаний к ЧКВ ad hoc по решению Кардиокоманды
|
СИБС с показаниями к ЧКВ ad hoc по решению Кардиокоманды
|
|
|
Мультидисциплинарные подходы в принятии решений
|
Необязательно во время острой фазы. Система вспомогательного кровообращения в соответствии с протоколом Кардиокоманды
|
Необязательно во время острой фазы
|
Необязательно во время острой фазы. После стабилизации — как рекомендуется при СИБС
|
Обязательно
|
Необязательно
|
|
Информирование пациента
|
Устное согласие при свидетелях или согласие семьи, без промедлений
|
Устного согласия при свидетелях может быть достаточно, если только по закону не требуется письменное
|
Письменное информированное согласие; в экстренных случаях достаточно устного согласия при свидетелях
|
Письменное информированное согласие
|
Письменное информированное согласие
|
|
Сроки выполнения реваскуляризации
|
Экстренно: без задержек
|
Экстренно: без задержек
|
Неотложно: в течение 24 ч, если возможно, и не позднее 72 ч
|
У пациентов высокого риска должна быть выполнена в течение 2 нед., в течение 6 нед. для всех остальных пациентов
|
Ad hoc
|
|
Процедура
|
Лучшее доступное вмешательство согласно доказательной медицине или по возможности.
Ad hoc лечение поражения, стадийное лечение не инфаркт- ответственного поражения — на основании алгоритма, принятого в учреждении или согласно решению Кардиокоманды |
Лучшее доступное вмешательство согласно доказательной медицине или по возможности.
Не инфаркт- ответственные поражение — на основании алгоритма, принятого в учреждении или согласно решению Кардиокоманды |
Лучшее доступное вмешательство согласно доказательной медицине или по возможности. Не инфаркт- ответственные поражения — на основании алгоритма, принятого в учреждении или согласно решению Кардиокоманды
|
Планировать наиболее приемлемое Вмешательство, оставляя достаточно времени между диагностической и лечебной процедурами
|
Вмешательство согласно протоколам учреждения, утверждены Кардиокомандой
|
Сокращения: ИМпST — инфаркт миокарда с подъёмом сегмента ST, ОКС — острый коронарный синдром, ОKCбпST — острый коронарный синдром без подъёма сегмента ST, СИБС — стабильная ишемическая болезнь сердца, ЧКВ — чрескожное коронарное вмешательство.
По рекомендациям Европейского общества кардиологов 2023г. [7-9]
|
Рекомендации
|
Класс
|
Уровень
|
|
Рекомендуется, чтобы пациенты перед коронарографией были информированы о преимуществах и рисках процедуры, как и о дальнейших путях лечения после получения данных этой процедуры. [7]
|
I |
C |
|
Рекомендуется, чтобы пациенты были адекватно информированы о кратко-и долгосрочных последствиях и рисках процедуры реваскуляризации, как и о вариантах лечения. Для принятия решения должно быть дано достаточно времени. [7,8,9]
|
I |
C |
ПОКАЗАНИЯ К ПРОВЕДЕНИЮ ЭКСТРЕННОЙ ЧКВ
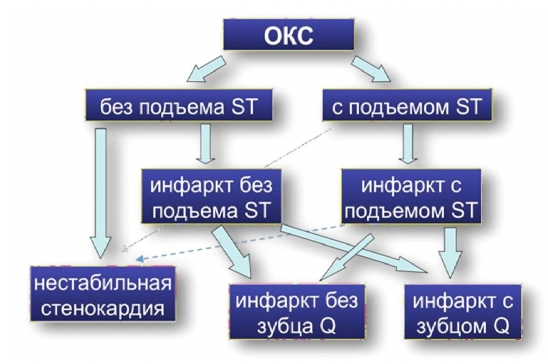
-
Острый инфаркт миокарда с подъемом сегмента ST на ЭКГ (ИМпST) – инфаркт миокарда, при котором в ранние сроки заболевания фиксируются стойкие (длительностью более 20 минут) подъемы сегмента ST как минимум в двух смежных отведениях ЭКГ.
-
Острый инфаркт миокарда без подъема сегмента ST на ЭКГ (ИМбпST) – инфаркт миокарда, при котором в ранние сроки заболевания отсутствуют стойкие (длительностью более 20 минут) подъемы сегмента ST на ЭКГ.
-
Нестабильная стенокардия - недавно возникшая или утяжелившаяся стенокардия, когда тяжесть и продолжительность ишемии недостаточны для развития некроза кардиомиоцитов.
-
Постинфарктная стенокардия – стенокардия, возникшая в первые 2 недели после инфаркта миокарда.
Абсолютных противопоказаний к проведению коронарографии и ЧКВ нет!!!
Имеются относительные противопоказания:
-
Индивидуальная непереносимость рентгенконтрастного вещества (аллергия на применяющиеся в ходе коронарографии медпрепараты).
-
Тяжелые заболевания печени и почек (повышение АЛТ, АСТ в 10 раз выше верхней границы нормы. СКФ <30 мл/мин)
-
Активное желудочно-кишечное, геморроидальное, маточное или иное кровотечение (независимо от этиологии и дислокации, инвазия может усилить кровопотерю, независимо от локализации органа, в котором отмечено кровотечение.
-
Обострение язвенной болезни желудка по результатам ЭГДС;
-
Нарушение свертывающих особенностей крови, тяжелые формы анемии (Hb ниже 90 г/л)
-
ОНМК (в остром периоде, а также ишемический от 3 месяцев, геморрагический от 6 месяцев).
-
Прогрессирующая желудочковая аритмия, злокачественная не корригируемая артериальная гипертензия.
-
Выраженный интоксикационный синдром, гипертермия (лихорадка неизвестной этиологии и острые инфекционные заболевания.
-
Декомпенсированная хроническая сердечная недостаточность.
-
Тяжелый симптоматический электролитный дисбаланс
-
Психические нарушения.
-
Отказ пациента от процедуры.
-
Тяжелые заболевания периферических сосудов, затрудняющие доступ
-
Эндокардит аортального клапана
-
Декомпенсация диабета. Сахар крови выше 20 ммоль/л
-
Тяжелые заболевания щитовидной железы
ЧРЕСКОЖНОЕ КОРОНАРНОЕ ВМЕШАТЕЛЬСТВО (ЧКВ) У БОЛЬНЫХ С ОКСпST.
Стратегии инвазивного лечения чувствительны ко времени. Рекомендуется, чтобы пациенты, отнесенные к группе немедленного инвазивного лечения (с высоким подозрением на продолжающуюся острую окклюзию коронарной артерии [т.е. сохраняющаяся элевация сегмента ST или ее эквиваленты] как можно скорее проходили экстренную ангиографию.
Инфаркт миокарда с подъемом сегмента ST (ИМпST) в большинстве случаев обусловлен тромботической окклюзией крупной коронарной артерии. Незамедлительное восстановление коронарного кровотока - основной метод лечения ИМ, который позволяет уменьшить размер пораженного миокарда, и таким образом улучшить прогноз и качество жизни. Проведение эффективной и своевременной реперфузионной терапии – главная лечебно-организационная задача у этой категории больных.
При ИМ события происходят драматически быстро. После развития тромботической окклюзии крупной коронарной артерии уже через 30 мин начинается гибель кардиомиоцитов. Через 3ч после начала ИМ погибает около 90% миокарда из зоны ишемии, через 6ч – почти 100%. Раннее восстановление коронарного кровотока – краеугольный камень лечения ИМ. Очевидно, что именно время до восстановления коронарного кровотока в ИСА в значительно большей степени определяет выживаемость пациентов, чем собственно метод реперфузии. Для эффективного лечения ИМ крайне важна организация логистики на каждом этапе, где возможна задержка, с целью сокращения времени от начала приступа до проведения реперфузионной терапии. Идеально, чтобы этот промежуток времени не превышал 1 ч. В этом случае эффективность восстановления кровотока максимальна, удается спасти основную часть миокарда из зоны риска. Задержка в своевременном проведении реперфузионной терапии является ключевой проблемой в лечении ИМ.
Инфаркт миокарда с подъемом сегмента ST (ИМпST) в большинстве случаев обусловлен тромботической окклюзией крупной коронарной артерии. Незамедлительное восстановление коронарного кровотока - основной метод лечения ИМ, который позволяет уменьшить размер пораженного миокарда, и таким образом улучшить прогноз и качество жизни. Проведение эффективной и своевременной реперфузионной терапии – главная лечебно-организационная задача у этой категории больных.
При ИМ события происходят драматически быстро. После развития тромботической окклюзии крупной коронарной артерии уже через 30 мин начинается гибель кардиомиоцитов. Через 3ч после начала ИМ погибает около 90% миокарда из зоны ишемии, через 6ч – почти 100%. Раннее восстановление коронарного кровотока – краеугольный камень лечения ИМ. Очевидно, что именно время до восстановления коронарного кровотока в ИСА в значительно большей степени определяет выживаемость пациентов, чем собственно метод реперфузии. Для эффективного лечения ИМ крайне важна организация логистики на каждом этапе, где возможна задержка, с целью сокращения времени от начала приступа до проведения реперфузионной терапии. Идеально, чтобы этот промежуток времени не превышал 1 ч. В этом случае эффективность восстановления кровотока максимальна, удается спасти основную часть миокарда из зоны риска. Задержка в своевременном проведении реперфузионной терапии является ключевой проблемой в лечении ИМ.
Дорожная карта при ОКС с подъемом сегмента ST
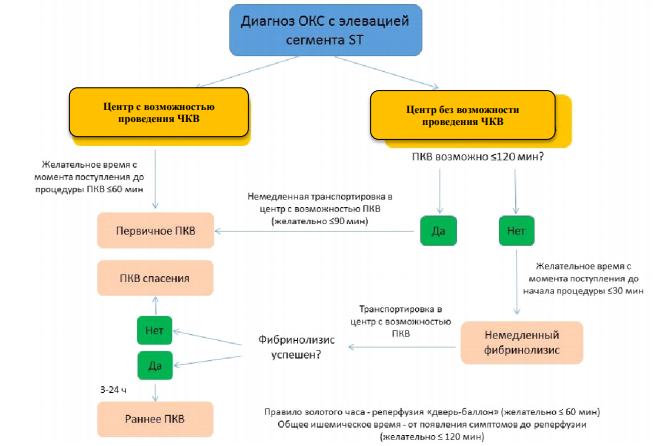
Рисунок 5. Сокращение: ЧКВ-чрескожные коронарные вмешательства;
Целевые временные интервалы реперфузионной стратегии:
|
Интервалы
|
Целевое
время |
|
Максимальное время от ПМК до регистрации ЭКГ и постановки диагноза
|
10 мин
|
|
Максимальное время от момента постановки диагноза ОКСпST до первичного ЧКВ (открытие ИСА), если данный временной промежуток не соблюдается, следует рассматривать проведение тромболитической терапии (ТЛТ)
|
120 мин
|
|
Целевое/оптимальное время от момента постановки диагноза ОКСпST до первичного ЧКВ (открытие ИСА)
|
90 мин
|
|
Максимальное время от момента постановки диагноза ИМпST до открытия ИСА у пациентов, доставленных в ЧКВ-центр
|
60 мин
|
|
Максимальное время от момента постановки диагноза ИМпST до открытия ИСА у пациентов, переведенных в ЧКВ-центр
|
90 мин
|
|
Максимальное время от постановки диагноза ИМпST в неинвазивном центре до перевода в ЧКВ-центр
|
30 мин
|
|
Максимальное время от момента постановки диагноза ИМпST до начала инфузии тромболитика у больных, не подходящих по времени для выполнения пЧКВ
|
10 мин
|
|
Временной интервал от начала тромболизиса до оценки его эффективности (успешный или неуспешный)
|
60-90 мин
|
|
Временной интервал от начала тромболизиса до выполнения КАГ (при успешном тромболизисе)
|
2-24 ч
|
Примечание: интерпретация ЭКГ должна быть выполнена незамедлительно
Первичный медицинский контакт (ПМК) - время первичного контакта на догоспитальном этапе или в стационаре с медицинским работником (врач, фельдшер, медсестра), которые могут зарегистрировать ЭКГ и расшифровать ее.
Вся система оказания помощи больным с ОКСпST на начальном этапе, включая службу скорой помощи и стационары, должна быть направлена на организацию проведения реперфузионной терапии в оптимальные сроки. Следует сосредоточить основное внимание на сокращении общего времени ишемии.
Общее время ишемии можно условно разделить на 5 временных отрезков, организация помощи на каждом из которых имеет свою специфику и самостоятельное значение (Рис. 5).
Вся система оказания помощи больным с ОКСпST на начальном этапе, включая службу скорой помощи и стационары, должна быть направлена на организацию проведения реперфузионной терапии в оптимальные сроки. Следует сосредоточить основное внимание на сокращении общего времени ишемии.
Общее время ишемии можно условно разделить на 5 временных отрезков, организация помощи на каждом из которых имеет свою специфику и самостоятельное значение (Рис. 5).
-
Время от начала ангинозного приступа до вызова СМП. Самая большая задержка происходит именно на этом этапе, который напрямую не связан, а значит не зависит от организации лечебного процесса. Многие больные не осведомлены о клинических проявлениях ИМ и важности экстренного обращения за помощью. Значительное количество больных с ИМ обращаются за помощью после 12ч и даже сутки после начала ИМ, когда восстановление кровотока почти бесполезно.
-
Время от вызова до приезда СМП. Целевое время до приезда СМП, принятое в большинстве крупных городов мира – не более 20 мин. По-видимому, это время можно считать оптимальным как с точки задачи ускорить процесс, так и с точки зрения достижимости. В отделенных населенных пунктах, особенно небольших, это время может быть значительно больше по объективным причинам.
-
Время, необходимое для постановки диагноза бригадой СМП. Этот этап включает сбор анамнеза, жалоб, физикальный осмотр и регистрацию ЭКГ с ее расшифровкой. Согласно последним рекомендациям, это время должно не превышать 10 мин. Если принимается решение о догоспитальной ТЛТ, она должна быть начата немедленно в течение 10 минут.
-
Время транспортировки больного в стационар. Согласно правилам маршрутизации, больные ИМ должны госпитализироваться в специализированные отделения для лечения ИМ. Приоритетом должна быть госпитализация в ЧКВ-центр. Вместе с тем продолжительная транспортировка сопряжена с неоправданно высоким риском. Нужно стремиться, чтобы это время не превышало один час. В городах, в которых находятся инфарктные отделения, реально ставить задачу, чтобы больные были доставлены в течение 10–30 мин.
- Последний этап актуален в случае планирования первичного ЧКВ. От момента подтверждения ОКСпST в стационаре на основании ЭКГ до проведения проводника в инфаркт-связанную артерию в инвазивном центре должно пройти не больше 60 мин. В многочисленных исследованиях показано, что чем короче этот интервал времени, тем лучше прогноз. Наилучшие результаты лечения в случае, если удается выполнить ЧКВ в пределах 30 мин от госпитализации. Для быстрого проведения ЧКВ необходима продуманная организация лечебного процесса, предусматривающая госпитализацию больного непосредственно в палату интенсивной терапии минуя приемное отделение, быструю регистрацию и интерпретацию ЭКГ, готовность круглосуточно работающей ангиографической лаборатории.
-
Острое повреждение (некроз) миокарда – повышение и/или снижение содержания в крови биомаркеров некроза миокарда (предпочтительно сердечного тропонина), которое как минимум однократно превышает 99-й перцентиль значений у здоровых лиц.
-
Инфаркт-связанная артерия (ИСА) – артерия, сужение просвета или окклюзия которой является причиной данного инфаркта миокарда.
1. Концепции восстановления коронарного кровотока.
На сегодняшний день существуют три концепции восстановления коронарного кровотока инфарктзависимой артерии:
-
Медикаментозная - тромболитическая (системное или интракоронарное введение тромболитиков);
-
Рентгенэндоваскулярная - основу ее составляют проводниковая реканализация, транслюминальная баллонная ангиопластика (ТЛБАП) и стентирование;
-
Хирургическая - экстренное аутовенозное или артериальное шунтирование коронарных артерий.
Тромболитическая терапия – способ реперфузионного лечения острого коронарного синдрома со стойкими подъемами сегмента ST на ЭКГ, когда осуществляется медикаментозное восстановление проходимости окклюзированной коронарной с помощью парентерального введения фибринолитического препарата.
Тромболитическая терапия в первые сутки сопряжена с риском развития церебрального кровоизлияния. Пожилой возраст, низкий вес, женский пол, цереброваскулярные заболевания в анамнезе и артериальная гипертензия при поступлении являются важными предикторами внутричерепного кровоизлияния. Частота внутричерепных кровоизлияний составляет 0,9–1,0%. В исследовании STREAM исходный риск внутричерепного кровоизлияния у пациентов старше 75 лет был снижен после коррекции протокола введения тенектеплазы с уменьшением дозы на 50%. Данные ряда исследований свидетельствуют о том, что большие нецеребральные кровотечения имели место у 4–13% пациентов. Чаще всего источник кровотечений — места пункции сосудов, далее следуют желудочно-кишечный тракта и почки. Возможны и забрюшинные кровотечения в паранефральную клетчатку и по ходу подвздошно-поясничной мышцы, особенно при проведении ангиографии доступом через бедренную артерию.
Широко изучался вопрос, при какой максимальной задержке пЧКВ по сравнению с ТЛТ, механическая реваскуляризация сохраняет преимущество. В различных исследованиях время задержки было 60, 110, 120 минут. Данные регистров говорят, что преимущество пЧКВ сохраняется, если время от постановки диагноза до проведения проводника в ИСА не превышает 120 мин. Это относится как к больным, госпитализированным сразу в ЧКВ-центр, так и к больным, госпитализированным в неинвазивный центр.
При ОКСпST проведение пЧКВ безусловно показано в первые 12ч после начала приступа при подтверждении на ЭКГ признаков острой ишемии.
В многоцентровом рандомизированном исследовании OAT (The Occluded Artery Trial) сравнивали стентирование инфаркт-связанной артерии с 3 по 28 сут. от начала ИМ и оптимальную медикаментозную терапию. Оказалось, что рутинное (без специальных показаний) устранение окклюзии инфаркт- связанной артерии не привело к снижению риска летальности и кардиальных осложнений. Результаты длительного наблюдения за этими больными (в среднем, 6 лет) также не выявили пользы от поздней реваскуляризации.
При ОКСпST проведение пЧКВ безусловно показано в первые 12ч после начала приступа при подтверждении на ЭКГ признаков острой ишемии.
В многоцентровом рандомизированном исследовании OAT (The Occluded Artery Trial) сравнивали стентирование инфаркт-связанной артерии с 3 по 28 сут. от начала ИМ и оптимальную медикаментозную терапию. Оказалось, что рутинное (без специальных показаний) устранение окклюзии инфаркт- связанной артерии не привело к снижению риска летальности и кардиальных осложнений. Результаты длительного наблюдения за этими больными (в среднем, 6 лет) также не выявили пользы от поздней реваскуляризации.
Таким образом, пЧКВ, выполненная в оптимальные сроки опытной бригадой, является на сегодняшний день «золотым стандартом» реперфузионной терапии при ОКСпST и имеет ряд преимуществ, по сравнению с тромболитической терапией:
-
Более частое (до 90–95%) и более полное, чем ТЛТ, восстановление кровотока по окклюзированной КА.
-
ЧКВ может быть использовано во многих случаях, когда имеются противопоказания к ТЛТ.
-
Для ЧКВ шире показания, чем для ТЛТ. Даже при отсутствии элеваций сегмента ST, а значит и показаний для проведения ТЛТ, могут выявляться тяжелые изменения в коронарных артериях, вплоть до острой окклюзии.
-
Наряду с восстановлением кровотока при ЧКВ устраняется резидуальный стеноз.
-
При ЧКВ существенно реже наблюдаются геморрагические осложнения.
К основным стратегиям восстановления коронарного кровообращения относятся:
В зависимости от времени проведения вмешательства, лекарственного сопровождения и других обстоятельств выделяют следующие варианты ЧКВ при ОКСпST:
-
Первичное чрескожное коронарное вмешательство (пЧКВ) – способ реперфузионного лечения острого коронарного синдрома со стойкими подъемами сегмента ST на ЭКГ, когда первым мероприятием по восстановлению проходимости коронарной артерии является чрескожное коронарное вмешательство.
-
“Подготовленное” чрескожное коронарное вмешательство – способ реперфузионного лечения острого коронарного синдрома со стойкими подъемами сегмента ST на ЭКГ, при котором вслед за введением полной или половинной дозы фибринолитика, иногда в сочетании с блокатором гликопротеинов IIb/IIIa тромбоцитов, безотлагательно выполняется чрескожное коронарное вмешательство.
-
“Спасительное” (“спасающее”) чрескожное коронарное вмешательство – срочное чрескожное коронарное вмешательство после неуспешной тромболитической терапии.
-
Фармако-инвазивный подход – способ реперфузионного лечения острого коронарного синдрома со стойкими подъемами сегмента ST на ЭКГ, когда в первые сутки после тромболитической терапии выполняется коронарная ангиография и при необходимости ЧКВ (срочно при неуспешной тромболитической терапии или через 2–24 часа от начала тромболизиса при неинвазивных признаках реперфузии миокарда).
По рекомендациям Европейского общества кардиологов 2023г. [10]
|
Рекомендации
|
Класс
|
Уровень
|
|
Реперфузионная терапия показана всем пациентам, у которых время от появления симптомов <12 ч и имеется стойкий подъем сегмента ST.
|
I |
A |
|
В обозначенные сроки первичное ЧКВ более целесообразно по сравнению с фибринолизом
|
I
|
A
|
|
Рекомендуется, чтобы догоспитальное ведение пациентов с ИМпST было основано на региональных сетях, предназначенных для своевременного эффективного обеспечения реперфузионной терапии и для проведения первичного ЧКВ как можно большему числу пациентов.
|
I |
B |
|
Рекомендуется, чтобы во всех отделениях скорой помощи, отделениях неотложной помощи, отделениях кардиореанимации и в рентген- операционных имелся протокол ведения пациентов с ИМпST, предпочтительно одинаковый в рамках одного географического региона.
|
I |
C |
|
Рекомендуется, чтобы медицинские центры с возможностью проведения ЧКВ обеспечивали круглосуточный прием и обеспечивали наиболее быстрое проведение вмешательства.
|
I |
B |
|
Пациентов рекомендуется переводить в центры с возможностью проведения ЧКВ для первичного ЧКВ в обход отделений неотложной помощи и кардиореанимации, и направлять непосредственно в рентген-операционную.
|
I
|
B
|
|
ТЛТ проводится в первые 12ч от начала ИМ при невозможности выполнить пЧКВ в течение 120 мин от постановки диагноза ИМпST.
|
I |
A |
|
Если выбрана стратегия реперфузии с помощью ТЛТ, ее следует проводить незамедлительно, лучше на догоспитальном этапе.
|
I |
A |
|
Предпочтительными являются фибрин- специфические тромболитики (альтеплаза, тенектеплаза, проурокиназа, стафилокиназа)
|
I |
A |
|
При отсутствии подъема сегмента ST первичное ЧКВ показано пациентам с подозрением на продолжающиеся ишемические симптомы, указывающие на ИМ, и наличием как минимум одного из следующих критериев:
|
I |
C |
|
Показано проведение ранней КАГ (в ближайшие 24ч) при полном купировании симптомов и нормализации сегмента ST – спонтанно или после использования нитроглицерина (при условии отсутствия повтора симптомов или новой элевации сегмента ST).
|
I |
C |
|
Пациентам с развитием ИМпST>12 ч показана стратегия первичного ЧКВ при сохранении симптомов ишемии, гемодинамической нестабильности, жизнеугрожающих нарушений ритма
|
I |
C |
|
Рутинная стратегия первичного ЧКВ должна быть рассмотрена у поздно поступивших пациентов – 12-48 ч от начала симптомов ОКСпST
|
IIa |
B |
|
ТЛТ проводится с 12 до 24ч от начала ИМ при сохраняющейся ишемии, большой зоне поражения миокарда, гемодинамической нестабильности.
|
IIa |
B |
2. Междисциплинарное принятие решения (Heart Team — Кардиокоманда).
Кардиокоманда должна быть создана для коллегиального обсуждения и принятия решения о тактике лечения пациента. В основной состав консилиума входят кардиолог, сердечно-сосудистый хирург и интервенционный кардиолог, при необходимости в него могут быть включены также анестезиолог и другие специалисты. Целью создания Кардиокоманды является выработка более сбалансированных, выверенных решений при обсуждении пациента специалистами разного профиля. Кардиокоманда должна созываться на регулярной основе для анализа и интерпретации диагностической информации, установления показаний к реваскуляризации миокарда и оценки эффективности и безопасности хирургических и эндоваскулярных вмешательств по реваскуляризации в краткосрочной и долгосрочной перспективе. Работа Кардиокоманды должна способствовать эффективным клиническим процессам и поддерживать их.
Потребность в междисциплинарном подходе продиктована несколькими причинами:
-
недостаточным использованием реваскуляризации миокарда у 18–40% больных ИБС.
-
необоснованным применением реваскуляризации ввиду недостаточного обсуждения пациента специалистами разного профиля.
Обоснование принятого решения о реваскуляризации в контексте выбора оптимальной лечебной тактики должно быть зафиксировано в истории болезни пациента. Клиники, где нет штатного подразделения сердечно- сосудистой хирургии, должны наладить взаимодействие с каким-либо подобным подразделением другого медицинского центра. Это необходимо для разработки протоколов лечебной тактики и определения ситуаций, когда необходимо обсуждение пациента Кардиокомандой.
По рекомендациям Европейского общества кардиологов 2023г
|
Рекомендации
|
Класс
|
Уровень
|
|
Рекомендуется разрабатывать Кардиокомандой внутренние протоколы стратегий реваскуляризации в соответствии с настоящими рекомендациями
|
I |
C |
|
Рекомендуется в ЧКВ-центрах без кардиохирургии применять протоколы, применяемые в центрах с кардиохирургией
|
I |
C |
Критерии для принятия решения
-
Прогнозируемая хирургическая смертность
-
Анатомические особенности поражения коронарных артерий
-
Возможность выполнения полной реваскуляризации
Принятие решения о предпочтительном методе лечения (консервативное лечение, ЧКВ или КШ) осуществляется при оценке соотношения риск- польза от вмешательства, уточнении рисков развития перипроцедурных осложнений (например, цереброваскулярных событий, потребности в гемотрансфузии, развития почечной недостаточности, нарушений ритма или раневой инфекции), а также изменений качества жизни, долгосрочного прогноза в отношении смертности, вероятности развития ИМ или потребности в повторной реваскуляризации.
3. Шкала SYNTAX.
SYNTAX Score - шкала для оценки тяжести поражения коронарного русла при использовании различных тактик реваскуляризации миокарда у пациентов с многососудистым поражением коронарных артерий. В исследовании SYNTAX под анатомически полной реваскуляризацией понималось выполнение ЧКВ или КШ на всех эпикардиальных коронарных артериях с диаметром ≥1,5 мм и стенозами по диаметру >50% как минимум в одной ангиографической проекции.
Калькулятор SYNTAX Score был разработан для оценки анатомически сложных поражений коронарных артерий у больных со стенозом ствола ЛКА и 3-х сосудистым поражения КА. Подсчет баллов производится в несколько этапов: 1-й этап определение типа коронарного кровоснабжения. На 2-м этапе оцениваются сегментарное поражение коронарных артерий, которые напрямую влияют на суммарный балл, а каждому сегменту КА назначается весовой коэффициент в зависимости от его расположения и составляет от 0,5 (за дистальные сегменты) до 6 (за стеноз ствол ЛКА при левом типе). 3-й – оценка диаметра стеноза, а в случае окклюзии, баллы за ее особенности. 4 и 5-й этапы оценка три- и бифуркационных стенозов. На 6-м балл за аорто-остиальное поражения КА. 7-й – баллы за наличие сильных извитостей КА. 8-10-й баллы – определение длины стеноза, кальцификации и наличия тромбоза. Последний этап – определение наличия диффузно пораженных и суженных сегменты дистальнее стеноза, т.е. не менее 75% длины артерии дистальнее стеноза имеет диаметром сосуд < 2 мм. Суммирование баллов и результат. Калькулятор SYNTAX Score позволил разделить пациентов на 3 группы риска:
Калькулятор SYNTAX Score был разработан для оценки анатомически сложных поражений коронарных артерий у больных со стенозом ствола ЛКА и 3-х сосудистым поражения КА. Подсчет баллов производится в несколько этапов: 1-й этап определение типа коронарного кровоснабжения. На 2-м этапе оцениваются сегментарное поражение коронарных артерий, которые напрямую влияют на суммарный балл, а каждому сегменту КА назначается весовой коэффициент в зависимости от его расположения и составляет от 0,5 (за дистальные сегменты) до 6 (за стеноз ствол ЛКА при левом типе). 3-й – оценка диаметра стеноза, а в случае окклюзии, баллы за ее особенности. 4 и 5-й этапы оценка три- и бифуркационных стенозов. На 6-м балл за аорто-остиальное поражения КА. 7-й – баллы за наличие сильных извитостей КА. 8-10-й баллы – определение длины стеноза, кальцификации и наличия тромбоза. Последний этап – определение наличия диффузно пораженных и суженных сегменты дистальнее стеноза, т.е. не менее 75% длины артерии дистальнее стеноза имеет диаметром сосуд < 2 мм. Суммирование баллов и результат. Калькулятор SYNTAX Score позволил разделить пациентов на 3 группы риска:
-
группу низкого риска с SYNTAX Score=0-22 баллов,
-
группу промежуточного риска SYNTAX Score=23-32 баллов,
-
группу высокого риска SYNTAX Score>32 баллов.
Рисунок 6. Схема деления коронарных артерий (КА) на сегментыв соответствии с классифицирующей системой SYNTAX.
КОРОНАРНОЕ ШУНТИРОВАНИЕ.
Коронарное шунтирование – это наложение обходного анастомоза, позволяющего улучшить кровоток дистальнее гемодинамически значимого стеноза в коронарной артерии. В зависимости от методики включает аортокоронарное, маммарокоронарное и другие виды шунтирования.
Рисунок 7.
Несмотря на многообещающие результаты первых исследований, к настоящему времени открытый хирургический подход в лечении ОИМ достоверно не получил должной оценки в мультицентровых рандомизированных исследованиях. При отборе пациентов для аортокоронарного шунтирования при ОИМ трудно производить рандомизацию, так как временные возможности оперативного лечения не отвечают требованиям ранней реперфузии. Однако у небольшой части больных с ОИМ невозможно применить рентгенэндоваскулярные методы лечения, а проводимая медикаментозная терапия, как правило, оказывается неэффективной. Аортокоронарное шунтирование сохраняет роль в лечении ОИМ после неудачного тромболизиса или ЧКВ, при кальцинированном поражении ствола ЛКА, диффузном и многососудистом поражении коронарных артерий, механических дефектах и клапанной патологии вследствие инфаркта миокарда.
Аортокоронарное шунтирование позволяет адекватно достичь реваскуляризации и сохранить миокард. Однако ситуацию осложняет вопрос выбора времени для оптимального выполнения хирургической реваскуляризации миокарда у больных с ОИМ. Раннее хирургическое вмешательство несет в себе риск повышенной летальности, развития сердечной недостаточности и кровотечений в послеоперационном периоде. В то же время, как показывает динамика летальности, неоправданная задержка увеличивает количество больных, умерших на этапе ожидания операции.
Противоречие между необходимостью в экстренной реваскуляризации, с одной стороны, и оптимальностью выполнения аортокоронарного шунтирования в период «стабилизации» больного, с другой стороны, оказалось трагичным для хирургической реваскуляризации миокарда. В исследовании VANQW1SH была обнаружена высокая (до 44%) периоперационная смертность при проведении экстренной хирургической реваскуляризации миокарда в ранний период проявления признаков инфаркта. Сопоставимые данные опубликованы Braxton и соавт.: летальность у больных, подвергшихся коронарному шунтированию в период 48 ч от момента развития Q-волнового инфаркта миокарда, осложненного ранней постинфарктной стенокардией, превысила 50%. Последующий мультивариантный анализ определил, что операция, выполненная в первые 48 ч от начала инфаркта миокарда, является независимым предиктором летальности. Таким образом, к середине 1980-х годов утвердилась концепция, в соответствии с которой операция аортокоронарного шунтирования (АКШ) не показана в острой фазе трансмурального неосложненного инфаркта миокарда. Экстренные вмешательства стали выполнять только при развитии жизнеугрожающих осложнений, но они сопровождались очень высокой госпитальной летальностью.
Противоречие между необходимостью в экстренной реваскуляризации, с одной стороны, и оптимальностью выполнения аортокоронарного шунтирования в период «стабилизации» больного, с другой стороны, оказалось трагичным для хирургической реваскуляризации миокарда. В исследовании VANQW1SH была обнаружена высокая (до 44%) периоперационная смертность при проведении экстренной хирургической реваскуляризации миокарда в ранний период проявления признаков инфаркта. Сопоставимые данные опубликованы Braxton и соавт.: летальность у больных, подвергшихся коронарному шунтированию в период 48 ч от момента развития Q-волнового инфаркта миокарда, осложненного ранней постинфарктной стенокардией, превысила 50%. Последующий мультивариантный анализ определил, что операция, выполненная в первые 48 ч от начала инфаркта миокарда, является независимым предиктором летальности. Таким образом, к середине 1980-х годов утвердилась концепция, в соответствии с которой операция аортокоронарного шунтирования (АКШ) не показана в острой фазе трансмурального неосложненного инфаркта миокарда. Экстренные вмешательства стали выполнять только при развитии жизнеугрожающих осложнений, но они сопровождались очень высокой госпитальной летальностью.
Многососудистое поражение коронарного русла.
На сегодняшний день установлено преимущество операции КШ над ЧКВ в плане снижения смертности у больных с трёхсосудистым поражением (промежуточно высоким индексом по шкале SYNTAX). Преимущество операции КШ заключается в отсутствии влияния проксимальных стенозов (выше сформированного шунто-коронарного анастомоза) на эффективность реваскуляризации.
Прогнозируемая хирургическая смертность.
Для оценки прогнозируемой хирургической смертности разработаны шкалы EuroSCORE II (European System for Cardiac Operative Risk Evaluation), www HYPERLINK"http://www.euroscore.org/calc.htm","http://www.euroscore.org/calc
.htm"htm и STS (Society of Thoracic Surgeons score, http HYPERLINK "http://riskcalc/":// HYPERLINK "http://riskcalc/"riskcalc), при помощи которых рассчитывают риск внутригоспитальной или 30-дневной летальности на основе клинических показателей. Обе приведенные системы оценки риска показали свою валидность при оценке различных когорт пациентов, которым выполняется операция КШ. Регулярно проводится калибровка шкалы STS. Существует мнение, что шкала STS превосходит шкалу EuroSCORE II при прямом сравнении пациентов с операцией КШ, однако, по другим данным, обе шкалы демонстрируют сопоставимую прогностическую ценность. На сегодняшний день не установлены контрольные значения для предсказания низкой хирургической смертности при оценке по шкалам STS и EuroSCORE II. Таким образом, необходима индивидуальная оценка тактика лечения каждого пациента примерно в два раза. Ограничениями при использовании различных моделей риска являются: 1) применение специальных определений или использованная методология; 2) отсутствие таких важных переменных, как “хрупкость”; 3) возможность выполнения вычислений; 4) неспособность учесть все случаи заболеваемости и смертности; 5) ограниченные возможности внешней валидации. Тактика лечения пациента не может целиком основываться на указанных шкалах риска. Данные шкалы могут использоваться только как информационный материал при обсуждении пациента Кардиокомандой.
.htm"htm и STS (Society of Thoracic Surgeons score, http HYPERLINK "http://riskcalc/":// HYPERLINK "http://riskcalc/"riskcalc), при помощи которых рассчитывают риск внутригоспитальной или 30-дневной летальности на основе клинических показателей. Обе приведенные системы оценки риска показали свою валидность при оценке различных когорт пациентов, которым выполняется операция КШ. Регулярно проводится калибровка шкалы STS. Существует мнение, что шкала STS превосходит шкалу EuroSCORE II при прямом сравнении пациентов с операцией КШ, однако, по другим данным, обе шкалы демонстрируют сопоставимую прогностическую ценность. На сегодняшний день не установлены контрольные значения для предсказания низкой хирургической смертности при оценке по шкалам STS и EuroSCORE II. Таким образом, необходима индивидуальная оценка тактика лечения каждого пациента примерно в два раза. Ограничениями при использовании различных моделей риска являются: 1) применение специальных определений или использованная методология; 2) отсутствие таких важных переменных, как “хрупкость”; 3) возможность выполнения вычислений; 4) неспособность учесть все случаи заболеваемости и смертности; 5) ограниченные возможности внешней валидации. Тактика лечения пациента не может целиком основываться на указанных шкалах риска. Данные шкалы могут использоваться только как информационный материал при обсуждении пациента Кардиокомандой.
По рекомендациям Европейского общества кардиологов 2023г.
|
Рекомендации
|
Класс
|
Уровень
|
|
Рекомендуется использовать шкалу STS для оценки внутрибольничной или 30- дневной смертности и внутрибольничной заболеваемости после КШ.
|
I |
B |
|
Использование шкалы EuroSCORE II может быть рекомендовано для оценки госпитальной смертности после КШ.
|
IIb |
B |
|
При рассмотрении выбора между КШ и ЧКВ должна быть приоритетной полнота реваскуляризации.
|
IIa
|
В
|
По рекомендациям Европейского общества кардиологов 2023г.
|
Рекомендации
|
Класс
|
Уровень
|
|
С целью снижения риска смерти при ИМпST неотложное КШ рекомендуется у пациентов с невозможностью выполнения ЧКВ, но имеющих кардиогенный шок или тяжелую сердечную недостаточность.
|
IIa |
B |
|
С целью снижения риска смерти неотложное КШ рекомендуется у пациентов с ИМпST с невозможностью выполнения ЧКВ или с безуспешной ЧКВ, имеющих продолжающуюся или рецидивирующую ишемию миокарда.
|
IIb |
C |
|
С целью снижения риска смерти при ИМпST КШ рекомендуется у пациентов, подвергнутых кардиохирургическим операциям в связи с механическим осложнениями ИМ, такими как разрыв межжелудочковой перегородки, отрыв или стойкая дисфункция папиллярной мышцы, наружный разрыв миокарда желудочков.
|
IIa |
C |
|
С целью снижения риска смерти и рецидива ИМ при ИМпST КШ рекомендуется при осложнениях ЧКВ, а именно при неудачном раскрытии стента, переломе стента или при рецидивирующем остром тромбозе в месте вмешательства. КШ рекомендуется и при расслоении или перфорации коронарной артерии, если осложнение не удается устранить применением эндоваскулярных методик.
|
IIb
|
С
|
Комментарий: за исключением явно неотложных случаев (с продолжающейся ишемией миокарда, шоком, механическими осложнениями ИМ), ясности со сроками выполнения КШ при ИMпST нет. Сроки отчасти определяются необходимостью обеспечить геморрагическую безопасность вмешательства, выждав 3–7 дней после отмены блокатора P2Y12-рецепторов тромбоцитов (АТХ-группа - антиагреганты, кроме гепарина) (тикагрелор**следует отменить как минимум за 3-5 дней, клопидогрел** - как минимум за 5 дней, прасугрел - как минимум за 7 дней до планового хирургического вмешательства). У отдельных стабильных пациентов с ИМпST после успешного первичного ЧКВ (с высоким индексом SYNTAX, сахарным диабетом, низкой фракцией выброса левого желудочка) следует рассматривать КШ как вариант отсроченной полной реваскуляризации при многососудистом поражении. При обсуждении вариантов КШ в каждом конкретном случае следует иметь в виду использование доступного вспомогательного кровообращения (до, во время и после операции) и выбор щадящих методик самой операции (например, КШ без подключения аппарата искусственного кровообращения).
Инвазивная стратегия при инфаркте миокарда с элевацией ST в поздние сроки.
Если у пациентов, поступивших в течение 12 ч от начала симптомов, рутинная немедленная ангиография и ЧКВ (при наличии показаний) однозначно ассоциируются с клинической пользой, то ценность рутинной стратегии пЧКВ у пациентов с ОИМпST, поступивших позднее 12 ч от начала симптомов, менее обоснована. В небольшом РКИ у 347 пациентов с ОИМпST, поступивших через 12-48 ч после начала симптомов и не имевших стойких симптомов, было показано, что рутинная стратегия пЧКВ улучшает спасение миокарда и долгосрочную выживаемость по сравнению с консервативным лечением. Это наблюдение подтверждается недавним анализом данных трех общенациональных обсервационных исследований в рамках программы FAST-MI (French Registry of Acute ST-elevation and non-ST-elevation Myocardial Infarction), который показал значительное снижение частоты смерти от всех причин через 1 месяц (2,1% против 7,2%) и после наблюдения через 8 месяцев (30,4% против 78,7%) при использовании вазоактивной стратегии по сравнению с консервативным лечением [11]. Однако у стабильных пациентов с сохраняющейся окклюзией ИСА через 3-28 дней после ИМ в крупном (n = 2166) исследовании Occluded Artery Trial (OAT) было отмечено отсутствие клинической пользы от планового коронарного вмешательства с медикаментозным лечением по сравнению только с медикаментозным лечением. Метаанализ исследований, в которых изучалась польза поздней реканализации окклюзированной ИСА, также не выявил пользы от реперфузии. Таким образом, рутинное ЧКВ окклюзированной ИСА у пациентов с ОКСпST, поступивших через >48 ч после начала симптомов и не имеющих стойких симптомов, не показан. Ведение таких пациентов должно осуществляться так же, как и пациентов с хронической тотальной окклюзией, в соответствии с рекомендациями ESC по диагностике и лечению хронических коронарных синдромов (ХКС) [12].
АНТИТРОМБОЦИТАРНАЯ И АНТИКОАГУЛЯНТНАЯ ТЕРАПИЯ перед пЧКВ.
Тромбоциты играют ключевую роль в инициации и нарастании коронарного тромбоза. Поэтому лекарства, подавляющие функцию тромбоцитов, т.к. антиагреганты или антитромбоцитарные препараты являются важнейшей составляющей в патогенетической терапии ОКС. Антитромбоцитарные препараты эффективны в отношении ишемических событий как в остром периоде, так и при вторичной профилактике атеротромботических эпизодов. По меньшей мере три класса антиагрегантов доказали свою эффективность у больных ОКС. К ним относятся ацетилсалициловая кислота (АСК), ингибиторы Р2Y12 рецепторов тромбоцитов и блокаторы гликопротеиновых рецепторов IIb/IIIa.
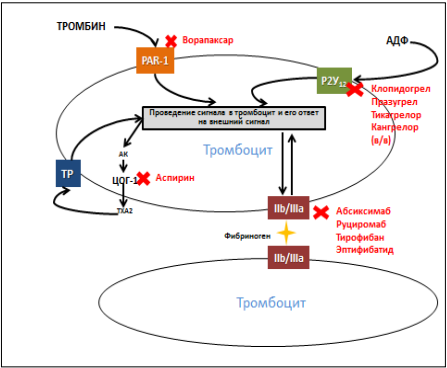
Рисунок 8. Механизмы действия антитромбоцитарных препаратов. Сокращения: АК – арахидоновая кислота; PAR-1 – рецептор, активируемый протеазами 1 типа; ТР – рецептор к тромбоксану; Р2Y12 – рецептор к АДФ (аденозиндифосфату); IIb/IIIa – гликопротеиновые рецепторы IIb/IIIa.
1. Ацетилсалициловая кислота (АСК).
Механизм действия: необратимо ингибирует циклооксигеназу 1 типа, что приводит к уменьшению синтеза тромбоксана А2 в тромбоцитах, уменьшение его образования в свою очередь снижает активацию тромбоцитов (рис. 8). АСК необратимо действует на тромбоциты, поэтому ее эффект сохраняется на протяжении всего периода жизни этих клеток (около 7 дней). Эффективность АСК у больных ИМ, подвергшихся ТЛТ, подтверждена на основании результатов исследования ISIS-2 в 1988 г. У больных, принимавших АСК в дозе 160 мг/сут и получивших ТЛТ стрептокиназой, риск летального исхода снизился на 23%. Польза от назначения АСК в комбинации ингибиторами P2Y12 рецепторов тромбоцитов по сравнению с монотерапией ингибиторами P2Y12 рецепторов тромбоцитов не доказана. Проводятся исследования.
На сегодняшний день рекомендовано назначать АСК при отсутствии противопоказаний всем больным ОКСпST независимо от тактики лечения (первичная ЧКВ, ТЛТ или отсутствие реперфузионной терапии).
Дозировка: Пероральная нагрузочная доза — 150—300 мг (или 150 мг внутривенно), поддерживающая доза — 75—100 мг в сутки. При отсутствии регулярного приема АСК в предшествующие несколько суток начальная доза составляет 150–300 мг действующего вещества (для ускорения всасывания таблетку предпочтительно, разжевать). Стартовой терапии АСК с использованием покрытых и кишечнорастворимых форм следует избегать.
Дозировка: Пероральная нагрузочная доза — 150—300 мг (или 150 мг внутривенно), поддерживающая доза — 75—100 мг в сутки. При отсутствии регулярного приема АСК в предшествующие несколько суток начальная доза составляет 150–300 мг действующего вещества (для ускорения всасывания таблетку предпочтительно, разжевать). Стартовой терапии АСК с использованием покрытых и кишечнорастворимых форм следует избегать.
2. Ингибиторы P2Y12 рецепторов тромбоцитов.
К этому классу препаратов относятся обратимые и необратимые блокаторы рецепторов тромбоцитов к АДФ. Среди них известны три производных тиенопиридина (не используемый в настоящее время тиклопидин, клопидогрел и прасугрел). Все они являются пролекарствами и должны пройти превращение в печени с помощью изоферментов цитохрома Р450 до образования короткоживущих активных метаболитов, которые необратимо модифицируют АДФ рецептор тромбоцитов. Тромбоциты, подвергнутые действию тиенопиридинов (также, как и действию АСК), не могут восстановить свою функцию на протяжении всего периода жизни (около 7 дней). Тикагрелор и кангрелор являются прямыми, обратимыми блокаторами Р2Y12 рецепторов, им не требуется метаболическая активация, а их антитромбоцитарный эффект напрямую зависит от присутствия препарата в кровотоке.
Фармакодинамика блокаторов Р2Y12-рецепторов:
|
Параметр
|
Клопидогрел
|
Прасугрел
|
Тикагрелор
|
|
Класс
|
Тиенопиридин
|
Тиенопиридин
|
Триазолопиримидин
|
|
Обратимость действия
|
Необратимое
|
Необратимое
|
Обратимое
|
|
Активность
|
Пролекарство активность ограничивается метаболизмом
|
Пролекарство, активность не ограничивается
метаболизмом |
Активный препарат
|
|
Начало действия*
|
2-6 ч
|
30 мин
|
30 мин
|
|
Длительность действия
|
3-10 сут
|
7-10 сут
|
3-5 сут
|
|
Отмена перед операцией
|
5 сут
|
7 сут
|
5 сут
|
Примечание. * Ингибирование агрегации тромбоцитов на 50%.
КЛОПИДОГРЕЛ.
Механизм действия: Клопидогрел является тиенопиридином второго поколения и представляет собой неактивное пролекарство, которое превращается в печени с помощью изоферментов цитохрома Р450 в активный метаболит. Установлено, что до 85% пролекарства гидролизуется эстеразами в неактивную форму, а оставшиеся 15% превращаются в активный метаболит, который селективно и необратимо инактивирует Р2Y12 рецептор и тем самым ингибирует АДФ-вызванную агрегацию тромбоцитов. Фармакодинамические и фармакокинетические исследования обнаружили межиндивидуальные различия в реакции на клопидогрел, связанные, прежде всего, с генетически детерминированной скоростью образования активного метаболита. Имеются доказательства того, что снижение чувствительности к клопидогрелу, определенное с помощью генотипирования или оценки остаточной реактивности тромбоцитов, может ассоциироваться с увеличением риска ишемических событий, главным образом - тромбозов стента после неотложных ЧКВ.
В исследовании CLARITY-TIMI 28 , включившем 3491 больных ИМ моложе 75 лет, подвергнутых тромботической терапии, кратковременное добавление клопидогрела (нагрузочная доза 300 мг, затем 75 мг/сут до 8 дней или до выписки из стационара), к аспирину снижало суммарную частоту случаев окклюзий инфаркт-связанной артерии, смертей и повторных ИМ на 36%. В крупном исследовании COMMIT (n= 45,852) включение клопидогрела в схему консервативного лечения ИМ на срок до 4 недель снижало суммарную частоту ишемических исходов на 9%. Клопидогрел не изучался в сравнении с плацебо у больных, подвергаемых первичной ЧКВ. Известно, однако, что при неотложных вмешательствах более высокие дозы клопидогрела (нагрузочная 600 мг/ поддерживающая 150 мг в течение недели) ассоциируются с меньшей частотой ишемических событий в сравнении с режимом приема препарата 300 мг / 75 мг в сут.
Механизм действия: Клопидогрел является тиенопиридином второго поколения и представляет собой неактивное пролекарство, которое превращается в печени с помощью изоферментов цитохрома Р450 в активный метаболит. Установлено, что до 85% пролекарства гидролизуется эстеразами в неактивную форму, а оставшиеся 15% превращаются в активный метаболит, который селективно и необратимо инактивирует Р2Y12 рецептор и тем самым ингибирует АДФ-вызванную агрегацию тромбоцитов. Фармакодинамические и фармакокинетические исследования обнаружили межиндивидуальные различия в реакции на клопидогрел, связанные, прежде всего, с генетически детерминированной скоростью образования активного метаболита. Имеются доказательства того, что снижение чувствительности к клопидогрелу, определенное с помощью генотипирования или оценки остаточной реактивности тромбоцитов, может ассоциироваться с увеличением риска ишемических событий, главным образом - тромбозов стента после неотложных ЧКВ.
В исследовании CLARITY-TIMI 28 , включившем 3491 больных ИМ моложе 75 лет, подвергнутых тромботической терапии, кратковременное добавление клопидогрела (нагрузочная доза 300 мг, затем 75 мг/сут до 8 дней или до выписки из стационара), к аспирину снижало суммарную частоту случаев окклюзий инфаркт-связанной артерии, смертей и повторных ИМ на 36%. В крупном исследовании COMMIT (n= 45,852) включение клопидогрела в схему консервативного лечения ИМ на срок до 4 недель снижало суммарную частоту ишемических исходов на 9%. Клопидогрел не изучался в сравнении с плацебо у больных, подвергаемых первичной ЧКВ. Известно, однако, что при неотложных вмешательствах более высокие дозы клопидогрела (нагрузочная 600 мг/ поддерживающая 150 мг в течение недели) ассоциируются с меньшей частотой ишемических событий в сравнении с режимом приема препарата 300 мг / 75 мг в сут.
Дозировка: нагрузочная доза 300–600 мг, поддерживающая – 75 мг 1 раз в сутки.
Комментарий:
-
формально у клопидогрела** нет доказательств его эффективности на уровне сравнения с плацебо или другим блокатором P2Y12- рецепторов тромбоцитов при первичном ЧКВ. Он используется по этому показанию задолго до конкурентов из-за экстраполяции результатов его оценки при ЧКВ у других категорий пациентов (ОКСбпST, стабильные формы ИБС).
-
При одновременном применении АСК** и клопидогрела** перед операцией КШ и другими крупными хирургическими вмешательствами клопидогрел** следует отменить за 5¬7 суток, кроме случаев, когда опасность последствий отказа от срочного вмешательства превосходит ожидаемые последствия возможного кровотечения.
-
Формально предпочтителен клопидогрел** из-за наличия данных о его сравнении с АСК** при других состояниях и из-за возможности сочетать его с низкой дозой ривароксабана** (после отмены парентерального антикоагулянта).
-
Что же изменилось за последние годы в этих схемах фармакотерапии? Прежде всего, специалисты обратили внимание на недостатки клопидогрела. Нагрузочная доза (600 мг) данного препарата начинает адекватно воздействовать на тромбоциты только через 2–4 ч после приема. Кроме того, клопидогрел метаболизируется в печени с помощью системы цитохрома Р450, что делает его восприимчивым к генетическому полиморфизму (некоторые пациенты абсолютно не реагируют на данный препарат), а также способствует взаимодействию с другими лекарствами, с потенциальным ослаблением антитромбоцитарного эффекта.
Для изменения данной ситуации были разработаны более мощные антиагрегантные средства.
ПРАСУГРЕЛ.
Механизм действия: Прасугрел представляет собой тиенопиридин третьего поколения, который также, как клопидогрел необратимо блокирует Р2Y12 рецепторы тромбоцитов и является пролекарством, но с более быстрым превращением в печени, что обеспечивает более быстрый и сильный антитромбоцитарный эффект. Прасугрел начинает активно влиять на агрегацию тромбоцитов уже через 15—30 мин после введения. В исследовании TRITON-TIMI- 38 прасугрел (насыщающая доза 60 мг, поддерживающая – 10 мг) сравнивался с клопидогрелом (300мг / 75мг) у больных ОКС, подвергаемых неотложным ЧКВ.
Также отмечаются более сильный эффект данного препарата по сравнению с клопидогрелом и простая (одноступенчатая) схема метаболизма в печени, что уменьшает вероятность взаимодействия с другими лекарствами. Продолжительность лечения в сравниваемых группах составила 15 месяцев. Прасугрел продемонстрировал преимущество перед клопидогрелом в отношении суммарной частоты ишемических событий (сосудистая смерть, нефатальный ИМ и инсульт) - 9,3% и 11,2%, в основном за счет меньшей частоты ИМ. Однако, частота крупных, жизненно-опасных и смертельных кровотечений оказалась существенно выше. В целом, соотношение частоты ишемических событий и кровотечений оказалось в пользу прасугрела для большинства больных за исключением лиц старше 75 лет, с массой тела ниже 60 кг, а также перенесших инсульт или транзиторную ишемическую атаку.
Дозировка: Нагрузочная доза — 60 мг, поддерживающая — 10 мг в сутки.
Комментарий:
-
безопасность перехода на прием прасугрела у пациентов, уже получивших клопидогрел**, изучена недостаточно. Лечение прасугрелом не исключает применение блокаторов ГПР IIb/IIIa при выполнении ЧКВ. При одновременном применении АСК** и прасугрела перед операцией КШ и перед другими крупными хирургическими вмешательствами прасугрел следует отменить за 7 суток, кроме случаев, когда опасность последствий отказа от срочного вмешательства превосходит ожидаемые последствия возможного кровотечения.
-
На основании результатов исследования TRITON-TIM 1–38 прасугрел рекомендуется пациентам с тромбозом стента на фоне приема клопидогрела и противопоказан у пациентов с перенесенным нарушением мозгового кровообращения или транзиторной ишемической атакой. Прасугрел не должен назначаться пациентам старше 75 лет, пациентам с низкой массой тела (<60 кг) вследствие повышения риска геморрагических осложнений. Относительным противопоказанием является средне- выраженная дисфункция печени. Если он все же назначен, в этой группе поддерживающая доза должна быть уменьшена до 5 мг в сутки.
ТИКАГРЕЛОР.
Механизм действия: Тикагрелор – пероральный обратимый ингибитор Р2Y12 рецепторов тромбоцитов с периодом полувыведения в плазме до 12 часов. Помимо вышеописанного механизма тикагрелор ингибирует обратный захват аденозина клетками.
В исследовании PLATO тикагрелор сравнивался с клопидогрелом у больных ОКС. В исследование вошли больные ОКСбпST средневысокого риска, которые могли лечиться как инвазивно, так и консервативно, а также больные ОКСпST, подвергаемые первичной ЧКВ. Предшествующий прием клопидогрела не являлся критерием исключения. Насыщающие и поддерживающие дозы тикагрелора и клопидогрела составляли соответственно 180 мг /90 мг 2 раза в сутки и 300 мг / 75 мг 1 раз в сутки. Кроме того, при выполнении ЧКВ в группе клопидогрела допускался дополнительный прием 300 мг препарата до общей насыщающей дозы 600 мг. Медиана наблюдения составила 9 месяцев. Суммарная частота сосудистой смерти, ИМ и инсульта была ниже на фоне приема тикагрелора в сравнении с клопидогрелом: 9,8% и 11,7%. Было также обнаружено снижение случаев смерти от любых причин: 4,0% и 5,1%. Преимущества тикагрелора перед клопидогрелом сохранялись вне зависимости от исходного диагноза и стратегии лечения.
Крупных, не связанных с операцией коронарного шунтирования (КШ) кровотечений, оказалось больше в группе тикагрелора, чем в группе клопидогрела (4,5% и 3,8%), но разницы в частоте угрожающих жизни и
фатальных кровотечений в сравниваемых группах не было. Помимо увеличения частоты не связанных с КШ кровотечений в группе тикагрелора чаще отмечались следующие побочные эффекты: одышка (без признаков бронхоспазма), брадикардия и повышение уровня мочевой кислоты и креатинина.
Дозировка. Нагрузочная доза 180 мг, поддерживающая доза 90 мг дважды в сутки, рекомендуется назначать тикагрелор пациентам со сниженной скоростью клубочковой фильтрации (СКФ) менее 15 мл/мин/1,73 м2.
Дозировка. Нагрузочная доза 180 мг, поддерживающая доза 90 мг дважды в сутки, рекомендуется назначать тикагрелор пациентам со сниженной скоростью клубочковой фильтрации (СКФ) менее 15 мл/мин/1,73 м2.
Комментарий:
-
переход на прием тикагрелора**, начиная с нагрузочной дозы, возможен у пациентов, уже получивших клопидогрел**, в том числе в нагрузочной дозе. Лечение тикагрелором** не исключает применение блокаторов GP IIb/IIIa при выполнении ЧКВ. При одновременном применении АСК** и тикагрелора** перед операцией КШ и перед другими крупными хирургическими вмешательствами тикагрелор** следует отменить за 3 суток, кроме случаев, когда опасность последствий отказа от срочного КШ превосходит ожидаемые последствия возможного кровотечения.
-
Противопоказаниями к назначению тикагрелора являются перенесенный геморрагический инсульт или дисфункция печени средней или тяжелой степени.
-
Отсутствуют данные об эффективности и безопасности раннего начала лечения либо назначения тикагрелора непосредственно перед вмешательством.
По рекомендациям Европейского общества кардиологов 2023г.
|
Рекомендации
|
Класс
|
Уровень
|
|
АСК рекомендуется всем больным, которым проводится ЧКВ.
|
I
|
A
|
|
АСК (per os или внутривенно при невозможности глотания) должна быть назначена как можно быстрее всем больным с подозрением на ОКСпST при отсутствии противопоказаний
|
I |
B |
|
Блокатор P2Y12 в дополнение к АСК рекомендуется назначить перед или самое позднее во время ЧКВ
|
I |
A |
|
Прасугрел рекомендован пациентам, не принимающим ингибиторы рецепторов P2Y12, для проведения PCI (60 мг нагрузочная доза, 10 мг поддерживающая доза, 5 мг поддержив. доза для пациентов в возрасте ≥75 лет или с массой тела <60 кг. [13,14]
|
I |
B |
|
Тикагрелор рекомендуется независимо от стратегии лечения (инвазивной или консервативной) (180 мг нагрузочная доза, 90 мг поддержив.доза). [13,14]
|
I |
B |
|
Клопидогрель (300-600 мг в сутки, 75 мг в сутки) рекомендуется в тех случаях, когда прасугрель или тикагрелор недоступны, плохо переносятся или противопоказаны.
|
I
|
C
|
|
Если пациенты, перенесшие ОКС, прекращают ДАТТ для проведения АКШ, рекомендуется возобновить ДАТТ после операции не менее чем на 12 месяцев.
|
I |
C |
|
Прасугрел должен рассматриваться в качестве альтернативы тикагрелору у пациентов с ОКС, которым предстоит ЧКВ [13,14].
|
IIa |
B |
|
Антагонисты рецепторов GP IIb/IIIa должны рассматриваться при наличии признаков отсутствия кровотока или тромботических осложнений во время ЧКВ.
|
IIa |
C |
|
У пожилых пациентов с ОКС, особенно при наличии высокого риска кровотечений, можно рассмотреть возможность применения клопидогреля в качестве ингибитора рецепторов P2Y12. [15].
|
IIb |
B |
|
Мощные пероральные ингибиторы P2Y12 рецепторов (прасугрел и тикагрелор) или если они недоступны или противопоказаны, то клопидогрел рекомендуется назначить до (или самое позднее во время) ЧКВ.
|
I |
A |
|
При планируемом первичном ЧКВ у пациента с ИMпST для снижения суммарного риска смерти, ИМ и инсульта (по сравнению с использованием клопидогрела**) при отсутствии противопоказаний (внутричерепное кровоизлияние в рошлом, продолжающееся кровотечение) в дополнение к АСК** рекомендуется тикагрелор**, назначенный перед или во время ЧКВ.
|
I |
B |
|
При планируемом первичном ЧКВ у пациента с ИМпST для снижения суммарного риска смерти, ИМ и инсульта (по сравнению с использованием клопидогрела**) при отсутствии противопоказаний (любое нарушение мозгового кровообращения в прошлом, продолжающееся кровотечение) в дополнение к АСК** рекомендуется прасугрел, назначенный перед или во время ЧКВ.
|
I |
B |
|
При планируемом первичном ЧКВ для снижения суммарного риска ишемических событий при отсутствии противопоказаний (продолжающееся кровотечение) в дополнение к АСК** рекомендован и клопидогрел**, с назначением его перед или во время ЧКВ. Основные кандидаты на лечение клопидогрелом** - пациенты, нуждающиеся в длительном приеме антикоагулянтов, и те, у кого по каким-то причинам невозможно лечение тикагрелором** или прасугрелом.
|
IIa |
C |
|
При планируемом первичном ЧКВ у пациентов с ИМпST для снижения риска тромботических осложнений любой из трех доступных блокаторов P2Y12 рецепторов тромбоцитов (клопидогрел**, #прасугрел или #тикагрелор**) (АТХ- группа - антиагреганты, кроме гепарина) в виде антитромбоцитарной монотерапии рекомендован вместо АСК**, когда ее применение невозможно из-за аллергии и других угрожающих жизни или плохо переносимых побочных эффектов.
|
IIa |
C |
3. Ингибиторы гликопротеиновых рецепторов IIB/IIIA.
Механизм действия:
Механизм действия:
Блокируют ключевой механизм агрегации тромбоцитов, а именно склеивание посредством связывания молекул фибриногена с активированными IIb/IIIa рецепторами тромбоцитов. Ингибиторы IIb/IIIa рецепторов преимущественно были изучены до появления клопидогрела, тикагрелора и широкого использования ЧКВ. В настоящее время на фоне стандартной ДАТТ дополнительное введение этих препаратов обычно не показано (как на догоспитальном этапе, так и во время ЧКВ) в связи с отсутствием явной пользы и увеличением риска кровотечений. Факторами, способствующими передозировке препаратов, являются пожилой возраст, женский пол, почечная недостаточность, малая масса тела, сахарный диабет и ХСН. Следует помнить, что применение ингибиторов IIb/IIIa рецепторов может вызывать тромбоцитопению. Блокаторы гликопротеина IIb/IIIa рецепторов тромбоцитов используются, в основном, как спасительное средство при тромботических осложнениях ЧКВ, либо высоком риске их развития (массивный тромб, феномен no-reflow и т.п.). Интракоронарное введение данных лекарств не имеет преимуществ перед внутривенным. Из препаратов этой группы используют эптифибатид, тирофибан, и Российский препарат монофрам.
Комментарий: многочисленные доказательства эффективности блокаторов GP IIb/IIIa при первичном и других видах ЧКВ у пациентов с ИМпST получены до внедрения в стандарты лечения таких пациентов ДАТТ. Их применение во время процедуры уместно, если пациент с ИМпST, подвергаемый ЧКВ, по каким-то причинам не получил и не получит в ближайшее время блокатор P2Y12-рецепторов тромбоцитов.
Комментарий: многочисленные доказательства эффективности блокаторов GP IIb/IIIa при первичном и других видах ЧКВ у пациентов с ИМпST получены до внедрения в стандарты лечения таких пациентов ДАТТ. Их применение во время процедуры уместно, если пациент с ИМпST, подвергаемый ЧКВ, по каким-то причинам не получил и не получит в ближайшее время блокатор P2Y12-рецепторов тромбоцитов.
В настоящее время доступны для применения в клинической практике 3 ингибитора гликопротеиновых llb/llla тромбоцитарных рецепторов.
АБЦИКСИМАБ (Abciximab).
Механизм действия. Абциксимаб является Fab- фрагментом химерных человеческих и мышиных моноклональных антител, которые неконкурентно и необратимо ингибируют гликопротеиновые IIb/IIIa рецепторы с высоким сродством. Вследствие быстрого связывания с тромбоцитами период полувыведения в плазме крови короткий (минуты), время связывания с тромбоцитарными рецепторами сохраняется более I нед. Дисфункция почек или гемодиализ не влияют на фармакокинетику абциксимаба.
Дозировка. Рекомендуемая дозировка — внутривенный болюс 0,25 мг/кг как минимум за 10 мин до ЧКВ с последующей инфузией в дозе 0,125 мкг/кг/мин (максимально — 10 мкг/мин) сроком 12 ч.
ЭПИФИБАТИД.
Механизм действия. Эпифибатид является белком, селективно и конкурентно связывающимся с гликопротеиновыми IIb/IIIа рецепторами. Он имеет очень быстрое время ассоциации и диссоциации с IIb/IIIa рецепторами. Эпифибатид выводится с мочой в неизмененной форме.
Дозировка. Рекомендуемая дозировка — внутривенный болюс 180 мкг/кг с последующей инфузией в дозе 2 мкг/кг/мин сроком до 72 ч или до выполнения АКШ или выписки из клиники. Если ЧКВ выполняется на фоне применения эпифибатида, инфузия должна быть продолжена на 20—24 ч. В случае дисфункции почек (скорость клубочковой фильтрации (eGFR) менее 50 мл/мин/1,73 м2) инфузия должна быть уменьшена до 1 мкг/кг/мин.
АБЦИКСИМАБ (Abciximab).
Механизм действия. Абциксимаб является Fab- фрагментом химерных человеческих и мышиных моноклональных антител, которые неконкурентно и необратимо ингибируют гликопротеиновые IIb/IIIa рецепторы с высоким сродством. Вследствие быстрого связывания с тромбоцитами период полувыведения в плазме крови короткий (минуты), время связывания с тромбоцитарными рецепторами сохраняется более I нед. Дисфункция почек или гемодиализ не влияют на фармакокинетику абциксимаба.
Дозировка. Рекомендуемая дозировка — внутривенный болюс 0,25 мг/кг как минимум за 10 мин до ЧКВ с последующей инфузией в дозе 0,125 мкг/кг/мин (максимально — 10 мкг/мин) сроком 12 ч.
ЭПИФИБАТИД.
Механизм действия. Эпифибатид является белком, селективно и конкурентно связывающимся с гликопротеиновыми IIb/IIIа рецепторами. Он имеет очень быстрое время ассоциации и диссоциации с IIb/IIIa рецепторами. Эпифибатид выводится с мочой в неизмененной форме.
Дозировка. Рекомендуемая дозировка — внутривенный болюс 180 мкг/кг с последующей инфузией в дозе 2 мкг/кг/мин сроком до 72 ч или до выполнения АКШ или выписки из клиники. Если ЧКВ выполняется на фоне применения эпифибатида, инфузия должна быть продолжена на 20—24 ч. В случае дисфункции почек (скорость клубочковой фильтрации (eGFR) менее 50 мл/мин/1,73 м2) инфузия должна быть уменьшена до 1 мкг/кг/мин.
Эпифибатид не должен применяться у пациентов, находящихся на гемодиализе.
ТИРОФИБАН.
Механизм действия. Тирофибан является непептидным дериватом тирозина, селективно и конкурентно связывающимся с гликопротеиновыми IIb/IIIа рецепторами с промежуточным по силе сродством (между абциксимабом и эпифибатидом). Тирофибан характеризуется очень быстрым временем ассоциации и диссоциации с гликопротеиновыми IIb/IIIа рецепторами. Он выделяется почками, а также элиминируется при проведении гемодиализа.
Дозировка. Рекомендуемая нагрузочная доза 25 мкг/кг, вводимая за промежуток времени до 5 мин, с последующей инфузией в дозировке 0,15 мкг/кг/мин сроком до 18 ч.
|
Для снижения риска/лечения тромботических осложнений ЧКВ и для снижения риска рецидива ИМ у пациентов с ИМпST рекомендуется использовать блокаторы GP IIb/IIIa при ЧКВ (в условиях широкого применения ДАТТ) только как аварийное вмешательство в случае возникновения тромботических осложнений или высокого риска их развития (выраженный исходный внутрикоронарный тромбоз, феномен slow-reflow или no-reflow).
|
IIa |
C |
|
Предварительное лечение антагонистом рецепторов GP IIb/IIIa не рекомендуется.
|
III
|
A
|
Тромбоцитопения после терапии ингибиторами GP IIb/IIIa.
Тромбоцитопения может возникнуть во время терапии ингибиторами GP IIb/ IIIa. Поэтому у пациентов, получающих терапию ингибиторами GP IIb/IIIa, необходимо определять количество тромбоцитов в течение 8-12 ч после первого приема препарата, при возникновении любых осложнений, связанных с кровотечением, и повторно через 24 ч. Инфузия ингибитора GP IIb/IIIa должна быть прекращена, если возникает клинически значимая тромбоцитопения. Переливание тромбоцитов рекомендуется в следующих случаях при активном кровотечении, связанном с глубокой тромбоцитопенией, определяемой как количество тромбоцитов <20000/мл. Переливание тромбоцитов может быть неэффективным, пока обратимо связывающие ингибиторы GP IIb/IIIa (эптифибатид или тирофибан) остаются в циркуляции (период полувыведения обоих препаратов составляет 2 ч). У пациентов с продолжающимся сильным кровотечением может быть рассмотрен вопрос о добавлении фибриногена в свежезамороженную плазму или криопреципитат, а другие поддерживающие меры могут включать внутривенное введение иммуноглобулина.
Другие поддерживающие меры могут включать внутривенное введение иммуноглобулинов и кортикостероидов.
Пациенты, у которых наблюдалась тромбоцитопения во время приема ингибиторов GP IIb/IIIa, должны избегать их последующего приема.
Тромбоцитопения может возникнуть во время терапии ингибиторами GP IIb/ IIIa. Поэтому у пациентов, получающих терапию ингибиторами GP IIb/IIIa, необходимо определять количество тромбоцитов в течение 8-12 ч после первого приема препарата, при возникновении любых осложнений, связанных с кровотечением, и повторно через 24 ч. Инфузия ингибитора GP IIb/IIIa должна быть прекращена, если возникает клинически значимая тромбоцитопения. Переливание тромбоцитов рекомендуется в следующих случаях при активном кровотечении, связанном с глубокой тромбоцитопенией, определяемой как количество тромбоцитов <20000/мл. Переливание тромбоцитов может быть неэффективным, пока обратимо связывающие ингибиторы GP IIb/IIIa (эптифибатид или тирофибан) остаются в циркуляции (период полувыведения обоих препаратов составляет 2 ч). У пациентов с продолжающимся сильным кровотечением может быть рассмотрен вопрос о добавлении фибриногена в свежезамороженную плазму или криопреципитат, а другие поддерживающие меры могут включать внутривенное введение иммуноглобулина.
Другие поддерживающие меры могут включать внутривенное введение иммуноглобулинов и кортикостероидов.
Пациенты, у которых наблюдалась тромбоцитопения во время приема ингибиторов GP IIb/IIIa, должны избегать их последующего приема.
4. Антикоагулянты и ЧКВ.
Задача антикоагулянтов в остром периоде ОКС подавить образование или активность ключевого фермента свертывания крови – тромбина и тем самым снизить риск тромботических осложнений. В настоящее время несколько антикоагулянтов для парентерального введения показали свою пользу у больных с ОКСпST (нефракционированный гепарин, эноксапарин, фондапаринукс и бивалирудин, (рис. 9).
Современные антикоагулянты
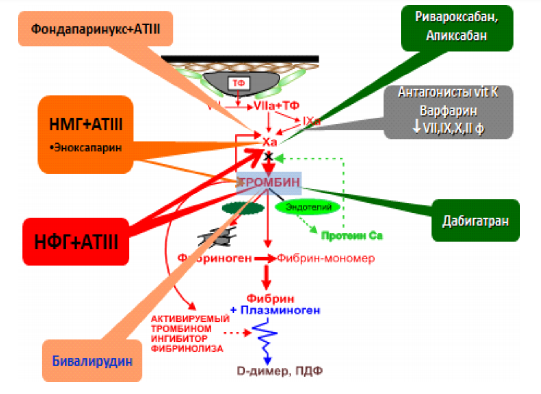
Рисунок 9.
Сокращения: НФГ – нефракционированный гепарин, НМГ – низкомолекулярный гепарин, АТIII– антитромбин III, ПДФ – продукты деградации фибриногена и фибрина, ТФ – тканевой фактор, VII– VII фактор свертывания крови, IX– IX фактор свертывания крови, X– X фактор свертывания крови, II– II фактор свертывания крови (протромбин).
Парентеральные антикоагулянты.
НЕФРАКЦИОНИРОВАННЫЙ ГЕПАРИН (НФГ).
Механизм действия: НФГ представляет собой гетерогенную смесь полисахаридов. Для осуществления антикоагулянтной активности НФГ в плазме крови необходим кофактор – антитромбин III (АТ III). Связывание молекулы НФГ с АТ III приводит к конформационным изменениям антитромбина, и он превращается в быстродействующий ингибитор. При ОКСпST нефракционированный гепарин применяется для сопровождения реперфузионной терапии (ЧКВ или ТЛТ), а также для профилактики или лечения артериальных или венозных тромбозов и тромбоэмболий. Узкое терапевтическое окно НФГ предполагает внутривенный режим введения и индивидуальный подбор дозы в соответствии с весом пациента (подкожное введение рекомендуется только с целью профилактики венозных тромбозов).
Дозировка: Для поддержки первичной ЧКВ НФГ используют в виде внутривенных болюсных введений: первый болюс 70—100 ЕД/кг (50 - 70 МЕ/кг в сочетании с блокаторами гликопротеина IIb/IIIa), при необходимости введение НФГ повторяют в дозе 20 МЕ/кг. Возможен подбор дозы / мониторирование антикоагулянтного действия НФГ путем определения активированного времени свертывания (АВС). Диапазон значений АВС составляет 250—350 с (200–250 в сочетании с блокаторами гликопротеина IIb/IIIa). Строгой доказательной базы в пользу такого подхода нет. В любом случае, определение АВС не должно задерживать выполнение реканализации инфаркт-связанной артерии при первичной ЧКВ.
Комментарий:
у НФГ** нет доказательств его эффективности на уровне сравнения с плацебо. Во время ЧКВ НФГ** вводят в/в болюсами, добиваясь поддержания определенных значений активированного времени свертывания крови (250–300 секунд для анализатора Hemotech или 300-350 секунд для анализатора Hemochron).
Механизм действия: НФГ представляет собой гетерогенную смесь полисахаридов. Для осуществления антикоагулянтной активности НФГ в плазме крови необходим кофактор – антитромбин III (АТ III). Связывание молекулы НФГ с АТ III приводит к конформационным изменениям антитромбина, и он превращается в быстродействующий ингибитор. При ОКСпST нефракционированный гепарин применяется для сопровождения реперфузионной терапии (ЧКВ или ТЛТ), а также для профилактики или лечения артериальных или венозных тромбозов и тромбоэмболий. Узкое терапевтическое окно НФГ предполагает внутривенный режим введения и индивидуальный подбор дозы в соответствии с весом пациента (подкожное введение рекомендуется только с целью профилактики венозных тромбозов).
Дозировка: Для поддержки первичной ЧКВ НФГ используют в виде внутривенных болюсных введений: первый болюс 70—100 ЕД/кг (50 - 70 МЕ/кг в сочетании с блокаторами гликопротеина IIb/IIIa), при необходимости введение НФГ повторяют в дозе 20 МЕ/кг. Возможен подбор дозы / мониторирование антикоагулянтного действия НФГ путем определения активированного времени свертывания (АВС). Диапазон значений АВС составляет 250—350 с (200–250 в сочетании с блокаторами гликопротеина IIb/IIIa). Строгой доказательной базы в пользу такого подхода нет. В любом случае, определение АВС не должно задерживать выполнение реканализации инфаркт-связанной артерии при первичной ЧКВ.
Комментарий:
у НФГ** нет доказательств его эффективности на уровне сравнения с плацебо. Во время ЧКВ НФГ** вводят в/в болюсами, добиваясь поддержания определенных значений активированного времени свертывания крови (250–300 секунд для анализатора Hemotech или 300-350 секунд для анализатора Hemochron).
-
Вводимый внутривенно НФГ** (в дополнение к ТЛТ) не имеет доказательств эффективности на уровне снижения риска крупных ишемических событий или смерти как в сравнении с плацебо, так и в сравнении с другими антикоагулянтами. Тем не менее он, как и АСК**, не одно десятилетие являлся обязательным элементом сопровождения ТЛТ у пациентов, получивших фибринспецифичные тромболитики (производные тканевого активатора плазминогена, в основном альтеплазу). Утраченные в результате прямых сравнений с эноксапарином**, приоритетные позиции НФГ** остаются неизменными, когда выбирается антикоагулянт в дополнение к ТЛТ у пациентов с тяжелым нарушением азотовыделительной функции почек и у пациентов с очень высокой или низкой массой тела. Подразумевается, что в каждом из этих случаев изменяемая в зависимости от значений АЧТВ скорость введения НФГ** призвана сделать лечение таких пациентов более эффективным и безопасным.
-
Внутривенная инфузия НФГ** должна осуществляться в дозе, обеспечивающей удлинение активированного частичного тромбопластинового времени в 1,5–2,5 выше контрольного для данной лаборатории. При использовании НФГ** во время ЧКВ рекомендуется ввести внутривенно болюсом 70–100 МЕ/кг (при одновременном применении ингибитора гликопротеиновых рецепторов IIb/IIIa 50-70 МЕ/кг), необходимость повторного введения определяется величиной активированного времени свертывания крови.
Низкомолекулярные гепарины (НМГ).
Механизм действия: НМГ являются фрагментами нефракционированного гепарина, которые имеют ряд преимуществ перед НФГ: более быструю абсорбцию при подкожном введении, меньшую степень связывания с белками плазмы и тромбоцитами и поэтому обладают более предсказуемым дозозависимым действием. Они реже, чем НФГ вызывают гепарин- индуцированную тромбоцитопению (ГИТ). Важное преимущество НМГ перед НФГ — простота введения и отсутствие необходимости в регулярном коагулологическом контроле при использовании как профилактических, так и высоких (лечебных) доз.
ЭНОКСАПАРИН является единственным НМГ, рекомендованным для лечения больных ОКСпST. Эноксапарин, как и НФГ, может использоваться во время первичной ЧКВ, при введении тромболитика, а также для профилактики или лечения артериальных или венозных тромбозов и тромбоэмболий.
При ЧКВ у больных, до этого не получавших антикоагулянтов, эноксапарин вводят внутривенно болюсом 0,5 мг/кг вне зависимости от сопутствующего использования блокаторов гликопротеина IIb/IIIa и функции почек. Если ЧКВ выполняется на фоне предшествующей терапии эноксапарином, то в первые 8 часов после очередной п/к инъекции дополнительного антикоагулянта не требуется. Если до ЧКВ была сделана только одна подкожная инъекция эноксапарина или ЧКВ выполняется через 8–12 часов после подкожной инъекции – ввести внутривенно болюсом 0,3 мг/кг эноксапарина.
Дозировка: Лечебные дозы эноксапарина (1 мг/кг под кожу живота 2 раза в сутки) применяют для профилактики кардиоэмболических осложнений и лечения артериальных тромбозов и эмболий. Для профилактики венозных тромбозов и эмболий рекомендованная доза эноксапарина составляет 40 мг 1 раз в сут.
Эноксапарин, как и другие НМГ, имеет почечный путь выведения из организма, поэтому у пациентов с клиренсом креатинина в пределах 15–30 мл/мин/1,73м2 требуется уменьшение лечебной дозы (1 мг/кг п/к 1 раз в сутки вне зависимости от возраста). Желательно при этом обеспечить мониторирование анти-Ха активности. Эноксапарин не рекомендуется больным с клиренсом креатинина <15 мл/мин/1,73 м2.
Комментарий: многократно продемонстрированное превосходство эноксапарина** над НФГ** распространяется в основном на пациентов, получивших фибринспецифичные тромболитики. Но доказательства целесообразности его применения есть и у пациентов, получивших стрептокиназу. Важно, что эноксапарин** в упомянутых выше сравнениях не имел преимущества на уровне геморрагической безопасности.
ФОНДАПАРИНУКС.
Механизм действия: Препарат является парентеральным селективным ингибитором Ха фактора и представляет собой синтетическую последовательность пентасахаридов, одинаковую для всех гепаринов. Он необратимо связывается с антитромбином, приводя к его конформационным изменениям, что повышает его способность инактивации фактора Ха. Фондапаринукс не влияет ни на тромбоциты, ни на тромбоцитарный фактор IV и, соответственно, не вызывает гепарин-индуцированную тромбоцитопению.
Дозировка. Рекомендуемая дозировка 2,5 мг подкожно один раз в сутки. У фондапаринукса 100% биодоступность после подкожного введения, а период полувыведения составляет 17 часов, что позволяет вводить препарат один раз в сутки. Препарат не оказывает влияния на лабораторно определяемые показатели гемостаза (АВС, АЧТВ, протромбиновое и тромбиновое время) и не требует мониторирования в рутинной практике. Практически не связывается с белками плазмы и не вызывает ГИТ.
Не рекомендуется применение фондапаринукса у пациентов с острым инфарктом миокарда с подъемом сегмента ST. На это повлияли результаты исследования OAS1S-6, в котором было продемонстрировано отсутствие преимуществ на фоне назначения фондапаринукса над нефракционированным гепарином у подвергнутых ЧКВ больных. Более того, в группе подвергнутых первичному ЧКВ больных использование фондапаринукса ассоциировалось с более высокой частотой тромбоза катетеров, других осложнений (острой окклюзии, феномена no-reflow, диссекций). Применение фондапаринукса при ОКСпST показано, прежде всего, у больных, получавших стрептокиназу, а также у больных, которым не проводится реперфузионное лечение. В этих случаях Фондапаринукс вводится 2,5 мг в/в струйно, со вторых суток 2,5 мг под кожу живота 1 раз в сутки. Препарат также может быть использован для профилактики и лечения венозных тромбозов и эмболий. Профилактическая доза препарата составляет 2,5 мг в сут, а лечебная рассчитывается по массе тела: 5 мг при массе тела <50 кг, 7,5 мг при массе тела 50–100 кг и 10 мг при массе тела >100 кг.
Использование фондапаринукса в качестве единственного антикоагулянта во время ЧКВ не рекомендуется.
Препарат выводится почками и противопоказан при клиренсе креатинина <20 мл/мин/1,73 м2.
Комментарий:
-
фондапаринукс натрия - средство выбора при наличии легкой и умеренной тромбоцитопении или при угрозе развития гепарин- индуцированной тромбоцитопении.
-
пациенту, получающему фондапаринукс натрия, во время ЧКВ следует внутривенно вводить НФГ** - первоначальный болюс в дозе 85 МЕ/кг (при одновременном применении блокатора ГПР IIb/IIIa - 60 МЕ/кг), необходимость повторного введения определяется величиной активированного времени свертывания крови.
БИВАЛИРУДИН.
Механизм действия: Препарат представляет собой полусинтетический полипептид, состоящий из 20 аминокислот. Бивалирудин в равной степени связывает свободный и связанный с тромбом тромбин, не инактивируется 4 фактором тромбоцитов и не нуждается в кофакторе - антитромбине. Бивалирудин обладает предсказуемой линейной фармакокинетикой и достигает пиковой концентрации после внутривенного болюса через 5 минут. Во время инфузии создается устойчивая концентрация, напрямую зависящая от дозы. Препарат быстро выводится из плазмы. Антикоагулянтный эффект зависит от дозы, показатели АЧТВ, тромбиновое время, АВС линейно нарастают с увеличением дозы, эффект проявляется через минуты после внутривенного болюса и у здоровых лиц прекращается примерно через 1 час после прекращения инфузии.
Бивалирудин применяется для сопровождения первичного ЧКВ. Предполагалось, что важное преимущество бивалирудина – уменьшение наклонности к кровотечениям, особенно при инвазивной тактике лечения. Данные о большей безопасности бивалирудина были получены в первую очередь при сравнении его с комбинацией НФГ и блокаторов гликопротеина IIb/IIIa. В исследованиях последних лет использовались современные блокаторы P2Y12 рецепторов и «спасительное» введение блокаторов гликопротеина IIb/IIIa, поэтому целесообразность использования бивалирудина вместо НФГ подвергается сомнению. Соответственно, при гепарин-индуцированной тромбоцитопении бивалирудин является препаратом первого выбора.
Дозировка: Бивалирудин вводится в дозе 0,75 мг/кг в/в струйно с последующей инфузией со скоростью 1,75 мг/кг/ч. Выводится преимущественно почками и не рекомендован при клиренсе креатинина <30 мл/мин/1,73 м2. У больных с клиренсом креатинина 30—59 мл/мин доза для струйного введения остается прежней, а скорость инфузии следует уменьшить до 1,4 мг/кг/ч.
Комментарий: в метаанализе сравнительных исследований НФГ** и бивалирудина при первичном ЧКВ не выявлено преимущества последнего на уровне смертности (что в основном и стало основанием для приоритетного размещения НФГ** в списке антикоагулянтов, используемых при этом методе реперфузии). Применение бивалирудина в этих сравнениях сопровождалось более высокой частотой тромбоза стентов и меньшей частотой кровотечений.
Дозировка: Бивалирудин вводится в дозе 0,75 мг/кг в/в струйно с последующей инфузией со скоростью 1,75 мг/кг/ч. Выводится преимущественно почками и не рекомендован при клиренсе креатинина <30 мл/мин/1,73 м2. У больных с клиренсом креатинина 30—59 мл/мин доза для струйного введения остается прежней, а скорость инфузии следует уменьшить до 1,4 мг/кг/ч.
Комментарий: в метаанализе сравнительных исследований НФГ** и бивалирудина при первичном ЧКВ не выявлено преимущества последнего на уровне смертности (что в основном и стало основанием для приоритетного размещения НФГ** в списке антикоагулянтов, используемых при этом методе реперфузии). Применение бивалирудина в этих сравнениях сопровождалось более высокой частотой тромбоза стентов и меньшей частотой кровотечений.
Бивалирудин является препаратом выбора у пациентов с наличием или угрозой развития тромбоцитопении и при высоком риске кровотечения.
По рекомендациям Европейского общества кардиологов 2023г.
|
Парентеральный антикоагулянт рекомендуется всем больным в дополнение к антитромбоцитарной терапии. Возможные варианты:
|
I |
A |
|
I
|
С
|
|
IIa
|
B
|
|
IIb
|
A
|
|
Для снижения суммарного риска смерти или рецидива ИМ эноксапарин рекомендуется как антикоагулянт первого выбора (по результатам сравнения с НФГ) у пациентов с ИМпST, получивших ТЛТ.
|
I |
A |
|
При первичном ЧКВ у пациентов с ИМПSТ для снижения риска тромботических осложнений и крупных ишемических событий рекомендуется использование НФГ в виде внутривенного болюса
|
IIa |
C |
|
У пациентов с ИМпST при первичном ЧКВ для снижения риска тромботических осложнений и крупных ишемических событий рекомендуется внутривенное введение эноксапарина натрия
|
IIa
|
B
|
|
Для снижения суммарного риска (смерть и рецидив ИМ) у пациентов ИМпST, получивших ТЛТ, рекомендуется ингибитор Ха фактора свертывания крови фондапаринукс натрия.
|
IIa |
B |
|
У пациентов с ИМпST при первичном ЧКВ для снижения риска тромботических осложнений и крупных ишемических событий рекомендуется внутривенное введение бивалирудина.
|
IIa |
B |
|
НФГ (в виде внутривенного болюса с последующей внутривенной инфузией с контролем за АЧТВ и изменением скорости инфузии с целью удержания АЧТВ в диапазоне 1,5–2 от верхней границы нормального значения) рекомендуется в качестве парентерального антикоагулянта у пациентов с ИМпST, получающих ТЛТ. Среди доказанных эффектов такой антикоагуляции - лучшая проходимость инфаркт- связанной артерии через несколько дней после введения тромболитика
|
IIb |
B |
|
В случае выполнения первичного ЧКВ у пациента, получившего до ЧКВ фондапаринукс натрия, для снижения риска тромботических осложнений ЧКВ в связи с процедурой рекомендуется вводить стандартный болюс НФГ (не рекомендуется выполнять ЧКВ на фоне антикоагуляции только фондапаринуксом натрия)
|
IIa |
B |
|
При ИМпST парентеральное введение антикоагулянтов для снижения риска тромботических осложнений рекомендуется продолжать максимально до 8 суток (или до выписки, если она произойдет раньше этого срока) или до успешного завершения ЧКВ, если нет иных показаний к продленной антикоагулянтной терапии
|
IIb |
C |
|
Для снижения риска тромботических осложнений фондапаринукс натрия (2,5 мг ежедневно подкожно, первое введение - 2,5 мг внутривенно) при ИМпST рекомендуется в качестве антикоагулянта для сопровождения ТЛТ с использованием стрептокиназы и у пациентов, не получивших реперфузионную терапию
|
IIb |
B |
|
Из-за неоправданного увеличения риска кровотечений продолжение антикоагуляции после успешного ЧКВ не рекомендуется, если только нет других оснований для лечебной (фибрилляция предсердий, тромбоз полости левого желудочка, венозный тромбоз или ТЭЛА) или профилактической тяжелая сердечная недостаточность, ограниченная подвижность пациента) антикоагуляции.
|
III |
C |
|
При ИMпST применение бивалирудина (внутривенно болюс 0,75 мг/кг и инфузия 1,75 мг/кг/час) рекомендуется рассмотреть в качестве альтернативы НФГ для антитромботической поддержки ЧКВ, т.е. для снижения риска тромботических осложнений ЧКВ.
|
IIa |
A |
|
При ИМпST внутривенная инфузия НФГ в сопровождение ТЛТ рекомендуется для поддержки реперфузии (снижения риска тромботических осложнений) в случаях, когда фондапаринукс натрия и эноксапарин** противопоказаны (в частности, из-за выраженной почечной недостаточности).
|
IIa |
C |
|
Если пациент с ИМпST получал эноксапарин до ЧКВ (в связи с ТЛТ), для снижения риска ишемических и геморрагических осложнений процедуру рекомендуется выполнять на фоне его продолжающегося применения
|
IIa |
B |
|
Если ЧКВ при ИМпST выполняется на фоне начатой внутривенной инфузии НФГ, во время процедуры для поддержания должного уровня антикоагуляции рекомендуется использовать дополнительное внутривенное введение болюсов НФГ под контролем активированного времени свертывания крови
|
IIa |
B |
|
У пациентов с ИМпST, с ожидаемыми высоким риском ишемических событий и низким риском кровотечений, не переносивших в прошлом инсульт или ТИА, для снижения риска смерти, снижения суммарного риска смерти, ИМ, инсульта и риска тромбоза коронарных стентов к сочетанию АСК и клопидогрела после завершения лечения парентеральным антикоагулянтом рекомендуется добавить ривароксабан в дозе 2,5 мг 2 раза в сутки сроком на 1 год.
|
IIa |
B |
|
У пациентов, перенесших ИМ, с сохраняющимся высоким коронарным риском, получающих АСК без блокатора P2Y 12-рецептора тромбоцитов, в рамках вторичной профилактики (для снижения суммарного риска ишемических событий и риска смерти) рекомендуется присоединение к АСК ривароксабана в
дозе 2,5 мг 2 раза в день на неопределенно долгое время. |
IIa |
B |
|
У больных с ГИТ рекомендуется использование бивалирудина
|
I
|
С
|
|
Фондапаринукс не рекомендован для сопровождения первичного ЧКВ
|
III
|
B
|
Комментарий:
-У пациентов, получающих антагонисты витамина K, рекомендуется воздержаться от парентерального введения антикоагулянтов (в том числе во время ЧКВ) при условии, что значение МНО равно или превышает 2,0 (для ЧКВ 2,5). При меньшем значении МНО рекомендуется стандартный болюс НФГ**.
-Добавление ривароксабана** в дозе 2,5 мг 2 раза в сутки не изучено в комбинации с двойной антитромбоцитарной терапией, в состав которой входят прасугрел или тикагрелор**. Данный подход не может использоваться у пациентов, нуждающихся в использовании более высоких доз пероральных антикоагулянтов (в частности, при наличии ФП с повышенным риском инсульта). При присоединении к ДАТТ ривароксабана в дозе 2,5 мг 2 раза в день следует потенциальное увеличение риска кровотечений, прежде всего внутричерепных.
-К пациентам, перенесшим ИМ, имеющим достаточный для предлагаемого вмешательства риск сердечно-сосудистых событий, относят лиц старше 65 лет или моложе, но в сочетании с документированным поражением или вмешательством в двух сосудистых бассейнах, или в сочетании с как минимум двумя факторами риска: курение, сахарный диабет, нарушение функции почек с рСКФ менее 60 мл/мин/1,73 м2, нетяжелая СН (ФВ ЛЖ > 30% и класс по NYHA I-II), нелакунарный ишемический инсульт (более месяца до назначения ривароксабана**).
-Не подходят для длительного совместного использования АСК** и низкой дозы ривароксабана** пациенты с высоким риском кровотечения, недавним инсультом, геморрагическим и лакунарным инсультом в прошлом, с тяжелой сердечной недостаточностью (ФВ ЛЖ < 30% или класс по NYHA III-IV), с рСКФ менее 15 мл/мин/1,73 м2, нуждающиеся в ДАТТ, лечении антиагрегантом, отличным от АСК**, или в использовании лечебных доз антикоагулянтов по другим показаниям.
-К пациентам, перенесшим ИМ, имеющим достаточный для предлагаемого вмешательства риск сердечно-сосудистых событий, относят лиц старше 65 лет или моложе, но в сочетании с документированным поражением или вмешательством в двух сосудистых бассейнах, или в сочетании с как минимум двумя факторами риска: курение, сахарный диабет, нарушение функции почек с рСКФ менее 60 мл/мин/1,73 м2, нетяжелая СН (ФВ ЛЖ > 30% и класс по NYHA I-II), нелакунарный ишемический инсульт (более месяца до назначения ривароксабана**).
-Не подходят для длительного совместного использования АСК** и низкой дозы ривароксабана** пациенты с высоким риском кровотечения, недавним инсультом, геморрагическим и лакунарным инсультом в прошлом, с тяжелой сердечной недостаточностью (ФВ ЛЖ < 30% или класс по NYHA III-IV), с рСКФ менее 15 мл/мин/1,73 м2, нуждающиеся в ДАТТ, лечении антиагрегантом, отличным от АСК**, или в использовании лечебных доз антикоагулянтов по другим показаниям.
Гепарин-индуцированная тромбоцитопения.
Неиммуноопосредованная легкая тромбоцитопения (количество тромбоцитов <100 000/мл) возникает в течение 48-72 ч после начала терапии нефракционированным гепарином (НФГ) и обычно проходит без осложнений, несмотря на продолжение терапии несмотря на продолжающееся применение НФГ. Напротив, иммуноопосредованная гепарин-индуцированная тромбоцитопения (ГИТ) - это потенциально фатальное протромботическое заболевание, возникающее у 0,5-3% пациентов, получающих либо НФГ, либо низкомолекулярный гепарин, или другие препараты гепарина. ГИТ следует подозревать, когда количество тромбоцитов падает до <100 000/мл (хотя обычно не падает до <10000-20 000/мл). ГИТ обычно возникает через 5-10 дней после первого приема НФГ,или в течение нескольких часов, если пациент ранее получал гепарин. При отсутствии гепарин-зависимых антител, повторное воздействие не обязательно вызывает. При подозрении на ГИТ необходимо прекратить все виды воздействия гепарина (включая промывания, катетеры с покрытием и т.д.).
Фондапаринукс и бивалирудин, хотя и не одобрены специально для лечения ГИТ. Бивалирудин является рекомендованной альтернативой НФГ для пациентов, поступающих с АКШ и имеющих в анамнезе ГИТ.
ГИТ. Переливание тромбоцитов не рекомендуется.
Пероральные антикоагулянты для длительного лечения больных, перенесших ОКСпST.
Данные препараты включают антагонисты витамина К (АВК) и пероральные антикоагулянты прямого действия (ПОАК). Назначаются при наличии показаний к длительному антикоагулянтному лечению, таких, как фибрилляция предсердий (ФП), венозные тромбоэмболические осложнения (ВТЭО), механические и в ряде случаев – биологические протезы клапанов сердца, а также тромбоз полостей сердца (прежде всего ЛЖ). При ФП или ВТЭО могут использоваться как АВК, так и ПОАК, при наличии механического протеза клапана или тромбозе ЛЖ – АВК.
Фондапаринукс и бивалирудин, хотя и не одобрены специально для лечения ГИТ. Бивалирудин является рекомендованной альтернативой НФГ для пациентов, поступающих с АКШ и имеющих в анамнезе ГИТ.
ГИТ. Переливание тромбоцитов не рекомендуется.
Пероральные антикоагулянты для длительного лечения больных, перенесших ОКСпST.
Данные препараты включают антагонисты витамина К (АВК) и пероральные антикоагулянты прямого действия (ПОАК). Назначаются при наличии показаний к длительному антикоагулянтному лечению, таких, как фибрилляция предсердий (ФП), венозные тромбоэмболические осложнения (ВТЭО), механические и в ряде случаев – биологические протезы клапанов сердца, а также тромбоз полостей сердца (прежде всего ЛЖ). При ФП или ВТЭО могут использоваться как АВК, так и ПОАК, при наличии механического протеза клапана или тромбозе ЛЖ – АВК.
В течение ближайших месяцев от момента ОКС антикоагулянт сочетают с одним или двумя антиагрегантными препаратами.
РИВАРОКСАБАН – единственный антикоагулянт, назначение которого оправдано для дополнительного снижения риска атеротромботических осложнений у больных, получающих аспирин или сочетание аспирина с клопидогрелом. С этой целью следует использовать низкую – «сосудистую» дозу ривароксабана 2,5 мг 2 раза в сутки. Использование ривароксабана допустимо в сочетании с аспирином или комбинацией аспирина с клопидогрелом. Опыта назначения ривароксабана с ДАТТ, включающей более мощные ингибиторы Р2Y12-рецепторов, пока нет и делать это до получения каких-либо новых данных не следует.
Неблагоприятный профиль пациента для назначения комбинации оральных антикоагулянтов антитромбоцитарной терапией:
-
Короткая предполагаемая продолжительность жизни
-
Наличие злокачественного новообразования
-
Плохая предполагаемая комплаентность
-
Когнитивные нарушения
-
Терминальная стадия почечной недостаточности
-
Пожилой возраст
-
Анамнез серьезных кровотечений/анамнез геморрагического инсульта
-
Хронический алкоголизм
-
Анемия
-
Клинически значимое кровотечение на двойной антитромботической терапии
По рекомендациям Европейского общества кардиологов 2023г.
|
В качестве стратегии по умолчанию для пациентов с фибрилляцией предсердий и баллом CHA2DS2- VASc ≥1 у мужчин и ≥2 у женщин после не более чем 1 недели тройной антитромботической терапии после ОКС рекомендуется двойная антитромботическая терапия с использованием ПОАК в рекомендуемой дозе для профилактики инсульта и одного перорального антитромбоцитарного препарата (предпочтительно клопидогреля) в течение 12 месяцев.305-3
|
I |
A |
|
У пациентов с ИМпST и ФП, нуждающихся в сочетании антикоагулянта и антитромбоцитарных препаратов, для снижения риска кровотечений рекомендуется использовать ПОАК, а не антагонисты витамина K (АВК) (если к ПОАК нет противопоказаний)
|
I |
B |
|
Во время ЧКВ рекомендуется вводить болюс НФГ в любом из следующих случаев:
- если пациент принимает ПОАК - если МНО <2,5 у пациентов, получающих варфарин. |
I |
C |
|
У пациентов с показаниями к оральному антикоагулянту с использованием варфарина в комбинации с аспирином и/или клопидогрелем следует тщательно регулировать интенсивность дозы варфарина с целевым значением МНО 2,0-2,5 и временем нахождения в терапевтическом диапазоне >70%.
|
IIa |
B |
|
Если при использовании ривароксабана опасения по поводу высокого риска кровотечения превалируют над опасениями по поводу ишемического инсульта, ривароксабан 15 мг в сутки следует предпочесть ривароксабану 20 мг в сутки на время проведения сопутствующей тройной или двойной антиагрегантной терапии.
|
IIa |
B |
|
У пациентов с высоким риском кровотечения для снижения риска кровотечений следует предпочесть дабигатран 110 мг в сутки по сравнению с дабигатраном 150 мг в сутки на время сопутствующей ТАТ и ДАТТ.
|
IIa |
B |
|
У пациентов, нуждающихся в антикоагуляции и получающих медикаментозное лечение, следует рассмотреть возможность использования одного антитромбоцитарного препарата в дополнение к ПОАК на срок до 1 года.
|
IIa |
B |
|
У пациентов, получающих ПОАК, следует рассмотреть возможность применения аспирина плюс клопидогреля в течение более 1 недели и до 1 месяца в случае высокого риска ишемии или других анатомических/процедурных характеристик, которые, по мнению специалистов, перевешивают риск кровотечения.
|
IIa |
C |
|
У пациентов, нуждающихся в применении орального антикоагулянта, можно рассмотреть возможность отмены антитромбоцитарной терапии через 6 месяцев при сохранении приема орального антикоагулянта
|
IIb |
B |
|
При необходимости в длительном использовании пероральных антикоагулянтов у пациентов с ИМпST, подвергнутых коронарному стентированию***, длительность применение сочетания перорального антикоагулянта с АСК** и клопидогрелом** (тройная антитромботическая терапия) для уменьшения риска геморрагических осложнений рекомендуется ограничить несколькими днями (1–7 дней), с последующей отменой АСК**. Двойная антитромботическая терапия (пероральный антикоагулянт и клопидогрел**) применяется до 12 месяцев, после чего клопидогрел** отменяется, продолжается "монотерапия" пероральным антикоагулянтом в целевой для профилактики тромбоэмболических событий (у пациентов с ФП) дозе.
|
IIa |
B |
|
Для снижения риска кровотечений при необходимости в длительном использовании пероральных антикоагулянтов у пациентов с ИМпST, подвергнутых коронарному стентированию***, использование двойной антитромботической терапии, состоящей из перорального антикоагулянта и клопидогрела**, рекомендуется в случаях, когда риск кровотечений превосходит риск коронарных осложнений
|
IIa
|
B
|
|
У пациентов с ИМпST и ФП, нуждающихся в сочетании антикоагулянта с антитромбоцитарным препаратом, для предотвращения эмболических событий рекомендуется апиксабан** в дозах, предназначенных для пациентов с неклапанной ФП, если к нему нет противопоказаний
|
IIa
|
B
|
|
Использование тикагрелора или прасугрела в составе тройной антитромботической терапии не рекомендуется.
|
III |
C |
|
Пациенты с ИМпST, развившимся на фоне терапии пероральным антикоагулянтом, из-за неприемлемого риска кровотечений не должны получать ТЛТ
|
III |
C |
Комментарий:
-
Показания к длительному применению антикоагулянтов - ФП в сочетании с умеренным/тяжелым митральным стенозом; неклапанная ФП с суммой баллов по шкале CHA2DS2-VASc >= 2 у мужчин или >= 3 у женщин; ТГВ/ТЭЛА, требующие лечения антикоагулянтами; тромб в ЛЖ; механические протезы клапанов сердца***.
-
Переход на двойную антитромботическую терапию (отмена АСК**, продолжение приема сочетания перорального антикоагулянта с клопидогрелом**) рекомендуется через несколько дней после коронарного стентирования***, обычно - при выписке из стационара. Данные о безопасности раннего перехода на двойную антитромботическую терапию у всех пациентов с ОКС, а также у имеющих наиболее высокий риск коронарных и кардиоэмболических осложнений, ограничены.
-
Данные о сравнительной эффективности прямых пероральных антикоагулянтов и варфарина** у пациентов с ИМ ограничены анализом подгрупп в рандомизированных контролируемых исследованиях.
-
Целевые значения МНО при использовании антагонистов витамина K в сочетании с антитромбоцитарными препаратами составляют МНО 2,0– 2,5 и могут быть выше в некоторых клинических ситуациях (у пациентов с механическими протезами клапанов сердца, при тромбоэмболических осложнениях на фоне указанных значений МНО). При применении антагонистов витамина K рекомендуется поддерживать время нахождения МНО в терапевтическом диапазоне не менее 70%, для сохранения надлежащей эффективности и снижения риска кровотечений.
-
По имеющимся данным, апиксабан** безопаснее варфарина** в составе двойной и тройной антитромботической терапии при сходной с варфарином** частоте коронарных осложнений. Рекомендуемой для большинства пациентов дозой является 5 мг 2 раза в день. Сниженная до 2,5 мг 2 раза в день доза используется при клиренсе креатинина от 15 до 30 мл/мин или при наличии двух и более из перечисленных факторов: возраст старше 80 лет, вес менее 60 кг и уровень креатинина крови выше 133 мкмоль/л.
Cтратегии снижения риска кровотечений при чрескожном коронарном вмешательстве.
-
Дозы антикоагулянтов корректируются в зависимости от массы тела и функции почек, особенно у женщин и пожилых пациентов.
-
Подход через лучевую артерию в качестве основного сосудистого доступа.
-
Ингибиторы протонной помпы у пациентов, получающих двойную антитромбоцитарную терапию, с риском желудочно-кишечных кровотечений выше среднего (например, язва/кровотечение желудочно-кишечного тракта в анамнезе, антикоагулянтная терапия, хроническое применение нестероидных противовоспалительных препаратов/кортикостероидов), или два или более из:
-
возраст ≥65 лет
-
диспепсия
-
гастро-эзофагеальная рефлюксная болезнь
-
инфекция Helicobacter pylori
-
Хроническое употребление алкоголя
Наиболее хорошо документировано взаимодействие клопидогрела с омепразолом и эзомепразолом.
-
У пациентов, принимающих ОАК:
-
ЧКВ выполняется без перерыва в приеме АВК или ПОАК
-
У пациентов, принимающих АВК не назначайте НФГ, если МНО >2,5
-
У пациентов, принимающих ПОАК, независимо от времени последнего приема ПОАК, добавьте низкодозовую парентеральную антикоагуляцию (например, эноксапарин 0,5 мг/кг внутривенно или НФГ 60 ЕД/кг).
-
Аспирин показан, но избегайте предварительного лечения ингибиторами рецепторов P2Y12
-
Ингибиторы рецепторов GP IIb/IIIa - только в качестве вспомогательного средства или при перипроцедурных осложнениях.
КОНТРАСТ-ИНДУЦИРОВАННАЯ НЕФРОПАТИЯ.
Пациенты с ХБП находятся в группе высокого риска развития нарушения функции почек после введения контрастного вещества во время проведения интервенционных вмешательств.
Контраст-индуцированная нефропатия (КИН) определяется как абсолютное (>0,5 мг/дл) или относительное (>25%) повышение уровня креатинина сыворотки крови (СК) в течение 48—72 ч после введения йодсодержащего контрастного вещества при отсутствии любых других причин для повышения уровня креатинина. Частота возникновения КИН колеблется от менее чем 5% у пациентов группы низкого риска до 50% у пациентов группы высокого риска. КИН может привести к развитию острой почечной недостаточности или к необратимому повреждению почек, а в некоторых случаях — и к терминальной почечной недостаточности, требующей проведения гемодиализа. Необходимость проведения диализа после развития КИН зависит от исходной функции почек при поступлении и в общем составляет менее 1%. Тем не менее отмечается значительное влияние КИН, требующей проведения диализа, на прогноз, что сопровождается высокой госпитальной и одногодичной летальностью.
Контраст-индуцированная нефропатия (КИН) определяется как абсолютное (>0,5 мг/дл) или относительное (>25%) повышение уровня креатинина сыворотки крови (СК) в течение 48—72 ч после введения йодсодержащего контрастного вещества при отсутствии любых других причин для повышения уровня креатинина. Частота возникновения КИН колеблется от менее чем 5% у пациентов группы низкого риска до 50% у пациентов группы высокого риска. КИН может привести к развитию острой почечной недостаточности или к необратимому повреждению почек, а в некоторых случаях — и к терминальной почечной недостаточности, требующей проведения гемодиализа. Необходимость проведения диализа после развития КИН зависит от исходной функции почек при поступлении и в общем составляет менее 1%. Тем не менее отмечается значительное влияние КИН, требующей проведения диализа, на прогноз, что сопровождается высокой госпитальной и одногодичной летальностью.
В основе патофизиологических механизмов развития КИН лежит первичный гемодинамический ответ на внутрисосудистое введение йодсодержащего рентгеноконтрастного вещества, который заключается в немедленном, преходящем расширении почечных сосудов с последующей длительной вазоконстрикцией. В экстраренальных сосудах преобладает стабильное снижение периферического сопротивления. Конечным результатом являются значительное снижение СКФ и развитие ишемии почек, особенно мозгового вещества. Было показано, что внутрисосудистое введение контрастного вещества вызывает снижение доставки кислорода на 60% с сопутствующим снижением медуллярного кровотока. Медуллярная гипоксия способствует развитию острого тубулярного некроза, что служит характерным признаком КИН.
Введение контрастного вещества повышает внутрипросветное давление в канальцевой системе из-за осмотического диуреза вследствие тубулярной обструкции, что приводит к повреждению тубулярного эпителия и к гипоксии мозгового вещества почки по причине компрессии микроциркуляторного русла прямых нисходящих сосудов.
Внутрисосудистое введение контраста также приводит к прямому клеточному повреждению, ведущему к нарушению регуляции синтеза NO и эндотелина и к дополнительному оксидативному стрессу.
Главный фактор риска развития КИН — исходное нарушение функции почек. Для пациентов с СКФ <60 мл/мин/1,73 м2 характерно значительное сокращение числа функционирующих нефронов, а состояние остаточной функции почек чрезвычайно чувствительно к любым спадам из-за повреждения почек. В данной группе пациентов следует учитывать, что любые совместно действующие повреждающие факторы, такие как устойчивая гипотензия, микроатероэмболия при смене катетера или использование внутриаортальной баллонной контрпульсации, могут усилить повреждение почек.
В качестве важного фактора риска развития КИН был выделен сахарный диабет, особенно при сочетании с почечной недостаточностью. В частности, при любой исходной степени снижения СКФ наличие диабета удваивает риск развития КИН.
Другими важными факторами риска являются дегидратация и избыточное выведение хлорида натрия из организма, застойная сердечная недостаточность, анемия, возраст старше 70 лет и использование нефротоксичных препаратов. Все пациенты, которым запланировано ЧКВ. должны быть полностью информированы о потенциальной пользе и рисках вмешательства, в том числе о риске ухудшения функции почек вследствие его проведения. Пациенты с диагностированной ХБП подвергаются особенно высокому риску дальнейшего ухудшения функции почек, а в итоге и необходимости проведения постоянного диализа, несмотря на принятие превентивных мер.
У пациентов с умеренной и тяжелой ХБП рекомендуется начать профилактическую инфузию изотонического раствора натрия хлорида примерно за 12 ч до ангиографии и продолжать в течение минимум 24 ч после вмешательства (класс IA).
Однако у пациентов с высоким риском перегрузки объемом, в частности при нарушении функции левого желудочка и, как следствие, с риском развития отека легких инфузионная терапия проводится существенно реже, чем необходимо для осуществления адекватной защиты почек.
G. Marenzi и соавт. проанализировали эффективность применения инфузионно-диуретической терапии с применением фуросемида в сравнении со стандартной инфузионной терапией в профилактике КИН у пациентов после проведения интервенционного вмешательства. Было показано, что применение инфузионно-диуретической терапии с применением фуросемида снижает риск развития КИН у пациентов в группе высокого риска. Дополнительно к данным превентивным мерам следует минимизировать объем вводимого контрастного вещества и использовать низкоосмолярные и изоосмолярные контрастные вещества (класс 1А).
Объем вводимого контрастного вещества должен быть сведен к минимально необходимому и не должен превышать 350 мл, в идеале составляя 4 мл/кг у пациентов с начальной и умеренной ХБП. Точным способом оценки максимально безопасной дозы контрастного вещества является подсчет по формуле: объем контрастного вещества/клиренс креатинина. Соотношение >3 значимо коррелирует с повышением уровня креатина после применения контрастного вещества, поэтому применения таких доз контраста следует избегать.
К другим рекомендациям по профилактике КИН относятся: отмена нефротоксичных препаратов, назначение высоких доз статинов, использование антиоксидантов, а в отдельных случаях — заместительной почечной терапии.
Роль N-ацетилцистеина (N-АЦЦ) обсуждалась в предшествующих исследованиях, но до сих пор остается противоречивой. Несмотря на то, что многие клинические исследования не продемонстрировали эффективности N- АЦЦ в профилактике КИН, он часто используется в клинической практике из- за низкой стоимости и отсутствия существенных побочных эффектов. Недавно проведенное крупное рандомизированное исследование [16] ясно показало, что N-АЦЦ не снижает риска развития КИН или других нежелательных явлений у пациентов после проведения коронарографии и ангиографии периферических сосудов. Соответственно, применение N-АЦЦ вместо стандартной инфузионной терапии не показано (класс IIIА).
Объем вводимого контрастного вещества должен быть сведен к минимально необходимому и не должен превышать 350 мл, в идеале составляя 4 мл/кг у пациентов с начальной и умеренной ХБП. Точным способом оценки максимально безопасной дозы контрастного вещества является подсчет по формуле: объем контрастного вещества/клиренс креатинина. Соотношение >3 значимо коррелирует с повышением уровня креатина после применения контрастного вещества, поэтому применения таких доз контраста следует избегать.
К другим рекомендациям по профилактике КИН относятся: отмена нефротоксичных препаратов, назначение высоких доз статинов, использование антиоксидантов, а в отдельных случаях — заместительной почечной терапии.
Роль N-ацетилцистеина (N-АЦЦ) обсуждалась в предшествующих исследованиях, но до сих пор остается противоречивой. Несмотря на то, что многие клинические исследования не продемонстрировали эффективности N- АЦЦ в профилактике КИН, он часто используется в клинической практике из- за низкой стоимости и отсутствия существенных побочных эффектов. Недавно проведенное крупное рандомизированное исследование [16] ясно показало, что N-АЦЦ не снижает риска развития КИН или других нежелательных явлений у пациентов после проведения коронарографии и ангиографии периферических сосудов. Соответственно, применение N-АЦЦ вместо стандартной инфузионной терапии не показано (класс IIIА).
Имеются достоверные данные о том, что применение форсированного диуреза способствует минимизации контраст-индуцированного повреждения: продемонстрировано, что чем больше объем выделяемой мочи, тем меньше изменяется уровень сывороточного креатинина в течение 48 ч. Недавно в клиническую практику была внедрена система для предотвращения острого повреждения почек после воздействия контрастного вещества.
Ранние симптомы контраст-индуцированной нефропатии.
В клинической практике рекомендовано определение ранних проявлений КИН, что позволит быстро поставить диагноз, а следовательно, незамедлительно начать терапию. Уровень сывороточного креатинина остается золотым стандартом мониторинга функции почек после ангиографии. Показано, что процентные долевые изменения уровней сывороточного креатинина, определяемые уже через 12, а после воздействия контрастного вещества, являются намного более информативными по сравнению с абсолютными значениями. Использование показателя изменений уровня креатинина сыворотки вместо абсолютных значений для определения почечной функции устраняет большинство ограничений, связанных с данным показателем, и сильно повышает его диагностическую чувствительность. Цистатин-С является альтернативным маркером в отношении сывороточного креатинина для мониторирования функции почек. Цистатин-С — низкомолекулярная цистеиновая протеиназа, продуцируемая всеми клетками, содержащими ядро, и с постоянной скоростью фильтруемая клубочками; этот показатель был предложен в качестве альтернативы сывороточному креатинину для оценки СКФ независимо от таких факторов, как возраст, пол и масса тела пациента. Более того, в некоторых экспериментах было выявлено, что изменения сывороточного уровня цистатина-С отражают более ранние изменения СКФ после введения контрастного вещества по сравнению с креатинином сыворотки крови. Однако диагностическое превосходство сывороточного цистатина-С над креатинином до сих пор недостаточно обосновано в текущей клинической практике.
По рекомендациям Европейского общества кардиологов 2023 г.
| Рекомендации | Класс | Уровень |
| Рекомендован скрининг всех пациентов на наличие КИН. | I | C |
| Рекомендована адекватная гидратация. | I | C |
| Рекомендовано использование низко- и изоосмолярного контрастного вещества. | I | A |
| Рекомендуется минимизировать количество контрастного вещества. Объем контраста/СКФ <3,7с. | I | B |
| Пациентам, не принимающим статины, можно рекомендовать предоперационное их назначение в высоких дозах. Розувастатин 40/20 мг или аторвастатин 80 мг. | IIa | A |
| Пре- и постгидратация физиологическим раствором рекомендована, если предполагаемая доза контраста превышает 1000 мл. 1 мл/кг/ч за 12 ч до и в течение 24 ч после процедуры (0,5 мл/кг/ч, если ФВЛЖ <35% NYHA >2). | IIa | C |
| Возможны альтернативы стандартным режимам гидратации. | IIb | B |
| Возможно выполнение профилактической процедуры гемофильтрации за 6 ч до сложного ЧКВ. Скорость замещения 1000 мл/ч без негативных потерь, гидратация физиологическим раствором должна быть продолжена в течение 24ч после процедуры ЧКВ. | IIb | B |
| Гемодиализ не рекомендован в качестве профилактической меры. | III | B |
Примечание: а — класс рекомендаций, b — уровень доказательности; Объем контраста/СКФ<3,7с: c — к примеру, 370 мл контрастного вещества, введенного пациенту с СКФ 100 мл/мин, даст коэффициент 3,7, d — возможные варианты: инфузия физиологического раствора, скорректированная по центральному венозному давлению, или инфузия фуросемида с соответствующей инфузией физиологического раствора.
Сокращения: ХБП — хроническая болезнь почек, СКФ — скорость клубочко- вой фильтрации, КИН — контраст-индуцированная нефропатия.
Сокращения: ХБП — хроническая болезнь почек, СКФ — скорость клубочко- вой фильтрации, КИН — контраст-индуцированная нефропатия.
СОПУТСТВУЮЩИЕ ЗАБОЛЕВАНИЯ И ОСОБЫЕ СОСТОЯНИЯ.
1. Хронические болезни почек.
Пациенты с ХБП и клинической картиной острого коронарного синдрома (ОКС) обычно имеют более диффузное поражение коронарных артерий и связаны с более высоким риском повторного инфаркта, сердечной недостаточности, а также смерти в сравнении с пациентами с ОКС и нормальной функцией почек. Ранняя инвазивная тактика представляется наиболее разумной стратегией у пациентов с ХБП, поступивших с нестабильной стенокардией/ИМ без подъема сегмента ST, в сравнении с консервативной стратегией, что отражено в рекомендациях Американского колледжа кардиологов/Американской ассоциации сердца (АСС/АНА) от 2012 г., за исключением пациентов с тяжелой ХБП, где данные оказались недостаточными. Однако, согласно данным недавнего метаанализа, отмечена лучшая одногодичная выживаемость у пациентов в группе инвазивной стратегии в сравнении с медикаментозным лечением во всех подгруппах пациентов с ХПН, в том числе у пациентов, находящихся на диализе. Согласно рекомендациям ESC по ведению пациентов с нестабильной стенокардией/ИМ без подъема сегмента ST от 2015 г., необходимо тщательно оценивать соотношение пользы и риска вмешательства, в частности с учетом выраженности почечной дисфункции. При выполнении ЧКВ предпочтительно использование стентов с лекарственным покрытием нового поколения. АКШ является предпочтительным вмешательством у пациентов с многососудистым поражением коронарного русла с приемлемым профилем риска и ожидаемой продолжительностью жизни более 1 года. В случаях высокого риска хирургического вмешательства или ожидаемой продолжительности жизни менее 1 года выбор следует сделать в пользу ЧКВ. У пациентов с ХБП и клинической картиной ИМ с подъемом сегмента ST медикаментозное лечение должно проводиться согласно принятым стандартам медицинской помощи. При назначении антикоагулянтной терапии дозировка или же сами препараты должны назначаться исходя из степени почечной дисфункции с целью снижения риска геморрагических осложнений:
-эноксапарин подкожно — половина дозы 1 р/сут в случае, если скорость клубочковой фильтрации меньше 30 мл/ мин;
фондапаринукс — противопоказан, если скорость клубочковой фильтрации меньше 20 мл/мин;
-бивалирудин — противопоказан, если скорость клубочковой фильтрации меньше 30 мл/мин, если же скорость клубочковой фильтрации составляет 30— 59 мл/мин, то используется инфузия в дозе 1,4 мг/кг/ч;
-эпифибатид — противопоказан, если скорость клубочковой фильтрации меньше 30 мл/мин, если же скорость клубочковой фильтрации составляет 30— 49 мл/мин, то используется болюс дозой 180 мкг/кг с последующей инфузией в дозе 1.0 мкг/кг/мин;
-тирофибан — если скорость клубочковой фильтрации меньше 30 мл/мин, то используется в половинной дозировке).
2. Сахарный диабет.
фондапаринукс — противопоказан, если скорость клубочковой фильтрации меньше 20 мл/мин;
-бивалирудин — противопоказан, если скорость клубочковой фильтрации меньше 30 мл/мин, если же скорость клубочковой фильтрации составляет 30— 59 мл/мин, то используется инфузия в дозе 1,4 мг/кг/ч;
-эпифибатид — противопоказан, если скорость клубочковой фильтрации меньше 30 мл/мин, если же скорость клубочковой фильтрации составляет 30— 49 мл/мин, то используется болюс дозой 180 мкг/кг с последующей инфузией в дозе 1.0 мкг/кг/мин;
-тирофибан — если скорость клубочковой фильтрации меньше 30 мл/мин, то используется в половинной дозировке).
2. Сахарный диабет.
Сахарный диабет (СД) – заболевание, которое многие специалисты рассматривают в качестве эпидемии и относят к социально значимым. По данным Международной федерации диабета, каждый 12-й человек в мире страдает СД, что составляет 387 млн человек с распространенностью 8,3% в общей популяции, причем у 46,3% данное заболевание еще не диагностировано. Доля пациентов с СД 2-го типа составляет 90—95%. Распространенность СД возрастает* с каждым годом во всех регионах мира. Ожидаемый прирост пациентов, страдающих СД, к 2035 г. составит 205 млн человек. Основной причиной такого прироста считается возрастание доли населения в возрасте от 45 до 65 лет. По данным Всемирной организации здравоохранения (ВОЗ), более 80% случаев смерти от СД происходит в странах с низким и средним уровнем дохода, а к 2030 г. СД станет 7-й по значимости причиной смерти в мире. Сахарный диабет повышает риск развития ишемической болезни сердца (ИБС), инсульта и поражения периферических артерий в 2–4 раза и является независимым дополнительным фактором риска развития неблагоприятных сердечно-сосудистых событий. Риск развития инфаркта миокарда (ИМ) в 3—5 раз выше у пациентов с СД 2- го типа. Наличие у пациента СД служит фактором риска, сопоставимым с ранее перенесенным ИМ. На основании представленных выше данных СД рассматривают в качестве эквивалента ИБС. Атеросклеротические изменения в различных артериальных бассейнах, в том числе в коронарном русле, статистически значимо чаще отмечаются, более выражены и имеют более диффузный характер у пациентов с СД.
Наличие у пациентов СД ассоциируется с повышенной частотой резистентности к ацетилсалициловой кислоте, что определяет необходимость контроля агрегации тромбоцитов, индивидуализации терапии, а также активного использования новых дезагрегантных препаратов в данной группе пациентов. Основные показатели, определяющие безопасность имплантации стентов, — частота тромбоза стента (ТС), ИМ и смертность за период наблюдения. СД служит независимым предиктором ТС по данным нескольких регистров имплантации стентов с лекарственным покрытием I поколения (SES и PES). По данным крупного многоцентрового регистра, включающего более 15 000 пациентов, которым были имплантированы SES, частота ТС в течение первого года наблюдения составила 0,87%, а наиболее значимым предиктором ТС был инсулинопотребный СД. Как уже отмечалось ранее, пациенты с СД вследствие неблагоприятных патофизиологических факторов и более комплексного поражения коронарного русла находятся в группе крайне высокого риска ТС.
Осложнения при сахарном диабете:
КОНТРАСТ-ИНДУЦИРОВАННАЯ НЕФРОПАТИЯ
Одним из главных осложнений после выполнения эндоваскулярных процедур с введением контрастных препаратов у пациентов с СД является контраст- индуцированная нефропатия (КИН). Данное тяжелое осложнение связано с более длительной госпитализацией пациентов, а также с повышенной частотой развития неблагоприятных исходов в отдаленном периоде.
Шкала Мехрана (Mehran Score). Данная шкала прогнозирует риск контраст- индуцированной нефропатии (КИН) перед проведением эндоваскулярных процедур.

Одним из главных осложнений после выполнения эндоваскулярных процедур с введением контрастных препаратов у пациентов с СД является контраст- индуцированная нефропатия (КИН). Данное тяжелое осложнение связано с более длительной госпитализацией пациентов, а также с повышенной частотой развития неблагоприятных исходов в отдаленном периоде.
Шкала Мехрана (Mehran Score). Данная шкала прогнозирует риск контраст- индуцированной нефропатии (КИН) перед проведением эндоваскулярных процедур.

На основании суммарной оценки баллов определяется категория степени риска: низкая, умеренная, высокая. Вероятность острого снижения функции почек возрастает с увеличением суммарного балла риска. Так, при низкой степени риска частота случаев КИН составляет 7,5%, а среди пациентов с высокой степенью — 26,1%.
Не следует использовать данную шкалу у пациентов с уже существующей терминальной стадией почечной недостаточности на диализе или у пациентов с воздействием контраста в течение 1 недели после индексной процедуры.
ЛАКТАТ-АЦИДОЗ
Метформин-индуцированный лактат-ацидоз после введения контрастных препаратов по-прежнему остается противоречивым осложнением. Не накоплено достаточно данных в пользу того, что прием метформина приводит к развитию лактат-ацидоза у пациентов с исходно нормальным уровнем креатинина. Данное осложнение обычно наблюдается у пациентов с инсулиннезависимым СД и исходно сниженной функцией почек. В некоторых исследованиях СД являлся независимым фактором риска развития лактат- ацидоза. Несмотря на то, что данное осложнение достаточно редкое и развивается с частотой 4,3/100 000 пациентов, летальность при его развитии варьирует от 25 до 50%.
По данным различных исследователей, пожилые пациенты с СД и с исходно сниженной функцией почек, а также с сопутствующими заболеваниями и состояниями, приводящими к снижению функции почек, получающие метформин, требуют тщательного контроля почечной функции и, при необходимости, коррекции проводимого лечения, вплоть до проведения почечной заместительной терапии.
Данные ряда исследователей свидетельствуют о возможном повышении рекомендуемых дозировок препарата, а также, возможно, о более широком и безопасном применении у пациентов с выраженной почечной недостаточностью. Следует отметить, что эти исследования представлены ограниченными нерандомизированными наблюдениями и не нашли отражения в официальных рекомендациях.
ЛАКТАТ-АЦИДОЗ
Метформин-индуцированный лактат-ацидоз после введения контрастных препаратов по-прежнему остается противоречивым осложнением. Не накоплено достаточно данных в пользу того, что прием метформина приводит к развитию лактат-ацидоза у пациентов с исходно нормальным уровнем креатинина. Данное осложнение обычно наблюдается у пациентов с инсулиннезависимым СД и исходно сниженной функцией почек. В некоторых исследованиях СД являлся независимым фактором риска развития лактат- ацидоза. Несмотря на то, что данное осложнение достаточно редкое и развивается с частотой 4,3/100 000 пациентов, летальность при его развитии варьирует от 25 до 50%.
По данным различных исследователей, пожилые пациенты с СД и с исходно сниженной функцией почек, а также с сопутствующими заболеваниями и состояниями, приводящими к снижению функции почек, получающие метформин, требуют тщательного контроля почечной функции и, при необходимости, коррекции проводимого лечения, вплоть до проведения почечной заместительной терапии.
Данные ряда исследователей свидетельствуют о возможном повышении рекомендуемых дозировок препарата, а также, возможно, о более широком и безопасном применении у пациентов с выраженной почечной недостаточностью. Следует отметить, что эти исследования представлены ограниченными нерандомизированными наблюдениями и не нашли отражения в официальных рекомендациях.
Рабочая группа Европейского общества кардиологов по изучению КИН пришла к заключению, что при сохранной функции почек прием метформина следует прекратить на момент выполнения эндоваскулярного вмешательства и возобновить через 48 ч после его окончания. В случае исходно нарушенной функции почек прием метформина следует прекратить за 48 ч до начала вмешательства и возобновить не ранее чем через 48 ч после его окончания, если состояние почечной функции осталось неизмененным. В случае экстренного вмешательства следует тщательно оценивать клиническое состояние пациента и проводить соответствующий мониторинг, особое внимание уделяя режиму гидратации.
| Рекомендации | Класс | Уровень |
| Рекомендуется проверка функции почек у пациентов на метформине до вмешательства и приостановление терапии метформином при ухудшении функции почек. | I | C |
3. Кровотечение.
Кровотечение ассоциируется с плохим прогнозом у пациентов с ОКС. Механизмы, с помощью которых кровотечение повышает риск смерти, сложны и многофакторны. В то время как внутричерепное или массивное кровоизлияние непосредственно угрожает жизни из-за фатального повреждения мозга или внезапного кардиоциркуляторного коллапса, другие менее тяжелые формы кровоизлияния могут повышать риск смерти через косвенные механизмы. Переливание крови может усиливать системное воспаление и представляет собой одну из возможных связей между кровотечением и последующей смертностью. Кровотечение также является одной из основных причин незапланированного прекращения ДАТТ и прерывания приема других лекарств (например, статинов, бета-блокаторов).
Пациенты с высоким риском кровотечения и с нарушениями крови (анемия и тромбоцитопения).
Анемия чаще встречается у пожилых/слабых пациентов с ОКС и у пациентов с мультиморбидностью (хронической болезнью почек, сахарным диабетом, раком и аутоиммунными заболеваниями). В некоторых случаях тяжелая анемия может ускорить развитие ИМ 2-го типа. Постоянная или усугубляющаяся анемия у пациентов с ОКС связана с повышенным риском повторных ишемических событий, смерти и большого кровотечения. [17] Согласно ARC-HBR, гемоглобин <110 г/л на момент ЧКВ является основным критерием для высокого риска кровотечения, а гемоглобин между 110 и 130 г/л (120 г/л для женщин) - второстепенным критерием.
Не существует установленной стратегии лечения анемии у пациентов с ОКС. Эффективность и безопасность переливания крови в этом клиническом сценарии остается неизвестной. В большинстве исследований, посвященных изучению различных протоколов переливания крови, либеральная стратегия переливания крови определялась как любое переливание эритроцитов при уровне гемоглобина <90-100 г/л, а ограничительная стратегия переливания крови - как любое переливание при уровне гемоглобина <70-80 г/л. Данные наблюдений свидетельствуют о том, что либеральная стратегия переливания крови может быть связана с увеличением смертности от всех причин. В открытом исследовании Restrictive and Liberal Transfusion Strategies in Patients With Acute Myocardial Infarction (REALITY) приняли участие 668 пациентов с ОКС, которые были рандомизированы на ведение с рестриктивной (вызванной гемоглобином ≤80) или либеральной (вызванной гемоглобином ≤100) стратегией переливания. [18] Композитный исход (смерть от всех причин, инсульт, повторный ИМ или экстренная реваскуляризация) в 30 дней наступил у сопоставимого числа пациентов в обеих группах (11% против 14%, ОР 0,79, с односторонним 97,5% ДИ 0,00-1,19), что соответствовало заранее определенному критерию неперспективности. Все компоненты комбинированной конечной точки были численно выше в группе с либеральной стратегией переливания крови. Для выявления превосходства ограничительной стратегии в исследовании не хватило мощности, а КИ включал в себя то, что может быть клинически значимым вредом. Предварительно определенное наблюдение в течение 1 года в исследовании REALITY дало противоречивые выводы относительно результатов 30 дней: в течение 1 года ограничительная стратегия переливания крови (по сравнению с либеральной стратегией) была более эффективной и не достигли неперспективности с точки зрения MACE. Кроме того, post-hoc анализ MACE между 30-м днем и 1 годом показал повышенный риск в группе с ограничительной трансфузионной стратегией. [19] Таким образом, в настоящее время нет официальных рекомендаций относительно оптимальной трансфузионной стратегии (либеральной или ограничительной) у пациентов с ОКС.
Не существует установленной стратегии лечения анемии у пациентов с ОКС. Эффективность и безопасность переливания крови в этом клиническом сценарии остается неизвестной. В большинстве исследований, посвященных изучению различных протоколов переливания крови, либеральная стратегия переливания крови определялась как любое переливание эритроцитов при уровне гемоглобина <90-100 г/л, а ограничительная стратегия переливания крови - как любое переливание при уровне гемоглобина <70-80 г/л. Данные наблюдений свидетельствуют о том, что либеральная стратегия переливания крови может быть связана с увеличением смертности от всех причин. В открытом исследовании Restrictive and Liberal Transfusion Strategies in Patients With Acute Myocardial Infarction (REALITY) приняли участие 668 пациентов с ОКС, которые были рандомизированы на ведение с рестриктивной (вызванной гемоглобином ≤80) или либеральной (вызванной гемоглобином ≤100) стратегией переливания. [18] Композитный исход (смерть от всех причин, инсульт, повторный ИМ или экстренная реваскуляризация) в 30 дней наступил у сопоставимого числа пациентов в обеих группах (11% против 14%, ОР 0,79, с односторонним 97,5% ДИ 0,00-1,19), что соответствовало заранее определенному критерию неперспективности. Все компоненты комбинированной конечной точки были численно выше в группе с либеральной стратегией переливания крови. Для выявления превосходства ограничительной стратегии в исследовании не хватило мощности, а КИ включал в себя то, что может быть клинически значимым вредом. Предварительно определенное наблюдение в течение 1 года в исследовании REALITY дало противоречивые выводы относительно результатов 30 дней: в течение 1 года ограничительная стратегия переливания крови (по сравнению с либеральной стратегией) была более эффективной и не достигли неперспективности с точки зрения MACE. Кроме того, post-hoc анализ MACE между 30-м днем и 1 годом показал повышенный риск в группе с ограничительной трансфузионной стратегией. [19] Таким образом, в настоящее время нет официальных рекомендаций относительно оптимальной трансфузионной стратегии (либеральной или ограничительной) у пациентов с ОКС.
Несмотря на то, что существует несколько классификаций для оценки тяжести тромбоцитопении, клинически значимую тромбоцитопению можно определить как количество тромбоцитов <100 000/мкл или относительное снижение количества тромбоцитов на 50% от исходного уровня на фоне ОКС. Тромбоцитопения повышает риск смерти, крупных кровотечений и угрожающих жизни тромботических событий. Критерии ARC-HBR определяют уровень тромбоцитов <100 000/мкл как основной критерий для HBR.
4. Пожилые люди с мультиморбидностью.
Пожилые люди составляют все большую долю пациентов с ОКС. Одним из основных предикторов неблагоприятных исходов после ОКС является возраст, однако пациенты в возрасте ≥75 лет часто исключаются из клинических исследований или недостаточно представлены в них. Пожилой возраст связан с хрупкостью, мультиморбидностью и большим риском ишемических событий и кровотечений у пациентов с ОКС. Анализ ВчТ имеет отличные диагностические характеристики у пожилых людей, но специфичность теста ниже, чем у молодых пациентов, а повышенный уровень ВчТ чаще всего связан с другими заболеваниями, кроме ОКС, у пожилых пациентов.
Данные об оптимальном ведении пожилых пациентов с ОКС ограничены. В небольшом РКИ, включавшем пожилых пациентов (≥80 лет) с ОКСбпST, было отмечено преимущество инвазивной стратегии по сравнению с консервативной в снижении совокупности ИМ, необходимости срочной реваскуляризации, инсульта и смерти. Эффект лечения не был показан в отношении смертности от всех причин, а польза, связанная с инвазивной стратегией, уменьшалась с увеличением возраста. В отсутствие надежных данных клинических исследований решения о том, как вести пожилых пациентов, должны приниматься индивидуально, исходя из характеристик пациента (т. е. риска ишемии и кровотечения, предполагаемой продолжительности жизни, сопутствующих заболеваний, необходимости несердечных операций, качества жизни, хрупкости, когнитивных и функциональных нарушений, ценностей и предпочтений пациента, а также предполагаемых рисков и преимуществ инвазивной стратегии).
Данные об оптимальном ведении пожилых пациентов с ОКС ограничены. В небольшом РКИ, включавшем пожилых пациентов (≥80 лет) с ОКСбпST, было отмечено преимущество инвазивной стратегии по сравнению с консервативной в снижении совокупности ИМ, необходимости срочной реваскуляризации, инсульта и смерти. Эффект лечения не был показан в отношении смертности от всех причин, а польза, связанная с инвазивной стратегией, уменьшалась с увеличением возраста. В отсутствие надежных данных клинических исследований решения о том, как вести пожилых пациентов, должны приниматься индивидуально, исходя из характеристик пациента (т. е. риска ишемии и кровотечения, предполагаемой продолжительности жизни, сопутствующих заболеваний, необходимости несердечных операций, качества жизни, хрупкости, когнитивных и функциональных нарушений, ценностей и предпочтений пациента, а также предполагаемых рисков и преимуществ инвазивной стратегии).
В контексте ОИМcST пЧКВ радикально улучшило исходы для пациентов всех возрастов. Однако данные в когорте "очень пожилых" ограничены, отсутствует формальная оценка хрупкости или коморбидности. В контексте кардиогеннного шока и остановки сердца возраст является независимым предиктором смертности после ЧКВ. В отсутствие надежных данных РКИ, пЧКВ следует рассматривать для всех пациентов с ОИМпST. Если своевременное проведение пЧКВ невозможно, разумной стратегией для таких пациентов может быть фибринолиз.
5. Беременность.
Диагностические критерии острого коронарного синдрома одинаковы для беременных и небеременных пациенток. Ведение беременных женщин с ОИМпST не должно отличаться от ведения небеременных женщин. Учитывая высокую смертность, связанную с ОИМпST при беременности, предпочтительной реперфузионной терапией является пЧКВ. [20] План ведения беременных женщин с ОКС должен определяться мультидисциплинарной командой, состоящей из кардиологов, акушеров, анестезиологов и неонатологов, и эти пациентки должны лечиться в отделении интенсивной терапии, которое может обеспечить материнский мониторинг и акушерскую помощь. Лечение ОКС не должно откладываться до родов. В идеале роды должны быть отложены как минимум на 2 недели после ОКС, так как в это время возрастает риск материнской смертности. Было показано, что СДКА является наиболее частой причиной ОИМ при беременности, и это, как правило, происходит в основном на поздних сроках беременности или в раннем послеродовом периоде.
6. Пациенты с онкологическими заболеваниями.
Четыре наиболее распространенных типа рака у пациентов с ОКС: простатит, молочная железа, толстая кишка и легкое.[21] Пациентов с раком в анамнезе следует лечить так же, как и всех остальных пациентов с ОКС, однако ведение пациентов с ОКС, у которых рак находится в активной стадии, имеет ряд специфических моментов, которые необходимо учитывать. Исходы различаются в зависимости от типа рака и баланс между рисками ишемии и кровотечения должен рассматриваться в индивидуальном порядке.
Процент пациентов с ОКС с текущим диагнозом рака растет и в настоящее время составляет ∼3% пациентов в крупных обсервационных исследованиях. Пациенты с активным раком, страдающие ОКС, представляют собой серьезную проблему, поскольку существуют значительные пробелы в научных знаниях. Поэтому рекомендаций, основанных на убедительных доказательствах, недостаточно. Пациенты с активным онкологическим заболеванием, протекающим с ОКС, как правило, старше, с большим количеством сопутствующих заболеваний и более обширным САД. Эти пациенты часто имеют сопутствующие гематологические и коагуляционные нарушения, которые могут представлять трудности как в отношении антитромботической терапии, так и в отношении проведения PCI. В обсервационных исследованиях сообщалось, что ОКС у пациентов с раком ассоциируется с повышенным риском основных сердечно-сосудистых событий, кровотечений, кардиальной и некардиальной смертности.[22] Согласно критериям ARC-HBR, пациенты с активным раком, диагностированным за последние 12 месяцев, считаются пациентами с высоким риском кровотечений.
Диагностика ОКС у пациентов с раком должна основываться на тех же принципах, что и у пациентов без рака. Лечение ОКС у пациентов с раком может быть сложным из-за хрупкости, повышенного риска кровотечений, тромбоцитопении и повышенного тромботического риска. Рекомендуется временное прекращение лечения рака и срочный мультидисциплинарный подход[23]. Сообщалось, что онкологические пациенты с ОКС реже подвергаются инвазивному лечению; тем не менее, инвазивное лечение (и ЧКВ с DES при необходимости) рекомендуется у онкологических пациентов с ОКС, если прогноз составляет >6 месяцев или, независимо от прогноза, если пациент нестабилен. Ретроспективные данные сообщают как о более редком использовании инвазивного лечения у онкологических пациентов с STEMI, так и о лучших исходах у пациентов, которым инвазивное лечение все же было проведено. По имеющимся данным, инвазивное лечение у пациентов с поздними стадиями рака или ожидаемой продолжительностью жизни <6 месяцев не дает преимущества в отношении смертности по сравнению с консервативным подходом, поэтому у таких пациентов следует рассматривать консервативную стратегию. Если анатомия коронарных сосудов не поддается PCI, после обсуждения с мультидисциплинарной командой и при прогнозе рака >12 месяцев может быть рассмотрена возможность проведения операции АКШ. Учитывая, что они относятся к группе ВРК, предпочтительным ингибитором P2Y12 у больных ОКС с активным раком является клопидогрель. При использовании тикагрелора или клопидогреля следует проверять потенциальные лекарственные взаимодействия с противораковыми препаратами, поскольку возможно возникновение некоторых фармакокинетических взаимодействий между препаратами через CYP450.
Процент пациентов с ОКС с текущим диагнозом рака растет и в настоящее время составляет ∼3% пациентов в крупных обсервационных исследованиях. Пациенты с активным раком, страдающие ОКС, представляют собой серьезную проблему, поскольку существуют значительные пробелы в научных знаниях. Поэтому рекомендаций, основанных на убедительных доказательствах, недостаточно. Пациенты с активным онкологическим заболеванием, протекающим с ОКС, как правило, старше, с большим количеством сопутствующих заболеваний и более обширным САД. Эти пациенты часто имеют сопутствующие гематологические и коагуляционные нарушения, которые могут представлять трудности как в отношении антитромботической терапии, так и в отношении проведения PCI. В обсервационных исследованиях сообщалось, что ОКС у пациентов с раком ассоциируется с повышенным риском основных сердечно-сосудистых событий, кровотечений, кардиальной и некардиальной смертности.[22] Согласно критериям ARC-HBR, пациенты с активным раком, диагностированным за последние 12 месяцев, считаются пациентами с высоким риском кровотечений.
Диагностика ОКС у пациентов с раком должна основываться на тех же принципах, что и у пациентов без рака. Лечение ОКС у пациентов с раком может быть сложным из-за хрупкости, повышенного риска кровотечений, тромбоцитопении и повышенного тромботического риска. Рекомендуется временное прекращение лечения рака и срочный мультидисциплинарный подход[23]. Сообщалось, что онкологические пациенты с ОКС реже подвергаются инвазивному лечению; тем не менее, инвазивное лечение (и ЧКВ с DES при необходимости) рекомендуется у онкологических пациентов с ОКС, если прогноз составляет >6 месяцев или, независимо от прогноза, если пациент нестабилен. Ретроспективные данные сообщают как о более редком использовании инвазивного лечения у онкологических пациентов с STEMI, так и о лучших исходах у пациентов, которым инвазивное лечение все же было проведено. По имеющимся данным, инвазивное лечение у пациентов с поздними стадиями рака или ожидаемой продолжительностью жизни <6 месяцев не дает преимущества в отношении смертности по сравнению с консервативным подходом, поэтому у таких пациентов следует рассматривать консервативную стратегию. Если анатомия коронарных сосудов не поддается PCI, после обсуждения с мультидисциплинарной командой и при прогнозе рака >12 месяцев может быть рассмотрена возможность проведения операции АКШ. Учитывая, что они относятся к группе ВРК, предпочтительным ингибитором P2Y12 у больных ОКС с активным раком является клопидогрель. При использовании тикагрелора или клопидогреля следует проверять потенциальные лекарственные взаимодействия с противораковыми препаратами, поскольку возможно возникновение некоторых фармакокинетических взаимодействий между препаратами через CYP450.
Если острая ишемия спровоцирована лечением рака, после обсуждения с мультидисциплинарной командой следует рассмотреть альтернативные методы лечения рака. Некоторые специфические методы лечения рака могут оказывать кардиотоксическое сосудистое действие, которое может привести к ОКС. После ОКС рекомендуется пересмотреть список онкологических препаратов и прекратить прием любого онкологического препарата, связанного с тромбозом и ИМ. Онкологические препараты, не связанные с ИМ, могут быть возобновлены после завершения реваскуляризации (при наличии показаний) и стабилизации состояния пациента на медикаментозной терапии ОКС без осложнений.
По рекомендациям Европейского общества кардиологов 2023г.
| Рекомендации | Класс | Уровень |
| Для инвазивных стратегий рекомендуется использовать низко- или изоосмолярные контрастные вещества (в минимально возможном объеме). | I | A |
| Гидратация во время и после ангиографии должна рассматриваться у пациентов с риском развития контраст-индуцированной нефропатии, особенно у пациентов с острым повреждением почек и/или ЦП с показателем СКФ <30 мл/мин | IIa | B |
| У пожилых пациентов рекомендуется применять те же стратегии диагностики и лечения, что и у молодых пациентов. | I | B |
| Для пожилых пациентов с сопутствующими заболеваниями рекомендуется комплексный индивидуальный подход к интервенционному и фармакологическому лечению после тщательной оценки рисков и преимуществ. | I | B |
| Инвазивная стратегия рекомендуется онкологическим пациентам, поступающим с высоким риском ОКС с ожидаемой выживаемостью ≥6 месяцев. | I | B |
| Консервативная неинвазивная стратегия должна рассматриваться у пациентов с ОКС с плохим онкологическим прогнозом (т.е. с ожидаемой выживаемостью <6 месяцев) и/или очень высоким риском кровотечения. | IIa | C |
| Аспирин не рекомендуется применять у онкологических больных с количеством тромбоцитов <10 000/мкл. | III | C |
| Клопидогрель не рекомендуется принимать онкологическим больным с количеством тромбоцитов <30 000/мкл. | III | C |
| У больных СКВ с раком и количеством тромбоцитов <50 000/мкл прасугрел или тикагрелор не рекомендуются. | III | C |
ИНФАРКТ МИОКАРДА С НЕОБСТРУКТИВНЫМИ КОРОНАРНЫМИ АРТЕРИЯМИ.
Под инфарктом миокарда с необструктивными коронарными артериями (MINOCA) понимается клиническая ситуация, когда у пациента имеются симптомы, указывающие на ОКС, повышение тропонина и необструктивные коронарные артерии на момент проведения коронарной ангиографии (определяется как стеноз коронарной артерии <50% в любом крупном эпикардиальном сосуде). Данные о распространенности MINOCA широко варьируют в разных исследованиях (от 1 до 14 % пациентов с ОКС, которым проводилась ангиография). МИНОКА можно рассматривать как зонтичный термин, который охватывает гетерогенную группу причин, лежащих в основе заболевания. К ним относятся как коронарные, так и некоронарные патологии, причем последние включают как кардиальные, так и экстракардиальные нарушения.
Когда диагноз не установлен после коронарной ангиографии, MINOCA представляет собой рабочий диагноз, а не окончательный. Клиницистам крайне важно провести дополнительные обследования и исследования, чтобы установить основную причину МИНОКА, что позволит установить окончательный диагноз и правильно вести пациента. Невыявление основной причины МИНОКА может привести к неадекватной или неправильной терапии. ИКА является рекомендуемым окончательным диагностическим тестом для пациентов с ОКС. Если основная причина МИНОКА не установлена только с помощью ИКА, дальнейшая оценка с помощью левой вентрикулографии (включая измерение конечного диастолического давления в ЛЖ), функциональная оценка с измерением микрососудистой функции/коронарной реактивности и внутрисосудистая визуализация могут быть полезны для выявления основной причины. Термин "функциональная коронарная ангиография" означает сочетание коронарной ангиографии с дополнительными тестами (например, тестами на микрососудистую дисфункцию коронарных сосудов и вазореактивность).
Коронарные причины:
- Коронарная эмболия
- Коронарная микрососудистая дисфункция
- Коронарный спазм
- Коронарный тромбоз
- Смыкание миокарда
- Разрыв/эрозия бляшки
- Спонтанная диссекция коронарной артерии
Некоронарные, сердечные причины:
- Травма сердца
- Кардиомиопатия
- Кардиотоксины
- Миокардит
- Напряженная физическая нагрузка
- Кардиомиопатия Такоцубо
- Отторжение трансплантата
Если основная причина MINOCA не установлена с помощью функциональной коронарной ангиографии, рекомендуется неинвазивная визуализация (например, эхокардиография, КМР, КТ) в зависимости от клинической ситуации. КМР является одним из ключевых диагностических инструментов для определения основной причины MINOCA. КМР может выявить основную причину у 87% пациентов с рабочим диагнозом MINOCA и должна быть проведена как можно скорее после поступления таких пациентов, чтобы максимизировать диагностический результат, в идеале - во время показательной госпитализации.
Диагностика основной причины MINOCA позволит начать соответствующее лечение на основании окончательного диагноза. Терапия вторичной профилактики должна рассматриваться для тех, у кого есть признаки коронарной атеросклеротической болезни, и для контроля факторов риска. Лечение синдрома Такоцубо не опирается на данные проспективных РКИ, и лечение в основном носит поддерживающий и эмпирический характер.
| Рекомендации | Класс | Уровень |
| Пациентам с рабочим диагнозом MINOCA после инвазивной ангиографии рекомендуется проведение КМРисследования, если окончательный диагноз не ясен |
I |
B |
| Рекомендуется вести MINOCA в соответствии с окончательно установленным основным диагнозом, согласно соответствующим рекомендациям по лечению конкретного заболевания. |
I |
B |
| Всем пациентам с первоначальным рабочим диагнозом MINOCA рекомендуется следовать диагностическому алгоритму для определения основного окончательного диагноза | I | C |
Спонтанная диссекция коронарной артерии.
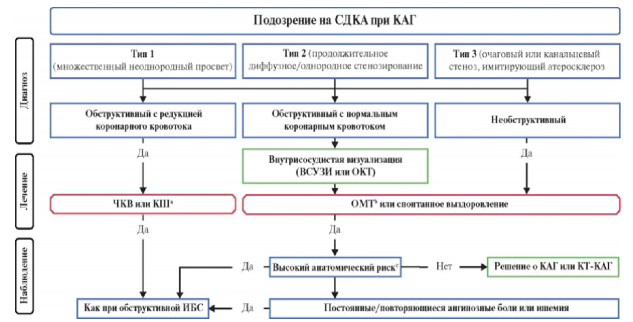
СДКА определяется как неатеросклеротическое, нетравматическое или ятрогенное расслоение коронарных артерий, вторичное по отношению к кровотечению из vasa vasorum или разрыву интимы, которое создает ложный просвет, коронарную компрессию и следующую за ней ишемию миокарда [24].
На СДКА приходится до 4% всех ОКС, но есть сообщения, что частота данной патологии намного выше (22-35% ОКС) у женщин <60 лет, при ИМ, связанном с беременностью, и у пациентов с фиброзно-мышечными заболеваниями в анамнезе, дисплазией соединительной ткани, повышенной тревожностью, депрессией или предшествующими психоневрологическими заболеваниями [25,26]. Клинические проявления могут значительно различаться, но повышение сердечных биомаркеров, связанное с дискомфортом в груди, — это наиболее частое проявление патологии. Существует три ангиографических типа СДКА, начиная от отсутствия обструкции до полной окклюзии коронарной артерии. Тип 1 СДКА (контрастирование артерии с множественным неоднородным просветом) и Тип 2 СДКА (продолжительное диффузное/однородное стенозирование) без окклюзии коронарной артерии (стеноз <50%) описаны как возможные причины ИМ без окклюзий коронарных артерии (см. Раздел 7), в то время как СДКА Тип 2 с тяжелой коронарной обструкцией (>50%) и СДКА Тип 3 (очаговый или протяженный стеноз, имитирующий атеросклероз) следует рассматривать отдельно. Поскольку СДКА может быть пропущена или не обнаружена на ККТА, отсутствие визуализации данной патологии не должно исключать диагноз СДКА. Интракоронарная визуализация (оптическая когерентная томография (ОКТ) и внутрисосудистое ультразвуковое исследование (ВСУЗИ)) могут быть наиболее точными методами в неоднозначных ситуациях для подтверждения наличия интрамуральной гематомы или двойного просвета [27]. Это может иметь важное значение для постановки правильного диагноза. Оптимальная тактика ведения СДКА все еще неясна, поскольку еще нет РКИ, сравнивающих медикаментозную терапию со стратегиями реваскуляризации при данной патологии. По имеющимся данным, консервативный подход должен быть предпочтительной стратегией, за исключением групп пациентов очень высокого риска [28, 29]. Выбор между консервативным лечением и выполнением операции ЧКВ или КШ должен быть индивидуальным для каждого пациента и основан как на клинических, так и на ангиографических данных. Возможный алгоритм лечения показан на рисунке 11. Оптимальное лечение для пациентов с СДКА все еще не определено, но т.к. артериальная гипертензия является независимым предиктором повторного СДКА, следует рассмотреть применение агрессивной антигипертензивной терапии для обеспечения оптимального контроля уровня артериального давления [30, 31].
На СДКА приходится до 4% всех ОКС, но есть сообщения, что частота данной патологии намного выше (22-35% ОКС) у женщин <60 лет, при ИМ, связанном с беременностью, и у пациентов с фиброзно-мышечными заболеваниями в анамнезе, дисплазией соединительной ткани, повышенной тревожностью, депрессией или предшествующими психоневрологическими заболеваниями [25,26]. Клинические проявления могут значительно различаться, но повышение сердечных биомаркеров, связанное с дискомфортом в груди, — это наиболее частое проявление патологии. Существует три ангиографических типа СДКА, начиная от отсутствия обструкции до полной окклюзии коронарной артерии. Тип 1 СДКА (контрастирование артерии с множественным неоднородным просветом) и Тип 2 СДКА (продолжительное диффузное/однородное стенозирование) без окклюзии коронарной артерии (стеноз <50%) описаны как возможные причины ИМ без окклюзий коронарных артерии (см. Раздел 7), в то время как СДКА Тип 2 с тяжелой коронарной обструкцией (>50%) и СДКА Тип 3 (очаговый или протяженный стеноз, имитирующий атеросклероз) следует рассматривать отдельно. Поскольку СДКА может быть пропущена или не обнаружена на ККТА, отсутствие визуализации данной патологии не должно исключать диагноз СДКА. Интракоронарная визуализация (оптическая когерентная томография (ОКТ) и внутрисосудистое ультразвуковое исследование (ВСУЗИ)) могут быть наиболее точными методами в неоднозначных ситуациях для подтверждения наличия интрамуральной гематомы или двойного просвета [27]. Это может иметь важное значение для постановки правильного диагноза. Оптимальная тактика ведения СДКА все еще неясна, поскольку еще нет РКИ, сравнивающих медикаментозную терапию со стратегиями реваскуляризации при данной патологии. По имеющимся данным, консервативный подход должен быть предпочтительной стратегией, за исключением групп пациентов очень высокого риска [28, 29]. Выбор между консервативным лечением и выполнением операции ЧКВ или КШ должен быть индивидуальным для каждого пациента и основан как на клинических, так и на ангиографических данных. Возможный алгоритм лечения показан на рисунке 11. Оптимальное лечение для пациентов с СДКА все еще не определено, но т.к. артериальная гипертензия является независимым предиктором повторного СДКА, следует рассмотреть применение агрессивной антигипертензивной терапии для обеспечения оптимального контроля уровня артериального давления [30, 31].
Медицинская реабилитация
РЕАБИЛИТАЦИЯ И ВТОРИЧНАЯ ПРОФИЛАКТИКА У БОЛЬНЫХ ПОСЛЕ ВЫПОЛНЕНИЯ пЧКВ ПО ПОВОДУ OИMпST.
Важность реабилитационного этапа и мероприятий вторичной профилактики у пациентов с ОИМпST, перенесших пЧКВ нельзя недооценивать. Именно во время реабилитации необходимо оценить комплаентность больного предписанной терапии, скорректировать потенциальные факторы риска, влияющие на прогноз. Во многом именно от этого зависит отдаленная эффективность лечебных мероприятий, выполненных ранее.
В общих чертах реабилитационный этап больного после первичного ЧКВ должен соответствовать классическим принципам восстановительного лечения после инфаркт миокарда. Этапность реабилитации с включением стационарного, поликлинического и санаторно-курортного периодов — залог достижения ключевых показателей здоровья пациента после вмешательства. Обязательные программы индивидуальных физических тренировок, занятия на образовательных курсах для пациентов, отказ от вредных привычек и коррекция образа жизни — важнейшие составляющие результативности системного подхода наряду с обязательным соблюдением режима назначенной фармакотерапии. Только комплексный, ответственный подход с максимальным соблюдением положений разработанных международных рекомендаций и максимальная персонификация тактических приемов с учетом клинико-характерологических особенностей пациента на всех этапах лечения могут обеспечить достижение положительных результатов лечения при ОИМ с подъемом сегмента ST.
В общих чертах реабилитационный этап больного после первичного ЧКВ должен соответствовать классическим принципам восстановительного лечения после инфаркт миокарда. Этапность реабилитации с включением стационарного, поликлинического и санаторно-курортного периодов — залог достижения ключевых показателей здоровья пациента после вмешательства. Обязательные программы индивидуальных физических тренировок, занятия на образовательных курсах для пациентов, отказ от вредных привычек и коррекция образа жизни — важнейшие составляющие результативности системного подхода наряду с обязательным соблюдением режима назначенной фармакотерапии. Только комплексный, ответственный подход с максимальным соблюдением положений разработанных международных рекомендаций и максимальная персонификация тактических приемов с учетом клинико-характерологических особенностей пациента на всех этапах лечения могут обеспечить достижение положительных результатов лечения при ОИМ с подъемом сегмента ST.
По Рекомендациям Европейского общества кардиологов 2023г.
| Рекомендации | Класс | Уровень |
| После выполнения КШ или ЧКВ по поводу инфаркта миокарда пациентам рекомендуется участие в программах реабилитации для улучшения прогноза. |
I |
A |
| После реваскуляризации миокарда рекомендуется инициировать и поощрять меры вторичной профилактики, включающие медикаментозную терапию и смену образа жизни. |
I |
A |
| Рекомендуется ведение пациентов после реваскуляризации миокарда (через 3 мес. и далее, как минимум, ежегодно) с пересмотром симптомов и оценки комплаентности в отношении медикаментозной терапии и вторичной профилактики, поощрением приверженности медикаментозной терапии и смене образа жизни, если уместно. |
I |
C |
| Бессимптомное течение заболевания. | ||
| Контрольное исследование с помощью визуализирующих неинвазивных методов пациентам высокого риска рекомендовано через 6 мес. после реваскуляризации. |
IIb |
С |
| Рутинное неинвазивное визуализирующее тестирование с нагрузкой может быть рекомендовано через 1 год после ЧКВ и через 5 лет после КШ. | IIb | С |
Информация
Источники и литература
-
Клинические протоколы Министерства здравоохранения Кыргызской Республики
- Клинические протоколы Министерства здравоохранения Кыргызской Республики - 1. Ibanez B, James S, ESC Scientific Document Group. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST- segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J 2018;39:119–177. 2. Thygesen K , Alpert JS , Jaffe AS , Chaitman BR , Bax JJ , Morrow DA , White HD , ESC Scientific Document Group. Fourth universal definition of myocardial infarction (2018). Eur Heart J 2019; 40:237–269. 3. Chapman AR , Shah ASV , Lee KK , Anand A , Francis O , Adamson P , McAllister DA , Strachan FE , Newby DE , Mills NL. Long-term outcomes in patients with type 2 myocardial infarction and myocardial injury. Circulation 2018;137:1236–1245. 4. Zhang J, Gao X , Kan J , Intravascular ultrasound versus angiography-guided drug-eluting stent implantation: the ULTIMATE trial. J Am Coll Cardiol 2018; 72:3126–3137. 5. 2018 ESC/EACTS Guidelines on myocardial revascularization; https://academic.oup.com/eurheartj/article/40/2/87/5079120#google_vignette 6. Lee P, Liew D, Brennan A, Stub D, Lefkovits J, Reid CM, et al. Cost- effectiveness of radial access percutaneous coronary intervention in acute coronary syndrome. Am J Cardiol 2021; 156:44–51. https://doi.org/10.1016/j.amjcard.2021.06.034; 2023 ESC Guidelines for the management of acute coronary syndromes: Developed by the task force on the management of acute coronary syndromes of the European Society of Cardiology (ESC); European Heart Journal, Volume 44, Issue 38, 7 October 2023, Pages 3720–3826, https://doi.org/10.1093/eurheartj/ehad191 7. Astin F, Stephenson J, Probyn J, Holt J, Marshall K, Conway D. Cardiologists’ and patients’ views about the informed consent process and their understanding of the anticipated treatment benefits of coronary angioplasty: a survey study. Eur J Cardiovasc Nurs 2020; 19:260–268. https://doi.org/10.1177/1474515119879050 8. Grant EV, Summapund J, Matlock DD, Vaughan Dickson V, Iqbal S, Patel S, et al. Patient and cardiologist perspectives on shared decision making in the treatment of older adults hospitalized for acute myocardial infarction. Med Decis Making 2020; 40:279–288. https://doi.org/10.1177/0272989x20912293 9. Shah P, Thornton I, Turrin D, Hipskind JE. Informed consent. In: StatPearls. Treasure Island (FL): StatPearls Publishing, Copyright © 2022, StatPearls Publishing LLC, 2022. 10. Lemkes JS, Janssens GN, van der Hoeven NW, van de Ven PM, Marques KMJ, Nap A, et al. Timing of revascularization in patients with transient ST-segment elevation myocardial infarction: a randomized clinical trial. Eur Heart J 2019; 40:283–291. https://doi.org/10.1093/eurheartj/ehy651 11. Bouisset F, Gerbaud E, Bataille V, Coste P, Puymirat E, Belle L, et al. Percutaneous myocardial revascularization in late-presenting patients with STEMI. J Am Coll Cardiol 2021; 78:1291–1305. 12. Knuuti J, Wijns W, Saraste A, Capodanno D, Barbato E, Funck-Brentano C, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J 2020; 41:407–477. 13. Schüpke S, Neumann FJ, Menichelli M, Mayer K, Bernlochner I, Wöhrle J, et al. Ticagrelor or prasugrel in patients with acute coronary syndromes. N Engl J Med 2019; 381:1524–1534. 14. Coughlan JJ, Aytekin A, Lahu S, Ndrepepa G, Menichelli M, Mayer K, et al. Ticagrelor or prasugrel for patients with acute coronary syndrome treated with percutaneous coronary intervention: a prespecified subgroup analysis of a randomized clinical trial. JAMA Cardiol 2021; 6:1121–1129. 15. Gimbel M, Qaderdan K, Willemsen L, Hermanides R, Bergmeijer T, de Vrey E, et al. Clopidogrel versus ticagrelor or prasugrel in patients aged 70 years or older with non-ST-elevation acute coronary syndrome (POPular AGE): the randomised, open-label, non-inferiority trial. Lancet 2020; 395:1374–1381. https://doi.org/10.1016/s0140-6736(20)30325-1 16. Investigators A. Acetylcysteine for prevention of renal outcomes in patients undergoing coronary and peripheral vascular angiography; main results from the randomized Acetylcysteine for Contrast-induced nephropathy Trial (ACT)//Circulation. 20LL Vol. 124. P. 1250-1259. 17. Vicente-Ibarra N, Marín F, Pernías-Escrig V, Sandín-Rollán M, Núñez- Martínez L, Lozano T, et al. Impact of anemia as risk factor for major bleeding and mortality in pa- tients with acute coronary syndrome. Eur J Intern Med 2019; 61:48–53. https://doi.org/ 10.1016/j.ejim.2018.12.004 18. Ducrocq G, Gonzalez-Juanatey JR, Puymirat E, Lemesle G, Cachanado M, Durand-Zaleski I, et al. Effect of a restrictive vs liberal blood transfusion strategy on major cardiovascular events among patients with acute myocardial infarction and an- emia: the REALITY randomized clinical trial. JAMA 2021; 325:552–560. https://doi.org/ 10.1001/jama.2021.0135 19. Gonzalez-Juanatey JR, Lemesle G, Puymirat E, Ducrocq G, Cachanado M, Arnaiz JA, et al. One-year major cardiovascular events after restrictive versus liberal blood trans- fusion strategy in patients with acute myocardial infarction and anemia: the REALITY randomized trial. Circulation 2022; 145:486–488. https://doi.org/10.1161/ circulationaha.121.057909 20. Regitz-Zagrosek V, Roos-Hesselink JW, Bauersachs J, Blomström-Lundqvist C, Cífková R, De Bonis M, et al. 2018 ESC Guidelines for the management of cardiovascular dis- eases during pregnancy. Eur Heart J 2018; 39:3165–3241. https://doi.org/10.1093/ eurheartj/ehy340 21. Bharadwaj A, Potts J, Mohamed MO, Parwani P, Swamy P, Lopez-Mattei JC, et al. Acute myocardial infarction treatments and outcomes in 6.5 million patients with a current or historical diagnosis of cancer in the USA. Eur Heart J 2020; 41:2183–2193. https:// doi.org/10.1093/eurheartj/ehz851 22. Potts JE, Iliescu CA, Lopez Mattei JC, Martinez SC, Holmvang L, Ludman P, et al. Percutaneous coronary intervention in cancer patients: a report of the prevalence and outcomes in the United States. Eur Heart J 2019; 40:1790–1800. https://doi.org/ 10.1093/eurheartj/ehy769 23. Lancellotti P, Suter TM, López-Fernández T, Galderisi M, Lyon AR, Van der Meer P, et al. Cardio-Oncology Services: rationale, organization, and implementation. Eur Heart J 2019; 40:1756–1763. https://doi.org/10.1093/eurheartj/ehy453 24. Saw J, Mancini GBJ, Humphries KH. Contemporary Review on Spontaneous Coronary Artery Dissection. Journal of the Ameri- can College of Cardiology. 2016;68(3):297–312. DOI: 10.1016/j. jacc.2016.05.034 25. DeMaio SJ, Kinsella SH, Silverman ME. Clinical course and long-term prognosis of spontaneous coronary artery dissection. The American Journal of Cardiology. 1989;64(8):471–4. PMID: 2773790 26. Saw J, Aymong E, Sedlak T, Buller CE, Starovoytov A, Ricci D et al. Spontaneous Coronary Artery Dissection: Association With Predisposing Arteriopathies and Precipitating Stressors and Cardiovascular Outcomes. Circulation: Cardiovascular Interventions. 2014;7(5):645–55. DOI: 10.1161/CIRCINTER- VENTIONS.114.001760. 27. European Heart Journal. 2019;40,87-165. doi:10.1093/eurheartj/ehy394. 28. Rogowski S, Maeder MT, Weilenmann D, Haager PK, Ammann P, Rohner F et al. Spontaneous Coronary Artery Dissection: Angiographic Follow-Up and Long-Term Clinical Outcome in a Predominantly Medically Treated Population. Catheterization and Cardiovascular Interventions. 2017;89(1):59–68. DOI: 10.1002/ccd.26383. 29. Hayes SN, Kim ESH, Saw J, Adlam D, Arslanian-Engoren C, Economy KE et al. Spontaneous Coronary Artery Dissection: Current State of the Science: A Scientific Statement From the American Heart Association. Circulation. 2018;137(19):e523– 57. DOI: 10.1161/CIR.0000000000000564 30. Saw J, Humphries K, Aymong E, Sedlak T, Prakash R, Starovoytov A et al. Spontaneous Coronary Artery Dissection: clinical outcomes and risk of recurrence. Journal of the American College of Cardiology. 2017;70(9):1148–58. DOI: 10.1016/j.jacc.2017.06.053 31. Tweet MS, Olin JW. Insights Into Spontaneous Coronary Artery Dissection: Can Recurrence Be Prevented? Journal of the American College of Cardiology. 2017;70(9):1159–61. DOI: 10.1016/j. jacc.2017.07.726
Информация
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ВНЕДРЕНИЯ ПРОТОКОЛА
Список разработчиков руководства:
Руководитель группы
Дадабаев М.Х. – доктор медицинских наук, профессор, заведующий отделением РХСиС НЦКиТ.
Дадабаев М.Х. – доктор медицинских наук, профессор, заведующий отделением РХСиС НЦКиТ.
Ответственные исполнители:
Эшмамбетова А.А. – научный сотрудник отделения РХСиС НЦКТ.
Жоошев К.Т. – кандидат медицинских наук, врач-кардиохирург отделения РХСиС НЦКТ.
Дуйшемаматов Ы.М. - врач-рентгенхирург отделения РХСиС НЦКиТ.
Жоошев К.Т. – кандидат медицинских наук, врач-кардиохирург отделения РХСиС НЦКТ.
Дуйшемаматов Ы.М. - врач-рентгенхирург отделения РХСиС НЦКиТ.
Медицинские консультанты
|
Мураталиев Т.М. |
д. м. н., профессор, консультант отделения острого инфаркта миокарда НЦКиТ
|
НЦКиТ
|
|
Бейшенкулов М.Т.
|
д.м.н., профессор, заведующий отделением УКиР НЦКиТ
|
НЦКиТ
|
Внешняя и внутренняя экспертиза
|
Сабиров И.С.
|
д. м. н., профессор, зав. кафедрой терапией №2 КРСУ
|
внутренний рецензент
|
|
Стаферов А.В.
|
к.м.н. Стаферов А.В. (Москва, Россия)
|
внешний рецензент
|
Конфликт интересов: отсутствует.
Условия пересмотра руководства: пересмотр руководства через 3 года после его опубликования и с даты его вступления в действие или при наличии новых методов с высоким уровнем доказательности.
Клиническое руководство предназначено врачам службы скорой медицинской помощи, семейным врачам, врачам ургентных и плановых кардиологических и терапевтических отделений стационаров, рентгенхирургам, интервенционным кардиологам, организаторам здравоохранения, экспертам ФОМС.
Условия пересмотра руководства: пересмотр руководства через 3 года после его опубликования и с даты его вступления в действие или при наличии новых методов с высоким уровнем доказательности.
Клиническое руководство предназначено врачам службы скорой медицинской помощи, семейным врачам, врачам ургентных и плановых кардиологических и терапевтических отделений стационаров, рентгенхирургам, интервенционным кардиологам, организаторам здравоохранения, экспертам ФОМС.
Список сокращений
АБ — атеросклеротическая бляшка
АВК — антагонисты витамина
АВС — активированное время свертывания крови
AГ — артериальная гипертензия
АД — артериальное давление
АКШ — аортокоронарное шунтирование
АСТ — аспартатаминотрансфераза
АЧТВ — активированное частичное тромбопластиновое время
БРИТ — блок реанимации и интенсивной терапии
БСК – болезни системы кровообращения
ВЧ-тропонин – высокочувствительный тест для определения тропонина
ГНМВ — гепарины с низким молекулярным весом
ГП IIb/IIIa-рецепторы — гликопротеиновые рецепторы IIb/IIIa
ДАТТ — двойная антитромбоцитарная терапия
ДМЖП — дефект межжелудочковой перегородки
ЖКК — желудочно-кишечное кровотечение
ЖТ — желудочковая тахикардия
ЖЭ — желудочковая экстрасистолия
ИБС — ишемическая болезнь сердца
ИВЛ — искусственная вентиляция легких
ИБК — интрааортальная баллонная контрпульсация
ИМбпST — инфаркт миокарда без подъема сегмента ST
ИМпST — инфаркт миокарда с подъемом сегмента ST
ИМПЖ — инфаркт миокарда правого желудочка
ИСА — инфаркт-связанная артерия
ИМТ — индекс массы тела
АВК — антагонисты витамина
АВС — активированное время свертывания крови
AГ — артериальная гипертензия
АД — артериальное давление
АКШ — аортокоронарное шунтирование
АСТ — аспартатаминотрансфераза
АЧТВ — активированное частичное тромбопластиновое время
БРИТ — блок реанимации и интенсивной терапии
БСК – болезни системы кровообращения
ВЧ-тропонин – высокочувствительный тест для определения тропонина
ГНМВ — гепарины с низким молекулярным весом
ГП IIb/IIIa-рецепторы — гликопротеиновые рецепторы IIb/IIIa
ДАТТ — двойная антитромбоцитарная терапия
ДМЖП — дефект межжелудочковой перегородки
ЖКК — желудочно-кишечное кровотечение
ЖТ — желудочковая тахикардия
ЖЭ — желудочковая экстрасистолия
ИБС — ишемическая болезнь сердца
ИВЛ — искусственная вентиляция легких
ИБК — интрааортальная баллонная контрпульсация
ИМбпST — инфаркт миокарда без подъема сегмента ST
ИМпST — инфаркт миокарда с подъемом сегмента ST
ИМПЖ — инфаркт миокарда правого желудочка
ИСА — инфаркт-связанная артерия
ИМТ — индекс массы тела
КА — коронарная артерия
КАГ— коронарная ангиография
КК — клиренс креатинина
КФК — креатинфосфокиназа
КШ — кардиогенный шок
ЛЖ — левый желудочек
МНО — международное нормализованное отношение
МРТ — магнитно-резонансная томография
МСКТ — мультиспиральная компьютерная томография
НМГ — низкомолекулярный гепарин
НПВС — нестероидные противовоспалительные средства
НФГ — нефракционированный гепарин
ОАК — пероральные антикогулянты ОКС — острый коронарный синдром
ОКСбпST — острый коронарный синдром без подъема сегмента ST на ЭКГ
ОКСпST — острый коронарный синдром с подъемом сегмента ST на ЭКГ
ОСН — острая сердечная недостаточность
ПЖ — правый желудочек
ПОАК — прямые пероральные антикоагулянты (апиксабан, дабигатрана этексилат, ривароксабан)
РМЖП — разрыв межжелудочковой перегородки
РП — реперфузионное повреждение
РССЛЖ — разрыв свободной стенки левого желудочка
рСКФ — расчетная скорость клубочковой фильтрации (с использованием формул CKD-EPI, MDRD)
СД — сахарный диабет
СИ — сердечный индекс
КАГ— коронарная ангиография
КК — клиренс креатинина
КФК — креатинфосфокиназа
КШ — кардиогенный шок
ЛЖ — левый желудочек
МНО — международное нормализованное отношение
МРТ — магнитно-резонансная томография
МСКТ — мультиспиральная компьютерная томография
НМГ — низкомолекулярный гепарин
НПВС — нестероидные противовоспалительные средства
НФГ — нефракционированный гепарин
ОАК — пероральные антикогулянты ОКС — острый коронарный синдром
ОКСбпST — острый коронарный синдром без подъема сегмента ST на ЭКГ
ОКСпST — острый коронарный синдром с подъемом сегмента ST на ЭКГ
ОСН — острая сердечная недостаточность
ПЖ — правый желудочек
ПОАК — прямые пероральные антикоагулянты (апиксабан, дабигатрана этексилат, ривароксабан)
РМЖП — разрыв межжелудочковой перегородки
РП — реперфузионное повреждение
РССЛЖ — разрыв свободной стенки левого желудочка
рСКФ — расчетная скорость клубочковой фильтрации (с использованием формул CKD-EPI, MDRD)
СД — сахарный диабет
СИ — сердечный индекс
СДКА — спонтанная диссекция коронарной артерии
СМП — скорая медицинская помощь
СН — сердечная недостаточность
СР — спонтанная реперфузия
ТГВ – тромбоз глубоких вен нижних конечностей
ТИА – транзиторная ишемическая атака
ТЛТ — тромболитическая терапия
ТП — трепетание предсердий
ТЭЛА – тромбоэмболия легочных артерий
УЗИ — ультразвуковое исследование
ФВ — фракция выброса
ФЖ — фибрилляция желудочков
ФК – функциональный класс
ФП — фибрилляция предсердий
ФР — фактор риска
ХБП – хроническая болезнь почек
ХС — холестерин
ХСН — хроническая сердечная недостаточность
ЧКВ — чрескожное коронарное вмешательство
ЧКВ-центр — стационар с возможностью круглосуточного выполнения
ЧКВ ЧПЭС — чреспищеводная стимуляция сердца
ЧСС — частота сердечных сокращений
ЭИТ — электроимпульсная терапия
ЭКГ — электрокардиография (электрокардиограмма)
ЭКС — электрокардиостимулятор
ЭП — эпистенокардитический перикардит
ЭхоКГ — эхокардиография
СМП — скорая медицинская помощь
СН — сердечная недостаточность
СР — спонтанная реперфузия
ТГВ – тромбоз глубоких вен нижних конечностей
ТИА – транзиторная ишемическая атака
ТЛТ — тромболитическая терапия
ТП — трепетание предсердий
ТЭЛА – тромбоэмболия легочных артерий
УЗИ — ультразвуковое исследование
ФВ — фракция выброса
ФЖ — фибрилляция желудочков
ФК – функциональный класс
ФП — фибрилляция предсердий
ФР — фактор риска
ХБП – хроническая болезнь почек
ХС — холестерин
ХСН — хроническая сердечная недостаточность
ЧКВ — чрескожное коронарное вмешательство
ЧКВ-центр — стационар с возможностью круглосуточного выполнения
ЧКВ ЧПЭС — чреспищеводная стимуляция сердца
ЧСС — частота сердечных сокращений
ЭИТ — электроимпульсная терапия
ЭКГ — электрокардиография (электрокардиограмма)
ЭКС — электрокардиостимулятор
ЭП — эпистенокардитический перикардит
ЭхоКГ — эхокардиография
Классы рекомендаций и уровни доказательности Классификация рекомендаций
|
Классы
рекомендаций |
Определение
|
Предлагаемая
формулировка |
|
Класс I |
Доказано, что данный вид лечения или диагностики полезен или эффективен, имеют преимущества
|
Рекомендуется/ показан
|
|
Класс II |
Существуют противоречивые доказательства и/или мнения о пользе/эффективности данного вида лечения или диагностики.
|
Целесообразно применять
|
|
Класс IIa |
Преобладают доказательства/мнения, свидетельствующие о пользе/эффективности.
|
Целесообразно применять
|
|
Класс IIb |
Существующие доказательства/мнения в меньшей степени подтверждают пользу/эффективность данного вида лечения.
|
Можно применять
|
|
Класс III |
Доказано или достигнуто соглашение, что данный вид лечения или диагностики не полезен/не эффективен, а в некоторых случаях может быть вреден.
|
Не рекомендуется
|
Уровни доказательности
|
Уровень доказательности А |
Данные многочисленных рандомизированных клинических исследований или мета-анализов
|
|
Уровень доказательности В |
Данные одного рандомизированного клинического исследования или крупных нерандомизированных исследований
|
|
Уровень доказательности С |
Согласованное мнение экспертов и/или небольшие исследования, ретроспективные исследования, регистры
|
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.