Рак шейки матки
 Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Злокачественное новообразование шейки матки (C53)
Онкология
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «08» сентября 2023 года
Протокол №189
КЛИНИЧЕСКИЙ ПРОТОКОЛ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
РАК ШЕЙКИ МАТКИ
Рак шейки матки - это злокачественное новообразование шейки матки. [1-4].
Коды МКБ-10:
Сокращения, используемые в протоколе:
Категория пациентов: взрослые.
Шкала уровня доказательности:
Рак шейки матки - это злокачественное новообразование шейки матки. [1-4].
ВВОДНАЯ ЧАСТЬ
Коды МКБ-10:
|
Код
|
Название |
| C53 | Злокачественное новообразование шейки матки |
| C53.0 | Внутренней части |
| C53.1 | Наружной части |
| C53.8 | Поражение шейки матки, выходящее за пределы одной и более вышеуказанных локализаций |
| C53.9 | Шейки матки неуточненной части |
Дата разработки/пересмотра протокола: 2015 год (пересмотр 2018 г./2022 г.)
Сокращения, используемые в протоколе:
|
КТ
|
Компьютерная томография |
|
МРТ
|
Магнитно – резонансная томография |
|
ОБП
|
Органы брюшной полости |
|
ОГК
|
Органы грудной клетки |
|
ПЭТ
|
Позитронная эмиссионная томография |
|
ССС
|
Сердечно – сосудистая система |
|
ЖКТ
|
Желудочно-кишечный тракт |
|
УЗИ
|
Ультразвуковое исследование |
|
РОД
|
Разовая очаговая доза |
|
ХТ
|
Химиотерапия |
|
ПХТ
|
Полихимиотерапия |
|
НАПХТ
|
Неоадъювантная полихимиотерапия |
|
ХЛТ
|
Химиолучевая терапия |
|
FIGO
|
International Federation Gynecology and Obstetrics |
|
CIN
|
Цервикальная интраэпителиальная неоплазия |
|
РШМ
|
Рак шейки матки |
|
ПЭТ, ПЭК/КТ
|
Позитронная эмиссионная томография/ компьютерная томография |
|
ПАП
|
Мазок по Паппаниколау |
|
VAIN
|
Влагалищная интраэпителиальная неоплазия |
Пользователи протоколов: онкологи, онкогинекологи, акушер-гинекологи, хирурги, радиологи, химиотерапевты, врачи общей практики, терапевты.
Категория пациентов: взрослые.
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| В |
Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с не высоким (+) риском систематической ошибки, результаты которых могут быть
распространены на соответствующую популяцию.
|
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). Результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++или+), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование, или мнение экспертов. |
Классификация
Классификация РШМ [7]
Таблица 1. Стадирование РШМ, пересмотр FIGO 2018 г.
|
Стадия
|
Описание |
| I | Первичная опухоль не может быть определена |
| I | Опухоль ограничена маткой (распространение на тело матки не принимается во внимание) |
| IА | Инвазивная карцинома диагностируется только при микроскопии; стромальная инвазия с максимальной глубиной <5,0 мм от основания эпителия; поражение сосудистого пространства, венозного или лимфатического, не влияет на классификацию |
| I А1 | Стромальная инвазия <3,0 мм в глубину |
| I А2 | Стромальная инвазия ≥ 3,0 мм и < 5,0 мм |
| IВ | Инвазивная карцинома с глубиной инвазии ≥ 5 мм (больше, чем стадия IA), поражение ограничено шейкой матки |
| I В1 | Инвазивная карцинома с глубиной стромальной инвазии ≥ 5 мм и < 2 см в наибольшем измерении |
| I В2 | Инвазивная карцинома, от 2 см до <4 см в наибольшем измерении |
| I В3 | Инвазивная карцинома, ≥ 4 см в наибольшем измерении |
| II | Рак шейки матки распространяется за пределы матки, но не на стенку таза или нижнюю треть влагалища |
| II А | Поражение ограничено верхней третью влагалища, без параметриальной инвазии |
| II А1 | Инвазивная карцинома <4 см в наибольшем измерении |
| II А2 | Инвазивная карцинома ≥ 4 см в наибольшем измерении |
| II В | Опухоль с инвазией параметрия, но не до стенки таза |
| III | Опухоль поражает нижнюю треть влагалища и/или распространяется на стенку таза и/или вызывает гидронефроз или нефункционирующую почку и/или поражает тазовые и/или парааортальные лимфатические узлы |
| III А | Опухоль поражает нижнюю треть влагалища, не распространяется на стенки таза. |
| III В | Опухоль распространяется на стенку таза и/или вызывает гидронефроз или нефункционирующую почку. |
| III С | Вовлечение тазовых и/или парааортальных лимфатических узлов, независимо от размера и распространенности опухоли (с обозначениями r [радиологически] и p [патология]) |
| III С1 | Метастазы только в тазовые лимфатические узлы |
| III С2 | Метастазы в парааортальные лимфатические узлы |
| IV А |
Прорастание слизистой оболочки мочевого пузыря и/или
прямой кишки без выхода за пределы малого таза*
|
| IV В | Отдаленные метастазы |
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ.
Диагностические критерии
Жалобы:
на ациклические кровянистые, водянистые, гноевидные выделения из половых путей;
Боли внизу живота и в поясничной области тянущего характера;
кровотечения на фоне менопаузы.
Анамнез:
Не существует патогномоничных жалоб для карциномы шейки матки. Как правило болезнь имеет выраженную преинвазивную стадию, которая может длиться от 1 года до 5 лет и более. Микроинвазивная карцинома шейки матки обнаруживается чаще всего при случайном обращении. Причиной обращения женщин с диагнозом рак шейки матки в стадии Ib1- IIa2 к гинекологу являются кровянистые выделения из половых путей. При более поздних стадиях (IIb-IVa) присоединяются жалобы на боли в поясничной области, внизу живота.
Бимануальный осмотр:
Физикальные обследования.
Гинекологический осмотр:
состояние наружных половых органов;
осмотр влагалища и шейки матки на зеркалах (наличие инфильтрации влагалища, метастатических очагов на стенках влагалища, размеры, состояние шейки матки);
наличие патологических выделений (гнойные, кровянистые).
Бимануальный осмотр:
размеры и форма матки;
состояние придатков;
инфильтраты в параметриях;
инфильтрация переднего и заднего влагалищного свода.
Лабораторные исследования:
цитологическое исследование – ПАП тест (увеличение размеров клетки вплоть до гигантских, изменение формы и количества внутриклеточных элементов, увеличение размеров ядра, его контуров, разная степень зрелости ядра и других элементов клетки, изменение количества и формы ядрышек);
гистологическое исследование (выраженный клеточный полиморфизм, увеличение размеров клеток, выраженная гипохромия, ядра крупные содержат одно или несколько ядрышек, имеются железистые структуры из раковых клеток в виде розеток, много клеток в состоянии митоза);
Инструментальные исследования:
УЗИ органов малого таза (при подозрении на рак шейки матки размер шейки матки будет в норме или увеличен, структура ее неоднородная, также оценивается состояние матки и яичников);
магнитно-резонансная томография органов малого таза. (при РШМ размер шейки матки будет в норме или увеличен, структура ее неоднородная, также оценивается состояние матки и яичников);
компьютерная томография органов грудной клетки, брюшной полости и малого таза (оценка лимфатических узлов малого таза и забрюшинного пространства, органические изменения органов грудной клетки и органов брюшной полости);
цистоскопия по показаниям (с целью диагностики прорастания опухолевого процесса в мочевой пузырь) назначается при подозрении на прорастание мочевого пузыря;
ректороманоскопия или колоноскопия по показаниям (с целью диагностики распространения опухолевого процесса в толстую или прямую кишку);
сцинтиграфия скелета (назначается при подозрении на метастазы в костях);
ПЭК/КТ всего тела (проводится для диагностики распространённости опухолевого процесса при первичном раке эндометрия или прогрессировании заболевания, либо для оценки динамики эффективности проведенного специальное лечения).
Диагностический алгоритм:
Схема -1. Диагностический алгоритм РШМ.
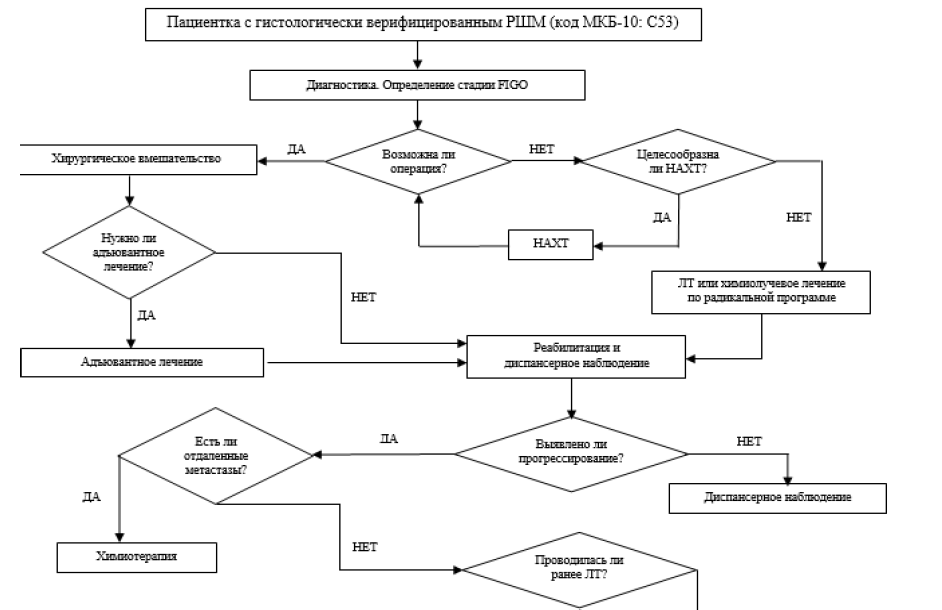
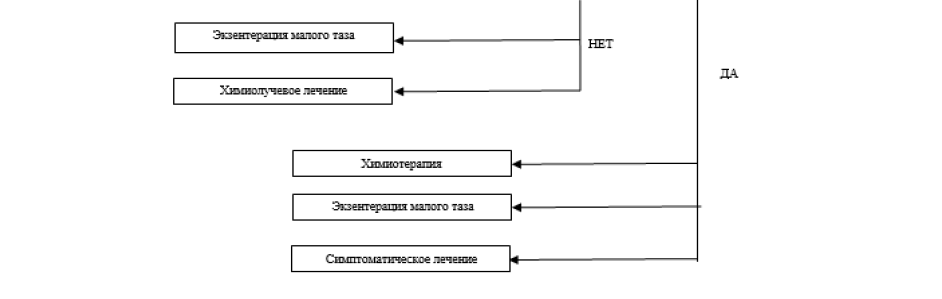
Показания для консультации узких специалистов:
консультация маммолога (при наличии патологии со стороны молочных желез);
консультация кардиолога (при наличии сопутствующей патологии ССС);
консультация невропатолога (при сосудистых мозговых нарушениях, в том числе инсультах, травмах головного и спинного мозга, эпилепсии, миастении, нейроинфекционных заболеваниях, а также во всех случаях потери сознания);
консультация гастроэнтеролога (при наличии сопутствующей патологии органов ЖКТ в анамнезе);
консультация нейрохирурга (при наличии метастазов в головной мозг, позвоночник);
консультация торакального хирурга (при наличии метастазов в легких);
консультация эндокринолога (при наличии сопутствующей патологии эндокринных органов);
консультация фтизиатра (при подозрении на туберкулезный процесс или перенесенный туберкулезный процесс).
NB! Консультация других узких специалистов по показаниям.
Диагностический алгоритм:
Схема -1. Диагностический алгоритм РШМ.


Дифференциальный диагноз
Дифференциальный диагноз [3,4]
Основные заболевания для дифференциальной диагностики представлены в таблице.
|
Диагноз
|
Обоснование для дифференциальной диагностики | Обследования | Критерии исключения диагноза |
| Эктопия шейки матки |
- Выделения из половых путей
- Участок псевдоэрозии ярко-красного цвета
|
кольпоскопия
взятие мазков на ПАП–тест
|
Участок, покрытый множеством округлых или продолговатых красных сосочков, что создает эффект бархатистой поверхности .
Ярко-красный цвет обусловлен
сосудами подлежащей стромы, просвечивающими через один
ряд цилиндрических клеток.
«Зона трансформации» метаплазированный и незрелый многослойный плоский эпителий в зоне эктопии, открытые и закрытые протоки желез.
|
| CIN |
- Видимые участки изменения шейки матки
- Безболезненное
- Выделения из половых путей.
|
- кольпоскопия
- взятие мазков на ПАП – тест
- биопсия
|
Кольпоскопическая картина: йоднегативная зона в виде белесоватой блестящей пленки складкой или бугристой поверхностью за счет развития рогового слоя эпителия. Окончательный диагноз устанавливают на основании гистологического исследования.
|
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ (10): нет.
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ [11-13,23-25]
Тактика лечения по стадиям [11,12]
|
Стадия
|
Вид лечения |
| CIN III | Широкая конизация шейки матки/ тотальная гистерэктомия |
| IА1 | Широкая конизация шейки матки/ тотальная гистерэктомия |
| IА2 |
Тотальная гистерэктомия с/без придатков +тазовая лимфодиссекция (II тип по Priver)/ трахелэктомия+тазовая лимфодиссекция/
При противопоказаниях к хирургическому лечению – лучевая терапия
|
| IВ1 |
Радикальная гистерэктомия +тазовая лимфодиссекция (III тип по Priver) у молодых женщин с транспозицией яичников / ЛТ или ХЛТ по радикальной программе Группа высокого риска прогрессирования – адъювантная ХЛТ Группа промежуточного риска – адъювантная ЛТ
Группа низкого риска – адъювантное лечение не проводится
|
| IВ2- IIA |
Радикальная гистерэктомия +тазовая лимфодиссекция (III тип) у молодых женщин с транспозицией яичников / ХЛТ по радикальной программе / неоадъювантная ХТ+ Радикальная гистерэктомия III тип
Группа высокого риска прогрессирования – адъювантная ХЛТ
Группа промежуточного риска – адъювантная ЛТ
Группа низкого риска – адъювантное лечение не проводится
|
| IIВ-IVА | Химиолучевая терапия |
| IVА | Системная ХТ |
Лечение в зависимости от стадии
Микроинвазивный рак:
Диагноз рака шейки матки стадии IA1 или IA2 ставится исключительно на основании морфологического исследования конуса шейки матки с негативными краями резекции или на основе удаленного макропрепарата после трахелэктомии либо гистерэктомии. В случае обнаружения в краях резекции после конизации шейки матки CIN III или инвазивного рака необходима повторная конизация или лечение пациента как при стадии заболевания IB1.
Стадия IA1
Основным методом лечения РШМ в данной стадии является тотальная абдоминальная или влагалищная гистерэктомия.
При наличии влагалищной интраэпитеальной неоплазии необходимо удаление соответствующей части влагалищной трубки. При необходимости сохранения фертильности возможно наблюдение после широкой конизации шейки матки с негативными краями резекции при условии проведения Пап -теста. Пап-тест проводится в сроки 6, 12 месяцев и в последующем ежегодно, если предыдущие два теста были отрицательными (УД –B).[4,7]
Стадия IA2
Существует определенная потенция к лимфогенному метастазированию у больных со стадией заболевания IA2, в связи с этим необходимо выполнение тазовой лимфаденэктомии во время хирургического лечения. Адекватной операцией для данных клинических случаев является модифицированная радикальная гистерэктомия (операция 2 типа) дополненная двусторонней тазовой лимфаденэктомией. При отсутствии лимфоваскулярной инвазии по данным предварительной биопсии возможно выполнение экстрафасциальной экстирпации (операция 1 типа) с тазовой лимфаденэктомией [11] (УД –С).
При желании сохранения фертильности возможными вариантами лечения являются:
широкая конизация шейки матки, дополненная экстраперитонеальным либо лапароскопическим удалением тазовых лимфоузлов;
радикальная трахелэктомия, дополненная удалением тазовых лимфоузлов. Наблюдение данной группы больных, главным образом, основано на ежегодном Пап-тесте после двух отрицательных тестов в сроках 6 и 12 месяцев.
Стадии IB1-IIA1
Хирургическое лечение
Стандартом хирургического лечения РШМ является радикальная абдоминальная гистерэктомия в сочетании с тазовой лимфодиссекцией. Хирургическое лечение необходимо выполнять только абдоминальным доступом.
Стадии IB2-IIIC
Конкурентная химиолучевая терапия: наиболее широко используемый метод лечения – сочетанная лучевая терапия в сочетании с еженедельной конкурентной химиотерапией препаратами платины.
Таблица 2. Бальная шкала GOG
Стадия IVA:
Лучевая терапия по стадиям: [6,8,9]
Стадии IB2-IIIC
Конкурентная химиолучевая терапия: наиболее широко используемый метод лечения – сочетанная лучевая терапия в сочетании с еженедельной конкурентной химиотерапией препаратами платины.
Рекомендуемые дозы лучевой терапии на точку А 85 – 90 Грей, на точку В 55 – 60 Грей. Цисплатин назначается в дозе 40 мг/м2 еженедельно на фоне дистанционного компонента лучевой терапии. У пациентов с метастазами в парааортальные и общие подвздошные лимфатические узлы необходимо расширение поля облучения до парааортальных зон. В настоящее время данные по токсичности конкурентной химиолучевой терапии, ассоциированной с расширением полей облучения малочисленны (УД –А).
Местнораспространенный рак шейки матки (включает стадии заболевания IIB,III и IVA).
Стандартным лечением является сочетанная лучевая терапия с конкурентной химиотерапией (УД – А).
Принципиально вопрос о назначении адъювантной лучевой/химиолучевой терапии при 1 стадии РШМ решается на основании бальной шкалы GOG, разработанной на основании крупного патолого- хирургического исследования.
Таблица 2. Бальная шкала GOG
|
Признак
|
Значение |
Относительный
риск
|
| Глубина инвазии в строму, в мм | ||
| Поверхностная | 3 | 1.0 |
| 4 | 3.0 | |
| 5 | 7.2 | |
| 6 | 14 | |
| 7 | 21 | |
| 8 | 26 | |
| 10 | 31 | |
| Средняя | 5 | 20 |
| 6 | 22 | |
| 7 | 23 | |
| 8 | 25 | |
| 10 | 28 | |
| 12 | 32 | |
| 14 | 36 | |
| Глубокая | 7 | 28 |
| 8 | 30 | |
| 10 | 34 | |
| 12 | 37 | |
| 14 | 41 | |
| 16 | 45 | |
| 18 | 49 | |
| 20 | 54 | |
| Клинический размер опухоли | Невидимый | 1.0 |
| 1 | 1.6 | |
| 2 | 1.9 | |
| 3 | 2.4 | |
| 4 | 2.9 | |
| 6 | 4.4 | |
| 8 | 6.6 | |
| Лимфо-васкулярная инвазия | Есть | 1.7 |
| Нет | 1.0 |
• Сумма баллов GOG рассчитывается умножением показателей относительного риска для глубины инвазии, размера опухоли и лимфоваскулярной инвазии. Например, поверхностная опухоль с глубиной инвазии 7.0 мм, размером 2.0 см, с наличием ЛВИ будет иметь балл: 21 x 1.9 x 1.7 = 67.8
• Количество баллов ≤ 40 имеет низкий риск развития рецидива и поэтому не требует адъювантного облучения, количество баллов от 40 до 120 имеет средний риск, а более 120 – высокий риск и в таких случаях необходимо решить вопрос о адъювантной терапии.
Стадия IVA:
• Возможно выполнение тазовой экзентерации на первом этапе, особенно при наличии пузырного или прямокишечного свища, однако не является противопоказанием к проведению химиолучевой терапии по радикальной программе. (УД – С).
Местные рецидивы после хирургического лечения РШМ.[10,11]
Стадия IVB и рецидивы:
Возможные методы лечения рецидивов после первичной радикальной гистерэктомии: рецидивы в малом тазу после радикальной гистерэктомии могут лечиться как лучевой терапией, так и хирургически (тазовая экзентерация). Облучение по радикальной программе (± конкурентная химиотерапия) локализованных тазовых рецидивов после первичного хирургического лечения эффективно у значительного количества больных. Дозы и объем лучевой терапии должны определяться распространенностью заболевания. Так, при микроскопических размерах опухоли обычная доза составляет 50 Грей при РОД 1,8 – 2,0 Грей с уменьшенными размерами полей облучения, а при больших по размеру опухолях доза составляет 64 – 66 Грей.
Местные рецидивы после хирургического лечения РШМ.[10,11]
|
Рекомендации
|
Уровень доказательности |
| Лучевая терапия показана пациентам с местными рецидивами после радикальной гистерэктомии | С |
| Конкурентная химиолучевая терапия с включением Цисплатина с/без 5- Фторурацила улучшает результаты лечения | В |
| Тазовая экзентерация может быть альтернативой лучевой и химиолучевой терапии у больных с рецидивами, не распространяющимися на стенки таза | В |
Местные рецидивы после радикального курса лучевой терапии:
Пациентки с центрально-локализованным рецидивом, вовлечением мочевого пузыря и прямой кишки при отсутствии интраперитонеальной диссеминации и отдаленных метастазов, наличии свободного пространства между шейкой матки и стенками таза являются потенциальными кандидатами для проведения тазовой экзентерации.
При прогрессировании заболевания рекомендовано определение PDL1 в опухолевом материале. При экспрессии PDL1 > 1 % в опухоли препаратом выбора является пембролизумаб.
При отсутствии патологических находок:
Отдаленные метастазы: лучевая терапия показана при симптомных метастазах опухоли в качестве паллиативного лечения, к примеру, при костных метастазах, увеличенных парааортальных, подключичных лимфатических узлах для купирования болевого синдрома или при метастазах в головной мозг.
При прогрессировании заболевания рекомендовано определение PDL1 в опухолевом материале. При экспрессии PDL1 > 1 % в опухоли препаратом выбора является пембролизумаб.
Послеоперационные находки РШМ.
Данные находки в основном относятся к случаям инвазивного РШМ, диагностированного после простой гистерэктомии, выполненной по иным показаниям. До начала лечения в таких ситуациях необходимо дополнительное обследование в объеме: КТ или МРТ органов малого таза и брюшной полости, рентгенография органов грудной клетки для уточнения распространенности процесса. Метод лечения должен определяться на основании данных морфологического исследования и рентгенологических находок.
При отсутствии патологических находок:
При стадии IA1 дополнительное лечение не проводиться. при стадии IA2 и выше, необходимо следующее лечение.
а) при положительных краях резекции, глубокой стромальной инвазии, вовлечении лимфоваскулярного пространства назначается конкурентная химиолучевая терапия [38].
б) у больных без глубокой стромальной инвазии, отрицательных краях резекции и отсутствии вовлечения лимфоваскулярного пространства выполняется радикальная параметрэктомия с верхней третью влагалища и лимфаденэктомией как альтернатива конкурентной химиолучевой терапии (УД –С).
РШМ во время беременности.
Лечение РШМ во время беременности основано на тех же принципах, что у небеременных женщин. Существует лишь несколько специальных рекомендаций. Конизация шейки матки выполняется только при подозрении на инвазивный рост по данным цитологического исследования и кольпоскопии в связи с высоким риском кровотечения, прерывания беременности или преждевременных родов. Важнейшим условием в определении тактики ведения беременных женщин с РШМ является мультидисциплинарный подход с привлечением неонатолога и акушера-гинеколога помимо радиолога и химиотерапевта.
Необходимо участие самой женщины и ее партнера в принятии решения, следует учитывать их желание сохранить беременность.
У пациенток с подозрением на микроинвазивный РШМ отсрочка в лечении не наносит ущерба матери и проявляется достоверным повышением жизнеспособности плода.
Женщины со стадией заболевания IA1, подтвержденной при конизации и отрицательными краями резекции могут донашивать беременность и рожать через естественные родовые пути.
Метод родоразрешения при микроинвазивной карциноме шейке матки не влияет на исход заболевания. При стадии заболевания IA2 и выше лечение необходимо подбирать индивидуально, главным образом решение о методе лечения и его сроках основано на стадии заболевания и сроке беременности. МРТ проводится с целью оценки распространенности процесса. В случае установления диагноза до 20 недель гестации лечение должно начинаться безотлагательно. Методом выбора является радикальная гистерэктомия с плодом in situ. При проведении химиолучевой терапии, как правило, прерывание беременности не проводиться, так как после начала лечения происходит самопроизвольный выкидыш.
При выявлении РШМ после 28 недельного срока беременности рекомендуется отсрочка лечения до получения жизнеспособного плода. Лечение РШМ в сроках от 20 до 28 недель беременности при стадии IA2 и IBI может быть отложено до получения жизнеспособного плода без значимого влияния на прогноз для матери. При стадии заболевания выше, чем IB1 отсрочка в лечении значительно ухудшает прогноз и влияет на выживаемость пациентов.
Следует отметить, что не существует стандартов по определению срока, на которое можно отложить начало лечения. На практике период отсрочки зависит от стадии заболевания, морфологических находок, сроке беременности и желании родителей.
Родоразрешение проводиться не позднее 34 недель гестации.
Карта наблюдения пациента, маршрутизация пациента:
Все больные РШМ после завершения лечения должны находиться под наблюдением врача онколога-гинеколога, онколога, врача общей практики по месту прикрепления пациента.
В течение первых 2-х лет – каждые 3 месяца;
В течение третьего года – каждые 6 месяцев;
С 4го года – каждые 12 месяцев – ежегодно.
Немедикаментозное лечение:
Медикаментозное лечение [13,14]
Одновременная химиолучевая терапия:
Немедикаментозное лечение:
Режим больного при проведении консервативного лечения – общий. В ранний послеоперационный период – постельный или полупостельный (в зависимости от объема операции и сопутствующей патологии). В послеоперационном периоде – палатный.
Диета стол - №15, после хирургического лечения – №1.
Консультация психолога.
Медикаментозное лечение [13,14]
Одновременная химиолучевая терапия:
Цисплатин – 40 мг/м2 60 минутная инфузия с гидратацией в 1,8,15,22,29 и 36 й дни за 4 ч до облучения еженедельно 6 нед.
Схемы химиотерапии:
1. Паклитаксел 175 мг/м2 в/в в 1-й день и карбоплатин AUC 5–6 в/в в 1-й день каждые 3 нед. (УД-А)
2. Паклитаксел 175 мг/м2 в/в в 1-й день и цисплатин 60–75 мг/м2 в/в в 1-й день каждые 3 нед. (УД-А).
3. Доксорубицин 50–60 мг/м2 в/в в 1-й день и цисплатин 50–75 мг/м2 в/в в 1-й день каждые 3 нед. (УД-А)
4. Ифосфомид 5000 мг/м2 24-часовая инфузия с местной – 400 мг/м2 раза в день и цисплатин 50 мг/м2 в/в в 1 день. (УД-А)
5. Гемцитабин 800-1000 мг/м2 в/в в 1-й и 8-й дни и цисплатин 50 мг/м2 в/в в 1 день. (УД-А)
NB! При невозможности использования платиновых комбинаций возможно назначение неплатиновых комбинаций.
6. Паклитаксел 175 мг/м2 в/в в 1-й день и топотекан 0,75 мг/м2 в 1-3 1 дни.(УД-А)
Перечень основных лекарственных средств (имеющих 100% вероятность применения) (18,21,22,25):
Виды хирургических вмешательств:
Перечень основных лекарственных средств (имеющих 100% вероятность применения) (18,21,22,25):
|
Лекарственная группа
|
Международное непатентованное наименование ЛС | Способ применения | Уровень доказательности |
| Антрациклины | Доксорубицин | 50–60 мг/м2 в/в в 1-й день | А |
| Производные платины | Цисплатин | 50–75 мг/м2 в/в в 1-й день | А |
| Противоопухолевые препараты таксанового ряда | Паклитаксел | 175 мг/м2 в/в в 1-й день | А |
| Производные платины | Карбоплатин | AUC 5–6 в/в в 1-й день | А |
| Алкилирующие соединения | Ифосфамид | 1,6 мг/м2 в/в в 1–3-й дни 1ч. инфузия | В |
| Противоопухолевые препараты таксанового ряда | Доцетаксел | 75 мг/м2 в/в каждые 3 нед. | А |
| Противоопухолевое средство, антиметаболит | Гемцитабин | 1000 мг/м2 в 1-й и 8-й дни | А |
Перечень дополнительных лекарственных средств (имеющих менее 100% вероятность применения) (3,4,16,18,22):
|
Лекарственная группа
|
Международное непатентованное наименование ЛС | Способ применения | Уровень доказательности |
| Алкалоид | Топотекан | 1,25 мг/м2 в/в в 1–5-й дни каждые 3 нед. | С |
| Производные платины | Оксалиплатин | 130 мг/м2 в/в каждые 3 нед. | С |
| Моноклональное антитело | Бевацизумаб | 7,5–15 мг/кг в/в каждые 3 нед | В |
| Иммуно онкологический препарат Моноклональное антитело | Пембролизумаб | 200 мг в/в каждые 3 недели | А |
Хирургическое лечение (11,17,19,23,26).
Виды хирургических вмешательств:
Широкая конизация шейки матки;
Тотальная абдоминальная или влагалищная гистерэктомия;
Абдоминальная модифицированная или радикальная гистерэктомия с тазовой/парааортальной лимфаденоэктомией;
Абдоминальная трахелэктомия;
Хирургическое (лапароскопическое) стадирование;
Радикальная трахелэктомия, дополненная удалением тазовых лимфоузлов;
Модифицированная экстраперитонеальная тотальная (задняя или передняя) экзентерация органов малого таза;
Дальнейшее ведение:
Все больные РШМ после завершения лечения должны находиться под наблюдением врача гинеколога-онколога, по месту прикрепления пациента;
В течение первых 2-х лет – каждые 3 месяца;
В течение третьего года – каждые 4 месяца;
В течение 4-5-го года – каждые 6 месяцев, далее – ежегодно;
Индикаторы эффективности лечения:
Рентгенологическое исследование легких в течение первых 3-х лет необходимо выполнять 1 раз в полгода, затем 1 раз в год;
В объем контрольного обследования входят: МРТ ОМТ, КТ ОБП и КТ ОГК,ПЭТ/КТ;
МРТ ОМТ, КТ ОБП и КТ ОГК – в течение первых 2-х лет – каждые 3 месяца; в течение третьего года – каждые 4 месяца;
ПЭТ/КТ ежегодно.
Индикаторы эффективности лечения:
«ответ опухоли» - регрессия опухоли после проведенного лечения;
безрецидивная выживаемость (трех и пятилетняя);
«качество жизни» включает кроме психологического, эмоционального и социального функционирования человека, физическое состояние организма больного.
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ
Показания для экстренной госпитализации:
кровотечение и некоторые другие более редкие осложнения опухолевого процесса, связанные с распространенностью или прогрессированием процесса (кишечная непроходимость, дыхательная недостаточность и др.).
Показания для плановой госпитализации:
морфологически верифицированный рак шейки матки.
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2023
- 1) Brisson M, Laprise JF, Drolet M, et al. Comparative costeffectiveness of the quadrivalent and bivalent human papillomavirus vaccines: a transmission-dynamic modeling study. Vaccine 2013; 31: 3863–71. 2) American Cancer Society. Cancer Facts and Figures 2018. Atlanta, Ga: American Cancer Society; 2018. 3) Anderson TA, Schick V, Herbenick D, Dodge B, Fortenberry JD. A study of human papillomavirus on vaginally inserted sex toys, before and after cleaning, among women who have sex with women and men. Sex Transm Infect. 2014 Apr 16. [Epub ahead of print] 4) Bentivegna E, Maulard A, Pautier P, et al. Fertility results and pregnancy outcomes after conservative treatment of cervical cancer: A systematic review of the literature. Fertil Steril. 2016;106:1195-1211. 5) Klopp AH, Eifel PJ, Berek JS, Konstantinopoulos PA. Chapter 72: Cancer of the cervix, vagina, and vulva. In: DeVita VT, Hellman S, Rosenberg SA, eds. Cancer: Principles and Practice of Oncology 10th ed. Philadelphia, Pa: Lippincott Williams & Wilkins; 2015. 6) Howlader N, Noone AM, Krapcho M, Miller D, Bishop K, Kosary CL, Yu M, Ruhl J, Tatalovich Z, Mariotto A, Lewis DR, Chen HS, Feuer EJ, Cronin KA (eds). SEER Cancer Statistics Review, 1975-2014, National Cancer Institute. Bethesda, MD, https://seer.cancer.gov/csr/1975_2014/, based on November 2016 SEER data submission, posted to the SEER web site, April 2017. 7) Kleinerman RA, Kosary C, Hildesheim A. New Malignancies Following Cancer of the Cervix Uteri, Vagina, and Vulva. In: Curtis RE, Freedman DM, Ron E, Ries LAG, Hacker DG, Edwards BK, Tucker MA, Fraumeni JF Jr. (eds). New Malignancies Among Cancer Survivors: SEER Cancer Registries, 1973-2000. National Cancer Institute. NIH Publ. No. 05-5302. Bethesda, MD, 2006. Accessed at http://seer.cancer.gov/archive/publications/mpmono/MPMonograph_complete.pdf on November 8, 2016. 8) Krishnansu S. Tewari, M.D., Michael W. Sill, Ph.D., Harry J. Long, III, M.D., Richard T. Penson, M.D., Helen Huang, M.S., Lois M. Ramondetta, M.D., Lisa M. Landrum, M.D., Ana Oaknin, M.D., Thomas J. Reid, M.D., Mario M. Leitao, M.D., Helen E. Michael, M.D., and Bradley J. Monk, M.D. Improved Survival with Bevacizumab in Advanced Cervical Cancer. N Engl J Med 2014; 370:734-743; DOI: 10.1056/NEJMoa1309748. 9) Committee F. FIGO staging for carcinoma of the vulva, cervix, and corpus uteri.Int J Gynaecol Obstet. 2014;125(2):97–8. doi:10.1016/j.ijgo.2014.02.003. 10) Chung HC, Schellens JH, Delord J-P, et al. Pembrolizumab treatment of advanced cervical cancer: Updated results from the phase 2 KEYNOTE-158 study [abstract]. J Clin Oncol 2018 36. 11) Frenel JS, Le Tourneau C, O'Neil B, et al. Safety and Efficacy of Pembrolizumab in Advanced, Programmed Death Ligand 1-Positive Cervical Cancer: Results From the Phase Ib KEYNOTE-028 Trial. J Clin Oncol 2017;35:4035-4041. 12) Le DT, Durham JN, Smith KN, et al. Mismatch repair deficiency predicts response of solid tumors to PD-1 blockade. Science 2017;357:409-413. 13) Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019. CA Cancer J Clin 2019;69:7-34. 14) Bhatla N, Berek JS, Cuello Fredes M, et al. Revised FIGO staging for carcinoma of the cervix uteri. Int J Gynaecol Obstet 2019;145:129-135. 15) Frumovitz M, Plante M, Lee PS, et al. The FILM Trial: A randomized phase III multicenter study assessing near infrared fluorescence in the identification of sentinel lymph nodes (SLN) [Abstract]. Gynecologic Oncology 2018;149:7. 16) Ramirez PT, Frumovitz M, Pareja R, et al. Minimally Invasive versus Abdominal Radical Hysterectomy for Cervical Cancer. N Engl J Med 2018. 17) Melamed A, Margul DJ, Chen L, et al. Survival after Minimally Invasive Radical Hysterectomy for Early-Stage Cervical Cancer. N Engl J Med 2018. 18) Margul DJ, Yang J, Seagle BL, et al. Outcomes and costs of open, robotic, and laparoscopic radical hysterectomy for stage IB1 cervical cancer. Journal of Clinical Oncology 2018. 19) Rosen VM, Guerra I, McCormack M, et al. Systematic Review and Network Meta-Analysis of Bevacizumab Plus First-Line Topotecan- Paclitaxel or Cisplatin-Paclitaxel Versus Non-Bevacizumab-Containing Therapies in Persistent, Recurrent, or Metastatic Cervical Cancer. Int J Gynecol Cancer 2017;27:1237-1246. 20) Bruni L., Diaz M., Barrionuevo-Rosas L., Herrero R., Bray F., Bosch F.X., Castellsagué X. Global estimates of human papillomavirus vaccination coverage by region and income level: a pooled analysis // Lancet Glob. Health. – 2016. – Vol. 4. – P. e453-e463. https://doi.org/10.1016/S2214-109X(16)30099-7. 21) World Health Organization. Meeting of the Strategic Advisory Group of Experts on Immunization, October 2018 – Conclusions and recommendations // Wkly Epidemiol. Rec. – 2018. – Vol. 49. – P. 661-680. https://www.who.int/publications-detail-redirect/WER9349. 22) Drolet M., Bénard É., Pérez N., Brisson M., Ali H., Boily M.-C., Callander D. HPV Vaccination Impact Study Group. Population-level impact and herd effects following the introduction of human papillomavirus vaccination programmes: updated systematic review and meta-analysis // Lancet. – 2019. – Vol. S0140-6736(19). – P. 30298-30303. https://doi.org/10.1016/S0140-6736(19)30298-3. 23) Vänskä S., Luostarinen T., Baussano I., Apter D., Eriksson T., Natunen K., Nieminen P., Paavonen J., Pimenoff V., Pukkala E., Söderlund-Strand A., Dubin G., Garnett G., Dillner J. , Lehtinen M. Vaccination with moderate coverage eradicates oncogenic human papillomaviruses if a gender-neutral strategy is applied // J. Infect. Dis. – 2020. – Vol. 222(6). – P. 948-956. https://doi.org/10.1093/infdis/jiaa099. 24) Hall M.T., Simms K.T., Lew J.-B., Smith M.A., Brotherton J.M., Saville M., Canfell K. The projected timeframe until cervical cancer elimination in Australia: a modelling study // Lancet Public Health. – 2019. – Vol. 4(1). – P. e19-e27. https://doi.org/10.1016/S2468-2667(18)30183-X . 25) Patel C., Brotherton J.M., Pillsbury A., Jayasinghe S., Donovan B., Macartney K., Marshall H. The impact of 10 years of human papillomavirus (HPV) vaccination in Australia: what additional disease burden will a nonavalent vaccine prevent? // Euro Surveill. – 2018. – Vol. 23(41). – Art. ID 1700737. https://doi.org/10.2807/1560-7917.es.2018.23.41.1700737. 26) Brisson M., Bénard É., Drolet M., Bogaards J.A., Baussano I., Vänskä S., Walsh C. Population-level impact, herd immunity, and elimination after human papillomavirus vaccination: a systematic review and metaanalysis of predictions from transmission-dynamic models // Lancet Public Health. – 2016. – Vol. 1(1). – P. e8-e17. https://doi.org/10.1016/S2468-2667(16)30001-9. 27) Office of the Prime Minister of Australia. A new vaccine to strengthen the health of young Australians. 08.10.2017. http://parlinfo.aph.gov.au/parlInfo/search/display/display.w3p;query=Id:"media/pressrel/5562151". 28) Smith M., Canfell K. Impact of the Australian National Cervical Screening Program in women of different ages // Med. J. Aust. – 2016. – Vol. 205. – P. 359-364. https://doi.org/10.5694/mja16.00289. 29) Tabrizi S.N., Brotherton J.M.L., Kaldor J.M., Skinner S.R., Liu B., Bateson D., Garland S.M. Assessment of herd immunity and cross-protection after a human papillomavirus vaccination programme in Australia: a repeat cross-sectional study // Lancet Infect. Dis. – 2014. – Vol. 14(10). – P. 958-966. https://doi.org/10.1016/S1473-3099(14)70841-2. 30) Cancer Council Australia Cervical Cancer Screening Guidelines Working Party. National cervical screening program: guidelines for the management of screen-detected abnormalities, screening in specific populations and investigation of abnormal vaginal bleeding. 04.12.2017. http://wiki.cancer.org.au/australia/Guidelines:Cervical_cancer/Screening. 31) WHO. Vaccine in National Immunization Programme Update January 2020. https://www.who.int/immunization/monitoring_surveillance/en. 32) Bruni L., Saura-Lázaro A., Montoliu A., Brotons M., Alemany L., Diallo M.S., Bloem P. HPV vaccination introduction worldwide and WHO and UNICEF estimates of national HPV immunization coverage 2010–2019 // Prevent. Med. – 2021. – Vol. 144. – Art. ID 106399. https://doi.org/10.1016/j.ypmed.2020.106399. 33) Department of Health and Ageing. Immunize Australia program: human papillomavirus (HPV). 14.02.2013. https://www.health.gov.au/sites/default/files/evaluation-national-hpv-program.pdf. 34) Machalek D.A., Garland S.M., Brotherton J.M.L., Bateson D., McNamee K., Stewart M., Tabrizi S.N. Very Low Prevalence of Vaccine Human Papillomavirus Types Among 18- to 35-Year-Old Australian Women 9 Years Following Implementation of Vaccination // J. Infect. Dis. – 2018. – Vol. 217(10). – P. 1590-1600. https://doi.org/10.1093/infdis/jiy075.
Информация
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ПРОТОКОЛА
Список разработчиков:
1) Кукубасов Ерлан Каирлыевич – кандидат медицинских наук, руководитель Центра онкогинекологии, онколог-гинеколог Республиканского научно- методического центра онкогинекологии, АО «Казахский научно – исследовательский институт онкологии и радиологии».
2) Тельгузиева Жаннат Ахметбековна – доктор медицинских наук, врач-радиолог АО «Казахский научно – исследовательский институт онкологии ирадиологии». 3) Смагулова Калдыгуль Кабаковна – кандидат медицинских наук, врач-химиотерапевт, заведующая отделением дневного стационара химиотерапии АО «Казахский научно – исследовательский институт онкологии и радиологии» ; 4) Сатанова Алима Ринаткызы – врач-онкогинеколог, Центр онкогинекологии, АО «Казахский научно – исследовательский институт онкологии и радиологии»; 5) Болатбекова Райхан Олмесхановна – PHD, врач-онкогинеколог ,заведующая отделением онкогинекологии, Алматинский онкологический центр. 6) Каримбаева Еркеш Мухтаровна – клинический фармаколог, руководитель отдела клинической фармации ГКП на ПХВ «Многопрофильный медицинский центр акимата города Нур-Султан». 7) Жагниев Жандос Ермухамбетович- врач-онкогинеколог, отделение маммологии и онкогинекологии, КГП на ПХВ Многопрофильный Центр Онкологии и Хирургии УЗ ВКО, г.Усть-Каменогорск
Указание на отсутствие конфликта интересов: нет.
Рецензенты:
1) Манамбаева Зухра Алпысбаевна – доктор медицинских наук, онколог, профессор, кафедры онкологии НАО КазНМУ имени С.Д. Асфендиярова
2) Есенкулова Сауле Аскеровна – доктор медицинских наук, онколог, доцент кафедры онкологии НАО КазНМУ имени С.Д. Асфендиярова.
3) Кудайбергенов Талгат Капаевич – доктор медицинских наук, профессор, гинеколог, директор по науке ИРМ. 4) Локшин Вячеслав Нотанович - доктор медицинских наук, профессор, Академик НАН РК, президент Казахстанской Ассоциации репродуктивной медицины, ректор Международной академии репродуктологии, президент Ассоциации международных фармацевтических производителей.
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его опубликования и вступления в действие или при наличии новых рекомендаций с уровнем доказательности.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.