Рак шейки матки: диагностика, лечение и профилактика
 Версия: Клинические протоколы КР 2024 (Кыргызстан)
Версия: Клинические протоколы КР 2024 (Кыргызстан)
Общая информация
Краткое описание
Приложение 1 к приказу МЗ КР №626 от 11.06.2024 г.
КЛИНИЧЕСКОЕ РУКОВОДСТВО ПО ДИАГНОСТИКЕ, ЛЕЧЕНИЮ И ПРОФИЛАКТИКЕ РАКА ШЕЙКИ МАТКИ
Этапы оказания помощи
Цель создания Клинического руководства
Целевые группы
Дата создания: декабрь 2021 – апрель 2024.
Рак шейки матки – злокачественная опухоль слизистой оболочки влагалищной части шейки матки и/или цервикального канала шейки матки.
|
Классификация по МКБ-10 [12] C53. Злокачественное новообразование шейки матки C53.0. Внутренней части C53.1. Наружной части C53.8. Поражение шейки матки, выходящее за пределы одной и более вышеуказанных локализаций C53.9. Шейки матки неуточнённой̆ части |
При РШМ 5-летняя выживаемость довольно высока. Лучшие ее показатели зарегистрированы в США и Европе (70 и 56% соответственно). В развивающихся странах этот показатель равен 48% [2].
В нашей стране РШМ занимает ведущее 2-е место в структуре онкозаболеваемости у женщин. И, к сожалению, показатели заболеваемости и смертности от данного заболевания в нашей стране не имеют тенденции к снижению [3].
Классификация
Для определения стадии РШМ возможно использование любых методов визуализации и/или данных морфологического исследования. В регионах с ограниченными ресурсами возможно установление стадии на основании клинических данных. Стадия РШМ устанавливается до начала специальной̆ терапии, что необходимо для выбора метода и составления плана лечения.
Стадия РШМ не изменяется после начала специального лечения. В случаях, когда есть затруднения в точном определении стадии, следует устанавливать более раннюю. Морфологические находки у больных, подвергнутых хирургическому лечению, должны быть отмечены отдельно. Для этой цели подходит номенклатура TNM (буквенной аббревиатурой). Перед TNM необходимо указывать, на основании каких данных определен статус:
Определение стадии производится на основании классификации FIGO (2018) [13] и TNM (8 издание, 2016 г.) [14].
| В | Рекомендуется установить стадию РШМ до начала специальной терапии, что необходимо для выбора метода и составления плана лечения [4-13] |
Классификация РШМ по стадиям (FIGO, 2018 г.) и распространенности опухолевого процесса (TNM, 2016 г.)
|
TNM
|
FIGO | |
| TX | Недостаточно данных для оценки первичной опухоли | |
| T0 | Первичная опухоль не определяется | |
| T is | Карцинома in situ | |
| T1 | Стадия IA | Опухоль ограничена маткой (распространение на тело матки не учитывается) |
| T1a | IA | Инвазивный рак, диагноз которого устанавливается только по данным микроскопии, максимальная глубина инвазии <5 мм |
|
T1a1
|
IA1 | Глубина инвазии не более 3 мм |
|
T1a2
|
IA2 | Глубина инвазии равна или более 3 мм, но не более 5 мм |
|
T1b
|
IB | Опухоли с глубиной инвазии равной или более 5 мм, ограниченные шейкой матки |
|
T1b1
|
IB1 | Глубина инвазии равна или более 5 мм и размер опухоли в наибольшем измерении менее 2 см |
|
T1b2
|
IB2 | Размеры опухоли в наибольшем измерении равен или более 2 см и менее 4 см |
| IB3 | Размер опухоли в наибольшем измерении равен или более 4 см | |
|
T2
|
Стадия II | Опухоль, распространившаяся за пределы матки без перехода на стенки таза и поражения нижней трети влагалища |
|
T2a
|
IIA | Поражение ограничено верхней третью влагалища без вовлечения параметрия |
|
T2а1
|
IIA1 | Инвазивная опухоль менее 4 см в наибольшем измерении |
|
Т2а2
|
IIA2 | Инвазивная опухоль более 4 см в наибольшем измерении |
|
Т2b
|
IIB | Вовлечение параметрия, но без вовлечения стенок таза |
|
T3
|
Стадия III | Опухоль, вовлекающая стенки таза (при ректальном исследовании отсутствует пространство между опухолью и стенкой таза) или нижнюю треть влагалища, а также все случаи РШМ с гидронефрозом и нефункционирующей почкой |
|
T3a
|
IIIA | Вовлечение нижней трети влагалища |
|
T3b
|
IIIB | Распространение на стенку таза или гидронефроз и нефункционирующая почка |
| IIIC | Вовлечение тазовых и/или пара-аортальных лимфатических узлов, вне зависимости от размеров и распространения первичной опухоли | |
| IIIC1 | Вовлечение только тазовых лимфоузлов | |
| IIIC2 | Вовлечение пара-аортальных лимфоузлов | |
| Стадия IV | Опухоль, распространившаяся за пределы таза или прорастающая слизистую мочевого пузыря или прямой кишки (буллезный отек не позволяет отнести опухоль к стадии IV) | |
|
T4
|
IVA | Опухоль распространяется на слизистую оболочку мочевого пузыря и/или прямой кишки |
|
M1
|
IVB | Отдаленные метастазы (исключая метастазы во влаглище, серозную оболочку таза и яичник, включая метастазы во внутриабдоминальные лимфатические лимфоузлы, кроме парааортальных и/или паховых) |
| Состояние регионарных лимфатических узлов | Отдаленные метастазы | ||
| Nx | Недостаточно данных для оценки | М0 | Отдаленные метастазы отсутствуют |
| N0 | Признаков поражения регионарных лимфатических узлов нет | М1 | Имеются отдаленные метастазы |
| N1 | Метастазы в регионарных лимфатических узлах | ||
В классификации FIGO стадию 0 (Tis) не применяют.
Морфологическая классификация злокачественных опухолей шейки матки (ВОЗ, 2020 г.) [15]
|
ОПУХОЛИ ИЗ ПЛОСКОГО ЭПИТЕЛИЯ Плоcкоклеточные интраэпителиальные поражения (поражение плоского эпителия (SIL)): - поражение плоского эпителия легкой степени (LSIL) - поражение плоского эпителия тяжелой степени (HSIL) Плоскоклеточный рак HPV-ассоциированный Плоскоклеточный рак HPV-не ассоциированный Плоскоклеточный рак неспецифического типа |
|
ОПУХОЛИ ИЗ ЖЕЛЕЗИСТОГО ЭПИТЕЛИЯ Аденокарцинома in situ Аденокарцинома in situ HPV‐ассоциированная Аденокарцинома in situ HPV‐не ассоциированная Аденокарцинома неспецифического типа Аденокарцинома HPV‐ассоциированная Аденокарцинома HPV‐не ассоциированная желудочного типа Аденокарцинома HPV‐не ассоциированная светлоклеточного типа Аденокарцинома HPV‐не ассоциированная мезонефроидного типа Аденокарцинома HPV‐не ассоциированная неспецифического типа Эндометриоидная аденокарцинома неспецифического типа Карциносаркома неспецифического типа Аденоплоскоклеточная карцинома Мукоэпидермоидная карцинома Аденоидно‐базальная карцинома Карцинома недифференцированная неспецифического типа |
|
СМЕШАННЫЕ ЭПИТЕЛИАЛЬНЫЕ И МЕЗЕНХИМАЛЬНЫЕ ОПУХОЛИ Аденосаркома |
|
ГЕРМИНОГЕННЫЕ ОПУХОЛИ Герминогенные опухоли неспецифического типа: - зрелая тератома неспецифического типа - опухоль желточного мешка неспецифического типа - опухоль эндодермального синуса - хориокарцинома - дермоидная киста неспецифического типа |
|
НЕЙРОЭНДОКРИННЫЕ ОПУХОЛИ Нейроэндокринные карциномы: - мелкоклеточная нейроэндокринная карцинома - крупноклеточная нейроэндокринная карцинома Смешанные нейроэндокринные‐не нейроэндокринные опухоли Аденокарцинома смешанная с нейроэндокринной карциномой |
Диагностика
Клинические критерии РМШ
|
Наиболее распространённые симптомы, на которые следует обратить внимание - «красные флаги» [4-11]: аномальные вагинальные кровотечения; межменструальные (ММК), посткоитальные (ПМК) или постменопаузальные кровотечения (ПМК). диспареуния – болевые ощущения в области половых органов, испытываемые во время полового акта; аномальные выделения из влагалища. |
Клинические проявления рака шейки матки [4-11]
|
Ранние проявления: Выделения из влагалища, иногда зловонные; Межменструальные кровянистые выделения любого характера у женщин детородного возраста; Кровянистые выделения после полового контакта у женщин любого возраста, даже молодого; Кровянистые выделения и кровотечение в постменопаузе. |
Поздние проявления: Учащенное мочеиспускание и императивные позывы на мочеиспускание Боль в спине Боль внизу живота Сильная боль в спине Похудание Уменьшение объема выделяемой мочи (в следствие обструкции мочеточников или почечной недостаточности) Выделения мочи или кала из влагалища (образование свищей) Отеки нижних конечностей Одышка (вследствие анемии или, реже, метастазов в легкие или плеврального выпота) |
Пациентки с подозрением на рак шейки матки должны быть срочно осмотрены, в идеале с проведением кольпоскопии для проведения направленной биопсии с целью постановки диагноза [4-11].
Визуальный осмотр шейки матки необходим при тщательном клиническом стадировании.
| D | Рекомендуется провести кольпоскопию с направленной биопсией всех пациенток с подозрением на РШМ [4-11] |
| D | Рекомендуется направить на обследование к гинекологу при наличии «красных флагов» у женщины [4-11] |
Всем женщинам с раком шейки матки за пределами стадии IA1 необходимо провести визуальный осмотр шейки матки и влагалища, а также бимануальное влагалищное исследование для оценки поражения влагалища и параметрия [4-11]
| D | Рекомендуется провести визуальный осмотр шейки матки и влагалища и бимануальное влагалищное исследование всем женщинам РШМ более чем стадии IA1 для оценки поражения влагалища и параметрия [4-11] |
Настоятельно рекомендуется ректальное или ректовагинальное исследование, особенно при оценке более крупных опухолей, а также в случае неуверенности при бимануальном вагинальном исследовании или несоответствия между визуализацией и первичным осмотром [4-11].
| D | Рекомендуется проведение ректального или ректовагинального исследования при оценке более крупных опухолей, а также в случае неуверенности при бимануальном вагинальном исследовании или несоответствии между визуализацией и первичным осмотром [4-11] |
Все женщины с подтвержденным или подозреваемым диагнозом рака шейки матки должны обсуждаться на заседании МДК специалистов по гинекологическому раку [4-11].
| D | Рекомендуется обсудить на заседании (консилиуме) МДК специалистов по гинекологическому раку всех женщин с подтвержденным или подозреваемым диагнозом РШМ [4-11] |
МДК должен состоять минимум из двух хирургов-гинекологов, радиационного онколога (специалиста по радиотерапии), медицинского онколога (специалиста по химиотерапии), радиолога, гистопатолога, цитопатолога, клинической медсестры и координатора междисциплинарной команды [4-11].
| D | Рекомендуется, чтобы в состав МДК входили минимум два хирурга-гинеколога, радиационный онколог (специалист по радиотерапии), медицинский онколог (специалист по химиотерапии), радиолог, гистопатолог, цитопатолог, клиническая медсестра и координатор МДК [4-10] |
| В | Рекомендуется скрининг на РШМ начиная с возраста 25 лет [4-11] |
Лицам в возрасте от 25 до 65 лет следует проходить первичный тест на ВПЧ каждые 5 лет. Если первичное тестирование на ВПЧ недоступно, скрининг может проводиться либо с помощью совместного теста (co-test), который сочетает тест на ВПЧ с тестом Папаниколау (Pap-test) каждые 5 лет, либо только Пап-тест каждые 3 года. Для совместного теста (co-test) тест на ВПЧ и мазок по Папаниколау (Pap/HPV) проводятся вместе. Один и тот же образец клетки используется как для теста на ВПЧ, так и для теста Папаниколау [4-11].
| В | Рекомендуется проводить первичное ВПЧ-тестирование каждые 5 лет женщинам в возрасте 25-65 лет [4-11] |
| В | Рекомендуется проводить co-test каждые 5 лет, если первичное тестирование на ВПЧ недоступно [4-11] |
| В | Рекомендуется проводить ПАП-тест каждые 3 года, если ВПЧ-тестирование не доступно [4-11] |
Лица старше 65 лет, которые в течение последних 10 лет проходили регулярный скрининг с нормальными результатами и не имели в анамнезе CIN2 или более серьезного диагноза в течение последних 25 лет, должны прекратить скрининг на РШМ. После остановки скрининга не следует запускать снова [4-11].
| В | Рекомендуется прекратить скрининг на РШМ пациентам старше 65 лет, регулярно проходившим скрининг и имеющим нормальные результаты, отсутствие в анамнезе CIN2 [4-11] |
Людям, у которых была полная гистерэктомия (удаление матки и шейки матки), следует прекратить скрининг (например, мазок Папаниколау и тесты на ВПЧ), если гистерэктомия не была сделана для лечения рака шейки матки или серьезного предракового заболевания.
| В | НЕ РЕКОМЕНДУЕТСЯ проводить скрининг на РШМ пациенткам после гистерэктомии, не связанной с РШМ [4-11] |
Людям, которым была выполнена гистерэктомия без удаления шейки матки (супрацервикальная гистерэктомия), следует продолжить обследование на РШМ в соответствии с приведенными выше рекомендациями [4-11].
| В | Рекомендуется проводить скрининг на РШМ пациенткам после супрацервикальной гистрэктомией [4-11] |
Люди, которые были вакцинированы против ВПЧ, по-прежнему должны следовать этим рекомендациям для своих возрастных групп [4-11].
| В | Рекомендуется продолжать проводить скрининг на РШМ после ВПЧ-вакцинации [4-11] |
ЛАБОРАТОРНЫЕ ДИАГНОСТИЧЕСКИЕ ИССЛЕДОВАНИЯ
| D |
Рекомендуется провести всем пациенткам РШМ с целью оценки их общего состояния, определения тактики, алгоритма лечения и прогноза заболевания следующие лабораторные исследования [9,10]:
общий (клинический) развернутый анализ крови;
анализ крови биохимический общетерапевтический (общий белок, глюкоза, билирубин, креатинин, мочевина, железо, аланинаминотрасфераза (АЛТ), аспартатаминотрансфераза (АСТ), билирубин общий, лактатаминотрансфераза (ЛДГ), щелочная фосфатаза (ЩФ), электролиты плазмы (калий, натрий, хлор) с оценкой показателей функции печени, почек;
общий (клинический) анализ мочи;
коагулограмма (фибриноген, протромбин, МНО, протромбиновое время, протромбиновыйиндекс, активированное частичное тромбопластиновое время (АЧТВ), тромбиновое время).
|
Клинический анализ крови выполняется (повторяется) не менее чем за 5 дней до начала очередного курса ХТ [9, 10].
| А | Рекомендуется определение уровня антигена плоскоклеточного рака - SCC (по возможности) всем пациенткам с плоскоклеточным РШМ и подозрением на него с целью оценки текущей клинической ситуации и дальнейшего течения заболевания [4-11] |
Кольпоскопия
Кольпоскопия – это гинекологический метод исследования с проведением прицельного и детального осмотра шейки матки при помощи микроскопа особой конструкции.
Показания для проведения кольпоскопии:
| В | Рекомендуется проводить кольпоскопию всем женщинам после 30 лет [4-11] |
Исследование проводит врач-гинеколог в специальном процедурном кабинете, где есть кольпоскоп [4-11]
| С | Рекомендуется проводить кольпоскопию в специально оборудованном кабинете обученным врачом-гинекологом [4-11] |
| В |
Признаки рака шейки матки при кольпоскопии: [4-11]
наличие экзофитной опухоли;
язва с грубыми приподнятыми краями;
атипические сосуды (нормальные сосуды при обработке уксусом, как правило, кратковременно исчезают, атипичные - не изменяются, они короткие, в форме непонятных образований (шпильки, штопора, запятой), разной толщины с резкой градацией, не реагирующие на обработку уксусом);
грубая пунктация (неравномерная точечность, когда на фоне ацетобелого эпителия – участков, которые побелели после обработки уксусной кислотой – появляются множественные красноватые точки разных размеров на разном расстоянии);
грубая мозаика (после обработки уксусом на белесом фоне появляются многоугольнички, фрагменты крупные и сильно отличаются размерами, напоминает булыжную мостовую);
легкая ранимость;
кровоточивость тканей шейки матки.
|
| В | Рекомендуется выполнять магнитно-резонансную томографию (МРТ) органов брюшной полости и малого таза с внутривенным (в/в) контрастированием всем пациенткам РШМ в целях определения распространенности опухолевого процесса и планирования алгоритма лечения [4-11] |
| В | Рекомендуется проводить КТ органов брюшной полости и малого таза с в/в контрастированием при отсутствии возможности выполнить МРТ [4-11] |
С помощью специализированных методов МРТ можно более точно определить кандидатов на проведение операции по сохранению фертильности по сравнению с клиническим обследованием [4-11].
| В | Рекомендуется проводить МРТ для определения кандидатов на проведение оперативного вмешательства с сохранением фертильности [4-11] |
Для выявления патологических клеток применяют различные радиофармпрепараты. ПЭТ/КТ всего тела проводится с введением 18F-фтордезоксиглюкозы (ФДГ), это радиофармпрепарат, который готовится накануне исследования, с учетом индивидуальных особенностей пациента [4-11]. Но на сегодняшний день существует новый радиофармпрепарат галлий-68 или (68Ga)-FAPI, доказавший свою эффективность при неинвазивной диагностике почти 30 типов злокачественных опухолей. (68Ga)-FAPI позволяет избавить пациентов от необходимости проходить специальную подготовку, воздерживаться от пищи или находиться в лежачем положении во время прохождения процедуры, что способствует повышению комфорта пациента и ускорению рабочего процесса [4-11].
| В | Рекомендуется проводить ПЭТ/КТ пациентам со стадией более IВ1 для планирования радикальной химиолучевой терапии [4-11] |
ФДГ-ПЭТ-сканирование следует проводить в случаях, более продвинутых, чем стадия IB2 (FIGO 2018), и во всех случаях, когда планируется комбинированная химиотерапия и лучевая терапия [4-11].
| В | Рекомендуется проведение ФДГ-ПЭТ-сканирования пациенткам со стадией РШМ более IB2 для планирования комбинированной химиотерапии и лучевой терапии [4-11] |
УЗИ брюшной полости, малого таза и забрюшинного пространства является наиболее простым и доступным методом визуализации распространенности опухолевого процесса в брюшной полости, забрюшинном пространстве, полости малого таза, а также в регионарных и отдаленных лимфатических узлах [4-11].
Цистоскопия проводится с целью исключения прорастания опухоли в мочевой пузырь.
Ректороманоскопия проводится с целью исключения прорастания опухоли в прямую кишку.
ЭКГ – электрокардиография с целью оценки общего состояния и выявления сердечно-сосудистой патологии пациентки.
Рентгенография грудной клетки и КТ
| D | Рекомендуется провести рентгенографию грудной клетки пациентам РШМ до начала проведения лечения [4-11] |
КТ органов грудной клетки информативнее данных рентгенографии в качестве уточняющей диагностики метастатического поражения легких и средостения [4-11].
| D | Рекомендуется провести КТ органов грудной клетки в качестве уточняющей диагностики метастатического поражения легких и средостения [4-11] |
Рекомендации по лабораторно-инструментальным исследованиям
| С |
Рекомендуется выполнить следующие ОБЯЗАТЕЛЬНЫЕ ДИАГНОСТИЧЕСКИЕ МЕРОПРИЯТИЯ всем больным при подозрении на РШМ для уточнения диагноза [4-11]:
Клинический анализ крови;
Биохимический анализ крови (показатели функции печени и почек);
Коагулограмма;
Общий анализ мочи;
ЭКГ
R-графия органов грудной клетки;
УЗИ органов брюшной полости, малого таза, забрюшинного пространства, паховых лимфоузлов, шейно‐надключичных лимфоузлов (при наличии метастазов в забрюшинных лимфоузлах)
Цистоскопия
Ректороманоскопия
Определение уровня SCC в сыворотке (при плоскоклеточном раке) – по возможности пациента.
|
| С |
Рекомендуются ДОПОЛНИТЕЛЬНЫЕ ДИАГНОСТИЧЕСКИЕ МЕРОПРИЯТИЯ всем больным РШМ по показаниям, доступности и возможности с целью уточнения диагноза [4-10]:
Экскреторная урография, ренография;
МРТ органов малого таза с в/в контрастированием (МРТ информативнее КТ при оценке глубины инвазии и перехода опухоли на параметрий и смежные органы);
КТ малого таза и забрюшинного пространства с в/в контрастированием (по показаниям) (при выявлении метастазов в лимфатических узлах информативность КТ и МРТ одинакова);
ПЭТ/КТ (по показаниям) (наиболее информативна для выявления поражения лимфатических узлов и отдаленных метастазов);
Колоноскопия (по показаниям);
Рентгенография или сцинтиграфия костей скелета (при подозрении на метастатическое поражение костей);
МРТ/КТ головного мозга с в/в контрастированием (при подозрении на метастатическое поражение головного мозга);
КТ/МРТ органов брюшной полости (по показаниям);
КТ/МРТ органов грудной клетки (по показаниям).
|
Биопсия
Биопсия шейки матки представляет собой взятие небольших кусочков ткани шейки матки специальными пинцетами для биопсии с целью диагностики патологий, обнаруженных при осмотре шейки матки без увеличения (например, при гинекологическом осмотре для скрининга шейки матки) или аномалии, наблюдаемые с помощью кольпоскопии.
| D | Рекомендуется помещать образцы ткани при биопсии в маркированную колбу с жидким фиксатором и отправить в гистологическую лабораторию [4-11] |
В гистологической лаборатории очень тонкие срезы окрашивают специальными красителями и исследуют под микроскопом в процессе, называемом гистопатологией. Если кусочки ткани имеют достаточный размер и хорошо сохранились, результаты гистопатологии позволят провести различие между предраком шейки матки, инвазивным раком и доброкачественными поражениями (например, бородавками [кондиломами], герпесом, инфекциями, доброкачественными кистами или полипами).
| В | Рекомендуется проводить биопсию всех подозрительных участков шейки матки [4-11] |
| В | Рекомендуется проводить гистологическое исследование хирургически удаленного опухолевого препарата [4-11] |
| В |
Рекомендуется в морфологическом заключении отразить следующие параметры [4-11]:
гистологический тип опухоли;
степень дифференцировки опухоли;
размеры опухоли (три размера);
глубину инвазии опухоли;
толщину шейки матки в месте наибольшей инвазии опухоли;
наличие/отсутствие опухолевых эмболов в кровеносных и лимфатических сосудах;
опухоль в крае резекции влагалища, параметриев, по границам резекции шейки матки (при выполнении конизации/ампутации или трахео
эктомии); при близком крае резекции указывается расстояние от края резекции до опухоли;
переход опухоли на влагалище;
опухолевое поражение параметрия справа, слева;
общее число удаленных и поражённых лимфоузлов параметрия справа, слева; размер метастазов в мм (изолированные опухолевые клетки, микрометастазы, макрометастазы);
общее число удаленных и поражённых тазовых лимфоузлов справа, слева; размер метастазов в мм (изолированные опухолевые клетки, микрометастазы, макрометастазы);
общее число удаленных и поражённых поясничных лимфоузлов; размер метастазов в мм (изолированные опухолевые клетки, микрометастазы, макрометастазы);
переход опухоли на тело матки;
метастатическое поражение яичников;
прорастание опухоли в стенку мочевого пузыря, прямой кишки (при выполнении экзентерации или резекции смежных органов);
степень лечебного патоморфоза первичной опухоли и метастазов в лимфоузлах в случае предоперационной терапии со ссылкой на классификацию, по которой оценивается степень лечебного патоморфоза.
|
| В |
Первичная оценка опухоли включает [4-11]: место опухоли; объем первичной опухоли (в нескольких измерениях); гистологический тип и степень; стромальная инвазия; состояние хирургического края; наличие лимфоваскулярной инвазии. |
Биопсия может быть слегка болезненной. Анестезия обычно не требуется. Кровотечение, как правило, может быть остановлено прижатием ватным тампоном и/или применением кровоостанавливающих препаратов.
| D | Рекомендуется выполнять биопсию в организации здравоохранения, имеющим обученного медицинского специалиста и оснащенным необходимым оборудованием, расходными материалами [4-11] |
| D | Не рекомендуется упоминать рак при разговоре с пациентом до получения результатов микроскопического исследования, т.к. диагноз пока неизвестен [4-11] |
Показания для эндоцервикального выскабливания:
цитологический скрининг-тест считается положительным, но при кольпоскопии никаких отклонений не наблюдается – внутри канала может быть скрыто предраковое состояние или рак;
аномальные железистые клетки видны при скрининговом тесте на основе цитологии;
кольпоскопия предполагает патологию, возникающую в канале;
При HSIL (CIN III) рекомендуется выполнять ножевую биопсию шейки матки (конусовиднную) или конусовидную радиоволновую биопсию шейки матки с последующим раздельным диагностическим выскабливанием цервикального канала (оставшейся его части) и, по показаниям, полости матки с лечебно-диагностической целью [4-11].
| В | Рекомендуется выполнять ножевую биопсию шейки матки (конусовидную) или конусовидную радиоволновую биопсию шейки матки с последующим раздельным диагностическим выскабливанием цервикального канала (оставшейся его части) при HSIL (CIN III) и по показаниям полости матки с лечебно-диагностической целью [4-11] |
При гистологическом подтверждении диагноза и отсутствии опухолевых клеток в краях резекции и соскобе из оставшейся части цервикального канала приведенный объем хирургического вмешательства считается адекватным. Выполнение экстирпации матки не улучшает результаты лечения. Если в краях резекции шейки матки или в соскобе из оставшейся части цервикального канала обнаруживаются HSIL, рекомендована повторная конизация при желании сохранить репродуктиную функцию.
| В | Рекомендуется повторная конизация при желании сохранить репродуктиную функцию, если в краях резекции шейки матки или в соскобе из оставшейся части цервикального канала обнаруживаются HSIL [4-11] |
Однако женщинам, не заинтересованным в сохранении репродуктивной функции, и пациенткам постменопаузального периода может быть предложена экстрипация матки (операция I тип по Piver). У молодых пациенток (до 45 лет) при удалении матки возможно сохранить функцию яичников [4-11].
Лечение
| В | Рекомендуется направлять больных РШМ в онкологические центры [9; 10] |
Лечение РШМ осуществляется, в первую очередь, с помощью хирургического вмешательства или лучевой терапии, при этом химиотерапия является ценным дополнением [4-11]. Перед началом лечения пациент подписывает информированное согласие на проведение оперативного лечения, лучевой терапии (см. Приложение 3, 4, 5).
| D | Рекомендуется подписать форму информированного согласия на проведение оперативного вмешательства и лучевой терапии перед началом лечения больных РШМ [4-11] |
| А |
При лечении РШМ применяются следующие методы [4-11]:
хирургический;
лучевой;
химиолучевой;
лекарственный (химиотерапия неоадъювантная, адъювантная терапия, паллиативная);
комбинированный (хирургический метод + лучевая терапия);
комплексный (хирургический метод + лучевая терапия + неоадьювантная и/или адьювантная химотерапия)
|
Выбор метода лечения РШМ определяется индивидуально и зависит от распространенности опухолевого процесса и тяжести сопутствующей соматической патологии [4-11] (см. Приложение 6. «Критерии оценки качества медицинской помощи»).
Показания для хирургического лечения:
Показания для лучевой терапии:
Прогноз зависит от клинической стадии на момент постановки диагноза, наличия условий и доступности для качественного лечения, возраста, состояния лимфоузлов, общего состояния, питания, наличия анемии.
Хирургическое лечение состоит в удалении различного объема тканей, пораженных опухолью и окружающих ее.
Операция может выполняться в рамках как первичного лечения, так и повторного, после другого лечения.
В табл. представлены две классификации типов хирургических вмешательств при РШМ по Piver M.S., Rutledge F. (1974 г.) и Querleu D., Morrow С.P. (2008 г.).
Классификация типов хирургических вмешательств при РШМ.
Piver M.S., Rutledge F. (1974 г.) и Querleu D., Morrow С.P. (2008 г.).
| I тип | Экстрафасциальная экстирпация матки с придатками |
| II тип | Модифицированная расширенная экстирпация матки подразумевает удаление медиальной трети кардинальных, пузырно-маточных и крестцово‐маточных связок, верхней трети влагалища и тазовую лимфаденэктомию. Мочеточники туннелируются, но не мобилизуются по нижне‐ латеральной полуокружности. Маточные сосуды пересекаются на уровне мочеточника |
| III тип | Расширенная экстирпация матки по Мейгсу подразумевает полное удаление кардинальных и крестцово-маточных связок от стенок таза, пузырно‐маточной связки — от стенки мочевого пузыря, верхней трети влагалища и тазовую лимфаденэктомию. Мочеточники мобилизуются полностью до места впадения в мочевой пузырь. Маточные сосуды пересекаются у места отхождения от внутренних подвздошных сосудов |
| IV тип | Расширенная экстирпация матки включает пересечение верхней пузырной артерии, удаление периуретеральной клетчатки и до 3/4 влагалища |
| V тип | Комбинированная расширенная экстирпация матки подразумевает удаление дистальных отделов мочеточников и резекцию мочевого пузыря |
Классификация Querleu D., Morrow С.P. (2008г.)
|
Тип
|
Латеральный параметрий | Передний параметрий | Задний параметрий |
| А |
Середина расстояния между шейкой матки и мочеточником (мочеточник не мобилизуется)
|
Минимально | Минимально |
| В1 | На уровне мочеточника (мочеточник мобилизуется от латерального параметрия) | Частичное удаление | Частичное удаление |
| В2 | В1 + парацервикальные лимфоузлы | B1 | B1 |
| С1 | Верхняя часть до стенки таза (латерально) и до уровня глубокой маточной вены (вертикально) |
Верхняя часть (над мочеточником) на уровне мочевого пузыря
|
Верхняя часть до уровня прямой кишки (гипогастральные нервы сохраняются) |
| С2 | Полностью до стенки таза |
Полностью до мочевого пузыря
|
Полностью до крестца |
| D1 | Удаление внутренних подвздошных сосудов и клетчатки за ними | C2 | C2 |
| D2 | Резекция примыкающих фасциальных и мышечных структур стенки таза | C2 | C2 |
радикальная программа;
адъювантное лечение (в послеоперационном периоде).
В послеоперационном периоде ЛТ выполняется через 14–28 дней после операции.
Основная цель ДЛТ – остановить рост и уменьшить опухоль в размере для облегчения последующей брахитерапии. Комбинация ДЛТ и брахитерапии максимизирует вероятность локально-регионарного контроля при минимальном риске осложнений лечения.
Особенности ДЛТ:
| В | Рекомендуется применять разовую дозу ДЛТ 1,8-2 Гр за фракцию, в режиме облучения 5 раз в неделю, до суммарной дозы 45-50 Гр за 25-28 фракций [4-11] |
| А | Рекомендуется не превышать общее время проведения ДЛТ – 5-6 недель[4-11] |
| А | НЕ РЕКОМЕНДУЕТСЯ прерывание курса лучевой терапии [4-11] |
Одновременная химиолучевая терапия, при непереносимости цисплатина, проводится с использованием карбоплатина или неплатиновых пар химиопрепаратов (non-platinum chemotherapy doublets).
На область первичной опухоли или метастатических лимфоузлов высокого риска необходимо применять одновременную модулированную ускоренную лучевую терапию, так называемую бустерную терапию (boost), которая позволяет доставлять к целевому объему высокого риска разовую дозу 2,2-2,4 Гр при одновременном облучении в режиме классического фракционирования 2 Гр остального объема облучения.
| А |
Рекомендуется проводить одновременную с ХЛТ цисплатином (в дозе из расчета 40 мг/м2 в/в один раз в неделю (1 цикл) (не более 70 мг/нед), минимум 4 цикла; максимум 6 циклов плюс лучевая терапия 1,8–2 Гр за фракцию.
Рекомендуется карбоплатин и 5FU, если цисплатин неприменим (в качестве альтернативы бустерной терапии) [4-11]
|
| D | НЕ РЕКОМЕНДУЕТСЯ ПРОВОДИТЬ ХТ после первичной ХЛТ местно-распространенного РШМ (systemic consolidation therapy), проводиться только в рамках клинических исследований [11] |
Адъювантная ДЛТ ложа опухоли и области лимфатических узлов назначается в разовой очаговой дозе (РОД) 1,8-2 Гр за одну фракцию, ежедневно, 5 раз в неделю, 25-28 фракций, до суммарной очаговой дозы (СОД) 45-50 Гр в зависимости от объема и гистологического результата операции.
| А | Рекомендуется проводить адъювантную ДЛТ ложа опухоли и области лимфатических узлов в РОД 1,8-2 Гр за одну фракцию ежедневно, 5 раз в неделю, 25-28 фракций, до СОД 45-50 Гр в зависимости от объема и гистологического результата операции [11] |
Проведение адъювантной ВПЛТ после ДЛТ спорно, она может быть рассмотрена для пациентов с положительными краями, большими или глубоко инвазивными опухолями, параметральным или вагинальным поражением, или обширной инвазией лимфо-сосудистого пространства (LVSI), т.е. присутствием клеток карциномы в лимфатических и/или кровеносных сосудах. Брахитерапия манжетки влагалища проводится с помощью овоидов или цилиндров к верхней трети остаточного влагалища, на расстоянии 5 мм от поверхности вагинального цилиндра/овоида и включает по 5 Гр за одну фракцию, 2 раза в неделю, до СОД 20 Гр за 4 фракции [11].
| D |
Рекомендуется рассмотреть проведение адъювантной ВПЛТ пациентам с положительными краями, большими, глубоко инвазивными опухолями, параметральным, вагинальным поражением, или обширной инвазией лимфо-сосудистого пространства (LVSI).
Рекомендуется проводить брахитерапию верхней трети остаточного влагалища овоидами/цилиндром на расстоянии 5 мм от поверхности вагинального цилиндра по 5 Гр за одну фракцию, 2 раза в неделю, до СОД 20 Гр за 4 фракции [11]
|
Модулированная по интенсивности лучевая терапия (IMRT / Intensity Modulated Radiation Therapy). При IMRT используют пространственное 3D-сканирование для направления к опухоли пучков излучения под разными углами. При каждом из этих углов модулируется интенсивность излучения (варьируется), и форма пучка изменяется для соответствия форме опухоли. Обеспечивается максимально точное соответствие распределения дозы радиации облучаемому объему, высокая однородность дозы в пределах мишени, возможность подведения более высоких, чем при традиционной лучевой терапии суммарных очаговых доз на область новообразования. При IMRT удается достичь максимального щажения окружающих опухоль нормальных тканей, но требуются более длительный период планирования и оценки показателей безопасности, прежде чем пациент сможет начать лечение. При IMRT рекомендуется ежедневный контроль визуализации за объемом мишени, учет неопределенностей в отношении движения органов (движение матки в зависимости от степени наполнения мочевого пузыря), уменьшения дозовой нагрузки на органы риска. Органами риска при РШМ являются мочевой пузырь, прямая, толстая и тонкая кишки, почки, головки бедренных костей и др. [16].
Объемно-модулированная лучевая терапия арками (VMAT / Volumetric Modulated Arc Therapy). Комплексная методика ротационного динамического облучения, где при помощи объемной модуляции интенсивности фотонного излучения за один или несколько оборотов гентри линейного ускорителя (одну или несколько арок) в мишень точно доставляется запланированное суммарное индивидуальное распределение дозы. Для получения заданного распределения дозы в процессе облучения происходит постоянное движение множества лепестков коллиматора, изменяющих размеры и форму поля облучения, а также варьируется комплексное дозовое распределение, доставляемое по всему объему мишени внутри тела пациента за счет изменения скорости вращения гентри ускорителя и мощности поглощенной дозы. Это увеличивает эффективность лечения, уменьшая дозовую нагрузку на окружающие ткани. Данная методика также позволяет значительно сократить время лечения, сочетая в себе точность радиотерапии с необходимой мощностью, но при этом меньше воздействует на окружающие ткани.
Лучевая терапия с визуальным контролем по изображениям (IGRT / Image Guided Radiation Therapy). Метод IGRT предполагает использование линейных ускорителей, оснащенных техническими средствами визуализации. Получают изображение облучаемой области непосредственно перед началом облучения или даже во время сеанса, когда пациент находится на процедурном столе. Реальные изображения сопоставляются с изображениями, полученными во время имитационного моделирования. Лучевая терапия и/или положение пациента корректируются по изображениям для достижения точного прицельного облучения опухоли и для предотвращения повреждения здоровых тканей, окружающих опухоль.
| А |
Рекомендуется проводить следующие виды ДЛТ при РШМ в зависимости от оснащения организации здравоохранения [4-11]:
2D-конвенциональная лучевая терапия;
3D-конформная лучевая терапия;
IMRT лучевая терапия;
VMAT облучение;
IGRT лучевая терапия.
|
| А |
Рекомендуется проводить следующие виды ДЛТ при РШМ в зависимости от вида излучения [4-11]:
гамматерапия на лучевых аппаратах с радиоактивным источником (например, кобальт-60);
облучение фотонами и электронами разных энергий на линейном ускорителе.
|
Алгоритм предлучевой подготовки, планирования, собственно ДЛТ с оценкой и адаптацией плана при необходимости на LINAC при РШМ представлен в Приложении 8 [17-18].
Проводится планирующая КТ, которая определяет расположение и размеры мишени (опухоли) и прилегающих здоровых структур. С помощью лазерной системы центрации на теле пациента отмечают опорные точки (метки), по которым в будущем будет воспроизводиться укладка для проведения сеансов лучевой терапии. После нанесения меток на тело, производится сканирование области расположения злокачественного очага, и полученные изображения загружаются в планирующую компьютерную систему, где производится планирование облучения. Далее метки на коже пациента закрепляют в виде татуировки.
| С | Рекомендуется проводить планирующую КТ для определения опорных точек (метки), по которым будет воспроизводиться укладка для проведения сеансов ДЛТ [17-18] |
| С | Рекомендуется проводить КТ-моделирование для позиционирования пациента на лечебном столе, изготовления и/или подбора индивидуальных фиксирующих устройств, укладки пациента на лечебном столе с учетом движения органов во время дыхания, иммобилизации пациента, установки референсных точек, маркировки на коже пациента [17-18] |
КТ-снимки передаются в компьютер системы планирования лечения (treatment planning system, TPS) для контурирования объема мишени и окружающих структур на каждом из снимков непосредственно на экране компьютера с помощью курсора или светового пера для трехмерной реконструкции этих структур.
| С | Рекомендуется проводить контурирование органов риска (OAR - Organs At Risk) и мишеней разными цветами [17-18] |
Объемы облучения мишеней [19-21]:
При наличии и необходимости проводится совмещение (фьюжн) и сравнение КТ, МРТ снимков (CT and MRI Image Fusion), и данных ПЭТ-КТ для точного планирования облучения.
| С | Рекомендуется сделать предписание ЛТ медицинскому физику по выбору суммарной дозы облучения и режима фракционирования [17-18] |
Медицинские физики определяют следующие параметры облучения:
Изображение BEV обычно содержит изображения анатомии пациента и модификаторов луча (таких как многолепестковые коллиматоры (Multi-Leaf Collimators (MLC)). Использование индивидуализированных настраиваемых блоков, закругленных полей, определяющих лечебный портал, чтобы сохранить минимальный объем высокой дозы, как эффективный метод уменьшения лучевых повреждений для окружающих нормальных тканей.
Для дальнейшей верификации лучевой терапии, врач маркирует неподвижные костные структуры на рентгеновских снимках пациента в специальной компьютерной программе, то есть создает цифровые реконструированные рентгенограммы (Digitally Reconstructed Radiographs, DRR's) которые воссоздают запланированное облучение для сравнения с изображениями на симуляторе и с портальными изображениями.
| С | Рекомендуется сделать маркировку неподвижных костных структур на рентгеновских снимках пациента в специальной компьютерной программе и создать цифровые реконструированные рентгенограммы (DRR's) для воссоздания запланированного облучения [17-18] |
| С | Рекомендуется оценить распределение дозы путем просмотра кривых в отдельных срезах, ортогональных плоскостях (поперечных, сагиттальных и коронарных) или трехмерных изодозных поверхностях [17-18] |
| С |
Рекомендуется проверить вместе с медицинским физиком гистограммы доза-объем (dose-volume histogram (DVH)) в двух формах [17-18]:
кумулятивная интегральная DVH;
дифференциальная DVH.
|
Старт лучевой терапии включает:
| С | Рекомендуется проводить при старте ЛТ верификацию локализации мишени с помощью портальных изображений ежедневно в течение 3- дней и далее 1 раз в неделю до конца лечения для оценки объема облучения в реальных условиях лечения [17-18] |
Здесь производится совмещение портальных снимков пациента в лечебной позиции и DRR из планирующей системы, выявляется и корректируется геометрическое смещение полей облучения. А также физиками-дозиметристами проводится дозиметрическая верификация. Врач и медицинский физик работают с единой базой данных, которая объединяет историю лучевой терапии онкологического больного в единую комплексную систему.
| С | Рекомендуется использовать единую информационную систему (интерфейс) с данными проведения ЛТ, параметрами облучения и другими протоколами для специалистов и медицинских физиков [17-18] |
Все данные используемые при проведении лучевой терапии, параметры облучения и прочие лечебные протоколы доступны для специалистов в едином пользовательском интерфейсе. Онкологическая информационная система обеспечивает полное управление данными, изображениями и процедурами на любом уровне, представляя собой надежное решение с возможностью обновления в соответствии с изменяющимися потребностями [4-11, 17-18].
| А |
Рекомендуется проводить при дистанционной 3D-лучевой терапии [4-11, 17-18]:
КТ-моделирование.
Предписание лучевой терапии.
Планирование лучевой терапии.
Оптимизация.
Создание DRR's.
Оценка плана лучевой терапии.
Старт лучевой терапии.
Верификация локализации мишени в течение первых трех дней и каждую неделю во время облучения.
Дозиметрическая верификация.
|
| А | Рекомендуется включать в объем CTV-T весь видимый объем опухоли (GTV), всю шейку матки, всю матку, параметрий, верхнюю половину влагалища / не менее чем на 2 см ниже уровня опухоли [4-11, 17-18] |
| А | Рекомендуется включать в CTV-N все тазовые лимфатические узлы (запирательные, внутренние, наружные, общие подвздошные и пресакральные) лимфатические узлы и очертить в соответствии с атласом контурирования [4-11, 17-18] |
| А | Рекомендуется включать в случае поражения тазовых/парааортальных лимфатических узлов в CTV-N парааортальные лимфоузлы, по крайней мере, до уровня почечных сосудов [4-11, 17-18] |
| А | Рекомендуется проводить ЛТ пораженных лимфатических узлов путем одновременной интегрированной (при наличии IMRT) или последовательной бустерной терапии, когда общая доза облучения на пораженные лимфоузлы, включая вклад брахитерапии, составляет 55–60 Гр (EQD2) [4-11, 17-18] |
Конформное облучение (такое как IMRT и стереотаксическое облучение) не заменяет применение брахитерапии в рутинной клинической практике лечения пациенток с распространенными формами РШМ.
Виды брахитерапии:
Внутриполостная брахитерапия
| В | Рекомендуется проводить внутриполостную брахитерапию пациенткам РШМ, получающим радикальную ЛТ [4-11] |
Внутриполостная лучевая терапия проводится под местной или внутривенной анестезией, а комбинированная внутриполостная+внутритканевая лучевая терапия проводится под общей анестезией. При выявлении на момент проведения брахитерапии остаточной опухолевой инфильтрации в параметрии, а также распространения опухоли за пределы шейки матки, например, во влагалище, тело матки или прилегающий орган, эти мишени включаются в CTV-HR [22].
| В | Рекомендуется проводить внутриполостную лучевую терапию под местной или внутривенной анестезией, а комбинированную внутриполостную + внутритканевую лучевую терапию проводить под общей анестезией [4-11] |
| С | Рекомендуется проводить брахитерапию в дозе 30-40 Гр за один или 2 сеанса при использовании радиоактивных источников низкой мощности дозы LDR (low-dose-rate) [4-11, 17-18] |
| С | Рекомендуется проводить брахитерапию в дозе от 5 до 10 Гр по 1–2 фракции в неделю при использовании радиоактивных источников высокой мощности дозы HDR (high-dose-rate) [4-11, 17-18] |
При использовании брахитерапии с импульсной мощностью дозы PDR (pulse-dose-rate) лечение проводится в несколько часовых импульсов, каждый из которых длится несколько минут, данный метод сочетает в себе физические преимущества технологии высокой мощности дозы (HDR) (оптимизация изодозы и радиационная безопасность) с радиобиологическими преимуществами брахитерапии с низкой мощностью дозы (LDR).
| А | Рекомендуется проводить во время процедуры внутриполостной брахитерапии визуализацию и объемное 3D-планирование на основе МРТ или КТ [4-11] |
| В | Рекомендуется проводить во время процедуры внутриполостной брахитерапии визуализацию и планирование на основе рентгена 2D-плоскостей, если объемное планирование на основе МРТ или КТ недоступно [4-11]. |
| В | Рекомендуется проводить внутриполостную брахитерапию аппликатором, который должен состоять из маточного тандема и вагинального аппликатора (яйцевидного или кольцевого) [11] |
| А | Рекомендуется проводить при внутриполостной 3D-брахитерапии объемное контурирование органов риска и использовать соответствущие ограничения дозы на них для повышения местного контроля и сведения к минимуму побочных эффектов [4-11] |
| В | Рекомендуется проводить брахитерапию, включающую остаточный общий объем опухоли, адаптивный клинический объем мишени высокого риска и клинический объем мишени промежуточного риска [4-11] |
| В |
Рекомендуется использовать для 2D-брахитерапии [4-11, 22]:
контроль расчета дозы по точке А (место пересечения маточных сосудов с мочеточником);
метод визуального контроля является рентген (С-дуга);
суммарную дозу в точке А ≥75 Гр (EQD2) при малых CTV-HR ≤3 см и выше при CTV-HR >4 см
|
| В |
Рекомендуется проводить 3D-брахитерапию [4-11, 23-24]:
под визуальным контролем с использованием МРТ или КТ;
в зависимости от объема для мишени:
- резидуальный (остаточный) объем опухоли шейки матки GTV-Tres (после этапа ХЛТ);
- клинический объем опухоли высокого риска HR-CTV (включает всю шейку матки и остаточную опухолевую инфильтрацию);
- клинический объем промежуточного риска IR-CTV.
|
Внутритканевая брахитерапия состоит из введения нескольких игл/катетеров в первичную опухоль и параметрий через промежность с помощью шаблона. Из-за риска травмы нормальных структур, таких как кишечник и мочевой пузырь, рекомендуется использовать трансректальное ультразвуковое исследование во время процедуры имплантации игл [11].
| В | Рекомендуется проводить внутритканевую брахитерапию специальными внутритканевыми иглами (например, в параметрии) под контролем трансректального ультразвукового исследования во время имплантации игл [11] |
|
Объем мишени
|
Компоненты | Дозы от ДЛТ + брахитерапии |
| GTV | Макроскопическая опухоль, определяемая с помощью визуализации во время брахитерапии или обследования | Минимальная доза должна быть ≥80 Гр |
| HR-CTV | GTV, вся шейка матки и области с неопределенным Т2-взвешенным сигналом МРТ (например, серые зоны) | D90 ≥80 Гр, с учетом большой опухоли или плохого ответа на первоначальную терапию |
| IR-CTV | HR-CTV с асимметричным расширением *, не распространяющимся на органы риска, и включая участки вовлечения первичной опухоли | Опционально: D90 ≥60 Гр, с учетом большой опухоли |
Расчет доз облучения при ДЛТ и брахитерапии
| В | Рекомендуется использовать при брахитерапии суммарную дозу облучения, эквивалентную 40-45 Гр, подводимые в режиме классического фракционирования дозы (EQD2) [4-11, 22] |
| В |
Рекомендуется использовать суммарные дозы* для полного курса ЛТ, включающего ДЛТ и брахитерапию [4-11, 22]:
85–90 Гр (D90) на CTV-HR (при суммарных дозах 45 Гр от ДЛТ);
≥60 Гр (D98) на CTV-IR;
≥90 Гр (D98) на GTV-Tres
|
| В |
Рекомендуется проводить адаптивную брахитерапию под визуальным контролем (IGABT) в дозе 40–45 Гр (EQD2) (D90) для достижения общей дозы ДЛТ + брахитерапии [4-11, 22]:
85–90 Гр в мишени высокого риска;
60 Гр (D98) в мишени промежуточного риска
|
| В | Рекомендуется ограничивать объемы дозы в 3D-брахитерапии для прямой кишки, влагалища, сигмовидной кишки и кишечника, исходя из объема органа (D2cc мочевой пузырь 80 Гр, D2cc прямая кишка 70–75 Гр, D2cc кишечник/сигмовидная кишка 70 Гр) [4-11, 22] |
Ограничения общей дозы на органы риска [4-11]
|
Органы риска
|
Идеальные ограничения дозы (Гр) (EQD23) | Максимальные* ограничения дозы (Гр) (EQD23) | ICRU-точка (Гр) (EQD23) |
| Прямая кишка |
<65 D2cc
|
<75 D2cc | <75 доза в точке |
| Мочевой пузырь |
<80 D2cc
|
<90 D2cc | <90 доза в точке |
|
Влагалище (Ректовагинальная точка)†
|
<65 доза в точке
|
<75 доза в точке | --- |
| Сигмовидная кишка‡ |
<70 D2cc
|
<75 D2cc | --- |
| Толстый кишечник‡ |
<70 D2cc
|
<75 D2cc† | --- |
| А |
Рекомендуется проводить брахитерапию [4-11]:
по РОД 7 Гр 1 раз в неделю, 4 фракции до СОД 28 Гр на точку А;
ИЛИ
по РОД 5 Гр 2 раза в неделю, 6 фракций до СОД 30 Гр на точку А
|
| А | Рекомендуется проводить радикальную лучевую терапию в общей дозе ДЛТ и 2D-брахитерапии ≥80 Гр [4-11] |
| А | Рекомендуется проводить радикальную лучевую терапию в общей дозе ДЛТ и 3D-брахитерапии HR-CTV D90 ≥80 Гр, с тщательным щажением нормальных тканей [4-11] |
| А | Рекомендуется проводить брахитерапию в общей доза ДЛТ и 3D-брахитерапии D90 ≥85 Гр для пациентов с плохим ответом или опухолью большого объема (> 4 см) при радикальной лучевой терапии [4-11] |
| А | Рекомендуется проводить гибридную брахитерапию (внутриполостную + внутритканевую), когда не достигаются необходимые дозы и защита органов риска при только внутриполостной брахитерапии [4-11] |
Биологическая эффективная доза (BED) и эквивалентная доза во фракциях 2 Гр (EQD2) часто используются для количественного преобразования радиобиологических концепций в конкретные интерпретируемые значения.
Рекомендуется использовать онлайн калькуляторы, доступные в Интернет - https://www.mdcalc.com/ или http://eqd2.com/
| А |
Общая равноэффективная доза (EQD2) рассчитывается по закону линейно-квадратичной модели через следующие шаги [25-26]:
• EQD2 брахитерапии для каждой фракции
• EQD2 всей брахитерапии
• EQD2 дистанционной лучевой терапии (ДЛТ)
Общая EQD2 ДЛТ и брахитерапии
*На основе ICRU/GEC ESTRO Report 89.
|
| А | Рекомендуется использовать концепцию EQD2 для расчета дозы лучевой терапии, полученной от ДЛТ и брахитерапии на мишень и органы риска [4-11] |
Адъювантная брахитерапия рекомендуется пациенткам в случаях высокого риска рецидива РШМ во влагалище, параметрии и проводится с учетом принципов планирования брахитерапии под визуальным контролем [4-11].
| В | Рекомендуется назначить суммарную дозу в точке А до ≥75 Гр (EQD2) при малых CTV-HR ≤3 см и выше при CTV-HR >4 см [4-11] |
| В | Рекомендуется включать в CTV-HR остаточную опухолевую инфильтрацию параметриев, влагалища, тела матки [4-11]. |
| D | Рекомендуется проводить развернутый анализ крови и мочи пациентам, получающим ЛТ или ХЛТ каждые 10 дней |
| D |
Рекомендуется проводить больным РШМ при кровотечении и болевом синдроме краткий паллиативный курс ДЛТ:
доза 20 Гр за 5 фракций по 4 Гр в течение 1 недели,
ИЛИ
30 Гр за 10 фракций по 3 Гр в течение 2 недель.
|
Прекращение кровотечения обычно достигается через 12–48 часов после лучевой терапии.
МЕРЫ ПРЕДОСТОРОЖНОСТИ ПРИ ПРОВЕДЕНИИ ЛУЧЕВОЙ И ЛЕКАРСТВЕННОЙ ТЕРАПИИ
Реакции со стороны кожи
|
НЕ РЕКОМЕНДУЕТСЯ использовать мыло-моющие средства при мытье!!!
Рекомендуется наносить кремы и мази на водной основе. Перед выходом на улицу использовать солнцезащитные средства!!!
|
| Рекомендуется обрабатывать влагалище и шейку матки раствором фурациллина (1:5000) или этакридин лактатом, использовать тампоны с синтомициновой эмульсией, метилурациловой мазью!!! |
| Рекомендуется назначить обильное питье, ограничить соленую и острую пищу!!! |
| Рекомендуется назначить общий анализ мочи и бакпосев для определения чувствительности к антибиотикам!!! |
Реакции и осложнения со стороны толстой кишки
|
Рекомендуется назначить обильное питье, вяжущие и адсорбирующие средства (смектит и др.), пре- и пробиотики, ферменты, введение солевых растворов!!!
НЕ НАЗНАЧАТЬ в качестве адсорбирующих и вяжущих средств препараты на основе лекарственных растений (зверобой, ромашка, кора дуба, шалфей и др.), т.к. могут быть нежелательные взаимодействия с ХЛТ!!!
Рекомендуется назначить при диарее лоперамид!
|
Постлучевой климакс наступает в первые месяцы после окончания лечения у молодых пациенток с разной степенью выраженности нервно-психических и обменно-эндокринных нарушений. Возможно назначение седативных средств, лечебной физической культуры.
Классификация противоопухолевых лекарственных средств [25]
| Группа | Препарат | Основной мезанизм действия |
| Алкилирующие средства |
Карбоплатин
Цисплатин
|
Образование меж‐ и внутрицепочных сшивок в молекуле ДНК |
| Ифосфамид | Алкилирование нуклеофильных центров с образованием перекрестных сшивок в молекулах ДНК и РНК и блокированием митотического деления клеток | |
| Антиметаболиты | 5‐фторурацил | Ингибирование активности тимидилат‐синтазы |
| Пеметрексед | Ингибирует тимидилат-синтетазу (TC), дигидрофолат-редуктазу (ДГФР), глицинамид-рибонуклеотид-формилтрансферазу (ГАРФТ) - ключевые фолат-зависимые ферменты при биосинтезе тимидиновых и пуриновых нуклеотидов. | |
| Гемцитабин | Инкорпорирование в предпоследнее звено цепочки ДНК. Ингибирование активности рибонуклеотидредуктазы | |
| Противоопухолевые антибиотики | Митомицин С | Алкилирование ДНК, образование поперечных сшивок, одиночных и двойных разрывов ДНК |
| Вещества растительного происхождения | Топотекан | Ингибирование топоизомеразы I |
| Таргетные препараты | Бевацизумаб | Моноклональное антитело к фактору роста эндотелия сосудов, ингибирование неоангиогенеза |
| Пембролизумаб | Селективно блокирует взаимодействие между PD-1 и его лигандами PD-L1 и PD-L2. PD-1 - рецептор, являющийся иммунной контрольной точкой, который ограничивает активность Т-лимфоцитов в периферических тканях. Опухолевые клетки могут использовать сигнальный путь с участием PD-1 для ингибирования активного Т-клеточного иммунологического надзора. | |
| Алкалоиды | Доцетаксел | Накопление тубулина в микротрубочках митотического веретена, что приводит к нарушению процессов их сборки и разборки. Нарушает клеточное деление в фазах G2 и M клеточного цикла. |
| Иринотекан | Ингибирование клеточного фермента топоизомеразы I, участвующего в синтезе ДНК. Обладает иммунодепрессивной активностью. | |
| Винорелбин | Блокирует митоз клеток на стадии метафазы за счет связывания с белком тубулином. | |
| Связанный с альбумином паклитаксел | Регулирует процессы трансэндотелиального переносапаклитаксела | |
| Паклитаксел | Ингибирование деполимеризации тубулина, образование дефектных микротрубочек, нарушение образования веретена деления | |
| Антидот антагонистов фолиевой кислоты | Лейковорин (Кальция фолиат) | Препятствует образованию из фолиевой кислоты тетрагидрофолата в результате происходит блокирование синтеза нуклеиновых кислот и клеточного деления. |
Химиолучевая терапия (ХЛТ) как первичная терапия, адьювантная терапия
| Предпочтительный режим |
|
Карбоплатин (при непереносимости цисплатина)
День 1: Карбоплатин AUC 2 внутривенно в течение 30 минут.
Повторяйте цикл еженедельно в течение 6 недель с одновременным облучением.
Цисплатин
День 1: Цисплатин в дозе из расчета 40 мг/м2 внутривенно в течение 60 минут.
Повторяйте цикл еженедельно в течение 6 недель с одновременным облучением.
|
| Другие рекомендуемые режимы |
|
Цисплатин + Фторурацил
День 1: Цисплатин в дозе из расчета 50–75 мг/м2 в/ в в течение 60 минут
Дни 1-4: Фторурацил в дозе из расчета 1000 мг/м2 в/ в непрерывной инфузией в течение 24 часов ежедневно.
Повторяйте цикл каждые 3 недели в течение 3-4 циклов.
|
Системная терапия рецидивов или метастазов
Химиотерапия 1-й линии
| Предпочтительные режимы |
|
Карбоплатин + Паклитаксел (Категория 1 для пациентов, ранее получавших терапию цисплатином)
День 1: Паклитаксел в дозе из расчета 175 мг/м2 в/ в в течение 3 часов, затем:
День 1: Карбоплатин AUC 5 внутривенно в течение 30 минут.
Повторяйте цикл каждые 3 недели.
Карбоплатин + паклитаксел + бевацизумаб
День 1: бевацизумаб в дозе из расчета 15 мг/кг внутривенно
День 1: Паклитаксел в дозе из расчета 175 мг/м2 в/ в в течение 3 часов, затем:
День 1: Карбоплатин AUC 5 внутривенно в течение 30 минут.
Повторить цикл 3 недели.
Цисплатин + паклитаксел (категория 1)
День 1: Паклитаксел в дозе из расчета 135 мг/м2 в/в непрерывная инфузия, затем:
День 2: Цисплатин в дозе из расчета 50 мг/м2 в/в в течение 60 минут.
Повторяйте цикл каждые 3 недели.
ИЛИ
День 1: Паклитаксел в дозе из расчета 175 мг/м 2 в/в в течение 3 часов, затем:
День 1: Цисплатин в дозе из расчета 50 мг/м 2 в/в в течение 60 минут.
Повторяйте цикл каждые 3 недели.
Цисплатин + Паклитаксел + Бевацизумаб (Категория 1)
День 1: Бевацизумаб в дозе из расчета 15 мг/кг внутривенно
День 1: Паклитаксел в дозе из расчета 135 мг/м2 в/ в непрерывная инфузия в течение 24 часов, затем:
День 2: Цисплатин в дозе из расчета 50 мг/м2 в/в, в течение 60 минут.
Повторяйте цикл каждые 3 недели.
ИЛИ
День 1: Бевацизумаб в дозе из расчета 15 мг/кг внутривенно
День 1: Паклитаксел в дозе из расчета 175 мг/м 2 в/в, в течение 3 часов,
затем:
День 1: Цисплатин в дозе из расчета 50 мг/м2 в/в, в течение 60 минут.
Повторяйте цикл каждые 3 недели.
Топотекан + Паклитаксел
День 1: Паклитаксел в дозе из расчета 175 мг/м2 в/в, в течение 3 часов.
Дни 1-3: Топотекан в дозе из расчета 0,75 мг/м2 в/в, в течение 30 минут.
Повторяйте цикл каждые 3 недели.
Топотекан + паклитаксел + бевацизумаб (категория 1)
День 1: Бевацизумаб в дозе из расчета 15 мг/кг внутривенно
День 1: Паклитаксел в дозе из расчета 175 мг/м2 в/в, в течение 3 часов.
Дни 1-3: Топотекан в дозе из расчета 0,75 мг/м2 в/в, в течение 30 минут.
Повторяйте цикл каждые 3 недели.
|
| Другие рекомендуемые режимы химиотерапии 1-й линии |
|
Цисплатин + Топотекан
Дни 1-3: Топотекан в дозе из расчета 0,75 мг/м2 в/в, в течение 30 минут, затем:
День 1: Цисплатин в дозе из расчета 50 мг/м2 в/в, в течение 60 минут.
Повторяйте цикл каждые 3 недели.
|
Возможная монохимиотерапия 1-й линии
|
Предпочтительный режим терапии
|
|
Цисплатин
День 1: Цисплатин в дозе из расчета 50 мг/м2 в/ в, в течение 60 минут.
Повторяйте цикл каждые 3 недели
|
|
Другие рекомендуемые режимы терапии
|
|
Карбоплатин
День 1: Карбоплатин AUC 5-6 внутривенно в течение 30 минут.
Повторяйте цикл каждые 3-4 недели.
Паклитаксел
День 1: Паклитаксел в дозе из расчета 175 мг/м2 в/в, в течение 3 часов.
Повторяйте цикл каждые 3-4 недели.
ИЛИ
День 1: Паклитаксел в дозе из расчета 155 мг/м2 в/в, в течение 3 часов, при условии предварительного облучения таза.
Повторяйте цикл каждые 3-4 недели.
ИЛИ
День 1: Паклитаксел в дозе из расчета 170 мг/м2 в/ в непрерывная инфузия в течение 24 часов.
Повторяйте цикл каждые 3-4 недели.
ИЛИ
День 1: Паклитаксел в дозе из расчета 135 мг/м2 в/ в, непрерывная инфузия в течение 24 часов, если до облучения таза.
Повторяйте цикл каждые 3-4 недели.
ИЛИ
День 1: Паклитаксел в дозе из расчета 80 мг/м2 внутривенно в течение 60 минут.
Повторяйте цикл еженедельно.
|
Химиотерапия 2-й линии
|
Предпочтительные режимы
|
|
Пембролизумаб (для PD-L1-положительных или MSI-H/dMMR опухолей)
День 1: пембролизумаб 200 мг внутривенно в течение 30 минут.
Повторяйте цикл каждые 3 недели.
|
|
Другие рекомендуемые режимы
|
|
Связанный с альбумином паклитаксел
Дни 1, 8, 15: Связанный с альбумином паклитаксел в дозе из расчета 125 мг/м2 внутривенно в течение 30 минут.
Повторяйте цикл каждые 4 недели.
ИЛИ
День 1: Связанный с альбумином паклитаксел в дозе из расчета 260 мг/м2 внутривенно в течение 30 минут.
Повторяйте цикл каждые 3 недели.
Бевацизумаб
День 1: бевацизумаб в дозе из расчета 15 мг/кг внутривенно.
Повторяйте цикл каждые 3 недели.
Доцетаксел
День 1: Доцетаксел в дозе из расчета 100 мг/м2 внутривенно в течение 60 минут.
Повторяйте цикл каждые 3 недели.
Фторурацил + Лейковорин
Дни 1-5: Лейковорин в дозе из расчета 200 мг/м 2 в/в ежедневно, затем:
Дни 1-5: Фторурацил в дозе из расчета 370 мг/м 2 внутривенно ежедневно.
Повторяйте каждые 28 дней в течение 2 циклов, затем каждые 35 дней.
Гемцитабин
Дни 1, 8, 15: Гемцитабин в дозе из расчета 800 мг/м2 в/в, в течение 30 минут.
Повторяйте цикл каждые 4 недели.
Ифосфамид
Дни 1-5: Ифосфамид в дозе из расчета 1500 мг/м2 в/в, в течение 3 часов ежедневно г
Дни 1-5: Месна в дозе из расчета 300 мг/м2 в/в, за 15 минут до ифосфамида, затем через 4 и 8 часов после начала введения каждой дозы ифосфамида.
Повторяйте цикл каждые 3 недели.
Иринотекан
Дни 1, 8, 15, 22: Иринотекан в дозе из расчета 125 мг/м2 в/в, в течение 90 минут.
Повторяйте цикл каждые 6 недель (4 недели приема и 2 недели перерыва).
Митомицин
День 1: Митомицин в дозе из расчета 10 мг/м2 внутривенно.
Повторяйте цикл каждые 4 недели.
Пеметрексед
День 1: Пеметрексед в дозе из расчета 900 мг/м 2 в/в, в течение 10 минут.
Повторяйте цикл каждые 3 недели.
ИЛИ
День 1: Пеметрексед в дозе из расчета 700 мг/м 2 в/в, в течение 10 минут, при условии предварительного облучения таза.
Повторяйте цикл каждые 3 недели.
Топотекан
Дни 1-5: Топотекан в дозе из расчета 1,5 мг/м 2 в/в, в течение 30 минут.
Повторяйте цикл каждые 4 недели.
ИЛИ
Дни 1, 8, 15: Топотекан в дозе из расчета 3-4 мг/м 2 в/в в течение 30 минут.
Повторяйте цикл каждые 4 недели.
Винорелбин
Дни 1,8: Винорелбин в дозе из расчета 30 мг/м 2 в/в, в течение 5-10 минут.
Повторяйте цикл каждые 3 недели.
|
Меры предосторожности!!!!
| D | Цисплатин, карбоплатин, доцетаксел и паклитаксел могут вызывать лекарственные реакции |
| D | Рекомендуется перед назначением препаратов ознакомиться с токсическими реакциями на них для предупреждения предсказуемых побочных реакций |
| D | Рекомендуется проведение гидратации с дополнительными электролитами до и после введения цисплатина |
| D | Рекомендуется проведение гидратации до и после введения ифосфамида |
Химиотерапию следует назначать в сочетании с лучевой терапией большинству пациентов со стадиями от IB (высокий риск) до IVA стадии рака шейки матки.
| В | Рекомендуется назначать ХТ в сочетании с ЛТ большинству пациентов со стадиями от IB (высокий риск) до IVA стадии рака шейки матки [4-11] |
Неоадъювантная химиотерапия
| В | НЕ РЕКОМЕНДУЕТСЯ назначать неоадъювантную ХТ перед проведением ЛТ или ХЛТ [4-11] |
Неоадъювантная химиотерапия (НАХТ) назначается в качестве индукционного или неоадъювантного средства перед плановой операцией.
Цель НАХТ - уменьшить размер опухоли и преобразовать ее из хирургически нерезектабельной в резектабельную, снижать риск метастатического распространения и/или устранять микрометастатическое заболевание.
НАХТ можно также рассмотреть в случаях, когда имеется дефицит средств лучевой терапии.
| В | Рекомендуется назначать неоадъювантную ХТ перед перед операцией с целью уменьшения размера опухоли и преобразования ее из хирургически нерезектабельной в резектабельную, для снижения риска метастатического распространения и/или устранения микрометастазов [4-11] |
| В | Рекомендуется назначать неоадъювантную ХТ когда имеется дефицит средств лучевой терапии [4-11] |
Сопроводительная терапия при режиме введения цисплатина во время лучевой терапии [26]
| D |
Рекомендуется назначать при ХЛТ прегидратацию (до введения цисплатина) [26]:
фуросемид 40 мг перорально или внутривенно по мере необходимости;
хлорид натрия 0,9% 500 мл с 8 ммоль сульфата магния в/в капельно в течение 30 минут
|
| D | Рекомендуется назначать гидратацию при ХЛТ, когда цисплатин вводится внутривенно в 1000 мл натрия хлорид 0,9% с 20 ммоль калия хлорида в/в капельно со скоростью 1 мг/мин (минимум 60 минут) [26] |
| D |
Рекомендуется назначать при ХЛТ постгидратацию (после введения цисплатина) [26]:
натрия хлорид 0,9% 500 мл в/в капельно за 30 минут
|
| D |
Рекомендуется назначать при ХЛТ за 15-30 минут до введения цисплатина средства, уменьшающие рвоту [26]:
дексаметазон 8 мг перорально или внутривенно;
ондансетрон 8 мг перорально или внутривенно.
|
| D |
Рекомендуется назначать для применения дома при ХЛТ [26]:
дексаметазон 4 мг 1 раз в сутки в течение 2 дней;
метоклопрамид по 10 мг перорально 3 раза в день в течение 2 дней, затем по 10 мг 3 раза в день раз в день по необходимости;
ондансетрон 8 мг перорально 2 раза в день в течение 2 дней.
|
| D | Рекомендуется назначать препараты железа (железа сульфат+фолиевая кислота) в зависимости от степени анемии во время/после ЛТ или ХЛТ |
| D | Рекомендуется назначать филграстим при лейкопении или нейтропении (показатели лейкоцитов или лимфоцитов ниже нормы) во время/после ЛТ или ХЛТ |
| D | Рекомендуется назначать при кровотечении эритроцитарную массу (при уровне Нв ниже 50 г/л) /тромбомассу (при кол-ве тромбоцитов ниже 50-75х109/л) во время/после ЛТ или ХЛТ больным РШМ |
Рекомендации по химиотерапии
| А | НЕ РЕКОМЕНДУЕТСЯ проводить неоадъювантную химиотерапию, т.к. она не является стандартной практикой и имеет худшие онкологические результаты по сравнению с одновременной химиолучевой терапией на основе цисплатина [4-11] |
| В | НЕ РЕКОМЕНДУЕТСЯ проводить адъювантную химиотерапию после операции (неодновременно с лучевой терапией) на ранней стадии РШМ, т.к. это может проводиться только в рамках клинических испытаний [4-11] |
| А | Рекомендуется проводить адъювантную химиолучевую терапию на основе платины после операции женщинам с ранним раком шейки матки (стадия IA2–IIA) и факторами риска рецидива, т.к. она снижает смертность [4-11] |
| В | Рекомендуется подключать к комбинированной химиотерапии бевацизумаб женщинам с рецидивирующим, персистирующим или метастатическим раком шейки матки, т.к. это улучшает общую выживаемость [4-11] |
| D | НЕ РЕКОМЕНДУЕТСЯ проводить ХТ в неоадъювантном и адъювантном режимах при проведении ХЛТ по радикальной программе пациенткам с РШМ стадий IIВ–IVA [4-11] |
| А | Рекомендуется проводить ХТ при проведении ХЛТ по радикальной программе пациенткам с РШМ стадий IB–IVA в режиме: цисплатин в дозе из расчета 40 мг/м2 1 раз в неделю до 6 циклов на фоне ЛТ [4-11] |
Факторы риска прогресcирования при раке шейки матки [4-11]
|
Факторы риска прогрессирования
|
Риск прогрессирования | Интерпретация |
| Инвазия опухоли в параметрий | Высокий риск | Наличие хотя бы 1 из факторов |
| Метастазы в подвздошных лимфоузлах | ||
| Опухоль в крае резекции влагалища | ||
| Лимфоваскулярная инвазия | Промежуточный риск | Присутствуют хотя бы 2 из факторов |
| Инвазия опухоли более чем на 1/3 толщины миометрия шейки матки | ||
| Размер первичной опухоли≥ 4 см | ||
| Лимфоваскулярная инвазия | Низкий риск | Отсутствуют факторы либо присутствует только 1 из факторов |
| Инвазия опухоли более чем на 1/3 толщины миометрия шейки матки | ||
| Размер первичной опухоли≥ 4 см |
Группа высокого риска прогрессирования
| С |
Рекомендуется проводить адъювантную ХЛТ [4-11]:
- лучевую терапию – разовая очаговая доза (РОД) 1,8-2 Гр за одну фракцию, ежедневно, 5 раз в неделю, 25-28 фракций, до суммарной очаговой дозы (СОД) 45-50 Гр
ПЛЮС ОДНОВРЕМЕННО
- в/в введение цисплатина в дозе из расчета 40 мг/м2 1 раз в неделю (1 цикл), одновременно с лучевой терапии, всего 4 цикла (1 курс лечения) [4-11]
|
Расчет площади поверхности тела (ППТ) рассчитывается по формуле Дюбуа:
| ППТ = 0.007184 х Рост 0.725 х Вес 0.425 |
*Можно использовать для расчета электронный калькулятор, доступной по следующей ссылке https://www.merckmanuals.com/medical-calculators/BodySurfaceArea-ru.htm.
|
Пример расчета:
Пациентка 40 лет, вес 60 кг, рост 165.
По формуле Дюбуа расчет ППТ = 0.007184 х 165 0.725 х 60 0.425 =1.66 м2.
Расчет разовой дозы цисплатина = 40 мг х 1,66 м2 = 66,4 мг
Значит, пациентке необходимо вводить цисплатину в дозе 66 мг, 1 раз в неделю (1 цикл), одновременно с лучевой терапии, всего 4 цикла.
|
При метастазах в поясничных лимфоузлах проводится облучение расширенным полем. При выполнении расширенной экстирпации матки (тип III/С2) в случае обнаружения метастазов в тазовых лимфатических узлах или поражения параметриев и противопоказаниях к лучевой терапии в качестве адъювантного лечения возможно проведение 6 курсов адъювантной ХТ. Эта методика лечения возможна только при наличии команды квалифицированных специалистов, имеющих соответствующий опыт [4-11].
| С | Рекомендуется проводить облучение расширенным полем при метастазах в поясничных лимфоузлах [4-11] |
| С | Рекомендуется проводить 6 курсов адъювантной ХТ при противопоказаниях к лучевой терапии после расширенной экстирпации матки (тип III/С2) в случае обнаружения метастазов в тазовых лимфатических узлах или поражения параметриев [4-11] |
Группа промежуточного риска прогрессирования
| С | Рекомендуется выполнять расширенную трахелэктомию (тип II/В или С1) при необходимости сохранить детородную функцию у больных РШМ IB1 стадии (опухоль <2 см) [4-11] |
| С | Рекомендуется выполнять расширенную трахелэктомию (тип III/С2) при необходимости сохранить детородную функцию у больных РШМ IB1 стадии (опухоль ≥2 см) [4-11] |
В случае расширенной экстирпации матки (тип II/В или С1) показана адъювантная дистанционная ЛТ [4-11].
| С | Рекомендуется проводить адъювантную дистанционную ЛТ при расширенной экстирпации матки (тип II/В или С1) – разовая очаговая доза (РОД) 1,8-2 Гр ежедневно за одну фракцию, 5 раз в неделю, 25-28 фракций, до суммарной очаговой дозы (СОД) 45-50 Гр [4-11] |
После расширенной экстирпации матки (тип III/С2) по факторам промежуточного риска адъювантная дистанционная ЛТ не показана (только если выполнен адекватный объем хирургического вмешательства командой квалифицированных специалистов, имеющих соответствующий опыт) [4-11].
| С | НЕ РЕКОМЕНДУЕТСЯ проводить адъювантную дистанционную ЛТ после расширенной экстирпации матки при выполненении адекватного объема хирургического вмешательства (тип III/С2) [4-11] |
Группа низкого риска прогрессирования
| С | НЕ РЕКОМЕНДУЕТСЯ проводить адъювантное лечение в случае расширенной экстирпации матки (типа II/В или С1) [4-11] |
Пациентам, при радикальной гистерэктомии, рекомендуется сохранение тазовых нервов, поскольку при радикальном лечении тазовые повреждения вегетативных нервов (т. е. гипогастрального нерва, чревного нерва и тазового сплетения) часто приводят к нарушению мочеиспускания, дефекации и половой функции, и, как следствие, ухудшение послеоперационного качества жизни [4-11].
| D | Рекомендуется сохранять при радикальной гистерэктомии тазовые нервы для удовлетворительного качества жизни после операции [4-11] |
При противопоказаниях к хирургическому лечению или по желанию больной может проводиться ЛТ [4-11].
| С | Рекомендуется проводить пациенткам РШМ IB1-IIА1 хирургическое лечение или ЛТ по желанию или при наличии противопоказаний [4-11] |
IA1 СТАДИЯ
Хирургическое лечение
| С | Рекомендуется выполнять конизацию шейки матки с выскабливанием оставшейся части цервикального канала при РШМ IA1стадии в отсутствие эмболов в лимфатических щелях и по показаниям полости матки [4-11] |
При обнаружении в краях резекции шейки матки или в соскобе из оставшейся части цервикального канала дисплазии (CIN III) или клеток рака необходимо провести повторную конизацию. При невозможности реконизации проводится лечение как при IB1 стадии [4-11].
| С | Рекомендуется повторная конизация при обнаружении в краях резекции шейки матки или в соскобе из оставшейся части цервикального канала дисплазии (CIN III) или клеток рака [4-11] |
При наличии лимфоваскулярной инвазии и отсутствии необходимости сохранения детородной функции показана экстирпация матки (операция I типа) или модифицированная экстирпация матки (операция II типа) и тазовая лимфодиссекция (возможна биопсия сторожевого лимфоузла). [4-11]
| С | Рекомендуется выполнять экстирпацию матки (операция I типа) при наличии лимфоваскулярной инвазии и отсутствии необходимости сохранения детородной функции [4-11] |
| С | Рекомендуется выполнять модифицированную экстирпацию матки (операция II типа) и тазовую лимфодиссекция (возможна биопсия сторожевого лимфоузла) при наличии лимфоваскулярной инвазии и отсутствии необходимости сохранения детородной функции [4-11] |
У молодых пациенток (до 45 лет) при удалении матки возможно сохранить функцию яичников, выполнив их транспозицию. [4-11]
| С | Рекомендуется выполнять транспозицию яичников у женщин до 45 лет для сохранения функции яичников [4-11] |
При наличии лимфоваскулярной инвазии и необходимости сохранения детородной функции показана конизация шейки матки с выскабливаем оставшейся части цервикального канала или трахелэктомия (операция I или II типа) и тазовая лимфодиссекция (возможна биопсия сторожевого лимфоузла). [4-11]
| С | Рекомендуется выполнять конизацию шейки матки с выскабливаем оставшейся части цервикального канала или трахелэктомию (операция I или II типа) и тазовую лимфодиссекцию (возможна биопсия сторожевого лимфоузла) при наличии лимфоваскулярной инвазии и необходимости сохранения детородной функции [4-11] |
| С | Рекомендуется выполнять конусообразную эксцизию, простую/экстрафасциальную гистерэктомию и модифицированную радикальную гистерэктомию пациентам с РШМ IA1 стадии [4-11] |
| С | Рекомендуется проводить пациенткам РШМ IА2 хирургическое лечение или ЛТ по желанию или при наличии противопоказаний [4-11] |
Пациенты, получившие как хирургическое вмешательство, так и лучевую терапию, имеют значительно повышенную токсичность, особенно урологические осложнения.
| С | Рекомендуется проводить пациенткам РШМ IA, IB1, IB2 и IIA1 либо радикальную гистерэктомию, либо только радикальную лучевую терапию без химиотерапии [4-11]. |
Если рак распространился на параметрии или на лимфатические узлы, или если удаленная ткань имеет положительные края, рекомендуется лучевая терапия (ЛТ) с химиотерапией.
| С | Рекомендуется выполнять ЛТ с химиотерапией, если рак распространился на параметрии или на лимфатические узлы, или если удаленная ткань имеет положительные края [4-11] |
Хирургическое лечение
| А | Рекомендуется выполнять хирургического вмешательства стандартным лапаротомным доступом [4-11] |
| А | Рекомендуется информировать о нежелательных рисках расширенной экстирпации матки лапароскопическим доступом пациенток РШМ IА2–IB1 стадий по сравнению с лапаротомией [4-11] |
Показано выполнение модифицированной расширенной экстирпации матки (тип II/В) и тазовой лимфодиссекции (возможна биопсия сторожевого лимфоузла). У молодых пациенток (до 45 лет) возможно сохранить функцию яичников, выполнив их транспозицию [4-11].
| С | Рекомендуется выполнять модифицированной расширенной экстирпации матки (тип II/В) и тазовой лимфодиссекции (возможна биопсия сторожевого лимфоузла) пациенткам РШМ IА2 [4-11] |
Молодым пациенткам, желающим сохранить фертильность, независимо от лимфо‐васкулярной инвазии и при отсутствии метастазов в тазовых лимфатических узлах, может быть предложена расширенная трахелэктомия (тип II/В) [4-10].
| В | Рекомендуется выполнять расширенную трахелэктомию (тип II/В) пациенткам РШМ IА2, желающим сохранить фертильность, независимо от лимфо‐васкулярной инвазии и при отсутствии метастазов в тазовых лимфатических узлах [4-11] |
При отсутствии лимфоваскулярной инвазии у молодых больных, желающих сохранить фертильность, возможно выполнение ультраконсервативного лечения в объеме ампутации шейки матки, выскабливания оставшейся части цервикального канала (отсутствие опухоли в крае резекции и соскобе из оставшейся части цервикального канала) и тазовой лимфодиссекции (возможна биопсия сторожевого лимфоузла) [4-11].
| С | Рекомендуется выполнять ампутацию шейки матки, выскабливание оставшейся части цервикального канала и тазовую лимфодиссекцию пациенткам РШМ IА2 при отсутствии лимфоваскулярной инвазии у молодых больных, желающих сохранить фертильность [4-11] |
| С | Рекомендуется выполнять ЛТ с химиотерапией, пациенткам РШМ со стадиями IA1-IB2, признанным неоперабельными с медицинской точки зрения [4-11] |
Пациенты, получившие как хирургическое вмешательство, так и лучевую терапию, имеют значительно повышенную токсичность, особенно урологические осложнения.
| С | Рекомендуется проводить пациенткам РШМ IA, IB1, IB2 и IIA1 либо радикальную гистерэктомию, либо только радикальную лучевую терапию без химиотерапии [4-11]. |
Если рак распространился на параметрии или на лимфатические узлы, или если удаленная ткань имеет положительные края, рекомендуется ЛТ с химиотерапией.
| С | Рекомендуется выполнять ЛТ с химиотерапией, если рак распространился на параметрии или на лимфатические узлы, или если удаленная ткань имеет положительные края [4-11] |
Применение комбинации хирургического лечения и ЛТ статистически значимо увеличивает частоту осложнений. Поэтому при планировании лечения больных с IB1 и IIА1 стадиями РШМ следует избегать комбинации хирургического лечения и ЛТ.
Хирургическое лечение
| С | Рекомендуется выполнять хирургическое вмешательство стандартным лапаротомным доступом больным РШМ IА2–IB1 стадий [4-11] |
Лапаротомный доступ статистически значимо увеличивает общую и безрецидивную выживаемость больных РШМ IA1- IIA стадий по сравнению с лапароскопическим доступом.
| С | Рекомендуется предупреждать о рисках ухудшения отдаленных онкологических результатов лечения при выполнении расширенной экстирпации матки лапароскопическим доступом пациенток РШМ IА2–IB1 стадий [4-11] |
При IB1 и IIА1 стадиях (опухоль ≤2 см) рекомендована модифицированная расширенная экстирпация матки (тип II/В или С1). У молодых пациенток (до 45 лет) при удалении матки возможно сохранить функцию яичников, выполнив их транспозицию.
| А | Рекомендуется проводить модифицированную расширенную экстирпацию матки (тип II/В или С1) больным РШМ IB1 и IIА1 стадиях (опухоль ≤2 см) [4-11] |
При IB1 и IIА1 стадиях (опухоль >2 см) рекомендована расширенная экстирпация матки (тип III/С2). У молодых пациенток (до 45 лет) при удалении матки возможно сохранить функцию яичников, выполнив их транспозицию [4-11].
| А | Рекомендуется выполнять расширенную экстирпацию матки (тип III/С2) больным РШМ IB1 и IIА1 стадиях (опухоль >2 см) [4-11] |
При IB1 и IIА1 стадий (опухоль <4 см) при наличии метастазов в тазовых лимфатических узлах рекомендовано выполнение парааортальной лимфодиссекции. При выполнении парааортальной лимфодиссекции показано удаление паракавальных, прекавальных, аортокавальных, преаортальных, парааортальных лимфатических узлов как минимум до уровня нижней брыжеечной артерии. По показаниям (данные ревизии или лучевых методов диагностики) возможно выполнение поясничной лимфодиссекции до уровня почечных сосудов. При этом удаление матки с первичной опухолью не обязательно (прерванная гистерэктомия) ввиду необходимости проведения послеоперационной ХЛТ.
| С | Рекомендуется выполнять парааортальную лимфодиссекцию больным РШМ IB1 и IIА1 стадиях (опухоль <4 см) при наличии метастазов в тазовых лимфатических узлах [4-11] |
| С |
Рекомендуется удалять следующие группы лимфатических узлов при выполнении парааортальной лимфодиссекции:
паракавальные;
прекавальные;
аортокавальные;
преаортальные;
парааортальные;
как минимум до уровня нижней брыжеечной артерии [4-11]
|
По данным проспективных исследований при наличии метастазов в тазовых лимфатических узлах с одной стороны и отсутствии метастатического поражения поясничных лимфатических узлов возможно выполнение расширенной параметрэктомии (тип D1) на стороне поражения. Выполнение данного вмешательства возможно только группой квалифицированных специалистов, имеющих соответствующий опыт.
| С | Рекомендуется выполнять расширенную параметрэктомию (тип D1) на стороне поражения больным РШМ IB1 и IIА1 стадиях (опухоль <4 см) при наличии метастазов в тазовых лимфатических узлах с одной стороны и отсутствии метастатического поражения поясничных лимфатических узлов [4-11] |
| С | Рекомендуется выполнять ЛТ с химиотерапией, пациенткам РШМ со стадиями, признанным неоперабельными с медицинской точки зрения [4-11] |
| С | Рекомендуется проводить ЛТ или ХЛТ по радикальной программе больным РШМ IA1, IB1, IB2, IB3 и IIА1 стадиях при невозможности хирургического лечения по медицинским показаниям или в связи с отказом пациентки [4-11] |
Пациенты, получившие как хирургическое вмешательство, так и лучевую терапию, имеют значительно повышенную токсичность, особенно урологические осложнения.
| С | Рекомендуется проводить пациенткам РШМ IA, IB1, IB2 и IIA1 либо радикальную гистерэктомию, либо только радикальную лучевую терапию без химиотерапии [4-11]. |
| С | НЕ РЕКОМЕНДУЕТСЯ проводить адъювантную гистерэктомию после ЛТ или ХЛТ по радикальной программе [4-11] |
Комбинация хирургического лечения с ЛТ крайне нежелательна, так как существенно увеличивает частоту осложнений. Поэтому при планировании лечения больных IB2 и IIА2 стадий РШМ следует избегать комбинации хирургического лечения и ЛТ [4-11].
| С | НЕ РЕКОМЕНДУЕТСЯ комбинировать хирургическое лечение с ЛТ, так как существенно увеличивается частота осложнений [4-11] |
Варианты лечения
1) Хирургическое лечение
| А | Рекомендуется выполнять расширенную экстирпацию матки (операция III типа), при наличии метастазов в тазовых лимфатических узлах обязательно выполнять поясничную лимфодиссекцию больным IB2 и IIА2 стадий РШМ (опухоль >4 см) [4-11] |
| А | Рекомендуется выполнять адъювантное лечение больным с метастазами в поясничных лимфатических узлах проводить облучение расширенным полем больным IB2 и IIА2 стадий РШМ (опухоль >4 см) по тем же принципам, что и при IB1 и IIА1 стадиях РШМ [4-11] |
У больных РШМ IB2 и IIА2 стадий стандартным хирургическим доступом является лапаротомия.
| А | Рекомендуется выполнять стандартный хирургический доступ - лапаротомия больным РШМ IB2 и IIА2 стадий [4-11] |
| А | НЕ РЕКОМЕНДУЕТСЯ выполнять лапароскопический доступ больным РШМ IB2 и IIА2 стадий [4-11] |
| С | Рекомендуется выполнять транспозицию яичников больным РШМ до 45 лет с целью сохранения их функции [4-11] |
| D | Рекомендуется проводить транспозицию яичников женщинам с целью сохранения их функции, которым требуется радикальная ЛТ таза [4-11] |
| D |
Рекомендуется проводить информирование и предостережение пациенток при планировании операции по транспозиции яичников [4-11]:
Женщинам, которым предстоит дистанционная лучевая терапия, следует предложить транспозицию яичников, если поле облучения будет удалено от сосудистой ножки.
Следует обсудить с пациентом возможность удаления маточных труб.
Следует проинформировать женщину перед операцией о том, что риск образования и защемления кисты яичника составляет около 5%.
Следует предупредить женщину перед операцией, что частота неудач составляет около 35%.
Следует предупредить женщину перед операцией о потенциальном риске метастазирования в транспонированный яичник.
|
| С | Рекомендуется выполнять обязательно поясничную лимфодиссекцию больным РШМ IB2 и IIА2 стадий при наличии метастазов в тазовых лимфатических узлах [4-11] |
Больным с метастазами в поясничных лимфатических узлах адъювантная ЛТ проводится расширенным полем [4-11].
| С | Рекомендуется выполнять адъювантную лучевую терапию расширенным полем больным РШМ IB2 и IIА2 стадий при наличии метастазов в поясничных лимфатических узлах [4-11] |
| С | Рекомендуется выполнять расширенную параметрэктомию (тип D1) на стороне поражения больным РШМ IB2 и IIА2 стадий при наличии метастазов в тазовых лимфатических узлах с одной стороны и отсутствии метастатического поражения поясничных лимфатических узлов [4-11] |
После выполнения расширенной параметрэктомии (тип D1) адъювантная ЛТ не показана. Возможно проведение адъювантной ХТ [4-11].
| D | НЕ РЕКОМЕНДУЕТСЯ выполнять адъювантную ЛТ после расширенной параметрэктомии (тип D1) [4-11] |
2) Химиолучевое лечение по радикальной программе
| В | НЕ РЕКОМЕНДУЕТСЯ проведение адъювантной гистерэктомии после ХЛТ [4-11] |
| А |
Рекомендуется проводить больным IB2 и IIА2 стадий РШМ (опухоль >4 см)
лучевую терапию в РОД по 1,8-2 Гр за одну фракцию ежедневно, 5 раз в неделю, 25-28 фракций до СОД 45-50 Гр;
ПЛЮС
в/в введение цисплатина в дозе из расчета 40 мг/м2 1 раз в неделю (1 цикл), одновременно с ЛТ, всего 4 цикла (1 курс лечения) [4-11]
|
| С | НЕ РЕКОМЕНДУЕТСЯ выполнять адъювантную гистерэктомию после ХЛТ больным IB2 и IIА2 стадий РШМ (опухоль >4 см) [4-11] |
| А | Рекомендуется выполнять неоадъювантную химиотерапию (ХТ) на основе препаратов платины с последующей расширенной экстирпацией матки III типа больным IB2 и IIА2 стадий РШМ (опухоль >4 см) [4-11] |
| А | Рекомендуется выполнять адъювантное лечение больным IB2 и IIА2 стадий РШМ (опухоль >4 см) по тем же принципам, что и при IB1 и IIА1 стадиях РШМ [4-11] |
Неоадъювантная химиотерапия с последующей гистерэктомией изучалась как альтернатива радикальной химиолучевой терапии при местно-распространенном РШМ (стадия ≥IB3). Исследования показали лучшую безрецидивную выживаемость при химиолучевой терапии.
| А | НЕ РЕКОМЕНДУЕТСЯ выполнять неоадъювантную химиотерапию (ХТ) с последующей гистерэктомией больным РШМ ≥IB3 стадий [4-11] |
| С | НЕ РЕКОМЕНДУЕТСЯ проводить неоадъювантную ХТ перед проведением ЛТ или ХЛТ [4-11] |
IIB, IIIA/IIIB, IVA СТАДИИ
Одновременное химиолучевое лечение считается стандартным лечением пациентов с местнораспространенным раком шейки матки.
Местно-распространенный рак шейки матки (Locally advanced cervical cancer - LACC) определяется как рак, который не распространился из шейки матки на какие-либо другие основные органы и может быть классифицирован как стадия IB2 - IVA.
Женщины с местнораспространенным раком шейки матки имеют более высокий уровень рецидивов и худшую выживаемость, чем женщины с ранней стадией заболевания.
| А | Рекомендуется проводить радикальную химиолучевую терапию и брахитерапию с бустерным облучением пораженных лимфатических узлов пациентам с метастазами в тазовые и забрюшинные лимфатические узлы [4-11] |
| А |
Рекомендуется проводить радикальную ХЛТ [4-11]:
ДЛТ – РОД 1,8-2 Гр за одну фракцию, ежедневно, 5 раз в неделю, 25-28 фракций, до СОД 45-50 Гр
ПЛЮС
Цисплатин в/в в дозе из расчета 40 мг/м2 в/в 1 раз в неделю (1 цикл) (не более 70 мг/неделю) в течение 4-6 циклов, одновременно с лучевой терапии (1 курс лечения)
ИЛИ
Цисплатин из расчета 50-75 мг/м2 в/в в 1-й день плюс 5-фторурацил (5-ФУ) из расчета 1000 мг/м2, непрерывная в/в инфузия в течение 24 ч в 1-4 дни (общая доза 4000 мг/м2 на каждый цикл) каждые 3 недели плюс лучевая терапия, 1,8-2,0 Гр ежедневно, всего три-четыре цикла
ПЛЮС
Брахитерапия – РОД 7 Гр за одну фракцию, еженедельно, всего 4 раза, до СОД 28 Гр
|
| С | Рекомендуется проводить тазовую экзентерацию в отдельных случаях с IVA стадией заболевания [4-14] |
Расширенные поля облучения включают парааортальную область как область высокого риска прогрессирования при метастатическом поражении тазовых лимфатических узлов до уровня сосудов почечных ножек (обычно включает L2) [4-11].
| С | Рекомендуется оконтуривать CTVn до уровня сосудов почечных ножек или по крайней мере на 2 см выше от пораженного парааортального лимфатического узла у пациенток с РШМ IIIc2 при метастатическом поражении парааортальных лимфатических узлов [4-11] |
| С | Рекомендуется проводить облучение регионарных лимфоузлов одновременно с облучением малого таза [4-11] |
В случае поражения регионарных лимфатических узлов возможно увеличение суммарной дозы на эту область в виде интегрированного или последовательного буста до 55–60 Гр.
IVB СТАДИЯ
Рак шейки матки стадии IVB считается неизлечимым.
На этой стадии рак распространился из таза на другие части тела.
Варианты лечения включают ЛТ с ХТ или без нее, чтобы попытаться замедлить рост рака или облегчить симптомы.
Стандартные схемы ХТ включают препараты платины (цисплатин или карбоплатин) вместе с другими препаратами, такими как паклитаксел, гемцитабин или топотекан.
Вариант лечения - таргетный препарат бевацизумаб с химиотерапией, иммунотерапия только пембролизумабом, или пембролизумаб с химиотерапией (с бевацизумабом).
| D | Рекомендуется проводить одновременную ХЛТ у пациентов с положительными парааортальными и надключичными лимфатическими узлами |
| D | Рекомендуется проводить ЛТ расширенными полями с одновременной ХТ при обнаружении метастазов в парааортальные лимфоузлы и/или в подвздошную кость |
| D | Рекомендуется комбинировать цисплатин с таксанами, топотеканом, 5-фторурацилом, гемцитабином или винорелбином, комбинировать карбоплатин и паклитаксел |
Для пациенток с отдаленными метастазами при РШМ (IVВ стадии) рекомендуется рассмотреть проведение ЛТ по индивидуальному плану.
Для пациенток с РШМ стадии IVВ или при прогрессировании заболевания рекомендована системная ХТ 1-й линии (6 циклов ХТ, или до прогрессирования, или до непереносимой токсичности).
| D | Рекомендуется проведение комбинированной ХТ, если пациентка ранее получала ХЛТ |
| С | Рекомендуется проведение платиносодержащей комбинированной ХТ через 6 и более месяцев после последнего курса ХТ 1-й линии пациенткам с РШМ при прогрессировании заболевания |
Рекомендуется проводить пациентам РШМ IVB ст., которые ранее не получали химиотерапию, ХТ 1-й линии с использованием цисплатина/паклитаксела или двойных препаратов карбоплатина/паклитаксела с бевацизумабом или без него, в зависимости от факторов риска пациента. Бевацизумаб может обеспечить длительный положительный эффект, и его следует назначать, если нет противопоказаний [25].
| В | Рекомендуется проводить ХТ 1-й линии с использованием цисплатина/паклитаксела или двойных препаратов карбоплатина/паклитаксела с бевацизумабом или без него пациентам РШМ IVB ст., которые ранее не получали химиотерапию, в зависимости от факторов риска пациента [25]. |
| В |
Рекомендуется проводить после неадекватной операции при РШМ [4-11]:
• ХЛТ
ИЛИ
• повторную лапаротомию с параметрэктомией и тазовой лимфаденэктомией с последующей адъювантной ХЛТ (ЛТ СОД 46–50 Гр, РОД 2 Гр, 5 раз в неделю, за 23-25 фракций еженедельно и одновременная ХТ 4-6 циклов цисплатина в дозе из расчета 40 мг/м2 в неделю)
|
Рак может вернуться локально (в том месте, где он впервые возник, или вблизи того места, например, в шейке матки, матке или в соседних органах таза), или он может вернуться в отдаленные области (например, в легкие или кости).
Если РШМ рецидивировал только в центре таза, для некоторых пациентов может быть показана обширная хирургия (например, экзентерация таза), которая дает наилучшие шансы на возможное излечение рака (хотя она может иметь серьезные побочные эффекты).
ЛТ (иногда вместе с ХТ) может быть еще одним вариантом.
Если нет, ХТ, иммунотерапия или таргетная терапия могут использоваться для замедления роста рака или облегчения симптомов, но не ожидается, что они излечат рак.
При РШМ IIIA, IIIB, IIIC, IVA, IVB стадиях хирургическое лечение представлено паллиативными операциями для устранения кишечной непроходимости или лечения пузырно-влагалищных и прямокишечно-влагалищных свищей, а также при профузном маточном кровотечении, угрожающем жизни пациентки, источником которого являются аррозивные сосуды экзофитной опухоли шейки матки, в целях остановки кровотечения и создания условий для дальнейшего лечения целесообразно использовать перевязку или селективную эмболизацию маточных сосудов.
При IVА стадии и центральном рецидиве РШМ возможно проведение операции экзентерации малого таза, но обычно с плохим прогнозом.
Рецидивы могут возникать локально в тазовой или парааортальной области, или могут развиваться отдаленные метастазы, или может быть их комбинация. Риск как тазовых, так и отдаленных рецидивов увеличивается пропорционально объему опухоли. Большинство рецидивов наблюдается в течение 3 лет, и прогноз плохой, так как большинство пациентов умирают от прогрессирующего заболевания, а уремия является наиболее частым конечным осложнением. План лечения зависит от состояния пациента, места и степени рецидива и / или метастазов, а также от полученного ранее лечения.
Если имеется обширный местный рецидив или отдаленный метастаз, пациенту назначается паллиативная терапия с поддерживающей терапией. Однако, если общий статус пациентки хороший и имеется ограниченный метастаз, оправдана ХТ с препаратами платины [21-26]. Местный рецидив, который нельзя исправить хирургическим вмешательством или ЛТ, скорее всего, будет иметь очень плохой ответ на системную химиотерапию.
| D |
Рекомендуется одна из стратегий лечения пациенткам с центральным рецидивом РШМ в малом тазу (без отдаленных метастазов), которым ранее проведена ЛТ [4-11]:
экзентерация органов малого таза (вопрос об экзентерации малого таза должен решаться до проведения ХТ);
лекарственная терапия;
ЛТ с учетом ранее подведеных доз;
симптоматическое лечение.
|
| D |
Рекомендуется одна из стратегий лечения при центральном рецидиве после первичного хирургического лечения (без отдаленных метастазов) [4-11]:
ХЛТ и брахитерапия. Применение локального буста при ДЛТ, заменяющей брахитерапию, не рекомендуется;
брахитерапия при поверхностном опухолевом поражении слизистой оболочки культи влагалища (<5 мм инвазии) (используются цилинрический аппликатор или овоиды), при более глубокой инвазии применяется комбинированная внутриполостная и внутритканевая лучевая терапия;
экзентерация малого таза.
|
Одновременная ХТ цисплатином и / или 5-фторурацилом может улучшить исход. IMRT, когда используют ЛТ с разной интенсивностью для разных частей облучаемой области превосходит традиционную одновременную химиолучевую терапию, обеспечивая лучшую сохранность дозы для кишечной сумки, прямой кишки и мочевого пузыря, со значительно более высокой 5-летней общей выживаемостью и выживаемостью без прогрессирования [4-11].
Экзентерация таза возможна пациентам, у которых нет доказательств внутрибрюшинного или экстратазового распространения, и между рецидивной опухолью и боковой стенкой таза имеется свободное от опухоли пространство [4-11].
ПЭТ/КТ - это наиболее чувствительный неинвазивный тест для определения любых участков отдаленного метастазирования, и его следует, по возможности, проводить до экзентерации.
| С | Рекомендуется проведение ПЭТ/КТ для определения любых участков отдаленного метастазирования до экзентрации [4-11] |
Оценка пациента и консультирование относительно последствий и способности ухаживать за стомой также должны быть выполнены до операции. Общая выживаемость после экзентерации таза составляет 10%, но, тщательный отбор пациентов дает 5-летнюю выживаемость с экзентерацией таза порядка 30–60%, и операционной смертностью менее 10% [4-11].
| С | Рекомендуется выполнять расширенную экстирпацию матки (III тип по Piver/тип С2 по Querleu–Morrow) пациенткам после ЛТ/ХЛТ по радикальной программе и при наличии рецидивной опухоли локально в шейке матки, не превышающей в размере 2 см [4-11] |
| D |
Рекомендуется проводить: • ФДГ-ПЭТ до консилиума • Междисциплинарный консилиум (МДК), • Повторное облучение, но с повышенным риском последующей токсичности ИЛИ • хирургическое иссечение рецидива изолированного лимфоузла там, где это уместно |
Экзентерация малого таза бывает:
| D | Рекомендуется проводить экзентерацию малого таза при центральном рецидиве РШМ или РШМ IVA стадии в качестве альтернативы ХЛТ, когда опухоль вовлекает мочевой пузырь и/или прямую кишку, не переходит на стенку таза, брюшину, нет регионарных и отдаленных метастазов [4-11] |
При отборе больных для экзентерации малого таза в первую очередь исключают метастазы. Тщательно пальпируют и выполняют пункцию всех увеличенных лимфатических узлов. Некоторые авторы рекомендуют производить биопсию надключичных лимфатических узлов. Проводят КТ грудной клетки для исключения мелких метастазов в легкие, не выявленных при рентгенографии. КТ брюшной полости позволяет исключить метастазы в печень и поясничные лимфоузлы. При выявлении подозрительных объемных образований выполняют их пункцию. Если обнаруживают метастазы, операцию не проводят.
| D |
Рекомендуется проводить для отбора пациентов на экзентерацию малого таза:
• пункцию всех увеличенных лимфатических узлов,
• биопсию надключичных лимфатических узлов
• КТ или рентгенографию грудной клетки
• КТ брюшной полости [4-11]
|
| D |
НЕ РЕКОМЕНДУЕТСЯ проводить экзентерацию малого таза [4-11]:
• при прорастании опухоли в параметрии и/или стенку таза,
• при тяжелых сопутствующих заболеваниях
|
Однако следует помнить, что отличить опухолевую инфильтрацию от лучевого фиброза не под силу даже опытному врачу. Если на основании физикального исследования уточнить распространенность опухоли не удается, выполняют диагностическую лапаротомию и биопсию параметрия.
|
Триада симптомов, свидетельствующие о прорастании опухолью стенки таза и невозможности экзентерации:
односторонний отек ноги;
боль в зоне иннервации седалищного нерва;
обструкция мочеточника.
|
Передняя экзентерация малого таза возможна, если опухоль локализуется в шейке, распространяется по передней стенке влагалища и прорастает в мочевой пузырь. При обследовании обязательно выполняют ректороманоскопию. Однако отсутствие опухоли при ректороманоскопии не исключает ее прорастание в мышечную оболочку прямой кишки, поэтому объем операции окончательно определяется только во время лапаротомии. При распространении опухоли по задней стенке влагалища обычно приходится удалять прямую кишку.
| С | Рекомендуется проводить переднюю экзентерацию малого таза если опухоль локализуется в шейке, распространяется по передней стенке влагалища и прорастает в мочевой пузырь [4-11] |
При рецидивах рака шейки матки задняя экзентерация малого таза выполняется редко, потому что в большинстве случаев опухоль вовлекает устья мочеточников и мочевой пузырь.
| С | Рекомендуется проводить заднюю экзентерацию малого таза если опухоль НЕ вовлекает устья мочеточников и мочевой пузырь [4-11] |
Тотальная экзентерация, подразумевающая наложение наданального сигморектального анастомоза, возможна при изолированном поражении шейки матки и проксимальной части влагалища. Чтобы убедиться в отсутствии микрометастазов в мышечной оболочке прямой кишки, во время операции проводят срочное гистологическое исследование краев резекции кишки.
| С | Рекомендуется проводить тотальную экзентерацию малого таза если опухоль распространяется на прямую кишку, мочевой пузырь и дистальную части влагалища [4-11] |
Летальность после адекватной экзентерации малого таза не превышает 10%. Основные причины смерти больных - сепсис, ТЭЛА и кровотечение. Серьезным осложнением являются кишечные и мочевые свищи. Летальность при возникновении свищей, несмотря на хирургическое лечение, достигает 30-40%. Риск образования мочевых свищей меньше, если для отведения мочи используют необлученные участки кишки.
5-летняя выживаемость после передней экзентерации малого таза составляет 33-60%, после тотальной – 20-46%. Прогноз хуже при рецидивах более 3 см, прорастании в мочевой пузырь, метастазах в тазовые лимфоузлы и при возникновении рецидива в течение 1 года после лучевой терапии. 5-летняя выживаемость больных с метастазами в тазовые лимфоузлы не превышает 5%. В связи с этим продолжение операции при интраоперационном обнаружении метастазов в лимфоузлы нецелесообразно. Тазовую лимфаденэктомию больным, получавшим ранее лучевую терапию, не проводят. При диссеминации по брюшной полости 5-летняя выживаемость равна 0% [4-11].
| С | НЕ РЕКОМЕНДУЕТСЯ продолжать операцию экзентерации малого таза при интраоперационном обнаружении метастазов в лимфоузлы [4-11] |
| С | НЕ РЕКОМЕНДУЕТСЯ проводить тазовую лимфаденэктомию больным, получавшим ранее лучевую терапию [4-11] |
Тактика ведения таких женщин индивидуализирована и зависит от стадии заболевания и срока беременности. Для адекватного ведения таких пациентов требуется многопрофильная команда. План необходимо обсудить с пациентом и, желательно, с ее партнером, поскольку их пожелания следует уважать [4-11].
| D | Рекомендуется направлять беременных женщин с подозрением на патологию шейки матки к опытному гинекологу для гинекологического осмотра в зеркалах, бимануального исследования, кольпоскопии в течение двух недель [4-11] |
| С | Рекомендуется проводить при аномальной цитологии во время беременности кольпоскопию и/или направлять к онкогинекологу [4-11] |
Диагностика делается по обычному алгоритму скрининга шейки матки. Кольпоскопию можно проводить в первой половине беременности, это не дает больших дополнительных затруднений. Биопсию следует проводить осторожно, что связано с повышенной васкуляризацией и возможностью кровотечения, поэтому в целом проведение биопсии ограничивают случаями, подозрительными на высокую степень ЦИН, микроинвазивное или инвазивное заболевание. Эндоцервикальный кюретаж при беременности не производится.
| С | Рекомендуется проводить кольпоскопию в первой половине беременности [4-11] |
| С | Рекомендуется проводить биопсию во время кольпоскопии осторожно, из-за возможности кровотечения, только в случаях, подозрительных на высокую степень CIN, микроинвазивное или инвазивное заболевание [4-11] |
| С | НЕ РЕКОМЕНДУЕТСЯ проводить эндоцервикальный кюретаж при беременности [4-11] |
| С | Рекомендуется проводить МРТ-исследование для определения стадии РШМ у беременных [4-11] |
В целом, лечение рака шейки матки во время беременности следует тем же принципам, что и в небеременном состоянии. До 20 недель беременности пациенты получают лечение без промедления. Режим терапии может быть хирургическим или химиолучевым, в зависимости от стадии заболевания.
| С | Рекомендуется проводить лечение РШМ во время беременности следует тем же принципам, что и в небеременном состоянии [4-11] |
| С | Рекомендуется проводить лечение РШМ во время беременности до 20 недель без промедления [4-11] |
В сроке беременности до 20 нед. беременная матка удаляется одномоментно с проведением лимфаденэктомии.
| С | Рекомендуется удалить беременную матку в сроке до 20 нед. одномоментно с проведением лимфаденэктомии [4-11] |
В первом и втором триместре беременности, если показана ЛТ, начинают с ДЛТ, которая приведет к гибели плода и самопроизвольному аборту. После аборта лечение продолжают как обычно.
| С | Рекомендуется проводить при РШМ в первом и втором триместре беременности ЛТ, начиная с ДЛТ [4-11] |
Если диагноз поставлен после 20 недель, отсрочка лечения до созревания плода является допустимым вариантом для стадий IA2, IB1 и IB2. Затем проводят родоразрешение путем классического кесарева сечения и радикальной гистерэктомии одновременно не позднее 34 недель беременности или начинают лучевую терапию (в зависимости от стадии опухоли).
| С | Рекомендуется отсрочить лечение до созревания плода, если диагноз поставлен после 20 недель беременности при РШМ IA2, IB1 и IB2 [4-11] |
| С |
Рекомендуется проводить при РШМ IA2, IB1, IB2 и беременности не позднее 34 недель [4-11]:
• родоразрешение путем классического кесарева сечения с одновременной радикальной гистерэктомией
ИЛИ
• лучевую терапию
|
При доношенной беременности исключаются роды через естественные родовые пути, а прибегают к кесареву сечению с последующим, соответствующим стадии процесса, лечением РШМ.
| D | Рекомендуется родоразрешать при доношенной беременности путем кесарева сечения с последующим лечением РШМ в условиях онкологического центра [4-11] |
| С | НЕ РЕКОМЕНДУЕТСЯ грудное вскармливание во время химиотерапии [4-11] |
Тактика ведения пациенток с инвазивным РШМ при заинтересованности в пролонгировании беременности представлена ниже (см. Приложение 9).
Тактика ведения пациенток с инвазивным РШМ при заинтересованности в пролонгировании беременности
Медицинская реабилитация
Реабилитация онкогинекологических больных
Онкогинекологические больные нуждаются в медицинской, психологической, сексуальной и социально-трудовой реабилитации. Возникают проблемы по поводу их профессиональных возможностей в свете изменившегося состояния здоровья, потери сексуальной функции и опасности распада семьи, психологические стрессы вследствие угрозы для жизни и страха перед возможным возвратом болезни.
Важно помочь установить правильные деонтологические отношения между больной и ее ближайшим социальным, в том числе семейным, окружением; проводить с ней беседы, успокаивать, ободрять, вселять веру в успех лечения, рассеивать опасения, ответить на все её вопросы, успокоить пациентку в отношении обычных посттерапевтических симптомов, обучить распознавать тревожные признаки и симптомы, о появлении которых необходимо сообщить врачу.
| С | Рекомендуется проводить профилактику, выявление и лечение осложнений, отдаленных последствий и проблем с качеством жизни после лечения РШМ [4-11] |
| С | Рекомендуется проводить документированную регистрацию поздних побочных эффектов [4-11] |
| С | Рекомендуется предоставлять пациенту письменную информацию о вариантах лечения и побочных эффектах, включая отдаленные эффекты [4-11] |
| С | Рекомендуется обеспечивать доступ пациента к специально обученной зарегистрированной медицинской сестре, которая может проводить текущее ведение пациентов амбулаторно, а также к психологу-консультанту в составе междисциплинарной команды [4-11] |
| С | Рекомендуется наблюдать пациента РШМ после лечения в специализированном медицинском учреждении и по месту жительства [4-11] |
Выписка из стационара и наблюдение должны быть обсуждены на встрече всех, кто участвовал в лечении, самой больной и членов ее семьи. Если наблюдение придется осуществлять вдалеке от места лечения, врач, оказывающий первичную медицинскую помощь (предпочтительно гинеколог), должен получить обстоятельный выписной эпикриз, в котором указаны стадия заболевания, проведенное лечение, прогноз и ожидаемые проблемы. Выписной эпикриз должен включать сведения о том, как поддерживать связь с учреждением, где проводилось лечение (номер телефона, адрес электронной почты и почтовый адрес), и просьбу о регулярной обратной связи.
| С |
Рекомендуется отражать в выписном эпикризе [4-11]:
• стадию заболевания,
• проведенное лечение,
• сведения об учреждении, где проводилось лечение (номер телефона, адрес электронной почты и почтовый адрес, с целью поддержки обратной связи
|
Большинство рецидивов происходит в течение двух лет после постановки диагноза. По истечении 5-летнего периода наблюдения без признаков рецидивирования, пациентка может вернуться к общей программе ежегодного скрининга.
| С | Рекомендуется вернуть пациента РШМ к общей программе ежегодного скрининга по истечении 5-летнего периода наблюдения без признаков рецидивирования [4-11] |
| С | Рекомендуется проводить клиническое наблюдение каждые 3–4 месяца в течение первых 2–3 лет пациентов РШМ после лечения, затем каждые 6 месяцев до 5 лет, а затем ежегодно на протяжении всей жизни [4-11] |
Особые обстоятельства, такие как поражение высоких тазовых лимфатических узлов, могут оправдать интервальную МРТ, КТ визуализацию брюшной полости для оценки потенциально излечимого прогрессирования заболевания.
| С |
Рекомендуется проводить при каждом контрольном посещении пациента РШМ после лечения [4-11]:
• сбор анамнеза;
• гинекологический осмотр в зеркалах (в том числе ректовагинальное исследование);
• физикальное обследование, в том числе паховых и надключичных лимфатических узлов;
• клиническое обследование;
• рентгенологическое исследование грудной клетки один раз в год;
• цитологическое исследование свода влагалища один раз в год;
• УЗИ органов брюшной полости, малого таза и забрюшинного пространства;
• определение уровня SCC;
• интервальную МРТ, КТ визуализацию брюшной полости и ПЭТ-КТ по показаниям.
|
У женщин, которым проведена ЛТ, могут выявляться ее осложнения (постлучевой фиброз), которые могут быть ошибочно приняты за прогрессирование рака шейки матки. Выявление и своевременная коррекция лучевых реакций и осложнений может проводиться амбулаторно, а при тяжелом течении – в стационаре.
| С | Рекомендуется проводить пациентам коррекцию лучевых реакций и осложнений амбулаторно, при тяжелом течении – стационарно после ЛТ [4-11] |
| D |
Симптомы распространенного РШМ включают [4-11]:
• боль,
• обструкцию мочеточника, вызывающую почечную недостаточность,
• кровотечение,
• выделения из влагалища с неприятным запахом,
• лимфостаз,
• свищи;
• симптомы, связанные с метастазами.
|
Пациентам требуется поддержка соответствующих клинических служб, а также психологическая помощь и поддержка их семей и лиц, осуществляющих уход. Обычно практикуется многоуровневый подход к боли. Доступ к пероральному морфину улучшается в странах с низким уровнем дохода и является важным аспектом паллиативной помощи. Наличие бригад по уходу на дому во многих регионах и участие неправительственных организаций в этих усилиях может помочь свести к минимуму необходимость транспортировки пациента в больницу, а также сократить расходы государства. В неизлечимых случаях некоторым пациентам также могут потребоваться услуги хосписа.
| D |
Рекомендуется организовать и обеспечить доступ пациентов с распространенным РШМ к:
• пероральному морфину;
• бригадам по уходу на дому в регионах;
• хосписам.
|
Прогноз
Стадия при условии ее правильного определения это зашифрованный прогноз. Прогноз при I стадии рассматривают как благоприятный, при II и III как сомнительный, при IV – неблагоприятный. В пределах каждой стадии, однако, прогноз значительно варьирует. Это объясняется различными особенностями первичной опухоли, состоянием регионарных лимфатических узлов и системы иммунитета, адекватностью проведенного лечения.
Лучший прогноз у женщин с I стадией, получавших хирургическое, комбинированное или сочетанное лучевое лечение.
Прогноз неблагоприятен у больных с опухолью размером более 4 см; локализацией опухоли в шеечном канале; эндофитной формой роста опухоли; большой степенью распространения опухолевого процесса - двусторонней инфильтрацией параметральной клетчатки и связочного аппарата, поражением нижней трети влагалища; наличием метастазов в парааортальных и/или тазовых лимфоузлах, и в неудаленных тазовых лимфоузлах; наличием опухоли в крае иссеченного макропрепарата (при хирургическом и комбинированном методах лечения); у больных с глубокой инвазией в строму, с сосудистой инвазией при IB и IIA стадиях; с аденокарциномой и низкодифференцированным раком. Также неблагоприятный прогноз у женщин с иммунодепрессией, лимфопенией, анемией ниже 80 г/л, и, как следствие, снижением чувствительности опухоли к облучению из-за гипоксии опухолевой ткани.
| D |
Неблагоприятные факторы прогноза [4-11]:
• опухоль размером более 4 см;
• локализация опухоли в шеечном канале;
• эндофитная форма роста опухоли;
• распространенность опухолевого процесса – двусторонняя инфильтрация параметральной клетчатки и связочного аппарата, поражение нижней трети влагалища;
• наличие метастазов в парааортальных и/или тазовых лимфоузлах, и в неудаленных тазовых лимфоузлах;
• наличие опухоли в крае иссеченного макропрепарата (при хирургическом и комбинированном методах лечения);
• наличие глубокой инвазии в строму, с сосудистой инвазией;
• аденокарцинома и низкодифференцированный рак;
• иммунодепрессия, лимфопения, анемия ниже 80 г/л, и, как следствие, снижением чувствительности опухоли к облучению из-за гипоксии опухолевой ткани
|
| С |
Показатели 5-летней выживаемости у больных РШМ:
• IА стадия – 95-100%,
• IВ стадии – 92-98%,
• II стадии – 62-84%,
• III стадии – 30-72%,
• IV стадии – 0-11% [4-11]
|
Информация
Источники и литература
-
Клинические протоколы Министерства здравоохранения Кыргызской Республики
- 1. Каприн А.Д., Старинский В.В., Шахзадова А.О. Состояние онкологической помощи населению России в 2020 году, МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России, Москва, 2021, 239 стр. https://oncology-association.ru/wp-content/uploads/2021/10/pomoshh-2020-el.-versiya.pdf 2. GLOBOCAN 2020: New Global Cancer Data | UICC 17 December 2020 https://www.uicc.org/news/globocan-2020-new-global-cancer-data 3. Отчет отдела эпидемиологии и профилактики злокачественных новообразований Национального центра онкологии и гематологии о состоянии онкологической службы в Кыргызской Республике за 2020г. С.15. 4. British Gynaecological Cancer Society (BGCS) Cervical Cancer Guidelines: Recommendations for Practice, 2020 https://www.bgcs.org.uk/wp-content/uploads/2020/05/FINAL-Cx-Ca-Version-for-submission.pdf 5. Рак шейки матки, NICE, 2021 https://www.nice.org.uk/guidance/conditions-and-diseases/cancer/cervical-cancer/products?Status=Published 6. ESMO Guidelines Committee eUpdate - Cervical Cancer Treatment Recommendations, Clinical Practice Guidelines, 01 April 2020 https://www.esmo.org/guidelines/gynaecological-cancers/cervical-cancer/eupdate-cervical-cancer-treatment-recommendations 7. Chino J., Annunziata C.M., Beriwal S. et al. Radiation Therapy for Cervical Cancer: Executive Summary of an ASTRO Clinical Practice Guideline, Clinical practice guidelines, July 01, 2020, Volume 10, Issue 4, P220-234 https://www.practicalradonc.org/article/S1879-8500(20)30094-1/fulltext#secsectitle0010 8. Boardman C.H. Cervical Cancer Guidelines, 2021 https://emedicine.medscape.com/article/253513-guidelines 9. РШМ. Клинические протоколы МЗ РК – 2018 https://diseases.medelement.com/disease/рак-шейки-матки-2018/16147 10. Клинические рекомендации «Рак шейки матки», МКБ10:С53, 2020, ID:КР537/1 URL https://oncology-association.ru/wp-content/uploads/2020/09/rak-sheiki-matki.pdf 11. NCCN guidelines panel. Cervical Cancer. Version 1.2022 – October 26, 2021 https://www.nccn.org/professionals/physician_gls/pdf/cervical_blocks.pdf 12. International Statistical Classification of Diseases and Related Health Problems 10th Revision https://icd.who.int/browse10/2019/en#/ 13. Bhatla N., Aoki D., Sharma D.N., Sankaranarayanan R. FIGO Cancer Report 2018, Cancer of the cervix uteri, October 2018, International Journal of Gynaecology and Obstetrics: the official organ of the International Federation of Gynaecology and Obstetrics 143(Suppl.3):22-36 DOI:10.1002/ijgo.12611 https://www.researchgate.net/publication/328220332_Cancer_of_the_cervix_uteri 14. Brierley J., Gospodarowicz M.K., Wittekind Ch. TNM classification of malignant tumours. Oxford, UK; Hoboken, NJ: John Wiley & Sons, Inc., 2017 https://www.wiley.com/en-gb/TNM+Classification+of+Malignant+Tumours,+8th+Edition-p-9781119263579 15. WHO Classification of Tumours Editorial Board: Female Genital Tumours, 5th Edition, Volume 4, 2020 https://publications.iarc.fr/Book-And-Report-Series/Who-Classification-Of-Tumours/Female-Genital-Tumours-2020 16. Хохлова С.В., Коломиец Л.А., Кравец О.А., Морхов К.Ю., Нечушкина В.М., Тюляндина А.С. и соавт. Практические рекомендации по лекарственному лечению рака шейки матки. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2021, Т. 11, стр. 197-217 https://www.malignanttumors.org/jour/article/download/861/609 17. ICRU Report 50, Prescribing, Recording, and Reporting Photon Beam Therapy https://www.icru.org/report/prescribing-recording-and-reporting-photon-beam-therapy-report-50/ 18. ICRU Report 62: Prescribing, Recording and Reporting Photon Beam Therapy (Supplement to ICRU Report 50) Journal of the ICRU, Volume os-32 Issue 1, November 1999 https://www.icru.org/report/prescribing-recording-and-reporting-photon-beam-therapy-report-62/ 19. Small W.J, Bosch W.R., Harkenrider, M.M., et al. NRG Oncology/RTOG Consensus Guidelines for Delineation of Clinical Target Volume for Intensity Modulated Pelvic Radiation Therapy in Postoperative Treatment of Endometrial and Cervical Cancer: An Update. International Journal of Radiation Oncology-Biology-Physics, 2021, V109, Number 2, P. 413-424. https://www.srobf.cz/downloads/nrgonc~1.pdf 20. Gay H.A., Barthold H.J., O’Meara E. et al. Female Pelvis Normal Tissue RTOG Consensus Contouring Guidelines, 129 pages. https://www.srobf.cz/downloads/cilove-objemy/female_rtog_normal_pelvis_atlas.pdf 21. Gay H.A., Barthold H.J., O’Meara E. et al. Pelvic Normal Tissue Contouring Guidelines for Radiation Therapy: A Radiation Therapy Oncology Group Consensus Panel Atlas. Int J Radiat Oncol Biol Phys. 2012 Jul 1; 83(3): e353–e362. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3904368/ 22. Cervical Cancer Pocket Guidelines based on ESGO-ESTRO-ESP Guidelines for the Management of Patients with Cervical Cancer, 2018, 48 pages. https://www.esgo.org/media/2015/12/ESGO_Cervical-Cancer_A6.pdf 23. ICRU Report 89, Prescribing, Recording, and Reporting Brachytherapy for Cancer of the Cervix https://www.icru.org/report/icru-report-89-prescribing-recording-and-reporting-brachytherapy-for-cancer-of-the-cervix/ 24. ICRU GEC ESTRO Report 89 Target Concept, 2016 https://www.brachyacademy.com/wp-content/uploads/2017/11/02_ICRUGEC_ESTRO_Vienna-RP-032017-with-examples.pdf 25. Cervical Cancer Treatment Regimens, 2020 NCCN Cervical Cancer Guidelines https://www.cancertherapyadvisor.com/home/cancer-topics/gynecologic-cancer/gynecologic-cancer-treatment-regimens/cervical-cancer-treatment-regimens/ 26. Chemotherapy Protocol Gynaecological Cancer Cisplatin (40) – Radiotherapy Version 1.1 (March 2014) https://www.uhs.nhs.uk/Media/SUHTExtranet/Services/Chemotherapy-SOPs/Cervical-cancer/Cisplatin(40)andRadiotherapy.pdf
Информация
Простая трахелэктомия – хирургическое вмешательство, направленное на удаление шейки матки без параметральных тканей и влагалищной манжеты с формированием анастомоза между телом матки и влагалищем.
Расширеннная трахелэктомия – хирургическое вмешательство, включающее удаление шейки матки с параметральной клетчаткой и влагалищной манжетой, шириной 1–2 см, двустороннюю тазовую лимфаденэктомию и формирование анастомоза между телом матки и влагалищем.
Курс лечения - в течение курса лечения обычно проводится от 4 до 8 циклов лечения.
Лечебная/индукционная. Лекарственная терапия при метастатическом или местно-распространенном опухолевом процессе, направлена на увеличение продолжительности жизни пациента, в определенных случаях может быть достигнуто выздоровление.
Паллиативная. Преследует цель устранения симптомов заболевания за счет уменьшения опухолевой массы, не преследует цель увеличения продолжительности жизни.
Поддерживающая лекарственная терапия направлена на поддержание эффекта, достигнутого при лечебной / индукционной лекарственной терапии. Противоопухолевые лекарственные препараты могут быть использованы отдельно в виде монотерапии или в составе режимов комбинированной лекарственной терапии, а также могут сочетаться с другими видами терапии (лучевая, операция и др.).
Химиолучевая терапия — одновременное или последовательное комбинированное применение лекарственной (возможна ХТ, таргетная терапия, иммунотерапия) и ЛТ.
Химиоиммунотерапия — одновременное комбинированное применение химиопрепаратов и иммунопрепаратов — моноклональных антител, интерферонов.
Ответственные за клиническое содержание по стационарному ведению РМШ
Кудайбергенова И.О. КГМА им. И.К. Ахунбаева, хирург онколог, доктор медицинских наук, профессор, ректор КГМА им. И.К. Ахунбаева
Оценка клинического содержания клинического руководства
Найденные электронные базы данных по клиническим руководствам и практическим рекомендациям
|
Страна и название ресурса
|
Интернет-адрес |
| Международная ассоциация | |
| Всемирная организация здравоохранения (World Health Organization, WHO) | https://www.who.int/publications/i/item/9789240030824 |
| Европа | |
| ESMO |
https://www.esmo.org/guidelines/gynaecological-cancers/cervical-cancer/eupdate-cervical-cancer-treatment-recommendations
https://www.annalsofoncology.org/article/S0923-7534(19)42148-0/pdf
|
| National Comprehensive Cancer Network (NCCN) |
https://www.nccn.org/guidelines/guidelines-detail?category=1&id=1426
https://jnccn.org/view/journals/jnccn/17/1/article-p64.xml
|
| European Society of Gynecological Oncology (ESGO) European Society for Radiotherapy&Oncology (ESTRO) European Society of Pathology | https://guidelines.esgo.org/media/2018/04/Cervical-cancer-Guidelines-Complete-report.pdf |
| Женевский фонд медицинского образования и исследований |
https://www.gfmer.ch/Guidelines/Female_genital_neoplasms/Cervical_cancer_treatment.htm
|
| Показатели качества хирургического лечения рака шейки матки Европейского общества гинекологической онкологии | https://ijgc.bmj.com/content/30/1/3.long |
| Америка | |
| Medscape | https://emedicine.medscape.com/article/253513-guidelines |
|
American Cancer Society (ACS)
|
https://www.cancer.org/cancer/cervical-cancer/detection-diagnosis-staging/cervical-cancer-screening-guidelines.html |
| American Society for Radiation Oncology (ASTRO) | https://www.astro.org/Patient-Care-and-Research/Clinical-Practice-Statements/Cervical-Cancer-Guideline |
| UpToDate | https://www.uptodate.com/contents/cervical-intraepithelial-neoplasia-management |
| Великобритания | |
| National Institute for Clinical Excellence (NICE) |
https://www.nice.org.uk/guidance/conditions-and-diseases/cancer/cervical-cancer/products?Status=Published
|
| British Gynecologist Cancer Society | https://www.bgcs.org.uk/wp-content/uploads/2020/05/FINAL-Cx-Ca-Version-for-submission.pdf |
| National Health Service (NHS) in England | https://www.gov.uk/government/collections/cervical-screening-professional-guidance |
| Новая Зеландия | |
| National Screening Unit | https://www.nsu.govt.nz/health-professionals/national-cervical-screening-programme/clinical-practice-guidelines-cervical |
| СНГ | |
| Казахстан | https://diseases.medelement.com/disease/%D1%80%D0%B0%D0%BA-%D1%88%D0%B5%D0%B9%D0%BA%D0%B8-%D0%BC%D0%B0%D1%82%D0%BA%D0%B8-2018/16147 |
| Российская Федерация | https://cr.minzdrav.gov.ru/recomend/537_1 |
| По лекарственным средствам | |
| The Global Drug Database |
www.globaldrugdatabase.com
www.drugs.com
|
Критерии включения/исключения
Оценка найденных клинических рекомендаций и доказательств
Характеристика отобранных клинических рекомендаций по РМШ
|
№
|
Название руководства | Качество | Новизна | Применимость | Варианты действий |
| 1 | Обновленные рекомендации по диагностике, лечению на рак шейки матки, BGSC, апрель, 2021 [4] | + | + | + | Взята за основу при разработке, рекомендации по диагностике, лечению, профилактике. |
| 2 | Рак шейки матки, NICE, 2021 [5] | + | + | + | Клинические рекомендации по диагностике и лечению рака шейки матки |
| 3 | Рекомендации по лечению РШМ, ESMO, 2020 [6] | + | + | + | Взята за основу при разработке, рекомендации по диагностике и лечению |
| 4 | Руководство ASTRO по лучевой терапии рака шейки матки, 2020 [7] | + | + | + | Взята за основу при разработке, рекомендации по лучевой терапии |
| 5 | Рекомендации по лечению рака шейки матки, Medscape, март, 2021 [8] | + | + | + | Рекомендации по схемам химиотерапевтического лечения рака шейки матки |
| 6 | Рак шейки матки, РЦРЗ (Республиканский центр развития здравоохранения МЗ РК), Казахстан, 2018 [9] | + | + | + | Рекомендации по классификации, МКБ-10, ведению |
| 7 | Клинические рекомендации по РМШ, РФ, 2020 [10] | + | + | + | Рекомендации по диагностике |
| 8 | Рекомендаций NCCN по лечению РШМ, 2021 [11] | + | + | + | Рекомендации по лечению |
Предпочтение для разработки руководства основывались на вебсайте BJSC, NICE, ESMO, ASTRO. По черновому варианту были получены комментарии и замечания специалистов. Обновление данного руководства предполагается по мере появления новых данных.
Шкала уровней доказательности и градации рекомендаций
| А | Высококачественный метаанализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с не высоким (+) риском систематической ошибки |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+) |
| D | Описание серии случаев или неконтролируемое исследование, или мнение экспертов |
Данное национальное клиническое руководство дополнено алгоритмами, формами информированного согласия пациентов на лечение, памяткой для пациентов, стандартами и индикаторами для мониторинга и аудита внедрения клинического руководства по РШМ, формой по критериям оценки качество медицинской помощи при РШМ (Приложения 1-13).
Задачи:
Целевая группа руководства
Ожидаемые результаты применения национального клинического руководства:
Показаниями для госпитализации больных раком шейки матки являются: проведение операции, лучевой терапии, химиотерапии, комбинированного или комплексного лечения, а также проведение паллиативной терапии. Лучевую терапию и химиотерапию также можно проводить амбулаторно.
В амбулаторно-диагностическое отделение (АДО) Национального центра онкологии и гематологии (НЦОГ) МЗ КР больные могут обратиться по направлению врачей ГСВ, врачей онкологов или самостоятельно с территории всей Кыргызской Республики.
Плановая госпитализация онкогинекологических больных в Национальный центр онкологии и гематологии осуществляется при наличии показаний:
Госпитализация в экстренном, срочном порядке осуществляется при наличии показаний:
Я, ________________________________________________________________
Я, _________________________________________________________
Мен,_______________________________________________________________________
Лучевая терапия – это применение особого вида энергии электромагнитных излучений или пучков элементарных ядерных частиц, способных убивать опухолевые клетки или сдерживать их рост и деление. Здоровые клетки, попадающие в зону облучения, также повреждаются, однако большинство из них способно восстанавливаться. Опухолевые клетки делятся быстрее, чем окружающие их здоровые клетки. Поэтому облучение действует на них более губительно. Именно эти различия и определяют эффективность лучевой терапии рака. Для проведения ЛТ используют специальные сложные аппараты, которые позволяют направить поток лечебной энергии на опухоль. Эти аппараты различаются по принципу действия и применяются в разных целях.
ПРОЦЕСС ПРОВЕДЕНИЯ ЛУЧЕВОЙ ТЕРАПИИ
КАК ПРОХОДИТ СЕАНС ЛЕЧЕНИЯ
ВО ВРЕМЯ ЛЕЧЕНИЯ СЛЕДУЕТ СОБЛЮДАТЬ НЕКОТОРЫЕ ПРАВИЛА:
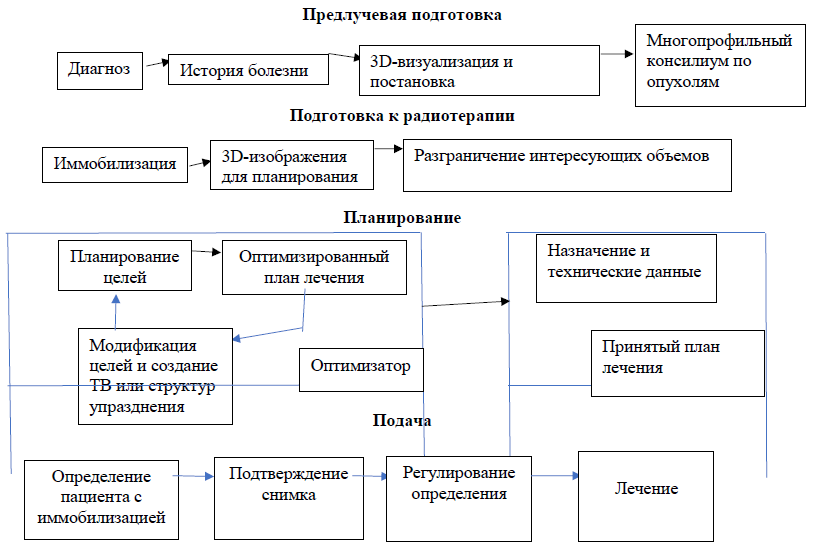
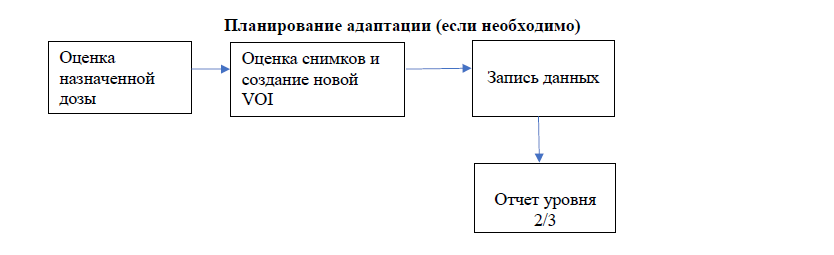
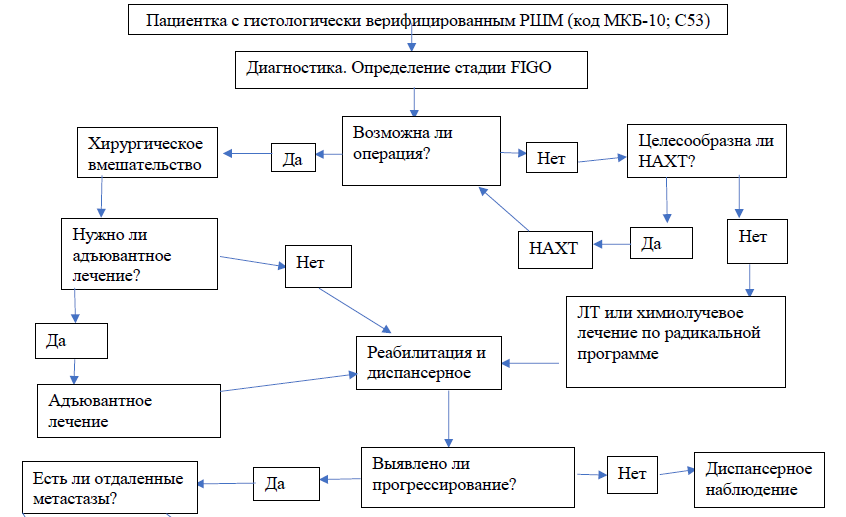
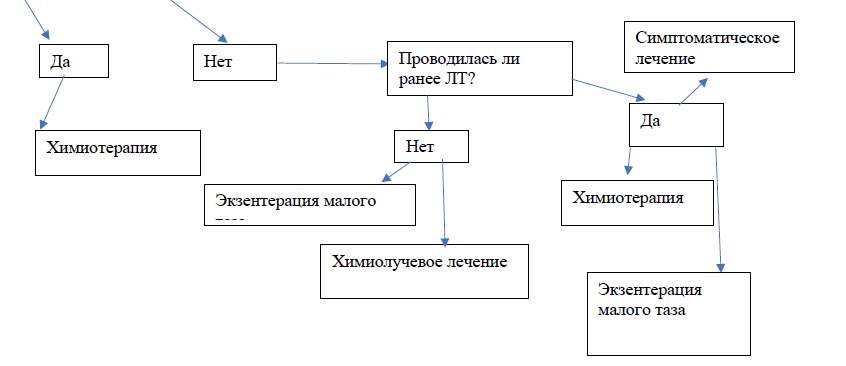
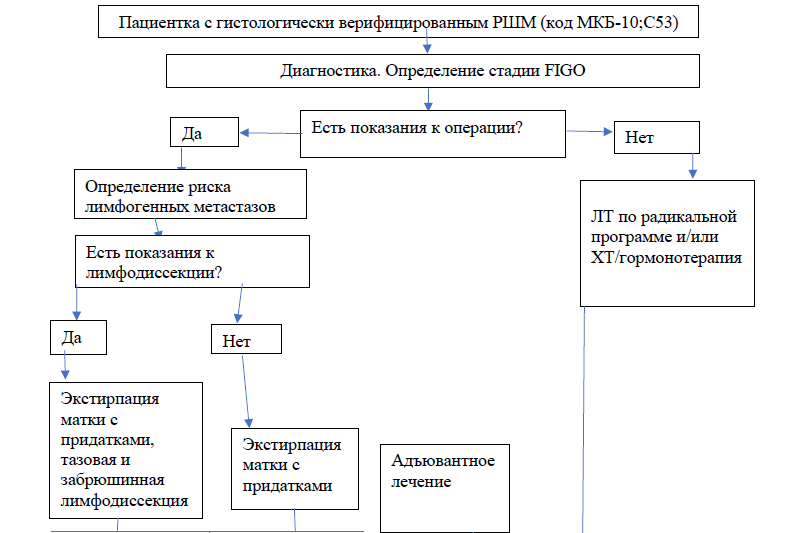
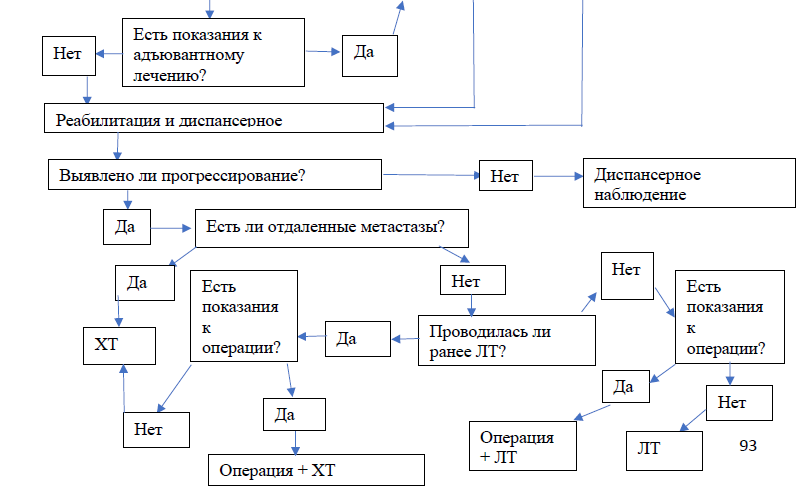







|
№
|
Критерии качества | Оценка |
| 1 | Выполнена биопсия шейки матки (при установлении диагноза) | Да/нет |
| 2 | Выполнено УЗИ органов брюшной полости (комплексное) и забрюшинного пространства и/или КТ органов брюшной полости и/или МРТ органов брюшной полости (при установлении диагноза) | Да/нет |
| 3 | Выполнено УЗИ органов малого таза и/или КТ органов малого таза и/или МРТ органов малого таза (при установлении диагноза) | Да/нет |
| 4 | Выполнена рентгенография органов грудной клетки и/или КТ органов грудной клетки (при установлении диагноза) | Да/нет |
| 5 | Выполнено исследование уровня антигена плоскоклеточного рака SCC в крови (при установлении диагноза) | Да/нет |
| 6 | Выполнено патологоанатомическое исследование операционного (биопсийного) материала с целью морфологической верификации диагноза | Да/нет |
| 7 | Выполнено радикальное хирургическое вмешательство при наличии морфологической верификации диагноза | Да/нет |
| 8 | Выполнена ЛТ и/или ХТ, и/или таргетная терапия при наличии морфологической верификации диагноза (при ЛТ и/или ХТ, и/или таргетной терапии) | Да/нет |
| 9 | Выполнена дозиметрическая верификация рассчитанного плана (при ЛТ) | Да/нет |
| 10 | Выполнен общий (клинический) анализ крови, развернутый не более чем за 5 дней до начала курса ЛТ и/или ХТ, и/или таргетной терапии | Да/нет |
| 11 | Выполнена адъювантная ЛТ и/или ХТ не позднее 60 дней от момента хирургического вмешательства (при наличии медицинских показаний и отсутствии медицинских противопоказаний) | Да/нет |
| 12 | Начат курс ЛТ и/или ХТ и/или таргетной терапии не позднее 60 дней от момента выявления клинических симптомов рецидивирования/метастазирования (при наличии медицинских показаний и отсутствии медицинских противопоказаний) | Да/нет |
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.