Рак полового члена
 Версия: Клинические рекомендации РФ 2024 (Россия)
Версия: Клинические рекомендации РФ 2024 (Россия)
Злокачественное новообразование полового члена (C60), Новообразования неопределенного или неизвестного характера других мужских половых органов (D40.7)
Онкология, Урология
Общая информация
Краткое описание
Разработчик клинической рекомендации
- Ассоциация онкологов России
- Общероссийская общественная организация "Российское общество онкоурологов"
- Общероссийская общественная организация «Российское общество клинической онкологии»
- Общероссийская общественная организация "Российское общество урологов"
- Общероссийская общественная организация "Российское общество онкопатологов"
Одобрено Научно-практическим Советом Минздрава РФ
– размещенные в Рубрикаторе после 1 января 2024 года – с 1 января 2025 года.
Клинические рекомендации
Рак полового члена
Год утверждения (частота пересмотра): 2024
Возрастная категория: Взрослые
Пересмотр не позднее: 2026
ID: 51
Определение заболевания или состояния (группы заболеваний или состояний)
Рак полового члена (далее – РПЧ) – онкологическое заболевание, связанное с развитием злокачественного новообразования в тканях полового члена.
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
По Международной статистической классификации болезней и проблем, связанных со здоровьем (далее – МКБ-10) рак полового члена классифицируется в соответствии с локализацией: например, злокачественное новообразование крайней плоти полового члена будет иметь код C60.0, а злокачественное новообразование тела полового члена – код С60.2.
Злокачественное новообразование (далее – ЗНО) полового члена (С60):
- С60.0 ЗНО крайней плоти полового члена;
- С60.1 ЗНО головки полового члена;
- С60.2 ЗНО тела полового члена;
- С60.8 ЗНО полового члена, выходящее за пределы вышеуказанных локализаций;
- С60.9 ЗНО полового члена неуточненной локализации.
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
Международная гистологическая классификация опухолей полового члена (классификация Всемирной организации здравоохранения (ВОЗ), 2016 г.) [4]
| Злокачественные эпителиальные опухоли: | |
|---|---|
| Плоскоклеточный рак: | 8070/3 |
| · Плоскоклеточный рак, не связанный с вирусом папилломы человека (ВПЧ): | |
| Плоскоклеточный рак, обычный тип | 8070/3 |
| Псевдогиперпластический рак | |
| Псевдожелезистый рак | 8075/3 |
| Веррукозный рак | 8051/3 |
| Карцинома cuniculatum | |
| Папиллярный плоскоклеточный рак | 8052/3 |
| Аденоплоскоклеточный рак | 8560/3 |
| Саркоматоидный плоскоклеточный рак | 8074/3 |
| Смешанный плоскоклеточный рак | 8070/3 |
| · Плоскоклеточный рак, связанный с ВПЧ: | |
| Базалоидный плоскоклеточный рак | 8083/3 |
| Папиллярный базалоидный рак | |
| Бородавчатый рак | 8054/3 |
| Бородавчато-базалоидный рак | |
| Светлоклеточный плоскоклеточный рак | 8084/3 |
| Лимфоэпителиомоподобный рак | 8082/3 |
| Другие редкие типы | |
| Поражения-предшественники: | |
| · Пенильная интраэпителиальная неоплазия | 8077/2 |
| Бородавчатая/базалоидная/бородавчато-базалоидная | |
| · Дифференцированная пенильная интраэпителиальная неоплазия | 8071/2 |
| · Болезнь Педжета | 8542/3 |
Более 95 % злокачественных опухолей полового члена представлены плоскоклеточным раком. Злокачественные меланомы и базальноклеточные карциномы встречаются гораздо реже. Мезенхимальные опухоли пениса крайне редки, их частота едва достигает 3 % (саркома Капоши, ангиосаркома, эпителиоидная гемангиоэндотелиома). Описаны случаи метастазирования опухолей мочевого пузыря, простаты, почки и прямой кишки в половой член.
Выделяют следующие типы плоскоклеточного рака полового члена:
1. Не-ВПЧ-ассоциированный плоскоклеточный рак:
– плоскоклеточный рак, обычный тип;
– псевдогиперпластическая карцинома;
– псевдогландулярная карцинома;
– веррукозная карцинома;
– папиллярная плоскоклеточная карцинома;
– аденосквамозная карцинома;
– саркоматоидная плоскоклеточная карцинома4
– смешанная плоскоклеточная карцинома.
2. ВПЧ-ассоциированный плоскоклеточный рак:
– базалоидная плоскоклеточная карцинома;
– папиллярно-базалоидная карцинома;
– бородавчатая карцинома;
– светлоклеточная плоскоклеточная карцинома;
– лимфоэпителиомоподобная карцинома.
Различают 3 основных типа роста рака полового члена: поверхностный, узловой и веррукозный [5].
Стадирование
Стадирование опухолей полового члена осуществляется в соответствии с классификацией TNM AJCC/UICC 8-го пересмотра (2017 г.) [6] (табл. 1).
Клиническая классификация TNM:
- сT – первичная опухоль;
- сTх – недостаточно данных для оценки первичной опухоли;
- сT0 – первичная опухоль не определяется;
- сTis – carcinoma in situ;
- сTa – неинвазивная веррукозная (бородавчатая) карцинома без деструктивного инвазивного роста;
- сT1 – опухоль, инвазирующая субэпителиальную соединительную ткань;
- сT1a – опухоль врастает в субэпителиальную соединительную ткань без признаков лимфоваскулярной инвазии и не является низкодифференцированной или недифференцированной (T1G1–2);
- сT1b – опухоль врастает в субэпителиальную соединительную ткань, имеет лимфоваскулярную инвазию либо является низкодифференцированной или недифференцированной (T1G3–4);
- сT2 – опухоль врастает в губчатое тело с инвазией в уретру или без нее;
- сT3 – опухоль врастает в кавернозное тело с инвазией в уретру или без нее;
- сT4 – опухоль распространяется на другие окружающие структуры;
- сN – регионарные лимфоузлы;
- сNх – регионарные лимфоузлы не могут быть оценены;
- сN0 – нет пальпируемых или визуально увеличенных паховых лимфоузлов;
- сN1 – подвижный пальпируемый увеличенный паховый лимфоузел с одной стороны;
- сN2 – подвижные пальпируемые множественные или двусторонние паховые лимфоузлы;
- сN3 – неподвижный конгломерат паховых лимфоузлов или увеличенные тазовые лимфоузлы с одной стороны или обеих сторон;
- сM – отдаленные метастазы;
- сM0 – нет данных о наличии отдаленных метастазов;
- сM1 – имеются отдаленные метастазы.
Патоморфологическая классификация TNM РПЧ
Патоморфологические категории Т соответствуют клиническим категориям Т. Категории pN основываются на данных биопсии или хирургического удаления лимфоузлов.
- pN – регионарные лимфоузлы pNх – недостаточно данных для оценки состояния регионарных лимфоузлов;
- pN0 – отсутствие метастазов в регионарные лимфоузлы;
- pN1 – внутриузловой метастаз (без выхода за капсулу лимфоузла) в 1 или 2 паховых лимфоузлах;
- pN2 – метастазы более чем в 2 паховых лимфоузлах с одной стороны или двустороннее поражение паховых лимфоузлов;
- pN3 – метастазы в 1 или нескольких тазовых лимфоузлах, односторонние или двусторонние метастазы в паховых лимфоузлах с экстранодальным распространением опухоли pM – отдаленные метастазы;
- рM0 – нет отдаленных метастазов;
- рM1 – отдаленные метастазы;
- G – гистопатологическая степень дифференцировки;
- Gx – недостаточно данных для оценки гистологической дифференцировки;
- G1 – высокодифференцированная опухоль;
- G2 – умеренно дифференцированная опухоль;
- G3– низкодифференцированная или недифференцированная опухоль.
Степень дифференцировки указывается для плоскоклеточного рака обычного типа. Специфические типы карцином, как правило, имеют характерную для них степень дифференцировки.
Таблица 1. Стадирование РПЧ в зависимости от категорий T, N, M.
| Стадия | Т | N | М |
|---|---|---|---|
| 0 | is, a | 0 | 0 |
| I | 1 | 0 | 0 |
| II | 1–2 | 1 | 0 |
| 2 | 0–1 | 0 | |
| III | 1–3 | 2 | 0 |
| 3 | 0–2 | 0 | |
| IV | 4 | 0 | 0 |
| 1–3 | 3 | 0 | |
| 1 |
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Развитию РПЧ способствуют фимоз и хронический баланопостит. Доказано повышение риска развития РПЧ у пациентов с псориазом, получавших псорален, фототерапию и терапию ультрафиолетовыми лучами, курящих, а также мужчин, имевших раннее начало половой жизни и множественных сексуальных партнеров. Выявлена корреляция риска развития РПЧ с вирусом папилломы человека (ВПЧ) 16-го и 18-го типов, который выявляется у 50 % пациентов; при базалиоидном и веррукозном вариантах рака полового члена этот показатель достигает 22–66 % [1, 2].
Заболеваниями, спорадически ассоциированными с РЧП, являются кожный рог, боуэноподобный папуллез полового члена и облитерирующий баланопостит (лихенизирующий склероз). Факторами высокого риска заболевания плоскоклеточным раком полового члена (до 30 % злокачественных трансформаций) являются интраэпителиальная неоплазия (carcinoma in situ), гигантская кондилома Бушке–Левенштейна, эритроплазия Кейра, болезнь Боуэна и болезнь Педжета [2].
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
РПЧ – редкое онкологическое заболевание, встречающееся с частотой 0,1–7,9 на 100 000 мужского населения. В Европе его частота составляет 0,1–0,9 на 100 000, в США – 0,7–0,9 на 100 000; однако в некоторых регионах Азии, Африки и Южной Америки данный показатель достигает 19 на 100 000. В этих странах РПЧ составляет 10–20 % всех злокачественных опухолей у мужчин [1]. В России в 2017 г. показатель заболеваемости составил 0,67 на 100 000 [3].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
На ранних стадиях заболевание характеризуется наличием небольшого экзофитного или плоского очага на коже головки или крайней плоти полового члена, который постепенно инфильтрирует спонгиозное и/или кавернозные тела. Часто происходит инфицирование распадающейся опухоли, возможно появление уретральных свищей, развитие флегмоны мягких тканей промежности и сепсиса. Описаны кровотечения из первичной опухоли. При отсутствии лечения возможна аутоампутация полового члена.
При РПЧ нередко отмечается увеличение паховых лимфоузлов, обусловленное наличием метастазов или инфекционным лимфаденитом. Пораженные лимфоузлы могут сливаться между собой, образуя конгломераты, прорастающие кожу с формированием наружных свищей с гнойным отделяемым. Нарушение оттока лимфы от нижних конечностей может повлечь за собой развитие отеков.
Появление отдаленных метастазов вызывает развитие симптомов, соответствующих их локализации.
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза/состояния:
- данные анамнеза;
- данные физикального обследования;
- данные лабораторных исследований;
- данные инструментального обследования.
Клинический диагноз основан на комбинации результатов анализов:
- физикального обследования (визуальный осмотр и пальпация) -дает критерии, которые указывают на подозрительное образование полового члена;
- заключения патолого-анатомического (морфологического) исследования опухолевого материала.
1. Жалобы и анамнез
- Рекомендуется сбор жалоб и анамнеза у всех пациентов с целью выявления факторов, которые могут повлиять на выбор тактики лечения [1, 2, 7].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
2. Физикальное обследование
- Рекомендуется осмотр и пальпация полового члена, а также паховых областей всем пациентам с подозрением на РПЧ для оценки степени распространённости опухолевого процесса [7].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
3. Лабораторные диагностические исследования
- Всем пациентам с РПЧ рекомендуется выполнять общий клинический анализ крови для выбора методов дополнительной диагностики и определения тактики лечения [1, 7].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- Всем пациентам с РПЧ рекомендуется выполнять биохимический анализ крови (включая определение уровня глюкозы, креатинина, мочевины, билирубина, трансаминаз, щелочной фосфатазы, калия сыворотки крови) для выбора методов дополнительной диагностики и определения тактики лечения [1, 7].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств –5)
- Всем пациентам с РПЧ рекомендуется выполнять коагулограмму, включающую определение протромбина, протромбинового времени, международного нормализованного отношения, активированного частичного тромбопластинового времени и фибриногена, для выбора методов дополнительной диагностики и определения тактики лечения [1, 7-10].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- Всем пациентам с РПЧ рекомендуется общий (клинический) анализ мочи для выбора методов дополнительной диагностики и определения тактики лечения [1, 7, 11, 153].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- Всем пациентам с РПЧ и клиническими признаками инфицирования первичной опухоли или регионарных метастазов рекомендуется выполнять микробиологическое (культуральное) исследование отделяемого из опухоли на аэробные и факультативно-анаэробные условно-патогенные микроорганизмы с целью определения тактики лечения инфекционных осложнений и профилактики сепсиса [1, 7, 12, 13].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
4. Инструментальные диагностические исследования
- Рекомендуется выполнить ультразвуковое исследование (УЗИ) и/или магнитно-резонансную томографию (далее – МРТ) полового члена с целью уточнения глубины инвазии опухоли при сомнительных данных осмотра и пальпации у пациентов с установленным диагнозом РПЧ [14 – 17, 89].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
Комментарий: МРТ имеет низкую диагностическую эффективность в отношении выделения категорий сТ1 и сТ2 и не имеет преимуществ по сравнению с осмотром и пальпацией. Чувствительность и специфичность МРТ в выявлении категории сТ3 достигает 80% (95% ДИ: 70–87%) и 96% (95% ДИ: 85–99%) соответственно. МРТ с искусственной эрекцией и без нее показала одинаковую точность определения категории сТ [89, 90].
- Рекомендуется выполнить УЗИ паховых областей всем пациентам с установленным диагнозом РПЧ с целью оценки состояния регионарных лимфоузлов [2, 14, 16, 17].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
- Рекомендуется выполнить компьютерную томографию (КТ) или МРТ паховых областей и таза с контрастным усилением всем пациентам с РПЧ, имеющим пальпируемые паховые лимфоузлы (или пациентам с ожирением, имеющим паховые лимфоузлы ≥10 мм, по данным УЗИ), с целью оценки состояния регионарных лимфоузлов [2, 14, 16 - 18].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
- Рекомендуется выполнить КТ или МРТ брюшной полости и забрюшинного пространства с внутривенным контрастированием всем пациентам с РПЧ, имеющим увеличенные паховые лимфоузлы с целью оценки состояния забрюшинных лимфоузлов [2, 18].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- Рекомендуется выполнить рентгенографию или КТ органов грудной клетки всем пациентам с РПЧ, имеющим увеличенные тазовые лимфоузлы с целью выявления метастазов в легких [2, 18].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- Рекомендуется выполнение сцинтиграфии костей скелета (остеосцинтиграфии) пациентам, предъявляющим жалобы на боль в костях, для выявления костных метастазов [18].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- Рекомендуется выполнение позитронно-эмиссионной томографии, совмещенной с КТ всего тела с флудезоксиглюкозой [18F] (18F-ПЭТ/КТ) всем пациентам с РПЧ, имеющим пальпируемые паховые лимфоузлы (или пациентам с ожирением, имеющим паховые лимфоузлы ≥10 мм, по данным УЗИ), с целью оценки распространенности опухолевого процесса для определения тактики дальнейшего лечения. При выполнении 18F-ПЭТ/КТ на этапе первичного стадирования дополнительная визуализация зон регионарного и отделенного метастазирования не требуется [87, 91].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 1)
Комментарий: по данным систематического обзора литературы, основанного на 12 исследованиях, включивших 479 пациентов с РПЧ, чувствительность 18F-ПЭТ/КТ в выявлении метастатически-пораженных лимфоузлов составляет 87%, специфичность – 88%, объединенное диагностическое отношение шансов - 47 (95% ДИ 19–116). В метарегрессионном анализе ни одна переменная не была источником гетерогенности исследования [87]. 18F-ПЭТ/КТ не выявляет микрометастазы РПЧ [91].
5. Иные диагностические исследования
- Рекомендуется: оценить статус инфицирования вирусом папилломы человека (ВПЧ) 6, 16 и 18 типов пациентам с раком полового члена для определения прогноза и формирования лечебной тактики [88].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 1).
Комментарии: от 45% до 80% случаев РПЧ ассоциированы с ВПЧ, чаще всего 6, 16 и 18 типов. Несмотря на то, что ВПЧ является фактором риска развития данного заболевания, позитивный ВПЧ статус ассоциирован с благоприятным прогнозом выживаемости, что может быть принято во внимание при формировании лечебной тактики [88].
- Рекомендуется проводить патолого-анатомическое исследование биопсийного и/или операционного материала всем пациентам с подозрением на РПЧ для определения: гистологического типа, варианта, степени анаплазии, наличия ангиолимфатической инвазии, глубины инвазии первичной опухоли; а также оценки количества удаленных лимфоузлов, выявления метастазов РПЧ в удаленных лимфоузлах, обнаружения экстранодальной экстензии опухоли [2, 18-20].
Уровень убедительности рекомендаций – (уровень достоверности доказательств – 5)
Комментарии: до начала лечения обязательно получение морфологической верификации диагноза РПЧ. Для определения лечебной тактики как отношении первичной опухоли, так и регионарных метастазов необходимо определение гистологического варианта опухоли, оценка категории Т и степени анаплазии G. Морфологический материал для цитологического исследования может быть получен методом соскоба или мазка-отпечатка, для патолого-анатомического исследования - путем открытой, столбчатой, аспирационной биопсии. При небольших опухолях дистальной локализации (крайняя плоть, головка пениса) допустимо полное удаление опухоли для первичной верификации диагноза. Исследование удаленных лимфатических узлов должно включать оценку количества метастатически-пораженных лимфоузлов, а также определение наличия экстракапсулярной экстензии опухоли [2, 18-20].
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Назначение и применение лекарственных препаратов, указанных в клинической рекомендации, направлено на обеспечение пациента клинически эффективной и безопасной медицинской помощью, в связи с чем их назначение и применение в конкретной клинической ситуации определяется в соответствии с инструкциями по применению конкретных лекарственных препаратов с реализацией представленных в инструкции мер предосторожности при их применении, также возможна коррекция доз с учетом состояния пациента.
1. Лечение первичной опухоли у пациентов с РПЧ
В связи с низкой частотой РПЧ и отсутствием рандомизированных исследований в данной области оптимальная тактика лечения этой категории пациентов не разработана. Общепринятым стандартом лечения первичной опухоли у пациентов с РПЧ является ампутация полового члена. В связи с высокой значимостью косметических и функциональных последствий лечения новообразований данной локализации, включая сохранение внешнего вида, способности к мочеиспусканию стоя и осуществлению копулятивной функции, разработан ряд альтернативных методов, включая органосохраняющие операции, местную лекарственную, лазерную аблацию и лучевую терапию, направленных на сохранение полового члена.
- Рекомендуется осуществлять индивидуальный выбор метода лечения первичной опухоли у пациентов с РПЧ в зависимости от локализации, количества, размеров, категории T и степени анаплазии G новообразования полового члена. Алгоритм выбора лечебной тактики в зависимости от характеристик первичной опухоли приведен в таблице 2 [1, 2, 21].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
1. Хирургическое лечение первичной опухоли у пациентов с РПЧ
Результаты хирургического лечения зависят от локализации, размеров, категории Т, степени анаплазии опухоли G и объема операции. Органосохраняющее лечение ассоциировано с большей частотой местных рецидивов (21,2%) по сравнению с ампутацией полового члена (0-10%), однако позволяет сохранить лучшее качество жизни [22].
- Рекомендуется хирургическое лечение пациентам с РПЧ категорий Тis-Т4 для достижения ремиссии [22-28]:
— пациентам с РПЧ категорий Tis-T3 при технической возможности рекомендовано выполнение органосохраняющих операций, таких как циркумцизия (обрезание крайней плоти) при локализации опухоли на крайней плоти, микрохирургическое удаление опухоли с циркумцизией, широкое иссечение первичной опухоли с циркумцизией, глансэктомия с или без реконструкции головки или резекция полового члена [22, 23].
— при отсутствии возможности органосохраняющего хирургического лечения пациентам с опухолями категорий Т2-Т3, не распространяющимися на ножки, рекомендовано ампутация полового члена [22, 23].
— пациентам с опухолями категории Т3, распространяющимися на ножки, рекомендовано экстирпация полового члена [22-24].
— пациентам с опухолями категории Т4, распространяющимися на ткани мошонки и/или семенного канатика, рекомендовано эмаскуляция; при наличии технической возможности допустимо иссечение пораженных тканей мошонки и сохранение яичек; сохраненные яички помещаются под кожу медиальных поверхностей бедер [24].
— пациентам с опухолями категории Т4, распространенность которых не позволяет произвести радикальное хирургическое вмешательство, рекомендовано выполнение паллиативных санационных операций до начала системной и/или лучевой терапии. Объем паллиативной санационной операции определяется индивидуально [24].
— пациентам с опухолями категории Т4, распространенность которых не позволяет произвести радикальное хирургическое вмешательство, с формированием уретральных свищей рекомендовано цистостомия до начала системной и/или лучевой терапии [25].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
- Рекомендуется срочное патолого-анатомическое исследование операционного материала края хирургического разреза во время хирургического удаления первичной опухоли у всех пациентов с РПЧ, кроме случаев выполнения паллиативных санационных операций [26].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- Рекомендуется резекция края хирургического разреза при обнаружении клеток опухоли при срочном патолого-анатомическом исследовании операционного материала края во время хирургического удаления первичной опухоли у всех пациентов с РПЧ [26].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- Рекомендуется индивидуально выбирать вид пластики образовавшегося дефекта тканей у пациентов с РПЧ, подвергнутых удалению первичной опухоли. Возможно закрытие дефекта кожи местными тканями, перемещенным лоскутом, свободным полнослойным кожным лоскутом, свободным расщепленным кожным лоскутом или лоскутом слизистой щеки, а также применение комбинации различных методов. Допустимо открытое ведение образовавшегося дефекта кожи [23, 24].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется формирование наружного отверстия уретры в области дистальной культи резецированного полового члена пациентам с РПЧ, у которых длина сохраненной культи позволяет мочиться стоя. При недостаточной длине культи полового члена показана промежностная уретростомия. После выполнения экстирпации полового члена или эмаскуляции с сохранением культи уретры, длина которой недостаточна для формирования промежностной уретростомы, показана цистостомия [22-24].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
- Рекомендуется проведения адъювантной лучевой терапии (см. раздел 3.1.4) на область послеоперационного рубца при обнаружении клеток опухоли при плановом патолого-анатомическое исследование исследовании для достижения ремиссии [26, 27, 28].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется в случаях развития неинвазивного местного рецидива РПЧ после органосохраняющего лечения повторное органосохраняющее хирургическое вмешательство. При технической невозможности сохранения полового члена, а также при выявлении инвазивного рецидива РПЧ выполнять резекцию или ампутацию полового члена [22, 24].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
- Рекомендуется хирургическое удаление первичной опухоли для достижения ремиссии пациентам с первичным неоперабельным РПЧ, достигшим частичной регрессии после химиотерапии (см. раздел 3.3), лучевой терапии (см. раздел 3.1.4) или химиолучевой терапии (см. раздел 3.1.4), позволяющей рассчитывать на техническую возможность выполнения радикального вмешательства. Объем операции выбирается индивидуально и зависит от степени распространения опухолевого процесса [18, 22, 23, 28].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
2. Лазерная аблация первичной опухоли у пациентов с РПЧ
Описаны случаи удовлетворительных отдаленных и функциональных результатов применения лазерной терапии пациентов с РПЧ Tis, T1a и T1b степени анаплазии G1-G2. По данным ретроспективных исследования, частота местных рецидивов после лазерной аблации составляет 18% при хороших косметических и функциональных результатах [29, 30].
- Рекомендуется применение лазерной аблации у пациентов с РПЧ Tis, T1a и T1b со степенями анаплазии G1-G2 с использованием карбонового лазера c длиной волны 10,600 нм (глубина проникновения – 0,1 мм, размер участка ткани, на который производится воздействие – 1-5 мм, мощность – 5-10 Вт, непрерывный или суперимпульсивный режим) или ниодимового лазера (Nd:YAG) с длиной волны 1,064 нм (глубина проникновения – 3-4 мм, размер участка ткани, на который производится воздействие – 1-5 мм, мощность – 40 Вт, длительность воздействия – 1 мсек, частота – 10-40 Гц) [29, 30].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
3. Местная лекарственная терапия первичной опухоли у пациентов с РПЧ
Использование топической лекарственной терапии позволяет добиться полного ответа у 23-70% пациентов с РПЧ [31].
- Рекомендуется применение #имихимода у пациентов с РПЧ Tis и Ta (крем 5%, наносить на зону поражения полового члена, 3 раза в неделю на ночь, в течение 4-16 недель) для достижения терапевтического эффекта [31, 147].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3).
4. Лучевая терапия первичной опухоли у пациентов с РПЧ
Лучевая терапия позволяет добиться длительного локального контроля с сохранением полового члена в 40% случаев у пациентов с РПЧ категорий Т1-Т2 и в 38% наблюдений при категориях Т3-Т4. Поздние осложнения развиваются у 40% пролеченных пациентов [32, 33].
Всем пациентам с РПЧ, являющимся кандидатами для лучевой терапии, выполняется циркумцизия [32, 33].
- Рекомендуется проведение брахитерапии с применением внутритканевых имплантов пациентам с РПЧ категорий Т1-Т2 и размерами первичной опухоли <4 см для достижения ремиссии. [32, 34].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
- Рекомендуется проведение дистанционной лучевой терапии пациентам с РПЧ категорий Т1-Т2 и размерами первичной опухоли <4 см до суммарной очаговой дозы (далее – СОД) 65-70 Гр с конвенционным фракционированием, используя болюс на опухоль полового члена с отступом от видимого края опухоли 2 см для достижения ремиссии [27].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется проведение дистанционной лучевой терапии пациентам с РПЧ категорий Т1-Т2 и размерами первичной опухоли ≥4 см или категорий Т3-4 в СОД 45-50,4Гр на весь половой член (или половой члена и ткани, вовлеченные в опухоль) и последующим облучением опухоли полового члена с отступом от ее видимого края 2 см до СОД 65-70Гр для достижения ремиссии [27, 28].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется использование радиомодифицирующей химиотерапии у пациентов, получающих дистанционную лучевую терапию при РПЧ для достижения ремиссии [28, 148, 149].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: исследований эффективности и безопасности химиолучевой терапии у пациентов с РПЧ не проводилось. Некоторые авторы [35] указывают на возможность заимствования схем радиомодифицирующей химиотерапии из протоколов лечения пациентов с раком анального канала и вульвы [28, 36-38, 85-86]:
#Цисплатин** 40 мг/м2 в/в еженедельно, всего 6 введений (но не более 70 мг на введение суммарно) [28];
#Цисплатин** 60 мг/м2 в/в в 1-й и 29-й дни + фторурацил** 1000 мг/м2/день в/в 24-часовая инфузия в 1–4-й и 29–32-й дни [28];
#Митомицин** 12 мг/м2 в/в в 1-й день (но не более 20 мг на введение суммарно) + фторурацил** 1000 мг/м2/день в/в 24-часовая инфузия в 1–4-й и 29–32-й дни [28];
#Капецитабин** 1650 мг/м2/день внутрь в дни лучевой терапии в течение всего курса лучевой терапии [28, 148, 149].
- Рекомендуется органоуносящее хирургическое лечение пациентам при неполном эффекте лучевой терапии или развитии нежелательных явлений, не позволяющих рассчитывать на благоприятный функциональный исход консервативного лечения (некроз полового члена) для достижения ремиссии [36].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- Рекомендуется адъювантная дистанционная лучевая терапия на область операционного рубца после удаления первичной опухоли пациентам с РПЧ при обнаружении клеток опухоли по краю хирургического разреза до СОД 45-60Гр. После выполнения паллиативной операции и наличии клинически определяемой опухоли в области послеоперационного рубца методика дистанционной лучевой терапии соответствует описанной выше для пациентов с РПЧ категорий Т3-Т4 для достижения ремиссии [27, 28].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
2. Лечение пациентов с регионарными метастазами РПЧ
РПЧ в основном метастазирует лимфогенно. При этом в первую очередь поражаются паховые, и лишь затем – тазовые лимфоузлы. Характерно двухстороннее поражение лимфоузлов, что объясняется наличием лимфатических коллатералей, перекрещивающихся у корня пениса. Клинически всех заболевших РПЧ разделяют на пациентов с непальпируемыми и пальпируемыми паховыми лимфоузлами. Радиологических критериев, позволяющих дифференцировать метастатически-пораженные и интактные лимфоузлы при РПЧ, не существует. Единственным точным методом оценки категории N является регионарная лимфодиссекция, ассоциированная с высокой частотой осложнений. Метастазы в лимфоузлы резко ухудшают прогноз, однако раннее выполнение лимфодиссекции позволяет увеличить выживаемость пациентов с РПЧ. Разработан алгоритм лечения пациентов с регионарными метастазами РПЧ, отраженный в таблице 3 [39].
1. Лечение пациентов с РПЧ и непальпируемыми паховыми лимфоузлами
Около 25% пациентов с непальпируемыми паховыми лимфоузлами имеет категорию рN+. Факторами риска наличия микрометастазов в клинически негативных лимфоузлах являются категория рТ>Т1, степень анаплазии G>G1 и наличие лимфоваскулярной инвазии. В группе низкого риска (Ta, Tis, T1аG1) вероятность обнаружения метастазов в непальпируемых лимфоузлах составляет 17%, в группе промежуточного риска (Т1bG1-2) – 29%, в группе высокого риска (Т>Т1 и/или G3-4) – 47-73% [39, 40].
- Рекомендуется оценивать риск регионарного метастазирования у всех пациентов с РПЧ: к группе низкого риска относятся случаи РПЧ категорий Ta, Tis, T1аG1, к группе промежуточного риска – категории Т1аG2, к группе высокого риска – категорий Т>Т1a и/или G3-4 для выбора тактики лечения [18, 40].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- Рекомендуется динамическое наблюдение пациентам с РПЧ и непальпируемыми паховыми лимфоузлами, относящимся к группе низкого риска метастазирования в паховые лимфоузлы (Ta, Tis, T1аG1). Альтернативой служат динамическая биопсия сторожевого лимфоузла со срочным патолого-анатомическим исследованием. При обнаружении метастаза в сторожевом лимфоузле объем операции должен быть расширен до двухсторонней стандартной пахово-бедренной лимфодиссекции [41, 42].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
Комментарий: динамическая биопсия сторожевого лимфоузла выполняется путем введения наноколлоида 99технеция [99mTc] (99mTc медроновая кислота, 99mTс сестамиби, 99mTс сукцимер, 99mTс фитат, 99mTс оксабифор) вокруг первичной опухоли за сутки до операции с последующей интраоперационной детекцией, удалением и гистологическим исследованием сторожевого лимфоузла. Гамма-зонд позволяет выявить сторожевой лимфоузел в 97% случаев. Чувствительность динамической биопсии сторожевого лимфоузла составляет 90-94%, частота ложно-отрицательных результатов достигает 12-15%. Диагностическая эффективность динамической биопсии сторожевого лимфоузла зависит от опыта выполнения данной манипуляции. Оптимальные результаты регистрируются в клинических центрах, выполняющих ≥20 процедур в год [41, 42].
В центрах, не располагающих возможностью и опытом выполнения динамической биопсии сторожевого лимфоузла в <20 случаях в течение года [40, 41], пациентам с РПЧ и непальпируемыми паховыми лимфоузлами, относящимся к группе низкого риска метастазирования в паховые лимфоузлы (Ta, Tis, T1аG1) проводят тщательное динамическое наблюдение [39].
- Рекомендуется пациентам группы промежуточного (Т1aG2) риска метастазирования в паховые лимфоузлы выполнять двухстороннюю модифицированную пахово-бедренную лимфодиссекцию со срочным патолого-анатомическим исследованием удаленных лимфоузлов. При обнаружении метастазов в паховые лимфоузлы объем операции со стороны поражения должен быть расширен до стандартной пахово-бедренной лимфодиссекции. Допустимой альтернативой у пациентов, информированных о рисках, служит динамическое наблюдение [43, 44, 45].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- Рекомендуется пациентам группы высокого (Т>Т1a и/или G3-4) риска метастазирования в паховые лимфоузлы выполнять двухстороннюю модифицированную пахово-бедренную лимфодиссекцию со срочным патолого-анатомическим исследованием удаленных лимфоузлов. При обнаружении метастазов в паховые лимфоузлы объем операции со стороны поражения должен быть расширен до стандартной пахово-бедренной лимфодиссекции. Допустимой альтернативой служит первичное выполнение двухсторонней стандартной пахово-бедренной лимфодиссекции [43, 44, 45].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- Рекомендуется у пациентов с РПЧ групп промежуточного (Т1aG2) и высокого (Т>Т1 и/или G3-4) риска метастазирования в паховые лимфоузлы использовать следующие границы стандартной пахово-бедренной лимфодиссекции: сверху - паховая связка, снизу – овальная ямка, медиально - портняжная мышца, латерально – латеральный край длинной отводящей мышцы бедра; глубина лимфаденэктомии ограничена бедренными артерией и веной. В процессе операции должны быть удалены все поверхностные и глубокие паховые и бедренные лимфоузлы, расположенные в центральной, верхних латеральном и медиальном, нижних медиальном и латеральном квадратах по Даселеру, а также иссечена малая подкожная вена бедра. Стандартная пахово-бедренная лимфодиссекция может выполняться одномоментно или последовательно с вмешательством на первичной опухоли полового члена. Допустимо применение эндоскопического и открытого доступа [43].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: данное вмешательство ассоциировано с высокой частотой осложнений (25-50%), включая расхождение краев раны, лимфостаз, нагноение раны [43, 44].
- Рекомендуется у пациентов с РПЧ групп промежуточного (Т1bG1-2) и высокого (Т>Т1 и/или G3-4) риска метастазирования в паховые лимфоузлы (Ta, Tis, T1аG1) в процессе модифицированной пахово-бедренной лимфодиссекции удалять поверхностные пахово-бедренные лимфоузлы из центральной зоны, а также верхних латерального и медиального квадратов по Даселеру с сохранением малой подкожной вены бедра. Модифицированная пахово-бедренная лимфодиссекция может выполняться одномоментно или последовательно с вмешательством на первичной опухоли полового члена [45].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарий: данное вмешательство снижает риск операционных осложнений по сравнению со стандартной пахово-бедренной лимфодиссекцией, однако ассоциировано с риском ложно-отрицательного результата в 15% случаев [43, 44, 45].
2. Лечение пациентов с РПЧ и пальпируемыми паховыми лимфоузлами
2.1 Лечение пациентов с РПЧ и пальпируемыми подвижными паховыми лимфоузлами <4 см
Пальпируемые паховые лимфоузлы имеются у 58% (20-96%) пациентов с РПЧ, при этом только у 17-45% из них имеются регионарные метастазы. У остальных пациентов увеличение лимфоузлов обусловлено лимфаденитом [41].
- Рекомендуется для определения тактики дальнейшего лечения пациентам с РПЧ и односторонними пальпируемыми паховыми лимфоузлами <4 см, относящимся к группе низкого риска регионарного метастазирования (Ta, Tis, T1аG1), выполнение чрескожной биопсии увеличенных лимфоузлов. При негативных результатах биопсии возможна открытая биопсия увеличенных паховых лимфоузлов; в качестве альтернативы допустимо тщательное динамическое наблюдение. При обнаружении опухоли в биопсийном материале показано выполнение двухсторонней стандартной пахово-бедренной лимфодиссекции [43, 44].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- Рекомендуется пациентам с РПЧ и односторонними пальпируемыми паховыми лимфоузлами <4 см, относящимся к группе промежуточного (Т1bG1-2) и высокого (Т>Т1 и/или G3-4) риска регионарного метастазирования, выполнять двухстороннюю стандартную пахово-бедренную лимфодиссекцию [43, 44].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- Рекомендуется пациентам с РПЧ категории рN1 (интранодальный метастаз в 1 или 2 паховых лимфоузлах) проводить динамическое наблюдение для определения дальнейшей тактики ведения пациентов [43, 44].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- Рекомендуется пациентам с РПЧ категорий рN2-N3 (экстранодальный метастаз, метастазы в 3 и более паховых лимфоузлах) выполнить профилактическую двухстороннюю тазовую лимфодиссекцию (см. раздел 3.2.3) [43, 44, 46, 47].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- Рекомендуется проведение адъювантной химиотерапии (см. раздел 3.3) или химиолучевой терапии (см. раздел 3.4) пациентам с РПЧ категорий рN2-N3 (экстранодальный метастаз, метастазы в 3 и более паховых лимфоузлах) для достижения ремиссии [43, 44, 48-51].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
2.2 Лечение пациентов с РПЧ и пальпируемыми подвижными паховыми лимфоузлами ≥4 см
- Рекомендуется выполнение чрескожной биопсии увеличенных регионарных лимфоузлов пациентам с РПЧ и пальпируемыми подвижными паховыми лимфоузлами ≥4 см для определения дальнейшей тактики ведения пациентов. При отсутствии опухолевых клеток в биоптате показана открытая биопсия. Пациентам с отсутствием опухоли в биопсийном материале показано динамическое наблюдение. Подтверждение метастатического поражения данными патолого-анатомического исследования биоптата является основанием для выполнения двухсторонней стандартной пахово-бедренной лимфодиссекции с неоадъювантной химиотерапией (см. раздел 3.3). Пациентам с противопоказаниями к назначению #цисплатина** неоадъювантная химиотерапия не проводится [43, 44, 52, 53].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- Рекомендуется динамическое наблюдение при обнаружении 0-1 интранодальных метастаза в лимфоузлах, удаленных во время двухсторонней пахово-бедренной лимфодиссекции с или без предшествующей неоадъювантной химиотерапии у пациентов с РПЧ и пальпируемыми подвижными паховыми лимфоузлами ≥4 см. для определения дальнейшей тактики ведения пациентов. [43, 44].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется двухсторонняя тазовая лимфодиссекция (см. раздел 3.2.3) при обнаружении 2 и более метастазов, а также экстранодального распространения опухоли в лимфоузлах, удаленных во время двухсторонней пахово-бедренной лимфодиссекции с или без предшествующей неоадъювантной химиотерапии у пациентов с РПЧ и пальпируемыми подвижными паховыми лимфоузлами ≥4 см для достижения ремиссии [43, 44, 47].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- Рекомендуется рассмотреть возможность проведения адъювантной химиотерапии (см. раздел 3.3) или химиолучевой терапии (см. раздел 3.4) при обнаружении 2 и более метастазов, а также экстранодального распространения опухоли в лимфоузлах, удаленных во время двухсторонней пахово-бедренной лимфодиссекции без предшествующей неоадъювантной химиотерапии у пациентов с РПЧ и пальпируемыми подвижными паховыми лимфоузлами ≥4 см. [44, 48-51].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
2.3. Лечение пациентов с РПЧ и пальпируемыми фиксированными паховыми лимфоузлами любых размеров
- Рекомендуется выполнение чрескожной биопсии увеличенных регионарных лимфоузлов пациентам с РПЧ и пальпируемыми фиксированными паховыми лимфоузлами любых размеров для определения дальнейшей тактики ведения пациентов. При отсутствии опухолевых клеток в биоптате показана открытая биопсия. Пациентам с отсутствием опухоли в биопсийном материале рекомендовано динамическое наблюдение. Подтверждение метастатического поражения данными патолого-анатомического исследования биопсийного материала является основанием для проведения неоадъювантной химиотерапии (см. раздел 3.3). Пациентам с ответом на системное лечение, позволяющим техническое удаление метастазов, показана двухсторонняя стандартная пахово-бедренная и тазовая лимфодиссекция. Пациентам без адекватного ответа на неоадъювантную химиотерапию рекомендована химиотерапия второй линии [43, 44, 52, 53].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
3. Лечение пациентов с РПЧ и высоким риском развития метастазов в тазовые лимфоузлы, а также увеличенными тазовыми лимфоузлами
Метастазы в тазовые лимфоузлы выявляются только у пациентов с поражением паховых лимфоузлов. Риск метастазов в тазовых лимфоузлах при 2-3 паховых метастазах составляет 23%, >3 паховых метастазов – 56%. Экстранодальная экстензия метастазов в паховые лимфоузлы повышает риск развития тазовых метастазов до 30% [54, 55].
- Рекомендуется пациентам с РПЧ и высоким риском метастазов в тазовые лимфоузлы (экстранодальное распространение опухоли, метастазы в 3 и более паховых лимфоузла) выполнять двухстороннюю тазовую лимфодиссекцию для профилактики метастазирования. Оптимальные границы тазовой лимфодиссекции при РПЧ не определены; в большинстве случаев в качестве анатомических ориентиров, ограничивающих объем лимфодиссекции, используются: бифуркация общей подвздошной артерии - сверху, вход в бедренный канал - снизу, бедренно-половой нерв – латерально, боковая стенка мочевого пузыря – медиально, запирательная мышца – сзади. Тазовая лимфодиссекция может выполняться одномоментно с вмешательством на первичной опухоли и пахово-бедренной лимфодиссекцией или на втором этапе хирургического лечения [47, 54, 55].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- Рекомендуется пациентам с РПЧ и увеличенными тазовыми лимфоузлами, потенциально являющимся кандидатами для хирургического лечения, проведение неоадъювантной химиотерапии (см. раздел 3.3). При противопоказаниях к цитостатическому лечению неоадъювантная химиотерапия не проводится. [52, 53].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- Рекомендуется пациентам с РПЧ и увеличенными тазовыми лимфоузлами с ответом на неоадъювантную химиотерапию, позволяющим техническое удаление метастазов, двухсторонняя тазовая лимфодиссекция. Тазовая лимфодиссекция может выполняться одномоментно с вмешательством на первичной опухоли и пахово-бедренной лимфодиссекцией или на втором этапе хирургического лечения. [43, 44, 47, 55].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- Рекомендуется пациентам с РПЧ и увеличенными тазовыми лимфоузлами с прогрессированием после проведения неоадъювантной химиотерапии назначение химиотерапии второй линии [18, 47-50].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- Рекомендуется проведение химиолучевой терапии пациентам с РПЧ и увеличенными тазовыми лимфоузлами, не являющимся кандидатами для хирургического лечения для достижения ремиссии [47-50].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
3. Химиотерапия в лечении пациентов с РПЧ
В связи с низкой заболеваемостью РПЧ в развитых странах крупных исследований, посвященных вопросам лекарственного лечения РПЧ, не проводилось. В небольших сериях наблюдений и отдельных клинических случаях продемонстрирована эффективность полихимиотерапии, основанной на #цисплатине**. Наиболее изученной является комбинация TIP (#цисплатин**, #паклитаксел**, #ифосфамид** (см. ниже)) [53]. Исторической альтернативой режиму TIP является комбинация PF (#цисплатин**, фторурацил** (см. ниже)), которая оказалась эффективна у ряда пациентов, однако частота нежелательных явлений, ассоциированных с лечением, часто служила показанием к редукции доз в опубликованных сериях наблюдений [56]. Применение режимов, основанных на блеомицине**, у пациентов с РПЧ приводит к высокой частоте неприемлемой токсичности [57].
Эффективность и безопасность неоадъювантной химиотерапии при РПЧ мало изучена. Тем не менее, в исследовании II фазы частота объективных ответов на неоадъювантную химиотерапию в режиме TIP составила 50% при длительной беспрогрессивной выживаемости, достигшей 36,7% [53]. Описаны случаи регрессии как первичной опухоли, так и регионарных метастазов с переходом в операбельное состояние после индукционной химиотерапии [52].
Адъювантная химиотерапия при РПЧ не изучалась. Однако экстраполируя скудные данные, касающиеся применения противоопухолевых препаратов в неоадъювантном режиме, можно предположить, что у пациентов с высоким риском прогрессирования, не получавших химиотерапию до операции, адъювантное лечение может привести к улучшению результатов.
Некоторые авторы указывают на возможность использования в качестве радиомодификаторов у пациентов с РПЧ, получающих дистанционную лучевую терапию, препараты, доказавшие свою эффективность при плоскоклеточном раке других локализаций: #цисплатин** (в монорежиме или в комбинации с фторурацилом**), #митомицина** (в монорежиме или в комбинации с фторурацилом**), а также #капецитабин** (см. ниже) [28, 35]. Оптимальные дозовые режимы не определены. Схема радиомодификации определяется индивидуально.
Лекарственная терапия второй линии при РПЧ практически не изучена. Описаны отдельные случаи достижения ответа на монотерапию #паклитакселом** (см. ниже) [58] и #цетуксимабом** (см. ниже) [59, 60]
- Рекомендуется назначение неоадъювантной химиотерапии у кандидатов для хирургического лечения РПЧ с верифицированными метастазами в паховые лимфоузлы ≥4 см и/или увеличенными тазовыми лимфоузлами с целью улучшения результатов хирургического лечения [28, 53].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- Рекомендуется назначение индукционной химиотерапии пациентам с верифицированным РПЧ и нерезектабельной первичной опухолью (категория Т4) и/или неудалимыми метастазами в паховые и/или тазовые лимфоузлы с целью уменьшения размеров опухоли и переводом ее в резектабельное состояние [28].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется назначение адъювантной химиотерапии пациентам с высоким риском прогрессирования РПЧ (категория N>N1) после радикального хирургического лечения, ранее не получавших химиотерапии для достижения ремиссии [28].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется назначение системной химиотерапии пациентам с местно-распространенным РПЧ, не являющихся кандидатами для дальнейшего хирургического лечения, неоперабельных рецидивах, а также при выявлении отдаленных метастазов РПЧ [18, 52, 53].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется в первой линии системной химиотерапии у кандидатов для цитотоксического лечения РПЧ использовать режимы, основанные на #цисплатине** для достижения терапевтического эффекта:
- TIP (#паклитаксел** в/в в дозе 175 мг/м2 в 1-й день, #ифосфамид** в/в в дозе 1200 мг/м2 в 1-й, 2-й и 3-й дни, #цисплатин** в/в в дозе 25 мг/м2 в 1-й, 2-й и 3-й дни), каждый 21 день. Периоперационная химиотерапия включает 4 лечебных цикла, самостоятельная химиотерапия подразумевает проведение 4-6 лечебных циклов [53, 61];
- PF (#цисплатин** в/в в дозе 70-80 мг/м2 в 1-й день, фторурацил** в/в в дозе 800-1000 мг/м2 в 2-й, 3-й, 4-й, 5-й дни) каждый 21 или 28 день. Периоперационная химиотерапия включает 4 лечебных цикла, самостоятельная химиотерапия подразумевает проведение 4-6 лечебных циклов [56].
- При противопоказаниях к #цисплатину** допустима его замена на #карбоплатин** (внутривенно капельно, AUC 3-5, каждый 21 или 28 день) [62, 150].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
- Рекомендуется во второй и последующих линиях терапии у кандидатов для цитотоксического лечения РПЧ для достижения ремиссии возможно назначение следующих режимов:
- монотерапия #паклитакселом** в/в в дозе 175 мг/м2 в 1-й день каждый 21 день. Количество лечебных циклов определяется индивидуально [58];
- монотерапия #цетуксимабом** в/в в дозе 400 мг/м2 (далее 250 мг/м2) в 1-й день каждые 7 дней или в/в в дозе 400 мг/м2 (далее 500 мг/м2) в 1-й день каждые 14 дней. Количество лечебных циклов определяется индивидуально [28, 59, 60, 63, 152].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
4. Лучевая терапия в лечении пациентов с РПЧ и метастазами в регионарные лимфоузлы
- Не рекомендуется рутинное применение неоадъювантной дистанционной лучевой терапии на зоны регионарного метастазирования у пациентов с РПЧ [28].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Не рекомендуется рутинное применение адъювантной дистанционной лучевой терапии на зоны регионарного метастазирования у пациентов с РПЧ [64, 65].
Уровень убедительности рекомендаций –B (уровень достоверности доказательств – 3).
Комментарий: Неоадъювантная лучевая терапия у пациентов с РПЧ и метастазами в регионарные лимфоузлы не изучалась. Результаты работ, посвященных адъювантному облучению противоречивы [64, 65].
- Рекомендуется назначение адъювантной химиолучевой терапии пациентам с высоким риском прогрессирования РПЧ (категория N>N1, наличие клеток опухоли по краю хирургического разреза) после хирургического лечения, а также пациентам с неоперабельными регионарными метастазами РПЧ для продления жизни пациента [28].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: исследований эффективности и безопасности химиолучевой терапии у пациентов с РПЧ не проводилось. Некоторые авторы указывают на возможность заимствования схем радиомодифицирующей химиотерапии из протоколов лечения пациентов с раком анального канала и вульвы [28, 35-38, 85-86]:
#Цисплатин** 40 мг/м2 в/в еженедельно, всего 6 введений (но не более 70 мг на введение суммарно) [28, 149];
#Цисплатин** 75 мг/м2 в/в в 1-й и 29-й дни + фторурацил** 1000 мг/м2/день в/в 24-часовая инфузия в 1–4-й и 29–32-й дни [28, 151];
#Митомицин** 10 мг/м2 в/в в 1-й и 29-й дни (но не более 20 мг на введение суммарно) + фторурацил** 1000 мг/м2/день в/в 24-часовая инфузия в 1–4-й и 29–32-й дни [28, 149];
#Капецитабин** 1650 мг/м2/день внутрь в дни лучевой терапии в течение всего курса лучевой терапии [28, 85].
В отдельных случаях описано применение дистанционной лучевой терапии на область регионарного метастазирования до СОД 45-50,4Гр с последующим облучением зоны операционного рубца или собственно увеличенных лимфоузлов до СОД 65-70Гр [28, 66].
5. Обезболивание
Принципы обезболивания и оптимального выбора противоболевой терапии у пациентов, страдающих РПЧ с хроническим болевым синдромом, соответствуют принципам обезболивания, изложенным в клинических рекомендации «Хронический болевой синдром у взрослых пациентов, нуждающихся в паллиативной медицинской помощи».
6. Сопроводительная терапия у пациентов с РПЧ
- Рекомендуется пациентам, получающим противоопухолевую лекарственную терапию препаратами с эметогенным побочным действием, проведение профилактики и лечения тошноты и рвоты [92, 93].
Уровень убедительности рекомендаций — А (уровень достоверности доказательств — 1).
Комментарии. Принципы диагностики, профилактики и лечения тошноты и рвоты при проведении противоопухолевой лекарственной терапии изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Владимирова Л. Ю. и соавт. Тошнота и рвота [94].
- Рекомендуется профилактика и лечение костных осложнений у пациентов с метастатическим поражением костей [95].
Уровень убедительности рекомендаций — А (уровень достоверности доказательств — 1).
Комментарии. Принципы диагностики, профилактики и лечения костных осложнений изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Багрова С. Г. и соавт. Патология костной ткани [96].
- Рекомендуется пациентам, получающим противоопухолевую лекарственную терапию, профилактика и лечение венозных тромбоэмболических осложнений [97, 98, 99].
Уровень убедительности рекомендаций — А (уровень достоверности доказательств — 1).
Комментарии. Принципы диагностики, профилактики и лечения венозных тромбоэмболических осложнений изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Сомонова О. В. и соавт. Тромбоэмболические осложнения [100]. https://rosoncoweb.ru/standarts/?chapter=thromboembolism
- Рекомендуется пациентам, получающим противоопухолевую лекарственную терапию, проведение профилактики и лечения фебрильной нейтропении и инфекционных осложнений [101, 102, 103].
Уровень убедительности рекомендаций — А (уровень достоверности доказательств — 1).
Комментарии. Детальный алгоритм диагностики, профилактики и лечения фебрильной нейтропении и инфекционных осложнений, принципы антибактериальной терапии изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Сакаева Д. Д. и соавт. Практические рекомендации по диагностике и лечению фебрильной нейтропении [104].
- Рекомендуется пациентам, получающим противоопухолевую лекарственную терапию, проведение коррекции гепатотоксичности [105, 106].
Уровень убедительности рекомендаций — C (уровень достоверности доказательств — 5).
Комментарии. Принципы диагностики, профилактики и лечения гепатотоксичности изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Ткаченко П. Е. и соавт. Гепатотоксичность [107].
- Рекомендуется профилактика и лечение кардиоваскулярных осложнений пациентам, получающим противоопухолевую лекарственную терапию [108, 109, 110, 111].
Уровень убедительности рекомендаций — А (уровень достоверности доказательств — 2).
Комментарии. Принципы диагностики, профилактики и лечения сердечно-сосудистых осложнений при проведении противоопухолевой терапии изложены в Практических Рекомендациях Российского общества по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Виценя М. В. И соавт. Кардиоваскулярная токсичность [112]. https://rosoncoweb.ru/standarts/?chapter=cardiovascular_toxicity
- Рекомендуется профилактика и лечение дерматологических реакций пациентам, получающим противоопухолевую лекарственную терапию [113].
Уровень убедительности рекомендаций — А (уровень достоверности доказательств — 1).
Комментарии. Принципы диагностики, профилактики и лечения кожных осложнений изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Королева И. А. и соавт. Дерматологические реакции [114].
- Рекомендуется нутритивная поддержка пациентам, получающим противоопухолевую лекарственную терапию, для поддержания метаболических резервов организма онкологического пациента и повышения его устойчивости к лечению (хирургическому, лекарственному, лучевому). Выбор метода нутритивной поддержки определяется различными видами нарушений питания у пациента. Может быть рекомендована установка назогастральной, назоинтестинальной, чрескожной, эндоскопической, лапароскопической, лапаротомной стомы, эндоскопическое стентирование при опухолевом стенозе, паллиативная лучевая терапия [115, 116].
Уровень убедительности рекомендаций — А (уровень достоверности доказательств — 1).
Комментарии. Принципы проведения нутритивной поддержки представлены в Практических рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Сытов А. В. и соавт. Нутритивная поддержка [117]. https://rosoncoweb.ru/standarts/?chapter=nutritional_support
- Рекомендуется профилактика и лечение нефротоксичности пациентам, получающим противоопухолевую лекарственную терапию [118, 119, 120].
Уровень убедительности рекомендаций — А (уровень достоверности доказательств — 1).
Комментарии. Детальный алгоритм диагностики, профилактики и лечения нефротоксичности представлен в Практических рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Громова Е. Г. и соавт. Нефротоксичность [121].
- Рекомендуется профилактика и лечение иммуноопосредованных нежелательных явлений пациентам, получающим противоопухолевую лекарственную терапию [122, 123, 124, 125].
Уровень убедительности рекомендаций — А (уровень достоверности доказательств — 1).
Комментарии. Детальный алгоритм диагностики, профилактики и лечения иммуноопосредованных нежелательных явлений изложен в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Проценко С. А. и соавт. Иммуноопосредованные нежелательные явления [126]. https://rosoncoweb.ru/standarts/?chapter=immunerelated_adverse_events
- Рекомендуется профилактика и лечение мукозитов пациентам, получающим противоопухолевую лекарственную терапию [127, 128].
Уровень убедительности рекомендаций — C (уровень достоверности доказательств — 5).
Комментарии. Детальный алгоритм диагностики, профилактики и лечения мукозитов изложен в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Семиглазова Т. Ю. и соавт. Мукозиты [129]. https://rosoncoweb.ru/standarts/?chapter=mucositis
- Рекомендуется пациентам, получающим противоопухолевую лекарственную терапию, лечение анемии, которая возникает как симптом злокачественного новообразования и как нежелательное явление [130, 131].
Уровень убедительности рекомендаций — А (уровень достоверности доказательств — 1).
Комментарии. Порядок и принципы профилактики и лечения анемии соответствуют принципам, изложенным в клинических рекомендациях «Анемия при злокачественных новообразованиях» (ID: КР624, год утверждения 2020, www.cr.rosminzdrav.ru) и в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Орлова Р.В. и соавт. Анемия [132].
- Рекомендуется пациентам, получающим противоопухолевую лекарственную терапию, лечение синдрома анорексии-кахексии [133].
Уровень убедительности рекомендаций — C (уровень достоверности доказательств — 3).
Комментарии. Детальный алгоритм диагностики и лечения синдрома анорексии-кахексии изложен в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Сытов А. В. и соавт. Практические рекомендации по лечению синдрома анорексии-кахексии у онкологических больных [134].
- Рекомендуется использование центрального венозного доступа и инфузионных помп пациентам, получающим противоопухолевую лекарственную терапию при неудовлетворительном состоянии периферических вен рекомендуется [135].
Уровень убедительности рекомендаций — B (уровень достоверности доказательств — 2).
Комментарии. Выбор варианта центрального доступа определяется запланированной длительностью всего курса лечения, предпочтениями пациента, анатомическими особенностями. При длительных (свыше 3 месяцев) курсах терапии наиболее удобным является имплантация подкожной венозной порт-системы. При меньших сроках альтернативой может служить периферически имплантируемый центральный венозный катетер. Принципы использования центрального венозного доступа изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Исянгулова А. З. и соавт. Центральный венозный доступ [136]. https://rosoncoweb.ru/standarts/?chapter=central_venous_access
- Рекомендуется профилактика и лечение экстравазатов противоопухолевых препаратов пациентам, получающим противоопухолевую терапию. При планировании противоопухолевой лекарственной терапии важен выбор сосудистого доступа для профилактики экстравазации противоопухолевых препаратов [137].
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 3).
Комментарии. Алгоритмы выбора сосудистого доступа, профилактики, диагностики и лечения эксравазации изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Буйденок Ю.В. и соавт. Экстравазация противоопухолевых препаратов [138]. https://rosoncoweb.ru/standarts/?chapter=extravasation_antitumor_drugs
- Рекомендуется лечение хронического болевого синдрома пациентам, получающим противоопухолевую терапию [139].
Уровень убедительности рекомендаций — А (уровень достоверности доказательств — 1).
Комментарии. Алгоритмы диагностики и лечения хронического болевого синдрома у онкологических больных изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Когония Л.М. и соавт. Хронический болевой синдром [140]. https://rosoncoweb.ru/standarts/?chapter=chronic_pain_syndrome
- Рекомендуется профилактика и лечение инфузионных реакций пациентам, получающим противоопухолевую терапию [141].
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 3).
Комментарии. Алгоритмы профилактики, диагностики и лечения инфузионных реакций изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Орлова Р.В. и соавт. Инфузионные реакции [142]. https://rosoncoweb.ru/standarts/?chapter=infusion_reactions
- Рекомендуется мониторинг и лечение реактивации/обострения хронических вирусных гепатитов пациентам, получающим противоопухолевую терапию [143].
Уровень убедительности рекомендаций — В (уровень достоверности доказательств — 3).
Комментарии. Принципы мониторинга и лечебной тактики у онкологических пациентов с хроническим вирусным гепатитом изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Феоктистова П.С. и соавт. Хронические вирусные гепатиты [144]. https://rosoncoweb.ru/standarts/?chapter=chronic_viral_hepatitis
- Рекомендуется пациентам, получающим противоопухолевую терапию, профилактика и лечение неврологических осложнений [145].
Уровень убедительности рекомендаций — В (уровень достоверности доказательств — 2).
Комментарии. Принципы диагностики, профилактики и лечения неврологических осложнений противоопухолевой терапии изложены в Практических Рекомендациях Российского общества клинической онкологии по профилактике и лечению осложнений злокачественных опухолей и противоопухолевой лекарственной терапии: Латипова Д.Х. и соавт. Неврологические осложнения [146].
7. Диетотерапия
До настоящего времени не получены сколько-нибудь надежные сведения о влиянии пищевого поведения на риск заболеть РПЧ, в связи с чем нецелесообразны какие-либо изменения в привычном рационе пациентов, если только они не продиктованы необходимостью коррекции коморбидных состояний либо купирования или профилактики осложнений проводимого лечения (хирургическое, лекарственное или лучевое)
Медицинская реабилитация
Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
В настоящее время для большинства видов медицинской реабилитации отсутствуют клинические исследования с участием пациентов с РПЧ. Данные рекомендации сделаны на основании того, что во многих исследованиях, в том числе метаанализах и систематических доказано, что различные виды медицинской реабилитации значительно ускоряют функциональное восстановление, сокращают сроки пребывания в стационаре после операции и снижают частоту развития осложнений и летальных исходов у пациентов с другими злокачественными новообразованиями.
Необходимо проводить реабилитацию, ориентируясь на общие принципы реабилитации пациентов после проведенных хирургических вмешательств и/или химиотерапии.
1. Предреабилитация
- Рекомендуется проведение предреабилитации всем пациентам с РПЧ. Предреабилитация включает физическую подготовку (ЛФК), психологическую (нейропсихологическая реабилитация) и нутритивную поддержку, информирование пациентов. Предреабилитация значительно ускоряет функциональное восстановление, сокращает сроки пребывания в стационаре после операции и снижает частоту развития осложнений и летальных исходов на фоне лечения онкологических заболеваний [67, 68].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: Психологическая поддержка в плане предреабилитации улучшает настроение, снижает уровень тревоги и депрессии. Пациенты, прошедшие курс психологической предреабилитации, лучше адаптируются к повседневной жизни после хирургического лечения.
2. Реабилитации при хирургическом лечении
Первый этап реабилитации при хирургическом лечении
- Рекомендуется мультидисциплинарный подход к обезболиванию болевого синдрома у пациентов в послеоперационном периоде с возможным включением таких подходов, как физическая реабилитация (ЛФК), лечение положением, клинико-психологических методов коррекции боли (релаксации), чрескожной электронейростимуляции [69, 70].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии. При наличии показаний необходимо сочетать лечение положением, ЛФК, криотерапию на область операции, медицинский массаж, электротерапию с целью обезболивания.
Второй этап реабилитации
- Рекомендуется пациентам при возникновении лимфедемы проводить полную противоотечную терапию, включающую мануальный лимфодренаж (массаж нижней конечности), ношение компрессионного трикотажа, выполнение комплекса ЛФК, уход за кожей [71].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств –5).
- Рекомендуется для профилактики лимфостаза нижних конечностей после операции Дюкена проведение следующих мероприятий [71]:
- контроль веса, профилактика ожирения;
- профилактика рожистого воспаления, уход за кожными покровами
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: при возникновении лимфостаза необходимо обратить внимание на необходимость снижения веса.
Третий этап реабилитации
- Рекомендуется всем пациентам после хирургического лечения выполнение и постепенное расширение комплекса ЛФК с включением аэробной нагрузки, что улучшает результаты комбинированного лечения злокачественных новообразований и качество жизни [72].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3).
Комментарии: Рекомендуется сочетание аэробной и силовой нагрузки.
- Рекомендуется всем пациентам после хирургического лечения (при отсутствии противопоказаний) медицинский массаж для улучшения качества жизни, уменьшения болевого синдрома, слабости [73].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 2).
3. Реабилитация при химиотерапии
- Рекомендуется всем пациентам, получающим химиотерапевтическое лечение, раннее начало физических нагрузок, что помогает профилактике мышечной слабости, гипотрофии, снижения толерантности к физической нагрузке [74, 75].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3).
Комментарии: применение аэробной нагрузки на фоне химиотерапии повышает уровень гемоглобина, эритроцитов и снижает длительность лейкопении и тромбоцитопении [75].
- Рекомендуется всем пациентам, получающим химиотерапевтическое лечение, проведение ЛФК, что позволяет уменьшать слабость и депрессию. Сочетание ЛФК с психологической поддержкой (нейропсихологическая реабилитация) в лечении слабости и депрессии на фоне химиотерапии более эффективно, чем только медикаментозная коррекция [74, 76].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1).
Комментарии: индивидуально подбирается объем и интенсивность ЛФК на фоне химиотерапии исходя из степени слабости (легкая, средняя, тяжелая), и увеличивается интенсивность ЛФК при улучшении общего состояния.
- Рекомендуется всем пациентам, получающим химиотерапевтическое лечение, при возникновении периферической полинейропатии на фоне химиотерапии назначать 6-недельный курс терренного лечения (лечение ходьбой), который помогает контролировать клинические проявления полинейропатии [77].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств –2).
- Рекомендуется пациентам, получающим химиотерапевтическое лечение, при возникновении периферической полинейропатии на фоне химиотерапии применение низкоинтенсивной лазеротерапии для ее лечения [78].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
- Рекомендуется пациентам, получающим химиотерапевтическое лечение, при возникновении периферической полинейропатии на фоне химиотерапии низкочастотная магнитотерапия для ее лечения [79].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 2).
- Рекомендуется пациентам, получающим химиотерапевтическое лечение, при возникновении полинейропатии на фоне химиотерапии чрескожная электронейростимуляция в течение 20 мин. в день 4 нед. для ее лечения [80].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
- Рекомендуется пациентам, получающим химиотерапевтическое лечение, низкоинтенсивная лазеротерапия в профилактике мукозитов полости рта на фоне химиотерапии [81].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3).
- Рекомендуется пациентам, получающим химиотерапевтическое лечение, проводить комплекс ЛФК, что снижает частоту развития кардиальных осложнений на фоне химиотерапии [82].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
- Рекомендуется при проведении химиотерапии использование систем охлаждения кожи головы, что обеспечивает профилактику алопеции на фоне химиотерапии [83].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
Госпитализация
Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 г. № 323-ФЗ (ред. от 25.05.2019 г.) «Об основах охраны здоровья граждан в Российской Федерации», организуется и оказывается:
- в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
- в соответствии с порядком оказания помощи по профилю «онкология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
- на основе настоящих клинических рекомендаций;
- с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При подозрении или выявлении у пациента рака полового члена врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам со злокачественными новообразованиями полового члена.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации рака полового члена, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При подозрении и (или) выявлении у пациента РПЧ в ходе оказания ему скорой медицинской помощи таких пациентов переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, не должен превышать 14 календарных дней с даты гистологической верификации ЗНО или 14 календарных дней с даты установления предварительного диагноза ЗНО (в случае отсутствия медицинских показаний для проведения патологоанатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациентам с онкологическими заболеваниями, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает в себя профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется в форме протокола, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания для госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную медицинскую помощь по профилю «онкология», определяются консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов.
Показаниями для госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
- наличие осложнений РПЧ, требующих оказания ему специализированной медицинской помощи в экстренной и неотложной форме;
- наличие осложнений лечения (хирургическое вмешательство, лучевая терапия, лекарственная терапия и т.д.) РПЧ.
Показаниями для госпитализации в медицинскую организацию в плановой форме являются:
- необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
- наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, лучевая терапия, в том числе контактная, дистанционная и другие виды лучевой терапии, лекарственная терапия и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациента из медицинской организации являются:
- завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи, в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
- отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
- необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
Критерии оценки качества медицинской помощи приведены в табл. 4.
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- Рекомендуется всем пациентам после первичного лечения наблюдаться у врача-онколога (проводить физикальное обследование, сбор жалоб и анамнеза, инструментальные диагностические исследования) от 1 до 4 раз в год, в зависимости от конкретной клинической ситуации, в течение первых 5 лет, далее — ежегодно. Основной целью наблюдения является максимально ранее выявление местных рецидивов и прогрессирования РПЧ, так как это обеспечивает возможность эффективного лечения [84].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: алгоритм обследования определяется лечащим врачом в зависимости от клинической ситуации.
Информация
Источники и литература
-
Клинические рекомендации Ассоциации онкологов России
- Клинические рекомендации Ассоциации онкологов России - 1. Brosman S. Penile Cancer Workup.// https://emedicine.medscape.com/article/446554-workup#c4. 2. Hakenberg O.W., Compérat E., Minhas S. et al. Guidelines on Penile Cancer. EAU 2017:20-21. 3. Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2015 году (заболеваемость и смертность). М.: МНИОИ им. П.А. Герцена (филиал ФГБУ «НМИРЦ» Минздрава России), 2017. 4. WHO Classification of Tumours of the Urinary System and Male Genital Organs. (ed. H Moch et al). IARC, Lyon, 2016. 5. Cubilla A.L., Reuter V., Velazquez E. et al. Histologic classification of penile carcinoma and its relation to outcome in 61 patients with primary resection. International Journal of Surgical Pathology. 2001;9(2):111-120. 6. Brierley J.D., Gospodorawicz M.K., Wittekind C. TNM Classification of Malignant Tumours, 8th еd. International Union Against Cancer, Wiley-Blackwell, 2016:188-9. 7. Халафьян Э.А. Органосохраняющее лечение больных раком полового члена. Дисс. канд. мед. наук. М. 2003. 8. Falanga A., Marchetti M., Vignoli A. Coagulation and cancer: biological and clinical aspects //Journal of Thrombosis and Haemostasis. – 2013. – Т. 11. – №. 2. – С. 223-233. 9. Loreto M. F. et al. Coagulation and cancer: implications for diagnosis and management //Pathology & Oncology Research. – 2000. – Т. 6. – №. 4. – С. 301-312. 10. Kvolik S. et al. An overview of coagulation disorders in cancer patients //Surgical oncology. – 2010. – Т. 19. – №. 1. – С. e33-e46. 11. JEFF A. SIMERVILLE, M.D., WILLIAM C. MAXTED, M.D., and JOHN J. PAHIRA, M.D.,Urinalysis: A Comprehensive Review Am Fam Physician. 2005 Mar 15;71(6):1153-1162. 12. Правосудова Н. А. и др. Особенности послеоперационных осложнений в отделении онкоурологии и онкогинекологии //Медицинский альманах. – 2016. – №. 3 (43). 13. В.М. Гельфанд Инфекционные осложнения у онкологических больных// Практическая онкология. – 2009. – Т. 10. - № 3. – стр. 141-146. 14. Lont A.P., Besnard A.P., Gallee M.P. et al. A comparison of physical examination and imaging in determining the extent of primary penile carcinoma. BJU International. 2003;91(6):493-5. 15. Kayes O., Minhas S., Allen C. et al. The role of magnetic resonance imaging in the local staging of penile cancer. European Urology. 2007;51:1313-8. 16. Lucchesi F.R., Reis R.B., Faria E.F. et al. Incremental value of MRI for preoperative penile cancer staging. Journal of Magnetic Resonance Imaging. 2017;45(1):118-124. 17. Andipa E., Liberopoulos K., Asvestis C. Magnetic resonance imaging and ultrasound evaluation of penile and testicular masses. World Journal of Urology. 2004;22(5):382-391. 18. Van Poppel H., N. A. Watkin, S. Osanto, L. Moonen, A. Horwich, V. Kataja Penile Carcinoma: ESMO Clinical Practice Guidelines Ann Oncol 2013; 24 (Suppl 6): vi115-vi124 19. Kroon BK et al: Ultrasonography-guided fine-needle aspiration cytology before sentinel node biopsy in patients with penile carcinoma. BJU Int 2005; 95:517. http://www.ncbi.nlm.nih.gov/pubmed/15705071 20. Saisorn I et al: Fine-needle aspiration cytology predicts inguinal lymph node metastasis without antibiotic pretreatment in penile carcinoma. BJU Int 2006; 97:1225. http://www.ncbi.nlm.nih.gov/pubmed/16686716 21. Ornellas A.A., Seixas A.L., Marota A. et al. Surgical treatment of invasive squamous Cell carcinoma of the penis: retrospective analysis of 350 cases. Journal Urology. 1994;151(5):1244-1249. 22. Baumgarten A., Chipollini J., Yan S. et al. Penile Sparing Surgery for Penile Cancer: A Multicenter International Retrospective Cohort. Journal Urology. 2018;199(5):1233-1237. 23. Kamel M.H., Bissada N., Warford R. et al. Organ Sparing Surgery for Penile Cancer: A Systematic Review. Journal Urology. 2017;198(4):770-779. 24. Gonzaga-Silva L.F., Lima G.R.M., Tavares J.M. et al. Locally advanced penile carcinoma: classic emasculation or testis-sparing surgery? International Brazilian Journal of Urology. 2012;38(6):750-759. 25. Peters P.C. Penis, urethra, trauma and fistulas. Journal Urology. 1989;142(6):1654-1658. 26. Minhas S., Kayes O., Hegarty P. et al. What surgical resection margins are required to achieve oncological control in men with primary penile cancer? BJU International. 2005;96(7):1040–1043 27. Korzeniowski Martin Arthur, Juanita Mary Crook Contemporary role of radiotherapy in the management of penile cancer Transl Androl Urol. 2017 Oct; 6(5): 855–867. 28. NCCN guidelines version 2.2019 Penile Cancer 29. Meijer R.P., Boon T.A., van Venrooij G.E., Wijburg C.J. Long-term follow-up after laser therapy for penile carcinoma. Urology. 2007;69(4):759-62. 30. Bandieramonte G., Colecchia M., Mariani L. et al. Peniscopically controlled CO2 laser excision for conservative treatment of in situ and T1 penile carcinoma: report on 224 patients. European Urology. 2008;54(4):875-82. 31. Deen K., Burdon-Jones D. Imiquimod in the treatment of penile intraepithelial neoplasia: An update. Australas J Dermatol. 2017;58(2):86-92. 32. Hu X., Huang J., Wen S. et al. Comparison of efficacy between brachytherapy and penectomy in patients with penile cancer: a meta-analysis. Oncotarget. 2017;8(59):100469-100477. 33. Azrif M., Logue J.P., Swindell R. et al. External-beam radiotherapy in T1-2 N0 penile carcinoma. Clinical Oncology (The Royal College of Radiologists). 2006;18(4):320-5. 34. Makarewicz Roman, Andrzej Lebioda, Joanna Terlikiewicz Interstitial brachytherapy for penile cancer: the experience of Oncology Centre in Bydgoszcz. J Contemp Brachytherapy. 2010 Dec; 2(4): 157–159. 35. Pagliaro L.C., Crook J. Multimodality therapy in penile cancer: when and which treatments? World Journal of Urology. 2009;27(2):221–225. 36. Crook J., Ma C., Grimard L. Radiation therapy in the management of the primary penile tumor: an update. World Journal of Urology. 2009;27(2):189-96. 37. Montana G.S., Thomas G.M., Moore D.H. et al. Preoperative chemo-radiation for carcinoma of the vulva with N2/N3 nodes: a gynecologic oncology group study. International Journal of Radiation Oncology, Biology, Physics. 2000;48(4):1007-13. 38. Ajani J.A., Winter K.A., Gunderson L.L. et al. Fluorouracil, mitomycin, and radiotherapy vs fluorouracil, cisplatin, and radiotherapy for carcinoma of the anal canal: a randomized controlled trial. JAMA. 2008;299(16):1914-21. 39. Solsona E., Iborra I., Rubio J. et al. Prospective validation of the association of local tumor stage and grade as a predictive factor for occult lymph node micrometastasis in patients with penile carcinoma and clinically negative inguinal lymph nodes. Journal of Urology. 2001;165(5):1506-9. 40. Theodorescu D., Russo P., Zhang Z.F. et al. Outcomes of initial surveillance of invasive squamous cell carcinoma of the penis and negative nodes. Journal of Urology. 1996;155(5):1626-31. 41. Leijte J.A., Kroon B.K., Valdés Olmos R.A. et al. Reliability and safety of current dynamic sentinel node biopsy for penile carcinoma. European Urology. 2007;52(1):170-7. 42. Ficarra V., Galfano A. Should the dynamic sentinel node biopsy (DSNB) be considered the gold standard in the evaluation of lymph node status in patients with penile carcinoma? European Urology. 2007;52(1):17-9. 43. Spiess P.E., Hernandez M.S., Pettaway C.A. Contemporary inguinal lymph node dissection: minimizing complications. World Journal of Urology. 2009;27(2):205-12. 44. Protzel C., Alcaraz A., Horenblas S. et al. Lymphadenectomy in the surgical management of penile cancer. European Urology. 2009;55(5):1075-88. 45. Lopes A., Rossi B.M., Fonseca F.P., Morini S. Unreliability of modified inguinal lymphadenectomy for clinical staging of penile carcinoma. Cancer. 1996;77(10):2099-102. 46. Pizzocaro G., Piva L., Bandieramonte G., Tana S. Up-to-date management of carcinoma of the penis. European Urology. 1997;32(1):5-15. 47. Zargar-Shoshtari K., Djajadiningrat R., Sharma P. et al. Establishing Criteria for Bilateral Pelvic Lymph Node Dissection in the Management of Penile Cancer: Lessons Learned from an International Multicenter Collaboration. Journal of Urology. 2015;194(3):696-701. 48. Pedrick T.J., Wheeler W., Riemenschneider H. Combined modality therapy for locally advanced penile squamous cell carcinoma. American Journal of Clinical Oncology. 1993;16(6):501-5. 49. Eliason M., Bowen G., Bowen A. et al. Primary treatment of verrucous carcinoma of the penis with fluorouracil, cis-diamino-dichloro-platinum, and radiation therapy. Arch Dermatol. 2009;145(8):950-2. 50. Chhabra A., Schwartz D., Leaf A., et al. Neoadjuvant concurrent chemoradiation for curative treatment of penile squamous cell carcinoma. Case Rep Oncol Med. 2014;2014:479376. 51. Sharma P., Djajadiningrat R., Zargar-Shoshtari K. et al. Adjuvant chemotherapy is associated with improved overall survival in pelvic node-positive penile cancer after lymph node dissection: a multi-institutional study. Urology Oncology. 2015;33(11):496.e17-23. 52. Bermejo C., Busby J.E., Spiess P.E. et al. Neoadjuvant chemotherapy followed by aggressive surgical consolidation for metastatic penile squamous cell carcinoma. Journal of Urology. 2007;177(4):1335-8. 53. Pagliaro L.C., Williams D.L., Daliani D. et al. Neoadjuvant paclitaxel, ifosfamide, and cisplatin chemotherapy for metastatic penile cancer: a phase II study. Journal of Clinical Oncology. 2010;28(24):3851-7. 54. Lughezzani G., Catanzaro M, Torelli T. et al. The relationship between characteristics of inguinal lymph nodes and pelvic lymph node involvement in penile squamous cell carcinoma: a single institution experience. Journal of Urology. 2014;191(4):977-82. 55. Lont A.P., Kroon B.K., Gallee M.P. et al. Pelvic lymph node dissection for penile carcinoma: extent of inguinal lymph node involvement as an indicator for pelvic lymph node involvement and survival. Journal of Urology. 2007;177(3):947-52. 56. Di Lorenzo G., Buonerba C., Federico P. et al. Cisplatin and 5-fluorouracil in inoperable, stage IV squamous cell carcinoma of the penis. BJU International. 2012;110(11 Pt B):E661-6. 57. Haas G.P., Blumenstein B.A., Gagliano R.G. et al. Cisplatin, methotrexate and bleomycin for the treatment of carcinoma of the penis: a Southwest Oncology Group study. Journal of Urology. 1999;161(6):1823-5. 58. Di Lorenzo G., Federico P., Buonerba C. et al. Paclitaxel in pretreated metastatic penile cancer. final results of a phase 2 study. European Urology. 2011;60:1280-1284. 59. Wu J., Cheng K., Yuan L. et al. Recurrent Penile Squamous Cell Carcinoma Successfully Treated With Cetuximab, Chemotherapy, and Radiotherapy. Clinical Genitourinary Cancer. 2016 Feb;14(1):e135-7. 60. Luo W.X., He J.P., Li X., Liu J.Y. Neoadjuvant chemotherapy with cetuximab for locally advanced penile cancer. J Cancer Res Ther. 2015;11(4):1041. 61. Sitompul A. P., Prapiska F. F., Warli S. M. Evaluation of Paclitaxel, Ifosfamide, and Cisplatin (TIP) Regimen on Penile Cancer in Adam Malik Medan: A Single Center 2 Years of Experience //Open access Macedonian journal of medical sciences. – 2019. – Т. 7. – №. 7. – С. 1148. 62. Joerger M., Warzinek T., Klaeser B. et al. Major tumor regression after paclitaxel and carboplatin polychemotherapy in a patient with advanced penile cancer. Urology. 2004;63(4):778-80. 63. Carthon B. C. et al. Epidermal growth factor receptor‐targeted therapy in locally advanced or metastatic squamous cell carcinoma of the penis //BJU international. – 2014. – Т. 113. – №. 6. – С. 871-877. 64. Winters B.R., Kearns J.T., Holt S.K. et al. Is there a benefit to adjuvant radiation in stage III penile cancer after lymph node dissection? Findings from the National Cancer Database. Urology Oncology. 2018;36(3):92.e11-92.e16. 65. Robinson R., Marconi L., MacPepple E. et al. Risks and Benefits of Adjuvant Radiotherapy After Inguinal Lymphadenectomy in Node-positive Penile Cancer: A Systematic Review by the European Association of Urology Penile Cancer Guidelines Panel. European Urology. 2018;74(1):76-83. 66. Pond G.R., Milowsky M.I., Kolinsky M.P. et al. Concurrent chemoradiotherapy for men with locally advanced penile squamous cell carcinoma. Clinical Genitourinary Cancer. 2014;12(6):440-6. 67. Silver JK, Baima J: Cancer prehabilitation: an opportunity to decrease treatment-related morbidity, increase cancer treatment options, and improve physical and psychological health outcomes. Am J Phys Med Rehabil 2013, 92(8):715-727. 68. Tsimopoulou I, Pasquali S, Howard R, Desai A, Gourevitch D, Tolosa I, Vohra R: Psychological Prehabilitation Before Cancer Surgery: A Systematic Review. Ann Surg Oncol 2015 Dec; 22(13):4117-23. doi: 10.1245/s10434-015-4550-z. Epub 2015 Apr 14. 69. Swarm R, Abernethy AP, Anghelescu DL et al. NCCN Adult Cancer Pain. Adult cancer pain. J Natl Compr Canc Netw. 2010;8:1046-1086. 70. Fallon M, Giusti R, Aielli F, Hoskin P, Rolke R, Sharma M, Ripamonti CI, Committee EG: Management of cancer pain in adult patients: ESMO Clinical Practice Guidelines. Ann Oncol 2018;29(Suppl 4):iv166-iv191. 71. Committee. NMA: Topic: The Diagnosis and Treatment of Lymphedema. Position Statement of the National Lymphedema Network. In., 2011. Р. 1-19. 72. Segal R, Zwaal C, Green E, Tomasone JR, Loblaw A, Petrella T: Exercise for People with Cancer Guideline Development G: Exercise for people with cancer: a systematic review. Curr Oncol 2017; 24(4):e290-e315. 73. Boyd C, Crawford C, Paat CF, Price A, Xenakis L, Zhang W: Evidence for Massage Therapy Working G: The Impact of Massage Therapy on Function in Pain Populations-A Systematic Review and Meta-Analysis of Randomized Controlled Trials: Part II, Cancer Pain Populations. Pain Med 2016; 17(8):1553-1568. 74. Stout NL, Baima J, Swisher AK, Winters-Stone KM, Welsh J: A Systematic Review of Exercise Systematic Reviews in the Cancer Literature (2005–2017). PM R 2017, 9(9S2):S347-S384. 75. Hu M, Lin W: Effects of exercise training on red blood cell production: implications for anemia. Acta Haematol 2012; 127(3):156-164. 76. Mustian KM, Alfano CM, Heckler C, Kleckner AS, Kleckner IR, Leach CR, Mohr D, Palesh OG, Peppone LJ, Piper BF et al: Comparison of Pharmaceutical, Psychological, and Exercise Treatments for Cancer-Related Fatigue: A Meta-analysis. JAMA Oncol 2017; 3(7):961-968. 77. Kleckner IR, Kamen C, Gewandter JS, Mohile NA, Heckler CE, Culakova E, Fung C, Janelsins MC, Asare M, Lin PJ et al: Effects of exercise during chemotherapy on chemotherapy-induced peripheral neuropathy: a multicenter, randomized controlled trial. Support Care Cancer 2018; 26(4):1019-1028. 78. Lee JM, Look RM, Turner C, Gardiner SK, Wagie T, Douglas J, Sorenson L, Evans L, Kirchner S, Dashkoff C et al: Low-level laser therapy for chemotherapy-induced peripheral neuropathy. Journal of Clinical Oncology 2012; 30(15_suppl):9019-9019. 79. Rick O, von Hehn U, Mikus E, Dertinger H, Geiger G: Magnetic field therapy in patients with cytostatics-induced polyneuropathy: A prospective randomized placebo-controlled phase-III study. Bioelectromagnetics 2017; 38(2):85-94.
Информация
Список сокращений
в/в – внутривенный
ЗНО – злокачественное новообразование
РПЧ – рак полового члена
ВОЗ – Всемирная организация здравоохранения
ВПЧ – вирус папилломы человека
ТЛАЭ – тазовая лимфодиссекция
КТ – компьютерная томография
ЛФК- лечебная физкультура
МКБ-10 – Международная классификация болезней 10-го пересмотра
МРТ – магнитно-резонансная томография
УЗИ-ультразвуковое исследование
** – жизненно необходимые и важнейшие лекарственные препараты
# – препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл)
Термины и определения
Второй этап реабилитации – реабилитация в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации), в ранний восстановительный период течения заболевания, поздний реабилитационный период, период остаточных явлений течения заболевания.
Операция Дюкена – пахово-бедренная лимфодиссекция.
Первый этап реабилитации – реабилитация в период специализированного лечения основного заболевания (включая хирургическое лечение/химиотерапию/лучевую терапию) в отделениях медицинских организаций по профилю основного заболевания.
Предреабилитация – реабилитация с момента постановки диагноза до начала лечения (хирургического лечения/химиотерапии/лучевой терапии).
Третий этап реабилитации – реабилитация в ранний и поздний реабилитационный периоды, период остаточных явлений течения заболевания в отделениях (кабинетах) реабилитации, физиотерапии, лечебной физкультуры, рефлексотерапии, мануальной терапии, психотерапии, медицинской психологии, кабинетах логопеда (учителя-дефектолога), оказывающих медицинскую помощь в амбулаторных условиях, дневных стационарах, а также выездными бригадами на дому (в том числе в условиях санаторно-курортных организаций).
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Наиболее значимыми факторами прогноза выживаемости при РПЧ являются категория N, количество и локализация пораженных лимфоузлов, а также опухолевая пенетрация капсулы лимфоузлов. Среди пациентов с категорией N0 5 лет переживает 53–100 %, N1–2 – 27 %, N3 – 0–38,4 %. Пятилетняя выживаемость пациентов с поражением 1 лимфоузла составляет 50 %, 2 и более – 7 %. В большинстве наблюдений опухоль прогрессирует медленно. Основными причинами смерти являются местные осложнения опухолевого процесса (инфекция, кровотечение) [21].
Критерии оценки качества медицинской помощи
|
№ п/п
|
Критерии качества
|
Уровень достоверности доказательств
|
Уровень убедительности рекомендаций
|
|---|---|---|---|
|
1
|
Выполнена патолого-анатомическая (морфологическая) верификация диагноза до начала лечения
|
1
|
A
|
|
2
|
Выполнено клинико-лабораторное обследование (для оценки степени распространения болезни) до начала лечения
|
1
|
A
|
|
3
|
Установлена стадия заболевания в соответствии с действующими классификациями TNM и ВОЗ
|
1
|
A
|
|
4
|
Выполнено патолого-анатомическое (гистологическое) исследование удаленной опухоли, включая оценку состояния краев резекции при выполнении органосохраняющего лечения и степени лекарственного патоморфоза в случае проведения неоадъювантной лекарственной терапии
|
1
|
A
|
|
5
|
Проведена оценка гематологической и негематологической токсичности в процессе лекарственной терапии
|
1
|
A
|
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
-
Каприн А.Д., академик РАН, д.м.н., профессор, заслуженный врач РФ, Генеральный директор ФГБУ «Национальный медицинский исследовательский центр радиологии», заведующий кафедрой урологии и оперативной нефрологии с курсом онкоурологии Медицинского института ФГАОУ ВО «Российский университет дружбы народов имени Патриса Лумумбы».
-
Матвеев В.Б., член-корреспондент РАН, профессор, д.м.н., заместитель директора по научной и инновационной работе и заведующий урологическим отделением ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России, Президент Российского общества онкоурологов.
-
Алексеев Б.Я., д.м.н., профессор, заместитель директора по науке ФГБУ «Национальный медицинский исследовательский центр радиологии» Минздрава России.
-
Волкова М.И., д.м.н., доцент, Онкологический центр №1 ГБУЗ «ГКБ им. С.С. Юдина ДЗМ», профессор кафедры онкологии и паллиативной медицины ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования" Минздрава России.
-
Пушкарь Д.Ю., член-корреспондент РАН, д.м.н., профессор, зав. кафедрой урологии ФГБОУ ВО «Российский университет медицины» Минздрава России (Москва, Россия), главный уролог МЗ РФ, Российское общество урологов.
-
Говоров А.В., д.м.н., профессор кафедры урологии ФГБОУ ВО «Российский университет медицины» Минздрава России, Российское общество урологов.
-
Киричек А.А., ассистент кафедры хирургических болезней с курсом онкологии АНО ДПО «Московский медико-социальный институт им. Ф.П. Гааза», врач-онколог МГОБ № 62 (Москва, Россия), Российское общество онкоурологов.
-
Горбань Н.А., к.м.н., начальник центра патоморфологии и молекулярно-генетической диагностики ФГБУ «ЦКБ с поликлиникой» Управления делами Президента Российской Федерации, Российское общество онкопатологов.
-
Халмурзаев О.А., к.м.н., научный сотрудник урологического отделения ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
-
Костин А.А., заместитель генерального директора по науке ФГБУ «НМИЦ радиологии» Минздрава России.
-
Хмелевский Е.В., заведующий отделом лучевой терапии МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России.
-
Феденко А.А., заведующий отделом лекарственного лечения опухолей МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России.
-
Болотина Л.В. заведующий отделением химиотерапии Отдела лекарственного лечения опухолей МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России.
-
Фалалеева Н.А., заведующий отделом лекарственного лечения злокачественных новообразований МРНЦ им. А.Ф. Цыба - филиал ФГБУ «НМИЦ радиологии» Минздрава России.
-
Филоненко Е.В., заведующий Центром лазерной и фотодинамической диагностики и терапии опухолей МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Блок по сопроводительной терапии:
-
Багрова Светлана Геннадьевна, к.м.н., научный сотрудник отделения химиотерапии №1 отдела лекарственного лечения ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России
-
Буйденок Юрий Владимирович, д.м.н., профессор, ведущий научный сотрудник отделения интервенционной радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России
-
Виценя Марина Вячеславовна, к.м.н., старший научный сотрудник, кардиолог ФГБУ «Национальный медицинский исследовательский центр кардиологии» Минздрава России
-
Владимирова Любовь Юрьевна, д.м.н., профессор, заведующая отделением противоопухолевой лекарственной терапии ФГБУ «НМИЦ онкологии» Минздрава России
-
Громова Елена Георгиевна, д.м.н., врач-анестезиолог-реаниматолог отделения реанимации и интенсивной терапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России
-
Исянгулова Алина Зульфатовна, к.м.н., врач-онколог поликлинического отделения ГАУЗ «Республиканский клинический онкологический диспансер им. профессора М.З. Сигала Министерства здравоохранения Республики Татарстан»
-
Карасева Вера Витальевна, д.м.н., профессор кафедры онкологии факультета усовершенствования врачей ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России
-
Когония Лали Михайловна, д.м.н., профессор кафедры онкологии ГБУЗ МО МОНИКИ им. М.Ф. Владимирского
-
Королева Ирина Альбертовна, д.м.н., профессор кафедры клинической медицины последипломного образования Медицинского университета «Реавиз»
-
Латипова Дилором Хамидовна, к.м.н., врач-онколог отделения противоопухолевой лекарственной терапии, старший научный сотрудник научного отдела инновационных методов терапевтической онкологии и реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, доцент кафедры онкологии ФБГОУ «СПбГПМУ» Минздрава РФ
-
Орлова Рашида Вахидовна, д.м.н., профессор, заведующая кафедрой онкологии медицинского факультета ФГБОУВО «Санкт-Петербургский государственный университет», главный специалист по клинической онкологии СПб ГБУЗ «Городской клинический онкологический диспансер»
-
Проценко Светлана Анатольевна, д.м.н., заведующая отделением химиотерапии и инновационных технологий ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России
-
Сакаева Дина Дамировна, д.м.н., профессор, заместитель главного врача по онкологии КГ «Мать и Дитя»
-
Семиглазова Татьяна Юрьевна, д.м.н., профессор, заведующая научным отделом инновационных методов терапевтической онкологии и реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, профессор кафедры ГБОУ ВО «СЗГМУ им. И.И. Мечникова» Минздрава России
-
Сомонова Оксана Васильевна, д.м.н., ведущий научный сотрудник НИИ КО ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, профессор кафедры клинической биохимии и лабораторной диагностики ФГБОУ ВО «МГМСУ им. А.И. Евдокимова» Минздрава России
-
Стенина Марина Борисовна, д.м.н., ведущий научный сотрудник отделения клинической фармакологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России
-
Сытов Александр Викторович, к.м.н., заведующий отделением-врач-анестезиолог-реаниматолог отделения реанимации и интенсивной терапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава
-
Ткаченко Петр Евгеньевич, к.м.н., врач-терапевт, гастроэнтеролог-гепатолог отделения гепатологии, клиника пропедевтики внутренних болезней, гастроэнтерологии и гепатологии им. В.Х. Василенко, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава
-
Трякин Алексей Александрович, д.м.н., заместитель директора по научной работе, заведующий онкологическим отделением лекарственных методов лечения (химиотерапевтическое) №2 НИИ клинической онкологии им. акад. РАН и РАМН Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России
-
Феоктистова Полина Сергеевна, к.м.н., заведующая отделением химиотерапии ГБУЗ Московский клинический научный центр им. А.С. Логинова ДЗМ
Блок по организации медицинской помощи:
-
Невольских А.А., д.м.н., заместитель директора по лечебной МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
-
Иванов С.А., профессор РАН, д.м.н., директор МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
-
Хайлова Ж.В., к.м.н., заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
-
Геворкян Т.Г., заместитель директора НИИ КЭР ФГБУ «НМИЦ онкологии им. Н.Н. Блохина».
Конфликта интересов нет.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
-
врачи–онкологи;
-
врачи-урологи;
-
врачи-радиологи;
-
врачи-радиотерапевты;
-
врачи-хирурги;
-
врачи-анестезиологи-реаниматологи;
-
врачи-терапевты;
-
врачи общей врачебной практики (семейной медицины);
-
врачи-неврологи;
-
врачи-генетики;
-
врачи-патологоанатомы
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных; анализ современных научных разработок по проблеме РПЧ в России и за рубежом; обобщение практического опыта российских и зарубежных специалистов.
Таблица 1. Шкала оценки уровней достоверности доказательств для методов диагностики (диагностических вмешательств)
|
Уровень достоверности доказательств
|
Расшифровка
|
|---|---|
|
1
|
Систематические обзоры исследований с контролем референтным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
|
|
2
|
Отдельные исследования с контролем референтным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
|
|
3
|
Исследования без последовательного контроля референтным методом или исследования с референтным методом, не являющимся независимым от исследуемого метода, или нерандомизированные сравнительные исследования, в том числе когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая
|
|
5
|
Имеется лишь обоснование механизма действия или мнение экспертов
|
Таблица 2. Шкала оценки уровней достоверности доказательств для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
|
Уровень достоверности доказательств
|
Расшифровка
|
|---|---|
|
1
|
Систематический обзор рандомизированного клинического исследования с применением метаанализа
|
|
2
|
Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
|
|
3
|
Нерандомизированные сравнительные исследования, в том числе когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай – контроль»
|
|
5
|
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
|
Таблица 3. Шкала оценки уровней убедительности рекомендаций для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
|
Уровень убедительности рекомендаций
|
Расшифровка
|
|---|---|
|
A
|
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
|
|
B
|
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
|
|
C
|
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
|
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Актуальные инструкции к лекарственным препаратам, упоминаемым в данных клинических рекомендациях, можно найти на сайте http://grls.rosminzdrav.ru.
Таблица 1.
Алгоритм выбора метода лечения первичной опухоли у пациентов с РПЧ.
|
Характеристики первичной опухоли
|
Лечение
|
|---|---|
|
Tis, Та
|
· аппликации #имихимода [31, 147];
· лазерная абляция
· хирургическое лечение
|
|
T1 (G1,G2)
|
· аппликации #имихимода [31, 147];
· лазерная абляция
· хирургическое лечение
· лучевая терапия
o дистанционная или внутритканевая - при опухоли <4 см
o дистанционная - при опухоли ≥4 см
|
|
T1 (G3,G4), Т2-4
|
· хирургическое лечение
· лучевая терапия
o дистанционная или внутритканевая - при опухоли <4 см
o дистанционная - при опухоли ≥4 см
· химиолучевая терапия
|
Таблица 2.
Алгоритм выбора тактики лечения регионарных метастазов у пациентов с РПЧ.
|
Регионарные лимфоузлы
|
Дополнительные характеристики
|
Лечебная тактика
|
|---|---|---|
|
Паховые лимфоузлы не пальпируются
|
Первичная опухоль Tis, Та, T1aG1
|
Динамическая биопсия сторожевого лимфоузла (при положительном результате – двухсторонняя стандартная пахово-бедренная лимфодиссекция).
Если динамическая биопсия сторожевого лимфоузла невозможна – динамическое наблюдение
|
|
Первичная опухоль T1aG2
|
Модифицированная двухсторонняя стандартная пахово-бедренная лимфодиссекциясо срочным патолого-анатомическим исследованием (при положительном результате – стандартная пахово-бедренная лимфаденэктомия со стороны обнаружения метастаза или метастазов). Альтернатива – динамическое наблюдение
|
|
|
Первичная опухоль Т>T1a, G3-4
|
Модифицированная двухсторонняя стандартная пахово-бедренная лимфодиссекциясо срочным патолого-анатомическим исследованием (при положительном результате – стандартная пахово-бедренная лимфаденэктомия со стороны обнаружения метастаза или метастазов)
|
|
|
Паховые лимфоузлы пальпируются
|
Первичная опухоль Tis, Та, TaG1
Паховые лимфоузлы <4 см, подвижные
|
· Чрескожная биопсия под УЗ-контролем
o Отрицательный результат чрескожной биопсии: открытая биопсия
o Отрицательный результат открытой биопсии: динамическое наблюдение
o Положительный результат биопсии: двухсторонняя стандартная пахово-бедренная лимфодиссекция
· Экстранодальный рост опухоли, 3 и более метастазов в паховые лимфоузлы
o двухсторонняя тазовая лимфодиссекция
o рассмотреть возможность проведения адъювантной химиотерапии или химиолучевой терапии
|
|
Первичная опухоль Т>T1a, G>G1
Паховые лимфоузлы <4 см, подвижные
|
· Двухсторонняя стандартная пахово-бедренная лимфодиссекция
· Экстранодальный рост опухоли, 3 и более метастазов в паховыве лимфоузлы – двухсторонняя тазовая лимфодиссекция
|
|
|
Паховые лимфоузлы ≥4 см, подвижные
|
· Чрескожная биопсия под УЗ-контролем
o Отрицательный результат чрескожной биопсии: открытая биопсия
o Отрицательный результат открытой биопсии: динамическое наблюдение
o Положительный результат биопсии: неоадъювантная химиотерапия, двухсторонняя стандартная пахово-бедренная лимфодиссекция
· Экстранодальный рост опухоли, 3 и более метастазов в паховые лимфоузлы
o двухсторонняя тазовая лимфодиссекция
o рассмотреть возможность проведения адъювантной химиотерапии или химиолучевой терапии (если не проводилась неоадъювантная химиотерапия)
|
|
|
Фиксированные
|
· Чрескожная биопсия под УЗ-контролем
o Отрицательный результат чрескожной биопсии: открытая биопсия
o Отрицательный результат открытой биопсии: динамическое наблюдение
o Положительный результат биопсии: индукционная химиотерапия, двухсторонняя стандартная пахово-бедренная, тазовая лимфодиссекция, при ответе на лечение
|
|
|
Тазовые лимфоузлы
|
Не увеличены, pN0-N1
|
Тазовая лимфодиссекция не показана
|
|
Не увеличены, pN2
|
Двухсторонняя тазовая лимфодиссекция
|
|
|
Увеличены, потенциально удалимы
|
Неоадъювантная химиотерапия, двухсторонняя тазовая лимфодиссекция
|
|
|
Увеличены, потенциально неудалимы
|
Индукционная химиотерапия, двухсторонняя тазовая лимфодиссекцияпри ответе на лечение
|
Таблица 3.
Режимы лекарственной терапии, рекомендованные для лечения РПЧ
|
Режим/препарат
|
Доза
|
Путь введения
|
Дни
|
|---|---|---|---|
|
Неоадъювантная, адъювантная и 1-я линия паллиативной лекарственной терапии
|
|||
|
TIP (каждые 21день) [53]:
|
|||
|
#Паклитаксел**
|
175 мг/м2
|
В/в в течение 3 часов
|
1-й
|
|
#Ифосфамид**
|
1200 мг/м2
|
В/в в течение 2 часов
|
1–3-й
|
|
#Цисплатин**
|
25 мг/м2
|
В/в в течение 2 часов
|
1–3-й
|
|
PF (каждые 21–28 дней) [56]:
|
|||
|
Фторурацил**
|
800–1000 мг/м2
|
В/в 24-часовая инфузия
|
1–4-й
|
|
#Цисплатин**
|
70–80 мг/м2
|
В/в в течение 2 часов
|
1-й
|
|
Вторая и последующие линии паллиативной лекарственной терапии
|
|||
|
#Цетуксимаб** еженедельно [63]
|
400 мг/м2, далее 250 мг/м2
|
В/в в течение 1 часа
В/в в течение 1 часа
|
1-й
|
|
#Цетуксимаб** каждые 14 дней [152]
|
400 мг/м2, далее 500 мг/м2
|
В/в в течение 1 часа
В/в в течение 1 часа
|
1-й
|
|
#Паклитаксел** каждые 21 день [58]
|
175 мг/м2
|
В/в капельно
|
1-й
|
|
Радиосенсибилизирующая химиотерапия как составляющая сочетанной химиолучевой терапии [28, 85-86]
|
|||
|
#Цисплатин** 40 мг/м2 в/в еженедельно, всего 6 введений (но не более 70 мг на введение суммарно) [149]
#Цисплатин** 75мг/м2 в/в в 1-й и 29-й дни + фторурацил** 1000 мг/м2/день в/в 24-часовая инфузия в 1–4-й и 29–32-й дни [151]
#Митомицин** 10 мг/м2 в/в в 1-й и 29-й дни (но не более 20 мг на введение суммарно) + фторурацил** 1000 мг/м2/день в/в 24-часовая инфузия в 1–4-й и 29–32-й дни [149]
#Капецитабин** 1650 мг/м2/день внутрь в дни лучевой терапии в течение всего курса лучевой терапии [85].
|
|||
Примечание. В режимах с аналогами пиримидина фторурацил** может быть заменен на #капецитабин** 1650 мг/м2/день внутрь в дни лучевой терапии в течение всего курса лучевой терапии.
Приложение Б. Алгоритмы действий врача
Рис. 1. Блок-схема лечения пациента с верифицированным раком полового члена.
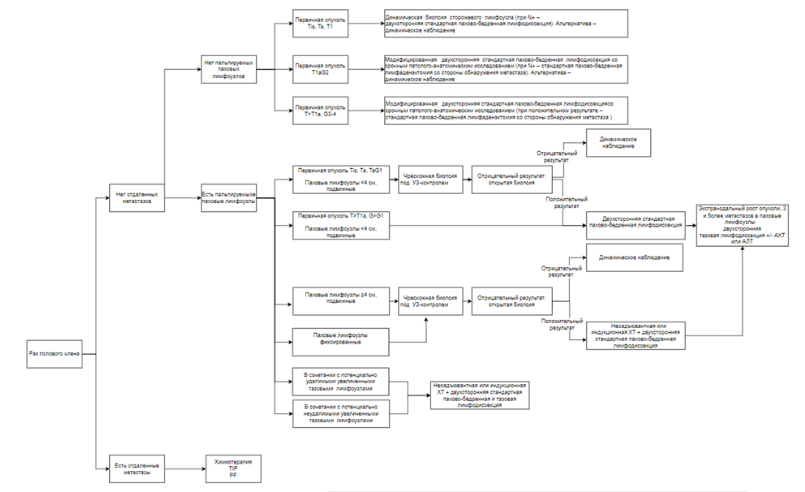
Приложение В. Информация для пациента
Пациента информируют о клинической картине и методах диагностики/стадирования РПЧ, знакомят с различными методами лечения и их потенциальными результатами/осложнениями. Выбор метода лечения следует выполнять в результате такого собеседования после того, как пациент имел возможность задать все интересующие его вопросы.
Необходимо убедить пациента не стыдиться болезни и ознакомиться с научно-популярной литературой о РПЧ.
Следует информировать пациента о характере последующего наблюдения после лечения РПЧ, о важности регулярного обследования.
Самостоятельный контроль за течением заболевания со стороны пациента невозможен, частота посещения врача определяется в индивидуальном порядке в каждом конкретном случае.
Рекомендации при осложнениях химиотерапии
При осложнениях химиотерапии необходимо связаться с врачом-онкологом (химиотерапевтом).
1. При повышении температуры тела 38 °C и выше:
-
начать прием антибиотиков: по назначению лечащего врача.
2. При стоматите:
-
диета – механическое, термическое щажение;
-
частое полоскание рта (каждый час) – ромашки цветки, дуба кора, шалфея лекарственного листья, смазывать рот облепихи крушиновидной плодов маслом ;
-
обрабатывать полость рта по рекомендации лечащего врача.
3. При диарее:
-
диета – исключить жирное, острое, копченое, сладкое, молочное, клетчатку. Можно нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье;
-
принимать препараты по назначению лечащего врача.
4. При тошноте:
-
принимать препараты по назначению лечащего врача.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Нет.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.